Изобретение относится к фрагменту ДНК, полученному из Rhodococcus rhodochrous и кодирующему полипептид с нитрилгидратазной активностью, который гидролизует нитрил в амид. Изобретение также относится к рекомбинантной ДНК, содержащей вышеуказанный фрагмент ДНК, и трансформанту, содержащему рекомбинантную ДНК.
Настоящее изобретение, кроме того, относится к способу получения нитрилгидратазы с помощью трансформанта.
Известный уровень техники
Нитрилгидратаза или нитрилаза известна как фермент, гидрелизирующий нитрилы в амиды. Микроорганизмы, образующие нитрилгидратазу, включают организмы, принадлежащие к роду Bacillus роду Bacteridium роду Micrococcus и роду Brevibacterium (см. JP-B-62-21517/1989, USP N 4001081), роду Corynebacterium и роду Nocardia (см. JP-B-56-17918/1989, USP N 4248968), роду Pseudomonas (см. JP-B-59-37951/1984), USP N 4637982), роду Rhodococcus, роду Arthrobacter и роду Microbacterium (см. JP-A-61-162193/1986, EP-A-0188316) и Rhodococcus rhodochraus (см. JP-A-2470/1990, EP-A-0307926).
Нитрилгидратазу применяют для гидролиза нитрилов в амиды. В изобретении микроорганизмы преобразуют с тем, чтобы они содержали множественные копии рекомбинантной ДНК, кодирующей нитрилгидратазу, использованием биотехнологии. Полученный рекомбинант продуцирует нитрилгидратазу на заметно более высоком уровне по сравнению с обычно применяемыми микроорганизмами.
Создателями настоящего изобретения ранее описан фрагмент ДНК, полученный из Rhodococcus N-774 (FERM BP-1936), который тоже кодирует полипептид с нитрилгидратазной активностью JP-A-2-119778/1988).
В отличие от вышеприведенной ссылки в настоящем изобретении используется фрагмент ДНК, полученный из Rhodococcus rhodochrous J-1, для продуцирования нитрилгидратазы. Нами выделен ген, кодирующий нитрилгидратазу, ген внедрен в приемлемый плазмидный вектор, которым трансформирован соответствующий хозяин, т.е. последовательно получен трансформант, продуцирующий нитрилгидратазу с высокой активностью также и по отношению к ароматическим нитрилам.
Краткое изложение сущности изобретения
Настоящее изобретение относится к:
(1) фрагменту ДНК(L), кодирующему полипептид с нитрилгидратазной активностью, при этом полипептид включает α(L)- и β(L)-субъединицы аминокислотных последовательностей 1 и 2 (см. в конце описания);
(2) рекомбинантной ДНК, включающей в векторе ДНК(L) по пункту (1);
(3) трансформанту, содержащему рекомбинантную ДНК по пункту (2);
(4) способу получения нитрилгидратазы, заключающейся в культивировании трансформанта, охарактеризованного в пункте (3), и выделении из культуры нитрилгидратазы.
Ниже настоящее изобретение описывается более подробно. Изобретение осуществляют проведением этапов (1)-(8):
(1) Выделение и очистка нитрилгидратазы и частичное аминокислотное секвенирование нитрилгидратазы.
Из Rhodococcus rhodochrous J-I (FERM BP-1478) выделяют и очищают два типа нитрилгидратазы (обозначены соответственно, как H-тип и L-тип) и оба фермента разделяют с помощью ВЭЖХ на α- и β-субъединицы. Определяют часть аминокислотной последовательности каждой субъединицы (фиг. 1).
(2) Получение ДНК-зонда для гена нитрилгидратазы.
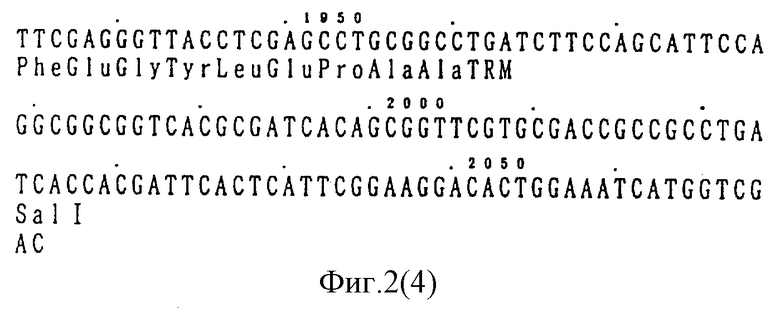
ДНК-зонд получают из JM105/pV UK121 (FERM BP-1937) по методике JP-A-2-119778/1990, что связано с высокой степенью гомологичности в аминокислотной последовательности между нитрилгидратазой β-субъединицы Rhodococcus N-774, охарактеризованной в указанной публикации из Official Gazette патентов Японии, и субъединицами Rhodococcus rhodochrous J-1. Плазмиду pVUK121, содержащую ген нитрилгидратазы, происходящей из Rhodococcus N-774, получают из культуры JM105/pVU-К121, ДНК pVU К-121 гидролитически расщепляют с помощью SphI и SalI SphI-SalI - фрагмент содержит ген нитрилгидратазы Rhodococcus N-774 (фиг. 2) фрагмент ДНК радиометят.
(3) Детектирование сегмента ДНК, содержащего ген нитрилгидратазы из хромосом Rhodococcus rhodochrous J-I. Хромосомную ДНК получают из культуры Rhodococcus rhodochrous J-1.
Хромосомную ДНК гидролитически расщепляют с помощью ферментов рестрикции и гибридизуют с зондом по методике гибридизации Саутерна (Southern Е.М., J. Mol. Biol. 98, 503 (1975)).
Отбирают два фрагмента ДНК различной длины.
(4) Конструирование рекомбинантной плазмиды.
Рекомбинантную плазмиду конструируют вставкой хромосомного фрагмента ДНК этапа (3) в плазмидный вектор.
(5) Трансформация и отбор трансформанта, содержащего рекомбинантную плазмиду.
Трансформант получают с помощью рекомбинантной плазмиды этапа (4). Содержащий рекомбинантную плазмиду трансформант отбирают с помощью зонда этапа (2) по методике гибридной колонии (R Bruce Wallace и др., Nuc.Aci.Res. 9, 879 (1981)). Кроме того, присутствие гена нитрилгидратазы подтверждают методом гибридизации Саутерна. Отобранные в результате плазмиды обозначают как pNHJ 20L.
(6) Выделение и очистка плазмидной ДНК и конструирование рестрикционной карты.
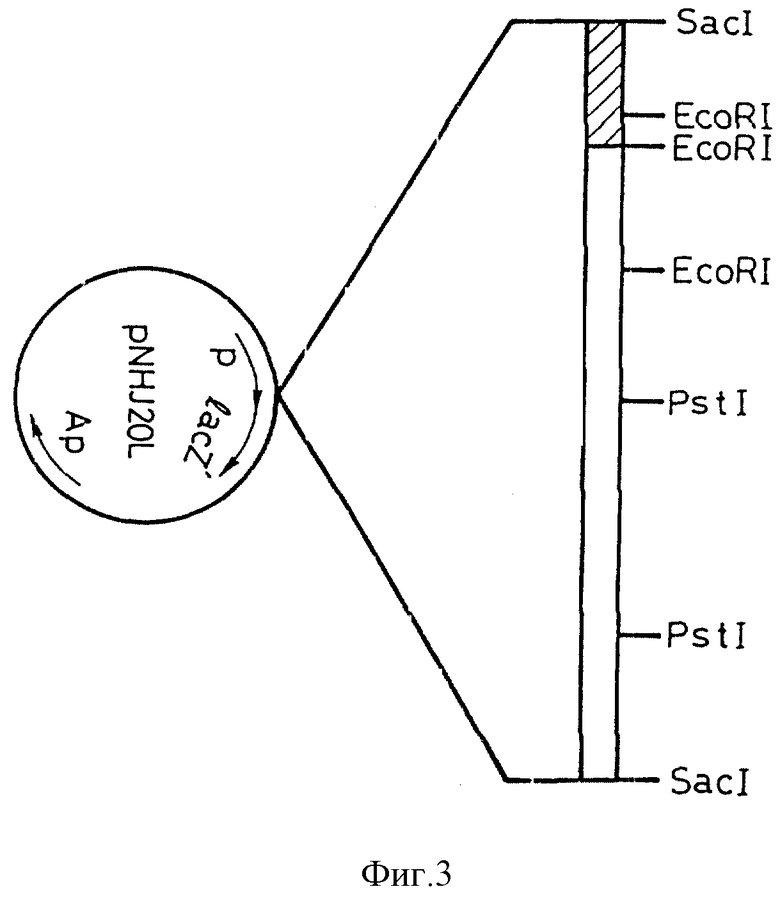
Выделяют и очищают полученную на этапе (5) плазмидную ДНК pNHJ20L. Конструируют рестрикционную карту этой ДНК (фиг. 3) для определения области, содержащей ген нитрилгидратазы.
(7) Секвенирование ДНК.
Встроенный в плазмиду pNHJ20L фрагмент ДНК отщепляют с помощью соответствующего фермента рестрикции и секвенируют. Нуклеотидная последовательность фрагмента ДНК (фиг. 4 и 5) показывает, что в ней содержится последовательность, прослеженная на основании аминокислотной последовательности этапа (1).
(8) Получение с помощью трансформанта нитрилгидратазы.
Культивируют трансформант этапа (7).
Rhodococcus rhodochrous J-1 депонирован в исследовательском институте ферментации агентства промышленных наук и технологий, где ему присвоен регистрационный номер FERM BP-1478. Трансформант TGI/NHJ20L, содержащий pNHJ20L этапа (5), депонирован там же, и ему присвоен регистрационный номер FERM BP-2778.
Могут быть использованы любые векторы, в том числе: плазмидный вектор (например, AT153, рМР9, pHC624, pKC7 и т.д.), фаговый вектор (например, λgt II (тойобо), Чарон 4A (Амерсхам) и т.д.). Ферменты, которые могут быть использованы, включают: SphI, SalI, EcoRI, SeaI, BumHI и т.п., выпускаемые промышленностью (Такара Шузо). Для трансформации могут быть использованы разнообразные реципиенты, в том числе, но без ограничения только ими: E.Coli, Jm105 и E.Coli TGI.
Культурной средой для трансформанта служат обычно применяемые для подобных целей среды.
Превращение нитрилов в амиды осуществляют использованием нитрилгидратазы, сырой нитрилгидратазы, культуры трансформанта, выделенных бактериальных клеток или обработанного материала клеток и т.п., полученных из культуры трансформанта.
Приемлемые для изобретения нитрилы включают: ароматические нитрилы с 4-10 атомами углерода в ароматическом фрагменте и алифатические нитрилы с 2-6 атомами углерода, описанные в публикации Европейского патента N 0307926. Типичные примеры нитрилов включают: 4-, 3- и 2-цианопиридин, бензонитрил, 2,6-дифторбензонитрил, 2-тиофенкарбонитрил, 2-фуронитрил, цианопиразин, акрилонитрил, метакрилонитрил, кротонитрил, ацетонитрил и 3-гидроксипропионитрил.
Технические результаты.
Описана аминокислотная последовательность α- и β-субъединиц нитрилгидратазы, происходящих из Rhodococcus rhodochrous J-1. Фрагмент ДНК, кодирующий нитрилгидратазу, встраивают в вектор экспрессии и для трансформации применяют рекомбинантный вектор. Трансформант содержит множество копий гена и способен продуцировать нитрилгидратазу на гораздо более высоком уровне по сравнению с обычно применяемыми микроорганизмами.
Пояснения к чертежам.
На фиг. 1 представлены N-концевые аминокислотные последовательности α- и β-субъединиц нитрилгидратазы, продуцированных Rhodococcus rhodochrous J-1.
На фиг. 2 представлена ДНК последовательность гена нитрилгидратазы Rhodococcus N-774, применяемого в качестве ДНК-зонда.
На фиг. 3 показана рестрикционная карта рекомбинантной плазмиды pNHJ20L.
На фиг. 4 представлена ДНК последовательность фрагмента ДНК в pNHJ201, происходящего из Rhodococcus rhodochrous J-I; и аминокислотная последовательность, соответствующая данной нуклеотидной последовательности.
Настоящее изобретение подробно иллюстрируется нижеследующим примером, который не предназначен для ограничения изобретения.
В примере использованы следующие сокращения:
ТЕ - Трис-HCl (10 мМ, pH 7, 8), ЭДТК (1 мМ, pH 8),
TNE - Трис-HCl (50 мМ, pH 8), ЭДТК (1 мМ, pH 8), NaCl (50 мМ),
STE - Трис-HCl (50 мМ, pH 8), ЭДТК (5 мМ, pH 8), сахароза (35 мМ),
среда 2xVT - 1,6% Триптона, 1%-ный дрожжевой экстракт, 0,5% NaCl.
Пример
(1) Выделение и очистка нитрилгидратазы и частичное аминокислотное секвенирование нитрилгидратазы.
Rhodococcus rhodochrous J-1 культивируют 80 часов в среде (3 г/л дрожжевого экстракта, 0,5 г/л KH2PO4 0,5 г/л K2HPO4, 0,5 г/л MgSO4 • 4H2O, 0,01 г/л CoCl2 и 3 г/л кротонамида, pH 7,2). Собирают бактериальные клетки. 50 г бактериальных клеток разрушают и фракционируют с сульфатом аммония. Образец диализуют и диализат центрифугируют. Жидкую часть хроматографируют на колонке с DEAE-Целлофином, колонке с фенил-Сефарозой, колонке с Сефадексом C-150 и колонке с Октил-Сефарозой. Получают и диализуют две фракции с ферментативной активностью. Диализат переносят на колонку высокоэффективной жидкостной хроматографии с обращенными фазами (Сеншу Пак VP-304-1251, Сеншу Кадаку) и получают соответственно две субъединицы (α и β). С помощью белкового секвенатора модели 470A прикладных биосистем определяют N-концевые аминокислотные последовательности α
(2) Получение ДНК-зонда на ген нитрилгидратазы.
B 100 мл среды 2хУТ, содержащей 50 мкг/мл ампицилина, культивируют 12 часов при 30oC Е.Coli JM105 (FERM BP-1937), содержащей pYU121. Бактериальные клетки собирают и к ним добавляют TNE. Клеточную суспензию затем центрифугируют. 8 мл STE и 10 мг лизозима добавляют к твердой части. Смесь инкубируют пять минут при 0oC, после чего добавляют 4 мл 0,25 М ЭДТА. Затем к смеси при комнатной температуре прибавляют 2 мл 10% SDS и 5 мл M NaCl. Полученную смесь инкубируют три часа при 0-4oC и затем ультрацентрифугируют. К жидкой части добавляют 1/2 объема ПЭГ 6000. Смесь инкубируют 12 часов при 0-4oC и центрифугируют. К твердой части добавляют TNE с доведением объема до 7,5 мл, после чего к суспензии прибавляют CSCl. Смесь центрифугируют с удалением белков. Затем к жидкой части добавляют 300-500 мг/мл этидий-бромида. Смесь переносят в центрифужную пробирку, пробирку герметизируют нагреванием и ультрацентрифугируют. С помощью перистальтического насоса экстрагируют ковалентно замкнутую кольцевую ДНК. К экстракту добавляют насыщенный водой изопропиловый спирт в количестве, несколько превышающем равное количество, с извлечением этидий-бромида. Образец диализуют по ТЕ и получают 3 мл очищенной плазмиды pVUK12L.
pVUK12I ДНК гидролитически расщепляют с помощью SphI и SalI и получают фрагмент ДНК в 2,07 т.п.о., содержащий ген нитрилгидратазы, происходящий из Rhodococcus N-774. Фрагмент радиометят 32P с получением зонда. Нуклеотидная последовательность зонда приведена на фиг. 2.
(3) Получение фрагмента ДНК, содержащего хромосомный ген нитрилгидратазы.
B 100 мл среды (10 г/л глюкозы, 0,5 г/л KH2PO4, 0,5 г/л K2HPO4, 0,5 г/л MgSO4 • 7H2O, 1 г/л дрожжевого экстракта, 7,5 г/л пептона, 0,01 г/л CoCl2, 7,5 г/л мочевины, 1% глицина или 0,3 мкг/мл ампицилина, 1 л воды, pH 7,2) культивируют Rhodococcus rhodochrous J-1. Бактериальные клетки собирают и твердую часть промывают TNE. Затем твердую часть суспендируют в 10 мл ТЕ. К суспензии добавляют 4 мл 0,25 М ЭДТА, 10-20 мг лизозима, 10-20 мг ахромопротеазы и 10 мл 10xSDS. Суспензию инкубируют три часа при 37oC и затем к ней добавляют 15 мл фенола. Смесь инкубируют 15 минут при комнатной температуре и затем центрифугируют. Верхний слой удаляют и к надосадочной жидкости добавляют 0,7 мл 2,5 М ацетата натрия и диэтиловый эфир. Смесь центрифугируют и верхний слой отбрасывают. К нижнему слою добавляют два объема этанола и ДНК извлекают стеклянной палочкой. ДНК ополаскивают по пять минут в каждом случае смесью ТЕ-этанол в отношениях 2:8, 1:9 и 0:9 (об./об.). Затем ДНК вновь суспендируют в 2-4 мл ТЕ (37oC). К суспензии добавляют 10 мкл смеси РНКазы A и T1 и смесь инкубируют при 37oC. К смеси добавляют равное количество фенола, после чего центрифугируют. К надосадочной жидкости добавляют более чем равное количество эфира. Смесь вновь центрифугируют, верхний слой отбрасывают, а нижний слой сохраняют. Нижний слой диализуют около суток в 2 л ТЕ, содержащих небольшое количество хлороформа, и дополнительно диализуют в свежем ТЕ в течение 3-4 часов. Получают 4 мл сырой хромосомной ДНК.
К 15 мкл сырой хромосомной ДНК добавляют 10 мкл ТЕ, 3 мкл реакционного буфера (10х) и 2 мкл SacI. Полученную смесь инкубируют 1 час при 37oC и подвергают электрофорезу на геле агарозы (60 B, три часа). Гибридизацию хромосомной ДНК по Саутерну проводят с применением зонда этапа (2). Найдено, что фрагменты в примерно 6 т.п.о. и 9,4 т.п.о. характеризуются сильной гибридизацией.
15 мкл хромосомной ДНК гидролитически расщепляют с помощью SacI и подвергают электрофорезу на геле агарозы по вышеприведенной методике. В геле вырезают фрагменты ДНК в 6 к.п.о. и 9 к.п.о. и каждый фрагмент переносят в три объема 8 М NClO4. После солюбилизации каждый раствор наносят в виде пятна на фильтровальную бумагу GF/C (Ватман) диаметром 6 мм. К фильтровальной бумаге добавляют десять капель (≈ 100 мкл) ТЕ, содержащего 6 М NaClO4, и затем десять капель (≈ 100 мкл) 95% этанола. Бумагу сушат 3 минуты на воздухе и помещают в пробирку Эппендорфа. В пробирку добавляют 40 мкл ТЕ и все инкубируют 30 минут при 47oC. Затем пробирку центрифугируют. В результате получают около 40 мкл надосадочной жидкости с фрагментами ДНК в 4,6 кв и 9,4 кв, содержащих ген нитрил-гидратазы хромосомной ДНК.
(4) Внедрение в вектор фрагмента хромосомной ДНК.
К 10 мкл pUC19 добавляют 10 мкл ТЕ, 3 мкл реакционного буфера (10х) и 2 мкл SacI и смесь инкубируют 1 час при 30oC. Затем для прекращения реакции к смеси прибавляют 2 мкл 0,25 М ЭДТА. После этого к смеси прибавляют 7 мкл Трис-HCl (1 М, pH 9) и 3 мкл бактериальной щелочной фосфатазы (БЩФ). Смесь инкубируют 1 час при 65oC и затем прибавляют ТЕ до полного объема в 100 мкл. Смесь трижды экстрагируют равным количеством фенола. К экстракту добавляют равное количество эфира. Нижний слой отделяют и к нему прибавляют 10 мкл 3 М ацетата натрия и 250 мкл этанола. Смесь инкубируют 30 минут при - 80oC, центрифугируют, сушат и вновь суспендируют в ТЕ.
Смешивают 5 мкл полученной в результате ДНК pUC19 и 40 мкл фрагмента ДНК 9,4 кв этапа (3). К смеси добавляют 6 мкл буфера лигации, 6 мкл АТФ (6 мг/мл) и 3 мкл Т4 ДНК-лигазы. Смесь инкубируют 12 часов при 4oC с получением рекомбинантной плазмиды, содержащей фрагмент ДНК размером 9,4 кв в SacI сайте pUC19.
(5) Трансформация и отбор трансформантов.
10 мл среды 2xУT инокулируют E.Coli TGI (Амерсхем) и инкубируют 12 часов при 37oC. После инкубирования полученную культуру прибавляют к свежей культуре 2хУТ до концентрации 1% и полученную смесь инкубируют два часа при 37oC. Культуру центрифугируют и твердую часть суспендируют в 5 мл холодного 50 мМ раствора CaCl2. Суспензию оставляют на сорок минут на льду и затем центрифугируют. К твердой части добавляют 0,25 мл холодного 50 мМ раствора CaCl2 и 60 мкл рекомбинантной ДНК этапа (4). Смесь инкубируют 40 минут при 0oC, подвергают тепловому шоку в течение двух минут при 42oC, пять минут выдерживают на льду и прибавляют к 10 мл среды 2хУТ. Смесь инкубируют 90 минут при 37oC со встряхиванием и затем центрифугируют. Твердую часть суспендируют в 1 мл среды 2хУТ и две аликвоты по 10 мкл суспензии наносят на 2хУТ агарозную пластинку, отдельно содержащую 50 мкг/мл ампицилина. Пластинку инкубируют при 37oC. Выращенные колонии переносят на нитроцеллюлозный фильтр и гидролитически расщепляют. ДНК фиксируется на фильтре и гибридизируется с зондом этапа (2). Фильтр подвергают радиоавтографии и затем отбирают рекомбинантную колонию. Кроме того, присутствие гена нитрилгидратазы в трансформанте подтверждено методом гибридизации Саутерна.
(6) Выделение и очистка рекомбинантной плазмиды и конструирование рестрикционной карты внедренных фрагментов ДНК.
Отобранный на этапе (5) трансформант выращивают 12 часов при 37oC в 100 мл среды 2xVT, содержащей 50 мгк/мл ампицилина. Бактериальные клетки собирают и к ним добавляют TNE. Клетки вновь собирают центрифугированием и к ним добавляют 8 мл STE и 10 мг лизозима. Смесь инкубируют пять минут при 0oC и затем добавляют 4 мл 0,25 М ЭДТА, 2 мл 10% SDS (при комнатной температуре) и 5 мл 5 М NaCl. Смесь инкубируют три часа при 0-4oC и ультрацентрифугируют. К надосадочной жидкости добавляют 1/2 объема 30% ПЭГ 6000, полученную смесь инкубируют 12 часов при 0-4oC и вновь центрифугируют. К твердой части добавляют TNE с доведением объема до 7,5 мл. Для удаления белков к суспензии прибавляют CSCl. Затем к надосадочной жидкости добавляют 300-500 мг/мл этидий-бромида и смесь переносят в центрифужную пробирку. Пробирку герметизируют нагреванием и ультрацентрифугируют. С помощью перисталлического насоса удаляют ковалентно замкнутую непрерывную кольцевую ДНК, к которой для удаления этидий-бромида добавляют несколько большее, чем равное количество изопропилового спирта, насыщенного водой. Образец ДНК диализуют в ТЕ с получением 3 мл очищенной рекомбинантной ДНК. Полученная в результате рекомбинантная плазмида, содержащая фрагмент ДНК размером 9,4 т. п.о., обозначена как pNHJ20L.
Полученные плазмидные ДНК гидролитически расщепляют с помощью EcoRI, BamHI, PsfI, SacI и SalI. Сконструированные рестрикционные карты приведены на фиг. 3.
(7) Секвенирование ДНК.
Положение гена нитрилгидратазы в фрагменте ДНК плазмиды pNHJ20L определяют в соответствии с конструированными рестрикционными картами и методом гибридизации Саутерна. Добавочный сегмент в pNHJ20L отщепляют с помощью EcoRI и SacI с получением из ДНК-фрагмента в 9,4 т.п.о. фрагмента в 1,73 т.п.о.
Полученные фрагменты ДНК секвенируют по методике Зангера (Sanger F., Science 214, 1205-1210 (1981)) использованием фагового вектора М13. Нуклеотидная последовательность фрагмента ДНК 1,73 кв (pNHJ20L) приведена соответственно на фиг. 4.
Аминокислотная последовательность, выведенная из нуклеотидной последовательности, как было найдено, оказалась полностью идентичной аминокислотной последовательности, определенной на этапе (1). Анализ последовательности, кроме того, выявил, что фрагмент ДНК содержит последовательность, кодирующую α- и β-субъединицы.
(8) Получение с помощью трансформанта нитрилгидратазы и превращение нитрилов в амиды использованием нитрилгидратазы.
10 мл среды 2хУТ, содержащей 50 г/мл ампицилина, инокулируют TG-I/pNHJ20L и инкубируют 12 часов при 30oC. 1 мл полученной культуры добавляют к 100 мл среды 2хУТ (50 мг/мл ампицилина, 0,1 г CoCl2 • 6H2O/л) и смесь инкубируют 4 часа при 30oC. К смеси добавляют ИПТГ до конечной концентрации 1 мМ и инкубируют 10 часов при 30oC. После сбора клеток их суспендируют в 5 мл 0,1 М фосфатного буфера (pH 7,5), суспензию разрушают действием в течение 5 мин ультразвука и центрифугируют 30 мин при 12000 g.
Полученную надосадочную жидкость используют для ферменивного испытания. Ферментивное испытание проводят в реакционной смеси (12 мл), содержащей 50 мМ калийфосфатного буфера (pH 7,5), 6 мМ бензонитрила и необходимое количество фермента. Реакцию осуществляют в течение 30 мин при 20oC и прекращают добавлением 0,2 мл 1 М HCl. Количество образовавшегося в реакции бензамида определяют с помощью ВЭЖХ. Для контроля используют смесь, приготовленную по вышеприведенной методике, но из E.coli TG-I. Уровень нитрилгидратазной активности в бесклеточных экстрактах E.coli, содержащих pNHJ20L, составляет 6,99 • 10-3 единиц/мг при культивировании в среде 2хУТ в присутствии CoCl2 и ИПТГ. В реакционной смеси TG-I/pNHJ20L обнаружен бензамид, в то время в реакционной смеси TG-I бензамид не обнаружен.












Изобретение относится к биотехнологии и касается аминокислотных последовательностей α- и β-субединиц полипептида с активностью нитрилгидратазы и фрагментов ДНК, кодирующих этот полипептид. Также изобретение касается рекомбинатной плазмидной ДНК pNHJ20L, кодирующей полипептид, проявляющий свойства нитрилгидратазы, трансформанта, содержащего рекомбинантную плазмидную ДНК, и способа получения нитрилгидратазы. Фрагмент ДНК, кодирующий полипептид с активностью нитрилгидратазы, вставляют в плазмидный вектор. Трансформируют штамм E. coli с помощью рекомбинантной плазмиды pNHJ20L. Полученный штамм E.coli TG1/pNHJ20L (FERM BP-2778) способен продуцировать полипептид со свойствами нитрилгидратазы на гораздо более высоком уровне, чем обычно применяемые микроорганизмы. 4 с.п. ф-лы, 4 ил.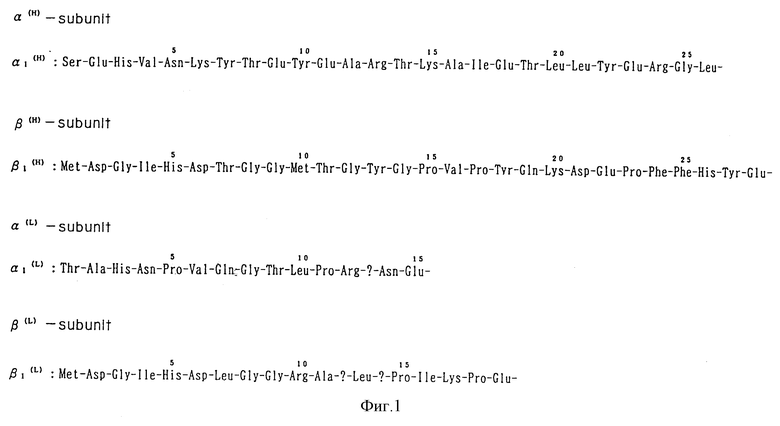
β(L)-субъединица: (см. графическую часть).
соответствующие следующим аминокислотным последовательностям: α(L)-субъединица: (см. графическую часть).
β(L)-субъединица: (см. графическую часть).
| Рекомбинантная плазмидная ДНК @ 435,кодирующая синтез ДНК-лигазы фага Т 4.способ ее конструирования и штамм @ . @ ВКМ в-1449-продуцент ДНК-лигазыфага Т4 | 1981 |
|
SU1122003A1 |
| ОСВЕТИТЕЛЬНАЯ ОПОРА | 2016 |
|
RU2633938C1 |
Авторы
Даты
2001-09-20—Публикация
1991-02-27—Подача