Изобретение относится к области органической химии и молекулярной биологии, а именно к фторированным производным 1,4-нафтохинона, обладающим цитотоксической активностью по отношению к раковым клеткам человека в культуре.
Клетки млекопитающих обычно используют обратимое фосфорилирование остатков тирозина в белках для передачи внеклеточного сигнала к внутриклеточным мишеням. Учитывая это, нарушение медиаторов передачи сигнала через фосфорилирование белков, а именно протеинкиназ и фосфатаз, связано с развитием большого числа заболеваний человека, включая раковые заболевания. Известно, что Cdc25A и Cd25B фосфатазы важны для контроля клеточного цикла и активируют циклин-зависимые киназы, которые играют важную роль в регуляции пролиферации клеток. Cdc25A и Cd25B фосфатазы человека обладают онкогенными свойствами и гиперэкспрессированы в различных раковых клетках человека. В связи с этим, они представляют интерес как мишени для антираковых препаратов [Boutros R., Dosier С., Ducommun В. Curr. Opin. Cell. Biol. 2006. V.18, P.185; Kristjansdottir K., Rudolf J.J. Chem. Biol., 2004. V.11. P.1043]. Среди большого числа различных исследованных соединений только некоторые производные нафтохинона [Eckstein J.W. Invest. New. Drugs. 2000. V.18, P.149; Pesttell K.Е, Ducruet A.P., Wipf P et al. Oncogene, 2002. V.19. P.6607], и особенно нафтохинон NSC 95397 из National Cancer Institute library [Lazo J.S., Nemoto K., Pestell K.E. et al., Mol. PharmacoL, 2002. V.61. P.720] обладают способностью эффективно ингибировать Cdc25A фосфатазу.
Было показано, что пара-нафтохиноны, 7-аминохинолин-5,8-хинон и замещенные изохинолин-5,8-хиноны являются коровыми структурами для синтеза потенциальных ингибиторов Cdc25 фосфатаз; примером таких производных является соединение DA3003-1 [Lazo J.S., Nemoto K., Pestell K.Е. et al., Mol. Pharmacol., 2002. V.61. P.720; Wipf P., Joo В., Nguyen Т., Lazo J.S. Org. Biol. Chem., 2004, V.2. P.2173]. Показано, что производные хинона инактивируют Cdc25B фосфатазу либо по реакции Михаэля, либо за счет окисления каталитически важного остатка цистеина [Brisson М., Nguyen Т., Wipf P. et al, Mol. Pharmocol., 2005. V.68. Р.1810-1820]. Известно, что некоторые замещенные производные хинолин-5,8-хинона по положениям С(2), С(3) и С(4) являются эффективными ингибиторами Cdc25B фосфатазы и роста раковых клеток [Cossy J., Belotti D., Brisson М. et al. Bioorg. Med. Chem., 2006. V.14. P.6283-6287]. Коровая структура пара-хинона входит в состав 14 широко используемых в клинике лекарственных препаратов и представляется фундаментальной для синтеза новых потенциальных ингибиторов ферментов, которые являются мишенями в антираковой терапии [Cossy J., Belotti D., Brisson М. et al. Bioorg. Med. Chem., 2006. V.14. P.6283-6287].
Ближайшим к заявляемым фторированным производным 1,4-нафтохинона - прототипом - является тетрафторированный 2-(2-меркаптоэтанол)-3-метил-5,6,7,8-тетрафтор-1,4-нафтохинон (фторированный-Cpd 5), который обладает более высокой активностью в подавлении роста Нер3В клеток, чем исходный Cpd 5 (Ham W.В. et al., 2004, Bioorg. Med. Chem. Lett., 2004, V.14. P.4103-4105). Фторированный-Cpd 5 был получен по реакции 2-метил-3,5,6,7,8-пентафтор-1,4-нафтохинона с 2-меркаптоэтанолом.
Недостатками известного Cpd 5 соединения и его фторированного производного являются их высокая токсичность, поскольку они содержат атомы серы - тиоловые группы, которые легко окисляются (подвергаются окислительному стрессу) с образованием токсичных радикалов.
Технической задачей изобретения является создание менее токсичных фторированных производных 1,4-нафтохинона, обладающих цитотоксической активностью по отношению к раковым клеткам человека в культуре, а также в меньшей степени подверженных реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса.
Поставленная техническая задача достигается предлагаемыми фторированными производными 1,4-нафтохинона общей формулы
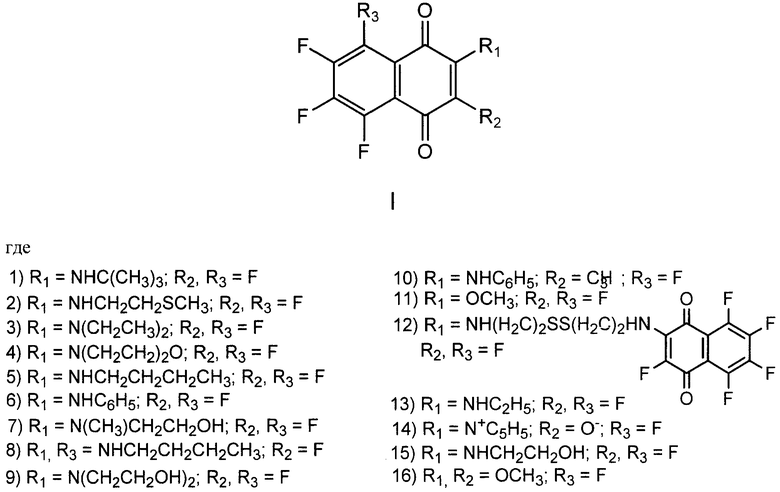
Предлагаемые соединения получают взаимодействием гексафтор-1,4-нафтохинона (II) или 2-метилпентафтор-1,4-нафтохинона (III) (для соединения 10) с азот- и кислородцентрированными нуклеофилами и характеризуют данными спектроскопии ЯМР 1Н и 19F, элементного анализа или масс-спектроскопии высокого разрешения.

II R1, R2=F
III R1=CH3, R2=F
исходное соединение, нуклеофил:
1) II, NH2C(СН3)3; 2) II, NH2CH2CH2SCH3; 3) II, NH(СН2СН3)2; 4) II, NH(CH2CH2)2O; 5) II, NH2CH2CH2CH2CH3; 6) II, NH2C6H8; 7) II, NH(СН3)CH2CH2OH; 8) II, NH2CH2CH2CH2CH3; 9) II, N(CH2CH2OH)2; 10) III, NH2C6H5; 11) II, НОСН3; 12) II, NH2(CH2)2SS(CH2)2NH2; 13) II, NH2C2H5; 14) II, NC5H5; 15) II, NH2CH2CH2OH; 16) II, НОСН3.
По сравнению с упомянутым выше прототипом предлагаемые производные 1,4-нафтохинона (при отсутствии атомов серы) в меньшей степени подвергаются реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса, а по сравнению с нефторированными аналогами - благодаря эффекту электроотрицательных атомов фтора. Поэтому они могут быть более перспективными соединениями для направленного подавления развития раковых клеток, синтезирующих в повышенных количествах онкогенные протеинкиназы и фосфатазы.
В таблице 1 представлены заявляемые фторированные производные 1,4-нафтохинона и их структурные формулы. Физико-химические характеристики фторированных производных 1,4-нафтохинона представлены в таблице 2. Характеристики спектров ЯМР 1Н и 19F представлены в таблице 3.
Изобретение иллюстрируется следующими примерами конкретного получения предлагаемых соединений.
Пример 1.
Получение 2-этиламинопентафтор-1,4-нафтохинона (соединение 13). Смесь 0.07 г (0.556 ммоль) гидробромида этиламина, 0.094 г (1.68 ммоль), KOH и 2 мл диоксана перемешивали 30 мин при комнатной температуре. Осадок отделяли на центрифуге, к раствору добавляли 0.1 г (0.38 ммоль) хинона (II) и перемешивали 2 ч при 20°С. Красный осадок отделяли на центрифуге, промывали водой. Получили 0.106 г (97%) указанного хинона. После возгонки при 150°С в вакууме 0.03 мм рт.ст. выход составил 0.095 г (88%), бордовые кристаллы, т.пл. 184-185°С. Найдено, %: С 49.23; Н 1.85; N 4.86. C12H5F5NO2. Вычислено, %: С 49.50; Н 2.08; N 4.81. Спектр ЯМР, δ/м.д. (J/Гц): 19F 5.3 уш.с. (F3), 24.2 д.д.д, 25.8 д.т.(F5,8), 15.1 д.т., 19.8 д.д.т.(F6,7) (J5,6, J6,7, J7,8 19.7-19.8, J5,7, J5,8, J6,8 10.1-12.1); 1H 1.29 д.т. (СН3), 3.58 м (СН2), 5.39 уш.с. (NH).
Пример 2.
Получение 1-(1,4-дигидро-1,4-диоксо-3-гидрокси-2-тетрафторнафтил)пиридиний бетаина (соединение 14). К раствору 0.20 г (0.75 ммоль) хинона (II) в 3 мл метанола в атмосфере аргона добавляли 0.59 г (7.46 ммоль) пиридина и перемешивали смесь в течение 1 ч при комнатной температуре. Осадок отделяли на центрифуге, промывали метанолом (3×2 мл) и получили 0.22 г (90%) указанного бетаина, оранжевые кристаллы, т.пл. 317-319°С. Найдено, %: С 55.59; Н 1.55; N 4.29, F 23.51. C15H5F4NO3. Вычислено, %: С 55.74; Н 1.56; N 4.33, F 23.51. Спектр ЯМР, δ/ м.д. (J/Гц): 19F 20.4 д.д.д., 21.9 д.т. (F5,8), 11.4 д.т., 16.5 д.т. (F6,7) (J5,6, J6,7, J7,8 18.7-19.3, J5,7, J5,8, J6,8 8.3-12.8); 1H 8.20 м., 8.60 т.т., 8.80 д.м.
Пример 3
Проводили испытание влияния предлагаемых соединений на рост различных линий раковых клеток в культуре. Клетки аденокарциномы молочной железы человека MCF-7 выращивали в среде IMDM, клетки миеломы человека (линия RPMI 6228) выращивали с использованием среды RPMI 1640 с 40 мкг/мл гентамицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы "Биолот" в атмосфере с 5% CO2 в 96-луночных планшетах.
Для сравнения относительной активности всех соединений в одинаковых условиях их растворяли в ДМСО в высокой концентрации (10 мг/мл), а затем стоковый раствор разбавляли ДМСО для получения серии растворов с нужной концентрацией. При использовании клеток аденокарциномы молочной железы после формирования 50-70% монослоя в культуральную среду добавляли исследуемые препараты фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема) и следили за ростом клеточной культуры в течение 3 суток.
При использовании клеток линии миеломы человека, которая является суспензионной культурой, клетки рассевали в 96-луночный планшет в количестве 100 мкл на лунку, концентрация 2х105 клеток/мл; через 12-24 часа добавляли исследуемые препараты фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 от общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема смеси в лунке).
Действие фторированных производных 1,4-нафтохинона на клетки MCF-7 и RPMI 6228 в культуре и подавление их роста проводили с помощью теста, основанного на способности митохондриальных дегидрогеназ конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в формазан (МТТ-тест), который кристаллизуется внутри клетки. Так как у нежизнеспособных клеток ферменты не функционируют и отсутствуют кофакторы этого превращения, они не окрашиваются МТТ. Образовавшийся осадок формазана в жизнеспособных клетках растворяли в изопропаноле и его количество определяли спектрофотометрически по поглощению на длине волны λ=560 нм.
В качестве положительного контроля использовали клетки, которые выращивали в отсутствие фторированных производных 1,4-нафтохинона. Было установлено, что ДМСО в использованной концентрации (1%) заметного влияния на рост раковых клеток не оказывает. Кроме того, установлено, что исследуемые соединения не влияют на окраску клеток в МТТ-тесте, если они добавлены в лунки с клетками непосредственно перед проведением теста.
Для оценки относительной активности всех предлагаемых соединений в подавлении роста раковых клеток были исследованы зависимости количества живых клеток от концентрации этих соединений. В качестве примера на чертеже приведены данные для трех из исследованных соединений. Определение концентрации соединений (C50), при которой происходит подавление (ингибирование) роста клеток на половину (50%), проводили с помощью МТТ-теста. На чертеже приведены данные для соединения 1 (С-1; 2-трет-бутиламинопентафтор-1,4-нафтохинон), соединения 8 (С-8; 2,8-бис(н-бутиламино)-3,5,6,7-тетрафтор-1,4-нафтохинон) и соединения 16 (С-16; 2,3-диметокситетрафтор-1,4-нафтохинон). Количество живых клеток в контроле (инкубация клеток без соединений) принимали за 100%.
С помощью таких кривых определяли концентрацию соединения (С50), при которой происходит подавление (ингибирование) роста клеток наполовину. Данные по влиянию заявляемых соединений (ингибирование на 50%, С50) на рост раковых клеток миеломы человека (RPMI 6228) и аденокарциномы человека (MCF-7), а также контрольных клеток мышиных фибробластов линии LMTK после инкубации в течение 48 ч приведены в таблице 4.
Из таблицы 4 видно, что предлагаемые соединения подавляют рост раковых клеток миеломы (RPMI 6228) и аденокарциномы человека (MCF-7) в культуре при концентрациях 0,1-7,5 мкг/ мл. Большая часть новых фторированных производных 1,4-нафтохинона (соединения 1-7, 9, 13, 15-16) демонстрирует близкие значения С50 (0,1-2,5 мкг/мл) в случае двух типов раковых клеток (RPMI 6228 и MCF-7), в то время как соединения 8, 10 и 12 ингибируют рост этих клеток в более высоких концентрациях (4,0-7,5 мкг/мл), а соединение 11 проявляет существенное различие в ингибировании клеток линии RPMI 6228 (1 мкг/мл) и линии MCF-7 (6,7 мкг/мл).
Фторированные производные 1,4-нафтохинона являются ингибиторами Cdc25A и Cd25B фосфатаз, которые играют важную роль в регуляции пролиферации клеток и гиперэкспрессированы в различных раковых клетках человека. Поскольку модификация киназ должна вести к гибели клеток, фторированные производные 1,4-нафтохинона проявляют цитотоксичность (как и другие известные антираковые препараты) как по отношению к раковым, так и по отношению к нормальным соматическим клеткам млекопитающих. Однако фторированные 1,4-нафтохиноны в большей степени ингибируют именно раковые клетки, а не обычные клетки млекопитающих.
Из таблицы 4 также видно, что подавление роста клеток на 50% с помощью соединений 1, 2, 6 и 8 происходит при концентрациях в 1,8-5,6 раз более низких, чем клеток фибробластов. Есть соединения (5, 7 и 9), которые ингибируют рост раковых клеток двух типов (RPMI 6228 и MCF-7) примерно с одинаковой эффективностью, а подавление роста клеток фибробластов происходит только при концентрациях в 6,9-14 раз более высоких. В то же время два соединения (3 и 4), проявляя приблизительно одинаковый эффект на клетки линий RPMI 6228 и MCF-7 (С50=1,3-2,2 мкг/мл), при высокой концентрации (25 мкг/мл) всего лишь на 10-20% ингибируют рост клеток фибробластов, что свидетельствует о том, что они подавляют рост клеток фибробластов на 50% при концентрациях в более чем 11,4-19,2 раза более высоких, чем в случае раковых клеток. Некоторые соединения (10 и 12) ингибируют рост RPMI 6228 и MCF-7 раковых клеток при относительно высоких концентрациях (4,0-7,5 мкг/мл), но демонстрируют слабое подавление роста клеток фибробластов (на 30-35%) при их высокой концентрации (25 мкг/мл), что также может быть потенциальной основой для их возможного применения в антираковой терапии. Часть новых соединений (11, 13-16) демонстрирует очень сильное различие в действии на раковые клетки линий RPMI 6228 и MCF-7, ингибируя рост RPMI 6228 при концентрациях в 3,8-24 раза более низких, чем MCF-7. В связи с этим отношение величин С50 для клеток фибробластов и клеток раковых линий для этих соединений варьирует от 1 до 25. Полученные данные свидетельствуют о том, что некоторые новые фторированные производные 1,4-нафтохинона могут оказаться универсальными для подавления раковых клеток различного типа, в то время как другие могут быть более перспективными для специфического воздействия лишь на определенный тип из всего известного многообразия раковых клеток. Таким образом, предлагаемые новые фторированные производные 1,4-нафтохинона являются эффективными ингибиторами роста раковых клеток и являются потенциально перспективными для их использования в антираковой терапии.



| название | год | авторы | номер документа |
|---|---|---|---|
| ФТОРИРОВАННЫЕ ПРОИЗВОДНЫЕ 1,4-НАФТОХИНОНА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА В КУЛЬТУРЕ | 2010 |
|
RU2443678C1 |
| ФОСФОРСОДЕРЖАЩИЕ ФТОРИРОВАННЫЕ ПРОИЗВОДНЫЕ 1,4-НАФТОХИНОНА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА В КУЛЬТУРЕ | 2013 |
|
RU2535676C1 |
| АЛКИЛИРУЮЩИЕ ФТОРИРОВАННЫЕ ПРОИЗВОДНЫЕ 1,4-НАФТОХИНОНА, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА В КУЛЬТУРЕ | 2012 |
|
RU2499789C1 |
| ТЕРАПЕВТИЧЕСКИЕ ХИНОНЫ | 2005 |
|
RU2411229C2 |
| СОСТАВЫ, ОБЛАДАЮЩИЕ АНТИКАНЦЕРОГЕННЫМИ СВОЙСТВАМИ | 2006 |
|
RU2435580C2 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ АПОПТОЗ КЛЕТОК ЛЕЙКЕМИИ ЧЕЛОВЕКА (ВАРИАНТЫ) | 2007 |
|
RU2372919C2 |
| АНАЛОГИ АЗАЦИТИДИНА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2488591C2 |
| ПРОИЗВОДНЫЕ 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛА, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2536824C1 |
| АНАЛОГИ АЗАЦИТИДИНА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2487883C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ФТАЛИДА | 2005 |
|
RU2394569C2 |

Изобретение относится к средству, представляющему собой фторированные производные 1,4-нафтохинона общей формулы (I), обладающему цитотоксической активностью по отношению к раковым клеткам человека в культуре. Предложенные соединения могут найти применение в медицине как основа для разработки лекарственных форм препаратов, используемых для терапии злокачественных новообразований. В общей формуле (I)
1) R1=NHC(CH3)3, R2, R3=F; 2) R1=NHCH2CH2SCH3, R2, R3=F; 3) R1=N(СН2СН)2, R2, R3=F; 4) R1=N(CH2CH2)2O, R2, R3=F; 5) R1=NHCH2CH2CH2CH3, R2, R3=F; 6) R1=NHC6H5, R3=F; 7) R1=N(СН3)CH2CH2OH, R2, R3=F; 8) R1, R3=NHCH2CH2CH2CH3, R2=F; 9) R1=N(CH2CH2OH)2, R2, R3=F; 10) R1=NHC6H5, R2=СН3, R3=F; 11) R1=ОСН3, R2, R3=F; 12) R1=NH(CH2)2SS(CH2)2HN(2-пентафтор-1,4-нафтохинонил), R2, R3=F; 13) R1=NHC2H5, R2, R3=F; 14) R1=N+C5H5, R2=О-, R3=F; 15) R1=NHCH2CH2OH, R2, R3=F; 16) R1, R2=ОСН3, R3=F. 1 ил., 4 табл.
Средство, представляющее собой фторированные производные 1,4-нафтохинона общей формулы

где 1) R1=NHC(CH3)3, R2, R3=F; 2) R1=NHCH2CH2SCH3, R2, R3=F; 3) R1=N(СН2СН3)2, R2, R3=F; 4) R1=N(CH2CH2)2O, R2, R3=F; 5) R1=NHCH2CH2CН2CH3, R2, R3=F; 6) R1=NHC6H5, R2, R3=F; 7) R1-N(СН3)CH2CH2OH, R2, R3=F; 8) R1, R3=NHCH2CH2CH2CH3, R2=F; 9) R1=N(CH2CH2OH)2, R2, R3=F; 10) R1=NHC6H5, R2=СН3, R3=F; 11) R1=ОСН3, R2, R3=F; 12) R1=NH(CH2)2SS(CH2)2HN(2-пентафтор-1,4-нафтохинонил), R2, R3=F; 13) R1=NHC2H5, R2, R3=F; 14) R1=N+C5H5, R2=О-, R3=F; 15) R1=NHCH2CH2OH, R2, R3=F; 16) R1, R2=ОСН3, R3=F, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре.
| АХМЕТОВА Н.Е | |||
| и др | |||
| Ароматические фторпроизводные | |||
| XXXIV | |||
| Синтез и ультрафиолетовые и инфракрасные спектры полифторированных гидроксипроизводных нафталина | |||
| Журнал общей химии, 1968, 38(8), 1874-81 | |||
| ИНГИБИТОРЫ ФОСФАТАЗ cdc25 | 2001 |
|
RU2285521C2 |
| Способ получения моноэфиров полифторированных 1,3-диоксиароматических соединений | 1973 |
|
SU481592A1 |
Авторы
Даты
2010-04-27—Публикация
2008-08-11—Подача