УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Область техники
В соответствии с настоящим изобретением предлагается способ стерилизации фармацевтических препаратов, например, дисперсии мелких частиц или капель фармацевтически активного соединения с использованием технологий заключительной стерилизации под высоким давлением и изделий из данного соединения.
Уровень техники
Количество органических соединений в рецептурных формах, разработанных для лечебно-терапевтических или диагностических воздействий, которые слабо растворяются или не растворяются в водных растворах, постоянно возрастает. Данные лекарственные средства представляют проблемы для их введения по путям введения, обычно используемым медицинским персоналом. Одним из возможных решений данной проблемы является получение мелких частиц нерастворимого потенциального лекарственного средства путем приготовления из них дисперсий микро- и наночастиц. Преимущества, получаемые от данной рецептуры, могут включать в себя более высокую нагрузку, меньшую токсичность, повышенную степень предельной растворимости и/или растворения лекарственного средства, повышенную эффективность и повышенную стабильность лекарственного средства.
Таким образом, лекарственные средства, которые прежде были непригодны для приготовления рецептуры в системе на водной основе, можно сделать пригодными для введения разными путями. Препараты дисперсий мелких частиц водонерастворимых лекарственных средств можно вводить внутривенным, оральным, пульмональным, местным, интратекальным, офтальмическим, назальным, буккальным, ректальным, вагинальным и трансдермальным путями. Оптимальный диапазон размеров для данных дисперсий обычно зависит от конкретного пути, характеристик частиц и других факторов, например, при внутривенном введении желательно, чтобы размер частиц был меньше, чем приблизительно 7 мкм. Частицы должны быть в данном диапазоне размеров и неагрегированными для безопасного прохода по капиллярам, не вызывая эмболии (Alien et al., 1987; Davis and Taube, 1978; Schroeder et al., 1978; Yokel et al., 1981).
В зависимости от пути введения и других факторов данные дисперсии мелких частиц должны удовлетворять некоторым требованиям стерильности. Одним из полезных способов стерилизации является обычное заключительное автоклавирование дисперсий мелких частиц при 121°C. Хорошо известно, что фармацевтические суспензии предохраняют от роста частиц и/или агрегации во время хранения при нормальных температурах присутствием поверхностно-активных веществ (ПАВ) в рецептурах. Однако даже в присутствии данных стабилизирующих поверхностно-активных вещест суспензии из мелких частиц часто в какой-то степени термочувствительны и не могут выдерживать заключительное автоклавирование. Фармацевтически активный ингредиент, поверхностно-активные вещества и агрегаты лекарственное средство/поверхностно-активное вещество должны оставаться как физически, так и химически стабильными во время всего стерилизационного цикла при 121°C. Как известно, химическая чувствительность дисперсий мелких частиц к заключительному автоклавированию является функцией как времени стерилизации, так и температуры. Способы уменьшения химической нестабильности обычно предусматривают способы высокотемпературной кратковременной стерилизации. В данном случае консервация термолабильных препаратов и деструкция микроорганизмов основаны на различии скоростей, соответственно, химического распада и инактивации. Значительной проблемой данного процесса является обеспечение достаточно быстрой теплопередачи, чтобы равномерная температура была по всему объему изделия во время очень короткого времени воздействия.
Очень сложно также обеспечить физическую стабильность агрегатов лекарственное средство/поверхностно-активное вещество. Мелкие частицы часто агрегируются, растут и/или разлагаются под действием тепла, из-за чего конечная дисперсия становится непригодной для использования. Кроме того, агрегаты поверхностно-активного вещества могут необратимо отделяться от фармацевтически активного соединения. Например, один механизм агрегирования или коалесценции дисперсий из твердых субмикронных частиц может быть непосредственно связан с осаждением стабилизирующего поверхностно-активного вещества в процессе стерилизации при температурах выше точки помутнения поверхностно-активного вещества. Термин «точка помутнения» относится к разделению изотропного раствора поверхностно-активных веществ на одну фазу с высоким содержанием поверхностно-активного вещества и одну фазу с низким содержанием поверхностно-активного вещества. При данных температурах поверхностно-активное вещество часто отделяется от частицы, что вызывает агрегирование и/или рост незащищенных частиц. Поэтому в ряде патентов (например, в патентах США №5298262, 5346702, 5470583 и 5336507) предлагается использование ионных и неионных модификаторов точки помутнения для стабилизации суспензии частиц при автоклавировании. Данные модификаторы повышают точку помутнения поверхностно-активного вещества выше 121°C, что предотвращает отделение поверхностно-активного вещества от частицы лекарственного средства и в результате стабилизируют частицы от роста во время заключительной стерилизации.
В патенте США №6267989 показано также, что наиболее важным для сведения к минимуму роста и нестабильности при автоклавировании является оптимальный диапазон размеров. В патенте №6267989 сообщается, что максимальная стабильность проявляется, когда, по меньшей мере, 50% частиц лекарственного средства, стабилизированных поверхностно-активным веществом, имеют средневесовой размер частиц 150-350 нм.
Поэтому сохраняется потребность в разработке новых и усовершенствованных способов заключительной стерилизации дисперсий мелких частиц в области фармацевтики, и настоящее изобретение направлено на удовлетворение данной потребности.
Системы и растворы, отличные от дисперсий частиц, часто требуют стерилизации перед применением. Примеры включают растворенные фармацевтические растворы, растворы для почечного применения (например, перитонеального диализа) и другие формы фармацевтических препаратов, таких как липидные эмульсии. Другие примеры включают медицинские устройства одноразового пользования, например, пакеты с фармацевтическими препаратами (часто изготовленными из пластифицированного PVC или других пластиков), пакеты с кровью, диализаторы, системы для использования в автоматизированных устройствах (например, устройствах сепарации крови, инфузионных насосах и т.д.). Данные системы могут быть чувствительными к традиционным технологиям стерилизации, например, стерилизации гамма-излучением, стерилизации ETO (этиленоксидом) или автоклавированию. Например, содержащие глюкозу растворы подвержены разложению глюкозы или агрегированию в результате стерилизации по традиционным технологиям. Поэтому существует также потребность в создании усовершенствованных технологий стерилизации, которые обеспечивают надлежащую стерилизацию с небольшим, вплоть до нулевого, риском для стерилизуемой системы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением предлагается способ стерилизации систем. Данные системы могут представлять собой, но без ограничения нижеследующим, композиции, например дисперсии частиц, и устройства, например контейнеры, которые могут содержать водные растворы, например, фармацевтические препараты. Способ обладает преимуществом обеспечения стерилизации без существенного снижения эффективности данных систем. Изобретение дополнительно обеспечивает стерилизованные фармацевтические препараты. К подходящим контейнерам относится любой контейнер, который стабилен в условиях настоящего способа, включая устройства доставки лекарственных средств, содержащие медицинские растворы.
Способ включает в себя подвод тепловой энергии к системе и поддерживания системы под давлением более 0,25 МПа в течение достаточного периода времени, чтобы сделать систему стерильной. В предпочтительном варианте система будет достигать температуры свыше 70°C. Этапы подвода энергии и давления выполняют одновременно в течение периода времени, по меньшей мере, достаточного для стерилизации системы. Затем системе можно предоставить возможность возврата к температуре и давлению окружающей среды для использования.
Способ можно применять к пустым контейнерам или контейнерам, содержащим любой из широкого множества растворов, включая растворы для парентерального введения, растворы для острого или хронического гемодиализа, гемофильтрационный или гемодиафильтрационный растворы для острого или хронического перитонеального диализа, амбулаторного перитонеального диализа и автоматизированного перитонеального диализа.
Способ особенно полезен при стерилизации растворов, которые содержат глюкозу. Низкая температура, используемая для стерилизации, сводит к минимуму разложение глюкозы, который происходит при более высоких температурах. Таким образом, способ можно использовать для стерилизации растворов, содержащих глюкозу, чтобы глюкоза сохранялась, по существу, без разложения. В предпочтительном варианте более приблизительно 75% глюкозы не разлагается, в более предпочтительном варианте не разлагается более приблизительно 80% глюкозы, еще более предпочтительными являются стерилизованные растворы, в которых не разлагается более приблизительно 85% или более приблизительно 90% или, даже предпочтительнее более приблизительно 95% глюкозы.
Эти и другие аспекты и признаки настоящего изобретения обсуждаются со ссылками на прилагаемые чертежи и описание.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 - мицелла;
фиг.2 - обратная мицелла;
фиг.3 - ламеллярная фаза;
фиг.4 - гексагональная фаза;
фиг.5 - кубическая фаза;
фиг.6 - график зависимости давления и температуры от времени;
фиг.7 - кривая распределения размеров частиц (пример 1);
фиг.8 - кривая распределения размеров частиц контрольного образца (пример 1);
фиг.9 - стерилизационный цикл высокого давления (пример 1);
фиг.10 - кривая распределения размеров частиц;
фиг.11 - контейнер для текучих материалов;
фиг.12 - многокамерный контейнер со вскрываемым изолирующим слоем;
фиг.13 - однослойная пленка;
фиг.14 - двухслойная пленка;
фиг.15 - трехслойная пленка;
фиг.16 - трехслойная пленка;
фиг.17 - четырехслойная пленка;
фиг.18 - четырехслойная пленка;
фиг.19 - пятислойная пленка;
фиг.20 - шестислойная пленка;
фиг.21 - шестислойная пленка;
фиг.22 - семислойная пленка;
фиг.23 - шприц;
фиг.24 - картридж для устройства введения лекарственного средства; и
фиг.25 - устройства для ввода жидкости.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Хотя осуществление настоящего изобретения возможно в многочисленных различных вариантах, на чертежах изображены и ниже подробно описаны конкретные варианты осуществления настоящего изобретения в предположении, что настоящее описание следует считать иллюстрацией принципов изобретения и нельзя рассматривать как предназначенное для ограничения изобретения конкретными представленными вариантами осуществления.
В соответствии с настоящим изобретением предлагается способ стерилизации системы без существенного снижения пригодности, стабильности и/или эффективности препарата. Согласно изобретению предлагается способ стерилизации динамической системы (т.е. системы, способной к переходу из стабильного состояния в нестабильное состояния), при этом систему подвергают воздействию высокого давления в течение времени, достаточного для стерилизации системы, не вызывая перехода системы из стабильного состояния в нестабильное состояние.
Для целей настоящего описания термин «стерилизация» и его варианты должен означать уничтожение бактерий, вирусов, простейших одноклеточных организмов или других биологических организмов или борьбу с ними в системе, чтобы система обеспечивала снижение риска инфекции при использовании млекопитающими, предпочтительно человеком. Предпочтительные способы по настоящему изобретению должны стерилизовать систему до момента, когда все или почти все биологические организмы убиты или сделаны неспособными к воспроизводству.
В предпочтительном варианте способ используют для стерилизации фармацевтической системы. Фармацевтический препарат может быть приготовлен при помощи многочисленных технологий, известных в данной области техники, и тех, которые еще будут разработаны. Как правило, способ обеспечивает проведение стерилизации системы под высоким давлением. Способ является целесообразным для стерилизации под высоким давлением дисперсий мелких частиц. Согласно изобретению дополнительно обеспечиваются стерилизованные фармацевтические дисперсии.
Технологии стерилизации под высоким давлением согласно настоящему изобретению обеспечивают стерилизацию дисперсий мелких частиц без сопутствующего существенного распада фармацевтически активного соединения, разложения поверхностно-активных веществ или изменения скопления лекарственное средство/поверхностно-активное вещество. Кроме того, теплота передается мгновенно по всей дисперсии по причине быстрого адиабатического нагревания препарата на этапе сжатия. Предполагается, что технологии стерилизации под высоким давлением пригодны для применения ко многим дисперсиям мелких частиц, содержащим различные фармацевтические соединения в контейнерах ряда конфигураций.
В целом, способ обеспечивает проведение стерилизации фармацевтического препарата под высоким давлением. Фармацевтический препарат может быть приготовлен при помощи многочисленных технологий, известных в данной области техники, и тех, которые еще будут разработаны. Технологии стерилизации под высоким давлением хорошо подходят для стерилизации препаратов во многих различных формах, включая фармацевтически эффективное соединение в сухой или порошковой форме, жидкой форме, газообразной форме, или диспергированное до мелких частиц или капель в водной или органической средах. В предпочтительном варианте подлежащая стерилизации система будет содержать некоторое количество воды. Как доказано, присутствие воды обеспечивает особенно эффективное снижение концентрации активных микроорганизмов. Широко известно, что для сообщения фармацевтически активным соединениям устойчивости к агрегированию и изменению размеров используют поверхностно-активные вещества. Поверхностно-активные вещества можно связывать с фармацевтически активным соединением любым из многих способов, широко известных в данной области. Технологии стерилизации под высоким давлением в соответствии с настоящим изобретением обеспечивают стерилизацию, не вызывая распада фармацевтически активного соединения или не вызывая значительного отщепления поверхностно-активных веществ от фармацевтически активного соединения. Способ и изделия по настоящему изобретению не нуждаются в применении химических модификаторов точки помутнения. Термин «точка помутнения» относится к усилению мутности фармацевтического препарата, когда изменение физической характеристики препарата, например, изменение температуры или уровня pH, или другой физической характеристики вынуждает поверхностно-активное вещество отщепляться от фармацевтически активного соединения.
Предполагается, что технологии стерилизации под высоким давлением пригодны к применению со многими органическими соединениями.
I. Фармацевтически активные соединения
Способ согласно настоящему изобретению пригоден для стерилизации фармацевтических препаратов в общем. В предпочтительных способах настоящего изобретения фармацевтически активный ингредиент будет таким, что он ассоциируется с диспергированной гидрофобной областью (например, гидрофобной фазой агрегированного поверхностно-активного вещества, циклодекстриновой полости, капли масла) в водном растворе. Фармацевтически активные соединения могут быть выбраны из терапевтических средств, средств для лечения почек, диагностических средств, косметических средств, пищевых добавок и пестицидов.
Фармацевтически активные средства могут быть выбраны из множества известных классов, например, но без ограничения нижеследующим: анальгетики, анестетики, аналептики, адренергические средства, адреноблокирующие средства, адренолитики, адренокортикоиды, адреномиметики, антихолинергические средства, антихолинэстеразные средства, противосудорожные средства, алкилирующие средства, алкалоиды, аллостерические ингибиторы, анаболические стероиды, препараты для снижения аппетита, антацидные средства, антидиарейные средства, антидоты, антифолические средства, антипиретики, противоревматические средства, психотерапевтические средства, нервноблокирующие средства, противовоспалительные средства, противоглистные средства, антиаритмические средства, антибиотики, антикоагулянты, антидепрессанты, противодиабетические средства, противоэпилептические средства, противогрибковые средства, антигистаминные средства, антигипертензивные средства, мускариновые холиноблокаторы, противомикобактериальные средства, противомалярийные средства, антисептики, антибластомные средства, противопротозойные средства, иммунодепрессанты, иммуностимуляторы, антитиреоидные средства, противовирусные средства, анксиолитические седативные средства, вяжущие средства, бета-адреноблокаторы, рентгеноконтрастные вещества, кортикостероиды, противокашлевые средства, диагностические средства, диагностические визуализирующие средства, мочегонные средства, допаминергические средства, кровоостанавливающие средства, гематологические средства, модификаторы гемоглобина, гормоны, снотворные средства, иммунологические средства, антигиперлипидемические или другие средства регулирования липидного обмена, мускариновые холинорецепторы, миорелаксанты, парасимпатомиметические средства, паратиреоидный кальцитонин, простагландины, радиофармацевтические средства, седативные средства, половые гормоны, противоаллергические средства, раздражители, симпатомиметические средства, тиреоидные средства, сосудорасширяющие средства, вакцины, витамины и ксантины. Антибластомные или противораковые средства, включая, но без ограничения нижеследующим, паклитаксел и производные соединения и другие антибластомные средства, выбранные из группы, состоящей из алкалоидов, антиметаболитов, ингибиторов ферментов, алкилирующих средств и антибиотиков. Лечебное средство может также представлять собой биопрепарат, который содержит, но без ограничения нижеследующим, белки, полипептиды, углеводы, полинуклеотиды и нуклеиновые кислоты. Белок может представлять собой антитело, которое может быть поликлональным или моноклональным.
Диагностические средства включают средства для рентгенологических исследований и рентгеноконтрастные вещества. Примеры средств для рентгенологических исследований включают в себя WIN-8883 (этил-3,5-диацетамидо-2,4,6-трийодбензоат), известный так же, как сложный этиловый эфир диатразоевой кислоты (EEDA), WIN 67722, т.е. (6-этокси-6-оксогексил-3,5-бис(ацетамидо)-2,4,6-трийодбензоат; этил-2-(3,5-бис(ацетамидо)-2,4,6-трийодбензоилокси)бутират (WIN 16318); этилдиатризоксиацетат (WIN 12901); этил-2-(3,5-бис(ацетамидо)-2,4,6-трийодбензоилокси)пропионат (WIN 16923); N-этил-2-(3,5-бис(ацетамидо)-2,4,6-трийодбензоилоксиацетамид (WIN 65312); изопропил-2-(3,5-бис(ацетамидо)-2,4,6-трийодбензоилокси)ацетамид (WIN 12855); диэтил-2-(3,5-бис(ацетамидо)-2,4,6-трийодбензоилоксималонат (WIN 67721); этил-2-(3,5-бис(ацетамидо)-2,4,6-трийодбензоилокси)фенилацетат (WIN 67585); [[3,5-бис(ацетиламино)-2,4,5-трийодбензоил]окси]бис(1-метил)эфир пропандионовой кислоты (WIN 68165); и 3,5-бис(ацетиламино)-2,4,6-трийод-4-(этил-3-этокси-2-бутеноат)эфир бензойной кислоты (WIN 68209). Предпочтительные контрастные вещества включают в себя такие вещества, которые, по расчетам, относительно быстро разлагаются в физиологических условиях, что сводит к минимуму любую воспалительную реакцию, обусловленную частицами. Разложение может происходить в результате ферментативного гидролиза, солюбилизации карбоновых кислот при физиологическом уровне pH или действия других механизмов. Следовательно, предпочтительными могут быть слаборастворимые йодированные карбоновые кислоты, такие как йодипамид, диатризойная кислота и метризойная кислота, вместе с гидролитически нестабильными йодированными продуктами, например, WIN 67721, WIN 12901, WIN 68165 и WIN 68209 или другие.
Другие рентгеноконтрастные вещества включают в себя, но без ограничения нижеследующим, препараты в форме частиц средств для визуализации с помощью ядерного магнитного резонанса, например, хелаты гадолиния или другие парамагнитные контрастные вещества. Примерами данных соединений являются гадопентетат димеглюмин (Magnevist®) и гадотеридол (Prohance®).
Описание данных классов терапевтических средств и диагностических средств и перечни продуктов каждого класса можно найти в публикации Martindale, The Extra Pharmacopoeia, Twenty-ninth Edition, The Pharmaceutical Press, London, 1989, которая включена в настоящее описание путем ссылки и является его частью. Терапевтические средства и диагностические средства имеются в продаже и/или могут быть приготовлены методами, известными в данной области.
Средства для лечения почек включают в себя растворы для непрерывного амбулаторного диализа, автоматизированного перитонеального диализа и гемодиализа.
Косметическое средство представляет собой любой активный ингредиент, способный к косметическому воздействию. Примерами данных активных ингредиентов могут быть, inter alia, мягчители, увлажнители, средства замедления образования свободных радикалов, противовоспалительные средства, витамины, депигментирующие средства, средства от угревой сыпи, противосеборейные средства, кератолитические средства, средства для похудения, тональные средства для кожи и солнцезащитные средства и, в частности, линолевая кислота, ретинол, ретиноевая кислота, сложные алкиловые эфиры аскорбиновой кислоты, полиненасыщенные жирные кислоты, сложные эфиры никотиновой кислоты, токоферол никотинат, неомыляемые вещества риса, соевых бобов или ши, керамиды, оксикислоты, например, гликолевая кислота, производные соединения селена, антиоксиданты, бета-каротин, гамма-оризанол и стеарилглицерат. Косметические средства имеются в продаже и/или могут быть приготовлены методами, известными в данной области.
Примерами пищевых добавок, предполагаемых для использования при практической реализации настоящего изобретения, являются, но без ограничения нижеследующим, белки, углеводы, водорастворимые витамины (например, витамин C, витамины группы B и т.п.), жирорастворимые витамины (например, витамины A, D, E, K и т.п.) и растительные экстракты. Пищевые добавки имеются в продаже и/или могут быть приготовлены методами, известными в данной области.
Следует понимать, что термин пестицид включает в себя гербициды, инсектициды, акарициды, нематоциды, средства против эктопаразитов и фунгициды. Примеры классов соединений, к которым могут принадлежать пестициды по настоящему изобретению, включают в себя мочевины, триазины, триазолы, карбаматы, сложные эфиры фосфорной кислоты, динитроанилины, морфолины, ацилаланины, пиретроиды, сложные эфиры бензиловой кислоты, простые дифениловые эфиры и полициклические галоидзамещенные углеводороды. Конкретные примеры пестицидов в каждом из данных классов перечислены в руководстве Pesticide Manual, 9th Edition, British Crop Protection Council. Пестициды имеются в продаже и/или могут быть приготовлены методами, известными в данной области.
В предпочтительном варианте фармацевтически активные соединения являются слабо растворимыми в воде. Под «слабой растворимостью в воде» понимается растворимость соединения в воде ниже приблизительно 10 мг/мл и, предпочтительно, ниже 1 мг/мл. Данные слаборастворимые в воде средства являются наиболее подходящими для препаратов в форме водных суспензий, поскольку варианты создания рецептур данных средств в водных средах ограничены.
Настоящее изобретение можно также практически осуществить с водорастворимыми фармацевтически активными соединениями в некоторых случаях посредством включения данных соединений в твердую гидрофобную диспергированную фазу (например, в полилактат-полигликолятном сополимере или твердых липидных наночастицах), или инкапсулирования данных соединений в окружающий агрегат поверхностно-активного вещества, который является непроницаемым для фармацевтического соединения. Примеры агрегатов поверхностно-активного вещества включают в себя, но без ограничения, везикулы и мицеллы. Примеры водорастворимых фармацевтических средств включают в себя, но без ограничения нижеследующим, простые органические соединения, белки, пептиды, нуклеотиды, олигонуклеотиды и углеводы.
II. Размер частиц дисперсии и пути введения
Когда фармацевтические средства по настоящему изобретению находятся в форме частиц (т.е. не растворены в растворителе), частицы будут иметь средний эффективный размер частиц, как правило, меньше приблизительно 100 мкм, при измерении с помощью способов динамического светорассеяния, например, фотокорреляционной спектроскопии, дифракции лазерного излучения, малоуглового рассеяния лазерного излучения (LALLS), среднеуглового рассеяния лазерного излучения (MALLS), теневых методов (например, методом Коутлера), реологии или микроскопии (оптической или электронной). Однако частицы могут быть приготовлены с размерами в широком диапазоне, например, от приблизительно 100 мкм до приблизительно 10 нм, от приблизительно 10 мкм до приблизительно 10 нм, от приблизительно 2 мкм до приблизительно 10 нм, от приблизительно 1 мкм до приблизительно 10 нм, от приблизительно 400 нм до приблизительно 50 нм, от приблизительно 200 нм до приблизительно 50 нм или в любом диапазоне или комбинации внутри упомянутых диапазонов. Предпочтительный средний эффективный размер частиц зависит от таких факторов, как предполагаемый путь введения, рецептуры, растворимости, токсичности и биодоступности соединения.
Чтобы частицы были пригодными для парентерального введения, средний эффективный размер частиц должен быть предпочтительно меньше, чем приблизительно 7 мкм, и предпочтительнее меньше, чем приблизительно 2 мкм, или в любом диапазоне или комбинации внутри упомянутых диапазонов. Парентеральное введение включает в себя внутривенную, внутриартериальную, интратекальную, интраперитонеальную, внутриглазную, внутрисуставную, интрадуральную, внутрижелудочковую, интраперикардиальную, внутримышечную, интрадермальную или подкожную инъекцию.
Размеры частиц для лекарственных форм для орального применения могут превосходить 2 мкм. Размеры частиц могут изменяться в диапазоне до приблизительно 100 мкм, при условии, что частицы обладают достаточной биодоступностью и другими характеристиками дозированных форм для орального применения. Лекарственные формы для орального применения включают в себя таблетки, капсулы, таблетки в виде капсулы, капсулы с мягким и плотным гелем или другой носитель для введения лекарственного средства оральным путем.
Кроме того, настоящее изобретение применимо для частиц фармацевтически активного соединения в форме, пригодной для пульмонального введения. Размеры частиц для дозированных форм для пульмонального применения могут превосходить 500 нм и обычно меньше, чем приблизительно 10 мкм. Частицы в суспензии можно аэрозолировать и вводить с помощью распылителя для пульмонального введения. В качестве альтернативы, частицы можно вводить в виде сухого порошка с помощью ингалятора для сухого порошка после удаления жидкой фазы из суспензии, или сухой порошок можно ресуспендировать в неводном пропелленте для введения дозирующим ингалятором. Подходящим пропеллентом является, например, гидрофторуглерод (HFC) типа HFC-134a (1,1,1,2-тетрафторэтан) и HFC-227ea (1,1,1,2,3,3,3-гептафторпропан). В отличие от хлорфторуглеродов (CFC) HFC меньше или совсем не разрушают озоновый слой.
Частицы и капли органических соединений с размерами в вышеприведенных диапазонах далее совокупно именуются мелкими частицами.
Дозированные формы для введения другими путями, например, назальным, местным, глазным, сбуккальным, ректальным, вагинальным, трансдермальным и т.п. также можно готовить из частиц, выполненных в соответствии с настоящим изобретением.
В соответствии с настоящим изобретением можно стерилизовать другие формы растворов. Примеры данных растворов включают в себя фармацевтические препараты для парентерального введения и растворы для почечного диализа, например, растворы для гемодиализа и перитонеального диализа.
III. Препарат из дисперсий мелких частиц
Существует много технологий для приготовления фармацевтических препаратов из мелких частиц фармацевтически активных соединений. Рассмотренные ниже технологии стерилизации пригодны для стерилизации данных фармацевтических препаратов. Ниже приведено краткое описание характерных, но не исчерпывающих примеров методологий для создания мелких частиц фармацевтически активных соединений.
A. Технологии подвода энергии для формирования дисперсий мелких частиц
Способ подготовки дисперсий мелких частиц с помощью технологий подвода энергии обычно содержит этап, состоящий в том, что фармацевтически активное соединение, которое иногда следует называть лекарственным средством, вводят в объеме в подходящий носитель, например, воду или раствор на водной основе, содержащий, по меньшей мере, одно нижеописанное поверхностно-активное вещество, или другую жидкость, в которой фармацевтическое соединение несущественно растворимо для формирования предсуспензии. К предсуспензии подводят энергию для формирования дисперсии частиц. Энергию подводят механическим растиранием, размолом на Бисерной мельнице, размолом на шаровой мельнице, размолом на молотковой мельнице, размолом в струйной мельнице или мокрым измельчением. Данные технологии описаны в патенте США №5145684, который включен в настоящее описание путем отсылки и является его частью.
Технологии подвода энергии дополнительно включают воздействие на предсуспензию больших усилий сдвига, включая кавитацию, сдвиговые или ударные усилия, с использованием микрофлюидизатора. В соответствии с настоящим изобретением дополнительно предлагается подвод энергии в предсуспензию с использованием плунжерного гомогенизатора или противоточного гомогенизатора типа описанных в патенте США №5091188, который включен в настоящее описание путем ссылки и является его частью. Подходящие плунжерные гомогенизаторы продаются под названием EMULSIFLEX фирмой Avestm и French Pressure Cells фирмой Spectronic Instruments. Производителем подходящих микрофлюидизаторов является фирма Microfluidics Corp.
Этап подвода энергии можно также выполнять с использованием технологий обработки ультразвуком. Этап обработки ультразвуком можно выполнять с помощью любого подходящего устройства для обработки ультразвуком, например, Branson Model S-450A или Cole-Panner 500/750 Watt Model. Данные устройства широко известны в промышленности. Обычно устройство для обработки ультразвуком содержит ультразвуковой рупорный излучатель или зонд, который вставляют в предсуспензию для излучения энергии звуковых волн в раствор. Устройство для обработки ультразвуком в предпочтительном варианте осуществления изобретения применяют на частоте от приблизительно 1 кГц до приблизительно 90 кГц и в более предпочтительном варианте от приблизительно 20 кГц до приблизительно 40 кГц или в любом диапазоне или комбинации внутри упомянутых диапазонов. Размеры зонда могут изменяться и, предпочтительно, имеют определенные значения, например, 1/2 дюйма или 1/4 дюйма или что-то подобное.
Независимо от применяемой технологии подвода энергии дисперсия мелких частиц должна удовлетворять соответствующим требованиям по обеспечению стерильности перед использованием. Стерилизацию можно выполнять с использованием нижеописанных технологий стерилизации под высоким давлением.
B. Способы осаждения для приготовления дисперсий субмикронных частиц
Дисперсии мелких частиц можно также приготавливать посредством широко известных технологий осаждения. Ниже представлены технологии осаждения, используемые для получения дисперсий субмикронных твердых частиц.
Способы микроосаждения
Один пример способа микроосаждения предложен в патенте США №5780062, который включен в настоящее описание путем ссылки и является его частью. В патенте США №5780062 приведено описание способа осаждения органического соединения, включающего следующие этапы: (I) растворяют органическое соединение в смешивающемся с водой первом растворителе; (II) приготавливают раствор полимера и амфифильного вещества в водном втором растворителе, при этом органическое соединение, по существу, не растворимо в данном втором растворителе, вследствие чего образуется комплекс полимер/амфифильное вещество; и (III) смешивают растворы с этапов (I) и (II) так, чтобы вызвать осаждение агрегата органического соединения и комплекса полимер/амфифильное вещество.
Другой пример подходящего способа осаждения описан в совместно рассматриваемых и принадлежащих общему владельцу заявках на патенты США №09/874499, 09/874799, 09/874637 и 10/021692, которые включены в настоящее описание путем ссылки и являются его частью. Описанные способы включают следующие этапы: (1) растворяют органическое соединение в смешивающемся с водой первом органическом растворителе для создания первого раствора; (2) смешивают первый раствор со вторым растворителем или водой для осаждения органического соединения, чтобы создать предсуспензию; и (3) подводят энергию к предсуспензии в форме смешивания с большим усилием сдвига или подвода тепла для обеспечения дисперсии мелких частиц. По меньшей мере, один нижеупомянутый возможный модификатор поверхности может быть введен в первый органический растворитель или второй водный раствор.
Способы эмульсионного осаждения
Одна подходящая технология осаждения эмульсии описана в совместно рассматриваемой и принадлежащей общему владельцу заявке на патент США №09/964273, которая включена в настоящее описание путем ссылки и является его частью. При данном подходе способ включает следующие этапы: (1) обеспечивают многофазную систему, содержащую органическую фазу и водную фазу, при этом органическая фаза содержит фармацевтически активное соединение; и (2) обрабатывают систему ультразвуком для выпаривания части органической фазы, чтобы вызвать осаждение соединения в водной фазе для формирования дисперсии мелких частиц. Этап обеспечения многофазной системы содержит следующие этапы: (1) смешивают смешивающийся с водой растворитель с фармацевтически активным соединением для образования органического раствора, (2) приготавливают раствор на водной основе с, по меньшей мере, одним поверхностно-активным соединением и (3) смешивают органический раствор с водным раствором для формирования многофазной системы. Этап смешения органической фазы и водной фазы может включать в себя применение плунжерных гомогенизаторов, коллоидных мельниц, высокоскоростного смесительного оборудования, экструзионного оборудования, ручного оборудования для активации или встряхивания, микрофлюидизатора или другого оборудования или технологий для обеспечения режима с большими усилиями сдвига. Необработанная эмульсия будет содержать масляные капли в воде с размерами приблизительно меньше 1 мкм в диаметре. Необработанную эмульсию обрабатывают ультразвуком для образования более тонкодисперсной эмульсии и, в конечном счете, обеспечения дисперсии мелких частиц.
Другой подход к приготовлению дисперсии мелких частиц описан в совместно рассматриваемой и принадлежащей общему владельцу заявке на патент США №10/183035, которая включена в настоящее описание путем ссылки и является его частью. Способ включает следующие этапы: (1) обеспечивают необработанную дисперсию многофазной системы, содержащей органическую фазу и водную фазу, при этом органическая фаза содержит фармацевтически активное соединение; (2) обеспечивают подвод энергии к необработанной дисперсии для формирования тонкой дисперсии; (3) замораживают тонкую дисперсию и (4) лиофилизируют тонкую дисперсию для получения мелких частиц фармацевтического соединения. Мелкие частицы можно стерилизовать с помощью нижеописанных технологий, или мелкие частицы могут быть восстановлены в водной среде и стерилизованы.
Этап обеспечения многофазной системы содержит следующие этапы: (1) смешивают смешивающийся с водой растворитель с фармацевтически активным соединением для образования органического раствора, (2) приготавливают раствор на водной основе с, по меньшей мере, одним поверхностно-активным соединением и (3) смешивают органический раствор с водным раствором для формирования многофазной системы. Этап смешения органической фазы и водной фазы может включать в себя применение плунжерных гомогенизаторов, коллоидных мельниц, высокоскоростного смесительного оборудования, экструзионного оборудования, ручного оборудования для активации или встряхивания, микрофлюидизатора или другого оборудования или технологий для обеспечения режима с большими усилиями сдвига.
Осаждение растворителем-осадителем
Дисперсии мелких частиц можно приготовить с использованием технологий осаждения растворителем-осадителем, описанных в патентах США №5118528 и 5100591, которые включены в настоящее описание путем ссылки и являются его частью. Способ включает следующие этапы: (1) готовят жидкую фазу биологически активного вещества в растворителе или смеси растворителей, к которой может быть добавлено, по меньшей мере, одно поверхностно-активное вещество; (2) готовят вторую жидкую фазу из осадителя или смеси осадителей, при этом осадитель способен смешиваться с растворителем или смесью растворителей вещества; (3) соединяют растворы (1) и (2) при перемешивании и (4) удаляют нежелательные растворители для образования дисперсии мелких частиц.
Осаждение инверсией фаз
Дисперсии мелких частиц можно создавать с использованием осаждения с инверсией фаз, как предлагается в патентах США №6235224, 6143211 и заявке на патент США №2001/0042932, которые, каждый(ая), включены в настоящее описание путем ссылки и являются его частью. Термин инверсия фаз используют для описания физических явлений, посредством которых полимер, растворенный в системе растворителей диспергирующей среды, преобразуется в твердотельную макромолекулярную сетчатую структуру, в которой полимер находится в непрерывной фазе. Один из способов вызова инверсии фазы состоит в добавлении осадителя в диспергирующую среду. Полимер проходит переход из однофазной в нестабильную двухфазную смесь: из обогащенной полимером и обедненной полимером фракций. Мицеллярные капли осадителя в обогащенной полимером фракции действуют как центры зародышеобразования и становятся покрытыми полимером. В патенте США №6235224 показано, что инверсия фаз растворов полимеров в некоторых условиях может привести к спонтанному образованию дискретных микрочастиц, включая наночастицы. Патент США №6235224 содержит описания растворения или дисперсии полимера в растворителе. Фармацевтическое средство также растворяют или диспергируют в растворителе. Полимер, средство и растворитель образуют в совокупности смесь однородной фазы, при этом растворитель находится в однородной фазе. Затем смесь вводят с, по меньшей мере, десятикратным избытком смешивающегося осадителя, чтобы вызвать спонтанное образование микроинкапсулированных микрочастиц средства со средним размером частиц от 10 нм до 10 мкм. Размер частиц зависит от объемного отношения растворитель:осадитель, концентрации полимера, вязкости раствора полимер-растворитель, молекулярной массы полимера и характеристик пары растворитель-осадитель.
Осаждение изменением pH
Дисперсии мелких частиц можно создавать с помощью технологий осаждения изменением pH. Данные технологии обычно включают этап, состоящий в том, что растворяют лекарственное средство в растворе с pH, при котором лекарственное средство является растворимым, после чего следует этап, состоящий в том, что изменяют pH до уровня, при котором лекарственное средство больше не растворимо. Уровень pH может быть кислотным или основным в зависимости от конкретного фармацевтического соединения. Затем раствор нейтрализуют для образования дисперсии мелких частиц. Один подходящий способ осаждения изменением pH предложен в патенте США №5665331, который включен в настоящее описание путем ссылки и является его частью. Способ включает этап, состоящий в том, что растворяют фармацевтическое средство совместно с модификатором роста кристаллов (CGM) в щелочном растворе и затем нейтрализуют раствор кислотой в присутствии подходящего модифицирующего поверхность поверхностно-активного вещества или веществ для образования дисперсии мелких частиц фармацевтического средства. За этапом осаждения могут следовать этапы диафильтрации и очистки дисперсии с последующим доведением концентрации дисперсии до требуемого уровня.
Другие примеры способов осаждения изменением pH описаны в патентах США №5716642, 5662883, 5560932 и 4608278, которые включены в настоящее описание путем ссылки и являются его частью.
Способ осаждения вливанием
Подходящие технологии осаждения вливанием для образования дисперсий мелких частиц описаны в патентах США №4997454 и 4826689, которые включены в настоящее описание путем ссылки и являются его частью. Во-первых, подходящее твердое соединение растворяют в подходящем органическом растворителе для образования растворяющей смеси. Затем осаждающий осадитель, смешивающийся с органическим растворителем, вливают в растворяющую смесь при температуре от приблизительно -10°C до приблизительно 100°C и со скоростью вливания от приблизительно 0,01 мл в минуту до приблизительно 1000 мл в минуту на объем 50 мл для образования суспензии осажденных неагрегированных твердых частиц соединения с, по существу, одинаковым средним диаметром менее чем 10 мкм. Целесообразна активация (например, перемешиванием) вливаемого раствора с осаждающим осадителем. Осадитель может содержать поверхностно-активное вещество для сообщения частицам устойчивости к агрегированию. Затем частицы сепарируют от растворителя. В зависимости от твердого соединения и требуемого размера частиц параметры температуры, отношение осадителя к растворителю, скорость вливания, скорость перемешивания и объем можно изменять согласно настоящему изобретению. Размер частиц пропорционален отношению объемов осадитель:растворитель и температуре вливания и обратно пропорционален скорости вливания и скорости перемешивания. Осаждающий осадитель может быть водным или неводным в зависимости от относительной растворимости соединения и требуемого суспендирующего носителя.
Осаждение изменением температуры
Технологии осаждения изменением температуры также можно применить для образования дисперсий мелких частиц. Данная технология описана в патенте США №5188837, который включен в настоящее описание путем ссылки и является его частью. В варианте осуществления изобретения липоидные сферы получают с помощью следующих этапов: (1) расплавляют или растворяют вещество, например, лекарственное средство, подлежащее введению в расплавленном носителе, для образования жидкости жидкой фракции вещества, подлежащего введению; (2) вводят фосфолипид вместе с водной средой в расплавленное вещество или носитель при температуре выше, чем температура плавления вещества или носителя; (3) смешивают суспензию при температуре выше температуры плавления носителя до тех пор, пока не получают гомогенный тонкодисперсный препарат; и затем (4) быстро охлаждают препарат при температуре, равной комнатной или ниже.
Осаждение выпариванием растворителя
Технология осаждения выпариванием растворителя описана в патенте США №4973465, который включен в настоящее описание путем ссылки и является его частью. Патент США №4973465 предлагает способы приготовления микрокристаллов, включающие следующие этапы: (1) обеспечивают раствор фармацевтической композиции и фосфолипида, растворенных в общеупотребительном органическом растворителе или комбинации растворителей, (2) выпаривают растворитель или растворители и (3) суспендируют пленку, полученную выпариванием растворителя или растворителей в водном растворе, интенсивным перемешиванием для образования дисперсии мелких частиц. Растворитель можно удалять подводом энергии к раствору, чтобы выпарить количество растворителя, достаточное для того, чтобы вызывать осаждение соединения. Растворитель можно также удалять с помощью других широко известных технологий, например, помещением раствора в вакуум или продуванием азота через раствор.
Осаждение взаимодействием
Осаждение взаимодействием содержит этапы растворения фармацевтического соединения в подходящем растворителе для образования раствора. Соединение следует вводить в количестве, равном или ниже предела насыщения соединения в растворителе. Соединение модифицируют посредством взаимодействия с реагентом или путем модификации в виде реакции на подвод энергии, например, тепла или УФ-излучения или подобного, так, чтобы модифицированное соединение обладало слабой растворимостью в растворителе и осаждалось из раствора с образованием мелких частиц.
Осаждение сжатой текучей средой
Подходящая технология осаждения сжатой текучей средой описана в публикации WO 97/14407 на имя Johnston, которая включена в настоящее описание путем отсылки и является его частью. Способ содержит этапы, состоящие в том, что растворяют водонерастворимое лекарственное средство в растворителе для образования раствора. Затем раствор распыляют в сжатую текучую среду, которая может представлять собой газ, жидкость или текучую среду в надкритическом состоянии. Введение сжатой текучей среды в раствор растворенного вещества в растворителе вынуждает растворенное вещество достигать или приближаться к перенасыщенному состоянию и осаждаться в форме тонкодисперсных частиц. В данном случае сжатая текучая среда действует как осадитель, который снижает плотность энергии межатомной связи растворителя, в котором растворено лекарственное средство.
В качестве альтернативы, лекарственное средство можно растворять в сжатой текучей среде, которую затем распыляют в водную фазу. Быстрое расширение сжатой текучей среды уменьшает растворяющую способность текучей среды, что, в свою очередь, вынуждает растворенное вещество осаждаться в форме мелких частиц в водной фазе. В данном случае сжатая текучая среда действует как растворитель.
Для сообщения частицам устойчивости к агрегированию по данной технологии применяют модификатор поверхности, например, поверхностно-активное вещество.
Существует множество других методологий приготовления дисперсий мелких частиц. В соответствии с настоящим изобретением предлагается методология для заключительной стерилизации данных дисперсий без существенного воздействия на эффективность препарата.
IV. Типы дисперсий мелких частиц
Дисперсию мелких частиц можно создавать из гидрофобной области водной системы (например, агрегатов поверхностно-активного вещества, циклодекстриновой полости, капли масла) и фармацевтически активного соединения или из самой гидрофобной области, если данная область является фармацевтически активной. Гидрофобная область может быть связана с фармацевтически активным соединением посредством ряда разных механизмов в дисперсии мелких частиц. Например, гидрофобная область может быть связана с фармацевтически активным соединением ковалентной связью и ионной связью, диполь-дипольными взаимодействиями, наведенными диполь-дипольными взаимодействиями или ван-дер-ваальсовыми силами. Кроме того, фармацевтически активное соединение может быть инкапсулировано в гидрофобную область.
A. Гидрофобные области
Агрегаты поверхностно-активного вещества
Как известно, гидрофобные области образуются в водном растворе из единственного поверхностно-активного вещества или комбинации поверхностно-активных веществ амфифильного типа в водном растворе (например, фосфолипидов). Агрегаты поверхностно-активных веществ включают в себя мицеллы (фиг.1), обратные мицеллы (фиг.2), ламеллярную форму смешанных мицелл, обратных смешанных мицелл (фиг.3), гексагональную фазу обратной ламеллярной формы (фиг.4), кубические фазы обратной гексагональной фазы (фиг.5), обратные кубические фазы, губчатые фазы L3, обратные губчатые фазы L3 и промежуточные фазы. Образование нормальной или обратной фаз зависит от типа поверхностно-активного вещества, концентрации поверхностно-активного вещества, давления и температуры. Кохелаты также следует относить к данному классу.
На фиг.1 изображена мицелла 10 с многочисленными амфифильными молекулами 12, расположенными по окружности на некотором расстоянии друг от друга и содержащими неполярные гидрофобные хвосты 14 амфифильных молекул, продолжающиеся аксиально внутрь с образованием сердцевины 16, и полярные гидрофильные головки 18, распространяющиеся радиально наружу от сердцевины с образованием поверхности 19.
На фиг.2 изображена обратная мицелла 20, которая аналогична мицелле на фиг.1 во всех отношениях, за исключением того, что полярные головки 18 продолжаются внутрь к сердцевине и неполярные хвосты распространяются наружу от сердцевины. Это будет верно для фаз в общем и их обратных модификаций. Поэтому фигура для каждой обратной формы опущена.
На фиг.3 изображена ламеллярная фаза 30. Ламеллярная фаза 30 содержит пространственно-разнесенные амфифильные молекулы 12, образующие многоуровневые двухслойные структуры 32. Пространство между двухслойными структурами 32 и пространство между гидрофобными хвостами известны как столбчатые слои 34 и 36. Столбчатый слой 34 является гидрофобным, а столбчатый слой 36 является гидрофильным.
На фиг.4 изображена гексагональная фаза 40. Гексагональную фазу можно представить как последовательность нормальных мицелл (фиг.1), расположенных одна над другой с образованием трубкообразных структур 42.
На фиг.5 изображен один пример кубической фазы 50. К настоящему времени выявлено семь кубических фаз и структура ориентировочно описана. Непрерывная в обе стороны кубическая фаза 50 содержит последовательность двухслойных структур 32, которые образуют связанную сетку пересекающихся трубок, обеспечивающих водные поры 52.
Фаза L3 описана в патенте США №5531925, который включен в настоящее описание путем отсылки и является его частью. Фаза L3 очень схожа с кубическими фазами, но лишена дальнего порядка кубической фазы.
Комплексообразователи
Гидрофобные зоны можно также создавать в водном растворе введением комплексообразователей, например, циклодекстринов. Циклодекстрины также широко применяют для взаимодействия с нерастворимым лекарственным соединением в водном растворе, как описано в патенте США №4764604, который включен в настоящее описание путем ссылки и является его частью.
Двухфазные дисперсии
Гидрофобные области в водной системе могут быть также выполнены из нескольких гетерогенных двухфазных систем, включая эмульсии, микроэмульсии, суспензии, а также другие системы.
Как упомянуто ранее, настоящее изобретение можно практически осуществить с любым из данных препаратов, в котором фармацевтически активное соединение связано с гидрофобной областью для образования дисперсии мелких частиц, или из самой гидрофобной области, если она является фармацевтически активной. Фармацевтически активное соединение может быть внедрено в гидрофобную область любого из препаратов упомянутых типов посредством многочисленных вышеописанных механизмов. Многие из данных систем подробно описаны в публикации “Surfactants and Polymers in Aqueous Solution”, 2003, John Wiley and Sons, которая включена в настоящее описание путем ссылки и является его частью.
V. Поверхностно-активные вещества
Особенно важные и безопасные классы амфифильных поверхностно-активных веществ содержат фосфолипиды. Фосфолипиды обычно представляют собой производные триглицерина, содержащие две гидроксильных группы сложного эфира глицерина, связанных с жирными кислотами (образующих полярный хвост), и одну концевую гидроксильную группу, связанную с фосфорной кислотой. Фосфорная кислота, в свою очередь, связана с другим соединением (например, холином, этаноламином, этиламином, глицерином или L-серином) с образованием полярной головной группы. Подходящие фосфолипиды включают в себя, например, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, фосфатидную кислоту, лизофосфолипиды, яичный или соевый фосфолипид или их комбинацию. Фосфолипид может быть насыщенным солью или обессоленным, гидрированным или частично гидрированным или натуральным, полусинтетическим или синтетическим.
Подходящие поверхностно-активные вещества согласно настоящему изобретению включают в себя анионные поверхностно-активные вещества, катионные поверхностно-активные вещества, неионогенные поверхностно-активные вещества, цвиттерионные поверхностно-активные вещества или биологически поверхностно-активные молекулы. Подходящие анионные и цвиттерионные поверхностно-активные вещества включают в себя, но без ограничения нижеследующим, лаурат калия, лаурилсульфат натрия, додецилсульфат натрия, алкилполиоксиэтиленсульфаты, альгинат натрия, диоктилсульфосукцинат натрия, сложные эфиры глицерина, натрий-карбоксиметилцеллюлозу, холиевую кислоту и другие желчные кислоты (например, холиевую кислоту, деоксихолиевую кислоту, гликохолиевую кислоту, таурохолиевую кислоту, гликодеоксихолиевую кислоту) и их соли (например, деоксихолат натрий и т.д.). Подходящие катионные поверхностно-активные вещества включают в себя, но без ограничения нижеследующим, четвертичные аммониевые соединения, например, хлорид бензалкония, бромид цетилтриметиламмония, хлорид лаурилдиметилбензиламмония, гидрохлориды ацилкарнитина или галогениды алкилпиридиния.
Подходящие неионогенные поверхностно-активные вещества включают в себя: полиоксиэтиленовые простые эфиры жирных спиртов (Macrogol и Brij), полиоксиэтиленовые сложные эфиры сорбита и жирных кислот (полисорбаты), полиоксиэтиленовые сложные эфиры жирных кислот (Myrj), сложные эфиры сорбита (Span), глицеринмоностеарат, полиэтиленгликоли, полипропиленгликоли, цетиловый спирт, цетостеариловый спирт, стеариловый спирт, спирты из алкилариловых простых полиэфиров, сополимеры вида полиоксиэтилен-полиоксипропилен (полоксамеры), полаксамины, метилцеллюлоза, гидроксицеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, некристаллическая целлюлоза, полисахариды, включая крахмал и производные крахмала, например, гидроксиэтилированный крахмал (HES), поливиниловый спирт и поливинилпирролидон. В одном из предпочтительных вариантов осуществления изобретения неионогенное поверхностно-активное вещество представляет собой сополимер полиоксиэтилена и полиоксипропилена и предпочтительно блок-сополимер пропиленгликоля и этиленгликоля. Данные полимеры присутствуют на рынке под торговым названием POLOXAMER (ПОЛОКСАМЕР), иногда также называются PLURONIC® и продаются несколькими поставщиками, включая BASF, Spectrum Chemical и Ruger. Некоторые полиоксиэтиленовые сложные эфиры жирных кислот содержат короткие алкильные цепи. Примером такого поверхностно-активного вещества является SOLUTOL® HS 15, полиэтилен-660-гидроксистеарат, производимый фирмой BASF Aktiengesellschaft.
Поверхностно-активные биологические молекулы включают в себя такие молекулы, как альбумин, казеин, гепарин, гирудин или другие соответствующие белки.
В лекарственных формах для орального применения можно использовать, по меньшей мере, один из следующих эксципиентов: желатин, казеин, лецитин (фосфатиды), аравийскую камедь, холестерин, трагакант, стеариновую кислоту, хлорид бензалкония, стеарат кальция, глицерилмоностеарат, цетостеариловый спирт, эмульгирующий воск для средства cetomacrogol, сложные эфиры сорбита, полиоксиэтиленовые простые алкиловые эфиры, например, простые эфиры типа макрогол, например, цетомакрогол 1000, полиоксиэтиленовые производные касторового масла, полиоксиэтиленовые сложные эфиры сорбита и жирных кислот, например, имеющиеся в продаже средства Tweens™, полиэтиленгликоли, полиэтиленстеараты, коллоидный диоксид кремния, фосфаты, додецилсульфат натрия, карбоксиметилцеллюлоза кальция, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, фталат гидроксипропилметилцеллюлозы, некристаллическая целлюлоза, алюмосиликат магния, триэтаноламин, поливиниловый спирт (PVA) и поливинилпирролидон (PVP). Большинство из данных наполнителей подробно описаны в справочнике Handbook of Pharmaceutical Excipients, опубликованных совместно American Pharmaceutical Association и The Pharmaceutical Society of Great Britain, издательство Pharmaceutical Press, 1986. Модификаторы поверхности имеются в продаже и/или могут быть приготовлены с использованием технологий, известных в данной области. По меньшей мере, два модификатора поверхности можно применять в сочетании.
VI. Стабилизирующее действие высокого давления на дисперсии мелких частиц
Высокое давление может стабилизировать системы из мелких частиц посредством ряда различных механизмов, которые могут быть либо термодинамического (объем реакционной смеси), либо кинетического (объем активации) происхождения. Кроме того, высокое давление может химически и/или физически стабилизировать фармацевтически активный ингредиент, поверхностно-активные вещества и/или агрегат лекарственного средства/гидрофобной области во время всего стерилизационного цикла. Примером термодинамической стабилизации является воздействие высокого давления на точку помутнения полиоксиэтиленовых поверхностно-активных веществ. Известно, что точки помутнения данных систем повышаются при сжатии благодаря усилению водородной связи и разрушению гидрофобной связи. Следовательно, дисперсии мелких частиц, которые являются нестабильными во время автоклавирования вследствие осаждения при точке помутнения, можно стабилизировать выполнением заключительной стерилизации под такими повышенными давлениями, при которых точка помутнения поверхностно-активных систем превосходит 121°C.
Пример 1
Стерилизация под высоким давлением наносуспензии итраконазола
Приготовили 1% наносуспензию интраконазола, содержащую 0,1% poloxamer 188, 0,1% дезоксихолат и 2,2% глицерин, с использованием комбинированной процедуры микроосаждения-гомогенизации (заявка на патент США №2002/0127278 A1). Исходное распределение размеров, измеренное методом статического светорассеяния (Horiba LA-920), показано на фиг.7.
Для положительного контроля сначала стерилизовали 5-мл образец наносуспензии с применением нормального цикла автоклавирования при 121°C в течение 15 минут. В результате имело место значительное агрегирование частиц, как видно из данных светорассеяния на фиг.8. Агрегирование такого типа характерно для наносуспензий, стабилизированных поверхностно-активными веществами, точка помутнения которых меньше 121°C (точка помутнения для Poloxamer 188 приблизительно равна 110°C).
Напротив, когда аналогичную наносуспензию стерилизовали с использованием стерилизационного цикла высокого давления, показанного на фиг.9, полученное распределение размеров частиц в 1% наносуспензии интраконазола оставалось совершенно неизменным, как показано на фиг.10.
VII. Оборудование и принципы стерилизации под высоким давлением
Стерилизационные аппараты высокого давления обычно содержат стерилизационную камеру с устройствами регулирования температуры и давления. Камера содержит крышку, которую плотно закрывают во время использования. Аппарат способен обеспечивать высокие давления до 1000 МПа. Аппарат также содержит источник тепла, который может нагревать стерилизационную камеру до 120°C и выше.
Способ применения аппарата содержит этапы, состоящие в том, что обеспечивают систему в требуемой форме. В случае с фармацевтическими препаратами, препарат будет представлять собой порошковую форму, раствор или водную дисперсию частиц, В предпочтительном варианте осуществления изобретения фармацевтический препарат содержится в контейнере, который изменяется в объеме или по форме в зависимости от давления, прилагаемого к контейнеру. Данные контейнеры могут включать в себя гибкий полимерный контейнер или другой гибкий контейнер, например, цилиндр шприца, картридж для безыгольного шприца или дозирующего ингалятора. Ниже приведено подробное описание данных контейнеров. В соответствии с настоящим изобретением предполагается введение фармацевтического препарата непосредственно в стерилизационную камеру.
Фармацевтический препарат помещают в стерилизационную камеру, в которой препарат будут подвергать изменению давления, изменению температуры или и тому и другому одновременно. В отличие от существующих автоклавов для стерилизации контейнеров для капельниц и подобных им, которые обеспечивают давления всего лишь ниже 0,25 МПа, по настоящему способу препарат подвергают действию давлений свыше 0,25 МПа. В предпочтительном варианте осуществления изобретения препараты будут подвергать действию давлений от более 0,25 МПа до приблизительно 1500 МПа, в более предпочтительном варианте от 0,25 МПа до приблизительно 700 МПа и в любом диапазоне или комбинации диапазонов в указанных пределах.
В соответствии с настоящим изобретением дополнительно включается воздействие температуры и давления так, чтобы сократить до минимума период, в течение которого препарат подвергают действию температуры выше 25°C. Предпочтительно температура системы будет превышать 70°C, предпочтительнее 90°C, еще более предпочтительно 100°C и в наиболее предпочтительном варианте 120°C и выше. Допускается применение различных графиков изменения температуры и давления в зависимости от времени, например, график, показанный на фиг.6, для стерилизации препарата без перехода препарата из стабильного состояния в нестабильное состояние.
В частности, на фиг.6 показан график зависимости давления и температуры от времени, согласно которому фармацевтический препарат подвергают действию давления приблизительно 700 МПа, подводят энергию для повышения температуры до приблизительно 121°C в течение некоторого периода в первом цикле, после которого следует второй цикл снижения давления до атмосферного давления и снижения температуры до комнатной температуры в течение некоторого периода. На фиг.6 показано, что препарат подвергается быстрым изменениям температуры во время каждого импульса давления. Данные температурные изменения вызывают мгновенным адиабатическим нагреванием и охлаждением изделия соответственно при сжатии и сбросе давления. Характерные значения времени для обеспечения стерильности имеют порядок минут, при этом проводят, по меньшей мере, 2 цикла.
Фармацевтический препарат считается стерилизованным, когда вероятность нестерильного образца-изделия равна или ниже одной миллионной. Данное условие удовлетворяет требованиям фармакопей США, Европы и Японии.
VIII. Летальность для способа стерилизации
Вышеописанную 1% наносуспензию итраконазола, обработанную с помощью стерилизационного цикла высокого давления, проверяют на стерильность. Воздействие стерилизации под высоким давлением в физиологическом растворе на летальность бактерий Bacillus stearothermophilus уже была показана (с использованием наиболее термостойких из штаммов, упомянутых как продемонстрировавших высокую стойкость к пропариванию, по их бионагрузке - смотрите стандарт ANSI/AAMI/ISO 11134-1993, Sterilization of health care products - Requirements for validation and routine control - Industrial moist heat sterilization. Американский национальный стандарт, разработанный Ассоциацией по совершенствованию медицинских приборов и утвержденный Американским национальным институтом стандартизации, стр.12, раздел A.6.6.). Испытуемый и контрольный образцы с посевом в, по меньшей мере, один миллион спор бактерии Bacillus stearothermophilus, подвергали обработке двумя разными способами, при этом в первом способе использовали давление около 600 МПа в течение 1 минуты и во втором способе использовали давление около 600 МПа в течение шести 10-секундных циклов. Исходная и максимальная температуры в обоих способах были 90 и 121°C соответственно. В обоих способах не было обнаружено никаких выживших организмов в физиологических растворах (смотрите таблицу 1). Предполагается, что аналогичные результаты будут выявлены, когда заражают и стерилизуют 1% наносуспензию итраконазола.
IX. Контейнеры
Различные контейнеры, предпочтительно используемые как медицинские устройства (например, для фармацевтического введения, почечного диализа и взятия/обработки крови), можно стерилизовать способами по настоящему изобретению. Примеры данных контейнеров включают в себя, но без ограничения нижеследующим, комплекты для введения текучих сред (включая комплекты со шприцами), устройства для взятия крови (например, упаковки для крови), одноразовые устройства для автоматизированной обработки крови, диализаторы, и мешки, катетеры и устройства для перитонеального диализа. Обычно данные системы будут содержать элемент (например, эластичную трубку) для перекачивания текучих сред.
На фиг.11 представлен контейнер 150 для текучих материалов с двумя боковыми стенками 152, ограничивающими между собой камеру 154. Элемент 155 для доступа обеспечивает стерильный доступ к содержимому контейнера. На фиг.12 показан многокамерный контейнер 160, содержащий первую и вторую камеры 162, 164, соединенные отделяемым уплотнением 166. Данные многокамерные контейнеры особенно пригодны для хранения жидкости в одной камере и порошка во второй камере или жидкости в обеих камерах. Отделяемое уплотнение обеспечивает смешение компонентов непосредственно перед применением. Подходящие многокамерные контейнеры включают в себя, но без ограничения нижеследующим, контейнеры, описанные в патентах США №5577369, 6017598, которые включены в настоящее описание путем ссылки и являются его частью. Способ по п.1, в котором контейнер выбран из группы, состоящей из контейнера, непроницаемого для текучих сред, шприца и герметичной эластичной трубки.
В предпочтительном варианте осуществления изобретения боковые стенки выполнены из полимера, не содержащего PVC. Боковые стенки могут быть выполнены из однослойной структуры 170 (фиг.13) или многослойной структуры 171 с первым и вторым слоями 172, 174, как показано на фиг.14. Предполагается, что пленка может содержать больше, чем 2 слоя. В другом варианте осуществления изобретения боковые стенки не являются ориентированными и не предполагаются термоусаживаемыми пленками.
Подходящие полимеры, не содержащие PVC, для выполнения боковых стенок включают в себя полиолефины, сополимеры этилена и низшего алкилакрилата, сополимеры этилена и низшего алкилзамещенного алкилакрилата, сополимеры этилена и винилацетата, полибутадиены, сложные полиэфиры, полиамиды и сополимеры стирола и углеводорода.
Подходящие полиолефины включают в себя гомополимеры и сополимеры, получаемые полимеризацией альфа-олефинов, содержащих от 2 до 20 атомов углерода, а предпочтительнее от 2 до 10 атомов углерода. Поэтому подходящие полиолефины включают в себя полимеры и сополимеры пропилена, этилена, бутена-1, пентена-1, 4-метил-1-пентена, гексена-1, гептена-1, октена-1, нонена-1 и децена-1. В наиболее предпочтительном варианте полиолефин представляет собой гомополимер или сополимер пропилена или гомополимер или сополимер полиэтилена.
Подходящие гомополимеры полипропилена могут характеризоваться стереохимией из аморфных, изотактических, синдиотактических, атактических, полуизотактических или стереоблоков. В одном предпочтительном варианте осуществления изобретения гомополимер полипропилена получен с использованием катализатора с единым центром полимеризации.
Подходящие сополимеры пропилена получают полимеризацией пропиленового мономера с α-олефином, содержащим от 2 до 20 атомов углерода. В более предпочтительном варианте осуществления изобретения пропилен сополимеризуют с этиленом в массовой пропорции от приблизительно 1% до приблизительно 20%, предпочтительнее от приблизительно 1% до приблизительно 10% и наиболее предпочтительно от 2% до приблизительно 5% по массе сополимера. Сополимеры пропилена и этилена могут представлять собой статистические или блочные сополимеры. В предпочтительном варианте осуществления изобретения пропиленовый сополимер получают с использованием катализатора с единым центром полимеризации.
Можно также использовать смесь сополимеров полипропилена и α-олефинов, в которой пропиленовые сополимеры могут различаться по количеству атомов углерода в α-олефине. Например, по настоящему изобретению предполагаются смеси сополимеров полипропилена и α-олефинов, в которых один сополимер содержит α-олефин с 2 атомами углерода и другой сополимер содержит α-олефин с 4 атомами углерода. Можно также использовать любую комбинацию α-олефинов с 2-20 атомами углерода, а предпочтительнее с 2-8 атомами углерода. Соответственно, по настоящему изобретению предполагаются смеси сополимеров полипропилена и α-олефинов, в которых первый и второй α-олефины содержат атомы углерода в следующих количественных сочетаниях: 2 и 6, 2 и 8, 4 и 6, 4 и 8. Предполагается также использование более чем 2 сополимеров полипропилена и α-олефина в смеси. Подходящие полимеры могут быть получены с использованием процесса Catalloy.
Возможно, было бы целесообразно применить полипропилен с высокой прочностью расплава. Полипропилены с высокой прочностью расплава могут представлять собой гомополимер или сополимер полипропилена с индексом текучести расплава в пределах от 10 граммов/10 мин до 800 граммов/10 мин, предпочтительнее от 30 граммов/10 мин до 200 граммов/10 мин или в любом диапазоне или комбинации внутри упомянутых диапазонов. Известно, что полипропилены с высокой прочностью расплава содержат разветвления с образованием длинной боковой цепи и свободными концами в пропиленовых молекулах. Способы приготовления полипропиленов, которые характеризуются высокой прочностью расплава, описаны в патентах США №4916198, 5047485 и 5605936, которые включены в настоящее описание путем отсылки и являются его частью. Один из таких способов заключается в том, что облучают линейный пропиленовый полимер в среде, в которой концентрация активного кислорода приблизительно равна 15% по объему, излучением с высокой энергией ионизации с дозой 1-104 мегарад в минуту в течение периода времени, достаточного для появления существенного количества разрывов цепей в линейном пропиленовом полимере, но недостаточного, чтобы материал стал гелеобразным. Облучение приводит к разрывам цепей. Последующая рекомбинация фрагментов цепей приводит к образованию новых цепей, а также к соединению фрагментов цепей в цепи с образованием разветвлений. Вышеизложенное дополнительно дает в результате искомый высокомолекулярный нелинейный пропиленовый полимерный материал с разветвлениями, с образованием длинной боковой цепи и свободными концами. Облучение обеспечивают до тех пор, пока не образуется значительное количество длинноцепочечных разветвлений. Затем материал обрабатывают для дезактивации, по существу, всех свободных радикалов, присутствующих в облученном материале.
Полипропилены с высокой прочностью расплава можно также получать так, как описано в патенте США №5416169, который полностью включен в настоящее описание путем ссылки и является его частью, когда заданный органический пероксид (ди-2-этилгексилпероксидикарбонат) подвергают взаимодействию с полипропиленом в заданных условиях и затем расплав перемешивают. Данные полипропилены представляют собой линейные кристаллические полипропилены с коэффициентом ветвления, по существу, равным 1, и поэтому не содержат разветвлений с образованием длинных боковых цепей и свободных концов и будут обладать истинной вязкостью от приблизительно 2,5 дл/г до 10 дл/г.
Подходящие гомополимеры этилена включают в себя гомополимеры с плотностью выше 0,915 г/см3, к которым относятся полиэтилен низкой плотности (LDPE), полиэтилен средней плотности (MDPE) и полиэтилен высокой плотности (HDPE).
Подходящие сополимеры этилена получают полимеризацией этиленовых мономеров с α-олефином, содержащим 3-20 атомов углерода, предпочтительнее 3-10 атомов углерода и наиболее предпочтительно 4-8 атомов углерода. Целесообразно также, чтобы сополимеры этилена обладали плотностью согласно данным измерений по ASTM D-792, менее приблизительно 0,915 г/см3 и предпочтительнее менее приблизительно 0,910 г/см3 и еще предпочтительнее менее приблизительно 0,900 г/см3. Данные полимеры часто называют VLDPE (полиэтилен очень низкой плотности) или ULDPE (полиэтилен сверхнизкой плотности). В предпочтительном варианте сополимеры этилена и α-олефинов получают с использованием катализатора с единым центром полимеризации и предпочтительнее систем металлоценовых катализаторов. Считается, что катализаторы с единым центром полимеризации характеризуются единственным, пространственно и электронно-эквивалентным положением каталитически активного центра в отличие от катализаторов типа Циглера-Натта, которые, как известно, содержат смешанный состав центров полимеризации. Такого рода сополимер этилена и α-олефином, катализированный на однотипных центрах, продаются фирмой Dow под торговым названием AFFINITY, фирмой DuPont Dow под торговым названием ENGAGE® и фирмой Exxon под торговым названием EXACT. Данные сополимеры иногда обозначены m-ULDPE в настоящем описании.
Подходящие сополимеры этилена включают в себя также сополимеры этилена и низших алкилакрилатов, сополимеры этилена и низших алкил-замещенных алкилакрилатов и сополимеры этилена и винилацетата с содержанием винилацетата от приблизительно 8% до приблизительно 40% по массе сополимера. Термин «низшие алкилакрилаты» относится к сомономерам с формулой, представленной на схеме 1:
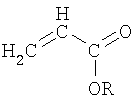
Схема 1
Группа R обозначает алкилы, содержащие 1-17 атомов углерода. Следовательно, термин «низшие алкилакрилаты» включает в себя, но без ограничения нижеследующим, метилакрилат, этилакрилат, бутилакрилат и т.п.
Термин «низшие алкил-замещенные алкилакрилаты» относится к сомономерам с формулой, представленной на схеме 2:
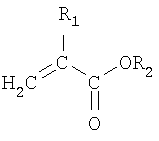
Схема 2
R1 и R2 обозначают алкилы, содержащие 1-17 атомов углерода, которые могут содержать одинаковое количество атомов углерода или разное количество атомов углерода. Следовательно, термин «низшие алкил-замещенные алкилакрилаты» включает в себя, но без ограничения нижеследующим, метилметакрилат, этилметакрилат, метилэтакрилат, этилэтакрилат, бутилметакрилат, бутилэтакрилат и т.п.
Подходящие полибутадиены включают в себя 1,2- и 1,4-аддитивные продукты 1,3-бутадиена (данные продукты собирательно именуются полибутадиенами). В более предпочтительном варианте осуществления изобретения полимер представляет собой 1,2-аддитивный продукт 1,3-бутадиена (данные продукты собирательно именуются «1,2-полибутадиенами»). В еще более предпочтительном варианте осуществления изобретения представляющий интерес полимер представляет собой синдиотактический 1,2-полибутадиен и даже предпочтительнее синдиотактический 1,2-полибутадиен с низкой степенью кристалличности. В еще более предпочтительном варианте осуществления изобретения синдиотактический 1,2-полибутадиен с низкой степенью кристалличности будет обладать кристалличностью ниже 50%, предпочтительнее ниже приблизительно 45%, еще предпочтительнее ниже приблизительно 40%, еще более предпочтительно степень кристалличности будет в пределах от приблизительно 13% до приблизительно 40% и в наиболее предпочтительном варианте от приблизительно 15% до приблизительно 30%. В предпочтительном варианте осуществления изобретения синдиотактический 1,2-полибутадиен с низкой степенью кристалличности будет иметь температуру плавления, согласно данным измерений по ASTM D 3418, от приблизительно 70°C до приблизительно 120°C. Подходящие смолы включают в себя смолы, продаваемые фирмой JSR (Japan Synthetic Rubber) под обозначениями марок: JSR RB 810, JSR RB 820 и JSR RB 830.
Подходящие сложные полиэфиры включают в себя продукты поликонденсации ди- или поликарбоновых кислот и ди- или многоатомные спирты или оксиды алкилена. В предпочтительном варианте осуществления изобретения сложный полиэфир представляет собой полиэфир алкоксикислоты. Подходящие полиэфиры алкоксикислоты получают из взаимодействия 1,4-циклогександиметанола, 1,4-циклогександикарбоновой кислоты и политетраметиленгликолевого простого эфира и далее совокупно обозначаются аббревиатурой PCCE. Подходящие PCCE продаются фирмой Eastman под торговым названием ECDEL. Подходящие сложные полиэфиры дополнительно включают в себя эластомеры со сложными полиэфирными звеньями, которые представляют собой блок-сополимеры твердого кристаллического сегмента из полибутилентерефталата и второго сегмента из мягких (аморфных) гликолей с простыми полиэфирными звеньями. Данные эластомеры со сложными полиэфирными звеньями продаются фирмой Du Pont Chemical Company под торговым названием HYTREL®.
Подходящие полиамиды включаются в себя полиамиды, которые образуются в результате взаимодействия с раскрытием кольца лактамов с 4-12 атомами углерода. Поэтому данная группа полиамидов включает в себя нейлон 6, нейлон 10 и нейлон 12. Подходящие полиамиды включают в себя также алифатические полиамиды, образующиеся в результате реакции конденсации диаминов с 2-13 атомами углерода, алифатические полиамиды, образующиеся в результате реакции конденсации двухосновных кислот с 2-13 атомами углерода, алифатические полиамиды, образующиеся в результате реакции конденсации димерных жирных кислот и содержащие амиды сополимеры. Следовательно, подходящие алифатические полиамиды включают в себя, например, нейлон 6,6 нейлон 6,10 и полиамиды димерных жирных кислот.
Стирольный сополимер стирола и углеводорода включает в себя стирол и различные замещенные стиролы, включая алкил-замещенный стирол и галоген-замещенный стирол. Алкильная группа может содержать от 1 до приблизительно 6 атомов углерода. Конкретные примеры замещенных стиролов включают в себя альфа-метилстирол, бета-метилстирол, винилтолуол, 3-метилстирол, 4-метилстирол, 4-изопропилстирол, 2,4-диметилстирол, o-хлорстирол, p-хлорстирол, o-бромстирол, 2-хлор-4-метилстирол и т.д. Наиболее предпочтительным является стирол.
Углеводородный участок сополимера стирола и углеводорода включает в себя диены с сопряженными двойными связями. Диены с сопряженными двойными связями, которые можно использовать, представляют собой соединения, содержащие от 4 до приблизительно 10 атомов углерода и, в более общем случае, от 4 до 6 атомов углерода. Примеры включают в себя 1,3-бутадиен, 2-метил-1,3-бутадиен (изопрен), 2,3-диметил-1,3-бутадиен, хлоропрен, 1,3-пентадиен, 1,3-гексадиен и т.д. Можно также использовать смеси данных диенов с сопряженными двойными связями, например, смеси бутадиена и изопрена. Предпочтительные диены с сопряженными двойными связями представляют собой изопрен и 1,3-бутадиен.
Сополимеры стирола и углеводорода могут представлять собой блок-сополимеры, включающие в себя двойные, тройные, мульти-, звездообразные блок-сополимеры и их смеси. Конкретные примеры двойных блок-сополимеров включают в себя стирол-бутадиен, стирол-изопрен и их гидрированные производные. Примеры тройных блок-сополимеров включают в себя стирол-бутадиен-стирол, стирол-изопрен-стирол, альфа-метилстирол-бутадиен-альфа-метилстирол и альфа-метилстирол-изопрен-альфа-метилстирол и их гидрированные производные.
Избирательное гидрирование вышеупомянутых блок-сополимеров может быть выполнено с помощью множества широко известных способов, включая гидрирование в присутствии таких катализаторов, как никелевый катализатор Ренея, катализаторы группы благородных металлов, например, платины, палладия и т.д., и растворимые катализаторы на переходных металлах. Подходящие способы гидрирования, которые можно использовать, представляют собой способы, в которых содержащий диен полимер или сополимер растворяют в инертном углеводородном разбавителе, например циклогексане, и гидрируют путем взаимодействия с водородом в присутствии растворимого гидрирующего катализатора. Данный способ описан в патентах США №3113986 и 4226952, описания которых включены в настоящее описание путем ссылки и являются его частью.
Особенно полезными гидрированными блок-сополимерами являются гидрированные блок-сополимеры типа стирол-изопрен-стирол, такой как блок-сополимер типа стирол-(этилен/пропилен)-стирол. Когда гидрируют блок-сополимер типа полистирол-полибутадиен-полистирол, образующийся продукт напоминает сополимер с регулярным распределением звеньев этилена и 1-бутена (EB). Как пояснялось выше, когда примененный диен с сопряженными двойными связями представляет собой изопрен, то образующийся гидрированный продукт напоминает сополимер с регулярным распределением звеньев этилена и пропилена (EP). Одним из примеров имеющегося в продаже избирательно гидрированного продукта является KRATON G-1652, который представляет собой гидрированный тройной блок-сополимер типа SBS (стирол-бутадиен-стирол), содержащий 30% концевых звеньев стирола, а эквивалент среднего звена представляет собой сополимер этилена и 1-бутена (EB). Данный гидрированный блок-сополимер часто обозначают аббревиатурой SEBS. Kraton G-1657 представляет собой смесь тройного блок-сополимера типа SEBS и двойного блок-сополимера типа SBS, которая также является подходящей. Другие подходящие сополимеры типа SEBS или SIS продаются фирмой Kurary под торговыми названиями SEPTON® и HYBRAR®.
Кроме того, может быть целесообразным использование привитых модифицированных блок-сополимеров стирола и углеводорода путем проведения реакции прививки реагента на основе ненасыщенной монокарбоновой или дикарбоновой кислоты с альфа-, бета-структурой на вышеописанные избирательно гидрированные блок-сополимеры.
Блок-сополимеры диена с сопряженными двойными связями и винилового ароматического соединения прививают реагентом на основе ненасыщенной монокарбоновой или дикарбоновой кислотой с альфа-, бета-структурой. Реагенты на основе карбоновых кислот включают в себя карбоновые кислоты сами по себе и их функциональные производные, например, ангидриды, имиды, соли металлов, сложные эфиры и т.д., которые способны к прививке на избирательно гидрированные блок-сополимеры. Привитой полимер будет обычно содержат от приблизительно 0,1 до приблизительно 20% и предпочтительно от приблизительно 0,1 до приблизительно 10% по массе от общей массы блок-сополимера и реагента на основе карбоновой кислоты типа привитой карбоновой кислоты. Конкретные примеры пригодных одноосновных карбоновых кислот включают в себя акриловую кислоту, метакриловую кислоту, фенилакриловую кислоту, кретоновую кислоту, ангидрид акриловой кислоты, акрилат натрия, акрилат кальция и акрилат магния и т.д. Примеры дикарбоновых кислот и их подходящих производных включают в себя малеиновую кислоту, малеиновый ангидрид, фумаровую кислоту, мезаконовую кислоту, итаконовую кислоту, цитраконовую кислоту, итаконовый ангидрид, цитраконовый ангидрид, монометилмалеат, мононатриймалеат и т.д.
Блок-сополимер стирола и углеводорода может быть модифицирован маслом, например, модифицированный маслом SEBS, продаваемый фирмой Shell Chemical Company под товарным знаком KRATON G2705.
Предполагается также, что пленки могут быть выполнены из смеси вышеупомянутых полимерных компонентов. В частности, пригодные смеси полимеров описаны в патенте США №5849843, который включен в настоящее описание путем ссылки и является его частью. В предпочтительном варианте осуществления изобретения один слой будет выполнен из смеси, содержащей, по меньшей мере, 2 компонента или предпочтительнее, по меньшей мере, три компонента. Данные смеси полимеров могут формировать однослойную пленку или могут быть объединены в многослойные пленки, как описано в патенте США №5998019, который включен в настоящее описание путем ссылки и является его частью.
Трехкомпонентные композиции
В первом варианте осуществления трехкомпонентной системы первый компонент будет сообщать термостойкость и гибкость композиции. Данный компонент можно выбирать из группы, состоящей из аморфных полиальфа-олефинов, и предпочтительно представляет собой гибкий полиолефин. Данные полиолефины должны быть устойчивыми к деформациям при высоких температурах до 121°C, обладать максимальной температурой плавления выше 130°C и большой гибкостью, с модулем не более 40000 фунт/кв. дюйм и предпочтительнее не более 20000 фунт/кв. дюйм. Кроме того, некоторые полипропилены с высокой синдиотактичностью также характеризуются высокой температурой плавления и низким модулем. Содержание первого компонента должно быть в пределах 40-90% по массе от композиции.
Второй компонент трехкомпонентной композиции представляет собой RF (радиочастотно) чувствительный полимер, который сообщает композиции способность к RF-свариванию и может быть выбран в любой из двух групп полярных полимеров. Первая группа состоит из этиленовых сополимеров, содержащих 50-85% этилена с сомономерами, выбранными из группы, состоящей из акриловой кислоты, метакриловой кислоты, сложных эфиров, производных от акриловой кислоты со спиртами, содержащими 1-10 атомов углерода, сложных эфиров, производных от метакриловой кислоты со спиртами, содержащими 1-10 атомов углерода, винилацетата и винилового спирта. RF-чувствительный полимер может быть выбран из второй группы, состоящей из полимеров, содержащих сегменты полиуретана, сложного полиэфира, полимочевины, полиимида, полисульфонов и полиамидов. Данные функционализированные структуры могут составлять 5-100% RF-чувствительного полимера. RF-чувствительный полимер должен составлять 5-50% по массе композиции.
В предпочтительном варианте RF-чувствительный компонент представлен сополимерами этилена и метилакрилата с содержанием метилакрилата в пределах 15-25% по массе полимера. Заключительный компонент трехкомпонентного соединения обеспечивает совместимость между первыми двумя компонентами и выбирается из стирольных блок-сополимеров и предпочтительно содержит функциональные группы малеинового ангидрида. Третий компонент должен составлять 5-30% по массе композиции.
Во втором варианте осуществления трехкомпонентной пленки первый компонент сообщает композиции способность к RF-свариванию и гибкость в заданном температурном диапазоне. Первый компонент сообщает термостойкость («термостойкий полимер») и выбран из группы, состоящей из полиамидов, полимидов, полиуретанов, полипропилена и полиметилпентена. В предпочтительном варианте первый компонент составляет 30-60% по массе композиции и предпочтительно представляет собой полипропилен. Второй компонент сообщает способность к RF-привариванию и гибкость в заданном температурном интервале. RF-полимер выбирают из вышеописанных первой и второй групп, за исключением этилен-винилового спирта. Второй компонент должен составлять 30-60% по массе композиции. Третий компонент обеспечивает совместимость между первыми двумя компонентами и выбран из блок-сополимеров типа SEBS и предпочтительно содержит функциональные группы малеинового ангидрида. Третий компонент должен составлять 5-30% по массе от композиции.
Четырехкомпонентные композиции
Первый компонент четырехкомпонентной пленки предназначен для сообщения термостойкости. Данный компонент может быть выбран из полиолефинов, предпочтительнее всего, полипропиленов и, в частности, статистических сополимеров пропилена и альфа-олефинов (PPE). В предпочтительном варианте молекулярные массы PPE будут ограничены узким интервалом. PPE обладают необходимой жесткостью и устойчивостью к пластической деформации при температурах автоклавирования около 121°C. Однако сами по себе PPE являются слишком жесткими для того, чтобы соответствовать требованиям к гибкости. При комбинировании смешением с некоторыми полимерами с низким модулем можно обеспечить высокую гибкость. Примеры подходящих PPE включают в себя продукты, продаваемые под названием Soltex 4208 и Exxon Escorene PD9272. Данные сополимеры с низким модулем могут включать в себя сополимеры на основе этилена, например, сополимер этилена и винилацетата («EVA»), сополимеры этилена и альфа-олефинов или так называемые полиэтилены сверхнизкой плотности (обычно менее 0,90 кг/л) («ULDPE»). Данные ULDPE включают в себя имеющиеся в продаже продукты, продаваемые под товарными знаками TAFMER® (Mitsui Petrochemical Co.) с обозначением A485, Exact® (Exxon Chemical Company) с обозначением 4023-4024, полимеры по технологии Insite® (Dow Chemical Co.). Кроме того, установлено, что пригодны сополимеры полибутена-1 («PB»), например, сополимеры, продаваемые фирмой Shell Chemical Company под обозначением PB-8010, PB-8310; термопластические эластомеры на основе блок-сополимеров типа SEBS (Shell Chemical Company), полиизобутилен («PIB») с обозначениями Vistanex L-80, L-100, L-120, L-140 (Exxon Chemical Company), сополимеры этиленалкилакрилата, метилакрилата («EMA»), например, сополимеры с названием EMAC 2707 и DS-1130 (Chevron), и н-бутилакрилаты («ENBA») (Quantum Chemical). Сополимеры этилена, например, сополимеры акриловой и метакриловой кислоты и их частично нейтрализованные соли и иономеры, например, PRIMACOR® (Dow Chemical Company) и SURYLN® (E.I.DuPont de Nemours & Company) также удовлетворяли требованиям.
Обычно сополимеры на основе этилена с температурами плавления ниже приблизительно 110°C не пригодны для автоклавирования. Кроме того, только при ограниченных диапазонах содержания каждого компонента возможно одновременное выполнение требований к гибкости и автоклавированию. В предпочтительном варианте первый компонент выбирают из группы гомо- и статистических сополимеров полипропилена с альфа-олефинами, которые составляют приблизительно 30-60%, предпочтительнее 35-45% и предпочтительнее всего 45% по массе композиции. Например, в качестве первого компонента предпочтительны статистические сополимеры пропилена с этиленом, в которых содержание этилена находится в диапазоне 1-6% и предпочтительнее 2-4% по массе полимера.
Второй компонент четырехкомпонентной композиции сообщает гибкость и пластичность при низкой температуре и представляет собой второй полиолефин, иной, чем полиолефин первого компонента, при этом упомянутый второй полиолефин не содержит повторяющихся звеньев пропилена («полиолефин не на основе пропилена»). Предпочтительно он представлен сополимерами этилена, включая ULDPE, полибутен, сополимеры бутена и этилена, этиленвинилацетат, сополимеры с содержанием винилацетата в пределах приблизительно 18-50%, сополимеры этилена и метилакрилата с содержанием метилакрилата в пределах приблизительно 20-40%, сополимеры этилена и н-бутилакрилата с содержанием н-бутилакрилата в пределах 20-40%, сополимеры этилена и акриловой кислоты с содержанием акриловой кислоты выше приблизительно 15%. Упомянутые продукты продаются, например, под такими обозначениями, как Tafmer A-4085 (Mitsui), EMAC DS-1130 (Chevron), Exact 4023, 4024 и 4028 (Exxon), и должны составлять приблизительно 25-50%, предпочтительнее 35-45% и наиболее предпочтительно 45% по массе композиции. Для придания четырехкомпонентной композиции способности к RF-диэлектрическим потерям в композицию включают некоторые известные ингредиенты с высокими диэлектрическими потерями («RF-чувствительные полимеры»). Данные полимеры можно выбирать из группы RF-полимеров в вышеописанных первой и второй группах.
Другие RF-активные материалы включают в себя PVC, винилиденхлориды и фториды, сополимер бис-фенола-A и эпихлоргидринов, известный как PHENOXYS® (Union Carbide). Однако существенное содержание данных хлор- и фторсодержащих полимеров дает нежелательную композицию, так как сжигание данного материала приводило бы к образованию неорганических кислот.
Полиамиды RF-чувствительного полимера предпочтительно выбирают из алифатических полиамидов, образующихся в результате реакции конденсации диаминов с 2-13 атомами углерода, алифатических полиамидов, образующихся в результате реакции конденсации двухосновных кислот с 2-13 атомами углерода, полиамидов, образующихся в результате реакции конденсации димерных жирных кислот и содержащих амиды (статистических, блок- и привитых) сополимеров. Полиамиды, например, нейлоны, широко применяются в тонкопленочных материалах, поскольку они обеспечивают прочность пленки на истирание. Однако нейлоны редко применяют в слое, который контактирует с медицинскими растворами, поскольку они обычно загрязняют раствор из-за вымывания в раствор. Наиболее предпочтительными RF-чувствительными полимерами являются разнообразные полиамиды из димерных жирных кислот, продаваемые фирмой Henkel Corporation под обозначениями MACROMELT и VERSAMID, которые не приводят к такому загрязнению. RF-чувствительный полимер предпочтительно должен составлять приблизительно 5-30%, предпочтительнее 7-13% и предпочтительнее всего 10% по массе композиции.
Четвертый компонент композиции придает совместимость между полярными и неполярными компонентами композиции (иногда именуется «совмещающий полимер») и предпочтительно представлен стирольными блок-сополимерами с мягкими углеродными сегментами. В более предпочтительном варианте четвертый компонент выбирали из блок-сополимеров типа SEBS, которые модифицируют функциональными группами малеинового ангидрида, эпоксидными или карбоксилатными функциональными группами, и предпочтительно представляет собой блок-сополимер типа SEBS, который содержит функциональные группы малеинового ангидрида («функционализирован»). Такой продукт продается фирмой Shell Chemical Company под обозначением KRATON RP-6509. Совмещающий полимер должен составлять приблизительно 5-40%, предпочтительнее 7-13% и предпочтительнее всего 10% по массе композиции. Может быть, целесообразно также добавить пятый компонент из блок-сополимера типа SEBS, не снабженного функциональными группами, например, блок-сополимеры, продаваемые фирмой Shell Chemical Company под обозначениями KRATON G-1652 и G-1657. Пятый компонент должен составлять приблизительно 5-40%, предпочтительнее 7-13% и больше всего по массе композиции.
Для каждой из вышеописанных композиций, возможно, потребуется вводить, в малых количествах, другие добавки, например, добавки, понижающие трение, лубриканты, воски и вещества, препятствующие слипанию, насколько необходимо и как широко известно в данной области, пока окончательная композиция не будет выполнять вышеописанные требования к физическим свойствам.
Пленка может быть выполнена с использованием технологий, широко известных в отрасли. Например, вышеупомянутые компоненты можно смешивать в сухой форме в высокоинтенсивном смесителе, например, смесителе Welex и подавать в экструдер. Компоненты можно также подавать под действием силы тяжести в высокоинтенсивный смеситель-экструдер двухшнековой конструкции, например, Werner Pfleiderer, и выходящий продукт можно гасить в нескольких потоках в водяной ванне, гранулировать и сушить для использования. Этап гранулирования можно исключить в третьем способе подачей выходного продукта экструзионного смесителя непосредственно в экструдер пленки. Можно также встроить секцию высокоинтенсивного смешения в экструдер пленки, чтобы пленку сплава можно было изготавливать с использованием единственного экструдера.
В многослойной пленке 171 можно использовать вышеописанные смеси в качестве одного слоя 172 и другого слоя 174. В одном из предпочтительных вариантов осуществления изобретения слой 174 представляет собой наружный слой. Наружный слой 174 сообщает устойчивость к деформациям при высоких температурах и устойчивость к истиранию и предпочтительно представляет собой полипропилен и предпочтительнее сополимер полипропилена, смешанный с блок-сополимерами стирола и углеводорода. В более предпочтительном варианте наружный слой 174 представляет собой сополимер полипропилена, смешанный с блок-сополимером типа SEBS в пропорции 0-20% по массе. Толщина наружного слоя 174 должна быть в пределах 0,2-3,0 мил.
На фиг.15 показан другой вариант осуществления настоящего изобретения, содержащий сердцевинный слой 176, расположенный между наружным слоем 172 и RF-чувствительным слоем ПА. Сердцевинный слой 176 сообщает устойчивость к деформациям при высоких температурах и гибкость пленочной конструкции 171 и совместимость между собой компонентов пленочной конструкции 171. В предпочтительном варианте сердцевинный слой будет иметь толщину в пределах 0,5-10 мил и предпочтительнее 1-4 мил. Сердцевинный слой 176 содержит три компонента. Первый компонент представляет собой полиолефин и предпочтительно полипропилен в количестве, которое составляет 20-60% от массы сердцевинного слоя 176, предпочтительнее 35-50% и наиболее предпочтительно 45% от сердцевинного слоя 176.
Второй компонент сердцевинного слоя 176 выбирают из группы, состоящей из соединений, которые сообщают гибкость сердцевинному слою 176, включая ULDPE, сополимеры полибутена. Вторым компонентом сердцевинного слоя предпочтительно является ULDPE или полибутен-1 с массовым содержанием 40-60% предпочтительнее 40-50% и наиболее предпочтительно 40%.
Третий компонент сердцевинного слоя 176 выбирается из группы соединений, которые придают совместимость между собой компонентам сердцевинного слоя 176, и содержит блок-сополимеры стирола и углеводорода и в наиболее предпочтительном варианте блок-сополимеры типа SEBS. Третий компонент содержится в пропорции предпочтительно в пределах 5-40% от массы сердцевинного слоя 176, предпочтительно 7-15% и наиболее предпочтительно 15%.
Можно также вводить четвертый компонент сердцевинного слоя 176, повторно размельчаемый обрезной материал, утилизируемый во время изготовления контейнеров. Обрезной материал распределяют по сердцевинному слою 176. Обрезь можно добавлять в пропорцию предпочтительно приблизительно в пределах 0-50% от массы сердцевинного слоя 176, предпочтительнее в пределах 10-30% и наиболее предпочтительно в пределах 3-12%.
На фиг.16 представлена пленка 180, содержащая слой 182 контакта с раствором, сцепленный со стороной RF-чувствительного слоя 172, противоположного наружному слою 174. Слой 182 контакта с раствором может быть выполнен из одного из вышеупомянутых материалов, в более предпочтительном варианте будет содержать полиолефин и еще предпочтительнее будет из такого же материала, как наружный слой 174, или такого же материала, как сердцевинный слой 176. Слой 182 контакта с раствором имеет толщину предпочтительно в пределах 0,2-1,0 мил и наиболее предпочтительно 1,0 мил.
На фиг.17 изображен другой вариант осуществления многослойной пленочной конструкции, содержащей наружный слой 174, сердцевинный слой 176 и RF-чувствительный слой 172, описанные выше, с дополнительным отдельным слоем из обрези 190 между наружным слоем 174 и сердцевинным слоем 176. На фиг.18 изображен отдельный слой из обрези 190 между сердцевинным слоем 176 и RF-чувствительным слоем 172. На фиг.19 изображен слой из обрези 190, разделяющий сердцевинный слой 176 на первый и второй сердцевинные слои 176а и 176b. Слой обрези 190 должен быть толщиной предпочтительно в пределах 0,5-5,0 мил и наиболее предпочтительно 1,0 мил.
На фиг.20 показан другой вариант осуществления настоящего изобретения, содержащий шесть слоев, включая наружный 174, сердцевинный 176 и RF-чувствительный 172 слои, описанные выше, с барьерным слоем 200, расположенным между сердцевинным 176 и RF-чувствительным 172 слоями и сцепленными с ними связующими слоями 202, прикрепленными к противоположным сторонам барьерного слоя 200. На фиг.21 показан барьерный слой 200 между сердцевинным слоем 176 и наружным слоем 174. На фиг.22 показан барьерный слой 200, разделяющий сердцевинный слой 176 на два сердцевинных слоя 176a и 176b. Барьерный слой 200 повышает газонепроницаемость пленочной конструкции. Барьерный слой 200 выбирают из группы, состоящей из этиленвиниловых спиртов, например, такого, который продается под названием Evalca (Evalca Co.), полиамида с высокой степенью стеклообразности или кристалличности, например, Sclar PA® (Dupont Chemical Co.), сополимеров акрилонитрила с высоким содержанием нитрила, например Barex®, продаваемых фирмой British Petroleum. В предпочтительном варианте, барьерный слой 200 представляет собой этиленвиниловый спирт и имеет толщину в пределах 0,3-1,5 мил и наиболее предпочтительно 1,0 мил.
Связующие слои 202 могут быть выбраны из модифицированных сополимеров этилена и пропилена, например, продуктов, продаваемых под обозначением Prexar (Quantum Chemical Co.) и Bynel (Dupont), и должны иметь толщину в пределах 0,2-1,0 мил и наиболее предпочтительно 0,5 мил.
Технологии стерилизации под высоким давлением по настоящему изобретению пригодны также для стерилизации пустых дренажных мешков для CAPD (хронического амбулаторного перитонеального) гемодиализа, например, контейнера, описанного в патенте США №6004636, который включен в настоящее описание путем ссылки и является его частью. Другие контейнеры, подходящие для заключительной стерилизации с использованием технологий стерилизации под высоким давлением по настоящему изобретению, включают в себя гибкие контейнеры для клеточной культуры, например, контейнеры, описанные в патентах США №5935847, 4417753, 4210686, которые целиком включены в настоящее описание путем ссылки и составляют его часть. Совместимые с белками пленки и контейнеры, например, такие, которые описаны в патенте США №6309723, который включен в настоящее описание путем ссылки и является его частью, также можно стерилизовать с использованием предлагаемых технологий стерилизации под высоким давлением по настоящему описанию. Кроме того, технологии стерилизации пригодны также для стерилизации контейнеров для содержания чувствительных к кислороду соединений, например, дезоксигемоглобина, например, контейнера, описанного в патенте США №6271351, который включен в настоящее описание путем ссылки и является его частью. Поскольку технологии стерилизации требуют, чтобы упомянутые контейнеры подвергались лишь кратковременному воздействию температур, превосходящих 100°C, то многие контейнеры, которые не пригодны для заключительной стерилизации с использованием стандартных технологий пропаривания контейнера при температуре 121°C в течение 1 часа, можно подвергать заключительной стерилизации по технологиям высокого давления согласно настоящему изобретению.
На фиг.23 изображен шприц 220 с цилиндром 222 и плунжером 224, широко известный в данной области. Шприц 220 может быть выполнен из вышеописанных материалов. Цилиндр шприца можно наполнить одной из дисперсий или сухим порошком фармацевтического соединения и затем автоклавировать вышеописанным способом. Цилиндр шприца и предпочтительно как цилиндр, так и плунжер должны быть способны к изменению объема при повышении давления, и обе части 222 и 224 должны иметь достаточную устойчивость к деформациям при высоких температурах, чтобы выдерживать способ заключительной стерилизации по настоящему изобретению.
На фиг.24 изображен картридж 230 или вставка с корпусом 232, образующие камеру 234. Камера 234 уплотняется торцевым колпачком 236 или парой торцевых колпачков, при необходимости. Картридж можно вставлять в устройство для введения, например, безыгольный шприц, например, устройство, описанное в патенте США №6132395, или в другое устройство для введения, которое способно получать доступ к содержимому камеры 234 и доставить содержимое для использования.
На фиг.25 изображено устройство 250 для ввода жидкости с медицинской эластичной трубкой 252 и устройством 254 доступа. Устройство доступа может быть предметом для прокалывания элемента 154 доступа или может быть выполнено с возможностью стыковки или другого соединения с цилиндром 222 шприца для транспорта текучей среды из контейнера, применяемого для стерилизации, чтобы производить введение пациенту или доставку в другое устройство, применяемое для введения композиции пациенту.
Существует множество контейнеров, например, некоторые полимерные медицинские контейнеры, которые не могут выдерживать способ заключительной стерилизации с пропариванием контейнера при 121°C в течение 1 часа.
X. Изделия
Настоящее изобретение обеспечивает стерилизованные изделия, причем, предпочтительно с фармацевтическими препаратами, включая, но без ограничения, контейнеры, содержащие стерильные фармацевтические препараты, причем препараты стерилизованы путем подведения тепла к изделию и воздействия давления на изделие вплоть до давлений выше 0,25 МПа. Настоящее изобретение обеспечивает также стерильные фармацевтические препараты, которые не содержат модификаторы точки помутнения.
Следует понимать, что специалистам в данной области станут очевидны различные изменения и модификации приведенных в описании предпочтительных вариантов осуществления. Данные изменения и модификации могут быть внесены без выхода за пределы сущности и объема настоящего изобретения и без умаления намеченных преимуществ. Поэтому предполагается, что данные изменения и модификации охватываются прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СУБМИКРОННЫХ ЧАСТИЦ ПАКЛИТАКСЕЛА | 2004 |
|
RU2402313C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2496482C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУСПЕНЗИЙ СУБМИКРОННЫХ ЧАСТИЦ | 2001 |
|
RU2272616C2 |
| СПОСОБ НАНЕСЕНИЯ ПОКРЫТИЙ НА ЧАСТИЦЫ И ЧАСТИЦЫ, ПОЛУЧЕННЫЕ ЭТИМ СПОСОБОМ | 2000 |
|
RU2250764C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНООБРАЗУЮЩЕГО СРЕДСТВА | 2008 |
|
RU2481395C2 |
| ПРЕПАРАТИВНАЯ ФОРМА АРГАТРОБАНА | 2006 |
|
RU2416393C2 |
| СПОСОБ ПРОГРАММИРУЕМОЙ ПЛАВУЧЕЙ ДОСТАВКИ | 2007 |
|
RU2420268C2 |
| СПОСОБ ПРОИЗВОДСТВА ЛАМИНИРОВАННОГО УПАКОВОЧНОГО МАТЕРИАЛА И УПАКОВОЧНЫЕ КОНТЕЙНЕРЫ, ИЗГОТОВЛЕННЫЕ ИЗ ЭТОГО УПАКОВОЧНОГО МАТЕРИАЛА | 2000 |
|
RU2236944C2 |
| НОВОЕ ПЛЕНОЧНОЕ ПОКРЫТИЕ | 2002 |
|
RU2323717C2 |
| СПОСОБ ПРОИЗВОДСТВА ЛАМИНИРОВАННОГО УПАКОВОЧНОГО МАТЕРИАЛА И УПАКОВОЧНЫЕ КОНТЕЙНЕРЫ, ИЗГОТОВЛЕННЫЕ ИЗ ЭТОГО УПАКОВОЧНОГО МАТЕРИАЛА | 2000 |
|
RU2236943C2 |
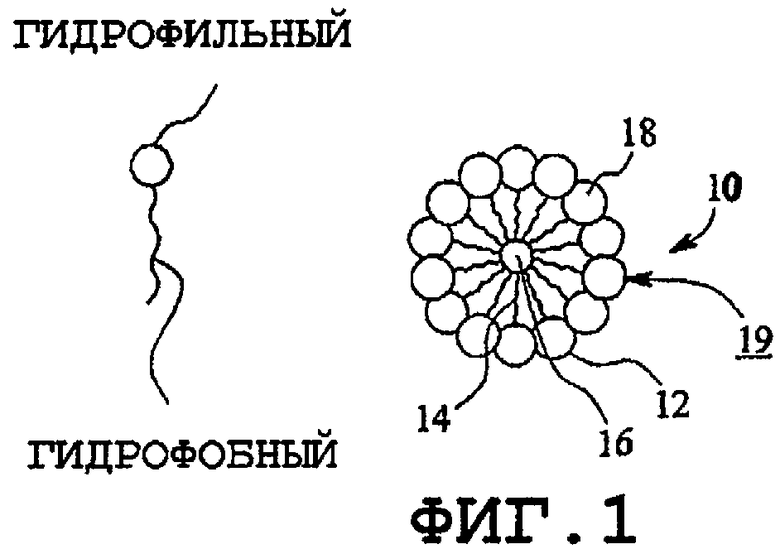
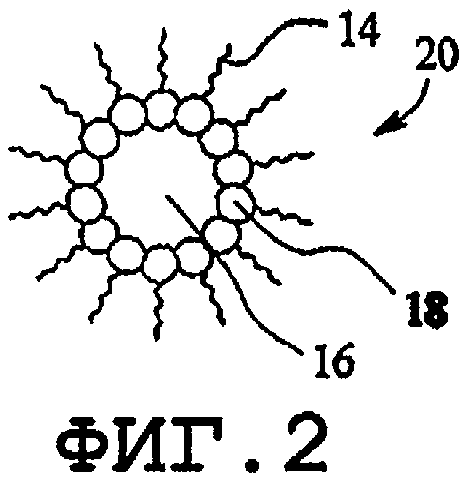
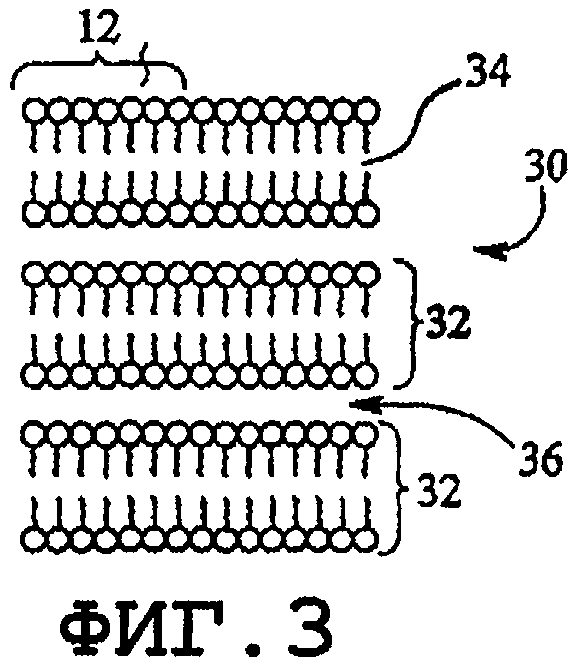
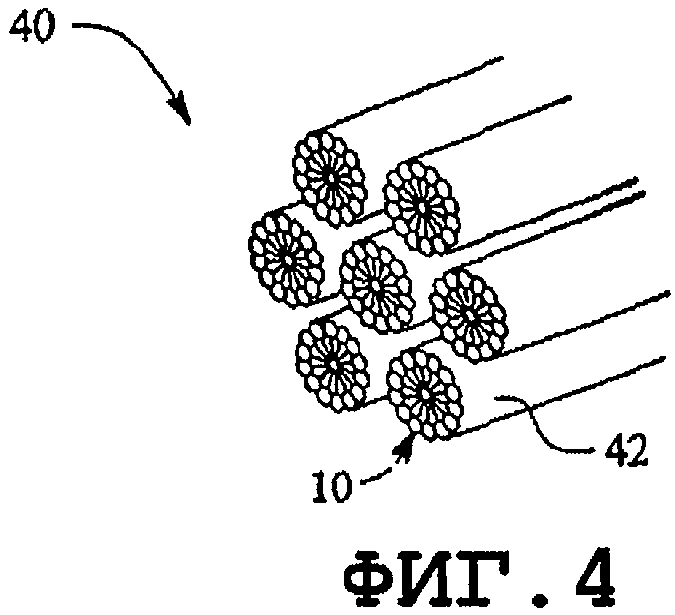
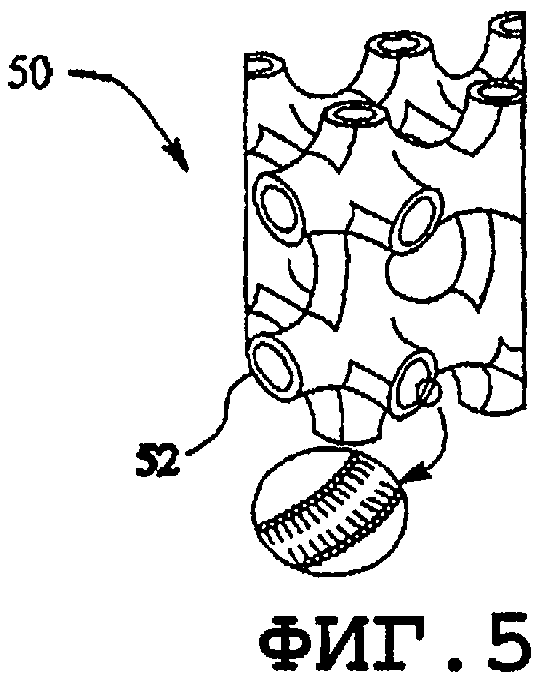
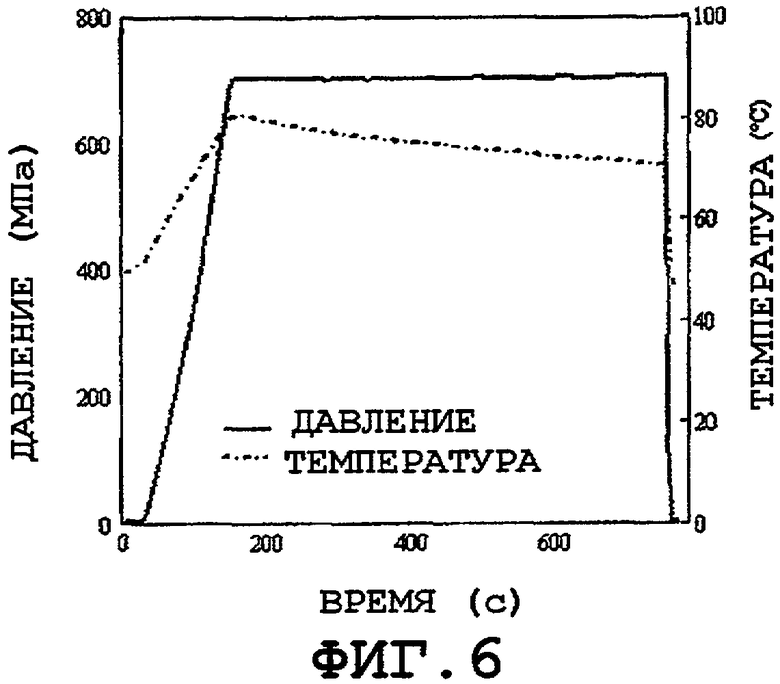
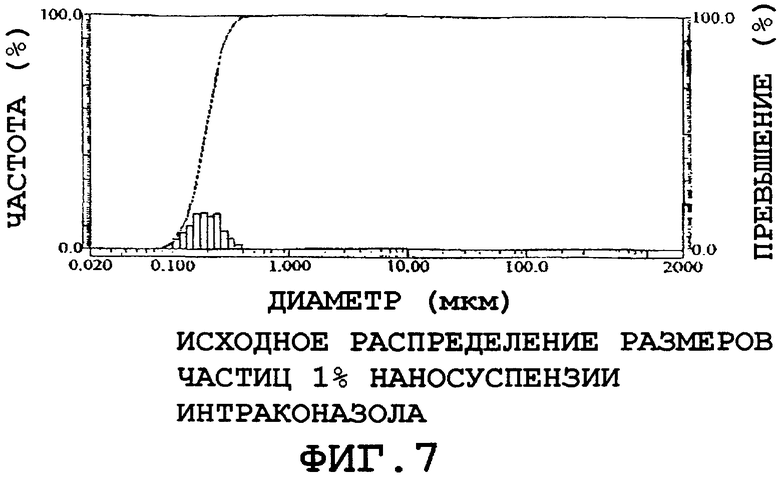
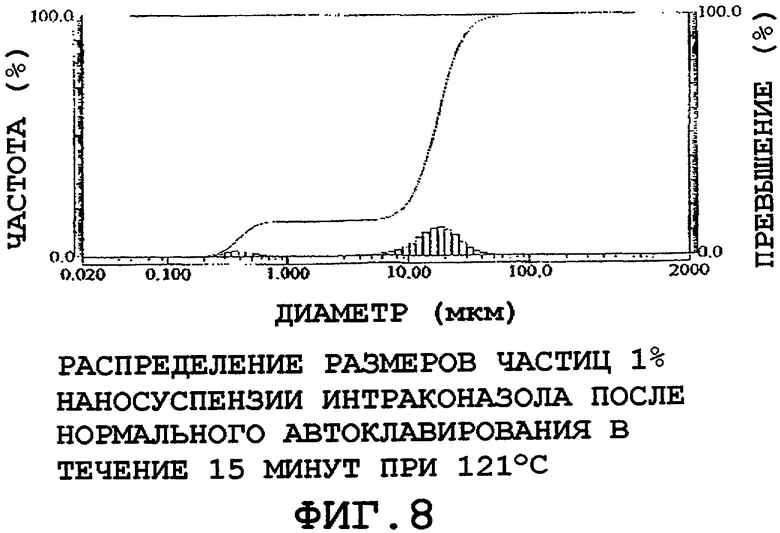
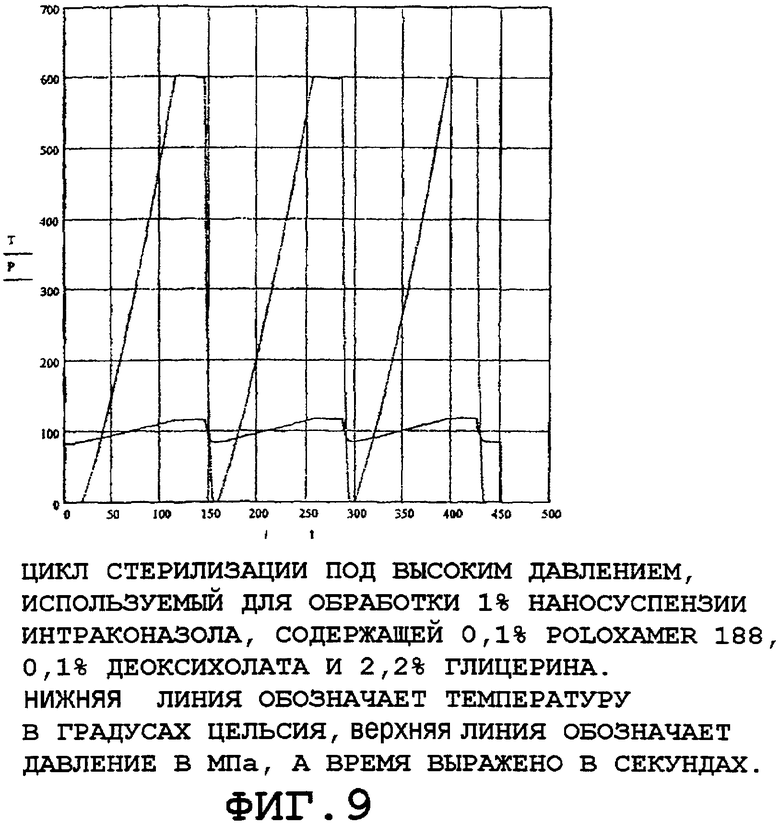
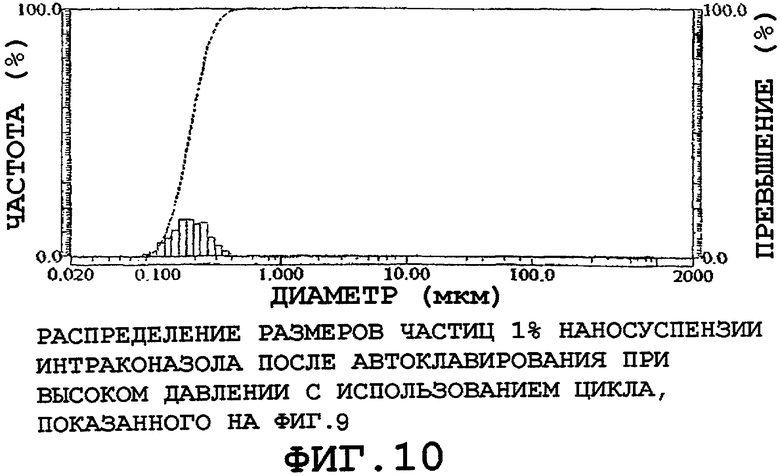
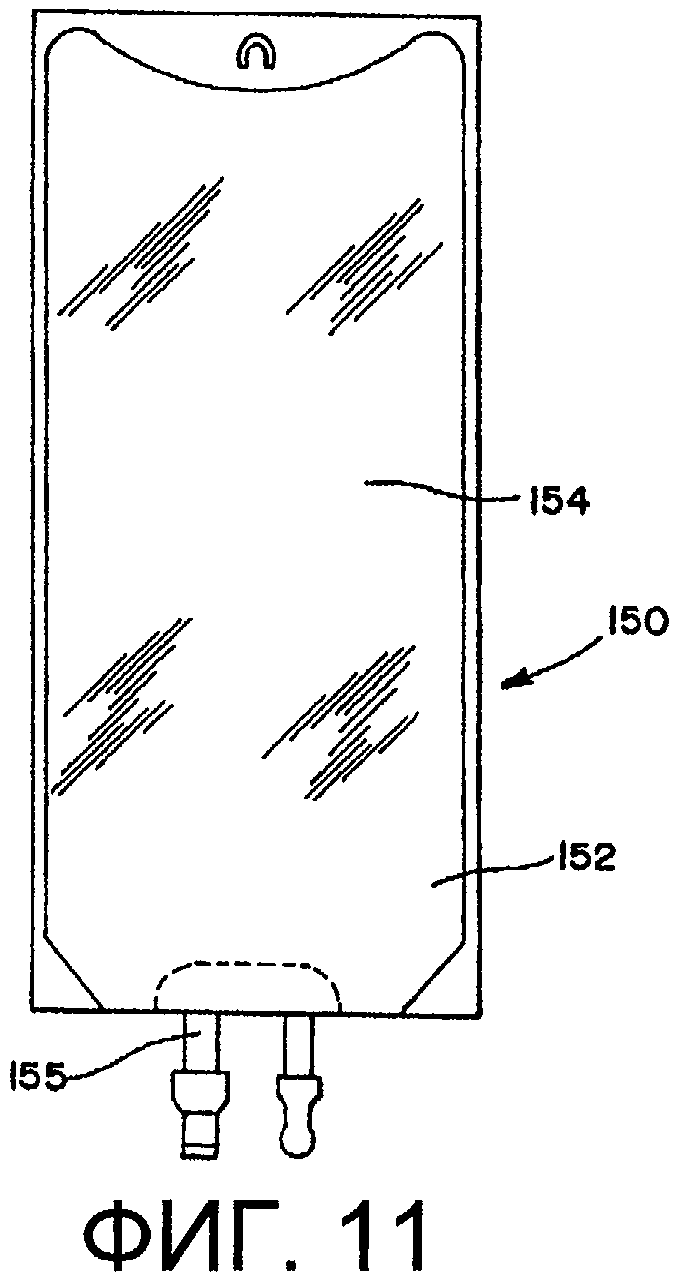
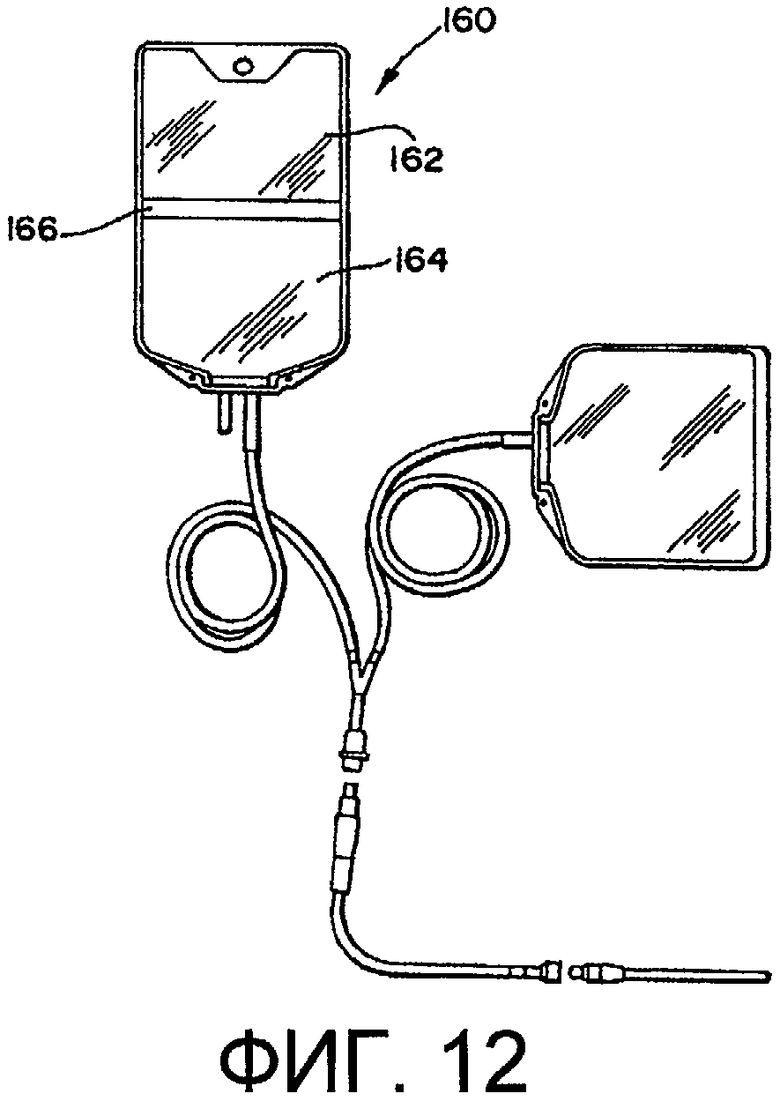
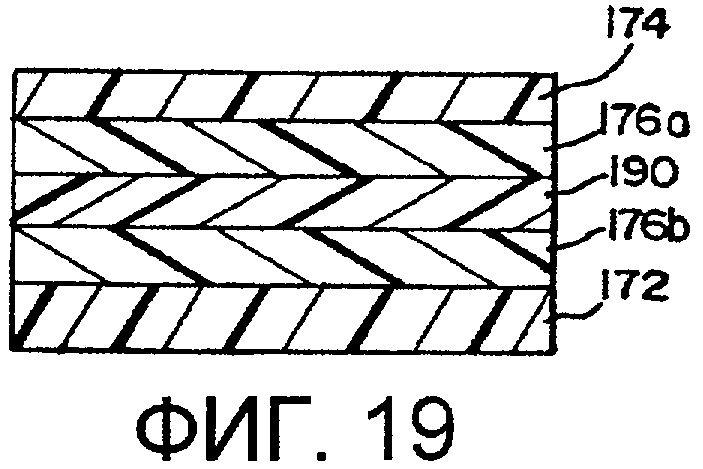
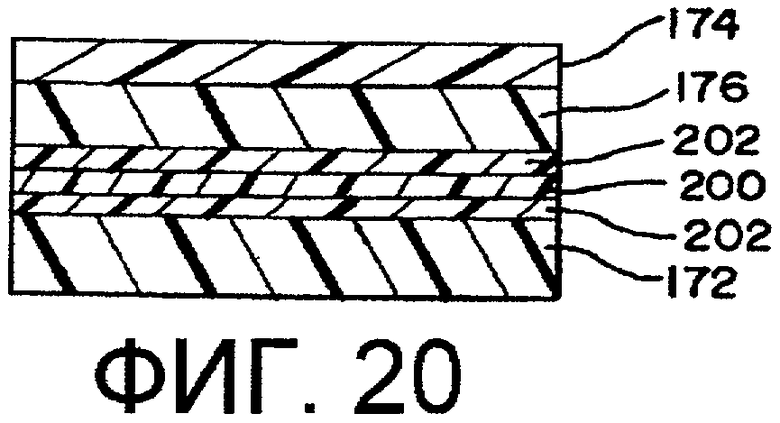
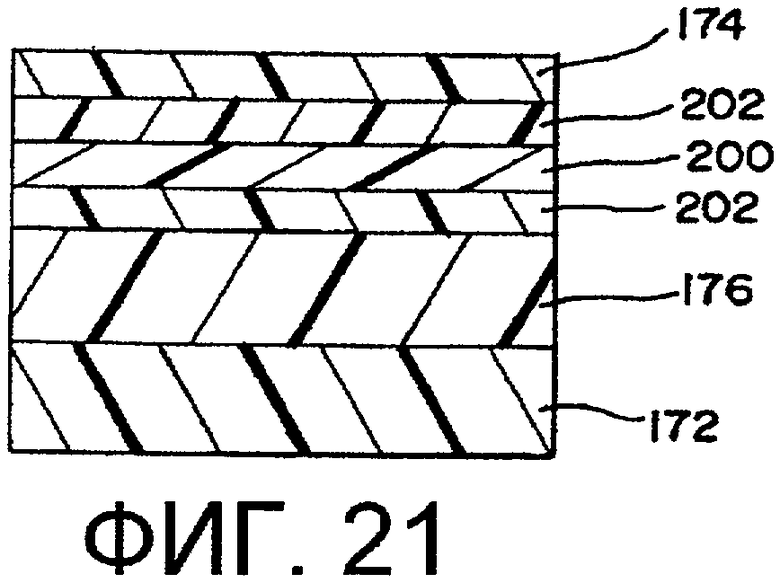
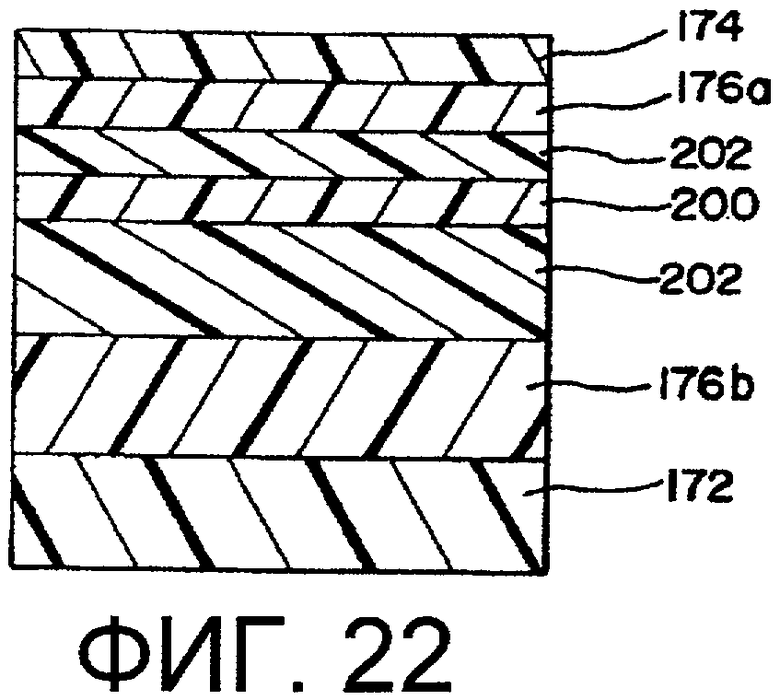
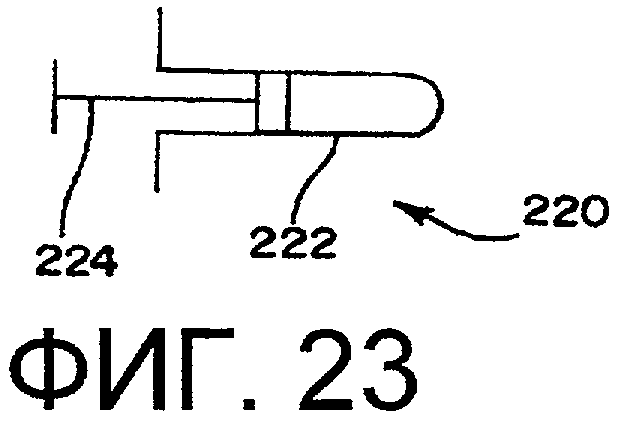
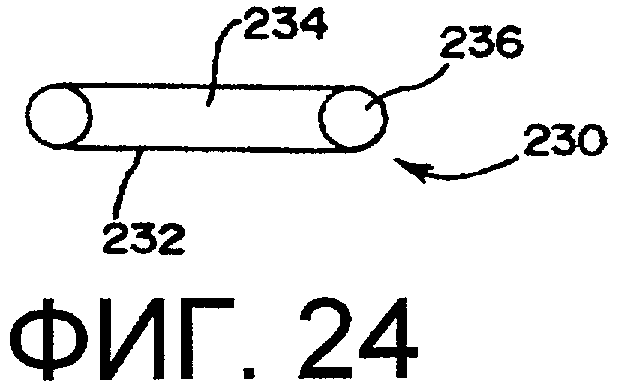
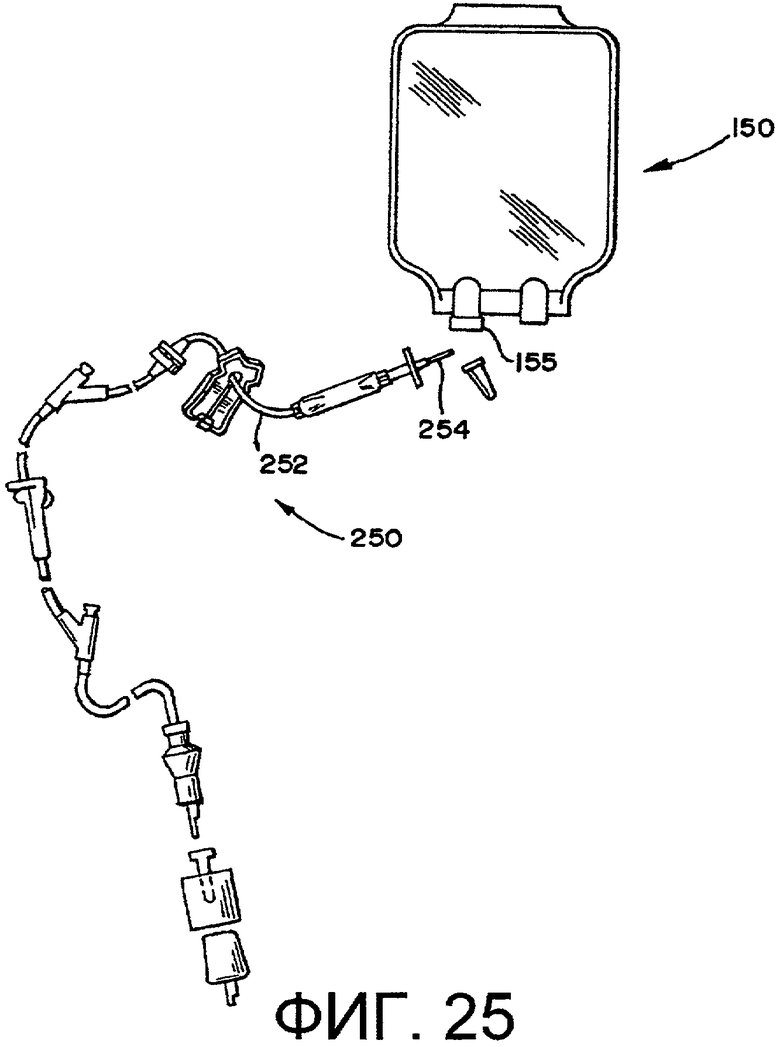
Изобретение относится к области стерилизации фармацевтических препаратов в виде дисперсии мелких частиц или капель и может быть использовано в фармацевтической промышленности. Способ стерилизации динамической дисперсионной системы, обладающей стабильным состоянием и нестабильным состоянием, включает воздействие на дисперсионную систему малых частиц или капель давления выше 0,25 МПа для повышения температуры системы до температуры выше 100°С в течение периода времени, достаточного для обеспечения стерильности системы, и снятие давления с указанной дисперсионной системы прежде, чем она перейдет в нестабильное состояние. При этом дисперсионная система включает дисперсию микро- и наночастиц в форме малых частиц или капель и имеет стабильное состояние и нестабильное состояние. Частицы или капли указанной дисперсионной системы включают фармацевтически активное соединение, связанное с эксципиентом, включающим поверхностно-активное вещество. Изобретение позволяет обеспечить стабилизацию ассоциатов фармацевтически активного соединения и эксципиента, представленных в виде дисперсионной системы частиц или капель, в процессе стерилизации при повышенной температуре. 2 н. и 35 з.п. ф-лы, 25 ил., 1 табл.
1. Способ стерилизации динамической дисперсионной системы, обладающей стабильным состоянием и нестабильным состоянием, при этом способ включает следующие стадии:
воздействие на дисперсионную систему малых частиц или капель давления выше 0,25 МПа для повышения температуры системы до температуры выше 100°С в течение периода времени, достаточного для обеспечения стерильности системы, где дисперсионная система включает дисперсию микро- и наночастиц в форме малых частиц или капель; при этом система малых частиц или капель имеет стабильное состояние и нестабильное состояние; и
снятия давления с дисперсионной системы малых частиц или капель прежде, чем система частиц или капель переходит в нестабильное состояние, где частицы или капли включают (i) фармацевтически активное соединение и (ii) эксципиент, при этом эксципиент связан с фармацевтически активным соединением, и эксципиент включает поверхностно-активное вещество.
2. Способ по п.1, в котором стадия воздействия давления повышает температуру системы до температуры выше 120°С.
3. Способ по п.1, в котором стадия воздействия давления на систему является импульсной.
4. Способ по п.1, в котором динамическая система дополнительно содержит носитель.
5. Способ по п.1, в котором стерильность устанавливается, когда вероятность нестерильности системы равна или меньше одной миллионной.
6. Способ по п.4, в котором носитель представляет собой водный раствор, органический растворитель или масло.
7. Способ по п.1, в котором частицы или капли имеют средний эффективный размер частиц меньше чем 100 мкм.
8. Способ по п.1, в котором частицы или капли имеют средний эффективный размер частиц меньше чем 10 мкм.
9. Способ по п.1, в котором частицы или капли имеют средний эффективный размер частиц меньше чем 7 мкм.
10. Способ по п.1, в котором частицы или капли имеют средний эффективный размер частиц меньше чем 3 мкм.
11. Способ по п.1, в котором частицы или капли имеют средний эффективный размер частиц меньше чем 1 мкм.
12. Способ по п.11, в котором частицы или капли имеют средний эффективный размер частиц меньше чем 500 нм.
13. Способ по п.1, в котором эксципиент связан с частицей или каплей по способу, выбранному из группы, состоящей из ковалентной связи с ними, ионной связи с ними, электронное притяжение к ним, адсорбирование на их поверхности и суспендирование в них.
14. Способ по п.1, в котором поверхностно-активное вещество выбрано из группы, состоящей из, по меньшей мере, одного из анионогенных, катионогенных, неионогенных и цвиттерионных поверхностно-активных веществ и биологических поверхностно-активных молекул.
15. Способ по п.1, включающий дополнительную стадию подвода тепла к системе дополнительным нагреванием.
16. Способ по п.15, в котором температуру системы повышают свыше 100°С на период времени свыше 1 мин.
17. Способ по п.16, в котором давление на систему оказывают импульсами изменяющегося давления.
18. Способ по п.1, дополнительно включающий обеспечение полимерного контейнера, содержащего малые частицы или капли, включающие фармацевтически активное соединение, где малые частицы или капли диспергированы в нестерильном носителе.
19. Способ по п.18, в котором полимерный контейнер выполнен из материала, не содержащего поливинилхлорид.
20. Способ по п.18, в котором контейнер выполнен из пленки, обладающей однослойной структурой или многослойной структурой.
21. Способ по п.18, в котором контейнер выполнен из полимеров.
22. Способ по п.18, в котором полимерный контейнер выполнен с возможностью подсоединения к элементу для перекачки текучей среды.
23. Способ по п.22, в котором элемент для перекачки текучей среды представляет собой эластичную трубку.
24. Способ по п.22, в котором элемент для перекачки текучей среды представляет собой комплект для введения текучей среды.
25. Способ по п.18, в котором контейнер выбран из группы, состоящей из контейнера, непроницаемого для текучих сред, шприца и герметичной эластичной трубки.
26. Способ по п.18, где полимерный контейнер содержит противоположные боковые стенки, при этом стенки имеют модуль упругости меньше чем приблизительно 275,8 МПа (40000 фунт/кв. дюйм).
27. Способ по п.1, где дисперсия основана на растворе на водной основе.
28. Способ по п.18, в котором тип контейнера выбран из группы, состоящей из контейнера для внутривенных вливаний, дренажного мешка, многокамерного контейнера, совместимого с белками контейнера, контейнера для клеточной культуры, контейнера для кровезаменителя, картриджа устройства для введения, цилиндра шприца и комплекта для введения текучей среды.
29. Способ по п.1, где распределение размера частиц или капель сохраняется неизменным при указанном способе стерилизации.
30. Способ по п.1, где фармацевтически активное соединение является слаборастворимым в воде.
31. Способ по п.30, где фармацевтически активное соединение имеет растворимость в воде ниже приблизительно 10 мг/мл.
32. Медицинское изделие, содержащее
гибкий полимерный контейнер, непроницаемый для текучих сред, содержащий стерильное фармацевтическое соединение, стерилизованное способом по п.1, и диспергированное в водном растворе, при этом соединение находится в форме частиц со средним размером меньше чем 1 мкм, и эксципиент связан с частицами, где раствор, по существу, не содержит модификаторов температуры помутнения.
33. Изделие по п.32, в котором контейнер выполнен из материала, не содержащего поливинилхлорид.
34. Изделие по п.33, в котором контейнер выполнен из пленки, имеющей однослойную структуру или многослойную структуру.
35. Изделие по п.33, в котором пленка содержит более чем 50 мас.% полиолефина.
36. Изделие по п.33, в котором пленка способна к укупорке в контейнере с использованием технологий радиочастотной сварки.
37. Изделие по п.33, в котором пленка имеет модуль упругости меньше чем 275,8 МПа (40000 фунт/кв. дюйм) при измерении по ASTM D-882.
| US 2002182107 A1, 05.12.2002 | |||
| СУБЛИНГВАЛЬНАЯ ИЛИ ТРАНСБУККАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2139051C1 |
| ВОДНАЯ СУСПЕНЗИЯ САБЕЛЮЗОЛА ДЛЯ ОРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1995 |
|
RU2141821C1 |
| ЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ПЛОХО РАСТВОРИМОЕ КРИСТАЛЛИЧЕСКОЕ ТЕРАПЕВТИЧЕСКОЕ ИЛИ ДИАГНОСТИЧЕСКОЕ СРЕДСТВО, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2124886C1 |
| US 5577369 A, 26.11.1996 | |||
| US 6267989 В1, 31.07.2001. | |||
Авторы
Даты
2010-06-20—Публикация
2004-09-22—Подача