Настоящее изобретение относится к производным циклического амина, способам их получения, фармацевтическим композициям, содержащим их, и их применению в медицине.
В WO 2004/005256 раскрываются некоторые производные циклических аминов в качестве антагонистов рецепторов тахикининов (особенно рецептора Nk1) и в качестве селективных ингибиторов обратного захвата серотонина (SSRI). Указанные соединения используют для лечения нарушений ЦНС и психотических расстройств, в частности, для лечения или профилактики депрессивных состояний и/или для лечения тревоги (страха).
Однако в вышецитированном документе не имеется ни раскрытия, ни какого-либо упоминания в отношении соединения, заявляемого в настоящем описании.
Таким образом, настоящее изобретение относится к соединениям формулы (I)
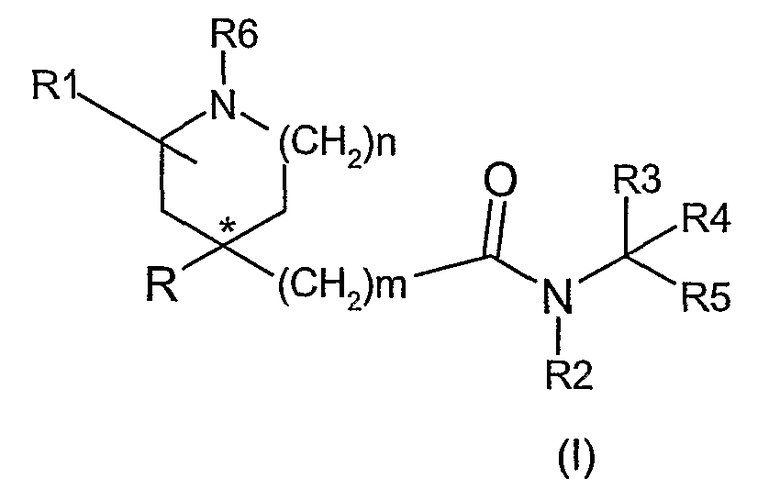
где R представляет радикал, выбранный из
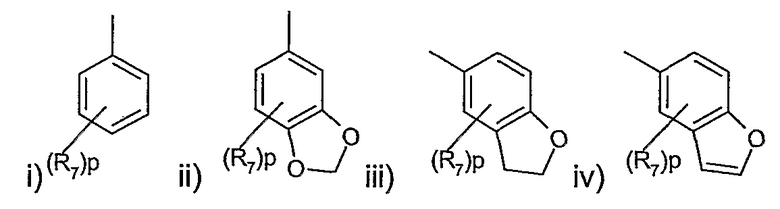
в которых R7 представляет галоген, циано, С1-4алкил, С1-4алкокси, трифторметил или трифторметокси;
p равно целому числу от 0 до 3;
R1 представляет водород, галоген, циано, С2-4алкенил, С1-4алкил, необязательно замещенный галогеном, циано или С1-4алкокси;
R2 представляет водород или С1-4алкил;
R3 и R4 независимо представляют водород, С1-4алкил или R3 вместе с R4 образуют С3-7циклоалкил;
R5 представляет
фенил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано, С1-4алкокси, трифторметокси, галогена или (SO)rC1-4алкила,
нафтил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано, С1-4алкокси, трифторметокси, галогена или (SO)rC1-4алкила,
9-10-членную конденсированную бициклическую гетероциклическую группу, замещенную 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано, С1-4алкокси, трифторметокси, галогена или (SO)rC1-4алкила, или
R5 представляет 5- или 6-членную гетероарильную группу, замещенную 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано, С1-4алкокси, трифторметокси, галогена или (SO)rC1-4алкила;
R6 представляет водород или (CH2)qR8;
R8 представляет водород, C3-7циклоалкил, С1-4алкокси, амин, С1-4алкиламин, (С1-4алкил)2амин, OC(О)NR9R10 или C(О)NR9R10;
R9 и R10 независимо представляют водород, С1-4алкил или С3-7циклоалкил;
m равно нулю или 1;
n равно 1 или 2;
q представляет целое число от 1 до 4;
r равно 1 или 2;
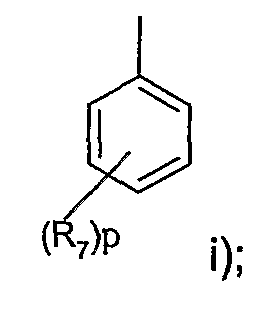
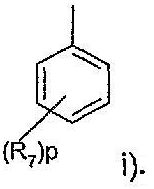
при условии, что когда R5 представляет фенил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано, С1-4алкокси, трифторметокси, галогена или (SO)rC1-4алкила, R не является радикалом i)
или их фармацевтически приемлемым солям или сольватам.
Другой вариант изобретения предлагает соединения формулы (I) или их фармацевтически приемлемые соли и сольваты, где R представляет радикал, выбранный из
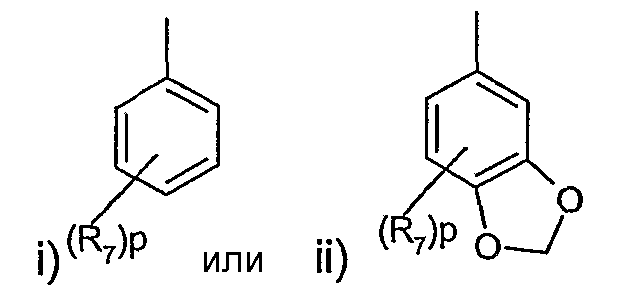
в которых R7 представляет галоген, циано, С1-4алкил, С1-4алкокси, трифторметил или трифторметокси;
p означает целое число от 0 до 3;
R1 представляет водород, галоген, циано, C1-4алкил, необязательно замещенный галогеном, циано, С1-4алкокси;
R2 представляет водород или С1-4алкил;
R3 и R4 независимо представляют водород, С1-4алкил или R3 вместе с R4 образуют С3-7циклоалкил;
R5 представляет замещенный фенил, замещенный нафтил, замещенную 9-10-членную конденсированную бициклическую гетероциклическую группу или замещенную 5- или 6-членную гетероарильную группу, и эти указанные группы замещены 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано, С1-4алкокси, трифторметокси, галогена или (SO)rC1-4алкила;
R6 представляет водород или (CН2)qR8;
R8 представляет водород, С3-7циклоалкил, С1-4алкокси, амин, С1-4алкиламин, (С1-4алкил)2амин, OC(О)NR9R10 или C(О)NR9R10;
R9 и R10 независимо представляют водород, С1-4алкил или С3-7циклоалкил;
m представляет нуль или целое число от 1 до 4;
n равно 1 или 2;
q представляет целое число от 1 до 4;
r равно 1 или 2;
при условии, что когда R5 представляет фенил, замещенный 1-3 группами, выбранными из трифторметила, С1-4алкила, циано, С1-4алкокси, трифторметокси, галогена или (SO)rC1-4алкила, R не является радикалом i)
Подходящие фармацевтически приемлемые соли соединений общей формулы (I) включают аддитивные соли кислоты, образованные с фармацевтически приемлемыми органическими или неорганическими кислотами, например гидрохлориды, гидробромиды, сульфаты, алкил- или арилсульфонаты (например, метансульфонаты или п-толуолсульфонаты), фосфаты, трифторацетаты, ацетаты, цитраты, сукцинаты, тартраты, лактаты, малаты, фумараты и малеаты.
Сольваты могут, например, быть гидратами.
В дальнейшем ссылки на соединение в соответствии с изобретением включают как соединения формулы (I), так и их фармацевтически приемлемые аддитивные соли кислоты и их фармацевтически приемлемые сольваты.
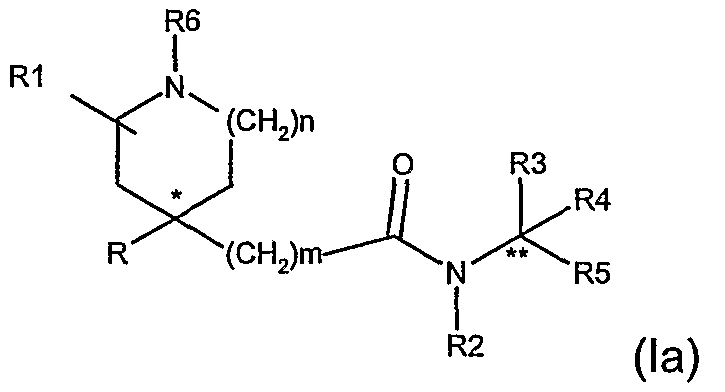
Для специалистов в данной области очевидно, что соединения формулы (I), когда n равно 1 и R1 не является водородом или когда n равно 2, содержат, по крайней мере, один асимметричный атом углерода (а именно, атом углерода, показанный * в формуле (I)), и могут быть представлены формулой (1a) и (1b).
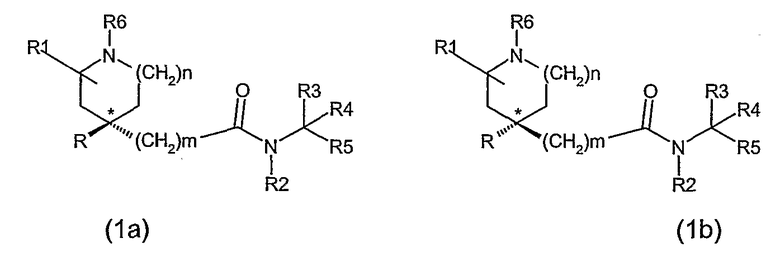
Клиновидная связь указывает, что связь расположена над плоскостью бумаги. Пунктирная связь указывает, что связь расположена ниже плоскости бумаги.
По крайней мере, два асимметричных атома углерода присутствуют в соединениях формулы (I), когда R1 является отличным от водорода (а именно, атом углерода, показанный как * в формуле (I), и атом углерода, с которым связана группа R1), и соединения могут быть представлены формулой (1а), (1b), (1с) и (1d).
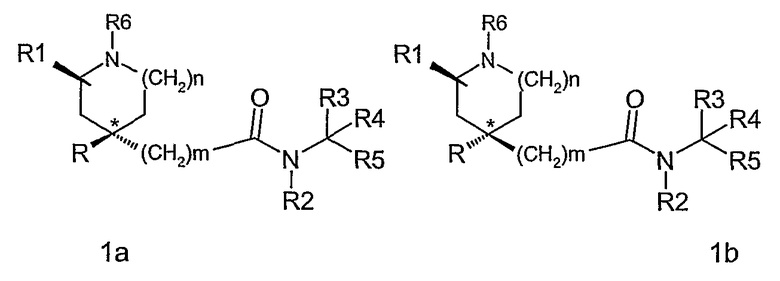
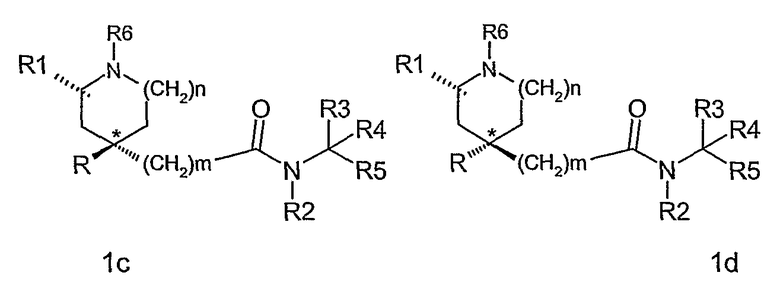
Для соединений по данному изобретению, где m равно 1, конфигурацию асимметричных атомов углерода соединений, показанных в формулах 1а и 1d, в дальнейшем обозначают как син-изомер, и в формулах 1b и 1c как антиизомер.
Для соединений по данному изобретению, где m равно 0, конфигурацию асимметричных атомов углерода соединений, показанных в формулах 1b и 1c, в дальнейшем обозначают как син-изомер, и в формулах 1a и 1d как антиизомер.
Возможны и другие асимметричные атомы углерода, когда R3 и R4 не являются одной и той же группой, а именно атом углерода, идентифицированный как ** в формуле (1a)
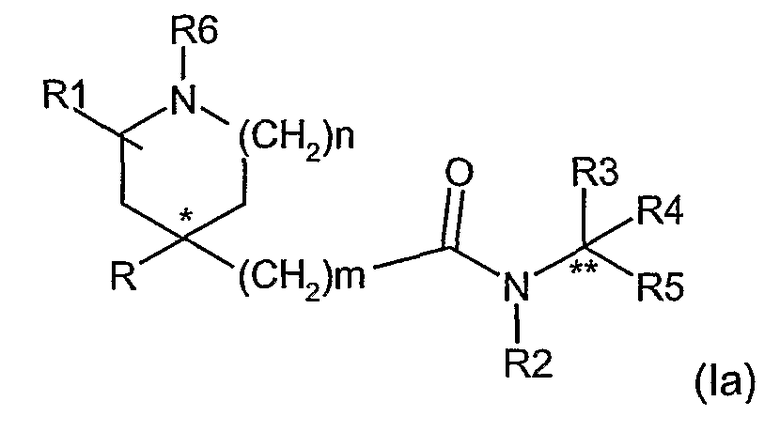
Таким образом, например, когда R1 представляет группу, отличную от водорода, и R3 и R4 не являются одной и той же группой, по крайней мере, три асимметричных атома углерода присутствуют в соединениях формулы (I) и они могут быть представлены формулой (1e) (1f), (1g), (1h), (1i), (1l), (1m) и (1n).
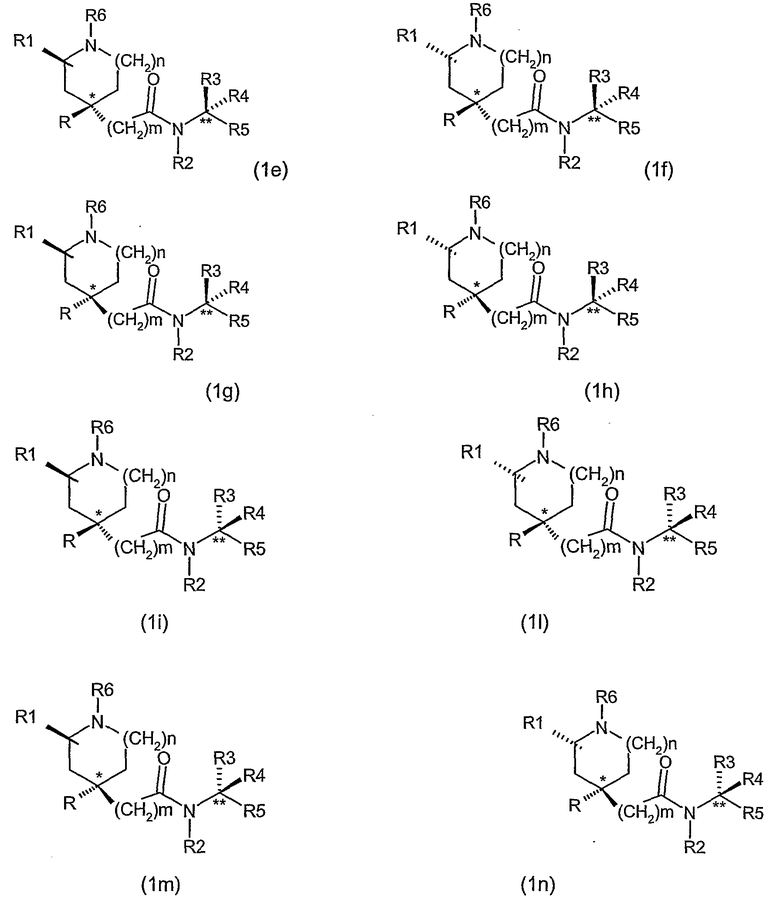
Необходимо иметь в виду, что все стереоизомерные формы, включая все энантиомеры и диастереоизомеры и их смеси, входят в объем данного изобретения и ссылки на соединения формулы (I) включают все стереоизомерные формы, если не оговорено особо.
Кроме того, соединения формулы (I) могут существовать в одной или нескольких кристаллических формах и кристаллические формы соединений структуры (I) могут существовать в виде полиморфных форм, которые также входят в настоящее изобретение.
Настоящее изобретение также включает меченные изотопом соединения, которые идентичны соединениям, описанным в формулах I и после, за исключением того факта, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречаемого в природе. Примеры изотопов, которые могут быть включены в соединения по данному изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, йода и хлора, такие как 3Н, 11C, 14C, 18F, 123I и 125I.
Соединения по данному изобретению и фармацевтически приемлемые соли указанных соединений, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, также входят в объем настоящего изобретения. Меченные изотопом соединения по изобретению, например соединения, в которые включены радиоактивные изотопы, такие как 3Н, 14C, используют в анализах распределения лекарственного средства и/или субстрата в тканях. Изотопы, тритированный, т.е. 3Н, и углерод-14, т.е. 14С, особенно предпочтительны из-за их легкости получения и обнаружительной способности. В частности, изотопы 11С и 18F используют в PET (позитрон-эмиссионная томография), и изотоп 125I, в частности, используют в SPECT (однофотонная эмиссионная компьютерная томография), все используют для визуализации (получения изображения) головного мозга. Кроме того, замена более тяжелыми изотопами, такими как дейтерий, т.е. 2Н, может предоставить определенные терапевтические преимущества, вытекающие из более высокой метаболической стабильности, например увеличение in vivo полупериода существования или снижение требований к дозировке и, следовательно, может оказаться предпочтительной в некоторых обстоятельствах. Меченные изотопом соединения формулы I и последующие по данному изобретению можно получить, осуществляя способы, раскрытые на схемах и/или в примерах, представленных ниже, заменяя немеченный изотопом реагент на легко доступный меченный изотопом реагент.
Используемый в описании термин “C1-4алкил” как группа или часть группы относится к прямой или разветвленной алкильной группе, содержащей от 1 до 4 углеродных атомов; примеры таких групп включают метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил.
Термин “С2-4алкенил” относится к прямой или разветвленной алкиленовой группе, содержащей от 2 до 4 углеродных атомов; примеры таких групп включают этенил, 1-пропенил, аллил, бутенил и т.п.
Термин “галоген” относится к фтору, хлору, брому или йоду.
Термин “С3-7циклоалкильная группа” означает неароматическую моноциклическую углеводородную циклическую структуру из 3-7 углеродных атомов, такую как, например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин “С1-4алкоксигруппа” может представлять алкоксигруппу с прямой или разветвленной цепью, например метокси, этокси, пропокси, проп-2-окси, бутокси, бут-2-окси или метилпроп-2-окси.
Когда R5 представляет 5- или 6-членную гетероарильную группу согласно данному изобретению, эта группа включает фуранил, тиофенил, пирролил, имидазолил, тиазолил, оксазолил, пиразолил, изоксазолил, изотиазолил, 1,2,3-триазолил, 1,2,3-оксадиазолил, 1,2,3-тиадиазолил, 1,2,4-триазолил, 1,3,4-оксадиазолил, 1,3,4-тиадиазолил, 1,2,5-оксадиазолил, 1,2,5-тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,2,4-оксадиазолил, 1,2,5-триазинил или 1,3,5-триазинил и т.п.
Термин “9-10-членная конденсированная бициклическая гетероциклическая группа” относится к 5,6/6,5- или 6,6- бициклической структуре, содержащей, по крайней мере, один гетероатом, выбранный из кислорода, серы или азота, которая может быть насыщенной, ненасыщенной или ароматической. Термин “9-10-членная конденсированная бициклическая гетероциклическая группа” также относится к фенилу, конденсированному с одной 5- или 6-членной гетероциклической группой. Примеры таких групп включают бензофуранил, бензотиофенил, индолил, бензоксазолил, 3Н-имидазо[4,5-с]пиридинил, дигидрофтазинил, 1Н-имидазо[4,5-с]пиридин-1-ил, имидазо[4,5-b]пиридил, 1,3-бензо[1,3]диоксолил, 2H-хроманил, изохроманил, 5-оксо-2,3-дигидро-5H-[1,3]тиазоло[3,2-a]пиримидил, 1,3-бензотиазолил, 1,4,5,6-тетрагидропиридазиил, 1,2,3,4,7,8-гексагидроптеридинил, 2-тиоксо-2,3,6,9-тетрагидро-1H-пурин-8-ил, 3,7-дигидро-1H-пурин-8-ил, 3,4-дигидропиримидин-1-ил, 2,3-дигидро-1,4-бензодиоксинил, бензо[1,3]диоксолил, 2H-хроменил, хроманил, 3,4-дигидрофталазинил, 2,3-дигидро-1H-индолил, 1,3-дигидро-2H-изоиндол-2-ил, 2,4,7-триоксо-1,2,3,4,7,8-гексагидроптеридинил, тиено[3,2-d]пиримидинил, 4-оксо-4,7-дигидро-3H-пирроло[2,3-d]пиримидинил, 1,3-диметил-6-оксо-2-тиоксо-2,3,6,9-тетрагидро-1H-пуринил, 1,2-дигидроизохинолинил, 2-оксо-1,3-бензоксазолил, 2,3-дигидро-5H-1,3-тиазоло[3,2-a]пиримидинил, 5,6,7,8-тетрагидрохиназолинил, 4-оксохроманил, 1,3-бензотиазолил, бензимидазолил, бензотриазолил, пуринил, фурилпиридил, тиофенилпиримидил, тиофенилпиридил, пирролилпиридил, оксазолилпиридил, тиазолилпиридил, 3,4-дигидропиримидин-1-ил, имидазолилпиридил, хинолиил, изохинолинил, хиназолинил, хиноксалинил, нафтиридинил, пиразолил[3,4]пиридин, 1,2-дигидроизохинолинил, циннолинил, 2,3-дигидробензо[1,4]диоксин-6-ил, 4,5,6,7-тетрагидробензо[b]тиофенил-2-ил, 1,8-нафтиридинил, 1,6-нафтиридинил, 3,4-дигидро-2H-1,4-бензотиазин, 4,8-дигидроксихинолинил, 1-оксо-1,2-дигидроизохинолинил или 4-фенил-[1,2,3]тиадиазолил и т.п.
В соединениях формулы (I), где n равно 1, группа R1 может быть в положении 2, 3, 5 или 6 пиперидинового кольца, как представлено в формуле (1b). Соединения, в которых R1 находится в положении 2 или 6, являются предпочтительными.
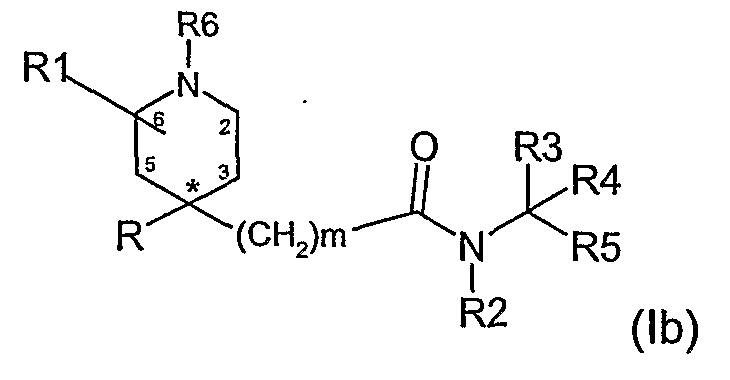
В соединениях формулы (I), где n равно 2, группа R1 может быть в положении 2, 3, 4, 6 или 7 кольца, как представлено в формуле (1с).
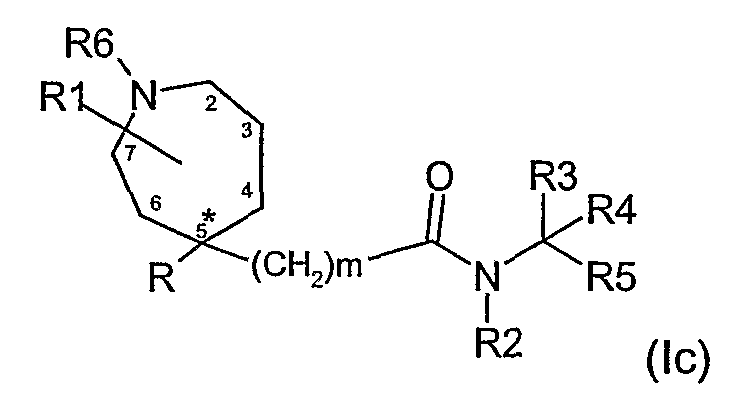
Для соединений формулы (I) n предпочтительно равно 1.
Для соединений формулы (I) m предпочтительно равно 1.
R является предпочтительно фенилом, в котором R7 представляет предпочтительно галоген (например, фтор или хлор), циано, трифторметил, С1-4алкокси (например, метокси) или С1-4алкил (например, метил) и в пределах этого класса p равно предпочтительно 0 или целому числу от 1 до 2 или R представляет предпочтительно группу, выбранную из
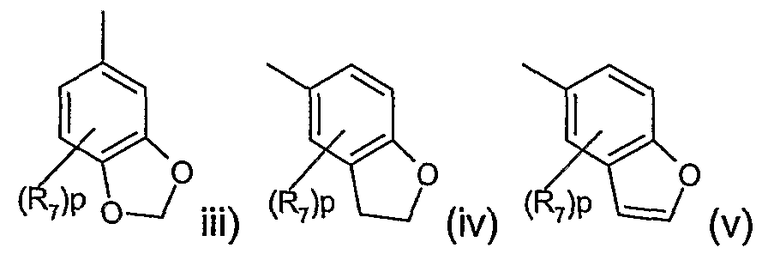
где p равно 0.
R1 представляет предпочтительно водород, С2-4алкенил (например, этенил), галоген (например, фтор) или С1-4алкил (например, метил). Внутри этого класса те соединения, в которых R1 находится в положении 1 или 2 пиперидинового кольца, являются предпочтительными.
R2 является предпочтительно водородом или метилом.
R3 является предпочтительно водородом или метилом.
R4 является предпочтительно водородом или метилом.
Когда R5 представляет замещенный фенил, то он предпочтительно замещен одной или 2 группами, выбранными из галогена (например, фтор, бром или хлор), циано, трифторметила или С1-4алкила (например, метил).
Когда R5 представляет замещенный нафтил, то это предпочтительно 1-нафтильная группа, замещенная одной или 2 группами, выбранными из галогена (например, фтор, бром или хлор), циано, трифторметила или С1-4алкила (например, метил).
Когда R5 представляет замещенную 9-10-членную конденсированную бициклическую гетероциклическую группу, то это предпочтительно бензофуранил (например, бензофуран-7-ил или бензофуран-4-ил), бензотиофенил (например, бензотиофен-4-ил или бензотиофен-7-ил), индолил (индо-4-ил или индол-7-ил) или бензоксазолил, и эти указанные группы замещены одной группой, выбранной из галогена (например, фтор, бром или хлор), циано, трифторметила или С1-4алкила (например, метил).
Когда R5 представляет замещенную 5- или 6-членную гетероарильную группу, то это предпочтительно фуранил (например, фуран-2-ил или фуран-3-ил), тиофенил или пирролил, и эти указанные группы замещены одной группой, выбранной из галогена (например, фтор, бром или хлор), циано, трифторметила или С1-4алкила (например, метил).
R6 является предпочтительно водородом или С1-4алкилом (например, метил).
R5 представляет, более предпочтительно, фенил, замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила, нафтил, замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила, бензофуранил, замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила, или R5 представляет фуранил, замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила.
Предпочтительный класс соединений формулы (I) включает соединения, где n и m равны 1.
Другой предпочтительный класс соединений представляет класс, где R2, R3 и R4 представляют независимо водород или метил.
Другим предпочтительным классом соединений является класс, где n равно 1, m равно 1, R3 и R4 представляют независимо водород или метил и R6 представляет водород или С1-4алкил.
Предпочтительная группа соединений формулы (I) включает соединения, где n равно 1, m равно 1, R2 представляет водород или метил, R3 представляет водород, R4 представляет водород или метил, R6 представляет водород или метил и R1 представляет водород, С2-4алкенил, галоген или С1-4алкил в положении 1 или 2 пиперидинового кольца.
Другая предпочтительная группа соединений формулы (I) включает соединения, где n и m равно 1, R2 представляет водород или метил, R3 представляет водород, R4 представляют водород или метил, R5 представляет фенил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), нафтил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), бензофуранил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), или R5 представляет фуранил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), или R5 представляет бензофуранил (замещенный фтором, бромом, хлором, циано или метилом), R6 представляет водород или метил и R1 представляет водород, С2-4алкенил, С1-4алкил или галоген в положении 1 или 2 пиперидинового кольца.
Другая предпочтительная группа соединений формулы (I) включает соединения, где n и m равно 1, R2 представляет водород или метил, R3 представляет водород, R4 представляют водород или метил, R5 представляет фенил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), нафтил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), бензофуранил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), или R5 представляет фуранил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), или R5 представляет бензофуранил (замещенный фтором, бромом, хлором, циано или метилом), R6 представляет водород или метил, R1 представляет водород, С2-4алкенил, С1-4алкил или галоген в положении 1 или 2 пиперидинового кольца и R представляет фенил, в котором R7 представляет галоген, трифторметил, циано, С1-4алкокси или С1-4алкил и p равно 0 или целому числу от 1 до 2 или R представляет группу, выбранную из
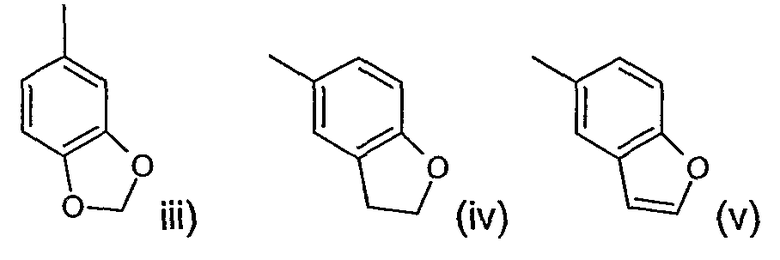
где р равно 0.
Другая предпочтительная группа соединений формулы (I) включает соединения, где n и m равны 1, R2 представляет водород или метил, R3 представляет водород, R4 представляет водород или метил, R5 представляет фенил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), нафтил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), бензофуранил (замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила), или R5 представляет бензофуранил (замещенный фтором, бромом, хлором, циано или метилом), R6 представляет водород или метил, R1 представляет водород, С2-4алкенил, С1-4алкил или галоген в положении 1 или 2 пиперидинового кольца и R представляет фенил, в котором R7 представляет галоген, трифторметил, циано, С1-4алкокси или С1-4алкил и р равно 0 или целому числу от 1 до 2, или R представляет группу, выбранную из
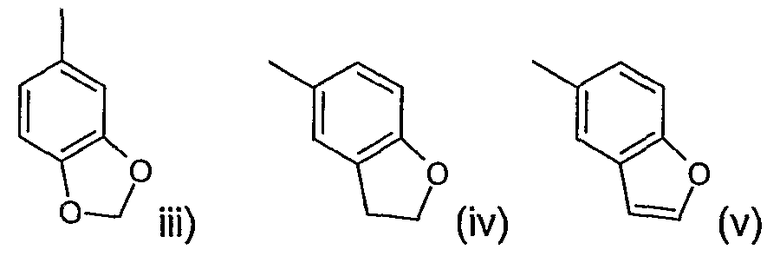
где р равно 0.
Следующая предпочтительная группа соединений формулы (I) включает соединения, где n и m равны 1, R2 представляет водород или метил, R3 представляет водород, R4 представляет водород или метил, R5 представляет фенил, замещенный одной или двумя группами, выбранными из фтора, брома или хлора, циано или метила, 1-нафтил, замещенный одной или двумя группами, выбранными из фтора, брома или хлора, циано или метила, или R5 представляет бензофуран-7-ил, замещенный фтором, бромом или хлором, циано или метилом, R6 представляет водород или метил, R1 представляет водород или этенил, фтор или метил в положении 1 или 2 пиперидинового кольца и R представляет фенил, в котором R7 представляет фтор, метокси, циано или метил и р равно 0 или целому числу от 1 до 2 или R представляет группу, выбранную из
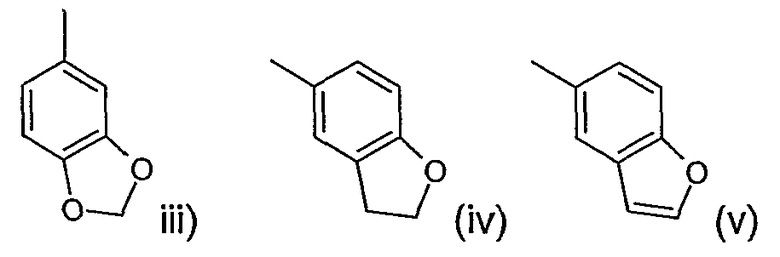
где р равно 0.
Конкретные предпочтительные соединения согласно данному изобретению представляют
N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-N-метил-2-(1-метил-4-фенил-4-пиперидинил]ацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-N-метил-2-(1-метил-4-фенил-4-пиперидинил]ацетамид (энантиомер 2);
2-[4-(1-бензофуран-5-ил)-1-метил-4-пиперидинил]-N-[1-(3-хлор-1-нафталинил)этил]-N-метилацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-N-метил-2-{1-метил-4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид (син-изомер 2, цепной энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил)-N-метилацетамид (син-изомер 2, цепной энантиомер 1);
или их фармацевтически приемлемые соли или сольваты.
Следует иметь в виду, что химические соединения могут быть названы различными способами и в соответствии с различными принятыми условностями наименования.
Соединения по данному изобретению являются антагонистами рецепторов тахикининов, включая вещество Р и другие нейрокинины, как in vitro, так и in vivo, и поэтому имеют применение для лечения состояний, опосредованных тахикининами, включая вещество Р и другие нейрокинины.
Тахикинины представляют семейство пептидов, которые имеют общую последовательность (Phe-X-Gly-Leu-Met-NH2), на С-конце. Они активно участвуют в физиологии как низших, так и высших жизненных [биологических] форм. У млекопитающих основные тахикинины представляют вещество Р (SP), нейрокинин A (NKA) и нейрокинин B (NKB), которые действуют как нейромедиаторы (нейротрансмиттеры) и нейромодуляторы. Тахикинины млекопитающих могут вносить свой вклад в патофизиологию ряда заболеваний человека.
Было идентифицировано три типа рецепторов тахикининов, а именно NK1(SP-предпочитающие), NK2 (NKA-предпочитающие) и NK3 (NKB-предпочитающие), которые распространены по всей центральной нервной системе (ЦНС) и периферической нервной системе.
В частности, соединения по данному изобретению являются антагонистами рецепторов NK1.
Кроме того, соединения по данному изобретению имеют активность как селективные ингибиторы обратного захвата серотонина (в дальнейшем называемые SSRI) и поэтому являются полезными для лечения состояний, опосредованных селективным ингибированием белка-транспортера обратного захвата серотонина.
Таким образом, соединения по изобретению объединяют в себе двойную активность как антагонисты тахикининов, включая вещество Р и другие нейрокинины, и как SSRI. В частности, соединения по изобретению объединяют в себе двойную активность как антагонисты рецептора NK1 и как SSRI.
Сродство к связыванию с NK1-рецепторами было определено in vitro с использованием сцинтилляционного проксимального анализа (SPA), измеряя способность соединений вытеснять [125I]Tyr8-вещество Р (SP) c рекомбинантных человеческих рецепторов NK1, стабильно экспрессируемых в клеточных мембранах яичника китайского хомячка (CHO), полученных, используя модификацию метода, описанного в Beattie D.T. et al. (Br. J. Pharmacol, 116:3149-3157, 1995). Кратко, шарики из полистирола Leadseeker WGA-SPA (Amersham Biosciences) смешивали с клеточными мембранами при соотношении шарик/мембрана 50:1 (мас./мас.) в буфере для анализа (75 мМ Трис рН 7,8, 75 мМ NaCl, 4 мМ MnCl2, 1 мМ EDTA, 0,05% Chaps, 1 мМ PMSF). Смесь помещали на лед в течение 30 мин, чтобы позволить образоваться комплексу мембрана/шарик, прежде чем добавить BSA (бычий сывороточный альбумин) до конечной концентрации 1%. После дополнительной инкубации на льду в течение 30 мин комплекс шарик/мембрана промывали дважды и суспендировали в буфере для анализа. Затем добавляли [125I]Tyr8-вещество Р (2200 Ки/ммоль, PerkinElmer) к комплексу шарик/мембрана при конечной концентрации 0,4 нМ. Затем 30 мкл конечной смеси дозировали в каждую лунку 384-луночного планшета Nalgen NUNC, содержащую 1 мкл соединения, предварительно распределенного в ДМСО. Затем планшеты герметизировали и кратковременно центрифугировали при 1100 об/мин. После инкубации при вибрации при комнатной температуре в течение 3 час планшеты центрифугировали в течение 2 мин при 1100 об/мин и измеряли в преобразователе изображения Viewlux (PerkinElmer) в течение 5 мин с фильтром 618-нм. Ингибирование связывания [125I]Tyr8-вещества Р с NK1-рецепторами измеряли по уменьшению люминесцентного сигнала. Значения IC50 каждого соединения определяли по кривой ингибирования, полученной для 11 точек 3× разбавления. Значения рKi рассчитывали, используя KD [125I]Tyr8-вещества Р, определенную в отдельном эксперименте.
Для предпочтительных соединений по изобретению также было определено сродство к связыванию с NK1-рецептором in vitro, используя обычные методы фильтрации, измеряя способность соединений вытеснять [3Н]-вещество P (SP) с рекомбинантных человеческих NK1-рецепторов, экспрессируемых в клеточных мембранах яичника китайского хомячка (CHO), как описано выше. Кратко, связывание лиганда выполняли в 0,2 мл 50 мМ HEPES, pH 7,4, содержащем 3 мМ MnCl2, 0,02% БСА (BSA), 0,5 нМ [3H]-вещество P (30-56 Ки/ммоль Amersham), конечная концентрация мембранного белка 30-50 мкг/мл, и испытуемые соединения. Инкубацию проводили при комнатной температуре в течение 40 мин и останавливали фильтрацией. Неспецифическое связывание определяли, используя избыточное количество вещества Р (1 мкМ), и оно составляет около 6-10% от общего связывания.
Кроме того, предпочтительные соединения по данному изобретению были охарактеризованы в функциональном тесте, заключающемся в определении их воздействия на ингибирование увеличения внутриклеточного кальция, индуцируемого SP в человеческих NK1-CHO клетках, используя метод FLIPR. Кратко, после 15-минутной инкубации с индикатором цитоплазматического кальция Fluo-4 АМ (2 мкМ) клетки промывали и инкубировали в отсутствие или присутствии трех или большего числа различных концентраций антагониста в течение 60 мин при 37°С в сбалансированном солевом растворе Хэнкса с 20 мМ Hepes и затем строили некумулятивные кривые доза-ответ SP (2пM-300нM). Эффективность антагониста (значение рКВ) рассчитывали исходя из Schild's анализа.
Действие соединений по данному изобретению на рецептор NK1 и/или транспортер серотонина может быть определено, используя обычные животные модели.
Так, способность связываться с NK1 рецептором и/или транспортером серотонина определяли, используя модель беспокойства на животных - крики детенышей морской свинки при их отделении, как описано Pettijohn, Psychol. Rep., 1979 and Rupniak et al., Neuropharmacology, 2000.
Проявление страх-подавляющей активности при введении соединения по изобретению может быть продемонстрировано в тесте на адаптацию к среде на модели песчанки по способу, описанному Cheeta et al. (Cheeta S. et al., 2001. Brain Research 915: 170-175).
Сродство к связыванию с SERT было определено in vitro по способности соединений вытеснять [3Н]-циталопрам с клеточных мембран hSERT-LLCPK. Для реакции связывания конечную концентрацию 0,25 нМ [3Н]-циталопрама (84 Ки/ммоль, Amersham) инкубировали с 3-5 мкг/мл клеточной мембраны и соединением, подлежащим испытанию, при различных концентрациях (7 концентрационных точек, каждая в двух экземплярах) в 50 мМ Трис HCl, рН 7,7, содержащем 120 мМ NaCl, 5 мМ KCl, 10 мкМ паргилина и 0,1% аскорбиновой кислоты. Реакцию проводили в течение 120 мин при 22°С и обрывали посредством кассетного фильтра (юнифильтра GF/B) (предварительно пропитанного в 0,5% PEI), используя харвестер клеток (Tomtec). К каждому фильтрованному пятну добавляли сцинтилляционную жидкость и определяли радиоактивность, используя сцинтилляционный счетчик (TopCount (Packard)). Неспецифическое связывание определяли, используя пароксетин (10 мкМ), и оно составляет около 2-5% от общего связывания. Эксперименты по конкурентному связыванию проводили, дублируя определение для каждой точки. Для обработки данных по конкурентному связыванию использовали Пакет программ Msat601. Значения IC50 переводили в значения Ki, используя уравнение Cheng-Prusoff и используя KD [3Н]-циталопрама, определенную в отдельных экспериментах.
Для предпочтительных соединений по данному изобретению была определена in vitro ингибирующая активность соединений в отношении человеческого транспортера серотонина (hSERT), используя свиные LLCPK клетки (ATCC), устойчиво трансфицированные с hSERT (hSERT-LLCPK). Клетки помещали на 96-луночные планшеты (10000 клеток/лунку). Через 24 часа клетки промывали в буфере поглощения (сбалансированный солевой раствор Хэнкса+20 мМ Hepes) и предварительно инкубировали в течение 10 мин при 30°C с 50 мкл буфера, содержащего испытуемые соединения. 50 мкл 50нМ раствора [3H]-серотонина (5-HT) (конечная концентрация: 25 нМ [3H]-5-HT) добавляли и планшеты инкубировали при 30°C в течение 7 мин, во время которых клетки поглощают меченный радиоактивным изотопом 5-HT. Удаление раствора и быстрое промывание клеток холодным буфером обрывало поглощение. Затем измеряли количество радиоактивного 5-НТ, вовлеченного в клетки, добавляя сцинтилляционный коктейль непосредственно на клетки и считывая планшет в Top Count. Полученные данные подвергали цифровой обработке, получая значения pIC50 ингибиторов поглощения.
Соединения по изобретению используют для лечения расстройств ЦНС и психотических расстройств, в частности для лечения или профилактики депрессивных состояний и/или для лечения страха, определенных в, но не ограничиваясь этим, Diagnostic Statistical of Mental Disorder (DSM) IV edition edit by American Psychiatric Association and International Classification Diseases 10th revision (ICD10).
Так, например, депрессивное состояние включает эпизоды подавленного настроения, депрессивные нарушения, биполярные нарушения, другое настроение, психотические расстройства, регулируемые расстройства, предменструальное и расстройство (дисфория), характеризуемое чувством недовольства или внутреннего дискомфорта (PMDD). Так, например, эпизоды подавленного настроения включают основные депрессивные эпизоды и смешанные эпизоды. Депрессивные нарушения включают основное депрессивное расстройство (MDD), однократные или рецидивирующие эпизоды (с или без психотических признаков, кататонических признаков, меланхолических признаков, атипических признаков; депрессии, выражающейся в патологическом страхе, или депрессии послеродового периода), дистимическое расстройство (с ранним или поздним проявлением и с или без атипических признаков) и депрессивное нарушение, которое не определено особо. Биполярные нарушения включают биполярные нарушения I и II типа, циклотимическое расстройство и биполярное нарушение, которое не определено особо. Другое настроение, психотические и регулируемые расстройства включают нейропатическую депрессию; нарушения настроения, обусловленные общим состоянием здоровья, включая, но не ограничиваясь ими, инфаркт миокарда, диабет, выкидыш, аборт, слабоумие типа Альцгеймера (с ранним или поздним проявлением) с симптомом подавленного настроения, сосудистую деменцию с симптомом подавленного настроения; нарушения настроения, индуцированные злоупотреблением веществ (лекарственных средств), включая, но не ограничиваясь ими, депрессию, вызванную спиртом, амфетаминами, кокаином, галлюциногенами; средствами, применяемыми при ингаляции; опиоидами, фенциклидинами, седативными средствами, снотворными средствами, анксиолитиками и другими веществами; шизоаффективное нарушение депрессивного типа; регулируемое расстройство с симптомом подавленного настроения; регулируемое расстройство с симптомами смешанного типа, тревожного состояния и угнетенного настроения.
Термин “тревога (беспокойство)” включает приступы беспричинной тревоги, агорафобию, состояния тревоги, регулируемые расстройства и расстройство, обусловленное страхом предстоящей разлуки; и предменструальное нарушение, характеризуемое чувством недовольства или внутреннего дискомфорта (PMDD). Так, например, состояния тревоги включают паническое расстройство с или без симптомов агорафобии, агорафобию без предшествующих симптомов приступов паники, специфическую фобию, социальную фобию (нарушение, связанное с социальной тревогой), обсессивно-компульсивное нарушение, острые и посттравматические стрессовые расстройства, расстройства генерализованной тревоги; невроз тревоги (тревожное состояние), обусловленный общим состоянием здоровья; тревожное состояние, вызванное злоупотреблением веществ (лекарственных средств), тревожное состояние, которое не определено особо, и расстройства с симптомами смешанного типа, тревожного состояния и подавленного настроения. Регулируемые расстройства включают регулируемое расстройство с симптомом тревожного состояния и регулируемое расстройство с симптомами смешанного типа, тревожного состояния и подавленного настроения. Соединения по изобретению используют в качестве анальгетиков. В частности, они являются полезными для лечения травматической боли, такой как послеоперационная боль; боли, вызванной травматической авульсией, например плечевого сплетения; хронической боли, как, например, артритной боли типа возникающей при остео-, ревматоидном или псориатическом артрите; нейропатической боли, как например, типа невралгии при опоясывающем лишае, невралгии тройничного нерва, сегментарной или межреберной невралгии, фибромиалгии, каузалгии, периферической нейропатии, диабетической нейропатии; нейропатии, индуцированной химиотерапией; нейропатии, обусловленной AIDS, невралгии в области затылка, невралгии при синдроме коленчатого ганглия, глоссофарингеальной невралгии, рефлексе симпатической дистрофии, фантомной боли; различных форм головной боли, таких как мигрень, острая или хроническая головная боль напряжения, боли в области височно-нижнечелюстного сустава, боли в области верхнечелюстной [гайморова] пазухи, гистаминовая головная боль; одонталгии; боли при раке; боли висцерального происхождения; боли в области желудочно-кишечного тракта; боли при ущемлении нерва; боли, вызванной травмой при занятии спортом; дисменореи; менструальной боли; менингита; арахноидита; костно-мышечной боли; поясничная боль, например спинальный стеноз; выпадение диска; ишиалгии; стенокардии; анкилозирующего спондилоартрита; подагры; ожогов; рубцовой боли; боли при зуде и таламической боли, как, например, таламическая боль после инсульта.
Соединения по изобретению являются также полезными для лечения нарушений сна или расстройств сна, включая дисомнию, бессонницу (инсомнию), приступы апноэ во сне, нарколепсию и нарушения циркадного (околосуточного) ритма, или для лечения нарушений сна и/или расстройств сна, связанных с или обусловленных другими нарушениями.
Соединения по изобретению также используют для лечения или профилактики когнитивных расстройств. Когнитивные расстройства включают слабоумие, амнестические расстройства и когнитивные расстройства, которые не определены особо.
Кроме того, соединения по изобретению являются полезными в качестве энхансеров памяти и/или энхансеров познания для здоровых людей без нарушения познавательских способностей и/или памяти.
Соединения по изобретению также являются полезными для лечения толерантности к ряду веществ и зависимости от ряда веществ. Например, они являются полезными для лечения зависимости от никотина, спирта, кофеина, фенциклидина (фенциклидинподобных соединений) или для лечения толерантности к опиатам (например, гашиш, героин, морфин) или бензодиазепинам или зависимости от опиатов или бензодиазепинов; для лечения привыкания к кокаину, седативному расслаблению, амфетамину или амфетаминродственным лекарственным средствам (например, декстроамфетамин, метиламфетамин) или их комбинациям.
Соединения по изобретению являются также полезными в качестве противовоспалительных средств. В частности, их используют для лечения воспаления при астме, гриппе, хроническом бронхите и ревматоидном артрите; для лечения воспалительных заболеваний желудочно-кишечного тракта, таких как болезнь Крона, язвенный колит, воспаление толстой кишки и поражение, вызванное нестероидным противовоспалительным лекарственным средством; воспалительных заболеваний кожи, таких как герпес и экзема; воспалительных заболеваний мочевого пузыря, таких как цистит и недержание мочи; и воспаления глаз и зубов.
Соединения по изобретению также используют для лечения аллергических расстройств, в частности аллергических расстройств кожи, таких как крапивница, и аллергических расстройств дыхательных путей, таких как ринит.
Соединения по изобретению также используют для лечения или профилактики шизофренических расстройств, включая параноидную шизофрению, дезорганизованную шизофрению, кататоническую шизофрению, недифференцированную шизофрению, резидуальную шизофрению.
Соединения по изобретению также являются полезными для лечения рвоты, т.е. тошноты, позыва на рвоту и рвоты как таковой. Рвота включает острую рвоту, замедленную рвоту и упреждающую рвоту. Соединения по изобретению используют для лечения рвоты, вызванной чем-либо. Например, рвота может быть вызвана лекарственными средствами, такими как раковые химиотерапевтические средства типа алкилирующих средств, например циклофосфамид, кармустин, ломустин и хлорамбуцил; цитотоксические антибиотики, например дактиномицин, доксорубицин, митомицин-С и блеомицин; антиметаболиты, например цитарабин, метотрексат и 5-фторурацил; алкалоиды барвика, например, этопозид, винбластин и винкристин; и другие, как например, цисплатин, дакарбазин, прокарбазин и гидроксимочевина; и их комбинации; лучевой болезнью; лучевой терапией, например облучение грудной клетки или живота, как, например, при лечении рака; ядами; токсинами, такими как токсины, вызванные метаболическими нарушениями или инфекцией, например гастритом, или высвобождаемые во время бактериальной или вирусной инфекции желудочно-кишечного тракта; беременностью; расстройствами вестибулярного аппарата, такими как укачивание, вертиго, головокружение и болезнь Меньера; послеоперационное недомогание (тошнота); обструкция желудочно-кишечного тракта; снижение перистальтики (моторики) желудочно-кишечного тракта; висцеральная боль, например инфаркт миокарда или перитонит; мигрень; повышенное внутричерепное давление; пониженное внутричерепное давление (например, высотная болезнь); опиоидные анальгетики, такие как морфин; и гастроэзофагеальная рефлюксная болезнь (GERD), такая как эрозивная GERD и симптоматическая GERD или неэрозивная GERD, изжога, излишества в еде или питье, гастрит, брожение, изжога/регуртация (отрыжка), изжога, как например, эпизодическая изжога, ночная изжога и вызванная едой изжога, диспепсия и функциональная диспепсия.
Соединения по изобретению также используют для лечения желудочно-кишечных расстройств, таких как синдром раздраженной толстой кишки, гастроэзофагеальная рефлюксная болезнь (GERD), как, например, эрозивная GERD и симптоматическая GERD или неэрозивная GERD, изжога, излишества в еде или питье, повышенной кислотности желудка, раздраженного желудка, изжога/регуртация, изжога, как, например, эпизодическая изжога, ночная изжога и индуцированная едой изжога, диспепсия и функциональная диспепсия (такая как диспепсия, связанная с язвой; диспепсия, связанная с нарушением моторики, и неспецифическая диспепсия), хронический запор; кожные расстройства, такие как псориаз, зуд и солнечная эритема; вазоспастические заболевания, такие как стенокардия, сосудистая головная боль и Reynaud's болезнь; церебральная ишемия, как, например, церебральный вазоспазм после субарахноидального кровоизлияния; заболевания, связанные с поражением фиброзной и коллагеновой ткани, такие как склеродермия и эозинофильный фасциолез; нарушения, связанные с иммунным усилением или подавлением, такие как красная волчанка, и ревматические болезни, такие как фиброзит; и кашель.
Соединения по изобретению также используют при предменструальном нарушении, характеризуемом чувством недовольства или внутреннего дискомфорта (PMDD), при хроническом синдроме переутомления и рассеянном склерозе.
Соединения по изобретению, как было установлено, демонстрируют активность в подавлении патологического страха и антидепрессивную активность в обычных испытаниях. Например, в модели беспокойства у животных - крики отчаяния детенышей морской свинки, вызванные разделением (Molewijk et al., 1996) и в модели социального взаимодействия у песчанок (в месте на адаптацию на модели песчанки), в соответствии со способом, описанным Cheeta et al. (Cheeta S. et al., 2001. Brain Research 915: 170-175).
Поэтому изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли или сольвату для использования в лечении, в частности, для лечения людей.
В качестве другого аспекта изобретения предлагается также использование соединения формулы (I) или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства для использования в лечении состояний, опосредованных тахикининами (включая вещество Р и другие нейрокинины) и/или путем селективного ингибирования обратного захвата серотонина.
Другим аспектом изобретения является также использование соединения формулы (I) или его фармацевтически приемлемой соли или сольвата для лечения состояний, опосредованных тахикининами (включая вещество Р и другие нейрокинины) и/или путем селективного ингибирования белка-транспортера обратного захвата серотонина.
В другом аспекте предлагается использование соединения формулы (I) или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства для использования в лечении депрессии и/или страха (тревоги).
В другом аспекте предлагается использование соединения формулы (I) или его фармацевтически приемлемой соли или сольвата для лечения депрессии и/или страха (тревоги).
В альтернативном или другом аспекте предлагается способ лечения млекопитающего, включая человека, в частности, для лечения состояний, опосредованных тахикининами, включая вещество Р и другие нейрокинины, и/или путем селективного ингибирования белка-транспортера обратного захвата серотонина, включающий введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В другом аспекте настоящего изобретения предлагается способ лечения млекопитающего, включая человека, в частности для лечения депрессии и/или страха (тревоги), и этот способ включает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата.
Следует иметь в виду, что ссылка на лечение подразумевает включение профилактики, а также облегчение установленных симптомов.
Соединения формулы (I) могут вводиться в виде исходного химиката, но предпочтительно, когда активный компонент представлен в виде фармацевтического препарата.
Соответственно изобретение также предлагает фармацевтическую композицию, которая содержит, по крайней мере, одно соединение формулы (I) или его фармацевтически приемлемую соль и которая составлена (в рецептуру) для введения любым удобным путем. Такие композиции предпочтительно находятся в форме, адаптированной для использования в медицине, в частности, для лечения человека, и могут быть получены обычным способом, используя один или несколько фармацевтически приемлемых носителей или наполнителей.
Таким образом, соединения формулы (I) могут быть объединены в состав для перорального, буккального, парентерального, местного (включая глазное и назальное) введения, введения в виде депо (замедленное всасывание) или ректального или в форме, подходящей для введения путем ингаляции или инсуффляции (либо через рот, либо через нос).
Для перорального введения фармацевтические композиции могут принимать форму, например, таблеток или капсул, полученных обычным способом с фармацевтически приемлемыми наполнителями, такими как связующие средства (например, предварительно клейстеризованный рисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтеграторы (например, картофельный крахмал или натрий крахмалгликолят); или увлажняющие средства (например, лаурилсульфат натрия). Таблетки могут быть покрыты (соответствующими оболочками) способами, известными в данной области. Жидкие препараты для перорального применения могут иметь форму, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для составления с водой или другим подходящим наполнителем перед использованием. Указанные жидкие препараты можно получить обычным способом с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сироп сорбита, производные целлюлозы или гидрогенизированные съедобные жиры); эмульгирующие средства (например, лецитин или акация); неводные наполнители (например, миндальное масло, маслянистые сложные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты могут также содержать буферные соли, ароматизаторы, красители и подслащивающие средства, если целесообразно.
Препараты для перорального введения могут быть получены в соответствующей лекарственной форме, обеспечивающей контролируемое высвобождение активного соединения.
Для буккального введения композиция может принимать форму таблеток или получена обычным способом.
Соединения по данному изобретению могут быть формулированы для парентерального введения путем инъекции ударной дозы активного вещества или непрерывной инфузии. Препараты для инъекции могут быть представлены в дозированной лекарственной форме, например в ампулах или в упаковках лекарственных средств для многократного введения, с добавлением консерванта. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в маслянистых или водных наполнителях, и могут содержать вспомогательные (формообразующие) средства, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Альтернативно, активный компонент может находиться в порошкообразной форме для составления с подходящим наполнителем, например стерильной апирогенной водой, перед использованием.
Соединения по изобретению могут быть формулированы для местного введения в форме мазей, кремов, гелей, лосьонов, пессария (вагинального суппозитория), аэрозолей или капель (например, глазные капли, капли для уха или носа). Мази и кремы могут быть, например, составлены с водной или маслянистой основой с добавлением подходящих загустителей и/или гелеобразующих средств. Смазки для введения в глаза можно приготовить стерильным способом, используя стерилизованные компоненты.
Лосьоны могут быть составлены с водной или маслянистой основой и могут, в общем случае, также содержать одно или несколько эмульгирующих средств, стабилизирующих средств, диспергирующих средств, суспендирующих средств, загустителей или красителей. Капли могут быть составлены с водной или неводной основой, при этом также могут содержать одно или несколько диспергирующих средств, стабилизирующих средств, солюбилизирующих средств или суспендирующих средств. Кроме того, они могут также содержать консервант.
Соединения по изобретению могут быть также составлены в ректальные композиции, такие как суппозитории или удерживающие клизмы, например содержащие обычные основы для суппозитория, такие как масло какао или другие глицериды.
Соединения по изобретению могут быть формулированы в виде препаратов-депо. Такие длительно действующие (замедленного всасывания) препараты могут быть введены путем имплантации (например, подкожно или внутримышечно) или при помощи внутримышечной инъекции. Так, например, соединения по изобретению могут быть объединены в состав с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле), или ионообменными смолами, или в виде труднорастворимых производных, например в виде труднорастворимой соли.
Для интраназального введения соединения по изобретению могут быть формулированы в виде растворов для введения с помощью подходящего устройства-дозатора (устройство с нормированной или однократной дозой) или, альтернативно, в виде порошкообразной смеси с подходящим носителем для введения, используя подходящее устройство для доставки.
Предполагаемая доза соединений по данному изобретению составляет от 1 до около 1000 мг в день. Следует иметь в виду, что возможно внесение обычных изменений в дозировку в зависимости от возраста и состояния пациента и, в конечном счете, точная доза обычно устанавливается лечащим врачом или ветеринаром. Кроме того, доза обычно зависит от пути введения и конкретного используемого соединения.
Таким образом, для парентерального введения суточная доза обычно находится в диапазоне от 1 до около 100 мг, предпочтительно от 1 до 80 мг в день. Для перорального введения суточная доза, как правило, находится в диапазоне от 1 до 300 мг, например от 1 до 100 мг.
Соединения формулы (I) и их соли и сольваты можно получить обычными способами, в общих чертах охарактеризованными в дальнейшем. В нижеследующем описании группы R, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, m, n, p и q имеют значения, определенные ранее для соединений формулы (I), если не оговорено особо.
Соединения формулы (I) можно получить взаимодействием активированного производного карбоновой кислоты (II), где R6 представляет азотзащитную группу, или (CH2)qR8, с амином (III)
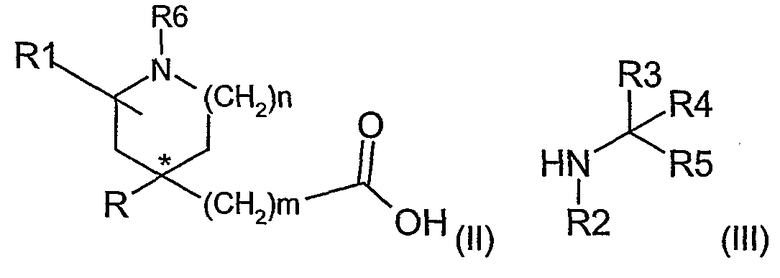
где R2 представляет водород, С1-4алкил или азотзащитную группу, за которым следует, если это необходимо, удаление любой азотзащитной группы.
Подходящие активированные производные карбоксильной группы включают ацилгалогенид, смешанный ангидрид, активированный сложный эфир, такой как тиоэфир или производное, полученное в результате взаимодействия группы карбоновой кислоты и связующего агента, такого как агент, используемый в химии пептидов, например карбонилдиимидазол или дициклогексилкарбодиимид.
Реакцию предпочтительно проводят в апротонном растворителе, таком как углеводород, галогенуглеводород, такой как дихлорметан, или простой эфир, такой как тетрагидрофуран.
Активированные производные карбоновой кислоты (II) можно получить обычным способом. Конкретным подходящим активированным производным, используемым в этой реакции, является тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония.
Реакцию проводят в растворителе, таком как N,N-диметилформамид.
Соединения формулы (I), где R2 представляет С1-4алкил, могут быть получены взаимодействием соединения формулы (I), в котором R2 представляет водород, с (С1-4алкил)L, где L представляет соответствующую удаляемую группу, выбранную из йода, брома, в присутствии основания, в присутствии неорганического основания (например, гидрида натрия).
Реакцию осуществляют в растворителе, таком как N,N-диметилформамид или тетрагидрофуран.
Соединения формулы (II), где m равно 1, могут быть получены взаимодействием производного (IV), где R11 представляет CH(CN)CО2R12, в котором R12 представляет подходящую карбоксилзащитную группу,
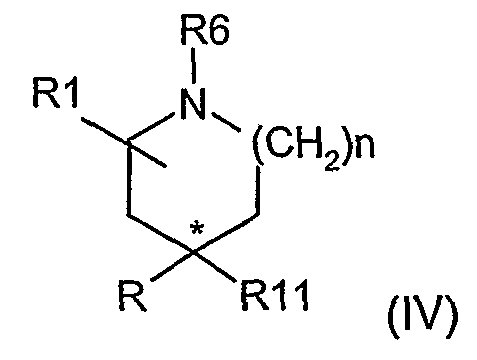
с кислотой, такой как, например, концентрированная серная кислота, с последующим (если это еще необходимо) удалением карбоксилзащитной группы R12.
Реакцию осуществляют в растворителе, таком как уксусная кислота, и нагревая реакционную смесь вплоть до 150°С.
Альтернативно соединения формулы (II), где m равно 1, можно получить реакцией производного (IV), где R11 представляет группу (V)
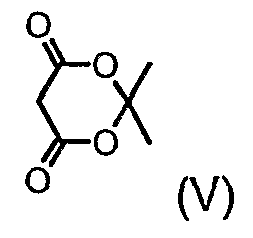
в 3-пентаноне и воде, нагревая реакционную смесь до температуры образования флегмы. Альтернативно реакцию можно осуществить в присутствии кислоты, такой как, например, хлористоводородная кислота, и растворителя, такого как тетрагидрофуран, нагревая реакционную смесь до температуры кипения с обратным холодильником.
Соединения формулы (II), где m равно нулю, могут быть получены гидролизом цианопроизводного (VI) в присутствии основания, такого как щелочное основание (т.е. гидроксид калия).
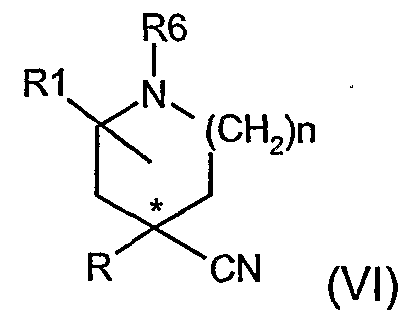
Реакцию соответственно осуществляют в водном растворителе и при нагревании.
Соединения формулы (IV), где m равно 1, R11 представляет CH(CN)CО2R12, в котором R12 представляет подходящую карбоксилзащитную группу, могут быть получены взаимодействием соединения формулы (VII) с R-MgL (VIII), где L представляет группу галогена (т.е. бром).
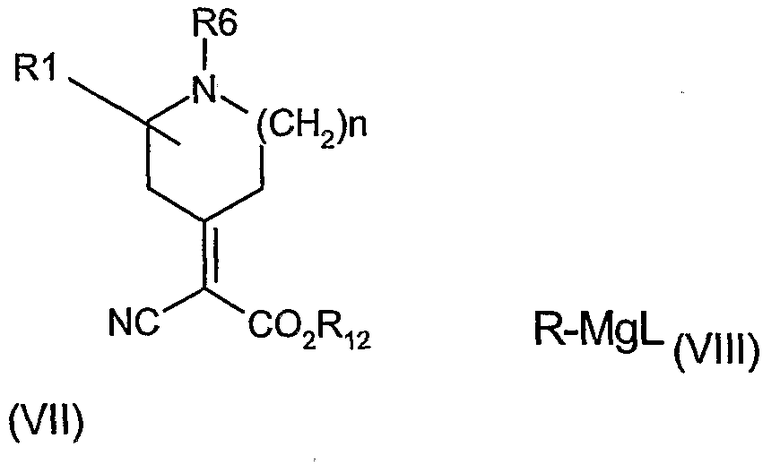
Реакция протекает в апротонном растворителе, таком как углеводород (например, толуол), простые эфиры (например, тетрагидрофуран) и при температуре в диапазоне 0-25°С, необязательно в присутствии солей меди(I), таких как, например, иодид меди.
Подходящие карбоксилзащитные группы R12 для использования в вышеупомянутых реакциях, включают алкил, такой как метил или этил, трихлоралкил, триалкилсилилалкил, или арилметильные группы, такие как бензил, нитробензил или тритил.
Соединения формулы (IV), где R11 представляет группу (V), могут быть получены взаимодействием соединения формулы (IX)
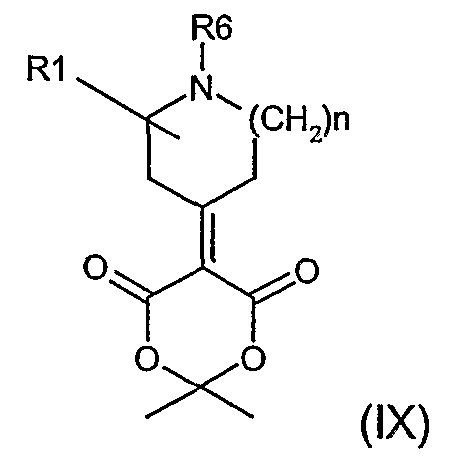
с соединением формулы (VIII), где L представляет группу галогена (например, бром), или соединением RW(VIIIa), в котором W представляет основание щелочного металла, такого как, например, литий или магний.
Реакция протекает в апротонном растворителе, таком как углеводород (например, толуол), простые эфиры (например, тетрагидрофуран) и при температуре в диапазоне -80-25°C, необязательно в присутствии солей меди(I), таких как, например, иодид меди.
Соединения формулы (VII) можно получить взаимодействием соединения формулы (X) с цианопроизводным (XI), где R12 имеет значение, определенное выше.
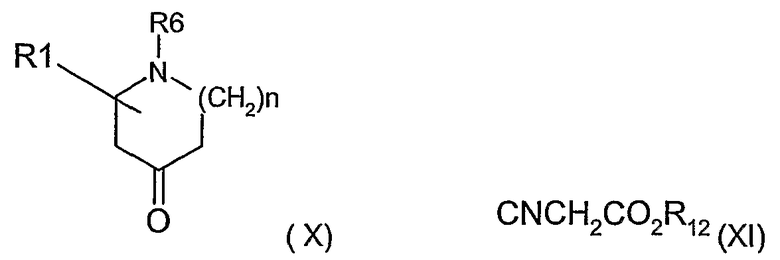
Соединения формулы (IX) можно получить взаимодействием соединения формулы (X) с производным (V).
Соединения формул (VI) и (X) могут быть получены способами, аналогичными способам, используемым для известных соединений. Так, соединения формулы (VI) можно получить согласно способу, описанному в Cammack et al., Heterocyclic 23, 73 (1986).
Соединения формулы (X) могут быть получены способом, описанным в WO 2001/000206.
Когда R6 и/или R2 представляют азотзащитную группу, примеры подходящих групп включают алкоксикарбонил, например трет-бутоксикарбонил, бензилоксикарбонил, арилсульфонил, например фенилсульфонил или 2-триметилсилилэтоксиметил.
Защита и снятие защиты могут быть осуществлены, используя обычные способы, такие как способы, описанные в "Protective Groups in Organic Synthesis 2nd Ed." by T.W. Greene and P. G. M. Wuts (John Wiley and Sons, 1991) и описанные в примерах ниже.
В тех случаях, когда требуется конкретный энантиомер или диастереоизомер соединения общей формулы (I), его можно получить, например, разделением соответствующей энантиомерной или диастереоизомерной смеси соединения формулы (I), используя обычные способы. Так, например, конкретные энантиомеры или диастереоизомеры соединений формулы (I) могут быть получены из соответствующей энантиомерной или диастереоизомерной смеси соединения формулы (I), используя методы хиральной хроматографии, такие как, например, хиральная ВЭЖХ или хиральная SFC (сверхкритическая жидкостная хроматография).
Альтернативно конкретный энантиомер или диастереоизомер соединения общей формулы (I) может быть синтезирован из соответствующих оптически активных промежуточных соединений, используя любой из общих способов, описанных в описании.
Так, в одном варианте осуществления данного изобретения конкретный энантиомер или диастереоизомер соединений формулы (I) может быть получен реакцией хирального амина (III), используя любой из способов, описанных выше, для получения соединений формулы (I) из амина (III). Таким образом, например, конкретный диастереоизомер соединений формулы (I), где R2 представляет водород и R3 и R4 не являются одной и той же группой, может быть получен реакцией син- или антиизомера соединения (II) c хиральным амином формулы (III), где R3 и R4 не являются одинаковой группой.
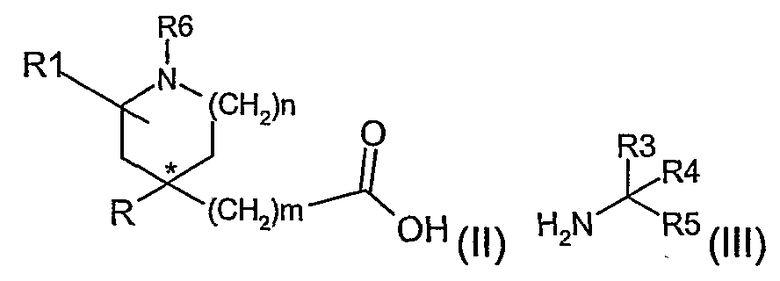
Хиральный амин (III) может быть получен из соответствующего рацемического амина (III), используя любые обычные способы, такие как солеобразование с подходящей оптически активной кислотой, такой как, например, (S)-метоксифенилуксусная кислота или (R)-метоксифенилуксусная кислота, или используя метод хиральной ВЭЖХ.
В тех случаях, когда требуется выделить соединение формулы (I) в виде соли, например фармацевтически приемлемой соли, этого можно достичь взаимодействием соединения формулы (I) в форме свободного основания с соответствующим количеством подходящей кислоты в подходящем растворителе, таком как спирт (например, этанол или метанол), сложный эфир (например, этилацетат) или простой эфир (например, диэтиловый эфир, трет-бутилметиловый эфир или тетрагидрофуран).
Для промежуточных соединений и примеров, если не оговорено особо:
Точки плавления (т.пл.) определяли на приборе для определения т.пл. Buchi, и они приведены без корректировки. Rt относится к комнатной температуре. Инфракрасные спектры (ИК, IR) измеряли в хлороформе или в растворах светлого нефтяного масла глубокой очистки на приборе FT-IR. Спектры протонного ядерного резонанса (ЯМР, NMR) регистрировали на приборах Varian при 300, 400 или 500 МГц, на приборе Bruker при 300 МГц, химические сдвиги представлены в м.д. (ppm) (δ), используя линию остаточного растворителя в качестве внутреннего стандарта. Типы расщепления (мультиплетность) представлены в виде с (s), синглета; д (d), дублета; т (t), триплета; к (q), квартета; м (m), мультиплета; уш (b), уширенный. ЯМР-спектры регистрировали при температуре в диапазоне от 25 до 90°С; в случаях детектирования более чем одного конформера химические сдвиги приводятся для конформера, содержащегося в наибольшем количестве. Масс-спектры получали на масс-спектрометре с тройным квадруполем (Micromass UK) или на масс-спектрометре Agilent MSD 1100, функционирующем в режиме электрораспылительной ионизации с регистрацией положительных (ES(+)) и отрицательных ионов (ES(-)) или на комбинированной системе Agilent ЖХ/масс-спектрометр MSD 1100, функционирующем в режиме электрораспылительной ионизации с регистрацией положительных ионов (ES(+)) и отрицательных ионов (ES(-)), в сочетании с системой ВЭЖХ Agilent 1100 Series [ЖХ/МС - ES(+): анализ выполняли на Supelcosil ABZ+Plus (33×4,6 мм, 3 мкм) (подвижная фаза: 100% [вода+0,1% HCO2H] в течение 1 мин, затем от 100% [вода+0,1% HCO2H] до 5% [вода+0,1% HCO2H] и 95% [CH3CN] в течение 5 мин, наконец, в этих условиях в течение 2 мин; T=40°C; поток=1 мл/мин; ЖХ/МС - ES(-): анализ выполняли на Supelcosil ABZ+Plus (33×4,6 мм, 3 мкм) (подвижная фаза: 100% [вода+0,05% NH3] в течение 1 мин, затем от 100% [вода+0,05% NH3] до 5% [вода+0,05% NH3] и 95% [CH3CN] в течение 5 мин, наконец, в этих условиях в течение 2 мин; T=40°C; поток=1 мл/мин]. В масс-спектрах для кластера молекулярных ионов приводится только один пик. Оптическое вращение определяли при 20°C на приборе Jasco DIP360 (l=10 см, объем ячейки=1 мл, λ=589 нм). Флэш-хроматографию на силикагеле проводили на силикагеле, размер частиц 230-400 меш, поставляемом Merck AG Darmstadt, Germany, или на предварительно упакованных картриджах Varian Mega Be-Si, или на предварительно упакованных картриджах силикагеля Biotage.
ВЭЖХ (ступенчатая) относится к анализу методом ВЭЖХ, выполняемому на неподвижной фазе Luna C18 (подвижная фаза: от 100% [вода+0,05% TFA] до 5% [вода+0,05% TFA] и 95% [CH3CN+TFA 0,05%] в течение 8 мин; T=40°C; поток=1 мл/мин).
ТСХ относится к тонкослойной хроматографии на пластинах с силикагелем, размер частиц 0,25 мм (60F-254 Merck), проявляемых при облучении УФ-светом. Для фазовых разделений, выполняемых с использованием микрофильтрационных устройств: картридж для фазового разделения с полипропиленовой фриттой Whatman или Alltech. Средство для SCX: SCX-картриджи (нагружение 0,75 ммоль/г) Varian.
Растворы сушили над безводным сульфатом натрия.
Метиленхлорид подвергали вторичной перегонке над гидридом кальция и тетрагидрофуран подвергали вторичной перегонке над натрием.
В тексте используют нижеследующие аббревиатуры: AcOEt=этилацетат, CH=циклогексан, DCM=метиленхлорид, DIPEA=N,N-диизопропилэтиламин, DMF=N,N'-диметилформамид, Et2О=диэтиловый эфир, EtOH=этанол, MeOH=метанол, TEA=триэтиламин, THF=тетрагидрофуран, TFA=трифторуксусная кислота, CH3CN=ацетонитрил, TBTU=тетрафторборат О-(бензотриазол-1-ил)-N,N,N'N'-тетраметилурония, std=насыщенный.
В тексте
Энантиомер 1 или энантиомер 2 относится к отдельному энантиомеру, чья абсолютная конфигурация не была охарактеризована.
Цепной энантиомер 1 или цепной энантиомер 2 относится к соединению по изобретению или его промежуточному соединению, где R3 и R4 не являются одинаковой группой, имеющему единственную, но не определенную конфигурацию при атоме углерода, показанном как ** в формуле (Ia).
Для соединений по данному изобретению, где m равно 1, антиизомер относится к соединениям по изобретению или их промежуточным соединениям, в которых группа R1 является отличной от водорода и где конфигурация атома углерода, с которым связана группа R1, и конфигурация атома углерода, показанного как *, представлены формулой 1(b) и 1(c).
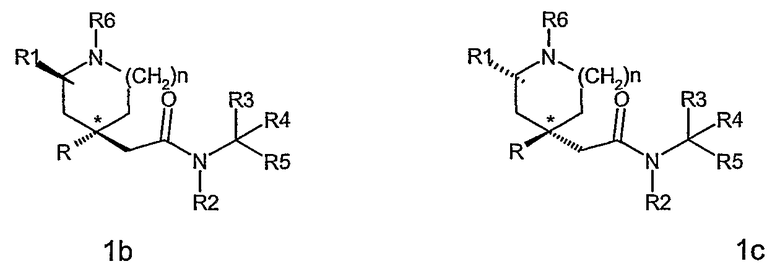
Для соединений по данному изобретению, где m равно 1, син-изомер относится к соединениям по изобретению или их промежуточным соединениям, в которых группа R1 является отличной от водорода и где конфигурация атома углерода, с которым связана группа R1, и конфигурация атома углерода, показанного как *, представлены формулой 1(a) и 1(d).
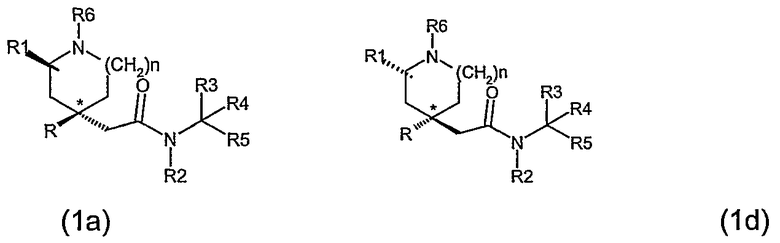
Син-изомер 1 или син-изомер 2 относится к отдельному изомеру, имеющему формулу (1а) или (1d).
Промежуточное соединение 1
Метил 4-бром-7-фтор-2-нафталинкарбоксилата
Изоамилнитрит (9,8 мл), растворенный в диметоксиэтане (59 мл), и раствор 2-амино-4-фторбензойной кислоты (11,5 г) в диметоксиэтане (59 мл), оба, добавляют в раздельных потоках с согласованной скоростью в течение 40 мин к кипящему раствору метилового эфира 3-бромкумалиновой кислоты (3,3 г) в диметоксиэтане (55 мл) и каталитического количества трихлоруксусной кислоты (30 мг). Для завершения реакции реакционную смесь нагревают при температуре кипения с обратным холодильником в течение еще 1 час после окончания добавлений. Затем температуру снижают до 50°С и добавляют толуол (77 мл). Затем смесь охлаждают до комнатной температуры, фазы разделяют и органическую фазу экстрагируют 2М водным NaOH (110 мл), 5% водным бисульфитом натрия (110 мл), водой (110 мл), 2М водной HCl (110 мл) и, наконец, водой (110 мл).
Затем растворитель удаляют выпариванием при пониженном давлении, получая сырой продукт, который очищают Biotage флэш-хроматографией, элюируя смесью CH:AcOEt=9:1, получая указанное в заголовке соединение (650 мг) в виде желтого масла.
ЯМР (d6-ДМСО): δ (м.д.) 8,66 (с, 1H); 8,23 (дд, 1H); 8,18 (д, 1H); 8,09 (дд, 1H); 7,73 (дт, 1H); 3,89 (с, 3H).
Промежуточное соединение 2
4-Бром-7-фтор-2-нафталинкарбоновая кислота
Промежуточное соединение 1 (970 мг) растворяют в смеси ТГФ (20 мл) и воды (10 мл) и затем добавляют LiOH·H2O (577 мг). Смесь нагревают при 80°С в течение 2 час. Затем ее охлаждают до комнатной температуры и добавляют 2М водную HCl. Водную фазу экстрагируют AcOEt и органические экстракты сушат и упаривают в вакууме, получая указанное в заголовке соединение (850 мг) в виде желтого твердого вещества.
ЯМР (d6-ДМСО): δ (м.д.) 13,4 (уш.с, 1H); 8,63 (с, 1H); 8,23 (дд, 1H); 8,18 (с, 1H); 8,07 (дд, 1H); 7,71 (тд, 1H).
Промежуточное соединение 3
4-Бром-7-фтор-N-гидрокси-2-нафталинкарбоксамид
Промежуточное соединение 2 (850 мг) растворяют в ДМФА (3 мл) и затем добавляют TBTU (1,32 г) и DIPEA (1,9 мл). Смесь перемешивают в течение 30 мин в атмосфере азота и затем добавляют гидроксиламин гидрохлорид (286 мг); после перемешивания в течение 2 час добавляют водный насыщенный NH4Cl и и водную фазу экстрагируют AcOEt. Затем органическую фазу промывают водным насыщенным NAHCO3, сушат и упаривают в вакууме, получая неочищенный продукт, который растирают с пентаном, получая указанное в заголовке соединение (360 мг) в виде не совсем белого твердого вещества.
МC (ES/+): m/z=284 [M+H]+.
Промежуточное соединение 4
4-Бром-7-фтор-2-нафталинкарбонитрил
Промежуточное соединение 3 (360 мг) суспендируют во фторбензоле (11 мл) в атмосфере азота при комнатной температуре и в смесь по каплям в течение 5 мин добавляют трибромид фосфора (358 мкл). Суспензию кипятят с обратным холодильником при 80°С в течение 18 час; затем ее охлаждают до комнатной температуры и добавляют водный насыщенный NaHCO3 и водную фазу экстрагируют AcOEt. Органические экстракты собирают, сушат и упаривают в вакууме, получая сырой продукт, который очищают флэш-хроматографией биотаж, элюируя смесью CH:AcOEt=98:2, получая указанное в заголовке соединение (200 мг) в виде бледно-коричневого твердого вещества.
ЯМР (d6-ДМСО): δ (м.д.) 8,66 (с, 1H); 8,32 (дд, 1H); 8,28 (д, 1H); 8,01 (дд, 1H); 7,84 (дт, 1H).
Промежуточное соединение 5
4-Этенил-7-фтор-2-нафталинкарбонитрил
Раствор промежуточного соединения 4 (25 мг), ТEТРАКИС (трифенилфосфин) палладия(0) (5 мг), трибутил(этенил)станнана (32 мкл) и одного кристалла гидрохинона в сухом толуоле (1 мл) нагревают при 110°С в течение 4 час. Затем смесь охлаждают до комнатной температуры и добавляют водный насыщенный NaHCO3 и AcOEt; органическую фазу отделяют, промывают 10% водным KF, сушат и упаривают в вакууме, получая неочищенный продукт. Затем его очищают флэш-хроматографией, элюируя смесью CH:AcOEt=9:1, получая указанное в заголовке соединение (14 мг) в виде желтого твердого вещества.
ЯМР (d6-ДМСО): δ (м.д.) 8,51 (с, 1H); 8,40 (дд, 1H); 7,98 (д, 1H); 7,92 (дд, 1H); 7,70 (тд, 1H); 7,57 (дд, 3H); 6,07 (д, 1H); 5,65 (д, 1H).
Промежуточное соединение 6
7-Фтор-4-формил-2-нафталинкарбонитрил
Промежуточное соединение 5 (14 мг) растворяют в смеси ТГФ (1,5 мл) и воды (0,3 мл); добавляют 4% водный раствор тетроксида осмия (22 мкл) и периодат натрия (30 мг) и раствор энергично перемешивают при комнатной температуре в атмосфере азота в течение 4 час. Затем добавляют 5% раствор метабисульфита натрия в водном насыщенном NaHCO3; органическую фазу экстрагируют AcOEt, сушат и упаривают в вакууме, получая указанное в заголовке соединение (14 мг) в виде бледно-желтого твердого вещества.
ЯМР (d6-ДМСО): δ (м.д.) 10,38 (с, 1H); 9,23 (дд, 1H); 8,90 (с, 1H); 8,50 (с, 1H); 8,03 (дд, 1H); 7,87 (тд, 1H).
Промежуточное соединение 7
7-Фтор-4-[(метиламино)метил]-2-нафталинкарбонитрил
Промежуточное соединение 6 (124 мг) суспендируют в сухом MeOH (6 мл) в атмосфере азота и затем добавляют 2,0М раствор метиламина в MeOH (1,6 мл). Смесь перемешивают при комнатной температуре в течение 2 час; затем добавляют калийборгидрид (66 мг) тремя порциями и раствор перемешивают в течение дополнительных 2 час. Добавляют водный насыщенный NH4Cl и AcOEt, органическую фазу отделяют, сушат и упаривают в вакууме, получая сырой продукт, который очищают с помощью SCX картриджа, получая указанное в заголовке соединение (100 мг) в виде желтого твердого вещества.
МС (ES/+): m/z=215 [M+H]+.
Промежуточное соединение 8
3-Бром-N-метил-N-(метилокси)-1-нафталинкарбоксамид
Раствор 3-бром-1-нафталинкарбоновой кислоты (1 г), гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1,97 г) и DIPEA (2,35 мл) в безводном ДМФА (5 мл) перемешивают при комнатной температуре в течение 30 мин в атмосфере азота. Добавляют N,O-диметилгидроксиламин гидрохлорид (465 мг) и смесь перемешивают при комнатной температуре в течение 2 час. Смесь промывают 5% водным NaHCO3, органический слой сушат, концентрируют в вакууме и остаток очищают флэш-хроматографией (CH/AcOEt 2:8), получая указанное в заголовке соединение (986 мг) в виде белой пены.
ЯМР (ацетон-d6): δ (м.д.) 8,22 (с, 1H); 7,97-7,60 (м, 4H); 7,65 (д, 1H); 3,50 (уш.с, 3H); 3,38 (уш.с, 3H).
Промежуточное соединение 9
1-(3-Бром-1-нафталинил)этанон
Промежуточное соединение 8 (986 мг) растворяют в сухом ТГФ (3 мл) при 0°С в атмосфере азота и затем добавляют 3,0М раствор метилмагнийбромида в Et2O (2,8 мл); раствор перемешивают в этих условиях в течение 2 час. Добавляют водный насыщенный NH4Cl и AcOEt, органическую фазу отделяют, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают флэш-хроматографией, элюируя смесью CH:AcOEt=9:1, получая указанное в заголовке соединение (753 мг) в виде твердого вещества.
ЯМР (CDCl3): δ (м.д.) 8,6 (д, 1H); 8,2 (с, 1H); 8,0 (с, 1H); 7,8 (д, 1H); 7,6 (м, 2H); 2,8 (с, 3H).
Промежуточное соединение 10
4-Ацетил-2-нафталинкарбонитрил
Промежуточное соединение 9 (367 мг) растворяют в сухом ДМФА (2,5 мл) и затем добавляют пиридин (360 мкл) и цианид меди (396 мг). Смесь нагревают при 150°С в течение 48 час. Добавляют водный насыщенный NH4Cl, водный NH4OH (1 мл) и AcOEt, органическую фазу отделяют, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают флэш-хроматографией, элюируя смесью CH:AcOEt=9:1, получая указанное в заголовке соединение (122 мг) в виде желтого твердого вещества.
ЯМР (CDCl3): δ (м.д.) 8,7 (д, 1H); 8,4 (с, 1H); 8,0 (с, 1H); 7,9 (д, 1H); 7,8 (т, 1H); 7,6 (т, 1H); 2,8 (с, 3H).
Промежуточное соединение 11
4-[1-(Метиламино)этил]-2-нафталинкарбонитрил
Промежуточное соединение 10 (210 мг) суспендируют в сухом MeOH (3 мл) в атмосфере азота и затем добавляют 2,0М раствор метиламина в MeOH (2,7 мл). Смесь перемешивают при комнатной температуре в течение ночи, затем добавляют калийборгидрид (59 мг) тремя порциями и раствор перемешивают в течение еще 1,5 час. Добавляют водный насыщенный NH4Cl и AcOEt, органическую фазу отделяют, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают SCX картриджем, получая указанное в заголовке соединение (128 мг) в виде желтого масла.
МС (ES/+): m/z=211 [M+H]+.
Промежуточное соединение 12 и промежуточное соединение 13
4-[1-(Метиламино)этил]-2-нафталинкарбонитрил (энантиомер 1)
4-[1-(Метиламино)этил]-2-нафталинкарбонитрил (энантиомер 2)
К раствору промежуточного соединения 11 (2,6 г) в ацетоне (18 мл) добавляют раствор (S)-метоксифенилуксусной кислоты (2,0 г) в ацетоне (18 мл). Густую суспензию нагревают при 56°С в течение 40 мин, затем ее перемешивают при комнатной температуре в течение ночи. Суспензию фильтруют и твердый остаток (2,15 г) растирают в ацетоне (12 мл), нагревая до температуры кипения с обратным холодильником 1 час и охлаждая до комнатной температуры. Суспензию фильтруют и твердый остаток (1,8 г) растирают снова, дважды, как описано выше, с ацетоном, получая соль (S)-метоксифенилуксусной кислоты 4-[1-(метиламино)этил]-2-нафталинкарбонитрила (1,3 г). Твердое вещество перемешивают в смеси 1М водного NaOH (20 мл) и DCM (20 мл). Органическую фазу промывают насыщенным раствором соли (20 мл), сушат и концентрируют в вакууме, получая указанное в заголовке соединение - промежуточное соединение 12 (0,760 г) в виде бесцветного масла.
Маточные растворы от осаждения и первого растирания собирают, концентрируют в вакууме, обрабатывают 1М водным NaOH (20 мл) и экстрагируют DCM (20 мл). Органическую фазу сушат и концентрируют в вакууме, получая бесцветное масло (1,49 г); затем масло обрабатывают (R)-метоксифенилуксусной кислотой (1,18 г) в ацетоне (2×5 мл), как описано выше (одно осаждение и два растирания), получая (R)-метоксифенилуксусную соль 4-[1-(метиламино)этил]-2-нафталинкарбонитрила (1,2 г). Это твердое вещество перемешивают в смеси 1М водного NaOH (10 мл) и DCM (10 мл). Органическую фазу промывают насыщенным раствором соли (20 мл), сушат и концентрируют в вакууме, получая указанное в заголовке соединение, промежуточное соединение 13 (0,720 г) в виде бесцветного масла.
Промежуточное соединение 12 (энантиомер 1):
ЯМР (CDCl3): δ (м.д.) 8,22 (д, 1H); 8,13 (с, 1H); 7,93 (дд, 1H); 7,84 (д, 1H); 7,66 (тд, 1H); 7,59 (тд, 1H); 4,50 (кв, 1H); 2,4 (с, 3H); 1,48 (д, 3H).
МС (ES/+): m/z=211[M+H]+
[α]D=+119,6 (c=0,98, CH3CN)
Аналитические условия ВЭЖХ: колонка: Chiralcel OD 5 мкМ, 25×4,6 мм; подвижная фаза: А: н-гексан; В: изопропанол+0,1% изопропиламин; градиент изократический 3% В; скорость потока=1 мл/мин; диапазон длин волн УФ-области: 200-400 нм; время анализа: 30 мин; время удерживания=14,6 мин; чистота (а/а%)=98,6%.
Промежуточное соединение 13 (энантиомер 2):
ЯМР (CDCl3): δ (м.д.) 8,22 (д, 1H); 8,13 (с, 1H); 7,93 (дд, 1H); 7,84 (д, 1H); 7,66 (тд, 1H); 7,59 (тд, 1H); 4,50 (кв, 1H); 2,4 (с, 3H); 1,48 (д, 3H).
МС (ES/+): m/z=211[M+H]+
[α]D=-118,6 (c=1,095, CH3CN)
Аналитические условия ВЭЖХ: колонка: Chiralcel OD 5 мкМ, 25×4,6 мм; подвижная фаза: А: н-гексан; В: изопропанол+0,1% изопропиламин; градиент изократический 3% В; скорость потока=1 мл/мин; диапазон длин волн УФ-области: 200-400 нм; время анализа: 30 мин; время удерживания=17,6 мин; чистота (а/а %)=98,4%.
Промежуточное соединение 14
[1-(3-Хлор-1-нафталинил)этил]амин
Раствор 3-хлорнафталинкарбальдегида (1,93 г) в сухом ТГФ (12 мл) добавляют по каплям к 1М раствору литий бис(триметилсилил)амида в ТГФ (10,1 мл) при -30°С в атмосфере азота. Полученную желтую смесь перемешивают в атмосфере азота при температуре от -30°С до -5°С в течение 1 час, затем ее охлаждают до -60°С и добавляют 1,6М раствор метиллития в Et2O (11 мл), поддерживая внутреннюю температуру реакционной смеси <-55°С.
Полученную темно-фиолетовую реакционную смесь перемешивают в течение 40 мин при -50°С в атмосфере азота, затем ее осторожно гасят при -50°С 2М водной HCl (30 мл) до установления рН 2. Реакционную смесь концентрируют в вакууме и водный остаток промывают смесью 1:1 CH/Et2O (50 мл). Затем отделенную водную фазу делают щелочной (рН 14) при 0°С с помощью добавления гранул NaOH. Эту щелочную водную фазу экстрагируют Et2O (3×60 мл), объединенные органические слои сушат и концентрируют в вакууме, получая указанное в заголовке соединение (1,12 г) в виде желтого масла.
ТСХ: AcOEt/MeOH 8:2, Rf=0,25 (детектирование нингидрином).
ЯМР (d6-ДМСО): δ (м.д.) 8,14 (дд, 1H); 7,94-7,85 (м, 2H); 7,73 (д, 1H); 7,58-7,50 (м, 2H); 4,80 (кв, 1H); 1,35 (д, 3H).
МС (ES/+): m/z=189[M-NH2]+
Промежуточное соединение 15 и промежуточное соединение 16
[1-(3-Хлор-1-нафталинил)этил]амин (энантиомер 2) и
[1-(3-Хлор-1-нафталинил)этил]амин (энантиомер 1)
К раствору промежуточного соединения 14 (1,12 г) в ацетоне (10 мл) добавляют раствор (S)-метоксифенилуксусной кислоты (0,9 г) в ацетоне (10 мл). Густую суспензию нагревают при 56°С в течение 40 мин, затем ее перемешивают при комнатной температуре в течение ночи. Суспензию фильтруют и твердый остаток промывают ацетоном (10 мл). Твердое вещество (0,87 г) растирают в ацетоне (10 мл), нагревая до температуры кипения с обратным холодильником 1 час, охлаждая до комнатной температуры и перемешивая в течение ночи. Суспензию фильтруют и твердый остаток (0,6 г) промывают ацетоном (10 мл) и растирают один раз снова, как описано выше, получая соль [1-(хлорнафталин-1-ил)этил]амина (S)-метоксифенилуксусной кислоты (0,45 г). Твердое вещество перемешивают в смеси водного насыщенного NaHCO3 (20 мл) и DCM (20 мл). Органическую фазу промывают насыщенным раствором соли (20 мл), сушат и концентрируют в вакууме, получая указанное в заголовке промежуточное соединение 15 (0,25 г) в виде бесцветного масла.
Маточные растворы от осаждения и первого растирания собирают, концентрируют в вакууме, обрабатывают водным насыщенным NaHCO3 (20 мл) и экстрагируют DCM (20 мл). Полученное таким образом бесцветное масло (1 г) обрабатывают (R)-метоксифенилуксусной кислотой (0,8 г) в ацетоне (8 мл), как описано выше (одно осаждение и два растирания), получая соль 1-(3-хлорнафталин-1-ил)этиламина (R)-метоксифенилуксусной кислоты (0,43 г). Часть этого твердого вещества (200 мг) перемешивают в смеси водного насыщенного NaHСO3 (10 мл) и DCM (10 мл). Органическую фазу промывают насыщенным раствором соли (20 мл), сушат и концентрируют в вакууме, получая указанное в заголовке промежуточное соединение 16 (0,100 г), в виде бесцветного масла.
Промежуточное соединение 15 (энантиомер 2):
ЯМР (d6-ДМСО): δ (м.д.) 8,14 (дд, 1H); 7,94-7,85 (м, 2H); 7,73 (д, 1H); 7,58-7,50 (м, 2H); 4,80 (кв, 1H); 1,35 (д, 3H).
МС (ES/+): m/z=189[M-NH2]+
[α]D=+69,7 (c=0,96, CH3CN)
Аналитические условия SFC (Gilson): колонка: Chiralcel OD 25×4,6 мм; подвижная фаза: СО2/этанол+0,1% изопропанол 92/8 об./об.; скорость потока=2,5 мл/мин; Р=180 бар; Т=35°С; детектирование: λ=225 нм): время удерживания=13,8 мин; чистота (а/а %)>99%.
Промежуточное соединение 16 (энантиомер 1):
ЯМР (d6-ДМСО): δ (м.д.) 8,14 (дд, 1H); 7,94-7,85 (м, 2H); 7,73 (д, 1H); 7,58-7,50 (м, 2H); 4,80 (кв, 1H); 1,35 (д, 3H).
МС (ES/+): m/z=189[M-NH2]+
[α]D=-66,9 (c=1,065, CH3CN)
Аналитические условия SFC (Gilson): колонка: Chiralcel OD 25×4,6 мм; подвижная фаза: СО2/этанол+0,1% изопропанол 92/8 об./об.; скорость потока=2,5 мл/мин; Р=180 бар; Т=35°С; детектирование: λ=225 нм): время удерживания=12,4 мин; чистота (а/а %)>99%.
Промежуточное соединение 17
1,1-Диметилэтил [1-(3-хлор-1-нафталинил)этил]карбамата (энантиомер 2)
Промежуточное соединение 15 (0,6 г) растворяют в сухом DCM (20 мл), затем добавляют TEA (1,094 мл) и ди-трет-бутилдикарбонат (820 мг). Смесь перемешивают в течение ночи и затем растворитель удаляют в вакууме, получая сырой продукт, который очищают флэш-хроматографией (элюируя смесью CH:AcOEt=9:1), получая указанное в заголовке соединение (1,17 г) в виде желтого масла.
ТСХ: CH:AcOEt 9:1, Rf=0,32.
МС (ES/+): m/z=328[M+Na]+.
Промежуточное соединение 18
1,1-Диметилэтил [1-(3-хлор-1-нафталинил)этил]метилкарбамата (энантиомер 2)
Промежуточное соединение 17 (1,16 г) растворяют в сухом ДМФА (7 мл), затем в атмосфере азота добавляют 60% дисперсию NaH в минеральном масле (200 мг) и смесь перемешивают при комнатной температуре в течение 15 мин. Затем добавляют метилиодид (2,3 мл) и раствор нагревают при 50°С в течение 2 час. Добавляют воду и AcOEt, органическую фазу отделяют, промывают насыщенным раствором соли, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают флэш-хроматографией (элюируя смесью CH:AcOEt=99:1 до 95:5), получая указанное в заголовке соединение (614 мг) в виде желтого масла.
ТСХ: CH/AcOEt 9:1, Rf=0,48.
МС (ES/+): m/z=342[M+Na]+.
Промежуточное соединение 19
1-(3-Хлор-1-нафталинил)-N-метилэтанамин (энантиомер 2)
К раствору промежуточного соединения 18 (614 мг) в сухом DCM (30 мл) при 0°С и в атмосфере азота добавляют TFA (7,5 мл) и раствор перемешивают в этих условиях в течение 2 час. Затем добавляют водный насыщенный NaHCO3, органическую фазу отделяют, сушат и упаривают в вакууме, получая указанное в заголовке соединение (446 мг) в виде бесцветного масла.
ТСХ: DCM/MeOH 9:1, Rf=0,40.
МС (ES/+): m/z=189[M-NHMe+H]+.
Промежуточное соединение 20
7-Формил-1-бензофуран-5-карбонитрил
К раствору 5-бром-1-бензофуран-7-карбальдегида (2,0 г) в ДМФА (15 мл) в атмосфере азота добавляют пиридин (1,08 мл) и CuCN (1,2 г). Смесь нагревают и перемешивают при 140°С в течение двух дней. Добавляют дополнительное количество CuCN (800 мг) и смесь перемешивают в течение еще 4 час в этих условиях. Добавляют AcOEt, раствор фильтруют на фильтре Гуча и промывают три раза водным насыщенным NaHCO3; органические экстракты сушат и упаривают в вакууме, получая неочищенный продукт, который очищают Biotage флэш-хроматографией, элюируя смесью CH:AcOEt=4:1, получая указанное в заголовке соединение (400 мг) в виде желтого твердого вещества.
ТСХ: CH:AcOEt 7:3, Rf=0,26.
ЯМР (CDCl3): δ (м.д.) 10,45 (с, 1H); 8,15 (д, 1H); 8,07 (д, 1H); 7,89 (д, 1H); 6,95 (д, 1H).
Промежуточное соединение 21
7-[(Метиламино)метил]-1-бензофуран-5-карбонитрил
Промежуточное соединение 20 (180 мг) суспендируют в сухом MeOH (2 мл) в атмосфере азота и затем добавляют 2,0М раствор метиламина в MeOH (2,1 мл). Смесь перемешивают при комнатной температуре в течение 2 час; затем добавляют калийборгидрид (84 мг) и раствор перемешивают в течение ночи. Добавляют AcOEt и раствор промывают водным насыщенным NaHCO3; органические экстракты сушат и упаривают в вакууме, получая неочищенный продукт, который очищают SCX картриджем, получая указанное в заголовке соединение (178 мг) в виде белого твердого вещества.
ЯМР (CDCl3): δ (м.д.) 7,78 (с, 1H); 7,65 (с, 1H); 7,45 (с, 1H); 6,79 (с, 1H); 3,99 (с, 2H); 2,44 (с, 3H).
МС (ES/+): m/z=187[M+H]+
Промежуточное соединение 22
7-(1-Гидроксиэтил)-1-бензофуран-5-карбонитрил
К перемешиваемому раствору 5-бром-1-бензофуран-7-карбальдегида в сухом ТГФ (10 мл), охлажденному при -65°С и в атмосфере азота, добавляют по каплям 3,0М раствор метилмагнийбромида в Et2O (1,52 мл) и раствор перемешивают в этих условиях в течение 2 час. Затем добавляют водный насыщенный NH4Cl и смесь экстрагируют AcOEt (3×20 мл). Органические экстракты собирают, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают флэш-хроматографией (элюируя смесью CH:AcOEt=8:2), получая указанное в заголовке соединение (225 мг) в виде желтого масла.
ТСХ: CH:AcOEt 8:2, Rf=0,2.
ЯМР (CDCl3): δ (м.д.) 7,8 (с, 1H); 7,7 (с, 1H); 7,6 (д, 1H); 6,8 (д, 1H); 5,4 (д, 1H); 2,2 (м, 1H); 1,6 (м, 3H).
Промежуточное соединение 23
7-Ацетил-1-бензофуран-5-карбонитрил
К раствору промежуточного соединения 22 (225 мг) в DCM (3 мл) добавляют Dess-Martin реагент периодинана (561 мг) и смесь перемешивают в течение 2 час при комнатной температуре в атмосфере азота. Добавляют водный насыщенный NaHCO3, вместе с 5% водным раствором тиосульфата натрия, и полученную смесь перемешивают в течение 20 мин; затем ее экстрагируют DCM, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают Biotage флэш-хроматографией, элюируя смесью CH:AcOEt=9:1, получая указанное в заголовке соединение (200 мг) в виде бледно-желтого масла.
ЯМР (CDCl3): δ (м.д.) 8,2 (с, 1H); 8,1 (с, 1H); 7,8 (с, 1H); 6,9 (с, 1H); 2,8 (с, 3H).
Промежуточное соединение 24
7-[1-(Метиламино)этил]-1-бензофуран-5-карбонитрил
Промежуточное соединение 23 (197 мг) суспендируют в сухом MeOH (8 мл) в атмосфере азота и затем добавляют 2,0М раствор метиламина в MeOH (2,7 мл). Смесь перемешивают при комнатной температуре в течение ночи; затем добавляют калийборгидрид (84 мг) и раствор перемешивают при комнатной температуре в течение 2 час. Добавляют воду при 0°С, затем MeOH удаляют выпариванием в вакууме и полученную водную фазу экстрагируют DCM; органические экстракты собирают, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают с помощью SCX картриджа, получая указанное в заголовке соединение (183 мг) в виде бесцветного масла.
ЯМР (CDCl3): δ (м.д.) 7,80 (с, 1H); 7,70 (с, 1H); 7,55 (с, 1H); 6,80 (с, 1H); 4,15 (кв, 1H); 2,30 (с, 3H); 1,45 (д, 3H).
Промежуточное соединение 25
1-(5-Бром-1-бензофуран-7-ил)этанол
5-Бром-1-бензофуран-7-карбальдегид (800 мг) растворяют в сухом ТГФ (50 мл) и к этому раствору, предварительно охлажденному при -78°С и в атмосфере азота, медленно добавляют 3,0М раствор метилмагнийбромида в диэтиловом эфире (2,4 мл). Раствору дают возможность нагреться до -50°С и затем добавляют водный насыщенный NH4Cl и AcOEt, органическую фазу отделяют, промывают водой и насыщенным раствором соли и упаривают в вакууме, получая неочищенный продукт, который очищают Biotage флэш-хроматографией, элюируя смесью CH:AcOEt=9:1, получая указанное в заголовке соединение (450 мг) в виде желтого твердого вещества.
ТСХ: СН:AcOEt 1:1, Rf=0,70.
Промежуточное соединение 26
[1-(5-Хлор-1-бензофуран-7-ил)этил]метиламин
К раствору промежуточного соединения 25 (450 мг) в CH2Cl2 (8 мл) добавляют реагент периодинана Dess-Martin (800 мг) и смесь перемешивают в течение 1 час при комнатной температуре в атмосфере азота. Добавляют водный насыщенный NaHCO3, вместе с 5% водным раствором тиосульфата натрия и полученную смесь перемешивают в течение 20 мин; затем ее экстрагируют DCM, сушат и упаривают в вакууме, получая неочищенное промежуточное соединение [ТСХ: CH:AcOEt=7:3, Rf=0,5 (детектирование 2,4-динитрофенилгидразином].
Это промежуточное соединение (250 мг) суспендируют в сухом метаноле (5 мл) в атмосфере азота и затем добавляют 2,0М раствор метиламина в MeOH (2,6 мл). Смесь перемешивают при комнатной температуре в течение 1 час; затем добавляют калийборгидрид (84 мг) и раствор перемешивают при комнатной температуре в течение 0,5 час. MeOH удаляют выпариванием в вакууме и неочищенный продукт очищают с помощью SCX картриджа, получая указанное в заголовке соединение в виде бледно-желтого масла (130 мг).
МС (ES/+): m/z=254-256[M+H]+
Промежуточное соединение 27
[(5-Бром-1-бензофуран-7-ил)метил]метиламин гидрохлорид
5-Бром-1-бензофуран-7-карбальдегид (5 г) суспендируют в сухом MeOH (20 мл) в атмосфере азота и затем добавляют 2,0М раствор метиламина в MeOH (16,7 мл). Смесь перемешивают при комнатной температуре в течение 1 час; затем добавляют калийборгидрид (1,79 г) и раствор перемешивают в течение 30 мин. MeOH удаляют выпариванием в вакууме и добавляют DCM (300 мл) для разбавления неочищенного продукта; насыщенный раствор соли используют для промывания органической фазы и затем добавляют 1,0М раствор HCl в диэтиловом эфире (25 мл), получая указанное в заголовке соединение в виде белого твердого вещества (5 г).
МС (ES/+): m/z=240, 242 [M+H]+
Промежуточное соединение 28
[(3-Хлор-1-нафталинил)метил]метиламин
Метиламин (2М раствор в MeOH - 7 мл) добавляют к раствору 3-хлорнафталин-1-карбальдегида (750 мг) в MeOH (20 мл) в атмосфере азота. Смесь перемешивают при комнатной температуре в течение 2 час, затем ее охлаждают до 0°С и добавляют калийборгидрид (290 мг). Смесь перемешивают при 0°С в течение 2 час, затем ее гасят водой и экстрагируют DCM. Органический слой сушат, концентрируют в вакууме и остаток очищают на SCX-картридже (нагружают DCM, промывают MeOH, элюируют 0,25М раствором NH3 в MeOH, а затем MeOН). Выпаривание растворителя дает указанное в заголовке соединение (650 мг) в виде желтого масла.
ТСХ: AcOEt/MeOH 9:1, Rf=0,2 (детектирование нингидрином).
МС (ES/+): m/z=206[M+H]+.
Промежуточное соединение 29
[(3-Бром-1-нафталинил)метил]метиламин
2М раствор метиламина в MeOH (2,46 мл) добавляют к раствору 3-бромнафталин-1-карбальдегида (290 мг) в безводном MeOH (12 мл) в атмосфере азота и раствор перемешивают при комнатной температуре в течение 2 час. Добавляют калийборгидрид (100 мг) при 0°С и полученную смесь перемешивают при комнатной температуре в течение ночи, затем ее охлаждают до 0°С и гасят, добавляя воду (15 мл), и экстрагируют DCM (3×15 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат и концентрируют в вакууме, получая указанное в заголовке соединение (288 мг) в виде желтого масла.
ТСХ: CH/AcOEt 3:7, Rf=0,1 (детектирование нингидрином).
МС (ES/+): m/z=250, 252[M+H]+
Промежуточное соединение 30
4-Формил-2-нафталинкарбонитрил
К раствору 4-(гидроксиметил)-2-нафталинкарбонитрила (87 мг) в безводном DCM (4 мл) медленно в атмосфере азота добавляют периодинан Dess Martin (222 мг). Реакционную смесь перемешивают при комнатной температуре в течение 2 час, затем ее разбавляют Et2O (5 мл) и гасят, добавляя тиосульфат натрия (375 мг), растворенный в водном насыщенном NaHCO3 (5 мл). Полученную смесь перемешивают в течение еще 15 мин, затем ее экстрагируют Et2O (3×5 мл). Объединенные органические экстракты сушат и концентрируют в вакууме, получая указанное в заголовке соединение (96,4 мг) в виде белого твердого вещества.
ТСХ: CH/AcOEt 6:4, Rf=0,7.
ЯМР (CDCl3): δ (м.д.) 10,40 (с, 1H); 9,25 (д, 1H); 8,45 (с, 1H); 8,10 (с, 1H); 8,00 (д, 1H); 7,85 (т, 1H); 7,75 (м, 1H).
МС (ES/+): m/z=182[M+H]+.
Промежуточное соединение 31
4-[(Метиламино)метил]-2-нафталинкарбонитрил
2,0М раствор метиламина в MeOH (1,06 мл) добавляют к раствору промежуточного соединения 6 (96 мг) в безводном MeOH (10 мл) в атмосфере азота и раствор перемешивают при комнатной температуре в течение 2 час. Добавляют калийборгидрид (43,0 мг) при 0°С и полученную смесь перемешивают при комнатной температуре в течение ночи, затем ее охлаждают до 0°С и гасят, добавляя воду (5 мл), и экстрагируют DCM (3×5 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат и концентрируют в вакууме. Остаток очищают с помощью SCX-картриджа (нагружают МеОН, промывают MeOH, элюируют NH3 0,25М в MeOH), получая указанное в заголовке соединение (79,5 мг) в виде желтого масла.
ТСХ: DCM/MeOH 8:2, Rf=0,61 (детектирование нингидрином).
МС (ES/+): m/z=197[M+H]+.
Промежуточное соединение 32
1,1-Диметилэтил 4-(1,3-бензодиоксол-5-ил)-4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-1-пиперидинкарбоксилата
Раствор 5-бром-1,3-бензодиоксола (1,11 мл) в безводном ТГФ (6 мл) добавляют по каплям в суспензию магниевых стружек (250 мг) и нескольких кристаллов йода в безводном ТГФ (2,5 мл) в атмосфере азота. Смесь кипятят с обратным холодильником в течение 30 мин, затем ей предоставляют возможность охладиться до комнатной температуры и добавляют по каплям в смесь 1,1-диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-1-пиперидинкарбоксилата (1 г) и иодида меди (351 мг) в безводном ТГФ (15 мл), предварительно охлажденную до 0°С в атмосфере азота. Смеси дают возможность нагреться до комнатной температуры и перемешивают при 23°С в течение 2 час. Смесь обрабатывают водным насыщенным раствором NH4Cl и водным NH4OH (1 мл) и экстрагируют AcOEt. Объединенные органические экстракты собирают, сушат и концентрируют в вакууме. Остаток очищают Biotage флэш-хроматографией (CH/AcOEt 8:2), получая указанное в заголовке соединение (720 мг) в виде белой пены.
ТСХ: CH:AcOEt 1:1, Rf=0,52 (детектирование нингидрином).
МС (ES/+): m/z=470 [M+Na]+.
Следуя той же самой методике, описанной для промежуточного соединения 32, получают промежуточные соединения 33, 34, 35, 36, 37.
Промежуточное соединение 33
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-4-[3-фтор-4-(метилокси)фенил]-1-пиперидинкарбоксилата
Исходя из 4-бром-2-фтор-1-(метилокси)бензола (6 г) и используя 1,1-диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-1-пиперидинкарбоксилата (4 г), получают 700 мг указанного в заголовке соединения.
ТСХ: CH:AcOEt 1:1, Rf=0,41 (детектирование нингидрином).
МС (ES/-): m/z=450[M-H]-.
Промежуточное соединение 34
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-4-(3-фтор-4-метилфенил)-1-пиперидинкарбоксилата
Путем добавления 0,5М раствора (3-фтор-4-метилфенил)магнийбромида в ТГФ (24,6 мл) и исходя из 1,1-диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-1-пиперидинкарбоксилата (2 г) получают 3,12 г указанного в заголовке соединения в виде желтой пены без какой-либо хроматографическорй очистки.
МС (ES/-): m/z=434 [M-H]-.
Промежуточное соединение 35
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата
Путем добавления 0,5М раствора [4-(метилокси)фенил]магнийбромида в ТГФ (6 мл) и исходя из 1,1-диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-1-пиперидинкарбоксилата (500 мг) получают 770 мг указанного в заголовке соединения без какой-либо хроматографической очистки.
МС (ES/-): m/z=432 [M-H]-.
Промежуточное соединение 36
1,1-Диметилэтил 4-(2,3-дигидро-1-бензофуран-5-ил)-4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-1-пиперидинкарбоксилата
Исходя из 5-бром-2,3-дигидро-1-бензофурана (2,98 г) и используя 1,1-диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-1-пиперидинкарбоксилата (1 г), получают 2 г указанного в заголовке соединения без какой-либо хроматографической очистки.
ВЭЖХ (ступенчатая): tR=5,02 мин.
Промежуточное соединение 37
1,1-Диметилэтил 4-(1-бензофуран-5-ил)-4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-1-пиперидинкарбоксилата
Исходя из 5-бром-1-бензофурана (824 мг) и используя 1,1-диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-1-пиперидинкарбоксилата (1 г), получают 940 мг указанного в заголовке соединения без какой-либо хроматографической очистки.
ВЭЖХ (ступенчатая): tR=5,023 мин.
Промежуточное соединение 38
1,1-Диметилэтил 4-(3-цианофенил)-4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-1-пиперидинкарбоксилата
Раствор 1,0М раствора 2-бромпропана в ТГФ (4,7 мл) в безводном ТГФ (30 мл) добавляют по каплям в суспензию магниевых стружек (1,46 г) в безводном ТГФ (20 мл) в атмосфере азота. Смесь кипятят с обратным холодильником в течение 45 мин, затем ей предоставляют возможность охладиться до комнатной температуры и капельным способом добавляют к смеси 3-иодбензонитрила (2,11 г) в сухом ТГФ (20 мл), предварительно охлажденной при -40°С в атмосфере азота. После перемешивания в течение 1 час в этих условиях часть (6,5 мл) указанного раствора прикапывают поверх 1,1-диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-1-пиперидинкарбоксилата (700 мг) и иодида меди (123 мг) в безводном ТГФ (10 мл), предварительно охлажденных до 0°С в атмосфере азота. Смеси позволяют нагреться до комнатной температуры и перемешивают при 23°С в течение 1,5 час. Смесь обрабатывают водным насыщенным раствором NH4Cl и экстрагируют AcOEt. Объединенные органические экстракты собирают, сушат и концентрируют в вакууме, получая указанное в заголовке соединение (1,9 г) в виде белой пены.
МС (ES/-): m/z=427[M-H]-.
Промежуточное соединение 39
(4-(1,3-Бензодиоксол-5-ил)-1-{[(1,1-диметилэтил)окси]карбонил}-4-пиперидинил)уксусная кислота
Смесь промежуточного соединения 32 (620 мг) в 3-пентаноне (80 мл) и воды (40 мл) нагревают до 102°С в течение 72 час. Раствору дают возможность охладиться до комнатной температуры и органическую фазу отделяют. Водную фазу подкисляют до рН 3 и экстрагируют AcOEt (2×100 мл).
Объединенные органические фазы сушат и концентрируют в вакууме, получая неочищенный продукт, который очищают Biotage флэш-хроматографией (элюирование смесью CH:AcOEt=9:1 до 1:1), получая указанное в заголовке соединение (310 мг) в виде желтого масла.
ТСХ: CH:AcOEt=1:1, Rf=0,25 (детектирование нингидрином).
МС (ES/-): m/z=362[M-H]-.
Следуя той же самой методике, описанной для промежуточного соединения 39, получают промежуточные соединения 40 и 41.
Промежуточное соединение 40
{1-{[(1,1-Диметилэтил)окси]карбонил}-4-[3-фтор-4-(метилокси)фенил]-4-пиперидинил}уксусная кислота
Исходя из промежуточного соединения 33 (800 мг) получают 620 мг указанного в заголовке соединения.
ТСХ: CH:AcOEt=1:1, Rf=0,13 (детектирование нингидрином).
МС (ES/-): m/z=366[M-H]-.
Промежуточное соединение 41
[1-{[(1,1-Диметилэтил)окси]карбонил}-4-(3-фтор-4-метилфенил)-4-пиперидинил]уксусная кислота
Исходя из промежуточного соединения 34 (3,12 г) получают 1,78 г указанного в заголовке соединения.
ТСХ: CH:AcOEt=1:1, Rf=0,13 (детектирование нингидрином).
ЯМР (CDCl3): δ (м.д.) 7,16 (т, 1H); 7,02-6,96 (м, 2H); 3,67 (уш.д, 2H); 3,17 (уш.т, 2H); 2,59 (с, 2H); 2,27 (с, 3H); 2,23 (уш.д, 2H); 1,91 (т, 2H); 1,46 (с, 9H).
Промежуточное соединение 42
{1-{[(1,1-Диметилэтил)окси]карбонил}-4-[4-(метокси)фенил]-4-пиперидинил}уксусная кислота
Смесь промежуточного соединения 35 (600 мг) в 3-пентаноне (6 мл) и воды (2 мл) подвергают облучению микроволнами при 150°С в течение 12 мин (2 цикла). Раствору дают возможность охладиться до комнатной температуры, органическую фазу отделяют и упаривают в вакууме. Затем неочищенный продукт растворяют в смеси CH:Et2O=1:1 и добавляют 1,0М водный NaOH; водную фазу отделяют и снова промывают смесью CH:Et2O=1:1. Затем смесь подкисляют до рН 5 и экстрагируют AcOEt. Органическую фазу сушат и концентрируют в вакууме, получая указанное в заголовке соединение (262 мг) в виде желтовато-коричневого масла.
МС (ES/-): m/z=348[M-H]-.
Следуя такой же методике, как описано для промежуточного соединения 42, получают промежуточные соединения 43, 44, 45.
Промежуточное соединение 43
(4-(2,3-Дигидро-1-бензофуран-5-ил)-1-{[(1,1-диметилэтил)окси]карбонил}-4-пиперидинил)уксусная кислота
Исходя из промежуточного соединения 36 (2 г) получают 630 мг указанного в заголовке соединения в виде желтой пены.
ЯМР (CDCl3): δ (м.д.) 7,17 (д, 1H); 7,06 (дд, 1H); 6,75 (д, 1H); 4,57 (м, 2H); 3,67 (уш.д, 2H); 3,21 (м, 2H); 3,16 (уш.д, 2H); 2,57 (с, 2H); 2,25 (уш.д, 2H); 1,89 (м, 2H); 1,46 (с, 9H).
Промежуточное соединение 44
(4-(1-Бензофуран-5-ил)-1-{[(1,1-диметилэтил)окси]карбонил}-4-пиперидинил)уксусная кислота
Исходя из промежуточного соединения 37 (940 мг) получают 170 мг указанного в заголовке соединения в виде желтовато-коричневой пены.
МС (ES/-): m/z=358[M-H]-.
Промежуточное соединение 45
(4-(3-Цианофенил)-1-{[(1,1-диметилэтил)окси]карбонил}-4-пиперидинил)уксусная кислота
Исходя из промежуточного соединения 38 (1,9 г), получают 263 мг указанного в заголовке соединения в виде желтого масла.
ЯМР (CDCl3): δ (м.д.) 7,64 (д, 1H); 7,62 (тд, 1H); 7,57 (тд, 1H); 7,5 (т, 1H); 3,64 (уш.м, 2H); 3,26 (тм, 2H); 2,67 (с, 2H); 2,24 (дм, 2H); 1,99 (тм, 2H); 1,47 (с, 9H).
Промежуточное соединение 46
Фенилметил 2-этенил-4-оксо-3,4-дигидро-1(2Н)-пиридинкарбоксилата
4-(Метилокси)пиридин (4,52 г) растворяют в сухом ТГФ (100 мл) при комнатной температуре в атмосфере азота и по каплям добавляют раствор фенилметилхлоридокарбоната (6,4 мл) в сухом ТГФ (75 мл). Затем смесь охлаждают при -78°С и добавляют 1,0М раствор винилмагнийбромида в ТГФ (50 мл). После перемешивания в течение 2 час, добавляют 10% водную HCl и смеси дают возможность нагреться до комнатной температуры. Смесь перемешивают в течение 1 час и затем органическую фазу отделяют, промывают водным насыщенным NaHCO3, насыщенным раствором соли, сушат и концентрируют в вакууме, получая неочищенный продукт, который очищают Biotage флэш-хроматографией (элюирование смесью CH:AcOEt=75:25), получая указанное в заголовке соединение (8,7 г) в виде бледно-желтого масла.
МС (ES/+): m/z=258[M+H]+.
Промежуточное соединение 47
1,1-Диметилэтил 2-этенил-4-оксо-3,4-дигидро-1(2Н)-пиридинкарбоксилата
К раствору промежуточного соединения 46 (5,3 г) в MeOH (100 мл) при 0°С и атмосфере азота добавляют метоксид натрия (1,71 г) и смеси дают возможность нагреться до комнатной температуры. После перемешивания в течение 1 час MeOH удаляют выпариванием и остаток растворяют в CH3CN (100 мл); добавляют ди-трет-бутилдикарбонат (7,0 г) и диметиламинопиридин (4,18 г). Смесь перемешивают в течение 1 час и затем CH3CN удаляют выпариванием и добавляют AcOEt (400 мл), промывают водой, насыщенным раствором соли, сушат и концентрируют в вакууме, получая неочищенный продукт, который очищают Biotage флэш-хроматографией (элюирование смесью CН:AcOEt=8:2, получая указанное в заголовке соединение (4,3 г) в виде желтого масла.
ТСХ: CH/AcOEt 7:3, Rf=0,41 (детектирование нингидрином).
МС (ES/+): m/z=168 [M-трет-бутил+H]+.
Промежуточное соединение 48
1,1-Диметилэтил 2-этенил-4-оксо-1-пиперидинкарбоксилата
К раствору промежуточного соединения 47 (400 мг) в сухом ТГФ (8 мл), охлажденному при -78°С и в атмосфере азота, добавляют 1,0М раствор L-селекрида в ТГФ (2,7 мл). После перемешивания в этих условиях в течение 20 мин добавляют воду (20 мл) и насыщенный раствор соли (10 мл) и водную фазу экстрагируют AcOEt (3×50 мл). Затем органическую фазу сушат и концентрируют в вакууме, получая неочищенный продукт, который очищают флэш-хроматографией (элюирование смесью CH:AcOEt=7:3), получая указанное в заголовке соединение (273 мг) в виде желтого масла.
ТСХ: CH/AcOEt 7:3, Rf=0,47 (детектирование нингидрином).
МС (ES/+): m/z=170[M-трет-бутил+H]+.
Промежуточное соединение 49
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-2-метил-1-пиперидинкарбоксилата
К раствору 2,2-диметил-1,3-диоксан-4,6-диона (кислота Meldrum) (12,8 г) в MeOH (190 мл) добавляют ацетат аммония (1,4 г) и 1,1-диметилэтил 2-метил-4-оксо-1-пиперидинкарбоксилата (19 г). Раствор перемешивают при комнатной температуре в течение 36 час, затем MeOH удаляют выпариванием в вакууме, получая указанное в заголовке соединение (29,6 г) в виде бледно-желтого твердого вещества.
ТСХ: CH:AcOEt 7:3, Rf=0,22 (детектирование нингидрином).
МС (ES/+): m/z=362[M+Na]+.
МС (ES/-): m/z=338[M-H]-.
Промежуточное соединение 50
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-илиден)-2-этенил-1-пиперидинкарбоксилата
Круглодонную колбу загружают 1,1-диметилэтил 2-этенил-4-оксо-1-пиперидинкарбоксилатом (1,22 г), 2,2-диметил-1,3-диоксан-4,6-дионом (кислота Meldrum) (770 мг), ацетатом аммония (74 мг) в безводном толуоле (3 мл). Смесь перемешивают в течение 18 час при комнатной температуре, затем органический раствор сушат и концентрируют в вакууме, получая указанное в заголовке соединение (1,68 г) в виде желтого твердого вещества.
МС (ES/-): m/z=350[M-H]-.
ВЭЖХ (ступенчатая): tR=5,48 мин.
Промежуточные соединения 51 и 52
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата
(промежуточное соединение 51 - антиизомер)
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата
(промежуточное соединение 52 - син-изомер)
1M раствор 4-фторфенилмагнийбромида в ТГФ (6,5 мл) добавляют по каплям к смеси промежуточного соединения 49 (4,5 г) и иодида меди (750 мг) в безводном ТГФ (45 мл), предварительно охлажденной до 0°С в атмосфере азота. Смесь перемешивают в этих условиях в течение 15 мин и затем дают возможность нагреться до комнатной температуры и перемешивают при 23°С в течение 1 час. Смесь охлаждают до 0°С, обрабатывают водным насыщенным NH4Cl (40 мл) и водным NH4OH (10 мл); ТГФ удаляют выпариванием и органическую фазу экстрагируют AcOEt (3×60 мл). Объединенные органические экстракты собирают, сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают флэш-хроматографией (смесь CH/AcOEt 9:1 до 7:3), получая указанные в заголовке соединения 51 (925 мг) в виде желтого масла и 52 (1,89 г) в виде желтого твердого вещества, которые характеризуют следующим образом:
Промежуточное соединение 51:
ВЭЖХ (ступенчатая): tR=6,08 мин.
ЯМР (CDCl3): δ (м.д.) 7,24 (дд, 2H); 6,99 (т, 2H); 3,91 (м, 1H); 3,85 (м, 1H); 3,65 (с, 1H); 3,2 (м, 1H); 2,25-2,50 (м, 4H); 1,55 (с, 3H); 1,29 (с, 9H); 1,23 (д, 3H); 1,01 (с, 3H).
МС (ES/-): m/z=434[M-H]-.
Промежуточное соединение 52:
ВЭЖХ (ступенчатая): tR=6,23 мин.
ЯМР (CDCl3): δ (м.д.) 7,33 (дд, 2H); 7,06 (т, 2H); 4,42 (м, 1H); 4,01 (дт, 1H); 3,25 (с, 1H); 2,96 (дм, 1H); 2,88 (т, 1H): 2,79 (дт, 1H); 2,25 (дд, 1H); 1,95 (тд, 1H); 1,53 (с, 3H); 1,44 (с, 9H); 0,97 (с, 3H); 0,63 (д, 3H).
МС (ES/-): m/z=434[M-H]-.
Следуя той же самой методике, описанной для промежуточного соединения 51 и 52, получают промежуточные соединения 53, 54 и 55, 56.
Промежуточные соединения 53 и 54
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-метил-4-фенил-1-пиперидинкарбоксилата
(промежуточное соединение 53 - антиизомер)
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-метил-4-фенил-1-пиперидинкарбоксилата
(промежуточное соединение 54 - син-изомер)
Исходя из 1,0М раствора фенилмагнийбромида в ТГФ (26,5 мл) и используя промежуточное соединение 49 (4,5 г), получают 610 мг указанного в заголовке соединения 53 и 495 мг указанного в заголовке соединения 54, характеризуемые, как следует ниже:
Промежуточное соединение 53:
ВЭЖХ (ступенчатая): tR=6,05 мин.
ЯМР (CDCl3): δ (м.д.) 7,20-7,32 (м, 5H); 3,88 (м, 2H); 3,67 (с, 1H); 3,23 (м, 1H); 2,30-2,50 (м, 4H); 1,52 (с, 3H); 1,28 (с, 9H); 1,25 (д, 3H); 0,85 (с, 3H).
МС (ES/-): m/z=416[M-H]-.
Промежуточное соединение 54:
ВЭЖХ (ступенчатая): tR=6,18 мин.
ЯМР (CDCl3): δ (м.д.) 7,20-7,32 (м, 5H); 4,38 (м, 1H); 3,97 (дт, 1H); 3,2 (с, 1H); 2,95 (дм, 1H); 2,87 (т, 1H); 2,8 (дт, 1H); 2,21 (дд, 1H); 1,91 (тд, 1H); 1,46 (с, 3H); 1,4 (с, 9H); 0,77 (с, 3H); 0,58 (д, 3H).
МС (ES/-): m/z=416[M-H]-.
Промежуточные соединения 55 и 56
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-этенил-4-(4-фторфенил)-1-пиперидинкарбоксилата
(промежуточное соединение 55 - антиизомер)
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-этенил-4-(4-фторфенил)-1-пиперидинкарбоксилата
(промежуточное соединение 56 - син-изомер)
Исходя из 1,0М раствора 4-фторфенилмагнийбромида в ТГФ (2,2 мл) и используя промежуточное соединение 50 (260 мг), получают 60 мг указанного в заголовке соединения 55 и 8 мг указанного в заголовке соединения 56, характеризуемые, как следует ниже:
Промежуточное соединение 55:
ЯМР (CDCl3): δ (м.д.) 7,27 (дд, 2H); 6,98 (t, 2H); 6,14 (ддд, 1H); 5,17 (дд, 1H); 5,04 (дт, 1H); 4,9 (м, 1H); 4,21 (с, 1H); 4,15 (дт, 1H); 3,32 (дт, 1H); 3,24 (тт, 1H); 2,88 (д,кв, 1H); 1,94 (дд, 1H); 1,74 (тд, 1H); 1,52 (с, 3H); 1,41 (с, 9H); 0,94 (с, 3H)
МС (ES/-): m/z=446[M-H]-.
Промежуточное соединение 56:
ЯМР (CDCl3): δ (м.д.) 7,27 (дд, 2H); 6,98 (t, 2H); 5,14 (ддд, 1H); 4,8 (уш.м, 2H); 4,68 (дт, 2H); 4,06 (м, 1H); 3,25 (с, 1H); 2,97 (м, 3H); 2,31 (дт, 1H); 1,94 (тт, 1H); 1,52 (с, 3H); 1,41 (с, 9H); 0,95 (с, 3H).
МС (ES/-): m/z=446[M-H]-.
Промежуточные соединения 57 и 58
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-метил-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (промежуточное соединение 57 - антиизомер)
1,1-Диметилэтил 4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-метил-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (промежуточное соединение 58 - син-изомер)
Раствор 1-бром-4-(метокси)бензола (4,4 мл) в безводном ТГФ (30 мл) медленно прикапывают в суспензию магниевых стружек (1,16 мг) в сухом ТГФ (10 мл) в атмосфере азота. Смесь кипятят с обратным холодильником в течение 30 мин, затем ей дают возможность охладиться до комнатной температуры и добавляют по каплям к смеси промежуточного соединения 49 (4,5 г) и иодида меди (757 мг) в безводном ТГФ (40 мл), предварительно охлажденной до 0°С в атмосфере азота. Смеси дают возможность нагреться до комнатной температуры и перемешивают при 23°С в течение 2 час. Смесь обрабатывают водным насыщенным NH4Cl и экстрагируют AcOEt. Объединенные органические экстракты собирают, сушат и концентрируют в вакууме. Остаток очищают флэш-хроматографией (CH:AcOEt 9:1 до 6:4), получая указанные в заголовке соединения 57 (1 г) и 58 (1,5 г), характеризуемые, как указано ниже:
Промежуточное соединение 57:
ТСХ: CH/AcOEt 7:3, Rf=0,23 (детектирование нингидрином).
ЯМР (CDCl3): δ (м.д.) 7,2 (д, 2H); 6,9 (д, 2H); 3,94-3,9 (м, 2H); 3,79 (с, 3H); 3,68 (с, 1H); 3,28 (м, 1H); 2,46 (м, 2H); 2,39 (м, 2H); 1,58 (с, 3H); 1,34 (м, 12H); 0,95 (с, 3H).
МС (ES/-): m/z=446 [M-H]-.
Промежуточное соединение 58:
ТСХ: CH/AcOEt 7:3, Rf=0,31 (детектирование нингидрином).
ЯМР (CDCl3): δ (м.д.) 7,25 (д, 2H); 6,9 (д, 2H); 4,45 (т, 1H); 4,0 (м, 1H); 3,82 (с, 3H); 3,23 (с, 1H); 2,95 (м, 1H); 2,9 (м, 1H); 2,83 (м, 1H); 2,1 (м, 1H); 1,95 (м, 1H); 1,53 (с, 3H); 1,45 (с, 9H); 0,91 (с, 3H); 0,67 (д, 3H)
МС (ES/-): m/z=446 [M-H]-.
Следуя той же самой методике, описанной для промежуточного соединения 57 и 58, получают промежуточные соединения 59 и 60.
Промежуточные соединения 59 и 60
1,1-Диметилэтил 4-(2,3-дигидро-1-бензофуран-5-ил)-4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-метил-1-пиперидинкарбоксилата
(промежуточное соединение 59 - антиизомер)
1,1-Диметилэтил 4-(2,3-дигидро-1-бензофуран-5-ил)-4-(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)-2-метил-1-пиперидинкарбоксилата
(промежуточное соединение 60 - син-изомер)
Исходя из 5-бром-2,3-дигидро-1-бензофурана (7 г) и используя промежуточное соединение 49 (4,5 г), получают 710 мг указанного в заголовке соединения 59 и 530 мг указанного в заголовке соединения 60, характеризуемые следующим образом:
Промежуточное соединение 59:
ВЭЖХ (ступенчатая): tR=5,87 мин.
ЯМР (CDCl3): δ (м.д.) 7,33 (дд, 1H); 7,07 (т, 1H); 7,0 (тд, 1H); 4,48 (с, 1H); 3,99-3,81 (м, 4H); 2,72-2,53 (м, 4H); 2,46 (с, 3H); 1,86-1,74 (м, 2H); 1,36 (с, 9H); 0,94 (т, 3H).
Промежуточное соединение 60:
ВЭЖХ (ступенчатая): tR=6,02 мин.
ЯМР (CDCl3): δ (м.д.) 7,33 (дд, 1H); 7,07 (т, 1H); 7,0 (тд, 1H); 4,48 (с, 1H); 3,99-3,81 (м, 4H); 2,72-2,53 (м, 4H); 2,46 (с, 3H); 1,86-1,74 (м, 2H); 1,36 (с, 9H); 0,94 (т, 3H).
Промежуточное соединение 61
[1-{[(1,1-Диметилэтил)окси]карбонил}-4-(4-фторфенил)-2-метил-4-пиперидинил]уксусная кислота (син-изомер)
Смесь промежуточного соединения 52 (1,89 г) в 3-пентаноне (12 мл) и воды (4 мл) подвергают облучению микроволнами при 140°С (2 цикла по 12 мин и один цикл из 10 мин). Раствору дают возможность охладиться до комнатной температуры, органическую фазу отделяют и упаривают в вакууме.
Затем неочищенный продукт растворяют в смеси CH:Et2O=1:1 (30 мл) и добавляют 1,0М водный NaOH (30 мл); затем смесь подкисляют до рН 5 и экстрагируют AcOEt (3×20 мл). Органическую фазу сушат и концентрируют в вакууме, получая указанное в заголовке соединение (875 мг) в виде желтого твердого вещества.
ТСХ: CH/AcOEt 1:1, Rf=0,15 (детектирование нингидрином).
МС (ES/-): m/z=350 [M-H]-.
ЯМР (CDCl3): δ (м.д.) 7,35 (дд, 2H); 7,03 (т, 2H); 4,32 (м, 1H); 3,99 (дт, 1H); 3,06 (тд, 1H); 2,58 (д, 1H); 2,42 (д, 1H); 2,28 (дт, 1H); 2,07 (м, 2H); 1,77 (тм, 1H); 1,47 (с, 9H); 0,67 (д, 3H).
Следуя той же самой методике, описанной для промежуточного соединения 61, получают промежуточные соединения 62, 63, 64, 65.
Промежуточное соединение 62
(1-{[(1,1-Диметилэтил)окси]карбонил}-2-метил-4-фенил-4-пиперидинил)уксусная кислота (син-изомер)
Исходя из промежуточного соединения 54 (495 мг) получают 380 мг указанного в заголовке соединения в виде белой пены, используя хроматографическую очистку с элюированием смесью AcOEt:CH=7:3.
ЯМР (CDCl3): δ (м.д.) 7,36 (дд, 2H); 7,31 (т, 2H); 7,22 (м, 1H); 4,3 (м, 1H); 3,97 (дт, 1H); 3,08 (тд, 1H); 2,67 (уш.м, 1H); 2,59 (д, 1H); 2,42 (д, 1H); 2,32 (дт, 1H); 2,04 (дд, 1H); 1,76 (тд, 1H); 1,44 (с, 9H); 0,64 (д, 3H).
Промежуточное соединение 63
[1-{[(1,1-Диметилэтил)окси]карбонил}-2-этенил-4-(4-фторфенил)-4-пиперидинил]уксусная кислота (син-изомер)
Исходя из промежуточного соединения 56 (54 мг) получают 30 мг указанного в заголовке соединения в виде желтой пены, используя хроматографическую очистку с элюированием смесью AcOEt:CH=7:3.
ЯМР (CDCl3): δ (м.д.) 7,26 (дд, 2H); 6,96 (т, 2H); 5,14 (м, 1H); 4,52-4,55 (м, 2H); 3,99 (уш.т, 1H); 3,08 (тд, 1H); 2,63 (дд, 1H); 2,56 (д, 1H); 2,45 (уш.д, 1H); 2,41 (д, 1H); 2,08 (дд, 1H); 1,77 (тд, 1H); 1,46 (дт, 1H); 1,43 (с, 9H).
Промежуточное соединение 64
{1-{[(1,1-Диметилэтил)окси]карбонил}-2-метил-4-[4-(метилокси)фенил]-4-пиперидинил}уксусная кислота (син-изомер)
Исходя из промежуточного соединения 58 (1,5 г) получают 500 мг указанного в заголовке соединения в виде желтой пены.
МС (ES/-): m/z=362 [M-H]-.
ЯМР (CDCl3): δ (м.д.) 7,25 (д, 2H); 6,9 (д, 2H); 4,45 (т, 1H); 4,03 (м, 1H); 3,1 (м, 1H); 3,82 (с, 3H); 2,7 (м, 1H); 2,3 (м, 1H); 2,59-2,39 (дд, 2H); 2,1 (м, 1H); 1,75 (м, 1H); 1,45 (с, 9H); 0,67 (д, 3H).
Промежуточное соединение 65
(4-(2,3-Дигидро-1-бензофуран-5-ил)-1-{[(1,1-диметилэтил)окси]карбонил}-2-метил-4-пиперидинил)уксусная кислота (син-изомер)
Исходя из промежуточного соединения 60 (530 мг) получают 220 мг указанного в заголовке соединения в виде желтого твердого вещества.
МС (ES/-): m/z=374[M-H]-.
ЯМР (CDCl3): δ (м.д.) 7,24 (д, 1H); 7,06 (д, 1H); 6,7 (д, 1H); 4,54 (т, 2H); 4,25 (уш.м, 1H); 3,93 (м, 1H); 3,17 (т, 2H); 3,05 (м, 1H); 2,53 (д, 1H); 2,37 (д, 1H); 2,6 (м, 1H); 2,21 (м, 1H); 2,00 (м, 1H); 1,71 (м, 1H); 1,41 (с, 9H); 0,67 (д, 3H).
Промежуточное соединение 66
1,1-Диметилэтил 4-{2-[[(3-хлор-1-нафталинил)метил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Раствор [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (100 мг), гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (146 мг) и TEA (0,123 мл) в безводном DCM (5 мл) перемешивают при комнатной температуре в течение 1 час в атмосфере азота. Промежуточное соединение 28 (67 мг) добавляют и смесь перемешивают при комнатной температуре в течение ночи. Смесь промывают 5% водным NaHCO3, органический слой сушат, концентрируют в вакууме и остаток очищают флэш-хроматографией (CH/AcOEt 2:8), получая указанное в заголовке соединение (140 мг) в виде белой пены.
ТСХ: CH/AcOEt 3:7, Rf=0,26 (детектирование нингидрином).
МС (ES/+): m/z=547[M+Na]+.
Следуя той же самой методике, описанной для промежуточного соединения 66, получают промежуточные соединения 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77.
Промежуточное соединение 67
1,1-Диметилэтил 4-{2-[[(3-циано-1-нафталинил)метил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (61 мг) и промежуточного соединения 31 (39 мг) получают 140 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: СН/AcOEt 6:4, Rf=0,21 (детектирование нингидрином).
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 8,05 (д, 1H); 7,90 (д, 1H); 7,60 (м, 2H); 7,30-7,20 (м, 3H); 6,90 (т, 2H); 4,85 (с, 2H); 3,65 (д, 2H); 3,10 (т, 2H); 2,65 (с, 2H); 2,35-2,20 (с+д, 5H); 2,00 (т,2H); 1,40 (с, 9H).
Промежуточное соединение 68
1,1-Диметилэтил 4-{2-[[(3-бром-1-нафталинил)метил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (61 мг) и промежуточного соединения 29 (35 мг) получают 58 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: СН/AcOEt 7:3, Rf=0,12 (детектирование нингидрином).
ЯМР (CDCl3): δ 11 (м.д.) 7,90-7,25 (м, 8H); 6,80 (т, 2H)); 4,85 (с, 2H); 3,6 (м, 2H); 3,10 (м, 2H); 2,60 (с, 2H); 2,25 (с, 3H); 2,25-2,00 (м, 4H); 1,40 (с, 9H).
МС (ES/+): m/z=591, 593 [M+Na]+.
Промежуточное соединение 69
1,1-Диметилэтил 4-{2-[[(5-бром-1-бензофуран-7-ил)метил](метил)
амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (100 мг) и промежуточного соединения 27 (90 мг) получают 164 мг указанного в заголовке соединения.
ТСХ: СН/AcOEt 7:3, Rf=0,19 (детектирование нингидрином).
МС (ES/+): m/z=581, 583 [M+Na]+.
Промежуточное соединение 70
1,1-Диметилэтил 4-{2-[[1-(5-бром-1-бензофуран-7-ил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил)уксусной кислоты (100 мг) и промежуточного соединения 26 (82 мг) получают 94 мг указанного в заголовке соединения в виде желтого масла.
ТСХ: СН/AcOEt 4:6, Rf=0,72 (детектирование нингидрином).
МС (ES/+): m/z=595-597 [M+Na]+.
Промежуточное соединение 71
1,1-Диметилэтил 4-{2-[[(5-циано-1-бензофуран-7-ил)метил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (100 мг) и промежуточного соединения 21 (60 мг) получают 133 мг указанного в заголовке соединения в виде желтого масла.
ТСХ: СН/AcOEt 4:6, Rf=0,48 (детектирование нингидрином).
МС (ES/+): m/z=528 [M+Na]+.
Промежуточное соединение 72
1,1-Диметилэтил 4-{2-[[1-(5-циано-1-бензофуран-7-ил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (146 мг) и промежуточного соединения 24 (95 мг) получают 204 мг указанного в заголовке соединения в виде желтоватого твердого вещества.
МС (ES/+): m/z=542 [M+Na]+.
Промежуточное соединение 73
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (41 мг) и промежуточного соединения 13 (28 мг) получают 61 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: СН/AcOEt 6:4, Rf=0,3 (детектирование нингидрином).
МС (ES/+): m/z=552 [M+Na]+.
Промежуточное соединение 74
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-фтор-3-метилфенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фтор-3-метилфенил)-4-пиперидинил]уксусной кислоты (43 мг) и промежуточного соединения 13 (28 мг) получают 65 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: СН/AcOEt 6:4, Rf=0,3 (детектирование нингидрином).
МС (ES/+): m/z=566 [M+Na]+.
Промежуточное соединение 75
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (40 мг) и промежуточного соединения 12 (29 мг) получают 55 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: СН/AcOEt 1:1, Rf=0,4 (детектирование нингидрином).
МС (ES/+): m/z=552 [M+Na]+.
Промежуточное соединение 76
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил-4-(4-фтор-3-метилфенил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фтор-3-метилфенил)-4-пиперидинил]уксусной кислоты (40 мг) и промежуточного соединения 12 (30 мг) получают 42 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: СН:AcOEt 1:1, Rf=0,6 (детектирование нингидрином).
МС (ES/+): m/z=566 [M+Na]+.
Промежуточное соединение 77
1,1-Диметилэтил 4-{2-[[(3-циано-6-фтор-1-нафталинил)метил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата
Исходя из промежуточного соединения [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (63 мг) и промежуточного соединения 7 (40 мг) получают 100 мг указанного в заголовке соединения в виде белой пены.
ТСХ: СН:AcOEt 1:1, Rf=0,39 (детектирование нингидрином).
ЯМР (CDCl3): δ (м.д.) 8,1 (м, 2H); 7,5 (дд, 1H); 7,4 (тд, 1H); 7,25 (дд, 2H); 7,21 (с, 1H); 6,91 (т, 2H); 4,82 (с, 2H); 3,68 (м, 2H); 3,15 (т, 2H); 2,8 (с, 3H); 2,35 (с, 2H); 2,02 (м, 2H); 1,68 (м, 2H); 1,45 (с, 9H).
Промежуточное соединение 78
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(4-фторфенил)-1-пиперидинкарбоксилата (энантиомер 1)
DIPEA (300 мкл) и тетрафторборат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (221 мг) добавляют к раствору промежуточного соединения [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (155 мг) в безводном ДМФА (4 мл) в атмосфере азота. После перемешивания в течение 30 мин добавляют промежуточное соединение 16 (95 мг). Смесь перемешивают при комнатной температуре в течение 2 дней, затем ее разбавляют AcOEt, промывают водным насыщенным NaHCO3, водой и насыщенным раствором соли; затем сушат и упаривают в вакууме, получая неочищенный продукт, который очищают флэш-хроматографией (CH/AcOEt от 9:1 до 8:2), получая указанное в заголовке соединение (196 мг) в виде бесцветного масла.
МС (ES/+): m/z=547 [M+Na]+.
Следуя той же самой методике, описанной для промежуточного соединения 78, получают промежуточные соединения 79-115.
Промежуточное соединение 79
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(4-фторфенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из [1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (155 мг) и промежуточного соединения 15 (95 мг) получают 212 мг указанного в заголовке соединения в виде бесцветного масла.
МС (ES/+): m/z=57 [M+Na]+.
Промежуточное соединение 80
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(4-цианофенил)-1-пиперидинкарбоксилата
(энантиомер 1)
Исходя из промежуточного соединения (4-(4-цианофенил)-1-{[(1,1-диметилэтил)окси]карбонил}-4-(4-фторфенил)-4-пиперидинил]уксусной кислоты (100 мг) и промежуточного соединения 16 (77 мг) получают 142 мг указанного в заголовке соединения в виде бесцветного масла.
МС (ES/+): m/z=476 [M-трет-бутил+Н]+.
Промежуточное соединение 81
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-цианофенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения (4-(4-цианофенил)-1-{[(1,1-диметилэтил)окси]карбонил}-4-пиперидинил)уксусной кислоты (48 мг) и промежуточного соединения 19 (46 мг) получают 31 мг указанного в заголовке соединения в виде коричневого масла.
ВЭЖХ (ступенчатая): tR=6,58 мин.
Промежуточное соединение 82
1,1-Диметилэтил 4-(1,3-бензодиоксол-5-ил)-4-{2-[[1-(3,5-дихлорфенил)этил](метил)амино]-2-оксоэтил}-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 39 (80 мг) и [1-(3,5-дихлорфенил)этил]метиламина (50 мг) получают 107 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=572 [M+Na]+.
ТСХ: СH/AcOEt 6:4, Rf=0,33.
Промежуточное соединение 83
1,1-Диметилэтил 4-(1,3-бензодиоксол-5-ил)-4-{2-[[1-(3,5-дибромфенил)этил](метил)амино]-2-оксоэтил}-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 39 (80 мг) и [1-(3,5-дибромфенил)этил]метиламина (71 мг) получают 128 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=661 [M+Na]+.
ТСХ: CH/AcOEt 7:3, Rf=0,3.
Промежуточное соединение 84
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(3-фтор-4-метилфенил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 41 (100 мг) и промежуточного соединения 16 (58 мг) получают 116 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=483 [M-трет-бутил+Н]+.
Промежуточное соединение 85
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(3-фтор-4-метилфенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 41 (100 мг) и промежуточного соединения 15 (58 мг) получают 105 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=483 [M-трет-бутил+Н]+.
Промежуточное соединение 86
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(3-цианофенил)-1-пиперидинкарбоксилата
(энантиомер 1)
Исходя из промежуточного соединения 45 (113 мг) и промежуточного соединения 16 (68 мг) получают 126 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=554 [M+Na]+.
Промежуточное соединение 87
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(3-цианофенил)-1-пиперидинкарбоксилата
(энантиомер 2)
Исходя из промежуточного соединения 45 (60 мг) и промежуточного соединения 15 (35 мг) получают 97 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=554 [M+Na]+.
Промежуточное соединение 88
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-фенил-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из (1-{[(1-метилэтил)окси]карбонил}-4-фенил-4-пиперидинил)уксусной кислоты (169 мг) и промежуточного соединения 16 (100 мг) получают 250 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=529 [M+Na]+.
Промежуточное соединение 89
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-фенил-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из (1-{[(1-метилэтил)окси]карбонил}-4-фенил-4-пиперидинил)уксусной кислоты (85 мг) и промежуточного соединения 15 (50 мг) получают 107 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=529 [M+Na]+.
Промежуточное соединение 90
1,1-Диметилэтил 4-(1-бензофуран-5-ил)-4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 44 (112 мг) и промежуточного соединения 16 (70 мг) получают 122 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=491 [M-трет-бутил+Н]+.
Промежуточное соединение 91
1,1-Диметилэтил 4-(1-бензофуран-5-ил)-4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 44 (50 мг) и промежуточного соединения 15 (31 мг) получают 55 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=491 [M-трет-бутил+Н]+.
Промежуточное соединение 92
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-[3-фтор-4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 40 (182 мг) и промежуточного соединения 12 (104 мг) получают 276 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
ТСХ: CH/AcOEt 1:1, Rf=0,45 (детектирование нингидрином).
МС (ES/+): m/z=582 [M+Na]+.
Промежуточное соединение 93
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-[3-фтор-4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 40 (166 мг) и промежуточного соединения 13 (95 мг) получают 300 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
ТСХ: CH/AcOEt 1:1, Rf=0,45 (детектирование нингидрином).
МС (ES/+): m/z=582 [M+Na]+.
Промежуточное соединение 94
1,1-Диметилэтил 4-{2-[[(3-циано-1-нафталинил)метил](метил)амино]-2-оксоэтил}-4-[3-фтор-4-(метилокси)фенил]-1-пиперидинкарбоксилата
Исходя из промежуточного соединения 40 (166 мг) и промежуточного соединения 31 (89 мг) получают 240 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
ТСХ: CH/AcOEt 1:1, Rf=0,28 (детектирование нингидрином).
МС (ES/+): m/z=568 [M+Na]+.
Промежуточное соединение 95
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 42 (120 мг) и промежуточного соединения 16 (63 мг) получают 166 мг указанного в заголовке соединения.
МС (ES/+): m/z=559 [M+Na]+.
Промежуточное соединение 96
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 42 (120 мг) и промежуточного соединения 15 (63 мг) получают 158 мг указанного в заголовке соединения.
МС (ES/+): m/z=481 [M-трет-бутил+Н]+.
Промежуточное соединение 97
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(2,3-дигидро-1-бензофуран-5-ил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 43 (150 мг) и промежуточного соединения 16 (92 мг) получают 135 мг указанного в заголовке соединения.
МС (ES/+): m/z=493 [M-трет-бутил+Н]+.
Промежуточное соединение 98
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(2,3-дигидро-1-бензофуран-5-ил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 43 (100 мг) и промежуточного соединения 15 (63 мг) получают 125 мг указанного в заголовке соединения.
МС (ES/+): m/z=571 [M+Na]+.
Промежуточное соединение 99
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-фенил-1-пиперидинкарбоксилата (син-изомер, цепной энантиомер 1)
Исходя из промежуточного соединения 62 (50 мг) и промежуточного соединения 16 (34 мг) получают 45 мг указанного в заголовке соединения в виде белой пены.
ТСХ: CH/AcOEt 7:3, Rf=0,27 (детектирование нингидрином).
МС (ES/+): m/z=470 [M-трет-бутил+Н]+.
Промежуточное соединение 100
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-фенил-1-пиперидинкарбоксилата (син-изомер, цепной энантиомер 2)
Исходя из промежуточного соединения 62 (50 мг) и промежуточного соединения 15 (34 мг) получают 55 мг указанного в заголовке соединения в виде белой пены.
ТСХ: CH/AcOEt 7:3, Rf=0,27 (детектирование нингидрином).
МС (ES/+): m/z=470 [M-трет-бутил+Н]+.
Промежуточное соединение 101
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата (син-изомер, цепной энантиомер 1)
Исходя из промежуточного соединения 61 (70 мг) и промежуточного соединения 16 (40 мг) получают 36 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=566 [M+Na]+.
Промежуточное соединение 102
1,1-Диметилэтил 4-{2-[[1-(3-циано-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата (син-изомер, цепной энантиомер 2)
Исходя из промежуточного соединения 61 (70 мг) и промежуточного соединения 15 (40 мг) получают 74 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=566 [M+Na]+.
Промежуточные соединения 103 и 104
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 1)
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата
(син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 61 (130 мг) и промежуточного соединения 16 (76 мг) получают 92 мг указанного в заголовке соединения 103 и 65 мг указанного в заголовке соединения 104 в виде белых пен.
Промежуточное соединение 103:
ТСХ: CH/AcOEt 6:4, Rf=0,35 (детектирование нингидрином).
МС (ES/+): m/z=561 [M+Na]+.
Промежуточное соединение 104:
ТСХ: CH/AcOEt 6:4, Rf=0,21 (детектирование нингидрином).
МС (ES/+): m/z=561 [M+Na]+.
Промежуточные соединения 105 и 106
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 2)
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(4-фторфенил)-2-метил-1-пиперидинкарбоксилата
(син-изомер 2, цепной энантиомер 2)
Исходя из промежуточного соединения 61 (130 мг) и промежуточного соединения 15 (76 мг) получают 100 мг указанного в заголовке соединения 105 и 87 мг указанного в заголовке соединения 106 в виде белых пен.
Промежуточное соединение 105:
ТСХ: CH/AcOEt 6:4, Rf=0,35 (детектирование нингидрином).
МС (ES/+): m/z=561 [M+Na]+.
Промежуточное соединение 106:
ТСХ: CH/AcOEt 6:4, Rf=0,21 (детектирование нингидрином).
МС (ES/+): m/z=561 [M+Na]+.
Промежуточные соединения 107 и 108
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-2-метил-4-фенил-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 1)
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-2-метил-4-фенил-1-пиперидинкарбоксилата
(син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 62 (90 мг) и промежуточного соединения 16 (61 мг) получают 48 мг указанного в заголовке соединения 107 и 38 мг указанного в заголовке соединения 108 в виде белых пен.
Промежуточное соединение 107:
ВЭЖХ (ступенчатая): tR=7,15 мин.
Промежуточное соединение 108:
ВЭЖХ (ступенчатая): tR=7,12 мин.
Промежуточные соединения 109 и 110
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-2-метил-4-фенил-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 2)
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-2-метил-4-фенил-1-пиперидинкарбоксилата
(син-изомер 2, цепной энантиомер 2)
Исходя из промежуточного соединения 62 (90 мг) и промежуточного соединения 15 (61 мг) получают 36 мг указанного в заголовке соединения 109 и 32 мг указанного в заголовке соединения 110 в виде белых пен.
Промежуточное соединение 109:
ВЭЖХ (ступенчатая): tR=7,15 мин.
Промежуточное соединение 110:
ВЭЖХ (ступенчатая): tR=7,12 мин.
Промежуточные соединения 111 и 112
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-2-метил-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (син-изомер 1, цепной энантиомер 1)
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-2-метил-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 64 (90 мг) и промежуточного соединения 16 (51 мг) получают 54 мг указанного в заголовке соединения 111 и 66 мг указанного в заголовке соединения 112 в виде белых пен.
Промежуточное соединение 111:
МС (ES/+): m/z=495 [M-трет-бутил+H]+.
ТСХ: CH/AcOEt 1:1, Rf=0,33 (детектирование нингидрином).
Промежуточное соединение 112:
МС (ES/+): m/z=495 [M-трет-бутил+H]+.
ТСХ: CH/AcOEt 1:1, Rf=0,28 (детектирование нингидрином).
Промежуточные соединения 113 и 114
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-1-пиперидинкарбоксилата (син-изомер 1, цепной энантиомер 1)
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-4-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-1-пиперидинкарбоксилата (син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 65 (100 мг) и промежуточного соединения 16 (61 мг) получают 43 мг указанного в заголовке соединения 113 и 43 мг указанного в заголовке соединения 114 в виде белых пен.
Промежуточное соединение 113:
МС (ES/+): m/z=507 [M-трет-бутил+H]+.
ТСХ: CH/AcOEt 1:1, Rf=0,32 (детектирование нингидрином).
Промежуточное соединение 114:
МС (ES/+): m/z=507 [M-трет-бутил+H]+.
ТСХ: CH/AcOEt 1:1, Rf=0,27 (детектирование нингидрином).
Промежуточное соединение 115
1,1-Диметилэтил 4-(2-{[1-(3-хлор-1-нафталинил)этил]амино}-2-оксоэтил)-2-этенил-4-(4-фторфенил)-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 63 (28 мг) и промежуточного соединения 16 (8 мг) получают 43 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=495 [M-трет-бутил+H]+.
ВЭЖХ (ступенчатая): tR=7,14
Промежуточное соединение 116
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата (энантиомер 1)
Промежуточное соединение 78 (196 мг) растворяют в сухом ДМФА (5 мл), в атмосфере азота и при 0°С, добавляют 60% дисперсию NaH в минеральном масле (30 мг). Смеси дают возможность нагреться до комнатной температуры и перемешивают в этих условиях в течение 20 мин. Затем добавляют метилиодид (0,13 мл) и раствор перемешивают в течение 2 час. Добавляют воду и AcOEt; органическую фазу отделяют и промывают насыщенным раствором соли, сушат и упаривают в вакууме, получая неочищенный продукт, который очищают флэш-хроматографией (элюирование смесью CH:AcOEt от 9:1 до 8:2), получая указанное в заголовке соединение (137 мг) в виде белой пены.
МС (ES/+): m/z=561 [M+Na]+.
Следуя той же самой методике, описанной для получения промежуточного соединения 116, получают промежуточные соединения 117-141.
Промежуточное соединение 117
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-фторфенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 79 (212 мг) получают 170 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=561 [M+Na]+.
Промежуточное соединение 118
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(4-цианофенил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 80 (142 мг) получают 184 мг указанного в заголовке соединения в виде желтого масла без какой-либо хроматографической очистки.
МС (ES/+): m/z=568 [M+Na]+.
Промежуточное соединение 119
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(3-фтор-4-метилфенил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 84 (116 мг) получают 93 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=575 [M+Na]+.
Промежуточное соединение 120
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(3-фтор-4-метилфенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 85 (105 мг) получают 91 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=575 [M+Na]+.
Промежуточное соединение 121
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(3-цианофенил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 86 (126 мг) получают 80 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=568 [M+Na]+.
Промежуточное соединение 122
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(3-цианофенил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 87 (97 мг) получают 33 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=568 [M+Na]+.
Промежуточное соединение 123
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-фенил-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 88 (250 мг) получают 127 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=543 [M+Na]+.
Промежуточное соединение 124
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-фенил-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 89 (107 мг) получают 71 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=543 [M+Na]+.
Промежуточное соединение 125
1,1-Диметилэтил 4-(1-бензофуран-5-ил)-4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 90 (122 мг) получают 108 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=583 [M+Na]+.
Промежуточное соединение 126
1,1-Диметилэтил 4-(1-бензофуран-5-ил)-4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 91 (55 мг) получают 51 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=583 [M+Na]+.
Промежуточное соединение 127
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 95 (166 мг) получают 47 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=573 [M+Na]+.
Промежуточное соединение 128
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 96 (158 мг) получают 57 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=573 [M+Na]+.
Промежуточное соединение 129
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(2,3-дигидро-1-бензофуран-5-ил)-1-пиперидинкарбоксилата (энантиомер 1)
Исходя из промежуточного соединения 97 (135 мг) получают 88 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=507 [M-трет-бутил+Н]+.
Промежуточное соединение 130
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(2,3-дигидро-1-бензофуран-5-ил)-1-пиперидинкарбоксилата (энантиомер 2)
Исходя из промежуточного соединения 98 (125 мг) получают 118 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=507 [M-трет-бутил+Н]+.
Промежуточное соединение 131
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-фенил-1-пиперидинкарбоксилата (син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 107 (46 мг) получают 47 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
ВЭЖХ (ступенчатая): tR=7,71 мин.
Промежуточное соединение 132
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-фенил-1-пиперидинкарбоксилата (син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 108 (36 мг) получают 37 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
ВЭЖХ (ступенчатая): tR=7,68 мин.
Промежуточное соединение 133
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-фенил-1-пиперидинкарбоксилата (син-изомер 1, цепной энантиомер 2)
Исходя из промежуточного соединения 109 (48 мг) получают 42 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
ВЭЖХ (ступенчатая): tR=7,70 мин.
Промежуточное соединение 134
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-фенил-1-пиперидинкарбоксилата (син-изомер 2, цепной энантиомер 2)
Исходя из промежуточного соединения 110 (48 мг) получают 39 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
ВЭЖХ (ступенчатая): tR=7,68 мин.
Промежуточное соединение 135
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 111 (54 мг) получают 48 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=565 [M+H]+.
Промежуточное соединение 136
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-метил-4-[4-(метилокси)фенил]-1-пиперидинкарбоксилата
(син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 112 (66 мг) получают 54 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=565 [M+H]+.
Промежуточное соединение 137
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 113 (43 мг) получают 43 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
МС (ES/+): m/z=599 [M+Na]+.
Промежуточное соединение 138
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-1-пиперидинкарбоксилата
(син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 114 (43 мг) получают 43 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
МС (ES/+): m/z=599 [M+Na]+.
Промежуточное соединение 139
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-2-этенил-4-(4-фторфенил)-1-пиперидинкарбоксилата
(син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 115 (8,5 мг) получают 8,5 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=509 [M-трет-бутил+Н]+.
ВЭЖХ (ступенчатая): tR=7,7 мин.
Промежуточное соединение 140
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-[3-фтор-4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 1)
DIPEA (290 мкл) и тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (239 мг) добавляют к раствору промежуточного соединения 40 (249 мг) в безводном ДМФА (4 мл) в атмосфере азота. После перемешивания в течение 30 мин добавляют промежуточное соединение 16 (140 мг). Смесь перемешивают при комнатной температуре в течение ночи, затем ее разбавляют AcOEt, промывают водным насыщенным NaHCO3, водой и насыщенным раствором соли; затем сушат и упаривают в вакууме, получая неочищенный продукт [ТСХ: CH/AcOEt 1:1, Rf=0,50 (детектирование нингидрином)]. Это промежуточное соединение растворяют в сухом ДМФА (4 мл) и в атмосфере азота и при 0°С добавляют 60% дисперсию NaH в минеральном масле (53 мг). Смеси дают возможность нагреться до комнатной температуры и перемешивают в этих условиях в течение 20 мин. Затем добавляют метилиодид (0,41 мл) и раствор перемешивают в течение 2 час при 50°С. Добавляют воду и AcOEt; органическую фазу отделяют и промывают насыщенным раствором соли, сушат и упаривают в вакууме, получая указанное в заголовке соединение (396 мг) в виде белой пены без какой-либо хроматографической очистки.
ТСХ: CH/AcOEt 1:1, Rf=0,62 (детектирование нингидрином).
МС (ES/+): m/z=591 [M+Na]+.
Промежуточное соединение 141
1,1-Диметилэтил 4-{2-[[1-(3-хлор-1-нафталинил)этил](метил)амино]-2-оксоэтил}-4-[3-фтор-4-(метилокси)фенил]-1-пиперидинкарбоксилата (энантиомер 2)
DIPEA (290 мкл) и тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (239 мг) добавляют к раствору промежуточного соединения 40 (249 мг) в безводном ДМФА (4 мл) в атмосфере азота. После перемешивания в течение 30 мин добавляют промежуточное соединение 15 (140 мг). Смесь перемешивают при комнатной температуре в течение ночи, затем ее разбавляют AcOEt, промывают водным насыщенным NaHCO3, водой и насыщенным раствором соли; затем сушат и упаривают в вакууме, получая неочищенный продукт [ТСХ: CH/AcOEt 1:1, Rf=0,50 (детектирование нингидрином)]. Этот промежуточное соединение растворяют в сухом ДМФА (5 мл) и в атмосфере азота и при 0°С добавляют 60% дисперсию NaH в минеральном масле (53 мг). Смеси дают возможность нагреться до комнатной температуры и перемешивают в этих условиях в течение 20 мин. Затем добавляют метилиодид (0,41 мл) и раствор перемешивают в течение 2 час при 50°С. Добавляют воду и AcOEt; органическую фазу отделяют и промывают насыщенным раствором соли, сушат и упаривают в вакууме, получая указанное в заголовке соединение (372 мг) в виде белой пены без какой-либо хроматографической очистки.
ТСХ: CH/AcOEt 1:1, Rf=0,62 (детектирование нингидрином).
МС (ES/+): m/z=591 [M+Na]+.
Пример 1
N-[(3-Хлор-1-нафталинил)метил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
TFA (1,5 мл) добавляют к раствору промежуточного соединения 66 (140 мг) в безводном DCM (6 мл) при 0°С в атмосфере азота. Реакционную смесь перемешивают 1 час, прежде чем ее концентрировать в вакууме при 0°С. Остаток очищают на SCX-картридже (нагружают DCM, промывают MeOH, элюируют 0,25М NH3 в MeOH, затем MeOH). Выпаривание растворителя дает указанное в заголовке соединение (90 мг) в виде белой пены.
ТСХ: DCM/MeOH 75:25, Rf=0,25 (детектирование нингидрином).
МС (ES/+): m/z=426 [M+H]+.
Пример 2
N-[(3-Хлор-1-нафталинил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Раствор формальдегида в воде (37% мас./мас.; 50 мкл) добавляют к перемешиваемому раствору примера 1 (80 мг) в CH3CN (6 мл) в атмосфере азота при комнатной температуре. Через 30 мин добавляют натрийтриацетоксиборгидрид (50 мг). Смесь перемешивают в течение еще 2 час, затем смесь гасят водным насыщенным NaHCO3 (5 мл) и экстрагируют AcOEt (3×50 мл). Объединенные органические фазы сушат, концентрируют в вакууме и остаток очищают на SCX-картридже (нагружают DCM, промывают MeOH, элюируют 0,25М NH3 в MeOH, а затем MeOH). Выпаривание растворителя дает указанное в заголовке соединение (70 мг) в виде белой пены.
ТСХ: DCM/MeOH 8:2, Rf=0,4 (детектирование нингидрином).
ЯМР (d6-ДМСО): δ 11 (м.д.) 7,96-7,90 (м, 2H); 7,95 (с,1H); 7,60-7,47 (м, 2H); 7,32 (дд, 2H); 7,08 (с, 1H); 6,92 (т, 2H); 4,75 (с, 2H); 2,70-2,01 (м, 16H).
МС (ES/+): m/z=440[M+H]+.
Следуя той же самой методике, описанной для получения примера 1, получают пример 3.
Пример 3
N-[(3-Циано-1-нафталинил)метил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
Исходя из промежуточного соединения 67 (81 мг) получают 50 мг указанного в заголовке соединения в виде белой пены.
ЯМР (CDCl3): δ 11 (м.д.) 8,18 (м, 1H); 8,1-7,9 (м, 2H); 7,7-7,5 (м, 2H); 7,3-6,8 (м, 5H); 4,86 (с, 2H); 3,99 (т, 2H); 3,5-2,0 (м, 11H).
МС (ES/+): m/z=416 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 4.
Пример 4
N-[(3-Циано-1-нафталинил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Исходя из примера 3 (45 мг) получают 40 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: DCM/MeOH 9:1, Rf=0,11 (детектирование нингидрином).
МС (ES/+): m/z=430 [M+H]+.
ЯМР (d6-ДМСО): δ 11 (м.д.) 8,50 (с, 1H); 8,15-8,00 (м, 2H); 7,75-7,70 (м, 2H); 7,40-7,25 (с+дд, 3H); 7,00-6,85 (т, 2H); 4,80 (с, 2H); 2,70 (с, 2H); 2,50-2,40 (м+с, 7H); 2,20-2,00 (м+с, 7H).
Пример 5
N-[(3-Циано-1-нафталинил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамида гидрохлорид
Пример 4 (37 мг) растворяют в Et2O (2,0 мл), охлаждают до 0°С и обрабатывают 1М раствором HCl в Et2O (1,0 мл). Смесь перемешивают при 0°С в течение 10 мин, затем ее концентрируют в вакууме и остаток растирают с пентаном, получая указанное в заголовке соединение (35,0 мг) в виде белого твердого вещества.
ЯМР (de-ДМСО): δ 12 (м.д.) 9,8-9,6 (уш., 1H); 8,50 (с, 1H); 8,1-7,6 (м, 4H); 7,50-7,25 (м, 3H); 7,00 (м, 2H); 4,76 (с, 2H); 3,4-2,4 (м, 14H); 2,1-1,8 (м, 2H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 6.
Пример 6
N-[(3-Бром-1-нафталинил)метил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
Исходя из промежуточного соединения 68 (58 мг) получают 30 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: DCM/MeOH 7:3, Rf=0,12.
ЯМР (d6-ДМСО): δ 11 (м.д.) 8,08 (д, 1H); 7,93 (д, 1H); 7,88 (д, 1H); 7,53-7,47 (м, 2H); 7,28 (дд, 2H); 7,23 (д, 1H); 6,89 (т, 2H); 4,73 (с, 2H); 2,68 (с, 2H); 2,8-1,8 (м, 8H); 2,42 (с, 3H).
МС (ES/+): m/z=469, 471 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 7.
Пример 7
N-[(3-Бром-1-нафталинил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Исходя из примера 6 (27 мг) получают 19 мг указанного в заголовке соединения в виде белого твердого вещества.
ТСХ: DCM/MeOH 7:3, Rf=0,25.
ЯМР (d6-ДМСО): δ 11 (м.д.) 8,08 (с, 1H); 7,92-7,88 (м, 2H); 7,53-7,46 (м, 2H); 7,29-6,85 (м, 5H); 4,72 (с, 2H); 2,7-1,9 (м, 16H).
МС (ES/+): m/z=483, 485 [M+H]+.
Следуя той же самой методике, описанной для получения примера 1, получают пример 8.
Пример 8
N-[(5-Бром-1-бензофуран-7-ил)метил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
Исходя из промежуточного соединения 69 (164 мг) получают 62 мг указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (d6-ДМСО): δ 11 (м.д.) 8,02 (д, 1H); 7,76 (д, 1H); 7,38-7,31 (дд, 2H); 7,00-6,98 (м, 2H); 6,96 (д, 1H); 6,94 (д, 1H); 6-5 (очень уш.с, 1H); 4,56 (с, 2H); 2,93 (м, 2H); 2,72 (с, 2H); 2,66 (м, 2H); 2,53 (с, 3H); 2,2-1,9 (м, 4H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 9.
Пример 9
N-[(5-Бром-1-бензофуран-7-ил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Исходя из примера 8 (57 мг) получают 45 мг указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (d6-ДМСО): δ 11 (м.д.) 8,00 (д, 1H); 7,74 (д, 1H); 7,35-7,25 (м, 2H); 7,1-6,9 (м, 4H); 6,96 (д, 1H); 4,54 (с, 2H); 2,60 (2д, 2H); 2,5 (с, 3H); 2,6-2,0 (м, 8H); 2,07 (с, 3H).
МС (ES/+): m/z=473, 475 [M+H]+.
Следуя той же самой методике, описанной для получения примера 1, получают пример 10.
Пример 10
N-[1-(5-Бром-1-бензофуран-7-ил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
Исходя из промежуточного соединения 70 (93 мг) получают 71 мг указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (CDCl3): δ (м.д.) 7,6 (с, 1H); 7,5 (с, 1H); 7,2 (м, 2H); 7,1 (с, 1H); 6,8 (т, 2H); 6,7 (с, 1H); 6,2 (кв, 1H); 2,9 (м, 2H); 2,7 (м, 2H); 2,6 (с, 2H); 2,5-2,0 (м, 4H); 2,1 (с, 3H); 1,3 (д, 3H).
МС (ES/+): m/z=473, 475 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 11.
Пример 11
N-[1-(5-Бром-1-бензофуран-7-ил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Исходя из примера 10 (50 мг) получают 32 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=487-489 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,6 (с, 1H); 7,5 (с, 1H); 7,3 (м, 2H); 7,1 (с, 1H); 6,8 (т, 2H); 6,7 (с, 1H); 6,2 (кв, 1H); 2,7-2,0 (м, 8H); 2,7 (с, 3H); 2,2 (с, 3H); 2,1 (с, 2H); 1,3 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 12.
Пример 12
N-[(5-Циано-1-бензофуран-7-ил)метил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
Исходя из промежуточного соединения 71 (93 мг) получают 71 мг указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (CDCl3): δ (м.д.) 7,8 (с, 1H); 7,6 (с, 1H); 7,4 (с, 1H); 7,3-7,1 (м, 3H); 6,8 (м, 2H); 4,6 (с, 2H); 3,0 (м, 2H); 2,7 (м, 2H); 2,6 (с, 2H); 2,5 (с, 3H); 2,3 (м, 2H); 2,1 (м, 2H).
МС (ES/+): m/z=406 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 13.
Пример 13
N-[(5-Циано-1-бензофуран-7-ил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Исходя из примера 12 (66 мг) получают 45 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=420 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,8 (с, 1H); 7,6 (с, 1H); 7,3 (с, 1H); 7,3-7,1 (м, 3H); 6,8 (м, 2H); 4,6 (с, 2H); 3,0-2,0 (м, 8H); 2,7 (с, 3H); 2,4 (с, 2H); 2,2 (с, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 14.
Пример 14
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 75 (55 мг) получают 24 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=430[M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 15.
Пример 15
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из примера 14 (24 мг) получают 11 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=444 [M+H]+.
Следуя той же самой методике, описанной для получения примера 5, получают пример 16.
Пример 16
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид гидрохлорид (энантиомер 1)
Исходя из примера 15 (155 мг) получают 136 мг указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (d6-ДМСО): δ (м.д.) 9,69 (уш.с, 1H); 8,56 (с, 1H); 8,10 (д, 1H); 7,82 (уш.с, 1H); 7,76 (с, 1H); 7,7 (т, 1H); 7,61 (м, 1H); 7,4-6,9 (м, 4H); 6,31 (кв, 1H); 2,9-2,0 (м, 16H); 1,33 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 17.
Пример 17
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фтор-3-метилфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 76 (42 мг) получают 14 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=444 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 18.
Пример 18
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фтор-3-метилфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из примера 17 (14 мг) получают 11 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=458 [M+H]+.
Следуя той же самой методике, описанной для получения примера 5, получают пример 19.
Пример 19
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фтор-3-метилфенил)-1-метил-4-пиперидинил]-N-метилацетамид гидрохлорид (энантиомер 1)
Исходя из примера 18 (11 мг) получают 10 мг указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (d6-ДМСО): δ (м.д.) 9,69 (уш.с, 1H); 8,56 (с, 1H); 8,10 (д, 1H); 7,82 (уш.с, 1H); 7,76 (с, 1H); 7,7 (т, 1H); 7,61 (м, 1H); 7,4-6,9 (м, 3H); 6,31 (кв, 1H); 2,9-2,0 (м, 19H); 1,33 (д, 3H).
МС (ES/+): m/z=458[M-HCl+H]+.
Следуя той же самой методике, описанной для получения примера 1, получают пример 20.
Пример 20
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 73 (61 мг) получают 47 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=430 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 21.
Пример 21
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из примера 20 (47 мг) получают 41 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=444 [M+H]+.
ЯМР (d6-ДМСО): δ (м.д.) 8,55 (с, 1H); 8,08 (д, 1H); 7,87 (д, 1H); 7,74 (с, 1H); 7,7 (т, 1H); 7,64 (т, 1H); 7,35 (дд, 2H); 6,95 (т, 2H); 6,31 (кв, 1H); 2,63 (д, 1H); 2,56 (д, 1H); 2,46 (уш.м, 2H); 2,25-2,0 (уш.м, 6H); 2,10 (с, 3H); 2,06 (с, 3H); 1,32 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 22.
Пример 22
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фтор-3-метилфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 74 (65 мг) получают 52 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=444 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 23.
Пример 23
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фтор-3-метилфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из примера 22 (52 мг) получают 38 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=458 [M+H]+.
ЯМР (d6-ДМСО): δ (м.д.) 8,55 (с, 1H); 8,08 (д, 1H); 7,88 (д, 1H); 7,75 (с, 1H); 7,69 (т, 1H); 7,64 (т, 1H); 7,20 (дд, 1H); 7,15 (м, 1H); 6,89 (т, 1H); 6,31 (кв, 1H); 2,62 (д, 1H); 2,52 (д, 1H); 2,45 (уш.м, 2H); 2,5-2,0 (уш.м, 6H); 2,10 (с, 3H); 2,09 (с, 3H); 2,01 (с, 3H); 1,31 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 24.
Пример 24
N-[1-(5-Циано-1-бензофуран-7-ил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
Исходя из промежуточного соединения 72 (200 мг) получают 22 мг указанного в заголовке соединения в виде желтоватого масла.
МС (ES/+): m/z=420 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,86 (с, 1H); 7,69 (с, 1H); 7,33 (с, 1H); 7,25 (м, 2H); 6,89 (т, 2H); 6,82 (с, 1H); 6,23 (кв, 1H); 2,59 (с, 2H); 2,17 (с, 3H); 3,2-2,0 (уш.м, 8H); 1,39 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 25.
Пример 25
N-[1-(5-Циано-1-бензофуран-7-ил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Исходя из примера 24 (137 мг) получают 118 мг указанного в заголовке соединения в виде белого твердого вещества.
ЯМР (CDCl3): δ (м.д.) 7,86 (с, 1H); 7,68 (д, 1H); 7,33 (с, 1H); 7,26 (дд, 2H); 6,88 (т, 2H); 6,82 (д, 1H); 6,23 (кв, 1H); 2,59 (с, 2H); 2,22 (с, 3H); 2,15 (с, 3Н); 2,65-2,0 (уш.м, 8H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 26.
Пример 26
N-[(3-Циано-6-фтор-1-нафталинил)метил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид
Исходя из промежуточного соединения 77 (100 мг) получают 75 мг указанного в заголовке соединения в виде желтого масла без какой-либо хроматографической очистки.
МС (ES/+): m/z=434 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,11 (дд, 1H); 8,09 (с, 1H); 7,51 (дд, 1H); 7,39 (ддд, 1H); 7,27 (дд, 2H); 7,21 (с, 1H); 6,9 (т, 2H); 4,81 (с, 2H); 2,67 (с, 2H); 2,64-2,52 (уш.м, 2H); 3,43-2,07 (уш.м, 6H); 2,34 (с, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 27.
Пример 27
N-[(3-Циано-6-фтор-1-нафталинил)метил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид
Исходя из примера 26 (71 мг) получают 52 мг указанного в заголовке соединения в виде желтого масла.
МС (ES/+): m/z=448 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,11 (дд, 1H); 8,09 (с, 1H); 7,51 (дд, 1H); 7,39 (ддд, 1H); 7,27 (дд, 2H); 7,21 (с, 1H); 6,9 (т, 2H); 4,81 (с, 2H); 2,67 (с, 2H); 2,64-2,52 (уш.м, 2H); 3,43-2,07 (уш.м, 6H); 2,34 (с, 3H); 2,23 (с, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 28.
Пример 28
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]ацетамид (энантиомер 1)
Исходя из промежуточного соединения 78 (61 мг) получают 39 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=425 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,96 (м, 1H); 7,78 (м, 1H); 7,77 (д, 1H); 7,53 (м, 2H); 7,17 (дд, 2H); 7,13 (д, 1H); 6,89 (т, 2H); 5,68 (м, 1H); 4,91 (д, 1H); 3,05 (м, 2H); 2,82 (м, 2H); 2,43 (2д, 2H); 2,5-2,0 (уш.м, 4H); 1,33 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 29.
Пример 29
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]ацетамид (энантиомер 1)
Исходя из примера 28 (27 мг) получают 23 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки, элюируя 100% DCM до DCM:MeOH=8:2.
МС (ES/+): m/z=439 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,94 (м, 1H); 7,72 (д, 1H); 7,75 (м, 1H); 7,48 (м, 2H); 7,14 (дд, 2H); 7,08 (д, 1H); 6,83 (т, 2H); 5,64 (м, 1H); 4,77 (д, 1H); 2,7-2,5 (уш.м, 2H); 2,4 (2д, 2H); 2,5-2,0 (уш.м, 6H); 2,23 (с, 3H); 1,27 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 30.
Пример 30
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]ацетамид (энантиомер 2)
Исходя из промежуточного соединения 79 (60 мг) получают 34 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=425 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,96 (м, 1H); 7,78 (м, 1H); 7,77 (д, 1H); 7,53 (м, 2H); 7,17 (дд, 2H); 7,13 (д, 1H); 6,89 (т, 2H); 5,68 (м, 1H); 4,91 (д, 1H); 3,05 (м, 2H); 2,82 (м, 2H); 2,43 (2д, 2H); 2,5-2,0 (уш.м, 4H); 1,33 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 31.
Пример 31
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]ацетамид (энантиомер 2)
Исходя из примера 30 (22 мг) получают 21 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки, элюируя 100% DCM до DCM:MeOH=8:2.
МС (ES/+): m/z=439 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,94 (м, 1H); 7,72 (д, 1H); 7,75 (м, 1H); 7,48 (м, 2H); 7,14 (дд, 2H); 7,08 (д, 1H); 6,83 (т, 2H); 5,64 (м, 1H); 4,77 (д, 1H); 2,7-2,5 (уш.м, 2H); 2,4 (2д, 2H); 2,5-2,0 (уш.м, 6H); 2,23 (с, 3H); 1,27 (д, 3H).
Cледуя той же самой методике, описанной для получения примера 1, получают пример 32.
Пример 32
2-[4-(1,3-Бензодиоксол-5-ил)-4-пиперидинил]-N-[1-(3,5- дихлорфенил)этил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 82 (107 мг) получают 85 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
МС (ES/+): m/z=449 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 33.
Пример 33
2-[4-(1,3-Бензодиоксол-5-ил)-1-метил-4-пиперидинил]-N-[1-(3,5- дихлорфенил)этил]-N-метилацетамид (энантиомер 1)
Исходя из примера 32 (85 мг) получают 60 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием 100% DCM до DCM:MeOH=8:2.
МС (ES/+): m/z=463 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,21 (с, 1H); 6,98 (с, 2H); 6,83-6,73 (м, 3H); 5,95-5,80 (с+кв, 2/1H); 2,7-2,0 (м, 8H); 2,58 (с, 2H); 2,24 (с, 3H); 2,11 (с, 3H); 1,24 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 34.
Пример 34
2-[4-(1,3-Бензодиоксол-5-ил)-4-пиперидинил]-N-[1-(3,5- дибромфенил)этил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 83 (128 мг) получают 106 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
МС (ES/+): m/z=539 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 35.
Пример 35
2-[4-(1,3-Бензодиоксол-5-ил)-1-метил-4-пиперидинил]-N-[1-(3,5-дибромфенил)этил]-N-метилацетамид (энантиомер 1)
Исходя из примера 34 (96 мг) получают 79 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки, элюируя 100% DCM до DCM:MeOH=8:2.
МС (ES/+): m/z=553 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,5 (с, 1H); 7,2 (с, 2H); 6,8-6,7 (м, 3H); 5,9-5,8 (с+кв, 2/1H); 2,7-2,0 (м, 8H); 2,6 (с, 2H); 2,2 (с, 3H); 2,1 (с, 3H); 1,2 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 36.
Пример 36
N-[1-(3-Циано-1-нафталинил)этил]-2-{4-[3-фтор-4-(метилокси)фенил]-4-пиперидинил}-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 92 (276 мг) получают 193 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=460 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,88 (м, 2H); 7,59 (м, 2H); 7,47 (с, 1H); 7,00 (м, 2H); 6,75 (т, 1H); 6,48 (кв, 1H); 3,83 (с, 3H); 3,14 (м, 2H); 2,86 (м, 2H); 2,54 (с, 2H); 2,6-2,35 (уш.м, 2H); 2,25-2,05 (м, 2H); 1,97 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 37.
Пример 37
N-[1-(3-Циано-1-нафталинил)этил]-2-{4-[3-фтор-4-(метилокси)фенил]-1-метил-4-пиперидинил}-N-метилацетамид (энантиомер 1)
Исходя из примера 36 (164 мг) получают 88 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием, начиная со 100% DCM до DCM:MeOH=7:3.
МС (ES/+): m/z=474 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,94 (д, 1H); 7,87 (м, 1H); 7,59 (м, 2H); 7,46 (с, 1H); 7,01 (м, 2H); 6,71 (т, 1H); 6,51 (кв, 1H); 3,82 (с, 3H); 2,7-2,5 (уш.м, 2H); 2,53 (с, 2H); 2,5-2,0 (уш.м, 6H); 2,22 (с, 3H); 1,94 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 38.
Пример 38
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(3-фтор-4-(метилокси)фенил]-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 93 (300 мг) получают 182 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=460 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,88 (м, 2H); 7,59 (м, 2H); 7,47 (с, 1H); 7,00 (м, 2H); 6,75 (т, 1H); 6,48 (кв, 1H); 3,83 (с, 3H); 3,14 (м, 2H); 2,86 (м, 2H); 2,54 (с, 2H); 2,6-2,35 (уш.м, 2H); 2,25-2,05 (м, 2H); 1,97 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 39.
Пример 39
N-[1-(3-Циано-1-нафталинил)этил]-2-{4-[3-фтор-4-(метилокси)фенил]-1-метил-4-пиперидинил}-N-метилацетамид (энантиомер 2)
Исходя из примера 38 (152 мг) получают 133 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием, начиная со 100% DCM до DCM:MeOH=7:3.
МС (ES/+): m/z=474 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,94 (д, 1H); 7,87 (м, 1H); 7,59 (м, 2H); 7,46 (с, 1H); 7,01 (м, 2H); 6,71 (т, 1H); 6,51 (кв, 1H); 3,82 (с, 3H); 2,7-2,5 (уш.м, 2H); 2,53 (с, 2H); 2,5-2,0 (уш.м, 6H); 2,22 (с, 3H); 1,94 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 40.
Пример 40
N-[(3-Циано-1-нафталинил)метил]-2-{4-[3-фтор-4-(метилокси)фенил]-4-пиперидинил}-N-метилацетамид
Исходя из промежуточного соединения 93 (240 мг) получают 164 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=446 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 8,1-8,0 (уш.м, 1H); 7,89 (м, 1H); 7,63 (м, 2H); 7,24 (с, 1H); 6,98 (м, 2H); 6,79 (т, 1H); 4,85 (с, 2H); 3,83 (с, 3H); 3,2 (уш.м, 2H); 2,9 (м, 2H); 2,66 (с, 2H); 2,6-2,1 (уш.м, 4H); 2,39 (с, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 41.
Пример 41
N-[(3-Циано-1-нафталинил)метил]-2-{4-[3-фтор-4-(метилокси)фенил]-1-метил-4-пиперидинил}-N-метилацетамид
Исходя из примера 40 (132 мг) получают 111 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием, начиная со 100% DCM до DCM:MeOH=7:3.
МС (ES/+): m/z=460 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 8,07 (д, 1H); 7,90 (д, 1H); 7,64 (м, 2H); 7,62 (с, 1H); 7,1-6,95 (м, 2H); 6,74 (т, 1H); 4,85 (с, 2H); 3,81 (с, 3H); 2,64 (с, 2H); 2,6 (уш.м, 2H); 2,5-2,0 (уш.м, 6H); 2,34 (с, 3H); 2,22 (с, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 42.
Пример 42
N-[1-(3-Хлор-1-нафталинил)этил]-2-{4-[3-фтор-4-(метилокси)фенил]-4-пиперидинил}-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 140 (396 мг) получают 230 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=469 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают пример 43.
Пример 43
N-[1-(3-Хлор-1-нафталинил)этил]-2-{4-[3-фтор-4-(метилокси)фенил]-1-метил-4-пиперидинил}-N-метилацетамид (энантиомер 1)
Исходя из примера 42 (195 мг) получают 180 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием, начиная со 100% DCM до DCM:MeOH=7:3.
МС (ES/+): m/z=483 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,9 (д, 1H); 7,73 (с, 1H); 7,75 (д, 1H); 7,36 (м, 2H); 7,3 (с, 1H); 7,03 (дд, 1H); 6,97 (д, 1H); 6,64 (т, 1H); 6,50 (кв, 1H); 3,80 (с, 3H); 2,7-2,5 (уш.м, 2H); 2,53 (с, 2H); 2,5-2,0 (уш.м, 6H); 2,22 (с, 3H); 1,92 (с, 3H); 1,35 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 44.
Пример 44
N-[1-(3-Хлор-1-нафталинил)этил]-2-{4-[3-фтор-4-(метилокси)фенил]-4-пиперидинил}-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 141 (372 мг) получают 226 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=469 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,85 (д, 1H); 7,74 (с, 1H); 7,7 (д, 1H); 7,46 (м, 2H); 7,3 (с, 1H); 7,03 (дд, 1H); 6,97 (д, 1H); 6,66 (т, 1H); 6,48 (кв, 1H); 3,80 (с, 3H); 3,06 (уш.м, 2H); 2,81 (кв, 2H); 2,54 (с, 2H); 2,5-2,25 (уш.м, 2H); 2,25-1,95 (уш.м, 2H); 1,94 (с, 3H); 1,36 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 45.
Пример 45
N-[1-(3-Хлор-1-нафталинил)этил]-2-{4-[3-фтор-4-(метилокси)фенил]-1-метил-4-пиперидинил}-N-метилацетамид (энантиомер 2)
Исходя из примера 44 (192 мг) получают 176 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием, начиная со 100% DCM до DCM:MeOH=7:3.
МС (ES/+): m/z=483 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,9 (д, 1H); 7,73 (с, 1H); 7,75 (д, 1H); 7,36 (м, 2H); 7,3 (с, 1H); 7,03 (дд, 1H); 6,97 (д, 1H); 6,64 (т, 1H); 6,50 (кв, 1H); 3,80 (с, 3H); 2,7-2,5 (уш.м, 2H); 2,53 (с, 2H); 2,5-2,0 (уш.м, 6H); 2,22 (с, 3H); 1,92 (с, 3H); 1,35 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 46.
Пример 46
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-цианофенил)-4-пиперидинил}-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 81 (31 мг) получают 13 мг указанного в заголовке соединения в виде белой пены.
ЯМР (CDCl3): δ (м.д.) 7,8 (д, 1H); 7,78 (д, 2H); 7,54 (д, 2H); 7,48-7,55 (м, 3H); 7,41 (тт, 1H); 7,35 (д, 1H); 6,47 (кв, 1H); 3,0 (м, 2H); 2,79 (м, 2H); 2,67 (с, 2H); 2,36 (уш.м, 2H); 2,14 (м, 2H); 2,13 (с, 3H); 1,4 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 47.
Пример 47
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-цианофенил)-4-пиперидинил}-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 118 (184 мг) получают 55 мг указанного в заголовке соединения в виде белой пены.
ЯМР (CDCl3): δ (м.д.) 7,8 (д, 1H); 7,78 (д, 2H); 7,54 (д, 2H); 7,48-7,55 (м, 3H); 7,41 (тт, 1H); 7,35 (д, 1H); 6,47 (кв, 1H); 3,0 (м, 2H); 2,79 (м, 2H); 2,67 (с, 2H); 2,36 (уш.м, 2H); 2,14 (м, 2H); 2,13 (с, 3H); 1,4 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 48.
Пример 48
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-цианофенил)-1-метил-4-пиперидинил}-N-метилацетамид (энантиомер 1)
Исходя из примера 47 (21 мг) получают 23 мг указанного в заголовке соединения в виде белой пены без какой-либо хроматографической очистки.
МС (ES/+): m/z=460 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,7 (д, 1H); 7,68 (д, 1H); 7,46-7,61 (уш.м, 3H); 7,38-7,47 (м, 3H); 7,26 (д, 1H); 7,24 (т, 1H); 6,32 (кв, 1H); 2,93 (уш.м, 2H); 2,61 (д, 1H); 2,56 (д, 1H); 2,75-2,25 (уш.м, 6H); 2,4 (уш.с, 3H); 2,08 (с, 3H); 1,31 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 49.
Пример 49
2-[4-(1-Бензофуран-5-ил)-4-пиперидинил]-N-[1-(3-хлор-1-нафталинил)этил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 125 (108 мг) получают 86 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=461 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,84 (д, 1H); 7,75 (д, 1H); 7,75 (с, 1H); 7,64 (д, 1H); 7,55 (д, 1H); 7,51 (т, 1H); 7,37 (д, 1H); 7,34 (т, 1H); 7,25 (дд, 1H); 7,24 (д, 1H); 6,63 (дд, 1H); 6,48 (кв, 1H); 3,19 (уш.м, 2H); 2,95 (м, 2H); 2,72 (уш.д, 1H); 2,69 (д, 1H); 2,62 (д, 1H); 2,57 (уш.д, 1H); 2,36 (уш.т, 1H); 2,24 (уш.т, 1H); 1,80 (с, 3H); 1,28 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 50.
Пример 50
2-[4-(1-Бензофуран-5-ил)-1-метил-4-пиперидинил]-N-[1-(3-хлор-1-нафталинил)этил]-N-метилацетамид (энантиомер 1)
Исходя из примера 49 (60 мг) получают 44 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки, элюируя 100% DCM до DCM:MeOH=9:1.
ЯМР (CDCl3): δ (м.д.) 7,8 (д, 1H); 7,75 (с, 1H); 7,74 (д, 1H); 7,64 (д, 1H); 7,58 (д, 1H); 7,5 (т, 1H); 7,39 (д, 1H); 7,33 (т, 1H); 7,3 (д, 1H); 7,24 (д, 1H); 6,64 (д, 1H); 6,46 (кв, 1H); 2,97 (уш.м, 2H); 2,8-2,5 (уш.м, 2H); 2,68 (д, 1H); 2,63 (д, 1H); 2,7-2,3 (уш.м, 4H); 2,42 (уш.с, 3H); 1,82 (с, 3H); 1,27 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 51.
Пример 51
2-[4-(1-Бензофуран-5-ил)-4-пиперидинил]-N-[1-(3-хлор-1-нафталинил)этил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 126 (51 мг) получают 35 мг указанного в заголовке соединения в виде белой пены.
ЯМР (CDCl3): δ (м.д.) 7,84 (д, 1H); 7,75 (д, 1H); 7,75 (с, 1H); 7,64 (д, 1H); 7,55 (д, 1H); 7,51 (т, 1H); 7,37 (д, 1H); 7,34 (т, 1H); 7,25 (дд, 1H); 7,24 (д, 1H); 6,63 (дд, 1H); 6,48 (кв, 1H); 3,19 (уш.м, 2H); 2,95 (м, 2H); 2,72 (уш.д, 1H); 2,69 (д, 1H); 2,62 (д, 1H); 2,57 (уш.д, 1H); 2,36 (уш.т, 1H); 2,24 (уш.т, 1H); 1,80 (с, 3H); 1,28 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 52.
Пример 52
2-[4-(1-Бензофуран-5-ил)-1-метил-4-пиперидинил]-N-[1-(3-хлор-1-нафталинил)этил]-N-метилацетамид (энантиомер 2)
Исходя из примера 51 (20 мг) получают 13 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с использованием элюирования, начиная со 100% DCM до DCM:MeOH=9:1.
ЯМР (CDCl3): δ (м.д.) 7,75 (с, 1H); 7,74 (д, 2H); 7,67 (д, 1H); 7,58 (уш.с, 1H); 7,49 (т, 1H); 7,42 (уш.д, 1H); 7,34-7,25 (м, 2H); 7,25 (д, 1H); 6,66 (уш.с, 1H); 6,43 (кв, 1H); 3,19 (уш.м, 2H); 2,79 (уш.м, 2H); 2,71 (д, 1H); 2,65 (д, 1H); 2,8-2,45 (уш.м, 4H); 2,57 (уш.с, 3H); 1,88 (с, 3H); 1,29(д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 53.
Пример 53
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-4-пиперидинил]-N-метилацетамид
(син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 137 (43 мг) получают 34 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=477 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,92 (д, 1H); 7,79 (с, 1H); 7,77 (д, 1H); 7,55 (т, 1H); 7,51 (т, 1H); 7,33 (д, 1H); 7,08 (с, 1H); 7,01 (д, 1H); 6,59 (д, 1H); 6,52 (кв, 1H); 4,52 (м, 2H); 3,43 (уш.м, 1H); 3,34 (уш.т, 1H); 3,01 (м, 1H); 2,92 (м, 1H); 2,78 (д, 1H); 2,75 (дм, 1H); 2,65 (д, 1H); 2,48 (уш.д, 1H); 1,96 (тд, 1H); 1,91 (с, 3H); 1,76 (уш.т, 1H); 1,49 (д, 3H); 1,38 (д, 3H); 1,3 (т, 1H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 54.
Пример 54
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 1, цепной энантиомер 1)
Исходя из примера 53 (24 мг) получают 19 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=491 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,85 (д, 1H); 7,69 (с, 1H); 7,68 (д, 1H); 7,45 (т, 1H); 7,42 (т, 1Н); 7,23 (с, 1H); 6,97 (с, 1H); 6,92 (дд, 1H); 6,49 (д, 1H); 6,44 (кв, 1H); 4,41 (м, 2H); 3,06 (уш.м, 1H); 2,93 (м, 1H); 2,89 (дм, 1H); 2,81 (м, 1H); 2,79 (м, 1H); 2,74 (д, 1H); 2,6 (дм, 1H); 2,52 (д, 1H); 2,46 (уш.м, 3H); 2,24 (уш.д, 1H); 1,99 (уш.м, 1H); 1,76 (с, 3H); 1,74 (уш.т, 1H); 1,29 (д, 3H); 1,26 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 55.
Пример 55
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-4-пиперидинил]-N-метилацетамид
(син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 138 (43 мг) получают 35 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=477 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,89 (д, 1H); 7,78 (с, 1H); 7,77 (д, 1H); 7,54 (т, 1H); 7,51 (т, 1H); 7,32 (с, 1H); 7,13 (с, 1H); 7,05 (д, 1H); 6,63 (д, 1H); 6,52 (кв, 1H); 4,54 (м, 2H); 3,48 (уш.м, 1H); 3,34 (уш.т, 1H); 3,21 (т, 1H); 3,04 (м, 1H); 2,98 (м, 1H); 2,83 (д, 1H); 2,79 (дм, 1H); 2,59 (д, 1H); 2,4 (уш.д, 1H); 2 (тд, 1H); 1,88 (с, 3H); 1,54 (уш.т, 1H); 1,43 (д, 3H); 1,39 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 56.
Пример 56
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 2, цепной энантиомер 1)
Исходя из примера 55 (25 мг) получают 19 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=491 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,86 (д, 1H); 7,73 (с, 1H); 7,72 (д, 1H); 7,49 (т, 1H); 7,46 (т, 1H); 7,28 (с, 1H); 7,03 (с, 1H); 6,98 (дд, 1H); 6,55 (д, 1H); 6,48 (кв, 1H); 4,47 (м, 2H); 3,46 (м, 2H); 3,14 (уш.м, 1H); 2,96 (м, 1H); 2,88 (м, 1H); 2,77 (д, 1H); 2,65 (уш.м, 1H); 2,54 (д, 1H); 2,53 (уш.м, 3H); 2,31 (уш.м, 1H); 1,82 (уш.м, 1H); 1,78 (с, 3H); 1,37 (д, 3H); 1,35 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 57.
Пример 57
N-[1-(3-Хлор-1-нафталинил)этил]-2-[2-этенил-4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид (син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 139 (8,5 мг) получают 3,4 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=465 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,79 (д, 1H); 7,69 (с, 1H); 7,68 (д, 1H); 7,45 (тд, 1H); 7,39 (тд, 1H); 7,23 (д, 1H); 7,18 (дд, 2H); 6,76 (тд, 2H); 6,41 (кв, 1H); 5,88 (м, 1H); 5,32 (д, 1H); 5,16 (д, 1H); 3,63 (м, 1H); 3,25 (уш.д, 1H); 2,75 (д, 1H); 2,65 (уш.д, 1H); 2,61 (д, 1H); 2,4 (дм, 1H); 1,8-2,0 (м, 1H); 1,86 (с, 3H); 1,78 (тм, 1H); 1,63 (уш.т, 1H); 1,27 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 58.
Пример 58
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(3-фтор-4-метилфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 119 (92 мг) получают 75 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,81 (д, 1H); 7,72 (д, 1H); 7,71 (д, 1H); 7,47 (т, 1H); 7,4 (т, 1H); 7,28 (д, 1H); 7,04-6,90 (м, 3H); 6,45 (кв, 1H); 3,02 (м, 2H); 2,79 (м, 2H); 2,54 (с, 2H); 2,45 (уш.д, 1H); 2,3 (уш.д, 1H); 2,21 (с, 3H); 2,17 (м, 1H); 2,01 (м, 1H); 1,94 (с, 3H); 1,33 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 59.
Пример 59
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(3-фтор-4-метилфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из примера 58 (37 мг) получают 38 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=467 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,83 (д, 1H); 7,82 (д, 1H); 7,77 (д, 1H); 7,53 (т, 1H); 7,41 (т, 1H); 7,33 (д, 1H); 7,1-6,99 (м, 3H); 6,49 (кв, 1H); 2,98 (уш.м, 2H); 2,6 (с, 2H); 2,7-2,2 (уш.м, 6H); 2,41 (с, 3H); 2,28 (с, 3H); 1,99 (с, 3H); 1,39 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 60.
Пример 60
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(3-фтор-4-метилфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 120 (90 мг) получают 72 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,77 (д, 1H); 7,72 (д, 1H); 7,71 (д, 1H); 7,46 (т, 1H); 7,38 (т, 1H); 7,28 (д, 1H); 7,04-6,90 (м, 3H); 6,43 (кв, 1H); 3,13 (м, 2H); 2,85 (м, 2H); 2,56 (д, 1H); 2,52 (д, 1H); 2,42 (уш.д, 1H); 2,26 (уш.т, 1H); 2,22 (с, 3H); 2,11 (уш.т, 1H); 2,01 (уш.м, 1H); 1,95 (с, 3H); 1,33 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 61.
Пример 61
N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(3-фтор-4-метилфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из примера 60 (30 мг) получают 24 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=467 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,83 (д, 1H); 7,82 (д, 1H); 7,77 (д, 1H); 7,53 (т, 1H); 7,41 (т, 1H); 7,33 (д, 1H); 7,1-6,99 (м, 3H); 6,49 (кв, 1H); 2,98 (уш.м, 2H); 2,6 (с, 2H); 2,7-2,2 (уш.м, 6H); 2,41 (с, 3H); 2,28 (с, 3H); 1,99 (с, 3H); 1,39 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 62.
Пример 62
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(3-цианофенил)-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 121 (80 мг) получают 61 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=446 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,79 (с, 1H); 7,78 (д, 1H); 7,78 (д, 1H); 7,69 (д, 1H); 7,66 (уш.д, 1H); 7,54 (д, 1H); 7,53 (т, 1H); 7,42 (тд, 1H); 7,35 (т, 1H); 7,35 (д, 1H); 6,47 (кв, 1H); 3,01 (уш.м, 2H); 2,81 (уш.м, 2H); 2,66 (с, 2H); 2,45-2,3 (уш.м, 2H); 2,2 (тм, 1H); 2,11 (с, 3H); 2,09 (м, 1H); 1,4 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 63.
Пример 63
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(3-цианофенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из примера 62 (40 мг) получают 41 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=460 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,79 (с, 1H); 7,77 (д, 1H); 7,7 (уш.м, 1H); 7,71 (уш.с, 1H); 7,64 (уш.м, 1H); 7,7-7,6 (уш.м, 1H); 7,6-7,45 (уш.м, 2H); 7,52 (т, 1H); 7,36 (д, 1H); 6,37 (уш.м, 1H); 3,5-3,15 (уш.м, 2H); 2,9-2,5 (уш.м, 2H); 2,72 (д, 1H); 2,68 (уш.с, 3H); 2,7-2,5 (уш.м, 3H); 2,66 (д, 1H); 2,25 (уш.с, 3H); 2,04 (уш.м, 1H); 1,43 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 64.
Пример 64
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(3-цианофенил)-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 122 (33 мг) получают 27 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=446 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,79 (с, 1H); 7,78 (д, 1H); 7,78 (д, 1H); 7,69 (д, 1H); 7,66 (уш.д, 1H); 7,54 (д, 1H); 7,53 (т, 1H); 7,42 (тд, 1H); 7,35 (т, 1H); 7,35 (д, 1H); 6,47 (кв, 1H); 3,01 (уш.м, 2H); 2,81 (уш.м, 2H); 2,66 (с, 2H); 2,45-2,3 (уш.м, 2H); 2,2 (тм, 1H); 2,11 (с, 3H); 2,09 (м, 1H); 1,4 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 65.
Пример 65
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(3-цианофенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из примера 64 (13 мг) получают 14 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=460 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,79 (с, 1H); 7,77 (д, 1H); 7,7 (уш.м, 1H); 7,71 (уш.с, 1H); 7,64 (уш.м, 1H); 7,7-7,6 (уш.м, 1H); 7,6-7,45 (уш.м, 2H); 7,52 (т, 1H); 7,36 (д, 1H); 6,37 (уш.м, 1H); 3,5-3,15 (уш.м, 2H); 2,9-2,5 (уш.м, 2H); 2,72 (д, 1H); 2,68 (уш.с, 3H); 2,7-2,5 (уш.м, 3H); 2,66 (д, 1H); 2,25 (уш.с, 3H); 2,04 (уш.м, 1H); 1,43 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 66.
Пример 66
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(4-фенил-4-пиперидинил)ацетамид (энантиомер 1)
Исходя из промежуточного соединения 123 (125 мг) получают 97 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=421 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,87 (д, 1H); 7,77 (с, 1H); 7,76 (д, 1H); 7,52 (тд, 1H); 7,46 (тд, 1H); 7,16-7,36 (м, 6H); 6,49 (кв, 1H); 3,21 (уш.т, 2H); 2,93 (уш.дд, 2H); 2,71 (уш.д, 1H); 2,64 (д, 1H); 2,59 (д, 1H); 2,54 (уш.д, 1H); 2,33 (уш.т, 1H); 2,2 (м, 1H); 1,88 (с, 3H); 1,35 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 67.
Пример 67
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(1-метил-4-фенил-4-пиперидинил)ацетамид (энантиомер 1)
Исходя из примера 66 (65 мг) получают 65 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием, начиная со 100% DCM до DCM:MeOH=8:2.
МС (ES/+): m/z=435 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,78 (д, 1H); 7,76 (д, 2H); 7,52 (т, 1H); 7,41 (т, 1H); 7,34 (с, 1H); 7,24-7,36 (м, 5H); 6,45 (кв, 1H); 3,23 (уш.м, 2H); 2,78 (уш.м, 2H); 2,68 (д, 1H); 2,61 (с, 3H); 2,6 (д, 1H); 2,46-2,75 (уш.м, 4H); 1,96 (уш.с, 3H); 1,35 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 68.
Пример 68
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(4-фенил-4-пиперидинил)ацетамид (энантиомер 2)
Исходя из промежуточного соединения 124 (70 мг) получают 54 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=421 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,81 (д, 1H); 7,77 (с, 1H); 7,76 (д, 1H); 7,52 (т, 1H); 7,43 (т, 1H); 7,16-7,36 (м, 6H); 6,46 (кв, 1H); 3,48 (уш.т, 1H); 3,39 (уш.м, 1H); 3,09 (уш.т, 1H); 3,03 (уш.т, 1H); 2,89 (уш.д, 1H); 2,73 (уш.д, 1H); 2,62 (д, 1H); 2,57 (д, 1H); 2,44 (уш.т, 1H); 2,35 (уш.м, 1H); 1,91 (с, 3H); 1,34 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 69.
Пример 69
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(1-метил-4-фенил-4-пиперидинил)ацетамид (энантиомер 2)
Исходя из примера 68 (35 мг) получают 34 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием от 100% DCM до DCM:MeOH=8:2.
МС (ES/+): m/z=435 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,77 (с, 1H); 7,74 (д, 1H); 7,68 (д, 1H); 7,55 (т, 1H); 7,5 (т, 1H); 7,3-7,4 (м, 6H); 6,41 (кв, 1H); 3,42 (уш.м, 2H); 3,04 (уш.д, 1H); 2,95 (уш.д, 1H); 2,5-2,8 (уш.м, 4H); 2,7 (д, 1H); 2,66 (с, 3H); 2,63 (д, 1H); 2,06 (с, 3H); 1,34 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 70.
Пример 70
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-{4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид (энантиомер 1)
Исходя из промежуточного соединения 127 (47 мг) получают 40 мг указанного в заголовке соединения в виде белой пены.
ЯМР (CDCl3): δ (м.д.) 7,93 (д, 1H); 7,78 (д, 1H); 7,77 (д, 1H); 7,54 (т, 1H); 7,49 (т, 1H); 7,32 (д, 1H); 7,22 (д, 2H); 6,71 (д, 2H); 6,53 (кв, 1H); 3,76 (с, 3H); 3,1 (уш.м, 2H); 2,87 (уш.м, 2H); 2,6 (д, 1H); 2,56 (д, 1H); 2,55 (уш.д, 1H); 2,41 (уш.д, 1H); 2,21 (уш.т, 1H); 2,11 (уш.т, 1H); 1,9 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 71.
Пример 71
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-{1-метил-4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид (энантиомер 1)
Исходя из примера 70 (30 мг) получают 16 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием от 100% DCM до DCM:MeOH=8:2.
ЯМР (CDCl3): δ (м.д.) 7,85 (д, 1H); 7,78 (д, 1H); 7,76 (д, 1H); 7,53 (т, 1H); 7,44 (т, 1H); 7,32 (д, 1H); 7,23 (д, 2H); 6,75 (д, 2H); 6,5 (кв, 1H); 3,78 (с, 3H); 3,05 (уш.м, 2H); 2,7 (уш.м, 2H); 2,63 (д, 1H); 2,6 (д, 1H); 2,51 (с, 3H); 2,35-2,15 (уш.м, 4H); 1,95 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 72.
Пример 72
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-{4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид (энантиомер 2)
Исходя из промежуточного соединения 128 (57 мг) получают 46 мг указанного в заголовке соединения в виде белой пены.
ЯМР (CDCl3): δ (м.д.) 7,93 (д, 1H); 7,78 (д, 1H); 7,75 (д, 1H); 7,6-7,4 (дт, 2H); 7,31 (д, 1H); 7,22 (д, 2H); 6,72 (д, 2H); 6,53 (м, 1H); 3,76 (с, 3H); 3,15 (м, 2H); 2,9 (м, 2H); 2,59 (с, 2H); 2,5 (м, 2H); 2,0 (м, 2H); 1,9 (уш.с, 3H); 1,38 (с, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 73.
Пример 73
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-{1-метил-4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид (энантиомер 2)
Исходя из примера 72 (36 мг) получают 31 мг указанного в заголовке соединения в виде белой пены после хроматографической очистки с элюированием смесью DCM:MeOH=98:2 до 8:2.
ЯМР (CDCl3): δ (м.д.) 7,89 (д, 1H); 7,77 (д, 1H); 7,76 (д, 1H); 7,54 (т, 1H); 7,49 (т, 1H); 7,32 (д, 1H); 7,23 (д, 2H); 6,73 (д, 2H); 6,51 (кв, 1H); 3,77 (с, 3H); 2,89 (уш.м, 2H); 2,5-2,7 (уш.м, 2H); 2,61 (д, 1H); 2,56 (д, 1H); 2,4 (с, 3H); 2,5-2,2 (уш.м, 4H); 1,91 (с, 3H); 1,37 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 74.
Пример 74
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 129 (88 мг) получают 65 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=463 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,83 (д, 1H); 7,78 (д, 1H); 7,76 (д, 1H); 7,53 (т, 1H); 7,51 (т, 1H); 7,33 (д, 1H); 7,33 (с, 1H); 7,11 (дд, 1H); 6,69 (д, 1H); 6,48 (кв, 1H); 4,58 (м, 2H); 3,46 (уш.м, 1H); 3,37 (м, 1H); 3,15-2,9 (м, 4H); 2,9-2,6 (уш.м, 2H); 2,62 (д, 1H); 2,54 (д, 1H); 2,38 (тд, 1H); 2,29 (уш.т, 1H); 1,96 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 75.
Пример 75
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из примера 74 (40 мг) получают 43 мг указанного в заголовке соединения без какой-либо дополнительной хроматографической очистки.
МС (ES/+): m/z=477 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,77 (д, 1H); 7,68 (д, 1H); 7,66 (д, 1H); 7,43 (т, 1H); 7,36 (т, 1H); 7,23 (д, 1H); 7,04 (с, 1H); 6,97 (дд, 1H); 6,58 (д, 1H); 6,41 (кв, 1H); 4,46 (м, 2H); 2,85-2,30 (м, 4H); 2,6-2,3 (уш.м, 5H); 2,52 (д, 1H); 2,49 (д, 1H); 2,37 (с, 3H); 2,21 (уш.т, 1H); 1,83 (с, 3H); 1,28 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 76.
Пример 76
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 130 (118 мг) получают 88 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=463 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,91 (д, 1H); 7,78 (д, 1H); 7,76 (д, 1H); 7,53 (т, 1H); 7,48 (т, 1H); 7,73 (д, 1H); 7,13 (с, 1H); 7,06 (дд, 1H); 6,67 (д, 1H); 6,53 (кв, 1H); 4,56 (м, 2H); 3,46 (уш.м, 1H); 3,14 (м, 1H); 3,15-2,85 (м, 4H); 2,61 (д, 1H); 2,58 (уш.м, 1H); 2,56 (д, 1H); 2,41 (уш.д, 1H); 2,26 (уш.м, 1H); 2,14 (уш.м, 1H); 1,92 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 77.
Пример 77
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(2,3-дигидро-1-бензофуран-5-ил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из примера 76 (40 мг) получают 29 мг указанного в заголовке соединения после хроматографической очистки с элюированием смесью DCM:MeOH=98:2 до 8:2.
МС (ES/+): m/z=477 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,86 (д, 1H); 7,78 (д, 1H); 7,76 (д, 1H); 7,53 (т, 1H); 7,46 (т, 1H); 7,33 (д, 1H); 7,14 (с, 1H); 7,07 (дд, 1H); 6,68 (д, 1H); 6,5 (кв, 1H); 4,57 (м, 2H); 3,2-2,9 (м, 2H); 3,02 (м, 1H); 2,97 (м, 1H); 2,75-2,5 (м, 2H); 2,62 (д, 1H); 2,6-2,4 (м, 2H); 2,56 (д, 1H); 2,46 (уш.с, 3H); 2,5-2,25 (уш.м, 2H); 1,94 (с, 3H); 1,38 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 78.
Пример 78
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-{2-метил-4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид
(син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 135 (47 мг) получают 36 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=465 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,94 (д, 1H); 7,78 (с, 1H); 7,77 (д, 1H); 7,55 (т, 1H); 7,51 (т, 1H); 7,31 (д, 1H); 7,19 (д, 2H); 6,65 (д, 2H); 6,52 (кв, 1Н); 3,74 (с, 3H); 3,3 (м, 2H); 2,79 (д, 1H); 2,69 (уш.д, 1H); 2,66 (д, 1H); 2,46 (дм, 1H); 1,88 (с, 3H); 1,83 (м, 1H); 1,57 (т, 1H); 1,37 (д, 3H); 1,35 (д, 3H); 1,25-1,4 (м, 1H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 79.
Пример 79
N-[1-(3-Хлор-1-нафталинил)этил]-2-{1,2-диметил-4-[4-(метилокси)фенил]-4-пиперидинил}-N-метилацетамид
(син-изомер 1, цепной энантиомер 1)
Исходя из примера 78 (25 мг) получают 23 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=479 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,91 (д, 1H); 7,78 (с, 1H); 7,77 (д, 1H); 7,55 (т, 1H); 7,52 (т, 1H); 7,31 (д, 1H); 7,1 (д, 2H); 6,55 (д, 2H); 6,53 (кв, 1Н); 3,74 (с, 3H); 3,25 (уш.м, 1H); 3, (уш.м, 1H); 2,7 (д, 1H); 2,69 (дм, 1H); 2,61 (д, 1H); 2,6 (уш.с, 3H); 2,45 (уш.д, 1H); 1,83 (т, 1H); 1,75 (с, 3H); 1,63 (м, 1H); 1,41 (д, 3H); 1,31 (м, 1H); 1,34 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают пример 80.
Пример 80
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-{2-метил-4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид
Исходя из промежуточного соединения 136 (50 мг) получают 23 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=465 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,85 (д, 1H); 7,73 (с, 1H); 7,72 (д, 1H); 7,5 (т, 1H); 7,51 (т, 1H); 7,27 (д, 1H); 7,17 (д, 2H); 6,65 (д, 2H); 6,52 (кв, 1Н); 3,7 (с, 3H); 3,3-3,17 (м, 2H); 2,79 (д, 1H); 2,69 (уш.д, 1H); 2,6 (д, 1H); 2,46 (дм, 1H); 1,8 (с, 3H); 1,98 (м, 1H); 1,57 (т, 1H); 1,37 (д, 3H); 1,35 (д, 3H); 1,25-1,4 (м, 1H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 81.
Пример 81
N-[1-(3-Хлор-1-нафталинил)этил]-2-{1,2-диметил-4-[4-(метилокси)фенил]-4-пиперидинил}-N-метилацетамид
(син-изомер 2, цепной энантиомер 1)
Исходя из примера 80 (13 мг) получают 12 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=479 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,91 (д, 1H); 7,78 (с, 1H); 7,77 (д, 1H); 7,55 (т, 1H); 7,52 (т, 1H); 7,31 (д, 1H); 7,18 (д, 2H); 6,65 (д, 2H); 6,53 (кв, 1Н); 3,74 (с, 3H); 3,18 (уш.м, 1H); 2,85 (уш.м, 1H); 2,8 (д, 1H); 2,69 (дм, 1H); 2,61 (д, 1H); 2,58 (уш.с, 3H); 2,42 (уш.д, 1H); 1,83 (т, 1H); 1,8 (с, 3H); 1,63 (м, 1H); 1,4 (д, 3H); 1,31 (м, 1H); 1,22 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают примеры 82 и 83, 84 и 85.
Примеры 82 и 83
N-[1-(3-Циано-1-нафталинил)этил]-N-метил-2-{2-метил-4-фенил-4-пиперидинил)ацетамид (син-изомер 1, цепной энантиомер 1)
N-[1-(3-Циано-1-нафталинил)этил]-N-метил-2-{2-метил-4-фенил-4-пиперидинил)ацетамид (син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 99 (42 мг) получают 38 мг смеси указанных в заголовке соединений 82 и 83 в виде белой пены.
Затем смесь очищают полупрепаративной SFC (Gilson) хроматографией [условия полупрепаративной хроматографии: хиральная колонка: CHIRALPAK AS-Н, 25×2,1 см; модификатор: (Этанол+0,1% изопропиламин) 15% против CO2; скорость потока=22 мл/мин; давление=196 бар; Т=36°С; длина волны в УФ-области: 220 нм; петля=2 мл], получая указанное в заголовке соединение 82 [аналитические условия: хиральная колонка: CHIRALPAK AS-Н, 25×0,46 см; модификатор: (этанол+0,1% изопропиламин) 15% против CO2; скорость потока=2,5 мл/мин; давление=190 бар; Т=35°С; длина волны в УФ-области: 220 нм; петля=2 мл; время удерживания=14,9 мин] (14 мг) и указанное в заголовке соединение 83 (6 мг) [те же аналитические условия; время удерживания=18,7 мин].
Пример 82:
МС (ES/+): m/z=426 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,97 (д, 1H); 7,88 (дд, 1H); 7,65 (тд, 1H); 7,6 (тд, 1H); 7,43 (с, 1H); 7,3 (дд, 2H); 7,2-7,1 (м, 3H); 6,51 (кв, 1H); 3,23 (м, 1H); 3,19 (дт, 1H); 3,14 (дм, 1H); 2,87 (д, 1H); 2,71 (уш.м, 1H); 2,63 (д, 1H); 2,35 (дм, 1H); 1,8 (с, 3H); 1,9-1,6 (м, 2H); 1,35 (д, 3H); 1,23 (д, 3H).
Пример 83:
МС (ES/+): m/z=426 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,98 (дд, 1H); 7,88 (дд, 1H); 7,64 (тд, 1H); 7,6 (тд, 1H); 7,43 (с, 1H); 7,3 (дд, 2H); 7,2-7,1 (м, 3H); 6,5 (кв, 1H); 3,23 (тд, 1H); 3,19 (дт, 1H); 3,11 (м, 1H); 2,86 (д, 1H); 2,69 (дм, 1H); 2,65 (д, 1H); 2,37 (тдт, 1H); 1,85 (с, 3H); 1,9-1,7 (м, 1H); 1,66 (тд, 1H); 1,32 (д, 3H); 1,17 (д, 3H).
Примеры 84 и 85
N-[1-(3-Циано-1-нафталинил)этил]-N-метил-2-(2-метил-4-фенил-4-пиперидинил)ацетамид (син-изомер 1, цепной энантиомер 2)
N-[1-(3-Циано-1-нафталинил)этил]-N-метил-2-(2-метил-4-фенил-4-пиперидинил)ацетамид (син-изомер 2, цепной энантиомер 2)
Исходя из промежуточного соединения 100 (36 мг) получают 28 мг смеси указанных в заголовке соединений 84 и 85 в виде белой пены (36 мг).
Затем смесь очищают полупрепаративной SFC (Gilson) хроматографией [условия полупрепаративной хроматографии: хиральная колонка: CHIRALPAK AS-Н, 25×2,1 см; модификатор: (этанол+0,1% изопропиламин) 15% против CO2; скорость потока=22 мл/мин; давление=196 бар; Т=36°С; длина волны в УФ-области: 220 нм; петля=2 мл], получая указанное в заголовке соединение 84 [аналитические условия: хиральная колонка: CHIRALPAK AS-Н, 25×0,46 см; модификатор: (этанол+0,1% изопропиламин) 15% против CO2; скорость потока=2,5 мл/мин; давление=190 бар; Т=35°С; длина волны в УФ-области: 220 нм; петля=2 мл; время удерживания=14,9 мин] (13 мг) и указанное в заголовке соединение 85 (8 мг) [те же аналитические условия; время удерживания=18,7 мин].
Пример 84:
МС (ES/+): m/z=426 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,14 (с, 1H); 7,97 (д, 1H); 7,86 (дд, 1H); 7,63 (т, 1H); 7,59 (тд, 1H); 7,42 (д, 1H); 7,29 (дд, 2H); 7,14 (м, 3H); 6,49 (кв, 1H); 3,21 (тд, 1H); 3,17 (м, 1H); 3,07(м, 1H); 2,84 (д, 1H); 2,67 (уш.д, 1H); 2,63 (д, 1H); 2,35 (дм, 1H); 1,83 (с, 3H); 1,64 (тд, 1H); 1,37 (тд, 1H); 1,29 (д, 3H); 1,15 (д, 3H).
Пример 85:
МС (ES/+): m/z=426 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,98 (дд, 1H); 7,88 (дд, 1H); 7,64 (тд, 1H); 7,6 (тд, 1H); 7,43 (с, 1H); 7,3 (дд, 2H); 7,2-7,1 (м, 3H); 6,5 (кв, 1H); 3,23 (тд, 1H); 3,19 (дт, 1H); 3,11 (м, 1H); 2,86 (д, 1H); 2,69 (дм, 1H); 2,65 (д, 1H); 2,37 (тдт, 1H); 1,85 (с, 3H); 1,9-1,7 (м, 1H); 1,66 (тд, 1H); 1,32 (д, 3H); 1,17 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают примеры 86, 87, 88, 89.
Пример 86
N-[1-(3-Циано-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил)-N-метилацетамид (син-изомер 1, цепной энантиомер 1)
Исходя из примера 82 (14 мг) получают 11 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=440 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,16 (с, 1H); 7,96 (д, 1H); 7,88 (дд, 1H); 7,65 (тд, 1H); 7,61 (тд, 1H); 7,43 (с, 1H); 7,27 (дд, 2H); 7,1-7,2 (м, 3H); 6,51 (кв, 1H); 3,15 (уш.м, 1H); 2,83 (д, 1H); 2,75-2,6 (м, 2H); 2,61 (д, 1H); 2,48 (уш.с, 3H); 2,4 (дм, 1H); 2,15 (уш.м, 1H); 1,77 (с, 3H); 1,73 (уш.м, 1H); 1,36 (д, 3H); 1,34 (д, 3H); 1,31 (уш.м, 1H).
Пример 87
N-[1-(3-Циано-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил)-N-метилацетамид (син-изомер 2, цепной энантиомер 1)
Исходя из примера 83 (6 мг) получают 4 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=440 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,98 (дд, 1H); 7,87 (дд, 1H); 7,64 (тд, 1H); 7,6 (тд, 1H); 7,43 (с, 1H); 7,28 (дд, 2H); 7,1-7,2 (м, 3H); 6,50 (кв, 1H); 2,97 (дт, 1H); 2,84 (д, 1H); 2,69 (дм, 1H); 2,67 (м, 1H); 2,62 (д, 1H); 2,42 (м, 1H); 2,38 (с, 3H); 2,31 (дт, 1H); 1,94 (тд, 1H); 1,83 (с, 3H); 1,66 (тд, 1H); 1,32 (д, 3H); 1,2 (д, 3H).
Пример 88
N-[1-(3-Циано-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил)-N-метилацетамид (син-изомер 1, цепной энантиомер 2)
Исходя из примера 84 (13 мг) получают 9 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=440 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,95 (дд, 1H); 7,87 (дд, 1H); 7,64 (тд, 1H); 7,59 (тд, 1H); 7,43 (с, 1H); 7,29 (дд, 2H); 7,13 (м, 3H); 6,50 (кв, 1H); 2,93 (дт, 1H); 2,84 (д, 1H); 2,63 (дм, 1H); 2,59 (д, 1H); 2,57 (дм, 1H); 2,51 (тм, 1H); 2,38 (с, 3H); 2,36 (дм 1H); 2,01 (тд, 1H); 1,79 (с, 3H); 1,54 (тд, 1H); 1,35 (д, 3H); 1,23 (д, 3H).
Пример 89
N-[1-(3-Циано-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил)-N-метилацетамид (син-изомер 2, цепной энантиомер 2)
Исходя из примера 85 (8 мг) получают 5 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=440 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,98 (дд, 1H); 7,87 (дд, 1H); 7,64 (тд, 1H); 7,6 (тд, 1H); 7,43 (с, 1H); 7,28 (дд, 2H); 7,1-7,2 (м, 3H); 6,5 (кв, 1H); 2,97 (дт, 1H); 2,84 (д, 1H); 2,69 (дм, 1H); 2,67 (м, 1H); 2,62 (д, 1H); 2,42 (м, 1H); 2,38 (с, 3H); 2,31 (дт, 1H); 1,94 (тд, 1H); 1,83 (с, 3H); 1,66 (тд, 1H); 1,32 (д, 3H); 1,2 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают примеры 90, 91
Пример 90
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-2-метил-4-пиперидинил)-N-метилацетамид (син-изомер, цепной энантиомер 1)
Исходя из промежуточного соединения 101 (36 мг) получают 25 мг указанных в заголовке соединений в виде белой пены.
МС (ES/+): m/z=444 [M+H]+.
Пример 91
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-2-метил-4-пиперидинил)-N-метилацетамид (син-изомер, цепной энантиомер 2)
Исходя из промежуточного соединения 102 (74 мг) получают 55 мг указанных в заголовке соединений в виде белой пены.
МС (ES/+): m/z=444 [M+H]+.
Следуя той же самой методике, описанной для получения примера 2, получают примеры 92 и 93, 94 и 95.
Примеры 92 и 93
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 1, цепной энантиомер 1)
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 2, цепной энантиомер 1)
Исходя из примера 90 (25 мг) получают 14 мг смеси указанных в заголовке соединений в виде белой пены.
Затем смесь очищают полупрепаративной SFC (Gilson) хроматографией [условия полупрепаративной хроматографии: хиральная колонка: CHIRALPAK AS-Н, 25×2,1 см; модификатор: (этанол+0,1% изопропиламин) 5% против CO2; скорость потока=22 мл/мин; давление=192 бар; Т=36°С; длина волны в УФ-области: 220 нм; петля=1 мл; инъекция: каждая инъекция 7,5 мг], получая указанное в заголовке соединение 92 [аналитические условия: хиральная колонка: CHIRALPAK AS-Н, 25×0,46 см; модификатор: (этанол+0,1% изопропиламин) 5% против CO2; скорость потока=2,5 мл/мин; давление=190 бар; Т=35°С; длина волны в УФ-области: 220 нм; время удерживания=14,8 мин] (4 мг) и указанное в заголовке соединение 93 [аналитические условия: хиральная колонка: CHIRALPAK AS-Н, 25×0,46 см; модификатор: (этанол+0,1% изопропиламин) 8% против CO2; скорость потока=2,5 мл/мин; давление=190 бар; Т=35°С; длина волны в УФ-области: 220 нм; время удерживания=18,2 мин] (5 мг).
Пример 92:
МС (ES/+): m/z=458 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,16 (с, 1H); 7,91 (тд, 1H); 7,87 (тд, 1H); 7,6 (д, 1H); 7,59 (д, 1H); 7,46 (д, 1H); 7,24 (дд, 2H); 6,81 (тд, 2H); 6,49 (кв, 1H); 2,91 (уш.д, 1H); 2,79 (д, 1H); 2,61 (д, 1H); 2,5 (уш.т, 1H); 2,6-2,3 (м, 1H); 2,48 (уш.д, 1H); 2,4 (уш.т, 1H); 2,35 (с, 3H); 1,94 (тм, 1H); 1,91 (с, 3H); 1,49 (уш.т, 1H); 1,37 (д, 3H); 1,19 (д, 3H).
Пример 93:
МС (ES/+): m/z=458 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,92 (тд, 1H); 7,87 (тд, 1H); 7,61 (д, 1H); 7,6 (д, 1H); 7,46 (д, 1H); 7,24 (дд, 2H); 6,82 (тд, 2H); 6,48 (кв, 1H); 2,93 (уш.д, 1H); 2,78 (д, 1H); 2,62 (д, 1H); 2,59 (уш.т, 1H); 2,56 (м, 1H); 2,35 (с, 3H); 2,3 (уш.д, 1H); 1,94 (с, 3H); 1,86 (тд, 1H); 1,61 (уш.д, 1H); 1,33 (д, 3H); 1,3 (м, 1H); 1,17 (д, 3H).
Примеры 94 и 95
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 1, цепной энантиомер 2)
N-[1-(3-Циано-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 2, цепной энантиомер 2)
Исходя из примера 91 (55 мг) получают 49 мг смеси указанных в заголовке соединений в виде белой пены.
Затем смесь очищают полупрепаративной SFC (Gilson) хроматографией [условия полупрепаративной хроматографии: хиральная колонка: CHIRALPAK AS-Н, 25×2,1 см; модификатор: (этанол+0,1% изопропиламин) 5% против CO2; скорость потока=22 мл/мин; давление=192 бар; Т=36°С; длина волны в УФ-области: 220 нм; петля=1 мл; инъекция: каждая инъекция 10 мг], получая указанное в заголовке соединение 94 [аналитические условия: хиральная колонка: CHIRALPAK AS-Н, 25×0,46 см; модификатор: (этанол+0,1% изопропиламин) 5% против CO2; скорость потока=2,5 мл/мин; давление=192 бар; Т=35°С; длина волны в УФ-области: 220 нм; время удерживания=14,8 мин] (12 мг) и указанное в заголовке соединение 95 [аналитические условия: хиральная колонка: CHIRALPAK AS-Н, 25×0,46 см; модификатор: (этанол+0,1% изопропиламин) 5% против CO2; скорость потока=2,5 мл/мин; давление=192 бар; Т=35°С; длина волны в УФ-области: 220 нм; время удерживания=16,4 мин] (5 мг).
Пример 94:
МС (ES/+): m/z=458 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,15 (с, 1H); 7,92 (тд, 1H); 7,87 (тд, 1H); 7,61 (д, 1H); 7,6 (д, 1H); 7,46 (д, 1H); 7,24 (дд, 2H); 6,82 (тд, 2H); 6,48 (кв, 1H); 2,95 (уш.д, 1H); 2,78 (д, 1H); 2,62 (д, 1H); 2,61 (уш.т, 1H); 2,57 (м, 1H); 2,37 (с, 3H); 2,31 (уш.д, 1H); 1,93 (с, 3H); 1,86 (тд, 1H); 1,62 (уш.д, 2H); 1,34 (д, 3H); 1,18 (д, 3H).
Пример 95:
МС (ES/+): m/z=458 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 8,16 (с, 1H); 7,9 (тд, 1H); 7,88 (тд, 1H); 7,61 (д, 1H); 7,6 (д, 1H); 7,46 (д, 1H); 7,24 (дд, 2H); 6,81 (тд, 2H); 6,49 (кв, 1H); 2,98 (уш.д, 1H); 2,77 (д, 1H); 2,61 (д, 1H); 2,57 (уш.т, 1H); 2,55 (м, 1H); 2,4 (с, 3H); 2,35 (уш.д, 1H); 2,02 (уш.м, 1H); 1,89 (с, 3H); 1,61 (уш.д, 2H); 1,37 (д, 3H); 1,24 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают примеры 96, 97.
Пример 96
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из промежуточного соединения 116 (136 мг) получают 95 мг указанного в заголовке соединения в виде белой пены.
ВЭЖХ (ступенчатая) tR=4,78
ЯМР (CDCl3): δ (м.д.) 7,84 (д, 1H); 7,73 (с, 1H); 7,72 (д, 1H); 7,49 (т, 1H); 7,42 (тд, 1H); 7,28 (дд, 2H); 7,27 (д, 1H); 6,86 (т, 2H); 6,47 (кв, 1H); 2,97 (уш.м, 2H); 2,78 (уш.м, 2H); 2,56 (с, 2H); 2,40 (уш.м, 1H); 2,27 (уш.м, 1H); 2,13 (уш.тм, 1H); 2,00 (уш.тм, 1H); 1,92 (с, 3H); 1,34 (д, 3H).
Пример 97
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из промежуточного соединения 117 (171 мг) получают 120 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z= 439 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,84 (д, 1H); 7,73 (с, 1H); 7,72 (д, 1H); 7,49 (т, 1H); 7,42 (тд, 1H); 7,28 (дд, 2H); 7,27 (д, 1H); 6,86 (т, 2H); 6,47 (кв, 1H); 2,97 (уш.м, 2H); 2,78 (уш.м, 2H); 2,56 (с, 2H); 2,40 (уш.м, 1H); 2,27 (уш.м, 1H); 2,13 (уш.тм, 1H); 2,00 (уш.тм, 1H); 1,92 (с, 3H); 1,34 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают пример 98 и 100.
Пример 98
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1)
Исходя из примера 96 (30 мг) получают 30 мг указанного в заголовке соединения в виде белого твердого вещества без какой-либо хроматографической очистки.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,81 (д, 1H); 7,73 (с, 1H); 7,72 (д, 1H); 7,48 (т, 1H); 7,41 (т, 1H); 7,28 (с, 1H); 7,27 (дд, 2H); 6,86 (т, 2H); 6,45 (кв, 1H); 2,62 (уш.м, 2H); 2,55 (с, 2H); 2,6-2,3 (уш.м, 2H); 2,40-2,0 (уш.м, 4H); 2,23 (с, 3H); 1,91(с, 3H); 1,32 (д, 3H).
Следуя той же самой методике, описанной для получения примера 3, получают пример 99.
Пример 99
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид гидрохлорид (энантиомер 1)
Исходя из примера 98 (27 мг) получают 21 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (d6-ДМСО): δ (м.д.) 10,2 (уш.с, 1H); 8,05 (д, 1H); 7,98 (д, 1H); 7,75 (уш.т, 1H); 7,61 (т, 1H); 7,49 (д, 1H); 7,46 (уш.м, 2H); 7,41 (уш.м, 1H); 7,06 (уш.м, 2H); 6,32 (м, 1H); 3,4 (м, 2H); 2,8 (м, 2H); 2,8-2,6 (уш.м, 2H); 2,6-2,0 (м, 4H); 2,71 (уш.с, 3H); 2,09 (уш.с, 3H); 1,35 (д, 3H).
Пример 100
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 2)
Исходя из примера 97 (30 мг) получают 30 мг указанного в заголовке соединения в виде белого твердого вещества без какой-либо хроматографической очистки.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,81 (д, 1H); 7,73 (с, 1H); 7,72 (д, 1H); 7,48 (т, 1H); 7,41 (т, 1H); 7,28 (с, 1H); 7,27 (дд, 2H); 6,86 (т, 2H); 6,45 (кв, 1H); 2,62 (уш.м, 2H); 2,55 (с, 2H); 2,6-2,3 (уш.м, 2H); 2,40-2,0 (уш.м, 4H); 2,23 (с, 3H); 1,91(с, 3H); 1,32 (д, 3H).
Следуя той же самой методике, описанной для получения примера 1, получают примеры 101, 102.
Пример 101
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(2-метил-4-фенил-4-пиперидинил]ацетамид (син-изомер 1, цепной энантиомер 1)
Исходя из промежуточного соединения 131 (50 мг) получают 33 мг указанного в заголовке соединения в виде белой пены.
ВЭЖХ (ступенчатая): tR=4,76
ЯМР (CDCl3): δ (м.д.) 7,82 (д, 1H); 7,72 (с, 1H); 7,71 (д, 1H); 7,49 (тд, 1H); 7,45 (тд, 1H); 7,22-7,31 (м, 3H); 7,16 (д, 1H); 7,15 (д, 2H); 6,45 (кв, 1H); 3,36 (уш.д, 1H); 3,17 (уш.т, 1H); 2,82 (уш.д, 1H); 2,8 (д, 1H); 2,57 (д, 1H); 2,39 (уш.д, 1H); 2,03 (тд, 1H); 1,76 (с, 3H); 1,59 (уш.т, 1H); 1,43 (д, 3H); 1,4 (уш.д, 1H); 1,31 (д, 3H).
Пример 102
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(2-метил-4-фенил-4-пиперидинил]ацетамид (син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 132 (34 мг) получают 28 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=436 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,82 (д, 1H); 7,72 (с, 1H); 7,71 (д, 1H); 7,49 (тд, 1H); 7,45 (тд, 1H); 7,22-7,31 (м, 3H); 7,16 (д, 1H); 7,15 (д, 2H); 6,45 (кв, 1H); 3,36 (уш.д, 1H); 3,17 (уш.т, 1H); 2,82 (уш.д, 1H); 2,8 (д, 1H); 2,57 (д, 1H); 2,39 (уш.д, 1H); 2,03 (тд, 1H); 1,76 (с, 3H); 1,59 (уш.т, 1H); 1,43 (д, 3H); 1,4 (уш.д, 1H); 1,31 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают примеры 103, 104.
Пример 103
N-[1-(3-Хлор-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил]-N-метилацетамид (син-изомер 1, цепной энантиомер 1)
Исходя из примера 101 (24 мг) получают 18 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=449 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,89 (д, 1H); 7,78 (с, 1H); 7,76 (д, 1H); 7,55 (тд, 1H); 7,5 (тд, 1H); 7,34-7,22 (м, 3H); 7,17 (д, 1H); 7,16 (д, 2H); 6,52 (кв, 1H); 3,15 (уш.м, 1H); 2,74 (уш.д, 2H); 2,8 (д, 1H); 2,67 (д, 1H); 2,51 (уш.с, 3H); 2,4 (дм, 1H); 2,2 (тд, 1H); 1,78 (с, 3H); 1,81 (тм, 2H); 1,37 (д, 3H); 1,35 (уш.м, 3H).
[α]D=-119,8 (с=0,54, CHCl3)
Пример 104
N-[1-(3-Хлор-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил]-N-метилацетамид (син-изомер 2, цепной энантиомер 1)
Исходя из примера 102 (24 мг) получают 20 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=449 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,87 (д, 1H); 7,75 (с, 1H); 7,71 (д, 1H); 7,5 (тд, 1H); 7,48 (тд, 1H); 7,34-7,22 (м, 3H); 7,15 (д, 1H); 7,14 (д, 2H); 6,5 (кв, 1H); 3,25 (уш.м, 1H); 2,74 (уш.м, 2H); 2,8 (д, 1H); 2,67 (д, 1H); 2,61 (уш.с, 3H); 2,4 (дм, 1H); 2,3 (тд, 1H); 1,75 (с, 3H); 1,81 (тм, 2H); 1,4 (уш.м, 3H); 1,36 (д, 3H).
[α]D=-103,9 (с=0,37, CHCl3)
Следуя той же самой методике, описанной для получения примера 1, получают примеры 105, 106.
Пример 105
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(2-метил-4-фенил-4-пиперидинил)ацетамид (син-изомер 1, цепной энантиомер 2)
Исходя из промежуточного соединения 133 (38 мг) получают 28 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=436 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,89 (д, 1H); 7,78 (с, 1H); 7,77 (д, 1H); 7,55 (тд, 1H); 7,5 (тд, 1H); 7,34-7,22 (м, 3H); 7,18 (д, 1H); 7,16 (д, 2H); 6,5 (кв, 1H); 3,47 (уш.м, 1H); 3,39 (м, 1H); 2,84 (уш.д, 1H); 2,8 (д, 1H); 2,67 (д, 1H); 2,55 (дм, 1H); 2,03 (тд, 1H); 1,86 (с, 3H); 1,81 (тм, 2H); 1,51 (д, 3H); 1,35 (д, 3H).
Пример 106
N-[1-(3-Хлор-1-нафталинил)этил]-N-метил-2-(2-метил-4-фенил-4-пиперидинил]ацетамид (син-изомер 2, цепной энантиомер 2)
Исходя из промежуточного соединения 134 (42 мг) получают 25 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=436 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,82 (д, 1H); 7,72 (с, 1H); 7,71 (д, 1H); 7,49 (тд, 1H); 7,45 (тд, 1H); 7,22-7,31 (м, 3H); 7,16 (д, 1H); 7,15 (д, 2H); 6,45 (кв, 1H); 3,36 (уш.д, 1H); 3,17 (уш.т, 1H); 2,82 (уш.д, 1H); 2,8 (д, 1H); 2,57 (д, 1H); 2,39 (уш.д, 1H); 2,03 (тд, 1H); 1,76 (с, 3H); 1,59 (уш.т, 1H); 1,43 (д, 3H); 1,4 (уш.д, 1H); 1,31 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают примеры 107, 108.
Пример 107
N-[1-(3-Хлор-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил]-N-метилацетамид (син-изомер 1, цепной энантиомер 2)
Исходя из примера 105 (24 мг) получают 22 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=449 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,93 (д, 1H); 7,78 (с, 1H); 7,77 (д, 1H); 7,55 (тд, 1H); 7,5 (тд, 1H); 7,34-7,22 (м, 3H); 7,15 (д, 1H); 7,14 (д, 2H); 6,52 (кв, 1H); 3,25 (уш.м, 1H); 3,0 (уш.м, 1H); 2,74 (уш.д, 1H); 2,8 (д, 1H); 2,67 (д, 1H); 2,61 (уш.с, 3H); 2,4 (дм, 1H); 2,2 (тд, 1H); 1,79 (с, 3H); 1,81 (тм, 2H); 1,4 (уш.м, 3H); 1,36 (д, 3H).
[α]D=+114,4 (с=0,86, CHCl3)
Пример 108
N-[1-(3-Хлор-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил]-N-метилацетамид (син-изомер 2, цепной энантиомер 2)
Исходя из примера 106 (24 мг) получают 20 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=449 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,89 (д, 1H); 7,78 (с, 1H); 7,76 (д, 1H); 7,55 (тд, 1H); 7,5 (тд, 1H); 7,34-7,22 (м, 3H); 7,17 (д, 1H); 7,16 (д, 2H); 6,52 (кв, 1H); 3,15 (уш.м, 1H); 2,74 (уш.д, 2H); 2,8 (д, 1H); 2,67 (д, 1H); 2,51 (уш.с, 3H); 2,4 (дм, 1H); 2,2 (тд, 1H); 1,78 (с, 3H); 1,81 (тм, 2H); 1,37 (д,3H); 1,35 (уш.м, 3H).
[α]D=+102,3 (с=0,86, CHCl3)
Пример 109
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-2-метил-4-пиперидинил]-N-метилацетамид (син-изомер 1, цепной энантиомер 1)
Промежуточное соединение 103 растворяют в сухом ДМФА (2 мл) и, в атмосфере азота и при 0°С, добавляют 60% дисперсию NaH в минеральном масле (20 мг). Смеси дают возможность нагреться до комнатной температуры и перемешивают в этих условиях в течение 20 мин. Затем добавляют метилиодид (0,064 мл) и раствор перемешивают в течение ночи при комнатной температуре. Добавляют воду и AcOEt; органическую фазу отделяют, сушат и упаривают в вакууме, получая промежуточное соединение без какой-либо дополнительной очистки [ТСХ CH:AcOEt=7:3, Rf=0,29]. TFA (0,5 мл) добавляют к раствору этого промежуточного соединения (103 мг) в безводном DCM (2 мл) при 0°С в атмосфере азота. Смесь перемешивают 1 час, затем добавляют 2М водный NaOH до щелочного рН и полученный раствор фильтруют через картридж фазового разделения с фриттой из полипропилена и концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 100% DCM до DCM:MeOH=7:3, получая указанное в заголовке соединение (56 мг) в виде белой пены.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,81 (д, 1H); 7,74 (с, 1H); 7,73 (д, 1H); 7,5 (тд, 1H); 7,43 (тд, 1H); 7,28 (д, 1H); 7,22 (дд, 2H); 6,82 (тд, 2H); 6,45 (кв, 1H); 3,33 (м, 1H); 3,25 (уш.д, 1H); 2,76 (д, 1H); 2,7 (уш.т, 1H); 2,63 (д, 1H); 2,48 (уш.д, 1H); 1,97 (уш.д, 1H); 1,92 (с, 3H); 1,87 (уш.т, 1H); 1,63 (уш.т, 1H); 1,38 (д, 3H); 1,33 (д, 3H).
Следуя той же самой методике, описанной для получения примера 109, получают примеры 110, 111, 112.
Пример 110
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-2-метил-4-пиперидинил]-N-метилацетамид (син-изомер 2, цепной энантиомер 1)
Исходя из промежуточного соединения 104 (65 мг) получают 24 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,79 (д, 1H); 7,74 (с, 1H); 7,73 (д, 1H); 7,5 (тд, 1H); 7,43 (тд, 1H); 7,28 (д, 1H); 7,24 (дд, 2H); 6,84 (тд, 2H); 6,45 (кв, 1H); 3,38 (м, 1H); 3,34 (уш.д, 1H); 3,16 (уш.т, 1H); 2,78 (д, 1H); 2,74 (уш.д, 1H); 2,6 (д, 1H); 2,43 (уш.д, 1H); 1,96 (уш.т, 1H); 1,88 (с, 3H); 1,54 (уш.т, 1H); 1,4 (д, 3H); 1,34 (д, 3H).
Пример 111
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-2-метил-4-пиперидинил]-N-метилацетамид (син-изомер 1, цепной энантиомер 2)
Исходя из промежуточного соединения 105 (100 мг) получают 59 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,81 (д, 1H); 7,75 (с, 1H); 7,73 (д, 1H); 7,5 (тд, 1H); 7,43 (тд, 1H); 7,28 (д, 1H); 7,24 (дд, 2H); 6,82 (тд, 2H); 6,45 (кв, 1H); 3,25 (м, 1H); 3,25 (уш.д, 1H); 2,77 (д, 1H); 2,64 (уш.т, 1H); 2,63 (д, 1H); 2,44 (уш.д, 1H); 1,92 (с, 3H); 1,81 (тд, 1H); 1,56 (уш.т, 1H); 1,32 (д, 3H); 1,32 (д, 3H); 1,28 (уш.т, 1H).
Пример 112
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-2-метил-4-пиперидинил]-N-метилацетамид (син-изомер 2, цепной энантиомер 2)
Исходя из промежуточного соединения 106 (87 мг) получают 50 мг указанного в заголовке соединения в виде белой пены.
МС (ES/+): m/z=453 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,8 (д, 1H); 7,74 (с, 1H); 7,73 (д, 1H); 7,5 (тд, 1H); 7,43 (тд, 1H); 7,28 (д, 1H); 7,22 (дд, 2H); 6,83 (тд, 2H); 6,45 (кв, 1H); 3,33 (м, 1H); 3,25 (уш.д, 1H); 2,79 (д, 1H); 2,7 (уш.т, 1H); 2,59 (д, 1H); 2,39 (уш.д, 1H); 1,9 (уш.д, 2H); 1,88 (с, 3H); 1,42 (уш.т, 1H); 1,34 (д, 3H); 1,32 (д, 3H).
Следуя той же самой методике, описанной для получения примера 2, получают примеры 113, 114, 115.
Пример 113
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 1, цепной энантиомер 1)
Исходя из примера 109 (43 мг) получают 44 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=467 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,87 (д, 1H); 7,77 (с, 1H); 7,76 (д, 1H); 7,53 (тд, 1H); 7,47 (тд, 1H); 7,3 (д, 1H); 7,22 (дд, 2H); 6,8 (тд, 2H); 6,49 (кв, 1H); 3,24 (уш.д, 1H); 2,77 (д, 1H); 2,68 (уш.д, 1H); 2,64 (д, 1H); 2,61 (уш.м, 1H); 2,6 (уш.м, 2H); 2,6 (уш.с, 3H); 2,41 (уш.д, 1H); 1,87 (с, 3H); 1,84 (уш.м, 1H); 1,57 (уш.м, 1H); 1,37 (д, 3H); 1,37 (д, 3H).
[α]D=-140,4 (с=0,955, CHCl3)
Пример 114
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 2, цепной энантиомер 1)
Исходя из примера 110 (19 мг) получают 19 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=467 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,82 (д, 1H); 7,76 (с, 1H); 7,75 (д, 1H); 7,52 (тд, 1H); 7,46 (тд, 1H); 7,3 (д, 1H); 7,24 (дд, 2H); 6,83 (тд, 2H); 6,47 (кв, 1H); 3,15 (уш.д, 1H); 2,81 (уш.м, 1H); 2,79 (д, 1H); 2,69 (уш.т, 1H); 2,61 (д, 1H); 2,57 (уш.д, 2H); 2,55 (уш.с, 3H); 2,41 (уш.д, 1H); 1,86 (с, 3H); 1,84 (уш.м, 1H); 1,62 (уш.м, 1H); 1,38 (д, 3H); 1,38 (д, 3H).
[α]D=-91,4 (с=0,507, CHCl3)
Пример 115
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 1, цепной энантиомер 2)
Исходя из примера 111 (47 мг) получают 47 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=467 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,84 (д, 1H); 7,75 (с, 1H); 7,74 (д, 1H); 7,5 (тд, 1H); 7,44 (тд, 1H); 7,28 (д, 1H); 7,2 (дд, 2H); 6,79 (тд, 2H); 6,46 (кв, 1H); 3,15 (уш.д, 1H); 2,76 (д, 1H); 2,65 (уш.д, 1H); 2,61 (д, 1H); 2,59 (уш.м, 1H); 2,52 (с, 3H); 2,36 (уш.д, 1H); 2,12 (уш.м, 1H); 1,86 (с, 3H); 1,84 (уш.м, 1H); 1,6 (уш.м, 1H); 1,34 (д, 3H); 1,34 (д, 3H).
[α]D=+134,6 (с=0,935, CHCl3)
Пример 116
N-[1-(3-Хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид
(син-изомер 2, цепной энантиомер 2)
Исходя из примера 112 (38 мг) получают 39 мг указанного в заголовке соединения в виде белого твердого вещества.
МС (ES/+): m/z=467 [M+H]+.
ЯМР (CDCl3): δ (м.д.) 7,81 (д, 1H); 7,75 (с, 1H); 7,73 (д, 1H); 7,5 (тд, 1H); 7,44 (тд, 1H); 7,28 (д, 1H); 7,24 (дд, 2H); 6,82 (тд, 2H); 6,46 (кв, 1H); 3 (уш.д, 1H); 2,79 (д, 1H); 2,63 (уш.м, 1H); 2,59 (д, 1H); 2,57 (уш.т, 1H); 2,42 (с, 3H); 2,37 (уш.д, 2H); 2,07 (уш.т, 1H); 1,86 (с, 3H); 1,6 (уш.т, 1H); 1,34 (д, 3H); 1,25 (д, 3H).
[α]D=+91,2 (с=1,135, CHCl3)
Фармацевтические примеры
А. Капсулы/Таблетки
Активный компонент смешивают с другими наполнителями. Смесь может быть использована для наполнения желатиновых капсул или может быть подвергнута прессованию с получением таблеток, используя соответствующие пуансоны. Таблетки могут быть с покрытием, используя обычные способы и известные покрытия.
В. Таблетки
Активный компонент смешивают с микрокристаллической целлюлозой и натрий-кроскармелозой. К этой предварительно полученной смеси затем добавляют стеарат магния. Полученная таким образом смесь может быть подвергнута прессованию, используя соответствующие пуансоны, и таблетки могут быть с покрытием, используя обычные способы и покрытия.
C. Вливание
до 100 мл
Состав может быть упакован в стеклянную ампулу или пластиковый мешок.
Биологические данные
Сродство соединения по данному изобретению по отношению к рецептору NK1 определяли, используя метод определения сродства по реакции конкурентного связывания с рецептором NK1, измеряя in vitro способность соединений вытеснять [3H]-вещество Р (SP) c рекомбинантных человеческих рецепторов NK1, экспрессируемых в клеточных мембранах яичника китайского хомячка (CHO). Значения сродства выражают как отрицательный логарифм константы ингибирования (Ki) лигандов-вытеснителей (pKi).
Значения pKi, полученные как среднее, по крайней мере, двух определений для типичных соединений по данному изобретению, находятся в диапазоне от 9,82 до 6,52.
Сродство соединения по изобретению по отношению к переносчику серотонина определяли, используя метод определения сродства по реакции конкурентного связывания с hSERT и измеряя in vitro способность соединений вытеснять [3H]-циталопрам с рекомбинатного человеческого транспортера серотонина, экспрессируемого в мембранах клеток LLCPK эпителия почки свиньи. Значения сродства выражают как отрицательный логарифм константы ингибирования (Ki) лигандов-вытеснителей (pKi).
Значения pKi, полученные как среднее, по крайней мере, двух определений для типичных соединений по данному изобретению, находятся в диапазоне от 9,71 до 6,54.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЛЛОСТЕРИЧЕСКИЕ МОДУЛЯТОРЫ МЕТАБОТРОПНЫХ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ | 2004 |
|
RU2360902C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2005 |
|
RU2409582C2 |
| ПРОИЗВОДНЫЕ АРИЛОКСИАЛКИЛКАРБАМАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2005 |
|
RU2392269C2 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЙ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2290179C2 |
| (3-ЦИКЛОАЛКИЛ-2,3,4,5-ТЕТРАГИДРО-1Н-БЕНЗО[d]АЗЕПИН-7-ИЛОКСИ)ПРОИЗВОДНЫЕ, ИХ ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ Н3 РЕЦЕПТОРОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ | 2003 |
|
RU2388752C2 |
| НОВЫЕ СОЕДИНЕНИЯ - АНТАГОНИСТЫ РЕЦЕПТОРА НЕЙРОКИНИНА 1 | 2013 |
|
RU2631319C2 |
| ПЕПТИДНЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2281955C2 |
| СОЕДИНЕНИЯ БЕНЗОЛСУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2017 |
|
RU2769827C2 |
| ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛПИПЕРИДИНКАРБОКСИЛАТОВ, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА FAAH | 2005 |
|
RU2376305C2 |
| АГОНИСТЫ РЕЦЕПТОРА GLP-1 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2740135C1 |
Изобретение относится к новым соединениям формулы (I)
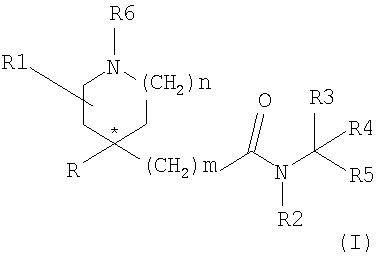
где R представляет радикал, выбранный из
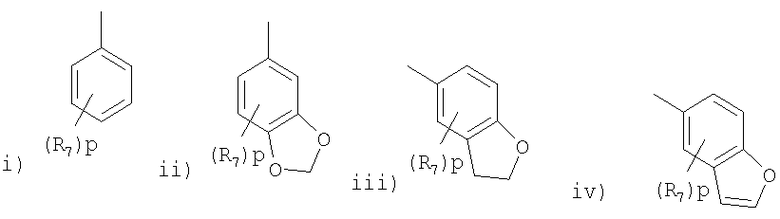
в которых R7 представляет галоген, циано, С1-4алкил, С1-4алкокси; р представляет целое число от 0 до 3; R1 представляет водород, С2-4алкенил или С1-4алкил; R2 представляет водород или С1-4алкил; R3 и R4 независимо представляют водород или С1-4алкил; R5 представляет: фенил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано или галогена; нафтил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано или галогена; бензофуран, замещенный 1-3 группами, независимо выбранными из С1-4алкила или галогена, R6 представляет водород или (CH2)qR8; R8 представляет водород; m равно нулю или 1; n равно 1; q равно целому числу от 1 до 4; r равно 1 или 2; при условии, что когда R5 представляет фенил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано или галогена, R не является радикалом i)
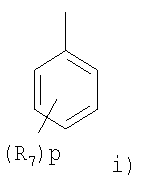
или к их фармацевтически приемлемым солям или сольватов.
Изобретение также относится к способу (А) получения соединений, к применению соединений, к фармацевтической композиции, а также к способу лечения млекопитающего. Технический результат - получение новых биологически активных соединений, обладающих активностью антагониста рецептора тахикинина. 7 н. и 9 з.п. формулы.
1. Соединение формулы (I)

где R представляет радикал, выбранный из

в которых R7 представляет галоген, циано, С1-4алкил, С1-4алкокси;
р представляет целое число от 0 до 3;
R1 представляет водород, С2-4алкенил или С1-4алкил;
R2 представляет водород или С1-4алкил;
R3 и R4 независимо представляют водород или С1-4алкил;
R5 представляет:
фенил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано или галогена;
нафтил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано или галогена;
бензофуран, замещенный 1-3 группами, независимо выбранными из C1-4алкила или галогена,
R6 представляет водород или (CH2)qR8;
R8 представляет водород;
m равно нулю или 1;
n равно 1;
q равно целому числу от 1 до 4;
r равно 1 или 2;
при условии, что, когда R5 представляет фенил, замещенный 1-3 группами, независимо выбранными из трифторметила, С1-4алкила, циано или галогена, R не является радикалом i)

или его фармацевтически приемлемые соли или сольваты.
2. Соединение по п.1, где m равно 1.
3. Соединение по любому из пп.1 и 2, где R2, R3 и R4 представляют независимо водород или метил.
4. Соединение по любому из пп.1 и 2, где R5 представляет фенил, замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила, нафтил, замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила, бензофуранил, замещенный одной или двумя группами, выбранными из фтора, брома, хлора, циано или метила.
5. Соединение по любому из пп.1 и 2, где R представляет фенил, в котором R7 представляет галоген (например фтор или хлор), циано, С1-4алкилокси (например метокси) или С1-4алкил (например метил) и в пределах этого класса р равно 0 или целому числу от 1 до 2, или R представляет группу, выбранную из
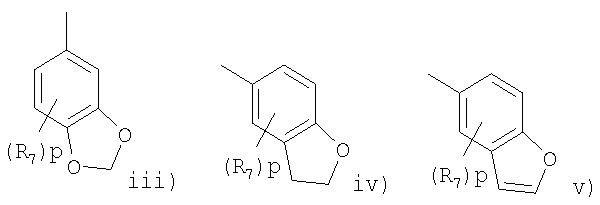
где р равно 0.
6. Соединение по любому из пп.1 и 2, где n и m равны 1, R2 представляет водород или метил, R3 представляет водород, R4 представляет водород или метил, R5 представляет фенил, замещенный одной или двумя группами, выбранными из фтора, брома или хлора, цианогруппы или метила, 1-нафтил, замещенный одной или двумя группами, выбранными из фтора, брома или хлора, цианогруппы или метила, или R5 представляет бензофуран-7-ил, замещенный фтором, бромом или хлором, циано или метилом, R6 представляет водород или метил, R1 представляет водород, этенил, фтор или метил в 1- или 2-положении пиперидинового кольца и R представляет фенил, в котором R7 представляет фтор, метокси, циано или метил и р равно 0 или целому числу от 1 до 2, или R представляет группу, выбранную из
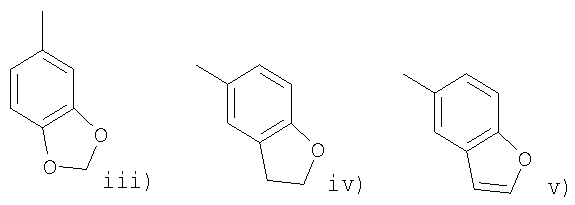
где р равно 0.
7. Соединение по п.1, выбранное из
N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-N-метил-2-(1-метил-4-фенил-4-пиперидинил)ацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-N-метил-2-(1-метил-4-фенил-4-пиперидинил)ацетамид (энантиомер 2);
2-[4-(1-бензофуран-5-ил)-1-метил-4-пиперидинил]-N-[1-(3-хлор-1-нафталинил)этил]-N-метилацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-N-метил-2-{1-метил-4-[4-(метилокси)фенил]-4-пиперидинил}ацетамид (энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1,2-диметил-4-пиперидинил]-N-метилацетамид (син-изомер 2, цепной энантиомер 1);
N-[1-(3-хлор-1-нафталинил)этил]-2-(1,2-диметил-4-фенил-4-пиперидинил)-N-метилацетамид (син-изомер 2, цепной энантиомер 1);
или его фармацевтически приемлемые соли или сольваты.
8. N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид или его фармацевтически приемлемая соль.
9. N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид по п.8 в форме его гидрохлорида.
10. N-[1-(3-хлор-1-нафталинил)этил]-2-[4-(4-фторфенил)-1-метил-4-пиперидинил]-N-метилацетамид по п.8 или 9 в форме энантиомера.
11. Способ (А) получения соединения по п.1, который включает взаимодействие активированного производного карбоновой кислоты формулы (II), где R6 представляет азот-защитную группу или (CH2)qR8, с амином (III)
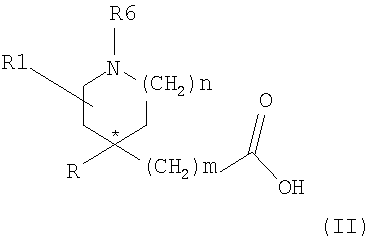
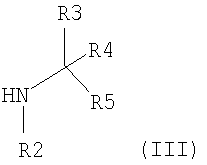
где R3, R4 и R5 определены в п.1, R2 представляет водород, С1-4алкил или азот-защитную группу, с последующим, если это необходимо, удалением любой азот-защитной группы.
12. Соединение по любому из пп.1-10, предназначенное для лечения нарушений ЦНС.
13. Применение соединения по любому из пп.1-10 для получения лекарственного средства для использования для лечения состояний, опосредованных тахикининами (включая вещество Р и другие нейрокинины) и/или селективным ингибированием белка-транспортера обратного захвата серотонина.
14. Применение соединения по любому из пп.1-10 для лечения состояний, опосредованных тахикининами (включая вещество Р и другие нейрокинины) и/или селективным ингибированием белка-транспортера обратного захвата серотонина.
15. Фармацевтическая композиция, обладающая активностью антагониста рецептора тахикинина, содержащая соединение по любому из пп.1-10 в смеси с одним или несколькими фармацевтически приемлемыми носителями или наполнителями.
16. Способ лечения млекопитающего, включая человека, в частности, для лечения состояний, опосредованных тахикининами, включая вещество Р и другие нейрокинины, и/или селективным ингибированием белка-транспортера обратного захвата серотонина, включающий введение эффективного количества соединения формулы (I) по любому из пп.1-10.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| US 3097209 А, 09.07.1963 | |||
| DE 19603767 А, 07.08.1997 | |||
| RU 99121844 А, 20.07.2001. | |||
Авторы
Даты
2010-06-20—Публикация
2004-05-07—Подача