Область техники, к которой относится изобретение
Настоящее изобретение относится к способу множественной молекулярной амплификации, способной к связыванию интересующих нуклеотидных последовательностей с помощью амплификации, в частности с помощью полимеразной цепной реакции (множественная PCR). Способ является особенно эффективным для создания библиотек родственных пар, а также комбинаторных библиотек последовательностей, кодирующих вариабельные области иммуноглобулинов, Т-клеточных рецепторов или В-клеточных рецепторов.
Уровень техники
Антигенсвязывающие белки, участвующие в иммунной реакции, присутствуют в организме млекопитающих в виде большого поликлонального набора, представляющего собой широкое разнообразие специфичностей связывания. Подобное разнообразие создается реаранжировкой генных последовательностей, кодирующих вариабельные области указанных связывающих белков. Такие связывающие белки, имеющие вариабельные области, включают растворимые и мембраносвязанные формы В-клеточного рецептора (известные также как иммуноглобулины или антитела) и мембраносвязанные Т-клеточные рецепторы (TcR). Что касается иммуноглобулинов, то их сродство усиливается после распознавания антигена рецептором антигена В-клеток вследствие процесса, именуемого “созреванием аффинности”, в который вовлечены циклы соматической сверхмутации этих генов вариабельных областей.
Кроме того, иммуноглобулины или их фрагменты, такие как Fab-фрагменты, Fv-фрагменты и одноцепочечные Fv-фрагменты (scFv), являются предметом клонирования и рекомбинантной экспрессии. Однако все другие связывающие белки, имеющие вариабельные области, в принципе могут быть клонированы и экспрессированы так же, как и антитела.
Известные методы выделения антител с требуемой специфичностью связывания чаще всего включают получение гибридом у иммунизированных хозяев с последующим скринингом специфических клонов или создание комбинаторных библиотек экспрессируемых последовательностей в E.coli, состоящих из вариабельных доменов иммуноглобулинов, которые затем обогащают при помощи таких методов, как, например, фаговый дисплей.
Главным ограничением, связанным с применением технологии гибридом для получения терапевтических антител, является отсутствие лимфомы человека, которая может использоваться в качестве сливающихся клеток для В-лимфоцитов человека. Гетерогибридомы (то есть В-клетки человека, слитые с лимфомами мыши) яляются, как известно, неустойчивыми и, таким образом, редко позволяют получить приемлемые линии клеток для целей продукции антител. В-клетки человека, иммортализованные в результате инфицирования вирусом Эпштейна - Барра, характеризуются такими же признаками неустойчивости. Отсутствие надежных клеточных методов получения антител человека для лечебных целей может быть компенсировано последними достижениями в области молекулярной биологии.
Применение комбинаторных библиотек и фагового дисплея позволяет создать большой спектр клонов антител с потенциальным разнообразием, превышающим 1010. Из вышеуказанного спектра можно выбрать тип связывания со специфической мишенью, создав таким образом подбиблиотеку. Такую подбиблиотеку можно использовать для создания поликлональных или моноклональных антител. Последовательности, кодирующие вариабельные области (например, последовательности, кодирующие вариабельную область тяжелой цепи и вариабельную область легкой цепи иммуноглобулина), которые образуют библиотеку, можно амплифицировать из лимфоцитов, плазматических клеток, гибридом или любой другой популяции клеток, экспрессирующей иммуноглобулин. Современные методы создания комбинаторных библиотек предусматривают раздельное выделение из популяции клеток последовательностей, кодирующих вариабельные области. Таким образом утрачивается первоначальное спаривание последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи иммуноглобулина. В комбинаторной библиотеке указанные последовательности спариваются произвольно, и первоначальные комбинации указанных вариабельных последовательностей образуются лишь случайно. Поэтому для выделения последовательностей, кодирующих вариабельные области, которые отвечают за требуемую специфичность связывания, необходимо произвести многостадийный скрининг. Такой скрининг обычно выполняют в сочетании с методами обогащения клонов, обладающих требуемой специфичностью, такими как фаговый или рибосомный дисплей. Даже после того как разнообразие достигнуто, оно может быть недостаточным для выделения пар последовательностей, кодирующих вариабельные области, с целью получения связывающих белков, обладающих таким же высоким сродством, которое может быть обнаружено в исходных клетках. Кроме того, методы обогащения, обычно применяемые для скрининга комбинаторных библиотек, вносят значительную стандартную ошибку, например, в случае полипептидов с особенно низкой токсичностью в E.coli, которая влияет на эффективность укладки цепи, замедляется скорость выделения или ухудшаются другие параметры, находящиеся в зависимости от системы, что еще больше уменьшает разнообразие библиотеки. Помимо этого клоны, полученные из таких комбинаторных библиотек, чаще продуцируют связывающие белки с перекрестной реактивностью против аутоантигенов, так как указанные пары белков, в отличие от первоначальных пар (далее именуемых родственными парами), не подвергаются происходящей in vivo отрицательной селекции на аутоантигены, как это имеет место в случае рецепторов В- и Т-лимфоцитов на определенных стадиях их развития. Поэтому желательно клонировать первоначальные пары последовательностей, кодирующих вариабельные области. Кроме того, ожидается, что частота встречаемости клонов, обладающих требуемой специфичностью связывания, будет значительно выше в библиотеке родственных пар, чем в обычной комбинаторной библиотеке, особенно если клетки исходного материала взяты от донора с высокой частотой встречаемости клеток, кодирующих пары со специфическим связыванием, то есть у иммунокомпетентных или иммунизированных доноров. Из вышеизложенного следует, что библиотека родственных пар необязательно должна быть такой же большой, как комбинаторная библиотека: библиотека родственных пар, содержащая 104-105 клонов или даже 102-103 клонов, полученных от донора с соответствующей иммунной реакцией, может быть вполне достаточной для получения связывающих белков, представляющих собой широкое разнообразие требуемых специфичностей связывания.
Для создания библиотек родственных пар необходимо связать последовательности, кодирующие вариабельные области, которые были выделены из одной клетки. В настоящее время описаны два разных подхода, обеспечивающих родственное спаривание последовательностей, кодирующих вариабельные области.
Внутриклеточная PCR представляет собой подход, при котором обеспечивают проницаемость фиксированной популяции клеток и осуществляют внутриклеточное связывание последовательностей иммуноглобулинов, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи. Указанное связывание можно осуществить методом RT-PCR с перекрыванием цепи (WO 93/03151) или путем рекомбинантного метода (Chapal, N. et al. 1997, Bio Techniques 23, 518-524). Процесс амплификации, описанный в указанных публикациях, является трех- или четырехстадийным процессом, предусматривающим i) обратную транскрипцию с использованием праймеров для константной области, образующих кДНК иммуноглобулина, ii) амплификацию методом PCR последовательностей, кодирующих вариабельные области тяжелой и легкой цепи, с использованием наборов праймеров, с сайтами перекрывания или рекомбинации, iii) связывание путем рекомбинации, если выбран данный метод, iv) осуществление гнездовой PCR продуктов, образующих сайты рестрикции для клонирования. Так как клетки являются проницаемыми, существует значительный риск выхода продуктов амплификации из клеток, в результате чего может произойти перестановка последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи, что ведет к утрате родственного спаривания. Поэтому такой метод предусматривает стадии промывки после каждой реакции, что делает процесс трудоемким и уменьшает эффективность реакций.
Как правило, внутриклеточная PCR является неэффективной и приводит к низкой чувствительности. Поэтому метод связывания при помощи внутриклеточной PCR не нашел широкого распространения, причем первоначальное исследование невозможно было повторить с получением надежных результатов, подтверждающих, что внутри клетки действительно происходит связывание. Между тем при этом методе необходимо избегать перестановки последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи, в результате которой происходит разрушение родственных пар.
Другой внутриклеточный метод описан в WO 01/92291. Указанный метод основан на транссплайсинге РНК и при нем достигается соединение VН- и VL-кодирующей мРНК внутри клетки. Указанный подход требует наличия конструкции ДНК, осуществляющей транссплайсинг внутри клеток.
Одноклеточная PCR представляет собой другой метод родственного спаривания последовательностей, кодирующих варибельную область тяжелой цепи и вариабельную область легкой цепи (см., например, публикации Coronella, J.A. et al. 2000, Nucleic Acids Res. 28, E85; Wang, X., et al. 2000, J. Immunol. Methods 20, 217-225). В указанных публикациях описан метод, в соответствии с которым популяцию иммуноглобулин-экспрессирующих клеток распределяют по пробиркам, разводя до плотности, соответствующей одной клетке в одной реакционной смеси, в результате чего в процессе клонирования устраняется перестановка последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи. Описанный метод состоит из трех-четырех стадий, включающих i) обратную транскрипцию с использованием олиго-dT-праймеров, произвольных гексамерных праймеров или праймеров для константной области, образующих кДНК, ii) фракционирование продукта кДНК в нескольких пробирках и амплификацию при помощи PCR отдельных последовательностей, кодирующих вариабельные области цепей (в отдельных пробирках), с использованием наборов праймеров, содержащих сайты рестрикции для клонирования, iii) осуществление гнездовой PCR продуктов, образующих сайты рестрикции для клонирования (необязательно), и iv) связывание последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи, из отдельных пробирок путем клонирования их в соответствующем векторе, что само по себе является многостадийным процессом.
У человека присутствуют легкие цепи двух типов: лямбда (λ) и каппа (κ). Из этого следует, что для кДНК, полученной из каждой отдельной клетки, необходимо выполнить по крайней мере три отдельные реакции PCR с последующим анализом и клонированием соответствущих фрагментов в единичном векторе для достижения родственного спаривания. Таким образом, вышеописанный метод одноклеточной РCR требует большого числа манипуляций для создания библиотеки родственных пар. Хотя библиотека родственных пар не обязательно должна быть такой же большой, как комбинаторная библиотека, для получения связывающих белков, представляющих собой широкое разнообразие специфичностей связывания, создание библиотеки, содержащей, например, 104-105 клонов, вышеописанным методом одноклеточной PCR по-прежнему остается трудоемкой задачей. Кроме того, большое число манипуляций значительно увеличивает риск загрязнения и ошибки, вызванной человеческим фактором.
Для получения связывающих белков с высоким сродством, соответствующим сродству, обычно наблюдаемому при возникновении иммунной реакции, весьма перспективным является родственное спаривание последовательностей, кодирующих вариабельные области, в сочетании с их амплификацией. Для создания библиотеки с большим разнообразием клонов необходимо разработать высокоэффективный метод клонирования, отличающийся минимальным риском загрязнения и перестановки последовательностей.
Кроме того, желательно сократить число стадий клонирования для достижения высокоэффективного создания комбинаторных библиотек.
Сущность усовершенствования
Настоящее изобретение относится к эффективному способу связывания двух или нескольких интересующих нуклеотидных последовательностей, то есть последовательностей, кодирующих вариабельные области, применяя множественную молекулярную амплификацию, такую как множественная RT-PCR с удлинением цепи путем перекрывания или множественная RT-PCR с последующим связыванием путем лигирования или рекомбинации. Этот способ может быть выполнен в формате одной клетки, что делает возможным высокоэффективное клонирование родственных пар.
Краткое описание чертежей
На фиг.1 схематически изображены разные типы концевых сегментов удлинения цепи путем перекрывания. Жирные линии соответствуют геноспецифической части праймера, а обычные линии соответствуют перекрывающему концевому сегменту. Вертикальные линии иллюстрируют комплементарные области. Праймеры облегчают связывание двух интересующих нуклеотидных последовательностей. На фиг.1 (I) показаны два варианта концевых сегментов удлинения цепи путем перекрывания типа I, где полностью или частично перекрываются только удлиняющие сегменты; на фиг.1 (II) показаны концевые сегменты удлинения цепи путем перекрывания типа II, где некоторые 5'-концевые нуклеотиды удлиняющего сегмента первого праймера комплементарны геноспецифической части соседнего праймера; на фиг.1 (III) показаны концевые сегменты удлинения цепи путем перекрывания типа III, где все удлиняющие сегменты являются комплементарными геноспецифической области соседнего праймера.
На фиг.2 схематически изображена смесь множественных праймеров для удлинения цепи путем перекрывания, используемая для связывания последовательностей, кодирующих вариабельные области иммуноглобулина. Подлежащие связыванию кДНК, кодирующие легкую цепь (LC) и вариабельную область тяжелой цепи (VH), изображены в виде трубок с обозначением 5'- и 3'-концов смысловых цепей, а также предполагаемого размера амплифицированного продукта. Множественные наборы праймеров для удлинения цепи путем перекрывания, используемые для амплификации кодирующей последовательностей, показаны стрелками. Изогнутые стрелки с пунктирными краями, направленные в сторону 5'-концов, показывают клонирующие концевые сегменты. Концевые сегменты удлинения цепи путем перекрывания изображены жирными линиями. Сайты рекстрикции, присутствующие в концевых сегментах, указаны рядом с концевым сегментом. Общее число праймеров в смеси множественных праймеров для удлинения цепи путем перекрывания равно шестнадцати и разделено на внешние праймеры, включающие один праймер для Ск и один праймер для СН1, и праймеры для удлинения цепи путем перекрывания, включающие шесть праймеров для VL и восемь праймеров для VН. Праймер для СН1 гибридизируется с 5'-концом константного домена 1 тяжелой цепи. Предполагается, что продукт, образующийся в результате множественной RT-PCR с удлинением цепи путем перекрывания, равен примерно 1070 п.о. и содержит всю легкую каппа-цепь, состоящую из константной области, J-гена и V-гена (Ск + JL + VL), и вариабельную область тяжелой цепи, состоящую из V-гена, D-сегмента и J-гена (VH + D + JH). 5'- и 3'-концы обозначают направление открытой рамки считывания. Только небольшая часть последовательности, кодирующей СН1-область, амплифицирована множественной смесью праймеров для удлинения цепи путем перекрывания, так как положение гибридизации праймера для СН1 находится рядом с J-областью тяжелой цепи.
На фиг.3 изображено несколько схем, показывающих разные направления связывания получаемых продуктов в зависимости от того, какие праймеры имеют концевой связывающий сегмент. Черным цветом показана область перекрывания. 5'- и 3'-концы обозначают направление открытой рамки считывания. На фиг.3А изображена схема, иллюстрирующая ориентацию продуктов “головной сегмент - головной сегмент”. На фиг.3В изображена схема, иллюстрирующая ориентацию продуктов “концевой сегмент - концевой сегмент”. На фиг.3С изображена схема, иллюстрирующая ориентацию “головной сегмент - концевой сегмент”, где первой является последовательность, кодирующая легкую цепь. На фиг.3D изображена схема, иллюстрирующая ориентацию “головной сегмент - концевой сегмент”, где первой является последовательность, кодирующая тяжелую цепь.
На фиг.4 схематически изображен вектор экспрессии иммуноглобулина pLL113, где кодирующие последовательности находятся в ориентации “головной сегмент - концевой сегмент”. Показанный вектор включает нижеследующие элементы: bla = промотор, экспрессии гена устойчивости к ампициллину. Amp = ген, кодирующий устойчивость к ампициллину. pUC ori = точка начала репликации pUC. AdMLP = главный поздний промотор аденовируса. Human IgG1 = последовательность, кодирующая тяжелую цепь иммуноглобулина изотипа G1 человека. hGH pA = поли-А-сигнальная последовательность гормона роста человека. bGH polyA = поли-А-последовательность гормона роста крупного рогатого скота. LC каппа человека = последовательность, кодирующая легкую каппа-цепь иммуноглобулина человека. FRT = сайт-мишень узнавания Flp. Гигромицин = ген, кодирующий устойчивость к гигромицину. SV40 polyA = поли-А-сигнальная последовательность вакуолизирующего обезьяньего вируса.
На фиг.5А изображен гель после электрофореза, показывающий результаты двухстадийной множественной RT-PCR с удлинением цепи путем перекрывания с последующей полугнездовой РCR. Продукты амплификации получены из кДНК, выделенной из отдельных клеток яичника китайского хомячка (СНО) Flp-In pLL113. Полосы 1-12 обозначают образцы, а стрелки показывают правильные продукты множественной гнездовой RT-PCR с удлинением цепи путем перекрывания длиной 1076 п.о.; М1 обозначает лэддер длиной 100 п.о. W обозначает воду, использованную в качестве отрицательного контрольного образца. С обозначает положительный контрольный образец кДНК, выделенный из линии клеток НВ-8501. Отдельно представлено менее контрастное изобретение тех же самых полос W, C и лэддера длиной 100 п.о. для выделения отдельных фрагментов ДНК. На фиг.5В дано схематическое изображение геля, показанного на фиг.5А, которое иллюстрирует соответствущие фрагменты геля.
На фиг.6 показано несколько фотографий и дано графическое изображение гелей после электрофореза, на которых представлены результаты одностадийной множественной RT-PCR с удлинением цепи путем перекрывания без дополнительной амплификации методом РCR. Во всех блоках М1 обозначает лэддер длиной 100 п.о., а М2 обозначает лэддер длиной 500 п.о. На фиг.6А изображен гель после электрофореза с продуктами амплификации, выделенными из лизата, соответствующего 100, 10, 1 или 0 клеток. Стрелка показывает продукт удлинения цепи путем перекрывания. На фиг.6В дано схематическое изображение геля, показанного на фиг.6А. На фиг.6С показан гель после электрофореза, подтверждающий наличие продукта, полученного удлинением цепи путем перекрывания, в полосах, соответствующих 100 и 1 клетке, на фиг.6А. На фиг.6D изображен гель после электрофореза, на котором видно расщепление рестрикционными ферментами NheI и NcoI продукта, полученного удлинением цепи путем перекрывания, из полосы, соответствующей 1 клетке, на фиг.6С.
На фиг.7 изображен гель после электрофореза, на котором видны результаты одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и последующей амплификации методом полугнездовой PCR. М1 обозначает лэддер длиной 100 п.о., и М2 обозначает лэддер длиной 500 п.о. Указанные результаты получены при использовании смесей множественных праймеров для удлинения цепи путем перекрывания, содержащих праймер для СН1, СН2, СН3, СН4 или СН5 в качестве внешнего праймера при выполнении множественной RT-PCR с удлинением цепи путем перекрывания. Указанные реакции выполняли в клеточных лизатах, соответствующих 100, 10, 1 или 0 клеток. Размер продукта, полученного удлинением цепи путем перекрывания, показан стрелкой.
На фиг.8 изображен гель после электрофореза, на котором видны результаты одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и последующей амплификации методом полугнездовой PCR с использованием обогащенных В-лимфоцитов человека в качестве матрицы. М1 обозначает лэддер длиной 100 п.о. Полосы 5 и 6 соответствуют размеру продукта, полученного удлинением цепи путем перекрывания.
На фиг.9А схематически изображены экспрессирущие векторы млекопитающих (Em465/01P582/Em465/01P581), использованные для получения линий клеток, экспрессирующих лямбда-цепь IgG1, где кодирующие последовательности находятся в ориентации “головной сегмент - головной сегмент”. Указанные векторы включают нижеследующие элементы: Amp = ген, кодирующий устойчивость к ампициллину. pUC ori = точка начала репликации pUC. AdMLP = главный поздний промотор аденовируса. EFP = промотор фактора элонгации. Лидерная AP = лидерная последовательность щелочной фосфатазы. VH = последовательность, кодирующая вариабельную область тяжелой цепи. IgG1 HC = последовательность, кодирующая константную область тяжелой цепи иммуноглобулина изотипа G1. rBG polyA = поли-А-сигнальная последовательность бета-глобулина кролика. bGH polyA = поли-А-последовательность гормона роста крупного рогатого скота. Лидерная IgK = последовательность, кодирующая лидерную последовательность каппа-цепи мыши. IgL (1b или 1с) = последовательность, кодирующая легкую лямбда-цепь иммуноглобулина семейства 1b или 1с. FRT = сайт-мишень узнавания Flp. Гигромицин = ген, кодирующий устойчивость к гигромицину. SV40 polyA = поли-А-сигнальная последовательность вакуолизирующего обезьяньего вируса. На фигурах 9В и 9С показаны агарозные гели, окрашенные этидием бромида, содержащие продукты PCR, выделенные из линий клеток СНО Flp-In/Em464/01P581 и CHOFlp-In/Em464/01P582 соответственно. Полосы 1-4 соответствуют концентрациям матрицы общей РНК, равным 50 пг, 5 пг, 0,5 пг или 0 пг, которые были использованы для выполнения множественной RT-PCR с удлинением цепи путем перекрывания. М обозначает лэддер длиной 100 п.о. (New England Biolabs, New England, USA). Стрелки показывают продукт PCR с удлинением цепи путем перекрывания.
На фиг.10 изображена блок-схема, показывающая стадии создания библиотеки экспрессируемых родственных антител, из которой могут быть экспрессированы поликлональные или моноклональные антитела.
На фиг.11 схематически изображен вектор JSK301 E.coli, используемый для создания библиотеки векторов экспрессии Fab-фрагментов путем введения в вектор фрагментов удлинения цепи путем перекрывания, содержащих родственные последовательности, кодирующие вариабельные области, на указанных сайтах рестрикции NotI/XhoI. Указанный вектор содержит нижеследующие элементы: Amp и Amp pro = ген устойчивости к ампициллину и его промотор. pUC19 Ori = точка начала репликации. СН1 человека = последовательность, кодирующая домен 1 тяжелой цепи иммуноглобулина гамма 1 человека. Вставка = вставка неродственной последовательности, которую вырезают при введении фрагментов удлинения цепи путем перекрывания. tac P и lac Z = бактериальные промоторы, которые могут быть вырезаны на сайтах рестрикции NheI и AscI.
На фиг.12 изображена схема, иллюстрирующая создание библиотеки векторов экспрессии родственных Fab-фрагментов. Стадия 1 иллюстрирует вставку родственных пар последовательностей, кодирующих вариабельные области (VH1-VL1 - VHХ-VLХ), в вектор JSK301 E.coli путем гидролиза XhoI-NotI. Стадия II иллюстрирует вставку кластера бактериального промотора и лидерной последовательности (лидерная последовательность pelB и Р tac-промотор, стимулирующие экспрессию VHx, Р lac-промотор и лидерная последовательность pelB, стимулирующие экспрессию VLx) путем гидролиза AscI-NheI.
На фиг.13 показано связывание α-, β- и γ-субъединиц, образующих G-белок, при помощи одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и дополнительной амплификации при помощи PCR. На изображениях указаны размеры отдельных кодирующих областей, а также размер связанного продукта. Для конечного продукта указаны сайты рестрикции, введенные при помощи концевых сегментов праймера во время амплификации.
На фиг.14 показаны точечные диаграммы окрашивания при выполнении FACS-анализа (A) мононуклеарных клеток периферической крови (РВМС), выделенных из крови донора; (В) фракции немеченных CD19-отрицательных клеток, полученных методом магнитной сортировки клеток, и (С) фракции CD19+ клеток, полученных методом магнитной сортировки клеток. Для каждой фракции изображена диаграмма рассеяния, диаграмма CD19/CD38 и диаграмма CD38/CD45.
На фиг.15 показана фракция CD19+ клеток, изображенных на фиг.9С, которые предварительно хранили в жидком азоте, оттаивали и окрашивали антителом против CD19, CD38 и CD45. Изображены точечные диаграммы, соответствующие показанным на фиг.9С.
На фиг.16 показаны диаграммы совпадений, используемые для сортировки фракции СD19+ клеток. Диаграмма рассеяния и диаграмма флуоресценции на основе CD38 и CD45 были использованы для выделения высокопродуктивных CD38 клеток (CD38hi) и промежуточных CD45 клеток (CD45in).
На фиг.17 изображен гель после электрофореза, на котором видно успешное выполнение множественной RT-PCR с удлинением цепи путем перекрывания с использованием пробы крови, полученной от донора ТТ03 (ряд А, лунки 1-12 из восьми 96-луночных планшетов). Образцы наносили на агарозный гель в два ряда (А и В) по 48 образцов в каждом. Ожидаемый размер фрагмента удлинения цепи путем перекрывания составлял примерно 1070 п.о. Предполагаемые фрагменты удлинения цепи путем перекрывания отмечены стрелками.
На фиг.18 показан анализ ELISA периплазматических экстрактов с планшета G060. Планшет для ELISA сенсибилизировали антителом козы против каппа-цепи человека, при этом захваченные Fab-фрагменты были обнаружены при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.19 показан анализ ELISA периплазматических экстрактов с планшета G060. Планшет для ELISA сенсибилизировали 10 мкг/мл овальбумина (Sigma A-5503), при этом захваченные Fab-фрагменты были обнаружены при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.20 показан анализ ELISA периплазматических экстрактов с планшета G060. Планшет для ELISA сенсибилизировали столбнячным токсином, при этом захваченные Fab-фрагменты были обнаружены при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.21 показан одностадийный конкуретный анализ ELISA периплазматических экстрактов с планшета G060. Планшет на ELISA сенсибилизировали столбнячным токсином (ТТ) и в каждую лунку добавляли растворимый ТТ в количестве 10-7 М для конкурентного связывания Fab-фрагментов бактериальных супернатантов с иммобилизованным ТТ. Захваченные Fab-фрагменты обнаруживали при помощи HRP-конъюгированного антитела козы против Fab-фрагмента человека.
На фиг.22 показан сравнительный анализ белковых последовательностей вариабельной области тяжелой цепи, полученных из клонов, связывающих ТТ-антиген, с планшета G060. Степень гомологии последовательностей выражена разными оттенками; 100%, 80% и 60% гомология изображена соответственно черным, серым и светло-серым цветом. CDR1 находится в сравниваемых положениях 34-41. CDR2 находится в сравниваемых положениях 55-73. CDR3 находится в сравниваемых положениях 107-127. Незрелые терминирующие кодоны обозначены звездочкой. Результаты сравнительного анализа показаны на восьми отдельных фигурах (a-h), расположенных в два ряда слева направо, при этом фиг.22а-d находятся в верхнем ряду и фиг.22е-h находятся в нижнем ряду.
На фиг.23 показан сравнительный анализ белковых последовательностей вариабельной области легкой цепи, полученных из клонов, связывающих ТТ-антиген, с планшета G060. Степень гомологии последовательностей выражена разными оттенками; 100%, 80% и 60% гомология изображена соответственно черным, серым и светло-серым цветом. CDR1 находится в сравниваемых положениях 26-42. CDR2 находится в сравниваемых положениях 58-64. CDR3 находится в сравниваемых положениях 97-106. Незрелые терминирующие кодоны обозначены звездочкой. Результаты сравнительного анализа показаны на восьми отдельных фигурах (a-h), расположенных в два ряда слева направо, при этом фиг.23а-d находятся в верхнем ряду и фиг.23е-h находятся в нижнем ряду.
На фиг.24 показан конкурентный анализ ELISA, выполненный для определения кажущегося сродства отобранных клонов с планшета G060. Растворимый ТТ, разведенный в концентрациях от 100 нМ до 25 пМ (четырехкратные разведения), добавляли к Fab-фрагментам, вызывая конкурентное связывание Fab-фрагментом с иммобилизованным ТТ. Степени взаимодействия выражены в виде соотношения наблюдаемого связывания при данной концентрации растворимого ТТ со связыванием, обнаруженным без добавления растворимого ТТ к реакционным смесям.
На фиг.25 представлена двойная филогенетическая гистограмма, показывающая внутригенетическую и межгенетическую взаимосвязь между последовательностями вариабельного домена тяжелой и легкой цепи антитела. Филогенетические группы из трех VН- и VL-последовательностей спарены на гистограмме для обозначения действительного спаривания конкретных V-генов. А) Клоны, связывающие ТТ-антиген, полученные из комбинаторной библиотеки методом отображения на фаге. В) Клоны, связывающие ТТ-антиген, полученные из библиотеки родственных пар способом по настоящему изобретению.
Описание изобретения
Настоящее изобретение относится к способу амплификации и связывания двух или нескольких интересующих несмежных нуклеотидных последовательностей, который обеспечивает высокоэффективное клонирование таких последовательностей. Указанный результат достигается главным образом за счет уменьшения числа стадий, необходимых для амплификации и связывания клонируемых последовательностей.
Одним из объектов настоящего изобретения является способ связывания нескольких несмежных нуклеотидных последовательностей, который предусматривает множественную молекулярную амплификацию интересующих нуклеотидных последовательностей с использованием матрицы, полученной из выделенной отдельной клетки, популяции изогенных клеток или популяции генетически разных клеток, и последующее связывание амплифицированных последовательностей. Если в качестве матрицы использована выделенная отдельная клетка или популяция изогенных клеток, то в результате связывания образуется сегмент нуклеиновой кислоты, содержащий родственные связанные интересующие нуклеотидные последовательности. Если в качестве матрицы использована популяция генетически разных клеток, то в результате связывания образуется библиотека сегментов, в которой каждый сегмент содержит произвольно связанные интересующие последовательности нуклеиновой кислоты; такая библиотека именуется также комбинаторной библиотекой.
В одном из вариантов осуществления настоящего изобретения вышеуказанная множественная молекулярная амплификация представляет собой амплификацию методом множественной PCR, которой предпочтительно предшествует стадия обратной транскрипции. В предпочтительном варианте осуществления изобретения обратную транскрипцию, амплификацию и связывание выполняют в виде одной стадии при помощи множественной RT-PCR с удлинением цепи путем перекрывания или, альтернативно, в виде двух стадий при помощи множественной RT-PCR и последующего связывания путем лигирования или рекомбинации.
Другой вариант осуществления настоящего изобретения относится к созданию библиотек родственных пар, включающих связанные последовательности, кодирующие вариабельные области, в частности последовательности, кодирующие вариабельные области тяжелой и легкой цепи, или последовательности, кодирующие альфа-цепь и бета-цепь Т-клеточного рецептора (TcR). Этот способ предусматривает получение лимфоцитсодержащей фракции клеток по крайней мере у одного приемлемого донора и, необязательно, обогащение определенной популяции лимфоцитов в указанной фракции, например В-лимфоцитов или Т-лимфоцитов, в зависимости от того, какие последовательности, кодирующие вариабельные области, желательно получить из иммуноглобулинов или TcR. Лимфоцитсодержащую фракцию клеток или обогащенную фракцию клеток распределяют в несколько сосудов, получая одну клетку в каждом сосуде. Несколько отдельных клеток подвергают обратной транскрипции (RT) или альтернативной процедуре получения кДНК, используя в качестве матрицы нуклеиновые кислоты, выделенные из популяции отдельных клеток. После стадии обратной транскрипции выполняют множественную молекулярную амплификацию и связывание пар полученных из каждой клетки последовательностей, кодирующих вариабельные области, одним из способов по настоящему изобретению.
Способы клонирования, описанные в настоящем изобретении, позволяют избежать трудоемкого и неэффективного клонирования и, кроме того, уменьшают риск загрязнения и потерю разнообразия на протяжении многочисленных стадий клонирования.
Другим объектом настоящего изобретения являются библиотеки родственных пар, получаемых в результате множественной молекулярной амплификации и связывания. Исходная библиотека родственных пар (первичная библиотека), полученная способом по настоящему изобретению, может быть подвергнута скринингу с созданием подбиблиотеки родственных пар, кодирующих вариабельные домены мишень-специфических связывающих белков или непроцессированные связывающие белки.
В другом варианте осуществления изобретения библиотеки и подбиблиотеки по настоящему изобретению могут быть использованы для экспрессии рекомбинантных моноклональных или поликлональных белков, в которых сохранено присущее донору первоначальное сродство и специфичность связывания.
Определения терминов
Термин “родственная пара” обозначает первоначальную пару интересующих несмежных нуклеиновых кислот, которые находятся внутри отдельной клетки или выделены из отдельной клетки. В предпочтительных вариантах осуществления изобретения родственная пара содержит две последовательности, кодирующие вариабельные области, которые вместе кодируют вариабельный домен связывающего белка и имеют генные последовательности, выделенные из одной и той же клетки. Таким образом, при экспрессии в виде полного связывающего белка или его устойчивого фрагмента они сохраняют сродство и специфичность связывания связывающего белка, первоначально экспрессированного из данной клетки. Родственная пара, например, может состоять из последовательности, кодирующей вариабельную область тяжелой цепи антитела, связанной с последовательностью, кодирующей вариабельную область легкой цепи, из той же клетки, или последовательности, кодирующей α-цепь Т-клеточного рецептора, связанной с последовательностью, кодирующей β-цепь, из той же клетки. Библиотека родственных пар представляет собой коллекцию таких родственных пар.
Под термином “полимераза, активируемая при нагревании” понимают полимеразы, которые являются неактивными или обладают очень низкой активностью при температурах, используемых для обратной транскрипции. Для активации таких полимераз нужны высокие температуры (90-95°С). Это является преимуществом выполнения одностадийных RT-PCR, так как при этом не происходит включение интерференции полимеразы в реакцию с участием обратной транскриптазы.
Термин “изогенная популяция клеток” обозначает популяцию генетически идентичных клеток. В частности, особый интерес при осуществлении настоящего изобретения представляет изогенная популяция клеток, полученная в результате клональной экспансии одной выделенной клетки.
Термин “выделенная отдельная клетка” обозначает клетку, которая физически отделена от популяции клеток и соответствует определению “одна клетка в одном сосуде”. Популяцию выделенных отдельных клеток получают при распределении популяции клеток в несколько сосудов. Как указано в разделе, озаглавленном “Источники матрицы”, число сосудов с одной клеткой необязательно должно быть пропорционально 100%, чтобы такую популяцию можно было назвать популяцией отдельных клеток.
Термины “связывать” или “связывание” применительно к амплификации обозначают соединение интересующих амплифицированных последовательностей нуклеиновых кислот в один сегмент. Применительно к родственным парам сегмент содержит последовательности нуклеиновых кислот, кодирующие вариабельный домен, например вариабельную область тяжелой цепи антитела, связанную с последовательностью, кодирующей вариабельную область легкой цепи антитела, полученной из той же клетки. Связывание может происходить одновременно с амплификацией или в виде стадии, выполняемой сразу же после амплификации. К форме или функциональности сегмента не предъявляется никаких требований, он может быть линейным, кольцевым, одноцепочечным или двухцепочечным. Указанное связывание необязательно должно быть постоянным, одна из интересующих последовательностей нуклеиновых кислот при желании может быть выделена из сегмента, например из сегмента родственной пары может быть выделена одна из последовательностей, кодирующих вариабельную область. Однако до тех пор, пока исходные вариабельные области, образующие родственную пару, не будут заменены другими вариабельными областями, они по-прежнему считаются родственной парой, даже не будучи связанными вместе в одном сегменте. Указанное связывание предпочтительно представляет собой связывание нуклеотидов фосфодиэфирной связью. Однако связывание может быть произведено другими химическими методами перекрестного сшивания.
Термин “множественная молекулярная амплификация” обозначает одновременную амплификацию двух или более заданных последовательностей в ходе одной реакции. Приемлемые методы амплификации включают полимеразную цепную реакцию (PCR) (патент США № 4683202), лигазную цепную реакцию (LCR) (Wu and Wallace, 1989, Genomics 4, 560-9), амплификацию с заменой цепи (SDA) (Walker et al., 1992, Nucl. Acids Res. 20, 1691-6), аутоустойчивую репликацию последовательности (Guatelli et al., 1990, Proc. Nat. Acad. Sci USA, 87, 1874-8) и амплификацию последовательности на основе нуклеиновой кислоты (NASBA) (Compton J., 1991, Nature 350, 91-2). Два последних метода амплификации предусматривают выполнение изотермических реакций на основе изотермической транскрипции с образованием как одноцепочечной РНК (ssРНК), так и двухцепочечной ДНК (dsДНК).
Термин “множественная PCR” обозначает вариант PCR, при котором происходит одновременная амплификация двух или нескольких заданных последовательностей в результате введения в реакционную смесь нескольких наборов праймеров, из которых, например, один набор праймеров предназначен для амплификации вариабельной области тяжелой цепи, а другой набор праймеров предназначен для амплификации вариабельной области каппа-цепи в ходе одной реакции PCR. Кроме того, с вышеуказанными наборами праймеров может быть объединен набор праймеров, предназначенный для амплификации вариабельной области лямбда-цепи.
Термин “множественная RT-PCR” обозначает множественную PCR, которой предшествует стадия обратной транскрипции (RT). Множественная RT-PCR может быть выполнена в виде двухстадийного процесса с отдельной стадией RT, выполняемой перед множественной PCR, или в виде одностадийного процесса, при осуществлении которого все компоненты, необходимые для RT и множественной PCR, объединяют в одной пробирке.
Термин “множественная PCR с удлинением цепи путем перекрывания” и “множественная RT-PCR с удлинением цепи путем перекрывания” обозначает, что множественную PCR или множественную RT-PCR выполняют, используя смесь множественных праймеров для удлинения цепи путем перекрывания, предназначенную для амплификации заданных последовательностей, благодаря чему происходит одновременная амплификация и связывание заданных последовательностей.
Термин “несколько сосудов” обозначает любой объект (или совокупность объектов), которые обеспечивают физическое разделение одной клетки от популяции клеток. Такими сосудами могут быть пробирки, многолуночные планшеты (например, 96-луночные планшеты, 384-луночные планшеты, титрационные микропланшеты или другие многолуночные планшеты), матрицы, микроматрицы, микрочипы, гели или гелевая матрица. Указанный объект предпочтительно используют для амплификации методом PCR.
Термин “поликлональный белок” или “поликлональность” в используемом здесь значении обозначает белок, в состав которого входят разные, но гомологичные белковые молекулы, предпочтительно, отобранные из надсемейства иммуноглобулинов. Таким образом, каждая белковая молекула гомологична другим молекулам в композиции, но содержит один или несколько фрагментов вариабельной области полипептидной последовательности, которые отличаются аминокислотной последовательностью от других членов поликлонального белка. Известные примеры таких поликлональных белков включают молекулы антител или иммуноглобулинов, Т-клеточные рецепторы и В-клеточные рецепторы. Поликлональный белок может состоять из определенной субпопуляции белковых молекул, которые имеют общий признак, такой как общая активность связывания требуемой мишени, например таким белком может быть поликлональное антитело, характеризующееся специфичностью связывания требуемого антигена-мишени.
Термин “популяция генетически разных клеток” в используемом здесь значении обозначает популяцию клеток, в которой отдельные клетки отличаются друг от друга на уровне генома. Популяцией генетически разных клеток является, например, популяция клеток, полученных от донора, или фракция таких клеток, в частности фракция клеток, содержащая В-лимфоциты или Т-лимфоциты.
Термин “набор праймеров”, или взаимозаменяемый термин “пара праймеров”, обозначает два или несколько праймеров, которые вместе способны инициировать амплификацию интересующей нуклеотидной последовательности (то есть одного из членов родственной пары). Набор праймеров по настоящему изобретению может быть предназначен для инициации семейства нуклеотидных последовательностей, содержащих последовательности, кодирующие вариабельные области. Примерами разных семейств являются легкие каппа-цепи антитела, легкие лямбда-цепи, вариабельные области тяжелой цепи и вариабельные области α-, β-, γ- или δ-цепи Т-клеточного рецептора. Набор праймеров для амплификации семейства нуклеотидных последовательностей, содержащих последовательности, кодирующие вариабельные области, часто состоит из нескольких праймеров, часть которых может быть вырожденными праймерами.
Термин “идентичность последовательностей” обозначает тождество, выраженное в процентах, которое определяет степень идентичности последовательностей нуклеиновых кислот на протяжении всей длины самой короткой из двух последовательностей. Идентичность можно вычислить как (Nref - Ndif)x100/Nref, где Nref обозначает число остатков в более короткой последовательности, Ndif обозначает общее число неидентичных остатков в оптимально совмещенном числе остатков Nref двух последовательностей. Следовательно, последовательность ДНК AGTCAGTC будет на 75% идентична последовательности TAATCAATCGG (Ndif = 2 и Nref = 8) (подчеркнуты оптимально совмещенные остатки и жирным шрифтом выделены два неидентичных остатка из 8).
Термины “произвольно” или “произвольный” применительно к связыванию обозначают связывание нуклеотидных последовательностей, выделенных из разных клеток, но поперечно-связанных в популяции генетически разных клеток. Если интересующие нуклеотидные последовательности являются последовательностями, кодирующими вариабельные области, то будет создана комбинаторная библиотека связанных последовательностей. Если, с другой стороны, интересующие нуклеотидные последовательности кодируют идентичный гетеромерный белок, то произвольно связанные последовательности, по-видимому, будут аналогичны последовательностям, связанным в отдельной клетке.
Термин “матрица, полученная из выделенной отдельной клетки” применительно к обратной транскрипции обозначает нуклеиновые кислоты такой выделенной клетки. Нуклеиновые кислоты могут представлять собой, например, РНК, мРНК, ДНК или геномную ДНК. Нуклеиновые кислоты могут быть выделены из клетки или находиться в клетке, которая может быть интактной или лизированной.
Способ амплификации и связывания
Одним из отличительных признаков настоящего изобретения является уменьшение числа пробирок, необходимых для амплификации интересующих нуклеотидных последовательностей, благодаря осуществлению варианта PCR, в котором две или несколько заданных последовательностей амплифицируют одновременно в одной пробирке путем введения нескольких наборов праймеров, например всех праймеров, необходимых для амплифицикации последовательностей, кодирующих вариабельные области, в одну реакционную смесь. Подобный метод известен как множественная полимеразная цепная реакция (множественная PCR).
Множественная PCR или множественная PCR с предшествующим выполнением обратной транскрипции (множественная RT-PCR) являются хорошо известными методами в области диагностики, применяемыми, например, при выполнении анализа мутаций, делеций и полиморфизмов ДНК, количественных анализов содержания мРНК и идентификации вирусов, бактерий и паразитов (см. публикацию Markoulatos, P. et al., 2002, J. Clin. Lab. Anal. 16, 47-51). Однако существует очень мало примеров амплификации последовательностей, кодирующих вариабельные области легкой цепи, в одном сосуде, а также последовательностей, кодирующих вариабельные области тяжелой цепи иммуноглобулинов, с использованием смеси множественных праймеров, состоящей из более чем четырех праймеров и включающей набор праймеров для Vк и/или Vλ вместе с набором праймеров для VH (Chapal, N. et al., 1997, BioTechniques 23, 518-524; Liu, A.H. et al., 1992, Proc. Natl. Acad. Sci. USA 89, 7610-7614; Embleton, M.J. et al., 1992, Nucleic Acids Res. 20, 3831-3837). Причиной этого может быть тот факт, что наборы праймеров, которые могут использоваться для амплификации последовательностей, кодирующих вариабельные домены антигенсвязывающих белков, обычно включают несколько вырожденных праймеров для соответствия разнообразию последовательностей, кодирующих вариабельные области. Таким образом, сложность реакции РCR значительно увеличивается при выполнении амплификации последовательностей, кодирующих вариабельные области, при помощи множественной PCR.
Другим отличительным признаком настоящего изобретения является связывание двух нескольких заданных последовательностей, амплифицированных при помощи множественной РCR, сразу же после выполнения амплификации. В частности, указанным способом связывают родственные пары последовательностей, кодирующих вариабельные области.
Один из вариантов осуществления настоящего изобретения относится к созданию смеси множественных праймеров, предназначенной для выполнения PCR с удлинением цепи путем перекрывания, в результате чего происходит одновременная амплификация и связывание интересующих нуклеотидных последовательностей. Указанная множественная PCR с удлинением цепи путем перекрывания позволяет уменьшить число реакций, необходимых для выделения и связывания интересующих нуклеотидных последовательностей, в частности, родственных пар связанных вариабельных областей.
Другие варианты осуществления настоящего изобретения относятся к связыванию путем лигирования или рекомбинации в качестве альтернативы множественной PCR с удлинением цепи путем перекрывания. В указанных способах связывание выполняют отдельно от амплификации при помощи множественной PCR, но сразу же после амплификации. Однако связывание может быть выполнено в той же пробирке, что и множественная PCR.
Для выполнения множественной PCR с удлинением цепи путем перекрывания необходимо наличие двух или нескольких наборов праймеров (смесь множественных праймеров), в которых по крайней мере один праймер в каждом наборе имеет концевой сегмент удлинения цепи путем перекрывания. Концевые сегменты удлинения цепи путем перекрывания позволяют производить связывание продуктов, образованных каждым набором праймеров, в процессе амплификации. Такая смесь праймеров именуется множественной смесью праймеров для удлинения цепи путем перекрывания. Множественная PCR с удлинением цепи путем перекрывания отличается от обычной PCR с удлинением цепи путем перекрывания тем, что связываемые последовательности образуются одновременно в одной пробирке, благодаря чему происходит немедленное связывание заданных последовательностей во время амплификации без какой-либо промежуточной очистки. Кроме того, при обычной РCR с удлинением цепи путем перекрывания требуется выполнение отдельной реакции связывания при помощи PCR с использованием внешнего набора праймеров или гнездового набора праймеров для получения связанного продукта (Horton, R.M. et al., 1989, Gene 77, 61-68). Такая дополнительная стадия амплификации является необязательной при выполнении множественной PCR с удлинением цепи путем перекрывания по настоящему изобретению.
Другим отличительным признаком настоящего изобретения является стадия обратной транскрипции (RT), предшествующая амплификации множественной PCR или множественной PCR с удлинением цепи путем перекрывания, с использованием матрицы, полученной из выделенной отдельной клетки или популяции изогенных клеток.
Другим отличительным признаком настоящего изобретения является использование нуклеотидных последовательностей, полученных из выделенной отдельной клетки или популяции изогенных клеток, в качестве матрицы для амплификации методом множественной PCR. РНК из отдельной клетки, предпочтительно, подвергают обратной транскрипции с образованием кДНК перед выполнением множественной РCR. Для амплификации некоторых интересующих последовательностей нуклеиновых кислот в качестве альтернативы мРНК можно использовать геномную ДНК. Используя выделенные отдельные клетки или популяцию изогенных клеток, полученную в результате клональной экспансии выделенной отдельной клетки, в качестве источника матрицы, можно избежать замены нуклеотидных последовательностей, кодирующих интересующий гетеромерный белок, нуклеотидными последовательностями, полученными из других клеток в популяции клеток. Это имеет важное значение, если желательно получить первоначальный состав интересующих последовательностей. Для образования родственной пары последовательностей, кодирующих вариабельные области, в качестве источника матрицы важно использовать выделенную отдельную клетку или популяцию изогенных клеток.
Множественная PCR с удлинением цепи путем перекрывания является редко используемым методом. В публикации WO 99/16904 описано связывание экзонов из геномной последовательности при выполнении одной реакции, в результате которой образуется кДНК без применения обратной транскрипции. В описанном способе использован один набор праймеров (состоящий из двух праймеров) на один экзон, подлежащий связыванию, при котором образуется смесь множественных праймеров для удлинения цепи путем перекрывания. С помощью каждого отдельного набора праймеров можно удлинять цепь путем перекрывания со смежным набором праймеров при помощи комплементарных концевых сегментов удлинения цепи путем перекрывания. кДНК образуется из матрицы геномной ДНК в результате осуществления PCR с удлинением цепи путем перекрывания с использованием смеси множественных праймеров для удлинения цепи путем перекрывания и последующей гнездовой PCR, которая в соответствии с описанием является необходимой стадией.
Образование кДНК из экзонов геномной ДНК, описанное в WO 99/16904, не имеет отношения к клонированию последовательностей, кодирующих гетеромерные белки. Прежде всего, гетеромерные белки обычно получают из разных генов, в то время как связывание экзонов в соответствии с описанием, приведенным в публикации WO 99/16904, относится к связыванию экзонов из одного гена. Кроме того, настоящее изобретение облегчает создание библиотек интересующих связанных последовательностей нуклеиновых кислот, в частности комбинаторных библиотек и библиотек родственных пар вариабельных областей, что полностью отличается от связывания серии экзонов из одного гена, в результате которого образуется одна невариабельная кДНК. В настоящем изобретении использованы нуклеиновые кислоты, выделенные из отдельных клеток, предпочтительно, в форме РНК, которая не требует отделения от остального содержимого клетки перед ее использованием в качестве матрицы.
В нескольких публикациях описана множественная RT-PCR с удлинением цепи путем перекрывания, применяемая для связывания последовательностей, кодирующих вариабельные области.
Наиболее простая форма множественной RT-PCR с удлинением цепи путем перекрывания описана для выделения последовательности, кодирующей scFv-фрагмент, из линии клеток гибридомы (Thirion, S. et al. 1996, Eur. J. Cancer Prev. 5, 507-511 and Mullinax, R.L. et al. 1992, BioTechniques 12, 864-869). Способы, описанные в публикации Thirion и Mullinax, предусматривают выполнение обратной транскрипции мРНК с использованием олиго-dT-праймеров в отношении общей РНК, экстрагированной из линии клеток гибридомы, с последующим выполнением отдельной стадии связывания. Стадию связывания выполняют с использованием в общей сложности четырех праймеров, включающих две пары праймеров для амплификации последовательностей, кодирующих соответственно вариабельную область тяжелой цепи и вариабельную область легкой цепи. Основной праймер для VL и обратный праймер для VН или СН содержат комплементарные концевые сегменты удлинения цепи путем перекрывания, что позволяет одновременно производить амплификацию и связывание последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи. В указанных способах не применяется гнездовая PCR для повышения чувствительности способа связывания.
Другой пример множественной RT-PCR с удлинением цепи путем перекрывания, относящийся к связыванию последовательностей, кодирующих вариабельные области, описан в вышеуказанной публикации WO 93/03151, в которой рассмотрен способ клонирования последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи, которые были получены из одной клетки без выделения отдельных клеток перед клонированием. Способ, описанный в WO 93/03151, требует выполнения промывки между стадией RT и стадией множественной PCR с удлинением цепи путем перекрывания. Кроме того, одной из конкретных целей публикации WO 93/03151 является решение проблемы выделения отдельных клеток для получения родственных пар последовательностей, кодирующих вариабельные области.
Ни один из известных методов множественной RT-PCR с удлинением цепи путем перекрывания не предназначен для осуществления на матрице, полученной из выделенной отдельной клетки. Кроме того, ни один из известных методов не может быть выполнен в виде одностадийных реакций RT-PCR.
Один из вариантов осуществления настоящего изобретения относится к связыванию нескольких интересующих несмежных нуклеотидных последовательностей. Такой способ предусматривает амплификацию при помощи множественной PCR или множественной RT-PCR интересующих нуклеотидных последовательностей с использованием матрицы, полученной из выделенной отдельной клетки или популяции изогенных клеток, и связывание интересующих амплифицированных нуклеотидных последовательностей. Кроме того, способ предусматривает необязательную стадию выполнения дополнительной амплификации связанных продуктов.
Другой вариант осуществления настоящего изобретения относится к способу создания библиотеки родственных пар, включающей связанные последовательности, кодирующие вариабельные области. Этот способ предусматривает получение от донора лимфоцитсодержащей фракции клеток, которую, необязательно, обогащают определенной популяцией лимфоцитов из указанной фракции клеток. Затем получают популяцию выделенных отдельных клеток, распределяя клетки из лимфоцитсодержащей фракции клеток или обогащенной фракции клеток в несколько сосудов. Затем выполняют множественную молекулярную амплификацию (амплификация методом множественной RT-PCR) последовательностей, кодирующих вариабельные области, которые находятся в популяции выделенных отдельных клеток, и связывание пар последовательностей, кодирующих вариабельные области, при этом отдельную пару получают из одной клетки в популяции выделенных отдельных клеток. Кроме того, этот способ предусматривает две необязательные стадии: на первой стадии происходит деление отдельной клетки, выделенной из популяции отдельных клеток, до образования популяции изогенных клеток перед выполнением амплификации методом множественной RT-PCR. Таким образом получают несколько сосудов с разной популяцией изогенных клеток (одна популяция изогенных клеток в одном сосуде). Вторая необязательная стадия предполагает выполнение дополнительной амплификации связанных последовательностей, кодирующих вариабельные области.
В предпочтительных вариантах осуществления настоящего изобретения один из членов указанной библиотеки родственных пар представляет собой последовательность, кодирующую вариабельную область легкой цепи иммуноглобулина, связанную с последовательностью, кодирующей вариабельную область тяжелой цепи иммуноглобулина, которые получены из одной клетки, или последовательности, кодирующие домен связывания Т-клеточного рецептора, состоящий из вариабельной области альфа-цепи, связанной с вариабельной областью бета-цепи, или вариабельной области гамма-цепи, связанной с вариабельной областью дельта-цепи, при этом связанные вариабельные области получают из одной клетки.
Амплификация методом множественной RT-PCR по настоящему изобретению может быть выполнена в виде двухстадийного способа, в котором обратную транскрипцию (RT) осуществляют отдельно от амплификации методом множественной PCR (или альтернативной множественной молекулярной амплификации), или в виде одностадийного способа, в котором стадии RT и амплификации методом множественной PCR выполняют с использованием одних и тех же праймеров в одной пробирке.
Обратную транскрипцию (RT) выполняют при помощи фермента, обладающего активностью обратной транскриптазы, получая при этом кДНК из общей РНК, мРНК или заданной специфической РНК в выделенной отдельной клетке. Праймеры, которые могут быть использованы для обратной транскрипции, представляют собой, например, олиго-dT-праймеры, произвольные гексамеры, произвольные декамеры, другие произвольные праймеры или праймеры, специфичные к представляющим интерес нуклеотидным последовательностям.
Двухстадийный способ амплификации при помощи множественной RT-PCR позволяет распределить кДНК, полученную на стадии RT, в несколько сосудов для хранения матричной фракции до выполнения амплификации. Кроме того, распределение кДНК в несколько пробирок делает возможным выполнение нескольких амплификаций методом множественной PCR нуклеиновой кислоты, полученной из одной и той же матрицы. Хотя этот способ характеризуется большим числом отдельных реакций, он позволяет, при желании, упростить смесь множественных праймеров. Указанный двухстадийный способ, например, может быть использован для амплификации и связывания последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой каппа-цепи, в одной пробирке и последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой лямбда-цепи, в другой пробирке с использованием одной и той же матрицы. Отдельная клетка обычно экспрессирует только одну из легких цепей. Однако часто гораздо проще выполнять реакции одновременно, не ожидая результата одной из реакций, прежде чем начать выполнение другой реакции. Кроме того, амплификация каппа-цепи и лямбда-цепи служит в качестве внутреннего отрицательного контроля, так как следует ожидать, что из отдельной клетки может быть амплифицирована только каппа-цепь или лямбда-цепь.
В одностадийном способе множественной RT-PCR обратную транскрипцию и амплификацию при помощи множественной PCR выполняют в одном сосуде. В сосуды вводят все компоненты, необходимые для выполнения как обратной транскрипции, так и множественной PCR в одной стадии, и затем осуществляют указанную реакцию. Как правило, не нужно вводить дополнительные компоненты после начала реакции. Преимуществом одностадийного способа амплификации при помощи множественной RT-PCR является сокращение числа стадий, необходимых для получения связанных нуклеотидных последовательностей по настоящему изобретению. Этот способ является особенно эффективным для выполнения множественной RT-PCR с использованием целого ряда отдельных клеток, когда одна и та же реакция должна быть выполнена в нескольких сосудах. Одностадийный способ множественной RT-PCR выполняют, используя обратные праймеры, присутствующие в смеси множественных праймеров, необходимой для амплификации методом множественной PCR, также в качестве праймеров для обратной транскрипции. Композиция, необходимая для одностадийного способа множественной RT-PCR, содержит матрицу нуклеиновой кислоты, фермент, обладающий активностью обратной транскриптазы, фермент, обладающий активностью ДНК-полимеразы, смесь дезоксинуклеозидтрифосфатов (смесь dNTP, содержащую dATP, dCTP, dGTP и dTTP) и смесь множественных праймеров. Матрицей нуклеиновой кислоты предпочтительно является общая РНК или мРНК, полученная из выделенной отдельной клетки в очищенном виде, содержащаяся в лизате клетки или находящаяся внутри интактной клетки. Точный состав реакционной смеси обычно требует некоторой оптимизации каждой смеси множественных праймеров по настоящему изобретению. Это относится как к двухстадийному, так и одностадийному методу множественной RT-PCR.
В альтернативных вариантах осуществления настоящего изобретения в качестве матрицы может быть желательно использовать геномную ДНК вместо РНК. В таких случаях стадию обратной транскрипции пропускают и остальные стадии по настоящему изобретению выполняют в соответствии с приведенным описанием.
При выполнении некоторых одностадийных множественных RT-PCR во время реакции может быть желательно ввести дополнительные компоненты. Например, после выполнения стадии RT можно добавить полимеразу. Другие компоненты могут включать, например, смесь dNTP или смесь множественных праймеров, возможно, с другим составом праймеров. Такой способ может рассматриваться как множественная RT-PCR, выполняемая в одной пробирке, которая обладает такими же преимуществами, что и одностадийный способ множественной RT-PCR, так как он также ограничивает число пробирок, необходимых для получения требуемых связанных продуктов.
Интересующие нуклеотидные последовательности, амплифицированные при помощи множественной RT-PCR, могут быть связаны друг с другом разными способами, такими как множественная RT-PCR с удлинением цепи путем перекрывания, лигирование или рекомбинация, с использованием разных смесей множественных праймеров. Амплификацию методом множественной RT-PCR и связывание осуществляют одностадийным или двухстадийным способом. Однако связывание может быть также выполнено путем многостадийного процесса с использованием, например, заполняющего фрагмента, служащего для связывания интересующих последовательностей нуклеиновых кислот при помощи PCR, лигирования или рекомбинации. Такой заполняющий фрагмент может содержать цис-элементы, промоторные элементы, соответствующую кодирующую последовательность или узнающую последовательность. В предпочтительном варианте осуществления изобретения связывание выполняют в том же сосуде, что и амплификацию методом множественной RT-PCR.
В одном из вариантов осуществления настоящего изобретения связывание нескольких интересующих несмежных нуклеотидных последовательностей осуществляют вместе с амплификацией методом множественной РCR, используя смесь множественных праймеров для удлинения цепи путем перекрывания. Такой способ позволяет объединить амплификацию и связывание заданных последовательностей. Композиция, необходимая для выполнения множественной PCR с удлинением цепи путем перекрывания, обычно содержит матрицу нуклеиновой кислоты, фермент, обладающий активностью ДНК-полимеразы, смесь дезоксинуклеозидтрифосфатов (смесь dNTP, содержащую dATP, dCTP, dGTP и dTTP) и смесь множественных праймеров для удлинения цепи путем перекрывания.
В конкретном варианте осуществления настоящего изобретения несколько интересующих несмежных нуклеотидных последовательностей связывают при помощи множественной RT-PCR с удлинением цепи путем перекрывания, используя матрицу, полученную из выделенной отдельной клетки или популяции изогенных клеток. Кроме того, этот способ предусматривает необязательную стадию выполнения дополнительной молекулярной амплификации связанных продуктов. Множественную RT-PCR с удлинением цепи путем перекрывания, предпочтительно, выполняют в виде одностадийной реакции в одной пробирке.
Смесь множественных праймеров для удлинения цепи путем перекрывания по настоящему изобретению включает по крайней мере два набора праймеров, способных инициировать амплификацию и связывание по крайней мере двух последовательностей, кодирующих вариабельные области, например амплификацию и связывание последовательностей из семейств вариабельных областей тяжелой цепи иммуноглобулина с семействами вариабельных областей легкой каппа- или лямбда-цепи либо амплификацию и связывание последовательностей из семейств α-, β-, γ- или δ-цепей Т-клеточных рецепторов.
В другом варианте осуществления настоящего изобретения несколько интересующих нуклеотидных последовательностей, амплифицированных при помощи множественной RT-PCR, связывают лигированием. Для этого смесь множественных праймеров, используемую для множественной RT-PCR, создают с таким расчетом, чтобы амплифицированные заданные последовательности можно было расщепить соответствущими рестрикционными ферментами и произвести ковалентное связывание путем лигирования ДНК (создание праймеров описано в разделе “Смеси праймеров и их создание”). После амплификации методом множественной RT-PCR с использованием такой смеси множественных праймеров к реакционной смеси вместе с лигазой добавляют рестрикционные ферменты, необходимые для образования совместимых концов заданных последовательностей. Продукты PCR перед этой стадией можно не очищать, хотя такая очистка может быть произведена. Температура реакции для объединенного рестрикционного расщепления и лигирования находится в пределах от около 0 до 40°С. Однако, если в смеси все еще присутствует полимераза, используемая в множественной РCR, предпочтительной является температура инкубации ниже комнатной температуры, наиболее предпочтительными являются температуры от 4 до 16°С.
В другом варианте осуществления настоящего изобретения несколько интересующих нуклеотидных последовательностей, амплифицированных методом множественной RT-PCR, связывают рекомбинацией. В данном случае амплифицированные заданные последовательности могут быть связаны с использованием идентичных сайтов рекомбинации. Связывание выполняют, добавляя рекомбиназы, облегчащие рекомбинацию. Некоторые приемлемые системы рекомбиназ включают Flp-рекомбиназу с несколькими сайтами FRT, Сre-рекомбиназу с несколькими сайтами lox, интегразу ΦС31, которая осуществляет рекомбинацию между сайтом attP и сайтом attB, систему из шести β-рекомбиназ, а также систему Gin-gix. Связывание рекомбинацией было показано на примере двух нуклеотидных последовательностей (связывание VH с VL) (публикация Chapal, N. et al. 1997, Bio Techniques 23, 518-524, включенная в данное описание изобретения в качестве ссылки).
В предпочтительном варианте осуществления настоящего изобретения интересующие нуклеотидные последовательности включают последовательности, кодирующие вариабельные области, при этом в результате связывания образуется родственная пара последовательностей, кодирующих вариабельные области. Такая родственная пара может содержать одну или несколько последовательностей, кодирующих константные области помимо вариабельных областей.
В еще более предпочтительном варианте осуществления настоящего изобретения интересующие нуклеотидные последовательности включают последовательности, кодирующие вариабельные области иммуноглобулина, при этом в результате связывания образуется родственная пара последовательностей, кодирующих вариабельную область легкой цепи и вариабельную область тяжелой цепи. Такая родственная пара может содержать одну или несколько последовательностей, кодирующих константные области помимо вариабельных областей. Кроме того, такая родственная пара может быть выделена из матрицы, полученной из клеток линии В-лимфоцитов, обогащенных из лимфоцитсодержащей фракции клеток, такой как цельная кровь, мононуклеарные клетки или лейкоциты.
В таком же предпочтительном варианте осуществления настоящего изобретения интересующие нуклеотидные последовательности включают последовательности, кодирующие вариабельные области TcR, при этом в результате связывания образуется родственная пара последовательностей, кодирующих вариабельную область α-цепи и вариабельную область β-цепи, или последовательностей, кодирующих вариабельную область γ-цепи и вариабельную область δ-цепи. Такая родственная пара может содержать одну или несколько последовательностей, кодирующих константные области помимо вариабельных областей. Кроме того, такая родственная пара может быть выделена из матрицы, полученной из клеток линии Т-лимфоцитов, обогащенных из лимфоцитсодержащей фракции клеток, такой как цельная кровь, мононуклеарные клетки или лейкоциты.
Другим объектом настоящего изобретения является применение множественной RT-PCR с использованием в качестве источника матрицы популяции генетически разных клеток. Большинство последовательностей, кодирующих гетеромерные белки, являются одинаковыми в разных клетках в отличие от последовательностей, кодирующих вариабельные области, в связывающих белках. Таким образом, при применении настоящего изобретения для клонирования таких последовательностей, кодирующих невариабельные области гетеромерных белков, не нужно производить первоначальное выделение отдельных клеток.
В этом варианте осуществления настоящего изобретения несколько интересующих несмежных нуклеотидных последовательностей произвольно связывают способом, предусматривающим амплификацию методом множественной RT-PCR интересующих нуклеотидных последовательностей с использованем матрицы, полученной из популяции генетически разных клеток, и связывание интересующих амплифицированных нуклеотидных последовательностей. Кроме того, этот способ предусматривает необязательную стадию выполнения дополнительной амплификации связанных продуктов. Как и в случае способа на основе отдельной клетки, связывание можно выполнять при помощи смеси множественных праймеров для удлинения цепи путем перекрывания, используемой для амплификации, или, альтернативно, лигированием или рекомбинацией. Матрица, полученная из популяции клеток, предпочтительно находится внутри клеток. Популяция клеток, например, может быть лизирована.
Применение способа произвольного связывания к популяции клеток, экспрессирующих вариабельные области связывающих белков, позволяет упростить создание комбинаторных библиотек последовательностей, кодирующих вариабельные области. Популяция клеток, предпочтительно, содержит клетки, экспрессирующие вариабельные области связывающих белков, такие как В-лимфоциты, Т-лимфоциты, клетки гибридомы, плазматические клетки или смесь указанных клеток.
Популяция клеток в вышеуказанном варианте осуществления, например, может быть сделана проницаемой или лизирована без дополнительной очистки, или матричные нуклеиновые кислоты могут быть выделены из клеток стандартными методами. Предпочтительным является одностадийный способ множественной RT-PCR. Однако в данном варианте осуществления изобретения можно также использовать двухстадийный способ.
Настоящее изобретение также относится к комбинаторной библиотеке, включающей связанные пары последовательностей, кодирующих вариабельную область легкой цепи и вариабельную область тяжелой цепи иммуноглобулина.
Эффективным способом повышения специфичности, чувствительности и выхода продукта при осуществлении множественной RT-PCR и связывания является выполнение дополнительной молекулярной амплификации связанных нуклеотидных последователностей, полученных в результате множественной RT-PCR с последующим связыванием путем лигирования или рекомбинации либо при помощи множественной RT-PCR с удлинением цепи путем перекрывания. Дополнительную амплификацию, предпочтительно, выполняют при помощи PCR, используя смесь праймеров, для амплификации интересующих связанных последовательностей нуклеиновых кислот. Смесь праймеров может включать внешние праймеры из смеси множественных праймеров или смеси множественных праймеров для удлинения цепи путем перекрывания, в частности праймеры, гибридизирующие с 5'-концом и 3'-концом смысловой цепи связанных последовательностей, кодирующих вариабельные области, что позволяет производить амплификацию всего связанного продукта. Внешние праймеры также можно определить как праймеры из смеси множественных праймеров для удлинения цепи путем перекрывания, не содержащие концевых сегментов удлинения цепи путем перекрывания. Альтернативно, для дополнительной амплификации связанных нуклеотидных последовательностей можно использовать набор праймеров для гнездовой или полугнездовой PCR. Такая гнездовая PCR особенно эффективна для повышения специфичности способа, а также для увеличения количества связанного продукта. В соответствии с целями настоящего изобретения полугнездовая PCR (описанная в разделе, озаглавленном “Смеси праймеров и их создание”) считается такой же эффективной, что и гнездовая PCR. Таким образом, желательным, хотя и необязательным, условием для настоящего изобретения является выполнение дополнительной амплификации при помощи PCR связанных продуктов, полученных в результате множественной RT-PCR с удлинением цепи путем перекрывания, или продуктов, связанных путем лигирования или рекомбинации, методом гнездовой PCR или полугнездовой PCR.
Дополнительную амплификацию можно выполнить, непосредственно используя фракцию или весь продукт, полученный в результате множественной RT-PCR с удлинением цепи путем перекрывания, продукт, полученный лигированием или рекомбинацией, фракцию любого из указанных продуктов или частично очищенные связанные продукты, полученные в результате любой из указанных реакций, например, при помощи электрофореза в агарозном геле и вырезания фрагмента, соответствующего предполагаемому размеру связанных последовательностей, кодирующих вариабельные области. Для продуктов, связанных при помощи множественной RT-PCR с удлинением цепи путем перекрывания, дополнительную амплификацию предпочтительно выполняют непосредственно во фракции, полученной в результате множественной RT-PCR с удлинением цепи путем перекрывания, так как это способствует связыванию отдельных заданных последовательностей, которые не были связаны в ходе первой реакции.
Интересующие последовательности
Интересующие нуклеотидные последовательности по настоящему изобретению могут быть выбраны из последовательностей, кодирующих разные субъединицы или домены, в результате экспрессии которых образуются белок или часть белка. Такие белки, состоящие по крайней мере из двух неидентичных субъединиц, известны как гетеромерные белки. Гетеромерные белки присутствуют во всех биологических видах. Некоторыми классами, к которым относятся такие белки, являются, например, ферменты, ингибиторы, структурные белки, токсины, каналообразующие белки, G-белки, рецепторные белки, белки надсемейства иммуноглобулинов, транспортирующие белки и т.д. Нуклеотидные последовательности, кодирующие такие гетеромерные белки, являются несмежными, из чего следует, например, что они образуются разными генами или разными молекулами мРНК. Однако термин “несмежные” в значении, используемом в настоящем изобретении, может также обозначать нуклеотидные последовательности, кодирующие домены одного белка, в котором указанные домены разделены неинтересующими нуклеотидными последовательностями.
В одном из вариантов осуществления настоящего изобретения интересующие нуклеотидные последовательности включают последовательности, кодирующие вариабельные области, из надсемейства иммуноглобулинов, таких как иммуноглобулины (антитела), В-клеточные рецепторы и Т-клеточные рецепторы (TcR). Особенно интересными являются последовательности, кодирующие вариабельные области иммуноглобулинов. Такие последовательности, кодирующие вариабельные области, включают непроцессированные антитела, а также Fab-, Fv-, scFv-фрагменты и комбинации фрагментов последовательностей, кодирующих вариабельные области, например гипервариабельные участки (CDR), J-гены, или V-гены, или их сочетания. Как правило, настоящее изобретение относится к любым комбинациям последовательностей, кодирующим вариабельные области, и к сочетаниям их фрагментов. В настоящей заявке рассмотрено связывание всей легкой цепи с вариабельным доменом тяжелой цепи. Однако настоящее изобретение также относится к связыванию только вариабельных доменов тяжелой и легкой цепей, образующих Fv- или scFv-кодирующие последовательности, или к связыванию всей легкой цепи с вариабельной областью тяжелой цепи, доменом константной области СН1 и частями шарнирной области, образующими Fab, Fab' или F(ab)2. Кроме того, к вариабельной области тяжелой цепи можно добавить любую область доменов константной области тяжелой цепи, в результате чего будут получены процессированные антителокодирующие последовательности или непроцессированные антителокодирующие последовательности.
В другом варианте осуществления настоящего изобретения последовательности, кодирующие вариабельные области, включают последовательность, кодирующую легкую цепь (каппа или лямбда) иммуноглобулина одного типа и одну последовательность, кодирующую вариабельную область тяжелой цепи иммуноглобулина.
Кроме того, интерес представляют последовательности, кодирующие вариабельные области, которые были получены из Т-клеточных рецепторов (TcR). Такие TcR-кодирующие последовательности включают кодирующие последовательности для непроцессированных альфа- и бета-цепей или гамма- и дельта-цепей, а также растворимые TcR, или только вариабельные домены указанных цепей, или их одноцепочечные слитые белки (например, одиночная αβ-цепь или одиночная γδ-цепь).
Источники матрицы
Одним из отличительных признаков настоящего изобретения является возможность связывать нуклеотидные последовательности, полученные из выделенной отдельной клетки, популяции изогенных клеток или генетически разной популяции клеток, которые не были распределены по отдельным сосудам. Клетки, используемые в настоящем изобретении, могут быть, например, бактериальными клетками, дрожжевыми клетками, грибными клетками, клетками насекомых, растительными клетками, клетками млекопитающих или фракциями таких клеток. Клетки крови млекопитающих являются одним примером фракции клеток, которые могут быть использованы в настоящем изобретении.
Предпочтительным отличительным признаком настоящего изобретения является использование выделенных отдельных клеток или популяции изогенных клеток в качестве источника матрицы, так как таким образом можно избежать замены интересующих последовательностей нуклеиновых кислот, в частности последовательностей, кодирующих вариабельные области. Это имеет особенно важное значение в том случае, если желательно получить первоначальную пару последовательностей, кодирующих вариабельные области.
Другим предпочтительным отличительным признаком настоящего изобретения является получение отдельной клетки или популяции отдельных клеток из лимфоцитсодержащей фракции клеток, таких как В-лимфоциты, Т-лимфоциты, плазматические клетки и/или линии указанных клеток на разных стадиях развития. Для получения отдельных клеток также можно использовать другие популяции клеток, экспрессирующих связывающие белки из надсемейства иммуноглобулинов. В настоящем изобретении можно также использовать такие линии клеток, как клетки гибридомы, линии клеток В-лимфоцитов или Т-лимфоцитов, иммобилизованные линии клеток вирусов или клетки, полученные от донора, которые участвуют в возбуждении иммунной реакции. Фракции лимфоцитсодержащих клеток, полученных от донора, можно выделить из естественных тканей или жидкостей с большим содержанием таких клеток, например из крови, костного мозга, лимфатических узлов, ткани селезенки, ткани миндалины, из инфильтратов внутри и вокруг опухолей или из инфильтратов воспалительной ткани. Приемлемыми донорами клеток по настоящему изобретению могут быть позвоночные с приобретенной иммунной системой. Донорами могут быть индивидуумы, не подвергавшиеся ранее какому-либо воздействию или гипериммунизированные против требуемой мишени. Для выделения антигенсвязывающих белков, обладающих специфичностью связывания к определенной мишени, предпочтительными являются гипериммунизированные доноры. Такими гипериммунизированными донорами могут быть доноры, иммунизированные антигеном-мишенью или его фрагментами, выздоравливающие или больные индивидуумы, у которых возникает естественная иммунная реакция на антиген-мишень, например индивидуумы, страдающие аутоиммунными заболеваниями, раком или инфекционными болезнями, такие как ВИЧ-инфицированные индивидуумы, индивидуумы, страдающие гепатитом А, В или С, тяжелым острым респираторным синдромом (SARS) и тому подобное, или индивидуумы, страдающие хроническими заболеваниями.
При использовании рекомбинантных белков в лечебных целях желательно, что они были выделены из последовательностей, характеризующихся видовой идентичностью с подлежащим лечению индивидуумом (например, для лечения людей должны быть использованы человеческие последовательности). Прежде всего потому, что рекомбинантные белки, выделенные из чужеродной последовательности (то есть отличные от человеческих), будут распознаны иммунной системой, в результате чего возникнет иммунная реакция с участием поликлональных антибелковых антител. Указанные антибелковые антитела могут блокировать действие лекарственного средства, заняв активный сайт, ускорить выведение лекарственного средства и вызвать вредные реакции, в частности аллергические реакции при повторном воздействии.
Иммуногенность, тем не менее, также может наблюдаться в тех случаях, когда рекомбинантный белок выделен из последовательности, характеризующейся видовой идентичностью. Такая иммуногенность, например, может быть индуцирована посттрансляционными модификациями, которые могут отличаться от наблюдаемых in vivo. Комбинаторные библиотеки последовательностей, кодирующих вариабельные области, также могут вызвать иммуногенность, так как они состоят из созданных in vitro произвольных пар последовательностей, кодирующих вариабельные области. Правила, определяющие образование in vivo пар последовательностей, кодирующих тяжелые и легкие цепи антитела (или Т-клеточных рецепторов), еще полностью не изучены. Из вышеизложенного следует, что некоторые образованные in vitro пары могут быть распознаны иммунной системой как чужеродные, даже если обе последовательности, образующие пару, принадлежат человеку. Связывающие белки, полученные из библиотек родственных пар, с другой стороны, не образуют таких аномальных комбинаций и поэтому являются потенциально менее иммуногенными, чем связывающие белки, полученных из комбинаторных библиотек. Это не значит, что продукты, полученные из комбинаторных библиотек, не пригодны для лечения, они просто требуют более тщательного контроля с целью выявления вышеуказанных побочных эффектов.
В соответствии с настоящим изобретением доноры клеток предпочтительно должны относиться к такому же биологическому виду, что и индивидуумы, подлежащие лечению продуктами, полученными из связанных нуклеотидных последовательностей по настоящему изобретению. Донором клеток предпочтительно является домашнее животное, комнатное животное, человек или трансгенное животное. Трансгенные животные, несущие локусы иммуноглобулина человека, описаны в патенте США № 6111166 и в публикации Kuroiwa, Y. et al. Nature Biotechnology; 2002; 20:889-893. Такие трансгенные животные могут продуцировать иммуноглобулины человека. Таким образом, полностью человеческие антитела против специфической мишени могут быть получены обычными методами иммунизации таких трансгенных животных. Это позволяет создать библиотеки, кодирующие связывающие белки, обладающие специфичностью в отношении более трудных мишеней, таких как антигены человека, в отношении которых у человека отсутствует или существует ограниченная естественная гуморальная иммунная реакция. Аналогичным образом могут быть созданы трансгенные животные, продуцирующие Т-клеточные рецепторы человека.
В другом варианте осуществления настоящего изобретения лимфоцитсодержащая фракция клеток состоит из цельной крови, костного мозга, мононуклеарных клеток или лейкоцитов, полученных от донора. Мононуклеарные клетки могут быть выделены из крови, костного мозга, лимфатических узлов, селезенки, инфильтратов вокруг раковых клеток и воспалительных инфильтратов. Мононуклеарные клетки могут быть выделены методами центрифугирования в градиенте плотности, например в градиентах фиколла. При выделении мононуклеарных клеток из образцов ткани используемую ткань разрушают до выполнения центрифугирования в градиенте плотности. Ткань может быть разрушена механическими методами, такими как, например, измельчение, электропорацией и/или химическими методами, такими как обработка ферментами. Лейкоциты можно выделить непосредственно у доноров при помощи лейкофереза. В настоящем изобретении можно также использовать неочищенные препараты костного мозга или ткани, содержащие лимфоциты. Такие препараты необходимо разрушить, например, вышеописанными методами для облегчения распределения отдельных клеток.
Другим отличительным признаком настоящего изобретения является обогащение лимфоцитсодержащей фракции клеток, например, цельной крови, мононуклеарных клеток, лейкоцитов или костного мозга, в отношении определенной популяции лимфоцитов, такой как клетки из линий В-лимфоцитов или Т-лимфоцитов. Обогащение В-лимфоцитов можно произвести, например, при помощи сортировки клеток методом магнитных гранул или сортировки клеток с возбуждением флуоресценции (FACS), используя специфичные к данной линии маркерные белки клеточной поверхности, такие как CD19 или другие маркеры, специфичные к линии В-клеток. Обогащение Т-лимфоцитов можно произвести, например, при помощи маркера клеточной поверхности, такого как CD3, или других маркеров, специфичных к линии Т-клеток.
Предпочтительным отличительным признаком настоящего изобретения является дополнительная сортировка обогащенных В-лимфоцитов для получения плазматических клеток до распределения отдельных клеток в несколько сосудов. Плазматические клетки обычно выделяют при помощи сортировки методом FACS, используя поверхностные маркеры, такие как CD38, возможно, в сочетании с CD45. Кроме того, можно использовать другие поверхностные маркеры, специфичные к плазматическим клеткам, или их комбинации, например CD138, CD20, CD21, CD40, CD9, HLA-DR или CD62L, причем выбор маркера зависит от источника плазматических клеток, такого как миндалины, кровь или костный мозг. Плазматические клетки можно также выделить из необогащенной лимфоцитсодержащей популяции клеток, полученной из любых вышеуказанных источников. Плазматические клетки, выделенные из крови, иногда называют ранними плазматическими клетками или лимфобластами. В настоящем изобретении указанные клетки также именуются плазматическими клетками, хотя они являются CD19-положительными клетками в отличие от плазматических клеток, находящихся в костном мозге. Для выделения родственных пар последовательностей, кодирующих иммуноглобулины, желательно использовать плазматические клетки, так как при более высокой частоте встречаемости указанные клетки продуцируют антигенспецифические антитела, которые отражают приобретенный иммунитет к требуемому антигену, при этом большинство указанных клеток подверглось соматической сверхмутации и поэтому кодирует высокоаффинные антитела. Кроме того, в плазматических клетках повышены уровни мРНК по сравнению с остальной популяцией В-лимфоцитов, благодаря чему обратная транскрипция оказывается более эффективной при использовании отдельных плазматических клеток. В качестве альтернативы выделению плазматических клеток из лимфоцитсодержащей фракции клеток можно выделить В-клетки памяти, используя маркер клеточной поверхности, такой как CD22.
Альтернативным отличительным признаком настоящего изобретения является отбор обогащенных В-лимфоцитов в отношении антигенной специфичности до распределения клеток в несколько сосудов. Антигенспецифические В-лимфоциты отбирают, осуществляя контактирование обогащенных В-лимфоцитов с требуемым антигеном или антигенами, в результате которого происходит связывание антигена с поверхностным иммуноглобулином и последующее выделение связанных клеток. Вышеуказанный отбор можно произвести путем нанесения на магнитные гранулы требуемого антигена или антигенов и путем сортировки клеток методом магнитных гранул, FACS, введения антигенов в колонку и выполнения аффинной хроматографии, скрининга на фильтре или других методов, известных в данной области. При желании отбору на антигенную специфичность можно подвергнуть плазматические клетки, а также В-лимфоциты, необогащенные мононуклеарные клетки, лейкоциты, цельную кровь, костный мозг или препараты ткани.
Другим отличительным признаком настоящего изобретения является сортировка обогащенных Т-лимфоцитов (например, CD3-положительных клеток) с использованием поверхностных маркеров CD45R0 и/или CD27 для получения фракции Т-клеток памяти. Т-лимфоциты можно также отобрать с учетом МНС-антигенной специфичности, используя комплексы МНС-пептид (см., например, публикации Callan, M.F et al. 1998, J. Exp. Med. 187, 1395-1402; Novak, E.J. et al. 1999, J. Clin. Invest. 104, R63-R67).
Другим отличительным признаком настоящего изобретения является иммортализация любых вышеописанных выделенных фракций клеток (например, В-лимфоцитов, плазматических клеток, клеток памяти или Т-лимфоцитов). Иммортализация может быть, например, выполнена при помощи вируса Эпштейна - Барра (Traggiai, E. et al., 2004, Nat. Med. 10, 871-875) перед распределением клеток по пробиркам. Альтернативно, выделенные отдельные клетки могут быть иммортализованы и размножены до выполнения обратной транскрипции. (Traggiai et al., Nat. Med. 2004, Aug.; 10(8):871-5).
Другим отличительным признаком настоящего изобретения является распределение популяции требуемых клеток (например, клеток гибридомы, линий клеток В-лимфоцитов или Т-лимфоцитов, клеток цельной крови, клеток костного мозга, мононуклеарных клеток, лейкоцитов, В-лмфоцитов, плазматических клеток, антигенспецифических В-лимфоцитов, В-клеток памяти, Т-лимфоцитов, антиген/МНС-специфических Т-лимфоцитов или Т-клеток памяти) в несколько сосудов для получения популяции выделенных отдельных клеток. Выделение отдельных клеток обозначает физическое отделение клеток от популяции клеток таким образом, чтобы в одном сосуде находилась одна клетка, или нанесение клеток на микроматрицу, чип или гелевую матрицу с возможностью получения отдельных клеток. Клетки можно распределить непосредственно в несколько рядом стоящих сосудов методом ограниченного разведения. Сосуды, используемые в настоящем изобретении, предпочтительно, аналогичны сосудам, применяемым для выполнения PCR (например, пробирки для РCR, 96-луночные или 384-луночные планшеты для РCR или более крупные массивы сосудов). Однако также можно использовать другие сосуды. При распределении отдельных клеток в большое число отдельных сосудов (например, 384-луночные планшеты) получают популяцию отдельных клеток. Распределение можно произвести путем дозированного введения определенного объема в отдельный сосуд, в котором средняя концентрации клеток равна одной, 0,5 или 0,3 клетки, в результате чего получают сосуды, в среднем содержащие одну клетку или меньше. Так как распределение клеток методом ограниченного разведения является статистическим методом, то часть сосудов будет пуста, основная часть сосудов будет содержать одну клетку и незначительная часть сосудов будет содержать две или несколько клеток. При нахождении в сосуде двух или несколько клеток может произойти некоторая перестановка последовательностей, кодирующих вариабельные области, из клеток, присутствующих в сосуде. Однако, так как такой результат является несущественным, он не будет влиять на общую применимость настоящего изобретения. Кроме того, сочетания последовательностей, кодирующих вариабельные области, которые не обладают требуемым сродством и специфичностью связывания, по-видимому, не будут отобраны и, следовательно, будут исключены в процессе скрининга. Поэтому незначительные случаи перестановки последовательностей не будут существенно влиять на конечную библиотеку по настоящему изобретению.
Существуют альтернативы распределению клеток методом ограниченного разведения, например клеточные сортеры, такие как FACS или роботы, которые могут быть запрограммированы на точное распределение отдельных клеток в отдельные сосуды. Подобные альтернативные методы более предпочтительны, так как они являются менее трудоемкими и более эффективными для достижения однородного распределения отдельных клеток в отдельные сосуды.
Вышеописанные методы обогащения, сортировки и выделения клеток выполняют таким образом, чтобы большинство клеток оставалось интактными. Разрушение клеток во время обогащения или сортировки может привести к перестановке последовательностей, кодирующих вариабельные области. Однако данная проблема не должна иметь серьезных последствий, так как предполагается, что частота разрушения клеток будет низкой. Благодаря промывке и возможной обработке клеток РНКазой до их распределения в отдельные сосуды будет удалена любая РНК, выделившаяся из клеток.
Кроме того, при ознакомлении с приведенным выше описанием распределения клеток для получения популяции отдельных клеток в нескольких отдельных сосудах указанное требование нельзя интерпретировать как абсолютно необходимый отличительный признак, в соответствии с которым в каждом сосуде должна находиться одна клетка. Вышеуказанный признак скорее предполагает, что в большинстве сосудов должны находиться отдельные клетки, например число сосудов с двумя или более клетками составляет менее 25% от общего количества распределенных клеток или даже менее 10%.
Другим отличительным признаком настоящего изобретения является выполнение обратной транскрипции с использованием матрицы, полученной из клеток, распределенных по одной в несколько сосудов.
В соответствии с целями обратной транскрипции (RT) по настоящему изобретению нуклеиновые кислоты в отдельной клетке, которая должна служить источником матрицы для RT, должны быть получены из одной клетки, хотя они, необязательно, должны быть отделены от остального содержания данной отдельной клетки.
После окончательного распределения отдельных клеток по отдельным сосудам отдельные клетки могут быть размножены для получения популяции изогенных клеток до выполнения обратной транскрипции. Таким образом увеличивается выход мРНК, используемой в качестве матрицы, что может иметь важное значение при амплификации и связывании редкой мишени. Однако клетки должны оставаться генетически идентичными в отношении гена-мишени во время размножения. Изолированные клетки или популяция изогенных клеток могут быть интактными или лизированными, если при этом не вырождается матрица для обратной транскрипции. Клетки предпочтительно лизируют, чтобы облегчить последующую обратную транскрипцию и амплификацию методом PCR.
В другом варианте осуществления настоящего изобретения описанный метод множественной RT-PCR c удлинением цепи путем перекрывания или множественной RT-PCR с последующим связыванием путем лигирования или рекомбинации также может быть выполнен на матрице, полученной из генетически разной популяции клеток, которые не были распределены по отдельным сосудам и остаются вместе в виде пула клеток. Указанный метод может быть использован для создания комбинаторных библиотек. Такой метод не требует распределения отдельных клеток. Однако клетки, которые могут быть использованы при осуществлении данного метода, должны быть аналогичны клеткам, применяемым в методе с использованием отдельных клеток, и представлять собой, например, популяцию (пул) сортированных В-лимфоцитов или Т-лимфоцитов. При выполнении одностадийной множественной RT-PCR с удлинением цепи путем перекрывания или одностадийной множественной RT-PCR с последующим связыванием путем лигирования или рекомбинации в такой популяции клеток желательно лизировать клетки до осуществления реакции, при этом при желании из лизата может быть выделена общая РНК или мРНК.
Чувствительность одностадийной множественной RT-PCR с удлинением цепи путем перекрывания по настоящему изобретению позволяет использовать очень небольшое количество матрицы. Как показано в примерах 2 и 3, одностадийная множественная RT-PCR с удлинением цепи путем перекрывания может быть выполнена на матрице, количество которой соответствует лизату отдельной клетки.
Смеси праймеров и их создание
Смеси праймеров по настоящему изобретению включают по крайней мере четыре праймера, образующих наборы праймеров, содержащие по два праймера в каждом, которые способны амплифицировать по крайней мере две интересующие разные заданные последовательности. Смеси двух или нескольких таких наборов праймеров образуют смесь множественных праймеров. Смесь множественных праймеров, предпочтительно, содержит по крайней мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 наборов праймеров (пар праймеров). В частности, для амплификации последовательностей, кодирующих вариабельные области, отдельные наборы праймеров в составе смеси множественных праймеров содержат более двух праймеров. Отдельный набор праймеров, предпочтительно, содержит по крайней мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 45, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 220, 240, 260, 280 или 300 праймеров. Общее число праймеров в смеси множественных праймеров, предпочтительно, составляет по крайней мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 45, 50, 60, 70, 80, 90, 100, 125, 150 или 200 и самое большее 225, 250, 275, 300, 325, 350, 375 или 400 праймеров.
Все праймеры по настоящему изобретению содержат геноспецифическую область, и, предпочтительно, все праймеры дополнительно имеют концевой сегмент у 5'-конца праймера, то есть 5'-концевые некодирующие последовательности, которые слиты с 3'-концом геноспецифической части праймера. Такой концевой сегмент праймера содержит примерно от 6 до 50 нуклеотидов, но при желании может быть длиннее. В процессе амплификации концевые сегменты праймера присоединяются к заданным последовательностям.
Концевые сегменты праймера по настоящему изобретению являются, например, клонирующими и связывающими концевыми сегментами, концевыми сегментами, адаптированными для связывания лигированием, концевыми сегментами, адаптированными для связывания рекомбинацией, или концевыми сегментами удлинения цепи путем перекрывания.
Клонирующие концевые сегменты могут содержить 6-20 или большее число нуклеотидов и содержать сайты рестрикции и/или сайты рекомбинации, которые могут использоваться для вставки связанного продукта в соответствущий вектор.
Для связывания лигированием наборы праймеров в составе смеси множественных праймеров создают таким образом, чтобы одна часть (основной или обратный праймер) первого набора праймеров имела связывающий концевой сегмент, содержащий сайт рестрикции, который при расщеплении должен быть совместим с сайтом рестрикции, расположенным в связывающем концевом сегменте одной части второго набора праймеров. Для связывания более двух заданных последовательностей вторая часть второго набора праймеров содержит сайт рестрикции, который при расщеплении должен быть совместим с сайтом рестрикции, расположенным в одной части третьего набора праймеров. Второй сайт рестрикции, расположенный во втором наборе праймеров, должен быть несовместим с вышеуказанным сайтом рестрикции первого набора праймеров. Благодаря подобному созданию наборов праймеров можно связать значительное число заданных последовательностей. В заданных последовательностях должны быть выбраны редко встречающиеся или вообще отсутствующие сайты рестрикции. Кроме того, желательно, чтобы совместимые сайты рестрикции не были идентичными, чтобы сайт лигирования был устойчив к расщеплению определенными используемыми рестрикционными ферментами. Благодаря этому реакция должна быть направлена на связывание первой заданной последовательности со второй заданной последовательностью, так как связь между идентичными заданными последовательностями будет расщепляться рестрикционными ферментами. Приемлемыми парами сайтов рестрикции являются, например, SpeI и XbaI (альтернативно NheI или AvrII могут заменять один или оба указанных фермента), NcoI и BspHI, EcoRI и MfeI или PstI и NsiI. Для осуществления связывания SpeI может находиться, например, в первой заданной последовательности, XbaI может находиться во второй заданной последовательности, NcoI может находиться у другого конца второй заданной последовательности, BsрHI может находиться в третьей заданной последовательности и так далее. Для дальнейшего облегчения процесса желательно использовать указанные рестрикционные ферменты в одном буфере.
Для связывания рекомбинацией наборы праймеров в смеси множественных праймеров могут быть, например, созданы в соответствии с описанием, приведенным в статье Чапала (Chapal, 1997, Bio Techniques 23, 518-524), которая включена в данное описание изобретения в качестве ссылки.
Для связывания интересующих нуклеотидных последовательностей на одной стадии с амплификацией методом множественной PCR по крайней мере к одному праймеру в каждом наборе праймеров смеси множественных праймеров добавляют концевые сегменты, адаптированные для PCR с удлинением цепи путем перекрывания, в результате чего получают смесь множественных праймеров для удлинения цепи путем перекрывания.
Концевые сегменты удлинения цепи путем перекрывания обычно являются более длинными, включая от 8 до 75 нуклеотидов, и могут содержать сайты рестрикции или сайты рекомбинации, которые обеспечивают последующую вставку регуляторных элементов, таких как промоторы, сайты связывания рибосом, терминирующие последовательности или линкерные последовательности, как, например, в scFv. Концевой сегмент удлинения цепи путем перекрывания может также при желании содержать терминирующий кодон. Обычно существуют три типа концевых сегментов удлинения цепи путем перекрывания, как показано на фиг.1. Концевые сегменты удлинения цепи путем перекрывания типа I в двух наборах праймеров перекрывают только друг друга. Все нуклеотиды двух концевых сегментов удлинения цепи путем перекрывания необязательно являются комплементарными друг другу. В соответствии с одним объектом настоящего изобретения комплементарные нуклеотиды составляют 60-85% концевого сегмента удлинения цепи путем перекрывания. В концевых сегментах удлинения цепи путем перекрывания типа II 4-6 5'-концевых нуклеотидов являются комплементарными геноспецифической области смежной заданной последовательности. В концевых сегментах удлинения цепи наложением типа III все перекрывающие нуклеотиды являются комплементарными смежной заданной последовательности. Концевые сегменты удлинения цепи путем перекрывания типа I и II являются предпочтительными при последующем введении регуляторных и подобных элементов между связанными заданными последовательностями. Концевые сегменты удлинения цепи путем перекрывания типа II являются предпочтительными, если заданные последовательности должны быть связаны определенным линкером, как это имеет место в случае scFv. Концевые сегменты удлинения цепи путем перекрывания типа III являются предпочтительными, если заданные последовательности должны быть связаны друг с другом в рамке считывания.
Создание концевых сегментов удлинения цепи путем перекрывания зависит от отличительных признаков последователности, таких как длина, относительное содержание GC (GC%), наличие сайтов рестрикции, палиндромы, температура плавления, геноспецифическая часть, с которой они связаны, и т.д. Длина концевых сегментов удлинения цепи путем перекрывания должна быть равна 8-75 нуклеотидам, предпочтительно 15-40 нуклеотидам. Длина таких сегментов еще предпочтительнее равна 22-28 нуклеотидам. Использование очень длинных концевых сегментов удлинения цепи путем перекрывания (50-75 нуклеотидов) может способствовать связыванию продуктов, продуцированных каждым набором праймеров. Однако при использовании очень длинных концевых сегментов удлинения цепи путем перекрывания необходимо отрегулировать соотношение между длиной концевого сегмента удлинения цепи путем перекрывания и геноспецифической областью. Выбор значения GC% зависит от длины концевого сегмента удлинения цепи путем перекрывания. Так как более короткие концевые сегменты имеют меньшую площадь, то в тех случаях, когда они являются комплементарными, необходимо более высокое значение GC% для усиления взаимодействия, чем при использовании более длинных концевых сегментов. Необходимо соблюдать другие принципы создания праймеров, например, следует мининизировать димеризацию праймеров и образование “шпилек”. Праймеры не должны вызывать ложную инициацию. Кроме того, известно, что Taq ДНК-полимераза часто добавляет аденозин (А) к 3'-концу только что синтезированной цепи ДНК, и это должно быть учтено при создании концевого сегмента удлинения цепи путем перекрывания путем адаптации концевых сегментов удлинения цепи путем перекрывания к нематричному добавлению аденозина к 3'-концу.
Выбор праймеров, несущих связывающий концевой сегмент, например концевой сегмент удлинения цепи путем перекрывания, концевой сегмент, адаптированный для связывания лигированием, или концевой сегмент, адаптированный для связывания рекомбинацией, определяет порядок и направление связывания заданных последовательностей. Для настоящего изобретения неважно, являются ли праймеры, имеющие связывающий концевой сегмент, основными или обратными праймерами в наборе праймеров или, возможно, как верхними, так и нижними праймерами. Однако данному вопросу необходимо уделить внимание, так как порядок и направление заданных последовательностей в конечном продукте может иметь определенное значение, например, для вставки регуляторных элементов, таких как промоторы и терминирующие последовательности, или для связывания отдельных заданных последовательностей внутри рамки считывания.
Для связывания двух интересующих нуклеотидных последовательностей связывающий концевой сегмент может быть добавлен к обратным или основным праймерам в каждом наборе праймеров, используемом для амплификации методом PCR каждой заданной последовательности. В настоящем изобретении описано добавление концевых сегментов удлинения цепи путем перекрывания и концевых сегментов, адаптированных для связывания лигированием, к основным праймерам для VН и VL в каждом наборе (см. соответственно фиг.1 и пример 9). В данном случае связывание продуктов происходит в направлении от 5'-конца к 5'-концу (головной сегмент с головным сегментом и двунаправленное связывание). Однако связывающие концевые сегменты могут быть также добавлены к обратным праймерам в каждом наборе (например, праймеры для Ск и/или Сλ в первом наборе и праймеры для СH или JH во втором наборе). В данном случае связывание продуктов происходит в направлении от 3'-конца к 3'-концу (концевой сегмент с концевым сегментом и двунаправленное связывание). Третьим вариантом является добавление связывающих концевых сегментов к обратным праймерам в первом наборе праймеров (например, праймеры для Ск и/или Сλ) и к основным праймерам во втором наборе праймеров (например, праймеры для VН) или наоборот. Таким образом, получают ориентацию в направлении от 3'-конца к 5'-концу (головной сегмент с концевым сегментом и однонаправленное связывание). На фиг.3 показаны возможные направления, которые могут быть получены в зависимости от того, какие праймеры в каждом наборе праймеров имеют связывающий концевой сегмент.
При связывании более двух интересующих нуклеотидных последовательностей в некоторых наборах праймеров связывающие концевые сегменты должны быть как у основных, так и у обратных праймеров, при этом один концевой сегмент является комплементарным концевому сегменту предшествующего набора праймеров и другой концевой сегмент является комплементарным одному из праймеров в последующем наборе праймеров. Этот принцип должен соблюдаться в отношении всех наборов праймеров, служащих для амплификации заданных последовательностей, предназначенных для связывания между двумя другими заданными последовательностями.
При создании геноспецифической части праймера обычно необходимо соблюдать известные правила создания праймеров, такие как минимизация димеризации праймеров, образования “шпилек” и неспецифической гибридизации. Кроме того, по возможности необходимо избегать нескольких нуклеотидов G и С в качестве основы 3'-конца. Температура плавления (Тm) геноспецифических областей в наборе праймеров предпочтительно должна быть одинаковой плюс/минус 5°С. В настоящем изобретении желательны значения Тm в интервале от 45°С до 75°С, при этом для большинства применений оптимальными являются значения Тm около 60°С. Праймер может быть первоначально создан при помощи компьютерных программ, разработанных для выполнения данной задачи. Однако созданные праймеры обычно требуют лабораторной проверки и оптимизации. Такую проверку можно произвести, анализируя размер и полиморфизм длины рестрикционных фрагментов (RFLP) и секвенируя продукты амплификации, полученные с использованием созданных наборов праймеров. Можно успешно использовать вырожденные положения в праймерах для амплификации последовательностей с вариабельными областями или для поиска новых членов семейства, относящихся к установленному классу белков. Число вырожденных положений может также потребовать оптимизации.
Настоящее изобретение относится к усовершенствованным наборам праймеров, которые могут быть использованы вместе в очень сложной смеси. В качестве основы был использован набор праймеров, описанный в публикации de Haard (de Haard, H.J. et al., 1999, J. Biol. Chem. 274, 18218-18230), который был модифицирован путем обрезки 3'-концов праймеров для уменьшения неспецифических взаимодействий и добавления концевых сегментов удлинения цепи путем перекрывания или концевых сегментов, адаптированных для связывания лигированием.
Одним из отличительных признаков настоящего изобретения являются смеси праймеров, состоящие по крайней мере из двух наборов праймеров, способных инициировать амплификацию и стимулировать связывание по крайней мере двух интересующих нуклеотидных последовательностей. Смеси праймеров по настоящему изобретению могут инициировать амплификацию по крайней мере двух субъединиц или доменов в гетеромерных белках, например, относящихся к классу ферментов, ингибиторов, структурных белков, токсинов, каналообразующих белков, G-белков, рецепторных белков, белков надсемейства иммуноглобулинов, транспортирующих белков и т.д.
Другим отличительным признаком настоящего изобретения является смесь множественных праймеров для удлинения цепи путем перекрывания, включающая наборы праймеров, в которых по крайней мере один праймер в каждом наборе праймеров имеет концевой сегмент удлинения цепи путем перекрывания, способный гибридизировать с концевым сегментом удлинения цепи путем перекрывания одного праймера в другом наборе праймеров.
Концевые сегменты удлинения цепи путем перекрывания делают возможным немедленное связывание интересующих нуклеотидов в процессе амплификации методом множественной PCR с удлинением цепи путем перекрывания благодаря тому, что к каждому продукту, образующемуся при помощи наборов праймеров, добавляется концевой сегмент, комплементарный присоединяемому продукту. Из вышеизложенного, однако, не следует, что связывание обязательно произойдет во время первой амплификации методом PCR. В зависимости от характера реакции большая часть фактического связывания может произойти во время дополнительной амплификации при помощи внешних праймеров, используемых в первой амплификации методом PCR (амплификация методом множественной PCR).
Другим отличительным признаком настоящего изобретения является набор праймеров, предназначенный для амплификации семейства нуклеотидных последовательностей, содержащих последовательности, кодирующие вариабельные области. Примерами таких семейств являются легкие каппа-цепи (например, VKI-VI у человека), легкие лямбда-цепи (например, VL1-10 у человека) и вариабельные области тяжелых цепей (например, VH1-7 у человека и VH1-15 у мышей) иммуноглобулинов, а также варибельные области α-, β-, γ- или δ-цепей ТсR. Набор праймеров для амплификации семейства нуклеотидных последовательностей, содержащих последовательности, кодирующие вариабельные области, часто включает несколько праймеров, часть которых может быть вырожденными праймерами. Амплификацию последовательностей, кодирующих вариабельные области легкой цепи семейств иммуноглобулинов, например, выполняют при помощи набора праймеров, содержащего несколько праймеров, комплементарных 5'-концу вариабельной области каппа-цепи (праймера для VLк), или лидерной последовательности каппа-цепи (праймер для VLкL) и/или лямбда-цепи (праймер для VLλ), или лидерной последовательности лямбда-цепи (праймер для VLλL) (основные праймеры), вместе с несколькими праймерами для константной области каппа-цепи (праймер для Ск) и/или лямбда-цепи (праймер для Сλ) (обратные праймеры). Альтернативно праймеры для соединительной области легкой цепи (праймеры для JLк и/или JLλ) можно использовать в качестве обратных праймеров вместо праймеров для константной области. Альтернативно основные праймеры гибридизируют с областью UTR, предшествующей лидерной последовательности вариабельной области легкой цепи. Последовательности, кодирующие вариабельную область тяжелой цепи семейств иммуноглобулинов, могут быть также амплифицированы при помощи одного набора праймеров с использованием разных комбинаций праймеров. Например, несколько праймеров, комплементарных 5'-концу вариабельной области тяжелой цепи (праймер для VН) или лидерной последовательности данной области (праймер для VHL) (основные праймеры), можно использовать вместе с несколькими праймерами для соединительной области тяжелой цепи (праймер для JН) или праймерами для константной области тяжелой цепи (обратные праймеры). Праймер для СН может быть изотип-специфическим, и в принципе можно использовать любой праймер для СН (например, СН1, СН2, СН3 или СН4), а также праймер, который позволит получить непроцессированную тяжелую цепь. Альтернативно, основные праймеры гибридизируют с областью UTR, предшествующей лидерной последовательности вариабельной области тяжелой цепи.
Использование основных праймеров, гибридизирующих с лидерной последовательностью вместо 5'-конца вариабельной области, является особенно полезным при обнаружении перекрестной гибридизации праймеров для вариабельной области, так как мутации, возникающие вследствие перекрестной гибридизации, будут удалены из конечного белка вследствие отщепления лидерных последовательностей во время процессинга белка внутри клетки. В примере 9 описано создание праймеров для лидерных последовательностей вариабельной области тяжелой цепи и легкой каппа-цепи антитела. То, что сайт инициации находится в 3'-конце последовательности, кодирующей лидерную последовательность (С-концевая), является преимуществом по сравнению с ранее известными праймерами для лидерной последовательности антитела, так как это позволяет переносить амплифицированные последовательности между бактериальными и эукариотическими экспрессирующими векторами с получением функциональных лидерных последовательностей в обеих системах. Система, описанная в примере 9, может быть легко применена к легким лямбда-цепям антитела, а также к α-, β-, γ- или δ-цепям ТсR.
Одним из отличительных признаков настоящего изобретения являются праймеры, гибридизирующие c 3'-концом последовательности, кодирующей лидерную последовательность, которая предшествует последовательности, кодирующей вариабельную область, и их применение для амплификации последовательностей, кодирующих вариабельные области.
Предпочтительным отличительным признаком настоящего изобретения является применение праймеров, характеризующихся по крайней мере 90% идентичностью последовательностей (предпочтительно по крайней мере 95% идентичностью) с геноспецифической областью SEQ ID NO:86-92, которые соответствуют праймерам, гибридизирующим с С-концом последовательностей, кодирующих лидерную последовательность тяжелой цепи (праймер для VHL). Геноспецифическая последовательность указанных SEQ ID NO соответствует 18-му основанию в направлении 3'-конца указанных последовательностей (см. также таблицу 11).
Другим предпочтительным отличительным признаком настоящего изобретения является применение праймеров, характеризующихся по крайней мере 90% идентичностью последовательностей (предпочтительно по крайней мере 95% идентичностью) с геноспецифической областью SEQ ID NO:93-98, которые соответствуют праймерам, гибридизирующим с С-концом последовательностей, кодирующих лидерные последовательности легкой каппа-цепи (праймер для VLкL). Геноспецифическая последовательность указанных SEQ ID NO соответствует 25-му основанию в направлении 3'-конца указанных последовательностей (см. также таблицу 11).
В одном варианте осуществления настоящего изобретения смесь множественных праймеров для удлинения цепи путем перекрывания, используемая для выполнения множественной PCR с удлинением цепи путем перекрывания и, возможно, для осуществления стадии обратной транскрипции, включает также а) по крайней мере один праймер для CL или JL, комплементарный смысловой цепи последовательности, кодирующей область легкой цепи иммуноглобулина; b) по крайней мере один 5'-концевой праймер для VL или праймер для лидерной последовательности VL, комплементарный антисмысловой цепи последовательности, кодирующей вариабельную область легкой цепи иммуноглобулина, и способный образовывать набор праймеров с праймерами по пункту а); с) по крайней мере один праймер для СH или JH, комплементарный смысловой цепи последовательности, кодирующей константный домен тяжелой цепи иммуноглобулина или соединительной области тяжелой цепи; и d) по крайней мере один 5'-концевой праймер для VH или праймер для лидерной последовательности VH, комплементарный антисмысловой цепи последовательности, кодирующей вариабельную область тяжелой цепи иммуноглобулина, и способный образовывать набор праймеров с праймерами по пункту с).
Наборы праймеров по настоящему изобретению, например, могут представлять собой VLк + Cк, VLλ + Cλ, VLк + JLк, VLλ + JLλ, VLкL + Cк, VLλL + Cλ, VLкL + JLк, VLλL + JLλ, VH + JH, VH + CH, VHL + JН, VHL + CН или их комбинации, способные амплифицировать заданную последовательность, кодирующую вариабельную область.
В другом варианте осуществления изобретения использованы праймеры для СL (JL) и праймеры для VL (VLL), адаптированные для амплификации последовательностей, включающих вариабельные области легкой каппа-цепи или вариабельные области легкой лямбда-цепи.
В предпочтительном варианте осуществления настоящего изобретения использованы праймеры для CL (JL) и праймеры для VL (VLL), адаптированные для амплификации последовательностей, кодирующих вариабельные области как легких каппа-цепей, так и легких лямбда-цепей.
В еще более предпочтительном варианте осуществления настоящего изобретения использованы основные праймеры для амплификации легких цепей VLL, характеризующиеся по крайней мере 90% идентичностью последовательностей (предпочтительно по крайней мере 95% идентичностью) с геноспецифической областью SEQ ID NO:93-98, и основные праймеры для амплификации тяжелых цепей VHL, характеризующиеся по крайней мере 90% идентичностью (предпочтительно по крайней мере 95% идентичностью) с геноспецифической областью SEQ ID NO:86-92.
В другом варианте осуществления настоящего изобретения праймеры для VL/VLL и VH/VHL иммуноглобулина имеют связывающие концевые сегменты, предпочтительно в форме комплементарных концевых сегментов удлинения цепи путем перекрывания. Указанные праймеры позволяют получить последовательности, кодирующие вариабельные области, которые связаны в направлении “головной сегмент - головной сегмент”. Для связывания последовательностей, кодирующих вариабельные области, в направлении “головной сегмент - концевой сегмент” праймеры для CL/JL и VH/VHL содержат связывающие концевые сегменты или праймеры для VL/VLL и CH/JH содержат связывающие концевые сегменты предпочтительно в форме комплементарных концевых сегментов удлинения цепи путем перекрывания. Для связывания последовательностей, кодирующих вариабельные области, в направлении “концевой сегмент - концевой сегмент” праймеры для CL/JL и CH/JH имеют связывающие концевые сегменты предпочтительно в форме комплементарных концевых сегментов удлинения цепи путем перекрывания (фиг.3).
Смеси множественных праймеров, в том числе смеси множественных праймеров для удлинения цепи путем перекрывания по настоящему изобретению, включают два набора праймеров. Таким образом, смесь множественных праймеров включает по крайней мере четыре разных праймера. В соответствии с другим объектом настоящего изобретения смесь множественных праймеров включает более четырех разных праймеров. Смесь множественных праймеров по настоящему изобретению используют для амплификации заданных последовательностей в одном сосуде. Например, в одном сосуде можно амплифицировать все вариабельные области каппа-, лямбда-цепей и тяжелых цепей. Одна смесь множественных праймеров по настоящему изобретению содержала 16 разных вырожденных праймеров, распределенных следующим образом: восемь праймеров для VH, один праймер для СH1, шесть праймеров для VLк и один праймер для Ск (фиг.2). Другой набор праймеров включал 19 вырожденных праймеров, распределенных следующим образом: восемь праймеров для VH, четыре праймера для JH, шесть праймеров для VLк и один праймер для Ск. Третий набор праймеров включал 22 вырожденных праймера, распределенных следующим образом: восемь праймеров для VH, один праймер для СH1, одиннадцать праймеров для VLλ и два праймера для Cλ. Четвертый набор праймеров включал 27 вырожденных праймеров, распределенных следующим образом: восемь праймеров для VH, один праймер для СH1, шесть праймеров для VLк, один праймер для Ск, одиннадцать праймеров для VLλ и два праймера для Сλ.
Настоящее изобретение относится также к праймерам для дополнительной амплификации методом РCR связанных продуктов, полученных при помощи множественной RT-PCR с последующим связыванием путем лигирования или рекомбинации либо при помощи множественной RT-PCR с удлинением цепи путем перекрывания. Дополнительную амплификацию методом PCR можно выполнить, используя смесь праймеров, адаптированную для амплификации связанных заданных последовательностей. Такая смесь праймеров может содержать внешние праймеры смеси множественных праймеров или смеси множественных праймеров для удлинения цепи путем перекрывания, которые являются праймерами, гибридизирующими с крайним 5'-концом и 3'-концом смысловой цепи связанных нуклеотидных последовательностей, делая возможной амплификацию всего связанного продукта. Одним примером праймеров, которые могут быть использованы в качестве внешних праймеров в настоящем изобретении, являются праймеры для Cк/Jк и/или Сλ/Jλ, образующие набор праймеров с праймерами для JН или СН. Дополнительная амплификация обычно служит для увеличения количества связанного продукта, полученного в результате множественной RT-PCR с последующим связыванием путем лигирования или рекомбинации либо в результате множественной RT-PCR с удлинением цепи путем перекрывания.
Альтернативно, для дополнительной амплификации связанных нуклеотидных последовательностей можно использовать набор праймеров, который является гнездовым по сравнению с внешними праймерами, используемыми при выполнении первичной реакции множественной RT-PCR или множественной RT-PCR с удлинением цепи путем перекрывания. В настоящем изобретении такой набор праймеров именуется гнездовым набором праймеров. Гнездовые праймеры обычно создают в соответствии с такими же правилами, что и ранее описанные геноспецифические праймеры, за исключением того, что они инициируют 3'-конец в положении гибридизации внешних праймеров, используемых в множественной RT-PCR или множественной RT-PCR с удлинением цепи путем перекрывания. Поэтому продукт, образующийся в результате выполнения гнездовой PCR, является короче связанного продукта, полученного в результате множественной RT-PCR с последующим связыванием путем лигирования или рекомбинации либо в результате множественной RT-PCR с удлинением цепи путем перекрывания. Помимо увеличения количества связанного продукта гнездовая PCR служит также для повышения общей специфичности, особенно метода множественной RT-PCR с удлинением цепи путем перекрывания. Однако следует отметить, что не все вышеописанные смеси множественных праймеров/смеси множественных праймеров для удлинения цепи путем перекрывания пригодны для использования в комбинации с гнездовым набором праймеров при выполнении дополнительной амплификации. В таких случаях для дополнительной амплификации можно использовать внешние праймеры смеси множественных праймеров/смеси множественных праймеров для удлинения цепи путем перекрывания или выполнить полугнездовую PCR, которая будет описана ниже.
В одном из вариантов осуществления настоящего изобретения в качестве гнездовых праймеров для дополнительной амплификации связанных последовательностей, кодирующих вариабельные области иммуноглобулина, используют праймеры для JL и JH.
Гнездовые наборы праймеров по настоящему изобретению могут также включать обратные (или основные) внешние праймеры из первой смеси множественных праймеров/смеси множественных праймеров для удлинения цепи путем перекрывания и второй гнездовой смеси праймеров, которые инициируют 3'-конец в положении гибридизации основных (или обратных) внешних праймеров первой смеси множественных праймеров/смеси множественных праймеров для увеличения цепи путем перекрывания. Использование такого набора праймеров для дополнительной амплификации методом PCR известно как полугнездовая PCR. Полугнездовая PCR может быть выполнена, например, в том случае, если трудно создать гнездовой праймер в одной специфической области, например, для последовательностей, кодирующих вариабельные области, (праймеры для V и J), так как такой праймер должен гибридизировать с гипервариабельными участками (CDR). Кроме того, полугнездовую PCR можно использовать в тех случаях, когда желательно сохранить интактным один конец связанных последовательностей, например, для клонирования.
В соответствии с одним из отличительных признаков настоящего изобретения последовательность, кодирующая константную область легкой цепи, остается интактной в процессе дополнительной амплификации. (Обратные) праймеры для CL, используемые для дополнительной амплификации, лишь незначительно модифицируются по сравнению с внешними праймерами, используемыми для первичной реакции (множественная RT-PCR или множественная RT-PCR с удлинением цепи путем перекрывания). Модификация включает добавление нескольких оснований к 3'-концу праймеров для CL, используемых для первичной амплификации. Кроме того, к гнездовым праймерам для СL может быть добавлен другой клонирующий концевой сегмент. Основные праймеры, используемые для дополнительной амплификации, являются полностью гнездовыми по сравнению с внешними праймерами, специфичными к константной области тяжелой цепи, используемыми в первичной реакции. Объединенное использование внешних праймеров в первичной реакции и незначительно модифицированных гнездовых праймеров для CL вместе с полностью гнездовыми основными праймерами в реакции дополнительной амплификации вызывает увеличение специфичности, сравнимое с достигаемым при выполнении гнездовой PCR с использованием полностью гнездового набора праймеров.
В предпочтительном варианте осуществления настоящего изобретения гнездовую PCR выполняют с использованием праймеров для JН и модифицированных праймеров для СL, к 3'-концу которых добавляют от 2 до 10 геноспецифических пар оснований по сравнению с первыми праймерами для СL в смеси множественных праймеров/смеси множественных праймеров для удлинения цепи путем перекрывания.
Оптимизация множественной PCR с удлинением цепи путем перекрывания
Параметры множественной PCR с удлинением цепи путем перекрывания как в двухстадийном методе, так и в одностадийном методе могут быть оптимизированы в нескольких отношениях (см., например, публикации Henegariu, O. et al. 1997, BioTechniques 23, 504-511; Markoulatos, P. et al. 2002, J. Clin. Lab. Anal. 16, 47-51). Обычно в множественной RT-PCR используют одинаково оптимизированные параметры, хотя соотношение между внешними и внутренними праймерами имеет менее важное значение для такой реакции.
а. Концентрация праймеров
Концентрация праймеров, имеющих концевой сегмент удлинения цепи путем перекрывания (например, праймеры для VН и VL), предпочтительно является ниже концентрации внешних праймеров, не имеющих концевого сегмента удлинения цепи путем перекрывания (например, праймеры для JH и каппа-цепи).
Если одна из заданных последовательностей амплифицируется менее эффективно, чем другие последовательности, например в результате более высокого значения GC%, можно уравновесить эффективность амплификации. Такой результат можно получить, увеличивая концентрацию набора праймеров, которая менее эффективно опосредует амплификацию, или уменьшая концентрацию другого набора праймеров. Например, последовательности, кодирующие вариабельные области тяжелой цепи, характеризуются более высоким значением GC% и, следовательно, более низкой эффективностью амплификации по сравнению с вариабельными областями легкой цепи. Из вышеизложенного следует, что праймер для VL следует использовать в меньшей концентрации, чем праймер для VH.
Кроме того, при использовании большого числа праймеров может возникнуть проблема с определением общей концентрации праймеров. Верхний предел определяют экспериментально путем титрования. Для системы PCR “AmpliTaq Gold” компании Applied Biosystems верхний предел концентрации всех олигонуклеотидов установлен равным 1,1 мкМ, хотя для других систем верхний предел может достигать 2,4 мкМ. Такой верхний предел концентрации всех олигонуклеотидов влияет на максимальную концентрацию отдельных праймеров. Слишком низкая концентрация отдельного праймера вызывает плохую чувствительность PCR.
Было также установлено, что качество олигонуклеотидных праймеров имеет важное значение для множественной PCR с удлинением цепи путем перекрывания. Лучшие результаты были получены при использовании олигонуклеотидов, очищенных ВЭЖХ.
b. Условия циклизации PCR
Условиями циклизации предпочтительно являются нижеследующие значения:
Для одностадийной множественной RT-PCR с удлинением цепи путем перекрывания в программу циклизации были введены нижеследующие стадии до вышеуказанной циклизации амплификации:
Все вышеуказанные параметры можно оптимизировать. Особенно важное значение имеет температура гибридизации. Таким образом, все отдельные наборы праймеров, которые должны образовать конечную смесь праймеров, необходимо испытать отдельно, чтобы установить оптимальную температуру и время гибридизации, а также время элонгации и денатурации. Благодаря этому будет определен диапазон, внутри которого указанные параметры могут быть оптимизированы для смеси множественных праймеров для удлинения цепи путем перекрывания.
Проблемы, связанные с плохой чувствительностью PCR, например, вследствие низкой концентрации праймеров или матрицы можно преодолеть, используя большое число тепловых циклов. Большое число тепловых циклов включает 35-80 циклов, предпочтительно около 40 циклов.
Кроме того, более продолжительное время удлинения цепи может повысить эффективность множественной PCR с удлинением цепи путем перекрывания. Продолжительное время удлинения цепи равно 1,5-4 минутам х EPL по сравнению с нормальным временем удлинения цепи, равным 1 минуте.
с. Применение адъювантов
Эффективность реакции множественной PCR можно значительно улучшить, используя добавку для PCR, такую как ДМСО, глицерин, формамид или бетаин, которые релаксируют ДНК, облегчая таким образом денатурацию матрицы.
d. dNTP и MgCl 2
Качество и концентрация дезоксинуклеозидтрифосфата (dNTP) имеют важное значение для множественной РCR с удлинением цепи путем перекрывания. Лучшая концентрация dNTP составляет от 200 до 400 мкМ каждого dNTP (dATP, dCTP, dGTP и dTTP), при превышении которой происходит быстрое ингибирование амплификации. Более низкие концентрации dNTP (100 мкМ каждого dNTP) являются достаточными для амплификации методом РCR. Запасы dNTP чувствительны к циклам оттаивания/замораживания. После трех-пяти таких циклов множественная PCR часто оказывается неэффективной. Во избежание таких проблем можно получать небольшие аликвоты dNTP и держать их замороженными при -20°С.
Оптимизация концентрации Mg2+ имеет важное значение, так как большая часть ДНК-полимераз представляет собой магнийзависимые ферменты. Помимо ДНК-полимеразы Mg2+ связывают праймеры для матричной ДНК и dNTP. Поэтому оптимальная концентрация Mg2+ будет зависеть от концентрации dNTP, матричной ДНК и состава буфера для образца. Если праймеры и/или буферы для матричной ДНК содержат хелаторы, такие как EDTA или EGTA, оптимальная концентрация Mg2+ может быть изменена. Избыточная концентрация Mg2+ стабилизирует двойную цепь ДНК и предотвращает полную денатурацию ДНК, в результате чего уменьшается выход продукта. Избыточная концентрация Mg2+ может также стабилизировать ложную гибридизацию праймера с неправильными сайтами матрицы, что уменьшает специфичность. С другой стороны, недостаточная концентрация Mg2+ сокращает количество продукта.
Хороший баланс между dNTP и MgCl2 равен примерно 200-400 мкМ dNTP (каждого) на 1,5-3 мМ MgCl2.
е. Концентрация буфера для РCR
Буферы на основе KCl обычно удовлетворяют требованиям множественной РCR с удлинением цепи путем перекрывания; однако буферы на основе других компонентов, таких как (NH4)2SO4, MgSO4, трис-HCl, или их комбинаций также могут быть оптимизированы для использования в множественной PCR с удлинением цепи перекрыванием. Пары праймеров, участвующие в амплификации более длинных продуктов, действуют лучше при более низких концентрациях солей (например, 20-50 мМ KCl), в то время как пары праймеров, участвующие в амплификации коротких продуктов, действуют лучше при более высоких концентрациях солей (например, 80-100 мМ KCl). Двукратное увеличение концентрации буфера вместо однократного увеличения может повысить эффективность множественной реакции.
f. ДНК-полимераза
Настоящее изобретение описано на примере использования Taq полимеразы. Альтернативно можно использовать другие типы теплостойких ДНК-полимераз, включающих, например, Pfu, Phusion, Pwo, Tgo, Tth, Vent, Deep-vent. Полимеразы, не обладающие или обладающие активностью 3'-5'-концевой экзонуклеазы, могут быть использованы отдельно или в комбинации друг с другом.
Векторы и библиотеки
В результате связывания интересующих нуклеотидных последовательностей по настоящему изобретению образуется нуклеотидный сегмент, включающий интересующие связанные нуклеотидные последовательности. Кроме того, способами по настоящему изобретению получают библиотеки таких интересующих связанных последовательностей нуклеиновых кислот, в частности библиотеки последовательностей, кодирующих вариабельные области.
Одним из отличительных признаков настоящего изобретения является введение в приемлемые векторы сегмента, содержащего интересующие связанные нуклеотидные последовательности, или библиотеки интересующих связанных нуклеотидных последовательностей, полученных способом по настоящему изобретению. Указанные библиотеки могут быть комбинаторными библиотеками или библиотеками родственных пар последовательностей, кодирующих вариабельные области. Сайты рестрикции, образованные внешними праймерами, гнездовыми праймерами или полугнездовыми праймерами, предпочтительно должны быть совместимы с соответствующими сайтами рестрикции выбранного вектора. Интересующие связанные последовательности нуклеиновых кислот можно также ввести в векторы путем рекомбинации, если одна из полугнездовых, гнездовых или внешних праймеров имеет приемлемый сайт рекомбинации и выбранный вектор содержит такой же сайт.
В основном не существует ограничений относительно векторов, которые можно использовать в качестве носителей продуктов, полученных одним из способов выполнения множественной RT-PCR и связывания по настоящему изобретению. Выбранные векторы могут использоваться для амплификации и экспрессии в клетках, включающих, например, бактериальные клетки, дрожжевые клетки, клетки других грибов, клетки насекомых, растительные клетки или клетки млекопитающих. Такие векторы могут быть использованы для облегчения последующих стадий клонирования, переноса между векторными системами, отображения продукта, введенного в вектор, экспрессии введенного продукта и/или встраивания в геном клетки-хозяина.
Клонирующие векторы и шаттл-векторы, предпочтительно, являются бактериальными векторами. Однако в процессе клонирования и переноса можно также использовать векторы других типов.
Векторные дисплеи могут быть, например, фаговыми векторами или фагмидными векторами, полученными из нитевидных бактериофагов класса fd, M13 или f1. Такие векторы способны облегчить дисплей белков, включая, например, связывающий белок или его фрагмент, на поверхности нитевидного бактериофага. В данной области известны также векторные дисплеи, которые могут быть использованы для дисплея на рибосомах, ДНК, дрожжевых клетках или клетках млекопитающих. Указанные векторы включают, например, вирусные векторы или векторы, кодирующие химерные белки.
Экспрессирующие векторы существуют для всех указанных видов, и выбор вектора полностью зависит от экспрессируемого белка. Некоторые экспрессирующие векторы дополнительно способны встраиваться в геном клетки-хозяина в результате произвольной интеграции или сайт-специфической интеграции с использованием соответствующих сайтов рекомбинации. Экспрессирующие векторы могут иметь дополнительные кодирующие последовательности, которые при введении связанного продукта в указанные последовательности в рамке считывания могут экспрессировать более длинный белок, например непроцессированное моноклональное антитело, в соответствующей клетке-хозяине. Такое введение в рамке считывания может также облегчить экспрессию химерных белков, что в свою очередь облегчает отображение на поверхности нитевидного бактериофага или клетки. В системе дисплея на основе бактериофага интересующие связанные нуклеотидные последовательности могут быть введены в рамке считывания в последовательность, кодирующую белок оболочки, такой как pIII или pVIII (Barbas, C.F et al. 1991, Proc. Natl. Acad. Sci. USA 88, 7978-7982; Kang, A.S. et al. 1991, Proc. Natl. Acad. Sci. USA 88, 4363-4366).
В одном из вариантов осуществления настоящего изобретения отдельные сегменты интересующих связанных нуклеотидных последовательностей включают последовательность, кодирующую вариабельную область тяжелой цепи иммуноглобулина, которая связана с последовательностью, кодирующей вариабельную область легкой цепи. Указанные связанные последовательности предпочтительно вводят в вектор, содержащий последовательности, кодирующие один или несколько константных доменов иммуноглобулина. Вставку осуществляют таким образом, чтобы связанные последовательности, кодирующие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, находились в рамке считывания последовательностей, кодирующих константные области. В результате такой вставки может быть создан, например, вектор экспрессиии Fab-фрагмента, вектор экспрессии непроцессированного антитела или экспрессирующий вектор, кодирующий фрагмент непроцессированного антитела. Такой вектор предпочтительно является экспрессирующим вектором, пригодным для скрининга (например, векторы на основе E.coli, фагомида или вектора млекопитающего), при этом последовательности, кодирующие константную область тяжелой цепи, выбирают из иммуноглобулина человека классов IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD или IgE, в результате чего происходит экспрессия Fab-фрагмента или непроцессированного рекомбинантного антитела. Помимо последовательностей, кодирующих константную область тяжелой цепи, указанный вектор может также содержать последовательность, кодирующую константную область легкой цепи, которую выбирают из лямбда- или каппа-цепей человека. Такой подход является обоснованным в тех случаях, когда связанные нуклеотидные последовательности кодируют только последовательности, кодирующие вариабельную область иммуноглобулина (Fv-фрагменты).
В другом варианте осуществления настоящего изобретения отдельные сегменты связанных нуклеотидных последовательностей включают последовательность, кодирующую вариабельную область α-цепи TcR, которая связана с последовательностью, кодирующей вариабельную область β-цепи, или последовательность, кодирующую вариабельную область γ-цепи, которая связана с последовательностью, кодирующей вариабельную область δ-цепи. Указанные связанные последовательности предпочтительно вводят в вектор, который содержит последовательности, кодирующие один или несколько константных доменов TcR. Вставку осуществляют таким образом, чтобы введенные связанные последовательности, кодирующие вариабельные области, находились в рамке считывания соответствующих последовательностей, кодирующих константные области TcR. В другом варианте осуществления изобретения такой вектор является химерным экспрессирующим вектором, включающим последовательности, кодирующие лейциновый зиппер, в рамке считывания константных областей TcR. Установлено, что такие конструкции увеличивают устойчивость растворимых TcR (Willcox, B.E. et al. 1999, Protein Sci. 8, 2418-2423).
Библиотеки родственных пар по настоящему изобретению могут быть введены в векторы двумя разными способами. В соответствии с первым способом в приемлемый вектор вводят отдельные родственные пары. Такая библиотека векторов может находиться в разрозненном или объединенном виде. В соответствии со вторым способом все родственные пары объединяют до введения в вектор и затем все вместе вводят в приемлемые векторы с образованием объединенной библиотеки векторов (иллюстрация на фиг.12). Такая библиотека векторов содержит большое разнообразие пар последовательностей, кодирующих вариабельные области.
Одним объектом настоящего изобретения является библиотека родственных пар связанных последовательностей, кодирующих вариабельные области. Отдельные родственные пары библиотеки предпочтительно включают последовательность, кодирующую вариабельную область легкой цепи иммуноглобулина, связанную с последовательностью, кодирующей вариабельную область тяжелой цепи.
Другая предпочтительная библиотека родственных пар содержит связанные последовательности, кодирующие области TcR, в которых каждая отдельная последовательность, кодирующая область TcR, включает последовательность, кодирующую вариабельную область альфа-цепи, связанную с последовательностью, кодирующей вариабельную область бета-цепи, и/или последовательность, кодирующую вариабельную область гамма-цепи TcR, связанную с последовательностью, кодирующей вариабельную область дельта-цепи.
Один вариант осуществления настоящего изобретения относится к подбиблиотеке родственных пар связанных последовательностей, кодирующих вариабельные области, которые определяют требуемые специфичности связывания в отношении определенной мишени. Указанные родственные пары предпочтительно включают связанные последовательности, кодирующие вариабельную область легкой цепи и вариабельную область тяжелой цепи иммуноглобулина, последовательности, кодирующие вариабельную область альфа-цепи и вариабельную область бета-цепи TcR, и/или последовательности, кодирующие вариабельную область гамма-цепи и вариабельную область дельта-цепи TcR.
Другой вариант осуществления изобретения относится к подбиблиотеке, отобранной из исходной библиотеки родственных пар последовательностей, кодирующих вариабельные области, по настоящему изобретению.
Предпочтительный вариант осуществления настоящего изобретения относится к библиотеке или подбиблиотеке, кодирующей родственные пары непроцессированных иммуноглобулинов, отобранных из иммуноглобулина человека классов IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM.
Другим предпочтительным отличительным признаком настоящего изобретения является библиотека или подбиблиотека, кодирующая растворимые и устойчивые родственные пары TcR.
Отличительным признаком настоящего изобретения является разнообразие указанных библиотек, которые включают по крайней мере 5, 10, 20, 50, 100, 1000, 104, 105 или 106 разных родственных пар.
В другом варианте осуществления настоящего изобретения указанные библиотеки родственных пар связанных последовательностей, кодирующих вариабельные области, получают способом, включающим вышеописанные стадии. Такая библиотека именуется также исходной библиотекой.
Скрининг и отбор
Можно предположить, что исходная библиотека пар связанных последовательностей, кодирующих вариабельные области, которые были получены от донора одним из способов по настоящему изобретению, должна представлять собой разнообразие связывающих белков, часть которых окажется непригодной, то есть не будет связываться с требуемой мишенью, что является особенно верным для комбинаторных библиотек. Поэтому в объем настоящего изобретения входят обогащение и скрининг для получения подбиблиотеки, кодирующей подмножество специфичностей связывания, направленных против определенной мишени.
Что касается библиотек родственных пар, то разнообразие библиотеки предположительно соответствует разнообразию материала донора при наличии незначительного числа произвольно связанных вариабельных областей. Таким образом, в библиотеке, состоящей из родственных пар, стадия обогащения может быть необязательной до скрининга мишень-специфического сродства связывания.
В другом варианте осуществления настоящего изобретения способ создания библиотеки пар связанных последовательностей, кодирующих вариабельные области, далее включает создание подбиблиотеки путем отбора подмножества пар связанных последовательностей вариабельных областей, которые кодируют связывающие белки с требуемой специфичностью к мишени. Такой отбор связанных последовательностей, кодирующих вариабельные области, именуется также библиотекой мишень-специфических родственных пар.
Предпочтительный вариант осуществления настоящего изобретения относится к библиотеке мишень-специфических родственных пар последовательностей, кодирующих вариабельные области, которые введены в экспрессирующий вектор млекопитающего.
Отбор последовательностей, кодирующих вариабельные области мишень-специфических иммуноглобулинов, обычно производят при помощи иммунологических анализов. Такие анализы хорошо известны в данной области и включают, например, ELISPOTS, ELISA, мембранные анализы (например, вестерн-блоттинги), матрицы на фильтрах или FACS. Указанные анализы могут быть выполнены непосредственно с использованием полипептидов, полученных из последовательностей, кодирующих вариабельные области иммуноглобулина. Альтернативно иммуноанализы могут быть выполнены в комбинации или после обогащения такими методами, как отображение на фагах, рибосомах, бактериальной поверхности, дрожжах, эукариотических вирусах и РНК или ковалентное отображение (см. FitzGerald, K., 2000, Drug Discov. Today 5, 253-258). Как показано на фиг.10, скринингу могут быть подвергнуты как библиотеки экспрессируемых родственных Fab-фрагментов, так и библиотеки экспрессируемых родственных непроцессированных антител, в результате чего будет создана подбиблиотека положительных клонов. Такие методы скрининга и обогащения пригодны также для Fv- или scFv-фрагментов или комбинаторных библиотек связанных вариабельных областей.
В предпочтительном варианте осуществления настоящего изобретения отбор подбиблиотеки мишень-специфических родственных пар или комбинаторных пар последовательностей, кодирующих вариабельные области, выполняют методом высокоэффективного скрининга. Методы высокоэффективного скрининга включают, не ограничиваясь ими, анализы ELISA, выполняемые при помощи полуавтоматического и автоматического оборудования. Могут быть также использованы мембранные анализы, при выполнении которых бактерии автоматически собирают и помещают на соответствующую мембрану поверх агаровых пластинок с образованием массивов колоний, экспрессирующих антигенсвязывающие молекулы. Указанные молекулы проникают через мембрану на вторую расположенную ниже мембрану, сенсибилизированную антигеном, которая может быть проявлена и использована для идентификации клонов, секретирующих антигенсвязывающие молекулы к требуемой мишени (de Wildt, R.M., et al. 2000, Nat. Вiotechnol. 18, 989-994).
После отбора соответствующим методом подбиблиотеки родственных пар или комбинаторных пар антигенсвязывающих клонов могут быть выполнены дополнительные анализы путем секвенирования ДНК связанных последовательностей, кодирующих вариабельную область легкой цепи и вариабельную область тяжелой цепи иммуноглобулина. Во-первых, такое секвенирование ДНК позволяет получить информацию о разнообразии библиотеки, таком как происхождение зародышевой линии, распределение семейства и созревание на гипервариабельных участках. Такой анализ позволяет отобрать клоны, характеризующиеся широким разнообразием, и удалить повторяющиеся клоны. Во-вторых, секвенирование ДНК позволяет выявить мутации, возникшие в процессе выделения.
При анализе последовательностей, кодирующих вариабельные области, необходимо рассмотреть три типа мутаций, прежде чем принять решение о приемлемости мутации: i) мутации наиболее часто встречающегося типа возникают в результате перекрестного связывания внутри семейства, когда праймеры для V-гена связываются с неправильным подмножеством в одном конкретном семействе V-генов. Введенные изменения являются главным образом заменами природных кодонов в одном конкретном положении. Из-за высокой степени гомологии последовательностей в семействе V-генов такие замены могут рассматриваться как консервативные и приемлемые замены; ii) менее часто встречающиеся мутации возникают в результате перекрестного связывания между семействами (например, праймер для семейства VH3 инициирует последовательность, кодирующую семейство VH1) и вызывают более значительные структурные изменения, иногда не имеющие природного варианта. Такие изменения потенциально могут влиять на иммуногенность вариабельной области в результате создания новых эпитопов. Такие изменения можно легко идентифицировать и затем устранить стандартными методами молекулярной биологии или исключить обнаруженные клоны из библиотеки; iii) ошибки, вызванные Taq ДНК-полимеразой, легче всего идентифицировать в последовательностях, кодирующих константные области, после чего их можно легко устранить. Однако мутации, индуцированные Taq полимеразой, несомненно будут также присутствовать в последовательностях, кодирующих вариабельные области, где их невозможно отличить от природных соматических мутаций, которые также являются результатом произвольных мутаций в последовательностях, кодирующих вариабельные области. Учитывая, что указанные мутации не являются системными и по-разному влияют только на определенные пары, кажется обоснованным не принимать во внимание таких изменения.
Кроме того, анализ последовательностей можно использовать для идентификации степени перестановки последовательностей в библиотеке родственных пар, как показано в таблице 20 для VH группы Н4.
Как описано в примере 9, мутации, рассмотренные в пунктах i) и ii), могут быть устранены в библиотеке экспрессируемых последовательностей при использовании праймеров, гибридизирующих с лидерным пептидом последовательностей, кодирующих вариабельные области, вместо праймеров, гибридизирующих с 5'-концом вариабельных областей.
В другом варианте осуществления настоящего изобретения подбиблиотеку мишень-специфических и, возможно, подвергнутых анализу пар связанных последовательностей, кодирующих вариабельную область легкой цепи и вариабельную область тяжелой цепи иммуноглобулина, переносят в экспрессирующий вектор млекопитающего. Такой перенос можно произвести в любые векторы, описанные в предыдущем разделе, которые позволяют экспрессировать непроцессированное рекомбинантное антитело. Если скрининг выполняют в отношении библиотеки родственных пар экспрессируемых непроцессированных антител, такой перенос может быть не нужен.
В другом варианте осуществления настоящего изобретения исходную библиотеку создают из лимфоцитсодержащей фракции клеток, обогащенной Т-лимфоцитами. Пары связанных последовательностей, кодирующих вариабельные области, которые образуют исходную библиотеку, можно отобрать с учетом кодирования подмножества пар связанных последовательностей вариабельных областей, состоящих из альфа- и бета-цепей и/или гамма- и дельта-цепей, кодирующих связывающие белки с требуемой специфичностью к мишени, в результате чего будет создана подбиблиотека родственных пар или комбинаторных пар. Антигенспецифические Т-клеточные рецепторы затем могут быть идентифицированы в пуле трансфецированных клеток стандартными методами, такими как окрашивание тетрамерными комплексами МНС-пептид (см., например, публикации Callan, M.F. et al. 1998, J. Еxp. Med. 187, 1395-1402; Novak, E.J. et al. 1999, J. Clin. Invest. 104, R63-R67), измерение клеточных реакций в виде высвобождения IL-2, или более сложными методами, такими как методы отображение на дрожжах или ретровирусах.
Клетки-хозяева и экспрессия
Библиотеки по настоящему изобретению можно перенести в векторы, пригодные для экспрессии и продуцирования белков, кодированных представляющими интерес связанными последовательностями нуклеиновых кислот, в частности связывающих белков, содержащих вариабельные области, или их фрагментов. Такие векторы описаны в разделе “Векторы и библиотеки” и применяются для экспрессии, например, непроцессированных антител, Fab-фрагментов, Fv-фрагментов, scFv-фрагментов, мембраносвязанных или растворимых TcR или фрагментов TcR выбранного вида.
Одним из отличительных признаков настоящего изобретения является введение в клетку-хозяина библиотеки или подбиблиотеки векторов, содержащих родственные пары связанных последовательностей, кодирующих вариабельные области, или единичный клон, включающий родственную пару связанных последовательностей, кодирующих вариабельные области, для амплификации и/или экспрессии. Клетки-хозяева могут быть выбраны из бактериальных клеток, дрожжевых клеток, клеток других грибов, клеток насекомых, растительных клеток или клеток млекопитающих. Для экспрессии предпочтительными являются клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО), клетки COS, клетки ВНК, миеломные клетки (например, клетки Sp2/0, NS0), NIH 3T3, фибробласты или иммортализованные клетки человека, такие как клетки HeLa, клетки НЕК 293 или PERC6.
Введение векторов в клетки-хозяева осуществляют при помощи целого ряда методов трансформации или трансфекции, известных специалистам в данной области, которые включают осаждением фосфатом кальция, электропорацию, микроинъекции, слияние с липосомами, слияние с гомолизированными эритроцитами, слияние с протопластами, вирусную инфекцию и тому подобные. Хорошо известны методы получения моноклональных непроцессированных антител, Fab-фрагментов, Fv-фрагментов и scFv-фрагментов.
Продуцирование рекомбинантных поликлональных антител, предназначенных для использования в лечебных целях, является новой областью. Способ получения рекомбинантных поликлональных антител описан в заявке РСТ WO 2004/061104. Указанный способ включает создание коллекции клеток, пригодной для использования в качестве линии продуцирующих клеток. Нижеследующее описание данного способа относится к библиотеке родственных пар, хотя он применим также к комбинаторной библиотеке. Отдельные клетки в коллекции клеток могут экспрессировать один член рекомбинантного поликлонального связыващего белка, например, из библиотеки родственных пар. Для гарантии экспрессии отдельными клетками одной родственной пары, а не нескольких родственных пар поликлонального связывающего белка, последовательности нуклеиновых кислот, кодирующие родственные пары, вводят в один специфический сайт генома каждой отдельной клетки. Это является важной особенностью коллекции клеток, так как предотвращает перестановку тяжелых и легких цепей, экспрессируемых каждой клеткой, а также позволяет получить клетки, по существу идентичные друг другу, за исключением небольших различий вариабельных областей отдельных родственных пар. Данная особенность делает возможным несмещенный рост коллекции клеток в течение периода времени, необходимого для продуцирования. Для гарантии единичной сайт-специфической интеграции необходимо использовать коммерчески доступную линию клеток-хозяев, имеющих только один сайт интеграции, например клетки CHO Flp-In компании Invitrogen, содержащие один сайт FRT. Векторы, пригодные для данной линии клеток, содержат соответствующий сайт FRT и встраиваются в геном при помощи Flp-рекомбиназы. Существует несколько других известных рекомбиназ, например Cre, бета-рекомбиназа, Gin, Pin, PinB, PinD, R/RS, лямбда-интеграза или фаговая интеграза ФС31, которые могут быть использованы в комбинации с соответствующими сайтами рекомбинации. Кроме того, приемлемые векторы содержат селектируемый маркер, который позволяет произвести выбор сайт-специфических интегрантов.
Создание линии поликлональных продуцирующих клеток и продуцирование рекомбинантного поликлонального белка такой линией клеток может быть произведено несколькими разными методами трансфекции и продуцирования.
Одним из методов является использование библиотеки векторов, смешанных с образованием одной композиции, предназначенной для трансфекции линии клеток-хозяев, имеющих в одной клетке один сайт интеграции. Данный метод именуется массовой трансфекцией. Ранее описанная структура вектора и клетки-хозяина гарантирует, что в результате соответствующего отбора должна быть получена линия поликлональных клеток, характеризующихся несмещенным ростом. Необходимо создать замороженный запас линии поликлональных клеток до начала продуцирования рекомбинантного поликлонального белка.
Другим методом является использование для трансфекции библиотеки векторов, разделенных на части, содержащие в композиции примерно 5-50 отдельных векторов библиотеки. Одна часть библиотеки предпочтительно содержит 10-20 отдельных векторов. Каждую композицию затем трансфецируют в одну аликвоту клеток-хозяев. Данный метод именуется полумассовой трансфекцией. Число трансфецированных аликвот зависит от размера библиотеки и числа отдельных векторов в каждой части. Если библиотека включает, например, 100 отдельных родственных пар, разделенных на части, содержащие в композиции 20 отдельных членов, необходимо трансфецировать 5 аликвот клеток-хозяев композицией библиотеки, составляющей отдельную часть исходной библиотеки. Аликвоты клеток-хозяев отбирают с учетом сайт-специфической интеграции. Разные аликвоты предпочтительно отбирают отдельно. Однако они могут быть также объединены до селекции. Указанные аликвоты могут быть подвергнуты анализу в отношении их клонального разнообразия, причем для создания запаса библиотеки поликлональных родственных пар используют только аликвоты, характеризующиеся достаточным разнообразием. Для получения требуемой линии поликлональных клеток аликвоты могут быть смешаны до создания замороженного запаса сразу же после их получения из запаса или после непродолжительного периода пролиферации и адаптации. Аликвоты клеток находятся отдельно в процессе продуцирования, и поликлональный белок получают, объединяя продукты всех аликвот, а не аликвоты клеток до продуцирования.
Третьим методом является высокоэффективный метод, в котором клетки-хозяева трансфецируют отдельно, используя отдельные векторы, составляющие библиотеку родственных пар. Такой метод именуется индивидуальной трансфекцией. Индивидуально трансфецированные клетки-хозяева предпочтительно отбирают отдельно с учетом сайт-специфической интеграции. Отдельные клоны клеток, полученные в результате отбора, могут быть подвергнуты анализу для определения времени пролиферации, причем для создания запаса библиотеки поликлональных родственных пар предпочтительно используют клетки, характеризующиеся одинаковыми скоростями роста. Отдельные клоны клеток могут быть смешаны для получения требуемой линии поликлональных клеток до создания запаса сразу же после их получения из запаса или после непродолжительной пролиферации и адаптации. Такой подход позволяет устранить любое возможное смещение последовательностей остатков во время трансфекции, интеграции и отбора. Альтернативно отдельно трансфецированные клетки-хозяева смешивают до выполнения отбора, что позволяет контролировать смещение последовательностей вследствие трансфекции.
Общим отличительным признаком вышеописанных методов является то, что все отдельные родственные пары, образующие рекомбинантный поликлональный белок, могут быть получены в одном или ограниченном числе биореакторов. Единственным отличием является стадия, на которой отбирают коллекцию клеток, которая образует линию поликлональных продуцирующих клеток.
Один из вариантов осуществления настоящего изобретения относится к популяции клеток-хозяев, образующих библиотеку родственных пар или подбиблиотеку связанных пар последовательностей, кодирующих вариабельные области.
Другой вариант осуществления настоящего изобретения относится к популяции клеток-хозяев, образующих библиотеку, полученную из популяции выделенных отдельных клеток, включающих лимфоциты, с использованием для связывания родственных пар метода множественной RT-PCR с последующим связыванием путем лигирования или рекомбинации либо множественной RT-PCR с удлинением цепи путем перекрывания по настоящему изобретению.
Другой вариант осуществления настоящего изобретения относится к популяции клеток-хозяев, образующих комбинаторную библиотеку или подбиблиотеку связанных пар последовательностей, кодирующих вариабельные области.
Популяция клеток-хозяев по настоящему изобретению включает популяцию разных клеток, соответствующих разнообразию библиотеки, использованной для трансформации и трансфекции клеток. Каждая клетка в популяции клеток предпочтительно образует только одну родственную пару из всей библиотеки родственных пар, и ни один член библиотеки родственных пар не превышает более 50%, более предпочтительно 25% или наиболее предпочтительно 10% от общего числа отдельных членов, экспрессированных из популяции клеток-хозяев.
В предпочтительном варианте осуществления настоящего изобретения популяция клеток-хозяев включает клетки млекопитающих.
Вышеописанную популяцию клеток-хозяев можно использовать для экспрессии рекомбинантного поликлонального связывающего белка, так как отдельные клетки популяции образуют разные последовательности, кодирующие вариабельные области.
Один из вариантов осуществления настоящего изобретения относится к рекомбинантному поликлональному белку, экспрессируемому популяцией клеток-хозяев, включающих библиотеку векторов, содержащих разные родственные пары связанных последовательностей, кодирующих вариабельные области, которая была создана способом по настоящему изобретению. Рекомбинантный поликлональный белок по настоящему изобретению обычно включает 2, 5, 10, 20, 50, 100, 1000, 104, 105 или 106 белков, состоящих из разных родственных пар.
Предпочтительный вариант осуществления настоящего изобретения относится к рекомбинантному поликлональному иммуноглобулину, экспрессированному популяцией клеток-хозяев, включающих библиотеку векторов, содержащих разные родственные пары последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи.
Другой предпочтительный вариант осуществления настоящего изобретения относится к рекомбинантному поликлональному TcR, экспрессированному популяцией клеток-хозяев, включающих библиотеку векторов, содержащих разные родственные пары последовательностей, кодирующих вариабельную область альфа-цепи TcR, связанную с вариабельной областью бета-цепи, и/или последовательностей, кодирующих вариабельную область гамма-цепи, связанную с вариабельной областью дельта-цепи.
Другой вариант осуществления настоящего изобретения относится к клетке-хозяину, пригодной для продуцирования моноклонального белка. В частности, моноклонального антитела, содержащего родственную пару вариабельной области легкой цепи и вариабельную область тяжелой цепи, или моноклонального TcR, содержащего родственную пару вариабельной области альфа-цепи и вариабельную область бета-цепи или вариабельную область дельта-цепи и вариабельную область гамма-цепи. Такая линия клеток, продуцирующих моноклональный белок, предпочтительно не является линией клеток гибридомы.
Такое моноклональное антитело или TcR может быть получено в результате добавления нижеследующих стадий к способу связывания нескольких интересующих несмежных нуклеотидных последовательностей: а) введение в вектор указанных связанных последовательностей нуклеиновых кислот; b) введение указанного вектора в клетку-хозяина; с) культивирование указанных клеток-хозяев в условиях, пригодных для экспрессии; и d) получение белкового продукта, экспрессированного вектором, введенным в указанную клетку-хозяина. Вектор, введенный в клетку-хозяина, предпочтительно содержит отдельную родственную пару последовательностей, кодирующих вариабельные области.
Применение изобретения
Основным применением настоящего изобретения является связывание родственных пар последовательностей, кодирующих вариабельные области, в частности последовательностей, кодирующих вариабельные области тяжелой и легкой цепи иммуноглобулина, или последовательностей, кодирующих вариабельные области альфа- и бета-цепи или гамма- и дельта-цепи TcR, при помощи высокоэффективного способа создания библиотек родственных пар. Помимо создания библиотек родственных пар множественную RT-PCR с последующим связыванием путем лигирования или рекомбинации или множественную RT-PCR с удлинением цепи перекрыванием по настоящему изобретению можно использовать для создания комбинаторных библиотек для популяции генетических разных клеток, клеточных лизатор из такой популяции клеток или РНК, выделенной из такой популяции клеток. Библиотеки, подбиблиотеки или единичные клоны из одной из таких библиотек облегчают экспрессию поликлональных или моноклональных белков. Из библиотек по настоящему изобретению могут быть получены, в частности, моноклональные или поликлональные антитела.
Хорошо известно применение рекомбинантных моноклональных антител для диагностики, лечения и профилактики заболеваний. Рекомбинантные моноклональные и поликлональные антитела, полученные способом по настоящему изобретению, имеют такое же применение, что и антитела, полученные существующими методами. В частности, способом по настоящему изобретению может быть получена фармацевтическая композиция, содержащая в качестве активного ингредиента поликлональный рекомбинантный иммуноглобулин, объединенный по крайней мере с одним фармацевтически приемлемым наполнителем. Более предпочтительными являются фармацевтические композиции, в которых поликлональный рекомбинантный иммуноглобулин содержит родственные пары последовательностей, кодирующих вариабельные области. Фармацевтические композиции на основе поликлональных рекомбинантных иммуноглобулинов могут быть использованы в качестве лекарственных средств. Поликлональный рекомбинантный иммуноглобулин, входящий в состав композиции, может быть специфичным к заранее определенному заболеванию, поэтому такая композиция может быть использована для лечения, уменьшения интенсивности или профилактики таких заболеваний, как рак, инфекционные заболевания, воспалительные заболевания, аллергии, астма и другие респираторные заболевания, аутоиммунные заболевания, нарушения функции иммунной системы, сердечно-сосудистые заболевания, заболевания центральной нервной системы, заболевания обмена веществ и эндокринные заболевания, отторжение трансплантата или нежелательная беременность у млекопитащих, таких как человек, домашние или комнатные животные.
Дальнейшее применение настоящего изобретения не имеет аналогов среди современных методов на основе моноклональных химерных антител. Когда защитные антигены плохо исследованы или совершенно неизвестны, как это имеет место в случае появления новых инфекционных заболеваний, невозможно найти моноклональное антитело, защищающее от данного заболевания.
Однако настоящее изобретение позволяет получить антитело-экспрессирующие клетки непосредственно у доноров с выработанной гуморальной иммунной реакцией, например у выздоравливающих индивидуумов, и использовать исходный материал, полученный у указанных индивидуумов, для создания библиотеки родственных пар последовательностей, кодирующих вариабельные области тяжелой и легкой цепей иммуноглобулина.
В тех случаях когда, например, вирус известен, но неизвестны защитные антигены, можно создать подбиблиотеку родственных пар генов антитела с широкой реактивностью в отношении антигенных структур вируса. Рекомбинантное поликлональное антитело, полученное из такой подбиблиотеки, по-видимому, будет содержать защитные антитела.
В тех случаях когда антигены совершенно неизвестны, рекомбинантное поликлональное антитело, полученное из библиотеки родственных пар, созданной на основе исходного материала выздоравливающих индивидуумов, можно использовать точно так же, как в настоящее время используются гипериммунные иммуноглобулины. Основанием для такого применения является родственное спаривание, которое гарантирует близкое соответствие полученного рекомбинантного поликлонального антитела гуморальной иммунной реакции выздоравливающего индивидуума.
Способы связывания родственных пар вариабельных областей, описанные в настоящем изобретении, находят применение в диагностических и аналитических методах. При введении индивидууму лекарственного средства всегда существует вероятность возникновения иммунной реакции против такого лекарственного средства. Иммуногенность можно определить существующими методами, такими как специфичные для лекарственного средства анализы связывания с сывороткой или плазмой, полученной у индивидуума, принимающего данное лекарственное средство. Альтернативно способы по настоящему изобретению можно использовать для отображения иммунной реакции индивидуумов сразу же после введения лекарственного средства путем выделения родственных пар последовательностей, кодирующих вариабельные области тяжелой и легкой цепей. Антитела, экспрессированные из такой библиотеки, можно исследовать на реактивность в отношении данного лекарственного средства или его компонентов. Указанный способ является особенно полезным в тех случаях, когда наличие лекарственного средства в плазме или сыворотке препятствует применению существующего метода. Такими лекарственными средствами являются, например, антитела. Иммунную реакцию против лекарственного средства (например, антиидиотипическую иммунную реакцию, иммунную реакцию на рамку считывания или Fc-фрагмент), вызванную введением антитела, нельзя идентифицировать известными методами до тех пор, пока антитело, используемое для лечения, не будет полностью выведено из крови. В соответствии с настоящим изобретением у подвергаемого лечению индивидуума можно выделить последовательности, кодирующие такие антитела против данного лекарственного средства, и исследовать в течения двух недель. Таким образом, настоящее изобретение является альтернативным методом исследования иммуногенности лекарственных средств вообще и лекарственных средств на основе антител, в частности.
Еще одним применением настоящего изобретения является проверка и сравнение вакцин и программ вакцинации. Это является особенно полезным в процессе создания вакцины, так как позволяет оценить и сравнить разнообразие последовательностей, участвующих в гуморальных иммунных реакциях, возникающих в ответ на воздействие новых вакцин-кандидатов, дополнительно к выполняемым в настоящее время сравнениям сродства связывания антитела и сывороточного титра. Кроме того, настоящее изобретение можно использовать для анализа, контроля и сравнения гуморальных иммунных реакций при осуществлении надзора за эффективностью вакцины у населения.
Настоящее изобретение находит также применение за пределами области связывающих белков, содержащих вариабельные области. Специалист в данной области может легко адаптировать способ, описанный в настоящем изобретении, для связывания двух или более транскрибированных нуклеотидных последовательностей, кодирующих гетеромерный белок, не являющийся связывающим белком. Такое связывание последовательностей, кодирующих домены или субъединицы гетеромерного белка, может быть весьма полезным для выделения кодирующих белок последовательностей, так как позволит значительно уменьшить число стадий. Кроме того, можно выделить, например, сплайсированные варианты, мутации или новые члены семейства таких белков, используя только одну смесь множественных праймеров/смесь множественных праймеров для удлинения цепи путем перекрывания.
Кроме того, возможно связывание последовательностей, кодирующих удаленные домены одного белка. Такой способ должен облегчить исследование значимости определенных доменов в мультидоменном белке, так как он упрощает делецию промежуточных доменов.
Создание химерных или связанных белков также является областью, в которой может быть использовано настоящее изобретение. Даже если подлежащие связыванию белки имеют разное происхождение, например представляют собой химерный белок, созданный из белка человека и мыши, настоящее изобретение можно использовать, смешивая клетки до выполнения обратной транскрипции. Такая смесь клеток может включать популяцию клеток из каждого вида или отдельную клетку из каждого вида.
Примеры
Пример 1. Двухстадийная множественная RT-PCR с удлинением цепи путем перекрывания
В данном примере рассмотрено выполнение обратной транскрипции (RT) с применением матрицы, полученной из выделенной отдельной клетки, при этом продуцированную кДНК используют в качестве матрицы для выполнения нескольких множественных PCR с удлинением цепи путем перекрывания.
а. Клетки
Линия клеток яичника китайского хомячка (СНО), экспрессирующих каппа-цепь IgG1, была получена методом Flp-In (Invitrogen, Carlsbad, CA, USA).
Плазмидный вектор pLL113, экспрессирующий каппа-цепь IgG (фиг.4), был создан на основе экспрессирующего вектора Flp-In, pcDNA5/FRT. Клетки СНО-Flp-In котрансфецировали вектором pLL113, содержащим гены антитела и pOG44, вызывающим временную экспрессию Flp-рекомбиназы, используя липофектамин 2000 (Invitrogen, Carlsbad, CA, USA), в соответствии с инструкциями изготовителя. Трансформанты отбирали и проверяли в отношении продуцирования каппа-цепи IgG при помощи иммуноанализов. Отобранную линию клеток, получившую название СНО Flp-In pLL113, помещали в среду F-12 Хэма, содержащую 2 мМ L-глутамина, 10% FCS и 900 гигромицин В (поддерживающая среда).
Клетки СНО Flp-In pLL113 собирали при помощи трипсина и трижды промывали в поддерживающей среде. После выполнения последней промывки клетки вторично суспендировали в исходном объеме поддерживающей среды. Концентрацию клеток определяли при помощи системы Casy-1 (Scharfe System GmbH, Reutlingen, Germany) и разводили в поддерживающей среде до концентрации 1 клетка/5 мкл.
b. Обратная транскрипция
Взвесь клеток СНО Flp-In pLL113, содержащую в среднем одну клетку, распределяли по отдельным лункам 96-луночного планшета для PCR (Thermo-Fast 96, skirted AB-0800, ABgene, Epsom, Surrey, UK).
кДНК синтезировали из распределенных клеток на стадии обратной транскрипции с использованием обратной транскриптазы (RT) в соответствии с одностадийным методом RT-PCR Qiagen (набор для выполнения одностадийной RT-PCR Qiagen, № по каталогу 210210 Hilden, Germany).
Каждая лунка содержала нижеследующие реагенты в общем объеме 20 мкл:
однократный буфер для одностадийной RT-PCR,
dNTP в конечной концентрации, равной 1 мМ каждого реагента,
5 пмоль олигонуклеотида поли-dT (18),
26 ед. ингибитора РНКазы (RNasin, Promega, Madison USA, № по каталогу N2111),
2 мкл смеси ферментов для одностадийной RT-PCR,
5 мкл взвеси клеток СНО Flp-In pLL113.
Реакцию обратной транскрипции с использованием RT выполняли, инкубируя реакционные смеси при 55°С в течение 30 минут. Затем обратную транскриптазу инактивировали, инкубируя реакционную смесь при 94°С в течение 10 минут.
с. Множественная PCR с удлинением цепи путем перекрывания
Часть продуктов кДНК, полученных на стадии b), использовали в качестве матрицы для множественной PCR с удлинением цепи путем перекрывания. Реакцию выполняли на 96-луночных планшетах.
Каждая лунка содержала нижеследующие реагенты в общем объеме 40 мкл:
однократный буфер для одностадийной RT-PCR,
dNTP в конечной концентрации, равной 500 мкМ каждого реагента,
смесь множественных праймеров для удлинения цепи путем перекрывания в концентрациях, указанных в таблице 1,
26 ед. ингибитора РНКазы (RNasin, Promega, Madison USA, № по каталогу N2111),
2 мкл смеси ферментов для одностадийной RT-PCR,
1 мкл матрицы кДНК (выделенной из отдельной клетки (стадия b)).
Использованная смесь множественных праймеров для удлинения цепи путем перекрывания содержала праймеры, показанные в таблице 1.
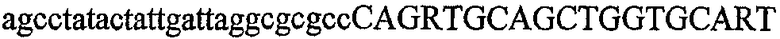
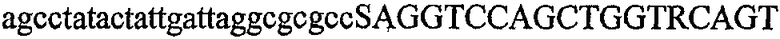
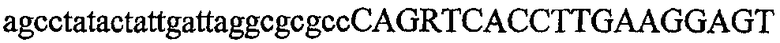


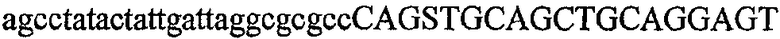
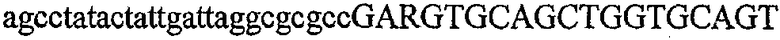
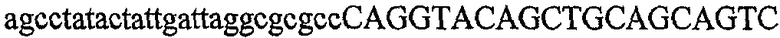


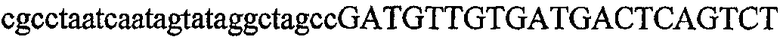

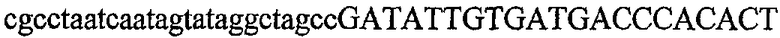
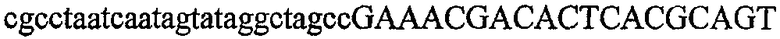

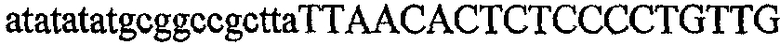
W=A/T, S=G/C, R=A/G. Последовательности, обозначенные заглавными буквами, соответствуют геноспецифической области.
Реакции выполняли в 96-луночном термоблоке Primus НT MWG (MWG Biotech AG, Ebersberg, Germany) при нижеследующих условиях циклизации:
d. Гнездовая PCR
Гнездовую PCR выполняли, используя в качестве матрицы продукты множественной РCR с удлинением цепи путем перекрывания. Реакции выполняли на 96-луночных планшетах.
Каждая лунка содержала нижеследующие реагенты в общем объеме 50 мкл:
однократный буфер для Bio Taq,
dNTP в конечной концентрации, равной 400 мкМ каждого реагента,
2 мМ MgCl2,
смесь праймеров для гнездовой PCR,
1,25 ед. ДНК-полимеразы BIOTAQ (№ по каталогу BIO-21040, Bioline, UK),
1 мкл продукта множественной PCR с удлинением цепи путем перекрывания (стадия с).
Использованные праймеры показаны в таблице 2.




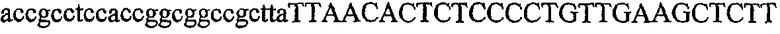
Последовательности, обозначенные заглавными буквами, соответствуют геноспецифической области.
Реакции выполняли в 96-луночном термоблоке Primus НT MWG (MWG Biotech AG, Ebersberg, Germany) в нижеследующих условиях циклизации:
Продукты гнездовой РCR анализировали электрофорезом в 1% агарозном геле, используя для обнаружения этидий бромид (фиг.5). Ожидаемый размер продукта, полученного удлинением цепи путем перекрывания, был равен 1076 п.о. Такой продукт показан в полосах 1, 5, 6, 7, 8 и 12, отмеченных стрелками (фиг.5А). В рассмотренном эксперименте отрицательный контрольный образец является загрязненным, и аналогичное загрязнение характерно также для испытуемых образцов. На фиг.5В показаны фрагменты, изображенные на фиг.5А, которые относятся к настоящему эксперименту.
В настоящем эксперименте иллюстрируется один из способов выполнения двухстадийной множественной PCR с удлинением цепи путем перекрывания с использованием матрицы, выделенной из отдельной клетки. Кроме того, было показано, что можно выполнить примерно двадцать множественных РCR с удлинением цепи путем перекрывания, используя кДНК, полученную из выделенной отдельной клетки.
Пример 2. Одностадийная множественная RT-PCR с удлинением цепи путем перекрывания
В данном примере рассмотрено выполнение обратной транскрипции и множественной PCR с удлинением цепи путем перекрывания в виде одной стадии с использованием матрицы, полученной из лизированных клеток, в концентрациях, соответствующих 100, 10 или 1 клетке.
а. Клетки
Линию клеток гибридомы человека НВ-8501, продуцирующую противостолбнячное антитело с каппа-цепью IgG1, которая была получена из Американской коллекции типовых культур, культивировали в среде Дульбекко, модифицированной по способу Исков (Vitacell, Kiev, Ukrain, № по каталогу 30-2005), содержащей 10% фетальной телячьей сыворотки. До выполнения множественной RT-PCR с удлинением цепи путем перекрывания клетки собирали, подсчитывали и замораживали при -80°С в культуральной среде в концентрации 200 клеток/мкл.
b. Одностадийная множественная RT-PCR с удлинением цепи путем перекрывания
Для выполнения множественной RT-PCR с удлинением цепи путем перекрывания использовали набор для одностадийной RT-PCR Qiagen (Qiagen, № по каталогу 210212, Hilden, Germany) в соответствии с рекомендациями изготовителя. Перед добавлением в пробирки для PCR клеточные лизаты оттаивали и разводили в Н2О до концентрации лизата, соответствущей 100, 10 и 1 клетке на 5 мкл.
Каждая пробирка для PCR содержала нижеследущие реагенты в общем объеме 50 мкл:
однократный буфер для одностадийной RT-PCR,
dNTP в конечной концентрации, равной 400 мкМ каждого реагента,
смесь множественных праймеров для удлинения цепи путем перекрывания в концентрациях, указанных в таблице 3,
2 мкл смеси ферментов для одностадийной RT-PCR,
50 ед. ингибитора РНКазы (RNasin, Promega, Madison USA, № по каталогу N2515),
5 мкл разведенного клеточного лизата.
Использованная смесь множественных праймеров для удлинения цепи путем перекрывания содержала праймеры, показанные в таблице 3.
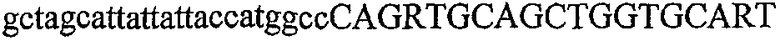

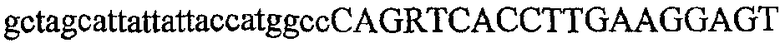
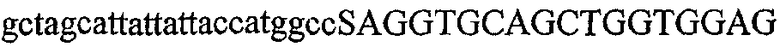


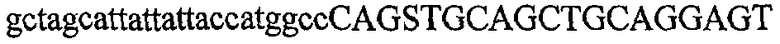
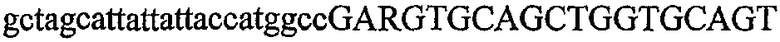





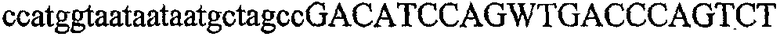
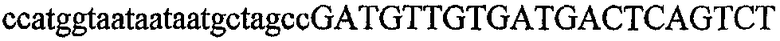



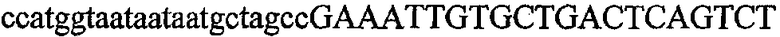
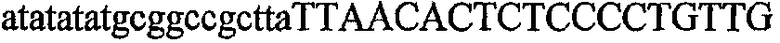
Реакции выполняли в нижеследующих условиях циклизации:
Реакция PCR:
Десять микролитров продуктов реакций анализировали электрофорезом в 1,5% агарозном геле, используя для обнаружения бромид этидия (фиг.6А).
Ожидаемый размер фрагментов (точный размер зависит от длины вариабельных областей):
VН: 410 п.о.
LC: 680 п.о.
Фрагмент удлинения цепи путем перекрывания: 1070 п.о.
Отдельные фрагменты ДНК с подвижностью, соответствующей длине вариабельной области тяжелой цепи (VH) и длине вариабельной и константной областей легкой цепи (LC), присутствуют при всех разведениях клеточного лизата. Менее интенсивный фрагмент с подвижностью, соответствующей предполагаемому фрагменту удлинения цепи путем перекрывания, присутствует в лизатах от 100 до 10 клеток. Фрагмент удлинения цепи путем перекрывания в образце лизата одной клетки обнаружен с трудом, хотя он присутствует в исходном геле (см. стрелку на фото, показанном на фиг.6А, и изображение, показанное на фиг.6В).
с. Идентификация фрагмента удлинения цепи путем перекрывания
В результате выполнения вышеописанного эксперимента было подтверждено наличие полосы, соответствующей фрагменту удлинения цепи путем перекрывания. Области агарозного геля в положении 1070 п.о. полосы, соответствующей 1 клетке, и полосы, соответствующей 100 клеткам, вырезали, ДНК очищали при помощи набора Qiaex II (Qiagen, № по каталогу 20051, Hilden, Germany) и разводили в 20 мкл воды.
Один микролитр элюата подвергали PCR (набор Biotaq, Bioline, UK № по каталогу BIO-21040) в соответствии с инструкциями изготовителей с использованием праймеров, фланкирующих предполагаемый фрагмент удлинения цепи путем перекрывания (праймеры для JH, соответствующие SEQ ID NO:32-35, и праймер для CLк, соответствующий SEQ ID NO:17, при использовании каждого праймера в концентрации 0,5 мкМ). Реакции выполняли в нижеследущих условиях циклизации:
Десять микролитров каждого продукта реакции анализировали электрофорезом в 1% агарозном геле, используя для обнаружения бромид этидия. Было обнаружено несколько фрагментов, в том числе с подвижностью ожидаемого фрагмента удлинения цепи путем перекрывания в образцах от 1 до 100 клеток (стрелка на фиг.6С). Фрагмент длиной 1 т.п.о. вырезали из полосы геля, соответствующей одной клетке, и очищали при помощи вышеописанного набора Qiaex II. Очищенный фрагмент гидролизовали рестрикционными ферментами NheI и NcoI (отдельно) и продукты реакции анализировали электрофорезом в 1% агарозном геле, используя для обнаружения бромид этидия (фиг.6D). Указанные сайты рестрикции присутствуют на участке перекрывания VH и LC, и ожидаемые размеры цепи после гидролиза равны примерно 410 и 680 п.о. (фиг.2). Гидролиз NheI был неполным, так как большая фракция все еще имеет первоначальный размер.
Пример 3. Объединенные реакции одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и гнездовой PCR
В данном примере рассмотрены реакции обратной транскрипции и множественной PCR с удлинением цепи путем перекрывания, выполненные в виде одной стадии, с последующей амплификацией при помощи полугнездовой PCR с использованием матрицы из лизированных клеток в концентрациях, соответствующих 100, 10 или 1 клетке.
а. Одностадийная множественная RT-PCR с удлинением цепи путем перекрывания
Множественную RT-PCR с удлинением цепи путем перекрывания выполняли, используя клеточный лизат НВ-8501, в соответствии с описанием, приведенным в примере 2, с применением смеси множественных праймеров для удлинения цепи путем перекрывания, включающей праймеры, показанные в таблице 4.
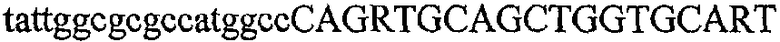


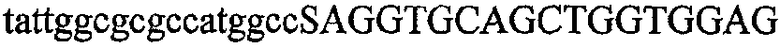
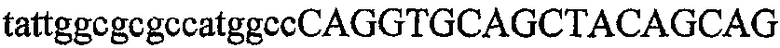

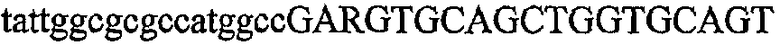



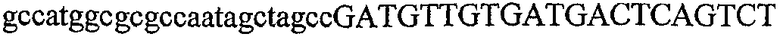
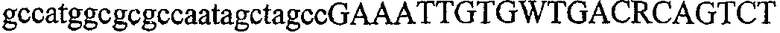
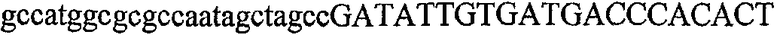
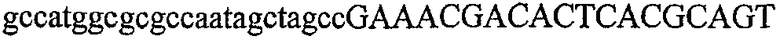


Однако следует отметить, что для каждой смеси множественных праймеров для удлинения цепи путем перекрывания использовали только однин из праймеров для СН1-5, в результате чего было получено пять разных смесей множественных праймеров для удлинения цепи перекрыванием.
Остальные параметры были аналогичны указанным в примере 2 для множественной RT-PCR с удлинением цепи путем перекрывания за исключением изменения температуры гибридизации, которая была равна 50°С. Реакцию выполняли с использованием каждого обратного праймера для константной области тяжелой цепи (СН1, СН2, СН3, СН4, СН5, соответствущие SEQ ID NO:49-53) и лизатов, соответствующих 100, 10, 1 и 0 клеткам.
b. Полугнездовая PCR
Один микролитр продукта реакции множественной RT-PCR с удлинением цепи путем перекрывания подвергали полугнездовой РCR (набор Biotaq, Bioline, UK, № по каталогу BIO-21040) в соответствии с рекомендациями изготовителя. Общий объем реакционных смесей был равен 50 мкл. Использованные праймеры показаны в таблице 5.




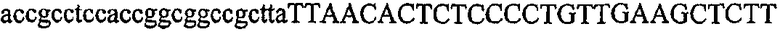
Реакцию выполняли в нижеследующих условиях циклизации:
Десять микролитров каждой реакционной смеси анализировали электрофорезом в 1,5% агарозном геле, используя для обнаружения бромид этидия (фиг.7).
Предполагаемый фрагмент удлинения цепи путем перекрывания, полученный в результате выполнения полугнездовой PCR с использованием праймера для СН4 в первой реакции и соответствующий лизату одной клетки (см. стрелку на фиг.7), вырезали из агарозного геля, очищали при помощи набора Qiaex II (Qiagen, № по каталогу 20051, Hilden, Germany) и вводили в pCR2.1-TOPO, используя набор для клонирования ТОРО ТА компании Invitrogen (Invitrogen, № по каталогу 45-0641, Carlsbad, CA, USA). Вставки из восьми клонов секвенировали, в результате чего было установлено, что семь из указанных вставок состояли из вариабельной области тяжелой цепи, связанной с вариабельной и константной областью легкой цепи, в предполагаемой области перекрывания.
Можно отметить, что чувствительность объединенной реакции множественной RT-PCR с удлинением цепи путем перекрывания и полугнездовой PCR была весьма удовлетворительной, при этом 4 из 5 праймеров для константной области амплифицировали значительные количества продуктов удлинения цепи путем перекрывания из лизата, соответствущего отдельной клетке.
Пример 4. Объединенные реакции одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и гнездовой PCR с использованием в качестве источника матрицы обогащенных В-имфоцитов человека
В данном примере рассмотрены реакции обратной транскрипции и множественной РCR с удлинением цепи путем перекрывания, выполненные в виде одной стадии, с последующей амплификацией при помощи полугнездовой РCR с использованием в качестве источника матрицы выделенных отдельных В-лимфоцитов человека.
а. Выделение В-клеток
Мужчину-донора иммунизировали столбнячным токсином. Через 6 дней после иммунизации от донора брали пробу крови, равную 120 мл, и выделяли мононуклеарные клетки периферической крови (РВМС) в устройстве Lymphoprep (Axis-Shield, Oslo, Norway, производственный № 1001967) в соответствии с инструкциями изготовителя. Популяцию CD19-положительных клеток обогащали методом сортировки клеток с использованием магнитных гранул. РВМС окрашивали FITC-конъюгированным антителом против CD19-леток (Becton Dickinson, NJ, USA, № по каталогу 345776). Магнитную сортировку клеток с использованием магнитных микрогранул, конъюгированных с анти-FITC-антителом, и очистку в колонке производили в соответствии с инструкциями изготовителей (Miltenyi Biotec, Gladbach, Germany, № по каталогу 130-042-401). Клетки разводили до концентрации, равной 200 клеткам на 1 мл в PBS, содержащем 2 нМ EDTA и 0,5% BSA. Пять микролитров разведенных клеток распределяли по пробиркам для PCR, содержащим приблизительно одну клетку в одной пробирке. Пробирки хранили до применения при -80°С.
b. Множественная RT-PCR с удлинением цепи путем перекрывания и полугнездовая PCR
Условия выполнения множественной RT-PCR с удлинением цепи путем перекрывания и полугнездовой РCR были аналогичны описанным в примере 3. Однако указанные реакции выполняли только с использованием смеси множественных праймеров для удлинения цепи путем перекрывания, включающей праймер для CН3, соответствующий SEQ ID NO:51. Шестнадцать образцов, полученных в результате выполнения объединенных реакций множественной RT-PCR с удлинением цепи путем перекрывания и полугнездовой РCR, анализировали электрофорезом в 1% агарозном геле, используя по 10 мкл продукта реакции каждой полугнездовой PCR и производя обнаружение бромидом этидия (фиг.8).
Как показано на фиг.8, 2 из 16 полос (полосы 5 и 6) содержали фрагменты с ожидаемой подвижностью (примерно 1 т.п.о.). Кроме того, полоса 2 содержала менее интенсивный фрагмент при ожидаемой подвижности. Фрагменты длиной 1 т.п.о., присутствующие в полосах 5 и 6, вырезали из агарозного геля, очищали при помощи набора Qiaex II (Qiagen, № по каталогу 20051) и вводили в pCR2.1-TOPO, используя набор для клонирования TOPO TA компании Invitrogen (Invitrogen, № по каталогу 45-0641 Carlsbad, CA, USA). Два клона из каждого выделенного фрагмента имели вставки правильного размера. В результате гидролиза рестрикционными ферментами (отдельно NcoI и NheI) были обнаружены фрагменты ожидаемых размеров (410 и 680 п.о.), что свидетельствует о правильном связывании последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную и константную области легкой цепи.
Два клона, полученных из фрагмента, присутствующего в полосе 5, секвенировали, обнаружив при этом их идентичность, указывающую на то, что связанные VН и LC были родственными парами.
Пример 5. Объединенные реакции одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и гнездовой PCR с использованием V λ -специфических праймеров
В данном примере рассмотрены реакции обратной транскрипции и множественной PCR с удлинением цепи, выполненные в виде одной стадии, с использованием Vλ-специфических праймеров с последующим осуществлением полугнездовой PCR. В качестве матриц использовали общую РНК, выделенную из двух разных линий клеток, экспрессирующих семейства генов лямбда-цепи 1b и 1е в комбинации с одной и той же вариабельной областью тяжелой цепи.
а. Клетки
Две линии клеток яичника китайского хомячка (СНО), экспрессирующих лямбда-цепь IgG1, были получены методом Flp-In (Invitrogen, Carlsbad, CA, USA).
Векторы pEm465/01P581 и pEm465/01P582, экспрессирующие лямбда-цепь IgG1 млекопитающего (фиг.9А) и представляющие два семейства генов лямбда-цепи IgG, были созданы на основе экспрессирующего вектора pcDNA5/FRT, полученного методом Flp-In. Клетки СНО-Flp-In котрансфецировали вышеуказанными плазмидами, содержащими гены антитела и pOG44, вызывающий временную экспрессию Flp рекомбиназы, с использованием фугена 6 (Roche, Mannheim, Germany), в соответствии с инструкциями изготовителя. Затем производили отбор трансформантов в отношении вставок. Отобранные линии клеток, получившие названия СНО Flp-In/Em464/01P581 и CHO Flp-In/Em464/01P582, помещали в среду F-12 Хэма, содержащую 2 мМ L-глутамина, 10% FCS и 900 мкг/мл гигромицина В (поддерживающая среда).
Линии клеток собирали при помощи трипсина и трижды промывали в поддерживающей среде. Примерно 107 клеток использовали для очистки общей РНК при помощи набора Nucleo Spin L (Macherey-Nagel, Duren, Germany) в соответствии с инструкциями изготовителя. Конечные концентрации РНК определяли методами измерения оптической плотности OD260.
b. Одностадийная множественная RT-PCR с удлинением цепи путем перекрывания
Множественную RT-PCR с удлинением цепи путем перекрывания выполняли аналогично примеру 3, используя 50 пг, 5 пг или 0,5 пг общей РНК в качестве матрицы и смесь множественных праймеров для удлинения цепи путем перекрывания, содержащую праймеры, показанные в таблице 6, в указанных ниже условиях циклизации.
Реакция PCR:
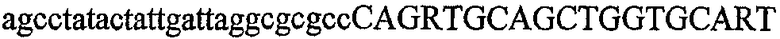
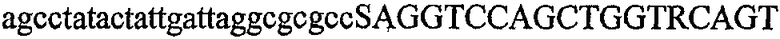
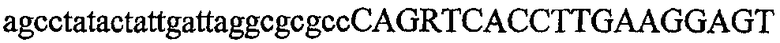


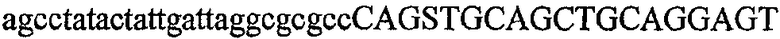
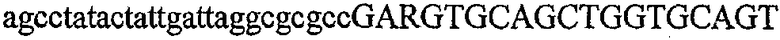
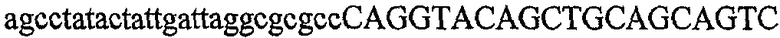

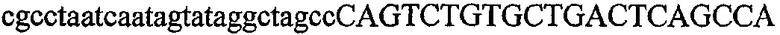

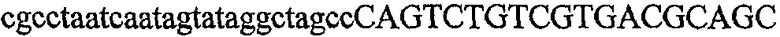
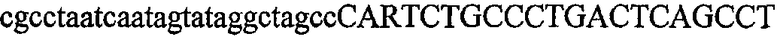
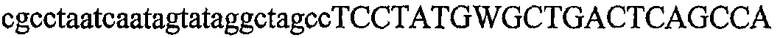


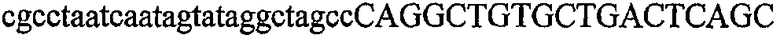

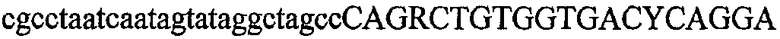
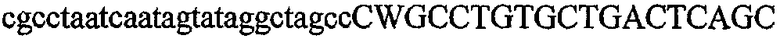
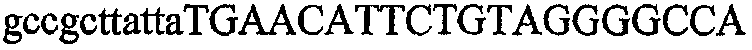
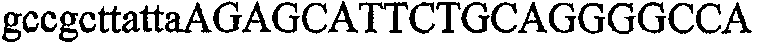
с. Полугнездовая PCR
Один микролитр продукта реакции множественной RT-PCR с удлинением цепи путем перекрывания подвергали полугнездовой PCR (набор Biotaq, Bioline, UK, № по каталогу BIO-21040) в соответствии с инструкциями изготовителя. Общие объемы реакционных смесей были равны 20 мкл. Использованные праймеры показаны в таблице 7.




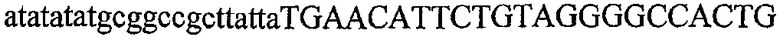

Реакцию выполняли в нижеследующих условиях циклизации:
Десять микролитров продуктов реакции гнездовой PCR анализировали электрофорезом в 1,5% агарозном геле, используя для обнаружения бромид этидия (фиг.9В и 9С). Стрелками показаны продукты удлинения цепи путем перекрывания с ожидаемыми свойствами миграции длиной примерно 1 т.п.о.
Данный эксперимент показывает, что смесь множественных праймеров для удлинения лямбда-цепи путем перекрывания, представленная в таблице 6, может быть использована в одностадийной множественной RT-PCR с удлинением цепи путем перекрывания независимо от используемой матрицы. Кроме того, специфические продукты реакции PCR с удлинением цепи путем перекрывания были получены при использовании 0,5 пг общей РНК. Обнаруженная чувствительность позволяет предположить, что родственные связанные последовательности, кодирующие вариабельную область тяжелой цепи и вариабельную область легкой цепи, могут быть амплифицированы из отдельной клетки.
Пример 6. Создание подбиблиотеки родственных пар последовательностей, кодирующих противостолбнячное антитело
В настоящем примере рассмотрены стадии, изображенные на блок-схеме, показанной на фиг.10, с использованием столбнячного токсина (ТТ) в качестве антигена-мишени.
а. Доноры
Доноров, которых ранее иммунизировали противостолбнячной вакциной, подвергали бустер-иммунизации противостолбнячной вакциной (Statens Serum Institut, Denmark). Через шесть дней после бустер-иммунизации противостолбнячной вакциной у доноров брали пробу крови, равную примерно 200 мл, которую вводили в пробирку с антикоагулянтом.
Доноры должны быть здоровы и не иметь дремлющих или хронических инфекций. Они не должны страдать аутоиммунными заболеваниями или принимать любые иммунодепрессивные средства и не должны подвергаться никаким вакцинациям в течение последних 3 месяцев. Кроме того, во время бустер-иммунизации ТТ-вакциной доноры не должны иметь каких-либо серьезных инфекций на протяжении последнего месяца.
b. Получение мононуклеарных клеток периферической крови (РВМС)
РВМС выделяют из проб крови при помощи устройства Lymphoprep (Axis-Shield PoC AS, Norway, производственный № 1001967) в соответствии с рекомендациями изготовителей. Кровь разводят в отношении 1:1 в РBS и вводят полученную взвесь в Lymphoprep в отношении 2:1. Пробирки центрифугируют с ускорением 800 g в течение 20 минут при 25°С и собирают полосу, соответствующую интерфазе лимфоцитов. Клетки промывают в PBS, содержащем 2 мМ EDTA.
с. Обогащение В-клеток
Линию В-клеток (CD19+ клетки) в PBMC обогащают методом сортировки клеток с использованием магнитных гранул в соответствии с нижеследующим описанием.
Выделенные РВМС окрашивают анти-CD19-FIТC (флуоресцинизотиоцианат) (Becton Dickenson, NJ, USA, № по каталогу 345776). Все стадии выполняют в темном помещении при 4°С. Окрашивание производят 10 мкл анти-CD19-FITC на 1х106 клеток в объеме, равном 100 мкл на 1х106 клеток, используя М-буфер (PBS, рН 7,2, 0,5% BSA, 2 мМ EDTA). В вышеуказанных условиях происходит окрашивание линии В-клеток РВМС. Клетки инкубируют в течение 20 минут и затем дважды промывают М-буфером. Клетки, окрашенные анти-CD19-FITC, подвергают магнитному мечению при помощи микрогранул, конъюгированных с анти-FITC-антителом, используя 10 мкл магнитных гранул, сенсибилизированных анти-FITC-антителом (Miltenyi Biotec, Gladbach, Germany, № по каталогу 130-042-401), на 1х106 клеток в объеме, равном 100 мкл М-буфера на 1х106 клеток. Клетки инкубируют в течение 15 минут и затем один раз промывают М-буфером. Клетки вторично суспендируют в дегазированном М-буфере.
Колонку МACS LS (Miltenyi Biotec, Gladbach, Germany, № по каталогу 130-042-401) предварительно обрабатывают дегазированным М-буфером в соответствии с инструкциями изготовителей. Взвесь клеток, окрашенных анти-CD19-FITC и меченных магнитными гранулами, сенсибилизированными анти-FITC-антителом, вводят в колонку с возможностью прохождения через нее. Окрашенные и меченые клетки (CD19+) остаются в магнитном поле, окружающем колонку, в то время как неокрашенные клетки (CD19-) проходят через колонку. Колонку промывают дегазированным М-уфером. Магнитное поле отключают и собирают CD19+ клетки.
d. Сортировка плазматических клеток
Элюат из колонки MACS центрифугируют и вторично суспендируют в буфере для FACS (PBS, рН 7,2, 2% BSA) в концентрации, равной 1х106 клеток/60 мкл буфера для FACS. Добавляют анти-CD19-FITC (Becton Dickenson, NJ, USA, № по каталогу 345776) (10 мкл/106 клеток), анти-CD38-РЕ (Becton Dickenson, NJ, USA, № по каталогу 555460) (10 мкл/106 клеток) и анти-CD45-PerCP (Becton Dickenson, NJ, USA, № по каталогу 345809) (20 мкл/106 клеток). Клетки инкубируют в темном помещении при 4°С в течение 20 минут, затем два раза промывают и вторично суспендируют в буфере для FACS.
Клетки сортируют методом сортировки клеток с возбуждением флуоресценции (FACS), используя нижеследующие параметры сортировки:
1. Прямое и боковое рассеяние для сохранения лимфоцитов и моноцитов, включая плазматические бласты и плазматические клетки, и удаление мертвых клеток и клеток с очень высоким боковым рассеянием, которые могут быть агрегатами или гранулоцитами.
2. Клетки, которые являются CD19-положительными и экспрессируют повышенные уровни CD38 (CD38hi). Подобным образом происходит улавливание в основном CD38 клеток, так как РВМС были обогащены в колонке MACS CD19 клетками, но указанный способ позволяет обнаружить любые загрязнения.
3. CD45-положительные клетки. Все лимфоциты экспрессируют CD45. Однако плазматические клетки характеризуются меньшей экспрессией CD45 по сравнению с более ранними стадиями дифференцировки лимфоцитов. Поэтому при улавливании CD45 можно получить дискретную популяцию клеток, соответствующую плазматическим клеткам.
Клетки, сортированные методом FACS, собирают в виде отдельных клеток и сразу же помещают в отдельные лунки 96-луночных планшетов, содержащих 5 мкл буфера РBS с 5 ед. ингибитора РНКазы (RNasin, Promega, Madison USA, № по каталогу N2515) в одной лунке. На данном этапе клетки могут быть заморожены для последующего выполнения RT-PCR или сразу же использованы для выполнения RT-PCR.
е. Связывание родственных пар последовательностей, кодирующих вариабельные области иммуноглобулина
Метод множественной RT-PCR с удлинением цепи путем перекрывания применим к отдельным клеткам, обеспечивая родственное связывание транскрибированных последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи антитела против столбнячного токсина.
е-1. Одностадийная множественная RT-PCR с удлинением цепи путем перекрывания
Набор для одностадийной RT-PCR компании Qiagen (Qiagen, № по каталогу 210212, Hilden, Germany) используют для выполнения множественной RT-PCR с удлинением цепи путем перекрывания в соответствии с рекомендациями изготовителя. Замороженные 96-луночные планшеты, содержащие одну клетку в одной лунке, удаляют из холодильника и, когда в лунках не остается кристаллов льда, к каждому образцу (отдельной клетке) сразу же добавляют 15 мкл реакционной смеси для RT-PCR.
Реакционная смесь для RT-PCR содержит в общем объеме, равном 20 мкл, нижеследующие реагенты:
однократный буфер для одностадийной RT-PCR,
dNTP в конечной концентрации, равной 400 мкМ каждого реагента,
смесь множественных праймеров для удлинения цепи путем перекрывания в концентрациях, указанных в таблице 8,
0,8 мкл смеси ферментов для одностадийной RT-PCR,
20 ед. ингибитора РНКазы (RNasin, Promega, Madison, USA, № по каталогу N2515).
Состав смеси множественных праймеров для удлинения цепи путем перекрывания показан в таблице 8.
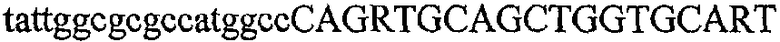


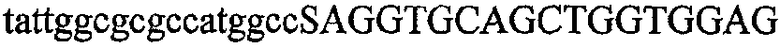
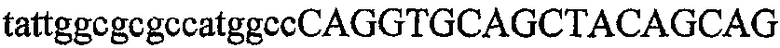

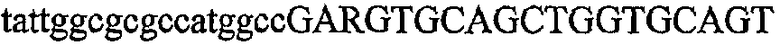
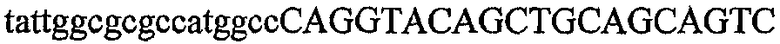


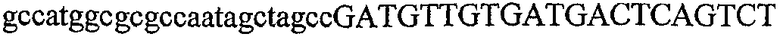
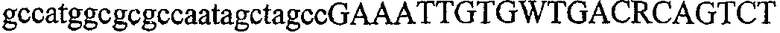
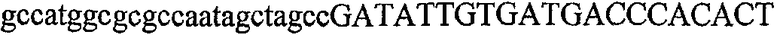
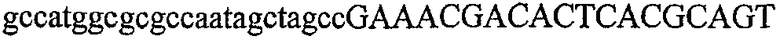


Реакцию выполняют в нижеследующих условиях циклизации:
Реакция PCR:
е-2. Дополнительная амплификация
Один микролитр продукта реакции множественной RT-PCR с удлинением цепи путем перекрывания из каждого образца подвергают полугнездовой РCR (набор Biotaq, Bioline, UK, № по каталогу BIO-1040) в соответствии с рекомендациями изготовителя набора, используя 96-луночные планшеты. Каждая реакционная смесь имеет общий объем, равный 50 мкл, и содержит однократный буфер Buiotaq, 200 мкМ dNTP (каждого реагента), 2 мМ MgCl2, 1,25 ед. Bio Taq полимеразы в конечной концентрации и праймеры, показанные в таблице 9.
Реакцию выполняют в нижеследующих условиях циклизации:




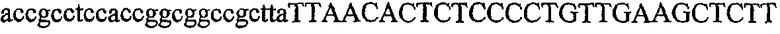
Последовательности, обозначенные заглавными буквами, соответствуют геноспецифической области.
Десять микролитров ограниченной серии образцов анализируют электрофорезом в 1,5% агарозном геле, используя для визуализации бромид этидия, для проверки успешного выполнения множественной RT-PCR с удлинением цепи путем перекрывания.
Ожидаемый размер фрагментов (точный размер зависит от длины вариабельных областей):
VН: ~410 п.о.
LC: ~680 п.о.
Фрагмент удлинения цепи путем перекрывания: ~1070 п.о.
По два микролитра из всех образцов, полученных у одного донора, которые культивировали на 96-луночных планшетах, объединяют в одной пробирке. Собранные образцы гидролизуют XhoI и NotI. Гидролизованные фрагменты удлинения цепи путем перекрывания очищают препаративным электрофорезом в 1% агарозном геле; фрагменты удлинения цепи путем перекрывания вырезают из агарозного геля и очищают при помощи набора Qiaex II (Qiagen, № по каталогу 20051, Hilden, Germany). На данной стадии не нужно объединять родственные пары, если этого не требуется. В таком случае каждую отдельную реакционная смесь расщепляют рестрикционными ферментами и полученные продукты клонируют отдельно в описанном ниже векторе.
f. Библиотека экспрессируемых родственных Fab-фрагментов
Библиотеку векторов экспрессии Fab-фрагментов создают путем введения пула фрагментов удлинения цепи путем перекрывания, гидролизованных XhoI/NotI, в вектор JSK301 E.coli (фиг.11), при помощи лигирования. E.coli (ТОР10) трансформируют методом электропорации библиотекой векторов экспрессии Fab-фрагментов и отбирают трансформанты на 2хYT агаре, содержащем 100 мкг/мл карбенициллина. Плазмидную ДНК получают из колоний сразу же после удаления с агаровых пластинок. Для сохранения разнообразия плазмидный препарат получают из минимального числа колоний одного донора, соответствующих трехкратному общему числу первоначально сортированных отдельных плазматических клеток. Библиотеку экспрессируемых родственных Fab-фрагментов создают путем введения кластера прокариотического промотора и лидерной последовательности, выделенного из phh3 (Den, W. et al. 1999, J. Immunol. Methods 222, 45-57), в полученный плазмидный препарат методом гидролиза AscI и NheI и последующего лигирования. Процесс создания библиотеки показан на фиг.12. E.coli (TG1) трансформируют методом электропорации библиотекой экспрессируемых родственных Fab-фрагментов и отбирают трансформанты на 2хYT агаре, содержащем 100 мкг/мл карбенициллина. Доноры не контактируют во время выполнения процеруды, описанной в публикации Den et al., J. Immunol. Methods, 1999, Jan. 1; 222(1-2):45-57. Однако при желании они могут находиться вместе на любой стадии.
g. Скрининг клонов
Fab-экспрессирующие клоны исследуют в отношении связывания ТТ-антигена методом антиген-специфического анализа ELISA.
g-1. Создание базовых планшетов и экспрессия Fab-фрагментов
Отобранные колонии клеток TG1, каждая из которых содержит вектор экспрессии родственных Fab-фрагментов из библиотеки, созданной на стадии (f), помещают в отдельные лунки 96-луночных планшетов, содержащие 2хYT/100 мкг/мл Amp/1% глюкозы. Колонии выращивают, осторожно встряхивая, в течение ночи при 37°С. Указанные планшеты, именуемые базовыми планшетами, хранят при -80°С после добавления глицерина до конечной концентрации, равной 15%.
До передачи базовых планшетов на хранение их используют для инокуляции одного или нескольких 384-луночных планшетов, содержащих 2хYT/100 мкг/мл Amp/0,1% глюкозы, при помощи 96-канального репликатора. Планшеты заклеивают и встряхивают в течение 2-3 часов при 37°С.
Экспрессию Fab-фрагментов индуцируют, добавляя равное количество 2хYT/100 мкг/мл Amp/0,2 мМ IPTG с достижением конечной концентрации IPTG, равной 0,1 мМ. Планшеты заклеивают и встряхивают в течение ночи при 30°С. На следующий день Fab-содержащие супернатанты анализируют в отношении специфичности связывания ТТ-антигена методом ELISA.
g-2. Анализ ELISA
384-луночные планшеты для ELISA (Nunc, Roskilde, Denmark, № по каталогу 265196) сенсибилизируют в течение ночи при 4°С антигеном столбнячного токсина (ТТ), разведенным до конечной концентрации 0,1 мкг/мл в PBS в объеме, равном 25 мкл на одну лунку. Избыток сайтов связывания в лунках блокируют в течение 1 часа при комнатной температуре, добавляя 2% М-PBS-T (2% сухого обезжиренного молока в PBS, 0,05% твина-20). Лунки дважды промывают PBS-T (PBS, 0,05% твина-20).
Fab-содержащие бактериальные супернатанты, полученные на стадии g-1, разводят в отношении 1:2 в 2% M-PBS-T и переносят в двух копиях в лунки планшета для ELISA. Культуру инкубируют в течение 1 часа при комнатной температуре. Лунки четыре раза промывают РBS-T. В лунки добавляют антитело козы к комплексу Fab/HRP человека (Sigma, St.Louis, MO, USA, № по каталогу А0293), разведенное в отношении 1:10000 в 2% M-PBS-T. Культуру инкубируют в течение 1 часа при комнатной температуре. Лунки четыре раза промывают PBS-T. Добавляют субстрат ТМВ Plus (KemEnTec, Copenhagen, Denmark, № по каталогу 4390L) и инкубируют в течение 5-15 минут. Реакции прекращают, добавляя равный объем 1М раствора Н2SO4. Степень выполнения реакций определяют в спектрофотометре для прочтения планшетов для ELISA при 450 нм (Multiscan Ascent, Labsystems, Franklin, USA).
Затем из базовых планшетов удаляют исходные бактериальные клоны, соответствующие клонам, связывающим ТТ-антиген. Из выделенных антиген-положительных клонов Fab-фрагментов получают плазмидную ДНК и создают подбиблиотеку экспрессируемых родственных Fab-фрагментов клонов, связывающих ТТ-антиген.
Указанные клоны могут быть также подвергнуты анализу ELISA с использованием антитела против легкой цепи для установления корреляции между числом антиген-связывающих клонов и числом Fab-экспрессирующих клонов. Кроме того, такой анализ позволяет получить информацию о легких каппа- и лямбда-цепях в указанных клонах.
h. Библиотека экспрессируемых родственных антител
Для облегчения экспрессии непроцессированных антител человека родственные вариабельные области из бактериального вектора экспрессии Fab-фрагментов должны быть перенесены в экспрессирующий вектор млекопитающего, содержащий константные области иммуноглобулина человека одного из изотипов. Такой перенос можно осуществить в результате последовательного или массового переноса клонов. Ниже описан способ массового переноса.
Массовый перенос выполняют в виде двух стадий. Сначала собирают плазмидные препараты отдельно выделенных антигенсвязыващих клонов Fab-фрагментов. Кластер, содержащий прокариотический промотор и лидерную последовательноть, заменяют кластером промотора и лидерной последовательности млекопитающего, состоящим из лидерной последовательности щелочной фосфатазы человека (лидерная последовательность АР), промотора фактора элонгации 1-альфа человека (EFP), аденовирусного главного позднего промотора (AdMLP), лидерной последовательности IgK, путем гидролиза подбиблиотеки собранных экспрессируемых Fab-фрагментов при помощи AscI и NheI с последующим введением кластера промотора и лидерной последовательности млекопитающего, выполняемого лигированием. E.coli (ТОР10) трансформируют методом электропорации полученной библиотекой экспрессируемых Fab-фрагментов с замененным промотором и отбирают трансформанты на 2хYT агаре, содержащем 100 мкг/мл карбенициллина. Плазмидную ДНК получают из колоний сразу же после удаления с агаровых пластинок. Для сохранения разнообразия плазмидный препарат получают из минимального числа колоний одного донора, соответствующего примерно трехкратному общему числу клонов в исходной библиотеке.
Затем, осуществляя гидролиз плазмидного препарата при помощи XhoI и NotI, из вектора экспрессии Fab-фрагментов с замененным промотором выделяют родственные вариабельные последовательности. Выделенный фрагмент вводят лигированием в экспрессирующий вектор млекопитающего, получая при этом библиотеку экспрессируемых родственных антител. Используемый вектор аналогичен показанному на фиг.9А за исключением того, что IgL в данном случае соответствует последовательности, кодирующей легкую каппа-цепь. Вышеуказанный экспрессирующий вектор млекопитающего получен на основе сайт-специфической системы Flp-In (Invitrogen Corporation, Carlsbad, CA, USA, № по каталогу К6010-01). E.coli (TOP10) трансформируют методом электропорации полученной библиотекой экспрессируемых родственных антител и отбирают трансформанты на 2хYT агаре, содержащем 100 мкг/мл карбенициллина. Плазмидную ДНК получают из колоний сразу же после удаления с агаровых пластинок. Для сохранения разнообразия плазмидный препарат снова получают из минимального числа колоний одного донора, соответствующего примерно трехкратному общему числу клонов в исходной библиотеке. Полученный плазмидный препарат из библиотеки экспрессируемых родственных антител можно использовать для трансфекции клетки-хозяина млекопитающего, например клеток СНО из системы Flp-In компании Invitrogen (Invitrogen Corporation, Carlsbad, CA, USA, № по каталогу К6010-01), с целью создания устойчивых экспрессирующих линий клеток млекопитающего путем интеграции, опосредуемой Flp-рекомбиназой. Такую линию клеток можно использовать для продуцирования рекомбинантных поликлональных антител.
Пример 7. Скрининг при помощи мембранного анализа высокой плотности
Fab-экспрессирующие клоны по примеру 6f исследуют при помощи мембранного анализа высокой плотности.
а. Создание базовых планшетов
Базовые планшеты создают в соответствии с описанием, приведенным на стадии (g-1) примера 6.
b. Получение PVDF мембран
PVDF (поливинилиденфторидные) мембраны (Amersham, Uppsala, Sweden, № по каталогу RPN2020F) сенсибилизируют ТТ-антигеном, разведенным до конечной концентрации 1 мкг/мл в PBS, в течение ночи при 4°С в соответствии с инструкциями изготовителя. Избыток сайтов связывания на мембранах блокируют в течение 1 часа в 2% М-PBS (2% сухого обезжиренного молока в PBS). Мембраны трижды промывают в PBS. Мембраны вымачивают в 2хYT в течение нескольких минут.
с. Консолидация клонов
Консолидацию клонов на 384-луночных планшетах выполняют путем переноса клонов с базовых планшетов на один или несколько 384-луночных планшетнов, содержащих 20 мкл 2хYT/лунку, используя 96-канальный репликатор.
При помощи 384-канального репликатора бактерии переносят в двух копиях на одну или несколько найлоновых мембран (Amersham, Uppsala, Sweden, № по каталогу RPN2020B), расположенных на агаровых пластинках, содержащих 2хYT/Carb/1% глюкозы. Планшеты инкубируют в течение 4-6 часов при 37°С.
d. Индукция экспрессии Fab-фрагментов
PVDF мембраны, полученные на стадии b, помещают на агаровые пластинки, содержащие 2хYT/Carb/0,1 мМ IPTG. Найлоновые мембраны с растущими бактериальными колониями помещают поверх PVDF мембран (одну найлоновую мембрану на одну PVDF мембрану) на IPTG-содержащую агаровую пластинку. IPTG-содержащую агаровую пластинку инкубируют при 30°С в течение ночи для облегчения IPTG-индуцируемой экспрессии Fab-фрагментов из колоний. Молекулы Fab-фрагментов проникают через найлоновую мембрану на PVDF мембрану, которая задерживает Fab-фрагменты, связывающие ТТ-антиген.
е. Обнаружение
Найлоновые мембраны удаляют и PVDF мембраны промывают PBS-T (PBS, 0,05% твина-20) 2 раза по 5 минут. Мембраны инкубируют в течение 30 минут с 2% М-PBS. PVDF мембраны промывают PBS-T 2 раза по 5 минут и инкубируют в течение 1 часа с антителом козы к комплексу IgG/HRP человека (Sigma, St. Louis, MO, USA, № по каталогу А0293) при разведении в 2% М-PBS в отношении 1:10000. PVDF мембраны промывают PBS-T 3 раза по 5 минут. И, наконец, PVDF мембраны инкубируют в течение 5 минут с хемилюминесцентным субстратом SuperSignal West Femto (Pierce, Rockford, Il, USA, № по каталогу 34095) в соответствии с инструкциями изготовителей. Избыток субстрата удаляют и PVDF мембраны помещают под видеокамеру на основе устройства с зарядовой связью (CCD) для обнаружения хемилюминесцентного сигнала, возникающего в тех положениях PVDF мембраны, где Fab-фрагмент связывает ТТ-антиген.
Положительные клоны, связывающие ТТ-антиген, появляются на изображении в виде точек. Исходный бактериальный клон затем удаляют с базовых планшетов. Из выделенных антиген-положительных клонов Fab-фрагментов получают плазмидную ДНК, создавая таким образом подбиблиотеку экспрессируемых родственных Fab-фрагментов клонов, связывающих ТТ-антиген.
f. Корреляция между антигенсвязывающими клонами и Fab-экспрессирующими клонами
Найлоновые мембраны, удаленные на стадии е., помещают на вторую серию PVDF мембран, сенсибилизированных антителом против легкой цепи или антителом против Fab-фрагментов, способом, описанным на стадии b. Затем повторяют стадии d. и е.
Fab-положительные клоны появляются на изображении в виде точек, при этом можно установить корреляцию между числом клонов, связывающих ТТ-антиген, и числом Fab-экспрессирующих клонов.
Пример 8. Пример, иллюстрирующий выделение последовательностей, кодирующих гетеромерный белок
Настоящий пример иллюстрирует возможность одностадийного выделения тримерного белка, связывающего гуаниннуклеотид (G-белок), при помощи множественной RT-PCR с удлинением цепи путем перекрывания по настоящему изобретению. Семейство субъединиц G-белка является обширным, только у человека насчитывается примерно 16 разных альфа-субъединиц, 5 бета-субъединиц и 12 гамма-субъединиц. Для настоящего примера были выбраны субъединица GαS (№ доступа в банке генов GenBank Х04408), субъединица Gβ1 (№ доступа в банке генов GenBank AF501822) и субъединица Gγ1 (№ доступа в банке генов GenBank BC029367). Способ связывания показан на фиг.13, где стадия 1 является стадией множественной RT-PCR с удлинением цепи путем перекрывания и стадия 2 является стадией дополнительной амплификации связанного продукта.
а. Клетки
Популяцию клеток печени человека получают из образцов, уничтожаемых после выполнения хирургических операций. Клетки печени разрушают и лизируют, общую РНК выделяют из лизата при помощи набора RNA L (Macherey - Nagel, Duren, Germany, № по каталогу 740962.20) в соответствии с инструкциями изготовителей.
b. Множественная RT-PCR с удлинением цепи путем перекрывания
Для выполнения множественной RT-PCR с удлинением цепи путем перекрывания используют набор для одностадийной RT-PCR компании Qiagen (Qiagen, № по каталогу 210212, Hilden, Germany) в соответствии с рекомендациями изготовителя.
Каждая пробирка для PCR содержит в общем объеме, равном 50 мкл, нижеследующие реагенты:
однократный буфер для одностадийной RT-PCR,
dNTP в конечной концентрации 400 мкМ каждого реагента,
смесь множественных праймеров для удлинения цепи путем перекрывания в концентрациях, указанных в таблице 10,
2 мкл смеси ферментов для одностадийной RT-PCR,
1 ед/мкл ингибитора РНКазы (RNasin, Promega, Madison USA, № по каталогу N2515),
50 нг общей РНК.
Использованная смесь множественных праймеров для удлинения цепи путем перекрывания содержит праймеры, показанные в таблице 10.

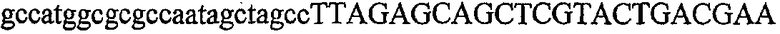
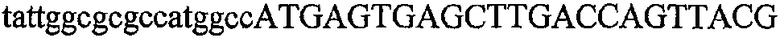


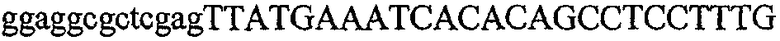
Реакцию выполняют в нижеследующих условиях циклизации:
Реакция PCR:
с. Амплификация методом PCR
Один микролитр продукта реакции множественной RT-PCR с удлинением цепи путем перекрывания подвергают дополнительной амплификации методом PCR (набор Biotaq, Bioline, UK, № по каталогу BIO-21040) в соответствии с рекомендациями изготовителя. Используют праймеры α1 и γ2, показанные в таблице 10, которые соответствуют SEQ ID NO:80 и 85. Общий объем реакционной смеси равен 50 мкл.
Реакцию выполняют в нижеследующих условиях циклизации:
Пять микролитров продукта реакции анализируют электрофорезом в 1% агарозном геле, используя для обнаружения бромид этидия. Ожидаемый размер продукта равен 2215 п.о. Однако могут присутствовать дополнительные несвязанные фрагменты указанных субъединиц. Ожидаемые размеры указанных фрагментов равны: Gα - 1228 п.о., Gβ - 1064 п.о. и Gγ - 262 п.о.
d. Клонирование
Остальной продукт реакции подвергают электрофорезу в 1% агарозном геле, используя для обнаружения бромид этидия, фрагмент удлинения цепи путем перекрывания длиной 2215 п.о. вырезают из агарозного геля, очищают при помощи набора Qiaex II (Qiagen, Hilden, Germany, № по каталогу 20051) и вводят в pCR2.1-TOPO, используя набор для клонирования ТОРО ТА компании Invitrogen (Invitrogen, № по каталогу 45-0641, Carlsbad, CA, USA).
Кроме того, вверху от последовательности, кодирующей каждую субъединицу, могут быть вставлены промоторные последовательности или сайты связывания рибосомы, для облегчения их экспрессии из вектора. Для такой вставки могут быть использованы сайты рестрикции, присутствующие в последовательностях для удлинения цепи путем перекрывания.
е. Общие соображения
Вышеописанное связывание последовательностей, кодирующих субъединицы, образующие гетеромерный белок, может быть выполнено для большинства гетеромерных белков, в которых известна последовательность отдельных субъединиц. Кроме того, при использовании смеси множественных праймеров для удлинения цепи путем перекрывания, способной амплифицировать несколько членов определенного семейства, например все α-, β- и γ-субъединицы G-белка, можно идентифицировать и связать любую комбинацию субъединиц из любой клетки без предварительного анализа, позволяющего определить, клетками какого типа какие члены семейства экспрессируются. Например, способ по вышеуказанному примеру может быть выполнен с использованием матрицы, полученной из выделенных отдельных клеток печени при помощи смеси множественных праймеров для удлинения цепи путем перекрывания, способной амплифицировать и связывать все 16 субъединиц Gα с 5 субъединицами Gβ и 12 субъединицами Gγ, благодаря чему можно определить, какая комбинация субъединиц экспрессирована в каждой клетке, и одновременно выделить кодирующие последовательности, определяющие данную комбинацию субъединиц. Кроме того, вырожденные праймеры могут даже служить для идентификации новых членов определенного семейства.
При связывании субъединиц гетеромерного белка при помощи множественной RT-PCR с удлинением цепи путем перекрывания по настоящему изобретению необходимо учесть общий размер связанного продукта, так как существуют пределы для числа пар оснований, амплифицируемых ДНК-полимеразой. Полимераза Deep Vent компании New England Biolabs, MA, USA, является одной ДНК-полимеразой, способной образовывать очень длинные удлинения праймеров, содержащие до 14000 п.о. Теоретически 14000 п.о. могут кодировать белок со средней массой 510 кДа. Таким образом, способом по настоящему изобретению можно выделить кодирующие последовательности для очень больших гетеромерных белков. Удлинение цепи можно еще больше увеличить, используя смеси ДНК-полимераз.
Пример 9. Создание праймеров для лидерных последовательностей
В данном примере рассмотрено создание множественного набора праймеров, в которых сайт инициации находится в последовательности, кодирующей лидерную область семейств тяжелой цепи и легкой каппа-цепи антитела человека.
При использовании праймеров, гибридизирующих с N-концевыми кодирующими последовательностями семейства вариабельных областей, может наблюдаться некоторая степень перекрестной гибридизации. Праймеры для последовательности одного определенного семейства генов могут гибридизировать с кДНК другого семейства генов, что во многих случаях вызывает образование новых последовательностей. Белки, образованные из таких последовательностей, являются потенциально иммуногенными при использовании в лечебных целях. Указанные новые последовательности обычно можно исправить при помощи PCR или удалить из библиотеки.
Альтернативным решением является введение сайта инициации в последовательность, кодирующую лидерный пептид вариабельной области антитела. Гибридные последовательности, образовавшиеся в результате перекрестной гибридизации, будут удалены во время внутриклеточного процессинга антитела, в результате которого лидерный пептид, содержащий потенциальные иммуногенные последовательности, будет расщеплен и, следовательно, не будет присутствовать в секретированном антителе. Известные наборы праймеров для лидерных пептидов, предназначенные для клонирования антитела, располагались у 5'-конца последовательности, кодирующей лидерный пептид, делая возможной прямую экспрессию эукариотической клеткой (Campbell M.J. et al. 1992, Mol. Immunol. 29, 193-203). К сожалению, лидерные пептиды эукариотической клетки плохо пригодны для процессинга в прокариотической клетке.
Простота манипуляции последовательностями нуклеиновых кислот в бактериях делает привлекательным создание систем клонирования, в которых возможен перенос последовательностей между бактериальными векторами и векторами для других организмов-хозяев. Поэтому в настоящем примере был создан множественный набор праймеров, в которых сайт инициации находится в положении последовательности, кодирующей область лидерного пептида, что делает возможной функциональную экспрессию антител или фрагментов антител как в эукариотических, так и в прокариотических экспрессирующих системах.
Требования, предъявляемые к расщеплению последовательностей сигнальной пептидазой в С-концевой области любого лидерного пептида, по-видимому, очень схожи для прокариотических и эукариотических систем (Nielsen H et al., 1997, Protein Eng. 10, 1-6). Кроме того, из вышеизложенного следует, что мутации в С-концевой области лидерного пептида, вероятно, оказывают незначительное влияние на конформацию N-концевой области и наоборот. Таким образом, можно ожидать, что С-концевые последовательности могут переноситься из одного вида в другой без утраты функциональной активности.
Основным принципом создания праймеров в настоящем примере было размещение сайта инициации в последних шести кодонах С-концевой области лидерного пептида. Остальная часть последовательности, кодирующей лидерный пептид, вверху от сайта инициации (примерно 50 нуклеотидов) должна быть введена приемлемым экспрессирующим вектором, соответствующим биологическому виду хозяину. Например, векторы, пригодные для экспрессии в грамотрицательных бактериях, могут быть созданы с использованием процессированной или непроцессированной лидерной последовательности PelB. Для экспрессии антител в эукариотах пригоден вектор с процессированной последовательностью, кодирующей лидерный пептид тяжелой цепи нативного антитела, и процессированной последовательностью, кодирующей лидерный пептид вариабельной области каппа-цепи. Независимо от экспрессирующей системы последние шесть аминокислот лидерного пептида образуются из последовательности, кодирующей лидерный пептид эндогенного антитела, которая находится в сегменте нуклеиновой кислоты, вставленном в вектор.
Для использования в множественной RT-PCR с удлинением цепи путем перекрывания были созданы нижеследующие праймеры (таблица 11). Однако концевые сегменты удлинения цепи путем перекрывания (строчные буквы) могут быть легко изменены для использования при связывании путем лигирования или рекомбинации.





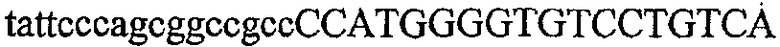


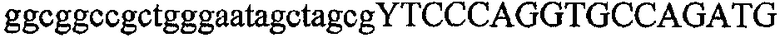

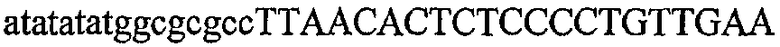
Необходимо отметить, что сайты рестрикции в данной конформации праймеров были несколько модифицированы по сравнению с праймерами, описанными в предыдущих примерах. Так, перекрывающая последовательность, расположенная между последовательностями, кодирующими вариабельные области тяжелой и легкой цепей, содержит сайт рестрикции NotI и NheI, и в затравке для константной области каппа-цепи (CLк) ранее существующий сайт NotI был заменен сайтом AscI. Последняя модификация должна быть обязательно произведена при создании праймеров для дополнительной амплификации методом PCR. Кроме того, сайт NotI в клонирующем векторе, показанном на фиг.11, должен быть заменен сайтом AscI, и сайт AscI в промоторе должен быть заменен сайтом NotI.
Функциональные свойства, относящиеся к расщеплению лидерного пептида, были проверены in silico с использованием программы SignalP, предоставленной CBS Датского технического университета.
Химерные лидерные пептиды, проверенные на наличие вариабельной области тяжелой цепи, были кодированы последовательностями нуклеиновых кислот, состоящими из процессированной последовательности PelB, С-концевого сайта NotI (SEQ ID NO 100: ATG AAA TAT CTT CTA CCA ACA GCG GCA GCT GGA TTA TTG GCG GCC GCC), и связаны с сайтом NotI геноспецифической части одной из SEQ ID NO 86-92, кодирующей шесть С-концевых аминокислот из нативных членов семейства VHL. При помощи программы SignalP было установлено, что все семь последовательностей характеризуются расщеплением сигнального пептида в грамотрицательных бактериях.
Химерные лидерные пептиды, проверенные на наличие вариабельной области легкой цепи, были кодированы последовательностями нуклеиновых кислот, состоящими из процессированной последовательности PelB, С-концевого сайта NheI (SEQ ID NO 101: ATG AAA TAT TTG CTA CCA ACA GCG GCA GCT GGA TTA TTG TTA CTA GCG), и связаны с сайтом NheI геноспецифической части одной из SEQ ID NO 93-98, кодирующей шесть С-концевых аминокислот из нативных членов семейства VLкL. При помощи программы SignalP было установлено, что все шесть последовательностей характеризуются расщеплением сигнального пептида в грамотрицательных бактериях.
Последовательности SEQ ID NO 100 и 101 пригодны для создания бактериального экспрессирующего вектора, аналогичного показанному на фиг.11, так как сайт AscI, показанный на фиг.11, заменен SEQ ID NO 100 и сайт NheI заменен SEQ ID NO 101. Кроме того, сайт NotI, показанный на фиг.11, должен быть заменен сайтом AscI.
Экспрессирующий вектор млекопитающего (фиг.9) аналогичным образом может быть изменен с возможностью экспрессии в клетках млекопитающих после переноса сегментов, кодирующих вариабельные области, из только что описанного бактериального вектора.
Пример 10. Выполнение множественной RT-PCR и связывания лигированием в одной пробирке
В настоящем примере рассмотрен способ получения родственной пары, включающей связанные последовательности, кодирующие вариабельную область тяжелой цепи и вариабельную область легкой цепи, в одной пробирке при выполнении связывания лигированием вместо PCR с удлинением цепи путем перекрывания.
а. Множественная RT-PCR
Полученную в собственной лаборатории линию клеток, экспрессирующих молекулы Fab-фрагментов со специфичностью в отношении столбнячного токсина, распределяют методом ограниченного разведения с получением одной клетки в одной пробирке для PCR.
Помимо одной клетки каждая пробирка для PCR содержит нижеследующие реагенты в общем объеме, равном 20 мкл:
однократный буфер Phusion HF,
dNTP в конечной концентрации, равной 200 мкМ каждого реагента,
смесь множественных праймеров в концентрациях, указанных в таблице 12,
0,8 ед. полимеразы Phusion (FinnZymes, № по каталогу F-530-L),
1 мкл обратной транскриптазы Sensiscript (Qiagen, № по каталогу 205213),
20 ед. ингибитора РНКазы.

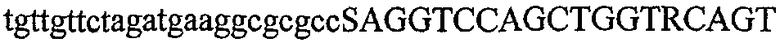

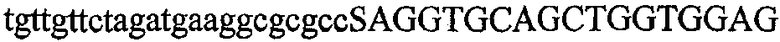

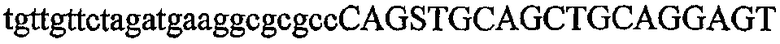

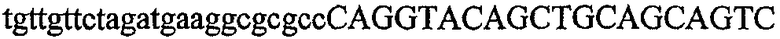





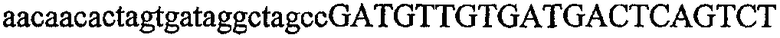




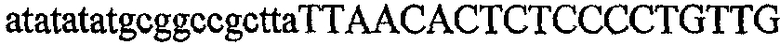
Реакцию выполняют в нижеследующих условиях циклизации:
b. Связывание лигированием
Для выполнения связывания лигированием рестрикционные ферменты и лигазу добавляют непосредственно к продуктам реакции множественной RT-PCR. Альтернативно продукт реакции множественной RT-PCR может быть очищен до вышеуказанного добавления для максимального освобождения смеси от полимеразы.
В каждую пробирку добавляют нижеследующие реагенты в общем объеме, равном 40 мкл:
однократный буфер NEBII,
1 мМ АТР,
50 ед. XbaI (New England Biolabs, № по каталогу R0145L),
25 ед. SpeI (New England Biolabs, № по каталогу R0133S),
100 мкг/мл BSA,
400 ед. ДНК-лигазы Т4 (New England Biolabs, № по каталогу М0202S).
Реакционную смесь инкубируют при 16°С в течение ночи.
Связанные последовательности, кодирующие вариабельные области тяжелой и легкой цепей, очищают от реакционной смеси при помощи гель-электрофореза и вырезают полосу, равную примерно 1000 п.о.
В альтернативном варианте данного способа множественную RT-PCR выполняют с использованием праймера для СН вместо праймеров для JН в множественном наборе праймеров. Указанный праймер может иметь клонирующий концевой сегмент, который делает возможным введение в рамке считывания вариабельной области тяжелой цепи в экспрессирующий вектор, либо может быть выполнена полугнездовая PCR с использованием праймеров, показанных в таблице 5.
Пример 11. Создание рекомбинантного поликлонального иммуноглобулина со специфичностью в отношении столбнячного токсина
В настоящем примере рассмотрены результаты иммунизации одного донора (ТТ03) столбнячным токсином (ТТ) с описанием стадий, показанных на блок-схеме, изображенной на фиг.10.
а. Доноры
Восемь доноров, которых ранее иммунизировали противостолбнячной вакциной, подвергали бустер-иммунизации противостолбнячной вакциной (Statens Serum Institut, Denmark). Донорам были присвоены номера ТТ01 - ТТ08. Через шесть дней после бустер-иммунизации противостолбнячной вакциной у доноров брали пробу крови, равную примерно 200 мл, которую вводили в пробирку с антикоагулянтом.
Доноры были здоровы, не имели хронических инфекций и аутоиммунных заболеваний, не принимали иммунодепрессивных средств и не подвергались никаким вакцинациям в течение последних 3 месяцев.
а-1. Проверка качества проб крови, полученных у доноров
Во время иммунизации у доноров брали предварительные пробы крови. Через четырнадцать дней у доноров брали дополнительные пробы крови для определения сывороточного титра. У всех доноров наблюдалось увеличение титра столбнячного токсина (ТТ). Кроме того, выполняли анализ ELISPOT для измерения частоты встречаемости ТТ-специфических плазматических клеток. Для выполнения анализа ELISPOT можно использовать разные фракции клеток, например цельную кровь, полученную на 6-й день, фракцию РВМС, фракцию, полученную в результате магнитной сортировки, или фракцию, полученную в результате сортировки методом FACS. Анализ ELISPOT можно использовать для оценки материала донора и идентификации лучших клеток-респондеров, которые затем могут быть использованы на стадии сортировки и множественной RT-PCR с удлинением цепи путем перекрывания. Анализ ELISPOT выполняли для донора ТТ03 с использованием фракции CD19+ клеток (см. раздел с). Анализ ELISPOT был выполнен в соответствии с описанием, приведенным в публикации Lakew, M. et al., 1997, J. Immunol. Methods 203, 193-198, с внесением незначительных изменений. Частота встречаемости ТТ-специфических плазматических клеток во фракции РВМС были вычислена равной 0,021%.
b. Получение мононуклеарных клеток периферической крови (РВМС)
Клетки РВМС выделяли из пробы крови в устройстве Lymphoprep (Axis-Shield РоС AS, Norway, производственный № 1001967) в соответствии с рекомендациями изготовителей. Кровь разводили в PBS в отношении 1:1 и полученную взвесь вводили в устройство Lymphoprep в отношении 2:1. Пробирки центрифугировали с ускорением 800 g в течение 20 минут при 25°С и собирали полосу интерфазы лейкоцитов. Клетки промывали в PBS, содержащем 2 мМ EDTA.
Из 200 мл цельной крови, отобранной от донора ТТ03, было получено примерно 2х108 РВМС.
с. Обогащение В-клеток
Линию В-клеток (CD19+ клетки) из РВМС обогащали путем сортировки клеток с использованием магнитных гранул нижеследующим способом.
Выделенные клетки РВМС окрашивали анти-CD19-FITC (Becton Dickenson, NJ, USA, № по каталогу 345776). Все стадии выполняли в темном помещении при 4°С. Окрашивание производили 10 мкл анти-CD19-FITC на 1х106 клеток в объеме 100 мкл на 1х106 клеток с использованием М-буфера (РBS, рН 7,2, 0,5% BSA, 2 мМ EDTA). Указанный краситель окрашивает линию В-клеток РВМС. Клетки инкубировали в течение 20 минут и затем дважды промывали М-буфером. Клетки, окрашенные анти-CD19-FITC, подвергали магнитному мечению при помощи микрогранул, конъюгированных с анти-FITC-антителом, используя 10 мкл магнитных гранул, сенсибилизированных анти-FITC-антителом (Miltenyi Biotec, Gladbach, Germany, № по каталогу 130-042-401), на 1х106 клеток в объеме 100 мкл М-буфера на 1х106 клеток. Клетки инкубировали в течение 15 минут и затем один раз промывали М-буфером. Клетки вторично суспендировали в дегазированном М-буфере.
Колонку MACS LS (Miltenyi Biotec, Gladbach, Germany, № по каталогу 130-042-401) предварительно обрабатывали дегазированным М-буфером в соответствии с инструкциями изготовителей. Взвесь клеток, окрашенных анти-CD19-FITC и меченных магнитными гранулами, сенсибилизованными анти-FITC-антителом, вводили в колонку с возможностью прохождения через нее. Окрашенные и меченые клетки (CD19+) оставались в магнитном поле, окружающем колонку, в то время как неокрашенные клетки (CD19+) проходили через колонку. Колонку промывали дегазированным М-буфером. Магнитное поле отключали и собирали CD19+ клетки.
Аналитическое окрашивание исходного материала (РВМС), немеченой фракции и CD19 меченой фракции донора ТТ03 производили, используя анти-CD19-FITC, анти-CD38-РЕ и анти-CD45-PerCP (фиг.14). Полученные данные показывают, в результате магнитной сортировки клеток образуются две разные фракции по сравнению с фракцией РВМС. CD19-отрицательные клетки, показанные в блоке В, и CD19-положительные клетки, показанные в блоке С. Фракция РВМС содержала 11% CD19+ клеток, причем степень очистки CD19-положительных клеток была равна 99,5% R1 (диаграмма рассеяния, показанная на фиг.14С) для ТТ03.
Как показано на фиг.14С, диаграмма рассеяния анти-CD38/CD45 позволила выявить отдельную популяцию CD38hi, CD45in клеток (R2), соответствующую 1,1% R1. Данная популяция содержала плазматические клетки и была собрана на последующей стадии сортировки. Из вышеизложенного следует, что во фракции РВМС 0,12% клеток соответствовало плазматическим клеткам.
Фракцию CD19-положительных клеток замораживали в FCS (Invitrogen, № по каталогу 16000-044), содержащей 10% ДМСО (Sigma, № по каталогу D2650), для последующей сортировки. Анализ, аналогичный показанному на фиг.14, выполняли в отношении клеток, очищенных в колонке MACS, которые были заморожены для гарантии целостности клеток (фиг.15). Картины окрашивания, показанные на фиг.15, были аналогичны изображенным на фиг.14С, хотя наблюдалась несколько большая интенсивность окрашивания. Клетки, собранные в результате сортировки, представляют собой субпопуляцию R1 и R2. Указанная субпопуляция соответствует примерно 1,1% клеток, очищенных в колонке MACS.
d. Сортировка плазматических клеток
Замороженный элюат, полученный из колонки MACS, оттаивали, центрифугировали и вторично суспендировали в буфере для FACS (PBS, рН 7,2, 2% BSA) в концентрации 1х106 клеток/60 мкл буфера для FACS. Добавляли анти-CD19-FITC (Becton Dickenson, NJ, USA, № по каталогу 345776) (10 мкл/106 клеток), анти-CD38-РЕ (Becton Dickenson, NJ, USA, № по каталогу 555460) (10 мкл/106 клеток) и анти-CD45-PerCP (Becton Dickenson, NJ, USA, № по каталогу 345809) (20 мкл/106 клеток), смесь инкубировали в темном помещении при 4°С в течение 20 минут, затем дважды промывали и вторично суспендировали в буфере для FACS.
Клетки сортировали методом сортировки клеток с возбуждением флуоресценции (FACS), используя нижеследующие параметры сортировки:
1. Прямое и боковое рассеяние для сохранения лимфоцитов и моноцитов, включая плазматические бласты и плазматические клетки, и удаление мертвых клеток и клеток с очень высоким боковым рассеянием, которые могут быть агрегатами или гранулоцитами.
2. Клетки, которые являются CD19-положительными и экспрессируют повышенные уровни CD38 (CD38hi). Подобным образом происходит улавливание в основном CD38 клеток, так как РВМС были обогащены в колонке MACS CD19 клетками, но указанный способ позволяет обнаружить любые загрязнения.
3. CD45-промежуточно положительные клетки. Все лимфоциты экспрессируют CD45. Однако плазматические клетки характеризуются меньшей экспрессией CD45 по сравнению с более ранними стадиями дифференцировки лимфоцитов. Поэтому при улавливании CD45 можно получить дискретную популяцию клеток, соответствующую плазматическим клеткам.
FACS-сортированные клетки, полученные от донора ТТ03, собирали в виде субпопуляции, полученной в результате двух сортировок Р2 и Р1 (фиг.16А и 16В). Указанные клетки представляли собой CD38hi (FL2-A), CD45in (FL3-A) и CD19+, причем последние клетки были получены в результате очистки в колонке MACS. Клетки собирали в общей массе, подсчитывали и разводили в RPMI (Invitrogen, № по каталогу 21875-034), содержащем 10% FCS (Invitrogen, № по каталогу 16000-044), 100 единиц/мл пенициллина-стрептомицина (Invitrogen, № по каталогу 15140-122), 2 мМ L-глутамина (№ по каталогу 25030-024). Затем клетки распределяли в пятьдесят 96-луночных планшетов для PCR (ABgene, № по каталогу АВ-0800) в количестве одной клетки на одну лунку в 5 мкл среды. Планшеты заклеивали, сразу же замораживали и хранили для последующего выполнения анализа RT-PCR.
е. Связывание родственных пар последовательностей, кодирующих вариабельные области иммуноглобулина
Множественную RT-PCR с удлинением цепи путем перекрывания выполняли в отношении отдельных клеток, полученных от донора ТТ03, в результате чего было произведено родственное связывание транскрибированных последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи антитела против столбнячного токсина.
е-1. Одностадийная множественная RT-PCR с удлинением цепи путем перекрывания
Для выполнения множественной RT-PCR с удлинением цепи путем перекрывания использовали набор для одностадийной RT-PCR компании Qiagen (Qiagen, № по каталогу 210212, Hilden, Germany) в соответствии с рекомендациями изготовителя. Пятьдесят замороженных 96-луночных планшетов для PCR, содержащих примерно одну клетку в одной лунке, удаляли из холодильника и, когда в лунках не оставалось кристаллов льда, в каждую лунку сразу же добавляли 15 мкл реакционной смеси для RT-PCR.
Реакционная смесь для RT-PCR содержала в общем объеме, равном 20 мкл, нижеследующие реагенты:
однократный буфер для одностадийной RT-PCR,
dNTP в конечной концентрации, равной 400 мкМ каждого реагента,
смесь множественных праймеров для удлинения цепи путем перекрывания в концентрациях, указанных в таблице 13,
0,8 мкл смеси ферментов для одностадийной RT-PCR,
20 ед. ингибитора РНКазы (RNasin, Promega, Madison, USA, № по каталогу N2515).
Состав смеси множественных праймеров для удлинения цепи путем перекрывания показан в таблице 13.









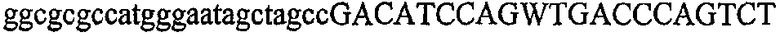

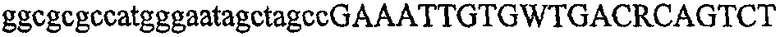
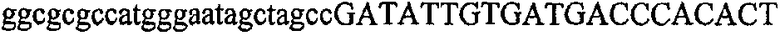

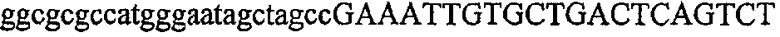

Реакцию выполняли в нижеследующих условиях циклизации:
Реакция PCR:
е-2. Дополнительная амплификация
Один микролитр продукта реакции множественной RT-PCR с удлинением цепи путем перекрывания из каждого образца подвергали полугнездовой PCR (набор Biotaq, Bioline, № по каталогу BIO-21040) в соответствии с рекомендациями изготовителя, используя 96-луночные планшеты для PCR (ABgene, № по каталогу АВ-0800). Каждая реакционная смесь, объем которой был равен 50 мкл, содержала однократный буфер Biotaq, 200 мкМ dNTP (каждого реагента), 2 мМ MgCl2, 1,25 ед. Bio Taq полимеразы и праймеры, показанные в таблице 14.




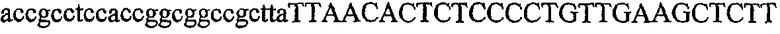
Последовательности, обозначенные заглавными буквами, соответствуют геноспецифической области.
Реакцию выполняли в нижеследующих условиях циклизации:
Десять микролитров образцов из ряда А, лунки 1-12 каждого планшета, анализировали электрофорезом в 1,5% агарозном геле, используя для визуализации бромид этидия, с целью проверки успешного выполнения множественной RT-PCR с удлинением цепи путем перекрывания. Ожидаемая длина фрагмента удлинения цепи путем перекрывания была равна примерно 1070 п.о. (точный размер зависит от длины вариабельных областей). На фиг.17 показаны образцы, отобранные из восьми 96-луночных планшетов. В результате успешного выполнения RT-PCR с удлинением цепи путем перекрывания с пятидесяти 96-луночных планшетов было получено в среднем по восемь фрагментов с одного планшета. Таким образом, общее число фрагментов, полученных в результате успешного выполнения RT-PCR с удлинением цепи путем перекрывания, было равно примерно 400.
По десять микролитров всех продуктов реакций на 96-луночных планшетах, принадлежащих одному донору, объединяли в одной пробирке. Аликвоту, состоящую из 200 мкл объединенных продуктов PCR, очищали при помощи набора для очистки продуктов PCR QIAquick в соответствии с рекомендациями изготовителей (Qiagen, № по каталогу 28106, Hilden, Germany), используя 60 микролитров буфера ЕВ для элюирования. Очищенный пул продуктов реакции PCR с удлинением цепи путем перекрывания гидролизовали XhoI и NotI и затем очищали препаративным электрофорезом в 1% агарозном геле; фрагменты удлинения цепи путем перекрывания вырезали из агарозного геля и очищали при помощи набора Qiaex II (Qiagen, № по каталогу 20051, Hilden, Germany).
f. Библиотека экспрессируемых родственных Fab-фрагментов
Библиотека экспрессируемых Fab-фрагментов была создана методом двухстадийного лигирования. Пул вышеописанных гидролизованных фрагментов удлинения цепи путем перекрывания лигировали с вектором JSK301 E.coli, гидролизованным XhoI/NotI (фиг.11). Лигированный продукт затем переносили в электрокомпетентные клетки E.coli (компетентные к электропорации XL1-Blue, Stratagen, № по каталогу 200228, La Jolla, USA) в соответствии с инструкциями изготовителя. Трансформированные клетки E.coli культивировали на 2xYT агаре, содержащем 100 мкг/мл карбенициллина. Биомассу, соответствующую примерно 1010-1011 клеткам, полученную из независимых колоний, число которых по крайней мере в 5 раз превышает общее число продуктов PCR с удлинением цепи путем перекрывания, использовали в качестве исходного материала для получения плазмидного препарата с использованием набора для получения плазмид Maxi компании Qiagen (Qiagen, № по каталогу 12163, Hilden, Germany). Для экспрессии Fab-фрагментов клонированных родственных и связанных VH- и VL-кодирующих последовательностей на второй стадии лигирования в вектор вводили кластер прокариотического промотера и лидерной последовательности. Использованный фрагмент двунаправленного промотора (SEQ ID NO:321) экстрагировали из исходного вектора JSK301 гидролизом AscI/NheI. Очищенный пул плазмид аналогичным образом гидролизовали рестрикционными эндонуклеазами AseI/NheI и очищали от геля вышеописанным способом. Очищенные фрагменты затем лигировали и переносили в электрокомпетентные клетки E.coli (TG1, Stratagene, № по каталогу 200123, La Jolla, USA) и культивировали на 2хYT агаре, содержащем 100 мкг/мл карбенициллина и 1% глюкозы. Процесс создания библиотеки экспрессируемых Fab-фрагментов показан на фиг.12.
g. Скрининг клонов
Fab-экспрессирующие клоны исследовали в отношении связывания ТТ-антигена при помощи антигенспецифических анализов ELISA.
g-1. Создание базовых планшетов и экспрессия Fab-фрагментов
Отобранные колонии клеток TG1, каждая из которых содержала вектор экспрессии родственных Fab-фрагментов из библиотеки, созданной в разделе (f), вводили в отдельные лунки 96-луночных планшетов, содержащих 2хYT/100 мкг/мл Сarb/1% глюкозы. Планшеты инкубировали, осторожно встряхивая, в течение ночи при 37°С. Четыре 96-луночных планшета объединяли в лунках одного 384-луночного планшета, содержащего 2хYT/100 мкг/мл Carb/1% глюкозы, при помощи 96-канальных репликаторов. 384-луночные планшеты инкубировали в течение дня при 37°С. Указанные планшеты, получившие название базовых планшетов, хранили при -80°С после добавления глицерина до конечной концентрации, равной 15%.
Базовые планшеты использовали для инкубации глубоких 384-луночных планшетов, содержащих 2хYT/100 мкг/мл Carb/0,1% глюкозы, при помощи 96-канального репликатора. Планшеты заклеивали и инкубировали, встряхивая, в течение 2-3 часов при 37°С.
Экспрессию Fab-фрагментов индуцировали, добавляя равный объем 2хYT/100 мкг/мл Carb/0,2 мМ IPTG с достижением конечной концентрации IPTG, равной 0,1 мМ. Планшеты заклеивали и инкубировали, встряхивая, в течение ночи при 30°С. На следующий день супернатанты, содержащие Fab-фрагменты, анализировали методом ELISA на специфичность связывания ТТ-антигенов.
g-2. Анализ ELISA
384-луночные планшеты для ELISA (Corning Inc., Corning, NY, USA, № по каталогу 3700) сенсибилизировали в течение ночи при 4°С антигеном столбнячного токсина (ТТ), разведенным до конечной концентрации 1 мкг/мл в PBS в объеме, равном 25 мкл на одну лунку. Избыток сайтов связывания в лунках блокировали в течение 1 часа при комнатной температуре (RT), добавляя 2% М-PBS-T (2% сухого обезжиренного молока в PBS, 0,05% твина-20). Лунки дважды промывали PBS-T (PBS, 0,05% твина-20).
Fab-содержащие бактериальные супернатанты, полученные на стадии g-1, разводили в отношении 1:2 в 2% M-PBS-T и переносили в двух копиях в лунки планшета для ELISA. Культуру инкубировали в течение 1 часа при комнатной температуре. Лунки четыре раза промывали РBS-T. В лунки добавляли антитело козы к комплексу Fab/HRP человека (Sigma, St.Louis, MO, USA, № по каталогу А0293), разведенное в отношении 1:10000 в 2% M-PBS-T. Культуру инкубировали в течение 1 часа при комнатной температуре. Лунки четыре раза промывали PBS-T. Добавляли субстрат ТМВ Plus (KemEnTec, Copenhagen, Denmark, № по каталогу 4390L) и инкубировали в течение 5-15 минут. Реакции прекращали, добавляя равный объем 1М раствора Н2SO4, и продукт реакции анализировали в спектрофотометре при 450 нм (Multiscan Ascent, Labsystems, Franklin, USA).
Первичные бактериальные клоны, соответствующие клонам, связывающим ТТ-антиген, затем могут быть удалены с базовых планшетов. Из выделенных антигенположительных клонов Fab-фрагментов может быть получена плазмидная ДНК с созданием подбиблиотеки экспрессируемых родственных Fab-фрагментов клонов, связывающих ТТ-антиген.
Субпопуляцию клонов далее анализировали методом ELISA с использованием антитела против каппа-цепи для установления корреляции между числом антигенсвязывающих клонов и числом Fab-экспрессирующих клонов. Анализ с использованием антитела против каппа-цепи обычно выполняли в виде анализа с использованием ТТ-антигена за исключением тех случаев, когда лунки сенсибилизировали антителом козы против каппа-цепи человека, разведенным в отношении 1:1000 (Caltag, California, USA, № по каталогу Н16000), используя карбонатный буфер, рН 9,6.
g-3. Результаты скрининга
Клоны из четырех 384-луночных планшетов исследовали на реактивность в отношении антитела против каппа-цепи и ТТ-антигена при помощи анализов ELISA способом, описанным в разделе g-2. Полученные результаты суммированы в таблицах 15-19. Результаты анализа ELISA с использованием антитела против каппа-цепи свидетельствуют об экспрессии Fab-фрагментов в данном клоне, и результаты анализа ELISA с использованием ТТ-антигена свидетельствуют о функциональной активности Fab-фрагментов.
Из 1440 отдельных клонов, подвергнутых анализу, 482 клона или 34% обладали реактивностью в отношении антитела против каппа-цепи на уровне, превышающем 2-кратную фоновую реактивность. 395 клонов или 27% обладали реактивностью, превышающей 3-кратную фоновую реактивность, и т.д.
Те же самые клоны анализировали методом ELISA на реактивность в отношении ТТ-антигена; полученные результаты приведены в нижеследующей таблице 16.
Из приведенной выше таблицы видно, что 9,0% клонов обладают реактивностью в отношении ТТ-антигена на уровне 2-кратной фоновой реактивности (определенной в виде сигнала, полученного на основании реактивности Fab-фрагмента с безотносительной специфичностью). 104 клона взаимодействовали на уровне 3-кратной фоновой реактивности (7,2%) и т.д.
Из Fab-положительных клонов (всего 482 клона) примерно 27% клонов (130/482) обладали реактивностью в отношении ТТ-антигена на уровне 2-кратной фоновой реактивности. Указанный уровень существенно не меняется при других уровнях фоновой реактивности.
Шесть 384-луночных планшетов исследовали с целью обнаружения клонов с реактивностью в отношении ТТ-антигена. Число клонов, обладающих реактивность в отношении данного антигена, показано в таблице 17. Для данных планшетов не выполняли анализ ELISA с использованием антитела против каппа-цепи.
Процентное значение ТТ-положительных клонов на планшетах G054-G059 было сравнимо с аналогичным значением, обнаруженным для планшетов G050-G053 (таблица 16).
Результаты, полученные для всех клонов, исследованных в отношении ТТ-антигена (таблицы 16 и 17), суммированы в таблице 18.
В общей сложности 339 клонов обладали реактивностью в отношении ТТ-антигена по крайней мере на уровне 2-кратной фоновой реактивности (таблица 18). Полученный результат соответствует 9,4% всех исследованных клонов.
Все положительные клоны, обладающие реактивностью в отношении ТТ-антигена на уровне 2-кратной фоновой реактивности, инокулировали с базового планшета на вышеописанные 96-луночные планшеты. На следующий день бактерии собирали центрифугированием со скоростью 4000 оборотов/мин в течение 15 минут, осадок вторично суспендировали в 0,8 мМ EDTA, 0,4 х PBS, 0,8 M NaCl и инкубировали на льду в течение 15 минут. Периплазматический экстракт собирали центрифугированием и анализировали реактивность клонов. Ниже приведены результаты реактивности для одного такого планшета (G060) в отношении антитела против каппа-цепи (фиг.18), овальбумина (неродственный антиген) (фиг.19), ТТ-антигена (фиг.20) и результаты одностадийного конкурентного анализа с использованием ТТ-антигена в концентрации 10-7 М в растворе (фиг.21). Вышеуказанные анализы ELISA выполняли на одном и том же периплазматическом экстракте при одинаковом разведении.
Большинство указанных клонов экспрессировали Fab-фрагменты (90/96) (фиг.13), при этом ни один из клонов не взаимодействовал с овальбумином (фиг.19). Реактивность в отношении иммобилизованного ТТ-антигена была ниже или полностью подавлялась ТТ-антигеном в растворе (фиг.21), указывая на то, что клоны специфически взаимодействуют с ТТ-антигеном. Показатели реактивности клонов на планшете G060 суммированы в таблице 19.
h. Анализ разнообразия и подтверждение клонов
Плазмиду, выделенную из 47 клонов (с планшета G060) подбиблиотеки экспрессируемых родственных Fab-фрагментов, связывающих ТТ-антиген, подвергали анализу последовательности. Последовательности, кодирующие вариабельную область тяжелой цепи, секвенировали при помощи праймера LSH-HCP: AGGAAACAGGAGATATACAT (SEQ ID NO:131) и гибридизировали с Р tac промотором; последовательности, кодирующие легкую цепь, секвенировали при помощи праймера LSN-LCP: TCGCCAAGGAGACAGTCATA (SEQ ID NO:132) и гибридизировали с Р lac промотором. Данные секвенирования последовательностей анализировали при помощи программного обеспечения Vector NTI (Informax, Frederick, MD, USA). Данные, полученные для последовательности тяжелой цепи, отсекали до одной пары оснований у 5'-конца вверху от сайта рестрикции AscI и у 3'-конца внизу от сайта рестрикции XhoI. Данные, полученные для последовательности легкой цепи, отсекали до второй пары оснований у 5'-конца вверху от сайта рестрикции NheI и у 3'-конца последнего кодона “ААА”, кодирующего С-концевой лизин вариабельной цепи. Отсечение производили для облегчения дальнейшего анализа, такого как трансляция каждой последовательности ДНК.
Последовательности, кодирующие вариабельные области тяжелой и легкой цепей, анализировали в отношении использования гена зародышевой линии путем сравнения указанных последовательностей с базой данных последовательностей, кодирующих вариабельную область зародышевой линии на основе V-гена (MRC Centre for Protein Engineering, Cambridge, UK). Таким образом был определен ближайший родственный аллель зародышевой линии для каждой последовательности, содержащей набор V-генов из 12 разных аллелей зародышевой линии вариабельной области тяжелой цепи, относящихся к VH-семейству VH1-VH5, и из 8 разных аллелей зародышевой линии вариабельной области легкой каппа-цепи, относящихся к VK1, VKIII и VKIV (таблица 20).
Кроме того, последовательности вариабельной области гена транслировали в белковые последовательности, которые подвергали сравнительному анализу при помощи программного обеспечения AlignX (Informax, Frederick, MD, USA), как показано на фигурах 22 и 23. На основании сравнительного анализа белковых последовательностей последовательности вариабельной области цепи можно было распределить по группам в соответствии с реаранжировкой V(D)J, обозначенной буквой Н для последовательности вариабельной области тяжелой цепи и буквой L для последовательности вариабельной области каппа-цепи с последующим указанием идентификационного номера. В каждой группе реаранжировки последовательности распределяли в соответствии с генотипом созревания (М-тип в таблице 20) по гипервариабельным участкам CDR1, 2 и 3, обозначенным строчной буквой в алфавитном порядке. Семь клонов содержали недозрелые терминирующие кодоны, из которых 6 клонов имели амбер-мутацию (TAG) (идентификационные номера клонов g060:b12, d08, f06, c12, f03, c04) и 1 клон имел опал-мутацию (TGA) (идентификационный номер клона g060:h12). Указанные кодоны были наиболее вероятно подавлены E.coli с образованием функциональных Fab-фрагментов. Четыре из указанных клонов были членами групп, содержащих аналогичные клоны, что делало их избыточными. Необходимо было произвести анализ дополнительных клонов, чтобы заменить остальные 3 клона с недозрелыми терминирующими кодонами, так как они были единственными членами своих групп. Альтернативно указанные последовательности можно было исправить стандартными методами молекулярной биологии, такими как PCR, замена терминирующего кодона приемлемым кодоном.
47 анализированных последовательностей V-области можно было разделить на 20 групп с однозначной реаранжировкой V(D)J (обозначенных “группы” в таблице 20) в зависимости от гена вариабельной области тяжелой цепи и вариабельной области каппа-цепи. Четыре из указанных групп реаранжировки можно было далее разделить на 1-4 типа созревания (а-d), в результате чего было получено 27 однозначных антителокодирующих последовательностей (таблица 12). Специфические группы реаранжировки тяжелой цепи обычно объединяются со специфическими группами реаранжировки легкой цепи (например, Н1 с L1, Н12 с L24 и так далее). Кроме того, тип созревания согласуется в парах последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи (например Н4с согласуется с L13c). Такая строгость спаривания в группах реаранжировки и типов созревания свидетельствует о родственном спаривании последовательностей, кодирующих вариабельные области.
Однако группа реаранжировки тяжелой цепи Н4 представляет исключение. Н4 спаривается с двумя разными легкими цепями L28 и L13. L13 была единственной цепью для Н4, включающей типы созревания а, b и с, которые согласуются с типами созревания L13. С другой стороны, было также обнаружено, что L28 спаривается с одним из членов в группе тяжелой цепи Н2. Две из семи последовательностей тяжелой цепи Н4а спариваются с тяжелой цепью L13a, и пять из семи последовательностей тяжелой цепи Н4а спариваются с L28a. Указанные наблюдения позволили предположить, что при выполнении множественной RT-PCR с удлинением цепи путем перекрывания в одной лунке находились две плазматические клетки, продуцирующие ТТ-специфическое антитело, с комбинациями генотипов Н2-L28 и Н4а-L13a. Редкие перестановки последовательностей при спаривании генов легкой и тяжелой цепей, таких как Н2 и Н4а с L28, были ожидаемыми, так как эксперимент выполнялся методом ограниченного разведения плазматических клеток.
Идентичность последовательностей в отдельных родственных парах последовательностей, кодирующих вариабельную область тяжелой и вариабельную область легкой цепи, относящихся к одной и той же группе и типу созревания, равна по крайней мере 90% и предпочтительно по крайней мере 95%. При рассмотрении, например, g060g03 и g060a01 из группы Н1 с типом созревания а оказывается, что клон g060g03 соответствует паре нуклеотидных последовательностей SEQ ID NO 168:215, где последовательность, кодирующая вариабельную область тяжелой цепи, соответствует SEQ ID NO 168 и последовательность, кодирующая вариабельную область легкой цепи, соответствует SEQ ID NO 215. Клон g060a01 соответствует паре нуклеотидных последовательностей SEQ ID NO 133:180. При сравнении SEQ ID NO 168 с SEQ ID NO 133 (вариабельные области тяжелых цепей) 4 из 369 оснований не являются идентичными и вариабельных областей легких цепей (SEQ ID NO 215 и 180) 8 из 327 оснований не являются идентичными, что соответствует 98,3% идентичности последовательностей в двух родственных парах (g060g03 и g060a01). Однако при рассмотрении идентичности последовательностей в разных группах нельзя ожидать высокой идентичности последовательностей, так как данная библиотека является поликлональной подбиблиотекой, в которой желательно разнообразие. В данном примере самая низкая идентичность в родственных парах равна примерно 40% (например, g060b11 и g060h11 характеризуются идентичностью последовательностей, равной 39,5%).
Один вариант осуществления настоящего изобретения относится к подбиблиотеке родственных пар последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи иммуноглобулина, причем иммуноглобулины, получаемые из указанной библиотеки, могут взаимодействовать или связываться со столбнячным токсином.
Другой вариант осуществления настоящего изобретения относится к такой подбиблиотеке родственных пар последовательностей, кодирующих вариабельную область тяжелой цепи и вариабельную область легкой цепи иммуноглобулина, которая содержит отдельные родственные пары с идентичностью последовательностей, равной по крайней мере 90%, выбираемые из группы, включающей пары SEQ ID NO 135:182, 168:215, 146:193, 151:198, 173:220, 152:199, 164:211, 148:195, 137:184, 169:216, 138:185, 143:190, 161:208, 166:213, 157:204, 139:186, 134:181, 150:197, 156:203, 158:205, 170:217, 178:225, 141:188 или 144:191.
Таблица 20
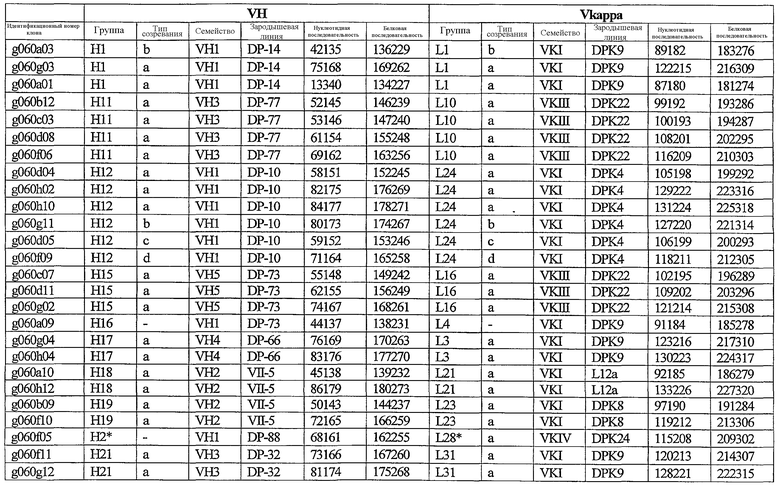
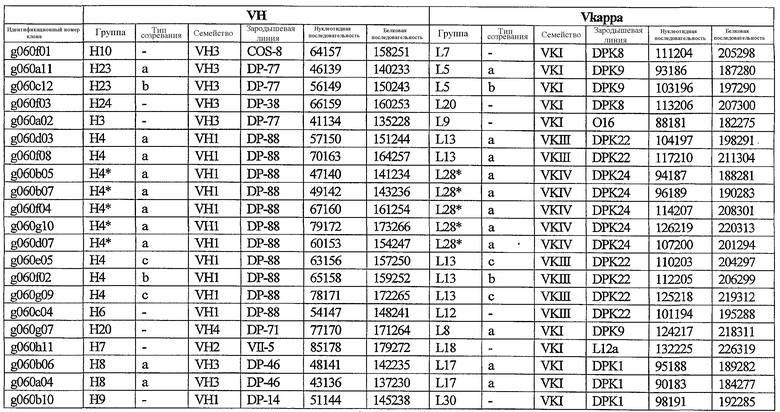
Звездочкой обозначены последовательности, кодирующие вариабельные области, которые подвергаются перестановке. В столбце “белковая последовательность” (Seq.prot.) указаны номера SEQ ID из списка последовательностей, соответствующие белковым последовательностям, и в столбце “нуклеотидная последовательность” (Seq nucl.) указаны номера SEQ ID, соответствующие последовательностям нуклеиновых кислот в списке последовательностей.
i. Кажущееся сродство
Конкурентный анализ был выполнен для определения кажущегося сродства или IC50 отобранных клонов с планшета G060.
Fab-фрагменты экспрессировали в 50 мл культур следующим образом: к 50 мл 2хYT/100 мкг/мл Carb/0,1% глюкозы добавляли 0,5 мл культуры, выдержанной в течение ночи, и встряхивали в течение 2 часов при 37°С. Затем добавляли IPTG до конечной концентрации, равной 0,1 мМ, и продолжали встряхивать в течение ночи при 30°С. На следующий день бактерии собирали центрифугированием со скоростью 4000 оборотов/мин в течение 15 минут, осадок вторично суспендировали в 1 мл 0,8 мМ EDTA, 0,4 х PBS, 0,8 M NaCl и инкубировали на льду в течение 15 минут. Периплазматический экстракт собирали центрифугированием и хранили при -20°С.
Конкурентный анализ выполняли следующим образом: периплазматические экстракты с соответствующим разведением, определяемым титрованием, вводили в несколько пробирок. В качестве положительного контрольного образца использовали Fag-фрагмент mp584, полученный отображением на фаге, который был выделен из линии клеток гибридомы человека НВ8501, экспрессирующих антитело против ТТ-антигена. Растворимый ТТ добавляли в первую пробирку в концентрации, равной 100 нМ, и на протяжении четырех стадий последовательно разводили в других пробирках, в результате чего было получено в общей сложности семь разведений ТТ (от 100 нМ до 25 пМ). Реакционные смеси инкубировали в течение примерно 45 минут при комнатной температуре. Образцы переносили на планшеты для ELISA, сенсибилизированные ТТ в количестве 1 мкг/мл и блокировали вышеописанным способом. Планшеты инкубировали в течение 1 часа при комнатной температуре, затем четыре раза промывали PBS-T, добавляли антитело козы к комплексу Fab/HRP человека в отношении 1:10000 и инкубировали в течение 1 часа. Добавляли субстрат ТМВ Plus (KemEnTech, Denmark, № по каталогу 4390А), культуру инкубировали в течение примерно 10 минут и прекращали реакции, добавляя 1 М раствор Н2SO4. Планшеты считывали при 450 нм. График данных показан на фиг.24.
Величины кажущегося сродства анализированных клонов приведены в таблице 21.
Как показано в таблице 21, Fab-фрагменты обладают кажущимся сродством в более низком наномолекулярном или более высоком пикомолекулярном диапазоне. Кроме того, все родственные спаренные Fab-фрагменты характеризуются более высоким кажущимся сродством по сравнению с Fab-фрагментом, полученным отображением на фаге.
j. Краткий обзор
Частота встречаемости ТТ-специфических плазматических клеток во фракции моноцитов периферической крови от донора ТТ03 была вычислена равной 0,022%. Из крови донора ТТ03 было создано примерно 400 родственных пар. 3600 клонов из клеток, трансформированных библиотекой родственных пар, исследовали методом ELISA, при этом было установлено, что 339 из указанных клонов характеризовались реактивностью в отношении ТТ при выполнении скрининга методом ELISA. 47 из указанных клонов анализировали для определения их клонального разнообразия. Из 47 указанных клонов 27 клонов имели сходство с однозначными, не подвергшимися перестановке последовательностями, кодирующими вариабельные области. Три из указанных клонов содержали недозрелый терминирующий кодон, который требует коррекции до переноса в экспрессирующий вектор млекопитающего. Перенос в экспрессирующие векторы млекопитающего описан в примере 1, раздел h. Кажущееся сродство, измеренное в отобранных клонах, находилось в пределах от более низкого наномолекулярного до более высокого пикомолекулярного диапазона.
k. Перспективы
Столбнячный токсин является одним из наиболее известных токсических веществ, летальная доза которого равна нескольким нанограммам. Указанный токсин продуцируют Clostridium tetani, почвенные бактерии, присутствующие также в пищеварительном тракте у 25% людей. Программа вакцинации против столбняка позволила эффективно побороть данное заболевание в западном мире, хотя в ведущих западных странах все еще ежегодно выявляют 100-200 случаев заболевания, причем соотношение между заболеваемостью и смертностью равно 50%. В развивающихся странах заболеваемость столбняком является значительно выше. Рост бактерий в загрязненных проникающих ранах вызывает высвобождение токсина, что в конечном счете ведет к ригидности, спазмам, нарушению дыхания и смерти.
Продукты гипериммунных иммуноглобулинов, выделенные из донорской крови людей с высоким титром гуморальной иммунной реакции против столбнячного токсина, можно использовать для профилактики или лечения столбняка на ранней стадии, а также в сочетании с активной вакцинацией. Однако из-за недостатка человеческого продукта в развивающихся странах используют гипериммунное антитело лошади против столбнячного токсина. Рекомбинантные моноклональные или поликлональные антитела против столбнячного токсина могут заменить продукты гипериммунных глобулинов в лечебных и/или профилактических целях. В научной литературе было описано успешное применение против ТТ рекомбинантных моноклональных антител, полученных известным методом на основе клеток гибридомы (Chim, J. et al. 2003, Biolоgicals 31, 45-53). Интересно отметить наличие синергичного действия при смешивании двух моноклональных антител. Таким образом, рекомбинантное поликлональное антитело против столбнячного токсина, способное взаимодействовать или связываться со столбнячным токсином, потенциально может быть очень эффективным для лечения или профилактики индивидуумов с повышенным риском заболевания столбняком.
Один вариант осуществления настоящего изобретения относится к рекомбинантному поликлональному иммуноглобулину или его фрагментам, способным взаимодействовать или связываться со столбнячным токсином.
Предпочтительный вариант осуществления настоящего изобретения относится к рекомбинантному поликлональному иммуноглобулину, способному взаимодействовать или связываться со столбнячным токсином, который состоит из родственных пар вариабельной области тяжелой цепи и вариабельной области легкой цепи иммуноглобулина.
Другой вариант осуществления настоящего изобретения относится к рекомбинантному поликлональному иммуноглобулину, способному взаимодействовать или связываться со столбнячным токсином, который получают способом по настоящему изобретению.
Другой вариант осуществления настоящего изобретения относится к рекомбинантному поликлональному иммуноглобулину, способному взаимодействовать или связываться со столбнячным токсином, который содержит отдельные родственные пары вариабельной области тяжелой цепи и вариабельной области легкой цепи иммуноглобулина, обладающие по крайней мере 90% идентичностью последовательностей с одной отдельной парой SEQ ID, выбранной из пар SEQ ID 229:276, 262:309, 240:287, 245:292, 267:314, 246:293, 258:305, 242:289, 231:278, 263:310, 232:279, 237:284, 255:302, 260:307, 251:298, 233:280, 228:275, 244:291, 250:297, 252:299, 264:311, 272:319, 235:282 или 238:285.
Другой вариант осуществления изобретения относится к фармацевтической композиции, содержащей в качестве активного ингредиента рекомбинантное поликлональное антитело, способное взаимодействовать или связываться со столбнячным токсином, которая предназначена для лечения или профилактики столбняка. Рекомбинантное поликлональное антитело предпочтительно объединяют с фармацевтически приемлемым наполнителем.
Другой вариант осуществления настоящего изобретения относится к применению рекомбинантного поликлонального иммуноглобулина, способного взаимодействовать или связываться со столбнячным токсином, в качестве лекарственного средства для лечения или профилактической защиты индивидуума с повышенным риском заболевания столбняком.
Дополнительный вариант осуществления изобретения относится к способу профилактики или лечения индивидуума с повышенным риском заболевания столбняком путем введения нуждающемуся индивидууму композиции, содержащей рекомбинантное поликлональное антитело, способное взаимодействовать или связываться со столбнячным токсином.
Пример 12. Сравнение результатов, полученных у двух доноров
В нижеследующем примере результаты, полученные от донора ТТ08, сравниваются с результатами, полученными от донора ТТ03 в примере 11. Результаты суммированы в таблице 22.
Данный пример ясно показывает, что у двух разных доноров, иммунизированных ТТ, могут быть получены библиотеки одинакового качества.
Наличие большего числа однозначных родственных пар в библиотеке, полученной от донора ТТ08, скорее всего связано с большим числом анализированных последовательностей.
Пример 13. Сравнение библиотеки родственных пар по примеру 11 с отображаемой на фаге комбинаторной библиотекой, полученной у того же донора
В настоящем примере отображаемая на фаге комбинаторная библиотека была получена от донора, кровь которого была ранее использована для получения библиотеки родственных пар, с целью сравнения разнообразия, сродства и специфичности библиотек родственных пар и комбинаторных библиотек.
а. Создание комбинаторной библиотеки на фаге
Отображаемая на фаге библиотека была создана из фракции CD19+ клеток, полученных от донора ТТ03 (идентичной фракции клеток, полученной в примере 11с).
Общая РНК была получена примерно из 5×106 CD19+ клеток при помощи набора NucleoSpin RNA L (Machery-Nagel, № по каталогу 740962.20). Затем синтезировали кДНК, выполняя реакцию, инициируемую олиго(dT)-затравкой, с использованием обратной транскриптазы ThermoScript (Invitrogen, № по каталогу 11146-016).
VН- и каппа-цепи амплифицировали методом PCR, используя Taq ДНК-полимеразу HotMaster (Eppendorf, № по каталогу 0032002.692) и праймеры, по существу аналогичные описанным в публикации de Haard et al., J. Biol. Chem. 274, 18218-18230; 1999), в которых были модифицированы только последовательности узнавания рестрикционных ферментов у 5'-конца.
Отображаемая на фаге комбинаторная библиотека была создана в результате последовательного введения продуктов PCR каппа- и VН-цепи в отображающий фаговый вектор Em351 (модифицированных из вектора phh3, описанного в публикации Den, W. et al. 1999, J. Immunol. Methods 222, 45-57).
Конечную библиотеку электропорировали в штамм TG1 E.coli (Stratagene). Комбинаторная библиотека содержала 3х106 независимых клонов с высокой частотой вставок.
b. Пэннинг комбинаторной библиотеки
Фаговые частицы, отображающие Fab-фрагменты, были получены стандартными методами (например, Antibody Engineering, A Practical Approach, 1996, ed. McCafferty, Hoogenbоom and Chiswell).
Пэннинг выполняли в отношении столбнячного токсина (ТТ; SSI, № партии 89-2), разведенного до 1 мкг/мл в PBS и иммобилизованного в пробирках для иммуноанализа MaxiSorp (Nunc, № по каталогу 444202). Культуру инкубировали в течение одного часа и несколько раз промывали, связанные фаговые частицы элюировали, используя 100 мМ ТЕА (триэтиламин).
Элюат фаговых частиц нейтрализовали и использовали для инфицирования экспоненциально растущих клеток TG1, из которых были получены фаговые частицы, отображающие Fab-фрагменты, с повышенной специфичностью к ТТ-антигену. Второй цикл пэннинга с использованием элюированных фагов выполняли вышеописанным стандартным способом.
Параллельно выполняли три цикла пэннинга в отношении С-фрагмента молекулы столбнячного токсина (Sigma, № по каталогу Т3694) после осуществления вышеописанного способа.
Отдельные колонии исследовали на связывание со столбнячным токсином и С-фрагментом из неотобранной библиотеки и после каждого цикла пэннинга в обеих сериях вышеописанного пэннинга.
с. Сравнение специфичности и сродства комбинаторных клонов на фаговых частицах и клонов родственных пар
Отдельные колонии получали из неотобранной библиотеки и после каждого цикла пэннинга (в отношении интактного столбнячного токсина (ТТ) и С-фрагмента столбнячного токсина). Фаговые частицы, отображающие Fab-фрагменты, анализировали на реактивность при помощи анализов ELISA. Число Fab-положительных клонов, обладающих реактивностью к ТТ и/или С-фрагменту, равной по крайней мере 2-кратной фоновой реактивности и по крайней мере 4-кратной фоновой реактивности, указано в приведенных ниже таблицах 23-25. Все результаты выражены в виде отношения числа специфических клонов к числу Fab-положительных клонов.
Пэннинг отображаемой на фаге библиотеки против ТТ позволил выявить возрастающее число ТТ-специфических клонов при увеличении числа циклов пэннинга, при этом в неотобранной библиотеке было идентифицировано всего несколько клонов. В неотобранной библиотеке или после двух циклов пэннинга библиотеки против ТТ не было обнаружено клонов с реактивностью к С-фрагменту столбнячного токсина. Для получения Fab-фрагментов со специфичностью к С-фрагменту из отображаемой на фаге комбинаторной библиотеки указанную библиотеку необходимо было подвергнуть пэннингу специально против С-фрагмента.
Для сравнения тринадцать ТТ-специфических клонов из семи клонов с реактивностью выше 2-кратной фоновой реактивности по примеру 11 подвергали анализу ELISA, специфичному к С-фрагменту. Таким образом, Fab-фрагменты со специфичностью к С-фрагменту столбнячного токсина можно было экспрессировать из библиотеки родственных пар, полученной из крови ТТ-иммунизированного индивидуума.
Данный пример ясно показывает недостаток использования пэннинга для идентификации клонов со специфичностью к определенному антигену. Неизвестные важные фрагменты или эпитопы антигена могут быть пропущены во время пэннинга, в результате чего будет получен менее эффективный продукт.
Кроме того, способом, описанным в анализе по примеру 11i, измеряли кажущееся сродство комбинаторных клонов. Анализировали десять комбинаторных клонов, полученных после двух циклов пэннинга в отношении ТТ, при этом были получены величины кажущегося сродства связывания в пределах от 1 до 15 нМ.
При сравнении четырех из девяти клонов, подвергнутых анализу из библиотеки родственных пар (таблица 21), были получены величины сродства в пикомолекулярном диапазоне.
Полученные результаты показывают, что спаривание вариабельных областей, первоначально отобранных иммунной системой донора, в сочетании с соматическими гипермутациями, которым были подвергнуты пары, потенциально увеличивает кажущееся сродство связывания по сравнению с произвольными комбинациями таких вариабельных областей.
d. Сравнение последовательностей ТТ-специфических комбинаторных клонов на фаговых частицах и клонов родственных пар
Большой объем данных о последовательностях, полученных из двух библиотек, препятствует выполнению прямого сравнения неочищенных последовательностей. Для визуализации различий между парами VН- и VL-последовательностей в отображаемой на фаге библиотеке и в библиотеке родственных пар было воссоздано филогенетическое дерево для VН- и VL-последовательностей, и пары были проиллюстрированы в виде точечной матрицы. Попарное сравнение филогенетической информации в точечной матрице (фиг.25) выявило очень разные профили распределения пар VН- и VL-последовательностей в двух библиотеках. Рассеянное изображение пар VН- и VL-последовательностей в отображаемой на фаге библиотеке (фиг.25А) свидетельствовало о небольшой филогенетической взаимосвязи между VН- и VL-генами, что согласуется с произвольным спариванием V-генов в данной библиотеке. В отличие от этого пары VН- и VL-последовательностей из библиотеки родственных пар (фиг.25В) характеризуются кластерным изображением, свидетельствующим о коэволюции V-генов, ожидаемой для родственных пар. Кроме того, генетическое разнообразие гораздо больше для V-генов в библиотеке родственных пар по сравнению с V-генами из комбинаторной библиотеки, указывая на то, что метод выделения родственных спаренных V-генов является менее ошибочным.
Пример 14. Объединенные реакции одностадийной множественной RT-PCR с удлинением цепи путем перекрывания и гнездовой PCR с использованием Т-клеток в качестве источника матрицы
В данном примере описано выполнение одностадийной множественной RT-PCR с удлинением цепи путем перекрывания с использованием Т-лимфоцитов человека.
а. Получение лимфоцитсодержащей фракции клеток
Пробу крови получают у доноров, подвергнутых воздействию требуемого антигена, например, в результате иммунизации, естественного инфицирования, неоплазии, аутоиммунной реакции или других заболеваний. Мононуклеарные клетки периферической крови (РВМС) выделяют в устройстве Lymphoprep (Axis-Shield, Oslo, Norway, производственный № 1001967) в соответствии с инструкциями изготовителя.
В настоящем примере антиген-специфические Т-клетки были получены в результате дальнейшей стимуляции фракции РВМС. Однако множественная RT-PCR с удлинением цепи путем перекрывания может быть также выполнена с использованием отдельных клеток из фракции РВМС или фракции клеток, обогащенной Т-клетками (например, путем сортировки методом FACS для CD3-положительных клеток).
b. Создание антиген-специфических Т-клеток
Фракцию клеток РВМС вторично суспендируют в соответствующей культуральной среде, содержащей необходимые цитокиты, такие как IL2. Затем к культуре добавляют требуемый антиген, где антиген-представляющие клетки (АРС), присутствующие во фракции РВМС, представляют его Т-лимфоцитам. Альтернативно к фракции РВМС могут быть добавлены АРС-питающие клетки, предварительно обработанные с возможностью представления требуемого антигена. Такие АРС-питающие клетки могут быть АРС, подвергнутыми воздействию требуемого антигена, например, в форме пептида, белка или других молекул, АРС, инфицированными микробами, клетками, трансфецированными для экспрессии и представления антигена, или АРС, сокультивируемыми с другими антигенными клетками, например с раковыми клетками в форме первичной ткани или линий клеток. В научной литературе описаны многочисленные разные типы АРС-питающих клеток, включая линии трансформированных клеток, линии В-клеток, дендритные клетки и т.д.
Фракцию РВМС культивируют в течение примерно 3-5 недель, на протяжении которых добавляют свежие антиген-представляющие клетки вместе с цитокинами, например, один раз в неделю. В результате этого происходит пролиферация, активация и созревание Т-лимфоцитов. В конце культивирования в культуре клеток преобладают антиген-специфические Т-клетки. Будут ли указанные клетки CD4+ или CD8+ клетками, зависит от заболевания, антигена, клеток АРС и смесей цитокинов, использованных во время стимуляции.
Антигенную специфичность можно проверить, например, при помощи анализа CTL, анализов пролиферации и тетрамеров МНС, сенсибилизированных требуемым антигеном (Altman, J.D. et al., 1996, Science 274, 94-96).
Антиген-специфические Т-клетки распределяют по пробиркам для PCR методом ограниченного разведения или FACS, получая при этом одну клетку в одном сосуде. Сосуд можно хранить при -80°С до использования.
b. Одностадийная множественная RT-PCR с удлинением цепи путем перекрывания
Для выполнения множественной RT-PCR с удлинением цепи путем перекрывания используют набор для одностадийной RT-PCR компании Qiagen (Qiagen, № по каталогу 210212, Hilden, Germany) в соответствии с рекомендациями изготовителя. Перед добавлением реакционной смеси PCR в пробирки для PCR клетки оттаивают.
Реакционные смеси РCR и условия циклизации первоначально определяют в соответствии с описанием, приведенным в примере 11 е-1. Однако при использовании нового набора праймеров может потребоваться некоторая оптимизация условий.
Используемая смесь множественных праймеров для удлинения цепи путем перекрывания включает праймеры, показанные в таблице 26.


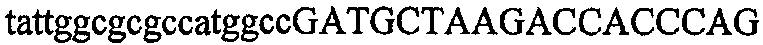


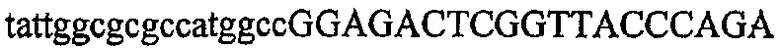




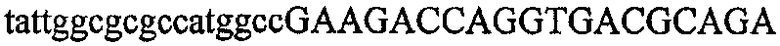
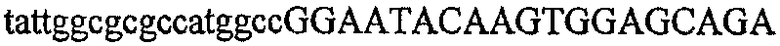



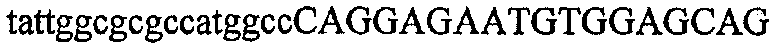
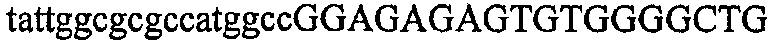
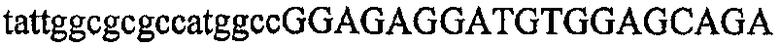




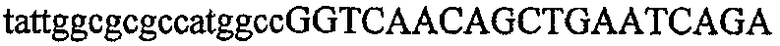






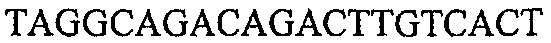
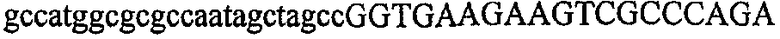









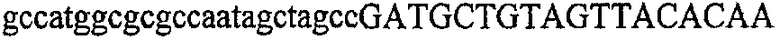
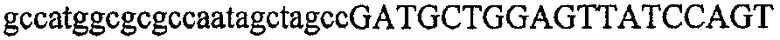

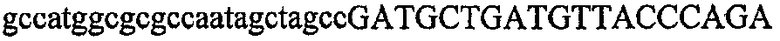


с. Полугнездовая PCR
Полугнездовая PCR может быть выполнена в соответствии с описанием, приведенным в примере 11 е-2, при этом может потребоваться некоторая оптимизация условий.
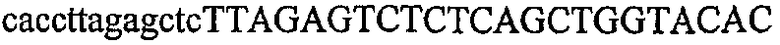

Для проверки успешного выполнения множественной RT-PCR с удлинением цепи путем перекрывания часть образцов из реакционных смесей полугнездовой РCR анализируют, подвергая 10 мкл каждой реакционной смеси полугнездовой PCR электрофорезу в 1% агарозном геле с использованием для обнаружения бромида этидия. Ожидаемый размер фрагмента удлинения цепи путем перекрывания равен примерно 850 п.о. (точный размер зависит от длины вариабельных областей).
Примерно десять микролитров из всех реакционных смесей, полученных у одного донора, объединяют в одной пробирке. Аликвоту объединенных продуктов PCR затем очищают при помощи набора для очистки PCR QIAquick в соответствии с инструкциями изготовителей (Qiagen, № по каталогу 28106, Hilden, Germany). Очищенный пул продуктов PCR с удлинением цепи путем перекрывания может быть гидролизован соответствующими рестрикционными ферментами, очищен и введен в приемлемый вектор.
В настоящем эксперименте праймеры для константной области (SEQ ID NO 376 и 377), используемые при выполнении полугнездовой PCR, создают для субклонирования продукта полугнездовой PCR в приемлемом векторе. При создании праймера для Сβ-цепи остаток SER заменяют остатком Met в положении 21 пептида константной области β-цепи, благодаря чему в указанную последовательность нуклеиновой кислоты можно ввести сайт NsiI:
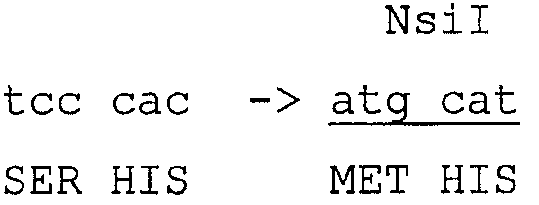
Такой переход должен быть относительно безопасным, так как SER 21 находится в константной области β-цепи в петле у проксимального конца домена мембраны. Поэтому вышеуказанная относительно консервативная замена, по-видимому, не нарушит общую структуру домена.
При создании праймера для Сα-цепи заменяют нуклеотиды, соответствующие положениям 15-17 в пептиде константной области α-цепи, благодаря чему в последовательность нуклеиновой кислоты можно ввести сайт SacI:

Поэтому приемлемые векторы содержат остальные части константных областей α- и β-цепей TcR и включают соответствующую модификацию сайтов рестрикции. Указанные замены можно произвести стандартными методами РCR и субклонирования.
е. Дополнительные соображения
Многие праймеры для вариабельных областей потенциально могут взаимодействовать друг с другом с оказанием ингибирующего действия во время амплификации методом множественной РCR с удлинением цепи путем перекрывания. Во избежание этого праймеры для вариабельных областей могут быть разделены на поднаборы и использованы отдельно в соответствующих комбинациях.
Другие варианты осуществления изобретения
Все публикации и заявки на патент, приведенные в данном описании изобретения, включены в настоящую заявку в качестве ссылки, как если бы все отдельные публикации или заявки на патент были полностью приведены в качестве ссылки. Хотя настоящее изобретение было подробно описано на примере отдельных иллюстративных вариантов осуществления для простоты понимания, специалистам в данной области должно быть понятно в свете приведенного описания, что в данное изобретение могут быть внесены определенные изменения и модификации, не выходящие за пределы объема и сущности прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КЛОНИРОВАНИЯ КОГНАТНЫХ АНТИТЕЛ | 2008 |
|
RU2459868C2 |
| ИДЕНТИФИКАЦИЯ АССОЦИИРОВАННЫХ С ОБРАЗЦОМ ПОЛИНУКЛЕОТИДОВ | 2012 |
|
RU2644681C2 |
| КОМПОЗИЦИИ РЕКОМБИНАНТНЫХ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2008 |
|
RU2488596C2 |
| БЫСТРЫЙ СПОСОБ КЛОНИРОВАНИЯ И ЭКСПРЕССИИ СЕГМЕНТОВ ГЕНА РОДСТВЕННОЙ ВАРИАБЕЛЬНОЙ ОБЛАСТИ АНТИТЕЛА | 2012 |
|
RU2612910C2 |
| ВЫЯВЛЕНИЕ АФФИННО-ЗРЕЛЫХ ЧЕЛОВЕЧЕСКИХ АНТИТЕЛ | 2012 |
|
RU2636045C2 |
| МУТАГЕНЕЗ ДНК ЗА СЧЕТ НЕУПОРЯДОЧЕННОЙ ФРАГМЕНТАЦИИ И ВТОРИЧНОЙ СБОРКИ | 1995 |
|
RU2157851C2 |
| АНТИТЕЛО ИЛИ ЕГО ФРАГМЕНТ, ИМЕЮЩИЕ НЕЙТРАЛИЗУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИЧ | 2005 |
|
RU2380378C2 |
| ПРОДУЦИРУЮЩИЕ АНТИТЕЛА МЛЕКОПИТАЮЩИЕ, НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ | 2009 |
|
RU2559524C2 |
| СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ ВИРУСА БЕШЕНСТВА НЕЙТРАЛИЗУЮЩИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА И НУКЛЕИНОВЫЕ КИСЛОТЫ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2001 |
|
RU2272809C2 |
| ПРОДУЦИРУЮЩИЕ АНТИТЕЛА МЛЕКОПИТАЮЩИЕ, НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ | 2009 |
|
RU2731084C2 |





























































































































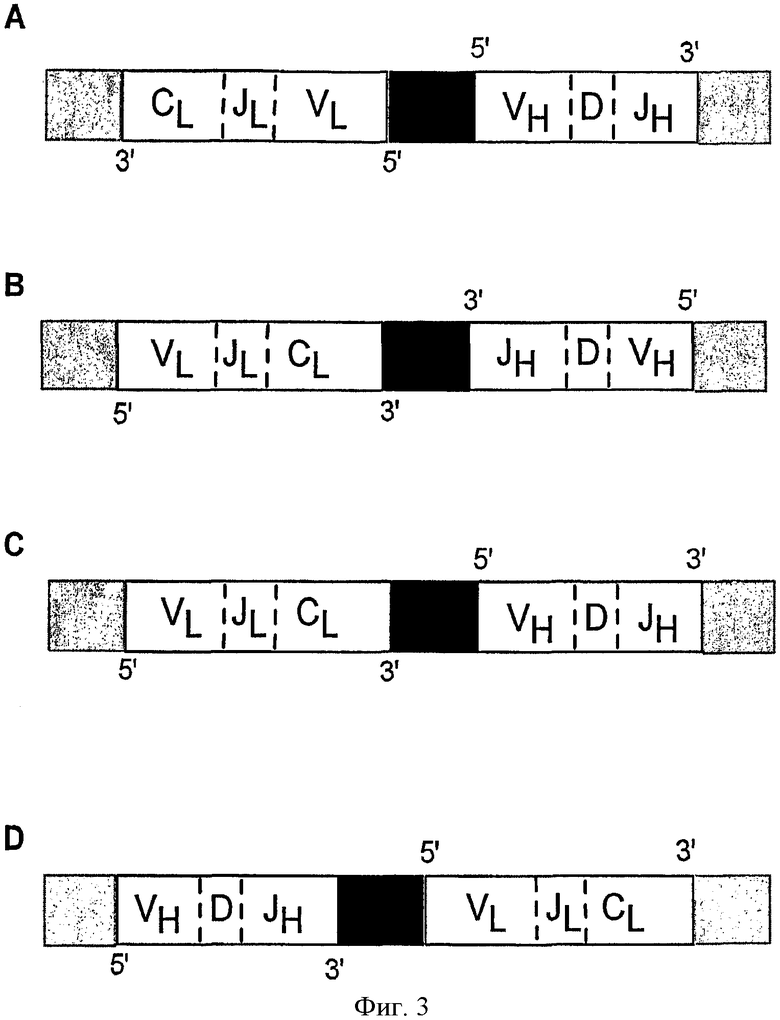





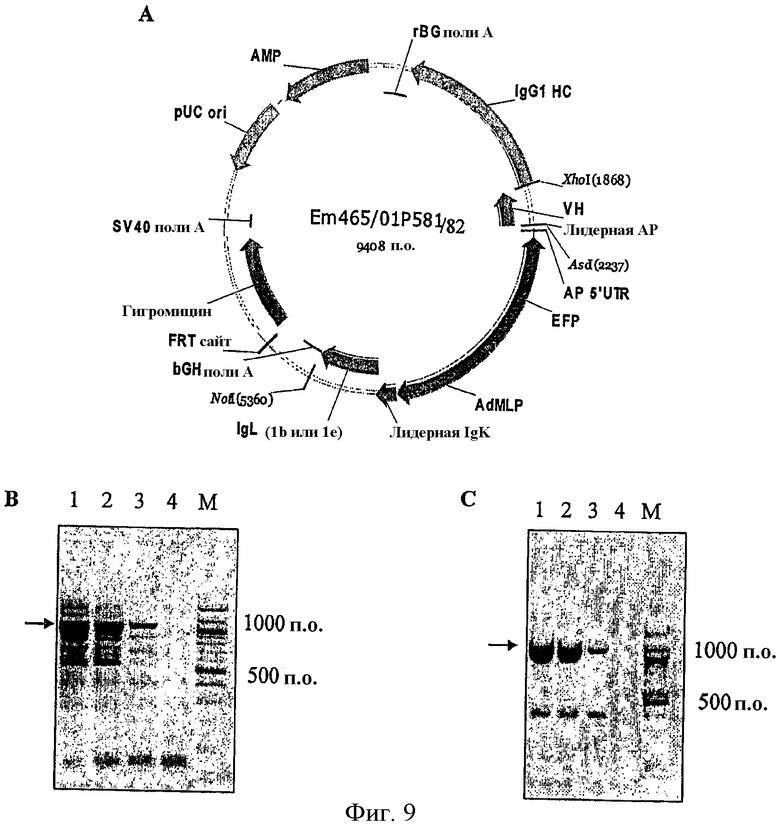
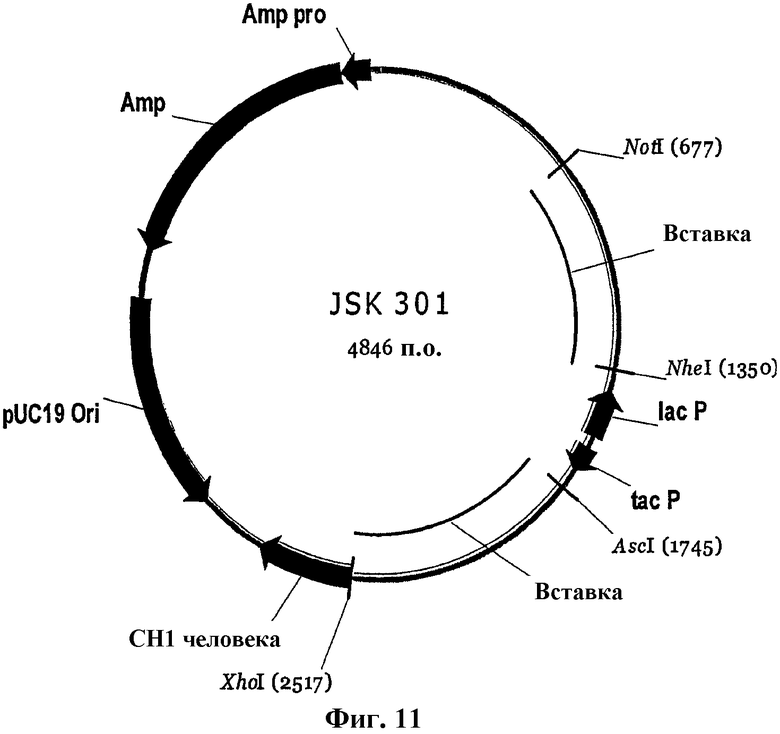






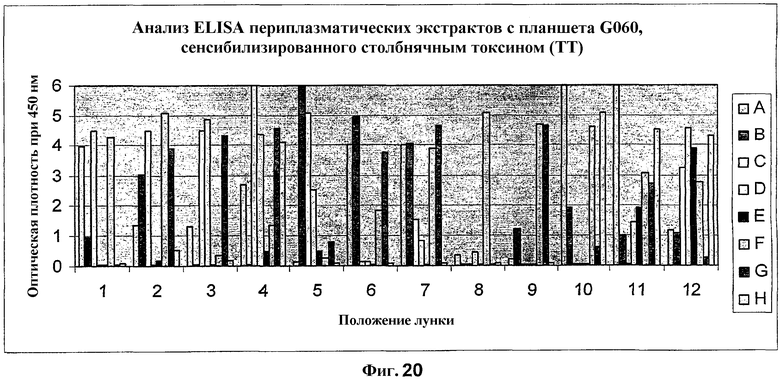


















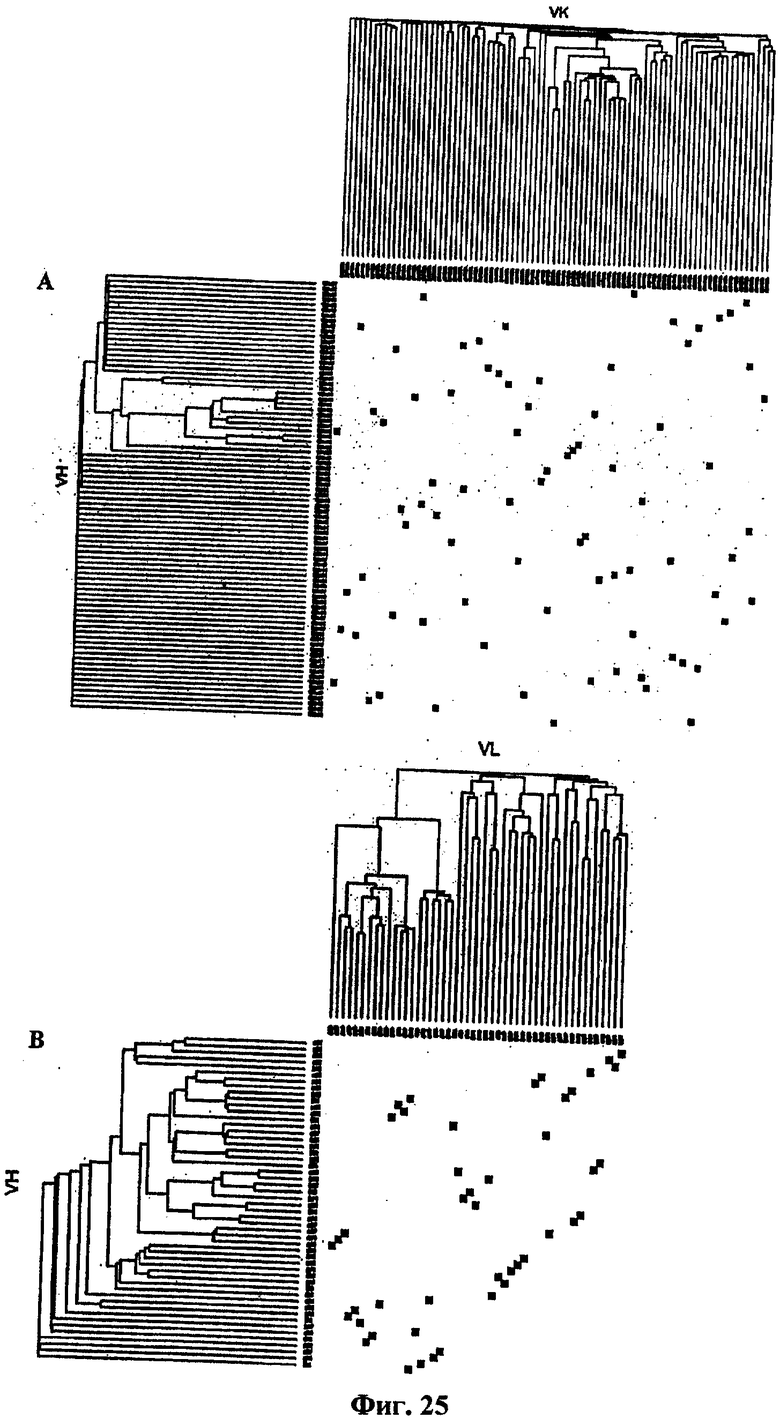
Изобретение относится к области биотехнологии, конкретно к множественной RT-PCR с удлинением цепи путем перекрывания. Предложенный способ эффективен для связывания двух или нескольких нуклеотидных последовательностей, кодирующих домены или субъединицы гетеромерного белка в результате выполнения одной реакции. Способ по настоящему изобретению, в частности, облегчает связывание последовательностей, кодирующих вариабельные области иммуноглобулинов, Т-клеточных рецепторов или В-клеточных рецепторов. Способ по настоящему изобретению также является более эффективным средством создания библиотек последовательностей, кодирующих вариабельные области. Возможность выполнения множественной RT-PCR с удлинением цепи путем перекрывания с использованием матрицы, полученной из выделенной отдельной клетки, обеспечивает высокоэффективное создание библиотек родственных пар. 4 н. и 47 з.п. ф-лы, 25 ил., 27 табл.
1. Способ связывания множества интересующих несмежных нуклеотидных последовательностей, который предусматривает:
a) амплификацию интересующих нуклеотидных последовательностей при помощи множественной молекулярной амплификации с использованием матрицы, полученной из выделенной отдельной клетки; и
b) связывание интересующих нуклеотидных последовательностей, амплифицированных на стадии а);
в котором интересующие нуклеотидные последовательности содержат последовательности, кодирующие вариабельную область, и в результате связывания образуется родственная пара последовательностей, кодирующих вариабельные области.
2. Способ по п.1, в котором интересующие нуклеотидные последовательности содержат последовательности, кодирующие вариабельные области иммуноглобулина, и в результате связывания образуется родственная пара, состоящая из последовательности, кодирующей вариабельную область легкой цепи, и связанной с ней последовательности, кодирующей вариабельную область тяжелой цепи.
3. Способ по п.1, в котором интересующие нуклеотидные последовательности содержат последовательности, кодирующие вариабельные области Т-клеточного рецептора, и в результате связывания образуется родственная пара, состоящая из последовательности, кодирующей вариабельную область альфа-цепи, и связанной с ней последовательности, кодирующей вариабельную область бета-цепи, или последовательности, кодирующей вариабельную область гамма-цепи, и связанной с ней последовательности, кодирующей вариабельную область дельта-цепи.
4. Способ по п.1, в котором семейство нуклеотидных последовательностей, содержащих последовательности, кодирующие вариабельные области, амплифицируют, используя множество праймеров.
5. Способ по п.1, в котором указанная множественная молекулярная амплификация представляет собой амплификацию методом множественной RT-PCR.
6. Способ по п.5, в котором указанная амплификация методом множественной RT-PCR является двухстадийным процессом, предусматривающим отдельную стадию обратной транскрипции (RT), выполняемую перед амплификацией методом множественной PCR.
7. Способ по п.5, в котором указанную амплификацию методом множественной RT-PCR выполняют в виде одной стадии, предусматривающей первоначальное введение в один сосуд всех компонентов, необходимых для выполнения как обратной транскрипции (RT), так и амплификации методом множественной PCR.
8. Способ по п.1, в котором отдельную клетку или популяцию генетически разных клеток получают из фракции клеток, содержащей лимфоциты.
9. Способ по п.8, в котором фракция клеток, содержащая лимфоциты, входит в состав цельной крови, костного мозга, мононуклеарных клеток или лейкоцитов.
10. Способ по п.9, в котором фракция клеток, содержащая лимфоциты, обогащена клетками В-лимфоцитов.
11. Способ по п.10, в котором фракция клеток, содержащая лимфоциты, или линия В-лимфоцитов обогащена плазматическими клетками.
12. Способ по п.8, в котором клетки из фракции клеток, содержащей лимфоциты, линии В-лимфоцитов или плазматические клетки обладают повышенной антигенной специфичностью.
13. Способ по п.8, в котором фракция клеток, содержащая лимфоциты, обогащена клетками Т-лимфоцитов.
14. Способ по п.8, в котором антигенспецифические Т-клетки получают путем стимуляции фракции клеток, содержащей лимфоциты.
15. Способ по п.8, который дополнительно предусматривает введение в вектор связанных нуклеотидных последовательностей или родственную пару из библиотеки.
16. Способ по п.8, в котором перед выполнением стадии обратной транскрипции и множественной молекулярной амплификации за счет интенсивного деления каждой выделенной отдельной клетки получают популяцию изогенных клеток.
17. Способ по п.1, в котором указанное связывание интересующих нуклеотидных последовательностей выполняют в том же сосуде, что и множественную молекулярную амплификацию.
18. Способ по любому из пп.5-17, в котором указанное связывание интересующих нуклеотидных последовательностей выполняют вместе с амплификацией методом множественной PCR, используя смесь множественных праймеров для удлинения цепи путем перекрывания.
19. Способ по любому из пп.5-17, в котором указанное связывание интересующих нуклеотидных последовательностей выполняют путем лигирования.
20. Способ по п.1, в котором выполняют дополнительную молекулярную амплификацию, используя смесь праймеров, адаптированную для амплификации интересующих связанных последовательностей нуклеиновых кислот.
21. Способ по п.18, в котором смесь множественных праймеров для удлинения цепи путем перекрывания содержит наборы праймеров, в которых по крайней мере один из праймеров набора содержит концевую последовательность для удлинения цепи за счет перекрывания, способную гибридизироваться с концевой последовательностью для удлинения цепи за счет перекрывания праймера второго набора праймеров.
22. Способ по п.18, в котором смесь множественных праймеров для удлинения цепи путем перекрывания включает:
a) по крайней мере один праймер для CL или JL, комплементарный смысловой последовательности, кодирующей вариабельную область легкой цепи иммуноглобулина;
b) по крайней мере один 5'-концевой праймер для VL или праймер для VLL, комплементарный антисмысловой последовательности, кодирующей вариабельную область легкой цепи иммуноглобулина, или лидерной последовательности вариабельной области легкой цепи, и способный образовывать набор праймеров с праймером(ами) по пункту а);
c) по крайней мере один праймер для СH или JH, комплементарный смысловой последовательности, кодирующей константный домен тяжелой цепи иммуноглобулина, или последовательности, кодирующей соединяющую область тяжелой цепи; и
d) по крайней мере один 5'-концевой праймер для VH или праймер для VHL, комплементарный антисмысловой цепи последовательности, кодирующей вариабельную область тяжелой цепи иммуноглобулина, или лидерной последовательности вариабельной области тяжелой цепи, и способный образовывать набор праймеров с праймером(амии) по пункту с).
23. Способ по п.22, в котором праймеры по пункту b) являются праймерами для VLL, отличающимися тем, что их последовательность по крайней мере на 90% идентична последовательности геноспецифической области, выбранной из SEQ ID NO: 93-98, и праймеры по пункту d) являются праймерами для VHL, отличающимися тем, что их последовательность по крайней мере на 90% идентична последовательности геноспецифической области, выбранной из SEQ ID NO: 86-92.
24. Способ создания библиотеки родственных пар, содержащих связанные последовательности, кодирующие вариабельные области, причем указанные последовательности, кодирующие вариабельные области, являются последовательностями суперсемейства иммуноглобулинов, причем способ предусматривает:
a) получение от донора фракции клеток, содержащей лимфоциты;
b) необязательное обогащение определенной популяции лимфоцитов указанной фракции клеток;
c) получение популяции выделенных отдельных клеток, предусматривающее распределение по одной клетке из указанной фракции клеток в несколько сосудов; и
d) амплификацию и связывание последовательностей, кодирующих вариабельные области, находящихся в указанной популяции выделенных отдельных клеток, способом по любому из пп.1-24.
25. Способ по п.24, в котором перед выполнением амплификации и связывания (стадия d) за счет интенсивного деления каждой выделенной отдельной клетки получают популяцию изогенных клеток.
26. Способ по п.24, в котором фракция клеток, содержащая лимфоциты, входит в состав цельной крови, костного мозга, мононуклеарных клеток или лейкоцитов.
27. Способ по п.26, в котором фракция клеток, содержащая лимфоциты, обогащена клетками В-лимфоцитов.
28. Способ по п.27, в котором фракция клеток, содержащая лимфоциты, или линия В-лимфоцитов обогащена плазматическими клетками.
29. Способ по п.24, в котором клетки из фракции клеток, содержащей лимфоциты, линии В-лимфоцитов или плазматические клетки обладают повышенной антигенной специфичностью.
30. Способ по п.24, в котором фракция клеток, содержащая лимфоциты, обогащена клетками Т-лимфоцитов.
31. Способ по п.24, в котором антигенспецифические Т-клетки получают путем стимуляции фракции клеток, содержащей лимфоциты.
32. Способ по п.24, который дополнительно предусматривает введение в вектор связанных нуклеотидных последовательностей или родственную пару из библиотеки.
33. Способ по п.32, в котором указанный вектор выбирают из клонирующих векторов, шаттл-векторов, векторных дисплеев или векторов экспрессии.
34. Способ по п.32, в котором связанные нуклеотидные последовательности или отдельные представители библиотеки родственных пар являются последовательностями, кодирующими вариабельную область тяжелой цепи иммуноглобулина, связанными с последовательностями, кодирующими вариабельную область легкой цепи, причем указанные последовательности вводят с сохранением рамки считывания в вектор, уже содержащий последовательности, кодирующие один или несколько константных доменов иммуноглобулина или их фрагментов.
35. Способ по п.32, в котором связанные нуклеотидные последовательности или отдельные представители библиотеки родственных пар являются последовательностями, кодирующими вариабельную область α-цепи Т-клеточного рецептора, связанными с последовательностями, кодирующими вариабельную область β-цепи, причем указанные последовательности вводят с сохранением рамки считывания в вектор, уже содержащий последовательности, кодирующие один или несколько константных доменов Т-клеточного рецептора или их фрагментов.
36. Способ по п.24, который дополнительно предусматривает создание подбиблиотеки путем отбора подмножества родственных пар связанных последовательностей вариабельных областей, кодирующих связывающие белки со специфичностью к требуемой мишени, с образованием библиотеки мишень-специфических родственных пар последовательностей, кодирующих вариабельные области.
37. Способ по любому из пп.34-36, который дополнительно предусматривает перенос указанной родственной пары или библиотеки мишень-специфических родственных пар последовательностей, кодирующих вариабельные области, в вектор экспрессии млекопитающего.
38. Способ по п.37, в котором вектор экспрессии млекопитающего кодирует один или несколько доменов константной области, выбранных из иммуноглобулина человека классов IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4, IgM, легкой каппа-цепи или легкой лямбда-цепи либо из альфа-, бета-, дельта- и/или гамма-цепей Т-клеточного рецептора человека.
39. Способ по п.32, который дополнительно предусматривает стадии:
a) введения вектора, кодирующего сегмент связанных нуклеотидных последовательностей, в клетку-хозяин;
b) культивирование указанных клеток-хозяев в условиях, адаптированных для экспрессии; и
c) получение белкового продукта, экспрессируемого вектором, введенным в указанную клетку-хозяин.
40. Способ по п.39, в котором указанный белковый продукт является моноклональным антителом, содержащим родственную пару вариабельной области легкой цепи и вариабельной области тяжелой цепи.
41. Способ по п.39, в котором указанный полипептидный продукт является моноклональным Т-клеточным рецептором, содержащим родственную пару вариабельной области альфа-цепи и вариабельной области бета-цепи.
42. Библиотека родственных пар, состоящая из связанных последовательностей, кодирующих вариабельные области, в которой указанные последовательности, кодирующие вариабельные области, являются последовательностями суперсемейства иммуноглобулинов, где каждая родственная пара встроена в вектор, способный экспрессировать указанную родственную пару.
43. Библиотека по п.42, в которой указанные родственные пары последовательностей, кодирующих вариабельные области, получают способом по п.24.
44. Библиотека по п.42 или 43, в которой отдельный представитель указанных родственных пар содержит последовательность, кодирующую вариабельную область легкой цепи иммуноглобулина, и связанную с ней последовательность, кодирующую вариабельную область тяжелой цепи.
45. Библиотека по п.44, в которой указанный отдельный представитель кодирует полноразмерное антитело, выбранное из иммуноглобулинов человека класса IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM.
46. Библиотека родственных пар по п.42 или 43, в которой отдельный представитель указанных родственных пар содержит последовательность, кодирующую вариабельную область альфа-цепи TcR, и связанную с ней последовательность, кодирующую вариабельную область бета-цепи, или последовательность, кодирующую вариабельную область гамма-цепи, и связанную с ней последовательность, кодирующую вариабельную область дельта-цепи.
47. Библиотека по п.46, в которой указанный отдельный представитель кодирует полноразмерный TcR.
48. Библиотека родственных пар связанных последовательностей, кодирующих вариабельные области, по любому из пп.42-47, в которой каждый отдельный представитель выбран с учетом его способности кодировать белок, обладающий требуемой специфичностью связывания в отношении определенной мишени.
49. Библиотека родственных пар по п.44, в которой антитела, экспрессируемые из указанной библиотеки, способны взаимодействовать или связываться со столбнячным токсином.
50. Популяция клеток-хозяев, содержащих библиотеку или суббиблиотеку по любому из пп.42-49, где популяция клеток-хозяев предназначена для экспрессии рекомбинантного поликлонального связывающего белка.
51. Популяция клеток-хозяев по п.50, в которой клетки являются клетками млекопитающего.
| KUROKAWA М | |||
| ЕТ AL: "Paired cloning of the T-cell receptor α and β genes from a single Т cell without the establishment of a T cell clone", Clin | |||
| Exp Immunol., 2001, v.123, p.340-345 | |||
| WO 9916904, 08.04.1999 | |||
| BURGART L.J | |||
| ЕТ AL: "Multiplex polymerase chain reaction", Mod Pathol., 1992, v.5, n.3, abstract; | |||
| CORONELLA J.A | |||
| ЕТ AL.: |
Авторы
Даты
2010-06-20—Публикация
2004-09-17—Подача