Ссылка на родственные заявки
[0001] Настоящая заявка является родственной предварительной заявке на патент США № 61/517976, поданной 28 апреля 2011 г., предварительной заявке на патент США № 61/575652, поданной 24 августа 2011 г., предварительной заявке на патент США № 61/599870, поданной 16 февраля 2012 г., и предварительной заявке на патент США № 61/608571, поданной 8 марта 2012 г., раскрытия которых тем самым включены посредством ссылки во всей их полноте для всех целей.
Правительственная поддержка
[0002] Настоящее изобретение осуществлено при правительственной поддержке по грантам № N01-HV-28183 NHLBI Proteomics Center и № N01-HV-00242 NHLBI Proteomics Center, выделенным National Heart Lung and Blood Institute при U.S. National Institutes of Health. Правительство США обладает определенными правами на настоящее изобретение.
Перечень последовательностей
[0003] Настоящая заявка содержит длинный Перечень последовательностей, который был предоставлен для рассмотрения на CD-R, а не на распечатанной бумажной копии, и тем самым включен во всей своей полноте посредством ссылки. Указанный CD-R, записанный 25 апреля 2012 г., называется «CRF», «Сору 1 - SEQUENCE LISTING PART», «Сору 2 - SEQUENCE LISTING PART» и «Сору 3 - SEQUENCE LISTING PART», соответственно, каждая из которых содержит только один отдельный саморазархивирующийся файл под названием 20786PCT_CRF_sequencelising.EXE (138571776 байт), который, в свою очередь, содержит один несжатый текстовый файл ASCII под названием 20786PCT_CRF_sequencelisting.TXT (795566080 байт).
Уровень техники
[0004] Получение терапевтических моноклональных антител из человеческих источников является биологически и технически проблематичным. На данный момент описано несколько подходов, включающих образование человеческих гибридом с использованием трансгенных мышей, экспрессирующих человеческие иммуноглобулины, и с использованием библиотек фаговых дисплеев человеческих иммуноглобулинов.
[0005] Человеческие гибридомы трудно получать, поскольку сливающиеся клетки человеческой миеломы, в отличие от их мышиных клеток-партнеров, неспособны к образованию гибридом. Человеческие гибридомы также имеют склонность к спонтанной потере экспрессированных генов антител после длительного культивирования. Трансформация вирусом Эпштейна-Барра (EBV) иммобилизирует В-клетки, но только очень небольшие фракции из всех EBV-трансформированных В-клеток характеризуются созревшей аффинностью или распознают целевой антиген. Создание гибридом, как правило, включает многочисленные скрининги для получения терапевтических моноклональных антител. Ни одно из терапевтических моноклональных антител, на данный момент одобренных U.S. F.D.A., не было создано путем образования человеческих гибридом или трансформации EBV В-клеток, что подтверждает технические сложности и проблемы, предполагаемые с этими способами.
[0006] Библиотеки фаговых дисплеев последовательностей человеческого антитела представляют другой способ получения терапевтических человеческих моноклональных антител. В этом способе используется технология рекомбинантной ДНК для произвольной экспрессии последовательностей тяжелой и легкой цепи человеческого антитела вместе для обеспечения скрининга по комбинациям, которые связываются с целевым антигеном. Однако эта стратегия не дает антител с созревшей аффинностью, и полученные таким путем антитела обычно связываются с антигеном с низкой аффинностью и авидностью. Поэтому для создания антител с высокой аффинностью необходимы последовательные стадии мутации и отбора/скрининга.
[0007] Другим путем получения терапевтических человеческих моноклональных антител является создание или использование трансгенных мышей, которые обладают репертуаром человеческих антител. При иммунизации такие мыши продуцируют антитела, нацеленные на иммунизирующий антиген, и затем могут быть образованы гибридомы для получения терапевтических человеческих моноклональных антител.
Такие трансгенные мыши являются проприетарными и не являются общедоступными для применения в получении человеческих антител.
[0008] Таким образом, авторы настоящего изобретения определили потребность в композициях, наборах и способах, с помощью которых можно, например, получить большое число человеческих антител с созревшей аффинностью без необходимости трудоемкого и времязатратного гуманизирования антитела или без необходимости проведения обширных скринингов. Описанные в настоящем документе композиции, наборы и способы направлены на удовлетворение этой потребности. Кроме того, описанные в настоящем документе композиции, наборы и способы широко применимы не только в области человеческих антител, а могут быть использованы в ряде различных применений, в том числе, например, для установления совпадения двух или более представляющих интерес полинуклеотидов, которые походят из отдельного образца и присутствуют в библиотеке полинуклеотидов.
Сущность изобретения
[0009] В настоящем документе раскрывается композиция, содержащая полинуклеотид, при этом полинуклеотид содержит первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит по меньшей мере один сигнальный (идентификационный) участок, и при этом первый участок соединяется со вторым участком.
[0010] Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участок VDJ иммуноглобулиновой нуклеотидной последовательности IgG, выделенной из активированной человеческой В-клетки, которая больше или равна 8 мкм в диаметре, и при этом 5'-конец иммуноглобулинового участка соединяется с 3'-концом сигнального участка. Некоторые аспекты относятся к композиции, состоящей из клонального семейства.
[0011] Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является активированная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является плазмобласт. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является одиночная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является одиночная активированная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является одиночная активированная В-клетка, находящаяся в крови субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является человеческая активированная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является В-клетка памяти. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является плазматическая клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является антиген-специфичная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки млекопитающих. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из человеческой В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из мышиной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта с представляющим интерес заболеванием или состоянием. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта, выздоравливающего или выздоровевшего от представляющего интерес заболевания или состояния. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта, которому вводили по меньшей мере один представляющий интерес антиген. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта, которому вводили по меньшей мере один представляющий интерес антиген и адъювант. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в крови субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в костном мозге субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в селезенке субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся по меньшей мере в одном лимфатическом узле субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в лимфоидной ткани субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в кишке субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой составляет приблизительно 8-20 мкм. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой составляет 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более 20 мкм. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, площадь которой составляет приблизительно 60, 70, 80, 90, 100, 120, 130, 140, 150, 200, 250, 300, 350 или более 350 мкм2. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, объем которой составляет приблизительно 250, 268, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000 или более 4000 мкм3. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой на 10% больше по размеру среднего диаметра контрольной находящейся в покое В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой на 15% больше по размеру среднего диаметра контрольной находящейся в покое В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой на 20% больше по размеру среднего диаметра контрольной находящейся в покое В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, способной секретировать иммуноглобулин. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки в промежуточной 1 (G1), синтетической (S), промежуточной 2 (G2) или митотической (М) фазе клеточного цикла. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, не находящейся в промежуточной 0 (G0) фазе клеточного цикла. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, характеризующейся FSC, в 1,2 раза большим среднего FSC находящихся в покое В-лимфоцитов при измерении с помощью проточной цитометрии. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, характеризующейся средним FSC, в 0,7-1,15 раза большим среднего FSC человеческих моноцитов при измерении с помощью проточной цитометрии. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD 19 положительной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD38 положительной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD27 положительной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD20 отрицательной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD19+CD20-CD27+CD38hi В-клетки.
[0012] Согласно некоторым аспектам 5'-конец иммуноглобулинового участка соединяется с 3'-концом сигнального участка.
[0013] Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участок VDJ иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участок VJ иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участки V, D и/или J иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему тяжелую и/или легкую цепи иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему иммуноглобулиновую последовательность IgG, IgM, IgD, IgE или IgA. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему человеческую иммуноглобулиновую последовательность IgGl, IgG2, IgG3 или IgG4. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему мышиную иммуноглобулиновую последовательность IgGl, IgG2a, IgG2b или IgG3. Некоторые аспекты относятся к иммуноглобулиновому участку, длина которого составляет приблизительно 200-2000 нуклеотидов. Некоторые аспекты относятся к иммуноглобулиновому участку, длина которого составляет менее 200, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000 или более 2000 нуклеотидов.
[0014] Некоторые аспекты относятся к сигнальному участку, содержащему множество сигнальных участков. Некоторые аспекты относятся к сигнальному участку, содержащему множество сигнальных участков, и при этом каждый сигнальный участок во множестве содержит отличающуюся последовательность. Некоторые аспекты относятся к сигнальному участку, содержащему по меньшей мере один сигнальный участок образца и по меньшей мере один сигнальный участок планшета. Некоторые аспекты относятся к сигнальному участку, содержащему последовательность, отличающуюся от последовательности иммуноглобулинового участка. Некоторые аспекты относятся к сигнальному участку, длина которого составляет приблизительно 2-100 нуклеотидов. Некоторые аспекты относятся к сигнальному участку, длина которого составляет 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более 100 нуклеотидов. Некоторые аспекты относятся к сигнальному участку, длина которого составляет приблизительно 2-1000 нуклеотидов. Некоторые аспекты относятся к сигнальному участку, длина которого составляет 100 или более нуклеотидов. Некоторые аспекты относятся к сигнальному участку, содержащему смежную некодирующую нуклеотидную последовательность. Некоторые аспекты относятся к сигнальному участку, содержащему некодирующую нуклеотидную последовательность. Некоторые аспекты относятся к сигнальному участку, содержащему несмежную некодирующую нуклеотидную последовательность. Некоторые аспекты относятся к длине последовательности сигнального участка, которая меньше длины последовательности иммуноглобулинового участка.
[0015] Некоторые аспекты относятся к описанной в настоящем документе композиции, которая может содержать третий участок, при этом третий участок содержит адаптерный участок. Некоторые аспекты относятся к третьему участку, содержащему адаптерный участок, и при этом третий участок расположен между первым участком и вторым участком. Некоторые аспекты относятся к третьему участку, содержащему адаптерный участок, и при этом адаптерный участок содержит по меньшей мере один нуклеотид G, расположенный на его 3'-конце.
[0016] Некоторые аспекты относятся к сигнальному участку, длина которого составляет 2-100 нуклеотидов, и который содержит последовательность, отличающуюся от последовательности иммуноглобулинового участка, и при этом адаптерный участок содержит по меньшей мере один нуклеотид G на своем 3'-конце и располагается 3' относительно сигнального участка образца и 5' относительно иммуноглобулинового участка, и при этом иммуноглобулиновый вариабельный участок подвергся гипермутации и отличается от родоначальной последовательности наивной В-клетки.
[0017] Некоторые аспекты относятся к композиции, находящейся в контейнере. Согласно некоторым аспектам в контейнере находятся несколько композиций. Согласно некоторым аспектам несколько композиций находятся в одной лунке одного планшета, содержащего несколько лунок.
[0018] Некоторые аспекты относятся к композиции, представленной в библиотеке композиций, при этом каждая композиция находится в отдельном контейнере, при этом каждая композиция содержит полинуклеотид, содержащий первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, при этом первый участок соединяется со вторым участком, при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков находящихся в библиотеке, и при этом последние нуклеотидные последовательности множества вариабельных иммуноглобулиновых участков в библиотеке обладают по меньшей мере 80-99% идентичностью последовательностей.
[0019] Некоторые аспекты относятся к композиции, состоящей из библиотеки, содержащей множество полинуклеотидных композиций, при этом каждая композиция находится в отдельном контейнере, при этом каждая композиция содержит полинуклеотид, при этом полинуклеотид содержит первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, при этом первый участок соединяется со вторым участком, и при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков, находящихся в каждом отдельном контейнере в библиотеке.
[0020] Также в настоящем документе описывается библиотека полинуклеотидных композиций, содержащая множество полинуклеотидных композиций, при этом каждая композиция находится в отдельном контейнере, при этом каждая композиция содержит полинуклеотид, при этом полинуклеотид содержит первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, при этом первый участок соединяется со вторым участком, и при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков, находящихся в каждом отдельном контейнере в библиотеке.
[0021] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид из множества находится в отдельном контейнере, при этом каждый полинуклеотид из множества содержит первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, при этом первый участок соединяется со вторым участком, при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков, находящихся в библиотеке, и при этом по меньшей мере два вариабельных иммуноглобулиновых участка во множестве обладают по меньшей мере 80-99% идентичностью последовательностей.
[0022] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая клональное семейство полинуклеотидов, при этом каждый полинуклеотид в семействе содержит первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, при этом первый участок соединяется со вторым участком, при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков в семействе, и при этом каждый из вариабельных иммуноглобулиновых участков в семействе обладает по меньшей мере 80-99% идентичностью последовательностей. Некоторые аспекты относятся к библиотеке, содержащей множество клональных семейств.
[0023] Также в настоящем документе описывается клональное семейство иммуноглобулиновых последовательностей, при этом каждая последовательность в семействе соединяется с сигнальным участком. Согласно некоторым аспектам каждый сигнальный участок отличается от других сигнальных участков. Некоторые аспекты относятся к иммуноглобулиновым последовательностям, содержащим иммуноглобулиновые последовательности тяжелой цепи. Некоторые аспекты относятся к иммуноглобулиновым последовательностям, содержащим иммуноглобулиновые последовательности легкой цепи. Некоторые аспекты относятся к иммуноглобулиновым последовательностям, содержащим иммуноглобулиновые последовательности тяжелой цепи и легкой цепей. Некоторые аспекты относятся к одному или нескольким сигнальным участкам, содержащим иммуноглобулиновую последовательность легкой цепи. Некоторые аспекты относятся к одному или нескольким сигнальным участкам, содержащим иммуноглобулиновую последовательность тяжелой цепи.
[0024] Также в настоящем документе описывается набор двух или более описанных в настоящем документе клональных семейств.
[0025] Также в настоящем документе описывается набор 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более описанных в настоящем документе клональных семейств. [0026] Также в настоящем документе описывается клональное семейство иммуноглобулиновых последовательностей, при этом каждая последовательность в семействе функционально соединяется по меньшей мере с одной смежной нуклеотидной последовательностью. Некоторые аспекты относятся к иммуноглобулиновым последовательностям, содержащим иммуноглобулиновые последовательности тяжелой цепи, и по меньшей мере к одной смежной нуклеотидной последовательности, содержащей иммуноглобулиновую последовательность легкой цепи. Некоторые аспекты относятся к иммуноглобулиновым последовательностям, содержащим иммуноглобулиновые последовательности легкой цепи, и по меньшей мере к одной смежной нуклеотидной последовательности, содержащей иммуноглобулиновую последовательность тяжелой цепи.
[0027] Также в настоящем документе описывается способ получения клонального семейства иммуноглобулиновых последовательностей, включающий получение множества иммуноглобулиновых последовательностей, каждая из которых содержит участки V, D и/или J и каждая из которых соединена с сигнальным участком; и группировку двух или более последовательностей из множества для получения клонального семейства, при этом каждая последовательность в клональном семействе является мутантной версией одной и той же родоначальной иммуноглобулиновой последовательности, содержащей участки V, D и/или J, или родоначальной иммуноглобулиновой последовательности, содержащей участки V, D и/или J.
[0028] Согласно некоторым аспектам каждый сигнальный участок отличается от других сигнальных участков.
[0029] Также в настоящем документе описывается способ получения клонального семейства иммуноглобулиновых последовательностей, включающий получение множества иммуноглобулиновых последовательностей, каждая из которых содержит участки V, D и/или J и каждая из которых соединена с сигнальным участком, и при этом каждый сигнальный участок отличается от других сигнальных участков; извлечение одного или нескольких сигнальных участков; и группировку двух или более последовательностей из множества для получения клонального семейства, при этом каждая последовательность в клональном семействе является мутантной версией одной и той же родоначальной иммуноглобулиновой последовательности, содержащей участки V, D и/или J, или родоначальной иммуноглобулиновой последовательности, содержащей участки V, D и/или J. [0030] Также в настоящем документе описывается способ идентификации второй кДНК, соединенной с первым сигнальным участком, включающий отбор первой кДНК, соединенной с первым сигнальным участком, и идентификацию второй кДНК на основе общей идентичности сигнального участка, соединенного с каждой кДНК.
[0031] Также в настоящем документе описывается способ получения 3'-хвоста на второй нуклеотидной последовательности, включающий получение первой нуклеотидной последовательности и контакт первой нуклеотидной последовательности с термостабильной обратной транскриптазой-РНКазой Н-, обладающей активностью переключения матрицы при менее 50°С, при этом при контакте получают 3'-хвост и вторую нуклеотидную последовательность. Некоторые аспекты относятся к приведению в контакт первой нуклеотидной последовательности при приблизительно менее 50, 49, 48, 47, 46, 45, 44, 43, 42 или менее 42°С. Некоторые аспекты относятся к приведению в контакт первой нуклеотидной последовательности при 42°С. Некоторые аспекты относятся к приведению в контакт первой нуклеотидной последовательности при 45,5°С. Согласно некоторым аспектам транскриптазой является обратная транскриптаза-РНКаза Н- вируса мышиного лейкоза Молони. Согласно некоторым аспектам транскриптазой является Superscript III.
[0032] Также в настоящем документе описывается способ определения встречающейся в природе последовательности представляющей интерес первой последовательности, включающий получение множества последовательностей, родственных первой последовательности, и каждая из которых соединена с первым сигнальным участком, при этом каждый первый сигнальный участок является идентичным, и при этом одна или несколько последовательностей во множестве отличаются от встречающейся в природе последовательности; и сравнение последовательностей во множестве для определения встречающейся в природе последовательности представляющей интерес первой последовательности. Некоторые аспекты относятся к множеству последовательностей, содержащих иммуноглобулиновые последовательности. Некоторые аспекты относятся к множеству последовательностей, содержащих иммуноглобулиновые последовательности. Некоторые аспекты относятся к множеству последовательностей, содержащих иммуноглобулиновые последовательности. Некоторые аспекты относятся к множеству последовательностей, каждая из которых соединена со вторым сигнальным участком, и каждый второй сигнальный участок является идентичным. Некоторые аспекты относятся к представляющей интерес первой последовательности, которая является иммуноглобулиновой последовательностью. Некоторые аспекты относятся ко множеству последовательностей, которые являются иммуноглобулиновыми последовательностями.
[0033] Также в настоящем документе описывается композиция, содержащая полинуклеотид, содержащий первый участок и второй участок, при этом первый участок содержит полученный из В-клетки вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, и при этом первый участок соединяется со вторым участком.
[0034] Также в настоящем документе описывается библиотека полинуклеотидных композиций, содержащая множество полинуклеотидных композиций, при этом каждая композиция находится в отдельном контейнере, при этом каждая композиция содержит полинуклеотид, содержащий полученный из В-клетки вариабельный иммуноглобулиновый участок и сигнальный участок, при этом вариабельный иммуноглобулиновый участок соединяется с сигнальным участком, при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков, находящихся в каждом отдельном контейнере в библиотеке.
[0035] Также в настоящем документе описывается способ получения полинуклеотидной композиции, включающий получение полинуклеотида, содержащего первый участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, ассоциированный с субъектом; и образование полинуклеотидной композиции, содержащей первый участок и второй участок, путем соединения первого участка со вторым участком, при этом второй участок содержит сигнальный участок.
[0036] Некоторые аспекты относятся к получению полинуклеотида, включающему получение В-клетки, ассоциированной с субъектом, и обработку клетки для получения полинуклеотида. Некоторые аспекты относятся к получению полинуклеотида, включающего получение полинуклеотида непосредственно или опосредованно от третьей стороны, которая обработала В-клетку, ассоциированную с субъектом, для получения полинуклеотида. Некоторые аспекты относятся к получению полинуклеотида, включающему получение полинуклеотида непосредственно или опосредованно от третьей стороны, которая растворила В-клетку, ассоциированную с субъектом, для получения полинуклеотида. Некоторые аспекты относятся к получению полинуклеотида, включающего получение В-клетки с использованием проточного цитометра. Некоторые аспекты относятся к получению полинуклеотида, включающего получение В-клетки с использованием микроструйного устройства.
[0037] Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участок VDJ иммуноглобулиновой нуклеотидной последовательности IgG, выделенный из активированной человеческой В-клетки, большей или равной 8 мкм в диаметре, и при этом 5'-конец иммуноглобулинового участка соединяется с 3'-концом сигнального участка. Некоторые аспекты относятся к композиции, состоящей из клонального семейства.
[0038] Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является активированная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является плазмобласт. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является одиночная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является одиночная активированная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является одиночная активированная В-клетка, находящаяся в крови субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является человеческая активированная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является В-клетка памяти. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является плазматическая клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, и при этом В-клеткой является антиген-специфичная В-клетка. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки млекопитающих. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из человеческой В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из мышиной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта с представляющим интерес заболеванием или состоянием. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта, выздоравливающего или выздоровевшего от представляющего интерес заболевания или состояния. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта, которому вводили по меньшей мере один представляющий интерес антиген. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки субъекта, которому вводили по меньшей мере один представляющий интерес антиген и адъювант. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в крови субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в костном мозге субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в селезенке субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся по меньшей мере в одном лимфатическом узле субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в лимфоидной ткани субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, находящейся в кишке субъекта. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой составляет приблизительно 8-20 мкм. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой составляет 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более 20 мкм. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, площадь которой составляет приблизительно 60, 70, 80, 90, 100, 120, 130, 140, 150, 200, 250, 300, 350 или более 350 мкм2. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, объем которой составляет приблизительно 250, 268, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000 или более 4000 мкм3. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой на 10% больше по размеру среднего диаметра контрольной находящейся в покое В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой на 15% больше по размеру среднего диаметра контрольной находящейся в покое В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, диаметр которой на 20% больше по размеру среднего диаметра контрольной находящейся в покое В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из активированной В-клетки, способной секретировать иммуноглобулин. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки в промежуточной 1 (G1), синтетической (S), промежуточной 2 (G2) или митотической (М) фазе клеточного цикла. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, не находящейся в промежуточной О (GO) фазе клеточного цикла. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, характеризующейся FSC, в 1,2 раза большим среднего FSC находящихся в покое В-лимфоцитов при измерении с помощью проточной цитометрии. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из В-клетки, характеризующейся средним FSC, в 0,7-1,15 раза большим среднего FSC человеческих моноцитов при измерении с помощью проточной цитометрии. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD 19 положительной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD38 положительной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD27 положительной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD20 отрицательной В-клетки. Некоторые аспекты относятся к иммуноглобулиновому участку, выделенному из одиночной CD19+CD20-CD27+CD38hi В-клетки.
[0039] Согласно некоторым аспектам 5'-конец иммуноглобулинового участка соединяется с 3'-концом сигнального участка.
[0040] Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участок VDJ иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участок VJ иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему участки V, D и/или J иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему тяжелую и/или легкую цепь иммуноглобулиновой нуклеотидной последовательности. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему иммуноглобулиновую последовательность IgG, IgM, IgD, IgE или IgA. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему человеческую иммуноглобулиновую последовательность IgGl, IgG2, IgG3 или IgG4. Некоторые аспекты относятся к вариабельному иммуноглобулиновому участку, содержащему мышиную иммуноглобулиновую последовательность IgGl, IgG2a, IgG2b или IgG3. Некоторые аспекты относятся к иммуноглобулиновому участку, составляющему в длину приблизительно 200-2000 нуклеотидов. Некоторые аспекты относятся к иммуноглобулиновому участку, составляющему в длину менее 200, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000 или более 2000 нуклеотидов.
[0041] Некоторые аспекты относятся к сигнальному участку, содержащему множество сигнальных участков. Некоторые аспекты относятся к сигнальному участку, содержащему множество сигнальных участков, и при этом каждый сигнальный участок во множестве содержит отличающуюся последовательность. Некоторые аспекты относятся к сигнальному участку, содержащему по меньшей мере один сигнальный участок образца и по меньшей мере один сигнальный участок планшета. Некоторые аспекты относятся к сигнальному участку, содержащему последовательность, отличающуюся от последовательности иммуноглобулинового участка. Некоторые аспекты относятся к сигнальному участку, составляющему в длину приблизительно 2-100 нуклеотидов. Некоторые аспекты относятся к сигнальному участку, составляющему в длину 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более 100 нуклеотидов. Некоторые аспекты относятся к сигнальному участку, составляющему в длину приблизительно 2-1000 нуклеотидов. Некоторые аспекты относятся к сигнальному участку, составляющему в длину 100 или более нуклеотидов. Некоторые аспекты относятся к сигнальному участку, содержащему смежную некодирующую нуклеотидную последовательность. Некоторые аспекты относятся к сигнальному участку, содержащему некодирующую нуклеотидную последовательность. Некоторые аспекты относятся к сигнальному участку, содержащему несмежную некодирующую нуклеотидную последовательность. Согласно некоторым аспектам длина последовательности сигнального участка меньше длины последовательности иммуноглобулинового участка.
[0042] Некоторые аспекты относятся к описанной в настоящем документе композиции, которая может содержать третий участок, при этом третий участок содержит адаптерный участок. Некоторые аспекты относятся к третьему участку, содержащему адаптерный участок, и при этом третий участок расположен между первым участком и вторым участком. Некоторые аспекты относятся к третьему участку, содержащему адаптерный участок, и при этом адаптерный участок содержит по меньшей мере один нуклеотид G, расположенный на его 3'-конце.
[0043] Некоторые аспекты относятся к сигнальному участку, составляющему в длину 2-100 нуклеотидов и содержащему последовательность, отличающуюся от последовательности иммуноглобулинового участка, и при этом адаптерный участок содержит по меньшей мере один нуклеотид G на своем 3'-конце и располагается 3' относительно сигнального участка образца и 5' относительно иммуноглобулинового участка, и при этом иммуноглобулиновый вариабельный участок подвергся гипермутации и отличается от родоначальной последовательности наивной В-клетки.
[0044] Согласно некоторым аспектам композиция находится в контейнере. Согласно некоторым аспектам в контейнере находятся несколько композиций. Согласно некоторым аспектам несколько композиций находятся в одной лунке одного планшета, содержащего несколько лунок.
[0045] Некоторые аспекты относятся к композиции, представленной в библиотеке композиций, при этом каждая композиция находится в отдельном контейнере, при этом каждая композиция содержит полинуклеотид, содержащий первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, при этом первый участок соединяется со вторым участком, при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков, находящихся в библиотеке, и при этом последние нуклеотидные последовательности множества вариабельных иммуноглобулиновых участков в библиотеке обладают по меньшей мере 80-99% идентичностью последовательностей.
[0046] Некоторые аспекты относятся к композиции, содержащейся в библиотеке, содержащей множество полинуклеотидных композиций, при этом каждая композиция находится в отдельном контейнере, при этом каждая композиция содержит полинуклеотид, при этом полинуклеотид содержит первый участок и второй участок, при этом первый участок содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, а второй участок содержит сигнальный участок, при этом первый участок соединяется со вторым участком, и при этом нуклеотидная последовательность каждого сигнального участка отличается от нуклеотидной последовательности других сигнальных участков, находящихся в каждом отдельном контейнере в библиотеке.
[0047] Также в настоящем документе описывается способ получения полинуклеотидной композиции, включающий получение В-клетки, ассоциированный с субъектом; выделение полинуклеотидов из клетки, содержащей экспрессированный В-клеткой вариабельный иммуноглобулиновый участок; и образование полинуклеотидной композиции, содержащей вариабельный иммуноглобулиновый участок и сигнальный участок, путем соединения вариабельного иммуноглобулинового участка с сигнальным участком.
[0048] Также в настоящем документе описывается способ получения полинуклеотидной композиции, включающий получение полинуклеотида, содержащего полученный из В-клетки вариабельный иммуноглобулиновый участок, ассоциированный с субъектом; и образование полинуклеотидной композиции, содержащей вариабельный иммуноглобулиновый участок и сигнальный участок, путем соединения вариабельного иммуноглобулинового участка с сигнальным участком.
[0049] Некоторые аспекты относятся к получению полинуклеотида, включающему получение В-клетки и обработку клетки для получения полинуклеотида. Некоторые аспекты относятся к получению полинуклеотида, включающему получение полинуклеотида непосредственно или опосредованно от третьей стороны, которая обработала В-клетку для получения полинуклеотида.
[0050] Также в настоящем документе описывается способ получения двух или более полинуклеотидных композиций, включающий получение библиотеки полинуклеотидов, содержащей множество полинуклеотидов, ассоциированных со множеством полученных от одного или нескольких субъектов образцов, при этом один или несколько полинуклеотидов содержит экспрессированный В-клеткой вариабельный иммуноглобулиновый участок, при этом каждый образец ассоциируется с В-клеткой, и при этом каждый полинуклеотид, ассоциированный с каждым образцом, находится в отдельном контейнере; и образование двух или более полинуклеотидных композиций, каждая из которых содержит полинуклеотид из множества полинуклеотидов и сигнальный участок, путем соединения полинуклеотида с сигнальным участком, при этом последовательность каждого сигнального участка отличается от последовательности сигнальных участков, соединенных с другими полинуклеотидами в библиотеке.
[0051] Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение множества В-клеток и обработку клеток для получения библиотеки полинуклеотидов. Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение библиотеки полинуклеотидов непосредственно или опосредованно от третьей стороны, которая обработала множество В-клеток для получения библиотеки полинуклеотидов.
[0052] Также в настоящем документе описывается способ получения двух или более полинуклеотидных композиций, включающий получение библиотеки полинуклеотидов, содержащей множество полинуклеотидов, ассоциированных со множеством полученных от одного или нескольких субъектов образцов, при этом один или несколько полинуклеотидов содержат полученный из В-клетки вариабельный иммуноглобулиновый участок, и при этом каждый полинуклеотид, ассоциированный с каждым образцом, находится в отдельном контейнере; и образование двух или более полинуклеотидных композиций, каждая из которых содержит полинуклеотид из множества полинуклеотидов и сигнальный участок, путем соединения полинуклеотида с сигнальным участком, при этом последовательность каждого сигнального участка отличается от последовательности сигнальных участков, соединенных с другими полинуклеотидами в библиотеке.
[0053] Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение множества В-клеток и обработку клеток для получения библиотеки полинуклеотидов. Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение библиотеки полинуклеотидов непосредственно или опосредованно от третьей стороны, которая обработала множество В-клеток для получения библиотеки полинуклеотидов.
[0054] Также в настоящем документе описывается библиотека полинуклеотидных композиций, содержащая множество полинуклеотидных композиций, при этом каждая композиция находится в отдельном контейнере, при этом каждая композиция содержит отдельный полученный из образца участок кДНК, содержащий нуклеотид С на 3'-конце участка кДНК, и адаптерный участок для идентификации образца, содержащий сигнальный участок образца, соединенный с адаптерным участком, при этом нуклеотидная последовательность сигнального участка образца каждого адаптерного участка для идентификации образца отличается от нуклеотидной последовательности сигнального участка образца других адаптерных участков для идентификации образца, находящихся в каждом отдельном контейнере в библиотеке, при этом адаптерный участок содержит нуклеотид G на 3'-конце адаптерного участка, и при этом адаптерный участок для идентификации образца присоединяется к участку кДНК путем связывания С и G.
[0055] Некоторые аспекты относятся к участку кДНК, содержащему полинуклеотид РНК, гибридизированный с полинуклеотидом ДНК. Некоторые аспекты относятся к участку кДНК, содержащему полинуклеотид mRNA, гибридизированный с полинуклеотидом кДНК. Некоторые аспекты относятся к участку кДНК, содержащему по меньшей мере один С на 3'-конце, и при этом адаптерный участок содержит по меньшей мере один G на 3'-конце.
[0056] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит сигнальный участок образца, адаптерный участок и отдельный полученный из образца участок кДНК, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом участок кДНК соединяется с 3'-концом адаптерного участка, при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца, и при этом сигнальный участок образца является двухнитевым. Согласно некоторым аспектам каждый полинуклеотид содержит множество участков для идентификации образцов.
[0057] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона из отдельного образца, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом участок ампликона функционально соединяется с адаптерным участком, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[0058] Согласно некоторым аспектам 5'-конец участка ампликона соединяется с 3'-концом адаптерного участка, при этом универсальный праймерный участок содержит последовательность CACGACCGGTGCTCGATTTAG, и при этом адаптерный участок содержит по меньшей мере один G. Некоторые аспекты относятся к последовательности универсального праймерного участка, которая не полностью комплементарна какому-либо экзону гена человека, и при этом универсальный праймерный участок характеризуется минимальной вторичной структурой, которая не мешает адаптерному участку. Согласно некоторым аспектам универсальным праймерным участком является последовательность CACGACCGGTGCTCGATTTAG. Некоторые аспекты относятся к участку ампликона, содержащему участок кДНК, содержащему нуклеотидную последовательность кДНК. Некоторые аспекты относятся к последовательности сигнального участка образца каждого полинуклеотида из первого отдельного образца, отличающегося по меньшей мере 1 нуклеотидом от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца. Некоторые аспекты относятся к последовательности сигнального участка образца каждого полинуклеотида из первого отдельного образца, отличающегося по меньшей мере 2 нуклеотидами от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца. Некоторые аспекты относятся к сигнальному участку образца, составляющему в длину по меньшей мере 10 нуклеотидов. Некоторые аспекты относятся к сигнальному участку образца, составляющему в длину по меньшей мере 1 нуклеотид. Некоторые аспекты относятся к последовательности каждого сигнального участка образца, выбранной из таблиц 2 и 7. Некоторые аспекты относятся к последовательности адаптерного участка, содержащего по меньшей мере один нуклеотид G на своем 3'-конце. Некоторые аспекты относятся к участку ампликона, содержащему последовательность ампликона тяжелой цепи иммуноглобулина, последовательность ампликона легкой цепи иммуноглобулина, последовательность ампликона рецептора альфа Т-клетки или последовательность ампликона рецептора бета Т-клетки.
[0059] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит последовательность 5'-A-B-C-D-3', при этом А представляет собой универсальный праймерный участок, при этом В представляет собой сигнальный участок образца, при этом С представляет собой адаптерный участок, при этом D представляет собой участок ампликона из отдельного образца, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[0060] Также в настоящем документе описывается полинуклеотид, содержащий универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона из отдельного образца, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, и при этом участок ампликона функционально соединяется с адаптерным участком.
[0061] Согласно некоторым аспектам 5'-конец участка ампликона соединяется с 3'-концом адаптерного участка, при этом универсальный праймерный участок содержит CACGACCGGTGCTCGATTTAG, и при этом адаптерный участок содержит по меньшей мере один G.
[0062] Также в настоящем документе описывается полинуклеотид, содержащий последовательность 5'-A-B-C-D-3', при этом А представляет собой универсальный праймерный участок, при этом В представляет собой сигнальный участок образца, при этом С представляет собой адаптерный участок, и при этом D представляет собой участок ампликона из отдельного образца.
[0063] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит первый сигнальный участок планшета, универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона из отдельного образца, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом первый сигнальный участок планшета функционально соединяется с универсальным праймерным участком, при этом участок ампликона функционально соединяется с адаптерным участком, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[0064] Некоторые аспекты относятся к последовательности первого сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов, отличающегося от последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Некоторые аспекты относятся к последовательности первого сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов, отличающегося по меньшей мере 1 нуклеотидом от последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Некоторые аспекты относятся к последовательности первого сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов, отличающегося по меньшей мере 2 нуклеотидами от последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Некоторые аспекты относятся к первому сигнальному участку планшета, составляющему в длину по меньшей мере 10 нуклеотидов. Некоторые аспекты относятся к последовательности первого сигнального участка планшета, выбранной из таблиц 3 и 6. Согласно некоторым аспектам 3'-конец первого сигнального участка планшета соединяется с 5'-концом универсального праймерного участка, при этом 5'-конец участка ампликона соединяется с 3'-концом адаптерного участка, при этом универсальный праймерный участок содержит CACGACCGGTGCTCGATTTAG, при этом адаптерный участок содержит по меньшей мере один G, при этом каждый полинуклеотид дополнительно содержит второй сигнальный участок планшета, первый участок секвенирования и второй участок секвенирования, при этом 5'-конец второго сигнального участка планшета соединяется с 3'-концом участка ампликона, при этом 3'-конец первого участка секвенирования соединяется с 5'-концом первого сигнального участка планшета, и при этом 5'-конец второго участка секвенирования соединяется с 3'-концом второго сигнального участка планшета. Некоторые аспекты относятся к последовательности второго сигнального участка планшета, являющейся идентичной последовательности первого сигнального участка планшета в каждом полинуклеотиде. Некоторые аспекты относятся к последовательности второго сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов, отличающейся от последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Некоторые аспекты относятся к последовательности второго сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов, отличающейся по меньшей мере 1 нуклеотидом от последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Некоторые аспекты относятся к последовательности второго сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов, отличающейся по меньшей мере 2 нуклеотидами от последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Некоторые аспекты относятся ко второму сигнальному участку планшета, составляющему в длину по меньшей мере 10 нуклеотидов. Некоторые аспекты относятся к последовательности второго сигнального участка планшета, выбранной из таблиц 3 и 6. Некоторые аспекты относятся к первому участку секвенирования, содержащему GAGAGACTGACAGCGTATCGCCTCCCTCGCGCCATCAG. Некоторые аспекты относятся ко второму участку секвенирования, содержащему CTATGCGCCTTGCCAGCCCGCTCAG.
[0065] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит последовательность 5'-A-B-C-D-E-3', при этом А представляет собой сигнальный участок планшета, при этом В представляет собой универсальный праймерный участок, при этом С представляет собой сигнальный участок образца, при этом D представляет собой адаптерный участок, при этом Ε представляет собой участок ампликона из отдельного образца, и при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца
[0066] Также в настоящем документе описывается полинуклеотид, содержащий первый сигнальный участок планшета, универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона из отдельного образца, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом первый сигнальный участок планшета функционально соединяется с универсальным праймерным участком, и при этом участок ампликона функционально соединяется с адаптерным участком.
[0067] Согласно некоторым аспектам 3'-конец первого сигнального участка планшета соединяется с 5'-концом универсального праймерного участка, при этом 5'-конец участка ампликона соединяется с 3'-концом адаптерного участка, при этом универсальный праймерный участок содержит CACGACCGGTGCTCGATTTAG, при этом адаптерный участок содержит по меньшей мере один G, при этом каждый полинуклеотид дополнительно содержит второй сигнальный участок планшета, первый участок секвенирования и второй участок секвенирования, при этом 5'-конец второго сигнального участка планшета соединяется с 3'-концом участка ампликона, при этом 3'-конец первого участка секвенирования соединяется с 5'-концом первого сигнального участка планшета, и при этом 5'-конец второго участка секвенирования соединяется с 3'-концом второго сигнального участка планшета.
[0068] Также в настоящем документе описывается полинуклеотид, содержащий последовательность 5'-A-B-C-D-E-3', при этом А представляет собой сигнальный участок планшета, при этом В представляет собой универсальный праймерный участок, при этом С представляет собой сигнальный участок образца, при этом D представляет собой адаптерный участок, и при этом Ε представляет собой участок ампликона из отдельного образца.
[0069] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит первый участок сайта рестрикции, универсальный праймерный участок, сигнальный участок образца, адаптерный участок, участок ампликона из отдельного образца и второй участок сайта рестрикции, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом первый участок сайта рестрикции функционально соединяется с универсальным праймерным участком, при этом участок ампликона функционально соединяется с адаптерным участком, при этом второй участок сайта рестрикции функционально соединяется с участком ампликона, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[0070] Некоторые аспекты относятся к первому участку сайта рестрикции, содержащему один или несколько сайтов рестрикции. Некоторые аспекты относятся к первому участку сайта рестрикции, содержащему один или несколько сайтов рестрикции, выбранных из группы, состоящей из NheI, XhoI, BstBI, EcoRI, SacII, BbvCI, PspXI, AgeI, ApaI, KpnI, Acc65I, XmaI, BstEII, DraIII, PacI, FseI, AsiSI и AscI. Некоторые аспекты относятся ко второму участку сайта рестрикции, содержащему один или несколько сайтов рестрикции. Некоторые аспекты относятся ко второму участку сайта рестрикции, содержащему один или несколько сайтов рестрикции выбранных из группы, состоящей из NheI, XhoI, BstBI, EcoRI, SacII, BbvCI, PspXI, AgeI, ApaI, KpnI, Acc65I, XmaI, BstEII, DraIII, PacI, FseI, AsiSI и AscI. Согласно некоторым аспектам 3'-конец первого участка сайта рестрикции соединяется с 5'-концом универсального праймерного участка, при этом 3'-конец адаптерного участка соединяется с 5'-концом участка ампликона, при этом 3'-конец участка ампликона соединяется с 5'-концом второго участка сайта рестрикции, при этом универсальный праймерный участок содержит CACGACCGGTGCTCGATTTAG, и при этом адаптерный участок содержит по меньшей мере один G.
[0071] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит последовательность 5'-A-B-C-D-E-F-3', при этом А представляет собой первый участок сайта рестрикции, при этом В представляет собой универсальный праймерный участок, при этом С представляет собой сигнальный участок образца, при этом D представляет собой адаптерный участок, при этом Ε представляет собой участок ампликона из отдельного образца, при этом F представляет собой второй участок сайта рестрикции, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[0072] Также в настоящем документе описывается полинуклеотид для вставки в вектор, содержащий первый участок сайта рестрикции, универсальный праймерный участок, сигнальный участок образца, адаптерный участок, участок ампликона из отдельного образца и второй участок сайта рестрикции, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом первый участок сайта рестрикции функционально соединяется с универсальным праймерным участком, при этом участок ампликона функционально соединяется с адаптерным участком, и при этом второй участок сайта рестрикции функционально соединяется с участком ампликона.
[0073] Согласно некоторым аспектам 3'-конец первого участка сайта рестрикции соединяется с 5'-концом универсального праймерного участка, при этом 3'-конец адаптерного участка соединяется с 5'-концом участка ампликона, при этом 3'-конец участка ампликона соединяется с 5'-концом второго участка сайта рестрикции, при этом универсальный праймерный участок содержит CACGACCGGTGCTCGATTTAG, и при этом адаптерный участок содержит по меньшей мере один G.
[0074] Также в настоящем документе описывается полинуклеотид для вставки в вектор, содержащий последовательность 5'-A-B-C-D-E-F-3', при этом А представляет собой первый участок сайта рестрикции, при этом В представляет собой универсальный праймерный участок, при этом С представляет собой сигнальный участок образца, при этом D представляет собой адаптерный участок, при этом Ε представляет собой участок ампликона из отдельного образца, и при этом F представляет собой второй участок сайта рестрикции.
[0075] Также в настоящем документе описывается полинуклеотидная адаптерная молекула, содержащая универсальный праймерный участок, сигнальный участок образца и адаптерный участок, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, и при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка. Некоторые аспекты относятся к универсальному праймерному участку, содержащему CACGACCGGTGCTCGATTTAG, и при этом адаптерный участок содержит по меньшей мере один G.
[0076] Также в настоящем документе описывается полинуклеотидный праймер, содержащий универсальный праймерный участок и сигнальный участок планшета, и при этом 3'-конец сигнального участка планшета соединяется с 5'-концом универсального праймерного участка. Некоторые аспекты относятся к универсальному праймерному участку, содержащему CACGACCGGTGCTCGATTTAG, при этом праймер дополнительно содержит участок секвенирования, и при этом 3'-конец участка секвенирования соединяется с 5'-концом сигнального участка планшета.
[0077] Также в настоящем документе описывается вектор, содержащий описанный в настоящем документе полинуклеотид. Некоторые аспекты относятся к вектору, содержащему множество полинуклеотидов. Некоторые аспекты относятся к вектору, выбранному из группы, состоящей из рЕЕ6.4 и рЕЕ12.4.
[0078] Также в настоящем документе описывается выделенная клетка-хозяин, содержащая описанный в настоящем документе вектор или описанный в настоящем документе полинуклеотид. Некоторые аспекты относятся к клетке-хозяину, выбранной из группы, состоящей из клеток СНО, клеток СНО-К1, клеток CHO-S, клеток NS0, клеток СНО, которые являются dhfr-, CHO-dhfr-клетками, клетками DUKX-B11 СНО и клетками DG44 СНО.
[0079] Также в настоящем документе описывается способ получения одного или нескольких представляющих интерес полинуклеотидов, включающий получение библиотеки cDNA, содержащей множество кДНК, ассоциированных со множеством полученных от одного или нескольких субъектов образцов, при этом каждая кДНК ассоциируется с отдельным образцом во множестве образцов, и при этом каждая кДНК, ассоциированная с каждым образцом, находится в отдельном контейнере; и добавление адаптерной молекулы к кДНК, ассоциированной с каждым образцом, для получения одного или нескольких представляющих интерес полинуклеотидов, при этом адаптерная молекула содержит сигнальный участок образца и адаптерный участок, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, и при этом последовательность сигнального участка образца каждой адаптерной молекулы отличается от последовательности сигнального участка образца других адаптерных молекул, добавленных к каждой кДНК в библиотеке.
[0080] Некоторые аспекты относятся к способу, дополнительно включающему обеспечение присоединения 3'-конца адаптерного участка к 3'-концу каждой кДНК в библиотеке для получения одного или нескольких представляющих интерес полинуклеотидов. Некоторые аспекты относятся к получению библиотеки cDNA, включающему получение множества образцов и обработку образцов для получения библиотеки cDNA. Некоторые аспекты относятся к адаптерной молекуле, дополнительно содержащей универсальный праймерный участок, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца. Согласно некоторым аспектам каждый участок кДНК содержит полинуклеотид mRNA, гибридизированный с полинуклеотидом кДНК. Согласно некоторым аспектам каждый образец содержит клетку. Согласно некоторым аспектам клеткой является В-клетка. Согласно некоторым аспектам В-клеткой является плазмобласт, В-клетка памяти или плазматическая клетка. Согласно некоторым аспектам каждый образец содержит множество клеток. Некоторые аспекты относятся к получению библиотеки cDNA, включающему получение библиотеки cDNA непосредственно или опосредованно от третьей стороны, которая обработала множество образцов для получения библиотеки cDNA. Согласно некоторым аспектам адаптер добавляется путем отжига адаптера на '3-хвосте образованной в ходе реакции обратной транскрипции кДНК. Согласно некоторым аспектам каждая кДНК содержит по меньшей мере один нуклеотид С, при этом С располагается на 3'-конце каждой кДНК, при этом адаптерный участок содержит по меньшей мере один нуклеотид G, при этом G располагается на 3'-конце адаптерного участка, и при этом адаптерный участок присоединяется к каждой кДНК путем связывания G и С. Согласно некоторым аспектам адаптерная молекула является однонитевой, и дополнительно включается встраивание адаптерной молекулы в каждую кДНК путем обеспечения фермента, делающего адаптерную молекулу двухнитевой. Согласно некоторым аспектам адаптерная молекула встраивается в каждую кДНК для получения представляющего интерес полинуклеотида с помощью обратной транскриптазы MMLV Н".
[0081] Также в настоящем документе описывается способ получения одного или нескольких представляющих интерес полинуклеотидов для секвенирования, включающий получение библиотеки полинуклеотидов, содержащей множество полинуклеотидов, при этом каждый полинуклеотид содержит универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона из отдельного образца, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, и при этом участок ампликона функционально соединяется с адаптерным участком, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца; и амплификацию библиотеки полинуклеотидов с набором праймеров для получения одного или нескольких представляющих интерес полинуклеотидов для секвенирования, при этом один или несколько представляющих интерес полинуклеотидов для секвенирования содержат первый участок секвенирования, первый сигнальный участок планшета, универсальный праймерный участок, сигнальный участок образца, адаптерный участок, участок ампликона из отдельного образца и второй участок секвенирования, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом первый сигнальный участок планшета функционально соединяется с универсальным праймерным участком, при этом участок ампликона функционально соединяется с адаптерным участком, при этом первый участок секвенирования располагается на 5'-конце представляющего интерес полинуклеотида, и при этом второй участок секвенирования располагается на 3'-конце представляющего интерес полинуклеотида.
[0082] Некоторые аспекты относятся к способу, дополнительно включающему секвенирование одного или нескольких представляющих интерес полинуклеотидов. Некоторые аспекты относятся к способу, дополнительно включающему секвенирование одного или нескольких представляющих интерес полинуклеотидов с помощью технологии секвенирования 454. Некоторые аспекты относятся к способу, дополнительно включающему секвенирование одного или нескольких представляющих интерес полинуклеотидов с помощью технологии секвенирования SMRT. Некоторые аспекты относятся к способу, дополнительно включающему секвенирование одного или нескольких представляющих интерес полинуклеотидов с помощью технологии секвенирования SOLiD. Некоторые аспекты относятся к способу, дополнительно включающему секвенирование одного или нескольких представляющих интерес полинуклеотидов с помощью технологии секвенирования SOLEXA. Некоторые аспекты относятся к способу, дополнительно включающему секвенирование одного или нескольких представляющих интерес полинуклеотидов с помощью технологии секвенирования tSMS. Некоторые аспекты относятся к набору праймеров, выбранных из показанных в таблицах 1 и 5 праймеров. Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение библиотеки полинуклеотидов в лаборатории. Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение библиотеки полинуклеотидов непосредственно или опосредованно от третьей стороны, которая получила библиотеку полинуклеотидов.
[0083] Также в настоящем документе описывается способ анализа данных секвенирования, включающий получение набора данных, ассоциированных со множеством полинуклеотидов, при этом набор данных содержит данные секвенирования для множества полинуклеотидов, при этом каждый полинуклеотид во множестве полинуклеотидов содержит сигнальный участок образца, и при этом каждый сигнальный участок образца в каждом полинуклеотиде является уникальным для отдельного образца, при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов во множестве полинуклеотидов из одного или нескольких образцов, отличающихся от первого отдельного образца; и анализ набор данных на совпадение полинуклеотидов с идентичными сигнальными участками образца, при этом совпадение показывает, что полинуклеотиды походят из одного и того же образца.
[0084] Согласно некоторым аспектам каждый полинуклеотид во множестве полинуклеотидов дополнительно содержит первый сигнальный участок планшета, при этом каждая комбинация каждого первого сигнального участка планшета и сигнального участка образца в каждом полинуклеотиде является уникальной для отдельного образца, при этом последовательность первого сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов отличается от последовательности первого сигнального участка планшета других полинуклеотидов во множестве полинуклеотидов из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора, и дополнительно включается анализ набора данных на совпадение полинуклеотидов с идентичными первыми сигнальными участками планшетов и идентичными сигнальными участками образца, при этом совпадение между обоими участками показывает, что полинуклеотиды походят из одного и того же образца. Некоторые аспекты относятся к получению набора данных, включающему получение множества полинуклеотидов и секвенирование множества полинуклеотидов для экспериментального определения набора данных. Некоторые аспекты относятся к получению набора данных, включающему получение набора данных непосредственно или опосредованно от третьей стороны, которая секвенировала множество полинуклеотидов для экспериментального определения набора данных. Согласно некоторым аспектам набор данных хранится в электронной среде для хранения информации. Согласно некоторым аспектам отдельным образцом является отдельная клетка. Согласно некоторым аспектам отдельный образец содержит отдельную клетку. Согласно некоторым аспектам отдельный образец содержит отдельную В-клетку. Согласно некоторым аспектам отдельный образец содержит множество В-клеток. Согласно некоторым аспектам дополнительно включается отбор одного или нескольких полинуклеотидов для клонирования.
[0085] Также в настоящем документе описывается способ идентификации второго представляющего интерес полинуклеотида на основе отбора первого представляющего интерес полинуклеотида, включающий получение набора данных, ассоциированных со множеством полинуклеотидов, при этом набор данных содержит данные секвенирования для множества полинуклеотидов, при этом каждый полинуклеотид во множестве полинуклеотидов содержит сигнальный участок образца, и при этом каждый сигнальный участок образца в каждом полинуклеотиде является уникальным для отдельного образца, посредством чего каждый полинуклеотид во множестве полинуклеотидов ассоциируется с отличающимся отдельным образцом, при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов во множестве полинуклеотидов из одного или нескольких образцов, отличающихся от первого отдельного образца; и отбор первого представляющего интерес полинуклеотида, ассоциированного с первым отдельным образцом, из набора данных и идентификацию второго представляющего интерес полинуклеотида в первом отдельном образце на основе сигнального участка образца первого представляющего интерес полинуклеотида.
[0086] Согласно некоторым аспектам каждый полинуклеотид во множестве полинуклеотидов дополнительно содержит первый сигнальный участок планшета, при этом каждая комбинация каждого первого сигнального участка планшета и сигнального участка образца в каждом полинуклеотиде является уникальной для отдельного образца, при этом последовательность первого сигнального участка планшета каждого полинуклеотида из первого набора отдельных образцов отличается от последовательности первого сигнального участка планшета других полинуклеотидов во множестве полинуклеотидов из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора, и дополнительно включается идентификация второго представляющего интерес полинуклеотида в первом отдельном образце на основе сигнального участка образца и первого сигнального участка планшета первого представляющего интерес полинуклеотида. Согласно некоторым аспектам первый отдельный образец содержит В-клетку. Согласно некоторым аспектам первый отдельный образец содержит множество В-клеток. Согласно некоторым аспектам первый отдельный образец содержит В-клетку, при этом первый представляющий интерес полинуклеотид содержит нуклеотидную последовательность тяжелой цепи антитела, и при этом второй представляющий интерес полинуклеотид содержит нуклеотидную последовательность легкой цепи антитела. Согласно некоторым аспектам первый отдельный образец содержит В-клетку, при этом первый представляющий интерес полинуклеотид содержит нуклеотидную последовательность легкой цепи антитела, и при этом второй представляющий интерес полинуклеотид содержит нуклеотидную последовательность тяжелой цепи антитела. Некоторые аспекты относятся к получению набора данных, включающему получение множества полинуклеотидов и секвенирование множества полинуклеотидов для экспериментального определения набора данных. Некоторые аспекты относятся к получению набора данных, включающему получение набора данных непосредственно или опосредованно от третьей стороны, которая секвенировала множество полинуклеотидов для экспериментального определения набора данных. Согласно некоторым аспектам набор данных хранится в электронной среде для хранения информации.
[0087] Также в настоящем документе описывается способ получения одного или нескольких представляющих интерес полинуклеотидов для клонирования, включающий получение библиотеки полинуклеотидов, содержащей множество полинуклеотидов, при этом каждый полинуклеотид содержит универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона из отдельного образца, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, и при этом участок ампликона функционально соединяется с адаптерным участком, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца; и амплификацию библиотеки полинуклеотидов с набором праймеров для получения одного или нескольких представляющих интерес полинуклеотидов для клонирования, при этом один или несколько представляющих интерес полинуклеотидов для клонирования содержит первый участок сайта рестрикции, универсальный праймерный участок, сигнальный участок образца, адаптерный участок, участок ампликона из отдельного образца и второй участок сайта рестрикции, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, при этом участок ампликона функционально соединяется с адаптерным участком, при этом первый участок сайта рестрикции располагается на 5'-конце представляющего интерес полинуклеотида, и при этом второй участок сайта рестрикции располагается на 3'-конце представляющего интерес полинуклеотида.
[0088] Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение библиотеки полинуклеотидов в лаборатории. Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение библиотеки полинуклеотидов непосредственно или опосредованно от третьей стороны, которая получила библиотеку полинуклеотидов.
[0089] Также в настоящем документе описывается способ получения представляющей интерес молекулы, включающий получение клетки-хозяина, содержащей полинуклеотид, содержащий сигнальный участок образца, адаптерный участок и участок ампликона из отдельного образца, при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка, и при этом участок ампликона функционально соединяется с адаптерным участком; и культивирование клетки-хозяина при условиях, достаточных для получения представляющей интерес молекулы. Некоторые аспекты относятся к получению клетки-хозяина, включающему получение содержащей полинуклеотид клетки-хозяина в лаборатории. Некоторые аспекты относятся к получению клетки-хозяина, включающему получение содержащей полинуклеотид клетки-хозяина непосредственно или опосредованно от третьей стороны, которая получила клетку-хозяина. Согласно некоторым аспектам представляющей интерес молекулой является белок. Согласно некоторым аспектам представляющей интерес молекулой является антитело. Согласно некоторым аспектам представляющей интерес молекулой является человеческое моноклональное антитело. Согласно некоторым аспектам дополнительно включается сбор представляющей интерес молекулы.
[0090] Также в настоящем документе описывается набор, содержащий полинуклеотид, библиотеку полинуклеотидов, вектор или клетку-хозяин, описанные в настоящем документе, а также инструкции по применению.
[0091] Также в настоящем документе описывается способ соединения и штрих-кодирования множества несмежных представляющих интерес полинуклеотидных последовательностей, при этом указанный способ включает (а) обеспечение множества молекул кДНК; (b) физическое соединение представляющих интерес молекул кДНК и (с) добавление штрих-кодированной последовательности к представляющей интерес кДНК до, во время или после физического связывания.
[0092] Некоторые аспекты относятся к физическому соединению, осуществляемому путем лигирования. Некоторые аспекты относятся к физическому соединению, осуществляемому путем рекомбинации. Некоторые аспекты относятся к физическому соединению, включающему использование перекрывающей/удлиненной последовательности. Согласно некоторым аспектам штрих-кодированная последовательность располагается на одном или на обоих концах физически связанных кДНК. Согласно некоторым аспектам штрих-кодированная последовательность располагается между физически связанными кДНК. Согласно некоторым аспектам лигирование выполняется путем отжига и лигирования совместимых концов. Согласно некоторым аспектам совместимыми концами являются сайты рестрикции. Согласно некоторым аспектам лигирование выполняется путем лигирования тупых концов. Согласно некоторым аспектам перекрывающая/удлиненная последовательность добавляется в ходе амплификации с использованием содержащего перекрывающий/удлиненный хвост праймера. Согласно некоторым аспектам перекрывающая/удлиненная последовательность добавляется в ходе обратной транскрипции с использованием содержащего перекрывающий/удлиненный хвост праймера. Согласно некоторым аспектам перекрывающая/удлиненная последовательность добавляется путем отжига адаптера с 3' -хвостом образованной в ходе реакции обратной транскрипции кДНК. Согласно некоторым аспектам штрих-кодированная последовательность добавляется путем лигирования. Согласно некоторым аспектам лигирование выполняется путем отжига и лигирования совместимых концов. Согласно некоторым аспектам совместимыми концами являются сайты рестрикции. Согласно некоторым аспектам лигирование выполняется путем лигирования тупых концов содержащего штрих-кодированную последовательность адаптера. Согласно некоторым аспектам штрих-кодированная последовательность добавляется в ходе реакции амплификации с использованием содержащего штрих-кодированную последовательность праймера. Согласно некоторым аспектам штрих-кодированная последовательность добавляется в ходе реакции обратной транскрипции с использованием содержащего штрих-кодированную последовательность праймера. Согласно некоторым аспектам штрих-кодированная последовательность добавляется путем отжига адаптера с '3-хвостом образованной в ходе реакции обратной транскрипции кДНК. Согласно некоторым аспектам '3-конец кДНК содержит по меньшей мере один нуклеотид С, и при этом 3'-конец адаптера содержит по меньшей мере один нуклеотид G, и при этом адаптер присоединяется к каждой кДНК путем связывания С и G. Согласно некоторым аспектам адаптер является однонитевым, и дополнительно включается встраивание адаптера в каждую кДНК путем обеспечения фермента, делающего адаптер двухнитевым. Согласно некоторым аспектам адаптер встраивается в каждую кДНК с помощью обратной транскриптазы MMLV Н". Некоторые аспекты относятся к перекрывающей/удлиненной последовательности, содержащей штрих-кодированную последовательность. Некоторые аспекты относятся к представляющим интерес полинуклеотидным последовательностям, содержащим тяжелую и легкую цепи антитела. Согласно некоторым аспектам дополнительно включается (d) добавление участка секвенирования к представляющим интерес кДНК до, во время или после физического связывания. Согласно некоторым аспектам участок секвенирования добавляется с адаптером. Согласно некоторым аспектам дополнительно включается (е) секвенирование физически связанных представляющих интерес молекул кДНК с использованием платформы секвенирования NextGen. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования 454. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SMRT. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SOLiD. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SOLEXA. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования tSMS. Согласно некоторым аспектам множество молекула кДНК походит из отдельных образцов, содержащихся в планшете по меньшей мере с 6 лунками, по меньшей мере с 12 лунками, по меньшей мере с 24 лунками, по меньшей мере с 48 лунками, по меньшей мере с 96 лунками, по меньшей мере с 384 лунками, по меньшей мере с 1536 лунками или с большим числом лунок. Согласно некоторым аспектам множество молекула кДНК походит из отдельных образцов, содержащихся по меньшей мере в одном, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, двадцати, тридцати, сорока, пятидесяти, семидесяти пяти, ста или более планшетах по меньшей мере с 96 лунками в каждом.
[0093] Также в настоящем документе описывается способ соединения и штрих-кодирования множества образцов, содержащих представляющие интерес полинуклеотидные последовательности, при этом указанный способ включает (а) распределение образцов во множество контейнеров; (b) синтез представляющих интерес полинуклеотидных последовательностей с использованием матриц из образца, при этом указанный синтез дает в результате добавление штрих-кодированной последовательности; и (с) осуществление связывания синтезированных на стадии (b) представляющих интерес полинуклеотидных последовательностей.
[0094] Согласно некоторым аспектам каждый образец содержит клетку. Согласно некоторым аспектам клеткой является В-клетка. Согласно некоторым аспектам В-клеткой является плазмобласт, В-клетка памяти или плазматическая клетка. Согласно некоторым аспектам каждый образец содержит множество клеток. Некоторые аспекты относятся к представляющим интерес полинуклеотидным последовательностям, содержащим тяжелую и легкую цепи антитела. Согласно некоторым аспектам указанный синтез включает амплификацию RT-PCR. Согласно некоторым аспектам указанная амплификация RT-PCR выполняется в одну стадию. Согласно некоторым аспектам указанное связывание представляющего интерес полинуклеотида выполняется в ходе амплификации RT-PCR с использованием перекрывающего/удлиненного праймера. Согласно некоторым аспектам дополнительно включается (d) добавление участка секвенирования к представляющим интерес полинуклеотидным последовательностям до, во время или после добавления или связывания штрих-кодированной последовательности. Согласно некоторым аспектам участок секвенирования добавляется с адаптером. Согласно некоторым аспектам дополнительно включается (е) секвенирование связанных представляющих интерес полинуклеотидных последовательностей с использованием платформы секвенирования NextGen. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования 454. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SMRT. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SOLiD. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SOLEXA. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования tSMS. Согласно некоторым аспектам множеством образцов являются отдельные образцы, содержащиеся в планшете по меньшей мере с 6 лунками, по меньшей мере с 12 лунками, по меньшей мере с 24 лунками, по меньшей мере с 48 лунками, по меньшей мере с 96 лунками, по меньшей мере с 384 лунками, по меньшей мере с 1536 лунками или с большим числом лунок. Согласно некоторым аспектам множеством образцов являются отдельные образцы, содержащиеся по меньшей мере в одном, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, двадцати, тридцати, сорока, пятидесяти, семидесяти пяти, ста, двухстах, пятистах или более планшетах по меньшей мере с 96 лунками в каждом.
[0095] Также в настоящем документе описывается способ соединения и штрих-кодирования множества несмежных представляющих интерес полинуклеотидных последовательностей, при этом указанный способ включает (а) распределение клеток во множество контейнеров для получения одной или нескольких выделенных клеток; (b) амплификацию представляющих интерес полинуклеотидных последовательностей с использованием матриц из указанных одной или нескольких выделенных клеток, при этом указанная амплификация дает в результате добавление штрих-кодированной последовательности; и (с) осуществление связывания апмплифицированных на стадии (b) представляющих интерес полинуклеотидных последовательностей.
[0096] Некоторые аспекты относятся к представляющим интерес нуклеотидным последовательностям, содержащим тяжелую и легкую цепи антитела. Согласно некоторым аспектам указанная амплификация включает амплификацию RT-PCR. Согласно некоторым аспектам указанная амплификация RT-PCR выполняется в одну стадию. Согласно некоторым аспектам указанное связывание представляющего интерес нуклеотида выполняется в ходе амплификации RT-PCR с использованием перекрывающего/удлиненного праймера. Согласно некоторым аспектам дополнительно включается (d) добавление участка секвенирования к представляющим интерес полинуклеотидным последовательностям до, во время или после добавления или связывания штрих-кодированной последовательности. Согласно некоторым аспектам участок секвенирования добавляется с адаптером. Согласно некоторым аспектам дополнительно включается (е) секвенирование связанных представляющих интерес полинуклеотидных последовательностей с использованием платформы секвенирования NextGen. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования 454. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SMRT. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SOLiD. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования SOLEXA. Согласно некоторым аспектам платформой секвенирования NextGen является платформа секвенирования tSMS. Согласно некоторым аспектам одна или несколько клеток содержатся в планшете по меньшей мере с 6 лунками, по меньшей мере с 12 лунками, по меньшей мере с 24 лунками, по меньшей мере с 48 лунками, по меньшей мере с 96 лунками, по меньшей мере с 384 лунками, по меньшей мере с 1536 лунками или с большим числом лунок. Согласно некоторым аспектам одна или несколько клеток содержатся по меньшей мере в одном, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, двадцати, тридцати, сорока, пятидесяти, семидесяти пяти, ста или более планшетах по меньшей мере с 96 лунками в каждом.
[0097] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит последовательность 5'-A-B-C-D-3', при этом А представляет собой сигнальный участок образца (штрих-кодированную последовательность), при этом В представляет собой первый участок кДНК из отдельного образца, при этом С представляет собой линкерный участок, при этом D представляет собой второй участок кДНК из одного и того же отдельного образца, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[0098] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит последовательность 5'-A-B-C-D-3', при этом А представляет собой первый участок кДНК из отдельного образца, при этом В представляет собой линкерный участок, при этом С представляет собой второй участок кДНК из одного и того же отдельного образца, при этом D представляет собой сигнальный участок образца (штрих-кодированную последовательность), и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[0099] Также в настоящем документе описывается библиотека полинуклеотидов, содержащая множество полинуклеотидов, при этом каждый полинуклеотид содержит последовательность 5'-А-В-С-3', при этом А представляет собой первый участок кДНК из отдельного образца, при этом В представляет собой линкерный участок, содержащий сигнальный участок образца (штрих-кодированную последовательность), при этом С представляет собой второй участок кДНК из одного и того же отдельного образца, и при этом последовательность сигнального участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке из одного или нескольких образцов, отличающихся от первого отдельного образца.
[00100] Согласно некоторым аспектам указанный первый участок кДНК содержит тяжелую цепь антитела, а указанный второй участок кДНК содержит легкую цепь антитела. Некоторые аспекты относятся к библиотеке, содержащей по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 3000, по меньшей мере 10000, по меньшей мере 30000, по меньшей мере 100000, по меньшей мере 300000, по меньшей мере 1000000, по меньшей мере 3000000, по меньшей мере 10000000, по меньшей мере 30000000 или более членов. Некоторые аспекты относятся к библиотеке, содержащей по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 3000, по меньшей мере 10000, по меньшей мере 30000 или более генов всего транскриптома клеточного образца. Некоторые аспекты относятся к библиотеке, содержащей по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 10000, по меньшей мере 100000, по меньшей мере 1000000, по меньшей мере 10000000, по меньшей мере 100000000 или более различных видов присутствующих в крови индивидуума антител. Согласно некоторым аспектам антитела экспрессируются плазмобластами, плазматическими клетками, В-клетками памяти, долгоживущими плазматическими клетками, другими происходящими от В-клеток клетками или их комбинациями.
Краткое описание чертежей
[00101] Эти и другие признаки, аспекты и преимущества станут более понятными при рассмотрении следующего описания и прилагаемых графических материалов.
[00102] Фиг. 1. Дифференцировка В-клеток. Зрелые наивные В-клетки являются CD19+ и могут быть активированы для пролиферации и дифференцировки при антигенной провокации во вторичных лимфоидных тканях, таких как лимфатические узлы и селезенка. Они пролиферируют и дифференцируются либо во внефолликулярном центре, либо в зародышевых центрах. Дифференцирующиеся В-клетки во внефолликулярном центре, как правило, дифференцируясь, становятся короткоживущими плазматическими клетками и обычно находятся во вторичной лимфоидной ткани, из которой они произошли. Дифференцирующиеся в зародышевых центрах В-клетки могут становиться либо В-клетками памяти, у которых можно далее стимулировать дифференцировку путем последующей антигенной провокации, либо плазмобластами, которые потенциально могут стать долгоживущими плазматическими клетками. Эти плазмобласты могут попадать в кровоток и перемещаются в различные ткани, в которых долгоживущие плазматические клетки находятся, таких как костный мозг, ткани слизистых оболочек (для IgA+ плазматических клеток) и воспаленные ткани. Некоторые транзитные плазматические клетки также присутствуют в крови. Все вышеупомянутые типы клеток также можно обнаружить в кровотоке.
[00103] Фиг. 2. Схематическая иллюстрация высокопроизводительного секвенирования, клонирования и экспрессии спаренных генов из отдельных отсортированных клеток. Желаемыми клеточными популяциями являются отдельные клетки, отсортированные на основе экспрессии ими маркеров клеточной поверхности в 96-луночных планшетах для PCR. При обратной транскрипции штрих-кодированные (ID образца) адаптерные молекулы ДНК добавляют в синтезированную 1-ую нить кДНК с использованием переключающего матрицу свойства обратных транскриптаз MMLV Н-. Затем отдельно объединяют продукты RT из каждого планшета и выполняют 2 цикла PCR для амплификации специфичных участков ампликона (ампликонов). PCR выполняют с праймерами с 5' фланкирующими штрих-кодами для добавления сигнальных участков планшета (ID планшетов) к ампликонам. Затем ампл иконы отправляют на секвенирование платформой 454 (а). Из полученных последовательностей составляют подгруппу по ID планшетов и ID образцов перед сборкой последовательности. Ампликоны из одной и той же клетки соединяют парами с использованием ID планшетов и ID образцов и отбирают желаемые клоны для клонирования и экспрессии (b). Специфичные ампликоны могут быть амплифицированы из каждого объединенного планшета ампликонов с использованием клонирующих праймеров, которые являются комплементарными к ID образца этого конкретного ампликона. Клонирующие праймеры также добавляют участки сайта рестрикции (RS), которые затем используются для вставки клона в векторы экспрессии млекопитающих для экспрессии и дальнейшего скрининга. В этом примере ампликонами являются гены легкой и тяжелой цепей иммуноглобулина (Ig), которые кодируют антитело. Экспрессированные антитела затем можно использовать для дальнейшего скрининга (с). 5' RS и 3' RS: 5'- и 3'-сайты рестрикции, соответственно. НС и LC: тяжелая цепь и легкая цепь, соответственно.
[00104] Фиг. 3. Схематическая иллюстрация обратной транскрипции и PCR для добавления ID образца и ID планшетов к ампликонам Ig. Обратную транскрипцию (RT) выполняли с помощью Superscript II или Superscript III, которые представляют собой обратные транскриптазы MMLV Н-. Эти транскриптазы обладают 3'-присоединяющей активностью и добавляют пару цитозинов к 3'-концу заново синтезированных 1-ых нитей кДНК. Олигонуклеотид, заканчивающийся -GGG (адаптерным участком), может дополнить ее парой оснований, и тогда обратная транскриптаза переключает матрицу на олигонуклеотид и выполняет транскрипцию, приводящую к встраиванию адаптера ID образца в 3'-конец кДНК (а). Поскольку адаптер ID образца содержит 5'-невариабельную последовательность (универсальный праймерный участок), то для последующих PCR могут быть использованы прямые праймеры, комплементарные к этой последовательности. Первую PCR выполняли с Fw Long Primer 1, Fw Short Primer 1 и GSP1. Fw Long Primer 1 обладает 5'-фланкирующим участком, содержащим штрих-код ID планшета и 454 Titanium Primer А для секвенирования на платформе 454, которые встраивали в ампликон. Fw Short Primer 1 характеризуется подобной праймеру GSP1 Тm и был встроен для небольшого усиления эффективности PCR. Каждый GSP1 (специфичный для гена праймер 1) содержит комплементарную специфичную для гена последовательность и был использован для амплификации специфичного гена. В данном документе для амплификации этих генов специфичными для генов праймерами являются легкие цепи каппа и лямбда и тяжелая цепь гамма. Показаны последовательности для праймеров (b). Вторая PCR является гнездовой PCR, которую выполняли с Fw Primer 2, Long GSP2 Primer и RV Primer 2. Показаны последовательности для праймеров. Long GSP2 Primer обладает 5'-фланкирующим участком, содержащим штрих-код ID планшета и 454 Titanium Primer В для секвенирования на платформе 454, которые встраивали в ампликон. Праймеры Long GSP2 снова амплифицировали легкие цепи каппа и лямбда и тяжелую цепь гамма. RV Primer 2 характеризуется подобной Fw Primer 2 Tm и был встроен для небольшого усиления эффективности PCR. Показаны последовательности для праймеров. После RT и 2 PCR каждая ампликон будет содержать 454 Titanium Primers А и В для секвенирования на платформе 454, два идентичных ID планшетов, каждый из которых идентифицирует ампликон как походящий из конкретного отсортированных по отдельной клетке 96-луночного планшета, и ID образца, определяющий его положение в 96-луночном планшете (с).
[00105] Фиг. 4. Успешная амплификация отсортированных по отдельной клетке В-клеток с использованием праймеров секвенирования и клонирования. 96-луночный планшет с отсортированными по отдельной клетке В-клетками обратно транскрибировали, объединяли и амплифицировали, как показано на схематических иллюстрациях на фиг. 1а и фиг. 2. Полоски для легкой цепи каппа, легкой цепи лямбда и тяжелой цепи гамма визуализировали на агарозном геле с предполагаемыми размерами: -600 пар оснований для каппа и лямбда и -700 пар оснований для гамма (а). Хроматограмма ДНК секвенирования по методу Сенгера тяжелой цепи гамма от 5'-конца показала «вариабельную» последовательность, соответствующую нескольким ID образца для объединенного планшета (b). Секвенирование по методу Сенгера легкой цепи каппа от 3'-конца показало «вариабельную» последовательность после константного участка и начало на соединении VJ, что соответствует нескольким легким цепям (с). Пару праймеров клонирования, специфичных для лунки Al, использовали для амплификации легкой цепи каппа. Секвенирование по методу Сенгера показало, что в отличие от (с) амплифицировали только одну чистую последовательность (d). Все результаты являются типичными для других амплифицированных генов иммуноглобулина. М: лэддер ДНК из 100 пар оснований, К: легкая цепь каппа, L: легкая цепь лямбда, G: тяжелая цепь гамма.
[00106] Фиг. 5. Корреляция процентных отношений плазмобластов периферической крови страдающих RA ССР+ больных с активностью заболевания и секретированными антителами против цитруллина. Плазмобласты являются CD19+CD20-CD27+CD38++, и их сначала гейтировали по CD3- клеткам, а затем гейтировали, как показано (а). Периферическую кровь получали от давших согласие страдающих RA больных, а плазмобласты отмечали на графике как процентное отношение от всех РВМС. Тест Манна-Уитни показывал, что страдающие RA ССР+ больные характеризуются значительно более высокими (р <0,05) процентными отношениями плазмобластов, чем страдающие RA ССР- больные (b). Процентные отношения плазмобластов в значительной степени коррелировали с клиническим индексом активности заболевания (CDAI) у ССР+ больных согласно линейной регрессии. Линейную регрессию выполняли на логарифмических процентных отношениях трансформированных плазмобластов для получения нормальности набора данных (с). Кроме того, ССР+ плазмобласты либо имитационно отсортировывали, либо подвергали сортировке с истощением плазмобластов с >95% элиминацией плазмобластов (d) и культивировали в течение 7 дней в RPMI, дополненной 10% FBS. Супернатант собирали и анализировали на реактивность антител против цитруллинированного пептида с помощью Luminex. Средние интенсивности флуоресценции для реактивности антител против каждого пептида отмечали на графике как реактивности против пептида (е).
[00107] Фиг. 6. Стратегия отбора и скрининга клонов для нейтрализующих антител. Спаренные последовательности LC и НС антител получали из биоинформатического анализа секвенированных на платформе 454 ампликонов и группировали в клональные семейства на основе использование их V(D)J LC и НС. Клон(ы), встречающийся с самой высокой частотой в каждом клональном семействе, подлежал селективному клонированию, экспрессии и скринингу по связыванию с целевым представляющим интерес антигеном с использованием ELISA. Типичный клон(ы) из всего клонального семейства, которое секретирует связывающие антитела, затем подлежал клонированию и экспрессии для скрининга нейтрализующих антител. Каждая диаграмма антитела представляет клон.
[00108] Фиг. 7. Характеристика последовательностей тяжелой цепи V(D)J иммуноглобулина и клональных семейств, полученных от отдельных субъектов-людей. Кровь получали от людей со следующими состояниями: (i) от человека с вызванным Staphylococcus aureus хроническим остеомиелитом, не принимающего антибиотики (из-за несоблюдения режима), но чья иммунная система эффективно подавляла инфекцию и предотвращала молниеносную инфекцию в течение нескольких месяцев без антибиотиков; (ii) от человека с острой и молниеносной вызванной Staphylococcus aureus бактериемией, требующей перевода в отделение интенсивной терапии и интенсивного лечения внутривенными антибиотиками; (iii) от 3 человек с хроническим активным ревматоидным артритом (RA) (с оценками активности заболевания (DAS) >5); (iv) от человека, получившего 7 дней назад трехвалентную вакцину против гриппа (Fluzone, Sanofi); и (v) от человека с метастатической аденокарциномой легкого, который по прогнозам мог умереть, но после химиотерапии вошел в состояние длительного отсутствия развития заболевания. Во всех случаях у пациентов-людей наблюдалось увеличение содержания плазмобластов в периферической крови (варьирующее от 1,5 до 6% В-клеток периферической крови, являющихся плазмобластами [CD20-CD19+CD38++CD27+], с содержанием у нормальных людей 0,1-0,2% В-клеток периферической крови), что указывает на активированную иммунную реакцию. Плазмобласты отсортировывали по отдельной клетке в 96-луночные планшеты и выполняли штрих-кодирование и секвенирование на платформе 454 экспрессированной кДНК иммуноглобулина, как описано на фиг. 2 и 3. Использовали биоинформатический анализ для пары тяжелой и легкой цепей иммуноглобулина, экспрессированных плазмобластами индивидуума. Представлены секторные диаграммы процента использования V(D)J тяжелой цепи для отдельных пациентов, каждый сектор представляет процент плазмобластов, экспрессирующих реаранжировку отличающихся последовательностей V(D)J тяжелой цепи.
[00109] Фиг. 8. Группировка последовательностей тяжелой цепи V(D)J иммуноглобулина от субъектов-людей, демонстрирующая клональные семейства и клональные подсемейства. Наборы данных последовательностей тяжелой цепи иммуноглобулина, созданные в описанных в фиг. 7 исследованиях, подвергали иерархической группировке с использованием программы Clustal. Иерархической группировкой получали эволюционные деревья, представляющие реакцию антител у каждого отдельного человека.
[00110] Фиг. 9. Схематическая иллюстрация RT и PCR с добавлением ID образцов и ID планшетов к любому ампликону и дальнейшая применимость.
Образцы индивидуумов, содержащие либо отдельные клетки, либо множество клеток, отдельно обратно транскрибировали в лунки. Обратная транскрипция добавляла ID образца и 5' универсальный праймерный участок ко всем 1-ым нитям кДНК, как описывалось ранее (а). кДНК из всех лунок планшета объединяли и подвергали 2 циклам PCR. В 1-ой PCR использовали Fw Short Primer 1, Fw Long Primer 1 в качестве прямых праймеров и добавляли 454 Titanium Primer А для секвенирования на платформе 454, а также ID планшета к 5'-концу последовательности. Fw Short Primer 1 характеризовался Tm, подобной таковой у праймера GSP1, и был внесен для небольшого повышения эффективности PCR. Каждый праймер GSP1 характеризуется специфичной для гена последовательностью и может специфично амплифицировать этот ген. Показаны последовательности для праймеров. Следует отметить, что независимо от того, какой ген амплифицируется, прямые праймеры остаются константными (b). Вторая PCR являлась гнездовой PCR. Fw Primer 2 представлял собой прямой праймер, а обратными праймерами являлись Long GSP2 Primer и Rv Primer 2. Long GSP2 являлся специфичным для гена и амплифицировал только определенный ген. Также добавлялся 454 Titanium Primer В для секвенирования на платформе 454 и ID планшета на 3'-конец ампликона. RV Primer 2 характеризовался Tm, подобной таковой у Fw Primer 2, и был внесен для небольшого повышения эффективности PCR. Показаны последовательности для праймеров. После RT и 2 PCR ампликоны из всех планшетов объединяли и секвенировали на платформе 454. Комбинация ID планшетов и ID образца позволяла идентифицировать последовательности, которые походят из одного и того же образца. Это позволяло сравнивать последовательности множества образцов. Последовательности одного и того же происхождения также можно было экспрессировать в парах для получения точного белка из оригинальной клетки, такого как Т-клеточный рецептор, и других изотипов Ig, таких как IgM, IgE и IgA (с).
[00111] Фиг. 10. Специфичные для гена праймеры для обратной транскрипции (RT-GSP) тяжелой и легкой цепей иммуноглобулина. RT-GSP использовали вместо oligo(dT) в качестве праймеров при обратной транскрипции генов легкой и тяжелой цепей. Затем кДНК амплифицировали с помощью PCR и визуализировали на агарозном геле. Праймеры RT-GSP представляли собой RT-GSP IgKC_v3(a), IgLC_v5, IgLC_v6, IgLC_v7 и IgLC_v8 в дорожках 1-4, соответственно, (b), IgHGC_v10, IgHGC_v11, IgHGC_vl3 и IgGC_vl5 в дорожках 1-4, соответственно, (с) и IgHGC_v16 (d). КС, LC и GC в названиях праймеров показывают, что праймер является специфичным для цепи каппа, цепи лямбда и тяжелой цепи гамма, соответственно. Белые полоски на фотографиях геля показывают, где нехарактерные дорожки были обрезаны.
[00112] Фиг. 11. Последовательности адаптерного участка. РНК обратно транскрибировали с олигонуклеотидами, содержащими универсальный праймерный участок и адаптерный участок на 3'-концевой области. Затем кДНК амплифицировали с использованием последовательности универсального праймерного участка в качестве прямого праймера, а специфичные для гена последовательности в качестве обратных праймеров. Продукты амплификации визуализировали на агарозном геле. Адаптерный участок состоял из G (a), GGGGG и rGrGrG в дорожках 1 и 2, соответственно, (b). rG показывает нуклеотиды РНК вместо нуклеотидов ДНК.
[00113] Фиг. 12. Последовательности универсальных праймеров. РНК обратно транскрибировали с олигонуклеотидами, содержащими последовательность универсального праймера и адаптерный участок на 3'-конце. Затем кДНК амплифицировали с помощью PCR с использованием прямого праймера, комплементарного универсальному праймерному участку, и обратного праймера, комплементарного специфичной для гена последовательности. Univ_seq_4 (а), univ_seq_5 (b) и univ_seq_f (с). Вертикальные белые полоски на фотографиях геля показывают, где нехарактерные дорожки были обрезаны. Другие дорожки принадлежат одной и той же фотографии геля.
[00114] Фиг. 13. Специфичные для гена последовательности праймеров для 1-ой PCR-реакции. Специфичные для гена обратные праймеры использовали при амплификации последовательностей в первой PCR-реакции. Продукты либо 1-ой PCR-реакции, либо последующей 2-ой гнездовой PCR прогоняли и визуализировали на агарозном геле. Используемыми обратными праймерами являлись IgKC_v4, IgLC_v5, IgHGC_vl3 на дорожках 1-3, соответственно, (a), K_GSPl, L_GSP1, G_GSP1 на дорожках 1-3, соответственно, (b), K_GSPlc, L_GSPlc на дорожках 1-2, соответственно, (с), G_GSPl (d), L_GSPld, G_GSPlg на дорожках 1-2, соответственно, (е), G_GSPlh, G_GSPlk, L_GSPlf, L_GSPlg на дорожках 1-4, соответственно, (f), G_GSPld (g) L_GSPlh-o на дорожках 1-8, соответственно, (h), G_GSPlm-q и G_GSPlt на дорожках 1-6, соответственно, (i). К, L и G в названиях праймеров показывают, что праймеры являются специфичными для константных участков каппа, лямбда и гамма иммуноглобулина, соответственно. Каждый гель стартует с маркера дорожки слева, за которой следуют дорожки образца. Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны.
[00115] Фиг. 14. Специфичные для гена последовательности для 2-ой PCR-реакции. Специфичные для гена обратные праймеры использовали при амплификации последовательностей во 2-ой PCR-реакции. Продукты PCR прогоняли и визуализировали на агарозном геле. Используемыми обратными праймерами являлись K_GSP2, L_GSP2, G_GSP2 в дорожках 1-3, соответственно, (a), K_GSP2v2a, K_GSP2v2b, L_GSP2v2 в дорожках 1-3, соответственно, (b), K_GSP2v2c, K_GSP2v2c, G_GSP2v2cl, G_GSP2v2c2 в дорожках 1-4, соответственно, (с), K_GSP2v2d-f в дорожках 1-3, соответственно, (d), K_GSP2v2g, L_GSP2v2d и G_GSP2b в дорожках 1-3, соответственно, (е). К, L и G в названиях праймеров показывают, что праймеры являются специфичными для константных участков каппа, лямбда и гамма иммуноглобулина, соответственно. Каждый гель стартует с маркера дорожки слева, за которой следуют дорожки образца. Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны.
[00116] Фиг. 15. Потенциальные местоположения штрих-кодированных последовательностей для идентификации связанной пары полинуклеотидных последовательностей. На схеме иллюстрируется физическое связывание двух сегментов нуклеиновой кислоты, А и В (например, двух кДНК). Штрих-код (ВС) добавляют на любой из концов, или на оба конца, или куда-либо в соединение последовательности А и В. Согласно одному варианту осуществления А и В представляют последовательности тяжелой и легкой цепей иммуноглобулина.
[00117] Фиг. 16. Различные типы перекрывающих/удлиненных хвостов. Жирная линия соответствует специфичной для гена последовательности, и тонкая линия соответствует перекрывающему хвосту. Как показано, перекрывание может осуществляться исключительно благодаря перекрыванию праймерной последовательности или еще благодаря частичному или полному перекрыванию специфичной для гена последовательности. Как показано, перекрывание также может содержать штрих-кодированную последовательность. На структурах I, II, и III показаны потенциальные местоположения перекрываний.
[00118] Фиг. 17. Схематическое представление внешнего добавления штрих-кода к связанной паре легкой и тяжелой цепей антитела. Показаны продукты реакции обратной транскрипции. Специфичный для гена LC праймер PCR содержит штрих-код, сайт секвенирующего праймера и сайт рестрикции (REI) для обеспечения добавления этих элементов к 3'-концу получившегося продукта PCR. Показаны специфичные для LC и НС праймеры с перекрываниями/удлинениями и кодирование сайта рестрикции (RE3). Также показаны специфичный для НС обратный праймер, содержащий сайт секвенирующего праймера и сайт рестрикции (RE2). Амплификация дает в результате нуклеиновую кислоту со связанной структурой, показанной со штрих-кодом на одном конце.
[00119] Фиг. 18. Схематическое представление внутреннего добавления штрих-кода к связанной паре легкой и тяжелой цепей антитела. Показан способ использования адаптеров, содержащих удлиняющее перекрывание и штрих-кодированные последовательности, для соединения с кДНК, получившимися из обратной транскрипции mRNA с использованием праймеров oligo(dT). В показанном способе используется преимущество 3'-присоединяющей и переключающей матрицу активностей обратной транскриптазы для добавления перекрывающих/удлиненных последовательностей к кДНК, подлежащим присоединению. В этом примере один из адаптеров добавляет и штрих-код, и перекрывающую/удлиненную последовательность к одной из кДНК, подлежащих присоединению, тогда как к другой кДНК, подлежащей присоединению, добавляется только перекрывающая/удлиненная последовательность. После амплификации образуется связанная структура, несущая одну штрих-кодированную последовательность между связанными кДНК.
[00120] Фиг. 19. Схематическое представление добавления двух внутренних штрих-кодов к связанной паре легкой и тяжелой цепей антитела с использованием перекрывающих/удлиненных праймеров универсальной последовательности. Показан способ использования адаптеров, содержащих и универсальную последовательность, и штрих-код для соединения с кДНК, получившимися от обратной транскрипции mRNA с использованием праймеров oligo(dT). В этом примере праймеры PCR для универсальной последовательности добавляют перекрывающую/удлиненную последовательность к каждой из кДНК, подлежащих присоединению. После амплификации согласно показанной схеме образуется связанная структура, несущая два штрих-кода между связанными кДНК.
[00121] Фиг. 20. Схематическое представление добавления двух внутренних штрих-кодов к связанной паре легкой и тяжелой цепей антитела с использованием перекрывающих/удлиненных адаптеров. Показан способ использования адаптеров, содержащих и штрих-код и перекрывающую/удлиненную последовательность для связывания с кДНК, получившимися из обратной транскрипции mRNA с использованием специфичных для гена праймеров (GSP). В этом примере перекрывающие/удлиненные последовательности в адаптерах, добавленных к каждой из кДНК, обеспечивают присоединение кДНК путем отжига. После амплификации согласно показанной схеме образуется связанная структура, несущая два штрих-кода между связанными кДНК.
[00122] Фиг. 21. Применение штрих-кодированных GSP при обратной транскрипции в комбинации с переключающими матрицу добавленными адаптерами. RT выполняли с РНК всех РВМС и переключающим матрицу oligo univ_seq_2 и IgKC_v3 GSP (дорожки 1-2) и IgLC_v5 GSP (дорожки 3-4) с добавленной 5'-фланкирующей последовательностью, из которых первая пара представляет собой Fixed_PCR3 последовательность, а последние 8 пар оснований представляют собой штрих-код. Использовали аликвоту реакционной смеси RT-реакции в последующей PCR-реакции либо с праймером 5'-Vk (дорожка 1), либо с праймером Vl (дорожка 3), либо с Univ_seq_2 (дорожки 2 и 4) в качестве 5'-праймера и Fixed_PCR3 в качестве 3'-праймера. Продукты PCR дорожек 2 и 4 после выполнения цикла выглядели как пятно, показывая, что штрих-кодированные GSP не являются специфичными в реакции RT и неприемлемы для применения с переключающими матрицу добавленными адаптерами.
[00123] Фиг. 22. Схема выполнения операций для проточной цитометрии, сортирующей отдельные клетки в 96-луночные планшеты. Плазмобласты характеризовали как CD19+CD20-CD27+CD38++. Отдельные РВМС сначала гейтировали по их профилю FSC и SSC (не показано). Затем гейтировали живые CD19+ В-клетки (левая панель), а далее сужали до CD20- В-клеток (2-ая панель слева) и очищали CD27+CD38++ клеток. Исходя из этого, плазмобласты IgG+ определяли как IgA- и IgM-, поскольку плазмобласты IgG+ не экспрессируют IgG клеточной поверхности. Эта популяция представляла собой отсортированную в 96-луночные планшеты отдельную клетку.
[00124] Фиг. 23. Плазмобласты, присутствующие у подвергшихся иммунологической провокации людей. Плазмобласты составляли 0,15% В-клеток периферической крови типичного здорового донора и варьировали от 0,5% до 16,4% у подвергшихся иммунологическим провокациям людей, в том числе инфекциям (инфекциям Staphylococcus aureus и Clostridium difficile), злокачественному заболеванию (у больного с метастатической меланомой, непрогрессирующей в течение >4 лет, благодаря лечению ипилимумабом, и у больного с метастатической аденокарциномой легкого, непрогрессирующей в течение длительного времени >3 лет после получения химиотерапии) и вакцинации (получение вакцины против вируса гриппа). Показано, что плазмобласты повышены у ряда субъектов и получаемы от таковых, поддерживающих представляющие интерес иммунные реакции для выделения отдельных плазмобластов при высокопроизводительном секвенировании репертуара антител для характеристики активного гуморального ответа.
[00125] Фиг. 24. Экспрессированные рекомбинантные антитела, секретированные в течение 2-3 недель при временных трансфекциях. Как показано на фиг. 2, спаренную кДНК тяжелой и легкой цепей иммуноглобулина клонировали с помощью PCR и совместно трансфицировали в клетки 293Т в 48-луночном масштабе. Супернатанты собирали через день в течение 18 дней. Выполняли ELISA по антителам против человеческого IgG для определения количества секретированных антител в собранных супернатантах, а концентрацию антител в супернатантах панели отдельных совместных трансфектантов наносили на график. Секреция, как правило, достигала максимума на день 9 и постепенно понижалась на день 18.
[00126] Фиг. 25. Спаренные тяжелая цепь (НС) и легкая цепь (LC) антитела от вакцинированного против гриппа человека, проявляющего вариацию по определяющим комплементарность участкам (CDR). Фиг. 25А: Частичная древовидная диаграмма антител против гриппа. После спаривания тяжелой и легкой цепей производили множественное выравнивание последовательностей для тяжелых цепей и производили другое множественное выравнивание последовательностей для легких цепей. Оба множественных выравнивания последовательностей производили с использованием Clustalw2 2.1 с параметрами по умолчанию. Два выравнивания соединяли вместе и использовали для построения древа в CLC Sequence Viewer версии 6.5.2 с использованием метода объединения соседних пар со 100 «бутстрепными» повторностями. Фиг. 25В: CDR тяжелой цепи для клонального семейства от вакцинированного против гриппа пациента. Идентификаторы на фиг. соответствуют следующим названиям последовательностей в перечне последовательностей: 51.А 11.1 = NA.51.11.A11.1.454.heavy.3.nb-aa, 49.А08.1 = NA.49.8.A08.1.454.heavy.3.nb-aa, 51.D07.1 является аминокислотной последовательностью, полученной путем считывания NA.51.40.D07.1.454.heavy.3.nb в рамке 1. Фиг. 25С: CDR легкой цепи для клонального семейства от вакцинированного против гриппа пациента. Идентификаторы на фиг. соответствуют следующим названиям последовательностей в перечне последовательностей: 51.A11.1 = NA.51.11.A11.1.454.1ight.4.nb-aa, 49.А08.1 = NA.49.8.A08.1.454.1ight.4.nb-aa, 51.D07.1 = NA.51.40.D07.1.454.1ight.4.zerom50-aa.
[00127] Фиг. 26. Рекомбинантные антитела против вируса гриппа, связанные с вакциной против вируса гриппа Fluzone. Выполняли анализ эволюционного древа (фиг. 8) набора данных тяжелой и легкой цепей репертуара антител, полученных для вакцинированного против гриппа человека и описанных на фиг. 7, для отбора типичных антител из идентифицированных клональных семейств. Тяжелую и легкую цепи для отобранных антител, представляющих оба клональных семейства, а также некоторые синглетные ветви, клонировали с помощью PCR и совместно трансфицировали в клетки 293 Τ (как показано на фиг. 2) и собирали супернатанты из трансфектантов, как описано на фиг. 24. Затем рекомбинантные антитела тестировали на реактивность по отношению к вакцине против вируса гриппа Fluzone (Sanofi) с помощью ELISA с нанесенной на планшет для ELISA вакциной Fluzone. Рекомбинантные антитела против вируса гриппа инкубировали на планшете для ELISA при 100 нг/мл и для выявления связывания антитела использовали конъюгированное с пероксидазой хрена (HRP) антитело против человеческого IgG. Обеспечивали протекание реакции с субстратом ТМВ в течение 30 минут до остановки ее кислотой. Считывание регистрировали как поглощение при 450 нм, поскольку никакие стандарты не были доступны. Множество рекомбинантных антител, представляющих идентифицированные клональные семейства, связывались с вакциной против вируса гриппа, тогда как типичные рекомбинантные антитела других клональных семейств и «тупики» не связывались с вакциной против гриппа.
[00128] Фиг. 27. Типичные рекомбинантные антитела против вируса гриппа клональных семейств, связывающие гемагглютинины вируса гриппа с пикомолярными аффинностями. Типичные рекомбинантные антитела против вируса гриппа клональных семейств от вакцинированного Fluzone человека (фиг. 7), которые связываются с вакциной против гриппа в анализе ELISA (фиг. 26), тестировали с использованием устройства для поверхностного плазмонного резонанса (SPR) (ProteOn System, Bio-Rad Laboratories) для определения их аффинностей связывания гемагглютинина вируса гриппа (штаммов H3N2 A/Perth/16/2009 и H1N1 A/California/07/2009, присутствующих в вакцине). Рекомбинантные антитела против вируса гриппа связывали с поверхностью с использованием химического реактива EDAC-NHS, а гемагглютинины H3N2 Perth и H1N1 California независимо тестировали как лиганды с гемагглютинином в качестве определяемого анализом вещества. В колонке Ка отмечены скорости ассоциации, в колонке Kd отмечены скорости диссоциации, а в КD - константа диссоциации. Множество рекомбинантных антител связывали гемагглютинин либо H3N2 Perth, либо H1N1 California с пикомолярными аффинностями.
[00129] Фиг. 28. Рекомбинантные антитела против вируса гриппа, нейтрализующие инфективность вируса гриппа в анализах микронейтрализации. Шесть антител, проявляющих реактивность в ELISA по Fluzone (фиг. 26) посылали в контрактную исследовательскую организацию (CRO) Virapur, LLC, (San Diego, CA) для тестирования в анализе микронейтрализации с использованием штамма H1N1 California/07/2009 вируса гриппа и штамма H3N2 A/Perth/16/2009 вируса гриппа - 2 из трех штаммов вируса гриппа в вакцине Fluzone. Из 6 рекомбинантных антител 5 нейтрализовали вирус гриппа в анализе микронейтрализации, предотвращая инфективность при уровнях микрограмм на миллилитр и возможных концентрациях менее микрограмма на миллилитр. Рекомбинантное антитело F21 нейтрализовало H3N2 Perth, и хотя оно связывало Fluzone в анализе ELISA, но не показывало связывание в анализе SPR (фиг. 27), вероятно из-за того, что используемые концентрации определяемого анализом гемагглютинина были слишком низкими для подлежащего выявлению связывания.
[00130] Фиг. 29. Рекомбинантные антитела против Staph. aureus, связанные с фиксированным S. aureus с помощью проточной цитометрии. Анализ эволюционного древа (фиг. 8) набора данных тяжелой и легкой цепей репертуара антител, полученных от вакцинированного против гриппа человека с контролированным (без антибиотиков) хроническим вызванным Staph. aureus остеомиелитом (как описано на фиг. 7), обеспечивал отбор типичных антител идентифицированных клональных семейств. Тяжелую и легкую цепи для отобранных антител, представляющих оба клональных семейства, а также некоторые синглетные ветви, клонировали с помощью PCR и совместно трансфицировали в клетки 293Т (как показано на фиг. 2) и собирали супернатанты из трансфектантов, как описано на фиг. 24. Затем рекомбинантные антитела против Staph. aureus тестировали на реактивность по отношению к фиксированному S. aureus. В качестве вторичного антитела использовали конъюгированное с FITC антитело мыши против человеческого IgG и образцы анализировали на BD LSR II или LSR Fortessa. Показано процентное отношение положительного окрашивания с использованием 2 антител против вируса гриппа в качестве отрицательных контролей. Антитело 2° отдельно не приводило к связыванию сверх фонового значения, поскольку белок А слабо связывается с мышиным IgGl, который является изотипом антитела 2°. Наблюдаемое окрашивание сверх фонового значения объясняется связыванием рекомбинантных антител против Staph. aureus до небольшого процентного отношения штамма Wood S. aureus, который экспрессирует белок А (а). Показаны графики проточной цитометрии для 2 положительно связывающих антител против Staph. aureus, S6 и Sil, вместе с совпадающими по изотипу антителами против вируса гриппа в качестве отрицательного контроля (b). Уровень связывания антител против Staph. aureus с S. aureus был пропорциональным количеству используемого антитела. Темная сплошная линия представляет концентрацию антител 10 мкг/мл, темная пунктирная линия - 5 мкг/мл, а серая пунктирная линия - 1 мкг/мл (с).
[00131] Фиг. 30. Антитела против Staph. Aureus, снижающие число колониеобразующих единиц S. aureus. Рекомбинантные антитела против Staph. aureus инкубировали с S. aureus в комбинации с сывороткой крови крольчонка в качестве источника комплемента перед серийным разбавлением и культивированием в течение ночи в планшетах с кровяным агаром, дополненным 5% триптиказо-соевого агара (TSA). Затем подсчитывали и наносили на график колониеобразующие единицы (CFU). Два рекомбинантных антитела против Staph. aureus (Ab-a и Ab-b) приводили к уничтожению Staph. Aureus и, таким образом, снижали число КОЕ/мл.
[00132] Фиг. 31. Идентификация антигена S. aureus направляет рекомбинантные антитела против Staph. aureus, полученные от человека, поддерживающего эффективную иммунную реакцию против хронической вызванной Staph. aureus инфекции. Получали белковый лизат из клинического изолята Staph. aureus. Типичные рекомбинантные антитела против Staph. aureus клональных семейств, идентифицированных в репертуаре антител от человека, поддерживающего иммунную реакцию, которые предотвращали развитие инфекции хронического вызванного Staph. aureus остеомиелита, использовали для иммунопреципитации белков из клинического изолята Staph. aureus Spa-. Иммунопреципитаты отделяли с помощью SDS-PAGE, идентифицированные полосы отрезали и использовали масс-спектрометрию (масс-спектрометр с ионной ловушкой Agilent XCT-Plus) для идентификации иммунопреципитированных белков, которые представлены на фиг.
[00133] Фиг. 32. Получение антител против аденокарциномы легкого от человека с метастатической аденокарциномой легкого, непрогрессирующей в течение длительного времени. У человека с метастатической аденокарциномой легкого, ставшей непрогрессирующей в течение длительного времени после химиотерапии, проявлялись устойчиво повышенные плазмобласты в крови, что говорило об устойчиво активированной иммунной реакции (фиг. 7). Плазмобласты периферической крови пациента отсортировывали, секвенировали репертуар антител, а типичные антитела клональных семейств (фиг. 8) клонировали и рекомбинантно экспрессировали. Одно из экспрессированных рекомбинантных антител, которое являлось типичным для одного из идентифицированных клональных семейств, связывалось с выделенной аденокарциномой легкого при иммуногистохимических окрашиваниях. Затем тканевые наборы использовали для дальнейшей характеристики реактивности этого антитела. Тканевые наборы, содержащие множество выделенных аденокарцином легкого, плоскоклеточную карциному и ткань здорового легкого блокировали в течение ночи с 100 мкг/мл F(ab) козьего антитела против человеческого антитела. Предметные стекла окрашивали антителами против аденокарциномы легкого антител или антителом против вируса гриппа в качестве отрицательного контроля и визуализировали с помощью Vector Red. Предметные стекла докрашивали гематоксилином. Синий цвет гематоксилина удаляли с использованием Photoshop так, что на изображении как более темно серые выделялись только ядра и окрашивание Vector Red (красным). Это рекомбинантное антитело связывалось с 4 из 5 тестированных образцов выделенной ткани аденокарциномы легкого (содержащихся в тканевых наборах), но не связывались с плоскоклеточной карциномой легкого или с тканью здорового легкого.
[00134] Фиг. 33. Идентифицированное антитело против аденокарциномы легкого (фиг. 32), связывающееся с поверхностью клеток линии аденокарциномы легкого. Рекомбинантное антитело против аденокарциномы легкого (фиг. 32) прочно окрашивало поверхность клеток линии аденокарциномы легкого H1650, но только проявляло низкий уровень окрашивания клеток линии почечного эпителия и плоскоклеточной опухоли легкого. Это антитело против аденокарциномы легкого не связывалось со второй клеточной линией аденокарциномы легкого (Н2009), что согласовывалось с наблюдением авторов настоящего изобретения того, что это антитело связывалось с 4 из 5 тестированных с помощью иммуногистохимии образцов выделенной ткани аденокарциномы легкого (фиг. 32).
[00135] Фиг. 34. Получение антител против ревматоидного фактора от больных с ревматоидным артритом (RA). Типичные рекомбинантные антитела клональных семейств, идентифицированных на эволюционных деревьях репертуаров антител, полученные от людей с RA (фиг. 8), отбирали, клонировали и рекомбинантно экспрессировали. Полученные от больных с RA рекомбинантные антитела использовали в качестве первичного антитела в прямом ELISA, а антитела против человеческого IgG, конъюгированные с HRP, использовали в качестве вторичного антитела и связывание визуализировали с субстратом ТМВ. Рекомбинантные антитела RA2 и RA3 проявляли реактивность и, таким образом, представляли собой антитела против ревматоидного фактора.
[00136] Фиг. 35. Получение антител против ССР и антител против гистона 2А от страдающих RA больных. Дополнительные рекомбинантные антитела, полученные от страдающих RA больных с активным заболеванием, характеризовали с использованием ELISA по гистону 2А и ELISA по циклическому цитруллинированному пептиду (ССР) (с использованием набора ССР2 ELISA [Axis Shield]). Использовали рекомбинантные антитела при 125 мкг/мл. На панели (а) представлены результаты ELISA по гистону 2А и множественных рекомбинантных антител, связанных с гистоном 2А. На панели (b) представлены результаты ELISA по ССР2 и некоторые рекомбинантные антитела, проявляющие положительную реактивность. ELISA по антителу против ССР2 включал сероотрицательные и 2 сероположительных контроля. Для обоих анализов поглощение регистрировали как считывание. Значения поглощения, превышающие фоновое значение (пунктирная линия), рассматривали как положительные.
[00137] Фиг. 36. Подтверждение независимого эксперимента, демонстрирующего получение антител против гистона 2А страдающих RA больных с активным заболеванием. Рекомбинантные антитела, полученные от страдающих RA больных по эволюционным деревьям (фиг. 8 и фиг. 35), дополнительно тестировали в анализе ELISA по гистону 2А. Антитела использовали при 30 мкг/мл, концентрации в 4 раза ниже используемой на фиг. 35. Поглощение регистрировали как считывание. Значения поглощения, превышающие фоновое значение, рассматривали как положительные.
[00138] Фиг. 37. Идентификация антител против гистона и антител против цитруллинированного белка с использованием наборов RA антигенов.
Антитела, полученные от страдающих RA больных, использовали для исследования набора RA антигенов, содержащего спектр нативных и цитруллинированных белков и пептидов. После инкубации с Су-3-меченным вторичным антителом против человеческого IgG связывание рекомбинантного антитела определяли количественно путем сканирования сканером микрочипов GenePix Axon Instruments. Реактивности регистрировали в виде «тепловой карты». Рекомбинантные антитела, полученные от страдающих RA пациентов, связывались с некоторыми отличающимися цитруллинированными или нативными антигенами.
[00139] Фиг. 38. Секвенирование по технологии Pacific Biosciences, обеспечивающее полноразмерные риды секвенирования ампликона тяжелой цепи IgG. Ампликоны тяжелой цепи IgG из планшета 44 обеспечивали для Pacific Biosciences для секвенирования SMRT. Показан ряд ридов кольцевой консенсусной последовательности (CCS) со штрих-кодами, соответствующими выбранным лункам.
[00140] Фиг. 39. Применение альтернативных маркеров клеточной поверхности и других клеточных признаков для идентификации плазмобластов крови. Плазмобласты можно идентифицировать и отсортировывать путем применения ряда маркеров клеточной поверхности и/или клеточных признаков. На панели (а) демонстрируется, что плазмобласты проявляют более высокое прямое светорассеяние (FSC), чем находящейся в покое В-клетки. Плазмобласты идентифицировали на основе CD19+CD20-CD27+CD38hi окрашивания, и эти результаты демонстрируют, что В-клетки (серые) являются более мелкими, чем плазмобласты (черные). На панели (b) демонстрируется, что применение окрашивания против CD19, объединенного с FSC, идентифицирует популяцию В-клеток, которая содержит 72% плазмобластов. На панели (с) демонстрируется, что для популяции CD19+ В-клеток (клетки предварительно гейтировали как CD 19 положительные) боковое светорассеяние (SSC) и FSC можно использовать для идентификации популяции В-клеток, которая содержит 37% плазмобластов. На панелях (d-f) представлены некоторые подходы для идентификации плазмобластов в популяции CD19+ В-клеток. Гейтирование по FSChi клеткам дает 37% чистоту плазмобластов (с). Гейтирование по FSChiCD20- клеткам дает 71% чистоту плазмобластов (d). Гейтирование по FSChiCD38+ клеткам дает 80% чистоту плазмобластов (е). Гейтирование по FSChiCD27+ клеткам дает 44% чистоту плазмобластов (f).
[00141] Фиг. 40. Человеческие бластные В-клетки (плазмобласты) в среднем являются более крупными, чем находящиеся в покое В-клетки, но более мелкими, чем моноциты. Синглетные моноциты, В-клетки и плазмобласты гейтировали и сравнивали по параметрам бокового и прямого светорассеяния. Моноциты определяли по их характерному профилю FSC и SSC и как CD19-CD3-. В-клетки определяли как CD19+CD20+. Плазмобласты определяли как CD19+CD20-CD27+CD38++. Клетки показаны на осях FSC-A (площадь прямого светорассеяния) и SSC-A (площадь бокового светорассеяния) (а). Клетки показаны на осях FSC-W (ширина прямого светорассеяния) и SSC-W (ширина бокового светорассеяния) (b). Среднее FSC-A, SSC-A, FSC-W, SSC-W плазмобластов делили на таковые находящихся в покое В-клеток или моноцитов с получением отношения, которое представляет зависимость размеров типов клеток (с). Среднее FSC-A, SSC-A, FSC-W, SSC-W 20-го процентиля плазмобластов делили на таковой среднего находящихся в покое В-клеток или моноцитов с получением отношения, которое представляет зависимость размеров типов клеток, при этом по меньшей мере 80% плазмобластов являются более крупными, чем при отношении (d). Планки погрешностей показывают 95% доверительный интервал.
[00142] Фиг. 41. Сравнение размеров человеческих плазмобластов и находящихся в покое В-клеток с помощью микроскопии. Плазмобласты и находящейся в покое В-клетки отсортировывали как CD19+CD20-CD27+CD38++ и CD19+CD20+, соответственно. Затем клетки визуализировали с использованием микроскопа Olympus при 200 х. Площадь клетки измеряли с использованием ImageJ, диаметр определяли с использованием уравнения: площадь = π х r2, в котором диаметр = 2 х радиус, а объем определяли уравнением: 4/3 х πτ3. Планки погрешностей показывают интерквартильную широту. Отсечение >8 мкМ или >50 мкМ2 или >268 мкМ3 будет включать 96% плазмобластов и исключать 92% находящихся в покое В-клеток.
[00143] Фиг. 42. Superscript III, обладающий переключающей матрицу активностью при температурах 50°С и ниже. Обратную транскрипцию (RT) выполняли в течение 90 минут с использованием показанных выше дорожек температур с использованием адаптера, добавляющего к концу rGrGrG, и 1 цикл PCR выполняли с использованием GAPDH в качестве 3'-праймера (последовательность ATGGTTCACACCCATGACG). Как видно, при 55°С не наблюдалось получение адаптером переключающей матрицу активности, но переключающая матрицу активность повышается от минимальной при 50°С до наивысшей при 42°С, самой низкой тестируемой температуре, как показано с помощью самой яркой полоски при -450 пар оснований. Маркером является маркер из 100 пар оснований. Superscript III представляет собой обратную транскриптазу MMLV, которая характеризуется специфичными мутациями, приводящими к потере активности РНКазы H, а также характеризуется мутациями, обеспечивающими повышение термостойкости полимеразного домена, и характеризуется временем полужизни 220 минут при температуре RT 50°С. Другие ферменты MMLV Н-, которые были сконструированы для более высокой термостойкости, как и ожидалось, проявляли подобную активность.
[00144] Фиг. 43. Добавленные праймеры для человеческих константных участков каппа, лямбда и гамма. Эти праймеры использовали для 1 -ой PCR, а затем 2-ую PCR выполняли с использованием праймеров из таблицы 1, продукты PCR разделяли на 2% агарозном геле и получали изображение. Используемыми для 1-ой PCR праймерами являются каппа GSP1, каппа GSPle, каппа GSPlf, лямбда GSP1, лямбда GSPlx и лямбда GSPly, соответственно. Последовательности представлены в таблице 10. Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны.
[00145] Фиг. 44. Дополнительные праймеры для других человеческих константных участков и генов. Выполняли 1-ую и 2-ую PCR, продукты прогоняли на 2% агарозном геле и визуализировали. Дорожки представляют собой слева: маркер, мю, константные участки альфа, TCR альфа (а) и маркер, TCR бета (b). Используемые праймеры и последовательности представлены в таблице 10. Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны.
[00146] Фиг. 45. Дополнительные праймеры для генов мыши. Выполнение 1-ой и 2-ой PCR, прогон продуктов на 2% агарозном геле и визуализация. Дорожки представляют собой слева: маркер, легкие цепи каппа, лямбда, лямбда, лямбда, лямбда и тяжелая цепь мю. 4 Дорожки лямбда характеризуются следующей комбинацией используемых праймеров: mouselambdaGSPla с mouse_lambda_GSP2a, mouselambdaGSPla с mouse_lambda_GSP2b, mouselambdaGSPlb с mouse_lambda_GSP2a и mouselambdaGSPlb с mouse_lambda_GSP2a (а). Маркер и тяжелая цепь альфа (b). Тяжелые цепи гамма 1, 2а, 2с со 2-ой PCR с использованием mo_gl2_GSP2d и mo_gl2_GSP2e, соответственно, маркер (с). Маркер, тяжелая цепь гамма 3 со 2-ой PCR с использованием mo_g3_GSP2d, mo_g3_GSP2e, соответственно, за которой следует тяжелая цепь гамма 2b со 2-ой PCR с использованием mo_g2b_GSP2d, mo_g2b_GSP2e, соответственно (d). Маркер, TCR альфа (е). Маркер, TCR бета (f). Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны.
[00147] Фиг. 46. Опосредованное антителом против S. aureus уничтожение S. aureus нейтрофильной клеточной линией HL-60. Различные рекомбинантные антитела против S. aureus (staph 1, staph 4, staph 6, staph 7, staph 9, staph 12) инкубировали при 4°C с S. aureus в течение 30 минут, после чего несвязанное антитело вымывали, a S. aureus инкубировали с активированными клетками HL-60 и комплементом крольчонка в течение 45 минут при 37°С. Затем клетки дважды промывали и внеклеточные бактерии серийно высевали на чашки с 5% кровяным агаром TSA, инкубировали в течение ночи и подсчитывали колониеобразующие единицы (КОЕ). Рекомбинантные антитела staph 6, stepha 9 и staph 12 индуцировали более 20% уничтожение S. aureus.
Подробное описание изобретения
Композиции
Полинуклеотиды
[00148] Некоторые аспекты относятся к композиции, которая может содержать полинуклеотид. Термин «полинуклеотид(ы)» относится к нуклеиновым кислотам, таким как молекулы ДНК и молекулы РНК, а также их аналоги (например, ДНК или РНК, полученные с использованием аналогов нуклеотида или с использованием химии нуклеиновых кислот). Если нужно, полинуклеотиды могут быть получены синтетически, например, с использованием признанной в уровне техники химии нуклеиновых кислот, или ферментативно с использованием, например, полимеразы, и, если желательно, могут быть модифицированы. Типичные модификации включают метилирование, биотинилирование и другие известные в уровне техники модификации. Кроме того, полинуклеотид может быть однонитевым или двухнитевым и, если желательно, связанным с выявляемой частью. Некоторые аспекты относятся к полинуклеотиду, который может содержать гибридные молекулы, например, содержащие ДНК и РНК.
[00149] Каждый символ «G», «С», «А», «Т» и «U», как правило, означает нуклеотид, который содержит гуанин, цитозин, аденин, тимидин и урацил в качестве основания, соответственно. Однако следует понимать, что термин «рибонуклеотид» или «нуклеотид» также может относиться к модифицированному нуклеотиду или к замещающей части. Специалисту в данной области будет известно, что гуанин, цитозин, аденин и урацил могут быть заменены на другие части без существенного изменения свойств спаривания оснований олигонуклеотида, содержащего несущий такую замещающую часть нуклеотид. Например, без ограничения содержащий инозин в качестве его основания нуклеотид может спариваться основаниями с содержащими аденин, цитозин или урацил нуклеотидами. Следовательно, содержащие урацил, гуанин или аденин нуклеотиды могут быть замещены в нуклеотидных последовательностях нуклеотидом, содержащим, например, инозин. В другом примере аденин и цитозин где-либо в олигонуклеотиде могут быть заменены гуанином и урацилом, соответственно, с образованием неоднозначного спаривания оснований G-U с целевой mRNA. Последовательности, содержащие такие замещающие части, являются приемлемыми для описанных в настоящем документе композиций и способов.
[00150] Используемый в настоящем документе, если не указано иное, термин «комплементарный» при использовании описании первой нуклеотидной последовательности по отношению ко второй нуклеотидной последовательности относится к способности полинуклеотида, содержащего первую нуклеотидную последовательность, к гибридизации и образованию двухцепочечной структуры при определенных состояниях с полинуклеотидом, содержащим вторую нуклеотидную последовательность, как будет понятно специалисту в данной области. Такие условия, например, могут быть жесткими условиями, при этом жесткие условия могут включать 400 мМ NaCl, 40 мМ PIPES, рН 6,4, 1 мМ EDTA, 50°С или 70°С в течение 12-16 часов с последующей промывкой. Можно применять другие условия, такие как физиологически соответствующие условия, которые могут наблюдаться внутри организма. Специалист в данной области сможет определить набор условий, наиболее подходящих для теста комплементарности двух последовательностей в соответствии с конечным применением гибридизированных нуклеотидов.
[00151] Комплементарные последовательности включают спаривание оснований участка полинуклеотида, содержащего первую нуклеотидную последовательность, с участком полинуклеотида, содержащим вторую нуклеотидную последовательность, по длине или части длины одной или обеих нуклеотидных последовательностей. Такие последовательности могут быть названы «комплементарными» по отношению друг к другу в настоящем документе. Однако, если первую последовательность называют «существенно комплементарной» по отношению ко второй последовательности в настоящем документе, то две последовательности могут быть комплементарными, или они могут содержать одну или несколько, но, как правило, не более приблизительно 5, 4, 3 или 2, несовпадающих пар оснований в участках, которые являются спаренными. Для двух последовательностей с несовпадающими парами оснований последовательности будут считаться «существенно комплементарными» при условии, что две нуклеотидные последовательности связываются друг с другом посредством спаривания оснований.
[00152] Используемые в настоящем документе «комплементарные» последовательности также могут содержать отличные от модели Уотсона-Крика пары оснований и/или пары оснований, образованные из невстречающихся в природе и модифицированных нуклеотидов, или могут быть полностью образованы из таковых, в той мере, в которой выполняются вышеупомянутые варианты осуществления, касающиеся их способности гибридизироваться. Такие отличные от модели Уотсона-Крика пары оснований включают без ограничения неоднозначное или хугстиновское спаривание оснований G:U.
[00153] Термин процент «идентичности» в контексте двух или более последовательностей нуклеиновых кислот или полипептидных последовательностей относится к двум или более последовательностям или подпоследовательностям, которые характеризуются определенным процентным отношением нуклеотидов или аминокислотных остатков, которые являются одинаковыми, при сравнении и выравнивании с максимальным соответствием, измеренным с использованием одного из описанных ниже алгоритмов сравнения последовательностей (например, BLASTP и BLASTN или других алгоритмов, доступных специалистам в данной области) или с помощью визуального осмотра. В зависимости от применения процент «идентичности» может рассматриваться по участку сравниваемой последовательности, например, по функциональному домену, или, в качестве альтернативы, рассматриваться по всей длине двух последовательностей, подлежащих сравнению.
[00154] При сравнении последовательностей, как правило, одна последовательность является эталонной последовательностью, с которой сравниваются тестируемые последовательности. При использовании алгоритма сравнения последовательностей тестируемые и эталонные последовательности вводят в компьютер, указывают координаты подпоследовательностей, если необходимо, и указывают параметры алгоритма программы сравнения последовательностей. Затем алгоритмом сравнения последовательностей рассчитывают процент идентичности последовательностей для тестируемой последовательности(ей) относительно эталонной последовательности на основе указанных параметров программы.
[00155] Оптимальное выравнивание последовательностей для сравнивания может быть выполнено, например, алгоритмом локальной гомологии Smith & Waterman, Adv. Appl. Math. 2:482 (1981), алгоритмом выравнивания по гомологии Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), методом поиска подобия Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988), компьютеризированными выполнениями этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в The Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wis.) или с помощью визуального осмотра (см. в основном Ausubel et al., ниже).
[00156] Одним примером алгоритма, приемлемого для определения процента идентичности последовательностей и подобия последовательностей, является алгоритм BLAST, который описан в Altschul et al., J. Mol. Biol. 215:403-410 (1990). Программное обеспечение для выполнения анализов BLAST является общедоступным на веб-сайте Национального центра биотехнологической информации.
[00157] Идентичные последовательности характеризуются 100% идентичностью полинуклеотида, содержащего первую нуклеотидную последовательность, с полинуклеотидом, содержащим вторую нуклеотидную последовательность, по всей длине одной или обеих нуклеотидных последовательностей. Такие последовательности можно назвать в настоящем документе «полностью идентичными» по отношению друг к другу. Однако в некоторых аспектах, если в настоящем документе первая последовательность называется «почти идентичной» по отношению ко второй последовательности, то две последовательности могут быть полностью комплементарными, или они могут содержать один или несколько, но, как правило, не более приблизительно 5, 4, 3 или 2 несовпадающих нуклеотидов, при выравнивании. В некоторых аспектах, если в настоящем документе первая последовательность называется «почти идентичной» по отношению ко второй последовательности, то две последовательности могут быть полностью комплементарными, или они могут быть на приблизительно 50, 60, 70, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичными друг другу.
[00158] Если первая последовательность называется «отличающейся» в отношении идентичности со второй последовательностью в настоящем документе, то две последовательности содержат по меньшей мере один или несколько несовпадающих нуклеотидов при выравнивании. Некоторые аспекты относятся к отличающимся последовательностям, которые могут содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более несовпадающих нуклеотидов при выравнивании. Некоторые аспекты относятся к отличающимся последовательностям, которые могут быть на приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или менее 100% идентичными друг другу. В некоторых аспектах, если в настоящем документе первая последовательность называется «отличающейся» от второй последовательности, то две последовательности могут быть существенно или полностью идентичными последовательностями, но отличаться друг от друга различающимися паттернами модификации в последовательностях. Такие модификации, как правило, известны в уровне техники, например, метилирование.
[00159] Некоторые аспекты относятся к полинуклеотидам, которые могут быть представлены в библиотеке полинуклеотидов. Некоторые аспекты относятся к библиотеке полинуклеотидов, которая может содержать множество полинуклеотидов. В некоторых аспектах каждый полинуклеотид во множестве полинуклеотидов может походить из отдельного образца. Некоторые аспекты относятся к отдельному образцу, который может содержать отдельную клетку, такую как В-клетка.
[00160] В настоящем документе для описания нуклеотидных последовательностей используются условные обозначения: находящийся слева конец однонитевой нуклеотидной последовательности является 5'-концом; левое направление двухнитевой нуклеотидной последовательности называется 5'-направлением. Направление 5'-3'-добавления нуклеотидов к растущим транскриптам РНК называется направлением транскрипции. Нить ДНК, характеризующаяся той же последовательностью, что и у mRNA, называется «кодирующей нитью»; последовательности нити ДНК, характеризующиеся той же последовательностью, что и у mRNA, транскрибированной по этой ДНК, и которые расположены 5' по отношению к 5'-концу транскрипта РНК, называются «последовательностями в 3'-5' направлении»; последовательности нити ДНК, характеризующиеся той же последовательностью, что и у РНК, и которые расположены 3' по отношению к 3'-концу кодирующего транскрипта РНК, называются «последовательностями в 5'-3'-направлении».
[00161] Термин «матричная РНК» или «mRNA» относится к РНК, которая не содержит интронов и которая может быть транслирована в полипептид.
[00162] Термин «кДНК» относится к ДНК, которая комплементарна или идентична mRNA, либо в однонитевой, либо в двухнитевой форме.
[00163] Термин «ампликон» относится к амплифицированному продукту реакции амплификации нуклеиновой кислоты, например, RT-PCR.
[00164] Термин «гибридизация» относится к взаимодействию специфичного нековалентного связывания последовательности с комплементарной нуклеиновой кислотой. Гибридизация может происходить со всей или частью последовательности нуклеиновой кислоты. Специалистам в данной области будет понятно, что стабильность двухцепочечной нуклеиновой кислоты или гибридов можно определить по Тm. Дополнительное руководство относительно условий гибридизации можно найти в Current Protocols in Молекулярной биологии, John Wiley & Sons, Ν.Y., 1989, 6.3.1-6.3.6, a также в Sambrook et al., Molecular Cloning, a Laboratory Manual, Cold Spring Harbor Laboratory Press, 1989, Vol. 3.
[00165] Используемый в настоящем документе термин «участок» относится к смежной части нуклеотидной последовательности полинуклеотида. Примеры описанных в настоящем документе участков включают в себя сигнальные участки, сигнальные участки образца, сигнальные участки планшета, адаптерные участки и т.п. Некоторые аспекты относятся к полинуклеотиду, который может содержать один или несколько участков. Некоторые аспекты относятся к полинуклеотиду, который может содержать менее 2, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более участков. Некоторые аспекты относятся к участкам, которые могут быть спаренными. Некоторые аспекты относятся к участкам, которые могут быть функционально спаренными. Некоторые аспекты относятся к участкам, которые могут быть физически спаренными.
[00166] Используемый в настоящем документе термин «вариабельный участок» относится к вариабельной нуклеотидной последовательности, которая возникает при событии рекомбинации, например, может содержать участки V, J и/или D иммуноглобулина, или последовательность рецептора Т-клетки, выделенная из представляющей интерес Т-клетки или В-клетки, такой как активированная Т-клетка или активированная В-клетка.
[00167] Используемый в настоящем документе термин «вариабельный иммуноглобулиновый участок В-клетки» относится к вариабельной иммуноглобулиновой нуклеотидной последовательности, выделенной из В-клетки. Например, вариабельная иммуноглобулиновая последовательность может содержать участки V, J и/или D иммуноглобулиновой последовательности, выделенной из представляющей интерес В-клетки, такой как В-клетка памяти, активированная В-клетка или плазмобласт.
[00168] Используемый в настоящем документе термин «сигнальный участок» относится к метке нуклеотидной последовательности (например, уникальной штрих-кодированной последовательности), которая может быть присоединена по меньшей мере к одной нуклеотидной последовательности, например, для дальнейшей идентификации по меньшей мере одной нуклеотидной последовательности.
[00169] Используемый в настоящем документе термин «иммуноглобулиновый участок» относится к смежной части нуклеотидной последовательности одной или обеих цепей (тяжелой и легкой) антитела.
[00170] Используемый в настоящем документе термин «адаптерный участок» относится к линкеру, который спаривает первую нуклеотидную последовательность со второй нуклеотидной последовательностью. Некоторые аспекты относятся к адаптерному участку, который может содержать смежную часть нуклеотидной последовательности, которая действует как линкер. Например, адаптерный участок может содержать последовательность GGG и спаривать первую последовательность со второй последовательностью посредством связывания GGG и ССС.
[00171] Некоторые аспекты относятся к полинуклеотиду, который может содержать участок кДНК. Некоторые аспекты относятся к полинуклеотиду, который может содержать адаптерный участок для идентификации образца. Некоторые аспекты относятся к полинуклеотиду, который может содержать сигнальный участок образца. Некоторые аспекты относятся к полинуклеотиду, который может содержать адаптерный участок. Некоторые аспекты относятся к полинуклеотиду, который может содержать универсальный праймерный участок. Некоторые аспекты относятся к полинуклеотиду, который может содержать участок ампликона. Некоторые аспекты относятся к полинуклеотиду, который может содержать сигнальный участок планшета. Некоторые аспекты относятся к полинуклеотиду, который может содержать первый сигнальный участок планшета. Некоторые аспекты относятся к полинуклеотиду, который может содержать второй сигнальный участок планшета. Некоторые аспекты относятся к полинуклеотиду, который может содержать участок сайта рестрикции. Некоторые аспекты относятся к полинуклеотиду, который может содержать первый участок сайта рестрикции. Некоторые аспекты относятся к полинуклеотиду, который может содержать второй участок сайта рестрикции. Некоторые аспекты относятся к полинуклеотиду, который может содержать участок секвенирования. Некоторые аспекты относятся к полинуклеотиду, который может содержать первый участок секвенирования. Некоторые аспекты относятся к полинуклеотиду, который может содержать второй участок секвенирования.
[00172] Некоторые аспекты относятся к полинуклеотиду, который может содержать множество каких-либо описанных в настоящем документе участков. Например, полинуклеотид может содержать первый сигнальный участок образца и второй сигнальный участок образца. В некоторых аспектах первый сигнальный участок образца и второй сигнальный участок образца являются идентичными или почти идентичными. В некоторых аспектах первый сигнальный участок образца и второй сигнальный участок образца отличаются. Некоторые аспекты относятся к сигнальному участку, который соединяется с вариабельным иммуноглобулиновым участком.
[00173] Некоторые аспекты относятся к последовательности участка, который будет по меньшей мере достаточно длинным, чтобы служить целевой последовательностью для праймера или зонда при PCR-реакции. Некоторые аспекты относятся к участку, который может составлять в длину от 1 до более 5000 пар оснований. Например, участок может составлять в длину 1-10000 нуклеотидов, например, 2-30 нуклеотидов, в том числе все поддиапазоны между ними. В качестве неограничивающих примеров участок может составлять в длину 1-30 нуклеотидов, 1-26 нуклеотидов, 1-23 нуклеотида, 1-22 нуклеотида, 1-21 нуклеотид, 1-20 нуклеотидов, 1-19 нуклеотидов, 1-18 нуклеотидов, 1-17 нуклеотидов, 18-30 нуклеотидов, 18-26 нуклеотидов, 18-23 нуклеотида, 18-22 нуклеотида, 18-21 нуклеотид, 18-20 нуклеотидов, 19-30 нуклеотидов, 19-26 нуклеотидов, 19-23 нуклеотида, 19-22 нуклеотида, 19-21 нуклеотид, 19-20 нуклеотидов, 20-30 нуклеотидов, 20-26 нуклеотидов, 20-25 нуклеотидов, 20-24 нуклеотида, 20-23 нуклеотида, 20-22 нуклеотида, 20-21 нуклеотид, 21-30 нуклеотидов, 21-26 нуклеотидов, 21-25 нуклеотидов, 21-24 нуклеотида, 21-23 нуклеотида или 21-22 нуклеотида. Некоторые аспекты относятся к участку, который может составлять в длину приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более нуклеотидов. Некоторые аспекты относятся к участку, который может составлять в длину менее 50, 50-100, 100-200, 200-300, 300-400, 400-500, 500-600, 600-700, 700-800, 800-900, 900-1000 или более 1000 нуклеотидов. Некоторые аспекты относятся к участку, который может составлять в длину менее 1000, 1000-2000, 2000-3000, 3000-4000, 4000-5000, 5000-6000, 6000-7000, 7000-8000, 8000-9000, 9000-10000 или более 10000 нуклеотидов. Некоторые аспекты относятся к участку, который может содержать по меньшей мере два нуклеотида, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20 или более нуклеотидов раскрытого в настоящем документе полинуклеотида.
[00174] Термин «образец» может включать РНК, ДНК, отдельную клетку или множество клеток, или фрагменты клеток, или аликвоту жидкости организма, взятой от субъекта (например, субъекта-млекопитающего, субъекта-животного, субъекта-человека или субъекта-животного, отличного от человека). Образцы могут быть отобраны специалистом в данной области с использованием каких-либо средств, известных на данный момент или раскрытых позже, в том числе центрифугирование, венопункция, взятие крови, экскреция, мазок, эякуляция, массаж, биопсия, отобранный шприцем аспират, образец промывания, выскабливание, хирургический разрез, лазерная захватывающая микродиссекция, градиентное разделение или вмешательство, или других известных в уровне техники средств. Образцы также могут быть отобраны специалистом в данной области с использованием одного или нескольких маркеров, как известно, ассоциированных с представляющим интерес образцом. Образцы также могут быть отобраны с использованием известных в уровне техники способов, таких как сортировка клеток и F ACS. Следующие примеры способов отбора образцов описаны в разделе примеры ниже.
[00175] Некоторые аспекты относятся к полинуклеотиду, который может быть получен из отдельного образца или ассоциирован с ним. Некоторые аспекты относятся к участку, который может быть получен из отдельного образца или ассоциирован с ним. Некоторые аспекты относятся к участку кДНК, который может быть получен из отдельного образца или ассоциирован с ним. Некоторые аспекты относятся к участку ампликона, который может быть получен из отдельного образца или ассоциирован с ним. Термин «отдельный образец» включает содержащий полинуклеотиды образец, который взят из отдельного источника. Некоторые аспекты относятся к отдельному источнику, включающему образец, взятый в конкретный момент времени или в конкретном местоположении, например, в субъекте, или в колбе с клетками, или в планшете с клетками. В некоторых аспектах первый отдельный образец берут от первого субъекта в первый момент времени, а второй отдельный образец берут от первого субъекта во второй момент времени, который отличается от первого момента времени. В некоторых аспектах первый отдельный образец берут от первого субъекта в первом местоположении, а второй образец берут от первого субъекта во втором местоположении, которое отличается от первого местоположения. В некоторых аспектах первый отдельный образец берут от первого субъекта в момент времени, а второй отдельный образец берут от второго субъекта в момент времени. В некоторых аспектах первый отдельный образец берут от первого субъекта в местоположении, а второй образец берут от второго субъекта в местоположении. Согласно одному варианту осуществления образец содержит полинуклеотиды, которые включают в себя mRNA, полученную от одной или нескольких В-клеток. Согласно другому варианту осуществления образец содержит полинуклеотиды, включающие кДНК, полученную от одной или нескольких В-клеток. Согласно другому варианту осуществления отдельный образец содержит mRNA, полученную от одной или нескольких В-клеток, отсортированных в отдельную лунку 96-луночного или 384-луночного планшета. Образцы, как правило, походят из прокариотической клетки(ок) (например, бактериальной клетки(ок)), эукариотической клетки(ок) (например, клетки(ок) млекопитающих и дрожжей) или других источников генетического материала, таких как вирус или фаг. Используемый в настоящем документе термин «млекопитающее» или «млекопитающего» включает и людей, и отличных от людей животных, в том числе без ограничения людей, отличных от человека приматов, собак, кошек, мышей, жвачных животных, лошадей и свиней. Некоторые аспекты относятся к способам в соответствии с настоящим изобретением, которые применимы к отдельным образцам в планшете по меньшей мере с 96 лунками, по меньшей мере 384 лунками, по меньшей мере 1536 лунками или большим числом лунок. Следующие аспекты относятся к способам в соответствии с настоящим изобретением, которые применимы к отдельным образцам по меньшей мере в одном, двух, трех, четырех, пяти, шести, семи, восьми, десяти, пятнадцати, двадцати, тридцати или более планшетах по меньшей мере с 96 лунками каждый.
[00176] Некоторые аспекты относятся к 5'-последовательности адаптерного участка и/или к сигнальному участку образца, которые добавляют ко всем кДНК из отдельного образца, например, при RT, а не только к генам Ig. Некоторые аспекты относятся к 3' специфичным для гена праймерам (GSP), которые могут быть использованы для амплификации какого-либо экспрессированного гена в отдельном образце. Некоторые аспекты относятся к амплифицированным генам, которые содержат 5'-вариабельный участок, например, рецепторы Т-клетки и рецепторы В-клетки, без необходимости образования множества 5'-праймеров для амплификации представляющего интерес гена(ов). GSP могут содержать праймеры, специфичные для IgG, IgM, IgD, IgA, IgE, цепи TCR и другие представляющие интерес гены.
[00177] Некоторые аспекты относятся к нескольким циклам PCR, которые также могут быть выполнены, например, с использованием гнездовых GSP. Что касается таких гнездовых GSP, то GSP для второго цикла PCR гибридизируется с последовательностью его целевого гена в 5'-положении по этой последовательности относительно положения, гибридизированного с GSP, использованным в первом цикле PCR.
[00178] Некоторые аспекты относятся к участку кДНК или участку ампликона, который может содержать полинуклеотид ДНК. Некоторые аспекты относятся к участку кДНК или участку ампликона, который может содержать полинуклеотид кДНК. Некоторые аспекты относятся к участку кДНК или участку ампликона, который может содержать полинуклеотид РНК, гибридизированный с полинуклеотидом ДНК. Некоторые аспекты относятся к участку кДНК или участку ампликона, который может содержать полинуклеотид mRNA, гибридизированный с полинуклеотидом кДНК.
[00179] Некоторые аспекты относятся к универсальному праймерному участку, не полностью комплементарному какому-либо человеческому экзону. Некоторые аспекты относятся к универсальному праймерному участку, не полностью комплементарному какому-либо экспрессированному человеческому гену. Некоторые аспекты относятся к универсальному праймерному участку, характеризующемуся минимальной вторичной структурой.
[00180] Некоторые аспекты относятся к участку ампликона, содержащему последовательность ампликона тяжелой цепи иммуноглобулина. Некоторые аспекты относятся к участку ампликона, содержащему последовательность ампликона легкой цепи иммуноглобулина. Некоторые аспекты относятся к участку ампликона, содержащему последовательность ампликона рецептора альфа Т-клетки. Некоторые аспекты относятся к участку ампликона, содержащему последовательность ампликона рецептора бета Т-клетки.
[00181] В некоторые аспектах полинуклеотид представлен в библиотеке полинуклеотидов и может быть дифференцирован среди других находящихся в библиотеке полинуклеотидов на основе участка полинуклеотида.
[00182] В некоторые аспектах последовательность сигнального участка образца каждого полинуклеотида в библиотеке, полученной из первого отдельного образца, отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке, полученной из одного или нескольких образцов, отличающихся от первого отдельного образца. В некоторые аспектах последовательность сигнального участка образца каждого полинуклеотида в библиотеке, полученной из первого отдельного образца, отличается по меньшей мере 1 нуклеотидом от последовательности сигнального участка образца других полинуклеотидов в библиотеке, полученной из одного или нескольких образцов, отличающихся от первого отдельного образца. В некоторые аспектах последовательность сигнального участка образца каждого полинуклеотида в библиотеке, полученной из первого отдельного образца, отличается по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более нуклеотидами от последовательности сигнального участка образца других полинуклеотидов в библиотеке, полученной из одного или нескольких образцов, отличающихся от первого отдельного образца. В некоторых аспектах последовательность сигнального участка образца каждого полинуклеотида в библиотеке, полученной из первого отдельного образца, может быть на приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или менее 100% идентичной последовательности сигнального участка образца других полинуклеотидов в библиотеке, полученной из одного или нескольких образцов, отличающихся от первого отдельного образца. В некоторых аспектах последовательность сигнального участка образца каждого полинуклеотида в библиотеке, полученной из первого отдельного образца, на менее 100% идентична последовательности сигнального участка образца других полинуклеотидов в библиотеке, полученной из одного или нескольких образцов, отличающихся от первого отдельного образца. Некоторые аспекты относятся к сигнальному участку образца, действующему как цифровой штрих-код на всей 1-ой нити кДНК, обратно транскрибированной из отдельного образца. Некоторые аспекты относятся к сигнальному участку образца, составляющему в длину по меньшей мере 1 нуклеотид. Некоторые аспекты относятся к сигнальному участку образца, который может содержать по меньшей мере 3 нуклеотида, и к сигнальному участку образца, который может отличаться от других по меньшей мере 1 нуклеотидом. Согласно одному варианту осуществления сигнальные участки образца составляют в длину 3-15 нуклеотидов и отличаются от других по меньшей мере 1 нуклеотидом. Некоторые аспекты относятся к сигнальным участкам образца, которые могут содержать по меньшей мере 64 варианта (с использованием сигнальных участков образца длиной 3 нуклеотида с каждым ID образца, отличающимся от других по меньшей мере 1 нуклеотидом), или некоторые аспекты относятся к большему числу вариантов. Некоторые аспекты относятся к последовательности, присоединенной 3' к сигнальному участку образца, которая может быть адаптерным участком, содержащим по меньшей мере 1 G. Согласно предпочтительному варианту осуществления последовательностью, присоединенной 3' к сигнальному участку образца, может быть адаптерный участок, содержащий по меньшей мере 2 G. Согласно одному варианту осуществления последовательностью, присоединенной к 5'-концу сигнального участка образца, является универсальная последовательность праймера, которая может быть использована при PCR-амплификации во избежание необходимости последующего добавления 5'-универсальной последовательности праймера (путем лигирования или другим способом) или применения множества вырожденных 5'-праймеров для амплификации генов с вариабельными 5'-участками. Примеры сигнальных участков образца показаны в таблицах 2 и 8.
[00183] В некоторых аспектах последовательность первого сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, отличается от последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. В некоторых аспектах последовательность первого сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, отличается по меньшей мере 1 нуклеотидом от последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. В некоторых аспектах последовательность первого сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, отличается по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более нуклеотидами от последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. В некоторых аспектах последовательность первого сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, могут быть на приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или менее 100% идентичными последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. В некоторых аспектах последовательность первого сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, на менее 100% идентична последовательности первого сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Примеры первых сигнальных участков планшета показаны в таблицах 3 и 7.
[00184] В некоторых аспектах последовательность второго сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, отличается от последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. В некоторых аспектах последовательность второго сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, отличается по меньшей мере 1 нуклеотидом от последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. В некоторых аспектах последовательность второго сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, отличается по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 или более нуклеотидами от последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Некоторые аспекты относятся к последовательности второго сигнального участка планшета, являющейся идентичной последовательности первого сигнального участка планшета в полинуклеотиде. В некоторых аспектах последовательность второго сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, может быть на приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 60, 70, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или менее 100% идентичной последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. В некоторых аспектах последовательность второго сигнального участка планшета каждого полинуклеотида в библиотеке, полученной от отдельных образцов первого набора, на менее 100% идентична последовательности второго сигнального участка планшета других полинуклеотидов в библиотеке, полученной из одного или нескольких наборов отдельных образцов, отличающихся от отдельных образцов первого набора. Примеры вторых сигнальных участков планшета показаны в таблицах 3 и 7.
[00185] Некоторые аспекты относятся к сигнальному участку планшета (например, первому сигнальному участку планшета или второму сигнальному участку планшета), который может содержать по меньшей мере 2 нуклеотида, и при этом сигнальные участки планшета отличаются друг от друга по меньшей мере 1 нуклеотидом. Согласно одному варианту осуществления сигнальные участки планшета составляют в длину 2-10 нуклеотидов и отличаются друг от друга по меньшей мере 1 нуклеотидом. Некоторые аспекты относятся к применению сигнальных участков планшета, которые обеспечены только в некоторых вариантах осуществления, поскольку применение большего числа различных сигнальных участков образца (чем один на отдельный образец, подлежащий анализу) может устранить потребность в сигнальных участках планшета. Некоторые аспекты относятся к сигнальным участкам планшета, которые используются для снижения числа уникальных олигонуклеотидов, содержащих сигнальный участок образца, которое необходимо для синтеза.
[00186] Некоторые аспекты относятся к полинуклеотиду, содержащему один или несколько адаптерных участков. Некоторые аспекты относятся к адаптерному участку, содержащему один или несколько G. Некоторые аспекты относятся к адаптерному участку, содержащему 2, 3, 4, 5, 6, 7, 8, 9, 10 или более G. Некоторые аспекты относятся к адаптерным участкам, присоединенным к 3'-концам кДНК с использованием переключающего матрицу свойства обратных транскриптаз MMLV Н-. Существуют различные способы присоединения адаптерных участков, в том числе без ограничения выполнение PCR с праймерами с 5'-фланкирующими последовательностями адаптерного участка, лигирования липких и тупых концов, опосредованное переключением матрицы добавление нуклеотидов или другие способы ковалентного присоединения нуклеотидов к 5'-концу, к 3'-концу или и к 5'-, и к 3'-концам полинуклеотидов. В этих способах могут использоваться свойства обычно применяемых в молекулярной биологии ферментов. В PCR, например, можно использовать термофильную ДНК-полимеразу. Липкие концы, которые являются комплементарными или в основном комплементарными, создают либо посредством разрезания dsDNA ферментами рестрикции, которые оставляют выступающие концы, либо посредством активностей присоединения 3'-хвоста у ферментов, таких как TdT (концевая трансфераза). Затем липкие и тупые концы могут быть лигированы с комплементарным адаптерным участком с использованием лигаз, таких как лигаза Т4. При переключении матрицы используется активность присоединения 3'-хвоста обратной транскриптазы MMLV Н- для добавления одного или нескольких цитозинов (С) к 3'-концу кДНК и ее способность переключать матрицу от mRNA на адаптерный участок с комплементарными G. Некоторые аспекты относятся к кДНК, содержащей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более С на своем 3'-конце.
[00187] Некоторые аспекты относятся к полинуклеотиду, содержащему один или несколько участков сайта рестрикции. Участки сайта рестрикции содержат один или несколько сайтов рестрикции. Сайты рестрикции могут содержать NheI, XhoI, BstBI, EcoRI, SacII, BbvCI, PspXI, AgeI, ApaI, KpnI, Acc65I, XmaI, BstEII, DraIII, Pacl, FseI, AsiSI и AscI. В некоторых аспектах может быть использован любой сайт рестрикции редкого отрезающего 8 оснований фермента.
[00188] Некоторые аспекты относятся к одному или нескольким участкам описанного в настоящем документе полинуклеотида, которые могут быть функционально соединены с одним или несколькими другими участками полинуклеотида. Некоторые аспекты относятся к двум или более отличающимся участкам отдельного полинуклеотида, которые могут быть функционально спарены. Например, универсальный праймерный участок может быть функционально соединен с адаптерным участком. Некоторые аспекты относятся к двум или более участкам, которые могут быть функционально соединены вместе и которые почти идентичны друг другу по последовательности или идентичны по описанию. Например, первый сигнальный участок образца может быть функционально соединен со вторым сигнальным участком образца. Некоторые аспекты относятся к последовательностям первого сигнального участка образца и второго сигнального участка образца, которые идентичны или почти идентичны. Некоторые аспекты относятся к последовательностям первого сигнального участка образца и второго сигнального участка образца, которые различны или отличаются.
[00189] Некоторые аспекты относятся к одному или нескольким участкам описанного в настоящем документе полинуклеотида, которые могут быть соединены с одним или несколькими другими участками полинуклеотида. Некоторые аспекты относятся к двум или более отличающимся участкам отдельного полинуклеотида, которые могут быть спаренными. Например, универсальный праймерный участок может быть соединен с адаптерным участком. Некоторые аспекты относятся к двум или более участкам, которые могут быть соединены вместе и которые почти идентичны друг другу по последовательности или идентичны по описанию. Например, первый сигнальный участок образца может быть соединен со вторым сигнальным участком образца. Некоторые аспекты относятся к последовательностям первого сигнального участка образца и второго сигнального участка образца, которые являются идентичными или почти идентичными. Некоторые аспекты относятся к последовательностям первого сигнального участка образца и второго сигнального участка образца, которые различны или отличаются.
[00190] Некоторые аспекты относятся к полинуклеотиду, содержащему последовательность 5'-А-В-3', при этом А представляет собой сигнальный участок образца, и при этом В представляет собой адаптерный участок. Некоторые аспекты относятся к полинуклеотиду, содержащему последовательность 5'-А-В-С-3', при этом А представляет собой универсальный праймерный участок, при этом В представляет собой сигнальный участок образца, и при этом С представляет собой адаптерный участок. Некоторые аспекты относятся к полинуклеотиду, содержащему последовательность 5'-А-В-С-3', при этом А представляет собой сигнальный участок образца, при этом В представляет собой адаптерный участок, и при этом С представляет собой участок ампликона, полученный из отдельного образца. Некоторые аспекты относятся к полинуклеотиду, содержащему последовательность 5'-A-B-C-D-3', при этом А представляет собой универсальный праймерный участок, при этом В представляет собой сигнальный участок образца, при этом С представляет собой адаптерный участок, и при этом D представляет собой участок ампликона, полученный из отдельного образца. Некоторые аспекты относятся к полинуклеотиду, содержащему последовательность 5'-A-B-C-D-E-3', при этом А представляет собой сигнальный участок планшета, при этом В представляет собой универсальный праймерный участок, при этом С представляет собой сигнальный участок образца, при этом D представляет собой адаптерный участок, и при этом Ε представляет собой участок ампликона, полученный из отдельного образца. Некоторые аспекты относятся к полинуклеотиду, содержащему последовательность 5'-A-B-C-D-E-F-3', при этом А представляет собой первый участок сайта рестрикции, при этом В представляет собой универсальный праймерный участок, при этом С представляет собой сигнальный участок образца, при этом D представляет собой адаптерный участок, при этом Ε представляет собой участок ампликона, полученный из отдельного образца, и при этом F представляет собой второй участок сайта рестрикции.
[00191] В некоторых аспектах участки каждой из вышеупомянутых последовательностей могут быть перестроены в другом порядке, например, 5'-C-A-D-Β-3', или 5'-E-A-C-B-D-F-3', или 5'-Β-Α-3'. В некоторых аспектах один или несколько участков из вышеупомянутых последовательностей могут быть удалены, например, 5'-A-D-3' или 5'-В-С-3'. В некоторых аспектах один или несколько дополнительных участков могут быть добавлены к вышеупомянутым последовательностям, например, 5'-A-A2-В-3' или 5'-A-B-C-D-E-F-G-3'. В таких примерах одним или несколькими дополнительными участками могут быть любые раскрытые в настоящем документе участки или их эквиваленты. В некоторых аспектах один или несколько участков вышеупомянутых последовательностей могут быть модифицированы, например, метилированы.
[00192] Некоторые аспекты относятся к полинуклеотиду, который может содержать адаптерную молекулу. Некоторые аспекты относятся к полинуклеотидной адаптерной молекуле, которая может содержать универсальный праймерный участок, сигнальный участок образца и адаптерный участок, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца, и при этом 3'-конец сигнального участка образца соединяется с 5'-концом адаптерного участка. Некоторые аспекты относятся к адаптерной молекуле, содержащей полинуклеотид, содержащий по меньшей мере 2 нуклеотида, которые связываются с С, добавленными с помощью обратной транскриптазы к 3'-концу 1-ой нити кДНК. Некоторые аспекты относятся к адаптерной молекуле, которая содержит полинуклеотид дезоксирибозного типа, содержащий 3-6 G (G ДНК). Согласно другому варианту осуществления адаптерная молекула содержит полинуклеотид рибозного типа, состоящий из 3-6 G (G РНК). Согласно другим вариантам осуществления в адаптерной молекуле могут использоваться нуклеотидные аналоги, такие как запертые нуклеиновые кислоты (LNA), например, G LNA. Согласно другим вариантам осуществления нуклеотидным основанием также может быть универсальное или вырожденное основание, такое как 5-нитроиндол и 3-нитропиррол, которое может спариваться с С, а также с другими нуклеотидами в любой комбинации.
[00193] Некоторые аспекты относятся к полинуклеотиду, который содержит праймер или зонд. Некоторые аспекты относятся к праймеру, который может содержать универсальный праймерный участок и сигнальный участок планшета, и при этом 3'-конец сигнального участка планшета соединяется с 5'-концом универсального праймерного участка.
[00194] Некоторые аспекты относятся к композиции, которая может содержаться в библиотеке полинуклеотидных композиций. Некоторые аспекты относятся к библиотеке полинуклеотидных композиций, содержащей множество полинуклеотидных композиций. В некоторых аспектах каждая композиция находится в отдельном контейнере. В некоторых аспектах контейнером может быть аналитическая пробирка. В некоторых аспектах контейнером может быть лунка в планшете. В некоторых аспектах контейнером может быть лунка в 96-луночном планшете. В некоторых аспектах контейнером может быть лунка в 384-луночном планшете. В некоторых аспектах каждая композиция содержит участок кДНК, полученный из отдельного образца. В некоторых аспектах каждая композиция содержит адаптерный участок для идентификации образца, содержащий сигнальный участок образца, соединенный с адаптерным участком. В некоторых аспектах последовательность сигнального участка образца каждого адаптерного участка для идентификации образца в библиотеке отличается от нуклеотидной последовательности сигнального участка образца других адаптерных участков для идентификации образца, находящихся в каждом отдельном контейнере в библиотеке. В некоторых аспектах адаптерный участок для идентификации образца присоединяется к участку кДНК. В некоторых аспектах адаптерный участок для идентификации образца присоединяется к участку кДНК путем связывания их 3'-участков. В некоторых аспектах адаптерный участок для идентификации образца присоединяется к участку кДНК путем связывания G:C. Некоторые аспекты относятся к участку кДНК, содержащему полинуклеотид РНК, гибридизированный с полинуклеотидом ДНК. Некоторые аспекты относятся к участку кДНК, содержащему полинуклеотид mRNA, гибридизированный с полинуклеотидом кДНК.
[00195] Некоторые аспекты относятся к множеству полинуклеотидных композиций в библиотеке полинуклеотидов, которая может содержать по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 3000, по меньшей мере 10000, по меньшей мере 30000, по меньшей мере 100000, по меньшей мере 300000, по меньшей мере 1000000, по меньшей мере 3000000, по меньшей мере 10000000, по меньшей мере 30000000 или более членов. Другие аспекты относятся к множеству полинуклеотидных композиций в библиотеке полинуклеотидов, которая может содержать по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 3000, по меньшей мере 10000, по меньшей мере 30000 или более генов всего транскриптома клеточного образца. Другие аспекты относятся к множеству полинуклеотидных композиций в библиотеке полинуклеотидов, содержащей по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 10000, по меньшей мере 100000, по меньшей мере 1000000, по меньшей мере 10000000, по меньшей мере 1000000000 или более различных видов присутствующих в крови индивидуума антител. Эти виды антител могут быть экспрессированы плазмобластами, плазматическими клетками, В-клетками памяти, долгоживущими плазматическими клетками, наивными В-клетками, другими В-линейными клетками или их комбинациями.
Векторы
[00196] Некоторые аспекты относятся к композиции, которая может содержать вектор. Векторы могут быть использованы в трансформации клетки-хозяина с последовательностью нуклеиновой кислоты. Некоторые аспекты относятся к вектору, который может содержать один или несколько описанных в настоящем документе полинуклеотидов. Согласно одному варианту осуществления библиотека последовательностей нуклеиновых кислот, кодирующих целевые полипептиды, может быть введена в популяцию клеток, тем самым делая возможным скрининг библиотеки. Используемый термин «вектор» относится к носителю молекулы нуклеиновой кислоты, в который может быть вставлена последовательность нуклеиновой кислоты для введения в клетку, в которой она может быть реплицирована. Последовательность нуклеиновой кислоты может быть «экзогенной» или «гетерологичной», что означает, что она является чужеродной по отношению к клетке, в которую подлежит введению вектор, или то, что последовательность гомологична последовательности в клетке, но в положении в нуклеиновой кислоте клетки-хозяина, в котором последовательность обычно не обнаруживается. Векторы содержат плазмиды, космиды и вирусы (например, бактериофаг). Специалист в данной области может сконструировать вектор посредством стандартных рекомбинантных методик, которые описаны в Maniatis et al., 1988, и в Ausubel et al., 1994, каждая из которых включена в настоящий документ посредством ссылки. Некоторые аспекты относятся к вектору, который может быть вектором с предварительно сконструированными константными участками антитела. Таким образом, специалист может клонировать только участки VDJ представляющего интерес антитела и клонировать эти участки в предварительно сконструированном векторе.
[00197] Термин «вектор экспрессии» относится к вектору, содержащему последовательность нуклеиновой кислоты, кодирующую по меньшей мере часть генного продукта, способного к транскрибированию. В некоторых случаях молекулы РНК затем транслируются в белок, полипептид или пептид. Векторы экспрессии могут содержать множество «контрольных последовательностей», которые относятся к последовательностям нуклеиновых кислот для транскрипции и, возможно, трансляции функционально связанной кодирующей последовательности в конкретном организме-хозяине. Кроме того, чтобы контролировать последовательности, которые управляют транскрипцией и трансляцией, векторы и векторы экспрессии могут содержать последовательности нуклеиновых кислот, которые также служат для других функций.
[00198] Некоторые аспекты относятся к вектору, который может
содержать промотор. Некоторые аспекты относятся к вектору, который может содержать энхансер. «Промотор» представляет собой контрольную последовательность, которая является участком последовательности нуклеиновой кислоты, при котором инициирование и скорость транскрипции контролируются. Он может содержать генетические элементы, при которых регуляторные белки и молекулы могут связывать такие факторы транскрипции как РНК-полимераза и другие. Фразы «функционально расположенный», «функционально связанный», «под контролем» и «под транскрипционным контролем» означают, что промотор находится в правильных функциональных местоположении и/или ориентации по отношению к последовательности нуклеиновой кислоты для контроля инициации транскрипции и/или экспрессии данной последовательности. Промотор может быть или не быть использован в сочетании с «энхансером», который относится к цис-действующей регуляторной последовательности, участвующей в активации транскрипции последовательности нуклеиновой кислоты.
[00199] Промотором может быть промотор, естественно ассоциированный с геном или последовательностью, в также полученный путем выделения 5'-некодирующих последовательностей, расположенных в 3'-5'-направлении, по отношению к кодирующему сегменту и/или экзону. Такой промотор может быть назван «эндогенным». Подобным образом, энхансером может быть энхансер, естественно ассоциированный с последовательностью нуклеиновой кислоты, расположенной либо в 5'-3'-направлении, либо в 3'-5'-направлении по отношению к данной последовательности. В качестве альтернативы, определенные преимущества будут достигнуты за счет установления над кодирующим сегментом нуклеиновой кислоты контроля рекомбинантного или гетерологичного промотора, который относится к промотору, в норме не ассоциированному с последовательностью нуклеиновой кислоты в его природной среде. Рекомбинантный или гетерологичный энхансер относится также к энхансеру, в норме не ассоциированному с последовательностью нуклеиновой кислоты в его природной среде. Такие промоторы или энхансеры могут содержать промоторы или энхансеры других генов, промоторы или энхансеры, выделенные из любой другой прокариотической клетки, а также промоторы или энхансеры не «природного происхождения», т.е. содержащие различные элементы различных транскрипционных регуляторных участков и/или мутации, которые изменяют экспрессию. Помимо синтетического продуцирования последовательностей нуклеиновых кислот промоторов и энхансеров последовательности могут быть получены с использованием технологий рекомбинантного клонирования и/или амплификации нуклеиновой кислоты, в том числе PCR, вместе с раскрытыми в настоящем документе композициями (см. патент США № 4683202, патент США № 5928906, каждый из которых включен в настоящий документ посредством ссылки).
[00200] Некоторые аспекты относятся к промотору и/или энхансеру,
который эффективно управляет экспрессией ДНК-сегмента в выбранном для экспрессии типе клетки. Одним из примеров такого промотора, который может быть использован, является арабиноза или промотор Т7 Е. coli. Специалисты в области молекулярной биологии, как правило, знакомы с применением промоторов, энхансеров и комбинаций типов клеток для экспрессии белка, например, см. Sambrook et al. (1989), включенную в настоящий документ посредством ссылки. Используемые промоторы могут быть конститутивными, специфичными для тканей, индуцируемыми и/или полезными при подходящих состояниях, чтобы управлять высоким уровнем экспрессии введенного ДНК-сегмента, например, такими, которые являются выгодными в крупномасштабном производстве рекомбинантных белков и/или пептидов. Промотор может быть гетерологичным или эндогенным.
[00201] Некоторые аспекты относятся к векторам, которые могут
содержать сигналы инициации и/или внутренние сайты связывания рибосомы. Специфичный сигнал инициации также может быть включен для эффективной трансляции кодирующих последовательностей. Эти сигналы содержат кодон инициации ATG или соседние последовательности. Может потребоваться обеспечение экзогенных сигналов контроля трансляции, содержащих кодон инициации ATG. Специалист в данной области без труда сможет определить это и обеспечить необходимые сигналы. Хорошо известно, что кодон инициации должен быть «в рамке» с рамкой считывания желаемой кодирующей последовательности для гарантии трансляции всей вставки. Экзогенные сигналы контроля трансляции и кодоны инициации могут быть либо природными, либо синтетическими. Эффективность экспрессии может быть усилена путем включения подходящих элементов энхансера транскрипции.
[00202] Некоторые аспекты относятся к вектору, который может содержать последовательности, которые увеличивают или оптимизируют уровень экспрессии сегмента ДНК, кодирующего представляющий интерес ген. В качестве примера, такие последовательности включают в себя добавление интронов в экспрессированную mRNA (Brinster, R.L. et al. (1988) Introns increase transcriptional efficiency in transgenic mice. Proc. Natl. Acad. Sci. USA 85, 836-40; Choi, T. et al. (1991) A generic intron increases gene expression in transgenic mice. Mol. Cell. Biol. 11, 3070-4). Другим примером способа оптимизации экспрессии сегмента ДНК является «оптимизация ко донов». Оптимизация ко дона предполагает введение молчащих мутаций в ДНК-сегмент, чтобы сократить применение редких кодонов для оптимизации трансляции белка (Codon engineering for improved antibody expression in mammalian cells. Carton JM, Sauerwald T, Hawley-Nelson P, Morse B, Peffer N, Beck H, Lu J, Cotty A, Amegadzie B, Sweet R. Protein Expr Purif. 2007 Oct; 55(2):279-86. Epub 2007 Jun 16.).
[00203] Некоторые аспекты относятся к вектору, который может содержать сайты множественного клонирования. Векторы могут содержать сайт множественного клонирования (MCS), который представляет собой участок нуклеиновой кислоты, содержащий несколько сайтов ферментов рестрикции, любой из которых может быть использован в сочетании со стандартной рекомбинантной технологией для расщепления вектора (см. Carbonelli et al., 1999, Levenson et al., 1998, и Cocea, 1997, включенные в настоящий документ посредством ссылки). Фраза «расщепление ферментами рестрикции» относится к каталитическому отщеплению молекулы нуклеиновой кислоты ферментом, который функционирует только в специфичных местоположениях в молекуле нуклеиновой кислоты. Многие из этих ферментов рестрикции являются коммерчески доступными. Применение таких ферментов понятно специалистам в данной области. Зачастую вектор линеаризуется или фрагментируется с использованием фермента рестрикции, который режет в пределах MCS для обеспечения лигирования экзогенных последовательностей с вектором. «Лигирование» относится к процессу формирования фосфодиэфирных связей между двумя фрагментами нуклеиновой кислоты, которые могут быть или могут не быть смежными друг с другом. Методики, включающие ферменты рестрикции и реакции лигирования, хорошо известны специалистам в области рекомбинантной технологии.
[00204] Некоторые аспекты относятся к вектору, который может содержать сигнал терминации. Векторы или конструкции, как правило, будут содержать по меньшей мере один сигнал терминации. «Сигнал терминации» или «терминатор» состоит из последовательностей ДНК, участвующих в специфичной терминации транскрипта РНК с помощью РНК-полимеразы. Таким образом, согласно некоторым вариантам осуществления сигнал терминации, который прекращает продуцирование РНК-транскрипта, является ожидаемым. Терминатор может быть необходим in vivo для достижения желаемых уровней транскриптов.
[00205] Терминаторы, предполагаемые для применения, включают любые известные терминаторы транскрипции, описанные в настоящем документе или известные рядовому специалисту в данной области, в том числе без ограничения, например, rho-зависимые или rho-независимые терминаторы. Согласно некоторым вариантам осуществления сигналом терминации может быть отсутствие транскрибируемой или транслируемой последовательности, например, за счет укорачивания последовательности.
[00206] Некоторые аспекты относятся к вектору, который может
содержать точку начала репликации.
[00207] Для распространения вектора в клетке-хозяине он может содержать один или несколько точек начала сайтов репликации (часто называемых «orí»), которые представляют собой специфичную последовательность нуклеиновой кислоты, с которой начинается репликация.
[00208] Некоторые аспекты относятся к вектору, который может содержать один или несколько селектируемых и/или скринируемых маркеров. Согласно некоторым вариантам осуществления клетки, содержащие конструкцию нуклеиновой кислоты, могут быть идентифицированы in vitro или in vivo путем включения маркера в вектор экспрессии. Такие маркеры будут обеспечивать идентифицируемое изменение в клетке, позволяющее легко идентифицировать клетки, содержащие вектор экспрессии. Как правило, селектируемым маркером является маркер, который придает свойство, обеспечивающее отбор. Положительным селектируемым маркером является маркер, присутствие которого обеспечивает его отбор, в то время как отрицательным селектируемым маркером является маркер, присутствие которого препятствует его отбору. Примером положительного селектируемого маркера является маркер устойчивости к лекарственному средству.
[00209] Обычно включение селектируемого по лекарственному средству
маркера позволяет клонирование и идентификацию трансформантов, например, гены, которые придают устойчивость к неомицину, пуромицину, гигромицин, DHFR, GPT, зеоцину и гистидинолу, представляют собой применимые селектируемые маркеры. В дополнение к обеспечивающим фенотип маркерам, которые дают возможность распознавать трансформантов на основе реализации состояний, также рассматриваются другие типы маркеров, с том числе скринируемые маркеры, такие как GFP, который используется в колориметрическом анализе. В качестве альтернативы, могут быть использованы скринируемые ферменты, такие как хлорамфеникол-ацетилтрансфераза (CAT). Специалисту в данной области также будет понятно, как использовать иммунологические маркеры, возможно в сочетании с анализом FACS. Используемый маркер не считается важным, при условии, что он способен экспрессироваться одновременно с нуклеиновой кислотой, кодирующей генный продукт. Специалистам в данной области хорошо известны другие примеры селектируемых маркеров и скринируемых маркеров.
[00210] Один аспект относится к вектору, который может экспрессировать ДНК-сегменты, кодирующие множество представляющих интерес полипептидов. Например, ДНК-сегменты, кодирующие как тяжелую цепь, так и легкую цепь иммуноглобулина, могут быть закодированы и экспрессированы одним вектором. Один аспект относится к обоим ДНК-сегментам, которые могут содержаться в тех же последовательностях экспрессированных РНК и внутреннего сайта связывания рибосом (1RES), используемых для включения экспрессии ДНК-сегментов в виде разделенных полипептидов (Pinkstaff JK, Chappell SA, Mauro VP, Edelman GM, Krushel LA., Internal initiation of translation of five dendritically localized neuronal mRNAs., Proc Natl Acad Sci USA. 2001 Feb 27; 98(5):2770-5. Epub 2001 Feb 20.). В другом аспекте каждый ДНК-сегмент имеет свой собственный промоторный участок, приводящий к экспрессии разделенных mRNA (Andersen CR, Nielsen LS, Baer A, Tolstrup AB, Weilguny D. Efficient Expression from One CMV Enhancer Controlling Two Core Promoters. Mol Biotechnol. 2010 Nov 27. [Epub ahead of print]).
Клетки-хозяева и системы экспрессии
[00211] Некоторые аспекты относятся к композиции, которая может содержать клетку-хозяина. Некоторые аспекты относятся к клетке-хозяину, которая может содержать описанные в настоящем документе полинуклеотид или вектор. Некоторые аспекты относятся к клетке-хозяину, которой может быть эукариотическая клетка (например, насекомого, дрожжей или млекопитающего) или прокариотическая клетка (например, бактерии). В контексте экспрессии гетерологичной последовательности нуклеиновой кислоты «клетка-хозяин» может относиться к прокариотической клетке, и она включает любой трансформируемый организм, способный к репликации вектора и/или экспрессии гетерологичного гена, кодируемого вектором. Клетка-хозяин может быть, и была, использована в качестве реципиента для векторов. Клетка-хозяин может быть «трансфицирована» или «трансформирована», что означает процесс, с помощью которого экзогенная нуклеиновая кислота переносится или встраивается в клетку-хозяина. Трансформированная клетка включает первичную клетку-субъект и ее потомство.
[00212] Согласно конкретным вариантам осуществления клеткой-хозяином является грамотрицательная бактериальная клетка. Эти бактерии подходят для применения, поскольку они обладают периплазматическим пространством между внутренней и наружной мембраной и, в частности, вышеупомянутой внутренней мембраной между периплазмой и цитоплазмой, которая также известна как цитоплазматическая мембрана. Таким образом, может быть использована любая другая клетка с таким периплазматическим пространством. Примеры грамотрицательных бактерий, включают в себя без ограничения Е. coli, Pseudomonas aeruginosa, Vibrio cholera, Salmonella typhimurium, Shigella flexneri, Haemophilus influenza, Bordotella pertussi, Erwinia amylovora, Rhizobium sp. Грамотрицательная бактериальная клетка может быть еще дополнительно определена как бактериальная клетка, которая была трансформирована с кодирующей последовательностью слитого полипептида, содержащего связывающий кандидатный полипептид, способный связываться с выбранным лигандом. Полипептид прикрепляется к наружной поверхности цитоплазматической мембраны перед периплазматическим пространством и может содержать кодирующую антитело последовательность или другую последовательность. Одно из средств экспрессии полипептида характеризуется присоединением лидерной последовательности к полипептиду, способному осуществлять такое руководство.
[00213] Многочисленные линии и культуры прокариотических клеток доступны для применения в качестве клетки-хозяина, и они могут быть получены из Американской коллекции типовых культур (АТСС), которая является организацией, выполняющей роль архива для живых культур и генетических материалов. Подходящий хозяин может быть определен специалистом в данной области на основании векторного остова и желаемого результата. Плазмида или космида, например, может быть встроена в прокариотическую клетку-хозяина для репликации нескольких векторов. Бактериальные клетки, используемые в качестве клеток-хозяев для репликации и/или экспрессии вектора, включают в себя ОН5-альфа, JM109 и КС8, а также ряд коммерчески доступных бактериальных хозяев, таких как SURE Competent Cells и SOLOPACK™ Gold Cells (STRATAGENE™, La Jolla). Некоторые аспекты относятся к другим бактериальным клеткам, таким как LE392 Е. coli, которые рассматриваются для применения в качестве клеток-хозяев.
[00214] Многие клетки-хозяева из различных типов клеток и организмов доступны и должны быть известны специалисту в данной области. Аналогичным образом, вирусный вектор может быть использован в сочетании с прокариотической клеткой-хозяином, в частности, той, которая является пермиссивной для репликации или экспрессии вектора. В некоторых векторах могут использоваться контрольные последовательности, что обеспечивает их репликацию и/или экспрессию как в прокариотических, так и в эукариотических клетках. Кроме того, специалисту в данной области будут понятны условия, при которых необходимо инкубировать все вышеописанные клетки-хозяева для поддерживания их, а также для обеспечения репликации вектора. Также понятны и известны методики и условия, которые могут обеспечивать крупномасштабное продуцирование векторов, а также продуцирование нуклеиновых кислот, кодируемых векторами, и их родственных полипептидов, белков или пептидов.
[00215] Некоторые аспекты относятся к клетке-хозяину, которая является клеткой млекопитающего. Примеры включают в себя клетки СНО, клетки СНО-К1 или клетки CHO-S. Другие клетки-хозяева млекопитающих включают в себя NS0 клетки и клетки СНО, которые являются dhfr-, например, CHO-dhfr-клетками, клетками DUKX-В11 СНО и клетками DG44 СНО.
[00216] Существует множество систем экспрессии, которые могут включать по меньшей мере часть или все из композиций, раскрытых в настоящем документе. Системы экспрессии могут включать эукариотические системы экспрессии и прокариотические системы экспрессии. Такие системы могут быть использованы, например, для продуцирования полипептидного продукта, идентифицированного как способный связывать конкретный лиганд. Системы на основе прокариот могут быть применены для получения последовательностей нуклеиновых кислот, или их родственных полипептидов, белков и пептидов. Многие из таких систем являются коммерчески доступными и общедоступными. Другие примеры систем экспрессии включают в себя векторы, содержащие сильный прокариотический промотор, такой как промоторы Т7, Tac, Trc, BAD, lambda pL, Tetracycline или Lac, систему экспрессии рЕТ и систему экспрессии Е. coli.
Полипептиды
[00217] Некоторые аспекты относятся к композиции, которая может содержать полипептид. Некоторые аспекты относятся к полипептиду, кодируемому описанным в настоящем документе полинуклеотидом, который может быть экспрессирован, например, из клетки-хозяина. Термины «полипептид» или «белок» включают макромолекулу, имеющую аминокислотную последовательность нативного белка, то есть белка, продуцированного встречающейся в природе и нерекомбинантной клеткой, или продуцированного генетически сконструированной или рекомбинантной клеткой, и включают молекулы, имеющие аминокислотную последовательность нативного белка, или молекулы, содержащие делеции, добавления и/или замены одной или нескольких аминокислот нативной последовательности. Данный термин также включает аминокислотные полимеры, в которых одна или несколько аминокислот являются химическими аналогами соответствующих встречающихся в природе аминокислоты и полимеров. Термины «полипептид» и «белок» охватывают связывающие антиген белки, антитела или последовательности, которые содержат делеции, добавления и/или замены одной или нескольких аминокислот связывающего антиген белка. Термин «полипептидный фрагмент» относится к полипептиду, который содержит аминоконцевую делецию, карбокси-концевую делецию и/или внутреннюю делецию по сравнению с полноразмерным нативным белком. Такие фрагменты могут также содержать модифицированные аминокислоты по сравнению с нативным белком. Согласно некоторым вариантам осуществления фрагменты имеют длину от приблизительно пяти до 500 аминокислот. Например, фрагменты могут быть длиной по меньшей мере 5, 6, 8, 10, 14, 20, 50, 70, 100, 110, 150, 200, 250, 300, 350, 400 или 450 аминокислот. Применимые полипептидные фрагменты содержат иммунологически функциональные фрагменты антител, содержащих связывающие домены. В случае связывающего антитела применимые фрагменты содержат без ограничения участок CDR, вариабельный домен тяжелой и/или легкой цепей, часть цепи антитела или только его вариабельный участок, содержащий два CDR, и т.п.
[00218] Термин «выделенный белок» означает, что субъектный белок (1) является свободным от по меньшей мере некоторых других белков, с которыми он обычно встречается, (2) является по сути свободным от других белков из того же источника, например, одних и тех же видов, (3) экспрессируется клетками других видов, (4) был выделен из по меньшей мере приблизительно 50 процентов полинуклеотидов, липидов, углеводов или других материалов, с которым он связывается в природе, (5) является функционально связанным (путем ковалентного или нековалентного взаимодействия) с полипептидом, с которым он не связывается в природе, или (6) не встречается в природе. Как правило, «выделенный белок» составляет по меньшей мере приблизительно 5%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 25% или по меньшей мере приблизительно 50% данного образца. Геномная ДНК, кДНК, mRNA или другая РНК, нуклеиновые кислоты синтетического происхождения или какая-либо их комбинация могут кодировать такой выделенный белок. Предпочтительно выделенный белок практически свободен от белков или полипептидов или других примесей, которые встречаются в их естественной среде, которые будут препятствовать его терапевтическому, диагностическому, профилактическому, исследовательскому или другому применению.
[00219] Некоторые аспекты относятся к полипептиду, который может содержать связывающий антиген белок (АВР). Используемый в настоящем документе термин «связывающий антиген белок» («АВР») означает любой белок, который связывает определенный целевой антиген. «Связывающий антиген белок» включает без ограничения антитела и их связывающие части, такие как иммунологически функциональные фрагменты. Пептидные антитела являются еще одним примером связывающих антиген белков. Используемый в настоящем документе термин «иммунологически функциональный фрагмент» (или просто «фрагмент») антитела или цепи иммуноглобулина (тяжелой или легкой цепей) антигенсвязывающего белка является видом связывающего антиген белка, содержащего часть (независимо от того, как эта часть получена либо синтезирована) антитела, у которого отсутствуют по меньшей мере некоторые из аминокислот, присутствующих в полноразмерной цепи, но которые все еще способны специфично связываться с антигеном. Такие фрагменты являются биологически активными, так как они связываются с целевым антигеном и могут конкурировать с другими связывающими антиген белками, в том числе интактными антителами, за связывание с заданным эпитопом. Согласно некоторым вариантам осуществления фрагменты являются нейтрализующими фрагментами. Эти биологически активные фрагменты могут быть получены с помощью методик рекомбинантной ДНК или могут быть получены путем ферментативного или химического расщепления связывающих антиген белков, в том числе интактных антител. Иммунологически функциональные фрагменты иммуноглобулина включают в себя без ограничения Fab, диатело (вариабельный домен тяжелой цепи на том же полипептиде, что и вариабельный домен легкой цепи, соединенный посредством короткого пептидного линкера, который является слишком коротким, чтобы позволить спаривание между двумя доменами на одной и той же цепи), Fab', F(ab')2, Fv, доменные антитела и одноцепочечные антитела, а также могут быть получены из любого источника у млекопитающего, в том числе без ограничения человека, мыши, крысы, верблюда или кролика. Кроме того, предполагается, что функциональная часть раскрытых в настоящем документе связывающих антиген белков, например, один или несколько CDR, может быть ковалентно связана со вторым белком или малой молекулой для создания терапевтического средства, направленного на конкретную цель в организме, обладающего бифункциональными терапевтическими свойствами или характеризующегося продолжительным временем полужизни в сыворотке. Как будет понятно специалисту в данной области, связывающий антиген белок может содержать небелковые компоненты. Дополнительные подробности о связывающих антиген белках и антителах, такие как модификации, варианты, способы получения и способы скрининга, можно найти в публикации патентного документа США № 20110027287, включенной в настоящий документ посредством ссылки во всей своей полноте для всех целей.
[00220] Некоторые аспекты относятся к полипептиду, который может включать в себя антитело. Термин «антитело» относится к интактному иммуноглобулину любого изотипа или к его фрагменту, который может конкурировать с интактным антителом за специфичное связывание с целевым антигеном, и включает в себя, например, химерные, гуманизированные, полностью человеческие и биспецифичные антитела. Термин «антитело» относится к видам связывающего антиген белка. Интактное антитело, как правило, будет содержать по меньшей мере две полноразмерные тяжелые цепи и две полноразмерные легкие цепи, но в некоторых случаях может содержать меньшее количество цепей, как например, встречающиеся в природе антитела у верблюдов, которые могут содержать только тяжелые цепи. Антитела могут быть получены исключительно из одного источника или могут быть «химерными», то есть, различные части антитела могут быть получены из двух различных антител. Связывающие антиген белки, антитела или связывающие фрагменты могут быть получены в гибридомах, с помощью методик рекомбинантной ДНК или путем ферментативного или химического расщепления интактных антител. Если не указано иное, термин «антитело» включает в дополнение к антителам, содержащим две полноразмерные тяжелые цепи и две полноразмерные легкие цепи, производные, варианты, фрагменты и их мутеины. Кроме того, если явно не исключено, антитела включают моноклональные антитела, биспецифичные антитела, миниантитела, доменные антитела, синтетические антитела (иногда называемые в настоящем документе «миметиками антител»), химерные антитела, гуманизированные антитела, человеческие антитела, антитела слияния (иногда называемые в настоящем документе «конъюгатами антител») и их фрагменты, соответственно. Согласно некоторым вариантам осуществления этот термин охватывает также пептидные антитела.
[00221] Субъекту, нуждающемуся в этом, может быть введено терапевтически эффективное количество АВР. АВР могут быть составлены в фармацевтических композициях. Эти композиции могут содержать, в дополнение к одному или нескольким АВР, фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие материалы, хорошо известные специалистам в данной области. Такие материалы должны быть нетоксичными и не должны влиять на эффективность активного ингредиента. Определенная природа носителя или другого материала может зависеть от пути введения, например, от перорального, внутривенного, кожного или подкожного, назального, внутримышечного, внутрибрюшинного путей.
[00222] Фармацевтические композиции для перорального введения могут быть в таблетированной, капсульной, порошковой или жидкой форме. Таблетка может содержать твердый носитель, такой как желатин, или вспомогательное вещество. Жидкие фармацевтические композиции, как правило, содержат жидкий носитель, такой как вода, нефть, животные или растительные масла, минеральное масло или синтетическое масло. Могут содержаться физиологический солевой раствор, раствор декстрозы или другого сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль.
[00223] Для внутривенной, кожной или подкожной инъекции или инъекции в больной участок активный ингредиент будет иметь форму парентерально приемлемого водного раствора, который является апирогенным и имеет подходящие рН, изотоничность и стабильность. Соответствующие специалисты в данной области без труда могут приготовить подходящие растворы с использованием, например, изотонических сред, таких как инъекция хлорида натрия, инъекция раствора Рингера, инъекция раствора Рингера с лактатом. При необходимости могут быть включены консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
[00224] Введение АВР осуществляют предпочтительно в «терапевтически эффективном количестве» или «профилактически эффективном количестве» (хотя в зависимости от обстоятельств профилактика может считаться терапией), которое является достаточным для обеспечения пользы для индивидуума. Фактическое вводимое количество, скорость и время курса введения будут зависеть от природы и тяжести заболевания, которое лечат. Назначение лечения, например, решения по дозировке и т.д., входят в обязанность врачей общей практики и других врачей, и, как правило, учитывают заболевание, подлежащее лечению, состояние отдельного пациента, участок доставки, способ введения и другие факторы, известные врачам общей практики. Примеры вышеупомянутых методик и протоколов можно найти в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed), 1980.
[00225] Композиция может быть введена отдельно или в сочетании с другими видами лечения, одновременно или последовательно в зависимости от состояния, подлежащего лечению.
Иммунные клетки
[00226] Образец может содержать иммунные клетки. Иммунные клетки могут включать в себя Т-клетки и В-клетки. Т-клетки (Т-лимфоциты) включают в себя, например, клетки, которые экспрессируют Т-клеточные рецепторы. В-клетки включают в себя, например, активированные В-клетки, бластоподобные В-клетки, плазматические клетки, плазмобласты, В-клетки памяти, В1-клетки, В2-клетки, В-клетки маргинальной зоны и фолликулярные В-клетки. Т-клетки включают в себя активированные Т-клетки, бластные Т-клетки, Т-хелперы (эффекторные Т-клетки или Th-клетки), цитотоксические Т-клетки (CTL), Т-клетки памяти, центральные Т-клетки памяти, эффекторные Т-клетки памяти и регуляторные Т-клетки. Образец может содержать одну клетку в некоторых применения (например, в калибровочном тесте для определения соответствующих Т- или В-клеток) или, как правило, по меньшей мере 1000, по меньшей мере 10000, по меньшей мере 100000, по меньшей мере 250000, по меньшей мере 500000, по меньшей мере 750000 или по меньшей мере 1000000 клеток.
В-клетки
[00227] Используемый в настоящем документе термин «В-клетка» относится к любой клетке, которая содержит по меньшей мере один реаранжированный локус гена иммуноглобулина. В-клетка может содержать по меньшей мере один реаранжированный локус тяжелой цепи иммуноглобулина или по меньшей мере один реаранжированный локус легкой цепи иммуноглобулина. В-клетка может содержать по меньшей мере один реаранжированный локус тяжелой цепи иммуноглобулина и по меньшей мере один реаранжированный локус легкой цепи иммуноглобулина. В-клетки представляют собой лимфоциты, которые являются частью адаптивной иммунной системы. В-клетки могут включать в себя любые клетки, которые экспрессируют антитела либо в мембранно-связанной форме как В-клеточный рецептор (BCR) на клеточной поверхности, либо в виде секретируемых антител. В-клетки могут экспрессировать иммуноглобулины (антитела, В клеточный рецептор). Антитела могут содержать гетеродимеры, образованные из тяжелых и легких цепей иммуноглобулина. Тяжелая цепь образуется из генных реаранжировок вариабельных, разнообразных и соединительных (VDJ) генов с формированием вариабельного участка, который соединяется с константным участком. Легкая цепь формируется из генных реаранжировок вариабельных и соединительных (VJ) генов с формированием вариабельного участка, который затем соединяется с константным участком. Благодаря большому возможному числу соединительных комбинаций, вариабельные участки гена антитела (которым также является BCR) характеризуются огромным разнообразием, что позволяет В-клеткам распознавать любой чужеродный антиген и осуществлять реакцию против него.
Активация и дифференцировка В-клеток
[00228] В-клетки активируются и дифференцируются, когда они распознают антиген в контексте воспалительной иммунной реакции. Как правило, они содержат 2 сигнала для активации, один сигнал доставляется посредством BCR (мембраносвязанной формой реаранжированного иммуноглобулина), а другой доставляется через CD40 или другую совместно стимулирующую молекулу. Этот второй сигнал может быть обеспечен за счет взаимодействия с хелперными Т-клетками, которые экспрессируют лиганд для CD40 (CD40L) на своей поверхности. В-клетки затем пролиферируют и могут подвергаться соматической гипермутации, если происходят произвольные изменения в нуклеотидных последовательностях генов антител, и отбирают В-клетки, чьи антитела характеризуются более высокой аффинностью к В-клеткам. Они также могут подвергаться «переключению классов», при котором константный участок тяжелой цепи, кодирующий изотип IgM, переключается на константный участок, кодирующий изотипы IgG, IgA или IgE.
Дифференцировка В-клеток может завершаться В-клетками памяти, которые обладают обычно более высокой аффинностью и переключением классов, хотя некоторые В-клетки памяти все же принадлежат изотипу IgM. В-клетки памяти также могут стать активированными и дифференцироваться в плазмобласты, а, в конечном счете, в плазматические клетки. Дифференцирующиеся В-клетки могут также сначала стать плазмобластами, которые затем дифференцируются, становясь плазматическими клетками.
Созревание аффинности и клональные семейства
[00229] Клональное семейство, как правило, определяется путем применения родственных последовательностей тяжелой цепи и/или легкой цепи V(D)J иммуноглобулина по 2 или более образцам. Родственные последовательности тяжелой цепи V(D)J иммуноглобулина могут быть идентифицированы по их совместному использованию генных сегментов V(D)J, закодированных в геноме. В клональном семействе обычно есть подсемейства, которые варьируют на основе общих мутаций в их сегментах V(D)J, которые могут возникнуть во время генной рекомбинации и соматической гипермутации В-клетки.
[00230] Активированные В-клетки мигрируют и образуют зародышевые центры в лимфоидных или других тканях, в которых они подвергаются созреванию аффинности. В-клетки могут также подвергаться созреванию аффинности за пределами зародышевых центров. Во время созревания аффинности В-клетки подвергаются произвольным мутациям в их генах антител, сосредоточенных в определяющих комплементарность участках (CDR) генов, которые кодируют те части антитела, которое непосредственно связывает и распознает целевой антиген, против которого В-клетка была активирована. Это создает субклоны от исходной пролиферирующей В-клетки, экспрессирующей иммуноглобулины, которые немного отличаются от исходного клона и друг от друга. Клоны конкурируют за антиген, и отбирают клоны с более высокой аффинностью, в то время как клоны с более низкой аффинностью погибают из-за апоптоза. Этот процесс приводит к «созреванию аффинности» В-клеток и, следовательно, к образованию В-клеток, экспрессирующих иммуноглобулины, которые связываются с антигеном с более высокой аффинностью. Все В-клетки, которые происходят от одной и той же «родительской» В-клетки, формируют клональные семейства, и эти клональные семейства содержат В-клетки, которые распознают одинаковые или сходные антигенные эпитопы. Некоторые аспекты относятся к предположению, что присутствующие с более высокой частотой клоны представляют собой клоны, которые связываются с антигеном с более высокой аффинностью, поскольку клоны с самой высокой аффинностью отбираются во время созревания аффинности. Некоторые аспекты относятся к клонам с различным используемым сегментом V(D)J, которые проявляют различные характеристики связывания. Некоторые аспекты относятся к клонам с одинаковым используемым сегментом V(D)J, но с различными мутациями, которые проявляют различные характеристики связывания.
В-клетки памяти
[00231] В-клетки памяти являются, как правило, аффинно созревшими В-клетками и могут характеризоваться переключением классов. Это клетки, которые могут более оперативно реагировать на последующую антигенную провокацию, значительно сокращая время для секреции аффинно созревшего антитела против антигена от ~ 14 дней в интактном организме до ~ 7 дней.
Плазмобласты и плазматические клетки
[00232] Плазматические клетки могут быть либо долгоживущими, либо короткоживущими. Долгоживущие плазматические клетки могут выживать в течение всего времени жизни организма, в то время как время жизни короткоживущих плазматических клеток может составлять 3-4 дня. Долгоживущие плазматические клетки находятся либо в областях воспаления, в областях слизистых оболочек (в случае секретирующих IgA плазматических клеток), во вторичных лимфоидных тканях (таких как, селезенка или лимфатические узлы), либо в костном мозге. Для достижения этих дивергирующих областей плазмобласты должны стать долгоживущими плазматическими клетками, способными сначала пройти через кровоток перед использованием различных хемокиновых градиентов для перехода в соответствующие области. Плазмобласты представляют собой клетки, которые являются аффинно зрелыми, как правило, характеризуются переключением классов и обычно секретируют антитела, хотя, как правило, в меньших количествах, чем количество продуцируемого плазматическими клетками антитела. Назначением плазматических клеток является секреция антител.
Характеристики генов TCR и BCR
[00233] Поскольку идентифицирующие рекомбинации присутствуют в ДНК каждой отдельной адаптивной иммунной клетки, так же как связанные с ними транскрипты РНК, как РНК, так и ДНК могут быть секвенированы. Рекомбинантная последовательность из Т-клетки или В-клетки также может быть названа клонотипом. ДНК или РНК может соответствовать последовательностям из генов Т-клеточного рецептора (TCR) или генов иммуноглобулина (Ig), которые кодируют антитела. Например, ДНК и РНК могут соответствовать последовательностям, кодирующим цепи альфа, бета, гамма или дельта TCR. В большинстве Т-клеток TCR представляет собой гетеродимер, состоящий из цепи альфа и цепи бета. Цепь альфа TCR образуется при рекомбинации VJ, а рецептор цепи бета образуется при рекомбинации V(D)J. В цепи бета TCR человека существует 48 сегментов V, 2 сегмента D и 13 сегментов J. В каждом из двух соединительных участков некоторые основания могут быть удалены, а другие добавлены (называемые нуклеотидами N и Р). В немногих Т-клетках TCR состоят из цепей гамма и дельта. Цепи гамма TCR образуются при рекомбинации VJ, а дельта цепь TCR образуются при рекомбинации V(D)J (Kenneth Murphy, Paul Travers, and Mark Walport, Janeway's Immunology 7th edition, Garland Science, 2007, которая включена в настоящий документ посредством ссылки во всей своей полноте).
[00234] ДНК и РНК, анализируемые в способах, могут соответствовать последовательностям, кодирующим тяжелые цепи иммуноглобулинов (IgH) с константными участками (альфа, дельта, гамма, эпсилон или мю) или легкие цепи иммуноглобулинов (IgK или IgL) с константными участками лямбда или каппа. Каждое антитело может иметь две идентичные легкие цепи и две идентичные тяжелые цепи. Каждая цепь состоит из константного (С) и вариабельного участка. В тяжелой цепи вариабельный участок состоит из вариабельного (V), разнообразного (D) и соединительного (J) сегментов. В геноме присутствуют несколько отличающихся кодирующих последовательностей для каждого типа данных сегментов. Событие специфичной рекомбинации VDJ происходит во время развития В-клетки, заставляя эту клетку образовывать специфичную тяжелую цепь. Разнообразие в легкой цепи обеспечивается таким же образом, за исключением того, что происходит рекомбинация только VJ, а не участка D. Соматическая мутация часто происходит близко к сайту рекомбинации, вызывая добавление или делецию нескольких нуклеотидов, дополнительно увеличивая разнообразие тяжелых и легких цепей, образуемых В-клетками. Возможное разнообразие антител, образуемых В-клеткой, является результатом различных тяжелых и легких цепей. Вариабельные участки тяжелой и легкой цепей способствуют образованию участка или сайта распознавания (или связывания) антигена. Дополнением к этому разнообразию является процесс соматической гипермутации, который может происходить после специфичного ответа против определенного эпитопа. В этом процессе мутации происходят в тех В-клетках, которые способны распознавать специфичный эпитоп, что ведет к большему разнообразию в антителах, которые могут быть способными сильнее связывать специфичный эпитоп. Все эти факторы способствуют большому разнообразию антител, образуемых В-клетками. Может быть образовано несколько миллиардов, а может быть и более триллиона, отличающихся антител. Основная предпосылка для возникновения разнообразия Т-клеток аналогична предпосылке образования антител В-клетками. Элементом активации Т-клетки и В-клетки является их связывание с эпитопами. Активация специфичной клетки приводит к продуцированию более одного типа клеток, что приводит к клональной экспансии.
[00235] Определяющие комплементарность участки (CDR) или гипервариабельные участки являются последовательностями в вариабельных доменах антигенных рецепторов (например, Т-клеточного рецептора и иммуноглобулина), которые могут связывать антиген. Цепь каждого антигенного рецептора содержит три CDR, (CDR1, CDR2 и CDR3). Два полипептида, обеспечивающие Т-клетки (альфа и бета), и иммуноглобулин (IgH и IgK или IgL) способствуют образованию этих трех CDR.
[00236] Часть CDR1 и CDR2, которая кодируется TCR-бета, находится в одном из 47 функциональных сегментов V. Наибольшее разнообразие CDR наблюдается в CDR3, при этом разнообразием создается событиями соматической рекомбинации во время развития Т-лимфоцитов.
[00237] Большое разнообразие BCR наблюдается между индивидуумами и у одного индивидуума. BCR состоит из двух генов IgH и IgK (или IgL), кодирующих тяжелые и легкие цепи антитела. Три последовательности определяющего комплементарность участка (CDR), которые связывают антигены и молекулы МНС, характеризуются наибольшим разнообразием в IgH и IgK (или IgL). Часть CDR1 и CDR2, кодируемых IgH, находится в одном из 44 функциональных сегментов V. Наибольшее разнообразие в наивных В-клетках возникает при образовании CDR3 посредством событий соматической рекомбинации во время разработки В-лимфоцитов.
При рекомбинации могут образовываться молекулы с каждым из сегментов V, D и J. В организме человека существует 44 сегмента V, 27 D и 6 J, таким образом, существует теоретическая вероятность более 7000 комбинаций. В небольшой фракции BCR (приблизительно 5%) находятся два сегмента D. Кроме того, несколько оснований могут быть удалены, а другие добавлены (называемые нуклеотидами N и Р) в каждом из двух соединительных участков, образующих большую степень разнообразия. После активации В-клеток происходит процесс созревания аффинности посредством соматической гипермутации. В этом процессе клетки-потомки активированных В-клеток накапливают отличающиеся соматические мутации по всему гену с высокой концентрацией мутаций в участках CDR, что ведет к образованию антител с более высокой аффинностью к антигенам. В дополнение к соматической гипермутации активированные В-клетки подвергаются процессу переключения изотипа. Антитела с теми же вариабельными сегментами могут иметь различные формы (изотипы) в зависимости от константного сегмента. В то время как все наивные В-клетки экспрессируют IgM (или IgD), активированные В-клетки экспрессируют в основном IgG, но также и IgM, IgA и IgE. Эта экспрессия, переключающаяся с IgM (и/или IgD) на IgG, IgA или IgE, происходит благодаря событию рекомбинации, что приводит к специализации одной клетки по продуцированию специфичного изотипа. Существует один сегмент для каждого IgM, IgD и IgE, два сегмента для IgA, и четыре сегмента для IgG.
Способы
Применение в здравоохранении и применения в биотехнологии
[00238] Использование описанных в настоящем документе композиций и способов для идентификации антител и TCR, а также для группировки последовательностей антител и TCR в клональные семейства находит много полезных и новых применений в здравоохранении и биотехнологическом исследовании. Клональные семейства антител могут содержать с созревшей аффинностью неидентичные клоны и клональные семейства TCR, которые могут содержать идентичные клоны. Такие применения включают без ограничения 1) открытие и разработку терапевтических средств из антитела или производных антитела, 2) открытие и разработку диагностики; 3) открытие и развитие исследовательских инструментов, используемых в медицинских и биотехнологических исследованиях, а также 4) разработку и оценку кандидатных вакцин, а также идентификацию антигенов, используемых в качестве компонентов вакцин.
[00239] Поскольку настоящее изобретение может быть использовано с любым типом В- или Т-клетки, исходная клетка и специфичный подтип(ы) В- или Т-клеток выбирают на основе профиля желаемого конечного продукта. Примеры специфичных подклассов В- или Т-клеток и их применение описаны в подразделе «Выделение и обогащение клеток и клеточных субпопуляций» в разделе «Общие материалы и способы». В целом, эти клетки могут быть от конкретного человека или животного, характеризующегося конкретным клиническим состоянием или течением заболевания, или получившего конкретную схему лечения, или, подвергшегося воздействию конкретной провокации, иммунизации или ряду состояний, которые индуцируют иммунный ответ.
Применение для открытия и развития терапевтических, диагностических и исследовательских инструментов
[00240] Для разработки антитела или молекулы, полученной из антитела, для применения в качестве терапевтических, диагностических или исследовательских инструментов антитело и/или производные связывающих антиген участков антитела сначала могут быть идентифицированы или обнаружены как связывающие желаемый антиген(ы) или эпитоп(ы) и/или характеризующиеся желаемым функциональным результатом в in vivo или in vitro системах. Эти кандидатные антитела затем дополнительно скринируют по другим желаемым свойствам, специфичным для предполагаемого продукта. Эти свойства целевого продукта будут различными для разных типов антител - терапевтических, диагностических и исследовательских инструментов, и в соответствии с настоящим изобретением обеспечивают применимое средство идентификации кандидатов для дальнейшей разработки любого из этих путей продуцирования.
[00241] На основе желаемого профиля свойств конечного продукта источником соответствующих В-клеток может быть без ограничения больной с заболеванием, таким как инфекционное заболевание, злокачественное заболевание или аутоиммунное состояние; больной, получающий лечение, такое как противораковая терапия или вакцина, или животное с заболеванием или получающее лечение путем индуцирования иммунного ответа, такое как иммунизация или индукция/установление модели заболевания.
[00242] Как правило, кандидатные антитела или кандидатные макромолекулы, полученные из связывающих антиген участков, которые предназначены для разработки в качестве терапевтических, диагностических или исследовательских инструментов, обнаруживают с помощью многочисленных технологий, которые попадают в один из двух общих подходов: 1) выделение представляющих интерес антител из В-клеток иммунного ответа у человека или животного и 2) выделение антител, полученных из экспрессионных библиотек молекул иммуноглобулинов или их производных, гетерологично экспрессированных и скринированных с помощью одной или нескольких технологий с использованием дисплеев (рассматриваемых в Hoogenboom HR, Trends Biotechnol., 1997, 15:62-70; Hammond PW, MAbs, 2010, 2:157-64; Nissim A, Chernajovsky Y, Handb Exp Pharmacol., 2008, (181):3-18; Steinitz M, Hum Antibodies, 2009;18:1-10; Bradbury AR, Sidhu S, Dübel S, and McCafferty, Nat Biotechnol., 2011, 29:245-54; Antibody Engineering (Kontermann RE and Dübel S eds., Springer, 2nd edition)).
[00243] Для первого подхода (№ 1) кандидатные антитела отбирают из конкретных клональных семейств, идентифицированных от соответствующих доноров, как описано, например, в разделе «Общие материалы и способы». Настоящее изобретение может быть применено в соответствии с описанным для приемлемых В-клеток (например, бластоподобных В-клеток) от приемлемого донора-человека или животного для обнаружения или идентификации кандидатных антител. Например, для противоракового терапевтического кандидатного антитела приемлемым донором-человеком может быть больной, у которого успешно подавили прогрессирование злокачественного заболевания с помощью иммунного ответа; или для конкретного диагностического кандидатного антитела приемлемым донором может быть пациент, у которого есть аутоантитела к диагностическому маркеру, или мышь, иммунизированная против маркера; или для кандидатного инструмента-реагентного антитела приемлемым донором может быть мышь, кролик, коза, крыса, лошадь, курица, собака или другое животное, иммунизированное целевой молекулой и/или эпитопом, при этом реагентное антитело предназначено для распознавания. Последовательности и отбор антител для экспрессии и тестирования могут быть выполнены, как описано в разделе «Общие материалы и способы». Такие применения технологии могут обеспечить кандидатные антитела, часто получаемые с помощью более трудоемких и времязатратных способов (например, гибридомной технологии, индуцированной вирусом иммортализации В-клеток и т.д.).
[00244] Для второго подхода (№ 2) использовали подгруппу или весь набор спаренных последовательностей тяжелой и легкой цепей от одного или нескольких репертуаров антител человека или животного, полученных согласно подходу № 1, для отбора экспрессионных библиотек, содержащих сигнальные участки, чтобы отслеживать происхождение образца и исходные родственные пары из образца при секвенировании библиотеки и/или отобранной/обогащенной подгруппы из библиотеки с использованием платформы секвенирования следующего поколения. Информация о вариабельных участках и каркасном участке может быть включена в одном или нескольких форматах дисплейной библиотеки антител для обнаружения кандидатных антител. Вариабельные участки генов Ig могут быть клонированы и встроены в векторы экспрессии с использованием способов, описанных в подразделе «Клонирование и экспрессия клонированных пар легкой и тяжелой цепей иммуноглобулина» в разделе «Общие материалы и способы». Например, фрагменты и/или домены от родственных пар тяжелой и легкой цепей, полученных как согласно № 1, могут быть использованы для отбора дрожжевой Fab (Weaver-Feldhaus JM, Lou J, Coleman JR, et al., FEBS Lett, 2004, 564:24-34) или фагмидной (Kashyap AK, Steel J, Oner AF, et al., Proc Natl Acad Sci USA, 2008, 105:5986-91) библиотек с сигнальным участком, позволяющим отслеживать каждую цепь для соответствующей первоначальной В-клетки источника, независимо от комбинаторного совпадения различных тяжелых и легких цепей при неэндогенных (неродственных) спариваниях. Родственные пары тяжелых и легких цепей, полученные согласно № 1, также могут быть использованы с другими дисплейными платформами, отличными от фагмидных или дрожжевых, и могут быть использованы с другими экспрессионными конструкциями производных антител, отличными от экспрессионных конструкций фрагментов Fab [Antibody Engineering (Kontermann, RE and Dübel S eds., Springer, 2nd edition)]. В альтернативном применении сигнальных участков сигнальные участки могут быть добавлены к уже существующим дисплейным библиотекам, чтобы обеспечить преимущества отслеживающих сигнальных участков и коррекцию ошибок данных секвенирования технологией следующего поколения. В зависимости от типа библиотеки, формата и системы экспрессии/дисплея сигнальные участки могут быть встроены с использованием PCR-реакций или обратной транскриптазы с последующими PCR-реакций (см., например, подраздел «Секвенирование спаренных легкой и тяжелой цепей генов иммуноглобулина от отдельных В-клеток» в разделе «Общие материалы и способы»).
[00245] Кандидатные антитела или из репертуаров В-клеток (см., например, раздел «Общие материалы и способы»), или из «репертуаров» дисплейной экспрессионной библиотеки (Kashyap АК, Steel J, Oner AF, et al., Proc Natl Acad Sci U S A, 2008, 105:5986-91; Weaver-Feldhaus JM, Lou J, Coleman JR, et al., FEBS Lett, 2004, 564:24-34; Ravn U, Gueneau F, Baerlocher L, et al., Nucleic Acids Res, 2010, 38:el93; Antibody Engineering (Kontermann, RE and Dübel S eds., Springer, 2nd edition) идентифицируют по экспрессии и тестированию антитела или происходящих из антител молекул, или библиотек молекул в анализах на связывание против желаемого антигена/цели(ей) и/или эпитопа(ов), или в анализах тестирования функционального проявления в условиях in vivo или in vitro (в том числе ex vivo образцы/препараты). В опубликованных отчетах описывали применение сигнальных участков для отслеживания донорского источника последовательностей антитела, полученных из репертуара В-клеток, для применения в экспрессионной библиотеке (например, Kashyap АК, Steel J, Oner AF, et al., Proc Natl Acad Sci USA, 2008, 105:5986-91). Описанная в настоящем документе технология сигнальных участков однозначно обеспечивает применимые усовершенствования при использовании такого сигнального участка. В соответствии с настоящим изобретением 1) обеспечивают средство для отслеживания не только каждого донора, но и каждой В-клетки донора для родственного спаривания тяжелой и легкой цепей; 2) обеспечивают средство для индексирования обратно по образцу исходной В-клетки для поиска дополнительного образца для клонирования и/или тестирования; 3) обеспечивают средство отслеживания происхождения тяжелой и легкой цепей, несмотря на неродственные комбинаторные спаривания в экспрессионной библиотеке; 4) обеспечивают средство отслеживания происхождения тяжелой и легкой цепей по всем циклам отбора/обогащения (например, при мониторинге эволюции последовательности при отборе пула in vitro, например, как в Ravn U, Gueneau F, Baerlocher L, et al., Nucleic Acids Res, 2010, 38:el93).
[00246] Было показано, что идентификация наиболее часто представленных последовательностей тяжелой или легкой цепей в репертуаре В-клеток иммунной реакции и объединение пар тяжелой и легкой цепей на основании порядка ранжирования частоты отдельных цепей является реальным способом идентификации некоторых кандидатных антител, несмотря на тот факт, что информация о родственной паре не сохраняется в анализах с секвенированием технологией следующего поколения, осуществляемых таким образом (Reddy ST, Ge X, Miklos ΑΕ, et al., Nat Biotechnol, 2010, 28:965-9). В соответствии с настоящим изобретением также обеспечивают метод анализа частоты для данного типа, а кроме того, можно обеспечивать средство для использования секвенирования технологией следующего поколения для оценки частоты фактических антител в репертуаре, а не просто выделенных независимых тяжелой или легкой цепей.
[00247] Кроме того, в соответствии с настоящим изобретением обеспечивают по меньшей мере три улучшения значительной применимости помимо частотного анализа 1) поскольку родственное спаривание тяжелой и легкой цепей может отслеживаться, обнаружение фактических антител от иммунной реакции и клональных семейств фактического антитела, произведенных В-клетками при иммунной реакции, может быть идентифицировано (клон включает в себя специфичную, родственную пару тяжелой и легкой цепей, которые совместно эволюционировали из одних и тех же клеток-предшественников, и информация о естественных спариваниях в процессе созревания аффинности улучшила бы подходы, описанные в литературе для анализа иммунных реакций с использованием секвенирования технологией следующего поколения [например, Wu X, Yang ZY, Li Y, Hogerkorp CM, et al., Science, 2010, 329:856-61]); 2) сигнальные участки обеспечивают средства для минимизации или даже устранения влияния на анализы последовательностей ошибок секвенирования, общих для платформ секвенирования следующего поколения (см., например, подраздел «Другие опции анализа данных секвенирования» в разделе «Общие материалы и способы»), и 3) сигнальные участки обеспечивают способность связывать и отслеживать >2 последовательностей, совместно экспрессированных на уровне отдельной клетки.
[00248] Для тех кандидатньгх антител, которые были идентифицированы, как обладающие желаемыми свойствами связывания с антигеном, целью или эпитопом или как обладающие желаемым функциональным эффектом, можно клонировать и экспрессировать больше антител из соответствующего клонального семейства (см., например, раздел «Общие материалы и способы») для тестирования присутствия подобных, но потенциально более оптимальных антител или антител, которые являются одинаковыми по связыванию или функциональным свойствам, но содержат другое отличие, важное для профиля конечного продукта.
[00249] Для случаев, при которых кандидатов идентифицируют из дисплейных экспрессионных библиотек, сигнальные участки могут обеспечить средства для идентификации антител потенциально подобной последовательности к кандидатам путем идентификации последовательностей, которые не были отобраны в скрининге/обогащении, но которые содержат сигнальные участки идентифицированных кандидатов и, таким образом, являются полученными из одних и тех же исходных тяжелой и/или легкой цепей, которые отбирают библиотеку. Антитела, которые теряются в циклах in vitro отбора, но подобны отобранным кандидатным антителам, могут быть восстановлены или «спасены» для дальнейшего анализа в качестве потенциальных кандидатов. Такое спасение может устранить эффект смещения в системах экспрессии или анализа, которые могут пропустить полезные и функциональные антитела (Ravn U, Gueneau F, Baerlocher L, et al., Nucleic Acids Res, 2010, 38:el93).
[00250] Как только кандидаты с желаемым связыванием и/или функциональными свойствами идентифицированы, их можно подвергать соответствующим анализам и другим оценкам на основе желаемого профиля дальнейшего продукта. Для терапевтических антител, предназначенных для применения в пассивной иммунизации, кандидаты подвергают анализу и доклиническому тестированию на моделях с целью определения лучших кандидатов для клинического тестирования на людях или для применения в ветеринарии, в том числе без ограничения для оценок свойств, таких как стабильность и агрегация, легкость составления и дозирования, экспрессия и изготовление белка, видовая селективность, фармакологические, фармакокинетические свойства, безопасность и токсикология, абсорбция, метаболизм и оборот цель-антитело, а также иммуногенность [см., например, Lynch CM, Hart BW, and Grewal IS, MAbs, 2009, 1: 2-11; Chapman K, Pullen N, Coney L, et al., mAbs, 2009, 1, 505-516; S. Dübel, Handbook of Therapeutic Antibodies: Technologies, Emerging Developments and Approved Therapeutics (John Wiley & Sons, 2010); Therapeutic Monoclonal Antibodies: From Bench to Clinic, (Z. An ed., John Wiley & Sons, 2009) Antibody Engineering (Kontermann RE and Dübel S eds., Springer, 2nd edition)]. Таким образом, отбирают много кандидатов, потому что большинство будут непригодными для терапевтического тестирования на людях в отношении по меньшей мере одного из множества свойств, которые должны быть оценены до тестирования на людях (т.е. потеряны). Клональные семейства могут быть получены, например, как описано выше, для кандидатов, подобных тем, которые уже охарактеризованы, но, возможно, несущих различия в отношении одного или нескольких свойств, которые оцениваются в доклинической работе. Для оптимизации определенных свойств должны быть использованы стратегии конструирования специфичных антител [Antibody Engineering (Kontermann RE and Dübel S eds., Springer, 2nd edition)].
[00251] Для диагностических целей настоящее изобретение может быть использовано в идентификации антител, TCR и клональных семейств, произведенных инфекцией или вакцинацией, для применения в выявлении инфекционных средств (Selvarajah S, Chatterji U, Kuhn R, et al., 2012, 6:29-37; Berry JD, Vet J, 2005, 170:193-211), a также для любого неинфекционного заболевания, патологического состояния или медицинского лечения или терапии. Такие антитела, TCR и/или клональные семейства могут обеспечить полезные диагностические зонды для биомаркеров или обеспечить иммунную систему информацией о состоянии заболевания или эффекта лечения человека или животного. Как таковые специфичные антитела, или TCR, или специфичные клональные семейства любого класса иммунного рецептора могут обеспечить применимость для диагностических инструментов и персонализированной медицины. В другом применении для диагностических целей известное заболевание или биомаркеры ответа на лечение могут быть использованы в качестве иммуногенов для иммунизации мышей и других животных, из которых собирают В-клетки для идентификации антител (см., например, раздел «Общие материалы и способы») против биомаркера, которые впоследствии могут быть использованы в диагностических тестах, таких как ELISA или другие иммунологические анализы (Selvarajah S, Chatterji U, Kuhn R, et al., 2012, 6:29-37). После того, как идентифицированы как обладающие потенциальной диагностической применимостью, кандидатные антитела, TCR и/или клональные семейства могут быть подвергнуты анализам, моделям и, возможно, испытаниям на соответствие желаемому профилю диагностического продукта [Berry JD, Vet J, 2005, 170:193-211; Diagnostic and Therapeutic Antibodies in Methods in Molecular Medicine, Vol. 40 (George AJT and Urch CE eds., Humana Press); Antibody Engineering (Kontermann RE and Diibel S eds., Springer, 2nd edition); Colwill K, Renewable Protein Binder Working Group, and Grâslund S, Nat Methods, 2011, 8:551-8; Pershad K, Pavlovic JD, Grâslund S, et al., Protein Eng Des Sel, 2010, 23:279-88]. Для оптимизации определенных свойств должны быть использованы стратегии конструирования специфичных антител [Antibody Engineering (Kontermann RE and Dübel S eds., Springer, 2nd edition)].
[00252] Для инструмента исследования антител идентифицированные кандидаты, например, как описано выше, могут быть подвергнуты тестированию того, как они работают при применении в исследованиях, для чего и предназначено антитело-исследовательский инструмент (например, при иммунопреципитации; иммуноблотинге; иммуноокрашивании и гистологии, иммуноаффинной очистки, детекционных иммунологических анализах с захватом и «сэндвич», например, как описано в Antibodies: A Laboratory Manual, Ε Harlow and D Lane (Cold Spring Harbor Laboratory Press, 1988). Критерий оценки будет основан на конечном применении предполагаемого исследования (Colwill К, Renewable Protein Binder Working Group, and Grâslund S, Nat Methods, 2011, 8:551-8; Pershad K, Pavlovic JD, Grâslund S, et al., Protein Eng Des Sel, 2010, 23:279-88). Для оптимизации определенных свойств должны быть использованы стратегии конструирования специфичных антител [Antibody Engineering (Kontermann RE and Dübel S eds., Springer, 2nd edition)].
Применение для открытия и разработки вакцины
[00253] Настоящее изобретение может быть использовано для идентификации антител, TCR и клональных семейств каждого из этих классов иммунного рецептора для вакцинной провокации у человека или животного. Специфичные антитела могут быть использованы в качестве зондов для идентификации компонента(ов) вакцины, распознаваемого антителом и клональным семейством, к которому принадлежит антитело, которое было использовано в качестве зонда. Эта информация об антителе и клональных семействах может быть использована для осуществления оценок пропорций или силы иммунной реакции, нацеленной на конкретные антигены и/или эпитопы вакцины. Оценка иммунных реакций антитела на различные компоненты вакцины может быть дополнена информацией, собранной о сопутствующем ответе репертуара TCR на вакцину (см., например, подразделы «Для других типов клеток» и «PCR других тяжелых цепей иммуноглобулина и цепей Т-клеточного рецептора (TCR)» в разделе «Общие материалы и способы»). Эта информация может быть впоследствии использована для понимания того, какие компоненты вакцины, или какие варианты вакцины, или какие адъюванты производят эффективные и более оптимальные ответы иммунной системы человека или животного (Haynes BF, Gilbert PB, McElrath MJ, et al., N Engl J Med, 2012, 366:1275-86). Данный подход также может быть использован для сравнения индивидуумов или популяций по их реакции на вакцину.
[00254] Подобный анализ может быть выполнен для идентификации и оценки антител, TCR, и клональных семейств, которые произведены в ответ на фактический патоген, и которые могут коррелировать с представляющими интерес клиническими результатами, такими как защитные реакции на инфекцию (например, для идентификации антител от выживших при тяжелой пандемии гриппа, Yu X, Tsibane Τ, McGraw ΡΑ, et al., Nature, 2008, 455:532-6; или для идентификации специфичных антител от ВИЧ-инфицированных индивидуумов с широко ВИЧ-нейтрализующей сывороткой, Wu X, Yang ZY, Li Y, Hogerkorp CM, et al., Science, 2010, 329:856-61, и Walker LM, Phogat SK, Chan-Hui PY, et al., Science, 2009, 326:285-9). Идентификация таких коррелятов защиты может сравниваться с реакцией, полученной от вакцины и/или специфичных компонентов вакцины, как описано выше, и два набора данных могут сравниваться для оценки способности вакцины производить иммунные реакции, которые коррелируют с желаемыми результатами, наблюдаемыми в случае фактической инфекции.
[00255] Таким образом, настоящее изобретение обеспечивает применимое средство получения суррогатного считывания защиты от заболевания и реакции на вакцину путем анализа антитела и/или последовательности репертуара TCR, прежде чем человек или животное будут спровоцированы фактической инфекцией. Как только клональное семейство идентифицировано как связывающее конкретный антиген или эпитоп, становится возможной идентификация антигенов или эпитопов, на которые нацелены другие репертуары иммунной реакции, без выполнения анализов в случаях, когда такие же или подобные клональные семейства встречаются в репертуарах. Таким образом, в тех случаях, когда достаточно информации о клональном семействе и известно его связывание антигена/эпитопа (см., например, подраздел «Скрининг экспрессированных человеческих антител» в разделе «Общие материалы и способы»), анализ последовательности только вновь анализируемых репертуаров может обеспечить считывание антигенов данного репертуара для известных содержащихся клональных семейств. Такое применение может служить применимым средством для контроля реакций по одному, нескольким или многим субъектам в клинических испытаниях вакцин и для контроля взаимосвязи иммунности и инфекционного заболевания на уровне одного, нескольких или многих человек в популяции.
[00256] Кроме того, антитело, TCR и клональные семейства, которые коррелируют с защитой от патогена, могут быть использованы для идентификации специфичных антигенов и наборов антигенов (в том числе известных и новых антигенов), которые опосредуют защитные и/или эффективные иммунные реакции против патогена. Идентификация целевых антигенов в эффективных иммунных реакциях может быть использована, чтобы направлять отбор антигенов, подлежащих включению в вакцины, которые, как ожидается, будут производить защитные опосредованные антителами и TCR реакции у иммунизированных людей или животных.
[00257] Антитела, TCR и клональные семейства, которые не связывают известные антигены в анализах, становятся кандидатами для идентификации потенциально новых антигенов и/или эпитопов патогена, против которого антитела и/или TCR обеспечивают защиту. Антитела, как известно, не связывающие уже известные антигены, могут быть использованы в качестве зондов в сочетании с иммуносепарацией и масс-спектроскопией для идентификации ранее неидентифицированных антигена или эпитопа (Zhu YZ, Cai CS, Zhang W, et al., PLoS One, 2010, 5:el3915; а также см., например, подразделы «Иммунопреципитация антигенов стафилококка с антителами, полученными от инфицированных стафилококком больных» и «Масс-спектрометрическая идентификация пептидов» в разделе «Общие материалы и способы»). Такие новые антигены или эпитопы можно использовать в качестве компонентов вакцины, которые, как предполагается, будут продуцировать или способствовать продуцированию защитных опосредованных антителом и TCR ответов у иммунизированных людей или животных.
[00258] В дополнение к упрощению разработки вакцин против микробных патогенов антитело, TCR и клональные семейства могут быть также использованы для разработки противоопухолевых вакцин. У людей или животных, у которых поддерживается иммунная реакция против раковых или предраковых клеток, можно получать антитела, TCR и клональные семейства, которые могут быть использованы для идентификации отдельных антигенов и их комбинаций, которые могут быть включены в профилактические или терапевтические вакцины против злокачественного заболевания.
Способы получения одного или нескольких представляющих интерес полинуклеотидов
[00259] Некоторые аспекты относятся к способу, включающему получение библиотеки кДНК, содержащей множество кДНК, ассоциированных с множеством образцов, полученных от одного или нескольких субъектов, при этом каждая кДНК ассоциирована с отдельным образцом во множестве образцов, и при этом каждая кДНК, ассоциированная с каждым образцом, находится в отдельном контейнере; добавление адаптерной молекулы к кДНК, ассоциированной с каждым образцом, при этом адаптерная молекула содержит сигнальный участок образца и адаптерный участок, при этом сигнальный участок образца соединяется с адаптерным участком, при этом последовательность сигнального участка образца каждой адаптерной молекулы отличается от последовательности сигнального участка образца других адаптерных молекул, добавленных к каждой кДНК в библиотеке; и обеспечение присоединения адаптерного участка к каждой кДНК в библиотеке для продуцирования одного или несколько представляющих интерес полинуклеотидов.
[00260] Некоторые аспекты относятся к получению библиотеки кДНК, включающему получение множества образцов и обработку образцов для получения библиотеки кДНК. Некоторые аспекты относятся к получению библиотеки кДНК, включающему получение библиотеки кДНК непосредственно или опосредованно из третьей стороны, которая обработала множество образцов для получения библиотеки кДНК.
[00261] Некоторые аспекты относятся к адаптерной молекуле, которая дополнительно содержит универсальный праймерный участок, при этом 3'-конец универсального праймерного участка соединяется с 5'-концом сигнального участка образца. В некоторых аспектах каждый участок кДНК содержит полинуклеотид mRNA, гибридизированный с полинуклеотидом кДНК.
[00262] В некоторых аспектах каждый образец содержит клетку. Некоторые аспекты относятся к клетке, которая является В-клеткой. Некоторые аспекты относятся к В-клетке, которая является плазмобластом, В-клеткой памяти или плазматической клеткой. В некоторых аспектах каждый образец содержит множество клеток.
[00263] В некоторых аспектах каждый адаптерный участок присоединяется к каждой кДНК посредством связывания, например, связывания G:C.
[00264] Некоторые аспекты относятся к адаптерной молекуле, которая является однонитевой и, кроме того, содержит встраивающую адаптерную молекулу в каждой кДНК, что позволяет ферменту делать адаптерную молекулу двухнитевой. Некоторые аспекты относятся к адаптерной молекуле, которая встраивается в каждую кДНК для продуцирования представляющего интерес полинуклеотида с помощью обратной транскриптазы MMLV H".
[00265] Некоторые аспекты относятся к способам, которые могут включать стадии амплификации, такие как PCR и другие реакций амплификации, как правило, известные в уровне техники.
Способы присоединения и штрих-кодирования представляющих интерес полинуклеотидов
[00266] Некоторые аспекты относятся к способу, включающему присоединение двух представляющих интерес полинуклеотидных последовательностей, например, легкой цепи (LC) и тяжелой цепи (НС) антитела из отдельного образца, а также обеспечение одного или нескольких штрих-кодов или последовательностей сигнальной последовательности. Этот аспект относится к обеспечению физического связывания между представляющими интерес полинуклеотидными последовательностями, а также одним или несколькими штрих-кодами для обеспечения идентификатора, чтобы позволить определение полинуклеотидных последовательностей, полученных из конкретного источника или образца, например, из отдельной клетки, лунки для образца, отдельного образца и т.п. Отдельные образцы могут содержать одну или несколько клеток, происходящих от В-клеток, или других типов клеток. Примеры способов соединения двух представляющих интерес полинуклеотидных последовательностей известны в уровне техники, например, из международных патентных публикаций WO 99/16904, WO 93/03151 и патента США № 7749697, которые включены в настоящий документ посредством ссылки. Наряду с другими преимуществами, связанными с применением штрих-кодов на связанных полинуклеотидных последовательностях, включают облегчение высокопроизводительного секвенирования и картирования последовательности обратно в исходный образец так, что он может быть повторно секвенирован и клонирован PCR для экспрессии полинуклеотидных последовательностей, например, полинуклеотидов НС и LC иммуноглобулина. Некоторые из высокопроизводительных технологий секвенирования демонстрируют коэффициенты ошибок секвенирования 1-10+%, а применение штрих-кодов позволяет повторить секвенирование матриц для облегчения биоинформатической коррекции ошибок. Это имеет особое значение для разграничения ошибок секвенирования от генных вариаций, таких как в полинуклеотидах иммуноглобулина. В частности, бывает трудно установить, являются ли на самом деле близкородственные последовательности отличающимися последовательностями, или представляют ли они собой вместо этого результат, произведенный ошибками секвенирования. Штрих-коды, обеспечивающие анализ повторного секвенирования отдельных матриц, тем самым, позволяют коррекцию ошибок секвенирования, обеспечивая, таким образом, определение того, являются ли последовательности отличающимися от результатов ошибки(ок) секвенирования.
Согласно одному варианту осуществления полинуклеотидные последовательности являются последовательностями НС и LC иммуноглобулина, которые дивергировали из-за соматической гипермутации и отличаются только 1 нуклеотидом.
[00267] Этот аспект относится к обычно получаемым физически связанным и имеющим штрих-код структурам, как показано на фиг. 15. На фиг. 15 иллюстрируется физическое связывание двух сегментов нуклеиновой кислоты А и В (например, двух кДНК). Штрих-код (ВС) добавляют к любому из концов или в линкер, соединяющий А и В. Такое физическое связывание А и В, а также добавление штрих-кода осуществляют с помощью любого из ряда средств, в том числе путем лигирования, рекомбинации, амплификации или перекрывания/удлинения или комбинацией этих способов, как описано более подробно ниже. Необязательно дополнительные штрих-коды могут быть добавлены к структуре, показанной на фиг. 15, с обеспечением штрих-кодирования соединения для облегчения секвенирования большого числа связанных полинуклеотидов с использованием меньшего числа штрих-кодов. Также следует иметь в виду, что в зависимости от конкретной используемой стратегии связывания двух сегментов нуклеиновой кислоты любая взаимная ориентация сегментов может быть получена по отношению к смысловой и антисмысловой ориентациям, т.е. сегменты, такие как кДНК, могут быть присоединены головой к хвосту, головой к голове или хвостом к хвосту.
[00268] Штрих-коды могут быть добавлены к полинуклеотидным последовательностям до, во время или после физического связывания с использованием известных в уровне техники способов. Эти способы включают без ограничения, например, способы лигирования, такие как лигирование тупых концов адаптеров штрих-кодов, и с использованием отжига и лигирования совместимых концов, таких как образуемые с помощью гомополимерного присоединения хвоста, расщепления линкера ферментами рестрикции или присоединения 3'-хвоста кДНК с помощью обратной транскриптазы. Штрих-коды также могут быть добавлены в реакции амплификации с использованием приемлемых праймеров, несущих последовательности штрих-кодов. Штрих-коды также могут быть добавлены в реакции обратной транскрипции с использованием приемлемых праймеров, содержащих последовательность штрих-кода. Штрих-коды также могут быть добавлены путем встраивания в олигонуклеотиды, используемые для связи представляющих интерес генов вместе, посредством перекрывания/удлинения хвостов или другими способами так, что они располагаются между двумя представляющими интерес генами.
Соответственно, с использованием этих способов штрих-коды могут быть встроены на концах физически связанных полинуклеотидных последовательностей или в линкерные последовательности, соединяющие две представляющие интерес полинуклеотидные последовательности.
[00269] Согласно одному варианту осуществления связывание осуществляется посредством применения перекрывания/удлинения (см. фиг. 16). В целом, перекрывающие/удлиненные хвосты представляют собой комплементарные последовательности, которые добавляют к представляющим интерес полинуклеотидным последовательностям для соединения. Отжиг перекрывающих/удлиненных хвостов, прилагаемых к представляющим интерес полинуклеотидным молекулам, обеспечивает их связывание (см. фиг. 17, 18, 19 и 20). Как описано ниже, перекрывающие/удлиненные хвосты могут быть добавлены с помощью ряда хорошо известных способов, в том числе без ограничения реакций синтеза полинуклеотидов, таких как амплификация нуклеиновых кислот и обратная транскрипция, лигирование и рекомбинация. Поскольку для эффективного связывания доступны различные способы, будет понятно, что могут быть получены различные взаимные ориентации сегментов полинуклеотида по отношению к смысловой и антисмысловой ориентациям, т.е. сегменты, например, тяжелая и легкая цепи антитела, могут быть соединены головой к хвосту, головой к голове или хвостом к хвосту.
[00270] Согласно одному варианту осуществления перекрывающие/удлиненные хвосты позволяют связывание полинуклеотидных последовательностей, образующихся в ходе реакции синтеза полинуклеотидов. Например, перекрывающие/удлиненные хвосты могут быть встроены в ходе реакций синтеза полинуклеотидов, таких как реакции амплификации или обратной транскрипции, с использованием праймеров, несущих перекрывающий/удлиненный хвост. В качестве альтернативы, могут быть использованы реакции лигирования. Как показано на фиг. 17, 18, 19 и 20, после отжига комплементарных перекрывающих/удлиненных хвостов ДНК заполняется в 5'-3'-направлении в течение фазы удлинения реакции синтеза полинуклеотидов, такой как PCR, с образованием двухнитевого полинуклеотида с двумя физически соединенными представляющими интерес полинуклеотидами.
[00271] В некоторых вариантах осуществления способ перекрывающей/удлиняющей RT-PCR обеспечивает одновременное связывание последовательностей, поскольку реакция протекает в одной пробирке, что, таким образом, устраняет необходимость в промежуточной очистке. В некоторых вариантах осуществления перекрывающий/удлиненный хвост содержит последовательность штрих-кода.
[00272] На фиг. 17 в общих чертах показан один пример применения перекрывающих/удлиненных хвостов для соединения полинуклеотидных последовательностей, кодирующих легкие и тяжелые цепи антитела, и для обеспечения по меньшей мере одного штрих-кода. Ниже обсуждаются другие способы, применимые для соединения двух представляющих интерес полинуклеотидных последовательностей. В этом примере после осуществления синтеза полинуклеотида, например, обратной транскрипции, применение специфичного для гена LC праймера PCR, содержащего штрих-код, необязательный сайт секвенирующего праймера и необязательный сайт рестрикции (REI), обеспечивает добавление этих элементов к концу получающегося в результате продукта PCR. Указываются праймеры, специфичные для LC (в одном варианте осуществления участок Vl) и НС (в одном варианте осуществления участок Vh) с удлиненными перекрытиями и кодирующие дополнительный сайт рестрикции (RE3). Согласно одному варианту осуществления LC содержит реаранжированный VJ с коротким сегментом константного участка или без такового, а НС содержит реаранжированный V(D)J с коротким сегментом константного участка тяжелой цепи или без такового. Согласно одному варианту осуществления перекрывающие/удлиненные праймеры также содержат последовательность штрих-кода. Также используют обратный праймер, специфичный для НС, содержащий необязательный RE2. По мере осуществления амплификации с этими праймерами создается нуклеиновая кислота с показанной связанной структурой со штрих-кодом на одном конце. Продукты реакций, проводимых в отдельных образцах, могут быть легко интегрированы в другие рабочие процессы, раскрытые в настоящем документе. Например, необязательный второй штрих-код может быть добавлен и использован в сочетании с первым штрих-кодом для дальнейшего обеспечения мультиплексирования для идентификации большого числа последовательностей с использованием относительного минимального числа штрих-кодов. Для секвенирования может быть недостаточно одного штрих-кода.
[00273] Будут очевидны вариации общей схемы, показанной на фиг. 17, примеры которой проиллюстрированы в настоящем документе. Например, штрих-код может быть помещен на другой конец конечного продукта, или на оба конца, или между полинуклеотидами. Кроме того, штрих-код может быть встроен как часть участка удлинения/перекрытия (например, по обе стороны RE3, или штрих-код может быть разделен последовательностью RE3).
[00274] Последовательности LC (в том числе последовательности Vl) и НС (в том числе последовательности Vh) могут быть получены с помощью ряда средств. Например, они могут быть образованы посредством обратной транскрипции mRNA либо с oligo-dT, либо со специфичными для гена праймерами. Согласно одному варианту осуществления одновременно проводят обратную транскрипцию и последующие реакции амплификации, т.е. реакцию RT-PCR, для достижения конечного продукта. При использовании обратной транскрипции удлиненный/перекрывающий участок, а также другие элементы, такие как сайты рестрикции, сайты секвенирующих праймеров или универсальные последовательности, могут быть добавлены с помощью отжига адаптера, содержащего один или несколько остатков G, к одному, двум, трем или более остаткам С, образованным путем присоединения 3'-хвоста кДНК, образованной в реакции обратной транскрипции, как это показано, например, на фиг. 18, 19 и 20. Переключение матрицы обратной транскриптазой позволяет добавление к кДНК удлиненного/перекрывающего участка (и других элементов последовательности). Например, как показано на фиг. 18, при использовании преимущества присоединения 3'-хвоста и переключающей матрицу активности обратной транскриптазы первый адаптер может быть использован для добавления удлиненной/перекрывающей последовательности и штрих-кода к первому представляющему интерес полинуклеотиду, в то время как второй адаптер с последовательностью, комплементарной перекрыванию/удлинению первого адаптера, может быть добавлен ко второй представляющей интерес кДНК. Комплементарные удлиненные/перекрывающие последовательности отжигают в ходе последующей реакции синтеза нуклеиновой кислоты, такой как PCR, для соединения двух представляющих интерес полинуклеотидов. Удлинение от точки перекрывания приводит к двухнитевой молекуле ДНК, в которой два представляющие интерес полинуклеотида связаны штрих-кодом между ними. Вариации, позволяющие образование двух штрих-кодов, расположенных внутри между двумя связанными полинуклеотидными последовательностями, показаны на фиг. 19 и 20.
[00275] Другие способы соединения или связывания представляющих интерес полинуклеотидных последовательностей включают лигирование. Согласно этому варианту осуществления используемую смесь праймеров для амплификации разрабатывают так, что амплифицированные целевые последовательности могут быть расщеплены подходящими ферментами рестрикции, и может быть выполнено ковалентное связывание путем лигирования ДНК. После амплификации с такой смесью праймеров к смеси добавляют ферменты рестрикции, необходимые для формирования совместимых концов целевых последовательностей. Целевые последовательности затем лигируют вместе с лигазой. Очистка продуктов PCR не требуется ни перед расщеплением ферментом рестрикции, ни перед стадиями лигирования, хотя очистка может быть выполнена.
[00276] Согласно другому варианту осуществления представляющие интерес полинуклеотидные последовательности могут быть связаны рекомбинацией. При таком подходе представляющие интерес амплифицированные полинуклеотидные последовательности могут быть соединены с использованием идентичных сайтов рекомбинации. Связывание осуществляется путем добавления соответствующей рекомбиназы для облегчения рекомбинации. Приемлемые рекомбиназные системы содержат Flp-рекомбиназу с различными сайтами FRT, Сге-рекомбиназу с различными сайтами 1ох, ФС31 -интегразу, которая осуществляет рекомбинацию между сайтом апР и сайтом attB, систему β-рекомбиназа-шесть, а также систему Gin-Gix. Связывание путем рекомбинации было иллюстрировано для двух нуклеотидных последовательностей (Vh, связанной с Vl) (Chapal, N. et al. 1997 BioTechniques 23, 518-524, включенная в настоящий документ посредством ссылки).
[00277] Соответственно, один аспект относится к способу, включающему амплификацию представляющих интерес нуклеотидных последовательностей с помощью PCR- или RT-PCR-амплификации с использованием матрицы, полученной из выделенной отдельной клетки или популяции изогенных клеток, и (1) осуществление связывания амплифицированных представляющих интерес нуклеотидных последовательностей и (2) добавление еще по одному штрих-коду к связанным полинуклеотидным последовательностям. Этот способ включает необязательную стадию выполнения дополнительной амплификации связанных продуктов, например, для добавления дополнительных штрих-кодов, сайтов рестрикции, сайтов секвенирующих праймеров и т.п.
[00278] Другой аспект относится к обеспечению способа получения библиотеки штрих-кодированных связанных пар, содержащих тяжелую и легкую цепи антитела, из отдельных клеток донора. Этот аспект относится к обеспечению содержащей лимфоциты клеточной фракции донора, которую необязательно обогащают конкретной популяцией лимфоцитов из указанной клеточной фракции.
Кроме того, популяцию выделенных отдельных клеток получают путем распределения клеток из содержащей лимфоциты клеточной фракции или обогащенной клеточной фракции отдельно в несколько сосудов, контейнеров или лунок. Осуществляют мультиплексную молекулярную амплификацию (например, мультиплексную RT-PCR-амплификацию) вариабельного участка, кодирующего последовательности, содержащиеся в популяции выделенных отдельных клеток, и выполняют связывание пар тяжелой и легкой цепей и добавление штрих-кода, при этом отдельную пару получают из отдельной клетки. Кроме того, согласно различным вариантам осуществления способ может включать две необязательных стадии: на первой стадии индивидуальная выделенная отдельная клетка в популяции отдельных клеток может быть размножена до популяции изогенных клеток перед выполнением мультиплексной RT-PCR-амплификации, тем самым обеспечивая множество сосудов, контейнеров или лунок популяцией изогенных клеток (одна популяция изогенных клеток в одном сосуде, контейнере или лунке). Другая необязательная стадия включает выполнение дополнительной амплификации кодирующих связанные легкую и тяжелую цепи последовательностей. Эта дополнительная стадия амплификации может быть использована просто для увеличения количества связанной нуклеиновой кислоты или для добавления первой или второй последовательности штрих-кода или других элементов последовательности к связанной нуклеиновой кислоте.
[00279] Некоторые аспекты относятся к мультиплексной RT-PCR-амплификации, которая может быть выполнена либо как двухстадийный процесс, при котором обратную транскрипцию (RT) выполняют отдельно от мультиплексной PCR-амплификации (или альтернативной мультиплексной молекулярной амплификации), либо как одностадийный процесс, при котором стадии RT и мультиплексной PCR-амплификации выполняют с теми же праймерами в одной пробирке.
[00280] Обратную транскрипцию (RT) выполняют с ферментом, обладающим активностью обратной транскриптазы, что приводит к образованию кДНК из полной РНК, mRNA или целевой специфичной РНК из выделенной отдельной клетки. Праймеры, которые могут быть использованы для обратной транскрипции, содержат oligo-dT праймеры, случайные гексамеры, случайные декамеры, другие случайные праймеры или праймеры, которые являются специфичными для представляющих интерес нуклеотидных последовательностей. Согласно некоторым вариантам осуществления такие праймеры могут содержать элементы, такие как штрих-коды, универсальные сайты праймеров, сайты рестрикции, сайты секвенирующего праймера и т.п.
[00281] Двухстадийная процедура мультиплексной RT-PCR-амплификации обеспечивает распределение образованной на стадии RT кДНК в более чем один сосуд, что позволяет хранение матричной фракции до продолжения амплификации, если это необходимо. Кроме того, распределение кДНК в более чем одну пробирку обеспечивает выполнение более чем одной мультиплексной PCR-амплификации нуклеиновой кислоты, полученной из той же матрицы. Этот двухстадийный подход может использоваться, например, для амплификации и связывания вариабельного участка тяжелой цепи и вариабельного участка легкой цепи каппа, кодирующих последовательности в одной пробирке, а также вариабельного участка тяжелой цепи и вариабельного участка легкой цепи лямбда, кодирующих последовательности в другой пробирке, с использованием одной и той же матрицы. Одна клетка обычно экспрессирует только одну из легких цепей. Тем не менее, часто будет легче выполнять реакции одновременно, вместо того, чтобы ожидать результат одной из реакций, перед выполнением другой. Кроме того, амплификация как каппа, так и лямбда служит в качестве внутреннего отрицательного контроля, поскольку можно было бы ожидать, что только каппа или лямбда могут быть амплифицированы из одной клетки.
[00282] В одностадийной процедуре мультиплексной RT-PCR обратную транскрипцию и мультиплексную PCR-амплификацию осуществляют в одном и том же сосуде, контейнере или лунке. Все компоненты, необходимые для выполнения как обратной транскрипции, так и мультиплексной PCR в одну стадию, изначально добавляют в сосуды, контейнеры или лунки и выполняют реакцию. Как правило, нет необходимости добавлять дополнительные компоненты после начала реакции. Преимущество одностадийной мультиплексной амплификации RT-PCR заключается в том, что она еще более снижает число стадий, необходимых для образования связанных со штрих-кодом нуклеотидных последовательностей в соответствии с настоящим изобретением. Это особенно полезно при выполнении мультиплексной RT-PCR на множестве отдельных клеток, при котором одну ту же реакцию выполняют во множестве сосудов. Как правило, композиция, необходимая для одностадийной мультиплексной RT-PCR, содержит нуклеиновую кислоту-матрицу, фермент с активностью обратной транскриптазы, фермент с активностью ДНК-полимеразы, дезоксинуклеозидтрифосфатную смесь (смесь dNTP, содержащую dATP, dCTP, dGTP и dTTP) и смесь мультиплексных праймеров. Нуклеиновая кислота-матрица является предпочтительной общей РНК или mRNA, полученной из выделенной отдельной клетки или в очищенной форме, как лизат клетки, или как содержимое интактной клетки.
[00283] Один аспект относится к способам образования библиотек представляющих интерес связанных и штрих-кодированных полинуклеотидов. Некоторые аспекты относятся к множеству полинуклеотидных композиций в полинуклеотидной библиотеке, которая может содержать по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 3000, по меньшей мере 10000, по меньшей мере 30000, по меньшей мере 100000, по меньшей мере 300000, по меньшей мере 1000000, по меньшей мере 3000000, по меньшей мере 10000000, по меньшей мере 30000000 или более членов. Другой аспект относится к множеству полинуклеотидных композиций в полинуклеотидной библиотеке, которая может содержать по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 3000, по меньшей мере 10000, по меньшей мере 30000 или более генов из всей транскриптомы клеточного образца. Другой аспект относится к множеству полинуклеотидных композиций в полинуклеотидной библиотеке, содержащей по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 10, по меньшей мере 30, по меньшей мере 100, по меньшей мере 300, по меньшей мере 1000, по меньшей мере 10000, по меньшей мере 100000, по меньшей мере 1000000, по меньшей мере 10000000, по меньшей мере 1000000000 или более различных видов антител, присутствующих в крови индивидуума. Эти виды антител могут быть экспрессированы плазмобластами, плазматическими клетками, В-клетками памяти, долгоживущими плазматическими клетками, наивными В-клетками, другими клетками, происходящими от В-клеток, или их комбинациями.
[00284] Связанные и штрих-кодированные полинуклеотидные композиции, образуемые раскрытыми выше способами, преимущественно можно успешно подвергать высокопроизводительному мультиплексному секвенированию, предпочтительно с использованием описанных в настоящем документе платформ секвенирования NextGen.
[00285] Связанные и штрих-кодированные полинуклеотидные композиции, образуемые раскрытыми выше способами, также могут использоваться для клонирования, продуцирования представляющих интерес полипептидов и скрининга, раскрытых в настоящем документе.
Способы получения одного или нескольких представляющих интерес полинуклеотидов для секвенирования
[00286] Некоторые аспекты относятся к способу, включающему получение полинуклеотидной библиотеки, содержащей множество полинуклеотидов, при этом каждый полинуклеотид содержит универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона, полученный из одного образца, при этом последовательность участка универсального праймера по сути идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида, полученная из первого отдельного образца, отличается от последовательности сигнального участка образца из других полинуклеотидов в библиотеке, полученных из одного или нескольких образцов, отличающихся от первого отдельного образца; и амплификацию библиотеки полинуклеотидов с набором праймеров для получения одного или нескольких представляющих интерес полинуклеотидов для секвенирования, при этом один или несколько представляющих интерес полинуклеотидов для секвенирования содержат первый участок секвенирования, первый сигнальный участок планшета, универсальный праймерный участок, сигнальный участок образца, адаптерный участок, участок ампликона, полученный из одного образца, и второй участок секвенирования.
[00287] Некоторые аспекты относятся к способу, дополнительно включающему секвенирование одного или нескольких представляющих интерес полинуклеотидов. Некоторые аспекты относятся к секвенированию, которое представляет собой секвенирование по технологии 454.
[00288] Некоторые аспекты относятся к секвенированию, включающему более длинные риды секвенирования так, что риды прямого и обратного секвенирования достаточно перекрываются для обеспечения перестройки всей последовательности длиной приблизительно 600 пар оснований (п.о.), например, легких цепей антител (LC) (у которых точная длина последовательности может зависеть от длины 5'-нетранслируемого участка (UTR)), а также последовательности тяжелых цепей (НС) приблизительно 700 п.о. Таким образом, некоторые аспекты относятся к любой технологии секвенирования, которая может быть использована для обеспечения ридов секвенирования по меньшей мере 350-400 п.о., и тем самым для обеспечения перекрывания, предусмотренного для сборки последовательности, а также к технологиям секвенирования, которые обеспечивают риды 600-700+ п.о. для обеспечения секвенирования с использованием только прямого праймера (секвенирования от 5'-конца).
[00289] Может быть использована любая методика секвенирования нуклеиновой кислоты, известная специалистам в данной области. Методики секвенирования ДНК включают классические реакции дидезоксисеквенирования (метод Сенгера) с использованием меченых терминаторов или праймеров, а также разделение на пластине с гелем или капиллярный электрофорез. Согласно предпочтительному варианту осуществления настоящего изобретения преимущественно используют платформы секвенирования следующего поколения (NextGen). Секвенирование NextGen относится к любому из нескольких постклассических способов секвенирования по методу Сенгера, которые обеспечивают высокую производительность, мультиплексное секвенирование одновременно большого числа образцов. Современные платформы секвенирования NextGen, такие как описанные более подробно ниже, способны давать риды из множества отличающихся нуклеиновых кислот в одном и том же цикле секвенирования. Производительность варьирует от 100 миллионов оснований до 600 гига оснований за цикл, и производительность быстро растет в связи с усовершенствованиями технологии. Принципы действия различных платформ секвенирования NextGen также разнообразны и могут включать секвенирование путем синтеза с использованием обратимо терминированных меченых нуклеотидов, пиросеквенирование, секвенирование по технологии 454, аллель-специфичную гибридизацию с библиотекой меченых олигонуклеотидных зондов, секвенирование путем синтеза с использованием аллель-специфичной гибридизации с библиотекой меченых клонов, которая следует за лигированием, мониторингом в реальном времени за встраиванием меченых нуклеотидов во время стадии полимеризации, метод секвенирования молекулярных колоний, секвенирование в реальном времени отдельной молекулы и секвенирование по технологии SOLiD. Секвенирование было продемонстрировано в последовательных или отдельных реакциях удлинения с использованием полимераз или лигаз, а также по одной или последовательным дифференциальным гибридизациям с библиотеками зондов. Эти реакции были проведены на многих клональных последовательностях параллельно, в том числе демонстрации в современных коммерческих применениях более 100 миллионов последовательностей параллельно. Данные подходы секвенирования, таким образом, могут быть использованы для изучения репертуара Т-клеточного рецептора (TCR) и/или В-клеточный рецептора (BCR), а также других представляющих интерес последовательностей.
[00290] Методиками секвенирования можно получать по меньшей мере 1000 ридов за цикл, по меньшей мере 10000 ридов за цикл, по меньшей мере 100000 ридов за цикл по меньшей мере 500000 ридов за цикл или по меньшей мере 1000000 ридов за цикл.
[00291] Методиками секвенирования можно получать приблизительно 30 пар оснований, приблизительно 40 пар оснований, приблизительно 50 пар оснований, приблизительно 60 пар оснований, приблизительно 70 пар оснований, приблизительно 80 пар оснований, приблизительно 90 пар оснований, приблизительно 100 пар оснований, приблизительно 110 пар оснований, приблизительно 120 пар оснований на рид, около 150 пар оснований, приблизительно 200 пар оснований, приблизительно 250 пар оснований, приблизительно 300 пар оснований, приблизительно 350 пар оснований, приблизительно 400 пар оснований, приблизительно 450 пар оснований, приблизительно 500 пар оснований, приблизительно 550 пар оснований, приблизительно 600 пар оснований, приблизительно 650 пар оснований или приблизительно 700 пар оснований или более пар оснований на рид.
[00292] Методиками секвенирования можно получать по меньшей мере 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или более нуклеотидов на рид.
[00293] Может быть использована методика секвенирования, описанная, например, в Helicos Trae Single Molecule Sequencing (tSMS) (Harris T. D. et al. (2008) Science 320:106-109). Согласно методике tSMS образец ДНК расщепляют на нити приблизительно 100-200 нуклеотидов и к 3'-концу каждой нити ДНК добавляют последовательность polyA. Каждую нить помечают путем добавления флуоресцентно меченого аденозинового нуклеотида. Затем нити ДНК гибридизируют с проточной ячейкой, содержащей миллионы сайтов захвата oligo-T, которые иммобилизованы на поверхности проточной ячейки. Матрицы могут быть плотностью приблизительно 100 миллионов матриц/см . Затем проточную ячейку помещают в прибор, например, секвенатор HeliScopeTM, и лазером освещают поверхность проточной кюветы, обнаруживая положение каждой матрицы. Камера CCD может отображать расположение матриц на поверхности проточной ячейки. Флуоресцентную метку матрицы затем расщепляют и отмывают. Реакцию секвенирования начинают с введения ДНК-полимеразы и флуоресцентно меченого нуклеотида. Нуклеиновая кислота oligo-T служит в качестве праймера. Полимераза встраивает меченые нуклеотиды в праймер направленным на матрицу способом. Полимеразу и невстроенные нуклеотиды удаляют. Матрицы с направленным встраиванием флуоресцентно меченого нуклеотида выявляют визуализацией поверхности проточной ячейки. После визуализации на стадии расщепления удаляют флуоресцентную метку и процесс повторяют с другими флуоресцентно мечеными нуклеотидами до тех пор, пока не будет достигнут рид нужной длины. Информацию о последовательности собирают с каждой стадии добавления нуклеотида.
[00294] Другим примером методики секвенирования ДНК, которая может быть использована, является секвенирование по технологии 454 (Roche) (Margulies, M et al. 2005, Nature, 437, 376-380). Секвенирование по технологии 454 включает две стадии. На первой стадии ДНК разрезают на фрагменты приблизительно 300-800 пар оснований, при этом фрагменты имеют тупые концы. Затем олигонуклеотидные адаптеры лигируют с концами фрагментов. Адаптеры служат в качестве праймеров для амплификации и секвенирования фрагментов. Фрагменты могут быть прикреплены к бусинам захвата ДНК, например, покрытым стрептавидином бусинам, с использованием, например, Adaptor В, содержащего 5'-биотиновую метку. Фрагменты, прикрепленные к бусинам, PCR-амплифицируют в каплях эмульсии масло-в-воде. В результате получается несколько копий клонально амплифицированных фрагментов ДНК на каждой бусине. На второй стадии бусины захватывают в лунки (пико-литрового размера). Выполняют пиросеквенирование параллельно на каждом фрагменте ДНК. Добавление одного или нескольких нуклеотидов генерирует световой сигнал, который записывают с помощью камеры CCD в устройстве секвенирования. Сила сигнала пропорциональна количеству встроенных нуклеотидов.
[00295] Пиросеквенирование позволяет применение пирофосфата (PPi), который высвобождается при добавлении нуклеотида. PPi преобразуется в АТФ с помощью АТФ-сульфурилазы в присутствии аденозина 5'-фосфосульфата. Люцифераза использует АТФ для преобразования люциферина в оксилюциферин, и эта реакция генерирует свет, который выявляют и анализируют.
[00296] Другим примером методики секвенирования ДНК, которая может быть использована, является технология SOLiD (Applied Biosystems). В секвенировании по технологии SOLiD геномную ДНК разрезают на фрагменты и адаптеры прикрепляют к 5'- и 3'-концам фрагментов для получения библиотеки фрагментов. В качестве альтернативы, внутренние адаптеры могут быть введены путем лигирования адаптеров с 5'- и 3'-концами фрагментов, циркуляризации фрагментов, расщепления циркуляризованного фрагмента с получением внутреннего адаптера и прикрепляющих адаптеров к 5'- и 3'-концам образовавшихся фрагментов для получения библиотеки спаренных объектов. Затем в микрореакторах, содержащих бусины, праймеры, матрицу и компоненты PCR, получают клональные популяции бусин. После PCR матрицы денатурируют, а бусины обогащают для отделения бусин с удлиненными матрицами. Матрицы на отобранных бусинах подвергают 3'-модификации, которая обеспечивает прикрепление к предметному стеклу.
[00297] Последовательность может быть определена путем последовательной гибридизации и лигирования частично случайных олигонуклеотидов с центральным определенным основанием (или парой оснований), которое идентифицируют специфичным флуорофором. После того как цвет записан, лигированные олигонуклеотиды отщепляют и удаляют, а затем этот процесс повторяют.
[00298] Другим примером технологии секвенирования, которая может быть использована, является секвенирование по технологии SOLEXA (Illumina). Секвенирование по технологии SOLEXA основано на амплификации ДНК на твердой поверхности с использованием «fold-back» PCR и закрепленных праймеров. Геномную ДНК фрагментируют и к 5'- и 3'-концам фрагментов добавляют адаптеры. Фрагменты ДНК, которые прикреплены к поверхности каналов поточной ячейки, удлиняют и подвергают мостиковой амплификации. Фрагменты становятся двухнитевыми, и двухнитевые молекулы денатурируют. Многочисленными циклами твердофазной амплификации с последующей денатурацией можно создать несколько миллионов кластеров приблизительно 1000 копий однонитевых молекул ДНК одной и той же матрицы в каждом канале проточной ячейки. Праймеры, ДНК-полимеразу и четыре меченных флуорофором обратимо терминирующих нуклеотида используют для выполнения последующего секвенирования. После введения нуклеотида используют лазер для возбуждения флуорофоров, получают изображение и записывают идентичность первого основания. 3'-Терминаторы и флуорофоры из каждого введенного основания удаляют и повторяют стадии включения, выявления и идентификации.
[00299] Другой пример технологии секвенирования, которая может быть использована, включает технологию по отдельной молекуле в режиме реального времени (SMRT ) Pacific Biosciences. При SMRT каждое из четырех оснований ДНК присоединяют к одному из четырех различных флуоресцентных красителей. Эти красители связываются через фосфатную группу. Одна ДНК-полимераза иммобилизуется с одной молекулой матричной однонитевой ДНК на дне волновода нулевой моды (ZMW). ZMW является конструкцией ограничения, которая дает возможность наблюдать введение одного нуклеотида с помощью ДНК-полимеразы на фоне флуоресцентных нуклеотидов, которые быстро диффундируют в ZMW и из него (в микросекундах). Введение нуклеотида в растущую нить занимает несколько миллисекунд. В течение этого времени флуоресцентная метка возбуждается и производит флуоресцентный сигнал, и флуоресцентная метка отщепляется. Выявление соответствующей флуоресценции красителя указывает на то, какое основание было введено. Этот процесс повторяют.
[00300] Другим примером методики секвенирования, которая может быть использована, является нанопоровое секвенирование (Soni G V and Meller Α. (2007) Clin Chem 53: 1996-2001). Нанопора представляет собой небольшое отверстие, порядка 1 нанометра в диаметре. Погружение нанопоры в проводящую жидкость и применение потенциала к ней дает слабый электрический ток, обусловленный проводимостью ионов через нанопору. Величина протекающего тока зависит от размера нанопоры. По мере прохождения молекулы ДНК через нанопору каждый нуклеотид в молекуле ДНК затрудняет проходимость нанопор в разной степени. Таким образом, изменение в тока, проходящего через нанопору, по мере того, как молекула ДНК проходит через нанопору, представляет считывание последовательности ДНК.
[00301] Другой пример методики секвенирования, которая может быть использована, включает использование системы химически-чувствительных транзисторов с управлением полем (chemFET) для секвенирования ДНК (например, как описано в публикации заявки на выдачу патента США № 20090026082). Согласно одному примеру данной методики молекулы ДНК могут быть помещены в реакционные камеры, а молекулы матрицы могут быть гибридизированы с секвенирующим праймером, связанным с полимеразой. Введение одного или нескольких трифосфатов в новую нить нуклеиновой кислоты на 3'-конце секвенирующего праймера может быть выявлено по изменению тока с помощью chemFET. Система может содержать несколько датчиков chemFET. Согласно другому примеру отдельные нуклеиновые кислоты могут быть прикреплены к бусинам, а так же нуклеиновые кислоты могут быть амплифицированы на бусине, а отдельные бусины могут быть перенесены в индивидуальные реакционные камеры в системе chemFET, при этом каждая камера содержит датчик chemFET, и нуклеиновые кислоты могут быть секвенированы.
[00302] Другой пример методики секвенирования, которая может быть использована, включает использование электронного микроскопа (Moudrianakis Ε. Ν. and Beer M. Proc Natl Acad Sci USA. 1965 March; 53:564-71). Согласно одному примеру методики отдельные молекулы ДНК помечают с использованием металлических меток, которые различимы с помощью электронного микроскопа. Эти молекулы затем распределяют на плоской поверхности и визуализируют с помощью электронного микроскопа для измерения последовательностей.
[00303] Некоторые аспекты относятся к получению полинуклеотидной библиотеки, включающему подготовку полинуклеотидной библиотеки в лаборатории. Некоторые аспекты относятся к получению полинуклеотидной библиотеки, включающему получение полинуклеотидной библиотеки непосредственно или опосредованно от третьей стороны, которая подготовила полинуклеотидную библиотеку.
Способы анализа данных секвенирования
[00304] Некоторые аспекты относятся к способу, включающему получение набора данных, связанного со множеством полинуклеотидов, при этом набор данных содержит данные секвенирования для множества полинуклеотидов, при этом каждый полинуклеотид во множестве полинуклеотидов содержит сигнальный участок образца, и при этом каждый сигнальный участок образца на каждом полинуклеотиде является уникальным для одного образца, при этом последовательность сигнального участка образца каждого полинуклеотида, полученная из первого отдельного образца, отличается от последовательности сигнального участка образца других полинуклеотидов во множестве полинуклеотидов, полученных из одного или нескольких образцов, отличающихся от первого отдельного образца; а также анализ набора данных на совпадение полинуклеотидов с идентичными сигнальными участками образцов, при этом совпадение показывает, что полинуклеотиды походят из одного и того же образца.
[00305] Некоторые аспекты относятся к каждому из полинуклеотидов во множестве полинуклеотидов, которые дополнительно содержат первый сигнальный участок планшета, при этом каждая комбинация каждого первого сигнального участка планшета и сигнального участка образца в каждом из полинуклеотидов является уникальной для отдельного образца, при этом последовательность первого сигнального участка планшета каждого из полинуклеотидов, полученная из первого набора отдельных образцов отличается от последовательности первого сигнального участка планшета других полинуклеотидов во множестве полинуклеотидов, полученных из одного или нескольких наборов отдельных образцов, отличающихся от первого набора отдельных образцов, и дополнительно включают анализ набора данных на совпадение полинуклеотидов с идентичными первыми сигнальными участками планшетов и идентичными сигнальными участками образцов, при этом совпадение между обоими участками указывает на то, что полинуклеотиды походят из одного и того же образца.
[00306] В некоторых аспектах оба полинуклеотида содержат вариабельный участок. В некоторых аспектах один полинуклеотид содержит вариабельный участок. В некоторых аспектах на один полинуклеотид не содержит вариабельный участок.
[00307] Некоторые аспекты относятся к получению набора данных, включающему получение множества полинуклеотидов и секвенирование множества полинуклеотидов для экспериментального выявления набора данных. Некоторые аспекты относятся к получению набора данных, включающему получение набора данных непосредственно или опосредованно от третьей стороны, которая секвенировала множество полинуклеотидов для экспериментального определения набора данных. Некоторые аспекты относятся к набору данных, который хранится в электронной среде для хранения информации. Некоторые аспекты относятся к набору данных, который передается через Интернет.
[00308] Некоторые аспекты относятся к способу, который осуществляют на компьютере, например, к осуществляемому на компьютере способу.
[00309] Некоторые аспекты относятся к отдельному образцу, который является отдельной клеткой. Некоторые аспекты относятся к отдельному образцу, который содержит отдельную клетку. Некоторые аспекты относятся к отдельному образцу, который содержит отдельную В-клетку. Некоторые аспекты относятся к отдельному образцу, который содержит множество В-клеток. Некоторые аспекты относятся к отдельному образцу, который содержит отдельную В-клетку и одну или несколько других клеток.
[00310] Некоторые аспекты относятся к данным, полученным в результате секвенирования (например, секвенирования по технологии 454), которые могут быть проанализированы с программным обеспечением для анализа данных 454 GS FLX, и последовательности с некачественными показателями могут быть отфильтрованы. Затем последовательности хорошего качества могут быть разделены в соответствии с их сигнальным участком образца (и согласно некоторым вариантам осуществления комбинации их сигнального участка образца и сигнального участка планшета) с использованием скрипта в Python до сборки последовательностей с использованием биоинформационных подходов, например, с использованием Newbler. Поскольку в некоторых аспектах обратные риды могут содержать только второй сигнальный участок планшета, возможно, что сборка последовательности может происходить между прямыми и обратными ридами последовательностей из различных клеток. Для обхода этой потенциальной проблемы сначала может быть идентифицирован используемый V(D)J тяжелой и легкой цепей прямого и обратного ридов с использованием HighV-QUEST. Затем последовательности могут быть далее сгруппированы согласно их используемому V(D)J перед сборкой. Некоторые аспекты относятся к сборке последовательности, которая может быть чувствительной к нуклеотидным несовпадениям, что тем самым предотвращает сборку из прямых и обратных ридов от разных клеток, которые содержат один и тот же используемый V(D)J. Некоторые аспекты относятся к последовательностям, которые затем могут быть сгруппированы вместе на основе их используемого V(D)J с помощью компьютерной программы.
[00311] Некоторые аспекты относятся к биоинформатическим способам, которые могут быть использованы для идентификации групп последовательностей, формирующих клональные семейства и подсемейства, и, таким образом, представляющих интерес иммуноглобулиновых последовательностей. Такие биоинформатические способы включают измерения подобия последовательностей. Такие биоинформатические способы могут быть использованы для идентификации представляющих интерес последовательностей, полученных от отдельного человека, полученных от одного или нескольких человек, полученных от одного или нескольких человек с одним состоянием или полученных от одного или нескольких человек с различными состояниями.
[00312] Некоторые аспекты относятся к родственным последовательностям тяжелой и/или легкой цепей иммуноглобулина, которые могут быть идентифицированы с помощью вычислительного филогенетического анализа гомологии между последовательностями V(D)J тяжелой цепи и/или легкой цепи иммуноглобулина. Некоторые аспекты относятся к стандартным методам классификации (т.е. кластеризации) последовательностей, представляющих отдельные сегменты генов V, D и/или J и/или других последовательности, полученных из тяжелой цепи и/или легкой цепи иммуноглобулина или комбинации таковых, которые могут быть использованы для идентификации клональных семейств или подсемейств (например, с помощью ClustalX).
[00313] Используемый в настоящем документе термин «клональное семейство» относится к множеству последовательностей иммуноглобулина, каждая из которых содержит участки V, D и/или J, при этом каждая последовательность является мутантной версией одной и той же родоначальной последовательности иммуноглобулина, содержащей участок V, D и/или J, или родоначальной последовательности иммуноглобулина, содержащей участок V, D и/или J. Некоторые аспекты относятся к множеству, которое является множеством последовательностей тяжелой цепи. Некоторые аспекты относятся к множеству, которое является множеством последовательностей легкой цепи. Некоторые аспекты относятся к множеству, которое является множеством спаренных последовательностей тяжелой и легкой цепей. Некоторые аспекты относятся к последовательности, каждая из которых содержит участки V, D, и J. Некоторые аспекты относятся к последовательности, каждая из которых содержит участки V и D. Некоторые аспекты относятся к последовательности, каждая из которых содержит участки D и J. Некоторые аспекты относятся к последовательности, каждая из которых содержит участки V и J. Некоторые аспекты относятся к последовательности, каждая из которых содержит участок V. Некоторые аспекты относятся к последовательности, каждая из которых содержит участок D. Некоторые аспекты относятся к последовательности, каждая из которых содержит участок J. Некоторые аспекты относятся к одной или нескольким мутациям, которые располагаются на участках V, D и/или J. Некоторые аспекты относятся к одной или нескольким мутациям, которые располагаются между участками V, D и/или J.
[00314] Некоторые аспекты относятся к являющемуся клональным семейством набору антител, у которых все тяжелые цепи используют одни и те же сегменты генов V и J. Некоторые аспекты относятся к являющемуся клональным семейством набору антител, у которых все тяжелые цепи используют одни и те же сегменты генов V и J, и у которых суммарная длина нуклеотидов P/N и нуклеотида D является одной и той же. Некоторые аспекты относятся к являющемуся клональным семейством набору антител, у которых все тяжелые цепи используют одни и те же сегменты генов V, D и J. Некоторые аспекты относятся к являющемуся клональным семейством набору антител, у которых все тяжелые цепи используют одни и те же сегменты генов V, D и J, и у которых нуклеотиды P/N между сегментами генов V и D имеют одинаковую длину, и у которых нуклеотиды P/N между сегментами генов D и J имеют одинаковую длину. Некоторые аспекты относятся к являющемуся клональным семейством набору антител, у которых все тяжелые цепи используют те же сегменты генов V и J, и у которых все легкие цепи используют одни и те же сегменты генов V и J. Некоторые аспекты относятся к являющемуся клональным семейством набору антител, у которых все тяжелые цепи используют одни и те же сегменты генов V и J, и у которых суммарная длина нуклеотидов P/N и нуклеотидов D являются одинаковыми, и у которых все легкие цепи используют одни и те же сегменты генов V и J, и у которых нуклеотиды P/N имеют одинаковую длину. Некоторые аспекты относятся к являющемуся клональным семейством набору антител, и у которых все тяжелые цепи используют одни и те же сегменты генов V, D и J, и у которых все легкие цепи используют одни и те же сегменты генов V и J. Некоторые аспекты относятся к являющемуся клональным семейством набору антител, у которых все тяжелые цепи используют одни и те же сегменты генов V, D и J, и у которых нуклеотиды P/N между сегментами генов V и D имеют одинаковую длину, и у которых нуклеотиды P/N между сегментами генов D и J имеют одинаковую длину, и у которых все легкие цепи используют одни и те же сегменты генов V и J, и у которых нуклеотиды P/N между сегментами генов V и J имеют одинаковую длину.
[00315] Способы конструирования клональных семейств
[00316] Использование V, D и J для рецептора Т-клетки (TCR) или вариабельного гена иммуноглобулина запрашиваемой последовательности могут быть выявлены путем идентификации родоначальных сегментов генов V, D (если применимо) и J, которые, наиболее вероятно, дали начало последовательности. Сегменты D присутствуют в некоторых TCR и последовательностях иммуноглобулина (например, в TCRp, TCRô и в последовательностях тяжелой цепи антитела), но не в других (например, в TCRa, TCRy и в последовательностях легкой цепи антитела). Следующее описание включает сегменты D, но одни и те же подходы могут быть применены к последовательностям вариабельных участков, у которых нет сегментов D. Во всех случаях для определения использования V(D)J применяют справочную базу данных родоначальных последовательностей сегментов генов V, D и J, таких как IMGT/GENE-DB (Giudicelli V, Chaume D, Lefranc MP. IMGT/GENE-DB : a comprehensive database for human and mouse immunoglobulin and Τ cell receptor genes. Nucleic Acids Res. 2005 Jan 1;33 (Database issue):D256-61).
[00317] Согласно одному подходу для определения использования V(D)J запрашиваемую последовательность последовательно сравнивают с каждым родоначальным сегментом генов V, D и J по отдельности и наиболее подобный сегмент гена каждого типа (В, D или J) выбирают в качестве наиболее вероятно дающего начало запрашиваемой последовательности. V-QUEST и High V-QUEST являются примерами данного подхода (Giudicelli V, Chaume D, Lefranc MP. IMGT/V-QUEST, an integrated software program for immunoglobulin and Τ cell receptor V-J and V-D-J rearrangement analysis. Nucleic Acids Res. 2004 Jul 1; 32 (Web Server issue):W435-40.; Brochet X, Lefranc MP, Giudicelli V. IMGT/V-QUEST: the highly customized and integrated system for IG and TR standardized V-J and V-D-J sequence analysis. Nucleic Acids Res. 2008 Jul 1;36 (Web Server issue):W503-8). С помощью V-QUEST сначала осуществляют попарные выравнивания для запрашиваемой последовательности и каждой последовательности сегмента гена V. Затем осуществляют попарные выравнивания для запрашиваемой последовательности участка в 5'-3'-направлении от установленного 3'-конца сегмента V и каждой последовательности сегмента гена J. Если сегмент D присутствует, с помощью V-QUEST затем осуществляют попарные выравнивания для участка запрашиваемой последовательности, обнаруженного между участками совпадающих сегментов V и J, и каждой последовательности сегмента гена D. С помощью V-QUEST можно также установить границы участков соединения V-D, V-J и/или D-J.
[00318] Согласно другому подходу для определения использования V(D)J комбинацию родоначальных сегментов V, D и J, наиболее вероятно, дающих начало запрашиваемой последовательности, идентифицируют в одну стадию, а не в трех отдельных стадиях для V, D и J, соответственно. Преимущество этого подхода заключается в том, что при идентификации одного типа сегмента (V, D или J) можно принимать во внимание информацию о потенциальных совпадениях с двумя другими типами сегментов. Например, лучшее совпадение сегмента D может зависеть от того, какое совпадение сегмента V рассматривается. SoDA является примером такого подхода (Volpe JM, Cowell LG, Kepler ТВ. SoDA: implementation of a 3D alignment algorithm for inference of antigen receptor recombinations. Bioinformatics. 2006 Feb 15;22(4):438-44). С помощью SoDA сначала выбирают кандидатные сегменты V, D и J.
При этом осуществляют попарные локальные выравнивания для запрашиваемой последовательности и каждой последовательности сегмента гена V, а затем оставляют только сегменты V с выравниваниями, соответствующими порогу оценки. Эти стадии повторяют для сегментов J и сегментов D. Затем оптимальное выравнивание осуществляют для каждой возможной комбинации кандидатных сегментов V, D и J. Эти выравнивания осуществляют с использованием одного и того же общего подхода динамического программирования, который широко используют в выравнивании последовательностей (Needleman,S.B. and Wunsch,C.D. (1970) A general method applicable to the search for similarities in the amino acid sequence of two proteins. J. Mol. Biol., 48,443^153.), но с обеспечением введения дополнительных нуклеотидов на участках соединения V-D, V-J и/или D-J. Такая вставка обычно происходит во время биологического процесса рекомбинации V(D)J. При выравнивании последовательностей путем динамического программирования, как правило, существуют штрафные оценки, связанные со вставками, делециями и несовпадениями. Однако при таком подходе определения использования V(D)J никакие штрафы не применяются для вставки нуклеотидов на участках соединения между сегментами. Комбинацию V(D)J, дающую самое высоко оцененное выравнивание, выбирают для указания использования V(D)J для запрашиваемой последовательности. С помощью этого подхода также можно идентифицировать границы участков соединения последовательности.
[00319] Из клональных семейств и подсемейств с помощью ряда подходов для отбора можно использовать специфичные клоны для экспрессии их кодированных спаренных тяжелой и легкой цепей генов иммуноглобулинов и характеристики их связывающих свойств. Некоторые аспекты относятся к наиболее часто встречающимся клонам из клональных семейств и/или клональных подсемейств, а также к другим типичным клонам из клональных семейств и подсемейств, которые экспрессируют и скринируют по их связывающим свойствам. Клоны также можно произвольно отбирать из всех клонов, из всех или отобранных клональных семейств, и/или из всех или отобранных клональных подсемейств для экспрессии и характеристики их свойств связывания. Клоны также можно отбирать на основе наличия большего числа вариаций в вариабельном участке антитела. Можно построить филогенетическое дерево и клоны можно отбирать на основе особенностей филогенетического дерева, например, опускаясь от верхушки древа, всегда выбирают ветвь с наибольшим числом нижележащих листовых узлов.
[00320] Некоторые аспекты относятся к способу, дополнительно включающему отбор одного или нескольких полинуклеотидов для клонирования.
Способы идентификации второго представляющего интерес полинуклеотида на основе отбора первого представляющего интерес полинуклеотида
[00321] Некоторые аспекты относятся к способу, который включает получение набора данных, ассоциированных со множеством полинуклеотидов, при этом набор данных содержит данные секвенирования для множества полинуклеотидов, при этом каждый полинуклеотид во множестве полинуклеотидов содержит сигнальный участок образца, и при этом каждый сигнальный участок образца в каждом полинуклеотиде является уникальным для отдельного образца, посредством чего каждый полинуклеотид во множестве полинуклеотидов ассоциируется с отличающимся отдельным образцом, при этом последовательность сигнального участка образца каждого полинуклеотида, полученного из первого отдельного образца, отличается от последовательности сигнального участка образца других полинуклеотидов во множестве полинуклеотидов, полученных из одного или нескольких образцов, отличающихся от первого отдельного образца; и отбор представляющего интерес первого полинуклеотида, связанного с первым отдельным образцом из набора данных, а также идентификацию представляющего интерес второго полинуклеотида в первом отдельном образце на основе сигнального участка образца представляющего интерес первого полинуклеотида.
[00322] Некоторые аспекты относятся к каждому полинуклеотиду во множестве полинуклеотидов, который дополнительно содержит первый сигнальный участок планшета, при этом каждая комбинация каждого первого сигнального участка планшета и сигнального участка образца в каждом полинуклеотиде является уникальной для отдельного образца, при этом последовательность первого сигнального участка планшета каждого полинуклеотида, полученного из первого набора отдельных образцов, отличается от последовательности первого сигнального участка планшета других полинуклеотидов во множестве полинуклеотидов, полученных из одного или нескольких наборов отдельных образцов, отличающихся от первого набора отдельных образцов, при этом дополнительно включают идентификацию представляющего интерес второго полинуклеотида в первом отдельном образце на основе сигнального участка образца и первого сигнального участка планшета представляющего интерес первого полинуклеотида.
[00323] В некоторых аспектах оба полинуклеотида содержат вариабельный участок. В некоторых аспектах один полинуклеотид содержит вариабельный участок. В некоторых аспектах ни один полинуклеотид не содержит вариабельный участок.
[00324] Некоторые аспекты относятся к способу, который осуществляют на компьютере, например, это к осуществляемому на компьютере способу.
[00325] Некоторые аспекты относятся к первому отдельному образцу, который содержит В-клетку. Некоторые аспекты относятся к первому отдельному образцу, который содержит отдельную В-клетку и одну или несколько других клеток. Некоторые аспекты относятся к первому отдельному образцу, который содержит множество В-клеток. Некоторые аспекты относятся к первому отдельному образцу, который содержит В-клетку, при этом представляющий интерес первый полинуклеотид содержит нуклеотидную последовательность тяжелой цепи антитела, и при этом представляющий интерес второй полинуклеотид содержит нуклеотидную последовательность легкой цепи антитела. Некоторые аспекты относятся к первому отдельному образцу, который содержит В-клетку, при этом представляющий интерес первый полинуклеотид содержит нуклеотидную последовательность легкой цепи антитела, и при этом второй представляющий интерес полинуклеотид содержит нуклеотидную последовательность тяжелой цепи антитела.
[00326] Некоторые аспекты относятся к получению набора данных, включающему получение множества полинуклеотидов и секвенирование множества полинуклеотидов для экспериментального определения набора данных. Некоторые аспекты относятся к получению набора данных, включающему получение набора данных непосредственно или опосредованно от третьей стороны, которая секвенировала множество полинуклеотидов для экспериментального определения набора данных. Некоторые аспекты относятся к набору данных, который хранится в электронной среде для хранения информации.
Способы получения одного или нескольких представляющих интерес полинуклеотидов для клонирования
[00327] Некоторые аспекты относятся к способу, включающему получение библиотеки полинуклеотидов, содержащей множество полинуклеотидов, при этом каждый полинуклеотид содержит универсальный праймерный участок, сигнальный участок образца, адаптерный участок и участок ампликона, полученный из отдельного образца, при этом последовательность универсального праймерного участка практически идентична в каждом полинуклеотиде во множестве полинуклеотидов, и при этом последовательность сигнального участка образца каждого полинуклеотида, полученного из первого отдельного образца, отличается от последовательности сигнального участка образца других полинуклеотидов в библиотеке, полученной из одного или нескольких образцов, отличающихся от первого отдельного образца; и амплификацию библиотеки полинуклеотидов с набором праймеров для получения одного или нескольких представляющих интерес полинуклеотидов для клонирования, при этом один или несколько представляющих интерес полинуклеотидов для клонирования содержат первый участок сайта рестрикции, универсальный праймерный участок, сигнальный участок образца, адаптерный участок, участок ампликона, полученный из отдельного образца, и второй участок сайта рестрикции.
[00328] Некоторые аспекты относятся к получению библиотеки полинуклеотидов, включающему получение библиотеки полинуклеотидов в лаборатории. Некоторые аспекты относятся к получению библиотека полинуклеотидов, включающему получение библиотека полинуклеотидов непосредственно или опосредованно от третьей стороны, которая получила библиотеку полинуклеотидов.
[00329] Некоторые аспекты относятся к способам, дополнительно включающим клонирование одного или нескольких полинуклеотидов, например, в раскрытый в настоящем документе вектор.
Способы получения представляющей интерес молекулы
[00330] Некоторые аспекты относятся к способу, включающему получение клетки-хозяина, содержащей представляющий интерес полинуклеотид, и культивирование клетки-хозяина в условиях, достаточных для получения представляющей интерес молекулы.
[00331] Некоторые аспекты относятся к получению клетки-хозяина, включающему получение содержащей полинуклеотид клетки-хозяина в лаборатории. Некоторые аспекты относятся к получению клетки-хозяина, включающему содержащей полинуклеотид клетки-хозяина, непосредственно или опосредованно от третьей стороны, которая получила клетку-хозяина.
[00332] Некоторые аспекты относятся к представляющей интерес молекуле, которая является полипептидом. Некоторые аспекты относятся к представляющей интерес молекуле, которая является антителом. Некоторые аспекты относятся к представляющей интерес молекуле, которая является человеческим моноклональным антителом.
[00333] Некоторые аспекты относятся к способу, дополнительно включающему сбор представляющей интерес молекулы.
[00334] В некоторых аспектах желательно «повторно сворачивать» некоторые полипептиды, например, полипептиды, содержащие один или несколько компонентов АВР или сам АВР сам по себе. Согласно некоторым вариантам осуществления такие полипептиды получают с использованием обсуждаемых в настоящем документе систем экспрессии. Согласно некоторым вариантам осуществления полипептиды «повторно сворачивают» и/или окисляют для образования желаемой третичной структуры и/или для образования дисульфидных связей. Согласно некоторым вариантам осуществления такие структура и/или связи связаны с определенной биологической активностью полипептида. Согласно некоторым вариантам осуществления повторное сворачивание осуществляют с использованием любого из ряда известных в уровне техники способов. Примеры способов включают без ограничения воздействие средства для повышения растворимости полипептида при рН, как правило, выше 7 в присутствии хаотропного средства. Типичным хаотропным средством является гуанидин. Согласно некоторым вариантам осуществления раствор для повторного сворачивания/окисления также содержит восстанавливающее средство и окисленную форму этого восстанавливающего средства. Согласно некоторым вариантам осуществления восстанавливающее средство и его окисленная форма присутствуют в отношении, которое будет обеспечивать конкретный окислительно-восстановительный потенциал, который позволяет произойти дисульфидной перестановке. Согласно некоторым вариантам осуществления такая перестановка обеспечивает образование цистеиновых мостиков. Примеры окислительно-восстановительных пар включают в себя без ограничения цистеин/цистамин, глутатион/дитиобисвЗН, хлорид меди, дитиотреитол DTT/дитиан DTT, а также 2-меркаптоэтанол (bМЕ)/дитио-bМЕ. Согласно некоторым вариантам осуществления для повышения эффективности повторного сворачивания используют совместный растворитель. Примеры совместных растворителей включают в себя без ограничения глицерин, полиэтиленгликоль с различной молекулярной массой и аргинин.
[00335] Согласно некоторым вариантам осуществления полипептид существенно очищают, например, полипептид, содержащий один или несколько компонентов АВР или АВР сам по себе. Определенные методики очистки белка известны специалистам в данной области. Согласно некоторым вариантам осуществления очистка белка включает грубое фракционирование полипептидных фракций из неполипептидных фракций. Согласно некоторым вариантам осуществления полипептиды очищают с использованием хроматографических и/или электрофоретических методик. Примеры способов очистки включают в себя без ограничения осаждение сульфатом аммония; осаждение с помощью PEG; иммунопреципитацию; тепловую денатурацию с последующим центрифугированием; хроматографию, в том числе без ограничения аффинную хроматографию (например, белок-А-сефарозой), ионообменную хроматографию, эксклюзионную хроматографию и хроматографию с обращенной фазой; гель-фильтрацию; гидроксиапатитную хроматографию; изоэлектрическое фокусирование; электрофорез в полиакриламидном геле, а также комбинации этих и других методик. Согласно некоторым вариантам осуществления полипептид очищают жидкостной экспресс-хроматографией белков или жидкостной хроматографией высокого давления (HPLC). Согласно некоторым вариантам осуществления стадии очистки могут быть изменены, или некоторые стадии могут быть опущены, но все же это будут приемлемые способы получения существенно очищенного полипептида.
[00336] Согласно некоторым вариантам осуществления осуществляют количественную оценку степени очистки полипептидного препарата. Некоторые способы количественной оценки степени очистки известны специалистам в данной области. Некоторые типичные способы включают без ограничения определение специфичного связывания активности препарата и оценку количества полипептида в препарате путем анализа SDS/PAGE. Некоторые типичные способы количественной оценки очистки полипептидного препарата включают вычисление связывающей активности препарата и сравнение ее со связывающей активностью исходного экстракта. Согласно некоторым вариантам осуществления результаты такого расчета называют «кратность очистки». Единицы, используемые для количественного представления связывающей активности, зависят от конкретного выполненного анализа.
[00337] Согласно некоторым вариантам осуществления полипептид, содержащий один или несколько компонентов АВР или АВР сам по себе, частично очищают. Согласно некоторым вариантам осуществления частичная очистка может быть осуществлена с использованием меньшего числа стадий очистки или путем использования различных форм одной и той же общей схемы очистки. Например, согласно некоторым вариантам осуществления катионообменная хроматография на колонке, выполняемая с использованием устройства для HPLC, как правило, будет обеспечивать большую «кратность очистки», чем та же методика с использованием системы хроматографии низкого давления. В некоторых вариантах осуществления способы, которые дают более низкую степени очистки, могут обладать преимуществами в общем восстановлении полипептида или в поддержании связывающей активность полипептида.
[00338] В некоторых случаях электрофоретическая миграция полипептида иногда может значительно варьировать при различных условиях SDS/PAGE. См., например, Capaldi et al, Biochem. Biophys. Res. Comm., 76: 425 (1977). Следует иметь в виду, что при различных условиях электрофореза относительные молекулярные массы очищенного или частично очищенного полипептида могут быть разными.
Способы скрининга
[00339] Некоторые аспекты относятся к представляющей интерес молекуле, которую скринируют по активности. Некоторые аспекты относятся к представляющей интерес молекуле, которой является АВР. Некоторые аспекты относятся к представляющей интерес молекуле, которой является антитело.
[00340] Некоторые аспекты относятся к способам скрининга библиотек, раскрытых в настоящем документе, которые используют для идентификации АВР, способных к связыванию с желаемыми целями. Предполагается любой in vitro или in vivo способ скрининга, который обеспечивает отбор АВР из библиотеки, основанный на связывании АВР с целевой молекулой.
[00341] Согласно одному варианту осуществления библиотеку можно скринировать с использованием признанного в уровне техники in vitro бесклеточного связанного с фенотипом/генотипом дисплея. Такие способы хорошо известны в уровне техники и описаны, например, в патентах США №№ 7195880; 6951725; 7078197; 7022479; 6518018; 7125669; 6846655; 6281344; 6207446; 6214553; 6258558; 6261804; 6429300; 6489116; 6436665; 6537749; 6602685; 6623926; 6416950; 6660473; 6312927; 5922545 и 6348315. Данные способы включают транскрипцию белка in vitro от нуклеиновой кислоты таким образом, что белок физически ассоциируется или связывается с нуклеиновой кислотой, из которой он походит. Путем отбора экспрессированного белка с целевой молекулой также может быть отобрана нуклеиновая кислота, которая кодирует белок.
[00342] Для улучшения экспрессии белков scFv вышеупомянутые in vitro анализы скрининга могут включать добавление или удаление определенных реагентов. Согласно одному варианту осуществления ферменты протеиндисульфидизомеразы могут быть добавлены к системе экспрессии in vitro для улучшения продуцирования функциональных молекул scFv. Согласно другому варианту осуществления мягкое окисляющее средство (например, GSSG (окисленный глутатион)/08Н (восстановленный глутатион), например, 100 мМ GSSG/10 мМ GSH) можно добавлять к реакционной смеси трансляции in vitro белков scFv для обеспечения образования внутрицепной дисульфидной связи в участках VH и VL молекулы scFv. Согласно другому варианту осуществления восстанавливающие средства (например, дитиотреитол (DTT)) можно удалять из реакционной смеси трансляции in vitro scFv.
[00343] Согласно другому варианту осуществления одну или несколько меченых аминокислот или их производных можно добавлять в систему трансляции in vitro таким образом, что меченая аминокислота(ы) становится встроенной в полученное в результате антитело. Предполагается любая признанная в уровне техники меченая аминокислота, например, радиоактивно меченная аминокислота, например, 35S-меченный метионин или цистеин.
[00344] Согласно одному варианту осуществления in vitro анализы скрининга могут включать в себя те, с помощью которых после in vitro отбора антитела или множества антител можно обратно транскрибировать mRNA, физически связанную с антителом или множеством антител, для образования кДНК, кодирующей указанное антитело или множество антител. Предполагается любой приемлемый способ обратной транскрипции, например, опосредованным ферментом, например, обратной транскриптазой вируса мышиного лейкоза Молони.
[00345] Способы скрининга могут включать амплификацию нуклеиновой кислоты, кодирующей антитела, которые специфично связываются с желаемой целью. Согласно одному варианту осуществления mRNA, физически связанную с антителом или множеством антител, можно амплифицировать, чтобы получить больше mRNA. Предполагается любой признанный в уровне техники способ репликации РНК, например, использование фермента РНК-репликазы. Согласно другому варианту осуществления mRNA, физически ассоциированную с антителом или множеством антител, сначала обратно транскрибируют в кДНК перед амплификацией при помощи PCR. Согласно одному варианту осуществления PCR-амплификацию осуществляют с использованием высокоточной корректирующей полимеразы, например, термостабильной ДНК-полимеразы KOD1 из Thermococcus kodakaraensis или Platinum Taq DNA Polymerase High Fidelity (Invitrogen, Carlsbad, Calif.). Согласно другому варианту осуществления можно выполнять PCR-амплификацию при условиях, которые обеспечивают введение мутаций в амплифицированную ДНК, т.е. допускающую ошибки PCR.
[00346] Способы скрининга могут также включать увеличение жесткости анализа скрининга целевого связывания для отбора антител с улучшенной аффинностью к цели. Включаются любые признанные в уровне техники способы повышения жесткости анализа взаимодействия антитела с целью. Согласно одному варианту осуществления один или несколько условий анализа могут варьировать (например, концентрация соли в буфере для анализа) для снижения аффинности молекул антител к желаемой цели. Согласно другому варианту осуществления можно уменьшить период времени, допускаемый для связывания антител с желаемой целью. Согласно другому варианту осуществления к анализу взаимодействия антитела с целью можно добавить стадию конкурентного связывания. Например, сначала может обеспечиваться связывание антител с желаемой иммобилизованной целью. Затем можно добавлять специфичную концентрацию неиммобилизованной цели, которая конкурирует за связывание с иммобилизованной целью так, что антитела с самой низкой аффинностью к антигену элюируют из иммобилизованной цели, что обеспечивает в результате обогащение антител с улучшенной аффинностью связывания антигена. Согласно одному варианту осуществления жесткость условий анализа можно дополнительно усилить за счет увеличения концентрации неиммобилизованной цели, которую добавляют при анализе.
[00347] Способы скрининга могут также включать несколько циклов отбора для обогащения одного или нескольких антител с улучшенным связыванием цели. Согласно одному варианту осуществления на каждом цикле отбора можно ввести дополнительные аминокислотные мутации в антитела с использованием признанных способов. Согласно другому варианту осуществления в каждом цикле отбора жесткость связывания с желаемой целью может быть усилена для отбора антител с повышенной аффинностью к желаемой цели.
[00348] Способы скрининга могут включать очистку слитых белков РНК-антитело из компонентов системы трансляции in vitro. Это можно осуществить с использованием любого признанного в уровне техники способа разделения. Согласно одному варианту осуществления слитые белки РНК-антитело можно разделять хроматографией с использованием полидезокситимидиновой (polydT) смолы. Согласно другому варианту осуществления слитые белки РНК-антитело можно разделять хроматографией с использованием антитела, специфичного по отношению к эпитопу, присутствующему в антителе-компоненте слитого белка РНК-антитело. Согласно одному варианту осуществления эпитопом может быть метка аминокислотной последовательности, например, метки FLAG или НА, введенные в аминокислотную последовательность антитела-компонента слитого белка РНК-антитело, например, на N-конце, С-конце или внутри вариабельного линкерного участка.
[00349] Отбор антител из библиотеки может включать применение иммобилизованных целевых молекул. Согласно одному варианту осуществления целевая молекула может быть непосредственно связана с твердым субстратом, например, с агарозными гранулами. Согласно другому варианту осуществления сначала целевую молекулу можно модифицировать, например, биотинилировать, а модифицированную целевую молекулу можно связать посредством модификации с твердой подложкой, например, со стрептавидином-М280, нейтравидином-М280, SA-М270, NA-M270, SA-MyOne, NA-MyOne, SA-агарозой и NA-агарозой.
[00350] Некоторые аспекты относятся к флуоресцентно меченным антигенам, которые используют для сортировки по отдельной клетке только плазмобластов или других клеток, происходящих от В-клеток, с реактивностью против специфичных меченых антигенов. Другие аспекты относятся к флуоресцентно меченным антигенам, которые используют для обогащения плазмобластов или других клеток, происходящих от В-клеток, с реактивностью против специфичных меченых антигенов перед осуществлением сортировки по отдельной клетке. Некоторые аспекты относятся к флуорогенным или хромогенным молекулам, которые можно использовать для идентификации и сортировки клеток, происходящих от В-клеток. Некоторые аспекты относятся к желаемым плазмобластам или другим клеткам, происходящим от В-клеток, которые можно выделять магнитно-активированной сортировкой клеток (MACS) или даже «пэннингом». Получившиеся продукты, как правило, представляют собой моноклональные антитела против различных целей, в том числе без ограничения раковых антигенов, цитокинов, хемокинов, факторов роста, секретируемых белков, антигенов клеточной поверхности и других антигенов для истощения представляющих особый интерес типов клеток, микробов, бактерий, микобактерий, паразитов и вирусов. Другие способы скрининга описаны ниже в разделе «Примеры».
Компьютерная реализация
[00351] Некоторые аспекты относятся к одному или нескольким описанным в настоящем документе способам, которые могут быть реализованы на компьютере. Согласно одному варианту осуществления компьютер содержит по меньшей мере один процессор, соединенный с чипсетом. Также, с чипсетом соединены память, устройство хранения информации, клавиатура, графический адаптер, указывающее устройство и сетевой адаптер. Дисплей соединяется с графическим адаптером. Согласно одному варианту осуществления функциональность чипсета обеспечивают концентратором контроллера памяти и концентратором контроллера ввода/вывода. Согласно другому варианту осуществления память соединена непосредственно с процессором, а не с чипсетом.
[00352] Устройством хранения информации может быть любое устройство, способное хранить данные, такое как жесткий диск, компакт-дисковое запоминающее устройство (CD-ROM), DVD или устройство твердотельной памяти. Память содержит инструкции и данные, используемые процессором. Указывающим устройством может быть мышь, трекбол или другой тип указывающего устройства, которое используют в комбинации с клавиатурой для ввода данных в компьютерную систему. Графический адаптер показывает изображения и другую информацию на дисплее. Сетевой адаптер соединяет компьютерную систему с локальной или глобальной сетью.
[00353] Как известно из уровня техники, компьютер может содержать различные и/или другие компоненты помимо вышеупомянутых. Кроме того, в компьютере могут отсутствовать некоторые компоненты. Более того, устройство хранения информации может быть локальным и/или удаленным от компьютера (таким как, например, реализованное в сети хранения данных (SAN)).
[00354] Как известно из уровня техники, компьютер приспособлен для выполнения компьютерных программных модулей для обеспечения функциональности, описанной в настоящем документе. Используемый в настоящем документе термин «модуль» относится к логике компьютерной программы, используемой для обеспечения указанной функциональности. Таким образом, модуль может быть реализован в аппаратном обеспечении, микропрограммном обеспечении и/или программном обеспечении. Согласно одному варианту осуществления программные модули хранят в устройстве хранения информации, загружают в память и осуществляют процессором.
[00355] Согласно вариантам осуществления объекты, описанные в настоящем документе, могут содержать другие и/или различные модули помимо описанных в настоящем документе. Кроме того, функциональность, отнесенная к модулям, может быть осуществлена другими или разными модулями согласно другим вариантам осуществления. Более того, в настоящем описании иногда опускается термин «модуль» с целью наглядности и удобства.
Наборы
[00356] Набор может содержать раскрытые в настоящем документе полинуклеотид, библиотеку полинуклеотидов, вектор и/или клетку-хозяина, а также инструкции по применению. Наборы могут содержать, в приемлемом контейнере, полинуклеотид, библиотеку полинуклеотидов, вектор и/или клетку-хозяина, раскрытые в настоящем документе, один или несколько контролей, а также различные буферы, реагенты, ферменты и другие стандартные ингредиенты, хорошо известные в уровне техники.
[00357] Контейнер может содержать по меньшей мере одну лунку в планшете, содержащем одну или несколько лунок. Контейнер может содержать по меньшей мере один сосуд, аналитическую пробирку, колбу, бутылку, шприц или другие контейнерные средства, в которые полинуклеотид, библиотека полинуклеотидов, вектор и/или клетка-хозяин могут быть помещены и, в некоторых случаях, разделены подходящим образом на аликвоты. При обеспечении дополнительного компонента набор может содержать дополнительные контейнеры, в которые этот компонент может быть помещен. Наборы могут также содержать средства для содержания полинуклеотида, библиотеки полинуклеотидов, вектора и/или клетки-хозяина, а также любые другие контейнеры для реагентов при тесном размещении для коммерческой продажи. Такими контейнерами могут быть формованные литьём под давлением или формованные раздувом пластиковые контейнеры, в которых сохраняются желаемые сосуды. Контейнеры могут содержать маркировку с инструкциями по применению и/или предупреждения.
Примеры
[00358] Примеры предлагаются исключительно в иллюстративных целях и не предназначены для ограничения объема какого-либо варианта осуществления настоящего изобретения каким-либо образом. Были предприняты усилия для обеспечения точности используемых показателей (например, количеств, температур и т.п.), но конечно, могут быть допустимы некоторые экспериментальные ошибки и отклонения.
[00359] Можно применять различные способы, если не указано иное, традиционные способы химии белков, биохимии, методик рекомбинантной ДНК и фармакологии, известные в уровне техники. Такие методики полностью описаны в литературе. См, например, Т.Е. Creighton, Proteins: Structures and Molecular Properties (W.H. Freeman and Company, 1993); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990); Carey and Sundberg Advanced Organic Chemistry 3rd Ed. (Plenum Press) Vols A and B(1992); Current Protocols in Molecular Biology (2002- ; Wiley; Online ISBN: 9780471142720; DOI: 10.1002/04711142727); Current Protocols in Immunology (2001- ; Wiley; Online ISBN: 9780471142737; DOI: 10.1002/0471142735).
Общие материалы способы
[00360] Сбор крови и выделение РВМС
[00361] Все человеческие образцы собирали после информированного согласия и по одобренным Investigational Review Board (IRB) протоколам для субъекта-человека. Кровь собирали в обработанные гепарином пробирки (Beckton Dickinson and Company, № по каталогу BD366664) или в пробирки СРТ (Beckton Dickinson and Company, № по каталогу BD362761). Для работы с обработанными гепарином пробирками один миллилитр крови переносили в микроцентрифужную пробирку и центрифугировали при 12000 оборотах в минуту в течение 3 минут, плазму собирали и замораживали при -80°С (для последующего тестирования на реакционные способности антител), оставшуюся часть крови наслаивали на Ficoll и центрифугировали в настольной центрифуге Beckman Coulter Allegra X-15R с SX4750 Swinging Bucket Rotor при 800 g для обработанных гепарином пробирок в течение 20 минут при комнатной температуре с минимальным ускорением и без использования тормоза и собирали слой мононуклеарных клеток периферической крови (РВМС). В качестве альтернативы, пробирки СРТ сразу центрифугировали при 1500 g в течение 20 минут при комнатной температуре с минимальным ускорением и без использования тормоза и собирали слой РМВС. Затем собранные РВМС дважды промывали PBS перед использованием.
[00362] РВМС также могут быть заморожены для будущего применения и выделения В-клеток, В-клеток памяти, плазмобластов, плазматических клеток или других популяций В-клеток. Один способ замораживания РВМС включает повторное суспендирование РВМС в 90% эмбриональной телячьей сыворотке (FBS) и 10% диметилсульфоксиде (DMSO) в криососудах, а затем медленное замораживание содержащихся в сосудах клеток в течение ночи при -80°С в Mr. Frosty (Sigma С1562-1ЕА). Затем сосуды с замороженными клетками переносили для длительного хранения в жидкий азот и позже могли размораживать для выделения индивидуальных В-клеток, а также для высокопроизводительного секвенирования спаренных генов иммуноглобулина. Размороженные клетки инкубировали в среде, содержащей избыток ДНКазы I, как правило, 25 мкг/мл (Sigma D4513), до конца 1-ой сортировки, чтобы предотвратить агрегацию клеток.
Выделение и обогащение клеток и клеточных субпопуляций
[00363] Плазмобласты. Для некоторых образцов РВМС сначала обогащали плазмобластами с использованием Plasma Cells Isolation Kit II (Miltenyi 130-093-628). Это является необязательной стадией. В результате получали меньше общих клеток для последующей сортировки, что приводило к сокращению времени сортировки. Это использовали, в первую очередь, когда необходимо было отсортировать множество образцов по отдельной клетке в один и тот же день. Также можно применять различные наборы для обогащения различных популяций В-клеток (см. ниже). На каждые 5 х 107 РВМС клетки суспендировали в 200 мкл охлажденного льдом буфера MACS (PBS с 0,5% FBS). Добавляли 50 мкл клеточного коктейля из биотинилированных антител без плазмы для выделения клеток и клетки инкубировали в холодильнике (4°С) в течение 10 минут. Добавляли 100 мкл буфера MACS, 100 мкл коктейля микрогранул без плазмы для выделения клеток и 50 мкл микрогранул CD56 и инкубировали в холодильнике в течение дополнительных 10 минут. Затем клетки промывали 7 мл буфера MACS, центрифугировали при 300 g в течение 5 минут при 4°С, повторно суспендировали в 500 мкл буфера MACS и прогоняли на уравновешенной колонке LS в магнитном поле. Колонку промывали 4 раза 3 мл буфера MACS и обогащенные клетки наблюдали в отрицательной фракции.
[00364] В-клетки памяти. Микрогранулы CD19+ (Miltenyi 130-050-301) и микрогранулы CD27+ (130-051-601) могут быть использованы для обогащения В-клеток памяти перед сортировкой клеток, чтобы сократить время сортировки. Другие способы обогащения, такие как с помощью набора для выделения В-клеток памяти (Miltenyi 130-093-546), также могут быть использованы при условии, что они обогащают CD19+CD27+ клетками. На каждые 5 х 107 РВМС использовали 300 мкл охлажденного льдом буфера MACS для повторного суспендирования. Затем добавляли 100 мкл микрогранул CD 19 и 100 мкл микрогранул CD27 и образец инкубировали при 4°С в течение 15 минут. Затем клетки промывали 7 мл буфера MACS, центрифугировали при 300 g в течение 5 минут при 4°С и повторно суспендировали в 500 мкл буфера MACS. Затем клетки прогоняли на уравновешенной колонке LS в магнитном поле и промывали 2 раза 3 мл буфера MACS. Затем колонку LS удаляли из магнитного поля, а клетки вымывали 5 мл буфера MACS для элюирования обогащенных клеток.
[00365] Общие В-клетки. Микрогранулы CD 19+ (Miltenyi 130-050-301) могут быть использованы для обогащения общих В-клеток перед сортировкой клеток, например, чтобы сократить время сортировки. Другие способы обогащения также могут быть использованы при условии, что они обогащают CD19+ клетками. На каждые 5 х 107 РВМС клетки повторно суспендировали в 400 мкл охлажденного льдом буфера MACS. Добавляли 100 мкл микрогранул CD 19+ и инкубировали в холодильнике (4°С) в течение 15 минут. Затем клетки промывали 7 мл буфера MACS, центрифугировали при 300 g в течение 5 минут при 4°С и повторно суспендировали в 500 мкл буфера MACS. Затем клетки прогоняли на уравновешенной колонке LS в магнитном поле и промывали 2 раза 3 мл буфера MACS. Затем колонку LS удаляли из магнитного поля, а клетки вымывали 5 мл буфера MACS с получение обогащенных клеток.
[00366] Другие типы клеток. Хотя и нет необходимости, обогащение с помощью MACS желаемой клеточной популяции может сократить время сортировки. Другие клеточные популяции, в том числе плазматические клетки, другие В-клеточные популяции и отличные от В-клеток популяции, также можно обогащать с помощью MACS или других систем с использованием подходящих реагентов. Например, общие Т-клетки могли быть обогащены с использованием микрогранул CD3+, а эффекторные Т-клетки и хелперные Т-клетки выделяли с использованием микрогранул CD8+ и CD4+, соответственно. Микрогранулы CD45RO могли быть использованы для выделения Т-клеток памяти и, в сочетании с гранулами CD8+ или CD4+, использованы для выделения эффекторных Т-клеток памяти или хелперных Т-клеток памяти, соответственно.
Сортировка по отдельной клетке
[00367] Обогащение с помощью MACS не требуется для сортировки, но обогащение с помощью MACS для плазмобластов может выполняться, чтобы сократить время сортировки. Если РВМС подвергали обогащению с помощью MACS, аликвоту необогащенных РВМС (~1 миллион клеток) также анализировали в тандеме, что позволяло определить базовый уровень процентного отношения плазмобласта в образце. Для сортировки плазмобластов клетки окрашивали рекомендованными изготовителем объемами CD3-V450 (BD 560365), IgA-FITC (AbD Serotec STAR 142F), IgM-FITC (AbD Serotec STAR 146F) или IgM-PE (AbD Serotec STAR146PE), CD20-PerCP-Cy5.5 (BD 340955), CD38-PE-Cy7 (BD 335808), CD19-APC (BD 340437) и CD27-APC-H7 (BD 560222) в 50 мкл буфера FACS (PBS или HBSS с 2% FBS) на льду в течение 20 минут в темноте. Вместо этого некоторые клетки также могли быть окрашены IgG-PE (BD 555787), CD138-PE (eBioscience 12-1389-42) или HLA-DR-PE (BD 555812) вместе с IgM-FITC. Для одновременной сортировки плазмобластов, В-клеток памяти и наивных В-клеток использовали следующую схему окрашивания: IgD-FITC (Biolegend 348205), IgG-PE (BD 555787), CD20-PerCP-Cy5.5, CD38-PECy7, IgM-APC (BD 551062), CD27-APC-H7, IgA-биотин (AbD Serotec 205008), за которым следуют Strepavidin-eFluor710 (eBioscience 49-4317-82) и CD19-BV421 (Biolegend 302233). В-клетки памяти также сортировали либо как CD19+CD27+IgG+, либо как CD19+CD20+IgG+, наивные В-клетки сортировали как CD19+IgD+IgM+. Плазмобласты IgA+ также сортировали и определяли как CD19+CD20-CD27+CD38++IgA+IgM-. Другие маркеры клеточной поверхности также могли быть использованы при условии, что В-клетки или другая популяция клеток фенотипически идентифицируема с использованием маркеров клеточной поверхности, при этом популяция могла быть отсортирована по отдельной клетке. Затем клетки промывали однократно 2 мл буфера FACS и повторно суспендировали в подходящем объеме для FACS. Клетки сначала сортировали на BD Aria II в 5 мл пробирке с круглым дном. Как правило, при первой сортировке достигали степеней чистоты >80%. Отдельные клетки сортировали в первых 11 колонках 96-луночного планшета для PCR, содержащего 6,65 мкл гипотонического буфера (10 мМ Tris-HCl, рН 7,6), содержащего 2 мМ dNTP (NEB N0447L), 5 мкМ oligo(dT)20VN и 1 часть Ribolock (Fermentas ЕО0384), ингибитора РНКазы. В качестве отрицательного контроля последнюю колонку оставляли без клеток. Для IgG+ плазмобластов стратегия гейтирования (отбора клеток) состояла в CD19+CD20-CD27+CD38IgA-IgM-. Отсортированные планшеты запечатывали покрытиями из алюминиевых пластин (Axygen PCR-AS-600), немедленно замораживали на сухом льду и хранили при -80°С.
[00368] Стратегии гейтирования при сортировке по отдельной клетке
[00369] В-клетки. Для В-клеток подход гейтирования включает сортировку по одному или нескольким следующим маркерам: IgM, IgG, IgA, IgD, CD 19 или CD20. Для общих IgG+ В-клеток подход гейтирования включает сортировку по IgG+. Для общих В-клеток IgA+ подход гейтирования включает сортировку по IgA+. Для общих IgM+ В-клеток подход гейтирования включает сортировку по IgM+.
[00370] Активированные В-клетки. Активированные В-клетки включают в себя В-клетки, которые стимулировали посредством связывания их мембранного антигенного рецептора с его родственным антигеном и/или с помощью Т-клетки от Т-клеток, распознающих эпитопы, полученные из одного и того же макромолекулярного антигена. Активированные В-клетки можно идентифицировать с помощью различных свойств, в том числе увеличенного размера клеток (например, «бластоподобных В-клеток», см. ниже), экспрессии маркера или маркеров клеточной поверхности, экспрессии внутриклеточного маркера или маркеров, экспрессии транскрипционного фактора или факторов, выхода из промежуточной 0 (G0) фазы клеточного цикла, прохождения через клеточный цикл, продуцирования цитокинов и других факторов, и/или даун-регуляции определенного маркера или маркеров клеточной поверхности, внутриклеточного маркера или маркеров, фактора транскрипции или другого фактора. Одним из способов идентификации активированной В-клетки является совместное выявление маркера В-клетки, такого как CD 19 или иммуноглобулина, с маркером активации, таким как увеличенный размер или объем клетки, маркер активации клеточной поверхности CD69 или прохождение через клеточный цикл на основе проницаемого в клетку ДНК-красителя акридинового оранжевого или другого анализа клеточного цикла.
[00371] Бластоподобные В-клетки. «Бластоподобными В-клетками» являются В-клетки, которые активируются и увеличиваются в размерах относительно находящихся в покое В-клеток. Бластоподобные В-клетки включают в себя популяцию плазмобластов, а также другие популяции активированных В-клеток, и бластоподобные В-клетки физически больше по размеру, чем находящиеся в покое В-клетки. Бластоподобные В-клетки могут быть отсортированы по отдельной клетке с использованием нескольких различных подходов, в том числе гейтирования (отбора) В-клеток на основе того, что они физически больше по диаметру клетки, клеточному объему, электрическому сопротивлению, FSC, интегралу (области) импульса FSC (FSC-А), высоты FSC (FSC-H), ширине импульса прямого светорассеяния (FCS-W), бокового светорассеяния (SSC), площади импульса бокового светорассеяние (SSC-A), высоте бокового светорассеяния (SSC-H), ширине бокового светорассеяния (SSC-3), аутофлуоресценции и/или другим измерениям размера клетки.
[00372] В проточной цитометрии прямое светорассеяние (FSC) измеряют с использованием светового луча, находящегося в одной линии с потоком клеток и обеспечивающего информацию относительно пропорционального размера и диаметра каждой клетки. Используя FSC, можно отбирать только В-клетки с FSC, большим среднего FSC находящейся в покое В-клетки, например, FSC-A или FSC-H на 5% больше, чем у находящихся в покое В-клеток, на 10% больше, чем у находящихся в покое В-клеток, на 15% больше, чем у находящихся в покое В-клеток, на 20% больше, чем у находящихся в покое В-клеток, на 30% больше, чем у находящихся в покое В-клеток, на 40% больше, чем у находящихся в покое В-клеток, на 50% больше, чем у находящихся в покое В-клеток, на 60% больше, чем у находящихся в покое В-клеток. При анализе калибровочных гранул определенных размеров можно использовать FSC, чтобы определить относительный размер В-клеток относительно калибровочных гранул. Таким образом, можно специфично включать гейты и, тем самым, выбирать В-клетки, у которых диаметр составляет приблизительно 8 мкм, >8 мкм, >9 мкм, >10 мкм, >11 мкм, >12 мкм, >13 мкм, >14 мкм, >15 мкм, >16 мкм, >17 мкм, >18 мкм, >19 мкм или >20 мкм.
[00373] Другим измерением размера клетки является клеточный объем. В качестве «золотого стандарта» для клеточного объема используют принцип Культера, который основан на электронном измерении (Tzur et al, PLoS ONE, 6(1): el6053. doi:10.1371/journal.pone.0016053, 2011). Однако способ сортировки капельным зарядом и отклонение были впервые использованы в устройстве, которым измеряли объем клеток за счет сопротивления, с помощью доступных в настоящее время проточных цитометров осуществляют только оптические измерения. Измерения FSС, в частности, FSC-A (интегральная область FSC), обычно используют для оценки размера клетки, хотя на измерения FSC могут влиять различия индекса преломления между частицами и жидкостью (Tzur et al, PLoS ONE, 6(1): el6053. doi:10.1371/journal.pone.0016053, 2011). Было показано, что оценка объема может быть улучшена путем объединения оптических параметров, в том числе FSC-W, SSC и 450/50-А аутофлуоресценции (Tzur et al, PLoS ONE, 6(1): el6053. doi:10.1371/journal.pone.0016053, 2011).
[00374] Например, отбор активированных В-клеток по увеличенному размеру может быть осуществлен посредством идентификации В-клеток с использованием маркера, такого как CD 19, и оценки размера по FSC или FSC-A. В настоящем документе описаны другие маркеры и/или параметры В-клеток для оценки размера.
[00375] Плазмобласты. Для выделения плазмобластов подход гейтирования включает сортировку CD19+CD38++ В-клеток. Для выделения IgG+ плазмобластов подход гейтирования включает сортировку CD19+CD38++IgA-IgM- В-клеток. Для выделения IgA+ плазмобластов подход гейтирования включает сортировку CD19+CD38++IgA+ В-клеток. Для выделения IgM+ плазмобластов подход гейтирования включает сортировку CD19+CD38++IgM+ В-клеток. Кроме того, другие стратегии гейтирования могут использоваться для выделения количества плазмобластов, достаточного для выполнения описанных в настоящем документе способов. Плазмобласты также выделяют с использованием следующих паттернов маркера экспрессии CD19low/+, CD20low/-, CD27+ и CD38++. Хотя применение всех этих маркеров, как правило, дает в результате чистейшую популяцию плазмобластов посредством сортировки по отдельной клетке, не все из вышеупомянутых маркеров подлежат использованию. Например, плазмобласты также могут быть выделены с использованием следующих стратегий гейтирования: интенсивное прямое светорассеяние (FSChi) для более крупных клеток, FSChiCD19lo клеток, а также FSChi и CD27+, CD38++ или CD20 клеток. Комбинация любого из этих маркеров или других маркеров, найденных для обеспечения возможности отличия плазмобластов от других В-клеток, как правило, будет увеличивать чистоту отсортированных плазмобластов, однако любой из вышеупомянутых маркеров в одиночку (в том числе FSChi) может отличить плазмобласты от других В-клеток, хотя и с более низкой чистотой.
[00376] Для В-клеток памяти. Для IgG+ В-клеток памяти подход гейтирования включает сортировку CD19+ CD27+IgG+ или CD19+ CD20+IgG+. Для IgA+ В-клеток памяти стратегия гейтирования включает сортировку CD19+CD27+IgA+ или CD19+CD20+IgA+. Для IgM+ В-клеток памяти стратегия гейтирования включает сортировку CD19+CD27+IgM+ или CD19+CD20+IgM+.
[00377] Для других типов клеток. Поскольку популяция В-клеток, Т-клеток или других клеток является фенотипически идентифицируемой с использованием клеточных маркеров, ее можно отсортировывать по отдельной клетке. Например, Т-клетки могут быть идентифицированы как CD3+ или TCR+, наивные Т-клетки могут быть идентифицированы как CD3+CD45RA+, Т-клетки памяти могут быть идентифицированы как CD3+CD45RO+. Эффекторные и хелперные Т-клетки могут быть идентифицированы как CD3+CD8+ и CD3+CD4+, соответственно. Клеточные популяции могут быть далее разделены с использованием комбинаций маркеров, таких как CD3+CD4+CD45RO+ для хелперных Т-клеток памяти.
Секвенирование спаренных легкой и тяжелой цепей генов иммуноглобулина из отдельных В-клеток
[00378] Обратная транскрипция с адаптерными молекулами
[00379] Отсортированные по отдельной клетке планшеты размораживали на льду и кратковременно центрифугировали перед использованием. Планшеты инкубировали в термоциклере при 55°С в течение 3 минут, при 42°С в течение 2 минут и в течение неограниченного срока при 4°С. Планшеты повторно кратковременно центрифугировали и осторожно открывали во избежание образования аэрозолей. В каждую лунку добавляли 1 мкл 10 мкМ раствора соответствующей адаптерной молекулы (каждая адаптерная молекула, как правило, содержит сигнальный участок образца (ID образца)), во все лунки отрицательного контроля (содержащие только консервирующий буфер для РНК или не содержащие В-клеток) добавляли идентичные адаптерные молекулы. В каждую лунку добавляли 2,35 мкл смеси, содержащей 0,75 мкл Н20, 1 мкл 10 х буфера M-MuLV RT (NEB B0253S), 0,6 мкл 50 мМ MgCl2, 0,25 мкл Ribolock (40 единиц/мкл) и 0,125 мкл Superscript III (200 единиц/мкл) (Invitrogen 18080-085) и перемешивали с помощью пипетки. Планшеты кратковременно центрифугировали и инкубировали при 42°С от 120 минут до 8 часов с использованием теплового планшетного шейкера, а затем выдерживали при -20°С. После реакции продукты RT из всех лунок объединяли в микроцентрифужную пробирку. Объединенные продукты RT затем экстрагировали фенол-хлороформ-изопропиловым спиртом с -0,1% 8-гидроксихлорохином (Sigma 77617), а затем экстрагировали хлороформом в пробирках Gel Lock Phase (5 PRIME 2302820). Продукты RT затем концентрировали и обессоливали 5-минутными центрифугированиями при 14000 g с 30 кДа Amicon Ultra-0,5 (Millipore UFC503096) или 100 кДа Ultra-0,5 (Millipore UFC510096) с последующим 5-минутным центрифугированием при 14000 g с ТЕ (10 мМ Tris-HCl рН 7,6 с 1 мМ EDTA) и окончательным 5-минутым вращением на 14000 g с ЕВ (Qiagen 19086). Продукты RT элюировали путем инвертирования колонки Amicon Ultra в новой центрифужной пробирке и центрифугировали при 1000 g в течение 2 минут. До этого момента продукты RT держали при -20°С или -80°С.
[00380] Touchdown PCR
[00381] Для циклов 1 и 2 секвенирования по технологии 454 использовали способ Touchdown PCR следующим образом. Для некоторых образцов в циклах 3 и 4 PCR способ PCR изменили, что приводило к увеличению количества спаренных тяжелых и легких цепей. Это изменение подробно изложено в нижеупомянутом подразделе «Отличная от touchdown PCR».
[00382] Для обеих 1-ой PCR и гнездовой 2-ой PCR использовали ДНК-полимеразу Phusion Hot Start II (NEB F-549L) в соответствующем буфере GC. Для IgG праймеры и адаптерные молекулы показаны в таблице 1. Последовательности ID образца показаны в таблице 2. Последовательности ID планшета показаны в таблице 3. См. также фиг. 3 и 9. Условия реакции включали конечную концентрацию 1,8 мМ MgCl, 200 мкМ dNTP, 0,2 мкМ для всех праймеров, 0,2 единицы полимеразы Phusion, различные количества DMSO в качестве добавки и 2 мкл матрицы в конечном объеме 25 мкл. Для 1-ой PCR легкие цепи лямбда и каппа, а также тяжелую цепь гамма амплифицировали в разных лунках и DMSO использовали при конечных концентрациях 8%, 5% и 10%, соответственно. Прямыми праймерами, используемыми в 1 -ой PCR, были Fw Long Primer 1 и Fw Short Primer 1. Поскольку Fw Long Primer 1 добавлял сигнальный участок планшета (ID планшета) к 5'-концу участков ампликона (ампликонов), Fw Long Primer 1, содержащий различные ID планшетов, добавляли к различным образцам. В качестве специфичных для гена обратных праймеров для амплификации цепей каппа, лямбда и гамма использовали GSP1 каппа, GSP1 лямбда и GSP1 гамма, соответственно. Условия циклов для 1-ой PCR включали начальную стадию денатурации при 98°С в течение 30" с последующими 2 циклами при 98°С в течение 10", при 72°С в течение 25", 7 циклами touchdown при 98°С в течение 10", при 71,5°С - 68,5°С в течение 15" и при 72°С в течение 20" с шагом 0,5°С для каждой последующей стадии отжига; 30 циклов при 98°С в течение 10", при 68°С в течение 15" и при 72°С в течение 20" с последующим конечное удлинением при 72°С в течение 5' и выдерживанием при 4°С в течение неопределенного срока. Продукты 1-ой PCR разводили в 100 раз в ТЕ и 2 мкл использовали для гнездовой 2-ой PCR. Для 2-ой PCR 5% DMSO использовали в качестве добавки во все образцы. Прямым праймером был праймер 2 Fw, а обратными праймерами были праймер 2 RV и длинный праймер 2 GSP. Каппа длинный праймер 2 GSP, лямбда длинный праймер 2 GSP и гамма длинный праймер 2 использовали для амплификации соответствующих им ампликонов. Поскольку длинный праймер 2 GSP также добавлял ID планшета к 3'-концу ампликонов, другой длинный праймер 2 GSP со специфичными для планшетов ID планшетов добавляли к каждому образцу из объединенного планшета. Условия циклов для гнездовой 2-ой PCR включали начальную стадию денатурации при 98°С в течение 30", 30-40 циклов при 98°С в течение 10", при 67°С в течение 15" и при 72°С в течение 20" с последующим окончательного удлинения при 72°С в течение 5' и выдерживанием при 4°С в течение неопределенного срока.
[00383] Отличная от touchdown PCR
[00384] Для отличной от touchdown PCR условия были идентичными таковым для touchdown PCR, если не указано иное. В 1-ой PCR параметры циклов включали начальную денатурацию при 95°С в течение 5', 15-25 циклов при 98°С в течение 30", при 62°С в течение 30", при 72°С в течение 30", окончательное удлинение при 72°С в течение 5' и выдерживание при 4°С в течение неопределенного срока. 1-ая PCR была мультиплексной PCR, при которой все 3 специфичные для гена обратных праймера - обратных праймера константных участков каппа, лямбда и гамма - использовали в сочетании при 0,2, 0,2 и 0,24 мкМ, соответственно. Все другие используемые праймеры были такими же, как и при touchdown PCR. Специфичные для гена праймеры могут быть такими, которые используют при touchdown PCR, а также любыми из тех, которые указаны как приемлемые для 1-ой PCR (таблица 6). DMSO использовали при конечной концентрации 5%; также могут быть добавлены 0,1 мг/мл BSA (NEB B9001S) и ET-SSB (NEB M2401S) при 1:100 для реакции PCR. В ходе 1-ой PCR 4-6 мкл матрицы кДНК использовали в общем реакционном объеме 80 или 90 мкл. Каждую реакционную смесь PCR 1 разделяли на восемь или девять 10 мкл реакционных смесей, при этом каждая находилась в отдельной лунке. Продукты 1-ой PCR объединяли снова после PCR, разбавляли в 100 раз ТЕ0,1 и 2 мкл использовали для 2-ой PCR. 2-ая PCR является отдельной реакцией для каждого специфичного для гена праймера (не мультиплексного), и реакционная смесь была идентична таковой при 2-ой touchdown PCR за исключением следующего: могут использоваться любые специфичные для гена праймеры константных участков, обозначенные как рабочие для 2-ой PCR (таблица 6), праймеры использовали для всех целей либо при 0,2 мкМ, либо при 0,4 мкМ, или специфичные для гена праймеры использовали при 0,2 мкМ, а остальные использовали при 0,4 мкМ. Добавляли 0,1 мг/мл BSA в реакционную смесь, а также могли использовать ET-SSB при 1:100. Параметры циклов 2-ой полугнездовой PCR включали первоначальную денатурацию при 95°С в течение 5', 20-35 циклов при 95°С в течение 30", при 67°С в течение 30", при 72°С в течение 30", окончательное удлинение при 72°С в течение 5' и выдерживание при 4°С в течение неопределенного срока. Общее число циклов PCR для 1-ой и 2-ой PCR вместе составляло, как правило, 50-60 циклов для отличной от touchdown PCR. Так как различные объединенные лунки, подлежащие циклу PCR, обычно служат для применения разного числа циклов, чтобы получить разумное количество продукта ДНК (как правило, 1-12 нг/мкл), проводили 4 различных цикла PCR для каждой 2-ой PCR, например, 23, 26, 30 и 33 цикла, 5 мкл прогоняли на 2% агарозном геле и сравнивали. На основании качественной оценки количества продукта PCR только количества продукта PCR от одного цикла 2-ой PCR использовали для каждой объединенной лунки 2-ой PCR при подготовке к циклу секвенирования по технологии 454.
[00385] Для PCR других тяжелых цепей иммуноглобулина у людей, тяжелых и легких цепей иммуноглобулинов у мышей и цепей TCR у людей и мышей условия PCR идентичны вышеупомянутым в разделе «Отличная от touchdown PCR» за исключением того, что 1-ая PCR является не мультиплексной, при этом каждая кДНК подлежит индивидуальной амплификации. Следующие приведенные в таблицах 10 и 11 3'-праймеры используют в PCR 1 и 2.
[00386] Подготовка к циклу секвенирования по технологии 454 XLR70
[00387] Для 1-го и 2-го циклов по технологии 454 добавляли секвенирующие праймеры (Titanium Primers А и В, соответственно) для цикла секвенирования по технологии 454 Titanium в ампликоны в ходе 1-ой и гнездовой 2-ой PCR. Прогоняли 5 мкл каждого ампликона в агарозном геле с лэддером массы ДНК (Fermentas SM0383), делали снимок и анализировали интенсивности полос, а также количественно оценивали с помощью программного обеспечения AlphaFC Imager (Cell Biosciences). Отдельно объединяли по 5 нг каждого из ампликонов каппа, лямбда и гамма, прогоняли на 0,8% агарозном геле и визуализировали с помощью GelGreen (Biotium 41005). Полосы подходящих размеров (-600 пар оснований для каппа и лямбда, и -750 пар оснований для гамма) вырезали и очищали с помощью MinElute Gel Extraction Kit (Qiagen 28606) в соответствии с инструкциями изготовителя с небольшими модификациями. Вкратце, агарозный гель расплавляли на буфере QG без нагревания и осуществляли дополнительную стадию отмывки QG. Промывочному буферу РЕ позволили постоять в течение 5 минут до центрифугирования. Также осуществляли дополнительную стадию отмывки РЕ. Образцы элюировали с 25 мкл буфера ЕВ. Образцы также однократно очищали с гранулами SPRI, используя отношение 1:0,65 для объем ДНК : объем гранул для 2-го цикла по технологии 454. Концентрацию ДНК определяли с помощью набора для анализа ДНК Picogreen (Invitrogen PI 1496) и образцы объединяли таким образом, что отношение концентрации ДНК для гамма:каппа:лямбда составляло 2:1:1. Объединенные образцы имели концентрацию >0,5 нг/мкл, их отправляли в установку секвенирования ДНК по технологии 454 для секвенирования по технологии 454.
[00388] Для 3-го и последующих циклов секвенирования по технологии 454 протокол изменяли. Ампликоны все еще отдельно объединяли, чтобы нормализовать количества ДНК из каждой реакции PCR, но сначала подвергали очистке гранулами SPRI для удаления небольших фрагментов ДНК в соответствии с инструкциями изготовителя. Ампликоны прогоняли на 3% агарозном геле, подходящие полосы вырезали и очищали с помощью MinElute Gel Extraction Kit, как указано ранее. После этого ампликоны подвергали еще 2 циклам очистки гранулами SPRI для удаления еще более мелких фрагментов ДНК и количественно оценивали с помощью Picogreen, качество проверяли с помощью Nanodrop, чтобы гарантировать, что отношение OD260/280 составляло >1,8, и 1 мкл прогоняли на геле, чтобы гарантировать отсутствие небольших фрагментов ДНК. Ампликоны лямбда и каппа объединяли с отношением 1:1, гамма использовали как есть. Затем ДНК разбавляли до 1 х 109 копий согласно инструкции для технологии 454, отправляли на установку для секвенирования (Roche) для emPCR при 1 cpb и секвенировали; при этом тяжелая цепь гамма на одном участке и объединенные легкие цепи на другом участке пиколитрового планшета.
[00389] Подготовка к циклу секвенирования по технологии 454 XL+
[00390] В настоящее время цикл секвенирования по технологии 454 XL+ не поддерживает набор для секвенирования Lib-A, который использовали для цикла XLR70. В настоящее время XL+ поддерживает только набор Lib-L, который является однонаправленной системой секвенирования. Протокол в соответствии с настоящим изобретением для проведения секвенирования по технологии XL+ адаптировали следующим образом: выполняли протокол для цикла XLR70, но после стадии очистки гелем каждый ампликон (каппа, лямбда и гамма) подвергали 2 отдельным PCR, каждая 5 циклов длиной, чтобы добавить в адаптеры А и В Lib-L. Условия PCR были следующими: использовали полимеразу Phusion с 5 х буфером GC и конечной концентрацией DMSO 5%. Праймеры использовали при 0,2 мкМ. К реакционной смеси добавляли 0,1 мг/мл В SA. Параметры цикла PCR включали начальную денатурацию при 95°С в течение 5', 20-35 циклов при 98°С в течение 30", при 67°С в течение 30", при 72°С в течение 30", окончательное удлинение при 72°С в течение 5' и выдерживание при 4°С в течение неопределенного срока. Две PCR выполняли для каждого ампликона: 5LIB-LA и 3LIB-LB в одной PCR, и 5LIB-LB и 3LIB-LA в другой PCR. Адаптеры добавляли так, что каждый ампликон становился либо 5'-LibA-amplicon-LibB-3', либо 5'-LibB-amplicon-LibA-3'. Эти ампликоны содержат или «А», или «В» адаптеры LibA на 5'-конце (и соответствующий адаптер «В» или «А» на 3'-конце), что позволяет двунаправленное секвенирование. Ампликоны с новыми адаптерами Lib А затем подвергали 3 циклам очистки гранулами SPRI перед осуществлением протокола для циклов XLR70 для количественной оценки и проверки качества ДНК перед разбавлением до 1 х 109 копий, отправкой на установку для секвенирования по технологии 454 (Roche) для emPCR при 1 cpb и секвенированием.
[00391] Подготовка к циклу секвенирования по технологии PacBio
[00392] Для цикла секвенирования по технологии PacBio использовали touchdown PCR, как описано выше. Объединение и очистку ДНК выполняли, как в вышеупомянутом разделе, посвященном «Подготовка к циклу секвенирования по технологии 454 XLR70». Для получения достаточного для потребностей секвенирования количества ДНК (500 нг) минимум 1 мкг ДНК объединяли для очистки гелем и SPRI. Количественное определение с помощью Picogreen и 1 х 109 разведения не выполняли, поскольку это не требуется для секвенирования по технологии PacBio. Если недостаточно ДНК получали из 2-ой PCR, то стадии 2-ой PCR и объединения повторяли до получения достаточного количества ДНК. Минимум 500 нг очищенной ДНК отправляли в установку для секвенирования по технологии PacBio для секвенирования.
[00393] Другие подходы секвенирования
[00394] Раскрытые в настоящем документе способы не зависят от секвенирования по технологии 454 или по технологии PacBio. Легкие цепи лямбда и каппа состоят из ~600 пар оснований, а тяжелая цепь гамма из ~700 пар оснований. Таким образом, возможность более длительных ридов секвенирования является, как правило, желательной так, что риды прямого и обратного секвенирования достаточно перекрываются для гарантии реконструкции всей последовательности приблизительно 600 пар оснований для легких цепей (LC) (точная длина последовательности зависит от длины 5'-нетранслируемого участка (UTR)) и приблизительно 700 пар оснований для тяжелых цепей (НС). Поэтому может быть использована любая технология секвенирования, которая может дать риды секвенирования по меньшей мере приблизительно 350-400 пар оснований и, тем самым, достичь перекрывания, используемого для сборки последовательности, и технологии секвенирования, позволяющие применение ридов на 600-700+ пар оснований, обеспечили бы секвенирование с использованием только прямого (Fw) праймера (секвенирования от 5'-конца).
Последовательности
[00395] Данные о последовательностях для вышеупомянутых циклов получали из соответствующей установки и обрабатывали, как описано ниже.
[00396] Обозначения последовательности
[00397] Каждая последовательность в перечне последовательностей, которая соответствует риду секвенирования, сборке последовательности или трансляции аминокислот из последовательности, содержит идентификатор. Каждый такой идентификатор содержит 9 полей, разделенных промежутком «.». Поля нумеруются от 1 до 9 и предоставляют следующую информацию.
1. ID рида. ID рида присваивали программным обеспечением, связанным с технологией секвенирования, используемой для определения рида, или «NA», если последовательность не является необработанным ридом.
2. Номер планшета. С номером планшета ассоциируется последовательность. См. таблицу 12 (таблицу соответствия планшета образцу) для соответствующей информации о биологическом образце.
3. ID образца. ID образца указывает лунку, с которой ассоциируется последовательность. Число ID образцов составляет от 1 до 89 включительно. См. таблицу 2 для соответствия между ID образца и названием лунки.
4. Название лунки. Название лунки включает лунку, с которой ассоциируется последовательность. Название лунки соответствует названию обычного 96-луночного планшета, например, D07. Название лунки и ID образца являются эквивалентными способами указания конкретной лунки в планшете.
1. ID континга. ID континга различает различные последовательности, ассоциированные с лункой из данной сборки и типа цепи.
2. Платформа. Поле платформы указывает на технологию секвенирования, которой последовательность получена. Возможными значениями для платформы являются 454, по Сенгеру и PacBio.
3. Тип цепи. Поле типа цепи указывает, является ли последовательность, ассоциированной с набором последовательностей тяжелой цепи антитела, последовательностей легкой цепи антитела или набором, содержащим последовательности как тяжелых, так и легких цепей антитела. Возможными значениями являются «тяжелая», «легкая» или «СМВ».
4. ID цикла. Идентификатор для набора ридов на конкретной платформе.
5. Тип последовательности. Указывает тип последовательности. Возможными значениями являются «неочищенный» для технологии секвенирования без очистки ридов, «nb», «urt», «multim50», «zerom50» или «pb» для собранных ридов (см. раздел «Сборка последовательностей») или «nb-aa», «urt-aa», «multim50-aa», «zerom50-aa» или «sanger-aa» для аминокислотных последовательностей, полученных из различных консенсусных последовательностей сборки nt.
[00398] Подготовка последовательностей для анализа
[00399] Данные, полученные из секвенирования по технологии 454, анализировали с помощью программного обеспечения 454 GS FLX для анализа данных, а также возвращали прошедшие фильтр последовательности высокого качества. Из-за жесткости фильтра нежелательных ампликонов, используемого программным обеспечением 454 GS FLX для анализа данных, может потребоваться ослабление жесткости фильтра для получения достаточно длинных ридов. Одним из способов является следование указаниям в технической инструкции 454 АРР № 001-2010. Изменение <vfScanAHFlows> от «TiOnly» к «False» фильтра ампликонов может привести к значительному увеличению прошедших фильтр последовательностей хорошего качества. Другой вариант заключается в изменении <vfTrimBackScaleFactor> на более низкое число. Для цикла 1454 использовали стандартную обработку «shotgun», а для цикла 2 <vfScanAHFlows> изменяли на «False», и стандартную конвейерную обработку ампликонов использовали для циклов 3 и 4.
[00400] Данные, полученные при секвенировании по технологии Pacific Biosciences, получали от Pacific Biosciences как риды кольцевых консенсусных последовательностей с ассоциированными оценками качества.
[00401] Соотнесение последовательностей с лунками
[00402] кДНК из образцов секвенировали технологией секвенирования либо 454, либо Pacific Biosciences. Риды являются ридами из перечня последовательностей, чей тип последовательности является «неочищенным». Риды секвенирования анализировали и либо соотносили с исходным планшетом и лункой, либо отбрасывали.
[00403] Соотнесения планшета и лунки для ридов осуществляли путем сравнения наблюдаемой последовательности рида с возможными последовательностями сигнального участка планшета, универсального праймерного участка и сигнального участка образца с использованием регулярных выражений. Сравнение проводили в три стадии с использованием регулярных выражений, приведенных в таблицах 13, 14 и 15.
[00404] На стадии 1 анализа возможных сигнальных участков планшета рид проверяли по всем регулярным выражениям, приведенным в колонке «Регулярное выражение сигнального участка планшета» в таблице 13 с необходимостью начала совпадения с первого нуклеотида последовательности. Если совпадений не находили, то рид отбрасывали и соотнесение планшета с лункой продолжали со следующим ридом, доступным для обработки, если таковой был. Если совпадение находили, то последовательность соотносили с соответствующим ID из колонки «ID планшета» как ее ID планшета. Нуклеотиды рида, совпадавшие с регулярным выражением планшета регистрировали для применения в ходе следующих стадий совпадения и в ходе сборки.
[00405] На стадии 2 анализа универсального праймерного участка рид проверяли по «регулярному выражению универсального праймера» «CACGACCGGTGCTCGATT+AG» с необходимостью начала совпадения рида с первого нуклеотида, следующего за последним нуклеотидом рида, совпадающим с регулярным выражением планшета. Если рид не совпадал с регулярным выражением универсального праймера, то рид отбрасывали и соотнесение планшета с лункой продолжали со следующим доступным для обработки ридом, если таковой был. В противном случае, нуклеотиды ридов, совпадающие с регулярным выражением универсального праймера, регистрировали для применения в ходе последней стадии совпадения и в ходе сборки.
[00406] На стадии 3 анализа возможных сигнальных участков образца рид проверяли по всем регулярным выражениям, приведенным в графе «Регулярной выражение сигнального участка образца» в таблице 14, с необходимостью начала совпадения рида с первого нуклеотида, следующего за последним нуклеотидом рида, совпадающим с регулярным выражением универсального праймера. Если совпадение не находили, то рид отбрасывали и соотнесение планшета с лункой продолжали со следующим доступным для обработки ридом, если таковой был. Если совпадение находили, а колонка ID образца содержала только один идентификатор, то ID образца рида соотносили с ID, который можно найти в колонке ID образца. Если колонка ID образца содержала более одного идентификатора, то эти идентификаторы рассматривали как «кандидатные ID образцов». Затем рид проверяли последовательно по всем регулярным выражениям, приведенным в колонке «Регулярное выражение сигнального участка образца» таблицы 15, в которой по меньшей мере один из соответствующих ID образцов в колонке «ID образца» таблицы 15 совпадал с кандидатным ID образца. Если рид совпадал с регулярным выражением, и совпадение начиналось с первого нуклеотида после последнего нуклеотида рида, совпадающего с регулярным выражением универсального праймера, то самый правый идентификатор из кандидатных ID образцов соотносили как ID образцов ридов. В противном случае, самый правый идентификатор удаляли из перечня кандидатных ID образцов и процесс повторяли с меньшим перечнем кандидатных ID образцов либо пока совпадение не обнаруживали, либо, если совпадение с регулярным выражением не обнаруживали в перечне регулярных выражений в таблице 15, то последний кандидатный ID образца (то есть самый левый в первоначальном перечне кандидатных ID образцов) определяли в качестве ID образца для рида.
[00407] Риды, которые отбрасывали в ходе процесса соотнесения ID планшета и ID образца, не включались в перечень последовательностей.
[00408] Сборка последовательностей
[00409] Все риды последовательности, соотнесенные с ID образца, ассоциированным с лункой, собирали с получением консенсусной последовательности. Эти консенсусные последовательности соответствуют последовательностям mRNA тяжелой и легкой цепей, экспрессированным в отсортированных клетках.
[00410] Последовательности собирали с помощью Newbler 2.5 (циклы 1 и 2), а также с помощью Newbler версии 2.6 и/или Mira версии 3.4.0 для других последовательностей.
[00411] Последовательности в перечне с полем платформа «454», полем тип цепей «смешанные», ID цикла «1» или «2» и типом последовательности «nb» являются контигами, получившимися из сборки с использованием Newbler. Чтобы собрать эти последовательности выходные файлы sff из секвенирования по технологии 454, которые содержат как последовательности, так и оценки качества для каждого нуклеотида, считывали в Python с использованием пакета Biopython и последовательности подразделяли в зависимости от их составных штрих-кодов (ID образца + ID планшета), как описано выше и вынесено в отдельные файлы sff. Затем эти файлы повторно интерпретировали через sfffile (предоставляется программным обеспечением для анализа данных GS FLX) в файлы sff с файловыми заголовками, понимаемыми Newbler, ассемблером последовательностей, представленным в наборе программного обеспечения для анализа данных GS FLX с использованием опций «-force», «-кДНК» и «-urt». Затем Newbler собирал прямые риды с общими составными штрих-кодами. Поскольку обратные риды содержат только ID планшета 3', то возможно, что сборка последовательности может происходить между прямыми и обратными ридами последовательностей из различных клеток. Для обхода этой потенциальной проблемы можно сначала идентифицировать использование V(D)J тяжелой и легкой цепей как собранного прямого, так и не собранного обратного ридов с использованием HighV-QUEST (http://imgt.cines.fr/HighV-QUEST/index.action). Затем последовательности можно далее группировать в соответствии с их использованием V(D)J перед повторной сборкой с Newbler с использованием одного собранного прямого рида и обратных ридов, которые используют один и тот же V(D)J. Это может повторяться для всех собранных прямых ридов. Сборка последовательности также может быть выполнена с чувствительностью к несовпадениям нуклеотидов, что тем самым предотвращает сборку прямого и обратного ридов из разных клеток, которые используют один и тот же V(D)J. Таким образом, ненадлежащая сборка последовательности обратных ридов между высоко подобными последовательностями из разных клеток, может быть в большинстве случаев предотвращена.
[00412] Последовательности в перечне с полем платформа «454», полем тип цепи «тяжелая» или «легкая», идентификационным номером цикла «3» или «4» и типом последовательности «nb» являются контигами, получившимися из сборок ридов 454, выполненными Newbler с этой командной строкой: runAssembly-кДНК -о output seqs.fastaq, где seqs.fastq содержит отдельные обрезанные риды лунок в формате FastQ.
[00413] В любых лунках для ридов ID цикла 3 или ID цикла 4, которые не созданы с помощью Newbler, ровно один контиг тяжелой цепи или ровно один контиг легкой цепи повторно анализировали путем сборки с помощью mira. Последовательности в перечне с полем платформа «454», полем тип цепи «тяжелая» или «легкая», ID цикла «3» или «4» и типом последовательности «multim50» или «zerom50» являются контигами, получившимися из этих сборок, выполненными с помощью mira с такой командной строкой: mira --project=seqs --job=denovo,est,accurate,454 454_SETTINGS -ED:ace=yes -AL:egp=no -CL:pvlc=yes --fastq -notraceinfo.
[00414] Файл под названием seqs in.454.fastq содержал обрезанные риды отдельных лунок в формате FastQ.
[00415] Для лунок из ридов ID цикла 3 или ID цикла 4, при которых ни Newbler, ни mira не создавали контиги с использованием вышеупомянутых команд сборки, выполняли другую команду Newbler. Последовательности в перечне с полем платформа «454», полем тип цепи «тяжелая» или «легкая», ID цикла «3» или «4» и типом последовательности «urt» являются контигами, получившимися из этих сборок, при которых Newbler использовали с такой командной строкой: runAssembly -кДНК -ud -urt -о output seqs.fastaq, в которой seqs.fastq содержал обрезанные риды отдельных лунок в формате FastQ.
[00416] Последовательности в перечне с полем платформа «PacBio», тип цепи «тяжелый» и тип последовательности «pb» являются контигами, получившимися из сборок ридов с платформой PacBio, выполняемых mira с командной строкой: mira -- project=seqs --job=denovo,est,accurate,454 454 SETTINGS -ED:ace=yes -AL:egp=no -CL:pvlc=yes --fastq -notraceinfo.
[00417] Файл под названием seqs in.454.fastq содержал обрезанные риды отдельных лунок в формате FastQ.
[00418] Аминокислотные последовательности
[00419] Последовательности в перечне с полем платформа «454» и тип последовательности «nb-aa», «urt-aa», «multim50-aa» или «zerom50-aa» являются аминокислотными последовательностями, определенными транслированием нуклеотидных последовательностей сборок ридов 454, как описано в разделе «Сборка последовательностей ».
[00420] Последовательности в перечне с полем платформа «PacBio» и тип последовательности «pb-aa» являются аминокислотными последовательностями, определенными транслированием нуклеотидных последовательностей сборок ридов Pacifc Biosciences, как описано в разделе «Сборка последовательностей».
[00421] Последовательности в перечне с типом последовательности «sanger-аа» являются аминокислотными последовательностями, определенными прямыми транслирующими ридами, определенными секвенированием по методу Сенгера.
[00422] Другие опции анализа данных секвенирования
[00423] Рабочий процесс описанного выше анализа данных можно использовать для точного определения последовательностей тяжелой и легкой цепей каждой клетки. Однако данная информация не является абсолютно необходимой для подхода «селективного скрининга» в соответствии с настоящим изобретением (см. «Скрининг экспрессированных человеческих антител»). Для осуществления селективного скрининга сначала объединяли спаренные последовательности антител в клональные семейства на основе их использования V(D)J тяжелой цепи и использования VJ легкой цепи. Таким образом, не требуется полная последовательность тяжелой и легкой цепей иммуноглобулина, и можно использовать достаточную информацию последовательности для определения использования V(D)J. Таким образом, можно допускать ошибки секвенирования и можно использовать риды более низкого качества, образованные технологией 454 или любой другой технологией секвенирования. Сборка последовательности прямого рида обычно не является проблемой, поскольку все последовательности могут быть сначала сгруппированы по их составному штрих-коду перед сборкой. Так как каждый составной штрих-код поступает из одного образца/клетки, существует только одна «корректная» последовательность для каждой цепи иммуноглобулина с одним и тем же составным штрих-кодом. Затем ошибки секвенирования в разных нитях могут быть усреднены, поскольку маловероятно, что все ошибки секвенирования происходят в одних и тех же основаниях, что означает, что принятие консенсусной последовательности оснований даст наиболее точную последовательность. В случаях неоднозначности взамен будут выбраны, как правило, основания с высокой оценкой качества Phred. Поскольку технология 454 урезает риды последовательности от 3'-конца, пока не остаются риды только более высокого качества, это может привести к очень коротким ридам. При использовании способа в соответствии с настоящим изобретением можно допускать риды более низкого качества и, тем самым, применять гораздо более длинные риды, образованные с помощью технологии 454 (400-500 пар оснований). С этими более длинными ридами в соответствии с настоящим изобретением можно определять использование V(D)J без необходимости сборки прямого рида с обратным ридом, что тем самым делает ID планшета 3' несущественным согласно некоторым аспектам. Кроме того, самым последним поколением секвенирования по технологии 454 можно секвенировать в среднем до 746 пар оснований и с модой в 800 пар оснований. Таким образом, секвенирование только из прямых ридов может быть достаточным для покрытия целых ампликонов тяжелой и легкой цепи иммуноглобулина, что также делает ID планшета 3' несущественным согласно некоторым аспектам, поскольку отпадает необходимость сборки прямого рида с обратным.
Отбор и клонирование антител
[00424] После сборки последовательности тяжелой и легкой цепей анализировали для отбора антител для характеристики. Антитела отбирали на основании прогнозируемого родоначального использования V(D)J и просмотра эволюционных деревьев, полученных из последовательностей антител. Отобранные антитела клонировали, экспрессировали и характеризовали в различных анализах.
[00425] Соотнесение V(D)J
[00426] Последовательности тяжелой и легкой цепей циклов 1 и 2 анализировали с помощью V-QUEST (Brochet, X. et al., Nucl. Acids Res. 36, W503-508 (2008)), программного обеспечения, которое сравнивает последовательность цепи антитела с базой данных известных аллелей родоначальных последовательностей и прогнозирует родоначальные аллели, используемые в антителе, как родоначальные последовательности рекомбинировали, и мутации в антителе относительно родоначальных. В таблице 18 показаны результаты соотнесение V(D)J с помощью V-QUEST для антител, которые выбрали для дальнейшей характеристики; те же данные получали для всех других сборок последовательностей как из цикла 1, так и из цикла 2. Некоторые последовательности сборок из цикла 3 и цикла 4 анализировали с помощью SoDA (Volpe, Cowell and Kepler, Bioinformatics (2006) 22 (4): 438-444), программного обеспечения, подобного V-QUEST.
[00427] Если геном пациента был секвенирован, данные последовательности генома могут быть использованы в качестве родоначальных последовательностей для анализа соотнесения VDJ, что дополнительно усиливает возможность надежной идентификации соматических гипермутаций в последовательностях антитела пациента.
[00428] Эволюционные деревья и клональные семейства
[00429] Нуклеотидные последовательности, соответствующие зрелым пептидам тяжелых цепей из циклов 1 и 2, разделяли на наборы, которые соответствовали пациенту, от которого их получали. Программное обеспечение clustalx2 (Brochet, X. et al., Nucl. Acids Res. 36, W503-508 (2008)) использовали для создания выравнивания и древа из этих индивидуальных наборов с использованием настроек по умолчанию для всех параметров.
[00430] Эволюционные деревья последовательностей от пациента также можно сконструировать из набора последовательностей от отдельных клональные семейств. Предполагаемые последовательности тяжелой и легкой цепей антитела-предшественника для семейства можно прогнозировать и добавлять к набору последовательностей, если их еще нет в наборе. Эволюционное древо для набора можно построить с использованием, например, Maximum Parsimony, Maximum Likelihood или какого-либо приемлемого алгоритма, и корнями древо может «уходить» в последовательность антитела-предшественника. Древо можно построить на основе только тяжелых цепей или только легких цепей, или предпочтительно можно построить на основе отдельных тяжелых и легких цепей одновременно так, чтобы данное древо представляло совместную эволюцию тяжелых и легких цепей.
[00431] Отбор антитела
[00432] Для каждого пациента таблицу результатов V-QUEST рассматривали в сочетании с деревьями, построенными из последовательностей цикла 1 или цикла 2 (оцененных в TreeViewX: http://darwin.zoology.gla.a.c.uk/~rpage/treeviewx)i. Типичные последовательности отбирали для покрытия различных семейств с наличием VDJ на основе данных V-QUEST, проверяя соответствующие последовательности на древе для выбора последовательностей, которые, как оказалось, были характерными для клады. Как правило, одну последовательность отбирали из каждой клады. Некоторые из отобранных последовательностей походили из семейств с множеством членов, но некоторые из них также отбирали из семейств с небольшим количеством членов или с одним членом. Отобранные последовательности описаны в таблице 18. Для каждого антитела в таблице 18 колонка «Антитело» такая же, как в тексте после «-» в поле ID контига названия, ассоциированного с последовательностью в перечне последовательностей.
Клонирование и экспрессия клонированных пар легкой и тяжелой цепей иммуноглобулина
[00433] Векторы
[00434] Одной системой является неомицин и селективная векторная система дигидрофолатредуктазы (DHFR), модифицированная из векторов Invitrogen ркДНК3.3 и pOptivec. Альтернативной системой является система Lonza GS, в которой амплифицируемым, селективным маркером является глутаминсинтетаза (GS) (см. ниже). Последовательности, кодирующие легкую цепь каппа, легкую цепь лямбда и тяжелую цепь гамма иммуноглобулина, вставляют в векторы. Консенсусные Kozak и лидерные последовательности уже присутствуют в клонах, и, таким образом, их не нужно встраивать в векторы. Константные участки синтезируют с содержанием 5'-фланкирующих сайтов рестрикции и одного или нескольких других внутренних сайтов рестрикции. Для облегчения клонирования различных тяжелых и легких цепей иммуноглобулина конструируют вставки с несколькими сайтами рестрикции, которые повышают вероятность того, что сам клон не будет содержать сайт рестрикции и, поэтому, не будет обрезан внутри. Вставки содержат два различных сайта рестрикции 8-cutter на 5'-конце участка вставки и на двух различных сайтах рестрикции, встроенные в константные участки. 5'-Сайтами рестрикции являются FseI и PacI для обеих легких цепей, а также AscI и AsiSI для тяжелой цепи гамма. Сайтами рестрикции, встроенными сами по себе в константный участок, являются NheI и XhoI для обеих легких цепей, а также EcoRI и SacII для тяжелой цепи гамма. См. таблицу 16 для последовательности вставок константного участка, содержащих сайты рестрикции. Затем клоны тяжелой или легкой цепи из 1-ой PCR-реакции подвергают 2-му циклу PCR с клонирующими праймерами, содержащими 5'-фланкирующие сайты рестрикции, которые встраивают в клоны. Подходящие ферменты рестрикции используют для резки векторов экспрессии и клонов, которые теперь содержат комплементарные концы, и лигируют вместе с использованием ДНК-лигазы Т4. Обе векторные системы Invitrogen и Lonza GS содержат амплифицируемый селективный маркер. Это маркером является DHFR в системе Invitrogen и GS в системе Lonza GS. Под давлением отбора из подходящего селектора (метотрексат для DHFR и L-метионин сульфоксимин для глюкозосинтетазы (GS)), гены, связанные с селективным маркером, амплифицируют вместе с ним. С большим количеством копий генов иммуноглобулина, наблюдается более высокая секреция антител. Это полезно, когда большие количества антитела нужно очистить для последующего скрининга in vivo для нейтрализации антител.
[00435] Клонирование и экспрессия
[00436] Исходя из предположения, что самые высоко аффинные плазмобласты отбирают во время созревания зародышевого центра, ожидали, что самое высоко аффинное клональное семейство также содержит самое большое количество клонов. Кроме того, самый высоко аффинный клон в каждом клональном семействе также будет наиболее часто встречающимся клоном этого семейства. На основе этих предположений, решили экспрессировать самый часто встречающийся клон из 5 крупнейших клональные семейств из образца каждого пациента согласно некоторым аспектам. Клоны амплифицировали из кДНК 1-ой PCR, при этом все образцы из одного и того же планшета, каждый из которых содержит отдельную клетку, объединяли вместе. Прямой праймер содержит ID образца и, поэтому, амплифицирует только штрих-кодированную ДНК с этим конкретным ID образца. Это является высокоспецифичным, потому что ID образцов различаются между собой нуклеотидами. Некоторые ID образцов могут иметь идентичные прямые клонирующие праймеры, и клоны, амплифицированные с помощью этих праймеров, должны впоследствии отличаться друг от друга также по отбору бактериальной колонии. И прямой, и обратный праймеры содержат фланкирующие сайты рестрикции (первый и второй участки сайта рестрикции), которые обеспечивают встраивание клона (выравнивание относительно рамки кодирования) в вектор, который уже содержит константный участок каппа, лямбда или гамма. См. таблицы 4 и 5 для клонирования последовательностей праймеров. Легкие цепи клонировали в модифицированном ркДНК3.3, а тяжелые цепи - в модифицированном pOptivec, или обе цепи клонировали в двойном векторе экспрессии Lonza GS. Клетки млекопитающих либо двукратно трансфицировали отдельными векторами экспрессии, кодирующими гены тяжелой и легкой цепей иммуноглобулина, либо отдельно трансфицировали двойным вектором экспрессии, содержащим гены и тяжелой, и легкой цепей. Затем супернатанты, содержащие секретируемые антитела, собирали и скринировали по желаемым свойствам.
[00437] В некоторых случаях вариабельные участки генов Ig можно клонировать путем синтеза ДНК и встраивания синтезированной ДНК в вектор, содержащий подходящий константный участок, с использованием ферментов рестрикции и стандартных методов молекулярной биологии. В ходе синтеза не обязательно должна наблюдаться точная нуклеотидная последовательность, лишь бы аминокислотная последовательность была неизменной, кроме случаев, когда мутагенез желателен. Это позволяет оптимизировать кодоны, что может привести к более высоким уровням экспрессии. Это также позволяет добавлять сайты рестрикции с целью клонирования. Не нужно синтезировать нетранслированные последовательности, такие как 5'-UTR и штрих-кодированные последовательности, лидерные последовательности также могут быть заменены другими сигнальными пептидными последовательностями, известными более высокими уровнями экспрессии. Это приводит к нуклеотидной последовательности Ig, которая может сильно отличаться от высокопроизводительных ридов, но дает при экспрессии идентичную секвенированную аминокислоту.
[00438] В некоторых случаях штрих-кодированный адаптер ID образца, добавленный в ходе обратной транскрипции, может уже содержать сайт рестрикции фермента. Это дает в результате адаптер с сайтом рестрикции 3' относительно штрих-кода ID образца в пуле ампликонов PCR. В ходе клонирования с клонирующими праймерами желаемые ампликоны амплифицировали из пула планшет-специфичных ампликонов с использованием 5'-праймеров, которые комплементарны последовательностям штрих-кода с ID образца, и специфичных для цепей 3'-праймеров (для цепей каппа, лямбда и гамма). В 3'-праймеры будут добавлены 3'-сайты рестрикции. На 5'-праймеры не нужно добавлять сайты рестрикции, поскольку 5'-праймер уже содержит сайт рестрикции 3' относительно штрих-кода с ID лунки. После такой амплификации ферменты рестрикции использовали для разрезания ампликона для лигирования в вектор, содержащий вставку константного участка. При отщеплении ферментом рестрикции последовательности добавляли на 5'-конец последовательностей гена Ig, такие как штрих-коды, и универсальные последовательности разрезали, поскольку они расположены 5' относительно 5'-сайта рестрикции.
[00439] Альтернативные способы для клонирования и экспрессии
[00440] Другой аспект относится к вариабельным участкам генов Ig, которые можно клонировать путем синтеза ДНК и встраивания синтезированной ДНК в вектор, содержащий подходящий константный участок с использованием ферментов рестрикции и стандартных методов молекулярной биологии. В ходе синтеза не обязательно должна наблюдаться точная нуклеотидная последовательность, лишь бы аминокислотная последовательность была неизменной, кроме случаев, когда мутагенез желателен. Это позволяет оптимизировать кодоны, что может привести к более высоким уровням экспрессии. Это также позволяет добавлять сайты рестрикции с целью клонирования. Не нужно синтезировать нетранслированные последовательности, такие как 5'-UTR и штрих-кодированные последовательности, лидерные последовательности также могут быть заменены другими сигнальными пептидными последовательностями, известными более высокими уровнями экспрессии. Это приводит к нуклеотидной последовательности Ig, которая может сильно отличаться от высокопроизводительных ридов, но дает при экспрессии идентичную секвенированную аминокислоту.
[00441] Другой аспект относится к штрих-кодированному адаптеру ID лунки, добавленному в ходе обратной транскрипции, который может уже содержать сайт рестрикции фермента. Это дает в результате адаптер с сайтом рестрикции 3' относительно штрих-кода ID лунки в пуле ампликонов PCR. В ходе клонирования с клонирующими праймерами желаемые ампликоны амплифицировали из пула планшет-специфичных ампликонов с использованием 5'-праймеров, которые комплементарны последовательностям штрих-кода с ID лунки, и специфичных для цепей 3'-праймеров (для цепей каппа, лямбда и гамма). В 3'-праймеры будут добавлены 3'-сайты рестрикции. На 5'-праймеры не нужно добавлять сайты рестрикции, поскольку 5'-праймер уже содержит сайт рестрикции 3' относительно штрих-кода с ID лунки. После такой амплификации ферменты рестрикции использовали для разрезания ампликона для лигирования в вектор, содержащий вставку константного участка. При отщеплении ферментом рестрикции последовательности добавляли на 5'-конец последовательностей гена Ig, такие как штрих-коды, и универсальные последовательности разрезали, поскольку они расположены 5' относительно 5'-сайта рестрикции.
[00442] Клонирование тяжелой и легкой цепей в векторах Lonza
[00443] Клонирование константных участков иммуноглобулина
[00444] Векторы Lonza получали посредством академического лицензионного соглашения Стэнфордского университета с Lonza. Легкие цепи каппа и лямбда встраивали в вектор рЕЕ12.4, а тяжелую цепь гамма встраивали в вектор рЕЕ6.4. Последовательности тяжелой и легкой цепей клонировали в две стадии: сначала клонировали константные участки, за которым следовал 5'-конец цепей иммуноглобулина (лидерной и последовательностей V(D)J). Вставки константных участков были генно синтезированы Intergrated DNA Technologies (IDT) и содержали подходящие молчащие мутации для оптимизации генов и встраивания сайтов рестрикции. Вставки получали от IDT в их проприетарном векторе pIDTSmart. Вставленные последовательности представлены в таблице 17. IgGl использовали как константный участок тяжелой цепи гамма. Используемыми аллелями были Кm3, Mcg-Ke-Oz- и Glm3 для цепей каппа, лямбда и гамма, соответственно. Чтобы встроить константные участки в векторы Lonza, векторы Lonza и вставки pIDTSmart-константного участка индивидуально трансформировали в компетентные dam-dcm- Ε. coli и плазмиды очищали с использованием минипрепаративного набора Qiagen согласно инструкциям изготовителя. Затем плазмиды расщепляли с использованием HindIII и Bell при 37°С в течение 1 часа и прогоняли на 1,2% агарозном геле при 150 В в течение 1 часа. Расщепленные векторы Lonza и вставки константных участков очищали в геле и лигировали (рЕЕ12.4 с легкими цепями Кm3 или Mcg-Ke-Oz и рЕЕ6.4 с тяжелой цепью гамма 1 Glm3) с использованием ДНК-лигазы Т4 в течение 10 минут при комнатной температуре при отношении вставка:вектор 3:1. Затем ДНК-лигазу Т4 инактивировали при 70°С в течение 8 минут и 5 мкл смеси для лигирования трансформировали в компетентные в отношении теплового шока клетки ТОР10 с использованием стандартных методов молекулярной биологии. Колонии пикировали и вставку проверяли с помощью секвенирования по методу Сенгера.
[00445] Клонирование вариабельных участков иммуноглобулина
[00446] Далее рЕЕ12.4, содержащие легкую цепь либо лямбда, либо каппа, расщепляли с использованием AscI и XmaI в течение 5 часов при 37°С и очищали на геле. рЕЕ6.4, содержащие тяжелую цепь гамма 1, расщепляли с использованием AscI и AgeI в течение 5 часов при 37°С и очищали на геле. Отобранные ампликоны избирательно амплифицировали с использованием специфичных по отношению к ID лунки прямых праймеров и специфичных по отношению к константному участку обратных праймеров (таблицы 4 и 5) из определенного ID планшета при 100 х разведении 1-ой PCR. Прямые праймеры содержали сайт рестрикции AscI на 5'-конце праймера, а обратные праймеры содержали сайт рестрикции XmaI или AgeI для праймеров легкой и тяжелой цепей праймеров константных участков, соответственно. Циклическую PCR выполняли с использованием первоначальной денатурации при 98°С в течение 30 секунд и от 35 до 45 циклов при 98°С в течение 10 секунд, при 68°С в течение 15 секунд и при 72"С в течение 20 секунд. Конечное удлинение осуществляли при 72°С в течение 5 минут и выдерживали при 4°С в течение неопределенного срока. Продукты PCR очищали с использованием ультрафильтрационных планшетов PCRU96 от Millipore, следуя инструкциям изготовителя. После этого продукты PCR дважды расщепляли в течение 3 часов при 37°С с использованием AscI и XmaI для легких цепей, а также AscI и AgeI для тяжелой цепи гамма 1. Затем расщепленные продукты прогоняли на 2,5% легкоплавкой агарозе с использованием GelGreen (Biotium) и визуализировали под синим светом. Гелевые срезы, содержащие полосы подходящих размеров, вырезали. В геле выполняли лигирование путем плавления срезов геля при 65 °С и добавления подходящих расщепленных и обработанных фосфатазой Antarctic (NEB) векторов Lonza, содержащих вставку константного участка, и инкубировали с ДНК-лигазой Т4 в течение 1-3 часов при комнатной температуре. Компетентные по отношению к тепловому шоку бактерии трансформировали и высевали на агар с ампициллином. Пикировали 6 клонов на конструкцию и выращивали в 2 х LB (2 х концентрированном бульоне Лурия-Бертани). Miniprep выполняли с использованием 96-луночных фильтрационных планшетов Multiscreen от Millipore в соответствии с инструкциями изготовителя (vvww.millipore.com/techpublications/tecgl/tn004) для получения плазмидной ДНК. PCR для колоний выполняли с использованием первоначальной денатурации при 95°С в течение 5 минут и 40 циклов при 95°С в течение 1 минуты, при 50°С в течение 2 минут, при 72°С в течение 1 минуты, окончательного удлинения при 72°С в течение 5 минут и выдерживали при 4°С в течение неопределенного периода времени. Клоны с подходящей вставкой направляли на секвенирование по методу Сенгера в Sequetech, Mountain View, СА, USA. Идентификацию клона VDJ выполняли с использованием IMGT HIGHV-Quest и корректные клоны сохраняли и как бактериальный маточный материал (хранили при -80°С с 15% глицерином), и как плазмиды.
[00447] Экспрессия моноклональных антител в 293Т
[00448] Временные двойные трансфекции спаренных конструкций рЕЕ12.4-lightchain и pEE6.4-heavychain проводили с использованием Lipofectamine 2000 согласно протоколу изготовителя. Трансфекции осуществляли в 48-луночных, 24-луночных, 6-луночных, 60 мм и 100 мм планшетах/чашках. Вкратце, клетки 293Т культивировали в DMEM + 10% сверхнизких IgG FBS (Invitrogen), чтобы предотвратить конкуренцию бычьего IgG с секретируемым человеческим IgG в следующей стадии очистки белка А. Клетки 293Т культивировали при 20 пассажах, прежде чем новые аликвоты жидкого N2 размораживали и использовали. Для трансфекций 48-луночного планшета за день перед этим в каждую лунку высевали 8 х 104 клеток и обеспечивали рост до ~ 90% слияния на следующий день. Инкубировали 50 нг каждой из конструкций тяжелой и легкой цепей в среде Optimem в конечном объеме 50 мкл, и Lipofectamine 2000 также отдельно инкубировали с 50 мкл среды Optimem. Обе инкубации длились 5-25 минут. Затем Lipofectamine 2000 и эти конструкции осторожно смешивали с помощью пипетки, инкубировали в течение 20 минут перед добавлением к клеткам 293Τ и осторожно перемешивали. Среду меняли на следующий день и культуральные супернатанты собирали через день (например, в понедельник, среду и пятницу) в течение 2 недель. Для трансфекций других размеров использовали следующие количества конструкций и Lipofectamine 2000: для трансфекций в 24-луночном планшете 100 нг каждой конструкции использовали с 1,25 мкл Lipofectamine 2000. Для 60 мм чашек 625 нг каждой конструкции использовали с 12,5 мкл Lipofectamine 2000. Для трансфекций в 100 мм чашках 3 мкг каждой конструкции использовали в 37,5 мкл Lipofectamine 2000.
[00449] ELISA по антителам против человеческого IgG
[00450] В некоторых случаях ELISA с человеческим IgG выполняли на образце для определения количества экспрессированного IgG в культуральном супернатанте и культуральный супернатант использовали непосредственно в дальнейших применениях после нормализации количества антитела. Набор для количественного определения с помощью ELISA по антителам против человеческого IgG приобретали у Bethyl Laboratories и использовали согласно инструкциям изготовителя. Вкратце, 100 мкл иммобилизованного антитела наносили на планшеты Nunc Maxisorp на ночь при 4°С и промывали 5 раз с помощью PBST (PBS с 0,05% Tween-20). Лунки блокировали с 1% BSA в PBS в течение часа при комнатной температуре, затем промывали 5 раз с помощью PBST. Затем лунки инкубировали с подходящими стандартными разведениями из набора или разводили культуральными супернатантами в течение 1 часа при комнатной температуре, затем промывали 5 раз с помощью PBST. Добавляли 100 мкл разведенного детектирующего сконъюгированного с HRP антитела в каждую лунку и инкубировали при комнатной температуре в течение часа, затем промывали 5 раз с помощью PBST. Добавляли 50 мкл раствора субстрата ТМВ и реакцию останавливали 50 мкл стоп-раствора. Поглощение считывали на спектрофотометре SpectraMax М5 при 450 нм и стандартные кривые строили с 4-параметрической кривой. Антитела держали при 4°С в PBS с 0,1% азидом натрия в качестве консерванта.
[00451] Очистка белка A-IgG экспрессированных моноклональных антител
[00452] В других случаях антитела сначала очищали от культурального супернатанта и количественно оценивали с использованием ВСА перед применением. Вкратце, культуральные супернатанты собирали 3 раза в неделю в течение 2 недель в 50 мл пробирки и хранили при 4°С с 0,1% азидом натрия в качестве добавки до очистки белка A-IgG. Культуральные супернатанты центрифугировали и декантировали для удаления каких-либо клеточных агрегатов. Добавляли 1 M Tris рН 9,0 к культуральным супернатантам, чтобы обеспечить рН 7,5-8,0, как определено индикаторными полосками рН. Белок А с агарозными гранулами (Pierce) промывали 2 раза с помощью PBST перед добавлением 400 мкл 50% суспензии к культуральным супернатантам и инкубировали при 4°С в течение ночи на шейкере, чтобы обеспечить равномерное смешивание гранул. Гранулы извлекали центрифугированием культурального супернатанта при 1000 g в течение 5 минут и пипетированием гранул из нижней части пробирок в 5 мл колонки «gravity flow». Гранулы промывали 4 раза 2 мл PBS перед элюированием 2 раз 1,5 мл буфера для элюирования IgG (Pierce), который является буфером элюирования с низким рН, в 100 кДа концентраторной колонке Amicon-4. Элюированное антитело немедленно нейтрализовали 400 мкл 1 M Tris рН 8,0. Затем антитела концентрировали центрифугированием при 1000 g в 100 кДа концентраторах Amicon-4 в течение 10 минут с последующей промывкой 2 мл PB S и промывкой 2 мл PBS с 0,1%) азидом натрия. Концентрации антител определяли с помощью анализа ВСА и доводили до 0,5 мг/мл. Белок А с агарозой восстанавливали промывкой 1 раз 2 мл PBS, 3 раза 2 мл буфера для элюирования IgG, промывали 3 мл PBS с 0,1% азидом натрия и выдерживали при 4°С. Колонки можно восстанавливать до 5 раз.
Скрининг экспрессированных человеческих антител
[00453] Скрининги связывания антитела с антигеном
[00454] Отобранные антитела (см. раздел вышеупомянутый раздел «Клонирование и экспрессия») сначала скринировали по их способности связываться с представляющим интерес антигеном, а затем антитела всего клонального семейства экспрессировали и скринировали по их способности блокировать или нейтрализовать антиген (см. нижеприведенный раздел «Функциональные скрининги»). Концентрацию IgG в супернатантах, содержащих представляющие интерес антитела, сначала определяли с помощью ELISA для IgG так, что то же самое количество IgG можно использовать для каждого образца в скрининге связывания антитела с антигеном. В других случаях IgG очищали от супернатанта с использованием агарозных гранул с белком А и количественно определяли с помощью анализа ВС А с использованием бычьих иммуноглобулинов в качестве стандарта. Затем очищенный IgG нормализовали в той же концентрации перед применением в скрининге антител. Для скрининга антител, которые связывают антиген, выполняли непрямой ELISA. 96-Луночный планшет покрывали в течение ночи представляющим интерес антигеном, а избыток антигена затем вымывали. Супернатанты, содержащие представляющие интерес антитела, затем добавляли в лунки и инкубировали в течение четырех часов, после чего лунки промывали. В качестве положительного контроля известные количества коммерчески доступных антител (от отличных от человека видов), которые являются специфическими для антигена, добавляли в отдельные лунки, содержащие антиген. В качестве отрицательного контроля коммерчески доступные антитела, специфичные к нерелевантному антигену, добавляли в отдельные лунки, содержащие представляющий интерес антиген. Затем в лунки добавляли конъюгированное с HRP вторичное антитело, инкубировали в течение 30 минут, а избыток вымывали. Затем в планшет добавляли тетраметилбензидин (ТМВ) и обеспечивали протекание реакции, пока наблюдали цвет в лунках положительного контроля. Затем реакцию останавливали кислотой и измеряли поглощение. Считали, что супернатанты из определенных лунок содержали антитела, которые связывают представляющий интерес антиген, если они давали значительно более высокие показания поглощения, чем в отрицательном контроле.
[00455] ELISA по Fluzone
[00456] Волонтерам вводили вакцину сезонного гриппа в 2010/2011 от Fluzone, которая состояла из 3 штаммов инактивированного вируса, штаммов A/California/7/2009, A/Perth/16/2009, B/Brisbane/60/2008. ELISA по Fluzone проводили, чтобы определить связываются ли моноклональные антитела, полученные от вакцинированных волонтеров, с самой вакциной против гриппа в качестве начального скрининга экспрессированных антител со связывающей активностью. Вакцину Fluzone разводили в 100 раз карбонатным буфером рН 9 и наносили на планшеты Nunc Maxisorp либо при комнатной температуре на 1 час, либо при 4°С на ночь. Затем планшеты промывали 5 раз с помощью PBST (PBS w/0,05% Tween-20) и блокировали PBS w/1% BSA в течение 1 часа при комнатной температуре. Затем 100 мкл 100 нг/мл экспрессированных антител против вируса гриппа добавляли в лунки при комнатной температуре в течение 1 часа перед промывкой 5 раз с помощью PBST и добавлением разведенного детектирующего сконъюгированного с HRP антитела (из набора количественного определения человеческого IgG для ELISA от Bethyl Labs) в течение 1 часа при комнатной температуре. Планшеты промывали 5 раз с помощью PBST и добавляли 50 мкл субстрата ТМВ. Обеспечивали проявление цвета в течение до 30 минут, прежде чем остановить реакцию с помощью 50 мкл стоп-раствора. Планшеты считывали на спектрофотометре SpectroMax М5 при 450 нм поглощении. Антитела, используемые в этом анализе, представлены в таблице 19. Последовательности антител можно найти в основной таблице - таблице 18.
[00457] Определение поверхностного плазмонного резонанса аффинностей антител против вируса гриппа
[00458] Связывание моноклональных антител (mAb) с молекулами НА анализировали при 25°С с использованием биосенсора поверхностного плазмонного резонанса ProteOn (BioRad Labs). Экспрессированные моноклональные антитела против вируса гриппа, полученные из плазмобластов вакцинированного против гриппа донора (25 нМ в ацетатном буфере рН 4,5), соединяли с сенсорным чипом GLC с аминной связью при целевой плотности 800 резонансных единиц (RU) в тестовых проточных кюветах с использованием химической технологии EDAC-NHS. Непрореагировавшие активные эфирные группы гасили этаноламином. Очищенный рекомбинантный гемагглютинин Н3 (HA(ΔTM)(H3N2/Perth/16/2009) и H1 (HA(ΔTM)(A/California/07/2009)(H1N1)) приобретали у Immune Technology Corp. (New York, NY) и разводили до 100, 50, 25, 12,5, 6,25 нМ, вместе с пустым буферным контролем вводили со скоростью потока 30 мкл/минута с 120 секундным периодом контакта и 2000 секундным периодом диссоциации. Кинетику связывания и анализ данных проводили с программным обеспечением BioRad Proteon. Измерения аффинности рассчитывали с использованием алгоритма для двухвалентного аналита, поскольку НА состоял из нескольких повторяющихся звеньев. Точность кривых по экспериментальным точкам подтверждали путем проверки того, что каждое из значений χ2 критерия адекватности было ниже 10% пикового значения связывания (Rmax). Антитела, используемые в этом анализе, представлены в таблице 20. Последовательности антител можно найти в основной таблице - таблице 18.
[00459] Реактивности антител против RA в микронаборах антигенов RA
[00460] Чтобы распечатать антигенные микронаборы, антигены разводили в фосфатно-буферном солевом растворе до 0,2 мг/мл и присоединяли к предметным стеклам Array It SuperEpoxy с использование системы Array It NanoPrint Protein LM210. Предметные стекла помечали мазком гидрофобного маркера и блокировали в течение ночи в PBS с 3% эмбриональной бычьей сывороткой и 0,05% Tween-20 при 4°С, осторожно помешивали при 30 оборотах в минуту. Наборы зондировали с помощью 400 мкл 40 мкг/мл моноклонального антитела в течение одного часа при 4°С, осторожно помешивали при 30 оборотах в минуту. Затем наборы промывали и инкубировали в конъюгированном с Су3 вторичном антителе против человеческого IgG/IgM, разбавленном 1:2500, в течение 45 минут при 4°С с осторожным помешиванием при 30 оборотах в минуту. После еще одной промывки предметные стекла сканировали с использованием GenePix 4300A Microarray Scanner. Использовали программное обеспечение GenePix 7, чтобы найти среднюю интенсивность флуоресценции каждой характеристики и фонового значения.
[00461] Чтобы проанализировать данные, фоновые значения интенсивности флуоресценции вычитали из каждой характеристики и выражали как среднее значение четырех характеристик антигена в каждом наборе. Среднюю интенсивность логарифмически преобразовывали с пороговым значением 10. Эти значения подвергали иерархической группировке с использованием программного обеспечения Cluster для организации антигенов на основании их сходства друг с другом. Взаимоотношения регистрировали в виде «тепловой карты» с использованием программного обеспечения Java Tree View. Антитела, используемые в этом анализе, представлены в таблице 21. Последовательности антител можно найти в основной таблице - таблице 18.
[00462] ELISA по антителу против гистона 2А
[00463] Для выявления антител против гистона 2А использовали прямой ELISA. Микротитрационные планшеты (Nunc Maxisorp) покрывали 100 мкл рекомбинантного Н2А в карбонатном буфере при концентрации 20 мкг/мл и инкубировали при 4°С в течение ночи. После блокировки в PBS, содержащем 1% бычий сывороточный альбумин (BSA), полученные от больного RA антитела использовали в титровании от 15 мкг/мл до 250 мкг/мл в буфере для разведения (PBS, содержащем 0,1% BSA и 0,1% Tween-20), добавляли в планшет в двух повторностях по 100 мкл/лунка и инкубировали в течение 2 часов при комнатной температуре. Затем образцы инкубировали в течение 1 часа при комнатной температуре при разведении 1:5000 моноклональным меченным пероксидазой хрена козьим антителом против человеческого антигена. Реакцию осуществляли с применением 3,3',5,5'-тетраметилбензидинового субстрата (ТМВ) (Sigma-Aldrich) в течение 15 минут и останавливали добавлением 50 мкл 2 н H2SO4. Относительную количественную оценку антител выполняли с помощью оптической денситометрии при 450 нм с использованием известной серопозитивной по RA сыворотки в качестве положительного контроля. Антитела, используемые в этом анализе, представлены в таблице 22. Последовательности антител можно найти в основной таблице - таблице 18.
[00464] ELISA по антителу против ССР2
[00465] ELISA по антителу против ССР2 выполняли согласно инструкциям изготовителя (Eurodiagnostica, Malmo, Sweden). Вкратце, антитела, полученные от больных с RA, разбавляли до приблизительно 125 мкг/мл в разбавляющем буфере (PBS, содержащем 0,1% BSA и 0,1% Tween-20), добавляли по 100 мкл/лунка к предварительно блокированному коммерческому планшету для ELISA по ССР2 и инкубировали в течение 2 часов при комнатной температуре. Затем образцы инкубировали в течение 1 часа при комнатной температуре при разведении 1:5000 моноклонального меченного пероксидазой хрена козьего антитела против человеческого антигена. Реакцию осуществляли с применением 3,3',5,5'-тетраметилбензидинового субстрата (ТМВ) (Sigma-Aldrich) в течение 15 минут и останавливали добавлением 50 мкл 2 н H2SO4. Относительную количественную оценку антител выполняли с помощью оптической денситометрии использованием предложенных продавцом стандартов и известной серопозитивной по RA сыворотки. Антитела, используемые в этом анализе, представлены в таблице 22. Последовательности антител можно найти в основной таблице - таблице 18.
[00466] ELISA по антителу против ревматоидного фактора
[00467] Для выявления антител против ревматоидного фактора (RF) микротитровальные планшеты (Nunc Maxisorp) покрывали 10 мкг/мл кроличьего IgG в карбонатном буфере и инкубировали при 4°С в течение ночи. После блокировки в PBS, содержащем 1% бычий сывороточный альбумин (BSA), полученные от больного с RA антитела разводили в 5 мкг/мл буфера для разведения (PBS, содержащем 0,1% BSA и 0,1%) Tween-20), добавляли в планшет в двух повторностях по 100 мкл/лунка и инкубировали в течение 2 часов при комнатной температуре. Затем образцы инкубировали в течение 1 часа при комнатной температуре при разведении 1:5000 моноклональным меченным пероксидазой хрена козьим антителом против человеческого антигена. Реакцию осуществляли с применением 3,3',5,5'-тетраметилбензидинового субстрата (ТМВ) (Sigma-Aldrich) в течение 15 минут и останавливали добавлением 50 мкл 2 н H2SO4. Относительную количественную оценку антител выполняли с помощью оптической денситометрии при 450 нм с использованием двух известных RF+ контрольных сывороток в качестве положительного контроля. Антитела, используемые в этом анализе, представлены в таблице 23. Последовательности антител можно найти в основной таблице - таблице 18.
[00468] Иммуногистохимия антител от больного аденокарциномой легкого на тканевых наборах рака легкого
[00469] Два различных типа предметных стекол тканевых микронаборов приобретали у US Biomax. Ими были VLC 12 и BS0481. Средние части ткани ряда карцином легкого помещали на предметные стекла, в том числе аденокарциномы легких, а также контроли - нормальную ткань легкого. Предметные стекла нагревали в цитратном восстанавливающем антиген буфере рН 6,0 при 95-99°С в течение 40 минут, а затем обеспечивали охлаждение до комнатной температуры. Предметные стекла предварительно обрабатывали 0,02% Triton-X и 0,6% Н2О2 в течение 20 минут. Затем предметные стекла блокировали 10% нормальной козьей сывороткой в TBST (TBS с 0,05% Tween-20) в течение 2 часов перед последующей блокировкой 100 мкг/мл F(ab) козьего антитела против человеческого IgG (Jackson Immunoresearch) в течение ночи при 4°С. Затем предметные стекла подвергли блокировке авидином/биотином (Vector Laboratories) согласно инструкциям изготовителя. Затем предметные стекла инкубировали в 5 или 10 мкг/мл экспрессированного антитела против аденокарциномы легкого в течение 1 часа при комнатной температуре, промывали 3 раза в течение 5 минут с помощью TBST, затем инкубировали с биотинилированным козьим вторичным антителом против человеческого антигена в течение 20 минут при комнатной температуре. Затем предметные стекла промывали 3 раза в течение 5 минут с помощью TBST и инкубировали с подготовленным реагентом Vectastain ABC в течение 30 минут при комнатной температуре. Затем предметные стекла промывали 3 раза в течение 5 минут с помощью TBST, окрашивали Vector Red (Vector Laboratories) и проявление цвета отслеживали с помощью светового микроскопа. После надлежащего времени окрашивания реакцию останавливали промывкой дистиллированной водой и доокрашивали гематоксилином. Предметные стекла монтировали с водой и фотографировали с помощью микроскопа ВХ-51. Антитела, используемые в этом анализе, представлены в таблице 24. Последовательности антител можно найти в основной таблице - таблице 18.
[00470] Определение с помощью проточной цитометрии связывания экспрессированных от больного с аденокарциномой легкого антител против линий клеток аденокарциномы легкого
[00471] Используемыми линиями клеток рака легких были А549, Н226, Н441, Н23, Н1975, Н1437, Н2126, Н1650 и Н2009. Клетки НЕК 293Т также использовали в качестве отрицательного контроля. Клетки отделяли путем инкубации клеток в PBS без Са2+ и Mg2+ с 2 мМ EDTA в течение 1 часа при 37°С. Это необходимо для предотвращения повреждения поверхностных антигенов клеток, которое может происходить при трипсинизации или любом другом протеолитическом отщеплении для отделения клеток. Клетки однократно промывали буфером FACS (HBSS с 2% FCS) перед суспендированием в 50 мкл буфера FACS и инкубировали с 10 мкг/мл, 3 мкг/мл, 1 мкг/мл, 0,2 мкг/мл экспрессированных антител против аденокарциномы легкого для титрования дозы. Оптимальная концентрация оказалась из диапазона 0,2-1 мкг/мл. Таким образом, впоследствии использовали 1 мкг/мл, 0,5 мкг/мл, 0,25 мкг/мл антител против аденокарциномы легкого. Антитела против аденокарциномы легкого инкубировали в течение 30 минут при 4°С, а затем промывали 2 раза с помощью 200 мкл буфера FACS в 96-луночных планшетах. Затем добавляли антитело против человеческого IgG-PE и инкубировали в течение 15 минут при 4°С в темноте. Затем образцы промывали 2 раза с помощью 200 мкл буфера FACS и повторно суспендировали в 200 мкл буфера FACS и анализировали на BD LSR II или LSR Fortessa. Использовали Sytox blue в качестве окрашивания на выявление живых/мертвых. Антитела, используемые в этом анализе, представлены в таблице 24. Последовательности антител можно найти в основной таблице - таблице 18.
[00472] Проточная цитометрия для стафилококка
[00473] Фиксированные частицы S. aureus (штамма Wood) получали от Invitrogen. Штамм Wood является штаммом, некоторые бактерии которого экспрессируют очень маленький белок А. Частицы суспендировали в 50 мкл буфера FACS при 10 х 106 клеток/50 мкл и инкубировали с титрованием 10 мкг/мл, 5 мкг/мл или 1 мкг/мл экспрессированных антител, полученных от инфицированных стафилококком индивидуумов в течение 1 часа при 4°С. Фиксированные частицы стафилококка затем дважды промывали буфером FACS перед инкубацией в течение 15 минут в темноте при 4°С с антителом, против человеческого IgG-FITC. Затем частицы промывали 1 мл буфера FACS и снова суспендировали в 200 мкл буфера FACS для анализа на BD LSR II или LSR Fortessa. Антитела, используемые в этом анализе, представлены в таблице 25. Последовательности антител можно найти в основной таблице - таблице 18.
[00474] Функциональные скрининги
[00475] Блокирование антитела для взаимодействий рецептора с лигандом
[00476] Для скрининга антител по их способности блокировать взаимодействия лиганда с рецептором (например, взаимодействия цитокина с рецептором) трансфицировали клетки 293Т с вектором, кодирующим подходящий рецептор. Эти клетки 293Т также стабильно трансфицировали с NF-кВ-зависимым репортером на основе люциферазы так, что эти стабильно трансфицированные клетки 293Т экспрессировали люциферазу при активации NF-κΒ. Затем культивировали трансфицированные клетки 293Т с подходящим лигандом в присутствии или в отсутствие кандидатных антител. Клетки 293Т окончательно анализировали на экспрессию люциферазы путем измерения зависимого от люциферазы светового излучения. Взаимодействие между лигандом и его рецептором, например, взаимодействие между IL-17A и IL-17R, активирует NF-κΒ. Блокирование антител предотвращает передачу сигнала NF-κΒ путем связывания лиганда с рецептором и, следовательно, отменяет экспрессию люциферазы. В случаях, если взаимодействие лиганда с рецептором не активирует NF-κΒ, другие транскрипционные элементы ответа используют для управления промотором гена люциферазы, например, элементы АР-1 ответа и т.п.
[00477] Скрининг антител по их способности ингибировать функцию цитокинов или ингибировать функциональный анализ
[00478] Функциональные анализы также можно использовать для скрининга антител против цитокинов в сыворотке пациента или в клонированных и экспрессированных антителах. При таком подходе экспрессированные человеческие антитела тестировали по их способности ингибировать цитокин или другой иммунный медиатор индукции клеточного ответа.
[00479] Антитела, нацеленные на бактерии, инфицированные вирусом клетки, паразитов или раковые клетки
[00480] Для скрининга антител, которые убивают или нейтрализуют бактерии, инфицированные вирусом клетки, паразитов или раковые клетки, культивировали подходящий тип клеток либо в присутствии, либо в отсутствие антитела вместе с сывороткой, не подвергнутой термической инактивации (которая содержит факторы комплемента). Если антитело представляет собой нейтрализующее антитело, то оно будет опсонировать бактерии, другие микробы или раковые клетки и активировать компоненты комплемента, которые образуют мембраноатакующий комплекс (MAC), который индуцирует гибель клеток. Чтобы протестировать нейтрализацию запускали флуоресцентный анализ на живые/мертвые клетки (Invitrogen), в котором живые и мертвые клетки окрашивали разными флуорофорами. Клетки могут быть проанализированы по процентным отношением живых и мертвых клеток с использованием проточной цитометрии. Антитело, которое дает в результате наибольшее процентное отношение мертвых клеток, будет хорошим кандидатом, нейтрализующим антитело, который в дальнейшем будет проанализирован в in vivo скринингах.
[00481] Антитела, которые нейтрализуют вирусы
[00482] Для скрининга антител, которые нейтрализуют вирусы, выполняли стандартный анализ снижения тромбоцитов или другие анализы инфекции in vitro на основе клеток. Нейтрализующие антитела, как ожидалось, снижали вирусную инфекцию клеток. Затем кандидатные антитела тестировали на модели in vivo.
[00483] Анализ микронейтрализации вируса гриппа
[00484] Некоторые экспрессированные антитела против вируса гриппа, которые показывали активность связывания с Fluzone при ELISA, отправляли на внешний CRO, Virapur, LLC для анализов микронейтрализации. Вкратце, двукратные разведения каждого антитела, начиная с 100 мкг/мл, смешивали с равным объемом приблизительно 100 TCID50 инфекционных единиц титрованного маточного материала вируса в четырех повторностях в лунки 96-луночного планшета. Растворы вируса/антитела инкубировали в течение 2 часов, а затем смесь переносили в 96-луночный планшет, содержащий 80% конфлюэнтных клеток MDCK. Клетки, антитело и вирус инкубировали в течение дополнительных 2 часов при 37°С, после чего вирус удаляли, монослои промывали и ростовую среду для вируса добавляли в каждую лунку. Лунки просматривали под микроскопом через 72 часа на наличие инфекции вируса гриппа. Антитела, используемые в этом анализе, представлены в таблице 26. Последовательности антител можно найти в основной таблице - таблице 18.
[00485] Анализ ингибирования стафилококка
[00486] S. aureus использовали в лог-фазе роста. Их добавляли в полипропиленовые 96-луночные планшеты и антитело против стафилококка от инфицированных стафилококком больных добавляли при 10 мкг/мл. Комплемент крольчонка (Cedarlane) добавляли в рекомендованном изготовителем количестве и тщательно перемешивали. Планшеты инкубировали при 37°С в течение 45 минут, после чего разводили 1:10, 1:100 и 1:1000 и высевали в чашки на 5% ТСА кровяной агар и выращивали в течение ночи. Бактериальные CFU подсчитывали и вносили в таблицу на следующий день. Антитела, используемые в этом анализе, представлены в таблице 27. Последовательности антител можно найти в основной таблице - таблице 18.
[00487] Иммунопреципитация стафилококковых антигенов с антителами, полученными от инфицированных стафилококком больных
[00488] Лизат белка стафилококка получали путем лизиса S. aureus с использованием B-Per Bacterial Protein Extraction Reagent (Pierce) с 100 нг/мл лизостафина в течение 30 минут при комнатной температуре вместе с 1 х ингибитора протеазы Halt и отделяли от нерастворимой фракции центрифугированием при 15000 оборотах в минуту в микроцентрифуге. Лизат предварительно очищали путем инкубации с Dynabeads с белком G в течение 1 часа при комнатной температуре. 5 мкг антитела, полученного от инфицированного стафилококком больного, связывали с Dynabeads с белком G путем инкубации в течение 1 часа при комнатной температуре. Затем связанные с белком G антитела инкубировали с предварительно очищенным лизатом стафилококка в течение ночи при 4°С. Затем гранулы промывали 3 раза с помощью PBST (PBS с 0,1% Tween-20) и нагревали с 5 х буфером, уменьшающим дорожки образцов (Thermo Scientific), при 95°С в течение 5 минут перед прогоном SDS-PAGE на 4-12% геле Criterion Bis-Tris. Белки визуализировали с помощью RAPIDStain Reagent (Calbiochem). Антитела, используемые в этом анализе, представлены в таблице 28. Последовательности антител можно найти в основной таблице - таблице 18.
[00489] Масс-спектрометрическая идентификация пептидов
[00490] Окрашенные белковые представляющие интерес полосы вырезали из геля, погружали в 10 мМ бикарбонат аммония, содержащий 10 мМ DTT и 100 мМ йодацетамид, обрабатывали 100% ацетонитрилом, а затем расщепляли в течение ночи при 37°С 0,1 мг трипсина (Sigma-Aldrich) в 10 мМ ацетате аммония, содержащем 10% ацетонитрил. Трипсинизированные белки идентифицировали с помощью LCMS с использованием системы Agilent 1100 LC и Agilent ХСТ Ultra Ion Trap (Agilent Technologies, Santa Clara, CA), как описывалось ранее (Lopez-Αvila V, Sharpe О, Robinson WH: Determination of ceruloplasmin in human serum by SEC-ICPMS. Anal Bioanal Chem 2006, 386:180-7.). Данные LCMS проверяли по базе данных SwissProt или NCBInr с использованием программного обеспечения SpectrumMill (Agilent) для выявления пептидов, используемых для идентификации белков. Антитела, используемые в этом анализе, представлены в таблице 29.
Пример 1: Высокопроизводительное секвенирование последовательностей спаренных тяжелой и легкой цепей из отдельных В-клеток
[00491] Разрабатывали способ добавления составных штрих-кодов (ID образца + ID планшета) к последовательностям для однозначной идентификации последовательностей, которые происходили из одной и той же лунки планшета. Использовали этот подход для генов последовательности спаренных тяжелой цепи и легкой цепи иммуноглобулина из отдельных В-клеток. Отдельные В-клетки можно было отсортировывать с помощью проточной цитометрии из крови, массы мононуклеарных клеток периферической крови (РВМС), массы В-клеток, плазмобластов, плазматических клеток, В-клеток памяти или других популяций В-клеток (фиг. 1).
[00492] Сначала В-клетки отсортировывали по отдельной клетке в 96-луночные планшеты для PCR, оставляя одну колонку лунок пустой в качестве отрицательного контроля. В ходе обратной транскрипции (RT) в разные лунки добавляли олигонуклеотиды, содержащие различные штрих-коды ID образца. После обратного транскрибирования mRNA обратная транскриптаза MMLV H- переключала матрицы и транскрибировала олигонуклеотид, встраивая его и штрих-код ID образца на 3'-конец 1-ой нити кДНК (фиг. 2а). Все кДНК (штрих-кодированные с ID образца) из одного планшета затем объединяли и подвергали двум циклам PCR. В ходе PCR праймеры секвенирования на платформе 454 (первый и второй участки секвенирования) и штрих-коды ID планшета добавляли на 5'- и 3'-концы ампликона путем использования праймеров PCR с 5'-фланкирующими штрих-кодированными последовательностями. Ампликоны (участки ампликона) из разных планшетов теперь содержали η разных ID планшетов, и по составному штрих-коду, содержащему ID планшета и ID образца, однозначно идентифицировали последовательности как походящие от конкретной клетки, обеспечивая спаривание секвенированных генов тяжелой и легкой цепей (фиг. 2b-с).
[00493] На фиг. 3 описана общая применяемая методика и ассоциированные последовательности. Праймеры и адаптерные молекулы показаны в таблице 1. Последовательности ID образца показаны в таблице 2. Последовательности ID планшета показаны в таблице 3. Праймеры клонирования показаны в таблице 4, 3'-последовательность прямых праймеров клонирования показана в таблице 5.
[00494] Получали продукты PCR с предполагаемыми размерами: -600 пар оснований для легких цепей каппа и лямбда и ~700 пар оснований для тяжелой цепи гамма (фиг. 4а). Затем отправляли материал на секвенирование по методу Сенгера. Получали последовательности, которые идентифицировали с помощью BLAST NCBI как цепи каппа, лямбда и гамма (данные не показаны). Дальнейшее исследование хроматограммы ДНК показало группу нескольких пиков, начинающихся со штрих-кодов ID образца, что свидетельствовало об успешном добавлении штрих-кодов ID образца к кДНК из клеток разных лунок при RT и об успешной амплификации их в двух последовательных циклах PCR (фиг. 4b). Секвенирование по методу Сенгера цепи от 3'-конца также показало группу нескольких пиков, начинающихся от соединения VJ, вследствие амплификации генов из разных клеток, которые отличаются после соединения VJ в результате вставок и делеций и произвольной рекомбинации разных генов V и J. Кроме того, при выполнении PCR с праймерами клонирования, специфичными для ID образца лунки Al, получали один пик, а не группу нескольких пиков, что свидетельствует о том, что действительно осуществлялась амплификация последовательностей из конкретной клетки в пуле (фиг. 4c-d).
Пример 2: Схема выполнения логических операций для сортировки плазмобластов по отдельной клетке
[00495] Для этого эксперимента плазмобласты определяли как CD19+CD20-CD27+CD38++. На фиг. 22 показана схема выполнения логических операций для сортировки проточной цитометрией отдельных плазмобластных клеток в 96-луночных планшетах.
[00496] Отдельные РВМС получали и окрашивали, как описано выше. Клетки сначала гейтировали по их профилю FSC и SSC (данные не показаны). Затем живые CD19+ В-клетки гейтировали (левая панель), а далее суживали до CD20- В-клеток (2-ая панель слева) и очищали до CD27+CD38++ клеток. Из них IgG+ плазмобласты определяли как IgA- и IgM-, поскольку IgG+ плазмобласты не экспрессируют IgG клеточной поверхности. Эту популяцию отсортировывали по отдельной клетке в 96-луночные планшеты.
Пример 3: Плазмобласты субъектов, подвергнутых иммунологической провокации
[00497] Плазмобласты, как правило, составляют приблизительно 0,15% В-клеток у здоровых доноров, но могут варьировать от приблизительно 3,3% до 16,4% у субъектов, подвергнутых различным иммунологическим провокациям, в том числе инфекциям (например, инфекциям S. aureus и С. diff), ассоциированному с непрогрессирующим состоянием злокачественному заболеванию (например, метастатической меланоме и метастатической аденокарциноме легкого, которые у больных после вмешательства (химиотерапии в случае больного с аденокарциномой легкого и лечения ипилимумабом в случае больного с метастатической меланомой) становятся долговременно непрогрессирующими, что связано с активным В-клеточным ответом) и вакцинациям (например, против гриппа).
[00498] На фиг. 23 показано, что плазмобласты присутствовали у ряда субъектов и получались от них для высокопроизводительного секвенирования репертуара спаренных антител и характеристики репертуара антител активного гуморального ответа. Продемонстрировано, что раскрытые в настоящем документе методики могут быть использовали для получения эволюционных деревьев тяжелой и легкой (H&L) цепей и применения этой информации для клонирования и/или экспрессии антител, например, для а) открытия новых антигенов; b) разработки информативной вакцины, например, с использованием иммунной системы, для информирования нас относительно известных и новых антигенов, которые, вероятно, применимы для опсонизации, и фагоцитоза, и/или уничтожения/ингибирования патогена или представляющей интерес цели, и необязательно для использования их в разработке вакцины; с) создания нейтрализующего моноклонального антитела, например, из вакцин; d) создания связывающих моноклональных антител; е) создания антител против микробных патогенов и f) создания антител против злокачественных заболеваний. Примеры таковых более подробно описаны ниже.
Пример 4: Активность заболевания при ССР+ RA, коррелирующая с циркулирующими плазмобластами
[00499] Показав, что способ в соответствии с настоящим изобретением может быть использован для секвенирования генов иммуноглобулина в идентифицируемых парах, использовали способ в соответствии с настоящим изобретением для исследования репертуара антител плазмобластов у страдающих RA ССР+ больных. Получали образцы крови от давших согласие страдающих RA больных и окрашивали плазмобласты для использования в проточной цитометрии (фиг. 5а). Циркулирующие плазмобласты выражали как процентное отношение всех РВМС. Выявили, что страдающие RA ССР+ больные характеризовались значительно более высокими процентными отношениями плазмобластов периферической крови, чем страдающие RA ССР- больные (фиг. 5b). Кроме того, процентные отношения плазмобластов у ССР+ больных, но не у ССР- больных, коррелировали с активностью заболевания (г = 0,35 и ρ = 0,028) (фиг. 5с).
Пример 5: Плазмобласты, продуцирующие антитела против ССР
[00500] Хотя ССР+ больные характеризуются процентными отношениями плазмобластов, коррелирующими с активностью заболевания, эти больные могли страдать от длительной инфекции или других факторов, которые повышают у них процентные отношения циркулирующих плазмоб ластом. Для определения специфичности циркулирующих плазмобластов у ССР+ больных обогащенные RosetteSep В-клетки от больных культивировали в RPMI, дополненной 10% FBS. Другие добавки к средам, такие как антитела против IgM, IL-6, BAFF и т.п., не использовали, так что только плазмобласты были клетками, секретирующими антитела (другие В-клетки оставались инактивированными). Для подтверждения того, что исключительно плазмобласты продуцируют антитела, истощали некоторые из образцов плазмобластов (фиг. 5d). Затем В-клетки культивировали в течение семи дней перед сбором супернатанта и прогоном их на наборе пептидов Luminex. С помощью набора анализировали реактивность антитела по отношению к цитруллинированным пептидам. Реактивность антитела отсутствовала в супернатантах истощенных по плазмобластам образцов в отличие от супернатантов имитировано истощенных В-клеток, что подтверждало секрецию плазмобластами значительных количеств аутоантител против цитруллинового пептида (фиг. 5е). Кроме того, при подсчете пептидов со средней интенсивностью флуоресценции (MFI) свыше 60 для каждого образца наблюдали существенную корреляцию между процентными отношениями циркулирующих плазмобластов и количеством пептидов, с которыми реагируют антитела (r = 0,90 и ρ = 0,0139). Выбирали MFI, равную 60, поскольку это был порог, ниже которого >99% реактивность по отношению к пептидам падала в супернатантах истощенных по плазмобластам образцов.
Пример 6: Секвенирование на платформе 454 и анализ последовательностей
[00501] Плазмобласты от пациентов отсортировывали по отдельной клетке в 96-луночные планшеты, как описано выше, и их РНК обратно транскрибировали и PCR-амплифицировали согласно разделу «Touchdown PCR» в «Материалах и способах» так, что они содержали штрих-коды ID образца (сигнальный участок образца) и ID планшета (сигнальный участок планшета), как описано выше. См. фиг. 3. Затем получали последовательности кДНК из лаборатории секвенирования по технологии 454 (Центр секвенирования ДНК, Brigham Young University и Центр секвенирования по технологии 454, Roche).
[00502] Последовательности получали из первого цикла секвенирования по технологии 454 с использованием Shotgun Pipeline. Последовательности приемлемого качества получали из 2-го цикла секвенирования по технологии 454 посредством модифицированного ампликонового фильтра набора программ для анализа данных 454 GS FLX. Ампликоновый фильтр модифицировали наличием <vfScanAllFlows> с установкой на «FALSE» и <vffîadFlowThreshold> с заменой на «6». Последовательности от третьего и четвертого циклов получали с использованием стандартного ампликонового фильтра 454. Пропущенные через фильтр последовательности затем обрабатывали, как описано в разделе «Соотнесение последовательностей с лунками» в «Материалах и способах», и последовательности в каждой лунке отдельно собирали, как описано в разделе «Сборка последовательностей» в «Материалах и способах». Затем собранные последовательности анализировали с IMGT HighV-Quest для получения идентификации использованных участков VDJ.
[00503] После сборки последовательности и идентификации использованных V(D)J применяли ClustalX для группировки последовательностей в клональные семейства (фиг. 6). В качестве альтернативы, последовательности могут быть собраны с использованием и прямого, и обратного ридов. В этом случае сначала собирали подразделенные прямые последовательности, как описано выше. Затем прямые и обратные последовательности с использованием V(D)J идентифицировали с помощью HighV-QUEST и подгруппы прямых и обратных последовательностей согласно ID планшета и использованию V(D)J, и прямые и обратные последовательности собирали с использованием Newbler. Поскольку иммуноглобулиновые последовательности в значительной степени подобны, сборка из более мелкой подгруппы последовательностей избегает потенциальных проблем некорректно спаренных последовательностей из различных клеток.
Пример 7: Группировка последовательностей в эволюционные деревья
[00504] Мононуклеарные клетки периферической крови (РВМС) выделяли у субъектов-людей с указанными диагнозами или после вакцинации. Плазмобласты отсортировывали по отдельной клетке в отдельные лунки 96-луночных планшетов, создавая образцы из одной клетки в каждой лунке, затем mRNA в каждой лунке обратно транскрибировали, а потом содержимое лунок объединяли и подвергали двум циклам PCR для амплификации кДНК тяжелой и легкой цепей иммуноглобулина. Путем обратной транскрипции добавляли идентифицирующий ID образца ко всем кДНК, образованным из каждого отдельного образца, а путем первого цикла и вторых циклов PCR добавляли ID планшетов, а затем 454 Titanium Primers А и В к каждому ампликону, соответственно, как описано в разделах «Touchdown PCR» и «Отличная от touchdown PCR» в «Материалах и способах». Общая методика описана на фиг. 3. Объединенные ампликоны секвенировали с помощью технологии секвенирования 454, риды приемлемого качества получали, как описано выше. Риды соотносили с лунками и собирали, как описано в разделах «Соотнесение ридов с лунками» и «Сборка последовательностей» в «Материалах и способах». Затем идентифицировали сегменты V(D)J в собранных последовательностях с использованием HighV-QUEST. Затем идентифицированные последовательности тяжелой и легкой цепей с общими составными штрих-кодами можно было спаривать, просто помещая собранные последовательности вместе с совпадающими составными штрих-кодами.
[00505] Ампликоны от отдельных субъектов-людей группировали на основе этих сегментов V(D)J и последовательности, экспрессирующие одинаковые сегменты V(D)J, классифицировали как принадлежащие одному и тому же клональному семейству (фиг. 7). Каждая секторная диаграмма представляет процентное отношение клонов, полученных из отдельных плазмобластов от отдельного субъекта-человека, экспрессирующего идентичные сегменты гена V(D)J (т.е. процентное отношение клонов в каждом клональном семействе). Среди субъектов-людей были страдающие сепсисом (2 субъекта), ревматоидным артритом (3 субъекта), раком легкого (1 субъект) и подвергнутый вакцинации против вируса гриппа (1 субъект). Этих субъектов выбирали, чтобы показать, что клональные семейства могут быть выделены из плазмобластов субъектов, испытывающих и острые (сепсис и вакцина против гриппа), и хронические состояния (ревматоидный артрит и рак легкого).
[00506] Последовательности V(D)J тяжелой цепи иммуноглобулина от отдельных субъектов-людей на фиг. 7 группировали с использованием ClustalX и регистрировали с использованием Treeview в виде некорневых радиальных деревьев (фиг. 8). Каждое радиальное дерево представляет последовательности тяжелой цепи, полученные от отдельного субъекта-человека. Для каждого радиального дерева концевые области представляют уникальную последовательность. Главные ветви представляют клональные семейства, а более мелкие ветви представляют клональные подсемейства, которые отличаются друг от друга мутациями, возникающими из-за множественности сегментов J (добавление Р-нуклеотидов или N-нуклеотидов или делеция нуклеотида), соматической гипермутации и созревания аффинности.
Пример 8: Клонирование, экспрессия и очистка антител
[00507] Все отобранные антитела клонировали, экспрессировали и выделяли, как описано выше в разделе «Общие материалы и способы» (см. разделы «Клонирование тяжелой и легкой цепей в векторах Lonza», «Экспрессия моноклональных антител в 293Т», «ELISA по антителам против человеческого IgG» и «Очистка белком A-IgG экспрессированных моноклональных антител»). Затем очищенные антитела использовали для дальнейшего исследования, как обсуждается ниже.
Пример 9: Характеристика антител от субъектов после вакцинации против гриппа
[00508] Антитела от людей, подвергшихся введению вакцины против гриппа, отбирали и выделяли, как описано выше. Антитела, отобранные для дальнейшей нижеприведенной характеристики, показаны в соответствующих разделах.
ELISA по Fluzone
[00509] Волонтерам вводили сезонную вакцину против вируса гриппа 2010/2011 от Fluzone, которая состояла из 3 штаммов инактивированного вируса -штаммов A/California/7/2009, A/Perth/16/2009, B/Brisbane/60/2008. ELISA по Fluzone выполняли, как описано выше, для определения связывания полученных от вакцинированных волонтеров моноклональных антител самих по себе с вакциной против вируса гриппа как первоначального скрининга по экспрессированным антителам со связывающей активностью. 14 из 31 антитела, связанных с ELISA по Fluzone (фиг. 26), и подгруппу из них последовательно отбирали и тестировали на активность связывания с гемагглютинином с использованием поверхностного плазмонного резонанса. Антителами, характеризуемыми с помощью ELISA по Fluzone, были Flul4 - Flu23, Flu25 - Flu27, Flu29, Flu30, Flu34, Flu35, Flu37, Flu39 - Flu41, Flu43 -Flu46. SI и S2 использовали в качестве отрицательных контролей.
Определение с помощью поверхностного плазмонного резонанса аффинностей антител против вируса гриппа
[00510] Связывание моноклональных антител (mAb) с молекулами НА анализировали при 25°С с использованием биосенсора поверхностного плазмонного резонанса ProteOn (BioRad Labs), как описано выше. Из 14 антител, которые связывались с ELISA по Fluzone, 10 связывались с Н3, а 1 связывалось с H1, тогда как 3 не связывались (фиг. 27). Одно из несвязывающихся, связывающееся с H1 и 4 других произвольно выбранных связывающихся с Н3 отбирали и посылали в контрактную исследовательскую организацию (CRO) для тестирования по нейтрализующей активности в анализе микронейтрализации. Антителами, характеризуемыми с помощью SPR, были Flu14 - Flu22, Flu26, Flu29, Flu34, Flu35, Flu46.
Анализ микронейтрализации вируса гриппа
[00511] Некоторые из экспрессированных антител против вируса гриппа, которые показали связывающую активность в ELISA по Fluzone, посылали во внешнюю CRO, Virapur LLC, для анализов микронейтрализации, как описано выше. Результаты анализов показали, что антитело, которое связывалось с H1 в предварительных анализах, нейтрализовало H1, тогда как антитела, которые связывались с Н3 в предварительных анализах, нейтрализовало Н3. Несвязывающееся не нейтрализовало вирус гриппа (фиг. 28). Антителами, характеризуемыми с помощью анализа микронейтрализации, были Flu15, Flu16, Flu18, Flu19, Flu20, Flu21.
Вариация CDR
[00512] Антитела против вируса гриппа получали, как описано выше. На фиг. 25 показана частичная древовидная диаграмма, увеличенная для ясности (а). Клональные семейства четко видны, а заштрихованное клональное семейство характеризовалось соотнесенным V(D)J, как показано в серой рамке. Аминокислотные последовательности через CDR (взятый в рамку участок) для тяжелой и легкой цепей показаны на фиг. 25 (b) и (с), соответственно, что указывает на различия некоторых остатков между цепями.
[00513] Вышеприведенные результаты демонстрируют, что эволюционные деревья могут быть получены с использованием описанных в настоящем документе композиций и способов. Человеческие моноклональные антитела вполне могут быть выделены из активированных В-клеток, таких как плазмобласты, от испытывающих острые состояния субъектов с использованием описанных в настоящем документе композиций и способов. Эти человеческие моноклональные антитела также вполне могут быть нейтрализующими антителами с использованием описанных в настоящем документе композиций и способов. Также результаты демонстрируют, что раскрытые в настоящем документе композиции и способы могут быть использованы для выделенных нацеленных против чужеродных антигенов mAb.
Пример 10: Характеристика антител от субъектов с RA
[00514] Антитела от людей, страдающих ревматоидным артритом (RA), отбирали и выделяли, как описано выше. Антитела, отобранные для дальнейшей нижеприведенной характеристики, показаны в соответствующих разделах.
Реактивности антител против RA в микронаборах антигенов RA
[00515] Антитела, полученные от страдающих RA больных, исследовали на наборе антигенов RA и сканировали флуоресценцию с помощью устройства GenePix, как описано в разделе «Реактивности антител против RA по наборам антигенов RA» в «Материалах и способах». Идентифицированные взаимоотношения регистрировали в виде «тепловой карты» с использованием программного обеспечения Java TreeView (фиг. 37). Характеризуемыми с помощью этого анализа антителами были RA1, RA2, RA3, RA4, RA8 - RA13, RA16, RA19, RA22 и RA23. Flu14 и Flu26 использовали в качестве отрицательных контролей.
ELISA по антителу против гистона 2А
[00516] Для выявления антител против Н2А прямой ELISA выполняли, как описано в разделе «ELISA по антителам против гистона 2А» в «Материалах и способах». На фиг. 35а показаны значения поглощения, выявленные для каждого тестируемого антитела. Антителами, характеризуемыми на фиг. 35а и в ELISA по антителу против ССР2 ниже, были RA1, RA2, RA4-RA16, RA19, RA23-RA24. На фиг. 36 показаны отобранные антитела (RA1, RA2, RA8, RA9) в другом независимом ELISA с использованием 30 мкг/мл антител.
ELISA по антителу против ССР2
[00517] ELISA по антителу против ССР2 выполняли, как описано в разделе «ELISA по антителу против ССР2» в «Материалах и способах». На фиг. 35b показаны значения поглощения, выявленные для каждого тестируемого антитела.
ELISA по антителу против ревматоидного фактора
[00518] Антитела, полученные от страдающих RA, пациентов использовали в качестве первичного антитела в прямом ELISA, а конъюгированные с HRP антитела против человеческого IgG использовали в качестве вторичного антитела и визуализировали с помощью субстрата ТМВ. Для выявления антител против ревматоидного фактора (RF) ELISA по антителу против RF выполняли, как описано в разделе «ELISA по антителу против ревматоидного фактора» в «Материалах и способах». На фиг. 34 показано, что антитела RA2 и RA3 показывали реактивность. Характеризуемыми в данном случае антителами были RA1-RA6, RA8-RA12, RA14.
[00519] Вышеприведенные результаты демонстрируют, что антитела могут быть выделены из активированных В-клеток, таких как плазмобласты, испытывающих хронические состояния субъектов с использованием описанных в настоящем документе композиций и способов. Результаты также демонстрируют, что раскрытые в настоящем документе композиции и способы могут быть использованы для выделения нацеленных против собственных антигенов mAb.
Пример 11 : Характеристика антител от субъектов с раком легкого
[00520] Антитела от непрогрессирующего в течение длительного времени человека, страдающего метастатической аденокарциномой легкого, отбирали и выделяли, как описано выше. У этого человека развилась метастатическая аденокарцинома легкого, и по прогнозам он мог умереть от злокачественного заболевания, однако после химиотерапии этот больной вошел в длительное непрогрессирующее состояние свыше 4 лет, что ассоциировали с плазмобластами, составляющими 3,1% всех В-клеток периферической крови. Повышенные уровни плазмобластов периферической крови у этого больного показали, что продолжающаяся иммунная реакция могла способствовать его длительному непрогрессирующему состоянию. Для дальнейшей нижеприведенной характеристики отбирали следующие антитела: LC1, LC5-LC7, LC9-LC18. Fluí6 использовали в качестве отрицательного контроля.
Иммуногистохимия антител от больного аденокарциномой легкого на тканевых наборах рака легкого
[00521] Иммуногистохимию с использованием двух различных типов предметных стекол тканевых микронаборов выполняли, как описано в разделе «Иммуногистохимия антител от больного аденокарциномой легкого на тканевых наборах рака легкого» в «Материалах и способах». Результаты в соответствии с настоящим изобретением демонстрировали, что одно из экспрессированных антител связывалось с аденокарциномой легкого (фиг. 32).
Определение с помощью проточной цитометрии связывания экспрессированных от больного с аденокарциномой легкого антител против линий клеток аденокарциномы легкого
[00522] Связывание антител с различными линиями клеток рака легкого выполняли, как описано в разделе «Определение с помощью проточной цитометрии связывания экспрессированных от больного с аденокарциномой легкого антител против линий клеток аденокарциномы легкого» в «Материалах и способах». Результаты в соответствии с настоящим изобретением показали, что одно антитело связывалось с линиями клеток аденокарциномы легкого и могло быть специфичным к аденокарциноме легкого (фиг. 33).
[00523] Эти вышеприведенные результаты демонстрируют, что антитела могут быть выделены из активированных В-клеток, таких как плазмобласты, субъектов, испытывающих хронические состояния, такие как злокачественное заболевание, с использованием описанных в настоящем документе композиций и способов. Результаты также демонстрируют, что раскрытые в настоящем документе композиции и способы могут быть использованы для выделения нацеленных против собственных антигенов mAb.
Пример 12: Характеристика антител от субъектов с инфекцией Staphylococcus aureus
[00524] Людей с инфекциями S. aureus, в том числе человека с хроническим вызванным S. aureus остеомиелитом с опосредованным иммунитетом контроля инфекции при отсутствии антибиотиков, использовали в качестве источников периферической крови, из которой окрашивали и отсортировывали плазмобласты периферической крови. С помощью обработки кДНК штрих-кодированием, секвенирования на платформе 454 и биоинформатического анализа создавали эволюционные деревья репертуаров антител людей, поддерживающих эффективные иммунные реакции против Staph. aureus. Антитела от людей, поддерживающих эффективные иммунные реакции против инфекции S. aureus, отбирали и выделяли, как описано выше. Антитела, отобранные для дальнейшей нижеприведенной характеристики, показаны в соответствующих разделах.
Проточная цитометрия для стафилококка
[00525] Антитела против стафилококка использовали для окрашивания фиксированного S. aureus, как описано в разделе «Проточная цитометрия для стафилококка» в «Материалах и способах». Результаты в соответствии с настоящим изобретением показали, что антитела S6 и S11 связываются с поверхностью S. aureus и могут быть кандидатами для опсонизации, приводящей к фагоцитозу и уничтожению/ингибированию S. aureus (фиг. 29). Характеризуемыми в этом анализе антителами были S1 - S4, S6 - S13, с F26 в качестве отрицательного контроля.
Анализ ингибирования стафилококка
[00526] S. aureus в фазе логарифмического роста объединяли с антителом против стафилококка для определения ингибиторной активности антител, как описано в разделе «Анализ ингибирования стафилококка» в «Материалах и способах». Результаты в соответствии с настоящим изобретением демонстрируют, что некоторые из клонированных и экспрессированных антител проявляли сильную активность уничтожения/ингибирования S. aureus (фиг. 30). Характеризуемыми в этом анализе антителами были S6 и S9, с LC1 в качестве отрицательного контроля.
Иммунопреципитация стафилококковых антигенов с антителами, полученными от инфицированных стафилококком больных
[00527] Антитела использовали для иммунопреципитации различных кандидатных стафилококковых антигенов, как описано в разделе «Иммунопреципитация стафилококковых антигенов с антителами, полученными от инфицированных стафилококком больных» в «Материалах и способах». Затем иммунопреципитированные белки идентифицировали с помощью масс-спектрометрии, как описано ниже. Характеризуемыми в этом анализе антителами были S1 - S13.
Масс-спектрометрическая идентификация пептидов
[00528] Полоски окрашенных представляющих интерес белков отбирали и подвергали масс-спектрометрии, как описано в разделе «Масс-спектрометрическая идентификация пептидов» в «Материалах и способах». Результаты идентифицировали либо растворимый в феноле пептид модулина альфа 1, либо дельта-гемолизин, как вероятную цель связывания для антитела S4. Это показывает, что раскрытые в настоящем документе способы могут быть использованы для открытия нового антигена (фиг. 31). Характеризуемым в этом анализе антителом было S4.
[00529] Вышеприведенные результаты демонстрируют, что антитела могут быть выделены из активированных В-клеток, таких как плазмобласты, субъектов, испытывающих острые состояния, такие как бактериальная инфекция, с использованием описанных в настоящем документе композиций и способов. Результаты также демонстрируют, что раскрытые в настоящем документе композиции и способы могут быть использованы для выделения mAb, нацеленных против чужеродных антигенов, и для определения идентичности антигенов, связываемых отобранными антителами.
Пример 13: Характеристика бластоподобных клеток и плазмобластов
[00530] Иммуноглобулиновые последовательности из В-клеток, которые активированы длительной иммунной реакцией, могут быть использованы для получения эволюционного древа длительной иммунной реакции, как описано выше. Это эволюционное древо, как правило, характеризовали множеством клональных семейств, представляющих активированные В-клетки из ряда линий поколения. Последовательности из наивных В-клеток, как правило, нельзя будет использовать для получения такого эволюционного древа, поскольку они не были активированы и, поэтому, практически не обеспечивают информацию активной длительной иммунной реакции. Активированные В-клетки сначала становятся бластоподобными клетками, которые активированы и имеют больший размер. Такие бластоподобные клетки затем становятся либо В-клетками памяти, либо плазматическими клетками. Хотя В-клетки памяти и плазматические клетки возникают в результате иммунной реакции, у людей они объединяются в большие пулы В-клеток памяти и плазматических клеток, которые возникали в результате реакций на предыдущие иммунологические повреждения, что создает трудности в разделении В-клеток памяти и плазматических клеток против последних или предыдущих иммунных реакций. Поэтому, у людей бластоподобные клетки являются предпочтительными кандидатами для секвенирования с получением эволюционных деревьев длительной иммунной реакции. В исследовании животных выращивали в контролируемых условиях (например, мышей), однако, все бластоподобные В-клетки, В-клетки памяти и плазматические клетки являются кандидатами для секвенирования с получением эволюционных деревьев, поскольку их выращивают в чистой окружающей среде, что создает возможность для большинства из В-клеток памяти и плазматических клеток после интенсивной иммунной реакции противостоять повреждению, особенно после повторных инъекций антигена, поскольку они не должны характеризоваться большой памятью или популяциями плазматических клеток, которые ранее сталкивались с какой-либо значительной иммунологической провокацией.
[00531] Подобно Т-клеткам, у людей предпочтительными клетками для секвенирования с получением эволюционного древа длительной иммунной реакции будут бластоподобные Т-клетки. Для мышей все активированные бластоподобные клетки и Т-клетки памяти являются предпочтительными кандидатами для секвенирования с получением эволюционного древа.
[00532] Известно, что бластоподобные В-клетки больше типичных В-клеток. Размер малого лимфоцита, к которому относится находящаяся в покое В-клетка, как правило, составляет 6-8 мкм. Бластоподобные лимфоциты (Т- и В-клетки), как правило, размером 8-14 мкм (см. фиг. 41, а также Tzur et al, PLoS ONE, 6(1): el6053. doi:10.1371/journal.pone.0016053, 2011; Teague et al, Cytometry, 14:7 2005). Плазмобласты могут характеризоваться следующим паттерном экспрессии: CD19низкий/+, CD20низкий/-, CD27+ и CD38высокий. Хотя применение всех этих маркеров дает в результате самую чистую популяцию при сортировке по отдельной клетке, не все из вышеупомянутых маркеров обязательно подлежат использованию для выделения плазмобластов.
[00533] Как представлено на фиг. 39, плазмобласты могут быть пропущены с использованием FSChi для более крупных клеток, что дает в результате 37% чистоту популяции плазмобластов. Гейтирование FSChiCD19hi клеток дает 72% чистоту плазмобластов. Гейтирование FSChi и CD27+, CD38hi или CD20- дает 44, 80 и 71 процентную чистоту плазмобластов, соответственно. Комбинация любого из этих маркеров или других маркеров, которая, как выявили, дает возможность отличать плазмобласты от других В-клеток, может использоваться для повышения чистоты отсортированных плазмобластов, однако, любой из этих маркеров сам по себе позволяет отличать плазмобласты от других В-клеток, хотя и с более низкой чистотой.
Пример 14: Альтернативная платформа для секвенирования и анализа
[00534] Риды тяжелых цепей из отдельного планшета, планшета 44, получали для цикла секвенирования PacBio с использованием способов, описанных в разделе «Touchdown PCR» в «Материалах и способах», для амплификации кДНК тяжелой цепи гамма. Выполняли 48 2-ых PCR для получения достаточного количества ДНК для цикла PacBio. Объединение и очистку ДНК выполняли, как описано в разделе «Подготовке к циклу секвенирования PacBio». ДНК отправляли на PacBio для приготовления и секвенирования. Риды CCS получали от PacBio, соотносили с лунками и собирали согласно разделам «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах». Результаты соотнесения представлены на фиг. 38. Показано, что способы и композиции в соответствии с настоящим изобретением не являются специфичными по отношению к платформе для высокопроизводительного секвенирования.
Пример 15: Секвенирование и анализ по циклам на 454 XL+
[00535] Секвенирование может быть приспособлено для циклов 454 XL+ с помощью следующего описанного в разделе «Подготовка к циклу секвенирования на 454 XL+» способа. Его необходимо выполнять в виде циклов на 454 XL+, применяемых на данный момент, только с обеспечением химии Lib-L, тогда как в циклах на 454 XLR70 в соответствии с настоящим изобретением использовали химию Lib-A. Их, как правило, можно приспосабливать к ситуациям, при которых химия Lib-L является предпочтительнее типичной химии Lib-A для секвенирования ампликонов в циклах на XLR70. Риды из циклов на 454 XL+ снова соотносили с лунками и собирали следующими описанными в разделах «Соотнесение последовательностей с лунками» и «Сборка последовательностей» способами. Риды из циклов на XLR70 и XL+ после фильтрации на 454 могут быть использованы идентичным образом, т.е. дальнейший отбор антител для клонирования, экспрессии и анализа функциональных свойств антитела по-прежнему можно осуществлять как на фиг. 6 и 9.
Пример 16: Клонирование спаренных генов иммуноглобулина
[00536] Предположив, что каждое клональное семейство распознает один и тот же эпитоп, и что вариантность последовательностей в каждом семействе объясняется соматической гипермутацией, в соответствии с настоящим изобретением сначала клонировали и экспрессировали наиболее часто встречающийся клон каждого клонального семейства для скрининга антител, связывающих представляющий интерес антиген (фиг. 6). В соответствии с настоящим изобретением использовали наиболее часто встречающийся клон потому, что при созревании аффинности и отборе в зародышевом центре центроциты, которые связывают антиген с самой высокой аффинностью, конкурируют с другими центроцитами за факторы выживания. Поэтому, полагали, что наиболее часто встречающийся клон также будет характеризоваться самой высокой аффинностью связывания. Как только клон идентифицировали как антитело, способное связывать антиген, типичные спаренные иммуноглобулиновые последовательности из всего клонального семейства клонировали, экспрессировали и скринировали на наличие нейтрализующих антител (фиг. 6). Этот процесс может включать клонирование и экспрессию последовательностей, представляющих множество субклонов в клональном семействе, или кодирование антител различных изотипов в клональном семействе для обеспечения непосредственного тестирования и сравнения связывания и функциональных свойств конкретных клонов, представляющих спектр антител, содержащихся в клональном семействе. Затем конкретный клон, проявляющий желаемые связывание и функциональные свойства, отбирали для дальнейшей характеристики и рассмотрения для разработки терапевтического человеческого антитела.
[00537] Альтернативный подход к отбору кандидатов для клонирования из семейства (или любого другого набора представляющих интерес антител) заключается в построении филогенетического древа для антител (начинающегося от родоначальной последовательности в случае клонального семейства). Листовые узлы в таком древе соответствуют членам семейства антител. Затем кандидатов для клонирования отбирали, опускаясь от верхушки древа, всегда выбирали нижележащую ветвь с наибольшим числом листовых узлов (выбирая произвольно в случае их схожести), затем на последнем узле вышележащих листьев выбирали лист с наибольшим числом мутаций или выбирали произвольно в случае их схожести. Затем можно было отбирать дополнительных кандидатов, если желательно, путем повторного отбора кандидатов до достижения желаемого числа, как изложено ниже. Для каждого узла на древе, если не было на одного листа, который происходил бы из отобранного узла, подсчитывали число листьев, которые являются потомками. Для узла с наибольшим таким счетом (выбирая произвольно в случае их схожести) происходящей всегда выбирали ветвь с наибольшим числом происходящих от нее листовых узлов (выбирая произвольно в случае схожести ветвей). В таком случае на последнем вышеупомянутом листовом узле выбирали лист с наибольшим числом мутаций или выбирали произвольно в случае их схожести.
[00538] Еще один подход к отбору кандидатов из семейства антител (или какого-либо другого набора представляющих интерес антител) заключается в перечне антител по убыванию числа немолчащих мутаций относительно родоначальной клетки и отборе из перечня таким образом, что выбранные антитела являются наиболее развитыми.
Пример 17: Постоянная трансфекция и экспрессия кандидатных человеческих антител
[00539] Желаемые клоны селективно амплифицировали из объединенного планшета последовательностей с использованием праймеров клонирования, специфичных к данному ID образца; эти праймеры также встраивали различные 5'- и 3'-сайты рестрикции в клон. Затем сайты рестрикции использовали для вставки клона в векторы. Поскольку амплифицированные клоны могут содержать только частичную последовательность константного участка, векторы уже содержат константные участки или каппа, или лямбда, или гамма с подходящими сайтами рестрикции, необходимыми для вставки амплифицированных клонов в открытую рамку считывания. В векторе конструировали несколько сайтов рестрикции, поскольку клоны содержали вариабельные последовательности, во избежание потенциальной проблемы с существующим также в самом клоне сайтом рестрикции, который затем также мог быть вырезан ферментом рестрикции. Это позволяло вставлять столько клонов, сколько возможно. Используемыми векторами являются либо два отдельных вектора с различными селектируемыми маркерами млекопитающих (модифицированных вектора Invitrogen ркДНК3.3 или pOptivec, которые содержат ген константного участка со сконструированными сайтами рестрикции), либо двойной вектор экспрессии, содержащий оба гена (система Lonza GS; рЕЕ6.4 и рЕЕ12.4). См. таблицы 16 и 17, соответственно, для последовательностей вставок константных участков. Селектируемые маркеры являются амплифицируемыми, например, дегидрофолатредуктаза (DHFR) в pOptivec или глутаминсинтетаза (GS) в системе Lonza GS, для обеспечения амплификации генов и эффективного продуцирования антител с целью дальнейшего скрининга, требующего большие количества антитела (например, скрининга in vivo). Клетки млекопитающих являются трансфицированными либо с использованием двойной трансфекции - легкой цепью в одном и тяжелой цепью в другом векторе (модифицированных pOptivec и ркДНК3.3), либо двойным вектором экспрессии (система Lonza GS), содержащим оба гена.
[00540] Модифицированные векторы Invitrogen. Векторы представляют собой два отдельных вектора с различными селектируемыми маркерами млекопитающих и сконструированными сайтами рестрикции). ркДНК3.3 содержит ген устойчивости к неомицину в качестве селектируемого маркера, a pOptivec содержит DHFR-селектируемый маркер. DHFR клетки СНО совместно трансфицировали модифицированными ркДНК3.3 и pOptivec при отборе по генетицину. Будут выживать только DHFR клетки, трансфицированные pOptivec, который содержит копию DHFR, а ген устойчивости к неомицину в ркДНК3.3 обеспечивает устойчивость к генетицину. Это позволяет отбор клеток, которые успешно трансфицированы обоими векторами (содержащие легкую цепь в одном векторе и тяжелую цепь в другом векторе) и поэтому будут продуцировать функциональные иммуноглобулины.
[00541] Система Lonza GS. В системе Lonza GS используют векторы рЕЕ12.4 и рЕЕ6.4. Вектор рЕЕ12.4 содержит ген GS в качестве амплифицируемого селектируемого маркера, и рЕЕ6.4 представляет собой добавочный вектор. Легкая цепь подлежит клонированию в один вектор, а тяжелая цепь в другой вектор. После этого оба вектора разрезают ферментами рестрикции и лигируют вместе с образованием одного вектора, который может экспрессировать оба гена и легкой, и тяжелой цепей в отдельных промоторах. Поэтому, эта система является системой двойного вектора экспрессии, обеспечивающей экспрессию обоих генов из одного вектора. Клетки СНО трансфицируют двойным вектором экспрессии при отборе по метионин сульфоксимину. Таким образом, отбирают трансфицированные клетки.
[00542] Амплификация генов
[00543] И дегидрофолатредуктаза (DHFR), и GS являются амплифицируемыми селектируемыми маркерами. Под давлением отбора при повышающихся количествах метотрексата и метионин сульфоксимина, соответственно, линии трансфицированных клеток, которые содержат дуплицированные геномные участки, содержащие гены DHFR и GS, будут выживать, поскольку они более устойчивые к селектируемым реагентам. Гены вблизи селектируемых маркеров, такие как вставленные гены тяжелой и легкой цепей иммуноглобулина также амплифицируют, что приводит к более высокому числу копий гена и к большим степеням продуцирования иммуноглобулинов. Клоны, продуцирующие антитела, которые, как обнаружили, обладают нейтрализующими свойствами в скринингах in vitro (см. ниже), амплифицируют так, что можно получить больше антител для последующих исследований in vivo.
Пример 18: Идентификация специфичности экспрессированных человеческих антител
[00544] Сгрининг антител осуществляли в две стадии. Использовали новый процесс «селективного скрининга», при котором сначала отбирали подходящие клональные семейства, подлежащие использованию в скрининге по нейтрализующим антителам. Скринировали наиболее часто встречающиеся 1-3 клона из каждого клонального семейства по их способности связываться с антигеном. Скрининг в соответствии с настоящим изобретением, как правило, включает формат непрямого ELISA, хотя может быть использована проточная цитометрия для идентификации связывающихся с клетками антител. Он включает сначала связывание подходящего антигена на планшете для ELISA, затем инкубацию его с супернатантами, содержащими экспрессированные антитела. Антитела, которые связываются с антигеном, выявляли с помощью специфичного вторичного антитела.
[00545] Как только идентифицировали связывающие антитела, все клональное семейство этого клона клонировали и экспрессировали на стадии скрининга «селективного скрининга». Хотя предполагается, что все антитела в клональном семействе связываются с одним и тем же эпитопом, они могут слегка отличаться авидностью связывания антигена и их местоположением по антигену, различия, которые могут влиять на свойства связывания и/или нейтрализующую способность антител; таким образом, в большинстве случаев несколько разных антител (обладающих незначительными различиями в их участках CDR3) экспрессировали и скринировали по связыванию и нейтрализующим свойствам.
[00546] Для нейтрализующих антител, которые нацелены на специфичные пары лиганд/рецептор, клетки 293Т сначала стабильно трансфицировали репортерной конструкцией пути передачи сигнала, такой как плазмида, содержащая ген люциферазы, связанный с транскрипционными элементами ответа NF-kB. Активация NF-kB в трансфицированной клетке индуцирует экспрессию люциферазы, содержание которой можно определить анализом люциферазы. В нем измеряли передачу сигнала NF-kB, активированную связыванием лиганда с рецептором. NF-kB является элементом выбора в передачи сигнала, поскольку большинство событий передачи сигнала активирует NF-kB. Для анализа других путей передачи сигнала промоторный участок гена люциферазы содержит подходящий транскрипционный сайт связывания, такой как, например, для АР-1. Затем клетки 293Т трансфицировали целевым рецептором. Затем клетки 293Т инкубировали с лигандом и представляющими интерес связывающими антителами в 96-луночных планшетах. Через 24 или 48 часов выполняли анализ с люциферазой для определения экспрессии гена люциферазы. В лунках с нейтрализующими антителами наблюдался минимум экспрессии люциферазы или не наблюдался совсем. Результаты подтверждали вестерн-блоттингом для фосфорилированных белков передачи сигнала в пути передачи сигнала NF-kB. Нейтрализующее антитело предотвращает передачу сигнала лиганд-рецептор и в результате отменяет фосфорилирование белков передачи сигнала.
[00547] Для антигенов, присутствующих на живых клетках, таких как антигены рака и бактериальные антигены, анализ нейтрализации in vitro принимал форму анализа, который выявлял живые/мертвые клетки и мог быть выполнен в высокопроизводительном формате. Раковые клетки или бактерии инкубировали в 96-луночных планшетах с кандидатным антителом. Затем к каждой лунке применяли окрашивание, которое отличало живые клетки от мертвых и было совместимым с проточной цитометрией. Живые и мертвые клетки окрашивали различными флуорофорами и скринировали с использованием потока для получения процентных отношений живых и мертвых клеток. Антитела, которые проходили скрининг in vitro затем подлежали скринингу in vivo по их нейтрализующей активности.
[00548] Анализ нейтрализации вируса in vitro мог быть проведен с использованием стандартного анализа нейтрализации пятен. С помощью выполнения анализов нейтрализации пятен в 96-луночных планшетах каждая лунка могла быть визуализирована с использованием микроскопа, а подсчет бляшек мог быть автоматизирован с программным обеспечением для визуализирующего анализа. Нейтрализующие антитела снижали образование пятен. Эти антитела затем дополнительно скринировали in vivo по нейтрализующей активности.
[00549] См. в примере 9 раздел «ELISA по Fluzone», в примере 11 раздел «Проточная цитометрия...» и в примере 12 раздел «Проточная цитометрия для стафилококка» для успешных анализов активности связывания с использованием ELISA (пример 7) и проточной цитометрии (примеры 9 и 10). См. в примере 9 раздел «Анализ микронейтрализации вируса гриппа» для успешного анализа антител с нейтрализующей активностью.
Пример 19: Секвенирование В-клеток при более чем одной клетке на лунку
[00550] Отдельные образцы, содержащие множество В-клеток, отдельно обратно транскрибировали в контейнерах. Обратной транскрипцией добавляли ID образца и 5'-универсальный праймерный участок ко всей 1-ой нити кДНК. кДНК из всех контейнеров набора контейнеров объединяли и подвергали 2 циклам PCR. Стадии описаны в разделах «Touchdown PCR» и «Отличная от touchdown PCR», «Подготовка к циклам секвенирования на 454 XLR70» в «Материалах и способах». Последовательности для праймеров также показаны на фиг. 9. Следует отметить, что независимо от того, какой ген амплифицировали, прямые праймеры оставались константными (b). После RT и 2 PCR ампликоны из наборов контейнеров объединяли и секвенировали на платформе 454. Соотносили с лунками и собирали последовательностей согласно протоколу, описанному в разделах «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах». Комбинация ID планшетов и ID образцов обеспечивала идентификацию последовательностей, которые походят из одного и того же образца.
[00551] Несмотря на то, что в лунке находится множество клеток, в соответствии с настоящим изобретением спаривали отдельные тяжелые цепи с легкими цепями. Тяжелые цепи из В-клеток, полученных от общего предшественника, будут клонально родственными, как и легкие цепи. Поэтому можно связать клональное семейство тяжелой цепи с клональным семейством легкой цепи путем наблюдения корреляции между лунками. Как только устанавливали связь между тяжелыми цепями клонального семейства и легкими цепями клонального семейства, пары соотносили с каждой лункой путем отбора тяжелой цепи, которая является членом клонального семейства тяжелой цепи, и легкой цепи, которая является членом клонального семейства легкой цепи. Отбор пары является однозначным, если только единственный экземпляр из семейства тяжелой цепи и единственный экземпляр из семейства легкой цепи находятся в лунке. После определения того, какая тяжелая и легкая цепи связаны друг с другом, могут быть составлены эволюционные деревья, и антитела отобраны для дальнейшей характеристики их функциональных свойств.
Пример 20: Секвенирование В-клеток при одной или нескольких клетках на лунку
[00552] Образцы можно отсортировывать при одной В-клетке на лунку в некоторых планшетах и при нескольких В-клетках на лунку в других планшетах, но тяжелая и легкая цепи все еще могут быть спаренными в тех лунках, где находится более чем одна В-клетка. Изучали последовательности, полученные от вакцинированного против гриппа пациента из вышеприведенного примера 9, в котором в некоторых лунках наблюдали более чем одну отличающуюся сборку последовательности тяжелой цепи или более чем одну отличающуюся сборку последовательности легкой цепи. RT, PCR, секвенирование и соотнесение с лунками, а также сборка последовательностей соответствовали протоколу вышеприведенного примера 9. Для определения того, какие тяжелая и легкая цепи связывались друг с другом, тяжелые цепи соотносили с клональным семейством путем группировки всех тяжелых цепей с теми же используемыми генами V и J и с тем же числом нуклеотидов между концом сегмента гена V и началом сегмента гена J. Легкие цепи соотносили с клональными семействами путем группировки всех легких цепей с теми же используемыми генами V и J и с тем же числом нуклеотидов между концом сегмента гена V и началом сегмента гена J. Взаимосвязи спаривания между тяжелой и легкой цепями сначала соотносили с лунками с точностью до одной тяжелой цепи и одной легкой цепи на основе их совместного нахождения в лунке (т.е. наличия одинаковых составных штрих-кодов). Затем вычисляли оценку для каждого возможного спаривания клонального семейства тяжелой цепи с клональным семейством легкой цепи. Оценку определяли путем подсчета числа раз, когда члены семейства тяжелой цепи и семейства легкой цепи совместного находились в лунке. Затем каждое семейство тяжелой цепи связывали с семейством легкой цепи, с которым была достигнута наивысшая оценка, или семейство тяжелой цепи не связывали с семейством легкой цепи, если наивысшая оценка была достигнута более чем с одним семейством легкой цепи. Затем отдельные тяжелую и легкую цепи спаривали, начиная с оцененного в итоге наивысшей оценкой семейства тяжелой цепи и переходя от лунки к лунке по соотнесенным парам семейств, затем продвигались к следующему семейству тяжелой цепи. Для данного семейства тяжелой цепи, для каждой лунки, если была одна тяжелая цепь в лунке, являющаяся членом семейства тяжелой цепи, то легкую цепь из этой лунки, принадлежащей семейству тяжелой цепи, связанной с семейством легкой цепи, соотносили как пару для тяжелой цепи. Если имелась более чем одна такая легкая цепь, пары не образовывали. Этот процесс связывания тяжелых цепей с легкими цепями продолжали до тех пор, пока все семейства и все цепи в этом семействе, не были оценены. Если для данных тяжелой или легкой цепей процесс приводил к более чем одному кандидату для спаривания, и тяжелую, и легкую цепи отбрасывали. Из спаренных цепей создавали эволюционные деревья, а антитела отбирали для дальнейшей характеристики их функциональных свойств. Часть эволюционного древа показана на фиг. 25А.
Пример 21: Применение отсортированных плазмобластов для создания человеческих моноклональных антител
[00553] Выполняли проточную цитометрию по периферической крови (либо по цельной крови, либо по мононуклеарным клеткам периферической крови (РВМС)) от субъекта с недавно возникшим или текущим состоянием, приводящим к острому, подострому или длительному образованию циркулирующего плазмобласта, для идентификации популяции плазмобластов. Затем эту популяцию В-клеток отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунки, содержащие гипотонический буфер с ингибитором РНКазы. Отсортированные клетки могли быть заморожены на это время или немедленно использованы в RT-PCR для создания кДНК. В ходе RT к реакционной среде добавляли специфичный для лунки адаптер ID образца олигонуклеотидов. Эти адаптеры содержали специфичные для лунки штрих-кодированные последовательности (ID образцов), которые могли идентифицировать последовательности как походящие из различных лунок. С использованием 3'-присоединяющей и переключающей матрицу активности обратных транскриптаз MMLV H- ID образцов добавляли к 3'-концу 1-ой нити кДНК. кДНК из каждого планшета объединяли вместе. В ходе первого цикла PCR с помощью планшет-специфичного Fw Long Primer 1 добавляли ID планшета к 5'-концу ампликонов. Таким образом, Fw Long Primer 1 с различными ID планшетов добавляли в различные планшеты с получением идентифицирующей штрих-кодированной последовательности в каждом продукте PCR. Специфичные для гена обратные праймеры использовали для амплификации цепей каппа, лямбда и гамма, они представляли собой GSP1 каппа, GSP1 лямбда и GSP1 гамма, соответственно. Эти праймеры связывались с константным участком генов иммуноглобулина. Продукты первого цикла PCR разбавляли и использовали для второй гнездовой PCR. Fw Primer 2 использовали в качестве прямого праймера, а в качестве обратных праймеров использовали длинные праймеры GSP каппа, лямбда и гамма для амплификации их соответствующих ампликонов. Следует отметить, что с помощью GPS Long Primer 2 для каждого планшета добавляли общий ID планшета к 3' -концу каждого ампликона для каждого планшета, таким образом, каждый конец будет содержать два штрих-кода ID планшетов и ID образца. Дальнейшие подробности для RT, 1-ой и 2-ой PCR находятся в разделе «Отличная от touchdown PCR» в «Материалах и способах». Затем несколько планшетов объединяли согласно способу, подробно изложенному в разделе «Подготовка цикла секвенирования по технологии 454 XLR70» и подвергали высокопроизводительному секвенированию ДНК на платформе 454, и индивидуальные последовательности, идентифицированные их штрих-кодами, служащими идентификаторами каждой тяжелой и/или легкой цепей, получали из каждой лунки, таким образом, обеспечивая руководство для установления совпадения индивидуальной вариабельной тяжелой и легкой цепей, полученных от одной и той же изначальной клетки, согласно способам, подробно изложенным в разделе «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах». Затем чертили эволюционные деревья и отбирали антитела для клонирования, экспрессии и определения функциональной активности (см. фиг. 6-8).
[00554] Затем кандидатные гены легкой и тяжелой цепей из конкретных клеток источника клонировали и экспрессировали для скрининга по желаемым свойствам, как в примере 8. При стабильной или временной трансфекции экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Затем супернатанты, содержащие секретированные антитела, скринировали по желаемым свойствам, в том числе без ограничения по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 продемонстрировано, как его выполняли с использованием композиций и способов в соответствии с настоящим документом для получения человеческих моноклональных антител против гемагглютинина от отсортированных по отдельной клетке плазмобластов вакцинированного против гриппа человека.
Пример 22: Применение отсортированных неотклоненных или антиген-специфичных В-клеток памяти для создания человеческих моноклональных антител
[00555] У субъекта с установленным или предполагаемым воздействием представляющего интерес антигена выполняли FACS на периферической крови (либо на цельной крови, либо на выделенных мононуклеарных клетках периферической крови, РВМС) для идентификации популяции В-клеток памяти (определяемых как CD19+CD20+CD27+). Кроме того, В-клетки памяти, специфичные против представляющих интерес антигенов, также можно отсортировывать путем окрашивания периферической крови или РВМС маркерами поверхности В-клеток памяти и конъюгированным с флуорофором антигеном(ами) (CD19+CD20+CD27+антиген+). Эту популяцию клеток затем отсортировывали с помощью FACS либо в виде отдельных клеток, либо в виде нескольких клеток в лунках. Процесс, подробно описанный в примере 21, повторяли для штрих-кодирования и получения последовательностей от секвенирования на платформе 454, соотносили последовательности с лунками и собирали последовательности. HighV-QUEST использовали для идентификации используемого гена VDJ и несколько членов из каждого клонального семейства на эволюционном древе отбирали для клонирования и экспрессии, как в примере 8. Клонирование и экспрессию выполняли, как подробно описано в примере 8. После трансфекции экспрессия взятых в целом спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Супернатанты, содержащие антитела, будут скринировать по антигенной специфичности против представляющего интерес целевого антигена(ов), а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 23: Применение отсортированных неотклоненных или антиген-специфичных общих В-клеток для создания человеческих моноклональных антител
[00556] У субъекта с установленным или предполагаемым воздействием представляющего интерес антигена или без такового выполняли FACS на периферической крови (либо на цельной крови, либо на выделенных мононуклеарных клетках периферической крови, РВМС) для идентификации популяции CD19+ В-клеток. Эту популяцию клеток затем отсортировывали с помощью FACS либо в виде отдельных клеток, либо в виде нескольких клеток в лунках. Подробно описанный в примере 21 процесс повторяли. Процесс, подробно описанный в примере 21, повторяли для штрих-кодирования и получения последовательностей от секвенирования на платформе 454, соотносили последовательности с лунками и собирали последовательности. HighV-QUEST использовали для идентификации используемого гена VDJ и несколько членов из каждого клонального семейства на эволюционном древе отбирали для клонирования и экспрессии, как в примере 8. После трансфекций экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Супернатанты, содержащие антитела, будут скринировать по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 24: Применение плазматических клеток для создания человеческих моноклональных антител
[00557] У субъекта с установленным или предполагаемым воздействием представляющего интерес антигена или без такового выполняли FACS на периферической крови (либо на цельной крови, либо на выделенных мононуклеарных клетках периферической крови, РВМС) или клетках костного мозга для идентификации популяции CD138+ плазматических клеток. Эту популяцию клеток затем отсортировывали с помощью FACS либо в виде отдельных клеток, либо в виде нескольких клеток в лунках. Процесс, подробно описанный в примере 21, повторяли для штрих-кодирования и получения последовательностей от секвенирования на платформе 454, соотносили последовательности с лунками и собирали последовательности. HighV-QUEST использовали для идентификации используемого гена VDJ и несколько членов из каждого клонального семейства на эволюционном древе отбирали для клонирования и экспрессии. После трансфекции экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Супернатанты, содержащие антитела, будут скринировать по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 25: Применение бластоподобных В-клеток для создания человеческих моноклональных антител
[00558] У субъекта с установленным или предполагаемым воздействием представляющего интерес антигена или без такового выполняли FАСS на периферической крови (либо на цельной крови, либо на выделенных мононуклеарных клетках периферической крови, РВМС) для идентификации популяции FSChi бластоподобных В-клеток. Бластоподобные клетки являются активированными В-клетками и, поэтому, являются клетками, которые отвечают на антиген и активно пролиферируют. Такие В-клетки состоят из клональных семейств, и их спаренные тяжелая и легкая цепи могут быть использованы для получения эволюционных деревьев. Также совместно могут быть использованы другие маркеры активации В-клеток, такие как CD69hi и CD44hi. Кроме того, содержание ДНК, которая может быть окрашена с использованием приникающих в клетку красителей ДНК, таких как SYTO Blue (Invitrogen), для определения клеток, которые являются активированными, пролиферирующими и в клеточном цикле, также можно использовать совместно для описания бластоподобных В-клеток. Эту популяцию клеток затем отсортировывали с помощью FACS либо в виде отдельных клеток, либо в виде нескольких клеток в лунках. Процесс, подробно описанный в примере 21, повторяли для штрих-кодирования и получения последовательностей от секвенирования на платформе 454, соотносили последовательности с лунками и собирали последовательности. HighV-QUEST применяли для идентификации используемого гена VDJ и несколько членов из каждого клонального семейства на эволюционном древе отбирали для клонирования и экспрессии. После трансфекции экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Супернатанты, содержащие антитела, будут скринировать по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 26: Применение мышиных В-клеток для создания моноклональных антител
[00559] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных В-клеток. Мышиные В-клетки можно получать из крови, из спленоцитов или из костного мозга. Выполняли проточную цитометрию для получения CD19+ или В220+ В-клеток. Эту популяцию В-клеток затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR выполняли, как подробно изложено в разделе «Отличная от touchdown PCR» в «Материалах и способах». Мышиные специфичные для гена праймеры представлены в таблице 11, а другие праймеры, используемые для RT и PCR, представлены в таблице 1. Затем несколько планшетов объединяли согласно способу, подробно изложенному в разделе «Подготовка цикла секвенирования по технологии 454 XLR70» и подвергали высокопроизводительному секвенированию ДНК по технологии 454 и индивидуальные последовательности идентифицировали с их штрих-кодами, служащими идентификаторами, по которым тяжелую и/или легкую цепи получали из каждой лунки, таким образом обеспечивая руководство для установления совпадения индивидуальных вариабельных тяжелой и легкой цепей, полученных от одной и той же изначальной клетки, согласно способам, подробно изложенным в разделах «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах». Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности.
[00560] Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров. Прямой клонирующий праймер является специфичным по ID образца и может амплифицировать специфичные последовательности из пула ампликонов. Последовательность для каждой тяжелой и легкой цепей затем клонировали в вектор экспрессии, содержащий комплементарные сайты рестрикции, для введения их с помощью клонирующих праймеров. Векторы также содержат константный участок либо тяжелой, либо легкой цепей, при этом последовательности тяжелой или легкой цепей клонировали (выравнивали относительно рамки считывания) с получением полного антитела. Векторы, содержащие клоны либо тяжелой, либо легкой цепей, затем дважды трансфицировали в систему экспрессии млекопитающих, или, в качестве альтернативы, оба ампликона могут быть клонированы в двойной вектор экспрессии для обеспечения отдельной трансфекции в клетках млекопитающих.
[00561] Затем кандидатные гены легкой и тяжелой цепи из конкретных клеток источника экспрессировали и использовали для скрининга по желаемым свойствам, как указано выше. При стабильной или временной трансфекции экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Затем супернатанты, содержащие секретированные антитела, скринировали по желаемым свойствам, в том числе без ограничения по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 27: Применение мышиных плазматических клеток для создания моноклональных антител
[00562] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных В-клеток. Мышиные плазматические клетки можно получать из крови, из спленоцитов или из костного мозга, хотя, как правило, использовали спленоциты и костный мозг. Выполняли проточную цитометрию для получения CD19low/-B220low/-CD138+ плазматических клеток. Эту популяцию плазматических клеток затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR выполняли, как подробно изложено в разделе «Отличная от touchdown PCR» в «Материалах и способах». Мышиные специфичные для гена праймеры представлены в таблице 11, а другие праймеры, используемые для RT и PCR, представлены в таблице 1. Затем несколько планшетов объединяли согласно способу, подробно изложенному в разделе «Подготовка цикла секвенирования по технологии 454 XLR70» и подвергали высокопроизводительному секвенированию ДНК по технологии 454 и индивидуальные последовательности идентифицировали с их штрих-кодами, служащими идентификаторами, по которым тяжелую и/или легкую цепи получали из каждой лунки, таким образом обеспечивая руководство для установления совпадения индивидуальных вариабельных тяжелой и легкой цепей, полученных от одной и той же изначальной клетки, согласно способам, подробно изложенным в разделах «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах». Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности.
[00563] Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров, как описано в примере 26. Затем кандидатные гены легкой и тяжелой цепи из конкретных клеток источника экспрессировали и использовали для скрининга по желаемым свойствам, как указано выше. При стабильной или временной трансфекции экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Затем супернатанты, содержащие секретированные антитела, скринировали по желаемым свойствам, в том числе без ограничения по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 28: Применение неотклоненных или антиген-специфичных мышиных В-клеток памяти для создания моноклональных антител
[00564] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных В-клеток. Мышиные В-клетки памяти, как правило, можно получать из крови, из спленоцитов или из лимфатических узлов. Выполняли проточную цитометрию для получения CD19+ или В220+ и CD38+IgG+ В-клеток памяти. Также можно было использовать другие маркеры, такие как CD45RO. Антиген-специфичные В-клетки памяти также можно было визуализировать путем окрашивания конъюгированным с флуорофором антигеном и отсортировывать. Эту популяцию В-клеток затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR с последующим секвенированием, соотнесение последовательностей с лунками и сборку последовательностей выполняли, как в примере 26. Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности.
[00565] Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров, как описано в примере 26. Затем кандидатные гены легкой и тяжелой цепей из конкретных клеток источника экспрессировали и использовали для скрининга по желаемым свойствам, как указано выше. При стабильной или временной трансфекции экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Затем супернатанты, содержащие секретированные антитела, скринировали по желаемым свойствам, в том числе без ограничения по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 3 и 9 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 29: Применение мышиных короткоживущих плазмобластов для создания моноклональных антител
[00566] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных В-клеток. Мышиные короткоживущие плазмобласты, как правило, можно получать из спленоцитов. Эти плазмобласты были по-разному описаны как CD19low/-B220low/- и CD22low или CD11c+, а также как CD138+. Выполняли проточную цитометрию для получения плазмобластов. Эту популяцию плазмобластов затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR с последующим секвенированием, соотнесение последовательностей с лунками и сборку последовательностей выполняли, как в примере 26. Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности.
[00567] Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров, как описано в примере 26. Затем кандидатные гены легкой и тяжелой цепей из конкретных клеток источника экспрессировали и использовали для скрининга по желаемым свойствам, как указано выше. При стабильной или временной трансфекций экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Затем супернатанты, содержащие секретированные антитела, скринировали по желаемым свойствам, в том числе без ограничения по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 30: Применение мышиных бластоподобных В-клеток для создания моноклональных антител
[00568] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных В-клеток. Мышиные бластоподобные В-клетки, как правило, можно получать из спленоцитов. Бластоподобные клетки являются активированными В-клетками и, поэтому, являются клетками, которые отвечают на антиген и активно пролиферируют. Эти В-клетки состоят из клональных семейств, и их спаренные тяжелую и легкую цепи можно использовать для получения эволюционных деревьев. Бластоподобные В-клетки можно гейтировать как FSChi, а также можно далее идентифицировать через маркеры клеточной поверхности, такие как CD44hiCD69hi, и поскольку бластоподобные В-клетки являются пролиферирующими, их можно идентифицировать как вошедшие в клеточный цикл по повышенному содержанию ДНК при окрашивании проникающими в клетку красителями ДНК, такими как SYTO Blue. Выполняли проточную цитометрию для получения бластоподобных В-клеток. Эту популяцию плазмобластов затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR с последующим секвенированием, соотнесение последовательностей с лунками и сборку последовательностей выполняли, как в примере 26. Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности.
[00569] Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров, как описано в примере 26. Затем кандидатные гены легкой и тяжелой цепей из конкретных клеток источника экспрессировали и использовали для скрининга по желаемым свойствам, как указано выше. При стабильной или временной трансфекции экспрессия спаренных тяжелой и легкой цепей приведет к образованию моноклональных антител, повторяющих специфичность изначально отсортированной клетки. Затем супернатанты, содержащие секретированные антитела, скринировали по желаемым свойствам, в том числе без ограничения по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 31: Получение моноклональных антител из неотклоненных или антиген-специфичных человеческих IgA+ В-клеток
[00570] Выполняли FACS на периферической крови (либо на цельной крови, либо на выделенных мононуклеарных клетках периферической крови, РВМС) или на костном мозге субъекта с установленным или предполагаемым воздействием представляющего интерес антигена или без такового для выделения IgA+ В-клеток. Этими В-клетками могут быть В-клетки памяти, плазматические клетки или плазмобласты. Такие IgA+ В-клетки также могут быть антиген-специфичными при сортировке по антиген-положительным В-клеткам с использованием конъюгированного с флуорофором антигена с окрашиванием IgA+ В-клеток. Эту популяцию клеток затем отсортировывали с помощью FАСS либо в виде отдельных клеток, либо в виде нескольких клеток в лунках. Процесс, подробно описанный в примере 21, повторяли для штрих-кодирования и получения последовательностей от секвенирования на платформе 454, соотносили последовательности с лунками и собирали последовательности, специфичные праймеры константного участка IgA, используемые для PCR, представлены в таблице 10. HighV-QUEST применяли для идентификации используемого гена VDJ и несколько членов из каждого клонального семейства на эволюционном древе отбирали для клонирования и экспрессии, как в примере 8. Супернатанты, содержащие антитела, будут скринировать по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 32: Получение моноклональных антител из неотклоненных или антиген-специфичных человеческих IgM+ В-клеток
[00571] Выполняли FACS на периферической крови (либо на цельной крови, либо на выделенных мононуклеарных клетках периферической крови, РВМС) субъекта с установленным или предполагаемым воздействием представляющего интерес антигена или без такового для выделения IgM+ В-клеток. Эти В-клетки могут быть В-клетками памяти, плазматическими клетками или бластоподобными В-клетками. Такие IgM+ В-клетки также могут быть антиген-специфичными при сортировке по антиген-положительным В-клеткам с использованием конъюгированного с флуорофором антигена с окрашиванием IgM+ В-клеток. Эту популяцию клеток затем отсортировывали с помощью FACS либо в виде отдельных клеток, либо в виде нескольких клеток в лунках. Процесс, подробно описанный в примере 21, повторяли для штрих-кодирования и получения последовательностей от секвенирования на платформе 454, соотносили последовательности с лунками и собирали последовательности, специфичные праймеры константного участка IgM, используемые для PCR, представлены в таблице 10. HighV-QUEST применяли для идентификации используемого гена VDJ и несколько членов из каждого клонального семейства на эволюционном древе отбирали для клонирования и экспрессии, как в примере 8. Супернатанты, содержащие антитела, будут скринировать по антигенной специфичности против представляющего интерес целевого антигена, а также по функциональности, с помощью подходящих функциональных анализов. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа. На фиг. 26-27 представлен другой пример получения человеческих моноклональных антител по функциональной характеристике отобранных клонированных и экспрессированных антител из эволюционных деревьев.
Пример 33: Получение моноклональных антител из неотклоненных или антиген-специфичных мышиных IgA+ В-клеток
[00572] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных IgA+ В-клеток. Эти В-клетки могут быть В-клетками памяти, плазматическими клетками, плазмобластами или бластоподобными В-клетками и, как правило, могут быть получены из спленоцитов. Такие IgA+ В-клетки также могут быть антиген-специфичными при сортировке по антиген-положительным В-клеткам с использованием конъюгированного с флуорофором антигена с окрашиванием IgA+ В-клеток. Эту популяцию IgA+ В-клеток затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR с последующим секвенированием, соотнесение последовательностей с лунками и сборку последовательностей выполняли, как в примере 26, и специфичные праймеры константного участка IgA, используемые для PCR, представлены в таблице 11. Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа.
Пример 34: Получение моноклональных антител из неотклоненных или антиген-специфичных мышиных IgM+ В-клеток
[00573] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных IgM+ В-клеток. Эти В-клетки могут быть В-клетками памяти, плазматическими клетками, плазмобластами или бластоподобными В-клетками и, как правило, могут быть получены из спленоцитов. Такие IgM+ В-клетки также могут быть антиген-специфичными при сортировке по антиген-положительным В-клеткам с использованием конъюгированного с флуорофором антигена с окрашиванием IgM+ В-клеток. Эту популяцию IgM+ В-клеток затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR с последующим секвенированием, соотнесение последовательностей с лунками и сборку последовательностей выполняли, как в примере 26, и специфичные праймеры константного участка IgA, используемые для PCR, представлены в таблице 11. Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности. На каждой из фиг. 9 и 6 представлен один пример общей методики выполнения этого способа.
Пример 35: Секвенирование более одной последовательности из человеческих Т-клеток
[00574] Выполняли проточную цитометрию на периферической крови (либо на цельной крови, либо на выделенных мононуклеарных клетках периферической крови, РВМС) субъекта с недавним или текущим состоянием, приводящим к острому, подострому или длительному образованию циркулирующих Т-клеток, для идентификации представляющей интерес популяции Т-клеток. Такой популяцией Т-клеток могут быть активированные Т-клетки или бластоподобные Т-клетки. Активированные Т-клетки можно идентифицировать с использованием CD44hi, CD69hi, CD154+, CD137+, или бластоподобные Т-клетки, которые также являются активированными Т-клетками, можно определить по их размеру или FSChi, а также можно идентифицировать как вошедшие в клеточный цикл по повышенному содержанию ДНК при окрашивании проникающими в клетку красителями ДНК, такими как SYTO Blue. Активированные Т-клетки должны состоять из клональных семейств, которые затем можно группировать в эволюционное древо, с идентичными членами семейства в клональных семействах, которых можно использовать для отбора клонов для дальнейшего функционального анализа. Т-клетки затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT и PCR для штрих-кодирования генов TCR подробно изложены в разделе «Отличная от touchdown PCR» в «Материалах и способах», подготовка секвенирования подробно изложена в разделе «Подготовка цикла секвенирования по технологии 454 XLR70» в «Материалах и способах», а соотнесение последовательностей с лунками и сборка ридов подробно изложены в разделах «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах», специфичные для гена TCR праймеры представлены в таблице 10. Затем строили эволюционные деревья, а потом из конкретных клеток источника выбирали кандидатные гены, подлежащие клонированию и экспрессии для скрининга по желаемым свойствам. Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров. Специфичные клоны можно выделять из пула клонов по наличию прямого клонирующего праймера, специфичного для штрих-кодированной последовательности ID образца. Обратные клонирующие праймеры являются комплементарными соответствующему гену. И прямые, и обратные праймеры содержат фланкирующие сайты рестрикции для встраивания клона (выравнивали относительно рамки кодирования) в вектор. Клетки либо дважды трансфицировали двумя векторами экспрессии, каждый из которых содержал представляющий интерес ген, либо один раз трансфицировали двойным вектором экспрессии, который экспрессировал оба представляющих интерес гена, например, цепей альфа и бета Т-клетки.
[00575] При стабильной или временной трансфекции представляющие интерес гены можно экспрессировать и скринировать по функциональным свойствам с использованием желаемых скринингов.
Пример 36: Секвенирование более одной последовательности из мышиных Т-клеток
[00576] Мышь провоцировали представляющим интерес антигеном и могли вводить бустер-инъекции за некоторое время до умерщвления мыши для получения мышиных Т-клеток. Т-клетки являются CD3+, хелперные Т-клетки являются CD4+, а цитотоксические Т-клетки являются CD8+. Этой популяцией Т-клеток могут быть Т-клетки памяти, или активированные Т-клетки, или бластоподобные Т-клетки. Т-клетки памяти могут быть идентифицированы как CD45RO+. Активированные Т-клетки могут быть идентифицированы с использованием CD44hi, CD69hi, или бластоподобные Т-клетки, которые также являются активированными Т-клетками, можно определить по их размеру или FSChi, а также можно идентифицировать как вошедшие в клеточный цикл по повышенному содержанию ДНК при окрашивании проникающими в клетку красителями ДНК, такими как SYTO Blue. Все эти Т-клетки у мыши, которые держали в чистом окружении после повторного воздействия антигена, должны характеризоваться большой фракцией клональных семейств, которые затем можно изображать в виде эволюционного древа, а потом использовать для отбора TCR для клонирования, экспрессии и для дальнейшего функционального анализа.
[00577] Т-клетки отсортировывали с помощью проточной цитометрии с использованием вышеупомянутых маркеров в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT и PCR для штрих-кодирования генов TCR подробно изложены в разделе «Отличная от touchdown PCR» в «Материалах и способах», подготовка секвенирования подробно изложена в разделе «Подготовка цикла секвенирования по технологии 454 XLR70» в «Материалах и способах», а соотнесение последовательностей с лунками и сборка ридов подробно изложены в разделах «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах», специфичные для гена TCR праймеры представлены в таблице 11. Затем строили эволюционные деревья, и потом из конкретных клеток источника выбирали кандидатные гены, подлежащие клонированию и экспрессии для скрининга по желаемым свойствам. Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров. Специфичные клоны можно выделять из пула клонов по наличию прямого клонирующего праймера, специфичного для штрих-кодированной последовательности ID образца. Обратные клонирующие праймеры являются комплементарными соответствующему гену. И прямые, и обратные праймеры содержат фланкирующие сайты рестрикции для встраивания клона (выравнивали относительно рамки кодирования) в вектор. Клетки либо дважды трансфицировали двумя векторами экспрессии, каждый из которых содержал представляющий интерес ген, либо один раз трансфицировали двойным вектором экспрессии, который экспрессировал оба представляющих интерес гена, например, цепей альфа и бета Т-клетки.
[00578] При стабильной или временной трансфекций представляющие интерес гены можно экспрессировать и скринировать по функциональным свойствам с использованием желаемых скринингов.
Пример 37: Секвенирование более одной последовательности из образца
[00579] Идентифицировали отдельный образец, содержащий представляющие интерес нуклеиновые кислоты. Отдельный образец может содержать отдельную клетку или популяцию клеток. Образец можно отсортировывать с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. Эту популяцию В-клеток затем отсортировывали с помощью проточной цитометрии в виде отдельных клеток в лунках, содержащих гипотонический буфер с ингибитором РНКазы. Отсортированные клетки можно замораживать на это время или использовать немедленно в RT-PCR для создания кДНК. RT, 1-ую и 2-ую PCR выполняли, как подробно изложено в разделе «Отличная от touchdown PCR» в «Материалах и способах». Затем несколько планшетов объединяли согласно способу, подробно изложенному в разделе «Подготовка цикла секвенирования по технологии 454 XLR70» и подвергали высокопроизводительному секвенированию ДНК по технологии 454 и индивидуальные последовательности идентифицировали по их штрих-кодам, служащими идентификаторами, по которым тяжелую и/или легкую цепи получали из каждой лунки, таким образом обеспечивая руководство для установления совпадения индивидуальных вариабельных тяжелой и легкой цепей, полученных от одной и той же изначальной клетки, согласно способам, подробно изложенным в разделах «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах». Затем чертили эволюционные деревья и антитела отбирали для клонирования, экспрессии и определения функциональной активности.
[00580] Затем выбирали кандидатные гены из конкретных клеток источника, подлежащие клонированию и экспрессии для скрининга по желаемым свойствам или для иных целей. Последовательности для клонирования могут быть либо получены путем синтеза синтетических генов, либо амплифицированы из продуктов 1-ой PCR с использованием клонирующих праймеров. Специфичные клоны можно выделять из пула клонов по наличию прямого клонирующего праймера, специфичного для штрих-кодированной последовательности ID образца. Обратные клонирующие праймеры являются комплементарными соответствующему гену. И прямые, и обратные праймеры содержат фланкирующие сайты рестрикции для встраивания клона (выравнивали относительно рамки кодирования) в вектор. Клетки либо трансфицировали двумя или более векторами экспрессии, каждый из которых содержал представляющий интерес ген, либо один раз трансфицировали вектором экспрессии, который экспрессировал представляющие интерес гены.
[00581] При стабильной или временной трансфекции представляющие интерес гены, если нужно, можно экспрессировать и скринировать. На фиг. 9 и 6 представлен один пример общей методики выполнения этого способа.
Пример 38: Клонирование участков V(D)J иммуноглобулина с помощью синтеза ДНК
[00582] Желаемые участки V(D)J легкой цепи и тяжелой цепи иммуноглобулина можно синтетически получить с помощью синтеза ДНК для клонирования в векторы экспрессии. Используемую для синтеза последовательность можно было получить непосредственно высокопроизводительными секвенированиями по технологии 454 или, в качестве альтернативы, кДНК, кодирующую тяжелую и легкую цепи иммуноглобулина из представляющего интерес образца(ов), можно было повторно секвенировать из индивидуального образца или объединенных образцов для дальнейшей проверки последовательности, и эту последовательность использовали для синтеза отобранных участков V(D)J легкой цепи и тяжелой цепи. Вариабельные участки генов Ig можно было клонировать с помощью синтеза ДНК и встраивать синтезированную ДНК в вектор, содержащий подходящий константный участок с использованием ферментов рестрикции и стандартных методов молекулярной биологии. В ходе синтеза не обязательно должна наблюдаться точная нуклеотидная последовательность, лишь бы аминокислотная последовательность была неизменной, кроме случаев, когда мутагенез желателен. Это позволяет оптимизировать ко доны, что может привести к более высоким уровням экспрессии. Это также позволяет добавлять сайты рестрикции с целью клонирования. Не нужно синтезировать нетранслированные последовательности, такие как 5'-UTR и штрих-кодированные последовательности, лидерные последовательности также могут быть заменены другими сигнальными пептидными последовательностями, известными более высокими уровнями экспрессии. Это приводит к нуклеотидной последовательности Ig, которая может сильно отличаться от высокопроизводительных ридов, но дает при экспрессии идентичную секвенированную аминокислоту.
[00583] Согласно одному варианту осуществления амплифицированные участки V(D)J вставляли в векторы, которые уже содержали константные участки изотипов либо каппа, лямбда, гамма, либо другой тяжелой цепи с подходящими сайтами рестрикции, необходимыми для вставки амплифицированных клонов в открытую рамку считывания. Согласно другому варианту осуществления весь вариабельный участок может быть геном, синтезированным с константным участком и клонированным в вектор экспрессии для экспрессии и дальнейшего функционального тестирования свойств антител.
Пример 39: Клонирование участков V(D)J иммуноглобулина с использованием сайта рестрикции, уже присутствующего в адаптере идентификации образца
[00584] Другой аспект относится к желаемым участкам V(D)J легкой цепи и тяжелой цепи иммуноглобулина, которые можно клонировать с использованием сайта рестрикции, уже встроенного в адаптер ID образца, добавленный в ходе обратной транскрипции. Это дает в результате адаптер с сайтом рестрикции 3' относительно штрих-кода ID лунки в пуле ампликонов PCR. В ходе клонирования с клонирующими праймерами желаемые ампликоны амплифицировали из пула планшет-специфичных ампликонов с использованием 5'-праймеров, которые комплементарны последовательностям штрих-кода с ID лунки, и специфичных для цепей 3'-праймеров (для цепей каппа, лямбда и гамма). В 3'-праймеры будут добавлены 3'-сайты рестрикции. На 5'-праймеры не нужно добавлять сайты рестрикции, поскольку 5'-праймер уже содержит сайт рестрикции 3' относительно штрих-кода с ID лунки. После такой амплификации ферменты рестрикции использовали для разрезания ампликона для лигирования в вектор, содержащий вставку константного участка. При отщеплении ферментом рестрикции последовательности добавляли на 5'-конец последовательностей гена Ig, такие как штрих-коды, и универсальные последовательности разрезали, поскольку они расположены 5' относительно 5'-сайта рестрикции.
Пример 40: Идентификация клональных семейств путем секвенирования только одной цепи (тяжелой цепи или легкой цепи) иммуноглобулина с последующим клонированием участков V(D)J спаренных тяжелой и легкой цепей иммуноглобулина
[00585] Тяжелую и легкую цепи антитела обратно транскрибировали из mRNA со встраиванием отличающихся ID образцов в кДНК, образованные из каждого образца, и кДНК образцов объединяли для PCR-амплификации. кДНК иммуноглобулина амплифицировали и секвенировали либо тяжелую цепь, либо легкую цепь иммуноглобулина с использованием высокопроизводительного секвенирования по технологии 454, а последовательности группировали в соответствии с применением их как последовательностей V(D)J тяжелой цепи или V(D)J легкой цепи иммуноглобулина, что демонстрирует применение одних и тех же кодированных геномом сегментов V(D)J. Биоинформатические данные использовали для идентификации представляющих интерес клональных семейств, а желаемые участки V(D)J легкой и тяжелой цепей иммуноглобулина из одного и того же образца затем селективно амплифицировали для секвенирования и/или клонирования. Для PCR-амплификации прямой праймер содержит ID образца, а обратный праймер является специфичным для константного участка легкой цепи или тяжелой цепи. Праймеры могут встраивать сайты рестрикции в ампликоны. Затем ампликоны могут быть вставлены в подходящие векторы экспрессии, которые уже содержат константный участок тяжелой или легкой цепей. Затем антитела можно экспрессировать и скринировать по желаемым свойствам.
Пример 41: Идентификация клональных семейств из секвенирования V(D)J тяжелой и легкой цепей иммуноглобулина для клонирования и экспрессии антител с использованием только ID образцов (без ID планшетов)
[00586] Тяжелую и легкую цепи антитела обратно транскрибировали из mRNA в каждом образце со встраиванием отличающихся ID образцов в кДНК, образованные из каждого образца. Каждый ID образца составляет в длину по меньшей мере 6 нуклеотидов с отличающейся 1 парой оснований, что дает в результате 4096 отличающихся потенциальных ID образцов. Отличающийся ID образца использовали для каждого образца, с помощью уникальных ID образцов идентифицировали кДНК, полученную из различных образцов, и обеспечивали секвенирование и клонирование спаренных среди 2 или более кДНК, экспрессированных в индивидуальном образце. Ампликоны тяжелой и легкой цепей амплифицировали с использованием PCR, при которой добавляются адаптеры Titanium А и В, необходимые для высокопроизводительного секвенирования по технологии 454, а затем все образца посылали на секвенирование. Последовательности соотносили с лунками и собирали согласно разделам «Соотнесение последовательностей с лунками» и «Сборка последовательностей» в «Материалах и способах». Соотнесения V(D)J выполняли с использованием HighV-QUEST и группировали в клональные семейства на основе их используемых V(D)J. Затем отобранные клоны специфично амплифицировали с клонирующими праймерами, которые также добавляли сайты рестрикции в ампликон. Затем ампликоны вставляли внутри рамки в векторы экспрессии, которые уже содержали подходящие константные участки тяжелой или легкой цепи для экспрессии антител для скрининга по желаемым свойствам.
Пример 42: Клонирование спаренных последовательностей с помощью лигирования на универсальную последовательность праймера
[00587] Гены легкой и тяжелой цепей антитела обратно транскрибировали из mPvNA, что добавляет 3'-последовательность к заново синтезированной кДНК, состоящей из адаптерного участка и штрих-кода с ID образца. Затем образцы объединяли вместе и добавляли универсальную последовательность праймера к 3'-концу 1-ой нити кДНК с использованием ДНК-лигазы Т4 и 5'-фосфорилированного антисмыслового универсального олигонуклеотида праймера. В качестве альтернативы, можно выполнять синтез 2-ой нити кДНК для получения двухнитевой кДНК вместо гибрида mRNA/кДНК перед лигированием с универсальной последовательностью праймера. Затем выполняли два цикла PCR для амплификации кДНК и для добавления ID планшетов и Titanium Primers А и В для секвенирования на платформе 454. В качестве альтернативы, ID планшетов и Titanium Primers также можно добавлять с помощью лигирования ДНК вместо встраивания в ходе PCR с использованием ДНК-лигазы Т4. После секвенирования на платформе 454 последовательности собирали и идентифицировали клональные семейства. Отобранные клоны из клональных семейств можно специфично клонировать с использованием клонирующих праймеров, которые добавляют сайты рестрикции к ампликонам. Затем последовательности вставляли внутри рамки в векторы экспрессии, которые уже содержат подходящие константные участки тяжелой или легкой цепи. Затем антитела экспрессировали и скринировали по желаемым свойствам.
Пример 43: Тестирование специфичных для гена праймеров для обратной транскрипции (RT-GSP) тяжелой и легкой цепей иммуноглобулина
[00588] RT-GSP использовали вместо oligo(dT) в качестве праймеров в обратной транскрипции генов легкой и тяжелой цепей. Затем кДНК амплифицировали с помощью PCR и визуализировали на агарозном геле. Праймеры RT-GSP представляли собой IgKC_v3(a), IgLC_v5, IgLC_v6, IgLC_v7 и IgLC_v8 в дорожках 1-4, соответственно, (b), IgHGC_v10, IgHGC_v11, IgHGC_v13 и IgGC_v15 в дорожках 1-4, соответственно, (с), и IgHGC_v10 (d). КС, LC и GC в названиях праймеров показывают, что праймер является специфичным для цепи каппа, цепи лямбда и тяжелой цепи гамма, соответственно. Белые полоски на фотографиях геля показывают, где нехарактерные дорожки были обрезаны. См. фиг. 10 и таблицу 6.
Пример 44: Тестирование последовательностей адаптерного участка
[00589] RNA обратно транскрибировали с олигонуклеотидами, содержащими универсальный праймерный участок и адаптерный участок на 3'-концевой области. Затем амплифицировали кДНК с использованием последовательности универсального праймерного участка в качестве прямого праймера и специфичных для гена последовательностей в качестве обратных праймеров. Амплифицированные продукты визуализировали на агарозном геле. Адаптерный участок состоит из G (a), GGGGG и rGrGrG в дорожках 1 и 2, соответственно, (b). rG показывает нуклеотиды РНК вместо нуклеотидов ДНК. См. фиг. 11 и таблицу 6.
Пример 45: Тестирование универсальных последовательностей праймеров
[00590] RNA обратно транскрибировали с олигонуклеотидами, содержащими универсальный праймерный участок и адаптерный участок на 3'-концевой области. Затем амплифицировали кДНК с помощью PCR с использованием прямого праймера, комплементарного универсальному праймерному участку, и обратного праймера, комплементарного специфичной для гена последовательности. Univ_seq_4 (a), univ_seq_5 (b) и univ_seq_f (с). Вертикальные белые полоски на фотографиях геля показывают, где нехарактерные дорожки были обрезаны. Прочие дорожки принадлежат той же фотографии геля. См. фиг. 12 и таблицу 6.
Пример 46: Тестирование специфичных для гена праймерных последовательностей для 1-ой PCR-реакции
[00591] Специфичные для гена обратные праймеры использовали при амплификации последовательностей в первой PCR-реакции. Продукты либо 1-ой PCR-реакции, либо последующей 2-ой гнездовой PCR прогоняли и визуализировали на агарозном геле. Используемые обратные праймеры представляли собой IgKC_v4, IgLC_v5, IgHGC_v13 на дорожках 1-3, соответственно, (a), K_GSP1, L GSPl, G_GSP1 на дорожках 1-3, соответственно, (b), K_GSPlc, L GSPlc на дорожках 1-2, соответственно, (с), G GSPl (d), L GSPld, G GSPlg на дорожках 1-2, соответственно, (е), G_GSPlh, G_GSPlk, L_GSPlf, L_GSPlg на дорожках 1-4, соответственно, (f), G_GSPld (g) L_GSPlh-o на дорожках 1-8, соответственно, (h), G_GSPlm-q и G_GSPlt на дорожках 1-6, соответственно (К, L и G в названиях праймеров показывают, что праймер является специфичным для константных участков иммуноглобулина каппа, лямбда и гамма, соответственно). Каждый гель стартует с дорожки маркера слева, за которой следуют дорожки образца. Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны. См. фиг. 13. Также тестировали больше праймеров, как показано на фиг. 43. Эти праймеры использовали для 1-ой PCR, а затем выполняли 2-ую PCR с использованием праймеров из таблицы 1, продукты PCR прогоняли на 2% агарозном геле и получали изображение. Используемые для 1-ой PCR праймеры представляли собой каппа GSP1, каппа GSPle, каппа GSPlf, лямбда GSP1, лямбда GSPlx и лямбда GSPly, соответственно. Также см. таблицу 6 для используемых последовательностей.
Пример 47: Тестирование специфичных для гена последовательностей для 2-ой PCR-реакции
[00592] Специфичные для гена обратные праймеры использовали при амплификации последовательностей во 2-ой PCR-реакции. Продукты PCR прогоняли и визуализировали на агарозном геле. Используемые обратные праймеры представляли собой K GSP2, L GSP2, G GSP2 в дорожках 1-3, соответственно, (a), K_GSP2v2a, K_GSP2v2b, L_GSP2v2 в дорожках 1-3, соответственно, (b), K_GSP2v2c, K_GSP2v2c, G_GSP2v2cl, G_GSP2v2c2 в дорожках 1-4, соответственно, (с), K_GSP2v2d-f в дорожках 1-3, соответственно, (d), K_GSP2v2g, L_GSP2v2d и G_GSP2b в дорожках 1-3, соответственно, (е). К, L и G в названиях праймеров показывают, что праймеры являются специфичными для константных участков каппа, лямбда и гамма иммуноглобулина, соответственно. Каждый гель стартует с маркера дорожки слева, за которой следуют дорожки образца. Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны. См. фиг. 14 и таблицу 6.
Пример 48: Тестирование специфичных для гена праймеров для других человеческих генов вариабельного участка
[00593] Выполняли 1-ую и 2-ую PCR с использованием специфичных для гена обратных праймеров, продукты прогоняли на 2% агарозном геле и визуализировали. Дорожки представляют слева: маркер, мю, константные участки альфа, TCR альфа (а) и маркер, TCR бета (b). Последовательности используемых 3'-праймеров представлены в таблице 10. Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны. См. фиг. 44.
Пример 49: Тестирование специфичных для гена праймеров для мышиных генов вариабельного участка
[00594] Выполняли 1-ую и 2-ую PCR, продукты прогоняли на 2% агарозном геле и визуализировали. Дорожки представляют слева: маркер, легкие цепи каппа, лямбда, лямбда, лямбда, лямбда и тяжелую цепь мю (а). 4 дорожки лямбда представляли такую комбинацию используемых праймеров: mouse_lambda_GSPla с mouselambda GSP2a, mouselambdaGSPla с mouselambda GSP2b, mouselambdaGSPlb с mouse lambda GSP2a и mouselambdaGSPlb с mouse lambda GSP2a. Маркер и тяжелая цепь альфа (b). Тяжелые цепи gammal, 2а, 2с со 2-ой PCR с использованием mo_gl2_GSP2d и mo_gl2_GSP2e, соответственно, маркер (с). 3 тяжелых цепи гамма со 2-ой PCR с использованием mo_g3_GSP2d, mo_g3_GSP2e, соответственно, за которыми следует тяжелая цепь гамма 2b со 2-ой PCR с использованием mo_g2b_GSP2d, mo_g2b_GSP2e, соответственно, за которыми следует маркер (d). Маркер, TCR альфа (е). Маркер, TCR бета (f). Белые полоски между дорожками на одной фотографии геля показывают, где нехарактерные дорожки в промежутке были обрезаны. См. фиг. 45 и таблицу 11.
Пример 50: Образование связанных пар тяжелой и легкой цепей антитела со штрих-кодом на одном конце
[00595] Как показано на фиг. 1, индивидуальные В-клетки можно отсортировывать с помощью проточной цитометрии из крови, массы мононуклеарных клеток периферической крови (РВМС), массы В-клеток, плазмобластов, плазматических клеток, В-клеток памяти или других популяций В-клеток. В-клетки отсортировывали по отдельной клетке в 96-луночных планшетах для PCR, оставляя одну колонку лунок пустой в качестве отрицательного контроля. На фиг. 17 описывается общая методика для способа, который может быть использован для связывания двух представляющих интерес полинуклеотидных последовательностей и добавления штрих-кода на одном конце.
[00596] Отдельную стадию мультиплексной перекрывающей RT-PCR можно выполнять с использованием коммерчески доступного набора для одностадийной RT-PCR (например, набора для одностадийной RT-PCR Qiagen) согласно рекомендациям изготовителя. Согласно этому конкретному примеру реакцию синтеза полинуклеотида, такую как реакция обратной транскрипции, использовали для создания матриц кДНК из образца mRNA. Согласно фиг. 17 прямой специфичный для гена праймер для RT-PCR-реакции содержит сайт фермента рестрикции (RE1), сайт секвенирующего праймера и штрих-код для добавления этих элементов к первой представляющей интерес кДНК. Два дополнительных праймера (показанных как содержащие RE3) содержат комплементарные перекрывающие/удлиненные хвосты. Применение этих праймеров в PCR-реакции дает в результате две представляющие интерес кДНК, несущие перекрывающие/удлиненные хвосты, которые обеспечивают отжиг и связывание двух представляющих интерес кДНК в ходе амплификации. В примере показано, что будет образовываться продукт с указанной структурой, в котором цепи LC и НС физически связаны со штрих-кодами на одном конце.
[00597] Сайты рестрикции RE1 и RE2 можно использовать для клонирования продукта PCR в приемлемых векторах для секвенирования.
Пример 51: Образование связанных пар тяжелой и легкой цепей антитела с внутренним штрих-кодом
[00598] Как показано на фиг. 1, индивидуальные В-клетки можно отсортировывать с помощью проточной цитометрии из крови, массы мононуклеарных клеток периферической крови (РВМС), массы В-клеток, плазмобластов, плазматических клеток, В-клеток памяти или других популяций В-клеток. В-клетки отсортировывали по отдельной клетке в 96-луночных планшетах для PCR, оставляя одну колонку лунок пустой в качестве отрицательного контроля. На фиг. 18 описывается общая методика для способа, который может быть использован для связывания двух представляющих интерес полинуклеотидных последовательностей и добавления штрих-кода между ними. Праймеры и олигонуклеотиды, которые можно использовать для тяжелой и легкой цепей антитела, показаны в таблице 30. Сайты рестрикции AsiSI и Pac1 встраивали в олигонуклеотиды RT. Последовательности ID образца показаны в таблице 2.
[00599] Показанный на фиг. 18 способ основан на присоединяющей 3'-хвост и переключающей матрицу активностях обратной транскриптазы в ходе реакции синтеза кДНК. Добавленный к синтезированной кДНК З'-С-хвост можно использовать для отжига адаптерной молекулы, несущей перекрывающую/удлиненную последовательность и штрих-код. Два типа адаптерных молекул использовали для связывания двух кДНК. Первый адаптер, несущий перекрывающую/удлиненную и штрих-кодированную последовательности, добавляли к первой кДНК. Второй адаптер, несущий обратную комплементарную последовательность перекрывающей/удлиненной последовательности без штрих-кода, добавляли ко второй кДНК. Переключающее матрицу свойство обратной транскриптазы обеспечивает добавление этих последовательностей на 3'-концы их соответствующих кДНК.
[00600] При PCR-реакции, показанной на фиг. 18, комплементарные перекрывающие/удлиненные последовательности выравнивали и синтезировали соответствующие нити ДНК из сайта отжига. Последовательные циклы PCR с использованием внешних праймеров дают в результате амплификацию связанных молекул кДНК.
[00601] Посредством добавления подходящих сайтов рестрикции и добавления сайтов секвенирующих праймеров, встроенных в праймеры для реакции амплификации, или позже путем лигирования продукты PCR можно клонировать в приемлемые векторы для секвенирования.
Пример 52: Образование связанных пар тяжелой и легкой цепей антитела с двумя внутренними штрих-кодами с использованием перекрывающих/удлиненных праймеров универсальной последовательности
[00602] Как показано на фиг. 1, индивидуальные В-клетки можно отсортировывать с помощью проточной цитометрии из крови, массы мононуклеарных клеток периферической крови (РВМС), массы В-клеток, плазмобластов, плазматических клеток, В-клеток памяти или других популяций В-клеток. В-клетки отсортировывали по отдельной клетке в 96-луночных планшетах для PCR, оставляя одну колонку лунок пустой в качестве отрицательного контроля. На фиг. 19 описывается общая методика для способа, который может быть использован для введения двух внутренних штрих-кодов между двумя представляющими интерес связанными полинуклеотидами. Праймеры и олигонуклеотиды, которые можно использовать для тяжелой и легкой цепей антитела, показаны в таблице 31. Сайты рестрикции AsiSI и Pac1 встраивали в олигонуклеотиды RT. Последовательности ID образца показаны в таблице 2.
[00603] Показанный на фиг. 19 способ основан на присоединяющей 3'-хвост и переключающей матрицу активностях обратной транскриптазы в ходе реакции синтеза кДНК. В этом примере добавленный к oligo(dT) праймированной кДНК 3'-С-хвост можно использовать для отжига адаптерной молекулы, несущей универсальную последовательность и штрих-код, с каждой из кДНК, подлежащих присоединению. Переключающее матрицу свойство обратной транскриптазы обеспечивает добавление этих последовательностей на 3'-концы их соответствующих кДНК. Последующая перекрывающая/удлиняющая PCR с использованием праймеров к универсальной последовательности, которые несут комплементарные перекрывающие/удлиненные последовательности, в комбинация с внешними специфичными для LC и НС праймерами дает в результате структуру, в которой LC связывается с НС двумя внутренними штрих-кодами между ними, как показано на фиг. 19.
[00604] Посредством добавления подходящих сайтов рестрикции и добавления сайтов секвенирующих праймеров, встроенных в праймеры для реакции амплификации, или позже путем лигирования продукты PCR можно клонировать в приемлемые векторы для секвенирования.
Пример 53: Образование связанных пар тяжелой и легкой цепей антитела с двумя внутренними штрих-кодами с использованием перекрывающих/удлиненных адаптеров
[00605] Как показано на фиг. 1, индивидуальные В-клетки можно отсортировывать с помощью проточной цитометрии из крови, массы мононуклеарных клеток периферической крови (РВМС), массы В-клеток, плазмобластов, плазматических клеток, В-клеток памяти или других популяций В-клеток. В-клетки отсортировывали по отдельной клетке в 96-луночных планшетах для PCR, оставляя одну колонку лунок пустой в качестве отрицательного контроля. На фиг. 20 описывается общая методика для другого способа, который может быть использован для введения двух внутренних штрих-кодов между двумя представляющими интерес связанными полинуклеотидами. Праймеры и олигонуклеотиды, которые можно использовать для тяжелой и легкой цепей антитела, показаны в таблице 32. Сайты рестрикции AsiSI и Pac1 встраивали в олигонуклеотиды RT. Последовательности ID образца показаны в таблице 2.
[00606] Показанный на фиг. 20 способ основан на присоединяющей 3'-хвост и переключающей матрицу активностях обратной транскриптазы в ходе реакции синтеза кДНК. В этом примере добавленный к кДНК, синтезированной с использованием специфичных для гена праймеров, 3'-С-хвост можно использовать для отжига адаптерной молекулы, несущей самокомплементарные или палиндромные перекрывающие/удлиненные последовательности и штрих-код, с каждой из кДНК, подлежащих присоединению. Переключающее матрицу свойство обратной транскриптазы обеспечивает добавление этих последовательностей на 3'-концы их соответствующих кДНК. Последующий отжиг перекрывающих/удлиненных последовательностей, добавленных к кДНК LC и НС, связывает их вместе в сайте перекрывания. Перекрывающая PCR с использованием внешних праймеров к LC и НС дает в результате структуру, в которой LC связывается с НС двумя внутренними штрих-кодами между ними, как показано на фиг. 20.
[00607] Посредством добавления подходящих сайтов рестрикции и добавления сайтов секвенирующих праймеров, встроенных в праймеры для реакции амплификации, или позже путем лигирования продукты PCR можно клонировать в приемлемые векторы для секвенирования.
Пример 54: Исследования с различными способами добавления штрих-кодов
[00608] Авторы настоящего изобретения исследовали ряд способов, посредством которых штрих-кодированные последовательности можно добавлять в ходе обратной транскрипции или реакции амплификации с использованием олигонуклеотида, содержащего штрих-кодированную последовательность. Авторы настоящего изобретения тестировали добавление штрих-кодов путем встраивания их в специфичные для гена праймеры (GSP) и в олигонуклеотиды, содержащие один или несколько G, которые можно добавлять на 3'-конец кДНК с помощью переключения матрицы. На основе литературы и полученных авторами настоящего изобретения научных фактов предполагали возможность эффективного штрих-кодирования кДНК с использованием либо 5'-штрих-кодированных олигонуклеотидов, или 3'-штрих-кодированых GSP.
[00609] Как показано на фиг. 21, RT выполняли с 1 мкг общей РНК РВМС и 0,5 мкМ univ_seq_2 переключающей матрицу oligo и 0,1 мкМ GSP IgKC_v3 (дорожки 1-2) и GSP IgLC_v5 (дорожки 3-4) с добавленной 5'-фланкирующей последовательностью, первая часть которой представляет собой последовательность Fixed_PCR3, а последние 8 пар оснований ААСААТАС являются штрих-кодом. Продукты RT-реакции очищали с использованием NucleoTraPCR (Macherey-Nagel) и растворяли в окончательном объеме 50 мкл. 2 мкл этой реакционной смеси использовали в каждой последующей PCR-реакции либо с внутренним 5'-праймером Vk (дорожка 1) или Vl (дорожка 3), либо с Univ_seq_2 (дорожки 2 и 4) в качестве 5'-праймера и с Fixed_PCR3 в качестве 3'-праймера. Следует отметить, что праймер Vk является специфичным для генов V каппа 1 и 2, а праймер Vl является специфичным для гена V лямбда 2. Последовательности представлены в таблице 33. Как можно видеть, продукты PCR в дорожках 2 и 4 прогоняли в виде пятна. Наоборот, внутренние 5'-праймеры давали отличающиеся полосы (дорожки 1 и 3), что показывает, что праймерные пары действительно работают, и что «размазывание», показанное на дорожках 1 и 3, не может быть отнесено к плохо сконструированным праймерам. Когда олигонуклеотид добавляется ко всем полноразмерным обратно транскрибированным последовательностям кДНК, тогда в ходе PCR-амплификация с univ_seq_2 и 3'-штрих-кодированными GSP получается пятно, это говорит о том, что обратная транскрипция со штрих-кодированными GSP дает в результате неспецифично праймированные последовательности нуклеиновой кислоты при RT-реакции. Результаты в соответствии с настоящим изобретением говорят о том, что применение 5'-адаптеров универсальных последовательностей и 3'-штрих-кодированных праймеров не является хорошей стратегией для штрих-кодирования и специфичной амплификации генов иммуноглобулина или других генов, экспрессированных В-клеткой или другой клеткой.
[00610] Ретроспективно некоторые биологические свойства ДНК и используемые молекулярные реакции, вероятно, способствовали наблюдениям в соответствии с настоящим изобретением. Обратную транскрипцию, как правило, выполняли при низких температурах, таких как 42°С или 56°С. В отличие от PCR, при которой стадию отжига, как правило, выполняли при температуре едва ниже Тm праймеров для обеспечения праймирующей специфичности, этого нельзя было делать при обратной транскрипции, поскольку обратные транскриптазы становятся инактивированными при высоких температурах. Поэтому специфичные для гена праймеры, используемые при RT, как правило, не являются высоко специфичными для представляющего интерес гена, поскольку реакция протекает при температуре, много ниже Тm праймера. В такой ситуации праймер также может связываться с нецелевыми последовательностями mRNA с некоторыми несовпадениями, и возникает ошибка. Если к GSP добавляется штрих-код, праймер также должен содержать фиксированную последовательность 5' относительно штрих-кода для применения в последующей PCR. От этого праймер становится очень длинным (~60 нуклеотидов), в результате чего праймер характеризуется даже еще более высокой степенью ошибочного праймирования. Однако специфичная амплификация в ходе PCR, как правило, все же может быть осуществлена с использованием высоко специфичного для гена прямого праймера, при условии, что один член праймерной пары является специфичным, амплификация, как правило, будет специфичной, как показано на дорожках 1 и 3.
[00611] Если для добавления адаптера использовали методику переключения матрицы, то этот адаптер добавлялся ко всем mRNA, которые синтезировали для образования первой нити кДНК. Как упоминается выше, штрих-кодированные GSP будут характеризоваться значительным числом ошибочных праймирований, особенно когда фермент Superscript III RT теряет совою переключающую матрицу активность при 56°С, а обратная транскрипция протекает при 42°С. Специфичные гнездовые 5'- или 3'-праймеры нельзя использовать, поскольку они либо будут терять способность к PCR-амплификации всех генов иммуноглобулина (таким образом, приходится прибегать к мультиплексной PCR с множеством вырожденных 5'-праймеров из-за вариабельных генов V), либо будут терять еще и 3'-штрих-код.
Поэтому штрих-кодированные GSP не приемлемы для применения с переключающими матрицу добавленными адаптерами или с какими-либо другими 5'-адаптерами, поскольку с помощью других способов добавления 5'-адаптеров, таких как присоединение TdT-хвоста или клонирование с тупыми концами, адаптеры также недискриминированно добавляются. Поэтому также требуются внутренние 3'-праймеры или стратегия гнездовой или полугнездовой PCR-амплификации, а штрих-кодированные 3'-GSP не позволяют использовать эти стратегии для специфичной амплификации генов из В-клетки или другой клетки. На основании результатов, полученных в соответствии с настоящим изобретением, также можно предположить, что штрих-кодированные oligo(dT) тоже будут плохо работать по многим из тех же причин, поэтому предполагали, что плохо будут работать и штрих-кодированные GSP. Эти причины включают без ограничения невозможность применения внутренних 3'-праймеров или стратегии гнездовой или полугнездовой PCR для специфичной амплификации генов из В-клетки или другой клетки.
[00612] Напротив, результаты в соответствии с настоящим изобретением (см. другие примеры) демонстрировали преимущество добавления штрих-кодированной последовательности в ходе реакции обратной транскрипции с использованием содержащего штрих-кодированную последовательность праймера и адаптера, который отжигается с 3'-хвостом образованной в ходе реакции обратной транскрипции кДНК. Согласно такому варианту осуществления адаптерная последовательность может содержать штрих-кодированную последовательность и может использоваться для метки генов, кодирующих тяжелую и легкую цепи антитела. Таким образом, как раскрыто в настоящем документе, с помощью переключения матрицы или каких-либо других способов присоединения хвоста к кДНК добавляется последовательность, которую можно использовать для PCR-амплификации без предварительно полученной информации о самих 5'-последовательностях, что обеспечивает эффективное и объективное представление репертуара антител. Кроме того, этот подход обеспечивает получение репертуара других совместно экспрессированных генов, кодирующих белки вдобавок к антителам. Кроме того, подход с использованием переключающих матрицу адаптеров обладает явными преимуществами над раскрытыми в уровне техники способами, при которых применяют наборы вырожденных прямых праймеров для амплификации нескольких генов V. Этими способами также невозможно захватывать весь репертуар антител, поскольку известные наборы 5'-праймеров: а) покрывают почти, но не весь, репертуарный набор; b) не способны покрывать только известные на данный момент варианты генов V (полиморфизмы) в человеческой популяция и с) могут быть неспособными эффективно амплифицировать последовательности антитела, которые были подвергнуты обширной соматической гипермутации (SHM). См., например, Scheid et al., Sciencexpress, 14 July 2011, для примера эффекта SHM.
[00613] Следовательно, применение переключающих матрицу адаптеров для получения библиотек экспрессированных генов, например, тяжелой и легкой цепей антитела, обеспечивает явные преимущества над другими известными в уровне техники способами, благодаря обеспечению объективного представления семейств конкретных генов и других совместно экспрессированных генов. Применение переключающих матрицу адаптеров или 5'-адаптеров, добавленных с использованием любых других способов, таких как без ограничения присоединение TdT-хвоста и лигирование тупых концов, также являются более совместимыми с применением штрих-кодированных 5'-адаптеров, а не штрих-кодированных 3'-GSP или штрих-кодированных oligo(dT) по обсуждаемым выше причинам.
Пример 55: Сортировка плазмобластов с помощью прямого светорассеяния и/или бокового светорассеяния на проточном цитометре и/или совместно с другими маркерами клеточной поверхности
[00614] Плазмобласты представляют собой бластоподобные В-клетки, которые являются активированными, пролиферировавшими/пролиферирующими и подвергались созреванию аффинности. Плазмобласты выполняют активную иммунную реакцию и при осуществлении способов и композиций в соответствии с настоящим документом обеспечивают биоинформатическую конструкцию эволюционных деревьев с клональными семействами антител, которые связываются с целевыми представляющими интерес антигенами, являются ли те инфекцией, вакциной, аутоиммунными или раковыми антигенами.
[00615] Плазмобласты представляют собой бластоподобные В-клетки и больше находящихся в покое В-клеток (фиг. 40А-В). Поэтому их можно отсортировывать на проточном цитометре с использованием их свойств прямого и бокового светорассеяния. Как показано на фиг. 40с, плазмобласты характеризуются средним FSC-A, который в -1,29-1,66 раза больше среднего FSC-A других CD20+ В-клеток, со средним FSC-W, который в 1,04-1,16 раза больше такового находящихся в покое CD20+ В-клеток. Плазмобласты также характеризуются средним FSC-A, который составляет 0,85-0,98 такового моноцитов, и средним FSC-W, составляющим 0,92-1,02 такового моноцитов, как определяли путем 95% доверительного интервала. В данном случае FSC-A и FSC-H могут быть равнозначными и эквивалентными, тогда как FSC-A и FSC-H дифференцируются на калиброванных проточных цитометрах для получения тех же значений. Подобно SSC-A (и SSC-H, вследствие дифференциации) и SSC-W, плазмобласты характеризуются средним SSC-A, составляющим 0,74-2,56 такового у CD20+ В-клеток и 0,21-0,84 такового у моноцитов, и средним SSC-W, составляющим 1,01-1,20 такового у CD20+ В-клеток и 0,82-1,03 такового у моноцитов. Отношение плазмобластов к В-клеткам является типичным и для лимфоцитов, поскольку находящейся в покое лимфоциты имеют подобный размер.
[00616] Альтернативный подход для идентификации плазмобластов заключается в применении 20-ого процентиля FSC или SSC плазмобластов к среднему FSC или SSC у CD20+ В-клеток или моноцитов (фиг. 44D), составляющего 1,04-1,50 (1,02-1,11) такового среднего FSC-A (FSC-W) для CD20+ В-клеток и 0,70-0,88 (0,88-1,00) такового для моноцитов. Плазмобласты характеризуются 20-ым процентилем SSC-A (SSC-W), составляющим 0,67-1,89 (0,99-1,11) такового среднего SSC-A (SSC-W) для CD20+ В-клеток и 0,20-0,62 (0,77-0,99) для моноцитов. Эти значения обеспечивают границу пропускания с включением 80% плазмобластов и исключением других лимфоцитов. Это позволяет использовать FSC (и/или SSC) совместно с одно- или двухцветными красителями для гейтирования плазмобластов при сортировке их по отдельной клетке. Такие комбинации могут содержать FSChiCD19lo (фиг. 39b), CD19+FSChi (фиг. 39с), CD19+FSChiCD20- (фиг. 39d), CD19+FSChiCD38hi (фиг. 39е) и CD19+FSChiCD27+ (фиг. 39f). Затем отсортированные клетки можно подвергать RT, PCR для штрих-кодирования при выполнении их согласно разделу «Отличная от touchdown PCR» в «Материалах и способах». Дальнейшую подготовку к секвенированию, клонированию и экспрессии осуществляли, как в примерах 6 и 8. Следует отметить, что для данных отношений доверительный интервал составляет 95%, или при этом 95% отношений должны попадать в этот диапазон.
Пример 56: Сортировка плазмобластов по размеру на каком-либо просеивающем устройстве, таком как микроструйное устройство
[00617] Плазмобласты представляют собой бластоподобные В-клетки, которые являются активированными, пролиферировавшими/пролиферирующими и подвергались созреванию аффинности. Плазмобласты выполняют активную иммунную реакцию и при осуществлении способов и композиций в соответствии с настоящим документом обеспечивают биоинформатическую конструкцию эволюционных деревьев с клональными семействами антител, которые связываются с целевыми представляющими интерес антигенами, являются ли те инфекцией, вакциной, аутоиммунными или раковыми антигенами.
[00618] Плазмобласты представляют собой бластоподобные В-клетки и больше находящихся в покое В-клеток. Плазмобласты и CD20+ В-клетки отсортировывали по FACS и окрашивали триптановым синим для исключения мертвых клеток и для визуализации при увеличении в 200 раз. Визуализировали 52 плазмобласта и 51 CD20+ В-клетку и измеряли площадь клеток с помощью ImageJ. Визуализированные плазмобласты характеризовались диаметром 7,8-13 мкм и площадью 48-121 мкм, а также объемом 251-996 мкм. CD20 В-клетки не являются бластоподобными и меньше по размеру, большинство из них характеризовались диаметром 6-8 мкм, или площадью менее 50 мкм, или объемом менее 268 мкм, и только 4 клетки из 51 были больше таковых (фиг. 41). С помощью любого просеивающего устройства, которое может отделять клетки больше или меньше 8 мкм в диаметре, или 50 мкм2 по площади, или 268 мкм3 по объему, можно отделять плазмобласты от находящихся в покое CD20+ В-клеток с 96% захваченных плазмобластов и отсеивать 92% находящихся в покое В-клеток. Таким устройством может быть мелкое сито с диаметром отверстий 8 мкм или микроструйное устройство с каналами, которые не пропускают клетки более 8 мкм в диаметре, или 50 мкм2 по площади, или 268 мкм по объему. Затем эти клетки можно отсортировывать с помощью приводов/насосов микроструйного устройства в лунки так, что в лунке будет только 1 или несколько клеток, а затем можно выполнять RT, PCR для штрих-кодирования согласно разделу «Отличная от touchdown PCR» в «Материалах и способах» с использованием тех же концентраций реагентов. Дальнейшую подготовку к секвенированию, клонированию и экспрессии осуществляли, как в примерах 6 и 8.
Пример 57: Усиление антителами против Staphylococcus aureus фагоцитоза S. aureus линией нейтрофильных клеток
[00619] Людей с вызванными S. aureus инфекциями, поддерживающих эффективные иммунные реакции против вызванной S. aureus инфекции, например, людей, очистившихся от S. aureus без потребности в антибиотической терапии, использовали как источники периферической крови, из которой окрашивали и отсортировывали плазмобласты периферической крови. Плазмобласты отсортировывали по отдельной клетке и штрих-кодировали, как подробно изложено в разделе «Отличная от touchdown PCR» в «Материалах и способах», и готовили для секвенирования, как подробно изложено в разделе «Подготовка секвенирования по технологии 454 XLR70» в «Материалах и способах». Биоинформатически строили эволюционные деревья и несколько отобранных представителей из каждого клонального семейства отбирали и клонировали для экспрессии как рекомбинантные антитела, как в примере 8. Штамм Wood S. aureus, который на -5% положительный по белку А, высевали на 5% триптиказо-соевый (ТСА) кровяной агар, выращивали колонию и держали при 4°С как маточный материал. Этот маточный материал еженедельно пересевали пикированием другой колонии. Использовали 1 мл этого маточного материала для инокуляции S. aureus, растущего до OD550 = 0,5, что представляет приблизительно среднюю логарифмическую фазу роста. S. aureus слегка фиксировали в 4% параформальдегиде (PFA) в течение 15 минут при комнатной температуре и промывали один раз сбалансированным солевым раствором Хенкса (HBSS) перед окрашиванием 1 мкМ CFSE в течение 15 минут при комнатной температуре. Затем фиксированные бактерии промывали и инкубировали с 10 мкг/мл экспрессированных рекомбинантных антител против S. aureus или с 10 мкг/мл экспрессированных антител против вируса гриппа в качестве отрицательного контроля. Затем бактерии дважды промывали. Линию нейтрофильных клеток HL-60 активировали в течение 96 часов 25 мкМ ретиноевой кислоты и инкубировали с мечеными, фиксированными бактериями при 1:1 - 1:100 в течение 45 минут при 37°С с осторожным взбалтыванием при 300 оборотах в минуту в 96-луночных планшетах. Затем HL-60 дважды промывали и анализировали на проточном цитометре. Количество мечения CFSE в HL-60 показывает количество фагоцитозированных S. aureus. Некоторое количество экспрессированных антител против S. aureus будет связываться с белками клеточной поверхности стафилококка и опсонировать бактерии, что приведет к усиленному фагоцитозу.
Пример 58: Усиление антителами против Staphylococcus aureus опосредованного нейтрофилами уничтожения S. aureus
[00620] Людей, способных эффективно контролировать у себя вызванные S. aureus инфекции и/или очищаться от вызванных S. aureus инфекций, отбирали, как в соответствующем вышеприведенном примере, а плазмобласты выделяли и отсортировывали по отдельным клеткам для секвенирования, клонирования и экспрессии, как в соответствующем вышеприведенном примере. Клинический изолят S. aureus высевали на 5% ТСА кровяной агар, выращивали колонию и держали при 4°С как маточный материал. Этот маточный материал еженедельно пересевали пикированием другой колонии. Использовали 1 мл этого маточного материала для инокуляции S. aureus, растущей до OD550 = 0,5, что представляет приблизительно среднюю логарифмическую фазу роста. Затем S. aureus инкубировали с 2 мкг/мл экспрессированных антител против S. aureus в течение 30 минут при 4°С перед двухкратной промывкой. Нейтрофильные клетки HL-60 активировали в течение 96 часов 25 мкМ ретиноевой кислоты и инкубировали с комплементом крольчонка и S. aureus в отношении 1:1 - 1:100 в течение 45 минут при 37°С со взбалтыванием при 300 оборотах в минуту в 96-луночных планшетах. Затем клетки HL-60 быстро помещали на лед и промывали 3 раза для удаления слабо присоединенных S. aureus. Затем внеклеточные S. aureus серийно разбавляли, высевали на 5% TSA кровяной агар и культивировали в течение ночи при 37°С. На следующий день колонии подсчитывали для определения числа колониеобразующих единиц (CFU). Снижение CFU специфичными рекомбинантными антителами против S. aureus (после инкубации с S. aureus) демонстрирует, что эти антитела были эффективными в опосредовании усиленного фагоцитоза и уничтожения или понижения роста S. aureus клетками HL-60 (фиг. 46).
Пример 59: Лечение инфицированных Staphylococcus aureus мышей с использованием экспрессированных антител против S. aureus на мышиной модели
[00621] Антитела против S. areus, которые демонстрируют in vitro уничтожающую, снижающую рост или связывающую активность, как в примере 58, также могут обладать in vivo активностью. Антитела против S. aureus с уничтожающей активностью выделяли у инфицированных S. aureus людей, способных контролировать у себя стафилококковую инфекцию, как в примерах 55-58. Мышам давали летальную дозу S. aureus, а затем обрабатывали контрольным антителом или рекомбинантным антителом(ами) против S. aureus, демонстрирующим in vitro уничтожающую, снижающую рост или связывающую активность. Мышей рассматривали как защищенных, если они характеризовались более длительной выживаемостью или пониженной тяжестью инфекции, как определяли тестом выживаемости по методу Каплана-Мейера. Антитела против S. aureus, полученные от людей, контролирующих или снижающих у себя тяжесть вызванных S. aureus инфекций, тем самым оценивали по их способности обеспечивать пассивную защиту против S. aureus.
Пример 60: Применение антигенных целей эффективных иммунных реакций против Staphylococcus aureus для разработки вакцин
[00622] Антигены S. aureus, на которые нацеливаются антитела против S. aureus, проявляющие уничтожающую, снижающую рост или связывающую активность, являются хорошими кандидатами для вакцины S. aureus. Вакцинируемые, у которых развивается сильный ответ против этих специфичных антигенов, могут быть защищены от инфекции S. aureus или могут проявлять пониженную тяжесть таковой. Антитела против S. aureus с уничтожающей, снижающей рост или связывающей активностью выделяли у инфицированных S. aureus людей, способных контролировать у себя вызванную S. aureus инфекцию, и их целевые антигены идентифицировали с использованием масс-спектрометрии, как в примерах 55-58. Мышей либо вакцинировали имитированным вектором, либо вакцинировали кандидатными антигенами S. aureus, а затем бустировали дважды в течение двухмесячного периода.
Мышей можно было иммунизировать кандидатными антигенами S. aureus отдельно или в комбинации. Титр антител против антигена S. подтверждали с помощью ELISA. Затем мышей провоцировали летальной дозой S. aureus. Мышей рассматривали как защищенных, если они характеризовались более длительной выживаемостью, как определяли тестом выживаемости по методу Каплана-Мейера. Иммунизация против этих отобранных антигенов S. aureus, поэтому, обеспечивает защиту или снижает тяжесть инфекции, показывая, что композиции и способы в соответствии с настоящим документом могут служить для разработки вакцины.
Пример 61: Лечение инфицированных Staphylococcus aureus людей с использованием рекомбинантных антител против S. aureus с in vivo уничтожающей, снижающей рост или связывающей активностью у людей
[00623] Антитела, полученные от людей, способных контролировать у себя вызванную S. aureus инфекцию, и проявляющие in vitro и in vivo уничтожающую, снижающую рост или связывающую активность, как в примерах 55-59, можно было использовать для лечения инфицированных S. aureus больных. Антитела получали и тестировали на in vitro и in vivo уничтожающую активность, как в примерах 55-59. Изготовленные согласно Правилам организации производства и контроля качества (GMP) моноклональные антитела против S. aureus можно было вводить внутривенно или подкожно инфицированным S. aureus людям, особенно больным, инфицированным устойчивым к метициллину S. aureus (MRSA) или другими штаммами устойчивых к лекарственному средству S. aureus, и сравнивать с антибиотиками по эффективности. Антитела против S. aureus рассматривали как обладающие терапевтической значимостью, если больные были защищены от инвазивных вызванных S. aureus инфекций, характеризовались менее тяжелыми вызванными S. aureus инфекциями и/или выздоравливали быстрее, чем больные, получавшие антибиотики отдельно или не получавшие антибиотики. Рекомбинантные анитела против S. aureus можно давать терапевтически больным с активными вызванными S. aureus инфекциями для снижения тяжести инфекции и/или для усиления очищения от инфекции, а также профилактически группам пациентов с высоким риском, таким как пациенты на гемодиализе при почечной недостаточности, пациентам, поступившим в госпиталь или пациентам с положительным скринингом по S. aureus или MRSA.
Пример 62: Вакцинация против Staphylococcus aureus с использованием идентифицированных антигенов S. aureus для обеспечения защитного иммунитета у людей
[00624] Антигены S. aureus, на которые нацеливаются антитела против S. aureus, проявляющие уничтожающую или связывающую активность in vivo и при вакцинировании на мышиной модели обеспечивающие защиту против провокации S. aureus, могут быть хорошими кандидатами для профилактической вакцины у людей. Антитела против S. aureus получали у людей, способных контролировать у себя вызванные S. aureus инфекции, и клонировали, экспрессировали и тестировали по уничтожающей, снижающей рост или связывающей активности in vivo и как вакцины-кандидаты у мышей, как в примерах 55-58 и 59. Затем людям давали вакцину против S. aureus, содержащую антигены S. aureus, которые являются целями для антител против S. aureus с уничтожающей, снижающей рост или связывающей активностью, с плацебо в качестве контроля. Группы изучали по их заболеваемости или тяжести вызванных S. aureus инфекций. Вакцину рассматривали как успешную, если она снижала у вакцинированной группы заболеваемость или тяжесть вызванной S. aureus инфекции по сравнению с получавшей плацебо группой.
Пример 63: Мониторинг иммунных реакций, индуцированных кандидатными вакцинами против Staphylococcus aureus, как коррелят защиты
[00625] После иммунизации людей кандидатной вакциной против S. aureus, как в примере 62, ответ на вакцину можно было контролировать путем определения того, вызывала ли она устойчивые клональные семейства против представляющих интерес целевых антигенов S. aureus. Кровь забирали через 7-14 дней после вакцинации, плазмобласты отсортировывали по отдельной клетке, штрих-кодировали и секвенировали по технологии 454, как подробно изложено в разделах «Отличная от touchdown PCR» и «Подготовка к циклам секвенирования на 454 XLR70» в «Материалах и способах». Чертили эволюционные деревья, а затем 2-3 члена из каждого клонального семейства клонировали и экспрессировали, как в примере 8, и тестировали по их связыванию с представляющими интерес стафилококковыми антигенами с помощью ELISA. Ожидали, что люди с сильной индуцированной вакциной иммунной реакцией против S. aureus будут характеризоваться большими клональными семействами против целевых антигенов S. aureus при эффективных иммунных реакциях у людей. Такой подход обладает потенциалом обеспечения коррелята защиты для вакцины против S. aureus и при этом облегчает клинические испытания, а также оптимизирует разработку. Такой мониторинг антитела и/или иммунного репертуара TCR позволяет быстро оценить вероятность того, что кандидатная вакцина будет обеспечивать эффективность.
Пример 64: Лечение мышей с аденокарциномой легкого с использованием рекомбинантных антител против аденокарциномы легкого
[00626] Антитело против аденокарциномы легкого, которое связывается с белком клеточной поверхности или другими белками аденокарциномы легкого, можно использовать как носитель для целевых токсинов в клетки аденокарциномы легкого или для других целевых молекул, экспрессированных клетками аденокарциномы легкого. Антитела против аденокарциномы легкого с активностью связывания с клеточной поверхностью или другими антигенами аденокарциномы легкого выделяли у ракового больного(ых) с непрогрессирующей в течение длительного времени аденокарциномой легкого, как в примере 11. Голым мышам вводили подкожную инъекцию клеток линии аденокарциномы легкого H1650 и обеспечивали рост опухоли в течение одной недели. Затем конъюгировали антитело против аденокарциномы легкого с токсином, таким как дифтерийный токсин, лишенный R-домена, который является доменом связывания клетки и пускает дифтерийный токсин в клетку. Поэтому дифтерийный токсин, лишенный R-домена, является летальным только для клеток аденокарциномы легкого, с которыми связывается антитело и доставляет нагрузку дифтерийного токсина. Контрольное антитело, конъюгированное с дифтерийным токсином без R-домена, использовали в качестве контроля. Антитело против аденокарциномы легкого рассматривали как успешно доставившее свою нагрузку для уничтожения клеток аденокарциномы, если опухолевая нагрузка снижалась больше, чем в контроле. В качестве альтернативы, в определенных случаях рекомбинантное антитело само по себе могло быть способным опосредовать уничтожение опухолевой клетки или предотвращать рост опухолевой клетки (при отсутствии конъюгированного токсина).
Пример 65: Лечение больных с аденокарциномой легкого с использованием экспрессированного антитела против аденокарциномы легкого
[00627] Антитело против аденокарциномы легкого, которое связывается с антигеном клеточной поверхности, можно использовать как носитель для целевых токсинов в клетки аденокарциномы легкого. Антитела против аденокарциномы легкого с активностью связывания с клеточной поверхностью выделяли у ракового больного с непрогрессирующей в течение длительного времени аденокарциномой легкого, как в примере 11. Моноклональное антитело GMP или другие моноклональные антитела против аденокарциномы легкого можно вводить внутривенно или подкожно больным с аденокарциномой легкого, особенно пациентам, чьи биопсированные клетки аденокарциномы экспрессировали высокие уровни антигенов клеточной поверхности, на которые нацелено моноклональное антитело. Рекомбинантное моноклональное антитело(а) против антигена(ов) аденокарциномы легкого или другие члены клональных семейств, из которых их получали, можно использовать для иммуногистохимического окрашивания образцов биопсии аденокарциномы легкого отдельного больного для получения информации об уровнях экспрессии опухолевого антигена, и эту информацию можно использовать для определения вероятности ответа отдельного больного на терапию этим моноклональным антителом. Антитела против аденокарциномы легкого могут быть конъюгированы с токсином, таким как дифтерийный токсин, лишенный R-домена, который является доменом связывания клетки и пускает дифтерийный токсин в клетку. Поэтому дифтерийный токсин, лишенный R-домена, является летальным только для клеток аденокарциномы легкого, с которыми связывается антитело и доставляет нагрузку дифтерийного токсина. Стандартную химиотерапию использовали для лечения группы сравнения. Антитела против аденокарциномы легкого рассматривали как успешно доставившие свою нагрузку и обладающие терапевтической значимостью, если больные жили дольше, или проходило больше времени до рецидива или прогрессии. В качестве альтернативы, в определенных случаях рекомбинантное антитело само по себе могло быть способным опосредовать уничтожение опухолевой клетки или предотвращать рост опухолевой клетки (при отсутствии конъюгированного токсина).
Пример 66: Терапевтическая вакцинация против аденокарциномы легкого с использованием идентифицированных антигенов у людей
[00628] Антигены клеточной поверхности, связанные антителами против аденокарциномы легкого, можно использовать в терапевтической вакцине для лечения установленной аденокарциномы легкого или для защиты от ее развития. Антитела против аденокарциномы легкого с активностью связывания с клеточной поверхностью, выделяли у ракового больного(ых) с непрогрессирующей в течение длительного времени аденокарциномой легкого, как в примере 11, и идентифицировали целевой антиген с использованием иммунопреципитации или иммуноблоттинга и масс-спектром етрии. Вакцинируемым вводили либо вакцину, содержащую представляющий интерес антиген(ы) аденокарциномы легкого, либо контрольную вакцину. Затем за группами наблюдали и исследовали у них заболеваемость или развитие аденокарциномы легкого. Вакцину рассматривали как успешную, если люди, вакцинированные целевым антигеном, жили дольше, или продлевалось время до рецидива по сравнению с получавшей стандартное лечение группой сравнения.
Пример 67: Иммунологический мониторинг вакцинации против аденокарциномы легкого по эффективности ответа
[00629] После иммунизации людей вакциной против аденокарциномы легкого, как в примере 66, ответ на вакцину можно контролировать путем определения того, вызывала ли она устойчивые клональные семейства против представляющего интерес целевого антигена(ов) аденокарциномы в вакцине. Кровь забирали через 7-14 дней после вакцинации, плазмобласты отсортировывали по отдельной клетке, штрих-кодировали и выполняли секвенирование по технологии 454, как подробно изложено в разделах «Отличная от touchdown PCR» и «Подготовка к циклам секвенирования на 454 XLR70» в «Материалах и способах». Чертили эволюционные деревья, а затем 2-3 члена из каждого клонального семейства клонировали и экспрессировали, как в примере 8, а также тестировали по их связыванию с представляющими интерес стафилококковыми антигенами с помощью ELISA. Ожидали, что люди с сильной иммунной реакцией будут характеризоваться большими клональными семействами против представляющего интерес антигена(ов) аденокарциномы легкого и/или большим числом клональных семейств против представляющего интерес антигена(ов) аденокарциномы. Такой иммунологический мониторинг позволяет быстро прогнозировать эффективность кандидатной вакцины.
Пример 68. Применение Superscript III для переключения матрицы в ходе обратной транскрипции
[00630] В способах в соответствии с настоящим изобретением сигнальный участок образца и адаптерные участки добавляли в ходе обратной транскрипции. При этм использовали присоединяющую 3'-хвост активность и переключающую матрицу активность обратных транскриптаз-РНКазы Н-. Наиболее часто использовали обратную транскриптазу, такую как Superscript II (Invitrogen), при ее рабочей температуре 42°С. Обратные транскриптазы MMLV H-, которые также были сконструированы как термостойкие, такие как Superscript III, с рекомендованной рабочей температурой 50°С, как сообщалось, не обладают такой присоединяющей 3'-хвост активностью, и, поэтому, не способны переключать матрицу (http://tools.mvitrogen.com/content/sfs/ProductNotes/F_Superscript%20III%20Enzyme%20R D-MKT-TL-HL0506021.pdf?ProductNoteId=36). Однако на фиг. 42 показано, что Superscript III обладает присоединяющей 3'-хвост и переключающей матрицу активностью. Это свойство проявляется слабо при 50°С, рекомендованной температуре при обратной транскрипции для Superscript III, и может объяснять, почему о присоединяющей 3'-хвост активности Superscript III не сообщалось ранее. Однако присоединяющая 3'-хвост активность и переключение матрицы значительно снижается, поскольку температуру RT понижали от 50°С до 45,5°С и до 42°С. Предполагали, что все обратные транскриптазы-РНКазы H- MMLV, которые были сконструированы как термостойкие, также обладают присоединяющей 3'-хвост активностью при более низких рабочих температурах, т.е. от 42°С до 50°С.
Пример 69. Анализ совместно экспрессированных генов для идентификации антител, ассоциированных с реакциями В-клеток памяти и плазматических клеток, а также хоминга в определенные ткани
[00631] Штрих-кодирование всей кДНК, продуцированной В-клетками, Т-клетками или другими клетками, отсортированными в индивидуальные лунки, как описано способами и композициями в соответствии с настоящим документом, обеспечивает характеристику совместной экспрессии генов в плазмобластах, других В-клетках, Т-клетках и других клетках на уровне отдельной клетки. Это обеспечивает применение совместно экспрессированных генов для идентификации специфичных антител и TCR, экспрессированных В- и Т-клетками, которых индуцировали к дифференцировке в В-клетки памяти, плазматические клетки, Т-клетки памяти, специфичные типы эффекторных Т-клеток (например, Тh1, Th2, Тh17 или Т-регуляторные Т-клетки) или индуцировали к хомингу в определенную ткань или сайт (например, в желудочно-кишечный тракт, кожу или головной мозг). Штрих-кодирование всей кДНК, продуцированной индивидуальной клеткой или группой клеток в конкретном образце, обеспечивает применение дополнительных 3'-праймеров PCR и в 1-ой, и во 2-ой PCR для характеристики совместной экспрессии таких специфичных генов. 5'-Праймеры оставались теми же, поскольку их использовали для амплификации генов вариабельных участков. Кроме того, анализ совместно экспрессированных генов обеспечивал биоинформатический анализ взаимосвязей между созреванием аффинности клональных семейств и совместной экспрессией генов, ассоциированных с дифференцировкой В-клеток в В-клетки памяти, короткоживущие плазмобласты и долгоживущие плазматические клетки (таблица 34), с дифференцировкой наивных Т-клеток или Т-клеток памяти в регуляторные Т-клетки или Thl, Th2, Тh17 клетки (таблица 35), или с хомингом В- или Т-клеток в определенные сайты. Кроме того, такой анализ может точно определять критические антитела или TCR, опосредующие эффективную иммунную реакцию.
[00632] Например, РМВС, полученные у индивидуумов, поддерживающих иммунную реакцию, использовали для сортировки плазмобластов по отдельной клетке. Способы и композиции в соответствии с настоящим документом использовали для агализа совместной экспрессии генов, ассоциированных с хомингом плазмобластов в различные ткани (см. таблицу 36). С помощью биоинформатического анализа наборов данных идентифицировали антитела, ассоциированные с секрецией в различных местоположениях в организме. Затем такие гены антитела рекомбинантно экспрессировали для характеристики в in vitro скрининговых анализах, как в примере 8.
[00633] Специалистам в соответствующей области будет понятно, что в настоящем документе могут быть сделаны различные изменения в форме и деталях без отступления от идеи и объема различных аспектов настоящего изобретения.
[00634] Следует отметить, что, используемая в настоящем описании и в приложенной формуле изобретения форма единственного числа подразумевает ссылки во множественном числе, если в контексте четко не указано иное.
[00635] Все цитированные в настоящем описании ссылки, выданные патенты и заявки на выдачу патентов тем самым включены посредством ссылки во всей их полноте для всех целей.
** Последовательности праймеров разрабатывали приемлемыми для амплификации
всех различных константных вариантов генов, находящихся в базе данных IMGT
(http://imgt.cines.fr/).
ID
NO
ID
NO


ID
NO
AGGCCCCAGTGTGTTTCCCTTGGCACCCTCGAG
CAAGAGTACATCTGGAGGTACAGCTGCCTTGGG
CTGTTTGGTGAAAGACTATTTCCCCGAACCGGT
TACTGTCTCTTGGAATTCCGGGGCCCTCACCAG
TGGTGTCCATACCTTTCCCGCGGTGCTTCAGAG
TTCCGGTTTGTATTCCCTGTCAAGTGTCGTGACG
GTACCAAGTTCAAGTCTAGGCACCCAGACATAT
ATCTGTAACGTCAACCACAAGCCAAGCAACACC
AAGGTTGACAAGCGGGTTGAACCTAAGTCCTGT
GACAAGACCCATACCTGCCCCCCATGCCCCGCA
CCCGAGCTCCTCGGAGGGCCTTCCGTCTTTCTTT
TCCCTCCCAAACCCAAGGACACTTTGATGATCT
CAAGAACACCAGAAGTCACTTGCGTCGTGGTTG
ACGTGTCTCACGAAGATCCCGAAGTGAAGTTCA
ACTGGTACGTGGATGGGGTAGAGGTTCATAACG
CCAAGACCAAACCCCGAGAGGAACAGTATAAC
TCCACCTATAGGGTAGTGTCCGTGCTCACCGTG
CTCCACCAAGACTGGCTGAATGGCAAGGAATA
CAAGTGCAAGGTGAGTAATAAGGCACTGCCTG
CACCCATTGAGAAGACAATATCTAAAGCAAAG
GGACAGCCCAGAGAGCCCCAGGTTTATACTCTG
CCACCTAGCAGAGAGGAAATGACTAAAAACCA
GGTCAGCCTTACTTGTCTCGTAAAAGGCTTTTAT
CCAAGCGACATCGCTGTGGAGTGGGAATCAAA
TGGCCAACCTGAGAATAATTATAAGACTACACC
TCCCGTCCTTGACTCAGACGGTTCCTTCTTCCTG
TATAGCAAGCTCACCGTCGATAAAAGTCGGTGG
CAACAGGGAAACGTGTTCTCATGCAGCGTCATG
CACGAGGCCTTGCACAATCATTACACCCAGAAG
TCTCTGTCCCTGAGCCCTGGAAAGTGATCA
TCCTTCCGTGTTCATATTCCCCCCATCCGACGAG
CAGCTTAAATCTGGGACTGCTAGCGTCGTGTGC
CTGTTGAATAATTTTTATCCCCGGGAGGCTAAG
GTACAGTGGAAGGTGGACAACGCCCTCCAATC
AGGGAATTCCCAGGAGTCGGTCACCGAACAGG
ACAGCAAGGACTCAACCTACTCTCTGTCATCCA
CTCTCACACTCAGCAAAGCCGACTATGAAAAAC
ACAAAGTGTATGCTTGCGAGGTGACTCATCAAG
GGCTCTCCAGTCCTGTGACTAAATCCTTCAACC
GAGGCGAATGCTGATCA
AGCCGCACCCAGTGTGACCCTGTTTCCTCCCTC
CTCTGAAGAGCTCCAGGCAAACAAAGCTACTCT
GGTGTGTCTTATTAGCGATTTCTATCCCGGGGC
GGTGACCGTGGCTTGGAAGGCCGACTCGAGCCC
AGTGAAGGCCGGAGTGGAAACTACAACCCCTT
CCAAACAGTCAAACAATAAATACGCCGCTAGC
AGCTATCTCTCTCTCACCCCAGAACAGTGGAAA
TCCCACAGGTCCTATTCTTGCCAGGTCACACAC
GAGGGGTCAACCGTTGAGAAGACTGTTGCCCCA
ACAGAGTGCAGCTGATCA
24*01
ORF
24*01
ORF
23*01
ORF
23*01
ORF
24*01
ORF
23*01
ORF
23*01
ORF
Общие ссылки
Burbelo, P. D., S. К. Browne, et al. (2010). "Anti-cytokine autoantibodies are associated with opportunistic infection in patients with thymic neoplasia." Blood 116(23): 4848-4858.
Hua, J., K. Kirou, et al. (2006). "Functional assay of type I interferon in systemic lupus erythematosus plasma and association with anti-RNA binding protein autoantibodies." Arthritis Rheum 54(6): 1906-1916.
May, L. T., R. Neta, et al. (1993). "Antibodies chaperone circulating IL-6. Paradoxical effects of anti-IL-6 "neutralizing" antibodies in vivo." J Immunol 151(6): 3225-3236.
Mostbock, S. (2009). "Cytokine/Antibody complexes: an emerging class of immunostimulants." Curr Pharm Pes 15(7): 809-825.
Robinson, W. H., C. DiGennaro, et al. (2002). "Autoantigen microarrays for multiplex characterization of autoantibody responses." Nat Med 8(3): 295-301.
Watanabe, M., K. Uchida, et al. (2007). "Anti-cytokine autoantibodies are ubiquitous in healthy individuals." FEBS Lett 581(10): 2017-2021.
Wildbaum, G., M. A. Nahir, et al. (2003). "Beneficial autoimmunity to proinflammatory mediators restrains the consequences of self-destructive immunity." Immunity 19(5): 679-688.
Wrammert, J., K. Smith, et al. (2008). "Rapid cloning of high-affinity human monoclonal antibodies against influenza virus." Nature 453(7195): 667-671.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ амплификации нуклеиновых кислот тяжелой и легкой цепи человеческих иммуноглобулинов для создания рекомбинантных антител, композиции праймеров (варианты) | 2020 |
|
RU2775914C2 |
| ХИМЕРНЫЕ АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ХАРАКТЕРИЗУЮЩИХСЯ ОТЛОЖЕНИЕМ АМИЛОИДА | 2018 |
|
RU2746325C1 |
| КОНЪЮГАТЫ АФФИННАЯ МОЛЕКУЛА-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2763554C2 |
| ДИАГНОСТИКА И ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2550925C2 |
| СПОСОБЫ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ФИБРОЗА АНТАГОНИСТАМИ IL-21/IL-21R | 2006 |
|
RU2419450C2 |
| СЕКВЕНИРОВАНИЕ ПОЛИНУКЛЕОТИДНЫХ БИБЛИОТЕК С ВЫСОКОЙ ПРОПУСКНОЙ СПОСОБНОСТЬЮ И АНАЛИЗ ТРАНСКРИПТОМОВ | 2018 |
|
RU2790291C2 |
| КОНЪЮГАТЫ АФФИННАЯ ЧАСТЬ-ОЛИГОНУКЛЕОТИД И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2778754C2 |
| ЧЕЛОВЕЧЕСКОЕ ОПУХОЛЕСПЕЦИФИЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО | 2008 |
|
RU2488593C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ IL-17 И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2663721C1 |
| СПОСОБЫ ДИСКРЕТНОЙ АМПЛИФИКАЦИИ ПОЛНОГО ГЕНОМА | 2016 |
|
RU2736351C2 |
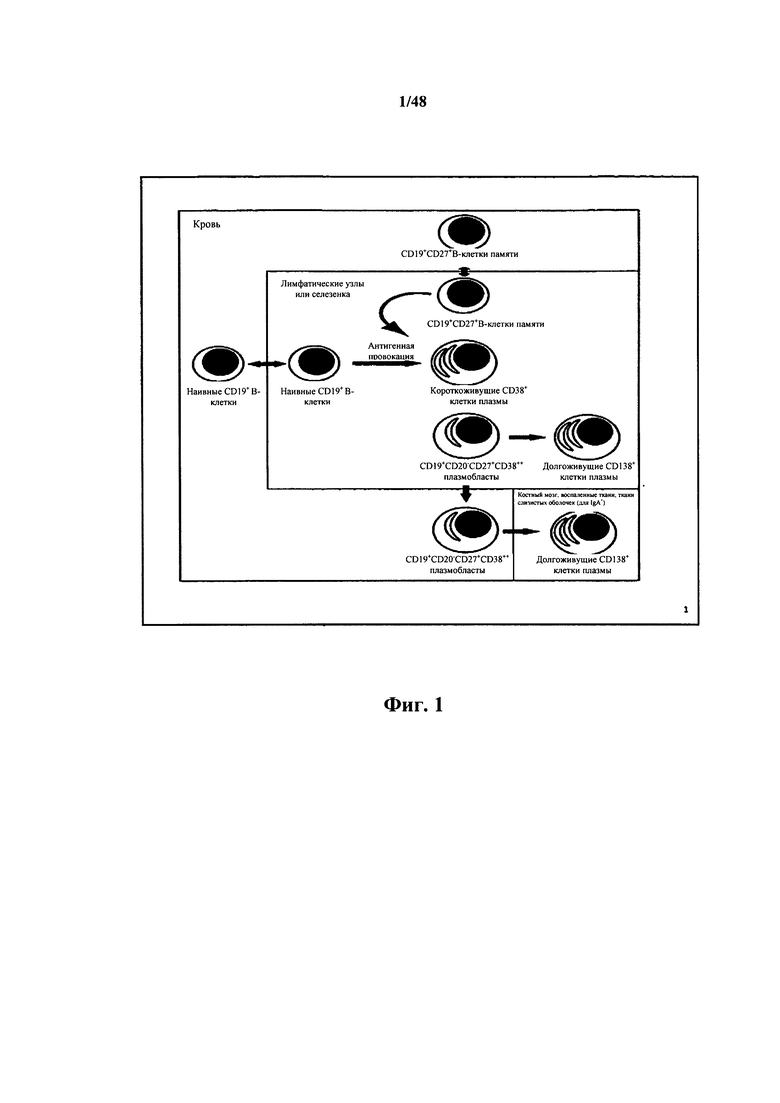
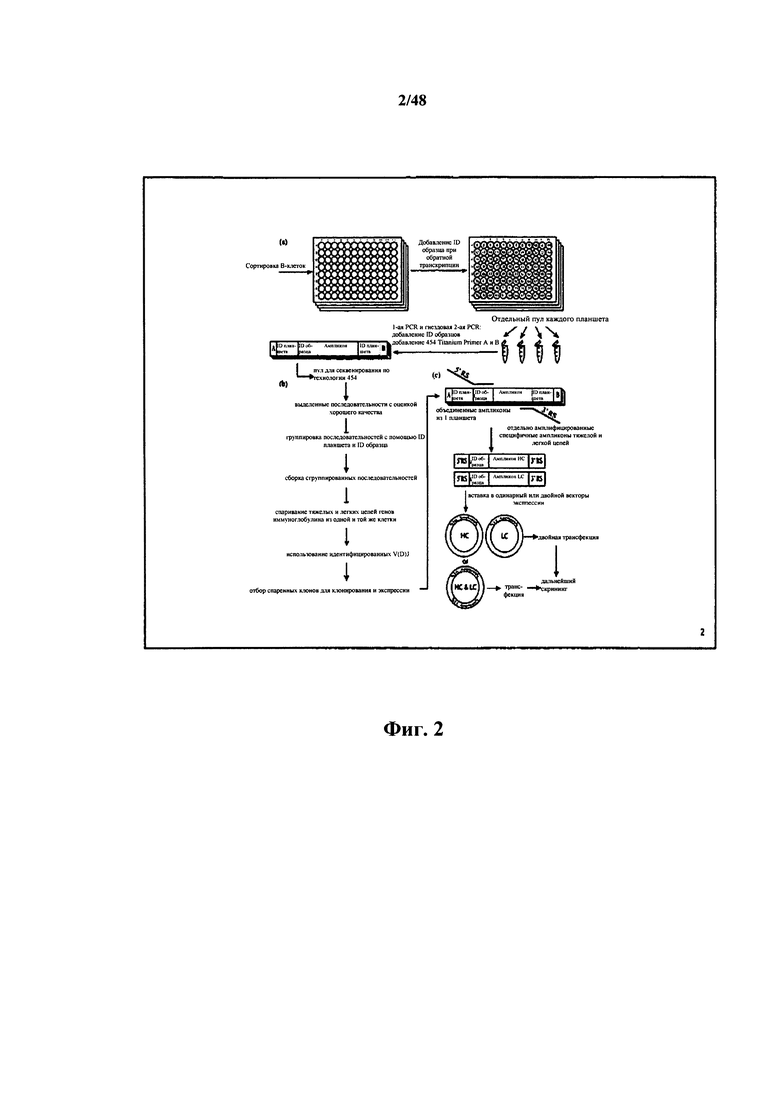

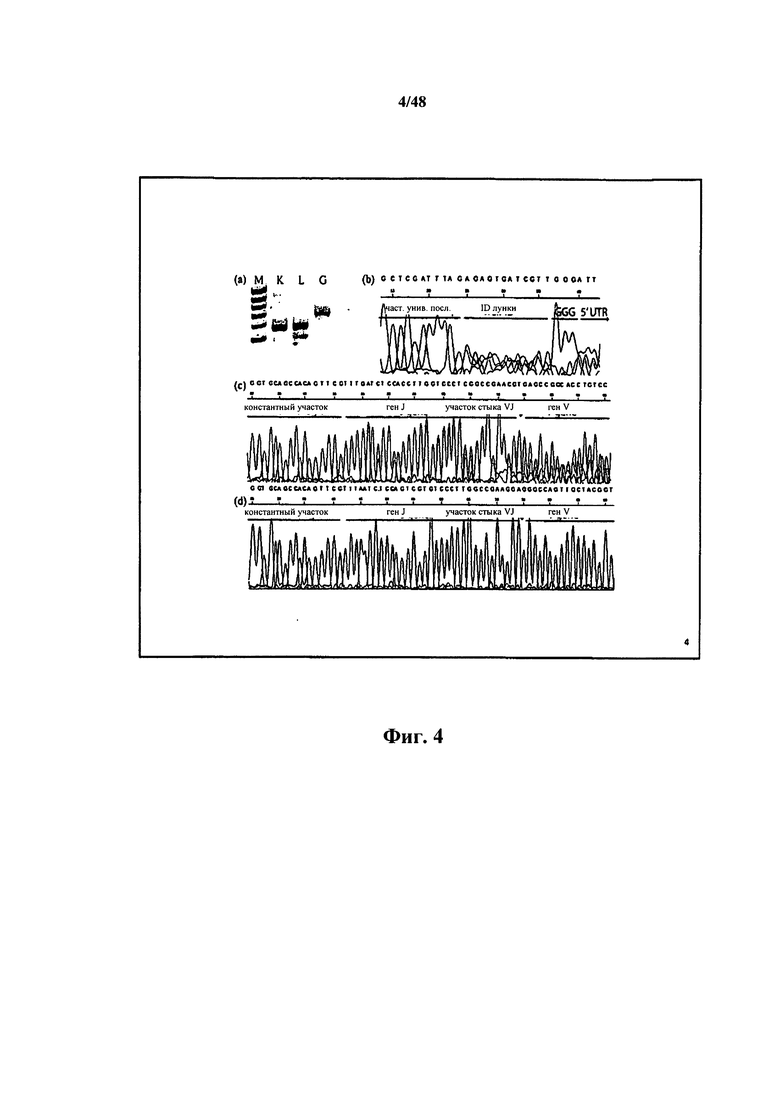
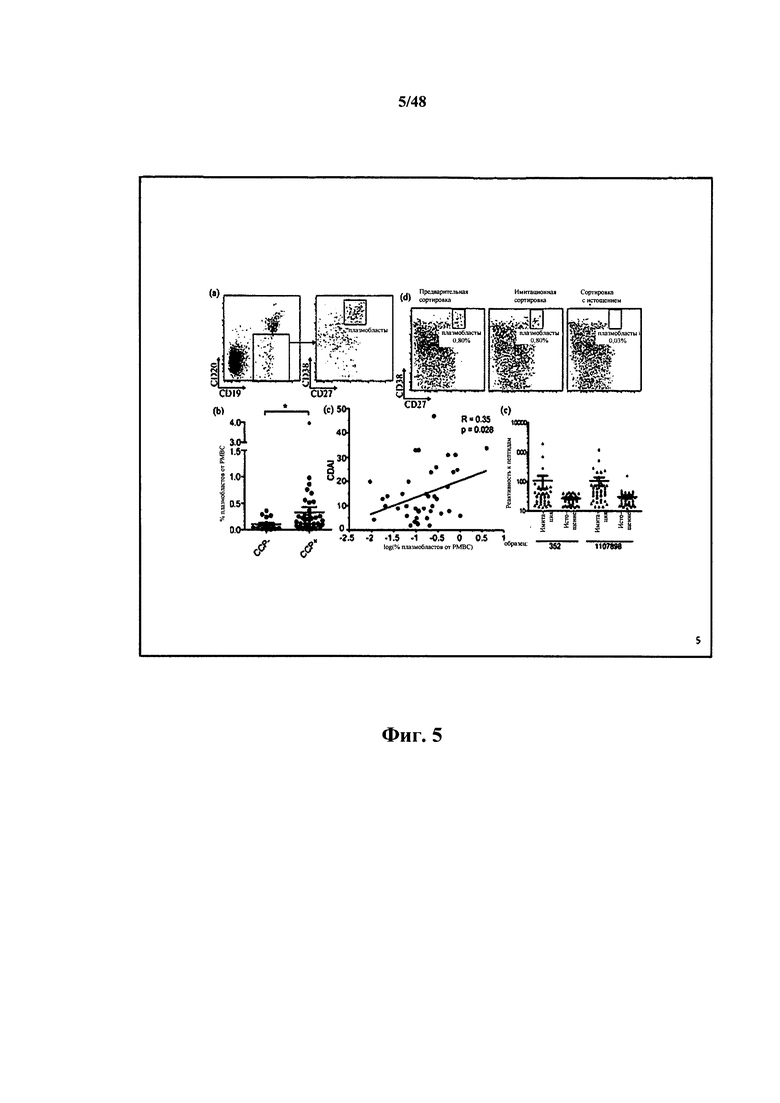
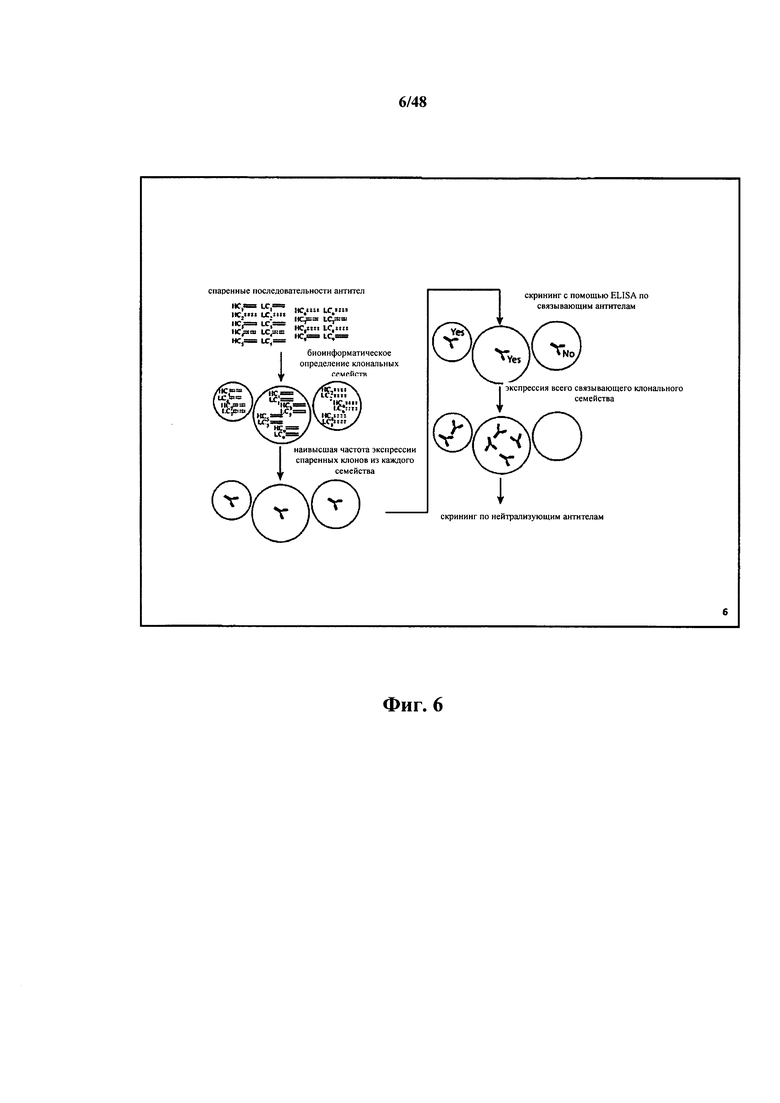

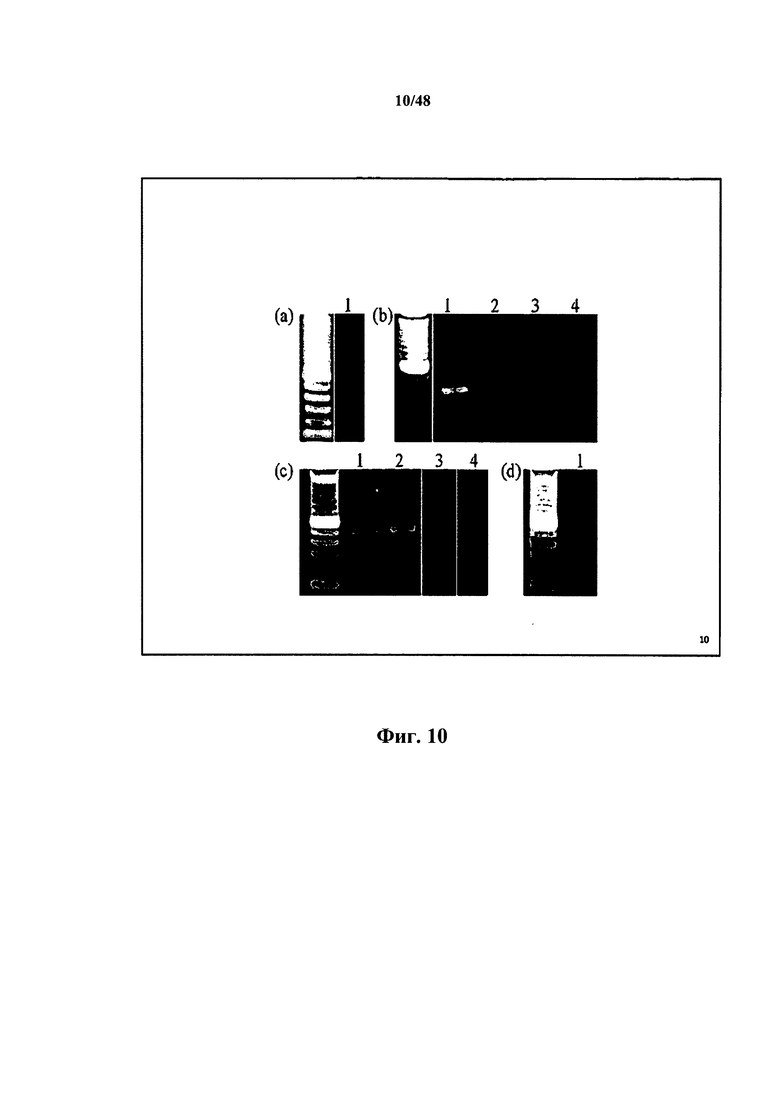
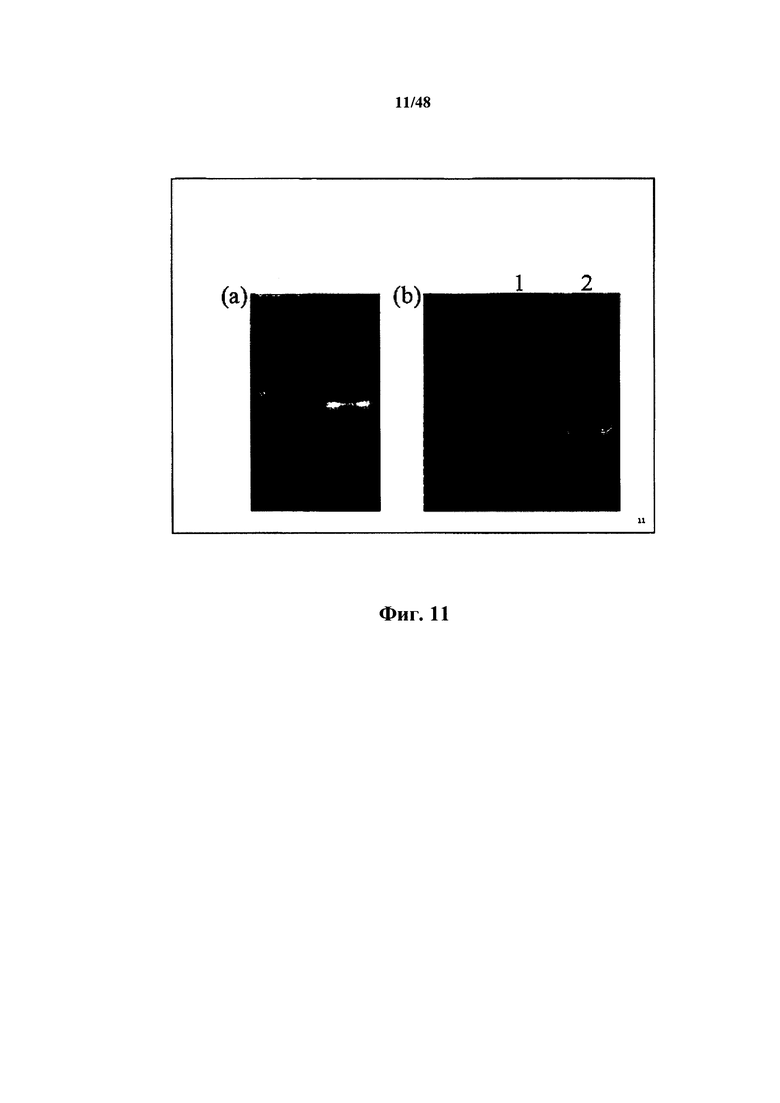
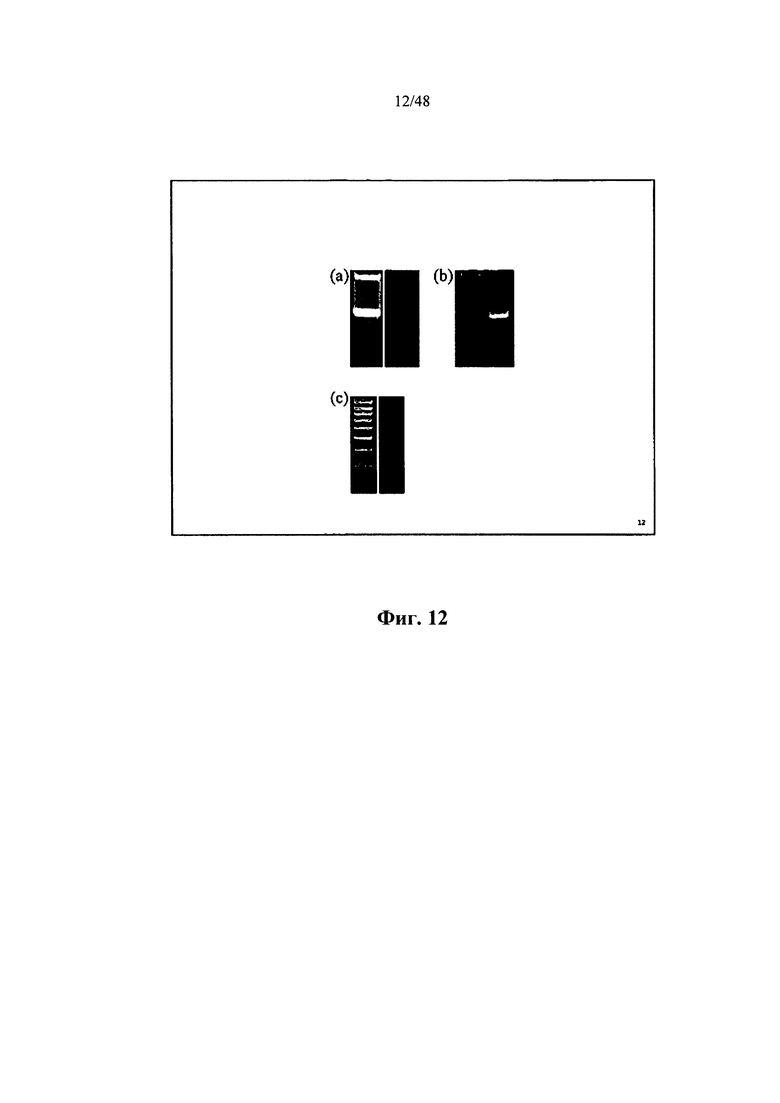


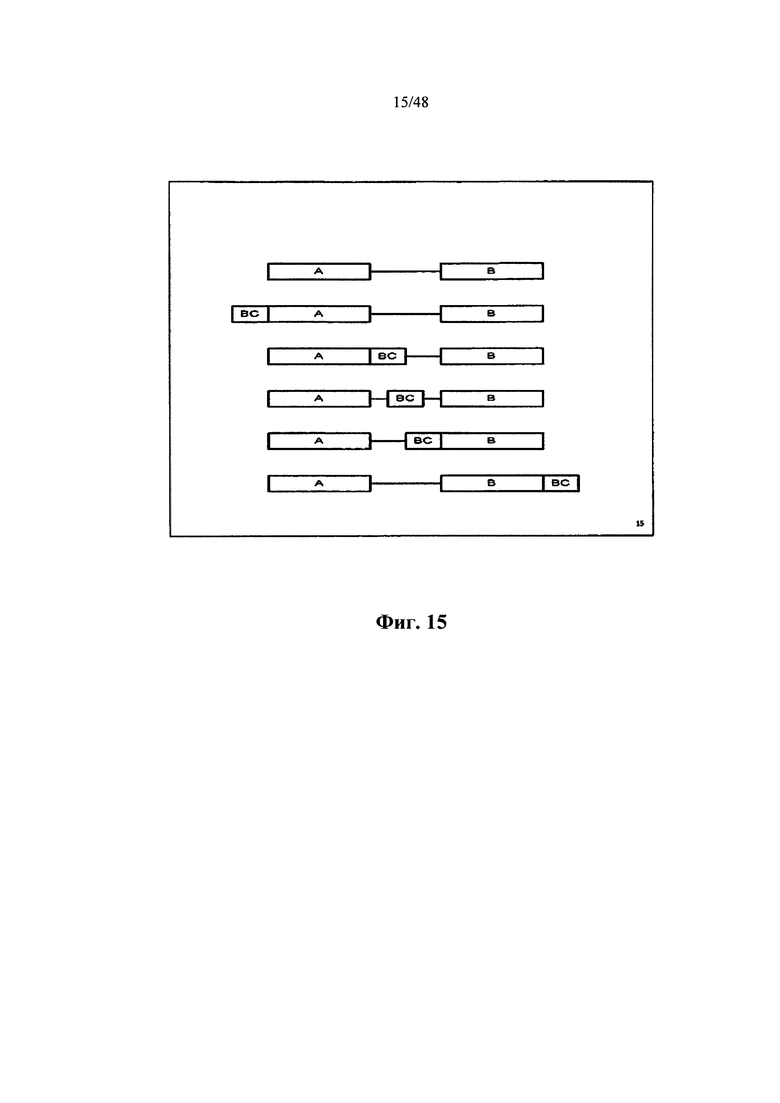

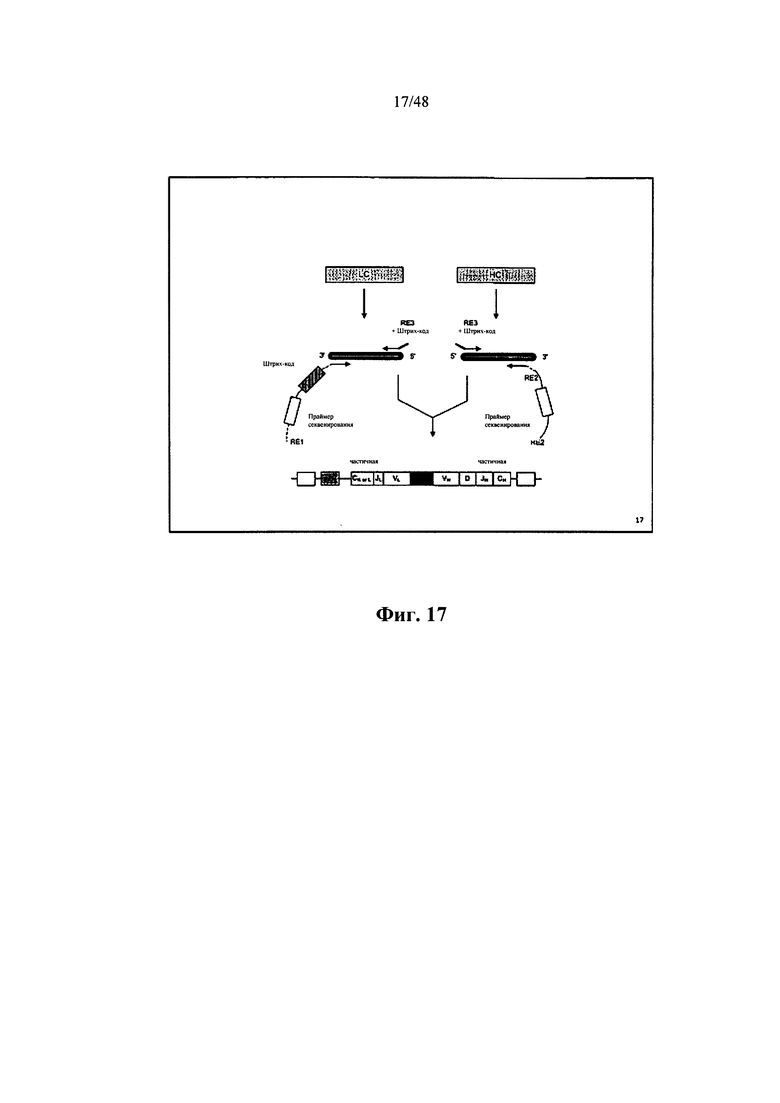


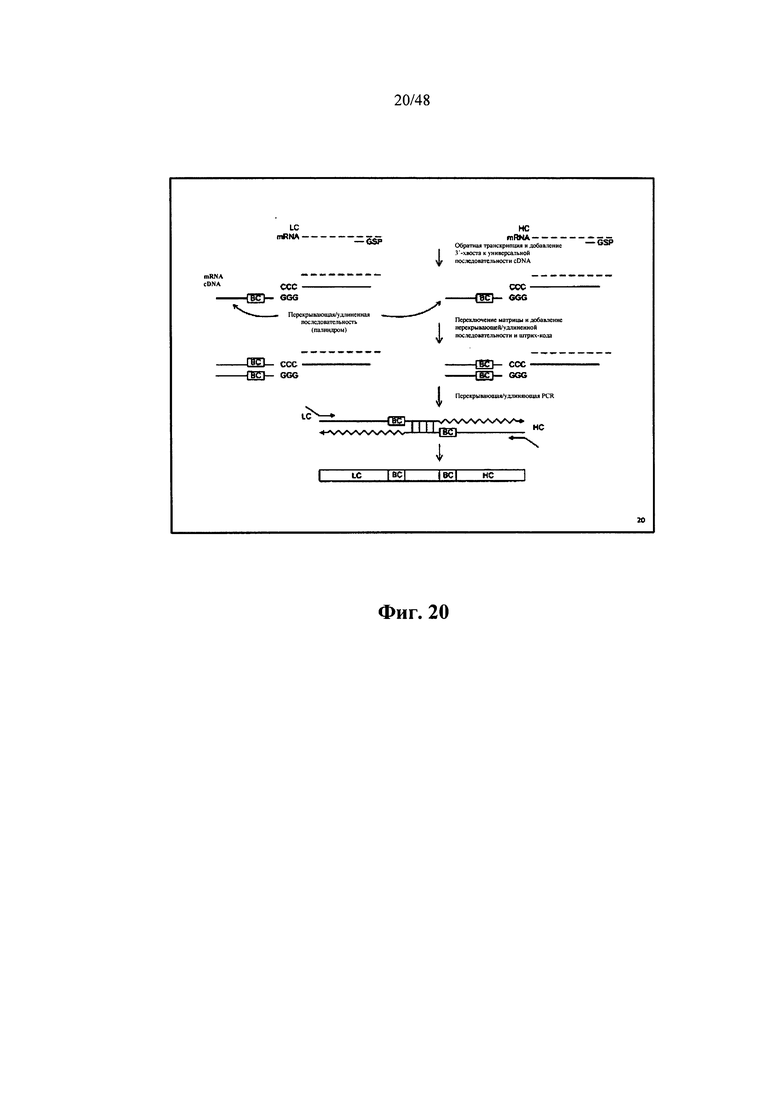


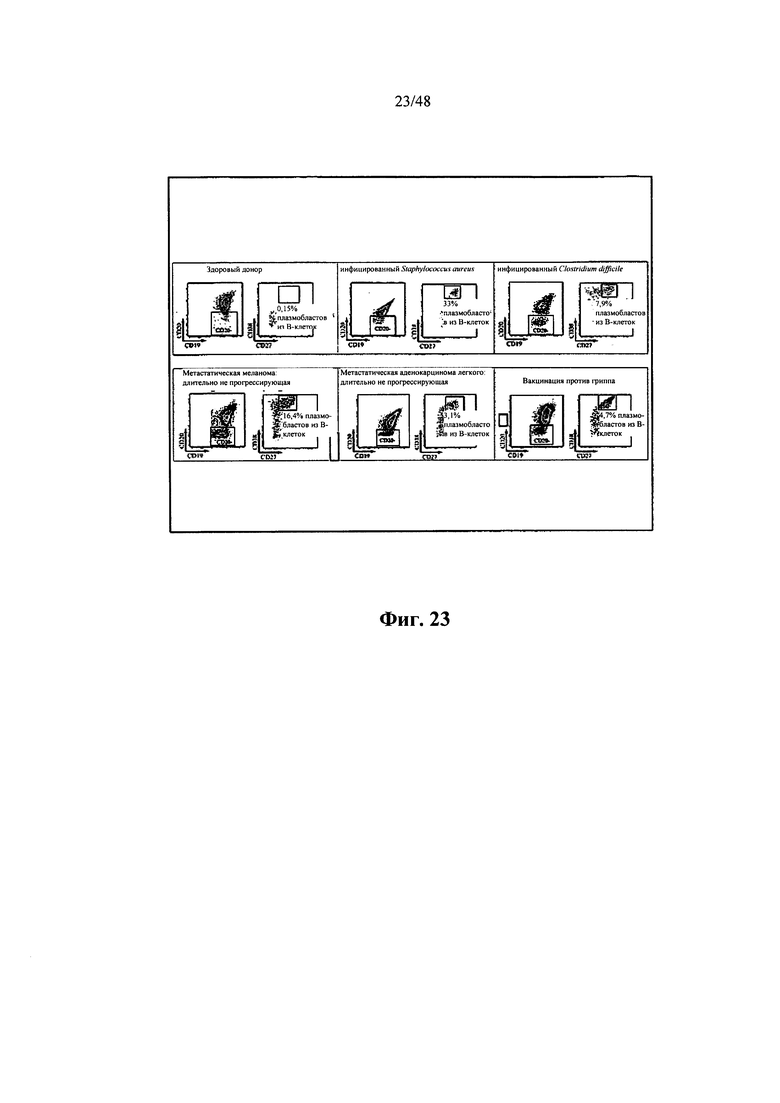
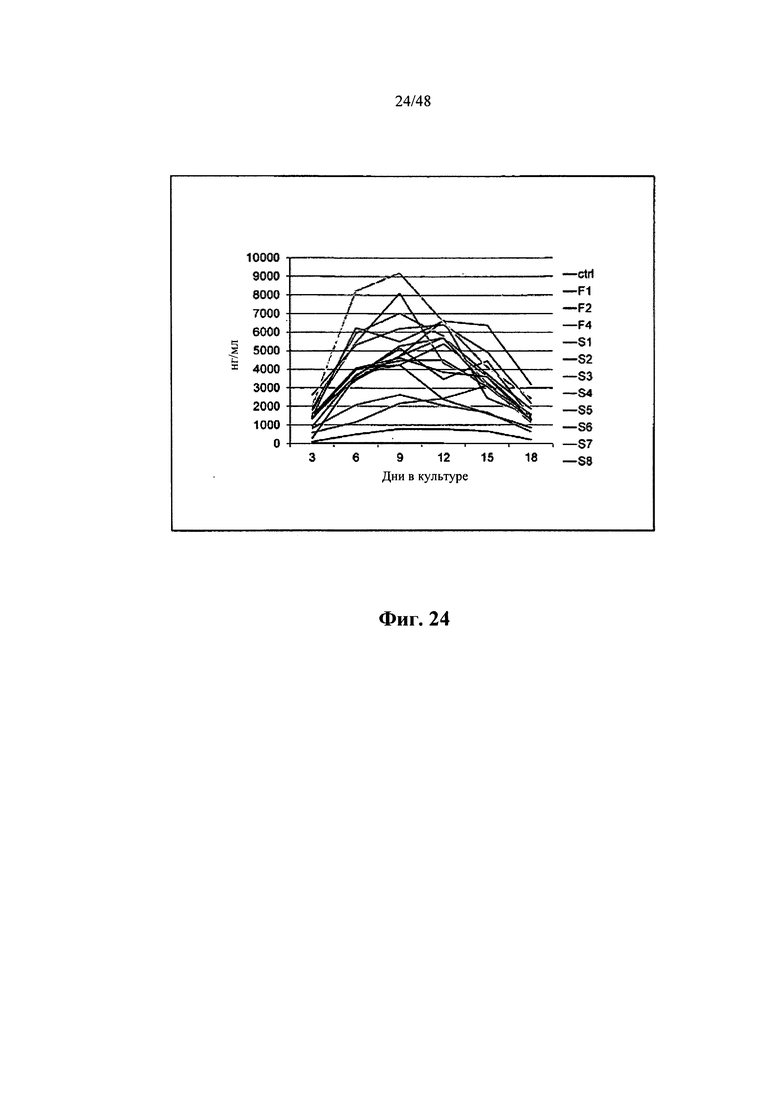
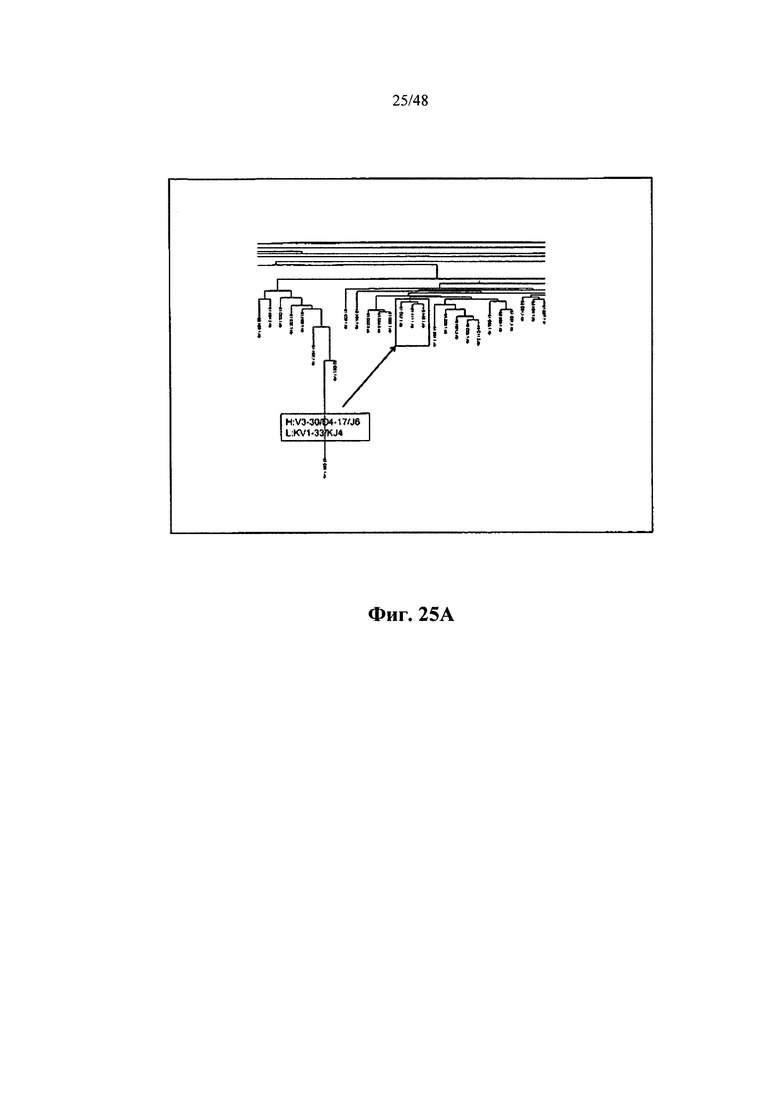
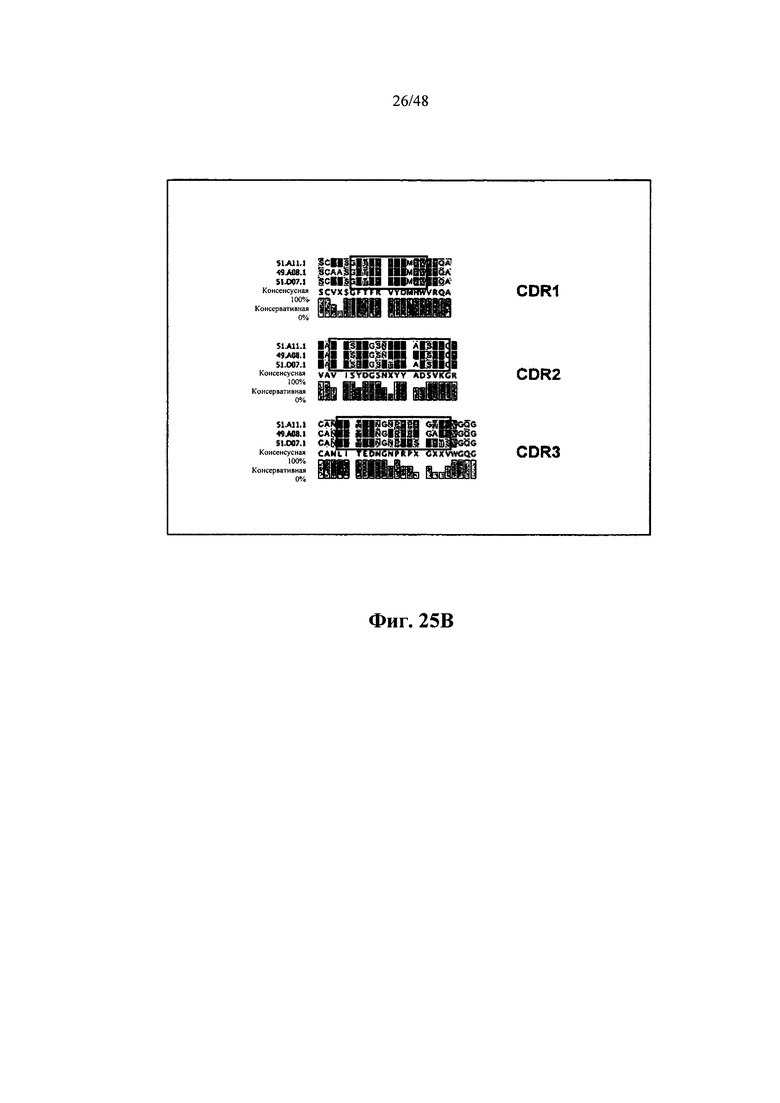
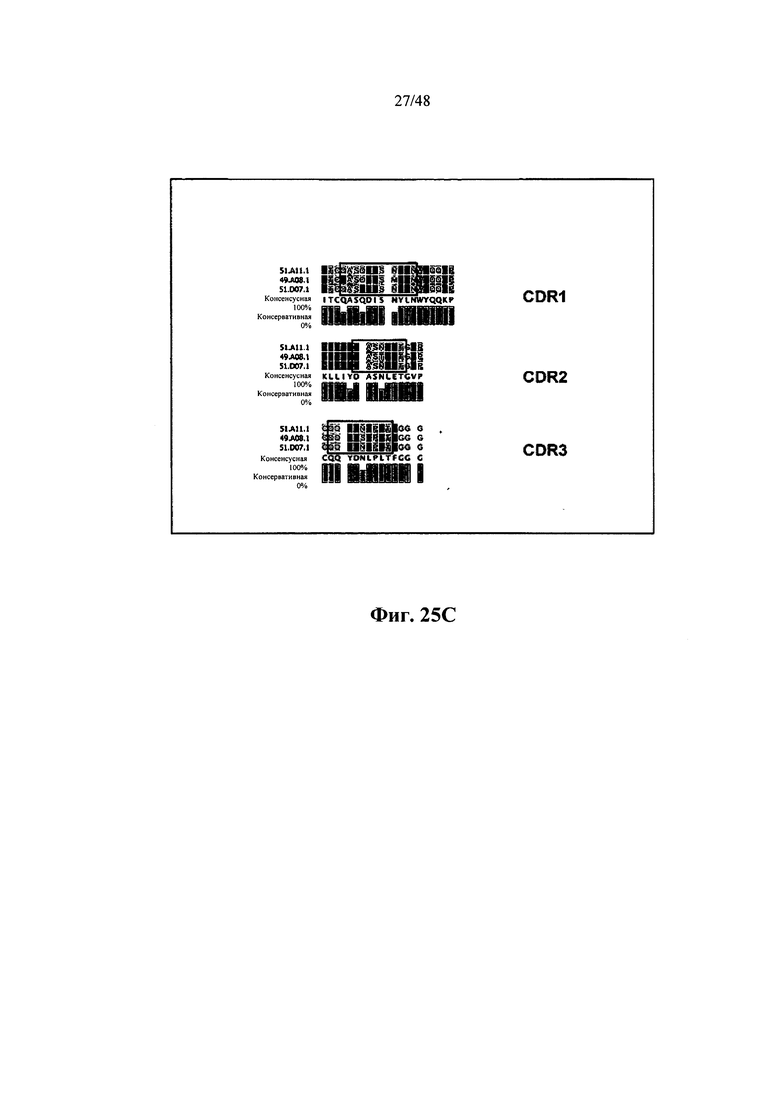



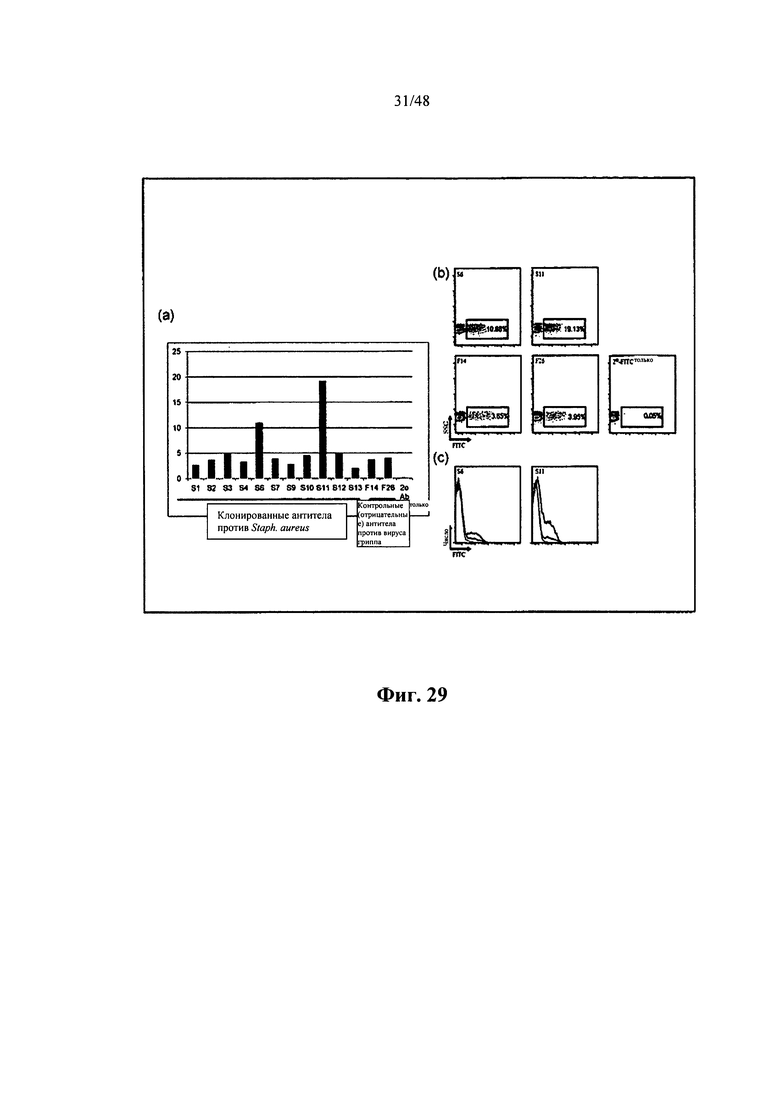
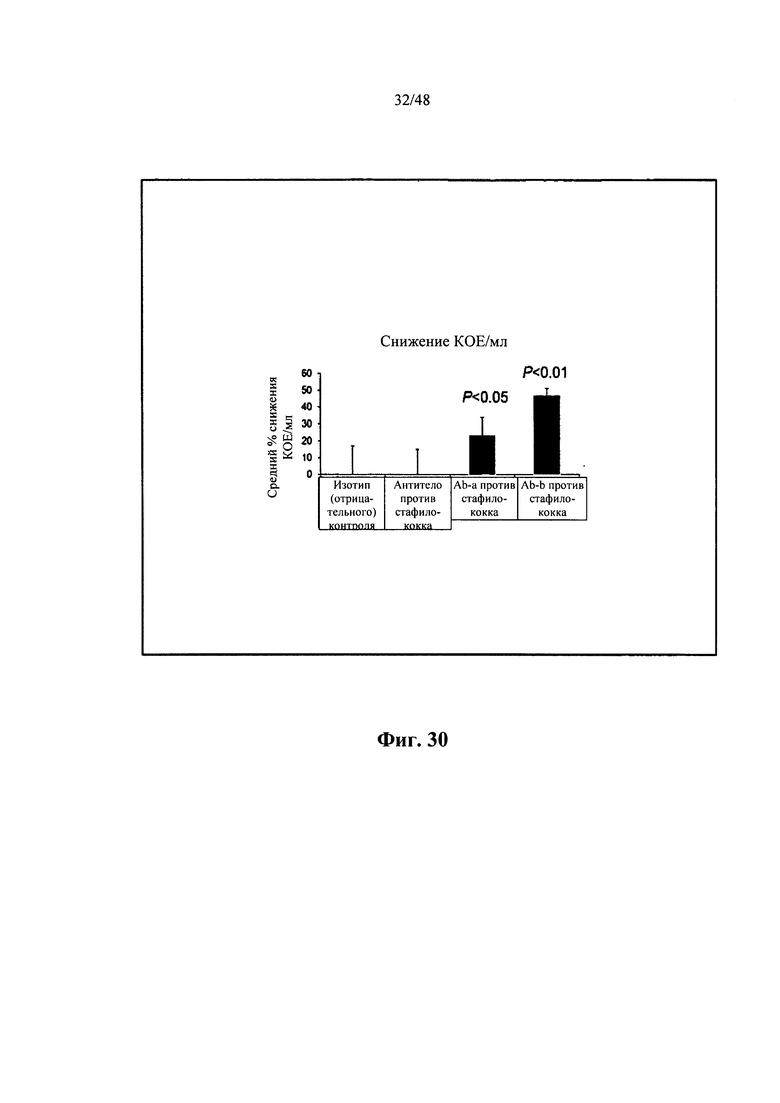

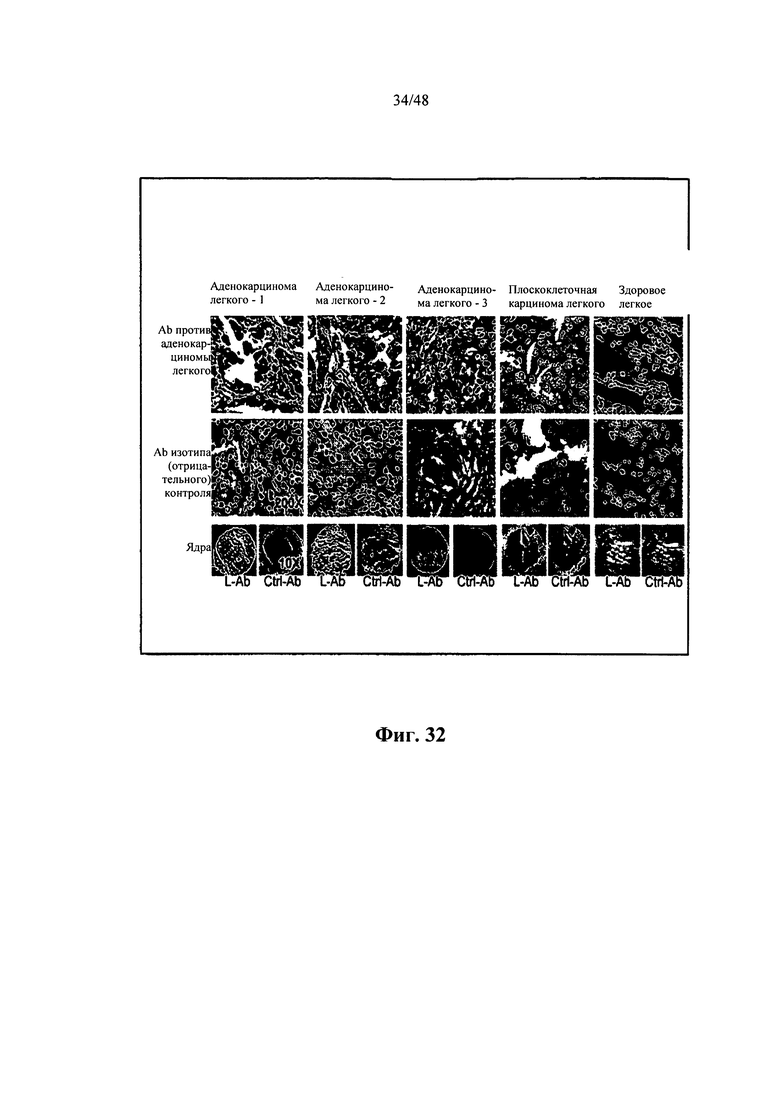

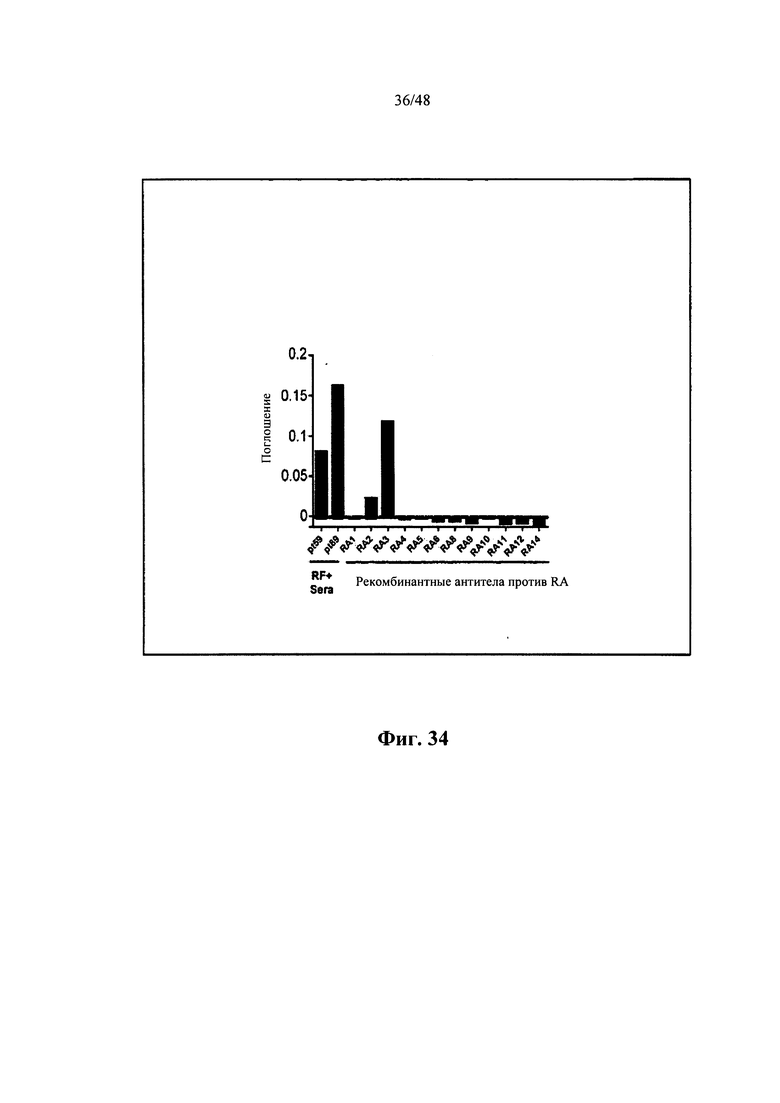
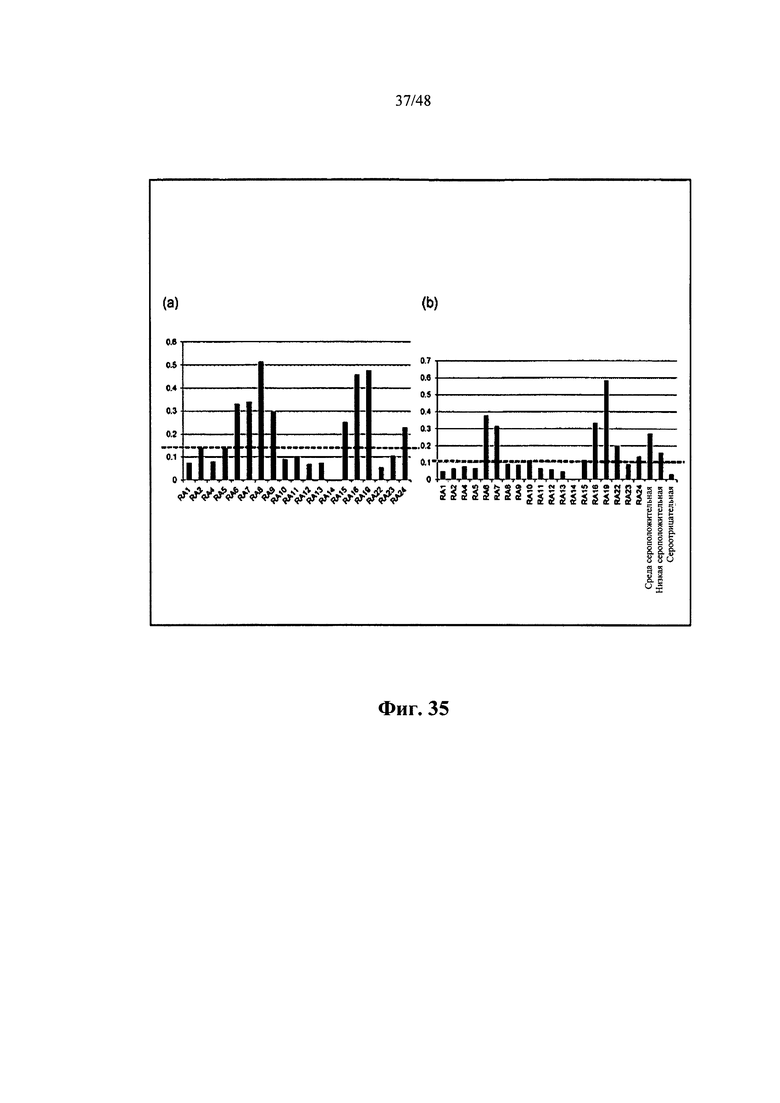
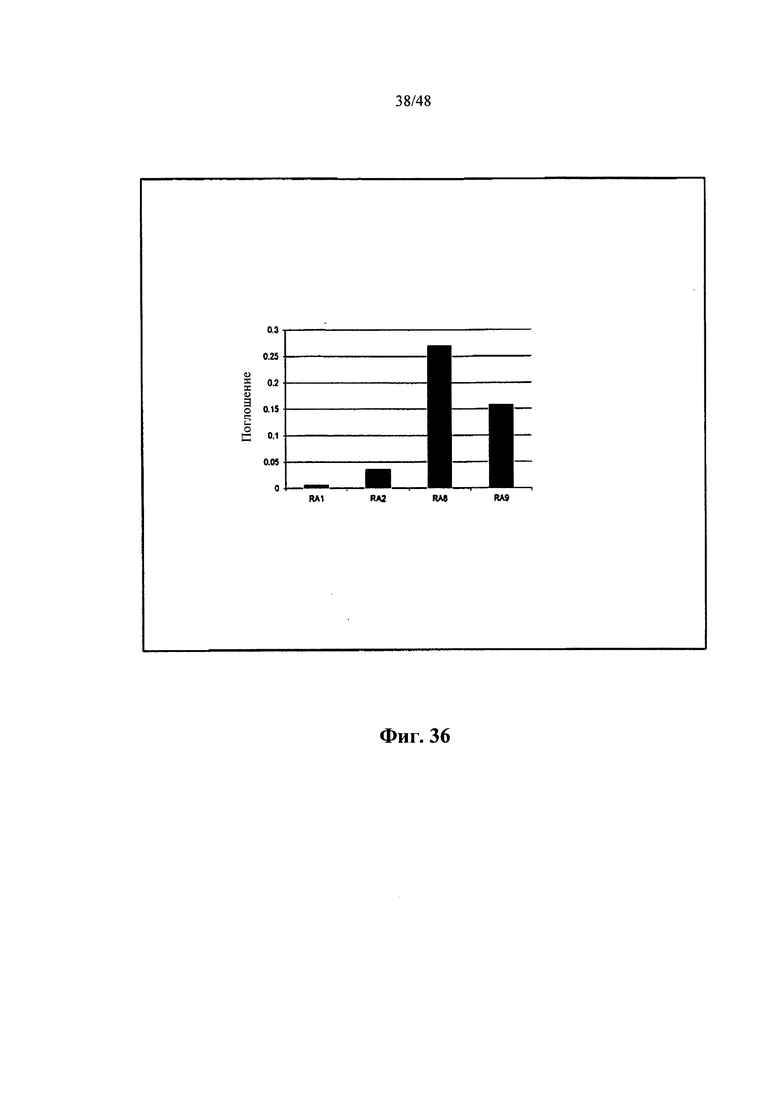

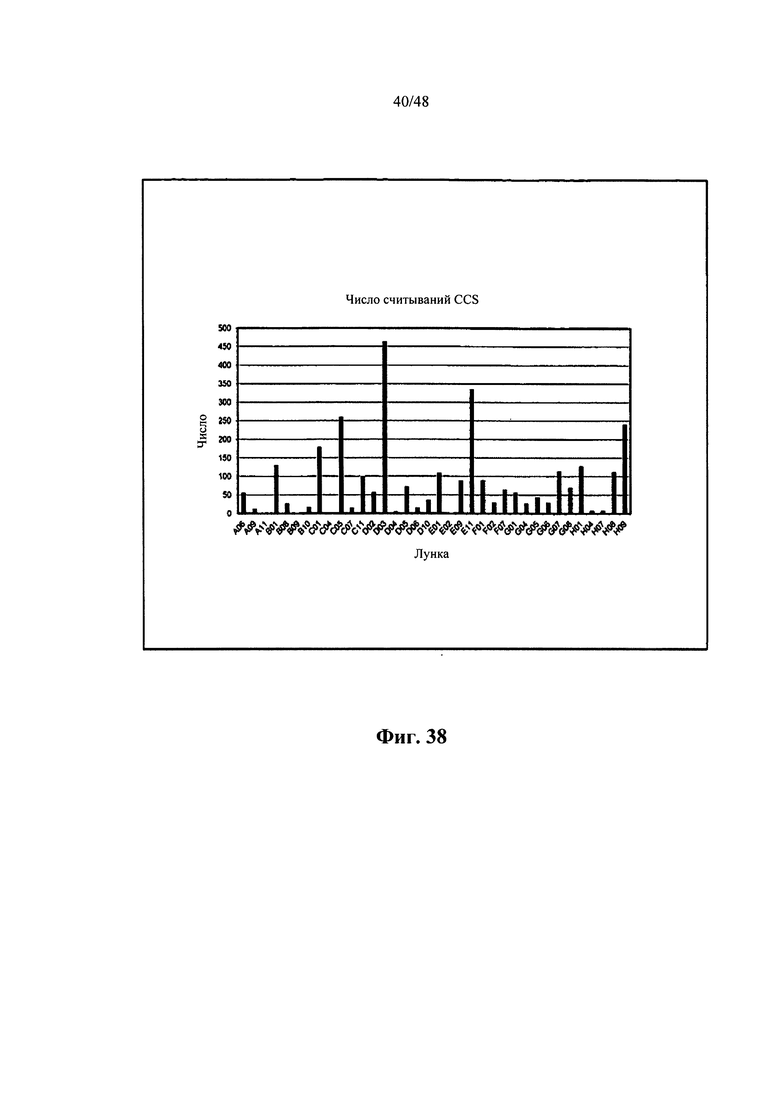
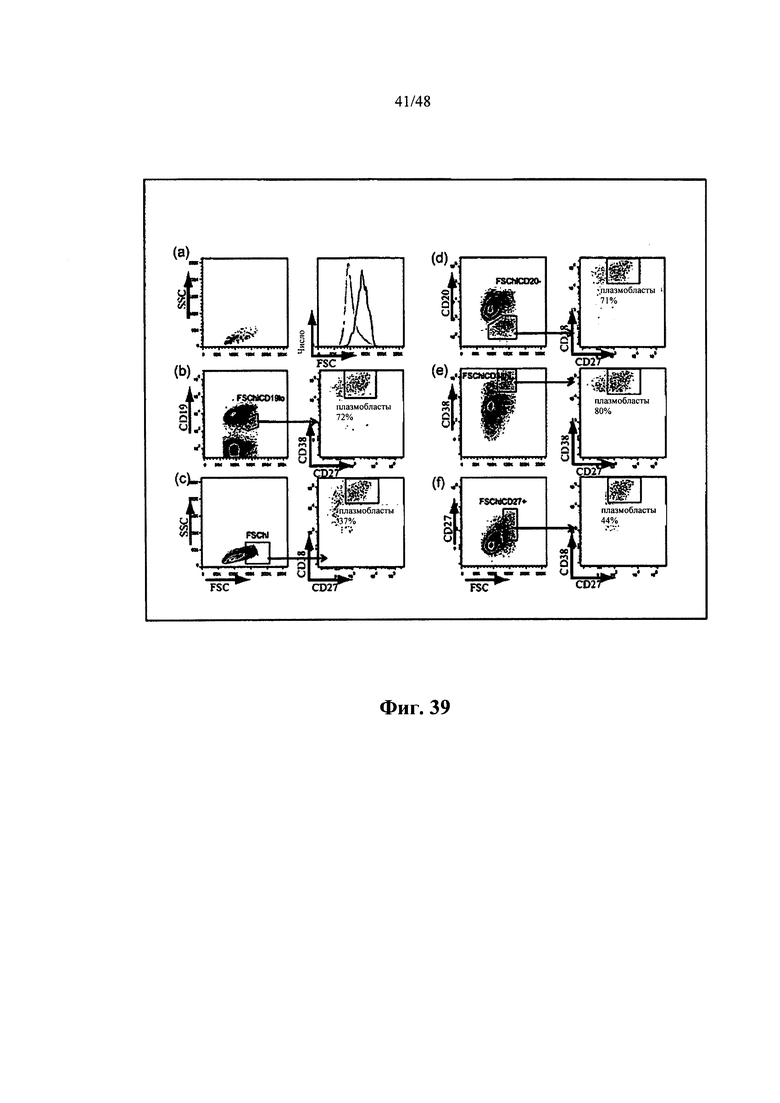
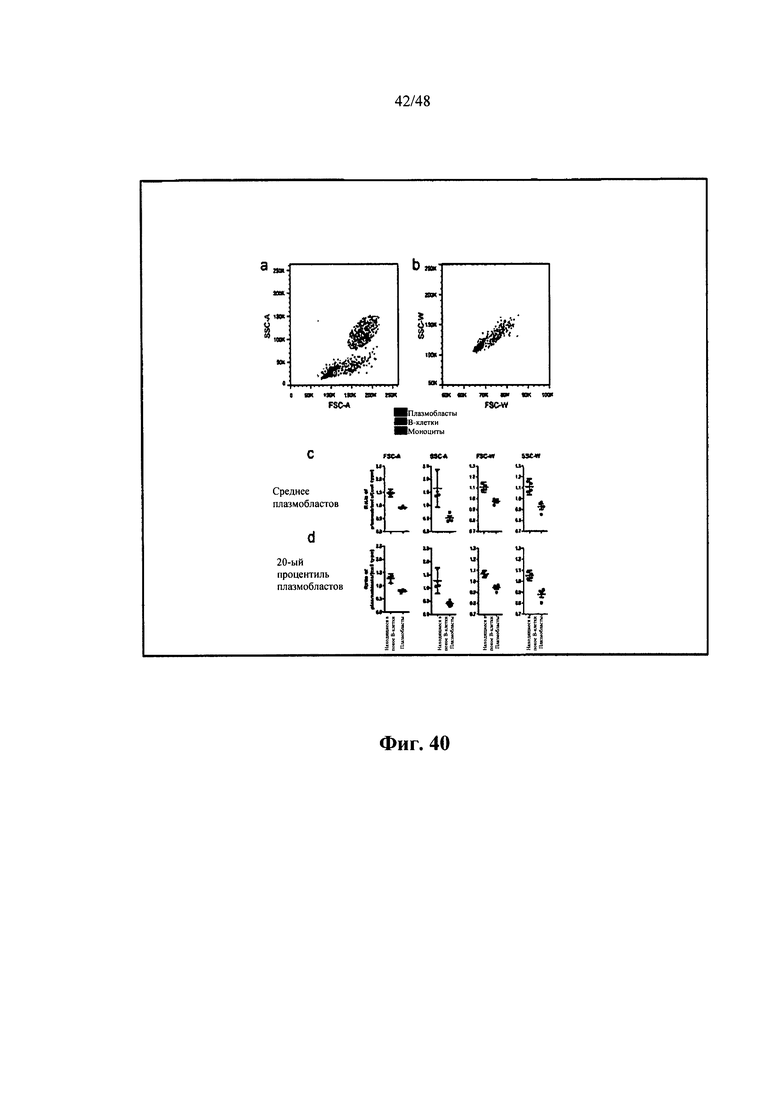




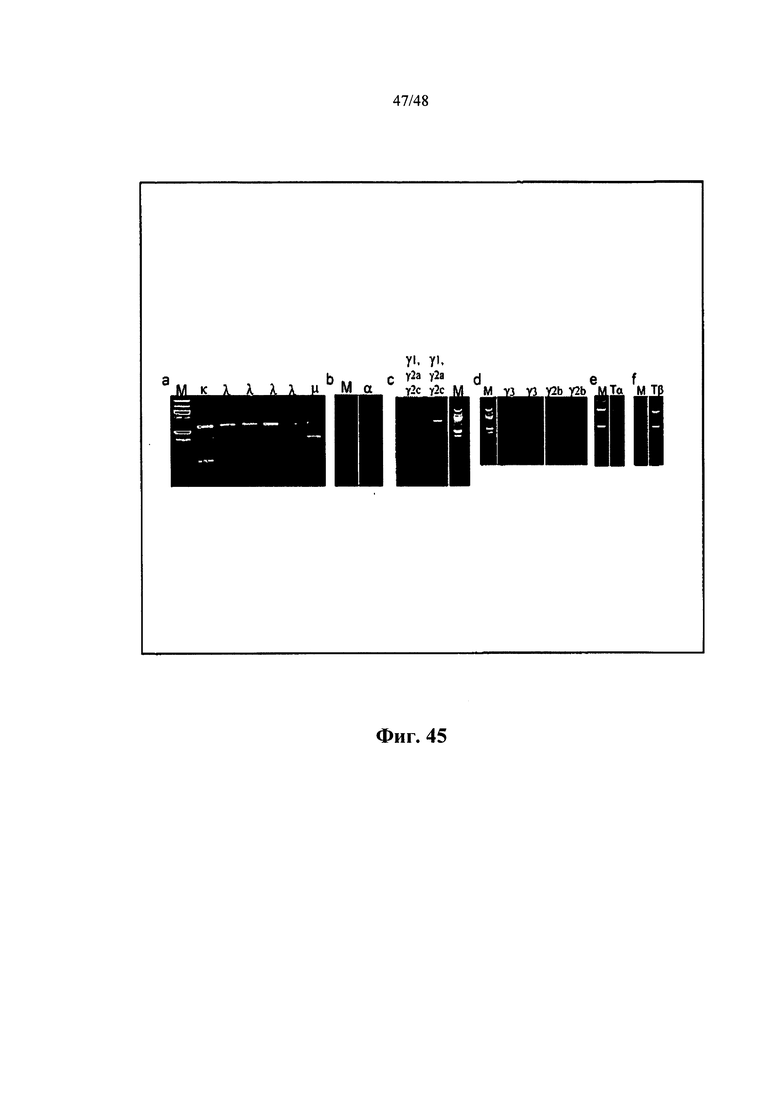
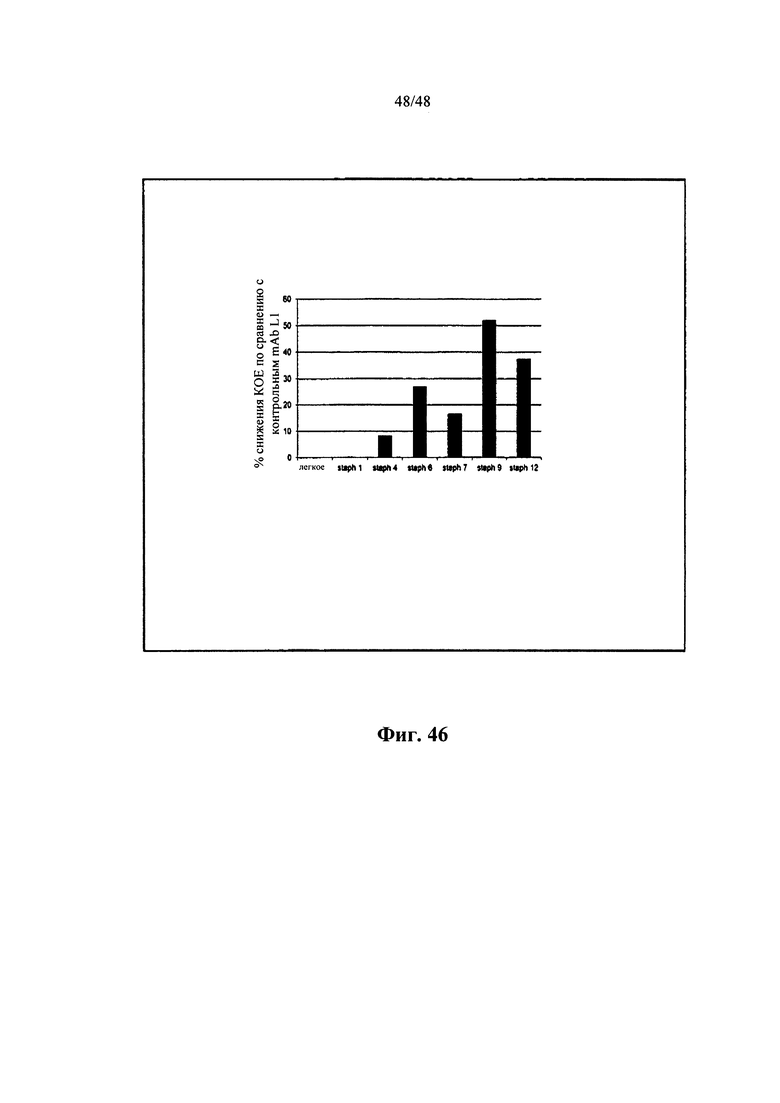
Представлены полинуклеотидная библиотека для получения спаренных последовательностей антител, способ получения представляющего интерес полинуклеотида и способ анализа и использования данных секвенирования. Полинуклеотидная библиотека состоит из композиций, содержащих cDNA, кодирующих тяжелую и легкую цепи вариабельной области иммуноглобулина одного и того же клонального семейства. При этом каждая композиция находится в отдельном контейнере и множество композиций находятся в множестве отдельных контейнеров. Каждая композиция при этом содержит: (i) молекулы cDNA, полученные из одного образца, содержащие молекулы cDNA, кодирующие вариабельные области тяжелой цепи иммуноглобулина, и молекулы cDNA, кодирующие вариабельные области легкой цепи иммуноглобулина из одной или более В-клеток; и (ii) идентификационный участок образца, присоединенный к молекулам cDNA. При этом нуклеотидная последовательность идентификационного участка образца отличается от нуклеотидной последовательности идентификационного участка образца других композиций, присутствующих в других отдельных контейнерах в библиотеке. Представленные изобретения могут быть использованы для получения спаренных последовательностей антител и скрининга представляющих интерес молекул. 4 н. и 20 з.п. ф-лы, 46 ил., 36 табл., 69 пр.
1. Полинуклеотидная библиотека для получения спаренных последовательностей антител, содержащая множество композиций, где библиотека содержит cDNA, кодирующие тяжелой и легкой цепи иммуноглобулина вариабельные области одного и того же клонального семейства, и при этом:
каждая композиция находится в отдельном контейнере и множество композиций находятся в множестве отдельных контейнеров, при этом каждая композиция содержит
(i) молекулы cDNA, полученные из одного образца, содержащие молекулы cDNA, кодирующие вариабельные области тяжелой цепи иммуноглобулина, и молекулы cDNA, кодирующие вариабельные области легкой цепи иммуноглобулина из одной или более В-клеток; и
(ii) идентификационный участок образца, присоединенный к молекулам cDNA,
при этом нуклеотидная последовательность идентификационного участка образца отличается от нуклеотидной последовательности идентификационного участка образца других композиций, присутствующих в других отдельных контейнерах в библиотеке,
так что множество отдельных контейнеров содержит cDNA, кодирующие тяжелой и легкой цепи иммуноглобулина вариабельные области одного и того же клонального семейства.
2. Библиотека по п. 1, в которой молекулы cDNA присоединены к идентификационному участку образца с помощью адаптерного участка.
3. Библиотека по п. 2, в которой адаптерный участок содержит нуклеотид dG на своем 3'-конце, а молекулы cDNA содержат нуклеотид С на 3'-конце.
4. Библиотека по любому из пп. 1-3, в которой каждая композиция дополнительно содержит универсальный праймерный участок, присоединенный к идентификационному участку образца, и в которой универсальный праймерный участок является существенно идентичным в каждом отдельном контейнере.
5. Библиотека по любому из пп. 1-3, в которой молекулы cDNA, полученные из одного образца, кодируют вариабельные области тяжелой цепи иммуноглобулина и вариабельные области легкой цепи иммуноглобулина из одной или более В-клеток.
6. Библиотека по п. 5, в которой одна или более В-клеток являются плазмобластами.
7. Библиотека по п. 5, в которой одна или более В-клеток являются мышиными В-клетками.
8. Библиотека по п. 5, в которой одним образцом является одна В-клетка.
9. Полинуклеотидная библиотека для получения спаренных последовательностей антител, содержащая множество композиций, в которой:
каждая композиция находится в отдельном контейнере и множество композиций находятся в множестве отдельных контейнеров;
при этом каждая композиция содержит:
множество молекул cDNA, полученных из одного образца, при этом каждая молекула cDNA содержит нуклеотид С на 3'-конце, и
адаптерный участок для идентификации образца, содержащий идентификационный участок образца, соединенный с адаптерным участком,
при этом нуклеотидная последовательность идентификационного участка образца каждого адаптерного участка для идентификации образца отличается от нуклеотидной последовательности идентификационного участка образца других адаптерных участков для идентификации образца других композиций в библиотеке, и
адаптерный участок для идентификации образца ковалентно присоединен к молекулам cDNA в композиции,
при этом молекулы cDNA, полученные из одного образца, содержат:
молекулы cDNA, кодирующие вариабельные области тяжелой цепи иммуноглобулина, и молекулы cDNA, кодирующие вариабельные области легкой цепи иммуноглобулина из одной или более В-клеток, так что множество отдельных контейнеров содержит cDNA, кодирующие тяжелой и легкой цепи иммуноглобулина вариабельные области одного и того же клонального семейства.
10. Библиотека по п. 9, в которой каждая молекула cDNA содержит вариабельный участок.
11. Библиотека по п. 10, в которой вариабельным участком является вариабельный участок иммуноглобулина В-клетки.
12. Библиотека по любому из пп. 9-11, в которой каждая композиция дополнительно содержит универсальный праймерный участок, присоединенный к идентификационному участку образца, и в которой универсальный праймерный участок является по существу идентичным в каждом отдельном контейнере.
13. Библиотека по п. 9, в которой одним образцом является одна В-клетка.
14. Библиотека по п. 13, в которой одной В-клеткой является один плазмобласт.
15. Способ получения одного или более представляющих интерес полинуклеотидов, включающий:
получение библиотеки по любому из пп. 1-14 и
амплификацию полинуклеотидной библиотеки с набором праймеров для получения одного или более представляющих интерес полинуклеотидов.
16. Способ по п. 15, дополнительно включающий секвенирование одного или более представляющих интерес полинуклеотидов и отбор одного или более представляющих интерес полинуклеотидов.
17. Способ по п. 15, при котором набор праймеров содержит один или более 3' специфичных для генов праймеров и необязательно 5' универсальный праймер.
18. Способ анализа и использования данных секвенирования, включающий
получение множества полинуклеотидов из библиотеки по любому из пп. 1-14 и секвенирование множества полинуклеотидов для экспериментального определения набора данных, при этом набор данных содержит данные секвенирования для множества полинуклеотидов,
при этом каждый идентификационный участок образца в каждом полинуклеотиде является уникальным для отдельного образца, при этом последовательность идентификационного участка образца каждого полинуклеотида из первого отдельного образца отличается от последовательности идентификационного участка образца других полинуклеотидов во множестве полинуклеотидов, при этом другие полинуклеотиды получены из одного или более образцов, отличающихся от первого отдельного образца;
анализ с помощью компьютера набора данных на совпадение данных, ассоциированных с полинуклеотидами с идентичными идентификационными участками образца, при этом совпадение показывает, что полинуклеотиды получены из одного и того же образца; и
отбор и клонирование cDNA, кодирующих полиеуклеотиды, полученные из одного образца, для анализа связывающих свойств кодированных спаренных вариабельных областей тяжелой и легкой цепей иммуноглобулина.
19. Библиотека по п. 1, в которой молекула cDNA и идентификационный участок образца включены в одну нить ДНК.
20. Библиотека по п. 1, в которой композиция дополнительно содержит молекулу ДНК, комплементарную (i) по меньшей мере части молекул cDNA и (ii) идентификационному участку образца.
21. Библиотека по п. 3, в которой молекулы cDNA содержат последовательность ССС на 3'-конце.
22. Библиотека по п. 1, в которой все молекулы cDNA в композиции, которые кодируют вариабельную область, получены из одной клетки.
23. Библиотека по п. 1, в которой по меньшей мере две вариабельные области тяжелой цепи иммуноглобулина или по меньшей мере две вариабельные области легкой цепи иммуноглобулина обладают по меньшей мере 80-99% идентичности последовательностей.
24. Библиотека по п. 1, в которой каждая из вариабельных областей тяжелой цепи иммуноглобулина или каждая из вариабельных областей легкой цепи иммуноглобулина обладает 80-99% идентичности последовательностей.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US 0006274321 B1, 14.08.2001 | |||
| MATTHIAS MEYER et al., Targeted high-throughput sequencing of tagged nucleic acid samples, Nucleic Acids Research, 2007, Vol | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| YANN-CHONG TAN et al., Barcode-Enabled Sequencing of Plasmablast Antibody Repertoires in Rheumatoid Arthritis, Arthritis Rheumatol | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2470941C2 |
Авторы
Даты
2018-02-13—Публикация
2012-04-27—Подача