ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет предварительной заявки на патент США под номером 61/506749, поданной 12 июля 2011 года.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит перечень последовательностей, который был подан в формате ASCII через EFS-Web и, таким образом, посредством ссылки включен в полном объеме. Вышеназванная копия в формате ASCII, созданная 12 июля 2012 года, названа 54070121.txt и имеет размер 40628 байт.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0003] Настоящее изобретение относится в целом к областям иммунологии и молекулярной биологии. Более конкретно, настоящее изобретение относится к способам, композициям и наборам для выявление "аффинно-зрелых" человеческих антител (Ab), содержащих соматические гипермутации.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0004] На протяжении 19 и 20 веков ученые и врачи мечтали получить возможность создавать индивидуализированные терапевтические средства, которые обладали бы высокой специфичностью в отношении единственной биологической мишени. Благодаря селективному воздействию на заболевание, при котором щадится здоровая ткань, эти "волшебные средства" считались идеальными терапевтическими средствами. Однако эта мечта начала воплощаться в жизнь только в начале 1970-х годов, когда Kohler и Milstein (Nature 256: 495, 1975) разработали новаторский способ создания антиген (Ag)-специфических моноклональных антител (mAb). Это было, возможно, одним из наиболее существенных событий в истории современной иммунологии. С применением этого нового подхода были разработаны многочисленные исследовательские, диагностические и терапевтические продукты, с общим объемом рынка в сотни миллиардов долларов.
[0005] Согласно способу Kohler и Milstein, В-клетки грызунов, каждая из которых экспрессирует уникальный иммуноглобулин (Ig), (т.е. mAb) иммортализировали путем слияния с клеткой миеломы. Способность этих mAb-секретирующих "гибридом" к репликации ad mfinitum позволяла провести отбор тех клеток, которые секретировали mAb с высокой аффинностью к данному антигену для того, чтобы использовать их в качестве фабрики для производства больших количеств идентичных mAb. MAb, полученные данным способом, в конечном счете применяли в качестве терапевтических средств для человека. Несмотря на эффективность, вскоре было обнаружено, что применение терапевтических mAb грызунов являются далеко не идеальным средством, потому что после нескольких введений они вызывали иммунные реакции по отношению к Ig грызунов, которые нейтрализовали активность mAb и часто становились причиной серьезных побочных реакций у пациентов, получавших лечение.
[0006] Для этого были предприняты попытки адаптировать способ Kohler и Milstein, использующий mAb грызунов, для получения человеческих mAb путем слияния человеческих В-клеток с клетками миеломы. Этот метод "человеческой гибридомы" оказался более сложным, чем ожидалось, по ряду различных причин. Во-первых, по этическим или медицинским причинам, часто было трудно увеличить количество антиген-специфических В-клеток путем многократной иммунизации субъектов-людей Ag. Во-вторых, также по этическим или медицинским причинам, было не осуществляемым выделение ткани селезенки человека для получения В-клеток, как это делали у грызунов. В-третьих, было нелегко получить иммортализированные mAb-продуцирующие клеточные линии человека, и эти линии, как правило, производили очень небольшие количества mAb. И, в-четвертых, поскольку разнообразие человеческих иммуноглобулинов, или репертуар индивидуальных специфичностей АЬ, намного выше, чем репертуар грызунов (~1012 по сравнению с ~107 индивидуальных специфичностей), и поскольку применяемая методология скрининга была ограничена количеством специфичностей не более чем примерно 104 в данной выборке, технически намного труднее выделить человеческие mAb-секретирующие клетки требуемой специфичности. Таким образом, выявление mAb, имеющих специфичности низкой частоты встречаемости, с применением этого способа остается сложной задачей по принципу "найти иголку в стоге сена".
|0007] Параллельно с разработкой способов "человеческих гибридом", ученые также начали предпринимать попытки "гуманизировать" антитела грызунов, заменяя различные аминокислотные последовательности грызунов последовательностями человеческих антител. В типичном применении, вариабельные области мышиного Ig объединяют с человеческими константными доменами, или мышиные участки, определяющие комплементарность (CDR) прививают на каркасный участок человеческого Ig. Этот новый рекомбинантный конструкт нуклеиновой кислоты вставляют в вектор экспрессии, который трансфицируют в клетки-хозяева, которые могут продуцировать большие количества химерных mAb при культивировании. Хотя этот метод произвел большой вклад в повышение практической значимости mAb в терапевтических применениях (за счет уменьшения ответа, развивающегося у человека против иммуноглобулинов грызунов), оставшиеся последовательности грызунов все еще могут вызвать развитие нежелательного ответа по отношению к mAb [например, ответа на НАМА (на человеческое антитело к антителу мыши)], который может нейтрализовать mAb или даже вызвать серьезные побочные реакции у пациента.
[0008] Другой подход к получению человеческих mAb включал использование химерных животных, где гены Ig животного-хозяина были частично заменены их человеческими аналогами. После вакцинации эти нокаутные/нокиновые животные продуцируют человеческие АЬ, и селезенки этих животных, содержащие В-клетки, могут использоваться для получения человеческих mAb с использованием обычного метода гибридом. Недостатки, которые были связаны с этим методом, включают: снижение разнообразия (специфичности) и аффинности вследствие неполного репертуара человеческих генов, связанных с Ig; гуморальные ответы, которые не были чисто человеческими ("гуманизированные" трансгенные животные сохраняют свои нативные Т-клетки и обладают остаточной экспрессией мышиных антител в ответ на различные антигены); характер гликозилирования продуцируемых антител отличался от человеческого (например, Galα 1-3Gal-содержащие олигосахариды в гуманизированных животных обычно не встречаются у человека и, таким образом, распознаются как чужеродные); а в отношении антител, которые проходят развитие в организме животного, не проводится "селекция" относительно толерантности у человека - таким образом, даже притом, что они происходят от частично человеческих последовательностей, они не обязательно являются неиммуногенными в организме человека (т.е. не являются истинно человеческими).
[0009] Появление способов полимеразной цепной реакции (ПЦР) сделало возможным амплификацию всех или части генов Ig, и позволило создать библиотеки плазмид, содержащих молекулы кДНК, кодирующих вариабельные области (V-области) тяжелых и легких цепей Ig из лейкоцитов периферической крови (PBL), которые необходимо получить. Традиционно, создание библиотеки для фагового дисплея включало набор из 6 праймеров в вариабельной области тяжелой цепи, 4 праймера в вариабельной области каппа-цепи и 9 праймеров в вариабельной области лямбда-цепи (как описано в Barbas et al., Phage Display: A Laboratory Manual. Cold Spring Harbor, 2001). Плазмиды из этих библиотек могут применяться для трансфекции бактерий или других клеток-хозяев (например, дрожжей), которые затем могут подвергаться скринингу на Ag-специфические компоненты Ig. В подходе фагового дисплея гены V-области человеческого Ig клонируют в бактериофаг для отображения фрагментов Ab на поверхности частиц бактериофагов. Гены из обширных библиотек генов человеческих Ab встраивают в библиотеку фага. Каждый фаг может потенциально нести ген для другой V-области и отображает другую V-область на своей поверхности. Обычно эти фаги применяют для отображения на поверхности бактериофага конструкта АЬ, состоящего из V-областей тяжелых и легких цепей Ig, разделенных линкером (одноцепочечный фрагмент вариабельной области Ab или scFv), таким образом, что каждая из V-областей тяжелых и легких цепей могла бы связаться с целевым антигеном таким образом, чтобы точно имитировать связывание mAb с Ag. Подобно фаговому дисплею, в дрожжевом дисплее компоненты Ig экспонируются на поверхности дрожжевой клетки в виде гибрида с белком Aga2p таким образом, что белок слияния выступает по отношению к клеточной поверхности. Затем может применяться проточная цитометрия для того, чтобы провести отбор тех дрожжевых клеток, которые экспрессируют компонент Ig, который реагирует с целевым Ag. После выявления с применением фагового или дрожжевого дисплея экспрессирущиеся гены V-областей тяжелых и/или легких цепей выделяют и встраивают в векторы экспрессии тяжелой и/или легкой цепи полной длины. Культивирование клеток-хозяев, трансфицированных такими векторами, позволяет получить большие количества mAb.
[0010] Основное преимущество методов фагового или дрожжевого дисплея заключается в том, что огромные библиотеки, включающие примерно 100 млрд. отдельных V-областей, могут быть подвергнуты скринингу для определения реактивности Ag. Недостатком этих методов является то, что V-области, выделенные на первом этапе дисплея, как правило, обладают очень низкой аффинностью. Распространенной причиной формирования низкоаффинных антител является потеря при использовании этого способа критически важных подвергшихся гипермутациям последовательностей (которые создают зрелые высокоаффинные антитела). В-лимфоциты, которые продуцируют высокоаффинные антитела, в целом претерпели процесс, известный как соматическая гипермутация. В этом процессе последовательности V-областей, кодируемые в зародышевой линии, подвергаются генетическим мутациям, таким образом, что генная последовательность V-области изменяется. Это может привести к получению "зрелой" последовательности V-области, которая имеет значительно более высокую аффинность по отношению к заданному антигену. В целом понимается, что соматическая гипермутация является принципиально важным явлением для создания разнообразия антител и высокоаффинных антитела. Эта соматическая гипермутация не может обнаруживаться в геномных последовательностях зародышевой линии, и представлена только в уникальном клоне В-лимфоцитов.
[0011] Создание низкоаффинных антител с применением подхода фагового дисплея является одним из основных ограничений этого способа. Это затруднение в действительности привело к разработке многих других комплексных подходов, включая гуманизированных мышей и соматическую гипермутацию in vitro, как описано выше. Антитела у человека проходят процесс селекции, который делает их переносимыми человеческим организмом. Эти методы приводят к применению последовательностей антител, которые не основаны на in vivo процессах селекции у человека, и таким образом, эти антитела могут быть иммуногенными у человека. В любом случае, преодоление продукции низкоаффинных антител стало серьезной проблемой для этих способов.
[0012] Причина, по которой фаговый дисплей обычно генерирует низкоаффинные антитела, заключается в том, что он включает использование последовательностей праймера, которые основанына последовательностях V-областей зародышевого типа. Применение праймеров V-области на основании последовательностей зародышевого типа может привести к двум возможным результатам: (1) праймеры не смогут гибридизоваться с подвергшимися соматическим мутациям последовательностями, поскольку несовпадение между праймером и подвергшимися гипермутациям последовательностями не может привести к отжигу праймера; или (2) несовпадение между праймером и подвергшимися гипермутациям последовательностями является консервативным, благодаря чему отжиг имеет место, но амплификация приводит к повторению последовательности зародышевого типа, кодируемой праймером, а не соответствующей подвергшейся гипермутациям последовательности. В любом случае, так как методология фагового дисплея включает критически важные этапы ПЦР-амплификации с применением последовательностей праймера для ГЩР, которые кодируют последовательности V-областей зародышевого типа, и так как эти праймеры амплифицируют последовательности Ig, расположенные внутри V-областей антитела, библиотеки кДНК, созданные с применением праймерных последовательностей зародышевого типа не будут содержать полный репертуар подвергшихся соматическим гипермутациям последовательностей. Кроме того, и что важно, репертуар будет полностью лишен антител с гипермутацией на 5'-конце V-области, т.е. области, кодируемой праймером, кодируемым зародышевой линией.
[0013] Другими словами, применение праймеров, основанных на последовательности зародышевого типа, повторяет последовательности V-областей зародышевого типа, таким образом, приводя к утрате гипермутаций в участке, кодируемой праймерной последовательностью. Таким образом, этот способ систематически ликвидирует гипермутацию в этих участках V-области и приводит к общей потере подвергшихся гипермутациям последовательностей подвергшегося гипермутациям антитела. В случае Ab низкой частоты встречаемости (т.е. менее 0,1; 0,01; 0,001; 0,0001 или 0,00001% от суммарного репертуара Ag специфичностей субъекта), для которых система фаговогого дисплея, возможно, подходит больше всего, нахождение генов V-областей, которые могут применяться для получения высокоаффинных mAb, становится все более сложной задачей.
КРАТКОЕ ОПИСАНИЕ
[0014] Настоящее изобретение основано на разработке улучшенного способа выявления Ag-специфических V-областей Ig, которые встречаются с низкой частотой в репертуарах человеческих Ab, таким образом, чтобы эти V-области могли применяться для получения Ag-специфических человеческих mAb или других Ag-направленных конструктов. Настоящее изобретение также позволяет выявление более полных библиотек V-областей, в частности тех, которые кодируют последовательности антител, содержащие критически важные соматические мутации для получения высокоаффинных антител.
[0015] Разработка этого улучшенного способа была основана на неожиданном открытии, касающемся того, что традиционные способы фагового и дрожжевого дисплея позволяют многим V-областям в человеческих мононуклеарных клетках периферической крови (РВМС), которые обладают высокой аффинностью к целевому антигену, избегать выявления. В традиционных способах фагового и дрожжевого дисплея ПЦР применяют для амплификации последовательностей нуклеиновых кислот, соответствующих V-областям тяжелых и/или легких цепей Ig. Прямые праймеры, которые инициируют процесс ПЦР-амплификации, имеют последовательность нуклеиновой кислоты, которая комплементарна последовательности-зародышевого типа, расположенной на 5'-конце каждой V-области, чтобы молекулы кДНК, кодирующие V-области, подвергались амплифицикации.
[0016] Благодаря нескольким процессам, отвечающим за создание разнообразия Ab, аминокислотные последовательности V-областей зрелых Ab отличаются от последовательностей зародышевого типа и друг от друга. Генные сегменты Ig у млекопитающих организованы в группы вариабельных (V), обеспечивающих разнообразие (D), соединительных (J) и константных (С) экзонов. ДНК, кодирующая тяжелую цепь человека включает приблизительно 50 функциональных VH сегментов, 30 DH сегментов и 6 JH сегментов. Каппа-цепь включает приблизительно 40 функциональных VΚ сегментов, пять Jκ сегментов и 1 Сκ сегмент. Лямбда-цепь ДНК содержит 30 Vλ сегментов и по 4 Jλ и Сλ сегмента. Разнообразие соединений является результатом неточного соединения генных сегментов, и в процессе рекомбинации не-шаблонные нуклеотиды могут вставляться между прилегающими генными сегментами с помощью терминальной дезоксинуклеотидилтрансферазы, и становиться частью участка, определяющего комплементарность (CDR). Разнообразие собранных V-D-J или V-J сегментов затем достигается путем поэтапного включения однонуклеотидных замен (соматическая гипермутация), приводящих к более широкому разнообразию антител и созреванию аффинности.
[0017] Три CDR-участка в каждой тяжелой и легкой цепях с V-областью демонстрируют наибольшее разнообразие последовательностей. В связи с этим разнообразием, эти участки также называются гипервариабельными участками. Шесть CDR тяжелых и легких цепей критически важны для определения Ag-связывающей специфичности Ab. Поскольку 5'-конец зародышевого типа каждой V-области не располагается внутри гапервариабельного участка, традиционный способ применения прямых праймеров, направленный на последовательности зародышевого типа в этом сайте, не считался проблематичным. Более того, для выявления этих V-областей в человеческих Ab высокой частоты встречаемости, была доказана высокая целесообразность применения этого способа.
[0018] Во время выполнения работ, ведущих к разработке настоящего изобретения, были предприняты попытки выявить Ab низкой частоты встречаемости. Хотя Ab с необходимой специфичностью могли быть выявлены в образцах периферической крови с применением таких методов как ELISA (иммуноферментный твердофазный анализ), когда эти образцы использовали в традиционных способах фагового дисплея, высокоаффинные Ab не могли быть получены. Это общая проблема в индустрии, и поэтому были разработаны комплексные in vitro способы индуцирования мутаций для создания комбинаторных библиотек V-областей. Эти способы являются сложными, трудоемкими и не обязательно приводят к получению антител, которые сохраняют нативные человеческие последовательности.
[0019] Настоящее изобретение проистекает из устранения причин невозможности фаговой системы генерировать высокоаффинные антитела для этих антител низкой частоты встречаемости. Рассматривая предыдущие эксперименты, которые показывали, что (а) существует значительная частота возникновения мутаций относительно зародышевой линии в аминокислотной последовательности, располагающейся на 5'-конце V-областей и (b) две аминокислотные замены в районе V-областей, расположенных за пределами CDR, оказывали значительное влияние на аффинность Ab к Ag, было сделано поразительное наблюдение, касающееся того, что традиционный способ амплифицирования последовательностей V-областей с применением праймеров для последовательностей 5'-конца зародышевого типа привел к созданию библиотек, в которых отсутствовали многие из тех V-областей, которые имеют мутации на их 5'-конце, и также вносил ошибки последовательностей в этом участке в ходе процесса ПЦР. Даже при строгих условиях ПЦР праймеры последовательности зародышевого типа подвергались кросс-гибридизации с V-областями, которые содержат некоторое число соматических мутаций. Таким образом, праймеры, при амплификации V-области, повторяют последовательность зародышевого типа в кДНК. Соматические гипермутации V-области с истинно высокой аффинностью, таким образом, будут утрачены. Важно, что также было обнаружено, что именно эти утраченные V-области, как ожидалось, должны включаться в Ab с наивысшей аффинностью. Первые десять аминокислот в V-области могут содержать и часто содержат соматические гипермутации. Изменение единичной аминокислоты в этой области может повлиять на связывание антител.
[0020] В инновационном подходе, который описывается в данном документе, вместо амплификации V-областей с применением ПЦР-праймеров для последовательностей 5'-концов V-областей, V-области амплифицируют с применением прямых праймеров, специфических по отношению к лидерной последовательности. Поскольку лидерная последовательность располагается чуть выше генов V-области, амплифицируются все последовательности V-области, в том числе с мутациями на 5'-конце. Поэтому получаемая в результате библиотека содержит более полный репертуар V-областей, чем полученная с применением традиционного способа (который приводит к потере всех последовательностей V-области, которые подверглись соматическим гипермутациям). Таким образом, возможно выделить V-области низкой частоты встречаемости, которые подверглись соматическим мутациям. Обратные праймеры могут быть выбраны для того, чтобы амплифицировать все подклассы изотипа Ig (например, гамма, мю, альфа, каппа, лямбда и т.д.) или отдельные подклассы тяжелых цепей (например, гамма 3 или гамма 4) для получения более направленных библиотек.
[0021] Экспрессия нуклеиновых кислот V-области, усиленная с применением праймеров лидерной последовательности, приводит к включению лидерных пептидов в белковый продукт V-области. Когда клетки млекопитающих, такие как СНО-клетки, используются для экспрессии этих нуклеиновых кислот, эндогенные посттрансляционные механизмы процессинга приводят к удалению лидерного пептида, обеспечивая экспрессию конструктов V-области или нескольких V-областей (например, тяжелой и легкой цепей) без лидерных пептидов, которые мешают проведению скрининговых исследований связывания с Ag. Однако при выполнении методов бактериального фагового дисплея лидерные пептиды не удаляются. Наличие лидерных пептидов может нарушать проведение скрининговых исследований связывания с Ag и тем самым предотвратить обнаружение V-областей, обладающих высокой аффинностью к целевому антигену.
[0022] Чтобы преодолеть эту проблему, настоящее изобретение также предусматривает создание второй библиотеки V-областей, которая создается с применением большего набора праймеров для 5'-конца V-области, чем традиционный набор (амплификация "Второго этапа"). Этот больший набор праймеров позволяет амплифицировать большее число последовательностей V-области, по сравнению с количеством, которое амплифицируется с применением традиционного набора праймеров. Конечно, поскольку эти праймеры предназначены для амплификации последовательностей зародышевого типа, а не тех последовательностей, которые подверглись соматическим мутациям, праймеры сами по себе будут вносить ошибки последовательностей в продукты амплификации (т.е. таким образом, что соматические мутации будут удалены и замещены последовательностями зародышевого типа). После применения фагового дисплея для изоляции тех V-областей в фаге, экспрессирующем scFv, которые связывают целевой Ag, нуклеиновые кислоты, кодирующие выявляемые V-области, затем секвенируют. С применением этой информации о последовательности, создают обратные праймеры, которые специфически амплифицируют эти нуклеиновые кислоты, и используют их наряду с прямыми праймерами лидерной последовательности для амплификации V-областей из первой библиотеки для того, чтобы выявить действительные и полные (подвергшиеся соматическим гипермутациям) последовательности Ag-специфических V-областей, которые возникают у донора, на основании которого была создана первая библиотека.
[0023] В дополнение к вышеизложенному, такой подход как протеомика, также используется там, где выделяют IgG плазмы (например, с применением хроматографии с выделением G-белка с последующей Ag-аффинной хроматографией). Полученную в результате Ag-специфическую смесь IgG дополнительно разделяют с применением капиллярного изоэлектрического фокусирования. IgG затем подвергают расщеплению под действием протеаз, а аминокислотные последовательности пептидного фрагмента определяют масс-спектрометрией (MS). В том случае, если амплификация второго этапа не может привести к созданию соответствующих подвергшихся соматической гипермутации последовательностей V-области (т.е. праймеры V-области зародышевого типа не были способны к кросс-гибридизации/отжигу с необходимой последовательностью 5'-конца V-области, которая содержала подвергшуюся соматической мутации последовательность, полученную в результате амплификации в первом цикле), информация, полученная при de novo секвенировании выделенных Ag-специфических IgG может применяться для выполнения секвенирования нуклеиновых кислот продуктов V-области кДНК, полученной на первом цикле. Более определенно, данные частичного секвенирования, полученные на основании de novo секвенирования белка способом MS, используются для конструирования обратных праймеров V-области. Эти обратные праймеры могут применяться вместе с прямыми праймерами лидерной последовательности для выявления и секвенирования 5'-концов V-области. После того, как эти подвергшиеся гипермутациям области выявлены, полные последовательности V-областей могут быть амплифицированы с применением традиционной ПЦР. Эти V-области могут быть собраны в полные, подвергшиеся соматической гипермутации антитела. Информация о последовательности пептида, полученная с применением MS, также может применяться для подтверждения того, что Ag-специфические V-области были корректно выявлены в процессе скрининга библиотеки.
[0024] Соответственно, настоящее изобретение представляет специфические по отношению к лидерной последовательности праймеры для амплификации нуклеиновой кислоты, кодирующей V-область человеческого иммуноглобулина. Праймеры могут включать (а) последовательность нуклеиновой кислоты, которая связывается при строгих условиях гибридизации с комплементарной цепью нуклеотидной последовательности, выбранной из SEQ ID NO:1-76, или (b) последовательность нуклеиновой кислоты, выбранную из SEQ ID NO:1-76.
[0025] В другом аспекте настоящее изобретение представляет набор специфических по отношению к лидерной последовательности праймеров для амплификации по меньшей мере 90% (например, по меньшей мере 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) нуклеиновых кислот, кодирующих V-область человеческого иммуноглобулина в образце человеческой ткани (например, периферической крови). Набор может быть таким, который амплифицирует 100% нуклеиновых кислот, кодирующих V-область человеческого иммуноглобулина в образце человеческой ткани. Набор может включать по меньшей мере 50 различных праймеров, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:1-76. Набор может также включать по меньшей мере 32 различных праймера, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:1-32. Набор может включать по меньшей мере 15 различных праймеров, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:33-48. Набор может включать по меньшей мере 27 различных праймеров, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:49-76.
[0026] Также настоящее изобретение включает фаговую библиотеку, которая содержит по меньшей мере 105 (например, по меньшей мере 105, 106 или 107) молекул нуклеиновых кислот, кодирующих тяжелые цепи иммуноглобулина, содержащих соматические гипермутации в первых 8 аминокислотах вариабельной области.
[0027] Настоящее изобретение дополнительно включает очищенное антитело, которое содержит последовательность вариабельной области, определенную путем скрининга библиотеки фагового дисплея, включая последовательности нуклеиновых кислот, кодирующие вариабельную область, выделенные путем ПЦР-амплификации В-лимфоцитов, выделенных из человеческого субъекта с применением специфических по отношению к лидерной последовательности праймеров.
[0028] В другом аспекте настоящее изобретение представляет способ, который включает этапы (а) применения первой ПЦР для амплификации нуклеотидных последовательностей тяжелых и легких цепей человеческого иммуноглобулина из образца человеческой ткани, содержащей В-лимфоциты, где для ПЦР-амплификации применяют специфические по отношению к лидерной последовательности праймеры; (b) выделения продуктов амплификации, полученных на первом этапе ПЦР; (с) создание первого набора конструктов путем встраивания выделенных продуктов амплификации, полученных на первом этапе ПЦР, в векторы экспрессии; и (d) введения первого набора конструктов в первый набор клеток-хозяев для создания первой библиотеки нуклеотидных последовательностей человеческого иммуноглобулина. В этом способе специфические по отношению к лидерной последовательности праймеры могут включать набор различных полинуклеотидов, каждый из которых связывается при строгих условиях гибридизации с комплементарной цепью отличающейся последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO:1-76. Способ может также включать один или несколько этапов (е) применения второй ПЦР для амплификации нуклеотидных последовательностей человеческого иммуноглобулина из первой библиотеки или образца человеческой ткани, где для ПЦР-амплификации применяют специфические по отношению к вариабельной области праймеры; (f) выделения второго набора продуктов амплификации, полученных на втором этапе ПЦР; (g) создания второго набора конструктов путем встраивания второго набора выделенных продуктов амплификации в векторы экспрессии; (h) введения второго набора конструктов во второй набор клеток-хозяев для создания второй библиотеки нуклеотидных последовательностей человеческого иммуноглобулина; (i) проведения скрининга второй библиотеки в отношении нуклеотидной последовательности, которая кодирует вариабельную область, которая специфически связывается с целевым антигеном; (j) получения последовательности нуклеотидной последовательности, кодирующую вариабельную область, которая специфически связывается с целевым антигеном; (k) применение полученной информации о последовательности для создания обратного праймера, специфического по отношению к нуклеотидной последовательности, кодирующей вариабельную область, которая специфически связывается с целевым антигеном; и (l) применения обратного праймера и специфических по отношению к лидерной последовательности праймеров на третьем этапе ПЦР для амплификации нуклеотидной последовательности из первой библиотеки, которая соответствует последовательности иммуноглобулина в В-лимфоците в образце человеческой ткани, которая способствует связыванию иммуноглобулина с целевым антигеном. Протеомика также может применяться в способах настоящего изобретения, которые описаны в данном документе.
[0029] Дополнительно настоящее изобретение включает библиотеку кДНК человеческих иммуноглобулинов, которая включает полный набор подвергшихся соматическим гипермутациям последовательностей V-областей.
[0030] Если не указано иное, то все технические термины, которые используются в данном документе, имеют то же значение, которое обычно понимается специалистом в той области техники, к которой относится настоящее изобретение. Обычно подразумеваемые определения биологических терминов можно найти в Rieger et al., Glossary of Genetics: Classical and Molecular, 5th edition, Springer-Verlag: New York, 1991; и Lewin, Genes V, Oxford University Press: New York, 1994. Обычно подразумеваемые определения медицинских терминов можно найти в Stedman's Medical Dictionary, 27th Edition, Lippincott, Williams & Wilkins, 2000.
[0031] Используемый в данном документе термин "антитело" или "АЬ" относится к иммуноглобулину (Ig), раствору идентичных или гетерогенных Ig или смеси Ig. Термин "антитело" также может относиться к фрагментам и сконструированным версиям Ig, таким как Fab, Fab' и F(ab')2 фрагменты; и scFv-фрагменты, гетероконъюгированные Ab и подобные искусственно созданные молекулы, которые задействуют CDR, полученные из Ig, для того, чтобы придать антигенную специфичность. Термином "моноклональное антитело" или "mAb" обозначается Ab, которое экспрессируется одной клональной линией В-клеток, или популяция молекул Ab, которые содержат только один вид антиген-связывающих сайтов, способных к иммунной реакции с определенным эпитопом определенного антигена. Термином "поликлональное антитело" или "поликлональное Ab" обозначают смесь гетерогенных антител. В типичном случае, поликлональное Ab будет включать множество различных молекул Ab, которые связываются с определенным антигеном, и при этом по меньшей мере некоторые из этих различных Ab вступают в иммунную реакцию с различными эпитопами антигена. Как используется в данном документе поликлональное антитело может быть смесью двух или нескольких mAb.
[0032] "Антиген-связывающий фрагмент" Ab содержится внутри вариабельной области Fab-фрагмента Ab и является фрагментом Ab, который придает Ab антиген-специфичность (т.е. типично трехмерный карман, сформированный CDR тяжелых и легких цепей Ab). "Fab-фрагмент" или "Fab область" представляет собой протеолитическую часть расщепляемого папином Ig, которая содержит антиген-связывающий фрагмент этого Ig. ''He-Fab-фрагмент" представляет собой тот фрагмент Ab, который находится вне Fab-фрагмента, например, "Fc-фрагмент" или "Fc-область." "Константная область" Ab представляет собой фрагмент Ab, расположенный вне вариабельной области.
[0033] В отношении белковой молекулы, такой как Ab, термин "очищенный" означает отделенный от компонентов, которые в естественных условиях сопутствуют таким молекулам. Обычно Ab или белок называют очищенным, когда по меньшей мере приблизительно 10% (например, 9%, 10%, 20%, 30% 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99%, 99,9% и 100%) по весу свободно от белков отличных от Ab или других встречающихся в природе органических молекул, с которыми Ab или белок связаны в естественных условиях. Чистоту можно измерить любым подходящим способом, например, путем колоночной хроматографии, электрофореза в полиакриламидном геле или HPLC-анализа. Химически синтезированный белок или другой рекомбинантный белок, продуцирован в типе клеток, отличном от типа клеток, в котором он встречается в природе, является "очищенным".
[0034] Под термином "связывать", "связываться" или "вступать в реакцию с" подразумевают, что одна молекула узнает и присоединяется к определенной второй молекуле в образце, но, по существу, не узнает или присоединяется к другим молекулам в образце. В целом, Ab, которое "специфически связывается" с другой молекулой, имеет Kd более чем приблизительно 103, 106, 107, 108, 109, 1010, 10" или 1012 литров/моль в отношении этой другой молекулы.
[0035] Как используется в данном документе термин "процент идентичности последовательности" по отношению к нуклеиновым кислотам и аминокислотам означает количество точных совпадений между двумя выровненными последовательностями, деленное на длину более короткой последовательности и умноженное на 100. Выравнивание последовательностей нуклеиновых кислот может быть выполнено, как описано в Smith and Waterman, Advances in Applied Mathematics 2:482-489 (1981), а в отношении аминокислотных последовательностей - как описано в Dayhoff, Atlas of Protein Sequences and Structure, M. 0. Dayhoff ed., 5 suppl. 3:353-358, National Biomedical Research Foundation, Washington, D.C., USA, и Gribskov (1986) Nucl. Acids Res. 14:6745. Две последовательности ДНК или две полипептидные последовательности являются "существенно гомологичными" друг другу, когда последовательности проявляют по меньшей мере приблизительно 80%-85%, по меньшей мере приблизительно 85%-90%, по меньшей мере приблизительно 90%-95% или по меньшей мере приблизительно 95%-98% идентичности последовательности в пределах заданной длины молекул, как определено с применением способов, описанных выше. Как используется в данном документе "существенно гомологичные" также относится к последовательностям, демонстрирующим полную идентичность по отношению к указанной последовательности ДНК или полипептидной последовательности. Последовательности ДНК, которые являются существенно гомологичными, могут быть выявлены в эксперименте, включающем Саузерн-гибридизацию, например, при жестких условиях, как определено для этой определенной системы. Определение соответствующих условий гибридизации находится в пределах знаний специалиста в данной области техники. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.; Nucleic Acid Hybridization: A Practical Approach, editors B. D. Hames and S. J. Higgins, (1985) Oxford; Washington, D.C.; IRL Press.
[0036] Как используется в данном документе термин "строгие условия гибридизации" означает гибридизацию в 6× натрия хлорида/натрия цитрата (SSC) при 45°С, с последующим отмыванием в 0,2×SSC, 0,1% SDS при по меньшей мере 60°С.
[0037] Хотя способы и материалы, аналогичные или эквивалентные тем, которые описываются в данном документе, могут применяться в практике или при тестировании настоящего изобретения, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, включены в полном объеме путем ссылки на них. В случае возникновения конфликта, контрольным документом будет выступать настоящее описание, включая приведенные определения. Кроме того, определенные варианты осуществления, которые рассматриваются ниже, являются только иллюстративными и не предназначены быть ограничительными.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
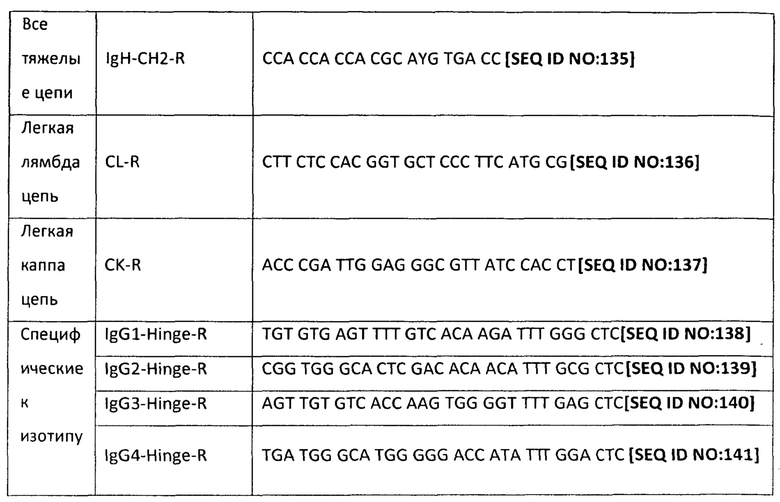
[0038] На фиг.1 представлено схематическое изображение этапа в стратегии настоящего изобретения для ПЦР-амплификации тяжелой цепи.
[0039] На фиг.2 представлено схематическое изображение другого этапа в стратегии настоящего изобретения для ПЦР-амплификации тяжелой цепи.
[0040] На фиг.3 представлено схематическое изображение этапа в стратегии настоящего изобретения для ПЦР-амплификации легкой цепи.
[0041] На фиг.4 представлено схематическое изображение другого этапа в стратегии настоящего изобретения для ПЦР-амплификации легкой цепи.
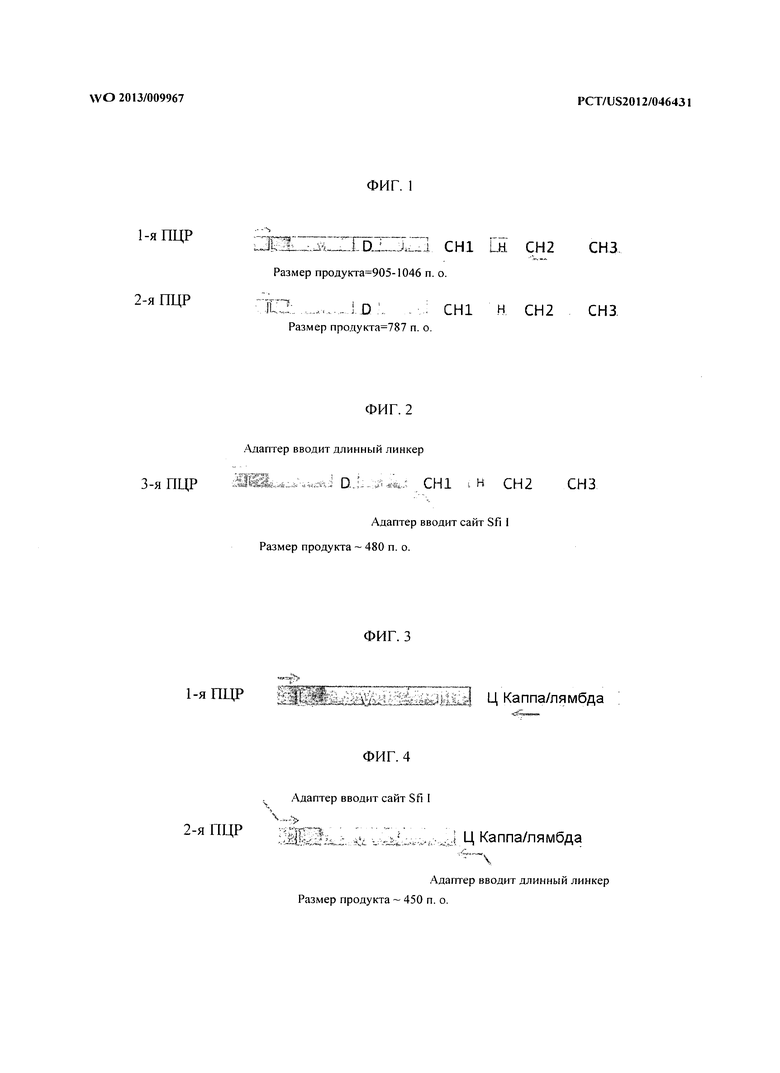
[0042] На фиг.5 представлен график, демонстрирующий, что присутствие лидерного пептида выше либо вариабельной области тяжелой цепи, либо вариабельной области легкой цепи подавляло связывание ScFv-фрагмента с его антигеном. ScFv-фрагмент, содержащий лидерную последовательность на тяжелой цепи (LC-LHC), лидерную последовательность на легкой цепи (LLC-HC) и лидерные последовательности на тяжелой и легкой цепях (LLC-LHC), снижает связывание с антигеном при сравнении с ScFv-фрагментами без лидерной последовательности (LC-HC).
ПОДРОБНОЕ ОПИСАНИЕ
[0043] Настоящее изобретение охватывает способы, композиции и наборы, относящиеся к выявлению последовательностей человеческих антител, содержащих соматические гипермутации. Описанные ниже предпочтительные варианты осуществления иллюстрируют адаптацию этих способов, композиций и наборов. Тем не менее, на основании описания этих вариантов осуществления могут быть созданы другие аспекты настоящего изобретения и/или применены на практике на основании описания, представленного ниже.
Общая методология
[0044] В данном документе описаны способы, включая традиционные иммунологические и молекулярно-биологические методы. Иммунологические способы (например, анализы для детектирования и локализации комплексов антиген-Ab, иммунопреципитация, иммуноблотинг и тому подобные) в целом известны в данной области и описаны в методологических трактатах, таких как Current Protocols in Immunology, Coligan et al., ed., John Wiley & Sons, New York. Молекулярно-биологические методы подробно описаны в таких трактатах, таких как Molecular Cloning: A Laboratory Manual. 2nd ed., vol. 1-3, Sambrook et al., ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2001; и Current Protocols in Molecular Biology, Ausubel et al., ed., Greene Publishing и Wiley-Interscience, New York. Способы анализа Ab описаны в Handbook of Therapeutic Abs, Dubel, S., ed., Wiley-VCH, 2007.
Обзор
[0045] В традиционных способах фагового и дрожжевого дисплея для выявления Ag-специфических V-областей Ig, ПЦР применяют для амплификации последовательностей нуклеиновых кислот, соответствующих V-областям тяжелых и/или легких цепей Ig. Прямые праймеры, которые запускают процесс ПЦР-амплификации, имеют последовательность нуклеиновой кислоты, которая комплементарна последовательности зародышевого типа, расположенной на 5'-конце каждой V-области, таким образом, что молекулы кДНК, кодирующие V-области будут амплифицироваться. В том случае, когда 5' V-генный сегмент отличается от последовательности зародышевого типа в связи с соматической гипермутацией, этот процесс ПЦР предпочтительно амплифицирует продукты, имеющие 5'-последовательность зародышевого типа, что ведет к утрате разнообразия в библиотеках фагового и дрожжевого дисплея.
[0046] В одном аспекте настоящего изобретения V-области амплифицируют с применением прямых праймеров, специфических по отношению к лидерной последовательности. Поскольку лидерная последовательность располагается чуть выше генов V-области, все последовательности V-области, включая последовательности с обширными мутациями 5'-конца, амплифицируют без утраты оригинальной последовательности 5' V-генного сегмента. Библиотеки, созданные с применением этого способа, таким образом, содержат более полный репертуар V-областей, чем библиотеки, подготовленные с применением традиционного способа. Эти библиотеки могут подвергаться скринингу в отношении Ag-специфических V-областей с применением клеток млекопитающих, сконструированных для экспрессии амплифицированных нуклеиновых кислот, кодирующих V-области. Путем эндогенных механизмов пост-трансляционного процессинга удаляют лидерный пептид, обеспечивая экспрессию конструктов V-области или нескольких V-областей (например, тяжелой и легкой цепей), исключая влияние лидерных пептидов на проведение скринингового исследования на связывание Ag. При выполнении методов дисплея с применением бактериофага, где лидерные пептиды могут влиять на проведение скринингового исследования на связывание Ag, настоящее изобретение также предусматривает создание второй библиотеки V-областей, созданной с применением большего, по сравнению с традиционным, набора праймеров для 5' V-области. Этот больший набор праймеров позволяет амплифицировать большее число последовательностей V-областей, по сравнению с числом последовательностей, которые могут быть амплифицированы с применением традиционного набора праймеров, но, как описано выше, вносит ошибки последовательностей в продукты амплификации. Фаговый дисплей применяют для скрининга в отношении этих V-областей в scFv, который связывается с высокой аффинностью с целевым Ag. Нуклеиновые кислоты, кодирующие выявленные V-области, затем секвенируют, и с использованием этой информации о последовательности создают обратные праймеры, специфически амплифицирующие эти нуклеиновые кислоты, и применяют их вместе с прямыми праймерами лидерной последовательности для амплификации V-областей из первой библиотеки для того, чтобы выявить действенные и полные последовательности Ag-специфических V-областей, которые возникают у донора, на основании которого была создана первая библиотека. Информация об аминокислотной последовательности из фрагментов Ig донора может применяться для содействия в выявлении нуклеиновых кислот, кодирующих тяжелые и легкие цепи Ab донора, а также для разработки ПЦР-праймеров для амплификации таких нуклеиновых кислот.
ПЦР-праймеры
[0047] Один аспект настоящего изобретения включает прямые ПЦР-праймеры для амплификации V-областей тяжелых и легких цепей человеческих Ig из нуклеотидов, кодирующих их лидерные последовательности. Набор (например, из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или большего числа) таких праймеров, которые могут применяться для амплификации 100% этих последовательностей является предпочтительным для обнаружения V-областей низкой частоты встречаемости, хотя также может применяться набор праймеров, который обнаруживает 100% (например, 70-99, 70-75, 75-80, 80-85, 85-90, 90-95 или 95-99%) этих последовательностей. Пример набора этих праймеров приведен ниже в Таблицах 1А, 1В и 1C. С применением этих наборов праймеров (или набора с праймерами, которые являются существенно гомологичными таковым в Таблицах 1А, 1В и 1C) и соответствующих обратных праймеров, поскольку лидерная последовательность располагается чуть выше генов V-области, могут быть амплифицированы все последовательности V-области, включая последовательности с обширными мутациями на 5'-конце.


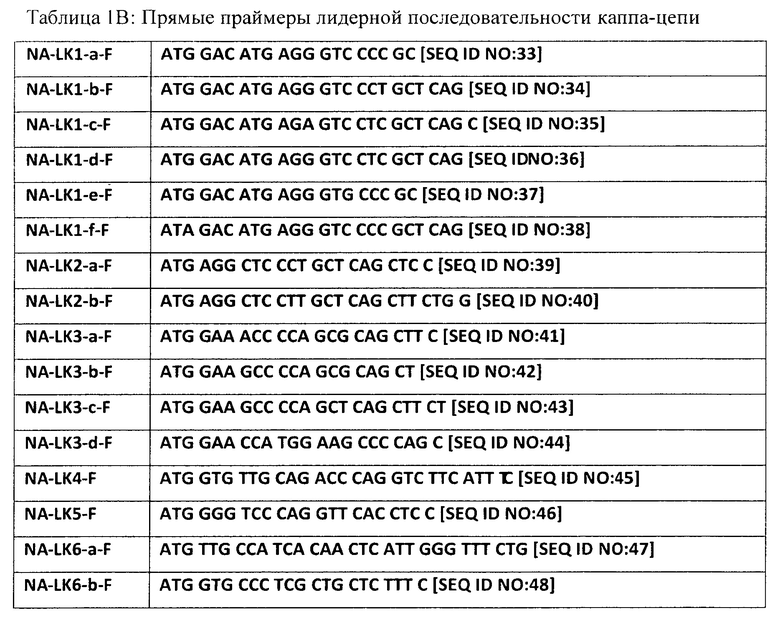


[0048] В другом аспекте настоящего изобретения набор ПЦР-праймеров V-области может применяться для амплификации нуклеиновых кислот, кодирующих вариабельные области тяжелой и легкой цепей Ig. Предпочтительными наборами таких праймеров являются те, которые позволяют амплифицировать большее число последовательностей V-области, по сравнению с числом последовательностей, которые могут быть амплифицированы с применением традиционного набора праймеров. Набор таких праймеров, который может применяться для амплификации 100% этих последовательностей является предпочтительным для обнаружения V-областей низкой частоты встречаемости, хотя также может применяться набор праймеров, который обнаруживает 100% (например, 70-99, 70-75, 75-80, 80-85, 85-90, 90-95 или 95-99%) этих последовательностей. Примеры наборов таких праймеров представлены ниже в Таблицах 2 и 3. С применением этих наборов праймеров (или набора с праймерами, которые являются существенно гомологичными таковым в Таблицах 2 и 3) и соответствующих обратных праймеров, большинство, если не все последовательности V-области могут быть амплифицированы ПЦР, хотя этот процесс вносит ошибки в эти цепи с подвергшимся гипермутациям 5' V-областями (что может быть устранено, как описано в данном документе). Для создания scFv каждый из прямых праймеров, которые описываются в данном документе, могут быть сконструирован таким образом, чтобы включить соответствующие линкерные последовательности, такие как последовательность длинного линкера GGTGGTTCCTCTAGATCTTCCTCCTCTGGTGGCGGTGGCTCGGGCGGTGGTGGG [SEQ ID NO:176] (которая может располагаться в направлении 5' от последовательности праймера для тяжелой цепи и использоваться с подходящим обратным праймером, таким как SEQ NO: 99, который показан в нижней части Таблицы 2) или линкерные последовательности, расположенные выше последовательности праймера в SEQ ID NO:142-175 (используемые с соответствующими обратными праймерами, такими как SEQ ID NO:114, 133 и 134).



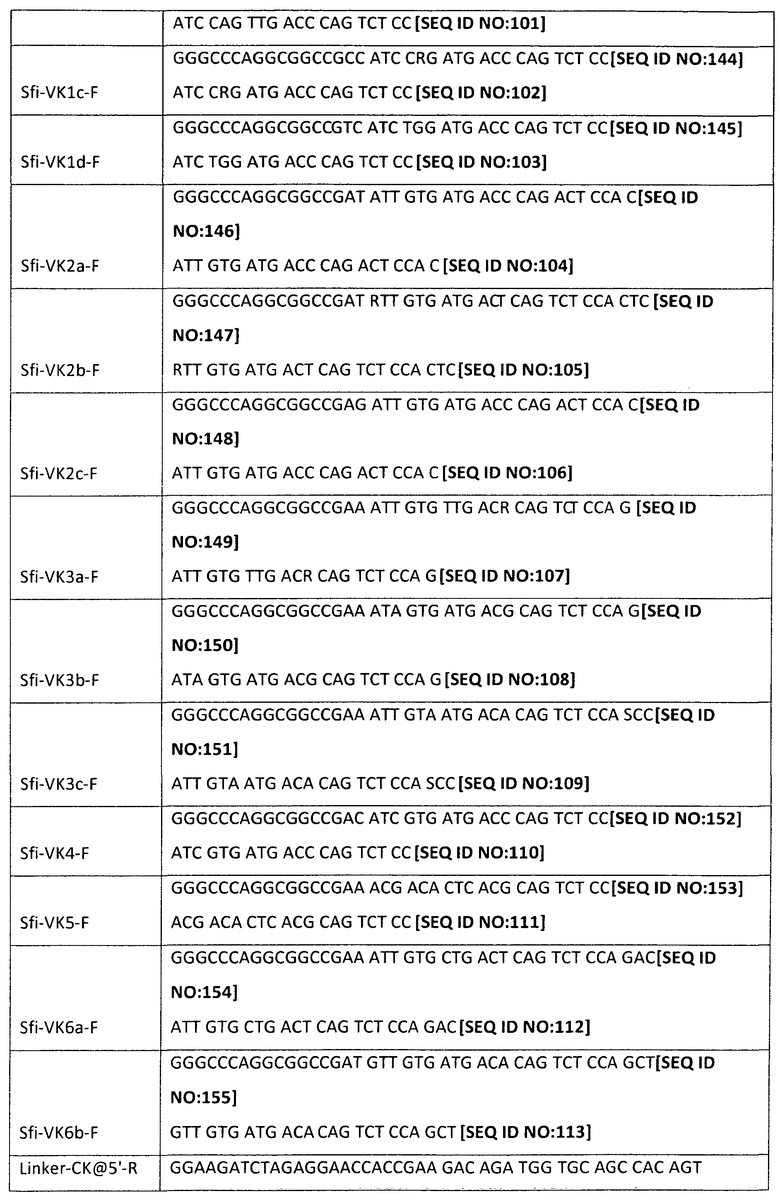

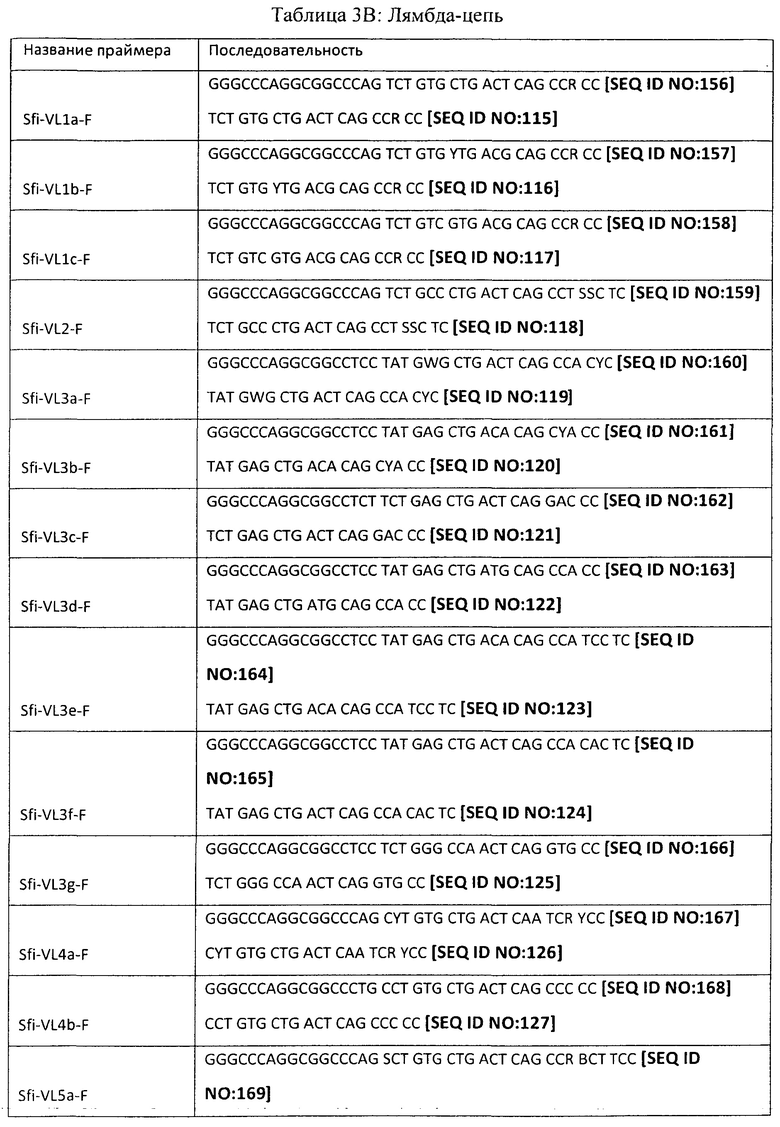
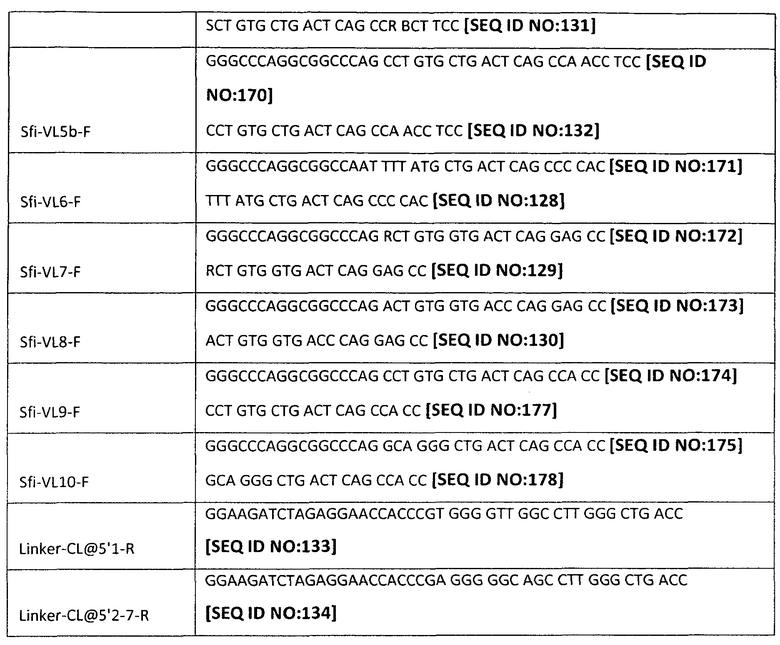
[0049] Настоящее изобретение может также включать набор обратных ПЦР-праймеров для амплификации V-областей тяжелой и легкой цепи человеческого Ig из последовательности, локализованной в направлении 3' от нуклеотидов, кодирующих V-область (например, последовательности нуклеиновых кислот, кодирующие шарнирную или константную область). Обратные праймеры могут быть выбраны для того, чтобы обеспечить амплификацию всех подклассов изотипа Ig (например, гамма, мю, альфа, эпсилон, каппа, лямбда и т.д.) или отдельных подклассов тяжелых цепей (например, гамма 1, гамма 2, гамма 3, гамма 4, альфа 1 и альфа 2) для получения более направленных библиотек. Отдельные последовательности таких обратных праймеров могут быть определены специалистом в данной области на основании опубликованных последовательностей изотипа Ig. Репрезентативные примеры показаны в Таблице 4 ниже:
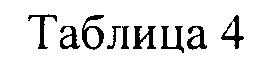
(0050] Хотя вышеуказанные специфические праймеры являются предпочтительными, другие праймеры, которые гибридизуются с комплементарной цепью специфических указанных в настоящем документе последовательностей при условиях гибридизации, применяемых при ПЦР-амплификации, или также могут применяться строгие условия гибридизации. Например, праймеры, обладающие по меньшей мере 75% (например, по меньшей мере 80%, 85%, 90% или 95%) идентичностью последовательностей по отношению к комплементарным цепям специфических последовательностей, указанных в настоящем документе, или являющиеся существенно гомологичными по отношению к ним и/или связывающиеся с ними при строгих условиях гибридизации. Длина этих последовательностей может варьировать в диапазоне приблизительно (+/-5 нуклеотидов) 15-100, 17-50, 18-40 или 20-30 нуклеотидов.
Библиотеки V-областей
[0051] Продукты амплификации тяжелых и легких цепей Ig, полученные с применением вышеуказанных праймеров в процессе ПЦР могут применяться для создания библиотек V-областей. Например, нуклеиновые кислоты, кодирующие цепи Ig, могут встраиваться в векторы, и образуемые в результате конструкты могут вводиться в клетки-хозяева (например, прокариотические клетки, такие как клетки бактерий, или эукариотические клетки, такие как дрожжевые клетки или клетки млекопитающих) для создания библиотеки.
[0052] В качестве одного примера, нуклеиновые кислоты, кодирующие встречающиеся в естественных условиях Ig, могут быть получены из донорского образца, содержащего В-лимфоциты (например, мононуклеарные клетки периферической крови, выделенные В-клетки или клетки плазмы, лейкоцитарные пленки, образцы костного мозга, лимфатических узлов, селезенки или клеток ЦНС). В типичном случае, образцы получают от доноров-людей, у которых ранее было установлено наличие Ab, характерных для целевых Ag, представляющих интерес (например, методами ELISA или RIA). Для выявления Ab к собственным Ag предпочтительными донорами являются те, которые имеют цитокин-специфические аутоантитела (например, к интерферону гамма, альфа фактору некроза опухоли, интерлейкину 4 и интерлейкину 10, GM-CSF, эритропоэтину, IL-6, IL-17, IL-22, интерферону-α, интерферону-β, IL-2, IL-8, фактору роста эндотелия сосудов и/или гранулоцитарному колониестимулирующему фактору), и те, которые имеют аутоиммунные заболевания, такие как ревматоидный артрит или волчанка.
[0053] В одном способе из этих клеток экстрагируют общую РНК и проводят обратную транскрипцию с применением полиА-праймеров. Полученную кДНК применяют в качестве матрицы для ПЦР-амплификации с применением описанных выше праймеров и подходящей стратегии ПЦР, например, как та, которая описана в примерах ниже. Продукты ПЦР, имеющие правильный размер, могут быть визуализированы на агарозном геле, выделены и очищены. Очищенные продукты могут затем подвергаться расщеплению с применением подходящего фермента рестрикции (например, NotI или NcoI для V-области тяжелой цепи и SfiI или SalI для V-области легкой цепи). Расщепленные фрагменты могут снова быть очищены с применением гель-фильтрации и вшиты под действием лигазы (например, Т4 ДНК-лигазы) в вектор (например, фагмидный вектор, ранее линеаризованный с применением либо NotI/NcoI, либо SfiI/SalI). Лигированные продукты могут быть перенесены посредством электропорации в компетентные клетки-хозяева (например, Е. со/г) для подготовки библиотек тяжелых и легких цепей. Специфические по отношению к изотипу и подклассу библиотеки могут быть созданы с применением обратных праймеров, специфических для изотипа или подкласса.
Библиотеки дисплея
[0054] Библиотеки тяжелых и легких цепей могут применяться для создания других библиотек клеток, которые отображают Fab-, scFv-фрагменты или другие Ab-подобные конструкты, которые содержат тяжелые и легкие цепи. Такие библиотеки могут быть созданы путем выделения нуклеиновых кислот, кодирующих тяжелые и легкие цепи, с применением вышеописанных способов или путем повторной очистки этих нуклеиновых кислот из существующих библиотек V-областей. Встраивая выделенные нуклеиновые кислоты, кодирующие тяжелые и легкие цепи, в подходящие векторы и экспрессируя эти конструкты в клетках-хозяевах, комбинации тяжелых и легких цепей могут оцениваться в отношении связывания с Ag и/или подвергаться нескольким циклам отбора для того, чтобы выявить те из них, которые связывают целевой Ag с высокой аффинностью. Они могут быть охарактеризованы путем секвенирования. См., например, Clackson et al., Nature 352:624-628, 1991; McCafferty et al., Nature 348:552-554, 1990; и Kang et al., Proc. Nat'l Acad. Sci. 88:4363-4366, 1991.
[0055] Для приготовления scFv-библиотеки, амплифицированные VH- и VL-гены очищают с применением гель-фильтрации на агарозе, и scFv-гены собирают путем перекрывающейся ПЦР с применением VH- и VL-фрагментов в качестве матрицы. Сначала VH- и VL-фрагменты собирают с участием линкера путем ПЦР без праймеров, при которой короткие области комплементарности, расположенные на концах линкера, обеспечивают гибридизацию различных фрагментов. ПЦР проводят сначала в отсутствие праймеров, а затем после добавления внешних праймеров. ScFv-фрагменты расщепляют под действием подходящего фермента, очищают в агарозном геле, а затем лигируют в вектор фагового дисплея, который был вырезан с применением того же фермента рестрикции. Лигированные продукты встраивают (например, путем электропорации) в компетентные клетки-хозяева (например, бактерии, дрожжи или клетки млекопитающих), и клетки, высеянные и культивированные на подходящих клонах, затем соскабливают с культуральных чашек в подходящую среду для замораживания, и замораживают (например, в среде-супер бульоне с 10% глицерина при -70°С). Библиотеки Fab-фрагментов могут быть получены аналогичным образом, но без применения линкера. Ag-специфические Fab- и scFv-фрагменты могут быть получены путем методов скрининга библиотек бактериального фагового дисплея, дрожжевого дисплея и/или дисплея клеток млекопитающих с применением таких способов отбора как пэннинг и сортировка клеток, с применением автоматизированного устройства для скрининга/отбора (например, системы CLONEPIX™) и разделений с применением магнитного микроносителя.
[0056] Экспрессия нуклеиновых кислот V-области, амплифицированных с применением праймеров лидерной последовательности ведет к встраиванию лидерных пептидов в белковый продукт V-области. Когда клетки млекопитающих, такие как клетки СНО. применяют для экспрессии этих нуклеиновых кислот, путем эндогенных механизмов посттрансляционного процессинга лидерный пептид удаляется, обеспечивая экспрессию конструктов V-области или нескольких V-областей (например, тяжелой и легкой цепей), исключая влияние лидерных пептидов на проведение скринингового исследования на связывание Ag. Однако при выполнении методов дисплея с применением бактериофага лидерные пептиды не удаляются. Присутствие лидерных пептидов может влиять на проведение скринингового исследования на связывание Ag и таким образом предотвращать определение V-областей с высокой аффинностью к целевому Ag.
[0057] Чтобы преодолеть эту проблему настоящее изобретение также предусматривает создание второй библиотеки V-областей, созданной с применением большего, по сравнению с традиционным, набора праймеров для 5'-конца V-области. Этот больший набор праймеров позволяет амплифицировать большее число последовательностей V-областей, по сравнению с числом последовательностей, которые могут быть амплифицированы с применением традиционного набора праймеров. Конечно, поскольку эти праймеры предназначены для амплификации последовательностей зародышевого типа, а не тех последовательностей, которые подверглись соматическим мутациям, праймеры сами по себе будут вносить ошибки последовательностей в продукты амплификации (т.е. таким образом, что соматические мутации удаляются и замещаются последовательностями зародышевого типа). Фаговый дисплей применяется для скрининга в отношении присутствия этих V-областей в scFv-фрагменте, который связывается с высокой аффинностью с целевым Ag. Нуклеиновые кислоты, кодирующие выявляемые V-области, затем секвенируют, и, используя эту информацию о последовательностях, создают обратные праймеры, которые специфически амплифицируют эти нуклеиновые кислоты, и применяют их вместе с прямыми праймерами лидерной последовательности для амплификации V-областей из первой библиотеки (продукты которых были амплифицированы с применением праймеров лидерной последовательности) для того, чтобы выявить действенные и полные последовательности Ag-специфических V-областей, которые возникают у донора, на основании которого была создана первая библиотека.
Ag-специфические человеческие mAb или другие Ag-нацеленные конструкты
[0058] V-области тяжелой цепи и/или легкой цепи (или их фрагменты, такие как CDR), выявленные как участвующие в связывании определенного целевого Ag, могут применяться для создания Ag-нацеленных конструктов, в том числе Ab полной длины, части Ab, сконструированные Ab и белки слияния. Ab полной длины и другие Ag-нацеленные конструкты могут содержать последовательности не V-областей, кодирующие последовательности Ig, специфичные по отношению к определенному изотипу или подклассу, например, IgG1, IgG2, IgG3, IgG4, IgD, IgA1, IgA2, IgE или IgM. Fab- фрагментом может быть Fab', F(ab)2, F(ab')2, F(ab)3, Fv, scFv, dsFv, Fd или dAb. Сконструированными Ab могут быть минитела, диатела, триатела, тетратела или каппа-тела. Ag-связывающие конструкты могут создаваться с применением методов рекомбинации или инжиниринга белков, например, где V-области или CDR-области вводятся в оставшиеся фрагменты конструктов на уровне нуклеиновых кислот.
Протеомика
[0059] В дополнение к вышеизложенному, подход протеомики также применяют там, где Ag-специфические Ab в образце донорской ткани (например, IgG плазмы) выделяют с применением известных методов (например, хроматография на протеин G, протеин А, протеин L или ионообменная хроматография с последующей Ag-аффинной хроматографией). Полученную в результате смесь Ag-специфических Ab дополнительно разделяют, например, с применением капиллярного изоэлектрического фокусирования. Ig затем подвергают расщеплению под действием протеаз, а аминокислотные последовательности пептидного фрагмента определяют с помощью MS. Информация о пептидной последовательности может затем применяться для подтверждения того, что Ag-специфические V-области были корректно выявлены в процессе скрининга библиотеки, и также могут быть разработаны ПЦР-праймеры для амплификации Ag-специфических V-областей из ранее подготовленных библиотек.
Наборы
[0060] Один или несколько наборов ПЦР-праймеров, которые описываются в данном документе, и/или библиотеки, которые описываются в данном документе, могут быть собраны в набор, который может включать инструкции по применению.
ПРИМЕРЫ
Пример 1: Стратегия ПЦР
[0061] Как показано на Фиг.1, проводят три цикла ПЦР для тяжелой цепи и два цикла ПЦР для легкой цепи. Библиотеку кДНК, созданная из человеческих РВМС, применяют в качестве матрицы, и первый цикл ПЦР проводят с применением различных прямых праймеров лидерной последовательности (см. таблицу 1А) и обратного праймера, расположенного в СН2-области тяжелой цепи. Размер образующегося в результате продукта ПЦР составляет 905-1046 нуклеотидов, в зависимости от подкласса IgG. Во втором цикле ПЦР используют тот же самый прямой праймер, что и в первом цикле, но обратные праймеры, расположенные в шарнирных областях четырех различных классов тяжелых цепей IgG с применением обратных праймеров, перечисленных в таблице 4. Этот этап приводит к специфической в отношении подкласса амплификации тяжелых цепей. Как показано на Фиг.2, в третьем цикле ПЦР для тяжелой цепи используют прямые праймеры, расположенные на 5'-конце V-области (см. таблицу 3) и обратный праймер, расположенный на 5'-конце СН1-домена. Прямые праймеры имеют адаптеры, которые вводят длинный линкер для ScFv-фрагмента, а обратный праймер имеет адаптер, который вводит сайт SfiI.
[0062| Для легких цепей, как показано на Фиг.3, библиотеку кДНК РВМС также применяют в качестве матрицы, и первый цикл ПЦР проводят с применением прямых праймеров и обратных праймеров лидерных последовательностей, расположенных в Сκ и Сλ-областях каппа- и лямбда-цепей. Образующийся в результате продукт ПЦР переносят на агарозный гель, и для каппа-цепи продукт длиной ~550 п.о. очищают с применением гель-фильтрации и применяют в качестве матрицы во втором цикле ПЦР-реакции.'Для лямбда-цепи продукт длиной ~630 п.о. очищают с применением гель-фильтрации и применяют в качестве матрицы во втором цикле ПЦР-реакции. Обратные праймеры перечислены в таблице 4. Обращаясь к Фиг.4, второй цикл ПЦР для легкой цепи использует прямые праймеры, расположенные на 5'-конце V-области, и обратный праймер, расположенный на 5'-конце Сκ или Сλ доменов. Прямые праймеры имеют адаптеры, которые вводят сайт SfiI, а обратный праймер имеет адаптер, который вводит длинную линкерную последовательность.
[0063] Проводят ПЦР с перекрыванием и удлинением продуктов, где продукты ПЦР тяжелой цепи, полученные в 3ем цикле, смешивают с продуктами ПЦР с равными соотношениями каппа- и лямбда-цепей, полученными во 2ом цикле, для получения перекрывающихся продуктов. Перекрывающиеся продукты амплифицируют с применением прямых праймеров, специфичных по отношению к адаптеру легкой цепи. и обратных праймеров, специфичных по отношению к адаптеру тяжелой цепи, для создания ScFv-фрагментов. ScFv-фрагменты расщепляют под действием SfiI и клонируют в вектор pComb3X.
Пример 2: ПЦР с применением праймеров V-области
[0064] Следующий эксперимент был проведен для того, чтобы исследовать влияние лидерной последовательности на связывание с фагом. Был создан тестовый ScFv-фрагмент, содержащий и не содержащий лидерные последовательности тяжелой и легкой цепей, и получена его экспрессия на поверхности фага. Фаги использовали в анализе ELISA к конкретным антигенам. На Фигуре 5 показано, что присутствие лидерного пептида выше либо вариабельной области тяжелой цепи, либо вариабельной области легкой цепи ингибирует связывание ScFv-фрагмента с антигеном.
[0065] На основании вышеописанного результата, специфические праймеры V-областей применяют в последнем цикле ПЦР, на котором вводят длинный линкер и сайт SfiI. После секвенирования высокоаффинных антиген-специфических вероятных ScFv-фрагментов, праймер конструируется в области каркасного участка 2 в качестве обратного праймера, а прямой праймер, специфический по отношению к лидерной последовательности, применяется на 2ом продукте ПЦР тяжелой цепи и 1ом продукте ПЦР легких цепей, для получения корректной 5'-последовательности V-области. Корректная V-область применяется для создания антител полной'длины для анализов биологической активности.
Пример 3: Открытие тяжелых и легких цепей, которые связывают человеческий цитокин
[0066] С применением способов и композиций, описанных выше, были выявлены гены тяжелых и легких цепей человека, кодирующие два различных моноклональных антитела к цитокину человека. Оба эти моноклональные антитела проявляли высокую аффинность в отношении связывания с антигеном (в диапазоне от наномоль до пикамоль). Это указывает, что способы и композиции настоящего изобретения применимы для выявления антител низкой частоты встречаемости (в этом случае антитела были против антигена самого организма-хозяина) из генома человека.
Другие варианты осуществления
[0067] Следует понимать, что поскольку настоящее изобретение было описано в связи с его подробным описанием, вышеуказанное описание предназначено для того, чтобы проиллюстрировать и при этом не ограничить объем настоящего изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в рамках объема следующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Выявление аффинно-зрелых человеческих антител | 2012 |
|
RU2762685C2 |
| ПРОДУЦИРУЮЩИЕ АНТИТЕЛА МЛЕКОПИТАЮЩИЕ, НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ | 2009 |
|
RU2559524C2 |
| ПРОДУЦИРУЮЩИЕ АНТИТЕЛА МЛЕКОПИТАЮЩИЕ, НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ | 2020 |
|
RU2820926C2 |
| ПРОДУЦИРУЮЩИЕ АНТИТЕЛА МЛЕКОПИТАЮЩИЕ, НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ | 2009 |
|
RU2731084C2 |
| МЫШИ, ЭКСПРЕССИРУЮЩИЕ ОГРАНИЧЕННЫЙ РЕПЕРТУАР ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНА | 2014 |
|
RU2689664C2 |
| МЫШЬ С ОБЩЕЙ ЛЕГКОЙ ЦЕПЬЮ | 2013 |
|
RU2683514C2 |
| СИСТЕМА ИНДИКАЦИИ НА ОСНОВЕ ПОЛНОРАЗМЕРНОГО АНТИТЕЛА ДЛЯ ЭУКАРИОТИЧЕСКИХ КЛЕТОК И ЕЕ ПРИМЕНЕНИЕ | 2012 |
|
RU2625033C2 |
| МЫШИ, ЭКСПРЕССИРУЮЩИЕ ОГРАНИЧЕННЫЙ РЕПЕРТУАР ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНА | 2014 |
|
RU2812814C2 |
| ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ K ИНТЕРЛЕЙКИНУ 1-АЛЬФА | 2021 |
|
RU2838383C1 |
| СПОСОБ КЛОНИРОВАНИЯ КОГНАТНЫХ АНТИТЕЛ | 2008 |
|
RU2459868C2 |



































Изобретения касаются способов для создания библиотеки нуклеотидных последовательностей человеческого иммуноглобулина для выявления последовательностей нуклеиновых кислот, кодирующих подвергшиеся соматической гипермутации вариабельные области иммуноглобулина, которые способствуют связыванию с представляющим интерес антигеном, и наборов для использования в указанных способах. Способ для создания библиотеки включает: этап ПЦР для амплификации нуклеотидных последовательностей лидерной и V-области тяжелых и легких цепей человеческого иммуноглобулина из кДНК библиотеки, созданной из образца человеческих мононуклеарных клеток периферической крови, полученных из донора-человека, у которого ранее было выявлено наличие антител, специфичных к представляющему интерес антигену, где для ПЦР-амплификации применяют набор специфических по отношению к лидерной последовательности праймеров, включающий специфические по отношению к 90% всех лидерных последовательностей праймеров. Выделение продуктов амплификации, полученных на этапе ПЦР. Создание набора конструктов путем встраивания выделенных продуктов амплификации, полученных на этапе ПЦР, в векторы экспрессии. Введение набора конструктов в набор клеток-хозяев для создания библиотеки нуклеотидных последовательностей человеческого иммуноглобулина. Способ выявления последовательностей включает: в качестве первого этапа получение библиотеки нуклеотидных последовательностей по предыдущему способу. Второй этап ПЦР для амплификации нуклеотидных последовательностей человеческого иммуноглобулина из полученной библиотеки или образца человеческой ткани. Выделение второго набора продуктов амплификации. Создание второго набора. Введение второго набора конструктов во второй набор клеток-хозяев. Проведение скрининга второй библиотеки. Получение нуклеотидной последовательности, кодирующей вариабельную область, которая специфически связывается с целевым антигеном. Создание обратного праймера и его применение на третьем этапе ПЦР. Изобретения обеспечивают выявление более полных библиотек V–областей, кодирующих последовательности антител, содержащие критически важные соматические мутации для получения высокоаффинных антител. 6 н.п. ф-лы, 5 ил., 4 табл., 3 пр.
1. Способ для создания библиотеки нуклеотидных последовательностей человеческого иммуноглобулина для выявления последовательностей нуклеиновых кислот, кодирующих подвергшиеся соматической гипермутации вариабельные области иммуноглобулина, которые способствуют связыванию с представляющим интерес антигеном, включающий этапы:
(a) применения этапа ПЦР для амплификации нуклеотидных последовательностей лидерной и V-области тяжелых и легких цепей человеческого иммуноглобулина из кДНК библиотеки, созданной из образца человеческих мононуклеарных клеток периферической крови, полученных из донора-человека, у которого ранее было выявлено наличие антител, специфичных к представляющему интерес антигену, где для ПЦР-амплификации применяют набор специфических по отношению к лидерной последовательности праймеров, включающий специфические по отношению к лидерной последовательности праймеры, специфические к по меньшей мере 90% всех лидерных последовательностей человеческих вариабельных областей;
(b) выделения продуктов амплификации, полученных на этапе ПЦР;
(c) создания набора конструктов путем встраивания выделенных продуктов амплификации, полученных на этапе ПЦР, в векторы экспрессии; и
(d) введения набора конструктов в набор клеток-хозяев для создания библиотеки нуклеотидных последовательностей человеческого иммуноглобулина.
2. Способ для выявления последовательности нуклеиновой кислоты, кодирующей подвергшуюся соматической гипермутации вариабельную область иммуноглобулина, которая способствует связыванию с представляющим интерес антигеном, включающий этапы:
(a) применения первого этапа ПЦР для амплификации нуклеотидных последовательностей лидерной и V-области тяжелых и легких цепей человеческого иммуноглобулина из кДНК библиотеки, созданной из образца человеческих мононуклеарных клеток периферической крови, полученных из донора-человека, у которого ранее было выявлено наличие антител, специфичных к представляющему интерес антигену, где для ПЦР-амплификации применяют набор специфических по отношению к лидерной последовательности праймеров;
(b) выделения продуктов амплификации, полученных на первом этапе ПЦР;
(c) создания первого набора конструктов путем встраивания выделенных продуктов амплификации, полученных на первом этапе ПЦР, в векторы экспрессии; и
(d) введения первого набора конструктов в первый набор клеток-хозяев для создания первой библиотеки нуклеотидных последовательностей человеческого иммуноглобулина;
(e) применения второго этапа ПЦР для амплификации нуклеотидных последовательностей человеческого иммуноглобулина из первой библиотеки или образца человеческой ткани, где для ПЦР-амплификации применяют специфические по отношению к вариабельной области праймеры;
(f) выделения второго набора продуктов амплификации, полученных на втором этапе ПЦР;
(g) создания второго набора конструктов путем встраивания второго набора выделенных продуктов амплификации в векторы экспрессии;
(h) введения второго набора конструктов во второй набор клеток-хозяев для создания второй библиотеки нуклеотидных последовательностей человеческого иммуноглобулина;
(i) проведения скрининга второй библиотеки в отношении нуклеотидной последовательности, которая кодирует вариабельную область, которая специфически связывается с целевым антигеном;
(j) получения последовательности нуклеотидной последовательности, кодирующей вариабельную область, которая специфически связывается с целевым антигеном;
(k) применения полученной информации о последовательности для создания обратного праймера, специфического по отношению к нуклеотидной последовательности, кодирующей вариабельную область, которая специфически связывается с целевым антигеном;
(l) применения обратного праймера и специфических по отношению к лидерной последовательности праймеров на третьем этапе ПЦР для амплификации нуклеотидной последовательности из первой библиотеки, которая соответствует последовательности иммуноглобулина в В-лимфоците в образце человеческой ткани, которая способствует связыванию иммуноглобулина с представляющим интерес антигеном.
3. Набор специфических по отношению к лидерной последовательности праймеров для использования в способе по п. 2, содержащий по меньшей мере 50 различных праймеров, и каждый из различных праймеров содержит отличающуюся последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-76.
4. Набор специфических по отношению к лидерной последовательности праймеров для использования в способе по п. 2, содержащий по меньшей мере 32 различных праймера, и каждый из различных праймеров содержит отличающуюся последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 1-32.
5. Набор специфических по отношению к лидерной последовательности праймеров для использования в способе по п. 2, содержащий по меньшей мере 15 различных праймеров, и каждый из различных праймеров содержит отличающуюся последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 33-48.
6. Набор специфических по отношению к лидерной последовательности праймеров для использования в способе по п. 2, содержащий по меньшей мере 27 различных праймеров, и каждый из различных праймеров содержит отличающуюся последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 49-76.
| POTJAMAS PANSERI et al., A compact phage display human scFv library for selection of antibodies to a wide variety of antigens, BMC Biotechnol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| JACOB GLANVILLE et al., Precise determination of the diversity of a combinatorial antibody library gives insight into the human immunoglobulin reperto, PNAS December 1, 2009, vol | |||
| Светоэлектрический измеритель длин и площадей | 1919 |
|
SU106A1 |
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| JAMES W | |||
| LARRICK et al., Polymerase Chain Reaction Using Mixed Primers: Cloning of Human Monoclonal Antibody Variable Region Genes from Single Hybridoma Cells, Nature Biotechnology, 1989, Vol | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| LARRICK JW et al., Rapid cloning of rearranged immunoglobulin genes from human hybridoma cells using mixed primers and the polymerase chain reaction, Biochem Biophys Res Commun, 1989 May 15, Vol.160, No.3, pp.1250-6 | |||
| MICHAEL J | |||
| CAMPBELL et al., Use of family specific leader region primers for PCR amplification of the human heavy chain variable region gene repertoire, Molecular Immunology, 1992, Vol | |||
| Солесос | 1922 |
|
SU29A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| АНАЛИЗ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ И ЕГО ПРИМЕНЕНИЕ | 2004 |
|
RU2370775C2 |
Авторы
Даты
2017-11-17—Публикация
2012-07-12—Подача