Данное изобретение относится к новой солевой форме агониста дофамина 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина (I):
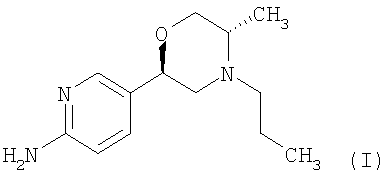
Более конкретно, данное изобретение относится к 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-(1S)-камфорсульфонату (ди-S-камсилату) и к способам получения, к промежуточным соединениям, используемым при получении данной соли, к композициям, содержащим данную соль, и к применениям данной соли.
Согласно описанию международной патентной заявки WO 2004/052372 было показано, что соединение формулы (I) представляет собой избирательный агонист D3, полезный для лечения и/или предупреждения сексуальной дисфункции, например женской сексуальной дисфункции (ЖСД), конкретно женского расстройства полового возбуждения (ЖРПВ), и мужской сексуальной дисфункции, конкретно мужской эректильной дисфункции (MЭД). Подразумевается, что мужская сексуальная дисфункция в том виде, как на нее здесь ссылаются, включает расстройства эякуляции, такие как преждевременная эякуляция, аноргазмию (неспособность достигнуть оргазма) или расстройства желания, такие как гипоактивное сексуальное расстройство желания (ГСРЖ; недостаток интереса к сексу). Подразумевается, что женская сексуальная дисфункция в том виде, как на нее здесь ссылаются, включает гипоактивное сексуальное расстройство желания, расстройство полового возбуждения, расстройства оргазма и болевые сексуальные расстройства. Это соединение также является полезным в лечении нейропсихиатрических расстройств и нейродегенеративных расстройств.
Форма свободного основания 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина имеет низкую температуру плавления и также является расплывающейся за счет поглощения влаги. Эти свойства делают данное соединение нежелательным выбором для включения в фармацевтическую композицию.
Примечательно то, что было обнаружено, что 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрат имеет преимущество обладания требуемыми свойствами, делающими возможным его приготовление в виде лекарственного средства. А именно, он не является расплывающимся за счет поглощения влаги, имеет высокую температуру плавления, не является гигроскопичным и имеет кристаллическую форму.
Кроме того, 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-8-камсилата моногидрат обладает следующими дополнительными полезными свойствами, которые делают его даже более соответствующим условиям, применяемым в производстве фармацевтического лекарственного продукта в промышленном масштабе, именно:
Он не теряет воду через 3,5 часа в условиях относительной влажности (ОВ) 0% и при 30°С. Типично ожидалось бы, что фармацевтический гидрат потеряет воду в пределах нескольких часов воздействия ОВ 0%. Кроме того, при нагревании образца 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата в токе с ОВ 0% факт потери влаги наблюдали при 85°С. Это значительно более высокая температура, чем температура, которая обычно ожидалась бы для гидратированной соли. Такая кинетическая стабильность является желательной для обеспечения успешного размола данного соединения перед его приготовлением в виде препарата.
Многие гидраты являются нестабильными в жестких условиях вакуумной сушки, требующейся при выделении фармацевтического лекарственного продукта. Однако 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-5-камсилата моногидрат был бы стабильным в таком процессе, поскольку при воздействии пониженного парциального давления при 40°С данный гидрат сохраняется вплоть до снижения давления до 10 мбар (1 кПа).
Настоящее изобретение включает следующие воплощения:
а) 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат:
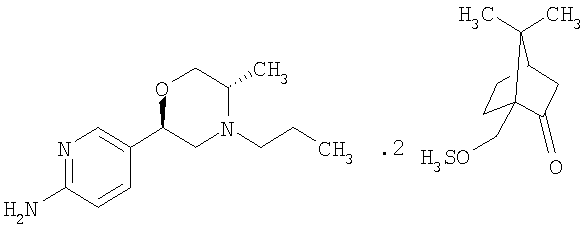
б) Соединение согласно а) в форме моногидрата.
в) Соединение согласно б), имеющее основные характеристические пики на картине дифракции рентгеновских лучей на порошке 6,3, 12,7, 15,1, 16,3 и 25,6 градусов 28.
г) Соединение согласно а), б) или в), имеющее энантиомерный избыток по меньшей мере 80%.
д) Соединение согласно г), имеющее энантиомерный избыток по меньшей мере 95%.
е) Фармацевтическая композиция, содержащая 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат и фармацевтически приемлемый разбавитель или носитель.
ж) Фармацевтическая композиция согласно е), где 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-5-камсилат находится в форме моногидрата.
з) Способ получения 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-3-камсилата моногидрата, включающий взаимодействие соединения формулы (X)
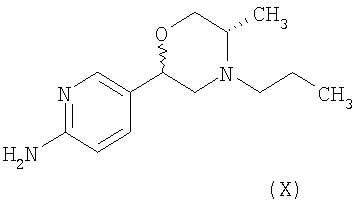
с (1S)-10-камфорсульфоновой кислотой в подходящем растворителе.
и) Способ согласно з), где растворителем является ацетон/вода.
й) Способ согласно и), где количество используемой воды находится в интервале от 0,7 л до 1 л воды на кг 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина.
к) Способ согласно и), где количество используемой воды находится в интервале от 0,8 л до 0,9 л воды на кг 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина.
л) Соединение формулы (VII)
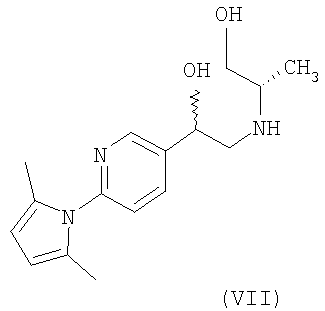
и его фармацевтически приемлемые соли и сольваты.
Соединение по изобретению может существовать, в зависимости от атмосферных условий (температура и влажность), в несольватированной и сольватированной формах. Термин «сольват» используется здесь для описания молекулярного комплекса, содержащего соединение по изобретению и одну или более чем одну молекулу фармацевтически приемлемого растворителя, например, этанола. Термин «гидрат» используется, когда указанным растворителем является вода. Соответственно, настоящее изобретение дополнительно включает фармацевтически приемлемые сольваты 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата.
Принятой в настоящее время системой классификации органических гидратов является система, которая определяет гидраты с изолированным сайтом, канальные гидраты и гидраты, координированные ионом металла - см. Polymorphism in Pharmaceutical Solids K.R. Morris (Ed. H.G.Brittain, Marcel Dekker, 1995). Гидраты с изолированным сайтом представляют собой гидраты, в которых молекулы воды изолированы от непосредственного контакта друг с другом органическими молекулами, находящимися между ними. В канальных гидратах молекулы воды лежат в каналах кристаллической решетки, где они находятся рядом с другими молекулами воды. В гидратах, координированных ионом металла, молекулы воды связаны с ионом металла.
Когда растворитель или вода являются прочно связанными, данный комплекс будет иметь хорошо определенную стехиометрию, независимо от влажности. Однако когда растворитель или вода являются слабо связанными, как в канальных сольватах и гигроскопических соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях нестехиометрические количества будут нормой.
Также включенными в объем данного изобретения являются многокомпонентные комплексы (отличные от солей и сольватов), где лекарственное средство и по меньшей мере один другой компонент присутствуют в стехиометрических или нестехиометрических количествах. Комплексы этого типа включают клатраты (комплексы включения лекарственное средство-хозяин) и сокристаллы. Последние обычно определяют как кристаллические комплексы нейтральных молекулярных компонентов, которые связаны друг с другом через нековалентные взаимодействия, но они также могли бы быть комплексом нейтральной молекулы с солью. Сокристаллы можно получить кристаллизацией из расплава, перекристаллизацией из растворителей или путем физического растирания компонентов друг с другом - см. Chem Commun, 17, 1889-1896, О.Almarsson, M.J.Zaworotko (2004). Что касается общего обзора многокомпонентных комплексов, см. J Pharm Sci, 64 (8), 1269-1288, Haleblian (август 1975).
Данное изобретение также включает все полиморфы и кристаллические формы 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата.
Настоящее изобретение включает все фармацевтически приемлемые меченые изотопами соединения 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и его моногидрата, где один или более чем один атом заменен атомами, имеющими тот же самый атомный номер, но атомную массу или массовое число, отличные от атомной массы или массового числа, которые превалируют в природе.
Примеры изотопов, подходящих для включения в соединение по изобретению, включают изотопы водорода, такие как 2H и 3Н, углерода, такие как 11С, 13С и 14С, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, и серы, такие как 35S.
Определенные меченые изотопами соединения по изобретению, например соединения, включающие радиоактивный изотоп, являются полезными в исследованиях распределения в тканях лекарственного средства и/или субстрата. Радиоактивные изотопы тритий, то есть 3Н, и углерод-14, то есть 14С, являются особенно полезными для этой цели в виду легкости их включения и простых способов обнаружения.
Замещение более тяжелыми изотопами, такими как дейтерий, то есть 2Н, может дать определенные терапевтические преимущества, происходящие из-за большей метаболической стабильности, например повышенного периода полураспада in vivo или пониженных требований по дозировке, и, следовательно, может быть предпочтительным в некоторых случаях.
Замещение изотопами, излучающими позитроны, такими как 11С, 18F, 15О и 13N, может быть полезным в исследованиях позитронно-эмиссионной томографией (ПЭТ) для изучения занятия рецептора субстратом.
Меченые изотопами соединения 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата обычно можно получить традиционными методиками, известными специалистам в данной области, или способами, аналогичными способам, описанным в сопровождающем экспериментальном разделе, используя подходящий меченый изотопами реагент вместо немеченого реагента, использованного ранее.
Фармацевтически приемлемые сольваты по данному изобретению включают сольваты, где растворитель кристаллизации может быть замещенным изотопами, например D2О, d6-ацетон, d6-DIVISO.
5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрат можно получить согласно следующей схеме. Специалисты в данной области могут знать другие способы синтеза, которые могут быть в равной степени осуществимыми.
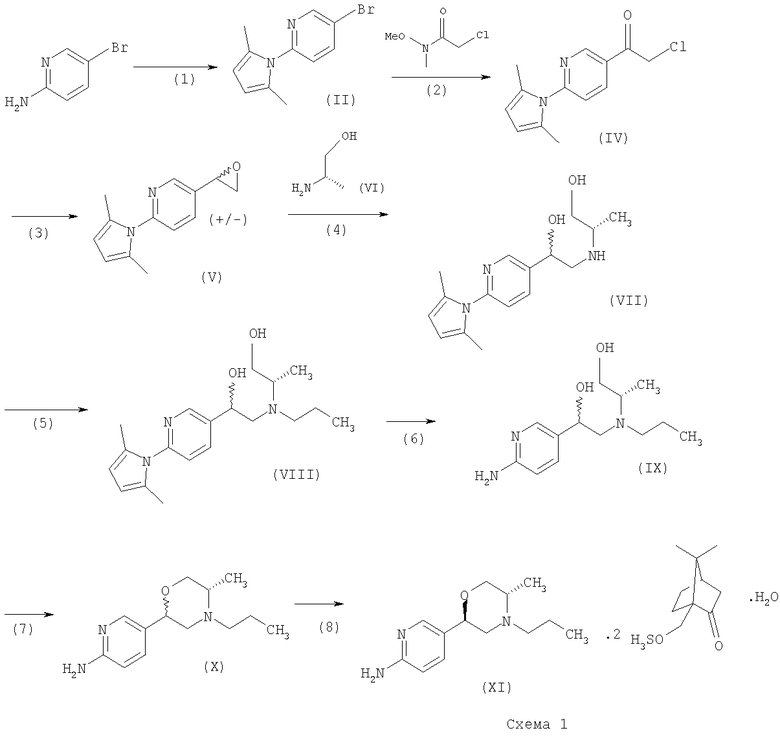
2-Амино-5-бромпиридину позволяют взаимодействовать с (1) 2,5-гександионом и п-толуолсульфоновой кислотой в условиях реакции Дина-Старка (Dean-Stark) в подходящем растворителе (таком как гептан) с получением защищенного бромпиридина (II). Бромпиридин (II) затем обрабатывают (2) н-бутиллитием в подходящем растворителе (таком как третичный-бутил-метиловый эфир) при пониженной температуре. Затем добавляют раствор амида (III) с получением хлоркетона (IV). Этот кетон затем превращают в эпоксид (V) путем (3) восстановления подходящим восстанавливающим агентом (таким как боргидрид натрия) в подходящем растворителе (таком как тетрагидрофуран) с последующей обработкой подходящим основанием (таким как гидроксид натрия). Эпоксид (V) подвергают (4) нуклеофильной атаке (S)-(+)-2-амино-1-пропанолом (VI) в подходящем растворителе (таком как тетрагидрофуран) при повышенной температуре с получением амина (VII). Амин (VII) затем превращают в соединение (VIII) путем (5) восстановительного алкилирования с пропиональдегидом в присутствии подходящего восстанавливающего агента (такого как триацетоксиборгидрид натрия). Соединение (VIII) превращают в соединение (IX) путем (6) снятия защиты гидроксиламином в подходящем растворителе (таком как этанол) при повышенной температуре. Соединение (X) генерируют путем (7) циклизации соединения (IX) в кислотных условиях. Наконец, 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрат (XI) генерируют путем (8) взаимодействия соединения (X) с (1S)-10-камфорсульфоновой кислотой в подходящем растворителе (таком как ацетон/вода) с последующей кристаллизацией соли.
5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат и его полиморфы и фармацевтически приемлемые сольваты имеют пользу в качестве избирательного агониста D3 при лечении болезненных состояний.
Соответственно, в первом другом воплощении согласно настоящему изобретению предложено применение 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-8-камсилата и его полиморфов и фармацевтически приемлемых сольватов в медицине.
5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат и его полиморфы и фармацевтически приемлемые сольваты могут быть особенно подходящими для лечения женской сексуальной дисфункции, мужской эректильной дисфункции, боли, нейродегенерации, депрессии и психиатрических расстройств.
Соответственно, во втором другом воплощении согласно настоящему изобретению предложено применение 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-3-камсилата и его полиморфов и фармацевтически приемлемых сольватов в изготовлении лекарственного средства для лечения и/или предупреждения сексуальной дисфункции; причем подходящие состояния включают женскую сексуальную дисфункцию (ЖСД), конкретно женское расстройство полового возбуждения (ЖРПВ), и мужскую сексуальную дисфункцию, конкретно мужскую эректильную дисфункцию (MЭД). Подразумевается, что мужская сексуальная дисфункция в том виде, как на нее здесь ссылаются, включает расстройства эякуляции, такие как преждевременная эякуляция, аноргазмия (неспособность достижения оргазма) или расстройства желания, такие как гипоактивное сексуальное расстройство желания (ГСРЖ; недостаток интереса к сексу). Подразумевается, что женская сексуальная дисфункция в том виде, как на нее здесь ссылаются, включает гипоактивное сексуальное расстройство желания, расстройство полового возбуждения, расстройства оргазма и болевые сексуальные расстройства.
В третьем другом воплощении согласно настоящему изобретению предложено применение 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и его полиморфов и фармацевтически приемлемых сольватов в получении лекарственного средства для лечения мужской эректильной дисфункции.
В четвертом другом воплощении согласно настоящему изобретению предложено применение 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и его полиморфов и фармацевтически приемлемых сольватов в получении лекарственного средства для лечения женской сексуальной дисфункции, конкретно женского расстройства полового возбуждения и гипоактивного сексуального расстройства желания.
Соль по настоящему изобретению также может быть полезной в лечении боли, конкретно хронической ноцицептивной боли, но не ограничиваясь ею.
Физиологическая боль является важным защитным механизмом, предназначенным для предупреждения об опасности от потенциально вредных стимулов из внешней среды. Данная система действует через конкретный набор первичных сенсорных нейронов и активируется вредными стимулами через периферические преобразующие механизмы (см. для обзора Millan, 1999, Prog. Neurobiol., 57, 1-164). Эти сенсорные волокна известны как ноцицепторы и представляют собой аксоны характерно малого диаметра с медленными скоростями проводимости. Ноцицепторы кодируют интенсивность, продолжительность и качество вредного стимула и, благодяря их топографически организованной проекции в спинной мозг, расположение стимула. Ноцицепторы находятся на ноцицептивных нервных волокнах, которых существует два главных типа: А-дельта волокна (миелинизированные) и С волокна (немиелинизированные). Активность, генерированная входом ноцицептора, после сложной обработки в спинном роге переносится либо прямо, либо через передающие ядра ствола мозга, в вентробазальный таламус и затем на кору, где генерируется ощущение боли.
Боль обычно можно классифицировать как острую или хроническую. Острая боль начинается внезапно и является кратковременной (обычно длящейся двенадцать недель или менее). Она обычно связана с конкретной причиной, такой как конкретное повреждение, и часто является резкой и сильной. Она представляет собой тип боли, который может иметь место после конкретных повреждений, происходящих в результате хирургического вмешательства, лечения зубов, растяжения или вывиха. Острая боль обычно не приводит к какой-либо постоянной психологической реакции. Напротив, хроническая боль представляет собой длительную боль, обычно сохраняющуюся в течение более чем трех месяцев и приводящую к значительным психологическим и эмоциональным проблемам. Обычными примерами хронической боли является невропатическая боль (например, болезненная диабетическая нейропатия, постгерпетическая невралгия), синдром канала запястья, боль в спине, головная боль, боль при раковом заболевании, артритная боль и хроническая постхирургическая боль.
Когда происходит существенное повреждение ткани организма, посредством заболевания или травмы, характеристики активации ноцицептора изменяются и имеет место сенсибилизация на периферии, местно вокруг повреждения и в центральной нервной системе, где заканчиваются ноцицепторы. Эти эффекты приводят к усиленному ощущению боли. При острой боли эти механизмы могут быть полезными в стимуляции защитных поведенческих реакций, которые могут лучше обеспечить ход процессов восстановления. Нормальным предсказанием было бы то, что чувствительность вернулась бы к обычной, как только данное повреждение было бы вылечено. Однако при многих состояниях хронической боли гиперчувствительность продолжается значительно дольше процесса заживления и часто является обусловленной повреждением нервной системы. Это повреждение часто приводит к ненормальностям в сенсорных нервных волокнах, связанным с неправильной адаптацией и нарушенной активностью (Woolf& Salter, 2000, Science, 288, 1765-1768).
Клиническая боль присутствует, когда дискомфорт и ненормальная чувствительность являются характерной чертой среди симптомов пациента. Пациенты имеют тенденцию быть довольно гетерогенными и могут иметь различные болевые симптомы. Такие симптомы включают: 1) спонтанную боль, которая может быть тупой, жгучей или стреляющей; 2) преувеличенные болевые реакции на вредные стимулы (гипералгезия); и 3) боль, производимую обычно безвредными стимулами (аллодиния - Meyer et al., 1994; Textbook of Pain, 13-44). Несмотря на то, что пациенты, страдающие от различных форм острой и хронической боли, могут иметь сходные симптомы, лежащие в их основе механизмы могут быть разными и, следовательно, могут требовать разных стратегий лечения. Боль, следовательно, также можно разделить на целый ряд разных подтипов согласно отличающейся патофизиологии, включая ноцицептивную, воспалительную и невропатическую боль.
Ноцицептивная боль индуцирована повреждением ткани или интенсивными стимулами, имеющими потенциал вызвать повреждение. Болевые афферентные волокна активируются преобразованием стимулов ноцицепторами в месте повреждения и активируют нейроны в спинном мозге на уровне их окончания. Это затем передается вверх по спинномозговым путям к головному мозгу, где воспринимается боль (Meyer et al., 1994; Textbook of Pain, 13-44). Активация ноцицепторов активирует два типа афферентных нервных волокон. Миелинизированные А-дельта волокна проводят быстро и являются ответственными за ощущения резкой и стреляющей боли, тогда как немиелинизированные С волокна передают с более медленной скоростью и сообщают тупую или ноющую боль. Ноцицептивная боль от умеренной до сильной является заметной характеристикой боли, возникающей в результате травмы центральной нервной системы, растяжений/вывихов, ожогов, инфаркта миокарда и острого панкреатита, постоперационной боли (боли после любого типа хирургической операции), посттравматической боли, почечной колики, боли при раковом заболевании и боли в спине. Боль при раковом заболевании может быть хронической болью, такой как боль, связанная с опухолью (например, боль в кости, головная боль, лицевая боль или висцеральная боль), или болью, связанной с терапией рака (например, постхимиотерапевтический синдром, синдром хронической постхирургической боли или пострадиотерапевтический синдром). Боль при раковом заболевании также может иметь место в ответ на химиотерапию, иммунотерапию, гормональную терапию или радиотерапию. Боль в спине может быть обусловлена грыжами межпозвоночных дисков или разорванными межпозвоночными дисками или отклонениями в поясничных фасеточных суставах, крестцово-подвздошных сочленениях, параспинальных мышцах или задней продольной связке. Боль в спине может пройти естественным способом, но у некоторых пациентов, где она продолжается свыше 12 недель, она становится хроническим состоянием, которое может быть особенно изнуряющим.
Невропатическую боль в настоящее время определяют как боль, инициируемую или вызываемую первичным повреждением или дисфункцией в нервной системе. Повреждение нервов может быть вызвано травмой и заболеванием, и, таким образом, термин «невропатическая боль» охватывает много расстройств с разными этиологиями. Они включают, но не ограничиваются, периферической невропатией, диабетической невропатией, постгерпетической невралгией, невралгией тройничного нерва, болью в спине, раковой невропатией, невропатией при ВИЧ, фантомной болью, синдромом канала запястья, центральной постинсультной болью и болью, связанной с хроническим алкоголизмом, гипотиреозом, уремией, рассеянным склерозом, повреждением спинного мозга, болезнью Паркинсона, эпилепсией и недостаточностью витаминов. Невропатическая боль является патологической, так как она не имеет защитной роли. Она часто присутствует намного позднее исчезновения первоначальной причины, часто продолжаясь в течение многих лет, значительно снижая качество жизни пациента (Woolf and Mannion, 1999, Lancet, 353, 1959-1964). Симптомы невропатической боли трудно лечить, так как они часто являются гетерогенными даже среди пациентов с одним и тем же заболеванием (Woolf & Decosterd, 1999, Pain Supp., 6, S141-S147; Woolf and IVIannion, 1999, Lancet, 353, 1959-1964). Они включают спонтанную боль, которая может быть длительной, пароксизмальной или ненормальной индуцированной болью, такой как гипералгезия (повышенная чувствительность к вредному стимулу) и аллодиния (чувствительность к обычно безвредному стимулу).
Воспалительный процесс представляет собой комплексный каскад биохимических и клеточных событий, активируемых в ответ на повреждение ткани или присутствие чужеродных веществ, который приводит к опуханию и боли (Levine and Taiwo, 1994, Textbook of Pain, 45-56). Артритная боль является самой распространенной воспалительной болью. Ревматоидное заболевание является одним из самых распространенных хронических воспалительных заболеваний в развитых странах, и ревматоидный артрит является распространенной причиной инвалидности. Точная этиология ревматоидного артрита является неизвестной, но текущие гипотезы предполагают, что важными могут быть как генетические, так и микробиологические факторы (Grennan & Jayson, 1994, Textbook of Pain, 397-407). Оценили, что почти 16 миллионов американцев имеют симптоматический остеоартрит (OA) или дегенеративную болезнь суставов, большинству из которых более 60 лет, и ожидается, что это число возрастет до 40 миллионов, по мере увеличения возраста населения, делая его проблемой здравоохранения огромного масштаба (Houge & Mersfelder, 2002, Ann Pharmacother, 36, 679-686; McCarthy et al., 1994, Textbook of Pain, 387-395). Большинство пациентов с остеоартритом требуют медицинского внимания из-за связанной с ним боли. Артрит имеет значительное влияние на психосоциальную и физическую функцию, и известно, что он является ведущей причиной инвалидности в старческом возрасте. Анкилозирующий спондилоартрит также представляет собой ревматическое заболевание, которое вызывает артрит сочленений позвоночника и крестцово-подвздошных сочленений. Он варьирует от периодических эпизодов боли в спине, которые случаются на протяжении всей жизни, до серьезного хронического заболевания, которое поражает позвоночник, периферические сочленения и другие органы тела.
Другим типом воспалительной боли является висцеральная боль, которая включает боль, связанную с воспалительным заболеванием кишечника (ВЗК). Висцеральная боль представляет собой боль, связанную с внутренними органами, которая охватывает органы брюшной полости. Эти органы включают половые органы, селезенку и часть пищеварительной системы. Боль, связанную с внутренними органами, можно разделить на висцеральную боль органов пищеварения и висцеральную боль, не связанную с органами пищеварения. Обычно встречающиеся желудочно-кишечные (ЖК) расстройства, которые вызывают боль, включают функциональное расстройство кишечника (ФРК) и воспалительное заболевание кишечника (ВЗК). Эти ЖК расстройства включают широкий спектр болезненных состояний, которые в настоящее время контролируются только в умеренной степени, включая, в том, что касается ФРК, желудочно-пищеводный рефлюкс, диспепсию, синдром раздраженного кишечника (СРК) и синдром функциональной абдоминальной боли, и в том, что касается ВЗК, болезнь Крона, илеит и неспецифический язвенный колит, которые все регулярно дают висцеральную боль. Другие типы висцеральной боли включают боль, связанную с дисменореей, циститом и панкреатитом, и боль в области таза.
Следует отметить, что некоторые типы боли имеют множественные этиологии и, таким образом, могут классифицироваться в более чем одной области, например боль в спине и боль при раковом заболевании имеют и ноцицептивный, и невропатический компоненты.
Другие типы боли включают:
- боль, происходящую от скелетно-мышечных расстройств, включающих миалгию, фибромиалгию, спондилит, серонегативные (неревматоидные) артропатии, несуставной ревматизм, дистрофинопатию, гликогенолиз, полимиозит и пиомиозит;
- сердечную и сосудистую боль, включая боль, вызванную стенокардией, инфарктом миокарда, митральным стенозом, перикардитом, феноменом Рейно, склередемой и ишемией скелетных мышц;
- головную боль, такую как мигрень (включая мигрень с аурой и мигрень без ауры), гистаминовую головную боль, головную боль напряжения, смешанную головную боль и головную боль, связанную с сосудистыми расстройствами; и
- ротолицевую боль, включая зубную боль, ушную боль, синдром жжения во рту и височно-нижнечелюстную миофасциальную боль.
Следовательно, в другом пятом предпочтительном воплощении согласно настоящему изобретению также может быть предложено применение 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и его полиморфов и фармацевтически приемлемых сольватов в приготовлении лекарственного средства для лечения или предупреждения боли. Кроме того, согласно настоящему изобретению также может быть предложено применение 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и его полиморфов и фармацевтически приемлемых сольватов в приготовлении лекарственного средства для лечения или предупреждения хронической ноцицептивной боли.
В другом шестом предпочтительном воплощении согласно настоящему изобретению также может быть предложено применение 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата и его полиморфов и фармацевтически приемлемых сольватов в приготовлении лекарственного средства для лечения нейропсихиатрических расстройств или нейродегенеративных расстройств, причем подходящие состояния могут включать гипертензию, нейродегенерацию, психиатрические расстройства, депрессию (например, депрессию у пациентов с раковыми заболеваниями, депрессию у пациентов с болезнью Паркинсона, депрессию после инфаркта миокарда, субсиндромную симптоматическую депрессию, депрессию у бесплодных женщин, большую депрессию, депрессию у детей, вызванную злоупотреблением, послеродовую депрессию и синдром раздражительного пожилого человека), одиночные эпизодические или рецидивные большие депрессивные расстройства, дистимические расстройства, депрессивный невроз и невротическую депрессию, меланхолическую депрессию, включая анорексию, потерю массы тела, бессонницу, раннее пробуждение утром или психомоторную заторможенность; атипическую депрессию (или реактивную депрессию), включая повышенный аппетит, гиперсомнию, психомоторное возбуждение или раздражительность, сезонное аффективное расстройство и педиатрическую депрессию; биполярные расстройства или маниакальную депрессию, например биполярное расстройство I, биполярное расстройство II и циклотимическое расстройство; расстройство поведения; расстройство, связанное с агрессивным поведением, трихотилломанию, клептоманию, синдром дефицита внимания с гиперактивностью (СДВГ); поведенческие расстройства, связанные с умственной отсталостью, аутизм, пограничное личностное расстройство; расстройство, связанное с замкнутостью личности; тревожные расстройства, такие как паническое расстройство с агорафобией или без нее, агорафобия без истории панического расстройства, специфические фобии, например специфические фобии по отношению к животным, тревожность в общественных местах, социальную фобию, обсессивно-компульсивное расстройство, стрессовые расстройства, включающие посттравматическое стрессовое расстройство и острое стрессовое расстройство, расстройства генерализованной тревоги; эмоциональную лабильность, патологический плач; шизофрению и другие психотические расстройства, например шизофреноформные расстройства, шизоаффективные расстройства, расстройства, связанные с бредом, краткие психотические расстройства, общие психотические расстройства, психотические расстройства с бредом или галлюцинациями, психотические эпизоды тревоги, тревогу, связанную с психозом, психотические расстройства настроения, такие как тяжелое большое депрессивное расстройство; расстройства настроения, связанные с психотическими расстройствами, такие как острая мания и депрессия, связанная с биполярным расстройством; расстройства настоения, связанные с шизофренией; расстройства питания (например, нервная анорексия и нейрогенная булимия), ожирение; расстройства двигательной активности, такие как акинезии, дискинезии, включая семейные пароксизмальные дискинезии, спастичности, синдром Туретта, синдром Скотта, параличи (palsys) и акинетический ригидный синдром; экстрапирамидальные расстройства двигательной активности, такие как расстройства двигательной активности, индуцированные лекарственными средствами, например паркинсонизм, индуцированный нейролептиками, злокачественный нейролептический синдром, острая дистония, индуцированная нейролептиками, острая акатизия, индуцированная нейролептиками, поздняя дискинезия, индуцированная нейролептиками, и постуральный тремор, индуцированный лекарственным средством; химические зависимости и пристрастия (например, зависимости от или пристрастия к алкоголю, героину, кокаину, бензодиазепинам, никотину или фенобарбитолу), и поведенческие пристрастия, такие как пристрастие к азартным играм; и глазные расстройства, такие как глаукома и ишемическая ретинопатия; синдром усталых ног, болезнь Гентингтона, рассеянный склероз, умеренное ухудшение познавательной способности, синдром Дауна, инсульт, наследственная мозговая геморрагия с амилоидозом голландского типа, мозговая амилоидная ангиопатия, делирий, деменция, связанное с возрастом снижение познавательной способности (ARCD), амнестические и другие когнитивные или нейродегенеративные расстройства, такие как болезнь Паркинсона (БП), болезнь Гентингтона (БГ), болезнь Альцгеймера, старческая деменция, деменция альцгеймеровского типа, расстройства памяти, потеря исполнительной функции, сосудистая деменция, деменции смешанного сосудистого и дегенеративного происхождения, деменция, связанная с болезнью Паркинсона, деменция, связанная с прогрессирующим супрануклеарным параличом, деменция, связанная с кортикобазальной дегенерацией, мультиинфарктная деменция, деменция у алкоголиков или другие деменции, связанные с лекарственными средствами, деменция, связанная с внутричерепными опухолями или мозговой травмой, деменция, связанная с болезнью Гентингтона, болезнь Пика, болезнь Крейтцфельда-Якоба, деменция, связанная с ВИЧ или СПИД, болезнь Альцгеймера с тельцами Леви диффузного типа, лобно-височные деменции с паркинсонизмом (FTDP), травма головы, повреждение спинного мозга, демиелинизирующие заболевания нервной системы, периферическая невропатия, боль, мозговая амилоидная ангиопатия, боковой амиотрофический склероз, рассеянный склероз, дискинезия, связанная с терапией агонистами дофамина, задержка умственного развития, расстройства обучения, включающие расстройство чтения, расстройство математических способностей или расстройство письменного выражения мыслей; связанное с возрастом снижение познавательной способности, амнестические расстройсва, паркинсонизм, индуцированный нейролептиками, поздние дискинезии и острые и хронические нейродегенеративные расстройства; предменструальный синдром, синдром фибромиалгии, недержание мочи при напряжении, эндокринные расстройсва (например, гиперпролактинемия), спазм сосудов (особенно в сосудистой системе мозга), мозжечковая атаксия, расстройства желудочно-кишечного тракта (включающие изменения сократительной способности и секреции), гистаминовую головную боль, мигрень, боль, хроническую пароксизмальную гемикранию, головную боль (связанную с сосудистыми расстройствами), расстройство сна (катаплексия) и шок.
В другом воплощении настоящее изобретение дополнительно включает применения, перечисленные выше, где 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амин ди-S-камсилат находится в форме моногидрата.
Активность в отношении рецептора дофамина D3 можно определить, используя способы, описанные в WO 2004/052372, которая включена в данное описание изобретения посредством ссылки. При использовании этого анализа 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-3-камсилата моногидрат имеет функциональную активность в отношении рецептора D3, выраженную как ЕС50, 21 нM, и 476-кратную селективность к D3 по сравнению с D2. Селективность рассчитывают как значение ЕС50 D2, поделенное на значение ЕС50 D3.
Подходящие анализы для определения пользы соединений по данному изобретению при разных болевых состояниях описаны ниже.
Невропатическая боль
Активность соединения при лечении невропатической боли можно измерить согласно следующему протоколу анализа.
Животные: Самцов крыс Sprague Dawley размещают группами. Всех животных содержат в условиях 12-часового цикла свет/темнота (свет включают в 07 ч 00 мин) без ограничения в корме и воде. Все эксперименты проводили методом слепого наблюдения в отношении лечения и согласно Акту о домашних и офисных животных (научные процедуры) 1986 (Home Office Animals (Scientific Procedures) Act 1986).
Крысиная модель хронического повреждения перетягиванием (CCl) невропатической боли
CCl седалищного нерва проводили, как описано ранее Bennett и Xie (Bennett GJ, Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain: 33:87-107, 1988). Животных анестезировали смесью 2%-ного изофлуорана/О2. Правое заднее бедро брили и смазывали 1%-ным йодом. Затем животных переносили на гомойотермное одеяло на время процедуры и поддерживали анестезию во время хирургического вмешательства через носовой обтекатель. Кожу разрезали вдоль линии бедренной кости. Общий седалищный нерв обнажали в середине бедра путем тупой диссекции через двуглавую мышцу бедра. Проксимально по отношению к трифуркации седалищного нерва высвобождали примерно 7 мм нерва вставлением щипцов под нерв и осторожно вынимали нерв из бедра. Используя щипцы, под нервом протягивали лигатуру и завязывали ее простым узлом, пока не чувствовали легкое сопротивление, и затем завязывали двойным узлом. Эту процедуру повторяли до тех пор, пока вокруг нерва не было свободно завязано 4 лигатуры (шелк 4-0) на расстоянии приблизительно 1 мм друг от друга. Разрез зашивали послойно и обрабатывали рану местными антибиотиками.
Диабетическая невропатия у крыс, индуцированная стрептозоцином (STZ)
Диабет индуцировали путем одиночной интраперитонеальной инъекции стрептозоцина (50 мг/кг), только что растворенного в 0,9%-ном стерильном физиологическом растворе. Инъекция стрептозоцина в пределах 3 недель индуцирует воспроизводимую механическую аллодинию, продолжающуюся по меньшей мере в течение 7 недель (Chen SR and Pan HL. Hypersensitivity of Spinothalamic Tract Neurons Associated With Diabetic Neuropathic Pain in Rats. J Neurophysiol 87: 2726-2733, 2002).
Оценка статической и динамической аллодинии
Статическая аллодиния
Перед оценкой аллодинии животных приучали к тестовым клеткам с проволочным дном. Статическую аллодинию оценивали путем прикладывания волосков фон Фрея (von Frey) (Stoelting, Wood Dale, Illinois, USA) в порядке возрастания силы (0,6, 1, 1,4, 2, 4, 6, 8, 10, 15 и 26 грамм) к поверхности подошв задних лап. Каждый волосок фон Фрея прикладывали к лапе максимум на 6 секунд или до ответной реакции отдергивания. Как только устанавливалась ответная реакция отдергивания на волосок фон Фрея, лапу тестировали повторно, начиная с волоска, предыдущего по отношению к тому, который вызывал отдергивание, и последовательно с остальными волосками в порядке убывания силы, пока отдергивание не прекращалось. Самая большая сила 26 г поднимала лапу, а также вызывала реакцию, являясь, таким образом, точкой отсечки. У каждого животного тестировали этим способом обе задние лапы. Наименьшее количество силы, требующееся для того, чтобы вызвать реакцию, записывали как порог отдергивания лапы (PWT) в граммах. Определяли, что статическая аллодиния присутствовала, если животные реагировали на стимул 4 г или менее 4 г, который является безвредным у нормальных крыс (Field MJ, Bramwell S, Hughes J, Singh L. Detection of static and dynamic components of mechanical allodynia in rat models of neuropathic pain: are they signalled by distinct primary sensory neurones? Pain, 1999:83:303-11).
Динамическая аллодиния
Динамическую аллодинию оценивали легким поглаживанием ватной палочкой по поверхности подошвы задней лапы. Заботились о выполнении этой процедуры у полностью привыкших крыс, не проявляющих активность, чтобы избежать регистрации общей двигательной активности. Делали по меньшей мере два измерения в каждой временной точке, среднее значение которых представляло собой время ожидания отдергивания лапы (PWL). Если в пределах 15 секунд реакция не проявлялась, процедуру заканчивали и животным приписывали это время отдергивания. Реакция болевого отдергивания часто сопровождалась повторным отдергиванием или облизыванием лапы. Считали, что динамическая аллодиния присутствовала, если животные реагировали на стимул ватной палочки до 8 секунд поглаживания (Field et al, 1999).
Ноцицептивная боль
Активность соединения при лечении ноцицептивной боли можно измерить согласно следующим протоколам анализа.
Электрическая плитка
Экспериментальная методика: Самцов крыс Sprague Dawley помещают на электрическую плитку (Ugo Basile, Italy), поддерживаемую при температуре 55±5°С. Измеряют время между помещением животного на электрическую плитку и появлением облизывания передней или задней лапы, дрожи или спрыгивания с данной поверхности. Будут проведены измерения исходного уровня, и животные будут повторно оцениваться после введения лекарства. Время отсечки для ожидания в отношении электрической плитки устанавливают на 20 секунд для предотвращения повреждения ткани.
Овариогистерэктомия (ОУХ)
Экспериментальная методика: Самок крыс Sprague Dawley размещают в анестетической камере и анестезируют смесью 2%-ного изофлуорана/О2. Во время хирургического вмешательства анестезию поддерживают через носовой обтекатель. OVX проводят через срединный разрез (2 см в длину) по белой линии, когда животное находится на термоодеяле. Накладывают лигатуру шелком 5-0 на связки яичника и шейку матки, используя методику одиночного зажима. Затем удаляют яичники и матку. Брюшную стенку зашивают с использованием 4 простых прерывистых швов, и кожу зашивают с использованием 4 скоб для ран. Немедленно после хирургического вмешательства животных помещают в отдельные плексигласовые камеры. Как только животные приходят в себя от анестезии, фиксируют абдоминальные положения тела за 30 мин, временные интервалы в различные моменты времени. Подсчитываемыми положениями тела являются горбатое положение, сокращение брюшной мышцы, связанное с движениями задней конечности внутрь, вытягивание тела и расплющивание нижней части брюха о пол. Каждый из этих типов поведения оценивается как одно положение тела.
Бреннан
Экспериментальная методика: Самцов крыс Sprague Dawley размещают в анестетической камере и анестезируют смесью 2%-ного изофлуорана/О2. Во время хирургического вмешательства анестезия поддерживается через носовой обтекатель. Подошвенную сторону правой задней лапы обеззараживают 50%-ным этанолом. Через кожу и фасцию подошвенной стороны лапы делают продольный разрез длиной 1 см лезвием номер 11, начиная в 0,5 см от проксимального края пятки и продолжая его в направлении пальцев. Подошвенную мышцу поднимают, используя пинцет, и продолно надрезают так, чтобы начало мышцы и прикрепление оставались интактными. После гемостаза при малом давлении кожу зашивают двумя простыми швами плетеного шелка.
Модель ОА, индуцированного монойодацетатом (MIA)
Самцов 6-недельных крыс Sprague-Dawley (SD, Japan SLC или Charles River Japan) анестезируют пентобарбиталом. Место инъекции выбривают и обеззараживают 70%-ным этанолом. 25 мкл раствора MIA или физиологического раствора инъецируют в правый коленный сустав, используя иглу 29G. Через 7, 14, 19 и 20 суток после инъекции MIA тренируют крыс для измерения весовой нагрузки (ВН) без подвергания их стрессу. Через 21 сутки после инъекции MIA измеряют ВН на каждой из двух задних лап, и недостаток ВН рассчитывают как 10,2. Определяют недостаток ВН как «предзначение». При рассмотрении предзначения и предпредзначения экспериментальную группу распределяют равномерно. После введения тестируемых соединений или носителя измеряли ВН на каждой из двух задних лап.
Модель боли при раковом заболевании
В этих экспериментах использовали взрослых самцов мышей С3Н/HeN (Ninon SLC, Shizuoka, Japan). Данных мышей размещали согласно указаниям Национального института здоровья в виварии, в котором поддерживали температуру 22°С с 12-часовым циклом чередования света-темноты, и давали им корм и воду без ограничений. Использованный протокол инъекции клеток саркомы был описан. После индукции общей анестезии ингаляцией изофлурана (2%) в коже, лежащей над коленной чашечкой, делали поверхностный разрез с использованием ножниц Мора. Затем разрезали связку коленной чашечки, обнажая мыщелки дистальной части бедренной кости. В костномозговую полость на уровне межмыщелковой выемки вставляли иглу 30-го номера для создания исходного центра прохода. После создания исходного центра использовали иглу 29-го номера для создания окончательного прохода в кость. Затем делали 0,5-мм выемку с использованием полукруглого бора в наконечнике пневматической высокоскоростной бормашины для того, чтобы она служила для механической задержки зубной резиновой пломбы. Затем инъецировали 20 мкл α-минимальной основной среды (Sigma; симуляция инъекции) или 20 мкл среды, содержащей 1×105 2472 остеолитических саркомных клеток (American Type Culture Collection, Rockville, Maryland; инъекция саркомы), используя иглу 29-го номера и шприц 0,25 см3. Для предотвращения утечки клеток из кости место инъекции закрывали связующим для зубопротезных материалов с последующей обильной промывкой фильтрованной водой. Закрытия раны достигали с использованием автоматических зажимов для ран (Becton Dickinson, San Jose, California). Зажимы для ран удаляли на 5-е сутки для того, чтобы они не мешали тестированию поведения.
Оценка статической и динамической аллодинии
Статическая аллодиния
Методика является такой же, как описано выше для невропатической боли.
Динамическая аллодиния
Методика является такой же, как описано выше для невропатической боли.
Отдергивание лапы в ответ на инфракрасное излучение
Экспериментальная методика: Термическое отдергивание лапы оценивали с использованием крысиного подошвенного теста (Ugo Basile, Italy), следуя модифицированному способу Hargreaves et al., 1988. Крыс приучали к установке, состоящей из трех отдельных боксов из органического стекла на приподнятом стеклянном столе. Подвижный источник инфракрасного излучения располагали под столом, фокусировали на задней лапе, и записывали время ожидания отдергивания лапы. Существует автоматическая точка отсечки 22,5 секунды для предотвращения повреждения ткани. Время ожидания отдергивания лапы записывают 2-3 раза для обеих задних лап каждого животного, среднее значение которых представляет собой исходный уровень для правой и левой задних лап. Установка откалибрована так, чтобы она показывала время ожидания отдергивания лапы приблизительно 10 секунд.
Весовая нагрузка
Экспериментальная методика: Животных исследуют на гиперчувствительность в тесте на весовую нагрузку, используя прибор «incapacitance tester» (Linton Instruments, Diss, Norfolk, U.K.). Крыс располагали так, что их передние конечности находились на скате из органического стекла, и измеряли распределение нагрузки на задние конечности посредством датчиков силы под каждой задней лапой. Каждое животное помещают в прибор и записывают весовую нагрузку, оказываемую задними лапами. Разницу в весовой нагрузке расчитывают путем вычитания весовой нагрузки на ипсилатеральную (с травмированным нервом) лапу из весовой нагрузки на контралатеральную (нормальную) лапу, и это составляет исходные данные.
Воспалительная боль
Активность соединения при лечении воспалительной боли можно измерить согласно следующему протоколу тестирования.
Недостаток весовой нагрузки у крыс, индуцированный CFA
Самцов крыс SD 7-недельного возраста не кормят в течение ночи. В подушечку правой задней лапы крысы инъецируют CFA (300 мкг Mycobacterium tuberculosis H37 RA (Difco Laboratories) в 100 мкл жидкого вазелина (Wako)). Через двое суток после введения CFA измеряют изменения распределения весовой нагрузки задних лап между левой (ипсилатеральной) и правой (контралатеральной) конечностью как индекс боли с использованием прибора Linton Incapacitance tester (Linton Instrumentation, UK). Тестируемое соединение, суспендированное в 0,1% МС (Wako), вводят перорально в объеме 1 мл на 100 г массы тела. Каждое животное помещают в установку, и весовую нагрузку, оказываемую задними лапами, имеряют до и через 1, 2 и 4 часа после введения лекарственного средства.
Механическая гипералгезия у крыс, индуцированная карагенином
Самцов крыс SD 4-недельного возраста не кормят в течение ночи. Гипералгезию индуцируют внутриподошвенной инъекцией лямбда-карагенина (0,1 мл 1%-ного мас./об. раствора в физиологическом растворе, Zushikagaku). Тестируемое соединение (1 мл 0,1%-ной метилцеллюлозы/100 г массы тела) дают перорально через 5,5 часов после инъекции карагенина. Порог отдергивания лапы (грамм) измеряют аналгезиметром (Ugo Basile) через 3,5, 4,5, 6,5 и 7,5 часов после инъекции карагенина (Randall L.O. & Selitto I.J., Arch. Int. Pharmacodyn. 111, 409-419, 1957).
Термическая гипералгезия у крыс, индуцированная карагенаном
Термическую гипералгезию оценивали, используя крысиный подошвенный тест (Ugo Basile, Comerio, Italy), согласно способу, модифицированному Hargreaves et al. (1988). Крыс приучали к установке, состоящей из трех отдельных боксов из органического стекла на стеклянном столе. Подвижный источник инфракрасного излучения располагали под столом и фокусировали на желательной лапе. Время ожидания отдергивания лапы записывали три раза для обеих задних лап каждого животного, среднее значение которых представляло собой исходный уровень для левой и правой задних лап. Установка была откалибрована так, чтобы у нормальных крыс она показывала время ожидания отдергивания лапы приблизительно 10 секунд. Для предотвращения повреждения ткани подошвенной зоны имела место точка отсечки в 22,5 секунды. Лямбда-карагенан инъецировали внутриподошвенно (100 мкл, 20 мг/мл) в правую заднюю лапу и записи исходного уровня времени ожидания отдергивания лапы производили через 2 ч после введения.
Висцеральная боль
Активность соединения при лечении висцеральной боли можно измерить согласно следующим протоколам тестирования.
Доступно несколько моделей для определения того, является ли соединение эффективным в лечении расстройств внутренних органов. Эти модели включают модель LPS (Eutamene H etal, J Pharmacol Exp Ther 2000 295 (1): 162-7), модель TNBS (Diop L. et al, Gastroenterology 1999, 116, 4(2): A986), модель IBD (Clemett D, Markham A, Drugs 2000 Apr; 59(4):929-56), модель боли в поджелудочной железе (Isia AM, Hosp Med 2000 Jun; 61(6):386-9) и модель висцеральной боли, не имеющей отношение к пищеварительной системе (Boucher M et al, J Urol 2000 Jul; 164(1):203-8).
Хроническая висцеральная аллодиния у крыс, индуцированная TNBS
В этой экспериментальной модели растяжения толстой кишки у бодрствующих крыс предварительная инъекция тринитробензолсульфоновой кислоты (TNBS) в проксимальную часть толстой кишки снижала порог висцеральной боли.
Материалы и способы: Используют самцов крыс Sprague-Dawley. Животных размещают по 3 на клетку в условиях регулируемой среды (20±1°С, влажность 50±5%, с освещением от 8:00 до 20:00). В сутки 0 под анестезией (кетамин 80 мг/кг, интраперитонеально; ацепромазин 12 мг/кг, интраперитонеально) в проксимальную стенку толстой кишки (1 см от слепой кишки) проводят инъекцию TNBS (50 мг/кг в 30%-ном этаноле) или физиологического раствора (1,5 мл/кг) для контрольных крыс. После хирургического вмешательства животных индивидуально размещают в полипропиленовых клетках и содержат в условиях регулируемой среды (20±1°С, влажность 50±5%, с освещением от 8:00 до 20:00) на протяжении 7 суток. На 7-е сутки после введения TNBS в анус вводят баллонный катетер (имеющий длину 5-6 см) и удерживают его в правильном положении (кончик баллонного катетера находится на расстоянии 5 см от ануса) путем приклеивания катетера липкой лентой к основанию хвоста. Пероральное введение тестируемого соединения проводят за 1 час до цикла растяжения толстой кишки: баллонный катетер постепенно накачивают шагами по 5 мм ртутного столба (0,667 кПа) от 0 до 75 мм ртутного столба (от 0 до 10 кПа), причем каждый шаг накачивания длится 30 с. Каждый цикл растяжения толстой кишки контролируется стандартным баростатом. Порог (мм ртутного столба) соответствует давлению, которое дает первое абдоминальное сокращение, и затем цикл растяжения прерывают. Порог для толстой кишки определяют после проведения четырех циклов растяжения у одного и того же животного.
Ректальная гиперчувствительность у крыс, индуцированная LPS
Было показано, что интраперитонеальная инъекция бактериального липополисахарида (LPS) индуцирует у бодрствующих крыс ректальную гипералгезию.
Материалы и способы: Животных хирургически готовят для электромиографии: крыс анестезируют интраперитонеальной инъекцией ацепромазина (0,6 мг/кг) и кетамина (120 мг/кг). Три группы из трех электродов имплантируют в наружную наклонную брюшную мускулатуру как раз над паховой связкой. Электроды выводят на заднюю сторону шеи и защищают стеклянной трубкой, прикрепленной к коже. Животных индивидуально размещают в полипропиленовых клетках и содержат в комнате с контролируемой температурой (21°С). Корм (гранулы UAR, Epinay, France) и воду дают без ограничений.
Электромиографические записи начинают через пять суток после хирургического вмешательства. Электрическую активность абдоминальных поперечно-полосатых мышц записывают установкой для электроэнцефалографии (Mini VIII Alvar, Paris, France), используя короткую константу времени (0,03 с) для удаления низкочастотных сигналов (менее 3 Гц) и скорость движения бумажной ленты 3,6 см/мин. Группы зубцов записывают как индекс абдоминальных сокращений.
Методика растяжения: Крыс помещают в пластмассовые туннели (6 см в диаметре × 25 см в длину), где они не могут двигаться, убегать или разворачиваться для того, чтобы предотвратить повреждение баллонного катетера. Животных приучают к этой процедуре в течение четырех суток перед ректальным растяжением для того, чтобы минимизировать стрессовые реакции на протяжении экспериментов. Баллонный катетер, используемый для растяжения, представляет собой артериальный катетер для эмболэктомии (Fogarty, Edwards Laboratories Inc.). Ректальное растяжение проводят, вставляя баллонный катетер (2 мм в диаметре × 2 см в длину) в прямую кишку на расстоянии 1 см от ануса, и катетер фиксируют у основания хвоста. Его постепенно накачивают прохладной водой шагами по 0,4 мл от 0 до 1,2 мл, причем каждый шаг накачивания длится 5 мин. Для определения возможной утечки объем воды, введенной в баллонный катетер, проверяют путем полного удаления шприцем в конце периода растяжения.
Соединение по изобретению можно вводить по отдельности или в комбинации с одним или более чем одним другим лекарственным средством. Обычно его будут вводить в виде композиции в ассоциации с одним или более чем одним фармацевтически приемлемым эксципиентом. Термин «эксципиент» используется здесь для описания любого ингредиента, отличного от соединения по изобретению. Выбор эксципиента в значительной степени будет зависеть от таких факторов как конкретный способ введения, эффект эксципиента на растворимость и стабильность и от природы лекарственной формы.
Подходящие вспомогательные активные агенты, которые можно использовать в комбинации с соединением по настоящему изобретению, включают:
1) встречающиеся в природе или синтетические простагландины или их сложные эфиры. Подходящие простагландины для применения в данном изобретении включают такие соединения как алпростадил, простагландин Е1, простагландин Е0, 13,14-дигидропростагландин E1, простагландин Е2, эпростинол, природные, синтетические и полусинтетические простагландины и их производные, включая те соединения, которые описаны в WO-00033825 и/или US 6037346, выданном 14 марта 2000, которые все включены в данное описание изобретения посредством ссылки, PGE0, PGE1, PGA1, PGB1, PGF1α, 19-гидрокси PGA1, 19-гидрокси PGB1, PGE2, PGB2, 19-гидрокси-РСА3, 19-гидрокси-PGB2, PGE3α, карбопроста трометамин, динопроста трометамин, динопростон, липопрост, гемепрост, метенопрост, сульпростун, тиапрост и моксисилат;
2) соединения-антагонисты α-адренергических рецепторов, также известные как α-адреноцепторы или α-рецепторы, или α-блокаторы. Подходящие соединения для применения в данном изобретении включают блокаторы α-адренергических рецепторов, как описано в РСТ заявке WO 99/30697, опубликованной 14 июня 1998, описание которой, относящееся к α-адренергическим рецепторам, включено в данное описание изобретения посредством ссылки и включает селективные блокаторы α1-адреноцепторов или α2-адреноцепторов и неселективные блокаторы адреноцепторов, причем подходящие блокаторы α1-адреноцепторов включают фентоламин, фентоламина мезилат, тразодон, алфузосин, индорамин, нафтопидил, тамсулозин, дапипразол, феноксибензамин, идазоксан, эфараксан, йохимбин, алкалоиды раувольфии, Recordati 15/2739, SNAP 1069, SNAP 5089, RS17053, SL 89.0591, доксазозин, теразозин, абаноквил и празозин; блокаторы α2-блокаторов из US 6037346 [14 марта 2000], дибенарнин, толазолин, тримазосин и дибенарнин; α-адренергические рецепторы, как описано в патентах США: 4188390; 4026894; 3511836; 4315007; 3527761; 3997666; 2503059; 4703063; 3381009; 4252721 и 2599000, каждый из которых включен в данное описание изобретения посредством ссылки; блокаторы α2-адреноцепторов включают клонидин, папаверин, папаверина гидрохлорид, возможно в присутствии кариотонического агента, такого как пирксамин;
3) соединения-доноры NO (NO-агонисты). Подходящие соединения-доноры NO для применения в данном изобретении включают органические нитраты, такие как моно-, ди- или тринитраты, или сложные эфиры органических нитратов, включающие глицерилтринитрат (также известный как нитроглицерин), изосорбида 5-мононитрат, изосорбида динитрат, пентаэритритола тетранитрат, эритритила тетранитрат, натрия нитропруссид (SNP), 3-морфолиносиднонимина молсидомин, S-нитрозо-N-ацетилпеницилламин (SNAP), S-нитрозо-N-глутатион (SNO-GLU), N-гидрокси-L-аргинин, амилнитрат, линзидомин, линзидомина хлоргидрат, (SIN-1) S-нитрозо-N-цистеин, диазения диолаты (NONOaты), 1,5-пентандинитрат, L-аргинен, женьшень, плод зизфи, молсидомин, Re-2047, нитрозилированные максисилитные производные, такие как NMI-678-11 и NMI-937, как описано в опубликованной РСТ заявке WO 0012075;
4) вещества, открывающие калиевые каналы, или модуляторы калиевых каналов. Подходящие вещества, открывающие калиевые каналы/ модуляторы калиевых каналов для применения в данном изобретении, включают никорандил, кромокалим, левкромакалим, лемакалим, пинацидил, клиазоксид, миноксидил, харибдотоксин, глибурид, 4-аминопиридин, BaCl2;
5) вазодилататоры. Подходящие вазодилататоры для применения в данном изобретении включают нимодепин, пинацидил, цикланделат, изокссуприн, хлорпрумазин, Rec 15/2739, тразодон;
6) агонисты тромбоксана А2;
7) ЦНС-активные агенты;
8) алкалоиды спорыньи; подходящие алкалоиды спорыньи, раскрыты в патенте США 6037346, выданном 14 марта 2000, и включают ацетергамин, бразерголин, бромергурид, цианерголин, делорготрил, дисулергин, эргоновина малеат, эрготамина тартрат, этисулергин, лерготрил, лизергид, месулергин, метерголин, метерготамин, ницерголин, перголид, прописергид, протергурид и тергурид;
9) соединения, которые модулируют действие натрийуретических факторов, конкретно атриального натрийуретического фактора (также известного как атриальный натрийуретический пептид), натрийуретических факторов типа В и С, таких как ингибиторы нейтральной эндопептидазы;
10) соединения, которые ингибируют ангиотензин-превращающий фермент, такие как энаприл и комбинированные ингибиторы ангиотензин-превращающего фермента и нейтральной эндопептидазы, такие как омапатрилат;
11) антагонисты рецептора ангиотензина, такие как лозартан;
12) субстраты NO-синтазы, такие как L-аргинин;
13) блокаторы кальциевых каналов, такие как амлодипин;
14) антагонисты эндотелиновых рецепторов и ингибиторы эндотелин-превращающего фермента;
15) агенты, снижающие уровень холестерина, такие как статины (например, аторвастатин/Lipitor-товарный знак) и фибраты;
16) антитромбоцитарные и антитромботические агенты, например tPA, uPA, варфарин, гирудин и другие ингибиторы тромбина, гепарин, ингибиторы фактора, активирующего тромбопластин;
17) сенсибилизаторы инсулина, такие как резулин и гипогликемические агенты, такие как глипизид;
18) ингибиторы ацетилхолинэстеразы, такие как донезипил;
19) стероидные и нестероидные противовоспалительные агенты;
20) модуляторы рецептора эстрогена, и/или агонисты эстрогена, и/или антагонисты эстрогена, предпочтительно ралоксифен или лазофоксифен, (-)-цис-6-фенил-5-[4-(2-пирролидин-1-ил-этокси)-фенил]-5,6,7,8-тетрагидронафталин-2-ол и его фармацевтически приемлемые соли, получение которых подробно описано в WO 96/21656;
21) ингибитор PDE (фосфодиэстеразы), более конкретно ингибитор PDE 2, 3, 4, 5, 7 или 8, предпочтительно ингибитор PDE2 или PDE5, и наиболее предпочтительно ингибитор PDE5 (см. ниже), причем указанные ингибиторы предпочтительно имеют ИК50 в отношении соответствующего фермента менее 100 нМ (при условии, что ингибиторы PDE3 и 4 вводят только местно или путем инъекции в пенис);
22) вазоактивный кишечный белок (VIP), миметик VIP, аналог VIP, более конкретно тот, действие которого опосредовано одним или более чем одним подтипом рецептора VIP VPAC1, VPAC или РАСАР (гипофизарный пептид, активирующий аденилатциклазу), один или более чем один агонист рецептора VIP или аналог VIP (например, Ro-125-1553) или фрагмент VIP, один или более чем один антагонист α-адреноцептора с комбинацией VIP (например, Инвикорп, Авиптадил);
23) агонист или модулятор рецептора меланокортина (конкретно подтип МС3 или МС4), или энхансер меланокортина, такой как меланотан II, РТ-14, РТ-141 или соединения, заявленные в WO-09964002, WO-00074679, WO-09955679, WO-00105401, WO-00058361, WO-00114879, WO-00113112, WO-09954358;
24) агонист, антагонист или модулятор рецептора серотонина, более конкретно агонисты, антагонисты или модуляторы рецепторов 5НТ1А (включая VML 670), 5НТ2А, 5НТ2С, 5НТ3 и/или 5НТ6, включая те, которые описаны в WO-09902159, WO-00002550 и/или WO-00028993;
25) агент, заменяющий тестостерон (включая дегидроандростендион), тестостернон (Tostrelle), дигидротестостерон или имплантат тестостерона;
26) эстроген, эстроген? и медроксипрогестерон или медроксипрогестерона ацетат (МРА) (то есть в виде комбинации), или агент гормонозаместительной терапии эстрогена или метилтестостерона (например, HRT, особенно Премарин, Ценестин, Эстрофеминал, Эквин, Естрас, Эстрофем, Эллесте Соло, Эстринг, Эстрадерм TTS, Эстрадерм Матрикс, Дерместрил, Премфаз, Преэмпро, Премпак, Премик, Эстратест, Эстратест HS, Тиболон);
27) модулятор транспортеров норадреналина, дофамина и/или серотонина, такой как бупропион, GW-320659;
28) агонист и/или модулятор пуринергического рецептора;
29) антагонист рецептора нейрокинина (NK), включая антагонисты, описанные в WO-09964008;
30) агонист, антагонист или модулятор опиоидного рецептора, предпочтительно агонисты рецептора ORL-1;
31) агонист, антагонист или модулятор рецепторов окситоцина, предпочтительно селективный агонист или модулятор окситоцина;
32) модуляторы каннабиноидных рецепторов;
33) ингибитор SEP (SEPi), например SEPi, имеющий HK50 менее 100 нМ, более предпочтительно менее 50 нМ.
Предпочтительно ингибиторы SEP согласно настоящему изобретению имеют более чем 30-кратную, более предпочтительно более чем 50-кратную селективность к SEP по сравнению с нейтральной эндопептидазой NEP EC 3.4.24.11 и ангиотензин-превращающим ферментом (АСЕ). Предпочтительно SEPi также имеет более чем 100-кратную селективность по сравнению с эндотелин-превращающим ферментом (ЕСЕ);
34) антагонист или модулятор рецептора NPY (конкретно подтипа Y1 и Y5);
35) антагонист или модулятор глобулина, связывающего половой гормон, который ингибирует связывание эстрогенов и/или андрогенов;
36) ингибитор аргиназы II;
37) агонист, антагонист или модулятор рецепторов вазопрессина, предпочтительно селективный к рецептору V1a;
38) ингибитор PDE5. Подходящие ингибиторы PDE5 включают:
5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он (силденафил), конкретно силденафила цитрат;
(6R,12aR)-2,3,6,7,12,12а-гексагидро-2-метил-6-(3,4-метилендиоксифенил)-пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дион (IС-351 или тадалафил);
2-[2-этокси-5-(4-этилпиперазин-1-ил-1-сульфонил)-фенил]-5-метил-7-пропил-3Н-имидазо[5,1-f][1,2,4]триазин-4-он (варденафил); 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он; 5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он; 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он; 4-[(3-хлор-4-метоксибензил)амино]-2-[(2S)-2-(гидроксиметил)пирролидин-1-ил]-N-(пиримидин-2-илметил)пиримидин-5-карбоксамид (ТА-1790); 3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1Н-пиразоло[4,3-α]пиримидин-5-ил)-N-[2-(1-метилпирролидин-2-ил)этил]-4-пропоксибензолсульфонамид (DA 8159) и их фармацевтически приемлемые соли;
39) селективный агонист рецептора дофамина D4, такой как 2-[(4-пиридин-2-илпиперазин-1-ил)метил]-1Н-бензимидазол (АВТ724);
40) один или более чем один селективный ингибитор обратного захвата серотонина (SSRIs), такой как дапоксетин, пароксетин, 3-[(диметиламино)метил]-4-[4-(метилсульфанил)фенокси]бензолсульфонамид (Пример 28, WO 0172687), 3-[(диметиламино)метил]-4-[3-метил-4-(метилсульфанил)фенокси]бензолсульфонамид (Пример 12, WO 0218333), N-метил-N-({3-[3-метил-4-(метилсульфанил)фенокси]-4-пиридинил}метил)амин (Пример 38, РСТ заявка номер РСТ/1 В02/01032);
41) один или более чем один ингибитор NEP, предпочтительно где указанная NEP представляет собой ЕС 3.4.24.11, и более предпочтительно, где указанный ингибитор NEP представляет собой селективный ингибитор ЕС 3.4.24.11, более предпочтительно селективный ингибитор NEP представляет собой селективный ингибитор ЕС 3.4.24.11, который имеет ИК50 менее 100 нМ (например омпатрилат, сампатрилат), подходящие соединения - ингибиторы NEP описаны в ЕР-А-1097719; значения UK50 по отношению к NEP и АСЕ можно определить, используя способы, описанные в опубликованной заявке на патент ЕР 1097719-А1, абзацы от [0368] до [0376];
42) агонисты рецептора меланокортина (например, Меланотан II и РТ141) и селективные агонисты МС3 и МС4 (например, THIQ);
43) ингибиторы транспорта моноаминов, такие как ингибиторы обратного захвата норадреналина (норэпинефрина) (NRIs), включая селективные NRIs, такие как ребоксетин либо в его рацемической (R,R/S,S), либо в оптически чистой (S,S) энантиомерной форме, например (S,S)-ребоксетин).
Посредством приведенной здесь перекрестной ссылки на соединения, содержащиеся в патентах и патентных заявках, которые можно использовать согласно изобретению, авторы данного изобретения имеют в виду терапевтически активные соединения, как определено в формуле изобретения (конкретно в п.1) и в конкретных примерах (которые все включены в данное описание изобретения посредством ссылки). Патенты и заявки на патент, на которые ссылались выше, дополнительно включены в данное описание изобретения посредством ссылки.
Если вводят комбинацию активных агентов, тогда их можно вводить одновременно, раздельно или последовательно.
Фармацевтические композиции, подходящие для доставки соединения по настоящему изобретению, и способы их получения будут совершенно очевидными специалисту в данной области. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995), которая включена в данное описание изобретения посредством ссылки.
Соединение по изобретению можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение входит в желудочно-кишечный тракт, и/или трансбуккальное, лингвальное или сублингвальное введение, посредством которых соединение входит в кровоток непосредственно изо рта.
Композиции, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие препараты в виде мульти- или наночастиц, жидкости, полутвердые или твердые матрицы или порошки; пастилки (включая пастилки, наполненные жидкостью); жевательные резинки; гели; быстро диспергируемые лекарственные формы; пленки; овули; спреи и внутриротовые/приклеивающиеся к слизистым оболочкам пластыри.
Жидкие композиции включают суспензии, растворы, сиропы и эликсиры. Такие композиции можно использовать как наполнители в мягких или твердых капсулах (изготовленных, например, из желатина или гидроксипропилметилцеллюлозы), и обычно они содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более чем один эмульгатор и/или суспендирующий агент. Жидкие композиции также можно получить путем растворения твердого вещества, например, из саше.
Соединение по настоящему изобретению также можно использовать в быстрорастворимых, быстрораспадающихся лекарственных формах, таких как лекарственные формы, описанные в Expert Opinion in Therapeutic Patents, 11 (6), 981-986 Liang и Chen (2001), которая включена в данное описание изобретения посредством ссылки.
Что касается лекарственных форм в виде таблетки, в зависимости от дозы лекарственное средство может составлять от 0,5% по массе до 80% по массе лекарственной формы, более типично от 1% по массе до 60% по массе лекарственной формы. Помимо лекарственного средства таблетки обычно содержат разрыхлитель. Примеры разрыхлителей включают натрия крахмал-гликолят, натрий-карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, натрий-кроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшим алкилом, крахмал, прежелатинизированный крахмал и альгинат натрия. Обычно разрыхлитель будет составлять от 1% по массе до 25% по массе, предпочтительно от 5% по массе до 20% по массе лекарственной формы.
Связывающие вещества обычно используют для придания таблетированному препарату когезионных свойств. Подходящие связывающие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические камеди, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, моногидрат, высушенный распылением, безводная и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат гидрофосфата кальция.
Таблетки также возможно могут содержать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и скользящие вещества, такие как диоксид кремния и тальк. Поверхностно-активные агенты, когда они присутствуют, могут составлять от 0,2% по массе до 5% по массе таблетки, и скользящие вещества могут составлять от 0,2% по массе до 1% по массе таблетки.
Таблетки также обычно содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества обычно составляют от 0,25% по массе до 10% по массе, предпочтительно от 0,5% по массе до 3% по массе таблетки.
Другие возможные ингредиенты включают антиоксиданты, красители, корригенты, консерванты и вещества, исправляющие вкус.
Показательные таблетки содержат вплоть до примерно 80% лекарственного средства, от примерно 10% по массе до примерно 90% по массе связывающего вещества, от примерно 0% по массе до примерно 85% по массе разбавителя, от примерно 2% по массе до примерно 10% по массе разрыхлителя и от примерно 0,25% по массе до примерно 10% по массе смазывающего вещества.
Смеси для таблеток можно прессовать непосредственно или при помощи цилиндра для образования таблеток. Смеси для таблеток или части смесей, в качестве альтернативы, можно гранулировать влажным, сухим гранулированием или гранулированием путем плавления, путем застывания расплава или выдавливать перед таблетированием. Конечный препарат может содержать один или более чем один слой и может быть покрытым или непокрытым; он даже может быть инкапсулированным.
Получение таблеток обсуждается в Pharmaceutical Dosage Forms: Tablets, Vol.1, H. Lieberman и L. Lachman (Marcel Dekker, New York, 1980), которая включена в данное описание изобретения посредством ссылки.
Годные к потреблению пероральные пленки для применения человеком или для ветеринарного применения обычно представляют собой гибкие водорастворимые или разбухающие в воде лекарственные формы в виде тонких пленок, которые могут быть быстрорастворимыми или приклеивающимися к слизистым оболочкам и обычно содержат соединение по изобретению, полимер, образующий пленку, связывающее вещество, растворитель, увлажнитель, пластификатор, стабилизатор или эмульгатор, агент, модифицирующий вязкость, и растворитель. Некоторые компоненты данного препарата могут выполнять более чем одну функцию.
Соединение по изобретению может быть водорастворимым или нерастворимым. Водорастворимое соединение обычно содержит от 0,5% по массе до 80% по массе, более типично от 20% по массе до 50% по массе растворенных веществ. Менее растворимые соединения могут составлять большую долю композиции, типично вплоть до 88% по массе растворенных веществ. В качестве альтернативы, соединение по изобретению может находиться в форме шариков из множества частиц.
Полимер, образующий пленку, можно выбрать из природных полисахаридов, белков или синтетических гидроколлоидов, и типично он присутствует в интервале от 0,01 до 99% по массе, более типично в интервале от 30 до 80% по массе.
Другие возможные ингредиенты включают антиоксиданты, красители, корригенты и усилители вкуса и аромата, консерванты, агенты, стимулирующие слюноотделение, охлаждающие агенты, сорастворители (включая масла), смягчители, наполнители, противопенные агенты, поверхностно-активные вещества и агенты, исправляющие вкус.
Пленки согласно данному изобретению обычно получают путем испарительной сушки тонких водных пленок, нанесенных на легкоотслаивающуюся подложку или бумагу. Это может быть сделано в сушильной печи или туннельной печи, обычно в комбинированном устройстве для нанесения покрытий/сушки, или сублимационной сушкой или вакуумированием.
Твердые композиции для перорального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Композиции с модифицированным высвобождением включают композиции с замедленным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Подходящие композиции с модифицированным высвобождением для целей данного изобретения описаны в патенте США №6106864. Подробности других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии и осмотические и покрытые оболочкой частицы, следует искать в Pharmaceutical Technology On-line, 25(2), 1-14, Verma et al (2001), которая включена в данное описание изобретения посредством ссылки. Применение жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298, которая включена в данное описание изобретения посредством ссылки.
Соединение по изобретению также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, внутригрудинное, внутричерепное, внутримышечное, внутрисуставное и подкожное введение. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и оборудование для инфузии.
Парентеральные композиции обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно до рН от 3 до 9), но для некоторых применений они могут быть приготовлены в виде препарата более подходящим способом как стерильный неводный раствор или как высушенная форма, которую следует использовать в сочетании с подходящим носителем, таким как стерильная апирогенная вода.
Получение парентеральных композиций в стерильных условиях, например путем лиофилизации, легко можно осуществить с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области.
Растворимость соединения по изобретению, используемого в получении парентеральных растворов, может быть повышена путем использования подходящих методик приготовления препаратов, таких как включение агентов, повышающих растворимость.
Композиции для парентерального введения могут быть приготовлены в виде препаратов с немедленным и/или модифицированным высвобождением. Композиции с модифицированным высвобождением включают композиции с замедленным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением. Таким образом, соединение по изобретению можно приготовить в виде препарата как суспензию или как твердое вещество, полутвердое вещество или тиксотропную жидкость для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких композиций включают покрытые лекарственным средством стенты и полутвердые вещества и суспензии, содержащие микросферы из поли(dl-молочно-согликолевой) кислоты (PGLA), загруженные лекарственным средством.
Соединение по изобретению также можно вводить местно, (интра)дермально или трансдермально на кожу или слизистую оболочку. Типичные композиции для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, облатки, имплантаты, губки, волокна, бандажи и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. В состав могут быть включены усилители проницаемости - см., например, J. Pharm. Sci., 88 (10), 955-958, Finnin and Morgan (October 1999), которая включена в данное описание изобретения посредством ссылки.
Другие способы местного введения включают доставку элекропорацией, ионтофорезом, фонофорезом, сонофорезом и микроигольной или безыгольной (например PowderjectТМ, BiojectТМ и так далее) инъекцией.
Композиции для местного введения могут быть приготовлены в виде препаратов с немедленным и/или модифицированным высвобождением. Композиции с модифицированным высвобождением включают композиции с замедленным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Соединение по изобретению также можно вводить интраназально или путем ингаляции, обычно в форме сухого порошка (либо одного, в виде смеси, например в сухой смеси с лактозой, либо в виде частицы из смешанных компонентов, например смешанных с фосфолипидами, такими как фосфатидилхолин) из сухого порошкового ингалятора, в виде аэрозольного спрея из контейнера под давлением, насоса, распылителя, пульверизатора (предпочтительно пульверизатора с использованием электрогидродинамики для получения мелких капелек) или небулайзера, с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или в виде капель для носа. Что касается интраназального применения, порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин.
Контейнер под давлением, насос, распылитель, пульверизатор или небулайзер содержит раствор или суспензию соединения(ий) по изобретению, содержащую, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, солюбилизации или продления высвобождения активного агента, пропеллент(ы) в качестве растворителя и возможно поверхностно-активное вещество, такое как сорбитантриолеат, олеиновая кислота или олигомолочная кислота.
Перед использованием в препарате в форме сухого порошка или суспензии лекарственный продукт микронизируют до размера, подходящего для доставки путем ингаляции (обычно менее 5 микрон). Этого можно достичь любым подходящим способом измельчения, таким как помол в спиральной струйной мельнице, струйной мельнице с псевдоожиженным слоем, сверхкритическая обработка жидкости с получением наночастиц, гомогенизация под высоким давлением или распылительная сушка.
Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы), блистеры и картриджи для использования в ингаляторе или в инсуфляторе могут быть приготовлены в виде препарата, который содержит порошковую смесь соединения по изобретению, подходящую порошковую основу, такую как лактоза или крахмал, и модификатор эффективности, такой как I-лейцин, маннит или стеарат магния. Лактоза может быть безводной или может находиться в форме моногидрата, предпочтительно в последней форме. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящая композиция в форме раствора для использования в пульверизаторе с использованием электрогидродинамики для получения мелких капель может содержать от 1 мкг до 20 мг соединения по изобретению на одно срабатывание, и объем при срабатывании может варьировать от 1 мкл до 100 мкл. Типичная композиция может содержать соединение по изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
В те композиции по изобретению, которые предназначены для ингаляционного/интраназального введения, могут быть добавлены подходящие корригенты, такие как ментол и левоментол, или подсластители, такие как сахарин и натрий-сахарин.
Композиции для ингаляционного/интраназального введения могут быть приготовлены в виде препаратов с немедленным и/или модифицированным высвобождением с использованием, например, PGLA. Композиции с модифицированным высвобождением включают композиции с замедленным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
В случае сухих порошковых ингаляторов и аэрозолей единицу дозировки устанавливают с помощью клапана, который доставляет отмеренное количество. Единицы согласно данному изобретению обычно устанавливают так, чтобы вводить отмеренную дозу или "пшик", содержащие соединение по изобретению.
Соединение по данному изобретению можно вводить ректально или вагинально, например, в виде суппозитория, пессария или клизмы. Масло какао является традиционной суппозиторной основой, но как подходящие можно использовать различные альтернативные варианты.
Композиции для ректального/вагинального введения могут быть приготовлены в виде препаратов с немедленным и/или модифицированным высвобождением. Композиции с модифицированным высвобождением включают композиции с замедленным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Соединение по данному изобретению также можно вводить непосредственно в глаз или в ухо, обычно в форме капель микронизированной суспензии или раствора в изотоническом, рН-отрегулированном стерильном солевом растворе. Другие композиции, подходящие для глазного и ушного введения, включают мази, гели, биоразлагаемые (например, всасывающие гелевые губки, коллаген) и небиоразлагаемые (например, силиконовые) имплантаты, облатки, линзы и системы частиц или везикул, такие как ниосомы или липосомы. В состав может быть включен полимер, такой как поперечно-связанная полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая камедь, вместе с консервантом, таким как бензалкония хлорид. Такие композиции также можно доставлять ионтофорезом. Композиции для глазного/ушного введения могут быть приготовлены в виде препаратов с немедленным и/или модифицированным высвобождением. Композиции с модифицированным высвобождением включают композиции с замедленным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Соединение по изобретению может быть объединено с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или полимеры, содержащие полиэтиленгликоль, для улучшения его растворимости, скорости растворения, исправления вкуса, улучшения биодоступности и/или стабильности для использования в любом из вышеупомянутых способов введения.
Обнаружено, например, что комплексы лекарственное средство-циклодекстрин обычно являются полезными для большинства лекарственных форм и путей введения. Можно использовать как комплексы включения, так и комплексы, не являющиеся комплексами включения. В качестве альтернативы прямому образованию комплекса с лекарственным средством циклодекстрин можно использовать в качестве вспомогательной добавки, то есть в виде носителя, разбавителя или солюбилизатора. Чаще всего используемыми для этих целей являются альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в международных патентных заявках №№ WO 91/11172, WO 94/02518 и WO 98/55148, которые включены в данное описание изобретения посредством ссылки.
Поскольку может быть желательным введение комбинации активных соединений, например, в целях лечения конкретного заболевания или состояния, в пределах объема настоящего изобретения находится то, что две или более чем две фармацевтические композиции, по меньшей мере одна из которых содержит соединение по данному изобретению, можно с удобством комбинировать в форме набора, подходящего для совместного введения данных композиций.
Таким образом, набор по данному изобретению содержит две или более чем две отдельные фармацевтические композиции, по меньшей мере одна из которых содержит соединение по изобретению, и средство для раздельного хранения указанных композиций, такое как контейнер, разделенный флакон или разделенная упаковка из фольги. Примером такого набора является привычная блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобного.
Набор по изобретению особенно подходит для введения разных лекарственных форм, например пероральных и парентеральных, для введения отдельных композиций с разными интервалами дозировки или для титрования отдельных композиций относительно друг друга. Чтобы содействовать соблюдению схемы и режима лечения, данный набор обычно содержит указания для введения и может быть снабжен так называемой памяткой.
Описание графических материалов
Фиг.1
Изотермический гравиметрический анализ 5-[(2R,5S)-5-метил-4-пропилморсролин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата при 40, 45, 80 и 85°С. Материал выдерживали при выбранной температуре с током азота, имеющего относительную влажность 0%. Соль 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат дегидратируется при 85°С при относительной влажности 0%. Многие гидраты были бы потеряны при 30°С/относительной влажности 0%.
Фиг.2
Сорбция воды 5-[(2R,5S)-5-мeтил-4-пpoпилмopфoлин-2-ил]пиpидин-2-амина ди-S-камсилата моногидратом при 30°С. Сорбция при относительной влажности 90% составляет 0,316% (мас./мас.) от массы в сухом состоянии. Это значение относится к несвязанной воде и, помимо этого, к воде, включенной в кристаллическую решетку.
Фиг.3
Сравнение сорбции воды 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата, свободного основания, ди-D-тартрата и гидробромидной соли при 30°С.
Фиг.4
Смоделированная картина дифракции рентгеновских лучей на порошке для 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата.
Фиг.5
Фактическая картина дифракции рентгеновских лучей на порошке для 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата.
Фиг.6
Термограмма ДСК (дифференциальная сканирующая калориметрия) для 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-Ы-камсилата моногидрата.
Экспериментальный раздел
Дифференциальная сканирующая калориметрия (ДСК): Дифференциальную сканирующую калориметрию проводили, используя установку Perkin Elmer Diamond DSC, в алюминиевых чашках с отверстиями и крышками. Приблизительно 3 мг образцов нагревали при 20°С в минуту в интервале от 30 до 250°С с продувкой газообразным азотом.
Термогравиметрический анализ (ТГА): Использовали модель установки 2950, изготовленную ТА Instruments. Приблизительно 8 мг образца выдерживали при температуре анализа в открытой чашке при токе азота с относительной влажностью 0% в течение минимум 30 мин. Результаты являются показателем кинетической стабильности гидрата на протяжении периода времени, когда образец подвергался воздействию.
Динамическая сорбция пара (ДСП): Использовали автоматический анализатор сорбции модели DVS-1, изготовленный Surface Measurements Systems Ltd. UK. Твердое вещество (10-20 мг) подвергали воздействию среды с контролируемой относительной влажностью (% относительной влажности) и регистрировали изменение массы во времени. Влажность ступенчато изменяли от относительной влажности 0 до 90 и до 0% с интервалами относительной влажности 15%. В данном способе при каждом значении влажности необходимо достигнуть скорости сорбции 0,0005%/мин перед воздействием следующего значения влажности. Когда образец является расплывающимся за счет поглощения влаги, равновесная сорбция достигается не всегда.
Дифрация рентгеновских лучей на порошке: Картины дифракции рентгеновских лучей на порошке получали, используя дифрактометр рентгеновских лучей на порошке Bruker-AXS Ltd. D5000, оснащенный автоматическим устройством для смены образцов, тета-тета гониометром, автоматическими щелями для расходимости пучка, вторичным монохроматором и сцинтилляционным счетчиком. Пробу анализировали в виде слоя порошка на держателе для образца в виде кремниевой пластины. Образец вращали при облучении медными К-альфа1 рентгеновскими лучами (длина волны =1,5406 Ангстрем) рентгеновской трубки, работающей при 40 кВ/40 мА. Данный анализ проводили с гониометром, работающим в непрерывном режиме, установленным на счет 5 секунд на шаг 0,02° на протяжении интервала в два тета от 2° до 55°.
Пики, полученные для 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата, сравнивали с пиками от расчетной картины от структуры монокристалла.
Углы 2-тета и относительные интенсивности смоделированной картины дифракции на порошке рассчитывали от структуры монокристалла, используя модуль "Reflex Powder Diffraction" Accelrys Materials StudioTM [версия 2.2]. Подходящие параметры моделирования в каждом случае представляли собой:
Длина волны =1,540562 Е (Сu Кα),
Фактор поляризации =0,5,
Псевдоконтур Фогта (U=0,01, V=-0,001, W=0,002).
Как будет понятно специалисту, относительные интенсивности разных пиков в таблицах, приведенных ниже, могут варьировать из-за целого ряда факторов, таких как, например, эффекты ориентации кристаллов в пучке рентгеновских лучей или чистота анализируемого материала, или уровень кристалличности образца. Положения пиков также могут сдвигаться из-за изменений высоты образца, но положения пиков по существу останутся такими, как определено в приведенных таблицах.
Специалист также поймет, что измерения с использованием разных длин волн приведут к разным сдвигам согласно уравнению Брэгга - nλ=2d sin θ.
Такие дополнительные картины дифракции рентгеновских лучей на порошке, генерированные путем использования альтернативных длин волн, рассматривают как альтернативные представления картин дифракции рентгеновских лучей на порошке кристаллических веществ по настоящему изобретению, и, как таковые, они находятся в пределах объема настоящего изобретения.
Соединение по данному изобретению можно синтезировать согласно методикам, приведенным ниже. Когда получение проводили в разных масштабах, приведены подходящие способы для выполнения синтезов как в большом, так и в малом масштабе. Используются следующие сокращения и определения:
Спектры ЯМР получали, используя спектрометр Varian Inova 300 МГц, растворяя образец в подходящем растворителе.
Масс-спектры получали с использованием системы ЖХ-МС (жидкостная хроматография - масс-спектрометрия), состоящей из системы ВЭЖХ (высокоэффективная жидкостная хроматография) Thermo-Finnigan Surveyor в сочетании с масс-спектрометром с ионной ловушкой Thermo Finnigan LCQ.
5-Бром-2-(2,5-диметилпиррол-1-ил)пиридин
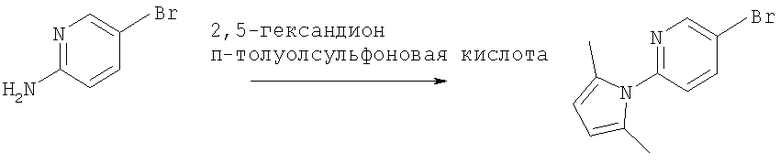
2-Амино-5-бромпиридин (6,0 кг, 34,7 моль), 2,5-гександион (4,35 кг, 38,2 моль) и п-толуолсульфоновую кислоту (12 г) растворяли в гептане (36 л) и кипятили с обратным холодильником в течение ночи в условиях Дина-Старка (Dean Stark). Было установлено оборудование для перегонки, и гептан (18 л) удаляли путем перегонки. Данную смесь охлаждали до 20°С в течение 60 минут. Добавляли затравочные кристаллы и гранулировали смесь при 20°С в течение 2 часов и затем при 5°С в течение ночи. Продукт собирали фильтрацией, промывали гептаном (2×6 л) и сушили при 45°С под вакуумом в течение ночи. Выход =80% (7,0 кг) δн (CDCl3 300 МГц) 2.20 (6Н, s), 5.95 (2Н, s), 7.15 (1Н, d), 7.95 (1H, d), 8.70 (1H, s) млн-1. МС m/z 253 (МН+, изотоп Вr).
2-Хлор-1-[6-(2,5-диметилпиррол-1-ил)пиридин-3-ил]этанон
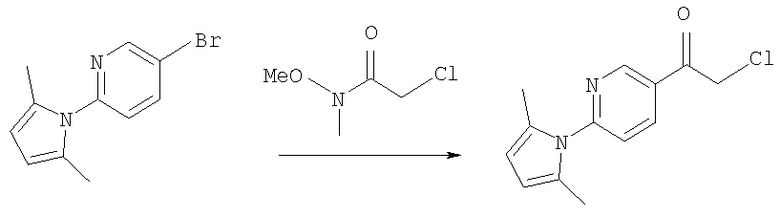
Раствор 5-бром-2-(2,5-диметилпиррол-1-ил)пиридина (1,00 кг, 3,98 моль) в ТВМЕ (7,5 л) охлаждали до -70°С. Добавляли по каплям н-бутиллитий (2,5 н в гексане; 1,73 л, 4,32 моль) в течение 1 часа, поддерживая температуру от -74°С до -69°С. Затем перемешивали данную смесь при температуре от -74°С до -69°С в течение дополнительных 15 минут. Затем добавляли по каплям раствор 2-хлор-N-метокси-N-метилацетамида (0,65 кг, 4,72 моль) в ТВМЕ (3,0 л) в течение 100 минут, поддерживая температуру от -73°С до -67°С. Образующуюся смесь затем перемешивали при температуре от -73°С до -67°С в течение дополнительных 100 минут. Затем добавляли по каплям в течение 45 минут 2 н HCl (5,0 л), давая температуре возрастать во время добавления от -70°С до 17°С. Добавляли к образующейся суспензии ТВМЕ (4,0 л) и воду (2,0 л) и перемешивали данную смесь перед тем как дать фазам разделиться. Органический слой промывали водой (2,0 л), водным NaHCO3 (0,13 кг в 2,0 л воды) и водой (2,0 л) перед концентрированием под вакуумом. Добавляли к остатку IPA (1,50 л) и смесь нагревали до температуры дефлегмации. Затем давали данной смеси охладиться до комнатной температуры и перемешивали ее в течение ночи перед охлаждением до 8-12°С в течение 1 часа. Продукт собирали фильтрацией, промывали IPA (2×0,1 л) и сушили при 45°С под вакуумом в течение ночи. Выход 78,8% (0,78 кг), δн (CDCl3, 300 МГц) 2.20 (6Н, s), 4.70 (2Н, s), 5.95 (2Н, s), 7.35 (1H, d), 8.40 (1H, dd), 9.15 (1H, d) млн-1. МС m/z 249 (МН+)
2-(2,5-Диметилпиррол-1-ил)-5-оксиранилпиридин
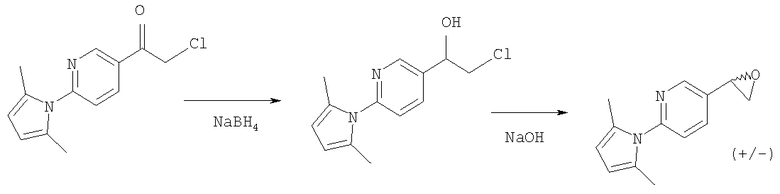
К суспензии боргидрида натрия (0,17 кг, 4,36 моль) в 1,4-диоксане (6,49 л) добавляли по каплям воду (1,08 кг) при 16°С и образующийся раствор перемешивали при комнатной температуре. Добавляли в течение 1 часа раствор 2-хлор-1-[6-(2,5-диметилпиррол-1-ил)пиридин-3-ил]этанона (1,08 кг, 4,35 моль) в тетрагидрофуране (2,16 л) и образующийся раствор перемешивали при комнатной температуре в течение 45 минут. Когда расходовался весь 2-хлор-1-[6-(2,5-диметилпиррол-1-ил)пиридин-3-ил]этанон, реакционную смесь охлаждали до 19°С и обрабатывали концентрированной HCl (36% мас./мас.) (1,08 л) в течение 40 минут. Данную смесь охлаждали до 11°С и добавляли NaOH (32% мас./мас.) (1,64 л) на протяжении 45 минут, поддерживая температуру менее 25°С. Затем давали смеси гранулироваться при комнатной температуре в течение ночи. Когда все хлорспиртовое промежуточное соединение было израсходовано, добавляли DCM (5,0 л) и воду (5,0 л) и перемешивали смесь перед тем как дать фазам разделиться. Водную фазу экстрагировали DCM (2,50 л) и объединенные органические фазы промывали водой (2×1,0 л) и концентрировали под вакуумом. Выход 98% (0,92 кг) δн (CDCl3, 300 МГц) 2.10 (6Н, s), 2.90 (1Н, dd), 3.25 (1Н, dd), 4.00 (1H, dd), 5.90 (2H, s), 7.20 (1Н, d), 7.70 (1Н, dd), 8.40 (1Н, d) млн-1 МС m/z 215 (МН+).
(2S)-2-[{(RS)-2-[6-(2,5-диметил-1H-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}пропиламино]пропан-1-ол
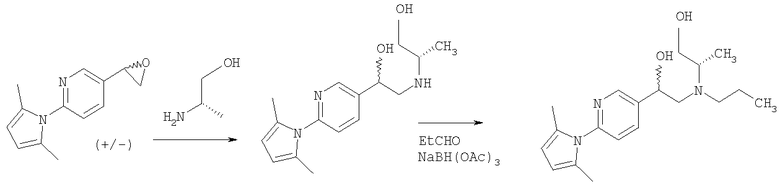
Смесь 2-(2,5-диметилпиррол-1-ил)-5-оксиранилпиридина (0,65 кг, 3,04 моль), (S)-(+)-2-амино-1-пропанола (0,30 кг, 3,95 моль) в толуоле (6,50 л) нагревали до температуры дефлегмации в течение ночи. Реакционную смесь охлаждали до комнатной температуры, добавляли DCM (6,5 л) и воду (1,30 л) и давали фазам разделиться. Добавляли к органическому слою триацетоксиборгидрид натрия (0,96 кг, 4,56 моль) с последующим добавлением по каплям пропиональдегида (0,48 л, 6,68 моль) и ледяной уксусной кислоты (0,17 л, 3,04 моль), поддерживая температуру ниже 30°С. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа перед гашением водой (1,20 л) и водным раствором карбоната калия (1,00 кг в 3,23 кг воды) и давали фазам разделиться. Водную фазу экстрагировали DCM (1,20 л) и объединенные органические фазы промывали водой (0,60 л), водой (0,30 л) и концентрировали в вакууме. Выход 89% (0,89 кг, данное вещество выделяли приблизительно с чистотой 70%) δн (CDCl3, 300 МГц) 0.8-1.0 (6Н, m), 1.50-1.70 (2Н, m), 2.10 (6Н, s), 2.50-3.15 (5H, m), 3.50 (2H, dd), 4.80 (1H, dd), 5.90 (2H, s), 7.20 (1H, m), 7.80-7.90 (1H, m), 8.60 (1H, m) млн-1. МС m/z 332 (МН+). Промежуточное аминное соединение было охарактеризовано как δн (CDCl3, 300 МГц) 1.10 (3Н, t), 2.10 (6Н, s), 2.7-3.2 (3H, m), 3.45 (1H, m), 3.70 (H, dd), 4.85 (1H, m), 5.90 (2H, s), 7.20 (1H, d), 7.90 (1H, dd), 8.60 (1H, d) млн-1. МС m/z 290 (MH+).
(2S)-2-[{(RS)-2-[6-(2,5-диметил-1Н-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}амино]пропан-1-ол
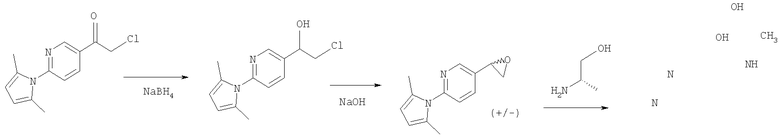
Воду (15,0 л) добавляли к суспензии боргидрида натрия (4,11 кг, 109 моль) в тетрагидрофуране (140 л) при 15°С и образующийся раствор перемешивали при 15°С. Добавляли в течение 40 минут раствор 2-хлор-1-[6-(2,5-диметилпиррол-1-ил)пиридин-3-ил]этанона (30,0 кг, 120,6 моль) в тетрагидрофуране (100 л) и воде (15 л), поддерживая температуру ниже 30°С. Образующийся раствор перемешивали в течение 60 минут при 15°С. Когда расходовался весь 2-хлор-1-[6-(2,5-диметилпиррол-1-ил)пиридин-3-ил]этанон, реакционную смесь обрабатывали концентрированной HCl (27% мас./мас., 47 кг) в течение 80 минут, поддерживая температуру ниже 30°С. Смесь охлаждали до 15°С и добавляли NaOH (34% мас./мас., 79 кг) в течение 60 минут, поддерживая температуру ниже 30°С. Данную смесь затем гранулировали при 20°С в течение ночи. Когда расходовалось все хлорспиртовое промежуточное соединение, отделяли водную фазу. Добавляли DCM (150 л) и воду (140 л) и перемешивали смесь перед тем как дать фазам разделиться. Органическую фазу промывали водой (2×30 л). Добавляли в течение 20 минут (S)-(+)-2-амино-1-пропанол (17,2 кг, 229 моль) и тетрагидрофуран (15 л). Устанавливали оборудование для перегонки и DCM заменяли тетрагидрофураном с получением конечного объема 160 литров. Реакционную смесь оставляли при температуре дефлегмации на ночь. После охлаждения до комнатной температуры добавляли DCM (150 л) и промывали смесь водой (3×30 л). Устанавливали оборудование для перегонки и тетрагидрофуран, и DCM заменяли ацетонитрилом с получением конечного объема 84 литра. Добавляли в течение 60 минут ααα-трифтортолуол (300 л), смесь охлаждали до 5°С в течение 8 часов и гранулировали при 5°С в течение 6 часов. Продукт собирали фильтрацией, промывали ααα-трифтортолуолом (2×30 л) и сушили при 45°С под вакуумом в течение ночи. Выход = 65% (22,7 кг) δн (CDCl3, 300 МГц) 1.10 (3Н, t), 2.10 (6Н, s), 2.7-3.2 (3H, m), 3.45 (1H, m), 3.70 (H, dd), 4.85 (1H, m), 5.90 (2H, s), 7.20 (1H, d), 7.90 (1H, dd), 8.60 (1H, d) млн-1 MC m/z 290 (MH+). Промежуточное эпоксидное соединение охарактеризовали как δн (CDCl3, 300 МГц) 2.10 (6Н, s), 2.90 (1H, dd), 3.25 (1H, dd), 4.00 (1H, dd), 5.90 (2H, s), 7.20 (1H, d), 7.70 (1H, dd), 8.40 (1H, d) млн-1 MC m/z 215 (МН+).
(2S)-2-[{(RS)-2-[6-(2,5-диметил-1Н-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил} пропиламино]пропан-1-ол
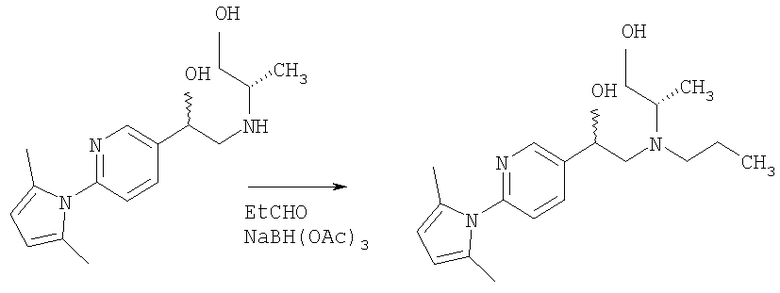
Пропионовый альдегид (5,02 кг, 86,4 моль) в течение 10 минут добавляли к раствору (2S)-2-[{(RS)-2-[6-(2,5-диметил-1H-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}амино]пропан-1-ола (22,7 кг, 78,6 моль) в DCM (123 л) при 20°С. Образующийся раствор перемешивали при 20°С в течение 2 часов и затем давали ему отстояться перед его добавлением к суспензии триацетоксиборгидрида натрия (25,8 кг, 122 моль) в DCM (123 л) в течение 90 минут, поддерживая температуру ниже 30°С. Реакционную смесь перемешивали при 20°С в течение 1 часа перед гашением водным раствором карбоната калия (36,4 кг в 136 л воды) и давали фазам разделиться. Органическую фазу промывали водой (2×23 л). Устанавливали оборудование для перегонки и удаляли DCM (190 л) перегонкой с получением конечного объема 45 литров. Данную смесь охлаждали до 20°С. Выход 100% (51,1 кг, 50,9% мас./мас. в DCM). δн (CDCl3, 300 МГц) 0.8-1.0 (6Н, m), 1.50-1.70 (2Н, m), 2.10 (6Н, s), 2.50-3.15 (5Н, m), 3.50 (2Н, dd), 4.80 (1H, dd), 5.90 (2Н, s), 7.20 (1H, m), 7.80-7.90 (1 H, m), 8.60 (1 H, m) млн-1. МС m/z 332 (MH+).
(2S)-2-[{(RS)-2-[6-аминопиридин-3-ил)-2-гидроксиэтил}(пропил)амино]пропан-1-ол
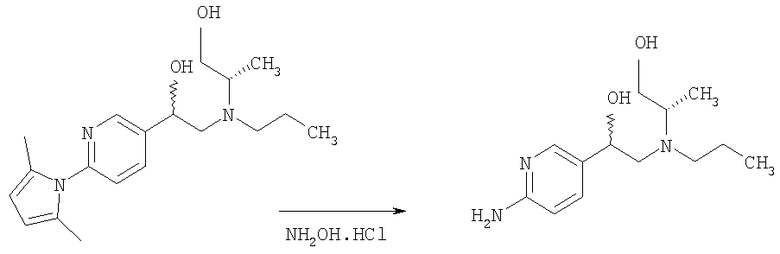
(2S)-2-[{(RS)-2-[6-(2,5-диметил-1H-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}пропиламино]пропан-1-ол (0,90 кг, 2,71 моль), гидроксиламина гидрохлорид (0,56 кг, 8,05 моль), этанол (5,20 л) и воду (0,45 л) объединяли и нагревали до температуры дефлегмации в течение ночи. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Добавляли воду (1,50 л) и охлаждали суспензию до 5°С. Образующуюся суспензию добавляли порциями к смеси концентрированной HCl (36% мас./мас., 0,25 л) и воды (3,10 л). Добавляли DCM (1,00 л) и давали фазам разделиться. Водную фазу промывали DCM (2×0,40 л) перед объединением с DCM (1,60 л) и подщелачиванием NaOH 10 н (1,45 л). После разделения фаз водную фазу экстрагировали DCM (1,60 л) и объединенную органическую фазу промывали NaOH 1,4 н (0,70 л), NaOH 0,9 н (0,55 л), водой (0,50 л), водой (0,25 л) и концентрировали в вакууме. Выход 87% (0,55 кг).
Объединяли (2S)-2-[{(R,S)-2-[6-(2,5-диметил-1H-пиррол-1-ил)пиридин-3-ил]-2-гидроксиэтил}пропиламино]пропан-1-ол (51,1 кг, 50,9% мас./мас. в DCM, 78,5 моль), гидроксиламина гидрохлорид (16,4 кг, 236 моль), бикарбонат натрия (3,30 кг, 39,3 моль) и этанол (136 л). Устанавливали оборудование для перегонки и заменяли DCM этанолом с получением конечного объема 130 литров. Реакционную смесь охлаждали до комнатной температуры и выдерживали в течение ночи при этой температуре. Реакционную смесь нагревали до температуры дефлегмации и перемешивали в течение 10,5 часов при температуре дефлегмации перед охлаждением до комнатной температуры. Устанавливали оборудование для вакуумной перегонки и этанол заменяли водой с получением конечного объема 120 литров. Данную смесь охлаждали до комнатной температуры и гранулировали в течение ночи. Побочный продукт выделяли фильтрацией и промывали водой (13 л). Фильтрат подкисляли HCl (22% мас./мас., 13,2 кг) и промывали DCM (3×26 л) перед объединением с DCM (78 л), водой (39 л) и подщелачиванием NaOH (40% мас./мас., 38,7 кг). После разделения фаз водную фазу экстрагировали DCM (52 л) и объединенную органическую фазу промывали NaOH (4,4% мас./мас., 14,6 кг) и водой (2×9 л). Выход 93% (196,3 кг, 9,5% мас./мас. в DCM).
δн (CDCl3, 300 МГц), 0.85 (3Н, t), 0.95 (3Н, m) 1.40-1.60 (2Н, m), 2.40-2.80 (4H, m), 2.95-3.10 (1H, m), 3.40 (1H, d), 3.45 (1H, d), 4.45 (2Н, br), 4.55 (1H, m), 6.50 (1H, d), 7.45 (1H, d), 8.00 (1H, s) млн-1. МС m/z 254 (MH+).
5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амин (Соединение А) и
5-[(2S,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амин (Соединение Б)
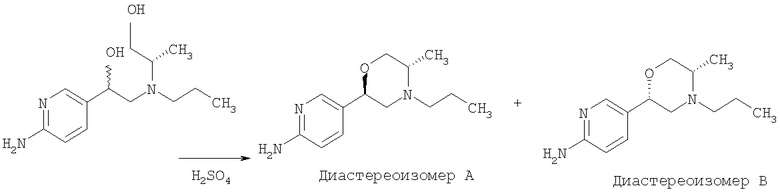
Раствор (2S)-2-[{(2RS)-2-[6-аминопиридин-3-ил)-2-гидроксиэтил}(пропил)амино]пропан-1-ола (0,50 кг, 1,97 моль) в DCM (1,0 л) добавляли порциями к концентрированной серной кислоте (98% масс./масс.) (1,10 л), поддерживая температуру ниже 25°С. Данную смесь перемешивали при комнатной температуре в течение 1 часа и затем охлаждали до температуры от 5°С до 10°С. Добавляли по каплям воду (2,0 л) и давали фазам разделиться. Водную фазу промывали DCM (0,5 л) и затем добавляли по каплям к раствору NaOH (1,71 кг) в воде (11,0 л). Добавляли DCM (1,5 л) и давали фазам разделиться. Водную фазу экстрагировали DCM (0,5 л) и объединенную органическую фазу промывали водой (0,5 л), водой (2×0,25 л) и концентрировали в вакууме. Выход 82% (0,38 кг).
(2S)-2-[{(2RS)-2-[6-аминопиридин-3-ил)-2-гидроксиэтил}(пропил)амино] пропан-1-ол в DCM (9,04% мас./мас., 340,6 кг, 122 моль) добавляли в течение 3,5 часов к концентрированной серной кислоте (98% мас./мас., 119,4 кг, 1217 моль), поддерживая температуру ниже 30°С. Данную смесь перемешивали при комнатной температуре в течение 1 часа и затем охлаждали до 5°С. Добавляли воду (145 л) на протяжении 2 часов, поддерживая температуру ниже 30°С, и давали фазам разделиться. К водной фазе на протяжении 2 часов добавляли DCM (92 л) и водный аммиак (35% мас./мас., 130 кг, 2678 моль), поддерживая температуру ниже 30°С. После разделения фаз водную фазу экстрагировали DCM (31 л) и объединенную органическую фазу промывали водой (2×16 л). Устанавливали оборудование для перегонки и DCM заменяли ацетоном с получением конечного объема 120 литров. Выход 92,5% (123,3 кг, 21,5% мас./мас. в ацетоне).
δн (CDCl3, 300 МГц), 0.85 (3Н, 2t), 1.00 (3Н×0.45, d, диастереоизомер А), 1.10 (3Н×0.55, d, диастереоизомер Б) 1.40-1.60 (2Н, m), 2.20-2.90 (5Н, m), 3.30-3.90 (2Н, m), 4.20 (2Н, br), 4.20-4.30 (1H, m), 6.50 (1Н, m), 7.45 (1Н, m), 8.05 (1Н, m) млн-1. МС m/z 236 (МН+).
Отношение диастереоизомера А и диастереоизомера Б определяют 1 Н-ЯМР после измерения отношения сигналов δн 1.00 млн-1 и δн 1.10 млн-1.
5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амин, ди((1S)-10-камфорсульфонат)моногидрат
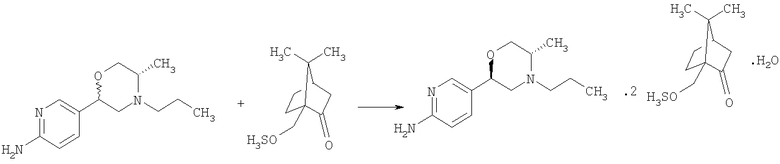
К раствору 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина и 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина (2,62 кг, 11,1 моль) в ацетоне (31,4 л) добавляли раствор (1S)-10-камфорсульфоновой кислоты (5,11 кг, 22,0 моль) в воде (2,29 л) и ацетоне (5,24 л). Данный раствор перемешивали при 20°С в течение 15 минут, добавляли затравочные кристаллы и гранулировали смесь при 20°С в течение ночи. Продукт собирали фильтрацией, промывали ацетоном (2×2,6 л) и сушили при 40°С под вакуумом в течение ночи. Выход 34% (2,71 кг).
К раствору 5-[(2S,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина и 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина (143,7 кг, 21,5% мас./мас. в ацетоне, 131 моль) в ацетоне (343 л) добавляли раствор (1S)-10-камфорсульфоновой кислоты (63,3 кг, 256 моль) в воде (24 л). Данный раствор перемешивали при 20°С в течение 15 минут, добавляли затравочные кристаллы и гранулировали смесь при 20°С в течение ночи. Продукт собирали фильтрацией, промывали ацетоном (62 л) и сушили при 45°С под вакуумом в течение ночи. Выход 37,8% (35,6 кг).
δн (CDCl3, 300 МГц) 0.7 (6Н, s), 0.9 (3Н, t), 1.05 (6H, s), 1.2-1.35 (7H, m), 1.5-1.75 (2H, m), 1.8 (2H, d), 1.8-1.9 (2H, m), 1.95 (2H, m), 2.25 (2H, m), 2.40 (2H, d), 2.55-2.7 (2H, m), 2.90 (2H, d), 2.95-3.35 (5Н, m), 3.65 (1H, m), 4.10 (1H, m), 4.7 (1H, m), 7.0 (1H, d), 7.95 (2H, m), 8.15 (2H, br), 9.8 (2H, br) млн-1. МС m/z 236 (MH+).
Характеристические пики дифракции рентгеновских лучей на порошке из расчетной картины для 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата
Основные характеристические пики;
Характеристические пики дифракции рентгеновских лучей на порошке для 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата
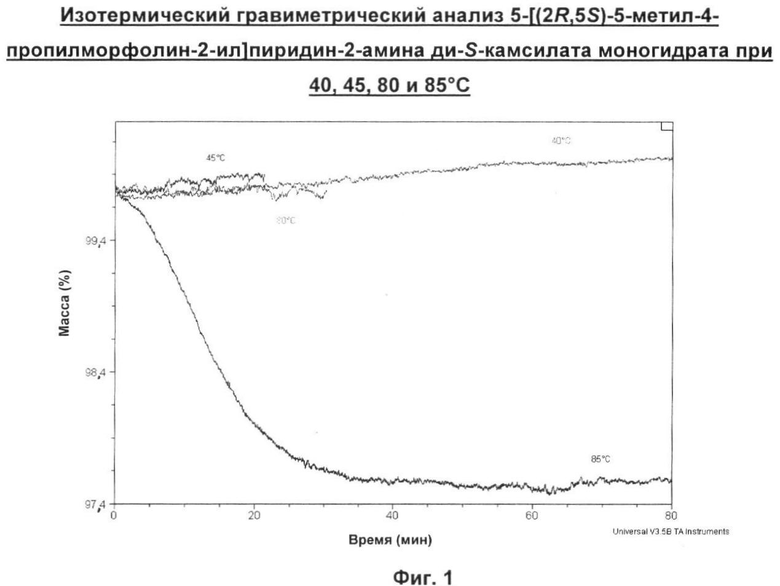
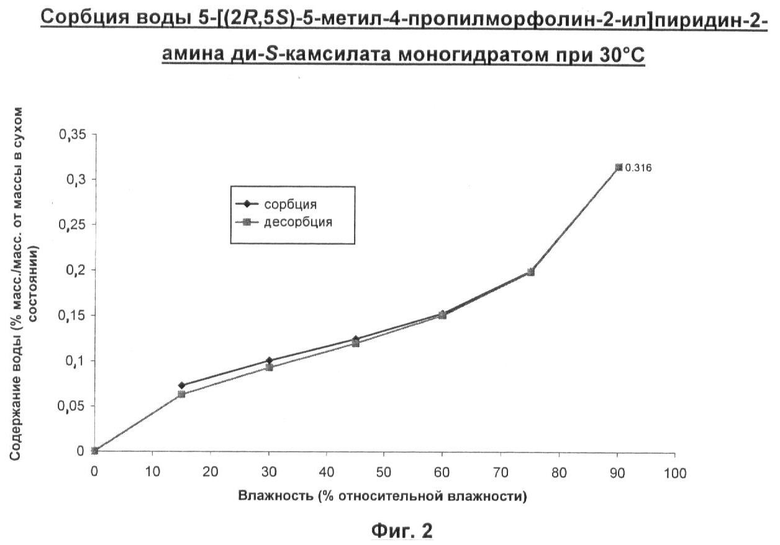
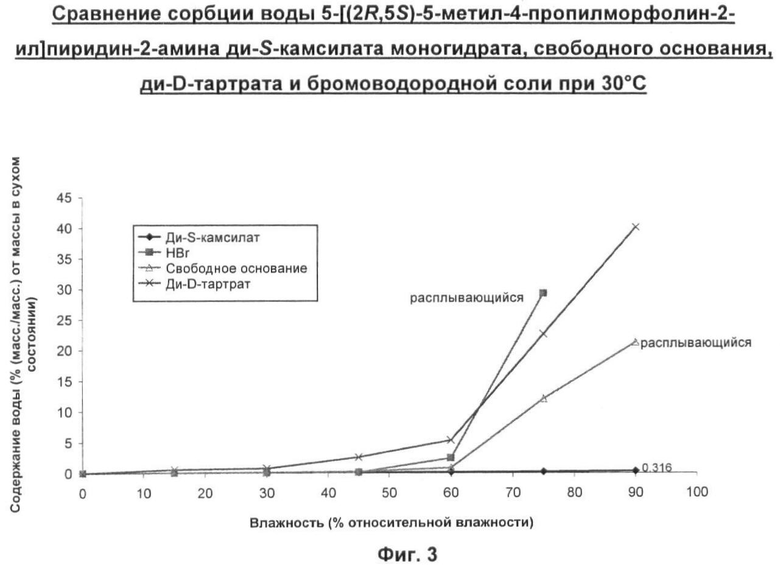
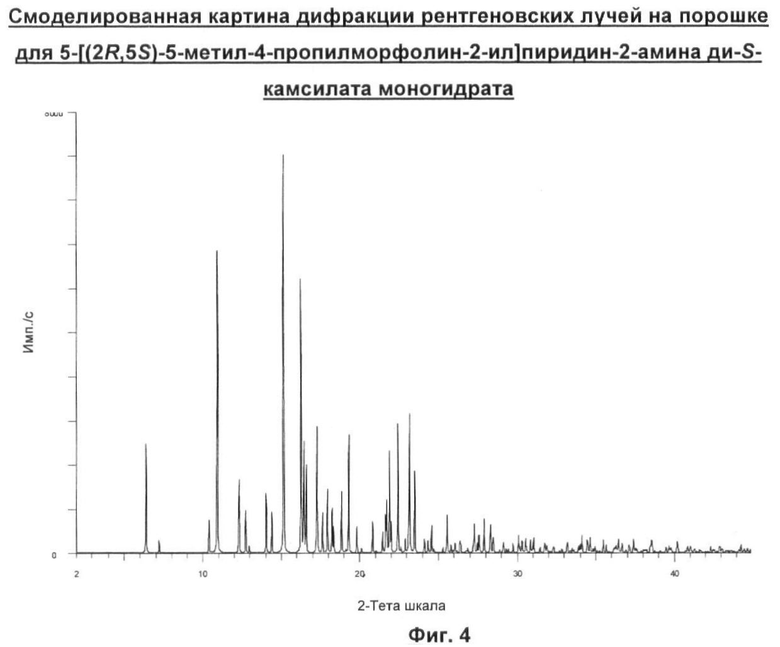
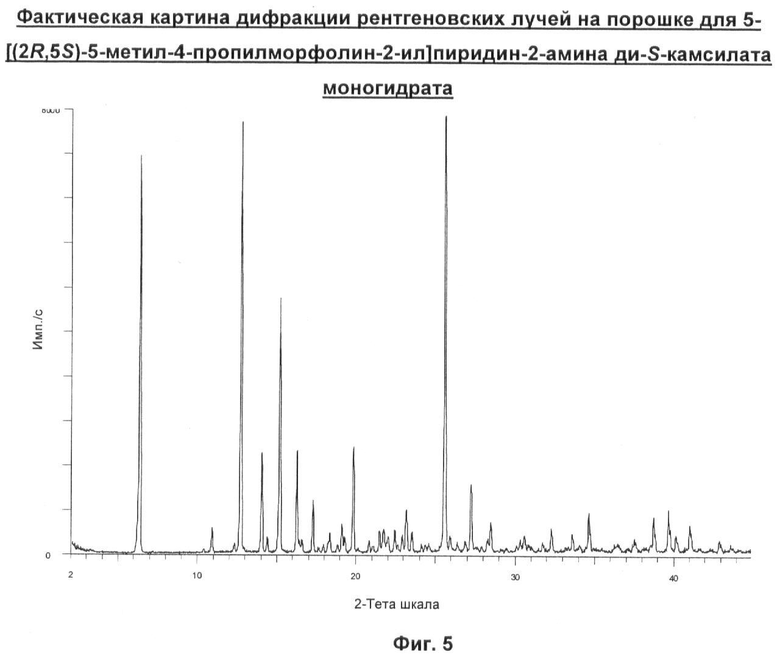
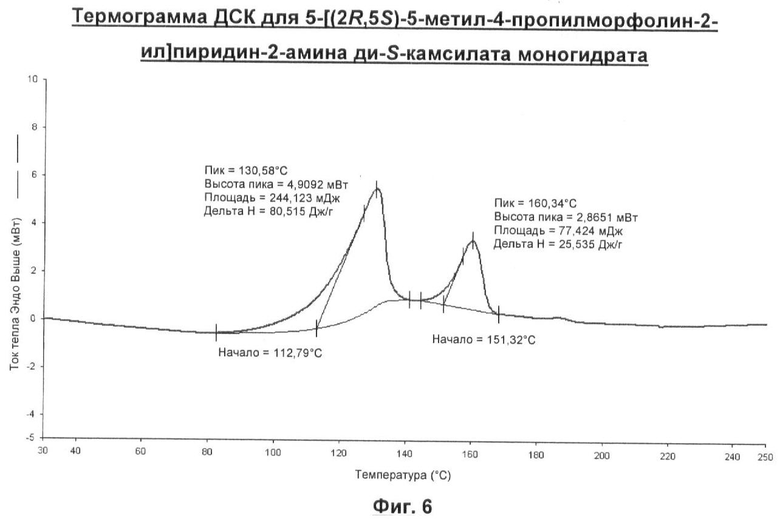
Данное изобретение относится к новой солевой форме 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина (I):
 , а конкретно данное изобретение относится к 5-[2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-(1S)-камфорсульфонату (ди-S-камсилату), к фармацевтической композиции, обладающей активностью в отношении рецептора дофамина D3, а также к применению данного соединения в приготовлении лекарственного средства для лечения сексуальной дисфункции и нейропсихиатрических расстройств, кроме того, к способу его получения и к промежуточному соединению. Технический результат: получена и описана новая солевая форма агониста дофамина, которая обладает преимуществами, а именно не является гигроскопичным, имеет кристаллическую форму и высокую температуру плавления. 6 н. и 5 з.п. ф-лы, 2 табл., 6 ил.
, а конкретно данное изобретение относится к 5-[2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-(1S)-камфорсульфонату (ди-S-камсилату), к фармацевтической композиции, обладающей активностью в отношении рецептора дофамина D3, а также к применению данного соединения в приготовлении лекарственного средства для лечения сексуальной дисфункции и нейропсихиатрических расстройств, кроме того, к способу его получения и к промежуточному соединению. Технический результат: получена и описана новая солевая форма агониста дофамина, которая обладает преимуществами, а именно не является гигроскопичным, имеет кристаллическую форму и высокую температуру плавления. 6 н. и 5 з.п. ф-лы, 2 табл., 6 ил.
1. 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат:
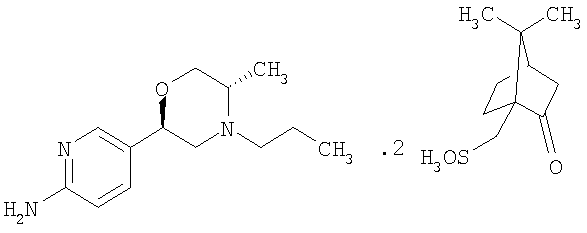
или его моногидрат.
2. Моногидрат по п.1, имеющий основные характеристические пики на картине дифракции рентгеновских лучей на порошке, генерированные с использованием медных К-альфа1 рентгеновских лучей (длина волны равна 1,54056 Å), составляющие 6,3, 12,7, 15,1, 16,3 и 25,6 градусов 2θ.
3. Фармацевтическая композиция, обладающая активностью в отношении рецептора дофамина D3, содержащая 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат или его моногидрат и фармацевтически приемлемый разбавитель или носитель.
4. Фармацевтическая композиция по п.3, где 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилат находится в форме моногидрата.
5. Соединение по любому из пп.1 и 2 для применения в медицине.
6. Применение соединения по любому из пп.1 и 2 в приготовлении лекарственного средства для лечения сексуальной дисфункции.
7. Применение по п.6, где сексуальная дисфункция представляет собой мужскую эректильную дисфункцию или женскую сексуальную дисфункцию.
8. Применение соединения по любому из пп.1 и 2 в приготовлении лекарственного средства для лечения нейропсихиатрических расстройств или нейродегенеративных расстройств.
9. Способ получения 5-[(2R,5S)-5-метил-4-пропилморфолин-2-ил]пиридин-2-амина ди-S-камсилата моногидрата, включающий взаимодействие соединения формулы (X)
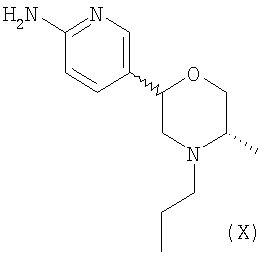
с (1S)-10-камфорсульфоновой кислотой в подходящем растворителе.
10. Способ по п.9, где растворителем является ацетон/вода.
11. Соединение формулы (VII)
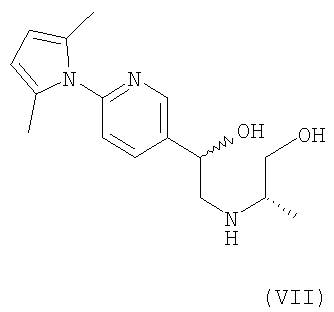
и его фармацевтически приемлемые соли и сольваты.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| 2-(N-МОРФОЛИЛ)-4-МЕТИЛПИРИДИН В КАЧЕСТВЕ ИНГИБИТОРА КИСЛОТНОЙ КОРРОЗИИ СТАЛИ | 1999 |
|
RU2168509C1 |
| Способ получения производных 2-амино-4-морфолино-6-пропил-1,3,5-триазина или их фармацевтически приемлемых кислотно-аддитивных солей | 1989 |
|
SU1806142A3 |
Авторы
Даты
2010-06-27—Публикация
2006-01-26—Подача