Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет согласно своду законов США 35 § 119 предварительной заявки с порядковым No. 60/730290, поданной 26 октября 2005 г.
Область техники, к которой относится изобретение
Изобретение относится к области промышленной микробиологии и получения спиртов. Более конкретно, изобутанол получают путем промышленной ферментации рекомбинантного микроорганизма.
Предшествующий уровень техники
Бутанол является важным промышленным химическим соединением, пригодным в качестве присадки к топливу, химического сырья для промышленного получения пластмасс и в качестве экстрагирующего средства в пищевой промышленности и производстве ароматизаторов. Каждый год от 10 до 12 миллиардов фунтов бутанола получают с помощью нефтехимических способов и потребность в этом химическом продукте массового спроса будет, очевидно, расти.
Известны способы химического синтеза изобутанола, такие как оксосинтез, каталитическая гидрогенизация монооксида углерода (Ullmann's Encyclopedia of Industrial Chemistry, 6th edition, 2003, Wiley-VCHVerlag GmbH and Co., Weinheim, Germany, Vol. 5, pp. 716-719) и конденсация метанола с н-пропанолом по Guerbet (Carlini et al., J. Mol. Catal. A:Chem. 220:215-220 (2004)). В этих способах применяют исходные реагенты, происходящие из нефтехимических продуктов, и они обычно дороги и не приемлемы с экологической точки зрения. Получение изобутанола из сырья растительного происхождения должно свести к минимуму выделение тепличного газа и должно представлять собой достижение в данной области техники.
Изобутанол получают биологически как побочный продукт ферментации дрожжей. Он является компонентом «сивушного масла», которое образуется в результате неполного метаболизма аминокислот этой группой грибов. Изобутанол специфически продуцируется в результате катаболизма L-валина. После того как аминогруппу L-валина собирают в качестве источника азота, оставшуюся α-кетокислоту декарбоксилируют и восстанавливают до изобутанола с помощью ферментов так называемого пути Эрлиха (Dickinson et al., J. Biol. Chem. 273(40):25752-25756 (1998)). Выходы сивушного масла и/или его компонентов, достигаемые в процессе ферментации напитков, обычно являются низкими. Например, концентрация изобутанола, получаемая при ферментации пива, как сообщается, составляет менее 16 частей на миллион (Garcia et al., Process Biochemistry 29:303-309 (1994)). Добавление экзогенного L-валина в систему ферментации повышает выход изобутанола, как описано Dickinson et al., выше, где сообщается, что выход изобутанола в 3 г/л получают при внесении L-валина в концентрации 20 г/л в систему ферментации. Однако применение валина в качестве промышленного сырья должно характеризоваться чрезвычайно высокой стоимостью для получения изобутанола в промышленном масштабе. Биосинтез изобутанола непосредственно из сахаров должен быть экономически целесообразным и должен представлять достижение в данной области техники. Сообщения о создании рекомбинантного микроорганизма, продуцирующего изобутанол, отсутствуют.
Следовательно, существует потребность в приемлемом для окружающей среды, рентабельном способе получения изобутанола в качестве единственного продукта. Настоящее изобретение обращено на эту потребность путем обеспечения рекомбинантным микробным хозяином-продуцентом, который экспрессирует компоненты пути биосинтеза изобутанола.
Краткое изложение сущности изобретения
В изобретении предлагается рекомбинантный микроорганизм, обладающий сконструированным путем биосинтеза изобутанола. Сконструированный микроорганизм может быть использован для промышленного получения изобутанола. Соответственно в одном осуществлении в изобретении предлагается рекомбинантная микробная клетка-хозяин, включающая по меньшей мере одну молекулу ДНК, кодирующую полипептид, который катализирует превращение субстрата в продукт, выбранное из группы, состоящей из
i) пирувата в ацетолактат (стадия a пути)
ii) ацетолактата в 2,3-дигидроксиизовалерат (стадия b пути)
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат (стадия c пути)
iv) α-кетоизовалерата в изобутиральдегид (стадия d пути) и
v) изобутиральдегид в изобутанол (стадия e пути),
где по меньшей мере одна молекула ДНК является гетерологичной по отношению к указанной микробной клетке-хозяину и где указанная микробная клетка-хозяин продуцирует изобутанол.
В другом осуществлении в изобретении предлагается рекомбинантная микробная клетка-хозяин, включающая по меньшей мере одну молекулу ДНК, кодирующую полипептид, который катализирует превращение субстрата в продукт, выбранное из группы, состоящей из
i) пирувата в ацетолактат, (стадия a пути)
ii) ацетолактата в 2,3-дигидроксиизовалерат, (стадия b пути)
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат, (стадия c пути)
iv) α-кетоизовалерата в изобутирил-КоА, (стадия f пути),
v) изобутирил-КоА в изобутиральдегид, (стадия g пути), и
vi) изобутиральдегид в изобутанол; (стадия e пути),
где по меньшей мере одна молекула ДНК является гетерологичной по отношению к указанной микробной клетке-хозяину и где указанная микробная клетка-хозяин продуцирует изобутанол.
В другом осуществлении в изобретении предлагается рекомбинантная микробная клетка-хозяин, включающая по меньшей мере одну молекулу ДНК, кодирующую полипептид, который катализирует превращение субстрата в продукт, выбранное из группы, состоящей из
i) пирувата в ацетолактат, (стадия a пути)
ii) ацетолактата в 2,3-дигидроксиизовалерат, (стадия b пути)
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат, (стадия c пути)
iv) α-кетоизовалерата в валин, (стадия h пути)
v) валина в изобутиламин, (стадия i пути)
vi) изобутиламина в изобутиральдегид, (стадия j пути), и
vii) изобутиральдегида в изобутанол; (стадия e пути),
где по меньшей мере одна молекула ДНК является гетерологичной по отношению к указанной микробной клетке-хозяину и где указанная микробная клетка-хозяин продуцирует изобутанол.
В другом осуществлении в изобретении предлагается способ получения изобутанола, включающий
1) получение рекомбинантной микробной клетки-хозяина, включающей по меньшей мере одну молекулу ДНК, кодирующую полипептид, который катализирует превращение субстрата в продукт, выбранное из группы, состоящей из
i) пирувата в ацетолактат (стадия a пути)
ii) ацетолактата в 2,3-дигидроксиизовалерат (стадия b пути)
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат (стадия c пути)
iv) α-кетоизовалерата в изобутиральдегид (стадия d пути), и
v) изобутиральдегида в изобутанол; (стадия e пути),
где по меньшей мере одна молекула ДНК является гетерологичной по отношению к указанной микробной клетке-хозяину; и
2) контактирование клетки-хозяина (1) с ферментируемым углеродным субстратом в ферментационной среде в условиях, при которых продуцируется изобутанол.
В другом осуществлении в изобретении предлагается способ получения изобутанола, включающий
1) получение рекомбинантной микробной клетки-хозяина, включающей по меньшей мере одну молекулу ДНК, кодирующую полипептид, который катализирует превращение субстрата в продукт, выбранное из группы, состоящей из
i) пирувата в ацетолактат, (стадия a пути)
ii) ацетолактата в 2,3-дигидроксиизовалерат, (стадия b пути)
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат, (стадия c пути)
iv) α-кетоизовалерата в изобутирил-КоА, (стадия f пути)
v) изобутирил-КоА в изобутиральдегид, (стадия g пути), и
vi) изобутиральдегида в изобутанол; (стадия e пути),
где по меньшей мере одна молекула ДНК является гетерологичной по отношению к указанной микробной клетке-хозяину; и
2) контактирование клетки-хозяина (1) с ферментируемым углеродным субстратом в ферментационной среде в условиях, при которых продуцируется изобутанол.
В другом осуществлении в изобретении предлагается способ получения изобутанола, включающий
1) получение рекомбинантной микробной клетки-хозяина, включающей по меньшей мере одну молекулу ДНК, кодирующую полипептид, который катализирует превращение субстрата в продукт, выбранное из группы, состоящей из
i) пирувата в ацетолактат, (стадия a пути)
ii) ацетолактата в 2,3-дигидроксиизовалерат, (стадия b пути)
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат, (стадия c пути)
iv) α-кетоизовалерата в валин, (стадия h пути)
v) валина в изобутиламин, (стадия i пути)
vi) изобутиламина в изобутиральдегид; (стадия j пути), и
vii) изобутиральдегида в изобутанол; (стадия e пути),
где по меньшей мере одна молекула ДНК является гетерологичной по отношению к указанной микробной клетке-хозяину; и
2) контактирование клетки-хозяина (1) с ферментируемым углеродным субстратом в ферментационной среде в условиях, при которых продуцируется изобутанол.
В альтернативном осуществлении в изобретении предлагается ферментационная среда, содержащая изобутанол, продуцируемая с помощью способов изобретения.
Краткое описание фигур и описание последовательностей
Изобретение может быть понято более полно из последующего подробного описания, фигур и сопровождающего описания последовательностей, которые составляют часть этой заявки.
На чертеже представлено четыре различных пути биосинтеза изобутанола. Стадии, обозначенные «a», «b», «c», «d», «e», «f», «g», «h», «i», «j» и «k», представляют собой превращения субстрата в продукт, описанные ниже.
Следующие последовательности согласуются с 37 C.F.R. 1.821-1.825 («Requirements for Patent Applications Containing Nucleotide Sequences and/or Amino Acid Sequence Disclosures - the Sequence Rules») и совместимы со стандартом ST.25 (1998) Всемирной организации интеллектуальной собственности (WIPO), и с требованиями перечня последовательностей EPO и PCT (правила 5.2 и 49.5(a-бис) и раздел 208 и приложение C административных инструкций). Символы и формат, применяемые для данных по нуклеотидной и аминокислотной последовательностям, подчиняются правилам, установленным в 37 C.F.R. §1.822.
SEQ ID NO:11-38, 40-69, 72-75, 85-138, 144, 145, 147-157, 159-176 представляют собой нуклеотидные последовательности клонированных олигонуклеотидов, скрининга или последовательностей праймеров, используемых в описанных здесь примерах.
SEQ ID NO:39 представляет собой нуклеотидную последовательность кластера генов cscBKA, описанную в примере 16.
SEQ ID NO:70 представляет собой нуклеотидную последовательность промотора глюкозоизомеразы 1.6Gl, описанную в примере 13.
SEQ ID NO:71 представляет собой нуклеотидную последовательность промотора 1.5Gl, описанную в примере 13.
SEQ ID NO:76 представляет собой нуклеотидную последовательность промотора GPD, описанную в примере 17.
SEQ ID NO:77 представляет собой нуклеотидную последовательность терминатора CYC1, описанную в примере 17.
SEQ ID NO:79 представляет собой нуклеотидную последовательность промотора FBA, описанную в примере 17.
SEQ ID NO:81 представляет собой нуклеотидную последовательность промотора ADH1, описанную в примере 17.
SEQ ID NO:82 представляет собой нуклеотидную последовательность терминатора ADH1, описанную в примере 17.
SEQ ID NO:84 представляет собой нуклеотидную последовательность промотора GPM, описанную в примере 17.
SEQ ID NO:139 представляет собой аминокислотную последовательность сахарозогидролазы (CscA).
SEQ ID NO:140 представляет собой аминокислотную последовательность D-фруктокиназы (CscK).
SEQ ID NO:141 представляет собой аминокислотную последовательность сахарозопермеазы (CscB).
SEQ ID NO:142 представляет собой нуклеотидную последовательность плазмиды pFP988DssPspac, описанную в примере 20.
SEQ ID NO:143 представляет собой нуклеотидную последовательность плазмиды pFP988DssPgroE, описанную в примере 20.
SEQ ID NO:146 представляет собой нуклеотидную последовательность фрагмента вектора pFP988Dss, описанную в примере 20.
SEQ ID NO:177 представляет собой нуклеотидную последовательность суммарного вектора pFP988, описанную в примере 21.
SEQ ID NO:267 представляет собой нуклеотидную последовательность плазмиды pC194, описанную в примере 21.
Подробное описание изобретения
Настоящее изобретение относится к способам получения изобутанола с применением рекомбинантных микроорганизмов. Настоящее изобретение удовлетворяет ряду коммерческих и промышленных потребностей. Бутанол является важным промышленным химическим продуктом с разнообразным применением, где его потенциал в качестве топлива или присадки к топливу особенно важен. Являясь только четырехуглеродным спиртом, бутанол обладает запасом энергии, сходным с таковым бензина, и может быть смешан с ископаемым топливом. Бутанол предпочтителен в качестве топлива или присадки к топливу, так как он дает выход только CO2 и не дает или дает мало SOx или NOx при сгорании в двигателе внутреннего сгорания. Дополнительно бутанол является менее коррозийным, чем этанол, наиболее предпочтительная присадка к топливу в настоящее время.
В дополнение к его применимости в качестве биотоплива или присадки к топливу бутанол обладает потенциалом влияния на проблемы распределения водорода в появляющейся индустрии топливных элементов. Топливные элементы в настоящее время представляют собой проблему для безопасности, связанную с транспортом и распределением водорода. Бутанол может быть легко перестроен в отношении его содержания водородов и может быть распределен между существующими бензозаправочными станциями в чистоте, требуемой либо для топливных элементов, либо для носителей.
Наконец, в настоящем изобретении изобутанол продуцируется из источников углерода, происходящих из растений, избегая воздействия на окружающую среду, связанного с нефтехимическими процессами получения бутанола.
Следующие определения и сокращения предназначены для применения при интерпретации формулы изобретения и описания.
Как здесь применяется, термин «изобретение» или «настоящее изобретение» представляет собой нелимитирующий термин и не предназначен для отнесения любого простого осуществления конкретного изобретения, но охватывает все возможные осуществления, как описано в описании и формуле изобретения.
Термин «путь биосинтеза изобутанола» относится к ферментативным путям получения изобутанола.
Термины «ацетолактатсинтаза» и «ацетолактатсинтетаза» применяются здесь взаимозаменяемо в отношении фермента, который катализирует превращение пирувата в ацетолактат и CO2. Предпочтительные ацетолактатсинтазы известны под номером EC 2.2.1.6 9 (Enzyme Nomenclature 1992, Academic Press, San Diego). Эти ферменты доступны из ряда источников, включая, но не ограничиваясь этим, Bacillus subtilis (GenBank NO: CAB15618 (SEQ ID NO:178), Z99122 (SEQ ID NO:78), аминокислотная последовательность NCBI (National Center for Biotechnology Information), нуклеотидная последовательность NCBI соответственно), Klebsiella pneumoniae [GenBank NO: AAA25079 (SEQ ID NO:2), M73842 (SEQ ID NO:1)) и Lactococcus lactis (GenBank NO: AAA25161 (SEQ ID NO:180), L16975; SEQ ID NO:179)).
Термины «изомероредуктаза ацетогидроксикислот» и «редуктоизомераза ацетогидроксикислот» применяются здесь взаимозаменяемо в отношении к ферменту, который катализирует превращение ацетолактата в 2,3-дигидроксиизовалерат с использованием НАДФН (восстановленного никотинамидадениндинуклеотид-фосфата) в качестве донора электронов. Предпочтительные изомероредуктазы ацетогидроксикислот известны под номером EC 1.1.1.86 и последовательности доступны из большого спектра микроорганизмов, включая, но не ограничиваясь этим, Escherichia coli (GenBank NO: NP_418222 (SEQ ID NO:4), NC_000913 (SEQ ID NO:3)), Saccharomyces cerevisiae (GenBank NO: NP_013459 (SEQ ID NO:181), NC_001144 (SEQ ID NO:80)), Methanococcus maripaludis (GenBank NO: CAF30210 (SEQ ID NO:183), BX957220 (SEQ ID NO:182)) и Bacillus subtilis (GenBank NO: CAB 14789 (SEQ ID NO:185), Z99118 (SEQ ID NO:184)).
Термин «дегидратаза ацетогидроксикислот» относится к ферменту, который катализирует превращение 2,3-дигидроксиизовалерата в α-кетоизовалерат. Предпочтительные дегидратазы ацетогидроксикислот известны под номером EC 4.2.1.9. Эти ферменты доступны из большого спектра микроорганизмов, включая, но не ограничиваясь этим, E. coli (GenBank NO: YP_026248 (SEQ ID NO:6), NC_000913 (SEQ ID NO:5)), S. cerevisiae (GenBank NO: NP_012550 (SEQ ID NO:186), NC_001142 (SEQ ID NO:83)), M. maripaludis (GenBank NO: CAF29874 (SEQ ID NO:188), BX957219 (SEQ ID NO:187)) и B. subtilis (GenBank NO: CAB14105 (SEQ ID NO:190), Z99115 (SEQ ID NO:189)).
Термин «декарбоксилаза α-кетокислоты с разветвленной цепью» относится к ферменту, который катализирует превращение α-кетоизовалерата в изобутиральдегид и CO2. Предпочтительные декарбоксилазы α-кетокислот с разветвленной цепью известны под номером EC 4.1.1.72 и доступны из ряда источников, включая, но не ограничиваясь этим, Lactococcus lactis (GenBank NO: AAS49166 (SEQ ID NO:193), AY548760 (SEQ ID NO:192); CAG34226 (SEQ ID NO:8), AJ746364 (SEQ ID NO:191), Salmonella typhimurium (GenBank NO: NP_461346 (SEQ ID NO:195), NC_003197 (SEQ ID NO:194)) и Clostridium acetobutylicum (GenBank NO: NP_149189 (SEQ ID NO:197), NC_001988 (SEQ ID NO:196)).
Термин «дегидрогеназа спиртов с разветвленной цепью» относится к ферменту, который катализирует превращение изобутиральдегида в изобутанол. Предпочтительные дегидрогеназы спиртов с разветвленной цепью известны под номером EC 1.1.1.265, но могут также классифицироваться как другие алкогольдегидрогеназы (конкретно, EC 1.1.1.1 или 1.1.1.2). Эти ферменты используют НАДН (восстановленный никотинамидадениндинуклеотид) и/или НАДФН в качестве донора электронов, и они доступны из ряда источников, включая, но не ограничиваясь этим, S. cerevisiae (GenBank NO: NP_010656 (SEQ ID NO:199), NC_001136 (SEQ ID NO:198); NP_0314051 (SEQ ID NO:201) NC_001145 (SEQ ID NO:200)), E. coli (GenBank NO: NP_417484 (SEQ ID NO:10), NC_000913 (SEQ ID NO:9)) и C. acetobutylicum (GenBank NO: NP_349892 (SEQ ID NO:203), NC_003030 (SEQ ID NO:202); NP_349891 (SEQ ID NO:204), NC_003030 (SEQ ID NO:158)).
Термин «дегидрогеназа кетокислот с разветвленной цепью» относится к ферменту, который катализирует превращение α-кетоизовалерата в изобутирил-КоА (изобутирил-коэнзим A) с использованием НАД+ (никотинамидадениндинуклеотида) в качестве акцептора электронов. Предпочтительные дегидрогеназы кетокислот с разветвленной цепью известны под номером EC 1.2.4.4. Эти дегидрогеназы кетокислот с разветвленной цепью включают четыре субъединицы и последовательности всех субъединиц доступны от большого набора микроорганизмов, включая, но не ограничиваясь этим, B. subtilis (GenBank NO: CAB14336 (SEQ ID NO:206), Z99116 (SEQ ID NO:205); CAB14335 (SEQ ID NO:208), Z99116 (SEQ ID NO:207); CAB14334 (SEQ ID NO:210), Z99116 (SEQ ID NO:209); и CAB14337 (SEQ ID NO:212), Z99116 (SEQ ID NO:211)) и Pseudomonas putida (GenBank NO: AAA65614 (SEQ ID NO:214), M57613 (SEQ ID NO:213); AAA65615 (SEQ ID NO:216), M57613 (SEQ ID NO:215); AAA65617 (SEQ ID NO:218), M57613 (SEQ ID NO:217); и AAA65618 (SEQ ID NO:220), M57613 (SEQ ID NO:219)).
Термин «ацилирующая альдегиддегидрогеназа» относится к ферменту, который катализирует превращение изобутирил-КоА в изобутиральдегид с использованием либо НАДН, либо НАДФН в качестве донора электронов. Предпочтительные ацилирующие альдегиддегидрогеназы известны под номерами EC 1.2.1.10 и 1.2.1.57. Эти ферменты доступны из множества источников, включая, но не ограничиваясь этим, Clostridium beijerinckii (GenBank NO: AAD31841 (SEQ ID NO:222), AF157306 (SEQ ID NO:221)), C. acetobutylicum (GenBank NO: NP_149325 (SEQ ID NO:224), NC_001988 (SEQ ID NO:223); NP_149199 (SEQ ID NO:226), NC_001988 (SEQ ID NO:225)), P. putida (GenBank NO: AAA89106 (SEQ ID NO:228), U13232 (SEQ ID NO:227)) и Thermus thermophilus (GenBank NO: YP_145486 (SEQ ID NO:230), NC_006461 (SEQ ID NO:229)).
Термин «трансаминаза» относится к ферменту, который катализирует превращение α-кетоизовалерата в L-валин с использованием либо аланина, либо глутамата в качестве донора амина. Предпочтительные трансаминазы известны под номерами EC 2.6.1.42 и 2.6.1.66. Эти ферменты доступны из ряда источников. Примеры источников для ферментов, зависимых от аланина, включают, но не ограничиваются этим, E. coli (GenBank NO: YP_026231 (SEQ ID NO:232), NC_000913 (SEQ ID NO:231)) и Bacillus licheniformis (GenBank NO: YP_093743 (SEQ ID NO:234), NC_006322 (SEQ ID NO:233)). Примеры источников для ферментов, зависимых от глутамата, включают, но не ограничиваются этим, E. coli (GenBank NO: YP_026247 (SEQ ID NO:236), NC_000913 (SEQ ID NO:235)), S. cerevisiae (GenBank NO: NP_012682 (SEQ ID NO:238), NC_001142 (SEQ ID NO:237)) и Methanobacterium thermoautotrophicum (GenBank NO: NP_276546 (SEQ ID NO:240), NC_000916 (SEQ ID NO:239)).
Термин «валиндегидрогеназа» относится к ферменту, который катализирует превращение α-кетоизовалерата в L-валин с использованием НАД(Ф)Н в качестве донора электронов и аммиака в качестве донора амина. Предпочтительные валиндегидрогеназы известны под номерами EC 1.4.1.8 и 1.4.1.9 и доступны из ряда источников, включая, но не ограничиваясь этим, Streptomyces coelicolor (GenBank NO: NP_628270 (SEQ ID NO:242), NC_003888 (SEQ ID NO:241)) и B. subtilis (GenBank NO: CAB14339 (SEQ ID NO:244), Z99116 (SEQ ID NO:243)).
Термин «валиндекарбоксилаза» относится к ферменту, который катализирует превращение L-валина в изобутиламин и CO2. Предпочтительные валиндекарбоксилазы известны под номером EC 4.1.1.14. Эти ферменты найдены в Streptomycetes, таких как, например, Streptomyces viridifaciens (GenBank NO: AAN10242 (SEQ ID NO:246), AY116644 (SEQ ID NO:245)).
Термин «омега-трансаминаза» относится к ферменту, который катализирует превращение изобутиламина в изобутиральдегид с использованием подходящей аминокислоты в качестве донора амина. Предпочтительные омега-трансаминазы известны под номером EC 2.6.1.18 и доступны из ряда источников, включая, но не ограничиваясь этим, Alcaligenes denitrificans (AAP92672 (SEQ ID NO:248), AY330220 (SEQ ID NO:247)), Ralstonia eutropha (GenBank NO: YP_294474 (SEQ ID NO:250), NC_007347 (SEQ ID NO:249)), Shewanella oneidensis (GenBank NO: NP_719046 (SEQ ID NO:252), NC_004347 (SEQ ID NO:251)) и P. putida (GenBank NO: AAN66223 (SEQ ID NO:254), AE016776 (SEQ ID NO:253)).
Термин «изобутирил-КоА-мутаза» относится к ферменту, который катализирует превращение бутирил-КоА- в изобутирил-КоА. Этот фермент использует коэнзим B12 в качестве кофактора. Предпочтительные изобутирил-КоА-мутазы известны под номером EC 5.4.99.13. Эти ферменты найдены в ряде Streptomycetes, включая, но не ограничиваясь этим, Streptomyces cinnamonensis (GenBank NO: AAC08713 (SEQ ID NO.256), U67612 (SEQ ID NO:255); CAB59633 (SEQ ID NO:258), AJ246005 (SEQ ID NO:257)), S. coelicolor (GenBank NO: CAB70645 (SEQ ID NO:260), AL939123 (SEQ ID NO:259); CAB92663 (SEQ ID NO:262), AL939121 (SEQ ID NO:261)) и Streptomyces avermitilis (GenBank NO: NP_824008 (SEQ ID NO:264), NC_003155 (SEQ ID NO:263); NP_824637 (SEQ ID NO:266), NC_003155 (SEQ ID NO:265)).
Термин «факультативный анаэроб» относится к микроорганизму, который может расти как в аэробных, так и в анаэробных условиях.
Термин «углеродный субстрат» или «ферментируемый углеродный субстрат» относится к источнику углерода, способному метаболизироваться организмами-хозяевами настоящего изобретения, и особенно к источникам углерода, выбранным из группы, состоящей из моносахаридов, олигосахаридов, полисахаридов и одноуглеродных субстратов или их смесей.
Термин «ген» относится к фрагменту нуклеиновой кислоты, который способен экспрессироваться в виде конкретного белка, необязательно включая регуляторные последовательности перед (5'-некодирующие последовательности) и после (3'-некодирующие последовательности) кодирующей последовательности. «Природный ген» относится к гену, в том виде как он находится в природе, с его собственными регуляторными последовательностями. «Химерный ген» относится к любому гену, который не является природным геном, включающему регуляторные и кодирующие последовательности, которые вместе не находят в природе. Соответственно химерный ген может включать регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят от одного и того же источника, но располагаются отличным от природного образом. «Эндогенный ген» относится к природному гену в своей природной локализации в геноме организма. «Чужеродный ген» или «гетерологичный ген» относится к гену, не обнаруживаемому в организме-хозяине в норме, но введенному в организм-хозяин с помощью переноса гена. Чужеродные гены могут включать природные гены, вставленные в неприродный организм или химерные гены. «Трансген» представляет собой ген, который введен в геном с помощью метода трансформации.
Используемый здесь термин «кодирующая последовательность» относится к последовательности ДНК, которая кодирует конкретную аминокислотную последовательность. «Подходящие регуляторные последовательности» относятся к нуклеотидным последовательностям, расположенным выше (5'-некодирующие последовательности), внутри или ниже (3'-некодирующие последовательности) кодирующей последовательности, которые влияют на транскрипцию, процессинг, или стабильность РНК, или трансляцию связанной кодирующей последовательности. Регуляторные последовательности могут включать промоторы, лидирующие последовательности трансляции, интроны, последовательности распознавания полиаденилирования, сайт процессинга РНК, эффекторный связывающий сайт и структуру основа-петля.
Термин «промотор» относится к последовательности ДНК, способной регулировать экспрессию кодирующей последовательности или функциональной РНК. В целом, кодирующая последовательность расположена на 3'-конце по отношению к промоторной последовательности. Промоторы могут происходить целиком из природного гена или состоять из различных элементов, происходящих из различных промоторов, существующих в природе, или даже включать синтетические сегменты ДНК. Специалистам в данной области техники понятно, что различные промоторы могут направлять экспрессию гена в разных тканях или клеточных типах, или на разных стадиях развития, или в ответ на различные условия окружающей среды или физиологические условия. Промоторы, которые заставляют ген экспрессироваться в большинстве клеточных типах большую часть времени, обозначают как «конститутивные промоторы». Очевидно также, что, так как в большинстве случаев точные границы регуляторных последовательностей полностью не определены, фрагменты ДНК различной длины могут иметь идентичную промоторную активность.
Термин «оперативно связанный» относится к связи последовательностей нуклеиновой кислоты на одиночном фрагменте нуклеиновой кислоты, так что функция одной влияет на другую. Например, промотор оперативно связан с кодирующей последовательностью, когда он способен влиять на экспрессию этой кодирующей последовательности (т.е. когда кодирующая последовательность находится под транскрипционным контролем промотора). Кодирующие последовательности могут быть оперативно связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
Используемый здесь термин «экспрессия» относится к транскрипции и стабильной аккумуляции смысловой (мРНК) или антисмысловой РНК, происходящей от фрагмента нуклеиновой кислоты изобретения. Экспрессия может также относиться к трансляции мРНК в полипептид.
Используемый здесь термин «трансформация» относится к переносу фрагмента нуклеиновой кислоты в организм-хозяин, что приводит к генетически стабильному наследованию. Организмы-хозяева, содержащие трансформированные фрагменты нуклеиновой кислоты, обозначаются как «трансгенные», или «рекомбинантные», или «трансформированные» организмы.
Термины «плазмида», «вектор» и «кассета» относятся к внехромосомному элементу, часто несущему гены, которые не являются частью центрального метаболизма клетки, и обычно в форме кольцевых фрагментов двуспиральной ДНК. Такие элементы могут представлять собой автономно реплицирующиеся последовательности, интегрирующиеся в геном последовательности, фаг или нуклеотидные последовательности, линейные или кольцевые, одно- или двуспиральные ДНК или РНК, происходящие из любого источника, в котором ряд нуклеотидных последовательностей соединен или рекомбинирован в единую конструкцию, которая способна вводить в клетку промоторный фрагмент и последовательность ДНК для выбранного продукта гена совместно с подходящей 3'-нетранслируемой последовательностью. «Трансформационная кассета» относится к конкретному вектору, содержащему чужеродный ген и обладающему элементами в дополнение к чужеродному гену, которые облегчают трансформацию конкретной клетки-хозяина. «Экспрессионная кассета» относится к конкретному вектору, содержащему чужеродный ген и обладающему элементами в дополнение к чужеродному гену, которые позволяют усиливать экспрессию гена в чужеродном хозяине.
Используемый здесь термин «вырожденность кодона» относится к природе генетического кода, допускающей вариацию нуклеотидной последовательности без влияния на аминокислотную последовательность кодируемого полипептида. Специалист в данной области техники хорошо осведомлен о «предпочтительности кодона», проявляемом конкретной клеткой-хозяином при использовании кодонов нуклеотидов для определения данной аминокислоты. Следовательно, при синтезе гена для улучшенной экспрессии в клетке-хозяине желательно создавать ген так, чтобы частота использования его кодонов приближалась к частоте использования предпочтительных кодонов клеткой-хозяином.
Термин «кодон-оптимизированный», когда это относится к генам или кодирующим областям молекул нуклеиновой кислоты для трансформации различных хозяев, относится к изменению кодонов в гене или кодирующих областях молекул нуклеиновой кислоты, отражающих типичное использование кодонов организмом-хозяином без изменения полипептида, кодируемого ДНК.
Стандартные способы рекомбинантной ДНК и молекулярного клонирования, применяемые здесь, хорошо известны в данной области техники и описаны Sambrook, J., Fritsch, E.F. and Maniatis, T., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1989) (здесь далее "Maniatis"); и Silhavy, T.J., Bennan, M.L. and Enquist, L.W., Experiments with Gene Fusions, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1984); и Ausubel, F.M. et al., Current Protocols in Molecular Biology, опубликованной Greene Publishing Assoc., and Wiley-lnterscience (1987).
Пути биосинтеза изобутанола
Микроорганизмы, использующие углеводы, осуществляют путь Embden-Meyerhof-Parnas (EMP), путь Entner-Doudoroff и пентозофосфатный цикл в качестве центральных метаболических путей обеспечения энергией и клеточными предшественниками для роста и поддержания жизнеспособности. Эти пути имеют общий промежуточный продукт глицеральдегид-3-фосфат и в конечном итоге образуется пируват, прямо или в сочетании с путем EMP. В последующем пируват трансформируется в ацетил-коэнзим A (ацетил-КоА) с помощью различных способов. Ацетил-КоА служит в качестве ключевого промежуточного соединения, например, при получении жирных кислот, аминокислот и вторичных метаболитов. Сочетанные реакции превращения сахаров в пируват дают энергию (например, аденозин-5'-трифосфат, АТФ) и восстановленные эквиваленты (например, восстановленный никотинамидадениндинуклеотид, НАДН, и восстановленный никотинамидаденидинуклеотидфосфат, НАДФН). НАДН и НАДФН могут быть рециклизованы до их окисленных форм (НАД+ и НАДФ+ соответственно). В присутствии неорганических акцепторов электронов (например, O2, NO3 - и SO4 2-) восстанавливающие эквиваленты могут быть использованы для пополнения пула энергии; альтернативно может быть образован восстановленный углеродный побочный продукт.
Изобретение дает возможность получать изобутанол из углеводных источников с помощью рекомбинантных микроорганизмов путем предоставления четырех полных путей реакций, как показано на чертеже. Три из этих путей включают превращение пирувата в изобутанол через серии ферментативных стадий. Предпочтительный путь биосинтеза изобутанола (чертеж, стадии a-e) включает следующие превращения субстрата в продукт:
a) пирувата в ацетолактат, катализируемого, например, ацетолактатсинтазой,
b) ацетолактата в 2,3-дигидроксиизовалерат, катализируемого, например, изомероредуктазой ацетогидроксикислот,
c) 2,3-дигидроксиизовалерата в α-кетоизовалерат, катализируемого, например, дегидратазой ацетогидроксикислот,
d) α-кетоизовалерата в изобутиральдегид, катализируемого, например, декарбоксилазой кетокислот с разветвленной цепью, и
e) изобутиральдегида в изобутанол, катализируемого, например, дегидрогеназой спиртов с разветвленной цепью.
В этом пути сочетаются ферменты, известные как вовлеченные в хорошо охарактеризованные пути биосинтеза валина (пируват в α-кетоизовалерат) и катаболизма валина (α-кетоизовалерат в изобутанол). Так как многие ферменты биосинтеза валина также катализируют аналогичные реакции в пути биосинтеза изолейцина, при выборе источников гена главным соображением является специфичность субстрата. По этой причине главными интересующими генами для фермента ацетолактатсинтазы являются таковые от Bacillus (alsS) и Klebsiella (budB). Эти конкретные ацетолактатсинтазы известны как участвующие в ферментации бутандиола в этих организмах и демонстрируют повышенное сродство к пирувату по сравнению с кетобутиратом (Gollop et al., J. Bacteriol. 172(6):3444-3449 (1990); Holtzclaw et al., J. Bacteriol. 121(3):917-922 (1975)). Вторая и третья стадии пути катализируются редуктоизомеразой и дегидратазой ацетогидроксикислот соответственно. Эти ферменты охарактеризованы из ряда источников, таких как, например, E. coli (Chunduru et al., Biochemistry 28(2):486-493 (1989); Flint et al., J. Biol. Chem. 268(29): 14732-14742 (1993)). Две конечные стадии предпочтительного пути биосинтеза изобутанола известны как встречающиеся у дрожжей, которые могут использовать валин в качестве источника азота и в процессе секретируют изобутанол. α-Кетоизовалерат может быть превращен в изобутиральдегид рядом ферментов декарбоксилаз кетокислот, таких как, например, пируватдекарбоксилаза. Для предотвращения выхода пирувата из продукции изобутанола желательна декарбоксилаза с пониженной аффинностью к пирувату. К настоящему времени два таких фермента известны в данной области техники (Smit et al., Appl. Environ. Microbiol. 71 (1):303-311 (2005); de la Plaza et al., FEMS Microbiol. Lett. 238(2):367-374 (2004)). Оба фермента происходят от штаммов Lactococcus lactis и в 50-200 раз предпочитают кетоизовалерат по сравнению с пируватом. Наконец, ряд альдегидредуктаз идентифицирован у дрожжей, причем многие с перекрывающейся субстратной специфичностью. Известные как предпочитающие субстраты с разветвленной цепью над ацетальдегидом включают, но не ограничиваются этим, алкогольдегидрогеназу VI (АДГ6) и Ypr1p (Larroy et al., Biochem. J. 361(Pt 1):163-172 (2002); Ford et al., Yeast 19(12): 1087-1096 (2002)), обе из которых используют НАДФН в качестве донора электронов. НАДФН-зависимая редуктаза YqhD, активная на субстратах с разветвленной цепью, также недавно была идентифицирована у E. coli (Sulzenbacher et al., J. Mol. Biol. 342(2):489-502 (2004)).
Другой путь превращения пирувата в изобутанол включает следующие превращения субстрата в продукт (чертеж, стадии a, b, c, f, g, e):
a) пирувата в ацетолактат, катализируемого, например, ацетолактатсинтазой,
b) ацетолактата в 2,3-дигидроксиизовалерат, катализируемого, например, изомероредуктазой ацетогидроксикислот,
c) 2,3-дигидроксиизовалерата в α-кетоизовалерат, катализируемого, например, дегидратазой ацетогидроксикислот,
f) α-кетоизовалерата в изобутирил-КоА, катализируемого, например, дегидрогеназой кетокислот с разветвленной цепью,
g) изобутирил-КоА в изобутиральдегид, катализируемого, например, ацилирующей альдегиддегидрогеназой, и
e) изобутиральдегида в изобутанол, катализируемого, например, дегидрогеназой спиртов с разветвленной цепью.
Первые три стадии этого пути (a, b, c) являются такими же, что и описанные выше. α-Кетоизовалерат превращается в изобутирил-КоА под действием дегидрогеназы кетокислот с разветвленной цепью. В то время как дрожжи могут использовать только валин в качестве источника азота, многие другие организмы (как эукариоты, так и прокариоты) могут использовать валин также как источник углерода. Эти организмы обладают дегидрогеназой кетокислот с разветвленной цепью (Sokatch et al. J. Bacteriol. 148(2):647-652 (1981)), которая генерирует изобутирил-КоА. Изобутирил-КоА может быть превращен в изобутиральдегид с помощью ацилирующей альдегиддегидрогеназы. Дегидрогеназы, активные на субстрате с разветвленной цепью, описаны, но не клонированы в Leuconostoc and Propionibacterium (Kazahaya et al., J. Gen. Appl. Microbiol. 18:43-55 (1972); Hosoi et al., J. Ferment. Technol. 57:418-427 (1979)). Однако возможно также, что ацилирующие альдегиддегидрогеназы, известные как функционирующие на ацил-КоА c линейной цепью (т.е. бутирил-КоА), могут также работать с изобутирил-КоА. Изобутиральдегид затем превращают в изобутанол с помощью дегидрогеназы спиртов с разветвленной цепью, как описано выше для первого пути.
Другой путь превращения пирувата в изобутанол включает следующие превращения субстрата в продукт (фиг.1, стадии a, b, c, h, i, j, e):
a) пирувата в ацетолактат, катализируемого, например, ацетолактатсинтазой,
b) ацетолактата в 2,3-дигидроксиизовалерат, катализируемого, например, изомероредуктазой ацетогидроксикислот,
c) 2,3-дигидроксиизовалерата в α-кетоизовалерат, катализируемого, например, дегидратазой ацетогидроксикислот,
h) α-кетоизовалерата в валин, катализируемого, например, валиндегидрогеназой или трансаминазой,
i) валина в изобутиламин, катализируемого, например, валиндекарбоксилазой,
j) изобутиламина в изобутиральдегид, катализируемого, например, омега-трансаминазой, и
e) изобутиральдегида в изобутанол, катализируемого, например, дегидрогеназой спиртов с разветвленной цепью.
Первые три стадии этого пути (a, b, c) являются такими же, что и описанные выше. Этот путь требует добавления валиндегидрогеназы или подходящей трансаминазы. Валин (и/или лейцин)-дегидрогеназа катализирует восстановительное аминирование и использует аммиак; величины Km аммиака находятся в миллимолярном диапазоне (Priestly et al., Biochem J. 261(3):853-861 (1989); Vancura et al., J, Gen. Microbiol. 134(12):3213- 3219 (1988), Zink et al., Arch. Biochem. Biophys. 99:72-77 (1962); Sekimoto et al. J. Biochem (Japan) 116(1):176-182 (1994)). Трансаминазы обычно используют либо глутамат, либо аланин в качестве доноров амина и охарактеризованы из ряда организмов (Lee-Peng et al,. J. Bacteriol. 139(2):339-345 (1979); Berg et al., J. Bacteriol. 155(3):1009-1014 (1983)). Может быть желательным аланин-специфический фермент, так как образование пирувата на этой стадии может сочетаться с потреблением пирувата позже в этом пути, когда удаляют аминогруппу (см. ниже). Следующей стадией является декарбоксилирование валина, реакция, которая осуществляется при биосинтезе валанимицина у Streptomyces (Garg et al., Mol. Microbiol. 46(2):505-517 (2002)). Полученный изобутиламин может быть превращен в изобутиральдегид в зависимой от пиридоксаль-5'-фосфата реакции с помощью, например, фермента семейства омега-аминотрансфераз. Такой фермент из Vibrio fluvialis демонстрирует активность на изобутиламине (Shin et al., Biotechnol. Bioeng. 65(2):206-211 (1999)). Другая омега-аминотрансфераза из Alcaligenes denitrificans клонирована и обладает некоторой активностью на бутиламине (Yun et al., Appl. Environ. Microbiol. 70(4):2529-2534 (2004)). В этом направлении эти ферменты используют пируват в качестве акцептора амина, давая аланин. Как указывалось выше, неблагоприятные эффекты на пул пирувата могут быть компенсированы более ранним использованием на этом пути пируват-продуцирующей трансаминазы. Изобутиральдегид затем превращают в изобутанол с помощью дегидрогеназы спиртов с разветвленной цепью, как описано выше для первого пути.
Четвертый путь биосинтеза изобутанола включает превращения субстрата в продукт, показанные как стадии k, g, e на чертеже. Ряд организмов известны как продуцирующие бутират и/или бутанол через бутирил-КоА промежуточное соединение (Dűrre et al., FEMS Microbiol. Rev. 17(3):251-262 (1995); Abbad-Andaloussi et al., Microbiology 142(5):1149-1158 (1996)). Продукция изобутанола в этих организмах может быть создана добавлением мутазы, способной превращать бутирил-КоА в изобутирил-КоА (фиг.1, стадия k). Гены для обеих субъединиц изобутирил-КоА мутазы, коэнзим B12-зависимого фермента, клонированы из Streptomycete (Ratnatilleke et al., J. Biol. Chem. 274(44):31679-31685 (1999)). Изобутирил-КоА превращают в изобутиральдегид (стадия g на чертеже), который превращают в изобутанол (стадия e на чертеже).
Таким образом, при обеспечении множественными рекомбинантными путями от пирувата до изобутанола существует ряд источников для осуществления индивидуальных стадий превращения и специалист в данной области техники должен быть способен применить открыто доступные последовательности для создания релевантных путей. Перечень представителей ряда генов, известных в данной области техники и пригодных для создания путей биосинтеза изобутанола, представлен ниже в таблице 2.
gi|32468830|emb|Z99122.2|BSUB0019[32468830]
gi|149210|gb|M73842.1|KPNILUK[149210]
gi|473900|gb|L16975.1|LACALS[473900]
gi|49175990|ref|NC_000913.2|[49175990]
gi|42742286|ref|NC_001144.3|[42742286]
gi|44920669|emb|BX957220.1|[44920669]
gi|32468802|emb|Z99118.2|BSUB0015[32468802]
gi|49175990|ref|NC_000913.2|[49175990]
gi|42742252|ref|NC_001142.5|[42742252]
gi|45047123|emb|BX957219.1|[45047123]
gi|32468778|emb|Z99115.2|BSUB0012[32468778]
gi|44921616|gb|AY547860.1|[44921616]
gi|51870501|emb|AJ746364.1[51870501]
gi|16763390|ref|NC_003197.1[16763390]
gi|15004705|ref|NC_001988.2|[15004705]
gi|50593138|ref|NC_001136.6|[50593138]
gi|44829554|ref|NC_001145.2|[44829554]
gi|49175990|ref|NC_000913.2|[49175990]
gi|15893298|ref|NC_003030.1|[15893298]
gi|32468787|emb|Z99116.2|BSUB0013[32468787]
gi|790512|gb|M57613.1|PSEBKDPPG2[790512]
gi|47422980|gb|AF157306.2|[47422980]
gi|15004705|ref|NC_001988.2|[15004705]
gi|595671|gb|U13232.1|PPU13232[595671]
gi|49175990|ref|NC_000913.2|[49175990]
gi|52783855|ref|NC_006322.1|[52783855]
gi|42742252|ref|NC_001142.5|[42742252]
gi|15678031|ref|NC_000916.1|[15678031]
gi|32141095|ref|NC_003888.3|[32141095]
gi|32468787|emb|Z99116.2|BSUB0013[32468787]
gi|27777548|gb|AY116644.1|[27777548]
gi|33086797|gb|AY330220.1|[33086797]
gi|73539706|ref|NC_007347.1|[73539706]
gi|24371600|ref|NC_004347.1|[24371600]
gi|48764549|ref|NZ_AAAG02000002.1|[48764549]
gi|26557019|gb|AE016776.1|[26557019]
gi|3002491|gb|U67612.1|SCU67612[3002491]
gi|6137076|emb|AJ246005.1|SCI246005[6137076]
gi|24430032|emb|AL939123.1|SCO939123[24430032]
gi|24429533|emb|AL939121.1|SCO939121[24429533]
gi|57833846|ref|NC_003155.3|[57833846]
Микробные хозяева для получения изобутанола
Микробные хозяева для получения изобутанола могут быть выбраны из бактерий, цианобактерий, нитчатых грибов и дрожжей. Микробный хозяин, применяющийся для получения изобутанола, предпочтительно толерантен к изобутанолу, так что выход не лимитируется токсичностью бутанола. Микробы, которые метаболически активны при высоких уровнях титров изобутанола, не известны хорошо в данной области техники. Хотя мутанты, толерантные к бутанолу, выделены из производящих данный продукт Clostridia, мало информации доступно в отношении толерантности к бутанолу других потенциально пригодных бактериальных штаммов. Большинство исследований по сравнению толерантности к спиртам у бактерий предполагает, что бутанол является более токсичным, чем этанол (de Cavalho et al., Microsc. Res. Tech. 64:215-22 (2004) и Kabelitz et al., FEMS Microbiol. Lett. 220:223-227 (2003)). Tomas et al. (J. Bacteriol. 186:2006-2018 (2004)) сообщает, что выход 1-бутанола при ферментации у Clostridium acetobutylicum может быть ограничен токсичностью 1-бутанола. Первичным эффектом 1-бутанола на Clostridium acetobutylicum является нарушение функций мембран (Hermann et al., Appl. Environ. Microbiol. 50:1238-1243 (1985)).
Микробные хозяева, выбранные для продукции изобутанола, предпочтительно толерантны к изобутанолу и должны быть способными превращать углеводы в изобутанол. Критерии для отбора подходящих микробных хозяев включают следующее: присущую толерантность к изобутанолу, высокую скорость утилизации глюкозы, доступность генетических способов для манипуляции с генами и способность генерировать стабильные хромосомные изменения.
Штаммы подходящих хозяев с толерантностью к изобутанолу могут быть идентифицированы путем скрининга, основанного на присущей толерантности штамма. Присущая толерантность микробов к изобутанолу может быть измерена путем измерения концентрации изобутанола, которая ответственна за 50%-ное ингибирование скорости роста (IC50), при росте на минимальной среде. Величины IC50 могут быть определены с применением методов, известных в данной области техники. Например, интересующие микробы могут выращиваться в присутствии различных количеств изобутанола, и скорость роста прослеживаться с помощью измерения оптической плотности при 600 нанометрах. Время удвоения может быть рассчитано из логарифмической части кривой роста и использовано как мера скорости роста. Концентрация изобутанола, которая дает 50% ингибирование роста, может быть определена из кривой процента ингибирования роста относительно концентрации изобутанола. Предпочтительно штамм хозяев должен иметь IC50 для изобутанола выше приблизительно 0,5%.
Микробный хозяин для продукции изобутанола должен также утилизировать глюкозу с высокой скоростью. Большинство микробов способно утилизировать углеводы. Однако определенные микробы окружающей среды не могут утилизировать углеводы с высокой эффективностью и, следовательно, не должны подходить в качестве хозяев.
Способность хозяина к генетической модификации существенна для получения любого рекомбинантного микроорганизма. Вариантом способа переноса генов может быть электропорация, конъюгация, трансдукция или природная трансформация. Доступен широкий диапазон плазмид, конъюгирующихся с хозяином, и маркеров устойчивости к лекарствам. Клонирующие векторы приспосабливают к организмам-хозяевам по природе маркеров устойчивости к антибиотикам, которые функционируют у этого хозяина.
С микробным хозяином также должны быть проведены манипуляции для инактивации конкурирующих путей движения углерода путем делеции различных генов. Это требует доступности либо транспозонов к прямой инактивации, либо хромосомных интеграционных векторов. Дополнительно хозяин-продуцент должен быть склонен к химическому мутагенезу, так чтобы можно было получить эти мутации с улучшенной присущей толерантностью к изобутанолу.
На основе критериев, описанных выше, подходящие микробные хозяева для продукции изобутанола включают, но не ограничиваются этим, члены родов Clostridium, Zymomonas, Escherichia, Salmonella, Rhodococcus, Pseudomonas, Bacillus, Lactobacillus, Enterococcus, Alcaligenes, Klebsiella, Paenibacillus, Arthrobacter, Corynebacterium, Brevibacterium, Pichia, Candida, Hansenula и Saccharomyces. Предпочтительные хозяева включают Escherichia coli, Alcaligenes eutrophus, Bacillus licheniformis, Paenibacillus macerans, Rhodococcus erythropolis, Pseudomonas putida, Lactobacillus plantarum, Enterococcus faecium, Enterococcus gallinarium, Enterococcus faecalis, Bacillus subtilis и Saccharomyces cerevisiae.
Конструирование хозяина-продуцента
Рекомбинантные организмы, содержащие необходимые гены, которые будут кодировать ферментативный путь превращения ферментируемого углеродного субстрата в изобутанол, могут быть сконструированы с применением способов, хорошо известных в данной области техники. В настоящем изобретении гены, кодирующие ферменты одного из путей биосинтеза изобутанола изобретения, например ацетолактатсинтаза, изомероредуктаза ацетогидроксикислот, дегидратаза ацетогидроксикислот, декарбоксилаза α-кетокислот с разветвленной цепью и дегидрогеназа спиртов с разветвленной цепью, могут быть выделены из различных источников, как описано выше.
Способы получения желаемых генов из бактериального генома обычны и хорошо известны в области молекулярной биологии. Например, если последовательность гена известна, подходящие геномные библиотеки могут быть созданы с помощью гидролиза рестрикционной эндонуклеазой и может быть сделан скрининг с зондами, комплементарными желаемой последовательности гена. Поскольку последовательность выделена, ДНК может быть амплифицирована с применением стандартных способов направляемой праймером амплификации, таких как полимеразная цепная реакция (патент США 4683202), с получением количеств ДНК, подходящих для трансформации с применением подходящих векторов. Способы оптимизации кодонов для экспрессии в гетерологичном хозяине легко доступны. Некоторые способы для оптимизации кодонов доступны на основе содержания GC в организме-хозяине. Содержание GC в некоторых примерах микробных хозяев представлено в таблице 3.
Поскольку гены релевантного пути идентифицированы и выделены, они могут быть трансформированы в подходящих экспрессионных хозяевах с помощью способов, хорошо известных в данной области техники. Векторы или кассеты, пригодные для трансформации разнообразных клеток-хозяев, общеизвестны и коммерчески доступны от таких компаний, как EPICENTRE® (Madison, WI), Invitrogen Corp. (Carlsbad, CA), Stratagene (La Jolla, CA) и New England Biolabs, Inc. (Beverly, MA). Обычно вектор или кассета содержит последовательности, направляющие транскрипцию и трансляцию релевантного гена, селектируемого маркера, и последовательности, позволяющие автономную репликацию или хромосомную интеграцию. Подходящие векторы включают 5'-область гена, которая осуществляет контроль инициации транскрипции, и 3'-область фрагмента ДНК, которая контролирует терминацию транскрипции. Обе контролирующие области могут происходить от генов, гомологичных трансформированной клетке-хозяину, хотя должно быть понятно, что такие контролирующие области могут также происходить от генов, которые не являются нативными по отношению к конкретных штаммам, выбранным в качестве хозяев-продуцентов.
Области, контролирующие инициацию, или промоторы, которые пригодны для управления экспрессией кодирующих областей релевантного пути в желаемой клетке-хозяине, многочисленны и знакомы специалистам в данной области техники. Фактически любой промотор, способный управлять этими генетическими элементами, подходит для настоящего изобретения, включая, но не ограничиваясь этим, CYC1, HIS3, GAL1, GAL10, ADH1, PGK, PHO5, GAPDH, ADC1, TRP1, URA3, LEU2, ENO, TPI, CUP1, FBA, GPD и GPM (пригодные для экспрессии в Saccharomyces); AOX1 (пригодный для экспрессии в Pichia); и lac, ara, tet, trp, IPL, IPR, T7, tac и trc (пригодные для экспрессии в Escherichia coli, Alcaligenes и Pseudomonas); промоторы amy, apr, npr и различные промоторы фагов пригодны для экспрессии в Bacillus subtilis, Bacillus licheniformis и Paenibacillus macerans; nisA (пригодный для экспрессии в грамположительных бактериях, Eichenbaum et al. Appl. Environ. Microbiol. 64(8):2763-2769 (1998)); и синтетический промотор P11 (пригодный для экспрессии в Lactobacillus plantarum, Rud et al., Microbiology 152:1011-1019 (2006)).
Области, контролирующие терминацию, также могут происходить от различных генов, нативных для предпочтительных хозяев. Необязательно сайт терминации может быть ненужным, однако наиболее предпочтительно его включение.
Определенные векторы способны реплицироваться в широком спектре бактерий-хозяев и могут быть перенесены с помощью конъюгации. Доступны полная и аннотированная последовательность pRK404 и трех родственных векторов - pRK437, pRK442 и pRK442(H). Эти производные, как доказано, являются ценными средствами для генетической манипуляции у грамотрицательных бактерий (Scott et al., Plasmid 50(1):74-79 (2003)). Некоторые плазмидные производные с широким спектром хозяев Inc P4 плазмиды RSF1010 доступны также с промоторами, которые могут функционировать в диапазоне грамотрицательных бактерий. Плазмиды pAYC36 и pAYC37 имеют активные промоторы вместе с множественными сайтами клонирования для допущения экспрессии гетерологичных генов у грамотрицательных бактерий.
Способы замены хромосомных генов также широко доступны. Например, термочувствительный вариант репликона для широкого спектра хозяев pWV101 модифицирован для создания плазмиды pVE6002, которая может быть использована для влияния на замену генов в диапазоне грамположительных бактерий (Maguin et al., J. Bacteriol. 174(17):5633-5638 (1992)). Кроме того, in vitro транспозомы для создания случайных мутаций во множестве геномов доступны из коммерческих источников, таких как EPICENTRE®.
Экспрессия пути биосинтеза изобутанола в различных предпочтительных микробных хозяевах описана более подробно ниже.
Экспрессия пути биосинтеза изобутанола в E. coli
Векторы или кассеты для трансформации E. coli общеизвестны и коммерчески доступны от компаний, перечисленных выше. Например, гены пути биосинтеза изобутанола могут быть выделены из различных источников, клонированы в модифицированный вектор pUC19 и трансформированы в E. coli NM522, как описано в примерах 6 и 7.
Экспрессия пути биосинтеза изобутанола в Rhodococcus erythropolis
Серии челночных векторов E. coli-Rhodococcus доступны для экспрессии в R. erythropolis, включая, но не ограничиваясь этим, pRhBR17 и pDA71 (Kostichka et al., Appl. Microbiol. Biotechnol. 62:61-68 (2003)). Кроме того, серии промоторов доступны для экспрессии гетерологичных генов в R. erythropolis (см., например, Nakashima et al., Appl. Environ. Microbiol. 70:5557-5568 (2004) и Tao et al., Appl. Microbiol. Biotechnol. 2005, DOI 10.1007/s00253-005-0064). Направленное генное разрушение хромосомных генов в R. erythropolis может быть создано с применением метода, описанного Tao et al., выше, и Brans et al. (Appl. Environ. Microbiol. 66: 2029-2036 (2000)).
Гетерологичные гены, требуемые для получения изобутанола, как описано выше, могут быть клонированы исходно в pDA71 или pRhBR71 и трансформированы в E coli. Векторы можно затем трансформировать в R. erythropolis с помощью электропорации, как описано Kostichka et al., выше. Рекомбинанты могут расти в синтетической среде, содержащей глюкозу, и продукция изобутанола может быть отслежена с применением методов, известных в данной области техники.
Экспрессия пути биосинтеза изобутанола в B. Subtilis
Методы генной экспрессии и создания мутаций в B. subtilis хорошо известны в данной области техники. Например, гены пути биосинтеза изобутанола могут быть выделены из различных источников, клонированы в модифицированный вектор pUC19 и трансформированы в Bacillus subtilis BE1010, как описано в примере 8. Кроме того, пять генов пути биосинтеза изобутанола могут быть разбиты в два оперона для экспрессии, как описано в примере 20. Три гена пути (bubB, ilvD и kivD) интегрировали в хромосому Bacillus subtilis BE 1010 (Payne and Jackson, J. Bacteriol. 173:2278-2282 (1991)). Оставшиеся два гена (ilvC и bdhB) клонировали в экспрессионный вектор и трансформировали в штамм Bacillus, несущий интегрированные гены изобутанола.
Экспрессия пути биосинтеза изобутанола в B. licheniformis
Большинство плазмид и челночных векторов, которые реплицируются в B. subtilis, может быть использовано для трансформации B. licheniformis с помощью либо трансформации протопластов, либо электропорации. Гены, требуемые для продукции изобутанола, могут быть клонированы в производные плазмид pBE20 или pBE60 (Nagarajan et al., Gene 114:121-126 (1992)). Способы трансформации B. licheniformis известны в данной области техники (см., например, Fleming et al. Appl. Environ. Microbiol, 61(11):3775-3780 (1995)). Плазмиды, созданные для экспрессии в B. subtilis, могут быть трансформированы в B. licheniformis с получением рекомбинантного микробного хозяина, который продуцирует изобутанол.
Экспрессия пути биосинтеза изобутанола в Paenibacillus macerans
Плазмиды могут быть созданы, как описано выше для экспрессии в B. subtilis, и использованы для трансформации Paenibacillus macerans с помощью трансформации протопластов с получением рекомбинантного микробного хозяина, который продуцирует изобутанол.
Экспрессия пути биосинтеза изобутанола в Alcaligenes (Ralstonia) eutrophus
Методы генной экспрессии и создания мутаций в Alcaligenes eutrophus известны в данной области техники (см., например, Taghavi et al., Appl. Environ. Microbiol, 60(10):3585-3591 (1994)). Гены пути биосинтеза изобутанола могут быть клонированы в любые векторы из широкого спектра хозяев, описанные выше, и перенесены с помощью электропорации для создания рекомбинантов, продуцирующих изобутанол. Поли(гидроксибутират)ный путь в Alcaligenes описан подробно, разнообразные генетические способы модификации генома Alcaligenes eutrophus известны, и эти способы могут быть применены для создания пути биосинтеза изобутанола.
Экспрессия пути биосинтеза изобутанола в Pseudomonas putida
Методы генной экспрессии в Pseudomonas putida известны в данной области техники (см., например, Ben-Bassat et al., патент США № 6586229, который включен здесь в качестве ссылки). Гены пути биосинтеза бутанола могут быть вставлены в pPCU18, и эта лигированная ДНК может быть электропорирована в электрокомпетентные C5aAR1 клетки Pseudomonas putida DOT-T1 с созданием рекомбинантов, которые продуцируют изобутанол.
Экспрессия пути биосинтеза изобутанола в Saccharomyces cerevisiae
Методы генной экспрессии в Saccharomyces cerevisiae известны в данной области техники (см., например, Methods in Enzymology, Volume 194, Guide to Yeast Genetics and Molecular and Cell Biology (Part A, 2004, Christine Guthrie and Gerald R. Fink (Eds.), Elsevier Academic Press, San Diego, CA). Экспрессия генов в дрожжах обычно требует промотора перед интересующим геном и терминатора транскрипции. При создании экспрессионных кассет для генов, кодирующих путь биосинтеза изобутанола, может быть использован ряд промоторов дрожжей, включая, но не ограничиваясь этим, конститутивные промоторы FBA, GPD, ADH1 и GPM и индуцибельные промоторы GAL1, GAL10 и CUP1. Подходящие терминаторы транскрипции включают, но не ограничиваются этим, FBAt, GPDt, GPMt, ERG10t, GAL1t, CYC1 и ADH1. Например, подходящие промоторы, терминаторы транскрипции и гены пути биосинтеза изобутанола могут быть клонированы в челночные векторы E. coli-дрожжи, как описано в примере 17.
Экспрессия пути биосинтеза изобутанола в Lactobacillus plantarum
Род Lactobacillus принадлежит к семейству Lactobacillales и многие плазмиды и векторы, применяемые для трансформации Bacillus subtilis и Streptococcus, могут быть использованы для lactobacillus. Неограничивающие примеры подходящих векторов включают pAMβ1 и его производные (Renault et al., Gene 183:175-182 (1996); и O'Sullivan et al., Gene 137:227-231 (1993)); pMBB1 и pHW800, производное pMBB1 (Wyckoff et al. Appl. Environ. Microbiol. 62:1481-1486 (1996)); pMG1, конъюгирующаяся плазмида (Tanimoto et al., J. Bacteriol. 184:5800-5804 (2002)); pNZ9520 (Kleerebezem et al., Appl. Environ. Microbiol. 63:4581-4584 (1997)); pAM401 (Fujimoto et al., Appl. Environ. Microbiol. 67:1262-1267 (2001)); и pAT392 (Arthur et al., Antimicrob. Agents Chemother. 38:1899-1903 (1994)). Сообщалось также о некоторых плазмидах из Lactobacillus plantarum (например, van Kranenburg R, Golic N, Bongers R, Leer RJ, de Vos WM, Siezen RJ, Kleerebezem M. Appl. Environ. Microbiol. 2005 Mar; 71(3): 1223-1230). Например, экспрессия пути биосинтеза изобутанола в Lactobacillus plantarum описана в примере 21.
Экспрессия пути биосинтеза изобутанола в Enterococcus faecium, Enterococcus qallinarium и Enterococcus faecalis
Род Enterococcus принадлежит к семейству Lactobacillales, и многие плазмиды и векторы, применяемые для трансформации Lactobacillus, Bacillus subtilis и Streptococcus, могут быть применены для Enterococcus. Неограничивающие примеры подходящих векторов включают pAMβ1 и его производные (Renault et al., Gene 183:175-182 (1996); и O'Sullivan et al., Gene 137:227-231 (1993)); pMBB1 и pHW800, производное pMBB1 (Wyckoff et al. Appl. Environ. Microbiol. 62:1481-1486 (1996)); pMG1, конъюгирующаяся плазмида (Tanimoto et al., J. Bacteriol. 184:5800-5804 (2002)); pNZ9520 (Kleerebezem et al., Appl. Environ. Microbiol. 63:4581-4584 (1997)); pAM401 (Fujimoto et al., Appl. Environ. Microbiol. 67:1262-1267 (2001)); и pAT392 (Arthur et al., Antimicrob. Agents Chemother. 38:1899-1903 (1994)). Экспрессионные векторы для E. faecalis, использующие ген nisA из Lactococcus, также могут быть использованы (Eichenbaum et al., Appl. Environ. Microbiol. 64:2763-2769 (1998). Дополнительно, векторы для замены генов в хромосоме E. faecium chromosome могут быть использованы (Nallaapareddy et al., Appl. Environ. Microbiol. 72:334-345 (2006)). Например, экспрессия пути биосинтеза изобутанола в Enterococcus faecalis описана в примере 22.
Ферментационные среды
Ферментационные среды настоящего изобретения должны содержать подходящие углеродные субстраты. Подходящие субстраты могут включать, но не ограничиваться этим, моносахариды, такие как глюкоза и фруктоза, олигосахариды, такие как лактоза или сахароза, полисахариды, такие как крахмал или целлюлоза, или их смеси и неочищенные смеси из возобновляемого сырья, такого как отфильтрованная сыворотка от сыра, кукурузный экстракт, черная патока из сахарной свеклы и ячменный солод. Дополнительно, углеродные субстраты могут также представлять собой одноуглеродные субстраты, такие как диоксид углерода или метанол, для которых продемонстрировано метаболическое превращение в ключевые биохимические промежуточные продукты. В дополнение к одному или двум углеродным субстратам известны также метилотрофные организмы, использующие для метаболической активности ряд других содержащих углерод соединений, таких как метиламин, глюкозамин и разнообразные аминокислоты. Например, известны метилотрофные дрожжи, использующие углерод из метиламина для образования трегалозы или глицерина (Bellion et al., Microb. Growth C1 Compd., [Int. Symp.], 7th (1993), 415-32. Editor(s): Murrell, J. Collin; Kelly, Don P. Publisher: Intercept, Andover, UK). Сходно, различные штаммы Candida будут метаболизировать аланин или олеиновую кислоту (Sulter et al., Arch. Microbiol. 153:485-489 (1990)). Следовательно, рассматривается, что источник углерода, используемый в настоящем изобретении, может охватывать широкое разнообразие углеродсодержащих субстратов и должен ограничиваться только выбором организма.
Хотя рассматривается, что все указанные выше углеродные субстраты и их смеси подходят для настоящего изобретения, предпочтительные углеродные субстраты представляют собой глюкозу, фруктозу и сахарозу.
В дополнение к подходящему источнику углерода, ферментационные среды должны содержать подходящие минералы, соли, кофакторы, буферы и другие компоненты, известные специалистам в данной области техники, подходящие для роста культур и стимуляции ферментативного пути, необходимого для продукции изобутанола.
Условия культивирования
Обычно клетки выращивают при температуре в диапазоне от приблизительно 25°С до приблизительно 40°С в подходящей среде. Подходящие ростовые среды настоящего изобретения представляют собой обычные коммерчески получаемые среды, такие как бульон Luria Bertani (LB), бульон Sabouraud Dextrose (SD) или бульон дрожжевой среды (YM). Могут быть также использованы другие ростовые среды, определенного состава или синтетические, и подходящая среда для роста конкретного микроорганизма должна быть известна специалисту в данной области микробиологии или науки о ферментации. Применение агентов, известных как прямо или косвенно модулирующих подавление катаболизма, например, циклического аденозин-2',3'-монофосфата, может также включаться в среду ферментации.
Подходящие диапазоны рН для ферментации находятся между рН 5,0 и рН 9,0, где от рН 6,0 до рН 8,0 предпочтителен в качестве исходного условия.
Ферментации могут быть осуществлены в аэробных или анаэробных условиях, где анаэробные или микроаэробные условия предпочтительны.
Количество изобутанола, продуцируемого в среде ферментации, может быть определено с применением ряда методов, известных в данной области техники, например, высокоэффективной жидкостной хроматографии (ВЭЖХ) или газовой хроматографии (ГХ).
Промышленные периодическая и непрерывная ферментации
В настоящем способе применяется периодический способ ферментации. Классическая периодическая ферментация представляет собой закрытую систему, в которой композиция среды устанавливается в начале ферментации и не подвергается искусственным изменениям в процессе ферментации. Таким образом, в начале ферментации среда инокулируется с желаемым организмом или организмами и дается возможность осуществления ферментации без добавления чего-либо в систему. Обычно, однако, «периодическая» ферментация является периодической в отношении добавления источника углерода, и часто делаются попытки контроля таких факторов, как рН и концентрация кислорода. В периодических системах композиции метаболита и биомассы системы изменяются постоянно до времени остановки ферментации. В периодических культурах клетки проходят через умеренный статический лаг-период к логарифмической фазе усиленного роста и, наконец, к стационарной фазе, когда скорость роста снижается или останавливается. Если не обрабатывать, клетки в стационарной фазе будут в конечном итоге погибать. Клетки в логарифмической фазе обычно ответственны за основную продукцию конечного продукта или промежуточного соединения.
Вариантом стандартной периодической системы является подпитываемая периодическая система. Процессы подпитываемой периодической ферментации также подходят для настоящего изобретения и включают обычную периодическую систему с тем исключением, что субстрат добавляют поэтапно в процессе ферментации. Подпитываемые периодические системы полезны, когда подавление катаболита способно ингибировать метаболизм клеток и когда желательно иметь ограниченные количества субстрата в средах. Измерение действительной концентрации субстрата в подпитываемых периодических системах затруднено и, следовательно, оценивается на основе изменений поддающихся измерению факторов, таких как рН, растворенный кислород и парциальное давление отходящего газа, такого как CO2. Периодическая и подпитываемая периодическая ферментации общеприняты и хорошо известны в данной области техники, и примеры можно найти в Thomas D. Brock in Biotechnology: A Textbook of Industrial Microbiology: Second Edition (1989) Sinauer Associates, Inc., Sunderland, MA. или Deshpande, Mukund V., Appl. Biochem. Biotechnol., 36:227, (1992), включенных здесь в качестве ссылки.
Хотя настоящее изобретение осуществляется по типу периодического способа, рассматривается, что способ должен быть адаптирован к методам непрерывной ферментации. Непрерывная ферментация представляет собой открытую систему, где среда ферментации определенного состава непрерывно добавляется в биореактор и равное количество кондиционированных сред удаляется одновременно для процессинга. Непрерывная ферментация обычно поддерживает культуры при постоянной высокой плотности, когда клетки находятся в основном в логарифмической фазе роста.
Непрерывная ферментация позволяет модулировать один фактор или любое количество факторов, которые влияют на клеточный рост или концентрацию конечного продукта. Например, один метод будет поддерживать лимитирующее питательное вещество, такое как источник углерода или уровень азота, при фиксированной скорости и позволять всем другим параметрам поддерживаться. В других системах ряд факторов, влияющих на рост, может непрерывно изменяться, в то время как концентрация клеток, измеряемая по помутнению, поддерживается на постоянном уровне. Непрерывные системы борются за поддержание условий роста в устойчивом состоянии и, таким образом, потеря клеток, обусловленная откачкой среды, должна быть сбалансирована относительно скорости клеточного роста при ферментации. Методы модуляции питательных веществ и ростовых факторов для непрерывных процессов ферментации, а также способов максимализации скорости образования продукта хорошо известны в области промышленной микробиологии и разнообразные методы детализированы Brock, выше.
Подразумевается, что настоящее изобретение может быть осуществлено на практике с применением либо периодических, подпитываемых периодических, либо непрерывных процессов и что любой известный способ ферментации должен подходить. Кроме того, подразумевается, что клетки могут быть иммобилизованы на субстрате в виде целых клеток-катализаторов и подвергаться условиям ферментации для получения изобутанола.
Методы выделения изобутанола из ферментационной среды
Продуцируемый биологически изобутанол может быть выделен из ферментационной среды с применением способов, известных в данной области техники. Например, твердые соединения могут быть удалены из ферментационной среды с помощью центрифугирования, фильтрации, декантирования или тому подобного. Затем изобутанол может быть выделен из ферментационной среды, которая обработана для удаления твердых соединений, как описано выше, с применением таких методов, как перегонка, экстракция жидкость-жидкость или разделение с помощью мембран. Так как изобутанол образует азеотропную смесь с водой с низкой точкой кипения, только перегонка может быть использована для разделения смеси до ее азеотропных компонентов. Перегонка может быть использована в сочетании с другим методом разделения для получения разделения вокруг азеотропа. Методы, которые могут быть использованы в сочетании с перегонкой, для выделения и очистки изобутанола включают, но не ограничиваются этим, декантирование, экстракцию жидкость-жидкость, адсорбцию и способы с использованием мембран. Кроме того, изобутанол может быть выделен с применением азеотропной перегонки с использованием азеотропообразователя (в качестве примера см. Doherty and Malone, Conceptual Design of Distillation Systems, McGraw Hill, New fork, 2001).
Смесь изобутанола с водой образует гетерогенный азеотроп так, что перегонка может быть использована в сочетании с декантированием для выделения и очистки изобутанола. В этом способе содержащий изобутанол ферментационный бульон перегоняют до примерно азеотропной композиции. Затем азеотропную смесь конденсируют и изобутанол отделяют от ферментационной среды с помощью декантирования. Декантированная водная фаза может быть возвращена на первую дистилляционной колонку в виде оттока. Обогащенная изобутанолом декантированная органическая фаза может быть дополнительно очищена с помощью перегонки во второй дистилляционной колонке.
Изобутанол может быть также выделен из ферментационной среды с применением экстракции жидкость-жидкость в сочетании с перегонкой. При этом способе изобутанол экстрагируют из ферментационного бульона с применением экстракции жидкость-жидкость в подходящем растворителе. Содержащую изобутанол органическую фазу затем перегоняют для отделения изобутанола от растворителя.
Для выделения изобутанола из ферментационной среды может быть также использована перегонка в сочетании с адсорбцией. При этом способе ферментационный бульон, содержащий изобутанол, перегоняют до приблизительно азеотропной композиции и затем оставшуюся воду удаляют с помощью применения адсорбента, такого как молекулярные сита (Aden et al. Lignocellulosic Biomass to Ethanol Process Design and Economics Utilizing Co-Current Dilute Acid Prehydrolysis and Enzymatic Hydrolysis for Corn Stover, Report NREL/TP-510-32438, National Renewable Energy Laboratory, June 2002).
Кроме того, для выделения и очистки изобутанола из ферментационной среды может быть использована перегонка в сочетании с испарением через полупроницаемую перегородку. При этом способе ферментационный бульон, содержащий изобутанол, перегоняют до приблизительно азеотропной композиции и затем оставшуюся воду удаляют испарением через гидрофильную мембрану (Guo et al., J. Membr. Sci. 245, 199-210 (2004)).
Примеры
Настоящее изобретение дополнительно определяется в следующих примерах. Должно быть понятно, что эти примеры несмотря на иллюстрацию предпочтительных осуществлений изобретения даны только в качестве иллюстрации. Из представленного выше обсуждения и этих примеров специалист в данной области техники может выяснить существенные характеристики этого изобретения, не отступая от его духа и объема, может сделать различные изменения и модификации изобретения для адаптации его к различным потребностям и условиям.
Общие методы
Стандартные способы рекомбинантной ДНК и молекулярного клонирования, применяемые в примерах, хорошо известны в данной области техники и описаны в Sambrook, J., Fritsch, E.F. and Maniatis, T., Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press: Cold Spring Harbor, NY (1989) (Maniatis); и T.J. Silhavy, M.L. Bennan, and L.W. Enquist, Experiments with Gene Fusions, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1984); и Ausubel, F.M. et al., Current Protocols in Molecular Biology, опубликованной Greene Publishing Assoc. и Wiley-lnterscience (1987).
Материалы и методы, подходящие для поддержания и роста бактериальных культур, хорошо известны в данной области техники. Способы, подходящие для применения в последующих примерах, могут быть найдены, как изложено в Manual of Methods for General Bacteriology (Phillipp Gerhardt, R.G.E. Murray, Ralph N. Costilow, Eugene W. Nester, Willis A. Wood, Noel R. Krieg and G. Briggs Phillips, eds), American Society for Microbiology, Washington, DC. (1994)) или в Thomas D. Brock in Biotechnology: A Textbook of Industrial Microbiology, Second Edition, Sinauer Associates, Inc., Sunderland, MA (1989). Все реагенты, ферменты рестрикции и материалы, применяемые для роста и поддержания бактериальных клеток, получены от Aldrich Chemicals (Milwaukee, WI), BD Diagnostic Systems (Sparks, MD), Life Technologies (Rockville, MD) или Sigma Chemical Company (St. Louis, MO), если не указано иначе.
Микробиологические штаммы получены от The American Type Culture Collection (ATCC), Manassas, VA, если не указано иначе.
Олигонуклеотидные праймеры для использования в последующих примерах приведены в таблице 4. Все олигонуклеотидные праймеры синтезированы Sigma-Genosys (Woodlands, TX).
Способы определения концентрации изобутанола в культуральных средах
Концентрация изобутанола в культуральных средах может быть определена с помощью ряда способов, известных в данной области техники. Например, конкретного способа высокоэффективной жидкостной хроматографии (ВЭЖХ) с применением колонки Shodex SH-1011 с защитной колонкой Shodex SH-G, обе которые продаются Waters Corporation (Milford, MA), с определением коэффициента преломления (RI). Хроматографическое разделение достигалось при применении 0,01М H2SO4 в качестве подвижной фазы при скорости тока 0,5 мл/мин и температуре колонки 50°С. При использованных условиях изобутанол имел время задержки 46,6 мин. Альтернативно, пригодны способы газовой хроматографии (ГХ). Например, в конкретном способе ГХ применяют колонку HP-INNOWax (30 м × 0,53 мм внутр. диам., толщина пленки 1 мкм, Agilent Technologies, Wilmington, DE) с детектором пламенной ионизации (FID). В качестве газа-носителя служил гелий при скорости тока 4,5 мл/мин, измеряемой при 150°С при постоянном давлении наконечника; зазор инжектора составлял 1:25 при 200°С, температура печи составляла 45°С в течение 1 мин, от 45 до 220°С при 10°С/мин и 220°С в течение 5 мин; и детекцию FID использовали при 240°С с кондиционированным газом гелия 26 мл/мин. Время задержки изобутанола составляло 4,5 мин.
Значения аббревиатур являются следующими: «сек» означает секунду(ы), «мин» означает минуту(ы) «час» означает час(ы), «psi» означает фунты на квадратный дюйм, «нм» означает нанометры, «день» означает день(дни), «мкл» означает микролитр(ы), «мл» означает миллилитр(ы), «л» означает литр(ы), «мм» означает миллиметр(ы), «нм» означает нанометры, «мМ» означает миллимолярный, «мкМ» означает микромолярный, «М» означает молярный, «ммоль» означает миллимоль(и), «мкмоль» означает микромоль(и), «г» означает грамм(ы), «мкг» означает микрограмм(ы) и «нг» означает нанограмм(ы), «ПЦР» означает полимеразную цепную реакцию, «ОП» означает оптическую плотность, «ОП600» означает оптическую плотность, измеренную при длине волны 600 нм, «кДа» означает килодальтоны, “g” означает постоянную гравитации, «п.н.» означает пару(ы) нуклеотидов, «т.п.н.» означает тысячу(и) пар нуклеотидов, «% мас./об.» означает процентное отношение масса/объем, «% об./об.» означает процентное отношение объем/объем, «IPTG» означает изопропил-β-D-тиогалактопиранозид, «RBS» означает сайт связывания с рибосомой, «ВЭЖХ» означает высокоэффективную жидкостную хроматографию и «ГХ» означает газовую хроматографию. Термин «молярная избирательность» представляет собой количество молей продукта, получаемых на моль потребленного сахарного субстрата и представленное в виде процента.
Пример 1
Клонирование и экспрессия ацетолактатсинтазы
Цель данного примера состояла в клонировании гена budB из Klebsiella pneumoniae и его экспрессии в E. coli BL21-AI. Ген budB амплифицировали из геномной ДНК штамма ATCC 25955 Klebsiella pneumoniae с помощью ПЦР с получением продукта 1,8 т.п.н.
Геномную ДНК получали с помощью набора Gentra Puregene (Gentra Systems, Inc., Minneapolis, MN; каталожный номер D-5000A). Ген budB амплифицировали из геномной ДНК Klebsiella pneumoniae с помощью ПЦР с применением праймеров N80 и N81 (см. таблицу 2), представленных как SEQ ID NO:11 и 12 соответственно. Другие реагенты амплификации ПЦР были получены в наборах производителей, например Finnzymes PhusionTM High-Fidelity PCR Master Mix (New England Biolabs Inc., Beverly, MA; каталожный № F-531), и использовались в соответствии с протоколом производителя. Амплификацию проводили в аппарате DNA Thermocycler GeneAmp 9700 (PE Applied Biosystems, Foster city, CA).
Для исследований экспрессии применяли переходный способ клонирования (Invitrogen Corp., Carlsbad, CA). Вводный вектор pENTRSDD-TOPO обеспечивал направленное клонирование и служил последовательностью Шайна-Дальгарно для интересующего гена. Целевой вектор pDEST14 использовал промотор T7 для экспрессии гена без метки. Прямой праймер включал четыре основания (CACC), непосредственно примыкавших к кодону старта трансляции, для обеспечения направленного клонирования в pENTRSDD-TOPO (Invitrogen) с получением плазмиды pENTRSDD-TOPObudB. Конструктом pENTR трансформировали клетки E. coli Top10 (Invitrogen), которые высевали в соответствии с рекомендациями производителя. Трансформанты выращивали в течение ночи и плазмидную ДНК получали с помощью набора QIAprep Spin Miniprep (Qiagen, Valencia, CA; каталожный № 27106) в соответствии с рекомендациями производителя. Клоны секвенировали для подтверждения того, что гены были вставлены в правильной ориентации, и для подтверждения последовательности. Нуклеотидная последовательность открытой рамки считывания (ORF) для данного гена и предсказанная аминокислотная последовательность фермента представлены в виде SEQ ID No:1 и SEQ ID No:2 соответственно.
Для создания экспрессионного клона ген budB переносили на вектор pDEST 14 путем рекомбинации с получением pDEST14budB. Вектором pDEST14budB трансформировали клетки E. coli BL21-AI (Invitrogen). Трансформанты инокулировали в среду Luria Bertani (LB) с добавкой 50 мкг/мл ампициллина и выращивали в течение ночи. Аликвоту ночной культуры использовали для инокуляции 50 мл LB с добавкой 50 мкг/мл ампициллина. Культуру инкубировали при 37°С при перемешивании до достижения ОП600 значения 0,6-0,8. Культуру разделяли на две 25-мл культуры, и в один из сосудов добавляли арабинозу в конечной концентрации 0,2% мас./об. Сосуд отрицательного контроля не индуцировали арабинозой. Сосуды инкубировали в течение 4 часов при 37°С при перемешивании. Клетки собирали центрифугированием и осадки клеток ресуспендировали в буфере 50 мМ MOPS, pH 7,0. Клетки разрушали либо обработкой ультразвуком, либо пропусканием через French Pressure Cell. Весь клеточный лизат центрифугировали с получением супернатанта, или бесклеточного экстракта и осадка, или нерастворимой фракции. Аликвоту каждой фракции (общего клеточного лизата, бесклеточного экстракта и нерастворимой фракции) ресуспендировали в ДДС-Na (MES) буфере для нанесения (Invitrogen), нагревали до 85°С в течение 10 минут и подвергали анализу ДДС-Na-ПААГ (NuPAGE 4-12% Bis-Tris Gel, каталожный № NP0322Box, Invitrogen). Белок с ожидаемой молекулярной массой приблизительно 60 кДа, рассчитанной на основании нуклеотидной последовательности, имелся в индуцированной культуре, но не в неиндуцированном контроле.
Активность ацетолактатсинтазы в бесклеточных экстрактах измеряли способом, описанным Bauerle et al. (Biochim. Biophys. Acta 92(1):142-149 (1964)).
Пример 2 (предсказательный)
Клонирование и экспрессия редуктоизомеразы ацетогидроксикислоты
Цель данного предсказательного примера заключается в описании клонирования гена ilvC из E. сoli K12 и его экспрессии в E. сoli BL21-AI. Ген ilvC амплифицируют из геномной ДНК E. coli с помощью ПЦР.
Ген ilvC клонируют и экспрессируют тем же способом, что и ген budB, описанным в примере 1. Геномную ДНК из E. сoli получают с помощью набора Gentra Puregene (Gentra Systems, Inc., Minneapolis, MN; каталожный номер D-5000A). Ген ilvC амплифицируют с помощью ПЦР с использованием праймеров N100 и N101 (см. таблицу 2), представленных как SEQ ID NO:13 и 14 соответственно, с получением продукта 1,5 т.п.н. Прямой праймер включает четыре основания (CCAC), непосредственно примыкающие к кодону старта трансляции, что обеспечивает направленное клонирование в pENTR/SD/D-TOPO (Invitrogen) с получением плазмиды pENTRSDD-TOPOilvC. Клоны секвенируют для подтверждения того, что гены вставлены в правильной ориентации, и для подтверждения последовательности. Нуклеотидная последовательность открытой рамки считывания (ORF) для данного гена и предсказанная аминокислотная последовательность фермента представлены в виде SEQ ID No:3 и SEQ ID No:4 соответственно.
Для создания экспрессионного клона ген ilvC переносили на вектор pDEST 14 путем рекомбинации с получением pDEST14ilvC. Вектором pDEST14ilvC трансформировали клетки E. coli BL21-AI и экспрессию с промотора T7 индуцировали добавлением арабинозы. Белок с ожидаемой молекулярной массой приблизительно 54 кДа, рассчитанной на основании нуклеотидной последовательности, имелся в индуцированной культуре, но не в неиндуцированном контроле.
Активность редуктоизомеразы ацетогидроксикислоты в бесклеточных экстрактах измеряют способом, описанным Arfin and Umbarger (J. Biol. Chem. 244(5): 1118-1127 (1969)).
Пример 3 (предсказательный)
Клонирование и экспрессия дегидратазы ацетогидроксикислоты
Цель данного предсказательного примера заключается в описании клонирования гена ilvD из E. сoli K12 и его экспрессии в E. сoli BL21-AI. Ген ilvD амплифицируют из геномной ДНК E. coli с помощью ПЦР.
Ген ilvD клонируют и экспрессируют тем же способом, что и ген budB, описанным в примере 1. Геномную ДНК из E. сoli получают с помощью набора Gentra Puregene (Gentra Systems, Inc., Minneapolis, MN; каталожный номер D-5000A). Ген ilvD амплифицируют с помощью ПЦР с использованием праймеров N102 и N103 (см. таблицу 2), представленных как SEQ ID NO:15 и 16 соответственно с получением продукта 1,9 т.п.н. Прямой праймер включает четыре основания (CCAC), непосредственно примыкающие к кодону старта трансляции, что обеспечивает направленное клонирование в pENTR/SD/D-TOPO (Invitrogen) с получением плазмиды pENTRSDD-TOPOilvD. Клоны секвенируют для подтверждения того, что гены вставлены в правильной ориентации, и для подтверждения последовательности. Нуклеотидная последовательность открытой рамки считывания (ORF) для данного гена и предсказанная аминокислотная последовательность фермента представлены в виде SEQ ID NO:5 и SEQ ID NO:6 соответственно.
Для создания экспрессионного клона ген ilvD переносят на вектор pDEST 14 (Invitrogen) путем рекомбинации с получением pDEST14ilvD. Вектором pDEST14ilvC трансформируют клетки E. coli BL21-AI и экспрессию с промотора T7 индуцируют добавлением арабинозы. Белок с ожидаемой молекулярной массой приблизительно 66 кДа, рассчитанной на основании нуклеотидной последовательности, имеется в индуцированной культуре, но не в неиндуцированном контроле.
Активность дегидратазы ацетогидроксикислоты в бесклеточных экстрактах измеряют способом, описанным Flint et al. (J. Biol. Chem. 268(20):14732-14742 (1993)).
Пример 4 (предсказательный)
Клонирование и экспрессия декарбоксилазы кетокислот с разветвленной цепью
Цель данного предсказательного примера заключается в описании клонирования гена kivD из Lactococcus lactis и его экспрессии в E. сoli BL21-AI.
Последовательность ДНК, кодирующей декарбоксилазу кетокислот с разветвленной цепью (kivD) из L. lactis, получена от GenScript (Piscataway, NJ). Полученная последовательность оптимизирована по кодонам для экспрессии и в E. coli, и в B. subtilis и клонируется в pUC57 с получением pUC57-kivD. Оптимизированная по кодонам нуклеотидная последовательность открытой рамки считывания (ORF) для данного гена и предсказанная аминокислотная последовательность фермента представлены в виде SEQ ID NO:7 и SEQ ID NO:8 соответственно.
Для создания экспрессионного клона используют сайты рестрикции NdeI и BamHI для клонирования 1,7 т.п.н. фрагмента kivD из pUC57-kivD в вектор 3ET-3a (Novagen, Madison, WI). Это обеспечивает экспрессию клона pET-3a-kivD. Вектором pET-3a-kivD трансформируют клетки E. coli BL21-AI и экспрессию с промотора T7 индуцируют добавлением арабинозы. Белок с ожидаемой молекулярной массой приблизительно 61 кДа, рассчитанной на основании нуклеотидной последовательности, имеется в индуцированной культуре, но не в неиндуцированном контроле.
Активность декарбоксилазы кетокислот с разветвленной цепью в бесклеточных экстрактах измеряют способом, описанным Smit et al. (Appl. Microbiol. Biotechnol. 64:396-402 (2003)).
Пример 5 (предсказательный)
Клонирование и экспрессия дегидрогеназы спиртов с разветвленной цепью
Цель данного предсказательного примера заключается в описании клонирования гена yqhD из E. coli K12 и его экспрессии в E. сoli BL21-AI. Ген yqhD амплифицируют из геномной ДНК E. coli с помощью ПЦР.
Ген yqhD клонируют и экспрессируют тем же способом, что и ген budB, описанным в примере 1. Геномную ДНК из E. сoli получают с помощью набора Gentra Puregene (Gentra Systems, Inc., Minneapolis, MN; каталожный номер D-5000A). Ген yqhD амплифицируют с помощью ПЦР с использованием праймеров N104 и N105 (см. таблицу 2), представленных как SEQ ID NO:17 и 18 соответственно, с получением продукта 1,2 т.п.н. Прямой праймер включает четыре основания (CCAC), непосредственно примыкающие к кодону старта трансляции, что обеспечивает направленное клонирование в pENTR/SD/D-TOPO (Invitrogen) с получением плазмиды pENTRSDD-TOPOyqhD. Клоны секвенируют для подтверждения того, что гены вставлены в правильной ориентации, и для подтверждения последовательности. Нуклеотидная последовательность открытой рамки считывания (ORF) для данного гена и предсказанная аминокислотная последовательность фермента представлены в виде SEQ ID NO:9 и SEQ ID NO:10 соответственно.
Для создания экспрессионного клона ген yqhD переносят на вектор pDEST 14 (Invitrogen) путем рекомбинации с получением pDEST14yqhD. Вектором pDEST14ilvD трансформируют клетки E. coli BL21-AI и экспрессию с промотора T7 индуцируют добавлением арабинозы. Белок с ожидаемой молекулярной массой приблизительно 42 кДа, рассчитанной на основании нуклеотидной последовательности, имеется в индуцированной культуре, но не в неиндуцированном контроле.
Активность дегидрогеназы спиртов с разветвленной цепью в бесклеточных экстрактах измеряют способом, описанным Sulzenbacher et al. (J. Mol. Biol. 342(2):489-502 (2004)).
Пример 6 (предсказательный)
Конструирование трансформирующего вектора для генов пути биосинтеза изобутанола
Цель данного предсказательного примера заключается в описании конструирования трансформирующего вектора, содержащего гены, кодирующие пять стадий пути биосинтеза изобутанола. Все гены помещали в единый оперон под контролем единого промотора. Отдельные гены амплифицируют с помощью ПЦР с праймерами, которые включают сайты рестрикции для последующего клонирования, и прямые праймеры содержат оптимизированный сайт связывания (AAAGGAGG) с рибосомой E. coli. Продукты ПЦР клонируют TOPO в вектор pCR 4Blunt-TOPO и трансформируют им клетки E. coli Top10 (Invitrogen). Из клонов TOPO получают плазмидную ДНК и проверяют последовательность генов. Ферменты рестрикции и T4 ДНК-лигазу (New England Biolabs, Beverly, MA) используют в соответствии с рекомендациями производителя. Для экспериментов по клонированию фрагменты рестрикции очищают в геле с помощью набора QIAquick Gel Extraction (Qiagen). После подтверждения последовательности гены субклонируют в модифицированный вектор pUC19 в качестве основы клонирования. Вектор pUC19 модифицируют гидролизом HindIII/SapI с созданием pUC19dHS. Гидролиз удаляет lac промотор, примыкающий к MCS (сайту множественного клонирования), что предотвращает транскрипцию оперонов в векторе.
Ген budB амплифицируют из геномной ДНК K. pneumoniae ATCC 25955 с помощью ПЦР с использованием пары праймеров N110 и N111 (см. таблицу 2), представленных как SEQ ID NO:19 и 20 соответственно, с получением продукта 1,8 т.п.н. Прямой праймер включает сайты рестрикции SphI и AflII и сайт связывания с рибосомой (RBS). Обратный праймер включает сайты рестрикции PacI и NsiI. Продукт ПЦР клонируют в pCR4 Blunt-TOPO с созданием pCR4 Blunt-TOPO-budB. Из клонов TOPO получают плазмидную ДНК и проверяют последовательность гена.
Ген ilvC амплифицируют из геномной ДНК E. coli K12 с помощью ПЦР с использованием пары праймеров N112 и N113 (см. таблицу 2), представленных как SEQ ID NO:21 и 22 соответственно, с получением продукта 1,5 т.п.н. Прямой праймер включает сайты рестрикции SalI и NheI и RBS. Обратный праймер включает сайт рестрикции XbaI. Продукт ПЦР клонируют в pCR4 Blunt-TOPO с созданием pCR4 Blunt-TOPO-ilvC. Из клонов TOPO получают плазмидную ДНК и проверяют последовательность гена.
Ген ilvD амплифицируют из геномной ДНК E. coli K12 с помощью ПЦР с использованием пары праймеров N114 и N115 (см. таблицу 2), представленных как SEQ ID NO:23 и 24 соответственно, с получением продукта 1,9 т.п.н. Прямой праймер включает сайт рестрикции XbaI и RBS. Обратный праймер включает сайт рестрикции BamHI. Продукт ПЦР клонируют в pCR4 Blunt-TOPO с созданием pCR4 Blunt-TOPO-ilvD. Из клонов TOPO получают плазмидную ДНК и проверяют последовательность гена.
Ген kivD амплифицируют из pUC57-kivD (описанной в примере 4) с помощью ПЦР с использованием пары праймеров N116 и N117 (см. таблицу 2), представленных как SEQ ID NO:25 и 26 соответственно, с получением продукта 1,7 т.п.н. Прямой праймер включает сайт рестрикции BamHI и RBS. Обратный праймер включает сайт рестрикции SacI. Продукт ПЦР клонируют в pCR4 Blunt-TOPO с созданием pCR4 Blunt-TOPO-kivD. Из клонов TOPO получают плазмидную ДНК и проверяют последовательность гена.
Ген yqhD амплифицируют из геномной ДНК E. coli K12 с помощью ПЦР с использованием пары праймеров N118 и N119 (см. таблицу 2), представленных как SEQ ID NO:27 и 28 соответственно, с получением продукта 1,2 т.п.н. Прямой праймер включает сайт рестрикции SacI. Обратный праймер включает сайты рестрикции SpeI и EcoRI. Продукт ПЦР клонируют в pCR4 Blunt-TOPO с созданием pCR4 Blunt-TOPO-yqhD. Из клонов TOPO получают плазмидную ДНК и проверяют последовательность гена.
Для конструирования оперона пути изобутанола ген yqhD вырезают из pCR4 Blunt-TOPO-yqhD с помощью SacI и EcoRI с получением фрагмента 1,2 т.п.н. Его лигируют с pUC19dHS, которую предварительно гидролизуют SacI и EcoRI. Полученный клон pUC19dHS-yqhD подтверждают гидролитической рестрикцией. Затем из pCR4 Blunt-TOPO-ilvC вырезают ген ilvC с помощью SalI и XbaI с получением фрагмента 1,5 т.п.н. Его лигируют с pUC19dHS-yqhD, которую предварительно гидролизуют SalI и XbaI. Полученный клон pUC19dHS-ilvC-yqhD подтверждают гидролитической рестрикцией. Затем из pCR4 Blunt-TOPO-budB вырезают ген budB с помощью SphI и NsiI с получением фрагмента 1,8 т.п.н. pUC19dHS-ilvC-yqhD гидролизуют SphI и PstI и лигируют с фрагментом SphI/NsiI budB (NsiI и PstI образуют совместимые концы) с образованием pUC19dHS-budB-ilvC-yqhD. Фрагмент 1,9 т.п.н, содержащий ген ilvD, вырезают из pCR4 Blunt-TOPO-ilvD с помощью XbaI и BamHI и лигируют с pUC19dHS-budB-ilvC-yqhD, которую гидролизуют теми же ферментами, с получением pUC19dHS-budB-ilvC-ilvD-yqhD. Наконец, из pCR4 Blunt-TOPO-kivD с помощью BamHI and SacI вырезают kivD с получением фрагмента 1,7 т.п.н. Данный фрагмент лигируют с pUC19dHS-budB-ilvC-ilvD-yqhD, которую предварительно гидролизуют с помощью BamHI and SacI, с образованием pUC19dHS-budB-ilvC-ilvD-kivD-yqhD.
Вектор pUC19dHS-budB-ilvC-ilvD-kivD-yqhD гидролизуют AflII и SpeI с получением оперонного фрагмента 8,2 т.п.н., который клонируют в pBenAS, челночный вектор E.coli-B. Subtilis. Плазмиду pBenAS создают путем модификации вектора pBE93, описанного Nagarajan, (WO 93/24631, пример 4). Для получения pBenAS промотор нейтральной протеазы (NPR) Bacillus amyloliquefaciens, сигнальную последовательность и ген phoA удаляют гидролизом pBE93 с помощью NcoI/HindIII. Промотор NPR амплифицируют с помощью ПЦР из pBE93 с применением праймеров BenNF и BenASR, представленных SEQ ID NO:29 и 30 соответственно. Праймер BenASR включает сайты AflII, SpeI и HindIII ниже промотора. Продукт ПЦР гидролизуют NcoI и HindIII и фрагмент клонируют в соответствующие сайты вектора с получением pBenAS. Оперонный фрагмент клонируют в сайты AflII и SpeI в pBenAS с получением pBen-budB-ilvC-ilvD-kivD-yqhD.
Пример 7 (предсказательный)
Экспрессия пути биосинтеза изобутанола в E. coli
Цель данного предсказательного примера заключается в описании экспрессии пути биосинтеза изобутанола в E. coli.
Плазмидой pBen-budB-ilvC-ilvD-kivD-yqhD, сконструированной, как описано в примере 6, трансформируют E. coli NM522 (ATCC No. 47000) с получением штамма E. coli NM522/pBen-budB-ilvC-ilvD-kivD-yqhD и экспрессию генов оперона отслеживают с помощью анализа ДДС-Na-ПАГЭ, ферментативного анализа и анализа Вестерн-блоттингом. Для иммуноблоттинга получают антитела против синтетических пептидов с помощью Sigma-Genosys (The Woodlands, TX).
Штамм E. coli NM522/pBen-budB-ilvC-ilvD-kivD-yqhD инокулируют в 250-мл перемешиваемый сосуд, содержащий 50 мл среды, и перемешивают при 250 об/мин и 35°С. Среда состоит из глюкозы (5 г/л), MOPS (0,05М), сульфата аммония (0,01М), фосфата калия, одноосновного (0,005М), смеси металлов S10 (1% (об./об.), дрожжевого экстракта (0,1% (мас./об.), казаминовых кислот (0,1% (мас./об.), тиамина (0,1 мг/л), пролина (0,05 мг/л) и биотина (0,002 мг/л) и титруется до pH 7,0 с помощью KOH. Смесь металлов S10 содержит MgCl2 (200 мМ), CaCl2 (70 мМ), MnCl2 (5 мМ), FeCl3 (0,1 мМ), ZnCl2 (0,1 мМ), тиамина гидрохлорид (0,2 мМ), CuSO4 (172 мкМ), CoCl2 (253 мкМ) и Na2MoO4 (242 мкМ). Через 18 час изобутанол определяют с помощью ВЭЖХ или ГХ-анализа с использованием способов, хорошо известных в данной области техники, например описанных в разделе «Общие способы» выше.
Пример 8 (предсказательный)
Экспрессия пути биосинтеза изобутанола в Bacillus subtilis
Цель данного предсказательного примера заключается в описании экспрессии пути биосинтеза изобутанола в Bacillus subtilis. Применяют тот же подход, что и описанный в примере 7.
Используют плазмиду pBen-budB-ilvC-ilvD-kivD-yqhD, сконструированную, как описано в примере 6. Плазмидой трансформируют Bacillus subtilis BE1010 (J. Bacteriol. 173:2278-2282 (1991)) с получением штамма B. subtilis BE1010/pBen-budB-ilvC-ilvD-kivD-yqhD и экспрессию генов каждого оперона отслеживают, как описано в примере 7.
Штамм B. subtilis BE1010/pBen-budB-ilvC-ilvD-kivD-yqhD инокулируют в 250 мл перемешиваемый сосуд, содержащий 50 мл среды, и перемешивают при 250 об/мин и 35°С в течение 18 час. Среда состоит из декстрозы (5 г/л), MOPS (0,05М), глутаминовой кислоты (0,02М), сульфата аммония (0,01М), фосфата калия, одноосновного буфера (0,005М), смеси металлов S10 (как описано в примере 11, 1% (об./об.)), дрожжевого экстракта (0,1% (мас./об.), казаминовых кислот (0,1% (мас./об.), триптофана (50 мг/л), метионина (50 мг/л) и лизина (50 мг/л) и титруется до pH 7,0 с помощью KOH. Через 18 час изобутанол определяют с помощью ВЭЖХ или ГХ-анализа с использованием способов, хорошо известных в данной области техники, например, описанных в разделе «Общие способы» выше.
Пример 9
Клонирование и экспрессия ацетолактатсинтазы
Для создания другого экспрессирующего ацетолактатсинтазу клона ген budB клонировали в вектор pTrc99A. Ген budB сначала амплифицировали из pENTRSDD-TOPObudB (описанной в примере 1) с использованием праймеров (N110.2 и N111.2, представленных в виде SEQ ID NO:31 и 32 соответственно), вводящих сайты SacI, SpeI и MfeI с 5'-конца и сайты BbvCI, AflII и BamHI с 3'-конца. Полученный 1,75 т.п.н. продукт ПЦР клонировали в pCR4-Blunt TOPO (Invitrogen) и подтверждали последовательность ДНК (с использованием секвенирующих праймеров N130Seq F1-F4 и R1-R4, представленных в виде SEQ ID NO:40-47 соответственно). Ген budB затем вырезали из этого вектора с помощью SacI и BamHI и клонировали в pTrc99A (Amann et al. Gene 69(2):301-315 (1988)) с получением pTrc99A::budB. Вектором pTrc99A::budB трансформировали клетки E. coli TOP10 и трансформанты инокулировали в среду LB с добавкой 50 мкг/мл ампициллина и выращивали в течение ночи при 37°С. Аликвоту ночной культуры использовали для инокуляции 50 мл среды LB с добавкой 50 мкг/мл ампициллина. Культуру инкубировали при 37°С с перемешиванием до достижения ОП600 значения от 0,6 до 0,8. Экспрессию budB с промотора Trc индуцировали добавлением 0,4 мМ IPTG. Готовили также сосуды отрицательного контроля, которые не индуцировали IPTG. Сосуды инкубировали в течение 4 час при 37°С с перемешиванием. Бесклеточные экстракты получали, как описано в примере 1.
Активность ацетолактатсинтазы в бесклеточных экстрактах измеряли, как описано в примере 1. Через три часа после индукции IPTG измеренная активность ацетолактатсинтазы составила 8 единиц/мг. Контрольный штамм, несущий лишь плазмиду pTrc99A, проявлял активность ацетолактатсинтазы 0,03 единицы/мг.
Пример 10
Клонирование и экспрессия редуктоизомеразы ацетогидроксикислоты
Цель данного примера состояла в клонировании гена ilvC из E. coli K12 и его экспрессии в E. coli TOP10. Ген ilvC амплифицировали из геномной ДНК штамма FM5 (ATCC 53911) E. coli K12 с помощью ПЦР.
Ген ilvC клонировали и экспрессировали способом, сходным с описанным для клонирования и экспрессии ilvC в примере 2 выше. ПЦР использовали для амплификации ilvC из генома E. coli FM5 с применением праймеров N112.2 и N113.2 (SEQ ID NO:33 и 34 соответственно). Праймеры создавали сайты SacI и AflII и оптимальный RBS на 5'-конце и сайты NotI, NheI и BamHI на 3'-конце ilvC. Продукт ПЦР 1,5 т.п.н. клонировали в pCR4Blunt TOPO в соответствии с протоколом производителя (Invitrogen) с получением pCR4Blunt TOPO::ilvC. Последовательность продукта ПЦР была подтверждена с помощью секвенирующих праймеров (N131SeqF1-F3 и N131SeqR1-R3, представленных как SEQ ID NO:48-53 соответственно). Для создания экспрессионного клона ген ilvC вырезали из pCR4Blunt TOPO::ilvC с помощью SacI и BamHI и клонировали в pTrc99A. Вектором pTrc99A::ilvC трансформировали клетки E. coli TOP10 и экспрессию с промотора Trc индуцировали добавлением IPTG, как описано в примере 9. Бесклеточные экстракты получали, как описано в примере 1.
Активность редуктоизомеразы ацетогидроксикислоты в бесклеточных экстрактах измеряли, как описано в примере 2. Через три часа после индукции IPTG измеренная активность редуктоизомеразы ацетогидроксикислоты составила 0,026 единиц/мг. Контрольный штамм, несущий лишь плазмиду pTrc99A, проявлял активность редуктоизомеразы ацетогидроксикислоты менее 0,001 единицы/мг.
Пример 11
Клонирование и экспрессия дегидратазы ацетогидроксикислоты
Цель данного примера состояла в клонировании гена ilvD из E. coli K12 и его экспрессии в E. coli TOP10. Ген ilvD амплифицировали из геномной ДНК штамма FM5 (ATCC 53911) E. coli K12 с помощью ПЦР.
Ген ilvD клонировали и экспрессировали способом, сходным с описанным для клонирования и экспрессии гена ilvC в примере 10. ПЦР использовали для амплификации ilvD из генома E. coli FM5 с применением праймеров N114.2 и N115.2 (SEQ ID NO:35 и 36 соответственно). Праймеры создавали сайты SacI и NheI и оптимальный RBS на 5'-конце и сайты Bsu36I, PacI и BamHI на 3'-конце ilvD. Продукт ПЦР 1,9 т.п.н. клонировали в pCR4Blunt TOPO в соответствии с протоколом производителя (Invitrogen) с получением pCR4Blunt TOPO::ilvD. Последовательность продукта ПЦР была подтверждена (секвенирующие праймеры N132SeqF1-F3 и N132SeqR1-R3, представленные как SEQ ID NO:54-61 соответственно). Для создания экспрессионного клона ген ilvD вырезали из pCR4Blunt TOPO::ilvD с помощью SacI и BamHI и клонировали в pTrc99A. Вектором pTrc99A::ilvD трансформировали клетки E. coli TOP10 и экспрессию с промотора Trc индуцировали добавлением IPTG, как описано в примере 9. Бесклеточные экстракты получали, как описано в примере 1.
Активность дегидратазы ацетогидроксикислоты в бесклеточных экстрактах измеряли, как описано в примере 3. Через три часа после индукции IPTG измеренная активность дегидратазы ацетогидроксикислоты составила 46 единиц/мг. Контрольный штамм, несущий лишь плазмиду pTrc99A, не проявлял выявляемой активности дегидратазы ацетогидроксикислоты.
Пример 12
Клонирование и экспрессия декарбоксилазы кетокислот с разветвленной цепью
Цель данного примера состояла в клонировании гена kivD из Lactococcus lactis и его экспрессии в E. coli TOP10.
Ген kivD клонировали и экспрессировали способом, сходным с описанным для ilvC в примере 10 выше. ПЦР использовали для амплификации kivD из плазмиды pUC57-kivD (см. пример 4 выше) с применением праймеров N116.2 и N117.2 (SEQ ID NO:37 и 38 соответственно). Праймеры создавали сайты SacI и PacI и оптимальный RBS на 5'-конце и сайты PciI, AvrII, BglII и BamHI на 3'-конце kivD. Продукт ПЦР 1,7 т.п.н. клонировали в pCR4Blunt TOPO в соответствии с протоколом производителя (Invitrogen) с получением pCR4Blunt TOPO::kivD. Последовательность продукта ПЦР была подтверждена с помощью праймеров N133SeqF1-F4 и N133SeqR1-R4 (представленных как SEQ ID NO:62-69 соответственно). Для создания экспрессионного клона ген kivD вырезали из плазмиды pCR4Blunt TOPO::kivD с помощью SacI и BamHI и клонировали в pTrc99A. Вектором pTrc99A::kivD трансформировали клетки E. coli TOP10 и экспрессию с промотора Trc индуцировали добавлением IPTG, как описано в примере 9. Бесклеточные экстракты получали, как описано в примере 1.
Активность декарбоксилазы кетокислот с разветвленной цепью в бесклеточных экстрактах измеряли, как описано в примере 4, за исключением того, что для выявления и количественного определения продуктов альдегидной реакции использовали реагент Purpald® (Aldrich, каталожный No. 162892). Через три часа после индукции IPTG измеренная активность декарбоксилазы кетокислот с разветвленной цепью была выше 3,7 единиц/мг. Контрольный штамм, несущий лишь плазмиду pTrc99A, не проявлял выявляемой активности декарбоксилазы кетокислот с разветвленной цепью.
Пример 13
Экспрессия дегидрогеназы спиртов с разветвленной цепью
E. coli содержит природный ген (yqhD), который был идентифицирован как 1,3-пропандиолдегидрогеназа (патент США № 6514733). Белок YqhD на 40% идентичен AdhB (кодируемому adhB) из Clostridium, предполагаемой НАДH-зависимой бутанолдегидрогеназе. Ген yqhD конститутивно экспрессировали, поместив под вариант промотора 1.6GI глюкозоизомеразы (SEQ ID NO:70) в штамме MG1655 1.6yqhD::Cm E. coli (WO 2004/033646) с использованием способа λ Red (Datsenko and Wanner, Proc. Natl. Acad. Sci U.S.A. 97:6640 (2000)). MG1655 1.6yqhD::Cm содержит кассету FRT-CmR-FRT так, что маркер антибиотика может быть удален. Сходным образом природный промотор заменяли промотором 1.5GI (WO 2003/089621) (SEQ ID NO:71) с получением штамма MG1655 1.5GI-yqhD::Cm, заместив таким образом промотор 1.6GI MG1655 1.6yqhD::Cm промотором 1.5GI.
Штамм MG1655 1.5GI-yqhD::Cm выращивали в среде LB до середины логарифмического роста и получали бесклеточные экстракты, как описано в примере 1. Было обнаружено, что штамм обладает НАДФH-зависимой изобутиральдегидредуктазной активностью при анализе клеточных экстрактов путем отслеживания снижения поглощения при 340 нм при pH 7,5 и 35°С.
Для создания второго экспрессионного штамма, содержащего 1.5GI yqhD::Cm, получали P1 лизат из MG1655 1.5GI-yqhD::Cm и кассету переносили на BL21 (DE3) (Invitrogen) путем трансдукции с получением BL21 (DE3) 1.5GI-yqhD::Cm.
Пример 14
Конструирование трансформирующего вектора для первых четырех генов пути биосинтеза изобутанола
Цель настоящего примера состояла в конструировании трансформирующего вектора для первых четырех генов (т.е. budB, ilvC, ilvD и kivD) пути биосинтеза изобутанола.
Для конструирования трансформирующего вектора первый ген, ilvC, получали из pTrc99A::ilvC (описанной в примере 10) путем гидролиза с помощью AflII и BamHI и клонировали в pTrc99A::budB (описанную в примере 9), которую гидролизовали AflII и BamHI с получением плазмиды pTrc99A::budB-ilvC. Затем получали гены ilvD и kivD из pTrc99A::ilvD (описанной в примере 11) и pTrc99A::kivD (описанной в примере 12) соответственно путем гидролиза с помощью NheI и PacI (ilvD) и PacI и BamHI (kivD). Эти гены вводили в pTrc99A::budB-ilvC, которую сначала гидролизовали с помощью NheI и BamHI путем трехстороннего лигирования. Наличие всех четырех генов в конечной плазмиде, pTrc99A::budB-ilvC- ilvD-kivD, подтверждали скринингом ПЦР и рестрикционным гидролизом.
Пример 15
Экспрессия пути биосинтеза изобутанола в E. coli, выращиваемой на глюкозе
Для создания продуцирующих изобутанол штаммов E. coli pTrc99A::budB-ilvC-ilvD-kivD (описанной в примере 14) трансформировали E. coll MG1655 1.5GI yqhD::Cm и E. coli BL21 (DE3) 1.5GI yqhD::Cm (описанные в примере 13). Трансформанты сначала выращивали в среде LB, содержащей 50 мкг/мл канамицина и 100 мкг/мл карбенициллина. Клетки из этих культур использовали для инокуляции перемешиваемых сосудов (суммарный объем приблизительно 175 мл), содержащих 50 или 170 мл среды TM3a/глюкоза (с соответствующими антибиотиками) для экспозиции в условиях высокого и низкого содержания кислорода соответственно. Среда TM3a/глюкоза содержала (на литр): глюкозу (10 г), KH2PO4 (13,6 г), моногидрат лимонной кислоты (2,0 г), (NH4)2SO4 (3,0 г), MgSO4·7H2O (2,0 г), CaCl2·2H2O (0,2 г), аммонийцитрат железа (0,33 г), тиамин-HCl (1,0 мг), дрожжевой экстракт (0,50 г) и 10 мл раствора микроэлементов. pH доводили до 6,8 с помощью NH4OH. Раствор микроэлементов содержал: лимонная кислота·H2O (4,0 г/л), MnSO4·H2O (3,0 г/л), NaCl (1,0 г/л), FeSO4·7H2O (0,10 г/л), CoCl2·6H2O (0,10 г/л), ZnSO4·7H2O (0,10 г/л), CuSO4·5H2O (0,010 г/л), H3BO4 (0,010 г/л) и Na2MoO4·2H2O (0,010 г/л).
Сосуды инокулировали при начальной ОП600≤0,01 единицы и инкубировали при 34°С с перемешиванием при 300 об/мин. Сосуды, содержащие 50 мл среды, закрывали крышками из фильтра 0,2 мкм; сосуды, содержащие 150 мл среды, закрывали запаиваемыми крышками. IPTG добавляли до конечной концентрации 0,04 мМ при достижении клетками ОП600 ≥0,4 единицы. Приблизительно через 18 час после индукции аликвоту бульона анализировали с помощью ВЭЖХ (колонка Shodex Sugar SH1011 (Showa Denko America, Inc. NY) с детекцией коэффициента преломления (RI)) и ГХ (Varian CP-WAX 58(FFAP) CB, 0,25 мм × 0,2 мкм × 25 м (Varian, Inc., Palo Alto, CA) с детекцией пламенной ионизации (FID)) на предмет содержания изобутанола, как описано в разделе «Общие способы». Изобутанол не был обнаружен в контрольных штаммах, несущих лишь вектор pTrc99A (результаты не показаны). Молярная избирательность и титры изобутанола, продуцируемого штаммами, несущими pTrc99A::budB-ilvC-ilvD-kivD, представлены в таблице 5. Значительно более высокие титры изобутанола были получены в культурах, выращиваемых в условиях низкого содержания кислорода.
Пример 16
Экспрессия пути биосинтеза изобутанола в E. coli, выращиваемой на сахарозе
Поскольку штаммы, описанные в примере 15, не были способны расти на сахарозе, была сконструирована дополнительная плазмида для обеспечения утилизации сахарозы для получения изобутанола. Кластер генов утилизации сахарозы cscBKA, представленный в виде SEQ ID NO:39, был выделен из геномной ДНК утилизирующего сахарозу штамма E. coli, полученного из штамма ATCC 13281. Гены утилизации сахарозы (cscA, cscK и cscB) кодируют сахарозогидролазу (CscA), представленную в виде SEQ ID NO:139, D-фруктокиназу (CscK), представленную в виде SEQ ID NO:140, и сахарозопермеазу (CscB), представленную в виде SEQ ID NO:141. Специфичный в отношении сахарозы репрессорный ген cscR не включали, в результате чего три гена cscBKA экспрессировались конститутивно со своих природных промоторов в E. сoli.
Геномную ДНК из утилизирующего сахарозу штамма E. coli гидролизовали до конца с помощью BamHI и EcoRI. Фрагменты, имеющие средний размер приблизительно 4 т.п.н., выделяли из агарозного геля и лигировали в плазмиду pLitmus28 (New England Biolabs), гидролизованную BamHI и EcoRI, и трансформировали ей сверхкомпетентные клетки E. coli TOP10F' (Invitrogen). Трансформанты наносили полосами на чашки агара MacConkey, содержащие 1% сахарозы и ампициллин (100 мкг/мл), и подвергали скринингу на появление пурпурных колоний. Плазмидную ДНК выделяли из пурпурных трансформантов и секвенировали с помощью M13 прямого и обратного праймеров (Invitrogen) и Scr1-4 (представленных как SEQ ID NO:72-75 соответственно). Плазмида, содержащая гены cscB, cscK и cscA (cscBKA), была обозначена как pScr1.
Для создания плазмиды утилизации сахарозы, которая была бы совместима с плазмидой пути изобутанола (пример 14), оперон из pScr1 субклонировали в pBHR1 (MoBiTec, Goettingen, Германия). Гены cscBKA выделяли гидролизом pScr1 с помощью XhoI (с последующей инкубацией с ферментом Кленова для получения тупых концов) и затем гидролизом AgeI. Полученный фрагмент 4,2 т.п.н. лигировали в pBHR1, которую перед этим гидролизовали NaeI и AgeI, что дало плазмиду pBHR1::cscBKA.
Сахарозной плазмидой pBHR1::cscBKA трансформировали E. coli BL21 (DE3) 1.5 yqhD /pTrc99A::budB-ilvC-ilvD-kivD и E. coli MG1655 1.5yqhD /pTrc99A::budB-ilvC-ilvD-kivD (описанные в примере 15) электропорацией. Трансформанты сначала подвергали селекции на среде LB, содержащей 100 мкг/мл ампициллина и 50 мкг/мл канамицина, и затем подвергали скринингу на чашках сахарозы (1%) MacConkey для подтверждения функциональной экспрессии сахарозного оперона. Для получения изобутанола штаммы выращивали в минимальной описанной среде TM3a (описанной в примере 15), содержащей 1% сахарозу вместо глюкозы, и культуральную среду анализировали на количество образованного изобутанола, как описано в примере 15, за исключением того, что образцы отбирали через 14 часов после индукции. И вновь изобутанол не определялся в контрольных штаммах, несущих лишь вектор pTrc99A (результаты не показаны). Молярная избирательность и титры изобутанола, продуцируемого MG1655 1.5yqhD, несущим pTrc99A::budB-ilvC-ilvD-kivD, представлены в таблице 6. Сходные результаты были получены с аналогичным штаммом BL21 (DE3).
Пример 17
Экспрессия генов пути изобутанола в Saccharomyces Cerevisiae
Для экспрессии генов пути изобутанола в Saccharomyces Cerevisiae был сконструирован ряд челночных векторов E. coli-дрожжи. Для соединения генов с промоторами и терминаторами дрожжей использовали подход ПЦР (Yu, et al. Fungal Genet. Biol. 41:973-981 (2004)). Конкретно, промотор GPD (SEQ ID NO:76) и терминатор CYC1 (SEQ ID NO:77) соединяли с геном alsS из Bacillus subtilis (SEQ ID NO:78), промотор FBA (SEQ ID NO:79) и терминатор CYC1 соединяли с геном ILV5 из S. cerevisiae (SEQ ID NO:80), промотор ADH1 (SEQ ID NO:81) и терминатор ADH1 (SEQ ID NO:82) соединяли с геном ILV3 из S. cerevisiae (SEQ ID NO:83) и промотор GPM (SEQ ID NO:84) и терминатор ADH1 соединяли с геном kivD из Lactococcus lactis (SEQ ID NO:7). Праймеры, показанные в таблице 7, были разработаны так, чтобы они включали сайты рестрикции для клонирования продуктов промотор/ген/терминатор в челночные векторы E. coli-дрожжи серии pRS400 (Christianson et al. Gene 110:119-122 (1992)) и для обмена промоторами между конструктами. Праймеры для 5'-концов ILV5 и ILV3 (N138 и N155 соответственно, представленные как SEQ ID NO:95 и 107 соответственно) создавали новые стартовые кодоны для предотвращения направления этих ферментов в митохондрии.
Все гибридные продукты ПЦР сначала клонировали в pCR-Blunt с помощью реакции клонирования TOPO (Invitrogen), и последовательности были подтверждены (с помощью M13 прямых и обратных праймеров (Invitrogen) и секвенирующих праймеров, представленных в таблице 7. Два дополнительных промотора (CUP1 и GAL1) были клонированы с помощью реакции TOPO в pCR4-Blunt и подтверждены секвенированием; последовательности праймеров показаны в таблице 7. Сконструированные плазмиды описаны в таблице 8. Плазмидами трансформировали либо Saccharomyces cerevisiae BY4743 (ATCC 201390), либо YJR148w (ATCC 4036939) для оценки удельной активности ферментов с помощью ферментативных анализов, описанных в примерах 1-4 и примерах 9-12. Для определения активности ферментов культуры выращивали до ОП600, равной 1,0, в синтетической полной среде (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202), не содержащей каких(ого)-либо метаболитов(а), необходимых(ого) для селекции экспрессионных(ой) плазмид(ы), собирали центрифугированием (2600g в течение 8 мин при 4°С), промывали буфером, вновь центрифугировали и замораживали при -80°С. Клетки оттаивали, ресуспендировали в 20 мМ трис-HCl, pH 8,0 до конечного объема 2 мл и затем разрушали шариковой взбивалкой с 1,2 г стеклянных шариков (размером 0,5 мм). Каждый образец обрабатывали при высокой скорости в течение в общей сложности 3 минут (с инкубацией на льду после каждой минуты взбивания). Экстракты осветляли от фрагментов клеток центрифугированием (20000g в течение 10 мин при 4°С).
Пример 18
Продукция изобутанола рекомбинантным Saccharomyces cerevisiae
Плазмидами pRS423::CUP1-alsS+FBA-ILV3 и pHR81::FBA- ILV5+GPM-kivD (описанными в примере 17) трансформировали Saccharomyces cerevisiae YJR148w с получением штамма YJR148w/pRS423::CUP1-alsS+FBA-ILV3/ pHR81::FBA-ILV5+GPM-kivD. Контрольный штамм получали трансформацией векторами pRS423 и pHR81 (описанными в примере 17) Saccharomyces cerevisiae YJR148w (штамм YJR148w/pRS423/pHR81). Штаммы вели на стандартной для S. cerevisiae синтетической полной среде (Methods in Yeast Genetics, 2005, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 201-202), содержащей 2% либо глюкозы, либо сахарозы, но не содержащей урацил и гистидин для обеспечения сохранения плазмид.
Для продукции изобутанола клетки переносили на синтетическую полную среду, не содержащую урацил, гистидин и лейцин. Удаление лейцина из среды было направлено на инициацию увеличения количества копий плазмиды на основе pHR81 из-за низкой транскрипции аллеля leu2-d (Erhart and Hollenberg, J. Bacteriol. 156:625-635 (1983)). Аэробные культуры выращивали в сосудах емкостью 175 мл, содержащих 50 мл среды, в инкубаторе Innova4000 (New Brunswick Scientific, Edison, NJ) при 30°С и 200 об/мин. Культуры с низким содержанием кислорода получали добавлением 45 мл среды в 60-мл сосуды для сыворотки, которые закрывали гофрированными крышками после инокуляции и хранили при 30°С. Для отбора образцов и добавления индуктора при необходимости использовали стерильные шприцы. Приблизительно через 24 час после инокуляции добавляли индуктор CuSO4 до конечной концентрации 0,03 мМ. Получали также контрольные культуры для каждого штамма без добавления CuSO4. Культуральные супернатанты анализировали через 18 или 19 час и 35 час после добавления CuSO4 на содержание изобутанола с помощью и ГХ, и ВЭЖХ, как описано выше в примере 15. Результаты для S. cerevisiae YJR148w/pRS423::CUP1-alsS+FBA-ILV3/pHR81::FBA-ILV5+GPM-kivD, выращенной на глюкозе, представлены в таблице 9. Для получения показанных в таблице 9 результатов образцы аэробных культур отбирали через 35 час, а образцы из культур с низким содержанием кислорода отбирали через 19 час и анализировали с помощью ВЭЖХ.
Результаты для S. cerevisiae YJR148w/pRS423::CUP1-alsS+FBA- ILV3/pHR81::FBA-ILV5+GPM-kivD, выращенной на сахарозе, представлены в таблице 10. Результаты данной таблицы были получены для образцов, отобранных через 18 час и анализированных с помощью ВЭЖХ.
Результаты показывают, что при выращивании на глюкозе или сахарозе и при аэробных условиях, и в условиях низкого содержания кислорода штамм YJR148w/pRS423::CUP1-alsS+FBA-ILV3/pHR81::FBA-ILV5+GPM-kivD продуцирует воспроизводимо большее количество изобутанола, чем контрольный штамм.
Пример 19
Продукция изобутанола рекомбинантным Saccharomyces cerevisiae
Плазмидами pRS425::CUP1-alsS+FBA-ILV3 и pRS426::GAL1- ILV5+GPM-kivD (описанными в примере 17) трансформировали Saccharomyces cerevisiae YJR148w с получением штамма YJR148w/pRS425::CUP1-alsS+FBA-ILV3/pRS426::GAL1-ILV5+GPM-kivD. Контрольный штамм получали трансформацией векторами pRS425 и pRS426 (описанными в примере 17) Saccharomyces cerevisiae YJR148w (штамм YJR148w/pRS425/pRS426). Штаммы поддерживали на синтетической полной среде, как описано в примере 18.
Для продукции изобутанола клетки переносили на синтетическую полную среду, содержащую 2% галактозы и 1% раффинозы и не содержащую урацил и лейцин. Аэробную культуру и культуру с низким содержанием кислорода получали, как описано в примере 18. Приблизительно через 18 час после инокуляции добавляли индуктор CuSO4 до конечной концентрации 0,5 мМ. Получали также контрольные культуры для каждого штамма без добавления CuSO4. Через 23 час после добавления CuSO4 отбирали образцы культуральных супернатантов для определения изобутанола с помощью ВЭЖХ, как описано в примере 18. Результаты представлены в таблице 11. Из-за наблюдаемой сильно варьирующей конечной оптической плотности и связанного с количественным определением остаточным источником углерода концентрация изобутанола в таблице выражена в единицах на ОП600 (вместо молярной избирательности), что позволяет сравнивать штаммы, содержащие гены пути биосинтеза изобутанола, с контрольными.
Результаты показывают, что в целом штамм YJR148w/pRS425::CUP1-alsS+FBA-ILV3/pRS426::GAL1-ILV5+GPM-kivD продуцировал большее количество изобутанола на единицу оптической плотности по сравнению с контрольным штаммом и в аэробных условиях, и в условиях низкого содержания кислорода.
Пример 20
Экспрессия пути биосинтеза изобутанола в Bacillus subtilis
Цель данного примера состояла в экспрессии пути биосинтеза изобутанола в Bacillus subtilis. Пять генов пути изобутанола (этапы пути с (a) по (e) на чертеже) были разделены на два оперона для экспрессии. Три гена budD, ilvD и kivD, кодирующие ацетолактатсинтазу, дегидратазу ацетогидроксикислоты и декарбоксилазу кетокислот с разветвленной цепью соответственно, были интегрированы в хромосому B. subtilis BE1010 (Payne and Jackson, J. Bacteriol. 173:2278-2282 (1991)). Два гена ilvC и bdhB, кодирующие изомероредуктазу ацетогидроксикислоты и бутанолдегидрогеназу соответственно, клонировали в экспрессионный вектор и трансформировали им штамм Bacillus, несущий интегрированные гены изобутанола.
Интеграция трех генов, budD, ilvD и kivD, в хромосому B. subtilis BE1010.
Для хромосомной интеграции трех генов, budB (SEQ ID NO:1), ilvD (SEQ ID NO:5) и kivD (SEQ ID NO:7), использовали векторы интеграции Bacillus pFP988DssPspac и pFP988DssPgroE. Обе плазмиды содержат репликон E. coli из pBR322, маркер антибиотика ампициллина для селекции в E. coli и два участка гомологии с геном sacB в хромосоме Bacillus, которые направляют интеграцию вектора и вставочной последовательности путем гомологичной рекомбинации. Между участками гомологии sacB находится промотор spac (PgroE) на pFP988DssPspac или промотор groEL (PgroE) на pFP988DssPgroE и маркер селекции для Bacillus, эритромицин. Промоторная область также содержит последовательность lacO для регуляции экспрессии белковым репрессором lacI. Последовательности pFP988DssPspac (6341 п.н.) и pFP988DssPgroE (6221 п.н.) представлены в виде SEQ ID NO:142 и SEQ ID NO:143 соответственно.
Кассету с тремя генами budB-ilvD-kivD конструировали путем делеции гена ilvC из плазмиды pTrc99a budB-ilvC-ilvD-kivD. Конструирование плазмиды pTrc99A::budB-ilvC-ilvD-kivD описано в примере 14. Плазмиду pTrc99A::budB-ilvC-ilvD-kivD гидролизовали AflII и NheI, обрабатывали фрагментом Кленова ДНК-полимеразы для получения тупых концов и полученный фрагмент 9,4 т.п.н., содержащий вектор pTrc99a, budB, ilvD и kivD, очищали в геле. Векторный фрагмент 9,4 т.п.н. аутолигировали с созданием pTrc99A::budB-ilvD-kivD и трансформировали ей компетентные клетки DH5α (Invitrogen). Делецию гена ilvC в клоне pTrc99A budB-ilvD-kivD подтверждали рестрикционным картированием. Полученную плазмиду pTrc99A::budB-ilvD-kivD гидролизовали SacI и обрабатывали фрагментом Кленова ДНК-полимеразы для получения тупых концов. Плазмиду затем гидролизовали BamHI и полученный фрагмент 5297 п.н. budB-ilvD-kivD очищали в геле. Фрагмент 5297 п.н. budB-ilvD-kivD лигировали в сайты SmaI и BamHI интегрирующего вектора pFP988DssPspac. Смесью лигирования трансформировали компетентные клетки DH5α. Трансформанты подвергали скринингу путем амплификации ПЦР фрагмента 5,3 т.п.н. budB-ilvD-kivD с праймерами T-budB(BamHI) (SEQ ID NO:144) и B-kivD(BamHI) (SEQ ID NO:145). Правильный клон был назван pFP988DssPspac-budB-ilvD-kivD.
Плазмиду pFP988DssPspac-budB-ilvD-kivD получали из трансформанта E. coli и трансформировали ей компетентные клетки B. subtilis BE1010, которые получали, как описано Doyle et al. (J. Bacteriol. 144:957 (1980)). Компетентные клетки собирали центрифугированием и клеточные осадки ресуспендировали в небольшом объеме супернатанта. К одному объему компетентных клеток добавляли два объема среды SPII-EGTA (Methods for General and Molecular Bacteriology, P. Gerhardt et al., Ed., American Society for Microbiology, Washington, DC (1994)). Аликвоты (0,3 мл) клеток разносили в пробирки для тестирования, после чего в пробирки добавляли от 2 до 3 мкг плазмиды pFP988DssPspac-budB-ilvD-kivD. Пробирки инкубировали в течение 30 мин при 37°С с перемешиванием, затем в каждую пробирку добавляли 0,1 мл 10% дрожжевого экстракта и пробирки инкубировали еще в течение 60 мин. Трансформанты выращивали для селекции на чашках LB, содержащих эритромицин (1,0 мкг/мл), используя способ двойного наложения агара (Methods for General and Molecular Bacteriology, выше). Трансформанты подвергали скринингу амплификацией ПЦР с праймерами N130SeqF1 (SEQ ID NO:40) и N130SeqR1 (SEQ ID NO:44) для budB, и N133SeqF1 (SEQ ID NO:62) и N133SeqR1 (SEQ ID NO:66) для kivD. В позитивных по интеграции клонах были обнаружены ожидаемые продукты ПЦР 1,7 т.п.н. budB и 1,7 т.п.н. kivD. Было идентифицировано два позитивных по интеграции клона, названных B. subtilis BE1O10 ΔsacB::Pspac-budB-ilvD-kivD #2-3-2 и B. subtilis BE1010 ΔsacB::Pspac-budB-ilvD-kivD #6-12-7.
Анализ ферментативной активности в клонах с интеграцией B. subtilis BE1010 ΔsacB::Pspac-budB-ilvD-kivD #2-3-2 и B. subtilis BE1010 ΔsacB::Pspac-budB-ilvD-kivD #6-12-7 показал, что активность BudB, IlvD и KivD была низкой под контролем промотора spac (Pspac). Для улучшения экспрессии функциональных ферментов промотор Pspac был заменен промотором PgroE из плазмиды pHT01 (MoBitec, Goettingen, Германия).
Фрагмент 6039 п.н. вектора pFP988Dss, представленный в виде SEQ ID NO:146, вырезали из неродственной плазмиды рестрикционным гидролизом XhoI и BamHI и очищали в геле. Промотор PgroE амплифицировали ПЦР из плазмиды pHT01 с праймерами T-groE(XhoI) (SEQ ID NO:147) и B-groEL(SpeI, BamH1) (SEQ ID NO:148). Продукт ПЦР гидролизовали XhoI и BamHI, лигировали с фрагментом 6039 п.н. вектора pFP988Dss и трансформировали им компетентные клетки DH5α. Трансформанты подвергали скринингу амплификацией ПЦР с праймерами T- groE(XhoI) и B-groEL(SpeI, BamHI). В позитивных клонах был обнаружен ожидаемый продукт ПЦР 174 п.н. PgroE, и они были названы pFP988DssPgroE. Плазмида pFP988DssPgroE была подтверждена секвенированием ДНК.
Плазмиду pFP988DssPspac-budB-ilvD-kivD гидролизовали SpeI и PmeI и полученный фрагмент 5313 п.н. budB-ilvD-kivD очищали в геле. Фрагмент budB-ilvD-kivD лигировали в сайты SpeI и PmeI pFP988DssPgroE и трансформировали ей компетентные клетки DH5α. Позитивные клоны скринировали на наличие продукта ПЦР 1690 п.н. путем амплификации ПЦР с праймерами T-groEL (SEQ ID NO:149) и N111 (SEQ ID NO:20). Позитивный клон был назван pFP988DssPgroE-budB-ilvD-kivD.
Плазмиду pFP988DssPgroE-budB-ilvD-kivD получали из трансформанта E. coli и трансформировали ей компетентные клетки Bacillus subtilis BE1010, как описано выше. Трансформанты подвергали скринингу амплификацией ПЦР с праймерами N130SeqF1 (SEQ ID NO:40) и N130SeqR1 (SEQ ID NO:44) для budB и N133SeqF1 (SEQ ID NO:62) и N133SeqR1 (SEQ ID NO:66) для kivD. В позитивных по интеграции клонах были обнаружены ожидаемые продукты ПЦР 1,7 т.п.н. budB и 1,7 т.п.н. kivD. Было выделено два позитивных по интеграции клона, названных B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD #1-7 и B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD #8-16.
Плазмидная экспрессия генов ilvC и bdhB.
Два остальных гена изобутанола, ilvC и bdhB, экспрессировали с плазмиды. Плазмиду pHT01 (MoBitec), челночный вектор Bacillus-E. coli, использовали для присоединения гена ilvC из B. subtilis к промотору PgroE, так что ген ilvC экспрессировался с промотора PgroE, содержащего последовательность lacO. Ген ilvC, представленный последовательностью SEQ ID NO:186, амплифицировали ПЦР с геномной ДНК B. subtilis BR151 (ATCC 33677) с праймерами T-ilvCB.s.(BamHI) (SEQ ID NO:150) и B-ilvCB.s.(SpeI BamHI) (SEQ ID NO:151). Продукт ПЦР 1067 п.н. ilvC гидролизовали BamHI и лигировали в сайт BamHI pHT01. Смесью лигирования трансформировали компетентные клетки DH5α. Позитивные клоны подвергали скринингу на наличие 1188 п.н. продукта ПЦР с помощью амплификации ПЦР с праймерами T-groEL и B-ilvB.s.(SpeI BamHI). Позитивный клон был назван pHT01-ilvC(B.s). Плазмиду pHT01-ilvC(B.s.) использовали в качестве матрицы для амплификации ПЦР объединенного фрагмента PgroE-ilvC.
Плазмида pBD64 (Minton et al., Nucleic Acids Res. 18:1651(1990)) представляет собой весьма стабильный вектор для экспрессии чужеродных генов в B. subtilis и содержит гены устойчивости к хлорамфениколу и канамицину для селекции в B. subtilis. Данную плазмиду использовали для экспрессии ilvC и bdhB под контролем промотора PgroE. Для клонирования PgroE-ilvC, bdhB и гена репрессора lacI в плазмиду pBD64 использовали одноступенчатый способ сборки (Tsuge et al., Nucleic Acids Res. 31:e133 (2003)). Фрагмент 3588 п.н. pBD64, содержащий ген repB, который включал функцию репликации, и маркер антибиотика канамицина, амплифицировали ПЦР с pBD64 с праймерами T-BD64(DraIII) (SEQ ID NO:152), который вводил последовательность DraIII (CACCGAGTG), и B-BD64(DraIII) (SEQ ID NO:153), который вводил последовательность DraIII (CACCTGGTG). Ген репрессора lacI 1327 п.н. амплифицировали ПЦР с pMUTIN4 (Vagner et al., Microbiol. 144:3097-3104 (1998)) с T-laclq(DraIII) (SEQ ID NO:154), который вводил последовательность DraIII (CACCAGGTG), и B-laclq(DraIII) (SEQ ID NO:155), который вводил последовательность DraIII (CACGGGGTG). Соединенную кассету 1224 п.н. PgroE-ilvC амплифицировали ПЦР с pHT01-ilvC(B.s) с T-groE(DraIII) (SEQ ID NO:156), который вводил последовательность DraIII (CACCCCGTG), и B-B.s.ilvC(DraIII) (SEQ ID NO:157), который вводил последовательность DraIII (CACCGTGTG). Ген bdhB 1,2 т.п.н. (SEQ ID NO:158) амплифицировали ПЦР с геномной ДНК Clostridium acetobutylicum (ATCC 824) с праймерами T-bdhB(DraIII) (SEQ ID NO:159), который вводил последовательность DraIII (CACACGGTG), и B-bdhB(rmBT1DraIII) (SEQ ID NO:160), который вводил последовательность DraIII (CACTCGGTG). Три подчеркнутые буквы в вариабельной области узнаваемых DraIII последовательностей были разработаны для специфического спаривания оснований при сборке четырех фрагментов в порядке pBD64-lacI-PgroEilvC-bdhB. Каждый продукт ПЦР с сайтами DraIII на обоих концах гидролизовали отдельно DraIII и полученные фрагменты DraIII, 3588 п.н. pBD64, lacI, PgroEilvC и bdhB очищали в геле с использованием набора QIAGEN для экстракции геля (QIAGEN). Готовили для лигирования смесь, содержащую эквимолярную концентрацию каждого фрагмента с общей концентрацией ДНК от 30 до 50 мкг/100 мкл. Раствор лигирования затем инкубировали при 16°С в течение ночи. Лигирование дало тандемный повтор ДНК с высокой молекулярной массой. Смесью лигирования с длинной линейной ДНК прямо трансформировали компетентную B. subtilis BE1010, полученную, как описано выше. B. subtilis предпочтительно использует длинные повторяющиеся линейные формы ДНК, а не кольцевую ДНК для формирования плазмиды. После трансформации культуру высевали на чашку LB, содержащую 10 мкг/мл канамицина для селекции. Позитивные рекомбинантные плазмиды подвергали скринингу гидролизом DraIII с получением четырех фрагментов ожидаемого размера 3588 п.н. (pBD64), 1327 п.н. (lacI), 1224 п.н. (PgroE-ilvC) и 1194 п.н. (bdhB). Позитивная плазмида была названа pBDPgroE-ilvC(B.s.)-bdhB.
Демонстрация продукции изобутанола из глюкозы или сахарозы B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD/pBDPgroE-ilvC(B.s.)-bdhB.
Для конструирования рекомбинантной B. subtilis, экспрессирующей пять генов пути биосинтеза изобутанола, получали, как описано выше, компетентные клетки двух штаммов с интегрированной ДНК B. subtilis BE1010 ΔsacB-PgroE-budB-ilvD-kivD #1-7 и B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD #8-16 и трансформировали их плазмидой pBDPgroE-ilvC(B.s.)-bdhB с получением B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD #1- 7/pBDPgroE-ilvC(B.s.)-bdhB и B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD #8-16/pBDPgroE-ilvC(B.s.)-bdhB.
Два рекомбинантных штамма инокулировали либо в 25 мл, либо 100 мл глюкозной среды, содержащей канамицин (10 мкг/мл) в 125-мл сосудах для моделирования условий с высоким и низким содержанием кислорода соответственно и аэробно выращивали при 37°С с перемешиванием при 200 об/мин. Среда состояла из 10 мМ (NH4)2SO4, 5 мМ калий-фосфатного буфера (pH 7,0), 100 мМ MOPS/KOH буфера (pH 7,0), 20 мМ глутаминовая кислота/KOH (pH 7,0), 2% смеси металлов S10, 1% глюкозы, 0,01% дрожжевого экстракта, 0,01% казаминовых кислот и 50 мкг/мл каждого из L-триптофана, L-метионина и L-лизина. Смесь металлов S10 состояла из 200 мМ MgCl2, 70 мМ CaCl2, 5 мМ MnCl2, 0,1 мМ FeCl3, 0,1 мМ ZnCl2, 0,2 мМ тиамингидрохлорида, 0,172 мМ CuSO4, 0,253 мМ CoCl2 и 0,242 мМ Na2MoO4. Клетки индуцировали 1,0 мМ изопропил-β-D-тиогалактопиранозидом (IPTG) в раннюю лог-фазу (ОП600 приблизительно 0,2). Через 24 час после инокуляции аликвоту бульона анализировали ВЭЖХ (колонка Shodex Sugar SH1011) с детекцией коэффициента преломления (RI) для определения содержания изобутанола, как описано в разделе «Общие способы». Результаты ВЭЖХ показаны в таблице 12.
B. subtilis b представляет собой B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD #8-16/ pBDPgroE-ilvC(B.s.)-bdhB
Изолят B. subtilis BE1010 ΔsacB::PgroE-budB-ilvD-kivD #1-7/ pBDPgroE-ilvC(B.s.)-bdhB также проверяли на продукцию изобутанола из сахарозы, по существу как описано выше. Рекомбинантный штамм инокулировали либо в 25 мл, либо 75 мл сахарозной среды, содержащей канамицин (10 мкг/мл) в 125 мл сосудах для моделирования условий с высоким и низким содержанием кислорода и выращивали при 37°С с перемешиванием при 200 об/мин. Сахарозная среда была идентична глюкозной среде за исключением того, что глюкоза (10 г/л) была заменена 10 г/л сахарозы. Клетки либо не индуцировали, либо индуцировали 1,0 мМ изопропил-β-D-тиогалактопиранозидом (IPTG) в раннюю лог-фазу (ОП600 приблизительно 0,2). Через 24 час после инокуляции аликвоту бульона анализировали ВЭЖХ (колонка Shodex Sugar SH1011) с детекцией коэффициента преломления (RI) для определения содержания изобутанола, как описано в разделе Общие способы. Результаты ВЭЖХ показаны в таблице 13.
Пример 21 (предсказательный)
Экспрессия пути биосинтеза изобутанола в Lactobacillus plantarum
Цель данного предсказательного примера заключается в описании того, как экспрессировать путь биосинтеза изобутанола в Lactobacillus plantarum. Пять генов пути изобутанола, кодирующие пять ферментативных активностей, разделяют на два оперона для экспрессии. Гены budВ, ilvD и kivD, кодирующие ферменты ацетолактатсинтазу, дегидратазу ацетогидроксикислоты и декарбоксилазу α-кетокислот с разветвленной цепью соответственно, интегрируют в хромосому Lactobacillus plantarum гомологичной рекомбинацией с помощью способа, описанного Hols et al. (Appl. Environ. Microbiol. 60:1401-1413 (1994)). Два остальных гена (ilvC и bdhB, кодирующие ферменты редуктоизомеразу ацетогидроксикислоты и бутанолдегидрогеназу соответственно) клонируют в экспрессионную плазмиду и трансформируют ей штамм Lactobacillus, несущий интегрированные гены изобутанола. Lactobacillus plantarum выращивают на среде MRS (Difco Laboratories, Detroit, Ml) при 37°С и хромосомную ДНК выделяют как описано Moreira et al. (BMC Microbiol. 5:15 (2005)).
Интеграция.
Кассету budB-ilvD-kivD под контролем синтетического промотора P11 (Rud et al., Microbiology 152:1011-1019 (2006)) интегрируют в хромосому Lactobacillus plantarum ATCC BAA-793 (NCIMB 8826) в локус IdhL1 гомологичной рекомбинацией. Для создания направляющего вектора интеграции IdhL фрагмент ДНК из Lactobacillus plantarum (Genbank NC_004567) с гомологией IdhL амплифицируют ПЦР с праймерами LDH EcoRV F (SEQ ID NO:161) и LDH AatIIR (SEQ ID NO:162). Фрагмент ПЦР 1986 п.н. клонируют в pCR4Blunt-TOPO и секвенируют. Клон pCR4Blunt-TOPO-IdhL1 гидролизуют EcoRV и AatII с выделением фрагмента 1982 п.н. IdhL1, который очищают в геле. Вектор интеграции pFP988, представленный в виде SEQ ID NO:177, гидролизуют HindIII и обрабатывают ДНК-полимеразой Кленова для получения тупых концов. Линеаризованную плазмиду затем гидролизуют AatII и фрагмент вектора 2931 п.н. очищают в геле. Фрагмент EcoRV/AatII IdhL1 лигируют с фрагментом вектора pFP988 и трансформируют этим клетки E. coli Top10. Трансформанты подвергают селекции на чашках агара LB, содержащих ампициллин (100 мкг/мл), и скринингу ПЦР колоний для подтверждения конструкции pFP988-IdhL.
Для добавления маркера селекции к интегрируемой ДНК амплифицируют ПЦР ген Cm со своим промотором из pC194-(GenBank NC_002013, SEQ ID NO:267) с праймерами Cm F (SEQ ID NO:163) и Cm R (SEQ ID NO:164), что дает амплифицированный ПЦР продукт 836 п.н. Данный продукт ПЦР клонируют в pCR4Blunt-TOPO и трансформируют ей клетки E. coli Top10 с созданием pCR4Blunt-TOPO-Cm. После секвенирования для подтверждения того, что ПЦР не внесла ошибок, кассету Cm гидролизуют из pCR4Blunt-TOPO-Cm в виде фрагмента 828 п.н. MluI/SwaI и очищают в геле. Вектор интеграции pFP988-IdhL, содержащий гомологию IdhL, гидролизуют MluI и SwaI и фрагмент вектора 4740 п.н. очищают в геле. Фрагмент кассеты Cm лигируют с вектором pFP988-IdhL с созданием pFP988-DldhL::Cm.
Наконец, кассету budB-ilvD-kivD из pFP988DssPspac-budB- ilvD-kivD, описанной в примере 20, модифицируют заменой амилазного промотора синтетическим промотором P11. Затем целый оперон перемещают в pFP988-DldhL::Cm. Промотор P11 строят отжигом олигонуклеотида с праймером P11 F-StuI (SEQ ID NO:165) и P11 R-SpeI (SEQ ID NO:166). Отожженный олигонуклеотид очищают в 6% геле Ultra PAGE (Embi Tec, San Diego, CA). Плазмиду pFP988DssPspac-budB-ilvD-kivD, содержащую амилазный промотор, гидролизуют StuI и SpeI и полученный фрагмент вектора 10,9 т.п.н. очищают в геле. Выделенный фрагмент P11 лигируют с гидролизованной pFP988DssPspac-budB-ilvD-kivD с созданием pFP988-P11-budB-ilvD-kivD. Плазмиду pFP988-P11-budB-ilvD-kivD затем гидролизуют StuI и BamHI и полученный фрагмент вектора 5,4 т.п.н. P11-budB-ilvD-kivD очищают в геле. pFP988-DldhL::Cm гидролизуют HpaI и BamHI, и фрагмент вектора 5,5 т.п.н. выделяют. Оперон budB-ilvD-kivD лигируют с вектором интеграции pFP988-DldhL::Cm с созданием pFP988-DldhL-P11-budB-ilvD-kivD::Cm.
Интеграция pFP988-DldhL-P11-budB-ilvD-kivD::Cm в L. plantarum BAA-793 с образованием L. plantarum ΔIdhL1::budB-ilvD-kivD::Cm, включающей экзогенные гены budB, ilvD и kivD.
Электрокомпетентные клетки L. plantarum получают, как описано Aukrust, T.W., et al. (In: Electroporation Protocols for Microorganisms; Nickoloff, J.A., Ed.; Methods in Molecular Biology, Vol. 47; Humana Press, Inc., Totowa, NJ, 1995, pp 201-208). После электропорации клетки наращивают в среде MRSSM (среда MRS с добавлением 0,5М сахарозы и 0,1М MgCl2), как описано Aukrust et al., выше, в течение 2 час при 37°С без перемешивания. Электропорированные клетки высевают для селекции на чашки MRS, содержащие хлорамфеникол (10 мкг/мл) и инкубируют при 37°С. Трансформанты сначала подвергают скринингу амплификацией ПЦР колоний для подтверждения интеграции и исходно позитивные клоны подвергают затем более тщательному скринингу амплификацией ПЦР с набором праймеров.
Плазмидная экспрессия генов ilvC и bdhB.
Остальные два гена изобутанола экспрессируют с плазмиды pTRKH3 (O'Sullivan DJ and Klaenhammer TR, Gene 137:227-231 (1993)) под контролем промотора IdhL L. plantarum (Ferain et al., J. Bacteriol. 176:596-601 (1994)). Промотор IdhL амплифицируют ПЦР с генома L. plantarum ATCC BAA-793 с использованием праймеров PIdhL F-HindIII (SEQ ID NO:167) и PIdhL R-BamHI (SEQ ID NO:168). Продукт ПЦР 411 п.н. клонируют в pCR4Blunt-TOPO и секвенируют. Полученную плазмиду pCR4Blunt-TOPO-PIdhL гидролизуют HindIII и BamHI с выделением фрагмента PIdhL.
Плазмиду pTRKH3 гидролизуют HindIII и SphI и очищенный в геле фрагмент вектора лигируют с фрагментом PIdhL и очищенным в геле фрагментом 2,4 т.п.н. BamHI/SphI, содержащим ilvC(B.s.)-bdhB из экспрессионной плазмиды Bacillus pBDPgroE-ilvC(B.s.)-bdhB (пример 20) трехсторонним лигированием. Смесью лигирования трансформируют клетки E. coli Top 10 и трансформанты выращивают на чашках Brain Heart Infusion (BHI, Difco Laboratories, Detroit, MI), содержащих эритромицин (150 мг/л). Трансформанты подвергают скринингу ПЦР для подтверждения конструкции. Полученной экспрессионной плазмидой pTRKH3-ilvC(B.s.)-bdhB трансформируют L. plantarum ΔIdhL1::budB-ilvD-kivD::Cm электропорацией, как описано выше.
L. plantarum ΔIdhL1::budB-ilvD-kivD::Cm, содержащую pTRKH3-ilvC(B.s.)-bdhB, инокулируют в 250 мл перемешиваемый сосуд, содержащий 50 мл среды MRS плюс эритромицин (10 мкг/мл), и выращивают при 37°С в течение от 18 до 24 час без перемешивания, после чего определяют изобутанол с помощью анализа ВЭЖХ или ГХ, как описано в разделе «Общие способы».
Пример 22 (предсказательный)
Экспрессия пути биосинтеза изобутанола в Enterococcus faecalis
Цель данного предсказательного примера заключается в описании того, как экспрессировать путь биосинтеза изобутанола в Enterococcus faecalis. Полная геномная последовательность штамма V583 Enterococcus faecalis, который используют в качестве штамма-хозяина для экспрессии пути биосинтеза изобутанола в данном примере, была опубликована (Paulsen et al., Science 299:2071-2074 (2003)). Челночный векто E. coli-грамположительные бактерии, плазмиду pTRKH3 (O'Sullivan DJ and Klaenhammer TR, Gene 137:227-231 (1993)) используют для экспрессии пяти генов (budB, ilvC, ilvD, kivD, bdhB) пути изобутанола в одном опероне. pTRKH3 содержит E. coli плазмидный p15A ориджин репликации, репликон pAMβ1 и два маркера селекции по устойчивости к антибиотикам тетрациклину и эритромицину. Устойчивость к тетрациклину экспрессируется только в E. coli, а устойчивость к эритромицину экспрессируется и в E. coli, и в грамположительных бактериях. Производные плазмиды pAMβ1 способны реплицироваться в E. faecalis (Poyart et al., FEMS Microbiol. Lett. 156:193-198 (1997)). Индуцируемый промотор nisA (PnisA), который ранее использовался для эффективного контроля экспрессии генов нисином во многих грамположительных бактериях, включая Enterococcus faecalis (Eichenbaum et al., Appl. Environ. Microbiol. 64:2763-2769 (1998)), применяют для контроля экспрессии пяти желаемых генов, кодирующих ферменты пути биосинтеза изобутанола.
Плазмиду pTrc99A::budB-ilvC-ilvD-kivD (описанную в примере 14), которая содержит оперон пути изобутанола, модифицируют заменой гена ilvC E. coli (SEQ ID NO:3) геном ilvC B. subtilis (SEQ ID NO:??). Кроме того, к концу оперона добавляют ген bdhB (SEQ ID NO:158) из Clostridium acetobutylicum. Сначала ген bdhB из pBDPgroE-ilvC(B.s.)-bdhB (описанной в примере 20) амплифицируют с помощью праймеров F-bdhB-AvrII (SEQ ID NO:169) и R-bdhB-BamHI (SEQ ID NO:170) и затем клонируют TOPO и секвенируют. Выделяют фрагмент 1194 п.н. bdhB гидролизом AvrII и BamHI и затем очищают в геле. Этот фрагмент bdhB лигируют с pTrc99A::budB-ilvC-ilvD-kivD, которую предварительно гидролизовали AvrII и BamHI, и полученный фрагмент очищают в геле. Смесью лигирования трансформируют клетки E. coli Top10 путем электропорации и трансформанты подвергают селекции выращиванием в течение ночи при 37°С на чашках агара LB, содержащих ампициллин (100 мкг/мл). Трансформанты затем подвергают скринингу ПЦР колоний для подтверждения правильного клона, содержащего pTrc99A::budB-ilvC-ilvD-kivD-bdhB.
Затем ilvC(B.s.) амплифицируют с pBDPgroE-ilvC(B.s.)-bdhB (описанной в примере 20) с использованием праймеров F-ilvC(B.s.)-AflII (SEQ ID NO:171) и R-ilvC(B.s.)-NotI (SEQ ID NO:172). Продукт ПЦР клонируют TOPO и секвенируют. Фрагмент 1051 п.н. ilvC(B.s.) выделяют гидролизом AflII и NotI и затем очищают в геле. Данный фрагмент лигируют с pTrc99A::budB-ilvC-ilvD-kivD-bdhB, которую предварительно разрезали AflII и NotI с выделением ilvC E. coli (полосу вектора 10,7 т.п.н. очищают перед лигированием с ilvC(B.s.)). Смесью лигирования трансформируют клетки E. coli Top10 электропорацией, и трансформанты подвергают селекции выращиванием в течение ночи при 37°С на чашках агара LB, содержащих ампициллин (100 мкг/мл). Трансформанты затем подвергают скринингу ПЦР колоний для подтверждения правильного клона, содержащего pTrc99A::budB-ilvC(B.s.)-ilvD-kivD-bdhB.
Для получения промотора для челночного вектора DTRKH3 E. coli/ грамположительные бактерии промотор nisA (Chandrapati et al., Mol. Microbiol. 46(2):467-477 (2002)) амплифицируют ПЦР с геномной ДНК Lactococcus lactis с праймерами F-PnisA(HindIII) (SEQ ID NO:173) и R-PnisA(SpeI BamHI) SEQ ID NO:174) и затем клонируют TOPO. После секвенирования выделяют фрагмент 213 п.н. промотора nisA гидролизом HindIII и BamHI с последующее очисткой в геле. Плазмиду pTRKH3 гидролизуют HindIII и BamHI и фрагмент вектора очищают в геле. Линеаризованную pTRKH3 лигируют с фрагментом PnisA и трансформируют этим клетки E. coli Top10 электропорацией. Трансформанты подвергают селекции выращиванием в течение ночи при 37°С на чашках агара LB, содержащих эритромицин (25 мкг/мл). Трансформанты затем подвергают скринингу ПЦР колоний для подтверждения правильного клона pTRKH3-PnisA.
Плазмиду pTRKH3-PnisA гидролизуют SpeI и BamHI и вектор очищают в геле. Плазмиду pTrc99A::budB-ilvC(B.s)-ilvD-kivD-bdhB, описанную выше, гидролизуют SpeI и BamHI и фрагмент 7,5 т.п.н. очищают в геле. Фрагмент 7,5 т.п.н. budB-ilvC(B.s)-ilvD-kivD-bdhB лигируют в вектор pTRKH3-PnisA по сайтам SpeI и BamHI. Смесью лигирования трансформируют клетки E. coli Top10 электропорацией и трансформанты подвергают селекции выращиванием в течение ночи на чашках агара LB, содержащих эритромицин (25 мкг/мл) при 37°С. Трансформанты затем подвергают скринингу ПЦР колоний. Полученная плазмида названа pTRKH3-PnisA-budB-ilvC(B.s)-ilvD-kivD-bdhB. Данную плазмиду получают из трансформантов E. coli и трансформируют ей электрокомпетентные клетки E. faecalis V583 электропорацией с помощью способов, известных в данной области техники (Aukrust, T.W., et al. In: Electroporation Protocols for Microorganisms; Nickoloff, J.A., Ed.; Methods in Molecular Biology, Vol. 47; Humana Press, Inc., Totowa, NJ., 1995, pp 217-226), что дает E. faecalis V583/ pTRKH3-PnisA-budB-ilvC(B.s)-ilvD-kivD-bdhB.
Второй плазмидой, содержащей регуляторные гены nisA, nisR и nisK, ген add9 резистентности к спектиномицину и ориджин репликации pSH71, трансформируют E. faecalis V583/ pTRKH3-PnisA-budB-ilvC(B.s)-ilvD-kivD-bdhB электропорацией. Плазмида, содержащая ориджин репликации pSH71, совместима с производными pAMβ1 в E. faecalis (Eichenbaum et al., выше). Трансформанты, резистентные к двум лекарствам, отбирают на чашках агара LB, содержащих эритромицин (25 мкг/мл) и спектиномицин (100 мкг/мл), выращиваемых при 37°С.
Полученный штамм V583B E. faecalis, несущий две плазмиды, т.е. экспрессионную плазмиду (pTRKH3-PnisA-budB-ilvC(B.s)-ilvD-kivD-bdhB) и регуляторную плазмиду (pSH71-nisRK), инокулируют в 250-мл встряхиваемый сосуд, содержащий 50 мл бульона Тодда-Хьювитта с добавлением дрожжевого экстракта (0,2%), (Fischetti et al., J. Exp. Med. 161:1384-1401 (1985)), нисина (20 мкг/мл) (Eichenbaum et al., выше), эритромицина (25 мкг/мл) и спектиномицина (100 мкг/мл). Сосуд инкубируют без перемешивания при 37°С в течение 18-24 час, после чего измеряют продукцию изобутанола анализом ВЭЖХ или ГХ, как описано в разделе «Общие способы».
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕРМЕНТАТИВНОЕ ПОЛУЧЕНИЕ 1-БУТАНОЛА | 2006 |
|
RU2429295C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИАЛУРОНАНА В РЕКОМБИНАНТНОЙ КЛЕТКЕ-ХОЗЯИНЕ | 2002 |
|
RU2346049C2 |
| ТАНДЕМНЫЙ ПРОМОТОР, ФУНКЦИОНИРУЮЩИЙ В БАКТЕРИИ РОДА Bacillus, ТРАНСФОРМИРОВАННАЯ БАКТЕРИЯ РОДА Bacillus - ПРОДУЦЕНТ ЦЕЛЕВОГО ПРОДУКТА, СОДЕРЖАЩАЯ УКАЗАННЫЙ ПРОМОТОР, И СПОСОБ ПОЛУЧЕНИЯ ЦЕЛЕВОГО ПРОДУКТА С ИСПОЛЬЗОВАНИЕМ УКАЗАННОЙ БАКТЕРИИ | 2019 |
|
RU2723722C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИГИДРОКСИБУТИРАТА | 2013 |
|
RU2645260C2 |
| НОВЫЙ ПРОМОТОР И СПОСОБ ПОЛУЧЕНИЯ ЖЕЛАЕМОГО ВЕЩЕСТВА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2020 |
|
RU2794946C1 |
| МАЛАЯ СУБЪЕДИНИЦА ИЗОЗИМА III И ИЗОЗИМ III СИНТЕТАЗЫ АЦЕТОГИДРОКСИКИСЛОТ ИЗ ESCHERICHIA COLI, ФРАГМЕНТ ДНК (ВАРИАНТЫ), ШТАММ БАКТЕРИИ ESCHERICHIA COLI - ПРОДУЦЕНТ L-ВАЛИНА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ L-ВАЛИНА | 2000 |
|
RU2209246C2 |
| БАКТЕРИЯ РОДА BACILLUS, ПРОДУЦИРУЮЩАЯ ГИАЛУРОНОВУЮ КИСЛОТУ, И СПОСОБ ПОЛУЧЕНИЯ ГИАЛУРОНОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОЙ БАКТЕРИИ | 2019 |
|
RU2719140C1 |
| БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ ESCHERICHIA - ПРОДУЦЕНТ L-ТРЕОНИНА И СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА | 2004 |
|
RU2288264C2 |
| МУТАНТЫ СИНТЕТАЗЫ АЦЕТООКСИКИСЛОТ, УСТОЙЧИВЫЕ К ОБРАТНОЙ СВЯЗИ | 2004 |
|
RU2325439C2 |
| РЕКОМБИНАНТНАЯ ДНК И СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА | 2009 |
|
RU2451748C1 |























































































































































































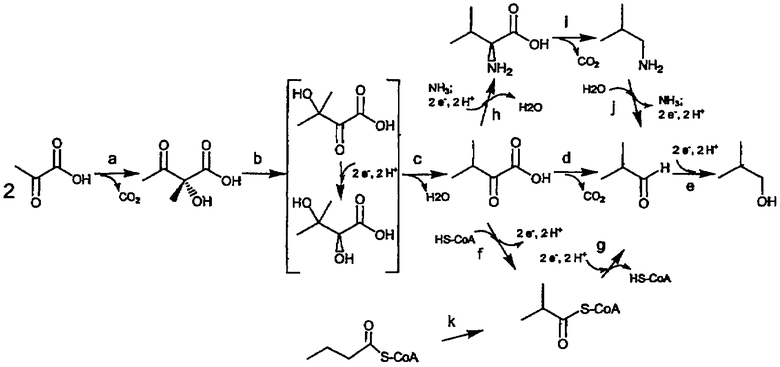
Изобретение относится к биотехнологии и представляет собой способ получения изобутанола, включающий получение рекомбинантной микробной клетки-хозяина, содержащей ферментативный путь изобутанола, включающий молекулы ДНК, кодирующие набор полипептидов, которые катализируют следующие превращения субстрата в продукт: i) пирувата в ацетолактат; ii) ацетолактата в 2,3-дигидроксиизовалерат; iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат; iv) α-кетоизовалерата в изобутиральдегид; и v) изобутиральдегида в изобутанол, и контактирование клетки-хозяина с ферментируемым углеродным субстратом в среде ферментации в условиях, при которых продуцируется изобутанол. Изобретение позволяет получать изобутанол с высокой степенью эффективности. 3 н. и 51 з.п. ф-лы, 1 ил., 13 табл.
1. Рекомбинантная микробная клетка-хозяин, содержащая ферментативный путь изобутанола, включающий молекулы ДНК, кодирующие набор полипептидов, которые катализируют следующие превращения субстрата в продукт:
i) пирувата в ацетолактат;
ii) ацетолактата в 2,3-дигидроксиизовалерат;
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат;
iv) α-кетоизовалерата в изобутиральдегид; и
v) изобутиральдегида в изобутанол,
где по меньшей мере одна из молекул ДНК гетерологична указанной микробной клетке-хозяину, и где указанная микробная клетка-хозяин продуцирует изобутанол.
2. Клетка-хозяин по п.1, где полипептид, который катализирует превращение субстрата в продукт, пирувата в ацетолактат, представляет собой ацетолактатсинтазу.
3. Клетка-хозяин по п.1, где полипептид, который катализирует превращение субстрата в продукт, ацетолактата в 2,3-дигидроксиизовалерат, представляет собой изомероредуктазу ацетогидроксикислоты.
4. Клетка-хозяин по п.1, где полипептид, который катализирует превращение субстрата в продукт, 2,3-дигидроксиизовалерата в α-кетоизовалерат, представляет собой дегидратазу ацетогидроксикислоты.
5. Клетка-хозяин по п.1, где полипептид, который катализирует превращение субстрата в продукт, изобутиральдегида в изобутанол, представляет собой дегидрогеназу спиртов с разветвленной цепью.
6. Клетка-хозяин по п.1, где полипептид, который катализирует превращение субстрата в продукт, α-кетоизовалерата в изобутиральдегид, представляет собой декарбоксилазу α-кетокислот с разветвленной цепью.
7. Клетка-хозяин по п.1, где клетка выбрана из группы, состоящей из бактерии, цианобактерии, нитчатого гриба и дрожжей.
8. Клетка-хозяин по п.7, где клетка является членом рода, выбранного из группы, состоящей из Clostridium, Zymomonas, Escherichia, Salmonella, Rhodococcus, Pseudomonas, Bacillus, Lactobacillus, Enterococcus, Alcaligenes, Klebsiella, Paenibacillus, Arthrobacter, Corynebacterium, Brevibacterium, Pichia, Candida, Hansenula и Saccharomyces.
9. Клетка-хозяин по п.8, где клетка представляет собой Escherichia coli.
10. Клетка-хозяин по п.8, где клетка представляет собой Alcaligenes eutrophus.
11. Клетка-хозяин по п.8, где клетка представляет собой Bacillus licheniformis.
12. Клетка-хозяин по п.8, где клетка представляет собой Paenibacillus macerans.
13. Клетка-хозяин по п.8, где клетка представляет собой Rhodococcus erythropolis.
14. Клетка-хозяин по п.8, где клетка представляет собой Pseudomonas putida.
15. Клетка-хозяин по п.8, где клетка представляет собой Bacillus subtilis.
16. Клетка-хозяин по п.8, где клетка представляет собой Lactobacillus plantarum.
17. Клетка-хозяин по п.8, где клетка выбрана из группы, состоящей из Enterococcus faecium, Enterococcus gallinarium и Enterococcus faecalis.
18. Клетка-хозяин по п.8, где клетка представляет собой Saccharomyces cerevisiae.
19. Клетка-хозяин по п.2, где ацетолактатсинтаза имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2, SEQ ID NO:178 и SEQ ID NO:180.
20. Клетка-хозяин по п.3, где изомероредуктаза ацетогидроксикислоты имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:43, SEQ ID NO:181, SEQ ID NO:183 и SEQ ID NO:185.
21. Клетка-хозяин по п.4, где дегидратаза ацетогидроксикислоты имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:6, SEQ ID NO:186, SEQ ID NO:188 и SEQ ID NO:190.
22. Клетка-хозяин по п.5, где дегидрогеназа спиртов с разветвленной цепью имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:199, SEQ ID NO:201, SEQ ID NO:203 и SEQ ID NO:204.
23. Клетка-хозяин по п.6, где декарбоксилаза α-кетокислот с разветвленной цепью имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:8, SEQ ID NO:193, SEQ ID NO:195 и SEQ ID NO:197.
24. Клетка-хозяин по п.1, где клетка-хозяин представляет собой факультативный анаэроб.
25. Способ получения изобутанола, включающий
1) получение рекомбинантной микробной клетки-хозяина, содержащей ферментативный путь изобутанола, включающий молекулы ДНК, кодирующие набор полипептидов, которые катализируют следующие превращения субстрата в продукт:
i) пирувата в ацетолактат;
ii) ацетолактата в 2,3-дигидроксиизовалерат;
iii) 2,3-дигидроксиизовалерата в α-кетоизовалерат;
iv) α-кетоизовалерата в изобутиральдегид; и
v) изобутиральдегида в изобутанол,
где по меньшей мере одна из молекул ДНК гетерологична указанной микробной клетке-хозяину; и
2) контактирование клетки-хозяина (1) с ферментируемым углеродным субстратом в среде ферментации в условиях, при которых продуцируется изобутанол.
26. Способ по п.25, где ферментируемый углеродный субстрат выбран из группы, состоящей из моносахаридов, олигосахаридов и полисахаридов.
27. Способ по п.25, где углеродный субстрат выбран из группы, состоящей из глюкозы, сахарозы и фруктозы.
28. Способ по п.25, где условия, при которых продуцируется изобутанол, являются анаэробными.
29. Способ по п.25, где условия, при которых продуцируется изобутанол, являются микроаэробными.
30. Способ по п.25, где клетка-хозяин контактирует с углеродным субстратом в минимальной среде.
31. Способ по п.25, где полипептид, который катализирует превращение субстрата в продукт, пирувата в ацетолактат, представляет собой ацетолактатсинтазу.
32. Способ по п.25, где полипептид, который катализирует превращение субстрата в продукт, ацетолактата в 2,3-дигидроксиизовалерат, представляет собой изомероредуктазу ацетогидроксикислоты.
33. Способ по п.25, где полипептид, который катализирует превращение субстрата в продукт, 2,3-дигидроксиизовалерата в α-кетоизовалерат, представляет собой дегидратазу ацетогидроксикислоты.
34. Способ по п.25, где полипептид, который катализирует превращение субстрата в продукт, изобутиральдегида в изобутанол, представляет собой дегидрогеназу спиртов с разветвленной цепью.
35. Способ по п.25, где полипептид, который катализирует превращение субстрата в продукт, α-кетоизовалерата в изобутиральдегид, представляет собой декарбоксилазу α-кетокислот с разветвленной цепью.
36. Способ по п.25, где клетка-хозяин выбрана из группы, состоящей из бактерии, цианобактерии, нитчатого гриба и дрожжей.
37. Способ по п.36, где клетка-хозяин является членом рода, выбранного из группы, состоящей из Clostridium, Zymomonas, Escherichia, Salmonella, Rhodococcus, Pseudomonas, Bacillus, Lactobacillus, Enterococcus, Alcaligenes, Klebsiella, Paenibacillus, Arthrobacter, Corynebacterium, Brevibacterium, Pichia, Candida, Hansenula и Saccharomyces.
38. Способ по п.37, где клетка-хозяин представляет собой Escherichia coli.
39. Способ по п.37, где клетка-хозяин представляет собой Alcaligenes eutrophus.
40. Способ по п.37, где клетка-хозяин представляет собой Bacillus licheniformis.
41. Способ по п.37, где клетка-хозяин представляет собой Paenibacillus macerans.
42. Способ по п.37, где клетка-хозяин представляет собой Rhodococcus erythropolis.
43. Способ по п.37, где клетка-хозяин представляет собой Pseudomonas putida.
44. Способ по п.37, где клетка-хозяин представляет собой Bacillus subtilis.
45. Способ по п.37, где клетка-хозяин представляет собой Lactobacillus plantarum.
46. Способ по п.37, где клетка-хозяин выбрана из группы, состоящей из Enterococcus faecium, Enterococcus gallinarium и Enterococcus faecalis.
47. Способ по п.37, где клетка-хозяин представляет собой Saccharomyces cerevisiae.
48. Способ по п.31, где ацетолактатсинтаза имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2, SEQ ID NO:178 и SEQ ID NO:180.
49. Способ по п.32, где изомероредуктаза ацетогидроксикислоты имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:43, SEQ ID NO:181, SEQ ID NO:183 и SEQ ID NO:185.
50. Способ по п.33, где дегидратаза ацетогидроксикислоты имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:6, SEQ ID NO:186, SEQ ID NO:188 и SEQ ID NO:190.
51. Способ по п.34, где дегидрогеназа спиртов с разветвленной цепью имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:10, SEQ ID NO:199, SEQ ID NO:201, SEQ ID NO:203 и SEQ ID NO:204.
52. Способ по п.35, где декарбоксилаза α-кетокислот с разветвленной цепью имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:8, SEQ ID NO:193, SEQ ID NO:195 и SEQ ID NO:197.
53. Способ по п.25, где клетка-хозяин представляет собой факультативный анаэроб.
54. Содержащая изобутанол среда ферментации, полученная способом по п.25.
| YOSHIMOTO H | |||
| et al | |||
| Genetic and physiological analysis of branched-chain alcohols and isoamyl acetate production in Saccharomyces cerevisiae | |||
| Appl Microbiol Biotechnol | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| DICKINSON J.R | |||
| An investigation of the metabolism of valine to isobutyl alcohol in Saccharomyces cerevisiae | |||
| J Biol Chem | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Станок для установки перфораторов | 1936 |
|
SU50624A1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ Escherichia coli - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2215782C2 |
Авторы
Даты
2010-07-20—Публикация
2006-10-25—Подача