Область применения
Настоящее изобретение касается лекарственных средств, содержащих диарилсульфид или диариловый эфир, имеющий структуру 2-амино-1,3-пропандиола, способных в комбинации с иммунодепрессантами восстанавливать лимфоциты периферического кровообращения, а точнее, касается лекарственного средства для предотвращения реакции отторжения органа или клетки при трансплантации и способа предотвращения реакции отторжения, создающих эффективное выражение иммунодепрессивной активности и снижающих выраженность побочных эффектов.
Предпосылки настоящего изобретения
Разработка способа подавления иммунного отклика очень важна для предотвращения реакции отторжения органа или клетки при трансплантации, а также для лечения и предотвращения различных аутоиммунных заболеваний. Соединения, которые обычно используют для подавления иммунного отклика, действуют по одному из следующих механизмов: (1) «атака» на специфическую иммунную клетку для ее удаления из иммунной системы или (2) подавление способности иммунной клетки реагировать на цитокины, тем самым снижая количество клеток, вовлеченных в иммунный отклик. Поскольку количество отвечающих клеток уменьшается, иммунная система становится неспособной дать нормальную ответную реакцию, и за счет этого происходит подавление иммунного отклика.
Более конкретно, группа соединений, действующих по первому механизму, должна подавлять синтез нуклеотидов в иммунных клетках, прекращать метаболизм и устранять иммунную активность этих клеток. В эту группу соединений входят азатиоприн (непатентный документ 1), мизорибин (непатентный документ 2), микофенольная кислота (далее обозначается аббревиатурой МРА; непатентный документ 3), бреквинар натрия (непатентный документ 4), лефлуномид и метотрексат. Однако эти соединения ставят проблему, состоящую в том, что они, вероятно, будут вызывать побочные токсические эффекты.
В группу соединений, действующих по второму механизму, входят:
циклоспорин А (далее обозначается аббревиатурой CsA), такролимус (далее обозначается аббревиатурой FK506), и рапамицин (непатентный документ 5) и ему подобные. Указанные соединения должны подавлять синтез цитокина (типа IL-2), которое необходимо для того, чтобы сделать невозможным индуцирование пролиферации и дифференциации более сильных клеток и подавить иммунный отклик. С другой стороны, рапамицин блокирует действие сигнала цитокина на иммунную клетку.
Для снижения побочных эффектов, связанных с отдельными иммунодепрессантами, широко использовали методы лечения, в которых применяли или CsA (или FK506) вместе с другими иммунодепрессантами (типа азатиоприна или мизорибина или стероидов; непатентный документ 6; непатентный документ 7), или методы с применением стероидов. Однако эти методы не всегда демонстрировали достаточное иммунодепрессивное действие, не создавая при этом побочных токсических эффектов.
Что касается производных аминопропандиола, обладающих иммунодепрессивной активностью, то известно совместное действие FTY720 и ингибитора кальциневрина (патентный документ 1). Однако для увеличения выраженности действия, а также для того, чтобы снизить побочные эффекты, важно разработать новые лекарственные средства.
Непатентный документ 1 - Nature, 183:1682 (1959)
Непатентный документ 2 - J. Clin. Invest., 87:940 (1991)
Непатентный документ 3 - Pharm. Res., 7:161 (1990)
Непатентный документ 4 - Transplantation, 53:303 (1992)
Непатентный документ 5 - N. Eng. Med., 321: 1725 (1989); Transpant. Proc., 23: 2977 (1991)
Непатентный документ 6 - Transplant. Proc., 17: 1222 (1985)
Непатентный документ 7 - Clin. Transplant., 4:191 (1990)
Патентный документ 1 - открытая выложенная публикация японского патента № Hei 11-80026
Раскрытие настоящего изобретения
Задачи, которые должно решить настоящее изобретение
Целью настоящего изобретения является разработка лекарственного средства для предотвращения реакции отторжения органа или клетки при трансплантации и способа предотвращения реакции отторжения, позволяющих обеспечить высокую фармакологическую активность при снижении токсичных побочных эффектов.
Способы решения этой задачи
Заявители настоящего изобретения обнаружили, что использование 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола или его фармацевтически приемлемой соли или гидрата, обладающих способностью восстанавливать лимфоциты периферического кровообращения, вместе с другими иммунодепрессантами допускает эффективное выявление иммунодепрессивной активности указанного комбинированного средства; а также то, что благодаря уменьшению количества, достаточного для выраженности действия указанного комбинированного средства, побочные эффекты могут быть снижены.
Цель достигнута тем, что согласно изобретению заявляется лекарственное средство для предотвращения реакции отторжения органа или клетки при трансплантации, содержащее 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина или микофенольной кислотой.
Указанное лекарственное средство может содержать 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой.
Указанное лекарственное средство также может содержать 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола гидрохлорид в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой.
Предпочтительно указанное лекарственное средство содержит 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина, который представляет собой циклоспорин А или такролимус.
Изобретением также является способ предотвращения реакции отторжения органа или клетки при трансплантации, включающий введение пациенту 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина или микофенольной кислотой. Пациенту могут вводить 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой или 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола гидрохлорид в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой.
Предпочтительно пациенту вводят 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина, в качестве которого используют циклоспорин А или такролимус.
Эффект настоящего изобретения
Несмотря на то что 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол сам способен восстанавливать лимфоциты периферического кровообращения и оказывать очень хороший иммунодепрессивный эффект, его комбинированное применение вместе с CsA или FK506 (являющимся ингибитором кальциневрина) взаимно усиливает иммунодепрессивное действие этих средств. Благодаря этому можно уменьшить количество используемого ингибитора кальциневрина, а также можно устранить ограничения клинического применения CsA или FK506, обусловленные их токсичностью для почек или печени; таким образом обеспечивается безопасность и эффективность терапевтического способа. Совместное использование вместе с микофенольной кислотой (МРА), которая обладает активностью по подавлению нуклеозидного синтеза в целях прекращения метаболизма и иммунной активности иммунных клеток, делает возможным взаимное усиление иммунодепрессивного действия обоих средств. Это, в свою очередь, уменьшает количество используемого МРА и предотвращает выраженность дигестивных симптомов (типа диареи или тошноты), панцитопении или нейтропении, вторичной инфекции или лимфомы, а также обеспечивает проведение безопасной и удовлетворительной терапии.
Далее, возможно также использование заявляемого соединения в комбинации с метотрексатом, который представляет собой препарат первого ряда для лечения ревматоидного артрита. Другими словами, 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол сам по себе способен восстанавливать лимфоциты периферического кровообращения, оказывает очень хороший эффект как вспомогательное средство для подавления адъювантного артрита, однако при использовании в комбинации с метотрексатом их эффективность взаимно усиливается, а развитие артрита можно подавить благодаря применению комбинации этих средств в меньших количествах. Метотрексат обладает сильными побочными действиями, так что в терапии ревматоидного артрита используют импульсную терапию. Однако дозу метотрексата можно будет снизить и обеспечить безопасный метод лечения, способный исключить побочные эффекты.
Краткое описание фигур
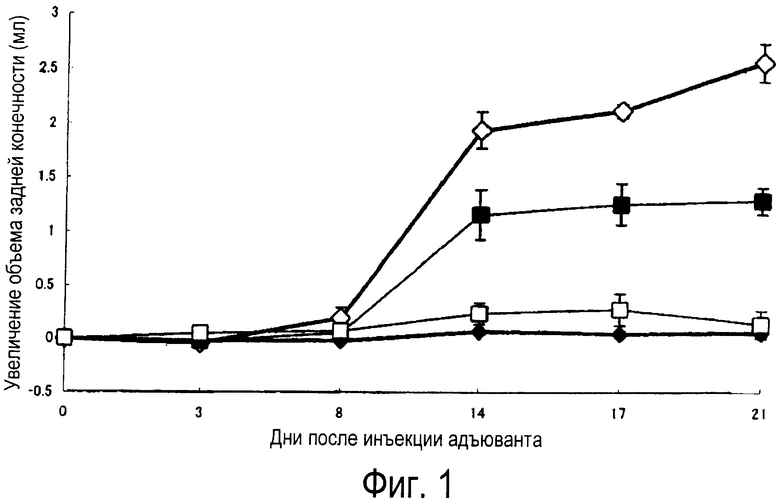
Фиг.1 представляет собой график, показывающий действие единичной дозы KNF-299 на адъювантный артрит крыс (в модели)
♦: стандартный контроль
◊: контроль адъюванта
сплошная площадь: KNF-299 0,03 мг/кг р.о.
□: KNF-299 0,1 мг/кг p.o.
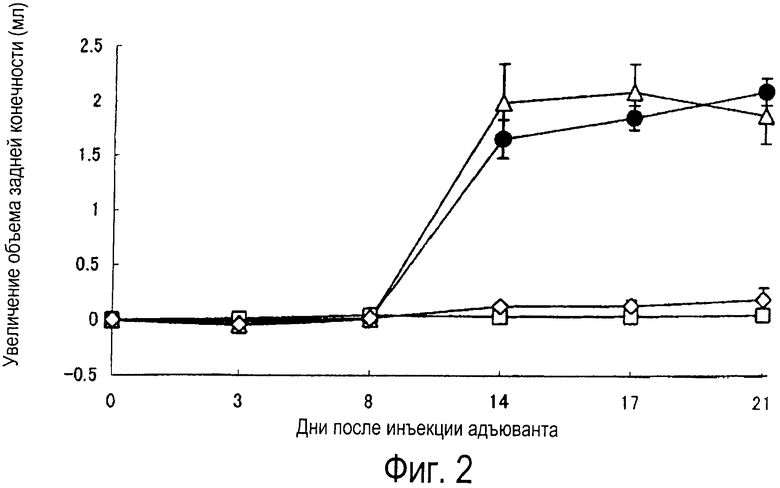
Фиг.2 представляет собой график, показывающий действие единичной дозы метотрексата (МТХ) на адъювантный артрит крыс (в модели)
●: контроль адъюванта
□: стандартный контроль
∆: МТХ 0,03 мг/кг
◊: МТХ 0,1 мг/кг
Фиг.3 представляет собой график, показывающий совместное действие KNF-299 и МТХ на адъювантный артрит крыс (в модели)
○: контроль адъюванта
∆: KNF-299 0,1 мг/кг
□: МТХ 0,025 мг/кг
◊: МТХ 0,05 мг/кг
сплошная площадь: KNF-299 (0,01 мг/кг) + МТХ (0,025 мг/кг)
♦: KNF-299 (0,01 мг/кг) + МТХ (0,05 мг/кг).
Наилучший способ реализации настоящего изобретения
Заявляемое лекарственное средство для предотвращения реакции отторжения органа или клетки при трансплантации содержит 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина или микофенольной кислотой.
В качестве примера фармацевтически приемлемой соли соединения можно привести соль соляной кислоты, соль бромисто-водородной кислоты, соль уксусной кислоты, соль трифторуксусной кислоты, соль метансульфоновой кислоты, соль лимонной кислоты, соль винной кислоты, а также аналогичные соли, наиболее предпочтительна солянокислая соль.
Соединение, представленное по настоящему изобретению, можно получить способами, описанными в публикациях WO 03/029184 и в WO 03/029205.
В качестве примера средства, которое можно использовать в комбинации, можно привести иммунодепрессант, имеющий иммунодепрессивную или иммунорегуляторную активность и используемый для лечения или профилактики острых или хронических отторжений аллотрансплантата или гетеротрансплантата, воспалительных заболеваний, аутоиммунных заболеваний.
Конкретные примеры включают CsA и FK506 (которые представляют собой ингибиторы кальневрина) и микофенольную кислоту (МРА). При совместном использовании эти вещества могут быть введены пациенту раздельно или одновременно. Введение может осуществляться в виде смеси или индивидуально. Дозировочная форма соединения может меняться в зависимости от природы конкретного соединения, например, можно получить препараты орального или парентерального применения. Другими словами, для того чтобы приготовить гранулы, порошки, таблетки, капсулы, сироп, суппозитории, суспензии, растворы или другие препараты для орального или парентерального введения, активные ингредиенты можно раздельно или одновременно смешивать с физиологически приемлемыми носителями, наполнителями, связующими, разбавителями и им подобными агентами. Если активные ингредиенты вводят в препараты по отдельности, то смешивание можно проводить непосредственно перед введением, или эти ингредиенты можно вводить пациенту одновременно или последовательно через определенные промежутки времени. Препараты для такого смешивания получают стандартным способом.
Дозу каждого активного ингредиента, используемого в такой комбинации, можно менять в зависимости от того, какой конкретный активный ингредиент должен входить в комбинацию, от способа введения или от того, какое конкретное болезненное состояние нуждается в лечении. Обычно если соединение используют, например, в сочетании с CsA и FK506 (которые представляют собой ингибитор кальциневрина) и микофенольной кислотой (МРА), то однократно или за несколько раз может быть введена доза, составляющая для взрослого человека в сутки от 0,01 мг до 100 мг. Полученный таким способом иммунодепрессант по настоящему изобретению полезен в целях профилактики или лечения устойчивости к трансплантации или отторжения при трансплантации органа или ткани (например, сердца, почки, печени, легкого, костного мозга, роговицы, тонкой кишки, конечности, мышцы, нерва, мозгового вещества, двенадцатиперстной кишки, фрагмента клетки кожи или поджелудочной железы, включая гетеротрансплантат), реакции «трансплантат против хозяина» (GVHD), вызванной трансплантацией костного мозга, аутоиммунных заболеваний типа ревматоидного артрита, системной красной волчанки, нефротического синдрома, тиреоидита Хашимото, рассеянного склероза, бульбоспинального паралича, диабета I типа, диабета взрослых II типа, увеита, стероиод-зависимого и стероид-резистентного нефроза, ладошно-подошвенного пустуллеза, аллергического энцефаломиелита, гломерулонефрита и им подобных, а также воспалений, вызванных патогенными микроорганизмами.
Эти средства полезны в целях профилактики и лечения воспалительных, пролиферативных и гиперпрофилеративных заболеваний кожи, а также иммунных заболеваний, опосредованных кожным проявлением, типа псориаза, псориатического артрита, атопической экземы (атопического дерматита), контактного дерматита, экзематозного дерматита, себорейного дерматита, плоского лишая, пемфигуса, буллезного пемфигоида, буллезного эпидермолиза, крапивницы, васкулярного отека, эритемы, ацидоцитоза кожи, акне, алопеции, ацидоцитоза фасции и атеросклероза.
Настоящее изобретение полезно также для лечения респираторных заболеваний, типа саркомы Бека, склероза легких, идиопатической интерстициальной пневмонии, двусторонних обструктивных заболеваний дыхательных путей, представленных бронхиальной астмой, бронхитом, и им подобных.
Далее, настоящее изобретение также может быть полезно для лечения офтальмологических заболеваний типа конъюнктивита, кератоконъюнктивита, кератита, весеннего конъюнктивита, увеита, связанного с болезнью Бешена, герпетического кератита, стафиломы роговой оболочки, дистрофии эпителия роговицы, лейкомы роговицы, окулярной пузырчатки, язвы Морена, склерита, связанного с базедовой болезнью паралича двигательных нервов глаз, тяжелых интраокулярных воспалений, и им подобных.
Настоящее изобретение полезно также для профилактики и лечения воспалений слизистых оболочек и сосудов (например, язвы желудка; сосудистые поражения, вызванные ишемической болезнью и тромбозом; ишемии кишечника; воспалительные заболевания кишечника типа болезни Хрона и язвенного колита; некротического колита) или поражений кишечника, связанных с термическим ожогом.
Помимо этого настоящее изобретение полезно также для профилактики и лечения заболеваний почек (например, интерстициальный нефрит, синдром Гудпастура, гемолитический уремический синдром и диабетическая нефропатия), заболеваний нервной системы (типа полиомиелита, синдрома Жуиллана-Барре, болезни Миньера и радикулита), заболеваний эндокринной системы (типа гипертиреодита и базедовой болезни), болезней крови (типа апластической анемии, гипопластической анемии, идиопатической тромбо(цито)пенической пурпуры, аутоиммунной гемолитической анемии, дефектного продуцирования гранулоцитопении и эритроцитов), заболеваний костной системы (типа остеопороза), респираторных заболеваний (типа саркомы Бека, склероза легких, идиопатической интерстициальной пневмонии), кожных заболеваний (типа дерматомиозита, витилиго, ихтиоза, фотоаллергенной сенситивности и лимфомы Т-клеток кожи), болезней кровеносной системы (типа артериосклероза, аортита, нодозного полиартериита и миопатии сердца), диффузных болезней соединительной ткани (типа склеродермы, грануломатоза Вегенера и синдрома Съергена), ожирения, эозинофильного фасцита, заболеваний десен, нефротического синдрома, гемолитического уремического синдрома, а также мышечной дистрофии.
Настоящее изобретение полезно также при заболеваниях пищеварительного тракта или аллергии (глютеновая болезнь, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Хрона и язвенный колит), а также связанных с пищей аллергозов, симптомы которых непосредственно не относятся к пищеварительному тракту (например, мигрень, ринит и экзема).
Настоящее изобретение обладает активностью инициировать регенерацию печени и/или уплотнения и гипертрофии гепатоцитов. В связи с этим настоящее изобретение полезно также для профилактики и лечения аллергенных заболеваний (например, хронические аутоиммунные заболевания печени, включая аутоиммунный гепатит, билиарный цирроз печени и склерозирующий холангит), частичной резекции печени, острого некроза печени (например некроз, вызванный токсичным вирусным гепатитом), а также заболеваний печени типа гепатита В, гепатита С и цирроза печени.
Помимо этого настоящее изобретение также может быть полезным для профилактики и лечения злокачественного ревматоидного артрита, амилоидоза, фульминантного гепатита, хронической идиопатической гипотензии, пустулезного псориаза, болезни Бехсета, системной красной волчанки, эндокринной офтальмопатии, прогрессивного системного склероза, сочетанных заболеваний соединительной ткани, синдрома аортита, гранулемы Вегенера, активного хронического гепатита, синдрома Эванса, сенной лихорадки, идиопатического гипопаратиреодита, болезни Аддисона (аутоиммунного адреналита), аутоиммунного охрита, хронического воспаления яичников, холодовой гемагглютинации, холодовой пароксизмальной гемоглобинурии, пернициозной анемии, Т-клеточной лейкемии взрослых, аутоиммунного атрофического гастрита, люпоидного гепатита, тубулоинтерстициального нефрита, мембранной нефропатии, болезни Шарко, ревматизма, постинфарктного миокардиального синдрома и симпатической офтальмии.
Примеры
Далее настоящее изобретение будет более подробно описано с помощью примеров. В этих примерах конкретно описаны комбинации 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола (далее называемого KNF-299) и циклоспорина A (CsA), такролимуса (FK506), метотрексата (МТХ) и микофенольной кислоты (МРА); однако необходимо понимать, что настоящее изобретение не должно быть ограничено этими примерами.
Пример 1
Пролонгированное действие на жизнеспособность кожного аллотрансплантата для штаммов крыс, совместимых по основному комплексу гистосовместимости
Была проведена аллогенная трансплантация кожи у совместимых по основному комплексу гистосовместимости крыс; процедура проводилась так, как это описано в литературе (Am. J. Med. Technol., 36, 149-157, 1970; Translant Proc., 28, 1056-1059, 1996). В каждой группе находилось по 5 животных, все животные получали корм в отдельных клетках. В качестве донора выбрали LEW (RT1 1), а в качестве реципиента - F344 (RT1 1v1). Части дермиса (1,8 см × 1,8 см) на спине реципиента подвергли иссечению, затем после обработки этого участка несколькими каплями раствора пенициллина (40000 ед./мл) на него был помещен кожный трансплантат (1,8 см × 1,8 см), приготовленный из абдоминального участка донора. Первичную повязку провели лейкопластырем (30×72 мм) таким образом, чтобы центральная часть его прокладки лежала на трансплантате, по периметру повязку закрепили перфорированным пластырем (3,8×15 см). Спустя 5 дней оба пластыря удалили с помощью ножниц.
Начиная с дня проведения трансплантации животные получали лекарственное средство в дозе 0,5 мг/100 г веса. Введение осуществляли орально, ежедневно и однократно. Контрольная группа получала дистиллированную воду. В качестве CsA делали инъекцию Sandimmun (50 мг/мл), растворенного дистиллированной водой. В качестве FK506 вводилось содержимое капсул Prograf (Fujisawa Pharmaceutical Co., Ltd), суспендированное в дистиллированной воде. KNF-299 вводили после его растворения в дистиллированной воде. Группа животных с комбинированным введением получала смесь, приготовленную смешиванием вводимых ингредиентов, которое проводили непосредственно перед введением.
Начиная с дня удаления повязок из лейкопластыря трансплантаты подвергались ежедневному осмотру. Показателем отторжения служили некроз 90% (или более) эпителия трансплантата и появление коричневой окраски. Жизнеспособность трансплантата в днях определяли как количество дней от трасплантации до отторжения.
Математическое ожидание времени жизнеспособности трансплантата в каждой группе вычисляли как среднее значение времени жизни (MST). В каждой группе (n=5) самое продолжительное время жизни определяли как медиану.
При однократном введении KNF-299 в дозе 3 мг/кг продемонстрировал продолжительное (в течение 27 дней и более) воздействие на среднее время жизнеспособности. Однократное введение CsA и FK506 в дозах 30 мг/кг и 10 мг/кг соответственно показало продолжительное воздействие на жизнеспособность (в течение 30 дней и более).
В таблице 1 показаны результаты, демонстрирующие комбинированный эффект применения дозы, меньшей, чем единичная доза, и оказывающей продолжительное влияние на жизнеспособность.
При однократном введении дозы KNF-299, составляющей 3 мг/кг, соединение демонстрирует четкий пролонгированный эффект на жизнеспособность трансплантата. CsA также демонстрирует четкий пролонгированный эффект на жизнеспособность трансплантата при однократном введении дозы, составляющей 30 мг/кг. Дозы CsA в 10 мг/кг и KNF-299 в 0,03 мг/кг вызывают увеличение времени жизнеспособности только приблизительно на 1-4 дня по сравнению с контролем. Однако при их комбинированном использовании в каждом случае наблюдалось увеличение времени жизнеспособности на 30 дней или более, при этом также создавалось очень сильное противодействие отторжению трансплантата. Комбинация с FK506 привела к аналогичным результатам, при однократном введении малых доз наблюдалось незначительное воздействие; однако при комбинации FK506 (в дозе 3 мг/кг) и KNF-299 (в дозе 0,1 мг/кг) проявляется четкий эффект, проявляющийся в том, что среднее время жизнеспособности составляет 26 дней или более.
Контроль
Контроль
Как это описано выше, было показано, что комбинированное применение KNF-299 усиливает действие ингибитора кальциневрина типа CsA или FK506. Поскольку используемое количество ингибитора кальциневрина может быть снижено, то становится возможным устранить ограничения клинического применения, вызванные проявлением токсичности в отношении почек или печени, а также обеспечивается эффективный терапевтический метод.
Пример 2
Эффект комбинированного использования метотрексата в модели адъювантного артрита крыс
Для индуцирования артрита в шкуру подушечки задней правой лапы 6-или 7-недельных самок крыс (LEW/Crj; Charles River Japan, Inc.) делали инъекцию 0,05 мл инактивированной M.butyricum (12 мг/мл; 0,6 мг/особь), суспендированной в жидком парафине (день 0); инъекцию осуществляли интрадермально. Исследуемое соединение растворяли или суспендировали в чистой воде и вводили крысам орально в дозе, составляющей 0,5 мл на 100 г веса особи. Для контроля адъюванта использовали только чистую воду. В группе, в которой проводили комбинированное введение, смешивание водного раствора KNF-299 и водного раствора МТХ (Sigma) проводили непосредственно перед введением. Введение осуществляли однократно и ежедневно, начиная с дня 0 вплоть до конца эксперимента.
Оценку степени артрита проводили по измерениям объемов правых и левых задних лап с использованием прибора для измерения объемов (МК-550, Muromachi Kikai); увеличение объема определялось относительно состояния задней лапы в день 0, а измерения осуществляли в дни 0, 3, 8, 14, 17 и 21.
Способность KNF-299 предотвращать наступление адъювантного артрита зависит от дозы; эффективность, близкая к максимальной, достигается при дозе 0,1 мг/кг (фиг.1). Способность МТХ предотвращать наступление адъювантного артрита при дозе 0,03 мг/кг не наблюдалась, максимум достигался при дозе 0,1 мг/кг (фиг.2).
Комбинированное действие исследовали с помощью комбинации доз, при однократном введении которых ожидался незначительный эффект. Доза KNF-299 составляла 0,01 мг/кг, а дозы МТХ составляли 0,025 мг/кг и 0,05 мг/кг. Полученные результаты приведены на фиг.3.
При введении единичной дозы МТХ, составляющей 0,025 мг/кг и 0,05 мг/кг, было продемонстрировано 20% и 35% ингибирование соответственно, однако этот эффект не был существенным (21 день). При введении единичной дозы KNF-299, составляющей 0,01 мг/кг, было продемонстрировано 36% ингибирование (21 день). Комбинированное применение KNF-299 в дозе 0,01 мг/кг и МТХ в дозе 0,05 мг/кг показало 84% ингибирование.
МТХ представляет собой антагонист метаболизма фолиевой кислоты; известно, что он вызывает миелосупрессию, интерстициальную пневмонию и аналогичные побочные эффекты. Было показано, что KNF-299 обладает очень высоким комбинационным эффектом при комбинированном применении с МТХ в модели АА, имеет самую высокую клиническую эффективность и поэтому является терапией первой линии. Следовательно, комбинированное использование KNF-299 должно быть эффективным для пациентов, страдающих некупирующимся ревматоидным артритом, действие МТХ для которых трудно выявляемо. МТХ имеет значительные побочные эффекты, поэтому в терапии ревматоидного артрита используют низкоимпульсную терапию. В этом случае также могут возникать побочные эффекты, поэтому для их снижения используется комбинация с фолиевой кислотой. Комбинированное использование KNF-299 с МТХ допускает снижение доз KNF-299 и МТХ, предотвращает побочные эффекты и допускает обеспечение безопасного терапевтического метода.
Пример 3
Пролонгированное действие комбинированного применения микофенольной кислоты (МРА) на жизнеспособность трансплантата сердца для штаммов крыс, несовместимых по основному комплексу гистосовместимости
Действие KNF-299 исследовали на аллогенных трансплантатах сердца крыс, несовместимых по основному комплексу гистосовместимости. Использовалась комбинация, в которой в качестве донора выступала крыса DA (RT1a), а в качестве реципиента - крыса LEW (RT1); гетеротопная трансплантация сердца, при которой сердце донора было соединено с сосудами шеи реципиента манжеткой, проводилась согласно описанному в литературе способу (Microsurgery; 21, 16-21, 2001) или подобным образом.
Лекарственное средство вводили орально, однократно и ежедневно, начиная с дня трансплантации сердца. МРА готовили из продукта, поставляемого Wako Pure Chemical Industries, Ltd., таким образом, чтобы концентрация микофенольной кислоты в физиологическом растворе (содержащем 0,5% карбоксиметилцеллюлозы, 0,4% Твин 80 и 0,9% бензилового спирта) составляла 20 мг/мл. Введение проводили в дозе 0,1 мл/100 г B.W.
KNF-299 растворили в дистиллированной воде в концентрации 0,06 мг/мл, и вводили в дозе, составляющей 0,5 мл/100 г B.W. Контрольная группа получала жидкий носитель, используемый при введении МРА.
Сердечную пульсацию трансплантированного сердца контролировали путем осмотра или пальпации, а отторжение фиксировали по остановке пульсации. Время жизнеспособности определяли как количество дней от дня трансплантации до дня регистрации отторжения. Математическое ожидание времени жизнеспособности трансплантата в каждой группе вычисляли как среднее значение времени жизни (MST). В таблице 2 показаны результаты теста, проведенного для штаммов с сильным отторжением; продемонстрировано предотвращение отторжения трансплантированного сердца с использованием комбинации
При однократном введении KNF-299 в дозе 0,3 мг/кг среднее время жизнеспособности составило 7,0 дней. Наблюдался лишь незначительный эффект пролонгирования, составляющий по сравнению с контрольной группой 1,2 дня. При однократном введении МРА в дозе 20 мг/кг индивидуальная вариабельность времени жизнеспособности была значительной, а эффект предотвращения отторжения незначителен несмотря на высокие дозы. При использовании этих средств в комбинации время жизнеспособности в каждом случае увеличилось на 100 дней или более, этот факт выявляет четкий эффект комбинированного применения.
Пример 4
Сравнение фармакологической активности соединения KNF-299 (2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол) с соединением FTY-720 (2-амино-2[2-(4-октилфенил)этил]пропан-1,3-диол).
(i) Трансплантация кожи
Были исследованы индивидуальные введения FTY-720 и KNF-299, а также комбинированные введения различных сочетаний FTY-720 и циклоспорина CsA, KNF-299 и циклоспорина CsA. Исследования проводились в соответствии со способом, который аналогичен способу, описанному в примере 1 настоящей заявки; полученные результаты приведены в таблице 3.
Как показано в таблице 3, индивидуальные введения FTY-720 и KNF-299 демонстрируют существенный эффект при дозе 0,3 мг/кг и выше. Следовательно, при индивидуальном введении каждый из них обладает одинаковой фармакологической активностью (см. столбец CsA (0)). Напротив, в случаях комбинированного введения KNF-299 с 10 мг/кг CsA (CsA в этой дозе не демонстрирует значительного воздействия) (см. столбец CsA (10)) KNF-299 способен показать существенный эффект в дозе 0,003 мг/кг или выше, в то время как FTY-720 демонстрирует значительный эффект только в дозе 0,1 мг/кг или выше. Другими словами, при комбинированном применении KNF-299 вместе с CsA он может оказывать существенный эффект в дозе, которая составляет 1/10 эффективной дозы FTY-720. Следовательно, на основе результатов для FTY-720 эффект настоящего изобретения невозможно было предвидеть.
(ii) Трансплантация сердца
Были исследованы индивидуальные введения FTY-720 и KNF-299, а также комбинированные введения различных сочетаний FTY-720 и CsA, KNF-299 и CsA. Исследования проводились в соответствии со способом, который аналогичен способу, описанному в примере 3 настоящей заявки; полученные результаты приведены в таблице 4.
Величина Р*: данные от групп, получавших лечение, и от контрольной группы (которая использовалась в качестве стандарта) были проанализированы по логарифмическому ранговому критерию. Статистическая значимость определялась как Р<0,05, аббревиатура «n.s.» обозначает «не существенно».
Как показано в таблице 3, индивидуальные введения FTY-720 и KNF-299 не демонстрируют существенного эффекта даже при дозе 1,0 мг/кг.Следовательно, при индивидуальном введении каждый из них обладает одинаковой фармакологической активностью. Напротив, в случаях комбинированного введения KNF-299 с 3 мг/кг CsA (CsA в этой дозе не демонстрирует значительного воздействия) (см. столбец CsA (10)) KNF-299 способен показать существенный эффект в дозе 0,01 мг/кг или выше, в то время как FTY-720 демонстрирует значительный эффект только в дозе 0,03 мг/кг или выше. Другими словами, при комбинированном применении KNF-299 вместе с CsA он может оказывать существенный эффект в дозе, составляющей 1/3 эффективной дозы FTY-720. Следовательно, на основе результатов для FTY-720 эффект настоящего изобретения невозможно было предвидеть.
Промышленная применимость
Комбинированное применение при трансплантации органов 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола, который способен восстанавливать лимфоциты периферического кровообращения и оказывать высокое иммунодепрессивное действие сам по себе, вместе с иммунодепрессантом (типа CsA или FK506 - ингибитором кальциневрина; или микофенольной кислоты (МРА) - ингибитором синтеза нуклеозидов), усиливает указанный иммунодепрессивный эффект. Поэтому клинические дозы иммунодепрессанта могут быть снижены, а следовательно, можно избежать ограничений в использовании ингибиторов кальциневрина, вызванных токсичностью в отношении почек или печени, или ограничения применения ингибиторов нуклеозидного синтеза из-за нейтропении; таким образом можно обеспечить безопасный и эффективный терапевтический способ. Короче говоря, поскольку средства, входящие в комбинации, оказывают существенный противовоспалительный эффект при использовании в незначительных количествах, то такие средства можно безопасно применять в течение продолжительного времени, а следовательно, ожидается существенное и продолжительное подавление развития ревматоидного артрита и его рецидива.
Таким образом, лекарственное средство по настоящему изобретению, способное восстанавливать лимфоциты периферического кровообращения, в комбинации с иммунодепрессантами представляет собой критерий эффективного выражения иммунодепрессивной активности, а также снижает выраженность побочных эффектов. Такие лекарственные средства полезны для профилактики и лечения аутоиммунных заболеваний и воспалений, вызванных патогенными микроорганизмами, чужеродными антителами или веществами, а также для профилактики и лечения воспалительных, пролиферативных и гиперпролиферативных заболеваний кожи и иммунногенных заболеваний с кожными проявлениями.

Изобретение относится к лекарственным средствам и касается лекарственного средства для предотвращения реакции отторжения органа или клетки при трансплантации, содержащего 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина или микофенольной кислотой. Также раскрыт способ предотвращения реакции отторжения органа или клетки при трансплантации. Предложенное лекарственное средство обеспечивает взаимное усиление эффективности входящих в его состав средств при меньших количествах, вследствие чего могут быть снижены побочные эффекты. 2 н. и 8 з.п. ф-лы, 3 ил., 4 табл.
1. Лекарственное средство для предотвращения реакции отторжения органа или клетки при трансплантации, содержащее 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина или микофенольной кислотой.
2. Лекарственное средство по п.1, отличающееся тем, что указанное лекарственное средство содержит 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой.
3. Лекарственное средство по п.1, отличающееся тем, что указанное лекарственное средство содержит 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола гидрохлорид в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой.
4. Лекарственное средство по п.1, отличающееся тем, что указанное лекарственное средство содержит 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина.
5. Лекарственное средство по п.4, отличающееся тем, что указанный ингибитор кальциневрина представляет собой циклоспорин А или такролимус.
6. Способ предотвращения реакции отторжения органа или клетки при трансплантации, включающий введение пациенту 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина или микофенольной кислотой.
7. Способ по п.6, отличающийся тем, что пациенту вводят 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой.
8. Способ по п.6, отличающийся тем, что пациенту вводят 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиола гидрохлорид в количестве от 0,01 мг до 100 мг в сутки в сочетании с ингибитором кальциневрина или микофенольной кислотой.
9. Способ по п.6, отличающийся тем, что пациенту вводят 2-амино-2-[4-(3-бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиол в количестве от 0,01 мг до 100 мг в сутки или его фармацевтически приемлемую соль или гидрат в сочетании с ингибитором кальциневрина.
10. Способ по п.9, отличающийся тем, что указанный ингибитор кальциневрина представляет собой циклоспорин А или такролимус.
| HISASHI SHIMIZU | |||
| Эксцентричный фильтр-пресс для отжатия торфяной массы, подвергшейся коагулированию и т.п. работ | 1924 |
|
SU203A1 |
| Prolongs Graft Survival and Attenuates Chronic Rejection in Rat Skin and Heart Allografts | |||
| Circulation, 2005, 111,222-229 | |||
| US 6004565 A, 21.12.1999 | |||
| EP 1431275 A1, 23.06.2004 | |||
| EP 1431284 A1, 23.06.2004 | |||
| КОКИЛЬ | 1989 |
|
RU2067915C1 |
| СПОСОБ ОБРАБОТКИ ДЛИННОМЕРНОЙ ДЕТАЛИ И УСТРОЙСТВО ДЛЯ ПОДДЕРЖКИ ДЕТАЛИ ПРИ ОБРАБОТКЕ НА СТАНКЕ | 1996 |
|
RU2100148C1 |
| ПОКРОВСКИЙ В.И | |||
| Краткая | |||
Авторы
Даты
2010-08-20—Публикация
2005-07-15—Подача