Изобретение касается замещенных 4-фенилтетрагидроизохинолинов. Лекарственные средства, содержащие соединения этого типа, полезны для профилактики или лечения различных заболеваний. Так соединения, кроме прочего, могут использоваться при заболеваниях почек, как острая или хроническая почечная недостаточность, при нарушениях функции желчного пузыря и при нарушениях дыхания, как храп или остановка дыхания во сне.
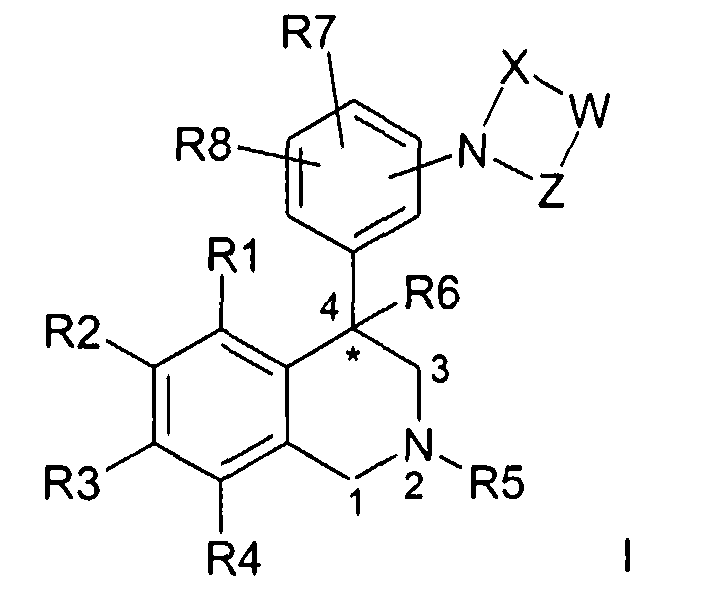
Изобретение касается соединений формулы I
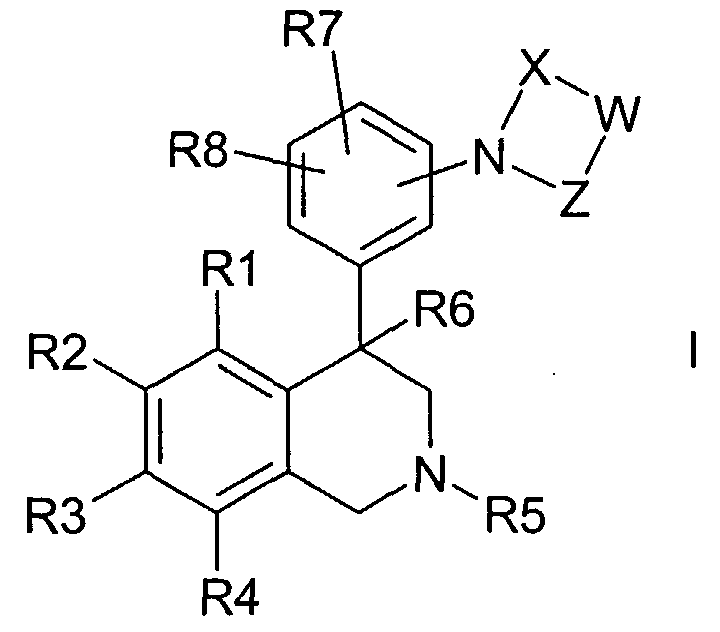
где
R1, R2, R3 и R4
независимо друг от друга обозначают водород, F, Cl, Br, I, CN, NO2 или R11-(CmH2m)-An-;
m обозначает ноль, 1, 2, 3 или 4;
n обозначает ноль или 1;
R11 обозначает водород, метил или CpF2p+1;
A обозначает кислород, NH, N(CH3) или S(O)q;
p обозначает 1, 2 или 3;
q обозначает ноль, 1 или 2;
R5 обозначает водород, алкил с 1, 2, 3, 4, 5 или 6 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
R6 обозначает водород, OH, F, CF3, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
R7 и R8
независимо друг от друга обозначают водород, F, Cl, Br, CN, CO2R12, NR13R14 или R16-(CmmH2mm)-Bnn-;
R12 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
R13 и R14
независимо друг от друга обозначают водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
или
R13 и R14
образуют с атомом азота, с которым они связаны, 4-, 5-, 6- или 7-членный цикл, в котором одна CH2-группа может быть замещена NR15, S или кислородом;
R15 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
mm обозначает ноль, 1, 2, 3 или 4;
nn обозначает ноль или 1;
R16 обозначает водород, метил или CppF2pp+1;
B обозначает кислород или S(O)qq;
pp обозначает 1, 2 или 3;
qq обозначает ноль, 1 или 2;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
r обозначает 1, 2, 3, 4, 5, 6, 7 или 8;
s обозначает 2, 3, 4, 5, 6, 7 или 8;
X обозначает -C(O)- или -S(O)2-;
Z обозначает -C(O)- или связь;
а также их фармацевтически приемлемые соли и трифторацетаты.
В форме выполнения изобретения предпочтительны соединения формулы I, где R1, R2, R3 и R4
независимо друг от друга обозначают водород, F, Cl, Br, CN или R11-(CmH2m)-An-;
m обозначает ноль или 1;
n обозначает ноль или 1;
R11 обозначает водород, метил или CpF2p+1;
A обозначает кислород, NCH3 или S(O)q;
p обозначает 1 или 2;
q обозначает ноль, 1 или 2;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород или метил;
R7 и R8
независимо друг от друга обозначают водород, F, Cl, CN, CO2R12, NR13R14 или R16-(CmmH2mm)-Bnn-;
R12 обозначает водород, метил или этил;
R13 и R14
независимо друг от друга обозначают водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
или
R13 и R14
образуют с атомом азота, с которым они связаны, 5-, 6- или 7-членный цикл, в котором одна CH2-группа может быть замещена NR15, S или кислородом;
R15 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
mm обозначает ноль, 1 или 2;
nn обозначает ноль или 1;
R16 обозначает водород, метил или CppF2pp+1;
B обозначает кислород или S(O)qq;
pp обозначает 1 или 2;
qq обозначает ноль, 1 или 2;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
r обозначает 2, 3, 4, 5, 6, 7 или 8;
s обозначает 2, 3, 4, 5, 6, 7 или 8;
X обозначает -C(O)- или -S(O)2-;
Z обозначает -C(O)-;
а также их фармацевтически приемлемые соли и трифторацетаты.
Особенно предпочтительны соединения формулы I, где
R1 и R3
обозначают водород;
R2 и R4
независимо друг от друга обозначают водород, F, Cl, Br, NH2, NHCH3 или N(CH3)2;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород или метил;
R7 и R8
обозначают водород;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород или метил;
r обозначает 2, 3, 4, 5 или 6;
s обозначает 2, 3, 4, 5 или 6;
X обозначает -C(O)- или -S(O)2-;
Z обозначает -C(O)-;
а также их фармацевтически приемлемые соли и трифторацетаты.
В следующей форме выполнения предпочтительны соединения формулы I, где
R1 и R3
обозначают водород;
R2 и R4
независимо друг от друга обозначают водород, F, Cl, NH2, NHCH3 или N(CH3)2;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород или метил;
R7 и R8
обозначают водород;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород или метил;
r обозначает 2, 3, 4, 5 или 6;
s обозначает 2, 3, 4, 5 или 6;
X обозначает -C(O)- или -S(O)2-;
Z обозначает -C(O)-;
а также их фармацевтически приемлемые соли и трифторацетаты.
Совсем особенно предпочтительные соединения формулы I выбраны из группы:
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
(S)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
4-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]морфолин-3,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,5-диметилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,3-диметилпирролидин-2,5-дион,
1-[2-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-метилимидазолидин-2,4-дион,
(3R,4S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,4-диметилпирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
3-[3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
1-[2-((R)-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-изопропилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-изобутилимидазолидин-2,4-дион,
(R и S)-3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-(2-метилсульфанилэтил)имидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5,5-диметилимидазолидин-2,4-дион,
1-[2-((R)-6,8-дихлор-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион,
1-[2-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((S)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,3,4,4-тетраметилпирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-4,4-диметилпиперидин-2,6-дион,
и 1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
а также их фармацевтически приемлемые соли и трифторацетаты.
Особенно предпочтительны соединения формулы I, выбранные из группы:
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
(S)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
4-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]морфолин-3,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,5-диметилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,3-диметилпирролидин-2,5-дион,
1-[2-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-метилимидазолидин-2,4-дион,
(3R,4S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,4-диметилпирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион
и
3-[3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
а также их фармацевтически приемлемые соли и трифторацетаты.
В особенности предпочтительны соединения формулы I, выбранные из группы:
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
(S)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
4-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]морфолин-3,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,5-диметилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,3-диметилпирролидин-2,5-дион,
1-[2-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион
и
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
а также их фармацевтически приемлемые соли и трифторацетаты.
Следующая форма выполнения включает соединения формулы I, где:
R1, R2, R3 и R4
независимо друг от друга обозначают водород, F, Cl, Br, CN или R11-(CmH2m)-An-;
m обозначает ноль или 1;
n обозначает ноль или 1;
R11 обозначает водород, метил или CpF2p+1;
A обозначает кислород, NCH3 или S(O)q;
p обозначает 1 или 2;
q обозначает ноль, 1 или 2;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород или метил;
R7 и R8
независимо друг от друга обозначают водород, F, Cl, CN, CO2R12, NR13R14 или R16-(CmmH2mm)-Bnn-;
R12 обозначает водород, метил или этил;
R13, R14 независимо друг от друга обозначают водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
или
R13 и R14
образуют с атомом азота, с которым они связаны, 5-, 6- или 7-членный цикл, в котором одна CH2-группа может быть замещена NR15, S или кислородом;
R15 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
mm обозначает ноль, 1 или 2;
nn обозначает ноль или 1;
R16 обозначает водород, метил или CppF2pp+1;
B обозначает кислород или S(O)qq;
pp обозначает 1 или 2;
qq обозначает ноль, 1 или 2;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С;
r обозначает 1, 2, 3, 4, 5, 6, 7 или 8;
s обозначает 2, 3, 4, 5, 6, 7 или 8;
X обозначает -C(O)- или -S(O)2-;
Z обозначает связь;
а также их фармацевтически приемлемые соли и трифторацетаты.
Особенно предпочтительными являются соединения формулы I, где
R1 и R3
обозначают водород;
R2 и R4
независимо друг от друга обозначают водород, F, Cl, Br, NH2, NHCH3 или N(CH3)2;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород или метил;
R7 и R8
обозначают водород;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород или метил;
r обозначает 1, 2, 3, 4, 5 или 6;
s обозначает 2, 3, 4, 5 или 6;
X обозначает -C(O)- или -S(O)2-;
Z обозначает связь;
а также их фармацевтически приемлемые соли и трифторацетаты.
В особенности предпочтительными являются соединения формулы I, где
R1 и R3
обозначают водород;
R2 и R4
независимо друг от друга обозначают водород, F, Cl, NH2, NHCH3 или N(CH3)2;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород или метил;
R7 и R8
обозначают водород;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород, метил;
r обозначает 1, 2, 3, 4, 5 или 6;
s обозначает 2, 3, 4, 5 или 6;
X обозначает -C(O)- или -S(O)2-;
Z обозначает связь;
а также их фармацевтически приемлемые соли и трифторацетаты.
Совсем особенно предпочтительные соединения формулы I выбраны из группы:
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метил-1,3-дигидроимидазол-2-он,
(R)-6,8-дихлор-4-[2-(1,1-диоксо-1-λ6-изотиазолидин-2-ил)фенил]-2-метил-1,2,3,4-тетрагидроизохинолин,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1,3-дигидроимидазол-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2-он,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он
и
6,8-дихлор-4-[4-(1,1-диоксо-1-λ6-[1,2,5]тиадиазолидин-2-ил)фенил]-2-метил-1,2,3,4-тетрагидроизохинолин,
а также их фармацевтически приемлемые соли и трифторацетаты.
Специально предпочтительны соединения формулы I, выбранные из группы:
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метил-1,3-дигидроимидазол-2-он,
(R)-6,8-дихлор-4-[2-(1,1-диоксо-1-λ6-изотиазолидин-2-ил)фенил]-2-метил-1,2,3,4-тетрагидроизохинолин,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1,3-дигидроимидазол-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2-он,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он
и
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он,
а также их фармацевтически приемлемые соли и трифторацетаты.
В особенности предпочтительными являются соединения формулы I, выбранные из группы:
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метил-1,3-дигидроимидазол-2-он,
(R)-6,8-дихлор-4-[2-(1,1-диоксо-1-λ6-изотиазолидин-2-ил)фенил]-2-метил-1,2,3,4-тетрагидроизохинолин,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1,3-дигидроимидазол-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он и
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
а также их фармацевтически приемлемые соли и трифторацетаты.
В следующей форме выполнения предпочтительны соединения формулы I, в которых остатки R1, R2, R3 и R4 независимо друг от друга обозначают водород, F, Cl, Br, CN или R11-(CmH2m)-An-, причем m и n независимо друг от друга обозначают ноль или 1, R11 обозначает водород, метил или CpF2p+1, и A обозначает кислород, NCH3 или S(O)q, причем p обозначает 1 или 2 и q обозначает ноль, 1 или 2; особенно предпочтительны соединения формулы I, в которых R1 и R3 обозначают водород, и R2 и R4 независимо друг от друга обозначают водород, F, Cl, Br, NH2, NHCH3 или N(CH3)2, например Cl или Br. В одной форме выполнения предпочтительны соединения формулы I, в которых R1 и R3 обозначают водород, и R2 и R4 независимо друг от друга обозначают F, Cl, NH2, NHCH3 или N(CH3)2, например Cl.
В следующей форме выполнения предпочтительны соединения формулы I, в которых R5 обозначает водород, метил, этил или циклопропил; особенно предпочтительны соединения формулы I, в которых R5 обозначает водород, метил или циклопропил, например, метил.
В следующей форме выполнения предпочтительны соединения формулы I, в которых R6 обозначает водород или метил, например водород.
В следующей форме выполнения предпочтительны соединения формулы I, в которых остатки R7 и R8 независимо друг от друга обозначают водород, F, Cl, CN, CO2R12, NR13R14 или R16-(CmmH2mm)-Bnn-, причем R12 обозначает водород, метил или этил, R13 и R14 независимо друг от друга обозначают водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С, или R13 и R14, вместе с атомом азота, с которым они связаны, образуют 5-, 6- или 7-членный цикл, в котором одна CH2-группа может быть замещена NR15, S или кислородом, и причем R15 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С, и причем mm обозначает ноль, 1 или 2, nn обозначает ноль или 1, и R16 обозначает водород, метил или CppF2pp+1, причем B обозначает кислород или S(O)qq, причем pp обозначает 1 или 2 и qq обозначает ноль, 1 или 2; особенно предпочтительны соединения формулы I, в которых R7 и R8 являются водородом.
В следующей форме выполнения предпочтительны соединения формулы I, в которых W обозначает CrH2r или CsH2s-2, причем одна или несколько CH2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S, причем R17 обозначает водород, алкил с 1, 2, 3 или 4 атомами С или циклоалкил с 3, 4, 5 или 6 атомами С, в особенности водород или метил, например водород, и причем r обозначает 2, 3, 4, 5, 6, 7 или 8, в особенности 2, 3, 4, 5 или 6, и s обозначает 2, 3, 4, 5, 6, 7 или 8, в особенности 2, 3, 4, 5 или 6.
В следующей форме выполнения предпочтительны соединения формулы I, в которых X обозначает -C(O)- или -S(O)2-.
В следующей форме выполнения предпочтительны соединения формулы I, в которых Z обозначает -C(O)-.
В другой форме выполнения предпочтительны соединения формулы I, в которых Z обозначает связь.
Если соединения формулы I содержат один или несколько центров асимметрии, то они могут независимо друг от друга существовать в форме как S, так и R конфигурации. Соединения могут существовать в качестве оптических изомеров, в качестве диастереомеров, в качестве рацематов, или в качестве их смесей во всех соотношениях. Далее, соединения формулы I могут существовать в виде поворотных изомеров.
Данное изобретение касается всех возможных таутомерных форм соединений формулы I.
Далее, изобретение касается производных соединений формулы I, например сольватов, как гидратов и продуктов присоединения спиртов, сложных эфиров, пролекарств и других физиологически приемлемых производных соединений формулы I, а также активных метаболитов соединений формулы I. Также изобретение касается всех кристаллических модификаций соединений формулы I.
Алкильные остатки могут быть неразветвленными и разветвленными. Это также имеет место, если они имеют заместители или встречаются в качестве заместителей других остатков, например во фторалкильных остатках или алкоксильных остатках. Примерами для алкильных остатков являются метил, этил, н-пропил, изопропил (=1-метилэтил), н-бутил, изобутил (=2-метилпропил), вторбутил (=1-метилпропил), трет-бутил (=1,1-диметилэтил), н-пентил, изопентил, третпентил, неопентил и гексил. Предпочтительными алкильными остатками являются метил, этил, н-пропил, изопропил и н-бутил. В алкильных остатках один или несколько, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14, атомов водорода могут быть замещены атомами фтора. Примерами таких фторалкильных остатков являются трифторметил, 2,2,2-трифторэтил, пентафторэтил, гептафторизопропил. Замещенные алкильные остатки могут быть замещены в любых положениях.
Алкиленовые остатки, как, например, CmH2m, CmmH2mm или CrH2r, могут быть неразветвленными или разветвленными. Это также относится к случаю, когда они имеют заместители или встречаются в качестве заместителей других остатков, например во фторалкиленовых остатках, как, например, в CpF2p и CppF2pp. Примерами для алкиленовых остатков являются метилен, этилен, 1-метилметилен, пропилен, 1-метилэтилен, бутилен, 1-пропилметилен, 1-этил-1-метилметилен, 1,2-диметилэтилен, 1,1-диметилметилен, 1-этилэтилен, 1-метилпропилен, 2-метилпропилен, пентилен, 1-бутилметилен, 1-пропилэтилен, 1-метил-2-этилэтилен, 1,2-диметилпропилен, 1,3-диметилпропилен, 2,2-диметилпропилен, гексилен и 1-метилпентилен. В алкиленовых остатках один или несколько, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, атомов водорода могут быть замещены атомами фтора. Замещенные алкиленовые остатки могут быть замещены в любых положениях. В алкиленовых остатках одна или несколько CH2-групп могут быть замещены кислородом, S, NH, N-алкилом или N-циклоалкилом. При этом как в неразветвленных, так и в разветвленных алкиленовых цепях CH2-группы могут быть замещены кислородом, S, NH, N-алкилом или N-циклоалкилом, например, как 1-гидроксиэтиленовый остаток.
Алкениленовые остатки, как, например, CsH2s-2, могут быть неразветвленными или разветвленными. Это также относится к случаю, когда они имеют заместители, например в фторалкениленовых остатках. Алкениленовые остатки могут быть ненасыщены в различных положениях. Примерами для алкениленовых остатков являются этенилен, 1-метилэтенилен, пропенилен, бут-1-енилен, бут-2-енилен, 1-метилпроп-1-енилен, 1,2-диметилэтилен, пентенилен или гексенилен. В алкениленовых остатках один или несколько, например 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов водорода могут быть замещены атомами фтора. Замещенные алкениленовые остатки могут быть замещены в любых положениях. В алкениленовых остатках одна или несколько CH2-групп могут быть замещены кислородом, S, NH, N-алкилом или N-циклоалкилом. При этом как в неразветвленных, так и в разветвленных алкениленовых цепях CH2-группы могут быть замещены кислородом, S, NH, N-алкилом или N-циклоалкилом.
Примерами циклоалкильных остатков являются циклопропил, циклобутил, циклопентил или циклогексил. В циклоалкильных остатках один или несколько, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, атомов водорода могут быть замещены атомами фтора. Замещенные циклоалкильные остатки могут быть замещены в любых положениях. Циклоалкильные остатки также могут быть разветвленными, как алкилциклоалкил или циклоалкилалкил, например метилциклогексил или циклогексилметил.
Примерами циклов из NR13R14, причем R13 и R14 образуют с атомом азота, с которым они связаны, 4, 5, 6 или 7-членный цикл, являются морфолин, пирролидин, пиперидин, пиперазин и N-метилпиперазин.
В качестве CH2-звеньев также имеют силу CH3-группы, находящиеся на конце алкильного остатка, которые в этой связи воспринимаются как CH2-H-группировки. Это также имеет силу в разветвленных алкиленовых остатках, как, например, CmH2m, CmmH2mm или CrH2r.
Если переменная, например циклоалкил или R1, встречается в качестве компонента больше одного раза, то определения переменной для каждого случая являются независимыми друг от друга.
Если соединения формулы I содержат одну или несколько кислых или щелочных групп или один или несколько основных гетероциклов, то к изобретению относятся также физиологически и токсикологически приемлемые соли, в особенности фармацевтически приемлемые соли. Так соединения формулы I могут быть депротонированы в одной кислой группе и использоваться, например, в качестве солей щелочных металлов, предпочтительно солей натрия или калия, или в качестве солей аммония, например в виде солей с аммиаком или органическими аминами или аминокислотами. Так как соединения формулы I всегда содержат, по меньшей мере, одну щелочную группу, они могут также быть получены в форме их физиологически приемлемых солей присоединения кислот, например со следующими кислотами: из неорганических кислот с такими, как соляная кислота, серная кислота или фосфорная кислота, или из органических кислот как, например, уксусная кислота, лимонная кислота, винная кислота, молочная кислота, малоновая кислота, метансульфокислота, фумаровая кислота. При этом в качестве солей присоединения кислот принимают во внимание все соли фармакологически приемлемых кислот, например галогениды, в особенности хлориды, лактаты, сульфаты, цитраты, тартраты, ацетаты, фосфаты, метилсульфонаты, п-толуолсульфонаты, адипинаты, фумараты, глюконаты, глутаматы, глицеролфосфаты, малеинаты и памоаты (эта группа соответствует также физиологически приемлемым анионам), а также трифторацетаты.
Объектом изобретения также являются способы получения соединений формулы I, описанные далее.
Описанные здесь соединения формулы I могут быть получены, например, по аналогии с известными из литературы методами исходя из производных анилина формулы VIII.
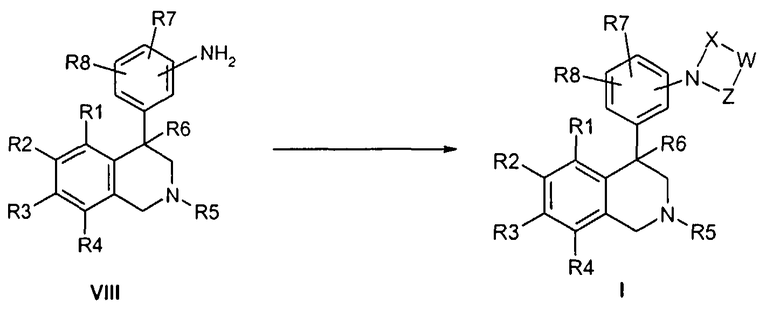
Анилин формулы VIII, например, путем нагревания с соответствующими кислотами формулы XXII в полифосфорной кислоте (PPA) может быть переведен в соединение формулы Ia (Tetrahedron Letters 2003, 44, 2133), причем R1 до R8 и W определены, как описано выше
и
X и Z соответствуют -C(O)-.
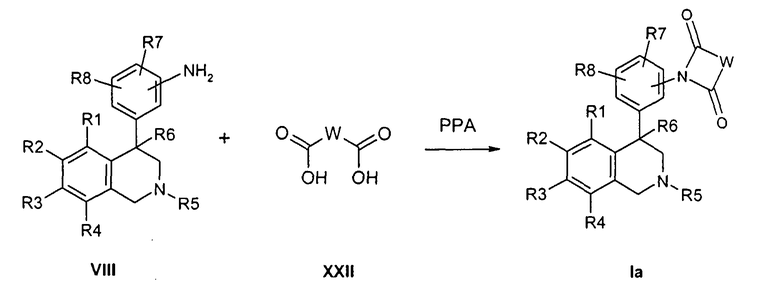
Альтернативно, соединения формулы Ia могут быть получены тем, что анилины формулы VIII подвергают превращению в апротонном растворителе как дихлорметан с ангидридами типа XXIX до промежуточных амидов кислот. Тогда получают желаемые имиды формулы Ia, тем что интермедиаты циклизуют в апротонном растворителе как дихлорметан с пригодным реагентом циклизации как EDC в присутствии основания как основание Хюнига (Hünig's base). Альтернативно, интермедиаты также могут нагревать в высококипящем растворителе как простой дифениловый эфир или совсем без растворителя, так что при обезвоживании происходит образование замкнутого цикла, причем остатки R1-R8 и W определены, как указано выше
и
X и Z соответствуют -C(O)-.
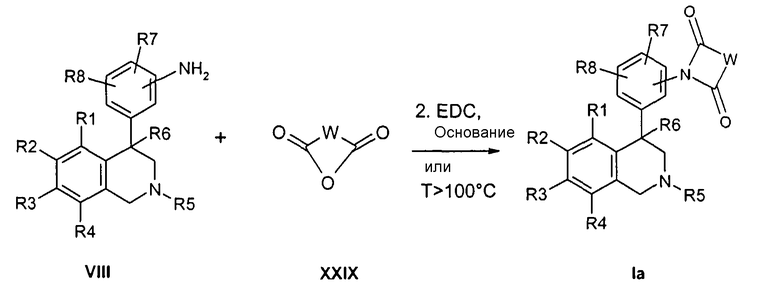
Соединения формулы Ib могут быть получены, например, в двухступенчатой реакции, исходя из сложных эфиров изоцианаткарбоновых кислот формулы XII. При этом сначала промежуточно путем реакции азота анилина с изоцианатной группой образуется мочевина, прежде чем затем происходит катализируемая кислотой циклизация, причем R1-R8 определены, как описано выше,
X и Z соответствуют -C(O)-,
R22 обозначает алкил с 1, 2, 3 или 4 атомами С, например метил или этил,
-VN-NH- обозначает остаток W, в котором концевая CH2-группа замещена NH,
и
-V'-NCO обозначает остаток W, в котором концевая CH2-группа замещена изоцианатной группой.
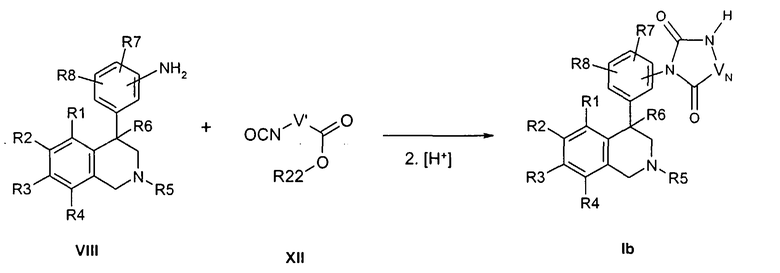
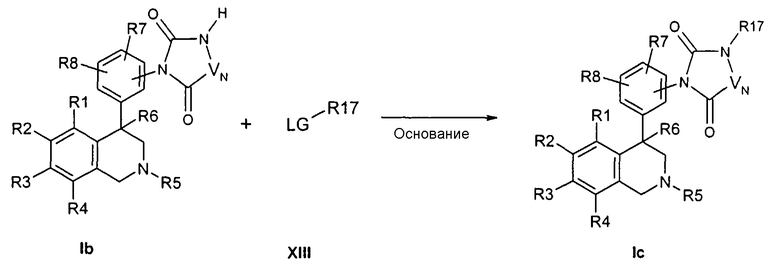
Вариация остатка R17 может достигаться затем путем алкилирования соединения формулы Ib в присутствии основания, например литийдиизопропиламида или литий- или натрий-гексаметилдисилазида с алкилирующим средством формулы XIII,
причем R1-R8 и R17 определены, как описано выше,
X и Z соответствуют -C(O)-,
-VN-NH- обозначает остаток W, в котором концевая CH2-группа замещена NH,
-VN-NR17- обозначает остаток W, в котором концевая CH2-группа замещена NR17,
и
LG обозначает при алкилировании подвижную отделяемую группу как, например, бромид, хлорид, тозилат или мезилат.
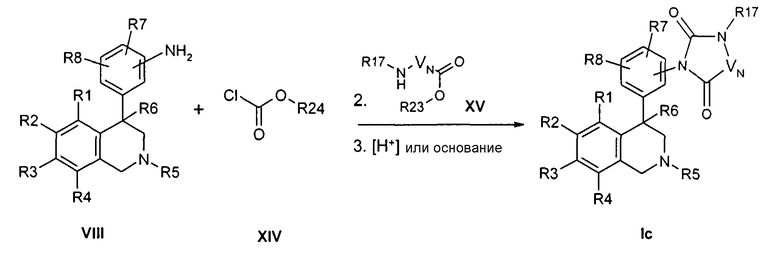
Альтернативно, цикл также может быть синтезирован в трехступенчатой последовательности. Для этого сначала на азот анилина переносят карбонильную группу. Это происходит, например, с помощью производных хлормуравьиной кислоты формулы XIV или карбонилдиимидазола. Последующее превращение со сложными аминоэфирами формулы XV вследствие циклизации, катализируемой кислотами или основаниями, предпочтительно с соляной кислотой или натрийгексаметилдисилазидом, приводит к образованию соединения формулы Ic,
причем R1 до R8, R17 и -VN-NR17- определены, как описано выше,
R23 обозначает алкил с 1, 2, 3 или 4 атомами С, например метил или этил,
и
R24 обозначает факультативно замещенный фенильный остаток, например фенил или 4-нитрофенил.
Циклические мочевины формулы Id могут быть получены из продукта анилина формулы VIII с помощью производных хлормуравьиной кислоты формулы XIV тем, что образованный карбамат подвергают превращению с аминами формулы XVI, вследствие стадии циклизации в присутствии основания как, например, гидрид натрия, карбонат калия или натрийгексаметилдисилазид,
причем
R1-R8, R17, R24, -VN-NR17- и -VN-NHR17 определены, как описано выше,
и
Y обозначает отделяемую группу, например хлор, или предварительную стадию для отделяемой группы, например гидрокси, которую затем переводят в отделяемую группу, например, с помощью мезилхлорида.

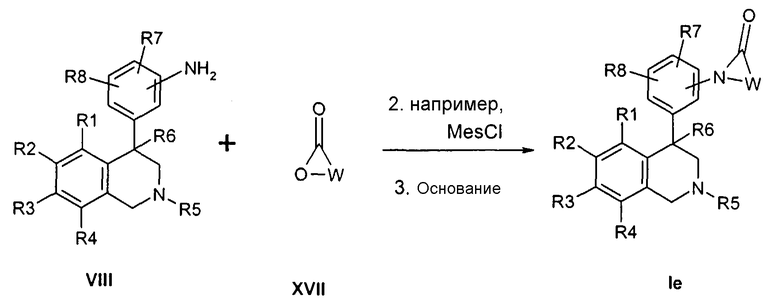
Лактамы формулы Ie могут быть получены посредством превращения анилина формулы VIII с лактонами формулы XVII (Synlett 2001, 1485) тем, что в промежуточно образованных гидроксиамидах из гидроксильной группы путем превращения, например, с сульфохлоридом, ангидридом или сильной кислотой делают хорошо отделяемую группу, которая затем замещается через азот анилина предпочтительно в присутствии основания, как, например, гидрид натрия, карбонат калия или натрийгексаметилдисилазид,
причем R1-R8 и W определены, как описано выше,
X соответствует -C(O)-
и
Z обозначает связь.
Альтернативно, также может происходить прямое превращение галогенароматических соединений формулы XVIII с лактамами формулы XIX в присутствии катализаторов, например иодида меди, до соединений формулы Ie (J. Am. Chem. Soc. 2001, 7727, ibid. 2002, 7421),
причем R1-R8 и W определены, как описано выше,
X соответствует -C(O)-,
Z обозначает связь
и
Hal обозначает Cl, Br, I или -O-трифлат.
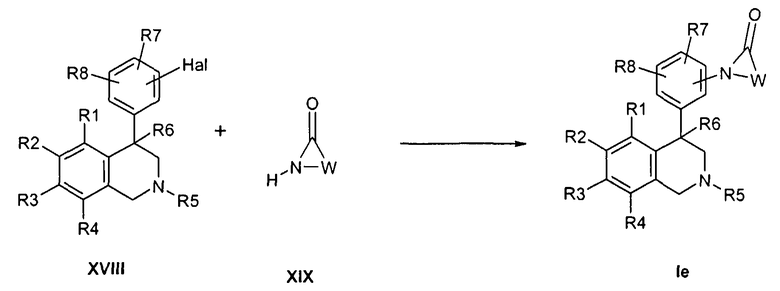
При этом получение галогенароматических соединений формулы XVIII происходит исходя из карбонильных производных формулы VI, аналогично с синтезом производных анилина формулы VIII, которое далее описано ниже.
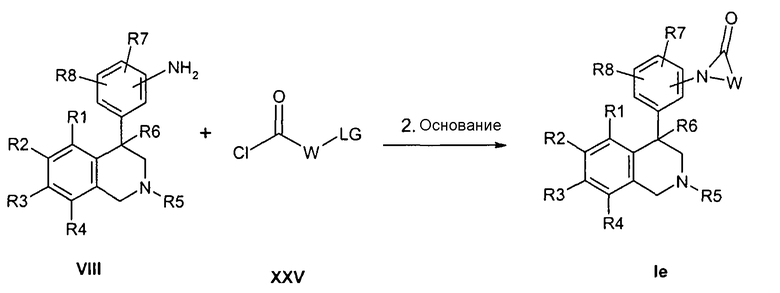
Следующей альтернативой является превращение анилинов формулы VIII с хлорангидридами кислот формулы XXV с образованием соединений формулы Ie. Промежуточно полученные амиды затем подвергают циклизации в присутствии основания, как гидрид натрия, карбонат калия или натрийгексаметилдисилазид в растворителях как ТГФ, ДМСО и ДМФ. При этом R1-R8, LG и W определены, как описано выше,
Z соответствует связи и
X обозначает -C(O)-.
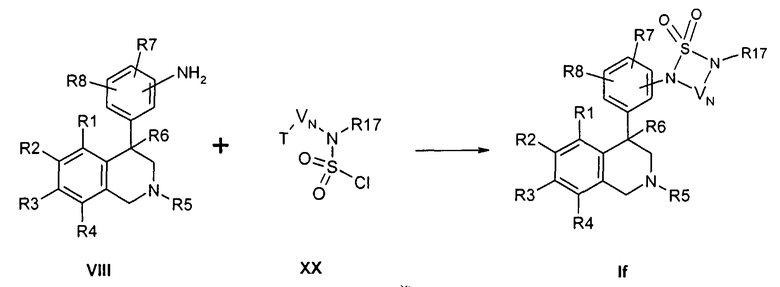
Сульфамиды формулы If могут быть получены исходя из анилинов формулы VIII путем превращения с хлоралкилсульфамилхлоридами формулы XX (Tetrahedron Letters 44, 5483 (2003)),
причем R1-R8, R17 и -VN-NR17- определены, как описано выше,
T обозначает Cl или Br,
X соответствует -SO2-
и
Z обозначает связь.
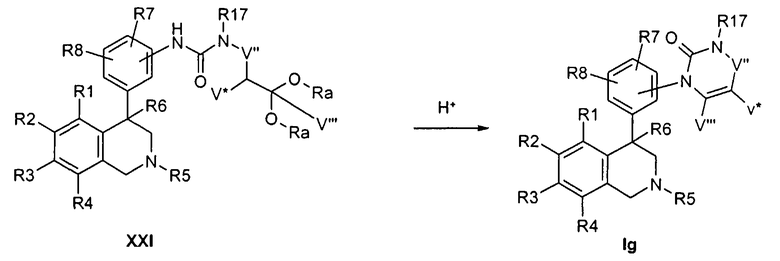
Соединения формулы Ig могут быть синтезированы посредством реакции циклизации, катализируемой кислотами. Исходя из мочевин формулы XXI, которые могут быть получены одним из вышеназванных методов в присутствии кислот, например соляной кислоты или муравьиной кислоты, при расщеплении кеталя или ацеталя получают соединения формулы Ig,
причем R1-R8 и R17 определены, как описано выше,
X соответствует -C(O)-,
Z обозначает связь,
-NR17-V''-CV*HCV'''(ORa)2 соответствует остатку W с обозначением CrH2r, в котором концевая CH2-группа замещена NR17, следующая CH2-группа замещена группировкой ацеталь/кеталь и V* и V''' указывают на возможные разветвления алкиленового остатка, причем Ra обозначает алкил с 1, 2, 3 или 4 атомами С, например метил или этил, или оба остатка Ra совместно образуют этиленовый остаток
и
-NR17-V''-CV*=CV'''- обозначает остаток W с обозначением CsH2s-2, в котором концевая CH2-группа замещена NR17, и V* и V''' указывают на возможные разветвления алкенилового остатка.
Соединения формулы Ih могут быть получены тем, что сначала анилин VIII подвергают превращению с хлортиоформиатами формулы XXVI как фенилхлортиоформиат, и затем, полученный промежуточный тиокарбамат после обработки раствором метилата натрия может реагировать с хлорангидридом кислоты типа XXVII. При этом остатки R1-R8, R24 и LG определены, как указано выше.
VK обозначает группу W, которая укорочена на одну группу CH2,
VS-S- обозначает группу W, в которой одна CH2-группа замещена серой и
X и Z соответствуют -C(O)-.
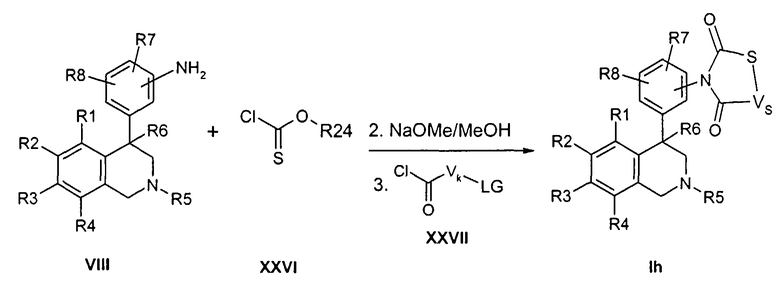
Соединения формулы Ii могут быть синтезированы в трехстадийной последовательности, как указано. Сначала анилины типа VIII подвергают превращению в апротонном растворителе, как ТГФ, в присутствии основания, как натрийгексаметилдисилазид, с хлорангидридами кислот типа XXVIII с образованием промежуточных амидов. Затем в присутствии нуклеофилов и оснований, как карбонат калия, в метаноле отделяют защитную группу P от кислорода. Наконец, полученный спирт в апротонном растворителе, как ТГФ, подвергают превращению с эквивалентом карбонила, как 1,1-карбонилдиимидазол или фосген, в присутствии основания, как натрийгексаметилдисилазид.
Остатки R1-R8 определены, как указано выше,
VO-O- соответствует группе W, в которой одна CH2-группа замещена кислородом,
P соответствует защитной группе, как ацетил, бензоил, бензоксикарбонил или тритил, и
X и Z соответствуют -C(O)-.
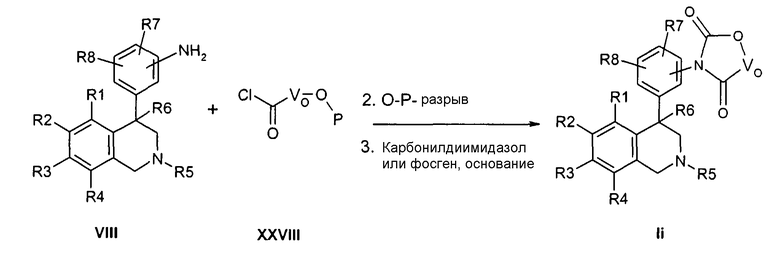
Соединения формулы Ij могут быть получены тем, что анилины формулы VIII подвергают превращению с хлорформатами формулы XXX в апротонном растворителе, как ТГФ, и затем полученный промежуточный карбамат подвергают циклизации в апротонном растворителе, как ТГФ, в присутствии основания, как гидрид натрия. При этом остатки R1-R8, LG и VO-O определены, как указано выше, и
Z соответствует связи, и
X обозначает -C(O)-.
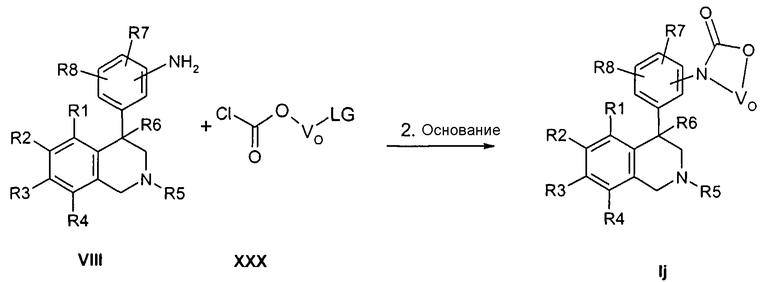
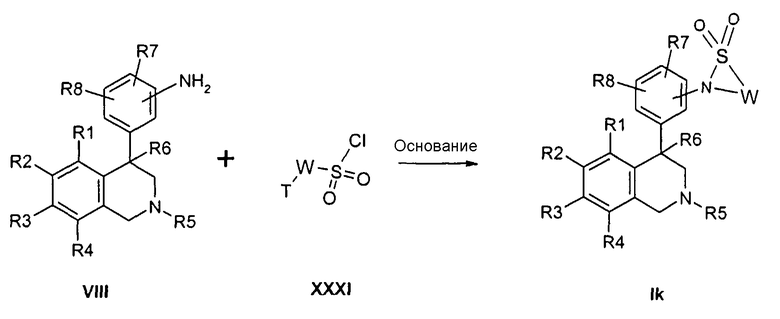
Соединения формулы Ik могут быть получены тем, что анилины формулы VIII подвергают превращению с сульфонилхлоридом формулы XXXI в апротонном растворителе, как ТГФ, в присутствии основания, как натрийгексаметилдисилазид. При этом остатки R1-R2, T и W определены, как указано выше, и
Z соответствует связи, и
X обозначает -SO2-.
Соединения формул XII, XIII, XIV, XV, XVI, XVII, XIX, XX, XXII, XXV, XXVI, XXVII, XXVIII, XXIX, XXX и XXXI являются коммерчески доступными или могут быть получены по аналогии с описанными в литературе способами, известными специалисту.
Исходные соединения формулы VIII могут быть получены следующим образом.
Посредством восстановления карбонильной группы в соединениях формулы VI и последующей циклизации соответствующих спиртов формулы VII, катализируемой кислотами (ср. Tetrahedron Lett. 1989, 30, 5837; Org. Prep. Proced. Int. 1995, 27, 513), известным способом могут быть получены тетрагидроизохинолины формулы VIIIa, причем R1-R8 определены, как указано выше, и
R20 обозначает известную специалисту защитную группу для азота, например ацетильный остаток.
До соединений формулы VIII затем доходят известным специалисту способом, исходя из соединений типа формулы VIIIa, тем что удаляют защитную группу R20. Это происходит в протонном растворителе как вода или низшие спирты предпочтительно при кислотном катализе, например, соляной кислотой или трифторуксусной кислотой, или при щелочном катализе, например, в присутствии метилата или этилата натрия.
Альтернативно, после произошедшего восстановления защитная группа R20 может быть отщеплена перед циклизацией, что предпочтительно удается в присутствии сильных оснований, например метилата- или этилата натрия в метаноле или этаноле. А также группа R20 может быть предпочтительно удалена с помощью кислот как соляная кислота в присутствии спиртов как метанол или этанол. Предварительное удаление R20 особенно рекомендуется в случае ортоаминопроизводных. Так непосредственно получают незащищенные анилины формулы VIII.
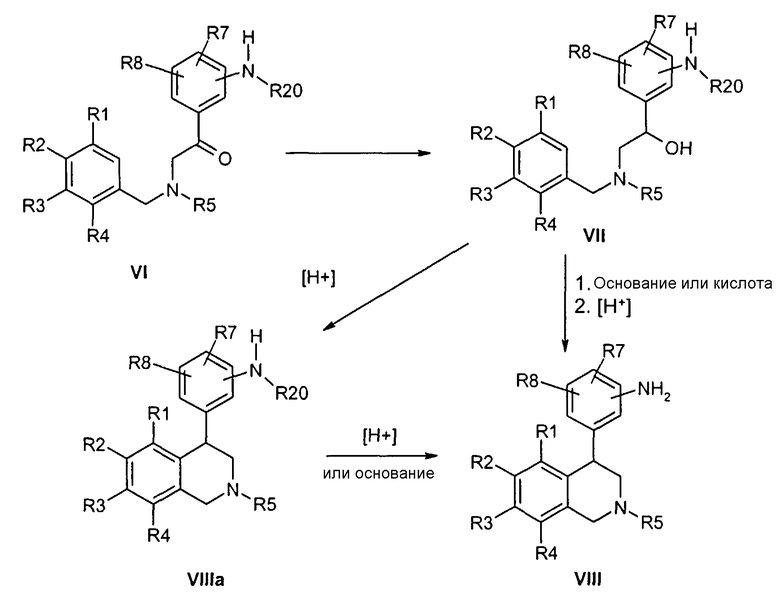
Для получения алкилразветвленных соединений формулы I, в которых R6 не является водородом, соответствующие сложные дифенилуксусные сложные эфиры формулы IX в альфа-положении к R6 могут быть алкилированы известными методами. При этом предпочтительно замещают атом водорода анилина защитной группой R21, например аллилом или бензилом. Соединения формулы X могут быть переведены стандартными методами в соответствующие амиды формулы XI, которые переводят в желаемые тетрагидроизохинолины формулы VIIIb по аналогичным реакциям Пикте-Шпенглера (ср. Tetrahedron 1987, 43, 439; Chem. Pharm. Bull. 1985, 33, 340),
причем R1-R8 и R20 определены, как указано выше,
R21 обозначает защитную группу, например аллил или бензил,
и
LG соответствует подвижной отделяемой группе при алкилировании как, например, бромид, хлорид, тозилат или мезилат.
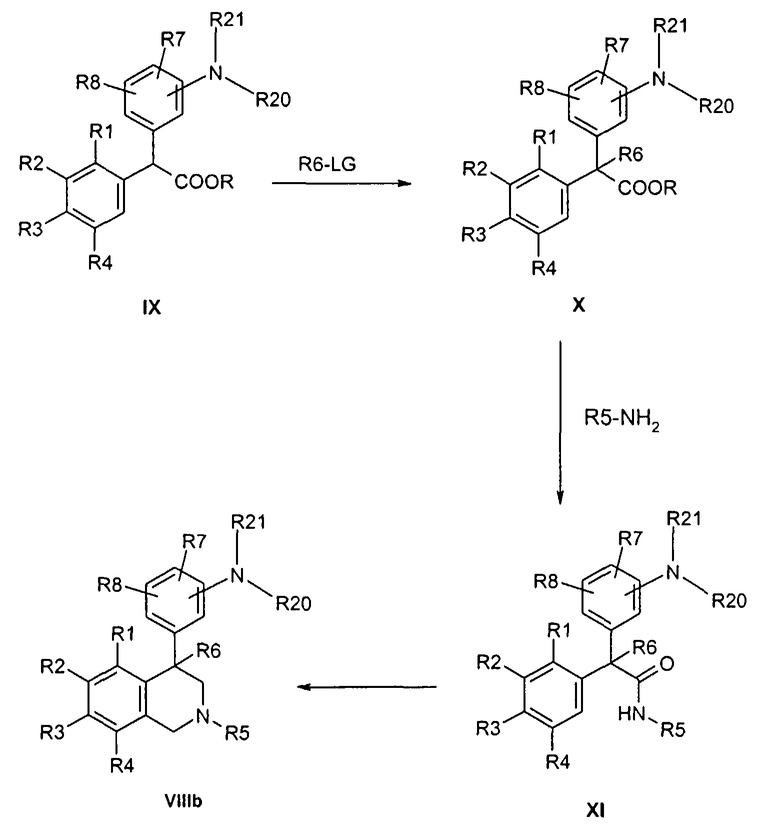
Снятие защиты соединений формулы VIIIb с помощью известных специалисту способов дает свободный анилин формулы VIII. При этом в зависимости от вида защитной группы карбонильные защитные группы, как ацетил, предпочтительно отделяются при кислотном (например, водный HCl) или основном катализе (например, с помощью метилата или этилата натрия), в то время как бензильная или аллильная защитные группы лучше всего отщепляются посредством гидрирования.
Соединения формулы IX являются коммерчески доступными или могут быть получены по аналогии с описанными в литературе способами, известными специалисту.
Используемые выше соединения формулы VI предпочтительно получают известными специалисту способами из бензиламинов формулы IV и соответствующих аминозамещенных соединений альфа-бромацетофенона формулы V,
причем R1-R8 и R20 определены, как указано выше.
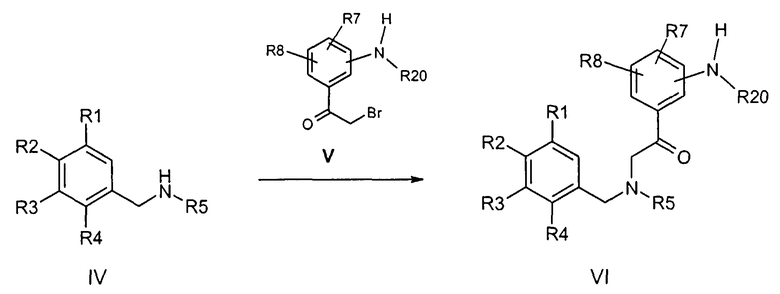
Соединения альфа-бромацетофенона формулы V могут быть получены по известным из литературы способам из соответственных предшественников ацетофенона посредством бромирования.
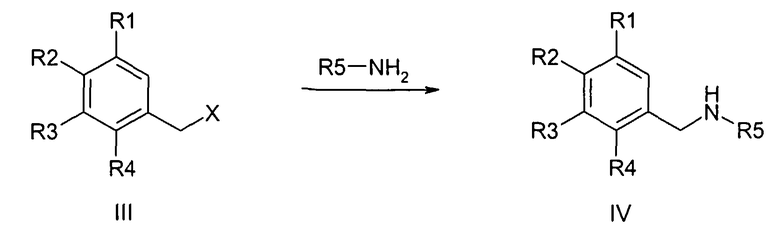
Предшественники бензиламина формулы IV, если они не являются коммерчески доступными, могут быть синтезированы известными специалисту стандартными способами из соответствующих бензилхлоридов или -бромидов формулы III и соответствующих аминов,
причем R1-R5 определены, как описано выше,
и
X обозначает F, Cl, Br или I, в особенности Cl или Br.
Альтернативно, соединения формулы IV могут быть получены также путем восстановительного аминирования альдегида формулы IIIa известными специалисту стандартными способами,
причем R1-R5 определены, как описано выше.
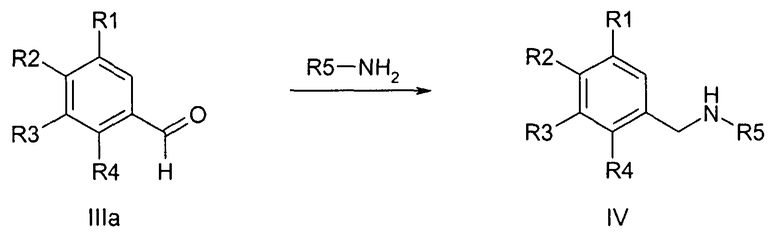
Соединения формул III и IIIa, и R5-NH2 являются коммерчески доступными или могут быть получены по аналогии с описанными в литературе способами, известными специалисту.
Обработка и, при желании, очистка продуктов и/или промежуточных продуктов происходит с помощью обычных методов, как экстракция, хроматография или кристаллизация и обычная сушка.
Было показано, что соединения формулы I представляют собой исключительные ингибиторы натрий-водородного обмена (NHE), в особенности натрий-водородного обмена субтипа 3 (NHE3).
До сих пор известные ингибиторы NHE3 происходили, например, от соединений типа ацилгуанидина (EP 825178), типа норборниламина (WO 0144164), типа 2-гуанидинхиназолина (WO 0179186) или типа бензамидина (WO 0121582, WO 0172742). Скваламин, также описанный в качестве ингибитора NHE3 (M. Donowitz et al., Am. J. Physiol. 276 (Cell Physiol. 45): C136-C144), действует по современному уровню знаний не непосредственно, как соединения формулы I, а через непрямой механизм, и, таким образом, его максимальная сила действия достигается только через час.
Тетрагидроизохинолины в качестве ингибиторов натрийводородного обмена субтипа 3 (NHE3) уже описаны в заявках на патент WO 03048129, WO 2004085404 и заявке Германии №102004046492.8. В заявке на патент WO 03055880 описаны используемые соединения класса солей тетрагидроизохинолиния как ингибиторы NHE3. Неожиданно было найдено, что описанные здесь соединения формулы I также являются эффективными ингибиторами NHE3 и при этом обладают предпочтительными фармакологическими и фармакокинетическими свойствами.
NHE3 имеет место в организме различных видов, предпочтительно в желчном пузыре, кишечнике и в почках (Larry Fliegel et al., Biochem. Cell. Biol. 76: 735-741, 1998), а также обнаружен в головном мозге (E. Ma et al., Neuroscience 79: 591-603).
Благодаря своим свойствам, ингибирующим NHE, соединения формулы I пригодны для профилактики и лечения заболеваний, вызванных активацией или активированным NHE, а также заболеваний, вызванных вторичными нарушениями, обусловленными NHE. Соединения формулы I также могут быть использованы для лечения и профилактики заболеваний, причем NHE ингибируют только частично, например при использовании сниженных доз.
Применение соединений согласно изобретению относится к профилактике и лечению острых и хронических заболеваний в ветеринарной медицине и медицине человека.
Вследствие своего фармакологического действия соединения формулы I пригодны для улучшения импульса дыхания. Поэтому они могут использоваться для лечения нарушенных состояний дыхания, которые могут возникать, например, при следующих клинических состояниях и заболеваниях: нарушение центрального импульса дыхания (например, центральная остановка дыхания во сне, внезапная детская смерть, послеоперационная гипоксия), мышечно-обусловленные нарушения дыхания, нарушения дыхания после длительной искусственной вентиляции легких, нарушения дыхания при адаптации в высокогорье, обструктивные и смешанные формы остановки дыхания во сне, острые и хронические заболевания легких с гипоксией и гиперкапнией.
Дополнительно соединения повышают мышечный тонус верхних дыхательных путей, так что храп подавляется. Поэтому названные соединения находят предпочтительное применение для получения лекарственного средства для профилактики и лечения остановки дыхания во сне и мышечно-обусловленных нарушений дыхания и для получения лекарственного средства для профилактики и лечения храпа.
Комбинация ингибитора NHE формулы I с ингибитором карбоангидразы (например, ацетазоламидом) может оказаться предпочтительной, причем последний приводит к метаболическому ацидозу и тем самым уже повышает дыхательную деятельность, так что может быть достигнуто усиленное действие и уменьшенное введение биологически активного вещества.
Соединения согласно изобретению благодаря своему ингибирующему NHE3 действию сберегают клеточные запасы энергии, которые при токсических и патогенных ситуациях быстро исчерпываются и таким образом приводят к повреждению или гибели клетки. При этом энергозатратная резорбция натрия, расходующая ATP, в проксимальных канальцах под влиянием ингибиторов NHE3 временно затихает (успокаивается) и клетка, таким образом, может перенести острую патогенную, ишемическую или токсическую ситуацию. Поэтому соединения пригодны, например, в качестве лекарственных средств для лечения ишемических вредных факторов, например острой почечной недостаточности.
Далее, соединения также пригодны для лечения всех хронических заболеваний почек и форм нефрита, которые вследствие увеличенного выделения белка приводят к хронической почечной недостаточности. Соответственно этому, соединения формулы I пригодны для получения лекарственного средства для лечения диабетических поздних повреждений, диабетической нефропатии и хронических заболеваний почек, в особенности всех воспалений почек (нефритов) (Nephritiden), которые связаны с увеличенным выделением протеина/альбумина.
Было показано, что используемые согласно изобретению соединения обладают мягким очищающим кишечник действием и вследствие этого также предпочтительно могут быть использованы в качестве слабительного или при угрожающих запорах.
Далее соединения согласно изобретению предпочтительно могут быть использованы для профилактики и лечения острых и хронических заболеваний кишечного тракта, вызываемых, например, ишемическими состояниями в кишечной области и/или последующей реперфузией, или воспалительными состояниями и ситуациями. Такие осложнения могут, например, наблюдаться при недостаточной перистальтике кишечника, например часто после хирургических вмешательств, при запоре или при сильно уменьшенной деятельности кишечника.
С помощью соединений согласно изобретению возникает возможность предупреждать образование желчных камней.
Ингибиторы NHE согласно изобретению универсально пригодны для лечения заболеваний, вызываемых ишемией и реперфузией.
Соединения согласно изобретению благодаря своим фармакологическим свойствам пригодны в качестве антиаритмических средств.
Благодаря своим кардиозащитным компонентам ингибиторы NHE исключительно пригодны для профилактики и лечения инфаркта, а также для лечения стенокардии, причем они также превентивно ингибируют или сильно сокращают патофизиологические процессы при возникновении ишемически индуцированных нарушений, в особенности при возникновении ишемически индуцированных сердечных аритмий. Благодаря их защитному действию по отношению к патологическим гипоксическим и ишемическим ситуациям соединения формулы I, используемые согласно изобретению, вследствие ингибирования клеточного механизма Na+/H+-ионообмена, могут быть использованы в качестве лекарственных средств для лечения всех острых или хронических нарушений, вызванных ишемией, или первично или вторично индуцированными заболеваниями.
Это касается также их применения в качестве лекарственных средств при хирургических вмешательствах. Так соединения согласно изобретению могут быть использованы при трансплантации органов, причем соединения могут быть использованы как для защиты органов донора перед и во время изъятия, для защиты изымаемых органов, например при лечении или их хранении в физиологическом растворе, а также при введении в организм реципиента, подвергаемый лечению соединениями формулы I.
Соединения также являются ценными лекарственными средствами с защитным действием при проведении ангиопластических операций, например на сердце, а также на периферических органах и сосудах.
Далее соединения согласно изобретению могут использоваться при проведении наложения байпаса, например при наложении байпаса на коронарные сосуды и при шунтировании коронарной артерии (Coronary Artery Bypass Graft) (CABG).
В соответствии со своим действием против нарушений, вызванных ишемией, соединения формулы I могут также быть использованы для реанимации после остановки сердца.
В соответствии со своим защитным действием против ишемически индуцированных повреждений соединения согласно изобретению также пригодны в качестве лекарственных средств для лечения ишемии нервной системы, в особенности центральной нервной системы (ЦНС), причем они, например, пригодны для лечения апоплексического удара или отека головного мозга.
Так как ингибиторы NHE не только эффективно защищают ткани и органы человека от повреждений, вызываемых ишемией и реперфузией, но и от цитотоксического действия лекарственных средств, в особенности используемых при лечении рака и аутоиммунных заболеваний, пригодно комбинированное применение соединений формулы I, которое может снизить или подавить цитотоксический эффект терапии. Путем уменьшения цитотоксического эффекта, в особенности кардиотоксичности, вследствие дополнительного назначения лекарства с ингибиторами NHE, кроме того, доза цитотоксического терапевтического средства может быть увеличена и/или предписание врача с такими лекарствами продлено. Терапевтическая польза такой цитотоксической терапии может быть существенно увеличена посредством комбинации с ингибиторами NHE.
Соединения формулы I в особенности пригодны для улучшения лечения лекарственными средствами, которые содержат нежелательные кардиотоксические компоненты.
В целом описанные здесь ингибиторы NHE благоприятным образом могут быть комбинированы с другими соединениями, также регулирующими внутриклеточное значение pH, причем имеются в виду ингибиторы ферментных групп карбоангидратаз, ингибиторы систем, транспортирующих бикарбонатные ионы, как ингибиторы натрий-бикарбонатного совместного транспортера (NBC) или зависимого от натрия хлоридбикарбонатного ионообменника (NCBE), а также с другими ингибиторами NHE с ингибирующим действием на другие субтипы NHE в качестве компонентов для комбинации, так как с их помощью существенный фармакологический регулирующий pH эффект описанных здесь ингибиторов NHE может быть усилен или модулирован.
В соответствии со своим защитным действием против ишемически индуцированных повреждений соединения согласно изобретению также пригодны в качестве лекарственных средств для лечения ишемии нервной системы, в особенности центральной нервной системы, причем они, например, пригодны для лечения апоплексического удара или отека головного мозга.
Соединения формулы I пригодны также для лечения и профилактики заболеваний и нарушений, вызванных повышенной возбудимостью центральной нервной системы, в особенности для лечения заболеваний, входящих в сферу эпилептических, вызванных клоническими и тоническими спазмами центральной нервной системы, психических депрессивных состояний, состояний страха и психозов. При этом ингибиторы NHE согласно изобретению могут быть использованы по отдельности или в комбинации с другими антиэпилептически действующими веществами или антипсихотическими биологически активными веществами, или ингибиторами карбоангидратаз, например, с ацетазоламидом, а также с другими ингибиторами NHE или натриево-зависимыми хлоридбикарбонатными ионообменниками (NCBE).
В дополнение к этому соединения формулы I согласно изобретению пригодны также для лечения заболеваний в форме шока, как, например, аллергический, кардиогенный, гиповолемический и бактериальный шок.
Соединения формулы I также могут использоваться для профилактики и лечения тромботических заболеваний, так как они в качестве ингибиторов NHE и сами могут ингибировать агрегацию тромбоцитов. Кроме этого они могут ингибировать или предотвращать высвобождение медиаторов воспаления и коагуляции, в избытке присутствующих после ишемии и реперфузии, в особенности фактор Виллебранда и тромбогенные селективные протеины. Тем самым может быть уменьшено и исключено патогенное действие тромбогенных и существенных воспалительных факторов. Поэтому ингибиторы NHE согласно данному изобретению комбинируемы с другими антикоагуляционными и/или тромболитическими биологически активными веществами, как, например, плазминогенные активаторы рекомбинантных или естественных тканей, стрептокиназы, урокиназы, ацетилсалициловая кислота, антагонисты тромбина, антагонисты фактора Xa, фибринолитически действующие лекарственные средства, антагонисты рецептора тромбоксана, ингибиторы фосфодиэстеразы, антагонисты фактора-VIIa, клопидогрел (Clopidogrel), тиклопидин и т.д. Комбинированное использование данных ингибиторов NHE с ингибиторами NCBE и/или с ингибиторами карбоангидратазы, например, с ацетазоламидом, особенно предпочтительно.
Кроме этого, ингибиторы NHE согласно изобретению характеризуются сильным ингибирующим действием на пролиферацию клеток, например, пролиферацию фибробластов и пролиферацию гладких клеток мускулатуры сосудов. Поэтому речь идет о соединениях формулы I в качестве ценных терапевтических средств для заболеваний, у которых пролиферация клеток является первичной или вторичной причиной, и поэтому они могут использоваться в качестве средств против атеросклероза, средств против хронической почечной недостаточности, онкологических заболеваний. Таким образом, они могут использоваться для лечения гипертрофии и гиперплазии органов, например сердца и простаты. Поэтому соединения формулы I пригодны для профилактики и лечения сердечной недостаточности (повреждение закупорившегося сердца) (congestive heart failure = CHF), а также для лечения и профилактики гиперплазии простаты или гипертрофии простаты.
Ингибиторы NHE далее характеризуются замедлением или предотвращением заболеваний, вызванных фиброзом. Таким образом, они пригодны в качестве отличных средств для лечения фиброзов сердца, а также фиброза легких, фиброза печени, фиброза почек и других фиброзных заболеваний.
Так как NHE у эссенциальных гипертоников является значительно повышенным, соединения формулы I пригодны для профилактики и лечения повышенного кровяного давления и сердечно-сосудистых заболеваний. При этом они могут использоваться отдельно или совместно с пригодными компонентами для комбинаций для лечения повышенного кровяного давления и сердечно-сосудистых заболеваний. Так, например, один или несколько тиазидоподобно действующих мочегонных средств, петлевых диуретиков, антагонистов альдостерона и псевдоальдостерона, как гидрохлоротиазид, индапамид, политиазид, фуросемид, пиретанид, торасемид, буметанид, амилорид, триамтерен, спиронолактон или эплерон, могут быть скомбинированы с соединениями формулы I. Далее, ингибиторы NHE данного изобретения могут использоваться в комбинации с антагонистами кальция, как верапимил, дилтиазем, амлодипин или нифедипин, а также с ингибиторами ACE, как, например, рамиприл, эналаприл, лисиноприл, фосиноприл или каптоприл. Другими благоприятными компонентами для комбинаций также являются β-блокаторы, как метопролол, албутерол и т.д., антагонисты рецептора ангиотензина и субтипов его рецепторов, как лосартан, ирбесартан, валсартан, омапатрилат, гемопатрилат, антагонисты эндотелина, ингибиторы ренина, агонисты рецепторов аденозина, ингибиторы и активаторы калиевых каналов как глибенкламид, глимепирид, диазоксид, кромокалим, миноксидил и их производные, активаторы митохондриального чувствительного к ATP (АТФ) калиевого канала (mitoK(ATP) Kanal), ингибиторы других калиевых каналов, как Kv1.5 и т.д.
Вследствие своего противовоспалительного действия, ингибиторы NHE согласно изобретению могут быть использованы в качестве противовоспалительных средств. Механистически при этом обращают на себя внимание ингибиторы высвобождения медиаторов воспаления. Таким образом, соединения могут использоваться по отдельности или в комбинации с противовоспалительным средством для профилактики или лечения хронических и острых воспалительных заболеваний. В качестве компонентов для комбинаций предпочтительно используют стероидные и нестероидные противовоспалительные средства.
Кроме того, было найдено, что ингибиторы NHE оказывают благоприятное влияние на сывороточные липопротеины. Поэтому они могут использоваться для профилактики и регрессии атеросклеротических изменений, в которых они исключают причинный фактор риска. Сюда относятся не только первичные гиперлипидемии, но и известные вторичные гиперлипидемии, которые встречаются, например, при диабете. Кроме того, ингибиторы NHE приводят к явному снижению инфарктов, вызванных нарушением обмена веществ, и в особенности, к значительному сокращению индуцированного масштаба инфаркта и его степени тяжести. Поэтому ингибиторы NHE формулы I предпочтительно находят применение для получения лекарственного средства для лечения гиперхолистеринемии, для получения лекарственного средства для предупреждения атерогенеза, для получения лекарственного средства для профилактики и лечения атеросклероза, для получения лекарственного средства для профилактики и лечения заболеваний, вызванных повышенным уровнем холестерина, для получения лекарственного средства для профилактики и лечения заболеваний, вызванных эндотелиальной дисфункцией, для получения лекарственного средства для профилактики и лечения гипертонии, индуцированной атеросклерозом, для получения лекарственного средства для профилактики и лечения тромбозов, индуцированных атеросклерозом, для получения лекарственного средства для профилактики и лечения ишемических нарушений и пост-ишемических реперфузионных нарушений, индуцированных гиперхолистеринемией и эндотелиальной дисфункцией, для получения лекарственного средства для профилактики и лечения сердечной гипертрофии и кардиомиопатии и конгестивной сердечной недостаточности (CHF), для получения лекарственного средства для профилактики и лечения коронарных спазмов сосудов и миокардиального инфаркта, индуцированных гиперхолистеринемией и эндотелиальной дисфункцией, для получения лекарственного средства для лечения названных болезней в комбинации с веществами, снижающими кровяное давление, предпочтительно с ингибиторами ферментов, преобразующих ангиотензин (Angiotensin Converting Enzyme) (ACE) и антагонистов рецепторов ангиотензина. Комбинация ингибитора NHE формулы I с биологически активными веществами, снижающими уровень жира в крови, предпочтительно с ингибитором HMG-CoA-редуктазы (например, ловастатином или правастатином), причем последний приводит к гиполипидемическому действию и вследствие этого гиполипидемические свойства ингибитора NHE формулы I повышаются, представляет собой благоприятную комбинацию с усиленным действием и сниженным использованием биологически активных веществ.
Таким образом, ингибиторы NHE ведут к эффективной защите против повреждений эндотелия различного генеза. С этой защитой сосудов против синдрома эндотелиальной дисфункции ингибиторы NHE являются ценными лекарственными средствами для профилактики и лечения спазмов коронарных сосудов, заболеваний периферических сосудов, в особенности интермиттирующей хромоты (claudicatio intermittens), атерогенеза и атеросклероза, левожелудочковой гипертрофии и дилатационной кардиомиопатии и тромботических заболеваний.
Кроме того, ингибиторы NHE пригодны для лечения неинсулинозависимого диабета (NIDDM), причем, например, резистентность к инсулину подавляется. При этом усилению антидиабетического эффекта и качеству действия соединений согласно изобретению может способствовать их комбинирование с бигуанидом, как метформин, с антидиабетической сульфонилмочевиной, как глибенкламид (Glyburid), глимепирид, толбутамид и т.д., ингибитором глюкозидазы, агонистом PPAR, как росиглитазон, пиоглитазон и т.д., с инсулиновыми препаратами различных форм применения, с ингибитором DB4, с сенсибилизатором инсулина или с меглитинидом.
Кроме острых антидиабетических эффектов ингибиторы NHE противодействуют возникновению диабетических поздних осложнений и поэтому могут использоваться в качестве лекарственных средств для профилактики и лечения диабетических поздних нарушений, как диабетическая нефропатия, диабетическая невропатия, диабетическая ретинопатия, диабетическая кардиомиопатия и другие заболевания, возникающие как следствие диабета. При этом они могут предпочтительно комбинироваться с антидиабетическими лекарственными средствами, описанными выше при лечении NIDDM. Комбинация с благоприятными формами применения инсулина при этом может иметь особое значение.
Ингибиторы NHE помимо защитного действия против острых ишемических ситуаций и последующих также остро отягощенных реперфузионных ситуаций обнаруживают также прямое терапевтическое действие против заболеваний и нарушений всего организма млекопитающих, которые тесно связаны с симптомами хронически протекающего процесса старения и которые также имеются независимо от острых состояний недостаточного кровоснабжения и также могут встречаться при нормальных, неишемических условиях. При этих патологических, возникающих после продолжительного старения возрастных проявлениях, как недомогания, хилость и смерть, которые в последнее время смогли сделать доступными для лечения с помощью ингибиторов NHE, речь идет о заболеваниях и нарушениях, в значительной степени обусловленных возрастными изменениями жизненно необходимых органов и их функций, приобретающих в стареющем организме возрастающее значение.
Заболеваниями, связанными с функциональными возрастными нарушениями, с обусловленными возрастом симптомами износа органов, являются, например, недостаточная контактность и способность кровеносных сосудов к реакции по отношению к контракции и реакциям релаксации. Это обусловленное возрастом ослабление способности к реакции сосудов на сжимающее и релаксирующее возбуждение, которое является существенным процессом сердечно-сосудистой системы и тем самым жизни и здоровья, может быть в значительной степени ликвидировано или сокращено с помощью ингибиторов NHE. Важной функцией и мерой для поддерживания способности сосудов к реакции является блокада или ретардация возрастной прогрессирующей эндотелиальной дисфункции, которая может быть значительно сокращена с помощью ингибиторов NHE. Таким образом, ингибиторы NHE исключительно пригодны для лечения и профилактики возрастной прогрессирующей эндотелиальной дисфункции, в особенности интермиттирующей хромоты. Кроме того, таким образом, ингибиторы NHE исключительно пригодны для лечения и профилактики сердечной недостаточности, congestive heart failure (CHF), а также для лечения и, в особенности, для профилактики обусловленных возрастом форм рака.
При этом принимают во внимание комбинацию с понижающими кровяное давление лекарственными средствами, как, например, ингибиторы ACE, антагонисты рецепторов ангиотензина, мочегонные средства, антагонисты Ca2+ и т.д., или с лекарственными средствами, нормализирующими обмен веществ, как вещества, понижающие холестерин. Таким образом, соединения формулы I пригодны для профилактики возрастных изменений тканей и для продления жизни при сохранении высокого качества жизни.
Соединения согласно изобретению являются эффективными ингибиторами клеточного антипорта натрий/протон (согласованного переноса двух растворов через мембрану в противоположных направлениях) (ионообменник Na/H), который при многочисленных заболеваниях (эссенциальная гипертония, атеросклероз, диабет и т.д.) в таких клетках также повышен, измерения являются легко доступными, как, например, в эритроцитах, тромбоцитах или лейкоцитах. Поэтому используемые согласно изобретению соединения пригодны в качестве исключительных и простых научных инструментов, например, при их применении в качестве диагностикумов для определения и распознавания определенных форм гипертонии, а также атеросклероза, диабета и поздних диабетических осложнений, пролиферативных заболеваний и т.д.
Далее ингибиторы NHE пригодны для лечения заболеваний (человека и животных), вызванных бактериями, а также простейшими. Среди заболеваний, вызванных простейшими, в особенности можно назвать малярию у человека и куриный кокцидиоз.
Кроме того, соединения пригодны в качестве средств для борьбы с сосущими паразитами в медицине человека и ветеринарии, а также для защиты растений. При этом предпочтительно использование в качестве средств против кровососущих паразитов в медицине человека и ветеринарии.
Поэтому названные соединения находят применение по отдельности или в комбинации с другими лекарственными средствами или биологически активными веществами для получения лекарственного средства для лечения или профилактики нарушений импульса дыхания, нарушений дыхания, нарушений дыхания во сне, остановки дыхания во сне, храпа, острых и хронических заболеваний почек, острой почечной недостаточности и хронической почечной недостаточности, нарушений функции кишечника, повышенного кровяного давления, эссенциальной гипертонии, заболеваний центральной нервной системы, заболеваний, являющихся результатом возбудимости ЦНС (ZNS), эпилепсии и судорог или состояния страха, депрессий и психозов, вызываемых центральной нервной системой, ишемических состояний периферийной или центральной нервной системы или апоплексического удара, острых и хронических нарушений и заболеваний органов и конечностей, обусловленных ситуациями ишемии или реперфузии, атеросклероза, нарушений жирового обмена, тромбозов, нарушений функции желчного пузыря, поражения эктопаразитами, заболеваний вследствие эндотелиальной дисфункции, заболеваний, вызванных простейшими, малярии, для консервации и хранения трансплантатов для хирургических мероприятий, для использования при хирургических операциях и трансплантации органов или для лечения шоковых состояний или сахарного диабета и поздних нарушений, являющихся следствием диабета, или заболеваний, первичной или вторичной причиной которых является пролиферация клеток, и для сохранения здоровья и продления жизни.
Далее изобретение касается применения соединений формулы I и их фармацевтически приемлемых солей для применения в качестве лекарственных средств.
Далее, изобретение касается также лекарственных средств для использования в медицине человека, ветеринарии или для защиты растений, содержащих эффективное количество соединения формулы I и/или его фармацевтически приемлемой соли, а также лекарственных средств для использования в медицине человека, ветеринарии или для защиты растений, содержащих эффективное количество соединения формулы I и/или его фармацевтически приемлемой соли по отдельности или в комбинации с одним или несколькими другими фармакологическими биологически активными веществами или лекарственными средствами.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемые соли, можно принимать, например, орально, парентерально, внутримышечно, внутривенно, ректально, назально, путем ингаляции, подкожно или путем пригодных чрескожных форм применения, причем предпочтительное применение зависит от соответствующей формы проявления болезни. Соединения формулы I при этом могут использоваться по отдельности или вместе с галеновыми вспомогательными веществами как в ветеринарной медицине, так и в медицине человека, и для защиты растений. Лекарственные средства содержат биологически активные вещества формулы I и/или их фармацевтически приемлемые соли в общем в количестве от 0,01 мг до 1 г на единицу дозы.
Какие вспомогательные вещества пригодны для желаемых лекарственных готовых форм, известно специалисту благодаря его специальным знаниям. Помимо растворителей, гелеобразователей, основ суппозиториев, вспомогательных веществ для таблеток и других носителей биологически активных веществ могут быть использованы, например, антиоксиданты, диспергаторы, эмульгаторы, антивспениватели, вещества, улучшающие вкус, консервирующие средства, агенты растворения или красители.
Для оральных форм приема активные соединения смешивают с пригодными для этого добавками, как носители, стабилизаторы или инертные разбавители, и с помощью обычных методов доводят до пригодных форм применения, как таблетки, драже, вкладывающиеся капсулы (Steckkapseln), водные, спиртовые или масляные растворы. В качестве инертных носителей могут быть использованы, например, гуммиарабик, магнезия, карбонат магния, фосфат калия, молочный сахар, глюкоза или крахмал, в особенности кукурузный крахмал. При этом композиция может существовать в виде как сухого, так и влажного гранулята. В качестве масляных носителей или в качестве растворителей используют, например, растительные или животные масла, например подсолнечное масло или рыбий жир.
Для подкожного, чрескожного или внутривенного введения употребляют используемые активные соединения по желанию с общепринятыми для этого веществами, как агенты растворения, эмульгаторы или другие вспомогательные вещества в растворе, суспензии или эмульсии. В качестве растворителей имеют в виду, например, воду, физиологический раствор поваренной соли или спирты, например этанол, пропанол, глицерин, наряду с этим также растворы сахаров, как растворы глюкозы или маннита, или также смесь из различных названных растворителей.
В качестве фармацевтических препаративных готовых форм для приема в форме аэрозолей или спреев пригодны, например, растворы, суспензии или эмульсии биологически активных веществ формулы I в фармацевтически безвредных растворителях, в особенности как этанол или вода, или смеси таких растворителей.
Препаративная готовая форма может при необходимости содержать и другие фармацевтические вспомогательные вещества, как тензиды, эмульгаторы и стабилизаторы, а также пропеллент. Одна такая препаративная готовая форма обычно содержит биологически активное вещество в концентрации от приблизительно 0,1 до 10, в особенности от приблизительно 0,3 до 3% вес.
Дозировка принимаемых биологически активных веществ формулы I и частота приема зависят от эффективности и времени воздействия используемых соединений; кроме того, также влияют вид и интенсивность болезни, подвергаемой лечению, а также пол, возраст, вес и индивидуальная предрасположенность млекопитающего, подвергаемого лечению.
В среднем дневная доза соединения формулы I при весе пациента около 75 кг составляет, по меньшей мере, 0,001 мг/кг, предпочтительно 0,1 мг/кг, вплоть до максимально 30 мг/кг, предпочтительно 1 мг/кг веса тела. В острых ситуациях, например непосредственно после перенесения состояния остановки дыхания в высокогорных областях, могут быть необходимы еще более высокие дозы. В особенности при внутривенном введении, например, у пациентов с инфарктом в отделении интенсивной терапии может быть необходима доза вплоть до 300 мг/кг в день. Дневная доза может быть разделена на одну или несколько, например вплоть до 4 разовых доз.
ОПИСАНИЕ ИСПЫТАНИЙ И ПРИМЕРЫ
Используемые сокращения
Общее
Из эпимеров C-4 формулы I один эпимер часто оказывается активнее, чем другие.
Поэтому используемые энантиомеры орто-, мета- и парааминов (2-, 3- или 4-(1,2,3,4-тетрагидроизохинолин-4-ил)фениламин, например 2-, 3- или 4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин), выделяли из хиральной фазы, как это описано в WO 2004085404.
Рацемические амины формулы VIII могут представлять собой, как это описано в WO 2004085404, например: рацемический параамин: 4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (пример 1, промежуточный продукт 6); мета-амин: 3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (пример 2, промежуточный продукт 1), ортоамин: 2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (пример 3, промежуточный продукт 5) и в последующем разделены на свои энантиомеры, как описано в заявке WO 2004085404, например, чистый энантиомер пара-амин: (S)-4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (пример 42, промежуточный продукт 1, энантиомер B); мета-амин: (S)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (пример 20, промежуточный продукт, энантиомер B); орто-амин: (R)-2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (пример 41, промежуточный продукт 1, энантиомер B).
2-(6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин и соответствующие (R)- и (S)-энантиомеры могут быть получены из этого, как описано в примере 41 b.
Описанные синтезы проводили, если не упомянуто другое, известным специалисту способом в атмосфере защитного газа, как аргон, в стандартных реакционных сосудах, как одно, двух или трехгорлые колбы, которые при необходимости были снабжены мешалкой, холодильником, устройством для прикапывания и тому подобным. Растворители отгоняли, если не указано другого, на роторном испарителе с пригодным вакуумом и при пригодной температуре.
Условия
Препаративная ВЭЖХ
Препаративную ВЭЖХ проводили при следующих условиях:
Аналитическая ВЭЖХ/МС
Методы ВЭЖХ
Метод A:
Метод B:
Масс-спектрометрия
Масс-спектрометр был непосредственно подключен к ВЭЖХ (LCMS). В качестве метода ионизации, если не указано другого, использовали рассеянные электроны (ESI+). Заданные времена удерживания относились на максимальный сигнал ионного тока соответствующего соединения, как они получались в соединении LCMS при помощи вышеупомянутой ВЭЖХ.
Пример 1
3-[4-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион
a) {3-[4-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]уреидо}этилацетатгидрохлорид;
4-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (95 мг; получение, как описано в WO 2004085404) растворяли в ацетонитриле (2 мл) и при перемешивании прикапывали этилизоцианатацетат (30 мг). Через четыре часа раствор концентрировали, и остаток очищали посредством препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали карбонатом калия и три раза экстрагировали этилацетатом. После сушки над сульфатом магния передавали для сушки. Остаток поглощали водным раствором соляной кислоты и сушили вымораживанием. Было получено 107 мг желаемого соединения.
LCMS-Rt (A): 1,14 мин;
[M+H+]: 436,5
b) 3-[4-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион
Брали {3-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]уреидо}этилацетатгидрохлорид (30 мг). Добавляли воду (3 мл) и 10%-ную соляную кислоту (231 мкл) и затем при перемешивании три часа нагревали с обратным потоком. После охлаждения и сушки вымораживанием реакционного раствора было получено белое твердое вещество.
LCMS-Rt (A): 0,98 мин;
[M+H+]: 390,4
Пример 2
3-[4-(-((S)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дионгидрохлорид
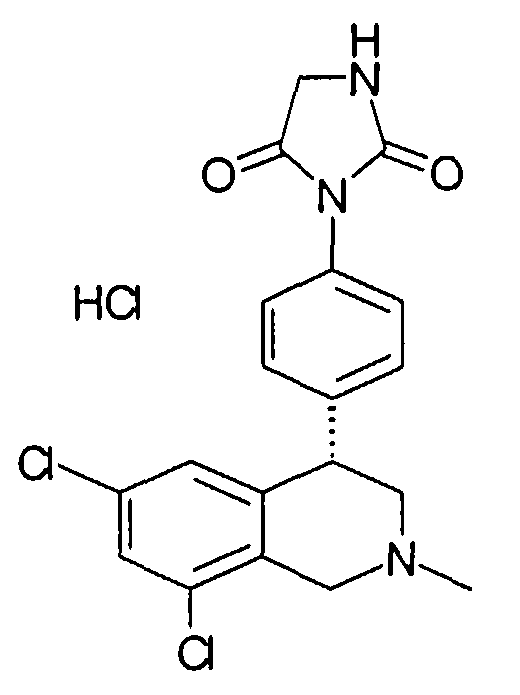
Пример 2 был синтезирован аналогично примеру 1. Необходимый для этого (S)-4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (энантиомер B, получение описано в WO 2004085404) был получен из рацемата посредством разделения на хиральные фазы.
LCMS-Rt (B): 0,89 мин;
[M+H+]: 390,1
Пример 3
3-[3-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион
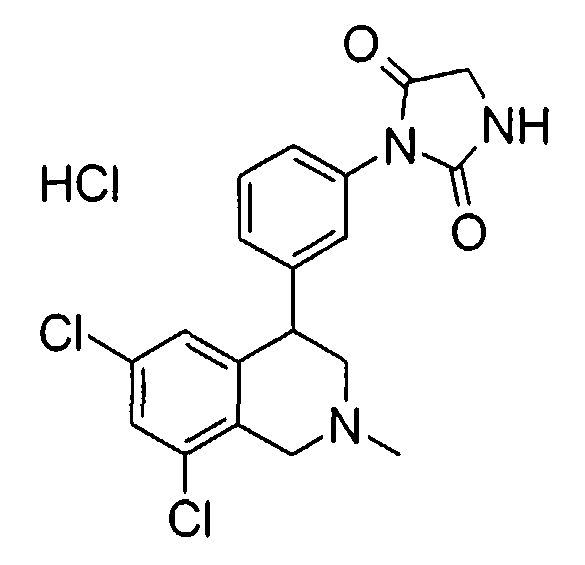
Пример 3 был синтезирован аналогично примеру 1. Необходимый для этого 3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин получали, как описано в WO 2004085404.
LCMS-Rt (A): 0,96 мин;
[M+H+]: 390,3
Пример 4
3-[3-((S)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дионгидрохлорид
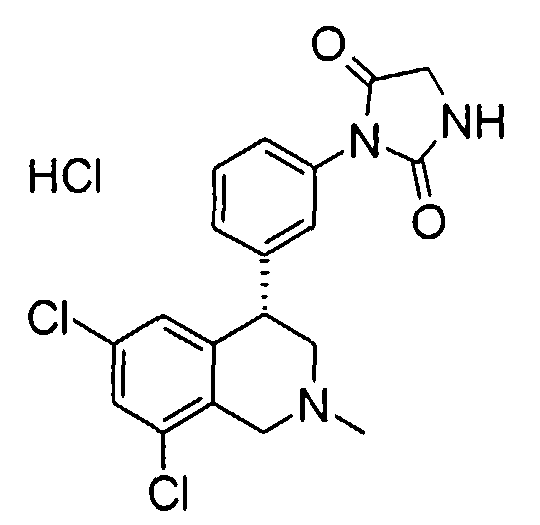
Пример 4 был синтезирован аналогично примеру 1. Необходимый для этого (S)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (энантиомер B, получение описано в WO 2004085404) был получен из рацемата посредством разделения на хиральные фазы.
LCMS-Rt (B): 0,90 мин;
[M+H+]: 390,0
Пример 5
3-[2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дионгидрохлорид
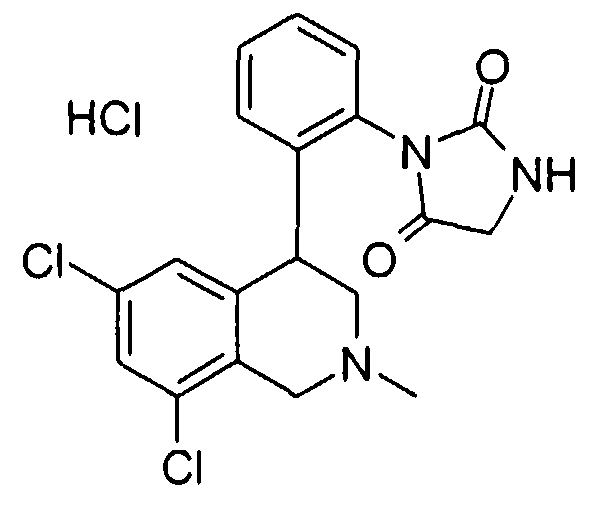
Пример 5 был синтезирован аналогично примеру 1. Необходимый для этого 2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин получали, как описано в WO 2004085404.
LCMS-Rt (A): 1,04 мин;
[M+H+]: 390,4
Пример 6
3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дионгидрохлорид
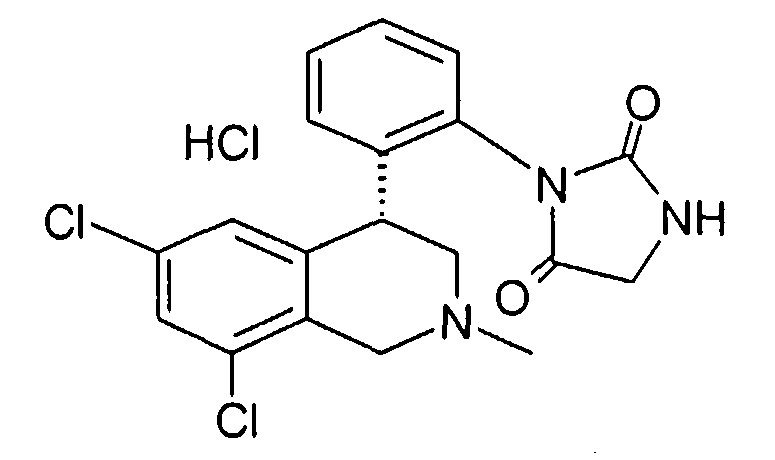
Пример 6 был синтезирован аналогично примеру 1. Необходимый для этого (R)-2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (энантиомер B, получение, как описано в WO 2004085404) был получен из рацемата посредством разделения на хиральные фазы.
LCMS-Rt (B): 0,98 мин;
[M+H+]: 390,0
Пример 7
1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дионгидрохлорид
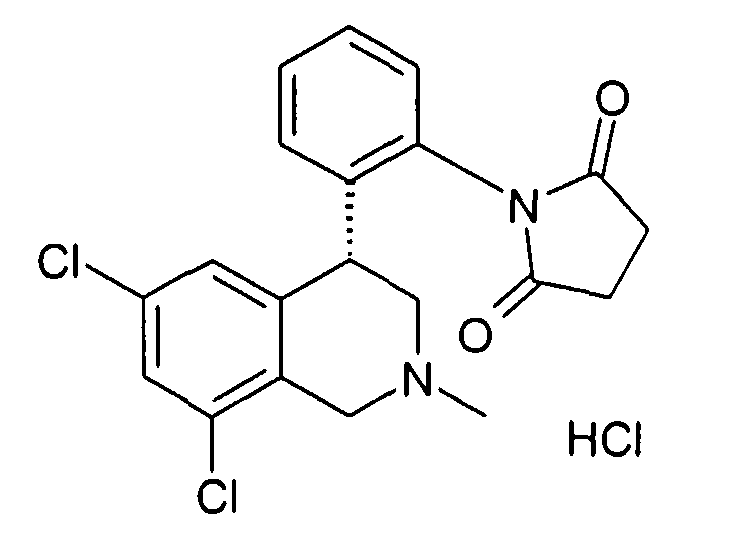
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (100 мг; энантиомер B, получение, как описано в WO 2004085404) был помещен в колбу вместе с янтарной кислотой (58 мг). К этому добавили полифосфорную кислоту (около 2 мл). Затем реакционную смесь перемешивали при 135°С. Через 4 часа добавили еще немного янтарной кислоты (~9 мг). Еще спустя 2 часа при 135°C оставили на ночь при комнатной температуре. Для обработки вылили на ледяную воду, у кислой фазы установили pH 10 с помощью раствора карбоната калия и затем три раза экстрагировали этилацетатом. Очищенные органические фазы один раз промыли водой, сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали карбонатом калия и три раза экстрагировали этилацетатом. После сушки над сульфатом магния фильтровали и передавали для сушки. Остаток поглощали водной соляной кислотой и сушили вымораживанием.
LCMS-Rt (B): 1,03 мин;
[M+H+]: 389,0
Пример 8
6,8-Дихлор-4-[4-(1,1-диоксо-1-λ 6 -[1,2,5]тиадиазолидин-2-ил)фенил]-2-метил-1,2,3,4-тетрагидроизохинолин
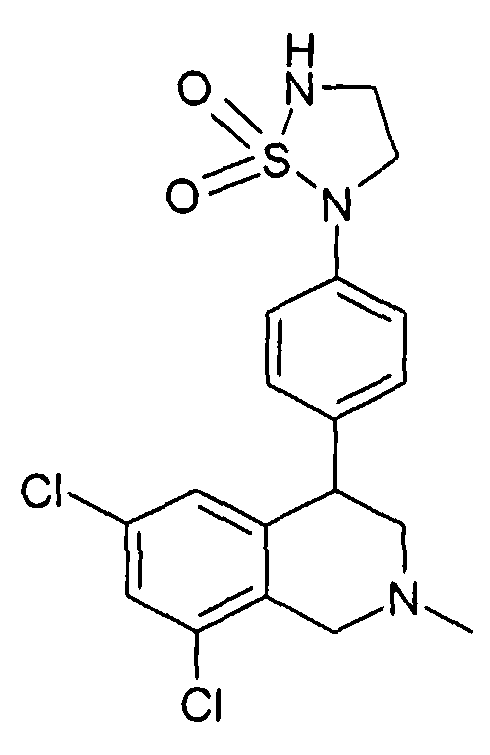
2-Хлорэтиламингидрохлорид (75 мг) перемешивали в течение ночи с сульфурилхлоридом (0,32 мл) в ацетонитриле (10 мл) при 75-80°C. Охлажденную до комнатной температуры смесь концентрировали, и остаток поглощали абсолютным диэтиловым эфиром (1 мл). Эфирную фазу, содержащую хлорсульфонамид, прикапывали к раствору 4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (110 мг, получение, как описано в WO 2004085404), абсолютного диэтилового эфира (1 мл) и триэтиламина (85 мкл) при -70°C. После окончания добавки реакционную смесь оставляли при комнатной температуре и перемешивали 2,5 часа. Затем смешивали со смесью из воды и насыщенного раствора гидрокарбоната натрия (3:1) и добавляли еще немного эфира. Фазы разделяли, и водную фазу еще два раза экстрагировали диэтиловым эфиром. Объединенные эфирные фазы сушили над сульфатом магния, фильтровали и концентрировали.
Сырой продукт очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали карбонатом калия и три раза экстрагировали дихлорметаном. После сушки над сульфатом магния фильтровали и передавали для сушки. Часть полученного таким образом продукта (20 мг) растворяли в ДМСО (0,5 мл), смешивали с карбонатом калия (6,2 мг) и шесть часов перемешивали при комнатной температуре. После хранения в шкафу-морозильнике в течение ночи при высоком вакууме отгоняли ДМСО, и остаток смешивали с небольшим количеством воды, насыщенным раствором гидрокарбоната натрия и диэтиловым эфиром. Фазы разделяли, и водную фазу еще два раза экстрагировали диэтиловым эфиром. Объединенные эфирные фазы сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали карбонатом калия и три раза экстрагировали дихлорметаном. После сушки над сульфатом магния фильтровали и передавали для сушки. Остаток поглощали водной соляной кислотой и сушили вымораживанием.
LCMS-Rt (B): 1,02 мин;
[M+H+]: 412,1
Исходя из соответствующих аминов, которые в случае необходимости использовались в энантиомерно чистой форме, и соответствующих дикарбоновых кислот, аналогично были получены следующие соединения.
пример
[M+H+]
Rt [мин]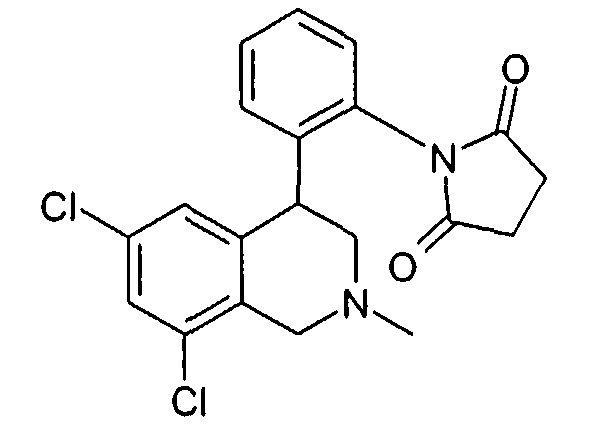
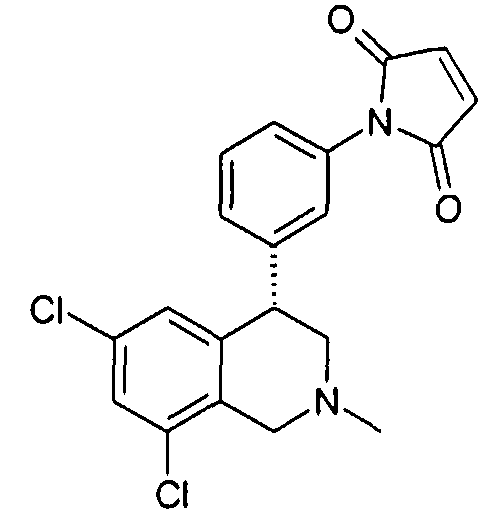
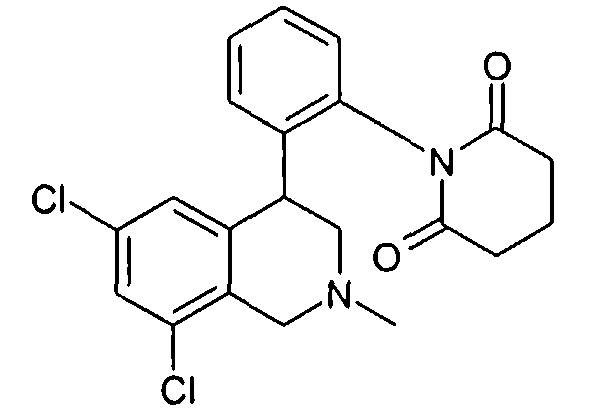
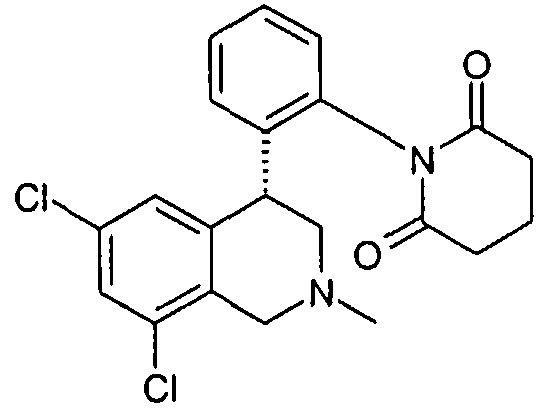
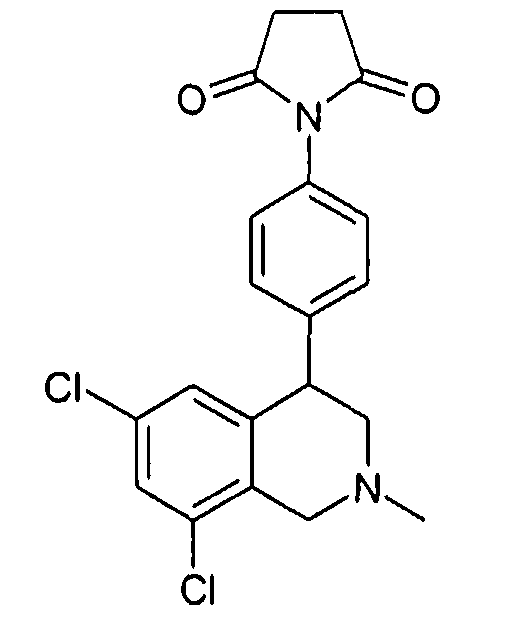
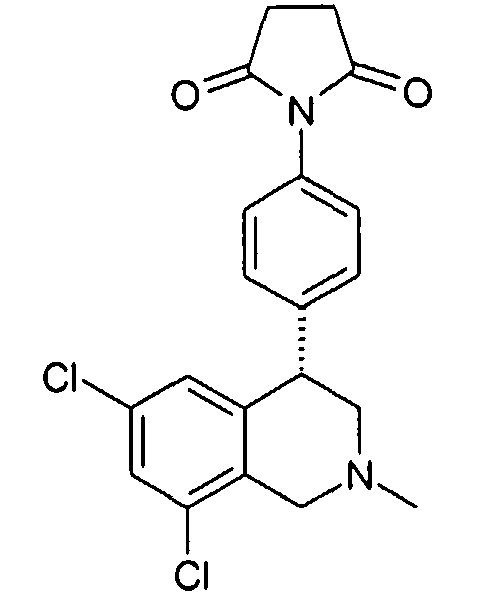
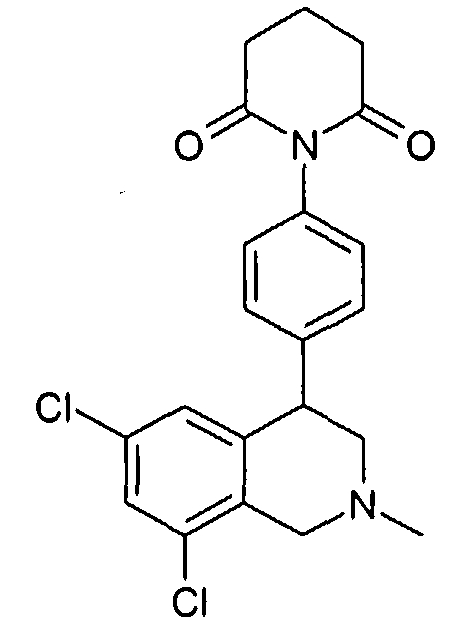
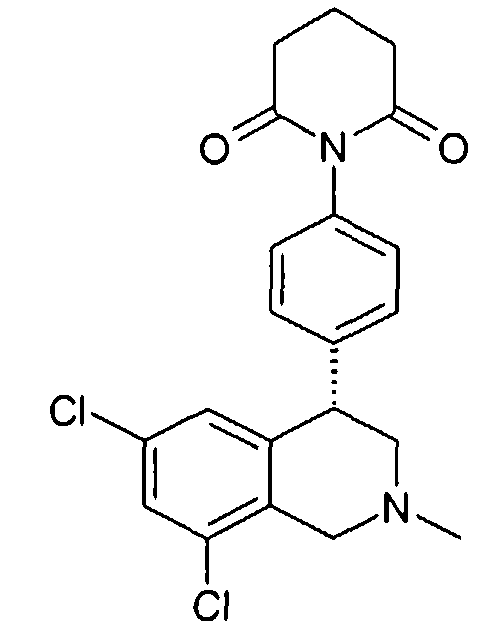
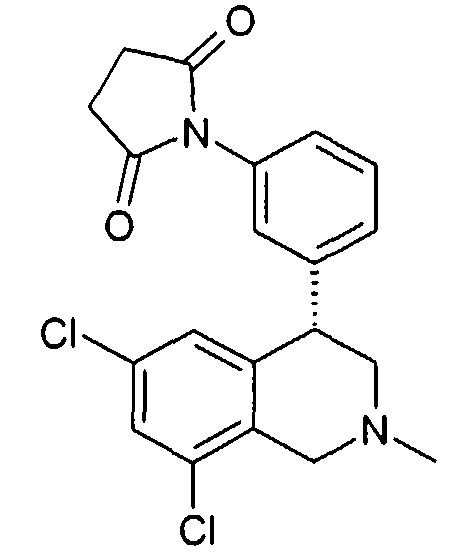
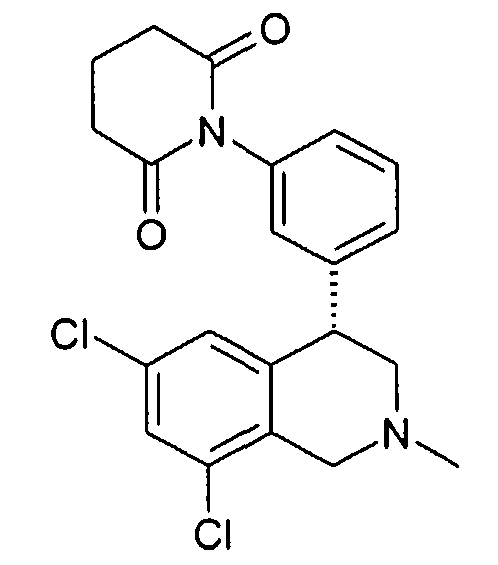
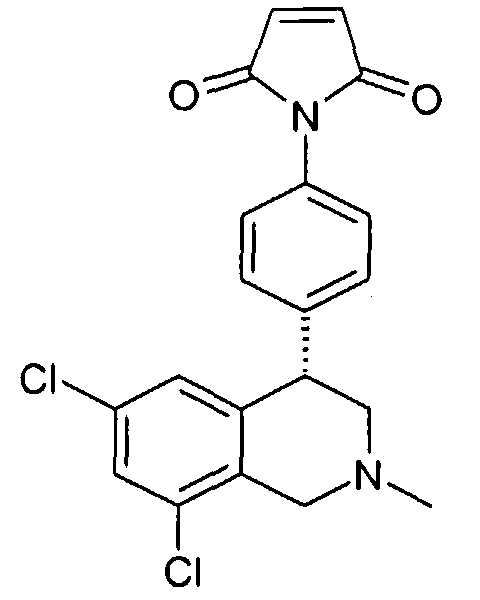
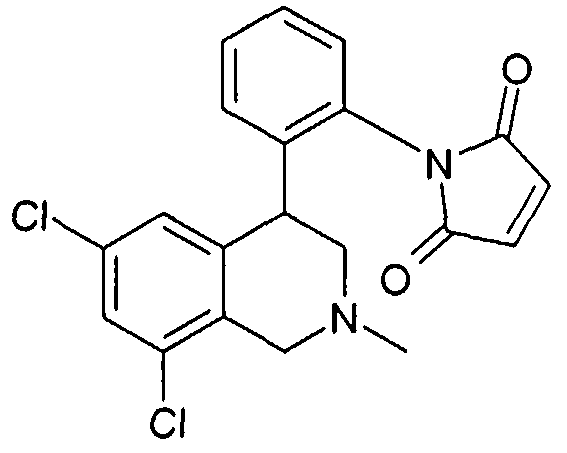
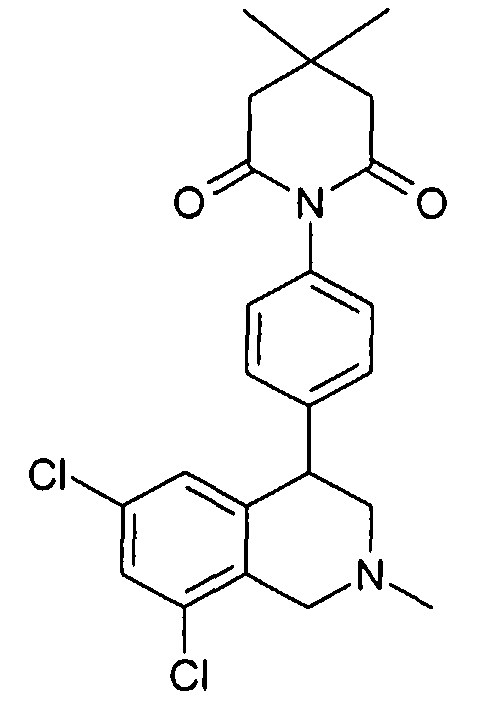
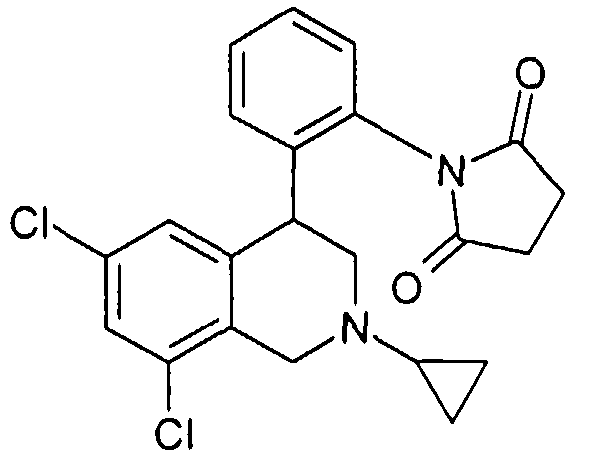
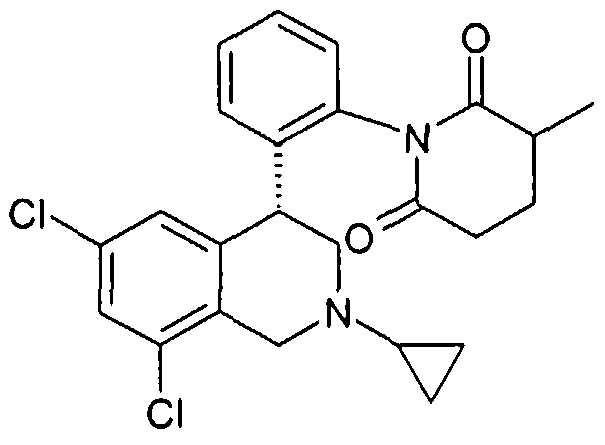
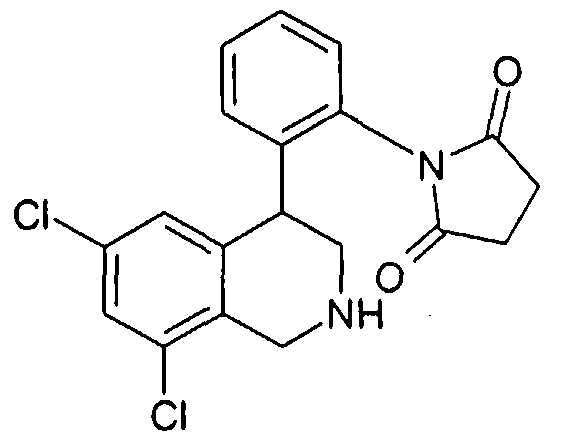
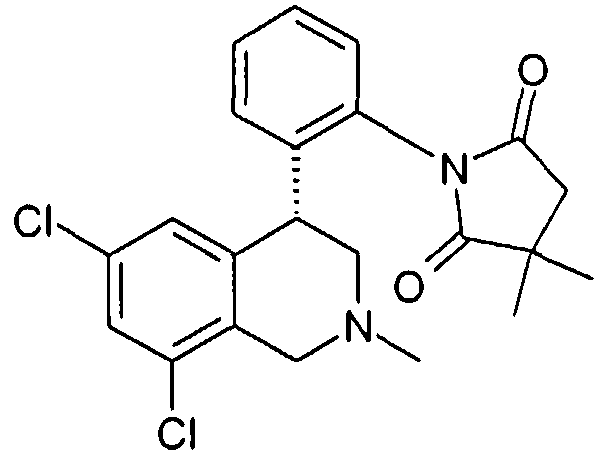
(ESI+)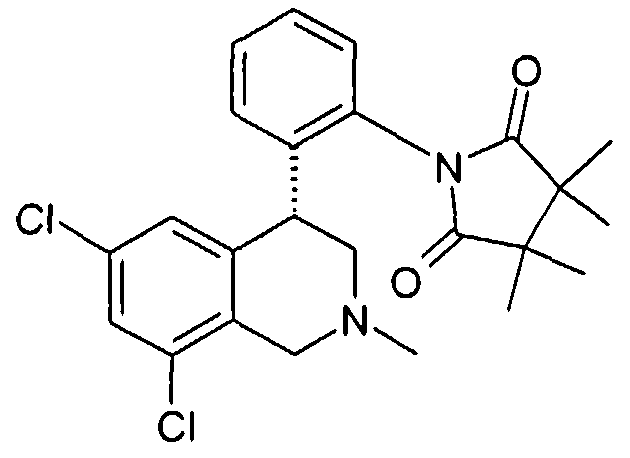
(ESI+)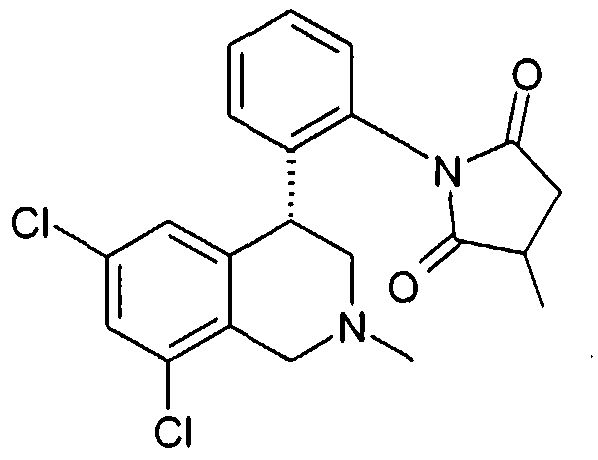
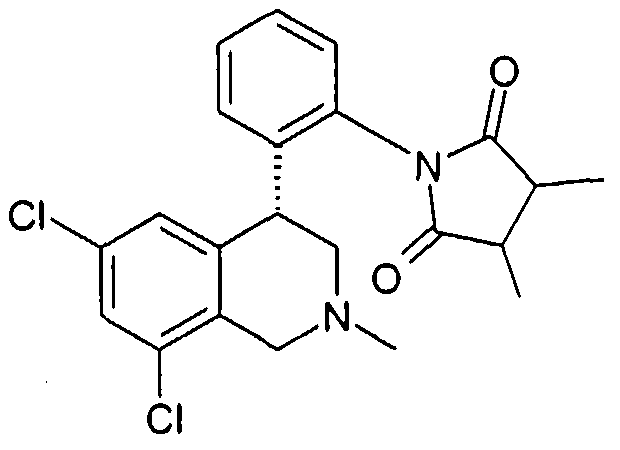
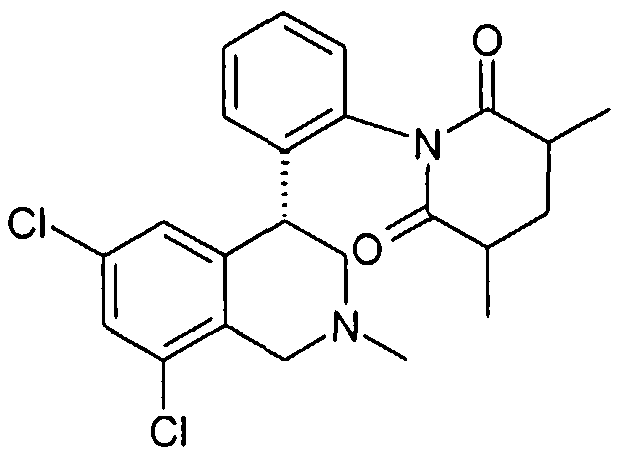
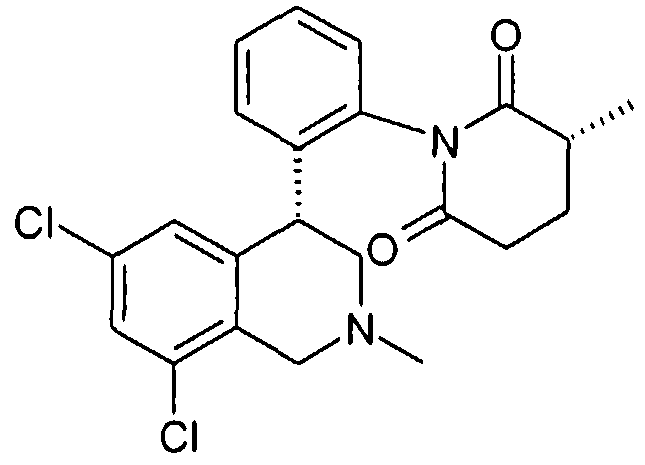
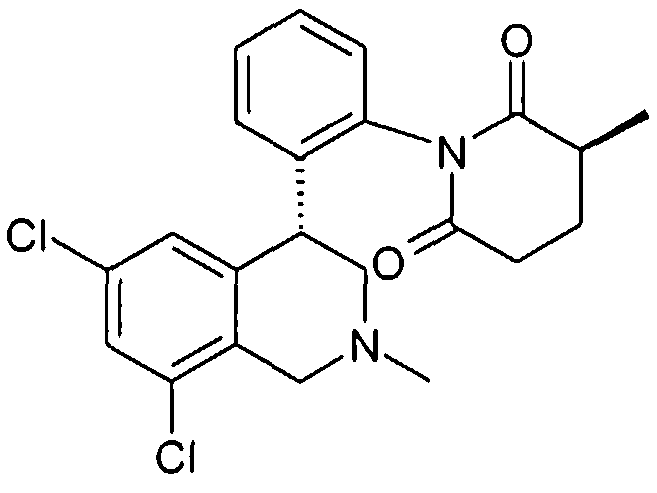
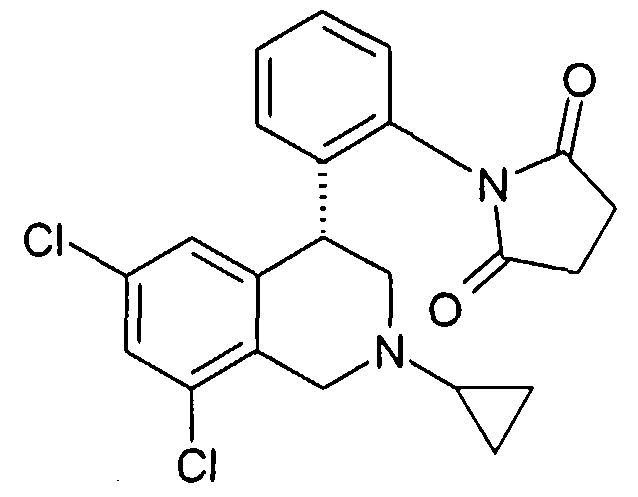
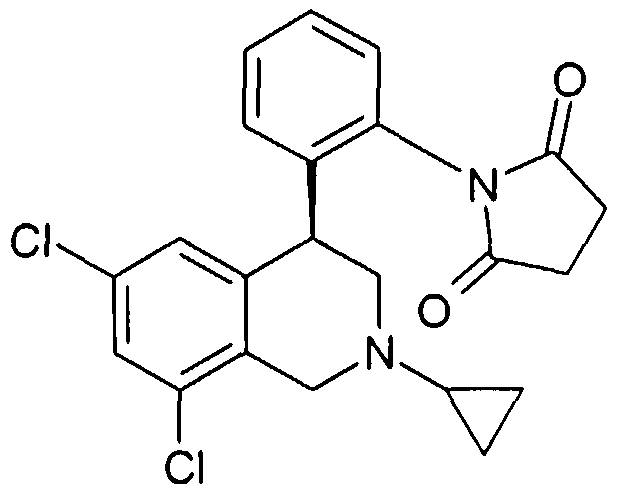
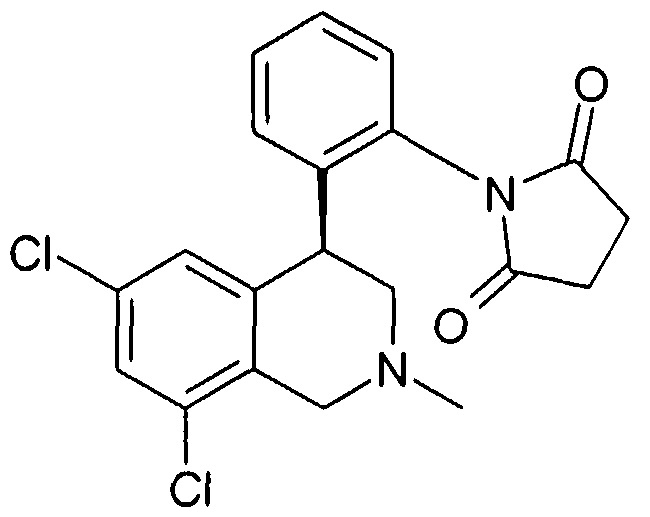
Пример 35
1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он-трифторацетат
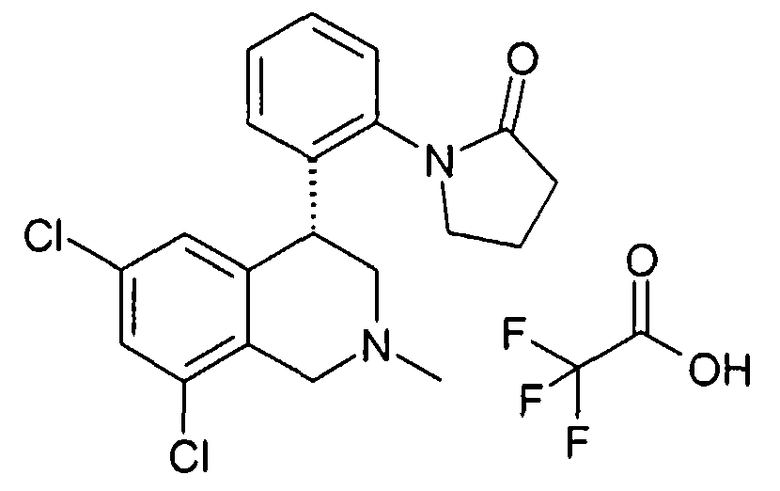
a) N-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-4-гидроксибутирамид
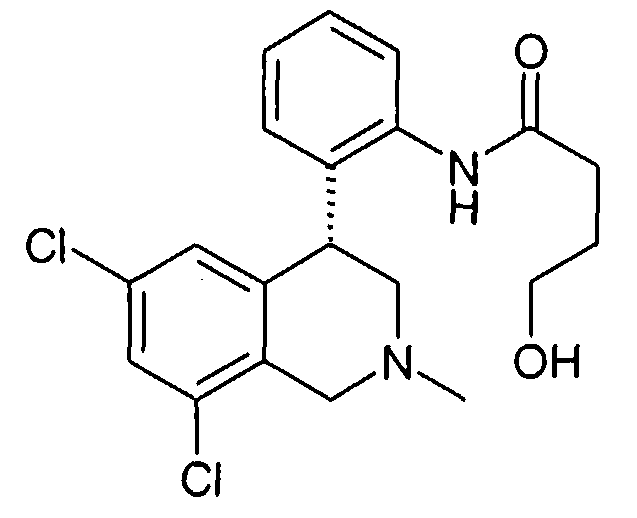
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (100 мг, энантиомер B, получение, как описано в WO 2004085404) загружали с γ-бутиролактоном (84 мг) в абсолютном ТГФ (8 мл) и затем прикапывали в течение 15 мин при 0°C натрий-гексаметилдисилазид (NaHMDS; 2M/ТГФ; 0,65 мл). После 10 мин перемешивания при 0°C, удаляли баню со льдом и далее перемешивали 2 часа. К реакции добавляли насыщенный раствор хлорида аммония (0,6 мл), этилацетат и воду. Фазы разделяли, и водную фазу два раза экстрагировали этилацетатом. Объединенные органические фазы один раз промывали насыщенным раствором поваренной соли, сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали карбонатом калия и три раза экстрагировали дихлорметаном. После сушки объединенной дихлорметановой фазы над сульфатом магния фильтровали и передавали для сушки.
LCMS-Rt (B): 0,98 мин;
[M+H+]: 393,1
b) 1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он-трифторацетат
N-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-4-гидроксибутирамид (100 мг) растворяли в абсолютном ТГФ (4 мл) и прикапывали триэтиламин (77 мкл) и раствор метансульфонилхлорида (44 мкл) в ТГФ (0,5 мл). После шести часов перемешивания при комнатной температуре отгоняли ТГФ, и остаток смешивали с насыщенным раствором гидрокарбоната натрия. После трехкратной экстракции этилацетатом объединяли органические фазы и сушили над сульфатом магния, фильтровали и концентрировали. Часть остатка (44 мг) растворяли в абсолютном ТГФ (2 мл), и реакционную смесь охлаждали до 0°C. При этой температуре в течение 10 мин прикапывали натрийгексаметилдисилазид (96 мкл). Затем еще 10 мин перемешивали при 0°C до того, как убирали баню со льдом. Через 1,5 часа добавляли в реакцию насыщенный раствор хлорида аммония (0,2 мл) и воду. Затем три раза экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали карбонатом калия и три раза экстрагировали дихлорметаном. После сушки объединенной дихлорметановой фазы над сульфатом магния фильтровали и передавали для сушки.
LCMS-Rt (B): 1,04 мин;
[M+H+]: 375,1
Пример 36
1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-онгидрохлорид
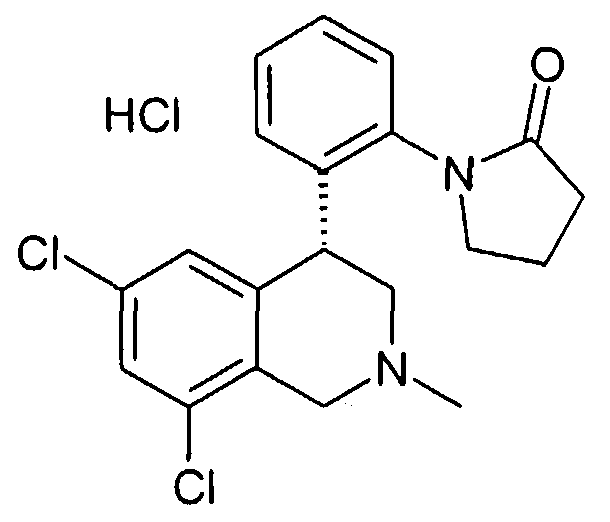
a) 4-Хлор-N-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]бутирамид
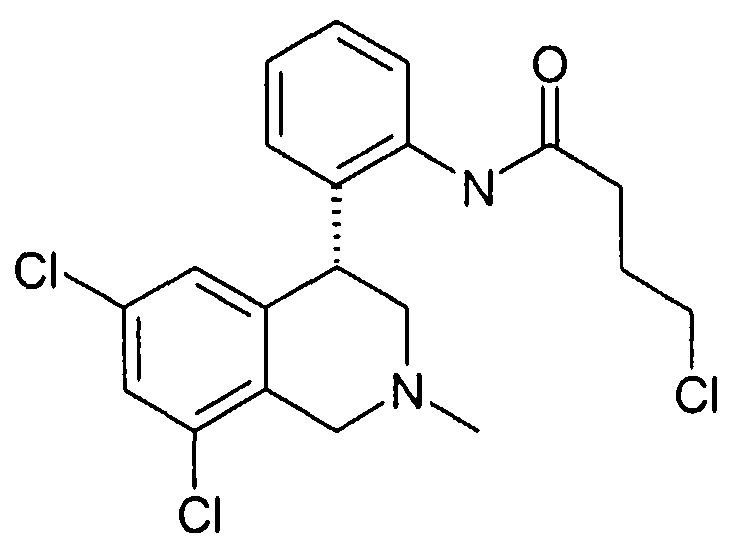
2-((R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (250 мг) растворяли в абсолютном ТГФ (20 мл). 4-хлорбутирилхлорид (115 мг) и триэтиламин (208 мкл) добавляли при перемешивании. 3 часа перемешивали при комнатной температуре. После выдерживания в течение ночи реакционную смесь концентрировали, и остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали гидрокарбонатом натрия и три раза экстрагировали этилацетатом. После сушки объединенной этилацетатной фазы над сульфатом магния фильтровали и передавали для сушки. Было получено 290 мг маслянистого продукта.
LCMS-Rt (B): 1,14 мин;
[M+H+]: 411,0
b) 1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-онгидрохлорид
4-Хлор-N-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]бутирамид (249 мг) растворили в абсолютном ДМСО (10 мл) и добавили мелкий порошкообразный и осушенный карбонат калия (250 мг). При исключении влаги 4 часа сильно перемешивали при комнатной температуре. После выдерживания в течение ночи реакционную смесь разбавляли водой (50 мл) и затем три раза экстрагировали этилацетатом. Объединенный экстракт сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали гидрокарбонатом натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Остаток растворяли в воде/ацетонитриле и с помощью 0,1н HCl устанавливали pH 2. После сушки вымораживанием в течение ночи получили желаемый продукт (116 мг) в виде белого порошка.
LCMS-Rt (B): 1,06 мин;
[M+H+]: 375,1
Пример 37
1-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он
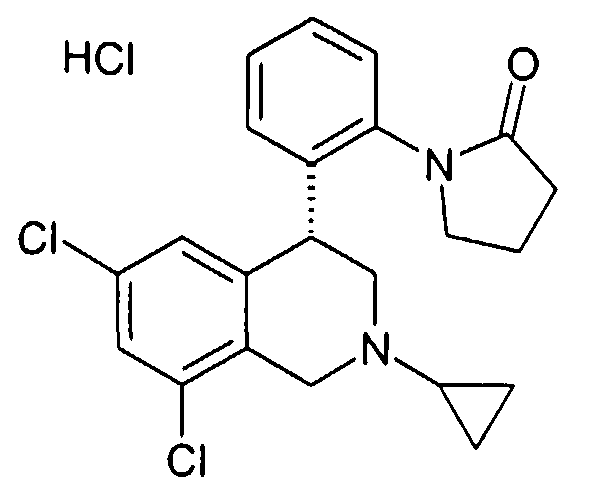
Титульное соединение синтезировали, исходя из 2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (пример 41b) аналогично примеру 36.
LCMS-Rt (B): 1,12 мин;
[M+H+]: 401,0
Пример 38
1-[3-((S)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2-он

Исходя из (S)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (энантиомер B, получение, как описано в WO 2004085404) и δ-валеролактона был синтезирован 1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2-он аналогично примеру 35.
LCMS-Rt (B): 1,05 мин;
[M+H+]: 389,1
Пример 39
1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2-онгидрохлорид
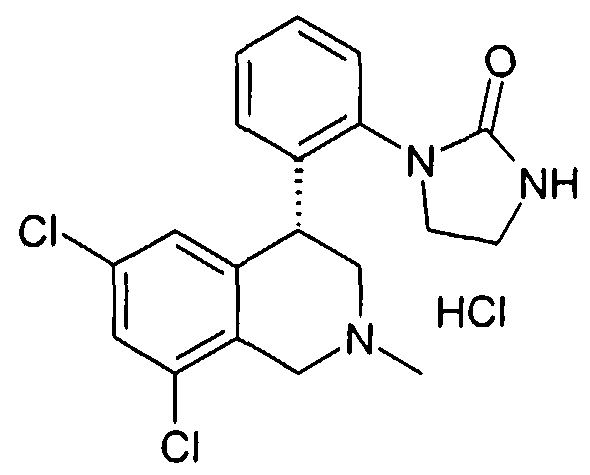
a) 1-(2-Хлорэтил)-3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]мочевина
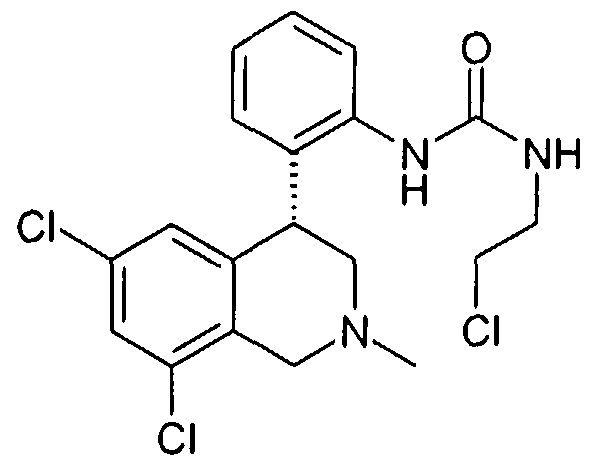
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (100 мг, энантиомер B, получение, как описано в WO 2004085404) растворили в абсолютном дихлорметане (5 мл) и при перемешивании добавили 4-нитрофенилхлорформат (79 мг). После 4 часов перемешивания при комнатной температуре оставляли стоять на ночь. На следующий день добавили еще 4-нитрофенилхлорформат (10 мг) и 1 час перемешивали при комнатной температуре. Реакционную смесь перенесли для сушки в вакууме, и остаток растворили в абсолютном дихлорметане (5 мл). После добавления триэтиламина (180 мкл) прикапывали раствор 2-хлорэтиламингидрохлорида (61 мг) в абсолютном дихлорметане (3 мл), и четыре часа перемешивали при комнатной температуре. Затем смешивали со следующей порцией метиленхлорида и разбавленным раствором карбоната калия, и органическую фазу три раза экстрагировали разбавленным раствором карбоната калия. После сушки над сульфатом магния и фильтрования органическую фазу концентрировали и очищали посредством препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Было получено 50 мг желаемого продукта.
LCMS-Rt (B): 1,05 мин;
[M+H+]: 412,1
b) 1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2-онгидрохлорид
1-(2-Хлорэтил)-3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]мочевину (40 мг) растворили в абсолютном ДМСО (1 мл) и при перемешивании добавили карбонат калия (14 мг). После четырех часов перемешивания при комнатной температуре добавили еще немного карбоната калия (7 мг). После выдерживания в течение ночи отгоняли в вакууме ДМСО, остаток смешивали с небольшим количеством воды и насыщенным раствором гидрокарбоната натрия, и затем образованную смесь три раза экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ, правда примесь не смогли отделить, так что далее проводили хроматографию на кизельгеле (дихлорметан/метанол 100/0 до 88/12 в течение 80 мин). Чистые фракции объединяли, передавали на сушку, и затем остаток с водой и небольшим количеством соляной кислоты сушили вымораживанием.
LCMS-Rt (B): 1,00 мин;
[M+H+]: 376,0
Пример 40
1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1,3-дигидроимидазол-2-онгидрохлорид
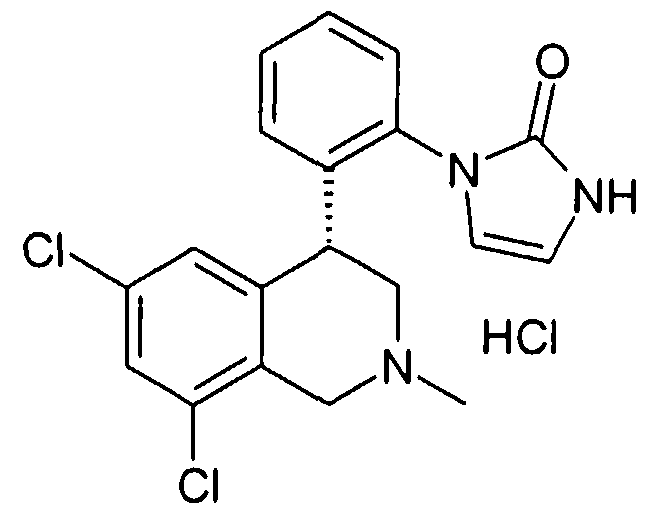
a) 1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-(2,2-диэтоксиэтил)мочевина
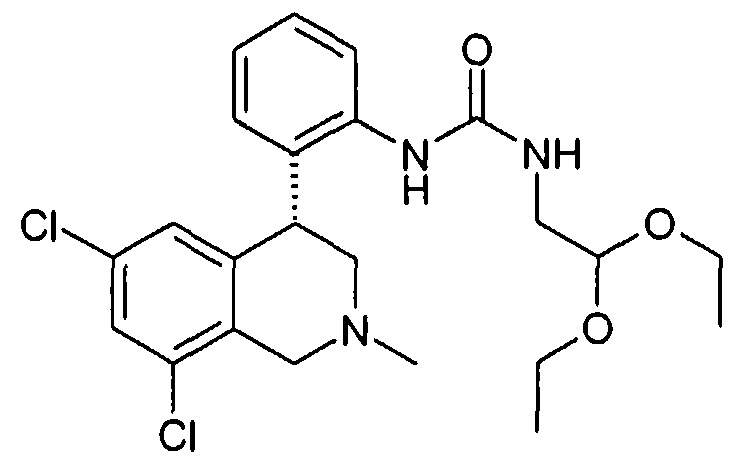
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (75 мг, энантиомер B, получение, как описано в WO2004085404) аналогично примеру 25a) подвергали превращению с 4-нитрофенилхлорформатом (64 мг) и затем с 2,2-диэтоксиэтиламином (46 мг).
LCMS-Rt (B): 1,14 мин;
[M+H+]: 466,1
b) 1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1,3-дигидроимидазол-2-онгидрохлорид
1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил-3-(2,2-диэтоксиэтил)мочевину (65 мг) растворили в муравьиной кислоте (0,4 мл) и 2 часа перемешивали при комнатной температуре. Затем смешали с водой и нейтрализовали насыщенным раствором гидрокарбоната натрия. После трехкратного экстрагирования этилацетатом объединенные органические фазы сушили над сульфатом магния, фильтровали, концентрировали и очищали посредством препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Остаток поглощали водной HCl и сушили вымораживанием.
LCMS-Rt (B): 1,05 мин;
[M+H+]: 374,0
Пример 41
3-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-
4-ил)фенил]тиазолидин-2,4-дион
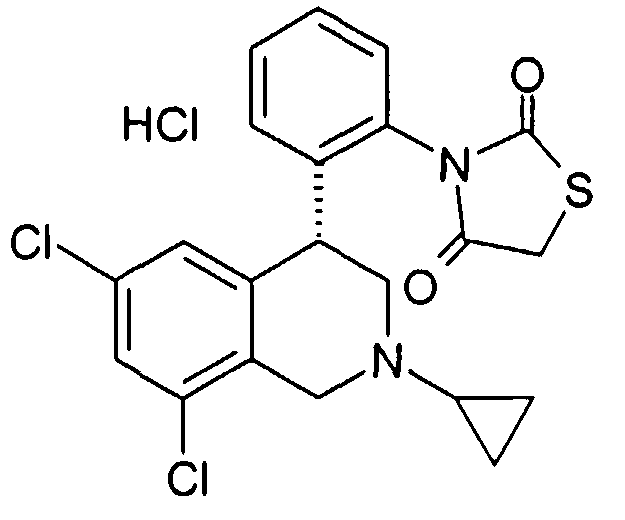
a) 1-(2-Аминофенил)-2-[циклопропил-(2,4-дихлорбензил)амино]этанол и 2-{2-[циклопропил-(2,4-дихлорбензил)амино]-1-метоксиэтил}фениламин
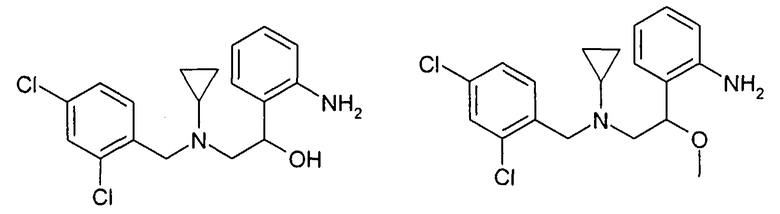
N-2-{2-[Циклопропил-(2,4-дихлорбензил)амино]-1-гидроксиэтил}фенил)ацетамид (46 г, получен аналогично примеру 15 в WO 0348129) растворили в метаноле (250 мл). К этому при перемешивании добавили 30%-ный раствор метилата натрия, и затем смесь 10 часов кипятили с обратным потоком. Для более полного проведения реакции добавили твердый метилат натрия (10 г) и кипятили с обратным потоком еще 4 часа. Для обработки затем к реакционной смеси добавили 1,5 л ледяной воды и три раза элюировали этилацетатом. Объединенные этилацетатные фазы один раз промыли насыщенным раствором поваренной соли, затем сушили над сульфатом магния, фильтровали и концентрировали. После хроматографической очистки на кизельгеле были получены:
14 г 1-(2-Аминофенил)-2-[циклопропил-(2,4-дихлорбензил)амино]этанола
LCMS-Rt (B): 1,03 мин;
[M+H+]: 351,0,
13,8 г 2-{2-[Циклопропил-(2,4-дихлорбензил)амино]-1-метоксиэтил}фениламина
LCMS-Rt (B): 1,18 мин;
[M+H+]: 365,0
и 5,5 г фракции смеси обоих продуктов.
Три фракции можно было подвергнуть циклизации, как описано ниже для 1-(2-аминофенил-2-[циклопропил-(2,4-дихлорбензил)амино]этанола под пунктом b) при воздействии серной кислоты с образованием 2-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина.
b) 2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин и 2-((S)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин
1-(2-Аминофенил)-2-[циклопропил-(2,4-дихлорбензил)амино]этанол (14 г) растворили в дихлорметане (250 мл) и при перемешивании охладили до 0°C. В холодную смесь прикапывали концентрированную серную кислоту (50 мл). После окончания добавления перемешивали около 7 часов при комнатной температуре и затем 2 часа при 45°C, причем дихлорметан медленно выпаривали. После выдерживания в течение ночи при комнатной температуре для полного проведения реакции вновь добавляли серную кислоту (5 мл) и в течение 12 часов поддерживали температуру 65°C. Затем реакционную смесь подавали на ледяную воду и с помощью раствора гидроксида натрия (10н) устанавливали pH 11. Водную фазу три раза промывали дихлорметаном. Объединенный экстракт сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт (12,3 г) подвергали хроматографии на кизельгеле (этилацетат/н-гептан 1:1 до 4:1). Полученный очищенный рацемический продукт (10,7 г) затем с помощью хиральной ВЭЖХ (Chiralpak ADH/45, элюент: гептан/изопропанол/метанол 20:1:1 +0,1% TFA) разделяли на его энантиомеры.
Было получено 7 г прежде всего элюированного 2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина P1 и 6 г более медленно элюированного 2-((S)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина P2 в форме их двойных солей ТФК (TFA).
Хиральная ВЭЖХ:
Колонка: Chiralpak ADH/45, 250×4,6 мм
Элюент: гептан/изопропанол/метанол: 20/1/1+0,1% TFA
Скорость потока: 1 мл/мин при 30°C
P1: Rt: 7,27 мин
P2: Rt: 12,81 мин
c) Фениловый эфир [2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиокарбамидной кислоты
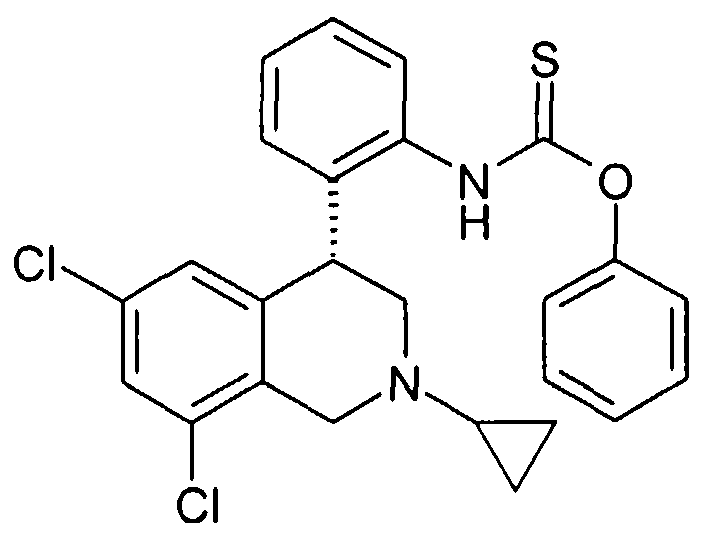
2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (300 мг) растворили в абсолютном ТГФ (5 мл) и прикапывали фенилхлортиоформиат (75 мкл), растворенный в абсолютном ТГФ (1 мл). Реакционную смесь перемешивали 4 часа при комнатной температуре и оставляли на ночь. Затем растворитель отгоняли, и остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки.
LCMS-Rt (B): 1,87 мин;
[M+H+]: 469,0
d) 3-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион
Фениловый эфир [2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиокарбамидной кислоты (50 мг) растворили в 30%-ном растворе метилата натрия в метаноле (5 мл). Для растворения слегка нагревали феном при перемешивании. Прозрачный раствор перемешивали около 3 часов при комнатной температуре и оставляли на ночь. Затем реакционную смесь разбавляли водой и три раза экстрагировали этилацетатом. Объединенный экстракт сушили над сульфатом магния, фильтровали и концентрировали. Полученный таким образом сырой продукт (45 мг) растворяли в абсолютном метиленхлориде (3,5 мл) и добавляли бромацетилхлорид (16,5 мг). При комнатной температуре перемешивали 3 часа без доступа влаги. После выдерживания в течение ночи в шкафу-морозильнике отгоняли растворитель и избыточный хлорангидрид кислоты, и остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Часть (12 мг) полученного осадка (15 мг) растворяли в воде/ацетонитриле, добавляли немного соляной кислоты и прозрачный раствор в течение ночи сушили вымораживанием.
LCMS-Rt (B): 1,40 мин;
[M+H+]: 433,0
Пример 42
3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион
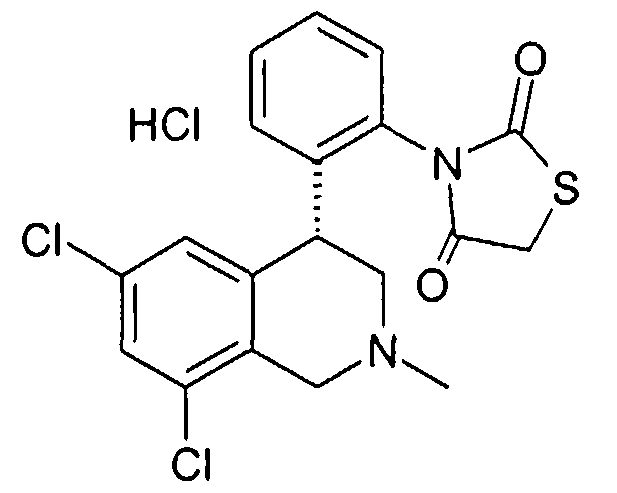
Аналогично примеру 41 подвергали превращению (R)-2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (энантиомер B, получение, как описано в WO 2004085404). Сырой продукт характеризовался двойным пиком идентичных масс в LCMS, так что оба продукта разделяли с помощью препаративной ВЭЖХ и затем идентифицировали. Наряду с загрязненной фракцией удалось выделить оба поворотных изомера P1 и P2.
P1:
LCMS Rt (B): 1,09 мин;
[M+H+]: 407,0
1H ЯМР (500 МГц, ДМСО-d6): 7,51-7,28 (м, 4H), 7,11 (м, 1H), 6,72 (с, 1H), 4,51 (д, 15 Гц, 1H), 4,34 (д, 15 Гц, 1H), 4,18 (м, 1H), 3,64 (д, 15 Гц, 1H), 3,50 (д, 15 Гц, 1H), 2,70 (м, 1H), 2,49 (м, с ДМСО), 2,33 (с, 3H) [в м.д.]
P2:
LCMS-Rt (B): 1,14 мин;
[M+H+]: 407,0
1H ЯМР (500 МГц, ДМСО-d6): 7,52-7,26 (м, 4H), 7,19-7,09 (м, 1H), 6,72 (с, 1H), 4,49 (д, 15 Гц, 1H), 4,35 (д, 15 Гц, 1H), 4,12 (м, 1H), 3,65 (д, 15 Гц, 1H), 3,50 (д, 15 Гц, 1H), 2,72 (м, 1H), 2,48 (м, с ДМСО), 2,33 (с, 3H) [в м.д.]
Альтернативный синтез
Использовали вместо бромацетилхлорида хлорацетилхлорид, таким образом получали преимущественно P2, который после препаративной ВЭЖХ был загрязнен P1 лишь в малой степени (<10% в соответствии с 1H ЯМР).
Пример 43
3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион
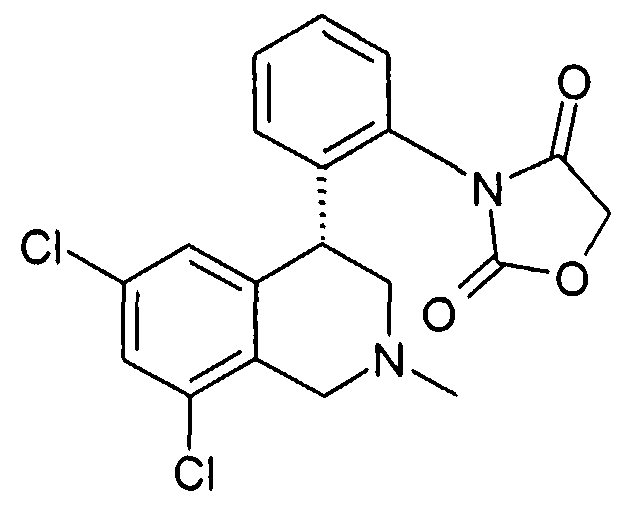
a) [2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилкарбамоил]метилацетат
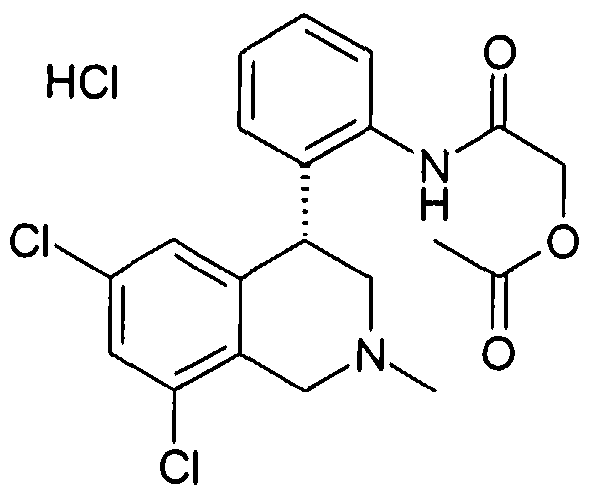
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (300 мг, энантиомер B, получение, как описано в WO 2004085404) растворяли в абсолютном ТГФ (10 мл) и при комнатной температуре при перемешивании добавляли раствор натрийгексаметилдисилазида (0,5 мл; 2M в ТГФ). Через 30 мин добавляли ацетоксиацетилхлорид (77 мкл) и 2 часа перемешивали при комнатной температуре. Затем реакционную смесь концентрировали, остаток растворяли в этилацетате/воде, устанавливали щелочную среду с помощью раствора гидрокарбоната натрия и разделяли фазы. Водную фазу еще три раза экстрагировали этилацетатом. Объединенный экстракт сушили над сульфатом магния, фильтровали и концентрировали. Было получено 380 мг желаемого продукта. Из них 40 мг растворили в ацетонитриле/воде, подкислили 0,1н соляной кислотой и сушили вымораживанием.
LCMS-Rt (B): 1,02 мин;
[M+H+]: 407,0
b) N-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-2-гидроксиацетамид
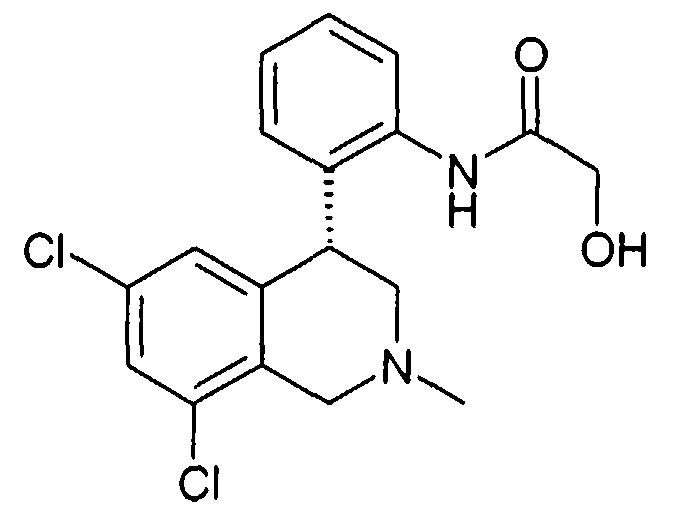
[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилкарбамоил]метилацетат (180 мг) растворили в метаноле (5 мл). При перемешивании добавили карбонат калия (305 мг, в виде тонкого порошка) и затем 4 часа хорошо перемешивали при комнатной температуре. Затем растворитель отгоняли, остаток поглощали этилацетатом и три раза промывали водой. Этилацетатную фазу сушили над сульфатом магния, фильтровали и концентрировали. Было получено 160 мг желаемого продукта.
LCMS-Rt (B): 0,94 мин;
[M+H+]: 365,0
c) 3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион
N-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-2-гидроксиацетамид (20 мг) растворили в абсолютном ТГФ (2 мл), при комнатной температуре при перемешивании подвергали превращению с раствором натрийгексаметилдисилазида (0,5 мл; 2M в ТГФ). Затем добавляли 1,1-карбонилдиимидазол (13 мг) и 2 часа перемешивали при комнатной температуре. После выдерживания в течение ночи реакционную смесь концентрировали, остаток растворяли в этилацетате/воде, устанавливали щелочную среду с помощью раствора гидрокарбоната натрия и разделяли фазы. Водную фазу еще три раза экстрагировали этилацетатом. Объединенный экстракт сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Осадок растворяли в воде/ацетонитриле, и прозрачный раствор в течение ночи сушили вымораживанием. Было получено 10 мг желаемого продукта.
LCMS-Rt (B): 1,09 мин;
[M+H+]: 391,0
Пример 43a
3-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-
4-ил)фенил]оксазолидин-2,4-дионгидрохлорид
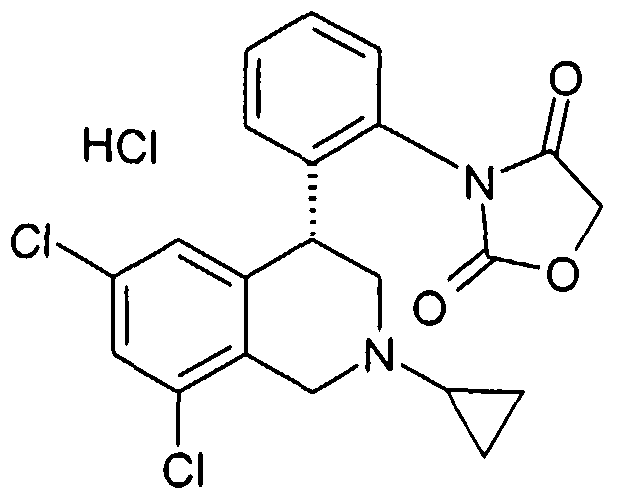
Аналогично последовательности в примере 43 синтезировали 25 мг титульного соединения. В стадии циклизации вместо 1,1-карбонилдиимидазола использовали трихлорметилхлорформат, и сушку вымораживанием проводили в присутствии соляной кислоты.
LCMS-Rt (B): 1,31 мин;
[M+H+]: 417,0
Пример 44
Соль трифторуксусной кислоты 4-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]морфолин-3,5-диона
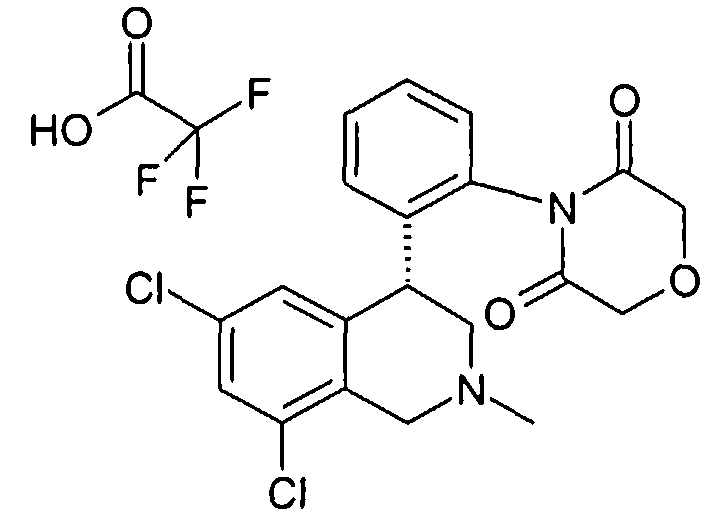
a) Соль трифторуксусной кислоты 4-{[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилкарбамоил]метокси}уксусной кислоты
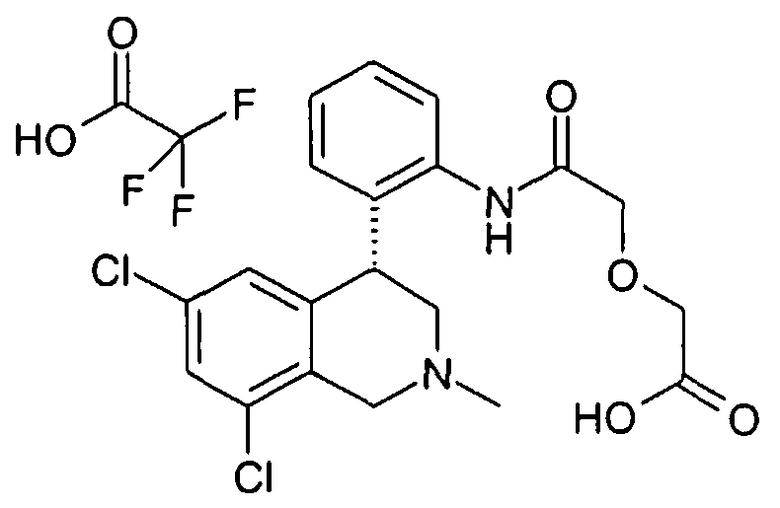
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (70 мг, энантиомер B, получение, как описано в WO 2004085404) растворяли при перемешивании в абсолютном дихлорметане (5 мл) и смешивали с ангидридом дигликолевой кислоты (27 мг). Несколько часов перемешивали при комнатной температуре и оставляли на ночь. После добавления следующего количества ангидрида дигликолевой кислоты (26 мг) перемешивали 10 часов и оставляли на ночь. После отгонки растворителя остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, ацетонитрил отгоняли на роторном испарителе, и водный остаток сушили вымораживанием.
LCMS-Rt (B): 0,93 мин;
[M+H+]: 423,1
b) Соль трифторуксусной кислоты 4-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]морфолин-3,5-диона
Соль трифторуксусной кислоты 4-{[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилкарбамоил]метокси}уксусной кислоты (50 мг) растворяли при перемешивании в абсолютном дихлорметане (2 мл) и смешивали с основанием Хюнига (46 мкл). Затем добавляли EDC (22 мг) и несколько часов перемешивали при комнатной температуре. После выдерживания в течение ночи добавляли следующую порцию EDC (22 мг) и основания Хюнига (46 мкл). Через 24 часа отгоняли растворитель, и остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил и сушили вымораживанием.
LCMS-Rt (B): 1,07 мин;
[M+H+]: 405,0
Пример 45
3-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он
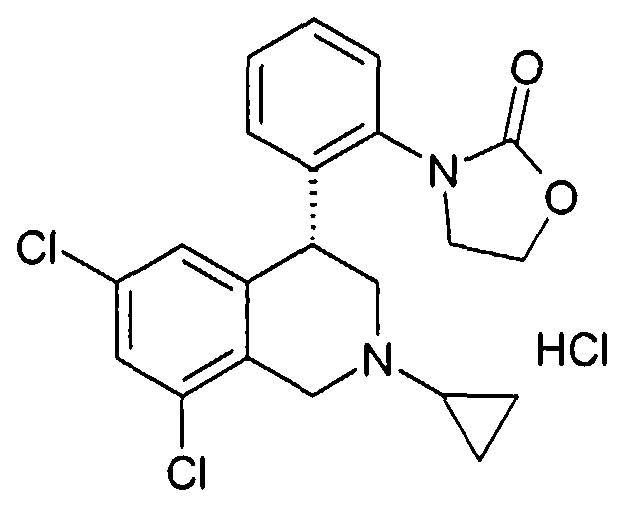
a) 2-Хлорэтил-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]карбамат
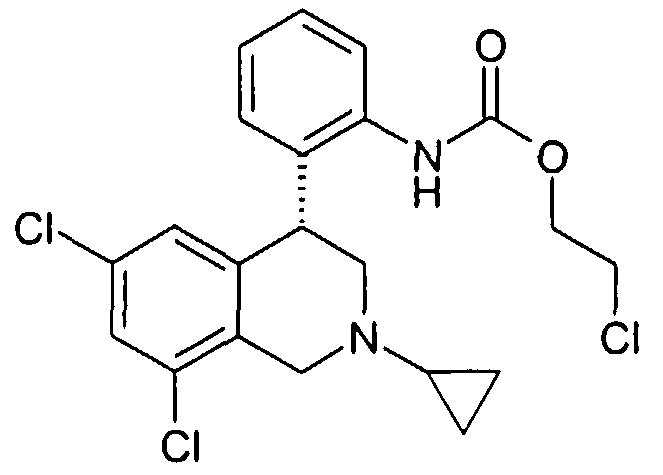
2-((R)-(6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (400 мг) растворяли в абсолютном ТГФ (25 мл), и добавляли при перемешивании 2-хлорэтилхлорформат (102 мг). После 3 часов перемешивания при комнатной температуре шихту оставляли на ночь. Затем отгоняли растворитель, и остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Было получено 380 мг желаемого продукта.
LCMS-Rt (B): 1,66 мин;
[M+H+]: 439,0
b) 3-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он
2-Хлорэтил-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]карбамат (320 мг) растворяли в абсолютном ТГФ (20 мл). При перемешивании добавили гидрид натрия (35 мг). После 2 часов перемешивания при комнатной температуре реакционную смесь концентрировали, остаток растворяли в этилацетате и два раза промывали водой. Этилацетатную фазу сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Остаток растворяли в ацетонитриле/воде, подкисляли 0,1н соляной кислотой и сушили вымораживанием. Было получено 176 мг желаемого продукта в виде гидрохлорида.
LCMS-Rt (B): 1,16 мин;
[M+H+]: 403,0
Пример 46
3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он
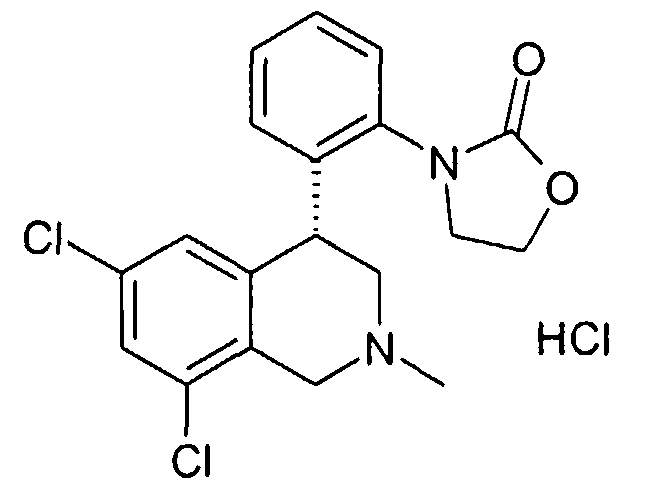
a) 2-Хлорэтил-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]карбамат
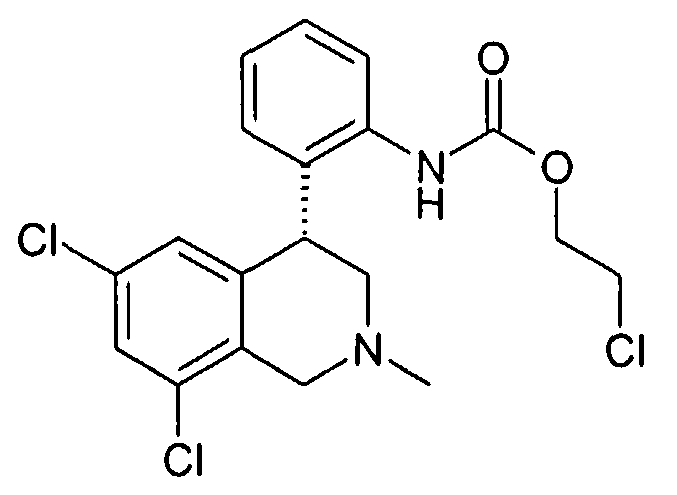
Аналогично примеру 45a) (R)-2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (300 мг, энантиомер B, получение, как описано в WO 2004085404) подвергали превращению с 2-хлорэтилхлороформатом (140 мг). Было получено 400 мг желаемого продукта.
LCMS-Rt (B): 1,15 мин;
[M+H+]: 413,0
b) 3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он
Аналогично примеру 45b) 2-хлорэтил-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]карбамат (340 мг) подвергали превращению с гидридом натрия (39 мг). Было получено 230 мг желаемого продукта в виде гидрохлорида.
LCMS-Rt (B): 1,01 мин;
[M+H+]: 377,0
Пример 47
(S)-1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион
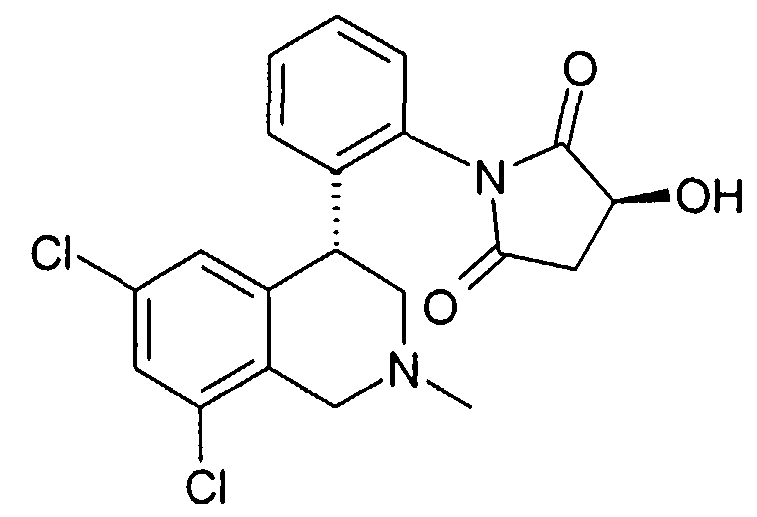
Загружали ((S)-5-оксо-2-трихлорметил[1,3]диоксолан-4-ил)уксусную кислоту (171 мг, см. Synthesis 2002, 2165) и тионилхлорид (2 мл) и при перемешивании 4 часа нагревали с обратным потоком. Затем отгоняли избыточный тионилхлорид на роторном испарителе (Rotavapor), остаток растворяли в абсолютном толуоле (14 мл), добавляли (R)-2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин и триэтиламин (0,91 мл), и смесь 2 часа нагревали с обратным потоком. После выдерживания в течение ночи реакционную смесь концентрировали, остаток смешивали с этилацетатом/водой, устанавливали pH 8 с помощью раствора гидрокарбоната натрия и три раза промывали насыщенным раствором поваренной соли. Этилацетатную фазу сушили над сульфатом магния, фильтровали и концентрировали. Остаток перекристаллизовывали из этилацетата/гептана. Получили 65 мг желаемого соединения, которое характеризовалось поворотной изомерией. Правда, LCMS показала только слабое, не количественное разделение.
LCMS-Rt (B): 1,02 мин;
[M+H+]: 405,0
Пример 48
(R)-1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион
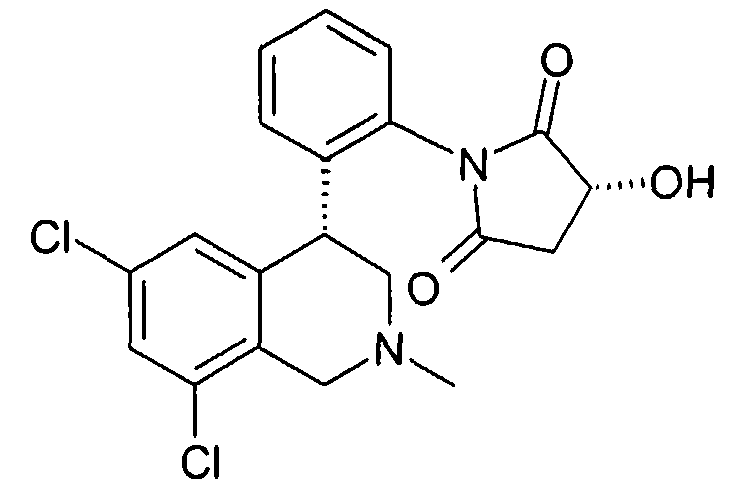
Загружали ((R)-5-оксо-2-трихлорметил[1,3]диоксолан-4-ил)уксусную кислоту (214 мг, см. Synthesis 2002, 2165) и тионилхлорид (2,5 мл) и при перемешивании 4 часа нагревали с обратным потоком. Затем отгоняли избыточный тионилхлорид на роторном испарителе, остаток растворяли в абсолютном толуоле (18 мл), добавляли (R)-2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (250 мг) и триэтиламин (1,13 мл), и смесь 2 часа нагревали с обратным потоком. Затем реакционную смесь концентрировали, остаток смешивали с этилацетатом/водой, устанавливали pH 8 с помощью раствора гидрокарбоната натрия и три раза промывали насыщенным раствором поваренной соли. Этилацетатную фазу сушили над сульфатом магния, фильтровали и концентрировали. Последующей кристаллизацией из этилацетата/н-гептана было получено 240 мг желаемого продукта, который характеризовался поворотной изомерией, так что LCMS показала два сигнала идентичной массы.
LCMS-Rt (B): 0,99 и 1,04 мин;
[M+H+]: 405,0
Пример 49
(R)-1-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион
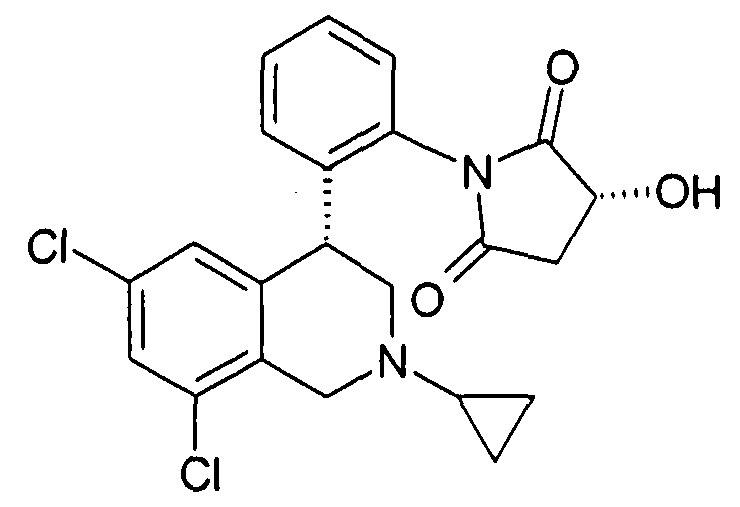
Загружали ((R)-5-оксо-2-трихлорметил[1,3]диоксолан-4-ил)-уксусную кислоту (94 мг, см. Synthesis 2002, 2165) и тионилхлорид (2 мл) и при перемешивании 4 часа нагревали с обратным потоком. Отгоняли избыточный тионилхлорид на роторном испарителе, и остаток растворяли в абсолютном толуоле (15 мл). Добавляли твердую соль трифторуксусной кислоты 2-((R)-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (200 мг), затем триэтиламин (0,5 мл). Затем смесь перемешивали 2 часа при комнатной температуре, потом 1 час при 60°C, затем 2 часа при 80°C и наконец 6 часов при 100°C. После охлаждения и удаления растворителя очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, и водный остаток сушили вымораживанием. Затем для дальнейшей очистки использовали кизельгель (дихлорметан/метанол 100:0 до 90:10). Очищенные фракции объединяли и удаляли растворитель. В результате сушки вымораживанием из воды/ацетонитрила было получено 20 мг желаемого продукта.
LCMS-Rt (B): 1,15 мин;
[M+H+]: 431,0
Пример 50
(S)-1-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион

Аналогично примеру 49 подвергали превращению ((R)-5-оксо-2-трихлорметил[1,3]диоксолан-4-ил)уксусную кислоту (94 мг, см. Synthesis 2002, 2165), тионилхлорид (2 мл) и соль трифторуксусной кислоты 2-((R)-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (200 мг). В результате сушки вымораживанием из воды/ацетонитрила было получено 31 мг желаемого продукта.
LCMS-Rt (B): 1,13 мин;
[M+H+]: 413,0
Пример 51
(R)-6,8-Дихлор-4-[2-(1,1-диоксо-1-λ 6 -изотиазолидин-2-ил)фенил]-2-метил-1,2,3,4-тетрагидроизохинолингидрохлорид
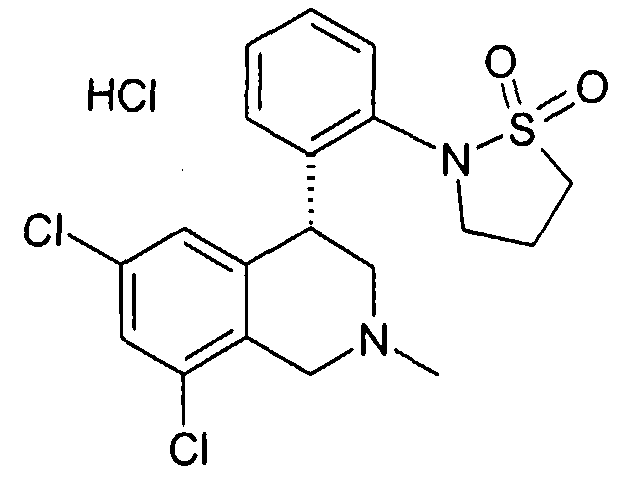
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (100 мг) растворяли в абсолютном ТГФ (8 мл) и при комнатной температуре прикапывали 3-хлорпропансульфонилхлорид (116 мг, растворенный в абсолютном ТГФ (1,5 мл)), и затем реакционную смесь 16 часов нагревали с обратным потоком. Для более полного проведения реакции еще раз добавляли хлорпропансульфонилхлорид (8 мг), затем раствор натрийгексаметилдисилазида (0,2 мл; 2M в ТГФ). Через 30 минут перемешивания при комнатной температуре и последующем нагревании с обратным потоком для более полного проведения реакции добавляли следующий эквивалент раствора натрийгексаметилдисилазида и вновь нагревали с обратным потоком. Затем смешивали с водой при комнатной температуре и три раза экстрагировали этилацетатом. Объединенные этилацетатные фазы сушили над сульфатом магния, фильтровали и концентрировали. Затем остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Остаток поглощали водой/соляной кислотой и сушили вымораживанием. Было получено 12 мг титульного соединения.
LCMS-Rt (B): 1,05 мин;
[M+H+]: 411,0
Пример 52
Соль трифторуксусной кислоты 1-[2-((R)-6,8-дихлор-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-диона
a) N-{2-[2-(2,4-Дихлорбензиламино)-1-гидроксиэтил]фенил}ацетамид
2,4-Дихлорбензиламин (2,1 мл) растворяли в абсолютном этаноле (20 мл) и при перемешивании при комнатной температуре прикапывали N-[2-(2-бромацетил)фенил]ацетамид (2 г), растворенный в абсолютном этаноле (50 мл). Через 30 мин добавляли боргидрид натрия (600 мг) при охлаждении льдом и перемешивали еще 1,5 часа. Затем отгоняли растворитель, и остаток поглощали смесью этилацетат/вода. Фазы разделяли, и водную фазу еще три раза экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной хроматографии. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток подщелачивали карбонатом калия и три раза экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Было получено 720 мг титульного соединения.
LCMS-Rt (B): 0,93 мин;
[M+H+]: 353,0
b) 1-(2-Аминофенил)-2-(2,4-дихлорбензиламино)этанол
N-{2-[2-(2,4-Дихлорбензиламино)-1-гидроксиэтил]фенил}ацетамид (100 мг) растворяли в метаноле (5 мл) и смешивали с раствором метилата натрия (0,3 мл; 30% в метаноле). После 6 часов нагревания с обратным потоком реакционную смесь подавали в ледяную воду, нейтрализовали 2н соляной кислотой и три раза экстрагировали этилацетатом. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором карбоната калия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Было получено 34 мг желаемого соединения, которое далее непосредственно подвергали превращению.
LCMS-Rt (B): 0,90 мин;
[M+H+]: 311,0
c) 2-((R)-6,8-Дихлор-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин
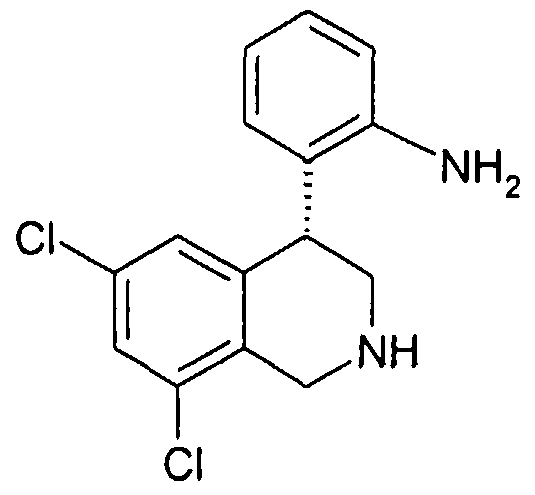
1-(2-Аминофенил)-2-(2,4-дихлорбензиламино)этанол (34 мг) растворяли в дихлорметане (1 мл) и смешивали с концентрированной серной кислотой при охлаждении льдом и перемешивании. Затем удаляли баню со льдом и при выпаривании дихлорметана смесь перемешивали 10 часов при 80°C. После охлаждения реакционную смесь при охлаждении льдом смешивали с ледяной водой и устанавливали щелочную среду с помощью 10M раствора гидроксида натрия. Водную фазу три раза экстрагировали дихлорметаном, и объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали на кизельгеле. Было получено 22 мг желаемого соединения.
LCMS Rt (B): 0,99 мин;
[M+H+]: 293,0
d) Соль трифторуксусной кислоты 1-[2-((R)-6,8-дихлор-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-диона
2-((R)-(6,8-Дихлор-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (22 мг) нагревали вместе с янтарной кислотой (10 мг) и полифосфорной кислотой (2 мл) в лабораторном стеклянном сосуде с завинчивающейся крышкой в течение 3 часов до 150°C. Для обработки еще горячую реакционную смесь подавали в ледяную воду и устанавливали щелочную среду с помощью насыщенного раствора карбоната калия. Водную фазу три раза экстрагировали этилацетатом, и объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, и остаток сушили вымораживанием. Было получено 7 мг титульного соединения.
LCMS-Rt (B): 1,04 мин;
[M+H+]: 375,0
Пример 53
3-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дионгидрохлорид
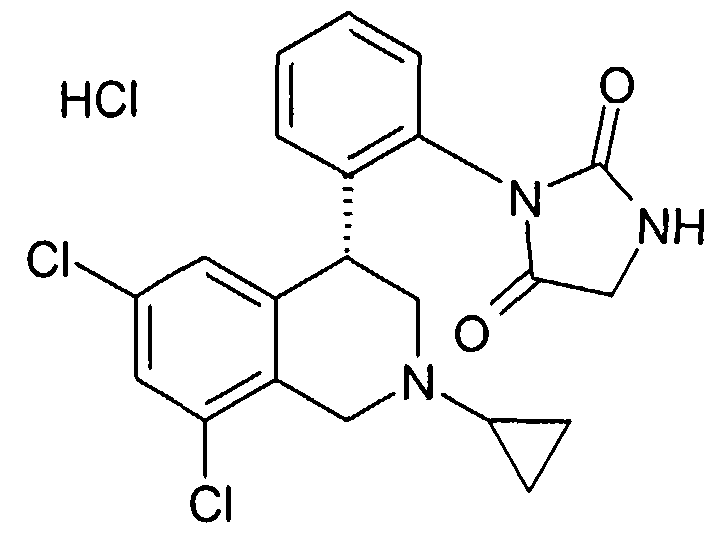
39 мг титульного соединения получали аналогично примеру 1 исходя из 2-((R)-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (пример 41b) и этилизоцианатацетата.
LCMS-Rt (B): 1,14 мин;
[M+H+]: 416,0
Пример 54
3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дионгидрохлорид
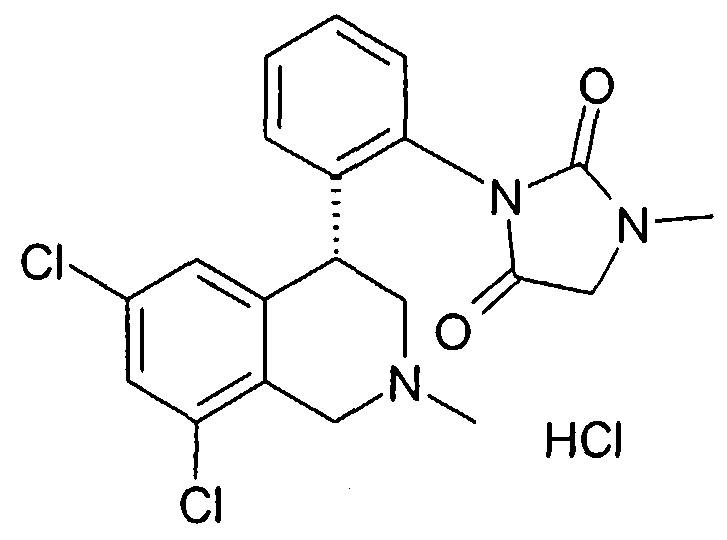
a) 4-Нитрофенил-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]карбамат
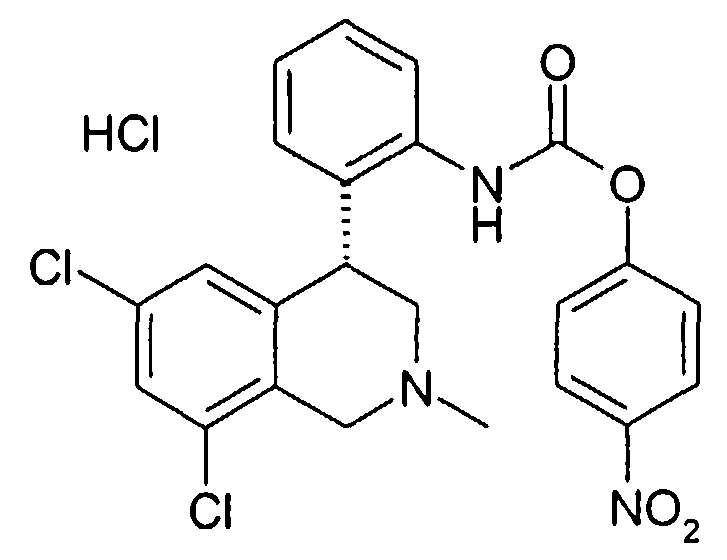
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (200 мг, энантиомер B, получение, как описано в WO 2004085404) растворяли в абсолютном дихлорметане (6 мл) и при перемешивании добавляли 4-нитрофенилхлорформат (157 мг). Через 4 часа добавляли еще 0,1 эквивалента 4-нитрофенилхлорформата. После выдерживания в течение ночи отгоняли дихлорметан, и остаток непосредственно использовали в следующей стадии.
LCMS-Rt (B): 1,29 мин;
[M+H+]: 472,0
b) 3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дионгидрохлорид
4-Нитрофенил-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]карбамат (125 мг) растворяли в абсолютном ТГФ (5 мл), и при перемешивании прикапывали гидрохлорид саркозинметилового (сложного) эфира и триэтиламин. Через 5 часов перемешивания реакционную смесь освобождали от растворителя, остаток смешивали с водой и 2н соляной кислотой и 2 часа нагревали с обратным потоком. После выдерживания в течение ночи реакционную смесь концентрировали и смешивали с этилацетатом, водой и насыщенным раствором карбоната калия. После разделения фаз органическую фазу пять раз промывали насыщенным раствором карбоната калия и два раза насыщенным раствором поваренной соли. После сушки над сульфатом магния и фильтрования концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором карбоната калия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Остаток поглощали водой/соляной кислотой и сушили вымораживанием. Было получено 60 мг титульного соединения.
LCMS-Rt (B): 1,02 мин;
[M+H+]: 404,0
Пример 55
3-[2-((R)-6,8-Дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дионгидрохлорид
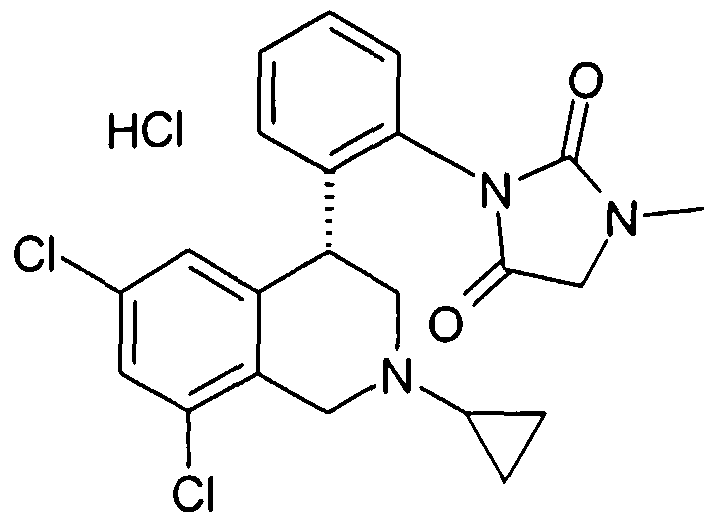
Исходя из 2-((R)-2-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (пример 41b), синтезировали титульное соединение аналогично примеру 54 и получили 55 мг титульного соединения в виде гидрохлорида.
LCMS-Rt (B): 1,17 мин;
[M+H+]: 430,0
Пример 56
3-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5,5-диметилимидазолидин-2,4-дионгидрохлорид
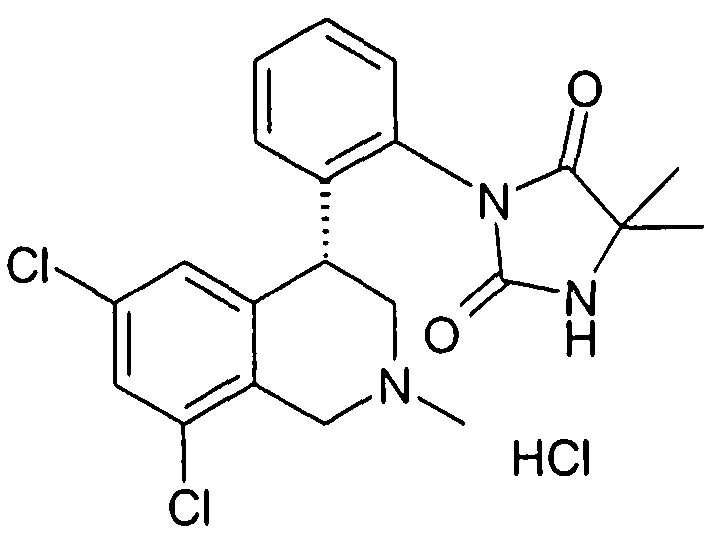
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (50 мг, энантиомер B, получение, как описано в WO 2004085404) растворяли в абсолютном дихлорметане (5 мл) и при перемешивании прикапывали метиловый эфир 2-изоцианат-2-метилпропионовой кислоты. Через 3 часа перемешивания и выдерживания в течение ночи смешивали с водой, фазы разделяли и водную фазу еще два раза экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором карбоната калия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Остаток растворяли в ацетонитриле (1 мл) и смешивали с 10%-ной соляной кислотой. После 2 часов перемешивания разбавляли водой (3 мл) и сушили вымораживанием. Было получено 68 мг титульного соединения.
LCMS-Rt (B): 1,08 мин;
[M+H+]: 418,0
Пример 57
Соль трифторуксусной кислоты (R и S)-3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-(2-метилсульфанилэтил)имидазолидин-2,4-диона
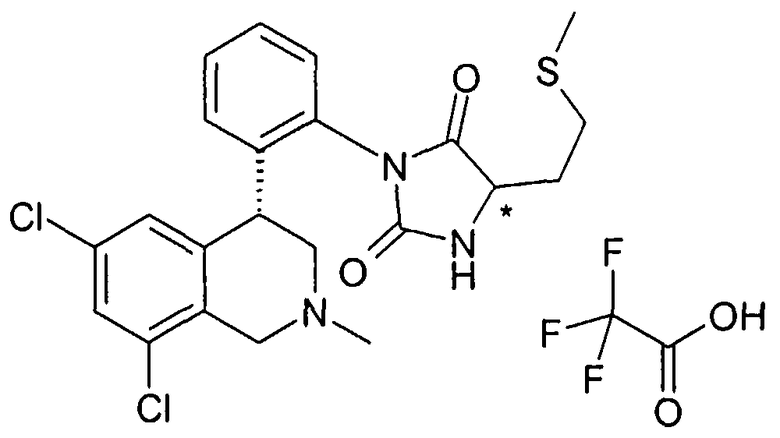
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (50 мг, энантиомер B, получение, как описано в WO 2004085404) подвергали превращению аналогично примеру 56 с этил-2-изоцианат-4-(метилтио)бутиратом (33 мг) в метиленхлориде, очищали и подвергали циклизации. Полученный таким образом сырой продукт затем очищали посредством ВЭЖХ и при этом смогли разделить на его диастереомеры, полярный P1 и неполярный P2.
P1:
LCMS-Rt (B): 1,11 мин;
[M+H+]: 464,0
P2:
LCMS-Rt (B): 1,16 мин;
[M+H+]: 464,0
Исходя из (R)-2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламина (энантиомер B, получение, как описано в WO 2004085404) и соответствующих изоцианатов аналогично примеру 56 были получены следующие продукты в виде смеси диастереомеров:
[M+H+]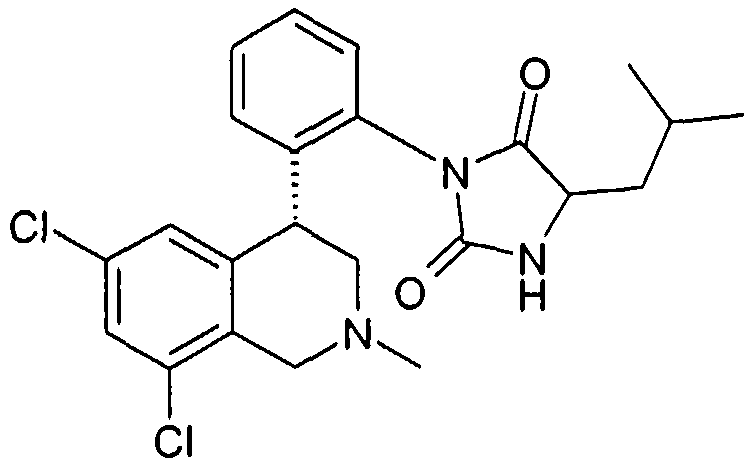
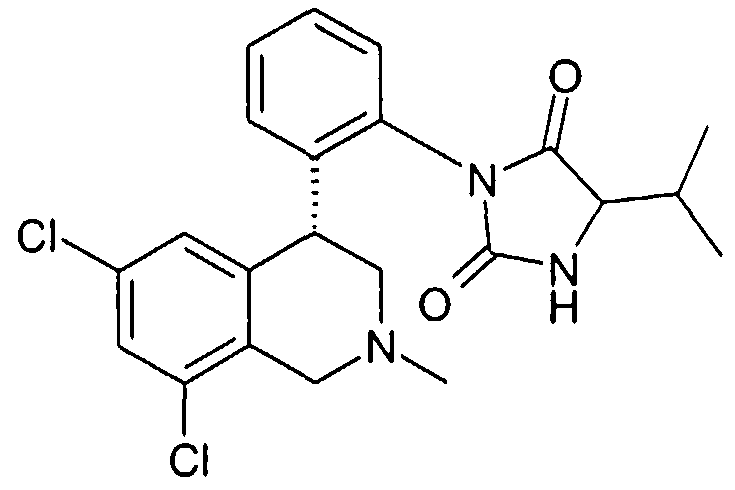
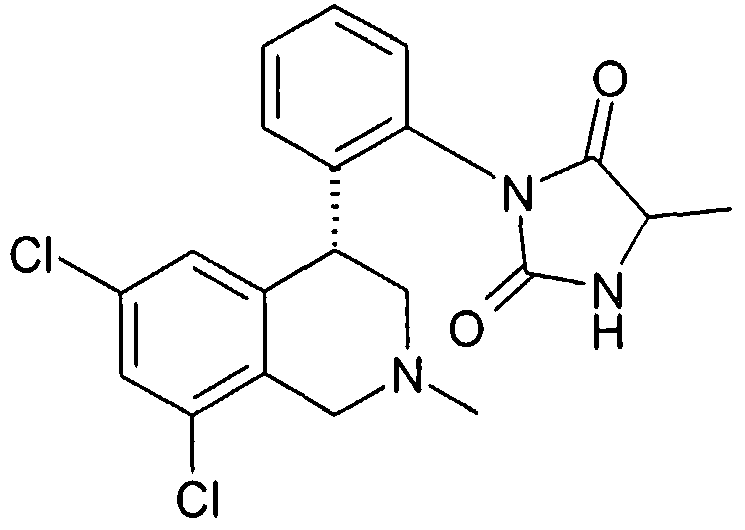
Пример 61
1-[2-((R)-2-Метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дионгидрохлорид
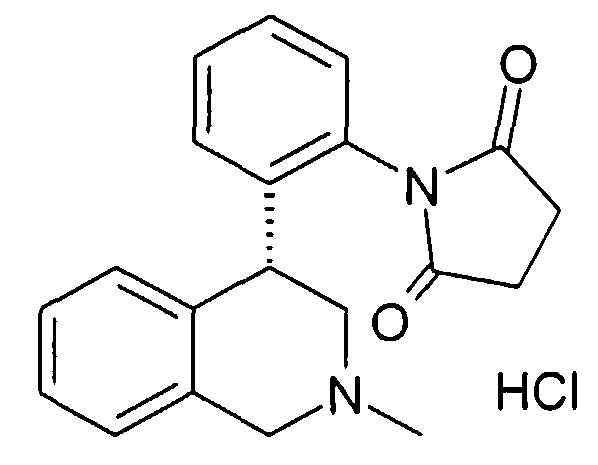
В гидрогенизатор к раствору 1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-диона (68 мг, пример 7) в метаноле (15 мл) добавляли на кончике шпателя палладий на активированном угле (5%) и после создания атмосферы водорода трясли 2 часа. После удаления водорода аппарат оставляли на ночь под аргоном, и затем отфильтровывали катализатор и промывали метанолом. Фильтрат передавали для сушки. 10 мг сырого продукта поглощали водой и 10%-ной соляной кислотой и сушили вымораживанием. Было получено 10 мг титульного соединения.
LCMS-Rt (B): 0,87 мин;
[M+H+]: 312,1
Пример 62
1-[2-((R)-6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метил-1,3-дигидроимидазол-2-онгидрохлорид
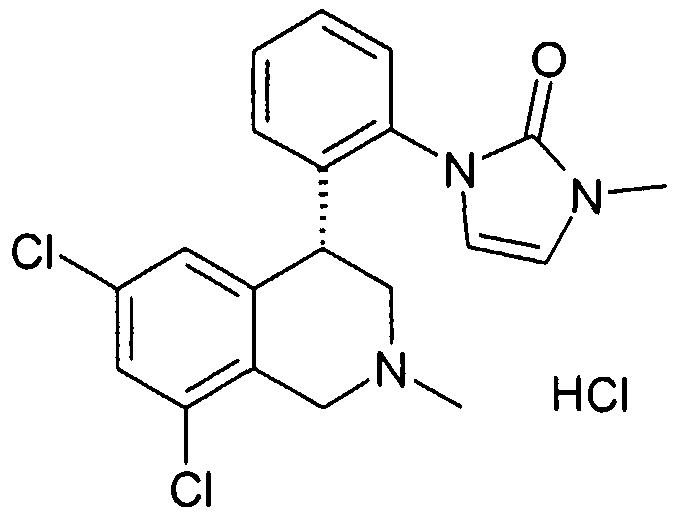
(R)-2-(6,8-Дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (энантиомер B, получение, как описано в WO 2004085404), 4-нитрофенилхлорформат и метиламиноацетальдегиддиметилацеталь подвергали превращению аналогично примеру 40, и затем полученный промежуточный продукт (85 мг) подвергали циклизации со смесью из воды (1 мл) и 10%-ной соляной кислоты (3,2 мл). Обработка и очистка происходила аналогично примеру 40. Было выделено 65 мг титульного соединения.
LCMS-Rt (B): 1,02 мин;
[M+H+]: 388,0
Пример 63
1-[2-(8-Бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дионгидрохлорид
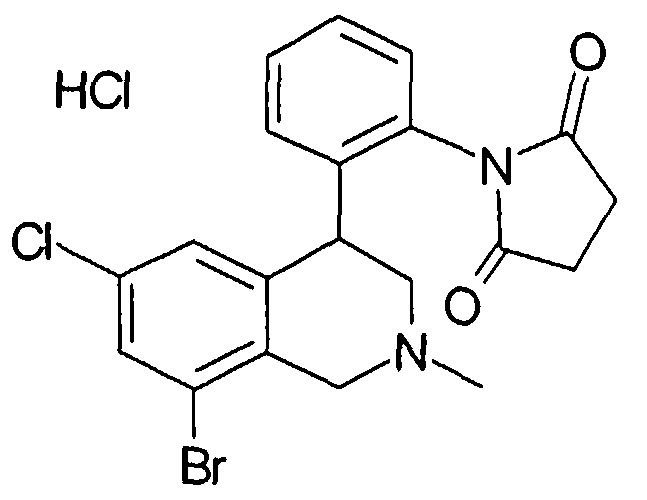
a) 2-Бром-1-бромметил-4-хлорбензол
2-Бром-4-хлортолуол (5 г) помещали в четыреххлористый углерод (120 мл), и затем друг за другом вводили при перемешивании AIBN (400 мг) и NBS (4,8 г). Затем реакционную смесь при перемешивании нагревали с обратным потоком в течение 6 часов, и затем добавляли следующую порцию NBS (0,6 г) при комнатной температуре. Еще через два часа нагревания с обратным потоком нагрев отключали и оставляли стоять на ночь. После отфильтровывания осадка промывали четыреххлористым углеродом, и затем фильтрат три раза экстрагировали 0,5н раствором гидрокарбоната натрия, несколько раз промывали водой до нейтрального значения pH промывочного раствора. Органические фазы сушили над сульфатом магния, фильтровали и концентрировали. После хроматографии на кизельгеле получили 3,57 г титульного соединения.
LCMS-Rt (B): 1,85 мин;
[M+H+]: 202,6 (Cl+)
b) (2-Бром-4-хлорбензил)метиламин
Брали 33% этанольный раствор метиламина (13 мл) и при перемешивании в течение 30 мин прикапывали 2-бром-1-бромметил-4-хлорбензол (3 г), растворенный в абсолютном этаноле (20 мл). После 4 часов перемешивания при комнатной температуре оставляли стоять на ночь. После отгонки растворителя остаток поглощали этилацетатом и один раз экстрагировали 1н соляной кислотой. С помощью 10н раствора гидроксида натрия устанавливали pH 11 водной фазы и затем три раза экстрагировали этилацетатом. Объединенные этилацетатные фазы сушили над сульфатом магния, фильтровали и концентрировали. Было получено 1,7 г желаемого соединения.
LCMS-Rt (B): 0,76 мин;
[M+H+]: 233,9
c) N-(2-{2-[(2-Бром-4-хлорбензил)метиламино]ацетил}фенил)ацетамид
(2-Бром-4-хлорбензил)метиламин (1,7 г) помещали в абсолютный этанол (5 мл). После добавления гидрокарбоната натрия (1,2 г) при перемешивании прикапывали N-[2-(2-бромацетил)фенил]ацетамид (2 г), растворенный в этаноле (80 мл). После перемешивания в течение 4 часов при комнатной температуре оставляли шихту на ночь. Для обработки растворитель отгоняли, остаток смешивали с этилацетатом/водой, водную фазу еще два раза экстрагировали этилацетатом и затем объединенные этилацетатные фракции сушили над сульфатом магния, фильтровали и концентрировали. Сырой продукт очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Было получено 1,5 г желаемого продукта.
LCMS-Rt (B): 1,07 мин;
[M+H+]: 409,0
d) N-(2-{2-[(2-Бром-4-хлорбензил)метиламино]-1-гидроксиэтил}фенил)ацетамид
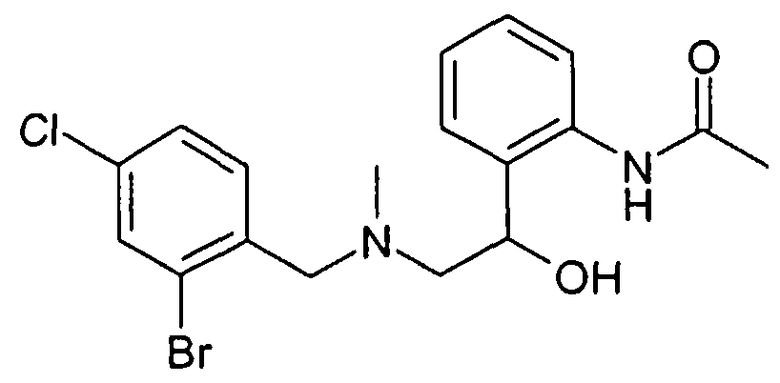
N-(2-{2-[(2-Бром-4-хлорбензил)метиламино]ацетил}фенил)ацетамид (1,5 г) помещали в метанол (45 мл) и охлаждали до 0°C с помощью водяной бани. После этого порционно вносили натрийборгидрид (266 мг), доводили до комнатной температуры и затем перемешивали еще 2 часа. Растворитель отгоняли, остаток смешивали с этилацетатом/водой, три раза экстрагировали этилацетатом, и объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Было получено 1,44 г титульного соединения.
LCMS-Rt (B): 0,94 мин;
[M+H+]: 411,0
e) 1-(2-Аминофенил)-2-[(2-бром-4-хлорбензил)метиламино]этанол
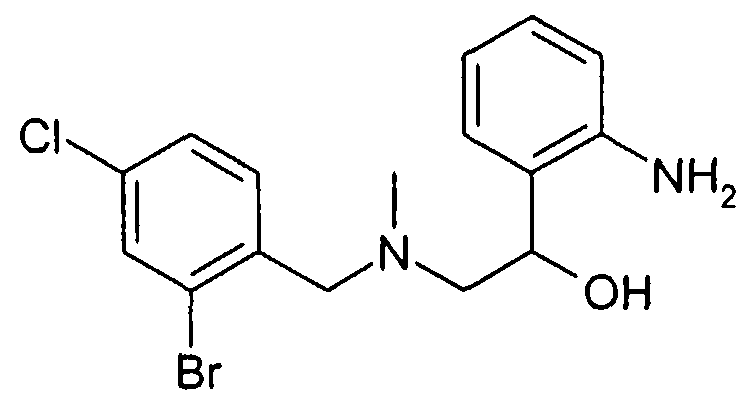
N-(2-{2-[(2-Бром-4-хлорбензил)метиламино]-1-гидроксиэтил}фенил)ацетамид (1,4 г) растворяли в абсолютном метаноле (50 мл), смешивали с раствором метилата натрия (3,5 мл) и 8 часов нагревали с обратным потоком. После следующего добавления раствора метилата натрия (1,5 мл) вновь 4 часа нагревали с обратным потоком. Реакционную смесь подавали в ледяную воду, три раза экстрагировали этилацетатом и объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором карбоната калия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Был получен 801 мг титульного соединения.
LCMS-Rt (B): 0,92 мин;
[M+H+]: 369,0
f) 2-(8-Бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин
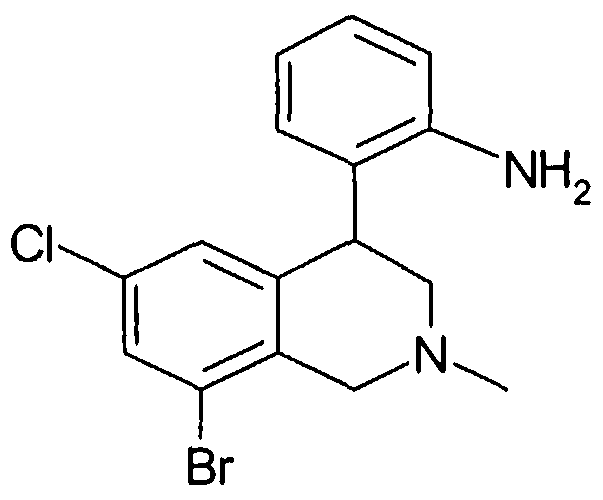
1-(2-Аминофенил)-2-[(2-бром-4-хлорбензил)метиламино]этанол (800 мг) растворяли в дихлорметане (1 мл) и при охлаждении льдом смешивали с концентрированной серной кислотой (8 мл). Затем перемешивали при 60°C в течение 7 часов. Для обработки реакционную смесь подавали в ледяную воду, устанавливали щелочную среду с помощью 10н раствора гидроксида натрия и три раза промывали этилацетатом. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ. Фракции, содержащие продукт, объединяли, отгоняли ацетонитрил на роторном испарителе, водный остаток нейтрализовали насыщенным раствором гидрокарбоната натрия и три раза экстрагировали этилацетатом. После сушки объединенных этилацетатных фаз над сульфатом магния фильтровали и передавали для сушки. Было получено 438 мг желаемого соединения.
LCMS-Rt (B): 1,03 мин;
[M+H+]: 351,0
g) 1-[2-(8-Бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дионгидрохлорид
2-(8-Бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (60 мг) смешивали с янтарной кислотой (22 мг) и подвергали превращению в полифосфорной кислоте аналогично примеру 7. Было получено 47 мг титульного соединения.
LCMS-Rt (B): 1,04 мин;
[M+H+]: 433,0
Пример 64
1-[2-(8-Бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он
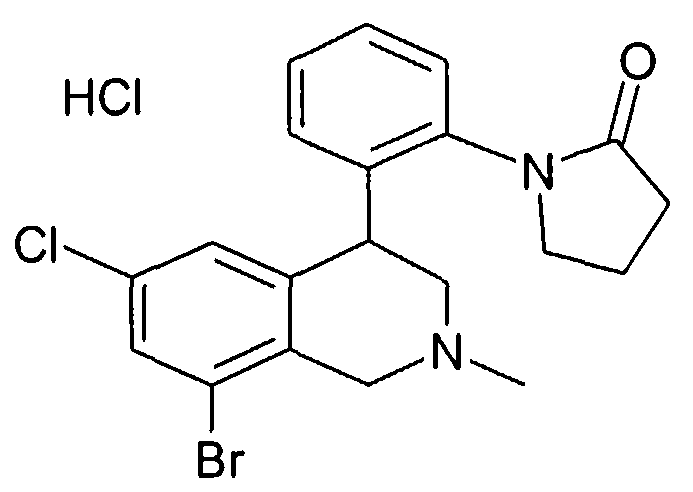
Аналогично примеру 36 подвергали превращению 2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фениламин (80 мг) с хлорангидридом 4-хлормасляной кислоты (35 мг), и полученный амид затем подвергали циклизации в ДМСО с карбонатом калия.
LCMS-Rt (B): 1,05 мин;
[M+H+]: 419,0
ФАРМАКОЛОГИЧЕСКИЕ ДАННЫЕ
Описание теста
В этом тесте определяют восстановление внутриклеточного значения pH (pHi) LAP1-клеток, которые стабильно экспримируют ионообменник натрий/протоны субтипа 3 (NHE3), после подкисления. Это восстановление наступает при нормально функционирующем NHE3 также в условиях отсутствия бикарбоната. Для этого определяют pHi с помощью pH-чувствительного флуоресцентного красителя BCECF (Molecular Probes, Eugene, OR, USA, используют предварительную стадию (Vorstufe) BCECF-AM). Клетки сначала инкубируют с BCECF (5 мкМ BCECF-AM) в буфере NH4Cl (буфер NH4Cl: 115 мМ CholinCl, 20 мМ NH4Cl, 5 мМ KCl, 1 мМ CaCl2, 1 мМ MgCl2, 20 мМ Hepes, 5 мМ глюкозы, посредством 1M KOH устанавливают pH 7,4). Внутриклеточное подкисление индуцируют промывкой клеток, инкубированных в буфере NH4Cl, буфером, не содержащим NH4Cl (133,8 мМ холинхлорида, 4,7 мМ KCl, 1,25 мМ CaCl2, 1,25 мМ MgCl2, 0,97 мМ K2HPO4, 0,23 мМ KH2PO4, 5 мМ Hepes, 5 мМ глюкозы; с помощью 1М KOH устанавливают pH 7,4). После процесса промывки ограничиваются 90 мкл буфера, не содержащего NH4Cl, на клетках. Восстановление pH вызывают добавлением 90 мкл Na+-содержащего буфера (133,8 мМ NaCl, 4,7 мМ KCl, 1,25 мМ CaCl2, 1,25 мМ MgCl2, 0,97 мМ Na2HPO4, 0,23 мМ NaH2PO4, 10 мМ Hepes, 5 мМ глюкозы, посредством 1M NaOH устанавливают pH 7,4) в измерительном приборе (FLIPR, "Fluorometric Imaging Plate Reader", Molecular Devices, Sunnyvale, Ca., USA). Флуоресценцию BCECF определяют при длине волны возбуждения 498 нм и эмиссионном фильтре FLIPR 1 (полосовой фильтр от 510 до 570 нм). Последующие изменения флуоресценции регистрируют как меру восстановления pH две минуты. Для расчета ингибирующей NHE3 способности тестируемых веществ сначала клетки исследуют в буфере, у которого полностью или в основном не наблюдается никакого восстановления pH. Для полного восстановления pH (100%) клетки инкубируют в Na+-содержащем буфере (см. выше), для определения значения 0% в буфере, не содержащем Na+ (см. выше). Они добавляются к тестируемым соединениям в Na+-содержащий буфер. Восстановление внутриклеточного pHs для каждой тестируемой концентрации вещества выражают в процентах максимального восстановления. Из процентной величины восстановления pH с помощью программы XLFit (idbs, Surrey, UK) рассчитывают значение IC50 соответствующего вещества для NHE3.
Ингибирующая активность (значение IC50) различных примеров соединений на NHE3 приведена в следующей таблице:
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ 4-ФЕНИЛТЕТРАГИДРОИЗОХИНОЛИНЫ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА, А ТАКЖЕ СОДЕРЖАЩЕЕ ИХ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2002 |
|
RU2298003C2 |
| ЗАМЕЩЕННЫЕ 4-ФЕНИЛТЕТРАГИДРОИЗОХИНОЛИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ, А ТАКЖЕ СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2004 |
|
RU2343147C2 |
| ЗАМЕЩЕННЫЕ АМИНОИНДАНЫ И ИХ АНАЛОГИ, И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2009 |
|
RU2522586C2 |
| ЗАМЕЩЕННЫЕ ТИОФЕНЫ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО ИЛИ ДИАГНОСТИЧЕСКОГО СРЕДСТВА И СОДЕРЖАЩЕЕ ИХ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2003 |
|
RU2315766C2 |
| ПИРАЗОЛОПИРИМИДИНЫ И РОДСТВЕННЫЕ ГЕТЕРОЦИКЛЫ КАК СК2 ИНГИБИТОРЫ | 2010 |
|
RU2607453C2 |
| НОВЫЕ АМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2011 |
|
RU2574409C2 |
| НОВЫЕ ИМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2772429C2 |
| ЛЕКАРСТВЕННЫЕ СОЕДИНЕНИЯ | 2014 |
|
RU2691105C1 |
| Соединения и способы для ингибирования NHE-опосредованного антипорта в лечении расстройств, ассоциированных с задержкой жидкости или солевой перегрузкой, и заболеваний желудочно-кишечного тракта | 2013 |
|
RU2684097C2 |
| ЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2000 |
|
RU2261248C2 |
Изобретение относится к новым соединениям формулы I
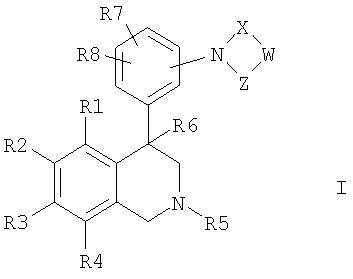
где R1, R2, R3 и R4 независимо друг от друга обозначают водород, F, Cl, Br, I; R5 обозначает водород, алкил с 1, 2, 3, 4, 5 или 6 атомами С, или циклоалкил с 3, 4, 5 или 6 атомами С; R6 обозначает водород; R7 и R8 независимо друг от друга обозначают водород, W обозначает CrH2r или CsH2s-2; причем одна или несколько СН2-групп в CrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S; R17 обозначает водород, алкил с 1, 2, 3 или 4 атомами С; r обозначает 1, 2, 3, 4, 5 или 6; s обозначает 2, 3 или 4; X обозначает -С(O)- или -S(O)2-; Z обозначает -С(O)- или связь; а также к их фармацевтически приемлемым солям и трифторацетатам. Изобретение также относится к применению соединений формулы I, а также к фармацевтической композиции. Технический результат - получение новых биологически активных соединений, которые обладают ингибирующей активностью NHE3. 3 н. и 13 з.п. ф-лы, 1 табл.
1. Соединения формулы I
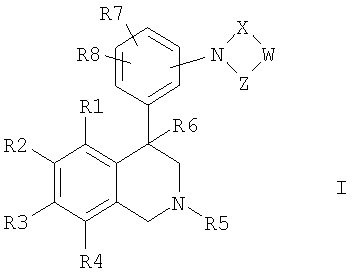
где
R1, R2, R3 и R4 независимо друг от друга обозначают водород, F, Cl, Вr, I;
R5 обозначает водород, алкил с 1, 2, 3, 4, 5 или 6 атомами С, или циклоалкил с 3, 4, 5 или 6 атомами С;
R6 обозначает водород;
R7 и R8 независимо друг от друга обозначают водород,
W обозначает СrН2r или CsH2s-2;
причем одна или несколько СН2-групп в СrН2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород, алкил с 1, 2, 3 или 4 атомами С;
r обозначает 1, 2, 3, 4, 5 или 6;
s обозначает 2, 3 или 4;
X обозначает -С(O)- или -S(O)2-;
Z обозначает -С(O)- или связь;
а также их фармацевтически приемлемые соли и трифторацетаты.
2. Соединения формулы I по п.1, где R1 и R3 обозначают водород;
R2 и R4 независимо друг от друга обозначают водород, F, Cl или Вr;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород;
R7 и R8 обозначают водород;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько CH2-групп в СrН2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород;
r обозначает 2, 3, 4, 5 или 6;
s обозначает 2, 3 или 4;
X обозначает -С(O)- или -S(O)2-;
Z обозначает -С(O)-;
а также их фармацевтически приемлемые соли и трифторацетаты.
3. Соединения формулы I по п.1, выбранные из группы
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
(S)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
4-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]морфолин-3,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,5-диметилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,3-диметилпирролидин-2,5-дион,
1-[2-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-метилимидазолидин-2,4-дион,
(3R,4S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,4-диметилпирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
3-[3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
1-[2-((R)-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-изопропилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-изобутилимидазолидин-2,4-дион,
(R и S)-3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5-(2-метилсульфанилэтил)имидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-5,5-диметилимидазолидин-2,4-дион,
1-[2-((R)-6,8-дихлор-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион,
1-[2-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((S)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,3,4,4-тетраметилпирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-4,4-диметилпиперидин-2,6-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
а также их фармацевтически приемлемые соли и трифторацетаты.
4. Соединения формулы I по п.1, выбранные из группы
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1-метилимидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
(S)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-гидроксипирролидин-2,5-дион,
4-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]морфолин-3,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]тиазолидин-2,4-дион,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
(S)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
(R)-1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,5-диметилпиперидин-2,6-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метилпирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3,3-диметилпирролидин-2,5-дион,
1-[2-(6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиперидин-2,6-дион,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пиррол-2,5-дион,
1-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2,5-дион,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[4-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2,4-дион,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2,4-дион,
а также их фармацевтически приемлемые соли и трифторацетаты.
5. Соединения формулы I по п.1, где
R1, R2, R3 и R4 независимо друг от друга обозначают водород, F, Cl или Вr;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород;
R7 и R8 независимо друг от друга обозначают водород;
W обозначает СrН2r или CsH2s-2;
причем одна или несколько СН2-групп в СrН2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород, алкил с 1,2, 3 или 4 атомами С;
r обозначает 1, 2, 3, 4, 5 или 6;
s обозначает 2, 3 или 4;
X обозначает -С(O)- или -S(O)2-;
Z обозначает связь;
а также их фармацевтически приемлемые соли и трифторацетаты.
6. Соединения формулы I по п.1 и/или 5, где
R1 и R3 обозначают водород;
R2 и R4 независимо друг от друга обозначают водород, F, Cl или Вr;
R5 обозначает водород, метил, этил или циклопропил;
R6 обозначает водород;
R7 и R8 обозначают водород;
W обозначает CrH2r или CsH2s-2;
причем одна или несколько СН2-групп в СrH2r и CsH2s-2 могут быть замещены NR17, кислородом или S;
R17 обозначает водород или метил;
r обозначает 1, 2, 3, 4, 5 или 6;
s обозначает 2, 3 или 4;
X обозначает -С(O)- или -S(O)2-;
Z обозначает связь;
а также их фармацевтически приемлемые соли и трифторацетаты.
7. Соединения формулы I по п.1 или 5, выбранные из группы
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метил-1,3-дигидроимидазол-2-он,
(R)-6,8-дихлор-4-[2-(1,1-диоксо-1-λ6-изoтиaзoлидин-2-ил)фeнил]-2-мeтил-1,2,3,4-тетрагидроизохинолин,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1,3-дигидроимидазол-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
1-[3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)феннл]пиперидин-2-он,
1-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
3-[2-((R)-6,8-дихлор-2-циклопропил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]оксазолидин-2-он,
6,8-диxлop-4-[4-(1,1-диoкco-1-λ6-[1,2,5]тиaдиaзoлидин-2-ил)фeнил]-2-метил-1,2,3,4-тетрагидроизохинолин,
а также их фармацевтически приемлемые соли и трифторацетаты.
8. Соединения формулы I по п.1 или 5, выбранные из группы
1-[2-(8-бром-6-хлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил] пирролидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-3-метил-1,3-дигидроимидазол-2-он,
(R)-6,8-дихлор-4-[2-(1,1-диоксо-1-λ6-изoтиaзoлидин-2-ил)фeнил]-2-мeтил-1,2,3,4-тетрагидроизохинолин,
3-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил] оксазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]-1,3-дигидроимидазол-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]имидазолидин-2-он,
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он
и
1-[2-((R)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил]пирролидин-2-он,
а также их фармацевтически приемлемые соли и трифторацетаты.
9. Соединения формулы I и их фармацевтически приемлемые соли по одному или нескольким пп.1 или 5 для применения в качестве лекарственных средств, обладающих ингибирующей активностью NHE3.
10. Соединения формулы I и их фармацевтически приемлемые соли по одному или нескольким пп.1 или 5 для получения лекарственного средства для лечения или профилактики нарушений импульса дыхания, нарушений дыхания, нарушений дыхания во сне, остановки дыхания во сне, храпа, острых и хронических заболеваний почек, острой почечной недостаточности и хронической почечной недостаточности, нарушений функции кишечника, нарушений функции желчного пузыря.
11. Применение соединений формулы I и их фармацевтически приемлемых солей по одному или нескольким пп.1-8 для получения лекарственного средства для лечения или профилактики нарушений импульса дыхания, нарушений дыхания, нарушений дыхания во сне, остановки дыхания во сне, храпа, острых и хронических заболеваний почек, острой почечной недостаточности и хронической почечной недостаточности, нарушений функции кишечника, нарушений функции желчного пузыря.
12. Применение по п.11 соединений формулы I и/или их фармацевтически приемлемых солей по одному или нескольким пп.1-8 для получения лекарственного средства для лечения или профилактики нарушений импульса дыхания и/или нарушений дыхания во сне как остановка дыхания во сне.
13. Применение по п.11 соединений формулы I и/или их фармацевтически приемлемых солей по одному или нескольким пп.1-8 для получения лекарственного средства для лечения или профилактики храпа.
14. Применение по п.11 соединений формулы I и/или их фармацевтически приемлемых солей по одному или нескольким пп.1-8 для получения лекарственного средства для лечения или профилактики острых или хронических заболеваний почек, острой почечной недостаточности или хронической почечной недостаточности.
15. Применение по п.11 соединений формулы I и/или их фармацевтически приемлемых солей по одному или нескольким пп.1-8 для получения лекарственного средства для лечения или профилактики нарушений функции кишечника.
16. Фармацевтическая композиция, обладающая ингибирующей активностью NHE3, для применения в медицине или ветеринарии, содержащая эффективное количество соединения формулы I и/или его фармацевтически приемлемой соли, по одному или нескольким пп.1-8.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| RU 2002114338 A, 27.12.2003. | |||
Авторы
Даты
2010-09-10—Публикация
2005-12-30—Подача