ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Область изобретения
Настоящее изобретение относится к соединениям, которые по существу активны в желудочно-кишечном тракте для ингибирования опосредованного NHE (Na+/Н+-обменник) антипорта ионов натрия и ионов водорода, и к применению таких соединений в лечении расстройств, ассоциированных с задержкой жидкости или солевой перегрузкой, и в лечении заболеваний желудочно-кишечного тракта, включая лечение или уменьшение боли, ассоциированной с заболеванием желудочно-кишечного тракта.
Описание уровня техники
Расстройства, ассоциированные с задержкой жидкости и солевой перегрузкой
Согласно Американской кардиологической ассоциации, более 5 миллионов американцев страдают сердечной недостаточностью, и по оценкам каждый год происходит 550000 случаев застойной сердечной недостаточности (CHF) (Schocken, D.D. et al., Prevention of heart failure: scientific statement from American Heart Association Councils on Epidemiology and Prevention, Clinical Cardiology, Cardiovascular Nursing, and High Blood Pressure Research; Quality of Care and Outcomes Research Interdisciplinary Working Group; and Functional Genomics and Translational Biology Interdisciplinary Working Group: Circulation, v. 117, no. 19, p. 2544-2565 (2008)). Клинический синдром застойной сердечной недостаточности возникает, когда сердечная дисфункция препятствует адекватной перфузии периферических тканей. Наиболее частая форма сердечной недостаточности, приводящей к CHF, представляет собой систолическую сердечную недостаточность, вызванную сократительной недостаточностью миокарда. Основной причиной CHF является ишемическая болезнь коронарных артерий, с инфарктом или в отсутствие инфаркта. Длительная гипертензия, в особенности плохо контролируемая, может привести к CHF.
У пациентов с CHF нейрогуморальные компенсаторные механизмы (то есть симпатическая нервная система и система ренин-ангиотензина) активируются в попытке поддержания нормального кровотока. Система ренин-ангиотензина активируется в ответ на снижение сердечного выброса, вызывая повышенные уровни в плазме ренина, ангиотензина II и альдостерона. Поскольку объем крови в сердце увеличивается, сердечный выброс увеличивается пропорционально, до точки когда сердце больше не способно расширяться. При сердечной недостаточности сократительная способность снижается, так что сердце работает при более высоких объемах и более высоких давлениях кровенаполнения, чтобы поддерживать выброс. Давления кровенаполнения могут в итоге увеличиться до уровня, который вызывает транссудацию жидкости в легкие и застойные симптомы (например отек, одышку). Все эти симптомы связаны с объемом жидкости и задержкой солей, и эта длительная перегрузка жидкостью и солью вносит дополнительный вклад в прогрессирование заболевания.
Согласие со схемой приема лекарств и ограничениями соли в пище является ключевым в самоконтроле для пациентов с сердечной недостаточностью и может продлить жизнь, сократить число госпитализаций и улучшить качество жизни. Врачи часто рекомендуют придерживаться количества потребляемой соли ниже 2,3 г в сутки и не более 2 г в сутки для людей с сердечной недостаточностью. Большинство людей потребляет значительно больше этого количества, так что по всей вероятности субъекту с застойной сердечной недостаточностью требуется найти пути для снижения количества соли в пище.
В настоящее время существует ряд лекарственных терапий для пациентов, страдающих CHF. Например, диуретики могут быть использованы или введены для освобождения от застоя путем уменьшения объема и соответственно давлений кровенаполнения ниже тех, которые вызывают отек легких. Противодействуя увеличению объема, диуретики сокращают сердечный выброс; однако, усталость и головокружение могут сменить симптомы CHF. Среди классов или типов диуретиков, используемых в настоящее время, имеются тиазиды. Тиазиды ингибируют транспорт NaCl в почках, тем самым предотвращая реабсорбцию Na в кортикальном сегменте конечного участка петли Генле и проксимальном участке дистального извитого канальца. Однако, эти лекарственные средства не эффективны при скорости клубочковой фильтрации (GFR) менее 30 мл/мин. Кроме того, тиазиды, а также другие диуретики могут вызывать гипокалиемию. Также среди классов или типов диуретиков, используемых в настоящее время, имеются петлевые диуретики (например фуросемид). Они являются наиболее сильнодействующими диуретиками и особенно эффективны в лечении отека легких. Петлевые диуретики ингибируют NaKCI транспортную систему, тем самым предотвращая реабсорбцию Na в петле Генле.
Пациенты, имеющие персистентный отек, несмотря на прием высоких доз диуретиков, могут проявлять или приобрести резистентность к диуретикам. Резистентность к диуретикам может быть вызвана плохой доступностью лекарственного средства. У пациентов с почечной недостаточностью, которая часто возникает у пациентов с CHF, эндогенные кислоты конкурируют с петлевыми диуретиками, такими как фуросемид, за секреторный путь органической кислоты в просвете канальцев нефрона. Поэтому требуются более высокие дозы или непрерывная инфузия для достижения поступления адекватного количества лекарственного средства в нефрон. Однако, современный мета-анализ выявил понимание долгосрочного риска длительного применения диуретиков в лечении CHF. Например, в недавнем исследовании (Ahmed et al., Int J Cardiol. 2008 April 10; 125(2): 246-253) было показано, что длительное применение диуретиков ассоциировано со значительно повышенной смертностью и госпитализацией у амбулаторных пожилых пациентов с сердечной недостаточностью, получающих ингибитор ангиотензин-превращающего фермента и диуретики.
Ингибиторы ангиотензин-превращающего фермента ("АСЕ") представляют собой пример другой лекарственной терапии, которая может быть использована для лечения застойной сердечной недостаточности. АСЕ-ингибиторы вызывают вазодилатацию путем блокирования системы ренин-ангиотензин-альдостерон. Аномально низкий сердечный выброс может вызвать ответ ренальной системы путем высвобождения ренина, который затем превращает ангиотензиноген в ангиотензин I. АСЕ превращает ангиотензин I в ангиотензин II. Ангиотензин II стимулирует центры жажды в гипоталамусе и вызывает сужение кровеносных сосудов, тем самым повышая кровяное давление и венозный приток. Ангиотензин II также вызывет высвобождение альдостерона, вызывая реабсорбцию Na и сопутствующую пассивную реабсорбцию жидкости, которая в свою очередь вызывает увеличение объема крови. АСЕ-ингибиторы блокируют эту компенсаторную систему и улучшают сердечную деятельность путем уменьшения системной и легочной сосудистой резистентности. АСЕ-ингибиторы проявляют преимущество выживания и традиционно представляют препараты выбора при лечении CHF. Однако, так как АСЕ-ингибиторы снижают альдостерон, К-секретирующий гормон, одним из побочных эффектов их применения является гиперкалиемия. Кроме того, АСЕ-ингибиторы, как было показано, приводят к острой почечной недостаточности у некоторых категорий пациентов с CHF (см., например, C.S. Cruz et al., "Incidence and Predictors of Development of Acute Renal Failure Related to Treatment of Congestive Heart Failure with ACE Inhibitors, Nephron Clin. Pract., v. 105, no. 2, pp C77-C83 (2007)).
Пациенты с поздней стадией заболевания почек ("ESRD"), то есть 5 стадией хронической почечной недостаточности, обязаны проходить гемодиализ три раза в неделю. Квази-отсутствие почечной функции и способности выводить соль и жидкость приводит в результате к большим колебаниям массы тела, так как жидкость и соль накапливаются в организме (солевая/объемная перегрузка). Задержка жидкости характеризуется междудиализным набором массы. Сильная задержка жидкости также осложняется сердечной дисфункцией, в частности CHF. Диализ используют для удаления уремических токсинов, а также для регулирования гомеостаза соли и жидкости. Однако, симптоматическая междудиализная гипотензия (SIH) может возникнуть у пациентов, прошедших диализ. SIH проявляется у примерно от 15% до 25% пациентов с ESRD (Davenport, Α., С.Сох, and R. Thuraisingham, Blood pressure control and symptomatic intradialytic hypotension in diabetic haemodialysis patients: cross-sectional survey; Nephron Clin. Pract., v. 109, no. 2, p.c65-c71 (2008)). Подобно пациентам с гипертонией и CHF, ограничения приема соли и жидкости настоятельно рекомендуются, но плохо выполнимы из-за плохой вкусовой привлекательности пищи с низким содержанием соли.
Причина первичной или "эссенциальной" гипертензии не выяснена. Однако, некоторые наблюдения указывают на почки как основной фактор. Убедительные данные в отношении избыточного потребления соли и повышенного кровяного давления получены от INTERSALT, перекрестного исследования более чем 10000 участников. Для индивидуумов была обнаружена значительная положительная независимая линейная взаимосвязь между 24-часовой экскрецией натрия и систолическим кровяным давлением. Было обнаружено, что более высокая индивидуальная 24-часовая экскреция натрия с мочой ассоциирована с более высоким систолическим/диастолическим кровяным давлением в среднем на 6-3/3-0 мм рт.ст. Первичная гипертензия является типичным примером комплексного, мультифакториального и полигенного признака. Все эти моногенные гипертензивные симптомы по существу локализованы в мутированных генах, включая увеличение функции различных компонентов системы ренин-ангиотензин-альдостерон, приводящей к задержке избыточного почечного натрия. В широком смысле эти синдромы характеризуются повышенной реабсорбцией почечного натрия, возникающей в результате либо первичных дефектов в транспортных системах натрия, либо стимуляции минералкортикоидной рецепторной активности (Altun, В., and M. Arid, 2006, Salt and blood pressure: time to challenge; Cardiology, v. 105, no. 1, p. 9-16 (2006)). Намного больше контролируемых исследований было осуществлено на пациентах с гипертонией за последние три десятилетия для определения того, будет ли уменьшение натрия снижать стойкое высокое кровяное давление. Мета-анализы этих исследований ясно показали существенное снижение кровяного давления у пациентов с гипертонией.
При поздней стадии заболевания печени (ESLD) накопление жидкости в виде асцита, отека или плеврального выпота из-за цирроза встречается часто и происходит в результате перестройки регуляторных механизмов объема внеклеточной жидкости. Задержка жидкости является наиболее частым осложнением ESLD и встречается у примерно 50% пациентов, имеющих 10-летний диагноз цирроза. Это осложнение значительно ухудшает качество жизни пациентов с циррозом и также ассоциировано с плохим прогнозом. Процент однолетнего и пятилетнего выживания составляет 85% и 56%, соответственно (Kashani et al., Fluid retention in cirrhosis: pathophysiology and management; QJM, v. 101, no. 2, p. 71-85 (2008)). Наиболее приемлемые теории постулируют, что инициирующим событием в образовании асцита у пациента с циррозом является синусоидальная гипертензия. Портальная гипертензия из-за повышения синусоидального давления активирует вазодилатирующие механизмы. На поздних стадиях цирроза расширение артериол вызывает недозаполнение системного артериального сосудистого пространства. Это событие, через снижение эффективного объема крови, приводит к падению артериального давления. Впоследствии возникает барорецептор-опосредованная активация системы ренин-ангиотензин-альдостерон, симпатической нервной системы и неосмотическое высвобождение антидиуретического гормона для восстановления нормального гомеостаза крови. Эти события вызывают также задержку почечного натрия и жидкости. Висцеральная вазодилатация увеличивает выработку внутренностной лимфы, превышающую емкость лимфатической транспортной системы, и приводит к просачиванию лимфы в перитонеальную область. Персистентная задержка почечного натрия и жидкости, наряду с повышенной висцеральной проницаемостью сосудов в дополнение к просачиванию лимфы в перитонеальную область, играют главную роль в непрерывном образовании асцита.
Тиазолидиндионы (TZD), такие как розиглитазон, являются агонистическими агентами активируемого пролифератором пероксисом рецептора (PPAR) гамма для лечения диабета 2 типа и повсеместно прописываются. К сожалению, задержка жидкости возникает как наиболее частый и тяжелый побочный эффект приема TZD и становится наиболее частой причиной прекращения терапии. Частота возникновения TZD-индуцированной задержки жидкости варьирует в интервале от 7% при монотерапии и вплоть до 15% при комбинированном приеме с инсулином (Yan, T., Soodvilai, S., PPAR Research volume 2008, статья ID 943614). Механизмы таких побочных эффектов полностью не выяснены, но могут быть связаны с реабсорбцией Na и жидкости в почках. Однако, TZD-индуцированная задержка жидкости устойчива к петлевым диуретикам или тиазидным диуретикам, а комбинация агонистов активируемого пролифератором пероксисом альфа-рецептора (PPAR) с агонистами PPAR гамма, которая была предложена для снижения такой перегрузки жидкостью, ассоциирована с большим числом случаев неблагоприятных сердечно-сосудистых эффектов.
В свете вышесказанного признается, что накопление соли и жидкости вносит вклад в инвалидизацию и смертность от многих заболеваний, включая сердечную недостаточность (в частности застойную сердечную недостаточность), хроническое заболевание почек, позднюю стадию заболевания почек, заболевание печени и тому подобное. Также принято, что накопление соли и жидкости является фактором риска для гипертензии. Соответственно, существует явная необходимость в лекарственном средстве, которое при введении нуждающемуся в этом пациенту приведет в результате к снижению задержки натрия, задержки жидкости или, предпочтительно, и того и другого. Такое лекарственное средство более предпочтительно также не будет вовлекать или иным образом нарушать почечные механизмы гомеостаза жидкость/Na.
Одна из возможностей рассмотрения лечения избыточной перегрузки жидкостью заключается в том, чтобы вызвать диарею. Диарею можно вызвать некоторыми агентами, включая, например, слабительные средства, такие как сорбитол, полиэтиленгликоль, бисакодил и фенолфталеин. Сорбитол и полиэтиленгликоль вызывают осмотическую диарею с низкими уровнями секретируемых электролитов; таким образом, их полезность в удалении соли натрия из ЖК-тракта ограничена. Механизм действия фенолфталеина точно не установлен, но считается, что он вызывает ингибирование Na/K-АТФазы и Cl/НСО3 анионный обмен и стимуляцию электрогенной анионной секреции (см., например, Eherer, A.J., С.A. Santa Ana, J. Porter, and J.S. Fordtran, 1993, Gastroenterology, v. 104, no. 4, p. 1007-1012). Однако, некоторые слабительные средства, такие как фенолфталеин, не представляют реальную возможность для длительного лечения задержки жидкости в виду потенциального риска карциногенности у людей. Более того, слабительные средства не могут быть использованы длительно, так как они, как было показано, вызывают раздражение и повреждение слизистой. Соответственно, следует признать, что вызывание хронической диареи в качестве попытки регулировать задержку соли и жидкости представляет нежелательный вид лечения для большинства пациентов. Таким образом, любое лекарственное средство, использующее ЖК-тракт для этой цели, было бы необходимо для регулирования диареи с целью достижения практического преимущества.
Одним из подходов для лечения умеренной диареи является введение полимера, абсорбирующего жидкость, такого как природное растительное волокно псиллиум. Полимерные материалы, и более конкретно гидрогелевые полимеры, могут также быть использованы для выведения жидкости из желудочно-кишечного (ЖК) тракта. Применение таких полимеров описано, например, в патентах США 4470975 и 6908609, полное содержание которых включено в данное описание ссылкой для всех релевантных и сопутствующих целей. Однако, что касается таких полимеров, для эффективного удаления значительных количеств жидкости они желательно должны выдерживать интервал статического и осмотического давления, существующий в ЖК-тракте. У многих млекопитающих, включая людей, вырабатывается мягкий стул при содержании воды примерно 70% и вырабатывается так путем транспорта жидкости против высокой гидравлической устойчивости, сообщаемой фекальными массами. Некоторые исследования показывают, что давление, требуемое для дегидратации фекалий от примерно 80% до примерно 60%, составляет от примерно 500 кПа до примерно 1000 кПа (то есть от примерно 5 до примерно 10 атм) (см., например, McKie, А.Т., W. Powrie, and R.J. Naftalin, 1990, Am J Physiol, v. 258, no. 3 Pt 1, p. G391-G394; Bleakman, D., and R.J. Naftalin, 1990, Am J Physiol, v. 258, no. 3 Pt 1, p. G377-G390; Zammit, P.S., M. Mendizabal, and R.J. Naftalin, 1994, J Physiol, v. 477 (Pt 3), p. 539-548). Однако, статическое давление, измеренное в просвете, составляет обычно от примерно 6 кПа до примерно 15 кПа. Скорее, высокое давление, необходимое для дегидратации фекалий, вызвано по существу осмотическим процессом, а не механическим процессом, вызываемым мышечными силами. Осмотическое давление возникает в результате активного транспорта соли через слизистую толстой кишки, что в итоге вызывает гипертоническую абсорбцию жидкости. Вызванный осмотический градиент продвигает жидкость из просвета к серозной части слизистой. Полимеры, абсорбирующие жидкость, такие как описанные, например, в патентах США 4470975 и 6908609, могут оказаться неспособными поддерживать такое давление. Такие полимеры могут спадаться в нормальной толстой кишке, где процесс абсорбции соли является интактным, тем самым удаляя небольшое количество жидкости и тем самым соль.
Также были описаны синтетические полимеры, которые связывают натрий. Например, ионообменные полимерные смолы, такие как катионообменные смолы типа Дауэкс, известны примерно с 1950-х. Однако, за исключением Kayexalate™ (или Kionex™), который представляет собой полистиролсульфонатную соль, одобренную для лечения гиперкалиемии, катионообменные смолы имеют очень ограниченное применение в качестве лекарственных средств в виду, по меньшей мере отчасти, их ограниченной емкости и плохой селективности связывания катионов. Кроме того, во время ионообменного процесса смолы могут высвобождать стехиометрическое количество экзогенных катионов (например Н, К, Са), что в свою очередь может потенциально вызывать ацидолиз (Н), гиперкалиемию (К) или вносить вклад в кальцификацию (Са). Такие смолы также могут вызывать запор.
Заболевания желудочно-кишечного тракта
Запор характеризуется нечастым и затрудненным прохождением стула и становится хроническим, когда пациент страдает специфическими симптомами в течение 12 недель не подряд в пределах 12-месячного периода. Хронический запор является идиопатическим, если он не вызван другими заболеваниями или использованием лекарств. Обоснованный подход для лечения хронического запора в Северной Америке (Brandt et al., 2005, Am. J. Gastroenterol. 100 (Suppl.1):S5-S21) выявил его встречаемость у приблизительно 15% общей популяции. Сообщают, что запором наиболее часто страдают женщины, пожилые, небелые и индивидуумы из низших социоэкономических групп.
Синдром раздраженной толстой кишки (IBS) представляет собой часто встречающееся заболевание ЖК-тракта, ассоциированное с изменениями в двигательной способности, секреции и висцеральном восприятии. Диапазон клинических симптомов характеризует это заболевание, включая частоту и форму стула, боль в животе и метеоризм. Идентификация клинических симптомов IBS еще пока требует определенности, но в настоящее время его часто делят на IBS с преобладанием диареи (D-IBS) и IBS с преобладанием запора (C-IBS), где D-IBS определяют как длительное прохождение неоформленного или водянистого стула, a C-IBS как группу функциональных расстройств, представляющих собой трудную, нечастую или по-видимому неполную дефекацию. Патофизиология IBS полностью не выяснена, и множество механизмов подтверждается. Висцеральная гиперчувствительность часто считается играющей основную этиологическую роль и была предложена как биологический маркер, даже полезный для отличения IBS от других случаев абдоминальной боли. В недавнем клиническом исследовании (Posserud, I. et al, Gastroenterology, 2007;133:1113-1123) пациентов с IBS подвергали тесту на висцеральную чувствительность (баллонное расширение) и сравнивали со здоровыми субъектами. Выявлено, что 61% пациентов с IBS имели измененное висцеральное восприятие по измерениям порога боли и дискомфорта. В других обзорах отмечена роль висцеральной гиперчувствительности в симптоматике абдоминальной боли, симптоматичной для различных заболеваний желудочно-кишечного тракта (Akbar, A, et al, Aliment. Pharmaco. Ther., 2009, 30, 423-435; Bueno et al., Neurogastroenterol Motility (2007) 19 (suppl.1), 89-119). Расширение толстой и прямой кишки широко используется в качестве инструмента для оценки висцеральной чувствительности в исследованиях на животном и человеке. Тип стресса, используемый для индуцирования висцеральной чувствительности, варьирует в разных мооделях (см., например, Eutamen, H Neurogastroenterol Motil. 2009 Aug 25 [электронная публикация перед печатью]), однако стресс, такой как стресс частичного закрепления (PRS), является относительно мягкой неязвенной моделью, которая считается наиболее репрезентативной для установления IBS.
Запор часто обнаруживают у пожилых людей, особенно пациентов с остеопорозом, которым приходится принимать кальциевые добавки. Показано, что кальциевые добавки приносят пользу у пациентов с остеопорозом для восстановления костной плотности, однако степень согласия пациентов с приемом лекарства является низкой из-за вызываемых кальцием эффектов в виде запора.
Вызываемый опиоидами запор (OIC) (также называемый как вызванная опиоидами дисфункция кишечника или опиоидная кишечная дисфункция (OBD)) является часто встречаемым побочным эффектом, ассоциированным с опиоидной терапией. OIC часто описывают как запор; однако, он представляет собой совокупность побочных желудочно-кишечных (ЖК) эффектов, которые также включают спазмы в животе, метеоризм и гастроэзофагеальный рефлюкс.Пациенты с раком могут иметь связанный с заболеванием запор, который обычно осложняет опиоидную терапию. Однако, OIC не ограничен пациентами с раком. Последние исследования пациентов, принимающих опиоидную терапию для лечения боли нераковой природы, обнаружили, что приблизительно 40% пациентов испытывали запор, связанный с опиоидной терапией (менее 3 полных опорожнений кишечника за неделю), по сравнению с 7,6% в контрольной группе. Из субъектов, которым требовалась терапия слабительными, только 46% принимающих опиоидную терапию пациентов (контрольные субъекты, 84%) сообщили о достижении желаемых результатов лечения более 50% того времени (Pappagallo, 2001, Am. J. Surg. 182(5A Suppl.):11S-18S).
Некоторых пациентов, страдающих хроническим идиопатическим запором, можно успешно лечить путем изменения образа жизни, питания и увеличения приема жидкости и клетчатки, и в общем таких пациентов пытаются лечить сначала таким образом. Для пациентов, которые не отвечают на такие подходы, врачи обычно рекомендуют слабительные средства, большинство из которых доступно без рецепта. Применение слабительных, доступных без рецепта, оценивается как неэффективное у примерно половины пациентов (Johanson and Kralstein, 2007, Aliment. Pharmacol. Ther. 25(5):599-608). Другие терапевтические возможности, в настоящее время предписанные или находящиеся в клинической разработке, для лечения IBS и хронического запора, включая OIC, описаны, например, в: Chang et al., 2006, Curr. Teat. Options Gastroenterol. 9(4):314-323; Gershon and Tack, 2007, Gastroenterology 132(1):397-414; и, Hammerle and Surawicz, 2008, World J. Gastroenterol. 14(17):2639-2649. Такие лечения включают, без ограничения, лиганды серотониновых рецепторов, активаторы хлоридных каналов, антагонисты опиоидных рецепторов, агонисты рецепторов гуанилатциклазы и агонисты рецептора нуклеотидов P2Y(2). Многие из этих возможностей лечения не адекватны, так как они могут вызывать зависимость, неэффективны у некоторых пациентов, могут вызывать длительные побочные эффекты или иным образом быть менее оптимальными.
Ингибиторы Na+/Н+-обменника (ΝΗΕ)
Основная функция ЖК-тракта состоит в том, чтобы поддерживать гомеостаз вода/Na путем абсорбции по существу всей воды и Na, воздействию которых подвергается ЖК-тракт. Эпителиальный слой, покрывающий апикальную поверхность толстой кишки млекопитающих, представляет собой типичный эпителий, транспортирующий электролиты, который способен перемещать большие количества соли и воды в обоих направлениях через слизистую оболочку. Например, каждый день ЖК-тракт производит примерно 9 литров жидкости и примерно 800 м-экв. Na (см., например, Zachos et al., Molecular physiology of intestinal Na+/H+ exchange; Annu. Rev. Physiol., v. 67, p. 411-443 (2005)). Только примерно 1,5 литра этой жидкости и примерно 150 м-экв. этого натрия происходит из потребляемой пищи; скорее, большая часть жидкости (например, примерно 7,5 литров) и натрия (примерно 650 м-экв.) секретируется через органы ЖК-тракта как часть пищеварения. Таким образом, ЖК-тракт представляет собой ценную мишень для модулирования системных уровней натрия и жидкости.
Много обзоров было опубликовано по физиологии и механизмам секреции и/или абсорбции в ЖК-тракте (см., например, Kunzelmann et al., Electrolyte transport in mammalian colon: mechanisms and implications for disease; Physiol. Rev., v. 82, no. 1, p. 245-289 (2002); Geibel, J.P.; Secretion and absorption by colonic crypts; Annu. Rev. Physiol, v. 67, p. 471-490 (2005); Zachos et al., выше; Kiela, P.R. et al., Apical NA+/H+ exchangers in mammalian gastrointestinal tract, J. Physiol. Pharmacol., v. 57 Suppl. 7, p. 51-79 (2006)). Два основных механизма абсорбции Na представляют собой электронейтральный и электрогенный транспорт. Электронейтральный транспорт по существу вызван Na+/H+ антипортом NHE (например NHE-3) и ответственен за величину абсорбции Na. Электрогенный транспорт обеспечивается натриевым каналом эпителия ("ENaC"). Электронейтральный транспорт локализован преимущественно в подвздошном сегменте и проксимальной части толстой кишки, а электрогенный транспорт локализован в дистальной части толстой кишки.
NHE плазматической мембраны вносят вклад в поддержание внутриклеточного рН и объема, трансцеллюлярную абсорбцию NaCl и NHCO3 и баланс жидкости, осуществляемый эпителиальными клетками, особенно в почках, тонком кишечнике, желчном пузыре и слюнных железах, а также регуляцию системного рН. Имеется много литературы, описывающей роль и клиническое вмешательство в системные NHE для лечения расстройств, связанных с ишемией и реперфузией, для кардиопротекции или ренопротекции. Девять изоформ NHE было идентифицировано (Kiela, P.R., et al.; Apical NA+/H+ exchangers in mammal gastrointestinal tract; J. Physiol. Pharmacol., v. 57 Suppl 7, p. 51-79 (2006)), из которых NHE-2, NHE-3 и NHE-8 экспрессируются на апикальной части ЖК-тракта, причем NHE-3 обеспечивает больший вклад в транспорт. Еще один, подлежащий идентификации, Cl-зависимый NHE был идентифицирован в криптах крысиных клеток. В дополнение, много исследований было осуществлено для идентификации ингибиторов NHE. Первичными мишенями таких исследований являлись NHE-1 и NHE-3. Низкомолекулярные NHE-ингибиторы описаны, например, в: патентах США №№5866610, 6399824, 6911453, 6703405, 6005010, 6736705, 6887870, 6737423, 7326705, 5824691 (WO 94/026709), 6399824 (WO 02/024637); публикациях заявок на патент США №№2004/0039001 (WO 02/020496), 2005/0020612 (WO 03/055490), 2004/0113396 (WO 03/051866), 2005/0020612, 2005/0054705, 2008/0194621, 2007/0225323, 2004/0039001, 2004/0224965, 2005/0113396, 2007/0135383, 2007/0135385, 2005/0244367, 2007/0270414; публикациях международных заявок WO 01/072742, WO 01/021582 (СА2387529), WO 97/024113 (СА 02241531) и Европейской патентной публикации ЕР 0744397 (СА 2177007); все из которых включены в данное описание ссылкой во всей полноте для всех релевантных и сопутствующих целей.
Однако такой поиск оказался неудачным для разработки или выявления ценности или важности NHE-ингибиторов, которые не абсорбируются (то есть не являются системными) и нацелены на желудочно-кишечный тракт, как раскрыто в WO 2010/078449. Такие ингибиторы могут быть использованы в лечении расстройств, ассоциированных с задержкой жидкости и солевой перегрузкой и в лечении заболеваний ЖК-тракта, включая лечение или ослабление боли, ассоциированной с заболеванием желудочно-кишечного тракта. Такие ингибиторы особенно благоприятны, так как они могут быть доставлены с пониженным риском системных целевых или нецелевых эффектов (например, небольшим риском или при отсутствии риска вовлечения почек или других системных эффектов).
Соответственно, несмотря на прогресс в вышеупомянутых областях, в данной области техники сохраняется необходимость в новых соединениях для применения в лечении расстройств, ассоциированных с задержкой жидкости и солевой перегрузкой, и в лечении заболеваний желудочно-кишечного тракта, включая лечение или уменьшение боли, ассоциированной с заболеванием желудочно-кишечного тракта. Настоящее изобретение направлено на реализацию этой необходимости и предоставляет дополнительные преимущества.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Вкратце, настоящее изобретение относится к соединениям, которые по существу активны в желудочно-кишечном тракте для ингибирования NHE-опосредованного антипорта ионов натрия и ионов водорода, и к применению таких соединений в лечении расстройств, ассоциированных с задержкой жидкости и солевой перегрузкой, и в лечении заболеваний желудочно-кишечного тракта, включая лечение или уменьшение боли, ассоциированной с заболеванием желудочно-кишечного тракта.
В одном воплощении предложено соединение, имеющее следующую структуру формулы (I):
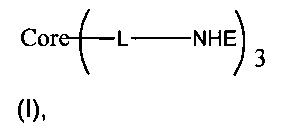
или его стереоизомер, пролекарство или фармацевтически приемлемая соль,
где:
(a) NHE представляет собой NHE-ингибирующую низкомолекулярную группировку, имеющую следующую структуру формулы (А):
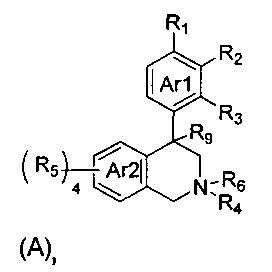
где:
каждый R1, R2, R3, R5 и R9 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из H, С1-6алкила, -C1-6алкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L;
R4 выбран из Н, С1-С7алкила или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L;
R6 отсутствует или выбран из Н и С1-С7алкила; и
Ar1 и Ar2 независимо представляют собой ароматическое кольцо или гетероароматическое кольцо;
(б) Core представляет собой коровую группировку, имеющую следующую структуру формулы (В):
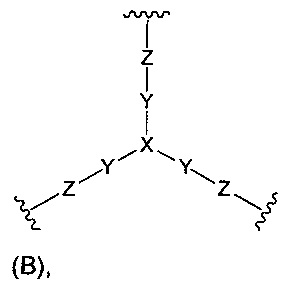
где:
X выбран из С(X1), N и группы N(С1-6алкил);
X1 выбран из водорода, возможно замещенного алкила, -NXaXb, -NO2, -NXc-C(=O)-NXc-Xa, -C(=O)NXc-Xa, -NXc-C(=O)-Xa, -NXc-SO2-Xa, -С(=O)-Ха и -OXa,
каждый Xa и Xb независимо выбран из водорода, возможно замещенного алкила, возможно замещенного циклоалкила, возможно замещенного циклоалкилалкила, возможно замещенного гетероциклила, возможно замещенного гетероциклилалкила, возможно замещенного арила, возможно замещенного аралкила, возможно замещенного гетероарила и возможно замещенного гетероарилалкила;
Y представляет собой С1-6алкилен;
Z выбран из -NZa-C(=O)-NZa-, -C(=O)NZa-, -NZa-C(=O)- и гетероарила, где X представляет собой CX1;
Z выбран из -NZa-C(=O)-NZa-, -NZa-C(=O)- и гетероарила, где X представляет собой N или N(С1-6алкил); и
каждый Хс и Za независимо выбран из водорода и С1-6алкила; и
(в) L представляет собой связь или линкер, соединяющие коровую группировку с NHE-ингибирующими низкомолекулярными группировками.
В более конкретных воплощениях NHE-ингибирующая низкомолекулярная группировка имеет следующую структуру:
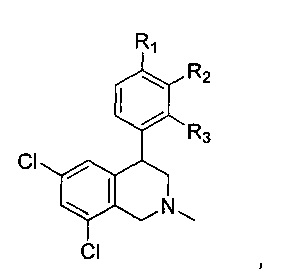
где:
каждый R1, R2 и R3 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8, и -NR7SO2NR8, где R7 и R8 независимо выбран из H, C1-6алкила, -C1-6алкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L.
В дополнительных конкретных воплощениях NHE-ингибирующая низкомолекулярная группировка имеет одну из следующих структур:
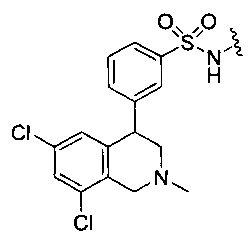 или
или 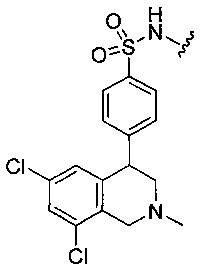
В других более конкретных воплощениях L представляет собой полиалкиленгликолевый линкер. Например, в некоторых воплощениях L представляет собой полиэтиленгликолевый линкер.
В других более конкретных воплощениях X представляет собой C(X1). В дополнительных воплощениях каждый Хс представляет собой водород.
В других более конкретных воплощениях X представляет собой N.
В других более конкретных воплощениях каждый Za представляет собой водород.
В еще одном воплощении предложено соединение, имеющее структуру формулы (II):
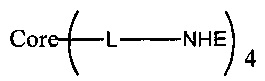
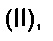
или его стереоизомер, пролекарство или фармацевтически приемлемая соль,
где:
(а) NHE представляет собой NHE-ингибирующую низкомолекулярную группировку, имеющую структуру формулы (А):
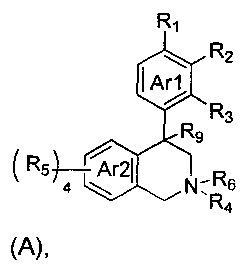
где:
каждый R1, R2, R3, R5 и R9 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из H, С1-6алкила, -C1-6элкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L;
R4 выбран из Н, С1-С7алкила или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L;
R6 отсутствует или выбран из Н и С1-С7алкила; и
Ar1 и Ar2 независимо представляют собой ароматическое кольцо или гетероароматическое кольцо;
(б) Core представляет собой коровую группировку, имеющую следующую структуру формулы (С):
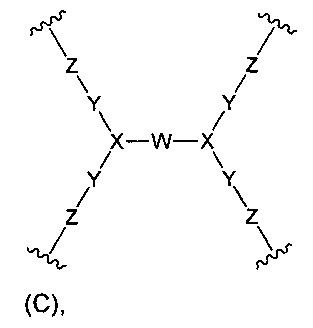
где:
W выбран из алкилена, полиалкиленгликоля, -С(=O)-NH-(алкилен)-NH-С(=O)-, -С(=O)-NH-(полиалкиленгликоль)-NH-С(=O)-, -С(=O)-(алкилен)-С(=O)-, -С(=O)-(полиалкиленгликоль)-С(=O)- и циклоалкила,
X представляет собой N;
Y представляет собой С1-6алкилен;
Z выбран из -NZa-C(=O)-NZa-, -C(=O)NZa-, -NZa-C(=O)- и гетероарила;
каждый Za независимо выбран из водорода и С1-6алкила; и
(в) L представляет собой связь или линкер, соединяющие коровую группировку с NHE-ингибирующими низкомолекулярными группировками.
В более конкретных воплощениях NHE-ингибирующая низкомолекулярная группировка имеет следующую структуру:
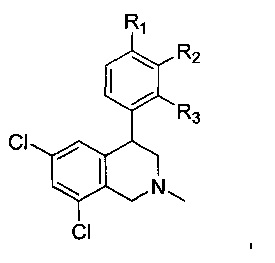
где:
каждый R1, R2 и R3 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из H, С1-6алкила, -C1-6алкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L.
В дополнительных конкретных воплощениях NHE-ингибирующая низкомолекулярная группировка имеет одну из следующих структур:
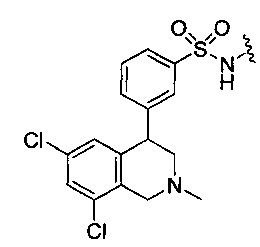 или
или 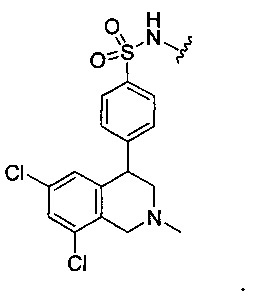
В других более конкретных воплощениях L представляет собой полиалкиленгликолевый линкер. Например, в некоторых воплощениях L представляет собой полиэтиленгликолевый линкер.
В других более конкретных воплощениях X представляет собой C(X1). В дополнительных воплощениях каждый Хс представляет собой водород.
В других более конкретных воплощениях X представляет собой N.
В других более конкретных воплощениях каждый Za представляет собой водород.
В еще одном воплощении предложена фармацевтическая композиция, содержащая соединение, как оно определено выше, или его стереоизомер, фармацевтически приемлемую соль или пролекарство и фармацевтически приемлемый носитель, разбавитель или эксципиент.
В дополнительных воплощениях композиция дополнительно содержит полимер, абсорбирующий жидкость. В дополнительных воплощениях полимер, абсорбирующий жидкость, доставляется непосредственно в толстую кишку. В дополнительных воплощениях полимер, абсорбирующий жидкость, характеризуется поглощаемостью жидкости по меньшей мере примерно 15 г изотонической жидкости на г полимера под статическим давлением примерно 5 кПа. В дополнительных воплощениях полимер, абсорбирующий жидкость, характеризуется поглощаемостью жидкости по меньшей мере примерно 15 г изотонической жидкости на г полимера под статическим давлением примерно 10 кПа. В дополнительных воплощениях полимер, абсорбирующий жидкость, характеризуется поглощаемостью жидкости по меньшей мере примерно 10 г/г. В дополнительных воплощениях полимер, абсорбирующий жидкость, характеризуется поглощаемостью жидкости по меньшей мере примерно 15 г/г. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой суперабсорбент. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой перекрестно-сшитый, частично нейтрализованный полиэлектролитный гидрогель. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой перекрестно-сшитый полиакрилат. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой полиэлектролит. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой карбофил кальция. В дополнительных воплощениях полимер, абсорбирующий жидкость, получен эмульсионным способом с высоким содержанием дисперсной фазы. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой пену. В дополнительных воплощениях полимер, абсорбирующий жидкость, получен водной свободнорадикальной полимеризацией акриламида или его производного, сшивающего агента и свободнорадикальной инициирующей редокс-системы в воде. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой гидрогель. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой N-алкилакриламид. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой сверхпористый гель. В дополнительных воплощениях полимер, абсорбирующий жидкость, является природным. В дополнительных воплощениях полимер, абсорбирующий жидкость, выбран из группы, состоящей из ксантана, гуара, велана, гемицеллюлоз, алкил-целлюлозы, гидроалкил-целлюлозы, карбоксиалкил-целлюлозы, каррагинана, декстрана, гиалуроновой кислоты и агарозы. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой псиллиум. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой полисахарид, включающий ксилозу и арабинозу. В дополнительных воплощениях полимер, абсорбирующий жидкость, представляет собой полисахарид, включающий ксилозу и арабинозу, где отношение ксилозы к арабинозе составляет по меньшей мере примерно 3:1 по массе.
В дополнительных воплощениях композиция дополнительно содержит другие фармацевтически активные агент или соединение. В дополнительных воплощениях композиция дополнительно содержит другие фармацевтически активные агент или соединение, выбранные из группы, состоящей из диуретика, сердечного гликозида, ингибитора ангиотензин-превращающего фермента (АСЕ), антагониста рецептора ангиотензина-2, антагониста альдостерона, ингибитора синтазы альдостерона, ингибитора ренина, блокатора кальциевых каналов, бета-блокатора, альфа-блокатора, центрального альфа-агониста, вазодилататора, антикоагулянта, антитромбоцитарного агента, агента, понижающего уровень липидов, и агониста гамма-рецептора, активируемого пролифератором пероксисом (PPAR). В дополнительных воплощениях диуретик выбран из группы, состоящей из петлевого диуретика, бензотиадиазидного диуретика, калийсберегающего диуретика и осмотического диуретика. В дополнительных воплощениях композиция дополнительно содержит другие фармацевтически активные агент или соединение, выбранные из группы, состоящей из анальгетического пептида или агента. В дополнительных воплощениях композиция дополнительно содержит другие фармацевтически активные агент или соединение, выбранные из группы, состоящей из слабительного средства, выбранного из агента, создающего объем (например, оболочки семян подорожника (метамуцила), метилцеллюлозы (цитруцела), поликарбофила, клетчатки, яблок, средств, размягчающих стул/поверхностно-активного вещества (например, докузата, Colace, Diocto), гидратирующего или осмотического агента (например, гидрофосфата натрия, цитрата магния, гидроксида магния (магнезии), сульфата магния (представляющего собой соль Эпсома), дигидрофосфата натрия, бифосфата натрия), гиперосмотического агента (например, глицериновых суппозиториев, сорбита, лактулозы и полиэтиленгликоля (PEG)).
В еще одном воплощении предложен способ NHE-опосредованного ингибирования антипорта ионов натрия и водорода, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения или фармацевтической композиции, как изложено выше.
В еще одном воплощении предложен способ лечения расстройства, ассоциированного с задержкой жидкости или солевой перегрузкой, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения или фармацевтической композиции, как изложено выше.
В еще одном воплощении предложен способ лечения расстройства, выбранного из группы, состоящей из сердечной недостаточности (такой как застойная сердечная недостаточность), хронического заболевания почек, поздней стадии заболевания почек, заболевания печени и задержки жидкости, вызванной агонистом гамма-рецептора, активируемого пролифератором пероксисом (PPAR), включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения или фармацевтической композиции, как изложено выше.
В еще одном воплощении предложен способ лечения гипертензии, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения или фармацевтической композиции, как изложено выше.
В дополнительных воплощениях способ включает введение млекопитающему фармацевтически эффективного количества соединения для увеличения суточной экскреции натрия и/или жидкости с фекалиями млекопитающего. В дополнительных воплощениях способ включает введение млекопитающему фармацевтически эффективного количества соединения для увеличения суточной экскреции натрия на по меньшей мере примерно 30 ммоль и/или жидкости на по меньшей мере примерно 200 мл с фекалиями млекопитающего. В дополнительных воплощениях суточная экскреция натрия и/или жидкости с фекалиями млекопитающего увеличивается в отсутствие введения другого типа катиона в стехиометрическом или близком к стехиометрическому отношении через ионообменный процесс. В дополнительных воплощениях способ дополнительно включает введение млекопитающему полимера, абсорбирующего жидкость, для абсорбции фекальной жидкости, образующейся в результате применения соединения, которое является по существу активным в желудочно-кишечном тракте для ингибирования NHE-опосредованного антипорта ионов натрия и ионов водорода в нем.
В дополнительных воплощениях соединение или композицию вводят для лечения гипертензии. В дополнительных воплощениях соединение или композицию вводят для лечения гипертензии, ассоциированной с приемом соли в пище. В дополнительных воплощениях введение соединения или композиции обеспечивает млекопитающему возможность приема более аппетитной пищи. В дополнительных воплощениях соединение или композицию вводят для лечения гиперволемии. В дополнительных воплощениях гиперволемия ассоциирована с застойной сердечной недостаточностью. В дополнительных воплощениях гиперволемия ассоциирована с поздней стадией заболевания почек. В дополнительных воплощениях гиперволемия ассоциирована с терапией агонистом гамма-рецептора, активируемого пролифератором пероксисом (PPAR). В дополнительных воплощениях соединение или композицию вводят для лечения перегрузки натрием. В дополнительных воплощениях соединение или композицию вводят для снижения междудиализного набора массы у пациентов с ESRD. В дополнительных воплощениях соединение или композицию вводят для лечения отека. В дополнительных воплощениях отек вызван химиотерапией, предменструальной задержкой жидкости или преэклампсией.
В дополнительных воплощениях соединение или композицию вводят перорально, посредством ректального суппозитория или клизмы.
В дополнительных воплощениях способ включает введение фармацевтически эффективного количества соединения или композиции в комбинации с одним или более дополнительными фармацевтически активными соединениями или агентами. В дополнительных воплощениях одно(один) или более дополнительных фармацевтически активных соединений или агентов выбраны из группы, состоящей из диуретика, сердечного гликозида, ингибитора ангиотензин-превращающего фермента (АСЕ), антагониста рецептора ангиотензина-2, антагониста альдостерона, ингибитора синтазы альдостерона, ингибитора ренина, блокатора кальциевых каналов, бета-блокатора, альфа-блокатора, центрального альфа-агониста, вазодилататора, антикоагулянта, антитромбоцитарного агента, агента, понижающего уровень липидов, и агониста гамма-рецептора, активируемого пролифератором пероксисом (PPAR). В дополнительных воплощениях диуретик выбран из группы, состоящей из петлевого диуретика, бензотиадиазидного диуретика, калийсберегающего диуретика и осмотического диуретика. В дополнительных воплощениях фармацевтически эффективное количество соединения или композиции и одно(один) или более дополнительных фармацевтически активных соединений или агентов вводят как часть одной фармацевтической композиции. В дополнительных воплощениях фармацевтически эффективное количество соединения или композиции и одно(один) или более дополнительных фармацевтически активных соединений или агентов вводят в виде индивидуальных фармацевтических композиций. В дополнительных воплощениях индивидуальные фармацевтические композиции вводят последовательно. В дополнительных воплощениях индивидуальные фармацевтические композиции вводят одновременно.
В еще одном воплощении предложен способ лечения заболевания желудочно-кишечного тракта, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения или фармацевтической композиции, как изложено выше.
В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой нарушение двигательной активности желудочно-кишечного тракта. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой синдром раздраженной толстой кишки. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой хронический запор. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой идиопатический хронический запор. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой хронический запор, возникающий у пациентов с муковисцидозом. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой вызванный опиоидами запор. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой функциональное расстройство желудочно-кишечного тракта. В дополнительных воплощениях заболевание желудочно-кишечного тракта выбрано из группы, состоящей из хронической псевдообструкции тонкой кишки и псевдообструкции толстой кишки. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой болезнь Крона. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой неспецифический язвенный колит. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой заболевание, называемое воспалительным заболеванием кишечника. В дополнительных воплощениях заболевание желудочно-кишечного тракта ассоциировано с хроническим заболеванием почек (стадия 4 или 5). В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой запор, вызванный кальциевой добавкой. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой запор, и где запор, подлежащий лечению, ассоциирован с применением терапевтического агента. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой запор, и где запор, подлежащий лечению, ассоциирован с невропатическим расстройством. В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой запор, и где запор, подлежащий лечению, представляет собой послеоперационный запор (послеоперационную кишечную непроходимость). В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой запор, и где запор, подлежащий лечению, является идиопатическим (функциональный запор или атонический запор). В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой запор, и где запор, подлежащий лечению, ассоциирован с невропатическим, метаболическим или эндокринным расстройством (например, сахарным диабетом, почечной недостаточностью, гипотиреозом, гипертиреозом, гипокальциемией, рассеянным склерозом, болезнью Паркинсона, повреждениями спинного мозга, нейрофиброматозом, вегетативной нейропатией, болезнью Шагаса, болезнью Гиршспрунга или муковисцидозом, и тому подобное). В дополнительных воплощениях заболевание желудочно-кишечного тракта представляет собой запор, и где запор, подлежащий лечению, вызван применением лекарственных средств, выбранных из анальгетиков (например опиоидов), гипотензивных средств, противосудорожных средств, антидепрессантов, спазмолитиков и антипсихотических средств.
В еще одном воплощении предложен способ лечения синдрома раздраженной толстой кишки, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения или фармацевтической композиции, как изложено выше.
В дополнительных воплощениях вышеописанных воплощений соединение или композицию вводят для лечения или уменьшения боли, ассоциированной с заболеванием желудочно-кишечного тракта. В дополнительных воплощениях соединение или композицию вводят для лечения или уменьшения висцеральной гиперчувствительности, ассоциированной с заболеванием желудочно-кишечного тракта. В дополнительных воплощениях соединение или композицию вводят для лечения или уменьшения воспаления желудочно-кишечного тракта. В дополнительных воплощениях соединение или композицию вводят для сокращения времени транзита по желудочно-кишечному тракту.
В дополнительных воплощениях соединение или композицию вводят перорально или посредством ректального суппозитория.
В дополнительных воплощениях способ включает введение фармацевтически эффективного количества соединения или композиции в комбинации с одним или более дополнительными фармацевтически активными соединениями или агентами. В дополнительных воплощениях один(одно) или более дополнительных фармацевтически активных агентов или соединений представляют собой анальгетический пептид или агент. В дополнительных воплощениях один(одно) или более дополнительных фармацевтически активных агентов или соединений выбраны из группы, состоящей из слабительного средства, выбранного из агента, создающего объем (например, оболочки семян подорожника (метамуцила), метилцеллюлозы (цитруцела), поликарбофила, клетчатки, яблок, средств, размягчающих стул/поверхностно-активного вещества (например, докузата, Colace, Diocto), гидратирующего или осмотического агента (например, гидрофосфата натрия, цитрата магния, гидроксида магния (магнезии), сульфата магния (представляющего собой соль Эпсома), дигидрофосфата натрия, бифосфата натрия) и гиперосмотического агента (например, глицериновых суппозиториев, сорбита, лактулозы и полиэтиленгликоля (PEG)). В дополнительных воплощениях фармацевтически эффективное количество соединения или композиции и одно(один) или более дополнительных фармацевтически активных соединений или агентов вводят как часть одной фармацевтической композиции. В дополнительных воплощениях фармацевтически эффективное количество соединения или композиции и одно(один) или более дополнительных фармацевтически активных соединений или агентов вводят в виде индивидуальных фармацевтических композиций. В дополнительных воплощениях индивидуальные фармацевтические композиции вводят последовательно. В дополнительных воплощениях индивидуальные фармацевтические композиции вводят одновременно.
Эти и другие аспекты изобретения будут понятны из последующего подробного описания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением и как дополнительно подробно описано здесь ниже, было обнаружено, что ингибирование NHE-опосредованного антипорта ионов натрия (Na+) и ионов водорода (Н+) в желудочно-кишечном тракте, и более конкретно желудочно-кишечном эпителии, представляет перспективный подход к лечению различных расстройств, которые могут быть ассоциированы с задержкой жидкости и/или солевой перегрузкой или могут быть вызваны ими, и/или расстройств, таких как сердечная недостаточность (в частности, застойная сердечная недостаточность), хроническое заболевание почек, поздняя стадия заболевания почек, заболевание печени и/или задержка жидкости, вызванная агонистом гамма-рецептора, активируемого пролифератором пероксисом (PPAR). Более конкретно, было обнаружено, что ингибирование NHE-опосредованного антипорта ионов натрия и ионов водорода в ЖК-тракте увеличивает экскрецию натрия с фекалиями, эффективно снижая системные уровни натрия и жидкости. Это, в свою очередь, улучшает клиническое состояние пациента, страдающего, например, CHF, ESRD/CKD и/или заболеванием печени. Также было обнаружено, что такое лечение может быть возможно усилено совместным введением других предпочтительных соединений или композиций, таких как, например, полимер, абсорбирующий жидкость. Полимер, абсорбирующий жидкость, может быть оптимально выбран таким образом, чтобы не блокировать или иным образом не влиять отрицательно на механизм действия совместно введенного NHE-ингибирующего соединения.
Кроме того, и также как подробно описано ниже, дополнительно обнаружено, что ингибирование NHE-опосредованного антипорта ионов натрия (Na+) и и ионов водорода (Н+) в желудочно-кишечном тракте, и более конкретно желудочно-кишечном эпителии, представляет перспективный подход к лечению гипертензии, которая может быть ассоциирована с задержкой жидкости или солевой перегрузкой или вызвана ими. Более конкретно, было обнаружено, что ингибирование NHE-опосредованного антипорта ионов натрия и ионов водорода в ЖК-тракте увеличивает экскрецию натрия с фекалиями, эффективно снижая системные уровни натрия и жидкости. Это, в свою очередь, улучшает клиническое состояние пациента, страдающего гипертензией. Такое лечение может быть возможно усилено совместным введением других предпочтительных соединений или композиций, таких как, например, полимер, абсорбирующий жидкость. Полимер, абсорбирующий жидкость, может быть оптимально выбран таким образом, чтобы не блокировать или иным образом не влиять отрицательно на механизм действия совместно введенного NHE-ингибирующего соединения.
Кроме того, и также как подробно описано ниже, дополнительно обнаружено, что ингибирование NHE-опосредованного антипорта ионов натрия (Na+) и и ионов водорода (Н+) в желудочно-кишечном тракте, и более конкретно желудочно-кишечном эпителии, представляет перспективный подход к лечению различных заболеваний желудочно-кишечного тракта, включая лечение или уменьшение боли, ассоциированной с заболеваниями желудочно-кишечного тракта, и более конкретно, к восстановлению соответствующей секреции жидкости в кишечнике и улучшению патологических состояний, встречающихся при запорах. Авторы также обнаружили, что путем блокирования реабсорбции иона натрия соединения по настоящему изобретению восстанавливают гомеостаз жидкости в ЖК-тракте, в частности в ситуациях, где секреция/абсорбция жидкости изменена так, что приводит к высокой степени обезвоживания фекалий, слабой двигательной активности кишечника, и/или замедляет время прохождения, вызывая состояния запора и дискомфорта в ЖК-тракте в целом. Также было обнаружено, что такое лечение может быть возможно усилено совместным введением других предпочтительных соединений или композиций, таких как, например, полимер, абсорбирующий жидкость. Полимер, абсорбирующий жидкость, может быть оптимально выбран таким образом, чтобы не блокировать или иным образом не влиять отрицательно на механизм действия совместно введенного NHE-ингибирующего соединения.
Ввиду присутствия NHE в других органах или тканях организма, в способе по настоящему изобретению используют соединения и композиции, которые желательно высокоселективны или локализованы, таким образом действуя по существу в желудочно-кишечном тракте без воздействия на другие ткани или органы. При этом любые системные эффекты могут быть минимизированы (независимо то того, целевые они или нет). Соответственно, следует отметить, что, как используют здесь или где-либо еще в данном описании, "по существу активны в желудочно-кишечном тракте" в общем относится к соединениям, которые по существу не являются системно биодоступными и/или по существу не проникают через слой эпителиальных клеток, и более конкретно эпителий ЖК-тракта. Следует также отметить, что, как используют здесь или где-либо еще в данном описании, "по существу не проникают" более конкретно охватывает соединения, которые не проникают через слой эпителиальных клеток, и более конкретно, желудочно-кишечный эпителий (или эпителиальный слой). "Желудочно-кишечный эпителий" относится к мембранной ткани, выстилающей внутреннюю поверхность желудочно-кишечного тракта. Соответственно, будучи по существу не проникающим, соединение имеет очень ограниченную способность пересекать желудочно-кишечный эпителий и таким образом контактировать с другими внутренними органами (например мозгом, сердцем, печенью и так далее). Типичный механизм, с помощью которого соединение может пересекать желудочно-кишечный эпителий, представляет собой трансцеллюлярный транспорт (вещество проходит через клетку, опосредованно путем пассивного транспорта или активного транспорта, пересекая как апикальные, так и базолатеральные мембраны), и/или парацеллюлярный транспорт, когда вещество проходит между клетками эпителия, обычно через высокоограничивающие структуры, известные как "плотные контакты".
Соединения по настоящему изобретению, таким образом, не абсорбируются и тем самым по существу совсем не являются системно биодоступными (например, совсем не проникают через желудочно-кишечный эпителий), или концентрация соединения в сыворотке не обнаружима. Альтернативно, соединения могут: (1) проявлять некоторую обнаружимую проникающую способность для слоя эпителиальных клеток, и более конкретно эпителия ЖК-тракта, составляющую менее чем примерно 20% введенного соединения (например, менее чем примерно 15%, примерно 10% или даже примерно 5% и, например, более чем примерно 0,5% или 1%), но затем быстро выводиться через печень (то есть печеночная экскреция) посредством метаболизма первого прохождения; и/или (2) проявлять некоторую обнаружимую проникающую способность для слоя эпителиальных клеток, и более конкретно эпителия ЖК-тракта, составляющую менее чем примерно 20% введенного соединения (например, менее чем примерно 15%, примерно 10% или даже примерно 5% и, например, более чем примерно 0,5% или 1%), но затем быстро выводиться через почки (то есть почечная экскреция).
Соединения также могут выводиться из кровотока в неизмененном виде в желчь посредством билиарной экскреции. Соединения по настоящему изобретению могут таким образом не проявлять обнаружимых концентраций в желчи. Альтернативно, соединения могут проявлять некоторую обнаружимую концентрацию в желчи и, более конкретно, эпителии желчевыводящих путей и желчного пузыря, составляющую 10 мкМ, менее 1 мкМ, менее 0,1 мкМ, менее 0,01 мкМ или менее чем примерно 0,001 мкМ.
В данном отношении следует дополнительно отметить, что, как используют здесь, "по существу не являющееся системно биодоступным" в общем относится к невозможности обнаружить соединение в системном кровотоке животного или человека после введения пероральной дозы соединения. Для того чтобы соединение было биодоступным, оно должно проходить через желудочно-кишечный эпителий (то есть быть по существу проникающим как определено выше), проходить через кровоток в системе воротной вены в печень, избегать значительного метаболизма в печени и затем проходить в системный кровоток.
Без связи с какой-либо теорией, NHE-ингибирующие соединения (например, NHE-3, -2 и/или -8 ингибиторы) по настоящему изобретению, как полагают, действуют через другой и уникальный механизм, вызывая задержку жидкости и ионов в ЖК-тракте (и стимулируя экскрецию с фекалиями), а не стимулируя повышенную секрецию указанной жидкости и ионов. Например, любипростон (Amitiza® Sucampo/Takeda) представляет собой бициклический жирнокислотный аналог простагландина Е1, который активирует канал для ионов хлора 2 типа (CIC-2) и повышает секрецию обогащенной хлоридами жидкости из серозной части ЖК-тракта в мембранную (см., например, Pharmacological Reviews for Amitiza®, NDA package). Линаклотид (MD-1100 ацетат, Microbia/Forest Labs) представляет собой пептидный аналог эндогенного гормона гуанилина из 14 аминокислот и непосредственно активирует трансмемранный регулятор муковисцидоза (CFTR), тем самым вызывая секрецию жидкости и электролитов в ЖК-тракт (см., например, Li et al., J. Exp. Med., vol. 202 (2005), pp. 975-986). По существу не проникающие NHE-ингибирующие соединения по настоящему изобретению действуют для ингибирования обратного захвата соли и жидкости, а не стимулируют секрецию. Поскольку ЖК-тракт вырабатывает примерно 9 литров жидкости и примерно 800 м-экв Na в сутки, ожидается, что ингибирование NHE позволит удалить значительные количества системной жидкости и натрия для ресорбции отека и устранения симптомов CHF.
I. По существу не проникающие или по существу не являющиеся системно биодоступными NHE-ингибирующие соединения
В одном воплощении предложено соединение, имеющее структуру формулы (I):
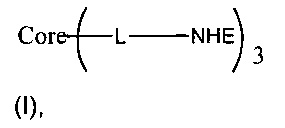
или его стереоизомер, пролекарство или фармацевтически приемлемая соль, где:
(a) NHE представляет собой NHE-ингибирующую низкомолекулярную группировку, имеющую следующую структуру формулы (А):
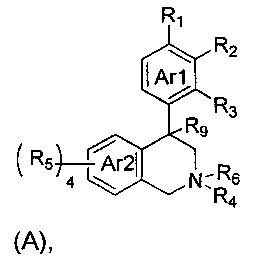
где:
каждый R1, R2, R3, R5 и R9 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из H, С1-6алкила, -C1-6элкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L;
R4 выбран из Н, С1-С7алкила или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L;
R6 отсутствует или выбран из Н и С1-С7алкила; и
Ar1 и Ar2 независимо представляют собой ароматическое кольцо или гетероароматическое кольцо;
(б) Core представляет собой коровую группировку, имеющую следующую структуру формулы (В):
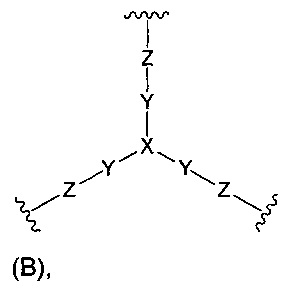
где:
X выбран из C(X1), N и группы N(С1-6алкил);
X1 выбран из водорода, возможно замещенного алкила, -NXaXb, -NO2, -NXc-C(=О)-NXc-Xa, -C(=O)NXc-Xa, -NXc-C(=O)-Xa, -NXc-SO2-Xa, -С(=O)-Ха и -OXa,
каждый Xa и Xb независимо выбран из водорода, возможно замещенного алкила, возможно замещенного циклоалкила, возможно замещенного циклоалкилалкила, возможно замещенного гетероциклила, возможно замещенного гетероциклилалкила, возможно замещенного арила, возможно замещенного аралкила, возможно замещенного гетероарила и возможно замещенного гетероарилалкила;
Y представляет собой C1-6алкилен;
Z выбран из -NZa-C(=O)-NZa-, -C(=O)NZa-, -NZa-C(=O)- и гетероарила, где X представляет собой CX1;
Z выбран из -NZa-C(=O)-NZa-, -NZa-C(=O)- и гетероарила, где X представляет собой N или N(С1-6алкил); и
каждый Хс и Za независимо выбран из водорода и С1-6алкила; и
(в) L представляет собой связь или линкер, соединяющие коровую группировку с NHE-ингибирующими низкомолекулярными группировками, с получением NHE-ингибирующего соединения (то есть соединения формулы (I)), обладающего в общем физико-химическими свойствами, которые делают его по существу не проникающим или по существу не являющимся системно биодоступным. Коровая группировка может быть связана с по существу любым положением на NHE-ингибирующей низкомолекулярной группировке или внутри нее, при условии, что ее включение не оказывает существенного неблагоприятного влияния на NHE-ингибирующую активность.
В другом воплощении предложено соединение, имеющее структуру формулы (II):
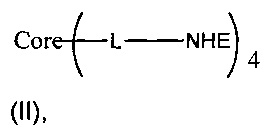
или его стереоизомер, пролекарство или фармацевтически приемлемая соль,
где:
(а) NHE представляет собой NHE-ингибирующую низкомолекулярную группировку, имеющую структуру формулы (А):
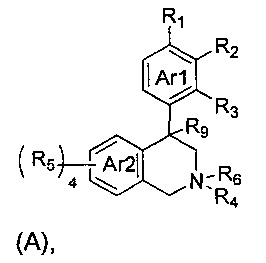
где:
каждый R1, R2, R3, R5 и R9 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из H, C1-6алкила, -C1-6алкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L;
R4 выбран из Н, С1-С7алкила или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L;
R6 отсутствует или выбран из Н и С1-С7алкила; и
Ar1 и Ar2 независимо представляют собой ароматическое кольцо или гетероароматическое кольцо;
(б) Core представляет собой коровую группировку, имеющую следующую структуру формулы (С):
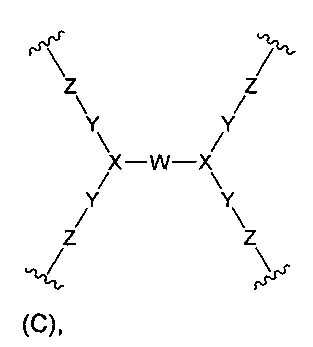
где:
W выбран из алкилена, полиалкиленгликоля, -С(=O)-NH-(алкилен)-NH-С(=O)-, -С(=O)-NH-(полиалкиленгликоль)-NH-С(=O)-, -С(=O)-(алкилен)-С(=O)-, -С(=O)-(полиалкиленгликоль)-С(=O)- и циклоалкила,
X представляет собой N;
Y представляет собой C1-6алкилен;
Z выбран из -NZa-C(=O)-NZa-, -C(=O)NZa-, -NZa-C(=O)- и гетероарила;
каждый Za независимо выбран из водорода и С1-6алкила; и
(в) L представляет собой связь или линкер, соединяющие коровую группировку с NHE-ингибирующими низкомолекулярными группировками, с получением NHE-ингибирующего соединения (то есть соединения формулы (II)), обладающего в общем физико-химическими свойствами, которые делают его по существу не проникающим или по существу не являющимся системно биодоступным. Коровая группировка может быть связана с по существу любым положением на NHE-ингибирующей низкомолекулярной группировке или внутри нее, при условии, что ее включение не оказывает существенного неблагоприятного влияния на NHE-ингибирующую активность.
Следует отметить, что во многих проиллюстрированных здесь структурах все из различных присоединений или связей не показаны в каждом случае. Например, в одной или более проиллюстрированных выше структур связь или присоединение между NHE-ингибирующей низкомолекулярной группировкой и коровой группировкой не всегда показаны. Однако, это не следует интерпретировать ограничивающим образом. Скорее, следует понимать, что NHE-ингибирующая низкомолекулярная группировка связана или присоединена каким-либо образом (например, посредством связи или линкера какого-либо типа) к коровой группировке, так что получаемое NHE-ингибирующее соединение является подходящим для применения (то есть по существу не проникающим или по существу не являющимся системно биодоступным в ЖК-тракте).
Отмеченные выше воплощения дополнительно проиллюстрированы здесь ниже. Например, первая указанная ниже структура репрезентативного олигомерного соединения, где разные части соединения идентифицированы, предназначено для предоставления широкого контекста раскрытия, приведенного в данном описании. Следует отметить, что хотя каждая NHE-ингибирующая низкомолекулярная группировка в структуре ниже является одной и той же, в объем данного изобретения входит то, что каждая из них выбрана независимо и может быть одной и той же или может отличаться. В приведенной ниже иллюстрации линкерная группировка представляет собой полиэтиленгликолевый (PEG) мотив. PEG-производные обладают преимуществами благодаря их водной растворимости, которая может помочь избежать гидрофобного разрушения (внутримолекулярное взаимодействие гидрофобных мотивов, которое может иметь место при воздействии на гидрофобную молекулу водной среды (см., например, Wiley, R.A.; Rich, D.Н. Medical Research Reviews 1993, 13(3), 327-384). Проиллюстрированная ниже коровая группировка также обладает преимуществами, так как обеспечивает молекуле некоторую ригидность, давая возможность увеличения расстояния между NHE-ингибирующими низкомолекулярными группировками, в то же время минимально увеличивая вращательную степень подвижности.
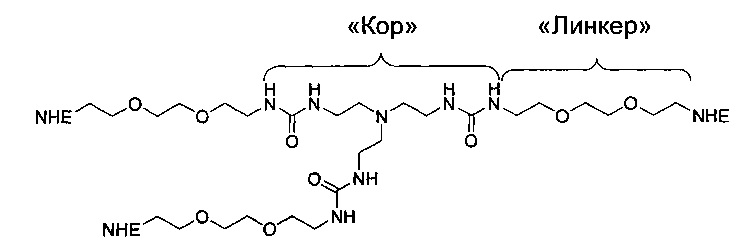
В разработке и создании по существу не проникающих или по существу не являющихся системно биодоступными NHE-ингибирующих соединений, которые могут быть использованы для лечения, подробно описанного в настоящем описании, в некоторых случаях может иметь преимущество сначала определить вероятную точку присоединения на NHE-ингибирующей низкомолекулярной группировке, где кор или линкер могут быть включены или присоединены, а затем создавать ряд мультивалентных или поливалентных соединений-кандидатов. Это может быть осуществлено специалистом в данной области техники известными способами путем системного включения функциональных групп или функциональных групп, представляющих фрагмент желаемого кора или линкера, по различным положениям NHE-ингибирующей низкомолекулярной группировки и затем тестирования этих аддуктов на предмет того, сохраняет ли еще такое модифицированное соединение желаемые биологические свойства (например, NHE-ингибирующую активность). Понимание SAR соединения также обеспечивает возможность разработки коровых групп и/или линкеров, которые вносят положительный вклад в активность полученных соединений.
Другой аспект, который следует принимать во внимание при разработке коровых групп и линкеров, заключается в ограничении или предотвращении гидрофобного разрушения. Соединения с распространенными гидрофобными функциональными группами могут разрушать сами себя внутримолекулярным образом, вызывая увеличение энтальпического барьера для взаимодействия с желаемой биологической мишенью. Соответственно, при разработке коровых групп и линкеров их предпочтительно следует разрабатывать устойчивыми к гидрофобному разрушению. Например, конформационные ограничения, такие как ригидные моноциклические, бициклические или полициклические кольца, могут быть включены в кор или линкер для повышения ригидности структуры. Ненасыщенные связи, такие как алкены и алкины, также могут быть альтернативно включены. Такие модификации могут обеспечить NHE-ингибирующему соединению доступность для продуктивного связывания со своей мишенью. Кроме того, гидрофильность линкеров может быть повышена путем добавления донорных или акцепторных мотивов с водородной связью, или ионных мотивов, таких как амины, которые протонируются в ЖКТ, или кислот, которые депротонируются. Такие модификации будут повышать гидрофильность кора или линкера и способствовать предотвращению гидрофобного разрушения. Кроме того, такие модификации будут также вносить вклад в отсутствие проникающей способности полученных соединений благодаря увеличению топологической площади молекулярной полярной поверхности (tPSA).
Следует понимать, что любое воплощение соединений по настоящему изобретению, как изложено выше, и любой раскрытый здесь конкретный заместитель в таких соединениях, как изложено выше, могут быть независимо объединены с другими воплощениями и/или заместителями таких соединений с образованием воплощений по изобретению, конкретно не раскрытых выше. В дополнение, в случае когда список заместителей перечислен для любого конкретного заместителя в конкретном воплощении и/или пункте формулы, следует понимать, что каждый индивидуальный заместитель может быть удален из конкретного воплощения и/или пункта формулы и что оставшийся перечень заместителей будет считаться находящимся в объеме изобретения. Кроме того, следует понимать, что в настоящем описании комбинации заместителей и/или переменных в изображенных формулах допустимы, только если такие комбинации приводят к стабильным соединениям.
II. Терминология, физические свойства и характеристики
А. Терминология
Если контекст не предусматривает иное, по всему описанию и формуле слово "содержать" и его варианты, такие как "содержит" и "содержащий", следует интерпретировать в широко охватывающем смысле, то есть как "включая, без ограничения".
Ссылка в данном описании на "одно воплощение" или "воплощение" означает, что конкретные признак, структура или характеристика, описанные в связи с этим воплощением, включены по меньшей мере в одно воплощение по настоящему изобретению. Так, фразы "в одном воплощении" или "в воплощении", появляющиеся в разных местах данного описания, не обязательно ссылаются на одно и то же воплощение. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом в одно или более чем одно воплощение.
"Амино" относится к радикалу -NH2.
"Циано" относится к радикалу -CN.
"Гидрокси" или "гидроксил" относится к радикалу -ОН.
"Имино" относится к заместителю =NH.
"Нитро" относится к радикалу -NO2.
"Оксо" относится к заместителю =О.
"Тиоксо" относится к заместителю =S.
"Алкил" относится к углеводородному радикалу с прямой или разветвленной цепью, состоящей исключительно из атомов углерода и водорода, являющемуся насыщенным или ненасыщенным (то есть содержит одну или более двойных и/или тройных связей), имеющему от одного до двенадцати атомов углерода (С1-С12алкил), предпочтительно от одного до восьми атомов углерода (C1-С8алкил) или от одного до шести атомов углерода (C1-С6элкил), и который присоединен к остальной части молекулы простой связью, например, метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил, 1,1-диметилэтил (трет-бутил), 3-метилгексил, 2-метилгексил, этенил, προπ-1-енил, бут-1-енил, пент-1-енил, пента-1,4-диенил, этинил, пропинил, бутинил, пентинил, гексинил и тому подобное. Если в описании конкретно не указано иное, алкильная группа может быть возможно замещена.
"Алкилен" или "алкиленовая цепь" относится к прямой или разветвленной двухвалентной углеводородной цепи, связывающей остальную часть молекулы с группой-радикалом, состоящей исключительно из атомов углерода и водорода, которая является насыщенной или ненасыщенной (то есть содержит одну или более двойных и/или тройных связей), и имеющей от одного до двенадцати атомов углерода, например, метилен, этилен, пропилен, н-бутилен, этенилен, пропенилен, н-бутенилен, пропинилен, н-бутинилен и тому подобное. Алкиленовая цепь присоединена к остальной части молекулы через простую или двойную связь и группе-радикалу через простую или двойную связь. Точки присоединения алкиленовой цепи к остальной части молекулы и к группе-радикалу могут находиться по одному углероду или по любым двум углеродам в пределах цепи. Если в описании конкретно не указано иное, алкиленовая цепь может быть возможно замещена.
"Алкокси" относится к радикалу формулы -ORa, где Ra представляет собой алкильный радикал, как он определен выше, содержащий от одного до двенадцати атомов углерода. Если в описании конкретно не указано иное, алкоксигруппа может быть возможно замещена.
"Алкиламино" относится к радикалу формулы -NHRa или -NRaRa, где каждый Ra независимо представляет собой алкильный радикал, как он определен выше, содержащий от одного до двенадцати атомов углерода. Если в описании конкретно не указано иное, алкиламиногруппа может быть возможно замещена.
"Тиоалкил" относится к радикалу формулы -SRa, где Ra представляет собой алкильный радикал, как он определен выше, содержащий от одного до двенадцати атомов углерода. Если в описании конкретно не указано иное, тиоалкильная группа может быть возможно замещена.
"Арил" относится к углеводородному радикалу кольцевой системы, содержащему водород, от 6 до 18 атомов углерода и по меньшей мере одно ароматическое кольцо. Для целей данного изобретения арильный радикал может представлять собой моноциклическую, бициклическую, три циклическую или тетрациклическую кольцевую систему, которая может включать конденсированные или связанные мостиковой связью кольцевые системы. Арильные радикалы включают, без ограничения, арильные радикалы, получаемые из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, кризена, флуорантена, флуорена, as-индацена, s-индацена, индана, индена, нафталина, феналена, фенантрена, плейадена, пирена и трифенилена. Если в описании конкретно не указано иное, термин "арил" или префикс "ар-" (такой как в "аралкиле") означает включающий арильные радикалы, которые возможно замещены.
"Аралкил" относится к радикалу формулы -Rb-Rc, где Rb представляет собой алкиленовую цепь, как определено выше, и Rc представляет собой один или более арильных радикалов, как определено выше, например, бензил, дифенилметил и тому подобное. Если в описании конкретно не указано иное, аралкильная группа может быть возможно замещена.
"Циклоалкил" или "карбоциклическое кольцо" относится к стабильному неароматическому моноциклическому или полициклическому углеводородному радикалу, состоящему исключительно из атомов углерода и водорода, который может включать конденсированные или связанные мостиковой связью кольцевые системы, имеющему от трех до пятнадцати атомов углерода, предпочтительно имеющему от трех до десяти атомов углерода, и который является насыщенным или ненасыщенным и присоединен к остальной части молекулы простой связью. Моноциклические радикалы включают, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Полициклические радикалы включают, например, адамантил, норборнил, декалинил, 7,7-диметил-бицикло[2.2.1]гептанил и тому подобное. Если в описании конкретно не указано иное, циклоалкильная группа может быть возможно замещена.
"Циклоалкилалкил" относится к радикалу формулы -RbRd, где Rd представляет собой алкиленовую цепь, как определено выше, и Rg представляет собой циклоалкильный радикал, как определено выше. Если в описании конкретно не указано иное, циклоалкилалкильная группа может быть возможно замещена.
"Конденсированный" относится к любой кольцевой структуре, описанной здесь, которая конденсирована с имеющейся кольцевой структурой в соединениях по изобретению. Когда конденсированное кольцо представляет собой гетероциклильное кольцо или гетероарильное кольцо, любой атом углерода в имеющейся кольцевой структуре, которая становится частью конденсированного гетероциклильного кольца или конденсированного гетероарильного кольца, может быть заменен атомом азота.
"Галогено" или "галоген" относится к брому, хлору, фтору или йоду.
"Галогеналкил" относится к алкильному радикалу, как определено выше, который замещен одним или более галогеновыми радикалами, как определено выше, например, трифторметил, дифторметил, трихлорметил, 2,2,2-трифторэтил, 1,2-дифторэтил, 3-бром-2-фторпропил, 1,2-дибромэтил и тому подобное. Если в описании конкретно не указано иное, галогеналкильная группа может быть возможно замещена.
"Гетероциклил" или "гетероциклическое кольцо" относится к стабильному 3-18-членному неароматическому кольцевому радикалу, который состоит из двух-двенадцати атомов углерода и одного-шести гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы. Если в описании конкретно не указано иное, гетероциклильный радикал может представлять собой моноциклическую, бициклическую, трициклическую или тетрациклическую кольцевую систему, которая может включать конденсированные или связанные мостиковой связью кольцевые системы; и атомы азота, углерода или серы в гетероциклильном радикале могут быть возможно окислены; атом азота может быть возможно кватернизованным; и гетероциклильный радикал может быть частично или полностью насыщенным. Примеры таких гетероциклильных радикалов включают, без ограничения, диоксоланил, тиенил[1,3]дитианил, декагидроизохинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, хинуклидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиоморфолинил, тиаморфолинил, 1-оксо-тиоморфолинил и 1,1-диоксо-тиоморфолинил. Если в описании конкретно не указано иное, гетероциклильная группа может быть возможно замещена.
"N-гетероциклил" относится к гетероциклильному радикалу, как определено выше, содержащему по меньшей мере один азот, и где точка присоединения гетероциклильного радикала к остальной части молекулы проходит через атом азота в гетероциклильном радикале. Если в описании конкретно не указано иное, N-гетероциклильная группа может быть возможно замещена.
"Гетероциклилалкил" относится к радикалу формулы -RbRe, где Rb представляет собой алкиленовую цепь, как определено выше, и Re представляет собой гетероциклильный радикал, как определено выше, и если гетероциклил является азот-содержащим гетероциклилом, гетероциклил может быть присоединен к алкильному радикалу через атом азота. Если в описании конкретно не указано иное, гетероциклилалкильная группа может быть возможно замещена.
"Гетероарил" относится к радикалу 5-14-членной кольцевой системы, содержащему атомы водорода, от одного до тринадцати атомов углерода, от одного до шести гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и по меньшей мере одно ароматическое кольцо. Для целей данного изобретения гетероарильный радикал может представлять собой моноциклическую, бициклическую, трициклическую или тетрациклическую кольцевую систему, которая может включать конденсированные или связанные мостиковой связью кольцевые системы; и атомы азота, углерода или серы в гетероарильном радикале могут быть возможно окислены; атом азота может быть возможно кватернизованным. Примеры включают, без ограничения, азепинил, акридинил, бензимидазолил, бензотиазолил, бензиндолил, бензодиоксолил, бензофуранил, бензооксазолил, бензотиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензопиранил, бензопиранонил, бензофуранил, бензофуранонил, бензотиенил (бензотиофенил), бензотриазолил, бензо[4,6]имидазо[1,2-а]пиридинил, карбазолил, циннолинил, дибензофуранил, дибензотиофенил, фуранил, фуранонил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, нафтиридинил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 1-оксидопиридинил, 1-оксидопиримидинил, 1-оксидопиразинил, 1-оксидопиридазинил, 1-фенил-1Н-пирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пирролил, пиразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, хиназолинил, хиноксалинил, хинолинил, хинуклидинил, изохинолинил, тетрагидрохинолинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазинил и тиофенил (то есть тиенил). Если в описании конкретно не указано иное, гетероарильная группа может быть возможно замещена.
"N-гетероарил" относится к гетероарильному радикалу, как определено выше, содержащему по меньшей мере один азот, и где точка присоединения гетероарильного радикала к остальной части молекулы проходит через атом азота в гетероарильном радикале. Если в описании конкретно не указано иное, N-гетероарильная группа может быть возможно замещена.
"Гетероарилалкил" относится к радикалу формулы -RbRf, где Rb представляет собой алкиленовую цепь, как определено выше, и Rf представляет собой гетероарильный радикал, как определено выше. Если в описании конкретно не указано иное, гетероарилалкильная группа может быть возможно замещена.
Термин "замещенная", используемый здесь, означает любую из вышеуказанных групп (то есть алкил, алкилен, алкокси, алкиламино, тиоалкил, арил, аралкил, циклоалкил, циклоалкилалкил, галогеналкил, гетероциклил, N-гетероциклил, гетероциклил а л кил, гетероарил, N-гетероарил и/или гетероарилалкил), где по меньшей мере один атом водорода заменен на связь с атомами, отличными от водорода, такими как, без ограничения: атом галогена, такой как F, Cl, Br и I; атом кислорода в группах, таких как гидроксильные группы, алкоксигруппы и сложноэфирные группы; атом серы в группах, таких как тиоловые группы, тиоалкильные группы, сульфоновые группы, сульфонильные группы и сульфоксидные группы; атом азота в группах, таких как амины, амиды, алкиламины, диалкиламины, ариламины, алкилариламины, диариламины, N-оксиды, имиды и енамины; атом кремния в группах, таких как триалкилсилильные группы, диалкиларилсилильные группы, алкилдиарилсилильные группы и триарилсилильные группы; и другие гетероатомы в различных других группах. "Замещенная" также означает любую из вышеуказанных групп, в которых один или более атомов водорода заменены на связь более высокого порядка (например, двойную или тройную связь) с гетероатомом, таким как кислород в оксо, карбонил, карбоксил и сложноэфирные группы; и азот в группах, таких как имины, оксимы, гидразоны и нитрилы. Например, "замещенный" включает любую из вышеуказанных групп, в которых один или более атомов водорода заменены на -NRgRh, -NRgC(=O)Rh, -NRgC(=O)NRgRh, -NRgC(=O)ORh, -NRgSO2Rh, -OC(=O)NRgRh, -ORg, -SRg, -SORg, -SO2Rg, -OSO2Rg, -SO2ORg, =NSO2Rg и -SO2NRgRh. "Замещенная" также означает любую из вышеуказанных групп, в которых один или более атомов водорода заменены на -C(=O)Rg, -C(=O)ORg, -C(=O)NRgRh, -CH2SO2Rg, -CH2SO2NRgRh, -(CH2CH2O)2-10Rg. В вышеуказанных группах Rg и Rh являются одинаковыми или разными и независимо представляют собой водород, алкил, алкокси, алкиламино, тиоалкил, арил, аралкил, циклоалкил, циклоалкилалкил, галогеналкил, гетероциклил, N-гетероциклил, гетероциклилалкил, гетероарил, N-гетероарил и/или гетероарилалкил. "Замещенная" также означает любую из вышеуказанных групп, в которых один или более атомов водорода заменены на связь с группой амино, циано, гидроксил, имино, нитро, оксо, тиоксо, галоген, алкил, алкокси, алкиламино, тиоалкил, арил, аралкил, циклоалкил, циклоалкилалкил, галогеналкил, гетероциклил, N-гетероциклил, гетероциклилалкил, гетероарил, N-гетероарил и/или гетероарилалкил. В дополнение, каждый из вышеуказанных заместителей также может быть возможно замещен одним или более вышеуказанными заместителями.
"Пролекарство" означает соединение, которое может превращаться в физиологических условиях или путем сольволиза в биологически активное соединение по изобретению. Таким образом, термин "пролекарство" относится к метаболическому предшественнику соединения по изобретению, которое является фармацевтически приемлемым. Пролекарство может быть неактивным при введении нуждающемуся в нем субъекту, но превращаться in vivo в активное соединение по изобретению. Пролекарства, как правило, быстро превращаются in vivo с получением исходного соединения по изобретению, например, посредством гидролиза в крови. Пролекарственное соединение часто имеет преимущества в растворимости, совместимости с тканями или замедленном высвобождении в организме млекопитающего (см., Bundgard, H., Design of Prodrugs (1985), pp. 7-9, 21-24 (Elsevier, Amsterdam)). Обсуждение пролекарств предложено в Higuchi, T., et al., A.C.S. Symposium Series, Vol. 14, и в Bioreversible Carriers in Drug Design, Ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987.
Термин "пролекарство" также подразумевает включение любых ковалентно связанных носителей, которые высвобождают активное соединение по изобретению in vivo при введении такого пролекарства млекопитающему субъекту. Пролекарства соединения по изобретению могут быть получены путем модифицирования функциональных групп, присутствующих в исходном соединении по изобретению, таким образом чтобы эти модификации расщеплялись, рутинной обработкой или in vivo, с получением исходного соединения по изобретению. Пролекарства включают соединения по изобретению, где группа гидрокси, амино или меркапто связана с любой группой, которая при введении пролекарства соединения по изобретению млекопитающему субъекту расщепляется с получением свободной группы гидрокси, свободной группы амино или свободной группы меркапто, соответственно. Примеры пролекарств включают, без ограничения, ацетатные, формиатные и бензоатные производные спирта или амидные производные аминофункциональных групп в соединениях по изобретению и тому подобное.
Раскрытое здесь изобретение также охватывает in vivo метаболические продукты раскрытых соединений. Такие продукты могут образовываться в результате, например, окисления, восстановления, гидролиза, амидирования, этерификации и тому подобного введенного соединения, главным образом вследствие ферментативных процессов. Соответственно, изобретение включает соединения, получаемые способом, включающим введение соединения по данному изобретению млекопитающему в течение периода времени, достаточного для получения его метаболического продукта. Такие продукты обычно идентифицируют путем введения меченного радиоактивным изотопом соединения по изобретению в детектируемой дозе животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, обеспечивая достаточное время для осуществления метаболизма, и выделения продуктов его превращения из мочи, крови или других биологических образцов.
"Стабильное соединение" и "стабильная структура" включают соединение, которое является достаточно устойчивым, чтобы выдерживать выделение до полезной степени чистоты из реакционной смеси, и изготовление в виде эффективного терапевтического агента.
"Возможный" или "возможно" означают, что последующие описанные событие или обстоятельство могут происходить или могут не происходить, и что описание включает случаи, когда указанные событие или обстоятельство имеют место, и случаи, когда их нет. Например, "возможно замещенный арил" означает, что арильный радикал может быть замещенным или может не быть замещенным, и что описание включает как замещенные арильные радикалы, так и арильные радикалы, не имеющие замещения.
"Фармацевтически приемлемый носитель, разбавитель или эксципиент" включает, без ограничения, любые адъювант, носитель, эксципиент, смазывающее вещество, подсластитель, разбавитель, консервант, краситель, корригент, поверхностно-активное вещество, увлажняющий агент, диспергирующий агент, суспендирующий агент, стабилизатор, изотонический агент, растворитель или эмульгатор, которые одобрены Управлением по контролю качества пищевых продуктов и лекарственных средств как приемлемые для применения у людей или домашних животных.
"Фармацевтически приемлемая соль" включает соли присоединения кислот и оснований.
"Фармацевтически приемлемая соль присоединения кислоты" относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или каким-либо иным образом нежелательными и которые образуются с неорганическими кислотами, такими как, без ограничения, соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органическими кислотами, такими как, без ограничения, уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, карбоновая кислота, коричная кислота, лимонная кислота, цикламиновая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксо-глутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, муциновая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглутаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, лара-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота и тому подобное.
"Фармацевтически приемлемая соль присоединения основания" относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или каким-либо иным образом нежелательными. Эти соли получают присоединением неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, без ограничения, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и тому подобного. Предпочтительные неорганические соли представляют собой соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают, без ограничения, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, например, аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминные смолы и тому подобное. Особенно предпочтительные органические основания представляют собой изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
Часто при кристаллизациях образуется сольват соединения по изобретению. Как используют здесь, термин "сольват" относится к агрегату, который содержит одну или более молекул соединения по изобретению с одной или более молекулами растворителя. Растворитель может представлять собой воду, в таком случае сольват может представлять собой гидрат. Альтернативно, растворитель может представлять собой органический растворитель. Таким образом, соединения по настоящему изобретению могут существовать в виде гидрата, включая моногидрат, дигидрат, полугидрат, полуторагидрат, тригидрат, тетрагидрат и тому подобное, а также соответствующих сольватированных форм. Соединение по изобретению может представлять собой истинные сольваты, в то время как в других случаях соединение по изобретению может просто удерживать внесенную воду или представлять собой смесь воды с некоторым количеством внесенного растворителя.
"Фармацевтическая композиция" относится к препарату соединения по изобретению и среды, в общем принятой в данной области техники для доставки биологически активного соединения млекопитающим, например людям. Такая среда включает все фармацевтически приемлемые носители, разбавители или эксципиенты для него.
Соединения по изобретению или их фармацевтически приемлемые соли могут содержать один или более асимметрических центров и могут таким образом давать энантиомеры, диастереомеры и другие стереоизомерные формы, которые могут быть определены, в контексте абсолютной стереохимии, как (R)- или (S)-, или как (D)- или (L)- в случае аминокислот. Настоящее изобретение включает все такие возможные изомеры, а также их рацемические и оптически чистые формы. Оптически активные (+) и (-), (R)- и (S)- или (D)- и (L)- изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов или разделены с использованием общепринятых методик, например, хроматографией и фракционной кристаллизацией. Традиционные методики для получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной жидкостной хроматографии высокого давления (ЖХВД). Когда описанные здесь соединения содержат олефиновые двойные связи и другие центры геометрической асимметрии, и если конкретно не указано иное, предусматривается, что соединения включают как Е, так и Ζ геометрические изомеры. Подобным образом также должны быть включены все таутомерные формы.
"Стереоизомер" относится к соединениям, полученным из тех же атомов, связанных такими же связями, но имеющим разные трехмерные структуры, которые не являются взаимозаменяемыми. Настоящее изобретение охватывает различные стереоизомеры и их смеси и включает "энантиомеры", которые относятся к двум стереоизомерам, молекулы которых не являются зеркальным отображением, получаемым при наложении друг на друга.
"Таутомер" относится к сдвигу протона от одного атома молекулы на другой атом той же молекулы. Настоящее изобретение включает таутомеры любых указанных соединений.
В соответствии с настоящим изобретением раскрытые здесь соединения разработаны так, чтобы быть по существу активными или локализованными в просвете желудочно-кишечного тракта субъекта человека или животного. Термин "просвет желудочно-кишечного тракта" используют здесь взаимозаменяемо с термином "просвет," со ссылкой на поверхность или полость в пределах желудочно-кишечного тракта (ЖК-тракта, на который также могут ссылаться как на просвет кишечника), ограниченные апикальной мембраной эпителиальных клеток ЖК-тракта субъекта. В некоторых воплощениях соединения не абсорбируются через слой эпителиальных клеток ЖК-тракта (также известных как ЖК-эпителий). "Желудочно-кишечная слизистая оболочка" относится к слою(ям) клеток, отделяющему(их) желудочно-кишечный просвет от остальной части организма, и включает желудочную и кишечную слизистую оболочку, такую как слизистая оболочка тонкого кишечника. "Желудочно-кишечная эпителиальная клетка" или "эпителиальная клетка кишечника", как используют здесь, относится к любой эпителиальной клетке на поверхности желудочно-кишечной слизистой оболочки, которая обращена к просвету желудочно-кишечного тракта, включая, например, эпителиальную клетку желудка, эпителиальная клетка тонкого кишечника, эпителиальная клетка толстого кишечника и тому подобное.
"По существу не являющееся системно биодоступным" и/или "по существу не проникающее", как используют здесь (а также их варианты), в общем относится к ситуациям, в которых статистически значимое количество, и в некоторых воплощениях по существу все соединение по настоящему изобретению (которое включает NHE-ингибирующую низкомолекулярную молекулу), остается в желудочно-кишечном просвете. Например, в соответствии с одним или более чем одним воплощением по настоящему изобретению, предпочтительно по меньшей мере примерно 70%, примерно 80%, примерно 90%, примерно 95%, примерно 98%, примерно 99%, или даже примерно 99,5% соединения остается в желудочно-кишечном просвете. В таких случаях локализация в желудочно-кишечном просвете относится к снижению продвижения через желудочно-кишечный слой эпителиальных клеток, например, посредством как трансцеллюлярного, так и парацеллюлярного транспорта, а также посредством активного и/или пассивного транспорта. В таких воплощениях затруднено проникновение соединения через слой желудочно-кишечных эпителиальных клеток в трансцеллюлярном транспорте, например, через апикальную мембрану эпителиальной клетки тонкого кишечника. В этих воплощениях также затруднено проникновение соединения через "плотные контакты" в парацеллюлярном транспорте между желудочно-кишечными эпителиальными клетками, выстилающими просвет.
В данном отношении следует отметить, что в одном конкретном воплощении соединение по существу вообще не абсорбируется в ЖК-тракте или желудочно-кишечном просвете. Как используют здесь, термины "по существу не проникающие" или "по существу не являющиеся системно биодоступными" относятся к воплощениям, где не обнаруживается никакого детектируемого количества абсорбции или проникновения либо системного действия соединения с использованием средств, хорошо известных в данной области техники.
В данном отношении следует, однако, также отметить, что в альтернативных воплощениях "по существу не проникающие" или "по существу не являющиеся системно биодоступными" обеспечивают или дают возможность для некоторой ограниченной абсорбции в ЖК-тракте, и более конкретно кишечном эпителии, с получением, например, некоторого обнаружимого количества абсорбции, такого как, например, интервал абсорбции от по меньшей мере примерно 0,1%, 0,5%, 1% или более, до менее чем примерно 30%, 20%, 10%, 5%, и так далее, например от примерно 1% до 30%, или от 5% до 20%, и так далее; иначе говоря, "по существу не проникающие" или "по существу не являющиеся системно биодоступными" относятся к соединениям, которые проявляют некоторое обнаружимое проникновение в эпителиальный слой клеток в ЖК-тракте, составляющее менее чем примерно 20% введенного соединения (например, менее чем примерно 15%, примерно 10% или даже примерно 5%, и, например, более чем примерно 0,5% или 1%), но затем выводятся через печень (то есть печеночная экскреция) и/или почки (то есть почечная экскреция).
В. Проникающая способность
В этом отношении следует понимать, что в различных воплощениях способность соединения не являться по существу системно биодоступным основана на заряде, размере и/или других физико-химических параметрах (например, площадь полярной поверхности, число доноров или акцепторов водородной связи в нем, число свободно вращаемых связей и так далее). Более конкретно, следует понимать, что абсорбционная природа соединения может быть выбрана с помощью фармакодинамических принципов, например, используя правило Липински, также известное как "правило пяти". Хотя это не правило, а скорее перечень руководств, оно показывает, что низкомолекулярные лекарства с (1) молекулярной массой, (2) количеством доноров водородной связи, (3) количеством акцепторов водородной связи и/или (4) коэффициентом распределения в системе вода/октанол (Log Ρ Моригучи (Moriguchi)), больше чем определенное пороговое значение, в общем не демонстрируют значительную системную концентрацию (то есть в общем не абсорбируются в какой-либо значительной степени) (см., например, Lipinski et al., Advanced Drug Delivery Reviews, 46, 2001 3-26, включено в данное описание посредством ссылки). Соответственно, по существу не являющиеся системно биодоступными соединения (например, по существу не являющиеся системно биодоступными NHE-ингибирующие соединения) могут быть разработаны имеющими молекулярные структуры, превышающие одно или более пороговых значений Липински (см. также Lipinski et al., Experimental and Computational Approaches to Estimate Solubility and Permeability in Drug Discovery and Development Settings, Adv. Drug Delivery Reviews, 46:3-26 (2001); и Lipinski, Druglike Properties and Causes of Poor Solubility and Poor Permeability, J. Pharm. & Toxicol. Methods, 44:235-249 (2000), включены в данное описание посредством ссылки). В некоторых воплощениях, например, по существу не проникающие или не являющиеся системно биодоступными NHE-ингибирующие соединения по настоящему изобретению могут быть разработаны так, чтобы иметь одну или более из следующих характеристик: (1) MW более чем примерно 500 кДа, примерно 1000 кДа, примерно 2500 кДа, примерно 5000 кДа, примерно 10000 кДа или более (в несолевой форме соединения); (2) общее количество NH и/или ОН и/или других потенциальных доноров водородной связи более чем примерно 5, примерно 10, примерно 15 или более; (3) общее количество атомов О и/или атомов N и/или других потенциальных акцепторов водородной связи более чем примерно 5, примерно 10, примерно 15 или более; и/или (4) коэффициентом распределения Моригучи более чем примерно 105 (то есть Log Ρ более чем примерно 5, примерно 6, примерно 7 и так далее), или альтернативно, менее чем примерно 10 (то есть Log Ρ менее 1 или даже 0).
В дополнение к указанным выше параметрам, площадь молекулярной полярной поверхности (то есть "PSA"), которая может быть охарактеризована как площадь, относящаяся к полярным атомам, является параметром, который, как было показано, хорошо коррелирует с пассивным транспортом через мембраны и, таким образом, дает возможность предсказать транспортные свойства лекарств. Этот параметр был успешно использован для предсказания кишечной абсорбции и проникновения через монослой клеток Сасо2 (в отношении подробностей тестирования проникновения через монослой клеток Сасо2, см., например, описание модели Сасо2, предложенной в Примере 31 патента США 6737423, полное содержание которого включено в данное описание посредством ссылки для всех релевантных и сопутствующих целей, и текст Примера 31 в частности, который может быть использован, например для оценки или тестирования соединений по настоящему изобретению). PSA выражают в Á2 (ангстремы в квадрате) и вычисляют на основании трехмерного представления структуры молекулы. Быстрый способ расчета в настоящее время доступен (см., например, ErtI et al., Journal of Medicinal Chemistry, 2000, 43, 3714-3717, полное содержание которой включено в данное описание посредством ссылки для всех релевантных и сопутствующих целей) с использованием персонального компьютера и имеющихся в продаже пакетов графического программного обеспечения, таких как ChemDraw. Термин "топологическая PSA" (tPSA) введен в обращение для этого способа быстрого расчета. tPSA хорошо коррелирует с данными абсорбции для человека для распространенных лекарств (см., например, Таблицу 1, ниже):
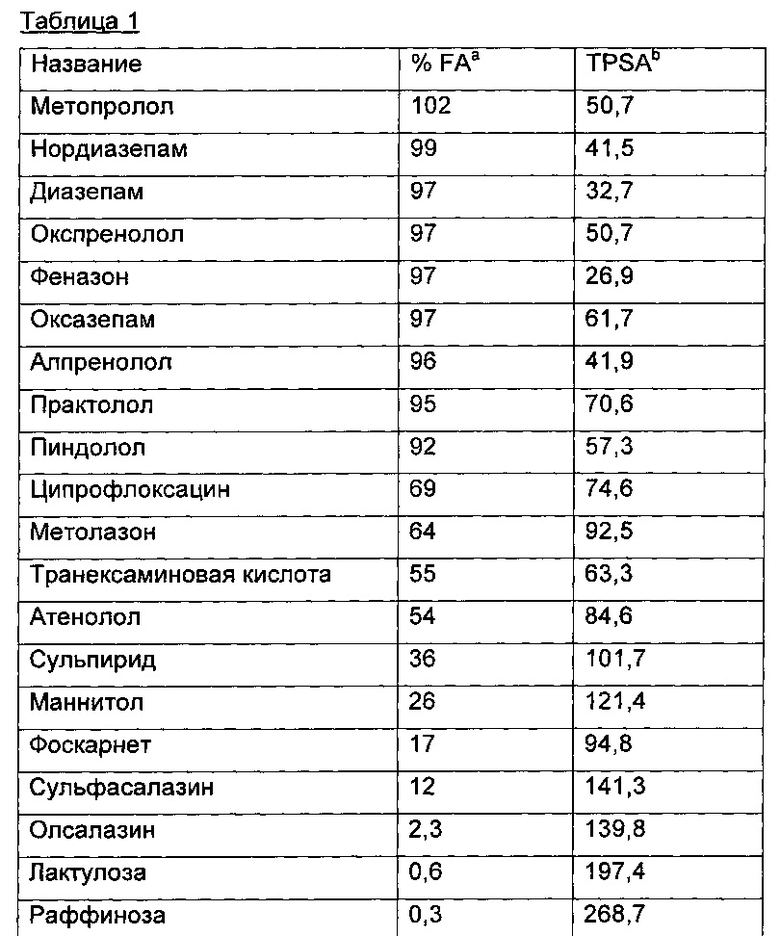
(из Ertl et al., J. Med. Chem., 2000, 43:3714-3717). Соответственно, в некоторых предпочтительных воплощениях соединения по настоящему изобретению могут быть разработаны так, чтобы проявлять значение tPSA более чем примерно  , примерно
, примерно  , примерно
, примерно  , или примерно
, или примерно 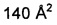 , и в некоторых случаях примерно
, и в некоторых случаях примерно  , примерно
, примерно 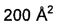 , примерно
, примерно 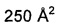 , примерно
, примерно 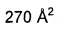 , примерно
, примерно  , примерно
, примерно  или даже примерно
или даже примерно  , так что соединения являются по существу не проникающими или не являются по существу системно биодоступными (как определено в данном описании).
, так что соединения являются по существу не проникающими или не являются по существу системно биодоступными (как определено в данном описании).
Из-за наличия исключений из «правила» Липински или модели tPSA, проникающие свойства соединений по настоящему изобретению могут быть проверены экспериментально. Коэффициент проницаемости может быть определен способами, известными специалисту в данной области техники, включая, например, анализ проницаемости клеток Сасо-2 и/или использование искусственной мембраны как модель желудочно-кишечной эпителиальной клетки. (Как было отмечено ранее, см., например, патент США 6737423, Пример 31 в отношении описания модели Сасо-2, который включен в данное описание посредством ссылки). Синтетическая мембрана, импрегнированная, например, лецитином и/или додеканом для имитации характеристик общей проницаемости желудочно-кишечной слизистой оболочки, может быть использована в качестве модели желудочно-кишечной слизистой оболочки. Мембрана может быть использована для отделения компартмента, содержащего соединение по настоящему изобретению, от компартмента, где будет наблюдаться скорость проникновения. Кроме того, может быть осуществлен параллельный анализ проницаемости искусственной мембраны (PAMPA). Такие in vitro измерения могут достоверно указывать на фактическую проницаемость in vivo (см., например, Wohnsland et al., J. Med. Chem., 2001, 44:923-930; Schmidt et al., Millipore Corp. Application Note, 2002, n° AN1725EN00, и n° AN1728EN00, включенные в данное описание посредством ссылки).
Соответственно, в некоторых воплощениях соединения, используемые в способах по настоящему изобретению, могут иметь коэффициент проницаемости Рарр менее чем примерно 100×10-6 см/сек, или менее чем примерно 10×10-6 см/сек, или менее чем примерно 1×10-6 см/сек, или менее чем примерно 0,1×10-6 см/сек, при измерении с использованием средств, известных в данной области техники (таких как, например, эксперимент проницаемости, описанный в статье Wohnsland et al., J. Med. Chem., 2001, 44. 923-930, содержание которой включено в данное описание посредством ссылки).
Как отмечалось выше, в соответствии с настоящим изобретением NHE-ингибирующая низкомолекулярная группировка модифицирована как указано выше, чтобы препятствовать общей абсорбции через слой эпителиальных клеток кишечника, делая полученное соединение по существу не являющимся системно биодоступным. В различных воплощениях соединения по настоящему изобретению содержат NHE-ингибирующую низкомолекулярную группировку, связанную, соединенную или иным образом прикрепленную к группировке, которая делает соединение в целом по существу не проникающим или не являющимся системно биодоступным. Более конкретно, NHE-ингибирующая низкомолекулярная группировка присоединена к димерной, мультимерной или полимерной группировке, так что полученное соединение является по существу не проникающим или не является системно биодоступным. Димерная, мультимерная или полимерная часть или группировка может иметь молекулярную массу более чем примерно 500 Дальтон (Да), примерно 1000 Да, примерно 2500 Да, примерно 5000 Да, примерно 10000 Да или более, и в частности, может иметь молекулярную массу в интервале от примерно 1000 Дальтон (Да) до примерно 500000 Да, предпочтительно в интервале от примерно 5000 до примерно 200000 Да, и более предпочтительно иметь молекулярную массу, которая достаточно высокая, чтобы по существу исключить какое-либо общее проникновение соединения через слой эпителиальных клеток кишечника.
С. Длительный ингибирующий эффект
В других воплощениях по существу не проникающие или по существу не являющиеся системно биодоступными NHE-ингибирующие соединения, используемые в способах лечения по настоящему изобретению, могут дополнительно проявлять длительный ингибирующий эффект. Этот эффект проявляется как таковой, когда ингибирующее действие соединения в определенной концентрации при равновесии с эпителиальной клеткой (например, при ингибирующей концентрации, IC, или выше) не возвращается к базовой линии (то есть транспорт натрия в отсутствие ингибитора) после того как соединение исчерпывается путем простого вымывания содержимого просвета.
Этот эффект может быть интерпретирован как результат тесного связывания NHE-ингибирующего соединения с NHE-белком на апикальной части эпителиальной клетки тонкого кишечника. Связывание можно считать как квази-необратимое до той степени, в которой, после того как соединение вступило в контакт с эпителиальной клеткой кишечника и затем было вымыто указанной эпителиальной клеткой кишечника, поток транспорта натрия все еще значительно ниже по сравнению с контролем в отсутствие соединения. Этот длительный ингибирующий эффект имеет явное преимущество сохранения активности лекарственного средства в ЖК-тракте даже несмотря на то, что время нахождения активного вещества в верхних отделах ЖК-тракта является коротким, и где нет эффективного кишечно-печеночного процесса рециркуляции для восполнения концентрации соединения рядом с его местом действия.
Такой длительный ингибирующий эффект имеет очевидное преимущество для согласия пациента со схемой приема лекарственного средства, а также в ограничении воздействия лекарственного средства в ЖК-тракте.
Длительный эффект может быть определен с использованием способов in vitro; в одном примере клеточные линии, экспрессирующие NHE транспортеры, расщепляют в разных флаконах и обрабатывают NHE-ингибирующим соединением и раствором натрия для измерения степени захвата натрия. Клетки в одном наборе флаконов промывают в течение различных периодов времени для удаления ингибитора и измерение захвата натрия повторяют после промывки. Соединения, которые сохраняют свой ингибирующий эффект после множества длительных стадий промывки (по сравнению с ингибирующим эффектом, измеренным во флаконах, где не осуществляют промывку), являются длительно действующими ингибиторами. Длительный эффект также может быть охарактеризован ex vivo с использованием методики вывернутой наружу слизистой, посредством которой транспорт Na контролируют с использованием иссеченного сегмента ЖК-тракта, залитого раствором, содержащим ингибитор, и сразу же после промывки раствора буферным раствором, свободным от ингибитора. Длительный эффект может также быть охарактеризован in vivo путем определения времени, необходимого для того чтобы баланс натрия вернулся к нормальному при прекращении обработки ингибитором. Ограничение способа заключается фактически в том, что апикальные клетки (и, следовательно, апикальные NHE-транспортеры) обновляются после периода от 3 до 4 суток, типичное время циркуляции эпителиальных клеток кишечника. Длительный эффект может быть достигнут путем увеличения времени нахождения активного соединения на апикальной поверхности эпителиальных клеток кишечника; это может быть достигнуто путем разработки ингибиторов NHE-антипорта с несколькими NHE-ингибирующими низкомолекулярными группировками, встроенными в небольшую молекулу или олигомер (где "несколько", как используют здесь, как правило означает по меньшей мере примерно 2, примерно 4, примерно 6 или более). Примеры таких структур в контексте аналогов антибиотика ванкомицина даны в Griffin, et al., J. Am. Chem. Soc, 2003, 125, 6517-6531. Альтернативно, соединение содержит группы, которые вносят вклад в увеличение аффинности в отношении эпителиальной клетки кишечника, так чтобы увеличить время контакта с поверхностью эпителиальной клетки кишечника. Такие группы называют "мукоадгезивными". Более конкретно, группировка Core или L может быть замещена такими мукоадгезивными группами, такими как полиакрилаты, частично деацетилированный хитозан или полиалкиленгликоль (см. также Patil, S.В. et al., Curr. Drug. Deliv., 2008, Oct. 5(4), pp. 312-8).
D. Устойчивость к действию ферментов ЖК-тракта
Поскольку соединения, используемые в способах лечения по настоящему изобретению предпочтительно не являются по существу системно биодоступными и/или предпочтительно проявляют длительно действующий ингибирующий эффект, также желательно, чтобы во время их пролонгированного нахождения в кишечнике эти соединения выдерживали гидролитические условия, преобладающие в верхних отделах ЖК-тракта. В таких воплощениях соединения по настоящему изобретению устойчивы к ферментативному метаболизму. Например, введенные соединения предпочтительно устойчивы к активности Р450 ферментов, глюкозурилтрансфераз, сульфотрансфераз, глутатион-8-трансфераз и тому подобному, в слизистой кишечника, а также желудочных ферментов (например, желудочной липазы и пепсина), панкреатических ферментов (например, трипсина, панкреатической триглицеридлипазы, фосфолипазы А2, эндонуклеаз, нуклеотидаз и альфа-амилазы) и ферментов щеточной каемки эпителиальной ткани (например, щелочной фосфатазы, гликозидаз и протеаз), в целом известных в данной области техники.
Соединения, которые используются в способах по настоящему изобретению, также предпочтительно устойчивы к метаболизму под действием бактериальной флоры кишечника; то есть соединения не являются субстратами для ферментов, продуцируемых бактериальной флорой. В дополнение, соединения, вводимые в соответствии со способами по настоящему изобретению, могут быть по существу неактивными в отношении желудочно-кишечной флоры и не нарушают рост и выживание бактерий. Как результат, в различных воплощениях, описанных здесь, минимальная ингибирующая концентрация (или "MIC") против флоры ЖК-тракта желательно составляет более чем примерно 15 мкг/мл, примерно 30 мкг/мл, примерно 60 мкг/мл, примерно 120 мкг/мл или даже примерно 240 мкг/мл, причем MIC в различных воплощениях составляет, например, от примерно 16 до примерно 32 мкг/мл, или от примерно 64 до примерно 128 мкг/мл, или более чем примерно 256 мкг/мл.
Специалисту в области медицинской химии понятно, что метаболическая стабильность может быть достигнута множеством путей. Функциональные группы, чувствительные к Р450-опосредованному окислению, могут быть защищены путем, например, блокирования точки метаболизма галогеновой или другой функциональной группой. Альтернативно, электроноакцепторные группы могут быть добавлены к конъюгированной системе, для того чтобы в целом обеспечить защиту против окисления путем снижения электрофильности соединения. Протеолитическая стабильность может быть достигнута путем устранения вторичных амидных связей или путем введения изменений в стереохимию или другие модификации, которые предохраняют лекарственное средство от распознавания метаболизирующим ферментом в качестве субстрата.
Е. Экскреция натрия и/или жидкости
Также следует отметить, что в некоторых воплощениях по настоящему изобретению одно или более NHE-ингибирующих соединений, описанных здесь, при введении отдельно или в комбинации с одним или более дополнительными фармацевтически активными соединениями или агентами (включая, например, полимер, абсорбирующий жидкость) нуждающемуся в этом пациенту могут действовать таким образом, чтобы увеличивать у пациента суточную экскрецию натрия с фекалиями на по меньшей мере примерно 20, примерно 30 ммоль, примерно 40 ммоль, примерно 50 ммоль, примерно 60 ммоль, примерно 70 ммоль, примерно 80 ммоль, примерно 90 ммоль, примерно 100 ммоль, примерно 125 ммоль, примерно 150 ммоль или более, причем увеличение находится, например, в диапазоне от примерно 20 до примерно 150 ммоль/сутки, или от примерно 25 до примерно 100 ммоль/сутки, или от примерно 30 до примерно 60 ммоль/сутки.
Дополнительно или альтернативно, также следует отметить, что в различных воплощениях по настоящему изобретению одно или более NHE-ингибирующих соединений, описанных здесь, при введении отдельно или в комбинации с одним или более дополнительными фармацевтически активными соединениями или агентами (включая, например, полимер, абсорбирующий жидкость) нуждающемуся в этом пациенту могут действовать таким образом, чтобы увеличивать у пациента суточную экскрецию жидкости на по меньшей мере примерно 100 мл, примерно 200 мл, примерно 300 мл, примерно 400 мл, примерно 500 мл, примерно 600 мл, примерно 700 мл, примерно 800 мл, примерно 900 мл, примерно 1000 мл или более, причем увеличение находится, например, в диапазоне от примерно 100 до примерно 1000 мл/сутки, или от примерно 150 до примерно 750 мл/сутки, или от примерно 200 до примерно 500 мл/сутки (в расчете на изотоническую жидкость).
F. Cmax и IC50
Также следует отметить, что в некоторых воплощениях по настоящему изобретению одно или более NHE-ингибирующих соединений, описанных здесь, при введении отдельно или в комбинации с одним или более дополнительными фармацевтически активными соединениями или агентами (включая, например, полимер, абсорбирующий жидкость) нуждающемуся в этом пациенту в дозе, обеспечиваемой по меньшей мере 10%-ное увеличение содержания воды в фекалиях, имеет Cmax, которая меньше чем IC50 в отношении NHE-3, более конкретно, менее чем примерно 10Х (в 10 раз) IC50, и более конкретно, все еще менее чем примерно 100Х (в 100 раз) IC50.
Дополнительно или альтернативно, также следует отметить, что в различных воплощениях по настоящему изобретению одно или более NHE-ингибирующих соединений, описанных здесь, при введении отдельно или в комбинации с одним или более дополнительными фармацевтически активными соединениями или агентами (включая, например, полимер, абсорбирующий жидкость) нуждающемуся в этом пациенту могут иметь Cmax менее чем примерно 10 нг/мл, примерно 7,5 нг/мл, примерно 5 нг/мл, примерно 2,5 нг/мл, примерно 1 нг/мл или примерно 0,5 нг/мл, причем Cmax находится, например, в диапазоне от примерно 1 нг/мл до примерно 10 нг/мл или от примерно 2,5 нг/мл до примерно 7,5 нг/мл.
Дополнительно или альтернативно, также следует отметить, что в различных воплощениях по настоящему изобретению одно или более NHE-ингибирующих соединений, описанных здесь, при введении отдельно или в комбинации с одним или более дополнительными фармацевтически активными соединениями или агентами (включая, например, полимер, абсорбирующий жидкость) нуждающемуся в этом пациенту могут иметь IC50 менее чем примерно 10 мкМ, примерно 7,5 мкМ, примерно 5 мкМ, примерно 2,5 мкМ, примерно 1 мкМ или примерно 0,5 мкМ, причем IC50 находится, например, в диапазоне от примерно 1 мкМ до примерно 10 мкМ или от примерно 2,5 мкМ до примерно 7,5 мкМ.
Дополнительно или альтернативно, также следует отметить, что в различных воплощениях по настоящему изобретению одно или более NHE-ингибирующих соединений, описанных здесь, при введении нуждающемуся в этом пациенту могут иметь соотношение IC50:Cmax, где IC50 и Cmax выражены в одинаковых единицах, составляющее по меньшей мере примерно 10, примерно 50, примерно 100, примерно 250, примерно 500, примерно 750 или примерно 1000.
Дополнительно или альтернативно, также следует отметить, что в различных воплощениях по настоящему изобретению, где одно или более NHE-ингибирующих соединений, описанных здесь, перорально вводят нуждающемуся в этом пациенту, в пределах терапевтического диапазона или концентрации, максимальная концентрация соединения, обнаруживаемая в сыворотке, определенная как Cmax, ниже чем NHE-ингибирующая концентрация IC50 указанного соединения. Как отмечалось ранее, IC50, как используют здесь, определена как количественная мера, указывающая концентрацию соединения, необходимую для ингибирования на 50% активности NHE-опосредованного Na/H антипорта в клеточном анализе.
III. Фармацевтические композиции и способы лечения А.
Композиции и способы
1. Расстройства, связанные с задержкой жидкости и/или солевой перегрузкой
Фармацевтическая композиция или препарат, которые могут быть использованы в соответствии с настоящим изобретением, для лечения различных расстройств, ассоциированных с задержкой жидкости и/или солевой перегрузкой в желудочно-кишечном тракте (например, гипертензии, сердечной недостаточности (в частности, застойной сердечной недостаточности), хронического заболевания почек, поздней стадии заболевания почек, заболевания печени и/или задержки жидкости, вызванной агонистом гамма-рецептора, активируемого пролифератором пероксисом (PPAR)), включают в общем по существу не проникающее или по существу не являющееся системно биодоступным NHE-ингибирующее соединение по настоящему изобретению, а также различные другие возможные компоненты, как более подробно изложено ниже (например, фармацевтически приемлемые эксципиенты, и так далее). Соединения, используемые в способах лечения по настоящему изобретению, а также содержащие их фармацевтические композиции могут, соответственно, быть введены сами по себе или как часть протокола или схемы лечения, которое включает введение или применение других полезных соединений (как более подробно изложено далее в данном описании). В некоторых конкретных воплощениях NHE-ингибирующее соединение, в том числе любую фармацевтическую композицию, содержащую соединение, вводят с полимером, абсорбирующим жидкость (как более подробно описано ниже).
"Субъект" или "млекопитающее" предпочтительно представляет собой человека, но также может представлять собой животное, нуждающееся в лечении соединением по изобретению, например, животные-компаньоны (например собаки, кошки и тому подобное), сельскохозяйственные животные (например коровы, свиньи, лошади и тому подобное) и лабораторные животные (например крысы, мыши, морские свинки и тому подобное).
Субъекты, "нуждающиеся в лечении" соединением по настоящему изобретению, или субъекты, "нуждающиеся в NHE-ингибировании", включают субъектов с заболеваниями и/или состояниями, которые можно лечить по существу не проникающими или по существу не являющимися системно биодоступными NHE-ингибирующими соединениями вместе с полимером, абсорбирующим жидкость, или в отсутствие такого полимера, для достижения благоприятного терапевтического и/или профилактического результата. Полезный эффект включает снижение тяжести симптомов или отсрочку возникновения симптомов, повышение выживаемости и/или более быструю или более полную регрессию заболевания или состояния. Например, субъект, нуждающийся в лечении, может страдать гипертензией; чувствительной к соли гипертензией, которая может возникать в результате потребления соли с пищей; иметь риск сердечно-сосудистого заболевания (например, инфаркта миокарда, застойной сердечной недостаточности и тому подобное) в результате гипертензии; сердечной недостаточностью (например, застойной сердечной недостаточностью) в результате задержки жидкости или соли; хроническим заболеванием почек в результате задержки жидкости или соли, поздней стадией заболевания почек в результате задержки жидкости или соли; заболеванием печени в результате задержки жидкости или соли; задержкой жидкости, вызванной агонистом гамма-рецептора, активируемого пролифератором пероксисом (PPAR); или отеком в результате застойной сердечной недостаточности или поздней стадии заболевания почек. В различных воплощениях субъект, нуждающийся в лечении, как правило проявляет симптомы гиперволемии в результате задержки соли и жидкости, которые являются распространенными признаками застойной сердечной недостаточности, почечной недостаточности или цирроза печени. Задержка жидкости и задержка соли проявляются сами по себе возникновением одышки, отека, асцита или междудиализным набором веса. Другие примеры субъектов, которым полезно лечение, представляют собой субъектов, страдающих застойной сердечной недостаточностью, и пациентов с гипертонией и, в частности, пациентов, не поддающихся лечению диуретиками, то есть пациентов, которым доступно очень мало терапевтических возможностей. Субъект, "нуждающийся в лечении", также включает субъекта с гипертензией, чувствительным к соли кровяным давлением и субъектов с систолическим/диастолическим кровяным давлением выше 130-139/85-89 мм рт.ст.
Введение NHE-ингибирующих соединений вместе с введением или в отсутствие введения полимера, абсорбирующего жидкость, может быть полезным для пациентов, находящихся на диете "без добавления соли" (то есть 60-100 ммоль Na в сутки), для расширения их диеты при сохранении нейтрального или слегка отрицательного баланса натрия (то есть суммарное потребление соли равно или меньше выделяемого количества соли). В данном контексте, "расширение их диеты" означает, что пациенты, которых лечат, могут добавлять соль в свои блюда, чтобы сделать их более приятными на вкус, или/и разнообразить свою диету соль-содержащими продуктами, тем самым поддерживая хороший нутритивный статус, в то же время улучшая качество их жизни.
Описанные здесь способы лечения могут также помочь пациентам с отеком, ассоциированным с химиотерапией, предменструальной задержкой жидкости и преэклампсией (гипертензией, вызванной беременностью).
Соответственно, следует понимать, что настоящее изобретение также относится к способам лечения, включающим введение соединения по настоящему изобретению или фармацевтической композиции, содержащей такое соединение. Такие способы могут включать, например, способ лечения гипертензии, включающий введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции. Способ может быть предназначен для уменьшения задержки жидкости, ассоциированной с сердечной недостаточностью (в частности, застойной сердечной недостаточностью), и включает введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции. Способ может быть предназначен для уменьшения задержки жидкости, ассоциированной с поздней стадией заболевания почек, и включает введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции. Способ может быть предназначен для уменьшения задержки жидкости, ассоциированной с терапией агонистом гамма-рецептора, активирумого пролифератором пероксисом (PPAR), и включает введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции. Дополнительно или альтернативно, способ может быть предназначен для снижения активности NHE-транспортера кишечника у пациента, где указанный способ включает введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его композиции.
2. Заболевания желудочно-кишечного тракта
Фармацевтическая композиция или препарат, которые могут быть использованы в соответствии с настоящим изобретением, для лечения различных заболеваний желудочно-кишечного тракта, включая лечение или уменьшение боли, ассоциированной с заболеваниями желудочно-кишечного тракта, содержит по существу не проникающее или по существу не являющееся системно биодоступным NHE-ингибирующее соединение по настоящему изобретению, а также различные другие возможные компоненты, как более подробно изложено ниже (например, фармацевтически приемлемые эксципиенты, и так далее). Соединения, используемые в способах лечения по настоящему изобретению, а также содержащие их фармацевтические композиции могут, соответственно, быть введены сами по себе или как часть протокола или схемы лечения, которое включает введение или применение других полезных соединений (как более подробно изложено далее в данном описании). В некоторых конкретных воплощениях NHE-ингибирующее соединение, в том числе любую фармацевтическую композицию, содержащую соединение, вводят с полимером, абсорбирующим жидкость (как более подробно описано ниже).
"Субъект" предпочтительно представляет собой человека, но также может представлять собой животное, нуждающееся в лечении соединением по изобретению, например, животные-компаньоны (например собаки, кошки и тому подобное), сельскохозяйственные животные (например коровы, свиньи, лошади и тому подобное) и лабораторные животные (например крысы, мыши, морские свинки и тому подобное).
Субъекты, "нуждающиеся в лечении" соединением по настоящему изобретению, или субъекты, "нуждающиеся в NHE-ингибировании", включают субъектов с заболеваниями и/или состояниями, которые можно лечить по существу не проникающими или по существу не являющимися системно биодоступными NHE-ингибирующими соединениями вместе с полимером, абсорбирующим жидкость, или в отсутствие такого полимера, для достижения благоприятного терапевтического и/или профилактического результата. Полезный эффект включает снижение тяжести симптомов или отсрочку возникновения симптомов, повышение выживаемости и/или более быструю или более полную регрессию заболевания или состояния. Например, субъект, нуждающийся в лечении, страдает заболеванием желудочно-кишечного тракта; пациент страдает расстройством, выбранным из группы, состоящей из нарушения двигательной активности желудочно-кишечного тракта, синдрома раздраженной толстой кишки, хронического запора, идиопатического хронического запора, хронического запора, возникающего у пациентов с муковисцидозом, хронического запора, возникающего у пациентов с хроническим заболеванием почек, запора, вызванного приемом кальция у пациентов с остеопорозом, вызванного опиоидами запора, функционального расстройства желудочно-кишечного тракта, гастроэзофагеальной рефлюксной болезни, функциональной изжоги, диспепсии, функциональной диспепсии, неязвенной диспепсии, пареза желудка, хронической псевдообструкции тонкой кишки, болезни Крона, неспецифического язвенного колита и родственных заболеваний, относящихся к синдрому воспаленного кишечника, псевдообструкции толстой кишки и тому подобное.
В различных предпочтительных воплощениях запор, подлежащий лечению: ассоциирован с применением терапевтического агента; ассоциирован с невропатическим расстройством; представляет собой послеоперационный запор (послеоперационную кишечную непроходимость); ассоциирован с заболеванием желудочно-кишечного тракта; является идиопатическим (функциональный запор или атонический запор); ассоциирован с невропатическим, метаболическим или эндокринным расстройством (например, сахарным диабетом, почечной недостаточностью, гипотиреозом, гипертиреозом, гипокальциемией, рассеянным склерозом, болезнью Паркинсона, повреждениями спинного мозга, нейрофиброматозом, вегетативной нейропатией, болезнью Шагаса, болезнью Гиршспрунга или муковисцидозом, и тому подобное). Запор также может быть результатом хирургического вмешательства (послеоперационная кишечная непроходимость) или вызван применением лекарственных средств, таких как анальгетики (например опиоиды), гипотензивные средства, противосудорожные средства, антидепрессанты, спазмолитики и антипсихотические средства.
Соответственно, следует отметить, что настоящее изобретение также относится к способам лечения, включающим введение соединения по настоящему изобретению или фармацевтической композиции, содержащей такое соединение. Такие способы могут включать, например, способ увеличения двигательной активности желудочно-кишечного тракта у пациента, включающий введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции. Дополнительно или альтернативно, способ может быть предназначен для снижения активности NHE-транспортера кишечника у пациента, где способ включает введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции. Дополнительно или альтернативно, способ может быть предназначен для лечения заболевания желудочно-кишечного тракта, нарушения двигательной активности желудочно-кишечного тракта, синдрома раздраженной толстой кишки, хронического запора, вызванного приемом кальция у пациентов с остеопорозом, хронического запора, возникающего у пациентов с муковисцидозом, хронического запора, возникающего у пациентов с хроническим заболеванием почек, функционального расстройства желудочно-кишечного тракта, гастроэзофагеальной рефлюксной болезни, функциональной изжоги, диспепсии, функциональной диспепсии, неязвенной диспепсии, пареза желудка, хронической псевдообструкции тонкой кишки, псевдообструкции толстой кишки, болезни Крона, неспецифического язвенного колита, воспалительного заболевания кишечника, где способ включает введение антагониста NHE кишечника, и более конкретно, по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции, либо перорально, либо посредством ректального суппозитория. Дополнительно или альтернативно, способ может быть предназначен для лечения или уменьшения боли, включая висцеральную боль, боль, ассоциированную с заболеванием желудочно-кишечного тракта, или боль, ассоциированную с каким-либо другим расстройством, где способ включает введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции. Дополнительно или альтернативно, способ может быть предназначен для лечения воспаления, включая воспаление желудочно-кишечного тракта, например, воспаление, ассоциированное с заболеванием или инфекцией желудочно-кишечного тракта или каким-либо другим расстройством, где способ включает введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции.
3. Метаболические расстройства
Фармацевтическая композиция или препарат, которые могут быть использованы в соответствии с настоящим изобретением для лечения различных метаболических расстройств, включая сахарный диабет II типа (T2DM), метаболический синдром и/или симптомы, ассоциированные с такими расстройствами, в общем содержит по существу не проникающее или по существу не являющееся системно биодоступным NHE-ингибирующее соединение по настоящему изобретению, а также различные другие возможные компоненты, как более подробно изложено ниже (например, фармацевтически приемлемые эксципиенты, и так далее). Соединения, используемые в способах лечения по настоящему изобретению, а также содержащие их фармацевтические композиции могут, соответственно, быть введены сами по себе или как часть протокола или схемы лечения, которое включает введение или применение других полезных соединений (как более подробно изложено далее в данном описании).
Ожирение приобретает масштабы эпидемии во всем мире. В Соединенных Штатах приблизительно 2/3 населения имеют избыточный вес (индекс массы тела [BMI] от 25 до 29,9) или ожирение (BMI≥30) (Ogden, CL et al, "Prevalence of overweight and obesity in united states, 1999-2004" JAMA 2006, 295, 1549-1555). Ожирение является основным фактором риска развития диабета и родственных осложнений, включая сердечно-сосудистое заболевание и хроническое заболевание почек (CKD). Преобладание T2DM катастрофически увеличивается в Соединенных Штатах. По оценкам Американской ассоциации по борьбе с диабетом (ADA) более 23 миллионов взрослых американцев в возрасте 20 лет и старше имеют диабет, причем T2DM насчитывает приблизительно 95% от этих случаев. Всемирная Организация Здравоохранения (ВОЗ) насчитала огромное количество субъектов с диабетом во всем мире, составляющее приблизительно 170 миллионов (Campbell, R.К. "Туре 2 diabetes: where we are today: overview of disease burden, current treatments, and treatment strategies" Journal of American Pharmacists Association 2009, 49(5), S3-S9).
Ожирение также является основным фактором риска развития метаболического синдрома и последующего развития CKD. Метаболический синдром, ранее известный как синдром X, множественный метаболический синдром, дисметаболический синдром и другие названия, заключается в комплексе метаболических аномалий, включая аномальное ожирение, гипертриглицеридемию, низкие уровни холестерина липопротеинов высокой плотности (HDL), повышенное кровяное давление (BP) и повышенный уровень глюкозы в крови натощак или диабет (Townsend, R. R. et al "Metabolic Syndrome, Components, and Cardiovascular Disease Prevalence in Chronic Kidney Disease: Findings from Chronic Renal Insufficiency Cohort (CRIC) Study" American Journal of Nephrology 2011, 33, 477-484). Метаболический синдром распространен у пациентов с CKD и повышенным фактором риска развития и прогрессирования CKD.
Гемодинамические факторы, по-видимому, играют существенную роль в нарушении функции почек, вызванном ожирением. Гипертензия, которая тесно связана с ожирением, по-видимому является главной причиной нарушения функции почек у пациентов с ожирением (Wahba, I.M. et al "Obesity and obesity-initiated metabolic syndrome: mechanistic links to chronic kidney disease" Clinical Journal of American Society of Nephrology 2007, 2, 550-562). Исследования на животных и на людях показали, что ожирение ассоциировано с повышенной скоростью клубочковой фильтрации (GFR) и повышенным почечным кровотоком. Оно вероятно возникает по причине афферентного артериолярного расширения как результат проксимальной реабсорбции соли в сочетании с эфферентным почечным артериолярным сужением сосудов как результат повышенных уровней ангиотензина II. Эти эффекты могут вносить вклад в гиперфильтрацию, гломеруломегалию и поздний фокальный гломерулосклероз. Хотя GFR повышается при ожирении, почечная экскреция натрия в ответ на солевую нагрузку часто замедляется, и индивидуумы проявляют аномальный натрийурез давления, указывая на патологическую реабсорбцию натрия в проксимальных канальцах. В дополнение, повышенное распределение жира может вызвать повышенное внутрибрюшное давление, приводя к компрессии почечных вен, тем самым повышая почечное венозное давление и минимизируя почечную перфузию. В жировых складках, через разнообразные механизмы можно вызвать увеличение почечной интерстициальной гидростатической жидкости и может стимулировать задержку почечного натрия, тем самым делая вклад в гипертензию (Wahba_2007).
В свете вышесказанного в данной области техники существует необходимость в агентах, которые могут выводить натрий и жидкость из организма субъекта через механизмы, которые избегают почек или не зависят от нормальной функции почек. "Субъект" с метаболическим заболеванием, включая T2DM, метаболический синдром и тому подобное, предпочтительно представляет собой человека, но также может представлять собой животное, нуждающееся в лечении соединением по изобретению, например, животные-компаньоны (например собаки, кошки и тому подобное), сельскохозяйственные животные (например коровы, свиньи, лошади и тому подобное) и лабораторные животные (например крысы, мыши, морские свинки и тому подобное).
Субъекты, "нуждающиеся в лечении" соединением по настоящему изобретению, или субъекты, "нуждающиеся в NHE-ингибировании", включают субъектов с заболеваниями и/или состояниями, которые можно лечить по существу не проникающими или по существу не являющимися системно биодоступными NHE-ингибирующими соединениями вместе с полимером, абсорбирующим жидкость, или в отсутствие такого полимера, для достижения благоприятного терапевтического и/или профилактического результата. Полезный эффект включает снижение тяжести симптомов или отсрочку возникновения симптомов, повышение выживаемости и/или более быструю или более полную регрессию заболевания или состояния. Например, субъект с метаболическим расстройством, вызывающим или обостряющим хроническое заболевание почек, будет получать пользу от метода лечения, который может выводить избыток натрия и жидкости из организма способом, который не требует нормально функционирующих почек. Такое лечение будет включать способ, включающий введение пациенту по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения или содержащей его фармацевтической композиции.
Соединения, используемые в способах лечения по настоящему изобретению, а также содержащие их фармацевтические композиции могут, соответственно, быть введены сами по себе или как часть комбинированной терапии или схемы лечения, которое включает введение или применение других терапевтических соединений, относящихся к лечению метаболических расстройств, таких как T2DM и метаболический синдром. В некоторых конкретных воплощениях NHE-ингибирующее соединение, в том числе любую фармацевтическую композицию, содержащую соединение, вводят с полимером, абсорбирующим жидкость.
В. Комбинированные терапии
1. Расстройства, связанные с задержкой жидкости и/или солевой перегрузкой
Как отмечено выше, описанные здесь соединения могут быть использованы отдельно или в комбинации с другими агентами. Например, соединения могут быть введены вместе с диуретиком (а именно, петлевыми диуретиками, бензотиадиазидными диуретиками, калийсберегающими диуретиками, осмотическими диуретиками), сердечным гликозидом, ингибитором ангиотензин-превращающего фермента (АСЕ), антагонистом рецептора ангиотензина-2, антагонистом альдостерона, ингибитором синтазы альдостерона, ингибитором ренина, блокатором кальциевых каналов, бета-блокатором, альфа-блокатором, центральным альфа-агонистом, вазодилататором, антикоагулянтом, антитромбоцитарным агентом, агентом, понижающим уровень липидов, агонистом гамма-рецептора, активируемого пролифератором пероксисом (PPAR), или соединением или полимером, абсорбирующим жидкость, как более подробно описано ниже. Агент может быть ковалентно присоединен к описанному здесь соединению, или он может представлять собой отдельный агент, который вводят вместе или последовательно с описанным здесь соединением в комбинированной терапии.
Комбинированная терапия может быть достигнута путем введения двух или более агентов, например, по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения, описанного здесь, и диуретика, сердечного гликозида, ингибитора ангиотензин-превращающего фермента (АСЕ), антагониста рецептора ангиотензина-2, антагониста альдостерона, ингибитора синтазы альдостерона, ингибитора ренина, блокатора кальциевых каналов, бета-блокатора, альфа-блокатора, центрального альфа-агониста, вазодилататора, антикоагулянта, антитромбоцитарного агента или соединения, каждый(ое) из которых изготавливают и вводят отдельно, или путем введения двух или более агентов в одном препарате. Другие комбинации также охватываются комбинированной терапией. Например, два агента могут быть изготовлены вместе и введены в сочетании с отдельным препаратом, содержащим третий агент. Хотя два или более агентов в комбинированной терапии могут быть введены одновременно, в этом нет необходимости. Например, введение первого агента (или комбинации агентов) может предшествовать введению второго агента (или комбинации агентов) на минуты, часы, сутки или недели. Так, два или более агентов могут быть введены в пределах минуты один от другого, или в пределах 1, 2, 3, 6, 9, 12, 15, 18 или 24 часов один от другого, или в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14 суток один от другого, или в пределах 2, 3, 4, 5, 6, 7, 8, 9 недель один от другого. В некоторых случаях возможны даже более длительные интервалы. Хотя во многих случаях желательно, чтобы два или более агентов, используемых в комбинированной терапии, присутствовали в организме пациента в одно и то же время, в этом нет необходимости.
Комбинированная терапия также может включать два или более введений одного или более агентов, используемых в комбинации. Например, если агент X и агент Y используют в комбинации, они могут быть введены последовательно в любом сочетании один или более раз, например, в порядке Χ-Υ-Χ, Χ-Χ-Υ, Υ-Χ-Υ, Υ-Υ-Χ, X-X-Y-Y и так далее.
Описанные здесь соединения могут быть использованы в комбинированной терапии с диуретиками. Среди полезных диуретических агентов имеются, например: петлевые диуретики [фуросемид (лазикс), этакриновая кислота (эдекрин), буметанид (бумекс)], бензотиадиазидные диуретики [гидрохлортиазид (гидродиурил), хлортиазид (диурил), хлорталидон (хигротон), бензтиазид (аквапрез), бендрофлуметиазид (натуретин), метиклотиазид (акватензен), политиазид (ренез), индапамид (лозол), циклотиазид (ангидрон), гидрофлуметиазид (диукардин), метолазон (Diulo), квинетазон (гидромокс), трихлорметиазид (Naqua)], калийсберегающие диуретики [спиронолактон (алдактон), триамтерен (дирениум), амилорид (мидамор)], и осмотические диуретики [маннитол (осмитрол)]. Диуретические агенты в различных классах известны и описаны в литературе.
Сердечные гликозиды (карденолиды) или другие препараты наперстянки могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных сердечных гликозидов имеются, например: дигитоксин (кристодигин), дигоксин (ланоксин) или десланозид (Cedilanid-D). Сердечные гликозиды в различных классах известны и описаны в литературе.
Ингибиторы ангиотензин-превращающего фермента (АСЕ-ингибиторы) могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных АСЕ-ингибиторов имеются, например: каптоприл (капотен), эналаприл (вазотек), лизиноприл (принивил). АСЕ-ингибиторы в различных классах известны и описаны в литературе.
Антагонисты рецептора ангиотернзина-2 (также известные как АТУ антагонисты, или блокаторы рецепторов ангиотензина, или ARB) могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных антагонистов рецептора ангиотензина-2 имеются, например: кандесартан (атакан), эпросартан (теветен), ирбесартан (авапро), лосартан (Cozaar), телмисартан (микардис), валсартан (диован). Антагонисты рецептора ангиотензина-2 в различных классах известны и описаны в литературе.
Блокаторы кальциевых каналов, такие как амлодипин (норваск, лотрел), бепридил (васкор), дилтиазем (кардизем, тиазак), фелодипин (плендил), нифедипин (адалат, прокардиа), нимодипин (нимотоп), нисолдипин (Sular), верапамил (Calan, изоптин, верелан) и родственные соединения, описанные, например, в ЕР 625162 В1, патенте США 5364842, патенте США 5587454, патенте США 5824645, патенте США 5859186, патенте США 5994305, патенте США 6087091, патенте США 6136786, WO 93/13128 А1, ЕР 1336409 А1, ЕР 835126 А1, ЕР 835126 В1, патенте США 5795864, патенте США 5891849, патенте США 6054429, WO 97/01351 А1, полные содержания которых включены в данное описание посредством ссылки для всех релевантных и родственных целей, могут быть использованы с соединениями по изобретению.
Бета-блокаторы могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных бета-блокаторов имеются, например: ацебутолол (сектрал), атенолол (тенормин), бетаксолол (керлон), бисопролол/гидрохлортиазид (Ziac), бисопролол (Zebeta), картеолол (картрол), метопролол (лопрессор, Toprol XL), надолол (Corgard), пропранолол (индерал), соталол (бетапак), тимолол (блокадрен). Бета-блокаторы в различных классах известны и описаны в литературе.
Агонисты гамма-рецептора PPAR, такие как тиазолидиндионы (также называемые глитазоны) могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных PPAR-агонистов имеются, например: розиглитазон (Avandia), пиоглитазон (Actos) и ривоглитазон.
Антагонисты альдостерона могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных антагонистов альдостерона имеются, например: эплеренон, спиронолактон и канренон.
Ингибиторы ренина могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных ингибиторов ренина имеется, например: алискирен.
Альфа-блокаторы могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных альфа-блокаторов имеются, например: доксазозина мезилат (кардура), празозина гидрохлорид (минипресс), празозин и политиазид (минизид), теразозина гидрохлорид (Hytrin). Альфа-блокаторы в различных классах описаны в литературе.
Центральные альфа-агонисты могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных центральных альфа-агонистов имеются, например: клонидина гидрохлорид (катапрез), клонидина гидрохлорид и хлорталидон (клорпрез, комбипрез), гуанабенз-ацетат (витензин), гуанфацина гидрохлорид (тенекс), метилдопа (алдомет), метилдопа и хлортиазид (алдохлор), метилдопа и гидрохлортиазид (алдоприл). Центральные альфа-агонисты в различных классах описаны в литературе.
Вазодилататоры могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных вазодилататоров имеются, например: изосорбида динитрат (изордил), незиритид (натрекор), гидралазин (апрезолин), нитраты/нитроглицерин, миноксидил (лонитен). Вазодилататоры в различных классах описаны в литературе.
Антикоагулянты могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных антикоагулянтов имеются, например: варфарин (кумадин) и гепарин. Антикоагулянты в различных классах описаны в литературе.
Антитромбоцитарные агенты могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных антитромбоцитарных агентов имеются, например: ингибиторы циклооксигеназы (аспирин), ингибиторы рецептора аденозиндифосфата (ADP) [клопидогрел (плавике), тиклопидин (тиклид)], ингибиторы фосфодиэстеразы [цилостазол (Pletal)], ингибиторы гликопротеина IIB/IIIA [абциксимаб (ReoPro), эптифибатид (интегрилин), тирофибан (Aggrastat), дефибротид], ингибиторы обратного захвата аденозина [дипиридамол (персантин)]. Антитромбоцитарные агенты в различных классах описаны в литературе.
Агенты, понижающие уровень липидов, могут быть введены с соединениями по изобретению в комбинированной терапии. Среди полезных агентов, понижающих уровень липидов, имеются, например: статины (ингибиторы HMG СоА редуктазы), [аторвастатин (липитор), флувастатин (лескол), ловастатин (мевакор, алтопрев), правастатин (правахол), розувастатин кальция (крестор), симвастатин (зокор)], селективные ингибиторы всасывания холестерина [эзетимиб (Zetia)], смолы (секвестранты желчных кислот или лекарства, связывающие желчные кислоты) [холестирамин (квестран, квестран лайт, превалит, лохолест, лохолест лайт), холестипол (колестид), холесевелам HCI (WelChol)], фибраты (производные фиброевой кислоты) [гемфиброзил (лопид), фенофибрат (антара, лофибра, трикор и триглид), клофибрат (атромид-S)], ниацин (никотиновая кислота). Агенты, понижающие уровень липидов, в различных классах описаны в литературе.
Соединения по изобретению могут быть использованы в комбинации с пептидами или пептидными аналогами, которые активируют рецептор гуанилатциклазы в тонкой кишке и приводят в результате к повышению уровня внутриклеточного вторичного мессенджера или циклического гуанозинмонофосфата (cGMP), при увеличении секреции хлорида и бикарбоната в просвет кишечника и сопутствующей секреции жидкости. Примерами таких пептидов являются линаклотид (MD-1100 ацетат), эндогенные гормоны гуанилин и урогуанилин и кишечные бактериальные пептиды семейства термостабильных энтеротоксинов (ST пептиды), а также описанные в US 5140102, US 5489670, US 5969097, WO 2006/001931 A2, WO 2008/002971 А2, WO 2008/106429 A2, US 2008/0227685 A1 и US 7041786, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей.
Соединения по изобретению могут быть использованы в комбинации с агонистами хлоридных каналов 2 типа, такими как амитиза (лубипростон) и другие родственные соединения, описанные в US 6414016, полное содержание которого включено в данное описание посредством ссылки для всех релевантных и родственных целей.
Соединения, раскрытые здесь, могут быть использованы в комбинированной терапии с агентами для лечения ожирения, T2DM, метаболического синдрома и тому подобного. Среди полезных агентов имеются: инсулин; стимуляторы секреции инсулина, такие как сульфонилмочевины; эффекторы, снижающие уровень глюкозы, такие как метформин; активаторы рецептора γ, активируемого пролифератором пероксисом (PPARγ), такие как тиазолидиндионы; агенты на основе инкретина, включающие ингибиторы дипептидилпептидазы-4, такие как ситаглиптин, и синтетические миметики инкретина, такие как лираглутид и эксенатид; ингибиторы альфа-глюкозидазы, такие как акарбоза; глиниды, такие как репаглинид и натеглинид и тому подобное.
Соединения по изобретению могут быть использованы в комбинации с агонистами рецептора P2Y2, такими как описанные в ЕР 1196396 В1 и US 6624150, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей.
Другие агенты включают натрийуретические пептиды, такие как незиритид, рекомбинантная форма мозгового натрийуретического пептида (BNP) и предсердный натрийуретический пептид (ANP). Антагонисты рецептора вазопрессина, такие как толваптан и кониваптан, могут быть совместно введены, также как и фосфат-связывающие агенты, такие как ренагель, ренлева, фосло и фосренол. Другие агенты включают ингибиторы транспорта фосфатов (как описано в патентах США №№4806532, 6355823, 6787528, 7119120, 7109184, патентных публикациях №№2007/021509, 2006/0280719, 2006/0217426, международных патентных публикациях WO 2001/005398, WO 2001/087294, WO 2001/082924, WO 2002/028353, WO 2003/048134, WO 2003/057225, WO 2003/080630, WO 2004/085448, WO 2004/085382; европейских патентных публикациях №№1465638 и 1485391; и патенте Японии 2007131532, или антагонисты транспорта фосфатов, такие как никотинамид.
2. Заболевания желудочно-кишечного тракта
Как отмечено выше, описанные здесь соединения могут быть использованы отдельно или в комбинации с другими агентами. Например, соединения могут быть введены вместе с анальгетическим пептидом или соединением. Анальгетический пептид или соединение может быть ковалентно присоединен к описанному здесь соединению, или он может представлять собой отдельный агент, который вводят вместе или последовательно с описанным здесь соединением в комбинированной терапии.
Комбинированная терапия может быть достигнута путем введения двух или более агентов, например, по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения, описанного здесь, и анальгетического пептида или соединения, каждый(ое) из которых изготавливают и вводят отдельно, или путем введения двух или более агентов в одном препарате. Другие комбинации также охватываются комбинированной терапией. Например, два агента могут быть изготовлены вместе и введены в сочетании с отдельным препаратом, содержащим третий агент. Хотя два или более агентов в комбинированной терапии могут быть введены одновременно, в этом нет необходимости. Например, введение первого агента (или комбинации агентов) может предшествовать введению второго агента (или комбинации агентов) на минуты, часы, сутки или недели. Так, два или более агентов могут быть введены в пределах минуты один от другого, или в пределах 1, 2, 3, 6, 9, 12, 15, 18 или 24 часов один от другого, или в пределах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14 суток один от другого, или в пределах 2, 3, 4, 5, 6, 7, 8, 9 недель один от другого. В некоторых случаях возможны даже более длительные интервалы. Хотя во многих случаях желательно, чтобы два или более агентов, используемых в комбинированной терапии, присутствовали в организме пациента в одно и то же время, в этом нет необходимости.
Комбинированная терапия также может включать два или более введений одного или более агентов, используемых в комбинации. Например, если агент X и агент Y используют в комбинации, они могут быть введены последовательно в любом сочетании один или более раз, например, в порядке Χ-Υ-Χ, Χ-Χ-Υ, Υ-Χ-Υ, Υ-Υ-Χ, X-X-Y-Y и так далее.
Описанные здесь соединения могут быть использованы в комбинированной терапии с анальгетическим агентом, например анальгетическим соединением или анальгетическим пептидом. Анальгетический агент может быть ковалентно присоединен к описанному здесь соединению. Среди полезных анальгетических агентов имеются, например: блокаторы Са-каналов, агонисты 5НТ3 (например, МСК-733), агонисты 5НТ4 (например, тегасерод, прукалоприд) и антагонисты рецептора 5НТ1, агонисты опиоидных рецепторов (лоперамид, федотозин и фентанил), антагонисты рецептора NK1, агонисты рецептора ССК (например, локсиглумид), антагонисты рецептора NK1, антагонисты рецептора NK3, ингибиторы обратного захвата норэпинефрина-серотонина (NSR1), агонисты ванилоидных и каннабиноидных рецепторов и сиалорфин. Анальгетические агенты в различных классах описаны в литературе.
Антагонисты и агонисты опиоидных рецепторов могут быть введены с соединениями по изобретению в комбинированной терапии или связанными с соединением по изобретению, например, ковалентной связью. Например, антагонисты опиоидных рецепторов, такие как налоксон, налтрексон, метилналозон, налмефен, ципридим, бета-фуналтрексамин, налоксоназин, налтриндол и нор-биналторфимин, считаются полезными в лечении запора, вызванного опиоидами (OIC). Может быть полезным изготавливать антагонисты опиоидов этого типа в виде препарата с замедленным или непрерывным высвобождением, так чтобы начальное высвобождение антагониста происходило в среднем или дистальном отделе тонкой кишки и/или восходящей ободочной кишке. Такие антагонисты описаны в US 6734188 (WO 01/32180 А2), полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей. Пентапептид энкефалин (НОЕ825; Tyr-D-Lys-Gly-Phe-L-гомосерин) представляет собой агонист μ- и γ-опиоидных рецепторов и считается полезным для усиления двигательной способности кишечника (Eur. J. Pharm., 219:445, 1992), и этот пептид может быть использован в сочетании с соединениями по изобретению. Также полезен тримебутин, который, как считают, связывается с мю/дельта/каппа опиоидными рецепторами и активирует высвобождение мотилина и модулирует высвобождение гастрина, вазоактивного интестинального пептида, гастрина и глюкагонов. Агонисты К-опиоидного рецептора, такие как федотозин, кетоциклазозин, а также соединения, описанные в US 2005/0176746 (WO 03/097051 А2), полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей, могут быть использованы или связаны с соединениями по изобретению. В дополнение, могут быть использованы агонисты μ-опиоидного рецептора, такие как морфин, дифенилоксилат, фракефамид (H-Tyr-D-Ala-Phe(F)-Phe-NH2; раскрытый в WO 01/019849 А1, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей) и лоперамид.
Tyr-Arg (киоторфин) представляет собой дипептид, который действует путем стимулирования высвобождения мет-энкефалинов с индуцированием анальгетического эффекта (J. Biol. Chem. 262:8165, 1987). Киоторфин может быть использован или связан с соединениями по изобретению. Агонисты ССК рецептора, такие как церулеин из земноводных и других видов, являются полезными анальгетическими агентами, которые могут быть использованы или связаны с соединениями по изобретению.
Пептиды конотоксина представляют собой большой класс анальгетических пептидов, которые действуют на потенциалозависимых Са каналах, NMDA рецепторах или никотиновых рецепторах. Эти пептиды могут быть использованы или связаны с соединениями по изобретению.
Пептидные аналоги тимулина (US 7309690 или FR 2830451, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей) могут обладать анальгетической активностью и могут быть использованы или связаны с соединениями по изобретению.
Антагонисты ССК (ССКа или CCKb) рецепторов, включая локсиглумид и декслоксиглумид (R-изомер локсиглумида) (US 5130474 или WO 88/05774, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей) могут обладать анальгетической активностью и могут быть использованы или связаны с соединениями по изобретению.
Другие полезные анальгетические агенты включают 5-НТ4 агонисты, такие как тегасерод/зелнорм и лирексаприд. Такие агонисты описаны в: ЕР 1321142 А1, WO 03/053432 A1, ЕР 505322 A1, ЕР 505322 В1, ЕР 507672 А1, ЕР 507672 В1, патенте США 5510353 и патенте США 5273983, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей.
Блокаторы кальциевых каналов, такие как зиконотид и родственные соединения, описанные, например, в ЕР 625162 В1, патенте США 5364842, патенте США 5587454, патенте США 5824645, патенте США 5859186, патенте США 5994305, патенте США 6087091, патенте США 6136786, WO 93/13128 А1, ЕР 1336409 А1, ЕР 835126 А1, ЕР 835126 В1, патенте США 5795864, патенте США 5891849, патенте США 6054429, WO 97/01351 А1, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей, могут быть использованы или связаны с соединениями по изобретению.
Различные антагонисты NK-1, NK-2 и NK-3 рецепторов (для обзора см. Giardina et al. 2003 Drugs 6:758) могут быть использованы или связаны с соединениями по изобретению.
Антагонисты NK1 рецептора, такие как: апрепитант (Merck & Со Inc), вофопитант, эзлопитант (Pfizer, Inc.), R-673 (Hoffmann-La Roche Ltd), SR-14033 и родственные соединения, описанные, например, в ЕР 873753 А1, US 20010006972 А1, US 20030109417 А1, WO 01/52844 А1, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей, могут быть использованы или связаны с соединениями по изобретению.
Антагонисты NK-2 рецептора, такие как непадутант (Menarini Ricerche SpA), саредутант (Sanofi-Synthelabo), SR-144190 (Sanofi-Synthelabo) и UK-290795 (Pfizer Inc), могут быть использованы или связаны с соединениями по изобретению.
Антагонисты NK3 рецептора, такие как осанетант (Sanofi-Synthelabo), талнетант и родственные соединения, описанные, например, в WO 02/094187 А2, ЕР 876347 А1, WO 97/21680 А1, патенте США 6277862, WO 98/11090, WO 95/28418, WO 97/19927 и Boden et al. (J Med. Chem. 39:1664-75, 1996), полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей, могут быть использованы или связаны с соединениями по изобретению.
Ингибиторы обратного захвата норэпинефрина-серотонина, такие как милнаципран и родственные соединения, описанные в WO 03/077897 А1, полное содержание которой включено в данное описание посредством ссылки для всех релевантных и родственных целей, могут быть использованы или связаны с соединениями по изобретению.
Антагонисты ванилоидного рецептора, такие как арванил и родственные соединения, описанные в WO 01/64212 А1, полное содержание которой включено в данное описание посредством ссылки для всех релевантных и родственных целей, могут быть использованы или связаны с соединениями по изобретению.
Соединения могут быть использованы в комбинированной терапии с ингибитором фосфодиэстеразы (примеры таких ингибиторов могут быть найдены в патенте США 6333354, полное содержание которого включено в данное описание посредством ссылки для всех релевантных и родственных целей).
Соединения могут быть использованы отдельно или в комбинированной терапии для лечения расстройств, ассоциированных с секрецией хлорида или бикарбоната, которая может привести к запору, например, муковисцидоза.
Соединения могут также или альтернативно быть использованы отдельно или в комбинированной терапии для лечения состояний запора, вызванных кальциевыми добавками. Запор часто обнаруживают у пожилого населения, в частности пациентов с остеопорозом, которым приходится принимать кальциевые добавки. Кальциевые добавки, как показано, полезны для пациентов с остеопорозом для восстановления костной плотности, однако согласие пациентов со схемой их приема является низким из-за побочных эффектов в виде запора, ассоциированных с ними.
Соединения по настоящему изобретению могут быть использованы в комбинации с опиоидом. Применение опиоидов направлено главным образом на снятие боли, с заметным побочным эффектом, выражающемся в заболевании ЖК-тракта, например запоре. Эти агенты действуют путем связывания с опиоидными рецепторами, которые обнаруживаются прежде всего в центральной нервной системе и желудочно-кишечном тракте. Рецепторы в этих двух системах органов опосредуют как благоприятные эффекты, так и нежелательные побочные эффекты (например, снижение двигательной способности кишечника и вызывание запора). Опиоиды, подходящие для применения, обычно относятся к одному из следующих примерных классов: природные опиаты, алкалоиды, содержащиеся в смоле опийного мака, включая морфин, кодеин и тебаин; полусинтетические опиаты, созданные из природных опиоидов, такие как гидроморфон, гидрокодон, оксикодон, оксиморфон, дезоморфин, диацетилморфин (героин), никоморфин, дипропаноилморфин, бензилморфин и этилморфин; полностью синтетические опиоиды, такие как фентанил, петидин, метадон, трамадол и пропоксифен; эндогенные опиоидные пептиды, продуцируемые естественным образом в организме, такие как эндорфины, энкефалины, динорфины и эндоморфины.
Соединение по изобретению может быть использовано отдельно или в комбинированной терапии для облегчения заболеваний ЖК-тракта, встречающихся у пациентов с почечной недостаточностью (стадия 3-5). Запор является вторым из наиболее сообщаемых симптомов в этой категории пациентов (Murtagh et al., 2006; Murtagh et al., 2007a; Murtagh et al., 2007b). He связывая с теорией, полагают, что почечная недостаточность сопровождается стимуляцией интестинальной реабсорбции Na (Hatch and Freel, 2008). Суммарное или частичное ингибирование такого транспорта путем введения соединений по изобретению может оказывать терапевтический эффект для улучшения транзита через ЖК-тракт и облегчения боли в животе. В данном контексте соединения по изобретению могут быть использованы в комбинации с ангиотензин-модулирующими агентами: ингибиторы ангиотензин-превращающего фермента (АСЕ) (например, каптоприл, эналаприл, лизиноприл, рамиприл) и терапия антагонистом рецептора ангиотензина II (также называемых АТУантагонистами, или блокаторами рецептора ангиотензина, или ARB); диуретики, такие как петлевые диуретики (например, фуросемид, буметанид), тиазидные диуретики (например, гидрохлортиазид, хлорталидон, хлортиазид) и калийсберегающие диуретики: амилорид; бета-блокаторы: бисопролол, карведиол, небиволол и метопролол с пролонгированным высвобождением; положительные инотропы: дигоксин, добутамин; ингибиторы фосфодиэстеразы, такие как милринон; альтернативные вазодилататоры: комбинация изосорбида динитрат/гидралазин; антагонисты рецептора альдостерона: спиронолактон, эплеренон; натрийуретические пептиды: незиритид, рекомбинантная форма мозгового натрийуретического пептида (BNP), предсердный натрийуретический пептид (ANP); антагонисты рецептора вазопрессина: толваптан и кониваптан; фосфат-связывающий агент (ренагел, ренлева, фосло, фосренол); ингибитор транспорта фосфата, такой как описанные в US 4806532, US 6355823, US 6787528, WO 2001/005398, WO 2001/087294, WO 2001/082924, WO 2002/028353, WO 2003/048134, WO 2003/057225, US 7119120, EP 1465638, заявке на патент США 2007/021509, WO 2003/080630, US 7109184, заявке на патент США 2006/0280719, ЕР 1485391, WO 2004/085448, WO 2004/085382, заявке на патент США 2006/0217426, JP 2007/131532, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей, или антагонист транспорта фосфата (никотинамид).
Соединения по изобретению могут быть использованы в комбинации с пептидами или пептидными аналогами, которые активируют рецептор гуанилатциклазы в тонком кишечнике и приводят в результате к увеличению уровня внутриклеточного вторичного мессенджера, или циклического гуанозинмонофосфата (cGMP), при повышенной секреции хлорида и бикарбоната в просвет тонкого кишечника и сопутствующей секреции жидкости. Примерами таких пептидов являются линаклотид (MD-1100 ацетат), эндогенные гормоны гуанилин и урогуанилин и кишечные бактериальные пептиды семейства термостабильных энтеротоксинов (ST пептиды) и те, которые описаны в US 5140102, US 5489670, US 5969097, WO 2006/001931 A2, WO 2008/002971 A2, WO 2008/106429 A2, US 2008/0227685 A1 и US 7041786, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей.
Соединения по изобретению могут быть использованы в комбинации с агонистами хлоридных каналов 2 типа, такими как Amitiza (лубипростон) и другие родственные соединения, описанные в US 6414016, полное содержание которого включено в данное описание посредством ссылки для всех релевантных и родственных целей.
Соединения по изобретению могут быть использованы в комбинации с агонистами рецептора P2Y2, такими как описанные в ЕР 1196396 В1 и US 6624150, полное содержание которых включено в данное описание посредством ссылки для всех релевантных и родственных целей.
Соединения по изобретению могут быть использованы в комбинации со слабительными средствами, такими как агенты, создающие объем, например оболочки семян подорожника (метамуцил), метилцеллюлоза (Citrucel), поликарбофил, клетчатка, яблоки, средства, размягчающие стул/поверхностно-активное вещество, например докузат (Colace, Diocto); гидратирующие агенты (осмотические агенты), такие как гидрофосфат натрия, цитрат магния, гидроксид магния (магнезия), сульфат магния (представляющий собой соль Эпсома), дигидрофосфат натрия, бифосфат натрия; гиперосмотические агенты: глицериновые суппозитории, сорбит, лактулоза и полиэтиленгликоль (PEG). Соединения по изобретению также могут быть использованы в комбинации с агентами, которые стимулируют перистальтику кишечника, такими как таблетки бисакодила (дулколакс), казантранол, сенна и алоин, из Aloe Vera.
В одном воплощении соединения по изобретению ускоряют транзит через желудочно-кишечный тракт, и более конкретно в толстой кишке, по существу не влияя на время нахождения в желудке, то есть не оказывая существенного влияния на время опорожнения желудка. Еще более конкретно, соединения по изобретению восстанавливают транзит по толстому кишечнику в отсутствие побочных эффектов, ассоциированных с замедленным опорожнением желудка, таких как тошнота. Транзит по желудочно-кишечному тракту и кишечнику измеряют у пациентов, используя способы, описанные, например, в: Burton DD, Camilleri M, Mullan BP, et al., J. Nucl. Med., 1997;38:1807-1810; Cremonini F, Mullan BP, Camilleri M, et al., Aliment. Pharmacol. Then, 2002;16:1781-1790; Camilleri M, Zinsmeister AR, Gastroenterology, 1992;103:36-42; Bouras EP, Camilleri M, Burton DD, et al., Gastroenterology, 2001;120:354-360; Coulie B, Szarka LA, Camilleri M, et al., Gastroenterology, 2000;119:41-50; Prather CM, Camilleri M, Zinsmeister AR, et al., Gastroenterology, 2000;118:463-468; и Camilleri M, McKinzie S, Fox J, et al., Clin. Gastroenterol. Hepatol., 2004; 2:895-904.
С. Комбинированная терапия с полимером
Описанные здесь NHE-ингибирующие соединения могут быть введены пациентам, нуждающимся в этом, в комбинации с полимером, абсорбирующим жидкость ("FAP"). Интестинальные полимеры, абсорбирующие жидкость, полезные для введения в соответствии с воплощениями по настоящему изобретению, могут быть введены перорально в комбинации с неабсорбируемыми NHE-ингибирующими соединениями (например NHE-3 ингибитором) для абсорбции кишечной жидкости, вырабатываемой в результате действия ингибиторов транспорта натрия. Такие полимеры набухают в толстой кишке и связывают жидкость для придания консистенции стулу, которая приемлема для пациентов. Описанные здесь полимеры, абсорбирующие жидкость, могут быть выбраны из полимеров с послабляющими свойствами, также известными как объемообразующие агенты (то есть полимеры, которые удерживают некоторое количество кишечной жидкости в стуле и придают более высокую степень гидратации в стуле и облегчают транзит). Полимеры, абсорбирующие жидкости, также могут быть возможно выбраны из фармацевтических полимеров с противодиарейным действием, то есть агентов, которые поддерживают некоторую консистенцию стула для избежания водянистого стула и возможного недержания.
Способность полимера поддерживать определенную консистенцию стула с высоким содержанием жидкости может быть охарактеризована его "водоудерживающей способностью". Wenzl et al. (in Determinants of decreased fecal consistency in patients with diarrhea; Gastroenterology, v. 108, no. 6, p. 1729-1738 (1995)) изучили детерминанты, регулирующие консистенцию стула пациентов с диареей, и обнаружили, что они тесно коррелировали с водоудерживающей способностью фекалий. Водоудерживающую способность определяют как содержание воды в данном стуле для достижения определенного уровня консистенции (соответствующего консистенции "оформленного стула") после центрифугирования разведенного образца фекалий на определенное количество в граммах. Не связывая с какой-либо конкретной теорией, было обнаружено, что водоудерживающая способность фекалий увеличивается при поглощении некоторых полимеров с данным профилем абсорбирования жидкости. Более конкретно, было обнаружено, что водоудерживающая способность указанных полимеров коррелирует с их поглощаемостью под нагрузкой (AUL); еще более конкретно, AUL указанных полимеров более чем 15 г изотонической жидкости/г полимера под статическим давлением 5 кПа, еще более предпочтительно под статическим давлением 10 кПа.
FAP, полезный в способах лечения по настоящему изобретению, предпочтительно имеет значение AUL по меньшей мере примерно 10 г, примерно 15 г, примерно 20 г, примерно 25 г или более изотонической жидкости/г полимера под статическим давлением примерно 5 кПа, и предпочтительно примерно 10 кПа, и может иметь поглощаемость жидкости примерно 20 г, примерно 25 г или более, как определяют с использованием средств, обычно известных в данной области техники. Дополнительно или альтернативно, FAP может придавать минимальную консистенцию фекальной массе и в некоторых воплощениях консистенцию, обозначаемую как "мягкая" по шкале, описанной ниже в способе тестирования, когда твердая не растворимая в воде фракция фекалий составляет от 10% до 20%, и концентрация полимера составляет от 1% до 5% массы стула. Определение твердой, не растворимой в воде фракции фекалий в стуле описано в Wenz et al. Полимер может быть незаряженным или может иметь низкую плотность заряда (например, 1-2 м-экв/г). Альтернативно или дополнительно, полимер может быть доставлен непосредственно в толстую кишку с использованием способов доставки, избегающих преждевременное набухание в пищеводе.
В одном воплощении по настоящему изобретению FAP представляет собой полимер "суперабсорбент" (то есть перекрестно-сшитый в небольшой степени, частично нейтрализованный полиэлектролитный гидрогель, подобный тем, которые используют в детских подгузниках, женских средствах гигиены, сельскохозяйственных добавках и так далее). Суперабсорбирующие полимеры могут быть получены из перекрестно-сшитых в небольшой степени полиакрилатных гидрогелей. Набухание полимера запускается по существу двумя эффектами: (1) гидратирование полимерной цепи и энтропия смешивания и (2) осмотическое давление, возникающее от противоионов (например ионов Na) в геле. Коэффициент набухания геля при равновесии регулируется эластическим сопротивлением, свойственным полимерной структуре, и химическим потенциалом погружения в жидкость, то есть гель будет сжиматься при более высокой концентрации соли из-за того, что фоновый электролит снижает кажущуюся плотность заряда на полимере и будет уменьшать разницу между концентрацией свободных ионов внутри и снаружи геля, который инициирует осмотическое давление. Коэффициент набухания SR (г жидкости на г сухого полимера, и в качестве синонима "поглощаемость жидкости") может варьировать от 1000 в чистой воде, снижаясь вплоть до 30 в 0,9%-ном растворе NaCI, представляющего собой физиологический раствор (то есть изотонический). SR может увеличиваться со степенью нейтрализации и может уменьшаться с плотностью перекрестного сшивания. SR в общем уменьшается с приложенной нагрузкой со степенью снижения в зависимости от крепости геля, то есть степени перекрестного сшивания. Концентрация соли в геле по сравнению с внешним раствором может быть ниже в результате эффекта Доннана, вызванного внутренним электрическим потенциалом.
Полимер, абсорбирующий жидкость, может включать перекрестно-сшитые полиакрилаты, которые являются абсорберами жидкости, такие как те, которые получают из α,β-этилен-ненасыщенных мономеров, таких как монокарбоновые кислоты, поликарбоновые кислоты, акриламид и их производные. Эти полимеры могут иметь повторяющиеся звенья акриловой кислоты, метакриловой кислоты, металлические соли акриловой кислоты, акриламид и акриламидные производные (такие как 2-акриламидо-2-метилпропан-сульфоновая кислота) наряду с различными комбинациями таких повторяющихся звеньев как сополимеры. Такие производные включают акриловые полимеры, которые включают гидрофильные прививки полимеров, таких как поливиниловый спирт.Примеры подходящих полимеров и процессов, включая процесс гель-полимеризации, для получения таких полимеров раскрыты в патентах США №№3997484, 3926891, 3935099, 4090013, 4093776, 4340706, 4446261, 4683274, 4459396, 4708997, 4076663, 4190562, 4286082, 4857610, 4985518, 5145906, 5629377 и 6908609, которые включены в данное описание посредством ссылки для всех релевантных и родственных целей (в дополнение, см. Buchholz, F.L. and Graham, A.T., "Modern Superabsorbent Polymer Technology," John Wiley & Sons (1998), которая включена в данное описание посредством ссылки для всех релевантных и родственных целей). Класс предпочтительных полимеров для лечения в комбинации с NHE-ингибиторами представляет собой полиэлектролиты.
Степень перекрестного сшивания может широко варьировать в зависимости от конкретного полимерного материала; однако, в большинстве применений субъектом суперабсорбирующие полимеры являются перекрестно-сшитыми лишь в слабой степени, то есть степень перекрестного сшивания является такой, что полимер все еще может абсорбировать свыше 10 раз его массы в физиологическом растворе (то есть 0,9%-ном физиологическом растворе). Например, такие полимеры обычно включают менее чем примерно 0,2 мол.% перекрестно-сшивающего агента.
В некоторых воплощениях FAP, используемые для лечения, представляют собой карбофил кальция (регистрационный номер: 9003-97-8, также называемый карбопол ЕХ-83) и карпопол 934Р.
В некоторых воплощениях полимер, абсорбирующий жидкость, получают эмульсионными способами с высоким содержанием дисперсной фазы ("HIPE"). HIPE-процесс приводит к полимерным пеноблокам с очень большой пористой фракцией взаимосвязанных больших пустот (примерно 100 микрон) (то есть структуры с открытыми порами). Эта технология дает эластичные и сминаемые пеноматериалы с исключительными давлением всасывания и поглощаемостью жидкости (см. патенты США No. 5650222, 5763499 и 6107356, которые включены в данное описание посредством ссылки для всех релевантных и родственных целей). Полимер является гидрофобным и, следовательно, поверхность должна быть модифицирована таким образом, чтобы увлажняться водной жидкостью. Это достигается путем последующей обработки пеноматериала поверхностно-активным веществом с целью снижения поверхностного натяжения на границе раздела фаз. Эти материалы декларируются как менее деформируемые к нагрузкам, то есть менее предрасположенные к сжиманию под статическим давлением.
В некоторых воплощениях абсорбирующие жидкость гели получают путем водной свободнорадикальной полимеризации акриламида или его производных, сшивающего агента (например метилен-бис-акриламида) и свободнорадикальной инициирующей редокс-системы в воде. Материал получают в виде пласта. Как правило, коэффициент набухания перекрестно-сшитого полиакриламида с низкой перекрестно-сшивающей плотностью (например, 2%-4%, выраженной в виде масс. % от метилен-бис-акриламида) составляет от 25 до 40 (F. Horkay, Macromolecules, 22, pp.2007-09 (1989)). Набухающие свойства этих полимеров широко изучались и являются по существу такими же, как у полимеров из перекрестно-сшитых полиакриловых кислот с высокой концентрацией соли. В этих условиях осмотическое давление равно нулю из-за присутствия противоионов, и набухание регулируется свободной энергией смешивания и суммарной энергией упругодеформированного тела. Говоря иначе, перекрестно-сшитый полиакриламидный гель с такой же плотностью поперечной сшивки как у нейтрализованной полиакриловой кислоты будет проявлять такой же коэффициент набухания (то есть абсорбирующие жидкость свойства) и, как полагают, такую же степень сжимаемости под давлением как у перекрестно-сшитого полиэлектролита при высоком содержании соли (например, 1 М). Свойства (например, набухания) нейтральных гидрогелей не будут чувствительны к солевому окружению в течение всего времени пока полимер остается в условиях хорошего растворителя. Не связывая с какой-либо конкретной теорией, полагают, что жидкость, содержащаяся в геле, имеет такой же солевой состав, что и окружающая жидкость (то есть нет соли, выделяющейся вследствие эффекта Доннана).
Еще один подкласс полимеров, абсорбирующих жидкость, который может быть использован, представляет собой гидрогелевые материалы, включающие N-алкилакриламидные полимеры (например N-изопропилакриламид (NIPAM)). Соответствующие водные поли-NIPAM гидрогели проявляют температуру фазового перехода при примерно 35°С. Выше этой температуры гидрогель может спадаться. Механизм в общем является обратимым, и гель снова набухает до своей исходной степени набухания, когда температура возвращается к комнатной температуре. Это обеспечивает получение наночастиц путем эмульсионной полимеризации (R. Pelton, Advances in Colloid and Interface Science, 85, pp. 1-33, (2000)). Характеристики набухания поли-NIPAM наночастиц ниже температуры фазового перехода были описаны, и они аналогичны тем, которые описаны для объемного геля поли-NIPAM, и эквивалентны тем, которые обнаружены для полиакриламида (то есть 30-50 г/г) (W. McPhee, Journal of Colloid and Interface Science, 156, pp. 24-30 (1993); и К. Oh, Journal of Applied Polymer Science, 69, pp. 109-114 (1997)).
В некоторых воплощениях FAP, используемый для лечения в комбинации с NHE-ингибитором, представляет собой сверхпористый гель, который может задерживать опорожнение желудка для лечения ожирения (J. Chen, Journal of Controlled Release, 65, pp. 73-82 (2000) или для доставки белков. SAP на основе полиакрилатов с макропористой структурой также может быть использован. Макропористые SAP и сверхпористые гели отличаются тем, что пористая структура остается почти интактной в сухом состоянии для сверхпоритсых гелей, но исчезает при сушке для макропористых SAPs. Способы получения отличаются, хотя в обоих способах используется пенообразователь (например соль карбонат, который образует пузырьки CO2 во время полимеризации). Типичные коэффициенты набухания, SR, сверхпористых материалов составляют около 10. Сверхпористые гели сохраняют большой объем внутренних пор в сухом состоянии.
Макропористые гидрогели также могут быть образованы с использованием способа, посредством которого отделение полимерной фазы индуцируется не-растворителем. Полимер может представлять собой поли-NIPAM, и используемый не-растворитель может представлять собой глюкозу (см., например, Z. Zhang, J. Org. Chem., 69, 23 (2004)) или NaCl (см., например, Cheng et al., Journal of Biomedical Materials Research - Part A. Vol. 67, Issue 1, 1 октября 2003 года, стр. 96-103). Отделение фазы, индуцируемое присутствием NaCl, приводит к увеличению коэффициента набухания. Эти материалы являются предпочтительными, если коэффициент набухания материала, SR, сохраняется в солевом изотоническом растворе и если гели не спадаются под нагрузкой. Температура "процедуры" должна сдвигаться выше температуры тела, например, путем разбавления NIPAM в полимере мономером, лишенным феномена температуры фазового перехода.
В некоторых воплощениях полимер, абсорбирующий жидкость, может быть выбран из некоторых природных полимеров, таких как полимеры, содержащие углеводные группировки. В предпочтительном воплощении такие углевод-содержащие гидрогели являются неперевариваемыми, имеют низкую фракцию растворимого материала и высокую фракцию гелеобразующих материалов. В некоторых воплощениях полимер, абсорбирующий жидкость, выбран из ксантана, гуара, велана, гемицеллюлоз, алкилцеллюлозы, гидроалкилцеллюлозы, карбоксиалкилцеллюлозы, каррагенана, декстрана, гиалуроновой кислоты и агарозы. В предпочтительном воплощении гелеобразующий полимер представляет собой псиллиум. Псиллиум (или "подорожник блошный") является общепринятым названием, используемым для нескольких представителей рода растений Plantage-, семена которых используют в промышленности для получения растительного клея. Наиболее предпочтительно, полимер, абсорбирующий жидкость, представляет собой гелеобразующую фракцию псиллиума, то есть нейтральный сахаридный сополимер арабинозы (25%) и ксилозы (75%), как охарактеризовано в (J. Marlett, Proceedings of Nutrition Society, 62, pp. 2-7-209 (2003); и M. Fischer, Carbohydrate Research, 339, 2009-2012 (2004)), и кроме того, описано в патентах США №№6287609, 7026303, 5126150, 5445831, 7014862, 4766004, 4999200, каждый из которых включен в данное описание для всех релевантных и родственных целей, а также продаваемые содержащие псиллиум агенты, такие как имеющиеся на рынке под наименованием Metamucil (компания The Procter and Gamble). Предпочтительно, содержащая псиллиум лекарственная форма является подходящей для разжевывания, причем жевательное действие разрыхляет таблетку на более мелкие дискретные частицы перед проглатыванием, но претерпевает минимальное гелеобразование в полости рта и имеет приемлемые вкусовые свойства и хороший эстетический вид для восприятия пациентом.
Содержащая псиллиум лекарственная форма включает физически отдельную единицу, подходящую в качестве стандартной лекарственной формы для субъектов людей и других млекопитающих, каждая из которых содержит заранее определенное количество активного вещества (например гелеобразующего полисахарида), рассчитанное так, чтобы вызывать желаемый терапевтический эффект. Твердые пероральные лекарственные формы, которые являются подходящими для настоящих композиций, включают таблетки, пилюли, капсулы, лепешки, жевательные таблетки, троше, крахмальные капсулы, гранулы, облатки и тому подобное.
В некоторых воплощениях FAP представляет собой полисахаридную частицу, где полисахаридный компонент включает ксилозу и арабинозу. Отношение ксилозы к арабинозе может составлять по меньшей мере примерно 3:1 по массе, как описано в патентах США №№6287609, 7026303 и 7014862, каждый из которых включен в данное описание для всех релевантных и родственных целей.
Полимеры, абсорбирующие жидкость, описанные здесь, могут быть использованы в комбинации с NHE-ингибирующим соединением или содержащей его фармацевтической композицией. NHE-ингибирующее соединение и FAP также могут быть введены с другими агентами, включая описанные в разделе под заголовком "Комбинированные терапии", не отходя от объема настоящего изобретения. Как описано здесь, NHE-ингибирующее соединение может быть введено само по себе без использования полимера, абсорбирующего жидкость, для облегчения симптомов, не вызывая значительную диарею или выделение жидкости с фекалиями, что потребовало бы совместного введения полимера, абсорбирующего жидкость.
Полимеры, абсорбирующие жидкость, описанные здесь, могут быть выбраны таким образом, чтобы не индуцировать значительное взаимодействие с NHE-ингибирующим соединением или содержащей его фармацевтической композицией. Как используют здесь, "не вызывать существенное взаимодействие" в общем означает, что совместное введение FAP полимера по существу не изменяет (то есть по существу не уменьшает или по существу не увеличивает) фармакологическое свойство NHE-ингибирующего соединения, введенного отдельно. Например, FAP, содержащие отрицательно заряженные функциональные группы, такие как карбоксилаты, сульфонаты и тому подобное, могут потенциально ионно взаимодействовать с положительно заряженными NHE-ингибирующими соединениями, препятствуя достижению ингибитором своей фармакологической мишени. В дополнение, возможно, что размер и расположение функциональной группы в FAP могут действовать как элемент молекулярного распознавания и блокировать NHE-ингибирующие соединения через взаимодействия "гость-хозяин" посредством распознавания специфических водородных связей и/или гидрофобных областей данного ингибитора. Соответственно, в различных воплощениях по настоящему изобретению FAP полимер может быть выбран для совместного введения или применения с соединением по настоящему изобретению, для обеспечения того, чтобы (1) он не взаимодействовал ионным образом или не связывался с соединением по настоящему изобретению (посредством, например, присутствующей на нем группировки, несущей заряд, противоположный заряду группировки в самом соединении), и/или (2) он не имел заряда и/или структурную конформацию (или размер или расположение), которые дают ему возможность устанавливать взаимодействие "гость-хозяин" с соединением по настоящему изобретению (посредством, например, присутствующей на нем группировки, которая может действовать в качестве элемента молекулярного распознавания, и блокировать NHE-ингибитор или ингибирующую группировку соединения).
D. Дозировка
Следует понимать, что, как используют здесь, "эффективное количество" (или "фармацевтически эффективное количество") раскрытого здесь соединения представляет собой количество, которое приводит к благоприятному клиническому избавлению от состояния, которое лечат, в сравнении с отсутствием лечения. Количество вводимого(ых) соединения или соединений зависит от степени, тяжести и типа заболевания или состояния, продолжительности желаемой терапии и характеристик высвобождения фармацевтического препарата. Оно также зависит от состояния здоровья, массы тела, возраста, пола субъекта и переносимости лекарств. Как правило, соединение вводят в течение периода, достаточного для достижения желаемого терапевтического эффекта.
В воплощениях, где и NHE-ингибитор соединения, и полимер, абсорбирующий жидкость, используют в лечебном протоколе, NHE-ингибирующее соединение и FAP могут быть введены вместе или в "двойной схеме", когда два терапевтических средства дозируют и вводят по отдельности. Когда NHE-ингибирующее соединение и полимер, абсорбирующий жидкость, дозируют по отдельности, типичная дозировка, вводимая нуждающемуся в NHE-ингибирующем соединении субъекту, обычно составляет от примерно 5 мг в сутки до примерно 5000 мг в сутки и, в других воплощениях, от примерно 50 мг в сутки до примерно 1000 мг в сутки. Такие дозировки могут вызывать экскрецию натрия (и его сопутствующих анионов) с фекалиями, от примерно 10 ммоль вплоть до примерно 250 ммоль в сутки, от примерно 20 ммоль до примерно 70 ммоль в сутки или даже от примерно 30 ммоль до примерно 60 ммоль в сутки.
Типичная доза полимера, абсорбирующего жидкость, зависит от степени фекальной секреции, вызываемой неабсорбируемым NHE-ингибирующим соединением. Типичная доза корректируется в соответствии с частотой движений кишечника и консистенции стула. Более конкретно, доза корректируется так, чтобы избежать жидкого стула и сохранить консистенцию стула "мягкой" или полуоформленной, или оформленной. Для достижения желаемой конститенции стула и обеспечения пациентам осовобождения от дискомфорта в животе типичные интервалы дозировок полимера, абсорбирующего жидкость, который вводят в комбинации с NHE-ингибирующим соединением, составляют от примерно 2 г до примерно 50 г в сутки, от примерно 5 г до примерно 25 г в сутки или даже от примерно 10 г до примерно 20 г в сутки. Когда NHE-ингибирующее соединение и FAP вводят по схеме отдельного дозирования, суточный прием может составлять от примерно 2 г до примерно 50 г в сутки, от примерно 5 г до примерно 25 г в сутки или от примерно 10 г до примерно 20 г в сутки, при массовом соотношении NHE-ингибирующего соединения и абсорбирующего жидкость полимера от примерно 1:1000 до 1:10 или даже от примерно 1:500 до 1:5 или от примерно 1:100 до 1:5.
Типичная дозировка по существу не проникающего или по существу не являющегося системно биодоступным NHE-ингибирующего соединения, когда его используют отдельно без FAP, может составлять от примерно 0,2 мг в сутки до примерно 2 г в сутки, или от примерно 1 мг до примерно 1 г в сутки, или от примерно 5 мг до примерно 500 мг, или от примерно 10 мг до примерно 250 мг в сутки, которое вводят субъекту, нуждающемуся в лечении.
Частота введения описанных здесь терапевтических средств может варьировать от одного раза в сутки (QD) до двух раз в сутки (BID) или трех раз в сутки (TID) и так далее. Точная частота введения варьирует в зависимости от, например, состояния пациента, дозировки и так далее. Например, в случае введения по двойной схеме, NHE-ингибирующее соединение можно принимать один раз в сутки, в то время как полимер, абсорбирующий жидкость, можно принимать с каждым приемом пищи (TID). Кроме того, как раскрыто в заявке на патент США 61/584753, поданной 9 января 2012 года, NHE-ингибирующее соединение вводят два раза в сутки (BID) или три раза в сутки (TID), и в более конкретном воплощении, NHE-ингибирующее соединение вводят в количестве в интервале от 2-200 мг на дозу BID или 2-100 мг на дозу TID. В более конкретных воплощениях NHE-ингибирующее соединение вводят в количестве от примерно 15 мг на дозу, примерно 30 на дозу или примерно 45 мг на дозу, и в более конкретном воплощении, в количестве 15 мг на дозу, 30 мг на дозу или 45 мг на дозу.
Е. Пути введения
По существу не проникающие или по существу не являющиеся системно биодоступными NHE-ингибирующие соединения по настоящему изобретению с полимером, абсорбирующим жидкость, или без него, как описано здесь, могут быть введены любым подходящим путем. Соединение предпочтительно вводят перорально (например с пищей) в капсулах, суспензиях, таблетках, пилюлях, драже, жидкостях, гелях, сиропах, взвесях и тому подобное. Способы инкапсулирования композиций (таких как в покрытиях из твердого желатина или циклодекстрана) известны в данной области техники (Baker, et al., "Controlled Release of Biological Active Agents", John Wiley и Sons, 1986). Соединения могут быть введены субъекту в сочетании с приемлемым фармацевтическим носителем как части фармацевтической композиции. Изготовление фармацевтической композиции зависит от пути выбранного введения. Подходящие фармацевтические носители могут содержать инертные ингредиенты, которые не взаимодействуют с соединением. Носители являются биосовместимыми, то есть нетоксичными, невоспалительными, неиммуногенными и избегают других нежелательных реакций в месте введения. Примеры фармацевтически приемлемых носителей включают, например, солевой раствор, имеющиеся в продаже инертные гели или жидкости, дополненные альбумином, метил целлюлозу или коллагеновый матрикс.Могут быть использованы стандартные методики изготовления фармацевтических композиций, такие как описано в Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa.
Фармацевтические композиции для перорального применения могут быть получены путем объединения соединения по настоящему изобретению с твердым эксципиентом, возможно измельчения полученной смеси и обработки для получения смеси гранул, после добавления подходящих вспомогательных веществ, при необходимости, с получением таблеток или ядер драже. Подходящие эксципиенты представляют собой, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, манит или сорбит; целлюлозные препараты, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). При необходимости могут быть добавлены разрыхлители, такие как поперечно-сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия.
Ядра драже покрывают подходящими оболочками. Для этой цели могут быть использованы концентрированные растворы Сахаров, которые могут возможно содержать аравийскую камедь, тальк, поливинилпирролидон, гель карбомера, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к таблеткам или покрытиям драже для идентификации или для отметки различных комбинаций доз активного соединения.
Фармацевтические препараты, которые могут быть использованы перорально, включают твердые капсулы, изготовленные из подходящего материала, такого как желатин, а также мягкие герметично закрытые капсулы, изготовленные из подходящего материала, например, желатина, и пластификатора, такого как глицерин или сорбит. Твердые капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими веществами, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий вазелин или жидкие полиэтиленгликоли. В дополнение, могут быть добавлены стабилизаторы. Все препараты для перорального введения должны быть в дозировках, подходящих для такого введения.
Следует понимать, что некоторые соединения по изобретению могут быть получены в виде различных стереоизомеров (например диастереомеров и энантиомеров) или в виде изотопов и что описание включает все изомерные формы, рацемические смеси и изотопы раскрытых соединений и способ лечения субъекта чистыми изомерами и их смесями, включая рацемические смеси, а также изотопы. Стереоизомеры могут быть выделены и разделены с использованием любого подходящего способа, такого как хроматография.
F. Замедленное высвобождение
NHE белки проявляют значительное разнообразие в картинах их экспрессии в тканях, локализации в мембранах и функциональных ролях (см., например, Sodium-hydrogen exchanger - From molecule To Its Role In Disease, Karmazyn, M., Avkiran, M., and Fliegel, L., eds., Kluwer Academics (2003)).
Было описано девять различных NHE генов (от NHE-1 до NHE-9) у млекопитающих. Из этих девяти пять (от NHE-1 до NHE-5) активны преимущественно в плазматической мембране, в то время как NHE-6, -7 и -9 находятся преимущественно во внутриклеточных компартментах.
NHE-1 экспрессируется повсеместно и главным образом ответственен за восстановление равновесного состояния внутриклеточного рН после цитозольного закисления и за поддержание клеточного объема. Последние обнаружения показывают, что NHE-1 является ключевым для функционирования органов и выживания (например, мыши с выключенным геном NHE-1 проявляют аномальную двигательную активность, подобные эпилептическим судороги и значительную летальность до отнятия от груди).
В противоположность NHE-1, экспрессируемому на базолатеральной части нефронов и эпителиальных клетках кишечника, NHE-2-4 преимущественно экспрессируются на апикальной части эпителия почек и желудочно-кишечного тракта. Некоторые данные свидетельствуют о том, что NHE-3 делает основной вклад в реабсорбцию почечного потока Na+ и жидкости проксимальными канальцами. Ассоциированная секреция Н+ посредством NHE-3 в просвет почечных канальцев также существенна на примерно 2/3 от почечной реабсорбции НСО3-. Полное нарушение функции NHE-3 у мышей вызывают резкое снижение реабсорбции НСО3-, Na+ и жидкости в почках, что соответственно ассоциировано с гиповолемией и ацидозом.
В одном воплощении соединения по изобретению предназначены для нацеливания на апикальные NHE антипортеры (например NHE-3, NHE-2 и NHE-8) в отсутствие значительного проникновения через слой эпителиальных клеток кишечника и/или в отсутствие значительной активности в отношении NHE, которые не находятся преимущественно в ЖК-тракте. В данном изобретении предлагается способ селективного ингибирования апикальных NHE антипортеров ЖК-тракта и обеспечивается желаемый эффект ингибирования всасывания соли и жидкости для корректировки аномального гомеостаза жидкости, приводящего к состояниям запора. Благодаря отсутствию их системного действия, указанные соединения не препятствуют другим ключевым физиологическим ролям NHE, описанным выше. Например, соединения по изобретению, как ожидают, предназначены для лечения запора у нуждающихся в этом пациентов, не вызывая нежелательные системные эффекты, такие как, например, истощение соли или потеря бикарбоната, приводящие к гипонатриемии и ацидозу среди других расстройств.
В еще одном воплощении соединения по изобретению доставляются в тонкий кишечник при незначительном взаимодействии или без взаимодействия с верхними отделами ЖК-тракта, такими как желудочный отдел и двенадцатиперстная кишка. Авторы изобретения обнаружили, что раннее высвобождение соединений в желудке или двенадцатиперстной кишке может оказывать нежелательное воздействие на желудочную секрецию или секрецию бикарбоната (также называемое «сбросом бикарбоната»). В данном воплощении соединения разработаны таким образом, чтобы высвобождаться в активной форме после прохождения двенадцатиперстной кишки. Это можно дополнить либо подходом с использованием пролекарств, либо использованием специфических систем доставки лекарственных средств.
Термин "пролекарство", как он использован здесь, следует понимать со ссылкой на модифицированную форму описанных здесь соединений, которая неактивна (или значительно менее активна) в верхних отделах ЖК-тракта, но после введения метаболизируется in vivo в активный метаболит после прохождения, например, двенадцатиперстной кишки. Так, в подходе использования пролекарств, активность NHE-ингибирующего соединения может быть замаскирована с помощью временной защитной группы, которая высвобождается после прохождения соединения через желаемый отдел желудка. Например, ацилирование или алкилирование существенной гуанидильной функциональной группы NHE-ингибирующего соединения сохранит его биохимически неактивным; однако, отщепление этих функциональных групп кишечными амидазами, энтеразами, фосфатазами и другими, а также ферментами, присутствующими в кишечной флоре, высвобождает активное исходное соединение. Пролекарства могут быть разработаны с использованием относительной экспрессии и локализации таких метаболических ферментов фазы I посредством тщательной оптимизации структуры пролекарства для распознавания специфических ферментов. В качестве примера, противовоспалительный агент сульфасалазин превращается в 5-аминосалицилат в толстой кишке посредством восстановления диазо связи с помощью бактерий кишечника.
В подходе доставки лекарств NHE-ингибирующие соединения по изобретению изготавливают в определенных фармацевтических композициях для перорального введения, которые высвобождают активное вещество в целевых областях ЖК-тракта, а именно в тощей, подвздошной или толстой кишке, или предпочтительно, дистальных отделах подвздошной кишки и в толстой кишке, или еще более предпочтительно, толстой кишке.
Могут быть использованы способы, известные специалистам в данной области техники (см., например, Kumar, Р. и Mishra, В., Colon Targeted Drug Delivery Systems - The Overview, Curr. Drug Deliv., 2008, 5 (3), 186-198; Jain, S.K. and Jain, Α., Target-specific Drug Release to Colon., Expert Opin. Drug Deliv., 2008, 5 (5), 483-498; Yang, L, Biorelevant Dissolution Testing of Colon-Specific Delivery Systems Activated by Colonic Microflora, J. Control Release, 2008, 125 (2), 77-86; Siepmann, F.; Siepmann, J.; Walther, M.; MacRae, R. J.; и Bodmeier, R., Polymer Blends for Controlled Release Coatings, J. Control Release 2008, 125 (1), 1-15; Patel, M.; Shah, T.; and Amin, Α., Therapeutic Opportunities in Colon-Specific Drug-Delivery Systems, Crit. Rev. Ther. Drug Carrier Syst, 2007, 24 (2), 147-202; Jain, Α.; Gupta, Y.; Jain, S. K., Perspectives of Biodegradable Natural Polysaccharides for Site-specific Drug Delivery to Colon., J. Pharm. Sci., 2007, 10 (1), 86-128; Van den, M. G., Colon Drug Delivery, Expert Opin. Drug Deliv., 2006, 3 (1), 111-125; Basit, A. W., Advances in Colonic Drug Delivery, Drugs 2005, 65 (14), 1991-2007; Chourasia, M.K.; Jain, S.K., Polysaccharides for Colon-Targeted Drug Delivery, Drug Deliv. 2004, 11 (2), 129-148; Shareef, Μ.Α.; Khar, R.K.; Ahuja, Α.; Ahmad, F.J.; and Raghava, S., Colonic Drug Delivery: The Updated Review, AAPS Pharm. Sci. 2003, 5 (2), E17; Chourasia, M.K.; Jain, S.K., Pharmaceutical Approaches to Colon Targeted Drug Delivery Systems, J. Pharm. Sci. 2003, 6 (1), 33-66; и Sinha, V.R.; Kumria, R., Colonic Drug Delivery: Prodrug Approach, Pharm. Res. 2001, 18 (5), 557-564. Типичный активный фармацевтический ингредиент (API) содержится в таблетке/капсуле, разработанной для высвобождения указанного API в зависимости от условий окружающей среды (например, рН, ферментативная активность, температура и так далее) или в зависимости от времени. Одним из примеров такого подхода является Eudracol™ (Pharma Polymers Business Line of Degussa's Specialty Acrylics Business Unit), где на API-содержащее ядро таблетки нанесены слои с различными полимерными покрытиями со специфическими профилями растворения. Первый слой обеспечивает прохождение таблетки интактной через желудок, а также чтобы она могла продолжать прохождение через тонкий кишечник. Изменение от кислой среды в желудке до щелочной среды в тонком кишечнике инициирует высвобождение из защитного внешнего слоя. Когда она проходит через толстый кишечник, следующий слой становится проницаемым из-за щелочной среды и кишечного сока. Это дает возможность жидкости проникать во внутренний слой и высвобождать активный ингредиент, который диффундирует из ядра к поверхности, где он может абсорбироваться кишечной стенкой. Другие способы предусматриваются в пределах объема настоящего изобретения.
В другом примере фармацевтические композиции по изобретению могут быть использованы с носителями для лекарства, включая пектин или галактоманнан, представляющие собой полисахариды, которые расщепляются бактериальными ферментами кишечника (см., например, патент США 6413494, полное содержание которого включено в данное описание посредством ссылки для всех подходящих и соответствующих целей). Хотя пектин или галактоманнан, при использовании отдельно в качестве носителей для лекарств, легко растворяются в искусственном желудочном соке и искусственном кишечном соке, смесь этих двух полисахаридов, приготовленная при рН примерно 7 или выше, образует прочный, эластичный и нерастворимый гель, который не растворяется или не разрушается в искусственном желудочном или кишечном соке, тем самым защищая лекарства, покрытые этой смесью, от высвобождения в верхних отделах ЖК-тракта. Когда смесь пектина и галактоманнана попадает в толстую кишку, она быстро разрушается под синергическим действием бактериальных ферментов кишечника. В еще одном аспекте композиции по изобретению могут быть использованы с фармацевтической матрицей из комплекса желатина и анионного полисахарида (например пектината, пектата, альгината, хондроитинсульфата, полигалактуроновой кислоты, трагакантовой камеди, аравийской камеди и их смеси), которая разрушается под действием ферментов кишечника (патент США 6319518).
В других воплощениях полимеры, абсорбирующие жидкость, которые вводят в соответствии со способами лечения по настоящему изобретению, изготавливают с получением препаратов, обеспечивающих приемлемые/благоприятные органолептические свойства, такие как создаваемое во рту ощущение, вкусовые свойства, и/или чтобы избежать преждевременного набухания/гелеобразования в полости рта и в пищеводе и вызывания удушья или обструкции. Препарат может быть разработан таким образом, чтобы обеспечить полную гидратацию и набухание FAP в ЖК-тракте и избежать образование комков. Пероральные лекарственные формы для FAP могут быть разными, включая, например, порошки, грануляты, таблетки, облатки, пластинки и тому подобное, и наиболее предпочтительно доставляются в тонкий кишечник при небольшом взаимодействии или без взаимодействия с верхними отделами ЖК-тракта, такими как желудочный отдел и двенадцатиперстная кишка.
Вышеописанные подходы или способы представляют лишь некоторые из множества описанных способов для избирательной доставки активного вещества в нижние отделы кишечника и поэтому не должны рассматриваться как ограничивающие или лимитирующие объем изобретения.
Следующие неограничивающие примеры представлены в качестве дополнительной иллюстрации настоящего описания изобретения.
ПРИМЕРЫ
Иллюстративный синтез соединений
Промежуточное соединение А
(S)-N-(2-(2-(аминометокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид
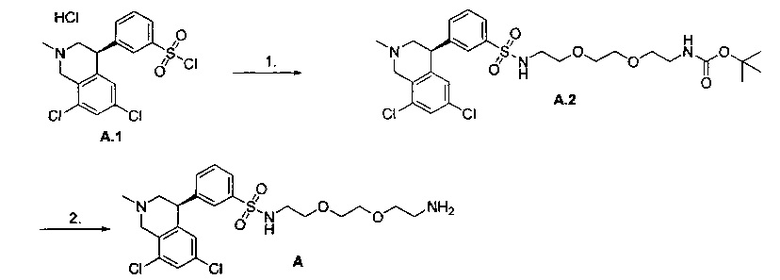
Схема А. 1. трет-бутил-2-(2-(2-аминоэтокси)этокси)этилкарбамат, K3PO4, вода, THF (тетрагидрофуран); 2. водная 25%-ная H2SO4, 2-пропанол
Промежуточное соединение А.2: (S)-трет-бутил-(2-(2-(2-(3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)-этокси)-этил)карбамат. трет-Бутил-(2-(2-(2-аминоэтокси)этокси)этил)карбамат (8,72 г, 35,1 ммоль) растворяли в THF (90 мл). К этому раствору добавляли раствор К3РО4 (37,3 г, 175 ммоль) в воде (90 мл). К этой быстро перемешиваемой смеси добавляли твердый сульфонилхлорид А.1 (смотри международная публикация РСТ № WO 2010/078449) (15,0 г, 35,1 ммоль) порциями приблизительно по 1 г в течение 15 мин. Через 1 ч смесь разбавляли EtOAc (90 мл) и органический слой отделяли. Водный слой промывали EtOAc (10 мл) и органические экстракты объединяли. Раствор концентрировали и очищали посредством флэш-хроматографии на силикагеле, элюируя градиентом от 0% до 10% метанола в DCM (дихлорметан), с получением промежуточного соединения А.2 (18,7 г) в виде вязкого масла. 1Н ЯМР (400 МГц, CDCl3) δ 7.75 (d, J=7,5 Гц, 1H), 7.68 (s, 1Н), 7.44 (t, J=7,7 Гц, 1H), 7.36 (d, J=7,4 Гц, 1H), 7.26-7.21 (m, 1Н), 6.73 (s, 1Н), 5.28 (s, 1Н), 5.08 (s, 1Н), 4.25 (t, J=6,1 Гц, 1H), 3.79-3.44 (m, 10Н), 3.30 (d, J=4,5 Гц, 2H), 3.12 (t, J=4,6 Гц, 2H), 2.93 (dd, J=11,5, 5,2 Гц, 1H), 2.58 (dd, J=11,6, 7,2 Гц, 1H), 2.44 (s, 3Н), 1.42 (s, 9Н). Масса (ИЭР (ионизация электрораспылением)+) 602,10 (М+Н+).
Промежуточное соединение А: (S)-N-(2-(2-(аминометокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид. Промежуточное соединение А.2 (15,2 г, 25,2 ммоль) растворяли в теплом (45°С) 2-пропаноле (80 мл). Этот раствор в течение 1 часа при 45°С добавляли к водной 25%-ной H2SO4. Раствор перемешивали в течение дополнительного часа, затем концентрировали при пониженном давлении для удаления 2-пропанола. Добавляли DCM (150 мл) и величину рН смеси доводили с помощью К3РО4 до рН 7-8, используя лакмусовую (рН) бумагу. DCM слой отделяли и водный слой экстрагировали еще три раза DCM (150 мл). Органический слой сушили и концентрировали при пониженном давлении с получением промежуточного соединения А (12 г) в виде пены. 1Н ЯМР (400 МГц, CDCl3) δ 7.83 (d, J=7,9 Гц, 1Н), 7.77 (s, 1Н), 7.41 (t, J=7,4 Гц, 1Н), 7.31 (d, J=7,4 Гц, 1Н), 7.22 (s, 1Н), 6.72 (s, 1Н), 4.26 (t, J=5,3 Гц, 1Н), 3.79-3.47 (m, 12Н), 3.13 (d, J=32,2 Гц, 4H), 2.93 (dd, J=11,8, 5,1 Гц, 1H), 2.59 (dd, J=10,7, 7,4 Гц, 1H), 2.43 (s, 3Н). Масса (ИЭР+) 502,11 (М+Н+).
Промежуточное соединение В
бис(перфторфенил)-4-нитро-4-(3-оксо-3-(перфторфенокси)пропил)-гептандиоат
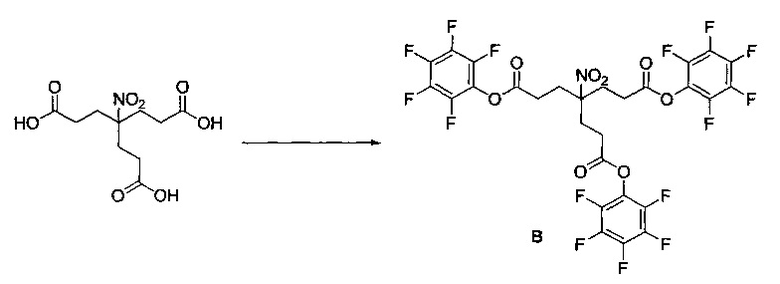
Схема В: перфторфенил-2,2,2-трифторацетат, TEA (триэтиламин), DCM
Промежуточное соединение В: Раствор 4-(2-карбоксиэтил)-4-нитрогептандиовой кислоты (3,00 г, 10,8 ммоль) в DCM (54 мл) загружали в капельную воронку и добавляли по каплям к раствору перфторфенил-2,2,2-трифторацетата (6,15 мл, 35,7 ммоль) и TEA (9,0 мл, 65 ммоль) в DCM (54 мл). После завершения добавления раствор перемешивали в течение дополнительных 20 мин при комнатной температуре, в течение этого времени образовывался белый осадок. Осадок отфильтровывали и промывали смесью 3:7 DCM: гексаны и затем промывали гексанами с получением указанного в заголовке соединения (6,87 г, 82%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CDCl3) δ 2.88-2.71 (m, 6Н), 2.59-2.41 (m, 6Н). 19F-ЯМР (376 МГц, CDCl3) δ - 152.71 (d, J=17,1 Гц), -157.08 (t, J=21,7 Гц), -161.86 (dt, J=21,4, 10,7 Гц).
Промежуточное соединение С
трис(перфторфенил)-2,2',2''-нитрилотриацетат
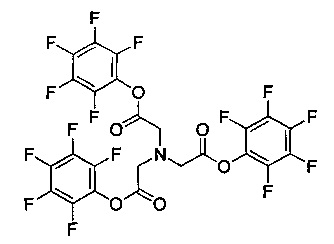
Промежуточное соединение С: указанное в заголовке соединение синтезировали аналогично синтезу бис(перфторфенил)-4-нитро-4-(3-оксо-3-(перфторфенокси)пропил)гептандиоата, используя 2,2',2''-нитрилотриксусную кислоту вместо 4-(2-карбоксиэтил)-4-нитрогептандиовой кислоты.
Промежуточное соединение D
(9Н-Флуорен-9-ил)метил-1,25-бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-13-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)-этокси)этиламино)-3-оксопропил)-10,16-диоксо-3,6,20,23-тетраокса-9,17-диазапентакозан-13-илкарбамат
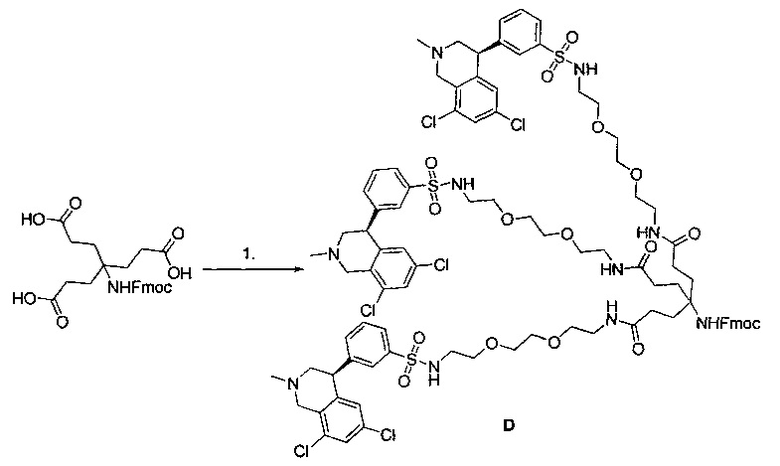
Схема D. 1. Карбонилдиимидазол, THF, затем A, DMF (диметилформамид)
Промежуточное соединение D: 4-(((9Н-флуорен-9-ил)метокси)карбониламино)-4-(2-карбоксиэтил)гептандиовую кислоту (2,07 г, 4,40 ммоль) растворяли в THF (80 мл), затем добавляли карбонилдиимидазол (2,21 г, 13,6 ммоль) и полученную смесь перемешивали в течение 2 ч при комнатной температуре. Тремя порциями в течение периода времени 1,5 часа добавляли дополнительное количество карбонилдиимидазола (357 мг, 2,20 ммоль) до тех пор, пока образец реакционной смеси, погашенный N1,N1-диметилпропан-1,3-диамином, не показывал, что весь исходный материал был потреблен. К смеси затем добавляли раствор А (7,30 г, 14,5 ммоль) в DMF и полученный раствор перемешивали в течение 2 ч при комнатной температуре. Раствор затем вливали в H2O (800 мл) и полученный белый осадок отфильтровывали. Осадок затем растворяли в DCM и промывали 1 М водной HCl и насыщенным водным NaHCO3, затем растворитель удаляли при пониженном давлении с получением D (8,36 г, 99%) в виде светло-желтой пены. 1Н-ЯМР (400 МГц, CDCl3) δ 7.76-7.67 (m, 7Н), 7.57 (t, J=8,1 Гц, 3Н), 7.39 (t, J=7,7 Гц, 3Н), 7.37-7.27 (m, 6Н), 7.26-7.18 (m, 2Н), 6.73-6.63 (m, 5Н), 4.30-4.19 (m, 6Н), 4.05 (t, J=6,7 Гц, 1Н), 3.61 (dd, J=36,9, 16,2 Гц, 6Н), 3.54-3.42 (m, 21Н), 3.37 (dd, J=10,1, 4,9 Гц, 6Н), 3.11-3.01 (m, 6Н), 2.95-2.84 (m, 5Н), 2.55 (dd, J=11,5, 7,2 Гц, 3Н), 2.41 (s, 9Н), 2.28-2.17 (m, 6Н), 2.04-1.93 (m, 6Н). МС (ЭР (электрораспыление), m/z): 1919,3 [М+Н]+.
Промежуточное соединение Е
(S)-N-(2-(2-(2-(2-аминоэтокси)этокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид
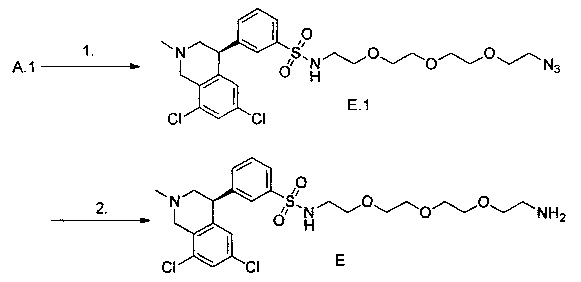
Схема Е. 1. 2-(2-(2-(2-азидоэтокси)этокси)этокси)этанамин, К3РО4, вода, THF (тетрагидрофуран); 2. Ме3Р, THF, вода, NaOH
Промежуточное соединение Е.1: (S)-N-(2-(2-(2-(2-азидоэтокси)этокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидро-изохинолин-4-ил)бензолсульфонамид. 2-(2-(2-(2-Азидоэтокси)этокси)этокси)-этанамин (6,49, 29,7 ммоль) растворяли в THF (90 мл). К этому раствору добавляли раствор K3PO4 (27,5 г, 130 ммоль) в воде (90 мл). К этой быстро перемешиваемой смеси порциями по приблизительно 1 г в течение 15 мин добавляли твердый сульфонилхлорид А.1 (12,1 г, 28,3 ммоль). Через 1 час смесь разбавляли EtOAc (90 мл) и органический слой отделяли. Водный слой промывали EtOAc (10 мл) и органические экстракты объединяли. Раствор концентрировали и очищали посредством флэш-хроматографии на диоксиде кремния, элюируя градиентом от 0% до 10% метанола в DCM с получением промежуточного соединения Е.1 (16 г) в виде вязкого масла. 1Н ЯМР (400 МГц, CDCl3) 7.73 (d, J=7,9 Гц, 1Н), 7.67 (s, 1Н), 7.43 (t, J=7,9 Гц, 1Н), 7.35 (d, J=7,6 Гц, 1Н), 6.72 (s, 1Н), 5.23 (dd, J=6,1, 5,7 Гц, 1Н), 4.23-4.25 (m, 1Н), 3.67-3.47 (комп., 14 Н), 3.37 (t, J=4,9 Гц, 2Н), 3.11 (q, J=10,4, 5,5 Гц, 2Н), 2.93 (dd, J=5,2, 11,6 Гц, 2Н), 2.58 (dd, J=11,7, 7,4 Гц, 1Н), 2.43 (s, 3Н). Масса (ИЭР+) 572,12 (М+Н+)
Промежуточное соединение Е: (S)-N-(2-(2-(2-(2-аминоэтокси)этокси)-этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)-бензолсульфонамид. К раствору Промежуточного соединения Е.1 (13,0 г, 22,7 ммоль) в THF (75 мл) при 10°С добавляли триметилфосфин (3,46 г, 45,4 ммоль), поддерживая внутреннюю температуру ниже 15°С. Раствор перемешивали в течение 1 часа при 10°С, затем нагревали до 20°С в течение 1 часа. К водному раствору добавляли охлажденный на льду NaOH (1 М, 10 ммоль, 10 мл) затем спустя 15 мин смесь концентрировали при пониженном давлении дя удаления THF. Перемешиваемую водную смесь разбавляли DCM (1,5 л) и добавляли воду (100 мл), затем водный 25%-ный раствор NaCl (25 мл). Перемешивание останавливали и смесь разделяли (приблизительно 1 час). Водный слой дважды экстрагировали DCM (200 мл) и объединенные экстракты сушили (MgSO4) и концентрировали при пониженном давлении с получением промежуточного соединения Е (13,5 г) в виде клейкой пены. 1Н ЯМР (400 МГц, CDCl3) δ 7.78-7.71 (m, 1Н), 7.67 (t, J=1,7 Гц, 1Н), 7.42 (t, J=7,7 Гц, 1Н), 7.33 (d, J=7,8 Гц, 1Н), 7.26-7.21 (m, 1Н), 6.73 (s, 1Н), 4.25 (t, J=6,3 Гц, 1Н), 3.76-3.46 (m, 8Н), 3.14-3.08 (m, 2Н), 2.93 (dd, J=11,7, 5,6 Гц, 1Н), 2.84 (t, 2Н), 2.58 (dd, J=11,7, 7,4 Гц, 1Н), 2.44 (s, 3Н). Масса (ИЭР+) 546,12 (М+Н+).
Промежуточное соединение F
Трис(перфторфенил)-3,3',3''-нитрилотрипропаноат
Промежуточное соединение F: указанное в заголовке соединение синтезировали аналогично синтезу бис(регфторфенил)-4-нитро-4-(3-оксо-3-(перфторфенокси)пропил)гептандиоата, используя 3,3',3''-нитрилотри-пропановую кислоту вместо 4-(2-карбоксиэтил)-4-нитрогептандиовой кислоты.
Промежуточное соединение G
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-изоцианатогептандиамид
Схема G: 1. трифосген, триэтиламин, DCM, THF
Промежуточное соединение G: к раствору соединения из примера 2 (120 мг, 0,0706 ммоль) и триэтиламина (49 мкл, 0,35 ммоль) в DCM (2 мл) и THF (2 мл), охлажденному до 0°С, добавляли трифосген (10,5 мг, 0,353 ммоль). Раствор затем оставляли нагреваться до комнатной температуры и перемешивали в течение 30 мин, затем перемешивали еще в течение доплнительно 1 ч при 40°С. Смесь затем разбавляли DCM и промывали насыщенным водным NaHCO3. Органический слой сушили над Na2SO4 и затем растворитель удаляли при пониженном давлении с получением продукта в виде желтого масла, которое использовали непосредственно без дополнительной очистки. МС (ЭР, m/z): 1722,8 [М+Н]+.
Промежуточное соединение Н
(S)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-(2-(2-(2-(метиламино)этокси)этокси)этил)бензолсульфонамид
Схема Н. 1. DCM; 2. 2-нитробензолсульфонилхлорид, TEA, DCM; 3. Mel, K2CO3, DMF; 4. HCl, диоксан, DCM; 5. Промежуточное соединение A.1; 6. тиофенол, K2CO3, DMF
Промежуточное соединение Н.1: трет-бутил-(2-(2-(2-аминоэтокси)этокси)этил)карбамат. К смеси 2,2'-(этилендиокси)бис(этиламина) (153 г, 1,032 моль, 4,5 эквив.) в DCM (250 мл) при 0°С добавляли раствор ди-трет-бутил-дикарбоната (50 г, 0,229 моль, 1 эквив.) в DCM (100 мл) в течение 3,5 ч. Смесь медленно нагревали до КТ, перемешивали при КТ в течение ночи и промывали 25%-ным водным раствором NaCl (3×100 мл) и водой (100 мл). Органический слой экстрагировали 20%-ной водной лимонной кислотой (250 мл). Водный слой промывали DCM (150 мл), подщелачивали до рН 13-14 с помощью водного раствора NaOH (2 М), экстрагировали DCM (3х). Объединенные органические слои сушили и концентрировали с получением 47 г (83%) промежуточного соединения Н.1 в виде прозрачного масла.
Промежуточное соединение Н.2: трет-бутил-(2-(2-(2-(2-нитрофенилсульфонамидо)этокси)этокси)этил)карбамат. К смеси трет-бутил-(2-(2-(2-аминоэтокси)этокси)этил)карбамата (4,0 г, 16,15 ммоль, 1,0 эквив.) и триэтиламина (3,38 мл, 24,22 ммоль, 1,5 эквив.) в DCM (30 мл) при 0°С по каплям добавляли раствор 2-нитробензолсульфонилхлорида (3,76 г, 16,95 ммоль, 1,05 эквив.) в DCM (20 мл). Смесь перемешивали при КТ в течение ночи, разбавляли этилацетатом и промывали 10%-ной лимонной кислотой (1х), Н2О (1х), насыщ. водным NaHCO3 (1х), рассолом (1х). Органический слой сушили и концентрировали с получением 7,34 г промежуточного соединения H.2 в виде желтого сиропа.
Промежуточное соединение Н.3: трет-бутил-(2-(2-(2-(N-метил-2-нитрофенилсульфонамидо)этокси)этокси)этил)карбамат. К смеси трет-бутил-(2-(2-(2-(2-нитрофенилсульфонамидо)этокси)этокси)этил)карбамата (7,34 г, 16,96 ммоль, 1,0 эквив.) в DMF (50 мл) добавляли K2CO3 (3,51 г, 25,44 ммоль, 1,5 эквив.) и йодметан (1,48 мл, 23,74 ммоль, 1,4 эквив.). Смесь перемешивали при КТ в течение 1,5 ч, разбавляли этилацетатом, промывали H2O (2х) и рассолом (1х), сушили и концентрировали с получением 7,58 г промежуточного соединения Н.3 в виде желтого сиропа.
Промежуточное соединение Н.4: N-(2-(2-(2-аминоэтокси)этокси)этил)-N-метил-2-нитробензолсульфонамид. К смеси трет-бутил-(2-(2-(2-(N-метил-2-нитрофенилсульфонамидо)этокси)этокси)этил)карбамата (7,58 г) в DCM (2 мл) добавляли раствор HCl в диоксане (4 М, 40 мл). Смесь перемешивали при КТ в течение 40 минут и концентрировали с получением 7,3 г промежуточного соединения Н.4 в виде HCl соли в виде желтого сиропа.
Промежуточное соединение Н.5: (S)-N-(2-(2-(2-(3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)этокси)этокси)этил)-N-метил-2-нитробензолсульфонамид. К смеси N-(2-(2-(2-аминоэтокси)этокси)этил)-N-метил-2-нитробензолсульфонамида (7,3 г неочищенного, примерно 16,15 ммоль, 1 эквив.) и TEA (11,25 мл, 80,73 ммоль, 5 эквив.) в DCM (80 мл) при 0°С добавляли (8)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензол-1-сульфонилхлорид А.1 (7,24 г, 16,95 ммоль, 1,05 эквив.). Смесь перемешивали при КТ в течение 1 часа, разбавляли этилацетатом, промывали водой (1х) и рассолом (1х), сушили, концентрировали и очищали с помощью колонки с получением 9,84 г (87%, 4 стадии) промежуточного соединения Н.5 в виде желтого твердого вещества.
Промежуточное соединение Н: (S)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-(2-(2-(2-(метиламино)этокси)этокси)этил)-бензолсульфонамид. К смеси (S)-N-(2-(2-(2-(3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)этокси)этокси)этил)-N-метил-2-нитробензолсульфонамида (5,1 г, 7,28 ммоль, 1 эквив.) и K2CO3 (3,01 г, 21,83 ммоль, 3 эквив.) в DMF (30 мл) при КТ добавляли тиофенол (1,12 мл, 10,91 ммоль, 1,5 эквив.). Смесь перемешивали при КТ в течение 1 часа, разбавляли эфиром и экстрагировали 1 н. водной HCl. Водный слой промывали эфиром (2х), подщелачивали NaHCO3 до рН 9 и экстрагировали DCM (3х). Объединенные органические слои сушили, концентрировали и очищали с помощью колонки С-18 с получением 4,03 г (75%) указанного в заголовке соединения в виде TFA соли в виде белого твердого вещества. МС (ЭР, m/z): 516 [М+Н]+. 1Н ЯМР (400 МГц, CD3OD) δ 7.77 (dt, J=7,6, 1,5 Гц, 1Н), 7.70-7.65 (m, 1Н), 7.58-7.47 (m, 2Н), 7.35 (d, J=1,5 Гц, 1Н), 6.80 (d, J=1,2 Гц, 1Н), 4.40 (t, J=6,5 Гц, 1Н), 3.78 (d, J=16,2 Гц, 1Н), 3.70-3.62 (m, 3Н), 3.62-3.58 (m, 2Н), 3.57-3.53 (m, 2Н), 3.51-3.46 (m, 2Н), 3.05-2.99 (m, 3Н), 2.98-2.91 (m, 2Н), 2.67 (dd, J=11,7, 7,8 Гц, 1H), 2.55 (s, 3Н), 2.48 (s, 3Н).
Промежуточное соединение I
(S)-N-(2-(2-(2-аминоэтокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-метилбензолсульфонамид
Схема I. 1. DEAD (диэтилазодикарбоксилат), PPh3, метанол, THF; 2. HCl, диоксан, DCM
Промежуточное соединение I.1: (S)-трет-бутил-(2-(2-(2-(3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-метилфенилсульфонамидо)-этокси)этокси)этил)карбамат. К смеси (S)-трет-бутил-(2-(2-(2-(3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)-этил)-карбамата (352 мг, 0,586 ммоль, 1 эквив.), метанола (47,4 мкл, 1,17 ммоль, 2 эквив.) и PPh3 (307 мг, 1,17 ммоль, 2 эквив.) в THF (2 мл) при 0°С добавляли по каплям раствор диэтилазодикарбоксилата (40% в толуоле, 0,534 мл, 1,17 ммоль, 2 зквив.). Смесь перемешивали при КТ в течение ночи, концентрировали и очищали с помощью колонки с получением 0,9 г (неочищенное) промежуточного соединения 1.1 в виде желтого сиропа.
Промежуточное соединение I: (S)-N-(2-(2-(2-аминоэтокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-метилбензол-сульфонамид. К смеси (S)-трет-бутил-(2-(2-(2-(3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-метилфенилсульфонамидо)этокси)этокси)этил)-карбамата (0,7 г) в DCM (0,5 мл) добавляли раствор HCl в диоксане (4 М, 3 мл). Смесь перемешивали при КТ в течение 0,5 ч, концентрировали и очищали посредством преп. ВЭЖХ с получением 200 мг (59%, 2 стадии) промежуточного соединения I в виде белого твердого вещества. МС (ЭР, m/z): 516 [М+Н]+. 1Н ЯМР (400 МГц, CD3OD) δ 7.87-7.80 (m, 1Н), 7.73-7.64 (m, 2Н), 7.60 (d, J=7,8 Гц, 1Н), 7.55 (d, J=2,0 Гц, 1Н), 6.83 (s, 1Н), 4.84-4.73 (m, 2Н), 4.50 (d, J=16,0 Гц, 1Н), 3.90 (ddd, J=12,2, 5,9, 1,3 Гц, 1Н), 3.75-3.70 (m, 2Н), 3.69-3.62 (m, 6Н), 3.59 (d, J=12,0 Гц, 1Н), 3.21 (dd, J=9,3, 5,2 Гц, 2Н), 3.17-3.08 (m, 5Н), 2.80 (s, 3Н).
Промежуточное соединение J
N1-метил-N3,N3-бис(3-(метиламино)пропил)пропан-1,3-диамин
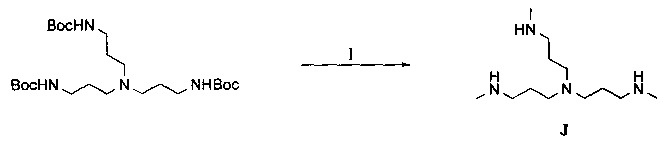
Схема J. 1. LAH (алюмогидрид лития), THF
Промежуточное соединение J: N1-метил-N3,N3-бис(3-(метиламино)-пропил)-пропан-1,3-диамин. К смеси три-трет-бутил(нитрилотрис(пропан-3,1-диил))трикарбамата (689 мг, 1,41 ммоль, 1 эквив.) в THF (8 мл) при 0°С добавляли алюмогидрид лития (2 M в THF, 4,24 мл, 8,48 ммоль, 6 эквив.). Смесь медленно нагревали до 70°С и перемешивали при 70°С в течение 3 ч. Реакционную смесь осторожно гасили Na2SO4.10Н2О и фильтровали. Фильтрат концентрировали с получением 281 мг (87%) промежуточного соединения J в виде прозрачного сиропа. МС (ЭР, m/z): 231 [М+Н]+. 1Н ЯМР (400 МГц, CD3OD) δ 2.57 (t, J=6,8 Гц, 6Н), 2.47-2.34 (m, 15Н), 1.62 (dt, J=14,0, 7,0 Гц, 6Н).
Промежуточное соединение К
(S)-N-(2-(2-(2-аминоэтокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-(2-гидроксиэтил)бензолсульфонамид
Промежуточное соединение К: (S)-N-(2-(2-(2-аминоэтокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-(2-гидроксиэтил)-бензолсульфонамид. Промежуточное соединение К синтезировали аналогично синтезу промежуточного соединения I, используя 2-(трет-бутокси)этанол вместо метанола. МС (ЭР (электораспыление), m/z): 546 [М+Н]+.
Промежуточное соединение L
(S)-N-(2-(2-(2-аминоэтокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-этилбензолсульфонамид
Промежуточное соединение L: (S)-N-(2-(2-(2-аминоэтокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-N-этилбензолсульфон-амид. Промежуточное соединение L синтезировали аналогично синтезу промежуточного соединения I, используя этанол вместо метанола. МС (ЭР, m/z): 530 [М+Н]+.
Промежуточное соединение М
3-амино-N,N-бис(3-аминопропил)-N-метилпропан-1-аминий
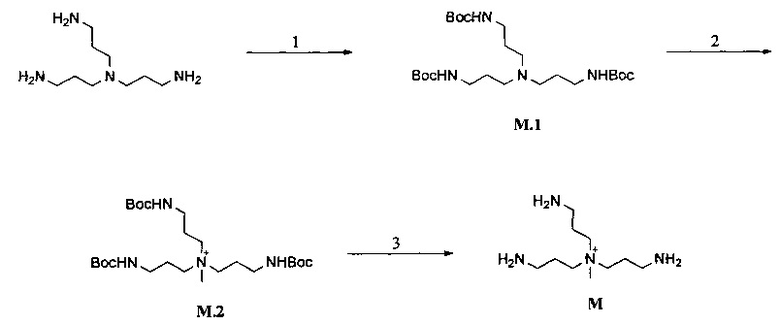
Схема М. 1. (Вос)2O, TEA, DCM; 2. Mel, CH3CN; 3. HCl, диоксан, DCM
Промежуточное соединение М.1: три-трет-бутил(нитрилотрис(пропан-3,1-диил))трикарбамат. К смеси N1,N1-бис(3-аминопропил)пропан-1,3-диамина (499 мг, 2,65 ммоль, 1 эквив.) в DCM (10 мл) при 0°С добавляли ди-трет-бутил-дикарбонат (2,08 г, 9,54 моль, 3,6 эквив.) и TEA (1,66 мл, 11,92 ммоль, 4,5 эквив.). Смесь медленно нагревали до КТ, перемешивали при КТ в течение ночи, разбавляли этилацетатом, промывали водой (1х) и рассолом (1х), сушили и концентрировали с получением 1,4 г (неочищенное) промежуточного соединения М.1.
Промежуточное соединение М.2: 3-((трет-бутоксикарбонил)амино)-N,N-бис(3-((трет-бутоксикарбонил)амино)пропил)-N-метилпропан-1-аминий. К смеси три-трет-бутил(нитрилотрис(пропан-3,1-диил))трикарбамата (258,2 мг, 0,529 ммоль, 1 эквив.) в ацетонитриле (5 мл) при КТ добавляли йодметан (39,6 мкл, 0,635 моль, 1,2 эквив.). Смесь перемешивали при КТ в течение ночи и концентрировали с получением 286 мг (86%) промежуточного соединения М.2 в виде прозрачного сиропа.
Промежуточное соединение М: 3-амино-N,N-бис(3-аминопропил)-N-метилпропан-1-аминий. К смеси 3-((трет-бутоксикарбонил)амино)-N,N-бис(3-((трет-бутоксикарбонил)амино)пропил)-N-метилпропан-1-аминия (286 мг) в DCM (0,5 мл) добавляли раствор HCl в диоксане (4 М, 3 мл). Смесь перемешивали при КТ в течение 1 ч и концентрировали с получением 190 мг (неочищенное) промежуточного соединения М в виде желтого твердого вещества. МС (ЭР, m/z): 203 [М]+. 1Н ЯМР (400 МГц, CD3OD) δ 3.62-3.54 (m, 6Н), 3.22 (s, 3Н), 3.11 (t, J=7,4 Гц, 6Н), 2.30-2.19 (m, 6Н).
Промежуточное соединение N
4-ацетил-4-(2-карбоксиэтил)гептандиовая кислота
Схема N. 1. КОН, трет-BuOH; 2. КОН, H2O (смотри Bruson, Н.А.; Riener, T.W. J. Am. Chem. Soc. 1942, 64, 2850-2858.)
Промежуточное соединение N.1. К хорошо перемешанному раствору ацетона (300 мг, 5,15 ммоль) и 30% этанольного КОН (25 мкл) в трет-BuOH (0,30 мл) при 0°С в течение 1 часа добавляли раствор акрилонитрила (0,82 г, 15,5 ммоль) в трет-BuOH (0,40 мл). Реакционную смесь затем хранили при 4°С в течение ночи. Твердое вещество собирали на воронке Бюхнера и промывали водой (2×5 мл). Продукт растворяли в ацетонитриле (10 мл) и DCM (50 мл), сушили (Na2SO4) и концентрировали с получением N.1 (667 мг) в виде не совсем белого твердого вещества.
Промежуточное соединение N: Смесь 4-ацетил-4-(2-цианоэтил)-гептандинитрила (667 мг, 3,1 ммоль) и КОН (840 г, 15 ммоль) в воде (4,8 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали до 50°С и декантировали с нерастворимой смолы. Супернатант подкисляли до рН приблизительно 2-3 с помощью конц. HCl и концентрировали досуха под вакуумом. Полутвердый остаток нагревали при 50°С с ацетоном (20 мл) и смесь фильтровали горячей и концентрировали с получением промежуточного соединения N в виде масла (690 мг), которое кристаллизовали при внесении затравки кристаллами, полученными из небольшой аликвоты в DCM.
Пример 1
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-нитрогептандиамид
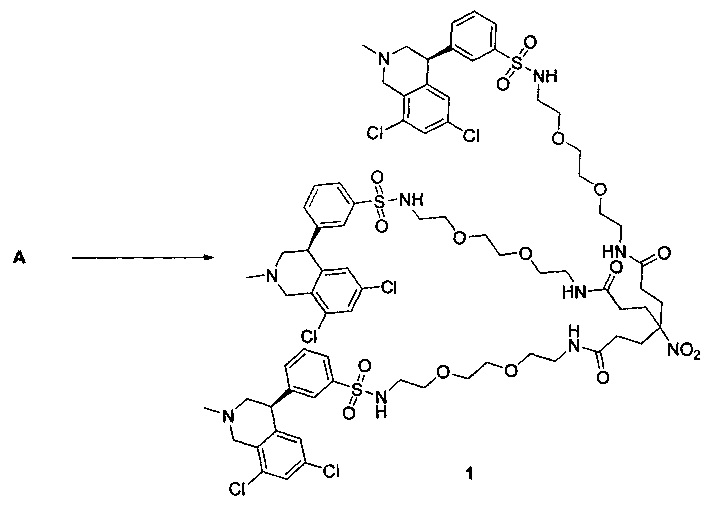
Схема 1. бис(перфторфенил)-4-нитро-4-(3-оксо-3-(перфторфенокси)-пропил)гептандиоат, DIEA, DCM
Пример 1: к раствору А (972 мг, 1,93 ммоль) и DIEA (657 мкл, 3,87 ммоль) в DCM (20 мл) добавляли бис(перфторфенил)-4-нитро-4-(3-оксо-3-(перфторфенокси)пропил)гептандиоат (промежуточное соединение В, 500 мг, 0,645 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 20 ч. Растворитель удаляли при пониженном давлении и полученный остаток очищали с помощью автоматизированной флэш-колоночной хроматографии на силикагеле, используя градиент DCM: МеОН (от 99: 1 до 9: 1), с получением указанного в заголовке соединения в виде желтого твердого вещества (516 мг, 46%) после удаления растворителя. 1Н-ЯМР (400 МГц, CD3OD) δ 7.79-7.75 (m, 3Н), 7.70 (t, J=1,5 Гц, 3Н), 7.53 (t, J=7,6 Гц, 3Н), 7.50-7.45 (m, 3Н), 7.34 (d, J=2,1 Гц, 3Н), 6.80 (s, 3Н), 4.44-4.36 (m, 3Н), 3.77 (d, J=16,1 Гц, 3Н), 3.64 (d, J=15,6 Гц, 3Н), 3.57-3.48 (m, 18Н), 3.45 (t, J=5,5 Гц, 6Н), 3.34 (, J=5,2 Гц, 6Н), 3.07-2.99 (m, 9Н), 2.67 (dd, J=11,7, 7,8 Гц, 3Н), 2.47 (s, 9Н), 2.28-2.16 (m, 12Н). МС (ЭР, m/z): 1727,1 [М+Н]+.
Пример 2
4-амино-N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидро-изо-хинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)этиламино)-3-оксопропил)гептандиамид
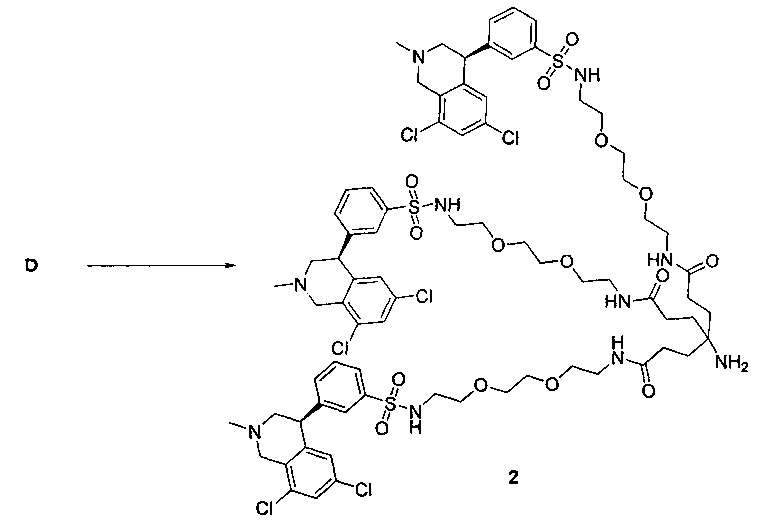
Схема 2а. N1,N1-Бис(2-аминоэтил)этан-1,2-диамин, DMF
Пример 2, способ А: к раствору N1,N1-бис(2-аминоэтил)этан-1,2-диамина (1,21 мл, 8,06 ммоль) в DMF (2 мл) медленно добавляли раствор промежуточного соединения D (7,75 г, 4,03 ммоль) в DMF (10 мл) и полученную смесь перемешивали в течение 30 мин при комнатной температуре. Раствор охлаждали до 0°С и добавляли 1 М водную TFA (20 мл) до тех пор, пока раствор не достигал величины рН, равной 1. Раствор затем разбавляли смесью 1:1 MeCN:H2O с получением конечного объема 60 мл. Раствор очищали с помощью автоматизированной флэш-колоночной хроматографии с обращенной фазой, используя градиент H2O 0,05% TFA: CH3CN 0,05% TFA (от 80:20 до 60:40) и детектирование с помощью ультрафиолета при 254 нм тремя партиями. Фракции, содержащие чистый материал, концентрировали и затем нейтрализовали до величины рН, равной 7, с помощью NaHCO3 с получением белого осадка. Суспензию экстрагировали дважды раствором 95:5 DCM: МеОН. Объединенные органические слои сушили над Na2SO4 и растворитель удаляли с получением указанного в заголовке соединения (3,52 г, 51%-ный выход) в виде белой пены. 1Н-ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=7,9 Гц, 3Н), 7.77 (t, J=1,6 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.58-7.52 (m, 6Н), 6.83 (s, 3Н), 4.81-4.71 (m, 6Н), 4.47 (d, J=15,9 Гц, 3Н), 3.87 (dd, J=12,4, 6,0 Гц, 3Н), 3.64-3.51 (m, 21Н), 3.48 (t, J=5,4 Гц, 6Н), 3.36 (t, J=5,5 Гц, 6Н), 3.13 (s, 9Н), 3.05 (t, J=5,4 Гц, 6Н), 2.44-2.34 (m, 6Н), 1.97 (m, 6Н). МС (ЭР, m/z): 1697,2 [М+Н]+.
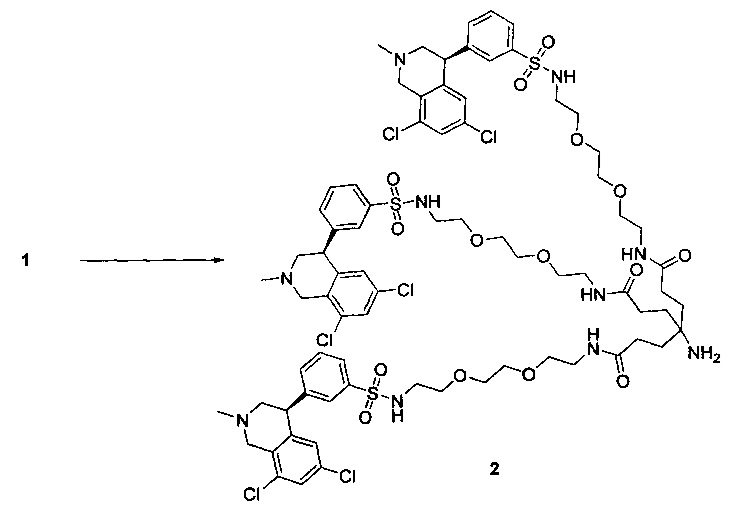
Схема 2b. Н2, никель Рэнея, МеОН
Пример 2, способ В: в сосуд Парра для гидрирования добавляли соединение из примера 1 (926 мг, 0,535 ммоль) в МеОН (40 мл) и Raney® никель (1,0 г), который промывали пять раз H2O до тех пор, пока водный слой не достигал величины рН, равной 7. Сосуд встряхивали в течение 16 ч при комнатной температуре при давлении Н2 50 фунт-сила на кв. дюйм (344,8 кПа). Затем добавляли дополнительный промытый Raney® никель (1,0 г) и суспензию встряхивали в течение 16 ч при при давлении Н2 50 фунт-сила на кв. дюйм (344,8 кПа). Затем добавляли последнюю порцию дополнительного Raney® никеля (2,0 г) и встряхивали в течение 16 ч при при давлении Н2 50 фунт-сила на кв. дюйм (344,8 кПа), после чего анализ посредством ЖХ-МС показал, что весь исходный материал был потреблен. Суспензию фильтровали через набивку Celite® и набивку промывали дважды ЕtOН. К объединенным органическим слоям концентрировали при пониженном давлении и очищали с помощью автоматизированной флэш-колоночной хроматографии с обращенной фазой, используя градиент H2O 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 50:50) и детектировали с помощью ультрафиолета при 254 нм. Растворитель удаляли при пониженном давлении и полученный остаток растворяли в DCM и промывали насыщенным водным NаНСОз. Органическую фазу сушили над Na2SO4 и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (280 мг, 31%).
Пример 3
1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-13,13-бис(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этиламино)-3-оксопропил)-10-оксо-3,6-диокса-9,14-диазагексадекан-16-сульфоновая кислота
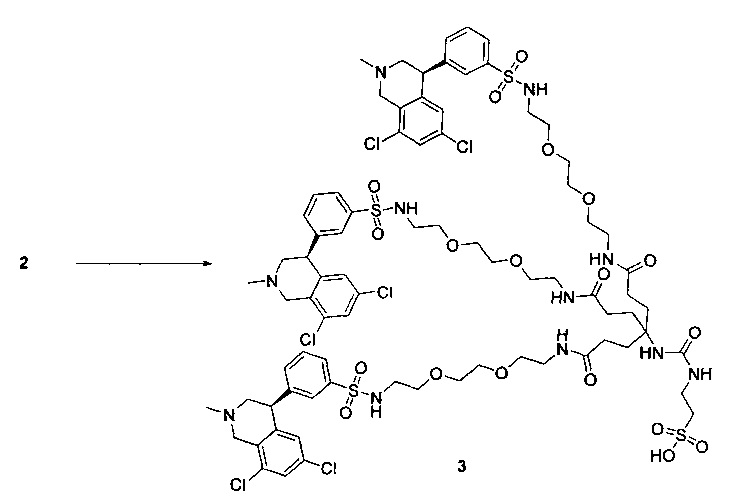
Схема 3. Таурин, DIEA (М,М-диизопропилэтиламин), N,N'-дисукцинимидилкарбонат, Н2О, DMF
Пример 3: таурин (9,2 мг, 0,074 ммоль) растворяли в Н2О (200 мкл), к которой добавляли DIEA (26 мкл, 0,15 ммоль), затем DMF (800 мкл). К полученному раствору добавляли N,N'-дисукцинимидилкарбонат (19 мг, 0,074 ммоль) и раствор перемешивали при 50°С в течение 1. Затем добавляли соединение из Примера 2 (25 мг, 0,015 ммоль) и раствор перемешивали в течение 18 ч при 50°С. Раствор затем разбавляли Н2О и подкисляли TFA, затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент Н2О 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 40:60) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (10 мг, 30%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.91-7.86 (m, 3Н), 7.86-7.82 (m, 3Н), 7.64 (t, J=7,8 Гц, 3Н), 7.58-7.51 (m, 6Н), 6.84 (s, 3Н), 4.83-4.74 (m, 6Н), 4.54 (d, J=15,4 Гц, 3Н), 3.93 (dd, J=12,0, 6,2 Гц, 3Н), 3.66 (t, J=11,9 Гц, 3Н), 3.58-3.49 (m, 18Н), 3.47 (t, J=5,4 Гц, 6Н), 3.44-3.37 (m, 2Н), 3.35-3.32 (m, 6Н), 3.17 (d, J=9,0 Гц, 9Н), 3.06 (t, J=5,3 Гц, 6Н), 2.90 (t, J=6,2 Гц, 2Н), 2.24-2.13 (m, 6Н), 1.92-1.81 (m, 6Н). МС (ЭР, m/z): 1847,9 [М+Н]+.
Пример 4
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-(диметиламино)гептандиамид
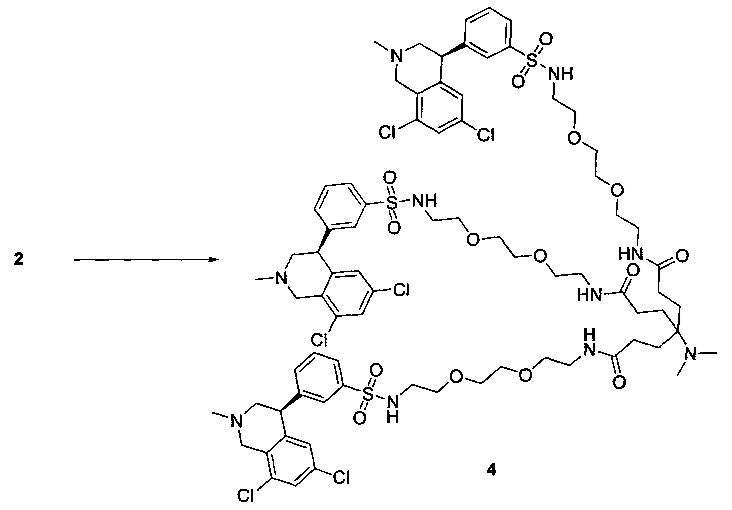
Схема 4. Формальдегид, триацетоксиборогидрид натрия, уксусная кислота, MeCN, Н2О
Пример 4: соединение из Примера 2 (200 мг, 0,118 ммоль) и 33 масс. % водного формальдегида (30 мкл) объединяли в смеси MeCN (2 мл) и H2O (2 мл). Затем добавляли пять капель уксусной кислоты, затем триацетоксиборогидрид натрия (15 мг, 0,24 ммоль) и смесь перемешивали в течение 30 мин при комнатной температуре. Смесь затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент H2O 0,05% TFA: CH3CN 0,05% TFA (от 80:20 до 40:60) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде тетра-TFA соли (146 мг, 57%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=7,9 Гц, 3Н), 7.77 (s, 3Н), 7.66 (t, J=7,8 Гц, 3Н), 7.59-7.51 (m, 6Н), 6.83 (s, 3Н), 4.82-4.74 (m, 6Н), 4.50 (d, J=15,9 Гц, 3Н), 3.90 (dd, J=11,8, 6,3 Гц, 3Н), 3.67-3.51 (m, 21Н), 3.48 (t, J=5,4 Гц, 6Н), 3.37 (t, J=5,4 Гц, 6Н), 3.16 (s, 9Н), 3.05 (t, J=5,4 Гц, 6Н), 2.91 (s, 6Н), 2.50-2.37 (m, 6Н), 2.16-2.06 (m, 6Н). МС (ЭР, m/z): 1725,0 [М+Н]+.
Пример 5
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-(метилсульфонамидо)гептандиамид
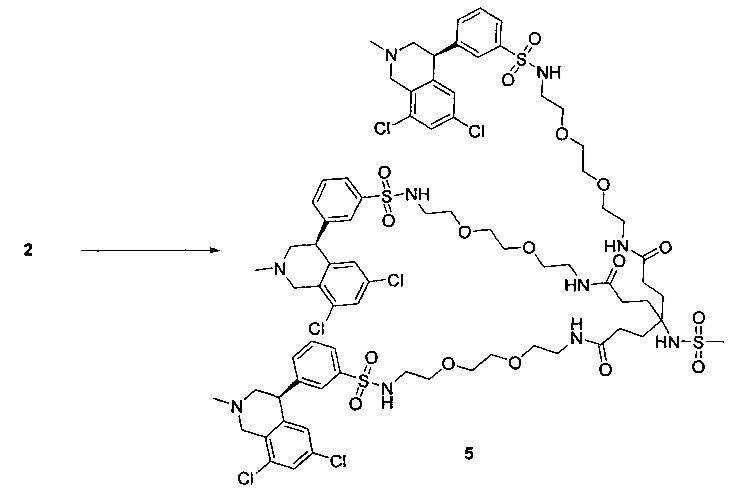
Схема 5. Метансульфоновый ангидрид, DIEA, MeCN
Пример 5: соединение из Примера 2 (47 мг, 0,028 ммоль) и DIEA (14 мкл, 0,83 ммоль) растворяли в MeCN (1 мл). Затем добавляли метансульфоновый ангидрид (6,0 мг, 0,35 ммоль) и раствор перемешивали в течение 1 ч при комнатной температуре и затем перемешивали в течение еще дополнительного 1 ч при 50°С. Раствор затем разбавляли H2O и подкисляли TFA, затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент H2O 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 20:80) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (6,7 мг, 11%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=8,1 Гц, 3Н), 7.78 (s, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.58-7.52 (m, 6Н), 6.84 (s, 3Н), 4.81-4.72 (m, 6Н), 4.51 (d, J=15,6 Гц, 3Н), 3.91 (dd, J=12,0, 6,0 Гц, 3Н), 3.63 (t, J=12,1 Гц, 3Н), 3.58-3.50 (m, 18Н), 3.48 (t, J=5,4 Гц, 6Н), 3.34 (t, J=5,5 Гц, 6Н), 3.17 (s, 9Н), 3.09-3.02 (m, 9Н), 2.34-2.24 (m, 6Н), 1.96-1.86 (m, 6Н). МС (ЭР, m/z): 1775,1 [М+Н]+.
Пример 6
1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)-13,13-бис(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этиламино)-3-оксопропил)-10,15-диоксо-3,6,17-триокса-9,14-диазанонадекан-19-овая кислота
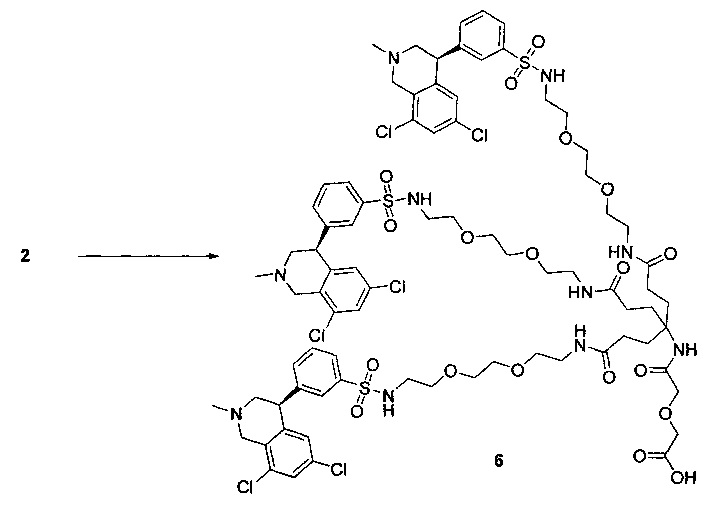
Схема 6. 1,4-диоксан-2,6-дион, DIEA, DMF
Пример 6: соединение из Примера 2 (50 мг, 0,029 ммоль) и DIEA (15 мкл, 0,088 ммоль) растворяли в DMF (1 мл). Затем добавляли 1,4-диоксан-2,6-дион (6,0 мг, 0,038 ммоль) и раствор перемешивали при 40°С в течение 1 ч, затем разбавляли Н2О и подкисляли TFA. Смесь затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент H2O 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 20:80) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (40 мг, 63%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.91-7.86 (m, 3Н), 7.79 (t, J=1,6 Гц, 3Н), 7.64 (t, J=7,8 Гц, 3Н), 7.58-7.52 (m, 6Н), 6.84 (s, 3Н), 4.84-4.75 (m, 6Н), 4.52 (d, J=15,9 Гц, 3Н), 4.17 (s, 2Н), 3.99 (s, 2Н), 3.92 (dd, J=11,1, 6,0 Гц, 3Н), 3.64 (t, J=12,0 Гц, 3Н), 3.58-3.49 (m, 18Н), 3.47 (t, J=5,4 Гц, 6Н), 3.37-3.32 (m, 6Н), 3.17 (s, 9Н), 3.06 (t, J=5,5 Гц, 6Н), 2.26-2.16 (m, 6Н), 2.05-1.96 (m, 6Н). МС (ЭР, m/z): 1813,1 [М+Н]+.
Пример 7
18-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)-6,6-бис(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2.3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этиламино)-3-оксопропил)-4,9-диоксо-13,16-диокса-3,5,10-триазаоктадекан-1-овая кислота
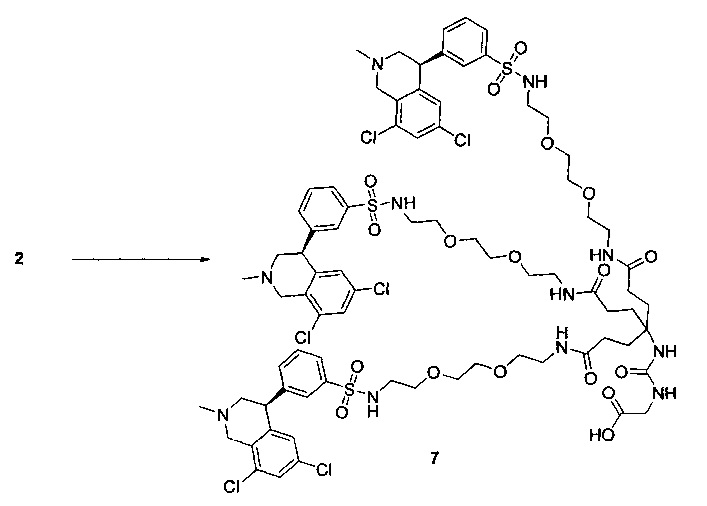
Схема 7. Этил-2-изоцианатоацетат, DIEA, THF; затем LiOH•H2O, H2O
Пример 7: к раствору соединения из примера 2 (150 мг, 0,0882 ммоль) и DIEA (30 мкл, 0,18 ммоль) в THF (3 мл) добавляли этил-2-изоцианатоацетат (20 мкл, 0,18 ммоль) и полученный раствор перемешивали в течение 1,5 ч при комнатной температуре. Затем добавляли H2O (2 мл) и LiOH•H2O (18,5 мг, 0,441 ммоль) и полученную смесь перемешивали в течение 2 ч при комнатной температуре. Смесь разбавляли DCM и промывали H2O, затем органический слой сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Полученный остаток затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент H2O 0,05% TFA: CH3CN 0,05% TFA (от 70:30 до 40:60) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (94 мг, 25%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.92-7.86 (m, 3Н), 7.79 (t, J=1,6 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.58-7.52 (m, 6Н), 6.84 (s, 3Н), 4.80 (dd, J=16,8, 5,4 Гц, 6Н), 4.51 (d, J=16,1 Гц, 3Н), 3.91 (dd, J=12,6, 6,4 Гц, 3Н), 3.77 (s, 2Н), 3.63 (t, J=12,0 Гц, 3Н), 3.58-3.50 (m, 18Н), 3.47 (t, J=5,4 Гц, 6Н), 3.36-3.32 (m, 6Н), 3.17 (s, 9Н), 3.06 (t, J=5,5 Гц, 6Н), 2.25-2.15 (m, 6Н), 1.96-1.85 (m, 6Н). МС (ЭР, m/z): 1798,1 [М+Н]+.
Пример 8
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидро-изохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-уреидогептандиамид
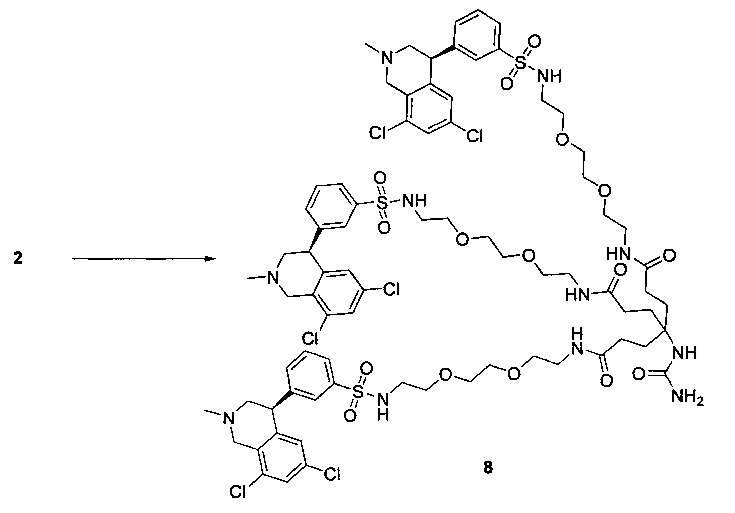
Схема 8. изоцианатотриметилсилан, TEA, DCM
Пример 8: к раствору соединения из примера 2 (50 мг, 0,029 ммоль) и TEA (12 мкл, 0,088 ммоль) в DCM (1 мл) добавляли изоцианатотриметилсилан (5,9 мкл, 0,044 ммоль). Полученный раствор перемешивали в течение 1 ч при комнатной температуре, затем перемешивали в течение дополнительных 16 ч при 40°С. Растворитель затем удаляли при пониженном давлении и неочищенный остаток очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент Н2О 0,5% TFA:CH3CN 0,05% TFA (от 80:20 до 20:80) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (26 мг, 42%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=7,9 Гц, 3Н), 7.79 (t, J=5,7 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.58-7.50 (m, 6Н), 6.84 (s, 3Н), 4.80 (d, J=12,2 Гц, 6Н), 4.51 (d, J=15,6 Гц, 3Н), 3.92 (dd, J=12,2, 5,7 Гц, 3Н), 3.64 (t, J=12,0 Гц, 3Н), 3.58-3.49 (m, 18Н), 3.47 (t, J=5,4 Гц, 6Н), 3.36-3.32 (m, 6Н), 3.17 (d, J=5,5 Гц, 9Н), 3.06 (t, J=5,4 Гц, 6Н), 2.25-2.15 (m, 5Н), 2.03-1.86 (m, 6Н). МС (ЭР, m/z): 1740,1 [М+Н]+.
Пример 9
4-амино-4-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-13-оксо-3,6,9-триокса-12-азапентадекан-15-ил)-N1,N7-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)этокси)этокси)этокси)этил)гептандиамид
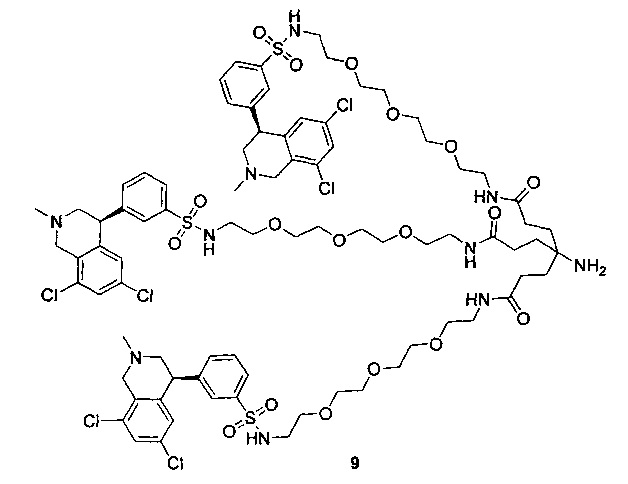
Пример 9: указанное в заголовке соединение синтезировали аналогично синтезу соединения из примера 2 (способ В), используя промежуточное соединение Е вместо промежуточного соединения А. МС (ЭР, m/z): 1829,2 [М+Н]+.
Пример 10
4-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)-13-оксо-3,6,9-триокса-12-азапентадекан-15-ил)-N1,N7-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этокси)этил)-4-пропионамидо-гептандиамид
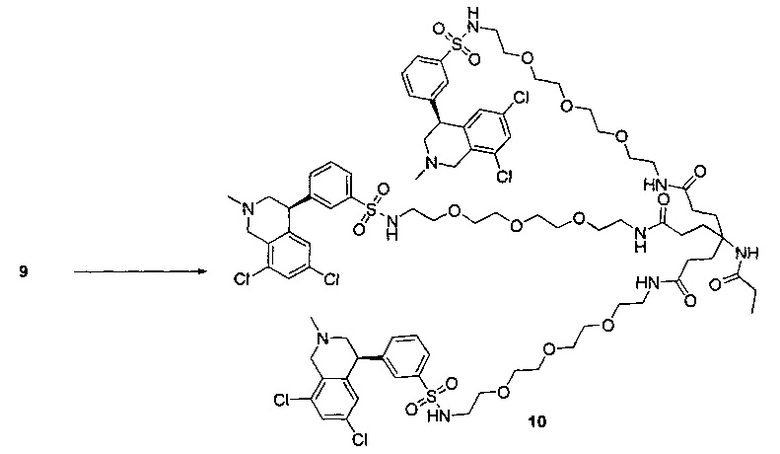
Схема 10. Пропионилхлорид, DIEA, MeCN
Пример 10: соединение из Примера 9 (75 мг, 0,041 ммоль) и DIEA (21 мкл, 0,12 ммоль) растворяли в MeCN (1 мл) и охлаждали до 0°С. К перемешиваемому раствору добавляли пропионилхлорид (4,3 мкл, 0,049 ммоль), затем полученную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 30 мин. Смесь разбавляли Н2О и подкисляли TFA, затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент H2O 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 20:80) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (18 мг, 23%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.90 (d, J=7,9 Гц, 3Н), 7.80-7.75 (m, 3Н), 7.66 (t, J=7,8 Гц, 3Н), 7.59-7.52 (m, 6Н), 6.85 (s, 3Н), 4.82-4.73 (m, 6Н), 4.51 (d, J=16,4 Гц, 3Н), 3.95-3.87 (m, 3Н), 3.69-3.50 (m, 23Н), 3.46 (t, J=5,4 Гц, 6Н), 3.38-3.32 (m, 6Н), 3.17 (s, 9Н), 3.06 (t, J=5,4 Гц, 6Н), 2.20-2.12 (m, 6Н), 2.00-1.90 (m, 6Н), 1.08 (t, J=7,6 Гц, 3Н). МС (ЭР, m/z): 1885,1 [М+Н]+.
Пример 11
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-(3-(1,3-дигидрокси-2-(гидрокси-метил)пропан-2-ил)уреидо)гептандиамид
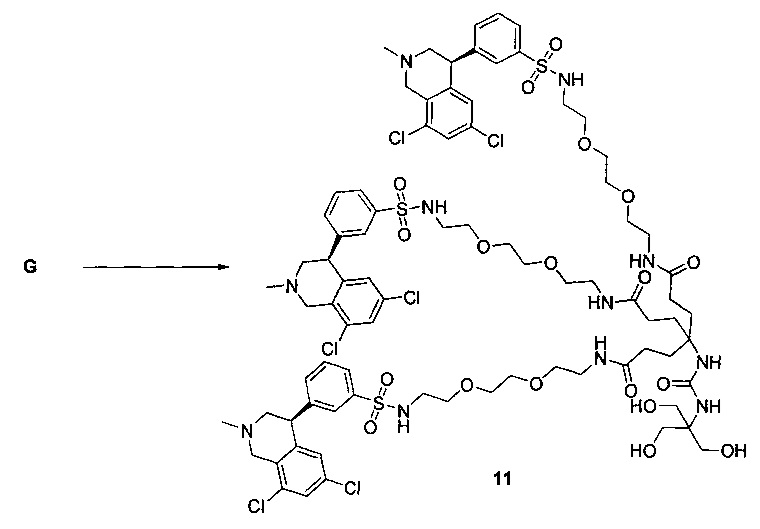
Схема 11. 2-Амино-2-(гидроксиметил)-1,3-пропандиол•HCl, DIEA, DMF
Пример 11: к раствору промежуточного соединения G (51 мг, 0,29 ммоль) и DIEA (25 мкл, 0,15 ммоль), растворенных в DMF (1 мл), добавляли 2-амино-2-(гидроксиметил)-1,3-пропандиол•HCl (9,2 мг, 0,059 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 2 ч, затем разбавляли H2O и подкисляли TFA. Смесь затем очищали посредством препаративной ВЭЖХ С18 силикагелевой стационарной фазой, используя градиент Н2О 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 40:60) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (17 мг, 26%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.92-7.86 (m, 3Н), 7.80-7.76 (m, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.58-7.53 (m, 6Н), 6.84 (s, 3Н), 4.83-4.74 (m, 6Н), 4.52 (d, J=16,1 Гц, 3Н), 3.91 (dd, J=11,5, 6,1 Гц, 3Н), 3.70-3.61 (m, 9Н), 3.61-3.50 (m, 18Н), 3.47 (t, J=5,4 Гц, 6Н), 3.34 (t, J=5,5 Гц, 6Н), 3.17 (s, 9Н), 3.06 (t, J=5,4 Гц, 6Н), 2.20 (dd, J=9,8, 6,4 Гц, 6Н), 1.91 (dd, J=9,8, 6,5 Гц, 6Н). МС (ЭР, m/z): 1844,0 [М+Н]+.
Пример 12
(S)-2-(3-(1,25-бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)фенилсульфонамидо)-13-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)-этиламино)-3-оксопропил)-10,16-диоксо-3,6,20,23-тетраокса-9,17-диазапентакозан-13-ил)уреидо)янтарная кислота
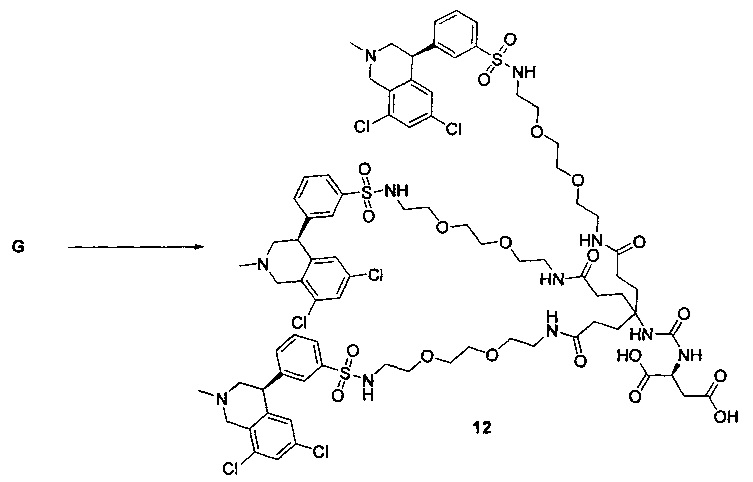
Схема 12. (S)-ди-трет-бутил-2-аминосукцинат, DIEA, MeCN
Пример 12: к раствору промежуточного соединения G (50 мг, 0,029 ммоль) и DIEA (10 мкл, 0,059 ммоль) в MeCN (1 мл) добавляли (S)-ди-трет-бутил-2-аминосукцинат (11 мг, 0,044 ммоль). Полученный раствор перемешивали в течение 18 ч при 40°С, затем разбавляли Н2О, подкисляли TFA и затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент H2O 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 20:80) и детектирование с помощью ультрафиолета при 254 нм. Фракции с чистым материалом объединяли и лиофилизировали. Полученное твердое вещество растворяли в TFA и оставляли при комнатной температуре в течение 30 мин, затем растворитель удаляли под потоком N2. Полученный остаток растворяли в смеси 1:1 MeCN:Н2О и лиофилизировали с получением указанного в заголовке соединения в виде три-TFA соли (13,5 мг, 21%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.92-7.87 (m, 3Н), 7.80 (t, J=1,6 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.59-7.51 (m, 6Н), 6.84 (s, 3Н), 4.80 (d, J=11,4 Гц, 6Н), 4.57-4.44 (m, 4Н), 3.92 (dd, J=12,5, 6,1 Гц, 3Н), 3.65 (d, J=12,1 Гц, 3Н), 3.58-3.49 (m, 18Н), 3.47 (t, J=5,4 Гц, 6Н), 3.36-3.33 (m, 6Н), 3.18 (s, 9Н), 3.06 (t, J=5,6 Гц, 6Н), 2.79 (ddd, J=21,5, 16,7, 5,5 Гц, 2Н), 2.24-2.13 (m, 6Н), 1.93-1.83 (m, 6Н). МС (ЭР, m/z): 1856,1 [М+Н]+.
Пример 13
4-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)-13-оксо-3,6,9-триокса-12-азапентадекан-15-ил)-N1,N7-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этокси)этил)-4-(3-фенилуреидо)-гептандиамид
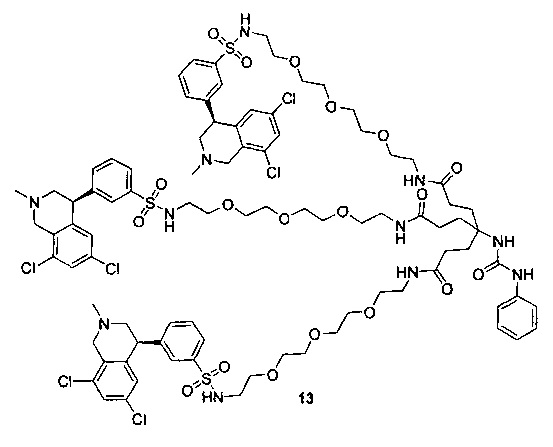
Пример 13: указанное в заголовке соединение синтезировали аналогично соединению из примера 11, используя соединение из примера 9 вместо соединения из примера 2 и фенилизосукцинат вместо изоцианатотриметилсилана. МС (ЭР, m/z): 1948,2 [М+Н]+.
Пример 14
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-(2-(диметиламино)ацетамидо)-гептандиамид
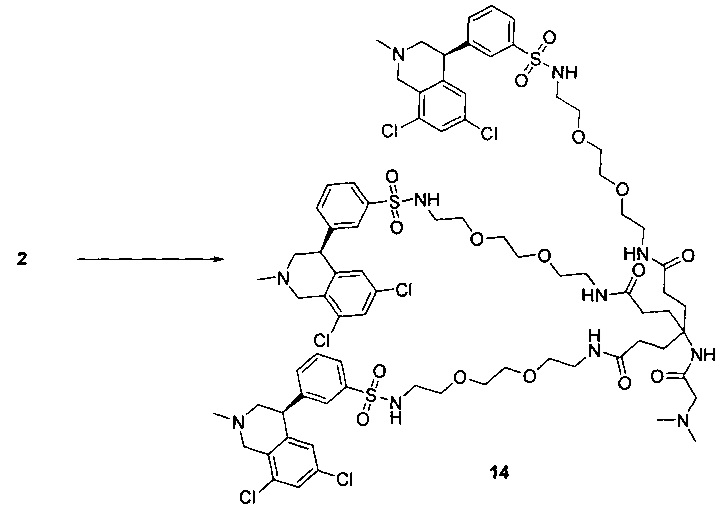
Схема 14. N,N-диметилглицин, HATU (гексафторфосфат 3-оксида 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния), DIEA, DMF
Пример 14: к раствору соединения из примера 2 (100 мг, 0,0588 ммоль), N,N-диметилглицина (9,0 мг, 0,088 ммоль) и DIEA (50 мкл, 0,29 ммоль) в DMF (2 мл) добавляли HATU (27 мг, 0,071 ммоль). Полученную смесь перемешивали в течение 2 ч при комнатной температуре, затем разбавляли Н2О и подкисляли TFA, затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент H2O 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 40:60) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (70 мг, 53%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=7,9 Гц, 3Н), 7.78 (d, J=1,6 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.58-7.52 (m, 6H), 6.83 (s, 3Н), 4.83-4.73 (m, 6H), 4.51 (d, J=15,7 Гц, 3Н), 3.95-3.87 (m, 5H), 3.63 (t, J=12,1 Гц, 3Н), 3.59-3.50 (m, 18H), 3.47 (t, J=5,4 Гц, 6H), 3.35 (t, J=5,5 Гц, 6H), 3.17 (s, 9H), 3.05 (t, J=5,4 Гц, 6H), 2.94 (s, 6H), 2.30-2.15 (m, 6H), 2.07-1.94 (m, 6H). МС (ЭР, m/z): 1782,2 [M+H]+.
Пример 15
4-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)-13-оксо-3,6,9-триокса-12-азапентадекан-15-ил)-N1,N7-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этокси)этил)-4-ундеканамидо-гептандиамид
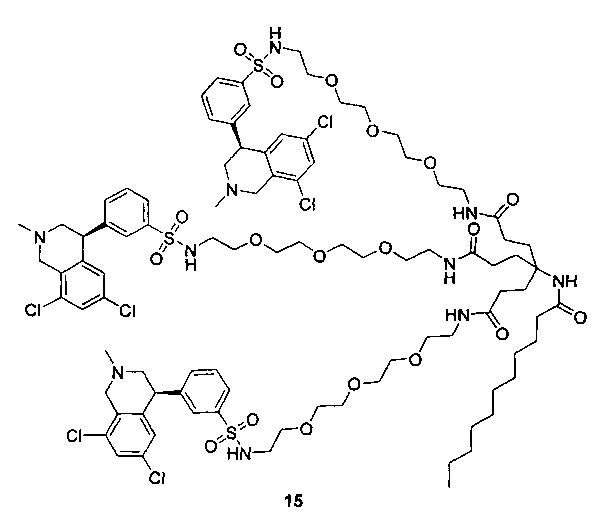
Пример 15: указанное в заголовке соединение синтезировали аналогично соединению из примера 14, используя соединение из примера 9 вместо соединения из примера 2 и ундекановую кислоту вместо N,N-диметилглицина. МС (ЭР, m/z): 1997,2 [М+Н]+.
Пример 16
4-(4'-хлорбифенил-4-илкарбоксамидо)-4-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-13-оксо-3,6,9-триокса-12-азапентадекан-15-ил)-N1,N7-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этокси)-этил)гептандиамид
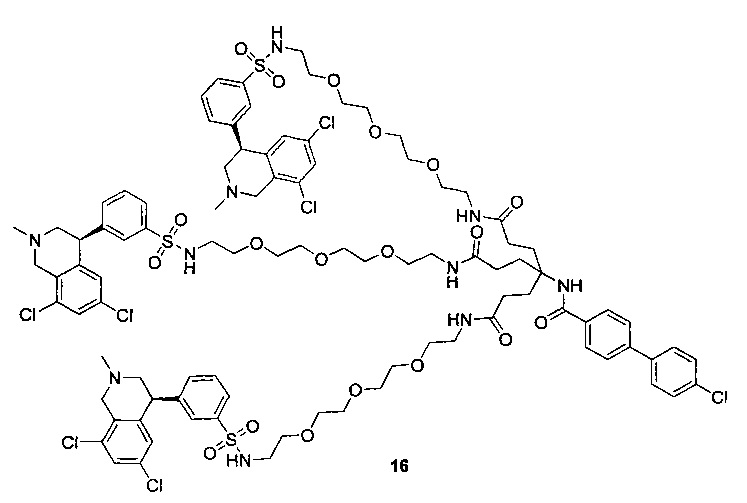
Пример 16: Указанное в заголовке соединение синтезировали аналогично соединению из Примера 14, используя соединение из примера 9 вместо соединения из примера 2 и 4'-хлорбифенил-4-карбоновую кислоту вместо N,N-диметилглицина. МС (ЭР, m/z): 1022,4 [М+2Н]2+.
Пример 17
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)-этиламино)-3-оксопропил)-4-(3-(2-морфолиноэтил)уреидо)-гептандиамид
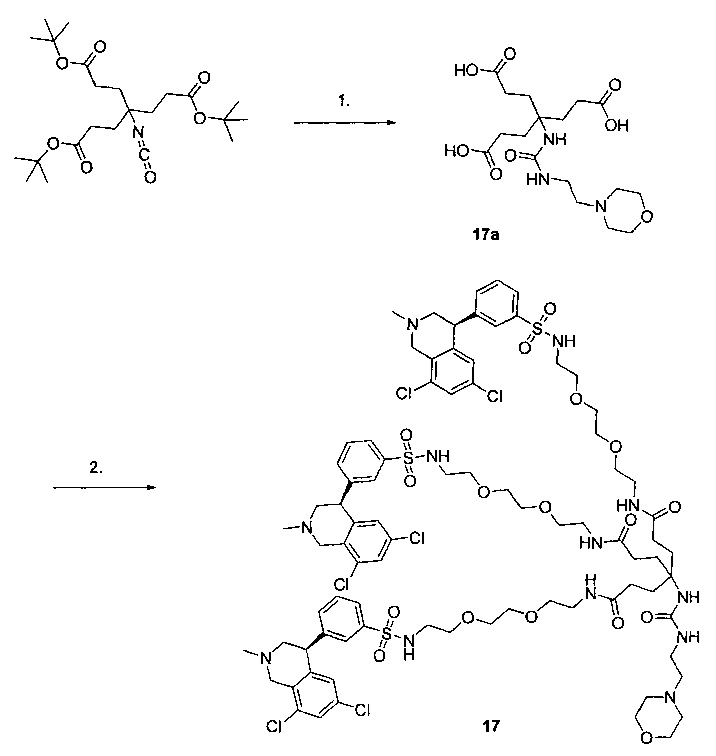
Схема 17. 1. 2-морфолиноэтанамин, THF, затем муравьиная кислота; 2. промежуточное соединение A, HATU, DIEA, DMF
Промежуточное соединение 17а: К перемешиваемому раствору ди-трет-бутил-4-(3-трет-бутокси-3-оксопропил)-4-изоцианатогептандиоата (150 мг, 0,340 ммоль) в THF (2 мл) добавляли 2-морфолиноэтанамин (47 мкл, 0,36 ммоль). Раствор перемешивали при комнатной температуре в течение 2 ч и затем растворитель удаляли при пониженном давлении. Полученный остаток растворяли в муравьиной кислоте и перемешивали при комнатной температуре в течение 16 ч и растворитель затем удаляли при пониженном давлении с получением 4-(2-карбоксиэтил)-4-(3-(2-морфолиноэтил)уреидо)гептандиовой кислоты в виде белого твердого вещества, которое использовали непосредственно без дополнительной очистки.
Пример 17: к перемешиваемому раствору соединения 17а (24 мг, 0,060 ммоль), промежуточного соединения А (100 мг, 0,199 ммоль) и DIEA (102 мкл) в DMF (1 мл) добавляли HATU (82 мг, 0,22 ммоль). Полученную смесь перемешивали в течение 2 ч при комнатной температуре, затем разбавляли Н2О и подкисляли TFA и очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент Н2О 0,05% TFA: CH3CN 0,05% TFA (от 80: 20 до 40: 60) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (63 мг, 45%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.89 (m, 3Н), 7.78 (t, J=1,5 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.60-7.51 (m, 6Н), 6.83 (s, 3Н), 4.82-4.71 (m, 6Н), 4.49 (d, J=15,9 Гц, 3Н), 4.03 (s, 2Н), 3.89 (dd, J=11,6, 6,3 Гц, 3Н), 3.85-3.75 (m, 2Н), 3.69-3.51 (m, 21Н), 3.48 (t, J=5,4 Гц, 6Н), 3.36 (t, J=5,4 Гц, 6Н), 3.25 (d, J=4,6 Гц, 2Н), 3.15 (s, 9Н), 3.05 (I, J=5,4 Гц, 6Н), 2.46-2.35 (m, 2Н), 2.29-2.13 (m, 6Н), 2.05-1.92 (m, 6Н). МС (ЭР, m/z): 1853,1 [М+Н]+.
Пример 18
(S,S)-N,N',N''-(2,2',2''-(2,2',2''-(2,2',2''-(2,2',2''-(4,4',4''-нитрилотрис(метилен)-трис(1Н-1,2,3-триазол-4,1-диил))трис(этан-2,1-диил))трис(окси)трис(этан-2,1-диил))трис(окси)трис(этан-2,1-диил))трис(окси)трис(этан-2,1-диил))трис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид)
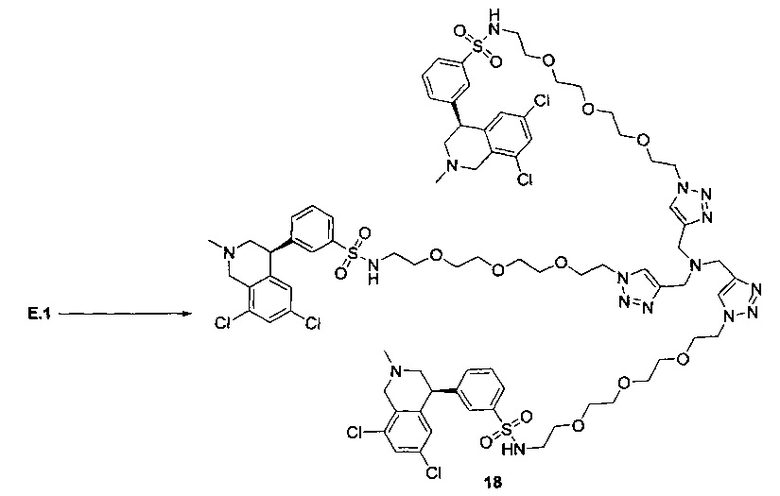
Схема 18. трипроп-2-иниламин, Cul, DMF
Пример 18: к раствору промежуточного соединения Е.1 (70 мг, 0,158 ммоль) и трипроп-2-иниламина (6,3 мг, 0,0478 ммоль) в DMF (1 мл) добавляли Cul (1,4 мг, 0,0072 ммоль) и полученную смесь перемешивали в течение 16 ч при комнатной температуре. Смесь затем разбавляли H2O и подкисляли TFA, затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент Н2О 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 20:80) и детектирование с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (40 мг, 36%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) 6 8.37 (s, 3Н), 7.86 (d, J=8,3 Гц, 3Н), 7.77 (s, 3Н), 7.63 (t, J=7,8 Гц, 3Н), 7.57-7.50 (m, 6Н), 6.82 (s, 3Н), 4.84-4.74 (m, 6Н), 4.66 (t, J=4,9 Гц, 6Н), 4.55-4.44 (m, 8Н), 3.97-3.83 (m, 8Н), 3.71-3.38 (m, 35Н), 3.16 (s, 9Н), 3.01 (t, J=5,4 Гц, 6Н). МС (ЭР, m/z): 1845,2 [М+Н]+.
Пример 19
4-((4'-хлорбифенил-4-ил)метиламино)-4-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-13-оксо-3,6,9-триокса-12-азапентадекан-15-ил)-N1,N7-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этокси)-этил)гептандиамид
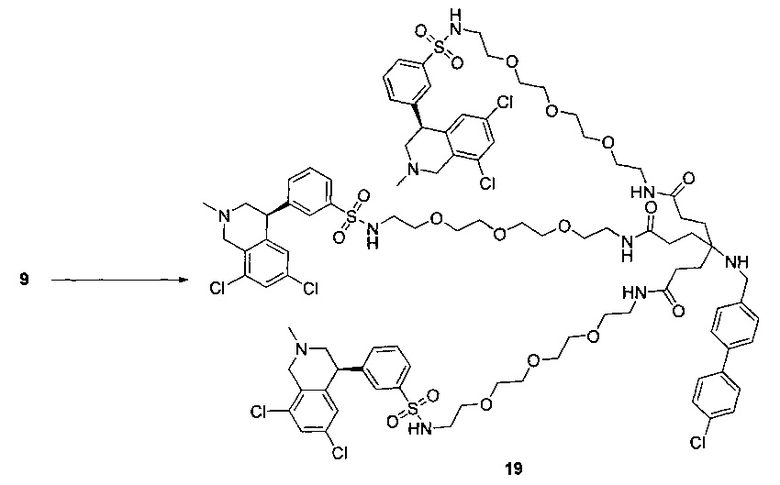
Схема 19. 4'-хлорбифенил-4-карбальдегид, NaBH4, МеОН
Пример 19: раствор соединения из примера 9 (75 мг, 0,041 ммоль) и 4'-хлорбифенил-4-карбальдегида (8,9 мг, 0,041 ммоль) в МеОН (1 мл) перемешивали при комнатной температуре в течение 4 ч. Затем добавляли NaBH4 (2,5 мг, 0,065 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель затем удаляли при пониженном давлении и полученный остаток растворяли в DCM и промывали 1 М водной HCl, насыщенным водным NaHCO3 и рассолом. Органический слой затем сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Остаток затем очищали посредством препаративной ВЭЖХ с С18 силикагелевой стационарной фазой, используя градиент Н2О 0,05% TFA:CH3CN 0,05% TFA (от 80:20 до 20:80) и детектирования с помощью ультрафиолета при 254 нм, с получением указанного в заголовке соединения в виде три-TFA соли (26 мг, 25%-ный выход) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, CD3OD) δ 7.88 (d, J=7,9 Гц, 3Н), 7.77 (s, 3Н), 7.72-7.59 (m, 9Н), 7.59-7.51 (m, 6Н), 7.45 (m, 2Н), 6.81 (s, 3Н), 4.82-4.73 (m, 6Н), 4.49 (d, J=16,2 Гц, 4Н), 4.25 (s, 2Н), 3.89 (dd, J=12,2, 6,0 Гц, 3Н), 3.68-3.48 (m, 33Н), 3.45 (t, J=5,4 Гц, 6Н), 3.40 (t, J=5,4 Гц, 6Н), 3.15 (s, 9Н), 3.05 (t, J=5,4 Гц, 6Н), 2.50 (t, J=7,2 Гц, 6Н), 2.13 (t, J=7,2 Гц, 6Н). МС (ЭР, m/z): 1015,3 [М+2Н]2+.
Пример 20
4-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил-сульфонамидо)-13-оксо-3,6,9-триокса-12-азапентадекан-15-ил)-N1,N7-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенил-сульфонамидо)этокси)этокси)этокси)этил)-4-(4-(октилокси)-бензиламино)-гептандиамид
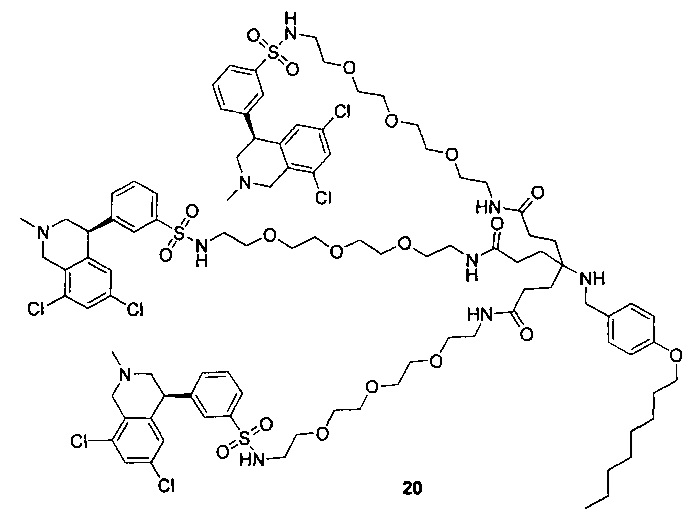
Пример 20: указанное в заголовке соединение синтезировали аналогично соединению из примера 19, с 4-(октилокси)бензальдегидом вместо 4'-хлорбифенил-4-карбальдегида. МС (ЭР, m/z): 1024,5 [М+2Н]2+.
Примеры 22-41
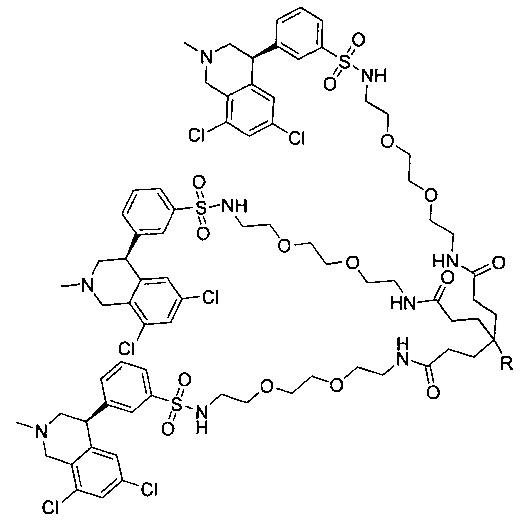
Соединения из следующих примеров синтезировали, используя способы, аналогичные предшествующим примерам, указанным в Таблице 2 ниже.
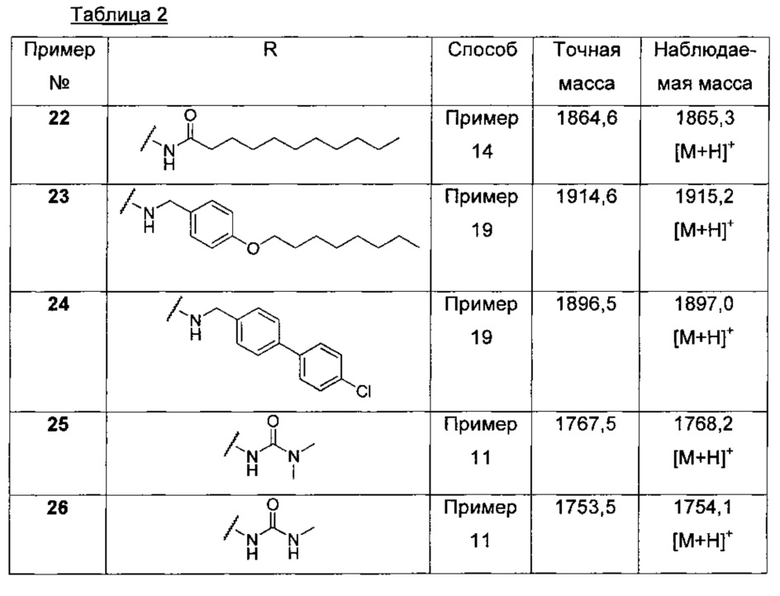
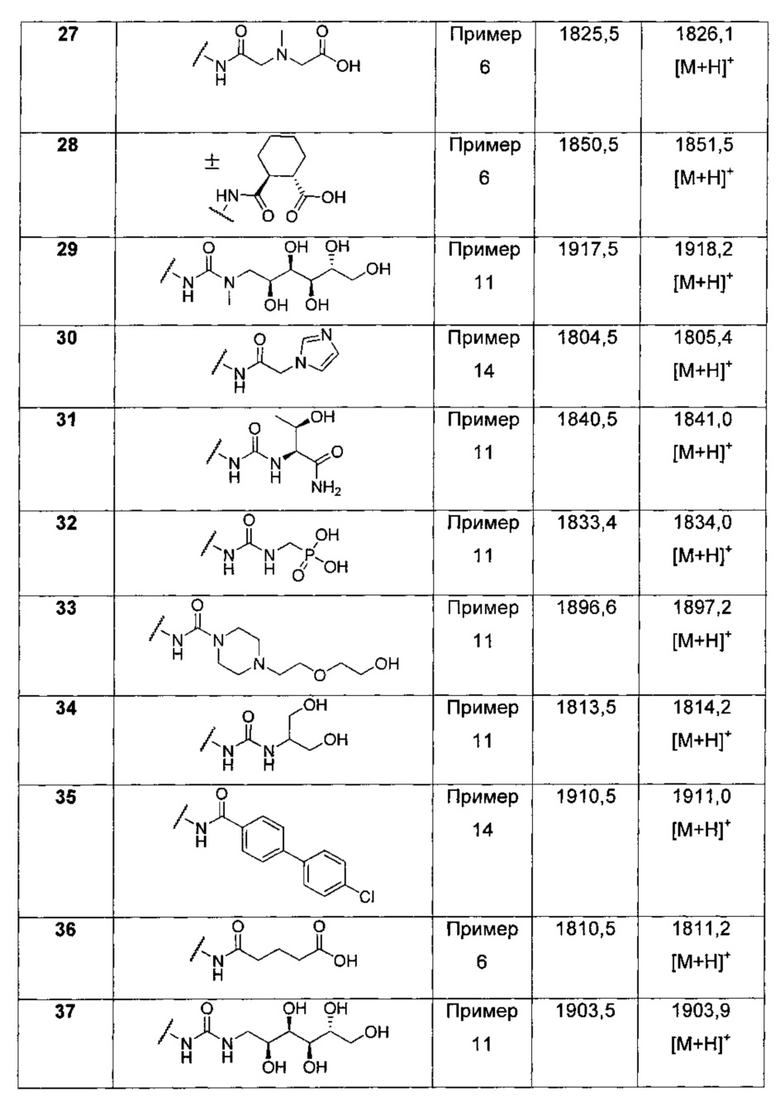
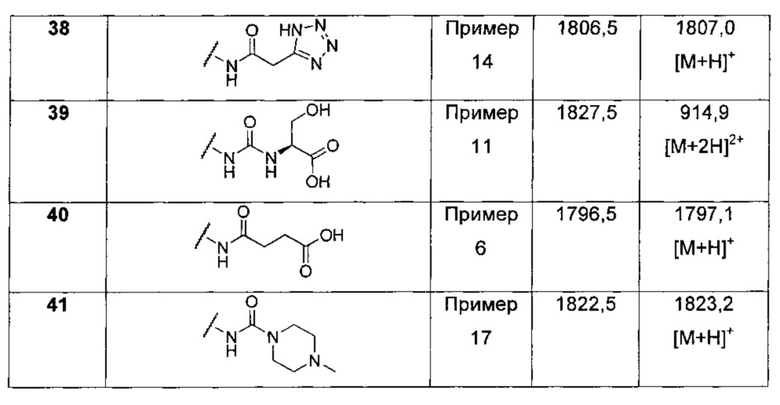
Пример 42
3,12-бис(14-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-2-оксо-6,9,12-триокса-3-азатетрадецил)-N1,N14-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этокси)этил)-6,9-диокса-3,12-диазатетрадекан-1,14-диамид
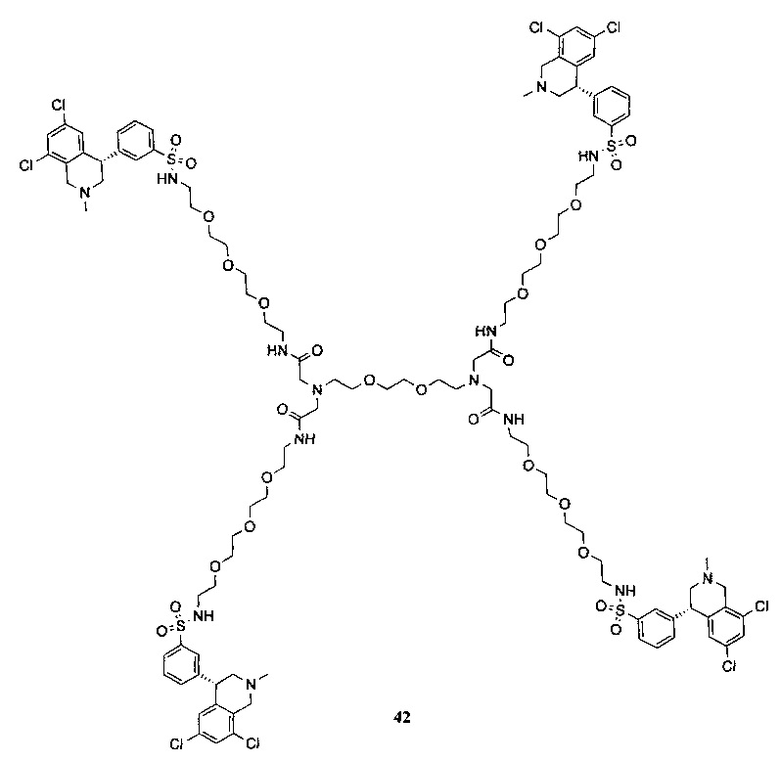
Пример 42: 3,12-бис(14-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-2-оксо-6,9,12-триокса-3-азатетрадецил)-N1,N14-бис(2-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетра-гидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этокси)этил)-6,9-диокса-3,12-диазатетрадекан-1,14-диамид. К смеси этиленгликоль-бис(2-аминоэтиловый эфир)-N,N,N',N'-тетрауксусная кислота (40 мл, 0,105 ммоль, 1 эквив.) в DMF (1,5 мл) при КТ добавляли DIEA (147 мкл, 0,84 ммоль, 8 эквив.) и HBTU (гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметил-урония, 160 мг, 0,42 ммоль, 4 эквив.). Смесь перемешивали при КТ в течение 0,5 ч с получением смеси активированной тетракислоты. К смеси промежуточного соединения Е (104,9 мг, 0,193 моль, 1,83 эквив.) в DMF (0,2 мл) при КТ порциями на протяжении 20 минут добавляли смесь активированной тетракислоты (626 мкл). Смесь перемешивали при КТ в течение 1 ч и очищали посредством преп. ВЭЖХ с получением 44,2 мг (29%) TFA соли указанного в заголовке соединения в виде бледно-желтого твердого вещества. МС (ЭР, m/z): 831 [М+3Н]3+. 1Н ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=7,8 Гц, 4Н), 7.77 (s, 4Н), 7.66 (t, J=7,8 Гц, 4H), 7.59-7.53 (m, 8H), 6.83 (s, 4H), 4.82-4.73 (m, 8H), 4.49 (d, J=15,9 Гц, 4H), 3.96-3.85 (m, 12H), 3.82-3.75 (m, 4H), 3.68-3.50 (m, 52H), 3.45 (dt, J=14,2, 5,5 Гц, 16H), 3.15 (s, 12H), 3.05 (t, J=5,3 Гц, 8H).
Пример 43
(S)-N,N'-(15-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-10-оксо-3,6-диокса-9,11-диазатетрадекан-14-ил)-10,20-диоксо-3,6,24,27-тетраокса-9,11,15,19,21-пентаазанонакозан-1,29-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид)
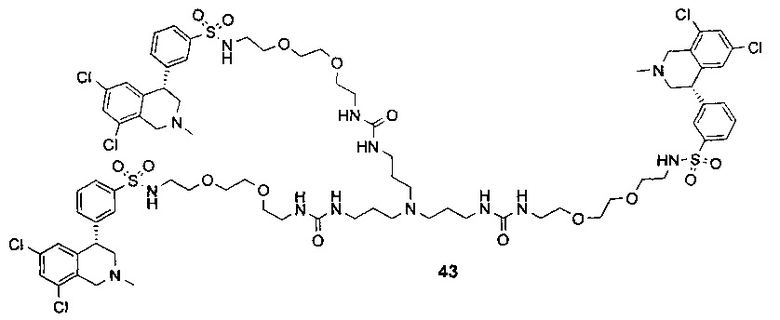
Пример 43: (S)-N,N'-(15-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-10-оксо-3,6-диокса-9,11-диазатетрадекан-14-ил)-10,20-диоксо-3,6,24,27-тетраокса-9,11,15,19,21-пентаазанонакозан-1,29-диил)бис(3-((3)-6,8-дихлор-2-метил-1,2,3,4-тетра-гидроизохинолин-4-ил)бензолсульфонамид). К смеси N,N'-карбонил-диимидазола (56,6 мг, 0,349 ммоль, 3 эквив.) в DMF (0,6 мл) добавляли по каплям раствор трис(3-аминопропил)амина (21,9 мг, 0,116 ммоль, 1 эквив.) в DMF (0,4 мл). Смесь перемешивали при КТ в течение 3 ч и использовали на следующей стадии без очистки. К смеси промежуточного соединения А (83,6 мг, 0,167 моль, 1,44 эквив.) в DMF (0,2 мл) при 50°С порциями в течение 30 минут добавляли вышеописанную реакционную смесь трис(3-аминопропил)амина (560 мкл). Смесь перемешивали при 50°С в течение 2 ч и очищали посредством преп. ВЭЖХ с получением 50,5 мг (41%) TFA соли указанного в заголовке соединения в виде белого твердого вещества. МС (ЭР, m/z): 1770 [М+Н]+. 1Н ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=7,8 Гц, 3Н), 7.78 (s, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.59-7.50 (m, 6Н), 6.83 (s, 3Н), 4.85-4.74 (m, 6Н), 4.50 (d, J=16,0 Гц, 3Н), 3.90 (dd, J=12,0, 6,3 Гц, 3Н), 3.62 (t, J=12,0 Гц, 3Н), 3.59-3.55 (m, 6Н), 3.55-3.53 (m, 6H), 3.49 (dt, J=12,5, 5,4 Гц, 12H), 3.30-3.27 (m, 6H), 3.23 (t, J=6,3 Гц, 6H), 3.20-3.12 (m, 15H), 3.05 (t, J=5,4 Гц, 6H), 2.00-1.76 (m, 6H).
Пример 44
N1,N1,N12,N12-тетракис(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)додекандиамид
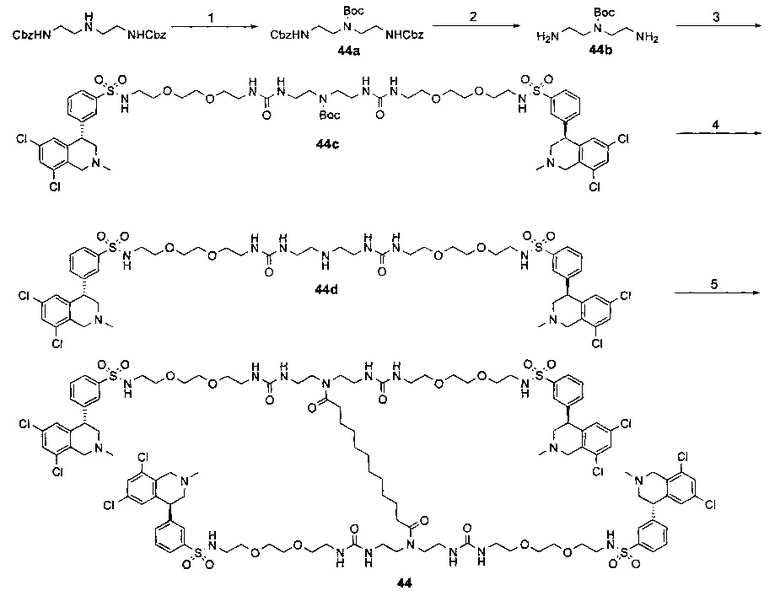
Схема 44. 1. (Вос)2O, TEA, DCM; 2. Pd/C, H2, МеОН; 3. Промежуточное соединение A, CDl (1,1'-карбонилдиимидазол), DMF; 4. HCl, диоксан, DCM; 5. додекандиовая кислота, HATU, DIEA
Промежуточное соединение 44а: дибензил-(((трет-бутоксикарбонил)азандиил)бис(этан-2,1-диил))дикарбамат. К смеси N,N'-ди-2-диэтилентриамина (740 мг, 1,99 ммоль, 1 эквив.) в DCM (3 мл) при 0°С добавляли ди-трет-бутил-дикарбонат (522 мг, 2,39 моль, 1,2 эквив.) и TEA (0,416 мл, 2,99 ммоль, 1,5 эквив.). Смесь перемешивали при КТ в течение ночи, разбавляли этилацетатом, промывали Н2О (1х) и рассолом (1х), сушили, концентрировали и очищали с помощью колонки с получением 0,918 мг (98%) промежуточного соединения 44а в виде прозрачного сиропа.
Промежуточное соединение 44b: трет-бутил-бис(2-аминоэтил)карбамат. К смеси дибензил-(((трет-бутоксикарбонил)азандиил)бис(этан-2,1-диил))дикарбамата (918 мг, 1,95 ммоль, 1,0 эквив.) в МеОН (20 мл) добавляли 10% Pd/C (150 мг). Смесь перемешивали при КТ под Н2 в течение 1,5 ч, фильтровали и концентрировали с получением 400 мг (неочищенное) промежуточного соединения 44b в виде белого твердого вещества.
Промежуточное соединение 44с: трет-бутил-бис(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)карбамат. К смеси Ν,Ν'-карбонилдиимидазола (88,8 мг, 0,548 ммоль, 2 эквив.) в DMF (1,4 мл) добавляли по каплям смесь трет-бутил-бис(2-аминоэтил)карбамата (55,6 мг, 0,274 ммоль, 1 эквив.). Смесь перемешивали при КТ в течение 3 ч и использовали на следующей стадии без очистки. К смеси промежуточного соединения А (191,5 мг, 0,382 моль, 1,39 эквив.) в DMF (0,4 мл) при 50°С порциями добавляли вышеописанную реакционную смесь трет-бутил-бис(2-аминоэтил)карбамата и перемешивали при 50°С в течение 1 ч. Смесь разбавляли этилацетатом, промывали Н2О (2х) и рассолом (1х), сушили, концентрировали и очищали с помощью колонки с получением 172 мг (71%) промежуточного соединения 44 с в виде прозрачного сиропа.
Промежуточное соединение 44d: (S)-N,N'-(10,18-диоксо-3,6,22,25-тетраокса-9,11,14,17,19-пентаазагептакозан-1,27-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид). К смеси трет-бутил-бис(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)карбамата (172 мг) в DCM (0,5 мл) добавляли раствор HCl в диоксане (4 М, 2 мл). Смесь перемешивали при КТ в течение 30 минут и концентрировали с получением 200 мг HCl соли промежуточного соединения 44d в виде белого твердого вещества.
Пример 44: N1, N1, N12, N12-тетракис(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)додекандиамид. К смеси соединения (S)-N,N'-(10,18-диоксо-3,6,22,25-тетраокса-9,11,14,17,19-пентаазагептакозан-1,27-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид) (44,3 мг, 0,0349 ммоль, 1 эквив.) и додекандиовой кислоты (3,66 мг, 0,0159 ммоль, 0,46 эквив.) в DMF (0,4 мл) при КТ добавляли DIEA (30,4 мкл, 0,175 ммоль, 5 эквив.) и HATU (14,6 мг, 0,0384 ммоль, 1,1 эквив.). Смесь перемешивали при КТ в течение 0,5 ч и очищали посредством преп. ВЭЖХ с получением 28 мг (59%) TFA соли указанного в заголовке соединения в виде белого твердого вещества. МС (ЭР, m/z): 1255 [М+2Н]2+. 1Н ЯМР (400 МГц, CD3OD) δ 7.89 (d, J=7,9 Гц, 4Н), 7.79 (d, J=1,4 Гц, 4Н), 7.65 (t, J=7,8 Гц, 4Н), 7.59 - 7.51 (m, 8Н), 6.83 (s, 4Н), 4.83 - 4.73 (m, 8Н), 4.52 (d, J=16,2 Гц, 4Н), 3.92 (dd, J=12,2, 6,0 Гц, 4Н), 3.64 (t, J=11,8 Гц, 4Н), 3.58-3.49 (m, 16Н), 3.49-3.36 (m, 24Н), 3.26 (dd, J=13,0, 5,5 Гц, 16Н), 3.17 (s, 12Н), 3.05 (t, J=5,4 Гц, 8Н), 2.37 (t, J=8,0 Гц, 4Н), 1.61-1.48 (m, 4Н), 1.36-1.21 (m, 12Н).
Пример 45
(S)-N,N'-(14-((1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-14-(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетра-гидроизохинолин-4-ил)фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)-10,15-диоксо-3,6-диокса-9,11,14,16-тетраазаоктакозан-28-ил)карбамоил)-10,18-диоксо-3,6,22,25-тетраокса-9,11,14,17,19-пента-азагептакозан-1,27-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид)
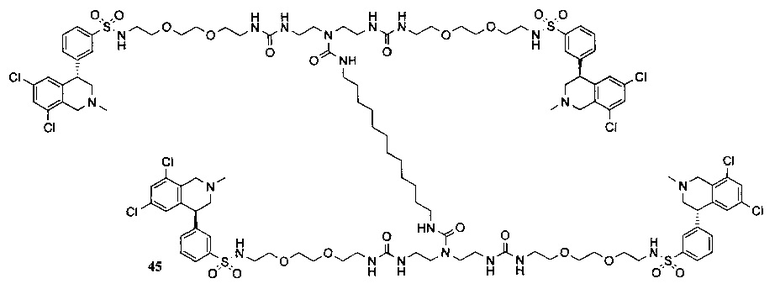
Пример 45: (S)-N,N'-(14-((1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-14-(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)-10,15-диоксо-3,6-диокса-9,11,14,16-тетраазаокта-козан-28-ил)карбамоил)-10,18-диоксо-3,6,22,25-тетраокса-9,11,14,17,19-пента-азагептакозан-1,27-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидро-изохинолин-4-ил)бензолсульфонамид). К смеси промежуточного соединения 44d (42,3 мг, 0,0365 ммоль, 2,1 эквив.) в DCM (0,25 мл) порциями добавляли раствор 1,2-диизоцианатододекана (4,7 мкл, 0,0174 ммоль, 1 эквив.) и TEA (4,8 мкл, 0,0347 ммоль, 2 эквив.) в DCM (0,1 мл). Смесь перемешивали при КТ в течение 20 минут, концентрировали и очищали посредством преп. ВЭЖХ с получением 31,6 мг (60%) TFA соли соединения из примера 45 в виде белого твердого вещества. МС (ЭР, m/z): 1284,6 [М+2Н]2+. 1Н ЯМР (400 МГц, CD3OD) δ 7.92-7.84 (m, 4Н), 7.79 (s, 4Н), 7.64 (t, J=7,8 Гц, 4Н), 7.58-7.48 (m, 8Н), 6.83 (s, 4Н), 4.84-4.75 (m, 8Н), 4.51 (d, J=15,9 Гц, 4Н), 3.92 (dd, J=11,8, 6,5 Гц, 4Н), 3.63 (t, J=12,1 Гц, 4Н), 3.58-3.53 (m, 8Н), 3.53-3.51 (m, 8Н), 3.51-3.43 (m, 16Н), 3.30-3.25 (m, 16Н), 3.21 (t, J=6,8 Гц, 8Н), 3.17 (s, 12Н), 3.15-3.09 (m, 4Н), 3.05 (t, J=5,4 Гц, 8Н), 1.56-1.44 (m, 4Н), 1.35-1.22 (m, 16Н).
Пример 46
(S)-N,N'-(14-амино-14-(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидро-изохинолин-4-ил)фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)-10,18-диоксо-3,6,22,25-тетраокса-9,11,17,19-тетраазагептакозан-1,27-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензол-сульфонамид)
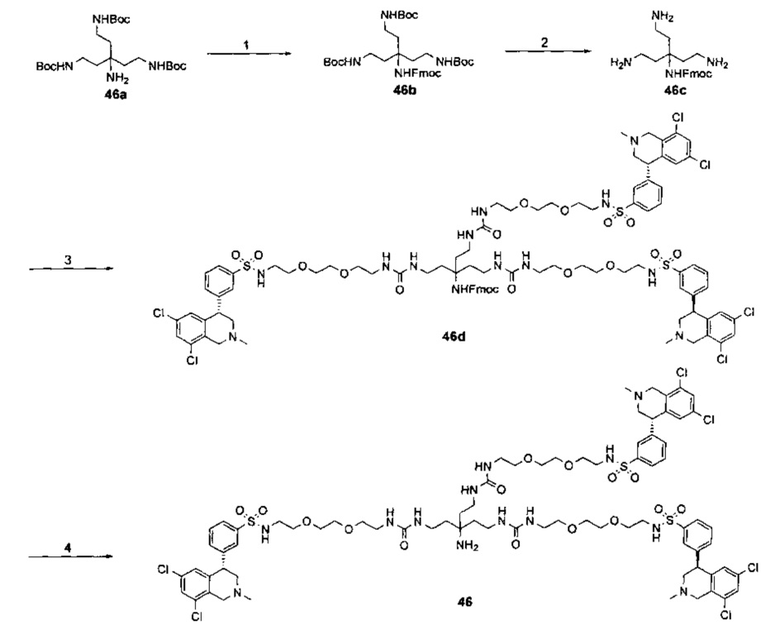
Схема 46. 1. Fmoc-OSu (N-(9-флуоренилметоксикарбонилокси)сукцинимид), DIEA, DCM; 2. HCl, диоксан; 3. Промежуточное соединение А, фосген, TEA, DCM, DIEA, DMF; 4. трис(2-аминоэтил)амин
Промежуточное соединение 46b: К смеси промежуточного соединения 46а (схема выше, первое соединение, 411 мг, 0,893 ммоль, 1 эквив.) и DIEA (238,6 мкл, 1,34 ммоль, 1,5 эквив.) в DCM (3,3 мл) при 0°С добавляли Fmoc-OSu (362 мг, 1,07 ммоль, 1,2 эквив.). Смесь перемешивали при КТ в течение 4 ч, концентрировали и очищали с помощью колонки с получением 0,59 г (97%) промежуточного соединения 46b в виде белого твердого вещества.
Промежуточное соединение 46с: (9Н-флуорен-9-ил)метил-(1,5-диамино-3-(2-аминоэтил)пентан-3-ил)карбамат. К промежуточному соединению 46b добавляли раствор HCl в диоксане (3 мл). Смесь перемешивали при КТ в течение 0,5 ч, концентрировали и растирали с этилацетатом с получением 0,216 г промежуточного соединения 46с в виде белого твердого вещества.
Промежуточное соединение 46d: (9Н-флуорен-9-ил)метил-(1,27-бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфон-амидо)-14-(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)-фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)-10,18-диоксо-3,6,22,25-тетраокса-9,11,17,19-тетраазагептакозан-14-ил)карбамат. К смеси фосгена (15% в толуоле, 577 мкл, 0,808 ммоль, 2 эквив.) в DCM (1 мл) при 0°С добавляли по каплям смесь промежуточного соединения А (202,4 мг, 0,404 ммоль, 1 эквив.) и TEA (113 мкл, 0,808 ммоль, 2 эквив.) в DCM (3 мл). Смесь перемешивали при КТ в течение 0,5 ч и концентрировали. Остаток разбавляли THF и фильтровали. Фильтрат концентрировали с получением желтого твердого вещества. К смеси этого желтого твердого вещества в DMF (2,5 мл) добавляли промежуточное соединение 46 с (52,2 мг, 0,106 ммоль, 0,263 эквив.) и DIEA (141 мкл, 0,808 ммоль, 2 эквив.). Смесь перемешивали при КТ в течение 1 ч и разбавляли водой. Желтый осадок собирали фильтрованием и очищали с помощью колонки с получением 122 мг (58%) промежуточного соединения 46d в виде слегка желтоватого твердого вещества.
Пример 46: (S)-N,N'-(14-амино-14-(13-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-4-оксо-8,11-диокса-3,5-диазатридецил)-10,18-диоксо-3,6,22,25-тетраокса-9,11,17,19-тетраазагепта-козан-1,27-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид). К смеси промежуточного соединения 46d (122 мг, 0,062 ммоль, 1 эквив.) в DMF (2 мл) добавляли трис(2-аминоэтил)амин. Смесь перемешивали при КТ в течение 0,5 ч и очищали посредством преп. ВЭЖХ с получением 81,5 мг (60%) TFA соли указанного в заголовке соединения в виде белого твердого вещества. МС (ЭР, m/z): 1742,8 [М+Н]+. 1Н ЯМР (400 МГц, CD3OD) δ 7.92-7.86 (m, 3Н), 7.78 (t, J=1,6 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.59-7.51 (m, 6Н), 6.83 (s, 3Н), 4.83-4.74 (m, 6Н), 4.50 (d, J=16,0 Гц, 3Н), 3.95-3.85 (m, 3Н), 3.62 (t, J=12,1 Гц, 3Н), 3.58-3.54 (m, 6Н), 3.53 (dd, J=3,7, 1,7 Гц, 6Н), 3.49 (dt, J=10,7, 5,5 Гц, 12Н), 3.30-3.22 (m, 12Н), 3.16 (s, 9Н), 3.05 (t, J=5,4 Гц, 6Н), 1.87 (t, J=8,0 Гц, 6Н).
Пример 47
(S)-N,N'-(15-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-11-метил-10-оксо-3,6-диокса-9,11-диазатетрадекан-14-ил)-11,19-диметил-10,20-диоксо-3,6,24,27-тетраокса-9,11,15,19,21-пентааза-нона-козан-1,29-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизо-хинолин-4-ил)бензолсульфонамид)
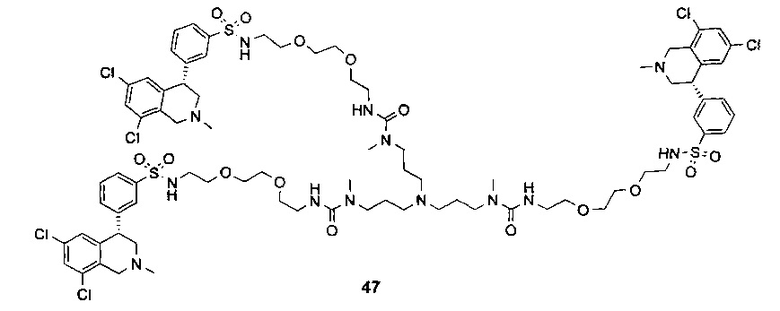
Пример 47: (S)-N,N'-(15-(1-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-11-метил-10-оксо-3,6-диокса-9,11-диазатетрадекан-14-ил)-11,19-диметил-10,20-диоксо-3,6,24,27-тетраокса-9,11,15,19,21-пентаазанонакозан-1,29-диил)бис(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамид). К смеси фосгена (15% в толуоле, 127 мкл, 0,178 ммоль, 1,5 эквив.) в DCM (0,2 мл) при 0°С по каплям добавляли смесь промежуточного соединения А (59,3 мг, 0,118 ммоль, 1 эквив.) и TEA (25 мкл, 0,178 ммоль, 1,5 эквив.) в DCM (1 мл). Смесь перемешивали при КТ в течение 0,5 ч и концентрировали. К смеси вышеуказанного изоцианатного остатка в DCM (0,3 мл) порциями добавляли смесь N1-метил-N3,N3-бис(3-(метиламино)-пропил)пропан-1,3-диамина (промежуточное соединение J, 9 мг, 0,039 ммоль, 0,33 эквив.) и TEA (16,4 мкл, 0,118 ммоль, 1 эквив.) в DCM (0,44 мл). Смесь перемешивали при КТ в течение 0,5 ч, концентрировали и очищали посредством преп. ВЭЖХ с получением 51,3 мг (57%) TFA соли указанного в заголовке соединения в виде белого твердого вещества. МС (ЭР, m/z): 1812,1 [М+Н]+. 1Н ЯМР (400 МГц, CD3OD) δ 7.92-7.86 (m, 3Н), 7.78 (t, J=1,6 Гц, 3Н), 7.65 (t, J=7,8 Гц, 3Н), 7.59-7.51 (m, 6Н), 6.82 (s, 3Н), 4.84-4.73 (m, 6Н), 4.50 (d, J=16,0 Гц, 3Н), 3.96-3.85 (m, 3Н), 3.63 (t, J=12,1 Гц, 3Н), 3.59-3.55 (m, 6Н), 3.55-3.50 (m, 12Н), 3.47 (t, J=5,4 Гц, 6Н), 3.40 (t, J=6,6 Гц, 6Н), 3.35 (t, J=5,8 Гц, 6Н), 3.16 (s, 9Н), 3.15-3.10 (m, 6Н), 3.05 (t, J=5,4 Гц, 6Н), 2.92 (s, 9Н), 2.05-1.86 (m, 6Н).
Примеры 48-71
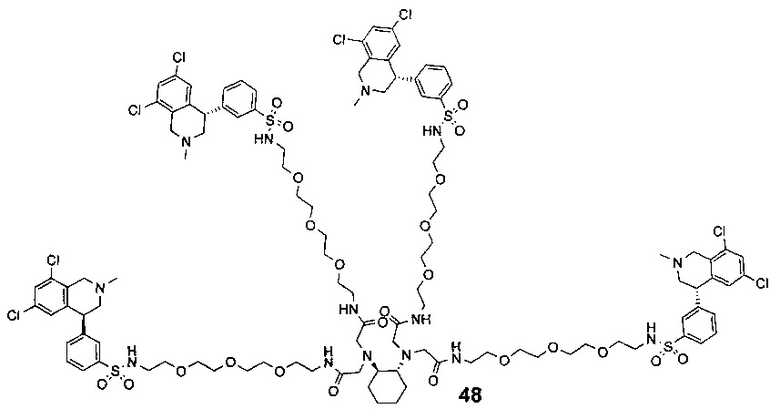
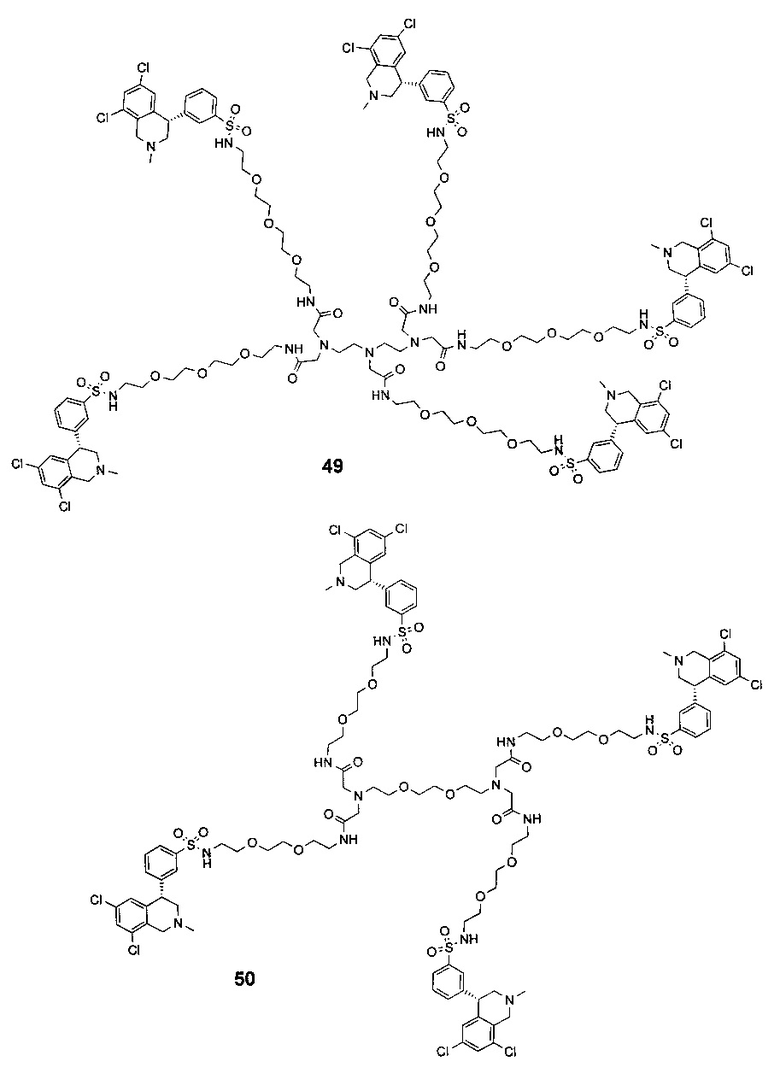
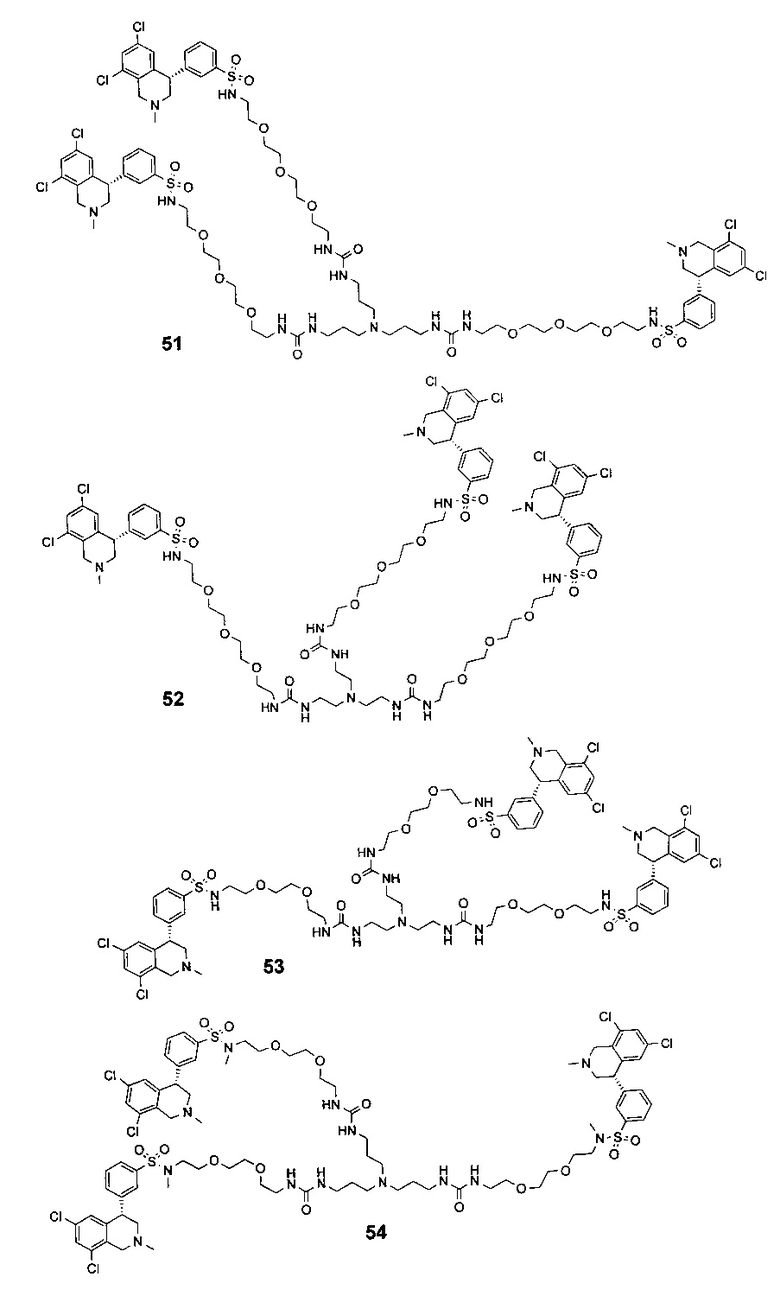
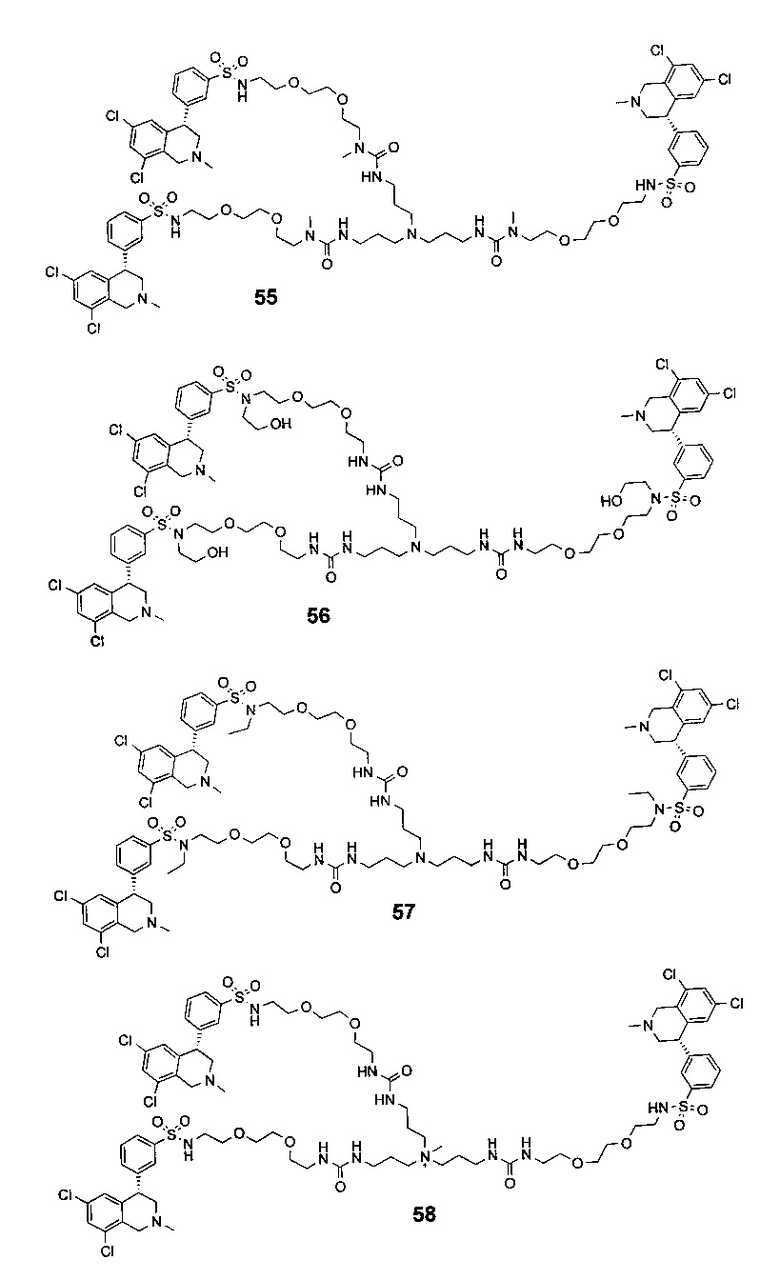
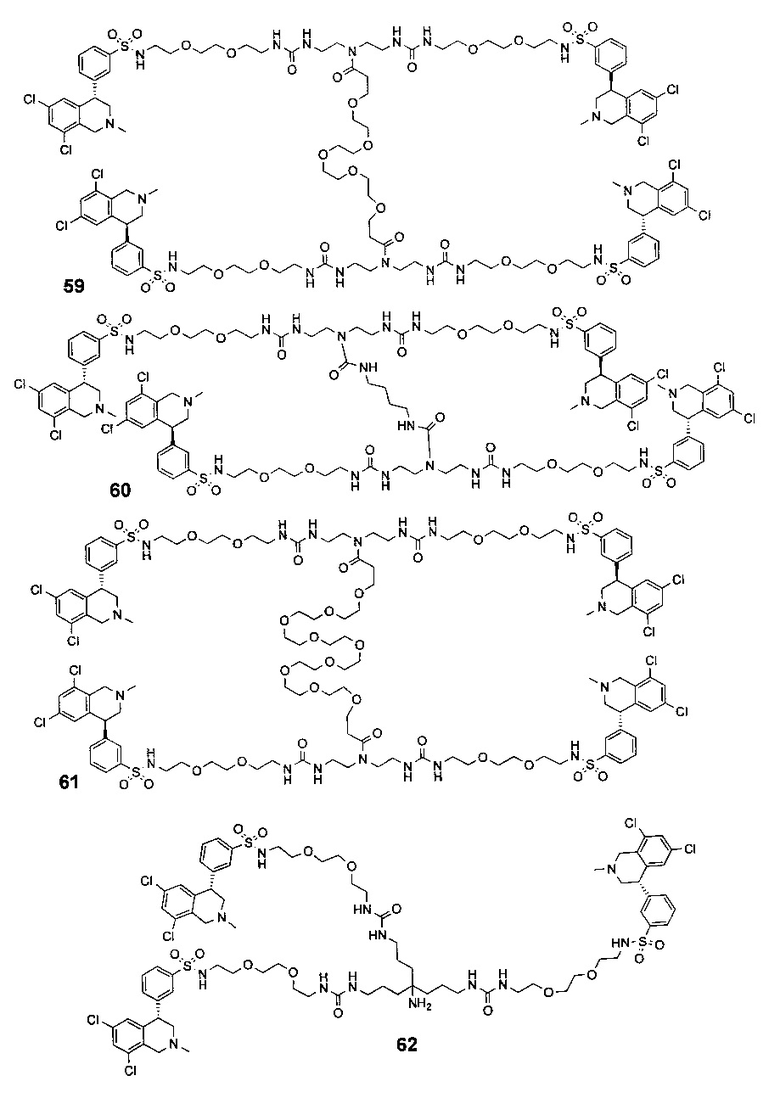
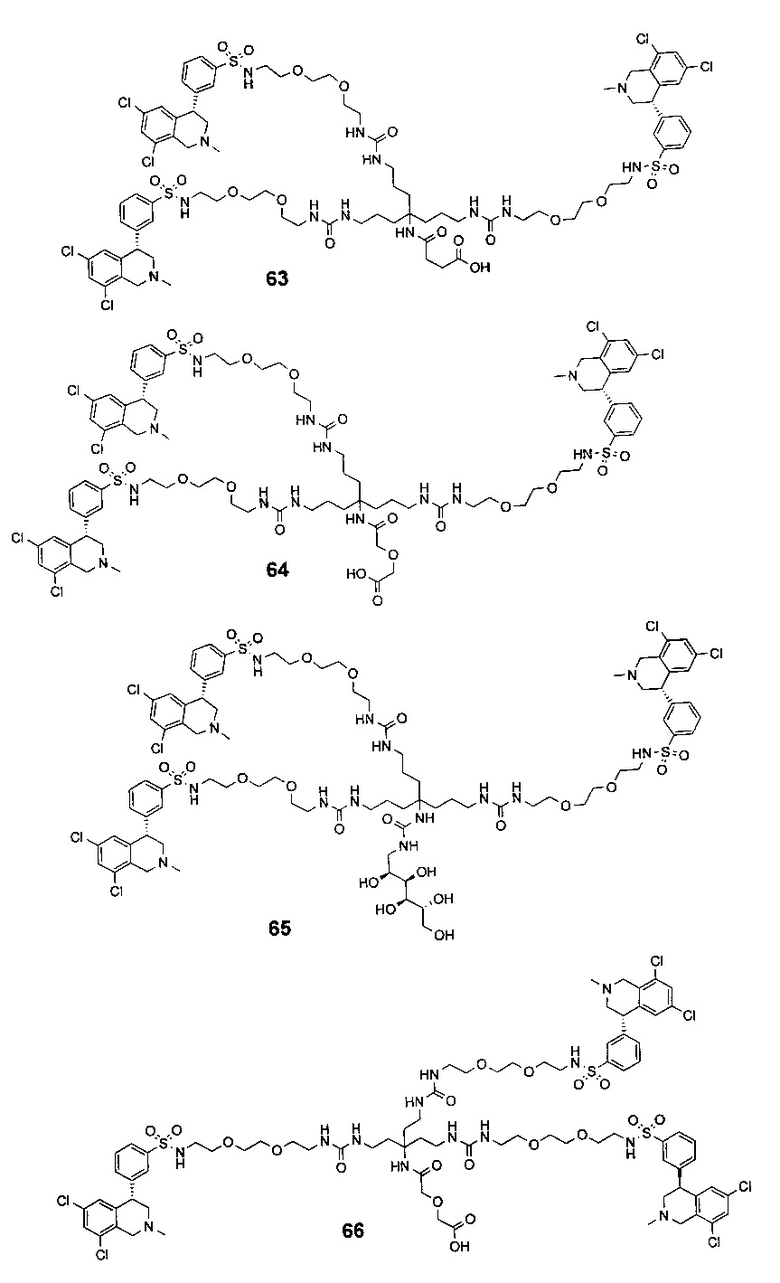
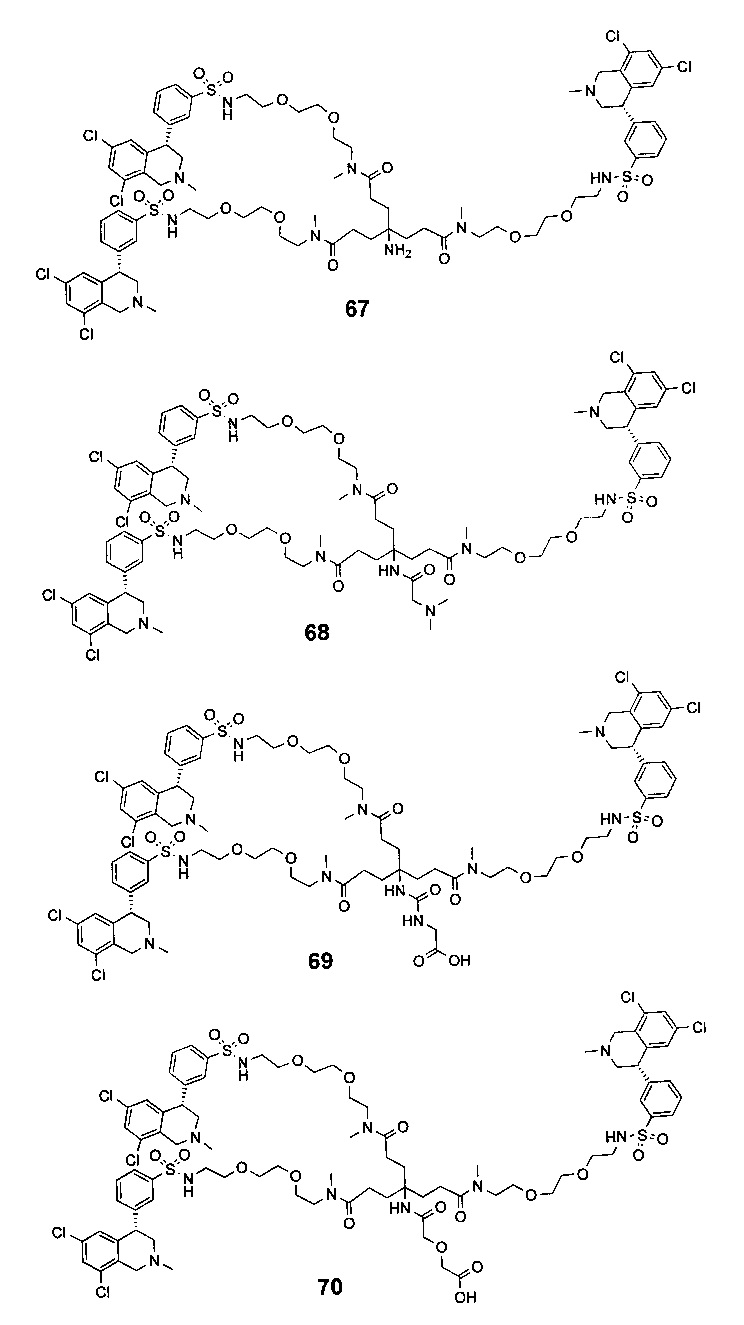
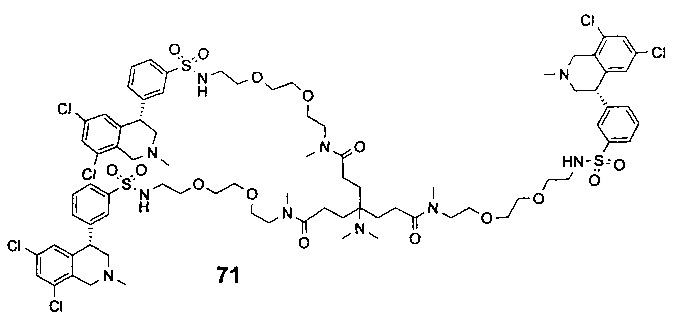

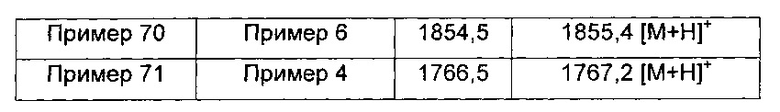
Пример 72
4-ацетил-N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетра-гидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этиламино)-3-оксопропил)гептандиамид
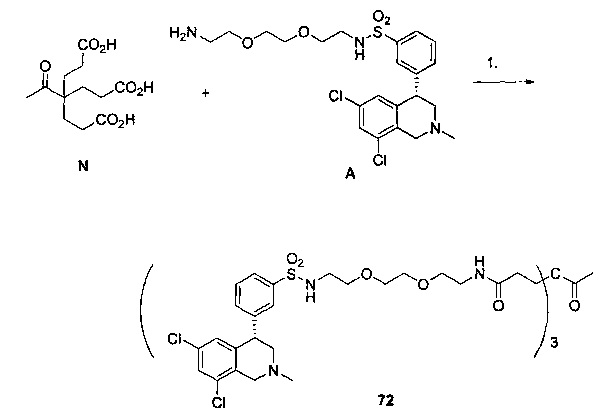
Схема 72. 1. HATU, DIEA, DMF
Пример 72. HATU (42 мг, 0,11 ммоль) добавляли к раствору 4-ацетил-4-(2-карбоксиэтил)гептандиовой кислоты (промежуточное соединение N, 8,2 мг, 0,03 ммоль), (S)-N-(2-(2-(2-аминоэтокси)этокси)этил)-3-(6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)бензолсульфонамида (промежуточное соединение А, 50 мг, 0,10 ммоль) и DIEA (28 мг, 0,022 ммоль) в DMF (0,50 мл). Через 30 минут растворитель удаляли под вакуумом и остаток очищали посредством ВЭЖХ с обращенной фазой (АСМ/вода/0,1% TFA) с получением TFA соли указанного в заголовке соединения (13 мг).
1Н-ЯМР (400 МГц, CD3OD): δ 7.87 (ddd, J1,2=7,8 Гц, J1,3=1,8 Гц, J1,4=1,2 Гц, 3Н), 7.75 (t, J=1,8 Гц, 3Н), 7.63 (t, J=7,7 Гц), 7.53 (m, 6Н), 6.82 (s, 3Н), 4.84-4.74 (m, 6Н), 4.49 (d, J=16,2 Гц, 3Н), 3.89, (dd, J1,2=6,1 Гц, J1,3=12,3 Гц, 3Н), 3.61 (t, J=12,1 Гц, 3Н), 3.55-3.48 (m, 18Н), 3.45 (t, J=5,5 Гц, 6H), 3.30 (m, 6Н), 3.15 (s, 9Н), 3.03 (t, J=5,5 Гц, 6H), 2.14 (s, 3Н), 2.05-2.01 (m, 6Н), 1.85-1.81 (m, 6Н). МС (m/z): 1724,3 (М+Н).
Пример 73
N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфон-амидо)этокси)этокси)-этиламино)-3-оксопропил)-4-(1-гидроксиэтил)гептан-диамид
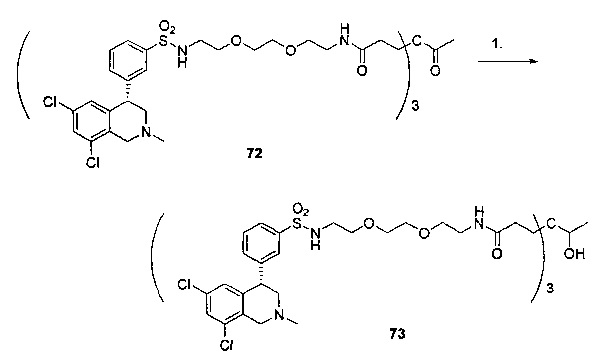
Схема 73. 1. NaBH4, МеОН
Пример 73: Борогидрид натрия (1 мг, 0,03 ммоль) добавляли к раствору TFA соли 4-ацетил-N1,N7-бис(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)этокси)этокси)этил)-4-(3-(2-(2-(2-(3-((S)-6,8-дихлор-2-метил-1,2,3,4-тетрагидроизохинолин-4-ил)фенилсульфонамидо)-этокси)этокси)этиламино)-3-оксопропил)гептандиамида (пример 72, 15 мг, 0,007 ммоль) в МеОН (200 мкл) и DCM (50 мкл). Через 2 часа реакционную смесь концентрировали при пониженном давлении и очищали посредством ВЭЖХ с обращенной фазой (ACN/вода/0,1% TFA) с получением TFA соли указанного в заголовке соединения (6,2 мг). 1Н-ЯМР (400 МГц, CD3OD) δ 7.87 (ddd, J1,2=7,8 Гц, J1,3=1,8 Гц, J1,4=1,2 Гц, 3Н), 7.75 (t, J=1,8 Гц, 3Н), 7.63 (t, J=7,8 Гц, 3Н), 7.53 m, 6Н), 6.82 (s, 3Н), 4.79-4.74 (m, 6Н), 4.49 (d, J=16,2 Гц, 3Н), 3.88 (dd, J1,2=11,6 Гц, J1,3=6,1 Гц, 3Н), 3.64-3.58 (m, 4Н), 3.55-3.47 (m, 18Н), 3.45 (t, J=5,4 Гц), 3.31 (m, 6H), 3.14 (s, 9H), 3.03 (t, J=5,5 Гц, 6H), 2.27-2.17 (m, 6H), 1.63-1.53 (m, 6H), 1.14 (d, J=5,7 Гц, 3Н). МС (m/z): 1726,1 (М+Н).
Фармакологические данные
Пример 74
Клеточный анализ NHE-3 активности
Крысиный или человеческий NHE-3-опосредованный Na+-зависимый Н+ антипорт измеряли, используя модификацию рН-чувствительного метода окраски, о котором впервые сообщил Paradiso (Proc. Natl. Acad. Sci. USA. (1984) 81(23): 7436-7440). Клетки почки опоссума (ОК) получали из АТСС и размножали согласно инструкциям. Ген крысиной NHE-3 (GenBank М85300) или ген человеческой NHE-3 (GenBank NM_004174.1) вводили в ОК клетки посредством электропорации и клетки высевали в 96-луночные планшеты и выращивали в течение ночи. Среду от клеток удаляли посредством аспирации, клетки промывали дважды буфером NaCl-HEPES (100 мМ NaCl, 50 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), 10 мМ глюкоза, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, рН 7,4), затем инкубировали в течение 30 мин при комнатной температуре с буфером NH4Cl-HEPES (20 мМ NH4Cl, 80 мМ NaCl, 50 мМ HEPES, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, рН 7,4), содержащим 5 мкМ бис(ацетоксиметил)-3,3'-(3',6,-бис(ацетоксиметокси)-5-((ацетоксиметокси)-карбонил)-3-оксо-3Н-спиро[изобензофуран-1,9'-ксантен]-2',7'-диил)дипропано-ата (BCECF-AM). Клетки промывали дважды не содержащим аммония и не содержащим Na+ HEPES (100 мМ холин, 50 мМ HEPES, 10 мМ глюкоза, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, рН 7,4) и инкубировали в том же самом буфере в течение 10 минут при комнатной температуре для понижения внутриклеточного рН. NHE-3-опосредованное восстановление нейтрального внутриклеточного рН инициировали посредством добавления буфера Na-HEPES, содержащего 0,4 мкМ этилизопропиламилорида (EIPA, селективный антагонист NHE-1 активности, который не ингибирует NHE-3) и 0-30 мкМ тестируемого соединения, и мониторинга рН-чувствительных изменений в BCECF флуоресценции (λех 505 нм, λem 538 нм), нормализованной к рН нечувствительной BCECF флуоресценции (λех 439 нм, λem 538 нм). Исходные соотношения представляли как среднее 2 или более повторов и устанавливали величины pIC50, используя GraphPad Prism.
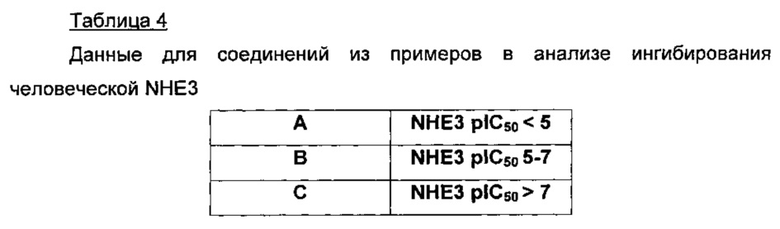
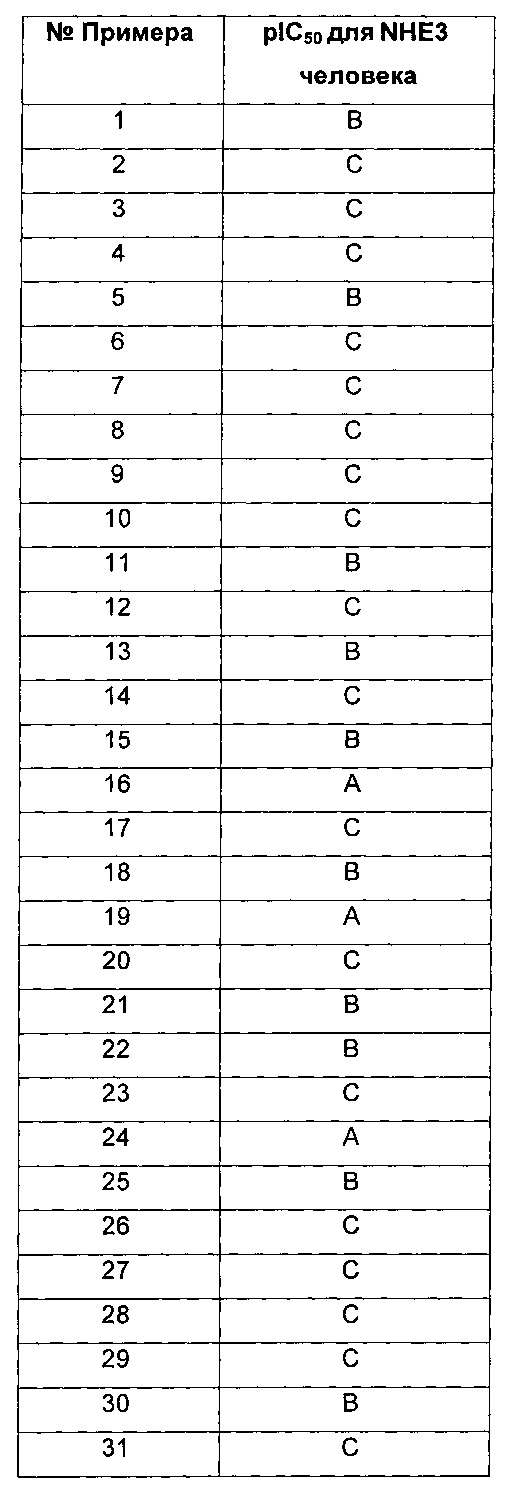
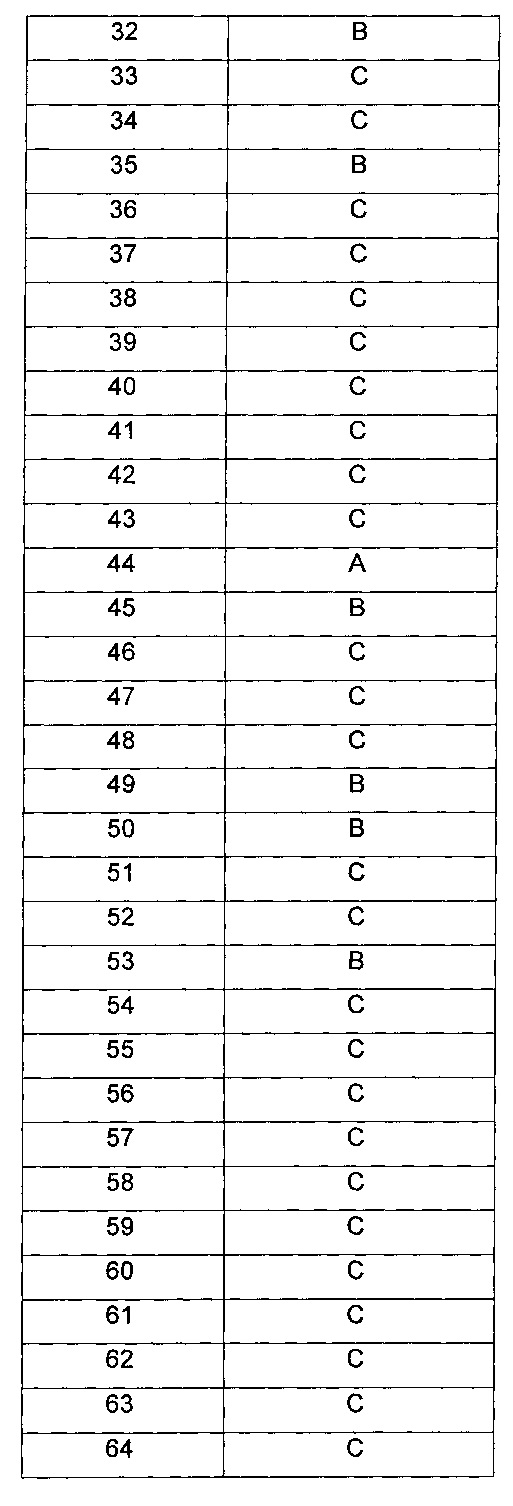
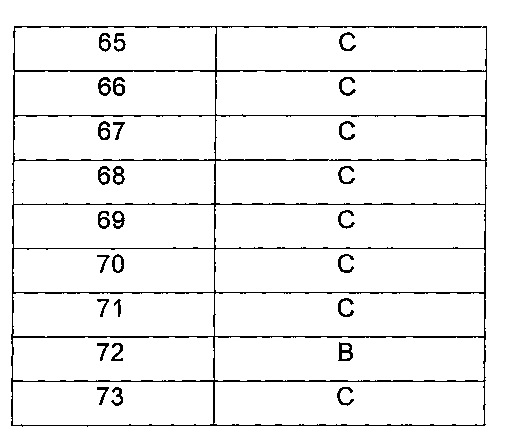
Пример 75
Ингибирование абсорбции натрия в кишечнике
Для оценки способности выбранных соединений из примеров ингибировать абсорбцию натрия из просвета кишечника измеряли концентрацию натрия в моче и форму фекалиев. Крыс Sprague-Dawley в возрасте восьми недель получали от Charles River Laboratories (Hollister, CA), размещали по двое на клетку и подвергали акклиматизации в течение по меньшей мере 3 суток до начала исследования. Животных кормили кормом для грызунов Harlan Teklad Global 2018 (Indianapolis, IN), обеспечивали свободный доступ к воде на протяжении исследования и содержали в условиях стандартного цикла свет/темнота от 6 утра до 6 вечера. В день исследования между 4 часами и 5 часами после полудня группе крыс (n=6) осуществляли дозирование с помощью желудочного зонда тестируемого соединения в указанных дозировках или носителя (вода) в объеме 10 мл/кг. После введения дозы животных помещали в индивидуальные метаболические камеры, где их также кормили тем же самым кормом в форме муки и обеспечивали свободный доступ к воде. Через 16 часов после введения дозы собирали образцы мочи и оценивали форму фекалиев посредством двух независимых наблюдений. Форму фекалиев оценивали в баллах согласно общепринятой шкале, ассоциированной с увеличением содержания воды в фекалиях, наблюдая за их подвижностью в воронке для сбора в клетке (1, нормальная гранула; 2, гранула, прилипающая к боковинам воронки для сбора из-за влажности; 3, потеря нормальной формы гранулы; 4, полная потеря формы в виде размазывания; 5, очевидные потоки жидких фекалиев). Балльную оценку формы крысиных фекалиев (FFS) определяли посредством усреднения оценок обоих наблюдений для всех крыс в группе (n=6). Средняя оценка для группы носителя составляла 1. Эти средние оценки представлены в Таблице 4. Для образцов мочи объемы определяли гравиметрически и центрифугировали их при 3600×g. Супернатанты разбавляли в 100 раз в деионизированной Milli-Q воде, затем фильтровали через плоский фильтр 0,2 мкм GHP Pall AcroPrep (Pall Life Sciences, Ann Arbor, MI), после чего проводили анализ посредством ионной хроматографии. Десять микролитров каждого профильтрованного экстракта инъецировали в систему для ионной хроматографии Dionex ICS-3000 (Dionex, Sunnyvale, СА). Катионы отделяли посредством изократического метода, используя 25 мМ метансульфоновую кислоту в качестве элюента, на катионообменной колонке lonPac CS12A, 2 мм i.d. (внутренний диаметр) х 250 мкм, размер частиц 8 мкм (Dionix). Натрий определяли количественно, используя стадарты, приготовленные из стандартной смеси катионов, содержащей Li+, Na+, NH4+, К+, Mg2+ и Са2+ (Dionix). Среднюю массу выделенного с мочой натрия для каждой группы в течение 16-часового периода определяли относительно группы носителя, обычно выделяющей с мочой приблизительно 21 мг натрия. Na мочи (uNa) для крыс в тестируемых группах выражали как процент от среднего показателя для носителя и эти средние показатели сравнивали со средними показателями для группы носителя посредством применения однофакторного дисперсионного анализа в сочетании с апостериорным критерием Даннета (Dunnett's post hoc). Средние показатели, которые были значительно ниже, чем группа носителя, как определено статистическим анализом, были обозначены следующим образом: *, Р<0,05; **, Р<0,01; ***, Р<0,001.

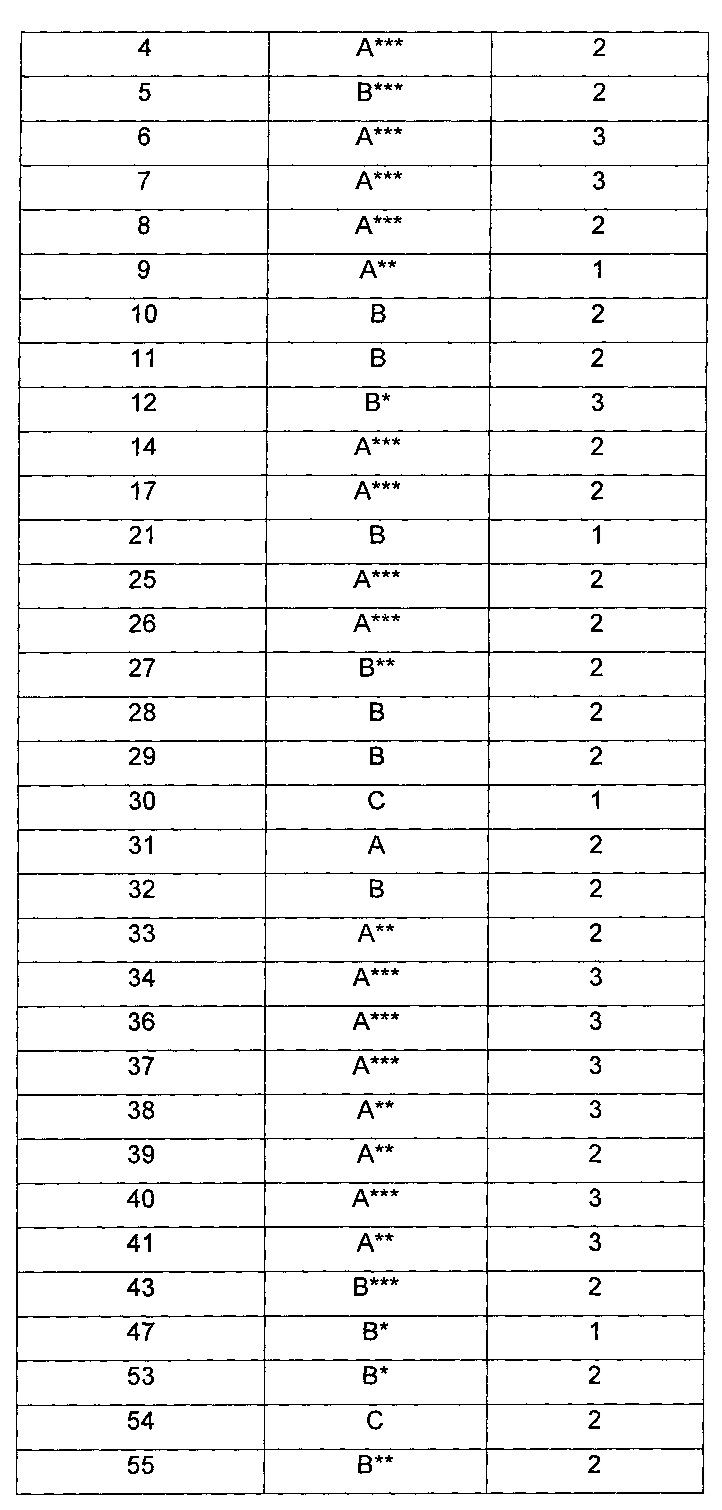
В Таблице 5 А указывает на то, что натрий мочи составлял менее 35% от процентного содержания среднего показателя для носителя; В указывает на то, что натрий мочи составлял 35-75% процентного содержания среднего показателя для носителя; С указывает на то, что натрий мочи составлял более 75% процентного содержания среднего показателя для носителя.
Пример 76
Фармакокинетика (РК) в плазме
Крысам Sprague-Dawley (n=3) дозировали тестируемые соединения с помощью желудочного зонда. Кровь собирали в моменты времени 0,5, 1, 2 и 4 ч путем забора крови из ретроорбитального синуса и перерабатывали ее в плазму, используя K2EDTA (этилендиаминотетрауксусная кислота) в качестве антикоагулянта. Образцы плазмы обрабатывали ацетонитрилом, содержащим внутренний стандарт, и выпавшие в осадок белки удаляли центрифугированием. Супернатанты анализировали посредством ЖХ-МС/МС и определяй концентрации соединения путем интерполяции из калибровочной кривой, полученной в плазме. Точное извлечение для образцов контроля качества подтверждали для принятия каждого аналитического прогона. В Таблице 6 проиллюстрированы данные из фармакокинетического профилирования выбранных соединений из примеров. Из исследований, в которых одна или более крыс имели образцы с уровнями тестируемых соединений ниже количественного предела, Cmax и AUC (площадь под кривой) (представленные как среднее из n=3) могут быть представлены как "<Х" для указания верхней границы.
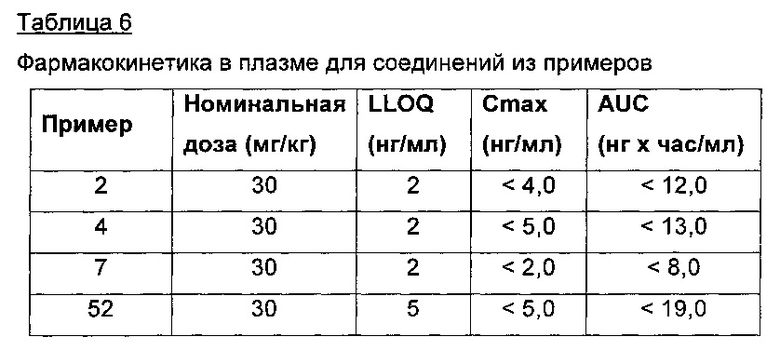
Пример 77
Извлечение из фекалий
Трем самцам крыс Sprague Dawley вводили 1 мг/кг тестируемого соединения с помощью желудочного зонда. От опытных животных собирали фекалии через 0-48 или 0-72 часа после введения соединений, сушили посредством лиофилизации и гомогенизировали. Реплицируемые аликвоты по 40-60 мг каждая подвергали экстракция/осаждению белка с помощью смеси 7:1 ацетонитрил : вода и центрифугировали. Супернатанты разбавляли 1:10 в смеси 50:50 ацетонитрил : вода, после чего осуществляли их анализ с помощью ЖХ-МС/МС. Концентрации соединений, определенные посредством интерполяции из стандартной калибровочной кривой, полученной для пустой фекальной пробы, конвертировали в процентную долю от извлеченного введенного материала путем учета общего собранного фекального материала. Процент извлечения для каждой крысы представляли как среднее из расчетов для реплицируемых образцов. Общий процент извлечения (извлечение из фекалиев [%]) представляли как средний процент извлечения от трех крыс. Для каждого прогона подтверждали точность извлечения для образцов контроля качества и периодически проверяли эффективность экстракции. В Таблице 7 проиллюстрированы данные извлечения из фекалиев для выбранных соединений из примеров.
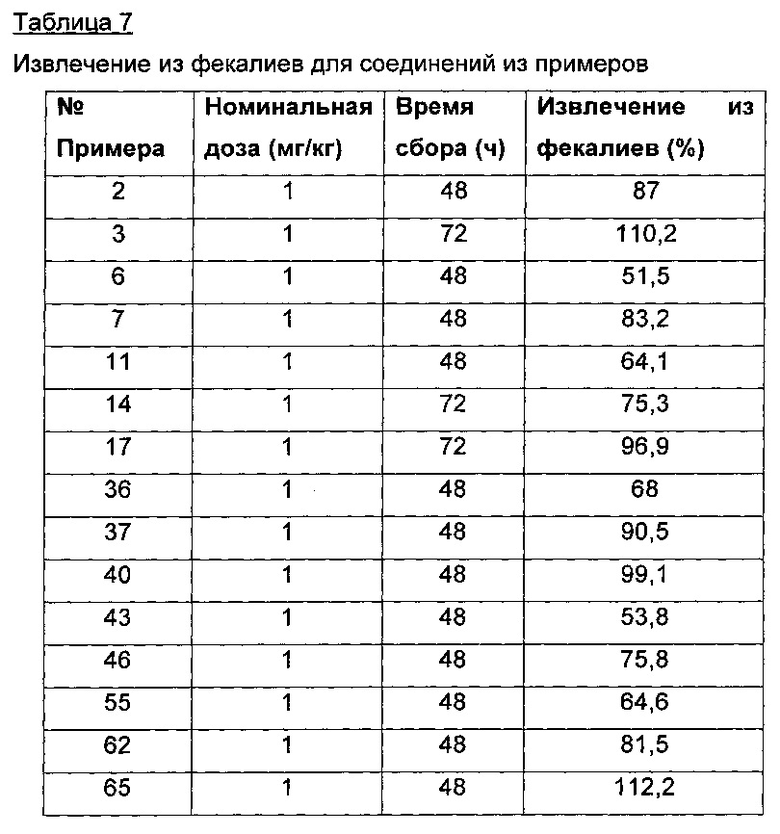
Пример 78
Клеточный анализ активности NHE-3 (непрерывное ингибирование) Способность соединений ингибировать крысиный NHE-3-опосредованный Na+-зависимый Н+ антипорт после их введения и отмывки от них измеряли, используя модификацию рН чувствительного метода окрашивания, описанного выше в Примере 74. Клетки почки опоссума (ОК) получали из АТСС и размножали согласно инструкциям. Ген крысиной NHE-3 (GenBank М85300) или ген человеческой NHE-3 вводили в ОК клетки посредством электропорации и клетки высевали в 96-луночные планшеты и выращивали в течение ночи. Среду от клеток удаляли посредством аспирации, клетки промывали дважды буфером NaCl-HEPES (100 мМ NaCl, 50 мМ HEPES, 10 мМ глюкоза, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, рН 7,4), затем покрывали буфером NaCl-HEPES, содержащим 0-30 мкг тестируемого соединения. После инкубирования в течение 60 мин буфер, содержащий тестируемое лекарство, удаляли от клеток посредством аспирации, клетки дважды промывали буфером NaCl-HEPES без лекарства, затем инкубировали в течение 30 минут при комнатной температуре с буфером NH4Cl-HEPES (20 мМ NH4Cl, 80 мМ NaCl, 50 мМ HEPES, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, рН 7,4), содержащим 5 мкМ бис(ацетоксиметил)-3,3'-(3',6'-бис(ацетоксиметокси)-5-((ацетоксиметокси)-карбонил)-3-оксо-3Н-спиро[изобензофуран-1,9'-ксантен]-2',7'-диил)дипропаноата (BCECF-AM). Клетки промывали дважды не содержащим аммония и не содержащим Na+ HEPES (100 мМ холин, 50 мМ HEPES, 10 мМ глюкоза, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, рН 7,4) и инкубировали в том же самом буфере в течение 10 минут при комнатной температуре для понижения внутриклеточного рН. NHE-3-опосредованное восстановление нейтрального внутриклеточного рН инициировали (через 40 минут после отмывки от соединения) посредством добавления буфера Na-HEPES, содержащего 0,4 мкМ этилизопропиламилорида (EIPA, селективный антагонист NHE-1 активности, который не ингибирует NHE-3), и мониторинга рН-чувствительных изменений в BCECF флуоресценции (λех 505 нм, λem 538 нм), нормализованной к рН нечувствительной BCECF флуоресценции (λех 439 нм, λem 538 нм). Исходные соотношения представляли как среднее 2 или более повторов и устанавливали величины рIC50, используя GraphPad Prism.
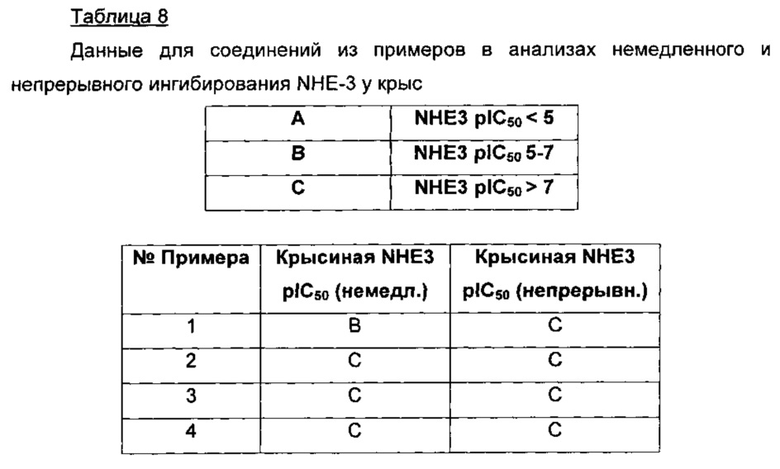
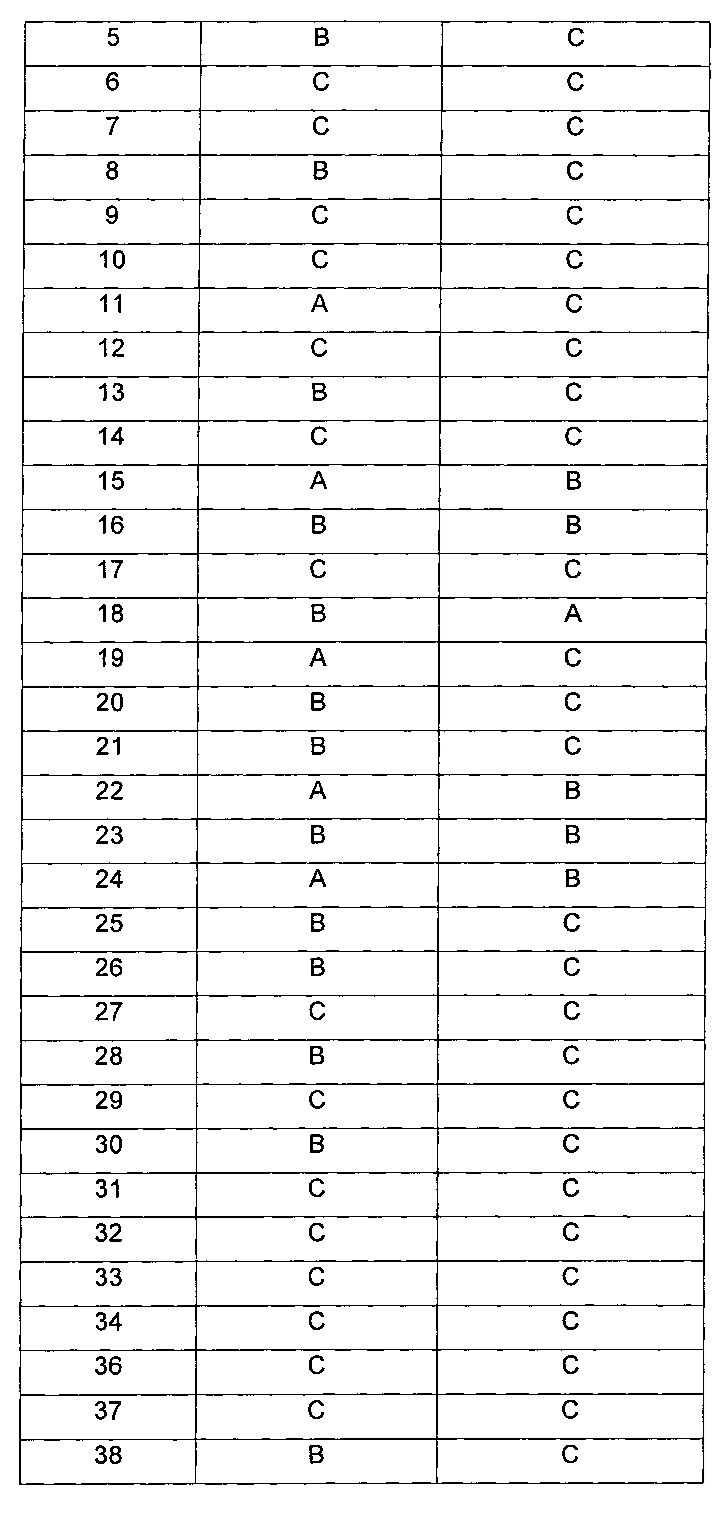
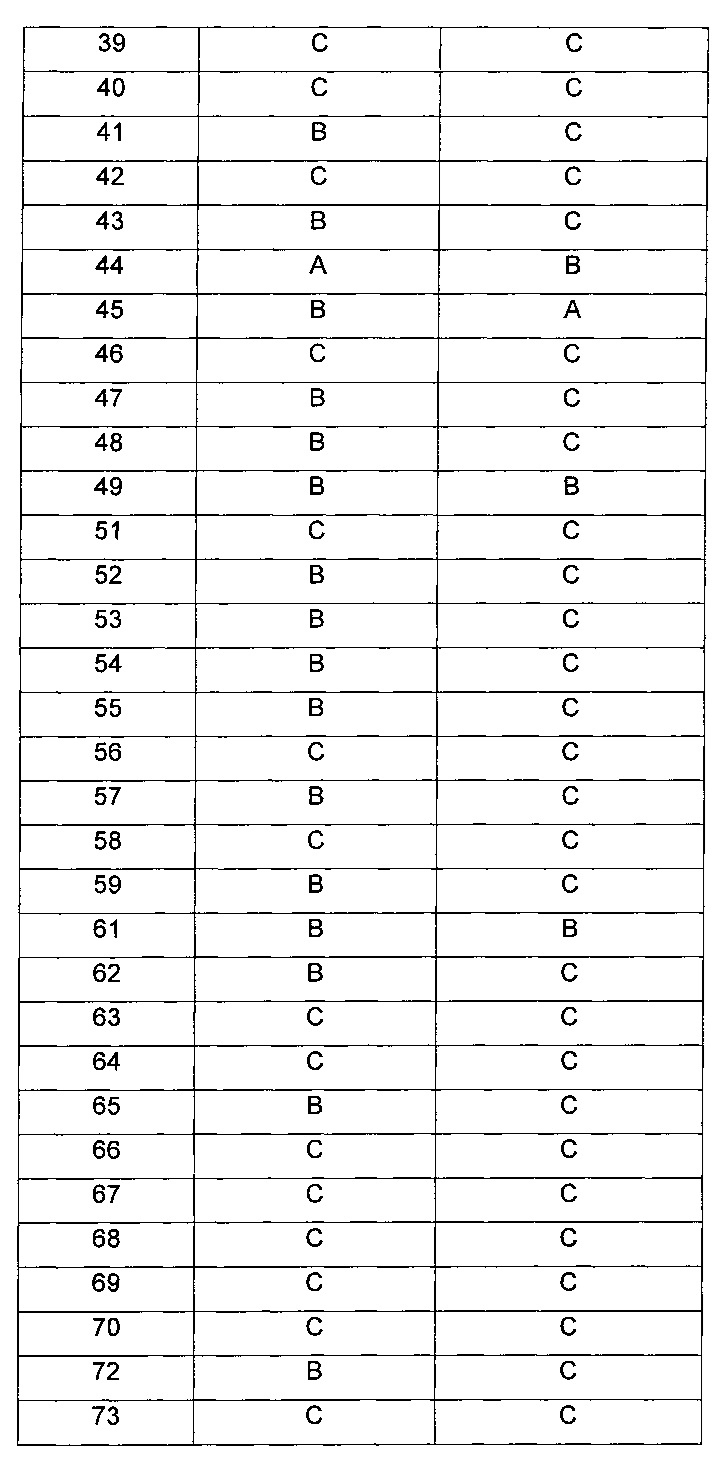
Пример 79
Оценка фармакокинетики в желчи
Крысам Sprague-Dawley с канюлями в желчном протоке (BDC) вводили тестируемые соединения посредством желудочного зонда и спустя 24 ч после введения соединения через канюлю собирали отдельную аликвоту желчи. Образцы желчи обрабатывали ацетонитрилом и выпавшие в осадок белки удаляли центрифугированием. Для некоторых соединений была необходима экстракции жидкость-жидкость с использованием МТВЕ (метил-трет-бутиловый эфир). После центрифугирования образцы разбавляли, как необходимо, в подвижной фазе и анализировали посредством ЖХ-МС/МС. Концентрации соединений в желчи определяли интерполированием из стандартной калибровочной кривой, полученной в желчи крыс от крыс, не подвергавшихся BDC. Точность извлечения в образцах контроля качества подтверждали для принятия каждого аналитического прогона. В Таблице 9 проиллюстрированы данные воздействия на желчь выбранных соединений из примеров. Концентрация в желчи представлена в нМ, и она представляет собой средний результат от n=3 крыс.
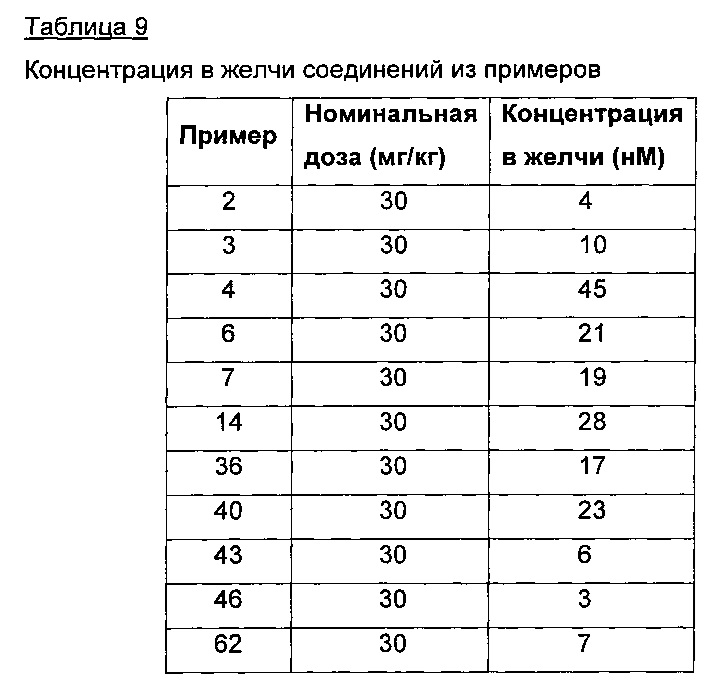
Все патенты США, публикации заявок на патент США, заявки на патент США, иностранные патенты, заявки на иностранные патенты и непатентные публикации, на которые сделаны ссылки в данном описании, включены в него посредством ссылки в той их полноте, которая не является несовместимой с настоящим описанием.
Из вышеизложенного понятно, что, хотя конкретные воплощения изобретения были раскрыты в данном описании в иллюстративных целях, могут быть осуществлены различные модификации в рамках сущности заявляемого изобретения. Соответственно, изобретение ограничено только прилагаемой формулой изобретения.
Группа изобретений относится к медицине, конкретно к соединениям и способам для лечения расстройств, ассоциированных с задержкой жидкости или солевой перегрузкой, таких как сердечная недостаточность, в частности застойная сердечная недостаточность, хроническое заболевание почек, поздняя стадия заболевания почек, болезнь печени и задержка жидкости, вызванная агонистом гамма-рецептора, активируемого пролифератором пероксисом (PPAR). Изобретение также относится к соединениям и способам для лечения гипертензии, для лечения заболеваний желудочно-кишечного тракта, включая лечение или уменьшение боли, ассоциированной с заболеваниями желудочно-кишечного тракта. Соединения не абсорбируются и не являются системно биодоступными. 6 н. и 5 з.п. ф-лы, 9 табл., 79 пр.
1. Соединение, имеющее структуру формулы (I)
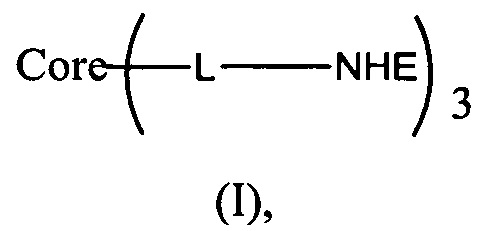
или его фармацевтически приемлемая соль, где:
(а) NHE (Na+/Н+-обменник) представляет собой NHE-ингибирующую низкомолекулярную группировку, имеющую следующую структуру формулы (А):
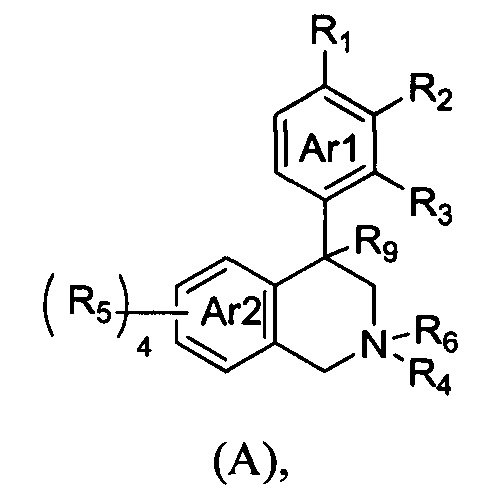
где каждый R1, R2, R3, R5 и R9 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из H, С1-6алкила, -С1-6алкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L;
R4 выбран из Н, С1-С7алкила или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L;
R6 отсутствует или выбран из Н и С1-С7алкила; и
Ar1 и Ar2 представляют собой фенил;
(б) Core представляет собой коровую группировку, имеющую следующую структуру формулы (В):
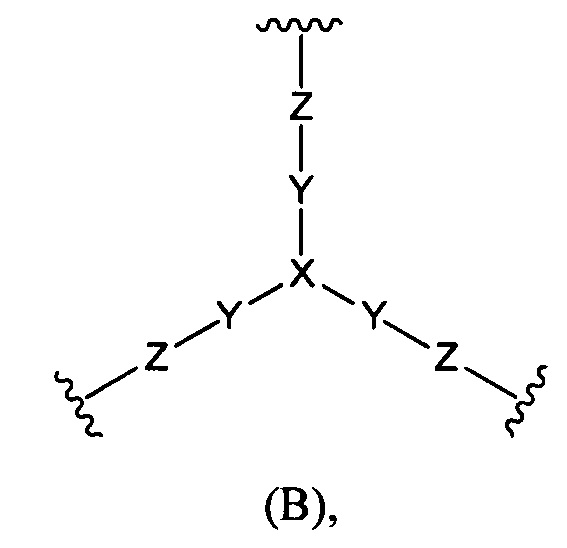
где: X выбран из C(X1), N и группы N(С1-6алкил);
X1 выбран из водорода, возможно замещенного алкила, -NXaXb, -NO2, -NXc-C(=O)-NXc-Xa, -C(=O)NXc-Xa, -NXc-C(=O)-Xa, -NXc-SO2-Xa, -С(=O)-Ха и -OXa,
каждый Xa и Xb независимо выбран из водорода, возможно замещенного алкила, возможно замещенного циклоалкила, возможно замещенного циклоалкилалкила, возможно замещенного гетероциклила, возможно замещенного гетероциклилалкила, возможно замещенного арила, возможно замещенного аралкила, возможно замещенного гетероарила и возможно замещенного гетероарилалкила;
Y представляет собой C1-6алкилен;
Z выбран из -NZa-C(=O)-NZa-, -C(=O)NZa-, -NZa-C(=O)- и гетероарила, когда X представляет собой CX1;
Z выбран из -NZa-C(=O)-NZa- и гетероарила, когда X представляет собой N или N(C1-6алкил); и
каждый Хс и Za независимо выбран из водорода и C1-6алкила; и
(в) L представляет собой полиалкиленгликолевый линкер, соединяющий коровую группировку с NHE-ингибирующими низкомолекулярными группировками;
где гетероциклил представляет собой диоксоланил, тиенил[1,3]дитианил, декагидроизохинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил, пиперазинил, 4-пиперидонил, пирролидинил, пиразолидинил, хинуклидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиоморфолинил, тиаморфолинил, 1-оксо-тиоморфолинил или 1,1-диоксо-тиоморфолинил; и
гетероарил представляет собой азепинил, акридинил, бензимидазолил, бензотиазолил, бензиндолил, бензодиоксолил, бензофуранил, бензооксазолил, бензотиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензопиранил, бензопиранонил, бензофуранил, бензофуранонил, бензотиенил, бензотриазолил, бензо[4,6]имидазо[1,2-а]пиридинил, карбазолил, циннолинил, дибензофуранил, дибензотиофенил, фуранил, фуранонил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, нафтиридинил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 1-оксидопиридинил, 1-оксидопиримидинил, 1-оксидопиразинил, 1-оксидопиридазинил, 1-фенил-1Н-пирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пирролил, пиразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, хиназолинил, хиноксалинил, хинолинил, хинуклидинил, изохинолинил, тетрагидрохинолинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазинил или тиенил.
2. Соединение, имеющее структуру формулы (II)
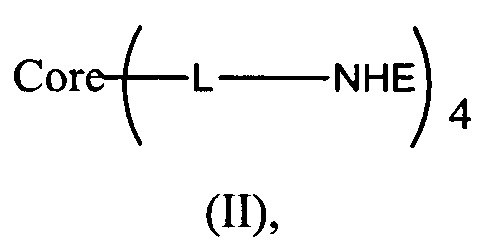
или его фармацевтически приемлемая соль, где:
(a) NHE представляет собой NHE-ингибирующую низкомолекулярную группировку, имеющую структуру формулы (А)
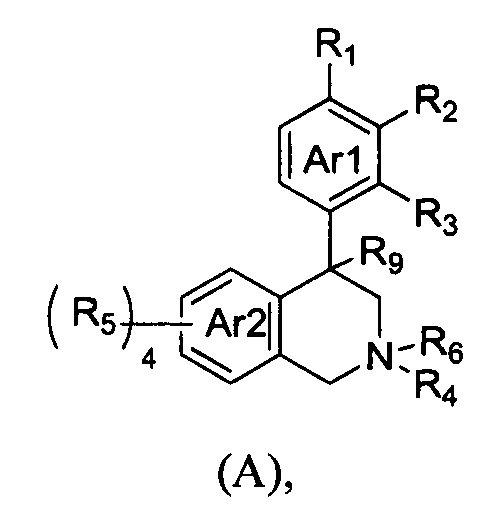
где каждый R1, R2, R3, R5 и R9 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из Н, С1-6алкила, -C1-6алкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L;
R4 выбран из Н, С1-С7алкила или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L;
R6 отсутствует или выбран из Н и С1-С7алкила; и
Ar1 и Ar2 представляют собой фенил;
(б) Core представляет собой коровую группировку, имеющую следующую структуру формулы (С):
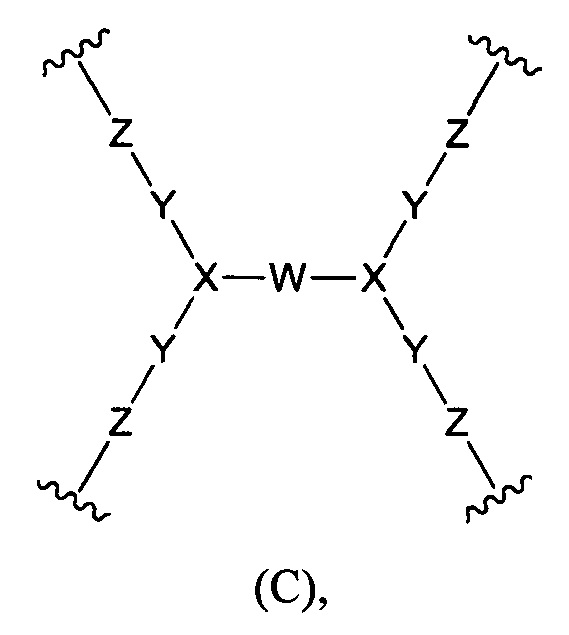
где: W выбран из алкилена, полиалкиленгликоля, -С(=O)-NH-(алкилен)-NH-С(=O)-, -С(=O)-NH-(полиалкиленгликоль)-NH-С(=O)-, -С(=O)-(алкилен)-С(=O)-, -С(=O)-(полиалкиленгликоль)-С(=O)- и циклоалкила,
X представляет собой N;
Y представляет собой С1-3алкилен;
Z выбран из -NZa-C(=O)-NZa-, -C(=O)NZa-, -NZa-C(=O)- и гетероарила; каждый Za независимо выбран из водорода и С1-6алкила; и
(в) L представляет собой полиалкиленгликолевый линкер, соединяющий коровую группировку с NHE-ингибирующими низкомолекулярными группировками;
где гетероарил представляет собой азепинил, акридинил, бензимидазолил, бензотиазолил, бензиндолил, бензодиоксолил, бензофуранил, бензооксазолил, бензотиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, 1,4-бензодиоксанил, бензонафтофуранил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензопиранил, бензопиранонил, бензофуранил, бензофуранонил, бензотиенил, бензотриазолил, бензо[4,6]имидазо[1,2-а]пиридинил, карбазолил, циннолинил, дибензофуранил, дибензотиофенил, фуранил, фуранонил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, нафтиридинил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 1-оксидопиридинил, 1-оксидопиримидинил, 1-оксидопиразинил, 1-оксидопиридазинил, 1-фенил-1Н-пирролил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пирролил, пиразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, хиназолинил, хиноксалинил, хинолинил, хинуклидинил, изохинолинил, тетрагидрохинолинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазинил или тиенил.
3. Соединение или его фармацевтически приемлемая соль по п. 1 или 2, где NHE-ингибирующая низкомолекулярная группировка имеет следующую структуру:
где каждый R1, R2 и R3 независимо выбран из Н, галогена, -NR7(CO)R8, -(CO)NR7R8, -SO2-NR7R8, -NR7SO2R8, -NR7R8, -OR7, -SR7, -O(CO)NR7R8, -NR7(CO)OR8 и -NR7SO2NR8, где R7 и R8 независимо выбраны из H, C1-6алкила, -С1-6алкил-ОН или связи, присоединяющей NHE-ингибирующую небольшую молекулу к L, при условии, что по меньшей мере один из них представляет собой связь, присоединяющую NHE-ингибирующую небольшую молекулу к L.
4. Соединение или его фармацевтически приемлемая соль по п. 1 или 2, где NHE-ингибирующая низкомолекулярная группировка имеет одну из следующих структур:
5. Соединение или его фармацевтически приемлемая соль по п. 1, где X представляет собой C(X1).
6. Соединение или его фармацевтически приемлемая соль по п. 1, где X представляет собой N.
7. Соединение или его фармацевтически приемлемая соль по п. 1 или 2, выбранные из: 
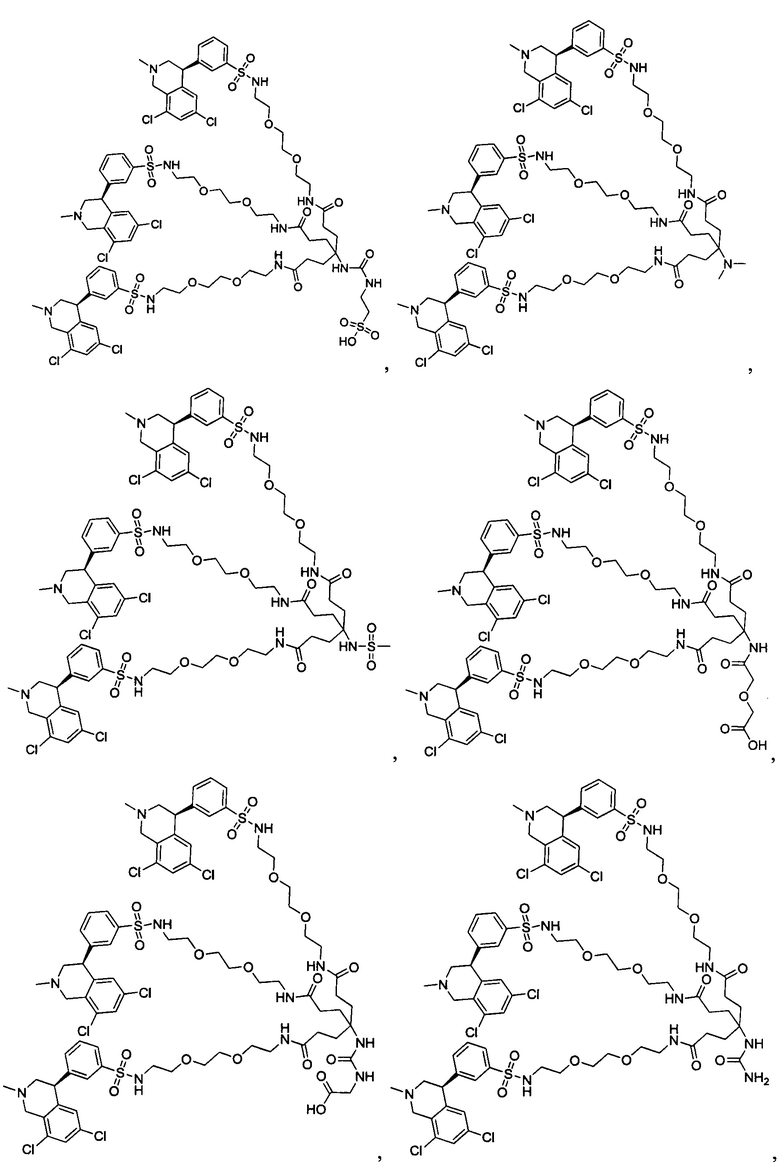
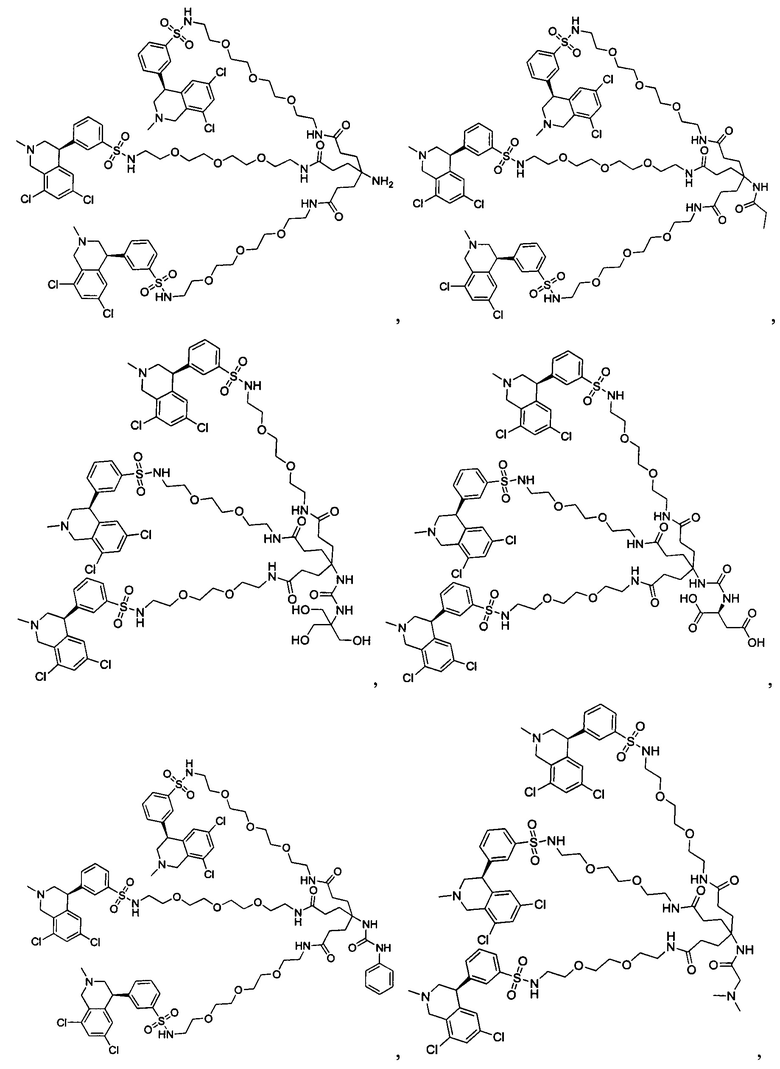
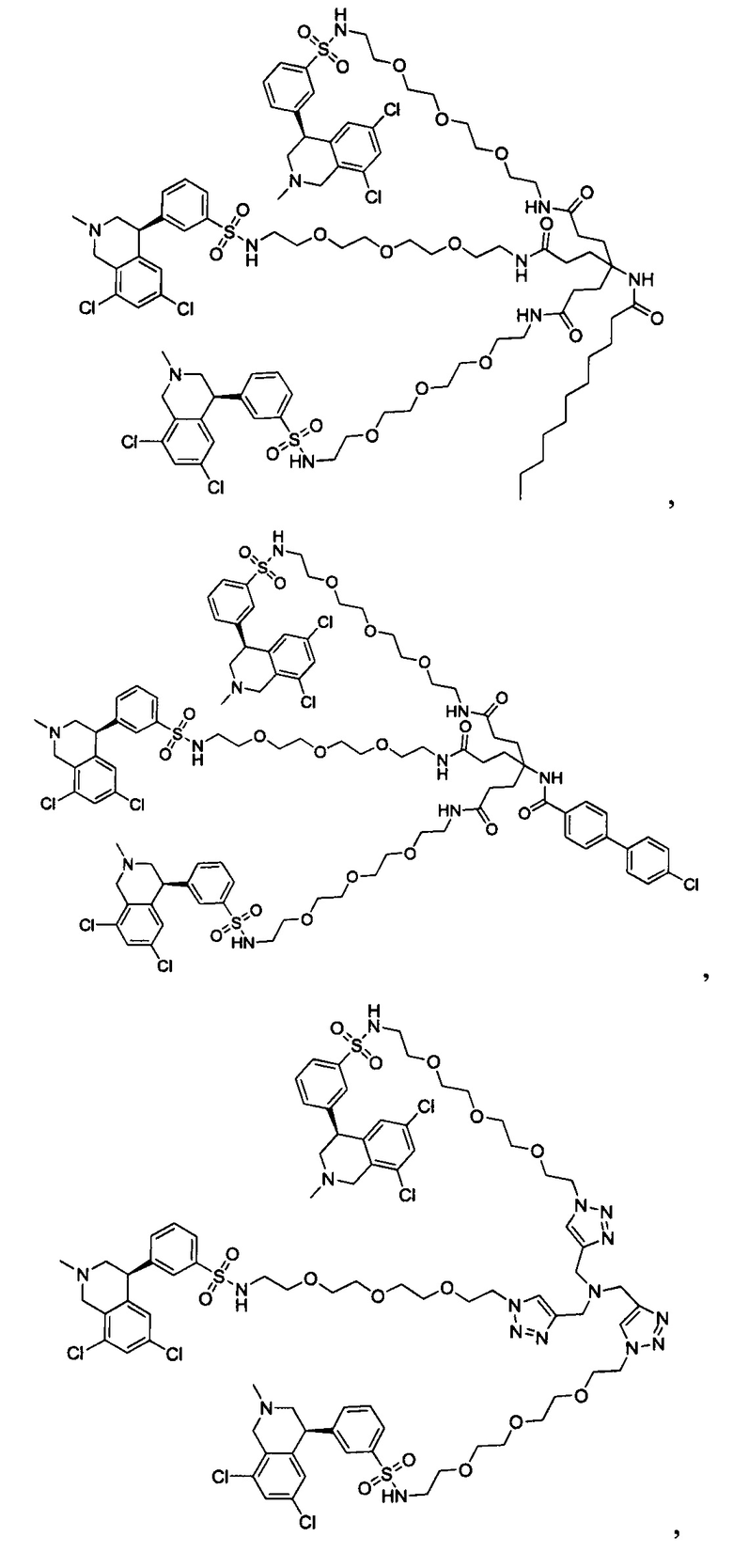
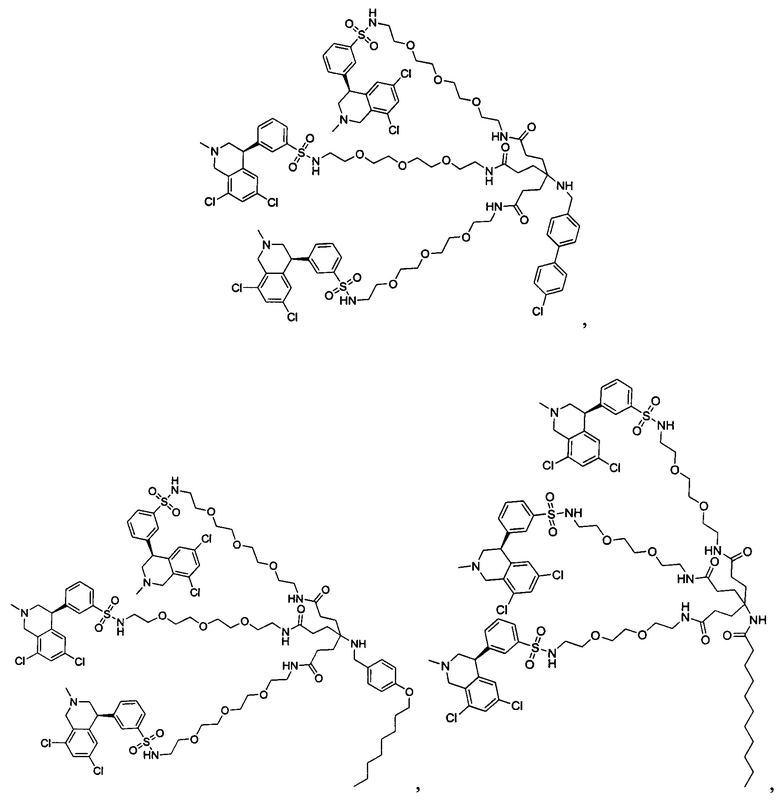
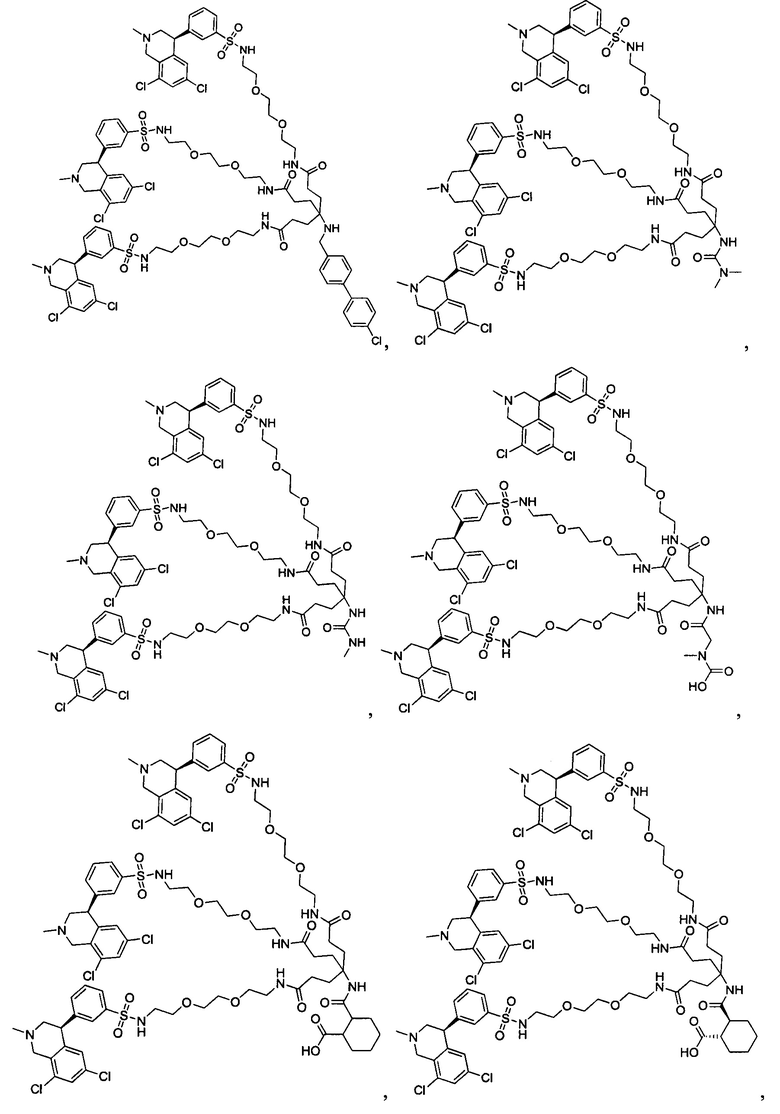
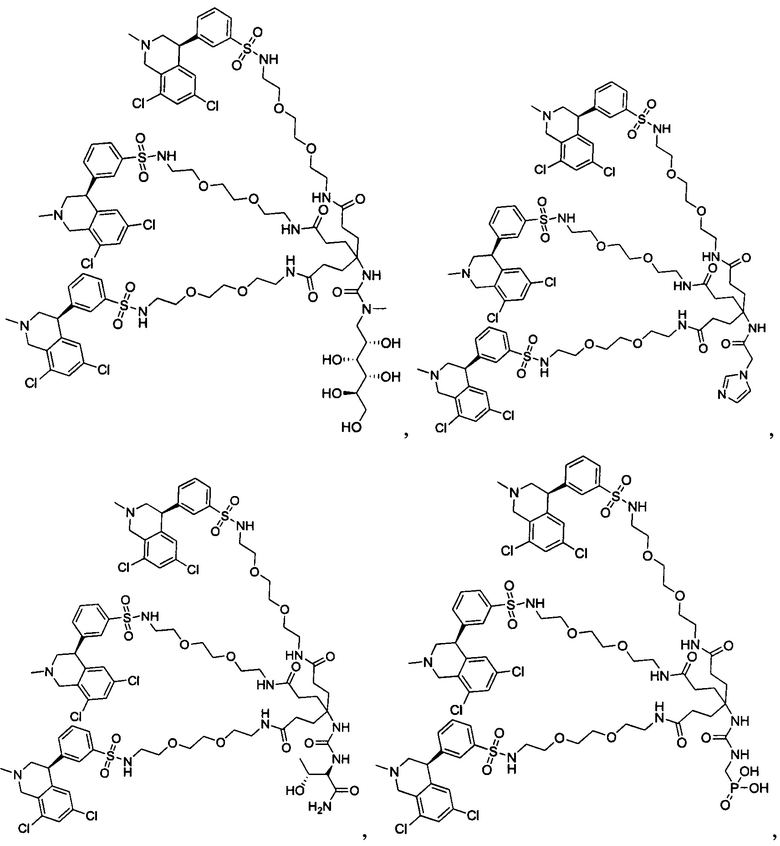
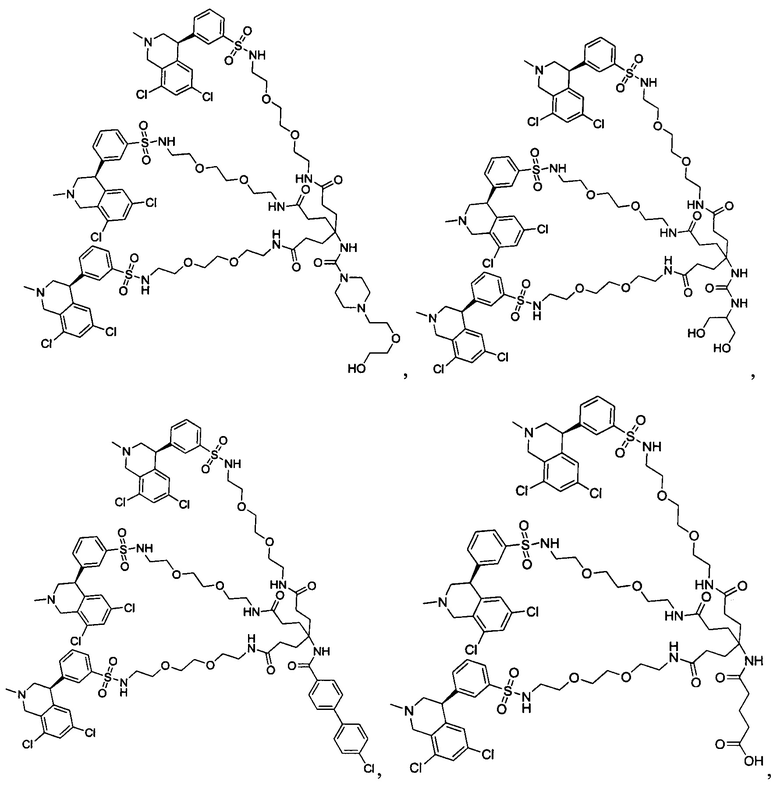
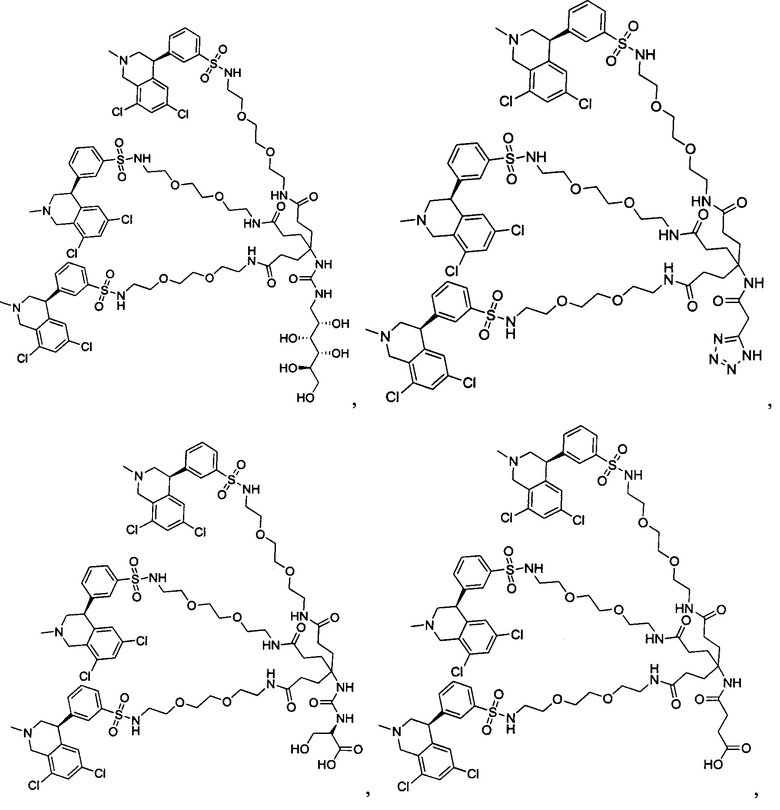
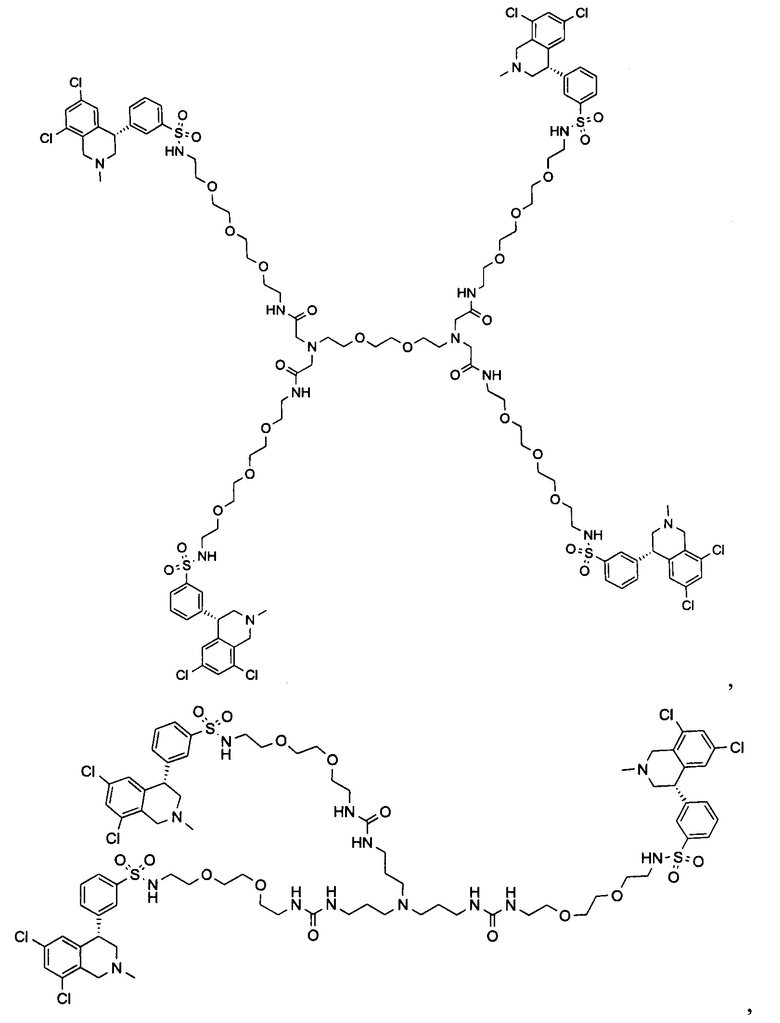
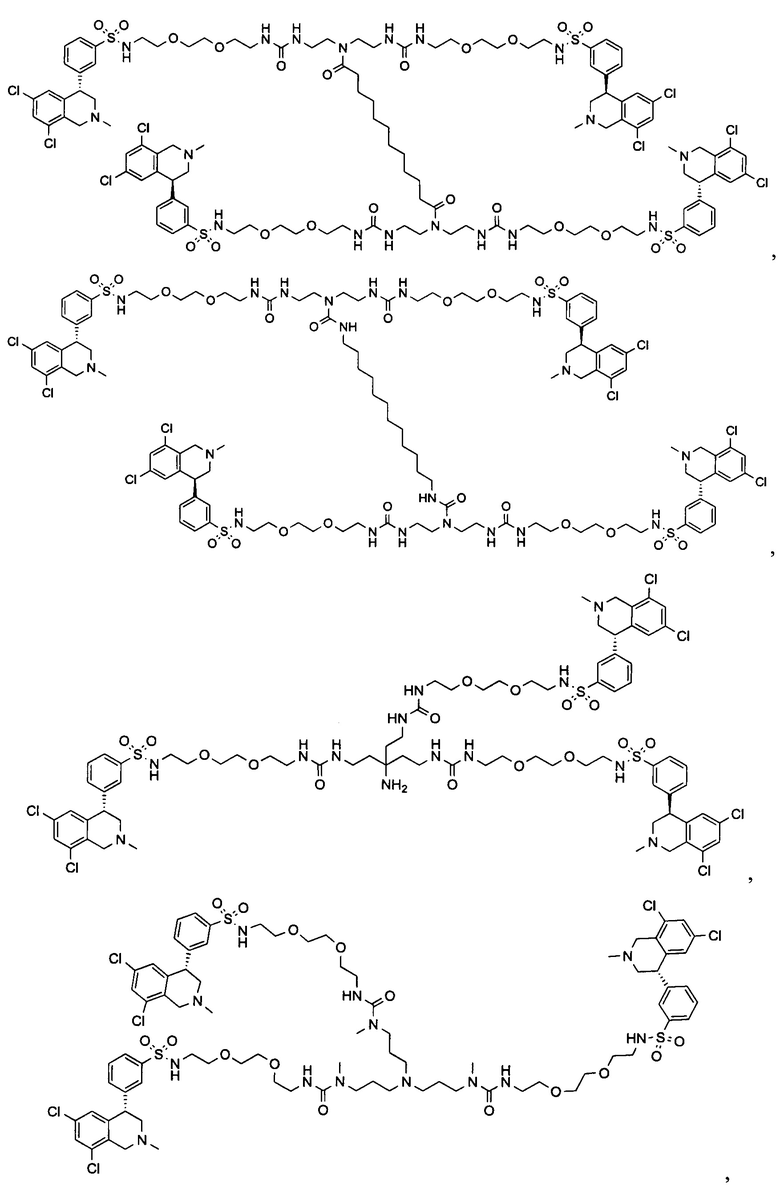
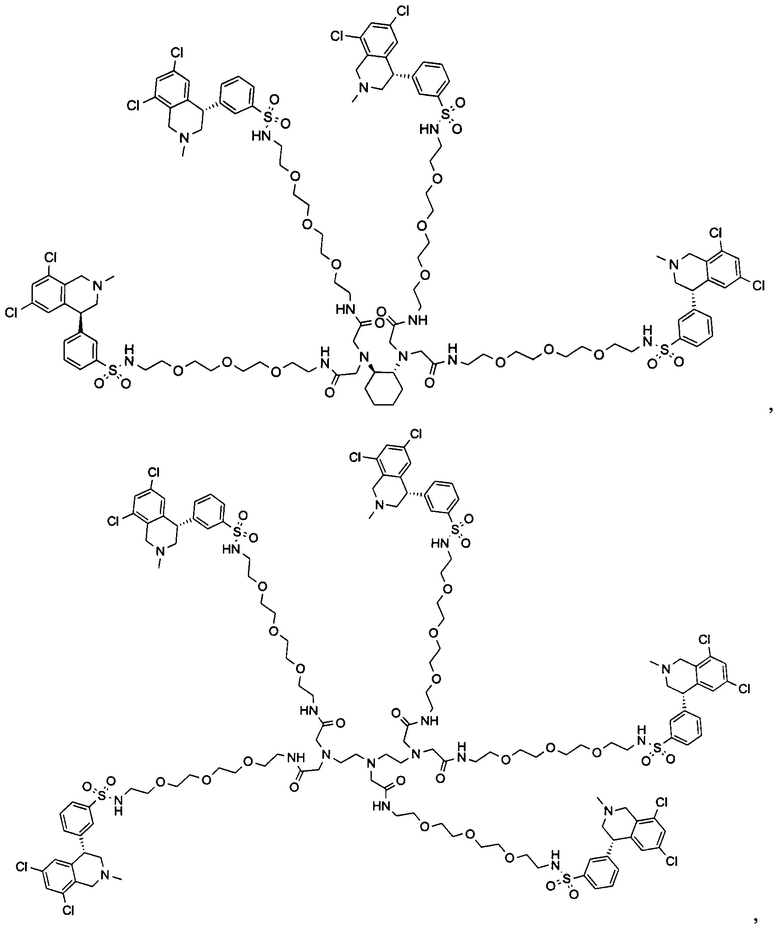
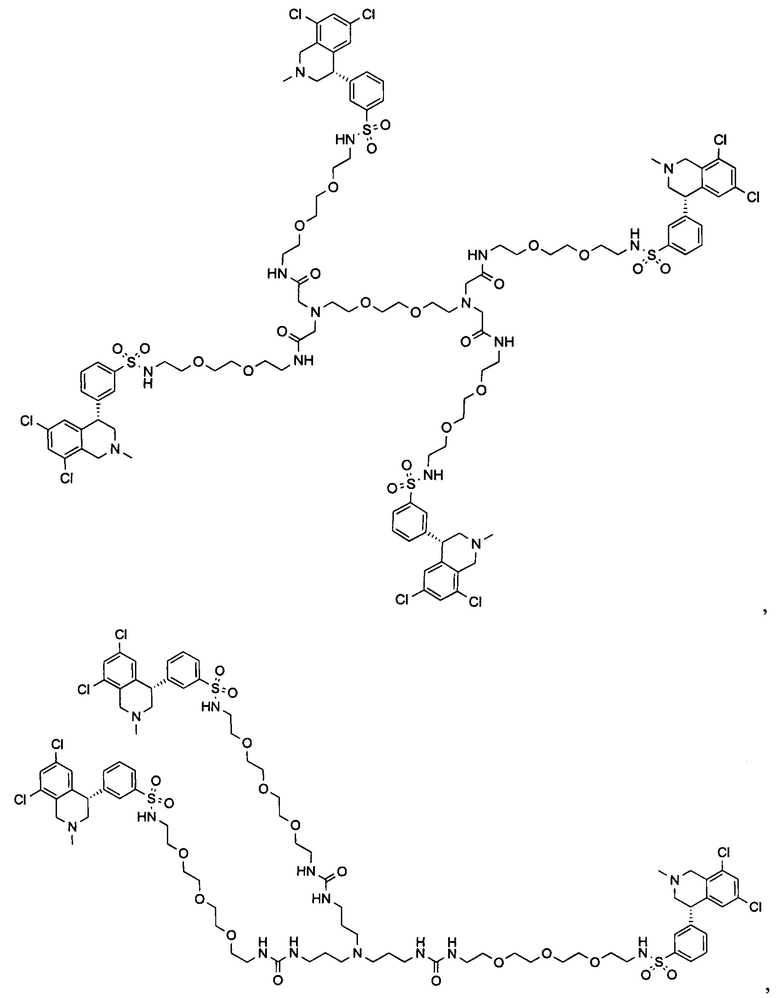
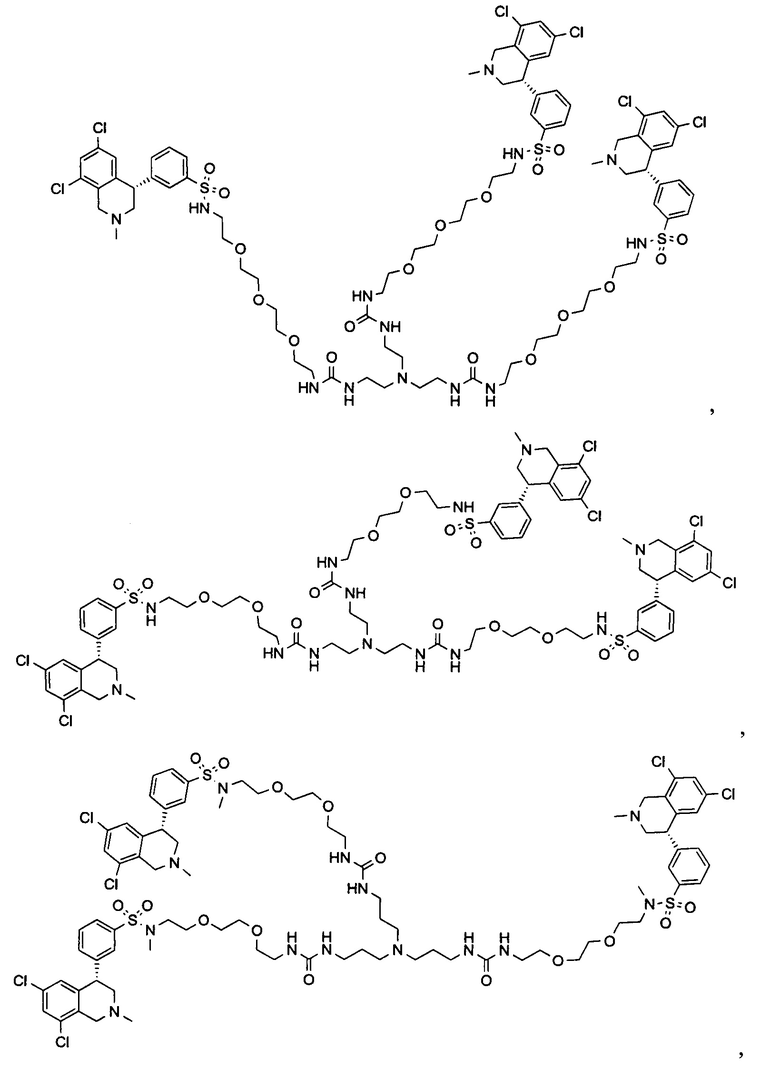
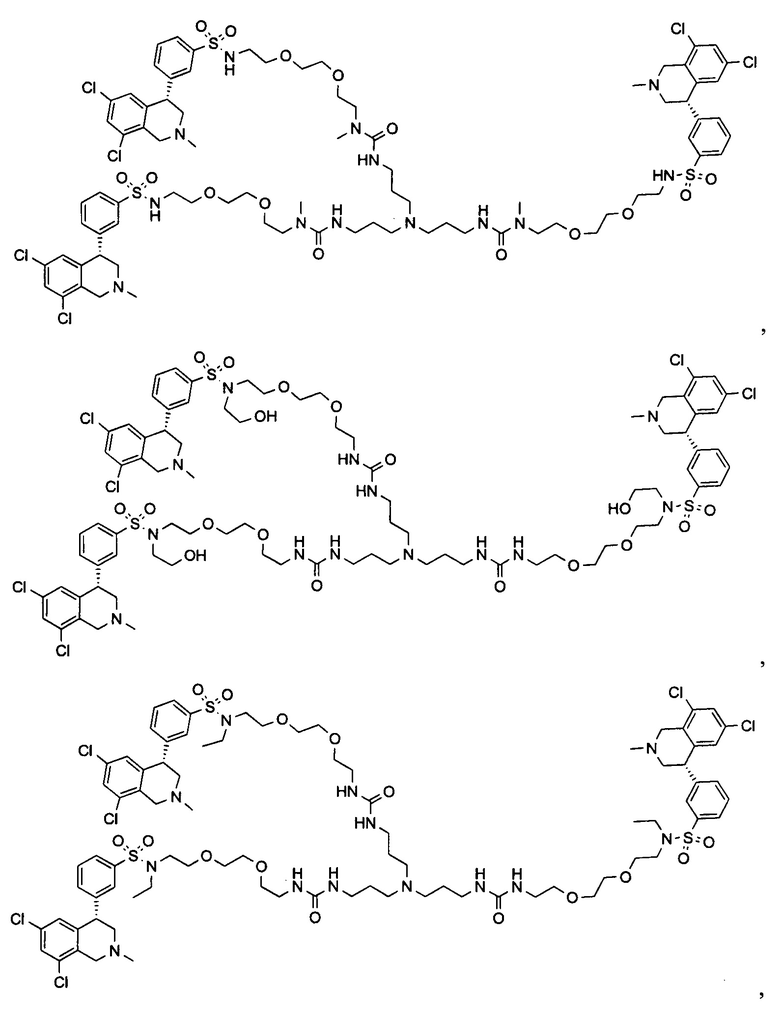
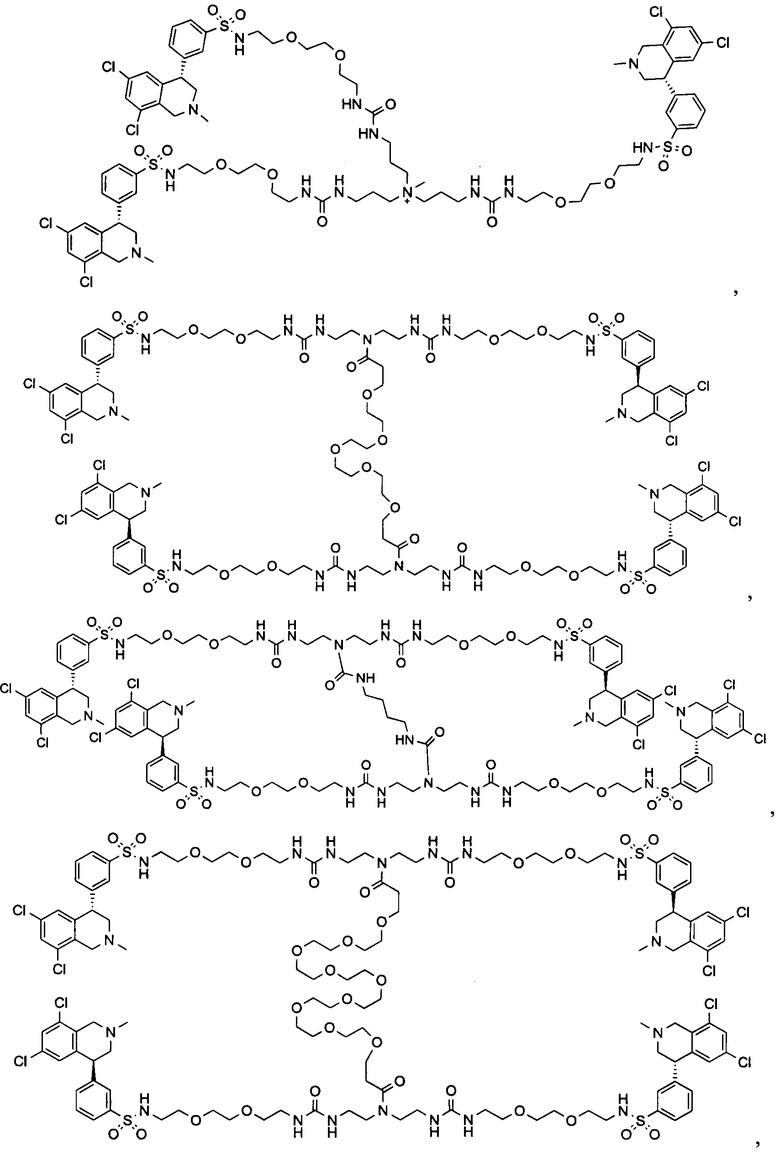
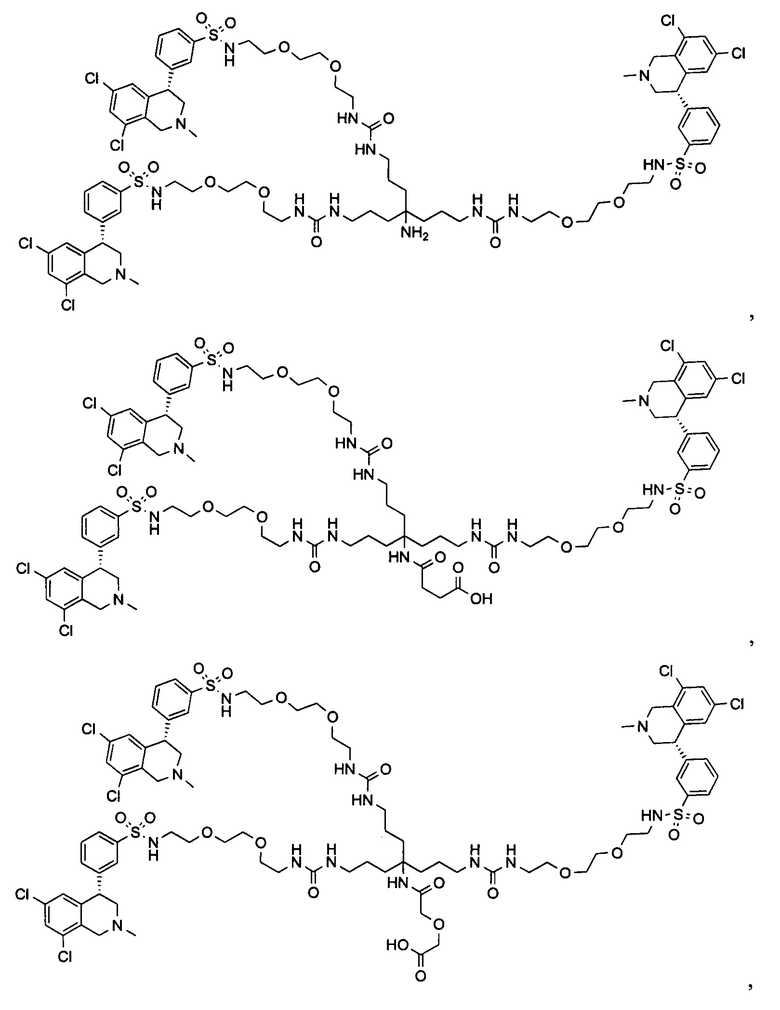
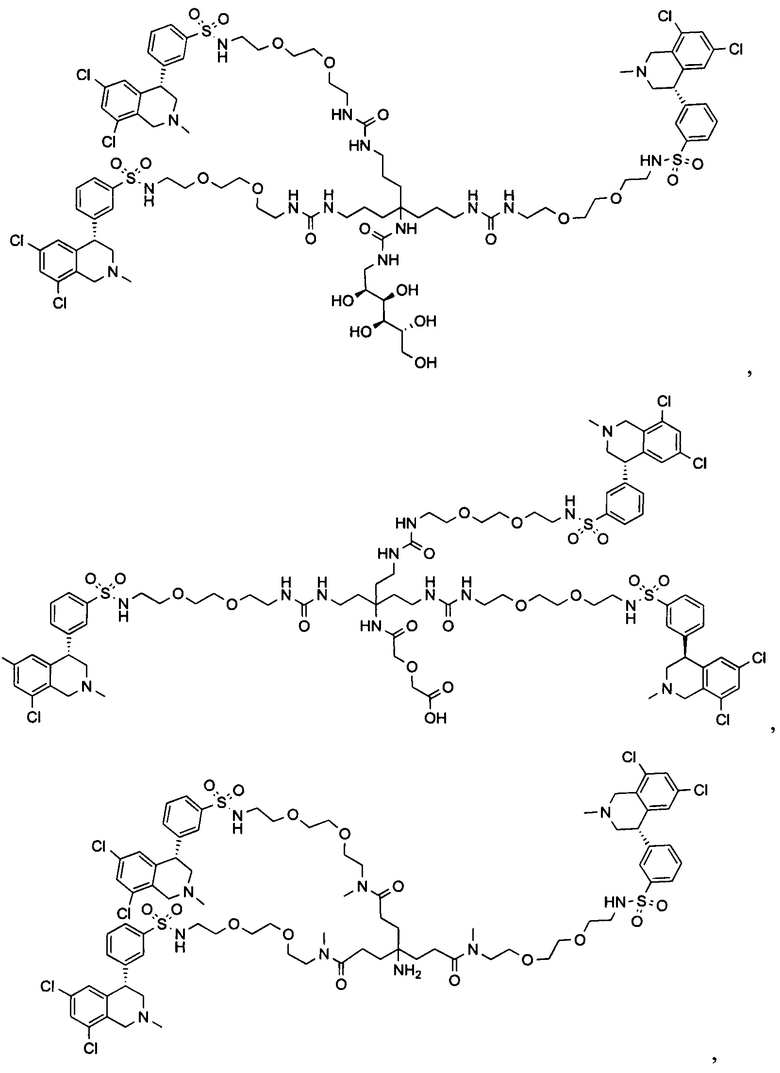
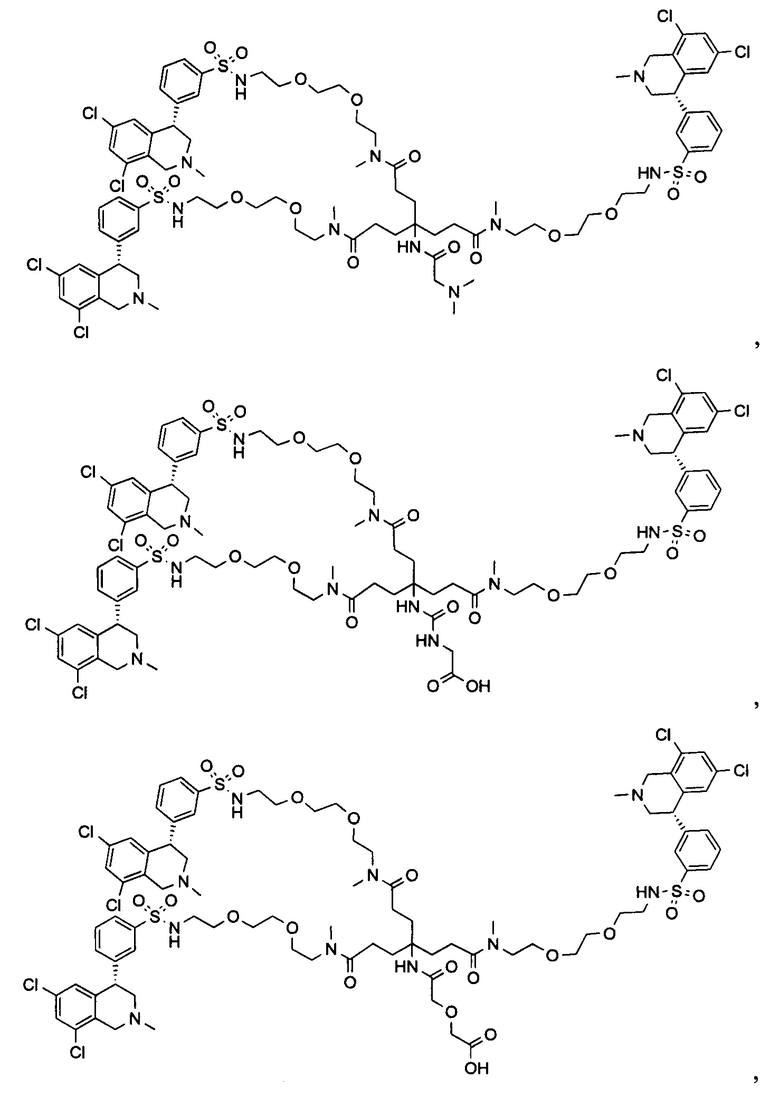
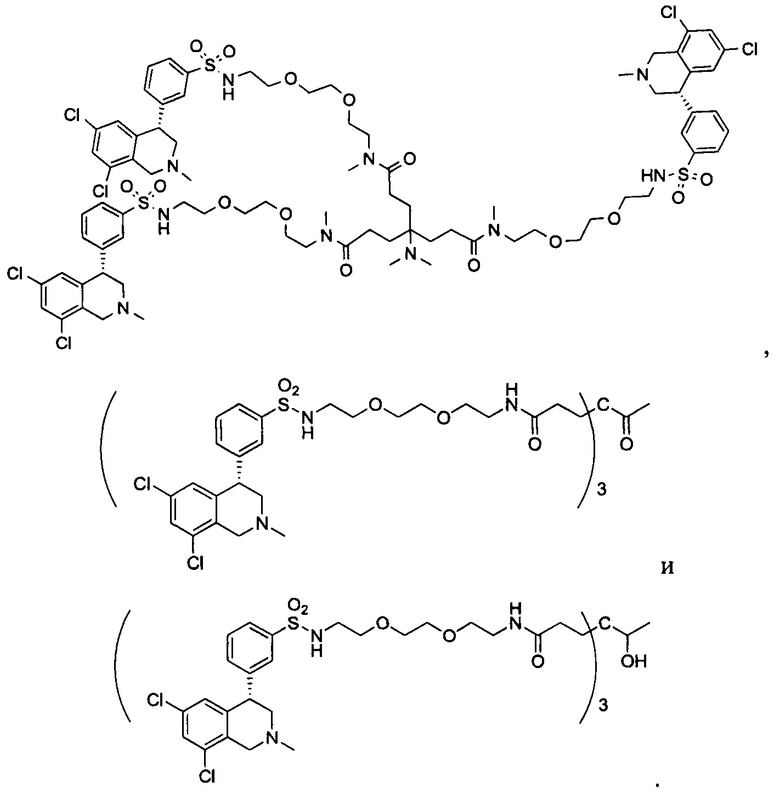
8. Фармацевтическая композиция, содержащая соединение по любому из пп. 1-7 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или эксципиент.
9. Применение соединения или его фармацевтически приемлемой соли по любому из пп. 1-7 для ингибирования NHE-опосредованного антипорта ионов натрия и водорода.
10. Применение соединения или его фармацевтически приемлемой соли по любому из пп. 1-7 в лечении синдрома раздраженной толстой кишки.
11. Применение соединения или его фармацевтически приемлемой соли по любому из пп. 1-7 в лечении хронического заболевания почек.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Б.В | |||
| Некрасов | |||
| Основы общей химии | |||
| Москва, Химия, 1973, стр | |||
| Уровень с пузырьком | 1922 |
|
SU388A1 |
| US 6451781 B1, 17.09.2002 | |||
| А.Е | |||
| Чичибабин | |||
| Основные начала органической химии, изд | |||
| пятое, под ред | |||
| П.Г | |||
| Сергеева, том II, Гос | |||
| Научно-техническое издательство химической литературы, Москва, 1957, с | |||
| Способ выделения сульфокислот из нефтяных масел | 1913 |
|
SU508A1 |
Авторы
Даты
2019-04-04—Публикация
2013-08-20—Подача