Техническая область
Настоящее изобретение относится к активатору глюкокиназы, включающему в качестве активного ингредиента арилоксизамещенное производное бензимидазола и пригодному в области лекарственных средств. Далее, оно относится к новому арилоксизамещенному производному бензимидазола.
Уровень техники
Глюкокиназа (ГК) (АТФ: D-гексоз-6-фосфотрансфераза, EC 2,7.1,1) является одной (гексокиназа IV) из четырех гексокиназ млекопитающих. Гексокиназа представляет собой фермент первой ступени гликолиза и катализирует реакцию от глюкозы до гексафосфата глюкозы. В отношении экспрессии глюкокиназа ограничена по существу бета-клетками печени и поджелудочной железы и контролирует ограничивающий скорость этап метаболизма глюкозы в этих клетках, таким образом, играя важную роль в системном сахарном обмене. Глюкокиназа в бета-клетках печени и глюкокиназа в бета-клетках поджелудочной железы отличаются друг от друга в том, что касается N-концевой последовательности из 15 аминокислот вследствие различия в сплайсинге, но они являются одинаковыми в отношении ферментативного свойства. Ферментативная активность других трех гексокиназ (I, II, III) кроме глюкокиназы насыщена при концентрации глюкозы самое большее 1 мМ, но Км глюкокиназы к глюкозе составляет 8 мМ и близко к физиологическому уровню сахара в крови. Поэтому в соответствии с изменением уровня сахара в крови от нормального уровня сахара в крови (5 мМ) к увеличенному уровню сахара в крови после введения пищи (10-15 мМ) межклеточный метаболизм глюкозы ускоряется посредством глюкокиназы.
Десять лет назад была предложена гипотеза, что глюкокиназа может действовать как сенсор глюкозы в бета-клетках поджелудочной железы и печени (например, см. Garfinkel D. et al. Computer modeling identifies glucokinase as glucose sensor of pancreatic beta-cells; American Journal Physiology, Vol.247 (3Pt2), 1984, pp.527-536).
Результат недавнего исследования глюкокиназы с управляемым геном глюкокиназы на модели мыши подтвердил, что глюкокиназа действительно играет важную роль в системном гомеостазе глюкозы. Мыши, у которых был разорван ген глюкокиназы, умирают вскоре после рождения (например, см. Grupe A. et al. Transgenic knockouts reveal a critical requirement for pancreatic beta cell glucokinase in maintaining glucose homeostasis; Cell, Vol.83, 1995, pp.69-78); но, с другой стороны, нормальные мыши или мыши с диабетом, в организме которых глюкокиназа чрезмерно экспрессируется, имеют пониженный уровень сахара в крови (например, см. Ferre T. et al., Correction of diabetic alterations by glucokinase; Proceedings of the National Academy of Sciences of the USA, Vol.93, 1996, pp.7225-7230).
С увеличением концентрации глюкозы реакция бета-клеток поджелудочной железы и клеток печени ведет в обоих случаях к сокращению уровня сахара в крови, но при этом различается. Бета-клетки поджелудочной железы секретируют больше инсулина, а печень поднимает сахар, чтобы сохранить его в форме гликогена, и одновременно уменьшает высвобождение сахара.
В рамках обеспечения этого эффекта изменение в ферментативной активности глюкокиназы играет важную роль в гомеостазе глюкозы млекопитающего через бета-клетки печени и поджелудочной железы. В случаях ювенильного диабета, который упоминается как MODY2 (maturity-onset diabetes of the young), была найдена мутация гена глюкокиназы, и сокращение глюкокиназной активности вызывает увеличение уровня сахара в крови (например, см. Vionnet N. et al., Nonsense mutation in the glucokinase gene causes early-onset non-insulin-dependent diabetes mellitus; Nature Genetics, Vol.356, 1992, pp.721-722).
С другой стороны, была обнаружена генеалогия, имеющая мутацию, увеличивающую глюкокиназную активность, и ее представители показывают низкие симптомы уровня сахара в крови (например, см. Glaser B. et al. Familial hyperinsulinism caused by an activating glucokinase mutation; New England Journal Medicine, Vol.338, 1998, pp.226-230).
Таким образом, глюкокиназа действует как сенсор глюкозы и играет важную роль в гомеостазе глюкозы также у человека. С другой стороны, регулирование уровня сахара в крови с использованием глюкокиназной сенсорной системы может быть возможно у многих пациентов с диабетом типа II. Можно предположить, что глюкокиназа-активирующее вещество обладает стимулирующим действием в отношении секреции инсулина в бета-клетках поджелудочной железы и активностью в отношении ускорения захвата сахара и ингибирования высвобождения сахара в печени и поэтому может быть полезным в лечении пациентов с диабетом типа II.
Недавно стало ясно, что глюкокиназа поджелудочной железы бета-клеточного типа экспрессируется исключительно локально в мозге крыс, особенно в вентромедиальном гипоталамусе (VMH). Приблизительно 20% нейронов в VMH упоминаются как чувствительные к глюкозе нейроны, и поэтому считается, что они могут играть важную роль в регулировании массы тела. Когда глюкозу вводят в мозг крысы, это уменьшает количество потребляемой пищи; но когда метаболизм глюкозы замедлен через внутрицеребральное введение глюкозамина, аналога глюкозы, это вызывает гиперфагию. На основании электрофизиологического эксперимента сделано допущение, что чувствительные к глюкозе нейроны активируются в соответствии с изменением физиологической концентрации глюкозы (5-20 мМ), но когда метаболизм глюкозы ингибируется глюкозамином или подобными препаратами, тогда их активность замедляется. В чувствительной к концентрации глюкозы системе в VHM ожидается опосредуемый глюкозой механизм, такой как секреция инсулина в бета-клетках поджелудочной железы. Соответственно, может существовать возможность, что вещество для активации глюкокиназы в VHM, в дополнение к бета-клеткам печени и поджелудочной железы, может быть эффективным не только для коррекции уровня сахара в крови, но также и для лечения ожирения, которое представляет собой проблему для многих пациентов с диабетом типа II.
Это указывает, что соединения, обладающие глюкокиназа-активизирующим действием, пригодны как терапевтические и/или профилактические средства для профилактики и/или лечения диабета, как терапевтические и/или профилактические средства для профилактики и/или лечения осложнений диабета, таких как ретинопатия, нефропатия, невроз, ишемическая болезнь сердца, артериосклероз и т.п., и как терапевтические и/или профилактические средства для профилактики и/или лечения ожирения.
В отношении производных бензимидазола, например, описано соединение следующей формулы (например, WO 2002/032872):
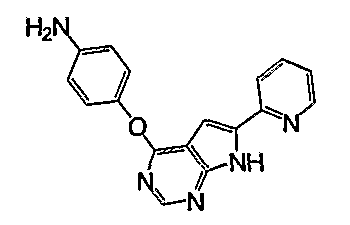
Соединение указанной формулы подобно соединению согласно настоящему изобретению в том, что они имеют 2-пиридинильную группу в положении 6 их 7H-пирроло[2,3-d]пиримидинильного скелета, группу фенокси в положении 4, но различаются структурно в том, что первое имеет один заместитель на 7H-пирроло[2,3-d]пиримидинильной группе, и тем, что в первом заместитель на феноксигруппе является аминогруппой.
Далее, указанное соединение представляет собой промежуточное соединение для получения соединения, ингибирующего ангиогенез, и не описано и не предполагается, что это соединение может быть полезным для лечения и/или профилактики определенного диабета и ожирения.
Раскрытие изобретения
Проблемы, которые решает изобретение
Объектом настоящего изобретения является новое арилоксизамещенное производное имидазола и включающий его активатор глюкокиназы, особенно как терапевтические и/или профилактические средства для лечения и/или профилактики диабета и ожирения.
Авторы провели глубокие исследования, чтобы разработать новое лекарственное средство для лечения диабета, которое обладает фармацевтическим потенциалом, превосходящим потенциал существующих лекарственных средств для лечения диабета вследствие эффекта, отличного от эффекта существующих лекарственных средств, и которое обладает дополнительным фармацевтическим потенциалом, и в результате обнаружили, что новое арилоксизамещенное производное бензимидазола имеет глюкокиназа-активирующий эффект, и осуществили настоящее изобретение.
В частности, изобретение относится к следующему:
(1) соединение формулы (I):
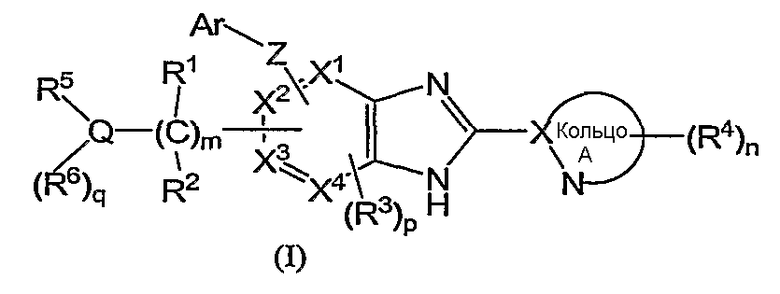
или его фармацевтически приемлемая соль, в которой:
R1 и R2, каждый независимо, обозначают атом водорода, атом галогена, низший алкил, гидроксильную группу, цианогруппу или низший алкокси;
R3 независимо обозначает атом водорода, атом галогена, низший алкил, низший алкокси, гидроксиалкил, трифторметил, низший алкенил или цианогруппу;
R4 независимо обозначает атом водорода, низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, аминоалкил, необязательно замещенный низшим алкилом, алканоил, карбоксильную группу, низший алкоксикарбонил или цианогруппу;
Q обозначает атом углерода, атом азота или атом серы, необязательно замещенный одной или двумя оксогруппами;
R5 и R6, каждый независимо, обозначают атом водорода, низший алкил, атом галогена, низший алкил, низший алкилсульфонил, низший алкилсульфинил, алканоил, формил, арил, моно- или ди-(низший) алкилкарбамоил или моно- или ди-(низший) алкилсульфамоил; или Q, R5 и R6 вместе могут образовывать следующее:
(A) 5- или 6-членную алифатическую азотсодержащую гетероциклическую группу, которая может иметь в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, и имеющую по меньшей мере один атом азота в дополнение к гетероатомам; указанная гетероциклическая группа может иметь одну или две двойные связи;
(B) 5- или 6-членную ароматическую азотсодержащую гетероциклическую группу, которая может иметь в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, и имеющую по меньшей мере один атом азота в дополнение к гетероатомам; или
(C) фенил,
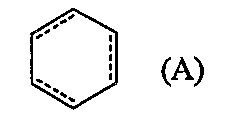
и алифатическая азотсодержащая гетероциклическая группа, ароматическая азотсодержащая гетероциклическая группа или фенил могут иметь от 1 до 3 групп, выбранных из следующей группы заместителей α, и/или могут иметь, в качестве заместителя, (3-6)-членное кольцо, образованное соединением друг с другом связываемых групп, выбранных из группы заместителей α, и/или могут конденсироваться с группой формулы (A):
в которой  обозначает простую связь или двойную связь;
обозначает простую связь или двойную связь;
Х1, Х2, Х3 и Х4, каждый независимо, обозначают атом углерода или атом азота;
Z обозначает атом кислорода, атом серы или атом азота;
Ar обозначает арил или гетероарил, необязательно замещенный группами числом от 1 до 3, выбранными из следующей группы заместителей β;
кольцо A обозначает 5- или 6-членную азотсодержащую гетероароматическую группу формулы (III):
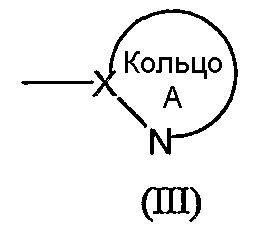
в которой X обозначает атом углерода;
m обозначает целое число от 1 до 6;
n обозначает целое число от 0 до 3;
p обозначает целое число от 0 до 2; при условии, что по меньшей мере два из X1-X4 обозначают атомы водорода;
q обозначает 0 или 1;
группа заместителей α:
оксогруппа, тиоксогруппа, низший алкил, низший алкокси, алканоил, формил, гидроксильная группа, карбоксильная группа, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, цианогруппа, моно - или ди-(низший) алкилкарбамоил, низший алкилсульфинил, низший алкилсульфонил и атом галогена;
группа заместителей β:
низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, низший алкилсульфонил, низший алкилсульфанил, низший алкилсульфинил, аминоалкил, необязательно замещенный низшим алкилом, алканоил, карбоксильная группа, моно- или ди-(низший) алкилкарбамоил, моно- или ди-(низший) алкилсульфамоил, низший алкоксикарбонил, цианогруппа, арил и гетероарил, имеющий в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы;
указанный арил и гетероарил могут иметь одну или две группы, выбранные из следующей группы заместителей γ;
группа заместителей γ:
низший алкил, низший алкокси, атом галогена, гидроксильная группа, низший алкилсульфонил, низший алкилсульфинил, алканоил, цианогруппа, моно- или ди-(низший) алкилкарбамоил;
(2) Соединение или фармацевтически приемлемая соль согласно (1), в котором кольцо A представляет собой тиазолил, имидазолил, изотиазолил, тиадиазолил, триазолил, оксазолил, изоксазолил, пиразинил, пиридил, пиридазинил, пиразолил или пиримидинил;
(3) Соединение или фармацевтически приемлемая соль по пунктам, в котором кольцо A представляет собой тиазолил, имидазолил, изотиазолил, тиадиазолил, триазолил, оксазолил, изоксазолил, пиразинил, пиридил, пиридазинил, пиразолил или пиримидинил, и формула (I) представлена следующей формулой (I-1):
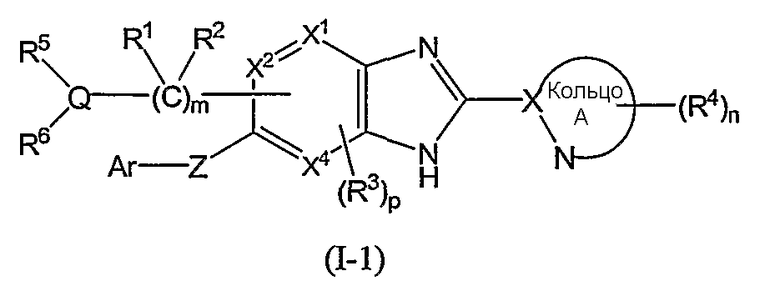
в которой символы имеют те же самые значения, как определено выше;
(4) Соединение или фармацевтически приемлемая соль согласно (1), в котором кольцо A представляет собой тиазолил, имидазолил, изотиазолил, тиадиазолил, триазолил, оксазолил, изоксазолил, пиразинил, пиридил, пиридазинил, пиразолил или пиримидинил, и формула (I) представлена формулой (I-2):
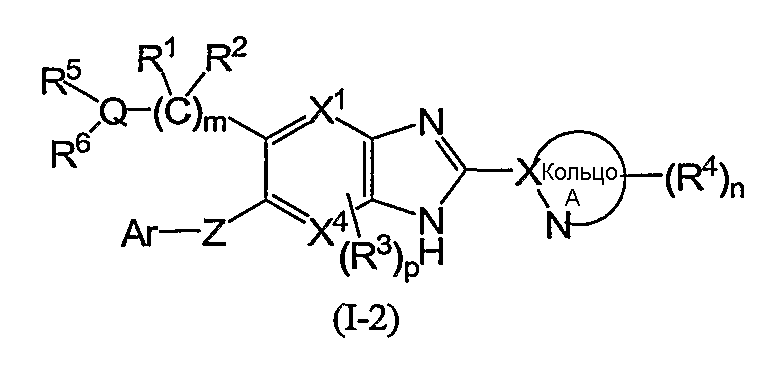
в которой символы имеют те же самые значения, как определено выше;
(5) Соединение или фармацевтически приемлемая соль согласно (1), в котором кольцо A представляет собой тиазолил, имидазолил, изотиазолил, тиадиазолил, триазолил, оксазолил, изоксазолил, пиразинил, пиридил, пиридазинил, пиразолил или пиримидинил, и формула (I) представлена формулой (I-3):
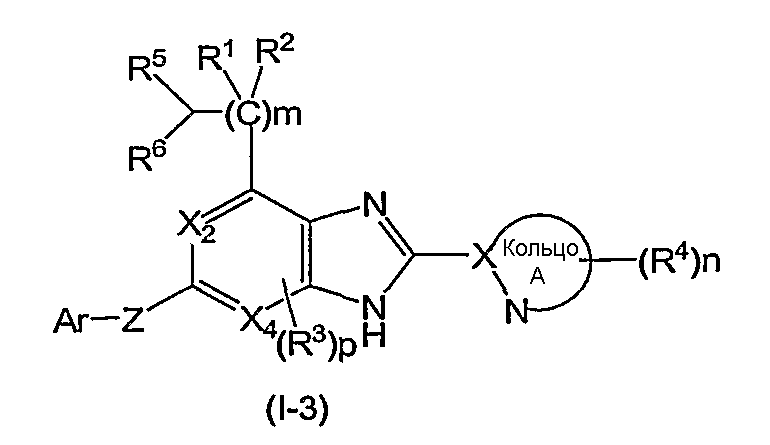
в которой символы имеют те же самые значения, как определено выше;
(6) Соединение или фармацевтически приемлемая соль согласно (3), в котором m составляет от 1 до 4;
(7) Соединение или фармацевтически приемлемая соль согласно (3), в котором Z обозначает атом кислорода или атом серы;
(8) Соединение или фармацевтически приемлемая соль согласно (3), в котором Ar обозначает фенил, фурил, тиенил, пирролил, имидазолил, триазолил, пиразолил, тиазолил, тиадиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиримидинил, пиридазинил или пиразинил, который может быть замещен группой, выбранной из группы заместителей β;
(9) Соединение или фармацевтически приемлемая соль согласно (3), в котором R5 и R6, каждый независимо, обозначают атом водорода, низший алкил, атом галогена, низший алкил, низший алкилсульфонил, низший алкилсульфинил, алканоил или формил;
(10) Соединение или фармацевтически приемлемая соль согласно (3), в котором Q обозначает атом азота;
(11) Соединение или фармацевтически приемлемая соль согласно (3), в котором Q обозначает атом углерода;
(12) Соединение или фармацевтически приемлемая соль согласно (3), в котором группа формулы (I-A):
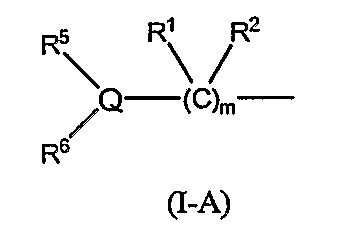
в формуле (I-1) представляет собой группу следующей формулы:
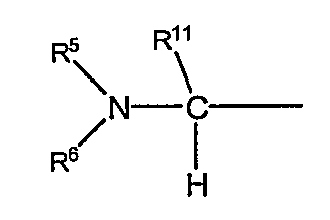
в которой R11 обозначает атом водорода или низший алкил; а другие символы имеют те же самые значения, как определено выше;
(13) Соединение или фармацевтически приемлемая соль согласно (3), в котором:
Q обозначает атом азота;
R5 и R6 вместе с атомом азота образуют 5- или 6-членную алифатическую азотсодержащую гетероциклическую группу, которая может иметь в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, и имеющую по меньшей мере один атом азота в дополнение к гетероатомам;
указанная 5- или 6-членная алифатическая азотсодержащая гетероциклическая группа может иметь одну или две двойные связи и может быть моно- или дизамещенной одинаковыми или разными группами, выбранными из следующей группы заместителей α1;
m=1;
Z обозначает атом кислорода;
Ar обозначает фенил или пиридил, необязательно моно- или дизамещенный одинаковыми или разными группами, выбранными из следующей группы заместителей β1;
R1 и R2 обозначают независимо атом водорода или низший алкил;
группа заместителей α1:
оксогруппа, тиоксогруппа, низший алкил, низший алкокси, алканоил, атом галогена, цианогруппа, моно- или ди-(низший) алкилкарбамоил;
группа заместителей β1:
низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, низший алкилсульфонил, алканоил, карбоксильная группа, моно- или ди-(низший) алкилкарбамоил, моно- или ди-(низший) алкилсульфамоил, низший алкоксикарбонил, цианогруппа, арил или гетероарил, имеющий в кольце 2 или 3 гетероатома, выбранные из группы, состоящей из атома азота, атома кислорода и атома серы;
указанный арил и гетероарил могут иметь одну или две группы, выбранные из группы заместителей γ;
(14) Соединение или фармацевтически приемлемая соль согласно (3), в котором Q, R5 и R6 вместе образуют 5- или 6-членную ароматическую азотсодержащую гетероциклическую группу, имеющую по меньшей мере один атом азота, необязательно имеющую в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, в дополнение к атому азота, или фенил;
указанная ароматическая гетероциклическая группа или фенил могут иметь от 1 до 3 групп, выбранных из следующей группы заместителей α2;
Z обозначает атом кислорода;
Ar обозначает фенил или пиридил, необязательно моно- или дизамещенный одинаковыми или разными группами, выбранными из следующей группы заместителей β1;
R1 и R2 обозначают независимо атом водорода или низший алкил;
группа заместителей α2:
гидроксильная группа, низший алкил, низший алкокси, алканоил, атом галогена, цианогруппа и моно- или ди-(низший) алкилкарбамоил;
группа заместителей β1:
низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, низший алкилсульфонил, алканоил, карбоксильная группа, моно- или ди-(низший) алкилкарбамоил, моно- или ди-(низший) алкилсульфамоил, низший алкоксикарбонил, цианогруппа, арил или гетероарил, имеющий в кольце 2 или 3 гетероатома, выбранные из группы, состоящей из атома азота, атома кислорода и атома серы;
указанный арил и гетероарил могут иметь одну или две группы, выбранные из группы заместителей γ;
(15) Соединение или его фармацевтически приемлемая соль согласно (1), в котором: формула (I) представляет собой одно из следующих соединений:
1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-тиоксо-2-пирролидинон,
4-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}морфолин-3,5-дион,
3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2,4-дион,
3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2-он,
1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион,
1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метилимидазолидин-2,5-дион,
2-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}изотиазолидин-1,1-диоксид,
3-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон,
1-{[5-{[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион,
1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1H-бензимидазол-6-ил)метил]-2-пирролидинон,
N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-N-метилацетамид,
3-{[5-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион,
5-[4-(этилсульфонил)фенокси]-6-((2-метил-2H-тетразол-5-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол,
5-[4-(этилсульфонил)фенокси]-6-(1-(1-метил-1H-тетразол-5-ил)этил)-2-(2-пиридинил)-1Н-бензимидазол,
1-[(6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он
или
4-(2,6-дифторбензил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол;
(16) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-тиоксо-2-пирролидинон;
(17) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 4-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил]метил}морфолин-3,5-дион;
(18) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2,4-дион;
(19) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2-он;
(20) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион;
(21) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метилимидазолидин-2,5-дион;
(22) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 2-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}изотиазолидин-1,1-диоксид;
(23) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 3-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон;
(24) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 1-{[5-{[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион;
(25) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]-2-пирролидинон;
(26) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-N-метилацетамид;
(27) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 3-{[5-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион;
(28) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 5-[4-(этилсульфонил)фенокси]-6-((2-метил-2H-тетразол-5-ил)метил)-2-(2-пиридинил)-1H-бензимидазол;
(29) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 5-[4-(этилсульфонил)фенокси]-6-(1-(1-метил-1Н-тетразол-5-ил)этил)-2-(2-пиридинил)-1Н-бензимидазол;
(30) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 1-[(6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он;
(31) Соединение или фармацевтически приемлемая соль согласно (1), в котором формула (I) обозначает 4-(2,6-дифторбензил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол;
(32) Фармацевтическая композиция, содержащая следующее от (1) до (3), которая используется для лечения, профилактики и/или задержки развития диабета типа II:
(1) соединение или его фармацевтически приемлемая соль, указанное в (1)-(31),
(2) одно или более соединений, выбранных из следующих групп (a)-(h):
(a) любой другой активатор глюкокиназы,
(b) бис-гуанид,
(c) агонист PPAR,
(d) инсулин,
(e) соматостатин,
(f) ингибитор α-глюкозидазы,
(g) промотор секреции инсулина и
(h) ингибитор DP-IV (ингибитор дипептидилпептидазы IV),
(3) фармацевтически приемлемый носитель;
(33) Активатор глюкокиназы, включающий соединение или фармацевтически приемлемую соль любого из указанных (1)-(31) в качестве активного ингредиента;
(34) Терапевтические и/или профилактические средства для лечения и/или профилактики диабета, содержащие соединение или фармацевтически приемлемую соль любого из указанных (1)-(31) в качестве активного ингредиента;
(35) Терапевтические и/или профилактические средства для лечения и/или профилактики ожирения, содержащие соединение или фармацевтически приемлемую соль любого из указанных (1)-(31) в качестве активного ингредиента.
Лучший способ осуществления изобретения
Значения терминов, используемых в этом описании, описаны ниже, и соединения по изобретению описаны более подробно ниже.
Если специально не указано иное, следующие группы имеют значения, описанные ниже.
"Атом галогена" включает, например, атом фтора, атом хлора, атом брома, атом йода.
"Низший алкил" обозначает прямой или разветвленный алкил, имеющий от 1 до 6 атомов углерода, включая, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, неопентил, изопентил, 1,1-диметилпропил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,2,2-триметилпропил, 1-этил-2-метилпропил.
"Низший алкокси" обозначает гидроксильную группу, в которой атом водорода замещен указанным выше низшим алкилом, и включает, например, метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, гексилокси, изогексилокси.
"Гидроксиалкил" обозначает указанный выше низший алкил, замещенный гидроксильной группой, и включает, например, гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил.
"Низший алкенил" обозначает прямой или разветвленный низший алкенил, имеющий от 2 до 6 атомов углерода, и включает, например, винил, аллил, 1-бутенил, 2-бутенил, 1-пентенил.
"Аминоалкил" обозначает указанный выше алкил, в котором атом водорода замещен аминогруппой, и включает, например, аминометил, аминоэтил, аминопропил.
"Алканоил" обозначает указанный выше алкил, связанный с карбонильной группой, и включает, например, метилкарбонил, этилкарбонил, пропилкарбонил, изопропилкарбонил.
"Низший алкоксикарбонил" обозначает карбоксильную группу, в которой атом водорода замещен указанным выше низшим алкилом, и включает, например, метоксикарбонил, этоксикарбонил, пропилкарбонил, изопропилкарбонил.
"Низший алкилсульфонил" обозначает указанный выше низший алкил, связанный с сульфонильной группой, и включает, например, метилсульфонил, этилсульфонил, изопропилсульфонил, н-пропилсульфонил.
"Низший алкилсульфинил" обозначает указанный выше низший алкил, связанный с сульфинильной группой, и включает, например, метилсульфинил, этилсульфинил, изопропилсульфинил.
"Низший алкилсульфанил" обозначает указанный выше низший алкил, связанный с сульфанильной группой, и включает, например, метилсульфанил, этилсульфанил, изопропилсульфанил.
"Моно-(низший) алкилкарбамоил" обозначает карбамоильную группу, однократно замещенную указанным выше низшим алкилом, и включает, например, метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, бутилкарбамоил, втор-бутилкарбамоил, трет-бутилкарбамоил.
"Ди-(низший) алкилкарбамоил" обозначает карбамоильную группу, дизамещенную одинаковыми или разными низшими алкильными группами из указанных выше, и включает, например, диметилкарбамоил, диэтилкарбамоил, этилметилкарбамоил, дипропилкарбамоил, метилпропилкарбамоил, диизопропилкарбамоил.
"Моно-(низший) алкилсульфамоил" обозначает сульфамоильную группу, однократно замещенную указанным выше низшим алкилом, и включает, например, метилсульфамоил, этилсульфамоил, пропилсульфамоил, изопропилсульфамоил.
"Ди-(низший) алкилсульфамоил" обозначает сульфамоильную группу, дизамещенную одинаковыми или разными низшими алкильными группами из указанных выше, и включает, например, диметилсульфамоил, диэтилсульфамоил, этилметилсульфамоил, изопропилметилсульфамоил.
Для более конкретного раскрытия соединений по изобретению следующей формулы (I):
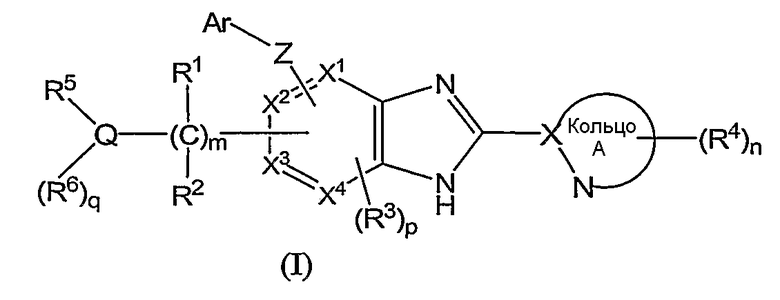
(в которой символы имеют те же самые значения, как определено выше), символы, используемые в этой формуле (I), описаны со ссылкой на их конкретные примеры.
R1 и R2, каждый независимо, обозначают атом водорода, атом галогена, низший алкил, гидроксильную группу, цианогруппу или низший алкокси.
"Атом галогена", "низший алкил" и "низший алкокси" для R1 и R2 имеют те же самые значения, как определено выше.
Предпочтительно один из R1 и R2 обозначает атом водорода, а другой обозначает низший алкил, или оба обозначают атомы водорода. Более предпочтительно оба обозначают атомы водорода.
R3 независимо обозначает атом водорода, атом галогена, низший алкил, низший алкокси, гидроксиалкил, трифторметил, низший алкенил или цианогруппу.
"Атом галогена", "низший алкил", "низший алкокси", "гидроксиалкил" и "низший алкенил" для R3 имеют те же самые значения, как определено выше.
Предпочтительно R3 обозначает атом водорода.
R4 независимо обозначает атом водорода, низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил (атом водорода гидроксильной группы в гидроксиалкиле может быть замещен низшим алкилом), аминоалкил (аминогруппа может быть замещена низшим алкилом), алканоил, карбоксильную группу, низший алкоксикарбонил или цианогруппу.
"Низший алкил", "низший алкокси", "атом галогена", "алканоил" и "низший алкоксикарбонил" для R4 имеют те же самые значения, как определено выше.
"Гидроксиалкил" для R4 включает, в дополнение к определенному выше "гидроксиалкилу", такие группы, где атом водорода в гидроксильной группе замещен низшим алкилом.
"Гидроксиалкил" для R4 включает, например, гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, метоксиметил, метоксиэтил, этоксиэтил.
R4 предпочтительно обозначает атом водорода, низший алкил, атом галогена, трифторметил или гидроксиалкил (атом водорода гидроксильной группы в гидроксиалкильной группе может быть замещен низшим алкилом); более предпочтительно атом водорода, низший алкил, атом галогена или трифторметил.
Q обозначает атом углерода, атом азота или атом серы (атом серы может быть замещен одной или двумя оксогруппами). Q предпочтительно обозначает атом углерода или атом азота.
R5 и R6, каждый независимо, обозначают атом водорода, низший алкил, атом галогена, низший алкил, низший алкилсульфонил, низший алкилсульфинил, алканоил, формил, арил, моно- или ди-(низший) алкилкарбамоил или моно- или ди-(низший) алкилсульфамоил; или Q, R5 и R6 в следующей формуле (II):
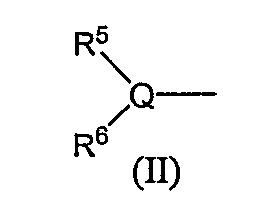
могут вместе образовывать 5- или 6-членную алифатическую азотсодержащую гетероциклическую группу (эта группа может иметь одну или две двойные связи), или ароматическую азотсодержащую гетероциклическую группу, которая может иметь в кольце от 1 до 4 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, или фенил.
Алифатическая азотсодержащая гетероциклическая группа, ароматическая азотсодержащая гетероциклическая группа или фенил могут иметь от 1 до 3 групп, выбранных из следующей группы заместителей α, и/или могут иметь, в качестве заместителя, (3-6)-членное кольцо, образованное соединением друг с другом связываемых групп, выбранных из группы заместителей α, и/или могут быть конденсированы с группой формулы (A):
(в которой  обозначает простую связь или двойную связь).
обозначает простую связь или двойную связь).
"Низший алкил", "атом галогена", "низший алкил", "низший алкилсульфонил", "низший алкилсульфинил" и "алканоил" для R5 и R6 могут иметь те же самые значения, как определено выше.
Группа следующей формулы (II):
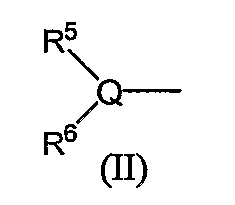
в которой Q является атомом углерода, атомом азота или атомом серы и R5 и R6 обозначают независимо атом водорода, низший алкил, атом галогена, низший алкил, низший алкилсульфонил, низший алкилсульфинил, алканоил, формил, арил, моно- или ди-(низший) алкилкарбамоил или моно- или ди-(низший) алкилсульфамоил, включает, например, ацетиламино, метансульфониламино, бензолсульфонил, бензолсульфинил, метансульфонил. Из них предпочтительными являются ацетиламино, ацетиламинометил, метансульфониламино.
5- или 6-членная алифатическая азотсодержащая гетероциклическая группа (эта группа может иметь одну или две двойные связи), или ароматическая азотсодержащая гетероциклическая группа, которая может иметь в кольце от 1 до 4 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, или фенил, который вместе образуют Q, R5 и R6, является предпочтительно 5- или 6-членной алифатической азотсодержащей гетероциклической группой (эта группа может иметь одну или две двойные связи), содержащей в кольце один или два гетероатома, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, или 5- или 6-членной ароматической азотсодержащей гетероциклической группой, которая может содержать от 1 до 4 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, или фенилом, образуемым вместе Q, R5 и R6.
Заместителем, который может иметь 5- или 6-членная алифатическая азотсодержащая гетероциклическая группа (эта группа может иметь одну или две двойные связи), предпочтительно является оксогруппа, тиоксогруппа, низший алкил, низший алкокси, алканоил, атом галогена, цианогруппа, моно- или ди-(низший) алкилкарбамоил, выбранные из группы заместителей α.
Заместителем, который может иметь 5- или 6-членная ароматическая азотсодержащая гетероциклическая группа или фенил, предпочтительно является гидроксильная группа, низший алкил, низший алкокси, алканоил, атом галогена, цианогруппа, моно- или ди-(низший) алкилкарбамоил, выбранные из группы заместителей α.
Конкретно, 5- или 6-членная алифатическая азотсодержащая гетероциклическая группа формулы (II) включает, например, следующие группы (II-1):
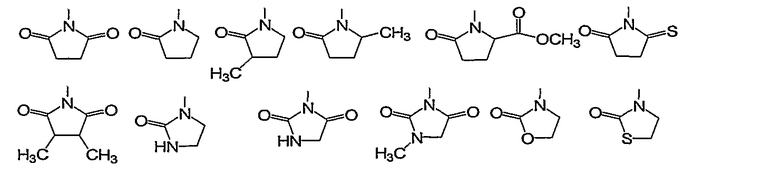
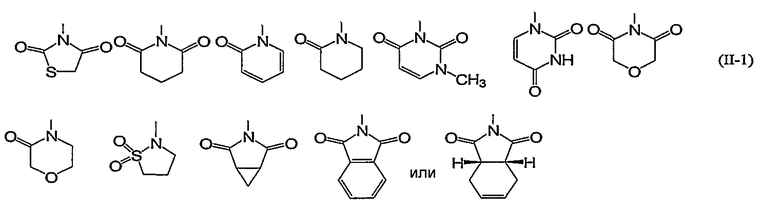
Из них предпочтительными являются группы следующей формулы (II-2):
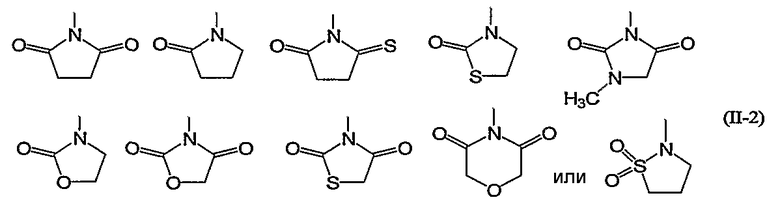
Конкретно, 5- или 6-членная ароматическая азотсодержащая гетероциклическая группа и фенил формулы (II) включают, например, группы следующей формулы (II-2):
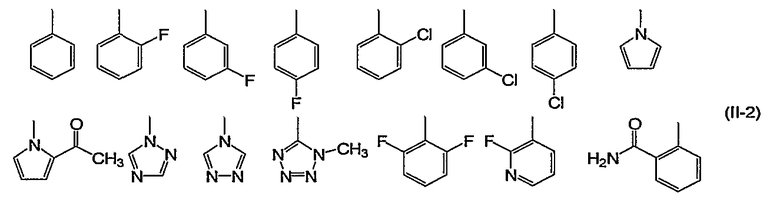
X1, X2, X3 и X4, каждый независимо, обозначают атом углерода или атом азота. Предпочтительно X1-X4 все обозначают атомы углерода.
Z обозначает атом кислорода, атом серы или атом азота, предпочтительно атом кислорода или атом серы, более предпочтительно атом кислорода.
Ar обозначает арил или гетероарил, необязательно замещенный группами числом от 1 до 3, выбранными из группы заместителей β.
"Арил" для Ar включает фенил и нафтил и предпочтительно обозначает фенил.
"Гетероарил" для Ar обозначает 5- или 6-членное моноциклическое кольцо, содержащее в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода.
Конкретно, гетероарил включает, например, фурил, тиенил, пирролил, имидазолил, триазолил, тиазолил, тиадиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиримидинил, пиридазинил, пиразолил, пиразинил. Из них предпочтительным является пиридил.
Заместитель, который может иметь Ar, включает группы, выбранные из указанной выше группы заместителей β. Из них предпочтительными являются низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил (атом водорода гидроксильной группы в гидроксиалкильной группе может быть замещен низшим алкилом), низший алкилсульфонил, алканоил, карбоксильная группа, моно- или ди-(низший) алкилкарбамоил, моно- или ди-(низший) алкилсульфамоил, низший алкоксикарбонил, цианогруппа, арил и гетероарил, содержащий в кольце 2 или 3 гетероатома, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы (арил и гетероарил могут иметь одну или две группы, выбранные из группы заместителей γ).
Группа заместителей γ включает низший алкил, низший алкокси, атом галогена, гидроксильную группу, низший алкилсульфонил, низший алкилсульфинил, алканоил, цианогруппу и моно- или ди-(низший) алкилкарбамоил. Из них предпочтительными являются низший алкилсульфонил, цианогруппа и атом галогена.
Кольцо А обозначает азотсодержащий гетероарил формулы (III):
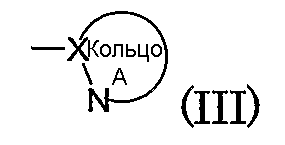
(в которой символы имеют те же самые значения, как определено выше). Кольцо A может иметь в кольце один или два гетероатома, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода, в дополнение к по меньшей мере одному атому азота.
Группа формулы (III) конкретно включает, например, тиазолил, имидазолил, изотиазолил, тиадиазолил, триазолил, оксазолил, изоксазолил, пиразинил, пиридил, пиридазинил, пиразолил и пиримидинил. Из них предпочтительными являются пиридил, тиазолил, пиразолил, пиразинил и тиадиазолил.
n обозначает целое число от 0 до 3, предпочтительно от 0 до 2.
Низший алкил для R4 обозначает, например, предпочтительно метил, этил, пропил.
Низший алкокси для R4 обозначает, например, предпочтительно метокси, этокси, пропокси, изопропокси.
Атом галогена для R4 обозначает, например, предпочтительно атом фтора, атом хлора, атом брома.
Гидроксиалкил для R4 обозначает, например, предпочтительно гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 2-гидрокси-1-метилэтил. Атом водорода гидроксильной группы в гидроксиалкильной группе может быть замещен низшим алкилом. Замещенный низшим алкилом гидроксиалкил включает, например, метоксиметил, этоксиметил.
Аминоалкил для R4 включает, например, метиламино, этиламино, изопропиламино.
Аминогруппа аминоалкила может быть замещена низшим алкилом.
Аминоалканоил для R4 включает, например, ацетиламино, этилкарбониламино, пропилкарбониламино, изопропилкарбониламино.
Низший алкоксикарбонил для R4 включает, например, метоксикарбонил, этоксикарбонил, изопропилкарбонил.
Из указанного выше группа формулы (III-1):
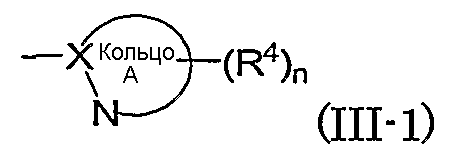
(в которой символы имеют те же самые значения, как определено выше) конкретно включает, например, тиазол-2-ил, 5-хлортиазол-2-ил, 4-метилтиазол-2-ил, 5-метилтиазол-2-ил, 4-гидроксиметилтиазол-2-ил, 4-метоксикарбонилтиазол-2-ил, 4-метоксиметилтиазол-2-ил, 4-цианотиазол-2-ил, 4-фтортиазол-2-ил, имидазол-2-ил, 4-метилимидазол-2-ил, 4-метоксикарбонилимидазол-2-ил, 4-ацетилимидазол-2-ил, 5-гидроксиметилимидазол-2-ил, изотиазол-3-ил, 4-гидроксиметилизотиазол-3-ил, 5-ацетил-[1,3,4]тиадиазол-2-ил, [1,3,4]тиадиазол-2-ил, 5-метил-[1,3,4]тиадиазол-2-ил, 5-фтор-[1,3,4]тиадиазол-2-ил, [1,2,4]тиадиазол-5-ил, 3-метил-[1,2,4]тиадиазол-5-ил, [1,2,4]триазол-3-ил, 5-гидроксиметил-[1,2,4]триазол-3-ил, 5-ацетил-[1,2,4]триазол-3-ил, оксазол-2-ил, изоксазол-3-ил, пиразин-2-ил, 5-метилпиразин-2-ил, пиридин-2-ил, 4-метилпиридин-2-ил, пиридазин-3-ил, 6-метилпиридазин-3-ил, 1Н-пиразол-3-ил, 1-метил-1Н-пиразол-3-ил, пиримидин-2-ил, пиримидин-4-ил.
m обозначает целое число от 1 до 6, предпочтительно от 1 до 4, более предпочтительно 1 или 2, еще более предпочтительно 1.
p обозначает целое число от 0 до 2, предпочтительно 0 или 1.
q обозначает 0 или 1, предпочтительно q=1.
Из соединений формулы (I) по изобретению предпочтительными являются соединения и их фармацевтически приемлемые соли формулы (I-11):
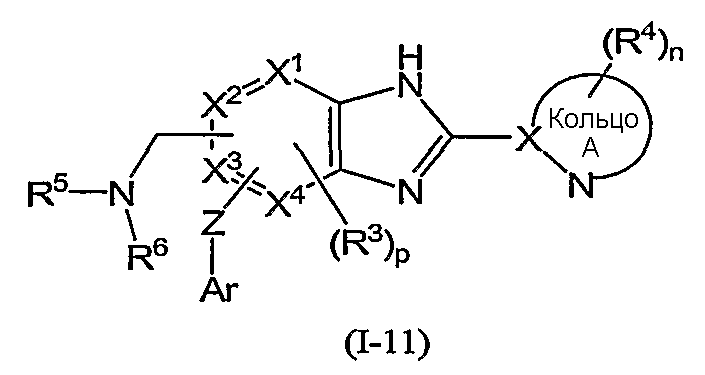
или формулы (I-1):
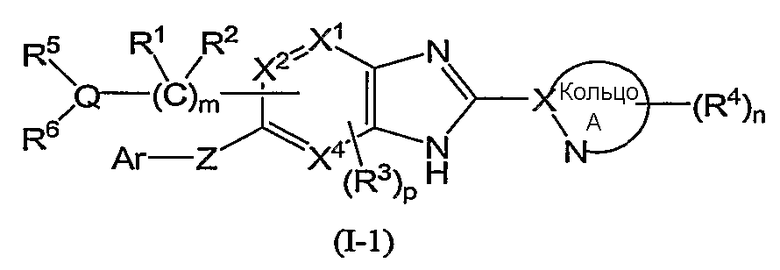
(в которой символы имеют те же самые значения, как определено выше); и из соединений формулы (I-1) более предпочтительны соединения формулы (I-2):
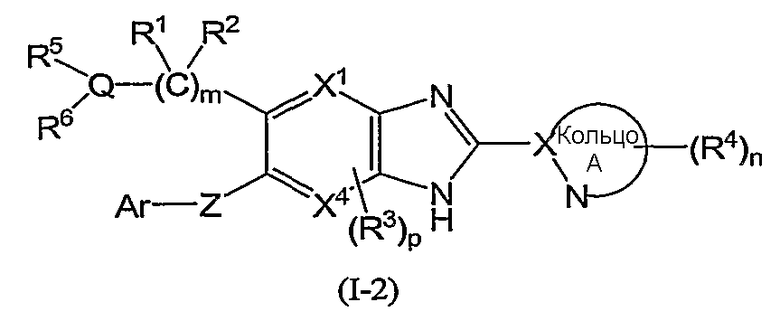
(в которой символы имеют те же самые значения, как определено выше), и соединения формулы (I-3):
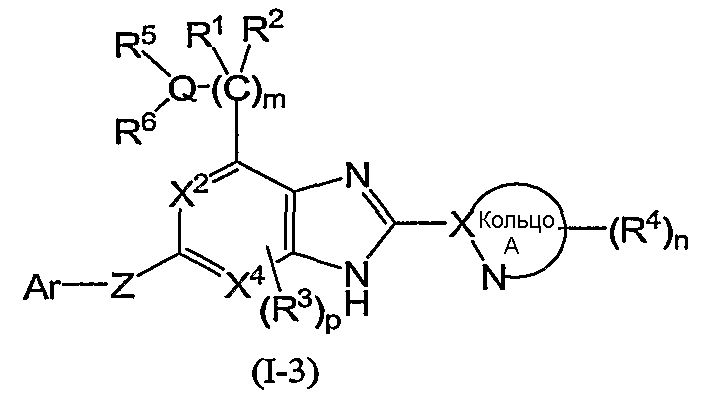
В формуле (I-1) следующая формула (I-A):
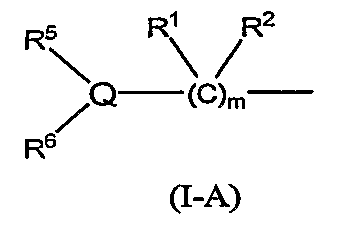
является предпочтительно группой следующей формулы:
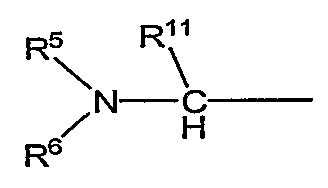
(в которой R11 обозначает атом водорода или низший алкил; а другие символы имеют те же самые значения, как определено выше).
Соединения формулы (I) включают, например, следующие соединения и их фармацевтически приемлемые соли:
1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил]метил}-5-тиоксо-2-пирролидинон,
4-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}морфолин-3,5-дион,
3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил]метил}-1,3-тиазолан-2,4-дион,
3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2-он,
1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион,
1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метилимидазолидин-2,5-дион,
2-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}изотиазолидин-1,1-диоксид,
3-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон,
1-{[5-{[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион,
1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1H-бензимидазол-6-ил)метил]-2-пирролидинон,
N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-N-метилацетамид,
3-{[5-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион,
5-[4-(этилсульфонил)фенокси]-6-((2-метил-2H-тетразол-5-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол,
5-[4-(этилсульфонил)фенокси]-6-(1-(1-метил-1H-тетразол-5-ил)этил)-2-(2-пиридинил)-1Н-бензимидазол,
1-[(6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он
или
4-(2,6-дифторбензил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол.
Описаны способы получения для соединений по изобретению.
Из соединений формулы (I) по изобретению соединения формулы (I-11):
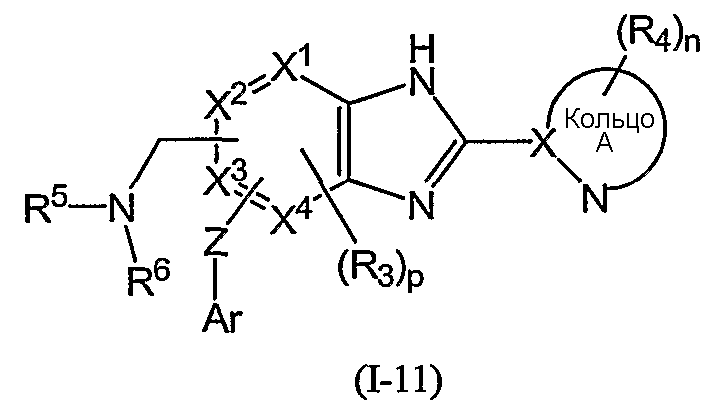
или формулы (I-21):
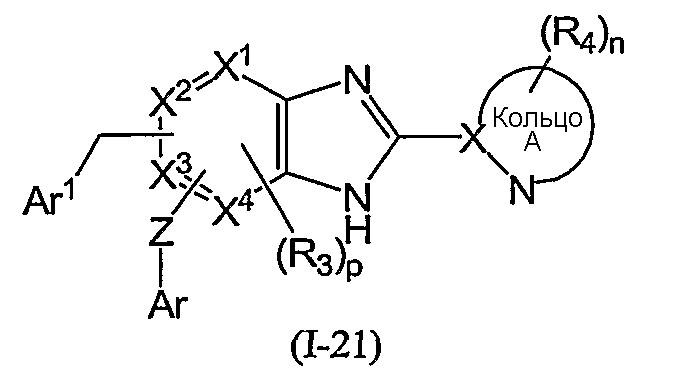
(в которой Ar1 имеет то же самое значение, как определено выше для Ar; а другие символы имеют те же самые значения, как определено выше) могут быть получены, например, согласно следующему способу:
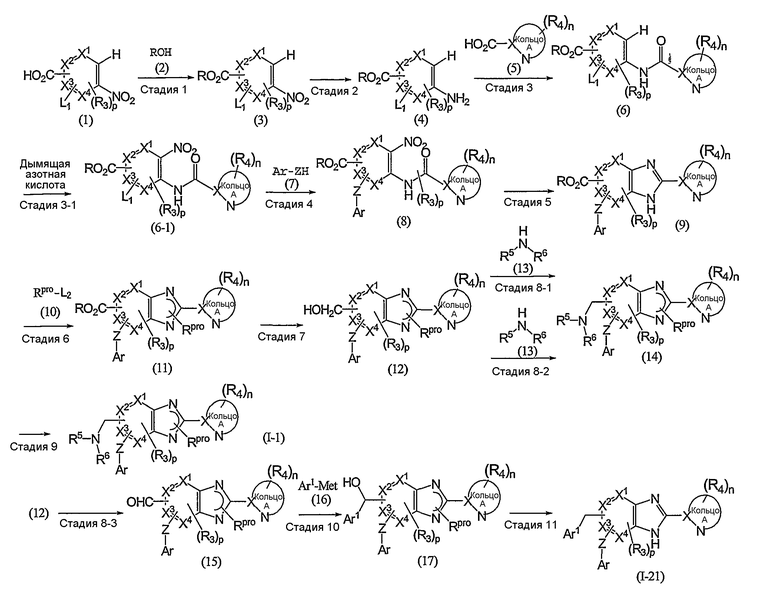
(R обозначает низший алкил; Rpro обозначает защитную группу ароматической группы; L1 и L2 каждый обозначает уходящую группу; Met обозначает металл; и другие символы имеют те же самые значения, как определено выше).
Стадия 1
Эта стадия представляет собой способ взаимодействия соединения (1) с соединением (2) в присутствии кислотного катализатора с получением соединения (3).
L1 может быть любой группой, пригодной для получения соединения (8) путем реакции соединения (7) с Ar-ZH на стадии 4, включая, например, атом фтора, атом хлора и атом брома. Из них предпочтительным является атом фтора.
Кислотный катализатор, который используется на этой стадии, включает, например, серную кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту, соляную кислоту, тионилхлорид.
Количество используемого кислотного катализатора может составлять в целом от 0,01 до 10 эквивалентов на один эквивалент соединения (1), предпочтительно от 0,1 до 1 эквивалента.
Соединение (1) включает, например, 2-фтор-4-нитробензойную кислоту, 2-фтор-5-нитробензойную кислоту, 5-фтор-2-нитробензойную кислоту, 3-фтор-5-нитробензойную кислоту.
Низший алкил для R обозначает те же самые группы, как в случае определенного выше низшего алкила.
Соединение (2) может служить также в качестве растворителя реакции, включая, например, метанол, этанол.
Количество используемого соединения (2) может обычно составлять количество для растворения одного эквивалента соединения (1).
Температура реакции может обычно находиться в диапазоне от комнатной температуры до температуры кипения растворителя реакции, предпочтительно от 60°C до температуры кипения растворителя реакции. Время реакции может обычно составлять от 1 до 120 часов, предпочтительно от 24 до 72 часов.
Растворитель реакции для использования на этой стадии включает, например, метанол, этанол, толуол, тетрагидрофуран, диметилформамид.
Полученное таким образом соединение (3) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 2
Эта стадия представляет собой способ восстановления нитрогруппы соединения (3), полученного выше на стадии 1, с получением таким образом соединения (4).
Для восстановления на этой стадии может использоваться способ, известный специалисту.
Восстановление на этой стадии конкретно включает, например, каталитическое восстановление с использованием водорода, муравьиной кислоты, формиата аммония или гидрата гидразина, и катализатора на основе палладия, платины или никеля; восстановление с использованием соляной кислоты или хлорида аммония и железа; и восстановление с использованием метанола и хлорида олова.
Количество восстановителя, который используется для восстановления, варьирует в зависимости от типа соединения и используемого растворителя, но может обычно составлять от 1 до 50 эквивалентов, предпочтительно от 2 до 20 эквивалентов на один эквивалент соединения (3).
Температура реакции может обычно составлять от -10 до 100°C, предпочтительно от 0 до 5°C.
Время реакции может обычно составлять от 1 до 20 часов, предпочтительно от 1 до 5 часов.
Используемый растворитель реакции специально не определен, если он не препятствует протеканию реакции. В этом качестве, например, может быть использован метанол, N,N-диметилформамид, этилацетат, тетрагидрофуран и их смеси.
Полученное таким образом соединение (4) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 3
Эта стадия представляет собой способ взаимодействия соединения (4), полученного на стадии 2, с соединением (5) с получением таким образом соединения (6).
Реакция образования амидной связи на этой стадии может быть проведена при помощи карбоновой кислоты соединения (5) или ее реакционно-способного производного.
Используемое соединение (5) включает, например, пиридин-2-карбоновую кислоту, пиразин-2-карбоновую кислоту, пиримидин-4-карбоновую кислоту, пиримидин-2-карбоновую кислоту, тиазол-2-карбоновую кислоту, изоксазол-3-карбоновую кислоту, 5-метил-изоксазол-3-карбоновую кислоту, 1-метил-1Н-имидазол-4-карбоновую кислоту, имидазол-2-карбоновую кислоту, 1-метил-1Н-имидазол-2-карбоновую кислоту, имидазол-1-карбоновую кислоту, [1,2,4]триазол-1-карбоновую кислоту, [1,2,4]триазол-3-карбоновую кислоту, [1,2,3]триазол-4-карбоновую кислоту, 3-метил-[1,2,4]тиадиазол-5-карбоновую кислоту, [1,2,5]тиадиазол-3-карбоновую кислоту, [1,2,3]оксадиазол-3-карбоновую кислоту, пиразол-3-карбоновую кислоту.
Количество используемого соединения (5) или его реакционно-способного производного может обычно составлять от 0,1 до 100 эквивалентов, предпочтительно от 0,1 до 20 эквивалентов, более предпочтительно от 0,1 до 3 эквивалентов на один эквивалент соединения (4).
Реакционно-способное производное соединения (5) включает, например, смешанные ангидриды кислоты, активные сложные эфиры, активные амиды. Они могут быть получены, например, согласно способу, описанному в WO 98/05641.
В указанной реакции когда используется карбоновая кислота соединения (5), тогда, например, реакцию предпочтительно осуществляют в присутствии конденсирующего агента, такого как карбонилдиимидазол, N,N'-дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид, дифенилфосфорилазид, дипиридил дисульфидтрифенилфосфин, более предпочтительно карбонилдиимидазол.
Не будучи строго определенным, количество используемого конденсирующего агента может составлять от 0,1 до 100 эквивалентов, предпочтительно от 1 до 10 эквивалентов относительно соединения (5).
Реакция может быть проведена, как правило, в инертном растворителе. Инертный растворитель включает, например, тетрагидрофуран, N,N-диметилформамид, 1,4-диоксан, бензол, толуол, метиленхлорид, хлороформ, тетрахлорметан, 1,2-дихлорэтан, пиридин и их смеси.
Температура реакции может обычно составлять от 0°C до температуры кипения растворителя реакции, предпочтительно от комнатной температуры до температуры кипения растворителя реакции.
Время реакции может обычно составлять от 0,1 часов до 72 часов, предпочтительно от 0,5 часов до 24 часов.
Для мягкого промотирования реакция может быть проведена в присутствии основания и промотора конденсации.
Основание включает 4-диметиламинопиридин, триэтиламин.
Количество используемого основания может обычно составлять от 0,1 до 100 эквивалентов, предпочтительно от 0,1 до 1 эквивалента на один моль карбоновой кислоты соединения (5) или его реакционно-способного производного.
Промотор конденсации включает гидрат N-гидроксибензотриазола, N-гидроксисукцинимид.
Количество промотора конденсации может обычно составлять от 1 до 100 эквивалентов, предпочтительно от 1 до 5 эквивалентов на один моль карбоновой кислоты соединения (5) или его реакционно-способного производного.
В указанной выше реакции, когда реагент имеет аминогруппу или иминогруппу, не участвующую в реакции, желательно, чтобы эти аминогруппа или иминогруппа были соответственно защищены защитной группой для аминогруппы или иминогруппы, и защитную группу удаляют после реакции.
Полученное таким образом соединение (6) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 3-1
Эта стадия представляет собой способ взаимодействия соединения (6), полученного на указанной стадии 3, с дымящей азотной кислотой с получением таким образом соединения (6-1).
Количество дымящей азотной кислоты, используемой на этой стадии, может обычно составлять от 1 до 100 эквивалентов, предпочтительно от 2 до 20 эквивалентов на один эквивалент соединения (6).
Температура реакции может обычно составлять от 0 до 100°C, предпочтительно от 10 до 50°C.
Время реакции может обычно составлять от 0,1 до 48 часов, предпочтительно от 0,5 до 12 часов.
Соединение (6-1) может также быть получено взаимодействием соединения (6) с нитратом калия в присутствии кислоты.
Количество используемого нитрата калия может обычно составлять от 1 до 100 эквивалентов, предпочтительно от 1 до 5 эквивалентов на один эквивалент соединения (6).
Используемая кислота включает, например, трифторуксусную кислоту, соляную кислоту, серную кислоту, азотную кислоту.
Количество используемой кислоты может обычно составлять от 1 эквивалента до растворяющего количества, предпочтительно от 1 до 100 эквивалентов на один эквивалент соединения (6).
Температура реакции может обычно составлять от 0°C до температуры кипения растворителя, предпочтительно от комнатной температуры до 100°C.
Время реакции может обычно составлять от 0,1 до 72 часов, предпочтительно от 0,5 до 12 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, хлороформ, дихлорметан.
Полученное таким образом соединение (7) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 4
Эта стадия представляет собой способ взаимодействия соединения (6-1), полученного на указанной выше стадии 3-1, с соединением (7) в присутствии основания с получением таким образом соединения (8).
Количество используемого соединения (7) может обычно составлять от 0,1 до 20 эквивалентов, предпочтительно от 0,5 до 5 эквивалентов на 1 эквивалент соединения (6-1).
Используемое соединение (7) включает, например, 4-метансульфонилфенол, 4-этансульфонилфенол, 3-хлор-4-метансульфонилфенол, 6-метансульфонилпиридин-3-ол, 6-этансульфонилпиридин-3-ол, 4-цианофенил, 6-(5-метил-[1,2,4]тиадиазол-3-ил)пиридин-3-ол, 6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинол, 4-(5-метил-1,2,4-оксадиазол-3-ил)фенол. Эти соединения могут быть коммерчески доступными или могут быть получены способом, известным специалисту, или согласно подобному ему способу, или согласно скомбинированному с ним способу, исходя из коммерчески доступных соединений.
Количество используемого основания может обычно составлять от 0,1 до 20 эквивалентов, предпочтительно от 0,5 до 5 эквивалентов на 1 эквивалент соединения (6-1).
Используемое основание может быть любым, пригодным для получения соединения (8) посредством реакции соединения (6-1) с соединением (7) на этой стадии, включая, например, гидрид натрия, карбонат цезия, карбонат натрия, карбонат калия, фосфат калия, ацетат калия, трет-бутират калия, триэтиламин. Из них предпочтительными являются карбонат калия, карбонат цезия. Когда соединение (7) представляет собой первичный или вторичный амин, тогда реакция на этой стадии может быть проведена в отсутствие основания.
Температура реакции может обычно составлять от 0°C до температуры кипения растворителя реакции, предпочтительно от комнатной температуры до температуры кипения растворителя реакции.
Время реакции может обычно составлять от 0,1 до 72 часов, предпочтительно от 0,5 до 5 часов.
Не будучи специально определенным, растворитель реакции может быть любым инертным растворителем, не препятствующим протеканию реакции, и конкретно включает, например, пиридин, толуол, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, 1-метил-2-пирролидинон.
Полученное таким образом соединение (8) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 5
Эта стадия представляет собой способ восстановления нитрогруппы соединения (8), полученного выше на стадии 4, и одновременно дегидрирования и циклизации соединения в присутствии кислотного катализатора с получением таким образом соединения (9).
Условия реакции на этой стадии могут быть теми же самыми, как на стадии 2, или могут быть подобны им, или могут представлять комбинацию с ними обычного способа.
Полученное таким образом соединение (9) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 6
Эта стадия представляет собой способ взаимодействия соединения (9), полученного на указанной выше стадии 8, с соединением (10) "в присутствии основания" с получением таким образом соединения (11).
Реакция на этой стадии представляет собой способ введения защитной группы в ароматическую аминогруппу, и она может быть проведена согласно способу, описанному в ссылках (например, Protective Groups in Organic Synthesis, T.W.Green, 2nd Ed., John Wiley & Sons, 1991), или согласно подобному способу, или согласно способу, скомбинированному с ним.
L2 в соединении (10) обозначает, например, атом галогена, предпочтительно атом хлора или атом брома.
Используемое соединение (10) включает 2-(триметилсилил)этоксиметилхлорид (SEMCl), метоксиметилхлорид (MOMCl).
Количество используемого соединения (10) может обычно составлять от 1 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения (9).
Используемое основание представляет собой, например, гидрид натрия.
Количество используемого основания может обычно составлять от 1 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов.
Температура реакции может обычно составлять от -20 до 50°C, предпочтительно от 0°C до комнатной температуры.
Время реакции может обычно составлять от 0,1 до 12 часов, предпочтительно от 0,1 до 3 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, N,N-диметилформамид, тетрагидрофуран, метиленхлорид.
Полученное таким образом соединение (11) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 7
Эта стадия представляет собой способ восстановления сложноэфирной группы соединения (11), полученного выше на стадии 6, с получением таким образом соединения (12).
Восстановитель, который используется на этой стадии, включает алюмогидрид лития (LiAlH4), боргидрид лития, боргидрид натрия. После гидролиза сложноэфирной формы соединения (11) в карбоновую кислоту она может быть переработана в соединение (12) согласно способу, описанному в ссылках (например, SYNLETT, 1995, Vol.8, pp.839-840), или согласно подобному способу, или согласно способу, скомбинированному с ним.
Количество используемого восстановителя может обычно составлять от 1 до 20 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения (11).
Температура реакции может обычно составлять от 0 до 80°C, предпочтительно от 0,1°С до комнатной температуры.
Время реакции может обычно составлять от 0,1 до 24 часов, предпочтительно от 0,1 до 3 часов.
Не будучи специально определенным, растворитель реакции может быть любым, не препятствующим протеканию реакции, и включает, например, метанол, N,N-диметилформамид, этилацетат, тетрагидрофуран, их смеси.
Полученное таким образом соединение (12) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 8
Эта стадия представляет собой способ взаимодействия соединения (12), полученного на предыдущей стадии 7, с соединением (13) с получением таким образом соединения 13.
Реакция на этой стадии может представлять собой стадию (8-1) реакции Mitsunobu или стадию (8-2) реакции образования зародышей, которую проводят в присутствии основания.
Стадия 8-1
Реакция на этой стадии представляет собой так называемую реакцию Mitsunobu, которая может быть проведена в присутствии фосфинового соединения и азосоединения, согласно способу, описанному в ссылках (например, The use of diethyl azodicarboxylate and triphenylphosphine in synthesis and transformation of natural products, Mitsunobu O.; Synthesis, Vol.1, 1981, pp.1-28), или согласно подобному способу, или согласно обычному способу, скомбинированному с этим способом.
Используемое соединение (13) включает, например, сукцинимид, морфолин-3,5-дион, имид фталевой кислоты, 1-метилгидантоин, 1-метилурацил.
Количество используемого соединения (13) может обычно составлять от 0,5 до 10 эквивалентов, предпочтительно, от 1 до 3 эквивалентов на 1 эквивалент соединения (12).
Используемое фосфиновое соединение обычно представляет собой, например, трифенилфосфин, триэтилфосфин.
Количество используемого фосфинового соединения может обычно составлять от 0,5 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения (12).
Используемое азосоединение включает, например, диэтилазодикарбоксилат, диизопропилазодикарбоксилат.
Количество используемого азосоединения может обычно составлять от 0,5 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения (12).
Время реакции на этой стадии может обычно составлять от 1 до 48 часов, предпочтительно от 4 до 12 часов.
Температура реакции на этой стадии может обычно составлять от 0°C до температуры кипения растворителя реакции, предпочтительно от 15 до 30°C.
Не будучи специально определенным, растворитель реакции, который используется на этой стадии, может быть любым, не препятствующим протеканию реакции, и включает, например, тетрагидрофуран, толуол.
Полученное таким образом соединение (14) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 8-2
Эта стадия представляет собой способ взаимодействия соединения (12) с соединением (13) в присутствии основания с получением таким образом соединения (14).
Используемое основание включает, например, гидрид натрия, бутиллитий, диизопропиламид лития.
Количество используемого основания может обычно составлять от 0,5 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения (12).
Используемое соединение (13) конкретно включает, например, соединения, перечисленные в отношении указанной стадии 8-1, и пирролидон, оксазолидон, 3-метилурацил, 1-метилимидазолидинон.
Температура реакции может обычно составлять от -78 до 50°C, предпочтительно от 0°C до комнатной температуры.
Время реакции может обычно составлять от 0,1 до 24 часов, предпочтительно от 0,1 до 6 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, N,N-диметилформамид, тетрагидрофуран, метиленхлорид.
Полученное таким образом соединение (14) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 8-3
Эта стадия представляет собой способ окисления гидроксильной группы соединения (12), полученного на указанной выше стадии 7, с получением таким образом соединения (15).
Реакция на этой стадии может быть проведена согласно способу, описанному в ссылках (например, Journal of the American Chemical Society, 1967, Vol.89, pp.5505-5507), или согласно подобному способу, или согласно обычному способу, скомбинированному с этим способом.
Полученное таким образом соединение (15) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 9
Эта стадия представляет собой способ удаления аминозащитной группы Rpro из соединения (14), полученного на указанной выше стадии 8-1 или 8-2, с получением таким образом соединения (I-1) по изобретению.
Удаление защитной группы может быть достигнуто тем же самым образом, как в способе, описанном в ссылках (например, Protective Groups in Organic Synthesis, by T.W.Green, 2nd Ed., John Wiley & Sons, 1991), или в соответствии с ним, или в комбинации его с обычным способом. Например, когда защитная группа представляет собой SEM, тогда соединение (14) может быть введено в реакцию с трифторуксусной кислотой, чтобы удалить группу SEM.
Полученное таким образом соединение (I-1) может быть выделено и очищено любым известным способом разделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией.
Стадия 10
Эта стадия представляет собой способ взаимодействия соединения (15), полученного на указанной выше стадии 8-3, с соединением (16) с получением таким образом соединения (17).
Ar1 в соединении (16) и соединении (17) имеет то же самое значение, как указано выше для Ar.
Используемое соединение (16) включает, например, 4-фторфенилмагнийбромид, 2-фторфенилмагнийбромид, 3-литий-2-фторпиридин.
Количество используемого соединения (16) может обычно составлять от 1 до 5 эквивалентов, предпочтительно от 1 до 10 эквивалентов на 1 эквивалент соединения (15).
Температура реакции может обычно составлять от -78 до 50°C, предпочтительно от -78°C до комнатной температуры.
Время реакции может обычно составлять от 0,1 до 24 часов, предпочтительно от 0,1 до 12 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, и включает, например, тетрагидрофуран, диэтиловый эфир.
Полученное таким образом соединение (17) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 11
Эта стадия представляет собой способ удаления защитной группы из соединения (17), полученного на указанной выше стадии 10, с получением таким образом соединения (I-2) по изобретению.
Реакция на этой стадии может быть осуществлена тем же самым способом, как на указанной выше стадии 9, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (1-2) по изобретению может быть выделено и очищено любым известным способом разделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией.
Соединение (12) может также быть получено согласно следующему способу:
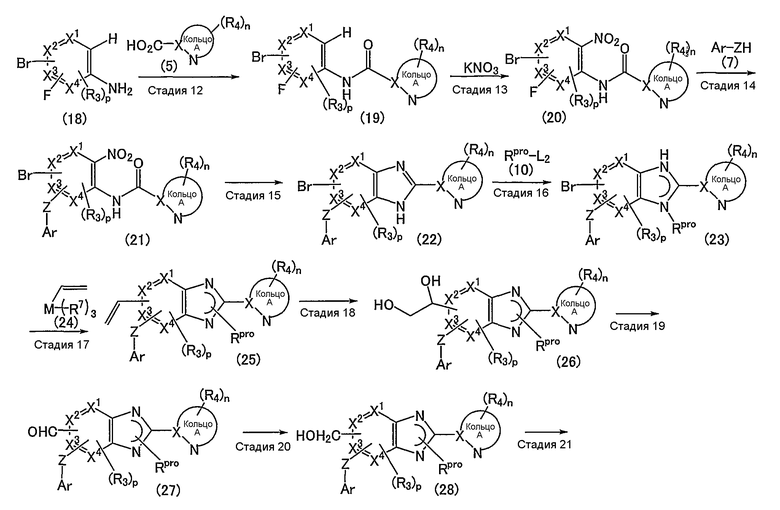
(где R7 обозначает низший алкил; М обозначает атом металла; а другие символы имеют те же самые значения, как определено выше).
Стадия 12
Эта стадия представляет собой способ взаимодействия соединения (18) с указанным выше соединением (5) с получением таким образом соединения (19).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 3, или в соответствии с ним, или его комбинацией с обычным способом.
Используемое соединение (18) включает, например, 4-бром-3-фторанилин, 3-бром-5-фторанилин.
Полученное таким образом соединение (19) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 13
Эта стадия представляет собой способ взаимодействия соединения (19), полученного на указанной выше стадии 12, с нитратом калия в присутствии кислоты с получением таким образом соединения (20).
Количество используемого нитрата калия может обычно составлять от 1 до 100 эквивалентов, предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединения (19).
Используемая кислота включает, например, трифторуксусную кислоту, соляную кислоту, серную кислоту, азотную кислоту.
Количество используемой кислоты может обычно составлять от 1 эквивалента до растворяющего количества, предпочтительно от 1 до 100 эквивалентов на 1 эквивалент соединения (19).
Температура реакции может обычно составлять от 0°C до температуры кипения растворителя реакции, предпочтительно от комнатной температуры до 100°C.
Время реакции может обычно составлять от 0,1 до 72 часов, предпочтительно от 0,5 до 12 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, хлороформ, дихлорметан.
Полученное таким образом соединение (20) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 14
Эта стадия представляет собой способ взаимодействия соединения (20), полученного на указанной выше стадии 13, с соединением (7) с получением таким образом соединения (21).
Реакция на этой стадии может быть осуществлена тем же самым способом, как на указанной выше стадии 4, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (21) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 15
Эта стадия представляет собой способ восстановления нитрогруппы соединения (21), полученного выше на стадии 14, с получением таким образом соединения (22).
Реакция на этой стадии может быть осуществлена тем же самым способом, как на указанной выше стадии 2 или 5, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (22) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 16
Эта стадия представляет собой способ взаимодействия соединения (22), полученного на указанной выше стадии 15, с соединением (10) с получением таким образом соединения (23).
Реакция на этой стадии может быть осуществлена тем же самым способом, как на указанной выше стадии 6, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (23) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 17
Эта стадия представляет собой способ взаимодействия соединения (23), полученного на указанной выше стадии 16, с соединением (24) в присутствии металлического катализатора с получением таким образом соединения (25).
Используемое соединение (24) включает, например, трибутил(винил)олово или винилтрифторборат калия, описанный в ссылке (Organic Letters, 2002, Vol.4, No.1, pp.107-109).
Количество используемого соединения (24) может обычно составлять от 1 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения (23).
Металлический катализатор, который используется, включает, например, тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, дихлор(1,1'-бис(дифенилфосфино)ферроцен)палладий.
Количество используемого металлического катализатора может обычно составлять от 0,01 до 10 эквивалентов, предпочтительно от 0,05 до 5 эквивалентов.
Растворитель реакции, который используется на этой стадии, может быть любым, не препятствующим протеканию реакции, и специально не определен. Например, он включает простой диметиловый эфир этиленгликоля, воду, толуол, тетрагидрофуран, N,N-диметилформамид, 1,4-диоксан, бензол, ацетон, изопропанол.
Температура реакции на этой стадии может обычно составлять от 0°C до температуры кипения растворителя реакции, предпочтительно от комнатной температуры до 150°C.
Время реакции на этой стадии может обычно составлять от 0,1 часов до 72 часов, предпочтительно от 0,5 часов до 12 часов.
Полученное таким образом соединение (25) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 18
Эта стадия представляет собой способ окисления соединения (25), полученного на указанной выше стадии 17, с получением таким образом диолового соединения (26).
Реакция на этой стадии включает взаимодействие соединения (25) с оксидом осмия.
Реакционная система может содержать 4-метилморфолин-N-оксид.
Количество используемого оксида осмия может обычно составлять от 0,001 до 3 эквивалентов, предпочтительно от 0,01 до 0,5 эквивалентов на 1 эквивалент соединения (25).
Количество используемого 4-метилморфолин-N-оксида может обычно составлять от 1 до 50 эквивалентов, предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединения (25).
Температура реакции может обычно составлять от 0 до 70°C, предпочтительно от 0°C до комнатной температуры.
Время реакции может обычно составлять от 0,5 до 72 часов, предпочтительно от 6 до 48 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, тетрагидрофуран, воду, ацетон, простой диметиловый эфир этиленгликоля, N,N-диметилформамид, 1,4-диоксан, изопропанол.
Полученное таким образом соединение (26) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 19
Эта стадия представляет собой способ окисления соединения (26), полученного на указанной выше стадии 18, с получением таким образом соединения (27).
Реакция на этой стадии включает взаимодействие соединения (26) с периодатом натрия.
Количество используемого периодата натрия может обычно составлять от 1 до 100 эквивалентов, предпочтительно от 1 до 10 эквивалентов на 1 эквивалент соединения (26).
Температура реакции может обычно составлять от 0 до 80°C, предпочтительно от комнатной температуры до 50°C.
Время реакции может обычно составлять от 0,5 до 72 часов, предпочтительно от 12 до 48 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, воду, тетрагидрофуран, ацетон, простой диметиловый эфир этиленгликоля, N,N-диметилформамид, 1,4-диоксан, изопропанол.
Полученное таким образом соединение (27) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 20
Эта стадия представляет собой способ восстановления соединения (27), полученного на указанной выше стадии 19, с получением таким образом соединения (12).
Реакция на этой стадии включает взаимодействие соединения (27) с восстановителем.
Используемый восстановитель включает, например, боргидрид натрия, триацетоксиборгидрид натрия.
Количество используемого восстановителя может обычно составлять от 1 до 50 эквивалентов, предпочтительно от 1 до 10 эквивалентов на 1 эквивалент соединения (27).
Температура реакции может обычно составлять от 0 до 100°C, предпочтительно от 0 до 50°C.
Время реакции может обычно составлять от 0,1 до 72 часов, предпочтительно от 0,5 до 24 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, метанол, тетрагидрофуран, 1,4-диоксан, изопропанол.
Полученное таким образом соединение (12) может быть использовано на указанной стадии 8, после выделения и очистки любым известным способом разделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Соединение (12-1), которое входит в рамки определения соединения (12), может также быть получено согласно следующему способу:
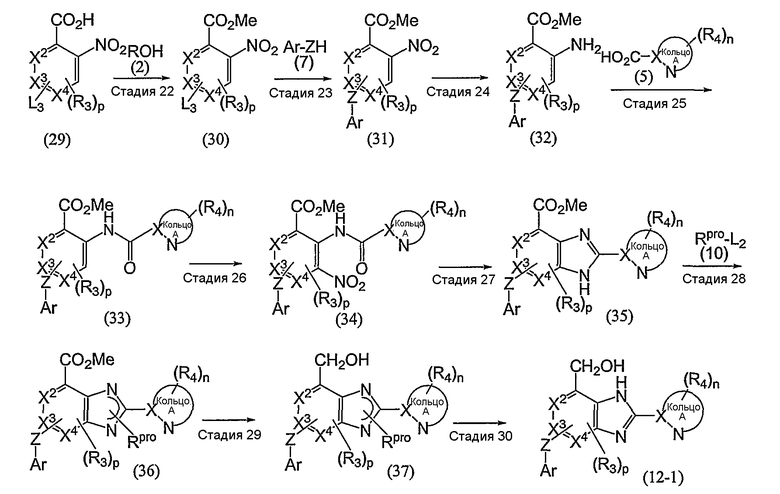
(где L3 обозначает уходящую группу; Rpro обозначает защитную группу ароматической аминогруппы; а другие символы имеют те же самые значения, как определено выше).
Стадия 22
Эта стадия представляет собой способ взаимодействия соединения (29) с соединением (2) в присутствии кислотного катализатора с получением таким образом соединения (30).
Используемым соединением (29) может быть, например, 5-фтор-2-нитробензойная кислота.
Реакция на этой стадии может быть осуществлена тем же самым способом, как на указанной выше стадии 1, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (30) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 23
Эта стадия представляет собой способ взаимодействия соединения (30), полученного на указанной выше стадии 22, с соединением (7) с получением таким образом соединения (31).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 4, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (31) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 24
Эта стадия представляет собой способ восстановления нитрогруппы соединения (31), полученного на указанной выше стадии 23, с получением таким образом соединения (32).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 2, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (32) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 25
Эта стадия представляет собой способ взаимодействия соединения (32), полученного на указанной выше стадии 24, с соединением (5) с получением таким образом соединения (33).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 3, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (33) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 26
Эта стадия представляет собой способ взаимодействия соединения (33), полученного на указанной выше стадии 25, с нитритом калия в присутствии кислоты с получением таким образом соединения (34).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 13, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (34) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 27
Эта стадия представляет собой способ восстановления нитрогруппы соединения (34), полученного на указанной выше стадии 26, с получением таким образом соединения (35).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 5, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (35) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 28
Эта стадия представляет собой способ взаимодействия соединения (35), полученного на указанной выше стадии 27, с соединением (10) с получением таким образом соединения (36).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 6, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (36) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 29
Эта стадия представляет собой способ восстановления соединения (36), полученного на указанной выше стадии 28, с получением таким образом соединения (37).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 7, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (37) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 30
Эта стадия представляет собой способ удаления ароматической аминозащитной группы Rpro из соединения (37), полученного на указанной выше стадии 29, с получением таким образом соединения (12-1).
Реакция на этой стадии может быть проведена тем же самым способом, как на указанной выше стадии 9, или в соответствии с ним, или его комбинацией с обычным способом.
Полученное таким образом соединение (12-1) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Соединение (I-1-1) или его фармацевтически приемлемая соль по изобретению формулы:
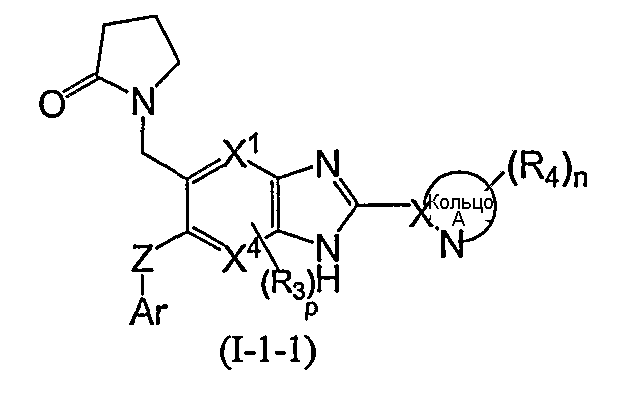
(в которой символы имеют те же самые значения, как определено выше) может быть получено, например, согласно следующему способу:
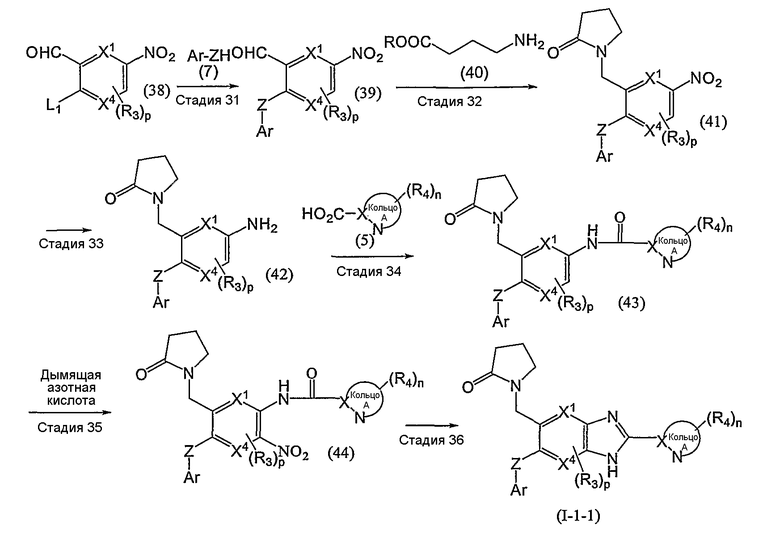
(где символы имеют те же самые значения, как определено выше).
Стадия 31
Эта стадия представляет собой способ взаимодействия соединения (38) с соединением (7) в присутствии основания с получением таким образом соединения (39).
Соединение (38), используемое на этой стадии, может быть коммерчески доступным или может быть получено способом, известным специалисту, или согласно подобному способу, или согласно способу, скомбинированному с этим способом, исходя из коммерчески доступного соединения. Конкретно, это, например, 2-хлор-5-нитробензальдегид.
Количество соединения (7), используемое на этой стадии, может обычно составлять от 0,1 до 20 эквивалентов, предпочтительно от 0,5 до 5 эквивалентов на 1 эквивалент соединения (38).
Используемое соединение (7) включает соединения, упомянутые для указанной выше стадии 4.
Количество используемого основания может обычно составлять от 0,1 до 20 эквивалентов, предпочтительно от 0,5 до 5 эквивалентов на 1 эквивалент соединения (38).
Используемое основание может быть любым, пригодным для получения соединения (39) на этой стадии, включающей взаимодействие соединения (38) с соединением (7), и включает, например, гидрид натрия, карбонат цезия, карбонат натрия, карбонат калия, фосфат калия, ацетат калия, трет-бутират калия, триэтиламин. Из них предпочтительными являются карбонат калия, карбонат цезия.
Температура реакции может обычно составлять от 0°C до температуры кипения растворителя реакции, предпочтительно от комнатной температуры до температуры кипения растворителя реакции.
Время реакции может обычно составлять от 0,1 до 72 часов, предпочтительно от 0,5 до 5 часов.
Растворитель реакции может быть инертным растворителем и специально не определен при условии, что он не препятствует протеканию реакции. Конкретно, он включает, например, пиридин, толуол, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, 1-метил-2-пирролидинон.
Полученное таким образом соединение (39) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 32
Эта стадия представляет собой способ взаимодействия соединения (39) с соединением (40) с получением таким образом соединения (41).
Используемое на этой стадии соединение (40) представляет собой, например, соединение, где R обозначает метил или этил.
Соединение (40) может также быть в форме кислотно-аддитивной соли, такой как гидрохлорид. В случае если используется кислотно-аддитивная соль соединения (40), затем к реакционной системе может быть добавлено основание, такое как триэтиламин.
Количество используемого соединения (40) может обычно составлять от 0,5 до 20 эквивалентов, предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединения (39).
Количество используемого основания может быть почти эквимолярным количеством относительно 1 эквивалента соединения (40).
Восстановитель, который используется на этой стадии, включает, например, триацетоксиборгидрид, цианоборгидрид натрия, триацетоксиборгидрид натрия.
Количество используемого гидридного реагента может обычно составлять от 1 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения (39).
Не препятствуя протеканию реакции, растворитель реакции специально не определен, и он включает, например, метанол, этанол, уксусную кислоту, тетрагидрофуран, дихлорметан и их смеси. Из них предпочтительными являются, например, метанол, этанол, тетрагидрофуран и их смеси.
Время реакции может обычно составлять от 1 часа до 8 часов, предпочтительно от 1 часа до 24 часов.
Температура реакции может обычно составлять от 0 до 100°C, предпочтительно от 0 до 40°C.
Полученное таким образом соединение (41) по изобретению может быть выделено и очищено любым известным способом разделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией.
Стадия 33
Эта стадия представляет собой способ восстановления нитрогруппы соединения (41) с получением таким образом соединения (42).
Восстановление на этой стадии может быть, например, каталитическим восстановлением с катализатором, таким как никель Ренея, в атмосфере водорода.
Количество никеля Ренея, который используется на этой стадии, может быть от 0,001 до 5 эквивалентов, предпочтительно от 0,01 до 1 эквивалента на 1 эквивалент соединения (41).
Температура реакции может обычно составлять от 0 до 80°C, предпочтительно от 20 до 50°C.
Время реакции может обычно составлять от 1 до 24 часов, предпочтительно от 1 до 10 часов.
Полученное таким образом соединение (42) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 34
Эта стадия представляет собой способ взаимодействия производного карбоновой кислоты (5) или его реакционно-способного производного с соединением (42) с получением таким образом соединения (3).
Эта реакция может быть обычным амидированием, которое осуществляют согласно способу, описанному в ссылках (например, Bases and Experiments of Peptide Synthesis. Nobuo Izumiya, et al. Maruzen, 1983; Comprehensive Organic Synthesis, Fol.6, Pergamon Press, 1991), или согласно подобному способу, или согласно обычному способу, скомбинированному с этим способом. В частности, используется конденсирующий агент, известный специалисту; или могут использоваться способ активации сложного эфира, способ смешанного ангидрида кислоты, способ хлорангидрида кислоты или способ карбодиимида, известные специалисту. Реактив амидирования включает, например, тионилхлорид, оксалилхлорид, N,N-дициклогексилкарбодиимид, 1-метил-2-бромпиридинийиодид, N,N'-карбонилдиимидазол, дифенилфосфорилхлорид, дифенилфосфорилазид, N,N'-дисукцинимидилкарбонат, N,N'-дисукцинимидилоксалат, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, этилхлорформиат, изобутилхлорформиат, гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония. Из них, например, предпочтительными являются тионилхлорид, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, N,N-дициклогексилкарбодиимид, гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония. В амидировании основание и промотор конденсации могут использоваться наряду с указанным реактивом амидирования.
Используемое основание включает, например, третичные алифатические амины, такие как триметиламин, триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, N-метилпирролидин, N-метилпиперидин, N,N-диметиланилин, 1,8-диазабицикло[5,4.0]ундец-7-ен (DBU), 1,5-азабицикло[4,3.0]нон-5-ен (DBN); ароматические амины, такие как пиридин, 4-диметиламинопиридин, пиколин, лутидин (диметилпиридин), хинолин, изохинолин. Из них, например, предпочтительными являются третичные алифатические амины, а более предпочтительными, например, триэтиламин, N,N-диизопропилэтиламин.
Используемый промотор конденсации включает, например, гидрат N-гидроксибензотриазола, N-гидроксисукцинимид, N-гидрокси-5-норборнен-2,3-дикарбоксиимид, 3-гидрокси-3,4-дигидро-4-оксо-1,2,3-бензотриазол. Из них, например, предпочтительным является N-гидроксибензотриазол.
Количество используемого соединения (42) может варьировать, в зависимости от типа этих соединений и используемого растворителя и других условий реакции, и, например, может обычно составлять от 0,1 до 10 эквивалентов, предпочтительно от 0,5 до 3 эквивалентов на 1 эквивалент производного карбоновой кислоты (5) или его реакционно-способного производного.
Количество используемого реактива амидирования может также варьировать, в зависимости от типа соединения и используемого растворителя и других условий реакции, и, например, может обычно составлять от 1 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент производного карбоновой кислоты (5) или его реакционно-способного производного.
Количество используемого промотора конденсации может также варьировать, в зависимости от типа соединения и используемого растворителя и других условий реакции, и, например, может составлять от 1 до 10 эквивалентов, предпочтительно от 1 до 3 эквивалентов на 1 эквивалент производного карбоновой кислоты (5) или его реакционно-способного производного.
Количество используемого основания может также варьировать, в зависимости от типа соединения и используемого растворителя и других условий реакции, и, например, может составлять от 0,1 до 10 эквивалентов, предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединения (42).
Растворитель реакции, который используется на этой стадии, представляет собой, например, инертный растворитель, который не является специально определенным при условии, что он не препятствует протеканию реакции. Конкретно, например, он включает метиленхлорид, хлороформ, 1,2-дихлорэтан, N,N-диметилформамид, этилацетат, метилацетат, ацетонитрил, бензол, ксилол, толуол, 1,4-диоксан, тетрагидрофуран, диметоксиэтан и их смеси. Чтобы обеспечить предпочтительную температуру реакции, например, предпочтительными являются метиленхлорид, хлороформ, 1,2-дихлорэтан, ацетонитрил, N,N-диметилформамид.
Температура реакции на этой стадии может обычно составлять от -78°C до температуры кипения растворителя, предпочтительно от 0 до 30°C.
Время реакции на этой стадии может обычно составлять от 0,5 до 96 часов, предпочтительно от 3 до 24 часов.
Основание, реактив амидирования и промотор конденсации, которые используются на этой стадии, могут относиться к одному или более различным типам соединений индивидуально или в комбинации.
Полученное таким образом соединение (43) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 35
Эта стадия представляет собой способ взаимодействия соединения (43) с дымящей азотной кислотой с получением таким образом соединения (44).
Количество дымящей азотной кислоты, которая используется на этой стадии, может обычно составлять от 1 до 100 эквивалентов, предпочтительно от 2 до 20 эквивалентов на 1 эквивалент соединения (43).
Температура реакции может обычно составлять от 0 до 100°C, предпочтительно от 10 до 50°C.
Время реакции может обычно составлять от 0,1 до 48 часов, предпочтительно от 0,5 до 12 часов.
Соединение (44) может также быть получено путем взаимодействия соединения (43) с нитратом калия в присутствии кислоты.
Количество используемого нитрата калия может обычно составлять от 1 до 100 эквивалентов, предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединения (6).
Используемая кислота включает, например, трифторуксусную кислоту, соляную кислоту, серную кислоту, азотную кислоту.
Количество используемой кислоты может обычно составлять от 1 эквивалента до растворяющего количества, предпочтительно от 1 до 100 эквивалентов на 1 эквивалент соединения (6).
Температура реакции может обычно составлять от 0°C до температуры кипения растворителя, предпочтительно от комнатной температуры до 100°C.
Время реакции может обычно составлять от 0,1 до 72 часов, предпочтительно от 0,5 до 12 часов.
Растворитель реакции может быть любым, не препятствующим протеканию реакции, включая, например, хлороформ, дихлорметан.
Полученное таким образом соединение (44) может быть подвергнуто следующей стадии, после выделения и очистки любым известным способом выделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией, или до выделения и очистки.
Стадия 45
Эта стадия представляет собой способ восстановления нитрогруппы соединения (44), с последующей циклизацией с получением таким образом соединения (I-1-1) по изобретению.
Восстановитель, который используется на этой стадии, представляет собой, например, хлорид олова (SnCl2). Восстановитель может также быть его гидратом.
Количество восстановителя, которое используется на этой стадии, может обычно составлять от 1 до 20 эквивалентов, предпочтительно от 1 до 10 эквивалентов на 1 эквивалент соединения (44).
Основание, которое используется на этой стадии, может представлять собой, например, триэтиламин.
Количество используемого основания может составлять от 1 до 10 эквивалентов, предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединения (44).
Температура реакции может обычно составлять от 0 до 100°C, предпочтительно от 20 до 80°C.
Время реакции может обычно составлять от 0,5 до 20 часов, предпочтительно от 1 до 5 часов.
Не будучи специально определенным, растворитель реакции может быть любым, не препятствующим протеканию реакции, и включает, например, метанол, хлороформ, N,N-диметилформамид, этилацетат, тетрагидрофуран и их смеси.
Полученное таким образом соединение (I-1-1) может быть выделено и очищено любым известным способом разделения и очистки, например концентрацией, концентрацией при пониженном давлении, кристаллизацией, экстракцией растворителем, повторным осаждением, хроматографией.
Арилоксизамещенные производные бензимидазола согласно изобретению могут быть в форме их фармацевтически приемлемых солей. Соли могут быть получены любым обычным способом из соединений указанных формул (I-1) и (I-2), которые входят в рамки определения соединений (I) по изобретению.
Конкретно, когда соединения формулы (I-1) или (I-2) имеют в молекуле основную группу, являющуюся производной, например, аминогруппы или пиридильной группы, тогда соединения могут быть обработаны кислотой для преобразования их в соответствующие фармацевтически приемлемые соли. Кислотно-аддитивные соли включают, например, гидрогалогениды, такие как гидрохлориды, гидрофториды, гидробромиды, гидроиодиды; соли неорганической кислоты, такие как нитраты, перхлораты, сульфаты, фосфаты, карбонаты; низшие алкилсульфонаты, такие как метансульфонаты, трифторметансульфонаты, этансульфонаты; арилсульфонаты, такие как бензолсульфонаты, п-толуолсульфонаты; соли органической кислоты, такие как фумараты, сукцинаты, цитраты, тартраты, оксалаты, малеаты; другие органические кислотно-аддитивные соли, образованные с аминокислотой, такие как глутаматы, аспартаты. Когда соединения по изобретению имеют кислотную группу в молекуле, например когда они имеют карбоксильную группу, тогда соединения могут быть обработаны основанием для преобразования их в соответствующие фармацевтически приемлемые соли. Аддитивные соли основания включают, например, соли щелочного металла, образованные с натрием или калием; соли щелочноземельного металла, образованные с кальцием или магнием; соли аммония; аддитивные соли органического основания, образованные с гуанидином, триэтиламином, дициклогексиламином и т.д. Кроме того, соединения по изобретению могут также быть в любой другой форме гидратов или сольватов их свободных соединений или их солей.
При получении лекарственных средств для профилактики и лечения диабета типа II или заболеваний или симптомов, связанных с ним, соединения формулы (I) по изобретению могут быть скомбинированы с носителями.
Доза соединений формулы (I) по изобретению для профилактики или лечения заболеваний естественно варьирует в зависимости от свойства подлежащего лечению симптома, конкретного выбранного соединения и пути введения.
Кроме того, доза также варьирует в зависимости от возраста, массы тела и чувствительности пациентов. В общем, суточная доза для однократного или многократного введения может составлять от приблизительно 0,001 мг/кг массы тела до приблизительно 100 мг/кг массы тела, предпочтительно от приблизительно 0,01 мг/кг массы тела до приблизительно 50 мг/кг массы тела, еще более предпочтительно от приблизительно 0,1 мг/кг массы тела до приблизительно 10 мг/кг массы тела. В зависимости от обстоятельств может понадобиться введение большей дозы.
Пример подходящей дозы для перорального введения описан далее. Суточная доза для однократного или двух-четырехкратного введения может составлять по меньшей мере от приблизительно 0,01 мг до самое большее 2,0 г. Предпочтительно ежедневная частота введения составляет несколько раз день, а суточная доза составляет от приблизительно 1,0 мг до приблизительно 200 г. Более предпочтительно суточная доза составляет от приблизительно 10 мг до 100 мг для введения один раз в день.
Для внутривенного введения или перорального введения типичная доза соединения (I) может составлять от приблизительно 0,001 мг/сутки/кг массы тела до приблизительно 100 мг/сутки/кг массы тела (предпочтительно от 0,01 мг/сутки/кг массы тела до приблизительно 10 мг/сутки/кг массы тела), более предпочтительно от приблизительно 0,1 мг/сутки/кг массы тела до 10 мг/сутки/кг массы тела.
Как упомянуто выше, фармацевтическая композиция по изобретению включает соединение формулы (I) и фармацевтически приемлемый носитель. Термин "композиция" включает не только продукт, полученный прямой или косвенной комбинацией, гибридизацией или агрегацией 2 или более ингредиентов, продукт, полученный в результате диссоциации одного или более ингредиентов, или соединение, полученное в результате реакции или взаимодействия различных типов ингредиентов, но также и активный и неактивный ингредиент, образующий носитель (фармацевтически приемлемый носитель).
Будучи скомбинированной с фармацевтически приемлемым носителем, композиция по изобретению предпочтительно содержит соединение формулы (I) в количестве, эффективном для лечения и профилактики диабета типа II и для задержки начала заболевания.
Для введения эффективной дозы соединения по изобретению млекопитающим, особенно людям, может использоваться любой подходящий путь введения. Например, этот путь может быть пероральным введением, ректальным введением, местным введением, внутривенным введением, глазным введением, введением через легкое или назальным введением. Примерами форм для введения являются таблетки, пастилки, порошки, суспензии, растворы, капсулы, кремы, аэрозоли. Предпочтительными являются пероральные таблетки.
Для получения пероральных композиций пригодной является любая обычная фармацевтическая среда. Примерами являются вода, гликоль, масло, спирт, ароматические добавки, консерванты, красители. Для получения жидких композиций для перорального введения, например, могут быть указаны суспензии, эликсиры и растворы. Их носителями являются, например, крахмал, сахар, микрокристаллическая целлюлоза, разбавитель, промотор гранулирования, лубрикант, связующее, дезинтегратор. Для получения твердых композиций для перорального введения могут быть указаны, например, порошки, капсулы и таблетки. Прежде всего, предпочтительны такие твердые композиции для перорального введения.
Ввиду легкости их введения таблетки и капсулы являются самыми предпочтительными формами для перорального введения. В случае необходимости таблетки могут быть покрыты согласно стандартным водным или неводным методикам покрытия.
В дополнение к указанным выше обычным способам введения соединения формулы (I) могут быть также введены в системах контролируемого высвобождения и/или системах контролируемой доставки, например, как в патентах США 3845770, 3916899, 3536809, 3598123, 3630200 и 4008719.
Фармацевтическая композиция по изобретению, подходящая для перорального введения, включает капсулы, облатки и таблетки, которые содержат предопределенное количество активного ингредиента в форме порошков или гранул или в форме водорастворимых жидкостей, нерастворимых в воде жидкостей, эмульсий типа "масло в воде" или эмульсий типа "вода в масле". Эти композиции могут быть получены любым фармацевтическим способом, и все способы включают процесс комбинирования активного ингредиента с носителем одного или более необходимых ингредиентов.
В общем, активный ингредиент однородно и полностью смешивают с жидким носителем, или хорошо отделенным твердым носителем, или с обоими и затем, если желательно, продукт формуют в подходящую форму, чтобы получить композицию. Например, таблетки получают прессованием и формованием, необязательно наряду с одним или более побочными компонентами. Используя подходящий механизм, прессованные таблетки можно получить смешивая активный ингредиент необязательно со связующим, лубрикантом, инертным носителем, поверхностно-активным веществом или диспергатором и прессуя полученную смесь любым желаемым образом в порошки или гранулы.
Формованные таблетки можно получить формируя смесь порошкообразного влажного соединения и инертного жидкого разбавителя, используя подходящий механизм.
Предпочтительно каждая таблетка содержит от приблизительно 1 мг до 1 г активного ингредиента; и каждая облатка и капсула содержит от приблизительно 1 мг до 500 мг активного ингредиента.
Примеры способов введения соединений формулы (I) для фармацевтического применения являются следующими.
Соединения формулы (I) могут использоваться в комбинации с любыми другими лекарственными средствами, пригодными не только для связанных с диабетом типа II заболеваний или симптомов, но также и для лечения/профилактики/задержки начала диабета типа II. Дополнительные лекарственные средства могут быть введены любым путем введения и в дозе, обычно используемой в данной области, одновременно с или отдельно от соединения формулы (I).
В случае если соединение формулы (I) используется наряду с одним или более другими лекарственными средствами, предпочтительна фармацевтическая композиция, включающая соединение формулы (I) и дополнительные лекарственные средства. Соответственно, фармацевтическая композиция по изобретению может включать не только соединение формулы (I), но также одно или более таких активных ингредиентов. Примеры активных ингредиентов, которые могут быть скомбинированы с соединениями формулы (I), приведены ниже, однако они не являются ограничительными. Они могут вводиться отдельно или могут вводиться одновременно в составе одной и той же фармацевтической композиции.
(а) другие активаторы глюкокиназы,
(b) бис-гуаниды (например, буформин, метоформин, фенформин),
(c) агонисты PPAR (например, триглитазон, пиоглитазон, нозиглитазон),
(d) инсулин,
(e) соматостатин,
(f) ингибиторы α-глюкозидазы (например, боглибоз, миглитол, акарбоза),
(g) промоторы секреции инсулина (например, ацетогексамид, кальбутамид, хлорпропамид, глибомлид, гликразид, глимеприд, глипидид, глихидин, глизоксепид, глибурид, глигексамид, глипинамид, фенбутамид, тразамид, толбутамид, толцикламид, натеглинид, репаглинид), и
(h) ингибиторы DPP-IV (дипептидилпептидаза IV).
Весовое отношение соединения формулы (I) ко второму активному ингредиенту может варьировать в пределах широкого диапазона и зависит от эффективного количества индивидуальных активных ингредиентов.
Соответственно, например, когда соединение формулы (I) скомбинировано с агонистом PPAR, тогда весовое отношение соединения формулы (I) к агонисту PPAR может обычно составлять от приблизительно 1000/1 до 1/1000, предпочтительно от приблизительно 200/1 до 1/200. Комбинация соединения формулы (I) и другого активного ингредиента может быть в пределах указанного диапазона. В любом случае в комбинации должно быть эффективное количество индивидуальных ингредиентов.
Глюкокиназа-активирующий потенциал соединений формулы (I) по изобретению и способ его тестирования описаны ниже.
Превосходный глюкокиназа-активирующий эффект соединений формулы (I) может быть определен способом, описанным в ссылках (например, Diabetes, Vol.45, pp.1671-1677, 1996), или в соответствии с этим способом.
Глюкокиназная активность может быть определена не непосредственным измерением глюкозо-6-фосфата, но измерением уровня тио-НАДН, который продуцируется, когда репортерный фермент, глюкозо-6-фосфатдегидрогеназа, производит фосфоглюконолактон из глюкозо-6-фосфата, и на основании этого уровня может быть определена степень глюкокиназной активности тестируемого соединения.
В этом тесте была использована рекомбинантная человеческая GK печени, которая экспрессировалась E.coli в виде слитого белка FLAG и которую очищали ANTIFLAG M2 AFFINITY GEL (Sigma).
Используя плоскодонный планшет с 96 лунками, тест проводили при 30°C. 69 мкл тестового буфера (25 мМ буфера Hepes /рН 7,2, 2 мМ MgCl2, 1 мМ АТФ, 0,5 мМ TNAD, 1 мМ дитиотреитола) помещали в планшет и добавляли 1 мкл раствора соединения в ДМСО или только ДМСО в качестве контроля. Затем добавляли 20 мкл охлажденной на льду ферментной смеси (FLAG-GK, 20 Ед./мл G6PDH) и 10 мкл субстрата, 25 мМ глюкозы и инициировали реакцию (конечная концентрация глюкозы = 2,5 мМ).
После начала реакции увеличение поглощения при 405 нм измеряли в течение 12 минут с промежутками в 30 секунд и увеличение в течение первых 5 минут использовали для оценки тестируемого соединения. FLAG-GK добавляли так, чтобы увеличение поглощения после 5 минут в присутствии 1% ДМСО могло составлять от 0,04 до 0,06.
Уровень оптической плотности (OD) ДМСО-контроля принимали за 100%; и определяли уровень OD тестируемого соединения в различных концентрациях. На основании уровня OD при каждой концентрации Emax (%) и EC50 (мкМ) вычисляли и использовали как показатель GK-активирующего потенциала соединения.
GK-активирующий потенциал соединений по изобретению измеряли в соответствии со способом, описанным выше, и результаты показаны ниже в таблице 5.
Соответственно, соединения по изобретению обладают превосходным GK-активирующим потенциалом, на который указывают Emax и EC50.
ПРИМЕРЫ
Изобретение описано более конкретно в отношении следующих примеров, которыми, однако, изобретение ни в коем случае не должно быть ограничено.
Пример получения 1
10 частей соединения примера продукта 1, 15 частей тяжелого оксида магния и 75 частей лактозы однородно смешивали, получая порошкообразный препарат или препарат в форме частиц размером самое большее 350 мкм. Препарат инкапсулировали, чтобы получить капсулы.
Пример получения 2
45 частей соединения примера продукта 1, 15 частей крахмала, 16 частей лактозы, 21 часть кристаллической целлюлозы, 3 части поливинилового спирта и 30 частей дистиллированной воды однородно смешивали, затем размалывали, гранулировали и высушивали, а затем просеивали, получая гранулы, имеющие размер от 1410 до 177 мкм в диаметре.
Пример получения 3
Гранулы получали тем же способом, как в примере получения 2. 3 части стеарата кальция добавляли к 96 частям гранул и формовали при сжатии, получая таблетки диаметром 10 мм.
Пример получения 4
10 частей кристаллической целлюлозы и 3 части стеарата кальция добавляли к 90 частям гранул, полученных согласно способу примера получения 2, и формовали при сжатии, получая таблетки, имеющие диаметр 8 мм. Их покрывали суспензией смеси желатинового сиропа и осажденного карбоната кальция, получая таблетки с сахарным покрытием.
В следующей части изобретение описано более конкретно в отношении примеров получения, примеров продукта и ссылочных примеров, которыми, однако, изобретение никоим образом не должно быть ограничено.
В тонкослойной хроматографии в примерах Silicagel 60F245 (Merck) использовали для планшета и УФ-детектор использовали для детекции. Для колонки использовали силикагель Wakogel™ C-300 (Wako Pure Chemical) и для колонки с обратной фазой использовали силикагель LC-SORB™ SP-B-ODS (Chemco) или YMC-GEL™ ODS-AQ 120-S50 (Yamamura Chemical Laboratory).
Значения сокращений в следующих примерах показаны ниже.
i-Bu: изобутил
n-Bu: н-бутил
t-Bu: трет-бутил
Ме: метил
Et: этил
Ph: фенил
i-Pr: изопропил
n-Pr: н-пропил
CDCl3: тяжелый хлороформ
CD3OD: тяжелый метанол
ДМСО-d6: тяжелый диметилсульфоксид
Значения сокращений в следующих спектрах ядерного магнитного резонанса показаны ниже.
с: синглет
д: дуплет
дд: двойной дуплет
т: триплет
м: мультиплет
уш.: уширенный
кв: квартет
J: константа взаимодействия
Гц: герц
Пример 1
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение N-(4-бром-3-фторфенил)-2-пиридинкарбоксамида:
2,9 мл триэтиламина и 1,87 г гидрохлорида хлорангидрида пиколиновой кислоты добавляли к раствору 1 г 4-бром-3-фторанилина в хлороформе (30 мл) и перемешивали при комнатной температуре в течение 4 часов. Реакционную жидкость разбавляли хлороформом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 4/1), получая 1,44 г целевого соединения в виде кристалла светло-желтого цвета.
Стадия 2. Получение N-(4-бром-5-фтор-2-нитрофенил)-2-пиридинкарбоксамида:
1,71 г сульфита калия добавляли к 10 мл N-(4-бром-3-фторфенил)-2-пиридинкарбоксамида и перемешивали в течение ночи при 70°C. Растворитель выпаривали, остаток разбавляли хлороформом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Среду высушивали над безводным сульфатом магния и растворитель выпаривали, получая 1,17 г целевого соединения в виде кристалла желтого цвета.
Стадия 3. Получение N-{4-бром-5-(4-(метилсульфонил)фенокси]-2-нитрофенил}-2-пиридинкарбоксамида:
100 мл N-(4-бром-5-фтор-2-нитрофенил)-2-пиридинкарбоксамида, 55 мг 4-(метилсульфонил)фенола, полученного в ссылочном примере 1, и 88 мг карбоната калия суспендировали в 2 мл диметилформамида и перемешивали при 70°C в течение 30 минут. Реакционной жидкости давали остыть до комнатной температуры, затем добавляли воду и полученный кристалл отделяли фильтрованием, получая 145 мг целевого соединения в виде кристалла светло-желтого цвета.
Стадия 4. Получение 6-бром-5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазола:
145 мл N-{4-бром-5-(4-(метилсульфонил)фенокси]-2-нитрофенил}-2-пиридинкарбоксамида суспендировали в 1 мл диметилформамида, 1 мл метанола и 0,5 мл концентрированной соляной кислоты, добавляли 327 мг дигидрата хлорида олова(II) и перемешивали при 70°C в течение 30 минут. Реакционную жидкость нейтрализовали водным раствором бикарбоната натрия и разбавляли хлороформом. Нерастворимое вещество отделяли фильтрованием, фильтрат промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель выпаривали, получая 121 мг целевого соединения в виде кристалла светло-желтого цвета.
Стадия 5. Получение 6-бром-5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола и 5-бром-6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола:
6,50 г 6-бром-5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазола растворяли в 65 мл диметилформамида и, при охлаждении на льду, добавляли 0,71 г гидрида натрия (с добавлением 30% жидкого парафина). Смесь перемешивали в течение 15 минут, а затем добавляли 3,9 мл 2-триметилсилилэтоксиметилхлорида и дополнительно перемешивали в течение 30 минут. Добавляли насыщенный водный раствор хлорида аммония, разбавляли этилацетатом, затем органический слой промывали водой и насыщенным солевым раствором и высушивали над безводным сульфатом натрия. Растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 6/4), получая 7,39 г целевого соединения в виде кристалла светло-желтого цвета.
Стадия 6. Получение 5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-6-винил-1Н-бензимидазола и 6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-5-винил-1Н-бензимидазола:
1 г кристалла, полученного на стадии 5, растворяли в 10 мл толуола и добавляли 0,83 г трибутил(винил)олова и 0,1 г тетракис(трифенилфосфин)палладия, очищали азотом и перемешивали при 110°C в течение 3 часов. Среду очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 3/1), получая 0,69 г целевого соединения в виде аморфного вещества белого цвета.
Стадия 7. Получение 1-(5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)-1,2-этандиола и 1-(6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)-1,2-этандиола:
0,69 г винилового соединения, полученного на стадии 6, растворяли в 7 мл тетрагидрофурана и 1 мл воды, добавляли 0,23 г 4-метилморфолин-N-оксида и 17 мг оксида осмия(VIII) и перемешивали в течение ночи при комнатной температуре. Добавляли водный раствор тиосульфата натрия, разбавляли этилацетатом и органический слой промывали насыщенным солевым раствором. Среду высушивали над безводным сульфатом магния, растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: от хлороформа до смеси хлороформ/метанол = 98/2), получая 0,57 г целевого соединения в виде аморфного вещества белого цвета.
Стадия 8. Получение 5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбальдегида и 6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбальдегида:
1,7 г диола, полученного на стадии 7, растворяли в 16 мл хлороформа, добавляли 11 мл воды и 0,84 г периодата натрия и перемешивали при комнатной температуре в течение 3 часов. Реакционную жидкость разбавляли хлороформом и промывали насыщенным солевым раствором. Среду высушивали над безводным сульфатом магния, растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 9/1-3/1-1/1), получая 1,2 г целевого соединения в виде аморфного вещества белого цвета.
Стадия 9. Получение (5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола или (6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
100 мг альдегида, полученного на стадии 8, растворяли в 1 мл метанола, добавляли 15 мг боргидрида натрия и перемешивали при комнатной температуре 1 час. Реакционную жидкость разбавляли этилацетатом и промывали насыщенным солевым раствором. Среду высушивали над безводным сульфатом магния, растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: от хлороформа до смеси хлороформ/метанол = 98/2), получая 94 мг целевого соединения в виде аморфного вещества белого цвета.
Стадия 10. Получение 1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
50 мг спиртового соединения, полученного на стадии 9, 47,5 мг сукцинимида и 127 мг трифенилфосфина растворяли в 1 мл тетрагидрофурана, при охлаждении на льду добавляли 0,21 мл диэтилазодикарбоксилата (40% раствор в толуоле) и перемешивали при комнатной температуре в течение 2 часов. Растворитель реакции выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 9/1-5/5-8/2), получая 52,3 мг масла желтого цвета.
52,3 мг полученного масла растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, остаток нейтрализовали триэтиламином и затем очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 11,2 мг целевого соединения в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 2,56 (2H, м), 2,66 (2H, м), 3,06 (3H, c), 4,79 (2H, c), 7,02-7,20 (2H+1/2H, м), 7,40 (1Н, м), 7,44 (1/2Н, м), 7,65 (1/2Н, м), 7,76 (1/2Н, м), 7,85-7,90 (3H, м), 8,35 (м, 1H), 8,64 (м, 1Н), 10,5 (уш., 1Н).
ESI-MASS (m/e): 477 [M+H].
Пример 2
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
При охлаждении на льду 22 мкл метансульфонилхлорида добавляли к раствору в тетрагидрофуране (0,75 мл) 75 мг спиртового соединения, полученного в примере 1 (стадия 9), и 40 мкл триэтиламина и перемешивали в течение 30 минут. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. Его высушивали и растворитель выпаривали при пониженном давлении, получая 62 мг аморфного вещества светло-желтого цвета.
При охлаждении на льду 22 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 62 мг полученного аморфного вещества и 46 мг 2-пирролидона в диметилформамиде (0,5 мл) и перемешивали при комнатной температуре в течение 40 минут. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 22,1 мг бесцветного масла.
22,1 мг полученного бесцветного масла растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали, остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 9,3 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 1,85-2,00 (2H, м), 2,30-2,38 (2H, м), 3,06 (3H, c), 3,25-3,35 (2H, м), 4,54 (2H, м), 7,04-7,10 (2H, м), 7,19 (1/2Н, c), 7,40 (1Н, м), 7,49 (1/2Н, c), 7,57 (1/2Н, c), 7,77 (1/2Н, c), 7,85-7,92 (3H, м), 8,40 (1Н, м), 8,65 (1Н, м), 10,7 (1/2Н, уш.с), 10,8 (1/2Н, уш.с).
ESI-MC (m/e): 463 [M+H].
Пример 3
3-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон
Используя 2-оксазолидон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,06 (3H, c), 3,42-3,60 (2H, м), 4,22-4,28 (2H, м), 4,52 (2H, м), 7,09 (2H, м), 7,21 (1/2Н, c), 7,41 (1Н, м), 7,51 (1/2Н, c), 7,65 (1/2Н, c), 7,82-7,95 (3H+1/2H, м), 8,40 (1Н, м), 6,67 (1Н, м), 10,7 (уш., 1Н).
ESI-MC (m/e): 465 [M+H].
Пример 4
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пиперидин-2,6-дион
Используя глутаримид, целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CD3OD) δ: 0,93 (1Н, м), 1,29 (1Н, c), 1,85-1,92 (2H, м), 2,66 (2H, м), 3,11 (3H, c), 5,02 (2H, c), 7,14 (м, 2H), 7,29 (с, 1Н), 7,49 (м, 2H), 7,87-7,98 (3H, м), 8,26 (1Н, м), 8,71 (1Н, м).
ESI-MASS (m/e): 491 (M+H).
Пример 5
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил]метил}-2(1H)пиридинон
Используя 2-гидроксипиридин, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,05 (3H, c), 5,21 (2H, c), 6,08 (1Н, м), 6,56 (1Н, м), 7,07 (2H, м), 7,26 (1Н, м), 7,37 (2H, м), 7,42 (1Н, c), 7,74 (1Н, c), 7,87 (3H, м), 8,35 (1Н, м), 8,62 (1Н, м).
ESI-MASS (m/e): 473 (M+H).
Пример 6
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пиперидинон
Используя δ-валеролактон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 0,91 (2H, м), 1,75 (2H, м), 2,37 (2H, м), 3,04 (3H, c), 3,24 (2H, м), 4,66 (2H, c), 7,06 (2H, м), 7,37-7,40 (1Н, м), 7,53 (1Н, м), 7,68 (1Н, м), 7,86 (3H, м), 8,38 (1Н, м), 8,64 (1Н, м).
ESI-MASS (m/e): 477.
Пример 7
2-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1Н-изоиндол-1,3(2H)дион
Используя имид фталевой кислоты, целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,03 (3H, c), 4,99 (2H, c), 7,05 (3H, м), 7,40 (1Н, м), 7,80 (8H, м), 8,38 (1Н, д, J=7,8 Гц), 8,64 (1Н, д, J=3,9 Гц), 10,79 (1Н, уш.с).
ESI-MASS (m/e): 525 (M+H).
Пример 8
2-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил]метил}-цис-3a,4,7,7a-тетрагидро-1Н-изоиндол-1,3(2Н)дион
Используя цис-1,2,3,6-тетрагидрофталимид, целевое соединение получали тем же самым способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,21 (2H, м), 2,59 (2H, м), 2,99 (2H, м), 3,05 (3H, м), 4,73 (2H, c), 5,91 (2H, м), 7,09 (2H, м), 7,29 (1Н, м), 7,39 (1Н, м), 7,51 (1Н, м), 7,86 (3H, м), 8,37 (1Н, м), 8,62 (1Н, м).
ESI-MASS (m/e): 529 (M+H).
Пример 9
5-Метил-1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя 5-метил-2-пирролидинон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 0,89 (1Н, м), 1,16 (3H, м), 2,11 (1Н, м), 2,25-2,33 (1Н, м), 2,46 (1Н, м), 3,07 (3H, д, J=3,5 Гц), 3,62 (1Н, м), 4,17 (1Н, д, J=15,2 Гц), 4,95 (2H, д, J=15,2 Гц), 7,08 (2H, м), 7,35 (1Н, c), 7,42 (1Н, м), 7,69 (1Н, c), 7,89 (3H, м), 8,41 (1Н, м), 8,66 (1Н, м).
ESI-MASS (m/e): 477 (M+H).
Пример 10
3-Метил-1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя 3-метил-2-пирролидинон, целевое соединение получали тем же самым способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 0,87 (1Н, c), 1,10-1,15 (3H, м), 1,51 (1Н, м), 2,41 (1Н, м), 3,04 (3H, м), 3,21 (2H, м), 4,44-4,61 (2H, м), 7,01-7,06 (2H, м), 7,38-7,40 (1Н, м), 7,50 (1Н, д, J=19,2 Гц), 7,74 (1Н, c), 7,85-7,90 (3H, м), 8,36-8,41 (1Н, м), 8,63-8,64 (1Н, м), 10,91 (1Н, уш.с).
ESI-MASS (m/e): 477 (M+H).
Пример 11
Метил 1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-оксо-2-пирролидинкарбоксилат
Стадия 1. Получение метилпироглутамата:
1 г dl-пироглутаминовой кислоты растворяли в смеси 25 мл метанола и 15 мл хлороформа, добавляли при комнатной температуре 7,7 мл триметилсилилдиазометана (2М раствор в гексане) и затем перемешивали в течение 20 минут. Растворитель выпаривали при пониженном давлении, остаток растворяли в хлороформе и промывали насыщенным солевым раствором. После высушивания растворитель удаляли, получая 1,03 г целевого соединения в виде масла светло-желтого цвета.
Стадия 2. Получение метил 1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-оксо-2-пирролидинкарбоксилата:
Используя метилпироглутамат, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,01 (1Н, м), 2,13 (1Н, м), 2,24 (1Н, м), 2,44-2,50 (1Н, м), 3,04 (3H, м), 3,67 (3H, м), 4,03-4,16 (2H, м), 5,01 (1/2Н, м), 5,12 (1/2Н, м), 7,01-7,09 (2H, м), 7,16 (1/2Н, д, J=2,0 Гц), 7,40 (1Н, дд, J=5,5, 6,7 Гц), 7,48 (1/2Н, д, J=21,5 Гц), 7,60 (1/2Н, c), 7,77 (1/2Н, д, J=2,3 Гц), 7,87 (3H, м), 8,36-8,39 (1Н, м), 8,64-8,65 (1Н, м), 10,65 (1Н, д, J=13,7 Гц).
ESI-MASS (m/e): 521 (M+H).
Пример 12
1-(1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил]метил}-1H-пиррол-2-ил)-1-этанон
Используя 2-ацетилпиррол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,29-2,39 (3H, м), 3,05 (3H, м), 5,64 (2H, c), 6,17 (1Н, м), 6,91 (1Н, м), 6,98 (1Н, м), 7,04-7,20 (3H, м), 7,34-7,37 (2H, м), 7,85 (3H, м), 8,53 (1Н, д, J=7,8 Гц), 8,59 (1Н, д, J=4,7 Гц).
ESI-MASS (m/e): 487 (M+H).
Пример 13
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-тиоксо-2-пирролидинон
Стадия 1. Получение 5-тиоксо-2-пирролидинона:
300 мг сукцинимида растворяли в 3 мл тетрагидрофурана при 60°C и добавляли 606 мг реактива Лоусона (Aldrich). Смесь перемешивали при 60°C в течение 1,5 часов и растворитель выпаривали. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. Его высушивали над безводным сульфатом магния, растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 20/1-7/3-1/1), получая 255 мг целевого соединения в виде твердого вещества светло-желтого цвета.
Стадия 2. Получение 1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-тиоксо-2-пирролидинона:
Используя 5-тиоксо-2-пирролидинон, целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,62 (1Н, м), 2,72 (1Н, м), 3,05 (1Н, м), 3,07 (3H, c), 3,12 (1Н, м), 5,18 (2H, c), 7,00-7,20 (2H+1/2H, м), 7,39-7,43 (1Н, м), 7,44 (1/2Н, уш.с), 7,49 (1/2Н, уш.с), 7,60 (1/2Н, уш.с), 7,82-7,90 (3H, м), 8,36 (1Н, д, J=8,0 Гц), 8,63 (1Н, уш.с), 10,6 (1Н, уш.).
ESI-MC (m/e): 493 [M+H].
Пример 14
5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-6-(1Н-1,2,4-триазол-1-илметил)-1Н-бензимидазол
Используя 1,2,4-триазол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,05-3,10 (3H, м), 5,46 (2H, c), 7,06 (2H, м), 7,36-7,44 (2H, м), 7,83-7,93 (5H, м), 8,05 (1Н, c), 8,41 (1Н, д, J=7,8 Гц), 8,66 (1Н, д, J=4,3 Гц).
ESI-MASS (m/e): 447 (M+H).
Пример 15
цис-3,4-Диметил-1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил]-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение цис-3,4-диметилпирролидин-2,5-диона:
2,3 мл ацетилхлорида и 0,24 мл тионилхлорида добавляли к 500 мг мезо-2,3-диметилянтарной кислоты и нагревали с обратным холодильником в течение 2 часов. Реакционной жидкости давали остыть до комнатной температуры и растворитель выпаривали при пониженном давлении. Остаток перекристаллизовывали из толуола и гексана, получая 398 мг ангидрида мезо-2,3-диметилянтарной кислоты в виде твердого вещества белого цвета.
На охлаждающей бане газообразный аммиак вводили в раствор 390 мг ангидрида цис-2,3-диметилянтарной кислоты в толуоле (5 мл) в течение 30 минут. Растворитель выпаривали при пониженном давлении, получая твердое вещество белого цвета. Его растворяли в 10 мл ДМФА, при -78°C добавляли 0,5 мл тионилхлорида и перемешивали при 0°C в течение 2 часов. Реакционной жидкости давали остыть до комнатной температуры, растворитель выпаривали при пониженном давлении, к остатку добавляли этилацетат и промывали насыщенным водным раствором гидрокарбоната натрия. После высушивания растворитель удаляли и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 7/3 до 0/1), получая 269 мг целевого соединения в виде твердого вещества белого цвета.
Стадия 2. Получение цис-3,4-диметил-1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя цис-3,4-диметилпирролидин-2,5-дион, целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,19 (6H, м), 2,84 (2Н, м), 3,04 (3Н, м), 4,74 (2Н, c), 7,08 (3Н, м), 7,38-7,42 (2Н, м), 7,84-7,86 (3Н, м), 8,37 (1Н, д, J=7,4 Гц), 8,61 (1Н, c), 10,88 (1Н, с).
ESI-MASS (m/e): 505 (M+H).
Пример 16
4-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}морфолин-3,5-дион
Используя морфолин-3,5-дион, целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,05 (3/2Н, c), 3,06 (3/2Н, c), 4,27 (2H, c), 4,34 (2H, c), 5,07 (2H, c), 7,05-7,10 (2H+1/2H, м), 7,35-7,42 (1Н, м), 7,44 (1/2Н, м), 7,53 (1/2Н, м), 7,74 (1/2Н, м), 7,85-7,92 (3H, м), 8,38 (1Н, м), 8,61 (1Н, м), 10,9 (1Н, уш.).
ESI-MC (m/e): 493 [M+H].
Пример 17
3-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2,4-дион
Используя 2,4-тиазолидиндион, целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,06 (3/2Н, c), 3,07 (3/2Н, c), 3,77 (1Н, c), 3,87 (1Н, c), 4,89 (1Н, c), 4,91 (1Н, c), 7,02-7,12 (2H+1/2H, м), 7,35-7,44 (1Н, м), 7,45 (1/2Н, c), 7,62 (1/2Н, c), 7,81 (1/2Н, c), 7,85-7,92 (3H, м), 8,37 (1Н, м), 8,63 (1Н, м), 10,7 (1/2Н, уш.), 10,8 (1/2Н, уш.).
ESI-MC (m/e): 495 [M+H].
Пример 18
3-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2-он
Используя 2-оксатиазолидин, полученный согласно способу, описанному в Synthetic communications, 1987, Vol.17, No.13, pp.1577-1785, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,06 (3H, c), 3,16 (2H, м), 3,55 (2H, м), 4,55 (1Н, c), 4,57 (1Н, c), 7,03-7,09 (2H, м), 7,17 (1/2Н, c), 7,41 (1Н, м), 7,49 (1/2Н, c), 7,58 (1/2Н, c), 7,83-7,92 (3H+1/2H, м), 8,41 (1Н, м), 8,65 (1Н, м), 10,95 (1/2Н, уш.), 10,91 (1/2Н, уш.).
ESI-MC (m/e): 481 [M+H].
Пример 19
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение метил 2-фтор-4-нитробензоата:
5 мл концентрированной серной кислоты добавляли к раствору 140 г 2-фтор-4-нитробензойной кислоты в метаноле (1300 мл) и нагревали с обратным холодильником в течение 48 часов. Растворитель выпаривали при пониженном давлении, к остатку добавляли воду и образовавшееся твердое вещество отделяли фильтрованием. Его высушивали при пониженном давлении, получая 141 мг целевого соединения в виде твердого вещества желтого цвета.
Стадия 2. Получение метил 4-амино-2-фторбензоата:
141 г метил 2-фтор-4-нитробензоата растворяли в 1000 мл метанола и 400 мл тетрагидрофурана, добавляли 20 г никеля Ренея и перемешивали в течение ночи в атмосфере водорода. Катализатор удаляли фильтрованием и растворитель выпаривали при пониженном давлении, получая 119 г метил 4-амино-2-фторбензоата.
Стадия 3. Получение метил 2-фтор-4-[(2-пиридинилкарбонил)амино]бензоата:
Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида добавляли к раствору 18,9 г метил 4-амино-2-фторбензоата и 16,5 г пиколиновой кислоты в пиридине (500 мл) и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали при пониженном давлении, добавляли к остатку 600 мл этилацетата, органический слой промывали водным 0,25 н. раствором соляной кислоты, водным 0,25 н. раствором гидроксида натрия и насыщенным солевым раствором, высушивали, концентрировали при пониженном давлении, отверждали из смеси растворителей гексан/этилацетат и твердый продукт отделяли фильтрованием. Его высушивали при пониженном давлении, получая 28,3 г целевого соединения в виде твердого вещества белого цвета.
Стадия 4. Получение метил 2-фтор-5-нитро-4-[(2-пиридинилкарбонил)амино]бензоата:
При охлаждении на льду 110 мл дымящей азотной кислоты постепенно добавляли к 27,7 г метил 2-фтор-4-[(2-пиридинилкарбонил)амино]бензоата и перемешивали при комнатной температуре в течение 1,5 часов. При охлаждении на льду реакционную жидкость постепенно добавляли к раствору карбоната натрия (138 г) в воде (2000 мл) и образовавшийся твердый продукт отделяли фильтрованием. Его высушивали при пониженном давлении, получая 27,5 г целевого соединения в виде твердого вещества желтого цвета.
Стадия 5. Получение метил 2-[4-(этилсульфонил)фенокси]-5-нитро-4-[(2-пиридинилкарбонил)амино]бензоата:
3,5 г карбоната калия добавляли к раствору в диметилформамиде (110 мл) 6 г метил 2-фтор-5-нитро-4-[(2-пиридинилкарбонил)амино]бензоата и 3,48 г 4-(этилсульфонил)фенола, полученного в ссылочном примере 2, и перемешивали при нагревании при температуре 80°C в течение 30 минут. Реакционной жидкости давали остыть до комнатной температуры, вливали в 300 мл воды и образовавшийся твердый продукт отделяли фильтрованием. Его высушивали при пониженном давлении, получая 7,46 г целевого соединения в виде твердого вещества желтого цвета.
Стадия 6. Получение метил 5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбоксилата:
7,46 г метил 2-[4-(этилсульфонил)фенокси]-5-нитро-4-[(2-пиридинилкарбонил)амино]бензоата суспендировали в 37 мл диметилформамида и 37 мл метанола, добавляли 17,3 г дигидрата хлорида олова(II) и 15 мл концентрированной соляной кислоты и перемешивали при нагревании при температуре 80°C в течение 40 минут. Реакционной жидкости давали остыть до комнатной температуры, затем постепенно добавляли водный раствор гидрокарбоната натрия и нейтрализовали. Добавляли этилацетат, перемешивали при комнатной температуре в течение 30 минут и образовавшуюся соль удаляли фильтрованием. Фильтрат промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали, получая 6,9 г сырого продукта метил 5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-карбоксилата в виде твердого вещества желтого цвета.
При охлаждении на льду 4 мл 2-(триметилсилил)этоксиметилхлорида и 0,92 г гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 6,9 г сырого продукта в диметилформамиде (70 мл) и перемешивали при комнатной температуре в течение 30 минут. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 3/2), получая 6,43 г целевого соединения в виде масла желтого цвета.
Стадия 7. Получение (5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
При охлаждении на льду раствор 0,99 г алюмогидрида лития и 5,9 г указанного сложного эфира в тетрагидрофуране (50 мл) постепенно добавляли к 60 мл тетрагидрофурана. Смесь перемешивали при комнатной температуре в течение 15 минут и при охлаждении на льду постепенно добавляли 10-гидрат сульфата натрия до прекращения вспенивания. Затем добавляли этилацетат и перемешивали при комнатной температуре в течение 1 часа. Образовавшуюся соль удаляли фильтрованием и растворитель выпаривали при пониженном давлении. Остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 3/2), получая 4,5 г целевого соединения в виде масла желтого цвета.
Стадия 8. Получение 1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
1,3 г сукцинимида и 3,5 г трифенилфосфина добавляли к раствору 2,4 г полученного спиртового соединения в тетрагидрофуране (24 мл), при охлаждении на льду добавляли 5,8 мл диэтилазодикарбоксилата (40% раствор в толуоле) и перемешивали при комнатной температуре в течение 1 часа. Растворитель реакции выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 8/2-1/1-1/9), получая 2,3 г масла желтого цвета.
15 мл трифторуксусной кислоты добавляли к полученному маслу и перемешивали в течение 2 часов. Растворитель выпаривали при пониженном давлении, остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: от хлороформа до смеси хлороформ/метанол = 99/1) и перекристаллизовывали (этилацетат), получая 1,02 г целевого соединения в виде кристалла белого цвета.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, м), 2,54 (2H, c), 2,65 (2H, c), 3,12 (2H, м), 4,79 (1Н, м), 4,80 (1Н, c), 7,05-7,12 (2H+1/2H, м), 7,39 (1Н, м), 7,44 (1/2Н, c), 7,64 (1/2Н, c), 7,76 (1/2Н, c), 7,81-7,90 (3H, м), 8,38 (1Н, м), 8,65 (1Н, м), 10,5 (1/2Н, уш.), 10,6 (1/2Н, уш.).
ESI-MASS (m/e): 491 (M+H).
Пример 20
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 19 (стадия 7), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,24-1,30 (3H, м), 1,91 (2H, дт, J=23,7, 7,8 Гц), 2,32 (2H, м), 3,06-3,13 (2H, м), 3,26 (2H, кв, J=10,4 Гц), 4,53 (2H, c), 7,05 (2H, м), 7,39 (2H, м), 7,79-7,89 (4H, м), 8,38 (1Н, д, J=8,2 Гц), 8,63 (1Н, д, J=4,7 Гц).
ESI-MASS (m/e): 477 (M+H).
Пример 21
3-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил]-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и 2-оксазолидон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,4 Гц), 3,11 (2H, кв, J=7,4 Гц), 3,46 (2H, м), 4,23 (2H, т, J=8,2 Гц), 4,51 (2H, c), 7,08 (2H, кв, J=9,0 Гц), 7,40 (1Н, т, J=6,3 Гц), 7,50 (1Н, м), 7,65-7,68 (1Н, м), 7,83-7,86 (3H, м), 8,36-8,38 (1Н, м), 8,64 (1Н, c), 10,63 (1Н, с).
ESI-MASS (m/e): 479 (M+H).
Пример 22
1-({2-(5-Бром-2-пиридинил)-[5-[4-(этилсульфонил)фенокси]-1Н-бензимидазол-6-ил}метил)пирролидин-2,5-дион
Используя 5-бромпиколиновую кислоту в примере 19 (стадия 3), целевое соединение получали тем же способом, как в примере 19, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, м), 2,55 (2H, c), 2,65 (2H, c), 3,12 (2H, c), 4,79 (1Н, c), 4,80 (1Н, c), 7,05-7,15 (2H+1/2H, м), 7,44 (1/2Н, c), 7,65 (1/2Н, c), 7,76 (1/2Н, c), 7,82-7,90 (2H, м), 8,00 (1Н, м), 8,26 (1Н, м), 8,70 (1Н, м), 10,3 (1/2Н, уш.), 10,4 (1/2Н, уш.).
ESI-MC (m/e): 569, 571 [M+H].
Пример 23
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-имидазолидинон
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и этиленмочевину, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3, одна капля CD3OD) δ: 1,28 (3H, т, J=7,2 Гц), 3,11 (2H, кв, J=7,2 Гц), 3,25-3,28 (4H, м), 4,41 (2H×1/2, c), 4,44 (2H×1/2, c), 4,63 (1Н×1/2, c), 4,65 (1Н×1/2, c), 7,05 (2H, д, J=8,2 Гц), 7,20 (1Н×1/2, c), 7,37-7,41 (1Н, м), 7,45 (1Н×1/2, c), 7,59 (1Н×1/2, c), 7,77 (1Н×1/2, c), 7,82 (2H, д, J=8,2 Гц), 7,85-7,90 (1Н, м), 8,37 (1Н, д, J=7,4 Гц), 8,61-8,65 (1Н, м).
ESI-MASS (m/e): ND.
Пример 24
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}имидазолидин-2,5-дион
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и гидантоин, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,4 Гц), 3,13 (2H, кв, J=7,4 Гц), 3,70-4,00 (2H, м), 4,77-4,89 (3H, м), 7,05-7,90 (8H, м), 8,37-8,42 (1Н, м), 8,62-8,67 (1Н, м), 10,64-10,95 (1Н, м).
ESI-MASS (m/e): 492 (M+H).
Пример 25
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1Н-пиримидин-2,4-дион
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и урацил, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,12 (3H, т, J=7,4 Гц), 3,24 (2H, кв, J=7,4 Гц), 4,94 (2H, c), 5,47 (1Н, д, J=8,2 Гц), 7,10 (2H, д, J=8,2 Гц), 7,55 (1Н, дд, J=7,8, 5,5 Гц), 7,57 (1Н, c), 7,59 (1Н, c), 7,83 (2H, д, J=8,2 Гц), 8,02 (1Н, дд, J=7,8, 7,8 Гц), 8,31 (1Н, д, J=7,8 Гц), 8,75 (1Н, д, J=5,5 Гц), 11,18 (1Н, уш.с).
ESI-MASS (m/e): 504 (M+H).
Пример 26
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метилимидазолидин-2,5-дион
Используя 1-метилгидантоин, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,0 Гц), 2,85 (3H×1/2, c), 2,92 (3H×1/2, c), 3,11 (2H, кв, J=7,0 Гц), 3,59 (2H×1/2, c), 3,74 (2H×1/2, c), 4,77 (2H×1/2, c), 4,78 (2H×1/2, c), 7,06 (2H, д, J=9,0 Гц), 7,10 (1Н×1/2, c), 7,36-7,40 (1Н, м), 7,45 (1Н×1/2, c), 7,66 (1Н×1/2, c), 7,79-7,89 (3H, м), 7,79-7,89 (1Н×1/2, м), 8,37 (1Н×1/2, д, J=8,2 Гц), 8,40 (1Н×1/2, д, J=8,2 Гц), 8,60-8,65 (1Н, м), 10,63 (1Н×1/2, уш.с), 10,67 (1Н×1/2, уш.с).
ESI-MASS (m/e): 506 (M+H).
Пример 27
3-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил]-1Н-бензимидазол-6-ил]метил}-1-метил-1Н-пиримидин-2,4-дион
Используя 1-метилурацил, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H×1/2, т, J=7,4 Гц), 1,28 (3H×1/2, т, J=7,4 Гц), 3,10 (2H×1/2, кв, J=7,4 Гц), 3,10 (2H×1/2, кв, J=7,4 Гц), 3,25 (3H×1/2, c), 3,33 (3H×1/2, c), 5,23 (2H×1/2, c), 5,24 (2H×1/2, c), 5,63 (1Н×1/2, д, J=7,8 Гц), 5,72 (1Н×1/2, д, J=7,8 Гц), 6,99 (1Н×1/2, д, J=7,8 Гц), 7,04 (2H×1/2, д, J=9,0 Гц), 7,09 (1Н×1/2, c), 7,10 (2H×1/2, д, J=9,0 Гц), 7,10 (1Н×1/2, д, J=7,8 Гц), 7,34-7,38 (1Н, м), 7,43 (1Н×1/2, c), 7,52 (1Н×1/2, c), 7,63 (1Н×1/2, c), 7,78 (2H×1/2, д, J=9,0 Гц), 7,81-7,87 (1Н, м), 7,82 (2H×1/2, д, J=9,0 Гц), 8,35 (1Н, д, J=7,8 Гц), 8,60 (1Н×1/2, д, J=5,1 Гц), 8,61 (1Н×1/2, д, J=5,1 Гц), 10,65 (1Н, уш.с).
ESI-MASS (m/e): 518 (M+H).
Пример 28
1-{[5-[4-Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метил-1Н-пиримидин-2,4-дион
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и 3-метилурацил, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,4 Гц), 3,12 (2H, кв, J=7,4 Гц), 3,26 (3H×1/2, c), 3,29 (3H×1/2, c), 5,00 (2H×1/2, c), 5,03 (2H×1/2, c), 5,65 (1Н×1/2, д, J=7,8 Гц), 5,65 (1Н×1/2, д, J=7,8 Гц), 7,05 (2H×1/2, д, J=8,6 Гц), 7,09 (2H×1/2, д, J=8,6 Гц), 7,13 (1Н×1/2, c), 7,19 (1Н×1/2, д, J=7,8 Гц), 7,27 (1Н×1/2, c), 7,38-7,42 (1Н, м), 7,43 (1Н×1/2, c), 7,70 (1Н×1/2, c), 7,83-7,90 (3H, м), 7,83-7,90 (1Н×1/2, м), 8,36 (1Н, д, J=7,8 Гц), 8,39 (1Н, д, J=7,8 Гц), 8,61-8,65 (1Н, м), 10,80 (1Н, уш.с).
ESI-MASS (m/e): 518 (M+H).
Пример 29
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метил-2-имидазолидинон
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и 1-метилимидазолидинон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,4 Гц), 2,73 (3H×1/2, c), 2,75 (3H×1/2, c), 3,10 (2H, кв, J=7,4 Гц), 3,16-3,20 (4H, м), 4,43 (2H×1/2, c), 4,43 (2H×1/2, c), 7,03 (2H, д, J=9,0 Гц), 7,06 (1Н×1/2, c), 7,16 (1Н×1/2, c), 7,37-7,40 (1Н, м), 7,47 (1Н×1/2, c), 7,61 (1Н×1/2, c), 7,80 (2H, д, J=9,0 Гц), 7,84-7,89 (1Н, м), 8,37 (1Н×1/2, д, J=7,8 Гц), 8,40 (1Н×1/2, д, J=7,8 Гц), 8,62 (1Н×1/2, д, J=4,7 Гц), 8,64 (1Н×1/2, д, J=4,7 Гц), 10,81 (1Н×1/2, уш.с), 10,84 (1Н×1/2, уш.с).
ESI-MASS (m/e): 492 (M+H).
Пример 30
3-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-азабицикло[3.1.0]гексан-2,4-дион
Используя 3-азабицикло[3.1.0]гексан-2,4-дион, целевое соединение получали тем же способом, как в примере 19 (стадия 7), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,17-1,75 (5H, м), 2,40-2,50 (2H, м), 3,05-3,18 (2H, м), 4,61 (1Н, c), 4,63 (1Н, c), 7,05-7,13 (2H+1/2H, м), 7,39-7,44 (1Н, м), 7,44 (1/2Н, c), 7,54 (1/2Н, c), 7,73 (1/2Н, c), 7,82-7,90 (3H, м), 8,39 (1Н, м), 8,63 (1Н, м), 10,8 (1/2Н, уш.), 10,9 (1/2Н, уш.).
ESI-MASS (m/e): 503 (M+H).
Пример 31
N-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}метансульфонамид
Стадия 1. Получение (5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метиламина или (6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)метиламина:
При охлаждении на льду 74 мкл метансульфонилхлорида добавляли к раствору в тетрагидрофуране (2,6 мл) 260 мг спиртового соединения, полученного в примере 19 (стадия 7), и 134 мкл триэтиламина и перемешивали в течение 30 минут. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая масло светло-желтого цвета.
156 мг азида натрия добавляли к раствору полученного масла в диметилформамиде (3 мл) и перемешивали при комнатной температуре в течение 1 часа. Добавляли воду, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 3/2), получая 177 мг масла желтого цвета.
5 мг пентагидрата сульфата меди(II) и 53 мг боргидрида натрия добавляли к раствору полученного масла в метаноле (3,2 мл) и перемешивали при комнатной температуре в течение 30 минут. Добавляли насыщенный водный раствор хлорида аммония, нейтрализовали насыщенным водным бикарбонатом натрия, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: от хлороформа до смеси хлороформ/метанол = 20/1), получая 141 мг целевого соединения в виде масла желтого цвета.
Стадия 2. Получение N-(5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метансульфонамида или N-(6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)метансульфонамида:
При охлаждении на льду 25 мкл триэтиламина и 11 мкл метансульфонилхлорида добавляли к раствору 63 мг полученного амина в хлороформе (1 мл). После перемешивания в течение 30 минут добавляли насыщенный водный раствор бикарбоната натрия, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: от хлороформа до смеси хлороформ/метанол = 20/1), получая 77 мг целевого соединения в виде масла желтого цвета.
Стадия 3. Получение N-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}метансульфонамида:
0,5 мл трифторуксусной кислоты добавляли к 77 мг полученного масла желтого цвета и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 6OF254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 9,4 мг целевого соединения в виде аморфного вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,3 Гц), 2,84 и 2,86 (общий 3H, c), 3,14 (2H, кв, J=7,3 Гц), 4,41 (2H, м), 4,93 (1Н, м), 7,07-7,13 (2H+1/2H, м), 7,41 (1Н, м), 7,45 (1/2Н, c), 7,67 (1/2Н, c), 7,87 (3H, м), 7,93 (1/2Н, c), 8,40 (1Н, м), 8,65 (1Н, м), 10,7 и 10,8 (общий 1Н, уш.).
ESI-MASS (m/e): 487 (M+H).
Пример 32
N-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-N-метилметансульфонамид
При охлаждении на льду 14 мкл метилиодида и 5,3 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 60 мг сульфонамида, полученного в примере 31 (стадия 2), в диметилформамиде (0,6 мл). Смесь перемешивали при комнатной температуре в течение 30 минут, затем добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая масло желтого цвета.
0,5 мл трифторуксусной кислоты добавляли к полученному маслу желтого цвета и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 6OF254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 38,4 мг целевого соединения в виде аморфного вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 2,83 (6H, м), 3,12 (2H, кв, J=7,4 Гц), 4,40 и 4,42 (общий 2H, c), 7,00-7,10 (2H, м), 7,14 (1/2Н, c), 7,41 (1Н, м), 7,48 (1/2Н, c), 7,72 (1/2Н, c), 7,83-7,95 (3H, м), 7,97 (1/2Н, c), 8,41 (1Н, м), 8,65 (1Н, м), 11,0 (1Н, уш.).
ESI-MASS (m/e): 501 (M+H).
Пример 33
2-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}изотиазолидин-1,1-диоксид
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и изотиазолидин-1,1-диоксид, полученный согласно способу, описанному в Organic letters, 2003, Vol.5, No.22, pp.4175-4277, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,5 Гц), 2,20-2,30 (2H, м), 3,05-3,20 (6H, м), 4,28 (2H, уш.с), 7,08 (2H, д, J=8,9 Гц), 7,19 (1/2Н, уш.с), 7,41 (1Н, м), 7,50 (1/2Н, уш.с), 7,71 (1/2Н, уш.с), 7,84 (2H, д, J=8,9 Гц), 7,89 (1Н, м), 7,96 (1/2Н, уш.с), 8,41 (1Н, м), 8,65 (1Н, м), 10,7 (1Н, уш.).
ESI-MASS (m/e): 513 (M+H).
Пример 34
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиразинил-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение метил 2-фтор-5-нитро-4-[(2-пиразинилкарбонил)амино]бензоата:
Используя метил 4-амино-2-фторбензоат, полученный в примере 19 (стадия 2), и пиразин-2-карбоновую кислоту, целевое соединение получали тем же способом, как в примере 19 (стадия 3, стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение метил 5-[4-(метилсульфонил)фенокси]-2-(2-пиразинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-[4-(метилсульфонил)фенокси]-2-(2-пиразинил)-1-{[2-(триметилсилил) этокси]метил}-1Н-бензимидазол-5-карбоксилата:
Используя метил 2-фтор-5-нитро-4-[(2-пиразинилкарбонил)амино]бензоат, полученный выше, и 4-(метилсульфонил)фенол, полученный в ссылочном примере 1, целевое соединение получали тем же способом, как в примере 19 (стадия 5, стадия 6), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 3. Получение (5-[4-(метилсульфонил)фенокси]-2-(2-пиразинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-[4-(метилсульфонил)фенокси]-2-(2-пиразинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)метанола:
570 мг полученного сложного метилового эфира растворяли в 4 мл метанола, добавляли 1 мл тетрагидрофурана, затем 1 мл водного 5 н. раствора гидроксида натрия и перемешивали при комнатной температуре в течение 2 часов. Контролировали рН=3 с помощью водного 10% раствора лимонной кислоты, затем экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 447 мг твердого вещества светло-желтого цвета.
201 мг 1,1'-карбодиимидазола добавляли к раствору полученного твердого вещества светло-желтого цвета в тетрагидрофуране (5 мл) и перемешивали в течение 12 часов.
Реакционную жидкость добавляли к раствору 157 мг боргидрида натрия в воде (5 мл) и перемешивали при комнатной температуре в течение 30 минут. Добавляли водный 10% раствор лимонной кислоты, экстрагировали этилацетатом, органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 1/9), получая 234 мг целевого соединения в виде масла желтого цвета.
Стадия 4. Получение 1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,71 (3H, c), 2,57 (2H, c), 2,69 (2H, c), 3,06 (3/2Н, c), 3,07 (3/2Н, c), 4,79 (1Н, c), 4,80 (1Н, c), 7,05-7,15 (2H+1/2H, м), 7,47 (1/2Н, c), 7,68 (1/2Н, c), 7,77 (1/2Н, c), 7,85-7,95 (2H, м), 8,60 (1Н, м), 8,68 (1Н, м), 9,61 (1Н, дд, J=1,6, 7,0 Гц), 10,59 (1Н, уш.).
ESI-МС (m/e): 478 [М+Н].
Пример 35
1-{[5-[4-(Метилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил]-2-пирролидинон
Используя спиртовое соединение, полученное в примере 34 (стадия 3), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,90-2,02 (2H, м), 2,30-2,45 (2H, м), 3,07 (3H, c), 3,30-3,40 (2H, м), 4,55 (2H, c), 7,00-7,10 (2H, м), 7,18 (3/7Н, c), 7,50 (4/7Н, c), 7,68 (4/7Н, c), 7,78 (3/7Н, c), 7,83-7,92 (2H, м), 8,55-8,66 (1Н, м), 8,67 (1Н, м), 9,62 (1Н, м), 11,0 (3/7Н, уш.), 11,5 (4/7Н, уш.).
ESI-МС (m/e): 464 [M+H].
Пример 36
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиразинил]-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение (5-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола:
Используя 4-(этилсульфонил)фенол, полученный в ссылочном примере 2, целевое соединение получали тем же способом, как в примере 34 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя полученный спирт, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,23-1,31 (3H, м), 2,54 (2H, c), 2,67 (2H, c), 3,11 (2H, кв, J=14,8 Гц), 4,79 (2H, c), 7,06 (1/2Н, c), 7,08-7,11 (2H, м), 7,46 (1/2Н, c), 7,67 (1/2Н, c), 7,76 (1/2Н, c), 7,81-7,87 (2H, м), 8,57-8,60 (1Н, м), 8,66 (1Н, м), 9,60 (1Н, м), 10,48 (1Н, д, J=11,7 Гц).
ESI-MASS (m/e): 492 (M+H).
Пример 37
1-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 36 (стадия 1), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,4 Гц), 1,94-2,01 (2H, м), 2,35-2,41 (2H, м), 3,14 (2H, кв, J=7,4 Гц), 3,33-3,36 (2H, м), 4,58 (2H, д, J=3,5 Гц), 7,09 (2H, м), 7,22 (1/2Н, м), 7,53 (1/2Н, c), 7,66 (1/2Н, c), 7,82 (1/2Н, c), 7,87 (2H, д, J=8,2 Гц), 8,62 (1Н, м), 8,70 (1Н, д, J=2,3 Гц), 9,63-9,66 (1Н, м), 10,48 (1/2Н, c), 10,73 (1/2H, с).
ESI-MASS (m/e): 478 (M+H).
Пример 38
3-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 36 (стадия 1), и 2-оксазолидон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, 7,4 Гц), 3,11 (2H, кв, J=7,4 Гц), 3,50 (2H, м), 4,25 (2H, м), 4,53 (2H, c), 7,06-7,09 (3H, м), 7,84-7,86 (3H, м), 8,61 (1Н, м), 8,68 (1Н, д, J=2,3 Гц), 9,62 (1Н, д, J=1,6 Гц).
ESI-MASS (m/e): 480 (M+H).
Пример 39
1-{[5-[6-(Этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение (5-{[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-{[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
Используя 6-(этилсульфонил)-3-пиридинол, полученный в ссылочном примере 4, целевое соединение получали тем же способом, как в примере 19 (стадии 5-7), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-{[5-[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,27-1,37 (3H, м), 2,63 (2H, c), 2,70 (2H, c), 3,30-3,45 (2H, м), 4,77 (1Н, 2), 4,79 (1Н, c), 7,10 (1/2Н, c), 7,35-7,45 (2H, м), 7,45 (1/2Н, м), 7,67 (1/2Н, c), 7,80 (1/2Н, c), 7,88 (1Н, м), 8,03 (1Н, м), 8,39 (1Н, м), 8,49 (1Н, м), 8,64 (1Н, м), 10,8 (1Н, уш.).
ESI-МС (m/e): 492 [M+H].
Пример 40
1-{[5-[6-(Этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 39 (стадия 1), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,6 Гц), 1,95 (2H, м), 2,34 (2H, дт, J=8,0, 16 Гц), 3,30 (2H, кв, J=7,0 Гц), 3,39 (2H, кв, J=7,6 Гц), 4,54 (1Н, c), 4,55 (1Н, c), 7,17 (1/2Н, c), 7,33 (1Н, дд, J=2,7, 8,8 Гц), 7,41 (1Н, м), 7,48 (1/2Н, c), 7,58 (1/2Н, c), 7,79 (1/2Н, c), 7,91 (1Н, м), 8,01 (1Н, м), 8,38-8,45 (1H+1/2H, м), 8,47 (1/2Н, м), 8,65 (1Н, м), 11,0 (1/2Н, уш.), 11,1 (1/2Н, уш.).
ESI-MC (m/e): 478 [M+H].
Пример 41
3-{[5-{[6-(Этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 39 (стадия 1), и 2-оксазолидон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,6 Гц), 3,34-3,42 (2H, кв, J=7,6 Гц), 3,43-3,53 (2H, м), 4,25 (2H, кв, J=8,0 Гц), 4,52 (1Н, c), 4,54 (1Н, c), 7,20 (1/2Н, м), 7,32-7,37 (1Н, м), 7,38-7,45 (1Н, м), 7,50 (1/2Н, c), 7,63 (1/2Н, c), 7,85-7,92 (1H+1/2H, м), 8,01 (1Н, д, J=8,6 Гц), 8,37-8,45 (1H+1/2H, м), 8,48 (1/2Н, м), 8,65 (1Н, м), 11,1 (1Н, уш.).
ESI-MC (m/e): 480 [M+H].
Пример 42
1-{[5-{[6-Метилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение (5-{[6-(метилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-{[6-(метилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
Используя 6-(метилсульфонил)-3-пиридинол, полученный в ссылочном примере 3, целевое соединение получали тем же способом, как в примере 19 (стадии 5-7), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-{[5-{[6-метилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,61 (2H, м), 2,69 (2H, м), 3,24 (3H, м), 4,77 (2H, д, J=9,0 Гц), 7,12 (1/2Н, c), 7,35-7,41 (2H, м), 7,44 (1/2Н, c), 7,69 (1/2Н, c), 7,80 (1/2Н, c), 7,87 (1Н, м), 8,02 (1Н, д, J=13,7, 8,6 Гц), 8,37 (1Н, м), 8,48 (1Н, м), 8,64 (1Н, м), 10,57 (1Н, с).
ESI-MASS (m/e): 478 (M+H).
Пример 43
1-{[5-{[6-Метилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 42 (стадия 1), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,90-1,98 (2H, м), 2,30-2,35 (2H, м), 3,21 (3H, c), 3,30 (2H, м), 4,53 (2H, д, J=3,9 Гц), 7,19 (1/2Н, c), 7,33 (1Н, c), 7,40 (1Н, м), 7,49 (1/2Н, м), 7,57 (1/2Н, м), 7,78 (1/2Н, м), 7,88 (1Н, c), 8,00-8,01 (1Н, м), 8,36-8,46 (2H, м), 8,64 (1Н, c), 10,65 (1Н, с).
ESI-MASS (m/e): 464 (M+H).
Пример 44
1-{[5-{[3-Хлор-4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение (5-[3-хлор-4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-[3-хлор-4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
Используя 3-хлор-4-(метилсульфонил)фенол, полученный в ссылочном примере 5, целевое соединение получали тем же способом, как в примере 19 (стадии 5-7), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-{[5-{[3-хлор-4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,63 (4H×1/2, c), 2,71 (4H×1/2, c), 3,28 (3H×1/2, c), 3,28 (3H×1/2, c), 4,77 (2H×1/2, c), 4,78 (2H×1/2, c), 6,99-7,04 (2H×1/2, м), 7,11 (1Н×1/2, д, J=2,3 Гц), 7,15 (1Н×1/2, д, J=2,3 Гц), 7,15 (1Н×1/2, c), 7,40-7,44 (1Н, м), 7,47 (1Н×1/2, c), 7,69 (1Н×1/2, c), 7,81 (1Н×1/2, c), 7,86-7,94 (1Н, м), 8,08-8,15 (1Н, м), 8,38-8,45 (1Н, м), 8,64-8,69 (1Н, м), 10,62 (1Н×1/2, уш.с), 10,65 (1Н×1/2, уш.с).
ESI-MASS (m/e): 511 (M+H).
Пример 45
1-{[5-{[3-Хлор-4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 44 (стадия 1), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,93-2,02 (2H, м), 2,33-2,41 (2H, м), 3,27 (3Н, c), 3,31-3,34 (2H, м), 4,53 (2H×1/2, c), 4,54 (2H×1/2, c), 6,93-7,03 (1Н, м), 7,08-7,10 (1Н, м), 7,21 (1Н×1/2, c), 7,41-7,44 (1Н, м), 7,51 (1Н×1/2, c), 7,59 (1Н×1/2, c), 7,80 (1Н×1/2, c), 7,88-7,93 (1Н, м), 8,08 (1Н, д, J=9,0 Гц), 8,42 (1Н, т, J=8,4 Гц), 8,65-8,69 (1Н, м), 10,79 (1Н×1/2, уш.с), 10,85 (1Н×1/2, уш.с).
ESI-MASS (m/e): 497 (M+H).
Пример 46
3-{[5-{[3-Хлор-4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон
Используя спиртовое соединение, полученное в примере 44 (стадия 1), и 2-оксазолидон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,25 (3H, c), 3,42-3,51 (2H, м), 4,22-4,29 (2H, м), 4,48 (2H×1/2, c), 4,50 (2H×1/2, c), 6,93-6,99 (1Н, м), 7,05-7,10 (1Н, м), 7,20 (1Н×1/2, c), 7,39-7,44 (1Н, м), 7,50 (1Н×1/2, c), 7,64 (1Н×1/2, c), 7,85-7,90 (1Н, м), 7,90 (1Н×1/2, c), 8,06 (1Н, д, J=8,6 Гц), 8,39 (1Н×1/2, д, J=8,6 Гц), 8,41 (1Н×1/2, д, J=8,6 Гц), 8,63-8,68 (1Н, м), 10,84 (1Н, уш.с).
ESI-MASS (m/e): 499 (M+H).
Пример 47
4-{[6-[(2,5-Диоксо-1-пирролидинил)метил]-2-(2-пиридинил)-1Н-бензимидазол-5-ил]окси}бензонитрил
Используя 4-цианофенол, целевое соединение получали тем же способом, как в примере 19 (стадии 5-8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,53 (4H×1/2, c), 2,63 (4H×1/2, c), 4,76 (2H×1/2, c), 4,77 (2H×1/2, c), 6,99 (1Н, д, J=9,0 Гц), 7,02 (1Н, д, J=9,0 Гц), 7,11 (1Н×1/2, c), 7,36-7,40 (1Н, м), 7,43 (1Н×1/2, c), 7,58 (1Н, д, J=9,0 Гц), 7,61 (1Н, д, J=9,0 Гц), 7,63 (1Н×1/2, c), 7,75 (1Н×1/2, c), 7,84-7,89 (1Н, м), 8,34-8,39 (1Н, м), 8,60-8,66 (1Н, м), 10,46 (1Н×1/2, уш.с), 10,52 (1Н×1/2, уш.с).
ESI-MASS (m/e): 424 (M+H).
Пример 48
1-{[5-[(6-Метил-3-пиридинил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил]пирролидин-2,5-дион
Используя 4-гидрокси-6-метилпиридин, целевое соединение получали тем же способом, как в примере 19 (стадии 5-8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,53 (3H, д, J=8,2 Гц), 2,60 (2H, c), 2,69 (2H, c), 4,87 (2H, д, J=9,4 Гц), 7,08-7,13 (1Н, м), 7,32 (2H, м), 7,52 (1Н, м), 7,65 (1/2Н, м), 7,83-7,85 (1Н, м), 8,26 (1/2Н, c), 8,32-8,34 (2H, м), 8,60 (1Н, м).
ESI-MASS (m/e): 414 (M+H).
Пример 49
1-{[5-[(6-Метил-3-пиридинил)сульфанил]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Используя 6-метилпиридин-3-тиол, полученный согласно способу, описанному в WO 2004/081001, целевое соединение получали тем же способом, как в примере 19 (стадии 5-8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 10,59 (уш.с, 1Н), 8,62 (д, 1Н, J=4,7 Гц), 8,40-8,37 (м, 2H), 7,85 (м, 1Н), 7,56 (д, 1Н, J=15,7 Гц), 7,42-7,43 (м, 3H), 7,03 (с, 1Н), 4,99 (с, 2H), 2,76 (с, 2H), 2,68 (с, 2H), 2,47 (с, 3H).
ESI-MASS (m/e): 414 (M+H).
Пример 50
1-{[5-[4-(Метоксиметил]фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение метил 5-(4-формилфенокси)-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-(4-формилфенокси)-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбоксилата:
Используя 4-гидроксибензальдегид, целевое соединение получали тем же способом, как в примере 19 (стадии 5-6), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение метил 5-[4-(гидроксиметил)фенокси]-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-[4-(гидроксиметил)фенокси]-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбоксилата:
На бане со льдом 54 мг боргидрида натрия добавляли к раствору 362 мг полученного продукта в метаноле (5 мл) и перемешивали при комнатной температуре в течение 20 минут. Насыщенный водный раствор хлорида аммония добавляли к реакционной жидкости, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель удаляли, получая 337 мг сырого продукта целевого соединения в виде твердого вещества желтого цвета.
Стадия 3. Получение метил 5-[4-(метоксиметилметил)фенокси]-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-[4-(метоксиметилметил)фенокси]-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбоксилата:
На бане со льдом 89 мкл метилиодида и 57 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 337 мг полученного продукта в ДМФА (5 мл) и перемешивали при комнатной температуре в течение 30 минут. Насыщенный водный раствор хлорида аммония добавляли к реакционной жидкости, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель удаляли, получая 346 мг сырого продукта целевого соединения в виде масла коричневого цвета.
Стадия 4. Получение 1-{[5-[4-(метоксиметил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя полученный продукт, целевое соединение получали тем же способом, как в примере 19 (стадия 7, стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,57 (4H, д, J=24,3 Гц), 3,37 (3H, c), 4,40 (2H, c), 4,85 (2H, c), 6,93 (2H, д, J=8,2 Гц), 7,27 (3H, д, J=8,2 Гц), 7,33-7,37 (1Н, м), 7,60 (1Н, уш.с), 7,84 (1Н, тд, J=7,8, 8,1 Гц), 8,35 (1Н, д, J=7,8 Гц), 8,60 (1Н, д, J=4,3 Гц).
ESI-MASS (m/e): 443 (M+H).
Пример 51
1-{5-[4-(2-Оксо-1,3-оксозолан-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил}пирролидин-2,5-дион
Стадия 1. Получение метил 5-(4-йодфенокси)-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-(4-йодфенокси)-2-(2-пиридинил)-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбоксилата:
Используя 4-йодфенол, целевое соединение получали тем же способом, как в примере 19 (стадия 5, стадия 6), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение метил 5-[4-(2-оксо-1,3-оксазолан-3-ил)]-2-(2-пиридинил)-1Н-бензимидазол-6-карбоксилата и метил 6-[4-(2-оксо-1,3-оксазолан-3-ил)]-2-(2-пиридинил)-1Н-бензимидазол-5-карбоксилата:
186 мг 2-оксазолидона, 20 мг йодида меди(I) и 148 мг карбоната калия добавляли к раствору 642 мг полученного продукта в ДМФА (7 мл) и перемешивали при 150°C в течение 28 часов. Реакционной жидкости давали остыть до комнатной температуры, затем добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол = от 10/0 до 100/1), получая 427 мг целевого соединения в виде масла коричневого цвета.
Стадия 3. Получение 1-{5-[4-(2-оксо-1,3-оксозолан-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил}пирролидин-2,5-диона:
Используя полученный продукт, целевое соединение получали тем же способом, как в примере 34 (стадия 3, стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,51-2,53 (2H, м), 2,65-2,71 (2H, м), 4,05-4,10 (2H, м), 4,56-4,49 (2H, м), 4,86 (2H, д, Гц J=12,5 Гц), 6,98 (2H, д, J=12,5 Гц), 7,32 (2H, м), 7,49 (2H, м), 7,63 (1Н, д, J=9,8 Гц), 7,84 (1Н, дд, J=7,8, 5,9 Гц), 8,34-8,36 (1Н, м), 8,59-8,61 (1Н, м).
ESI-MASS (m/e): 484 (M+H).
Пример 52
1-[(5-{[6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил]-1Н-бензимидазол-6-ил)метил]пирролидин-2,5-дион
Стадия 1. Получение метил 5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-карбоксилата:
Используя 6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинол, полученный в ссылочном примере 6, целевое соединение получали тем же способом, как в примере 19 (стадия 5, стадия 6), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение (5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
Целевое соединение получали тем же способом, как в примере 34 (стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 3. Получение 1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]пирролидин-2,5-диона:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,58 (2H, c), 2,67 (2H, c), 2,67 (3H, c), 4,82 (2H×1/2, c), 4,84 (2H×1/2, c), 7,08 (1Н×1/2, c), 7,30-7,40 (2H, м), 7,44 (1Н×1/2, c), 7,61 (1Н×1/2, c), 7,74 (1Н×1/2, c), 7,86 (1Н×1/2, т, J=8,2 Гц), 7,86 (1Н×1/2, т, J=8,2 Гц), 8,02 (1Н×1/2, д, J=8,6 Гц), 8,06 (1Н×1/2, д, J=9,4 Гц), 8,35 (1Н×1/2, д, J=8,2 Гц), 8,37 (1Н×1/2, д, J=8,2 Гц), 8,53 (1Н×1/2, д, J=2,3 Гц), 8,57 (1Н×1/2, д, J=2,3 Гц), 8,61 (1Н×1/2, д, J=4,3 Гц), 8,63 (1Н, д×1/2, J=4,3 Гц), 10,60 (1Н×1/2, уш.с), 10,64 (1Н×1/2, уш.с).
ESI-MASS (m/e): 482 (M+H).
Пример 53
1-[(5-{[6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]-2-пирролидинон
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,90-1,98 (2H, м), 2,30-2,38 (2H, м), 2,67 (3H, c), 3,29-3,35 (2H, м), 4,57 (2H×1/2, c), 4,59 (2H×1/2, c), 7,14 (1Н×1/2, c), 7,30 (1Н×1/2, дд, J=9,0, 2,7 Гц), 7,33 (1Н×1/2, дд, J=9,0, 2,3 Гц), 7,38 (1Н×1/2, дд, J=8,2, 5,5 Гц), 7,38 (1Н×1/2, дд, J=8,2, 5,1 Гц), 7,47 (1Н×1/2, c), 7,57 (1Н×1/2, c), 7,77 (1Н×1/2, c), 7,86 (1Н×1/2, т, J=8,2 Гц), 7,87 (1Н×1/2, т, J=8,2 Гц), 8,02 (1Н×1/2, д, J=9,0 Гц), 8,04 (1Н×1/2, д, J=9,0 Гц), 8,37 (1Н×1/2, д, J=8,2 Гц), 8,40 (1Н×1/2, д, J=8,2 Гц), 8,47 (1Н×1/2, д, J=2,3 Гц), 8,54 (1Н×1/2, д, J=2,7 Гц), 8,62 (1Н×1/2, д, J=5,5 Гц), 8,64 (1Н×1/2, д, J=5,1 Гц), 10,84 (1Н×1/2, уш.с), 10,94 (1Н×1/2, уш.с).
ESI-MASS (m/e): 468 (M+H).
Пример 54
1-[(5-{[6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]-2-оксазолидинон
Используя спиртовое соединение, полученное в примере 52 (стадия 2), и 2-оксазолидон, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,67 (3H, c), 3,46-3,53 (2H, м), 4,21-4,27 (2H, м), 4,55 (2H×1/2, c), 4,58 (2H×1/2, c), 7,17 (1Н×1/2, c), 7,32 (1Н×1/2, дд, J=8,6, 2,7 Гц), 7,35 (1Н×1/2, дд, J=8,6, 2,3 Гц), 7,39 (1Н×1/2, дд, J=8,2, 5,5 Гц), 7,39 (1Н×1/2, дд, J=8,2, 5,0 Гц), 7,49 (1Н×1/2, c), 7,64 (1Н×1/2, c), 7,84-7,90 (1Н, м), 7,87 (1Н×1/2, c), 8,04 (1Н×1/2, д, J=8,6 Гц), 8,06 (1Н×1/2, д, J=8,6 Гц), 8,38 (1Н×1/2, д, J=8,2 Гц), 8,40 (1Н×1/2, д, J=8,2 Гц), 8,47 (1Н×1/2, д, J=2,3 Гц), 8,54 (1Н×1/2, д, J=2,7 Гц), 8,62 (1Н×1/2, д, J=5,5 Гц), 8,65 (1Н×1/2, д, J=5,0 Гц), 10,79 (1Н×1/2, уш.с), 10,85 (1Н×1/2, уш.с).
ESI-MASS (m/e): 470 (M+H).
Пример 55
1-{[5-[4-(5-Метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион
Стадия 1. Получение (5-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
Используя 4-(5-метил-1,2,4-оксадиазол-3-ил)фенол, полученный в ссылочном примере 7, целевое соединение получали тем же способом, как в примере 52 (стадия 1, стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-{[5-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-диона:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,44 (4H×1/2, c), 2,57 (4H×1/2, c), 2,63 (3H×1/2, c), 2,64 (3H×1/2, c), 4,82 (2H×1/2, c), 4,85 (2H×1/2, c), 6,99 (2H×1/2, д, J=8,6 Гц), 7,04 (2H×1/2, д, J=8,6 Гц), 7,10 (1Н×1/2, c), 7,34-7,39 (1Н, м), 7,45 (1Н×1/2, c), 7,61 (1Н×1/2, c), 7,73 (1Н×1/2, c), 7,83-7,87 (1Н, м), 7,99 (2H×1/2, д, J=8,6 Гц), 8,02 (2H×1/2, д, J=8,6 Гц), 8,35 (1Н×1/2, д, J=7,0 Гц), 8,37 (1Н×1/2, д, J=6,7 Гц), 8,60 (1Н×1/2, д, J=5,3 Гц), 8,64 (1Н×1/2, д, J=5,1 Гц), 10,46 (1Н×1/2, c), 10,55 (1Н×1/2, с).
ESI-MASS (m/e): 481 (M+H).
Пример 56
1-{[5-[4-(5-Метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя спиртовое соединение, полученное в примере 55 (стадия 1), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,87-1,95 (2H, м), 2,30-2,36 (2H, м), 3,27-3,33 (2H, м), 4,57 (2H×1/2, c), 4,59 (2H×1/2, c), 7,01 (2H×1/2, д, J=8,6 Гц), 7,03 (2H×1/2, д, J=8,6 Гц), 7,15 (1Н×1/2, c), 7,35-7,39 (1Н, м), 7,49 (1Н×1/2, c), 7,56 (1Н×1/2, c), 7,75 (1Н×1/2, c), 7,83-7,88 (1Н, м), 8,00 (2H×1/2, д, J=8,6 Гц), 8,00 (2H×1/2, д, J=8,6 Гц), 8,37 (1Н×1/2, д, J=8,6 Гц), 8,39 (1Н×1/2, д, J=8,6 Гц), 8,61 (1Н×1/2, д, J=5,5 Гц), 8,64 (1Н×1/2, д, J=5,3 Гц), 10,57 (1Н×1/2, уш.с), 10,66 (1Н×1/2, уш.с).
ESI-MASS (m/e): 467 (M+H).
Пример 57
1-[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]-1-этанол
Стадия 1. Получение метил 5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбоксилата и метил 6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбоксилата:
Альдегидное соединение, полученное в примере 1 (стадия 8), обрабатывали согласно процессу, описанному в J. Org. Chem. 64(4), 1191 (1999), получая целевое соединение. Используя 4-(метилсульфонил)фенол, полученный в ссылочном примере 1, целевое соединение может также быть получено тем же способом, как в примере 19 (стадия 5, стадия 6), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-(5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)-1-этанола или 1-(6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)-1-этанола:
400 мг полученного сложного метилового эфира растворяли в 4 мл тетрагидрофурана, добавляли 4 мл метанола и 1,5 мл 5 н. водного раствора гидроксида натрия и перемешивали при комнатной температуре в течение 3 часов. Смесь нейтрализовали водным 10% раствором лимонной кислоты, экстрагировали этилацетатом и промывали насыщенным солевым раствором. Смесь высушивали над безводным сульфатом магния и растворитель выпаривали, получая 376 мг твердого вещества желтого цвета.
376 мг полученного твердого вещества желтого цвета растворяли в 5 мл диметилформамида, добавляли 0,29 мл триэтиламина, 205 мг гидрохлорида N,О-диметилгидроксиламина, 284 мг моногидрата 1-гидроксибензотриазола и 205 мг гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и перемешивали в течение ночи при комнатной температуре. Добавляли воду к реакционной жидкости, разбавляли этилацетатом и органический слой промывали насыщенным солевым раствором, высушивали безводным сульфатом магния, затем растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 9/1-3/1-1/1), получая 347 мг аморфного вещества белого цвета.
110 мг полученного аморфного вещества белого цвета растворяли в 2 мл тетрагидрофурана, при -78°C добавляли 0,76 мл метиллития (1,02М раствор в диэтиловом эфире) и перемешивали при -78°C в течение 30 минут. Добавляли насыщенный водный хлорид аммония, разбавляли этилацетатом и органический слой промывали насыщенным солевым раствором. Его высушивали безводным сульфатом магния, растворитель выпаривали и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 6OF254, Art 5744 (Merck), гексан/этилацетат = 1/2), получая 66,3 мг целевого соединения в виде масла светло-желтого цвета.
Стадия 3. Получение 1-(5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-6-ил)-1-этанола или 1-(6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)-1-этанола:
20 мг полученного ацетильного соединения растворяли в 0,5 мл метанола, добавляли 20 мг боргидрида натрия и перемешивали при комнатной температуре в течение 15 минут. Реакционную жидкость разбавляли этилацетатом и промывали насыщенным солевым раствором. Смесь высушивали безводным сульфатом магния, растворитель выпаривали и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 20/1), получая 18,3 мг целевого соединения в виде бесцветного масла.
Стадия 4. Получение 1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]-1-этанола:
18,3 мг полученного продукта растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 11,2 мг целевого соединения в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,53 (3H, м), 3,06 (3H, c), 5,18 (1Н, м), 7,05-7,10 (2H+1/2H, м), 7,40 (1H+1/2H, м), 7,80 (1/2Н, c), 7,82-7,90 (2H, м), 8,10 (1/2Н, c), 8,37-8,43 (1Н, м), 8,64 (1Н, м), 10,6 (1/2Н, уш.), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 410 [М+Н].
Пример 58
Трифторацетат 1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]-1,2-этандиола
Используя диоловое соединение, полученное в примере 1 (стадия 7), целевое соединение получали тем же способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CD3OD) δ: 2,69 (1Н, уш.с), 3,17 (3H, c), 3,62-3,67 (1Н, м), 3,82-3,83 (1Н, м), 5,12-5,13 (1Н, м), 7,27-7,29 (2H, м), 7,42 (1Н, c), 7,67-7,71 (1Н, м), 8,00-8,02 (2H, м), 8,14-8,17 (2H, м), 8,32-8,34 (1Н, м), 8,89 (1Н, м).
ESI-MASS (m/e): 410 [M+H].
Пример 59
[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метанол
Используя диоловое соединение, полученное в примере 1 (стадия 7), целевое соединение получали тем же способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,18-3,19 (3H, м), 4,48-4,51 (2H, м), 5,18-5,19 (1/2Н, м), 5,21-5,28 (1/2Н, м), 7,05-7,13 (2H, м), 7,40 (1Н, c), 7,51-7,55 (1Н, м), 7,75 (1Н, c), 7,86-7,90 (2H, м), 7,98-8,02 (1Н, м), 8,29-8,34 (1Н, м), 8,72-8,75 (1Н, м), 13,12 (1/2Н, уш.с), 13,25 (1/2Н, уш.с).
ESI-MASS (m/e): 396 (M+H).
Пример 60
N-Метил-N-{1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил]-1Н-бензимидазол-6-ил]этил}амин
Стадия 1. Получение N-1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил]этил-N-метиламина или N-1-[6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил]этил-N-метиламина:
33 мг ацетильного соединения, полученного в примере 57 (стадия 2), растворяли в 0,2 мл метанола, добавляли 0,2 мл метиламина (40% раствор в метаноле), добавляли раствор 41 мг хлорида цинка в метаноле и 38 мг цианотригидробората натрия и перемешивали при комнатной температуре в течение 6 часов. Добавляли 10% водный раствор лимонной кислоты, нейтрализовали водным бикарбонатом натрия и экстрагировали этилацетатом. Среду высушивали безводным сульфатом магния и растворитель выпаривали, получая 30 мг целевого соединения в виде масла желтого цвета.
Стадия 2. Получение N-метил-N-{1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этил}амина:
Используя полученное масло, целевое соединение получали тем же способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,36 (3H, м), 2,30 (3H, c), 3,07 (3H, c), 3,98 (1Н, м), 7,08 (2H+2/5H, м), 7,39 (1Н, м), 7,45 (3/5Н, м), 77,75 (3/5Н, м), 7,88 (3H, м), 7,98 (2/5Н, м), 8,40 (1Н, м), 8,65 (1Н, м).
ESI-MASS (m/e): 423 (M+H).
Пример 61
N-Метил-N-{1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этил}ацетамид
Стадия 1. Получение N-метил-N-(1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил]этил)ацетамида или N-метил-N-(1-[6-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил]этил)ацетамида:
30 мг N-метиламина, полученного в примере 60 (стадия 1), растворяли в 0,3 мл хлороформа, добавляли 15 мкл триэтиламина и 8 мкл ацетилхлорида и перемешивали при комнатной температуре в течение 30 минут. Добавляли воду, разбавляли этилацетатом и промывали насыщенным солевым раствором. Смесь высушивали безводным сульфатом магния, растворитель выпаривали и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 20/1), получая 19,1 мг бесцветного масла.
Стадия 2. Получение N-метил-N-{1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этил}ацетамида:
Используя полученное масло, целевое соединение получали тем же способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,55 (3H, д, J=7,0 Гц), 1,86 (3H, c), 2,68 (3H, c), 3,06 (3H, c), 6,03 (1Н, м), 6,98 (2H, д, J=8,9 Гц), 7,33 (1Н, c), 7,56 (1Н, м), 7,85 (2H, д, J=8,9 Гц), 7,90-8,06 (2H, м), 8,53 (1Н, м), 8,71 (1Н, м).
ESI-MASS (m/e): 465 [M+H].
Пример 62
N,N-Диметил-N-{1-[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этил}амин
Используя N,N-диметиламин, целевое соединение получали тем же способом, как в примере 60 (стадия 1), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,33 (3H, м), 2,20 (6H, м), 3,07 (3H, c), 3,57 (3/5Н, м), 3,71 (2/5Н, м), 7,07 (2H, м), 7,14 (2/5Н, c), 7,39 (1Н, м), 7,45 (3/5Н, c), 7,75 (3/5Н, c), 7,84-7,90 (3H, м), 8,02 (2/5Н, c), 8,40 (1Н, м), 8,65 (1Н, м), 10,5 (1Н, уш.).
ESI-MASS (m/e): 437 [M+H].
Пример 63
1-{1-[5-[4-(Метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этил}пирролидин-2,5-дион
Используя спиртовое соединение, полученное в примере 57 (стадия 3), целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,79 (3H, м), 2,10-2,28 (2H, м), 2,28-2,40 (2H, м), 3,06 (3H, c), 5,69 (1Н, м), 7,00 (2H, м), 7,42 (1H+1/2H, м), 7,80-8,00 (3H+1/2H, м), 8,20-8,50 (2H, уш.), 8,67 (1Н, м), 10,8 (1Н, уш.).
ESI-MASS (m/e): 491 [M+H].
Пример 64
{5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}(4-фторфенил)метанол
Стадия 1. Получение 5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-карбальдегида и 6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбальдегида:
5 мл триэтиламина и 750 мг пиридина-триоксида серы добавляли к раствору 1,0 г спиртового соединения, полученного в примере 19 (стадия 7), в диметилсульфоксиде (10 мл) и реакционную жидкость перемешивали при комнатной температуре в течение 15 минут. Реакционную жидкость разбавляли этилацетатом, промывали водой и насыщенным солевым раствором в этом порядке и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая 1,0 г целевого соединения в виде твердого вещества оранжевого цвета.
Стадия 2. Получение {5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил}(4-фторфенил)метанола или {6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил}(4-фторфенил)метанола:
При 0°C 0,5 мл 4-фторфенилмагнийбромида (1М раствор в тетрагидрофуране) добавляли к раствору 45 мг полученного альдегида в тетрагидрофуране (1 мл) и реакционную жидкость перемешивали в течение 1 часа. Реакционную жидкость разбавляли этилацетатом, промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором в этом порядке и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 1/2), получая 35 мг целевого соединения в виде бесцветного твердого вещества.
Стадия 3. Получение {5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}(4-фторфенил)метанола:
20 мг полученного продукта растворяли в 1 мл раствора трифторуксусной кислоты и реакционную жидкость перемешивали при комнатной температуре в течение 3 часов. Растворитель выпаривали и остаток очищали жидкостной хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции разбавляли этилацетатом, промывали насыщенным водным бикарбонатом натрия и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая 5,4 мг целевого соединения в виде бесцветного твердого вещества.
1Н-ЯМР (CD3OD) δ: 1,24 (3H, т, J=7,4 Гц), 3,18 (2H, кв, J=7,4 Гц), 6,05 (1Н, c), 6,88-6,95 (4H, м), 7,20-7,42 (1Н, м), 7,30 (2H, дд, J=8,2, 5,5 Гц), 7,48-7,53 (1Н, м), 7,76 (2H, д, J=8,6 Гц), 7,99 (1Н, т, J=8,0 Гц), 8,02-8,20 (1Н, м), 8,28-8,34 (1Н, м), 8,73-8,78 (1Н, м).
ESI-MASS (m/e): 504.
Пример 65
5-[4-(Этилсульфонил)фенокси]-6-(4-фторбензил)-2-(2-пиридинил)-1Н-бензимидазол
0,5 мл триэтилсилана добавляли к раствору 4,9 мг спиртового соединения, полученного в примере 64 (стадия 2), в трифторуксусной кислоте (0,2 мл) и реакционную жидкость перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали при пониженном давлении и остаток очищали жидкостной хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции разбавляли этилацетатом, промывали насыщенным водным бикарбонатом натрия и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая 5,5 мг целевого соединения в виде твердого вещества светло-желтого цвета.
1Н-ЯМР (CD3OD) δ: 1,17 (3Н, т, J=7,4 Гц), 3,12 (2H, кв, J=7,4 Гц), 3,96 (2H, c), 6,83 (2H, т, J=8,8 Гц), 6,92 (2H, д, J=9,0 Гц), 7,09 (2H, дд, J=8,8, 5,0 Гц), 7,27 (1Н, c), 7,43 (1Н, дд, J=7,0, 5,0 Гц), 7,58 (1Н, c), 7,72 (2H, д, J=9,0 Гц), 7,92 (1Н, т, J=7,4 Гц), 8,22 (1Н, д, J=7,4 Гц), 8,68 (1Н, д, J=5,0 Гц).
ESI-MASS (m/e): 488.
Пример 66
{5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}(4-фторфенил)метанон
0,1 мл триэтиламина и 15 мг пиридина-триоксида серы добавляли к раствору 15 мг спиртового соединения, полученного в примере 64 (стадия 3), в диметилсульфоксиде (0,2 мл) и реакционную жидкость перемешивали при комнатной температуре в течение 20 минут. Реакционную жидкость разбавляли этилацетатом, промывали водой и насыщенным солевым раствором в этом порядке и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая сырой продукт. Полученный сырой продукт растворяли в 1 мл трифторуксусной кислоты и реакционную жидкость перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали при пониженном давлении и остаток очищали жидкостной хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции разбавляли этилацетатом, промывали насыщенным водным бикарбонатом натрия и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая 7,9 мг целевого соединения в виде бесцветного твердого вещества.
1Н-ЯМР (CD3OD) δ: 1,18 (3H, т, J=7,4 Гц), 3,16 (2H, кв, J=7,4 Гц), 6,93-6,99 (2H, м), 7,18 (2H, т, J=8,6 Гц), 7,40-7,60 (2H, м), 7,77 (2H, д, J=8,6 Гц), 7,82 (2H, дд, J=8,4, 5,3 Гц), 7,84-8,00 (1Н, м), 8,02 (1Н, т, J=7,6 Гц), 8,35 (1Н, д, J=7,6 Гц), 8,77-8,80 (1Н, м).
ESI-MASS (m/e): 502.
Пример 67
(2-Фторфенил)[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метанол
Стадия 1. Получение {5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил}(2-фторфенил)метанола или {6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил}(2-фторфенил)метанола:
Используя альдегидное соединение, полученное в примере 1 (стадия 8), и 2-фторфенилмагнийбромид, целевое соединение получали тем же способом, как в примере 64 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение (2-фторфенил)[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метанола:
Используя полученный продукт, целевое соединение получали тем же способом, как в примере 64 (стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,05 (3Н, c), 6,39 (1Н, c), 6,84 (1Н, c), 6,85 (2H, д, J=8,7 Гц), 6,98-7,02 (1Н, м), 7,10-7,15 (1Н, м), 7,25-7,31 (3H, м), 7,49-7,53 (1Н, м), 7,75 (2H, д, J=8,7 Гц), 7,97-8,01 (1Н, м), 8,15 (1Н, c), 8,50 (1Н, д, J=8,0 Гц), 8,73 (1Н, д, J=5,1 Гц).
ESI-MASS (m/e): 490 (M+H).
Пример 68
(2-Бромфенил)[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метанол
Используя альдегидное соединение, полученное в примере 1 (стадия 8), и 2-бромфенилмагнийбромид, целевое соединение получали тем же способом, как в примере 64 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,15 (3H, c), 6,20 (1Н, c), 6,95-7,60 (2H, м), 6,96 (2H, д, J=8,5 Гц), 7,08-7,13 (1Н, м), 7,29-7,33 (1Н, м), 7,62 (1Н, д, J=8,2 Гц), 7,49-7,53 (1Н, м), 7,67 (1Н, c), 7,77 (2H, д, J=8,5 Гц), 7,96-8,00 (1Н, м), 8,27-8,31 (1Н, м), 8,70-8,72 (1Н, м).
ESI-MASS (m/e): 550, 552 (M+H).
Пример 69
6-(2-Фторбензил)-5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол
Используя альдегидное соединение, полученное в примере 67 (стадия 1), целевое соединение получали тем же способом, как в примере 65, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 3,06 (3H, c), 4,00-4,05 (2H, м), 6,96-7,02 (3H, м), 7,08-7,17 (2H, м), 7,25-7,28 (1Н, м), 7,37-7,43 (1Н, м), 7,53-7,58 (1Н, м), 7,68-7,80 (1Н, м), 7,80-7,94 (3H, м), 8,38-8,55 (1Н, м), 8,60-8,75 (1Н, м).
ESI-MASS (m/e): 474 (M+H).
Пример 70
1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазол-7-ил}метил)пирролидин-2,5-дион
Стадия 1. Получение метил 5-фтор-2-нитробензоата:
2 мл концентрированной серной кислоты добавляли к раствору 10 г 5-фтор-2-нитробензойной кислоты в метаноле (200 мл) и нагревали с обратным холодильником в течение 22 часов. Добавляли 200 мл водного раствора гидрокарбоната натрия и полученный твердый продукт отделяли фильтрованием. Его высушивали при пониженном давлении, получая 10,7 г целевого соединения в виде твердого вещества желтого цвета.
Стадия 2. Получение метил 5-[4-(этилсульфонил)фенокси]-2-нитробензоата:
11 г карбоната калия добавляли к раствору в диметилформамиде (150 мл) 10,7 г метил 5-фтор-2-нитробензоата и 11,1 г 4-(этилсульфонил)фенола, полученного в ссылочном примере 2, и перемешивали при 80°C в течение 90 минут. Реакционной жидкости давали остыть до комнатной температуры, затем добавляли 300 мл воды и полученный твердый продукт отделяли фильтрованием. Его высушивали при пониженном давлении, получая 19,7 г целевого соединения в виде твердого вещества сливочно-белого цвета.
Стадия 3. Получение метил 2-амино-5-[4-(этилсульфонил)фенокси]бензоата:
0,7 г никеля Ренея добавляли к раствору 6,98 г метил 5-[4-(этилсульфонил)фенокси]-2-нитробензоата в метаноле (150 мл) и перемешивали в течение ночи в атмосфере водорода. Катализатор удаляли фильтрованием, растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 2/1 до 1/1), получая 2,65 г целевого соединения в виде бесцветного масла.
Стадия 4. Получение метил 5-[4-(этилсульфонил)фенокси]-2-[(2-пиридинилкарбонил)амино]бензоата:
При охлаждении на льду 4,4 мл триэтиламина и 2,8 г гидрохлорида хлорангидрида пиколиновой кислоты добавляли к раствору 2,65 г метил 2-амино-5-[4-(этилсульфонил)фенокси]бензоата в хлороформе (30 мл) и перемешивали при комнатной температуре в течение 90 минут. Водный насыщенный раствор гидрокарбоната натрия добавляли к реакционной жидкости, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 2/1 до 1/1), получая 1,9 г целевого соединения в виде твердого вещества сливочно-белого цвета.
Стадия 5. Получение метил 5-[4-(этилсульфонил)фенокси]-3-нитро-2-[(2-пиридинилкарбонил)амино]бензоата:
1,9 г метил 5-[4-(этилсульфонил)фенокси]-2-[(2-пиридинилкарбонил)амино]бензоата растворяли в 20 мл трифторуксусной кислоты, добавляли 2,2 г нитрата калия и перемешивали при 80°C в течение 2 часов. Реакционной жидкости давали остыть до комнатной температуры, трифторуксусную кислоту выпаривали при пониженном давлении, остаток растворяли в хлороформе и добавляли насыщенный водный раствор гидрокарбоната натрия. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 2/1 до 1/1), получая 1,86 г целевого соединения в виде твердого вещества желтого цвета.
Стадия 6. Получение метил 6-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-карбоксилата и метил 5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-карбоксилата:
1,86 г метил 5-[4-(этилсульфонил)фенокси]-3-нитро-2-[(2-пиридинилкарбонил)амино]бензоата суспендировали в 15 мл диметилформамида и 15 мл метанола, добавляли 4,3 г дигидрата хлорида олова(II) и 11 мл концентрированной соляной кислоты и перемешивали при 80°C в течение 81 часа. Реакционной жидкости давали остыть до комнатной температуры, затем постепенно добавляли водный раствор гидрокарбоната натрия, чтобы нейтрализовать ее. Добавляли этилацетат и перемешивали при комнатной температуре в течение 30 минут. Полученную соль удаляли фильтрованием, фильтрат экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали, получая 1,44 г сырого продукта метил 5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазол-7-карбоксилата в виде масла желтого цвета.
При охлаждении на льду 0,87 мл 2-(триметилсилил)этоксиметилхлорида и 197 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 1,44 г метил 5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазол-7-карбоксилата в диметилформамиде (15 мл) и перемешивали при комнатной температуре в течение 30 минут. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 1/1), получая 1,34 г целевого соединения в виде масла коричневого цвета.
Стадия 7. Получение (6-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил)метанола и (5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-ил)метанола:
При охлаждении на льду раствор 113 мг алюмогидрида лития и 681 мг указанного выше сложноэфирного соединения в тетрагидрофуране (5 мл) постепенно добавляли к 5 мл тетрагидрофурана. Смесь перемешивали при комнатной температуре в течение 15 минут, затем постепенно добавляли 10-гидрат сульфата натрия до прекращения вспенивания, добавляли этилацетат и перемешивали при комнатной температуре в течение 1 часа. Полученную соль удаляли фильтрованием и растворитель выпаривали при пониженном давлении. Остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол = от 100/0 до 100/5), получая 519 мг целевого соединения в виде масла желтого цвета.
Стадия 8. Получение 1-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазол-7-ил}метил)пирролидин-2,5-диона:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 1 (стадия 10), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,32 (3H, т, J=7,4 Гц), 2,80 (4H, c), 3,13 (2H, кв, J=7,4 Гц), 4,94 (2H, c), 7,10 (2H, д, J=9,4 Гц), 7,23 (1Н, д, J=9,4 Гц), 7,40-7,42 (1Н, м), 7,53-7,54 (1Н, м), 7,85-7,88 (3H, м), 8,38 (1Н, т, J=4,5 Гц), 8,80 (1Н, дд, J=3,9, 0,8 Гц), 11,55 (1Н, уш.с).
ESI-MASS (m/e): 491 (M+H).
Пример 71
Метил 5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазол-7-карбоксилат
Используя продукт, полученный в примере 70 (стадия 6), целевое соединение получали тем же самым способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,27 (3H, т, J=7,4 Гц), 3,11 (2H, кв, J=7,4 Гц), 4,04 (3H, с), 7,09 (2H, дд, J=7,0, 2,0 Гц), 7,40-7,43 (1Н, м), 7,71 (1Н, д, J=2,3 Гц), 7,76 (1Н, д, J=2,3 Гц), 7,82-7,90 (3H, м), 8,39 (1Н, д, J=7,8 Гц), 8,70 (1Н, д, J=5,1 Гц), 11,36 (1Н, уш.с).
ESI-MASS (m/e): 438 (M+H).
Пример 72
[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазол-7-ил]метанол
Используя продукт, полученный в примере 70 (стадия 7), целевое соединение получали тем же способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=11,1 Гц), 3,14 (2H, кв, J=11,1 Гц), 5,12-5,16 (2H, м), 6,94 (1Н, д, J=20,7 Гц), 7,07-7,12 (2H, м), 7,17 (1/2Н, д, J=2,0 Гц), 7,39 (1Н, дд, J=18,2, 10,7 Гц), 7,48 (1/2Н, c), 7,84-7,89 (3H, м), 8,41 (1Н, д, J=7,8 Гц), 8,66-8,67 (1Н, м), 10,62 (1/2Н, уш.с), 11,02 (1/2Н, уш.с).
ESI-MASS (m/e): 410 (M+H).
Пример 73
5-[4-(Этилсульфонил)фенокси]-7-(метоксиметил)-2-(2-пиридил)-1Н-бензимидазол
На бане со льдом 12 мкл метилиодида и 7,8 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 53 мг продукта, полученного в примере 70 (стадия 7), в ДМФА (1 мл) и перемешивали при комнатной температуре в течение 1 часа. Насыщенный водный раствор хлорида аммония добавляли к реакционной жидкости, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая сырой продукт в виде масла коричневого цвета. Полученный продукт обрабатывали тем же самым способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом, получая, таким образом, целевое соединение.
1Н-ЯМР (CDCl3) δ: 1,27 (3H, т, J=7,4 Гц), 3,10 (2H, кв, J=7,4 Гц), 3,51 (9/4Н, c), 3,53 (3/4Н, c), 4,81 (3/2Н, c), 5,02 (1/2Н, c), 6,90 (1Н, c), 7,09-7,12 (2H, м), 7,38-7,39 (1Н, м), 7,47 (1Н, c), 7,82-7,86 (3H, м), 8,39 (3/4Н, д, J=7,8 Гц), 8,43 (1/4Н, д, J=7,8 Гц), 8,61 (1/4Н, с, J=4,7 Гц), 8,67 (3/4Н, д, J=7,8 Гц), 10,67 (1/4Н, уш.с), 10,81 (3/4Н, уш.с).
ESI-MASS (m/e): 424 (M+H).
Пример 74
5-[4-(Этилсульфонил)фенокси]-7-(2-феноксиметил)-2-(2-пиридил)-1Н-бензимидазол
Используя продукт, полученный в примере 70 (стадия 7), и фенол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,32-1,33 (3H, м), 3,12 (2H, кв, J=7,5 Гц), 5,41 (1Н, c), 5,69 (1Н, c), 6,82-6,76 (1/2Н, м), 7,02-7,06 (5H, м), 7,30-7,42 (4H, м), 7,54-7,56 (1/2Н, м), 7,83-7,89 (3H, м), 8,41-8,44 (1Н, м), 8,69-8,72 (1Н, м), 10,75 (1/2Н, уш.с), 10,90 (1/2Н, уш.с).
ESI-MASS (m/e): 486 (M+H).
Пример 75
N-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридил]-1Н-бензимидазол-7-ил]метил}-N,N-диметиламин
Используя продукт, полученный в примере 70 (стадия 7), и диметиламин, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29-1,31 (3H, м), 2,33 (6H, c), 3,07-3,15 (2H, м), 3,76 (2H, c), 6,90 (1Н, c), 7,11 (2H, д, J=9,4 Гц), 7,39-7,41 (1Н, м), 7,46 (1Н, c), 7,82-7,90 (3H, м), 8,42 (1Н, д, J=8,2 Гц), 8,71 (1Н, д, J=4,3 Гц).
ESI-MASS (m/e): 437 (M+H).
Пример 76
7-(2,6-Дифторбензил)-5-[4-(этилсульфонил)фенокси]-2-(2-пиридил]-1Н-бензимидазол
Стадия 1. Получение 6-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-карбальдегида и 5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-карбальдегида:
Используя продукт, полученный в примере 70 (стадия 7), целевое соединение получали тем же способом, как в примере 64 (стадия 1), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение {6-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил}(2,6-дифторфенил)метанола или {5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1-{[2-триметилсилил)этокси]метил}-1Н-бензимидазол-7-ил}(2,6-дифторфенил)метанола:
Используя полученный альдегид и 2,6-дифторфениллитий, полученный согласно способу, описанному в Journal of The American Chemical Society, 1966, Vol.31, p.746, целевое соединение получали тем же способом, как в примере 64 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 3. Получение 7-(2,6-дифторбензил)-5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазола:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 65, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,24-1,33 (3H, м), 3,12 (2H, кв, J=25 Гц), 4,17 (1Н, c), 4,59 (1Н, c), 6,93 (1Н, c), 7,03-7,06 (3H, м), 7,19 (1Н, м), 7,39-7,48 (2H, м), 7,81-7,84 (4H, м), 8,34-8,44 (1Н, м), 8,59-8,67 (1Н, м).
ESI-MASS (m/e): 506 (M+H).
Пример 77
7-(4-Фторбензил)-5-[4-(этилсульфонил)фенокси]-2-(2-пиридил)-1Н-бензимидазол
Используя альдегидное соединение, полученное в примере 76 (стадия 1), и 4-фторфторфенилмагнийбромид, целевое соединение получали тем же способом, как в примере 76 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,27 (3Н, т, J=13,8 Гц), 3,10 (2H, кв, J=13,8 Гц), 4,23 (1Н, c), 4,44 (1Н, c), 6,72 (1Н, c), 6,85 (1Н, c), 6,97-7,01 (4H, м), 7,21 (1/2Н, м), 7,34-7,38 (2H, м), 7,43 (1/2Н, м), 7,81-7,85 (3H, м), 8,39-8,44 (1Н, м), 8,61 (1Н, c), 10,60 (1Н, уш.с).
ESI-MASS (m/e): 488 (M+H).
Пример 78
1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридил]-1Н-бензимидазол-7-ил}метил)-2-пирролидинон
Используя продукт, полученный в примере 70 (стадия 7), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,27-1,42 (3H, м), 2,00-2,13 (2H, м), 2,51 (2H, м), 3,13 (2H, кв, J=8,3 Гц), 3,43-3,50 (2H, м), 4,67 (2H, c), 6,93 (1Н, д, J=2,0 Гц), 7,10 (2H, д, J=18,0 Гц), 7,38 (1Н, дд, J=7,0, 4,3 Гц), 7,53 (1Н, c), 7,86-7,88 (3H, м), 8,39 (1Н, д, J=9,2 Гц), 8,79-8,82 (1Н, м), 12,04 (1Н, с).
ESI-MASS (m/e): 477 (M+H).
Структуры соединений примеров 1-78 показаны в таблицах 6-8.
Таблица 6
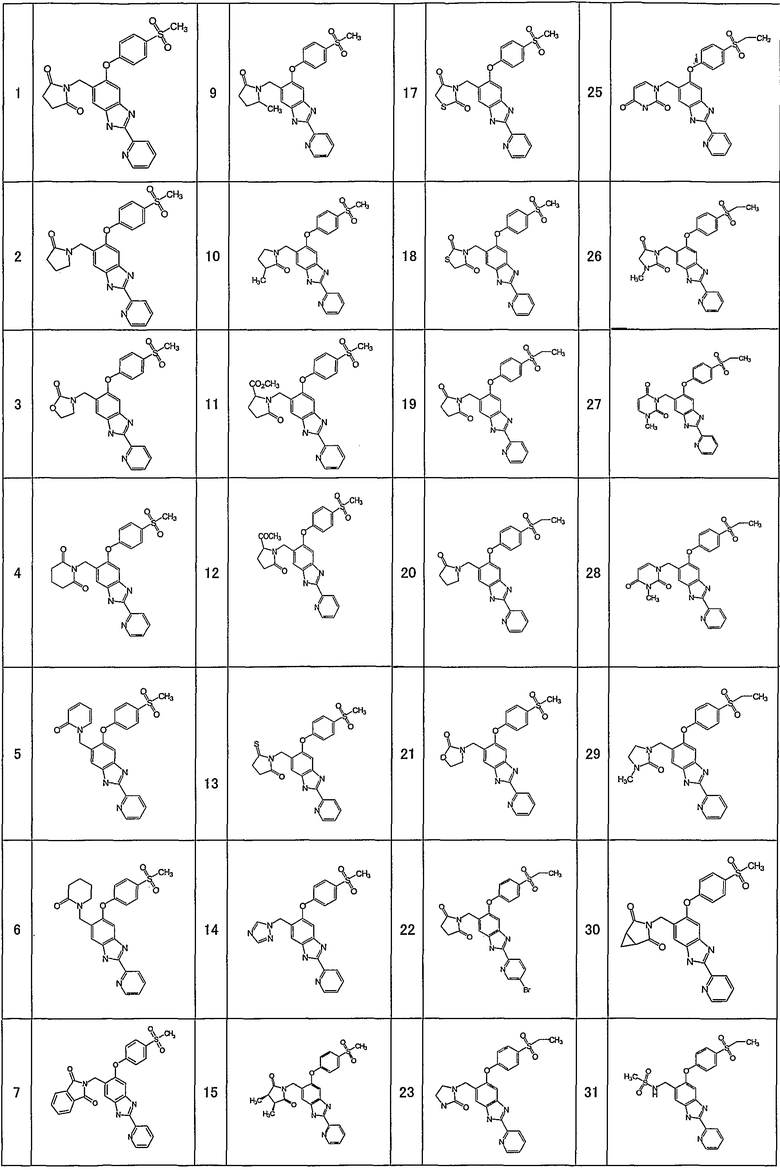
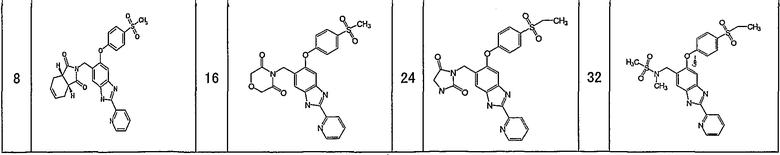
Таблица 7
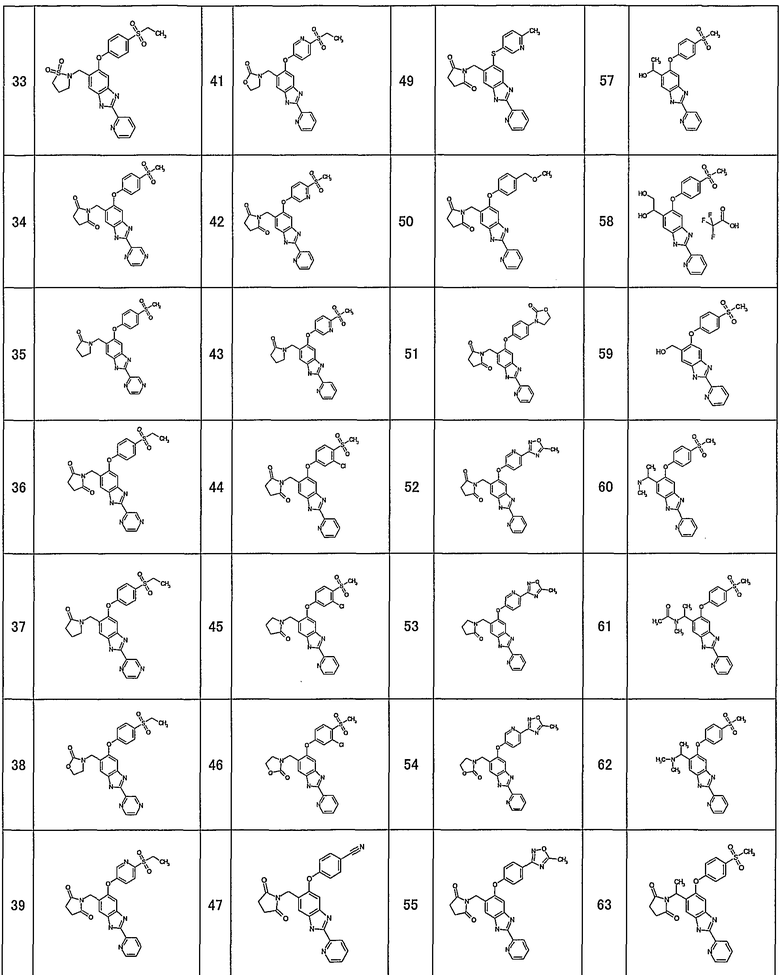
Таблица 8
Пример 79
6-[(Этилсульфонил)метил]-5-[4-(этилсульфонил)фенокси]-2-пиридинил)-1Н-бензимидазол
Стадия 1. Получение 5-[4-(этилсульфонил)фенокси]-6-[(этилтио)метил]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола и 6-[4-(этилсульфонил)фенокси]-5-[(этилтио)метил]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола:
При охлаждении на льду 15 мкл метансульфонилхлорида добавляли к раствору 50 мг спиртового соединения, полученного в примере 19 (стадия 7), и 26 мкл триэтиламина в тетрагидрофуране (0,5 мл) и перемешивали в течение 30 минут. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая аморфное вещество светло-желтого цвета.
При охлаждении на льду 11 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору полученного аморфного вещества и 15 мкл этантиола в диметилформамиде (0,5 мл) и перемешивали при комнатной температуре в течение 1 часа. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 15,5 мг целевого соединения.
Стадия 2. Получение 6-[(этилсульфонил)метил]-5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1H-бензимидазола:
0,67 мл раствора 0,4М оксона в метаноле добавляли к раствору 15,5 мг масла, полученного на стадии 1, в метаноле (0,6 мл) и перемешивали при комнатной температуре в течение 2 часов. Нерастворимое вещество удаляли фильтрованием, фильтрат разбавляли хлороформом и промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая аморфное вещество желтого цвета.
Полученное аморфное вещество желтого цвета растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали, остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 9,8 мг целевого соединения в виде твердого вещества светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,5 Гц), 1,39 (3H, т, J=7,0 Гц), 2,98 (2H, кв, J=7,5 Гц), 3,13 (2H, кв, J=7,0 Гц), 4,39 (2H×1/2, c), 4,41 (2H×1/2, c), 7,10-7,20 (3H+1/2H, м), 7,42 (1Н, м), 7,47 (1/2Н, c), 7,81 (1/2Н, c), 7,88 (3H, м), 8,02 (1/2Н, c), 8,38 (1Н, м), 8,67 (1Н, м), 10,7 (1/2Н, уш.), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 486 (M+H).
Пример 80
1-{[5-[4-(Изопропилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Стадия 1. Получение 6-({[трет-бутил(диметил)силил]окси}метил}-5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола и 5-({[трет-бутил(диметил)силил]окси}метил}-6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола:
34 мг имидазола и 30 мг трет-бутил(диметил)силилхлорида добавляли к раствору 100 мг спиртового соединения, полученного в примере 19 (стадия 7), в N,N-диметилформамиде (2 мл) и перемешивали в течение ночи при комнатной температуре. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат), получая 69 мг целевого соединения в виде масла желтого цвета.
Стадия 2. Получение 6-({[трет-бутил(диметил)силил]окси}метил}-5-[4-(изопропилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола и 5-({[трет-бутил(диметил)силил]окси}метил}-6-[4-(изопропилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола:
В атмосфере азота при -78°C 1 мл 0,126М раствора диизопропиламида лития в тетрагидрофуране, который был предварительно приготовлен, добавляли к раствору 69 мг простого силилового эфира, полученного на стадии 1, в тетрагидрофуране (1 мл) и перемешивали при этой температуре в течение 30 минут. При -78°C по каплям добавляли раствор 45 мг йодометана в тетрагидрофуране (1 мл) и дополнительно перемешивали в течение 1 часа. Затем его постепенно нагревали до 0°C и добавляли водный насыщенный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), проявляющий растворитель: гексан/этилацетат = 1/1), получая 30 мг целевого соединения в виде масла желтого цвета.
Стадия 3. Получение (5-[4-(изопропилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-[4-(изопропилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
При охлаждении на льду 49 мкл 1,0М раствора тетрабутиламмонийфторида в тетрагидрофуране по каплям добавляли к раствору 30 мг простого силилового эфира, полученного на стадии 2, в тетрагидрофуране (1 мл) и перемешивали в течение 10 минут. Добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали фосфатным буфером (рН 7,0). После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), проявляющий растворитель: гексан/этилацетат = 1/2), получая 24 мг целевого соединения в виде масла желтого цвета.
Стадия 4. Получение 1-{[5-[4-(изопропилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинона:
Используя спиртовой продукт, полученный на стадии 3, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30 (6H, д, J=7,0 Гц), 1,88-1,96 (2H, м), 2,29-2,36 (2H, м), 3,17 (1Н, септет, J=7,0 Гц), 3,26-3,31 (2H, м), 4,53 (2H×1/2, c), 4,54 (2H×1/2, c), 7,04 (2H×1/2, д, J=9,0 Гц), 7,06 (2H×1/2, д, J=9,0 Гц), 7,17 (1Н×1/2, c), 7,37-7,41 (1Н, м), 7,48 (1Н×1/2, c), 7,56 (1Н×1/2, c), 7,76 (1Н×1/2, c), 7,80 (2H×1/2, д, J=9,0 Гц), 7,80 (2H×1/2, д, J=9,0 Гц), 7,84-7,90 (1Н, м), 8,36-8,41 (1Н, м), 8,62-8,66 (1Н, м), 10,66 (1Н×1/2, уш.с), 10,73 (1Н×1/2, уш.с).
ESI-MASS (m/e): 491 (М+Н).
Пример 81
4-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)морфолин-3-он
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и морфолин-3-он (полученный согласно способу, описанному в US 5349045), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 3,11 (2H, кв, J=7,4 Гц), 3,34 (2H, м), 3,81 (2H, м), 4,15 (2H, м), 4,72 (2H, м), 7,07 (2H, м), 7,18 (1/2Н, c), 7,40 (1Н, м), 7,49 (1/2Н, c), 7,68 (1/2Н, c), 7,80-7,90 (1H+1/2H, м), 7,84 (2H, д, J=8,8 Гц), 8,39 (1Н, м), 8,66 (1Н, м), 10,7 (1/2Н, уш.), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 493 (M+H).
Пример 82
1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-1Н-имидазол-2-карбонитрил
Стадия 1. Получение 2-цианоимидазола:
Это соединение было получено согласно способу, описанному в WO 2003/011836.
Стадия 2. Получение 1-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-1Н-имидазол-2-карбонитрила:
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и 2-цианоимидазол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, м), 3,13 (2H, м), 5,41 (2H, c), 7,00-7,15 (4H+1/2H, м), 7,42 (1Н, м), 7,47 (1/2Н, м), 7,55 (1/2Н, c), 7,80-7,95 (3H+1/2H, м), 8,39 (1Н, м), 8,65 (1Н, м), 10,75 (1/2Н, уш.), 10,83 (1/2Н, уш.).
ESI-MASS (m/e): 485 (M+H).
Пример 83
N-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил]ацетамид
Стадия 1. Получение N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил}метил)ацетамида или N-({6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил}метил)ацетамида:
21 мкл ацетилхлорида добавляли к раствору 81,5 мг амина, полученного в примере 31 (стадия 1), и 42 мкл триэтиламина в хлороформе (0,8 мл). Смесь перемешивали в течение 30 минут, добавляли насыщенный водный раствор бикарбоната натрия, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ-хлороформ/метанол = 20/1), получая 82 мг целевого соединения в виде желтого масла.
Стадия 2 Получение N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)ацетамида:
12 мг полученного желтого масла растворяли в 0,5 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 9,8 мг целевого соединения в виде твердого вещества светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 1,95 (3H, c), 3,11 (2H, кв, J=7,4 Гц), 4,49 (2H, м), 5,83 (1/2Н, уш.), 5,97 (1/2Н, уш.), 7,15 (1/2Н, c), 7,40 (1Н, м), 7,46 (1/2Н, c), 7,65 (1/2Н, c), 7,85 (3H+1/2H, м), 8,39 (1Н, м), 8,65 (1Н, м), 10,7 (1/2Н, уш.), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 451 (М+Н).
Пример 84
N-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-N-метилацетамид
При охлаждении на льду 18 мкл метилиодида и 5,2 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 38 мг ацетамида, полученного в примере 83 (стадия 1), в диметилформамиде (0,3 мл). Смесь перемешивали при комнатной температуре в течение 2 часов, затем добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 18,1 мг желтого масла.
0,5 мл трифторуксусной кислоты добавляли к 18,1 мг полученного желтого масла и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 13,2 мг целевого соединения в виде аморфного вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, м), 2,05 и 2,08 (общие 3H, c), 2,96 и 2,99 (общие 3H, c), 3,12 (2H, м), 4,58 и 4,66 (общие 2H, м), 7,08 (2H, м), 7,17-7,73 (общие 3H, м), 7,82-7,90 (3H, м), 8,40 (1Н, м), 8,65 (1Н, м), 10,8 (1Н, уш.).
ESI-MASS (m/e): 465 (M+H).
Пример 85
3-{[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион
Используя 1,3-оксазолидин-2,4-дион, полученный согласно способу, описанному в JOURNAL OF MEDICINAL CHEMISTRY, 1991, Vol.34, No.5, pp.1538-1544, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 3,12 (2H, кв, J=7,4 Гц), 4,52 (2H×1/2, c), 4,59 (2H×1/2, c), 4,81 (2H×1/2, c), 4,83 (2H×1/2, c), 7,10 (2H, д, J=8,2 Гц), 7,11 (1Н×1/2, c), 7,38-7,44 (1Н, м), 7,47 (1Н×1/2, c), 7,70 (1Н×1/2, c), 7,83-7,92 (3H, м), 7,83-7,92 (1Н×1/2, м), 8,37-8,42 (1Н, м), 8,62-8,67 (1Н, м), 10,85 (1Н×1/2, уш.с), 10,90 (1Н×1/2, уш.с).
ESI-MASS (m/e): 493 (M+H).
Пример 86
N-Ацетил-N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)ацетамид
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и диацетамид, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 3,11 (2H, кв, J=7,4 Гц), 2,42 (6H×1/2, c), 2,43 (6H×1/2, c), 5,00 (2H, c), 7,11 (2H, д, J=8,6 Гц), 7,15 (1/2Н, c), 7,25 (1/2Н, c), 7,41 (1Н, м), 7,48 (1/2Н, c), 7,57 (1/2Н, c), 7,88 (3H, м), 8,38 (1Н, м), 8,64 (1Н, м), 10,75 (1Н, уш.).
ESI-MASS (m/e): 493 (M+H).
Пример 87
5-[4-(Этилсульфонил)фенокси]-6-(1Н-пиразол-1-илметил)-2-(2-пиридинил)-1Н-бензимидазол
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и пиразол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3Н, т, J=7,4 Гц), 3,11 (2H, кв, J=7,4 Гц), 5,41 (2H, c), 6,19 (1Н, c), 7,01 (2H, м), 7,11 (1/2Н, c), 7,35-7,50 (4H, м), 7,65 (1/2Н, c), 7,80 (2H, м), 7,86 (1Н, м), 8,38 (1Н, м), 8,62 (1Н, м), 10,8 (1/2Н, уш.), 10,9 (1/2Н, уш.).
ESI-MASS (m/e): 460 (M+H).
Пример 88
5-[4-(Этилсульфонил)фенокси]-6-(1Н-имидазол-1-илметил)-2-(2-пиридинил)-1Н-бензимидазол
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и имидазол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,34 (3H, м), 3,13 (2H, м), 5,20 (2H, c), 6,88-7,20 (4H, м), 7,40 (1Н, м), 7,45-7,60 (2H, м), 7,70-7,80 (1Н, м), 7,80-7,94 (3H, м), 8,39 (1Н, м), 8,64 (1Н, м), 10,7 (1/2Н, уш.), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 460 (M+H).
Пример 89
4-[({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)амино]-4-оксомасляная кислота (трифторацетат)
50 мг конечного продукта, полученного в примере 19, растворяли в 1 мл тетрагидрофурана и 0,2 мл воды, добавляли 60 мкл 5 н. гидроксида натрия и перемешивали при комнатной температуре в течение 1 часа. Смесь нейтрализовали с помощью 2 н. соляной кислоты, разбавляли хлороформом и высушивали безводным сульфатом магния. После фильтрования растворитель выпаривали при пониженном давлении и остаток очищали хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, получая 21,1 мг целевого соединения в виде бесцветного твердого вещества.
1Н-ЯМР (ДМСО-d6) δ: 1,12 (3H, т, J=7,5 Гц), 2,34 (2H, м), 2,41 (2H, м), 3,28 (2H, кв, J=7,5 Гц), 4,29 (2H, д, J=5,5 Гц), 7,14 (2H, J=8,8 Гц), 7,37 (1Н, c), 7,60 (1Н, м), 7,69 (1Н, c), 7,87 (2H, д, J=8,8 Гц), 8,07 (1Н, м), 8,34 (2H, м), 8,79 (1Н, д, J=4,5 Гц).
ESI-MASS (m/e): 508 (M+H).
Пример 90
N-(Цианометил)-N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)ацетамид
Стадия 1. Получение [5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метанола:
Используя спиртовое соединение, полученное в примере 19 (стадия 7), целевое соединение получали тем же способом, как в примере 57 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 6-(хлорметил)-5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазола:
11 мкл тионилхлорида добавляли к раствору 30 мг полученного спиртового соединения в хлороформе (3 мл) и перемешивали при комнатной температуре в течение 1 часа. Смесь нейтрализовали насыщенным водным бикарбонатом натрия, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 30 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
Стадия 3. Получение N-(цианометил)-N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)ацетамида:
2,1 г ацетонитрила растворяли в 50 мл хлороформа, при охлаждении на льду добавляли 5,6 мл триэтиламина и 2 мл ацетилхлорида и перемешивали при комнатной температуре в течение 3 часов. Добавляли насыщенный водный бикарбонат натрия, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 4/1-1/1-1/9, -хлороформ/метанол), получая 0,85 г N-(цианометил)ацетамида в виде кристалла белого цвета.
При охлаждении на льду 5,2 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 21,6 мг полученного N-(цианометил)ацетамида в диметилформамиде (0,25 мл). Смесь перемешивали при комнатной температуре в течение 30 минут, добавляли раствор 30 мг хлорида, полученного на стадии 2, в диметилформамиде (0,75 мл) и перемешивали в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 3,3 мг целевого соединения в виде аморфного вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, м), 2,22 (3H, м), 3,15 (2H, м), 4,10-4,30 (2H, м), 4,75 (2H, м), 7,12-7,20 (2H+1/2H, м), 7,42 (1Н, м), 7,50 (1Н, c), 7,77 (1/2Н, c), 7,90 (3H, м), 8,39 (1Н, м), 8,65 (1Н, м), 10,6 (1/2Н, уш.), 10,7 (1/2Н, уш.).
ESI-MASS (m/e): 490 (M+H).
Пример 91
1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-1Н-пиррол-2,5-дион
При -78°C 0,21 мл диэтилазодикарбоксилата (40% раствор в толуоле) добавляли к раствору 50 мг трифенилфосфина в тетрагидрофуране (0,5 мл) и перемешивали в течение 5 минут. При -78°C к реакционной жидкости постепенно добавляли раствор 100 мг спиртового соединения, полученного в примере 19 (стадия 7), в тетрагидрофуране (0,5 мл) и добавляли 18 мг малеимида. После растворения малеимида реакционной жидкости давали остыть до комнатной температуры и перемешивали в течение 2 часов. Растворитель выпаривали при пониженном давлении и остаток очищали жидкостной хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, получая 11 мг желтого масла.
11 мг полученного желтого масла растворяли в 0,3 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали и остаток нейтрализовали триэтиламином и очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 4,1 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, м), 3,12 (2H, м), 4,80 (2H, c), 6,62 (2H×1/2, c), 6,67 (2H×1/2, c), 7,08 (2H, м), 7,13 (1/2Н, c), 7,40 (1Н, м), 7,46 (1/2Н, c), 7,59 (1/2Н, c), 7,78 (1/2Н, c), 7,80 (3H, м), 8,37 (1Н, м), 8,67 (1Н, м), 10,6 (1Н, м).
ESI-MASS (m/e): 489 (M+H).
Пример 92
1-[1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил}-1Н-имидазол-2-ил]этанон
Стадия 1. Получение 2-ацетилимидазола:
При -78°C 1,6 мл метилмагнийбромида (3М, раствор в диэтиловом эфире) добавляли к раствору 151 мг 1Н-имидазол-2-карбонитрила, полученного в примере 82 (стадия 1), в тетрагидрофуране (3 мл) и перемешивали при этой температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и хлороформом, органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 187 мг целевого соединения в виде твердого вещества желтого цвета.
Стадия 2. Получение 1-[1-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-1Н-имидазол-2-ил]этанона:
Используя полученный 2-ацетилимидазол и спиртовое соединение, полученное в примере 19 (стадия 7), целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,2 Гц), 2,61 (3H×1/2, c), 2,64 (3H×1/2, c), 3,13 (2H, д, J=7,2 Гц), 5,71 (2H×1/2, c), 5,74 (2H×1/2, c), 7,05-7,15 (4H+1/2H, м), 7,32 (1/2Н, c), 7,38 (1Н, м), 7,41 (1/2Н, c), 7,53 (1/2Н, c), 7,85 (3H, м), 8,37 (1Н, м), 8,67 (1Н, м), 10,80 (1/2Н, уш.), 10,82 (1/2Н, уш.).
ESI-MASS (m/e): 502 (M+H).
Пример 93
N-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил]-2,2,2-трифтор-N-метилацетамид
При охлаждении на льду 40 мкл ангидрида трифторуксусной кислоты добавляли к раствору 50 мг амина, полученного в примере 31 (стадия 1), в пиридине (0,5 мл) и перемешивали в течение 30 минут. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ-хлороформ/метанол = 20/1), получая 37,8 мг целевого соединения в виде твердого вещества белого цвета.
Используя 25 мг полученного твердого вещества белого цвета, целевое соединение получали тем же способом, как в примере 84, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, м), 3,00-3,20 (5H, м), 4,73 (2H×1/2, c), 4,76 (2H×1/2, c), 7,00-7,10 (2H, м), 7,19 (1/2Н, c), 7,41 (1Н, м), 7,50 (1/2Н, c), 7,55 (1/2Н, c), 7,70-7,90 (3H+1/2H, м), 8,41 (1Н, м), 8,64 (1Н, м), 10,8 (1Н, уш.).
ESI-MASS (m/e): 519 (M+H).
Пример 94
N-Этил-N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)ацетамид
Используя этилиодид, целевое соединение получали тем же способом, как в примере 84, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,13 (3H, м), 1,29 (3H, м), 2,07 (3H×1/2, c), 2,11 (3H×1/2, c), 3,11 (2H, м), 3,29 (2H×2, м), 3,45 (2H×1/2, м), 4,56 (2H×1/2, c), 4,66 (2H×1/2, м), 7,00-7,11 (2H+1/2H, м), 7,41 (1H+1/2H, м), 7,64 (1/2Н, м), 7,86 (3H+1/2H, м), 8,39 (1Н, м), 8,64 (1Н, м), 10,8 (1Н, уш.).
ESI-MASS (m/e): 479 (M+H).
Пример 95
1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-3-гидроксипирролидин-2,5-дион
Стадия 1. Получение 1-[(5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метил]-3-гидроксипирролидин-2,5-диона или 1-[(6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)метил]-3-гидроксипирролидин-2,5-диона:
31 мг [5-оксо-2-(трихлорметил)-1,3-диоксолан-4-ил]ацетилхлорида, полученного согласно способу, описанному в Synthesis, 2002, Vol.15, pp.2165-2166, и 40 мкл пиридина добавляли к раствору 54 мг амина, полученного в примере 31 (стадия 1), в хлороформе (0,5 мл) и перемешивали при 80°C в течение 3 часов. Реакционной жидкости давали остыть до комнатной температуры, разбавляли этилацетатом и промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали жидкостной хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, остаток разбавляли этилацетатом, промывали насыщенным водным бикарбонатом натрия и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая 20,8 мг целевого соединения в виде бесцветного кристалла.
Стадия 2. Получение 1-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-3-гидроксипирролидин-2,5-диона:
20,8 мг полученного кристалла растворяли в 0,5 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, добавляли насыщенный водный бикарбонат натрия, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 9,1 мг целевого соединения в виде бесцветного кристалла.
1Н-ЯМР (CDCl3) δ: 1,27 (3H, т, J=7,2 Гц), 2,47 (1Н, м), 2,97 (1Н, м), 3,23 (2H, кв, J=7,2 Гц), 4,79 (1Н, м), 4,88 (2H, м), 7,16 (2H, д, J=8,8 Гц), 7,35 (1Н, м), 7,52 (1Н, м), 7,78 (1Н, м), 7,91 (2H, д, J=8,8 Гц), 8,00 (1Н, т, J=8,2 Гц), 8,30 (1Н, д, J=8,2 Гц), 8,76 (1Н, м).
ESI-MASS (m/e): 507 (M+H).
Пример 96
4-[({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)амино]-2-гидрокси-4-оксомасляная кислота (трифторацетат)
Водный 1 н. раствор гидроксида натрия добавляли к раствору 50 мг соединения, полученного в примере 95 (стадия 1), в тетрагидрофуране (0,5 мл) и перемешивали при комнатной температуре в течение 15 минут. Смесь нейтрализовали 2 н. соляной кислотой, затем разбавляли хлороформом и высушивали безводным сульфатом магния. После фильтрования растворитель выпаривали при пониженном давлении и остаток очищали хроматографией среднего давления с обратной фазой [OD-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, получая 43,5 мг аморфного вещества желтого цвета.
Полученный кристалл растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали и остаток очищали хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, получая 19,9 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
1Н-ЯМР (CD3OD) δ: 1,27 (3H, т, J=7,4 Гц), 2,59 (1Н, дд, J=8,2 Гц, 14,5 Гц), 2,71 (1Н, д, J=4,1, 14,5 Гц), 3,25 (2H, кв, J=7,4 Гц), 4,55 (1Н, м), 4,56 (2H, м), 7,27 (2H, д, J=8,8 Гц), 7,45 (1Н, c), 7,70 (1Н, м), 7,94 (1Н, c), 7,97 (2H, д, J=8,8 Гц), 8,15 (1Н, т, J=7,6 Гц), 8,32 (1Н, д, J=7,6 Гц), 8,90 (1Н, д, J=4,7 Гц).
ESI-MASS (m/e): 507 (M+H).
Пример 97
(2Z)-4-[({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)амино]-4-оксо-2-бутеновая кислота (трифторацетат)
27 мг малеинового ангидрида добавляли к раствору 100 мг амина, полученного в примере 31 (стадия 1), в хлороформе (1 мл) и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали и остаток очищали хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, получая 121,8 г желтого масла.
40 мг полученного желтого масла растворяли в 0,5 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали и остаток очищали хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, получая 19,3 мг целевого соединения в виде бесцветного кристалла.
1Н-ЯМР (ДМСО-d6) δ: 1,12 (3H, т, J=7,2 Гц), 3,27 (2H, кв, J=7,2 Гц), 4,45 (2H, д, J=5,3 Гц), 6,23 (1Н, д, J=12,3 Гц), 6,35 (1Н, д, J=12,3 Гц), 7,15 (2H, д, J=8,8 Гц), 7,39 (1Н, c), 7,60 (1Н, м), 7,79 (1Н, c), 7,86 (2H, д, J=8,8 Гц), 8,06 (1Н, т, J=7,6 Гц), 8,35 (1Н, д, J=7,6 Гц), 8,79 (1Н, д, J=7,6 Гц), 9,39 (1Н, м).
ESI-MASS (m/e): 507 (M+H).
Пример 98
(4S)-1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-4-гидроксипирролидин-2-он
Стадия 1. Получение (S)-4-{[трет-бутил(диметил)силил]окси}пирролидин-2-она:
1,02 г имидазола и 1,58 г трет-бутилдиметилхлорсилана добавляли к раствору 1,01 г (S)-4-гидрокси-2-пирролидона в диметилформамиде (5 мл) и перемешивали в течение ночи при комнатной температуре. Добавляли воду к реакционной жидкости и перемешивали при охлаждении на льду.
Осажденный кристалл собирали фильтрованием и высушивали, получая 2,07 г целевого соединения в виде бесцветного кристалла.
Стадия 2. Получение (4S)-4-{[трет-бутил(диметил)силил]окси}-1-({5-[4-этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил]}метил)пирролидин-2-она или (4S)-4-{[трет-бутил(диметил)силил]окси}-1-({6-[4-этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил]}метил)пирролидин-2-она:
При охлаждении на льду 15 мкл метансульфонилхлорида добавляли к раствору 50 мг спиртового соединения, полученного в примере 19 (стадия 7), и 26 мкл триэтиламина в тетрагидрофуране (0,5 мл) и перемешивали в течение 30 минут. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая аморфное вещество светло-желтого цвета.
При охлаждении на льду 22 мг гидрида натрия (с добавлением 30% жидкого парафина) добавляли к раствору 120 мг бесцветного кристалла, полученного на стадии 1, в диметилформамиде (1 мл) и перемешивали при комнатной температуре в течение 1 часа. Раствор светло-желтого аморфного вещества, полученного в указанной операции, в тетрагидрофуране (1,5 мл) добавляли к реакционной жидкости и дополнительно перемешивали при комнатной температуре в течение 1 часа. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали жидкостной хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, остаток разбавляли этилацетатом, промывали насыщенным водным бикарбонатом натрия и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая 55,5 мг целевого соединения в виде желтого масла.
Стадия 3. Получение (4S)-1-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-4-гидроксипирролидин-2-она:
55,5 мг полученного желтого масла растворяли в 1 мл трифторуксусной кислоты и 0,2 мл воды и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, к остатку добавляли насыщенный водный бикарбонат натрия, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 24,2 мг целевого соединения в виде аморфного вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,4 Гц), 2,43 (1Н, м), 2,65 (1Н, м), 3,10 (2H, кв, J=7,4 Гц), 3,30 (1Н, м), 3,55 (1Н, м), 4,30-4,70 (3H, м), 7,00 (2H, д, J=8,4 Гц), 7,09 (1/3Н, c), 7,30-7,45 (1H+2/3H), 5,51 (2/3Н, м), 7,62-7,90 (3H+1/3H, м), 8,36 (1Н, д, J=7,6 Гц), 8,62 (1Н, д, J=4,5 Гц), 11,0 (1/3Н, уш.), 11,4 (2/3Н, уш.).
ESI-MASS (m/e): 493 (M+H).
Пример 99
(4R)-1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-4-гидроксипирролидин-2-он
Используя (R)-4-гидрокси-2-пирролидон, целевое соединение получали тем же способом, как в примере 98, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,4 Гц), 2,43 (1Н, м), 2,65 (1Н, м), 3,10 (2H, кв, J=7,4 Гц), 3,30 (1Н, м), 3,55 (1Н, м), 4,30-4,70 (3H, м), 7,00 (2H, д, J=8,4 Гц), 7,09 (1/3Н, c), 7,30-7,45 (1H+2/3H), 5,51 (2/3Н, м), 7,62-7,90 (3H+1/3H, м), 8,36 (1Н, д, J=7,6 Гц), 8,62 (1Н, д, J=4,5 Гц), 11,0 (1/3Н, уш.), 11,4 (2/3Н, уш.).
ESI-MASS (m/e): 493 (M+H).
Пример 100
(4R)-1-({5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-4-фторпиридин-2-он
Стадия 1. Получение (4S)-1-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил]}метил)-4-гидроксипиридин-2-она или (4S)-1-({6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил]}метил)-4-гидроксипиридин-2-она:
0,72 мл раствора 1М тетрабутиламмонийфторида в тетрагидрофуране добавляли к раствору 267 мг соединения, полученного в примере 98 (стадия 2), в тетрагидрофуране (2,5 мл) и перемешивали при комнатной температуре в течение 30 минут. Фосфатный буфер (0,1М, рН 6) добавляли к реакционной жидкости, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ-хлороформ/метанол = 20/1), получая 77,5 мг целевого соединения в виде бесцветного масла.
Стадия 2. Получение (4R)-1-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]}метил)-4-фторпиридин-2-она:
46 мкл бис(2-метоксиметил)аминотрифторида серы добавляли к раствору 77,5 мг полученного масла в хлороформе (0,8 мл) и перемешивали при комнатной температуре в течение 15 минут. Смесь очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ-хлороформ/метанол = 20/1), получая 42,1 мг целевого соединения в виде бесцветного масла.
42,1 мг полученного желтого масла растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, к остатку добавляли насыщенный водный бикарбонат натрия, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 11,1 мг целевого соединения в форме аморфного вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 2,55-2,75 (2H, м), 3,11 (2H, кв, J=7,4 Гц), 3,45-3,70 (2H, м), 4,47-4,75 (2H, м), 5,10-5,30 (1Н, м), 7,03-7,10 (2H, м), 7,16 (1/2Н, c), 7,40 (1Н, м), 7,49 (1/2Н, c), 7,56 (1/2Н, c), 7,75-7,92 (3H+1/2H, м), 8,40 (1Н, м), 8,64 (1Н, м), 10,9 (1/2Н, уш.), 11,0 (1/2Н, уш.).
ESI-MASS (m/e): 495 (M+H).
Пример 101
6-[(1,1-Диоксидоизотиазолидин-2-илметил]-5-[(6-метилпиридин-3-ил)окси]-2-(2-пиридинил)-1Н-бензимидазол
Стадия 1. Получение (5-[(6-метилпиридин-3-ил)окси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (6-[(6-метилпиридин-3-ил)окси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)метанола:
Используя 4-гидрокси-6-метилпиридин, целевое соединение получали тем же способом, как в примере 19 (стадии 5-7), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 6-[(1,1-диоксидоизотиазолидин-2-ил)метил]-5-[(6-метилпиридин-3-ил)окси]-2-(2-пиридинил)-1Н-бензимидазола:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 33, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,29 (2H, м), 2,54 (3H, c), 3,14 (2H, м), 3,24 (2H, м), 4,37 (2H×1/2, c), 4,38 (2H×1/2, c), 7,00 (1/2Н, c), 7,05-7,24 (2H, м), 7,35 (1/2Н, c), 7,38 (1Н, м), 7,67 (1/2Н, c), 7,86 (1Н, м), 7,92 (1/2Н, c), 8,27 (1Н, м), 8,38 (1Н, м), 8,64 (1Н, м), 10,6 (1/2Н, уш.), 10,7 (1/2Н, уш.).
ESI-MASS (m/e): 495 (M+H).
Пример 102
1-[4-[(6-((2-Оксопирролидин-1-ил)метил]-2-(2-пиридинил)-1Н-бензимидазол-5-ил)окси]фенил]-2-пирролидинон
Стадия 1. Получение 2-фтор-4-нитробензальдегида:
43,3 г 2-фтор-4-нитробензойной кислоты растворяли в 600 мл диметилформамида, добавляли 1,1'-карбодиимид и перемешивали при комнатной температуре в течение 2 часов. Добавляли 11,1 г боргидрида натрия и дополнительно перемешивали в течение 30 минут. Добавляли насыщенный водный раствор хлорида аммония, добавляли 800 мл воды, экстрагировали 1,2 литра этилацетата и органический слой промывали насыщенным солевым раствором. Растворитель выпаривали при пониженном давлении, остаток снова разбавляли этилацетатом и органический слой промывали водой и насыщенным солевым раствором. Его высушивали безводным сульфатом натрия и растворитель выпаривали, получая 32,7 г коричневого масла.
Полученное масло растворяли в 200 мл диметилсульфоксида, постепенно добавляли 60 мл триэтиламина и 88,7 г комплекса триоксид серы/пиридин и перемешивали при комнатной температуре в течение 2 часов. Смесь разбавляли этилацетатом и органический слой промывали водой, водным 0,1 н. раствором соляной кислоты и насыщенным солевым раствором. Растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат) и кристаллизацией (метанол/диэтиловый эфир), получая 14,0 г целевого соединения в виде твердого вещества оранжевого цвета.
Стадия 2. Получение 1-(2-фтор-4-нитробензил)пирролидин-2-она:
100 мл метанола добавляли к 1 г полученного 2-фтор-4-нитробензальдегида и 3,0 г гидрохлорида метил-4-аминомасляной кислоты, затем добавляли 87 мл 0,3М раствора цианотригидробората цинка/метанола (1/2 раствор хлорида цинка и цианотригидробората натрия в метаноле) и перемешивали в течение 1 часа. Добавляли насыщенный водный бикарбонат натрия, разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 5,2 г аморфного вещества красного цвета.
Полученное аморфное вещество растворяли в метаноле, добавляли 1,5 мл 4,7М раствора метоксида натрия/метанола и перемешивали при комнатной температуре в течение 1,5 часов, затем при 45°C в течение 30 минут. Растворитель выпаривали и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 5/1-1/1-0/1), получая 1,9 г целевого соединения в виде оранжевого масла.
Стадия 3. Получение 1-(4-амино-2-фторбензил)пирролидин-2-она:
К раствору 1,5 г соединения, полученного на стадии 2, в метаноле (20 мл) добавляли никель Ренея и перемешивали в течение ночи при комнатной температуре. После фильтрования фильтрат упаривали при пониженном давлении, получая 1,4 г целевого соединения в виде оранжевого масла.
Стадия 4. Получение N-{5-фтор-2-нитро-4-[(2-оксопирролидин-1-ил)метил]фенил}пиридин-2-карбоксамида:
Гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида добавляли к раствору 1,13 г соединения, полученного на стадии 3, и 801 мг 2-пиколиновой кислоты в пиридине (25 мл) и перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали при пониженном давлении, остаток растворяли в 200 мл хлороформа и промывали 80 мл 0,2 н. соляной кислоты (×4), 50 мл 0,5 н. раствора гидроксида натрия (×3) и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 1,51 г твердого вещества светло-желтого цвета.
Раствор 1,51 г твердого вещества светло-желтого цвета в дымящей азотной кислоте (7 мл) перемешивали при комнатной температуре в течение 1 часа, затем вливали насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и перемешивали при комнатной температуре в течение 1 часа. Нерастворимое вещество отделяли фильтрованием, промывали водой, затем высушивали в течение ночи при пониженном давлении, получая 1,56 г целевого соединения в виде твердого вещества светло-желтого цвета.
Стадия 5. Получение 1-[4-[(6-((2-оксопирролидин-1-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол-5-ил)окси]фенил]-2-пирролидинона:
20 мг карбоната кальция добавляли к раствору 20 мг соединения, полученного на стадии 4, и 12 мг 1-(4-гидроксифенил)пирролидин-2-она в диметилформамиде (0,5 мл) и перемешивали при 80°C в течение 30 минут. Затем добавляли 126 мг дигидрата хлорида олова и перемешивали при 80°C в течение 30 минут. Воду и хлороформ добавляли к реакционной жидкости и нерастворимое вещество отделяли фильтрованием. Фильтрат экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали жидкостной хроматографией среднего давления с обратной фазой [ODS-AS-360-CC (YMC), подвижная фаза: вода/ацетонитрил/0,1% трифторуксусной кислоты]. Растворитель полученной фракции выпаривали при пониженном давлении, остаток разбавляли хлороформом, промывали насыщенным водным бикарбонатом натрия и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении.
Далее, остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 13,7 мг целевого соединения в виде аморфного вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,91-2,02 (2H, м), 2,14-2,22 (2H, м), 2,36-2,41 (2H, м), 2,60-2,65 (2H, м), 3,33-3,39 (2H, м), 3,84-3,88 (2H, м), 4,60 (2H×1/2, c), 4,63 (2H×1/2, c), 6,96 (1Н×1/2, c), 6,98 (2H×/2, д, J=9,0 Гц), 6,99 (2H×1/2, д, J=9,0 Гц), 7,34-7,39 (1Н, м), 7,38 (1Н×1/2, c), 7,53 (1Н×1/2, c), 7,54 (2H×1/2, д, J=9,0 Гц), 7,55 (2H×1/2д, J=9,0 Гц), 7,71 (1Н×1/2, c), 7,82-7,88 (1Н, м), 8,34-8,40 (1Н, м), 8,60-8,65 (1Н, м), 10,55 (1Н×1/2, уш.с), 10,63 (1Н×1/2, уш.с).
ESI-MASS (m/e): 468 (M+H).
Пример 103
1-[4-[(6-((2-Оксопирролидин-1-ил]метил)-2-(2-пиридинил)-1Н-бензимидазол-5-ил)окси]фенил]пиридин-2(1Н)он
Используя 1-(4-гидроксифенил)пиридин-2(1Н)-он, полученный в ссылочном примере 12, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,93-2,00 (2H, м), 2,35-2,41 (2H, м), 3,31-3,38 (2H, м), 4,60 (2H×1/2, c), 4,61 (2H×1/2, c), 6,22-6,28 (1Н, м), 6,64-6,69 (1Н, м), 7,01 (2H×1/2, д, J=8,6 Гц), 7,05 (2H×1/2, д, J=8,6 Гц), 7,10 (1Н×1/2, c), 7,31-7,43 (3H, м), 7,32 (2H, д, J=8,6 Гц), 7,48 (1Н×1/2, c), 7,56 (1Н×1/2, c), 7,74 (1Н×1/2, c), 7,84-7,89 (1Н, м), 8,36-8,40 (1Н, м), 8,63-8,66 (1Н, м), 10,73 (1Н×1/2, уш.с), 10,82 (1H×1/2, уш.с).
ESI-MASS (m/e): 478 (M+H).
Пример 104
5-((6-((2-Оксопирролидин-1-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол-5-ил)окси)пиридин-2-карбонитрил
Используя 5-гидроксипиридин-2-карбонитрил, полученный в ссылочном примере 10, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,91-1,99 (2H, м), 2,27-2,37 (2H, м), 3,27-3,33 (2H, м), 4,53 (2H, c), 7,20 (1Н×1/2, c), 7,23-7,28 (1Н, м), 7,40-7,43 (1Н, м), 7,49 (1Н×1/2, c), 7,57 (1Н×1/2, c), 7,62 (1Н×1/2, д, J=8,6 Гц), 7,64 (1Н×1/2, д, J=8,2 Гц), 7,79 (1Н×1/2, c), 7,87-7,92 (1Н, м), 8,37-8,45 (2H, м), 8,64-8,67 (1Н, м), 10,75 (1Н×1/2, уш.с), 10,84 (1Н×1/2, уш.с).
ESI-MASS (m/e): 411 (M+H).
Пример 105
1-{[5-[(6-(Метоксиметил)пиридин-3-ил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя 6-(метоксиметил)пиридин-3-ол, полученный в ссылочном примере 11, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,93-2,00 (2H, м), 2,35-2,41 (2H, м), 3,32-3,39 (2H, м), 3,48 (3H×1/2, c), 3,48 (3H×1/2, c), 4,57 (2H, c), 4,61 (2H×1/2, c), 4,63 (2H×1/2, c), 7,03 (1Н×1/2, c), 7,25-7,29 (1Н, м), 7,35 (1Н×1/2, c), 7,36-7,40 (2H, м), 7,55 (1Н×1/2, c), 7,74 (1Н×1/2, c), 7,84-7,90 (1Н, м), 8,30-8,41 (2H, м), 8,61-8,65 (1Н, м), 10,73 (1Н×1/2, уш.с), 10,84 (1Н×1/2, уш.с).
ESI-MASS (m/e): 430 (M+H).
Пример 106
1-({5-[4-(5-Метил-1,3,4-оксадиазол-2-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)пирролидин-2-он
Используя 6-(5-метил-1,3,4-оксадиазол-2-ил)пиридин-3-ол, полученный в ссылочном примере 12, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,95 (2H, м), 2,33 (2H, м), 2,61 (3H, c), 3,31 (2H, м), 4,58 (2H, c), 7,04 (2H, д, J=8,8 Гц), 7,10-7,80 (2H, уш.), 7,39 (1Н, м), 7,88 (1Н, дт, J=1,7, 8,0 Гц), 7,97 (2H, д, J=8,8 Гц), 8,39 (1Н, д, J=8,0 Гц), 8,65 (1Н, д, J=5,0 Гц), 10,0-11,0 (1Н, уш.).
ESI-MASS (m/e): 467 (M+H).
Пример 107
1-({5-[4-(3-Метил-1,2,4-оксадиазол-5-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)пирролидин-2-он
Используя 6-(3-метил-1,2,4-оксадиазол-5-ил)пиридин-3-ол, полученный в ссылочном примере 13, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,93 (2H, м), 2,33 (2H, м), 2,46 (3H, м), 3,30 (2H, м), 4,57 (2H, м), 7,05 (2H, м), 7,19 (1/2Н, c), 7,40 (1Н, м), 7,52 (1/2Н, c), 7,57 (1/2Н, c), 7,78 (1/2Н, c), 7,86 (1Н, м), 8,06 (2H, д, J=8,8 Гц), 8,40 (1Н, м), 8,66 (1Н, м), 10,7 (1Н, уш.), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 467 (M+H).
Пример 108
1-({5-[4-(1-Метил-1H-тетразол-5-ил)фенокси]-2-(2-пиридинил)-1H-бензимидазол-6-ил}метил)пирролидин-2-он
Используя 6-(1-метил-1Н-тетразол-5-ил)пиридин-3-ол, полученный в ссылочном примере 14, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,94 (2H, м), 2,35 (2H, м), 3,33 (2H, м), 4,18 (3H, c), 4,59 (2H, c), 7,13 (2H, c), 7,20 (1/2Н, c), 7,40 (1Н, м), 7,51 (1/2Н, c), 7,56 (1/2Н, c), 7,70 (2H, д, J=8,8 Гц), 7,77 (1/2Н, c), 7,88 (1Н, м), 8,39 (1Н, м), 8,64 (1Н, м), 10,9 (1/2Н, уш.), 11,0 (1/2Н, уш.).
ESI-MASS (m/e): 467 (M+H).
Пример 109
1-({5-[4-(1,3-Оксазол-4-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)пирролидин-2-он
Используя 6-(1,3-оксазол-4-ил)пиридин-3-ол, полученный в ссылочном примере 15, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,94 (2H, м), 2,36 (2H, м), 3,34 (2H, м), 4,62 (2H, м), 7,00 (2H, м), 7,07 (1/2Н, м), 7,37 (1Н, м), 7,46 (1/2Н, c), 7,54 (1/2Н, c), 7,69 (2H, д, J=8,8 Гц), 7,74 (1/2Н, c), 7,86 (1Н, м), 7,90 (1Н, c), 7,94 (1Н, c), 8,39 (1Н, м), 8,63 (1Н, м), 10,8 (1/2Н, уш.), 10,9 (1/2Н, уш.).
ESI-MASS (m/e): 452 (M+H).
Пример 110
1-[(5-((2'-Фторбифенил-4-ил)окси)-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-2-пирролидинон
Стадия 1. Получение N-{5-фтор-2-нитро-4-{[(2-оксопирролидин-1-ил)метил]фенил}пиразин-2-карбоксамида:
Используя пиразин-2-карбоновую кислоту, целевое соединение получали тем же способом, как в примере 102 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-[(5-((2'-фторбифенил-4-ил)окси)-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-2-пирролидинона:
Используя соединение, полученное на стадии 1, и 6-(2-фторфенил)пиридин-3-ол, полученный в ссылочном примере 16, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,94-2,02 (2H, м), 2,37-2,44 (2H, м), 3,36-3,46 (2H, м), 4,67 (2H, c), 7,05 (2H, д, J=8,6 Гц), 7,13-7,34 (3H, 1Н×1/2, м), 7,40-7,45 (1Н, м), 7,48 (1Н×1/2, c), 7,51 (2H, д, J=8,6 Гц), 7,66 (1Н×1/2, c), 7,77 (1Н×1/2, c), 8,59 (1Н, c), 8,64 (2H, д, J=2,7 Гц), 9,62 (1Н, c), 10,47 (1Н×1/2, уш.с), 10,95 (1Н×1/2, уш.с).
ESI-MASS (m/e): 480 (M+H).
Пример 111
1-{[2-(5-Бром-2-пиридинил)-5-[(6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Стадия 1. Получение метил 4-{[(5-бромпиразин-2-ил)карбониламино]-2-фторбензоата:
Используя метил 4-амино-2-фторбензоат, полученный в примере 19 (стадия 2), и 5-бромпиразин-2-карбоновую кислоту, целевое соединение получали тем же способом, как в примере 19 (стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение (2-(5-бромпиразин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)метанола и (2-(5-бромпиразин-2-ил)-6-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)метанола:
Используя соединение, полученное на стадии 1, целевое соединение получали тем же способом, как в примере 52 (стадии 1, 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 3. Получение 1-{[2-(5-бром-2-пиридинил)-5-[(6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-1Н-бензимидазол-6-ил]метил}-2-пирролидинона:
Используя спирт, полученный на стадии 2, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,92-1,99 (2H, м), 2,31-2,39 (2H, м), 3,30-3,36 (2H, м), 4,59 (2H×1/2, c), 4,61 (2H×1/2, c), 7,17 (1Н×1/2, c), 7,30-7,37 (1Н, м), 7,47 (1Н×1/2, c), 7,60 (1Н×1/2, c), 7,78 (1Н×1/2, c), 7,98-8,02 (1Н, м), 8,04 (1Н×1/2, д, J=8,6 Гц), 8,07 (1Н×1/2, д, J=9,0 Гц), 8,26 (1Н×1/2, д, J=8,6 Гц), 8,29 (1Н×1/2, д, J=8,6 Гц), 8,49 (1Н×1/2, д, J=2,3 Гц), 8,55 (1Н×1/2, д, J=2,3 Гц), 8,69 (1Н×1/2, д, J=1,6 Гц), 8,71 (1Н×1/2, д, J=2,0 Гц), 10,40 (1Н×1/2, уш.с), 10,52 (1Н×1/2, уш.с).
ESI-MASS (m/e): 546, 548 (M+H).
Пример 112
1-Метил-3-{[5-[(6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}имидазолидин-2,4-дион
Используя спиртовое соединение, полученное в примере 52 (стадия 2), и 1-метилгидантоин, целевое соединение получали тем же способом, как в примере 19 (стадия 8), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,68 (3H, c), 2,89 (3H×1/2, c), 2,95 (3H×1/2, c), 3,70 (2H×1/2, c), 3,82 (2H×1/2, c), 4,83 (2H×1/2, c), 4,85 (2H×1/2, c), 7,07 (1Н×1/2, c), 7,30-7,41 (2H, м), 7,45 (1Н×1/2, c), 7,66 (1Н×1/2, c), 7,81 (1Н×1/2, c), 7,84-7,89 (1Н, м), 8,02 (1Н×1/2, д, J=8,6 Гц), 8,05 (1Н×1/2, д, J=9,0 Гц), 8,36 (1Н×1/2, д, J=7,8 Гц), 8,38 (1Н×1/2, д, J=7,8 Гц), 8,55-8,59 (1Н, м), 8,61-8,65 (1Н, м), 10,63 (1Н, уш.с).
ESI-MASS (m/e): 497 (M+H).
Пример 113
6-((1,1-Диоксидоизотиазолин-2-ил]метил)-5-((6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси)-2-(2-пиридинил)-1Н-бензимидазол
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере 33, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,19-2,27 (2H, м), 2,69 (3H, c), 3,04-3,12 (2H, м), 3,16-3,23 (2H, м), 4,33 (2H×1/2, c), 4,35 (2H×1/2, c), 7,18 (1Н×1/2, c), 7,31-7,43 (2H, м), 7,50 (1Н×1/2, c), 7,72 (1Н×1/2, c), 7,85-7,92 (1Н, м), 7,96 (1Н×1/2, c), 8,04 (1Н×1/2, д, J=8,6 Гц), 8,07 (1Н×1/2, д, J=8,6 Гц), 8,38 (1Н×1/2, д, J=7,8 Гц), 8,41 (1Н×1/2, д, J=8,2 Гц), 8,48 (1Н×1/2, д, J=2,7 Гц), 8,55 (1Н×1/2, д, J=2,3 Гц), 8,64 (1Н×1/2, д, J=4,3 Гц), 8,66 (1Н×1/2, д, J=4,7 Гц), 10,57 (1Н×1/2, уш.с), 10,60 (1Н×1/2, уш.с).
ESI-MASS (m/e): 504 (M+H).
Пример 114
4-{[5-[(6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-2-(2-пиридинил]-1Н-бензимидазол-6-ил]метил}морфолин-3-он
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере 81, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,69 (3Н, c), 3,35 (2H×1/2, т, J=5,1 Гц), 3,39 (2H×1/2, т, J=5,1 Гц), 3,83 (2H×1/2, т, J=5,1 Гц), 3,84 (2H×1/2, т, J=5,1 Гц), 4,15 (2H×1/2, c), 4,19 (2H×1/2, c), 4,76 (2H×1/2, c), 4,78 (2H×1/2, c), 7,17 (1Н×1/2, c), 7,29-7,35 (1Н, м), 7,38-7,42 (1Н, м), 7,49 (1Н×1/2, c), 7,65 (1Н×1/2, c), 7,83 (1Н×1/2, c), 7,85-7,91 (1Н, м), 8,04 (1Н×1/2, д, J=8,6 Гц), 8,07 (1Н×1/2, д, J=8,6 Гц), 8,37 (1Н×1/2, д, J=7,8 Гц), 8,40 (1Н×1/2, д, J=8,2 Гц), 8,52 (1Н×1/2, д, J=2,7 Гц), 8,57 (1Н×1/2, д, J=2,7 Гц), 8,64 (1Н×1/2, д, J=5,1 Гц), 8,66 (1Н×1/2, д, J=5,5 Гц), 10,59 (1Н×1/2, уш.с), 10,68 (1Н×1/2, уш.с).
ESI-MASS (m/e): 484 (M+H).
Пример 115
3-{[5-[(6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере 85, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,68 (3H, c), 4,58 (2H×1/2, c), 4,64 (2H×1/2, c), 4,86 (2H×1/2, c), 4,89 (2H×1/2, c), 7,06 (1Н×1/2, c), 7,32-7,42 (2H, м), 7,46 (1Н×1/2, c), 7,68 (1Н×1/2, c), 7,86 (1Н×1/2, c), 7,89 (1Н, д, J=6,3 Гц), 8,02-8,08 (1Н, м), 8,37-8,42 (1Н, м), 8,53-8,58 (1Н, м), 8,61-8,66 (1Н, м), 10,97 (1Н, уш.с).
ESI-MASS (m/e): 484 (M+H).
Пример 116
1-{[5-[(6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1H-имидазол-2-карбонитрил
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере 82, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (ДМСО-d6) δ: 2,66 (3H, c), 5,52 (2H, c), 7,09 (1Н, д, J=6,7 Гц), 7,15 (1Н×1/2, c), 7,26-7,35 (1Н, м), 7,50-7,62 (2H, м), 7,50-7,62 (1Н×1/2, с, перекрытие), 7,71 (1Н×1/2, c), 7,93-8,04 (2H, м), 7,93-8,04 (1Н×1/2, с, невидимый), 8,29-8,34 (1Н, м), 8,42-8,45 (1Н, м), 8,72-8,77 (1Н, м), 13,26 (1Н×1/2, уш.с), 13,45 (1H×1/2, уш.с).
ESI-MASS (m/e): 476 (M+H).
Пример 117
4-{[5-[(6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}морфолин-3,5-дион
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же самым способом, как в примере 16, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,69 (3H, c), 4,29 (4H×1/2, c), 4,36 (4H×1/2, c), 5,13 (2H×1/2, c), 5,13 (2H×1/2, c), 7,08 (1Н×1/2, c), 7,30-7,39 (2H, м), 7,45 (1Н×1/2, c), 7,53 (1Н×1/2, c), 7,73 (1Н×1/2, c), 7,85-7,89 (1Н, м), 8,03 (1Н×1/2, д, J=9,0 Гц), 8,07 (1Н×1/2, д, J=9,4 Гц), 8,37 (1Н×1/2, д, J=7,0 Гц), 8,39 (1Н×1/2, д, J=7,0 Гц), 8,58-8,65 (2H, м), 10,74 (1Н, уш.с).
ESI-MASS (m/e): 498 (M+H).
Пример 118
3-{[5-[(6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-2-(2-пиридинил]-1Н-бензимидазол-6-ил]метил}-1,3-тиазолидин-2,4-дион
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере 17, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,69 (3H, c), 3,82 (2H×1/2, c), 3,90 (2H×1/2, c), 4,94 (2H×1/2, c), 4,97 (2H×1/2, c), 7,08 (1Н×1/2, c), 7,30-7,41 (2H, м), 7,45 (1Н×1/2, c), 7,60 (1Н×1/2, c), 7,80 (1Н×1/2, c), 7,86-7,90 (1Н, м), 8,03-8,08 (1Н, м), 8,36-8,40 (1Н, м), 8,55-8,65 (2H, м), 10,74 (1Н×1/2, уш.с), 10,79 (1Н×1/2, уш.с).
ESI-MASS (m/e): 500 (M+H).
Пример 119
1-{[5-[4-(5-Метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя N-{5-фтор-2-нитро-4-[(2-оксопирролидин-1-ил)метил]фенил}пиразин-2-карбоксамид, полученный в примере 110 (стадия 1), и 4-(5-метил-1,2,4-оксадиазол-3-ил)фенол, полученный в ссылочном примере 7, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,92-2,00 (2H, м), 2,34-2,41 (2H, м), 3,32-3,39 (2H, м), 4,61 (2H×1/2, c), 4,62 (2H×1/2, c), 7,04 (2H×1/2, д, J=8,6 Гц), 7,05 (2H×1/2, д, J=8,6 Гц), 7,17 (1Н×1/2, c), 7,51 (1Н×1/2, c), 7,65 (1Н×1/2, c), 7,79 (1Н×1/2, c), 8,02 (2H, д, J=8,6 Гц), 8,57-8,61 (1Н, м), 8,66 (1Н, д, J=2,0 Гц), 9,61-9,64 (1Н, м), 10,45 (1Н×1/2, уш.с), 10,83 (1Н×1/2, уш.с).
ESI-MASS (m/e): 468 (M+H).
Пример 120
3-{[5-[4-(5-Метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион
Используя спиртовое соединение, полученное в примере 55 (стадия 1), целевое соединение получали тем же способом, как в примере 85, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3, 2 капли CD3OD) δ: 2,66 (3H, c), 4,44 (2H×1/2, c), 4,52 (2H×1/2, c), 4,87 (2H×1/2, c), 4,90 (2H×1/2, c), 7,03 (2H×1/2, д, J=8,6 Гц), 7,06 (2H×1/2, д, J=8,6 Гц), 7,17 (1Н×1/2, c), 7,38-7,43 (1Н, м), 7,47 (1Н×1/2, c), 7,71 (1Н×1/2, c), 7,88-7,91 (1Н, м), 7,92 (1Н×1/2, c), 8,01 (2H×1/2, д, J=8,6 Гц), 8,03 (2H×1/2, д, J=8,6 Гц), 8,38-8,42 (1Н, м), 8,61-8,67 (1Н, м), пик NH невидим.
ESI-MASS (m/e): 483 (M+H).
Пример 121
3-{[5-[(6-(5-Метил-1,2,4-оксадиазол-3-ил)-3-пиридинил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
Используя N-{5-фтор-2-нитро-4-[(2-оксопирролидин-1-ил)метил]фенил}пиразин-2-карбоксамид, полученный в примере 110 (стадия 1), и 6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинол, полученный в ссылочном примере 6, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,95-2,02 (2H, м), 2,36-2,42 (2H, м), 2,69 (3H, c), 3,34-3,41 (2H, м), 4,62 (2H, c), 7,18 (1Н×1/2, c), 7,34 (1Н, д, J=7,8 Гц), 7,50 (1Н×1/2, c), 7,69 (1Н×1/2, c), 7,79 (1Н×1/2, c), 8,06 (1Н, д, J=8,6 Гц), 8,49-8,57 (1Н, м), 8,60 (1Н, c), 8,67 (1Н, д, J=2,7 Гц), 9,63 (1Н, c), 10,58 (1Н×1/2, уш.с), 10,98 (1Н×1/2, уш.с).
ESI-MASS (m/e): 469 (M+H).
Пример 122
5-Гидрокси-1-[(6-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-5-ил)метил]пирролидин-2-он
7 мг боргидрида натрия и 8 мг хлорида лития добавляли к раствору 30 мг соединения, полученного в примере 51, в 2 мл тетрагидрофурана и 0,2 мл метанола и перемешивали при комнатной температуре в течение 1 часа. Добавляли водный 10% раствор лимонной кислоты, экстрагировали хлороформом, органический слой высушивали и растворитель выпаривали при пониженном давлении. Остаток очищали тонкослойной хроматографией (проявляющий растворитель: хлороформ/метанол = 9/2), получая 7 мг целевого соединения в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,91-1,88 (1Н, м), 2,22-2,20 (2H, м), 2,57-2,55 (1Н, м), 2,64 (3H, c), 4,37 (2H, д, J=15,5 Гц), 5,24 (1Н, м), 7,36-7,35 (2H, м), 7,83 (2H, д, J=7,8 Гц), 7,96 (1Н, д, J=8,8 Гц), 8,34-8,33 (3H, м), 8,63-8,60 (1Н, м).
ESI-MASS (m/e): 484 (M+H).
Пример 123
1-{[5-[(6-(5-Метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил)окси]-2-(1-оксидопиридин-2-ил)-1Н-бензимидазол-6-ил]метил}-2-пирролидинон
2 мг метилтриоксоления(VII) добавляли к раствору 20 мг соединения, полученного в примере 53, в хлороформе (2 мл), добавляли 100 мкл водной 30% перекиси водорода и перемешивали при комнатной температуре в течение 4 часов. Добавляли водный раствор тиосульфата натрия и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 5/1), получая 1,0 мг целевого соединения в виде белого кристалла.
1Н-ЯМР (CDCl3) δ: 1,99 (2H, м), 2,40 (2H, м), 2,71 (3H, c), 3,36 (2H, м), 4,46 (2H×1/2, м), 4,65 (2H×1/2, c), 7,27 (1/2Н, c), 7,40 (2H, м), 7,45-7,60 (1H+1/2H, м), 7,66 (1/2Н, м), 7,82 (1/2Н, c), 8,09 (1Н, м), 8,41 (1Н, м), 8,57 (1Н, м), 8,72 (1Н, м), 13,2 (1/2Н, c), 13,3 (1/2Н, с).
ESI-MASS (m/e): 484 (M+H).
Пример 124
4-Гидрокси-1-{[5-[(6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил)окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2-он
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере L-001471821, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 2,30-2,50 (1Н, м), 2,60-2,75 (1Н, м), 2,68 (3H, c), 3,30-3,55 (1Н, м), 3,55-3,70 (1Н, м), 4,40-4,80 (3H, м), 7,10-7,80 (4H, м), 7,86 (1Н, м), 8,02 (1Н, д, J=8,8 Гц), 8,38 (1Н, д, J=7,8 Гц), 8,46 (1Н, д, J=2,7 Гц), 8,65 (1Н, д, J=4,9 Гц).
ESI-MASS (m/e): 484 (M+H).
Пример 125
1-[Гидрокси-(5-{[6-[5-метил-1,2,4-оксадиазол-3-ил]-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]-2-пирролидинон
Стадия 1. Получение (5-[{6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метанола:
Используя спиртовое соединение, полученное в примере 52 (стадия 2), целевое соединение получали тем же способом, как в примере 59, или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-карбальдегида:
1,5 мл триэтиламина и 796 мг комплекса триоксид серы/пиридин добавляли к раствору 400 мг полученного спиртового соединения в диметилсульфоксиде (5 мл) и перемешивали при комнатной температуре в течение 30 минут. Добавляли воду, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток кристаллизовали в смеси диэтиловый эфир/метанол, получая 183 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
Стадия 3. Получение 1-[гидрокси-(5-{[6-[5-метил-1,2,4-оксадиазол-3-ил]-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]-2-пирролидинона:
7 мг карбоната натрия добавляли к раствору 8,7 мкл 1-пирролидона в N,N-диметилформамиде (500 мкл). При перемешивании при 80°C добавляли 10 мг альдегида, полученного предварительно, и перемешивали в течение ночи при 80°C. Растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 5/1), получая 1,0 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 0,79-0,94 (1Н, м), 1,77-1,91 (1Н, м), 1,97-2,09 (1Н, м), 2,14-2,34 (1Н, м), 2,68 (3H, c), 2,83-2,94 (1Н, м), 3,37-3,52 (1Н, м), 6,87-6,95 (1Н, м), 7,18 (1Н×1/2, c), 7,33-7,46 (2H, м), 7,50 (1Н×1/2, c), 7,86-7,94 (1Н, м), 7,99-8,08 (1Н, м, 1Н×1/2, c), 8,31 (1Н×1/2, c), 8,36-8,46 (2H, м), 8,60-8,72 (1Н, м), 10,58 (1Н×1/2, уш.с), 10,86 (1Н×1/2, уш.с).
ESI-MASS (m/e): 484 (M+H).
Пример 126
5-[4-(Этилсульфонил)фенокси]-6-[(2-фторпиридин-3-ил)метил]-2-(2-пиридинил)-1Н-бензимидазол
Стадия 1. Получение (5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)(2-фторфенил)метанола или (6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-ил)(2-фторфенил)метанола:
При -78°C 6,2 мл 1,5М раствора бутиллития/гексана добавляли к раствору 1,31 мл диизопропилэтиламина в тетрагидрофуране (10 мл) и перемешивали при 0°C в течение 30 минут. При -78°C 0,8 мл 2-фторпиридина добавляли к реакционной жидкости и перемешивали при -78°C в течение 2 часов. Затем добавляли раствор 1 г альдегида, полученного в примере 64 (стадия 1), в тетрагидрофуране (5 мл) и перемешивали при -78°C в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания его очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ-хлороформ/метанол = 50/1), получая 0,72 г целевого соединения в виде коричневого масла.
Стадия 2. Получение 5-[4-(этилсульфонил)фенокси]-6-[(2-фторпиридин-3-ил)метил]-2-(2-пиридинил)-1Н-бензимидазола:
26 мкл тионилхлорида добавляли к раствору 75 мг полученного масла в хлороформе (0,75 мл) и перемешивали при комнатной температуре в течение 20 минут. Растворитель выпаривали при пониженном давлении, добавляли 0,7 мл трифторуксусной кислоты и 39 мг цинка и нагревали с обратным холодильником в течение 30 минут. Растворитель выпаривали при пониженном давлении, остаток разбавляли хлороформом, добавляли насыщенный водный бикарбонат натрия и водный аммиак и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 15,2 мг целевого соединения в виде бесцветного кристалла.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, м), 3,11 (2H, м), 4,03 (2H, c), 7,00 (3H, м), 7,15 (1/2Н, c), 7,37-7,57 (3H, м), 7,75 (1/2Н, c), 7,79 (2H, м), 7,87 (1Н, м), 8,02 (1Н, м), 8,39 (1Н, м), 8,64 (1Н, м), 10,6 (1/2H, уш.), 10,7 (1/2Н, уш.).
ESI-MASS (m/e): 489 (M+H).
Пример 127
(5-(4-Этилсульфонил)фенокси)-2-(2-пиридинил)-1Н-бензимидазол-6-ил)ацетонитрил
Стадия 1. Получение (5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)ацетонитрила или (6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)ацетонитрила:
При охлаждении на льду 268 мкл метансульфонилхлорида добавляли к раствору 930 мг спиртового соединения, полученного в примере 19 (стадия 7), и 494 мкл триэтиламина в тетрагидрофуране (20 мл) и перемешивали в течение 20 минут. Смесь разбавляли 60 мл этилацетата и добавляли воду. Органический слой отделяли и промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая бесцветное аморфное вещество.
При охлаждении на льду 269 мг цианида натрия добавляли к раствору полученного аморфного вещества в N,N-диметилформамиде (20 мл) и перемешивали при комнатной температуре в течение 3 часов. При охлаждении на льду добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат), получая 623 мг желтого масла.
Стадия 2. Получение (5-(4-этилсульфонил)фенокси)-2-(2-пиридинил)-1H-бензимидазол-6-ил)ацетонитрила:
28 мг полученного масла растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали при пониженном давлении, остаток разбавляли хлороформом и затем нейтрализовали насыщенным водным раствором гидрокарбоната натрия. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 14 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 3,13 (2H, кв, J=7,4 Гц), 3,82 (2H, c), 7,10-7,16 (1Н×1/2, с, перекрытие), 7,13 (2H, д, J=8,2 Гц), 7,39-7,44 (1Н, м), 7,48 (1Н×1/2, c), 7,71 (1Н×1/2, c), 7,85-7,91 (1Н, м), 7,88 (2H, д, J=8,2 Гц), 7,91 (1Н×1/2, c), 8,37-8,42 (1Н, м), 8,63-8,69 (1Н, м), 10,72 (1Н×1/2, уш.с), 10,79 (1Н×1/2, уш.с).
ESI-MASS (m/e): 419 (M+H).
Пример 128
2-(5-(4-(Этилсульфонил)фенокси)-2-(2-пиридинил)-1Н-бензимидазол-6-ил)ацетамид
Раствор 30 мг цианосоединения, полученного в примере 127, в 80% серной кислоте (1 мл) перемешивали в течение ночи при 70°C. При охлаждении на льду реакционный раствор добавляли по каплям в насыщенный водный раствор гидрокарбоната натрия, который нейтрализуется им, и затем экстрагировали хлороформом. Органический слой высушивали, растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 5,7 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3, 2 капли CD3OD) δ: 1,30 (3Н, т, J=7,4 Гц), 3,13 (2H, кв, J=7,4 Гц), 3,61 (2H×1/2, c), 3,63 (2H×1/2, c), 7,10 (2H, д, J=9,0 Гц), 7,18 (1Н×1/2, c), 7,40-7,43 (1Н, м), 7,47 (1Н×1/2, c), 7,62 (1Н×1/2, c), 7,83 (1Н×1/2, c), 7,84 (2H, д, J=9,0 Гц), 7,88-7,93 (1Н, м), 8,37-8,42 (1Н, м), 8,62-8,66 (1Н, м), пики NH и NH2 невидимы.
ESI-MASS (m/e): 437 (M+H).
Пример 129
2-[5-(4-(Этилсульфонил)фенокси)-2-(2-пиридинил)-1Н-бензимидазол-6-ил]-N,N-диметилацетамид
Стадия 1. Получение (5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-6-ил)уксусной кислоты или (6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)уксусной кислоты:
10 мл 5 н. водного раствора гидроксида натрия добавляли к раствору 1,04 г цианосоединения, полученного в примере 127 (стадия 1), в этаноле (15 мл) и перемешивали в течение ночи при 70°C. Этанол выпаривали при пониженном давлении, остаток разбавляли хлороформом и при охлаждении на льду к реакционному раствору добавляли водный 10% раствор лимонной кислоты, таким образом, делая его слабокислым. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат), получая 631 мг аморфного вещества желтого цвета.
Стадия 2. Получение целевого соединения:
8,7 мг 1-гидроксибензотриазола и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида добавляли к раствору 17,7 мг полученной карбоновой кислоты в хлороформе (1 мл), а затем добавляли 48 мкл раствора 2,0М диметиламина в тетрагидрофуране и перемешивали при комнатной температуре в течение 1,5 часов. При охлаждении на льду добавляли воду и органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 20/1), получая 10,8 г аморфного вещества желтого цвета.
Используя 10,8 мг полученного аморфного вещества, 8,6 мг целевого соединения получали в виде бесцветного аморфного вещества тем же способом, как в примере 127 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 2,90 (3H×1/2, c), 2,91 (3H×1/2, c), 2,98 (3H, c), 3,11 (2H, кв, J=7,4 Гц), 3,73 (2H×1/2, c), 3,74 (2H×1/2, c), 7,08 (2H, д, J=9,0 Гц), 7,12 (1Н×1/2, c), 7,37-7,40 (1Н, м), 7,44 (1Н×1/2, c), 7,55 (1Н×1/2, c), 7,77 (1Н×1/2, c), 7,80-7,89 (1Н, м), 7,82 (2H, д, J=9,0 Гц), 8,36-8,42 (1Н, м), 8,61-8,65 (1Н, м), 10,88 (1Н×1/2, уш.с), 10,94 (1Н×1/2, уш.с).
ESI-MASS (m/e): 465 (M+H).
Пример 130
Метил [5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]ацетат
80 мкл (триметилсилил)диазометана добавляли к раствору 27,8 мг карбоновой кислоты, полученной в примере 129 (стадия 1), в смеси 500 мкл тетрагидрофурана и 500 мкл метанола и перемешивали в течение 1 часа. Затем добавляли 80 мкл (триметилсилил)диазометана и перемешивали в течение 30 минут. Растворитель выпаривали при пониженном давлении, остаток разбавляли этилацетатом и добавляли насыщенный водный раствор гидрокарбоната натрия. Экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 20/1), получая 11,9 мг соединения SEM.
Используя 10,8 мг полученного соединения SEM, 7,4 мг целевого соединения получали тем же способом, как в примере 127 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 3,12 (2H, кв, J=7,4 Гц), 3,57 (3H×1/2, c), 3,58 (3H×1/2, c), 3,72 (2H, c), 7,09 (2H, д, J=9,0 Гц), 7,10 (1Н×1/2, c), 7,38-7,42 (1Н, м), 7,47 (1Н×1/2, c), 7,50 (1Н×1/2, c), 7,83 (1Н×1/2, c), 7,83 (2H, д, J=9,0 Гц), 7,86-7,91 (1Н, м), 8,38-8,43 (1Н, м), 8,62-8,67 (1Н, м), 10,82 (1Н, уш.с).
ESI-MASS (m/e): 452 (M+H).
Пример 131
5-[4-(Этилсульфонил)фенокси]-6-(2-оксо-2-(1-пирролидинил)этил)-2-(2-пиридинил]-1Н-бензимидазол
Используя пирролидин, целевое соединение получали тем же способом, как в примере 129 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 1,72-1,89 (4H, м), 3,11 (2H, кв, J=7,4 Гц), 3,38 (4H, т, J=6,7 Гц), 3,68 (2H×1/2, c), 3,69 (2H×1/2, c), 7,06 (2H×1/2, д, J=9,0 Гц), 7,06 (2H×1/2, д, J=9,0 Гц), 7,09 (1Н×1/2, c), 7,36-7,40 (1Н, м), 7,43 (1Н×1/2, c), 7,60 (1Н×1/2, c), 7,79-7,89 (3H, м), 7,81 (1Н×1/2, c), 8,36 (1Н×1/2, д, J=8,2 Гц), 8,40 (1Н×1/2, д, J=8,2 Гц), 8,61-8,65 (1Н, м), 10,78 (1Н×1/2, уш.с), 10,90 (1Н×1/2, уш.с).
ESI-MASS (m/e): 491 (М+Н).
Пример 132
N,N-Диэтил-2-[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]ацетамид
Используя N,N-диэтиламин, целевое соединение получали тем же способом, как в примере 129 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 0,98 (3H×1/2, т, J=5,9 Гц), 1,00 (3H×1/2, т, J=5,9 Гц), 1,05 (3H, т, J=7,0 Гц), 1,24 (3H, т, J=7,4 Гц), 3,07 (2H, кв, J=7,4 Гц), 3,22-3,32 (4H, м), 3,67 (2H×1/2, c), 3,69 (2H×1/2, c), 7,04 (2H, д, J=9,0 Гц), 7,05 (1Н×1/2, c), 7,32-7,37 (1Н, м), 7,40 (1Н×1/2, c), 7,51 (1Н×1/2, c), 7,77 (2H, д, J=9,0 Гц), 7,79 (1Н×1/2, c), 7,83 (1Н, т, J=8,0 Гц), 8,33 (1Н×1/2, д, J=8,0 Гц), 8,36 (1Н×1/2, д, J=8,0 Гц), 8,57-8,61 (1Н, м), 10,76 (1Н×1/2, уш.с), 10,86 (1Н×1/2, уш.с).
ESI-MASS (m/e): 493 (M+H).
Пример 133
6-(2-(1-Азетидинил)-2-оксоэтил)-5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол
Используя гидрохлорид азетидина и диизопропилэтиламин, целевое соединение получали тем же способом, как в примере 129 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 2,11-2,21 (2H, м), 3,12 (2H, кв, J=7,4 Гц), 3,47 (2H×1/2, c), 3,49 (2H×1/2, c), 3,88-3,94 (2H, м), 4,03-4,08 (2H, м), 7,07-7,11 (2H, 1Н×1/2, м), 7,37-7,41 (1Н, м), 7,43 (1Н×1/2, c), 7,63 (1Н×1/2, c), 7,82-7,90 (2H, 1Н, 1Н×1/2, м), 8,36 (1Н×1/2, д, J=7,8 Гц), 8,40 (1Н×1/2, д, J=7,8 Гц), 8,62-8,66 (1Н, м), 10,78 (1Н, уш.с), 10,90 (1Н, уш.с).
ESI-MASS (m/e): 477 (M+H).
Пример 134
2-[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]-N-метилацетамид
Используя гидрохлорид метиламина и диизопропилэтиламин, целевое соединение получали тем же способом, как в примере 129 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 2,70 (3H×1/2, c), 2,72 (3H×1/2, c), 3,11 (2H, кв, J=7,4 Гц), 3,59 (2H×1/2, c), 3,62 (2H×1/2, c), 5,52 (1Н×1/2, уш.с), 5,59 (1Н×1/2, уш.с), 7,05 (2H×1/2, д, J=8,6 Гц), 7,07 (2H×1/2, д, J=8,6 Гц), 7,15 (1Н×1/2, c), 7,39-7,43 (1Н, м), 7,48 (1Н×1/2, c), 7,56 (1Н×1/2, c), 7,83 (2H, д, J=8,6 Гц), 7,87-7,91 (1Н, м), 7,88 (1Н×1/2, c), 8,37-8,42 (1Н, м), 8,63-8,67 (1Н, м), 10,81 (1Н×1/2, уш.с), 10,85 (1Н×1/2, уш.с).
ESI-MASS (m/e): 451 (M+H).
Пример 135
2-[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этанол
Стадия 1. Получение 2-(5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)этанола или 2-(6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)этанола:
При охлаждении на льду 43 мг 1,1'-бискарбонил-1Н-имидазола добавляли к раствору 100 мг карбоновой кислоты, полученной в примере 129 (стадия 1), в тетрагидрофуране (2 мл) и перемешивали при комнатной температуре в течение 2,5 часов. При охлаждении на льду полученную реакционную смесь по каплям добавляли к 1,5 мл водного раствора 34 мг боргидрида натрия и перемешивали в течение 5 минут. Смесь нейтрализовали 10% лимонной кислотой, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол), получая 95,3 мг спиртового соединения.
Стадия 2. Получение 2-[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этанола:
9,0 мг полученного спиртового соединения растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1,5 часов. Растворитель выпаривали и остаток разбавляли хлороформом и нейтрализовали насыщенным водным раствором гидрокарбоната натрия. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 9,0 мг трифторацетата. Карбонат калия добавляли к раствору 9,0 мг трифторацетата в метаноле (1 мл) и перемешивали при комнатной температуре в течение 30 минут. Смесь разбавляли хлороформом и добавляли насыщенный водный раствор хлорида аммония, экстрагировали хлороформом и органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 6,6 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3, 2 капли CD3OD) δ: 1,30 (3H, т, J=7,4 Гц), 2,89-2,93 (2H, м), 3,12 (2H, кв, J=7,4 Гц), 3,85-3,89 (2H, м), 7,05 (2H, д, J=8,6 Гц), 7,16 (1Н×1/2, c), 7,39-7,44 (1Н, м), 7,41 (1Н×1/2, c), 7,53 (1Н×1/2, c), 7,79 (1Н×1/2, c), 7,82 (2H, д, J=8,6 Гц), 7,88-7,93 (1Н, м), 8,37-8,41 (1Н, м), 8,62-8,67 (1Н, м), пики NH и О невидимы.
ESI-MASS (m/e): 424 (M+H).
Пример 136
1-(2-[5-[4-(Этилсульфонил)фенокси]-2-пиридинил)-1Н-бензимидазол-6-ил]этил)пирролидин-2,5-дион
10,7 мг сукцинимида и 28,3 мг трифенилфосфина добавляли к раствору 20 мг спиртового соединения, полученного в примере 135 (стадия 1), в тетрагидрофуране (1 мл) и при охлаждении на льду добавляли 42 мкл диэтилазодикарбоксилата (40% раствор в толуоле) и перемешивали при комнатной температуре в течение 30 минут. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол) и разделяющей ЖХ с обратной фазой, получая 14,8 мг желтого масла.
14,8 мг полученного масла растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали, остаток разбавляли хлороформом и нейтрализовали насыщенным водным раствором гидрокарбоната натрия. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 11 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3) δ: 1,29 (3H×1/2, т, J=7,2 Гц), 1,30 (3H×1/2, т, J=7,2 Гц), 2,63 (4H×1/2, c), 2,65 (4H×1/2, c), 2,90-2,96 (2H, м), 3,11 (2H×1/2, кв, J=7,2 Гц), 3,12 (2H×1/2, кв, J=7,2 Гц), 3,79-3,83 (2H, м), 7,12 (2Н×1/2, д, J=8,6 Гц), 7,17 (2H×1/2, д, J=9,0 Гц), 7,37-7,42 (1Н, м), 7,46 (1Н×1/2, c), 7,48 (1Н×1/2, c), 7,65 (1Н×1/2, c), 7,82-7,89 (1Н, м), 7,83 (2H×1/2, д, J=8,6 Гц), 7,86 (2H×1/2, д, J=9,0 Гц), 7,89 (1Н×1/2, c), 8,36-8,40 (1Н, м), 8,62-8,67 (1Н, м), 10,54 (1Н, уш.с).
ESI-MASS (m/e): 505 (M+H).
Пример 137
1-(2-[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этил)-2-пирролидинон
Стадия 1. Получение (5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-6-ил)ацетальдегида или (6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-5-ил)ацетальдегида:
300 мкл триэтиламина и 120 мг комплекса триоксид серы/пиридин добавляли к раствору 28,9 мг спиртового соединения, предварительно полученного в примере 135 (стадия 1), в диметилсульфоксиде (1 мл) и перемешивали при комнатной температуре в течение 5 минут. Добавляли воду, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей жидкостной хроматографией с обратной фазой, получая 11,7 мг целевого соединения в виде бесцветного аморфного вещества.
Стадия 2. Получение 1-(2-[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]этил)-2-пирролидинона:
6,6 мг гидрохлорида метил 4-аминобутаноата добавляли к раствору 11,7 мг полученного альдегида в тетрагидрофуране (1 мл) и перемешивали при комнатной температуре в течение 10 минут. Затем добавляли 106 мкл раствора 0,25М комплекса цианоборат натрия-1/2-хлорид цинка и перемешивали при комнатной температуре в течение 1 часа. При охлаждении на льду добавляли насыщенный водный раствор гидрокарбоната натрия, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 4,4 мг бесцветного аморфного вещества.
100 мкл 5 н. водного раствора гидроксида натрия добавляли к раствору 4,4 мг аморфного вещества в смеси 250 мкл тетрагидрофурана и 250 мкл метанола и перемешивали при комнатной температуре в течение 45 минут. При охлаждении на льду смесь нейтрализовали 10% лимонной кислотой, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток растворяли в 500 мкл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 2,5 часов. Растворитель выпаривали и остаток разбавляли хлороформом и нейтрализовали насыщенным водным раствором гидрокарбоната натрия. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 3,3 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3) δ: 1,30 (3Н, т, J=7,6 Гц), 1,90-1,98 (2H, м), 2,30-2,38 (2H, м), 2,87 (2H, т, J=7,0 Гц), 3,12 (2H, кв, J=7,6 Гц), 3,20-3,29 (2H, м), 3,57 (2H, т, J=7,0 Гц), 7,09 (2H, д, J=8,6 Гц), 7,11 (1Н×1/2, c), 7,12 (2H, д, J=8,6 Гц), 7,37-7,42 (1Н, м), 7,48 (1Н×1/2, c), 7,52 (1Н×1/2, c), 7,73 (1Н×1/2, c), 7,82-7,90 (3H, м), 8,37-8,41 (1Н, м), 8,62-8,68 (1Н, м), 10,64 (1Н×1/2, уш.с), 10,71 (1Н×1/2, уш.с).
ESI-MASS (m/e): 491 (М+Н).
Пример 138
2-[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]-N-метокси-N-метилацетамид
Используя гидрохлорид N,О-диметилгидроксиламина и диизопропилэтиламин, целевое соединение получали тем же способом, как в примере 129 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 3,11 (2H, кв, J=7,6 Гц), 3,12 (3H×1/2, c), 3,13 (3H×1/2, c), 3,58 (3H×1/2, c), 3,60 (3H×1/2, c), 3,84 (2H, c), 7,09 (1Н×1/2, c), 7,10 (2H, д, J=8,6 Гц), 7,36-7,40 (1Н, м), 7,45 (1Н×1/2, c), 7,53 (1Н×1/2, c), 7,80-7,85 (1Н×1/2, м(с)), 7,82 (2H×1/2, д, J=8,6 Гц), 7,83 (2H×1/2, д, J=8,6 Гц), 7,85-7,90 (1Н, м), 8,36-8,42 (1Н, м), 8,62-8,66 (1Н, м), 10,76 (1Н, уш.с).
ESI-MASS (m/e): 481 (M+H).
Пример 139
1-[5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]ацетон
При охлаждении на льду 14 мкл раствора 3,0М метилмагнийбромида в тетрагидрофуране добавляли к раствору 8,7 мг соединения, полученного в примере 138, в тетрагидрофуране (500 мкл) и перемешивали при комнатной температуре в течение 30 минут, затем добавляли 14 мкл раствора 3,0М метилмагнийбромида в тетрагидрофуране и перемешивали при комнатной температуре в течение 5 минут. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделением с помощью тонкослойной хроматографии (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 20/1), получая 4,0 мг целевого соединения.
1Н-ЯМР (CDCl3) δ: 1,30 (3H, т, J=7,4 Гц), 2,16 (3H, c), 3,12 (2H, кв, J=7,4 Гц), 3,78 (2H, c), 7,09 (2H, д, J=8,6 Гц), 7,12 (1Н×1/2, c), 7,37-7,44 (1Н, м), 7,43 (1Н×1/2, c), 7,47 (1Н×1/2, c), 7,74 (1Н×1/2, c), 7,84 (2H×1/2, д, J=8,6 Гц), 7,85 (2H×1/2, д, J=8,6 Гц), 7,85-7,91 (1Н, м), 8,36-8,42 (1Н, м), 8,63-8,67 (1Н, м), 10,68 (1Н, уш.с).
ESI-MASS (m/e): 436 (M+H).
Пример 140
5-[4-(Этилсульфонил)фенокси]-6-((5-метил-1,2,4-оксадиазол-3-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол
8 мкл водного 50% раствора гидроксиламина добавляли к раствору 33 мг цианосоединения, полученного в примере 127 (стадия 1), в этаноле (1 мл) и перемешивали в течение ночи. После концентрации 6 мкл ацетангидрида добавляли к раствору полученного остатка в уксусной кислоте (500 мкл) и перемешивали при комнатной температуре в течение 1 часа, а затем при 70°C в течение 5 часов. После концентрации остаток растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали, остаток разбавляли хлороформом и нейтрализовали насыщенным водным раствором гидрокарбоната натрия. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделением с помощью жидкостной хроматографии с обратной фазой и разделяющей тонкослойной хроматографии (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 15/1), получая 9,1 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,2 Гц), 2,48 (3H×1/2, c), 2,49 (3H×1/2, c), 3,11 (2H, кв, J=7,2 Гц), 4,12 (2H, c), 7,06 (2H, д, J=8,2 Гц), 7,14 (1Н×1/2, c), 7,37-7,43 (1Н, м), 7,49 (1Н×1/2, c), 7,55 (1Н×1/2, c), 7,78 (1Н×1/2, c), 7,82 (2H, д, J=8,2 Гц), 7,86-7,90 (1Н, м), 8,37-8,41 (1Н, м), 8,62-8,66 (1Н, м), 10,70 (1Н, уш.с).
ESI-MASS (m/e): 476 (M+H).
Пример 141
5-[4-(Этилсульфонил)фенокси]-2-(2-пиридинил)-6-(2H-тетразол-5-илметил)-1Н-бензимидазол (трифторацетат)
Стадия 1. Получение 5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-6-(2H-тетразол-5-илметил)-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазола или 6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-6-(2H-тетразол-5-илметил)-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазола:
162 мкл триметилсилилазида и 30,4 мг оксида дибутилолова добавляли к раствору 35 мг цианосоединения, полученного в примере 127 (стадия 1), в толуоле (3 мл) и в течение ночи нагревали с обратным холодильником. Растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол), получая 160 мг аморфного вещества K желтого цвета.
Стадия 2. Получение 5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-6-(2H-тетразол-5-илметил)-1H-бензимидазола (трифторацетата):
13,3 г полученного аморфного вещества желтого цвета растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1,5 часов. Растворитель выпаривали при пониженном давлении и остаток очищали разделяющей жидкостной хроматографией с обратной фазой, получая 11,1 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CD3OD) δ: 1,23 (3H, т, J=7,4 Гц), 3,19 (2H, кв, J=7,4 Гц), 4,48 (2H, c), 7,07 (2H, д, J=9,0 Гц), 7,41 (1Н, c), 7,63 (1Н, дд, J=8,2, 4,7 Гц), 7,84 (2H, д, J=9,0 Гц), 7,95 (1Н, c), 8,09 (1Н, тд, J=8,2, 1,6 Гц), 8,30 (1Н, д, J=8,2 Гц), 8,84 (1Н, д, J=4,7 Гц).
ESI-MASS (m/e): 462 (M+H).
Пример 142
5-[4-(Этилсульфонил)фенокси]-6-((2-метил-2H-тетразол-5-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол
Стадия 1. Получение 5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-6-(2-метил-2H-тетразол-5-илметил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола или (6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-6-(2-метил-2Н-тетразол-5-илметил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазола:
12,5 мг трет-бутоксида калия и 13,3 мг йодометана добавляли к раствору 50 мг тетразола, полученного в примере 141 (стадия 1), в N,N-диметилформамиде (1 мл) и перемешивали при комнатной температуре в течение 1 часа. Добавляли 12,5 мг трет-бутоксида калия и перемешивали при комнатной температуре в течение 30 минут. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 15/1), получая 15,0 мг соединения низкой полярности (целевое соединение) и 17,5 мг соединения высокой полярности в виде бесцветного аморфного вещества.
Стадия 2. Получение 5-[4-(этилсульфонил)фенокси]-6-((2-метил-2H-тетразол-5-ил)метил)-2-(2-пиридинил)-1Н-бензимидазола:
Используя 15 мг полученного соединения низкой полярности, целевое соединение получали тем же способом, как в примере 127 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H×1/2, т, J=7,4 Гц), 1,30 (3H×1/2, т, J=7,4 Гц), 3,11 (2H×1/2, кв, J=7,4 Гц), 3,11 (2H×1/2, кв, J=7,4 Гц), 4,18 (3H×1/2, c), 4,21 (3H×1/2, c), 4,31 (2H, c), 7,00 (2H×1/2, д, J=8,6 Гц), 7,02 (2H×1/2, д, J=8,6 Гц), 7,17 (1Н×1/2, c), 7,37-7,42 (1Н, м), 7,49 (1Н×1/2, c), 7,59 (1Н×1/2, c), 7,77 (2H×1/2, д, J=8,6 Гц), 7,80 (2H×1/2, д, J=8,6 Гц), 7,81 (1Н×1/2, c), 7,85-7,91 (1Н, м), 8,36-8,41 (1Н, м), 8,62-8,67 (1Н, м), 10,58 (1Н, уш.с).
ESI-MASS (m/e): 476 (M+H).
Пример 143
5-[4-(Этилсульфонил)фенокси]-6-((1-метил-1Н-тетразол-5-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол
Используя 17,5 мг соединения высокой полярности, полученного в примере 142 (стадия 1), целевое соединение получали тем же способом, как в примере 127 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,4 Гц), 3,13 (2H, кв, J=7,4 Гц), 3,90 (3H×1/2, c), 3,91 (3H×1/2, c), 4,34 (2H, c), 7,02 (2H×1/2, д, J=8,6 Гц), 7,05 (2H×1/2, д, J=8,6 Гц), 7,17 (1Н×1/2, c), 7,39-7,43 (1Н, м), 7,46 (1Н×1/2, c), 7,48 (1Н×1/2, c), 7,70 (1Н×1/2, c), 7,84 (2H, д, J=8,6 Гц), 7,85-7,91 (1Н, м), 8,35-8,40 (1Н, м), 8,63-8,67 (1Н, м), 10,65 (1Н, уш.с).
ESI-MASS (m/e): 476 (M+H).
Пример 144
5-[4-(Этилсульфонил)фенокси]-6-(1-(1-метил-1Н-тетразол-5-ил]метил)-2-(2-пиридинил)-1Н-бензимидазол
При охлаждении на льду 7,1 мг гидрида натрия и 20 мг йодометана добавляли к раствору 64 мг тетразола, полученного в примере 141 (стадия 1), в N,N-диметилформамиде (2 мл) и перемешивали при комнатной температуре в течение 2 часов. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 15/1), получая 10,0 мг аморфного вещества светло-желтого цвета. 10,0 мг аморфного вещества светло-желтого цвета растворяли в 1 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали, остаток разбавляли хлороформом и нейтрализовали насыщенным водным раствором гидрокарбоната натрия. Экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 10/1), получая 7,1 мг целевого соединения в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3) δ: 1,31 (3H, т, J=7,4 Гц), 1,81 (3H×1/2, д, J=7,2 Гц), 1,84 (3H×1/2, д, J=6,8 Гц), 3,14 (2H, кв, J=7,4 Гц), 3,74 (3H×1/2, c), 3,79 (3H×1/2, c), 4,60-4,75 (1Н, м), 7,03-7,13 (2H, м), 7,16 (1Н×1/2, c), 7,37-7,44 (1Н, м), 7,39 (1Н×1/2, c), 7,48 (1Н×1/2, c), 7,71 (1Н×1/2, c), 7,75-7,91 (3H, м), 8,32-8,42 (1Н, м), 8,58-8,70 (1Н, м), 10,63 (1Н×1/2, уш.с), 10,66 (1Н×1/2, уш.с).
ESI-MASS (m/e): 490 (M+H).
Пример 145
N-[{6-[(4-Этилсульфонил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол-4-ил}метил]метансульфонамид
Используя продукт, полученный в примере 70 (стадия 7), целевое соединение получали тем же способом, как в примере 31, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, кв, J=10,6 Гц), 2,83 (3H, c), 3,10 (2H, т, J=10,6 Гц), 4,74 (2H, д, J=6,3 Гц), 6,34 (1Н, c), 6,98 (1Н, c), 7,08 (2H, д, J=6,3 Гц), 7,18 (1Н, c), 7,48-7,42 (1Н, м), 7,90-7,85 (3H, м), 8,37 (1Н, д, J=7,4 Гц), 8,64 (1Н, д, J=5,1 Гц), 10,64 (1Н, уш.с).
ESI-MASS (m/e): 487 (M+H).
Пример 146
3-[{6-[4-Этилсульфонил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол-4-ил}метил]-1,3-оксазолидин-2-он
Используя продукт, полученный в примере 70 (стадия 7), целевое соединение получали тем же способом, как в примере 3, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 3,11 (2H, кв, J=7,4 Гц), 3,62-3,57 (2H, м), 4,35-4,33 (2H, м), 4,67 (2H, c), 6,91 (1Н, c), 7,09 (2H, д, J=8,6 Гц), 7,37-7,35 (1Н, м), 7,52 (1Н, c), 7,84-7,82 (3H, м), 8,34 (1Н, д, J=8,2 Гц), 8,74 (1Н, д, J=3,9 Гц), 11,72 (1Н, уш.с).
ESI-MASS (m/e): 479 (M+H).
Пример 147
1-[{6-[4-Этилсульфонил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол-4-ил}метил]пиперидин-2-он
Используя продукт, полученный в примере 70 (стадия 7), целевое соединение получали тем же способом, как в примере 6, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 1,77-1,70 (4H, м), 2,51 (2H, м), 3,11 (2H, кв, J=7,4 Гц), 3,34-3,32 (2H, м), 4,76 (2H, c), 6,90-6,98 (1Н, м), 7,08 (2H, д, J=8,8 Гц), 7,36-7,34 (1Н, м), 7,51-7,50 (1Н, м), 7,83-7,82 (3H, м), 8,34 (1Н, д, J=7,8 Гц), 8,78 (1Н, д, J=5,1 Гц), 12,13 (1Н, уш.с).
ESI-MASS (m/e): 491(М+Н).
Пример 148
6-[4-(Этилсульфонил)фенокси]-4-(3-фторбензил)-2-пиридин-2-ил-1Н-бензимидазол
Используя альдегидное соединение, полученное в примере 76 (стадия 1), и 3-фторфенилмагнийбромид, целевое соединение получали тем же способом, как в примере 76 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,26-1,23 (3H, м), 3,11-2,92 (2H, м), 4,23 (1Н, c), 4,44 (1Н, c), 6,72 (1/2Н, c), 6,89-6,86 (2H, м), 7,12-7,02 (5H, м), 7,35-7,33 (1Н, м), 7,84-7,75 (4H, м), 8,43 (1/2Н, д, J=8,6 Гц), 8,58-8,54 (1Н, м), 10,66 (1Н, уш.с).
ESI-MASS (m/e): 488 (M+H).
Пример 149
4-(3,4-Дифторбензил)-6-[4-(этилсульфонил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол
Используя альдегидное соединение, полученное в примере 76 (стадия 1), и 3,4-дифторфенилмагнийбромид, целевое соединение получали тем же способом, как в примере 76 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28-1,22 (3H, м), 3,11-3,05 (2H, м), 4,11 (1Н, c), 4,39 (1Н, c), 6,72 (1Н, c), 7,06-7,03 (5H, м), 7,40-7,35 (2H, м), 7,85-7,78 (3H, м), 8,41 (1Н, c), 8,60-8,54 (1Н, м), 10,59 (1Н, уш.с).
ESI-MASS (m/e): 506 (M+H).
Пример 150
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он
Стадия 1. Получение (6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил)метанола и (5-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-ил)метанола:
Используя 6-(этилсульфонил)-3-пиридинол, полученный в ссылочном примере 4, целевое соединение получали тем же способом, как в примере 70 (стадии 2-7), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 1-[(6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-она:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,6 Гц), 2,05-1,97 (2H, м), 2,48-2,46 (2H, м), 3,39-3,36 (4H, м), 4,64 (2H, c), 6,89 (1Н, д, J=1,6 Гц), 7,36-7,34 (2H, м), 7,49 (1Н, c), 7,82 (1Н, т, J=7,0 Гц), 7,98 (1Н, д, J=8,6 Гц), 8,33 (1Н, д, J=7,8 Гц), 8,46 (1Н, д, J=2,7 Гц), 8,75-8,73 (1Н, м).
ESI-MASS (m/e): 478 (M+H).
Пример 151
4-({6-[4-(Этилсульфонил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол-4-ил}метил)морфолин-3-он
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 81, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,26 (3H, т, J=7,4 Гц), 3,08 (2H, кв, J=7,4 Гц), 3,40 (2H, c), 3,82-3,80 (2H, м), 4,26 (2H, c), 4,77 (2H, c), 6,89 (1Н, c), 7,07-7,05 (2H, м), 7,35-7,33 (1Н, м), 7,51 (1Н, c), 7,81 (3H, д, J=9,0 Гц), 8,33 (1Н, д, J=7,4 Гц), 8,76-8,73 (1Н, м), 11,93 (1Н, уш.с).
ESI-MASS (m/e): 493 (M+H).
Пример 152
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пиридин-2(1Н)-он
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 5, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,26 (3H, т, J=8,6 Гц), 3,39-3,32 (2H, м), 5,36 (2H, c), 6,26 (1Н, т, J=6,8 Гц), 6,75 (1Н, д, J=9,0 Гц), 7,03 (1Н, д, J=2,0 Гц), 7,36-7,34 (3H, м), 7,43 (1Н, д, J=6,7 Гц), 7,51 (1Н, д, J=2,0 Гц), 7,86-7,78 (1Н, м), 7,99-7,95 (1Н, м), 8,31 (1Н, д, J=7,8 Гц), 8,47 (1Н, д, J=2,7 Гц), 8,77 (1Н, д, J=4,7 Гц), 12,49 (1Н, c).
ESI-MASS (m/e): 488 (M+H).
Пример 153
6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-4-[(пиридин-2-илокси)метил]-1Н-бензимидазол
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 5, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30-1,22 (3H, м), 3,36 (2H, кв, J=7,6 Гц), 5,68 (2H, c), 6,82 (1Н, д, J=8,2 Гц), 6,97-6,95 (1Н, м), 7,12 (1Н, c), 7,37-7,34 (2H, м), 7,51 (1Н, c), 7,62-7,60 (1Н, м), 7,85-7,83 (1Н, м), 7,97 (1Н, д, J=8,6 Гц), 8,35 (1Н, д, J=7,8 Гц), 8,43-8,42 (1Н, м), 8,49-8,48 (1Н, м), 8,70 (1Н, д, J=5,1 Гц), 12,27 (1Н, с).
ESI-MASS (m/e): 488 (M+H).
Пример 154
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-3-метилпирролидин-2-он
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 10, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28-1,23 (6H, м), 1,64-1,55 (1Н, м), 2,18-2,14 (1Н, м), 2,43-2,34 (1Н, м), 2,58-2,50 (1Н, м), 3,36 (2H, кв, J=7,4 Гц), 3,61 (1Н, м), 4,40 (1Н, д, J=14,9 Гц), 4,89 (1Н, д, J=14,9 Гц), 6,88 (1Н, c), 7,34-7,32 (2H, м), 7,48 (1Н, c), 7,82-7,80 (1Н, м), 7,98 (1Н, д, J=8,6 Гц), 8,34 (1Н, д, J=10,4 Гц), 8,45-8,44 (1Н, м), 8,77-8,74 (1Н, м), 12,12 (1Н, уш.с).
ESI-MASS (m/e): 492 (M+H).
Пример 155
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-1Н-имидазол-4,5-дикарбонитрил
Используя спиртовое соединение, полученное в примере 150 (стадия 1), и 4,5-дицианоимидазол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 3,37 (2H, кв, J=7,4 Гц), 5,66 (2H, c), 7,12 (1Н, д, J=2,0 Гц), 7,32 (1Н, д, J=2,0 Гц), 7,40 (1Н, дд, J=8,6, 2,7 Гц), 7,49-7,47 (1Н, м), 7,99-7,97 (1Н, м), 8,03 (1Н, д, J=8,6 Гц), 8,22 (1Н, c), 8,42 (1Н, с, J=8,2 Гц), 8,47 (1Н, м), 8,64-8,63 (1Н, м).
ESI-MASS (m/e): 511 (M+H).
Пример 156
1-{1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-1Н-пиррол-3-ил}этанон
Используя спиртовое соединение, полученное в примере 150 (стадия 1), и 3-ацетилпиррол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,27 (3H, т, J=7,4 Гц), 2,36 (3H, c), 3,35 (2H, кв, J=7,4 Гц), 5,55 (2H, c), 6,57 (1Н, c), 6,67 (1Н, c), 6,80 (1Н, c), 7,12 (1Н, c), 7,36-7,32 (2H, м), 7,48 (1Н, c), 7,88-7,86 (1Н, м), 7,97 (1Н, д, J=8,6 Гц), 8,42-8,39 (2H, м), 8,60 (1Н, c), 10,95 (1Н, с).
ESI-MASS (m/e): 502 (M+H).
Пример 157
1-{1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-1Н-пиррол-2-ил}этанон
Используя спиртовое соединение, полученное в примере 150 (стадия 1), и 2-ацетилпиррол, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30-1,22 (3H, м), 2,39 (1Н, c), 2,54 (2H, c), 3,39-3,32 (2H, м), 5,81 (1Н, c), 6,08 (1Н, c), 6,15-6,14 (1/2Н, c), 6,21-6,20 (1/2Н, c), 6,61 (1/2Н, c), 6,97-6,95 (1Н, м), 7,07-7,02 (2H, м), 7,38-7,30 (2H, м), 7,47 (1/2Н, c), 7,88-7,80 (1Н, м), 7,96-7,94 (1Н, м), 8,31 (1Н, д, J=7,4 Гц), 8,38-8,37 (1/2Н, c), 8,46-8,43 (1Н, м), 8,60-8,59 (1/2Н, м), 8,70-8,69 (1/2Н, c), 10,62 (1/2Н, уш.с), 11,61 (1/2Н, уш.с).
ESI-MASS (m/e): 502 (M+H).
Пример 158
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-5-метилпирролидин-2-он
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 9, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,21-1,20 (3H, м), 1,28 (3H, т, J=7,4 Гц), 1,63-1,56 (1Н, м), 2,24-2,23 (1Н, м), 2,56-2,54 (1Н, м), 3,36-3,31 (4H, м), 4,36 (2H, c), 6,89 (1Н, м), 7,36-7,34 (2H, м), 7,49 (1Н, c), 7,83-7,80 (1Н, м), 7,99 (1Н, д, J=8,6 Гц), 8,33 (1Н, д, J=7,8 Гц), 8,46-8,45 (1Н, м), 8,84-8,75 (1Н, м).
ESI-MASS (m/e): 492 (M+H).
Пример 159
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-1Н-имидазол-2-карбонитрил
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 82, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,4 Гц), 3,36 (2H, кв, J=7,4 Гц), 5,72 (2H, c), 6,95 (1Н, c), 7,14 (1Н, c), 7,18 (1Н, c), 7,34 (1Н, дд, J=8,6, 2,7 Гц), 7,40-7,38 (1Н, м), 7,46 (1Н, c), 7,89 (1Н, т, J=7,8 Гц), 8,00 (1Н, д, J=8,6 Гц), 8,44-8,43 (2H, м), 8,61-8,60 (1Н, м), 11,09 (1Н, уш.с).
ESI-MASS (m/e): 486 (M+H).
Пример 160
6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-4-[(2-фторпиридин-3-ил)метил]-2-пиридин-2-ил-1Н-бензимидазол
Стадия 1. Получение 6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-4-карбальдегида и 5-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-(2-пиридил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-карбальдегида:
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 64 (стадия 1), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение (6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил)(2-фторпиридин-3-ил)метанола или (5-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-ил)(2-фторпиридин-3-ил)метанола:
При -78°C 0,80 мл нормального бутиллития (1,5М раствор в гексане) добавляли к раствору 169 мкл диизопропиламина в тетрагидрофуране (1 мл) и, при охлаждении на льду, перемешивали в течение 30 минут, получая литийдиизопропиламин. При -78°C добавляли 103 мкл 2-фторпиридина и перемешивали в течение 3 часов при этой температуре. При -78°C раствор 130 мг альдегида, полученного на стадии 1, в тетрагидрофуране (2 мл) добавляли к указанной реакционной жидкости и перемешивали в течение приблизительно 1 часа, поддерживая ту же температуру. Насыщенный водный раствор хлорида аммония добавляли к реакционной жидкости и экстрагировали этилацетатом. Органический слой высушивали, растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 2/1), получая 106 мг (6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил)(2-фторпиридин-3-ил)метанола в виде оранжевого масла.
Стадия 3. Получение 6-{[6-(этилсульфонил)пиридин-3-ил]окси}-4-[(2-фторпиридин-3-ил)метил]-2-пиридин-2-ил-1Н-бензимидазола:
При комнатной температуре 8,2 мкл тионилхлорида добавляли к раствору 24 мг спиртового соединения, полученного на стадии 2, в хлороформе (0,5 мл) и перемешивали в течение 30 минут. Растворитель выпаривали при пониженном давлении, получая сырой продукт. 12 мг цинка добавляли к раствору этого сырого продукта в трифторуксусной кислоте (0,7 мл) и перемешивали при 100°C в течение 30 минут. После возврата к комнатной температуре смесь фильтровали через Целит (растворитель для элюирования: хлороформ, метанол), растворитель выпаривали при пониженном давлении, остаток промывали насыщенным водным раствором гидрокарбоната натрия, высушивали, растворитель выпаривали при пониженном давлении и остаток очищали тонкослойной хроматографией на колонках (проявляющий растворитель: хлороформ/метанол = 9/1), получая 3,5 г целевого соединения в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,6 Гц), 3,35 (2H, кв, J=7,6 Гц), 4,25 (1Н, c), 4,46 (1Н, c), 6,86-6,82 (1Н, м), 7,10-7,08 (2H, м), 7,35-7,32 (2H, м), 7,87-7,85 (2H, м), 7,98 (1Н, д, J=8,6 Гц), 8,10-8,04 (1Н, м), 8,43-8,40 (2H, м), 8,62-8,60 (1Н, м), 10,53 (1Н, уш.с).
ESI-MASS (m/e): 490 (M+H).
Пример 161
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он
Стадия 1. Получение метил 2-амино-5-[{[6-(этилсульфонил)пиридин-2-ил]окси}бензоата:
Используя 6-(этилсульфонил)-3-пиридинол, полученный в ссылочном примере 4, целевое соединение получали тем же способом, как в примере 70 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение метил 5-{[6-(этилсульфонил)пиридин-3-ил]окси}-3-нитро-2-[(пиразин-2-илкарбонил)амино]бензоата:
4,7 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида добавляли к раствору 5,5 г метил 2-амино-5-[{[6-(этилсульфонил)пиридин-3-ил]окси}бензоата и 2,4 г пиразин-2-карбоновой кислоты в пиридине (150 мл) и перемешивали при комнатной температуре в течение 6 часов. Растворитель выпаривали при пониженном давлении, добавляли к остатку хлороформ и органический слой промывали водным 0,25 н. раствором соляной кислоты, водным 0,25 н. раствором гидроксида натрия и насыщенным солевым раствором. После высушивания концентрировали при пониженном давлении, перекристаллизовывали из толуола и полученный кристалл отделяли фильтрованием. Его высушивали при пониженном давлении, получая 5,6 г целевого соединения в виде кристалла коричневого цвета.
Используя 5,6 г полученного твердого вещества, 5,44 г целевого соединения получали в виде аморфного вещества коричневого цвета тем же способом, как в примере 70 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 3. Получение метил 6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-карбоксилата и метил 5-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-карбоксилата:
3,1 г железа добавляли к раствору 5,44 г полученного аморфного вещества в уксусной кислоте (60 мл) и перемешивали при 80°C в течение 40 минут. После фильтрования растворитель выпаривали при пониженном давлении, к остатку добавляли воду, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания его упаривали при пониженном давлении, перекристаллизовывали из толуола и полученный кристалл отделяли фильтрованием. Его высушивали при пониженном давлении, получая 4,0 г целевого соединения в виде кристалла серого цвета.
80 мл диметилформамида и 80 мл тетрагидрофурана добавляли к 4,0 г полученного кристалла, нагревали и растворяли. При охлаждении водой добавляли 2,4 мл 2-(триметилсилил)этоксиметилхлорида и 476 мг гидрида натрия (с добавлением 30% жидкого парафина) и перемешивали при комнатной температуре в течение 1 часа. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 1/9), получая 5,22 г целевого соединения в виде аморфного вещества желтого цвета.
Стадия 4. Получение (6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил)метанола и (5-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1H-бензимидазол-7-ил)метанола:
Используя 5,22 г полученного сложного метилового эфира, 1,57 г целевого соединения получали в виде аморфного вещества желтого цвета тем же способом, как в примере 34 (стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 5. Получение 1-[(6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-она:
Используя полученное спиртовое соединение, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,29 (3H, т, J=7,4 Гц), 2,07-1,99 (2H, м), 2,48 (2H, т, J=8,2 Гц), 3,44-3,34 (4H, м), 4,62 (2H, c), 6,92 (1Н, м), 8,36 (1Н, м), 7,53 (1Н, м), 8,00 (1Н, д, J=8,6 Гц), 8,47-8,46 (1Н, м), 8,63-8,62 (1Н, м), 8,72-8,70 (1Н, м), 9,57 (1Н, д, J=1,2 Гц), 12,18 (1Н, с).
ESI-MASS (m/e): 479 (M+H).
Пример 162
4-[(2-Хлорпиридин-3-ил)метил]-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол
Используя 2-хлорпиридин, целевое соединение получали тем же способом, как в примере 160 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30-1,21 (3H, м), 3,35 (2H, кв, J=7,4 Гц), 4,34 (1Н, c), 4,57 (1Н, c), 6,80-6,78 (1Н, м), 7,15-7,13 (1Н, м), 7,46-7,31 (3H, м), 7,75 (1Н, д, J=7,8 Гц), 7,86-7,85 (1Н, м), 7,97 (1Н, д, J=8,6 Гц), 8,40-8,29 (3H, м), 8,61 (1Н, c), 10,63 (1Н, с).
ESI-MASS (m/e): 506 (M+H).
Пример 163
6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-4-[(3-фторпиридин-4-ил)метил]-2-пиридин-2-ил-1Н-бензимидазол
Стадия 1. Получение (6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил)(3-фторпиридин-4-ил)метанола или (5-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазол-7-ил)(3-фторпиридин-4-ил)метанола:
При -20°C 0,92 мл нормального бутиллития (1,5М раствор в гексане) добавляли к раствору 154 мг 4-диазабицикло[2,2,2]октана в диэтиловом эфире (1,5 мл) и перемешивали при этой температуре в течение 1 часа. Затем добавляли 119 мкл 3-фторпиридина при -78°C и перемешивали при этой температуре в течение 2 часов. При -60°C добавляли раствор 149 мг 6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-[{2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-карбальдегида в тетрагидрофуране (2 мл) и перемешивали при этой температуре в течение 1 часа. Затем добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой высушивали, растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 2/1 до 0/1), получая 32 мг целевого соединения в виде желтого масла.
Стадия 2. Получение 6-{[6-(этилсульфонил)пиридин-3-ил]окси}-4-[(3-фторпиридин-4-ил)метил]-2-пиридин-2-ил-1Н-бензимидазола:
Целевое соединение получали тем же способом, как в примере 160 (стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30-1,21 (3H, м), 3,35 (2H, кв, J=7,4 Гц), 4,49 (2H, c), 6,80 (1Н, c), 7,10 (1Н, c), 7,38-7,32 (3H, м), 7,86 (1Н, т, J=7,2 Гц), 7,98 (1Н, т, J=8,6 Гц), 8,28-8,26 (1Н, м), 8,45-8,41 (3H, м), 8,61-8,60 (1Н, м), 10,56 (1Н, с).
ESI-MASS (m/e): 490 (M+H).
Пример 164
1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-1Н-пиррол-2-карбонитрил
Используя 2-цианопиррол, целевое соединение получали тем же способом, как в примере 150, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,4 Гц), 3,36 (2H, кв, J=7,4 Гц), 5,68 (2H, c), 6,16 (1Н, c), 6,79-6,75 (2H, м), 7,17-7,12 (2H, м), 7,32 (1Н, дд, J=8,8, 2,5 Гц), 7,39-7,37 (1Н, м), 7,89-7,87 (1Н, м), 7,97 (1Н, д, J=8,6 Гц), 8,44-8,41 (2H, м), 8,61-8,60 (1Н, м), 10,92 (1Н, уш.с).
ESI-MASS (m/e): 485 (M+H).
Пример 165
(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)(3-фторпиридин-2-ил)метанол
Используя 3-фторпиридин, целевое соединение получали тем же способом, как в примере 160 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,6 Гц), 3,36 (2H, кв, J=7,6 Гц), 6,67 (1Н, c), 6,80 (1Н, c), 7,33-7,29 (3H, м), 7,53-7,51 (1Н, м), 7,77-7,74 (1Н, м), 7,99 (2H, д, J=9,0 Гц), 8,41-8,39 (2H, м), 8,48-8,45 (1Н, м), 8,68-8,66 (1Н, м).
ESI-MASS (m/e): 506 (M+H).
Пример 166
1-{1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-1Н-имидазол-2-ил}этанон
Используя 2-ацетилимидазол, полученный в примере 92 (стадия 1), целевое соединение получали тем же способом, как в примере 150, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,42 (3H, т, J=7,4 Гц), 2,78 (2H, c), 2,91 (1Н, c), 3,50 (2H, кв, J=7,4 Гц), 5,99 (2/3Н, c), 6,24 (4/3Н, c), 7,03 (2/3Н, c), 7,12 (1/3Н, c), 7,25 (1Н, д, J=7,8 Гц), 7,53-7,40 (3H, м), 7,64 (2/3Н, c), 7,70 (1/3Н, c), 8,03-8,01 (1Н, м), 8,12-8,10 (1Н, м), 8,57-8,48 (2H, м), 8,75-8,74 (2/3Н, м), 8,85-8,82 (1/3Н, м), 11,08 (2/3Н, c), 11,70 (1/3Н, с).
ESI-MASS (m/e): 503 (M+H).
Пример 167
4-[(3,5-Дифторпиридин-4-ил)метил]-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол
Используя 3,5-дифторпиридин, целевое соединение получали тем же способом, как в примере 160 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,26 (3H, т, J=7,6 Гц), 3,36 (2H, кв, J=7,6 Гц), 4,46 (2H, c), 6,81 (1Н, c), 7,30 (2H, м), 7,40-7,39 (1Н, м), 7,88 (1Н, т, J=7,0 Гц), 7,97 (1Н, д, J=8,6 Гц), 8,33 (2H, c), 8,42-8,39 (2H, м), 8,64-8,63 (1Н, м).
ESI-MASS (m/e): 508 (M+H).
Пример 168
1-{1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1H-бензимидазол-4-ил)метил]-1H-пиррол-2-ил}-2,2,2-трифторэтанон
Используя 2,2,2-трифтор-1-(1Н-пиррол-2-ил)-1-этанон, целевое соединение получали тем же способом, как в примере 150, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,27 (3H, т, J=7,4 Гц), 3,35 (2H, кв, J=7,4 Гц), 6,05 (2H, c), 6,29 (1Н, c), 6,73 (1Н, c), 7,09 (1Н, c), 7,39-7,37 (1Н, м), 7,58 (1Н, c), 7,89-7,86 (1Н, м), 7,94 (1Н, д, J=8,2 Гц), 8,41-8,38 (3H, м), 8,62-8,60 (2H, м), 10,90 (1Н, с).
ESI-MASS (m/e): 556 (M+H).
Пример 169
4-(2,6-Дифторбензил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-ил-1Н-бензимидазол
Используя 1,3-дифторбензол, целевое соединение получали тем же способом, как в примере 160 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,27 (3H, т, J=7,4 Гц), 3,35 (2H, кв, J=7,4 Гц), 4,24 (1Н, c), 4,57 (1Н, c), 6,89-6,91 (3H, м), 7,19-7,17 (1Н, м), 7,29-7,27 (1Н, м), 7,39-7,37 (2H, м), 7,85-7,84 (1Н, м), 7,95 (1Н, д, J=8,6 Гц), 8,45-8,35 (2H, м), 8,69-8,66 (1Н, м), 10,74 (1Н, с).
ESI-MASS (m/e): 507 (M+H).
Пример 170
1-{1-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]-1Н-пиразол-3-ил}этанон
Используя гидрохлорид 5-ацетилпиразола, целевое соединение получали тем же самым способом, как в примере 150, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,30-1,24 (3H, м), 2,54 (1Н, c), 2,88 (2H, c), 3,39-3,33 (2H, м), 5,59 (1Н, c), 5,85 (1Н, c), 6,84-6,75 (1Н, м), 7,02 (1Н, c), 7,38-7,33 (2H, м), 7,51-7,50 (1Н, м), 7,90-7,82 (1Н, м), 7,99-7,97 (1Н, м), 8,33 (1Н, д, J=7,8 Гц), 8,43-8,41 (1Н, м), 8,47-8,46 (1Н, м), 8,62-8,61 (1Н, м), 10,81 (1/3H, c), 11,79 (2/3Н, с).
ESI-MASS (m/e): 503 (M+H).
Пример 171
1-[(6-{[6-(5-Метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он
1,54 г 6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ола и 1,86 г карбоната калия добавляли к раствору 955 мг метил 5-фтор-2-нитробензоата в диметилформамиде (10 мл) и перемешивали при 80°C в течение 1 часа. Смесь охлаждали до комнатной температуры, затем добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом, органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 1,38 г метил 5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитробензоата в виде твердого вещества желтого цвета.
1,96 мл водного 5 н. раствора гидроксида натрия добавляли к раствору 700 мг метил 5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитробензоата в 5 мл метанола и 5 мл тетрагидрофурана и перемешивали при комнатной температуре в течение 2,5 часов. Водный 10% раствор лимонной кислоты добавляли для нейтрализации, затем экстрагировали этилацетатом, органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 399 мг 5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитробензойной кислоты в виде твердого вещества светло-желтого цвета.
282 мг N,N'-карбоксидиимидазола добавляли к раствору 399 мг указанной карбоновой кислоты в тетрагидрофуране (5 мл) и перемешивали при комнатной температуре в течение 30 минут. При охлаждении на льду указанную реакционную жидкость добавляли к водному раствору 219 мг боргидрида натрия (5 мл) и перемешивали в течение 20 минут. Нейтрализовали водным 10% раствором лимонной кислоты, экстрагировали этилацетатом, органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 367 мг (5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитрофенил)метанола в виде твердого вещества светло-желтого цвета.
0,92 мл триэтиламина и 530 мг комплекса триоксид серы/пиридин добавляли к раствору 367 мг (5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитрофенил)метанола в диметилсульфоксиде (5 мл) и перемешивали при комнатной температуре в течение 30 минут. Добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом, органический слой высушивали, растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 3/7), получая 174 мг 5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитробензилальдегида в виде твердого вещества желтого цвета.
123 мг гидрохлорида 4-аминобутановой кислоты и 0,11 мл триэтиламина добавляли к раствору 174 мг указанного выше соединения в хлороформе (4 мл) и перемешивали при комнатной температуре в течение 30 минут. Затем добавляли 339 мг триацетоксиборгидрида натрия и перемешивали в течение ночи. Добавляли насыщенный солевой раствор, экстрагировали хлороформом, органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 210 мг 1-(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитробензил)пирролидин-2-она в виде твердого вещества светло-желтого цвета.
599 мг дигидрата хлорида олова добавляли к раствору 210 мг указанного выше соединения в 2 мл диметилформамида и 2 мл метанола и перемешивали при 80°C в течение 90 минут. Смесь охлаждали до комнатной температуры, затем нейтрализовали насыщенным водным раствором гидрокарбоната натрия и образовавшуюся соль удаляли фильтрованием. Органический слой фильтрата промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали, получая 144 мг сырого продукта 1-(2-амино-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}бензил)пирролидин-2-она в виде желтого масла.
При охлаждении на льду 0,33 мл триэтиламина и 210 мг хлорангидрида пиколиновой кислоты добавляли к раствору 144 мг 1-(2-амино-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}бензил)пирролидин-2-она в хлороформе (2 мл) и перемешивали при комнатной температуре в течение 1 часа. Добавляли воду, экстрагировали хлороформом, органический слой высушивали, растворитель удаляли и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 2/8), получая 117 мг N-{4-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-[(2-оксопирролидин-1-ил)метил]фенил}пиридин-2-карбоксамида в виде твердого вещества светло-желтого цвета.
126 мг нитрата калия добавляли к раствору 117 мг N-{4-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-[(2-оксопирролидин-1-ил)метил]фенил}пиридин-2-карбоксамида в трифторуксусной кислоте (3 мл) и перемешивали при 80°C в течение 7 часов. Трифторуксусную кислоту выпаривали при пониженном давлении, затем добавляли к остатку хлороформ и промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 122 мг N-{4-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-нитро-6-[(2-оксопирролидин-1-ил)метил]фенил}пиридин-2-карбоксамида в виде коричневого масла.
266 мг дигидрата хлорида олова добавляли к раствору 122 мг указанного выше соединения в 1 мл диметилформамида и 1 мл метанола и перемешивали в течение ночи при 80°C. Смесь охлаждали до комнатной температуры, затем добавляли насыщенный водный раствор гидрокарбоната натрия и полученную соль удаляли фильтрованием. Органический слой фильтрата промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали и остаток очищали тонкослойной хроматографией на колонках (проявляющий растворитель: хлороформ/метанол = 9/1), получая 20 мг 1-[(6-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-она в виде твердого вещества коричневого цвета.
1Н-ЯМР (CDCl3) δ: 2,03-1,98 (2H, м), 2,48-2,46 (2H, м), 2,66 (3H, c), 3,39 (2H, т, J=7,2 Гц), 4,62 (2H, c), 6,90 (1Н, д, J=2,3 Гц), 7,34-7,31 (2H, м), 7,50 (1Н, c), 7,82-7,80 (1Н, м), 8,01-7,99 (1Н, м), 8,33 (1Н, д, J=7,4 Гц), 8,53 (1Н, д, J=2,7 Гц), 8,76-8,75 (1Н, м), 11,99 (1Н, с).
ESI-MASS (m/e): 468 (M+H).
Пример 172
4-[(2,4-Дихлорпиридин-3-ил)метил]-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол
Используя 3,5-дихлорпиридин, целевое соединение получали тем же способом, как в примере 160 (стадии 2, 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,28-1,20 (3H, м), 3,34 (2H, кв, J=7,4 Гц), 4,54 (1Н, c), 4,84 (1Н, c), 6,37 (1Н, c), 7,03 (1Н, д, J=2,0 Гц), 7,27-7,23 (1Н, м), 7,41-7,31 (2H, м), 7,87-7,85 (1Н, м), 7,94 (1Н, кв, J=9,0 Гц), 8,23-8,22 (1Н, м), 8,44-8,36 (2H, м), 8,65-8,60 (1Н, м), 11,00 (1Н, с).
ESI-MASS (m/e): 540 (M+H).
Пример 173
4-(2,6-Дифторбензил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол
При охлаждении на льду 44 мкл триэтиламина и 16 мкл метансульфонилхлорида добавляли к раствору 57 мг спиртового соединения, полученного в примере 161 (стадия 4), в тетрагидрофуране (1,0 мл) и перемешивали при этой температуре в течение 30 минут. Добавляли к реакционной жидкости насыщенный солевой раствор, экстрагировали этилацетатом, органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 67 мг сырого продукта в виде желтого масла.
27 мг бромида лития добавляли к раствору 67 мг указанного выше сырого продукта в диметилформамиде (1 мл) и перемешивали при комнатной температуре в течение 40 минут. Добавляли воду к реакционной жидкости, экстрагировали этилацетатом, органический слой высушивали, растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 2/8), получая 32 мг 4-(бромметил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол в виде желтого масла.
5,9 г тетракистрифенилфосфин/палладия добавляли к раствору 31 мг полученного бромида в диметоксиэтане (1,0 мл) и перемешивали при 50°C в течение 10 минут. Добавляли 12 мг (2,6-дифторфенил)бороновой кислоты, 0,5 мл этанола и 0,1 мл водного (2M) раствора карбоната натрия и нагревали с обратным холодильником в течение 1,5 часов. Смесь охлаждали до комнатной температуры, экстрагировали хлороформом, органический слой высушивали и растворитель выпаривали при пониженном давлении, получая 39 мг сырого продукта в виде желтого масла.
0,7 мл трифторуксусной кислоты добавляли к 39 мг указанного выше сырого продукта и перемешивали в течение 1 часа. Избыток трифторуксусной кислоты выпаривали при пониженном давлении, остаток растворяли в хлороформе и промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой высушивали, растворитель удаляли и остаток очищали тонкослойной колоночной хроматографией (проявляющий растворитель: хлороформ/метанол = 9/1), получая 13 мг целевого соединения в виде твердого вещества желтого цвета.
1Н-ЯМР (CDCl3) δ: 1,26 (3H, т, J=7,4 Гц), 3,36 (2H, кв, J=7,4 Гц), 4,25 (4/3H, c), 4,56 (2/3Н, c), 6,93-6,91 (2H, м), 7,06-7,04 (1Н, м), 7,20-7,18 (1Н, м), 7,32-7,30 (1Н, м), 7,43 (1Н, c), 7,97 (1Н, д, J=9,0 Гц), 8,44 (1Н, д, J=16,0 Гц), 8,66-8,64 (2H, м), 9,66-9,58 (1Н, м), 10,39 (1/3Н, c), 10,61 (2/3Н, с).
ESI-MASS (m/e): 508 (M+H).
Пример 174
Метил 6-(4-(этилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоксилат
Метил 6-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-5-карбоксилат подвергали взаимодействию с трифторуксусной кислотой с получением целевого соединения.
Пример 175
6-(4-(Этилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоновая кислота
10 мл водного 1 н. раствора гидроксида натрия добавляли к 2,3 г сложного метилового эфира, полученного в примере 174, и реакционную жидкость перемешивали в течение ночи при 50°C. К реакционной жидкости добавляли 4 мл 3 н. соляной кислоты и осажденный осадок отделяли фильтрованием, получая целевое соединение.
Пример 176
(6-(4-Этилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-ил)метанол
700 мг 1,1'-карбонилдиимидазола добавляли к раствору 1,5 г карбоновой кислоты, полученной в примере 175, в диметилформамиде (5 мл) и реакционную жидкость перемешивали при комнатной температуре в течение 15 минут. Реакционную жидкость добавляли к 5 мл водного раствора 1,5 г боргидрида натрия и реакционную жидкость перемешивали при комнатной температуре в течение 5 минут, затем разбавляли этилацетатом, промывали водой и насыщенным солевым раствором в этом порядке и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая целевое соединение в виде твердого вещества оранжевого цвета.
Пример 177
6-(4-(Этилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбальдегид
5 мл триэтиламина и 750 мг пиридина-триоксида серы добавляли к раствору 1,0 г спиртового соединения, полученного в примере 176, в диметилсульфоксиде (10 мл) и реакционную жидкость перемешивали при комнатной температуре в течение 15 минут. Реакционную жидкость разбавляли этилацетатом, промывали водой и насыщенным солевым раствором в этом порядке и высушивали безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, получая целевое соединение в виде твердого вещества оранжевого цвета.
Исходя из фенолов, полученных в ссылочных примерах, следующие соединения с примера 178 по пример 209 получали тем же способом, как в примерах 174-177, или его комбинацией с обычным способом.
Пример 178
Метил 6-(4-(метилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 179
6-(4-(Метилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 180
(6-(4-Метилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 181
6-(4-(Метилсульфонил)фенокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 182
Метил 6-((6-(этилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 183
6-((6-(Этилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 184
(6-((6-(Этилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 185
6-((6-(Этилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 186
Метил 6-((6-(метилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 187
6-((6-(Метилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 188
(6-((6-Метилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 189
6-((6-Метилсульфонил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 190
Метил 6-(6-(5-метил-(1,2,4)оксадиазол-3-ил)пиридин-3-илокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 191
6-(6-(5-Метил-(1,2,4)оксадиазол-3-ил)пиридин-3-илокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 192
(6-(6-(5-Метил-(1,2,4)оксадиазол-3-ил)пиридин-3-илокси)-2-пиридин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 193
6-(6-(5-Метил-(1,2,4)оксадиазол-3-ил)пиридин-3-илокси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 194
Метил 6-((6-(метоксиметил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 195
6-((6-(Метоксиметил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 196
(6-((6-(Метоксиметил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 197
6-((6-(Метоксиметил)пиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 198
Метил 6-(4-этилсульфонил)фенокси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 199
6-(4-Этилсульфонил)фенокси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 200
(6-(4-Этилсульфонил)фенокси)-2-пиразин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 201
6-(4-Этилсульфонил)фенокси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 202
Метил 6-((6-этилсульфонил)пиридин-3-ил)окси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 203
6-((6-Этилсульфонил)пиридин-3-ил)окси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 204
(6-((6-Этилсульфонил)пиридин-3-ил)окси)-2-пиразин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 205
6-((6-Этилсульфонил)пиридин-3-ил)окси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 206
Метил 6-((6-цианопиридин-3-ил)окси)-2-пиридин-2-ил-1Н-бензимидазол-5-карбоксилат
Пример 207
6-((6-Цианопиридин-3-ил)окси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбоновая кислота
Пример 208
(6-((6-Цианопиридин-3-ил)окси)-2-пиразин-2-ил-1Н-бензимидазол-5-ил)метанол
Пример 209
6-((6-Цианопиридин-3-ил)окси)-2-пиразин-2-ил-1Н-бензимидазол-5-карбальдегид
Пример 210
1-({5-[4-(2-Метил-2H-тетразол-5-ил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол-6-ил}метил)пирролидин-2-он
Используя 4-(2-метил-2Н-тетразол-5-ил)фенол, полученный в ссылочном примере 17, целевое соединение получали тем же способом, как в примере 102 (стадия 5), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,95 (2H, м), 2,37 (2H, м), 3,33 (2H, м), 4,39 (3H, c), 4,61 (2H, c), 7,05 (2H, д, J=8,8 Гц), 7,20-7,60 (1Н, уш.), 7,38 (1Н, м), 7,65 (1Н, уш.), 7,87 (1Н, м), 8,08 (2H, д, J=8,8 Гц), 8,39 (1Н, д, J=8,0 Гц), 8,64 (1Н, д, J=4,5 Гц).
ESI-MASS (m/e): 467 (M+H).
Пример 211
1-[(2-(5-Фторпиридин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Используя 5-фторпиридин-2-карбоновую кислоту, полученную в ссылочном примере 18, целевое соединение получали тем же способом, как в примере 53, или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,97 (2H, м), 2,35 (2H, м), 2,69 (3H, c), 3,33 (2H, м), 4,60 (2H, c), 7,17 (1/2Н, c), 7,33 (1Н, м), 7,46 (1/2Н, c), 7,58 (2H+1/2H, м), 7,76 (1/2Н, c), 8,03 (1Н, м), 8,40-8,60 (3H, м), 10,5 (1/2H, уш.), 10,8 (1/2H, уш.).
ESI-MASS (m/e): 486 (M+H).
Пример 212
(3S)-1-({6-[4-(Этилсульфонил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол-5-ил}метил)-3-гидроксипирролидин-2-он
Стадия 1. Получение (3S)-3-{[трет-бутилдиметилсилил]окси}пирролидин-2-она:
На бане со льдом 3,1 мл триметилсилилдиазометана (2,0М, раствор в гексане) добавляли к раствору 500 мг (2S)-4-амино-2-гидроксимасляной кислоты в 5 мл метанола и 4 мл хлороформа и перемешивали в течение ночи. Растворитель выпаривали при пониженном давлении, получая 503 мг (3S)-3-гидроксипирролидин-2-она в виде твердого вещества белого цвета.
На бане со льдом 570 мг имидазола и 947 мг трет-бутилдиметилсилилхлорида добавляли к раствору 503 мг (3S)-3-гидроксипирролидин-2-она в диметилформамиде (5 мл) и перемешивали при комнатной температуре в течение 1 часа. Добавляли воду к реакционной жидкости, экстрагировали этилацетатом, органический слой промывали водой и насыщенным солевым раствором и высушивали. Растворитель выпаривали при пониженном давлении, получая 452 мг целевого соединения в виде светло-желтого масла.
Стадия 2. Получение (3S)-1-({6-[4-(этилсульфонил)фенокси]-2-пиридин-2-ил-1Н-бензимидазол-5-ил}метил)-3-гидроксипирролидин-3-она:
Используя спиртовое соединение, полученное в примере 19 (стадия 7), и (3S)-3-{[трет-бутилдиметилсилил]окси}пирролидин-2-он, полученный на стадии 1, целевое соединение получали тем же способом, как в примере 2, или в соответствии с этим способом, или его комбинацией с обычным способом.
1H-ЯМР (CDCl3) δ: 1,25 (3H, т, J=7,4 Гц), 1,95 (1Н, c), 2,43 (1Н, c), 3,09 (2H, кв, J=7,4 Гц), 3,37-3,47 (2H, м), 4,45-4,49 (2H, м), 4,68 (1Н, м), 7,07 (2H, д, J=8,0 Гц), 7,37-7,39 (1Н, м), 7,43 (1Н, c), 7,81-7,89 (3H, м), 7,99 (1Н, c), 8,44 (1Н, д, J=8,0 Гц), 8,60 (1Н, д, Гц J=4,1).
ESI-MASS (m/e): 493 (M+H).
Пример 213
1-[(2-(5-Метоксипиридин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Используя 5-метоксипиридин-2-карбоновую кислоту, полученную в ссылочном примере 19, целевое соединение получали тем же способом, как в примере 53, или в соответствии с этим способом, или его комбинацией с обычным способом.
1H-ЯМР (CDCl3) δ: 1,94 (2H, м), 2,35 (2H, м), 2,68 (3H, c), 3,30 (2H, м), 3,94 (3H, c), 4,58 (2H, м), 7,14 (1/2Н, c), 7,25-7,38 (2H, м), 7,45 (1/2Н, c), 7,55 (1/2Н, c), 7,74 (1/2Н, c), 8,03 (1Н, м), 8,28-8,38 (2H, м), 8,47 (1/2Н, м), 8,54 (1/2Н, м), 10,7 (1/2Н, м), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 498 (M+H).
Пример 214
(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)ацетонитрил
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 127, или в соответствии с этим способом, или его комбинацией с обычным способом.
1H-ЯМР (CDCl3) δ: 1,29 (3H, м), 3,37 (2Н, кв, J=7,4 Гц), 4,27 (2H, c), 7,16 (2H, д, J=13,3 Гц), 7,35-7,39 (2H, м), 7,87 (1Н, т, J=7,8 Гц), 8,01 (1Н, c), 8,39 (1Н, д, J=7,8 Гц), 8,46 (1Н, д, J=2,7 Гц), 8,62 (1Н, c), 10,83 (1Н, уш.с).
ESI-MASS (m/e): 420 (M+H).
Пример 215
6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-4-[(5-метил-1,2,4-оксадиазол-3-ил)метил]-2-пиридин-2-ил-1Н-бензимидазол
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 140, или в соответствии с этим способом, или его комбинацией с обычным способом.
1H-ЯМР (CDCl3) δ: 1,26 (3H, м), 2,56 (3H, c), 3,33-3,38 (2H, м), 4,28 (1Н, c), 4,59 (1Н, c), 6,91-7,00 (1Н, м), 7,31-7,37 (2H, м), 7,45 (1Н, c), 7,85 (1Н, т, J=8,6 Гц), 7,97-8,01 (1Н, м), 8,37-8,44 (2H, м), 8,59-8,61 (1/2Н, м), 8,68 (1/2Н, д, J=4,7 Гц).
ESI-MASS (m/e): 477 (M+H).
Пример 216
1-{2-[(6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]фенил}этанон
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 173, или в соответствии с этим способом, или его комбинацией с обычным способом.
1H-ЯМР (CDCl3) δ: 1,28 (3H, кв, J=7,4 Гц), 2,53 (1Н, c), 2,71 (2H, c), 3,36 (2H, кв, J=7,4 Гц), 4,36 (4/3Н, c), 4,76 (2/3Н, c), 6,96 (1Н, д, J=2,2 Гц), 7,51 (2H, дд, J=10,3, 4,6 Гц), 7,61-7,68 (5H, м), 7,79 (1Н, т, J=8,6 Гц), 7,98 (1Н, д, J=8,6 Гц), 8,30 (1Н, д, J=8,6 Гц), 8,48 (1Н, д, J=2,9 Гц), 8,66 (1Н, д, J=4,9 Гц), 12,11 (1Н, уш.с).
ESI-MASS (m/e): 513 (M+H).
Пример 217
2-[(6-{6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]бензонитрил
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 173, или в соответствии с этим способом, или его комбинацией с обычным способом.
1H-ЯМР (CDCl3) δ: 1,22-1,29 (3H, м), 3,30-3,37 (2H, м), 4,45 (2/3Н, c), 4,68 (4/3Н, c), 6,79-6,81 (1Н, м), 7,03 (1Н, д, J=2,0 Гц), 7,28-7,34 (2H, м), 7,57 (1Н, д, J=7,8 Гц), 7,61-7,66 (3H, м), 7,85 (1Н, т, J=7,6 Гц), 7,95 (1Н, д, J=8,6 Гц), 8,37-8,44 (2H, м), 8,56 (1Н, д, J=4,7 Гц), 11,08 (1/3Н, уш.с), 11,26 (2/3Н, уш.с).
ESI-MASS (m/e): 496 (M+H).
Пример 218
6-{[6-(Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-4-(2H-тетразол-5-илметил)-1Н-бензимидазол
41 мг азида натрия и 87 мг гидрохлорида триэтиламина добавляли к раствору 116 мг (6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1-{[2-(триметилсилил)этокси]метил}-1Н-бензимидазол-4-ил)ацетонитрила в толуоле (2 мл) и перемешивали в течение ночи при 100°C. Реакционной жидкости давали остыть до комнатной температуры, затем добавляли соляную кислоту (1 н.), экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. Растворитель выпаривали при пониженном давлении, получая 121 мг сырого продукта в виде желтого масла.
0,7 мл трифторуксусной кислоты добавляли к 121 мг указанного выше сырого масла и перемешивали при комнатной температуре в течение 1 часа. Избыток трифторуксусной кислоты выпаривали при пониженном давлении и остаток очищали высокоэффективной жидкостной хроматографией на колонках с обратной фазой (вода/ацетонитрил = от 90/10 до 10/90), получая 14 мг целевого соединения в виде твердого вещества белого цвета.
1H-ЯМР (CDCl3) δ: 1,29 (3H, м), 3,37 (2H, кв, J=7,4 Гц), 4,68 (2H, c), 7,07 (1Н, c), 7,33-7,36 (2H, м), 7,48-7,50 (1Н, м), 7,98-8,00 (2H, м), 8,44 (2H, м), 8,69 (1Н, м).
ESI-MASS (m/e): 463 (M+H).
Пример 219
2-[(6-{6-Этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]бензамид
Используя спиртовое соединение, полученное в примере 150 (стадия 1), целевое соединение получали тем же способом, как в примере 173, или в соответствии с этим способом, или его комбинацией с обычным способом.
1H-ЯМР (CDCl3) δ: 1,32-1,56 (3H, м), 3,33-3,40 (2H, м), 4,40 (2H, c), 7,06 (1Н, д, J=8,6 Гц), 7,27-7,42 (5H, м), 7,48-7,50 (2H, м), 7,76-7,80 (2H, м), 7,97-8,01 (1Н, м), 8,47-8,48 (1Н, м), 8,63 (1Н, м).
ESI-MASS (m/e): 514 (M+H).
Пример 220
1-[Гидрокси(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Стадия 1. Получение (5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-6-ил)метанола:
Используя 6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинол, полученный в ссылочном примере 6, целевое соединение получали тем же способом, как в примере 19 (стадия 5) и примере 34 (стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. Получение 5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-6-карбальдегида:
1,5 мл триэтиламина и 796 мг комплекса триоксид серы/пиридин добавляли к раствору 400 мг спиртового соединения, полученного на стадии 1, в диметилсульфоксиде (5 мл) и перемешивали при комнатной температуре в течение 30 минут. Добавляли воду, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, остаток перекристаллизовывали из смеси диэтиловый эфир/метанол, получая 183 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
Стадия 3. Получение 1-[гидрокси(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-6-ил)метил]пирролидин-2-она:
7 мг карбоната натрия добавляли к раствору 8,7 мкл 2-пирролидона в N,N-диметилформамиде (500 мкл). При перемешивании при 80°C добавляли 10 мг альдегида, полученного на стадии 2, и перемешивали в течение ночи при 80°C. Растворитель выпаривали при пониженном давлении и остаток очищали разделяющей тонкослойной хроматографией (Kieselgel™ 60F254, Art 5744 (Merck), хлороформ/метанол = 5/1), получая 1,0 мг целевого соединения в виде аморфного вещества светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 0,79-0,94 (1Н, м), 1,77-1,91 (1Н, м), 1,97-2,09 (1Н, м), 2,14-2,34 (1Н, м), 2,68 (3H, c), 2,83-2,94 (1Н, м), 3,37-3,52 (1Н, м), 6,87-6,95 (1Н, м), 7,18 (1Н×1/2, c), 7,33-7,46 (2H, м), 7,50 (1Н×1/2, c), 7,86-7,94 (1Н, м), 7,99-8,08 (1Н, м, 1Н×1/2, c), 8,31 (1Н×1/2, c), 8,36-8,46 (2H, м), 8,60-8,72 (1Н, м), 10,58 (1Н×1/2, уш.с), 10,86 (1Н×1/2, уш.с).
ESI-MASS (m/e): 484 (M+H).
Пример 221
1-[(2-(5-Фторпиридин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Используя 5-фторпиридин-2-карбоновую кислоту, полученную в ссылочном примере 18, целевое соединение получали тем же способом, как в примере 53 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,97 (2H, м), 2,35 (2H, м), 2,69 (3H, c), 3,33 (2H, м), 4,60 (2H, c), 7,17 (1/2Н, c), 7,33 (1Н, м), 7,46 (1/2Н, c), 7,58 (2H+1/2H, м), 7,76 (1/2Н, c), 8,03 (1Н, м), 8,40-8,60 (3H, м), 10,5 (1/2H, уш.), 10,8 (1/2H, уш.).
ESI-MASS (m/e): 486 (M+H).
Пример 222
1-[(2-(5-Метоксипиридин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Используя 5-метоксипиридин-2-карбоновую кислоту, полученную в ссылочном примере 19, целевое соединение получали тем же способом, как в примере 53 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,94 (2H, м), 2,35 (2H, м), 2,68 (3H, c), 3,30 (2H, м), 3,94 (3H, c), 4,58 (2H, м), 7,14 (1/2Н, c), 7,25-7,38 (2H, м), 7,45 (1/2Н, c), 7,55 (1/2Н, c), 7,74 (1/2Н, c), 8,03 (1Н, м), 8,28-8,38 (2H, м), 8,47 (1/2Н, м), 8,54 (1/2Н, м), 10,7 (1/2Н, м), 10,8 (1/2Н, уш.).
ESI-MASS (m/e): 498 (M+H).
Пример 223
1-[((2-(5-Метилпиридин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Используя 6-метилпиридин-2-карбоновую кислоту, целевое соединение получали тем же способом, как в примере 53 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,95 (2H, м), 2,33 (2H, м), 2,60 (3H, c), 2,68 (3H, c), 3,32 (2H, м), 4,58 (2H, c), 7,10-7,35 (2H+1/2H, м), 7,47 (1/2Н, c), 7,56 (1/2Н, c), 7,75 (1H+1/2H, м), 8,03 (1Н, м), 8,19 (1Н, м), 8,47 (1/2Н, c), 8,54 (1/2Н, c), 10,9 (1Н, уш.).
ESI-MASS (m/e): 482 (M+H).
Пример 224
1-[(2-(6-Метоксипиридин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Используя 6-метилпиридин-2-карбоновую кислоту, целевое соединение получали тем же способом, как в примере 53 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,96 (2H, м), 2,34 (2H, м), 2,69 (3H, c), 3,34 (2H, м), 4,03 (3/2Н, c), 4,07 (3/2Н, c), 4,58 (2/2Н, c), 4,59 (2/2Н, c), 6,86 (1Н, д, J=8,2 Гц), 7,16 (1/2Н, c), 7,32 (1Н, м), 7,46 (1/2Н, c), 7,61 (1/2Н, c), 7,78 (1H+1/2H, м), 7,96-8,06 (2H, м), 8,46 (1/2Н, д, J=2,9 Гц), 8,54 (1/2Н, д, J=2,5 Гц), 10,5 (1/2H, уш.), 10,6 (1/2H, уш.).
ESI-MASS (m/e): 498 (M+H).
Пример 225
Метил 6-{5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-6-[(2-оксопирролидин-1-ил)метил]-1Н-бензимидазол-2-ил}никотинат
Используя 5-(метоксикарбонил)пиридин-2-карбоновую кислоту, целевое соединение получали тем же способом, как в примере 53 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,99 (2H, м), 2,40 (2H, м), 2,69 (3H, c), 3,35 (2H, м), 4,00 (3H, c), 4,61 (2H, c), 7,19 (1/2Н, c), 7,35 (1Н, м), 7,53 (1/2Н, c), 7,65 (1/2Н, c), 7,80 (1/2Н, c), 8,05 (1Н, м), 8,45 (2H, м), 8,48 (1/2Н, д, J=3,0 Гц), 8,55 (1/2Н, д, J=2,6 Гц), 9,22 (1Н, м), 10,8 (1/2Н, уш.), 11,1 (1/2Н, уш.).
ESI-MASS (m/e): 526 (M+H).
Пример 226
1-[(2-(4-Метилпиридин-2-ил)-5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Используя 4-метилпиридин-2-карбоновую кислоту, целевое соединение получали тем же способом, как в примере 53 (стадия 2, стадия 3), или в соответствии с этим способом, или его комбинацией с обычным способом.
1Н-ЯМР (CDCl3) δ: 1,94 (2H, м), 2,34 (2Н, м), 2,46 (3/2Н, c), 2,47 (3/2Н, c), 2,68 (3H, c), 3,32 (2H, м), 4,58 (2/2Н, c), 4,61 (2/2Н, c), 7,16 (1/2Н, c), 7,72 (1Н, д, J=4,7 Гц), 7,33 (1Н, м), 7,48 (1/2Н, c), 7,57 (1/2Н, c), 7,77 (1/2Н, c), 8,05 (1Н, м), 8,23 (1/2Н, c), 8,26 (1/2Н, c), 8,49 (1H+1/2H, м), 8,55 (1/2Н, д, J=2,7 Гц), 10,8 (1Н, уш.).
ESI-MASS (m/e): 482 (M+H).
Пример 227
Трифторацетат 3-гидрокси-1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-6-ил)метил]пирролидин-2-он
Стадия 1. Получение 3-{[трет-бутил(диметил)силил]окси}пирролидин-2-она:
5 г dl-малеиновой-кислоты растворяли в 20 мл ацетилхлорида и перемешивали при 45°C в течение 3 часов. Ацетилхлорид выпаривали при пониженном давлении, полученный сырой продукт растворяли в 30 мл метанола и перемешивали в течение ночи. Растворитель выпаривали при пониженном давлении, получая 5,3 г 3-(ацетилокси)-4-метокси-4-оксобутановой кислоты в виде светло-желтого масла. На бане со льдом 10 мл комплекса боргидрид-диметилсульфид (10M) добавляли к раствору 5,3 г 3-(ацетилокси)-4-метокси-4-оксобутановой кислоты в тетрагидрофуране (25 мл) и перемешивали при комнатной температуре в течение 24 часов. К реакционной жидкости добавляли водный 10% раствор лимонной кислоты, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 5,1 г метил 2-(ацетилокси)-4-гидроксибутаноата в виде бесцветного прозрачного масла.
На бане со льдом 6,1 мл триэтиламина и 2,3 мл метансульфонилхлорида добавляли к раствору 2,59 г метил 2-(ацетилокси)-4-гидроксибутаноата в хлороформе (15 мл) и перемешивали в течение 30 минут. К реакционной жидкости добавляли насыщенный солевой раствор, экстрагировали хлороформом и органический слой высушивали. Растворитель выпаривали при пониженном давлении, получая 2,54 г метил 2-(ацетилокси)-4-[(метилсульфонил)окси]бутаноата в виде коричневой жидкости.
1,91 г азида натрия добавляли к раствору 2,54 г метил 2-(ацетилокси)-4-[(метилсульфонил)окси]бутаноата в диметилформамиде (10 мл) и перемешивали при 70°C в течение 8 часов. Реакционной жидкости давали остыть до комнатной температуры и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали и растворитель выпаривали при пониженном давлении, получая 2,70 г метил 2-(ацетилокси)-4-азидобутаноата в виде коричневого масла.
2,53 г карбоната калия и 1 мл воды добавляли к раствору 2,47 г метил 2-(ацетилокси)-4-азидобутаноата в метаноле (15 мл) и перемешивали при комнатной температуре в течение 30 минут. Насыщенный водный раствор хлорида аммония добавляли к реакционной жидкости и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали. Растворитель выпаривали при пониженном давлении, получая 591 мг метил 4-азидо-2-гидроксибутаноата в виде оранжевого масла.
692 мг трифенилфосфина и 8 мкл воды добавляли к раствору 351 мг метил 4-азидо-2-гидроксибутаноата в тетрагидрофуране (3 мл), перемешивали при комнатной температуре в течение 24 часов, затем перемешивали в течение ночи при 50°C. Тетрагидрофуран выпаривали при пониженном давлении и остаток экстрагировали этилацетатом, получая 255 мг 3-гидроксипирролидин-2-она в виде светло-коричневого масла.
На бане со льдом 300 мг имидазола и 497 мг трет-бутилдиметилхлорсилана добавляли к раствору 255 мг 3-гидроксипирролидин-2-она в диметилформамиде (2 мл) и перемешивали в течение 1 часа. Добавляли воду к реакционной жидкости, экстрагировали этилацетатом и промывали соляной кислотой (1 н.) и насыщенным солевым раствором. Органический слой высушивали, получая 370 мг сырого продукта. 208 г продукта очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 2/8), получая 62 мг целевого соединения в виде твердого вещества белого цвета.
Стадия 2. Получение трифторацетата 3-гидрокси-1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-6-ил)метил]пирролидин-2-она:
На бане со льдом 36 мкл триэтиламина и 14 мкл метансульфонилхлорида добавляли к раствору 47 мг спирта, полученного в примере 52 (стадия 2), в тетрагидрофуране (1 мл) и перемешивали в течение 30 минут. К реакционной жидкости добавляли насыщенный солевой раствор, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором и высушивали. Растворитель выпаривали при пониженном давлении, получая 48 мг сырого продукта в виде светло-желтого масла.
На бане со льдом 62 мг 3-{[трет-бутил(диметил)силил]окси}пирролидин-2-она, полученного на стадии 1, и 11 мг гидрида натрия (60%) добавляли к раствору указанного выше сырого продукта в диметилформамиде (2 мл) и перемешивали при комнатной температуре в течение 90 минут. К реакционной жидкости добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали водой и насыщенным солевым раствором и высушивали. Растворитель выпаривали при пониженном давлении и остаток очищали тонкослойной хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол = 9/1), получая 38 мг сырого продукта в виде желтого масла.
83 мкл тетрабутиламмонийфторида (1,0М, раствор в тетрагидрофуране) добавляли к раствору 20 мг указанного выше сырого продукта в тетрагидрофуране (0,2 мл) и перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали и 0,7 мл трифторуксусной кислоты добавляли к остатку и перемешивали в течение 1 часа. Избыток трифторуксусной кислоты выпаривали при пониженном давлении и остаток очищали высокоэффективной жидкостной хроматографией на колонках с обратной фазой (проявляющий растворитель: вода/ацетонитрил = от 9/1 до 1/9), получая 6 мг целевого соединения в виде бесцветного прозрачного масла.
1Н-ЯМР (CD3OD) δ: 1,79-1,85 (1Н, м), 2,36 (1Н, м), 2,69 (3H, c), 3,26-3,31 (1Н, м), 3,39 (1Н, д, J=6,5 Гц), 4,19 (1Н, т, J=8,2 Гц), 4,72-4,66 (2H, м), 7,49 (1Н, c), 7,60-7,62 (1Н, м), 7,66-7,68 (1Н, м), 7,85 (1Н, c), 8,11-8,16 (2H, м), 8,29 (1Н, д, J=8,0 Гц), 8,48 (1Н, д, J=2,3 Гц), 8,86 (1Н, д, J=4,7 Гц).
ESI-MASS (m/e): 484 (M+H).
Ссылочный пример 1
Получение 4-(метилсульфонил)фенола
На водяной бане 18,5 мл метилиодида и 28,7 г карбоната калия добавляли к раствору 25 г 4-гидрокситиофенола в ацетоне (250 мл) и перемешивали при комнатной температуре в течение 5 часов. Соль удаляли фильтрованием, растворитель выпаривали при пониженном давлении, к остатку добавляли диэтиловый эфир и экстрагировали водным 2 н. раствором гидроксида натрия. Полученный водный слой подкисляли водным 6 н. раствором соляной кислоты, экстрагировали диэтиловым эфиром и органический слой промывали насыщенным водным раствором хлорида натрия. После высушивания растворитель выпаривали при пониженном давлении, получая 27,3 г 4-(метилсульфанил)фенола в виде твердого вещества светло-желтого цвета. На водяной бане 67 мл водного 30% раствора перекиси водорода постепенно и по каплям добавляли к раствору 27,3 г 4-(метилсульфанил)фенола в уксусной кислоте (130 мл). После добавления смесь постепенно нагревали до 100°C и перемешивали в течение 1 часа. Реакционной жидкости давали остыть до комнатной температуры и нейтрализовали насыщенным водным раствором бикарбоната натрия. Экстрагировали этилацетатом, промывали насыщенным водным бикарбонатом натрия и насыщенным солевым раствором. После высушивания растворитель выпаривали, получая 31,6 г целевого соединения в виде твердого вещества светло-желтого цвета.
Ссылочный пример 2
Получение 4-(этилсульфонил)фенола
Используя этилиодид, целевое соединение получали тем же способом, как в ссылочном примере 1, или в соответствии с этим способом, или его комбинацией с обычным способом.
Ссылочный пример 3
Получение 6-(метилсульфонил)-3-пиридинола
6,6 г бис(пинаколат)диборона, 5,9 г ацетата калия и 980 мг комплекса (1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладия(II)-дихлорметана добавляли к раствору 4,72 г 3-бром-6-(метилсульфонил)пиридина в диметилсульфоксиде (80 мл) и реакционную жидкость перемешивали при 80°C в течение 2 часов. К реакционной жидкости добавляли этилацетат и воду, нерастворимое вещество удаляли фильтрованием через Целит и органический слой отделяли. Органический слой промывали водой и насыщенным солевым раствором, затем высушивали безводным сульфатом магния и растворитель выпаривали при пониженном давлении.
При 0°C 60 мл водного 5 н. раствора гидроксида натрия и 30 мл водной 30% перекиси водорода добавляли к раствору полученного остатка в тетрагидрофуране (200 мл) и реакционную жидкость перемешивали в течение ночи при комнатной температуре. Реакционную жидкость разбавляли диэтиловым эфиром и промывали водой. Водный слой подкисляли 5 н. соляной кислотой и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Полученный остаток промывали смесью хлороформа и гексана, получая 1,17 г целевого соединения в виде твердого вещества коричневого цвета.
Ссылочный пример 4
Получение 6-(этилсульфонил)-3-пиридинола
Используя 3-хлор-6-(этилсульфонил)пиридин, целевое соединение получали тем же способом, как в ссылочном примере 3, или в соответствии с этим способом, или его комбинацией с обычным способом.
Ссылочный пример 5
Получение 3-хлор-4-(метилсульфонил)фенола
48,3 мл тионилхлорида добавляли к 108 мл метансульфоновой кислоты и нагревали с обратным холодильником в течение 1 часа. Охлаждали до комнатной температуры, добавляли 1,3-дихлорбензол и 2,9 мл трифторсульфоновой кислоты и перемешивали при 120°C в течение 4 часов. После охлаждения до комнатной температуры реакционную жидкость выливали в воду со льдом и экстрагировали этилацетатом. Органический слой промывали водой, насыщенным водным бикарбонатом натрия и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении. Остаток перекристаллизовывали из смеси гексан/этилацетат, получая 48,3 г 2,4-дихлорфенилметилсульфона.
Водный раствор (1 мл) 360 мг гидроксида калия добавляли к раствору 1 г 2,4-дихлорфенилметилсульфона в диметилсульфоксиде (3 мл) и перемешивали при 100°C в течение 4 часов. Смесь подкисляли водным 1 н. раствором соляной кислоты, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 2/1), получая 300 мг 3-хлор-4-(метилсульфонил)фенола.
Ссылочный пример 6
Получение трифторацетата 6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинола
Стадия 1. Получение 6-бром-3-пиридинола:
При охлаждении на льду 435 мл изопропилмагнийхлорида (2М раствор в тетрагидрофуране) добавляли к раствору 200 г 2,5-дибромпиридина в тетрагидрофуране (800 мл) и перемешивали при комнатной температуре в течение 1,5 часов. При охлаждении на льду добавляли раствор 214 мл триизопропилбората в тетрагидрофуране (200 мл) и перемешивали в течение ночи при комнатной температуре. При охлаждении на льду реакционную жидкость постепенно добавляли к водному (2,5 л) раствору 160 г гидроксида натрия. Добавляли 1 л воды и 1 л гексана и экстрагировали водный слой. При охлаждении льдом 150 мл водной перекиси водорода (30%) постепенно добавляли к водному слою, что занимало 1 час, и затем перемешивали в течение ночи при комнатной температуре. При охлаждении на льду реакционную жидкость нейтрализовали концентрированной соляной кислотой, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 130 г целевого соединения.
Стадия 2. Получение 2-бром-5-(метоксиметокси)пиридина:
73 мл метоксиметилхлорида добавляли к раствору 129 г полученного 6-бром-3-пиридинола в тетрагидрофуране (1,3 л) и добавляли 32 г гидрида натрия (с добавлением 30% жидкого парафина) таким образом, чтобы внутренняя температура не могла превысить -10°C. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9,1 до 8/1), получая 105 г целевого соединения в виде бесцветного масла.
Стадия 3. Получение 5-(метоксиметокси)-2-пиридинкарбонитрила:
88,9 г цианида цинка и 29,1 г тетракис(трифенилфосфин)палладия(0) добавляли к раствору 105 г полученного масла в диметилформамиде (1100 мл) и перемешивали при 105°C в течение 1 часа. Охлаждали до комнатной температуры, добавляли 1,5 л этилацетата и 1,2 л воды и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали, растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = 8/1-7/1-2/1), получая 53,4 г целевого соединения.
Стадия 4. Получение 6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинола:
При охлаждении на льду 35,4 мл гидроксиламина (50% водный раствор) добавляли к раствору 41 г полученного продукта в этаноле (400 мл) и перемешивали при комнатной температуре в течение 30 минут. При охлаждении льдом добавляли 1 л воды и перемешивали в течение 1 часа. Образовавшийся кристалл отделяли фильтрованием, получая 39,5 г продукта.
200 мл уксусной кислоты добавляли к 39,5 г полученного кристалла и, при охлаждении льдом, добавляли 20,8 мл уксусного ангидрида и перемешивали при комнатной температуре в течение 1 часа. Смесь нагревали также при 70°C и перемешивали в течение ночи. Растворитель реакции выпаривали при пониженном давлении и к полученному твердому веществу коричневого цвета добавляли 100 мл трифторуксусной кислоты и перемешивали при комнатной температуре в течение 3 часов. Растворитель выпаривали при пониженном давлении и к остатку добавляли смесь гексан/этилацетат = 20/1 и перемешивали. Полученный твердый продукт отделяли фильтрованием и высушивали, получая 57,1 г целевого соединения в виде его трифторацетата.
Ссылочный пример 7
Получение 4-(5-метил-1,2,4-оксадиазол-3-ил)фенола
Стадия 1. Получение 4-(метоксиметокси)бензонитрила:
Используя 4-цианофенол, целевое соединение получали тем же способом, как в ссылочном примере 6 (стадия 2), или в соответствии с этим способом, или его комбинацией с обычным способом.
Стадия 2. 4-(5-Метил-1,2,4-оксадиазол-3-ил)фенол:
Используя 4-(метоксиметокси)бензонитрил, целевое соединение получали тем же способом, как в ссылочном примере 6 (стадия 4), или в соответствии с этим способом, или его комбинацией с обычным способом.
Ссылочный пример 8
1-(4-гидроксифенил)пирролидин-2-он
Стадия 1. Получение 1-йод-4-(метоксиметокси)бензола:
2,33 мл N,N-диизопропилэтиламина и 900 мкл метоксиметилхлорида добавляли к раствору 2 г 4-йодфенола в хлороформе (20 мл) и перемешивали в течение ночи при комнатной температуре. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат), получая 1,08 г целевого соединения в виде бесцветного масла.
Стадия 2. Получение 1-(4-гидроксифенил)пирролидин-2-она:
5 мкл этилендиамина, 14,5 мг йодида меди(I) и 321 мг фосфата калия добавляли к раствору (2 мл) 200 мг соединения, полученного на стадии 1, и 70 мкл 2-пирролидона в 1,4-диоксане и перемешивали в течение ночи в атмосфере азота при 110°C. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, разбавляли этилацетатом и нерастворимое вещество удаляли фильтрованием через Целит. Экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол), получая 174 мг промежуточного соединения.
250 мкл 4 н. раствора соляной кислоты/диоксана и 10 мкл воды добавляли к раствору (1,0 мл) 80 мг полученного промежуточного продукта в 1,4-диоксане и перемешивали при комнатной температуре в течение 2,5 часов. После концентрации смесь делали азеотропной с помощью хлороформа и остаток отверждали диэтиловым эфиром, получая 60,1 мг целевого соединения в виде твердого вещества белого цвета.
Ссылочный пример 9
Получение 1-(4-гидроксифенил)пиридин-2(1Н)-она
Раствор 200 мг соединения, полученного в ссылочном примере 11 (стадия 11), 72 мг 2-гидроксипиридина, 29 мг йодида меди(I), 210 мг карбоната калия и 22 мг (1R,2R)-(-)-N,N'-диметилциклогексан-1,2-диамина в толуоле (1 мл) перемешивали в течение ночи в атмосфере азота при 115°C. Смесь разбавляли хлороформом, нерастворимое вещество удаляли фильтрованием через Целит и органический слой промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ/метанол), получая 163 мг промежуточного продукта.
80 мг полученного промежуточного продукта растворяли в 1,5 мл воды и 500 мкл хлороформа и добавляли 500 мкл 4 н. раствора соляной кислоты/диоксана и 10 мкл воды и перемешивали при комнатной температуре в течение 40 минут. После концентрации смесь делали азеотропной с помощью хлороформа и остаток отверждали простым эфиром, получая 65,6 мг целевого соединения в виде твердого вещества белого цвета.
Ссылочный пример 10
5-Гидроксипиридин-2-карбонитрил
Это соединение получали комбинируя стадию 3 и стадию 4 ссылочного примера 6.
Ссылочный пример 11
6-(Метоксиметил)пиридин-3-ол
Стадия 1. Получение 5-бензилокси-2-метилпиридина:
140 г 3-гидрокси-6-метилпиридина растворяли в 1,4 л диметилформамида и при охлаждении на льду добавляли 178 мл бензилхлорида и перемешивали в течение ночи при комнатной температуре. Реакционную жидкость выливали в воду со льдом, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 40/1 до 2/1), получая 246,7 г целевого соединения в виде оранжевого масла.
Стадия 2. Получение [5-(бензилокси)пиридин-2-ил]метанола:
При охлаждении на льду 335,8 г м-хлорпербензойной кислоты добавляли к раствору 246,7 г полученного масла в хлороформе (2,8 л) и перемешивали в течение 1 часа. Реакционную жидкость промывали водным 10% раствором карбоната натрия и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток перекристаллизовывали (гексан/этилацетат), получая 256,2 г светло-желтого кристалла.
600 мл уксусного ангидрида добавляли к 266 г полученного кристалла, постепенно нагревали и перемешивали при 120°C в течение 20 минут. Растворитель выпаривали при пониженном давлении, к остатку добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 50/1 до 2/1), получая 259 г коричневого масла.
259 г полученного масла растворяли в 2 л этанола и 500 мл воды, добавляли 80 г гидроксида натрия и нагревали с обратным холодильником в течение 30 минут. Растворитель выпаривали при пониженном давлении, добавляли к остатку 300 мл воды и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором и высушивали над безводным сульфатом магния. После высушивания растворитель выпаривали при пониженном давлении и остаток перекристаллизовывали (диэтиловый эфир), получая 142,2 г целевого соединения в виде коричневого кристалла.
Стадия 3. Получение 6-(метоксиметил)пиридин-3-ола:
169 г полученного коричневого кристалла растворяли в 1,6 л тетрагидрофурана и при охлаждении на льду добавляли 37,7 г гидрида натрия (с добавлением 30% жидкого парафина) и перемешивали при комнатной температуре 1 час. При охлаждении на льду постепенно по каплям добавляли 53,7 мл йодометана и перемешивали в течение ночи при комнатной температуре. При охлаждении на льду добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 60/1 до 2/1), получая 162,7 г оранжевого масла. 91,4 г полученного масла растворяли в 900 мл этанола, добавляли 13 г 10% палладия на угле и перемешивали в атмосфере водорода в течение 2 часов. После фильтрования растворитель выпаривали при пониженном давлении и остаток перекристаллизовывали (этилацетат/гексан), получая 53,0 г целевого соединения в виде светло-желтого кристалла.
Ссылочный пример 12
6-(5-Метил-1,3,4-оксадиазол-2-ил)пиридин-3-ол
Это соединение получали согласно способу, описанному в European Journal of Pharmaceutical Science, Vol.15, No.4, pp.367-378.
Ссылочный пример 13
6-(3-Метил-1,2,4-оксадиазол-5-ил)пиридин-3-ол
Это соединение получали согласно способу, описанному в European Journal of Pharmaceutical Science, Vol.15, No.4, pp.367-378.
Ссылочный пример 14
6-(1-Метил-1Н-тетразол-5-ил)пиридин-3-ол
Стадия 1. Получение 4-(бензилокси)-N-метилбензамида:
1,77 г гидрохлорида метиламина добавляли к раствору 3 г 4-бензилоксибензойной кислоты в пиридине (60 мл), добавляли 5,04 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и перемешивали при комнатной температуре. После реакции растворитель выпаривали при пониженном давлении, остаток разбавляли этилацетатом и промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток перекристаллизовывали из смеси хлороформ/гексан и отделяли фильтрованием, получая 2,272 г целевого соединения.
Стадия 2. Получение 6-(1-метил-1Н-тетразол-5-ил)пиридин-3-ола:
1 г полученного кристалла растворяли в 20 мл толуола, добавляли 0,36 мл тионилхлорида и перемешивали в течение ночи при 90°C. Растворитель выпаривали при пониженном давлении, добавляли 10 мл ацетонитрила, 0,54 г азида натрия и 1,1 мл хлортриметилсилана и перемешивали в течение ночи при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и промывали насыщенным водным бикарбонатом натрия и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан-гексан/этилацетат = 1/1), получая 0,75 г промежуточного продукта.
0,75 г полученного промежуточного продукта растворяли в 10 мл этанола, добавляли 30 мг палладия на угле и перемешивали в атмосфере водорода при комнатной температуре. После фильтрования растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: хлороформ-хлороформ/метанол = 5/1), получая 0,24 г целевого соединения в виде кристалла.
Ссылочный пример 15
6-(1,3-Оксазол-4-ил)пиридин-3-ол
Стадия 1. Получение 4-(4-метоксифенил)-1,3-оксазола:
10 мл формамида добавляли к 2 г 2-бром-4'-метоксиацетофенона и перемешивали при 180°C в течение 20 минут. Охлаждали до комнатной температуры, разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан-гексан/этилацетат = 7/3), получая 0,76 г целевого соединения.
Стадия 2. Получение 6-(1,3-оксазол-4-ил)пиридин-3-ола:
При охлаждении на льду 12 мл 1М раствора трифторида бора/дихлорметана добавляли к раствору 0,76 г полученного соединения в хлороформе (8 мл) и перемешивали в течение 4 часов. Добавляли воду, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат = от 9/1 до 1/1), получая 0,36 г целевого соединения.
Ссылочный пример 16
Получение 6-(2-фторфенил)пиридин-3-ола
Водный раствор (1 мл) 127 мг 2-фторфенилбороновой кислоты, 240 г карбоната натрия и 53,4 мг дихлорбис(трифенилфосфин)палладия добавляли к раствору 200 мг 1-йод-4-(метоксиметокси)бензола, полученного в ссылочном примере 11 (стадия 1), в тетрагидрофуране (4 мл) и перемешивали в течение ночи в атмосфере азота при нагревании с обратным холодильником. При охлаждении на льду добавляли насыщенный водный раствор хлорида аммония, разбавляли этилацетатом и нерастворимое вещество удаляли фильтрованием через Целит. Экстрагировали этилацетатом и органический слой промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат), получая 135 мг бесцветного масла.
750 мкл 4 н. раствора соляной кислоты/диоксана и 10 мкл воды добавляли к раствору (3 мл) 67 мг полученного бесцветного масла в 1,4-диоксане и перемешивали при комнатной температуре в течение 3 часов. После концентрации смесь делали азеотропной с помощью хлороформа, получая 53,7 мг целевого соединения в виде твердого вещества белого цвета.
Ссылочный пример 17
Получение 4-(2-метил-2Н-тетразол-5-ил)фенола
Это соединение было получено согласно способу, описанному в European Journal of Pharmaceutical Science, Vol.15, No.4, pp.367-378.
Ссылочный пример 18
Получение 5-фторпиридин-2-карбоновой кислоты
Стадия 1. Получение 2-хлор-5-фторпиридина:
При охлаждении на льду 16,3 мл 42% тетрафторборной кислоты добавляли к раствору 5 г 5-амино-2-хлорпиридина в этаноле (50 мл), затем постепенно по каплям добавляли водный раствор (10 мл) 2,95 г нитрита натрия и перемешивали в течение 10 минут. Полученный твердый продукт отделяли фильтрованием, получая 9,9 г твердого вещества желтого цвета. Добавляли 100 мл гептана и нагревали с обратным холодильником. После реакции добавляли водный бикарбонат натрия, экстрагировали диэтиловым эфиром и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/хлороформ), получая 1,32 г целевого соединения в виде светло-желтого масла.
Стадия 2. Получение этил 5-фторпиридин-2-карбоксилата:
1,57 г карбоната калия, 0,34 г 1,3-бис(дифенилфосфино)пропана и 0,17 г ацетата палладия добавляли к раствору 1 г 2-хлор-5-фторпиридина в 8 мл диметилформамида и 8 мл этанола и перемешивали в атмосфере угарного газа при 90°C в течение 2 часов. Реакционную жидкость отфильтровывали, фильтрат экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат), получая 0,97 г целевого соединения в виде белого кристалла.
Стадия 3. Получение 5-фторпиридин-2-карбоновой кислоты:
2,4 мл водного 2,5 н. раствора гидроксида натрия добавляли к раствору 0,44 г этил 5-фторпиридин-2-карбоксилата в 5 мл тетрагидрофурана и 2 мл метанола и перемешивали при комнатной температуре в течение 15 минут. Смесь нейтрализовали водным 10% раствором лимонной кислоты, экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 0,41 г целевого соединения в виде белого кристалла.
Ссылочный пример 19
Получение 5-метоксипиридин-2-карбоновой кислоты
100 мг этил 5-фторпиридин-2-карбоксилата, полученного в ссылочном примере 18 (стадия 2), растворяли в 1 мл диметилформамида и 1 мл метанола, добавляли 163 мг карбоната калия и перемешивали при 90°C в течение 40 минут. Смесь нейтрализовали водным 10% раствором лимонной кислоты, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на колонках с силикагелем (проявляющий растворитель: гексан/этилацетат), получая 46,5 мг метил 5-метоксипиридин-2-карбоксилата в виде белого кристалла.
Полученное сложноэфирное соединение растворяли в 0,5 мл метанола и 0,5 мл тетрагидрофурана, добавляли 0,52 мл водного 1 н. раствора гидроксида натрия и перемешивали при комнатной температуре в течение 2 часов. Смесь нейтрализовали водным 10% раствором лимонной кислоты, экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором. После высушивания растворитель выпаривали при пониженном давлении, получая 17,2 мг целевого соединения в виде белого кристалла.
Промышленная применимость
Арилоксизамещенные производные бензимидазола формулы (I) и их фармацевтически приемлемые соли по изобретению имеют превосходный эффект в отношении активации глюкокиназы и могут быть использованы в области лекарственных средств для лечения и/или профилактики диабета, осложнений диабета или ожирения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ 2-ГЕТЕРОАРИЛ-ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА | 2004 |
|
RU2329261C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2004 |
|
RU2346938C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНОПИРРОЛИДИНА | 2002 |
|
RU2270192C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| ЗАМЕЩЕННЫЕ ФЕНОКСИУКСУСНЫЕ КИСЛОТЫ, ОБЛАДАЮЩИЕ МОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ РЕЦЕПТОРОВ CRTh2 | 2004 |
|
RU2372330C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2013 |
|
RU2652117C2 |
| Новые соединения пиридопиримидинона для модулирования каталитической активности гистонлизиндеметилаз (KDMS) | 2015 |
|
RU2684396C2 |
| БЕНЗИМИДАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2005 |
|
RU2374234C2 |
| ПИРАЗОЛО[3,4-С]ПИРИДИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2638116C2 |
| ИСПОЛЬЗОВАНИЕ ЛИГАНДОВ РЕЦЕПТОРА ЕР4 ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ IL-6 ЗАБОЛЕВАНИЙ | 2003 |
|
RU2285527C2 |
Изобретение относится к соединению формулы (I)
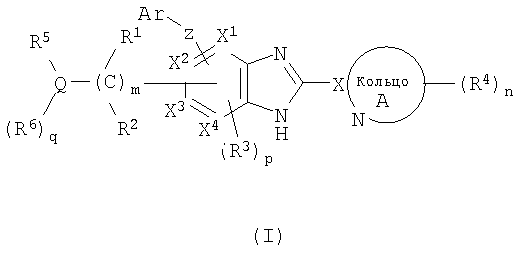 или его фармацевтически приемлемой соли, где R1 и R2, каждый независимо, обозначают атом водорода, атом галогена, низший алкил, гидроксильную группу, цианогруппу или низший алкокси; R3 независимо обозначает атом водорода, атом галогена, низший алкил, низший алкокси, гидроксиалкил, трифторметил, низший алкенил или цианогруппу; R4 независимо обозначает атом водорода, низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, аминоалкил, необязательно замещенный низшим алкилом, алканоил, карбоксильную группу, низший алкоксикарбонил или цианогруппу; Q обозначает атом азота; R5 и R6, каждый независимо, обозначают атом водорода, низший алкил, атом галогена, низший алкилсульфонил, низший алкилсульфинил, алканоил, формил, арил, моно- или ди-(низший) алкилкарбамоил или моно- или ди-(низший) алкилсульфамоил; и далее, как указано в формуле изобретения. Кроме того, изобретение относится к активатору глюкокиназы, включающему соединение по п.1, и к терапевтическому средству на основе этих соединений. Технический результат: получены и описаны новые соединения, которые могут быть полезны в лечении и профилактике диабета и ожирения. 4 н. и 25 з.п. ф-лы, 8 табл.
или его фармацевтически приемлемой соли, где R1 и R2, каждый независимо, обозначают атом водорода, атом галогена, низший алкил, гидроксильную группу, цианогруппу или низший алкокси; R3 независимо обозначает атом водорода, атом галогена, низший алкил, низший алкокси, гидроксиалкил, трифторметил, низший алкенил или цианогруппу; R4 независимо обозначает атом водорода, низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, аминоалкил, необязательно замещенный низшим алкилом, алканоил, карбоксильную группу, низший алкоксикарбонил или цианогруппу; Q обозначает атом азота; R5 и R6, каждый независимо, обозначают атом водорода, низший алкил, атом галогена, низший алкилсульфонил, низший алкилсульфинил, алканоил, формил, арил, моно- или ди-(низший) алкилкарбамоил или моно- или ди-(низший) алкилсульфамоил; и далее, как указано в формуле изобретения. Кроме того, изобретение относится к активатору глюкокиназы, включающему соединение по п.1, и к терапевтическому средству на основе этих соединений. Технический результат: получены и описаны новые соединения, которые могут быть полезны в лечении и профилактике диабета и ожирения. 4 н. и 25 з.п. ф-лы, 8 табл.
1. Соединение формулы (I)
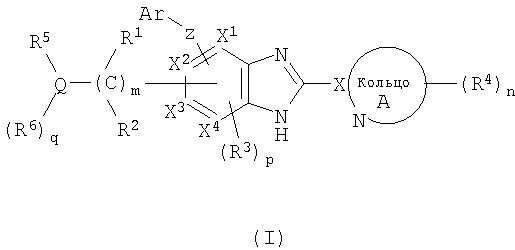
или его фармацевтически приемлемая соль, в которой
R1 и R2, каждый независимо, обозначают атом водорода, атом галогена, низший алкил, гидроксильную группу, цианогруппу или низший алкокси;
R3 независимо обозначает атом водорода, атом галогена, низший алкил, низший алкокси, гидроксиалкил, трифторметил, низший алкенил или цианогруппу;
R4 независимо обозначает атом водорода, низший алкил, низший алкокси, атом галогена, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, аминоалкил, необязательно замещенный низшим алкилом, алканоил, карбоксильную группу, низший алкоксикарбонил или цианогруппу;
Q обозначает атом азота;
R5 и R6, каждый независимо, обозначают атом водорода, низший алкил, атом галогена, низший алкилсульфонил, низший алкилсульфинил, алканоил, формил, арил, моно- или ди-(низший) алкилкарбамоил или моно- или ди-(низший) алкилсульфамоил; или Q, R5 и R6 вместе могут образовывать следующее:
(A) 5- или 6-членную алифатическую азотсодержащую гетероциклическую группу, которая может иметь в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота и атома кислорода, и имеющую по меньшей мере один атом азота в дополнение к гетероатомам; указанная гетероциклическая группа может иметь одну или две двойные связи;
(B) 5- или 6-членную ароматическую азотсодержащую гетероциклическую группу, которая может иметь в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота и атома кислорода, и имеющую по меньшей мере один атом азота в дополнение к гетероатомам, или
(C) фенил,
и алифатическая азотсодержащая гетероциклическая группа, ароматическая азотсодержащая гетероциклическая группа или фенил могут иметь от 1 до 3 групп, выбранных из следующей группы заместителей α, и/или могут иметь в качестве заместителя 3-6-членное кольцо, образованное соединением друг с другом связываемых групп, выбранных из группы заместителей α, и/или могут конденсироваться с группой формулы (А):
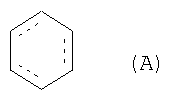
в которой  обозначает простую связь или двойную связь;
обозначает простую связь или двойную связь;
X1, X2 X3 и X4, каждый независимо, обозначают атом углерода;
Z обозначает атом кислорода или атом серы;
Ar обозначает арил или гетероарил, необязательно замещенный группами числом от 1 до 3, выбранными из следующей группы заместителей β;
кольцо А обозначает 5- или 6-членную азотсодержащую гетероароматическую группу формулы (III):
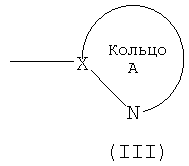
представляет собой пиразинил или пиридил;
m обозначает целое число от 1 до 6;
n обозначает целое число от 0 до 3;
р обозначает целое число от 0 до 2;
q обозначает 0 или 1;
группа заместителей α:
оксогруппа, тиоксогруппа, низший алкил, низший алкокси, алканоил, формил, гидроксильная группа, карбоксильная группа, трифторметил, гидроксиалкил, необязательно замещенный низшим алкилом, цианогруппа, моно- или ди-(низший) алкилкарбамоил, низший алкилсульфинил, низший алкилсульфонил и атом галогена;
группа заместителей β:
низший алкил, низший алкокси, атом галогена, трифторметил, низший алкилсульфонил, низший алкилсульфанил, низший алкилсульфинил, цианогруппа, арил и гетероарил, имеющий в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота и атома кислорода;
указанный арил и гетероарил могут иметь одну или две группы, выбранные из следующей группы заместителей γ;
группа заместителей γ;
низший алкил, низший алкокси, атом галогена, гидроксильная группа, низший алкилсульфонил.
2. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) представлена формулой (1-2)
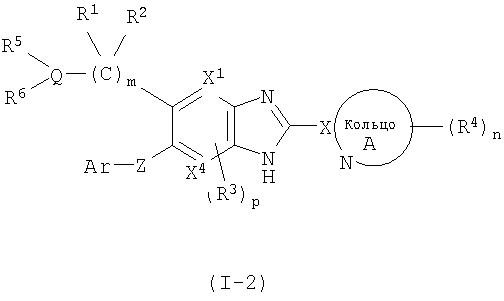
в которой символы имеют те же самые значения, как определено выше.
3. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) представлена формулой (1-3):
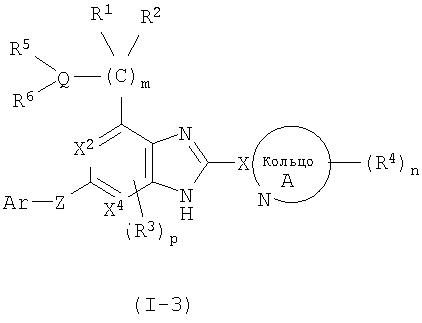
в которой символы имеют те же самые значения, как определено выше.
4. Соединение или его фармацевтически приемлемая соль по п.1, в котором m составляет от 1 до 4.
5. Соединение или его фармацевтически приемлемая соль по п.1, в котором Ar обозначает фенил, фурил, тиенил, пирролил, имидазолил, триазолил, пиразолил, тиазолил, тиадиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиримидинил, пиридазинил или пиразинил, который может быть замещен группой, выбранной из группы заместителей β.
6. Соединение или его фармацевтически приемлемая соль по п.1, в котором R5 и R6, каждый независимо, обозначает атом водорода, низший алкил, атом галогена, низший алкилсульфонил, низший алкилсульфинил, алканоил или формил.
7. Соединение или его фармацевтически приемлемая соль по п.1, в котором группа формулы (I-A)
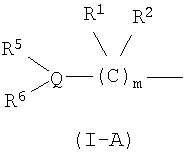
в формуле (1-1) представляет собой группу следующей формулы
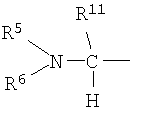
в которой R11 обозначает атом водорода или низший алкил; а другие символы имеют те же самые значения, как определено выше.
8. Соединение или его фармацевтически приемлемая соль по п.1, в котором
R5 и R6 вместе с атомом азота образуют 5-или 6-членную алифатическую азотсодержащую гетероциклическую группу, которая может иметь в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота и атома кислорода, и имеющую по меньшей мере один атом азота в дополнение к гетероатомам;
указанная 5- или 6-членная алифатическая азотсодержащая гетероциклическая группа может иметь одну или две двойные связи и может быть моно- или дизамещенной одинаковыми или разными группами, выбранными из следующей группы заместителей α1;
m=1;
Z обозначает атом кислорода;
Ar обозначает фенил или пиридил, необязательно моно- или дизамещенный одинаковыми или разными группами, выбранными из следующей группы заместителей β1;
R1 и R2 обозначают независимо атом водорода или низший алкил,
группа заместителей α1:
оксогруппа, тиоксогруппа, низший алкил, низший алкокси, алканоил, атом галогена, цианогруппа, моно- или ди-(низший) алкилкарбамоил;
группа заместителей β1:
низший алкил, низший алкокси, атом галогена, трифторметил, низший алкилсульфонил, цианогруппа, арил или гетероарил, имеющий в кольце 2 или 3 гетероатома, выбранные из группы, состоящей из атома азота и атома кислорода;
указанный арил и гетероарил могут иметь одну или две группы, выбранные из группы заместителей γ.
9. Соединение или его фармацевтически приемлемая соль по п.1, в котором Q, R5 и R6 вместе образуют 5- или 6-членную ароматическую азотсодержащую гетероциклическую группу, имеющую по меньшей мере один атом азота, необязательно имеющую в кольце от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома азота и атома кислорода, в дополнение к атому азота, или фенил;
указанная ароматическая гетероциклическая группа или фенил могут иметь от 1 до 3 групп, выбранных из следующей группы заместителей α2;
Z обозначает атом кислорода;
Ar обозначает фенил или пиридил, необязательно моно- или дизамещенный одинаковыми или разными группами, выбранными из следующей группы заместителей β1;
R1 и R2 обозначают независимо атом водорода или низший алкил;
группа заместителей α2:
гидроксильная группа, низший алкил, низший алкокси, алканоил, атом галогена, цианогруппа и моно- или ди-(низший) алкилкарбамоил;
группа заместителей β1:
низший алкил, низший алкокси, атом галогена, трифторметил, низший алкилсульфонил, цианогруппа, арил или гетероарил, имеющий в кольце 2 или 3 гетероатома, выбранные из группы, состоящей из атома азота и атома кислорода;
указанный арил и гетероарил могут иметь одну или две группы, выбранные из группы заместителей γ.
10. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает
1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-тиоксо-2-пирролидинон,
4-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}морфолин-3,5-дион,
3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2,4-дион,
3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2-он,
1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион,
1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метилимидазолидин-2,5-дион,
2-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}изотиазолидин-1,1-диоксид,
3-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон,
1-{[5-{[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион,
1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]-2-пирролидинон,
N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил}метил)-N-метилацетамид,
3-{[5-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион,
5-[4-(этилсульфонил)фенокси]-6-((2-метил-2Н-тетразол-5-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол,
5-[4-(этилсульфонил)фенокси]-6-(1-(1-метил-1Н-тетразол-5-ил)этил)-2-(2-пиридинил)-1Н-бензимидазол,
1-[(6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он
или
4-(2,6-дифторбензил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол.
11. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 1-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-5-тиоксо-2-пирролидинон.
12. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 4-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}морфолин-3,5-дион.
13. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2,4-дион.
14. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 3-{[5-[4-(метилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-тиазолан-2-он.
15. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион.
16. Соединение или его фармацевтически приемлемая соль или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 1-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-3-метилимидазолидин-2,5-дион.
17. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 2-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}изотиазолидин-1,1-диоксид.
18. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 3-{[5-[4-(этилсульфонил)фенокси]-2-(2-пиразинил)-1Н-бензимидазол-6-ил]метил}-2-оксазолидинон.
19. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 1-{[5-{[6-(этилсульфонил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}пирролидин-2,5-дион.
20. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 1-[(5-{[6-(5-метил-1,2,4-оксадиазол-3-ил)-3-пиридинил]окси}-2-(2-пиридинил)-1Н-бензимидазол-6-ил)метил]-2-пирролидинон.
21. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает N-({5-[4-(этилсульфонил)фенокси]-2-(2-пиридииил)-1Н-бензимидазол-6-ил} метил)-N-метилацетамид.
22. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 3-{[5-[4-(5-метил-1,2,4-оксадиазол-3-ил)фенокси]-2-(2-пиридинил)-1Н-бензимидазол-6-ил]метил}-1,3-оксазолидин-2,4-дион.
23. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 5-[4-(этилсульфонил)фенокси]-6-((2-метил-2Н-тетразол-5-ил)метил)-2-(2-пиридинил)-1Н-бензимидазол.
24. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 5-[4-(этилсульфонил)фенокси]-6-(1-(1-метил-1Н-тетразол-5-ил)этил)-2-(2-пиридинил)-1Н-бензимидазол.
25. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 1-[(6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиридин-2-ил-1Н-бензимидазол-4-ил)метил]пирролидин-2-он.
26. Соединение или его фармацевтически приемлемая соль по п.1, в котором формула (I) обозначает 4-(2,6-дифторбензил)-6-{[6-(этилсульфонил)пиридин-3-ил]окси}-2-пиразин-2-ил-1Н-бензимидазол.
27. Активатор глюкокиназы, включающий соединение или фармацевтически приемлемую соль по любому из пп.1-26 в качестве активного ингредиента.
28. Терапевтические и/или профилактические средства для лечения и/или профилактики диабета, содержащие соединение или фармацевтически приемлемую соль по любому из пп.1-26 в качестве активного ингредиента.
29. Терапевтические и/или профилактические средства для лечения и/или профилактики ожирения, содержащие соединение или фармацевтически приемлемую соль по любому из пп.1-26 в качестве активного ингредиента.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| α-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ | 2000 |
|
RU2219172C2 |
Авторы
Даты
2010-09-10—Публикация
2005-11-01—Подача