Изобретение относится к методам введения изотопной метки в пептиды и белки, для их последующего количественного определения с использованием масс-спектрометрии, метода, которому по части чувствительности и универсальности подходов для количественного анализа биоорганических соединений нет равных, но использование которого для этих целей возможно только при наличии стандартов, химически идентичных измеряемым соединениям, но отличающимися изотопным составом, путем включения стабильных изотопов (2Н, 13С, 15N, 18О).
Особенно важно получение белков и их пептидных фрагментов, в которые включены стабильные изотопы, поскольку это открывает новые возможности для клинической протеомики и для раздела биологической науки, изучающей экспрессированные геномом белки. Известно, что возникновение патологических состояний у человека обусловлено изменением концентраций отдельных компонентов протеом. Именно мониторинг этих изменений открывает возможность, как для понимания патологических процессов, так и для разработки новых методов лечения или диагностики различных болезней.
Таким образом, изобретение найдет широкое применение в биотехнологии, медицине, органической химии и других областях науки и техники.
Известен способ введения стабильных изотопов в биоорганическое соединение для количественной масс-спектрометрии, заключающийся в использовании изотопсодержащих исходных веществ в процессах их биосинтеза с использованием изотопно-меченых предшественников. Так для получения изотопно-меченых белков для биосинтеза используют аминокислоты, уже имеющих стабильные изотопы [1]. Недостатком этого способа является то, что он пригоден только для пептидов и белков, получаемых в процессе только микробиологического биосинтеза, и не пригоден для получения белков млекопитающих, в том числе и человека. В качестве источника изотопсодержащих компонентов используются коммерческие образцы изотопсодержащих аминокислот, из которых лишь малая доля используется для включения в целевой продукт, таким образом процесс является достаточно дорогостоящими. Кроме того, способ требует разработки специальных технологий выделения каждого из отдельных изотопсодержащих объектов, которые используются далее как стандарты.
Таким образом, известный способ далеко не универсален и не технологичен, и хотя он и сохраняет первичную структуру образца, и полученная в результате его применения изотопная метка стабильна, используется преимущественно для изучения клеточных моделей.
Известен также способ [2], основанный на введении изотопов в вещество путем обработки специфических участков (функциональных групп) молекул вещества реагентом, содержащим стабильные изотопные метки, при этом часто используют модификацию по SH-группам или аминогруппам. При этом способе должна быть обеспечена достаточно полная или идентичная степень модификации, как в образце, так и в стандарте для получения достоверных результатов. Кроме того, необходимо последующее фракционирование для отделения реагентов от целевых продуктов, что значительно осложняет процесс подготовки проб к анализу. Таким образом, способ получения изотопно-модифицированных соединений осложнен необходимостью выделения целевых продуктов и не сохраняет первичную структуру образца.
Ближайшим из известных способов получения изотопно-модифицированных биоорганических соединений является принятый в качестве прототипа [3] способ, который заключается во введении изотопа 18О при протеолизе белков или пептидов в присутствии Н2 18О и ферментов, преимуществом которого по сравнению с известными способами является отсутствие дополнительных стадий в процессе приготовления образца, однако этот способ имеет ряд существенных недостатков. В процессе введения метки нарушается исходная целостность объекта, и изотопно-мечеными являются не исходные пептиды и белки, а их фрагменты.
Поскольку известный способ заключается во введении изотопа 18О при протеолизе белков или пептидов в присутствии Н2 18О и ферментов, использование и сохранение такой метки требует соблюдения особых условий: так на определенном этапе необходимо инактивировать ферменты (например, изменить рН раствора до значений, при которых фермент не активен) до переноса в среду, содержащую Н2 16О.
Задачей предлагаемого изобретения является получение устойчивых к разрушению (распаду) изотопно-модифицированных меток, пригодных к количественному масс-спектрометрическому анализу при сохранении исходной структуры соединений и одновременном упрощении способа.
Указанная задача решается за счет введения изотопной метки в карбоксильные группы пептидов и белков, которые помещают в смесь H2 18O с трифторуксусной кислотой и выдерживают в ней при температуре, не вызывающей нарушения первичной структуры. Далее кислоту удаляют нейтрализацией, либо раствор высушивают или пропускают через хроматографическую колонку.
Предлагаемая здесь в качестве катализатора трифторуксусная кислота отвечает сразу двум необходимым требованиям: 1) обладает высокой каталитической активностью в реакции изотопного обмена подобно сильным минеральным кислотам и едким щелочам, и 2) практически не нарушает первичную структуру пептидов и белков, которая в присутствии сильных минеральных кислот и щелочей разрушается [4].
Благодаря такому уникальному сочетанию свойств, способ введения изотопа 18О в присутствии трифторуксусной кислоты оказался пригодным для получения ранее труднодоступных изотопных стандартов белков и пептидов, необходимых для количественного анализа методами масс-спектрометрии.
Введение метки осуществляется независимым образом и в каждую из карбоксильных групп соединения, поэтому степень введения стабильного изотопа 18О пропорциональна количеству имеющихся в образце карбоксильных групп. Полученные соединения сохраняют метку после удаления сильной кислоты и таким образом пригодны для использования в качестве стандартов.
Отметим, что практически во всех белках наиболее широко представлены карбоксилсодержащие аминокислоты, а в пептидах, как правило, присутствует С-концевая карбоксильная группа, также пригодная для введения изотопной метки, вводимой путем изотопного обмена в карбоксильных группах в сильнокислой среде в присутствии воды H2 18O.
Предложенный способ осуществляется следующим образом.
Пептид или белок выдерживается в присутствии в H2 18O в сильной кислоте с рКα<2. Обмен осуществляется во всех карбоксильных группах (как для боковых, так и для концевых аминокислот). Поскольку карбоксилсодержащие аминокислоты широко представлены в белках, метод является пригодным практически для большинства подобных соединений, при этом степень введения 18O пропорциональна количеству имеющихся групп, а время выдерживания образца в растворе и температура раствора подбираются таким образом, чтобы не происходило нарушения первичной структуры. Далее кислота нейтрализуется или удаляется из раствора пропусканием через хроматографическую колонку или высушиванием. Полученные образцы содержат органическое соединение, у которого в карбоксильных группах 16О обменен на 18О, готовое к использованию в качестве анализируемого объекта или стандарта.
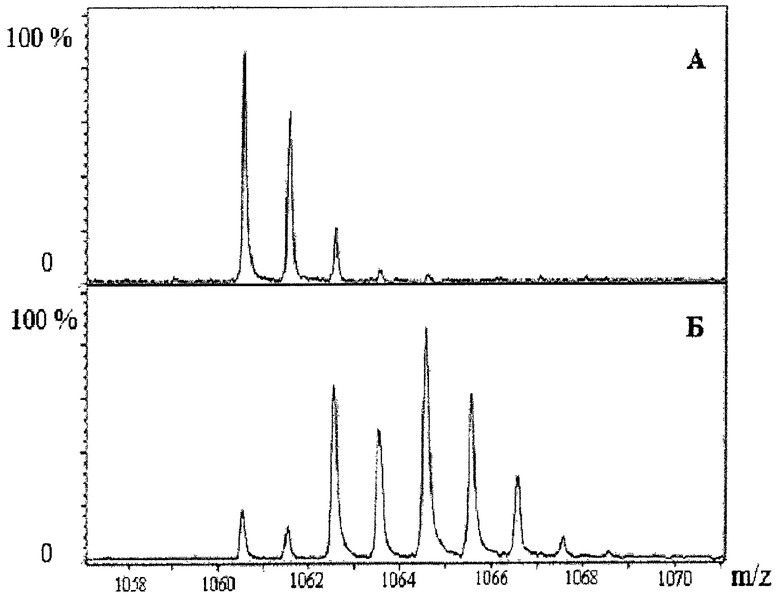
На Фиг.1 представлены фрагменты масс-спектров, демонстрирующих изотопное распределение в брадикинине до (А) и после обмена (Б). Из сравнения спектров видно, что обмен произошел и имеет место включение от одного до двух атомов 18О.
Примеры осуществления предложенного способа.
1. Получение брадикинина с обмененными атомами 16О на 18О.
Сухие 0,3 мг брадикинина растворялись в 93 мкл раствора, содержащего 40 мкл (90%) Н2 18О, 50 мкл ацетонитрила и 3 мкл трифторуксусной кислоты. Пептид в этом растворе инкубировался при 50°С в течение 5 часов, затем высушивался на вакуумной центрифуге. Далее пептид перерастворялся в обычной воде и использовался в качестве стандарта для количественного масс-спектрометрического анализа.
2. Получение трипсиногена (Tgn) с обмененными атомами 16О на 18О. Сухие 0,1 мг Tgn растворялись в 50 мкл раствора, содержащего 90% Н2 18О и 3 мкл трифторуксусной кислоты. Белок в этом растворе инкубировался при 50°С в течение 3 часов, затем высушивался на вакуумной центрифуге. Далее белок перерастворялся в обычной воде и использовался в качестве стандарта для количественного масс-спектрометрического анализа.
3. Получение никотиновой кислоты с обмененными атомами 16О на 18О. Сухие 0,3 мг никотиновой кислоты растворялись в 50 мкл раствора, содержащего 90% Н2 18О и 5 мкл трифторуксусной кислоты. Кислота в этом растворе инкубировалась при 50°С в течение 5 часов, затем высушивалась на вакуумной центрифуге. Далее никотиновая кислота перерастворялась в обычной воде и использовалась в качестве стандарта для количественного масс-спектрометрического анализа.
В заключение укажем на преимущества предлагаемого способа получения изотопно-модифицированных пептидов и белков:
- Предлагаемый способ не требует химической модификации анализируемого образца и не загрязняет пробу посторонними примесями. Введение изотопов не влияет на хроматографическую и электрофоретическую подвижность исследуемого соединения.
- Получаемая метка стабильна в водных растворах при широком диапазоне рН (от 3 до 9).
- Предлагаемый способ может быть использован для изучения кинетики метаболизма и ферментативной активности in vivo, поскольку получаемая метка достаточно устойчива в биологических тканях.
- Предлагаемый способ прост в применении, протекает достаточно быстро (в течении нескольких часов), причем степень введения метки можно контролировать масс-спектрометрически.
- Карбоксильные группы, по которым идет обмен 16О на 18О, значительно распространены в природе, что заметно расширяет область применения предлагаемого способа по сравнению с другими.
- Предлагаемый метод может быть использован для анализа соединений в биологических средах без предварительного фракционирования.
- Предлагаемый способ применим в медицине для количественных измерений даже при недоступности индивидуальных стандартов, в частности при анализе биопроб. В этом случае меченый стандарт может быть с успехом приготовлен из биопробы, взятой у контрольной (или здоровой) группы, а вычисленные количественные данные будут представлять собой относительные величины между нормой и патологией.
Источники информации
1. Aebersold R. and Mann M. Mass spectrometry-based proteomics // Nature. 2003. V.422. P.198-207.
2. Smolka M.B., Zhou H., Purkayastha S. and Aebersold R. Optimization of the isotope-coded affinity tag-labeling procedure for quantitative proteome analysis // Anal. Biochem. 2001. V.297. P.25-31.
3. United States Patent 6864089. Labeling of proteomoc samples during proteolysis for quantitation and sample multiplexing (прототип).
4. Dippy, J.F.J.; Hughes, S.R.C.; Rozanski, A. The dissociation constants of some symmetrically disubstituted succinic acids. J. Chem. Soc. 1959, 2492.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественного мультиплексного анализа альфа-2-макроглобулина, фетуина А и сывороточного амилоида А1 как факторов воспаления в сыворотке крови с использованием MALDI-TOF масс-спектрометрии | 2022 |
|
RU2789503C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОИСХОЖДЕНИЯ ЭТАНОЛА В АЛКОГОЛЬНОЙ ПРОДУКЦИИ | 2017 |
|
RU2661606C1 |
| Способ идентификации меда на основе изотопной масс-спектрометрии | 2022 |
|
RU2809285C1 |
| СРЕДСТВО ДЛЯ УХОДА ЗА КОЖЕЙ, ВОЛОСАМИ, НОГТЯМИ, ПОЛОСТЬЮ РТА ЧЕЛОВЕКА, УЛУЧШАЮЩЕЕ ИХ СОСТОЯНИЕ И ВНЕШНИЙ ВИД | 2004 |
|
RU2287318C2 |
| МЕЧЕНЫЕ НЕОРГАНИЧЕСКИЕ ДОБАВКИ | 2006 |
|
RU2430128C2 |
| ПИТЬЕВАЯ ВОДА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ Н О И ПИЩЕВЫЕ ПРОДУКТЫ, ЕЕ СОДЕРЖАЩИЕ | 2004 |
|
RU2270590C1 |
| СПОСОБ И УСТАНОВКА ДЛЯ ПРОИЗВОДСТВА ЛЕГКОЙ ВОДЫ | 2004 |
|
RU2295493C2 |
| СПОСОБ И УСТАНОВКА ДЛЯ ПРОИЗВОДСТВА ЛЕГКОЙ ВОДЫ | 2007 |
|
RU2390491C2 |
| ДИЕТИЧЕСКОЕ УПРАВЛЕНИЕ ДЕПРЕССИЕЙ И ТРЕВОЖНЫМИ РАССТРОЙСТВАМИ, ЛЕЧЕБНОЕ ПИТАНИЕ И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2011 |
|
RU2481009C1 |
| Способ оценки риска развития болезни Альцгеймера с использованием панели белков крови | 2021 |
|
RU2794040C1 |
Изобретение относится к методам введения изотопной метки в белки и пептиды. Предложен способ получения изотопно-модифицированных пептидов и белков, основанный на введении стабильного изотопа 18О (изотопной метки) в карбоксильные группы пептидов и белков посредством выдерживания в растворе, содержащем одновременно Н2 18О и трифторуксусную кислоту. Заявленный способ позволяет получать устойчивые к разрушению изотопно-модифицированные метки, пригодные к количественному масс-спектрометрическому анализу при сохранении исходной структуры анализируемых соединений. 1 ил.
Способ получения изотопно-модифицированных пептидов и белков, основанный на введении стабильного изотопа 18О (изотопной метки) в карбоксильные группы пептидов и белков, отличающийся тем, что изотоп 18O вводят в карбоксильные группы посредством выдерживания в растворе, содержащем одновременно Н2 18О и трифторуксусную кислоту, после чего оба реагента или только кислоту удаляют, причем оба реагента удаляют высушиванием раствора, а кислоту удаляют нейтрализацией или пропусканием через хроматографическую колонку.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 6864089 B2, 08.03.2005 | |||
| Водоотводчик | 1925 |
|
SU1962A1 |
| NEW YORK AND LONDON, на с.42-58 | |||
| Юодка Б.А | |||
| и др | |||
| Олигонуклеотиды и нуклеотидопептиды | |||
| XXXVI | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ВНУТРИМОЛЕКУЛЯРНЫЙ КАТАЛИЗ С УЧАСТИЕМ α-КАРБОКСИЛЬНОЙ ГРУППЫ АМИНО КИСЛОТ, БИООРГАНИЧЕСКАЯ ХИМИЯ, 1981, т.7, №2, с.240-247. | |||
Авторы
Даты
2010-09-20—Публикация
2008-02-13—Подача