Настоящее изобретение относится к полимерной матрице для контролируемого высвобождения лекарственных средств для местного трансдермального применения, которая улучшает растворимость и стабильность активного ингредиента.
Технологические предпосылки
Терапевтические системы контролируемого высвобождения (основанные на матрице) для трансдермального введения изготавливают посредством включения активного компонента (действующего начала) в полимерную матрицу, которая действует и как адгезив, и как «резервуар» для лекарственного средства.
По этой причине полимерная матрица должна удовлетворять ряду особых требований:
обладать способностью растворять действующее начало в желаемых концентрациях;
не иметь химических взаимодействий с действующим началом, чтобы избежать разрушения или изменения его свойств;
обладать способностью обеспечивать диффузию активного начала в направлении рогового слоя;
не вызывать раздражения или эритемы на месте нанесения;
обладать способностью обеспечить сцепление системы с кожей в течение всего периода лечения.
Матрицы изготавливают из растворов адгезивных полимеров, также именуемых как «чувствительные к давлению адгезивы».
Наиболее широко применяемые полимеры представляют класс акрилов и доступны в виде порошков, гранул, растворов в воде или в растворителе.
В общем, полимеры, используемые в фармацевтических препаративных формах, принадлежат к двум классам: тем, что имеют температуру стеклования (Тg) выше, чем комнатная температура (или температура применения), и тем, что имеют Тg ниже, чем комнатная температура. Первые нуждаются в пластификаторах для использования в составе трансдермальных пластырей, тогда как последние могут быть использованы как таковые, так как они (полимеры) уже имеют мягкую консистенцию. По этой причине полимеры с Тg < комнатной Т являются предпочтительными, даже если из-за своих свойств они продаются растворенными в органических растворителях.
Многие из этих полимеров являются сополимерами акриловой или метакриловой кислот и/или их эфирами, поэтому полимерные цепи обладают кислыми свойствами, которые могут приводить к взаимодействию с активным началом, вызывая окисление и/или разрушение активного начала.
В настоящее время обнаружено, что терапевтические матричные системы для контролируемого высвобождения лекарственных средств могут быть приготовлены посредством образования соответствующих солей со свободными карбоксильными группами полимерных цепей макромолекулярных смесей, имеющих низшую Тg.
Описание изобретения
Изобретение относится к полимерной матрице для контролируемого высвобождения лекарственных средств для местного трансдермального применения, матрица содержит сополимеры акриловой или метакриловой кислот и/или их эфиров, имеющие Тg ниже 0°С и где свободные карбоксильные группы образуют соли с совместимыми органическими или неорганическими основаниями.
Сополимеры, которые могут быть использованы согласно изобретению, состоят из двух или нескольких мономеров в различных процентных соотношениях.
Примеры указанных мономеров содержат:
акриловую кислоту
бутилакрилат
2-этилгексилакрилат
глицидилметакрилат
2-гидроксиэтилакрилат
метилакрилат
винилацетат
т-октилакриламид.
Примеры сополимеров согласно изобретению содержат сополимеры 2-этилгексилакрилата и акриловой кислоты, сополимеры 2-гидроксиэтилакрилата, акриловой кислоты и метилакрилатов, сополимеры 2-этилгексилакрилата, акриловой кислоты и метакрилата, сополимеры 2-этилгексилакрилата и акриловой кислоты, бутилакрилата и винилацетата.
Эти сополимеры доступны под следующими торговыми наименованиями: Duro-tak® (компания National and Starch), MG-0607® (компания Dow Corning), Gelva® (компания UCB Chemicals), Luvimer® (компания BASF).
Эти акриловые или метакриловые сополимеры имеют процентное содержание свободных карбоксильных групп 0,1-15%, предпочтительно, 1-10%. Так как они не подлежат горячей экструзии, они поступают в продажу растворенными в органических растворителях.
Основания, с которыми карбоксильные группы образуют соли, могут быть или неорганическими, например гидроксиды, карбонаты или бикарбонаты щелочных, щелочноземельных или переходных металлов, или органическими, например аммиак, сополимеры метилакрилатов аммония, этилендиамин, лизин.
Матрицы согласно изобретению, кроме того, содержат воду от 0,1 до 20% по весу, предпочтительно, от 1 до 5%.
Изобретение позволяет вводить в рецептуру любой активный компонент, имеющий терапевтическое, дерматологическое или косметическое действие, при местном и/или трансдермальном способе введения.
Примеры лекарственных средств, которые могут быть успешно введены в рецептуру, по изобретению содержат: нестероидные противовоспалительные средства, кортикостероиды, местные обезболивающие, альфа-адренергические агонисты, анальгетики, лекарственные средства против мигрени, противоаллергические средства, антигистамины, противомикробные средства, противорвотные средства, холинолитики, бронхолитические средства, противовирусные препараты, мышечные релаксанты, холинергические агенты, стимуляторы центральной нервной системы, кардиотонические средства, бета-адренергические агонисты, гормоны, анксиолитики, антидепрессанты, нейролептики, опиоидные антагонисты, коронарные дилататоры.
Особенно предпочтительными являются нестероидные противовоспалительные средства, такие как Диклофенак, Фенопрофен, Флюрбипрофен, Ибупрофен, Ибупроксам, Индопрофен, Кетопрофен, Кеторолак, Напроксен, Оксаметацин, Оксифенбутазон, Пироксикам, Супрофен, Целекоксиб и другие селективные ингибиторы COX-2 и аналогичные им.
Матрицы изобретения особенно подходят в качестве адгезивного слоя в трансдермальных пластырях.
Также объектом изобретения является способ для изготовления трансдермальных матриц, который содержит обработку сополимера, имеющего Тg ниже 0°С и свободные карбоксильные группы, суспендированного в органическом растворителе, водным раствором органических или неорганических оснований в стехиометрических количествах по отношению к карбоксильным группам с последующим добавлением активного компонента или любых других вспомогательных веществ.
Матрицы согласно изобретению позволяют улучшить растворимость, стабильность и диффузию активного начала из матрицы.
Подробное описание изобретения
Полимерная матрица в конечной рецептуре может присутствовать в количестве, находящемся в пределах от 20 до 95%, предпочтительно, от 50 до 90%, от сухого веса конечного состава.
Кислотные группы нейтрализуются стехиометрическими количествами неорганических (гидроксиды щелочных и переходных металлов, например гидроксид натрия, гидроксид калия) или органических (например, аммиак, сополимеры метилакрилата аммония, этилендиамин, лизин) оснований в присутствии соответствующего количества деминерализованной воды для активации ионного обмена между кислотными группами полимерной структуры и основными противоионами в системе растворителя.
Вода используется в количестве, которое образует сольватационную сферу свободных ионов, не дестабилизируя систему растворителя, чтобы предотвратить выпадение полимера. Полимерная матрица, сначала на основе растворителя, превращается согласно изобретению в смесь на основе растворитель/вода. Количество воды находится в пределах от 0,1 до 20%, предпочтительно, от 1 до 5% от веса адгезивной смеси во влажном состоянии.
Таким образом, кислотные свойства нейтрализуются, и взаимодействия с действующим началом не происходит.
Действующее начало полностью растворяется при высоких концентрациях в этой системе посредством синергичного взаимодействия полимерной матрицы, растворителя и ионообменных процессов, активизированных протонами воды. Количество действующего начала, включенного в систему, варьирует в соответствии с природой действующего начала и желаемым терапевтическим эффектом.
Обычно количество действующего начала находится в пределах от 0,1 до 50%, предпочтительно, от 0,1 до 30% от веса конечного состава в сухом состоянии. После сушки полимерная матрица, которая включает в себя действующее начало, образует терапевтическую систему контролируемого высвобождения для местного применения. Эта матрица облегчает диффузию действующего начала, так же как образование солей кислотными группами полимерной цепи делает структуру матрицы более гидрофильной.
Рецептура может включать в себя одно или несколько вспомогательных веществ, имеющих разные функции, например средства для смягчения кожи, вещества, усиливающие проницаемость кожи, консерванты и аналогичные им. Количество каждого вспомогательного вещества варьирует в широких пределах, например от 0,01 до 30%, и в соответствии с их действием. Консерванты обычно содержатся в конечной рецептуре в количествах 0,01-2%, тогда как средства для смягчения кожи содержатся в конечной рецептуре в количествах 5-20%.
Изобретение подробнее описано в следующих примерах.
Пример 1
1 кг Durotak® 87-2852 сополимер 2-этилгексилакрилата акриловой кислоты и метилакрилата, имеющего содержание сухого вещества 33,5 весовых %, добавили при механическом перемешивании к 62 г водного раствора гидроксида калия с концентрацией 32 весовых %; смесь становилась более вязкой и была оставлена при умеренном перемешивании на 30 мин.
После этого добавили 90 г Диклофенака и продолжили перемешивание до полного растворения.
Для приготовления матричного слоя смесь была распределена по поверхности пленки из силиконового полиэстера и растворители были выпарены в статической сушилке при 60°С в течение 20 мин. Нанесенная на подложку матрица имеет сухой вес приблизительно 50 г/м2. После соединения с полиэтиленовой пленкой образуется пластырь с соответствующей перфорацией.
Пример 2
1 кг Durotak® 87-2051 сополимер 2-этилгексилакрилата акриловой кислоты, бутилакрилата и винилацетата, имеющего содержание сухого вещества 51 весовых %, добавили при механическом перемешивании к 64 г водного раствора гидроксида калия с концентрацией 32 весовых %; смесь становилась более вязкой и была оставлена при умеренном перемешивании на 30 мин.
После этого добавили 90 г Кетопрофена и продолжили перемешивание до полного растворения.
Для приготовления матричного слоя смесь была распределена по поверхности пленки из силиконового полиэстера и растворители были выпарены в статической сушилке при 60°С в течение 20 мин. Нанесенная на подложку матрица имеет сухой вес приблизительно 60 г/м2. После соединения с полиэтиленовой пленкой образуется пластырь с соответствующей перфорацией.
Пример 3
1 кг Durotak® 87-2852, имеющего содержание сухого вещества 33,5 весовых %, добавили при механическом перемешивании к 300 г раствора Eudragit E100 (сополимер метилметакрилата, диметиламиноэтилметакрилата и бутилметакрилата) на основе растворитель/вода с концентрацией 30 весовых %; смесь становилась более вязкой и была оставлена при умеренном перемешивании на 30 мин.
После этого добавили 100 г Диклофенака и продолжили перемешивание до полного растворения.
Для приготовления матричного слоя смесь была распределена по поверхности пленки из силиконового полиэстера и растворители были выпарены в статической сушилке при 60°С в течение 20 мин. Нанесенная на подложку матрица имеет сухой вес приблизительно 60 г/м2. После соединения с полиэтиленовой пленкой образуется пластырь с соответствующей перфорацией.
СРАВНИТЕЛЬНЫЕ ТЕСТЫ ТРАНСДЕРМАЛЬНЫХ ПЛАСТЫРЕЙ СОГЛАСНО US 6689379(D1) И ТРАНСДЕРМАЛЬНЫХ ПЛАСТЫРЕЙ В СООТВЕТСТВИИ С ПРИЛАГАЕМОЙ ФОРМУЛОЙ ИЗОБРЕТЕНИЯ.
Экспериментальные способы
Было получено 12 составов двух различных активных ингредиентов. Каждый состав получали растворением активного ингредиента непосредственно в адгезивной массе, содержащей пригодное количество соли и пластификатор. Адгезивную массу наслаивали на подложку из полиэфира и растворители выпаривали в сушильном шкафу при 70°С в течение 15 мин. Высушенные матрицы связывали с нетканой тканью из полиэфира и распределяли в закрытые обертки.
Композиции тестируемых составов описаны в представленной ниже таблице 1.

Составы А представляют собой контрольные составы, составы В соответствуют составам согласно D1 (на основе акрилатного сополимера, приклеиваемого при нажатии адгезивного Durotak 387-2051®, конкретно описанного в D1, таблица 3), составы C, D и Е представляют собой составы согласно заявленному в настоящей заявке изобретению.
Растворение матриц проводили с использованием устройства Sotax®, фосфатного буфера, рН 7,4 и объема приемной фазы 900 мл. Результаты % растворения относительно времени представлены в следующей таблице.
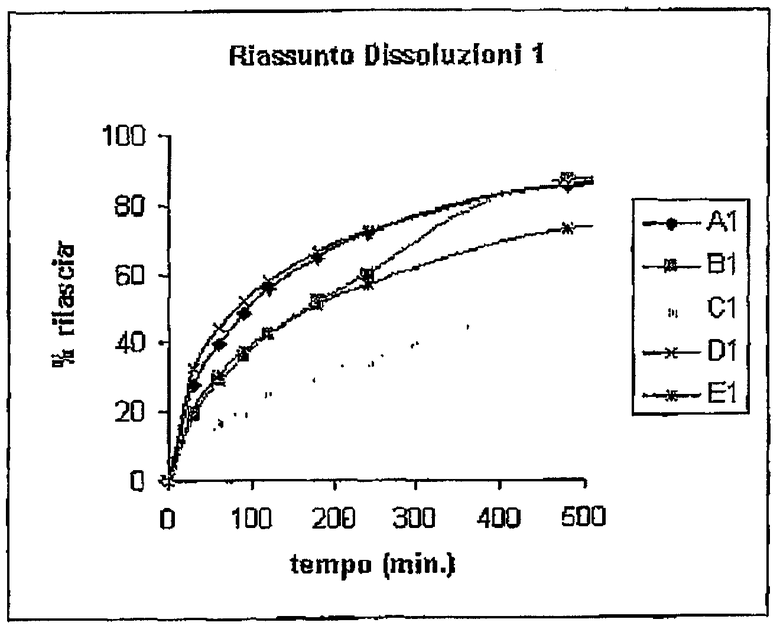
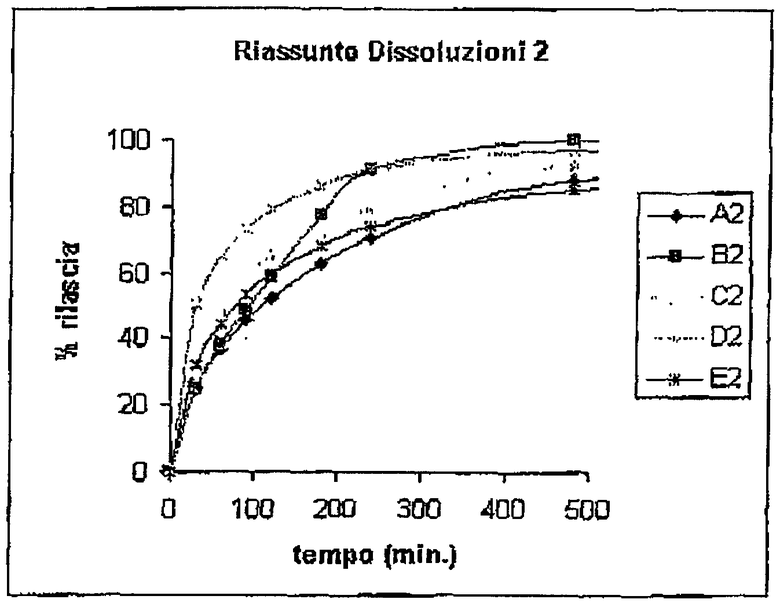
ТЕСТЫ АДГЕЗИВНОСТИ IN VITRO
Тесты адгезивности in vitro проводили с использованием динамометра посредством измерения адгезивности тестируемого образца на стальной подложке.
Измеренные значения представлены в следующей таблице.
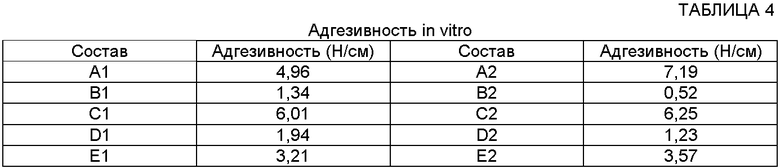
ТЕСТЫ АДГЕЗИВНОСТИ IN VIVO
Тесты адгезивности in vivo проводили с привлечением 5 здоровых добровольцев и приклеиванием на спину каждого добровольца 5 пластырей с плацебо, имеющих размер приблизительно 20 см2. Адгезивность пластырей оценивали через заданные интервалы времени и оценивали согласно следующей оценочной шкале:
+++: пластырь полностью приклеился к коже (100% размера пластыря);
++: пластырь отклеился на границах (80-90% размера пластыря);
+: пластырь отклеился с углов (60-70% размера пластыря);
-: пластырь отклеился от кожи приблизительно на 50% (50% размера пластыря);
--: полностью отклеившийся пластырь.

Заключения
Тесты растворения показывают, что:
- матрицы с органическими солями по изобретению проявляют профиль растворения, позволяющий более постепенное высвобождение лекарственного средства по сравнению с матрицами с неорганическими основаниями. В частности, через 4 часа для диклофенака и через 2 часа для кетопрофена матрицы с А и В полностью теряют контроль высвобождения лекарственного средства, в то время как составы согласно настоящему изобретению сохраняют оптимальные профили высвобождения с течением времени. Более того, профили растворения матриц с органическими солями можно модулировать в зависимости от выбранного противоиона.
Результаты адгезивности показывают, что:
- даже несмотря на то, что значения адгезивности пластыря (составы В1 м В2) in vitro являются приемлемыми, оказывается, что они всегда ниже значений адгезивности пластыря согласно настоящему изобретению;
- тесты адгезивности in vivo показывают, что пластырь согласно настоящему изобретению сохраняет хорошие адгезивные свойства в течение вплоть до 24 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЛАСТЫРЬ МЕСТНОГО ДЕЙСТВИЯ С НЕСТЕРОИДНЫМИ АНТИРЕВМАТИЧЕСКИМИ СРЕДСТВАМИ, СОДЕРЖАЩИМИ КИСЛОТНУЮ ГРУППУ | 1999 |
|
RU2212232C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ГУАНФАЦИНА, СОДЕРЖАЩАЯ ПО МЕНЬШЕЙ МЕРЕ ОДНО ВСПОМОГАТЕЛЬНОЕ ВЕЩЕСТВО | 2018 |
|
RU2812734C2 |
| ВЫСОКОЧИСТЫЕ СЛОЖНЫЕ 3,3-ДИФЕНИЛПРОПИЛАМИНОМОНОЭФИРЫ | 2004 |
|
RU2394019C2 |
| УСТРОЙСТВО ДЛЯ ТРАНСДЕРМАЛЬНОЙ ДОСТАВКИ ТЕТРАБЕНАЗИНА | 2019 |
|
RU2800536C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ГУАНФАЦИНА, СОДЕРЖАЩАЯ СИЛИКОНОВЫЙ ПОЛИМЕР | 2018 |
|
RU2792822C2 |
| ТРАНСДЕРМАЛЬНО АБСОРБИРУЕМЫЙ СОСТАВ, СОДЕРЖАЩИЙ ДОНЕПЕЗИЛ | 2010 |
|
RU2545696C2 |
| СРЕДСТВО И СПОСОБ ТРАНСДЕРМАЛЬНОЙ ДОСТАВКИ ЭСТРОГЕНА | 2009 |
|
RU2526186C2 |
| ТРАНСДЕРМАЛЬНАЯ СИСТЕМА ДОСТАВКИ ДОНЕПЕЗИЛА | 2017 |
|
RU2779471C2 |
| ПОЛУЧЕНИЕ ГИДРОФИЛЬНЫХ, ЧУВСТВИТЕЛЬНЫХ К ДАВЛЕНИЮ АДГЕЗИВОВ С ОПТИМИЗИРОВАННЫМИ АДГЕЗИОННЫМИ СВОЙСТВАМИ | 2001 |
|
RU2276177C2 |
| ТРАНСДЕРМАЛЬНЫЙ ПЛАСТЫРЬ ДЛЯ ВВЕДЕНИЯ ФЕНТАНИЛА | 2002 |
|
RU2301059C2 |
Настоящее изобретение относится к полимерной матрице для контролируемого высвобождения лекарственных средств для местного трансдермального применения. Описана полимерная матрица для контролируемого высвобождения лекарственных средств для местного трансдермального применения, содержащая сополимеры акриловой или метакриловой кислот и их эфиров, имеющие Tg ниже 0°С, где свободные карбоксильные группы образуют соли со стехиометрическими количествами совместимых органических оснований. Также описан способ изготовления указанных выше матриц, который включает обработку сополимера, имеющего Tg ниже 0°С и свободные карбоксильные группы, суспендированного в органическом растворителе, водным раствором органических оснований в стехиометрических количествах по отношению к карбоксильным группам с последующим добавлением активного компонента и любых других вспомогательных веществ. Технический результат - матрицы согласно изобретению позволяют улучшить растворимость, стабильность и диффузию активного начала из матрицы. 2 н. и 7 з.п. ф-лы, 5 табл.
1. Полимерная матрица для контролируемого высвобождения лекарственных средств для местного трансдермального применения, содержащая сополимеры акриловой или метакриловой кислот и их эфиров, имеющие Tg ниже 0°С, где свободные карбоксильные группы образуют соли со стехиометрическими количествами совместимых органических оснований.
2. Матрица по п.1, где сополимеры выбраны из сополимера 2-этилгексилакрилата и акриловой кислоты, сополимеров 2-гидроксиэтилакрилата, акриловой кислоты и метилакрилатов, сополимеров 2-этилгексилакрилата, акриловой кислоты и метакрилатов, сополимеров 2-этилгексилакрилата, акриловой кислоты, бутилакрилата и винилацетата.
3. Матрица по п.1, где основания включают Eudragit Е-100, этилендиамин.
4. Матрица по п.1, где акриловые или метакриловые сополимеры имеют процентное содержание свободных карбоксильных групп, находящееся в пределах от 0,1 до 15%.
5. Матрица по п.4, где акриловые или метакриловые сополимеры имеют процентное содержание свободных карбоксильных групп, находящееся в пределах от 1 до 10%.
6. Матрица по п.1, содержащая воду от 0,1 до 20% по весу.
7. Матрица по п.6, содержащая воду от 1 до 5% по весу.
8. Матрица по любому одному из пп.1-7 в качестве адгезивного слоя в трансдермальном пластыре.
9. Способ изготовления матриц по пп. 1-8, который включает обработку сополимера, имеющего Tg ниже 0°С и свободные карбоксильные группы, суспендированного в органическом растворителе, водным раствором органических оснований в стехиометрических количествах по отношению к карбоксильным группам, с последующим добавлением активного компонента и любых других вспомогательных веществ.
| US 2004010054 A1, 15.01.2004 | |||
| US 6689379 В1, 10.02.2004 | |||
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2108812C1 |
| УСТРОЙСТВО ДОПУСКОВОГО КОНТРОЛЯ УРОВНЯ СИГНАЛА ЦВЕТНОСТИ СИСТЕМЫ «СЕКАМ» | 0 |
|
SU394956A1 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Разностно-дальномерный способ определения координат источника радиоизлучения и устройство для его реализации | 2019 |
|
RU2719770C1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2010-10-10—Публикация
2005-07-06—Подача