Настоящее изобретение относится к новому и неочевидному способу получения маркированного С-терминальным гистидином ТАТ-НОХВ4 гибридного белка (ТАТ-НОХВ4Н), содержащего как минимум 6 остатков гистидина на С-конце. Способ получения обеспечивает неожиданные преимущества в виде повышенных стабильности и выхода, которые предусматривают успешное назначение этого белка in vivo.
Растущая заинтересованность в регенеративной медицине поддерживается за счет поиска органоспецифических стволовых или самоподдерживающихся клеток. Наиболее изученная популяция самоподдерживающихся клеток - это гемопоэтические стволовые клетки (HSC), поскольку они представляют собой новаторские средства лечения заболеваний от рака до болезни обмена веществ и иммунодефицита.
Процесс образования клеток крови, посредством которого эритроциты и лейкоциты заменяются путем деления находящихся в костном мозге HSC, называется гематопоэзом. HSC обладают ключевыми способностями к самоподдержанию и дифференцировке в зрелые клетки как лимфоидной. так и миелоидной линии. Однако генетические механизмы, ответственные за контроль над результатами самоподдержания и дифференцировки делений HSC, остаются в значительной степени неизвестными.
В настоящее время трансплантация HSC из костного мозга взрослого человека, мобилизующая периферическую кровь и пуповинную кровь (UCB), используется в клинических условиях для лечения гемопоэтических видов рака (лейкозы и лимфомы). а также для того, чтобы способствовать восстановлению иммунной системы после высокодозной химиотерапии негемопоэтических видов рака. Однако для эффективной трансплантации необходимо значительное количество HSC из различных источников, а также может возникнуть необходимость в экспансии.
HSC могут браться из костного мозга, периферической крови и UCB. Экстракция клеток костного мозга производится посредством хирургической операции и сопровождается болезненными ощущениями, что делает ее менее приемлемым методом. Использование клеток периферической крови также представляет собой проблему, поскольку сложность получения пригодных HSC из гемопоэза подвергает риску больного, страдающего от болезни или химиотерапии. UCB относительно легче получить, а качество HSC намного выше, однако количество полученных с помощью этого метода HSC все еще ограничено. Количества экстрагированных каждым способом клеток вполне достаточно для ребенка, но может не хватить взрослому. Для преодоления этой потенциальной проблемы к трансплантации HSC действительно необходим новый подход, который бы способствовал пролиферации HSC в лабораторных условиях путем вмешательства в процесс самоподдержания стволовых клеток.
Как уже было указано, факторы транскрипции играют ключевую роль в регуляции экспрессии гена и в дифференцировке в стволовые клетки (Orkin. S.H. Nature Reviews Genetics 1. 57-64, 2000). Фактор транскрипции путем связывания направляет различные клеточные процессы на конкретный ген-мишень, и эта регуляция также зависит от его клеточной концентрации. Ранее было установлено, что группа факторов транскрипции, именуемая ДНК-связывающий гомеобокс (НОХ). играет главную роль в эмбриогенезе. Недавно обнаружилось, что семейство НОХ также участвует в развитии HSC (Buske С.и др., J. Hematol. 71, 301-308, 2000). Регуляцию самоподдержания HSC с помощью фактора транскрипции НОХ изучал д-р Ги Соважо из Монреальского университета. Группа Соважо доказала, что гомеобокс-содержащий ген НОХВ4 крайне важен для регуляции самоподдержания HSC ввиду его способности сохранения популяции HSC в костном мозге. Сначала гены НОХ, экспрессированные в клетках крови, наблюдались в линиях клеток человека и мыши. Некоторые типы генов НОХ повсеместно экспрессированы в различных типах клеток, тогда как другие типы конкретно экспрессированы в определенном типе клеток или в определенные моменты времени в ходе развития. Например, восемь членов кластера человеческого НОХВ экспрессированы на ранней стадии развития эритроцита. Однако такие гены НОХВ. как НОХВ4 и НОХВ7, также экспрессированы в Т-клетках и В-клетках. Группа Соважо подтвердила, что девять генов НОХА. восемь генов НОХВ и четыре гена НОХС экспрессированы в CD34+-клетках костного мозга. Среди этих CD34+-клеток костного мозга НОХВ2. НОХВ9 и НОХА10 наиболее обогащены в клетках-предшественниках эритроцитов. Однако в CD34+-клетках никакие гены НОХ не экспрессированы. Недавно было доказано, что гомеобокс-содержащий ген человека В4 (НОХВ4) эффективно увеличивает HSC в форме ретровирусного или рекомбинантного белка. Рекомбинантные белки ТАТ-НОХВ4 использовались для увеличения стволовых клеток в лабораторном масштабе без риска ретровирусной вставки или сокультуры со стромальными клетками костного мозга (см. Krosl J. и др., Nature Medicine 9, 1428-1432, 2003). Поэтому белок НОХВ4 обычно используется в качестве стимулятора экспансии HSC in vitro (см. фиг.1).
Согласно последним данным экзогенный НОХВ4 можно доставить в клетку, прибавляя метку белковой ТАТ-последовательности к N-концу НОХВ4. Эта ТАТ-последовательность меняет направление переноса НОХВ4 с внеклеточного на внутриклеточное. После входа в цитозоль НОХВ4 можно повторно свернуть в его естественную конформацию с помощью шаперона HSP90. ТАТ-НОХВ4 может стимулировать 2-х -6-кратную пролиферациию HSC (Amsellem S. и др., Nature Medicine 9, 1423-1427, 2003; Krosl J. и др., Nature Medicine 9, 1428-1432, 2003). Однако выход рекомбинантного белка ТАТ-НОХВ4 из кишечной палочки (E.coli) при использовании обычной техники очистки слишком низок.
В целях повышения выхода рекомбинантного белка ТАТ-НОХВ4 был разработан способ создания белка ТАТ-НОХВ4Н с дополнительными шестью остатками гистидина, помеченными на С-конце, что привело к 3-х - 4-кратному увеличению выхода по сравнению с первоначальным белком после очистки. Образующийся при этом рекомбинантный белок (ТАТ-НОХВ4Н) содержит 6 остатков гистидина на С-конце. Этот способ был подробно описан в поданной заявке PCT/CN 2006/000646.
Установлено, что рекомбинантный белок ТАТ-НОХВ4Н может применяться для экспансии стволовых клеток периферической крови или UCB человека, а увеличенному числу стволовых клеток по-прежнему присуща плюрипотенция. Кроме того, стволовые клетки человека, обработанные рекомбинантным белком ТАТ-НОХВ4Н, были введены в костный мозг больной диабетом без ожирения мыши с тяжелым комбинированным иммуннодефицитом (NOD-SCID), и лейкоциты человека обнаружились в лейкоцитах периферической крови, что указывает на восстановление у мыши иммунитета и гемопоэза.
Однако рекомбинантные белки ТАТ-НОХВ4Н никогда ранее не использовались в качестве стимулятора гемопоэза in vivo, а именно, для усиления восстановления гемопоэза, экспансии, репопуляции костного мозга, а также для увеличения количества циркулирующих стволовых клеток периферической крови, особенно после химиотерапии или облучения. Krosl и др. (2003) и Amsellem и др. (2003) не смогли получить большие объемы высокостабильного белка НОХВ4, который используется в клинических исследованиях для экспансии HSC. В настоящем изобретении общий объем белка ТАТ-НОХВ4Н, полученного после очистки, в большинстве случаев составляет от 6-10 мг с 1 литра культуры, тогда как общий объем белка ТАТ-НОХВ4, полученного после очистки с 1 литра культуры посредством известного уровня техники обычно составляет от 1-2 мг. Плазмида рТАТ-НА-НОХВ4, использованная для экспрессии белка ТАТ-НОХВ4 посредством известного уровня техники, стала подарком от д-ра Ги Соважо, Монреальский университет, Канада. Метод очистки белка ТАТ-НОХВ4Н с помощью настоящего изобретения четко указывает на увеличение выхода белка, необходимого для назначения in vivo. Krosl и др. (2003) также заявили, что большая часть их белка ТАТ-НОХВ4 была утрачена через 4 часа инкубации в среде с сывороткой. Настоящее изобретение демонстрирует весьма высокую стабильность белка ТАТ-НОХВ4Н даже через 4 недели, что является ключевым фактором использования белка ТАТ-НОХВ4 в клинических исследованиях.
Настоящее изобретение основано на новом и неочевидном способе получения ТАТ-НОХВ4Н белка с высоким выходом и стабильностью, а также на заключении о том, что при назначении нуждающемуся в нем объекту рекомбинантный белок ТАТ-НОХВ4Н увеличивает количество HSC как в костном мозге, так и в периферической крови in vivo.
Один аспект изобретения относится к способу получения белка ТАТ-НОХВ4Н. Способ включает в себя: (а) получение клетки-хозяина, содержащей вектор, кодирующий белок; (b) экспрессию белка в клетке-хозяине; (с) сбор неочищенного раствора экспрессированного белка; (d) очистка белка из раствора посредством следующих этапов: (i) внесение раствора в колонку HisTrap; (ii) промывка колонки HisTrap; (iii) элюирование частично очищенного белка из колонки HisTrap в целях получения раствора частично очищенного белка; (iv) внесение раствора частично очищенного белка в колонку MonoSP; (v) промывка колонки MonoSP; (vi) элюирование очищенного белка из колонки MonoSP в денатурированной форме; (е) рефолдинг белка, элюированного в денатурированнй форме, с помощью гидрофобных соединений посредством следующих этапов: (i) объединение элюированного денатурированного белка и раствора гидрофобных соединений в целях получения раствора, содержащего белок и гидрофобные соединения; (ii) обессоливание раствора, содержащего белок и гидрофобные соединения, для получения обессоленного раствора; (iii) удаление гидрофобных соединений из обессоленного раствора с помощью ультрафильтрации.
Еще один аспект изобретения относится к способу усиления активации в периферической крови клеток HSC из костного мозга объекта. Способ включает в себя: а) назначение эффективного количества белка ТАТ-НОХВ4Н, полученного описанными в данном документе способами, нуждающемуся в нем объекту, и b) обеспечение посредством белка ТАТ-НОХВ4Н увеличения абсолютного числа гемопоэтических стволовых клеток в костном мозге объекта для усиления активации гемопоэтических стволовых клеток в периферической крови объекта.
Другой аспект изобретения относится к способу сокращения времени восстановления пациента, перенесшего трансплантацию HSC, облучение или химиотерапию. Способ включает в себя: а) назначено эффективного количества белка ТАТ-НОХВ4Н, полученного описанными в данном документе способами, нуждающемуся в нем объекту, и b) обеспечение посредством белка ТАТ-НОХВ4Н увеличения абсолютного числа HSC в костный мозг объекта.
Еще один аспект изобретения относится к фармацевтическим композициям для усиления активации в периферической крови клеток HSC из костного мозга нуждающегося в этом объекта. Фармацевтическая композиция по изобретению включает в себя эффективное количество полученного описанными в данном документе способами белка ТАТ-НОХВ4Н, достаточного для увеличения абсолютного числа HSC в костном мозге объекта, что усиливает активацию клеток HSC в периферической крови объекта.
Фармацевтическую композицию по изобретению можно вводить пациенту, перенесшему аутотрансплантацию HSC, в целях сокращения времени восстановления после трансплантации HSC.
Фармацевтическую композицию по изобретению можно вводить невосприимчивому к гранулоцитарному колониестимулирующему фактору (G-CSF) пациенту вместо G-CSF для активации HSC в периферической крови.
Фармацевтическую композицию по изобретению можно вводить донору HSC, обеспечивая тем самым забор для трансплантации достаточного количества HSC гораздо менее инвазивным способом из периферической крови, а не из костного мозга упомянутого донора.
Другой аспект изобретения относится к лечению заболеваний, вызванных наследственным дефицитом HSC, посредством систематического приема эффективного количества рекомбинантного белка ТАТ-НОХВ4Н, полученного описанными в данном документе способами, или фармацевтической композиции того же состава страдающему заболеванием объекту. Таким образом введенный рекомбинантный белок ТАТ-НОХВ4Н увеличивает абсолютное число HSC в костном мозге объекта.
Еще один аспект изобретения относится к способу сокращения времени восстановления после трансплантации HSC путем систематического приема эффективного количества рекомбинантного белка ТАТ-НОХВ4Н, полученного описанными в данном документе способами, или фармацевтической композиции того же состава нуждающемуся в этом объекту.
И еще один аспект изобретения относится к способу стимуляции восстановления HSC у прошедшего облучение или химиотерапию пациента посредством систематического приема эффективного количества рекомбинантного белка ТАТ-НОХВ4Н, полученного описанными в данном документе способами, или фармацевтической композиции того же состава нуждающемуся в этом объекту.
Вышеизложенные особенности и преимущества данного изобретения могут стать очевидными из следующего подробного описания, сопровождаемого фигурами графических материалов, на которых представлено следующее.
Фиг.1 представлено схематичное изображение активации HSC из клеток CD34 в периферической крови (РВ) посредством экспансии in vivo;
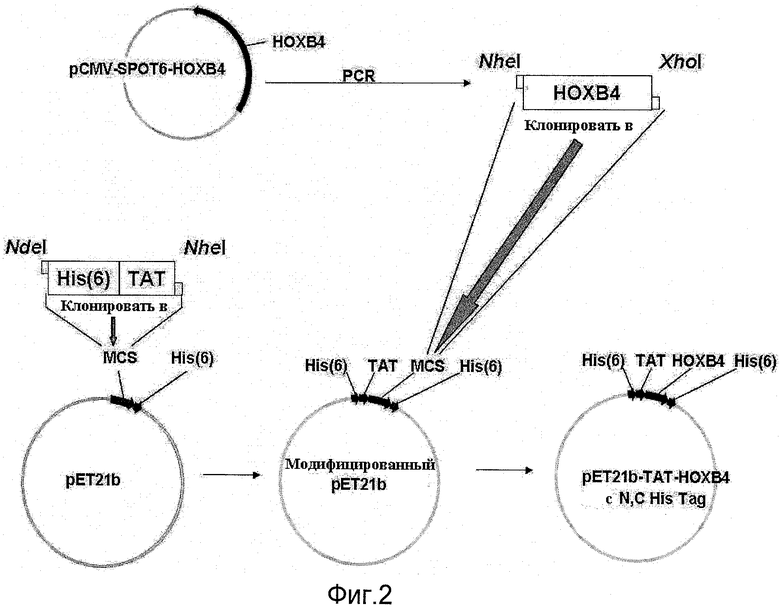
Фиг.2 - схематичное изображение конструирования и клонирования рТАТ-НОХВ4Н в модифицированном векторе рЕТ21 b;
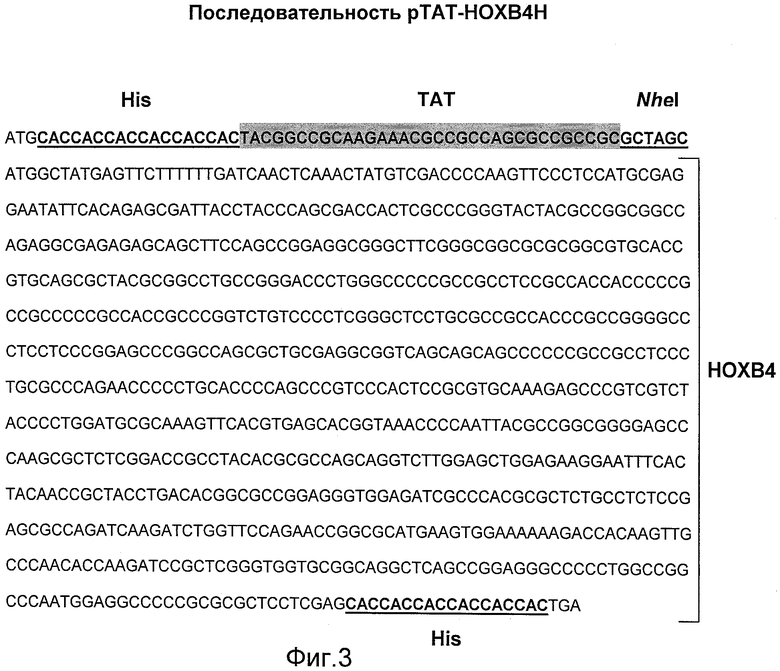
Фиг.3 иллюстрирует последовательность ДНК рТАТ-НОХВ4Н, где дополнительные 6 остатков гистидина, введенных на N- и С-концах в рТАТ-НОХВ4Н подчеркнуты, а ТАТ выдвинут на передний план.
Фиг.4 иллюстрирует последовательность протеинов белка ТАТ-НОХВ4Н.
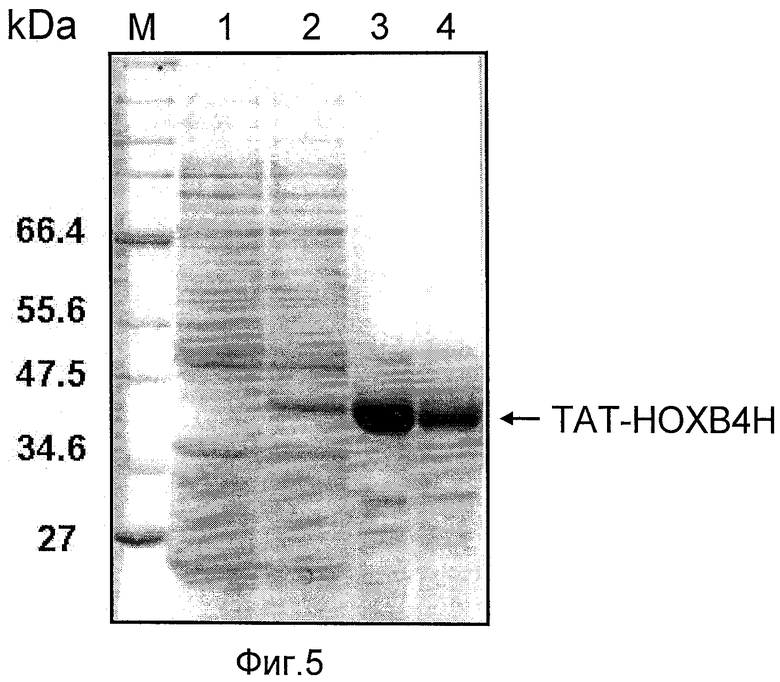
Фиг.5 иллюстрирует очистку 10%-ным SDS-полиакриламидным гелем (1.5 мм) белка ТАТ-НОХВ4Н. SDS-полиакриламидный гель был прокрашен кумасси синим. Полоска 1, маркеры молекулярной массы (М), 0.3 мкг белка; полоска 2, клеточный лизат из неиндуцированных клеток BL21 (DE3) pLysS. экспрессирующих белок ТАТЕТ-НОХВ4Н, 1 мкг белка; полоска 3, клеточный лизат из индуцированных клеток BL21 (DE3) pLysS, экспрессирующих белок ТАТ-НОХВ4Н с 1 ммоль IPTG, 1 мкг белка; полоска 4, очищенный ТАТ-НОХВ4Н, 0,7 мг белка; полоска 5, очищенный ТАТ-НОХВ4 (0.2 мг белка). Плазмида рТАТ-НА-НОХВ4, использованная для экспрессии белка ТАТ-НОХВ4 (полоска 5) была подарком от д-ра Ги Соважо из Монреальского университета Канады. Равный объем фракций, собранных с колонки MonoSP, поместили в полоски 4 и 5.
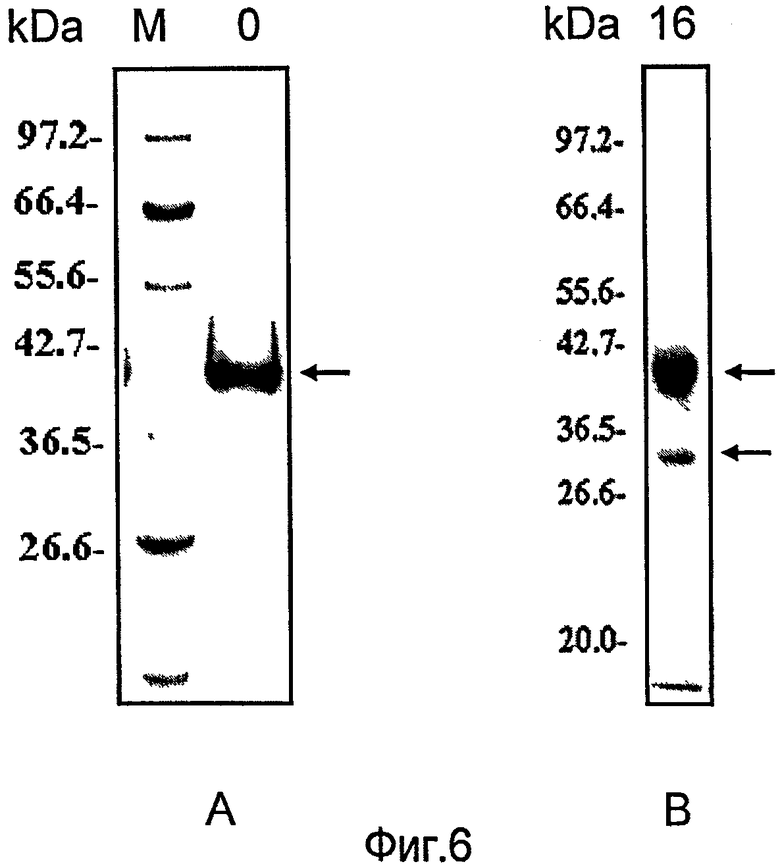
Фиг.6 иллюстрирует SDS-полиакриламидный гелевый анализ стабильности очищенного белка ТАТ-НОХВ4Н, хранящегося в забуференном фосфатом физиологическом растворе (ЗФР) в течение 0 час (А) и 16 час (В) при температуре 4°С. М обозначает маркеры молекулярной массы, 0 обозначает инкубацию в течение 0 час при 4°С. 16 обозначает инкубацию в течение 16 часов при 4°.
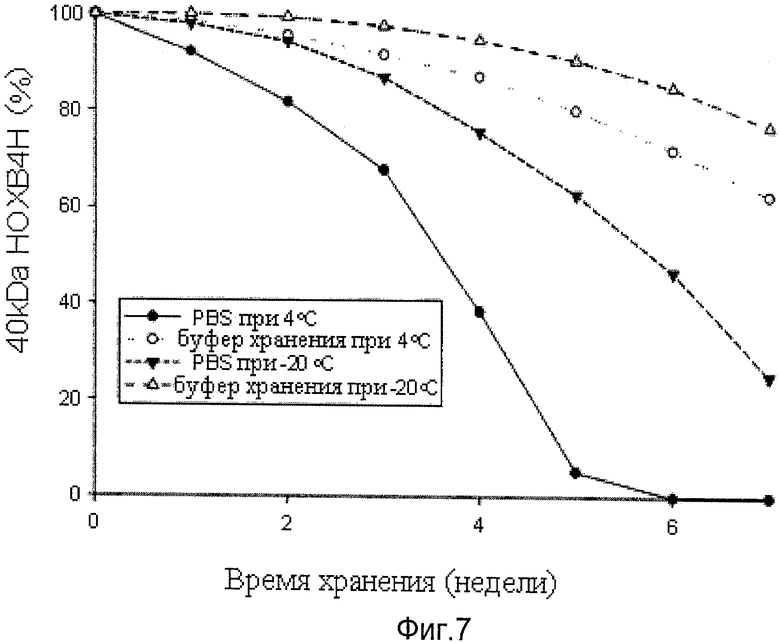
Фиг.7 иллюстрирует стабильность белка ТАТ-НОХВ4Н, хранящегося при 4°С и -20°С в ЗФР и буфер хранения. 1MDM, проанализированном 10%-ным SDS-полиакриламидом с окрашиванием кумасси. Стрелки указывают на полосы белка ТАТ-НОХВ4Н.
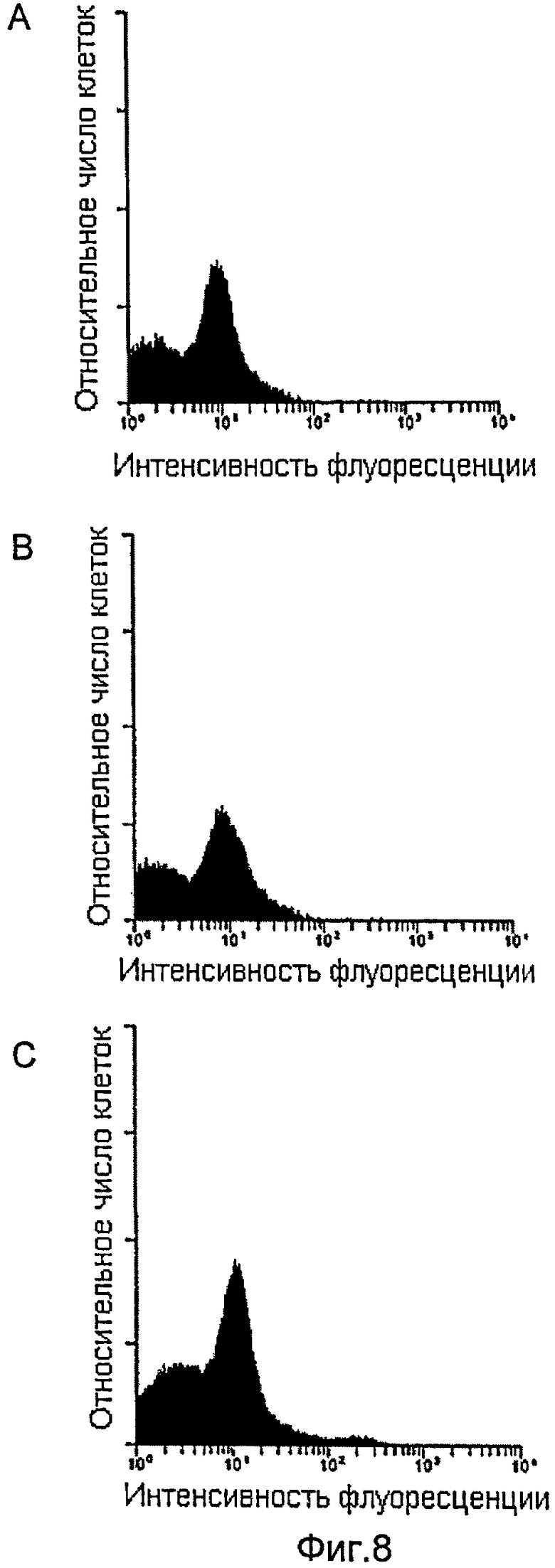
Фиг.8А иллюстрирует стимулирующее воздействие G-CSF на ряд стволовых клеток CD34+ в костном мозге мышей анализом на проточном цитометре.
Фиг.8В иллюстрирует воздействие ЗФР на ряд стволовых клеток CD34+ в костном мозге мышей в результате анализом на проточном цитометре.
Фиг.8С иллюстрирует стимулирующее воздействие на ряд стволовых клеток CD34+ в костном мозге мышей анализом на проточном цитометре.
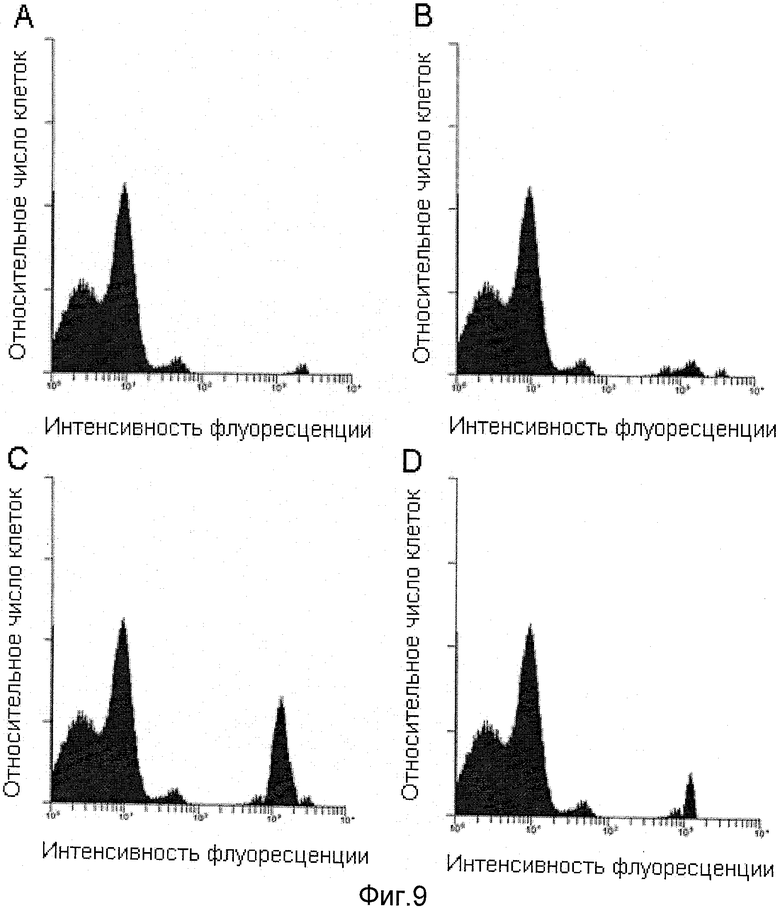
Фиг.9А иллюстрирует стимулирующее воздействие на ряд стволовых клеток CD34+ в костном мозге макаки-резуса анализом на проточном цитометре.
Фиг.9В иллюстрирует стимулирующее воздействие ТАТ-НОХВ4Н наряду с G-CSF на ряд стволовых клеток CD34+ в костном мозге макаки-резуса анализом на проточном цитометре.
Фиг.9С иллюстрирует стимулирующее воздействие ТАТ-НОХВ4Н на ряд стволовых клеток CD34+ в костном мозге макаки-резуса анализом на проточном цитометре.
Фиг.9D иллюстрирует воздействие ЗФР на ряд стволовых клеток CD34+ в костном мозге макаки-резуса анализом на проточном цитометре.
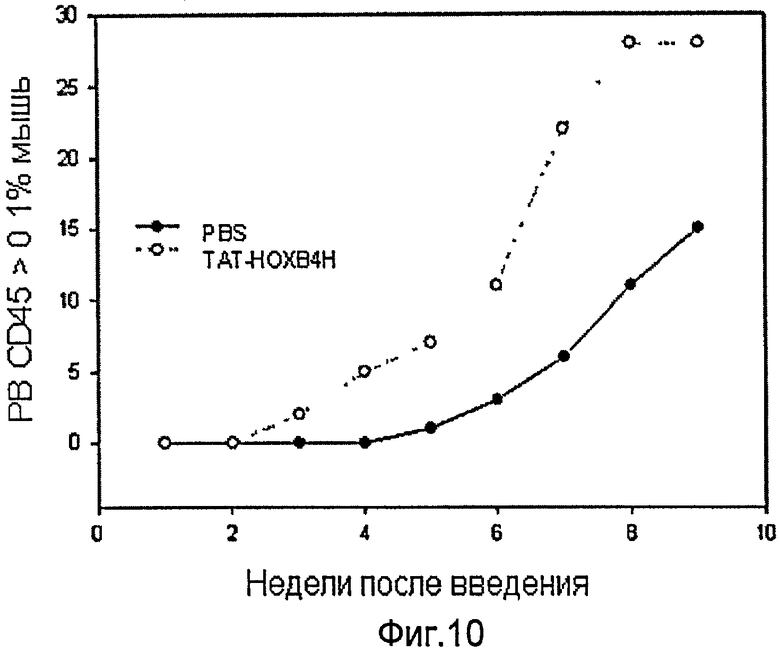
Фиг.10 иллюстрирует воздействие белка ТАТ-НОХВ4Н на гематопоэтическое восстановление у мышей NOD-SCID.
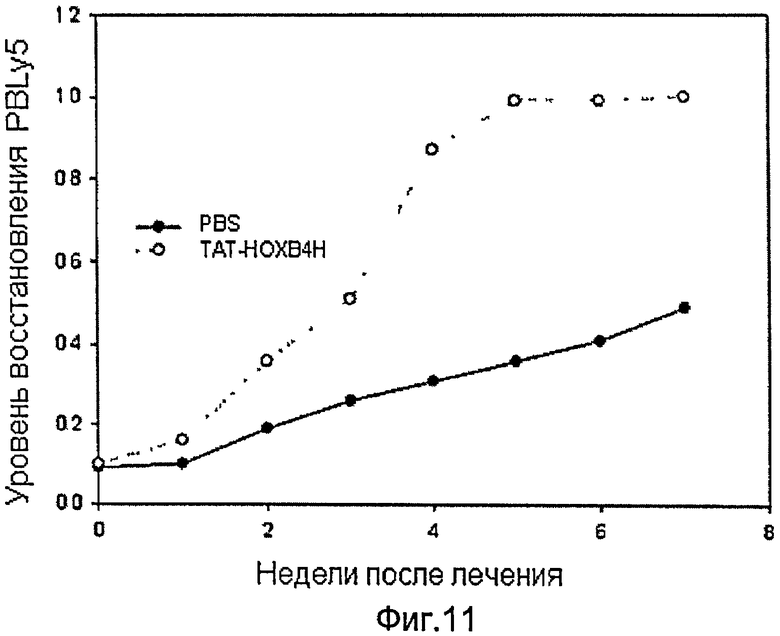
Фиг.11 иллюстрирует воздействие белка ТАТ-НОХВ4Н на гематопоэтическое восстановлении у мышей Balb/c после химиотерапии цисплатином.
Далее следует подробное описание.
I. Белок ТАТ-НОХВ4Н
Настоящее изобретение относится к новому и неочевидному способу получения белка ТАТ-НОХВ4 с обеспечением неожиданных преимуществ повышенных стабильности и выхода, что позволяет назначение данного белка in vivo. Белок ТАТ-НОХВ4Н - это конструкция, включающая в себя три элемента: TAT, HOXB4 и гистидиновую метку. HOXB4 - это член семейства НОХ факторов транскрипции и способствует экспансии HSC. ТАТ позволяет доле HOXB4 транспортироваться в клетку. Гистидиновая метка принимает в расчет начальный повышенный выход из рекомбинантных источников экспрессии, хотя далее способ получения увеличивает выход белка. рТАТ-НОХВ4Н сконструирован так, как показано на фиг.2, а на фиг.3 представлена последовательность ДНК. Рекомбинантный белок ТАТ-НОХВ4Н относится гибридному белку ТАТ-НОХВ4 с дополнительными шестью остатками гистидина, помеченными на С-конце (см. фиг.4).
Если не указано иначе, последовательность аминокислот белка (то есть его "первичная структура" или "первичная последовательность") может быть записана с амино-конца на карбокси-конец. В небиологических системах (например, в которых используется твердофазный синтез), первичную структуру белка (которая также включает в себя участки дисульфидных (цистеиновых) связей) может определить пользователь.
"Деления" относится к изменению в аминокислоте или последовательности нуклеотидов вследствие отсутствия одного или более остатков аминокислоты или нуклеотидов. Термины "вставка" или "дополнение" относятся к изменениям в аминокислоте или последовательности нуклеотидов, приводящие к их дополнению одной или более аминокислотой или нуклеотидом, соответственно, а также к молекуле или представлению этого, по сравнению со стандартной последовательностью, например последовательность, обнаруженную в естественно возникающей молекуле. "Замещение" относится к замене одной или более аминокислот или нуклеотидов различными аминокислотами или нуклеотидами соответственно.
Последовательности, подобные или гомологичные (например, по крайней мере приблизительно 85%-ная идентичность последовательности) раскрытым в данном изобретении последовательностям также являются относятся к настоящей заявке. В некоторых вариантах осуществления изобретения идентичность последовательности может примерно составлять 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше. И наоборот, значительная идентичность существует, когда могут гибридизироваться сегменты нуклеиновой кислоты при выбранных условиях гибридизации (например, очень жесткие условия гибридизации) к дополнению цепи. Нуклеиновые кислоты могут присутствовать в целых клетках, в клеточном лизате или в частично очищенной или существенно чистой форме.
Расчеты "гомологии" или "идентичности последовательности" между двумя последовательностями (термины используются здесь во взаимозаменяемом порядке) выполнены следующим образом. Последовательности варавниваются оптимально для целей сравнения (например, можно ввести разрывы в одной или обеих первой и второй аминокислот или последовательности нуклеотидов для оптимального выравнивания, а негомологичные последовательности в целях сравнения можно игнорировать). В предпочтительном варианте осуществления длина выровненной для сравнения стандартной последовательности составляет не менее 30%, желательно не менее 40%, более желательно не менее 50%, а еще более желательно - не менее 60%, и еще более желательно - не менее 70%, 80%, 90%, 100% длины стандартной последовательности. Затем сравнивают остатки аминокислот или нуклеотидов в соответствующих позициях аминокислоты или позициях нуклеотида. Когда позиция в первой последовательности занята тем же самым остатком аминокислоты или нуклеотидом как соответствующая позиция во второй последовательности, тогда в этой позиции молекулы идентичны (как используется в данном тексте, аминокислотная или нуклеинокислотная "идентичность" эквивалентна аминокислотной или нуклеинокислотной "гомологии"). Процентная идентичность между этими двумя последовательностями представляет собой функцию числа разделяемых последовательностями идентичных позиций с учетом числа разрывов, а также длину каждого разрыва, который необходимо ввести для оптимального выравнивания этих двух последовательностей.
Сравнение последовательностей и определение процентной идентичности между двумя последовательностями можно осуществить посредством использования математического алгоритма. В предпочтительном варианте осуществления процентная идентичность между двумя аминокислотными последовательностями определяется посредством использования алгоритма Нидлмана-Вунша ((1970) J. Mol. Biol. 48:444-453), включенного в программу GAP в программном пакете GCG (имеется на http://www.gcg.com) с использованием либо матрицы Blossum 62, либо матрицы РАМ250, а также веса разрыва 16, 14, 12, 10, 8, 6 или 4 и веса длины 1, 2, 3, 4, 5 или 6. В еще одном предпочтительном варианте осуществления процентная идентичность между двумя нуклеотидными последовательностями определяется посредством использования программы GAP в программном пакете GCG (имеется на http://www.gcg.com) с использованием матрицы NWSgapdna, CMP и веса разрыва 40, 50, 60, 70 или 80, а также веса длины 1, 2, 3, 4, 5 или 6. Особенно предпочтительным набором параметров (и тот, который может использоваться при неуверенности специалиста-практика в том, какие можно применять параметры для определения находится ли молекула в пределах последовательной идентичности или гомологичного ограничения изобретения) является оценочная матрица Blossum 62 со штрафом разрыва 12, штрафом длины разрыва 4, и штрафом разрыва сдвига рамки 5. Процентная идентичность между двумя аминокислотными или нуклеотидными последовательностями можно также определить посредством использования алгоритма Э. Майерса и У. Миллера ((1989) CABIOS, 4:11-17), включенного в программу ALIGN (версия 2.0) с использованием таблицы остатков веса РАМ120, штрафа длины разрыва 12 и штрафа разрыва 4.
II. Способы создания рекомбинантного белка ТАТ-НОХВ4Н
А. Клонирование и экспрессия
Из уровня техники известны системы для клонирования и экспрессии белков в разнообразии клеток-хозяинов. Пригодные для получения белков клетки описаны, например, в (Fernandez et al. Gene Expression Systems, Academic Press, eds., 1999). Кратко говоря, пригодные клетки-хозяины включают в себя клетки млекопитающих, клетки насекомых, растительные клетки, дрожжевые клетки или прокариотические клетки, например E.coli. Известные из уровня техники клетки млекопитающих для гетерологичной экспрессии белка включают лимфоцитарные клеточные линии (например, NSO), клетки НЕК293, клетки яичников китайских хомячков (СНО), клетки COS, клетки HeLa, клетки почек детенышей хомячков, ооцитные клетки, а также клетки от трансгенного животного, например грудные эпителиальные клетки. Подходящие векторы можно выбрать или построить так, чтобы они содержали соответствующие регулирующие последовательности, в т.ч. стимулирующие последовательности, терминальные последовательности, полиаденилированные последовательности, энхансер-последовательности, ген-маркеры и другие последовательности. Векторы могут также включать в себя плазмиду или вирусный остов. Более подробную информацию можно найти в (Sambrook el al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, 1989). Множество установленных используемых с векторами методов, в т.ч. манипуляция, подготовка, мутагенез, секвенирование и трансфекция ДНК, описаны в (Current Protocols in Molecular Biology, Second Edition, Ausubel el al. eds., John Wiley & Sons, 1992).
Следующий признак предусматривает способ введения нуклеиновой кислоты в клетку-хозяина. Для эукариотных клеток подходящая методика трансфекции может включить использование фосфата кальция, DEAE-декстрана, электропорацию, трансфекцию с помощью липосом, а также трансдукцию с использованием ретровируса или других вирусов, например коровьей оспы или бакуловируса. Для бактериальных клеток подходящая методика может включить трансформацию хлоридом кальция, электропорацию и трансфекцию с использованием бактериофага. Введение ДНК может сопровождаться методом отбора (например, устойчивость к лекарственному средству) для отбора клеток, содержащих нуклеиновую кислоту.
В. Очистка и рефолдинг
Белок ТАТ-НОХВ4Н можно первоначально выделить из рекомбинантной клетки-хозяина любыми приемлемыми и известными из области техники средствами. Например, белок можно выделить из клеточного супернатанта, если белок способен к секреции или его можно выделить из клеточного лизата.
Белок ТАТ-НОХВ4Н можно очистить посредством использования хроматографических способов, включая: (а) внесение клеточного лизата или клеточного супернатанта, если белок секретируется в раствор, в колонку HisTrap; (b) промывка колонки HisTrap буфером; (с) элюирование частично очищенного белка из колонки HisTrap; (d) внесение полученного с колонки HisTrap частично очищенного белка в колонку MonoSP; (e) промывка колонки MonoSP буфером; (f) элюирование очищенного белка ТАТ-НОХВ4Н из колонки MonoSP.
Клеточный лизат или клеточный супернатант, если белок способен к секреции в растворе, можно очистить центрифугированием при 20000×g в течение 30 минут при 4°С, при этом супернатант регулируется до 10 ммоль имидазола и вводится в хелатообразующую колонку HisTrap (Amersham Pharmacia), например с Ni-сефарозой в качестве наполнителя. Колонку можно промыть мочевиной 8 моль, HEPES 20 ммоль, DTT 0,5 ммоль, NaCl 10 ммоль рН 0,8 и имидазолом 10 ммоль в целях удаления несвязанных белков. Частично очищенный белок ТАТ-НОХВ4 можно элюировать из колонки HisTrap высокой концентрацией имидазола и соли.
Для дальнейшей очистки частично очищенный полученный из колонки HisTrap белок можно ввести в колонку MonoSP (Amersham Pharmacia), например с SP-сефарозой в качестве наполнителя. Колонку можно промыть мочевиной 4 моль, HEPES 20 ммоль, NaCl 50 ммоль рН 6,5 в целях удаления несвязанных белков. Связанный ТАТ-НОХВ4Н можно элюировать высоким содержанием соли. Собранный при данной процедуре очищенный белок ТАТ-НОХВ4Н находится в денатурированной форме.
Далее, элюированный из колонки MonoSP денатурированный белок ТАТ-НОХВ4Н можно повторно свернуть с использованием гидрофобных соединений посредством: (i) объединение элюированного денатурированного белка и раствора гидрофобных соединений для получения раствора, содержащего белок и гидрофобные соединения; (ii) обессоливание раствора, содержащего белок и гидрофобные соединения, для получения обессоленного раствора; и (iii) удаление гидрофобных соединений из обессоленного раствора с использованием ультрафильтрации.
Используемый в настоящем изобретении термин "гидрофобные соединения" относится к любым гидрофобным соединениям, которые способны защитить желаемый белок от образования нерастворимых соединений в период удаления денатурированной соли. Пригодные для использования в настоящем изобретении гидрофобные соединения описаны в (Oganesyan et al. Suitable hydrophobic compounds include, but are not limited to, Triton X-100, tween-20 or polybenzene compounds. Pharmagenomics (2004) 71, 22-26). Ультрафильтрацию или буферный обмен можно осуществлять с помощью центрикона или концентратора stir-cell. Условия для ультрафильтрации или буферного обмена могут варьироваться специалистами в данной области, в зависимости от типов желаемого белка.
В одном варианте осуществления настоящего изобретения гидрофобное соединение в обессоленном, содержащем денатурированный белок НОХВ4Н растворе, удаляется посредством 5-10-кратного буферного обмена (каждый производится центрифугированием при 1000-2500×g в течение 10 минут) с раствором, содержащим крупные гидрофобные соединения в концентрации от низкой до высокой, например бета-циклодекстрин, где денатурированный белок НОХВ4Н подвергают рефолдингу в соответствующую нативную форму.
В одном варианте осуществления очищенный белок ТАТ-НОХВ4Н можно хранить в имеющейся в продаже среде IMDM (среда Дюльбекко в модификации Искова; HyClone; буфер хранения 1) при 4°С или -20°С.
В другом варианте осуществления очищенный белок ТАТ-НОХВ4Н можно хранить в имеющейся в продаже среде DMEM (среда Игла в модификации Дюльбекко; HyClone; буфер хранения 2) при 4°С или -20°С.
В еще одном варианте осуществления метку His на С-конце белка ТАТ-НОХВ4Н можно удалить до назначения in vivo.
В другом варианте осуществления метку His на N-конце белка ТА-Т-НОХВ4Н можно удалить до назначения in vivo.
В еще одном варианте осуществления обе метки His на N- и С-концах можно удалить до назначения in vivo.
С. Приготовление фармацевтической композиции
Белок ТАТ-НОХВ4Н можно использовать в качестве фармацевтической композиции в сочетании с приемлемым носителем с фармацевтической точки зрения. Такая композиция, помимо белка ТАТ-НОХВ4Н и носителя, может содержать различные разбавители, наполнители, соли, буферы, стабилизаторы, сжижающие агенты и прочие хорошо известные из уровня техники вещества. Термин "приемлемый с фармацевтической точки зрения" означает нетоксичное вещество, которое не препятствует эффективности биологической активности активного(ых) компонента(ов). Характеристики носителя могут зависеть от способа назначения.
Особенно предпочтительно готовить композиции в форме дозированной единицы для простоты приема и однородности дозировки. Используемая в данном описании форма дозированной единицы относится к физически дискретным единицам, пригодным в качестве единых дозировок для проходящего лечение объекта;
каждая единица содержит предварительно определенное количество активного соединения, рассчитанного для достижения желаемого лечебного эффекта в сочетании с необходимым фармацевтическим носителем. Требования к формам дозированной единицы по настоящему изобретению продиктованы и непосредственно зависят от уникальных характеристик активного соединения и конкретного достигаемого лечебного эффекта, а также от ограничений, присущих уровню техники, например, для активных соединений для лечения людей.
Типичные пути введения включают в себя без ограничений: пероральный, местный, парентеральный (например, сублингвально или трансбуккально), сублингвальный, ректальный, вагинальный, а также интраназальный. Используемый в данном описании термин "парентеральный" предусматривает подкожные инъекции, внутривенные, внутримышечные, интрастернальные, интракавернозные, внутриоболочковые, интрамеатальные, интрауретральные методы инъекций или вливания. Фармацевтическая композиция подбирается так, чтобы содержащиеся в ней активные компоненты могли быть в биологически доступной форме при введении данной композиции пациенту. Вводимые пациенту композиции принимают форму одной или более дозированных единиц, где например, таблетка может быть единственной дозированной единицей, а емкость с одним или несколькими соединениями по настоящему изобретению в форме аэрозоля может содержать множество дозированных единиц.
При пероральном введении эффективного с лечебной точки зрения белка ТАТ-НОХВ4Н, связующее вещество может быть в форме таблетки, капсулы, порошка, раствора или эликсира. При введении в форме таблетки фармацевтическая композиция может дополнительно содержать твердый носитель типа желатина или адьюванта. В таблетке, капсуле и порошке содержится примерно 5-95% связующего вещества, а предпочтительнее примерно 25-90% связующего вещества. Примерами являются сахароза, каолин, глицерин, крахмальные декстрины, альгинат натрия, карбоксиметилцеллюлоза и этилцеллюлоза. Могут присутствовать красящие и/или ароматизирующие добавки. Может использоваться оболочка-покрытие. При введении в жидкой форме может добавляться жидкий носитель такой, как вода, нефтепродукты, масла животного или растительного происхождения такие, как арахисовое масло, минеральное масло, соевое масло или кунжутное масло, а также синтетические масла. Жидкая форма фармацевтической композиции может далее содержать физиологический солевой раствор, декстрозу или другой раствор сахарида, а также гликоли такие, как этиленгликоль, пропиленгликоль или полиэтиленгликоль. При введении в жидкой форме фармацевтическая композиция содержит примерно 0,5-90% по весу связующего вещества, а предпочтительнее примерно 1-50% связующего вещества.
При внутривенном, кожном или подкожном введении эффективного, с лечебной точки зрения, количества белка ТАТ-НОХВ4Н, связующее вещество может быть в форме парентерально приемлемого водного раствора без пирогена. Должным образом учитывая рН, приготовление таких парентерально приемлемых белковых растворов, изотоничность, стабильность и тому подобное лежит в пределах известного из области техники. В некоторых вариантах осуществления фармацевтическая композиция для внутривенной, кожной, или подкожной инъекции может включать в себя, помимо связующего вещества, изотоническое средство, как например, инъекции хлорида натрия, инъекции раствора Рингера. инъекции декстрозы и хлорида натрия, инъекции лактированного раствора Рингера или прочие известные из уровня техники средства. Фармацевтическая композиция по настоящему изобретению может также содержать стабилизаторы, консерванты, буферы, антиоксиданты или другие известные для специалистов в данной области техники добавки.
При применении способа лечения или использовании настоящего изобретения, эффективное с лечебной точки зрения количество белка ТАТ-НОХВ4Н вводится объекту, например млекопитающему (например, человеку). Используемый в данном описании термин "эффективное с лечебной точки зрения количество" означает общее количество каждого активного компонента (фармацевтической композиции или способа, которого достаточно для демонстрации убедительной пользы для пациента, например уменьшение интенсивности симптомов, излечивание или увеличение степени излечения при таких условиях. При применении к отдельному, только одному вводимому активному компоненту, данный термин относится только к этому одному компоненту. При применении к комбинации данный термин относится к комбинированным количествам активных компонентов, приводящих к лечебному эффекту, независимо от комбинированного, последовательного или одновременного введения.
Количество белка ТАТ-НОХВ4Н в фармацевтической композиции по настоящему изобретению может зависеть от характера и тяжести состояния, при которых проходит лечение, а также от характера ранее прошедшего пациентом лечения, возраста и пола пациента. В конечном счете, лечащий врач может определить количество активного компонента для лечения каждого отдельного пациента. Первоначально, лечащий врач может вводить низкие дозы активного компонента и наблюдать ответную реакциию пациента. Более высокие дозы активного компонента можно вводить до тех пор, пока у пациента не будет достигнут оптимальный лечебный эффект, и на этом этапе дозировку далее не увеличивают. Предполагается, что различные используемые для применения способа по настоящему изобретению фармацевтические композиции могут содержать примерно от 1 мкг до 1 мг белка ТАТ-НОХВ4Н на килограмм массы тела. Примеры диапазонов дозировки, которые можно вводить объекту, можно выбрать из следующего: 1 мкг/кг - 1 мг/кг, 1 мкг/кг - 0,5 мг/кг, 1 мкг/кг - 0,1 мг/кг, 10 мкг/кг - 0,5 мг/кг, 10 мкг/кг - 0,1 мг/кг, 100 мкг - 0,5 мг/кг, 250 мкг/кг - 0,5 мг/кг. Далее, примеры диапазонов дозировки, которые можно выбрать из: 50 мкг - 100 мг, 100 мкг - 50 мг, 500 мкг - 50 мг, 1 мг - 50 мг. Продолжительность внутривенной терапии с использованием фармацевтической композиции по настоящему изобретению может варьироваться в зависимости от тяжести заболевания, состояния и потенциальной специфической реакции каждого отдельного пациента. В одном варианте осуществления предполагается, что продолжительность каждого применения белка ТАТ-НОХВ4Н может находиться в диапазоне от 12 до 24 часов непрерывного внутривенного введения. В другом осуществлении продолжительность применения белка ТАТ-НОХВ4Н может продолжаться до тех пор, пока продолжается курс облучения или химиотерапии пациента. Белок ТАТ-НОХВ4 можно вводить в диапазоне 10-100 мкг/кг внутривенно, два раза в день от 4,5 до 5 дней. Одного цикла лечения может быть достаточно для увеличения HSC in vivo. В конечном счете, лечащий врач может определить соответствующую продолжительность внутривенной терапии с использованием фармацевтической композиции по настоящему изобретению.
Токсичность и лечебную эффективность таких соединений можно определить посредством стандартных фармацевтических процедур на клеточных культурах или экспериментальных животных, например, для определения LD50 (летальная доза для 50% населения) и ED50 (эффективная доза с лечебной точки зрения у 50% населения). Соотношение дозы между токсическим и лечебным эффектами представляет собой лечебный коэффициент, который можно выразить в виде соотношение LD50/ED50. Полученные из анализа клеточной культуры и исследования животных данные можно использовать в оценке диапазона дозировки для использования на человеке. Дозировка таких соединений может находиться в пределах диапазона циркулирующих концентраций, включающих в себя ED50 с незначительной токсичностью или без таковой. Дозировка может варьироваться в пределах данного диапазона в зависимости от используемой формы дозировки и способа введения. Эффективную с лечебной точки зрения дозу белка ТАТ-НОХВ4Н можно первоначально оценить на основании анализа клеточной культуры. Дозу можно определить на животных моделях для достижения диапазона концентрации циркулирующей плазмы, включающей IC50 (т.е. концентрации испытуемого белка, которая достигает полумаксимального ингибирования симптомов), как определено в клеточной культуре. Уровни в плазме можно измерить, например, жидкостной хроматографией высокого разрешения. Действие любой конкретной дозировки можно проконтролировать приемлемым биологическим анализом. Примеры приемлемых биологических анализов включают в себя, но не ограничиваются, измерением стволовых клеток CD34+ в мононуклеарной клетке с использованием антител с флуоресцентной меткой (например, FITC) к стволовым клеткам CD34+ с измерением процентного соотношения клеток LY5 в периферической крови или костном мозге HSC проточной цитометрией. Предполагается, что полинуклеотид и белки по настоящему изобретению продемонстрируют одно или несколько проявлений нижеуказанной биологической активности (в т.ч. связанной с изложенным в данном описании анализом). Описанные в отношении белков по настоящему изобретению проявления или активность можно обеспечить посредством назначения или использования таких белков, а также посредством назначения или использования полинуклеотидов, кодирующих такие белки (как например, в генных терапиях или приемлемых для введения ДНК векторах).
III. Способы стимулирования гематопоэза in vivo
А. Пациенты, нуждающиеся в лечении
Фармацевтическую композицию по изобретению можно использовать для лечения заболеваний, которые включают в себя, но не ограничиваются, аутоиммунные расстройства, иммунодефицита, а также гематологические нарушения. Кроме того, фармацевтические композиции по изобретению можно использовать для улучшения реабилитационного периода после трансплантации гемопоэтических стволовых клеток.
Фармацевтическая композиция по изобретению включает, но не ограничивается, лечение пациентов, страдающих от или восприимчивых к лимфомам, лейкемиям, болезни Ходжкина и миелопролифератимным нарушениям. Кроме того, наследственные заболевания, вызванные дефицитом гемопоэтических стволовых клеток и гипопластической анемией, можно лечить фармацевтической композицией по настоящему изобретению.
Далее, фармацевтическую композицию по настоящему изобретения можно назначать донорам гемопоэтических стволовых клеток и пациентам с невосприимчивым гранулоцитарным колониестимулирующим фактором.
В одном варианте осуществления изобретения белок ТАТ-НОХВ4Н представляет собой единственное активное вещество, вводимое для активации гемопоэтических стволовых клеток, а фтороурацил (5-FU) не вводится донору, будь-то в виде схемы предварительного лечения или комплексной терапии.
Связанные с возросшим выживанием клетки дополнительные заболевания или состояния, которые можно лечить фармацевтическими композициями по изобретению, включают, но не ограничиваются, прогрессирование и/или метастазы злокачественности и связанные с такими расстройствами, как лейкемия (в т.ч. острая лейкемия (например, острый лимфобластный лейкоз, острый миелобластный лейкоз (в т.ч. миелобластный, промиелоцитарный, моноцитарный лейкоз и эритромиелоз), а также хроническая лейкемия (например, хронический миелобластный (гранулоцитарный) лейкоз и хроническая лимфоцитарная лейкемия)), миелодиспластический синдром истинной полицитемии, лимфома (например, болезнь Ходжкина и болезнь не-Ходжкина), множетвенная миелома, болезнь Вальденстрема (макроглубулинемия), а также опухоли, включая, но не ограничиваясь, саркомы и карциномы типа фибросаркомы, миксосаркомы, липосаркомы, хондросаркомы, остеогенной саркомы, хордомы, ангиосаркомы, эндотелиосаркомы, лимфангиосаркомы, лимфангиоэндотелиосаркомы, синовиомы, опухоли Юинга, лейомиосаркомы, рабдомиосаркомы, карциномы толстой кишки, рака поджелудочной железы, рака молочной железы, рака яичников, рака простаты, плоскоклеточного рака, базально-клеточного рака, аденокарциномы, карциномы потовых желез, карциномы сальных желез, папиллярного рака, папиллярной аденокарциномы, цистаденокарциномы, медуллярного рака, бронхогенного рака, рака почки, гепатомы, карциномы желчных протоков, хориокарциномы, семинокарциномы, эмбрионального рака, опухоли Вильмса, цервикального рака, опухоли яичек, плоскоклеточного рака легких, рака мочевого пузыря, эпителиального рака, глиомы, астроцитомы, бедуллобластомы, краниофарингиомы, эпендимомы, пинеаломы, гемангиобластомы, акустической невромы, олигодендроглиомы, менангоимы, меланомы, нейробластомы и ретинобластомы.
Настоящее изобретение не ограничивается конкретной методологией, протоколами, клеточными линиями, видами или родами животных, а также нижеописанными реагентами. Используемая для описания конкретных осуществлений терминология не предназначена для ограничения объема настоящего изобретения, которое может быть ограничено приложенными пунктами формулы изобретения. Используемые в данном описании формы единственного числа включают в себя ссылки на множественное число, если в контексте ясно не указано иным образом. Таким образом, например, ссылка на "клетку" является ссылкой на одну или несколько клеток, и предусматривает соответствующие известные специалистам в данной области технике эквиваленты.
Если не определено иначе, все используемые в данном описании технические и научные термины имеют то же самое значение, которое обычно понято среднему специалисту в области техники, к которой относится это изобретение. Хотя любые подобные или эквивалентные описанным в данном изобретении способы, устройства и вещества можно использовать на практике или при испытании изобретения, здесь описаны предпочтительные способы, устройства и вещества. Все упомянутые в данном описании публикации и патенты настоящим включены в данное изобретение посредством ссылки в целях описания и раскрытия, например, описанные в публикациях толкования и методологии, которые могли бы использоваться в связи с настоящим описанным изобретением. Рассмотренные выше и встречающиеся по всему тексту публикации предусмотрены исключительно для целей раскрытия до возникновения правовой охраны настоящей заявки. Ничто описанное в данном изобретении не должно истолковываться как допущение того, что изобретатели не вправе использовать предшествующее в раскрытии изобретения в силу предшествующего изобретению.
Определения
"Стволовая клетка" - это плюрипотентная или мультипотентная клетка со способностью самообновляться, оставаться недифференцированной и становиться дифференцированной. Стволовые клетки могут делиться без ограничений, по крайней мере, на протяжении жизни животного, в котором они находятся. Стволовые клетки не являются терминально дифференцированными, т.е. они не находятся на конце пути дифференцирования. При делении стволовой клетки каждая дочерняя клетка может остаться стволовой клеткой, либо может пойти по пути терминальной дифференцировки. "Химерная" стволовая клетка - это стволовая клетка с частью своей ДНК, принадлежащей гетерологичному организму.
"Гематопоэтическая" клетка - это клетка, вовлеченная в процесс гематопоэза, т.е. в процесс образования зрелых кровяных клеток из клеток-предшественников. У взрослого гематопоэз происходит в костном мозге. В начале развития гематопоэз происходит в различных участках в течение различных этапов развития; примитивные кровяные клетки появляются в желточном мешке, и впоследствии, кровяные клетки образуются в печени, селезенке и костном мозге. Гематопоэз проходит комплексное регулирование, в т.ч. регулирование гормонами, например эритропоэтин; факторы роста, например колониестимулирующие факторы, а также цитокины. например интерлейкины.
Используемый в данном описании термин "вектор" предназначен для обозначения молекулы нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Один тип вектора - это "плазмида", которая относится к петле кольцевой двухцепочечной ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другой тип вектора - это вирусный вектор, в котором дополнительные сегменты ДНК можно лигировать в вирусный геном. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы с бактериальным происхождением репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) можно интегрировать в геном клетки-хозяина при введении в клетку-хозяина, и таким образом, происходит репликация наряду с геномом хозяина. Более того, определенные векторы способны направлять экспрессию генов, с которыми они действенно связанны. Такие векторы именуются в дальнейшем "рекомбинантные экспрессионные векторы" (или просто, "экспрессионные векторы"). Вообще, экспрессионные векторы полезности в рекомбинантных методах ДНК зачастую находятся в форме плазмид. В настоящем описании изобретения "плазмида" и "вектор" можно использовать во взаимозаменяемом порядке, поскольку плазмида - это обычно используемая форма вектора. Однако изобретение предназначено для включения и других форм экс-прессионных векторов, таких как вирусные векторы (например, дефектные ретро-вирусы репликации, аденовирусы и адено-ассоциированные вирусы), которые служат эквивалентным функциям.
Используемый в данном описании термин "трансформация" относится к инсерции экзогенного полинуклеотида в клетку-хозяин, независимо от используемого для инсерции способа: например, трансформация посредством непосредственного поглощения, трансфекции, инфекции и т.п. Конкретные способы трансфекции смотри ниже. Экзогенный полинуклеотид можно сохранять в виде неинтегрированного вектора, например эписомы, или наоборот, можно интегрировать в геном хозяина.
Вообще, термин "белок" относится к любому полимеру двух или нескольких отдельных аминокислот (встречающихся в природе или нет) через пептидную связь, что происходит, когда связанный с α-углеродом одной аминокислоты (или аминокислотного остатка) атом углерода карбоксила группы карбоксильной кислоты становится ковалентно связанным с атомом аминоазота аминогруппы, связанной с α-углеродом прилегающей аминокислоты. Эти пептидные связи, включающие их атомы (т.е. атомы α-углерода, атомы углерода карбоксила (и их замещающие атомы кислорода), а также атомы аминоазота (и их замещающие атомы водорода)) образуют "полипептидный остов" белка. Кроме того, используемый в данном описании термин "белок" понимается для включения терминов "полипептид" и "пептид" (которые периодически можно использовать во взаимозаменяемом порядке в данном описании). Точно так же, фрагменты белка, аналоги, производные и варианты, можно именовать "белки" и считать "белком", если не указано иначе. Термин "фрагмент" белка относится к полипептиду, включающему меньше всех аминокислотных остатков белка. По оценке "фрагмент" белка может быть формой белка, усеченного на аминоконце, карбоксиконце и/или внутренне (как например, естественный сплайсинг), и также может быть вариантом и/или производным. "Домен" белка - это также фрагмент, который включает в себя аминокислотные остатки белка, требующий придачи биохимической активности, соответствующей естественно возникающему белку.
Используемый для описания молекулы нуклеиновой кислоты термин "ре-комбинантный" означает полинуклеотид геномной кДНК вирусного, полусинтетического или синтетического происхождения, который в силу своего происхождения или действия не ассоциирован со всем полинуклеотидом или с его частью, с которым ассоциирован по природе. Используемый в отношении белка или полипептида термин "рекомбинантный" означает полипептид, полученный посредством экспрессии рекомбинантного полинуклеотида.
"Изолированная", "очищенная", "существенно изолированная" или "существенно чистая" молекула (как например, полипептид или полинуклеотид) - это та молекула, которую воздействовали так, чтобы она присутствовала в более высокой концентрации, чем в природе. Например, объектный белок изолирован, очищен, существенно изолирован или существенно очищен, когда удалены не менее 50%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более веществ с необъектным белком, с которыми он ассоциирован в природе. Используемая в данном описании "изолированная", "очищенная", "существенно изолированная" или "существенно чистая" молекула включает в себя рекомбинантные молекулы.
Мышь "SCID" - это модель мыши для тяжелого комбинированного синдрома иммуннодефицита (SCID), который вызывает тяжелые расстройства в развитии иммунной системы. У этих мышей имеется недостаточное количество Т- и В-лимфоцитов, либо они полностью отсутствуют. Мутация SCID ухудшает рекомбинацию антигенных рецепторных генов, тем самым вызывая нехватку функциональных Т- и В-лимфоцитов. Другие типы гематопоэтических клеток развиваются и функционируют нормально. Мыши SCID охотно поддерживают нормальную дифференцировку лимфоцитов и могут быть воссозданы с нормальными лимфоцитами из изогенных или аллогенных мышей, или с лимфоцитами человека. Эти мыши также поддерживают рост аллогенных и ксеногенных опухолей. Поэтому, мышей SCID, которые допускают диссеминированный рост ряда человеческих опухолей, в частности, гематологических нарушений и злокачественных меланом, можно использовать для исследования злокачественности.
Термины "объект", "человек", "хозяин" и "пациент" используются в данном описании во взаимозаменяемом порядке для отсылки к живой особи, в т.ч. человеческой и нечеловеческой особи. Объектом, например, может быть организм с иммунными клетками, которые способны реагировать на антигенное стимулирование и стимулирующую ингибиторную сигнальную трансдукцию через связывание поверхностно-клеточного рецептора. Объектом может быть млекопитающее - млекопитающее-человек или млекопитающее-нечеловек, например собаки, кошки, свиньи, коровы, овцы, козы, лошади, крысы и мыши. Термин "объект" не исключает индивиды, которые полностью нормальны в отношении заболевания или нормальны во всех отношениях.
Термин "лечение" относится к лечебной или профилактической мере. Можно назначать лечение объекту, который страдает заболеванием или, в конечном итоге, может заболеть, в целях профилактики, лечения, отсрочки, снижения тяжести, а также уменьшения интенсивности одного или нескольких симптомов заболевания или рецидивирующего заболевания, или в целях продления выживания объекта сверх ожидаемого при отсутствии такого лечения.
Термин "эффективное с лечебной точки зрения количество" означает количество испытуемого соединения, могущее выявить желаемую реакцию, например, биологическую или медицинскую реакцию ткани, системы, животного или человека, к которому стремится, например, исследователь, ветеринар, врач или другой клиницист.
Примеры
Следующие частные примеры следует в любом случае рассматривать просто как иллюстративные, а не ограничивающие оставшуюся часть описания. Без дальнейшей проработки считается, что специалист в этой области техники на основании данного описания может использовать настоящее изобретение в полном объеме.
Пример 1: Конструирование плазмиды pET21b-His-pTAT-HOXB4-His
(а) Модификация плазмиды pET21b, содержащей сигнальный пептид ТАТ и метку His с N- и С-концом
Экспрессионный вектор pET21b, содержащий метку His с М-концом и сигнальный пептид ТАТ, был получен посредством введения олигонуклеотидов 5'T-TATGCACCACCACCACCACCACTACGGCCGCAAGAAACGCCGCCAGCGCC GCCGGCG-3' (смысл) и 5'-CTAGCGGCGCTGGCGGCGTTTCTTGCGGCC GTAGTGGTGGTGGTGGTGGTGCA-3' (антисмысл) в плазмиду pET21b. Метка His с С-концом уже присутствует в векторе pET21b.
(b) Клонирование НОХВ4 в модифицированный экспрессионный вектор pET21b
Фрагмент ДНК, содержащий открытую рамку считывания (ORF) HOXB4 и дополнительно 6 гистидиновых кодирующих последовательностей, был получен посредством амплификации ПЦР (PRC - полимеразная цепная реакция) с использованием плазмиды MGC54130 (GeneDiscovery, Тайбэй, Тайвань, номер по каталогу 5533346) в качестве матрицы, а фрагмент кДНК HOXB4, полученный методом ПЦР, был субклонирован в модифицированный экспрессионный вектор pET21b. Конструирование плазмиды и нуклекислотные последовательности показаны на фиг.2 и 3.
Пример 2: Экспрессия рекомбинантного белка ТАТ-НОХВ4Н в Е. coli
Экспрессионный вектор pET21b-His-TAT-HOXB4-His был трансформирован в штамм Е. coli BL21 (DE3) pLysS (Novagen). Трансформированные клетки выращивали всю ночь при 37°С. Выращенные культуры развели до первоначального OD600 из 0,05. Затем культуры выращивали до OD600 из 0,5 при 37°С с индукцией 1 ммоль изопропил-бета-Д-тиогалактопиранозида (IPTG) при 37°С в течение 3 часов при энергичном встряхивании.
Пример 3: Очистка рекомбинантного белка ТАТ-НОХВ4Н
После индукции клетки собрали центрифугированием и повторно суспендировали в буфере А (8 моль мочевины, 20 ммоль HEPES, 0,5 ммоль DTT и 100 ммоль NaCl, pH 8,0). Клеточную суспензию трижды проводили через французский пресс, клеточный лизат очистили центрифугированием при 20000×g в течение 30 минут при 4°С, супернатант отрегулировали с имидазолом 10 ммоль и поместили в хелатообразующие колонку HisTrap (Amersham Pharmacia). Связанные белки элюировали имидазолом 50, 100 и 250 ммоль в буфере А. Фракции с содержанием белка ТАТ-НОХВ4Н поместили в колонку MonoSP в буфере В (мочевина 4 моль, HEPES 20 ммоль и NaCl 50 ммоль, pH 6,5) и элюировали NaCl 1,5 моль и HEPES 20 ммоль (pH 8,0).
Пример 4: Ренатурация рекомбинантного белка ТАТ-НОХВ4Н
Белок ТАТ-НОХВ4Н в элюированных фракциях был солюбилизорован и денатурирован в растворе, содержащем денатурированную соль (например, гуанидин гидрохлорид), а затем был смешан с буфером D-PBS-T (1% Triton X-100 в 2х PBS). Соотношение белкового раствора ТАТ-НОХВ4Н к буферу D-PBS-T составляло 1:4. Полученную в результате смесь добавили в пробирку-фильтр концентратора «Центрикон 10К» (50 мл или 15 мл), предварительно обработанную водой (10 мл или 3 мл), а затем центрифугировали при 3000 об/мин в течение 10 мин. На данном этапе денатурированная соль замещается буфером D-PBS-T, в котором Triton X-100 способен связываться с гидрофобной областью белка НОХВ4Н.
Данный этап ультрафильтрации или буферного обмена с использованием «Центрикон 10К» осуществляли десять раз с раствором, содержащим различные концентрации бета-циклодекстрина (по два раза каждые 1 ммоль, 2 ммоль, 3 ммоль, 4 ммоль и 5 ммоль бета-циклодекстрина в буфере хранения IMDM посредством центрифугирования при 1000-2500×g в течение 10 мин). Оставшийся в пробирке-фильтре «Центрикон 10К» образец собрали и хранили при -80°С.
Гомогенность очищенного белка ТАТ-НОХВ4Н была подвергнута анализу на SDS-полиакриламидном геле, после провели окрашивание кумасси (см. фиг.5). Как показано на фиг.5, очищеный с использованием колонок HisTrap и MonoSP белок ТАТ-НОХВ4Н был получен с 3 - 4-кратным выходом по сравнению с тем же белком ТАТ-НОХВ4. Плазмида рТАТ-НА-НОХВ4 была подарком от д-ра Ги Соважо из Монреальского университета Канады. Данная плазмида была трансформирована в BL21 (DE3) pLysS (Novagen), а очистка белка ТАТ-НОХВ4 была произведена в соответствии с описанием в (Krosl et al, 2003).
Пример 5: Стабильность рекомбинантного белка ТАТ-НОХВ4Н
Стабильность белка ТАТ-НОХВ4Н была измерена анализом с SDS-полиакриламидным гелем. После хранения белок ТАТ-НОХВ4Н можно деградировать на фрагменты 30 КД и 10 КД. Как показано на фиг.6, полученный способом по этому изобретению белок ТАТ-НОХВ4Н был стабилен даже спустя 16 часов при хранении в забуференном фосфатом физиологическом растворе при 4°С.
Далее, стабильность хранившегося при 4°С и -20°С в забуференном фосфатом физиологическом растворе белка ТАТ-НОХВ4Н была проанализирована на электрофорезе 10%-ном полиакриламидным гелем, после провели окрашивание кумасси. Как показано на фиг.7, при использовании IMDM в качестве буфера хранения, стабильность белка ТАТ-НОХВ4Н сохранялась даже спустя 4 недели.
Пример 6: Воздействие рекомбинантного белка ТАТ-НОХВ4Н на гематопоэз у диких мышей типа Balb/c
Мыши Balb/c использовались для исследования возможного воздействия рекомбинантного белка ТАТ-НОХВ4Н на активацию в периферической крови HSC из костного мозга. Рекомбинантный белок ТАТ-НОХВ4Н в ЗФР вводили подкожно четыре раза в день в течение 4 дней. В целях изучения реакции на дозу экспериментальные группы (n=21) получали дозу в диапазоне от 1 мкг, 5 мкг, 10 мкг, 15 мкг … до 100 мкг на кг массы мыши. Отдельная группа контрольных мышей получала только забуференный фосфатом физиологический раствор, а другой группе контрольных мышей подкожно вводили дважды в день в течение 4 дней дозу 5 мкг на 1 кг массы G-CSF/мышь.
У всех мышей взяли периферическую кровь и провели анализ на проточном цитометре для определения содержания стволовых клеток CD34+ в мононуклеарной клетке (MNC). Результаты представлены в таблице 1 как среднее значение ± среднеквадратичное отклонение.
Процентное соотношение CD34+/MNC в периферической крови, взятой у обработанных мышей, представлено в таблице 1. Белок ТАТ-НОХВ4Н, которым обрабатывали экспериментальные группы 3-21 (получали дозу 10 мкг или выше на кг массы), показал почти такое же активное действие, как и в контрольной группе, которую обрабатывали G-CSF.
Костный мозг из мышей, обработанных ТАТ-НОХВ4Н (экспериментальная группа 3 получала дозу 10 мкг на кг массы), мышей, обработанных G-CSF, а также мышей, которым вводили ЗФР, был далее фенотипирован с использованием антитела, меченного флуоресцинизотиоцианатом (ФИТЦ) до CD34+ (Becton Dickinson), и проанализирован на проточном цитометре. Костный мозг из мышей, обработанных ТАТ-НОХВ4Н (см. фиг.8С), был более богат стволовыми клетками CD34+, чем костный мозг от мышей, которым вводили G-CSF (см. фиг.8А) и ЗФР (см. фиг.8В). Следовательно, данные результаты указывают на то, что введение рекомбинантного белка ТАТ-НОХВ4Н приводит к возросшему числу HSC и в костном мозге, и в периферической крови у мышей.
Пример 7: Воздействие рекомбинантного белка ТАТ-НОХВ4Н на гематопоэз макаки-резуса
Для исследования эффективности рекомбинантного белка ТАТ-НОХВ4Н у обезьян использовались взрослые самцы макаки-резуса. Экспериментальной группе I (n=5) внутривенно вводили 10 мкг на 1 кг массы рекомбинантного белка ТАТ-НОХВ4Н четыре раза в день в течение 4 дней. Экспериментальной группе II (n=5) внутривенно вводили 10 мкг на 1 кг массы рекомбинантного белка ТАТ-НОХВ4Н четыре раза в день, также подкожно вводили 5 мкг на 1 кг массы G-CSF в течение 4 дней. Контрольная группа получала только ЗФР, а контрольной группе II подкожно вводили дважды в день в течение 4 дней дозу 5 мкг на 1 кг массы G-CSF. У всех обезьян взяли кровь и провели анализ на проточном цитометре для получения процентного соотношения стволовых клеток CD34+ в мононуклеарной клетке (MNC). Результаты представлены в таблице 2.
Как показано в таблице 2, обезьяны (экспериментальная группа I), обработанные только белком ТАТ-НОХВ4Н, продемонстрировали гораздо лучшее активированное воздействие, чем обезьяны, обработанные G-CSF (контрольная группа II). Обезьяны, обработанные белком ТАТ-НОХВ4Н и G-CSF (экспериментальная группа), продемонстрировали незначительно лучшее воздействие, чем обезьяны, обработанные G-CSF (контрольная группа II).
Образцы костного мозга от обезьян, обработанных ТАТ-НОХВ4Н, G-CSF или ЗФР, были затем фенотипированы с использованием антитела, меченного флуоресцинизотиоцианатом (ФИТЦ) до CD34+ (Becton Dickinson), и проанализированы на проточном цитометре. Образцы костного мозга от обезьян, обработанных ТАТ-НОХВ4Н (см. фиг.9С), были более богаты стволовыми клетками CD34+, чем образцы костного мозга от обезьян, которым вводили G-CSF (см. фиг.9А), ТАТ-НОХВ4Н+G-CSF (см. фиг.9В) и ЗФР (см. фиг.9D).
Пример 8: Воздействие рекомбинантного белка ТАТ-НОХВ4Н на гематопоэтическое восстановление у мышей NOD-SCID
Человеческие клетки 104 Lin-/CD34+ были введены облученным (2,5 Гр) мышам NOD-LtSz-scid/scid (NOD-SCID) наряду с А-клетками 105 CD34. Мышей произвольно разделили на две группы: одной группе (n=28) внутривенно вводили 10 мкг на 1 кг массы рекомбинантный белок ТАТ-НОХВ4Н дважды в день, а другая (n=28) получала ЗФР дважды в день. Наличие человеческих клеток CD45+ в клетках периферической крови всех мышей периодически измеряли проточной цитометрией после трансплантации. Гематопоэтическое восстановление было оценено по количеству мышей, человеческие клетки CD45+, которых достигли уровня > 0,1% в периферической крови (ПК) после трансплантации. Как показано на фиг.10, улучшенное гематопоэтическое восстановление наблюдалось у мышей, которым вводили рекомбинантный белок ТАТ-НОХВ4Н.
Пример 9: Воздействие рекомбинантного белка ТАТ-НОХВ4Н на геммапоэтическое восстановление у мышей Balb/c после химиотерапии цисплатином
Мышам пятинедельного возраста Balb/c неоднократно внутривенно вводили цисплатин, пока количество клеток Ly5 (мышиный CD45) в периферической крови мышей не уменьшились приблизительно до 10% от первоначального количества. Обработанных цисплатином мышей произвольно разделили на две группы: одной группе (n=28) внутривенно вводили 10 мкг на 1 кг массы рекомбинантный белок ТАТ-НОХВ4Н дважды в день, а другая (n=28) дважды в день получала ЗФР. Наличие клеток Ly5 в клетках периферической крови всех мышей периодически измеряли проточной цитометрией после трансплантации. Степень гематопоэтического восстановления оценивали как процентное соотношение количества клеток Ly5 в периферической крови к первоначальному количеству. Как показано на фиг.11, улучшенное гематопоэтическое восстановление наблюдалось у мышей, которым вводили рекомбинантный белок ТАТ-НОХВ4Н.
Используемые в данных экспериментах модели животных признаны в области техники как предвещающие результаты, которые будут получены на пациенте-человеке (см., например, Broxmeyer el al. (2005) The Journal of Experimental Medicine, 201, 1207-1318: Larochelle el al. (2006) Blood 107, 3772-3778).
Хотя изобретение пояснено различными вариантами осуществления, следует понимать, что можно выполнить много других возможных модификаций и вариантов, не выходя за пределы существа и объема охраны изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиция, ингибирующая белки MEIS | 2017 |
|
RU2755212C2 |
| ГЕННАЯ ТЕРАПИЯ ПАЦИЕНТОВ С АНЕМИЕЙ ФАНКОНИ | 2017 |
|
RU2801241C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ЭКСПРЕССИРУЮЩИЕ EPO ЧЕЛОВЕКА | 2015 |
|
RU2711744C1 |
| СПОСОБЫ ГЕННОЙ МОДИФИКАЦИИ ГЕМОПОЭТИЧЕСКИХ КЛЕТОК | 2019 |
|
RU2824194C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ЭКСПРЕССИРУЮЩИЕ EPO ЧЕЛОВЕКА | 2015 |
|
RU2799086C2 |
| КОМПОЗИЦИИ И СПОСОБЫ УСИЛЕНИЯ ЭКСПРЕССИИ ГЕНА PKLR | 2017 |
|
RU2773358C2 |
| СРЕДСТВО ДЛЯ ВОВЛЕЧЕНИЯ ПРОИСХОДЯЩЕЙ ИЗ КОСТНОГО МОЗГА ПЛЮРИПОТЕНТНОЙ СТВОЛОВОЙ КЛЕТКИ В ПЕРИФЕРИЧЕСКИЙ КРОВОТОК | 2009 |
|
RU2519714C2 |
| ПЕРЕПРОГРАММИРОВАНИЕ ЭНДОТЕЛИЯ ЧЕЛОВЕКА В ГЕМОПОЭТИЧЕСКИХ ПРЕДШЕСТВЕННИКОВ МНОЖЕСТВЕННЫХ ЛИНИЙ ДИФФЕРЕНЦИРОВКИ С ИСПОЛЬЗОВАНИЕМ ОПРЕДЕЛЕННЫХ ФАКТОРОВ | 2014 |
|
RU2691062C2 |
| СПОСОБ СБОРА ФУНКЦИОНАЛЬНЫХ КЛЕТОК IN VIVO С ВЫСОКОЙ ЭФФЕКТИВНОСТЬЮ | 2009 |
|
RU2571230C2 |
| ЛЕНТИВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ДОСТАВКИ PKLR ДЛЯ ЛЕЧЕНИЯ ДЕФИЦИТА ПИРУВАТКИНАЗЫ | 2018 |
|
RU2777934C2 |

Настоящее изобретение относится к новому и неочевидному способу получения рекомбинантного белка ТАТ-НОХВ4Н. Применение данного способа обеспечивает неожиданные преимущества в виде повышения стабильности и выхода белка. Также предлагается фармацевтическая композиция, включающая в качестве эффективного компонента белок ТАТ-НОХВ4. Данная композиция обладает стимулирующим действием на производство гематопоэтических стволовых клеток. Более конкретно, рекомбинантный белок ТАТ-НОХВ4 усиливает приживление костномозговых трансплантатов, гемапотоэтическую реконструкцию, репопуляцию и количество циркулирующих стволовых клеток, в частности, после химиотерапии или облучения. 3 н. и 21 з.п. ф-лы, 11 ил., 2 табл.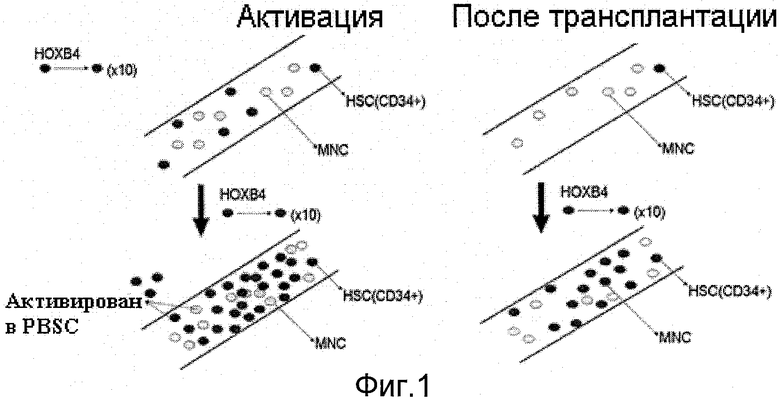
1. Способ получения белка ТАТ-НОХВ4Н, включающий следующие стадии:
(a) получение клетки-хозяина Е. coli, трансформированной экспрессионным вектором, содержащим фрагменты ДНК кодирующей последовательности для сигнального пептида ТАТ, метку His с С-конца и открытую рамку считывания НОХВ4;
(b) экспрессия рекомбинантного белка ТАТ-НОХВ4Н в клетке-хозяине E.coli;
(c) лизис клеток пропусканием через французский пресс и центрифугированием для сбора неочищенного раствора экспрессированного белка;
(d) очистка белка из раствора за счет следующих этапов:
(i) введение раствора в колонку HisTrap;
(ii) промывка колонки HisTrap промывающим буфером, содержащим мочевину 8 моль, HEPES 20 ммоль, DTT 0,5 ммоль, NaCl 100 ммоль, рН 8,0 и имидазол 10 ммоль;
(iii) элюирование частично очищенного белка из колонки HisTrap с использованием элюирующего буфера, содержащего 50-250 ммоль имидазола, 8 моль мочевины, 20 ммоль HEPES, 0,5 ммоль DTT, 100 ммоль NaCl при рН 8,0 для получения частично очищенного раствора белка;
(iv) введение частично очищенного раствора белка в колонку MonoSP;
(v) промывка колонки MonoSP промывающим буфером, содержащим мочевину 4 моль, HEPES 20 ммоль и NaCl 50 ммоль при рН 6,5;
(vi) элюирование очищенного белка из колонки MonoSP в денатурированной форме с использованием элюирующего буфера, содержащего NaCl 1,5 моль и HEPES 20 ммоль при рН 8,0;
(е) рефолдинг белка, элюированного в денатурированной форме, с использованием гидрофобных соединений, таких как Triton Х-100, Tween-20 или полибензольные соединения за счет следующих этапов:
(i) солюбилизация и денатурирование белка, элюированного в денатурированной форме, в растворе, содержащем соль типа гуанидин гидрохлорид;
(ii) объединение солюбилизированного денатурированного белка и раствора гидрофобных соединений для получения раствора, содержащего белок и гидрофобные соединения;
(iii) обессоливание раствора, содержащего белок и гидрофобные соединения для получения обессоленного раствора;
(iv) удаление гидрофобных соединений из обессоленного раствора за счет ультрафильтрации с использованием раствора, содержащего циклодекстрин.
2. Способ по п.1, отличающийся тем, что частично очищенный белок из колонки HisTrap элюируют элюирующим буферным раствором, который содержит имидазол 50-100 ммоль.
3. Способ по п.1, отличающийся тем, что частично очищенный белок из колонки HisTrap элюируют элюирующим буферным раствором, который содержит имидазол 100-250 ммоль.
4. Способ по п.1, отличающийся тем, что ультрафильтрацию осуществляют с использованием пробирки-фильтра концентратора центрикона или концентратора stir-cell.
5. Способ по п.1, отличающийся тем, что очищенный белок хранят в IMDM или DMEM.
6. Способ по п.1, отличающийся тем, что метку His с С-конца белка ТАТ-НОХВ4Н удаляют.
7. Фармацевтическая композиция для увеличения абсолютного числа клеток HSC в костном мозге объекта, содержащая эффективное количество белка ТАТ-НОХВ4Н, полученного способом по п.1, и фармацевтически приемлемый носитель.
8. Композиция по п.7, отличающаяся тем, что объект является донором HSC.
9. Композиция по п.7, отличающаяся тем, что объект является пациентом, подвергавшимся аутологической трансплантации клеток HSC.
10. Композиция по п.7, отличающаяся тем, что объект является пациентом, невосприимчивым к G-CSF.
11. Композиция по п.10, отличающаяся тем, что объект страдает заболеванием, вызванным наследственным дефицитом клеток HSC.
12. Композиция по п.11, отличающаяся тем, что объект страдает наследственной гипопластической анемией.
13. Композиция по п.7, отличающаяся тем, что объект страдает гематологическими нарушениями, солидными опухолями или иммунологическими расстройствами.
14. Композиция по п.13, отличающаяся тем, что гематологическое нарушение выбрано из группы: лимфома, лейкемия, болезнь Ходжкина или миелопролиферативные нарушения.
15. Композиция по п.7, отличающаяся тем, что белок ТАТ-НОХВ4Н не содержит метку His с С-конца.
16. Фармацевтическая композиция для уменьшения времени выздоровления объекта, прошедшего трансплантацию гемопоэтических стволовых клеток HSC, облучение или химиотерапию, содержащая эффективное количество белка ТАТ-НОХВ4Н, полученного способом по п.1, и фармацевтически приемлемый носитель.
17. Композиция по п.16, отличающаяся тем, что нуждающийся объект является донором клеток HSC.
18. Композиция по п.16, отличающаяся тем, что нуждающийся объект является пациентом, подвергшимся аутологической трансплантации клеток HSC.
19. Композиция по п.16, отличающаяся тем, что нуждающийся объект является пациентом, невосприимчивым к G-CSF.
20. Композиция по п.19, отличающаяся тем, что объект страдает заболеванием, вызванным наследственным дефицитом HSC.
21. Композиция по п.20, отличающаяся тем, что объект страдает наследственной гипопластической анемией.
22. Композиция по п.16, отличающаяся тем, что объект страдает гематологическими нарушениями, солидными опухолями или иммунологическими расстройствами.
23. Композиция по п.22, отличающаяся тем, что гематологическое нарушение выбрано из группы: лимфома, лейкемия, болезнь Ходжкина или миелопролиферативные нарушения.
24. Композиция по п.16, отличающаяся тем, что белок ТАТ-НОХВ4Н не содержит метку His с С-конца.
| WO 2007090317, 16.08.2007 | |||
| ROSEMA ET AL.: "Artificial chaperones: protein refolding via sequential use of detergent and cyclodextrin", J.Am.Chem.Soc., 1995, v.l 17, p.2373-2374 | |||
| US 20040072298, 15.04.2004 | |||
| US 20040082003, 29.04.2004 | |||
| KROSL J | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| WO 2005026196, 24.03.2005. | |||
Авторы
Даты
2010-10-20—Публикация
2008-08-20—Подача