РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет и преимущество предварительной заявки на патент США № 62/385185, поданной 8 сентября 2016 года, и предварительной заявки на патент США № 62/412028, поданной 24 октября 2016 года, содержание которых включено в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение в целом относится к переносу генов в клетки с пониженной или отсутствующей активностью белков, выбранных из одного или нескольких белков, кодируемых FANCA.
ЗАЯВЛЕНИЕ, КАСАЮЩЕЕСЯ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0003] Перечень последовательностей, связанный с настоящей заявкой, представлен в текстовом формате вместо бумажной копии и тем самым включен в настоящее описание посредством ссылки. Текстовый файл, содержащий последовательность, называется ROPA_002_01WO_ST25.txt. Текстовый файл размером 46 Кбайт был создан 8 сентября 2017 года и подается в электронном виде через EFS-WEB.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0004] Анемия Фанкони (FA) представляет собой аутосомно-рецессивное заболевание (за исключением группы комплементации FA-B, которая сцеплена Х-хромосомой), при котором медиана выживаемости пациентов составляет около 24 лет (Butturini A, et al. (1994) Blood 84:1650-1655; Kutler DI, et al. (2003) Blood 101:1249-1256). При рождении число форменных элементов крови у этих пациентов в целом нормальное. Зачастую первой гематологической аномалией, выявляемой у этих пациентов, является макроцитоз. Он обычно развивается с тромбоцитопенией, анемией и панцитопенией. Недостаточность костного мозга (BMF) обычно наблюдается у этих пациентов через 5-10 лет, при этом средний возраст начала гематологического заболевания составляет 7 лет. У приблизительно 80% пациентов с FA признаки BMF разовьются в первые десять лет жизни. Исходя из эпидемиологических исследований, проведенных на сегодняшний день, известно, что если злокачественные эпизоды не проявляются до аплазии, то практически у всех пациентов с FA в возрасте до 40 лет развивается BMF (Butturini A, et al. (1994) Blood 84:1650-1655; Kutler DI, et al. (2003) Blood 101:1249-1256), которая является основной причиной смертности среди таких пациентов.
[0005] Вследствие комплексных клинических проявлений FA лечение этих пациентов направлено, в первую очередь, на нормализацию следующих синдромов: недостаточность костного мозга (BMF), миелоидный лейкоз и солидные опухоли.
[0006] Современные средства лечения предусматривают андрогены, такие как содержащие флуоксиместерон, оксиметолон или станозолол. Согласно недавнему обзору Dufour и коллег (Dufour, C. and Svahn, J. (2008). Bone Marrow Transplant 41 Suppl 2: S90-95) пациенты с FA могут демонстрировать некоторый ответ на терапию андрогенами, если данное лечение не начато на очень поздней стадии заболевания. Приблизительно 75% пациентов демонстрируют ответ на терапию андрогенами. Комбинация с преднизолоном в дозе 2 мг/кг/сутки снижает риск токсичности для печени. В целом, при отсутствии подходящего донора костного мозга андрогены могут рассматриваться в качестве альтернативного лечения, если имеется некоторый остаточный гемопоэз, но не в качестве основного эффективного долговременного лечения.
[0007] Tischkowitz et al. отметили, что хотя на ранних стадиях заболевания пациенты с FA могут демонстрировать ответ на терапию андрогенами, подавляющее большинство пациентов с FA плохо поддаются таким методам лечения в долгосрочной перспективе (Tischkowitz, M. and Dokal, I. (2004). Br J Haematol 126: 176-191).
[0008] При лечении FA отсутствуют специальные показания к применению гемопоэтических факторов роста. Однако были идентифицированы две фармакологические группы лекарственных средств с показаниями к применению при специфических симптомах FA (анемии и нейтропении): 1) эритропоэтин и 2) гранулоцитарные колониестимулирующие факторы (G-CSF). Несколько препаратов эритропоэтина (например, Аранесп, Неспо, Эксиджад) одобрены для лечения анемии, а G-CSF (например, аналоги G-CSF, такие как филграстим, биогастрин, неуласта) одобрены для лечения нейтропении. Хотя гемопоэтические факторы роста, такие как эритропоэтин и гранулоцитарные колониестимулирующие факторы, были протестированы на ограниченном числе пациентов с FA, ответы были частичными и временными (Dufour et al., 2008). В настоящее время эти средства лечения не являются хорошими долгосрочными вариантами лечения. В виде краткосрочного лечения G-CSF можно применять у пациентов с нейтропенией при острых инфекциях, чтобы увеличить число периферических нейтрофилов, усиливающих действие антибиотиков. Тем не менее, эти лекарственные методы лечения далеки от основного эффективного лечения пациентов с FA.
[0009] В настоящее время единственным радикальным лечением гематологических проявлений заболевания является аллогенная гемопоэтическая трансплантация. Хотя результат вмешательства для пациентов с FA, которым провели трансплантацию материала от доноров-сиблингов, идентичных по HLA, в целом является удовлетворительным, только приблизительно 20% пациентов с FA будут иметь сиблингов, идентичных по HLA. Значительной доле пациентов с FA без донора-сиблинга можно проводить трансплантацию от альтернативных доноров, хотя такие трансплантации ассоциированы с более высокой частотой осложнений и смертностью. Для остальных пациентов с FA в настоящее время отсутствуют альтернативные средства лечения.
[000010] Следовательно, сохраняется острая потребность в эффективной схеме лечения FA. Настоящее изобретение решает данную и другие проблемы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[000011] В вариантах осуществления настоящего изобретения предусмотрены полинуклеотидные кассеты для усиленной экспрессии FANCA. В некоторых вариантах осуществления полинуклеотидная кассета содержит последовательность, кодирующую кодон-оптимизированную кДНК FANCA человека, для усиления стабильности мРНК при транскрипции.
[000012] В одном варианте осуществления настоящее изобретение относится к кассете экспрессии, содержащей полинуклеотидную последовательность, содержащую следующее в 5'-3'-направлении: (a) промоторную последовательность гена фосфоглицераткиназы (PGK) человека или ее функциональный гомолог или вариант; (b) последовательность, кодирующую полипептид FANCA человека или его функциональный фрагмент или вариант; (c) сигнальную последовательность экспорта РНК регуляторного элемента вируса гепатита сурков (WPRE) или ее функциональный вариант или фрагмент, где последовательность, кодирующая полипептид FANCA человека или его функциональный фрагмент или вариант, функционально связана с промоторной последовательностью гена PGK. В конкретных вариантах осуществления полипептид FANCA или его функциональный фрагмент или вариант содержат последовательность, изложенную под SEQ ID NO: 25; последовательность, кодирующая полипептид FANCA или его функциональный фрагмент или вариант, содержит последовательность, изложенную под SEQ ID NO: 8; промотор гена PGK содержит нуклеотидную последовательность под SEQ ID NO: 7; и/или элемент WPRE содержит нуклеотидную последовательность под SEQ ID NO: 23. В конкретных вариантах осуществления кассета содержит участок нуклеотидной последовательности под SEQ ID NO: 24. В определенных вариантах осуществления кассета дополнительно содержит одну или более энхансерных последовательностей, полипуриновый тракт (PPT) или сигнальную последовательность полиаденилирования (polyA), последовательность сигнала упаковки, усеченную последовательность Gag, Rev-чувствительный элемент (RRE); центральный полипуриновый тракт (cPPT), центральную терминальную последовательность (CTS) и/или элемент последовательности, расположенный против хода транскрипции (USE), необязательно из вируса обезьян 40 (SV40-USE).
[000013] В одном варианте осуществления настоящего изобретения представлена кассета экспрессии, содержащая полинуклеотидную последовательность, содержащую: a) промоторную последовательность; b) последовательность, кодирующую полипептид; и c) сигнал экспорта рибонуклеиновой кислоты (РНК), где промоторная последовательность функционально связана с последовательностью, кодирующей полипептид FANCA (SEQ ID NO: 25), и необязательно где a)-c) присутствуют в кассете экспрессии в 5'-3'-направлении. В определенных вариантах осуществления промотор представляет собой промотор гена фосфоглицераткиназы (PGK). В определенных вариантах осуществления последовательность, кодирующая полипептид, является кодон-оптимизированной. В некоторых вариантах осуществления последовательность, кодирующая полипептид, представляет собой кодон-оптимизированную версию кДНК FANCA человека, характеризующуюся по меньшей мере 85% идентичностью с SEQ ID NO: 8. В конкретных вариантах осуществления сигнал экспорта РНК представляет собой мутантный посттранскрипционный регуляторный элемент вируса гепатита сурков (wPRE).
[000014] В определенных вариантах осуществления мутантный wPRE представляет собой химерный wPRE, содержащий последовательность, характеризующуюся по меньшей мере 80% идентичностью с SEQ ID NO: 23. В некоторых вариантах осуществления кассета экспрессии дополнительно содержит одну или более энхансерных последовательностей. В некоторых вариантах осуществления кассета экспрессии дополнительно содержит последовательность полипуринового тракта (PPT) или сигнала полиаденилирования (polyA). В некоторых вариантах осуществления кассета экспрессии дополнительно содержит одну или более из следующих последовательностей: i) последовательность сигнала упаковки; ii) усеченную последовательность Gag; iii) Rev-чувствительный элемент (RRE); iv) центральный полипуриновый тракт (cPPT); v) центральную терминальную последовательность (CTS) и vi) элемент последовательности, расположенный против хода транскрипции (USE), необязательно из вируса обезьян 40 (SV40-USE). В некоторых вариантах осуществления кассета экспрессии дополнительно содержит последовательности длинных концевых повторов (LTR) 5'- и 3'-конца.
[000015] В связанном варианте осуществления настоящего изобретения представлен рекомбинантный вектор доставки гена, содержащей кассету экспрессии, раскрываемую в данном документе. В определенных вариантах осуществления рекомбинантный вектор доставки гена представляет собой вирус или вирусный вектор. В определенных вариантах осуществления вирус или вирусный вектор представляет собой лентивирус (LV).
[000016] В другом родственном варианте осуществления настоящего изобретения представлена клетка, содержащая кассету экспрессии или вектор доставки гена, раскрываемые в данном документе. В некоторых вариантах осуществления клетка представляет собой клетку крови. В некоторых вариантах осуществления клетка представляет собой эритроидную клетку. В некоторых вариантах осуществления клетка представляет собой клетку костного мозга, например, клетку костного мозга, подвергнутую истощению по линии дифференцировки. В конкретных вариантах осуществления клетка представляет собой гемопоэтическую стволовую клетку или CD34+ клетку. В некоторых вариантах осуществления клетка представляет собой гемопоэтическую стволовую клетку. В некоторых вариантах осуществления клетка представляет собой CD34+ гемопоэтическую стволовую клетку. В некоторых вариантах осуществления клетка представляет собой коммитированную гемопоэтическую эритроидную клетку-предшественник.
[000017] В связанном варианте осуществления настоящего изобретения представлена фармацевтическая композиция, содержащая фармацевтически приемлемый наполнитель и рекомбинантный вектор доставки гена или клетку, раскрываемые в данном документе. В определенных аспектах настоящего изобретения представлены фармацевтические композиции, содержащие полинуклеотидную кассету по настоящему изобретению и фармацевтический наполнитель. В других вариантах осуществления фармацевтическая композиция содержит вектор доставки гена по настоящему изобретению и фармацевтический наполнитель.
[000018] Представлены способы и композиции для применения композиций на основе векторов для генной терапии, например, вирусных векторов, содержащих такие генетические кассеты экспрессии, для применения в получении лекарственных средств, применимых в базовой и нацеленной генной терапии заболеваний, нарушений и дисфункций у животного и, в частности, у людей.
[000019] В другом варианте осуществления настоящего изобретения представлен способ лечения или предупреждения заболевания или нарушения у субъекта, нуждающегося в этом, предусматривающий обеспечение субъекта кассетой экспрессии, вектором доставки гена или фармацевтической композицией, раскрываемыми в данном документе.
[000020] В другом варианте осуществления настоящее изобретение относится к способу лечения анемии Фанкони у субъекта, нуждающегося в этом, предусматривающему обеспечение субъекта фармацевтической композицией, раскрываемой в данном документе.
[000021] В родственном варианте осуществления настоящее изобретение относится к способу лечения анемии Фанкони у субъекта, нуждающегося в этом, предусматривающему обеспечение субъекта CD34+ клетками, содержащими кассету экспрессии, где кассета экспрессии содержит полинуклеотидную последовательность, содержащую следующее в 5'-3'-направлении: (a) промоторную последовательность гена фосфоглицераткиназы (PGK) человека или ее функциональный гомолог или вариант; (b) последовательность, кодирующую полипептид FANCA человека или его функциональный фрагмент или вариант; (c) сигнальную последовательность экспорта РНК регуляторного элемента вируса гепатита сурков (WPRE) или ее функциональный вариант или фрагмент, где последовательность, кодирующая полипептид FANCA человека или его функциональный фрагмент или вариант, функционально связана с промоторной последовательностью гена PGK. В определенных вариантах осуществления CD34+ клетки были получены от субъекта. В конкретных вариантах осуществления CD34+ клетки были получены от субъекта после обработки субъекта комбинацией из: (i) G-CSF или филграстима и (ii) плериксафора. В конкретных вариантах осуществления CD34+ клетки были трансдуцированы рекомбинантным вектором доставки гена, содержащим кассету экспрессии. В одном варианте осуществления CD34+ клетки были трансдуцированы за счет приведения CD34+ клеток в контакт с рекомбинантным вектором доставки гена на протяжении приблизительно 24 часов.
[000022] В других вариантах осуществления настоящего изобретения представлен способ лечения анемии Фанкони у субъекта, нуждающегося в этом, предусматривающий: (a) обеспечение субъекта комбинацией из: (i) G-CSF или филграстима и (ii) плериксафора для мобилизации CD34+ клеток у субъекта; (b) получение биологического образца, содержащего CD34+ клетки, от субъекта, где биологический образец необязательно представляет собой периферическую кровь или костный мозг; (c) получение клеточной популяции, обогащенной CD34+ клетками, из биологического образца; (d) трансдуцирование клеточной популяции, обогащенной CD34+ клетками, рекомбинантным вектором доставки гена, содержащим кассету экспрессии, содержащую полинуклеотидную последовательность, содержащую следующее в 5'-3'-направлении: (i) промоторную последовательность или ее функциональный гомолог или вариант; и (ii) последовательность, кодирующую полипептид FANCA человека или его функциональный фрагмент или вариант, где последовательность, кодирующая полипептид FANCA человека или его функциональный фрагмент или вариант, функционально связаны с промоторной последовательностью гена PGK, где трансдуцирование предусматривает приведение клеточной популяции, обогащенной CD34+ клетками, в контакт с лентивирусным вектором на протяжении приблизительно 24 часов; и (e) обеспечение субъекта клеточной популяцией, трансдуцированной лентивирусным вектором, полученной на стадии (d). В определенных вариантах осуществления получение клеточной популяции предусматривает проведение истощения по эритроцитам и/или обогащения CD34+ клетками путем положительного отбора, отрицательного отбора или их комбинации. В конкретных вариантах осуществления способ подавляет развитие, препятствует прогрессированию и/или обращает прогрессирование гематологического проявления анемии Фанкони у субъекта. В конкретных вариантах осуществления гематологическое проявление анемии Фанкони выбрано из одного или более из BMF, тромбоцитопении, лейкопении, панцитопении, нейтропении и анемии.
[000023] Другие признаки и преимущества настоящего изобретения станут очевидными из следующих подробного описания и формулы изобретения и охватываются таковыми.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[000024] Фигура 1 представляет собой схематическую диаграмму приведенной в качестве примера конструкции LV PGK-FANCA.WPRE*.
[000025] На фигуре 2A показано схематическое изображение LV, экспрессирующих FANCA под контролем различных внутренних промоторов. На фигуре 2B показан вестерн-блоттинг анализ FANCA в клетках FA-A, трансдуцированных векторами, показанными на панели A. Показана коррекция гиперчувствительности к MMC у гемопоэтических предшественников от мышей FA-A, подвергнутых генной терапии. Клетки FA-A костного мозга (BM) трансдуцировали с помощью LV PGK_FANCA-WPRE* или контрольного LV SF1-EGFP и трансплантировали облученным мышам FA-A. Через 7 месяцев после трансплантации образцы BM собирали и культивировали в метилцеллюлозе в присутствии повышающихся концентраций митомицина C (MMC).
[000026] На фигуре 3 представлены данные, отображающие функциональный анализ лентивирусных векторов, экспрессирующих FANCA под контролем различных внутренних промоторов. На фигуре 3A показано обращение чувствительности к MMC у клеток лимфобластной клеточной линии (LCL) FA-A, трансдуцированных с помощью LV. Показаны средние значения 3 различных экспериментов. На фигуре 3B показано восстановленное образование очагов ядерного FANCD2 в LCL FA-A, трансдуцированных векторами и подвергнутых воздействию митомицина C (MMC).
[000027] На фигуре 4 представлены данные, отображающие in vivo эффективность и безопасность генной терапии FA с помощью LV PGK-FANCA.Wpre*. На фигуре 4A показана конструкция. На фигуре 4B изображена методика, посредством которой клетки костного мозга (BM) от мышей FA-A трансдуцировали с помощью LV FANCA, а затем трансплантировали облученным мышам-реципиентам FA-A. На фигуре 4C показаны образцы ВМ от получивших трансплантацию мышей FA-A, которые культивировали в метилцеллюлозе в отсутствие и в присутствии MMC.
[000028] На фигуре 5 показано число копий провируса у FANCA-/- мышей, получивших трансплантацию клеток сингенного костного мозга, предварительно трансдуцированных лентивирусными векторами, несущими терапевтический ген FANCA под контролем промотора гена PGK. PB = периферическая кровь; BM = костный мозг.
[000029] На фигуре 6 представлены данные, отображающие коррекцию гиперчувствительности к MMC у гемопоэтических предшественников от мышей FAA, подвергнутых генной терапии с помощью медицинского продукта. Клетки FA-A костного мозга (BM) трансдуцировали с помощью LV PGK_FANCA-Wpre* или LV SF1-EGFP и трансплантировали облученным мышам FA-A. Через семь (7) месяцев после трансплантации образцы BM собирали и культивировали в метилцеллюлозе в присутствии повышающихся концентраций MMC.
[000030] На фигуре 7 изображена улучшенная эффективность трансдукции криоконсервированных клеток-предшественников костного мозга от трех пациентов с анемией Фанкони. Образцы подвергали процедурам стандартной трансдукции, предусматривающей один цикл трансдукции (16 ч) после 2 ч статической предварительной нагрузки (белые столбики; 1xS), или улучшенной трансдукции, состоящей из трех циклов трансдукции (2 ч + 2 ч + 12 ч) лентивирусными векторами (серые столбики; 3xD).
[000031] На фигуре 8 показано значение последовательности WPRE для функциональных свойств лентивирусных векторов, экспрессирующих FANCA под контролем промотора гена PGK. Фигура 8A: обращение чувствительности (к MMC) у LCL FA-A, трансдуцированных с помощью LV PGK-FANCA и LV PGK-FANCA-WPRE. Показаны средние значения 3 различных экспериментов. Фигура 8B: обращение чувствительность к MMC у гемопоэтических предшественников FA-A (колониеобразующие клетки, CFC), трансдуцированных с помощью LV SFFV-FANCA и LV PGK-FANCA («Эксперимент 1») и с помощью LV PGK-FANCA и LV PGK-FANCA-WPRE («Эксперимент 2»). Белые столбики = без MMC; черные столбики = 10 нM MMC. MMC = митомицин C
[000032] На фигуре 9 показана эффективность лентивирусных векторов, псевдотипированных GALV-TR и VSV-G, в отношении трансдукции гемопоэтических предшественников из костного мозга пациентов с анемией Фанкони с помощью EGFP-LV.
[000033] На фигуре 10 показан низкий потенциал in vitro трансформации у лентивирусных векторов, несущих промотор гена hPGK. Фигура 10A: изображение векторов. Фигура 10B: трансформационная способность, измеренная как частота пересева относительно числа копий.
[000034] Фигура 11 представляет собой изображение иллюстративного процесса сбора гемопоэтических стволовых клеток (HSC) и генной терапии пациентов с FA-A.
[000035] На фигуре 12 показаны гематологические параметры пациентов, набранных для участия в исследовании, описанном в примерах. На фигуре 12A показаны результаты для гемоглобина. На фигуре 12B показаны результаты для нейтрофилов. На фигуре 12C показаны результаты для тромбоцитов. На фигуре 12D показаны результаты для CD34+ клеток.
[000036] На фигуре 13 проиллюстрировано исследование фазы II по протоколу Fancostem, целью которого является оценка безопасности и эффективности мобилизации и сбора CD34+ клеток после обработки плериксафором (MOZOBIL) и филграстимом (также известным как G-CSF) (NEUPOGENE) у пациентов с анемией Фанкони. Число пациентов равно 10.
[000037] На фигуре 14 показана опосредованная G-CSF/плериксафором мобилизация CD34+ клеток у пациентов с FA-A.
[000038] На фигуре 15 показана опосредованная G-CSF/плериксафором мобилизация CFC у пациентов с FA-A.
[000039] Фигура 16 представляет собой краткое описание CD34+ клеток, собранных у пациентов с FA-A, у которых проводили мобилизацию G-CSF/плериксафором. На фигуре 16A показан сбор CD34+ клеток в FANCOSTEM, а на фигуре 16B показано сравнение с предыдущими исследованиями.
[000040] Фигура 17 представляет собой таблицу, отображающую сравнение между предсказанным числом CD34+ клеток в костном мозге (BM) и фактическим числом в мобилизованной периферической крови (mPB).
[000041] Фигура 18 представляет собой таблицу сбора и очистки CD34+ клеток из мобилизованной периферической крови (mPB) пациентов с FA-A.
[000042] На фигуре 19 показана экспрессия CD34 до и после иммуноселекции CD34+ клеток из мобилизованной периферической крови (mPB) от здоровых доноров (HD) и пациентов с FA.
[000043] На фигуре 20 показано, что пациент FA 02005 соответствует критериям обоих исследований FANCOSTEM и FANCOLEN. На фигуре 20A показаны количества клеток; на фигуре 20B показано содержание гемопоэтических стволовых клеток (HSC) в зависимости от возраста.
[000044] На фигуре 21 (A-E) представлены результаты теста, отображающие диагноз FA у пациента FA-02005 до проведения генной терапии.
[000045] На фигуре 22 показан параметр последующего наблюдения за процессом выработки клеток у пациента с FA-A 02005.
[000046] Фигура 23 представляет собой диаграмму, изображающую число копий вектора до и через 2 недели, 4 недели, 6 недель, 2 месяца, 3 месяца, 4 месяца и 5 месяцев после проведения генной терапии у пациента FA-02005.
[000047] На фигуре 24 представлено последующее наблюдение за первым не подвергавшимся кондиционированию пациентом с FA-A (FA-02005) до и после проведения генной терапии, как измерено по количеству гемоглобина.
[000048] На фигуре 25 представлено последующее наблюдение за первым не подвергавшимся кондиционированию пациентом с FA-A (FA-02005) до и после проведения генной терапии, как измерено по количеству нейтрофилов.
[000049] На фигуре 26 представлено последующее наблюдение за первым не подвергавшимся кондиционированию пациентом с FA-A (FA-02005) до и после проведения генной терапии, как измерено по количеству тромбоцитов.
[000050] Фигура 27 представляет собой таблицу изменения гематологических показателей у пациента с FA-A 02002.
[000051] На фигуре 28 показана диагностика пациента с FA 02002 как «отсутствие мозаицизма; гомозиготный по FANCA c.239 C>T p.Gln99*, гиперчувствительный к MMC; улучшенная за счет FANC».
[000052] На фигуре 29 показан процесс выработки клеток у пациента с FA-A 02002.
[000053] На фигуре 30 представлен анализ экспрессии CD34 в мобилизованной периферической крови (mPB) здорового донора (HD) и пациента с FA во время различных стадий, необходимых для трансдукции LV пациенту FA 02002.
[000054] Фигура 31 представляет собой диаграмму, изображающую число копий вектора до и после проведения генной терапии у пациента FA 02002.
[000055] На фигуре 32 представлены данные последующего наблюдения пациента с FA-A 02002, которому провели инфузию криоконсервированными клетками, как измерено по количеству гемоглобина.
[000056] На фигуре 33 представлены данные последующего наблюдения пациента с FA-A 02002, которому ввели инфузией криоконсервированные клетки, как измерено по количеству нейтрофилов.
[000057] На фигуре 34 представлены данные последующего наблюдения пациента с FA-A 02005, которому ввели инфузией криоконсервированные клетки, как измерено по количеству тромбоцитов.
[000058] На фигуре 35 показана трансдукция свежих CD34+ клеток из мобилизованной периферической крови (mPB) от пациентов с FA-A с применением валидированных условий. На фигуре 35A представлен протокол. На фигуре 35B показана диаграмма результатов для пациента 02002. На фигуре 35С показана диаграмма результатов для пациента 02003. На фигуре 35D показана диаграмма результатов для пациента 02004.
[000059] На фигуре 36 показаны данные по приживлению скорректированных CD34+ клеток из mPB FA-A у мышей NSG. На фигуре 36A показан протокол. На фигуре 36B показаны результаты для пациента 02002. На панели С показаны результаты для пациента 02003. На фигуре 36D показаны результаты для пациента 02004. mPB = мобилизованная периферическая кровь.
[000060] На фигуре 37 изображен in vivo отбор скорректированных HPC FA от пациента 02002 у мышей NOD SCID Gamma (NSG). На фигуре 37A показан протокол. Фигура 37B представляет собой диаграмму содержания CFC перед трансплантацией. Фигура 37C представляет собой диаграмму содержания hCFC через 30 дней после трансплантации.
[000061] Фигура 38 представляет собой карту плазмиды из 5,7 т.п.о., кодирующей гликопротеин G оболочки VSV под контролем промотора CMV и несущей ген устойчивости к канамицину для целей отбора.
[000062] Фигура 39 представляет собой карту плазмиды из 3,5 т.п.о., кодирующей ген rev HIV-1 под контролем промотора CMV и несущей ген устойчивости к канамицину для целей отбора.
[000063] Фигура 40 представляет собой карту плазмиды из 8,8 т.п.о., содержащей гены gag и pol HIV-1, которые кодируют структурный и ферментативный белки HIV-1, под контролем промотора CMV. Она содержит интрон 2 бетаглобина человека (HBB2), Rev-чувствительный элемент (RRE) HIV-1 и ген устойчивости к канамицину.
[000064] Фигура 41 представляет собой карту кассеты переноса pCCL-SIN-cPPT/CTS-hPGK-hFANCA-WPRE из 11621 пар оснований.
[000065] На фигуре 42 представлен LAM-PCR-анализ сайтов вставки FANCA-LV в гемопоэтических стволовых клетках (HSC) FA.
[000066] На фигуре 43 изображены результаты LAM-PCR по отслеживанию клеток, обработанных с помощью FANCA-LV. На фигуре 43A изображен протокол, а фигура 43B представляет собой таблицу с данными.
[000067] На фигуре 44 показано клональное разнообразие у реципиентов Fanca -/-, которым провели трансплантацию HSC, скорректированных с помощью LV. На фигуре 44A показан протокол, а на фигуре 44B представлена диаграмма с данными.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[000068] Настоящее изобретение в целом относится к областям молекулярной биологии и вирусологии и, в частности, к генным кассетам экспрессии и векторам, содержащим их, применимым для доставки сегментов нуклеиновой кислоты, кодирующих выбранные терапевтические конструкции (включая, например, пептиды, полипептиды, рибозимы и каталитические молекулы РНК), в выбранные клетки и ткани позвоночных животных. В частности, эти генетические конструкции применимы в генной терапии для лечения заболеваний, нарушений и дисфункций, связанных с дисрегуляцией продуктов гена FANCA, у млекопитающих и, в частности, у человека.
[000069] В определенных вариантах осуществления настоящего изобретения представлены композиции для генной терапии субъектов с анемией Фанкони (FA), и способы лечения с ее применением. В частности, представлены композиции и способы восстановления экспрессии гена FANCA. Специфические способы, раскрываемые в данном документе, относятся к применению лентивирусных векторов для доставки гена FANCA человека в гемопоэтические клетки-предшественники субъекта с FA, в частности, с FA-A.
Определения
[000070] Если не определено иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, как его обычно понимает специалист в данной области техники, к которой принадлежит настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные описанным в данном документе, могут быть использованы при осуществлении настоящего изобретения на практике, ниже описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие источники, упомянутые в данном документе, явным образом включены посредством ссылки в своем полном объеме. В случаях противоречий преимущественную силу будет иметь настоящее описание, включая определения. Кроме того, материалы, способы и примеры, описываемые в данном документе, являются исключительно иллюстративными и не предусматривают его ограничение.
[000071] Используемый в данном документе «вектор» относится к макромолекуле или ассоциации макромолекул, которые содержат полинуклеотид или ассоциированы с ним, и которые можно использовать для опосредования доставки полинуклеотида в клетку. Иллюстративные векторы включают, например, плазмиды, вирусные векторы (например, ретровирусные векторы, такие как лентивирусные векторы), липосомы и другие носители для доставки гена.
[000072] Термин «LV» является аббревиатурой лентивируса, и он может использоваться в отношении вируса самого по себе или его производных. Термин охватывает все подтипы, а также как встречающиеся в природе, так и рекомбинантные формы, кроме случаев, когда указано иное.
[000073] Используемый в данном документе термин «ген» или «кодирующая последовательность» относится к нуклеотидной последовательности in vitro или in vivo, которая кодирует продукт гена. В некоторых случаях ген состоит или состоит фактически из кодирующей последовательности, то есть последовательности, которая кодирует продукт гена. В других случаях ген содержит дополнительную некодирующую последовательность. Например, ген может включать или может не включать области, расположенные перед и после кодирующей области, например, 5'-нетранслируемые (5'-UTR) или «лидерные» последовательности и 3'-UTR или «трейлерные» последовательности, а также промежуточные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
[000074] Используемый в данном документе «терапевтический ген» относится к гену, при экспрессии которого обеспечивается полезный эффект в клетке или ткани, в которой он находится, или у млекопитающего, в котором ген экспрессируется. Примеры полезных эффектов включают облегчение признака или симптома состояния или заболевания, предупреждение или подавление состояния или заболевания, или обеспечение необходимой характеристики. Терапевтические гены включают гены, которые корректируют генетическую недостаточность в клетке или у млекопитающего.
[000075] Используемый в данном документе «трансген» представляет собой ген, который доставляется в клетку вектором.
[000076] Используемый в данном документе термин «продукт гена» относится к необходимому продукту экспрессии полинуклеотидной последовательности, такому как полипептид, пептид, белок или интерферирующая РНК, включая короткую интерферирующую РНК (siRNA), miRNA или малую шпилечную РНК (shRNA).
[000077] Используемые в данном документе термины «полипептид», «пептид» и «белок» относятся к полимерам любой длины из аминокислот. Термины также охватывают аминокислотный полимер, который был модифицирован; например, с помощью образования дисульфидной связи, гликозилирования, липидирования, фосфорилирования или конъюгации с компонентом для нанесения метки.
[000078] Под «содержащий» подразумевается, что упомянутые элементы являются необходимыми, например, в композиции, способе, наборе и т.д., но в объем заявляемого пункта могут включаться и другие элементы для образования, например, композиции, способа, набора и т.д. Например, кассета экспрессии, «содержащая» ген, кодирующий терапевтический полипептид, функционально связанный с промотором, представляет собой кассету экспрессии, которая может включать другие элементы в дополнение к гену и промотору, например, последовательность полиаденилирования, энхансерные элементы, другие гены, линкерные домены и т.д.
[000079] Под «состоящий фактически из» подразумевается ограничение объема, например, описанных композиции, способа, набора и т.д., указанными материалами или стадиями, которые существенно не влияют на основную и новую характеристику(и), например, композиции, способа, набора и т.д. Например, кассета экспрессии, «состоящая фактически из» гена, кодирующего терапевтический полипептид, функционально связанного с промотором и последовательностью полиаденилирования, может включать дополнительные последовательности, например, линкерные последовательности, при условии, что они существенно не влияют на транскрипцию или трансляцию гена. В качестве другого примера, вариантный или мутантный полипептидный фрагмент, «состоящий фактически из» упомянутой последовательности, имеет аминокислотную последовательность упомянутой последовательности плюс или минус приблизительно 10 аминокислотных остатков на границах последовательности, исходя из полноразмерного не подвергавшегося воздействию полипептида, из которого он был получен, например, на 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 остаток меньше, чем упомянутый граничный аминокислотный остаток, или на 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 остатков больше, чем упомянутый граничный аминокислотный остаток.
[000080] Под «состоящий из» подразумевается исключение из композиции, способа или набора любого элемента, стадии или ингредиента, не указанных в пункте формулы изобретения. Например, кассета экспрессии, «состоящая из» гена, кодирующего терапевтический полипептид, функционально связанного с промотором и посттранскрипционным регуляторным элементом, состоит только из промотора, полинуклеотидной последовательности, кодирующей терапевтической полипептид, и посттранскрипционного регуляторного элемента. В качестве другого примера полипептид, «состоящий из» упомянутой последовательности содержит только упомянутую последовательность.
[000081] Используемый в данном документе «вектор экспрессии» охватывает вектор, например, плазмиду, миникольцо, вирусный вектор, липосому и т.п., обсуждаемые выше или известные из уровня техники, содержащие полинуклеотид, который кодирует представляющий интерес продукт гена, и он используется для осуществления экспрессии продукта гена в предполагаемой клетке-мишени. Вектор экспрессии также содержит контрольные элементы, функционально связанные с кодирующей областью, для содействия экспрессии продукта гена в мишени. Комбинацию контрольных элементов, например, промоторов, энхансеров, UTR, последовательностей, на которые нацеливается miRNA, и т.д., и гена или генов, с которыми они функционально связаны для экспрессии, иногда называют «кассетой экспрессии». Многие такие контрольные элементы известны и доступны из уровня техники или могут быть легко сконструированы из компонентов, которые доступны из уровня техники.
[000082] Используемый в данном документе «промотор» охватывает последовательность ДНК, которая управляет связыванием РНК-полимеразы и тем самым обеспечивает синтез РНК, т.е. минимальную последовательность, достаточную для управления транскрипцией. Промоторы и соответствующая экспрессия белка или полипептида могут быть убиквитарными, это означает, что они проявляют сильную активность в самых разнообразных клетках, тканях и видах, или специфическими в отношении типа клетки, тканеспецифическими или видоспецифическими. Промоторы могут быть «конститутивными», это означает постоянно активные, или «индуцибельными», это означает, что промотор может быть активирован или дезактивирован за счет присутствия или отсутствия биотических или абиотических факторов. Также в состав конструкций нуклеиновой кислоты или векторов по настоящему изобретению входят энхансерные последовательности, которое могут быть или могут не быть смежными с промоторной последовательностью. Энхансерные последовательности влияют на зависимую от промотора экспрессию гена и могут быть расположены в 5'- или 3'-областях нативного гена.
[000083] Используемый в данном документе «энхансер» охватывает цис-действующий элемент, который стимулирует или подавляет транскрипцию примыкающих генов. Энхансер, который подавляет транскрипцию, также называется «сайленсер». Энхансеры могут функционировать (т.е. могут быть ассоциированы с кодирующей последовательностью) в любой ориентации, на расстояниях до нескольких тысяч пар оснований (т.п.о.) от кодирующей последовательности и из положения в направлении против хода транскрипции от транскрибируемой области.
[000084] Используемая в данном документе «последовательность сигнала терминации» охватывает любой генетический элемент, который заставляет РНК-полимеразу завершить транскрипцию, такой как, например, последовательность сигнала полиаденилирования.
[000085] Используемые в данном документе термины «оперативно связанный» или «функционально связанный» относятся к смежному положению генетических элементов, например, промотора, энхансера, последовательности сигнала терминации, последовательности полиаденилирования и т.д., где элементы находятся во взаимосвязи, позволяющей им функционировать ожидаемым образом. Например, промотор функционально связан с кодирующей областью, если промотор помогает инициировать транскрипцию кодирующей последовательности. Между промотором и кодирующей областью могут находиться промежуточные остатки, при условии, что поддерживается функциональная взаимосвязь.
[000086] Используемый в данном документе термин «гетерологичный» означает полученный из объекта, генотипически отличного от остальной части объекта, с которой его сравнивают. Например, полинуклеотид, введенный с помощью методик генной инженерии в плазмиду или вектор, полученные от другого вида, является гетерологичным полинуклеотидом. В качестве другого примера, промотор, удаленный из своей нативной кодирующей последовательности и функционально связанный с кодирующей последовательностью, с которой он не связан в природе, является гетерологичным промотором. Таким образом, например, LV-вектор, который включает гетерологичную нуклеиновую кислоту, кодирующую гетерологичный продукт гена, представляет собой LV-вектор, который включает нуклеиновую кислоту, которая в норме не включена во встречающийся в природе LV дикого типа, а кодируемый гетерологичный продукт гена представляет собой продукт гена, в норме не кодируемый встречающимся в природе LV дикого типа.
[000087] Термин «эндогенный», используемый в данном документе в отношении нуклеотидной молекулы или продукта гена, относится к последовательности нуклеиновой кислоты, например, гену или генетическому элементу, или к продукту гена, например, РНК, белку, которые встречаются в природе в вирусе-хозяине или клетке или ассоциированы с ними.
[000088] Используемый в данном документе термин «нативный» относится к нуклеотидной последовательности, например, гену, или к продукту гена, например, РНК, белку, которые присутствуют в вирусе или клетке дикого типа.
[000089] Используемый в данном документе термин «вариант» относится к мутанту эталонной полинуклеотидной или полипептидной последовательности, например, нативной полинуклеотидной или полипептидной последовательности, т.е. он характеризуется менее чем 100% идентичностью последовательности с эталонной полинуклеотидной или полипептидной последовательностью. Другими словами, вариант содержит по меньшей мере одно аминокислотное отличие (например, аминокислотную замену, аминокислотную вставку, аминокислотную делецию) относительно эталонной полинуклеотидной последовательности, например, нативной полинуклеотидной или полипептидной последовательности. Например, вариантом может быть полинуклеотид, характеризующийся идентичностью последовательности, составляющей 70% или более, с полноразмерной нативной полинуклеотидной последовательностью, например, идентичностью, составляющей 75% или 80% или более, например, 85%, 90% или 95% или более, например, 98% или 99% идентичностью с полноразмерной нативной полинуклеотидной последовательностью. В качестве другого примера, вариантом может быть полипептид, характеризующийся идентичностью последовательности, составляющей 70% или более, с полноразмерной нативной полипептидной последовательностью, например, идентичностью, составляющей 75% или 80% или более, например, 85%, 90% или 95% или более, например, 98% или 99% идентичностью с полноразмерной нативной полипептидной последовательностью. Варианты также могут включать вариантные фрагменты эталонной, например нативной, последовательности, разделяющие идентичность последовательности, составляющую 70% или более, с фрагментом эталонной, например нативной, последовательности, например, идентичность, составляющую 75% или 80% или более, например, 85%, 90% или 95% или более, например, 98% или 99% идентичность с нативной последовательностью.
[000090] Используемые в данном документе термины «биологическая активность» и «биологически активный» относятся к активности, свойственной конкретному биологическому элементу в клетке. Например, «биологическая активность» иммуноглобулина, антитела или их фрагмента или варианта относится к способности связывать антигенную детерминанту и тем самым содействовать иммунологической функции. В качестве другого примера, биологическая активность полипептида или его функционального фрагмента или варианта относится к способности полипептида или его функционального фрагмента или варианта выполнять свои нативные функции, например, связывание, ферментативную активность и т.д. В качестве третьего примера, биологическая активность регуляторного элемента гена, например промотора, энхансера, последовательности kozak и т.п., относится к способности регуляторного элемента или его функционального фрагмента или варианта регулировать, т.е. обеспечивать, усиливать или активировать, трансляцию и соответственно экспрессию гена, с которым он функционально связан.
[000091] Используемые в данном документе термины «применение» или «введение» относятся к доставке вектора для экспрессии рекомбинантного белка в клетку, в клетки и/или органы субъекта или субъекту. Такое применение или введение может происходить in vivo, in vitro или ex vivo. Вектор для экспрессии продукта гена может быть введен в клетку путем трансфекции, которая, как правило, означает внедрение гетерологичной ДНК в клетку с помощью физических средств (например, трансфекция с применением фосфата кальция, электропорация, микроинъекция или липофекция); инфекции, которая, как правило, относится к введению с помощью инфекционного агента, т.е. вируса; или трансдукции, которая, как правило, означает стабильное инфицирование клетки вирусом или перенос генетического материала из одного микроорганизма в другой с помощью вирусного агента (например, бактериофага).
[000092] «Трансформация», как правило, используется в отношении бактерий, содержащих гетерологичную ДНК, или клеток, которые экспрессируют онкоген и, следовательно, переведены в режим непрерывного роста, таких как опухолевые клетки. Вектором, применяемым для «трансформации» клетки, может быть плазмида, вирус или другой носитель.
[000093] Как правило, клетку называют «трансдуцированной», «инфицированной», «трансфицированной» или «трансформированной» в зависимости от средств, используемых для применения, введения или внедрения гетерологичной ДНК (т.е. вектора) в клетку. Термины «трансдуцированный», «трансфицированный» и «трансформированный» могут использоваться в данном документе взаимозаменяемо, независимо от способа введения гетерологичной ДНК.
[000094] Используемый в данном документе термин «клетка-хозяин» относится к клетке, которая была трансдуцирована, инфицирована, трансфицирована или трансформирована вектором. Вектором может быть плазмида, вирусная частица, фаг и т.д. Условия культивирования, такие как температура, pH и т.п., представляют собой условия, ранее применяемые для клетки-хозяина, выбранной для экспрессии, и они будут очевидны специалистам в данной области. Следует принимать во внимание, что термин «клетка-хозяин» относится к исходной трансдуцированной, инфицированной, трансфицированной или трансформированной клетке и к ее потомству.
[000095] Термины «лечение», «осуществление лечения» и т.п. используются в данном документе в основном для обозначения получения необходимого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим по типу полного или частичного предупреждения заболевания или его симптома, например, снижения вероятности того, что заболевание или его симптом возникнет у субъекта, и/или может быть терапевтическим по типу частичного или полного излечения заболевания и/или неблагоприятного воздействия, свойственного этому заболеванию. Используемое в данном документе «лечение» охватывает любое лечение заболевания у млекопитающего и включает: (a) предупреждение возникновения заболевания у субъекта, который может быть предрасположен к заболеванию, но при этом ему еще не поставлен диагноз наличия заболевания; (b) подавление заболевания, т.e. прекращение его развития; или (c) ослабление заболевания, т.e. обеспечение регрессии заболевания. Терапевтическое средство можно применять до, во время или после проявления заболевания или повреждения. Особый интерес представляет лечение протекающего заболевания, при этом лечение стабилизирует или уменьшает нежелательные клинические симптомы у пациента. Такое лечение желательно выполнять до полной потери функции у пораженных тканей. Указанную терапию желательно применять во время симптомaтической стадии заболевания, а в некоторых случаях после симптомaтической стадии заболевания.
[000096] Термины «индивидуум», «хозяин», «субъект» и «пациент» используются в данном документе взаимозаменяемо и относятся к млекопитающему, включая без ограничения человека и отличных от человека приматов, включая обезьян и людей; используемым в спорте млекопитающим (например, лошадям); сельскохозяйственным млекопитающим (например, овцам, козам и т.д.); домашним млекопитающим (собакам, кошкам и т.д.) и грызунам (например, мышам, крысам и т.д.). Терминология, используемая в данном документе, служит исключительно для описания конкретных вариантов осуществления и не предусмотрена для ограничения настоящего изобретения. Используемые в данном документе формы единственного числа предусматривают также включение форм множественного числа, если контекст четко не указывает на иное. Кроме того, термины «включающий», «включает», «имеющий», «имеет», «с» или их варианты в том объеме, в котором они используются или в подробном описании и/или в формуле изобретения, предусматриваются как включающие по аналогии с термином «содержащий».
[000097] Термин «приблизительно» или «примерно» означают в пределах допустимого диапазона погрешности для конкретного значения, определяемого рядовым специалистом в данной области, который будет частично зависеть от того, как измеряется или определяется значение, т.е. от ограничений измерительной системы. Например, «приблизительно» может означать в пределах 1 или более 1 стандартного отклонения, согласно установленному порядку в данной области. В качестве альтернативы «приблизительно» может означать диапазон до 20%, предпочтительно до 10%, более предпочтительно до 5% и еще более предпочтительно до 1% данного значения. В качестве альтернативы, в частности в отношении биологических систем или процессов, термин может означать в пределах порядка величины, предпочтительно в пределах 5-кратного и более предпочтительно в пределах 2-кратного значения. Если конкретные значения описываются в настоящей заявке и формуле изобретения, если не указано иное, следует принимать, что термин «приблизительно» означает в пределах допустимого диапазона погрешности для конкретного значения.
[000098] Если не указано иное, для осуществления настоящего изобретения на практике используются традиционные методики клеточной биологии, молекулярной биологии (включая рекомбинантные методики), микробиологии, биохимии и иммунологии, которые известны специалистам в данной области. Такие методики полностью описаны в литературе, например, в «Molecular Cloning: A Laboratory Manual», второе издание (Sambrook et al., 1989); «Oligonucleotide Synthesis» (M. J. Gait, ed., 1984); «Animal Cell Culture» (R. I. Freshney, ed., 1987); «Methods in Enzymology» (Academic Press, Inc.); «Handbook of Experimental Immunology» (D. M. Weir & C. C. Blackwell, eds.); «Gene Transfer Vectors for Mammalian Cells» (J. M. Miller & M. P. Calos, eds., 1987); «Current Protocols in Molecular Biology» (F. M. Ausubel et al., eds., 1987); «PCR: The Polymerase Chain Reaction», (Mullis et al., eds., 1994); и «Current Protocols in Immunology» (J. E. Coligan et al., eds., 1991), при этом каждый из документов явным образом включен в данный документ посредством ссылки.
[000099] Некоторые аспекты настоящего изобретения описаны ниже со ссылкой на типичные пути применения для иллюстрации. Следует учитывать, что многочисленные специфические подробности, взаимосвязи и способы изложены для обеспечения полного понимания настоящего изобретения. Однако рядовой специалист в данной области без усилий поймет, что настоящее изобретение может быть осуществлено на практике без одной или более специфических подробностей или с помощью других способов. Настоящее изобретение не ограничивается проиллюстрированным порядком действий или событий, поскольку некоторые действия могут осуществляться в другом порядке и/или одновременно с другими действиями или событиями. Кроме того, не все проиллюстрированные действия или события необходимы для реализации методов в соответствии с настоящим изобретением.
[000100] Если не указано иное, все термины, используемые в данном документе, имеют то же самое значение, которое вкладывает в них специалист в данной области, и при осуществлении настоящего изобретения на практике будут использоваться традиционные методики микробиологии и технологии рекомбинантной ДНК, которые известны специалистам в данной области.
[000101] В некоторых вариантах осуществления настоящего изобретения представлены полинуклеотиды, полинуклеотидные кассеты и векторы экспрессии для экспрессии гена в клетках. Также представлены фармацевтические композиции и способы применения любой из композиций в обеспечении экспрессии гена в клетках, например, у индивидуума, например, для лечения или профилактики нарушения. Эти и другие цели, преимущества и признаки настоящего изобретения станут очевидны специалистам в данной области после прочтения подробного описания композиций и способов, которые более полно описаны ниже.
[000102] В определенных вариантах осуществления представлены способы и композиции для получения композиций на основе векторов для генной терапии, например, вирусных векторов, содержащих такие генетические кассеты экспрессии, для применения в получении лекарственных средств, применимых в базовой и нацеленной генной терапии заболеваний, нарушений и дисфункций у животного и, в частности, у людей.
[000103] В некоторых вариантах осуществления настоящего изобретения представлена генная терапия анемии Фанкони на основе LV-вектора, несущего эукариотический промотор гена hPGK, который управляет экспрессией кДНК FANCA. Этот терапевтический вектор может применяться для трансдукции гемопоэтических стволовых клеток (HSC) человека, которые впоследствии могут быть трансплантированы людям с анемией Фанкони.
[000104] В определенных вариантах осуществления настоящего изобретения представлен LV-вектор FANCA для генетической коррекции анемии Фанкони. В целом, результаты демонстрируют доказательства пригодности генной терапии FA с помощью LV, разработанного для клинического применения.
[000105] Раскрываемые композиции могут использоваться в целом ряде исследовательских, диагностических и терапевтических схем, включая предупреждение и лечение целого ряда заболеваний человека. Различные композиции и способы по настоящему изобретению описаны ниже.
[000106] Хотя в данном документе в качестве примера представлены конкретные композиции и способы, следует учитывать, что любые из целого ряда альтернативных композиций и способов применимы и пригодны для применения при осуществлении настоящего изобретения на практике. Также следует учитывать, что оценку конструкций экспрессии и способов по настоящему изобретению можно выполнять с применением стандартных процедур из уровня техники.
Анемия Фанкони
[000107] Анемия Фанкони (FA) представляет собой редкий наследственный синдром хромосомной нестабильности, характеризующийся, в первую очередь, недостаточностью костного мозга (BMF) и предрасположенностью к раку (Butturini A et al. Blood. 1994;84:1650-1655; Kutler DI et al. Blood. 2003; 101:1249-1256.). Распространенность FA составляет 1-5 человек на миллион, а частота гетерозиготных носителей оценивается как 1 к 300 (Tamary H et al. Eur J Haematol. 2004;72:330-335).
[000108] FA является как генетически, так и фенотипически гетерогенной. На сегодняшний день были описаны тринадцать (13) групп комплементации (FA-A, B, C, D1, D2, E, F, G, I, J, L, M и N), ассоциированных с мутациями в соответствующих 13 генах групп комплементации анемии Фанкони (FANC): FANCA, FANCB, FANCC, FANCD1/BRCA2, FANCD2, FANCE, FANCF, FANCG/XRCC9, FANCI, BRIP1/FANCJ, FANCL, FANCM/Hef и FANCN/PABLB2 (Wang W. Nat Rev Genet. 2007;8:735-748). За исключением случая пациентов с FA-B (FANCB расположен в X-хромосоме) FA является аутосомно-рецессивной.
[000109] Белки, кодируемые генами FA, участвуют в биохимическом пути, известном как путь FA/BRCA (см. Wang W. Nat Rev Genet. 2007;8:735-748). В пути FA были идентифицированы тринадцать белков FA, причем каждый из них участвует в одном из трех комплексов белков FA, охарактеризованных в этом пути на данный момент. Предшествующий комплекс, коровый комплекс FA, составлен за счет восьми белков FA (FANCA, FANCB, FANCC, FANCE, FANCF, FANCG, FANCL, FANCM) и двух FA-ассоциированных белков (FAAP24 и FAAP100). Второй комплекс образуется за счет FANCD2 и FANCI, которые действуют вместе в комплексе FA-ID. Вследствие E3-лигазной активности (FANCL) корового комплекса FA белки FANCD2 и FANCI могут подвергаться моноубиквитинированию, а затем загружаться на хроматин с образованием большого ядерного очага в ответ на повреждение ДНК или остановку репликации. Наконец, моноубиквитинированные FANCD2/FANCI взаимодействуют с последующими белками FA, такими как FANCJ/BRIP1, FANCN/PALB2 и FANCD1/BRCA2, которые формируют стабильные комплексы с белками, участвующими в гомологичной репарации (HDR), такими как BRCA1 и RAD51.
[000110] FA-A представляет собой наиболее часто встречающуюся группу комплементации FA, при этом приблизительно 50%-80% пациентов с FA соответствуют этой группе комплементации (Casado JA et al. J Med Genet. 2007;44:241-249; Levitus M et al. Blood. 2004; 103:2498-2503; Taniguchi T, D'andrea AD. Blood. 2006;107:4223-4233). Вследствие недостаточной или нулевой экспрессии FANCA не может образовываться коровый комплекс FA. Это не дает осуществиться активации комплекса ID и, следовательно, миграции этих белков к хроматину, что приводит к характерному фенотипу клеток FA.
[000111] Согласно обзору в D'Andrea et al. (Blood. 1997; 90:1725-1736) клетки FA характеризуются различными клеточными фенотипами, связанными, в первую очередь, с дефектами выживаемости клеток, репарации ДНК и геномной стабильности.
[000112] В первую очередь, FA характеризуется врожденными аномалиями, развитием недостаточности костного мозга и высоким риском развития острого миелоидного лейкоза и определенных солидных опухолей. В среднем 70% пациентов с FA имеют врожденные дефекты. Аномалии скелета (лучевой кости, бедра, сколиоз позвоночника, ребра) и генерализованная гиперпигментация кожи, пятна цвета «кофе с молоком», присутствуют у 60-70% пациентов с FA. Большинство пациентов обладают низким ростом, и около трети из них имеют микрофтальмию и почечные нарушения. У приблизительно 30% пациентов с FA не наблюдается явных врожденных аномалий (Tischkowitz M, Dokal I. Br J Haematol. 2004; 126:176-191).
[000113] Важнейшими клиническими признаками пациентов с FA являются гематологические. Недостаточность костного мозга (BMF) является основной характеристикой заболевания. Она обычно появляется в возрасте от 5 до 10 лет. У восьмидесяти процентов 15-летних пациентов развивается BMF, при этом актуарный риском развития BMF к 40-летнему возрасту превышает 90% (Butturini et al., 1994, Kutler et al., 2003). Анемии обычно предшествуют тромбоцитопения или лейкопения. С течение времени панцитопения обычно прогрессирует. Нейтропения ассоциирована с повышенным риском инфекций.
[000114] Пациенты с FA также склонны к развитию рака, главным образом, острого миелоидного лейкоза (AML) и миелодиспластического синдрома (MDS). Большинство опухолей, ассоциированных с FA, развиваются после 13 лет, при этом средний возраст составляет 23 года. Относительный риск развития AML увеличивается в 785 раз, при этом средний возраст пациентов с FA, у которых развивается AML, составляет 14 лет, а совокупная частота возникновения гематологических злокачественных новообразований составляет 30-55% к 40-летнему возрасту (Kutler et al., 2003; Rosenberg PS et al. Blood. 2003;101:822-826). Более взрослые пациенты с FA также подвержены высокому риску развития солидных опухолей, главным образом типов плоскоклеточного рака (SCC). Средний возраст, при котором у этих пациентов развиваются солидные опухоли, составляет 26 лет, а к 40 годам совокупная частота солидных опухолей составляет 30% (Kutler et al.., 2003, Rosenberg et al.,2003).
[000115] Вследствие комплексных клинических проявлений FA лечение этих пациентов направлено, в первую очередь, на снижение симптомов недостаточности костного мозга (BMF), миелоидного лейкоза и солидных опухолей. Об ограничениях каждого из существующих средств терапии для пациентов с FA сообщается в документации медицинских продуктов для лечения орфанных заболеваний на основе лентивирусного вектора, несущего ген FANCA, спонсором которых является CIEMAT/CIBER по редким заболеваниям (Bueren, J. (2010). Center for Biomedical Network Research on Rare Diseases Ref EU/3/10/822).
[000116] В определенных вариантах осуществления представлены способы и композиции для получения композиций на основе векторов для генной терапии, например, вирусных векторов, содержащих такие генетические кассеты экспрессии, для применения в получении лекарственных средств, применимых в базовой и нацеленной генной терапии заболеваний, нарушений и дисфункций у животного и, в частности, у людей.
[000117] В некоторых вариантах осуществления настоящего изобретения представлена генная терапия анемии Фанкони на основе LV-вектора, несущего эукариотический промотор гена hPGK, который управляет экспрессией кДНК FANCA. Этот терапевтический вектор может применяться для трансдукции гемопоэтических стволовых клеток (HSC) человека, которые впоследствии могут быть трансплантированы людям с анемией Фанкони.
[000118] В определенных вариантах осуществления настоящего изобретения представлен LV-вектор FANCA для генетической коррекции анемии Фанкони. В целом, результаты демонстрируют доказательства пригодности генной терапии FA с помощью LV, разработанного для клинического применения.
[000119] Настоящее изобретение относится к кассетам экспрессии гена (например, терапевтическим кассетам), кассетам переноса гена, содержащим кассеты экспрессии гена (например, кассетам для интеграции), плазмидам, содержащим кассеты переноса гена, и векторам доставки гена, содержащим кассеты переноса гена. Кассеты экспрессии гена, кассеты переноса гена, плазмиды и векторы доставки гена содержат полинуклеотидную последовательность, кодирующую продукт терапевтического гена, функционально связанную с промоторной последовательностью. В определенных вариантах осуществления полинуклеотидная последовательность представляет собой ДНК или РНК. В определенных вариантах осуществления кассета экспрессии гена представляет собой полинуклеотид, кассета переноса гена представляет собой полинуклеотид, а вектор представляет собой вирус, например, лентивирус.
[000120] В определенных вариантах осуществления продукт терапевтического гена представляет собой белок FANCA или его функциональный фрагмент или вариант, необязательно белок FANCA человека дикого типа.
[000121] В конкретных вариантах осуществления кассета экспрессии гена содержит промоторную область, кодирующую последовательность и посттранскрипционный регуляторный элемент. В определенных вариантах осуществления промоторная область содержит промоторную последовательность или ее функциональный фрагмент. В одном варианте осуществления промотор представляет собой промотор гена PGK человека. В некоторых вариантах осуществления кассета экспрессии также содержит сигнал экспорта РНК. Сигнал экспорта РНК может предусматривать последовательность wPRE. В некоторых вариантах осуществления для улучшения уровня экспрессии и стабильности терапевтического гена включают мутантный wPRE, не содержащий никакой остаточной открытой рамки считывания (Schambach, Bohne et al. 2006).
[000122] В некоторых вариантах осуществления настоящего изобретения представлены кассеты экспрессии гена для усиленной экспрессии продукта гена FANCA. В некоторых вариантах осуществления полинуклеотидная кассета содержит последовательность, кодирующую кДНК FANCA дикого типа, или кодон-оптимизированную версию кДНК FANCA человека для усиления стабильности мРНК при транскрипции. Для оптимизации можно использовать программное обеспечение GeneArt®, повышая содержание GC и удаляя криптические сайты сплайсинга, чтобы исключить транскрипционный сайленсинг, с увеличением тем самым экспрессии трансгена. В качестве альтернативы можно использовать любой способ оптимизации, известный из уровня техники.
[000123] В некоторых аспектах настоящего изобретения представлены фармацевтические композиции, содержащие вектор доставки гена по настоящему изобретению и фармацевтический наполнитель. В некоторых вариантах осуществления фармацевтическая композиция содержит вектор доставки гена по настоящему изобретению и фармацевтический наполнитель.
[000124] В некоторых аспектах настоящего изобретения представлены способы экспрессии трансгена в клетках млекопитающего. В некоторых вариантах осуществления способ предусматривает приведение одной или более клеток млекопитающего в контакт с эффективным количеством полинуклеотидной кассеты по настоящему изобретению или вектора доставки гена по настоящему изобретению, при этом трансген экспрессируется на выявляемых уровнях в одной или более клетках млекопитающего. В некоторых вариантах осуществления способ предусматривает приведение одной или более клеток млекопитающего в контакт с эффективным количеством полинуклеотидной кассеты по настоящему изобретению или вектора доставки гена по настоящему изобретению, при этом трансген экспрессируется на терапевтических уровнях в одной или более клетках млекопитающего. В некоторых вариантах осуществления способ осуществляют in vitro. В других вариантах осуществления способ осуществляют in vivo.
[000125] В некоторых аспектах настоящего изобретения представлены способы лечения или профилактики заболевания или нарушения у млекопитающего, нуждающегося в лечении или профилактике заболевания или нарушения. В некоторых вариантах осуществления способ предусматривает введение млекопитающему эффективного количества фармацевтической композиции по настоящему изобретению, при этом кодирующая последовательность кодирует продукт терапевтического гена.
Композиции
[000126] В некоторых аспектах настоящего изобретения представлены композиции для экспрессии трансгена FANCA в эукариотических клетках. В определенных вариантах осуществления эукариотическая клетка представляет собой клетку млекопитающего. В одном варианте осуществления клетка млекопитающего представляет собой гемопоэтическую стволовую клетку (HSC). В одном варианте осуществления клетка млекопитающего представляет собой гемопоэтический предшественник. В одном варианте осуществления клетка млекопитающего представляет собой CD34+ клетку. В одном варианте осуществления клетка млекопитающего представляет собой клетку человека. В конкретных вариантах осуществления клетка представляет собой CD34+ клетку человека, полученную от субъекта с диагнозом FA, который подлежит лечению с помощью CD34+ клетки, после ее трансдуцирования за счет доставки гена, раскрываемой в данном документе, и содержит раскрытую кассету экспрессии гена.
[000127] В одном специфическом варианте осуществления настоящее изобретение относится к лентивирусному вектору, содержащему кассету экспрессии гена, содержащую полинуклеотидную последовательность, кодирующую терапевтический белок FANCA или его функциональный фрагмент или вариант. Используемый в данном документе функциональный вариант эталонного полинуклеотида или полипептида содержит одну или более аминокислотных или нуклеотидных делеций, добавлений или замен по сравнению с эталонной последовательностью и сохраняет по меньшей мере 50%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 99% функциональной активности эталонного полинуклеотида или полипептида. Используемый в данном документе функциональный фрагмент представляет собой фрагмент эталонного полинуклеотида или полипептида и сохраняет по меньшей мере 50%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 99% функциональной активности эталонного полинуклеотида или полипептида.
[000128] В одном варианте осуществления каркас лентивирусного вектора является таким же как каркас, соответствующий медицинскому продукту «лентивирусный вектор, несущий белок синдрома Вискотта-Олдрича (WASP-LV)» (Ref141/2000), хотя в случае средства для лечения FA промотор представляет собой промотор гена фосфоглицераткиназы человека (hPGK), характеризующийся своей стабильной активностью in vivo и улучшенными свойствами безопасности по сравнению с другими промоторами, уже используемыми в генной терапии (Modlich U, Navarro S, Zychlinski D et al. Insertional Transformation of Hematopoietic Cells by Self-Inactivating Lentiviral And Gammaretroviral Vectors. Mol Ther. 2009; 17:1919-1928; Montini E, Cesana D, Schmidt M et al. Hematopoietic Stem Cell Gene Transfer in a Tumor prone Mouse Model Uncovers Low Genotoxicity Of Lentiviral Vector Integration. Nat Biotechnol. 2006;24:687-696.).
[000129] В некоторых вариантах осуществления настоящего изобретения композиция содержит полинуклеотидную кассету. Под «полинуклеотидной кассетой» подразумевают полинуклеотидную последовательность, содержащую две или более функциональных полинуклеотидных последовательностей, например, регуляторных элементов, последовательностей инициации трансляции, кодирующих последовательностей, последовательностей терминации и т.д., как правило, в функциональной связи друг с другом. Подобным образом, под «полинуклеотидной кассетой для экспрессии трансгена в клетке млекопитающего» подразумевают комбинацию двух или более функциональных полинуклеотидных последовательностей, например, промотора, энхансера, 5'-UTR, последовательности инициации трансляции, кодирующей последовательности, последовательностей терминации и т.д., которая обеспечивает экспрессию трансгена в клетке. Кассеты экспрессии гена и кассеты переноса гена являются примерами полинуклеотидных кассет.
[000130] В некоторых вариантах осуществления полинуклеотидные кассеты по настоящему изобретению обеспечивают усиленную экспрессию трансгена в клетках млекопитающего. Как продемонстрировано в рабочих примерах настоящего изобретения, авторы настоящего изобретения обнаружили целый ряд полинуклеотидных элементов, т.е. улучшенных элементов по сравнению с элементами, известными из уровня техники, которые по отдельности и синергически обеспечивают усиленную экспрессию трансгенов в клетках млекопитающего. В определенных вариантах осуществления расположение двух или более функциональных полинуклеотидных последовательностей в пределах полинуклеотидных кассет по настоящему изобретению обеспечивают усиленную экспрессию трансгена в клетках млекопитающих. Под «усиленная» подразумевается, что экспрессия трансгена повышается, возрастает или становится более сильной в клетках, несущих полинуклеотидные кассеты по настоящему изобретению, по сравнению с клетками, несущими трансген, функционально связанный с аналогичными регуляторными элементами, например, известными из уровня техники. Другими словами, экспрессия трансгена повышается, возрастает или становится более сильной за счет полинуклеотидных кассет по настоящему изобретению по сравнению с экспрессией за счет полинуклеотидной кассеты, не содержащей один или более оптимизированных элементов по настоящему изобретению, т.е. эталонного контроля. В определенном варианте осуществления усиленная экспрессия является специфической в отношении одного или более необходимых типов клеток или ограничена ими.
[000131] Например, экспрессия трансгена может повышаться, или увеличиваться, или становиться более сильной в клетках, содержащих полинуклеотидную кассету, содержащую промотор, раскрываемый в данном документе, по сравнению с экспрессией в клетках, которые несут трансген, функционально связанный с другим промотором, например, известным из уровня техники. В качестве другого примера, экспрессия трансгена может усиливаться или повышаться, увеличиваться или становиться сильнее в клетках, содержащих полинуклеотидную кассету, содержащую энхансерную последовательность, раскрываемую в данном документе, по сравнению с экспрессией в клетках, которые несут трансген, функционально связанный с другой энхансерной последовательностью.
[000132] Не желая быть связанными какой-либо конкретной теорией, полагают, что усиленная экспрессия трансгена в клетках обусловлена более быстрым наращиванием продукта гена в клетках или более стабильным продуктом гена в клетках. Вследствие этого, усиленную экспрессию трансгена за счет полинуклеотидных кассет по раскрываемому изобретению можно наблюдать с помощью целого ряда способов. Например, усиленную экспрессию можно наблюдать путем выявления экспрессии трансгена после контакта полинуклеотидной кассеты с клетками раньше, например, на 2 суток раньше, на 7 суток раньше, на 2 недели раньше, на 3 недели раньше, на 4 недели раньше, на 8 недель раньше, на 12 недель раньше или более, по сравнению с экспрессией, которую выявляли бы, если бы трансген был функционально связан с аналогичными регуляторными элементами, например, известными из уровня техники. Усиленную экспрессию также можно наблюдать как повышение количества продукта гена на клетку. Например, может наблюдаться 2-кратное повышение или более, например, 3-кратное повышение или более, 4-кратное повышение или более, 5-кратное повышение или более или 10-кратное повышение или более количества продукта гена на клетку млекопитающего. Усиленную экспрессию также можно наблюдать как повышение числа клеток млекопитающего, которые экспрессируют трансген, который несет полинуклеотидная кассета, на выявляемых уровнях. Например, может наблюдаться 2-кратное повышение или более, например, 3-кратное повышение или более, 4-кратное повышение или более, 5-кратное повышение или более или 10-кратное повышение или более числа клеток млекопитающего, которые экспрессируют трансген на выявляемых уровнях.
[000133] В качестве другого примера полинуклеотид по настоящему изобретению может обеспечивать выявляемые уровни трансгена у большей процентной доли клеток по сравнению с традиционной полинуклеотидной кассетой; например, если традиционная кассета может обеспечивать выявляемые уровни экспрессии трансгена, например, у менее чем 5% клеток в определенной области, то полинуклеотид по настоящему изобретению обеспечивает выявляемые уровни экспрессии у 5% или более клеток в этой области; например, 10% или более, 15% или более, 20% или более, 25% или более, 30% или более, 35% или более, 40% или более, или 45% или более, в некоторых случаях 50% или более, 55% или более; 60% или более, 65% или более, 70% или более, или 75% или более, например, 80% или более, 85% или более, 90% или более, или 95% или более клеток, которые были приведены в контакт, будут экспрессировать продукт гена на выявляемых уровнях. Усиленную экспрессию также можно наблюдать как изменение жизнеспособности и/или функционирования клеток.
[000134] Полинуклеотидные кассеты по настоящему изобретению, как правило, содержат промоторную область. Любая подходящая промоторная область или промоторная последовательность в ней могут использоваться в заявляемых полинуклеотидных кассетах, при условии, что промоторная область обеспечивает экспрессию кодирующей последовательности в эукариотических клетках. В определенных вариантах осуществления промоторная область обеспечивает экспрессию кодирующей последовательности в клетках млекопитающего. В некоторых случаях промотор представляет собой убиквитарный промотор, т.е. промотор, который активен в самых разнообразных клетках, тканях и видах. В других случаях промотор представляет собой промотор гена PGK человека.
[000135] Промоторные и энхансерные элементы могут быть тканеспецифическими или специфическими в отношении стадии. Например, тканеспецифический промотор или энхансер преимущественно управляют экспрессией (или более высоким уровнем экспрессии) в одном или более конкретных типах клеток. Примеры типов клеток включают без ограничения гемопоэтические стволовые клетки, долгоживущие гемопоэтические стволовые клетки, короткоживущие гемопоэтические стволовые клетки, мультипотентные клетки-предшественники, гемопоэтические CD34+ клетки и клетки с любой субпопуляцией кластера дифференцировки в пределах CD34+ популяции. Специфический в отношении стадии промотор или энхансер преимущественно управляют экспрессией (или более высоким уровнем экспрессии) во время одной или более определенных стадий клеточного цикла или развития. Они включают без ограничения контрольную область локуса гена бета-глобина, промотор гена спектрина и промотор, специфический в отношении эритроидных клеток.
[000136] В некоторых вариантах осуществления полинуклеотид содержит один или более энхансеров. Энхансеры представляют собой известные из уровня техники элементы в виде нуклеиновой кислоты для усиления транскрипции, и они могут располагаться в любом месте в ассоциации с геном, который они регулируют, например, в направлении против хода транскрипции, в направлении по ходу транскрипции, в интроне и т.д. Любой энхансерный элемент можно использовать в полинуклеотидных кассетах и векторах для генной терапии по настоящему изобретению, при условии, что он усиливает экспрессию гена, если применяется в комбинации с промотором.
[000137] Кодирующей последовательностью, подлежащей экспрессии в клетках, может быть любая полинуклеотидная последовательность, например, ген или кДНК, которая кодирует продукт гена, например, полипептид или терапевтическое средство на основе РНК (siRNA, антисмысловая последовательность, рибозим, shRNA и т.д.). Кодирующая последовательность может быть гетерологичной по отношению к промоторной последовательности, с которой она функционально связана, т.е. не ассоциирована с ней функционально в природе. В качестве альтернативы кодирующая последовательность может быть эндогенной по отношению к промоторной последовательности, с которой она функционально связана, т.е. ассоциирована с данным промотором в природе. Продукт гена может оказывать действие внутри клетки млекопитающего, или он может оказывать действие снаружи, например, он может секретироваться. Например, если трансген представляет собой терапевтический ген, то кодирующей последовательностью может быть любой ген, который кодирует необходимый продукт гена, или его функциональный фрагмент, или вариант, которые могут применяться в качестве терапевтического средства для лечения заболевания или нарушения. В различных предпочтительных вариантах осуществления трансген кодирует FANCA человека, т.e. SEQ ID NO: 25.
[000138] В одном варианте осуществления настоящего изобретения кодирующая последовательность трансгена является модифицированной или «кодон-оптимизированной» для усиления экспрессии путем замены редко представленных кодонов более часто представленными кодонами. Кодирующая последовательность представляет собой часть последовательности мРНК, которая кодирует аминокислоты для трансляции. Во время трансляции каждый из 61 тринуклеотидных кодонов транслируется в одну из 20 аминокислот, что приводит к вырожденности или избыточности генетического кода. Однако различные типы клеток и различные виды животных используют тРНК (каждая из которых несет антикодон), кодирующие одни и те же аминокислоты с различной частотой. Если последовательность гена содержит кодоны, которые редко представлены на соответствующей тРНК, то работа аппарата рибосомной трансляции может замедляться, что препятствует эффективной трансляции. Экспрессия может быть улучшена путем «кодон-оптимизации» для конкретного вида, при этом кодирующую последовательность изменяют, чтобы она кодировала ту же белковую последовательность, но с применением кодонов, которые представлены на высоком уровне и/или используются в белках человека с высоким уровнем экспрессии (Cid-Arregui et al., 2003; J. Virol. 77: 4928). В одном аспекте настоящего изобретения кодирующая последовательность трансгена модифицирована для замены кодонов, которые редко экспрессируются у млекопитающих или у приматов, кодонами, которые часто экспрессируются у приматов. Например, в некоторых вариантах осуществления кодирующая последовательность, кодируемая трансгеном, кодирует полипептид, характеризующийся по меньшей мере 85% идентичностью последовательности с полипептидом, кодируемым последовательностью, раскрываемой выше или в данном документе, например, по меньшей мере 90% идентичностью последовательности, например, по меньшей мере 95% идентичностью последовательности, по меньшей мере 98% идентичностью, по меньшей мере 99% идентичностью, где по меньшей мере один кодон кодирующей последовательности характеризуется более высокой частотой встречаемости тРНК у человека, чем соответствующий кодон в последовательности, раскрываемой выше или в данном документе.
[000139] В дополнительном варианте осуществления настоящего изобретения кодирующая последовательность трансгена модифицирована для усиления экспрессии за счет терминации или удаления открытых рамок считывания (ORF), которые не кодируют необходимый трансген. Открытая рамка считывания (ORF) представляет собой последовательность нуклеиновой кислоты, которая следует за старт-кодоном и не содержит стоп-кодон. ORF могут находиться в прямой или обратной ориентации, а также могут находиться «внутри рамки» или «вне рамки» относительно представляющего интерес гена. Такие открытые рамки считывания потенциально могут экспрессироваться в кассете экспрессии одновременно с представляющим интерес геном, и это может привести к нежелательным побочным эффектам. В одном аспекте настоящего изобретения кодирующая последовательность трансгена была модифицирована для удаления открытых рамок считывания путем дальнейшего изменения частоты использования кодонов. Это выполняли путем удаления старт-кодонов (ATG) и введения стоп-кодонов (TAG, TAA или TGA) в ORF обратной ориентации или ORF вне рамки считывания, при этом сохраняя аминокислотную последовательность и поддерживая используемые в высокой степени кодоны в представляющем интерес гене (т.е. избегая кодонов с частотой <20%). В настоящем изобретении кодирующая последовательность трансгена может быть оптимизирована либо путем кодон-оптимизации, либо удалением ORF, не принадлежащих трансгену, либо путем применения обеих методик. Как будет понятно рядовому специалисту в данной области, предпочтительно удалять или минимизировать ORF, не принадлежащие трансгену, после кодон-оптимизации, чтобы удалить ORF, введенные во время кодон-оптимизации.
[000140] В некоторых вариантах осуществления полинуклеотидная кассета содержит:
[000141] (i) промоторную последовательность гена фосфоглицераткиназы (PGK) или ее функциональный вариант или фрагмент;
[000142] (ii) последовательность, кодирующую белок FANCA человека или его функциональный фрагмент или вариант, и
[000143] (iii) посттранскрипционный регуляторный элемент последовательности вируса гепатита сурков (WPRE).
[000144] В некоторых вариантах осуществления полинуклеотидная кассета содержит:
[000145] (i) промоторную последовательность гена фосфоглицераткиназы (PGK) человека;
[000146] (ii) последовательность, кодирующую белок FANCA человека, и
[000147] (iii) мутантную последовательность WPRE.
[000148] В некоторых вариантах осуществления полинуклеотидная кассета содержит:
[000149] a) 5'-LTR, необязательно модифицированный 5'-LTR;
[000150] b) последовательность cPPT;
[000151] c) промоторную последовательность гена PGK, необязательно промоторную последовательность гена PGK человека;
[000152] d) последовательность, кодирующую белок FANCA человека, необязательно последовательность кДНК или кодон-оптимизированную последовательность;
[000153] e) мутантную последовательность wPRE и
[000154] f) 3'-LTR, необязательно модифицированный 3'-LTR.
[000155] В одном варианте осуществления модифицированный WPRE обозначается как WPRE*. WPRE* представляет собой модифицированный WPRE, который не содержит открытую рамку считывания (см., например, Schambach et al, 2006 Gene Ther. 13:641-645).
[000156] В определенных вариантах осуществления кассета переноса гена содержит один или более дополнительных элементов, например, один или более элементов, выбранных из следующих: 5'-LTR, 3'-LTR, cPPT, CTS, RRE, энхансерные последовательности и сигналы упаковки.
[000157] Последовательность RRE улучшает эффективность переноса гена. В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, последовательность RRE содержит или состоит из любой из следующих последовательностей или последовательностей, характеризующихся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующими последовательностями:
(AGGAGCTTTGTTCCTTGGGTTCTTGGGAGCAGCAGGAAGCACTATGGGCGCAGCGTCAATGACGCTGACGGTACAGGCCAGACAATTATTGTCTGGTATAGTGCAGCAGCAGAACAATTTGCTGAGGGCTATTGAGGCGCAACAGCATCTGTTGCAACTCACAGTCTGGGGCATCAAGCAGCTCCAGGCAAGAATCCTGGCTGTGGAAAGATACCTAAAGGATCAACAGCTCCT (SEQ ID NO: 1) или
последовательностью, содержащей или состоящей из нуклеотидов 2649-2882 из SEQ ID NO:24.
[000158] Ретровирусная лидерная область содержит сигнал упаковки (Ψ), который принимает участие в упаковке ретровирусного генома в вирусный капсид. Полагали, что для LV-векторов требуется примерно 300 п.о. гена Gag в этой области. В настоящее время эта последовательность Gag была уменьшена всего лишь до 40 п.о. (фигура 65). В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, последовательность ψ представляет собой последовательность ψ HIV-1, или последовательность ψ содержит или состоит из следующих последовательностей или последовательностей, характеризующихся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующими последовательностями: CTCTCTCGACGCAGGACTCGGCTTGCTGAAGCGCGCACGGCAAGAGGCGAGGGGCGGCGACTGGTGAGTACGCCAAAAATTTTGACTAGCGGAGGCTAGAAGGAGAGAGATGGGTGCGAGAGCGTC (SEQ ID NO: 2) или
последовательностью, содержащей или состоящей из полинуклеотидов 2031-2156 из SEQ ID NO:24.
[000159] В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, усеченный 5'-LTR HIV-1 содержит или состоит из любой из следующих последовательностей или последовательностей, характеризующихся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью с любой из следующих последовательностей: GGGTCTCTCTGGTTAGACCAGATCTGAGCCTGGGAGCTCTCTGGCTAACTAGGGAACCCACTGCTTAAGCCTCAATAAAGCTTGCCTTGAGTGCTTCAAGTAGTGTGTGCCCGTCTGTTGTGTGACTCTGGTAACTAGAGATCCCTCAGACCCTTTTAGTCAGTGTGGAAAATCTCTAGCA (SEQ ID NO: 3) или
последовательностью, содержащей или состоящей из полинуклеотидов 1586-9495 из SEQ ID NO:24.
[000160] В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, самоинактивирующийся 3'-LTR HIV-1 содержит или состоит из любой из следующих последовательностей или последовательностей, характеризующихся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующими последовательностями: TGGAAGGGCTAATTCACTCCCAACGAAGACAAGATCTGCTTTTTGCTTGTACTGGGTCTCTCTGGTTAGACCAGATCTGAGCCTGGGAGCTCTCTGGCTAACTAGGGAACCCACTGCTTAAGCCTCAATAAAGCTTGCCTTGAGTGCTTCAAGTAGTGTGTGCCCGTCTGTTGTGTGACTCTGGTAACTAGAGATCCCTCAGACCCTTTTAGTCAGTGTGGAAAATCTCTAGCA (SEQ ID NO: 4) или
последовательностью, содержащей или состоящей из полинуклеотидов 9262-9495 из SEQ ID NO:24.
[000161] В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, немедленно-ранний промотор цитомегаловируса (CMV) человека содержит или состоит из любой из следующих последовательностей, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью с любой из следующих последовательностей: GTGATGCGGTTTTGGCAGTACATCAATGGGCGTGGATAGCGGTTTGACTCACGGGGATTTCCAAGTCTCCACCCCATTGACGTCAATGGGAGTTTGTTTTGGCACCAAAATCAACGGGACTTTCCAAAATGTCGTAACAACTCCGCCCCATTGACGCAAATGGGCGGTAGGCGTGTACGGTGGGAGGTCTATATAAGCAGAGCT (SEQ ID NO: 5) или
последовательностью, содержащей или состоящей из полинуклеотидов 1586-1789 из SEQ ID NO:24.
[000162] Как было обнаружено, cPPT, который облегчает ядерную транслокацию прединтеграционных комплексов, вместе с CTS, принимающей участие в отделение обратной транскриптазы, увеличивают вирусный титр (Zennou, et al. 2000; Follenzi et al. 2000). В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, центральный полипуриновый тракт и центральной последовательность терминации HIV-1 (cPPT/CTS) содержит или состоит из любой из следующих последовательностей, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью с любой из следующих последовательностей: TTTTAAAAGAAAAGGGGGGATTGGGGGGTACAGTGCAGGGGAAAGAATAGTAGACATAATAGCAACAGACATACAAACTAAAGAATTACAAAAACAAATTACAAAAATTCAAAATTTT (SEQ ID NO: 6);
TTTAAAAGAAAAGGGGGGATTGGGGGGT (SEQ ID NO:12) или
последовательностью, содержащей или состоящей из нуклеотидов 3378-3495 из SEQ ID NO:24.
[000163] В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, промотор гена фосфоглицераткиназы 1 человека (hPGK) содержит или состоит из любой из следующих последовательностей, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью с любой из следующих последовательностей: GGGGTTGGGGTTGCGCCTTTTCCAAGGCAGCCCTGGGTTTGCGCAGGGACGCGGCTGCTCTGGGCGTGGTTCCGGGAAACGCAGCGGCGCCGACCCTGGGTCTCGCACATTCTTCACGTCCGTTCGCAGCGTCACCCGGATCTTCGCCGCTACCCTTGTGGGCCCCCCGGCGACGCTTCCTGCTCCGCCCCTAAGTCGGGAAGGTTCCTTGCGGTTCGCGGCGTGCCGGACGTGACAAACGGAAGCCGCACGTCTCACTAGTACCCTCGCAGACGGACAGCGCCAGGGAGCAATGGCAGCGCGCCGACCGCGATGGGCTGTGGCCAATAGCGGCTGCTCAGCAGGGCGCGCCGAGAGCAGCGGCCGGGAAGGGGCGGTGCGGGAGGCGGGGTGTGGGGCGGTAGTGTGGGCCCTGTTCCTGCCCGCGCGGTGTTCCGCATTCTGCAAGCCTCCGGAGCGCACGTCGGCAGTCGGCTCCCTCGTTGACCGAATCACCGACCTCTCTCCCCAG (SEQ ID NO: 7) или
последовательностью, содержащей или состоящей из нуклеотидов 3541-4051 из SEQ ID NO:24.
[000164] Поскольку большинство пациентов с FA принадлежат группе комплементации FA-A (Casado et al., 2007, Levitus et al., 2004, Taniguchi et al., 2006), в конкретных вариантах осуществления кодируемый продукт терапевтического гена представляет собой FANCA, хотя в настоящем изобретении подразумевается, что белки FA из других групп комплементации также могут доставляться и, таким образом, они закодированы в кассетах экспрессии, раскрываемых в данном документе, например, вместо FANCA.
[000165] В конкретных вариантах осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, полинуклеотидная последовательность, кодирующая FANCA, представляет собой последовательность кДНК FANCA человека, которая содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: ATGTCCGACTCGTGGGTCCCGAACTCCGCCTCGGGCCAGGACCCAGGGGGCCGCCGGAGGGCCTGGGCCGAGCTGCTGGCGGGAAGGGTCAAGAGGGAAAAATATAATCCTGAAAGGGCACAGAAATTAAAGGAATCAGCTGTGCGCCTCCTGCGAAGCCATCAGGACCTGAATGCCCTTTTGCTTGAGGTAGAAGGTCCACTGTGTAAAAAATTGTCTCTCAGCAAAGTGATTGACTGTGACAGTTCTGAGGCCTATGCTAATCATTCTAGTTCATTTATAGGCTCTGCTTTGCAGGATCAAGCCTCAAGGCTGGGGGTTCCCGTGGGTATTCTCTCAGCCGGGATGGTTGCCTCTAGCGTGGGACAGATCTGCACGGCTCCAGCGGAGACCAGTCACCCTGTGCTGCTGACTGTGGAGCAGAGAAAGAAGCTGTCTTCCCTGTTAGAGTTTGCTCAGTATTTATTGGCACACAGTATGTTCTCCCGTCTTTCCTTCTGTCAAGAATTATGGAAAATACAGAGTTCTTTGTTGCTTGAAGCGGTGTGGCATCTTCACGTACAAGGCATTGTGAGCCTGCAAGAGCTGCTGGAAAGCCATCCCGACATGCATGCTGTGGGATCGTGGCTCTTCAGGAATCTGTGCTGCCTTTGTGAACAGATGGAAGCATCCTGCCAGCATGCTGACGTCGCCAGGGCCATGCTTTCTGATTTTGTTCAAATGTTTGTTTTGAGGGGATTTCAGAAAAACTCAGATCTGAGAAGAACTGTGGAGCCTGAAAAAATGCCGCAGGTCACGGTTGATGTACTGCAGAGAATGCTGATTTTTGCACTTGACGCTTTGGCTGCTGGAGTACAGGAGGAGTCCTCCACTCACAAGATCGTGAGGTGCTGGTTCGGAGTGTTCAGTGGACACACGCTTGGCAGTGTAATTTCCACAGATCCTCTGAAGAGGTTCTTCAGTCATACCCTGACTCAGATACTCACTCACAGCCCTGTGCTGAAAGCATCTGATGCTGTTCAGATGCAGAGAGAGTGGAGCTTTGCGCGGACACACCCTCTGCTCACCTCACTGTACCGCAGGCTCTTTGTGATGCTGAGTGCAGAGGAGTTGGTTGGCCATTTGCAAGAAGTTCTGGAAACGCAGGAGGTTCACTGGCAGAGAGTGCTCTCCTTTGTGTCTGCCCTGGTTGTCTGCTTTCCAGAAGCGCAGCAGCTGCTTGAAGACTGGGTGGCGCGTTTGATGGCCCAGGCATTCGAGAGCTGCCAGCTGGACAGCATGGTCACTGCGTTCCTGGTTGTGCGCCAGGCAGCACTGGAGGGCCCCTCTGCGTTCCTGTCATATGCAGACTGGTTCAAGGCCTCCTTTGGGAGCACACGAGGCTACCATGGCTGCAGCAAGAAGGCCCTGGTCTTCCTGTTTACGTTCTTGTCAGAACTCGTGCCTTTTGAGTCTCCCCGGTACCTGCAGGTGCACATTCTCCACCCACCCCTGGTTCCCAGCAAGTACCGCTCCCTCCTCACAGACTACATCTCATTGGCCAAGACACGGCTGGCCGACCTCAAGGTTTCTATAGAAAACATGGGACTCTACGAGGATTTGTCATCAGCTGGGGACATTACTGAGCCCCACAGCCAAGCTCTTCAGGATGTTGAAAAGGCCATCATGGTGTTTGAGCATACGGGGAACATCCCAGTCACCGTCATGGAGGCCAGCATATTCAGGAGGCCTTACTACGTGTCCCACTTCCTCCCCGCCCTGCTCACACCTCGAGTGCTCCCCAAAGTCCCTGACTCCCGTGTGGCGTTTATAGAGTCTCTGAAGAGAGCAGATAAAATCCCCCCATCTCTGTACTCCACCTACTGCCAGGCCTGCTCTGCTGCTGAAGAGAAGCCAGAAGATGCAGCCCTGGGAGTGAGGGCAGAACCCAACTCTGCTGAGGAGCCCCTGGGACAGCTCACAGCTGCACTGGGAGAGCTGAGAGCCTCCATGACAGACCCCAGCCAGCGTGATGTTATATCGGCACAGGTGGCAGTGATTTCTGAAAGACTGAGGGCTGTCCTGGGCCACAATGAGGATGACAGCAGCGTTGAGATATCAAAGATTCAGCTCAGCATCAACACGCCGAGACTGGAGCCACGGGAACACATTGCTGTGGACCTCCTGCTGACGTCTTTCTGTCAGAACCTGATGGCTGCCTCCAGTGTCGCTCCCCCGGAGAGGCAGGGTCCCTGGGCTGCCCTCTTCGTGAGGACCATGTGTGGACGTGTGCTCCCTGCAGTGCTCACCCGGCTCTGCCAGCTGCTCCGTCACCAGGGCCCGAGCCTGAGTGCCCCACATGTGCTGGGGTTGGCTGCCCTGGCCGTGCACCTGGGTGAGTCCAGGTCTGCGCTCCCAGAGGTGGATGTGGGTCCTCCTGCACCTGGTGCTGGCCTTCCTGTCCCTGCGCTCTTTGACAGCCTCCTGACCTGTAGGACGAGGGATTCCTTGTTCTTCTGCCTGAAATTTTGTACAGCAGCAATTTCTTACTCTCTCTGCAAGTTTTCTTCCCAGTCACGAGATACTTTGTGCAGCTGCTTATCTCCAGGCCTTATTAAAAAGTTTCAGTTCCTCATGTTCAGATTGTTCTCAGAGGCCCGACAGCCTCTTTCTGAGGAGGACGTAGCCAGCCTTTCCTGGAGACCCTTGCACCTTCCTTCTGCAGACTGGCAGAGAGCTGCCCTCTCTCTCTGGACACACAGAACCTTCCGAGAGGTGTTGAAAGAGGAAGATGTTCACTTAACTTACCAAGACTGGTTACACCTGGAGCTGGAAATTCAACCTGAAGCTGATGCTCTTTCAGATACTGAACGGCAGGACTTCCACCAGTGGGCGATCCATGAGCACTTTCTCCCTGAGTCCTCGGCTTCAGGGGGCTGTGACGGAGACCTGCAGGCTGCGTGTACCATTCTTGTCAACGCACTGATGGATTTCCACCAAAGCTCAAGGAGTTATGACCACTCAGAAAATTCTGATTTGGTCTTTGGTGGCCGCACAGGAAATGAGGATATTATTTCCAGATTGCAGGAGATGGTAGCTGACCTGGAGCTGCAGCAAGACCTCATAGTGCCTCTCGGCCACACCCCTTCCCAGGAGCACTTCCTCTTTGAGATTTTCCGCAGACGGCTCCAGGCTCTGACAAGCGGGTGGAGCGTGGCTGCCAGCCTTCAGAGACAGAGGGAGCTGCTAATGTACAAACGGATCCTCCTCCGCCTGCCTTCGTCTGTCCTCTGCGGCAGCAGCTTCCAGGCAGAACAGCCCATCACTGCCAGATGCGAGCAGTTCTTCCACTTGGTCAACTCTGAGATGAGAAACTTCTGCTCCCACGGAGGTGCCCTGACACAGGACATCACTGCCCACTTCTTCAGGGGCCTCCTGAACGCCTGTCTGCGGAGCAGAGACCCCTCCCTGATGGTCGACTTCATACTGGCCAAGTGCCAGACGAAATGCCCCTTAATTTTGACCTCTGCTCTGGTGTGGTGGCCGAGCCTGGAGCCTGTGCTGCTCTGCCGGTGGAGGAGACACTGCCAGAGCCCGCTGCCCCGGGAACTGCAGAAGCTACAAGAAGGCCGGCAGTTTGCCAGCGATTTCCTCTCCCCTGAGGCTGCCTCCCCAGCACCCAACCCGGACTGGCTCTCAGCTGCTGCACTGCACTTTGCGATTCAACAAGTCAGGGAAGAAAACATCAGGAAGCAGCTAAAGAAGCTGGACTGCGAGAGAGAGGAGCTATTGGTTTTCCTTTTCTTCTTCTCCTTGATGGGCCTGCTGTCGTCACATCTGACCTCAAATAGCACCACAGACCTGCCAAAGGCTTTCCACGTTTGTGCAGCAATCCTCGAGTGTTTAGAGAAGAGGAAGATATCCTGGCTGGCACTCTTTCAGTTGACAGAGAGTGACCTCAGGCTGGGGCGGCTCCTCCTCCGTGTGGCCCCGGATCAGCACACCAGGCTGCTGCCTTTCGCTTTTTACAGTCTTCTCTCCTACTTCCATGAAGACGCGGCCATCAGGGAAGAGGCCTTCCTGCATGTTGCTGTGGACATGTACTTGAAGCTGGTCCAGCTCTTCGTGGCTGGGGATACAAGCACAGTTTCACCTCCAGCTGGCAGGAGCCTGGAGCTCAAGGGTCAGGGCAACCCCGTGGAACTGATAACAAAAGCTCGTCTTTTTCTGCTGCAGTTAATACCTCGGTGCCCGAAAAAGAGCTTCTCACACGTGGCAGAGCTGCTGGCTGATCGTGGGGACTGCGACCCAGAGGTGAGCGCCGCCCTCCAGAGCAGACAGCAGGCTGCCCCTGACGCTGACCTGTCCCAGGAGCCTCATCTCTTCTGA
(SEQ ID NO: 8).
[000166] Настоящее изобретение относится к плазмидам, содержащим кассету экспрессии или кассету переноса, описываемые в данном документе. В конкретных вариантах осуществления плазмида представляет собой pCCL-PGK-FANCA-WPRE* (фигура 41; SEQ ID NO: 24).
[000167] В определенных вариантах осуществления настоящее изобретение относится к клетке, например, упаковывающей клетке или линии упаковывающих клеток, например, клеткам 293, содержащим плазмиду, раскрываемую в данном документе. В конкретных вариантах осуществления клетка содержит плазмиды, изображенные на фигурах 38-41.
[000168] В определенных вариантах осуществления кассета переноса или плазмида, раскрываемые в данном документе, дополнительно содержат один или более дополнительных элементов, например, промотор и/или энхансер CMV, последовательность polyА SV40, точку начала репликации, например, последовательность ori SV40, или любой из элементов, раскрываемых в данном документе.
[000169] В конкретных вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, энхансер CMV человека содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: GACATTGATTATTGACTAGTTATTAATAGTAATCAATTACGGGGTCATTAGTTCATAGCCCATATATGGAGTTCCGCGTTACATAACTTACGGTAAATGGCCCGCCTGGCTGACCGCCCAACGACCCCCGCCCATTGACGTCAATAATGACGTATGTTCCCATAGTAACGCCAATAGGGACTTTCCATTGACGTCAATGGGTGGAGTATTTACGGTAAACTGCCCACTTGGCAGTACATCAAGTGTATCATATGCCAAGTACGCCCCCTATTGACGTCAATGACGGTAAATGGCCCGCCTGGCATTATGCCCAGTACATGACCTTATGGGACTTTCCTACTTGGCAGTACATCTACGTATTAGTCATCGCTATTACCATG (SEQ ID NO: 9).
[000170] В конкретных вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, сигнал poly(A) вируса обезьян 40 (SV40) содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: AACTTGTTTATTGCAGCTTATAATGGTTACAAATAAAGCAATAGCATCACAAATTTCACAAATAAAGCATTTTTTTCACTGCATTCTAGTTGTGGTTTGTCCAAACTCATCAATGTATCTTA (SEQ ID NO: 10).
[000171] В конкретных вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, точка начала репликации SV40 содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью:
ATCCCGCCCCTAACTCCGCCCAGTTCCGCCCATTCTCCGCCCCATGGCTGACTAATTTTTTTTATTTATGCAGAGGCCGAGGCCGCCTCGGCCTCTGAGCTATTCCAGAAGTAGTGAGGAGGCTTTTTTGGAGGCC (SEQ ID NO: 11).
[000172] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, сигнал dNEF, присутствующий в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: GAATTCGAGCTCGGTACCTTTAAGACCAATGACTTACAAGGCAGCTGTAGATCTTAGCCACTTTTTAAAAGAAAAGGGGGGAC (SEQ ID NO: 13).
[000173] В конкретных вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, последовательность KanR, присутствующая в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности: ATGATTGAACAAGATGGATTGCACGCAGGTTCTCCGGCGGCTTGGGTGGAGAGGCTATTCGGCTATGACTGGGCACAACAGACAATCGGCTGCTCTGATGCCGCCGTGTTCCGGCTGTCAGCGCAGGGGCGTCCGGTTCTTTTTGTCAAGACCGACCTGTCCGGTGCCCTGAATGAACTGCAAGACGAGGCAGCGCGGCTATCGTGGCTGGCGACGACGGGCGTTCCTTGCGCGGCTGTGCTCGACGTTGTCACTGAAGCGGGAAGGGACTGGCTGCTATTGGGCGAAGTGCCGGGGCAGGATCTCCTGTCATCTCACCTTGCTCCTGCCGAGAAAGTATCCATCATGGCTGATGCAATGCGGCGGCTGCATACGCTTGATCCGGCTACCTGCCCATTCGACCACCAAGCGAAACATCGCATCGAGCGAGCACGTACTCGGATGGAAGCCGGTCTTGTCGATCAGGATGATCTGGACGAAGAGCATCAGGGGCTCGCGCCAGCCGAACTGTTCGCCAGGCTCAAGGCGTCTATGCCCGACGGCGAGGATCTCGTCGTGACCCACGGCGATGCCTGCTTGCCGAATATCATGGTGGAAAATGGCCGCTTTTCTGGATTCATCGACTGTGGCCGTCTGGGTGTGGCGGACCGCTATCAGGACATAGCGTTGGCTACCCGTGATATTGCTGAAGAGCTTGGCGGCGAATGGGCTGACCGCTTCCTTGTGCTTTACGGTATCGCCGCGCCCGATTCGCAGCGCATCGCCTTCTATCGCCTTCTTGACGAGTTCTTCTGA (SEQ ID NO: 14)
[000174] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, терминатор rrnG (терминатор транскрипции из оперона rrnG рибосомной РНК E. coli (Albrechtsen et al., 1991)), присутствующий в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности: GCATTGGCGCAGAAAAAAATGCCTGATGCGACGCTGCGCGTCTTATACTCCCACATATGCCAGATTCAGCAACGGATACGGCTTCCCCAACTTGCCCACTTCCATACGTGTCCTCCTTACCAGAAATTTATCCTTAA (SEQ ID NO: 15)
[000175] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, ori (точка начала репликации высококопийного ColE1/pMB1/pBR322/pUC), присутствующая в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: TTGAGATCCTTTTTTTCTGCGCGTAATCTGCTGCTTGCAAACAAAAAAACCACCGCTACCAGCGGTGGTTTGTTTGCCGGATCAAGAGCTACCAACTCTTTTTCCGAAGGTAACTGGCTTCAGCAGAGCGCAGATACCAAATACTGTTCTTCTAGTGTAGCCGTAGTTAGGCCACCACTTCAAGAACTCTGTAGCACCGCCTACATACCTCGCTCTGCTAATCCTGTTACCAGTGGCTGCTGCCAGTGGCGATAAGTCGTGTCTTACCGGGTTGGACTCAAGACGATAGTTACCGGATAAGGCGCAGCGGTCGGGCTGAACGGGGGGTTCGTGCACACAGCCCAGCTTGGAGCGAACGACCTACACCGAACTGAGATACCTACAGCGTGAGCTATGAGAAAGCGCCACGCTTCCCGAAGGGAGAAAGGCGGACAGGTATCCGGTAAGCGGCAGGGTCGGAACAGGAGAGCGCACGAGGGAGCTTCCAGGGGGAAACGCCTGGTATCTTTATAGTCCTGTCGGGTTTCGCCACCTCTGACTTGAGCGTCGATTTTTGTGATGCTCGTCAGGGGGGCGGAGCCTATGGAAA (SEQ ID NO: 16).
[000176] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, сайт связывания CAP, присутствующий в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: TAATGTGAGTTAGCTCACTCAT (SEQ ID NO: 17).
[000177] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, промотор lac E. coli, присутствующий в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: TTTACACTTTATGCTTCCGGCTCGTATGTTG (SEQ ID NO: 18).
[000178] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, оператор lac, присутствующий в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: TTGTGAGCGGATAACAA (SEQ ID NO: 19)
[000179] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, промотор T3 (промотор гена РНК-полимеразы бактериофага T3), присутствующий в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: AATTAACCCTCACTAAAGG (SEQ ID NO: 20).
[000180] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, промотор T7 (промотор гена РНК-полимеразы бактериофага T7), присутствующий в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: CCTATAGTGAGTCGTATTA (SEQ ID NO: 21).
[000181] В некоторых вариантах осуществления любых из кассет переноса, плазмид или векторов, описываемых в данном документе, ori f1 (точка начала репликации бактериофага f1), присутствующая в любых из кассет экспрессии или векторов доставки гена, описываемых в данном документе, содержит или состоит из следующей последовательности, ее функционального фрагмента или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью: ACGCGCCCTGTAGCGGCGCATTAAGCGCGGCGGGTGTGGTGGTTACGCGCAGCGTGACCGCTACACTTGCCAGCGCCCTAGCGCCCGCTCCTTTCGCTTTCTTCCCTTCCTTTCTCGCCACGTTCGCCGGCTTTCCCCGTCAAGCTCTAAATCGGGGGCTCCCTTTAGGGTTCCGATTTAGTGCTTTACGGCACCTCGACCCCAAAAAACTTGATTAGGGTGATGGTTCACGTAGTGGGCCATCGCCCTGATAGACGGTTTTTCGCCCTTTGACGTTGGAGTCCACGTTCTTTAATAGTGGACTCTTGTTCCAAACTGGAACAACACTCAACCCTATCTCGGTCTATTCTTTTGATTTATAAGGGATTTTGCCGATTTCGGCCTATTGGTTAAAAAATGAGCTGATTTAACAAAAATTTAACGCGAATT (SEQ ID NO: 22).
[000182] Как обсуждается в данном документе, полинуклеотидные кассеты по настоящему изобретению могут содержать сигнал экспорта РНК. Приведенные в качестве примера последовательности экспорта РНК включают без ограничения wPRE. wPRE значимо повышает экспрессию трансгена в клетках-мишенях за счет увеличения стабильности РНК трансгена способом, независимым от промотора и вектора (Zuffrey et al, 1999). Однако он может приводить к экспрессии усеченного белка из 60 аминокислот, происходящего из X-гена WHV, принимающего участие в раке печени (Kingsman et al, 2005). Поэтому, в большинство доклинических протоколов и клинических испытаний включают мутантную версию элемента wPRE (Zanta-Boussif et al, 2009). С другой стороны, было обнаружено, что применение двух элементов SV40-USE в векторах SIN-LV было более эффективным в подавлении транскрипционного прочитывания, чем последовательность wPRE (Schambach et al, 2007). Точнее говоря, wPRE, раскрываемый в данном документе, представляет собой химерный wPRE, который несет 589 нуклеотидов из модифицированного WPRE, полученного Axel Schambach (нуклеотиды 1-589) (WO 2008136670 A2; [5]), и 88 из прежнего wPRE (нуклеотиды 590-677) (Zuffrey et al, 1999). Данные, раскрываемые в данном документе, показывают, что этот химерный wPRE работает лучше, чем прежний wPRE. Последовательность химерного wPRE содержит следующую последовательность, ее функциональный фрагмент или последовательность, характеризующуюся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью со следующей последовательностью:
CGAGCATCTTACCGCCATTTATTCCCATATTTGTTCTGTTTTTCTTGATTTGGGTATACATTTAAATGTTAATAAAACAAAATGGTGGGGCAATCATTTACATTTTTAGGGATATGTAATTACTAGTTCAGGTGTATTGCCACAAGACAAACATGTTAAGAAACTTTCCCGTTATTTACGCTCTGTTCCTGTTAATCAACCTCTGGATTACAAAATTTGTGAAAGATTGACTGATATTCTTAACTATGTTGCTCCTTTTACGCTGTGTGGATATGCTGCTTTAATGCCTCTGTATCATGCTATTGCTTCCCGTACGGCTTTCGTTTTCTCCTCCTTGTATAAATCCTGGTTGCTGTCTCTTTATGAGGAGTTGTGGCCCGTTGTCCGTCAACGTGGCGTGGTGTGCTCTGTGTTTGCTGACGCAACCCCCACTGGCTGGGGCATTGCCACCACCTGTCAACTCCTTTCTGGGACTTTCGCTTTCCCCCTCCCGATCGCCACGGCAGAACTCATCGCCGCCTGCCTTGCCCGCTGCTGGACAGGGGCTAGGTTGCTGGGCACTGATAATTCCGTGGTGTTGTCGGGGAAGGGCCTGCTGCCGGCTCTGCGGCCTCTTCCGCGTCTTCGCCTTCGCCCTCAGACGAGTCGGATCTCCCTTTGGGCCGCCTCCCCGCCTG (SEQ ID NO:23).
[000183] В конкретных вариантах осуществления последовательность мутантного WPRE содержит или состоит из WPRE*, который соответствует нуклеотидам 8502-9178 из SEQ ID NO:24, или характеризуется по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью с этой областью в SEQ ID NO:24.
[000184] Другие комбинации элементов, как раскрываемых в данном документе, так и известных из уровня техники, будут очевидны рядовому специалисту в данной области.
[000185] Кроме того, рядовому специалисту в данной области будет понятно, что полинуклеотидные кассеты необязательно могут содержать другие элементы, включая без ограничения сайты рестрикции для облегчения клонирования и регуляторные элементы для вектора экспрессии конкретного гена.
[000186] В некоторых аспектах настоящего изобретения заявляемые полинуклеотидные кассеты применяют для доставки гена в клетки, например, для определения влияния, которое ген оказывает на жизнеспособность и/или функционирование клетки, для лечения клеточного нарушения и т.д. В различных вариантах осуществления доставка вирусного вектора в клетки путем трансдукции может осуществляться in vitro, ex vivo или in vitro. Следовательно, в некоторых аспектах настоящего изобретения композиция, которая обеспечивает экспрессию трансгена в клетках млекопитающего, представляет собой вектор доставки гена, где вектор доставки гена содержит полинуклеотидную кассету, например, кассету переноса гена по настоящему раскрытию.
[000187] Любой подходящий вектор доставки гена, который находит применение в доставке полинуклеотидных последовательностей в клетки млекопитающего, входит в число векторов доставки гена по настоящему изобретению. Например, вектор может содержать одно- или двухнитевую нуклеиновую кислоту, например, однонитевую или двухнитевую ДНК. Например, вектором доставки гена может быть ДНК, например, депротеинизированная ДНК, например, плазмида, миникольцо и т.д. Вектор может содержать однонитевую или двухнитевую РНК, включая модифицированные формы РНК. В другом примере вектором доставки гена может быть РНК, например, мРНК или модифицированная мРНК.
[000188] В качестве другого примера вектором доставки гена может быть вирусный вектор, полученный из вируса, например, аденовируса, аденоассоциированного вируса, лентивируса (LV), вируса герпеса, альфавируса или ретровируса, например, вируса мышиного лейкоза Молони (M-MuLV), вируса саркомы мышей Молони (MoMSV), вируса саркомы мышей Харви (HaMuSV), вируса опухоли молочной железы мышей (MuMTV), вируса лейкоза гиббонов (GaLV), вируса лейкоза кошек (FLV), спумавируса, вируса лейкоза мышей Френда, вируса стволовых клеток мышей (MSCV) или вируса саркомы Роуса (RSV). Хотя ниже более подробно описаны варианты осуществления, охватывающие применение LV, предполагается, что рядовому специалисту в данной области будет понятно, что подобные знания и навыки в данной области также могут быть применены к отличным от LV-векторам для генной терапии.
[000189] В некоторых вариантах осуществления вектор доставки гена представляет собой самоограничивающийся LV. В конкретном варианте осуществления любых из кассет экспрессии и векторов доставки гена, описываемых в данном документе, кассета переноса, представляющая собой pCCL-SIN-cPPT/CTS - hPGK-hFANCA-WPRE (фигура 41) по настоящему изобретению, содержит или состоит из следующей последовательности или последовательности, характеризующейся по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью с SEQ ID NO: 24. SEQ ID NO: 24 соответствует плазмиде pCCL-PGK-FANCA-WPRE* на фигуре 41.
[000190] В одном варианте осуществления ген FANCA доставляется с помощью лентивирусного вектора (LV). В LV FANCA, описываемых в данном документе, используется самоинактивирующийся лентивирусный вектор (LV). В одном варианте осуществления LV FANCA содержит промотор гена фосфоглицераткиназы (PGK) человека. Свойства безопасности этого вектора были заметно улучшены по сравнению с уже используемыми в клиниках векторами на основе гамма-ретровирусов, которые содержат сильные вирусные промоторы.
[000191] В определенных вариантах осуществления лентивирусный вектор представляет собой LV PGK-FANCA.WPRE*, который содержит кассету переноса гена, изображенную на фигуре 1 и содержащую последовательности, раскрываемые под SEQ ID NO: 24. Часть LV PGK-FANCA-WPRE*, представляющая собой кассету экспрессии гена, содержит промотор гена PGK человека, кодирующую последовательность для кДНК FANCA и WPRE*, и соответствует нуклеотидам 3541-9178 из SEQ ID NO: 24. Часть LV PGK-FANCA-WPRE*, представляющая собой кассету переноса, содержит от приблизительно 5'-LTR (U5) до приблизительно 3'-LTR (U5) последовательности, показанной на фигуре 41. Что касается SEQ ID NO: 24, нуклеотиды 1586-1789 из SEQ ID NO: 24 составляют немедленно-ранний промотор CMV человека. Нуклеотиды 2031-2156 из SEQ ID NO: 24 составляют сигнал упаковки psi HIV1. Нуклеотиды 2649-2882 из SEQ ID NO: 24 составляют элемент RRE HIV1. Нуклеотиды 3378-3495 из SEQ ID NO: 24 составляют элемент cPPT/CTS HIV. Нуклеотиды 3541-4051 из SEQ ID NO: 24 составляют промотор гена hPGK. Нуклеотиды 4078-8445 из SEQ ID NO: 24 составляют кДНК FANCA-A человека. Нуклеотиды 8502-9178 из SEQ ID NO: 24 составляют мутантный элемент WPRE. Нуклеотиды 9262-9495 из SEQ ID NO: 24 составляют delta-U 3'-LTR HIV.
[000192] В еще одном варианте осуществления лентивирусный вектор содержит следующие элементы:
(i) каркас лентивирусного вектора, полученный из исходного pCCLsin-cppt-hPGK-eGFP-WPRE (Dull et al, 1998; J.Virol 72 (11), 9873-9880). В каркасе pCCL гетерологичный 5'-LTR CMV-HIV используется для получения высоких уровней транскрипции вирусной РНК в клетках-продуцентах. Такой гетерологичный LTR придает конструкции независимость от необходимости применения белка Tat HIV для продуцирования частиц rHIV и, поэтому, является признаком, связанным с безопасностью. U3-область 3'-LTR содержит делецию из 400 п.о., как описано в Zufferey et al J Virol, 1998, которая придает вектору свойства самоинактивации;
(ii) кДНК гена FANCA человека (4368 п.о., номер доступа в GenBank: X_99226 или как раскрыто в данном документе), кодирующая белок FANCA (1455 AA) под контролем промотора гена PGK человека. Данный промотор уже обнаружил своею стабильную активность in vivo и улучшенные свойства безопасности по сравнению с другими промоторами, уже применяемыми в генной терапии;
(iii) мутантная версия посттранскрипционного регуляторного элемента вируса гепатита сурков (WPRE), которая имеет делецию в 3'-области последовательности, кодирующей белок X и какую-либо остаточную ORF, описываемую у Schambach et al (Gene therapy, 2006; 13, 641-645), или WPRE*.
[000193] Векторы для генной терапии, инкапсулирующие полинуклеотидные кассеты по настоящему изобретению, могут быть получены с применением стандартных методов. Например, в случае LV-вирионов в клетку-продуцент может вводиться LV-вектор экспрессии по настоящему изобретению с последующим введением конструкции LV-помощника, при этом конструкция помощника включает кодирующие области LV, способные экспрессироваться в клетке-продуценте и которые комплементируют функции LV-помощника, отсутствующие у LV-вектора. За этим следует введение вируса-помощника и/или дополнительных векторов в клетку-продуцент, при этом вирус-помощник и/или дополнительные векторы обеспечивают вспомогательные функции, способные поддерживать эффективное продуцирование вируса LV. Затем клетки-продуценты культивируют для продуцирования LV. Эти стадии выполняют с применением стандартных методов. В конкретных вариантах осуществления плазмиды, изображенные на фигурах 38-41, применяются для продуцирования векторов доставки гена.
[000194] Для доставки заявляемых полинуклеотидных кассет может применяться любой подходящий способ продуцирования вирусных частиц, включая без ограничения описываемые в приведенных ниже примерах. Для приведения в контакт с клетками млекопитающего in vitro или in vivo можно приготовить любую концентрацию вирусных частиц, подходящую для эффективной трансдукции клеток млекопитающего. Например, вирусные частицы можно составлять при концентрации 108 векторных геномов на мл или более, например, 5×108 векторных геномов на мл; 109 векторных геномов на мл; 5×109 векторных геномов на мл, 1010 векторных геномов на мл, 5×1010 векторных геномов на мл; 1011 векторных геномов на мл; 5×1011 векторных геномов на мл; 1012 векторных геномов на мл; 5×1012 векторных геномов на мл; 1013 векторных геномов на мл; 1,5×1013 векторных геномов на мл; 3×1013 векторных геномов на мл; 5×1013 векторных геномов на мл; 7,5×1013 векторных геномов на мл; 9×1013 векторных геномов на мл; 1×1014 векторных геномов на мл, 5×1014 векторных геномов на мл или более, но, как правило, не больше 1×1015 векторных геномов на мл.
[000195] При получении заявляемых композиций LV можно использовать любые клетки-хозяева для продуцирования LV-вирионов, включая, например, клетки млекопитающих (например, клетки 293), клетки насекомых (например, клетки SF9), микроорганизмы и дрожжи. Клетками-хозяевами также могут быть упаковывающие клетки, при этом гены rep и cap LV стабильно поддерживаются в клетке-хозяине, или клетки-продуценты, в которых геном LV-вектора стабильно поддерживается и упаковывается. Приведенные в качестве примера упаковывающие и клетки-продуценты получены из клеток SF-9, 293, A549 или HeLa. LV-векторы очищают и составляют с применением стандартных методик, известных из уровня техники.
[000196] В определенных вариантах осуществления настоящее изобретение относится к клетке, содержащей кассету экспрессии гена, кассету переноса гена или вектор доставки гена, раскрываемые в данном документе. В связанных вариантах осуществления клетка трансдуцирована вектором доставки гена, содержащим кассету экспрессии, раскрываемую в данном документе, или кассета экспрессии, раскрываемая в данном документе, интегрирована в геном клетки.
[000197] В определенных вариантах осуществления клетка представляет собой клетку, применяемую для продуцирования вирусного вектора доставки гена, например, упаковывающую клетку.
[000198] В других вариантах осуществления клетка представляет собой клетку, подлежащую доставке в субъект, чтобы обеспечить субъекта продуктом гена, кодируемым кассетой экспрессии. Таким образом, в определенных вариантах осуществления клетка является аутологичной для субъекта, подлежащего лечению, или была получена от субъекта, подлежащего лечению. В других вариантах осуществления клетка является аллогенной по отношению к субъекту, подлежащему лечению, или была получена от донора, отличного от субъекта, подлежащего лечению. В конкретных вариантах осуществления клетка представляет собой клетку млекопитающего, например, клетку человека. В определенных вариантах осуществления клетка представляет собой клетку крови, эритроцит, гемопоэтическую клетку-предшественник, клетку костного мозга, например, клетку костного мозга, подвергнутую истощению по линии дифференцировки, гемопоэтическую стволовую клетку (например, CD34+) или коммитированную гемопоэтическую эритроидную клетку-предшественник. В конкретных вариантах осуществления клетка представляет собой CD34+ клетку, полученную от субъекта, подлежащего лечению клеткой после ее трансдукции вектором доставки гена, раскрываемым в данном документе. В конкретном варианте осуществления клетка представляет собой CD34+ клетку FA, полученную от субъекта с диагнозом FA.
[000199] Настоящее изобретение относится к фармацевтическим композициям, содержащим полинуклеотидную кассету, вектор доставки гена или клетку, описываемые в данном документе, и фармацевтически приемлемый носитель, разбавитель или наполнитель. Заявляемые полинуклеотидная кассета, вектор доставки гена или клетка могут быть объединены с фармацевтически приемлемыми носителями, разбавителями и реагентами, применимыми в получении состава, который в целом является безопасным, нетоксичным и желательным, и он включает наполнители, которые приемлемы для применения у приматов. Такие наполнители могут быть твердыми, жидкими, полужидкими или, в случае аэрозольной композиции, газообразными. Примеры таких наполнителей, носителей или разбавителей включают без ограничения воду, солевой раствор, растворы Рингера, раствор декстрозы и 5% человеческий сывороточный альбумин. Дополнительные активные соединения также могут быть включены в составы. Растворы или суспензии, применяемые для составов, могут включать стерильный разбавитель, такой как вода для инъекций, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные соединения, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие соединения, такие как этилендиаминтетрауксусная кислота (EDTA); буферы, такие как ацетаты, цитраты или фосфаты; поверхностно-активные вещества, такие как Tween 20, для предотвращения агрегации и соединения для регулирования тоничности, такие как хлорид натрия или декстроза. pH можно регулировать с помощью кислот или оснований, таких как хлористоводородная кислота или гидроксид натрия. В конкретных вариантах осуществления фармацевтические композиции являются стерильными.
[000200] Фармацевтические композиции, подходящие для применения в настоящем изобретении, дополнительно включают стерильные водные растворы или дисперсии, а также стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсии.
[000201] Стерильные растворы могут быть получены путем введения необходимого количества активного соединения в соответствующий растворитель вместе с одним или комбинацией ингредиентов, перечисленных выше, при необходимости с последующей стерилизацией фильтрованием. В целом, дисперсии получают путем введения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов к способам получения относятся вакуумная сушка и сушка вымораживанием, который приводят к получению порошка активного ингредиента с любым дополнительным необходимым ингредиентом из предварительно стерилизованного фильтрованием их раствора.
[000202] В одном варианте осуществления композиции получают с носителями, которые будут защищать генную кассету или вектор экспрессии от быстрого выведения из организма, как, например, в случае состава с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Могут применяться биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Способы получения таких составов будут очевидны специалистам в данной области. Материалы также могут быть получены коммерческим путем.
[000203] Особенно удобно составлять композиции для перорального, глазного или парентерального применения в виде единичной дозированной формы для легкости введения и однородности дозы. Используемая в данном документе «единичная дозированная форма» относится к физически дискретным единицам, подходящим в качестве однократной дозы для субъекта, подлежащего лечению; при этом каждая единица содержит предварительно заданное количество активного соединения, рассчитанное для получения необходимого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация единичных дозированных форм по настоящему изобретению обусловлена и непосредственно зависит от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который следует достигнуть, а также от ограничений в области составления такого активного соединения для лечения индивидуумов.
[000204] Фармацевтические композиции могут быть включены в контейнер, пакет или дозатор, например, шприц, например, предварительно заполненный шприц, вместе с инструкциями по применению.
[000205] Фармацевтические композиции по настоящему изобретению охватывают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров, или любое другое соединение, которое после введения животному, включая человека, способно обеспечивать (непосредственно или опосредованно) его биологически активный метаболит или остаток.
[000206] Термин «фармацевтически приемлемая соль» относится к физиологически и фармацевтически приемлемым солям соединений по настоящему изобретению, т.е. солям, которые сохраняют необходимую биологическую активность исходного соединения и не вызывают нежелательные токсикологические эффекты, присущие ему. Множество фармацевтически приемлемых солей известно из уровня техники и описано, например, в «Remington's Pharmaceutical Sciences», 17-е издание, Alfonso R. Gennaro (Ed.), Mark Publishing Company, Easton, PA, USA, 1985 (и более поздние его издания), в «Encyclopaedia of Pharmaceutical Technology», 3-е издание, James Swarbrick (Ed.), Informa Healthcare USA (Inc.), NY, USA, 2007, а также в J. Pharm. Sci. 66: 2 (1977). См. также обзор подходящих солей в Handbook of Pharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, 2002).
[000207] Фармацевтически приемлемые соли присоединения основания образуются с металлами или аминами, такими как щелочные и щелочноземельные металлы или органические амины. Металлы, применяемые в качестве катионов, включают натрий, калий, магний, кальций и т.п. Амины предусматривают N-N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин и прокаин (см., например, Berge et al., «Pharmaceutical Salts», J. Pharma Sci., 1977, 66, 119). Соли присоединения основания указанных кислотных соединений получают путем приведения формы свободной кислоты в контакт с достаточным количеством необходимого основания c получением соли традиционным путем. Форма свободной кислоты может быть восстановлена путем приведения солевой формы в контакт с кислотой и выделения свободной кислоты традиционным путем. Формы свободной кислоты несколько отличаются от своих соответствующих солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях, но в остальном соли эквивалентны своей соответствующей свободное кислоте для целей настоящего изобретения.
[000208] Заявляемые полинуклеотидная кассета, вектор доставки гена, например, рекомбинантный вирус (вирионы), или клетка (например, трансдуцированная вектором доставки гена, раскрываемым в данном документе) могут быть включены в фармацевтические композиции для применения у пациентов-млекопитающих, в частности у приматов и более конкретно у людей. Заявляемые полинуклеотидная кассета, вектор доставки гена, например, вирионы, или клетка могут быть составлены в нетоксичных, инертных фармацевтически приемлемых водных носителях, предпочтительно при pH, варьирующем от 3 до 8, более предпочтительно варьирующем от 6 до 8. Такие стерильные композиции будут содержать вектор или вирион, содержащие нуклеиновую кислоту, кодирующую терапевтическую молекулу, растворенные в водном буфере с приемлемым pH после растворения.
[000209] В некоторых вариантах осуществления фармацевтическая композиция, представленная в данном документе, содержит терапевтически эффективное количество клетки, вектора или вириона, раскрываемых в данном документе, в смеси с фармацевтически приемлемым носителем и/или наполнителем, например, солевым раствором, забуференным фосфатом солевым раствором, фосфатом и аминокислотами, полимерами, многоатомными спиртами, сахаром, буферами, консервантами и другими белками. Приведенными в качестве примера аминокислотами, полимерами, сахарами и т.п. являются окстилфеноксиполиэтоксиэтанольные соединения, соединения полиэтиленгликольмоностеарата, полиоксиэтиленсорбитановые сложные эфиры жирных кислот, сахароза, фруктоза, декстроза, мальтоза, глюкоза, маннит, декстран, сорбит, инозит, галактит, ксилит, лактоза, трегалоза, бычий или человеческий сывороточный альбумин, цитрат, ацетат, растворы Рингера и Хэнкса, цистеин, аргинин, карнитин, аланин, глицин, лизин, валин, лейцин, поливинилпирролидон, полиэтилен и гликоль. Предпочтительно данный состав остается стабильным на протяжении по меньшей мере шести месяцев при 4°C.
[000210] В некоторых вариантах осуществления фармацевтическая композиция, представленная в данном документе, содержит буфер, такой как забуференный фосфатом солевой раствор (PBS) или фосфат натрия/сульфат натрия, tris буфер, глициновый буфер, стерильная вода и другие буферы, известные рядовым специалистам в данной области, как, например, описываемые в Good et al. (1966) Biochemistry 5:467. pH буфера, в котором находится фармацевтическая композиция, содержащая подавляющий опухоль ген, содержащийся в системе доставки на основе аденовирусного вектора, может быть в диапазоне от 6,5 до 7,75, предпочтительно от 7 до 7,5 и наиболее предпочтительно от 7,2 до 7,4.
[000211] В определенных вариантах осуществления вирусные векторы могут быть составлены в виде любой подходящей однократной дозы, включающей без ограничения 1×10s векторных геномов или более, например, 1×109, 1×1010, 1×1011, 1×1012 или 1×1013 векторных геномов или более, в определенных случаях 1×1014 векторных геномов, но обычно не больше 4×1015 векторных геномов. В некоторых случаях однократную дозу составляют не более приблизительно 5×1015 векторных геномов, например, 1×1014 векторных геномов или менее, например 1×1013, 1×1012, 1×1011, 1×1010 или 1×109 векторных геномов или менее, в определенных случаях 1×108 векторных геномов или менее и, как правило, не меньше 1×108 векторных геномов. В некоторых случаях однократную дозу составляют от 1×1010 до 1×1011 векторных геномов. В некоторых случаях однократную дозу составляют от 1×1010 до 3×1012 векторных геномов. В некоторых случаях однократную дозу составляют от 1×910 до 3×1013 векторных геномов. В некоторых случаях однократную дозу составляют от 1×810 до 3×1014 векторных геномов. В одном варианте осуществления диапазон составляет от приблизительно 5×1010 до приблизительно 1×1011 векторных геномов. В некоторых вариантах осуществления диапазон составляет от приблизительно 1×109 до приблизительно 1×1010 векторных геномов.
[000212] В некоторых случаях однократную дозу фармацевтической композиции можно измерять с применением множественности заражения (MOI). Под MOI подразумевают отношение числа векторных или вирусных геномов к числу клеток, в которые может быть доставлена нуклеиновая кислота, или удельный показатель. В некоторых случаях MOI может составлять 1×106. В некоторых случаях MOI может составлять 1×105 - 1×107. В некоторых случаях MOI может составлять 1×104 - 1×108. В некоторых случаях рекомбинантные вирусы по настоящему изобретению характеризуются по меньшей мере приблизительно 1×101, 1×102, 1×103, 1×104, 1×105, 1×106, 1×107, 1×108, 1×109, 1×1010, 1×1011, 1×1012, 1×1013, 1×1014, 1×1015, 1×1016, 1×1017 и 1×1018 MOI. В некоторых случаях рекомбинантные вирусы по настоящему изобретению характеризуются 1×108 - 3×1014 MOI. В некоторых случаях рекомбинантные вирусы по настоящему изобретению характеризуются не более приблизительно 1×101, 1×102, 1×103, 1×104, 1×105, 1×106, 1×107, 1×108, 1×109, 1×1010, 1×1011, 1×1012, 1×1013, 1×1014, 1×1015, 1×1016, 1×1017 и 1×1018 MOI. В некоторых вариантах осуществления диапазон составляет от приблизительно 20 до приблизительно 400 MOI.
[000213] В некоторых аспектах определенное количество фармацевтической композиции содержит от приблизительно 1×108 до приблизительно 1×1015 рекомбинантных вирусов, от приблизительно 1×109 до приблизительно 1×1014 рекомбинантных вирусов, от приблизительно 1×1010 до приблизительно 1×1013 рекомбинантных вирусов или от приблизительно 1×1011 до приблизительно 3×1012 рекомбинантных вирусов.
Способы
[000214] Как обсуждается более подробно ниже, заявляемые полинуклеотидные кассеты и векторы доставки гена, называемые в данном документе совместно «заявляемые композиции», находят применение в экспрессии трансгена, например FANCA, в клетка животного, например, млекопитающего или человека. Например, заявляемые композиции могут применяться в исследовании, например, для определения влияния, которое данный ген оказывает на жизнеспособность и/или функционирование клетки. В качестве другого примера, заявляемые композиции могут применяться в медицине, например, для лечения нарушения, такого как FA. Таким образом, в некоторых аспектах настоящего изобретения представлены способы экспрессии гена в клетках, при этом способ предусматривает приведение клеток в контакт с композицией по настоящему изобретению. В некоторых вариантах осуществления приведение в контакт осуществляется in vitro. В некоторых вариантах приведение в контакт осуществляется in vivo, т.е. заявляемая композиция применяется в отношении субъекта.
[000215] В тех случаях, когда клетки млекопитающего подлежат in vitro или in vivo приведению в контакт с заявляемыми полинуклеотидной кассетой или вектором доставки гена, содержащими заявляемую полинуклеотидную кассету, клетки могут быть получены от любого вида млекопитающих, например, грызуна (например, мышей, крыс, песчанок, белок), кролика, представителя кошачьих, представителя собачьих, козы, представителя овечьих, свиньи, лошади, представителя бычьих, примата, человека. Клетки могут быть получены из стабильных клеточных линий, или они могут представлять собой первичные клетки, где «первичные клетки», «первичные клеточные линии» и «первичные культуры» используются в данном документе взаимозаменяемо для обозначения клеток и клеточных культур, которые были получены от субъекта и росли in vitro в течение ограниченного числа пассажей, т.е. разделений культуры. Например, первичными культурами являются культуры, которые могли быть пассированы 0 раз, 1 раз, 2 раза, 4 раза, 5 раз, 10 раз или 15 раз, но не достаточное число раз для прохождения кризисной стадии. Как правило, первичные клеточные линии по настоящему изобретению поддерживают на протяжении менее 10 пассажей in vitro.
[000216] В вариантах осуществления настоящего изобретения предусмотрены клетки млекопитающего (например, CD34+ клетки), трансдуцированные вирусным вектором доставки, например, LV-вектором, содержащим ген FANCA человека. Кроме того, настоящее изобретение относится к способу трансдукции клетки млекопитающего, например, гемопоэтической стволовой клетки человека или другой клетки, описываемой в данном документе, предусматривающему приведение клетки в контакт с вектором доставки гена, например, LV-вектором, раскрываемым в данном документе или содержащим кассету экспрессии, описываемую в данном документе. В определенных вариантах осуществления клетку ранее получили от субъекта, подлежащего лечению, или от другого донора. В конкретных вариантах осуществления у субъекта диагностирована анемия Фанкони, а клетку трансдуцируют с помощью LV, содержащего кассету экспрессии, кодирующую область или кДНК FANCA. Следует учитывать, что раскрываемые способы, например, применяемые для доставки продукта гена FANCA субъекту, например, с применением последовательности кДНК FANCA, также могут применяться для лечения анемии Фанкони. В конкретных вариантах осуществления трансдуцированные клетки представляют собой популяцию клеток, полученных от субъекта с FA, который подлежит лечению клетками после проведения их трансдукции. Клетки могут быть получены из костного мозга или крови. В определенных вариантах осуществления субъекта с FA обрабатывают средствами для мобилизации стволовых клеток, затем у субъекта проводят забор крови, удаляют эритроциты и отбирают CD34+ клетки. Вскоре после отбора клетки затем подвергают трансдукции. В конкретных вариантах осуществления трансдуцированные клетки хранят или замораживают перед применением, тогда как в определенных вариантах осуществления субъекта обеспечивают ими немедленно или вскоре после того, как они были трансдуцированы, например, не позднее одного часа, двух часов или четырех часов.
[000217] В определенных вариантах осуществления при трансдукции клеток вектором доставки гена, раскрываемым в данном документе, клетки приводят в контакт с вектором доставки гена на протяжении приблизительно 30 минут, приблизительно 1 часа, приблизительно 1,5 часа, приблизительно 2 часов, приблизительно 2,5 часа, приблизительно 3 часов, приблизительно 3,5 часа, приблизительно 4 часов, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 12 часов, приблизительно 16 часов, приблизительно 18 часов, приблизительно 20 часов, приблизительно 24 часов, приблизительно 36 часов, приблизительно 48 часов, приблизительно 60 часов. В некоторых вариантах осуществления трансдукцию клеток проводят в течение менее 60 часов, менее 48 часов, менее 36 часов или менее 24 часов.
[000218] Заявляемые полинуклеотидная кассета или вектор доставки гена, содержащий заявляемую полинуклеотидную кассету, могут применять в отношении заявляемых клеток один раз или более, например, один раз, два раза, три раза или более трех раз, и клетки оставляют инкубироваться со средством(ами) в течение некоторого количества времени после каждого приведения в контакт, например, в течение 16-24 часов, после чего среду замещают на свежую среду и клетки культивируют далее. Приведение клеток в контакт может происходить в любой культуральной среде и при любых условиях культивирования, которые обеспечивают выживание клеток. Культура может содержать факторы роста, к которым чувствительны клетки. Факторы роста, как определяется в данном документе, представляют собой молекулы, способные обеспечивать выживание, рост и/или дифференцировку клеток либо в культуре, либо в интактной ткани за счет специфического воздействия на трансмембранный рецептор. Факторы роста включают полипептиды и факторы, отличные от полипептидов.
[000219] Как правило, для осуществления экспрессии трансгена в клетках обеспечивают эффективное количество заявляемого вектора доставки гена или трансдуцированных клеток, содержащих заявляемую полинуклеотидную кассету. Как обсуждалось в другом месте данного документа, эффективное количество можно легко определить эмпирически, например, путем выявления присутствия или уровней продукта трансгенного гена, путем выявления влияния на жизнеспособность или функционирование клеток и т.д. Как правило, эффективное количество заявляемых полинуклеотидной кассеты или вектора доставки гена, содержащего заявляемую полинуклеотидную кассету, будет обеспечивать более высокую экспрессию трансгена в клетках, чем такое же количество полинуклеотидной кассеты, известной из уровня техники. Как правило, экспрессия будет усиливаться в 2 раза или более по сравнению с экспрессией за счет эталонной или контрольной полинуклеотидной кассеты, например, известной из уровня техники, например, в 3 раза, 4 раза или 5 раз или более, в некоторых случаях в 10 раз, 20 раз или 50 раз или более, например, в 100 раз.
[000220] В тех случаях, когда клетки следует приводить в in vivo контакт с заявляемыми полинуклеотидной кассетой или вектором доставки гена, содержащим заявляемую полинуклеотидную кассету, субъектом может быть любое млекопитающее, например, грызун (например, мыши, крысы, песчанки), кролик, представитель кошачьих, представитель собачьих, коза, представитель овечьих, свинья, лошадь, представитель бычьих или примат. В дополнительном предпочтительном варианте осуществления приматом является человек. В дополнительном варианте осуществления клетки представляют собой CD34+ клетки.
[000221] Способы и композиции по настоящему изобретению находят применение, например, в лечении анемии Фанкони.
[000222] В некоторых вариантах осуществления заявляемый способ приводит к терапевтическому эффекту, например, к предупреждению развития нарушения, прекращению прогрессирования нарушения, обращению прогрессирования нарушения и т.д. Например, в одном варианте осуществления нарушение представляет собой BMF. В одном варианте осуществления нарушение представляет собой тромбоцитопению. В других вариантах осуществления нарушение представляет собой лейкопению. В одном варианте осуществления нарушение представляет собой панцитопению. В одном варианте осуществления нарушение представляет собой нейтропению. В других вариантах осуществления нарушение представляет собой анемию. В некоторых вариантах осуществления заявляемый способ предусматривает стадию выявления того, что терапевтический эффект был достигнут. Рядовому специалисту в данной области будет понятно, что такие измерения терапевтической эффективности будут применимы к конкретному заболеванию, подлежащему модифицированию, и ему будут известны соответствующие способы выявления, чтобы применять их при измерении терапевтической эффективности.
[000223] В другом варианте осуществления настоящее изобретение относится к способу лечения заболевания у субъекта, нуждающегося в этом, предусматривающему обеспечение субъекта эффективным количеством клеток, трансдуцированных вектором доставки гена, например, вирусным вектором, который экспрессирует продукт терапевтического гена в клетках. В конкретных вариантах осуществления клетки являются аутологичными для субъекта. В определенных вариантах осуществления клетки представляют собой эритроидные клетки, например, гемопоэтические стволовые клетки или коммитированные гемопоэтические эритроидные клетки-предшественники. В некоторых вариантах осуществления клетка представляет собой клетку костного мозга, например, клетку костного мозга, подвергнутую истощению по линии дифференцировки. В конкретных вариантах осуществления способ применяют для лечения FA, а вирусный вектор представляет собой LV, содержащий конструкцию экспрессии, раскрываемую в данном документе, содержащую промотор гена PGK человека, функционально связанный с кДНК или кодирующей последовательностью гена FANCA, и мутантный wPRE, раскрываемый в данном документе. В конкретных вариантах осуществления обеспечение субъекта клетками осуществляют парентерально, например, путем внутривенной инъекции.
[000224] В другом варианте осуществления настоящее изобретение относится к способу лечения FA у субъекта, нуждающегося в этом, предусматривающему обеспечение субъекта эффективным количеством аутологичных стволовых CD34+ клеток, трансдуцированных LV-вектором, который экспрессирует кДНК FANCA в клетках, где LV-вектор содержит промотор гена PGK человека, функционально связанный с кДНК или кодирующей последовательностью FANCA, и мутантную последовательность wPRE, раскрываемую в данном документе. В конкретных вариантах осуществления клетки представляют собой гемопоэтические стволовые клетки или коммитированные гемопоэтические эритроидные клетки-предшественники, например, клетки костного мозга. В конкретных вариантах осуществления обеспечение субъекта клетками осуществляют парентерально, например, путем внутривенной инъекции.
[000225] Ожидается, что экспрессия трансгена с применением заявляемого трансгена будет надежной. Следовательно, в некоторых случаях экспрессию трансгена, например, выявляемую путем измерения уровней продукта гена, путем измерения терапевтической эффективности и т.д., можно наблюдать через два месяца или менее после введения, например, через 4, 3 или 2 недели или менее после введения, например, через 1 неделю после введения заявляемой композиции. Также ожидается, что экспрессия трансгена будет сохраняться со временем. Следовательно, в некоторых случаях экспрессию трансгена, например, выявляемую путем измерения уровней продукта гена, путем измерения терапевтической эффективности и т.д., можно наблюдать в течение 2 месяцев или более после введения заявляемой композиции, например, в течение 4, 6, 8 или 10 месяцев или более, в некоторых случаях в течение 1 года или более, например, в течение 2, 3, 4 или 5 лет, в определенных случаях в течение более 5 лет.
[000226] В определенных вариантах осуществления способ предусматривает стадию выявления экспрессии трансгена в клетках или у субъекта, где экспрессия усилена по сравнению с экспрессией за счет полинуклеотидной кассеты, не содержащей один или более улучшенных элементов по настоящему изобретению. Как правило, экспрессия будет усилена в 2 раза или более по сравнению с экспрессией за счет эталонной, т.е. контрольной, полинуклеотидной кассеты, например, известной из уровня техники, например, в 3 раза, 4 раза или 5 раз или более, в некоторых случаях в 10 раз, 20 раз или 50 раз или более, например, в 100 раз, доказательством чего служит, например, более ранее выявление, более высокие уровни продукта гена, более сильное функциональное воздействие на клетки и т.д.
[000227] Как правило, если заявляемая композиция представляет собой LV, содержащий заявляемую полинуклеотидную кассету по настоящему изобретению, то эффективное количество для достижения изменения будет составлять приблизительно 1×108 векторных геномов или более, в некоторых случаях 1×109, 1×1010, 1×1011, 1×1012 или 1×1013 векторных геномов или более, в определенных случаях 1×1014 векторных геномов или более, и обычно не больше 1×1015 векторных геномов. В некоторых случаях количество доставляемых векторных геномов составляет не более приблизительно 1×1015 векторных геномов, например, 1×1014 векторных геномов или менее, например, 1×1013, 1×1012, 1×1011, 1×1010 или 1×109 векторных геномов или менее, в определенных случаях 1×108 векторных геномов и, как правило, не меньше 1×108 векторных геномов. В некоторых случаях количество доставляемых векторных геномов составляет от 1×1010 до 1×1011 векторных геномов. В некоторых случаях количество доставляемых векторных геномов составляет от 1×1010 до 3×1012 векторных геномов. В некоторых случаях количество доставляемых векторных геномов составляет от 1×910 до 3×1013 векторных геномов. В некоторых случаях количество доставляемых векторных геномов составляет от 1×810 до 3×1014 векторных геномов.
[000228] В некоторых случаях количество фармацевтической композиции, подлежащей введению, может быть измерено с применением множественности заражения (MOI). В некоторых случаях MOI может означать отношение числа векторных или вирусных геномов к числу клеток, в которые может быть доставлена нуклеиновая кислота, или удельный показатель. В некоторых случаях MOI может составлять 1×106. В некоторых случаях MOI может составлять 1×105 - 1×107. В некоторых случаях MOI может составлять 1×104 - 1×108. В некоторых случаях рекомбинантные вирусы по настоящему изобретению характеризуются по меньшей мере приблизительно 1×101, 1×102, 1×103, 1×104, 1×105, 1×106, 1×107, 1×108, 1×109, 1×1010, 1×1011, 1×1012, 1×1013, 1×1014, 1×1015, 1×1016, 1×1017 и 1×1018 MOI. В некоторых случаях рекомбинантные вирусы по настоящему изобретению характеризуются 1×108 - 3×1014 MOI. В некоторых случаях рекомбинантные вирусы по настоящему изобретению характеризуются не более приблизительно 1×101, 1×102, 1×103, 1×104, 1×105, 1×106, 1×107, 1×108, 1×109, 1×1010, 1×1011, 1×1012, 1×1013, 1×1014, 1×1015, 1×1016, 1×1017 и 1×1018 MOI.
[000229] В некоторых аспектах определенное количество фармацевтической композиции содержит от приблизительно 1×108 до приблизительно 1×1015 частиц рекомбинантных вирусов, от приблизительно 1×109 до приблизительно 1×1014 частиц рекомбинантных вирусов, от приблизительно 1×1010 до приблизительно 1×1013 частиц рекомбинантных вирусов или от приблизительно 1×1011 до приблизительно 3×1012 частиц рекомбинантных вирусов.
[000230] Млекопитающего можно обеспечивать любым общим числом вирусных частиц, подходящим для соответствующей трансдукции клеток, чтобы обеспечить необходимый эффект или лечение заболевания. В разных предпочтительных вариантах осуществления инъецируют по меньшей мере 108; 5×108; 109; 5×109, 1010, 5×1010; 1011; 5×1011; 1012; 5×1012; 1013; 1,5×1013; 3×1013; 5×1013; 7,5×1013; 9×1013, 1×1014 вирусных частиц или 5×1014 вирусных частиц или более, но, как правило, не больше 1×1015 вирусных частиц. Вектор можно вводить млекопитающему или в глаз примата любое подходящее число раз. В одном варианте осуществления способы предусматривают однократное введение; в других вариантах осуществления осуществляют многократные введения за период времени, который лечащий врач считает соответствующим. В некоторых вариантах осуществления в случае однократного введения (24-часовая трансдукция) требуется по меньшей мере 2×108 VG/мл для 5×105 клеток/мл, чтобы добиться высокой эффективности трансдукции. Как правило, в состав индивидуальных доз входит количество, которое не меньше количества, необходимого для осуществления измеримого влияния на субъект, и они могут быть определены на основании показателей фармакокинетики и фармакологии в отношении абсорбции, распределения, метаболизма и выведения («ADME») заявляемой композиции или ее побочных продуктов и, таким образом, на основании этапов фармакокинетики в субъекте. Это подразумевает учет особенностей пути введения, а также величины дозы. Эффективную величину дозы и/или схему введения доз можно легко определить эмпирически на основании доклинических анализов, из испытаний по безопасности и по повышению и определению диапазона доз, индивидуальных взаимоотношений лечащего врача и пациента, а также in vitro и in vivo анализов, таких как описываемые в данном документе и проиллюстрированные в примерах.
[000231] В некоторых вариантах осуществления доза клеток, которую пациенты получают путем инфузии, будет такой, которая получена в результате процесса трансдукции. В различных предпочтительных вариантах осуществления пациенту вводят инфузией по меньшей мере приблизительно 1×101, 1×102, 1×103, 1×104, 1×105, 1×106, 1×107, 1×108 или больше CD34+ клеток/кг массы пациента. В некоторых вариантах осуществления пациенту вводят инфузией от 1×106 до 4×106 CD34+ клеток/кг массы пациента. В других вариантах осуществления пациенту вводят инфузией от 3×105 до 4×106 CD34+ клеток/кг массы пациента. В некоторых вариантах осуществления пациенту клетки будут вводить инфузией в виде однократной дозы. В других вариантах осуществления клетки будут вводить инфузией пациенту в виде нескольких доз. Трансдуцированные клетки могут быть введены инфузией немедленно после завершения процесса трансдукции.
[000232] После интеграции терапевтический белок (например, белок FANCA человека) экспрессируется клетками. Трансдуцированные клетки FA являются генетически скорректированными и, таким образом, способны активировать путь FA за счет моноубиквитинирования FANCD2 и FANCI. Эти белки мигрируют в зоны повреждения ДНК и совместно с другими белками репарации ДНК обеспечивают репарацию ДНК в этих клетках, как происходит в здоровых клетках.
[000233] Как описывается более подробно в примерах, доклинические in vitro данные с образцами ВМ от пациентов-людей с FA уже показали эффективность LV FANCA в коррекции фенотипа этих клеток.
[000234] Соответственно, в настоящем изобретении представлены способы лечения гематологических проявлений FA. В одном варианте осуществления гематологическое проявление FA выбрано из одного или более из BMF, тромбоцитопении, лейкопении, панцитопении, нейтропении и анемии. В конкретном варианте осуществления гематологическое проявление представляет собой недостаточность костного мозга (BMF), которая появляется в детском возрасте у большинства пациентов с FA. В одном варианте осуществления гематологическое проявление представляет собой тромбоцитопению. В других вариантах осуществления гематологическое проявление представляет собой лейкопению. В одном варианте осуществления гематологическое проявление представляет собой панцитопению. В одном варианте осуществления гематологическое проявление представляет собой нейтропению. В других вариантах осуществления гематологическое проявление представляет собой анемию. В одном варианте осуществления гематологическое проявление представляет собой комбинацию двух или более из BMF, тромбоцитопении, лейкопении, панцитопении, нейтропении и анемии.
[000235] LV FANCA напрямую не лечит солидные опухоли, которые могут возникать на более поздних стадиях заболевания. Тем не менее, улучшение гематологического статуса пациентов с FA, подвергнутых лечению гемопоэтической генной терапией, также может улучшать иммунологический надзор над развитием солидных опухолей. Поэтому, непрямой противоопухолевый эффект также может возникать как следствие лечения пациентов с FA с помощью LV FANCA.
[000236] Чтобы достичь успеха при генной терапии FA, целесообразно собрать у субъекта «достаточное» число гемопоэтических стволовых клеток (HSC).
[000237] В одном варианте осуществления HSC получают или собирают из образца костного мозга. В одном варианте осуществления образец костного мозга подвергают истощению по эритроцитам. В некоторых вариантах осуществления образец костного мозга подвергают истощению по CD16+ лейкоцитам. В некоторых вариантах осуществления клетки, оставшиеся после проведения методик истощения, промывают. В других вариантах осуществления к промытым клеткам добавляют неспецифический IgG. В некоторых вариантах осуществления неспецифический IgG представляет собой флебогамму. Затем из промытых клеток можно отбирать CD34+ клетки. В одном варианте осуществления CD34+ клетки отбирают из образца костного мозга. Способы отбора CD34+ клеток могут представлять собой положительный отбор, отрицательный отбор или их комбинацию.
[000238] В других вариантах осуществления HSC получают из периферической крови. В одном варианте осуществления образец периферической крови подвергают истощению по эритроцитам. В некоторых вариантах осуществления образец крови подвергают истощению по CD16+ лейкоцитам. В некоторых вариантах осуществления клетки крови, оставшиеся после проведения методик истощения, промывают. В других вариантах осуществления к промытым клеткам добавляют неспецифический IgG. В некоторых вариантах осуществления неспецифический IgG представляет собой флебогамму. Затем из промытых клеток можно отбирать CD34+ клетки. В одном варианте осуществления CD34+ клетки отбирают из образца периферической крови. Способы отбора CD34+ клеток могут представлять собой положительный отбор, отрицательный отбор или их комбинацию.
[000239] В некоторых вариантах осуществления настоящего изобретения HSC получают от субъекта после мобилизации. Мобилизации можно достигнуть за счет обработки субъекта лекарственными средствами или соединениями, которые вызывают перемещение стволовых клеток из костного мозга в кровь. Стволовые клетки можно собирать и хранить. В некоторых вариантах осуществления мобилизации достигают за счет обработки субъекта с помощью G-CSF (филграстим). В других вариантах осуществления мобилизации достигают за счет обработки субъекта плериксафором. В других вариантах осуществления мобилизации достигают за счет обработки субъекта комбинацией из филграстима и плериксафора (фигура 11 и фигура 14).
[000240] В одном варианте осуществления для восстановления гемопоэза у не подвергавшегося кондиционированию пациента с FA вводят по меньшей мере 1-4×106 скорректированных CD34+ клеток (например, HSC, трансдуцированных FANCA) на килограмм массы пациента. В некоторых вариантах осуществления трансдуцированные клетки вводят инфузией или вводят пациенту немедленно после трансдукции (фигура 11). В других вариантах осуществления трансдуцированные клетки замораживают до проведения инфузии или введения пациенту (фигура 11).
[000241] Генетическая коррекция HSC от пациентов с FA с последующей аутологичной трансплантацией этих клеток (гемопоэтическая генная терапия) является хорошей альтернативой для пациентов с FA, особенно для тех, у которых отсутствует сиблинг, идентичный по HLA. В одном варианте осуществления гемопоэтических генная терапия является предпочтительной схемой лечения для пациента, у которого отсутствует сиблинг, идентичный по HLA. В других вариантах осуществления гемопоэтических генная терапия является предпочтительной схемой лечения для пациента, у которого имеется сиблинг, идентичный по HLA.
[000242] Все публикации, упомянутые в данном документе, включены в данный документ посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которыми данные публикации цитируются. Следует учитывать, что настоящее раскрытие заменяет любое раскрытие включенной публикации в тех случаях, когда имеется противоречие.
[000243] Кроме того, следует отметить, что пункты формулы изобретения могут быть составлены с исключением любого необязательного элемента. В связи с этим, данное заявление предназначено для использования в качестве ранее упомянутого основания для применения такой исключающей терминологии, как «исключительно», «только» и т.п., в отношении изложения заявляемых элементов или для применение «отрицательного» ограничения.
[000244] Публикации, обсуждаемые в данном документе, представлены исключительно для их раскрытия до даты подачи настоящей заявки. Кроме того, представленные даты публикации могут отличаться от фактических дат публикации, которые, возможно, необходимо будет подтвердить независимо.
[000245] Поскольку FA-A представляет собой группу комплементации, наиболее часто встречающуюся у пациентов с FA (Casado et al., 2007, Taniguchi et al., 2006), примеры направлены на векторы, экспрессирующие ген FANCA и/или маркерный ген EGFP; однако другие гены FANCA могут быть использованы для аналогичного лечения других групп комплементации.
Примеры
Пример 1
Лентивирусные векторы FANCA
[000246] Вследствие более безопасного паттерна интеграции LV по сравнению с RV (Gonzalez-Murillo et al., 2008; Modlich et al., 2009; Montini et al., 2006; Mitchell RS, Beitzel BF, Schroder AR et al. Plos Biol. 2004;2:E234; Montini E et al. J Clin Invest. 2009;119:964-975; Schroder AR et al. Cell. 2002;110:521-529) была поставлена задача разработать LV в качестве терапевтических векторов для коррекции фенотипа клеток FA (Gonzalez-Murillo et al., 2009). Наряду с этим, поскольку последние исследования показали, что LV, несущие сильные внутренние промоторы, также могут транс-активировать соседние гены (Modlich et al., 2009), применение LV в клинике рассматривалось как компромисс между терапевтической эффективностью и рисками транс-активации соседних генов. Таким образом, цель заключалась в том, чтобы определить пороговые уровни экспрессии FANCA, которые могли бы быть терапевтическими, чтобы ограничить риски транс-активации гена энхансером/промотором, управляющим экспрессией терапевтического гена. Эффективность LV FANCA была впервые подтверждена in vitro на LCL FA-A, затем на первичных образцах BM от пациентов с FA-A и, наконец, in vivo на мышиной модели FA-A.
[000247] С этой целью конструировали LV, экспрессирующие FANCA под контролем различных промоторов: промоторы генов vav, PGK, CMV и SFFV. Фигура 1 представляет собой принципиальную схему медицинского продукта. На фигуре 2A показано схематическое изображение LV, экспрессирующих FANCA под контролем различных внутренних промоторов. Кроме того, авторы настоящего изобретения также изучали влияние посттранскрипционных элементов WPRE как на уровень экспрессии FANCA, так и на терапевтическую эффективность LV. Первоначально все LV упаковывали с помощью химерной оболочки GALV-TR. Обычно получали титры 1-2×106 ед. трансдукции/мл, а трансдукцию проводили при расчетной MOI 1-2 ед. трансдукции/клетка. На фигуре 2B показан вестерн-блоттинг анализ FANCA в трансдуцированных клетках FA-A.
[000248] Чтобы определить уровень мРНК FANCA, который обеспечивался каждым вектором, клеточные линии трансдуцированных лимфобластов FA-A (LCL) отбирали с помощью 30 нМ MMC в течение 5 дней. После процесса отбора трансдуцированные LCL FA-A содержали от 0,81 до 3,04 копии соответствующего LV на клетку (таблица 1). В качестве контроля применяли не подвергнутые отбору LCL FA-A, трансдуцированные EGFP-LV, и LCL от здорового донора (HD).
[000249] Общие уровни мРНК FANCA, а также относительные уровни мРНК FANCA на число копий LV определяли в LCL, трансдуцированных разными LV (таблица 1). Проводя сравнение с уровнями мРНК FANCA, наблюдаемыми в LCL от HD, аналогичные уровни мРНК FANCA/копия наблюдали в клетках FA-A, трансдуцированных LV vav-FANCA и PGK-FANCA. LV CMV-FANCA и, с большей значимостью, SFFV-FANCA обеспечивали уровни мРНК FANCA/копия, превышающие физиологические (в 3,6 раза и 5,6 раза соответственно). LV PGK-FANCA, несущие последовательности WPRE или мутантного WPRE* (Schambach et al., 2006), повышали уровни мРНК FANCA в 2,3-2,6 раза по сравнению с PGK-LV без WPRE. Что согласуется с другими исследованиями (Schambach et al., 2006; Zanta-Boussif MA, Charrier S, Brice-Ouzet A et al. Validation of a Mutated Pre Sequence Allowing High and Sustained Transgene Expression While Abrogating WHV-X Protein Synthesis: Application to the Gene Therapy of WAS. Gene Ther. 2009; 16:605-619; Zufferey R, Donello JE, Trono D, Hope TJ. Woodchuck Hepatitis Virus Posttranscriptional Regulatory Element Enhances Expression of Transgenes Delivered by Retroviral Vectors. J Virol. 1999; 73:2886-2892), вставка последовательностей WPRE или WPRE* значимо повышала уровни мРНК FANCA в клетках, трансдуцированных LV PGK-FANCA. Поскольку элемент WPRE дикого типа кодирует усеченную на C-конце версию белка Х вируса гепатита, который мог бы опосредовать онкогенный эффект (Bouchard MJ, Schneider RJ. The Enigmatic X Gene Of Hepatitis B Virus. J Virol. 2004; 78:12725-12734. 2004; Kingsman SM, Mitrophanous K, Olsen JC. Potential Oncogene Activity of the Woodchuck Hepatitis Post-Transcriptional Regulatory Element (WPRE). Gene Ther. 2005; 12:3-4), LV с последовательностью мутантного WPRE* (Schambach et al., 2006), в котором отсутствует какая-либо остаточная открытая рамка считывания, считается более адекватным для путей применения в клинической практике.
[000250] Таблица 1. Уровни экспрессии FANCA в LCL FA-A, трансдуцированных лентивирусными векторами, экспрессирующими FANCA
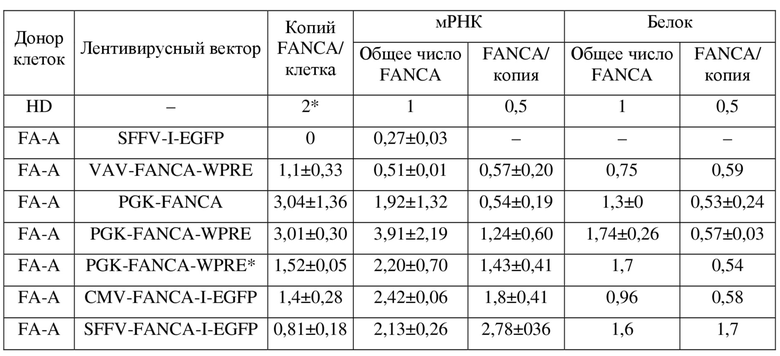
*Для оценки уровней мРНК FANCA и белка FANCA на копию FANCA, считали, что в LCL от здоровых доноров присутствует по 2 копии геномного FANCA.
[000251] Чтобы проверить, подтверждалась ли различия в экспрессии мРНК FANCA на уровне белка, проводили вестерн-блоттинг анализы (фигура 2В) образцов, показанных в таблице 1. Как и в случае определения уровней мРНК FANCA, значения белка FANCA зависели не только от белковой нагрузки, но также от числа копий провируса, определенных в каждой трансдуцированной LCL FA. Проводя сравнение с уровнями FANCA/копия, определенными в LCL от HD, практически нормальные уровни FANCA/копия обеспечивали все протестированные FANCA-LV, за исключением LV SFFV-FANCA. В данном случае относительные уровни FANCA/копия в 3,4 раза превышали уровни, определенные для LCL от HD. Вестерн-блоты, повторно окрашенные антителом к FANCD2, показали, что, хотя LCL FA-A, трансдуцированные контрольным вектором, не были способны осуществлять моноубиквитинирование FANCD2, LCL FA-A, трансдуцированные любым типом FANCA-LV, экспрессировали как неубиквитинированные, так и моноубиквитинированные формы FANCD2, что соответствует функциональному пути FA в этих клетках.
[000252] При сравнении уровней экспрессии FANCA, обеспечиваемых различными LV в LCL FA-A, с уровнями, наблюдаемыми в LCL от здоровых доноров (HD) (с двумя копиями FANCA), авторы настоящего изобретения сделали заключение, что вставка двух копий LV на клетку может приводить к физиологическим уровням терапевтического белка, за исключением случая SFFV-LV, которые могли обеспечивать уровни FANCA, превышающие физиологические. Достижение данного числа копий может удовлетворять требования клинического испытания пациентов с FA, при котором могут быть необходимы эффективности трансдукции, составляющие по меньшей мере 50%, поскольку у таких пациентов в BM присутствует малое число клеток-предшественников (Gonzalez-Murillo et al., 2009, Jacome et al., 2006, Kelly et al., 2007; Larghero J, Marolleau JP, Soulier J et al. Hematopoietic Progenitor Cell Harvest and Functionality in Fanconi Anemia Patients. Blood. 2002; 100:3051).
[000253] Чтобы проанализировать возможные различия в терапевтической эффективности различных LV, экспрессирующих FANCA, определяли эффективность каждого вектора в отношении коррекции гиперчувствительности к MMC у клеточных линий лимфобластов FA-A (LCL). С этой целью LCL FA-A трансдуцировали различными LV (фигура 3A), а затем подвергали воздействию повышающихся концентраций MMC. После этого определяли жизнеспособность трансдуцированных клеток. Как показано на фигуре 3A, все протестированные FANCA-LV были одинаково эффективны при обращении гиперчувствительности LCL FA-A. Аналогичным образом, все векторы обеспечивали образование ядерных очагов FANCD2 в клетках, обработанных MMC (фигура 3B), что соответствовало функциональному пути FA в клетках FA-A, трансдуцированных любым FANCA-LV.
[000254] Пример 2. Исследования на мышиной модели
[000255] Чтобы оценить репопуляционные свойства образцов ВМ от пациентов с FA, как подвергнутых, так и не подвергнутых генетической коррекции, нескольким группам иммунодефицитных мышей трансплантировали клетки ВМ от пациентов с FA. Тем не менее, о значимом приживлении клеток не сообщалось ни в одном из случаев, скорее всего, из-за сниженного числа гемопоэтических предшественников и HSC, присутствующих в BM этих пациентов.
[000256] Чтобы оценить эффекты медицинского продукта in vivo, применяли мышиную модель FA-A, которая содержит делецию в гене Fanca. В отличие от пациентов с FA, у этих животных не развиваются выраженные гематологические дефекты. Тем не менее, клетки-предшественники из их BM очень чувствительны к MMC (Rio et al., 2002), как и в случае пациентов с FA. Поэтому, чтобы определить приводил ли LV FANCA (фигура 4A) к стабильной коррекции фенотипа HSC от мышей с FA-A in vivo, клетки ВМ от мышей с FA-A трансдуцировали с помощью LV FANCA, а затем трансплантировали облученным реципиентам с FA-A (фигура 4B). Чтобы оценить подвергся ли коррекции фенотип гемопоэтических предшественников после трансплантации генетически скорректированных клеток, образцы BM от трансплантированных мышей с FA-A культивировали в метилцеллюлозе при отсутствии и присутствии MMC (фигура 4C). Дополнительные данные, подтверждающие интеграцию терапевтической кассеты, представлены на фигурах 42-44. ПЦР, опосредованная линейной амплификацией (LAM-PCR), представляет собой способ поиска сайтов интеграции различных интегрирующих векторов в геноме. Для идентификации положения интеграции вектора в пределах генома получают и секвенируют ПЦР-продукт, который начинается с известной последовательности вектора и продолжается как неизвестный фланкирующий геном. На фигуре 42 представлен LAM-PCR-анализ сайтов вставки FANCA-LV в гемопоэтических стволовых клетках (HSC) FA. На фигуре 43 изображены результаты LAM-PCR по отслеживанию клеток, обработанных с помощью FANCA-LV. На фигуре 44 показано клональное разнообразие у реципиентов Fanca -/-, которым провели трансплантацию HSC, скорректированных с помощью LV.
[000257] Через 1 месяц после трансплантации у этих животных наблюдали нормальные гематологические показатели без явных проявления токсичности LV. В это время число копий провирусного FANCA на клетку варьировало от 0,5 до 10 копий/клетка (аналогичные результаты наблюдали через 3 и 6 месяцев после трансплантации) (фигура 5). Чтобы оценить подвергся ли коррекции фенотип гемопоэтических предшественников после трансплантации генетически скорректированных клеток, образцы BM от трансплантированных мышей с FA-A культивировали в метилцеллюлозе при отсутствии и присутствии MMC.
[000258] Как показано на фигуре 6, наблюдали значимую коррекцию гиперчувствительности к MMC у гемопоэтических предшественников от мышей FA, которых подвергли генной терапии с помощью LV FANCA, в сравнении с контролем, обработанным с помощью LV SF1-EGFP. Клетки FA-A костного мозга (BM) трансдуцировали с помощью LV PGK_FANCA-WPRE* или контрольного LV SF1-EGFP и трансплантировали облученным мышам FA-A. Через 7 месяцев после трансплантации образцы BM собирали и культивировали в метилцеллюлозе в присутствии повышающихся концентраций митомицина C (MMC).
[000259] Следовательно, эти данные указывают на то, что LV FANCA может восстанавливать фенотип гемопоэтических предшественников от мышей FA-A после in vivo трансплантации. С точки зрения безопасности, ни у одной из 30 мышей, которым трансплантировали клетки BM, предварительно трансдуцированные с помощью FANCA-LV, не развивались симптомы миелопролиферативных нарушений или лейкоза (данные получены вплоть до 1 года после трансплантации).
[000260] Пример 3. Эффективная трансдукция свежих гемопоэтических предшественников от пациентов с FA лентивирусными векторами
[000261] Поскольку ранее было показано, что трансдукция криоконсервированных гемопоэтических стволовых клеток (HSC) с FA менее эффективна по сравнению с трансдукцией свежих трансплантатов (Jacome et al., 2009), предприняли попытку оптимизировать эффективность трансдукции криоконсервированных образцов ВМ с FA. Как показано на фигуре 7, выполнение трех циклов трансдукции значимо повышало эффективность трансдукции CFC FA по сравнению со значениями, полученными после одного цикла трансдукции (45,7±4,2% по сравнению с 13,5±5,1% соответственно). Образцы подвергали процедурам стандартной трансдукции, предусматривающей один цикл трансдукции (16 ч) после 2 ч статической предварительной нагрузки (белые столбики; 1xS), или улучшенной трансдукции, состоящей из трех циклов трансдукции (2 ч + 2 ч + 12 ч) лентивирусными векторами (серые столбики; 3xD).
[000262] Пример 4. Лентивирусный вектор PGK-FANCA-WPRE* эффективно корректирует фенотип предшественников из костного мозга от пациентов с FA-A
[000263] В силу эффективности LV, в которых FANCA находился под управлением промотора гена PGK, и на основании предыдущих исследований, демонстрирующих стабильность (Follenzi A et al. Nat Genet.2000; 25:217-222) и свойства низкой генотоксичности LV, несущих промотор гена PGK (Modlich et al., 2009, Montini et al., 2006,Montini et al., 2009), дальнейшие эксперименты на LCL, а также на клетках костного мозга от пациентов с FA-A выполняли с применением LV PGK-FANCA, не содержащих элемент WPRE или содержащих последовательности WPRE или WPRE*. Как показано на фигуре 8A, все эти три вектора обеспечивали одинаковое обращение гиперчувствительности LCL FA-A к MMC.
[000264] Чтобы сравнить эффективность LV SFFV-FANCA и PGK-FANCA в отношении коррекции фенотипа гемопоэтических предшественников от пациентов с FA-A, истощенные по эритроцитам образцы ВМ от пациентов с FA-A трансдуцировали, как описано ранее (Jacome et al., 2009). Истощенные по эритроцитам клетки BM трансдуцировали в течение 16 часов в планшетах, предварительно нагруженных надосадочными жидкостями c LV, как описано ранее (Gonzalez-Murillo et al., 2009). Через четырнадцать дней оценивали число колоний, растущих при отсутствии и присутствии 10 нM MMC, чтобы определить долю предшественников, которые стали устойчивыми к данному лекарственному средству.
[000265] Как показано на фигуре 8B, когда образцы трансдуцировали с помощью EGFP-LV, то в присутствии MMC почти не образовывались колонии. В противоположность этому наблюдению, трансдукция клеток ВМ FA-A с помощью LV SFFV-FANCA и PGK-FANCA обеспечивала рост 26 и 38% колоний, оцениваемых по культурам в отсутствие MMC. Эффективность LV PGK-FANCA, содержащих последовательности WPRE и WPRE*, сравнивали с LV PGK-FANCA без WPRE. Как показано на фигуре 8B, все три LV опосредовали высокий и аналогичный уровень защиты от ММС. Хотя вставка посттранскрипционного регуляторного элемента WPRE* (Schambach et al., 2006) не была необходимой для повышения эффективности LV PGK-FANCA, этот элемент будет избыточным элементом для поддержания долгосрочных терапевтических уровнях эктопического FANCA у пациента.
[000266] В совокупности, данные, полученные в этих исследованиях, убедительно свидетельствуют о том, что LV PGK-FANCA-WPRE* обеспечивают достаточные уровни экспрессии FANCA для коррекции гемопоэтического фенотипа у пациентов с FA-A. Данные результаты вместе с предыдущими наблюдениями, показывающими стабильность (Follenzi et al.., 2000), свойства безопасности PGK-LV (Modlich et al., 2009, Montini et al., 2006, Montini et al., 2009) и эффективность мутантного посттранскрипционного элемента WPRE* (Schambach et al., 2006), подкрепляют предположение о том, что LV PGK-FANCA-WPRE* может представлять собой эффективный и безопасный вектор для генной терапии пациентов с FA-A.
[000267] Пример 5. Анализ эффективности лентивирусных векторов, упакованных с помощью GALV-TR и VSV-G, с точки зрения трансдукции гемопоэтических предшественников от пациентов с FA
[000268] Поскольку LV можно псевдотипировать как с помощью оболочки GALV-TR, так и с помощью оболочки VSV-G, проводили новые эксперименты, в которых не подвергнутые отбору клетки костного мозга от пациентов с FA трансдуцировали при оптимизированных условиях с помощью EGFP-LV, псевдотипированных с помощью этих двух оболочек.
[000269] Для LV, псевдотипированных с помощью GALV-TR, выполняли два цикла трансдукции с неконцентрированными LV (расчетный титр: 2×105 МЕ/мл; расчетная MOI: 2 МЕ/клетка).
[000270] Для LV, псевдотипированных с помощью VSV-G, выполняли один цикл трансдукции с концентрированными и очищенными LV (расчетный титр: 108 МЕ/мл; расчетная MOI: 50 МЕ/клетка).
[000271] Как показано на фигуре 9, при обоих условиях получали аналогичные результаты трансдукции гемопоэтических предшественников от пациентов с FA, что указывает на то, что при изготовлении можно определить компромиссное решение для обеспечения наилучшей оболочки для упаковки.
Пример 6. Исследования безопасности
[000272] Трансформирующий потенциал лентивирусных векторов, показанных на фигуре 10A, измеряли по частоте пересева относительно числа копий. Как показано на фигуре 10B, трансформирующий потенциал лентивирусного каркаса, соответствующего LV PGK-FANCA-WPRE* (лентивирусный вектор с PGK) заметно ниже по сравнению с трансформационной способностью векторов, несущих вирусные промоторы, которые уже применяются в клинических испытаниях X1-SCID и CGD.
[000273] Что касается исследований in vivo с мышами, которым трансплантировали клетки ВМ, трансдуцированные с помощью LV PGK-FANCA-WPRE*, трансплантация была проведена у 30 мышей и до настоящего го времени (вплоть до 1 года после трансплантации), ни у одного из подвергнутых трансплантации животных не развились симптомы миелопролиферативных нарушений или лейкоза.
[000274] Пример 7. Фармацевтический продукт
[000275] Лентивирусный вектор FANCA представляет собой производный от rHIV1 самоинактивируемый вектор третьего поколения, кодирующий кДНК FANCA человека под контролем промотора гена PGK человека и регулируемый на посттранскрипционном уровне за счет мутантного WPRE, в котором отсутствует ORF белка Х (см. фигуру 1, фигуру 41 и SEQ ID NO: 24). Такой лентивирусный вектор FANCA обладает рядом преимуществ по сравнению с векторами на основе гамма-ретровирусов, ранее применявшимися в генной терапии FA, в частности, способностью трансдуцировать клетки, невзирая на короткие протоколы предварительной активации, что является преимуществом для сохранения у гемопоэтических стволовых клеток потенциала дифференцировки в множественные линии.
[000276] При получении терапевтического лентивирусного вектора клетки 293Т, трансфицированные тремя дополнительными плазмидами, обеспечивающими все необходимые хелперные белки для упаковки вектора (см. фигуры 38-40), будут содержать конечную упаковку медицинского продукта PGK-FANCA-WPRE* (фигура 41).
[000277] Терапевтическая кассета LV PGK-FANCA-WPRE* содержит промотор гена PGK человека, кодирующую последовательность для кДНК FANCA и энхансер WPRE*, и состоит из нуклеотидов 3541-9178 из SEQ ID NO: 24. Область кассеты переноса, содержащая немедленно-ранний промотор CMV человека, упаковывающую последовательность HIV, элементы gag и RRE, терапевтическую кассету и самоинактивирующийся 3'-LTR HIV, где терапевтическая кассета содержит промотор гена PGK человека, кодирующую последовательность для кДНК FANCA и энхансер WPRE*, закодирована нуклеотидами 1586-9495 из SEQ ID NO: 24.
[000278] Нуклеотиды 1586-1789 из SEQ ID NO: 24 составляют немедленно-ранний промотор CMV человека. Нуклеотиды 2031-2156 из SEQ ID NO: 24 составляют сигнал упаковки psi HIV1. Нуклеотиды 2649-2882 из SEQ ID NO: 24 составляют элемент RRE HIV1. Нуклеотиды 3378-3495 из SEQ ID NO: 24 составляют элемент cPPT/CTS HIV. Нуклеотиды 3541-4051 из SEQ ID NO: 24 составляют промотор гена hPGK. Нуклеотиды 4078-8445 из SEQ ID NO: 24 составляют кДНК FANCA-A человека. Нуклеотиды 8502-9178 из SEQ ID NO: 24 составляют мутантный элемент WPRE. Нуклеотиды 9262-9495 из SEQ ID NO:24 составляют delta-U 3'-LTR HIV.
[000279] Пример 8. Клиническое исследование FANCOSTEM
[000280] В США было проведено два испытания генной терапии у пациентов с FA-A и FA-C, которые не продемонстрировали клиническую эффективность (Liu, J. M., et al. (1999). Engraftment of hematopoietic progenitor cells transduced with the Fanconi anaemia group C gene (FANCC). Hum.Gene Ther. 10: 2337-2346; Kelly, P. F., et al. (2007). Stem cell collection and gene transfer in fanconi anaemia. Mol Ther 15: 211-219). Эффективность вышеупомянутых испытаний можно было бы значительно улучшить за счет различных методов оптимизации. Два клинических испытания проводили совместно, чтобы определить реализуемость способа сбора и очистки достаточного числа CD34+ клеток для предстоящего клинического применения (FANCOSTEM) и параллельно оценить безопасность и эффективность генной терапии у пациентов с FA группы комплементации A (FA-A) (FANCOLEN), см. фигуру 11.
[000281] Основными критериями включения для FANCOSTEM были следующие: пациенты с диагнозом AF, подтвержденным тестом на хромосомную нестабильность с диэпоксибутаном или митомицином C, возраст > 1 года, и по меньшей мере один из следующих параметров не должен превышать: 1) гемоглобин: 8,0 г/дл, 2) нейтрофилы: 750/мм3, 3) тромбоциты: 30000/мм3. Для участия набрали десять пациентов, девятерых подвергли скринингу, из них 2 потерпели неудачу (пациенты с мозаицизмом) На фигуре 12 представлены гематологические параметры пациентов, набранных для участия. Семерых (7) пациентов обрабатывали с помощью G-CSF и плериксафора. В схеме мобилизации предусматривалось введение G-CSF (нейпоген; 12 мкг/кг/12 часов) и плериксафор (мозобил; 240 мкг/кг массы тела/сутки). CD34+ клетки мобилизованной периферической крови (mPB) трансдуцировали в соответствии с GMP-условиями с помощью LV PGK-FANCA-WPRE* с применением короткого протокола ex vivo трансдукции (фигура 13). Принимая во внимание то, что у двух пациентов возрастом 15 и 16 лет не был достигнут пороговый уровень CD34+ клеток в периферической крови, аферез можно было проводить у пяти пациентов возрастом 3-5 лет. У этих пациентов среднее число CD34+клеток/кг составляло 6,6×106 (диапазон: 1,6×106 - 7,6×106). После отбора CD34+ клеток число CD34+ клеток/кг составляло 2,0×106 (диапазон: 8,5×105 и 5,1×106). Серьезные нежелательные явления, связанные со схемой мобилизации, не были обнаружены ни у одного обработанного пациента при последующем наблюдение в течение до 2,5 года.
[000282] На фигуре 14 показана опосредованная G-SCF/плериксафором мобилизация CD34+ клеток у пациентов с FA-A, а на фигуре 15 показана опосредованная G-SCF/плериксафором мобилизация колониеобразующих клеток (CFC) у пациентов с FA-A. На фигуре 16A показан сбор CD34+ клеток в FANCOSTEM, а на фигуре 16B показано сравнение с предыдущими исследованиями.
[000283] На фигуре 17 показано сравнение между предсказанными числом CD34+ клеток в костном мозге (BM) и фактическим числом в мобилизованной периферической крови (mPB). Фигура 18 представляет собой краткое описание CD34+ клеток, собранных у пациентов с FA-A, у которых проводили мобилизацию G-CSF/плериксафором. Число CD34+ клеток после отбора коррелирует с числом CD34+ клеток/мкл в BM в день 0 (данные не показаны).
[000284] На фигуре 19 изображена экспрессия CD34 до и после иммуноселекции CD34+ клеток mPB от здоровых доноров (HD) и пациентов с FA.
[000285] На основании этих данных авторы настоящего изобретения пришли к выводу, что в сравнении с другими клиническими исследованиями, проведенными к настоящему времени, наблюдались очевидные улучшения в сборе CD34+ клеток у пациентов,
обработанных помощью филграстима (G-CSF) и плериксафора, и при этом только пациенты с FA на ранних стадиях заболевания, по-видимому, подходят для сбора клинически значимого числа HSC.
[000286] Пример 9. Клиническое исследование FANCOLEN
[000287] Целью второго параллельного клинического испытания (FANCOLEN) была оценка безопасности и эффективности генной терапии у пациентов с FA группы комплементации A (FA-A) (FANCOLEN). Для восстановления гемопоэза у пациентов с FA за счет инфузии генетически скорректированных аутологичных HSC разрабатывали оптимизированные векторы и протоколы трансдукции. В частности, оно представляло собой клиническое испытание фазы I/II для оценки безопасности и эффективности инфузии аутологичных CD34+клеток, трансдуцированных лентивирусным вектором, несущим ген FANCA (орфанное лекарственное средство), для пациентов с анемией Фанкони подтипа A.
[000288] Основные критерии включения были следующими: пациенты с диагнозом FA-A, возраст > 1 года, и по меньшей мере один из следующих параметров не должен был достигать следующего порога: 1) гемоглобин:е 8,0 г/дл, 2) нейтрофилы: 1000/мм3, 3) тромбоциты: 50000/мм3.
[000289] Более конкретные критерии включения субъектов предусматривают следующее: 1) пациенты группы комплементации FA-A; 2) по меньшей мере один из следующих параметров не должен был достигать указанных значений: гемоглобин: 8,0 г/дл, нейтрофилы: 750/мм3, тромбоциты: 30000/мм3; 3) минимальный возраст: 1 год; 4) максимальный возраст: 21 год; 5) индекс Ланского > 60%; 6) легкая степень нарушения функций органов; 7) предоставление информированного согласия в соответствии с действующим законодательством; 8) число клеток для трансдукции: по меньшей мере 3×105 очищенных CD34+ клеток/кг массы пациента; 9) женщины детородного возраста должны иметь отрицательный тест мочи на беременность при визите исходного уровня и соглашаться на применение эффективного метода контрацепции на протяжении участия в исследовании.
[000290] Критерии исключения субъектов предусматривают следующее: 1) пациенты с семейным донором, идентичным по HLA; 2) доказательства миелодиспластического синдрома или лейкоза или цитогенетические аномалии, предвещающие эти состояния, при анализе пункции костного мозга. Данную оценку следует проводить с помощью валидированных исследований за два месяца до того, как пациент войдет в клиническое испытание; 3) доказательства наличия у пациента признаков соматического мозаицизма с улучшенными гематологическими показателями; 4) любое сопутствующее заболевание или состояние, которое, по мнению исследователя, делает субъекта непригодным для участия в исследовании; 5) сенсорные или двигательные нарушения > = 2 степени согласно критериям Национального института рака (NCI) в анамнезе; 6) беременные или кормящие женщины.
[000291] Путь введения: пациенты получали клетки, трансдуцированные терапевтическим вектором, путем внутривенной инфузии.
[000292] Доза клеток: доза клеток, получаемая пациентами путем трансфузии, составляла столько, сколько было получено за счет трансдукции, от 3×105 до 4×106 очищенных CD34+ клеток/кг массы пациента.
[000293] При дозе менее 3×105 CD34+ клеток/кг существует крайне небольшая вероятность приживления трансдуцированных клеток у пациента, особенно, учитывая тот факт, что в данном клиническом испытании изначально будут получать инфузию не подвергавшиеся кондиционированию пациенты. В испытании генной терапии у пациентов с анемией Фанкони, проведенном др. Williams (Kelly et al.., 2007) число инфузированных клеток у 2 пациентов (FAAGT1001 и 1003) составило 4,5×105 и 3,25×105 ядросодержащих клеток/кг массы пациента соответственно. У обоих пациентов наблюдали временное увеличение содержания Hb и количества тромбоцитов, но при этом не смогли продемонстрировать присутствие трансгена, ассоциированное с этим. В отличие от испытания др. Williams, где клетки трансдуцировали вектором на основе гамма-ретровируса течение 4 суток, в данном клиническом испытании клетки трансдуцировали более эффективным лентивирусным вектором, и трансдукция будет проводиться в течение максимум 48 часов, т.е. намного меньше 4 суток, которые применяли в предыдущем протоколе. С учетом этого авторы настоящего изобретения считали, что 3×105 очищенных CD34+ клеток/кг массы тела пациента составляют разумный нижний предел для этого испытания.
[000294] Верхний предел, составляющий 4×106 очищенных CD34+ клеток/кг, не основан на необходимости ограничивать число инфузируемых клеток, поскольку большее число клеток увеличивает вероятность приживления. Скорее, предел в 4×106 очищенных CD34+ клеток/кг массы тела пациента, обусловлен сложностью мобилизации и сбора клеток, превышающих данное число, у пациентов с анемией Фанкони, для которой характерно снижение количества клеток CD34+ в костном мозге (Jacome et al., 2009).
[000295] Схема приема: клетки, трансдуцированные терапевтическим вектором, вводили пациенту инфузией в виде однократной дозы. Это было обусловлено двумя основными причинами. 1) Все исследования гемопоэтической генной терапии, проведенные до настоящего времени, осуществляли с применением однократной инфузии трансдуцированных клеток (Naldini, 2011). Исходя из этого предыдущего опыта, авторы настоящего изобретения не хотели менять данный параметр. 2) Однократная инфузия всех трансдуцированных клеток будет увеличивать вероятность большего приживления по сравнению с инфузией той же дозы, разделенной на части.
[000296] Период набора участников: пациентов набирали в течение 3 лет. Поскольку пациенты с подтипом FA-A встречаются с наибольшей частотой в популяции пациентов с FA (приблизительно 80% испанских пациентов с FA соответствуют данной группе комплементации (Casado et al. (2007)), сконструированный терапевтический вектор несет ген FANCA. Следовательно, среди пациентов с FA в данном исследовании могут участвовать только пациенты, которые относятся к подтипу FA-A. Всех пациентов данной группы комплементации, детей или взрослых, включали в данное исследование при условии, что они соответствуют установленным критериям включения и исключения.
[000297] Конкретное описание первичной и, если таковые имеются, вторичных переменных, которые будут оцениваться в клиническом испытании, предусматривает следующее: 1) главная переменная: A) определение токсичности, ассоциированной с инфузией аутологичных CD34+ клеток, трансдуцированных терапевтическим лентивирусным вектором, у пациентов с анемией Фанкони подтипа A; B) определение степени приживления, ассоциированного с инфузией аутологичных CD34+ клеток, трансдуцированных терапевтическим лентивирусным вектором, у пациентов с анемией Фанкони подтипа A; 2) вторичные переменные: определение клинического ответа, ассоциированного с инфузией аутологичных CD34+ клеток, трансдуцированных терапевтическим лентивирусным вектором, у пациентов с анемией Фанкони подтипа A.
[000298] CD34+ клетки из костного мозга и/или мобилизованные в периферической крови (свежей и/или криоконсервированной) от пациентов с анемией Фанкони подтипа A (FA-A) трансдуцировали ex vivo лентивирусным вектором, несущим ген FANCA (орфанное лекарственное средство) (фигура 11). После трансдукции клеток пациенты получали инфузию этих генетически скорректированных стволовых клеток для восстановления гемопоэза.
[000299] Оценка: пациентов оценивали до начала лечения, предварительно получив информированное согласие. Оценку проводили за месяц до проведения инфузии генетически скорректированных клеток с помощью стандартного физикального обследования (включая измерение массы и роста), подсчета количества клеток периферической крови, измерения основных биохимических показателей и анализа пункции костного мозга.
[000300] Трансдукция и инфузия генетически скорректированных CD34+ клеток: Популяцию очищенных CD34+ клеток трансдуцировали ex vivo терапевтическим лентивирусным вектором. После трансдукции клеток продукт проходил оценки контроля качества, аликвоты подвергали криоконсервированию для последующих исследований и продукт готовили для инфузии пациентам.
[000301] Если у двух пациентов, которым ввели инфузию приемлемого числа трансдуцированных клеток (по меньшей мере 1 миллион инфузированных клеток/кг массы тела, в аликвоте, в которой по меньшей мере 0,3 копии вектора/клетка обнаруживали после по меньшей мере 7 суток культивирования in vitro), по МЕНЬШЕЙ МЕРЕ 0,1 КОПИИ ВЕКТОРА/КЛЕТКА не наблюдается ни в костном мозге, ни в периферической крови через 6 МЕСЯЦЕВ ПОСЛЕ ИНФУЗИИ, следующие пациенты будут подвергаться процессу кондиционирования до проведения инфузии клеток.
[000302] Для того чтобы пациент мог подвергаться любому типу кондиционирования, должен существовать подходящий способ восстановления потенциальной аплазии костного мозга, ассоциированной с кондиционированием, и возможной неудачи имплантации трансдуцированных клеток. Способы восстановления предусматривают применение дозы пуповинной крови или гемопоэтических клеток от идентичного по гаплотипу донора. Клетки будут вводиться внутривенной инфузией.
[000303] Доза клеток, которую пациенты получали путем инфузии, составляла столько, сколько было получено в процессе трансдукции, от 3×105 до 4×106 CD34+ клеток/кг массы пациента.
[000304] Пациенту клетки вводят инфузией в виде однократной дозы.
[000305] Трансдуцированные клетки вводят инфузией немедленно после завершения процесса трансдукции.
[000306] Инфузируемый продукт состоит из суспензии CD34+ клеток, которая была упакована в стерильный пакет для инфузии GMP-лабораторией CLINISTEM при CIEMAT.
[000307] Период набора участников: 3 года от проведения инфузии у 1-го пациента.
[000308] Период последующего наблюдения: два года после проведения инфузии трансдуцированных клеток. Однако за пациентами продолжают следить вне клинического испытания в течение 10 лет.
[000309] Отслеживание приживления трансдуцированных клеток будет проводиться на образцах периферической крови и костного мозга.
[000310] Первые 72 часа после проведения инфузии: в течение этого периода основные физиологические показатели регистрировали каждые 8 часов, а функции жизненно важных органов (профиль электролитов, гематологические показатели, функции почек и печени) контролировали каждые 24 часа.
[000311] Впоследствии проводили следующие проверки, как показано в таблице 2.
[000312] Таблица 2.
[000313] В данное исследование будут включать пациентов с диагнозом FA и принадлежащих группе комплементации FA-A. Пациентов рассматривают, если была продемонстрирована коррекция клеточного фенотипа за счет трансдукции векторами, несущими ген FANCA, или если демонстрируются биаллельные патогенные мутации в этом гене.
[000314] Пациент FA 02005 соответствует критериям для FANCOSTEM и FANCOLEN, как показано на фигуре 20. На фигуре 21 изображены тесты, показывающие диагностику FA у пациента FA-02005 до проведения генной терапии, а на фигуре 22 показан контроль процесса получения клеток от пациента FA-02005. На фигуре 23 показано число копий вектора у пациента FA02005 до проведения генной терапии и через 2 недели, 4 недели, 6 недель, 2 месяца, 3 месяца, 4 месяца и 5 месяцев после проведения генной терапии. Последующее наблюдение за первым подвергавшимся кондиционированию пациентом с FA-A, пациент FA02005 (возрастом 4 года), до и после проведения генной терапии представлено для гемоглобина (фигура 24), нейтрофилов (фигура 25) и тромбоцитов (фигура 26) .
[000315] Для пациента FA02002 изменение гематологических показателей представлено на фигуре 27, диагностика представлена на фигуре 28, а последующее наблюдение за процессом выработки клеток представлено на фигуре 29. На фигуре 30 показан анализ экспрессии CD34 в mPB здорового донора и пациента с FA во время различных стадий, необходимых для трансдукции LV пациенту FA-02002. На фигуре 31 показано число копий вектора у пациента FA02002 до проведения генной терапии и через 2 недели, 4 недели, 6 недель после проведения генной терапии. Последующее наблюдение за пациентом FA02002 (получившим инфузию криоконсервированных клеток) представлено для гемоглобина (фигура 32), нейтрофилов (фигура 33) и тромбоцитов (фигура 34).
[000316] Данные, полученные для этих двух пациентов, подтверждают вывод о том, что пациентам провели инфузию значительного числа CD34+ клеток мобилизованной периферической крови (mPB), скорректированных по гену. Ни у одного из двух получивших лечение пациентов не наблюдали никаких серьезных побочных эффектов. Генные маркеры на уровнях приблизительно 1-5 копий/1000 клеток периферической крови выявляли у получивших лечение пациентов через 15 суток - 5 месяцев после проведения GT, при умеренном повышении с течением времени. Эти числа вирусных копий были примерно в 100 раз выше по сравнению с самым высоким значением, выявленным через 3 недели после проведения GT в предыдущих испытаниях (3 копии/105 клеток; Kelly et al. 2007).
[000317] Пример 10. Трансдукция свежих CD34+ клеток mPB от пациентов с FA-A
[000318] Короткая трансдукция терапевтическим вектором небольших аликвот образцов CD34+ клеток мобилизованной периферической крови (mPB) от пациентов, обработанных по схеме G-CSF/плериксафор, показала значения эффективности трансдукции от 17 до 45% (фигура 35). Небольшие аликвоты этих образцов трансплантировали мышам NSG, кондиционированным с помощью 1,5 Гр. Большинство из трансплантированных образцов прижились у мышей NSG (1-10% клеток ВМ являлись hCD45+/mCD45-) (фигура 36). Более того, очевидное преимущество отбора скорректированных CD34+ клеток FA-A наблюдали у мышей, получивших трансплантат (фигура 37).
[000319] Эти результаты показывают, что трансдуцированные CD34+ клетки FA-A mPB приживаются у мышей NSG, и при этом у мышей-реципиентов NSG наблюдается благоприятный эффект in vivo пролиферации скорректированных человеческих репопулирующих клеток FA-A.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> СЕНТРО ДЕ ИНВЕСТИГАСЬОНЕС ЭНЕРХЕТИКАС МЕДИОАМБЬЕНТАЛЕС И
ТЕКНОЛОХИКАС
ФУНДАСЬОН ИНСТИТУТО ДЕ ИНВЕСТИГАСЬОН САНИТАРИА ФУНДАСЬОН
ХИМЕНЕС ДИАС
СЕНТРО ДЕ ИНВЕСТИГАСЬОН БИОМЕДИКА ЭН РЕД
ФУНДАСЬОН ПАРА ЛА ИНВЕСТИГАСЬОН БИОМЕДИКА ДЕЛЬ ХОСПИТАЛЬ ИНФАНТИЛЬ
УНИВЕРСИТАРИО НИНО ХЕСУС
БУЭРЕН, Хуан А.
РИО, Паула
НАВАРРО, Сусана
СЕВИЛЬЯ, Хулиан
СЕГОВИЯ, Хосе Карлос
ГОНСАЛЕС, Африка
КАСАДО, Хосе Антонио
ГУЕНЕЧЕА, Гильермо
<120> ГЕННАЯ ТЕРАПИЯ ПАЦИЕНТОВ С АНЕМИЕЙ ФАНКОНИ
<130> ROPA-002/01WO 329592-2007
<160> 25
<170> PatentIn версия 3.5
<210> 1
<211> 234
<212> ДНК
<213> Вирус иммунодефицита человека 1 (HIV-1)
<400> 1
aggagctttg ttccttgggt tcttgggagc agcaggaagc actatgggcg cagcgtcaat 60
gacgctgacg gtacaggcca gacaattatt gtctggtata gtgcagcagc agaacaattt 120
gctgagggct attgaggcgc aacagcatct gttgcaactc acagtctggg gcatcaagca 180
gctccaggca agaatcctgg ctgtggaaag atacctaaag gatcaacagc tcct 234
<210> 2
<211> 126
<212> ДНК
<213> Вирус иммунодефицита человека 1 (HIV-1)
<400> 2
ctctctcgac gcaggactcg gcttgctgaa gcgcgcacgg caagaggcga ggggcggcga 60
ctggtgagta cgccaaaaat tttgactagc ggaggctaga aggagagaga tgggtgcgag 120
agcgtc 126
<210> 3
<211> 181
<212> ДНК
<213> Вирус иммунодефицита человека 1 (HIV-1)
<400> 3
gggtctctct ggttagacca gatctgagcc tgggagctct ctggctaact agggaaccca 60
ctgcttaagc ctcaataaag cttgccttga gtgcttcaag tagtgtgtgc ccgtctgttg 120
tgtgactctg gtaactagag atccctcaga cccttttagt cagtgtggaa aatctctagc 180
a 181
<210> 4
<211> 234
<212> ДНК
<213> Вирус иммунодефицита человека 1 (HIV-1)
<400> 4
tggaagggct aattcactcc caacgaagac aagatctgct ttttgcttgt actgggtctc 60
tctggttaga ccagatctga gcctgggagc tctctggcta actagggaac ccactgctta 120
agcctcaata aagcttgcct tgagtgcttc aagtagtgtg tgcccgtctg ttgtgtgact 180
ctggtaacta gagatccctc agaccctttt agtcagtgtg gaaaatctct agca 234
<210> 5
<211> 204
<212> ДНК
<213> Герпесвирус человека-5
<400> 5
gtgatgcggt tttggcagta catcaatggg cgtggatagc ggtttgactc acggggattt 60
ccaagtctcc accccattga cgtcaatggg agtttgtttt ggcaccaaaa tcaacgggac 120
tttccaaaat gtcgtaacaa ctccgcccca ttgacgcaaa tgggcggtag gcgtgtacgg 180
tgggaggtct atataagcag agct 204
<210> 6
<211> 118
<212> ДНК
<213> Вирус иммунодефицита человека 1 (HIV-1)
<400> 6
ttttaaaaga aaagggggga ttggggggta cagtgcaggg gaaagaatag tagacataat 60
agcaacagac atacaaacta aagaattaca aaaacaaatt acaaaaattc aaaatttt 118
<210> 7
<211> 511
<212> ДНК
<213> Homo sapiens
<400> 7
ggggttgggg ttgcgccttt tccaaggcag ccctgggttt gcgcagggac gcggctgctc 60
tgggcgtggt tccgggaaac gcagcggcgc cgaccctggg tctcgcacat tcttcacgtc 120
cgttcgcagc gtcacccgga tcttcgccgc tacccttgtg ggccccccgg cgacgcttcc 180
tgctccgccc ctaagtcggg aaggttcctt gcggttcgcg gcgtgccgga cgtgacaaac 240
ggaagccgca cgtctcacta gtaccctcgc agacggacag cgccagggag caatggcagc 300
gcgccgaccg cgatgggctg tggccaatag cggctgctca gcagggcgcg ccgagagcag 360
cggccgggaa ggggcggtgc gggaggcggg gtgtggggcg gtagtgtggg ccctgttcct 420
gcccgcgcgg tgttccgcat tctgcaagcc tccggagcgc acgtcggcag tcggctccct 480
cgttgaccga atcaccgacc tctctcccca g 511
<210> 8
<211> 4368
<212> ДНК
<213> Homo sapiens
<400> 8
atgtccgact cgtgggtccc gaactccgcc tcgggccagg acccaggggg ccgccggagg 60
gcctgggccg agctgctggc gggaagggtc aagagggaaa aatataatcc tgaaagggca 120
cagaaattaa aggaatcagc tgtgcgcctc ctgcgaagcc atcaggacct gaatgccctt 180
ttgcttgagg tagaaggtcc actgtgtaaa aaattgtctc tcagcaaagt gattgactgt 240
gacagttctg aggcctatgc taatcattct agttcattta taggctctgc tttgcaggat 300
caagcctcaa ggctgggggt tcccgtgggt attctctcag ccgggatggt tgcctctagc 360
gtgggacaga tctgcacggc tccagcggag accagtcacc ctgtgctgct gactgtggag 420
cagagaaaga agctgtcttc cctgttagag tttgctcagt atttattggc acacagtatg 480
ttctcccgtc tttccttctg tcaagaatta tggaaaatac agagttcttt gttgcttgaa 540
gcggtgtggc atcttcacgt acaaggcatt gtgagcctgc aagagctgct ggaaagccat 600
cccgacatgc atgctgtggg atcgtggctc ttcaggaatc tgtgctgcct ttgtgaacag 660
atggaagcat cctgccagca tgctgacgtc gccagggcca tgctttctga ttttgttcaa 720
atgtttgttt tgaggggatt tcagaaaaac tcagatctga gaagaactgt ggagcctgaa 780
aaaatgccgc aggtcacggt tgatgtactg cagagaatgc tgatttttgc acttgacgct 840
ttggctgctg gagtacagga ggagtcctcc actcacaaga tcgtgaggtg ctggttcgga 900
gtgttcagtg gacacacgct tggcagtgta atttccacag atcctctgaa gaggttcttc 960
agtcataccc tgactcagat actcactcac agccctgtgc tgaaagcatc tgatgctgtt 1020
cagatgcaga gagagtggag ctttgcgcgg acacaccctc tgctcacctc actgtaccgc 1080
aggctctttg tgatgctgag tgcagaggag ttggttggcc atttgcaaga agttctggaa 1140
acgcaggagg ttcactggca gagagtgctc tcctttgtgt ctgccctggt tgtctgcttt 1200
ccagaagcgc agcagctgct tgaagactgg gtggcgcgtt tgatggccca ggcattcgag 1260
agctgccagc tggacagcat ggtcactgcg ttcctggttg tgcgccaggc agcactggag 1320
ggcccctctg cgttcctgtc atatgcagac tggttcaagg cctcctttgg gagcacacga 1380
ggctaccatg gctgcagcaa gaaggccctg gtcttcctgt ttacgttctt gtcagaactc 1440
gtgccttttg agtctccccg gtacctgcag gtgcacattc tccacccacc cctggttccc 1500
agcaagtacc gctccctcct cacagactac atctcattgg ccaagacacg gctggccgac 1560
ctcaaggttt ctatagaaaa catgggactc tacgaggatt tgtcatcagc tggggacatt 1620
actgagcccc acagccaagc tcttcaggat gttgaaaagg ccatcatggt gtttgagcat 1680
acggggaaca tcccagtcac cgtcatggag gccagcatat tcaggaggcc ttactacgtg 1740
tcccacttcc tccccgccct gctcacacct cgagtgctcc ccaaagtccc tgactcccgt 1800
gtggcgttta tagagtctct gaagagagca gataaaatcc ccccatctct gtactccacc 1860
tactgccagg cctgctctgc tgctgaagag aagccagaag atgcagccct gggagtgagg 1920
gcagaaccca actctgctga ggagcccctg ggacagctca cagctgcact gggagagctg 1980
agagcctcca tgacagaccc cagccagcgt gatgttatat cggcacaggt ggcagtgatt 2040
tctgaaagac tgagggctgt cctgggccac aatgaggatg acagcagcgt tgagatatca 2100
aagattcagc tcagcatcaa cacgccgaga ctggagccac gggaacacat tgctgtggac 2160
ctcctgctga cgtctttctg tcagaacctg atggctgcct ccagtgtcgc tcccccggag 2220
aggcagggtc cctgggctgc cctcttcgtg aggaccatgt gtggacgtgt gctccctgca 2280
gtgctcaccc ggctctgcca gctgctccgt caccagggcc cgagcctgag tgccccacat 2340
gtgctggggt tggctgccct ggccgtgcac ctgggtgagt ccaggtctgc gctcccagag 2400
gtggatgtgg gtcctcctgc acctggtgct ggccttcctg tccctgcgct ctttgacagc 2460
ctcctgacct gtaggacgag ggattccttg ttcttctgcc tgaaattttg tacagcagca 2520
atttcttact ctctctgcaa gttttcttcc cagtcacgag atactttgtg cagctgctta 2580
tctccaggcc ttattaaaaa gtttcagttc ctcatgttca gattgttctc agaggcccga 2640
cagcctcttt ctgaggagga cgtagccagc ctttcctgga gacccttgca ccttccttct 2700
gcagactggc agagagctgc cctctctctc tggacacaca gaaccttccg agaggtgttg 2760
aaagaggaag atgttcactt aacttaccaa gactggttac acctggagct ggaaattcaa 2820
cctgaagctg atgctctttc agatactgaa cggcaggact tccaccagtg ggcgatccat 2880
gagcactttc tccctgagtc ctcggcttca gggggctgtg acggagacct gcaggctgcg 2940
tgtaccattc ttgtcaacgc actgatggat ttccaccaaa gctcaaggag ttatgaccac 3000
tcagaaaatt ctgatttggt ctttggtggc cgcacaggaa atgaggatat tatttccaga 3060
ttgcaggaga tggtagctga cctggagctg cagcaagacc tcatagtgcc tctcggccac 3120
accccttccc aggagcactt cctctttgag attttccgca gacggctcca ggctctgaca 3180
agcgggtgga gcgtggctgc cagccttcag agacagaggg agctgctaat gtacaaacgg 3240
atcctcctcc gcctgccttc gtctgtcctc tgcggcagca gcttccaggc agaacagccc 3300
atcactgcca gatgcgagca gttcttccac ttggtcaact ctgagatgag aaacttctgc 3360
tcccacggag gtgccctgac acaggacatc actgcccact tcttcagggg cctcctgaac 3420
gcctgtctgc ggagcagaga cccctccctg atggtcgact tcatactggc caagtgccag 3480
acgaaatgcc ccttaatttt gacctctgct ctggtgtggt ggccgagcct ggagcctgtg 3540
ctgctctgcc ggtggaggag acactgccag agcccgctgc cccgggaact gcagaagcta 3600
caagaaggcc ggcagtttgc cagcgatttc ctctcccctg aggctgcctc cccagcaccc 3660
aacccggact ggctctcagc tgctgcactg cactttgcga ttcaacaagt cagggaagaa 3720
aacatcagga agcagctaaa gaagctggac tgcgagagag aggagctatt ggttttcctt 3780
ttcttcttct ccttgatggg cctgctgtcg tcacatctga cctcaaatag caccacagac 3840
ctgccaaagg ctttccacgt ttgtgcagca atcctcgagt gtttagagaa gaggaagata 3900
tcctggctgg cactctttca gttgacagag agtgacctca ggctggggcg gctcctcctc 3960
cgtgtggccc cggatcagca caccaggctg ctgcctttcg ctttttacag tcttctctcc 4020
tacttccatg aagacgcggc catcagggaa gaggccttcc tgcatgttgc tgtggacatg 4080
tacttgaagc tggtccagct cttcgtggct ggggatacaa gcacagtttc acctccagct 4140
ggcaggagcc tggagctcaa gggtcagggc aaccccgtgg aactgataac aaaagctcgt 4200
ctttttctgc tgcagttaat acctcggtgc ccgaaaaaga gcttctcaca cgtggcagag 4260
ctgctggctg atcgtgggga ctgcgaccca gaggtgagcg ccgccctcca gagcagacag 4320
caggctgccc ctgacgctga cctgtcccag gagcctcatc tcttctga 4368
<210> 9
<211> 380
<212> ДНК
<213> Герпесвирус человека-5
<400> 9
gacattgatt attgactagt tattaatagt aatcaattac ggggtcatta gttcatagcc 60
catatatgga gttccgcgtt acataactta cggtaaatgg cccgcctggc tgaccgccca 120
acgacccccg cccattgacg tcaataatga cgtatgttcc catagtaacg ccaataggga 180
ctttccattg acgtcaatgg gtggagtatt tacggtaaac tgcccacttg gcagtacatc 240
aagtgtatca tatgccaagt acgcccccta ttgacgtcaa tgacggtaaa tggcccgcct 300
ggcattatgc ccagtacatg accttatggg actttcctac ttggcagtac atctacgtat 360
tagtcatcgc tattaccatg 380
<210> 10
<211> 122
<212> ДНК
<213> Вирус обезьян 40
<400> 10
aacttgttta ttgcagctta taatggttac aaataaagca atagcatcac aaatttcaca 60
aataaagcat ttttttcact gcattctagt tgtggtttgt ccaaactcat caatgtatct 120
ta 122
<210> 11
<211> 136
<212> ДНК
<213> Вирус обезьян 40
<400> 11
atcccgcccc taactccgcc cagttccgcc cattctccgc cccatggctg actaattttt 60
tttatttatg cagaggccga ggccgcctcg gcctctgagc tattccagaa gtagtgagga 120
ggcttttttg gaggcc 136
<210> 12
<211> 28
<212> ДНК
<213> Вирус иммунодефицита человека 1 (HIV-1)
<400> 12
tttaaaagaa aaggggggat tggggggt 28
<210> 13
<211> 83
<212> ДНК
<213> Вирус иммунодефицита человека 1 (HIV-1)
<400> 13
gaattcgagc tcggtacctt taagaccaat gacttacaag gcagctgtag atcttagcca 60
ctttttaaaa gaaaaggggg gac 83
<210> 14
<211> 795
<212> ДНК
<213> Escherichia coli
<400> 14
atgattgaac aagatggatt gcacgcaggt tctccggcgg cttgggtgga gaggctattc 60
ggctatgact gggcacaaca gacaatcggc tgctctgatg ccgccgtgtt ccggctgtca 120
gcgcaggggc gtccggttct ttttgtcaag accgacctgt ccggtgccct gaatgaactg 180
caagacgagg cagcgcggct atcgtggctg gcgacgacgg gcgttccttg cgcggctgtg 240
ctcgacgttg tcactgaagc gggaagggac tggctgctat tgggcgaagt gccggggcag 300
gatctcctgt catctcacct tgctcctgcc gagaaagtat ccatcatggc tgatgcaatg 360
cggcggctgc atacgcttga tccggctacc tgcccattcg accaccaagc gaaacatcgc 420
atcgagcgag cacgtactcg gatggaagcc ggtcttgtcg atcaggatga tctggacgaa 480
gagcatcagg ggctcgcgcc agccgaactg ttcgccaggc tcaaggcgtc tatgcccgac 540
ggcgaggatc tcgtcgtgac ccacggcgat gcctgcttgc cgaatatcat ggtggaaaat 600
ggccgctttt ctggattcat cgactgtggc cgtctgggtg tggcggaccg ctatcaggac 660
atagcgttgg ctacccgtga tattgctgaa gagcttggcg gcgaatgggc tgaccgcttc 720
cttgtgcttt acggtatcgc cgcgcccgat tcgcagcgca tcgccttcta tcgccttctt 780
gacgagttct tctga 795
<210> 15
<211> 137
<212> ДНК
<213> Escherichia coli
<400> 15
gcattggcgc agaaaaaaat gcctgatgcg acgctgcgcg tcttatactc ccacatatgc 60
cagattcagc aacggatacg gcttccccaa cttgcccact tccatacgtg tcctccttac 120
cagaaattta tccttaa 137
<210> 16
<211> 589
<212> ДНК
<213> неизвестно
<220>
<223> ColE1/pMB1/pBR322/pUC origin of replication plasmid sequence
<400> 16
ttgagatcct ttttttctgc gcgtaatctg ctgcttgcaa acaaaaaaac caccgctacc 60
agcggtggtt tgtttgccgg atcaagagct accaactctt tttccgaagg taactggctt 120
cagcagagcg cagataccaa atactgttct tctagtgtag ccgtagttag gccaccactt 180
caagaactct gtagcaccgc ctacatacct cgctctgcta atcctgttac cagtggctgc 240
tgccagtggc gataagtcgt gtcttaccgg gttggactca agacgatagt taccggataa 300
ggcgcagcgg tcgggctgaa cggggggttc gtgcacacag cccagcttgg agcgaacgac 360
ctacaccgaa ctgagatacc tacagcgtga gctatgagaa agcgccacgc ttcccgaagg 420
gagaaaggcg gacaggtatc cggtaagcgg cagggtcgga acaggagagc gcacgaggga 480
gcttccaggg ggaaacgcct ggtatcttta tagtcctgtc gggtttcgcc acctctgact 540
tgagcgtcga tttttgtgat gctcgtcagg ggggcggagc ctatggaaa 589
<210> 17
<211> 22
<212> ДНК
<213> Escherichia coli
<400> 17
taatgtgagt tagctcactc at 22
<210> 18
<211> 31
<212> ДНК
<213> Escherichia coli
<400> 18
tttacacttt atgcttccgg ctcgtatgtt g 31
<210> 19
<211> 17
<212> ДНК
<213> Escherichia coli
<400> 19
ttgtgagcgg ataacaa 17
<210> 20
<211> 19
<212> ДНК
<213> Бактериофаг T3
<400> 20
aattaaccct cactaaagg 19
<210> 21
<211> 19
<212> ДНК
<213> Бактериофаг T7
<400> 21
cctatagtga gtcgtatta 19
<210> 22
<211> 428
<212> ДНК
<213> Бактериофаг F1
<400> 22
acgcgccctg tagcggcgca ttaagcgcgg cgggtgtggt ggttacgcgc agcgtgaccg 60
ctacacttgc cagcgcccta gcgcccgctc ctttcgcttt cttcccttcc tttctcgcca 120
cgttcgccgg ctttccccgt caagctctaa atcgggggct ccctttaggg ttccgattta 180
gtgctttacg gcacctcgac cccaaaaaac ttgattaggg tgatggttca cgtagtgggc 240
catcgccctg atagacggtt tttcgccctt tgacgttgga gtccacgttc tttaatagtg 300
gactcttgtt ccaaactgga acaacactca accctatctc ggtctattct tttgatttat 360
aagggatttt gccgatttcg gcctattggt taaaaaatga gctgatttaa caaaaattta 420
acgcgaat 428
<210> 23
<211> 677
<212> ДНК
<213> Вирус гепатита сурков
<400> 23
cgagcatctt accgccattt attcccatat ttgttctgtt tttcttgatt tgggtataca 60
tttaaatgtt aataaaacaa aatggtgggg caatcattta catttttagg gatatgtaat 120
tactagttca ggtgtattgc cacaagacaa acatgttaag aaactttccc gttatttacg 180
ctctgttcct gttaatcaac ctctggatta caaaatttgt gaaagattga ctgatattct 240
taactatgtt gctcctttta cgctgtgtgg atatgctgct ttaatgcctc tgtatcatgc 300
tattgcttcc cgtacggctt tcgttttctc ctccttgtat aaatcctggt tgctgtctct 360
ttatgaggag ttgtggcccg ttgtccgtca acgtggcgtg gtgtgctctg tgtttgctga 420
cgcaaccccc actggctggg gcattgccac cacctgtcaa ctcctttctg ggactttcgc 480
tttccccctc ccgatcgcca cggcagaact catcgccgcc tgccttgccc gctgctggac 540
aggggctagg ttgctgggca ctgataattc cgtggtgttg tcggggaagg gcctgctgcc 600
ggctctgcgg cctcttccgc gtcttcgcct tcgccctcag acgagtcgga tctccctttg 660
ggccgcctcc ccgcctg 677
<210> 24
<211> 11433
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Созданная в лаборатории кассета переноса pCCL-SIN-cPPT/CTS -hPGK-hFANCA-WPRE
<400> 24
catgaccaaa atcccttaac gtgagttttc gttccactga gcgtcagacc ccgtagaaaa 60
gatcaaagga tcttcttgag atcctttttt tctgcgcgta atctgctgct tgcaaacaaa 120
aaaaccaccg ctaccagcgg tggtttgttt gccggatcaa gagctaccaa ctctttttcc 180
gaaggtaact ggcttcagca gagcgcagat accaaatact gttcttctag tgtagccgta 240
gttaggccac cacttcaaga actctgtagc accgcctaca tacctcgctc tgctaatcct 300
gttaccagtg gctgctgcca gtggcgataa gtcgtgtctt accgggttgg actcaagacg 360
atagttaccg gataaggcgc agcggtcggg ctgaacgggg ggttcgtgca cacagcccag 420
cttggagcga acgacctaca ccgaactgag atacctacag cgtgagctat gagaaagcgc 480
cacgcttccc gaagggagaa aggcggacag gtatccggta agcggcaggg tcggaacagg 540
agagcgcacg agggagcttc cagggggaaa cgcctggtat ctttatagtc ctgtcgggtt 600
tcgccacctc tgacttgagc gtcgattttt gtgatgctcg tcaggggggc ggagcctatg 660
gaaaaacgcc agcaacgcgg cctttttacg gttcctggcc ttttgctggc cttttgctca 720
catgttcttt cctgcgttat cccctgattc tgtggataac cgtattaccg cctttgagtg 780
agctgatacc gctcgccgca gccgaacgac cgagcgcagc gagtcagtga gcgaggaagc 840
ggaagagcgc ccaatacgca aaccgcctct ccccgcgcgt tggccgattc attaatgcag 900
ctggcacgac aggtttcccg actggaaagc gggcagtgag cgcaacgcaa ttaatgtgag 960
ttagctcact cattaggcac cccaggcttt acactttatg cttccggctc gtatgttgtg 1020
tggaattgtg agcggataac aatttcacac aggaaacagc tatgaccatg attacgccaa 1080
gcgcgcaatt aaccctcact aaagggaaca aaagctggag ctgcaagctt ggccattgca 1140
tacgttgtat ccatatcata atatgtacat ttatattggc tcatgtccaa cattaccgcc 1200
atgttgacat tgattattga ctagttatta atagtaatca attacggggt cattagttca 1260
tagcccatat atggagttcc gcgttacata acttacggta aatggcccgc ctggctgacc 1320
gcccaacgac ccccgcccat tgacgtcaat aatgacgtat gttcccatag taacgccaat 1380
agggactttc cattgacgtc aatgggtgga gtatttacgg taaactgccc acttggcagt 1440
acatcaagtg tatcatatgc caagtacgcc ccctattgac gtcaatgacg gtaaatggcc 1500
cgcctggcat tatgcccagt acatgacctt atgggacttt cctacttggc agtacatcta 1560
cgtattagtc atcgctatta ccatggtgat gcggttttgg cagtacatca atgggcgtgg 1620
atagcggttt gactcacggg gatttccaag tctccacccc attgacgtca atgggagttt 1680
gttttggcac caaaatcaac gggactttcc aaaatgtcgt aacaactccg ccccattgac 1740
gcaaatgggc ggtaggcgtg tacggtggga ggtctatata agcagagctc gtttagtgaa 1800
ccggggtctc tctggttaga ccagatctga gcctgggagc tctctggcta actagggaac 1860
ccactgctta agcctcaata aagcttgcct tgagtgcttc aagtagtgtg tgcccgtctg 1920
ttgtgtgact ctggtaacta gagatccctc agaccctttt agtcagtgtg gaaaatctct 1980
agcagtggcg cccgaacagg gacttgaaag cgaaagggaa accagaggag ctctctcgac 2040
gcaggactcg gcttgctgaa gcgcgcacgg caagaggcga ggggcggcga ctggtgagta 2100
cgccaaaaat tttgactagc ggaggctaga aggagagaga tgggtgcgag agcgtcagta 2160
ttaagcgggg gagaattaga tcgcgatggg aaaaaattcg gttaaggcca gggggaaaga 2220
aaaaatataa attaaaacat atagtatggg caagcaggga gctagaacga ttcgcagtta 2280
atcctggcct gttagaaaca tcagaaggct gtagacaaat actgggacag ctacaaccat 2340
cccttcagac aggatcagaa gaacttagat cattatataa tacagtagca accctctatt 2400
gtgtgcatca aaggatagag ataaaagaca ccaaggaagc tttagacaag atagaggaag 2460
agcaaaacaa aagtaagacc accgcacagc aagcggccgc tgatcttcag acctggagga 2520
ggagatatga gggacaattg gagaagtgaa ttatataaat ataaagtagt aaaaattgaa 2580
ccattaggag tagcacccac caaggcaaag agaagagtgg tgcagagaga aaaaagagca 2640
gtgggaatag gagctttgtt ccttgggttc ttgggagcag caggaagcac tatgggcgca 2700
gcgtcaatga cgctgacggt acaggccaga caattattgt ctggtatagt gcagcagcag 2760
aacaatttgc tgagggctat tgaggcgcaa cagcatctgt tgcaactcac agtctggggc 2820
atcaagcagc tccaggcaag aatcctggct gtggaaagat acctaaagga tcaacagctc 2880
ctggggattt ggggttgctc tggaaaactc atttgcacca ctgctgtgcc ttggaatgct 2940
agttggagta ataaatctct ggaacagatt tggaatcaca cgacctggat ggagtgggac 3000
agagaaatta acaattacac aagcttaata cactccttaa ttgaagaatc gcaaaaccag 3060
caagaaaaga atgaacaaga attattggaa ttagataaat gggcaagttt gtggaattgg 3120
tttaacataa caaattggct gtggtatata aaattattca taatgatagt aggaggcttg 3180
gtaggtttaa gaatagtttt tgctgtactt tctatagtga atagagttag gcagggatat 3240
tcaccattat cgtttcagac ccacctccca accccgaggg gacccgacag gcccgaagga 3300
atagaagaag aaggtggaga gagagacaga gacagatcca ttcgattagt gaacggatct 3360
cgacggtatc ggttaacttt taaaagaaaa ggggggattg gggggtacag tgcaggggaa 3420
agaatagtag acataatagc aacagacata caaactaaag aattacaaaa acaaattaca 3480
aaaattcaaa attttatcga tcacgagact agcctcgaga agcttgatat cgaattccac 3540
ggggttgggg ttgcgccttt tccaaggcag ccctgggttt gcgcagggac gcggctgctc 3600
tgggcgtggt tccgggaaac gcagcggcgc cgaccctggg tctcgcacat tcttcacgtc 3660
cgttcgcagc gtcacccgga tcttcgccgc tacccttgtg ggccccccgg cgacgcttcc 3720
tgctccgccc ctaagtcggg aaggttcctt gcggttcgcg gcgtgccgga cgtgacaaac 3780
ggaagccgca cgtctcacta gtaccctcgc agacggacag cgccagggag caatggcagc 3840
gcgccgaccg cgatgggctg tggccaatag cggctgctca gcagggcgcg ccgagagcag 3900
cggccgggaa ggggcggtgc gggaggcggg gtgtggggcg gtagtgtggg ccctgttcct 3960
gcccgcgcgg tgttccgcat tctgcaagcc tccggagcgc acgtcggcag tcggctccct 4020
cgttgaccga atcaccgacc tctctcccca gggggatccc ccgggctgca ggaattcatg 4080
tccgactcgt gggtcccgaa ctccgcctcg ggccaggacc cagggggccg ccggagggcc 4140
tgggccgagc tgctggcggg aagggtcaag agggaaaaat ataatcctga aagggcacag 4200
aaattaaagg aatcagctgt gcgcctcctg cgaagccatc aggacctgaa tgcccttttg 4260
cttgaggtag aaggtccact gtgtaaaaaa ttgtctctca gcaaagtgat tgactgtgac 4320
agttctgagg cctatgctaa tcattctagt tcatttatag gctctgcttt gcaggatcaa 4380
gcctcaaggc tgggggttcc cgtgggtatt ctctcagccg ggatggttgc ctctagcgtg 4440
ggacagatct gcacggctcc agcggagacc agtcaccctg tgctgctgac tgtggagcag 4500
agaaagaagc tgtcttccct gttagagttt gctcagtatt tattggcaca cagtatgttc 4560
tcccgtcttt ccttctgtca agaattatgg aaaatacaga gttctttgtt gcttgaagcg 4620
gtgtggcatc ttcacgtaca aggcattgtg agcctgcaag agctgctgga aagccatccc 4680
gacatgcatg ctgtgggatc gtggctcttc aggaatctgt gctgcctttg tgaacagatg 4740
gaagcatcct gccagcatgc tgacgtcgcc agggccatgc tttctgattt tgttcaaatg 4800
tttgttttga ggggatttca gaaaaactca gatctgagaa gaactgtgga gcctgaaaaa 4860
atgccgcagg tcacggttga tgtactgcag agaatgctga tttttgcact tgacgctttg 4920
gctgctggag tacaggagga gtcctccact cacaagatcg tgaggtgctg gttcggagtg 4980
ttcagtggac acacgcttgg cagtgtaatt tccacagatc ctctgaagag gttcttcagt 5040
cataccctga ctcagatact cactcacagc cctgtgctga aagcatctga tgctgttcag 5100
atgcagagag agtggagctt tgcgcggaca caccctctgc tcacctcact gtaccgcagg 5160
ctctttgtga tgctgagtgc agaggagttg gttggccatt tgcaagaagt tctggaaacg 5220
caggaggttc actggcagag agtgctctcc tttgtgtctg ccctggttgt ctgctttcca 5280
gaagcgcagc agctgcttga agactgggtg gcgcgtttga tggcccaggc attcgagagc 5340
tgccagctgg acagcatggt cactgcgttc ctggttgtgc gccaggcagc actggagggc 5400
ccctctgcgt tcctgtcata tgcagactgg ttcaaggcct cctttgggag cacacgaggc 5460
taccatggct gcagcaagaa ggccctggtc ttcctgttta cgttcttgtc agaactcgtg 5520
ccttttgagt ctccccggta cctgcaggtg cacattctcc acccacccct ggttcccagc 5580
aagtaccgct ccctcctcac agactacatc tcattggcca agacacggct ggccgacctc 5640
aaggtttcta tagaaaacat gggactctac gaggatttgt catcagctgg ggacattact 5700
gagccccaca gccaagctct tcaggatgtt gaaaaggcca tcatggtgtt tgagcatacg 5760
gggaacatcc cagtcaccgt catggaggcc agcatattca ggaggcctta ctacgtgtcc 5820
cacttcctcc ccgccctgct cacacctcga gtgctcccca aagtccctga ctcccgtgtg 5880
gcgtttatag agtctctgaa gagagcagat aaaatccccc catctctgta ctccacctac 5940
tgccaggcct gctctgctgc tgaagagaag ccagaagatg cagccctggg agtgagggca 6000
gaacccaact ctgctgagga gcccctggga cagctcacag ctgcactggg agagctgaga 6060
gcctccatga cagaccccag ccagcgtgat gttatatcgg cacaggtggc agtgatttct 6120
gaaagactga gggctgtcct gggccacaat gaggatgaca gcagcgttga gatatcaaag 6180
attcagctca gcatcaacac gccgagactg gagccacggg aacacattgc tgtggacctc 6240
ctgctgacgt ctttctgtca gaacctgatg gctgcctcca gtgtcgctcc cccggagagg 6300
cagggtccct gggctgccct cttcgtgagg accatgtgtg gacgtgtgct ccctgcagtg 6360
ctcacccggc tctgccagct gctccgtcac cagggcccga gcctgagtgc cccacatgtg 6420
ctggggttgg ctgccctggc cgtgcacctg ggtgagtcca ggtctgcgct cccagaggtg 6480
gatgtgggtc ctcctgcacc tggtgctggc cttcctgtcc ctgcgctctt tgacagcctc 6540
ctgacctgta ggacgaggga ttccttgttc ttctgcctga aattttgtac agcagcaatt 6600
tcttactctc tctgcaagtt ttcttcccag tcacgagata ctttgtgcag ctgcttatct 6660
ccaggcctta ttaaaaagtt tcagttcctc atgttcagat tgttctcaga ggcccgacag 6720
cctctttctg aggaggacgt agccagcctt tcctggagac ccttgcacct tccttctgca 6780
gactggcaga gagctgccct ctctctctgg acacacagaa ccttccgaga ggtgttgaaa 6840
gaggaagatg ttcacttaac ttaccaagac tggttacacc tggagctgga aattcaacct 6900
gaagctgatg ctctttcaga tactgaacgg caggacttcc accagtgggc gatccatgag 6960
cactttctcc ctgagtcctc ggcttcaggg ggctgtgacg gagacctgca ggctgcgtgt 7020
accattcttg tcaacgcact gatggatttc caccaaagct caaggagtta tgaccactca 7080
gaaaattctg atttggtctt tggtggccgc acaggaaatg aggatattat ttccagattg 7140
caggagatgg tagctgacct ggagctgcag caagacctca tagtgcctct cggccacacc 7200
ccttcccagg agcacttcct ctttgagatt ttccgcagac ggctccaggc tctgacaagc 7260
gggtggagcg tggctgccag ccttcagaga cagagggagc tgctaatgta caaacggatc 7320
ctcctccgcc tgccttcgtc tgtcctctgc ggcagcagct tccaggcaga acagcccatc 7380
actgccagat gcgagcagtt cttccacttg gtcaactctg agatgagaaa cttctgctcc 7440
cacggaggtg ccctgacaca ggacatcact gcccacttct tcaggggcct cctgaacgcc 7500
tgtctgcgga gcagagaccc ctccctgatg gtcgacttca tactggccaa gtgccagacg 7560
aaatgcccct taattttgac ctctgctctg gtgtggtggc cgagcctgga gcctgtgctg 7620
ctctgccggt ggaggagaca ctgccagagc ccgctgcccc gggaactgca gaagctacaa 7680
gaaggccggc agtttgccag cgatttcctc tcccctgagg ctgcctcccc agcacccaac 7740
ccggactggc tctcagctgc tgcactgcac tttgcgattc aacaagtcag ggaagaaaac 7800
atcaggaagc agctaaagaa gctggactgc gagagagagg agctattggt tttccttttc 7860
ttcttctcct tgatgggcct gctgtcgtca catctgacct caaatagcac cacagacctg 7920
ccaaaggctt tccacgtttg tgcagcaatc ctcgagtgtt tagagaagag gaagatatcc 7980
tggctggcac tctttcagtt gacagagagt gacctcaggc tggggcggct cctcctccgt 8040
gtggccccgg atcagcacac caggctgctg cctttcgctt tttacagtct tctctcctac 8100
ttccatgaag acgcggccat cagggaagag gccttcctgc atgttgctgt ggacatgtac 8160
ttgaagctgg tccagctctt cgtggctggg gatacaagca cagtttcacc tccagctggc 8220
aggagcctgg agctcaaggg tcagggcaac cccgtggaac tgataacaaa agctcgtctt 8280
tttctgctgc agttaatacc tcggtgcccg aaaaagagct tctcacacgt ggcagagctg 8340
ctggctgatc gtggggactg cgacccagag gtgagcgccg ccctccagag cagacagcag 8400
gctgcccctg acgctgacct gtcccaggag cctcatctct tctgatgaga attcgatatc 8460
aagcttatcg ataccgtcga atcccccggg ctgcaggaat tcgagcatct taccgccatt 8520
tattcccata tttgttctgt ttttcttgat ttgggtatac atttaaatgt taataaaaca 8580
aaatggtggg gcaatcattt acatttttag ggatatgtaa ttactagttc aggtgtattg 8640
ccacaagaca aacatgttaa gaaactttcc cgttatttac gctctgttcc tgttaatcaa 8700
cctctggatt acaaaatttg tgaaagattg actgatattc ttaactatgt tgctcctttt 8760
acgctgtgtg gatatgctgc tttaatgcct ctgtatcatg ctattgcttc ccgtacggct 8820
ttcgttttct cctccttgta taaatcctgg ttgctgtctc tttatgagga gttgtggccc 8880
gttgtccgtc aacgtggcgt ggtgtgctct gtgtttgctg acgcaacccc cactggctgg 8940
ggcattgcca ccacctgtca actcctttct gggactttcg ctttccccct cccgatcgcc 9000
acggcagaac tcatcgccgc ctgccttgcc cgctgctgga caggggctag gttgctgggc 9060
actgataatt ccgtggtgtt gtcggggaag ggcctgctgc cggctctgcg gcctcttccg 9120
cgtcttcgcc ttcgccctca gacgagtcgg atctcccttt gggccgcctc cccgcctgga 9180
attcgagctc ggtaccttta agaccaatga cttacaaggc agctgtagat cttagccact 9240
ttttaaaaga aaagggggga ctggaagggc taattcactc ccaacgaaga caagatctgc 9300
tttttgcttg tactgggtct ctctggttag accagatctg agcctgggag ctctctggct 9360
aactagggaa cccactgctt aagcctcaat aaagcttgcc ttgagtgctt caagtagtgt 9420
gtgcccgtct gttgtgtgac tctggtaact agagatccct cagacccttt tagtcagtgt 9480
ggaaaatctc tagcagtagt agttcatgtc atcttattat tcagtattta taacttgcaa 9540
agaaatgaat atcagagagt gagaggaact tgtttattgc agcttataat ggttacaaat 9600
aaagcaatag catcacaaat ttcacaaata aagcattttt ttcactgcat tctagttgtg 9660
gtttgtccaa actcatcaat gtatcttatc atgtctggct ctagctatcc cgcccctaac 9720
tccgcccatc ccgcccctaa ctccgcccag ttccgcccat tctccgcccc atggctgact 9780
aatttttttt atttatgcag aggccgaggc cgcctcggcc tctgagctat tccagaagta 9840
gtgaggaggc ttttttggag gcctagggac gtacccaatt cgccctatag tgagtcgtat 9900
tacgcgcgct cactggccgt cgttttacaa cgtcgtgact gggaaaaccc tggcgttacc 9960
caacttaatc gccttgcagc acatccccct ttcgccagct ggcgtaatag cgaagaggcc 10020
cgcaccgatc gcccttccca acagttgcgc agcctgaatg gcgaatggga cgcgccctgt 10080
agcggcgcat taagcgcggc gggtgtggtg gttacgcgca gcgtgaccgc tacacttgcc 10140
agcgccctag cgcccgctcc tttcgctttc ttcccttcct ttctcgccac gttcgccggc 10200
tttccccgtc aagctctaaa tcgggggctc cctttagggt tccgatttag tgctttacgg 10260
cacctcgacc ccaaaaaact tgattagggt gatggttcac gtagtgggcc atcgccctga 10320
tagacggttt ttcgcccttt gacgttggag tccacgttct ttaatagtgg actcttgttc 10380
caaactggaa caacactcaa ccctatctcg gtctattctt ttgatttata agggattttg 10440
ccgatttcgg cctattggtt aaaaaatgag ctgatttaac aaaaatttaa cgcgaatttt 10500
aacaaaatat taacgcttac aatttaggtg gcacttttcg gggaaatgtg cgcggaaccc 10560
ctatttgttt atttttctaa atacattcaa atatgtatcc gctcatgaga caataaccct 10620
gataaatgct tcaataatag cacctagatc aagagacagg atgaggatcg tttcgcatga 10680
ttgaacaaga tggattgcac gcaggttctc cggccgcttg ggtggagagg ctattcggct 10740
atgactgggc acaacagaca atcggctgct ctgatgccgc cgtgttccgg ctgtcagcgc 10800
aggggcgccc ggttcttttt gtcaagaccg acctgtccgg tgccctgaat gaactgcaag 10860
acgaggcagc gcggctatcg tggctggcca cgacgggcgt tccttgcgca gctgtgctcg 10920
acgttgtcac tgaagcggga agggactggc tgctattggg cgaagtgccg gggcaggatc 10980
tcctgtcatc tcaccttgct cctgccgaga aagtatccat catggctgat gcaatgcggc 11040
ggctgcatac gcttgatccg gctacctgcc cattcgacca ccaagcgaaa catcgcatcg 11100
agcgagcacg tactcggatg gaagccggtc ttgtcgatca ggatgatctg gacgaagagc 11160
atcaggggct cgcgccagcc gaactgttcg ccaggctcaa ggcgagcatg cccgacggcg 11220
aggatctcgt cgtgacccat ggcgatgcct gcttgccgaa tatcatggtg gaaaatggcc 11280
gcttttctgg attcatcgac tgtggccggc tgggtgtggc ggaccgctat caggacatag 11340
cgttggctac ccgtgatatt gctgaagagc ttggcggcga atgggctgac cgcttcctcg 11400
tgctttacgg tatcgccgct cccgattcgc agc 11433
<210> 25
<211> 1455
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Met Ser Asp Ser Trp Val Pro Asn Ser Ala Ser Gly Gln Asp Pro Gly
1 5 10 15
Gly Arg Arg Arg Ala Trp Ala Glu Leu Leu Ala Gly Arg Val Lys Arg
20 25 30
Glu Lys Tyr Asn Pro Glu Arg Ala Gln Lys Leu Lys Glu Ser Ala Val
35 40 45
Arg Leu Leu Arg Ser His Gln Asp Leu Asn Ala Leu Leu Leu Glu Val
50 55 60
Glu Gly Pro Leu Cys Lys Lys Leu Ser Leu Ser Lys Val Ile Asp Cys
65 70 75 80
Asp Ser Ser Glu Ala Tyr Ala Asn His Ser Ser Ser Phe Ile Gly Ser
85 90 95
Ala Leu Gln Asp Gln Ala Ser Arg Leu Gly Val Pro Val Gly Ile Leu
100 105 110
Ser Ala Gly Met Val Ala Ser Ser Val Gly Gln Ile Cys Thr Ala Pro
115 120 125
Ala Glu Thr Ser His Pro Val Leu Leu Thr Val Glu Gln Arg Lys Lys
130 135 140
Leu Ser Ser Leu Leu Glu Phe Ala Gln Tyr Leu Leu Ala His Ser Met
145 150 155 160
Phe Ser Arg Leu Ser Phe Cys Gln Glu Leu Trp Lys Ile Gln Ser Ser
165 170 175
Leu Leu Leu Glu Ala Val Trp His Leu His Val Gln Gly Ile Val Ser
180 185 190
Leu Gln Glu Leu Leu Glu Ser His Pro Asp Met His Ala Val Gly Ser
195 200 205
Trp Leu Phe Arg Asn Leu Cys Cys Leu Cys Glu Gln Met Glu Ala Ser
210 215 220
Cys Gln His Ala Asp Val Ala Arg Ala Met Leu Ser Asp Phe Val Gln
225 230 235 240
Met Phe Val Leu Arg Gly Phe Gln Lys Asn Ser Asp Leu Arg Arg Thr
245 250 255
Val Glu Pro Glu Lys Met Pro Gln Val Thr Val Asp Val Leu Gln Arg
260 265 270
Met Leu Ile Phe Ala Leu Asp Ala Leu Ala Ala Gly Val Gln Glu Glu
275 280 285
Ser Ser Thr His Lys Ile Val Arg Cys Trp Phe Gly Val Phe Ser Gly
290 295 300
His Thr Leu Gly Ser Val Ile Ser Thr Asp Pro Leu Lys Arg Phe Phe
305 310 315 320
Ser His Thr Leu Thr Gln Ile Leu Thr His Ser Pro Val Leu Lys Ala
325 330 335
Ser Asp Ala Val Gln Met Gln Arg Glu Trp Ser Phe Ala Arg Thr His
340 345 350
Pro Leu Leu Thr Ser Leu Tyr Arg Arg Leu Phe Val Met Leu Ser Ala
355 360 365
Glu Glu Leu Val Gly His Leu Gln Glu Val Leu Glu Thr Gln Glu Val
370 375 380
His Trp Gln Arg Val Leu Ser Phe Val Ser Ala Leu Val Val Cys Phe
385 390 395 400
Pro Glu Ala Gln Gln Leu Leu Glu Asp Trp Val Ala Arg Leu Met Ala
405 410 415
Gln Ala Phe Glu Ser Cys Gln Leu Asp Ser Met Val Thr Ala Phe Leu
420 425 430
Val Val Arg Gln Ala Ala Leu Glu Gly Pro Ser Ala Phe Leu Ser Tyr
435 440 445
Ala Asp Trp Phe Lys Ala Ser Phe Gly Ser Thr Arg Gly Tyr His Gly
450 455 460
Cys Ser Lys Lys Ala Leu Val Phe Leu Phe Thr Phe Leu Ser Glu Leu
465 470 475 480
Val Pro Phe Glu Ser Pro Arg Tyr Leu Gln Val His Ile Leu His Pro
485 490 495
Pro Leu Val Pro Ser Lys Tyr Arg Ser Leu Leu Thr Asp Tyr Ile Ser
500 505 510
Leu Ala Lys Thr Arg Leu Ala Asp Leu Lys Val Ser Ile Glu Asn Met
515 520 525
Gly Leu Tyr Glu Asp Leu Ser Ser Ala Gly Asp Ile Thr Glu Pro His
530 535 540
Ser Gln Ala Leu Gln Asp Val Glu Lys Ala Ile Met Val Phe Glu His
545 550 555 560
Thr Gly Asn Ile Pro Val Thr Val Met Glu Ala Ser Ile Phe Arg Arg
565 570 575
Pro Tyr Tyr Val Ser His Phe Leu Pro Ala Leu Leu Thr Pro Arg Val
580 585 590
Leu Pro Lys Val Pro Asp Ser Arg Val Ala Phe Ile Glu Ser Leu Lys
595 600 605
Arg Ala Asp Lys Ile Pro Pro Ser Leu Tyr Ser Thr Tyr Cys Gln Ala
610 615 620
Cys Ser Ala Ala Glu Glu Lys Pro Glu Asp Ala Ala Leu Gly Val Arg
625 630 635 640
Ala Glu Pro Asn Ser Ala Glu Glu Pro Leu Gly Gln Leu Thr Ala Ala
645 650 655
Leu Gly Glu Leu Arg Ala Ser Met Thr Asp Pro Ser Gln Arg Asp Val
660 665 670
Ile Ser Ala Gln Val Ala Val Ile Ser Glu Arg Leu Arg Ala Val Leu
675 680 685
Gly His Asn Glu Asp Asp Ser Ser Val Glu Ile Ser Lys Ile Gln Leu
690 695 700
Ser Ile Asn Thr Pro Arg Leu Glu Pro Arg Glu His Ile Ala Val Asp
705 710 715 720
Leu Leu Leu Thr Ser Phe Cys Gln Asn Leu Met Ala Ala Ser Ser Val
725 730 735
Ala Pro Pro Glu Arg Gln Gly Pro Trp Ala Ala Leu Phe Val Arg Thr
740 745 750
Met Cys Gly Arg Val Leu Pro Ala Val Leu Thr Arg Leu Cys Gln Leu
755 760 765
Leu Arg His Gln Gly Pro Ser Leu Ser Ala Pro His Val Leu Gly Leu
770 775 780
Ala Ala Leu Ala Val His Leu Gly Glu Ser Arg Ser Ala Leu Pro Glu
785 790 795 800
Val Asp Val Gly Pro Pro Ala Pro Gly Ala Gly Leu Pro Val Pro Ala
805 810 815
Leu Phe Asp Ser Leu Leu Thr Cys Arg Thr Arg Asp Ser Leu Phe Phe
820 825 830
Cys Leu Lys Phe Cys Thr Ala Ala Ile Ser Tyr Ser Leu Cys Lys Phe
835 840 845
Ser Ser Gln Ser Arg Asp Thr Leu Cys Ser Cys Leu Ser Pro Gly Leu
850 855 860
Ile Lys Lys Phe Gln Phe Leu Met Phe Arg Leu Phe Ser Glu Ala Arg
865 870 875 880
Gln Pro Leu Ser Glu Glu Asp Val Ala Ser Leu Ser Trp Arg Pro Leu
885 890 895
His Leu Pro Ser Ala Asp Trp Gln Arg Ala Ala Leu Ser Leu Trp Thr
900 905 910
His Arg Thr Phe Arg Glu Val Leu Lys Glu Glu Asp Val His Leu Thr
915 920 925
Tyr Gln Asp Trp Leu His Leu Glu Leu Glu Ile Gln Pro Glu Ala Asp
930 935 940
Ala Leu Ser Asp Thr Glu Arg Gln Asp Phe His Gln Trp Ala Ile His
945 950 955 960
Glu His Phe Leu Pro Glu Ser Ser Ala Ser Gly Gly Cys Asp Gly Asp
965 970 975
Leu Gln Ala Ala Cys Thr Ile Leu Val Asn Ala Leu Met Asp Phe His
980 985 990
Gln Ser Ser Arg Ser Tyr Asp His Ser Glu Asn Ser Asp Leu Val Phe
995 1000 1005
Gly Gly Arg Thr Gly Asn Glu Asp Ile Ile Ser Arg Leu Gln Glu
1010 1015 1020
Met Val Ala Asp Leu Glu Leu Gln Gln Asp Leu Ile Val Pro Leu
1025 1030 1035
Gly His Thr Pro Ser Gln Glu His Phe Leu Phe Glu Ile Phe Arg
1040 1045 1050
Arg Arg Leu Gln Ala Leu Thr Ser Gly Trp Ser Val Ala Ala Ser
1055 1060 1065
Leu Gln Arg Gln Arg Glu Leu Leu Met Tyr Lys Arg Ile Leu Leu
1070 1075 1080
Arg Leu Pro Ser Ser Val Leu Cys Gly Ser Ser Phe Gln Ala Glu
1085 1090 1095
Gln Pro Ile Thr Ala Arg Cys Glu Gln Phe Phe His Leu Val Asn
1100 1105 1110
Ser Glu Met Arg Asn Phe Cys Ser His Gly Gly Ala Leu Thr Gln
1115 1120 1125
Asp Ile Thr Ala His Phe Phe Arg Gly Leu Leu Asn Ala Cys Leu
1130 1135 1140
Arg Ser Arg Asp Pro Ser Leu Met Val Asp Phe Ile Leu Ala Lys
1145 1150 1155
Cys Gln Thr Lys Cys Pro Leu Ile Leu Thr Ser Ala Leu Val Trp
1160 1165 1170
Trp Pro Ser Leu Glu Pro Val Leu Leu Cys Arg Trp Arg Arg His
1175 1180 1185
Cys Gln Ser Pro Leu Pro Arg Glu Leu Gln Lys Leu Gln Glu Gly
1190 1195 1200
Arg Gln Phe Ala Ser Asp Phe Leu Ser Pro Glu Ala Ala Ser Pro
1205 1210 1215
Ala Pro Asn Pro Asp Trp Leu Ser Ala Ala Ala Leu His Phe Ala
1220 1225 1230
Ile Gln Gln Val Arg Glu Glu Asn Ile Arg Lys Gln Leu Lys Lys
1235 1240 1245
Leu Asp Cys Glu Arg Glu Glu Leu Leu Val Phe Leu Phe Phe Phe
1250 1255 1260
Ser Leu Met Gly Leu Leu Ser Ser His Leu Thr Ser Asn Ser Thr
1265 1270 1275
Thr Asp Leu Pro Lys Ala Phe His Val Cys Ala Ala Ile Leu Glu
1280 1285 1290
Cys Leu Glu Lys Arg Lys Ile Ser Trp Leu Ala Leu Phe Gln Leu
1295 1300 1305
Thr Glu Ser Asp Leu Arg Leu Gly Arg Leu Leu Leu Arg Val Ala
1310 1315 1320
Pro Asp Gln His Thr Arg Leu Leu Pro Phe Ala Phe Tyr Ser Leu
1325 1330 1335
Leu Ser Tyr Phe His Glu Asp Ala Ala Ile Arg Glu Glu Ala Phe
1340 1345 1350
Leu His Val Ala Val Asp Met Tyr Leu Lys Leu Val Gln Leu Phe
1355 1360 1365
Val Ala Gly Asp Thr Ser Thr Val Ser Pro Pro Ala Gly Arg Ser
1370 1375 1380
Leu Glu Leu Lys Gly Gln Gly Asn Pro Val Glu Leu Ile Thr Lys
1385 1390 1395
Ala Arg Leu Phe Leu Leu Gln Leu Ile Pro Arg Cys Pro Lys Lys
1400 1405 1410
Ser Phe Ser His Val Ala Glu Leu Leu Ala Asp Arg Gly Asp Cys
1415 1420 1425
Asp Pro Glu Val Ser Ala Ala Leu Gln Ser Arg Gln Gln Ala Ala
1430 1435 1440
Pro Asp Ala Asp Leu Ser Gln Glu Pro His Leu Phe
1445 1450 1455
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ГЕННОЙ МОДИФИКАЦИИ ГЕМОПОЭТИЧЕСКИХ КЛЕТОК | 2019 |
|
RU2824194C2 |
| ЛЕНТИВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ДОСТАВКИ PKLR ДЛЯ ЛЕЧЕНИЯ ДЕФИЦИТА ПИРУВАТКИНАЗЫ | 2018 |
|
RU2777934C2 |
| КОМПОЗИЦИИ И СПОСОБЫ УСИЛЕНИЯ ЭКСПРЕССИИ ГЕНА PKLR | 2017 |
|
RU2773358C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ТРАНСПЛАНТАЦИИ СТВОЛОВЫХ КЛЕТОК | 2019 |
|
RU2809803C2 |
| ЛЕЧЕНИЕ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2834339C1 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ К BCMA | 2015 |
|
RU2747457C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ ПОСРЕДСТВОМ ЭКСПРЕССИИ ФЕРМЕНТА, ОБЛАДАЮЩЕГО ДЕЗОКСИРИБОНУКЛЕАЗНОЙ (ДНКазной) АКТИВНОСТЬЮ, В ПЕЧЕНИ | 2019 |
|
RU2773691C2 |
| КОНСТРУКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ И ВЕКТОРЫ ДЛЯ ГЕНОТЕРАПИИ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА И ДРУГИХ СОСТОЯНИЙ | 2015 |
|
RU2745567C2 |
| Композиции и библиотеки, содержащие рекомбинантные полинуклеотиды, кодирующие Т-клеточные рецепторы, и способы применения рекомбинантных Т-клеточных рецепторов | 2017 |
|
RU2752528C2 |
| МОДИФИЦИРОВАННЫЙ ФАКТОР IX, А ТАКЖЕ КОМПОЗИЦИИ, СПОСОБЫ И ВАРИАНТЫ ПРИМЕНЕНИЯ ПЕРЕНОСА ГЕНОВ В КЛЕТКИ, ОРГАНЫ И ТКАНИ | 2016 |
|
RU2811445C2 |
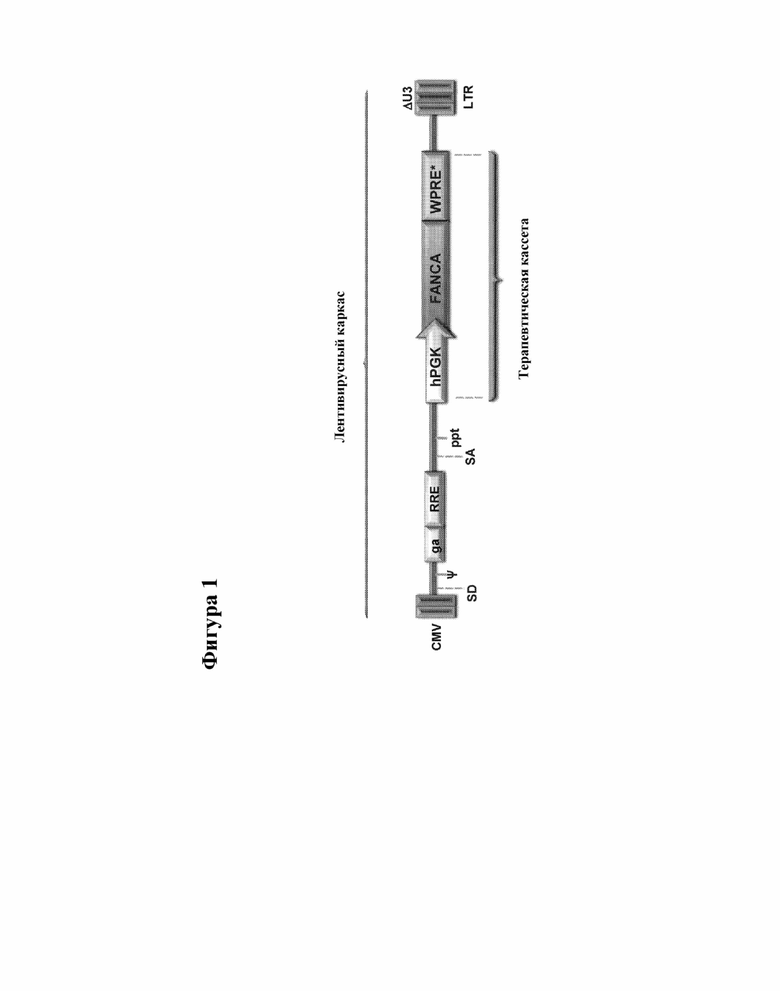

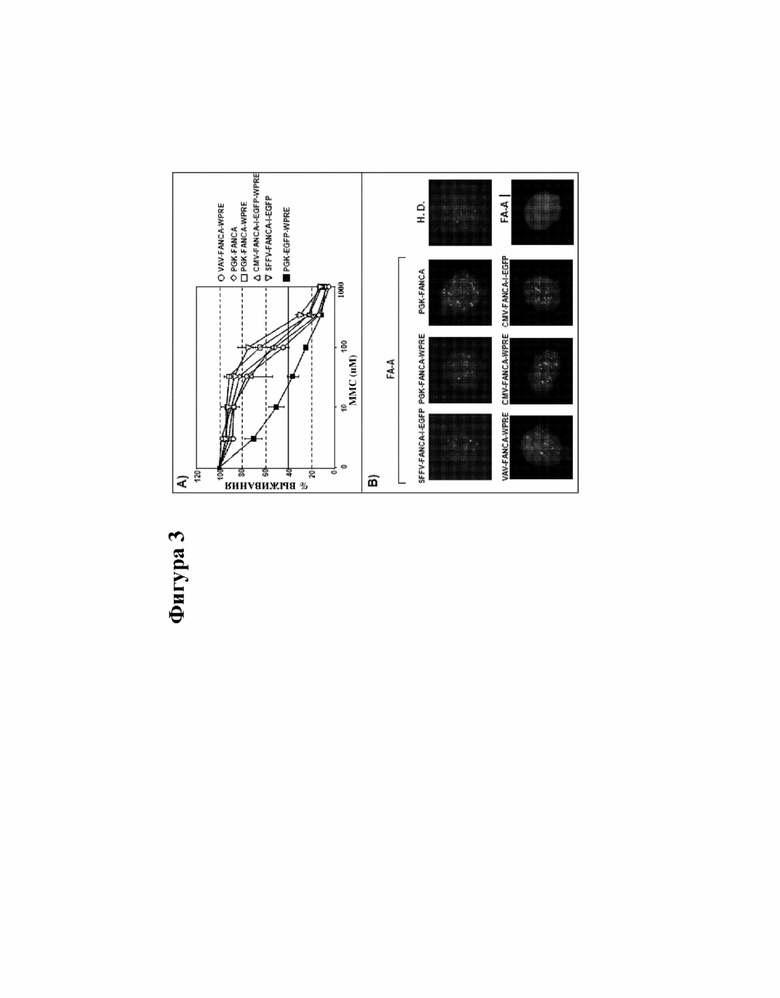
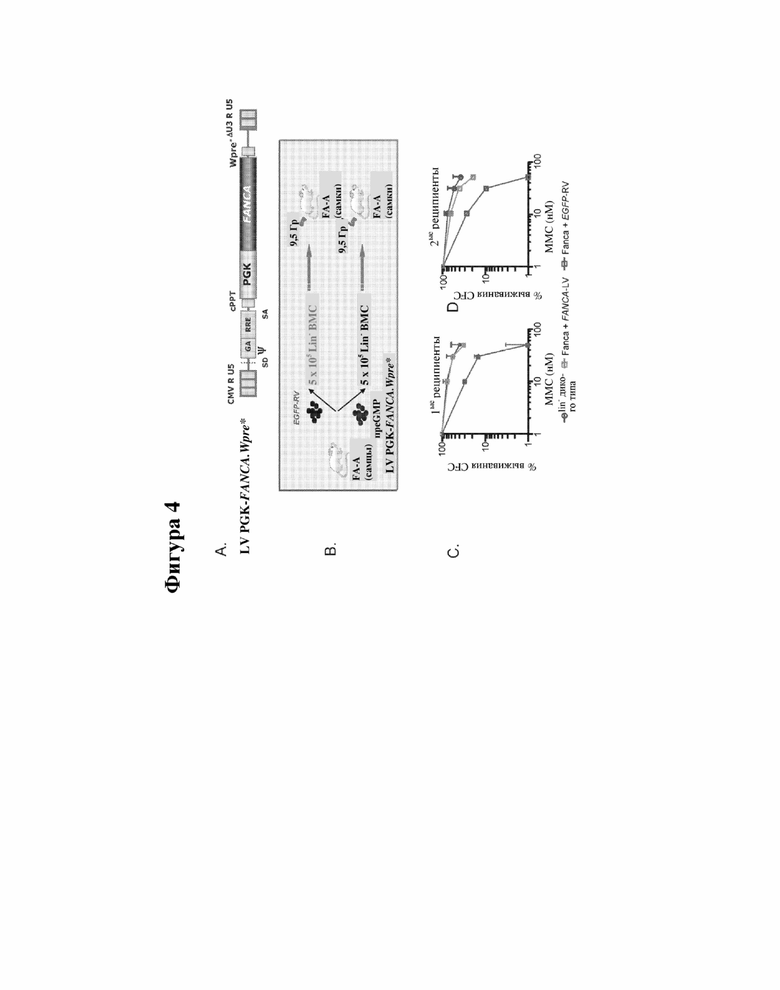
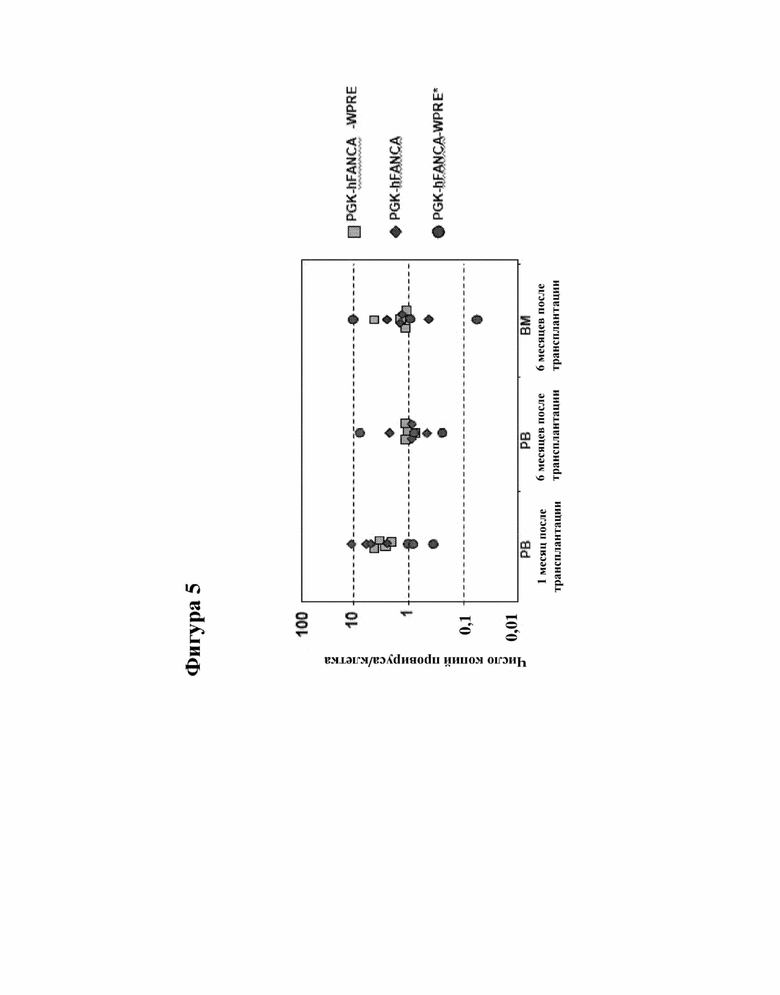


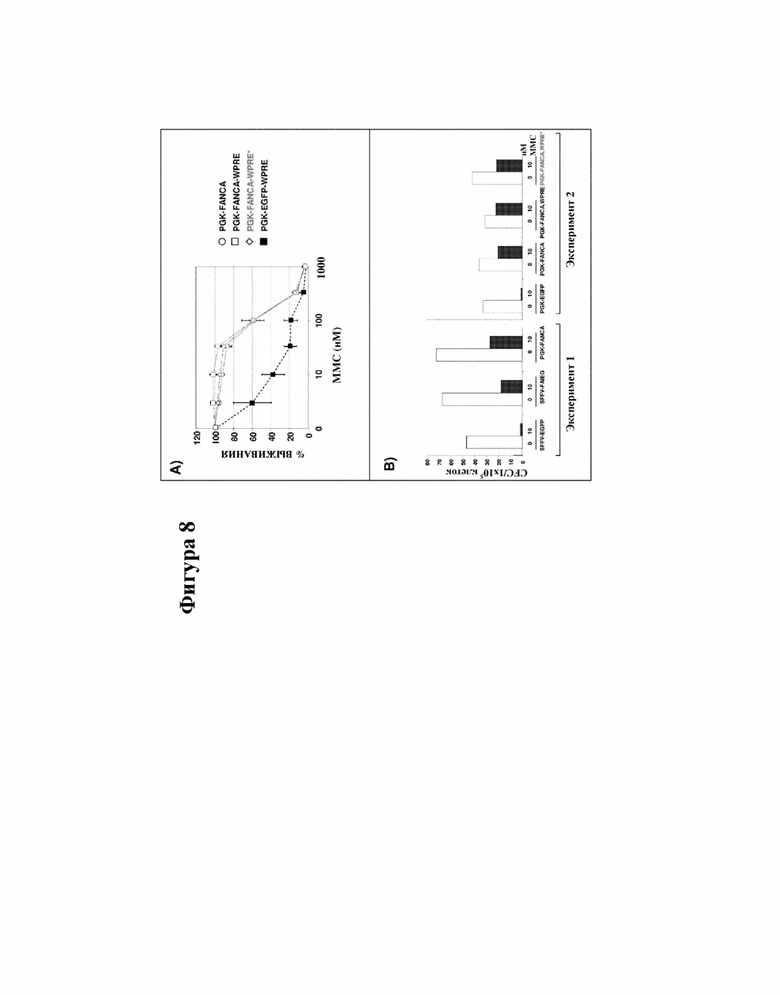
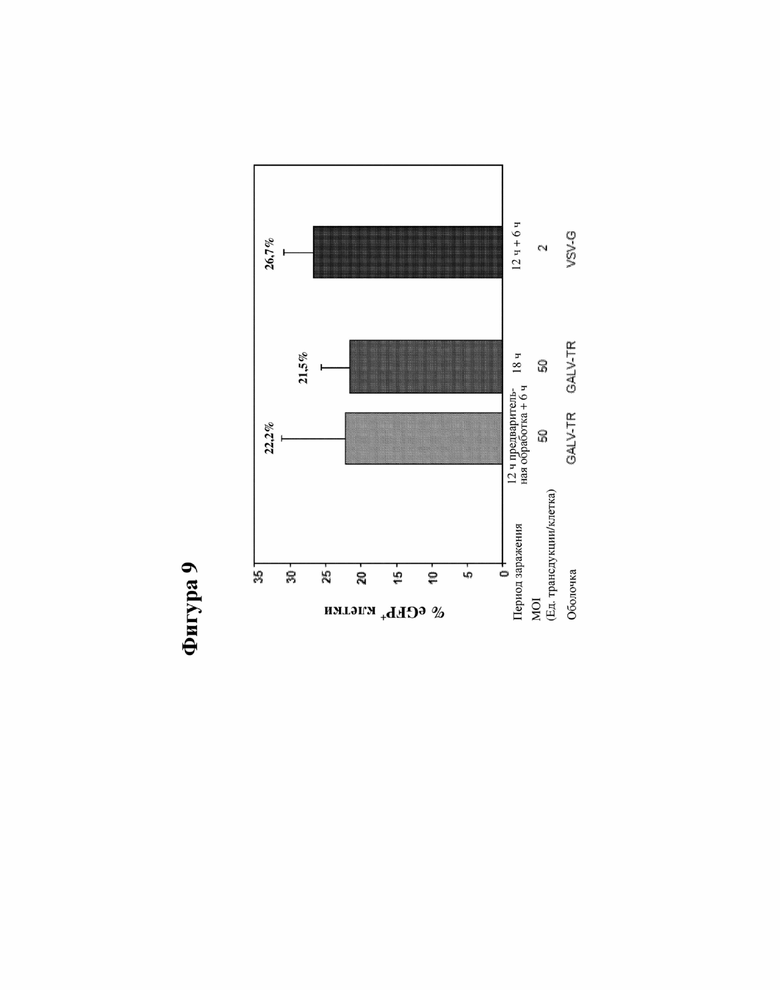

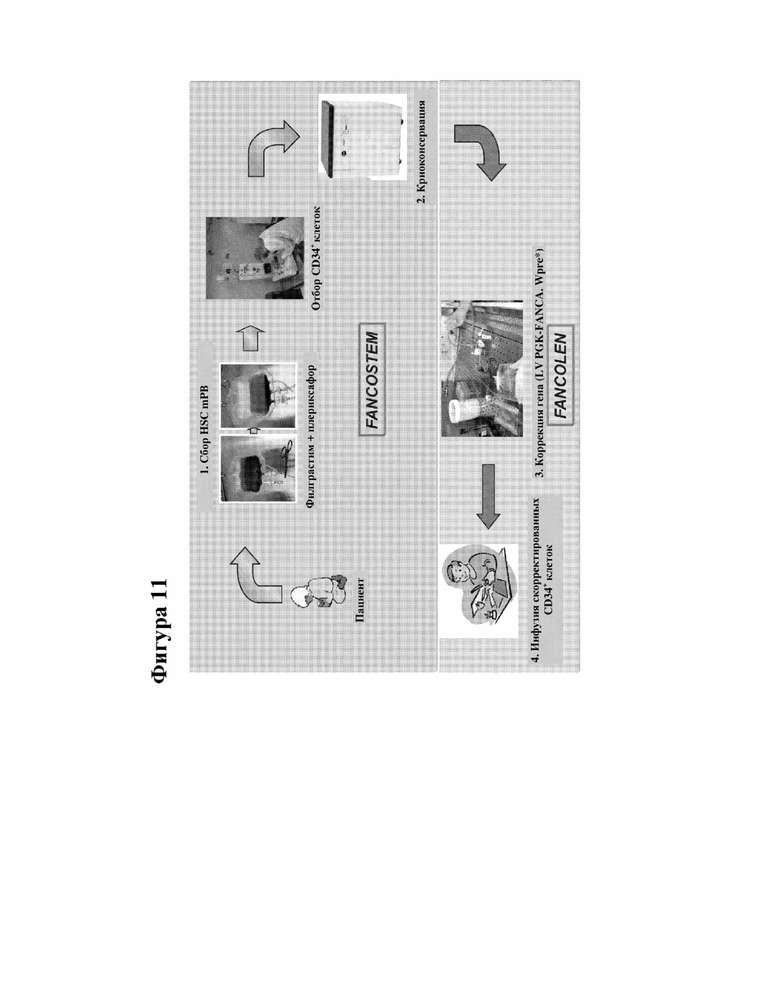





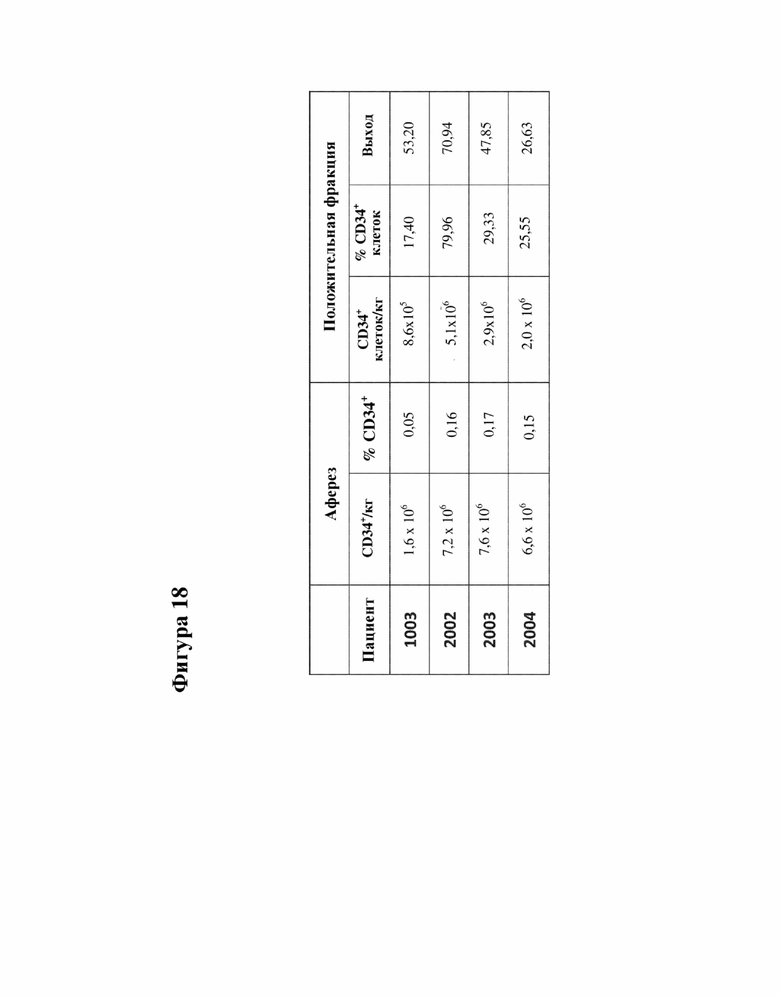
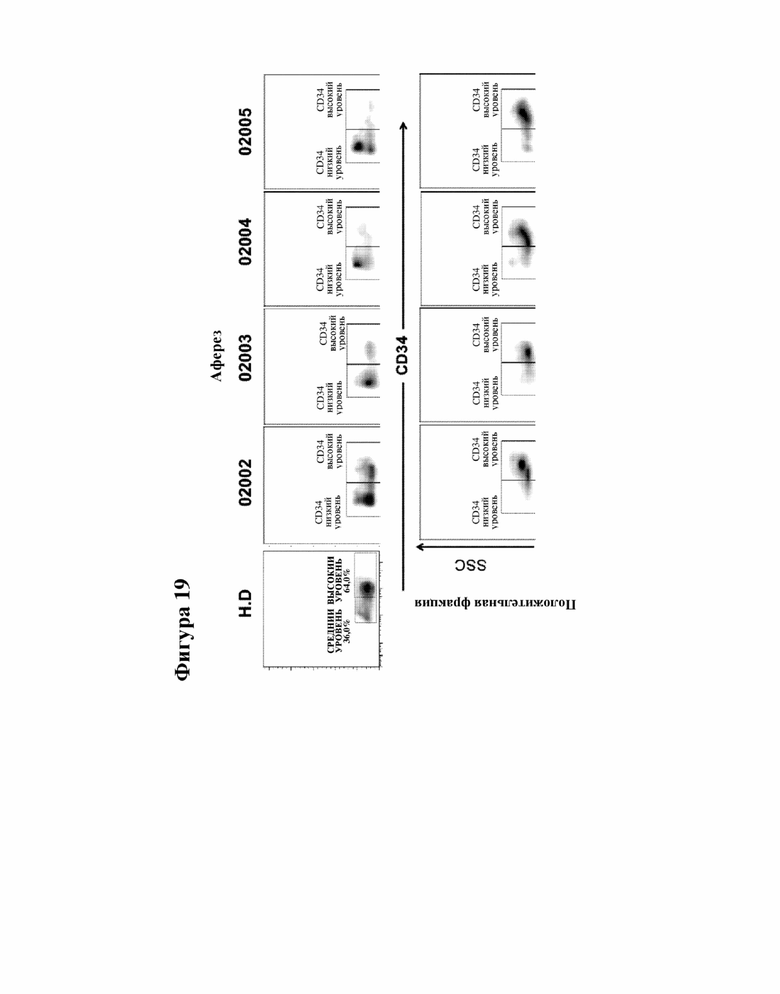


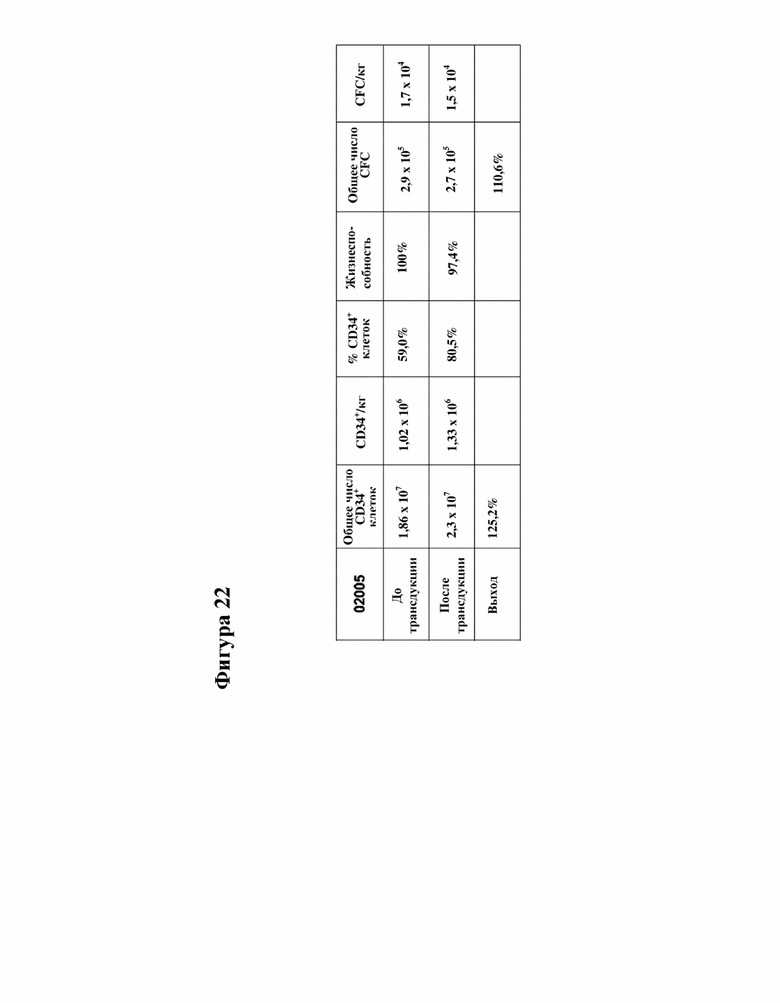

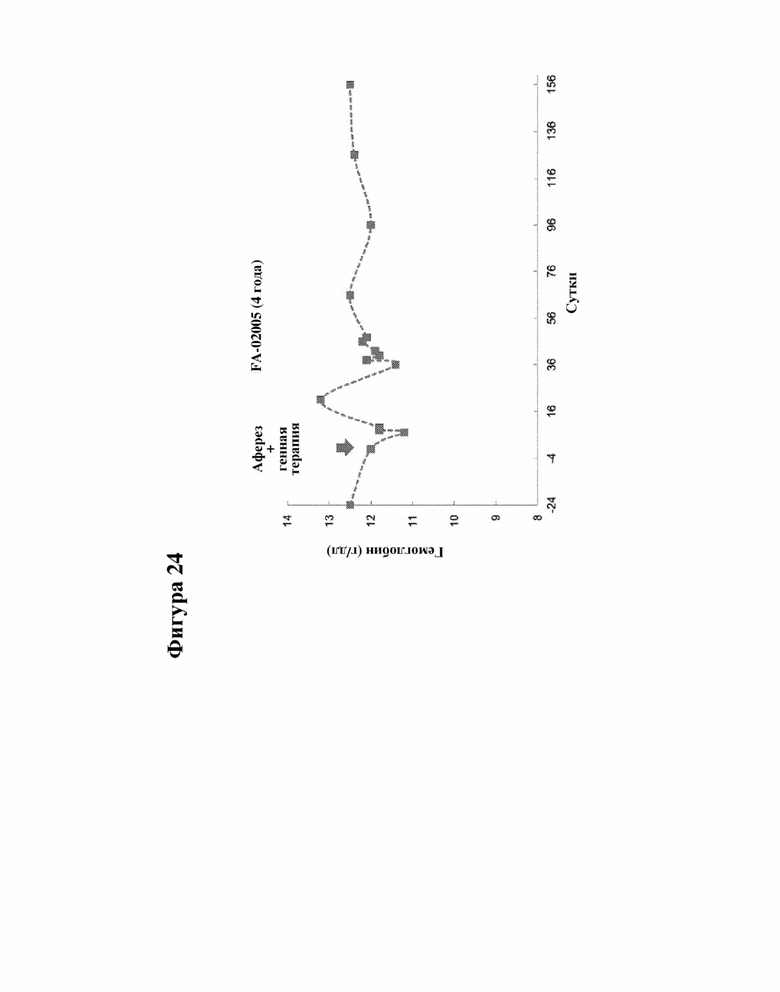





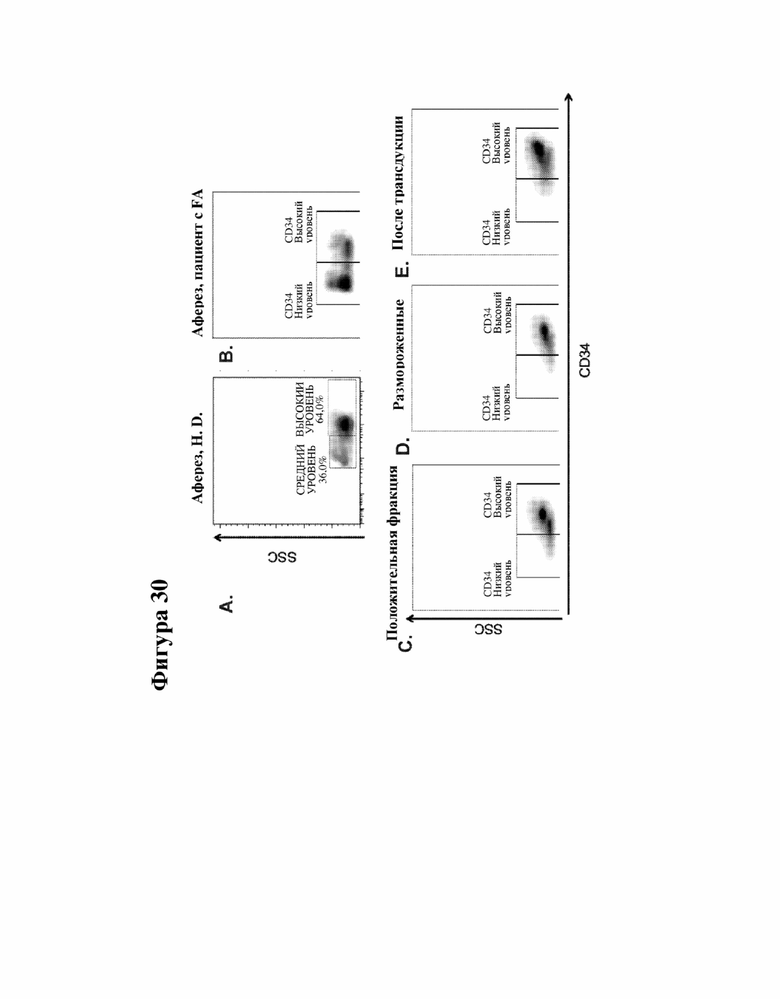

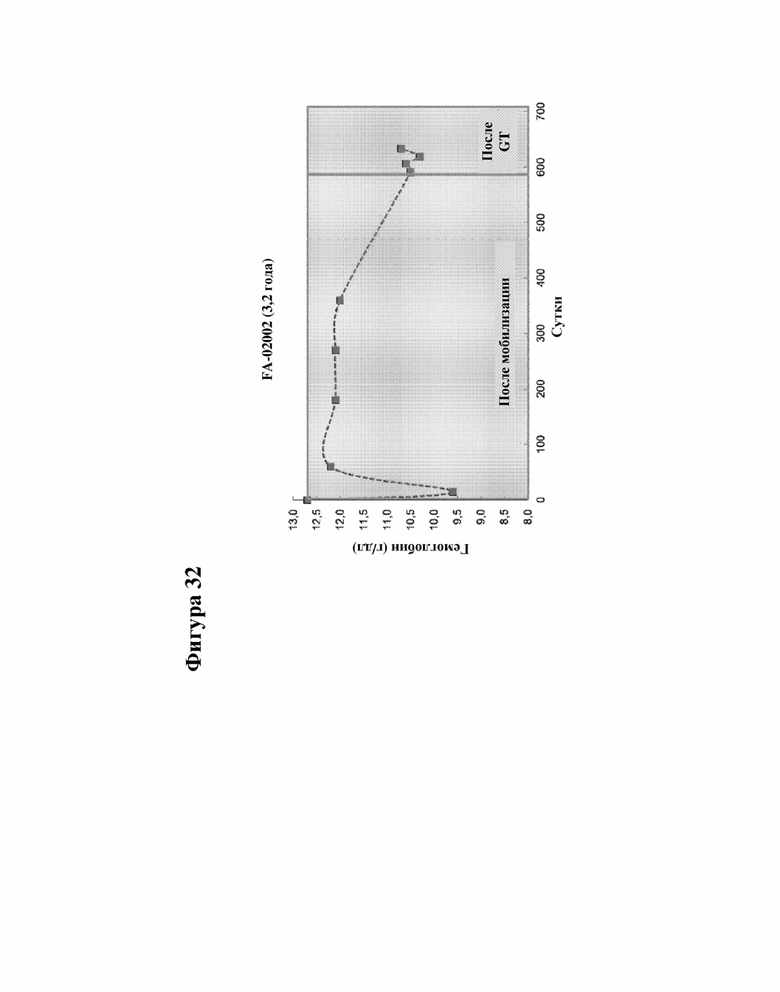

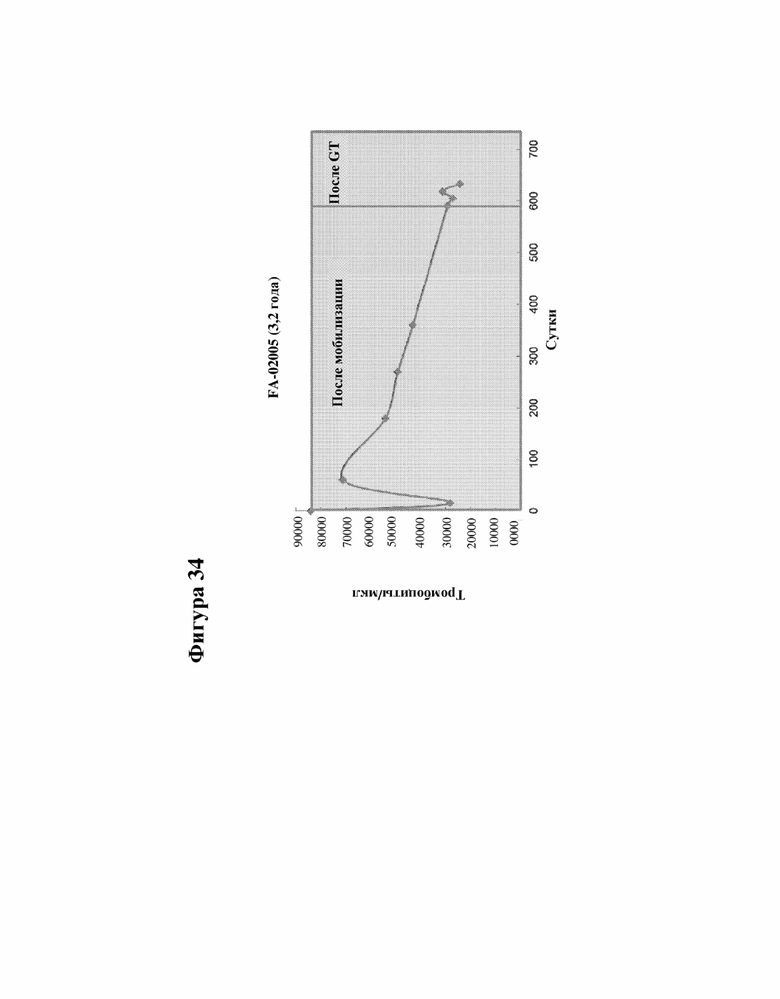



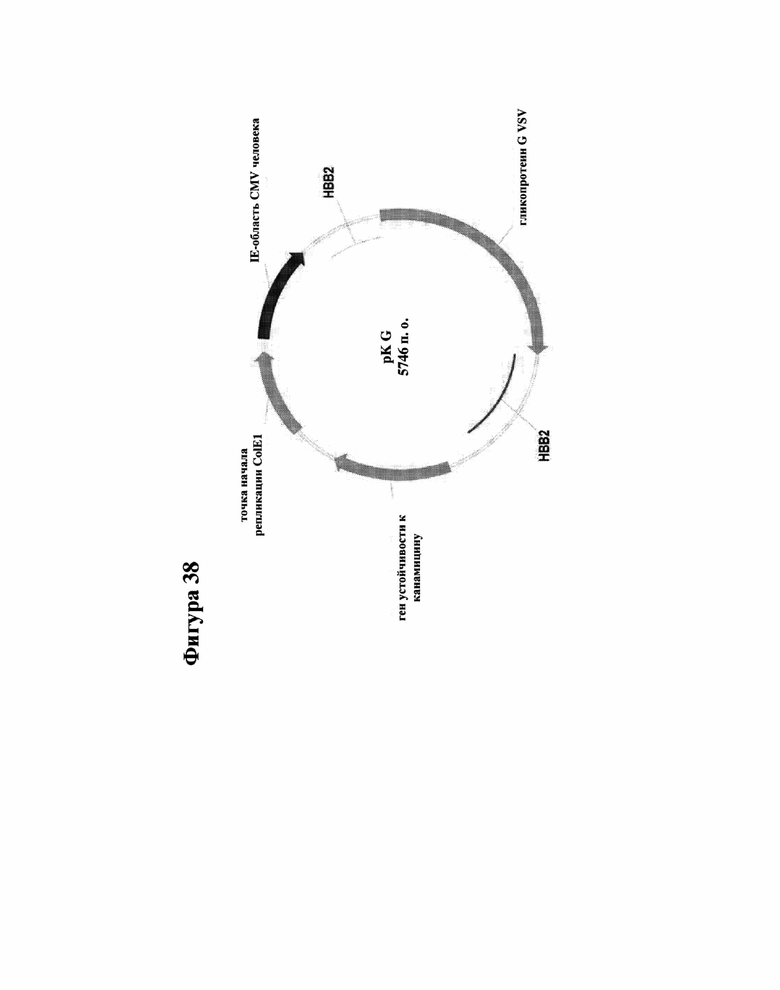


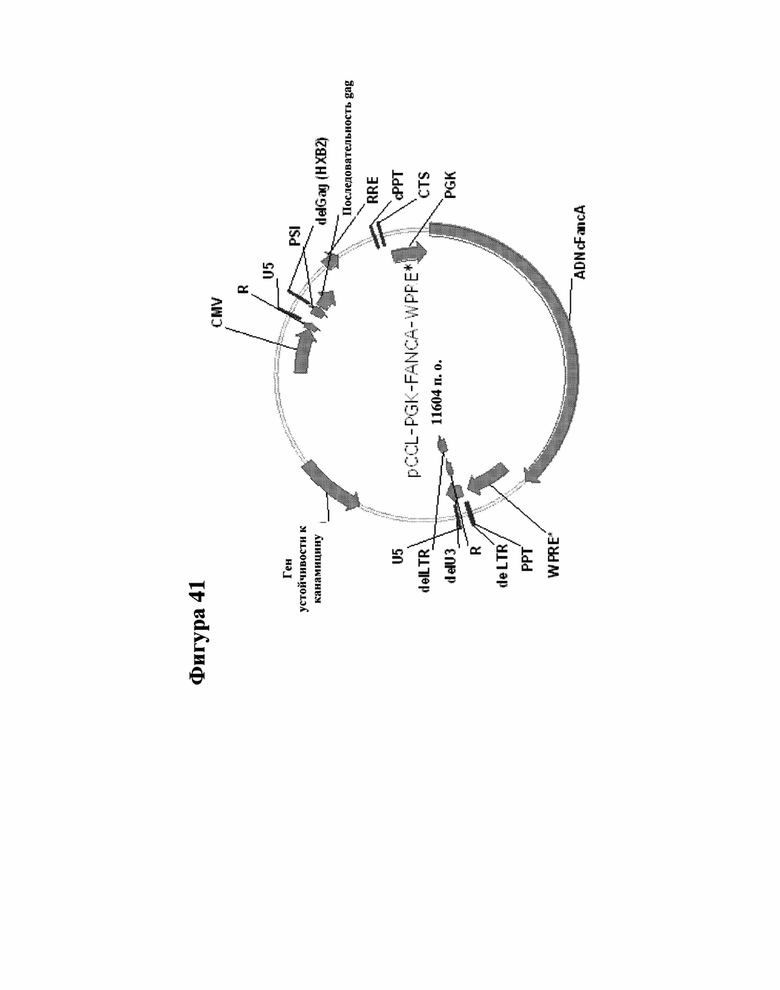



Группа изобретений относится к биотехнологии. Представлены: CD34+ клетка для лечения анемии Фанкони, содержащая кассету экспрессии, содержащую полинуклеотидную последовательность. Фармацевтическая композиция для лечения анемии Фанкони, содержащая фармацевтически приемлемый наполнитель и эффективное количество CD34+ клетки, а также способы лечения анемии Фанкони у субъекта, нуждающегося в этом. Изобретение позволяет использовать его для лечения анемии Фанкони у пациентов. 4 н. и 11 з.п. ф-лы, 44 ил., 2 табл., 10 пр.
1. CD34+ клетка для лечения анемии Фанкони, содержащая кассету экспрессии, содержащую полинуклеотидную последовательность, содержащую следующее в 5'-3'-направлении:
(a) промоторную последовательность гена фосфоглицераткиназы (PGK) человека;
(b) последовательность, кодирующую полипептид FANCA человека;
(c) сигнальную последовательность экспорта РНК регуляторного элемента вируса гепатита сурков (WPRE),
где последовательность, кодирующая полипептид FANCA человека, функционально связана с промоторной последовательностью гена PGK,
где промотор гена PGK содержит нуклеотидную последовательность под SEQ ID NO: 7,
где полипептид FANCA содержит последовательность, изложенную под SEQ ID NO: 25,
где элемент WPRE содержит нуклеотидную последовательность под SEQ ID NO: 23; и
где кассета экспрессии содержит нуклеотидную последовательность под SEQ ID NO: 24.
2. CD34+ клетка по п. 1, где последовательность, кодирующая полипептид FANCA, содержит последовательность, изложенную под SEQ ID NO: 8.
3. CD34+ клетка по п. 1 или 2, где кассета экспрессии дополнительно содержит одну или более энхансерных последовательностей.
4. CD34+ клетка по п. 1, где кассета экспрессии дополнительно содержит:
(d) полипуриновый тракт (PPT) или сигнальную последовательность полиаденилирования (polyA).
5. CD34+ клетка по п. 1, где кассета экспрессии дополнительно содержит:
(e) последовательность сигнала упаковки;
(f) усеченную последовательность Gag;
(g) Rev-чувствительный элемент (RRE);
(h) центральный полипуриновый тракт (сРРТ);
(i) центральную терминальную последовательность (CTS); и
(j) элемент последовательности, расположенный против хода транскрипции (USE), необязательно из вируса обезьян 40 (SV40-USE).
6. Фармацевтическая композиция для лечения анемии Фанкони, содержащая фармацевтически приемлемый наполнитель и эффективное количество CD34+ клетки по любому из пп. 1-5.
7. Способ лечения анемии Фанкони у субъекта, нуждающегося в этом, предусматривающий обеспечение субъекта CD34+ клетками, содержащими кассету экспрессии, где кассета экспрессии содержит полинуклеотидную последовательность, содержащую следующее в 5'-3'-направлении:
(a) промоторную последовательность гена фосфоглицераткиназы (PGK) человека;
(b) последовательность, кодирующую полипептид FANCA человека;
(c) сигнальную последовательность экспорта РНК регуляторного элемента вируса гепатита сурков (WPRE),
где последовательность, кодирующая полипептид FANCA человека, функционально связана с промоторной последовательностью гена PGK,
где промотор гена PGK содержит нуклеотидную последовательность под SEQ ID NO: 7,
где полипептид FANCA содержит последовательность, изложенную под SEQ ID NO: 25,
где элемент WPRE содержит нуклеотидную последовательность под SEQ ID NO: 23; и
где кассета экспрессии содержит нуклеотидную последовательность под SEQ ID NO: 24.
8. Способ по п. 7, где CD34+ клетки были получены от субъекта.
9. Способ по п. 8, где CD34+ клетки были получены от субъекта после обработки субъекта комбинацией из: (i) G-CSF или филграстима и (ii) плериксафора.
10. Способ по п. 8, где CD34+ клетки были трансдуцированы рекомбинантным вектором доставки гена, содержащим кассету экспрессии.
11. Способ по п. 9, где CD34+ клетки были трансдуцированы за счет приведения CD34+ клеток в контакт с рекомбинантным вектором доставки гена на протяжении приблизительно 24 часов.
12. Способ лечения анемии Фанкони у субъекта, нуждающегося в этом, предусматривающий:
(a) обеспечение субъекта комбинацией из: (i) G-CSF или филграстима и (ii) плериксафора для мобилизации CD34+ клеток у субъекта;
(b) получение биологического образца, содержащего CD34+ клетки, от субъекта, где биологический образец необязательно представляет собой периферическую кровь или костный мозг;
(c) получение клеточной популяции, обогащенной CD34+ клетками, из биологического образца;
(d) трансдуцирование клеточной популяции, обогащенной CD34+ клетками, рекомбинантным вектором доставки гена, где рекомбинантный вектор доставки гена представляет собой лентивирусный вектор, содержащий кассету экспрессии, содержащую полинуклеотидную последовательность, содержащую следующее в 5'-3'-направлении:
(i) промоторную последовательность гена фосфоглицераткиназы (PGK) человека;
(ii) последовательность, кодирующую полипептид FANCA человека;
(iii) сигнальную последовательность экспорта РНК регуляторного элемента вируса гепатита сурков (WPRE),
где последовательность, кодирующая полипептид FANCA человека, функционально связана с промоторной последовательностью гена PGK, и
где трансдуцирование предусматривает приведение клеточной популяции, обогащенной CD34+ клетками, в контакт с лентивирусным вектором на протяжении приблизительно 24 часов; и
(e) обеспечение субъекта клеточной популяцией, трансдуцированной лентивирусным вектором, полученной на стадии (d).
13. Способ по п. 12, где способ подавляет развитие, препятствует прогрессированию и/или обращает прогрессирование анемии Фанкони у субъекта.
14. Способ по п. 13, где способ подавляет развитие, препятствует прогрессированию и/или обращает прогрессирование одного или более из недостаточности костного мозга (BMF), тромбоцитопении, лейкопении, панцитопении, нейтропении и анемии.
15. Способ по любому из пп. 7-14, где субъект является не подвергавшимся кондиционированию субъектом.
| BECKER et al | |||
| Preclinical Correction Of Human Fanconi Anemia Complementation Group A Bone Marrow Cells Using A Safety-Modified Lentiviral Vector, 2010, Gene Therapy, Vol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| US 5952190 A, 14.09.1999 | |||
| US 20150203852 A, 23.07.2015 | |||
| US 20150291966 A1, 15.10.2015 | |||
| US 20160194660 A1, 07.07.2016 | |||
| СПОСОБЫ ЛЕЧЕНИЯ, ДИАГНОСТИКИ И МОНИТОРИНГА РЕВМАТОИДНОГО АРТРИТА | 2010 |
|
RU2539112C2 |
Авторы
Даты
2023-08-03—Публикация
2017-09-08—Подача