ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к селекции растений и молекулярной биологии. Более конкретно, настоящее изобретение относится к способу обнаружения локуса количественного признака (QTL), связанного с устойчивостью к Botrytis cinerea у томата, к способу получения растений томата, устойчивых к Botrytis, а также к полученным таким способом растениям томата и их частям, устойчивым к Botrytis.
УРОВЕНЬ ТЕХНИКИ
Botrytis cinerea представляет собой некротрофный патогенный гриб с исключительно широким диапазоном организмов-хозяев, содержащим по меньшей мере 235 возможных организмов-хозяев. Из-за такого широкого диапазона организмов-хозяев и из-за его влияния на экономически важные части растений B. cinerea является основной проблемой для многих сельскохозяйственных культур, выращиваемых для коммерческих целей. Среди производителей указанный гриб обычно называется Botrytis. Культурный томат (преимущественно Lycopersicon esculentum) также восприимчив к инфекции Botrytis, причем гриб в основном поражает стебель, листья и плоды растения томата. В обогреваемых парниках возникновение инфекций Botrytis на стеблях особенно распространено.
Botrytis интенсивно убивает зараженные клетки, вызывая мягкую гниль, увядание, пятнистость листьев, черную ножку и рак стебля. Пораженные листья покрываются конидиофорами и конидиями и впоследствии разрушаются и увядают. Гриб прорастает из больных листьев в стебель и вызывает сухие светло-коричневые поражения длиной от нескольких миллиметров до нескольких сантиметров. Поражения также могут образовываться при обрезке рубцов на стебле. Указанные поражения стебля также могут быть покрыты серой гнилью. В тяжелых случаях инфекция опоясывает стебель и убивает растение. Более старая, увядающая ткань растения томата обычно более восприимчива к поражению Botrytis, чем молодая ткань.
Для предотвращения развития Botrytis в парнике, где выращивают томаты, следует внимательно контролировать температуру и относительную влажность. Также важно подавать воду без увлажнения листьев. На полях, где выращивают растения, должен быть обеспечен хороший дренаж и контроль над сорняками. Кроме того, уровни питательных веществ растений должны сохраняться высокими. Тем не менее, эти профилактические меры не могут полностью предотвратить значительную потерю урожая в случае возникновения инфекции.
Для контроля Botrytis и в оранжерее, и на полях, где выращивают томаты, имеются фунгициды. В качестве примеров некоторых фунгицидов можно привести Dowicide А® и хлорталонил, которые также можно использовать для плодов томатов после сбора урожая. Однако у Botrytis, как известно, развивается устойчивость к некоторым обычно используемым фунгицидам. Кроме того, использование фунгицидов является нежелательным как с экономической, так и с экологической точки зрения. В настоящее время существует потребность в коммерческих сортах томатов, которые проявляют устойчивость к Botrytis.
Частичная устойчивость к Botrytis была обнаружена у нескольких диких видов Lycopersicon (Egashira et al. 2000; Nicot et al. 2002; Urbasch 1986). Однако эти растения не дают коммерческих культур томатов.
Из WO 02/085105 известно, что L. hirsutum содержит генетическую область в 10-й хромосоме генома, которая связана с частичной устойчивостью к Botrytis. Интрогрессия этого генетического материала в культурные сорта томатов, вероятно, будет способствовать получению культурных растений томата, частично устойчивых к Botrytis.
На настоящий момент, однако, программы селекции, направленные на обеспечение устойчивости к Botrytis у томатов, имели ограниченный успех. Причина таких плохих результатов на настоящий момент не ясна. С одной стороны, это может быть связано с недостаточным знанием генетической основы и наследования устойчивости к Botrytis. С другой стороны, это может быть связано с отсутствием подходящих биоанализов для оценки уровней устойчивости к Botrytis у томатов, полученных в программах селекции. Отсутствие знаний и методов также усложняет селекцию растений как среди диких образцов, так и среди потомства, содержащего гены, связанные с устойчивостью к Botrytis.
Цель настоящего изобретения состоит в повышении успеха программ скрещивания, направленных на получение коммерческих сортов томатов, устойчивых к Botrytis. Другой целью настоящего изобретения является получение дополнительной и/или улучшенной устойчивости к Botrytis у коммерческих сортов томата. Еще одна цель настоящего изобретения состоит в создании способа обнаружения дополнительных диких образцов Lycopersicon в качестве источников устойчивости к Botrytis и в нахождении дополнительного генетического материала в геноме таких растений, который связан с устойчивостью томатов к Botrytis. Такие дополнительные источники и дополнительный генетический материал можно использовать для расширения основы для получения устойчивых к Botrytis сортов культурного томата.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что специфический количественный биоанализ, который заключается в измерении начальных и/или прогрессирующих параметров инфекции Botrytis у растений томата в сочетании со способом обнаружения молекулярного маркера, обеспечивает очень эффективный способ обнаружения источников устойчивости к Botrytis среди диких образцов Lycopersicon и способ обнаружения генетического материала в геноме таких растений, который связан с повышением устойчивости томатов к Botrytis.
При использовании указанной комбинации способов авторы настоящего изобретения успешно идентифицировали частичную устойчивость к Botrytis в двух линиях диких родственников томата, т.е. Lycopersicon hirsutum LYC 4/78 и Lycopersicon parviflorum G1.1601.
Авторы смогли впоследствии получить Botrytis-устойчивые растения томата, скрещивая растения указанных Botrytis-устойчивых диких (донорных) линий томата с неустойчивыми реципиентными растениями томата. Было показано, что эти растения обладают более высоким уровнем устойчивости, чем растения, содержащие геномную область в 10-й хромосоме L. hirsutum, связанную с устойчивостью к Botrytis, как описано в WO 02/085105.
Оценивая уровень устойчивости к Botrytis в изолированных популяциях (популяции F2) этих недавно полученных гибридов в отношении присутствия молекулярных маркеров растения донора, авторы настоящего изобретения смогли идентифицировать множественные локусы количественного признака (QTL), связанные с Botrytis-устойчивостью в устойчивых линиях диких томатов, и смогли таким образом установить расположение в геноме множественных последовательностей ДНК, придающих устойчивость. В результате авторы настоящего изобретения установили, что устойчивость к Botrytis у томатов наследуется полигенетически, что может частично объяснить плохие результаты скрещивания. На основании этого открытия были усовершенствованы способы получения Botrytis-устойчивых растений томата. В последующем описании локус количественного признака (QTL), связанный с устойчивостью к Botrytis у томатов, сокращен до "QTL Botrytis-устойчивости" или "QTL, связанный с Botrytis-устойчивостью".
В общей сложности шесть новых QTL Botrytis-устойчивости были обнаружены в двух линиях диких томатов. Четыре из указанных шести QTL могли быть связаны с количественным параметром, который отражает способность растения к снижению начального распространения инфекции, называемым далее "параметр частоты возникновения заболевания". Два из этих шести QTL могли быть связаны с количественным параметром, который отражает способность растения к замедлению развития инфекции, называемым далее "параметр темпа роста повреждений".
При составлении карт генетического сцепления было обнаружено, что хромосома 1 L. hirsutum LYC 4/78 несет QTL, который связан со снижением скорости роста повреждений, вызванных инфекцией Botrytis, и что обе хромосомы 2 и 4 из того же самого указанного образца несут QTL, который связан с пониженной заболеваемостью. В L. parviflorum G1.1601 QTL, ответственный за снижение скорости роста повреждений, как было установлено, расположен на хромосоме 9, в то время как два отдельных QTL, отвечающих за пониженную заболеваемость, как было найдено, расположены на хромосомах 3 и 4. QTL в хромосоме 10, как сообщалось в предшествующем уровне техники, не мог быть обнаружен этим способом. При использовании вышеуказанного количественного биоанализа все QTL L. hirsutum LYC 4/78, протестированные до настоящего времени, могут быть подтверждены в оценке сопротивления болезни в BC2S1 (обратное скрещивание 2, сами с собой) потомства, расщепляющихся на QTL при исследовании.
Настоящее изобретение относится в первом аспекте к растению томата, устойчивому к Botrytis, где указанное растение обладает восприимчивостью к Botrytis cinerea, которая по меньшей мере в 3 раза ниже, чем у контрольного растения, при измерении биоанализом, где средняя длина повреждений стебля, вызванных инфекцией Botrytis cinerea у взрослых растений, измерена в течение трехнедельного периода при стандартных условиях опыта. Длина повреждений стебля в течение трех недель, используемых в настоящем описании как критерий уровня устойчивости, должна быть определена стандартными условиями опыта, как описано в настоящем описании. В предпочтительном варианте осуществления указанное растение, представляющее собой Botrytis-устойчивый томат, характеризуется тем, что содержит в своем геноме по меньшей мере один QTL или его участок, ответственный за устойчивость к Botrytis, выбранный из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанных с устойчивостью к Botrytis, и где указанный QTL или его часть, ответственная за устойчивость к Botrytis, отсутствует в естественном генетическом фоне.
Настоящее изобретение относится в другом аспекте к способу обнаружения локуса количественного признака (QTL), связанного с устойчивостью к Botrytis у растений томата. В способе предусмотрены стадии скрещивания донорного Botrytis-устойчивого растения томата с неустойчивым или частично устойчивым (Botrytis-восприимчивым) реципиентным растением томата; контакт одного или нескольких растений потомства с инфекционной дозой Botrytis; количественное определение заболеваемости и/или скорости роста повреждений у одного или нескольких указанных растений потомства; создание карты генетического сцепления, которая связывает наблюдаемую заболеваемость и/или скорость роста повреждений с присутствием хромосомных маркеров указанного донорного растения томата у одного или нескольких указанных растений потомства; а также назначение в качестве локуса количественного признака смежных маркеров на указанной карте, которые связаны с пониженной заболеваемостью и/или уменьшенной скоростью роста повреждений.
В другом аспекте настоящее изобретение относится к QTL, которые получают способом обнаружения QTL Botrytis-устойчивости по настоящему изобретению, как описано выше. Эти QTL отличаются от QTL предшествующего уровня техники. Во-первых, в предшествующем уровне техники QTL не может быть обнаружен. Кроме того, QTL по настоящему изобретению более информативны, чем QTL предыдущего уровня техники, поскольку они являются показателями либо характеристики, касающейся способности растения противостоять началу болезни, либо характеристики, связанной со способностью растения замедлить развитие болезни. Такая информация является очень ценной для программ селекции, так как их сочетания могут надлежащим образом обеспечить более высокую устойчивость и лучший контроль за правильным наследованием признака устойчивости от одного поколения к другому.
Настоящее изобретение дополнительно относится к QTL Botrytis-устойчивости у растений томата, где указанный QTL выбран из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанных с устойчивостью к Botrytis. Эти QTL расположены в положениях генома, которые ранее не были связанны с устойчивостью к Botrytis. Более подробно эти QTL описаны ниже.
Аллели, присутствующие в положениях генома, обозначенные этими QTL, представляют собой один из аспектов настоящего изобретения.
QTL по настоящему изобретению может быть в форме выделенной, предпочтительно, двунитевой последовательности нуклеиновой кислоты, содержащей указанный QTL или его часть, вызывающую устойчивость. Очень удобно, что размер последовательности нуклеиновой кислоты, которая может, например, быть выделена из хромосомы подходящего донорного растения, может иметь генетическое расстояние, равное 1-100 сМ (сантиморган), предпочтительно, 10-50 сМ на указанной хромосоме. Указанная нуклеиновая кислота может содержать по меньшей мере 50, более предпочтительно, по меньшей мере 500 или, еще более предпочтительно, по меньшей мере 1000, однако, еще более предпочтительно, по меньшей мере 5000 пар оснований. Одна или несколько последовательностей нуклеиновых кислот, содержащих QTL или его часть, придающую устойчивость, по настоящему изобретению могут в свою очередь быть включены в конструкцию нуклеиновой кислоты, причем указанная конструкция может дополнительно содержать области, которые фланкируют указанные одну или несколько последовательностей нуклеиновых кислот, и области, которые способны к интеграции в подходящий вектор для переноса указанной одной или нескольких последовательностей нуклеиновых кислот в подходящее восприимчивое к Botrytis реципиентное растение томата. Вектор может дополнительно содержать подходящие промоторные области или другие регуляторные последовательности. QTL может также находиться в форме, присутствующей в геноме растения томата. QTL по настоящему изобретению, предпочтительно, содержит по меньшей мере один маркер, предпочтительно, два, более предпочтительно, три, еще более предпочтительно, четыре и, еще более предпочтительно, более четырех маркеров, которые связанны с Botrytis-устойчивостью, и выбраны из группы, состоящей из маркеров, перечисленных в таблицах 1 и 2, а также маркеров, показанных на фиг.1, 5 и 6, связанных с указанным QTL.
Настоящее изобретение относится в другом аспекте к способу обнаружения QTL Botrytis-устойчивости, в котором предусмотрено обнаружение по меньшей мере одного маркера, выбранного из группы, состоящей из маркеров, перечисленных в таблицах 1 и 2, и маркеров, показанных на фиг.1, 5 и 6, связанных с указанным QTL Botrytis-устойчивости в предположительно устойчивом к Botrytis растении томата.
Настоящее изобретение дополнительно относится к способу создания Botrytis-устойчивого растения томата. В указанном способе предусмотрена стадия обнаружения QTL Botrytis-устойчивости в Botrytis-устойчивом донорном растении томата путем применения любого из способов обнаружения локуса количественного признака (QTL) Botrytis-устойчивости по настоящему изобретению, а также стадия переноса нуклеиновой кислоты, содержащей по меньшей мере один QTL, обнаруженный указанным способом, или его часть, ответственную за устойчивость к Botrytis, из указанного растения-донора в Botrytis-восприимчивое реципиентное растение томата.
Для получения дочерних растений перенос нуклеиновой кислоты, содержащей по меньшей мере один QTL или его часть, ответственную за устойчивость к Botrytis, удобно осуществлять путем скрещивания указанного Botrytis-устойчивого донорного растения томата с Botrytis-восприимчивым реципиентным растением томата; и отбора из числа дочерних растений растения, которое содержит в своем геноме нуклеиновую кислоту, интрогрессированную от указанного донорного растения томата, где указанная интрогрессированная нуклеиновая кислота содержит по меньшей мере один QTL Botrytis-устойчивости по настоящему изобретению или его часть, ответственную за устойчивость к Botrytis. Наличие в указанной интрогрессированной нуклеиновой кислоте по меньшей мере одного QTL Botrytis-устойчивости по настоящему изобретению или его части, ответственной за устойчивость к Botrytis, может соответственно быть обнаружено способом по настоящему изобретению, в котором обнаруживают по меньшей мере один маркер, выбранный из группы, состоящей из маркеров, перечисленных в таблицах 1 и 2, и маркеров, показанных на фиг.1, 5 и 6, связанных с указанным QTL Botrytis-устойчивости.
Таким образом, в предпочтительном способе селекции предусмотрена маркер-опосредованная селекция (MAS) (см., например, Tanksley et al. 1998) указанной интрогрессированной ДНК, в которой один или несколько маркеров, связанных с указанным QTL, обнаружены в растениях потомства. MAS может, например, быть выполнен путем выделения генетического материала из указанных дочерних растений и определения в них наличия молекулярными методами одного или нескольких маркеров растения-донора. Альтернативно, молекулярные методы обнаружения маркера могут использоваться без предшествующего выделения генетического материала. Необязательно, кроме обнаружения маркера, может быть выполнен фенотипический тест на устойчивость к Botrytis, для отбора подходящего растения. Наиболее подходящий тест, таким образом, представляет собой количественный биоанализ, описанный в настоящем описании, посредством которого определяют такие параметры, как заболеваемость и/или скорость роста повреждений. Подтверждение наличия по меньшей мере одного маркера QTL Botrytis-устойчивости в комбинации с определением наличия устойчивого фенотипа обеспечивает подтверждение успешного переноса нуклеиновой кислоты, содержащей по меньшей мере один QTL или его часть, ответственную за устойчивость к Botrytis, от растения-донора к растению-реципиенту.
В альтернативном варианте осуществления способа получения устойчивого к Botrytis растения томата указанный перенос нуклеиновой кислоты может быть выполнен соответствующим способом трансгенными методами (например, трансформацией), слиянием протопластов, методом удвоения гаплоидов или изъятия эмбриона.
В предпочтительном варианте осуществления способа получения растения томата, устойчивого к Botrytis, растениями-донорами являются Lycopersicon hirsutum LYC 4/78 и/или Lycopersicon parviflorum G1.1601, а нуклеиновая кислота, перенесенная из указанных растений-доноров в растения-реципиенты, предпочтительно содержит по меньшей мере один QTL Botrytis-устойчивости, выбранный из группы, состоящей из QTL на хромосомах 1 (QTL-1h), 2 (QTL-2h) и 4 (QTL-4h) Lycopersicon hirsutum LYC 4/78, и QTL на хромосомах 3 (QTL-3p), 4 (QTL-4p) и 9 (QTL-9p) Lycopersicon parviflorum G1.1601, связанных с устойчивостью к Botrytis, или его часть, ответственную за устойчивость к Botrytis.
В другом предпочтительном варианте осуществления способа получения растения томата, устойчивого к Botrytis, в указанном способе предусмотрено скрещивание указанного Botrytis-устойчивого донорного растения томата с Botrytis-восприимчивым реципиентным растением томата, с получением первого поколения дочерних растений; отбор из первого поколения дочерних растений растения, которое содержит в своем геноме нуклеиновую кислоту, интрогрессированную от указанного донорного растения томата, где указанная интрогрессированная нуклеиновая кислота содержит по меньшей мере один QTL, предпочтительно, два, еще более предпочтительно, более двух QTL Botrytis-устойчивости по настоящему изобретению, или его часть, ответственную за устойчивость к Botrytis; скрещивание указанного отобранного дочернего растения с подходящей коммерческой линией томатов с получением второго поколения дочерних растений; отбор из второго поколения дочерних растений растения, которое содержит в своем геноме нуклеиновую кислоту, интрогрессированную от указанного донорного растения томата первого поколения, где указанная интрогрессированная нуклеиновая кислота содержит по меньшей мере один QTL, предпочтительно, два, еще более предпочтительно, более двух QTL Botrytis-устойчивости по настоящему изобретению, или часть QTL, ответственную за устойчивость к Botrytis, и, необязательно, создание последующих поколений дочерних растений. Указанные, предпочтительно, два, более предпочтительно, более двух QTL Botrytis-устойчивости, которые интрогрессированы в дочерние растения, могут быть QTL заболеваемости, QTL скорости роста повреждения или комбинацией этих типов.
В другом аспекте настоящее изобретение относится к Botrytis-устойчивому растению томата, или его частям, полученному способом по настоящему изобретению.
В еще одном аспекте настоящее изобретение относится к Botrytis-устойчивому растению томата, или его части, содержащему в своем геноме по меньшей мере один QTL или часть QTL, ответственную за устойчивость к Botrytis, где указанный QTL выбран из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанных с устойчивостью к Botrytis, и где указанный QTL или указанная часть QTL, ответственная за устойчивость к Botrytis, отсутствует в природном генетическом фоне.
В еще одном аспекте настоящее изобретение относится к способу получения Botrytis-устойчивого инбредного растения томата. В указанном способе предусмотрены стадии получения Botrytis-устойчивого растения томата способом по настоящему изобретению, самоопыляемое указанное растение, новые растения, выращенные из семян, полученных от указанного самоопыляемого растения; стадии идентификации растений, которые демонстрируют устойчивость к Botrytis и обладают коммерчески требуемыми характеристиками из числа указанных новых растений, а также повторения стадий самоопыления и селекции до тех пор, пока не будет получено инбредное растение томата, которое демонстрирует устойчивость к Botrytis и обладает коммерчески требуемыми характеристиками.
В способе получения Botrytis-устойчивого инбредного растения томата может быть дополнительно предусмотрена стадия отбора гомозиготных инбредных растений томата, которые демонстрируют устойчивость к Botrytis и обладают коммерчески требуемыми характеристиками.
В дополнительном аспекте настоящее изобретение относится к способу получения Botrytis-устойчивого инбредного растения томата или его частям, получаемым способом по настоящему изобретению.
В следующем аспекте настоящее изобретение относится к гибридному растению томата или его частям, которые демонстрируют устойчивость к Botrytis, где указанное гибридное растение томата можно получить, скрещивая Botrytis-устойчивое инбредное растение томата, получаемое способом по настоящему изобретению, с инбредным растением томата, которое обладает коммерчески требуемыми характеристиками.
Изобретение дополнительно относится к культуре ткани регенерируемых клеток растений томата по настоящему изобретению. В предпочтительном варианте осуществления указанной культуры ткани, клетки или протопласты указанных клеток, выделенных из ткани, выбранной из группы, состоящей из листьев, пыльцы, эмбрионов, корней, концов корней, пыльников, цветов, плодов, а также стеблей и семян.
Изобретение дополнительно относится к применению маркера, выбранного из группы, состоящей из маркеров, перечисленных в таблицах 1 и 2, и маркеров, показанных на фиг.1, 5 и 6, для обнаружения QTL Botrytis-устойчивости по настоящему изобретению и/или для обнаружения Botrytis-устойчивых растений томата.
Botrytis-устойчивое донорное растение томата, используемое в способах по настоящему изобретению, предпочтительно, выбрано из группы, состоящей из Lycopersicon cerasiforme, Lycopersicon cheesmanii, Lycopersicon chilense, Lycopersicon chmielewskii, Lycopersicon esculentum, Lycopersicon hirsutum, Lycopersicon parviflorum, Lycopersicon pennellii, Lycopersicon peruvianum, Lycopersicon pimpinellifolium и Solanum lycopersicoides, более предпочтительно, образец дикого Lycopersicon используется как растение-донор. Наиболее предпочтительными растениями-донорами являются Lycopersicon hirsutum и Lycopersicon parviflorum, особенно Lycopersicon hirsutum LYC 4/78 и Lycopersicon parviflorum G1.1601.
Botrytis-восприимчивое донорное растение томата, используемое в способах по настоящему изобретению, предпочтительно, является растением вида Lycopersicon esculentum, более предпочтительно, культурным сортом L. esculentum, которые обладают коммерчески требуемыми характеристиками, или другой коммерческой томатной линией.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показано расположение локусов количественных признаков (QTL) устойчивости к B. cinerea, происходящих из L. hirsutum LYC 4/78, с картами сцепления, представляющими хромосомы 1 и 2. Положения на карте дано в сМ (сантиморган). QTL, обнаруженный на хромосоме 1, относится к росту повреждений, а QTL, обнаруженный на хромосоме 2, относится к заболеваемости. Столбики показывают интервалы QTL. Рамка показывает LOD 1 интервал, а линия показывает LOD 2 интервал. Коды для маркеров AFLP более подробно описаны в таблице 1. Все маркеры, обозначенные как связанные с QTL, могут использоваться в качестве маркеров в аспектах настоящего изобретения.
На фиг.2 показан схематический обзор развития популяций L. esculentum × L. hirsutum LYC 4/78. Линии BC4 обратно скрещены с L. esculentum сорта Moneymaker с получением линии BC5, способствующей созданию линий QTL-NIL для двух главных эффектов, которые идентифицированы в популяции F2. Линии BC3 и BC4 обратно скрещены с L. esculentum сорта Moneymaker с получением популяции обратно скрещенной инбредной линии (BIL) (см. пример 3).
На фиг.3 показано расщепление в двух популяциях BC2S1 (размер популяции 60 относительно 47), разделяющихся по росту повреждений (фиг.3B и 3D) и заболеваемости (фиг.3А и 3C). Рост повреждения приведен на оси X в мм (фиг.3B и 3D), деления равны 0,5 мм (2,75-3,25; 3,25-3,75 и так далее), а заболеваемость (фиг.3А и 3C) приведена в делениях, равных 5% (12,5-17,5%; 17,5-22,5% и так далее). На оси Y показано количество растений в каждом делении. Средние исходные значения обозначены стрелками для ММ относительно Lyc 4/78.
На фиг.4 показаны результаты скрещивания L. esculentum сорта Moneymaker × L. parviflorum G1.1601. Расщепление в популяции F2 (основано на среднем значении линий F3) для заболеваемости (фиг.4A) и скорости роста (фиг.4B). Заболеваемость приведена на оси X в процентах (фиг.4A) с делениями по 5% (12,6-17,5%; 17,5-22,5% и так далее). Рост повреждения приведен на оси X в мм (фиг.4B) с делениями по 0,5 мм (2,75-3,25; 3,25-3,75 и так далее). На оси Y показано количество растений в каждом делении.
На фиг.5 показана карта связей L. parviflorum QTL, как описано в описании. QTL-3p расположен в области, отмеченной маркерами P15M48-234, P18M50-167, TG599, P18M51-486, P22M50-151 и P14M60-65. QTL-4p расположен в области, отмеченной маркерами P14M48-158 и P14M48-34xCD (= P14M48-349 в таблице 2). QTL-9p расположен в области, отмеченной маркерами TG10, P22M50-56, P14M48-56, P14M50-82, P14M50-204, P15M48-138 (= P15M48-137 в таблице 2), P14M50-174 (= P14M50-176 в таблице 2), P22M51-201, P15M48-54, TM2a, P22M51-165, P14M48-120, TG551, P15M48-15xCD (= P15M48-155 в таблице 2).
На фиг.6 показана карта спления и участки QTL L. hirsutum QTL, как описано в описании. Карта представляет собой обновленный вариант карты фиг.1, на которой геномные области показаны более четко. Все маркеры, обозначенные как связанные с QTL (которые расположены на С1 от TG301 до TG460, включительно; которые расположены на C2 от TG145 до At5g64670, включительно; и те, которые расположены на C4 от TG339 до T1405, включительно), могут использоваться в качестве маркеров в аспектах настоящего изобретения. Эта обновленная версия дает основу для предпочтительных вариантов осуществления в аспектах настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Обозначения
Приведенные в настоящем описании признаки не являются ограничениями различных аспектов или вариантов осуществления настоящего изобретения, которые могут использоваться по отношению к описанию изобретения в целом. Соответственно, термины, определенные ниже, более подробно определены по отношению к описанию изобретения в целом.
Используемый в настоящем описании термин "Botrytis" означает Botrytis cinerea, который также известен, как серая гниль или серая пятнистость, - болезнь, которая обычно обнаруживается на стебле, листьях и плодах томатов. В целом полагают, механизм инфицирования растительного патогенного гриба Sclerotinia sclerotiorum подобен механизму инфицирования B. cinerea (Prins et al., 2000). Хотя инфекция S. sclerotiorum у томатов экономически намного менее важна, чем инфекция B. cinerea, оба гриба выделяют спектр протеаз, ферментов деградации клеточной стенки растения, токсинов, а также щавелевую кислоту. Некоторые из этих факторов, как известно, играют роль в механизме инфицирования обоих грибов. В результате механизмы и гены, которые вызывают устойчивость к Botrytis, как полагают, одинаково эффективны в обеспечении устойчивости к инфекции S. sclerotiorum. Поэтому в том случае, когда дана ссылка на "Botrytis-устойчивость", под такой устойчивостью следует понимать устойчивость, включающую устойчивость к любому грибу семейства Sclerotiniaceae, предпочтительно, устойчивость к S. sclerotiorum и B. cinerea, более предпочтительно, устойчивость к B. cinerea.
Используемый в настоящем описании термин "аллель (аллели)" означает любую одну или несколько альтернативных форм гена, все аллели которого касаются по меньшей мере одного признака или характеристики. В диплоидной клетке или организме два аллеля данного гена занимают соответствующие локусы на паре гомологичных хромосом. Так как настоящее изобретение относится к QTL, т.е. геномным областям, которые могут включать один или несколько генов, а также и к регулирующим последовательностям, в некоторых случаях более точно ссылаться на "гаплотип" (т.е. аллель хромосомного сегмента), а не на "аллель", однако, в таких случаях, под термином "аллель" следует понимать и термин "гаплотип".
"Ген" определен в настоящем описании как единица наследственности, состоящая из последовательности ДНК, которая занимает определенное положение на хромосоме и которая содержит генетическую инструкцию для отдельных характеристик или признаков в организме.
"Локус" определен в настоящем описании как положение, которое данный ген занимает на хромосоме данной разновидности.
Используемый в настоящем описании термин "гетерозиготный" означает генетическое состояние, существующее, когда другие аллели располагаются в соответствующих локусах на гомологичных хромосомах.
Используемый в настоящем описании термин "гомозиготный" означает генетическое состояние, существующее, когда идентичные аллели располагаются в соответствующих локусах на гомологичных хромосомах.
Используемый в настоящем описании термин "гибрид" означает любое потомство скрещивания между двумя генетически различными особями, включающий, но не ограниченный скрещиванием между двумя инбредными линиями.
Используемый в настоящем описании термин "инбредный" означает по существу гомозиготную особь или линию.
В настоящей заявке под "актом рекомбинации" следует понимать мейотический кроссинговер.
Используемый в настоящем описании термин "интрогрессия", "интрогрессированный" и "интрогрессирующийся" относятся как к природному, так и к искусственному процессу, посредством которого гены одного вида, сорта или культурного сорта растения переносят в геном другого вида, сорта или культурного сорта растения путем скрещивания указанных видов. Процесс может дополнительно быть завершен обратным скрещиванием с родительской формой.
Все термины "генная инженерия", "трансформация" и "генетическая модификация" используются в настоящем описании как синонимы для переноса выделенных и клонированных генов в ДНК, обычно в хромосомную ДНК или геном, другого организма.
Используемый в настоящем описании термин "молекулярный маркер" относится к индикатору, который используют в способах для визуализации различий в характеристиках последовательностей нуклеиновых кислот. Примерами таких индикаторов являются маркеры полиморфизма длины фрагмента рестрикции (RFLP), маркеры полиморфизма длины амплифицированного фрагмента (AFLP), однонуклеотидные полиморфизмы (SNP), микросателлитные маркеры (например, SSR), маркеры характеризованной последовательностью амплифицированной области (SCAR), маркеры расщепленной амплифицированной полиморфной последовательности (CAPS) или изозимные маркеры или комбинации маркеров, описанных в настоящем описании, которые определяют определенное генетическое и хромосомное положение.
Термины "устойчивые" и "устойчивость" охватывают как частичную, так и полную устойчивость к инфекции. Botrytis-восприимчивое растение томата может или быть неустойчивым, или иметь низкие уровни устойчивости к инфекции Botrytis.
Используемый в настоящем описании термин "часть растения" означает часть растения томата, включающую отдельную клетку и клеточные ткани, такие как растительные клетки, которые являются интактными в растениях, скоплениях клеток и культурах тканей, из которых могут быть регенерированы растения томатов. Примеры частей растения включают, но ими не ограничиваются, отдельные клетки и ткани пыльцы, яйцеклеток, листьев, эмбрионов, корней, концов корней, пыльников, цветов, плодов, стеблей, побегов и семян; а также пыльцу, яйцеклетки, листья, эмбрионы, корни, концы корней, пыльники, цветы, плоды, стебли, побеги, отростки, корневища, семена, протопласты, мозоли и т.п.
Используемый в настоящем описании термин "популяция" означает генетически гетерогенную коллекцию растений, объединенную общим генетическим происхождением.
Используемый в настоящем описании термин "томат" означает любое растение, линию или популяцию Lycopersicon, включающее, но ими не ограниченное, Lycopersicon cerasiforme, Lycopersicon cheesmanii, Lycopersicon chilense, Lycopersicon chmielewskii, Lycopersicon esculentum (или Solanum lycopersicum), Lycopersicon hirsutum, Lycopersicon parviflorum, Lycopersicon pennellii, Lycopersicon peruvianum, Lycopersicon pimpinellifolium или Solanum lycopersicoides. Хотя Линней сперва классифицировал современный томат как Solanum и его научным названием много лет являлось Lycopersicon esculentum. Точно также дикие родственники современного томата были классифицированы в пределах рода Lycopersicon, как L. pennellii, L. hirsutum, L. peruvianum, L. chilense, L. parviflorum, L. chmielewskii, L. cheesmanii, L. cerasiforme и L. pimpinellifolium. За последние несколько лет между исследователями томатов и ботаниками были дебаты по поводу переклассификации названия этих видов. Новым предложенным научным названием для современного томата является Solanum lycopersicum. Точно так же могут быть изменены названия диких видов. L. pennellii может стать Solanum pennellii, L. hirsutum может стать S. habrochaites, L. peruvianum может разделиться на S. 'Nperuvianum' и S. 'Callejon de Huayles', S. peruvianum и S. corneliomuelleri, L. parviflorum может стать S. neorickii, L. chmielewskii может стать S. chmielewskii, L. chilense может стать S. chilense, L. cheesmaniae может стать S. cheesmaniae или S. galapagense, и L. pimpinellifolium может стать S. pimpinellifolium (Solanacea Genome Network (2005) Spooner и Knapp; httr>://www.sgn.comell.edu/help/about/solanum nomenclature.html).
Используемый в настоящем описании термин "сорт" или "культурный сорт" означает группу подобных растений, которые по структурным или генетическим особенностям и/или по продуктивности можно отличить от других сортов в пределах одного и того же вида.
Термин "QTL" используется в настоящем описании в значении, принятом в данной области техники. Термин "QTL, связанный с устойчивостью к B. cinerea у томата", так же как и более короткий термин "QTL Botrytis-устойчивости" относится к области, расположенной на специфической хромосоме томата и которая связана по меньшей мере с одним геном, кодирующим Botrytis-устойчивость, или по меньшей мере к регуляторной области, то есть области хромосомы, которая управляет экспрессией одного или нескольких генов, связанных с Botrytis-устойчивостью. Например, фенотипическая экспрессия указанного гена может наблюдаться в виде пониженной скорости роста повреждений и/или в виде пониженной заболеваемости. Например, QTL может содержать один или несколько генов, продукты которых вызывают генетическую устойчивость. Альтернативно, QTL может содержать, например, регуляторные гены или последовательности, продукты которых влияют на экспрессию генов в других локусах в геноме растения, вызывая таким образом Botrytis-устойчивость. QTL по настоящему изобретению могут быть определены путем указания их генетического положения в геноме соответствующего дикого образца Lycopersicon, используя один или несколько молекулярных геномных маркеров. Один или несколько маркеров, в свою очередь, показывают определенный локус. Расстояния между локусами обычно измеряют частотой кроссинговера между локусами на той же самой хромосоме. Чем дальше два локуса отстоят друг от друга, тем более вероятно, что между ними произойдет кроссовер. Наоборот, если два локуса будут располагаться близко друг к другу, то кроссовер между ними произойдет с меньшей вероятностью. Как правило, один сантиморган (сМ) равен 1%-й рекомбинации между локусами (маркерами). Когда QTL может быть обозначен множественными маркерами, генетическое расстояние между маркерами конечной точки показывает размер QTL.
Используемый в настоящем описании термин "Botrytis-восприимчивое реципиентное растение томата" используется в настоящем описании, чтобы указать растение томата, которое должно получить ДНК, полученную от донорного растения томата, который включает QTL Botrytis-устойчивости. Указанное "Botrytis-восприимчивое реципиентное растение томата" может не содержать или, возможно, уже не содержит один или несколько QTL для устойчивости к Botrytis. В таком случае данный термин определяет растение, которое должно получить дополнительный QTL.
Термин "природный генетический фон" используется для указания первоначального генетического фона QTL. Например, такой фон может быть геномом Botrytis-устойчивого дикого образца томата. Например, QTL по настоящему изобретению были найдены в определенных положениях на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601. В качестве примера Lycopersicon hirsutum LYC 4/78 представляет собой природный генетический фон QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78. Также Lycopersicon hirsutum LYC 4/78 представляет собой природный генетический фон указанных QTL. Наоборот, способ, в котором предусмотрен перенос ДНК, содержащей QTL или часть QTL, вызывающую устойчивость, из хромосомы 1 Lycopersicon hirsutum LYC 4/78 в то же самое положение на хромосоме 1 другого вида томатов, приведет к тому, что QTL или указанная часть QTL, вызывающая устойчивость, будет отсутствовать в своем природном генетическом фоне.
Термин "заболеваемость" определен в настоящем описании как параметр, который отражает способность растения замедлить распространение инфекции, и может быть, например, установлен путем определения возникновения инфекции в растении после контакта с инфекционным агентом.
Термин "скорость роста повреждений" или "темп роста повреждений" определен в настоящем описании как параметр, который отражает способность растения замедлить или уменьшить развитие инфекции и может, например, быть установлен путем определения скорости роста распространяющихся повреждений.
Термин "количественное определение" определен в настоящем описании как установление или оценка способом, включающим измерение, в частности измерение аспектов, измеряемых в количественных и числовых значениях. Определения степени тяжести заболевания и показания более, больше, меньше или равные, или же растущие или уменьшающиеся значения не включены в настоящий термин "количественное определение", который, в конечном счете, подразумевает присутствие объективного механизма подсчета для определения абсолютных значений. Поэтому термин "количественное определение заболеваемости и/или скорости роста повреждений", предпочтительно, включает определение процента всех потенциально инфекционных контактов между растением и инфекционным агентом, которые приводят к измеряемым повреждениям (с целью оценки заболеваемости), и/или определение увеличений диаметра, окружности, поверхностной области или объема одного или нескольких указанных повреждений в течение времени при благоприятных для роста грибков условиях (с целью оценки скорости роста повреждения).
Термины "стандартные условия деятельности", "стандартные условия парника" и "стандартные условия" относятся к условиям света, влажности, температуры и т.д., при которых, как являющихся стандартными, растения выращены или выдержаны, например, для фенотипической характеристики устойчивости к болезни. Например, для парников такие условия относятся к 16-часовому дню при 15-25°C. В общем, условия относятся к стандартным и отвечают условиям роста с фотопериодом 8-24 часа (фотосинтетический фотонный поток (PPF) 50-1000 мкмоль·м-2·с-1) с, предпочтительно, легким режимом 16 часов света и 8 часов темноты, температурой воздуха приблизительно 19°C в течение дня и 15°C ночью, дефицит давления водяного пара приблизительно 4,4 г·м-3, что соответствует относительной влажности (RH) приблизительно 60-85% при 600-700 ч/млн CO2 и атмосферной концентрации O2 при атмосферном давлении воздуха (обычно 1008 гПа). Воду и питательные вещества можно подавать капельно, рядом со стеблем, или в форме аэрозоля или тумана. Стандартные условия биоаналитического эксперимента, такого как оценка длины повреждений стебля, измерение заболеваемости и темпа роста повреждений, указаны далее в нижеследующих примерах. Более подробно оценка средней длины повреждений стебля должна быть выполнена в соответствии с описанием, приведенным в примерах 3.10 и 3.11.
Выявление QTL, связанных с устойчивостью к Botrytis у томатов
Известно, что дикие виды Lycopersicon обеспечивают подходящие источники признаков устойчивости к болезням и вредителям, причем было зарегистрировано присутствие частичной устойчивости к B. cinerea в листьях диких видов Lycopersicon (Urbasch, 1986). В прошлом выведению устойчивости к B. cinerea у томатов препятствовали два фактора. Во-первых, перенос частичной устойчивости в коммерческие селекционные линии имел ограниченный успех. Во-вторых, отсутствовали надежные и воспроизводимые анализы заболевания, которые бы позволили проводить идентификацию и обнаружение генетического материала, ответственного за придание устойчивости.
Urbasch (Urbasch, 1986), например, заражал листья мицелием, используя агаровые пробки, предоставляющие грибу избыток питательных веществ, которые сильно влияли на процесс инфекции. Другие исследователи использовали субъективные показатели болезни растения, которые являются неподходящими для количественного анализа, требуемого для идентификации локусов количественного признака (QTL).
Инфекция Botrytis cinerea в Lycopersicon esculentum в лабораторных условиях относительно хорошо изучена (например, Benito et al., 1998). Капельная инокуляция листьев и последующая инкубация при умеренных температурах (15-20°C) приводит к быстрому (16-24 часа после инфицирования (hpi)) развитию некротических пятен на участке инокуляции. Инфекция временно ограничена на этом месте приблизительно в течение 48 часов. После указанного момента доля повреждений (обычно 5-10%) начинает увеличиваться. Рост этих так называемых "растущих повреждений" сопровождается увеличением грибковой биомассы и приводит к колонизации целого листка в последующие 48 часов.
Авторы настоящего изобретения обнаружили, что специфические QTL, связанные с Botrytis-устойчивостью у томата, могут быть идентифицированы при использовании биоанализа для измерения устойчивости, где скорость развития инфекции и/или успех в достижении инфекции после контакта с инфекционным агентом измерен количественно на частях растения томата, предпочтительно, на отдельных частях, более предпочтительно, на сегментах стебля. Неожиданно было найдено, что в геномах Botrytis-устойчивых растений томатов присутствовали множественные QTL Botrytis-устойчивости, тогда как способы из предшествующего уровня техники приводили к предварительной идентификации всего лишь одного QTL Botrytis-устойчивости. Кроме того, QTL, которые были обнаружены при использовании указанных способов, были расположены на хромосомах, не связывавшихся ранее с Botrytis-устойчивостью томатов, причем QTL были связаны с различными фенотипическими проявлениями устойчивости. Поэтому способы по настоящему изобретению обеспечили новое понимание того, что генетическая основа Botrytis-устойчивости у томатов является полигенной.
Например, было обнаружено, что генетические области, присутствующие на хромосомах 2 и 4 L. hirsutum LYC 4/78, были ответственны за пониженную заболеваемость, в то время как генетические области, присутствующие на хромосоме 1 были по меньшей мере частично ответственны за сниженную скорость роста повреждений. Аналогичные генетические области, связанные с указанными фенотипами, как установили, присутствовали в L. parviflorum G1.1601, хотя они были расположены необязательно на тех же самых хромосомах.
Кроме того, было обнаружено, что новые области QTL были связаны с более высокими уровнями устойчивости, чем уровни устойчивости, связанные с QTL на хромосоме 10 из предшествующего уровня техники. Таким образом, способ по настоящему изобретению делает возможным открытие основных QTL, ответственных за устойчивость к Botrytis, которые придают растению уровень устойчивости, более высокий, чем ранее достигнутый. Таким образом, одно преимущество способа по настоящему изобретению состоит в том, что указанный способ приводит к открытию QTL, которые связаны с более высокими уровнями устойчивости к Botrytis. Этот уровень устойчивости может быть определен таким любым доступным способом, как, например, при использовании способов по настоящему изобретению или же при использовании обычных способов из предшествующего уровня техники. Подробное описание плана эксперимента и условий приводится в примерах, приведенных ниже.
Способ обнаружения локуса количественного признака (QTL), связанного с устойчивостью к Botrytis у томатов по настоящему изобретению, иначе называемый способом идентификации или определения положения локуса количественного признака (QTL), требует наличия Botrytis-устойчивого (частично) растения томата. Такое растение можно получить каким-либо способом, известным из уровня техники, а также при использовании любого способа для определения наличия указанной (частичной) устойчивости в указанном растении. Обеспечение Botrytis-устойчивого (частично) растения томата (которое будет далее служить растением-донором в способе по настоящему изобретению) позволяет установить или обеспечить хромосомные маркеры, предпочтительно, маркеры AFLP, CAPS и/или SCAR, наиболее предпочтительно, маркеры CAPS и/или SCAR по меньшей мере для одной и, более предпочтительно, для всех хромосом указанного растения. При создании коллекции хромосомных маркеров по всей длине указанных хромосом могут быть по сути отмечены различные положения указанных хромосом. Такие способы хорошо известны из уровня техники, а характерные способы далее будут описаны более подробно.
В способе обнаружения локуса количественного признака (QTL), связанного с устойчивостью к Botrytis у томатов по настоящему изобретению, предусмотрено в качестве первого шага скрещивание указанного Botrytis-устойчивого (частично) донорного растения томата с неустойчивым, или Botrytis-восприимчивым реципиентным растением томата, с целью получения дочерних растений. Впоследствии одно или несколько дочерних растений подвергают контакту с инфекционной дозой Botrytis. Указанная доза может различаться среди тестируемых растений и среди видов грибков. Обычно достаточной является доза порядка 1-10 к количеству приблизительно 500-5000 конидий указанного гриба.
Последующая стадия включает количественное определение заболеваемости и/или скорости роста повреждений на одном или нескольких растениях потомства, полученных от указанного скрещивания. Указанное количественное определение, предпочтительно, выполняют на множественных растениях потомства. Растения потомства, предпочтительно, представляют собой растения популяции F2, полученной в результате скрещивания Botrytis-устойчивого донорного растения томата и неустойчивого или Botrytis-восприимчивого реципиентного растения томата. Предпочтительно, в качестве потомства используют расщепляющуюся популяцию F2, более предпочтительно популяцию F2, полученную в результате скрещивания L. esculentum сорта Moneymaker и L. hirsutum LYC 4/78. Практически, из семени F1, полученного в результате указанного скрещивания, можно вырастить растения F1, после чего единственное растение F1 самоопыляется с целью получить семя F2, из которого впоследствии получают растения F2, которые используют для определения заболеваемости и/или скорости роста повреждений в способе по настоящему изобретению. Альтернативно, для анализа устойчивости можно использовать линии F3.
Стадия контактирования одного или нескольких растений потомства с инфекционной дозой Botrytis и количественное определение заболеваемости и/или скорости роста повреждений в указанном или большем количестве дочерних растений, предпочтительно, выполняется как часть биоанализа устойчивости на сегментах стебля или листьях, как описано в настоящем описании, причем предпочтительным является проведение биоанализа устойчивости на сегментах стебля. Специалист в данной области техники поймет, что возможно внести изменения в указанные тесты, как описано в настоящем описании ниже.
Биоанализ устойчивости на сегментах стебля по существу может быть выполнен следующим образом: сначала семена растений потомства сажают и выращивают рассаду/растения до подходящего рамера приблизительно 50 см в высоту. Верхние 5-10 см и нижние 5-10 см стебля растений могут быть удалены, а остающиеся 30 см могут быть разрезаны на равные сегменты по 5-6 см. Сегменты стебля размещают, предпочтительно, вертикально в решетке, основанием стебля на влажную фильтровальную бумагу. До инокуляции сегменты стебля соответственно обрызгивают водой, чтобы гарантировать равное распространение инокулята по поверхности раны. Каждый сегмент стебля можно тогда инокулировать суспензией конидий B. cinerea. Подходящее количество инокулята, например одна капля объемом приблизительно 5 мкл, содержит приблизительно 106 конидий·мл-1, может таким образом быть нанесена на верхушку каждого сегмента стебля. Затем сегменты стебля инкубируют при подходящей температуре приблизительно 16°C, предпочтительно, в темноте, и, предпочтительно, при высокой влажности (например, 100% относительная влажность (RH)). Развитие инфекции может быть оценено количественно путем измерения при помощи штангенциркуля максимального развития симптома гнили в различных временных периодах после инокуляции. Во множестве подходящих временных периодов, например в 96, 120 и 144 часов после инфицирования (hpi), стебли могут быть осмотрены на предмет формирования повреждений (заболеваемость) и роста повреждений, в количественном способе. Наиболее подходящие параметры включают измерение размера повреждения, например, с использованием штангенциркуля. Для того чтобы скорректировать различия, вызванные временем года или культивированием растений, количественные измерения биоанализов могут быть связаны с сопоставимыми измерениями в восприимчивых контрольных или эталонных линиях. Заболеваемость может быть эффективно определена путем деления общего количества распространяющихся повреждений на общее количество капель инокулята. Пропорция распространяющихся на специфическом генотипе повреждений может быть затем разделена на пропорцию распространяющихся повреждений, наблюдаемых в контрольном или эталонном генотипе, и выражена в процентах. Альтернативно, или дополнительно, темпы роста повреждения могут быть определены путем вычисления увеличения размера повреждения (например, в мм) за подходящий период, например за 24-часовой период. Данные для нераспространяющихся повреждений могут быть исключены из количественного анализа. Полученный темп роста повреждений может затем дополнительно быть разделен на темп роста повреждений, наблюдаемый в контрольном или эталонном генотипе, и выражен в процентах или как абсолютная величина, например, в миллиметрах.
Альтернативно, растения могут быть проанализированы с использованием биоанализа инфекции листа следующим образом. Сначала семена томатов сажают и выращивают рассаду/растения. Для каждого индивидуального растения один или два сложных листа могут быть отделены от главного стебля и помещены в предварительно смоченную цветочную пену. Затем цветочную пену помещают в чашку Петри, содержащую воду из-под крана, и впоследствии помещают в опрысканный водой контейнер, содержащий влажную фильтровальную бумагу. Подходящий инокулят, включающий конидии B. cinerea, может быть приготовлен способами, известными из уровня техники, например, как описано Benito et al., 1998. Затем сложные листья инокулируют суспензией конидий B. cinerea, помещая некоторое подходящее количество капелек, например 6-10 капелек объемом по 2 мкл каждая, на верхнюю поверхность листьев. Затем контейнер закрывают, а листья инкубируют при подходящей температуре между 15-20°C, предпочтительно, в темноте и, предпочтительно, при высокой влажности. Во множестве подходящих временных периодов, например, в 96, 120 и 144 часов после инфицирования (hpi), стебли могут быть осмотрены на предмет заболеваемости и роста повреждений, в количественном способе, как описано выше для биоанализа стебля.
Способ обнаружения локуса количественного признака (QTL), связанного с устойчивостью к Botrytis у томата по настоящему изобретению, дополнительно включает стадию создания карты генетического сцепления, которая связывает наблюдаемую заболеваемость и/или скорость роста повреждений с присутствием хромосомных маркеров указанного донорного растения томата в указанном одном или нескольких растениях потомства и стадию подписывания на указанной карте смежных маркеров, которые связаны с уменьшенной заболеваемостью и/или сниженной скоростью роста повреждений, к локусу количественного признака.
Карта генетического сцепления, которая связывает наблюдаемую заболеваемость и/или скорость роста повреждения с присутствием хромосомных маркеров донорного растения томата в указанном или большем количестве растений потомства, может быть составлена любым способом, известным из уровня техники. Специалист в данной области техники осведомлен о способах идентификации молекулярных маркеров, связанных с устойчивостью, вызванной локусами количественного признака (QTL) и картировании этих маркеров на карте генетического сцепления (смотрите, например, Bai et al., 2003; Foolad et al., 2002; van Heusden et al., 1999). Связь между Botrytis-устойчивым фенотипом и генотипом маркера может быть осуществлена подходящим способом при использовании таких пакетов программ, как JoinMap® и MapQTL® (см. примеры), или любого стандартного статистического пакета, который может выполнить оценку дисперсионного анализа. Молекулярные маркеры могут использоваться для построения карт генетического сцепления и для идентификации локусов количественного признака (QTL), вызывающих устойчивость к Botrytis. Подходящие типы молекулярных маркеров и способов для их получения описаны в настоящем описании более подробно ниже.
Способ обнаружения локуса количественного признака (QTL), связанный с устойчивостью к Botrytis у томата по настоящему изобретению, может далее быть улучшен путем уменьшения экспериментальных различий в биоанализе и/или созданием инбредной популяции полного возвратного скрещивания (BIL). При использовании такой линии BIL в комбинации со способами по настоящему изобретению количественная устойчивость к B. cinerea может быть оценена еще более точно, причем могут быть идентифицированы дополнительные QTL.
Молекулярные маркеры и QTL
Молекулярные маркеры используются для визуализации различий в последовательностях нуклеиновых кислот. Эта визуализация возможна благодаря методам ДНК-ДНК гибридизации (RFLP) и/или благодаря методам с использованием полимеразной цепной реакции (например, STS, микросателлиты, AFLP). Все различия между двумя родительскими генотипами будут расщепляться при составлении карты популяции (например, ВС1, F2; см. фиг.2), основанной на скрещивании указанных родительских генотипов. Может быть сравнено расщепление различных маркеров, причем могут быть вычислены частоты рекомбинации. Частоты рекомбинации молекулярных маркеров на различных хромосомах обычно составляют 50%. Между молекулярными маркерами, расположенными на той же самой хромосоме, частота рекомбинации зависит от расстояния между маркерами. Низкая частота рекомбинации соответствует малому расстоянию между маркерами на хромосоме. Сравнение всех частот рекомбинации приведет к самому логичному порядку молекулярных маркеров на хромосомах. Указанный самый логичный порядок может быть изображен на карте сцепления (Paterson, 1996). Группа соседних или смежных маркеров на карте сцепления, которая является связанной с уменьшенной заболеваемостью и/или сниженной скоростью роста повреждений, точно определяет положение QTL.
После идентификации QTL эффект QTL (устойчивость) может, например, быть подтвержден путем оценки Botrytis-устойчивости в потомствах BC2S1, расщепляющихся по QTL при исследовании. Оценка Botrytis-устойчивости может быть выполнена подходящим способом при использовании биоанализа стебля или листа, как описано в настоящем описании.
QTL, вызывающие устойчивость к Botrytis у томата, получаемые при использовании способа по настоящему изобретению, представляют собой объект настоящего изобретения. Особенность указанных QTL заключается в том, что, присутствуя в растениях, они являются показателем наличия уменьшенной заболеваемости и/или сниженного темпа роста повреждений после контакта указанного растения с инфекционной дозой материала Botrytis, причем указанный материал можно приготовить в любой форме, как в форме конидий, так и мицелия.
Настоящее изобретение также относится к QTL для устойчивости к Botrytis у томата, где указанный QTL отобран из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанных с устойчивостью к Botrytis. Эти QTL могут быть более четко определены или обозначены маркерами, перечисленными в таблицах 1 и 2, и как показано в фиг.1, 5 и 6. Таблица 1 и фиг.1 и 6 показывают QTL, найденные в популяции F2, полученной скрещиванием L. esculentum сорта Moneymaker × L. hirsutum LYC 4/78. Таблица 2 и фиг.5 показывают QTL, найденные в популяции F2, полученной скрещиванием L. esculentum сорта Moneymaker × L. parviflorum G1.1601. В обеих таблицах область генома, где расположены QTL, обозначена перечисленными AFLP-маркерами. QTL по настоящему изобретению включают генетическую информацию в форме ДНК, ответственную за то, чтобы вызвать (частичную) заболеваемость Botrytis или сниженный темп роста повреждений Botrytis на растении томата. Генетическая информация может, например, включать ген или регуляторный элемент.
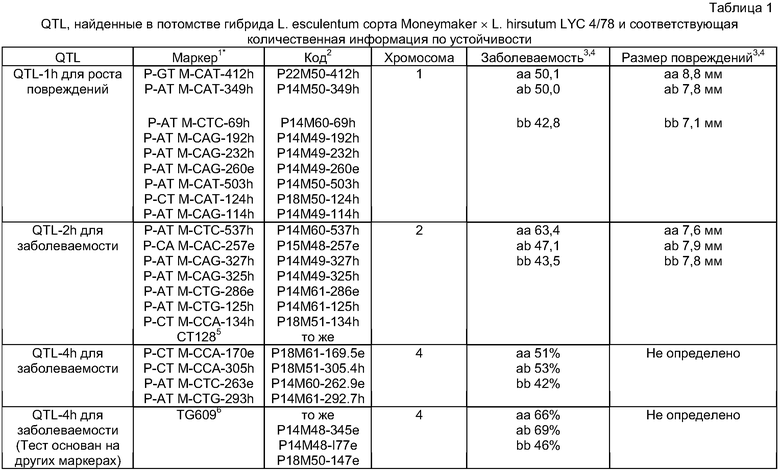
1Номенклатура маркеров: например, P-GT М-САТ-412h, где P и М представляют собой обычные последовательности праймеров или универсальные праймеры PstI и MseI (Vos et al., 1995; Bai et al. 2003), дополненные 2 или 3 дополнительными селективными основаниями, что обозначено двузначным расширенным кодом. 412 означает приблизительный размер, в парах оснований, получающегося полиморфного фрагмента (данный размер ± 2 п.н.). Указанный размер обычно округляется, но может также приводиться в дробных числах. Этот фрагмент амплифицирован либо в L. esculentum сорта Moneymaker (e), либо в L. hirsutum LYC 4/78 (h). Последовательности праймеров и адаптеров подробно описаны Bai et al. 2003.
2Коды, которыми обычно обозначается комбинация праймеров AFLP. Для P, М см. номенклатуру маркеров. Двузначные расширенные коды следующие: 14: AT; 15: CA; 18: CT; 22: GT; 48: CAC; 49: CAG; 50: CAT; 51: CCA; 60: CTC; 61: CTG.
3aa, маркер гомозиготного L. esculentum; ab, маркер гетерозиготного; bb, маркер гомозиготного дикого родственного вида L. hirsutum LYC 4/78.
4Заболеваемость и рост повреждений определены с использованием методов, как подробно объяснено в примерах.
5CT128 (см. таблицу 25) является маркером, расположенным на хромосоме 2 в положении 44 сМ на карте Тенксли (Tanksley et al., 1992).
6TG609 (см. таблицу 20) является маркером RFLP, расположенным на хромосоме 4 в положении 38 сМ на комбинированной карте Tomato-EXPEN 1992, основанной на S. lycopersicum сорта VF36 × S. pennellii LA716 популяции F2 (Tanksley et al., 1992).
Наиболее достоверно геномная область, где расположен QTL-1h, помещена между маркерами TG301 (таблица 11) и TG460.61 (таблица 12), как показано на фиг.6. Таким образом, любой маркер, расположенный в пределах указанной области, может использоваться для оценки присутствия QTL в геноме растения, так же как и любой другой маркер, о котором известно, что он расположен в указанной области, что основано на публично доступной информации, такой как консенсусные карты Tomato-EXPEN 1992 (Tanksley et al., 1992), Tomato-EXHIR 1997 (Bernacchi и Tanksley, 1997), Tomato-EXPEN 2000 (Fulton et al., 2002) или Tomato-EXPIMP 2001 (Grandillo и Tanksley, 1996; Tanksley et aL 1996, Doganlar et al. 2002). Большинство предпочтительных областей обозначено столбцом на фиг.6.
Наиболее достоверно геномная область, где расположен QTL-2h, помещена между маркерами TG145 (таблица 15) и At5g64670 (таблица 19), как показано на фиг.6. Таким образом, любой маркер, расположенный в пределах указанной области, может использоваться для оценки присутствия QTL в геноме растения, так же как и любой другой маркер, о котором известно, что он расположен в указанной области, что основано на публично доступной информации. Большинство предпочтительных областей обозначено столбцом на фиг.6.
Наиболее достоверно геномная область, где расположен QTL-4h, помещена между маркерами TG609 (таблица 20) и C2At1g74970 (таблица 24), как показано на фиг.6. Таким образом, любой маркер, расположенный в пределах указанной области, может использоваться для оценки присутствия QTL в геноме растения, так же как и любой другой маркер, о котором известно, что он расположен в указанной области, что основано на публично доступной информации.
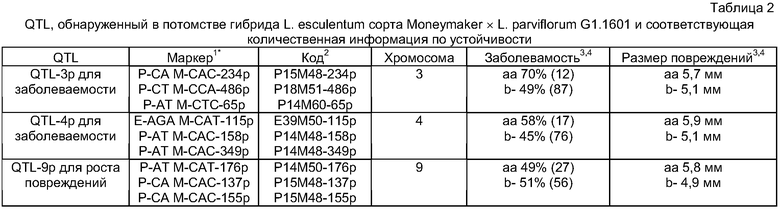
1Номенклатура маркеров: например, P-CA M-CAC-234p, где P, M и E представляют собой обычные последовательности праймеров или универсальные праймеры PstI, EcoRI и MseI (Vos et al., 1995; Bai et al. 2003), дополненные 2 или 3 дополнительными селективными основаниями. 234 означает приблизительный размер, в парах оснований получающегося полиморфного фрагмента (данный размер ± 2 п.н.). Этот фрагмент амплифицирован либо в L. esculentum сорта Moneymaker (e), либо в L. parviflorum G1.1601 (p). Последовательности праймеров и адаптеров подробно описаны Bai et al., 2003.
2Коды, которыми обычно обозначается комбинация праймеров AFLP. Для P, М см. номенклатуру маркеров.
3aa, маркер гомозиготного L. esculentum; b-, одноаллельный дикий родственный вид (в настоящем описании L. parviflorum), а другим аллелем может быть либо L. esculentum, либо дикий родственный вид.
Наиболее достоверно геномная область, где расположен QTL-3р, обозначена маркерами P15M48-234, Р18М50-167, TG599, P18M51-486, P22M50-151 и P14M60-65.
Наиболее достоверно геномная область, где расположен QTL-4p, обозначена маркерами P14M48-158 и P14M48-34xCD (= P14M48-349 в таблице 2).
Наиболее достоверно геномная область, где расположен QTL-9p, обозначена маркерами TG10, P22M50-56, P14M48-56, P14M50-82, P14M50-204, P15M48-138 (= P15M48-137 в таблице 2), P14M50-174 (= P14M50-176 в таблице 2), P22M51-201, P15M48-54, TM2a, P22M51-165, P14M48-120, TG551, P15M48-16xCD (= P15M48-155 в таблице 2).
Все маркеры для QTL, найденного в потомстве гибрида L. esculentum сорта Moneymaker × L. parviflorum G1.1601, как описано в настоящем описании, так же как и любой другой маркер, о котором известно, что он расположен в указанной области, что основано на публично доступной информации, могут использоваться в качестве объектов настоящего изобретения.
Предпочтительно, QTL по настоящему изобретению включает по меньшей мере один маркер таблицы 1 или 2 или показанный на фиг.1, 5 или 6, связанный с указанным QTL, поскольку последовательность нуклеиновых кислот QTL, который является ответственным за придание устойчивости к Botrytis, может быть всего лишь фрагментом целого QTL, описанного в настоящем описании, причем маркеры просто указывают связанное наследование генетических областей или отсутствие наблюдаемой рекомбинации в пределах таких генетических областей. Поэтому отмечено, что маркеры, перечисленные в таблицах 1 и 2, а также обозначенные на фиг.1, 5 и 6, указывают хромосомную область, где QTL по настоящему изобретению расположен в геноме указанных линий Lycopersicon, и что указанные маркеры необязательно определяют границы или структуру указанного QTL. Таким образом, часть QTL, которая включает основную придающую устойчивость последовательность (последовательности) нуклеиновых кислот, может быть значительно меньшей, чем последовательность, обозначенная смежными маркерами, перечисленными для конкретного QTL. Указанная часть в настоящем описании упоминается как "придающая устойчивость часть" QTL. В результате придающая устойчивость часть QTL необязательно должна включать любой из указанных перечисленных маркеров. Для того чтобы указать различные QTL, можно также использовать другие маркеры, при условии, что такие маркеры генетически связаны с QTL, и специалист в данной области техники может найти или использовать QTL, который является аналогом маркеров по настоящему изобретению, но среди которых отсутствует один или несколько маркеров, которые перечислены в таблице 1 или 2 или обозначены на фиг.1, 5 или 6, как связанные с указанным QTL.
Часть QTL для устойчивости к Botrytis у томата, придающая устойчивость к Botrytis, может быть обнаружена с использованием метода молекулярных маркеров, например, с одним или несколькими маркерами для QTL, указанными в таблице 1 или 2 или показанными на фиг.1, 5 или 6, как связанные с указанным QTL, предпочтительно, в комбинации с биоанализом на устойчивость. Растения томатов, которые не включают часть QTL, придающую устойчивость к Botrytis по настоящему изобретению, относительно восприимчивы к инфекции Botrytis.
Маркеры по настоящему изобретению могут очень целесообразно использоваться, чтобы обнаружить присутствие одного или нескольких QTL по настоящему изобретению в предполагаемо устойчивом к Botrytis растении томата, и могут поэтому использоваться в методах, включающих маркер-опосредованную селекцию и отбор устойчивых к Botrytis растений томата. Предпочтительно, обнаружение присутствия QTL по настоящему изобретению выполняется с по меньшей мере одним из маркеров для QTL, показанных в таблице 1 или 2 или также указанным на фиг.1, 5 или 6, как связанным с указанным QTL. Настоящее изобретение, таким образом, относится в другом аспекте к способу обнаружения присутствия QTL Botrytis-устойчивости, включая обнаружение присутствия последовательности нуклеиновых кислот указанного QTL в предполагаемо устойчивом к Botrytis растении томата, причем указанное присутствие может быть обнаружено при помощи упомянутых маркеров.
Последовательность нуклеиновых кислот QTL по настоящему изобретению может быть определена методами, известными специалисту в данной области техники. Например, последовательность нуклеиновых кислот, включающая указанный QTL или придающую устойчивость часть указанного QTL, может быть выделена из Botrytis-устойчивого растения-донора путем фрагментации генома указанного растения, с последующим отбором тех фрагментов, которые содержат один или несколько маркеров, являющихся показательными по отношению к указанному QTL. Впоследствии, или альтернативно, последовательности маркеров (или части указанных последовательностей), показательные по отношению к указанному QTL, могут использоваться как (ПЦР) амплификационные праймеры для того, чтобы амплифицировать последовательность нуклеиновых кислот указанного QTL из образца геномной ДНК или фрагмента генома, полученного от указанного растения. Для того чтобы получить отдельный QTL, амплифицированная последовательность затем может быть очищена. Нуклеотидная последовательность QTL и/или любых дополнительных маркеров, включенных в указанную последовательность, может затем быть получена с помощью стандартных методов секвенирования.
Поэтому настоящее изобретение также относится к выделенной последовательности нуклеиновых кислот (предпочтительно, ДНК), которая включает QTL по настоящему изобретению или части QTL, придающие устойчивость к Botrytis. Таким образом, маркеры, которые точно определяют различные QTL, описанные в настоящем описании, могут использоваться для идентификации, выделения и очистки одного или нескольких генов томата, которые кодируют устойчивость к Botrytis.
Нуклеотидная последовательность QTL по настоящему изобретению может также быть определена, например, путем определения нуклеотидной последовательности одного или нескольких маркеров, связанных с указанным QTL, и созданием внутренних праймеров для указанных последовательностей маркера, которые могут затем использоваться для дальнейшего определения последовательности QTL вне указанных маркерных последовательностей. Например, нуклеотидная последовательность маркеров AFLP таблиц 1 и 2 может быть получена путем выделения указанных маркеров из электрофорезного геля, используемого в определении присутствия указанных маркеров в геноме анализируемого растения, и определения нуклеотидной последовательности указанных маркеров, например, с помощью методов терминации синтеза цепи в присутствии дидезоксинуклеотидов, хорошо известных из уровня техники.
В вариантах осуществления данных методов для обнаружения присутствия QTL в предполагаемом устойчивом к Botrytis растении томата указанный метод может также включать следующие стадии: получение олигонуклеотида или полинуклеотида, способного к гибридизации при жестких гибридизационных условиях с нуклеотидной последовательностью маркера, связанного с указанным QTL и, предпочтительно, выбранного из маркеров таблиц 1 и 2 и показанных на фиг.1, 5 или 6 как связанных с указанным QTL; связывание указанного олигонуклеотида или полинуклеотида с геномной ДНК предполагаемо устойчивого к Botrytis растения томата; а также определение наличия специфической гибридизации указанного олигонуклеотида или полинуклеотида с указанной геномной ДНК. Предпочтительно, указанный способ выполняется на образце ДНК, выделенном из указанного предполагаемо устойчивого к Botrytis растения томата, хотя могут также использоваться методы in situ гибридизации. Альтернативно, и в более предпочтительном варианте осуществления, специалист в данной области техники может, как только нуклеотидная последовательность QTL была определена, создать специфические гибридизационные пробы или олигонуклеотиды, способные к гибридизации при жестких гибридизационных условиях с нуклеотидной последовательностью указанного QTL, и может использовать указанные гибридизационные пробы в способах обнаружения присутствия QTL по настоящему изобретению в предполагаемо устойчивом к Botrytis растении томата.
Фраза "строгие гибридизационные условия" относится к условиям, при которых проба или полинуклеотид будут гибридизоваться со своей целевой субпоследовательностью, обычно в сложной смеси нуклеиновых кислот, но по существу ни с какими другими последовательностями. Строгие условия зависят от последовательности и будут отличаться при различных обстоятельствах. Более длинные последовательности гибридизуются при определенно более высоких температурах. Обширное руководство по гибридизации нуклеиновых кислот найдено Thijssen, 1993. В основном строгие условия выбирают таким образом, чтобы температура была на 5-10°C ниже, чем точка теплового плавления (т.пл.) для конкретной последовательности при определенной ионной силе и pH. Т.пл. представляет собой температуру (при определенной ионной силе, pH и концентрации нуклеиновой кислоты), при которой 50% проб, комплементарных целевой последовательности, гибридизуются с целевой последовательностью в равном отношении (так как целевые последовательности присутствуют в избытке при т.пл., 50% проб заняты в равном отношении). Строгие условия будут являться такими условиями, при которых концентрация соли является меньшей приблизительно 1,0 М ионов натрия, обычно приблизительно от 0,01 до 1,0 М ионов натрия (или других солей), при pH от 7,0 до 8,3 и температуре по меньшей мере 30°C для коротких проб (например, 10-50 нуклеотидов) и по меньшей мере 60°C для длинных проб (например, более 50 нуклеотидов). Строгие условия могут также быть достигнуты с помощью добавки дестабилизирующих агентов, таких как формамид. В случае селективной или специфической гибридизации положительный сигнал превышает фон по меньшей мере в два раза, предпочтительно, в 10 раз. Стандартные строгие гибридизационные условия являются следующими: 50% формамид, 5×SSC (цитратно-солевой буфер) и 1% SDS, инкубация при 42°C, или 5×SSC, 1% SDS, инкубация при 65°C, с отмывкой в 0,2×SSC, и 0,1% SDS при 65°C. Для ПЦР температура приблизительно 36°C является типичной для амплификации низкой строгости, хотя температуры отжига можно варьировать между приблизительно 32 и 48°C в зависимости от длины праймера. Дополнительные методические руководства для определения параметров гибридизации приведены в многочисленных ссылках, например Current Protocols in Molecular Biology, eds. Ausubel, et al., 1995.
"Нуклеиновая кислота" или "олигонуклеотид", или "полинуклеотид", или грамматические эквиваленты, используемые в настоящем описании, означают по меньшей мере два ковалентно связанных нуклеотида. Олигонуклеотиды обычно составляют в длину от приблизительно 7, 8, 9, 10, 12, 15, 18, 20, 25, 30, 40, 50 до приблизительно 100 нуклеотидов. Нуклеиновые кислоты и полинуклеотиды представляют собой полимеры любой длины, включая большие длины, например, 200, 300, 500, 1000, 2000, 3000, 5000, 7000, 10000 и т.д. Нуклеиновая кислота по настоящему изобретению обычно будет включать сложные фосфодиэфирные связи, хотя в некоторых случаях используются аналоги нуклеиновой кислоты, которые могут иметь дополнительные основания, включающие, например, фосфорамидат, фосфортиоат, фосфордитиоат, или O-метилфосфорамидитные связи (смотрите Eckstein, 1991), и основания и связи пептидо-нуклеиновых кислот. Могут использоваться смеси встречающихся в природе нуклеиновых кислот и их аналогов. Особенно предпочтительными аналогами олигонуклеотидов являются пептидо-нуклеиновые кислоты (PNA).
Получение Botrytis-устойчивых растений томатов трансгенными методами
Согласно другому объекту настоящего изобретения последовательность нуклеиновых кислот (предпочтительно, ДНК), включающая по меньшей мере один QTL по настоящему изобретению или части QTL, придающие устойчивость к Botrytis, может использоваться для получения Botrytis-устойчивого растения томата. В указанном аспекте изобретение предусматривает использование QTL по настоящему изобретению или частей QTL, придающих устойчивость к Botrytis, чтобы получить Botrytis-устойчивое растение томата, использование которого включает введение последовательности нуклеиновых кислот, соответствующей указанному QTL, в Botrytis-восприимчивое реципиентное растение томата. Как отмечено, указанная последовательность нуклеиновых кислот может быть получена из подходящего Botrytis-устойчивого донорного растения томата. Два подходящих Botrytis-устойчивых донорных растения томата, способных предоставить последовательность нуклеиновых кислот, включающую по меньшей мере один из вышеописанных QTL или частей QTL, придающих устойчивость к Botrytis, являются L. hirsutum LYC 4/78 и L. parviflorum G1.1601. Другие родственные растения томата, которые показывают устойчивость к Botrytis и включают один или несколько генов, которые кодируют устойчивость к Botrytis, могут также использоваться в качестве растений-доноров Botrytis-устойчивости, поскольку настоящее изобретение описывает, каким образом может быть проанализирован указанный материал. Образцы других видов томатов могут быть исследованы на предмет Botrytis-устойчивости, включающие, но не ограниченные: Lycopersicon cerasiforme, Lycopersicon cheesmanii, Lycopersicon chilense, Lycopersicon chmielewskii, Lycopersicon esculentum, Lycopersicon hirsutum, Lycopersicon parviflorum, Lycopersicon pennellii, Lycopersicon peruvianum, Lycopersicon pimpinellifolium и Solanum lycopersicoides.
После того, как в подходящем донорном растении томата обнаружена последовательность нуклеиновых кислот, которая включает QTL Botrytis-устойчивости по настоящему изобретению или части QTL, придающие устойчивость к Botrytis, указанная последовательность может быть перенесена в подходящее растение-реципиент любым доступным способом. Например, указанная последовательность нуклеиновых кислот может быть перенесена путем скрещивания Botrytis-устойчивого донорного растения томата с восприимчивым реципиентным растением томата (т.е. интрогрессией), путем трансформации, слияния протопластов, метода удвоения гаплоидов или изъятия эмбриона, или с использованием любой другой системы переноса нуклеиновых кислот, дополнительно сопровождаемой селекцией растений потомства, включающих QTL и демонстрирующих Botrytis-устойчивость. Для трансгенных методов переноса последовательность нуклеиновых кислот, включающая QTL Botrytis-устойчивости по настоящему изобретению или части QTL, придающие устойчивость к Botrytis, может быть выделена из указанного растения-донора при использовании способов, известных из уровня техники, и выделенная таким образом последовательность нуклеиновых кислот может быть перенесена в растение-реципиент трансгенными методами, например посредством вектора, в гамете или в любом другом подходящем элементе переноса, таком как баллистическая частица, покрытая указанной последовательностью нуклеиновых кислот.
Трансформация растений обычно включает конструирование экспрессионного вектора, который будет функционировать в клетках растения. В настоящем изобретении указанный вектор включает последовательность нуклеиновых кислот, которая включает QTL Botrytis-устойчивости по настоящему изобретению или части QTL, придающие устойчивость к Botrytis, причем указанный вектор может включать ген, придающий устойчивость к Botrytis, который находится под контролем или функционально связан с регуляторным элементом, таким как промотор. Экспрессионный вектор может включать одну или несколько указанных функционально связанных комбинаций ген/регуляторный элемент, при условии, что по меньшей мере один из генов, включенных в комбинации, кодирует Botrytis-устойчивость. Вектор(ы) может быть в форме плазмиды и может использоваться один или в комбинации с другими плазмидами, с целью получения трансгенных растений, которые являются устойчивыми к Botrytis, с использованием способов трансформации, известных из уровня техники, таких как система трансформации на основе Agrobacterium (агробактериальная трансформация).
Экспрессионные векторы могут включать по меньшей мере один маркерный ген, функционально связанный с регуляторным элементом (таким как промотор), и которые позволяют отбирать трансформированные клетки, содержащие маркер, либо с помощью негативной селекции (путем ингибирования роста клеток, которые не содержат селективный маркерный ген), либо с помощью позитивной селекции (путем скрининга продукта, кодируемого маркерным геном). Из уровня техники известно много обычно используемых селективных маркерных генов для трансформации растений, в перечень которых включены, например, гены, кодирующие ферменты, которые метаболически детоксифицируют селективный химический агент, которым может являться антибиотик или гербицид, или же гены, кодирующие измененную мишень, которая является нечувствительной к ингибитору. Несколько способов позитивной селекции известны из уровня техники, например маннозная селекция. Альтернативно, может использоваться трансформация без маркера, чтобы получать растения без упомянутых маркерных генов с помощью способов, которые известны из уровня техники.
Один метод введения экспрессионного вектора в растение основан на природной системе трансформации на основе Agrobacterium (см., например, Horsch et al., 1985). А. tumefaciens и A. rhizogenes представляют собой растительные патогенные почвенные бактерии, которые генетически трансформируют клетки растения. Плазмиды Ti и Ri А. tumefaciens и А. rhizogenes, соответственно, несут гены, ответственные за генетическую трансформацию растения (см., например, Kado, 1991). Методы введения экспрессионных векторов в ткань растения включают прямое заражение или сокультивирование клеток растения с Agrobacterium tumefaciens (Horsch et al., 1985). Описания систем векторов Agrobacterium и методов для Agrobacterium-опосредованного переноса генов приведены Gruber и Crosby, 1993, и Moloney et al., 1989. См. также патент США 5591616. Общие описания растительных экспрессионных векторов и репортерных генов, а также методики трансформации и описания векторных систем Agrobacterium и методов для Agrobacterium-опосредованного переноса генов могут быть найдены у Gruber и Crosby, 1993. Основные методы культивирования растительных тканей приведены, например, Mild et al., 1993, и Phillips et al., 1988. Подходящим рекомендованным руководством для методов молекулярного клонирования и подходящих экспрессионных векторов является Sambrook и Russell (2001).
Другой способ введения экспрессионного вектора в растение основан на трансформации, опосредованной микроснарядами, где ДНК нанесена на поверхность микроснарядов. Экспрессионный вектор вводят в ткани растения биолистическим устройством, которое ускоряет микроснаряды до скоростей 300-600 м/с, которые являются достаточными, чтобы проникнуть через растительные клеточные стенки и мембраны (см. Sanford et al., 1987, 1993; Sanford, 1988, 1990; Klein et al., 1988, 1992). Другой метод введения ДНК в растение состоит в обработке целевых клеток ультразвуком (см. Zhang et al., 1991). Альтернативно, для введения экспрессионного вектора в растение использовалиь слияние липосом или сферопластов (см., например, Deshayes et al., 1985, и Christou et al., 1987). Также сообщалось о прямом введении ДНК в протопласты, используя осаждение CaCl2, поливиниловый спирт или поли-L-орнитин (см., например, Hain et al., 1985, и Draper et al., 1982). Также была описана электропорация протопластов и целых клеток и тканей (D'Halluin et al., 1992, и Laursen et al., 1994).
Последующая трансформация целевых тканей томата, экспрессия вышеописанных селективных маркерных генов позволяют проводить избирательную селекцию трансформированных клеток, тканей и/или растений, используя способы регенерации и отбора, хорошо известные из современного уровня техники. Маркеры таблицы 1 или 2 можно также использовать с этой целью.
Получение Botrytis-устойчивых растений томатов нетрансгенными методами
В альтернативном варианте осуществления для получения Botrytis-устойчивого растения томата можно использовать слияние протопластов для переноса нуклеиновых кислот из растения-донора в растение-реципиент. Слияние протопластов представляет собой вынужденное или спонтанное объединение, такое как соматическая гибридизация, между двумя или большим количеством протопластов (клеток, клеточные стенки которых удалены ферментативной обработкой), с целью получения одиночной, ди- или многоядерной клетки. Объединенная клетка, которая может даже быть получена с теми разновидностями растения, которые не могут быть подвергнуты межвидовому скрещиванию в природе, является тканью, культивируемой в гибридное растение, проявляющее требуемую комбинацию признаков. Более конкретно, первый протопласт может быть получен от растения томата или другой линии растений, которые показывают устойчивость к инфекции Botrytis. Например, может использоваться протопласт от L. hirsutum LYC 4/78. Второй протопласт может быть получен от второго томата или от растения другого вида, предпочтительно томатной линии, которая включает коммерчески требуемые признаки, такие как, но не ограниченные устойчивостью к болезням, устойчивостью к насекомым, ценными характеристиками плодов и т.д. Слияние протопластов далее проводят с использованием традиционных способов слияния протопластов, которые известны из уровня техники.
Альтернативно, для переноса нуклеиновой кислоты, включающей один или несколько QTL по настоящему изобретению, от растения-донора к растению-реципиенту, может использоваться изъятие эмбриона. Изъятие эмбриона может использоваться в качестве способа для выделения эмбриона от гибридов, которые представляют собой растения, неспособные производить жизнеспособное семя. В этом процессе, из оплодотворенной яйцеклетки или незрелого семени растения культивируют ткань, чтобы создать новые растения (Pierik, 1999).
Настоящее изобретение также относится к способу создания Botrytis-устойчивого растения томата, включающему стадии выполнения метода для обнаружения присутствия локуса количественного признака (QTL), связанного с устойчивостью к B. cinerea в донорном растении томата по настоящему изобретению, как описано выше, и стадии переноса последовательности нуклеиновых кислот, включающую по меньшей мере один QTL, таким образом обнаруженный, или часть QTL, придающую устойчивость к Botrytis, от указанного растения-донора к Botrytis-восприимчивому реципиентному растению томата. Перенос указанной последовательности нуклеиновых кислот может быть выполнен любым из методов, предварительно описанных в настоящем описании.
Предпочтительный вариант осуществления такого метода включает перенос путем интрогрессии указанной последовательности нуклеиновых кислот от Botrytis-устойчивого донорного растения томата в Botrytis-восприимчивое реципиентное растение томата с помощью скрещивания указанных растения. Этот перенос может быть, таким образом, надлежащим способом достигнут при использовании традиционных способов селекции. QTL в предпочтительном варианте осуществления интрогрессируются в коммерческие сорта томатов при использовании маркер-опосредованного скрещивания (MAS). Маркер-опосредованное скрещивание или маркер-опосредованная селекция включают использование одного или нескольких молекулярных маркеров для идентификации и отбора тех растений потомства, которые содержат один или несколько генов, которые кодируют требуемый признак. В настоящем случае такая идентификация и селекция основаны на отборе QTL по настоящему изобретению или маркеров, связанных с QTL. MAS может также использоваться, чтобы вывести почти изогенные линии (NIL), содержащие нужные QTL, и позволяющий более детально исследовать эффект каждого QTL, и являющийся также эффективным способом для выведения популяций обратно скрещенных инбредных линий (BIL) (см., например, Nesbitt et al, 2001; van Berloo et al, 2001). Растения томата, выведеные согласно указанному предпочтительному варианту осуществления, могут успешно унаследовать большинство исходных признаков от растения-реципиента и унаследовать Botrytis-устойчивость от растения-донора.
Так как теперь известно, что устойчивость к B. cinerea наследуется полигенетически, целесообразно, чтобы по меньшей мере два, предпочтительно, три QTL или части QTL, придающие устойчивость к Botrytis, были введены подходящим способом переноса в конкретное растение-реципиент, то есть чтобы множественные QTL были помещены в геноме растения-реципиента. Полагают, что введение кассет из двух или большего количества QTL по настоящему изобретению может привести к увеличенной устойчивости к Botrytis. Поскольку специалист в данной области техники без труда поймет, что введение кассет может быть достигнуто любым способом, например, при помощи трансформации растения конструкцией нуклеиновой кислоты, включающей множественные QTL по настоящему изобретению. Альтернативно, по меньшей мере, один QTL может присутствовать в каждом родительском растении гибрида так, чтобы по меньшей мере два QTL содержались в получающемся в результате гибриде. С помощью кассетной укладки указанных признаков устойчивости могут быть получены очень устойчивые растения. Такие растения представляют собой в высшей степени предпочтительные варианты осуществления настоящего изобретения.
Как кратко обсуждалось выше, для интрогрессии последовательности нуклеиновых кислот, кодирующей устойчивость к Botrytis, в Botrytis-восприимчивое реципиентное растение томата могут использоваться традиционные способы селекции. В одном способе, который упоминается как племенная селекция, донорное растение томата, которое показывает устойчивость к Botrytis, и включает последовательности нуклеиновой кислоты, кодирующей устойчивость к Botrytis, скрещивают с Botrytis-восприимчивым реципиентным растением томата, который, предпочтительно, проявляет коммерчески требуемые признаки, такие как, но не ограниченные, устойчивостью к болезням, устойчивостью к насекомым, ценными характеристиками плодов и т.д. Получающаяся в результате популяция растений (представляющая собой гибриды F1) далее самоопыляется и дает семена (семена F2). Растения F2, выращенные из семян F2, затем тестируют на предмет устойчивости к Botrytis. Указанная популяция может быть проскринирована множеством различных способов.
Во-первых, популяция может быть проскринирована с использованием стандартного скрининга болезни. Такие методы скрининга болезни известны из уровня техники. Предпочтительно, используется количественный биоанализ инфекции стебля или листа, предпочтительно, биоанализ стебля, используемый в способах по настоящему изобретению, как более подробно изложено выше и используется в примерах. Во-вторых, может быть выполнен маркер-опосредованный отбор с использованием одного или нескольких вышеописанных молекулярных маркеров, с целью идентифицировать те растения потомства, которые включают последовательности нуклеиновых кислот, кодирующие Botrytis-устойчивость. Для обнаружения присутствия QTL могут использоваться другие вышеуказанные методы. Кроме того, для подтверждения результатов, полученных из количественных биоанализов, может использоваться маркер-опосредованный отбор и таким образом могут также использоваться несколько методов в комбинации.
Botrytis-устойчивые растения и семена томата
Botrytis-устойчивое растение томата по настоящему изобретению характеризуется наличием высокого уровня устойчивости. Высокий уровень устойчивости определен как являющийся уровнем устойчивости, который выше наблюдаемого у восприимчивых контрольных растений. Фактически, растения по настоящему изобретению имеют уровень устойчивости, который выше уровня устойчивости у любого коммерческого сорта томатов, то есть сорта, имеющего коммерчески требуемые признаки, известные до настоящего времени. Растение по настоящему изобретению имеет восприимчивость к Botrytis cinerea, которая по меньшей мере в 3 раза ниже, чем у восприимчивого контрольного растения при измерении биоанализом. Например, при измерении биоанализом средней длины повреждения стебля, вызванного Botrytis cinerea, инфекция у взрослых растений оценивалась в течение периода трех недель при стандартных условиях деятельности, как описано более подробно в примерах 3.10 и 3.11. Типично, растение по настоящему изобретению имеет уровень устойчивости, который приводит к средней длине повреждения стебля, вызванного Botrytis cinerea на взрослых растениях, меньше 3,2 см через три недели после инокуляции с использованием стандартных условий деятельности в биоанализе на устойчивость, разработанном для определения устойчивости, основанной на указанных признаках. Более типично, растение по настоящему изобретению показывает среднюю длину повреждения стебля меньше 2,9 см. Некоторые растения по настоящему изобретению показывают среднюю длину повреждения стебля даже 2,0 см. Принимая во внимание то, что указанные числа выражают длину повреждения, включая первоначальный размер раны от инокуляции, равный 2 см, можно сделать вывод, что высокий уровень устойчивости, и даже полная устойчивость в случае некоторых QTL, наблюдается у растений по настоящему изобретению. В сравнении, восприимчивые контрольные растения показывают среднее значение длины повреждения стебля при тех же самых условиях от приблизительно 3,6 см до приблизительно 6,0 см, со средним значением 4,85 см (см. таблицу 10). Также в качестве сравнения, L. hirsutum LA 1777, включающий QTL-10, частично Botrytis-устойчивый источник WO02/085105, показывает среднюю длину повреждения стебля при тех же самых условиях приблизительно 4,3 см. Таким образом, растения по настоящему изобретению показывают в вышеупомянутом биоанализе на устойчивость чистые повреждения стебля, которые являются в основном меньше приблизительно 30% (0,9/2,85 х 100%) от чистой длины повреждений восприимчивых контрольных растений, и в основном меньше приблизительно 40% (0,9/2,3×100%) от чистой длины повреждений частично стойкого L. hirsutum LA 1777.
Таким образом, растение по настоящему изобретению при измерении в биоанализе имеет восприимчивость к Botrytis cinerea, которая в 3 раза ниже или которая является меньшей 1/3 уровня восприимчивости восприимчивого контрольного растения. Соответственно, растение по настоящему изобретению является более чем в 3 раза более устойчивым, чем восприимчивое контрольное растение, также определенное в настоящем описании и оцененное биоанализом, как было описано. В случае некоторых QTL или комбинаций QTL (например, QTL-1h и комбинаций QTL-3p+QTL-4p или QTL-9p+QTL-4p) наблюдали полную устойчивость (см. таблицу 10). Восприимчивое контрольное растение определено как растение, показывающее нормальную восприимчивость, или не проявляющее устойчивость, к инфекции Botrytis cinerea. Примерами восприимчивых растений контроля являются гибрид Lycopersicon esculentum сорта "Tradiro" и Lycopersicon esculentum сорта "Moneyberg" (De Ruiter Seeds CV, Bergschenhoek, Нидерланды).
Botrytis-устойчивое растение томата или его часть, доступная в соответствии со способом по настоящему изобретению, также представляет собой объект настоящего изобретения.
Другой объект настоящего изобретения относится к Botrytis-устойчивым растениям томата или их частям, включающим в пределах своего генома по меньшей мере один QTL или его часть, придающую Botrytis-устойчивость, отобранную из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанных с устойчивостью к Botrytis, где указанный QTL или указанная часть QTL, придающая Botrytis-устойчивость, не находится в своем естественном генетическом фоне. Botrytis-устойчивые растения томата по настоящему изобретению могут представлять собой любой генетический тип, такой как инбредный, гибридный, гаплоидный, диплоидный, партенокарпический или трансгенный. Далее, растения по настоящему изобретению могут быть гетерозиготные или гомозиготные по признаку устойчивости, предпочтительно, гомозиготные. Хотя QTL по настоящему изобретению, так же как и QTL, достижимые с помощью способа по настоящему изобретению, так же как и части QTL, придающие Botrytis-устойчивость, могут быть перенесены в любое растение с целью получения Botrytis-устойчивого растения, причем способы и растения по настоящему изобретению, предпочтительно, относятся к растениям семейства Solanaceae, более предпочтительно, к томату.
При использовании способов возвратной селекции и обратного скрещивания, самоопыления и/или метода дигаплоидов или любого другого способа, используемого для получения родительских линий, могут быть выведены инбредные Botrytis-устойчивые линии растений томата. В методе селекции и обратного скрещивания Botrytis-устойчивость может быть интрогрессирована в целевое растение-реципиент (который называется "возвратный родитель") путем скрещивания возвратного родителя с первым растением-донором (который отличается от возвратного родителя и упоминается в настоящем описании как "невозвратный родитель"). Возвратный родитель представляет собой растение, которое является неустойчивым или имеет низкий уровень устойчивости к Botrytis и обладает коммерчески требуемыми характеристиками, такими как, но не ограничиваясь ими, устойчивостью к болезням, устойчивостью к насекомым, ценными характеристиками плодов и т.д. Невозвратный родитель показывает устойчивость к Botrytis и включает нуклеотидную последовательность, кодирующую устойчивость к Botrytis. Невозвратный родитель может быть растением любого сорта или инбредной линии, которая является перекрестно опыляемой с возвратным родителем. Потомство, полученное от скрещивания возвратного родителя и невозвратного родителя, является обратным скрещиванием с возвратным родителем. Затем получающаяся в результате популяция растений подвергается скринингу. Популяция может быть подвергнута скринингу множеством различных способов. Например, популяция может быть подвергнута скринингу с использованием количественных биоанализов стебля, как в настоящем описании было описано предварительно. Гибридные растения F1, которые демонстрируют Botrytis-устойчивый фенотип, включающие необходимую нуклеотидную последовательность, кодирующую устойчивость к Botrytis, и обладающие коммерчески требуемыми характеристиками, затем отбирают и самоопыляют, после чего подвергают селекции в течение нескольких поколений с целью получения растения томата, которое становится все более и более инбредными. Этот процесс продолжительного самоопыления и селекции может быть выполнен в течение двух-пяти или большего количества поколений. Результат такого скрещивания и селекции представляет собой линии, которые являются генетически гомогенными в отношении генов, связанных с устойчивостью к Botrytis, так же как и в отношении других генов, связанных с признаками коммерческого интереса. Вместо использования фенотипических патологических скринингов биоанализов может быть выполнен MAS с использованием одного или нескольких вышеописанных молекулярных маркеров, гибридизационных проб или полинуклеотидов, чтобы идентифицировать те растения потомства, которые включают последовательности нуклеиновых кислот, кодирующие Botrytis-устойчивость. Альтернативно, MAS может использоваться для подтверждения результатов, полученных из количественных биоанализов. После того, как сделают соответствующие отборы, процесс повторяют. Процесс обратного скрещивания с возвратным родителем и селекцию на Botrytis-устойчивость повторяют приблизительно в течение пяти или большего количества поколений. Потомство, полученное в результате этого процесса, является гетерозиготным по одному или нескольким генам, которые кодируют Botrytis-устойчивость. Последнее поколение обратного скрещивания затем самоопыляют с целью получения чистого сорта Botrytis-устойчивого гомозиготного потомства.
Botrytis-устойчивые инбредные линии томатов, описанные в настоящем описании, могут использоваться в дополнительных скрещиваниях, чтобы создать Botrytis-устойчивые гибридные растения. Например, первое Botrytis-устойчивое инбредное растение томата по настоящему изобретению может быть скрещено со вторым инбредным растением томата, обладающим коммерчески требуемыми признаками, такими как, но не ограничиваясь ими, устойчивостью к болезням, устойчивостью к насекомым, ценными характеристиками плодов и т.д. Эта вторая инбредная линия томатов может быть или же не быть Botrytis-устойчивой.
Другой объект настоящего изобретения относится к способу создания семян, из которых могут быть выращены Botrytis-устойчивые растения томата. В одном варианте осуществления метод включает стадии получения Botrytis-устойчивого растения томата по настоящему изобретению, скрещивания указанного Botrytis-устойчивого растения с растением вида Lycopersicon esculentum, а также сбора семян, полученных от указанного гибрида, которые при посадке дают растения томата, являющиеся Botrytis-устойчивыми.
В другом варианте осуществления метод включает следующие стадии: получение Botrytis-устойчивого растения томата по настоящему изобретению; скрещивание указанного Botrytis-устойчивого растения с растением вида Lycopersicon esculentum, сбора семян, полученных от указанного гибрида; регенерация указанных семян в растения; селекция Botrytis-устойчивых растений любым из методов, описанных в настоящем описании; самоскрещивание отобранных растений в течение достаточного количества поколений, чтобы получить растения, которые проверены на наличие аллеля, который придает растениям Botrytis-устойчивость; обратное скрещивание растений, полученных таким образом, с растениями вида L. esculentum, имеющими требуемые фенотипические признаки, в течение достаточного количества поколений, с целью получения растений L. esculentum, которые являются Botrytis-устойчивыми и имеют требуемые фенотипические признаки; а также сбор семян от растений, полученных в результате последнего обратного скрещивания, которые при посадке дают растения томата, являющиеся Botrytis-устойчивыми.
В качестве примера, а не ограничения, далее будут приведены примеры настоящего изобретения.
ПРИМЕРЫ
Пример 1. Метод выявления растений, устойчивых к Botrytis cinerea
1.1. Введение
Этот пример представляет достижение количественного биоанализа для оценки устойчивости к Botrytis cinerea в коллекции диких генотипов томата.
О частичной устойчивости к Botrytis cinerea в диких разновидностях Lycopersicon уже сообщалось, но эти сообщения в значительной степени были описательными и качественными. Идентификация частично устойчивых генотипов обеспечила бы перспективы для интрогрессии устойчивости в коммерческие сортовые линии, чтобы получить линии с управляемыми уровнями устойчивости. Доступность воспроизводимого, объективного и количественного анализа, наряду с выявлением генотипов с генетически определенной (частичной) устойчивостью к серой гнили, открывает путь для выведения устойчивости у культурных сортов томатов.
Настоящий пример описывает количественный анализ болезни. Анализ проводился на листьях (анализ инокуляции листа) и сегментах стебля (анализ инокуляции стебля). Были исследованы два параметра восприимчивости болезни. Первый параметр был заболеваемостью (DI), т.е. относительное количество капелек инокулята, которое приводило к распространению повреждений. Если неудача (частичная) распространения первичного повреждения, вызванного B. cinerea на растении-хозяине с конкретным генотипом, является генетическим признаком указанного растения, такая черта представляется важной, поскольку это непосредственно ограничивает количество очагов болезни у сельскохозяйственной культуры. Второй проверенный параметр был темпом роста повреждений в течение 24-часов (рост повреждений, LG). Повреждения, которые распространялись от первичного места инокуляции, предположительно, распространялись с равной скоростью (мм/день) в течение долгого времени, пока повреждение не достигало края листа или заднего конца сегмента стебля. Настоящие анализы позволяют количественно оценить как возникновение (заболеваемость), так и развитие (рост повреждения) инфекции, вызванной B. cinerea, приводя к двум сериям количественных характерных данных. Анализ использовался для скрининга коллекции видов Lycopersicon (в дальнейшем также называемых "образцы") на присутствие в них устойчивости.
1.2. Растения
Протестированные генотипы растений перечислены в таблице 3.
Список протестированных генотипов Lycopersicon
(1)DRS: De Ruiter Seeds, Bergschenhoek, The Netherlands; WU PPW: Plantkundig, Proefcentrum Вагенинген, Вагенинген University, Вагенинген, The Netherlands; LoPB: Laboratory of Plant Breeding, Вагенинген University, Вагенинген, The Netherlands; MPIZK: Max Planck Institut für Züchtungsforschung an Kulturpflanze, Köln, Germany; TGRC: Tomato Genetics Resource Center, University of California at Davis, Davis CA, USA; IPK: Institut für Pflanzengenetik und Kulturpflanzenforschung, Gatersleben, Germany.
(2)Y указывает, что генотип был протестирован в индивидуальном испытании, S указывает, что генотип служил восприимчивым эталонным контролем.
(3)Опубликовано до подтверждения устойчивости к B. cinerea.
Растения были выращены в горшечной почве в 12-см горшках в оранжерее с минимальной температурой 15°C. Применялось искусственное освещение натриевой лампой (16 ч/день) с октября до марта. В 6-7 дни после прорастания было добавлено 10 мл раствора FeNa-ЭДТА (3,5 г/л), за которым через 3 дня последовало добавление 10 мл раствора микроэлементов (0,286 г/л H3BO3; 0,1558 г/л MnSO4·H2O; 0,008 г/л CuSO4·Н2О; 0,022 г/л ZnSO4; 0,00196 г/л (NH4)6Mo7O24·4H2O). Начиная с двух недель после прорастания, еженедельно добавляли по 5 мл раствора Хоагланда (5 мМ Са(NO3)2; 5 мМ KNO3; 2 мМ MgSO4; 1 мМ KH2PO4).
1.3. Анализ листьев
Инокулят из штамма B. cinerea B05.10 был приготовлен согласно Benito (1998). Для каждого индивидуального растения один или два сложных листа, которые полностью распрямились, были отделены от главного стебля при помощи острого лезвия и перенесены в предварительно смоченную цветочную пену. Цветочная пена была помещена в чашку Петри, содержащую воду из-под крана, и впоследствии помещена в смоченный брызгами контейнер, содержащий влажную фильтровальную бумагу. Сложные листья затем инокулировали суспензией конидий B. cinerea путем осторожного пипетирования в общей сложности 6-10 капелек инокулята (2 мкл) на верхнюю поверхность листьев. Контейнеры закрывали смоченной брызгами крышкой и инкубировали при 15°C в темноте при 100% RH, в сущности, как описано у Benito et al., 1998. Данные таблицы 4 были получены из теста, в котором один сложный лист был разделен на четыре листка, где каждый листок инокулировали 10 каплями, по 2 мкл каждая, содержащими 2000 конидий. И размеры агрессивно распространяющихся повреждений (заболеваемость), и темп роста повреждений были оценены через несколько дней.
Чтобы исправить погрешность, вызванную временем года или культивированием растений, заболеваемость конкретного генотипа в каждом эксперименте была связана с заболеваемостью сорта Moneymaker, проверенного в том же самом эксперименте.
Размеры повреждений были измерены через 96, 120 и 144 hpi с помощью штангенциркуля. Заболеваемость была оценена путем деления общего количества распространяющихся повреждений на общее количество капелек инокулята. Темпы роста повреждений были определены с помощью вычисления увеличения размера повреждений (в мм) за 24-часовой период. Данные для нераспространяющихся повреждений были удалены из количественного анализа. Результаты анализа листьев представлены в таблице 4.
Заболеваемость (DI, в %) и темпы роста повреждений
(LG, в мм/день ± стандартное отклонение) в листьях образцов Lycopersicon инокулированных B. cinerea.
Эксперименты проводили в 1999 и 2000 годах
в разные недели, как показано
1.4. Анализ стеблей (стандартизованный метод)
Анализ стеблей был проведен следующим образом: верхние 5-10 см и нижние 5-10 см стебля растений приблизительно 50 см высотой были удалены, а остающиеся 30 см, были разрезаны на равные сегменты по 5-6 см. Каждый сегмент стебля был помещен вертикально в решетке, основанием стебля на влажную фильтровальную бумагу. До инокуляции сегменты стебля обрызгивали водой из-под крана, чтобы гарантировать равное распространение инокулята по поверхности раны. Инокулят был приготовлен, как описано в анализе листьев. Одна капля инокулята объемом 5 мкл, включающая приблизительно 106 конидий в 1 мл, была нанесена на вершину каждого сегмента стебля. Инкубации были выполнены при 15±2°C в темноте при 100%-й относительной влажности. Развитие инфекции было определено при измерении максимального усиления симптома гнили штангенциркулем в различных временных периодах после инокуляции.
Для каждого генотипа был вычислен процент инфицированных частей стебля. Заболеваемость была определена путем деления общего количества сегментов стебля с распространяющимися повреждениями на общее количество инокулированных сегментов. Темпы роста повреждений были определены путем вычисления увеличения размера повреждений за 24-часовой период, в соответствии с чем данные для нераспространяющихся повреждений были исключены из анализа. Результаты анализа стеблей представлены в таблице 5.
Заболеваемость (DI, в %) и темпы роста повреждений
(LG, в мм/день ± стандартное отклонение) в сегментах стебля инокулированных B. cinerea образцов Lycopersicon.
Эксперименты проводили в 1999 и 2000 годах
в обозначенных неделях
1.5. Результаты
Заболеваемость и рост повреждений в отдельных экспериментах инфицирования листьев были определены через несколько дней для каждого генотипа, обычно через 2-4 дня после инфицирования. Заболеваемость L. esculentum сорта Moneymaker, который служил эталоном, колебалась в указанных экспериментах между 16 и 78%. В таблице 4 показаны результаты 14 генотипов, для получения которых отдельные сложные листы, происходящие по меньшей мере из 5 индивидуальных растений, инокулировали в 40 точках инокуляции на лист (10 на листок). Заболеваемость в этих 14 генотипах должна быть сравнена с заболеваемостью в контрольной линии L. esculentum сорта Moneymaker, определенной в том же самом эксперименте/неделе.
За исключением генотипов 82/2577 и 83/2896 (оба из вида L. esculentum), проверенные генотипы показали во всех экспериментах более низкую заболеваемость, чем Moneymaker. Генотипы G1.1556, G1.1560 и G1.1601 показали низкую заболеваемость в трех независимых экспериментах, в пределах от 0 до 21%. Статистический анализ показал, что заболеваемость в генотипах 78/1604, 91/4311, 96/4326, G1.1556, G1.1558, G1.1560, G1.1601, LA716 и LYC 4/78 была значительно ниже, чем в контрольной линии L. esculentum сорта Moneymaker (p<0,05). Однако была большая разница между неделями, и некоторые из различий, наблюдаемых в отдельных анализах листьев, возможно, по сути, могут быть недостаточно надежными из-за колебаний в заболеваемости между экспериментами/неделями (15-78%).
В пределах этих устойчивых генотипов (с заболеваемостью значительно более низкой, чем заболеваемость в контрольном Moneymaker), повреждения, которые распространились успешно, часто распространились со скоростью, такой же как в Moneymaker (например, 96/4326, G1.1560, LA716). Обратная ситуация не была обнаружена: ни один из генотипов не показал заболеваемость, подобную заболеваемости Moneymaker, но показал темп роста повреждения более медленный, чем у Moneymaker.
Таблица 4 также представляет данные по среднему темпу роста повреждений, распространяющихся на каждом генотипе за 24-часовой период (между 48 и 72 hpi). Темп роста повреждения в большинстве генотипов был в том же самом диапазоне, как и у Moneymaker. Пять образцов (91/4311, 160/79, G1.1556, G1.1601 и LYC 4/78) показали более низкий темп роста повреждений, который был статистически значительно отличен от темпа роста повреждений у L. esculentum сорта Moneymaker.
Анализ инфекции сегментов стеблей (таблица 5) оказался более надежным, чем анализ листьев в плане воспроизводимости между экспериментами, выполненными в различное время года. Даже при том, что количество точек данных с сегментами стебля (5-8 сегментов на растение) является намного меньшим, чем при анализе листьев (40 капелек инокулята на сложный лист, причем один или два листа в растении могут быть протестированы), погрешность в экспериментах была существенно ниже в анализе сегментов стебля. Заболеваемость в анализе стебля для контрольного генотипа L. esculentum сорта Moneymaker лежала в пределах от 52-95%. Заболеваемость в 17 генотипах (таблица 5) должна быть сравнена с заболеваемостью контрольной линии L. esculentum сорта Moneymaker, определенной в том же самом эксперименте/неделе. Большинство генотипов показало заболеваемость в диапазоне, подобном с контрольной линией Moneymaker. Генотипы G1.1556 (29% и 41%) и G1.1560 (28% и 7%) показали пониженную заболеваемость. Только G1.1560 статистически существенно отличался (p<0,05) от контроля.
Темпы роста повреждений в анализе стеблей (таблица 5) для контрольного генотипа L. esculentum сорта Moneymaker располагались в пределах от 5,4 до 9,2 мм/день. Темпы роста повреждений многих генотипов находились в диапазоне, подобном с контролем. Однако в образцах 89/3793, G1.1601, LYC 4/78, T566-81 темп роста повреждения был статистически значительно отличен (p<0,01) от контрольного сорта Moneymaker.
Со множеством генотипов, которые были оценены как частично устойчивые в анализе сегментов стеблей, был проведен качественный анализ на целых растениях, выращенных в теплице на Rockwool®. Цель состояла в том, чтобы оценить, были ли генотипы, которые казались устойчивыми в сегментах стеблей при лабораторных условиях, действительно более устойчивыми, чем контрольные линии в полукоммерческой системе культивирования растений. Растения были выращены в рандомизированном порядке в рядах Rockwool®; помещение теплицы было заполнено плодами цитрусовых, тяжело инфицированными B. cinerea в точке спорулирования. В помещении теплицы поддерживали высокую влажность путем обрызгивания пола два раза в день водой из-под крана и оставления дверей и окон закрытыми. Резаные раны были сделаны через равные интервалы на всех растениях и возникновение серой гнили наблюдали через некоторое время.
Множество диких образцов Lycopersicon было идентифицировано, что показало серьезное снижение обоих параметров, таким образом предоставляя в качестве вероятного источника для интрогрессии два потенциально независимых механизма частичной устойчивости в L. esculentum.
Пример 2. Картирование QTL для сопротивления к Botrytis cinerea в межвидовом гибриде Lycopersicon (L. esculentum сорта Moneymaker Ч Lycopersicon parviflorum G1.1601)
2.1. Введение
Коллекция образцов Lycopersicon из разнообразных источников была протестирована на устойчивость к грибковому патогену Botrytis cinerea, как описано в примере 1. Образец Lycopersicon parviflorum G1.1601 показал в анализе листьев более низкую заболеваемость, а также более медленный рост повреждений (см. таблицы 4 и 5, приведенные выше). Расщепляющаяся популяция, состоящая из 130 F2-производных популяций F3, происходящих из гибрида L. parviflorum G1.1601 и L. esculentum сорта Moneymaker, была оценена на предмет устойчивости к B. cinerea в анализе стеблей.
Маркеры полиморфизма длины амплифицированного фрагмента использовались для построения карты сцепления и для выполнения анализа локуса количественного признака. Были обнаружены QTL и для роста повреждений, и для заболеваемости.
2.2. Растительный материал
После идентификации устойчивого образца Lycopersicon parviflorum G1.1601, расщепляющуюся популяцию с этим образцом как основной родительской особью (Huang, 2001), использовали для дальнейшего анализа. Расщепляющаяся популяция состояла из 130 F2-производных популяций F3.
2.3. Анализы болезни
Из каждой из 130 популяций F3 было выращено 5 сеянцев и подвергнуто анализу стеблей, описанному в примере 1 (см. 1.4). По практическим соображениям полный набор тестируемых образцов был разделен (случайно) на 13 частей с равным количеством. Каждую неделю тестировали одну часть, состоящую из 50 растений. Для исправления экологически обусловленных различий между неделями использовали большой набор восприимчивых контрольных растений Moneymaker. Из практических соображений L. parviflorum G1.1601 не был включен в эксперимент. Количественные измерения были выполнены, как описано в примере 1.
Развитие инфекции было зарегистрировано в двух временных точках после инокуляции (через 96 и 120 часов после заражения). Таким образом, как заболеваемость, которая определена как процент от инокулированных сегментов стеблей, которые показали признаки болезни в заключительный момент наблюдения, так и рост повреждений, который определен как средняя скорость развития повреждений по стеблю томата в 24-часовой период, была определена, как описано в примере 1.
Распределение количественных измерений показано на фиг.4. Распределения предполагают нормальные характеристики количественных признаков, подходящие таким образом для подхода к картированию QTL.
2.4. Молекулярные маркеры
Материал листьев F2 не был доступен, поэтому листья двенадцати растений F3, полученных от каждой из 130 популяций F2-производных, были объединены в пулы и использованы для выделения ДНК. Анализы AFLP были выполнены согласно Vos et al. (1995) с использованием набора из 10 комбинаций праймеров Pst/Mse.
2.5. Анализ сцепления и картирование QTL
Из-за доминантного характера маркеров AFLP отцовская (L. parviflorum) и материнская (L. esculentum) группы сцепления были составлены отдельно. Данные маркеров были проанализированы, и генетическая карта сцепления была составлена с использованием пакета программ JoinMap® (версия 3.0; Plant Research International, Вагенинген, Нидерланды). Группы сцепления были сформированы с различной вероятностью порогов логарифмического подобия (LOD). Отрезки рекомбинации были преобразованы в расстояния на карте с использованием функции Kosambi (Kosambi, 1944). Выходные данные, полученные от JoinMap®, были преобразованы в графический формат для карт сцепления и участков QTL с помощью программы MapChart (Plant Research International). Фенотипические данные были проанализированы, и QTL были вычислены с использованием MapQTL® (версия 4.0; Kyazma B.V., Вагенинген, Нидерланды) путем картирования интервалов (IM) и картирования множественных QTL (MQM) (Jansen, 1993, 1994). Рассчитанные фенотипические данные для популяции F2 были получены из средних значений анализов болезни всех растений в пределах линии F3. Для нормализации данных заболеваемости использовали арксинус-преобразование. QTL были вычислены с использованием алгоритма картирования интервалов.
Для каждой из 130 популяций F3 комбинированные данные маркеров и данные по болезни были подвергнуты анализу QTL с использованием MapQTL®. Первый раунд картирования интервалов был выполнен, и были идентифицированы пики в профиле LOD. Все маркеры, происходящие из того или другого родителя, непосредственно использовали для вычисления независимых карт сцепления. Всего 192 маркера AFLP были размещены в отцовских и материнских картах сцепления. Мужские и женские карты сцепления индивидуально использовали для картирования QTL. Были определены три QTL (см. таблицу 6).
Сводка результатов картирования QTL,
основанных на неинтегрированной карте
(хромосома 3)
(хромосома 4)
(хромосома 9)
aa представляет собой гомозиготный L. esculentum по полной хромосомной области, b- представляет собой гетерозиготный или гомозиготный L. parviflorum по области QTL.
Средняя устойчивость к Botrytis у 11 гетерозиготных или гомозиготных растений L. parviflorum (b-) со всеми тремя областями QTL отражала заболеваемость 40% и рост повреждений 5,0 мм в день. Только одно растение L. esculentum было гомозиготным по всем трем областям QTL и имело заболеваемость 72% и рост повреждений 7,2 мм в день. Пять растений L. esculentum были гомозиготными по двум из трех QTL и их средняя заболеваемость была 67%, сочетающаяся с ростом повреждений 5,8 мм (данные не показаны).
Этот пример показывает, что генетические источники, такие как L. parviflorum G1.1601, могут использоваться, чтобы увеличить устойчивость к B. cinerea у растений томата. Могут быть выявлены несколько QTL как для заболеваемости, так и для роста повреждений (таблица 6). Эти QTL могут быть подтверждены в наиболее совершенном селекционном материале, таком как линии обратного скрещивания.
В таблице 7 показаны экспериментальные результаты тестов на устойчивость к болезни различных линий F3, полученных из гибрида L. esculentum сорта Moneymaker и L. parviflorum G1.1601. Четко показано, что эталонная линия BChirs5, используемая в этом эксперименте, показывает более высокий уровень устойчивости, чем уровень устойчивости перечисленных линий L. parviflorum (L. parv). Однако присутствие эффектов QTL может также быть установлено для QTL parviflorum.
Средняя длина повреждений стеблей, вызванных Botrytis cinerea,
на взрослых растениях L. parviflorum образца G.1601
через три недели после инокуляции
*) Эталонные линии выделены жирным шрифтом: Tradiro является гибридом, восприимчивым к Botrytis согласно описанию производителей; Durintha является гибридом с частичной устойчивостью согласно описанию производителей; Moneyberg и Moneymaker представляют собой схожие типы восприимчивых линий; GT представляет собой Moneyberg с устойчивостью к ВТМ; BChirs5 представляет собой гибридную линию, полученную из L. hirsutum LYC 4/78 путем интрогрессии, и включает QTL-1h из hirsutum для роста повреждений. (+): гетерозиготное или гомозиготное присутствие; (-): нет присутствия; н.д.: нет данных.
Пример 3. Картирование частичной устойчивости к Botrytis cinerea в межвидовой популяции растений томатов (L. esculentum сорта Moneymaker Ч L. hirsutum образца LYC 4/78)
В данном примере представлены два локуса QTL, придающих частичную устойчивость к B. cinerea, происходящих из L. hirsutum LYC 4/78. Подтверждение результатов было получено при оценке уровня устойчивости к B. cinerea в двух популяциях BC2S1, расщепляющихся по одному из двух локусов QTL соответственно.
3.1. Растительный материал
Семена Lycopersicon hirsutum LYC 4/78 (в дальнейшем именуемые как LYC 4/78) были получены из банка генов, расположенного в Institute for Plant Genetics and Crop Plant Research, Гатерслебен, Германия.
Семена Lycopersicon esculentum сорта Moneymaker (в дальнейшем именуемые как Moneymaker) были получены из банка генов De Ruiter Seeds cv, Бергшенхоек, Нидерланды.
Межвидовый гибрид Moneymaker и LYC 4/78 был создан для того, чтобы произвести семена F1. Из семян F1 были выращены растения F1. Семена F2, полученные в результате самоопыления одного растения F1, посеяли, чтобы получить популяцию F2 из 174 особей. Популяция BC2 (обратное скрещивание 2) из 59 особей была получена в двух раундах обратного скрещивания с Moneymaker в качестве возвратной и женской родительской особи. Используя MAS, были отобраны генотипы BC2, BC3 и ВС4, включающие один из двух идентифицированных QTL, и некоторые BC2 были самоопылены с целью получения семян BC2S1 (см. фиг.2). Были выращены две популяции BC2S1: одна, состоящая из 60 особей BC2S1, расщепляющихся по QTL для заболеваемости, и другая, состоящая из 47 особей BC2S1, расщепляющихся по QTL для роста повреждения.
3.2. Анализ стеблей
Инокулят из штамма B05.10 B. cinerea был приготовлен согласно Benito (1998). Анализ стеблей был выполнен, как описано в примере 1.
3.3. Выделение ДНК и маркерный анализ
Геномная ДНК была выделена из двух молодых (скрученных) листьев, используя цетилтриметиламмоний бромид (СТАВ), на основе методики в соответствии со Steward и Via (1993), модифицированной с целью высокоэффективного выделения ДНК, с использованием 1 мл микропробирок (Micronic BV, Лелистад, Нидерланды), и осаждена с использованием 300-мм шейкера Retsch на максимальной скорости (Retsch BV, Охтен, Нидерланды). Был проведен анализ AFLP (Vos et al, 1995) популяций F2, BC2, BC3, BC4 и BC2S1, и фрагменты AFLP были расшифрованы на секвенсоре LI-COR 4200 DNA, по существу в соответствии с методом, опубликованным Myburg (Myburg et al, 2001). Селективныей праймер Pst был помечен флуоресцентными метками IRD 700 или IRD 800. Изображения гелей AFLP были обработаны при помощи пакета программ AFLP-Quantar Pro (Keygene BV, Вагенинген, Нидерланды). Для генотипирования использовали следующие десять комбинаций праймеров и адаптерных последовательностей: P14M48, P14M49, P14M50, P14M60, P14M61, P15M48, P18M50, P18M51, P22M50 и P22M51, как описано Bai et al. (2003).
3.4. Фенотипический анализ популяции F2
Наблюдали различие в заболеваемости между различными анализами Botrytis (см. пример 1, выше). Поэтому было выполнено семь независимых последовательных анализов болезни стеблей на 172 особях популяции F2 из 174, полученных из гибрида Moneymaker × LYC 4/78. Это приводило по меньшей мере к пяти независимым оценкам биоанализа болезни для почти каждого генотипа F2. В каждом индивидуальном биоанализе болезни шесть сегментов стебля использовали в вычислении роста повреждений. Средние значения заболеваемости и роста повреждений для популяции F2 показывали нормальное распределение (данные не показаны). Средняя заболеваемость для Moneymaker составляла 59% с ростом повреждений 9,2 мм/день. Средняя заболеваемость в Moneymaker лежала в пределах между 10% и 97% со средним популяционным значением 48%. Рост повреждений находился в пределах между 3,3 мм и 11,5 мм/день со средним значением 7,8 мм/день.
Значения средней заболеваемости в каждом индивидуальном эксперименте располагались в пределах от 31% до 73%, в то время как значения среднего роста повреждений лежали в пределах от 6,2 до 7,9 мм/день (таблица 8). Рост повреждений может быть вычислен только в том случае, если инфекцию наблюдают по меньшей мере в одной из шести частей стебля. Следовательно, увеличение количества генотипов, информативных для роста повреждений, можно было наблюдать в связи с более высокой заболеваемостью. Например, с низкой средней заболеваемостью (31%) только 52% генотипов были информативны для роста повреждения.
Средняя заболеваемость и средний рост повреждений
семи экспериментов в соответствии с примерами 3.4.
Средние значения недель упорядочены
в соответствии с процентом заболеваемости
3.5. Молекулярные маркеры и карта генетического сцепления
Карта генетического сцепления была составлена для популяции F2 (n=174), полученной в результате скрещивания Moneymaker × LYC 4/78. Десять комбинаций праймеров использовали, чтобы получить 218 маркеров полиморфизма длины амплифицированного фрагмента (AFLP) в популяции F2 (n=174). В общей сложности 69 маркеров (31,7%) легко могли быть размечены, позволяя таким образом составить интегрированную карту генетического сцепления F2. Маркерный анализ, выполненный на генотипах BC2, BC3 и BC2S1, позволил внести дополнительных 145 маркеров AFLP. В общей сложности 102 из этих 145 дополнительных маркеров AFLP не были предварительно размечены из-за сложности гелей F2. Полная карта генетического сцепления состояла из 315 маркеров AFLP 14-ти групп сцепления и имела полную длину 958 сМ. Так как совместно мигрирующие в пределах вида маркеры AFLP являются в основном аллель-специфичными, для обозначения групп сцепления на хромосомах использовали солинейность с другими картами сцепления AFLP. Некоторые специфические маркеры AFLP Moneymaker были подобны картам генетического сцепления, как было опубликовано (Haanstra et al., 1999; Bai et al, 2003), и поэтому некоторые группы сцепления могли быть обозначены на хромосомах, включая группы сцепления, несущие идентифицированные QTL. Чтобы усовершенствовать карту сцепления в интервалах QTL, в указанные области были добавлены диагностические маркеры CAPS, что основано на опубликованной карте L. esculentum × L. pennellii (Tanksley et al, 1992; Haanstra et al, 1999).
3.6. Анализ сцепления и картирование QTL
Данные маркеров были проанализированы, и генетическая карта сцепления была составлена, как описано в примере 2.
Полная длина карты сцепления F2 составляла 958 сМ, что являлось меньшим значением, чем у других опубликованных межвидовых карт Lycopersicon с генетическими длинами в пределах от 1200-1400 сМ (Foolad et al 2002; Haanstra et al 1999; Tanksley et al 1992). Дополнительные маркеры AFLP были размечены с использованием данных маркеров AFLP, полученных в результате обратного скрещивания популяций BC2S1. Хотя более 46% маркеров было помещено на карту сцепления, длина карты генетического сцепления не увеличивалась. Причина указанного факта заключается в том, что используемые данные были получены от нескольких маленьких подсемейств и таким образом являющихся неинформативными для вычисления генетических расстояний, но при этом возможна оценка положения с помощью визуального осмотра графических генотипов (Van Berloo, 1999).
3.7. Картирование QTL в популяции F2
Фенотипические и маркерные данные использовали для идентификации QTL посредством картирования интервалов (IM, см. пример 2). IM был и применен к данным, полученным от индивидуальных повторностей, и к средним значениям повторностей.
Заболеваемость
Картирование интервалов для заболеваемости в популяции F2 было сделано для тех индивидуальных анализов болезни, в которых средняя заболеваемость была ниже 50%, и для усредненных данных, полученных от всех анализов болезни (таблица 8). Усредненные данные всех анализов, на основе которых в процессе нанесения интервалов на карту было получено единственное существенное значение QTL для заболеваемости (подобие вероятностей (LOD), которое должно быть выше 3,4 для общегеномного уровня значимости P<0,05). Этот QTL имел значение LOD 4,5 и позволял изучить 13% полного фенотипического разнообразия (таблица 9). Аллель, вносящий свой вклад в устойчивость, произошел из устойчивой родительской особи LYC 4/78. Картирование QTL на карте в каждом индивидуальном эксперименте дало во всех четырех случаях ту же самую область QTL. В каждом независимом эксперименте, иногда, наблюдались другие "минорные QTL".
Рост повреждений
Рост повреждений лучше всего может быть оценен в указанных анализах болезни с высокой заболеваемостью. Для картирования QTL использовали среднее значение всех 7 анализов болезни, причем был идентифицирован один QTL для роста повреждений, вызванных B. cinerea, со значением выше порогового (LOD 3,4 для общегеномного уровня значимости P<0,05). Этот QTL имел значение LOD 4,2 и позволял изучить 12% полного фенотипического разнообразия (таблица 9). Положительный эффект происходил из устойчивой родительской особи LYC 4/78. Потребность в выполнении многократных анализов болезни является очевидной, поскольку только в одном единственном повторении был найден профиль LOD выше порогового.
Оценка эффектов, рассчитанных для растений
гомозиготного сорта Moneymaker (A), гетерозиготного (H)
или гомозиготного LYC 4/78 (B).
Значения для популяции F2 были вычислены
с помощью процедуры нанесения интервалов на карту,
в то время как значения для популяции BC2S1 были вычислены
при помощи анализа Крускала-Валлиса
aH.О. = не определено
3.8. Подтверждение QTL в биоанализе
Растение F1 гибрида Moneymaker × LYC 4/78 было дважды обратно скрещено с Moneymaker, и полученные в результате 59 растений потомства были подвергнуты скринингу на присутствие двух идентифицированных областей QTL (одна для заболеваемости и один для роста повреждений) с использованием маркеров AFLP. Были отобраны и самоопылены растения, гетерозиготные по одному из двух идентифицированных QTL, чтобы получить две популяции BC2S1 с каждым генотипом BC2S1 в общей сложности были выполнены четыре биоанализа болезни. Данные обеих субпопуляций BC2S1, проанализированные с SPSS, показывали нормальные распределения для роста повреждений, но не для заболеваемости, которую наблюдали в некоторые подклассах (фиг.2).
Все растения BC2S1 были генотипированы AFLP с помощью тех же 10 комбинаций праймеров, как описано выше для популяции F2 в пункте 3.3. Средний рост повреждений в популяции, расщепляющейся по локусу роста повреждений, составлял 5,3 мм/день, в то время как в другой популяции наблюдали средний рост повреждений 6,3 мм/день. Ни одно растение не имело рост повреждений столь же низкий, как устойчивые родительские особи LYC 4/78. В случае заболеваемости, однако, наблюдали растения с более низкой заболеваемостью, чем у устойчивых родительских особей LYC 4/78. Средняя заболеваемость в обеих популяциях BC2S1 была равной (57-59%).
Положительный эффект каждого QTL был подтвержден в популяциях BC2S1. QTL для заболеваемости снизил шанс заражения на 17% (46% родительской разновидности), и QTL для роста повреждений сократил рост грибков на 1,3 мм/день (33% родительской разновидности).
Сравнительные данные, полученные в популяции F2, представлены в таблице 8. Только часть изменений можно было бы объяснить эффектом обоих QTL. Были идентифицированы некоторые дополнительные ("минорные") локусы QTL.
Во время анализа данных, полученных из анализов болезни, генотипов F2 и BC2S1, был идентифицирован один основной QTL для заболеваемости (QTL-2h). Помимо этого QTL, были идентифицированы другие "предполагаемые" локусы QTL для заболеваемости. Используя эту информацию, были отобраны кофакторы для того, чтобы провести упрощенную процедуру 'картирования множественных QTL' (MQM) на основе группы данных F2. В этом анализе были идентифицированы дополнительные "минорные" локусы QTL для заболеваемости (QTL-4h). QTL обозначается как "минорный", когда его значение LOD ниже порогового значения 3,4. Однако их эффекты, как полагают, являются реальными эффектами QTL.
QTL-4h располагается на хромосоме 4 и снижает заболеваемость (см. таблицу 1). QTL имеет коэффициент LOD 2,9 и связан со следующими маркерами AFLP: P18M51-169.5e, P18M51-305.4h, P14M60-262.9e и P14M61-292.7h. Положительный эффект этого локуса происходит от устойчивого родительского растения L. hirsutum. Положительный эффект был определен и в популяции F2, и в популяции BC2S1. Указанный QTL был первоначально идентифицирован в популяции BC2S1, испытывающей недостаток в сегрегации QTL-2h, причем указанный QTL также связан с маркерами AFLP P14M48-345e, P14M48-177e и P18M50-147e. Сегрегация кодоминантных маркеров CAPS для этой области была оценена и в популяции BC2S1, и в популяции F2 для локусов, расположенных и на хромосоме 2, и на хромосоме 4. Маркер CAPS на хромосоме 2, AT4G30930, сильно связывается с QTL на хромосоме 2, в то время как для хромосомы 4 были проанализированы данные сегрегации для набора 10 маркеров CAPS, одинаково распределенных по этой хромосоме. Анализ ANOVA, включающий маркер CAPS AT4G30930 и маркер CAPS TG609 на хромосоме 4, показал, что маркер CAPS TG609 в значительной степени связывается с признаком заболеваемости.
Для подтверждения эффекта каждого "минорного" QTL, могут быть созданы изогенные линии (NIL), включающие области, близко расположенные к областям, включающим эффект QTL. Параллельно с этим, может быть создана популяция обратно скрещенных инбредных линий (BIL) L. hirsutum LYC 4/78 на генетическом фоне L. esculentum сорта Moneymaker.
3.9 Выводы по анализу болезни и разметке QTL
Биоанализ для измерения устойчивости к B. cinerea оказался ценным инструментом. Однако все еще большая и неизвестная вариация, как оказалось, влияет на развитие процесса инфекции. Эта большая негенетическая вариация может быть минимизирована при использовании стандартизированных процедур и при выполнении множественных независимых повторностей. Вариация может быть вызвана условиями теплицы, изменяющимися из недели в неделю (длина дня, часы солнечного света и температура), порождающими различия в физиологических состояниях стебля. Кроме того, небольшие вариации при подготовке грибкового инокулята, могут играть роль в изменении процесса инфекции. Другое наблюдение состоит в том, что развитие болезни может также быть затронуто микроклиматом в поддонах, в которые были помещены части стебля. Для биоанализов BC2S1 использовали десять различных экспериментальных поддонов. Статистический анализ использовали для компенсирования вариации между экспериментами и в пределах отдельного эксперимента. Эксперименты с самой высокой средней заболеваемостью были самые информативные для измерения роста повреждений, в то время как эксперименты с более умеренной заболеваемостью были более информативны. Заболеваемость и рост повреждений являются независимыми признаками, так как никакая линейная корреляция между этими двумя признаками не может быть соблюдена.
Локусы количественного признака для устойчивости к B. cinerea у растений томата были идентифицированы в F2. Указанные идентифицированные QTL были подтверждены в популяциях BC2S1 и объясняли 46% и 33% родительской вариации по заболеваемости и росту повреждений, соответственно. На основе указанных результатов можно предположить, что не все QTL, придающие устойчивость к B. cinerea, были обнаружены при первоначальном картировании популяции F2. В обеих популяциях BC2S1 были найдены растения с более высокими уровнями сопротивления, как у устойчивого родительского растения LYC 4/78. Это является показателем в отношении присутствия дополнительных локусов устойчивости, выделяющихся в популяции BC2S1. Дополнительная сегрегация устойчивости была удивительна, поскольку можно было ожидать, что уже большие части генома двух популяций BC2S1 были гомозиготными с Moneymaker.
3.10. Подтверждение эффекта индивидуальных QTL в условиях теплицы
Растения, содержащие любой из QTL, описанных выше, были помещены в фон L. esculentum, используя метод, описанный на фиг.2. Линии BC2S2 в теплице были помещены в почву и выращены при стандартных условиях деятельности в Нидерландах. По прошествии 3-х месяцев растения инокулировали путем размещения агарового диска, включающего Botrytis, в ране на главном стебле. Рана была впоследствии закрыта при помощи Parafilm®. Через три недели после инокуляции была измерена длина повреждений стебля (в см) (подробнее см. ниже). Результаты перечислены в таблице 10. Четко показано, что линии, содержащие QTL для роста повреждений, показывают чрезвычайное уменьшение размера повреждений.
Средняя длина повреждений стебля, вызванных Botrytis cinerea,
на взрослых растениях L. hirsutum образца LYC 4/78
и L. hirsutum LA 1777,
через три недели после инокуляции
***) a, b, с и d являются повторениями, в соответствии с чем каждое повторение представляет 5 растений; e и f являются повторениями, в соответствии с чем каждое повторение представляет 3 растения; GT представляет собой сорт Moneyberg с устойчивостью к ВТМ; Durintha является гибридом с частичной устойчивостью согласно описанию производителей; Tradiro является гибридом, восприимчивым к Botrytis согласно описанию производителей; BChirs обозначает линии обратного скрещивания, полученные в результате интрогрессии из L. hirsutum LYC 4/78; LA 1777 является диким образцом вида L. hirsutum LA 1777; ВС chrs 10 обозначает линии обратного скрещивания с интрогрессией на хромосоме 10 из L. hirsutum LA 1777; parv обозначает линии, полученные в результате интрогрессии из L. parviflorum.
3.11. Уровень устойчивости к Botrytis, вызванный QTL из L. hirsutum LYC 4/78, выше уровня устойчивости, вызванного QTL из L. peruvianum LA 1777 на хромосоме 10.
Уровень устойчивости в растениях, содержащих QTL из L. hirsutum LYC 4/78, описанный в настоящем описании, был сравним с уровнями устойчивости L. hirsutum LA1777 источника WO02/085105, который содержит QTL частичной устойчивости к Botrytis на хромосоме 10, и с уровнями устойчивости интрогрессированных линий, полученных из указанного образца интрогрессией в хромосоме 10.
Указанные линии в теплице были помещены в почву и выращены при стандартных условиях деятельности в Нидерландах. Через 3 месяца растения инокулировали путем размещения агарового диска размером 0,5×0,5 см, включавшего Botrytis, в вертикальной ране длиной 2 см на основном стебле. Рана была впоследствии закрыта с помощью Parafilm®. Через три недели после инокуляции была измерена длина повреждений стебля (длина обесцвеченной ткани, усеянной грибковой культурой) (в см) от вершины повреждения к основанию повреждения. Результаты представлены в таблице 10. Наблюдали, что линии, включающие QTL из L. hirsutum LYC 4/78 показывали более высокий уровень устойчивости к Botrytis, чем LA 1777 источника и IL-линии. Дополнительно, линии L. parviflorum, включающие комбинацию любого QTL заболеваемости на хромосоме 4 и любого QTL роста повреждений на хромосоме 9 (линия 68), или комбинацию обоих QTL для заболеваемости на хромосоме 3 и хромосоме 4 (линия 78), были сравнимы с LA 1777 источника и IL-линиями. Первые линии показывали меньший рост повреждений на стебле и поэтому показывали более высокий уровень устойчивости к Botrytis, чем линии, полученные из LA 1777 (см. таблицу 10). В тех случаях, когда регистрировали длину повреждения 2,0 см, можно было измерять только первоначальный размер раны, и никакого грибкового роста не наблюдали, что указывало на высокий уровень устойчивости. Таким образом, длина повреждения стебля, равная 2 см, указывала на отсутствие чистого роста.
Последовательности маркеров, которые используются в настоящем описании.
Следующие таблицы предоставляют подробную информацию относительно различных маркеров RFLP и COS-II, показанных на различных картах сцепления и связанных с QTL по настоящему изобретению. Информация была непосредственно скопирована из базы данных SOL Genomic Network (SGN), размещенной в Cornell University, версия от 7 октября 2005 года.
Таблицы 11÷29 смотри в конце описания.
Список литературы
1. Bai YL, Huang CC, van der Hulst R, Meijer Dekens F, Bonnema G, Lindhout P (2003) QTLs for tomato powdery mildew resistance (Oidium lycopersici) in Lycopersicon parvillorum G1.1601 co-localize with two qualitative powdery mildew resistance genes. Mol. plant microbe interactions 16:169-176.
2.Benito EP, ten Have A, van 't Klooster JW, van Kan JAL (1998) Fungal and plant gene expression during synchronized infection of tomato leaves by Botrytis cinerea. Eur. J. Plant Pathol. 104:207-220.
3. Bernacchi D, Tanksley SD (1997) An interspecific backcross of Lycopersicon esculentum Ч L. hirsutum: Linkage analysis and a QTL study of sexual compatibility factors and floral traits. Genetics 147:861-877.
4. Christou P, Murphy JE, and Swain WF (1987) Stable transformation of soybean by electroporation and root formation from transformed callus. Proc. Natl. Acad. Sci. USA 84:3962-3966.
5. Churchill GA, Doerge RW (1994) Empirical threshold values for Quantitative trait mapping. Genetics 138: 963-971.
6. Deshayes A, Herrera-Estrella L, Caboche M (1985) Liposome-mediated transformation of tobacco mesophyll protoplasts by an Escherichia coli plasmid. EMBO J. 4:2731-2737.
7. D'Halluin K, Bonne E, Bossut M, De Beuckeleer M, Leemans J (1992) Plant. Cell 4:1495-1505.
8. Dik AJ, Koning G, Kohl J (1999) Evaluation of microbial antagonists for biological control of Botrytis cinerea stem infection in cucumber and tomato. Eur. J. Plant Pathol. 105:115-122.
9. Doganlar S, Frary A, Ku HM and Tanksley SD (2002) Mapping Quantitative Trait Loci in Inbred Backcross Lines of Lycopersicon pimpinellifolium (LA1589). Genome 45:1189-1202.
10. Draper J, Davey MR, Freeman JP, Cocking EC and Cox BJ (1982) Ti plasmid homologous sequences present in tissues from Agrobacterium plasmid-transformed Petunia protoplasts. Plant and Cell Physiol. 23:451-458.
11. Eckstein F (ed) (1991) Oligonucleotides and Analogues, A Practical Approach. Oxford Univ. Press, NY 1991.
12. Egashira H, Kuwashima A, Ishiguro H, Fukushima K, Kaya T, Imanishi S (2000) Screening of wild accessions resistant to gray mold (Botrytis cinerea Pers.) in Lycopersicon. Acta physiologiae plantarum 22:324-326.
13. Foolad MR, Zhang LP, Khan AA, Nino Liu D, Liln GY (2002) Identification of QTLs for early blight (Alternaria solani) resistance in tomato using backcross populations of a Lycopersicon esculentwn × L. hirsutum cross. Theor. Appl. Genetics 104:945-958.
14.Fulton T, van der Hoeven R, Eannetta N, Tanksley S (2002). Identification, Analysis and Utilization of a Conserved Ortholog Set (COS) Markers for Comparative Genomics in Higher Plants. The Plant Cell 14(7): 1457-1467.
15. Godoy G, Steadman JR, Dickman MB, Dam R (1990) Use of mutants to demonstrate the role of oxalic acid in pathogenicity of Sclerotinia sclerotiorum on Phaseolus vulgaris. Physiological Molecular Plant Pathology 37, 179-191.
16. Grandillo S, Tanksley SD (1996) QTL analysis of horticultural traits differentiating the cultivated tomato from the closely related species Lycopersicon pimpinellifolium. Theor Appl Genet 92: 935-951.
17. Gruber MY, Crosby WL (1993) Vectors for Plant Transformation. In: Glick BR and Thompson JE (Eds.) Methods in Plant Molecular Biology & Biotechnology, CRC Press, pp. 89-119.
18. Haanstra JPW, Wye C, Verbakel H, Meijer Dekens F, van den Berg P, Odinot P, van Heusden AW, Tanksley S, Lindhout P, Peleman J (1999) An integrated high density RFLP-AFLP map of tomato based on two Lycopersicon esculentum × L. pennellii F2 populations. Theor. Appl. Genetics 99: 254-271.
19. Hain R, Stabel P, Czernilofsky AP, Steinbliss HH, Herrera-Estrella L, Schell J (1985) Uptake, integration, expression and genetic transmission of a selectable chimaeric gene to plant protoplasts. Mol. Gen. Genet. 199:161-168.
20. Horsch RB, Fry JE, Hoffman NL, Eichholts D, Rogers SG, Fraley RT (1985) A simple method for transferring genes into plants. Science 227:1229-1231.
21. Jansen RC (1993) Interval Mapping of Multiple Quantitative Trait Loci. Genetics 135:205-211.
22. Jansen RC (1994) Controlling the Type I and Type II Errors in Mapping Quantitative Trait Loci. Genetics 138:871-881.
23. Kado CI (1991) Molecular mechanisms of crown gall tumorigenesis. Crit. Rev. Plant Sci. 10:1-32.
24. Klein TM, Gradziel T, Fromm ME, Sanford JC (1988). Factors influencing gene delivery into zea mays cells by high velocity microprojectiles. Biotechnology 6:559-563.
25. Klein TM, Arentzen R, Lewis PA, and Fitzpatrick-McElligott S (1992) Transformation of microbes, plants and animals by particle bombardment. Bio/Technology 10:286-291.
26. Kosambi DD (1944) The estimation of map distances from recombination values. Ann. Eugen. 12:172-175.
27. Laursen CM, Krzyzek RA, Flick CE, Anderson PC, Spencer TM (1994) Production of fertile transgenic maize by electroporation of suspension culture cells. Plant Mol Biol. 24(1):51-61.
28. Miki BL, Fobert PF, Charest PJ, Iyer VN (1993) Procedures for Introducing Foreign DNA into Plants. In: Glick BR and Thompson JE (Eds.) Methods in Plant Molecular Biology & Biotechnology, CRC Press, pp. 67-88.
29. Moloney MM, Walker JM, Sharma KK (1989) High efficiency transformation of Brassica napus using Agrobacterium vectors. Plant Cell Reports 8:238-242.
30.Myburg AA, Remington DL, O' Malley DM, Sederoff RR, Whetten RW (2001) High-throughput AFLP analysis using infrared dye-labeled primers and an automated DNA sequencer. Biotechniques 30: 348-357.
31. Nesbitt TC, Tanksley SD (2001) fw2.2 directly affects the size of developing tomato fruit, with secondary effects on fruit number and photosynthate distribution. Plant Physiol. 127: 575-583.
32. Nicot PC, Moretti A, Romiti C, Bardin M, Caranta C, Ferriere H (2002) Differences in susceptibility of pruning wounds and leaves to infection by Botrytis cinerea among wild tomato accessions. TGC Report 52: 24-26.
33. Paterson AH (ed.) (1996) Genome Mapping in Plants, Academic Press Inc San Diego, CA, USA.
34. Phillips RL, Somers DA, Hibberd KA. 1988. Cell/tissue culture and in vitro manipulation. In: G.F. Sprague & J.W. Dudley, eds. Corn and corn improvement, 3rd ed., p. 345-387. Madison, WI, USA, American Society of Agronomy.
35. Pierik RLM (1999) In vitro Culture of Higher Plants, 4th edition, 360 pages, ISBN: 0-7923-5267-X.
36. Prins TW, Tudzynski P, von Tiedemann A, Tudzynski B, ten Have A, Hansen ME, Tenberge K, van Kan JAL (2000) Infection strategies of Botrytis cinerea and related necrotrophic pathogens. In "Fungal Pathology" (J. Kronstad, editor). Kluwer Academic Publishers, pp. 33-64.
37. Roupe van der Voort JNAM, van Zandvoort P, van Eck HJ, Folkertsma RT, Hutten RGB, Draaistra J, Gommers FJ, Jacobsen E, Helder J, Bakker J (1997) Use of allele specificity of comigrating AFLP markers to align genetic maps from different potato genotypes. Mol. Gen Genetics 255: 438-447.
38. Sambrook J, and Russell DW (2001). Molecular Cloning: A Laboratory Manual. New York, NY, USA., Cold Spring Harbor Laboratory Press.
39. Sanford JC, Klein TM, Wolf ED, Allen N (1987). Delivery of substances into cells and tissues using a particle bombardment process. J. Particulate Sci. Technol. 5:27-37.
40. Sanford JC (1988) The biolistic process. Trends in Biotechnology 6:299-302.
41. Sanford JC (1990) Biolistic plant transformation. Physiologica Plantarum 79: 206-209.
42. Sanford JC, Smith FD, and Russell JA (1993) Optimizing the biolistic process for different biological applications. Methods in Enzymology 217:483-509.
43. Steward CN, Via LE (1993) A rapid CTAB DNA isolation technique useful for RAPD fingerprinting and other PCR applications. Biotechniques 14: 748-750.
44. Tanksley SD, Ganal MW, Prince JP, de Vicente MC, Bonierbale MW, Broun P, Fulton TM, Giovannoni JJ, Grandillo S, Martin GB (1992) High density molecular linkage maps of the tomato and potato genomes. Genetics 132: 1141-1160.
45. Tanksley SD, Grandillo S, Fulton TM, Zamir D, Eshed Y, Petiard V, Lopez J and Beck-Bunn T (1996) Advanced backcross QTL analysis in a cross between an elite processing line of tomato and its wild relative L. pimpinellifolium. Theor Appl Genet 92: 213-224.
46. Tanksley SD, Young ND, Paterson AH, Bonierbale MW (1998) RFLP mapping in plant breeding: New tools for an old science. Bio/technology 7: 257-263.
47. Tijssen P (1993) Hybridization With Nucleic Acid Probes. Part I. Theory and Nucleic Acid Preparation. In: Laboratory Techniques in Biochemistry and Molecular Biology. Elsevier.
48. Urbasch I (1986) Resistenz verschiedener Kultur- und Wildtomatenpf Lanzen (Lycopersicon spp.) gegentiber Botrytis cinerea Pers. J Phytopathol 116: 344-351.
49. Utkhede R, Bogdanoff C, McNevin J (2001) Effects of biological and chemical treatments on Botrytis stem canker and fruit yield of tomato under greenhouse conditions. Can. J. Plant Pathol 23: 253-259.
50. Utkhede RS, Mathur S (2002) Biological control of stem canker of greenhouse tomatoes caused by Botrytis cinerea. Can. J. Microbiol. 48: 550-554.
51. Van Berloo R (1999) GGT: Software for the display of graphical genotypes. J. Heredity 90: 328-329.
52. Van Berloo R, Aalbers H, Werkman A, Niks RE (2001) Resistance QTL confirmed through development of QTL-NILs for barley leaf rust resistance. Mol. Breeding 8: 187-195.53
53. Pet G, Vrielink van Ginkel R, Chen X, Lindhout P (1999) Three QTLs from Lycopersicon peruvianum confer a high level of resistance to Clavibacter michiganensis ssp michiganensis. Theor. Appl. Genetics 99: 1068-1074.
54. Voorrips RE (2002) MapChart: software for the graphical presentation of linkage maps and QTLs. J. Heredity 93: 77-78.
55. Vos P, Hogers R, Bleeker M, Reijans M, van de Lee T, Homes M, Frijters A, Pot J, Peleman J, Kuiper M (1995) AFLP: a new technique for DNA fingerprinting. Nucl. Acids Res. 23: 4407-4414.
56. Zhang L, Cheng L, Xu N, Zhao M, Li C, Yuan J, and Jia S (1991) Efficient transformation of tobacco by ultrasonication. Biotechnology 9:996-997.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАСТЕНИЯ ТОМАТА, ОБЛАДАЮЩИЕ ПОВЫШЕННЫМИ УРОВНЯМИ УСТОЙЧИВОСТИ К BOTRYTIS | 2007 |
|
RU2469094C2 |
| РАСТЕНИЯ ОГУРЦА, УСТОЙЧИВЫЕ К ЗАБОЛЕВАНИЯМ | 2006 |
|
RU2418405C2 |
| РАСТЕНИЕ, УСТОЙЧИВОЕ К НАСЕКОМЫМ | 2008 |
|
RU2522477C2 |
| РАСТЕНИЕ, УСТОЙЧИВОЕ К НАСЕКОМЫМ | 2014 |
|
RU2617955C2 |
| РАСТЕНИЯ ТОМАТА С УЛУЧШЕННОЙ УСТОЙЧИВОСТЬЮ К БОЛЕЗНЯМ | 2015 |
|
RU2721952C2 |
| ГЕНЫ И СПОСОБЫ ОБЕСПЕЧЕНИЯ УСТОЙЧИВОСТИ К ФИТОФТОРОЗУ ПАСЛЕНОВЫХ | 2008 |
|
RU2511423C2 |
| ГЕН, ПРИДАЮЩИЙ УСТОЙЧИВОСТЬ К PHYTOPHTHORA INFESTANS (ФИТОФТОРОЗУ) В СЕМЕЙСТВЕ SOLANACEAE | 2003 |
|
RU2361920C2 |
| РАСТЕНИЯ САЛАТ-ЛАТУК, ИМЕЮЩИЕ РЕЗИСТЕНТНОСТЬ ПРОТИВ NASONOVIA RIBISNIGRI БИОТИПА 1 | 2015 |
|
RU2731639C2 |
| ИНТРОГРЕССИЯ ДВУХ QTL УРОЖАЯ В РАСТЕНИЯ CUCUMIS SATIVUS | 2017 |
|
RU2746936C2 |
| РАСТЕНИЕ ТОМАТА, ОБРАЗУЮЩЕЕ ПЛОДЫ С МОДИФИЦИРОВАННЫМ СОДЕРЖАНИЕМ САХАРОВ | 2019 |
|
RU2817600C2 |
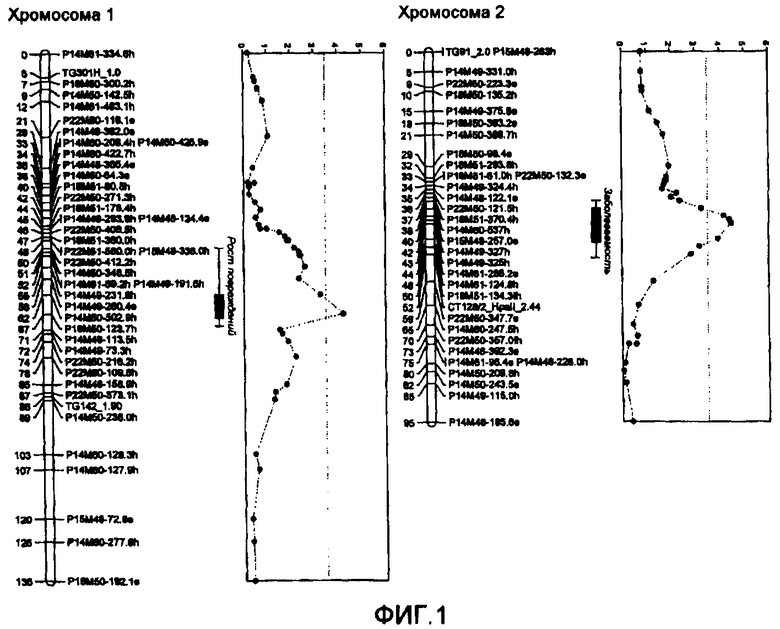
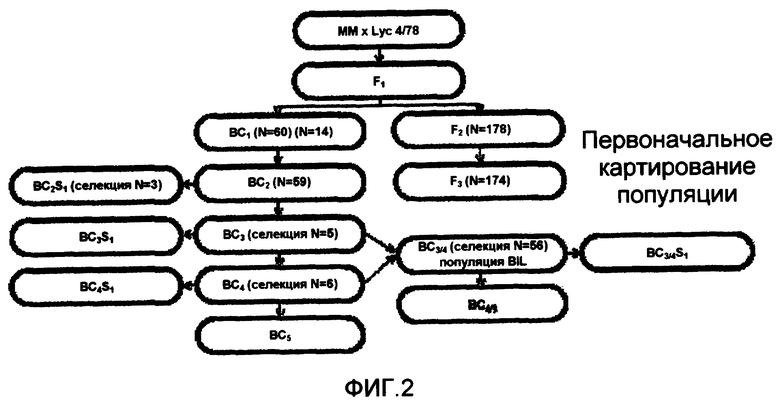
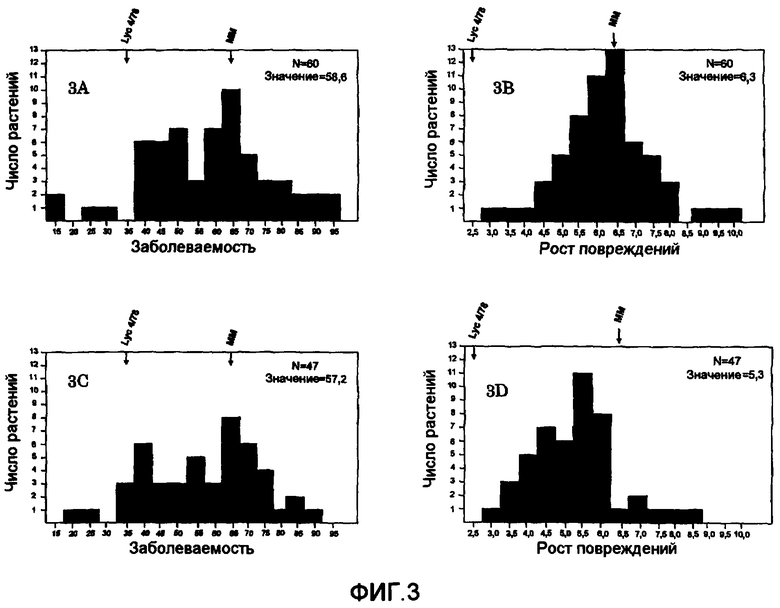
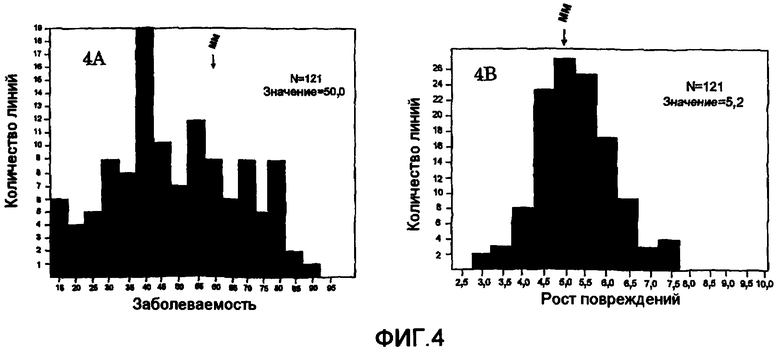

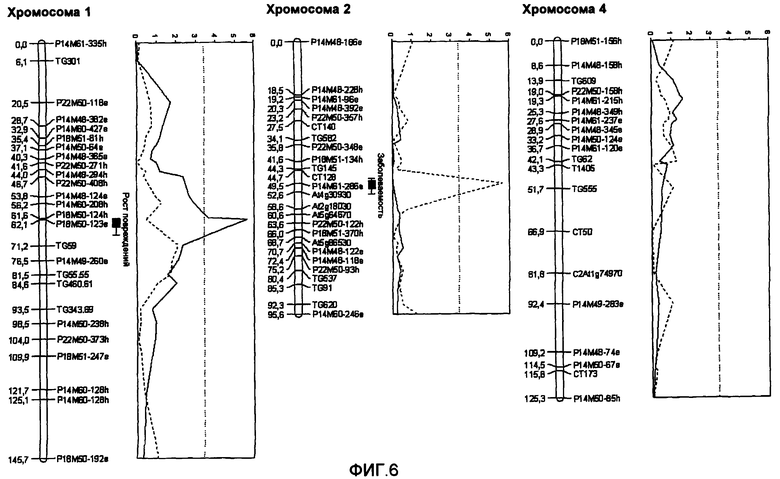
Определяют локусы количественного признака (QTL), связанного с устойчивостью к Botrytis томата. Выявленные локусы используют для получения Botrytis-устойчивого растения томата путем переноса нуклеиновой кислоты, содержащей по меньшей мере один QTL или его часть, придающую устойчивость к Botrytis, из донорного растения томата в чувствительное к Botrytis рецепиентное растение томата. Перенос нуклеиновой кислоты осуществляют посредством методов трансформации, слияния протопластов, удвоения гаплоидов или изъятия эмбриона. Маркер-опосредованная селекция позволяет получить гибриды и семена Botrytis-устойчивых растений томата. 9 н. и 5 з.п. ф-лы, 6 ил., 28 табл.
1. Локус количественного признака (QTL), связанный с устойчивостью к Botrytis томата, где указанный QTL выбран из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, содержащий по меньшей мере один маркер, выбранный из группы, состоящей из маркеров, перечисленных в таблицах 1 и 2, и маркеров, обозначенных на фиг.1, 5 и 6, как связанные с указанным QTL или его частью, придающей устойчивость к Botrytis.
2. Способ получения Botrytis-устойчивого растения томата, в котором предусмотрена стадия переноса нуклеиновой кислоты, содержащей по меньшей мере один QTL по.1 или его часть, придающую устойчивость к Botrytis, из Botrytis-устойчивого донорного растения томата в Botrytis-восприимчивое реципиентное растение томата, где указанный перенос указанной нуклеиновой кислоты выполнен трансформацией, слиянием протопластов, методом удвоения гаплоидов или изъятием эмбриона.
3. Способ по п.2, где указанное Botrytis-устойчивое донорное растение томата выбрано из группы, состоящей из Lycopersicon cerasiforme, Lycopersicon cheesmanii, Lycopersicon chilense, Lycopersicon chmielewskii, Lycopersicon esculentum, Lycopersicon hirsutum, Lycopersicon parviflorum, Lycopersicon pennellii, Lycopersicon peruvianum, Lycopersicon pimpinellifolium и Solarium lycopersicoides.
4. Способ по п.2, где указанное Botrytis-устойчивое донорное растение томата представляет собой дикое растение Lycopersicon hirsutum или Lycopersicon parviflorum, более предпочтительно Lycopersicon hirsutum LYC 4/78 или Lycopersicon parviflorum G 1.1601.
5. Способ по п.2, где указанное Botrytis-восприимчивое реципиентное растение томата представляет собой растение вида Lycopersicon esculentum, более предпочтительно линию L.esculentum, которая обладает коммерчески требуемыми характеристиками.
6. Способ получения устойчивого к Botrytis растения томата, включающий стадию переноса нуклеиновой кислоты, содержащей по меньшей мере один QTL, выбранный из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78, связанный с резистентностью к Botrytis, и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанный с резистентностью к Botrytis, и его часть, придающую устойчивость к Botrytis, от Botrytis-устойчивого донорного растения томата в Botrytis-чувствительное реципиентное растение томата,
где указанный перенос нуклеиновой кислоты включает скрещивание указанных Botrytis-устойчивого донорного растения томата с Botrytis-восприимчивым реципиентным растением томата с получением растений потомства и отбор из числа растений потомства растения, которое включает в своем геноме по меньшей мере один из указанных QTL или его часть, придающую устойчивость к Botrytis,
где в указанной селекции предусмотрена маркер-опосредованная селекция с маркером, выбранным из группы, состоящей из:
маркеров, перечисленных в таблицах 1 и 2, и маркеров, обозначенных на фиг.1, 5 и 6, как связанные с указанным QTL.
7. Способ по п.2, где указанное донорное растение представляет собой Lycopersicon hirsutum LYC 4/78 и/или Lycopersicon parviflorum G1.1601 и где указанная ДНК, перенесенная из указанного донорного растения в указанное реципиентное растение, включает по меньшей мере один QTL, связанный с Botrytis-устойчивостью томата, или его часть, придающую устойчивость к Botrytis, выбранные из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанных с Botrytis-устойчивостью.
8. Botrytis-устойчивое растение томата, или его часть, полученное способом по любому из пп.2-7.
9. Botrytis-устойчивое растение томата или его часть, содержащая в пределах своего генома по меньшей мере один QTL или его часть, придающую устойчивость к Botrytis, где указанные QTL выбраны из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78 и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанных с Botrytis-устойчивостью, и где указанный QTL или указанная часть QTL, придающая устойчивость к Botrytis, отсутствует в своем природном генетическом фоне.
10. Растение или часть растения по п.9, где указанные QTL обозначены по меньшей мере одним маркером, выбранным из группы, состоящей из маркеров, перечисленных в таблицах 1 и 2, и маркеров, обозначенных на фиг.1, 5 и 6, как связанные с указанным QTL.
11. Гибридное растение томата или его часть, полученная в результате скрещивания растения томата по любому из пп.8-10 с растением томата, которое обладает коммерчески требуемыми характеристиками.
12. Семя томата, полученное путем выращивания растения томата по любому из пп.8-11, где указанное семя включает нуклеиновую кислоту, содержащую по меньшей мере один QTL, выбранный из группы, состоящей из QTL на хромосомах 1, 2 и 4 Lycopersicon hirsutum LYC 4/78, связанный с резистентностью к Botrytis, и QTL на хромосомах 3, 4 и 9 Lycopersicon parviflorum G1.1601, связанный с устойчивостью к Botrytis, и его часть, придающую устойчивость к Botrytis.
13. Семя томата, полученное путем обратного скрещивания растения по п.11 с растением L.esculentum, имеющим требуемые фенотипические признаки, с целью получения растения L.esculentum, которое является Botrytis-устойчивым и имеет требуемые фенотипические признаки, а также сбора семян, произведенных указанным растением.
14. Применение QTL по п.1 для получения растений томата, устойчивых к Botrytis.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| DENBY KATHERINE ЕТ AL., PLANT JOURNAL, 2004; 38 (3):473-86 | |||
| BROUWER D.J | |||
| ET AL., GENOME, 2004; 47 (3): 475-92 | |||
| ZHANG L.P | |||
| ET AL., GENOME, 2002; 45 (1): 133-46. | |||
Авторы
Даты
2010-11-20—Публикация
2005-10-24—Подача