Область техники, к которой относится изобретение
Настоящее изобретение относится к набору праймеров для использования при детекции дрожжей рода Dekkera и дрожжей рода Brettanomyces, которые приводят к снижению качества спиртных напитков или безалкогольных напитков. Кроме того, настоящее изобретение относится к способу выявления и количественного определения дрожжей рода Dekkera и дрожжей рода Brettanomyces с использованием указанного набора праймеров.
Предпосылки создания изобретения
Ухудшение качества напитков в связи с загрязнением дрожжами и пролиферацией в них дрожжей создает определенные экономические проблемы. И такие проблемы, связанные с ухудшением качества напитков, имеют место во всем мире. Известно, что дрожжи рода Dekkera (вегетативное поколение которого известно как род Brettanomyces), которые рассматриваются в качестве причины такого снижения качества напитков, вызывают помутнение и неприятный запах пива, вина и безалкогольных напитков (Kurtzman C. P. & Fell J. W. The Yeasts, A taxonomic Study, 4th edition, 1998, Elsevier Science B. V., The Netherlands).
В пивоваренной промышленности дрожжи рода Dekkera вызывают образование уксусной кислоты или ацетатов при их пролиферации в пиве, что вызывает ухудшение качества пива (Back W.: Farbatlas und Handbuch der Geraenkebiologie, Teil I, 1994, Verlag Hans Carl, Nuernberg, European Brewery Convention: ANALYTICA-MICROBIOLOGICA-EBC, 2nd ed. 2005 Fachverlag Hans Carl, Nuernberg). В винодельческой промышленности дрожжи рода Dekkera образуют вещества с запахом фенола, такие как 4-этилфенол, амины, уксусная кислота и т.п. Запах вина, загрязненного такими дрожжами, описывается такими терминами как «запах животного» или «запах скотного двора» и соответственно коммерческая ценность такого вина снижается (Mitrakul et al.: Food Microbiology, 1999, Vol. 16, 3-14, Phister et al.: Applied and Environmental Microbiology, 2003, Vol. 69, 7430-7434, Silva et al.: Am. J. Enol. Vitic, 2004, Vol. 55, 65-72).
В безалкогольной промышленности дрожжи рода Dekkera также вызывают образование большого количества кислоты, такой как уксусная кислота, из глюкозы или других источников углерода, и такая кислота создает характерный запах, свойственный ацетату или аналогичным соединениям (Back W.: Farbatlas und Handbuch der Geraenkebiologie, Teil II, 1999, Verlag Hans Carl, Nuernberg).
Таким образом, когда дрожжи рода Dekkera размножаются в продукте или в ходе производственного процесса, это оказывает серьезное влияние на промышленность. Соответственно очень важна методика быстрого выявления и/или идентификации таких дрожжей для контроля качества.
Традиционным способом детекции дрожжей дикого типа является метод, основанный на культивировании. В случае культивирования дрожжей рода Dekkera используют селективную среду, к которой добавляют циклогексимид, и затем растят дрожжи в течение обычно 1-2 недель. Кроме того, метод биохимической идентификации этих дрожжей также требует 3-4 недель и при этом часто получают неопределенные результаты (Phister et al., Applied and Environmental Microbiology, 2003, Vol. 69, 7430-7434, Silva et al.: Am. J. Enol. Vitic, 2004, Vol. 55, 65-72).
Было опубликовано несколько методов детекции дрожжей рода Dekkera с использованием молекулярных биологических стратегий. Ибеас с соавт. (Ibeas et al., Applied and Environmental Microbiology, 1996, Vol. 62, 998-1003) сообщили, что примерно 10 клеток дрожжей рода Dekkera могут быть выявлены в загрязненном хересе с использованием метода двухступенчатой ПЦР. Хилдиг-Нильсен с соавт. (Hyldig-Nielsen et al., WO00/77259) и Стендер с соавт. (Stender et al., Applied and Environmental Microbiology, 2001, Vol. 67, 938-941) разработали зонд на основе пептидной нуклеиновой кислоты, который они использовали применительно к гену 26S рРНК Dekkera bruxellensis и разработали способ выявления и идентификации дрожжей вида Dekkera bruxellensis из вина по флуоресцентному методу с гибридизацией in situ. Делаэрш с соавт. (Delaherche et al., Journal of Applied Microbiology, 2004, Vol. 97, 910-915) и Фистер с соавт. (Phister et al., Applied and Environmental Microbiology, 2003, Vol. 69, 7430-7434) опубликовали методику идентификации Dekkera bruxellensis в вине с использованием методики ПЦР в реальном времени.
Кроме того, что касается идентификации дрожжей рода Dekkera на уровне вида, имеется несколько соответствующих работ. В частности, Митракул с соавт. (Mitrakul et al., Food Microbiology, 1999, Vol. 16, 3-14) сообщили, что дрожжи рода Dekkera могут быть идентифицированы на уровне вида или штамма с использованием методики RAPD-ПЦР. Кроме того, Коколин с соавт. (Cocolin et al., FEMS Microbiol. Lett., 2000, Vol. 189, 81-87) опубликовали метод, включающий непосредственную амплификацию генов дрожжей рода Dekkera, содержащихся в вине, по методу ПЦР с последующим выявлением их с помощью денатурирующего градиентного гель-электрофореза (DGGE).
Эгли с соавт. (Egli et al., Am. J. Enol. Vitic, 2001, Vol. 52, 241-247) провели амплификацию по процедуре ПЦР двух участков внутреннего транскрибированного спейсера (ITS), организованного в виде «сэндвича» за счет генов рибосомальной РНК в дрожжах рода Dekkera и гена 5,8S рРНК, локализованного между двумя участками, и далее дифференцировали их на основе различия в картинах фрагментов, полученных при обработке рестриктазой.
При исследовании представителей дрожжей рода Dekkera, используемых при сбраживании для получения традиционного ирландского сидра, Морриссей с соавт. (Morrissey et al., Journal of Applied Microbiology, 2004, Vol. 97, 647-655) провели реакцию амплификации ITS-участков и гена 5,8S рРНК по процедуре ПЦР и проанализировали полученные продукты с использованием расщепления рестриктазой.
Однако поскольку метод ПЦР, метод ПЦР в реальном времени и метод флуоресцентной гибридизации in situ требуют высокочувствительного температурного контроля и оценки флуоресценции, эти методы требуют дорогостоящей аппаратуры. Кроме того, метод двухстадийной ПЦР, метод RAPD-ПЦР, метод, основанный на рестриктазной обработке амплифицированного продукта, и метод DGGE требуют длительного периода времени для их проведения и достаточно сложных манипуляций. Таким образом, все эти методы являются проблематичными при их использовании в ежедневном тестировании микроорганизмов.
Метод амплификации нуклеиновой кислоты, известный как LAMP-метод (изотермальная петлевая амплификация (loop mediated isothermal amplification), характеризуется тем, что реакция проводится при постоянной температуре, а также высокой специфичностью реакции, обусловленной тем, что для ее проведения используются 4 типа праймеров, которые распознают 6 участков, высокой эффективностью амплификации, и, таким образом, данный метод позволяет осуществлять амплификацию за короткий период времени и, кроме того, данный метод обеспечивает получение продукта амплификации в большом количестве и пригоден для простой детекции (WO00/28082 and T. Notomi et al.: Nucleic Acids research, 2000, 28(12), е63). Цучия с соавт. (Tsuchiya et al.) разработали праймеры для использования в LAMP-методе с целью детекции дрожжей рода Brettanomyces и рода Dekkera из D2 участков генов рРНК дрожжей этих родов (WO2005/093059).
Однако набор праймеров, необходимый для использования в LAMP-методе, направленный на ITS-участки дрожжей рода Brettanomyces и дрожжей рода Dekkera, был до настоящего времени неизвестен.
Краткое описание сущности изобретения
Авторам настоящего изобретения удалось разработать набор праймеров для использования в LAMP-методе, который позволяет точно идентифицировать дрожжи рода Dekkera и дрожжи рода Brettanomyces и проводить их количественное определение.
Целью настоящего изобретения является создание набора праймеров для использования в LAMP-методе, который позволяет точно, быстро и просто идентифицировать дрожжи рода Dekkera и дрожжи рода Brettanomyces на уровне вида и также дает возможность точно определять их количество.
Далее в тексте идет описание относящееся: к детекции Dekkera anomala, в качестве первого варианта осуществления настоящего изобретения, к детекции Dekkera bruxellensis, в качестве второго варианта осуществления настоящего изобретения, к детекции Dekkera custersiana, в качестве третьего варианта осуществления настоящего изобретения, и к детекции Brettanomyces naardenensis, в качестве четвертого варианта осуществления настоящего изобретения.
Первый вариант осуществления настоящего изобретения
Согласно первому варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Dekkera anomala (который далее называется как «набор праймеров согласно первому варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 1, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 1);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 2, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 2);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 3, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 3); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 4, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 4).
Согласно первому варианту осуществления настоящего изобретения предлагается способ детекции Dekkera anomala, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 1, 2, 3 и 4.
Второй вариант осуществления настоящего изобретения
Согласно второму варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Dekkera bruxellensis (который далее называется как «набор праймеров согласно второму варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 7, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 7);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 8, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 8);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 9, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 9); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 10, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 10).
Согласно второму варианту осуществления настоящего изобретения предлагается способ детекции Dekkera bruxellensis, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 7, 8, 9 и 10.
Третий вариант осуществления настоящего изобретения
Согласно третьему варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Dekkera custersiana (который далее называется как «набор праймеров согласно третьему варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 12, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 12);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 13, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 13);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 14, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 14); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 15, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 15).
Согласно третьему варианту осуществления настоящего изобретения предлагается способ детекции Dekkera custersiana, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 12, 13, 14 и 15.
Четвертый вариант осуществления настоящего изобретения
Согласно четвертому варианту осуществления настоящего изобретения предлагается набор LAMP-праймеров для использования с целью детекции Brettanomyces naardenensis (который далее называется как «набор праймеров согласно четвертому варианту»), который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO: 17, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 17);
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO: 18, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 18);
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 19, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 19); и
полинуклеотид (B3), имеющий последовательность оснований SEQ ID NO: 20, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную данной последовательности оснований (полинуклеотид 20).
Согласно четвертому варианту осуществления настоящего изобретения предлагается способ детекции Brettanomyces naardenensis, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 17, 18, 19 и 20.
При использовании наборов праймеров согласно настоящему изобретению дрожжи рода Dekkera и дрожжи рода Brettanomyces могут быть точно идентифицированы на уровне вида с очень высокой чувствительностью, а также дрожжи рода Dekkera и дрожжи рода Brettanomyces могут быть выявлены с высокой чувствительностью. Дополнительно наборы праймеров согласно настоящему изобретению могут использоваться в реакции амплификации нуклеиновой кислоты по LAMP-методу и при детекции целевого вида, на основании данных о наличии или отсутствии амплифицированного продукта. Таким образом, на основе разработанных в рамках настоящего изобретения наборов праймеров, дрожжи рода Dekkera и дрожжи рода Brettanomyces могут быть точно, быстро и просто идентифицированы на уровне вида.
На основе наборов праймеров согласно настоящему изобретению может быть количественно определено количество клеток дрожжей рода Dekkera и клеток дрожжей рода Brettanomyces, которые содержатся в образце. Таким образом, в соответствии с разработанными в рамках настоящего изобретения наборами праймеров может быть проведено точное количественное определение уровня дрожжей рода Dekkera и дрожжей рода Brettanomyces.
Дрожжи рода Dekkera и дрожжи рода Brettanomyces представляют собой такие виды дрожжей, которые, в случае их присутствия, вызывают помутнение различных видов напитков, таких как спиртные напитки и безалкогольные напитки. Таким образом, наличие или отсутствие указанных видов дрожжей может использоваться в качестве определенного индикатора при контроле качества различных типов напитков. Соответственно наборы праймеров согласно настоящему изобретению применимы для контроля и оценки качества различных типов напитков (например, спиртных напитков и безалкогольных напитков, и в частности пива, слабосолодового пива (хаппошу) и вина), а также для оценки образцов окружающей среды.
Краткое описание чертежей
На фиг. 1 проиллюстрирована специфичность реакции с набором праймеров (DA1LF1LB1), используемым при детекции Dekkera anomala, в отношении детекции целевого вида. При этом используют указанные ниже штаммы: WY97: Dekkera bruxellensis, выделенный на пивоваренном заводе; WY101: Saccharomyces cerevisiae, выделенный на пивоваренном заводе; BFY70: дрожжи, используемые при сбраживании; NBRC1588: Brettanomyces naardenensis; DSM70001: Dekkera bruxellensis; DSM70736: Dekkera custersiana; Nega: без добавления геномной ДНК; DSM70727: Dekkera anomala.
На фиг.2 проиллюстрированы результаты детекции по методу LAMP при использовании в качестве выявляемого образца серийно разбавленного раствора ДНК (WY97). DB1LF1 используют в качестве набора праймеров для LAMP.
На фиг.3 проиллюстрированы результаты детекции по методу ПЦР, получаемые при использовании в качестве выявляемого образца раствора ДНК при ее серийном разбавлении (WY97). Последовательности ДНК SEQ ID NO: 22 и 23 используют в качестве набора праймеров в методе ПЦР. М.в.: маркер молекулярного веса; линия 1: 107 КОЕ (WY97); линия 2: 106 КОЕ; линия 3: 105 КОЕ; линия 4: 104 КОЕ; линия 5: 103 КОЕ; линия 6: 102 КОЕ; линия 7: 101 КОЕ.
На фиг.4 приведена аппроксимированная кривая, описывающая процесс образования колоний Dekkera anomala (ATCC56868) применительно ко времени детекции по LAMP-методу с использованием DA1LF1LB1. Пороговые временные значения, приведенные на горизонтальной оси, указывают ту временную точку реакции, когда показатель мутности превышает 0,1.
На фиг. 5 продемонстрирована реакционная способность набора праймеров (DC2) с целью использования их при детекции применительно к Dekkera custersiana. При этом используют приведенные ниже штаммы. WY97: Dekkera bruxellensis, выделенный на пивоваренном заводе; WY101: Saccharomyces cerevisiae, выделенный на пивоваренном заводе; BFY70: дрожжи, используемые при пивоварении; NBRC1588: Brettanomyces naardenensis; DSM70727: Dekkera anomala; DSM70001: Dekkera bruxellensis; Nega: без добавления геномной ДНК; DSM70736: Dekkera custersiana.
На фиг.6 проиллюстрирована реакционная способность контрольного набора праймеров (DC1), применительно к детекции в качестве контроля для набора праймеров, используемого в случае Dekkera custersiana. Используют приведенные ниже штаммы. WY97: Dekkera bruxellensis, выделенный на пивоваренном заводе; WY101: Saccharomyces cerevisiae, выделенный на пивоваренном заводе; BFY70: дрожжи, используемые при сбраживании; NBRC1588: Brettanomyces naardenensis; DSM70727: Dekkera anomala; DSM70001: Dekkera bruxellensis; Nega: без добавления геномной ДНК; DSM70736: Dekkera custersiana.
На фиг.7 проиллюстрирована реакционная способность набора праймеров (DA1LF1LB1), применяемого при детекции Dekkera anomala. Используют приведенные ниже штаммы. WY126: дрожжи дикого типа, выделенные на пивоваренном заводе; WLY9·WLY10·WLY13·WLY15·WLY16·WLY17: дрожжи дикого типа, выделенные из вина; BFY84·TFY3·TFY23: дрожжи, используемые при сбраживании; Nega: без добавления геномной ДНК; DSM70727: Dekkera anomala.
На фиг.8 проиллюстрирована реакционная способность контрольного набора праймеров (DA2LF1LB1) применительно к детекции в качестве контроля для набора праймеров, используемого при детекции Dekkera anomala. Используют приведенные ниже штаммы. WY126: дрожжи дикого типа, выделенные на пивоваренном заводе; WLY9·WLY10·WLY13·WLY15·WLY16·WLY17: дрожжи дикого типа, выделенные из вина; BFY84·TFY3·TFY23: дрожжи, используемые при сбраживании; Nega: без добавления геномной ДНК; DSM70727: Dekkera anomala.
Подробное описание изобретения
Праймеры и наборы праймеров
Набор праймеров согласно настоящему изобретению состоит из 4 типов праймеров, а именно: FIP, F3, BIP и B3. Указанные праймеры соответствуют 6 участкам на целевой нуклеотидной последовательности. Конкретно, участки F3c, F2c, F1c, B1, B2 и B3 определяют в указанном порядке с 3-концевой части в направлении к 5'-концевой части целевой последовательности основания. Далее получают 4 типа праймеров, а именно: FIP, F3, BIP и B3, соответствующие 6 участкам. В контексте настоящего описания участки, соответствующие участкам F3c, F2c и F1c представляют собой F3, F2 и F1, соответственно. Дополнительно участки, комплементарные участкам B1, B2 и B3, представляют собой B1c, B2c и B3c соответственно.
FIP представляет собой праймер, получаемый таким образом, чтобы он содержал F2 участок, комплементарный к F2c участку целевой последовательности на 3'-концевой части и так, чтобы он имел такую же последовательность, что и F1c участок целевого гена на 5'-концевой части. При необходимости может быть введен сайт для фермента рестрикции на участке между F1c и F2 в FIP праймере.
F3 представляет собой праймер, получаемый таким образом, чтобы он содержал F3 участок, комплементарный F3c участку на целевом гене.
BIP представляет собой праймер, получаемый таким образом, чтобы он содержал B2 участок, комплементарный B2c участку целевой последовательности на 3'-концевой части и так, чтобы он имел ту же последовательность, что и B1c участок целевого гена на 5'-концевой части. При необходимости может быть введен сайт для фермента рестрикции на участке между B1c и B2 в BIP праймере.
B3 представляет собой праймер, получаемый таким образом, чтобы он содержал B3 участок, комплементарный B3c участку целевого гена.
В том случае, когда в FIP и BIP праймерах имеется сайт фермента рестрикции, амплифицированный продукт обрабатывают рестриктазами по завершении реакции амплификации нуклеиновой кислоты согласно LAMP-методу, так, чтобы наблюдалось образование одной полосы после электрофореза. В этом случае, если целевая последовательность содержит сайт рестриктазы, искусственное введение такого сайта рестриктазы может быть необязательным.
В случае использования набора праймеров согласно настоящему изобретению могут быть добавлены один или два типа петлевых праймера (LF праймер или LB праймер) с тем, чтобы ускорить реакцию амплификации нуклеиновой кислоты. Такой петлевой праймер разрабатывается таким образом, чтобы его можно было отжечь до участка между F1 и F2 или участка между B1 и B2, после чего его добавляют в реакционную систему для проведения LAMP-процедуры. Таким образом, указанные праймеры связываются с теми петлевыми частями, которые не используются в амплификации нуклеиновой кислоты, так что использование всех петлевых частей в качестве ориджинов будет способствовать реакционной способности нуклеиновой кислоты и соответственно реакция амплификации нуклеиновой кислоты может быть ускорена (см. публикацию по выложенной заявке на патент Японии No 2002-345499).
В конкретном случае набор праймеров согласно первому варианту осуществления настоящего изобретения может также включать в качестве одного или нескольких петлевых праймеров, любой из указанных полинуклеотидов, один или оба: полинуклеотид (LF), имеющий последовательность оснований SEQ ID NO: 5, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 5); и полинуклеотид (LB), имеющий последовательность SEQ 35 ID NO: 6, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 6).
Набор праймеров согласно второму варианту осуществления настоящего изобретения может также включать, в качестве петлевого праймера, полинуклеотид (LF), содержащий последовательность оснований SEQ ID NO: 11, или полинуклеотид, состоящий, по меньшей мере из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 11).
Набор праймеров согласно третьему варианту осуществления настоящего изобретения может также включать, в качестве петлевого праймера, полинуклеотид (LB), содержащий последовательность оснований SEQ ID NO: 16 или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 16).
Набор праймеров согласно четвертому варианту осуществления настоящего изобретения может также включать, в качестве петлевого праймера, полинуклеотид (LF), имеющий последовательность оснований SEQ ID NO: 21, или полинуклеотид, состоящий, по меньшей мере, из 10 оснований, который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную указанной последовательности оснований (полинуклеотид 21).
В рамках настоящего изобретения не только полинуклеотиды, имеющие последовательности оснований SEQ ID NO: 1-21, но также полинуклеотиды, гибридизующиеся с полинуклеотидами, имеющими последовательности, комплементарные данным последовательностям оснований SEQ ID NO: 1-21 (далее называемые как «гомологичные полинуклеотиды»), могут использоваться в качестве LAMP-праймеров.
Термин «гибридизуется» используется в контексте настоящего описания для обозначения того факта, что определенный полинуклеотид гибридизуется с целевым полинуклеотидом и что он, по существу, не гибридизуется с полинуклеотидами, отличными от целевого полинуклеотида. Такая гибридизация может быть проведена в жестких условиях. В данном контексте термин «жесткие условия» может быть определен относительно Т.пл. (°C) двойной цепи праймерной последовательности и ее комплементарной последовательности, необходимой концентрации соли и т.п. Методика отбора последовательности, используемой в качестве зонда, и затем на этой основе определения жестких условий, применимых в данном случае, известна специалистам в данной области (см., например, J. Sambrook, E.F. Frisch, T. Maniatis; Molecular Cloning 2nd edition, Cold Spring Harbor Laboratory (1989) и т.п.). В качестве таких жестких условий можно указать реакцию гибридизации, которую проводят при температуре несколько меньшей, чем значение Т.пл., определенное на основании нуклеотидной последовательности (например, при температуре, которая примерно на 0°C - 5°C ниже, чем Т.пл.) в соответствующем буферном растворе, который обычно используют при гибридизации. Кроме того, в качестве другого варианта жестких условий промывка после реакции гибридизации проводится при высокой концентрации раствора с низкой концентрацией соли. Примеры таких жестких условий включают условия промывки, где указанную промывку поводят в 6 × SSC/0,05% раствора пирофосфата натрия при температурах 37°C (в случае олигонуклеотида, состоящего примерно из 14 оснований), 48°C (в случае олигонуклеотида, состоящего примерно из 17 оснований), 55°C (в случае олигонуклеотида, состоящего примерно из 20 оснований) и 60°C (в случае олигонуклеотида, состоящего примерно из 23 оснований).
Длина нуклеотидной цепи гомологичного полинуклеотида составляет по, меньшей мере, 10 оснований.
Длина нуклеотидной цепи каждого из гомологичных полинуклеотидов, FIP и BIP, может предпочтительно составлять, по меньшей мере, 30 оснований (например, 30-60 оснований) и более предпочтительно, по меньшей мере, 39 оснований (например, 39-52 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида FIP может особенно предпочтительно составлять, по меньшей мере, 39 оснований (например, 39-46 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида BIP может особенно предпочтительно составлять, по меньшей мере, 46 оснований (например, 46-52 основания).
Кроме того, длина нуклеотидной цепи каждого из гомологичных полинуклеотидов F3, B3, LF и LB может предпочтительно составлять, по меньшей мере, 12 оснований (например, 12-30 оснований) и более предпочтительно, по меньшей мере, 16 оснований (например, 16-25 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида F3 может особенно предпочтительно составлять, по меньшей мере, 16 оснований (например, 16-20 оснований и 16-25 оснований). Длина нуклеотидной цепи гомологичного полинуклеотида B3 может особенно предпочтительно составлять, по меньшей мере, 19 оснований (например, 19-22 оснований и 19-25 оснований). Длина нуклеотидной цепи каждого из гомологичных полинуклеотидов, LF и LB, особенно предпочтительно может составлять, по меньшей мере, 19 оснований (например, 19-22 основания и 19-25 оснований).
Такой гомологичный полинуклеотид может представлять собой полинуклеотид, включающий, по меньшей мере 10, предпочтительно, по меньшей мере, 15, более предпочтительно, по меньшей мере, 18, и особенно предпочтительно, по меньшей мере 20 последовательных нуклеотидов в соответствующей последовательности оснований.
Примеры полинуклеотидов, гомологичных полинуклеотидам, имеющим последовательность оснований SEQ ID NONO: 1-21, представлены ниже.
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 1, полинуклеотид, включающий, по меньшей мере, 34 (34-42), более предпочтительно, по меньшей мере, 39 (39-42) последовательных нуклеотидов из SEQ ID NO: 1 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований, предпочтительно, максимум 52 основания, и более предпочтительно, максимум 46 оснований).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 2, полинуклеотид, включающий, по меньшей мере, 16 (16-20), более предпочтительно, по меньшей мере, 18 (18-20) последовательных нуклеотидов из SEQ ID NO: 2 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид BIP, имеющий последовательность оснований SEQ ID NO: 3, полинуклеотид, включающий, по меньшей мере, 42 (42-51), более предпочтительно, по меньшей мере, 46 (46-51) последовательных нуклеотидов из SEQ ID NO: 3 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 основания).
- Гомологичный полинуклеотид B3, имеющий последовательность оснований SEQ ID NO: 4, полинуклеотид, включающий, по меньшей мере, 16 (16-21), более предпочтительно, 19 (19-21) последовательных нуклеотидов из SEQ ID NO: 4 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид LF, имеющий последовательность оснований SEQ ID NO: 5, полинуклеотид, включающий, по меньшей мере, 16 (16-22), более предпочтительно, 19 (19-22) последовательных нуклеотидов из SEQ ID NO: 5 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований и предпочтительно, максимум 25 оснований).
- Гомологичный полинуклеотид LB, имеющий последовательность оснований SEQ ID NO: 6, полинуклеотид, включающий, по меньшей мере, 14 (14-19), более предпочтительно, 16 (16-19) последовательных нуклеотидов из SEQ ID NO: 6 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 7, полинуклеотид, включающий, по меньшей мере, 39 (39-45), более предпочтительно, по меньшей мере, 41 (41-45) последовательных нуклеотидов из SEQ ID NO: 7 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований, предпочтительно, максимум 52 основания, и более предпочтительно, максимум 46 оснований).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 8, полинуклеотид, включающий, по меньшей мере, 12 (12-16), более предпочтительно, 14 (14-16) последовательных нуклеотидов из SEQ ID NO: 8 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, более предпочтительно, максимум 22 основания и особенно предпочтительно, максимум 20 оснований).
- Гомологичный полинуклеотид для BIP, имеющий последовательность оснований SEQ ID NO: 9, полинуклеотид, включающий, по меньшей мере, 42 (42-51), более предпочтительно, по меньшей мере, 46 (46-51) последовательных нуклеотидов из SEQ ID NO: 9 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 оснований).
- Гомологичный полинуклеотид B3, имеющий последовательность оснований SEQ ID NO: 10, полинуклеотид, включающий, по меньшей мере, 14 (14-19), более предпочтительно, 16 (16-19) последовательных нуклеотидов из SEQ ID NO: 10 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, более предпочтительно, максимум 22 основания и наиболее предпочтительно, 20 оснований).
- Гомологичный полинуклеотид LF, имеющий последовательность оснований SEQ ID NO: 11, полинуклеотид, включающий, по меньшей мере, 14 (14-19), более предпочтительно, 16 (16-19) последовательных нуклеотидов из SEQ ID NO: 11 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований, более предпочтительно, максимум 22 основания и наиболее предпочтительно, 20 оснований).
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 12, полинуклеотид, включающий, по меньшей мере, 33 (33-39), более предпочтительно, по меньшей мере, 36 (36-39) последовательных нуклеотидов из SEQ ID NO: 12 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований, предпочтительно, максимум 52 оснований, более предпочтительно, максимум 46 основания и наиболее предпочтительно, 42 основания).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 13, полинуклеотид, включающий, по меньшей мере, 16 (16-20), более предпочтительно, 18 (18-20) последовательных нуклеотидов из SEQ ID NO: 13 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид BIP, имеющий последовательность оснований SEQ ID NO: 14, полинуклеотид, включающий, по меньшей мере, 39 (39-46), более предпочтительно, по меньшей мере, 42 (42-46) последовательных нуклеотидов из SEQ ID NO: 14 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 основания).
- Гомологичный полинуклеотид B3, имеющий последовательность оснований SEQ ID NO: 15, полинуклеотид, включающий, по меньшей мере, 16 (16-21), более предпочтительно, 19 (19-21) последовательных нуклеотидов из SEQ ID NO: 15 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид LB, имеющий последовательность оснований SEQ ID NO: 16, полинуклеотид, включающий, по меньшей мере, 16 (16-22), более предпочтительно, 19 (19-22) последовательных нуклеотидов из SEQ ID NO: 16 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований и предпочтительно, максимум 25 оснований).
- Гомологичный полинуклеотид FIP, имеющий последовательность оснований SEQ ID NO: 17, полинуклеотид, включающий, по меньшей мере, 39 (39-46), более предпочтительно, по меньшей мере, 42 (42-46) последовательных нуклеотидов из SEQ ID NO: 17 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований и предпочтительно, максимум 52 основания).
- Гомологичный полинуклеотид F3, имеющий последовательность оснований SEQ ID NO: 18, полинуклеотид, включающий, по меньшей мере, 16 (16-20), более предпочтительно, по меньшей мере, 18 (18-20) последовательных нуклеотидов из SEQ ID NO: 18 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований и более предпочтительно, максимум 22 основания).
- Гомологичный полинуклеотид BIP, имеющий последовательность оснований SEQ ID NO: 19, полинуклеотид, включающий, по меньшей мере, 42 (42-52), более предпочтительно, по меньшей мере, 47 (47-52) последовательных нуклеотидов из SEQ ID NO: 19 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 60 оснований).
- Гомологичный полинуклеотид B3, имеющий последовательность оснований SEQ ID NO: 20, полинуклеотид, включающий, по меньшей мере, 16 (16-22), более предпочтительно, по меньшей мере, 18 (18-22) последовательных нуклеотидов из SEQ ID NO: 20 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований и предпочтительно, максимум 25 оснований).
- Гомологичный полинуклеотид LF, имеющий последовательность оснований SEQ ID NO: 21, полинуклеотид, включающий, по меньшей мере, 16 (16-21), более предпочтительно, 18 (18-21) последовательных нуклеотидов из SEQ ID NO: 21 (где может быть встроена одна или несколько мутаций) (и где длина нуклеотидной цепи может составлять максимум 30 оснований, предпочтительно, максимум 25 оснований и более предпочтительно, максимум 22 основания).
Такой гомологичный полинуклеотид может представлять собой полинуклеотид, обладающий, по меньшей мере, 90%-ной и более предпочтительно, 95%-ной идентичностью c соответствующей последовательностью оснований. Численное выражение идентичности может быть рассчитано по известному алгоритму. Так, например, численное значение идентичности может быть вычислено с использованием алгоритма BLAST ().
Кроме того, гомологичный полинуклеотид может представлять собой полинуклеотид, который состоит из последовательности модифицированных оснований, где может быть встроена одна или несколько мутаций, применительно к каждой из последовательностей оснований SEQ ID NO: 1-21, и который гибридизуется с полинуклеотидом, имеющим последовательность, комплементарную каждой из последовательностей оснований SEQ ID NO: 1-21.
В контексте настоящего описания термин «мутация», который может обозначать одинаковые или разные мутации, может быть выбран из таких вариантов мутаций, как замещение, делеция, вставка и добавление. Такая мутация может быть предпочтительно выбрана из «замещения одного основания», где некоторое основание замещают другим основанием, мутации по типу «делеция одного основания», при которой делетируют определенное основание, мутации по типу «вставка одного основания», при которой встраивают определенное основание, и мутации по типу «добавление одного основания», при которой добавляют определенное основание. Количество мутаций может быть разным и включать 1-6 оснований, 1, 2, 3 или 4 основания, 1 или 2 основания или 1 основание.
В рамках настоящего изобретения термин «полинуклеотид» включает ДНК, РНК и ПНК (пептид-нуклеиновая кислота).
Полинуклеотид, который входит в набор праймеров согласно настоящему изобретению, может быть получен по процедуре химического синтеза нуклеиновой кислоты, согласно известному методу, такому как фосфат-триэфирный метод (Hunkapiller M. et al., Nature, 310, 105, 1984). В другом варианте получают суммарную ДНК штамма, подлежащего детекции, и далее может быть получен фрагмент ДНК, содержащий интересующую нуклеотидную последовательность, по соответствующему методу, ПЦР-процедуре или аналогичной процедуре, на основании нуклеотидных последовательностей, представленных в настоящем описании.
Более конкретные варианты осуществления метода детекции согласно настоящему изобретению могут включать способы детекции дрожжей рода Dekkera и дрожжей рода Brettanomyces, которые включают проведение реакции амплификации нуклеиновой кислоты, на основе образца нуклеиновой кислоты, по LAMP-методу, с последующей детекцией наличия или отсутствия продукта амплификации нуклеиновой кислоты. В конкретном варианте могут быть использованы следующие методики.
В первом варианте осуществления настоящего изобретения предлагается способ детекции Dekkera anomala, который включает:
(a) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 1, 2, 3 и 4; и
(b) детекцию наличия или отсутствия продукта амплификации, где образование продукта амплификации указывает на наличие Dekkera anomala.
Во втором варианте осуществления настоящего изобретения предлагается способ детекции Dekkera bruxellensis, который включает:
(c) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 7, 8, 9 и 10; и
(d) детекцию наличия или отсутствия продукта амплификации, где образование продукта амплификации указывает на наличие Dekkera bruxellensis.
В третьем варианте осуществления настоящего изобретения предлагается способ детекции Dekkera custersiana, который включает:
(e) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 12, 13, 14 и 15; и
(f) детекцию наличия или отсутствия продукта амплификации, где образование продукта амплификации указывает на наличие Dekkera custersiana.
В четвертом варианте осуществления настоящего изобретения предлагается способ детекции Brettanomyces naardenensis, который включает:
(g) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 17, 18, 19 и 20; и
(h) детекцию наличия или отсутствия продукта амплификации, где образование продукта амплификации указывает на наличие Brettanomyces naardenensis.
Образец, который подвергают реакции амплификации нуклеиновой кислоты по LAMP-методу, может быть изготовлен по способу, в рамках которого содержащиеся в образце клетки культивируют и далее из культуры клеток экстрагируют нуклеиновую кислоту или такую нуклеиновую кислоту экстрагируют из клеток, не проводя процесса культивирования. Ниже описана процедура получения образца нуклеиновой кислоты, такой как процедура, включающая получение культуры клеток и выделение нуклеиновой кислоты.
В процессе амплификации нуклеиновой кислоты по LAMP-методу указанную реакцию амплификации проводят на основе нуклеиновой кислоты, содержащейся в образце. Ниже приводится описание процедуры реакции амплификации такой нуклеиновой кислоты по LAMP-методу.
В том случае, когда подлежащий детекции целевой вид имеется в образце, проводят амплификацию специфического участка в качестве участка-мишени и получают продукт амплификации. При образовании такого продукта амплификации, раствор образца, в котором проводилась реакция амплификации нуклеиновой кислоты, становится мутным. Таким образом, наличие или отсутствие продукта может быть установлено при оценке мутности раствора образца. Методика определения мутности в LAMP-процедуре хорошо известна. Мутность может быть измерена с использованием коммерчески доступного прибора, позволяющего определять конечную точку создаваемой мутности (например, прибор LA-100, производимый компанией Teramecs Co., Ltd.), или прибор для измерения мутности в масштабе реального времени (например, прибор LA-200, производимый компанией Teramecs Co., Ltd.).
Как будет описано ниже в приведенных примерах, измеряют время, необходимое для того, чтобы раствор исследуемого образца достиг определенной мутности, с тем, чтобы определить число клеток, содержащихся в исследуемом образце. В конкретном случае, в другом аспекте метода детекции согласно настоящему изобретению предлагается методика количественного подсчета дрожжей рода Dekkera и дрожжей рода Brettanomyces, которая включает проведение реакции амплификации нуклеиновой кислоты на основе образца нуклеиновой кислоты по LAMP-методу и измерение времени, необходимого для того, чтобы после инициации реакции амплификации нуклеиновой кислоты раствор образца достиг определенной степени мутности, и выявление числа клеток, содержащихся в образце на основе определения указанного периода времени. Ниже приводится более подробное описание метода количественного определения согласно настоящему изобретению.
В первом варианте осуществления настоящего изобретения предлагается способ количественного определения Dekkera anomala, который включает:
(a) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 1, 2, 3 и 4;
(b') определение периода времени, необходимого для того, чтобы после начала реакции амплификации нуклеиновой кислоты раствор образца достиг определенной степени мутности; и
(b") определение числа клеток, содержащихся в образце, на основе указанного показателя времени.
Во втором варианте осуществления настоящего изобретения предпочтительно предлагается способ количественного определения Dekkera bruxellensis, который включает:
(с) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 7, 8, 9 и 10;
(d') определение периода времени, необходимого для того, чтобы после начала реакции амплификации нуклеиновой кислоты раствор образца достиг определенной степени мутности; и
(d") определение числа клеток, содержащихся в образце, на основе указанного показателя времени.
В третьем варианте осуществления настоящего изобретения предпочтительно предлагается способ количественного определения Dekkera custersiana, который включает:
(e) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 12, 13, 14 и 15;
(f') определение периода времени, необходимого для того, чтобы после начала реакции амплификации нуклеиновой кислоты раствор образца достиг определенной степени мутности; и
(f") определение числа клеток, содержащихся в образце, на основе указанного показателя времени.
В четвертом варианте осуществления настоящего изобретения предпочтительно предлагается способ количественного определения Brettanomyces naardenensis, который включает:
(g) проведение реакции амплификации нуклеиновой кислоты на основе нуклеиновой кислоты, содержащейся в образце, по LAMP-методу с использованием набора праймеров, состоящего из полинуклеотидов 17, 18, 19 и 20;
(h') определение периода времени, необходимого для того, чтобы после начала реакции амплификации нуклеиновой кислоты раствор образца достиг определенной степени мутности; и
(h") определение числа клеток, содержащихся в образце, на основе указанного показателя времени.
При проведении количественного определения согласно настоящему изобретению предварительно строят калибровочную кривую с использованием известного числа клеток и известного периода времени, необходимого для того, чтобы раствор образца достиг определенной степени мутности. После этого количество клеток, содержащихся в образце, может быть определено на основании показателя времени, полученного по данным калибровочной кривой. Калибровочная кривая может быть построена, например, при изготовлении образцов путем постадийного разбавления культуры клеток, с последующим проведением процедуры амплификации нуклеиновой кислоты на основе каждого образца, согласно LAMP-методу, и с последующим построением графика зависимости времени, необходимого для того, чтобы после начала реакции амплификации нуклеиновой кислоты степень мутности достигла показателя 0,1, от логарифма числа колониеобразующих клеток.
В способе детекции и в способе количественного определения согласно настоящему изобретению один или несколько петлевых праймеров (LF и/или LB) могут быть добавлены к набору праймеров, состоящему из FIP, F3, BIP и B3, и затем может быть проведена реакция амплификации нуклеиновой кислоты по LAMP-методу. В конкретном варианте в способе детекции и в способе количественного определения согласно первому варианту осуществления настоящего изобретения могут быть добавлены и использованы один или оба полинуклеотида: полинуклеотид 5 и полинуклеотид 6, в качестве одного или нескольких петлевых праймеров. В способе детекции и в способе количественного определения согласно второму варианту осуществления настоящего изобретения может быть добавлен полинуклеотид 11, в качестве петлевого праймера, для его использования. В способе детекции и в способе количественного определения согласно третьему варианту осуществления настоящего изобретения может быть добавлен полинуклеотид 16, в качестве петлевого праймера, для его использования. В способе детекции и в способе количественного определения согласно четвертому варианту осуществления настоящего изобретения может быть добавлен полинуклеотид 21, в качестве петлевого праймера, для его использования.
Набор праймеров согласно настоящему изобретению может быть представлен в форме определенного фармацевтического набора, одного или в определенном сочетании. Таким образом, согласно настоящему изобретению предлагается набор для детекции дрожжей рода Dekkera и/или дрожжей рода Brettanomyces, которые содержат набор праймеров, выбранный из группы, состоящей из набора праймеров согласно первому варианту осуществления настоящего изобретения, набора праймеров согласно второму варианту осуществления настоящего изобретения, набора праймеров согласно третьему варианту осуществления настоящего изобретения и набора праймеров согласно четвертому варианту осуществления настоящего изобретения, а также сочетания указанных наборов праймеров.
Набор согласно настоящему изобретению может включать реагенты (например, ДНК-полимеразы Bst, раствор смеси реактивов для проведения реакции) и аппаратные устройства (например, реакционную пробирку), которые необходимы для осуществления реакции амплификации нуклеиновой кислоты по LAMP-методу.
Если реакцию амплификации нуклеиновой кислоты проводят по LAMP-методу с использованием набора праймеров согласно настоящему изобретению, дрожжи рода Dekkera и дрожжи рода Brettanomyces, которые вызывают снижение качества спиртных напитков или безалкогольных напитков, могут быть точно идентифицированы на уровне вида и в то же время эти дрожжи могут быть выявлены с высокой чувствительностью. Соответственно набор праймеров и набор реагентов согласно настоящему изобретению может использоваться при контроле качества спиртных напитков (например, пива, низкомальтозного пива, вина, фруктового вина) и/или безалкогольных напитков (например, безалкогольных шипучих напитков, таких как лимонад и газированная вода), а также при исследовании образцов, взятых из окружающей среды (например, воды, используемой в качестве исходного материала).
Dekkera anomala, Dekkera bruxellensis и Dekkera custersiana могут быть выявлены как виды дрожжей, вызывающих ухудшение качества продукта в процессе производства пива и низкомальтозного пива или качества уже готовых продуктов. В этой связи набор праймеров согласно первому варианту осуществления настоящего изобретения, набор праймеров согласно второму варианту осуществления настоящего изобретения, набор праймеров согласно третьему варианту осуществления настоящего изобретения, их объединенное использование, способы детекции и количественного определения, включающие использование одного или нескольких указанных праймеров, а также набор реагентов, включающий один из этих наборов праймеров, могут быть предпочтительно использованы при контроле качества пива и низкомальтозного пива.
Dekkera bruxellensis может быть выявлен в качестве вида дрожжей, вызывающих ухудшение качества продукта в процессе производства вина или качества уже готового продукта. В этой связи набор праймеров согласно второму варианту осуществления настоящего изобретения, способы детекции и количественного определения, включающие использование указанного набора праймеров, а также набор реагентов, включающий данный набор праймеров, могут быть предпочтительно использованы при контроле качества вина.
Brettanomyces naardenensis может быть выявлен в качестве вида дрожжей, вызывающего ухудшение качества продукта в процессе производства безалкогольных напитков (в частности, содовой воды и лимонада) или качества готовых продуктов. В этой связи набор праймеров согласно четвертому варианту осуществления настоящего изобретения, способы детекции и количественного определения, включающие использование этого набора праймеров, а также набор реагентов, включающий указанный набор праймеров, могут быть предпочтительно использованы при контроле качества безалкогольных напитков (в частности, содовой воды и лимонада).
Реакция амплификации нуклеиновой кислоты по LAMP-методу
Набор праймеров согласно настоящему изобретению может использоваться в качестве праймеров для реакции амплификации нуклеиновой кислоты по LAMP-методу. Набор праймеров согласно настоящему изобретению может также использоваться в качестве праймеров не только для реакции амплификации нуклеиновой кислоты по LAMP-методу, но также для реакции амплификации нуклеиновой кислоты по модифицированному LAMP-методу. Принцип LAMP-метода и реакция амплификации нуклеиновой кислоты, основанной на этом методе, хорошо известны. Для проведения реакции амплификации нуклеиновой кислоты по LAMP-методу могут быть использованы подходы, описанные в WO00/28082, и в работе Notomi T. et al., Nucleic Acids Research, 28(12), e63(2000), которые приведены в качестве ссылки.
Реакция амплификации нуклеиновой кислоты по LAMP-методу может быть проведена с использованием коммерчески доступного набора реагентов для проведения амплификации гена по LAMP-методу. Реакция амплификации нуклеиновой кислоты может быть проведена, например, при смешивании образца ДНК, раствора праймеров и реагентов, входящих в состав коммерчески доступного набора реагентов для проведения амплификации генов по LAMP-методу (например, набор для амплификации ДНК Loopamp DNA, производимый Eiken Chemical Co., Ltd.), в соответствии с инструкциями, прилагаемыми к набору, с последующим выдерживанием полученной смеси при определенной температуре (60-65°C) с тем, чтобы прошла реакция в течение определенного периода времени (в основном, в течение 1 часа).
Реакция амплификации нуклеиновой кислоты по LAMP-методу может быть проведена в рамках описанных ниже процессов:
(i) синтезируют цепь ДНК, комплементарную матричной ДНК, под действием ДНК-полимеразы, функционирующей по типу замещения цепи, с использованием 3'-конца F2 участка FIP, в качестве ориджина репликации;
(ii) проводят отжиг F3 праймера до сайта, локализованного за пределами FIP, и расширяют синтез ДНК под действием ДНК-полимеразы замещающего цепь типа, с использованием 3'-конца в качестве ориджина репликации, что приводит к удалению ранее синтезированной цепи ДНК из FIP;
(iii) формируют двухцепочечную структуру на основе цепи ДНК, синтезированной с помощью F3 праймера и матричной ДНК;
(iv) цепь ДНК, ранее синтезированную на основе FIP, удаляют с использованием цепи ДНК из F3 праймера, так что она становится одноцепочечной ДНК. Однако указанная цепь ДНК содержит комплементарные участки F1c и F1 на 5'-концевой стороне, что приводит к самоотжигу с образованием петли;
(v) BIP отжигают до получения цепи ДНК, которая формирует петлю в ходе указанного выше в пункте (iv) процесса, и синтезируют комлементарную ДНК с использованием 3'-конца BIP в качестве ориджина репликации. В рамках данного процесса петлю отбирают и расширяют. Далее B3 праймер отжигают до сайта, локализованного за пределами BIP, и синтез ДНК расширяют под действием ДНК-полимеразы, функционирующей по типу замещения цепи, с использованием ее 3'-конца в качестве ориджина репликации, при удалении ранее синтезированной цепи ДНК из BIP;
(vi) формируют двуцепочечную ДНК в рамках указанного выше способа (v);
(vii) поскольку цепь ДНК, которая была синтезирована на основе BIP и была удалена в рамках указанного выше процесса (v), содержит комплементарные последовательности к обоим концам, это вызывает самоотжиг с формированием петли, так что образуется колоколоподобная структура;
(viii) с использованием указанной выше цепи ДНК, содержащей колоколоподобную структуру в качестве ориджина репликации, проводят цикл амплификации желательной ДНК, через стадию отжига FIP и с последующим отжигом BIP.
Для специалистов в данной области очевидно, что можно провести реакцию амплификации нуклеиновой кислоты по LAMP-методу при введении в него соответствующих модификаций. Набор праймеров согласно настоящему изобретению может также использоваться в рамках такого модифицированного способа.
Набор праймеров согласно настоящему изобретению вводят в реакцию синтеза ДНК при температуре от примерно 60°C до примерно 65°C (например, при температуре 65°C), а также используют на стадии отжига. Реакцию проводят в течение примерно 1 часа, через реакции отжига и синтеза цепи ДНК, так что нуклеиновая кислота может быть амплифицирована от 109 до 1010 раз.
Если набор праймеров согласно настоящему изобретению вводят в реакцию с образцом нуклеиновой кислоты в условиях, подходящих для реакции амплификации нуклеиновой кислоты по LAMP-методу, целевой участок в ITS участке цепи, в качестве мишени для детекции, амплифицируется. В том случае, когда такая реакция амплификации происходит, реакционный раствор мутнеет за счет воздействия пирофосфата магния, образуемого в качестве побочного продукта. Таким образом, на основании мутности может быть установлен факт проведения амплификации (за счет наличия или отсутствия продукта) при визуальном осмотре. Наличие или отсутствие амплификации может быть также определено путем оптического измерения мутности с использованием прибора для оценки мутности раствора. Альтернативно может быть использован электрофорез в агарозном геле или аналогичный метод для подтверждения и детекции наличия или отсутствия фрагмента ДНК.
Если выявляется амплификация нуклеиновой кислоты, это означает, что присутствует целевой ген, а это, в свою очередь, указывает на то, что штамм, использованный в качестве мишени для детекции, является для данного набора праймеров позитивным (+). И наоборот, если не выявляется такая амплификация нуклеиновой кислоты, это означает, что целевой ген отсутствует и это, в свою очередь, указывает на то, что данный штамм, в качестве мишени для детекции для данного набора праймеров, является отрицательным (-).
Образец нуклеиновой кислоты и его получение
Примеры образца, используемого в качестве мишени для детекции с набором праймеров и набором реагентов согласно настоящему изобретению, включают: спиртные напитки, такие как пиво, низкомальтозное пиво и вино; безалкогольные напитки, такие как сидр, содовая вода и газированная вода; образцы, взятые из окружающей среды, такие как вода, используемая в качестве сырьевого материала, и полуготовые продукты, отобранные в процессе производства спиртных напитков, безалкогольных напитков и т.п.
В том случае, когда эти продукты используют в качестве образцов для проведения LAMP-метода, такие процедуры, как концентрирование, разделение и культивирование клеток в образце, выделение нуклеиновой кислоты из клеток и концентрирование нуклеиновой кислоты, могут быть проведены в рамках предварительной обработки материалов. Способы концентрирования и отделения клеток, имеющихся в образце, включают фильтрование и центрифугирование, и такие методики могут быть выбраны соответствующим образом. Дополнительно клетки, концентрированные и отделенные от образца, могут быть далее подвергнуты культивированию с тем, чтобы увеличить количество таких клеток. Для культивирования может использоваться твердая агаровая среда или жидкая среда, подходящая для пролиферации целевого штамма дрожжей. Кроме того, для отбора целевого штамма дрожжей может быть добавлен агент, такой как циклогексимид. Для высвобождения нуклеиновой кислоты из клеток, имеющихся в образце напитка или в образце из окружающей среды или из культивированных клеток, может быть выбран, например, метод, в котором используется коммерчески доступный набор реагентов, или метод обработки клеток щелочным раствором с последующим нагреванием клеток до температуры 100°C с целью выделения из них нуклеиновой кислоты. Кроме того, при необходимости проведения дополнительной очистки нуклеиновой кислоты указанная нуклеиновая кислота может быть очищена при фенольной/хлороформной обработке, путем осаждения этанолом, центрифугирования и т.п., и такая очищенная нуклеиновая кислота может быть затем перерастворена в ТЭ буфере или аналогичном буфере с тем, чтобы ее можно было использовать в качестве матричной ДНК в соответствующих тестах (European Brewery Convention: ANALYTICA-MICROBIOLOGICA-EBC, 2nd ed. 2005, Fachverlag Hans Carl, Nuernberg; Rolf et al.: PCR-Clinical diagnostics and research, Springer-Verlag, Berlin, 1992; Yasuji Oshima et al.: Tanpaku kakusan koso (Proteins, Nucleic acids, Enzymes), Vol. 35, 2523-2541, 1990).
Детекция дрожжей рода Dekkera и дрожжей рода Brettanomyces с использованием набора праймеров реагентов согласно настоящему изобретению может быть осуществлена, например, указанным ниже способом.
Вначале дрожжи рода Dekkera и дрожжи рода Brettanomyces, которые, как предполагается, присутствуют в образце, культивируют в подходящей среде. Затем отделяют ДНК от образованных на агаровой среде колоний и проводят LAMP-процедуру с использованием набора праймеров согласно настоящему изобретению на основе ДНК с тем, чтобы амплифицировать специфические генные участки дрожжей рода Dekkera и дрожжей рода Brettanomyces. Полученный продукт генной амплификации будет указывать на наличие штамма, используемого в качестве мишени для набора праймеров.
Термин «род Dekkera» обозначает полученное при половом размножении поколение дрожжей «рода Brettanomyces». С точки зрения таксономии можно сказать, что это один тип дрожжей, который имеет разные обозначения для поколений, полученных половым и неполовым размножением и, таким образом, оба обозначения сочетаются друг с другом. При этом нет необходимости говорить, что наборы праймеров согласно первому, второму и третьему вариантам осуществления настоящего изобретения могут также использоваться при детекции штамма соответствующего рода Brettanomyces, а набор праймеров согласно четвертому варианту осуществления настоящего изобретения может использоваться при детекции штамма соответствующего рода Dekkera.
Примеры
Ниже настоящее изобретение поясняется соответствующими примерами. Однако данные примеры не следует рассматривать как ограничивающие область настоящего изобретения.
Пример 1. Детекция дрожжей рода Dekkera и дрожжей рода Brettanomyces
(а) Метод экстракции геномной ДНК
Клетки, которые культивировались на чашке с агаровой средой, отделяют от среды и затем суспендируют в стерильной дистиллированной воде. Указанную суспензию центрифугируют (15000 об/мин, 5 минут) и полученный супернатант отбрасывают. К осажденным клеткам снова добавляют дистиллированную воду и объединенный раствор далее суспендируют и снова центрифугируют. Супернатант снова отбрасывают и затем к полученным клеткам добавляют 100 мкл раствора PrepMan Ultra (производство Applied Biosystems). Смесь нагревают при температуре 95°C в течение 10 минут. Затем полученный продукт центрифугируют со скоростью 15000 об/мин в течение 1 минуты и супернатант используют в качестве раствора геномной ДНК. В ином случае к промытым клеткам добавляют 100 мкл 0,1 N раствора NaOH и смесь затем нагревают при температуре 95°C в течение 10 минут. После этого полученный продукт нейтрализуют добавлением 1 M Трис-буфера (pH 7,0) и супернатант используют в качестве раствора геномной ДНК.
(b) Праймеры, используемые в LAMP-методе
Праймеры, используемые для 4 типов штаммов дрожжей рода Dekkera, описанных ниже, химически синтезируют с использованием eGenome Order (), производства компании Fujitsu System Solutions Ltd., и затем растворяют в ТЭ буфере (pH 8,0), с достижением концентрации 100 мкМ. Указанные растворы смешивают так, чтобы каждый содержал заданную концентрацию (FIP и BIP праймеры: 16 мкМ; F3 и B3 праймеры: 2 мкМ; и LF и LB праймеры: 8 мкМ), и затем их разбавляют.
[Набор праймеров, используемый при детекции Dekkera anomala (DA1LF1LB1)]
FIP: ACCGCGTATTCTCATAACCACTCCGGGCATGCCTGTTTGAGC
(SEQ ID NO: 1)
F3: AGTTCTTGAACGCACATTGC (SEQ ID NO: 2)
BIP:
ACTGGGAGGAGTAATAATTACAAGGTTTCGGGGACTCAGTAGGAGTTGCTA (SEQ ID NO: 3)
B3: TCCTCCTACCTGATTTGAGGT (SEQ ID NO: 4)
LF: AGAGAAGTGAGAAGGAAATGAC (SEQ ID NO: 5)
LB: GCCGATTTATTGCGTCTTC (SEQ ID NO: 6)
[Набор праймеров, используемый при детекции Dekkera bruxellensis (DB1LF1)]
FIP: ACCCTCGTGTAATCTCATAACCACTAAGGAGGGCATGCCTGTTTG
(SEQ ID NO: 7)
F3: ACATTGCGCCCTCTGG (SEQ ID NO: 8)
BIP:
GATTTAAGGTTTCGGCCGTTCATTATTTTCTCCTACCTGATTTGAGGTCAA (SEQ ID NO: 9)
B3: TGCTTAAGTTCAGCGGGTC (SEQ ID NO: 10)
LF: AGTGAGAAGGAAATGACGC (SEQ ID NO: 11)
[Набор праймеров, используемый при детекции Dekkera custersiana (DC2LB1)]
FIP: CGGTGCCGTCATCACAACTACGGGCATGCCTGTTTGAGC (SEQ ID NO: 12)
F3: AGTTCTTGAACGCACATTGC (SEQ ID NO: 13)
BIP: GCGGTCCGTCGAAGAGAATGACGTAGATAAAAGTCAACGACTGGTC (SEQ ID NO: 14)
B3: TCCTCCTACCTGATTTGAGGT (SEQ ID NO: 15)
LB: AGTTAACGGAGTAAGGTTTC (SEQ ID NO: 16)
[Набор праймеров, используемый при детекции Brettanomyces naardenensis (BN1LF1)]
FIP:
GAGAGGTATCTTCAAAACCACTTGCGATTCTGGGGGGTATTCCTGT
(SEQ ID NO: 17)
F3: AGTTCTTGAACGCACATTGC (SEQ ID NO: 18)
BIP: GGAATTCTGAATTTAGTTGGCTTCTTGTTTGCTTTCAACGAATGGTCGAAAC (SEQ ID NO: 19)
B3: AAACGTCAAGGTCATTGACTAC (SEQ ID NO: 20)
LF: TGAGAAGGAAATGACGCTCAA (SEQ ID NO: 21)
(c) Получение раствора для проведения реакции амплификации по LAMP-методу.
Используют набор для амплификации ДНК Loopamp, производство Eiken Chemical Co., Ltd., в качестве набора реагентов для генной амплификации по LAMP-методу. В реактивную пробирку добавляют 2,5 мкл раствора геномной ДНК, 2,5 мкл праймерного раствора, 12,5 мкл концентрированного в 2 раза реакционного буфера, 1 мкл ДНК-полимеразы Bst и 6,5 мкл стерильной воды, получая реакционный раствор общим объемом 25 мкл.
(d) Реакция по LAMP-методу
Для проведения реакции по LAMP-методу используют нефелометр LA-200, функционирующий в масштабе реального времени, производства компании Teramecs Co., Ltd. Устанавливают реакционную пробирку и проводят реакцию указанного реакционного раствора при постоянной температуре 65°C (температура кожуха: 75°C), и каждые 6 секунд измеряют изменение мутности в ходе реакции. Реакционный раствор, мутность которого повышается, определяют как положительный по данному методу, а реакционный раствор, мутность которого не повышается по данному методу, определяют как отрицательный.
(e) Оценка специфичности праймера, используемого для каждого штамма дрожжей
Применительно к 4 типам штаммов дрожжей рода Dekkera получают праймеры, специфичные для каждого штамма дрожжей, и такие праймеры оценивают по LAMP-методу с использованием каждого из штаммов дрожжей.
В результате было показано, что каждый праймер специфически взаимодействует со штаммом дрожжей, взятым в качестве мишени, и плохо взаимодействует с другими штаммами дрожжей. На фиг.1 проиллюстрирован процесс, при котором, в том случае, когда праймер реагирует со штаммом, являющимся мишенью для детекции, амплификация происходит в течение 60 минут после начала реакции, и повышается мутность в реакционной пробирке.
Кроме того, оценивают специфичность каждого праймера с использованием различных типов стандартных штаммов дрожжей, штаммов дрожжей, используемых при пивоварении, штаммов дрожжей дикого типа, выделенных при пивоварении, и штаммов дрожжей дикого типа, выделенных из вина. В результате было показано, что практически отсутствует амплификация, в случае штаммов, отличных от штамма, используемого в качестве исследуемой мишени для каждого праймера, и что специфичность каждого праймера для штамма дрожжей, представляющего собой соответствующую мишень, была очень высокой (Таблицы 1-4).
Таблица 1. Оценка праймеров с использованием различных типов штаммов дрожжей рода Dekkera (числовые значения в каждой позиции таблицы обозначают: время реакции, необходимое для проведения амплификации; -: реакция амплификации не проходит в течение 60-минутного взаимодействия)
Таблица 2. Оценка праймеров с использованием различных типов стандартных штаммов дрожжей (числовые значения в каждой позиции таблицы обозначают: время реакции, необходимое для проведения амплификации; -: реакция амплификации не проходит в течение 60-минутного взаимодействия)
Таблица 3. Оценка праймеров с использованием различных типов штаммов дрожжей, используемых в пивоварении, и штаммов диких дрожжей, выделенных на пивоваренном заводе (числовые значения в каждой позиции таблицы обозначают: время реакции, необходимое для проведения амплификации; -: реакция амплификации не проходит в течение 60-минутного взаимодействия)
Таблица 4. Оценка праймеров с использованием штаммов дрожжей, выделенных из вина различного типа (числовые значения в каждой позиции таблицы обозначены: время реакции, необходимое для проведения амплификации; -: реакция амплификации не проходит в течение 60-минутного взаимодействия)
Приведенные выше результаты показывают, что набор праймеров согласно настоящему изобретению, получаемый для 4 типов штаммов дрожжей, позволяет точно выявлять наличие дрожжей рода Dekkera и наличие дрожжей рода Brettanomyces на уровне вида.
Пример 2. Сравнение предела определения по LAMP-методу с пределом определения по ПЦР-методу
Для сравнения эффективности амплификации по LAMP-методу с эффективностью амплификации в рамках традиционного метода по процедуре ПЦР клетки Dekkera bruxellensis WY97, которые культивировали на чашке Петри с агаровой средой, постадийно разбавляют и экстрагируют ДНК по указанному выше методу. Экстрагированный ДНК далее подвергают реакции по процедурам LAMP-метода и ПЦР-метода.
Для проведения ПЦР-метода используют Ex Taq, производство компании Takara Bio Inc. Последовательности оснований праймеров, которые используются при детекции Dekkera bruxellensis и которые применялись в рамках ПЦР, имеют следующий вид.
Смысловой праймер: GATAAAAATACATTAAATTTATTTAGTT (SEQ ID NO:22)
Антисмысловой праймер: GAACGGCCGAAACCTTAAATC (SEQ ID NO: 23)
Антисмысловой праймер в составе данного набора праймеров имеет тот же участок, что и последовательность, использованная для создания LAMP-праймера. Последовательности, специфичные для штаммов дрожжей, используемых согласно настоящему описанию, могут также применяться в других методиках генной амплификации. Указанные реагенты смешивают согласно инструкциям по Ex Taq, предоставляемым производителем Takara Bio Inc.; и затем смесь вводят в термический цикл. Температура, используемая в программе циклической обработки, соответствует следующему режиму: 94°C - в течение 30 секунд, 50°C - в течение 30 секунд и 72°C - в течение 1 минуты, и затем программу повторяют 25 раз с тем, чтобы осуществить ПЦР-реакцию.
В результате наблюдается реакция амплификации, даже для клеток в количестве 101 КОЕ (1,8 × 101 КОЕ) согласно LAMP-методу, тогда как в рамках ПЦР-метода не выявляются соответствующие полосы в случае клеток в количестве ниже, чем 104 КОЕ (1,8 × 104 КОЕ) (фиг. 2 и 3). Таким образом, согласно методу детекции дрожжей рода Dekkera по LAMP-методу, ген может быть амплифицирован в клетках, содержащихся в меньшем количестве, даже с использованием той же самой ДНК. Соответственно можно сказать, что чувствительность детекции по методу, включающему использование процедуры LAMP, значительно выше, чем чувствительность традиционного метода ПЦР.
Даже в случае ПЦР-процедуры, если число циклов возрастает, то чувствительность такой детекции может быть увеличена. Однако в этом случае удлиняется время, в течение которого реагенты устанавливаются в термальном цикле. В случае ПЦР-метода время, необходимое для проведения реакции в термическом цикле, составляет примерно 1,5 часа, и результаты не могут быть подтверждены без проведения электрофореза и окрашивания ДНК. В методе детекции по LAMP-процедуре детекция может быть проведена в течение 60 минут после начала реакции, даже в том случае, если количество клеток небольшое, и, таким образом, было показано, что метод детекции по LAMP-процедуре более приемлем, чем ПЦР-метод, с точки зрения эффективности амплификации и продолжительности этой процедуры.
В случае LAMP-праймеров, отличных от DB1LF1, анализируют предел детекции каждого праймера применительно к штамму дрожжей, используемому в качестве мишени для праймеров, при детекции, включающей LAMP-метод. В результате было показано, что DA1LF1LB1, DC2LB1 и BN1LF1 также характеризуются чувствительностью по детекции, равной примерно 1 × 101 КОЕ, как и в случае DB1LF1.
Предел детекции каждого праймера в случае суспендирования клеток в стерильной воде был определен следующим образом.
DA1LF1LB1: 9,8 × 100 КОЕ
DB1LF1: 1,8 × 101 КОЕ
DC2LB1: 9,3 × 100 КОЕ
BN1LF1: 6,3 × 101 КОЕ
Дополнительно реакцию амплификации нуклеиновой кислоты по LAMP-методу проводят на геномной ДНК, экстрагированной из разбавленного раствора клеток на каждой стадии. Определяют время, необходимое от момента инициации реакции до помутнения реакционного раствора, которое превышает показатель 0,1. Строят график в логарифмической шкале, описывающий время в случае использования DB1LF1, DA1LF1LB1, DC2LB1 и BN1LF1 (пороговое время) и соответствующее число образовавшихся колоний. В результате экспоненциальной аппроксимации может быть построена приблизительная кривая с высоким коэффициентом корреляции (R2 = 0,971-0,999). Аппроксимированная кривая для DA1LF1LB1 соответствует кривой, показанной на фиг. 4.
Как было указано выше, при использовании калибровочной кривой, построенной на основе зависимости времени, необходимого для достижения определенной степени мутности реакционного раствора, и количества образованных колоний клеток, дрожжи рода Dekkera и дрожжи рода Brettanomyces, содержащиеся в образце, могут быть количественно определены в диапазоне от 1 × 101 КОЕ до 1 × 107 КОЕ.
Пример 3. Прямая детекция клеток в вине и пиве
Для определения могут ли быть выявлены дрожжи рода Dekkera в вине, проводят культивирование Dekkera bruxellensis (ATCC64276) в среде с мальтозным агаром. Далее полученные клетки суспендируют в красном вине, простерилизованном через фильтр, и проводят ступенчатое разбавление с использованием того же красного вина. Разбавленный раствор клеток и красного вина центрифугируют и супернатант отбрасывают, получая осадок. К данному осадку добавляют щелочной раствор по приведенному выше методу и экстрагируют ДНК. В случае данного экстракта выявляется ситуация, в соответствии с которой амплификация не происходит по процедуре LAMP-реакции, или время, необходимое для инициации амплификации, задерживается на 10 минут или более. Это означает, что красное вино, оставшееся в центрифужной пробирке, ингибирует LAMP-реакцию.
Разбавленный раствор клеток-красного вина, полученный по указанному выше способу, центрифугируют и отбрасывают супернатант. Добавляют 1 мл стерильной воды для промывки осадка. Затем получают осадок при проведении повторного центрифугирования и экстрагируют ДНК. В результате появляется возможность выявить клетки в рамках LAMP-реакции. Таким образом, было показано, что когда проводится выявление клеток, по LAMP-методу, непосредственно в напитках, таких как вино, необходимы стадии отбора и промывки клеток. Было обнаружено, что когда клетки собирают и промывают, предел детекции клеток, суспендированных в вине, определяется на том же уровне, что и в случае суспендирования клеток в стерильной воде. Кроме того, при суспендировании Dekkera bruxellensis WY97 в пиве наблюдается такой же предел детекции.
В случае суспендирования Dekkera bruxellensis в вине, пиве и стерильной воде соответствующий предел выявления имеет ниже указанный вид (отбор клеток и их промывку проводят один раз в случае образцов вина и пива).
Стерильная вода: 1,8 × 101 КОЕ
Вино: 1,5 × 101 КОЕ
Пиво: 5,4 × 101 КОЕ
При производстве вина, в основном, используют дрожжи рода Saccharomyces в качестве винных дрожжей, добавляемых к фруктовому соку, для ферментации. Поскольку дрожжи рода Dekkera присутствуют во фруктовом соке в качестве контаминантов из внешней среды, количество дрожжевых клеток рода Dekkera существенно ниже, чем количество дрожжевых клеток рода Saccharomyces. Однако даже если количество клеток небольшое, в случае наличия дрожжей рода Dekkera, такие дрожжи рода Dekkera пролиферируют во второй половине ферментации и в ходе хранения, так что они могут влиять на качество вина. Соответственно раннее выявление дрожжей рода Dekkera достаточно важно. При этом 1 × 107 клеток Saccharomyces cerevisiae суспендируют в вине и затем разбавленный раствор клеток Dekkera bruxellensis (ATCC64276), полученный по указанному выше методу, смешивают с ними, после чего проводят отбор и промывку. Далее клетки собирают и экстрагируют из них ДНК. Таким образом, определяют, возможно ли выявить дрожжи рода Dekkera по LAMP-методу.
В результате было показано, что независимо от наличия дрожжей рода Saccharomyces, дрожжи рода Dekkera могут быть выявлены, и при этом сохраняется тот же предел детекции. Аналогично дрожжи в нижней части ферментера суспендируют в пиве, и затем с ними смешивают разбавленный раствор клеток Dekkera bruxellensis WY97. В этом случае получают те же самые результаты.
Предел детекции клеток Dekkera bruxellensis, в случае добавления дрожжей рода Saccharomyces к вину и пиву, имеет следующий вид.
Вино + Saccharomyces cerevisiae (1 × 107 клеток): 1,5 × 101 КОЕ
Пиво + дрожжи из нижней части ферментера (1 × 107 клеток): 5,4 × 101 КОЕ
Пример 4. Сравнение праймеров, используемых для детекции
(а) Сравнение праймеров, которые используют при детекции Dekkera custersiana
Набор праймеров, используемый при детекции Dekkera custersiana (DC2), и контрольный набор праймеров (DC1), указанный ниже, синтезируют химически по процедуре, описанной в примере 1(b), и одновременно получают праймерный раствор, используемый в методе LAMP. Контрольный набор праймеров (DC1) направлен на ITS участок (ITS1), который отличается от другого ITS участка (ITS2), представляющего собой мишень для набора праймеров согласно настоящему изобретению (DC2). Дополнительно ITS2 соответствует участку между геном 5,8S рРНК и геном 26S рРНК (большая субъединица).
[Набор праймеров, используемый при детекции Dekkera custersiana (DC2)]
FIP: CGGTGCCGTCATCACAACTACGGGCATGCCTGTTTGAGC (SEQ ID NO: 12)
F3: AGTTCTTGAACGCACATTGC (SEQ ID NO: 13)
BIP:
GCGGTCCGTCGAAGAGAATGACGTAGATAAAAGTCAACGACTGGTC
(SEQ ID NO: 14)
B3: TCCTCCTACCTGATTTGAGGT (SEQ ID NO: 15)
[Контрольный набор праймеров (DC1)]
F3:AACAAGGTTTCCGTAGGTGA (SEQ ID NO: 24)
B3:AATTCACATTAGTTATCGCAATTCG (SEQ ID NO: 25)
FIP:CATGTGTTATAATGCTTGCACTCGGCTGCGGAAGGATCATTAACGA (SEQ ID NO: 26)
BIP:GCATACAAACACAACAAACCAAAATTTATCAACTTCATCGACGCGAGAACCA (SEQ ID NO: 27)
Согласно описанию, приведенному в примерах 1(c) и (d), выявляются различные типы дрожжевых штаммов по процедуре LAMP-метода с использованием указанных выше наборов праймеров. Результаты определения показаны на фиг. 5 и 6.
В случае использования набора праймеров (DC2) согласно настоящему изобретению может быть выявлен целевой штамм, причем за достаточно короткое время (фиг. 5). Тогда как, в случае использования контрольного набора праймеров (DC1), требуется очень длительный период времени для детекции целевого штамма (фиг. 6). Петлевой праймер добавляют к контрольному набору праймеров (DC1) и проводят такой же тест для детекции. В результате было показано, что время, необходимое для повышения мутности, снижается, но при сравнении с набором праймеров согласно настоящему изобретению (DC2), все еще наблюдается различие примерно в 10 минут (данные не приведены).
Таким образом, было показано, что, при сравнении с набором праймеров, направленным на другой ITS участок, набор праймеров согласно настоящему изобретению характеризуется очень высокой реактивностью в плане детекции.
(b) Сравнение праймеров, используемых при детекции Dekkera anomala
Набор праймеров, используемый при детекции Dekkera anomala (DA1LF1LB1), и контрольный набор праймеров (DA2LF1LB1), указанный ниже, химически синтезируют по обычной методике, и растворы праймеров, используемые в LAMP-методе получают по способу, описанному в примере 1(b). FIP, F3 и LF в контрольном наборе праймеров (DA2LF1LB1) соответствуют набору праймеров согласно настоящему изобретению (DA1LF1LB1). Однако обозначение положений в BIP, B3 и LB несколько отличается от соответствующих обозначений в наборе праймеров согласно настоящему изобретению (DA1LF1LB1).
[Набор праймеров, используемый при детекции Dekkera anomala (DA1LF1LB1)]
FIP: ACCGCGTATTCTCATAACCACTCCGGGCATGCCTGTTTGAGC
(SEQ ID NO: 1)
F3: AGTTCTTGAACGCACATTGC (SEQ ID NO: 2)
BIP:
ACTGGGAGGAGTAATAATTACAAGGTTTCGGGGACTCAGTAGGAGTT
GCTA (SEQ ID NO: 3)
B3: TCCTCCTACCTGATTTGAGGT (SEQ ID NO: 4)
LF: AGAGAAGTGAGAAGGAAATGAC (SEQ ID NO: 5)
LB: GCCGATTTATTGCGTCTTC (SEQ ID NO: 6)
[Контрольный набор праймеров (DA2LF1LB1)]
FIP:ACCGCGTATTCTCATAACCACTCC-GGGCATGCCTGTTTGAGC
(SEQ ID NO: 1)
F3:AGTTCTTGAACGCACATTGC (SEQ ID NO: 2)
BIP:CCGGTGGGGAGTATACTGGGAGTAGGAGTTGCTAGAAGACG
(SEQ ID NO: 28)
B3:AAAATTGGGGGGGGACTC (SEQ ID NO: 29)
LF: AGAGAAGTGAGAAGGAAATGAC (SEQ ID NO: 5)
B:ATTACAAGGTTTCGGCCGATTT (SEQ ID NO: 30)
Согласно описанию, приведенному в примерах 1(c) и (d), различные типы дрожжевых штаммов выявляются по LAMP-методу с использованием указанных выше наборов праймеров. Результаты приведены на фиг.7 и 8.
В случае использования набора праймеров согласно настоящему изобретению (DA1LF1LB1) не наблюдается неспецифической реакции, даже через 60 минут после начала реакции (фиг.7). Тогда как в случае использования контрольного набора праймеров (DA2LF1LB1) по прошествии 60 минут от начала реакции наблюдается взаимодействие с дрожжевыми штаммами, которые отличаются от дрожжевого штамма, взятого в качестве мишени для детекции (фиг.8).
Таким образом, было показано, что набор праймеров согласно настоящему изобретению характеризуется специфичностью, которая значительно выше, чем специфичность набора праймеров, где положение мишени несколько изменено, и что набор праймеров согласно настоящему изобретению позволяет точно выявить целевой штамм дрожжей.
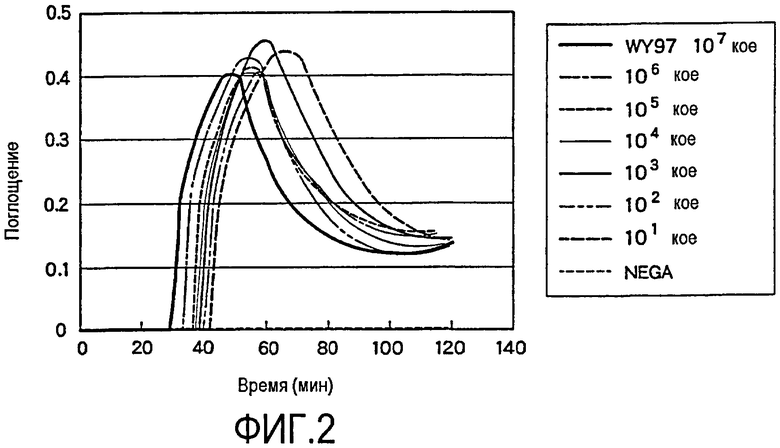












Изобретение относится к области биотехнологии. Способ детекции дрожжей Dekkera anomala, Dekkera bruxellensis, Dekkera custersiana и Brettanomyces naardenensis предусматривает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора специфических праймеров. Наборы праймеров обладают высокой специфичностью и позволяют количественно определять дрожжи рода Dekkera и Brettanomyces. Изобретение может быть использовано в области пищевой промышленности для определения качества спиртных и безалкогольных напитков. 10 н. и 4 з.п. ф-лы, 8 ил., 4 табл.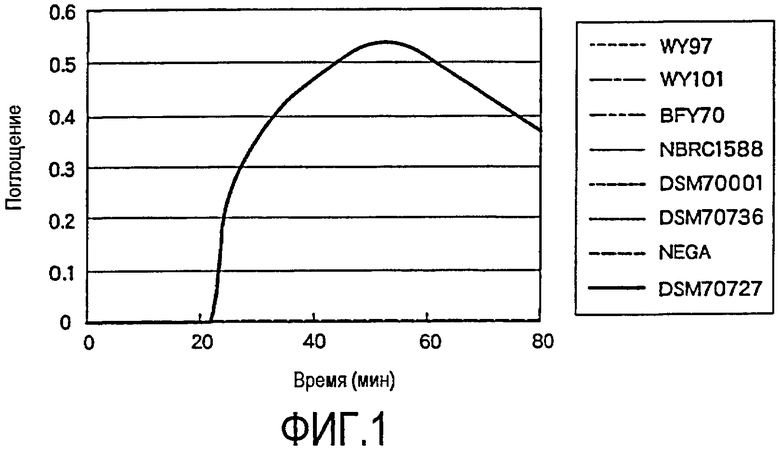
1. Набор праймеров для LAMP, используемый при детекции Dekkera anomala, который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO:1;
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO:2;
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO:3; и
полинуклеотид (ВЗ), имеющий последовательность оснований SEQ ID NO:4.
2. Набор праймеров по п.1, который дополнительно включает один или оба из приведенных ниже полинуклеотидов:
полинуклеотид (LF), имеющий последовательность оснований SEQ ID NO:5; и
полинуклеотид (LB), имеющий последовательность оснований SEQ ID NO:6.
3. Набор праймеров для LAMP, используемый при детекции Dekkera bruxellensis, который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO:7;
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO:8;
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO:9; и
полинуклеотид (В3), имеющий последовательность оснований SEQ ID NO:10.
4. Набор праймеров по п.3, который дополнительно включает полинуклеотид (LF), имеющий последовательность оснований SEQ ID NO:11.
5. Набор праймеров для LAMP, используемый при детекции Dekkera custersiana, который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO:12;
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO:13;
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO: 14; и
полинуклеотид (В3), имеющий последовательность оснований SEQ ID NO:15.
6. Набор праймеров по п.5, который дополнительно включает полинуклеотид (LB), имеющий последовательность оснований SEQ ID NO:16.
7. Набор праймеров для LAMP, используемый при детекции Brettanomyces naardenensis, который включает следующие полинуклеотиды:
полинуклеотид (FIP), имеющий последовательность оснований SEQ ID NO:17;
полинуклеотид (F3), имеющий последовательность оснований SEQ ID NO:18;
полинуклеотид (BIP), имеющий последовательность оснований SEQ ID NO:19; и
полинуклеотид (В3), имеющий последовательность оснований SEQ ID NO:20.
8. Набор праймеров по п.7, который дополнительно включает полинуклеотид (LF), имеющий последовательность оснований SEQ ID NO:21.
9. Способ детекции Dekkera anomala, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров по п.1 или 2.
10. Способ детекции Dekkera bruxellensis, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров по п.3 или 4.
11. Способ детекции Dekkera custersiana, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров по п.5 или 6.
12. Способ детекции Brettanomyces naardenensis, который включает проведение реакции амплификации нуклеиновой кислоты по LAMP-методу с использованием набора праймеров по п.7 или 8.
13. Набор для детекции дрожжей рода Dekkera и/или дрожжей рода Brettanomyces, который включает набор праймеров, выбранный из группы, состоящей из набора праймеров по п.1 или 2, набора праймеров по п.3 или 4, набора праймеров по п.5 или 6, набора праймеров по п.7 или 8, и сочетания указанных наборов праймеров.
14. Набор, используемый при контроле качества спиртовых напитков и/или безалкогольных напитков, который включает набор праймеров, выбранный из группы, состоящей из набора праймеров по п.1 или 2, набора праймеров по п.3 или 4, набора праймеров по п.5 или 6, набора праймеров по п.7 или 8, и сочетания указанных наборов праймеров.
| WO 2005093059 A1, 06.10.2005 | |||
| WO 9600298 A1, 04.01.1996 | |||
| WO 9621741 A1, 18.07.1996 | |||
| WO 9850584 A2, 12.11.1998. |
Авторы
Даты
2010-11-20—Публикация
2007-03-14—Подача