ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к анти-кластериновым антителам и к их использованию для уменьшения объема новообразований. Более конкретно, изобретение относится к гуманизированным антителам, гибридным антителам и антигенсвязывающему фрагменту, связывающемуся с кластерином и их использованию для уменьшения объема опухоли, для ингибирования роста опухоли и метастазов.
УРОВЕНЬ ТЕХНИКИ
Наиболее частые злокачественные образования у людей - карциномы - происходят из эпителиальных клеток. Прогрессирование эпителиального рака начинается с разрушения межклеточных контактов и приобретения миграционного фенотипа (мезенхимального типа). Этот феномен, называемый эпителиально-мезенхимальным переходом (ЭМП), считается ключевым на поздних стадиях прогрессирования опухоли и метастазирования.
Секретируемый белок TGF-β (трансформирующий фактор роста) вначале подавляет выраженный рост опухоли вследствие его ингибирующего действия на клетки эпителиального происхождения, а на поздних стадиях ускоряет прогрессирование опухоли и метастазирование. Один из механизмов, по которому TGF-β может стимулировать прогрессирование опухоли - индукция ЭМП.
Вследствие двойной роли TGF-β в развитии рака, использование прямых ингибиторов TGF-β может быть рискованным, поскольку, хотя они могут оказывать благоприятное действие на поздних стадиях опухолей, но, в то же время, они могут способствовать развитию предраковых поражений. Более подходящим был бы препарат, который ингибирует про-онкогенное ЭМП-стимулирующее действие TGF-β, но не ингибирует супрессивное воздействие на рост опухоли, оказываемое TGF-β. Чтобы разработать такой ингибитор, необходимо определить точку, при которой происходит раздвоение сигнального пути TGF-β, в одной ветви которого медиаторы участвуют в ЭМП-ответе, но не участвуют в ингибировании роста опухоли, оказываемом TGF-β. Лекарственные препараты, ингибирующие медиаторы, которые действуют исключительно в ветви ЭМП-ответа TGF-β сигнального пути, будут уменьшать метастазирование, не способствуя образованию предраковых поражений.
До настоящего времени не было выявлено специфических компонентов TGF-β сигнального пути, ускоряющих или опосредующих ЭМП-действие TGF-β, которые бы не участвовали в ингибировании роста, оказываемом TGF-β.
Наоборот, был установлен эндогенный белок (ядерный фактор YY1), который способен воздействовать (обратно ускорению) на онкогенное действие ЭМП, оказываемое TGF-β, не затрагивая подавление опухоли (ингибирование роста) (Kurisaki et al., 2004).
Известны ингибиторы, направленные на лиганды TGF-β, его рецепторы и сигнальные белки Smad. Растворимые эктодомены рецепторов, антитела и иные связывающие белки способны оказывать антагонистическое воздействие при взаимодействии с лигандами TGF-β и их секвестировании из рецепторов, расположенных на поверхности клеток. Известны небольшие молекулы, которые ингибируют киназную активность TGF-β рецептора I типа, а также эндогенные ингибиторы сигнальных белков Smad. Поскольку все эти компоненты сигнального пути вовлечены как в прокарциногенное так и в антикарциногенное воздействия TGF-β, эти ингибиторы могут оказывать благоприятное влияние при новообразованиях поздних стадий, но, в то же время, могут способствовать образованию предраковых поражений.
В международной патентной заявке PCT/CA2006/001505, поданной 13 сентября 2006 и опубликованной 22 марта 2007 WO2007/030930, описаны анти-кластериновые антитела и антигенсвязывающие фрагменты, которые направлены против специфического эпитопа кластерина и способные ингибировать эпителиально-мезенхимальный переход клеток карциномы. В данной патентной заявке более конкретно описана способность анти-кластериновых антител ингибировать ЭМП карциномы предстательной железы и карциномы молочной железы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, в одном аспекте, к антителу, способному к специфическому связыванию с кластерином и содержащему гуманизированный вариабельный регион легкой цепи и/или гуманизированный вариабельный регион тяжелой цепи.
Более конкретно, настоящее изобретение предоставляет гуманизированные антитела нечеловеческого происхождения, способные специфически связываться с кластерином, а также гибридные антитела и антигенсвязывающий фрагмент.
Гуманизированные или гибридные антитела по настоящему изобретению включают вариабельный регион легкой цепи и вариабельный регион тяжелой цепи, которые могут содержать нечеловеческие аминокислотные последовательности области, определяющей комплементарность и человеческие аминокислотные последовательности каркасной области натурального человеческого антитела.
Настоящее изобретение также относится к антигенсвязывающему фрагменту, который включает вариабельный регион легкой цепи и вариабельный регион тяжелой цепи, которые могут содержать нечеловеческие аминокислотные последовательности области, определяющей комплементарность и человеческие аминокислотные последовательности каркасной области.
Антитела и антигенсвязывающий фрагмент по настоящему изобретению могут использоваться для ингибирования эпителиально-мезенхимального перехода, индуцируемого кластерином.
В ином аспекте настоящее изобретение относится к анти-кластериновому антителу (поликлональному антителу, моноклональному антителу, химерному антителу, гуманизированному антителу, изолированному человеческому антителу, гибридному антителу или их фрагменту), используемому для уменьшения объема опухоли и к способам его получения.
Также настоящее изобретение охватывает изолированные нуклеиновые кислоты, кодирующие вариабельный регион легкой цепи и/или вариабельный регион тяжелой цепи гуманизированного антитела, гибридного антитела или антигенсвязывающего фрагмента, описанных в данном документе или изолированного антитела, описанного в данном документе.
Также изобретение охватывает вектор или конструкцию, содержащую нуклеиновую кислоту, описанную в данном документе. В соответствии с данным изобретением, вектор может являться, к примеру, но не ограничиваясь перечисленным, вектором экспрессии млекопитающего, бактериальным вектором экспрессии и т. д.
Изобретение также относится к клеткам, содержащим или экспрессирующим антитело или антигенсвязывающий фрагмент согласно данному изобретению или содержащим нуклеиновые кислоты или векторы согласно данному изобретению.
В еще одном аспекте настоящее изобретение предоставляет набор, включающий флакон или флаконы, которые могут содержать, к примеру, гуманизированное антитело, описанное в данном документе, гибридное антитело, описанное в данном документе, антигенсвязывающий фрагмент, описанный в данном документе, изолированное антитело, описанное в данном документе, изолированную нуклеиновую кислоту, описанную в данном документе, либо вектор, описанный в данном документе.
В ином аспекте настоящее изобретение относится к фармацевтической композиции, которая может содержать, к примеру, гуманизированное антитело, описанное в данном документе, гибридное антитело, описанное в данном документе, антигенсвязывающий регион, описанный в данном документе, изолированное антитело, описанное в данном документе и фармацевтически приемлемый носитель.
В другом аспекте, изобретение относится к комбинированной терапии, включающей фармацевтическую композицию, описанную в данном документе и химиотерапевтический препарат.
Помимо этого, изобретение охватывает способы получения гуманизированных или гибридных анти-кластериновых антител или антигенсвязывающих фрагментов, а также способы лечения болезней, ассоциированных с экспрессией или секрецией кластерина при помощи гуманизированных или гибридных анти-кластериновых антител или антигенсвязывающих фрагментов.
Охват, применимость и преимущества настоящего изобретения следуют из нелимитирующего детального описания, приведенного ниже. Необходимо понимать, что данное детальное описание, показывая приблизительные воплощения изобретения, приведено лишь в качестве примера, со ссылкой на сопутствующие фигуры.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1. Гомологическая 3D-модель вариабельного региона мышиного анти-кластеринового антитела 16B5. Помечены определяющие комплементарность области (L1, L2, L3 в легкой цепи, H1, H2, H3 в тяжелой цепи). Мышиные каркасные остатки, замещенные на человеческие каркасные остатки, показаны в виде сферических моделей.
Фигура 2. Выравнивание последовательности мышиного 16B5, гуманизированного 16B5 и выбранной каркасной человеческой области (с указанными ссылками на базу данных NCBI). Нумерация Kabat обозначена сверху. Выделены области, определяющие комплементарность. Остатки, представляющие интерес для обратных мутаций выделены ниже выравнивания последовательности в соответствии с близостью к определяющим комплементарность областям (5: в пределах 5 ангстрем), нахождением на поверхности (B: скрытые) и контактом с парными вариабельными регионами.
Фигура 3. Кинетический анализ мышиных антител 16B5 и гуманизированных анти-кластериновых антител.
Фигура 4. Блокирование h16B5 миграции раковых клеточных линий. В анализе способом царапины на клетках мышиной карциномы молочной железы h16B5 обладает, по меньшей мере, такой же активностью, что и мышиный 16B6. На фигуре ниже показана способность антител в различных конфигурациях блокировать миграцию клеток in vitro.
Фигура 5. Уменьшение инвазивности клеток рака предстательной железы человека при ингибировании, оказываемом h16B5. Нижняя часть 12-луночных планшетов была покрыта 200 мкл матригеля, обедненного факторами роста (Becton Dickinson). Клетки (2,5×104) были ресуспендированы в 200 мкл матригеля, помещенного сверху, затем сверху матригеля добавили 500 мкл питательной среды для роста клеток. В каждый слой матригеля и в среду добавили h16B5 в концентрации 8 мкг/мл. Планшеты были инкубированы при 37°C в течение 3 недель, питательную среду (+/- h16B5) обновляли еженедельно. Стрелками показаны области роста клеток эпителиального типа.
Фигура 6. Уменьшение роста опухолей и увеличение их чувствительности к химиотерапии при обработке опухолей предстательной железы антителами h16B5. Клетки рака предстательной железы DU145 (2×106) были имплантированы подкожно мышам с ТКИН, опухоли выращивали до достижения объема, равного, примерно, 100 мм3. Размеры опухолей измеряли два раза в неделю при помощи цифрового штангенциркуля, объемы опухолей рассчитывали по формуле L×W×H (длина×ширина×высота). В каждой группе было по 8 животных, проходивших рандомизацию до начала процедур. Результаты выражались в мм3 ± стандартная погрешность средней величины. p-величины определялись по t-тесту Стьюдента.
Фигура 7. Гомологическая 3D-модель вариабельного регионамышиного анти-кластеринового антитела 21B12. Помечены определяющие комплементарность области (L1, L2, L3 в легкой цепи, H1, H2, H3 в тяжелой цепи). Мышиные каркасные остатки, замещенные на человеческие каркасные остатки, показаны в виде сферических моделей.
Фигура 8. Выравнивание последовательности мышиного 16B5, гуманизированного 21B12 и выбранной каркасной человеческой области (с указанными ссылками на базу данных NCBI). Нумерация Kabat обозначена сверху. Выделены области, определяющие комплементарность. Остатки, представляющие интерес для обратных мутаций выделены ниже выравнивания последовательности в соответствии с близостью к определяющим комплементарность областям (5: в пределах 5 ангстрем), нахождением на поверхности (B: скрытые) и контактом с парными вариабельными фрагментами.
Фигура 9. Кинетический анализ мышиных антител 21B12 и гуманизированных анти-кластериновых антител.
Фигура 10. Ингибирование, оказываемое h16B5 на рост опухолей предстательной железы РС-3. Клетки рака предстательной железы ЗС-3 (2×106) были имплантированы подкожно мышам с ТКИН, опухоли выращивали до достижения объема, равного, примерно, 100 мм3. Размеры опухолей измеряли два раза в неделю при помощи цифрового штангенциркуля, объемы опухолей рассчитывали по формуле L×W×H (длина×ширина×высота). В каждой группе было по 8 животных, проходивших рандомизацию до начала процедур. Результаты выражались в мм3 ± стандартная погрешность средней величины.
Фигура 11. Экспрессия кластерина опухолями поджелудочной железы человека. У мышей с ТКИН были выращены опухоли, происходящие из клеточных линий рака поджелудочной железы (как показано), далее они были отобраны, зафиксированы в формалине, были изготовлены срезы, которые изучались иммуногистохимическим способом с использованием h16B5. Положительное окрашивание было визуализировано стандартными способами с использованием вторичного антитела, конъюгированного с пероксидазой хрена. В аналогичных условиях проводились эксперименты отрицательного контроля с использованием контролируемых по изотипу антител.
Фигура 12. Блокирование h16B5 миграции клеточных линий рака поджелудочной железы. Клетки PANC-1 были высеяны на среду без сыворотки в верхнюю камеру 24-луночного планшета Transwell, содержащую барьер матригеля. Нижние лунки были заполнены средой, содержащей 10% фетальной телячьей сыворотки в качестве хемоаттрактанта. После 24-часовой инкубации в присутствии и отсутствии TGFβ и/или h16B5 (как указано), клетки в слое матригеля были окрашены и подсчитаны.
Фигура 13. Поглощение раковыми клетками секретируемого кластерина. Рекомбинантный человеческий кластерин экспрессировался в клетках 293-6E, очищался и помечался Alexa Fluor 488 при помощи доступного в продаже набора для внедрения меток (Invitrogen). Клетки мышиной карциномы молочной железы BRI-JM01 были высеяны на покровные стекла и обработаны 250 нг/мл меченного секретированного кластерина. С установленными временными интервалами, клетки промывались ледяным фосфатно-солевым буферным раствором и фиксировались в 2% параформальдегиде. Стекла устанавливали на Antifade Gold, делали снимки флуоресцентным микроскопом.
Фигура 14. Ингибирование интернализации секретируемого кластерина раковыми клетками при помощи H16B5. Эксперимент проводился так, как описано в подписи к фигуре 13. H16B5 добавлялся в концентрации 10 мкг/мл.
Фигура 15. Показана область гомологии человеческого кластерина (NP_001822) и мышиного кластерина (NP_038520).
Фигура 16. Показано связывание h16B5 (помеченного AB-16B5 на фигуре) с мышиным кластерином, экспрессированы в зафиксированных замороженных срезах, полученных из опухолей молочной железы мыши 4T1. Эксперимент проводился с использованием иммуногистохимического способа, детектирование осуществлялось с использованием конъюгированного с пероксидазой хрена вторичного антитела.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в одном аспекте к антителам, способным к специфическому связыванию с кластерином и содержащим гуманизированный вариабельный регион легкой цепи и/или гуманизированный вариабельный регион тяжелой цепи.
Последовательность человеческого кластерина доступна по номеру доступа RefSeq; NM_001831.2 (ID белка=NP_001822), последовательность мышиного кластерина доступна по номеру доступа RefSeq; NM_013492.2 (ID белка = NP_038520).
Антитела или антигенсвязывающий фрагмент по настоящему изобретению могут быть способны к связыванию с мышиной и/или человеческой формой кластерина. Антитела или антигенсвязывающий фрагмент по настоящему изобретению может, также, быть способен связываться с природным вариантом и синтетическими вариантами кластерина, имеющими, по меньшей мере, 75% (например, 80%, 85%, 90%, 95%, 99%) идентичность в аминокислотной последовательности с человеческим или мышиным кластерином.
Настоящее изобретение предоставляет гуманизированные антитела нечеловеческого происхождения, способные специфически связываться с кластерином или его антигенсвязывающим фрагментом, а также гибридные антитела и их антигенсвязывающие фрагменты.
В соответствии с воплощением изобретения, гуманизированное или гибридное антитело может ингибировать (понижать) рост опухолевой клетки, экспрессирующей или секретирующей кластерин.
В соответствии с последующим воплощением изобретения, гуманизированное или гибридное антитело может уменьшать объем опухоли, содержащей клетки, экспрессирующие или секретирующие кластерин.
В соответствии с иным воплощением изобретения, гуманизированное или гибридное антитело может ингибировать (понижать) миграцию или инвазию опухолевых клеток, экспрессирующих или секретирующих кластерин.
В соответствии с еще одним воплощением изобретения, гуманизированное или гибридное антитело может ингибировать (понижать) метастазирование опухолевых клеток, экспрессирующих или секретирующих кластерин.
В ином аспекте, настоящее изобретение относится к способу уменьшения объема опухоли, содержащей кластерин-экспрессирующие клетки, который может включать введение анти-кластеринового антитела (поликлонального антитела, моноклонального антитела, химерного антитела, гуманизированного антитела, изолированного человеческого антитела, гибридного антитела или его фрагмента) млекопитающему, испытывающему в этом необходимость. Более конкретно, способ включает введение химерных, гуманизированных или гибридных антител.
В одном воплощении гибридное антитело или его фрагмент могут содержать, к примеру, вариабельный регион легкой цепи гуманизированного антитела и вариабельный регион тяжелой цепи гуманизированного антитела.
В ином воплощении гибридное антитело или его фрагмент могут содержать, к примеру, вариабельный регион легкой цепи нечеловеческого антитела и вариабельный регион тяжелой цепи гуманизированного антитела.
Термин «антитело» относится к интактному антителу, моноклональному, (полностью или частично) гуманизированному, гибридному, химерному или поликлональному антителу, а также к изолированным человеческим антителам. Термин «антитело», также, охватывает мультиспецифические антитела, например, биспецифические. Человеческие антитела, как правило, состоят из двух легких и двух тяжелых цепей, каждая из которых содержит вариабельные и постоянные участки. Вариабельный участок легкой цепи содержит 3 области, определяющих комплементарность (CDR), обозначенных в данном документе как CDRL1, CDRL2 и CDRL3, фланкированных каркасными областями. Вариабельный участок тяжелой цепи содержит 3 области, определяющих комплементарность (CDR), обозначенных в данном документе как CDRH1, CDRH2 и CDRH3, фланкированных каркасными областями.
Термин «гуманизированное антитело» относится к антителу, содержащему от одной до шести областей, определяющих комплементарность, включающих нечеловеческие аминокислотные последовательности областей, определяющих комплементарность и у которых значительная часть каркасных областей тяжелой и/или легкой цепей соответсвует человеческим антителам. В некоторых случаях, каркасные области тяжелой и/или легкой цепей гуманизированных антител полностью идентичны с областями антител, закодированных в человеческом спектре антител (натуральных природных антител). В иных случаях, каркасные области тяжелой и/или легкой цепей гуманизированных антител могут содержать от одной до тридцати аминокислот гуманизируемого нечеловеческого антитела, с остальной частью последовательности, происходящей от натурального человеческого антитела. В других случаях, гуманизированное антитело может содержать от 1 до 6 полностью нечеловеческих определяющих комплементарность областей, часто шесть определяющих комплементарность областей полностью происходят от нечеловеческих антител. В иных случаях «гуманизированное антитело» может содержать постоянную область человеческого или иного (например, от млекопитающего) происхождения.
Термин «гибридное антитело» относится к антителу, в котором одна из вариабельных областей тяжелой или легкой цепей (тяжелая или легкая цепь) гуманизирована или происходит от натурального природного антитела (имеющего аффинность к кластерину), а другой вариабельный регион тяжелой или легкой цепи (тяжелая или легкая цепь) остается нечеловеческим.
Термин «химерное антитело» относится к антителу с нечеловеческими вариабельными областями и человеческой постоянной областью.
Термин «натуральное человеческое антитело» относится к антителу, закодированному в человеческом спектре антител, например, в последовательности антител эмбрионального типа.
При использовании в данном документе, изолированное человеческое антитело «происходит из» конкретной зародышевой последовательности, если антитело получено из системы с использованием человеческих последовательностей иммуноглобулинов, например, путем иммунизации трансгенных мышей, несущих человеческие гены иммуноглобулинов или путем скрининга библиотеки генов человеческих иммуноглобулинов. Изолированное человеческое антитело, «происходящее из» последовательности человеческого зародышевого иммуноглобулина, может быть идентифицировано путем сравнивания аминокислотной последовательности человеческого антитела с аминокислотной последовательностью человеческих зародышевых иммуноглобулинов. Выбранное человеческое антитело, как правило, по меньшей мере, на 90% идентично по аминокислотной последовательности с аминокислотной последовательностью, кодируемой геном зародышевого иммуноглобулина и содержит аминокислотные остатки, которые идентифицируют антитело как человеческое при сравнении с аминокислотными последовательностями зародышевых иммуноглобулинов иных видов (например, мышиными зародышевыми последовательностями). В определенных случаях аминокислотная последовательность человеческого антитела может быть, по меньшей мере, на 95% или даже, по меньшей мере, на 96%, 97%, 98% или 99% идентична аминокислотной последовательности, кодируемой геном зародышевого иммуноглобулина. Как правило, у человеческого антитела, происходящего от конкретной человеческой зародышевой последовательности, будет не более 10 аминокислотных отличий от аминокислотной последовательности, кодируемой человеческим геном зародышевого иммуноглобулина. В некоторых случаях, у человеческого антитела, происходящего от конкретной человеческой зародышевой последовательности, может быть не более 4, 3, 2, 1 аминокислотных отличия от аминокислотной последовательности, кодируемой геном зародышевого иммуноглобулина.
Термин «антигенсвязывающий фрагмент», при использовании в данном документе, относится к одному и более фрагментов антитела, сохраняющих способность связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами неизмененного антитела. Примерами связывающих фрагментов, охватываемых термином «антигенсвязывающий фрагмент» антитела служат: (i) фрагмент Fab - моновалентный фрагмент, состоящий из фрагментов VL, VH, CL и CH1; (ii) фрагмент F(ab’)2 - бивалентный фрагмент, включающий два фрагмента Fab, соединенных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из фрагментов VH и CH1; (iv) фрагмент Fv, состоящий из фрагментов VL и VH единой спейсерной группы антитела, а также (v) фрагмент dAb (Ward et al., (1989) Nature 341:544-546), состоящий из фрагмента VH. Далее, хотя два домена фрагмента Fv, VL и VH, кодируются различными генами, они могут быть соединены, при помощи рекомбинантных способов, синтетическим сшивающим агентом, благодаря чему они могут быть получены в виде единой полипептидной цепочки, в которой области VL и VH спарены с образованием моновалентных молекул (известны как одинарные цепи Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; а также Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Подобные антитела с одинарной цепью также охватываются термином «антигенсвязывающий фрагмент антитела». Далее, антигенсвязывающие фрагменты включают иммуноглобулиновые слитые белки фрагментов связывания, содержащие (i) полипептид фрагмента связывания (например, вариабельный регион тяжелой цепи, вариабельный регион легкой цепи, вариабельный регион тяжелой цепи, слитую с вариабельной областью легкой цепи через сшивающий пептид), слитый с полипептидом шарнирной области иммуноглобулина, (ii) константную область тяжелой цепи иммуноглобулина CH2, слитую с шарнирной областью, (iii) константную область тяжелой цепи иммуноглобулина CH3, слитую с константной областью CH2. Шарнирная область может быть модифицирована путем замены одного и более цистеиновых остатков на сериновые остатки, чтобы предотвратить димеризацию. Подобные слитые белки связывающих фрагментов иммуноглобулинов описаны в патентных заявках США US 2003/0118592 и US 2003/0133939. Эти фрагменты антител были получены по обычным методикам, известным в отрасли, фрагменты были проверены на пригодность аналогично целым антителам.
Антигенсвязывающий сайт, обычно, состоит из вариабельных регионов, образованных при спаривании легкой и тяжелой цепей иммуноглобулина. Структура вариабельных областей антител весьма постоянна и сходна. Данные вариабельные области, как правило, состоят из относительно гомологичных каркасных областей (FR), перемежающихся гипервариабельными областями, называемыми областями, определяющими комплементарность (CDR). Совокупная связывающая активность антигенсвязывающего фрагмента часто определяется последовательностью области, определяющей комплементарность. Однако, зачастую каркасные области необходимы для правильного расположения и упорядочивания в пространстве областей, определяющих комплементарность, чтобы обеспечить наилучшее связывание антигена.
Гуманизированное или гибридное антитело по настоящему изобретению может включать вариабельный регион тяжелой цепи, который может содержать нечеловеческие аминокислотные последовательности области, определяющей комплементарность и человеческие аминокислотные последовательности каркасной области натурального человеческого антитела и комплементарную легкую цепь.
Гуманизированное или гибридное антитело по настоящему изобретению может включать вариабельный регион легкой цепи, который может содержать нечеловеческие аминокислотные последовательности области, определяющей комплементарность и человеческие аминокислотные последовательности каркасной области натурального человеческого антитела и комплементарную тяжелую цепь.
Гуманизированное или гибридное антитело по настоящему изобретению могут ингибировать метастазирование, миграцию или инвазию опухолевых клеток или ингибировать рост кластерин-экспрессирующих, включая, к примеру, клетки карциномы. Заявителем было сделано неожиданное открытие, заключающееся в том, что анти-кластериновые антитела, включая гуманизированные или гибридные антитела по настоящему изобретению, уменьшают объем опухоли in vivo. Альтернативно, гуманизированное или гибридное антитело по настоящему изобретению может использоваться для выявления кластерин-экспрессирующих клеток.
Натуральное человеческое антитело, выбранное для гуманизирования нечеловеческого родительского антитела, может содержать вариабельный участок, содержащий трехмерную структуру, сходную (совпадающую) с (моделированным) вариабельным участком нечеловеческого родительского антитела. Таким образом, у гуманизированного или гибридного антитела есть больше шансов иметь трехмерную структуру, аналогичную нечеловеческому родительскому антителу.
Гуманизированное антитело по настоящему изобретению имеет высокую аффинность к кластерину. Было показано, что гуманизированное антитело связывается с рекомбинантным мономерным кластерином с аффинностью 4,49×10-9 M±8,5×10-10 и больше.
В соответствии с настоящим изобретением, человеческие аминокислотные последовательности легкой цепи гуманизированного или гибридного антитела происходят из каркасной области легкой цепи натурального человеческого антитела. Каркасная область легкой цепи натурального человеческого антитела, выбранного для гуманизирования, может обладать, к примеру, по меньшей мере, 70%-й идентичностью с каркасной областью легкой цепи нечеловеческого родительского антитела. Предпочтительно, чтобы натуральное человеческое антитело, выбранное для гуманизирования, имело такое же или практически такое же число аминокислот в определяющем комплементарность фрагменте легкой цепи, что и у определяющего комплементарность фрагмента легкой цепи нечеловеческого родительского антитела.
В иных воплощениях изобретения человеческие аминокислотные последовательности легкой цепи гуманизированного или гибридного антитела происходят из каркасной области легкой цепи натурального человеческого антитела, обладающей, по меньшей мере, 75, 80, 83% идентичностью (и более) с каркасной областью легкой цепи нечеловеческого родительского антитела.
Также, в соответствии с настоящим изобретением, аминокислотные остатки человеческой каркасной области тяжелой цепи гуманизированного или гибридного антитела происходят из каркасной области тяжелой цепи натурального человеческого антитела, обладающей, по меньшей мере, 70% идентичностью с каркасной областью тяжелой цепи нечеловеческого родительского антитела. Предпочтительно, чтобы натуральное человеческое антитело, выбранное для гуманизирования, имело такое же или практически такое же число аминокислот в определяющем комплементарность фрагменте тяжелой цепи, что и у определяющего комплементарность фрагмента тяжелой цепи нечеловеческого родительского антитела.
В иных воплощениях изобретения аминокислотные остатки человеческой каркасной области тяжелой цепи гуманизированного или гибридного антитела происходят из каркасной области тяжелой цепи натурального человеческого антитела, обладающей, по меньшей мере, 73, 75, 80% идентичностью с каркасной областью тяжелой цепи нечеловеческого родительского антитела.
В одном воплощении изобретения вариабельный участок тяжелой цепи гуманизированного или гибридного антитела может содержать, по меньшей мере, один нечеловеческий определяющий комплементарность регион.
Альтернативно, в иных воплощениях изобретения вариабельный участок тяжелой цепи гуманизированного или гибридного антитела может содержать, по меньшей мере, два или даже три нечеловеческих определяющих комплементарность регионов.
В дополнительном воплощении изобретения вариабельный участок легкой цепи может содержать, по меньшей мере, один нечеловеческий определяющий комплементарность регион.
Альтернативно, в дополнительных воплощениях изобретения вариабельный участок легкой цепи может содержать, по меньшей мере, два или даже три нечеловеческих определяющих комплементарность регионов.
Гуманизированное антитело может, предпочтительно, содержать все шесть определяющих комплементарность регионов нечеловеческого антитела. В случае двухвалентного гуманизированного антитела, все двенадцать определяющих комплементарность регионов могут происходить из нечеловеческого антитела.
Кластерин-экспрессирующие клетки, которые могут выявляться гуманизированными или гибридными антителами, включают клетки карциномы. Гуманизированные или гибридные антитела также могут использоваться для ингибирования роста клеток кластерин-экспрессирующей карциномы и, особенно, клеток человеческой карциномы.
Было показано, что кластерин секретируют или экспрессируют несколько типов человеческих клеток карциномы, среди которых: клетки эндометриальной карциномы, карциномы молочной железы, печеночно-клеточной карциномы, карциномы предстательной железы, почечно-клеточной карциномы, карциномы яичника, колоректального рака, карциномы поджелудочной железы и т. д.
Примеры воплощений изобретения включают, к примеру, гуманизированное или гибридное антитело, содержащее аминокислотные остатки каркасной области тяжелой цепи натурального человеческого антитела, как описано в данном документе и определяющую комплементарность область тяжелой цепи (CDRH), выбранную из группы, состоящей из: CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:1, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:2 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:3 и их комбинаций с определяющей комплементарность областью тяжелой цепи, выбранной из группы, состоящей из CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:11, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:12 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:13 и их комбинаций.
В ином приблизительном воплощении изобретения гуманизированное или гибридное антитело может содержать аминокислотные остатки каркасной области тяжелой цепи натурального человеческого антитела, как описано в данном документе и, по меньшей мере, две определяющие комплементарность области тяжелой цепи (CDRH), выбранные из группы, состоящей из: CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:1, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:2 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:3 или, по меньшей мере, две определяющие комплементарность области тяжелой цепи, выбранные из группы, состоящей из CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:11, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:12 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:13 и их комбинаций.
Альтернативно, в другом приблизительном воплощении изобретения гуманизированное или гибридное антитело согласно данному изобретению, может содержать аминокислотные остатки каркасной области тяжелой цепи натурального человеческого антитела, как описано в данном документе и CDRH1, обладающую аминокислотной последовательностью SEQ ID NO.:1, CDRH2, обладающую аминокислотной последовательностью SEQ ID NO.:2 и CDRH3, обладающую аминокислотной последовательностью SEQ ID NO.:3 или CDRH1, обладающую аминокислотной последовательностью SEQ ID NO.:11, CDRH2, обладающую аминокислотной последовательностью SEQ ID NO.:12 и CDRH3, обладающую аминокислотной последовательностью SEQ ID NO.:13.
В более специфическом воплощении изобретения гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них), может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:26 (h16B5 VL consensus1):
DIVMXQSPXSLAVSXGEXXTXXCKSSQSLLNSRTRKNYLAWYQQKPGQXPKLLIYWASTRESGVPDRFXGSGSGTDFTLTISSXQAEDXAVYYCKQSYNLWTFGXGTKLEXK; причем, по меньшей мере, одна из аминокислот, обозначенных буквой X, заменена в сравнении с соответствующей аминокислотой полипептидного набора SEQ ID NO.:25 (мышиный 16B5 VL). Аминокислотная замена может быть консервативной или неконсервативной. В соответствии с изобретением, аминокислотная замена может быть консервативной.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:27 (16B5 VL consensus2):
DIVMXa1QSPXa2SLAVSXa3GEXa4Xa5TXa6Xa7CKSSQSLLNSRTRKNYLAWYQQKPGQXa8PKLLIYWASTRESGVPDRFXa9GSGSGTDFTLTISSXa10QAEDXa11AVYYCKQSYNLWTFGXa12GTKLEXa13K;
Где Xa1 может являться нейтральной гидрофильной аминокислотой, например, T или S;
Где Xa2 может являться, например, D или S;
Где Xa3 может являться гидрофобной аминокислотой, например, L или A;
Где Xa4 может являться основной аминокислотой, например, R или K;
Где Xa5 может являться гидрофобной аминокислотой, например, A или V;
Где Xa6 может являться гидрофобной аминокислотой, например, I или M;
Где Xa7 может являться, например, N или S;
Где Xa8 может являться, например, P или S;
Где Xa9 может являться нейтральной гидрофильной аминокислотой, например, S или T;
Где Xa10 может являться гидрофобной аминокислотой, например, L или V;
Где Xa11 может являться гидрофобной аминокислотой, например, V или L;
Где Xa12 может являться, например, Q или G;
Где Xa13 может являться, например, I или F; и
где вариабельный участок легкой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:25.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:28 (16B5 VL consensus3):
DIVMXa1QSPXa2SLAVSXa3GEXa4Xa5TXa6Xa7CKSSQSLLNSRTRKNYLAWYQQKPGQXa8PKLLIYWASTRESGVPDRFXa9GSGSGTDFTLTISSXa10QAEDXa11AVYYCKQSYNLWTFGXa12GTKLEXa13K;
Где Xa1 может являться, например, T или S;
Где Xa2 может являться, например, D или S;
Где Xa3 может являться, например, L или A;
Где Xa4 может являться, например, R или K;
Где Xa5 может являться, например, A или V;
Где Xa6 может являться, например, I или M;
Где Xa7 может являться, например, N или S;
Где Xa8 может являться, например, P или S;
Где Xa9 может являться, например, S или T;
Где Xa10 может являться, например, L или V;
Где Xa11 может являться, например, V или L;
Где Xa12 может являться, например, Q или G;
Где Xa13 может являться, например, I или F; и
где вариабельный участок легкой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:25.
В ином, более специфическом воплощении изобретения, гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них), может включать вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:30 (16B5 VH consensus1);
XVQLXQSGAEXXKPGAXVXXSCXXSGFNIKDIYMHWVXQXPXXGLEWXGRIDPAYGNTKYDPKFQGXXTITADTSXXTAYXXLSSLXSEDTAVYYCARRYDTAMDYWGQGTXVTVSS;
причем, по меньшей мере, одна из аминокислот, обозначенных буквой X, заменена в сравнении с соответствующей аминокислотой полипептидного набора SEQ ID NO.:29 (мышиный 16B5 VH). Аминокислотная замена может быть консервативной или неконсервативной. В соответствии с изобретением аминокислотная замена может быть консервативной.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:31 (16B5 VH consensus2);
Xb1VQLXb2QSGAEXb3Xb4KPGAXb5VXb6Xb7SCXb8Xb9SGFNIKDIYMHWVXb10QXb11PXb12Xb13GLEWXb14GRIDPAYGNTKYDPKFQGXb15Xb16TITADTSXb17Xb18TAYXb19Xb20LSSLXb21SEDTAVYYCARRYDTAMDYWGQGTXb22VTVSS;
Где Xb1 может являться, например, Q или E;
Где Xb2 может являться, например, V или Q;
Где Xb3 может являться гидрофобной аминокислотой, например, V или L;
Где Xb4 может являться, например, K или V;
Где Xb5 может являться нейтральной гидрофильной аминокислотой, например, T или S;
Где Xb6 может являться основной аминокислотой, например, K или R;
Где Xb7 может являться гидрофобной аминокислотой, например, I или L;
Где Xb8 может являться, например, K или T;
Где Xb9 может являться, например, V или T;
Где Xb10 может являться основной аминокислотой, например, Q или K;
Где Xb11 может являться, например, A или R;
Где Xb12 может являться, например, G или E;
Где Xb13 может являться основной аминокислотой, например, K или Q;
Где Xb14 может являться гидрофобной аминокислотой, например, M или I;
Где Xb15 может являться основной аминокислотой, например, R или K;
Где Xb16 может являться гидрофобной аминокислотой, например, V или A;
Где Xb17 может являться нейтральной гидрофильной аминокислотой, например, T или S;
Где Xb18 может являться, например, D или N;
Где Xb19 может являться гидрофобной аминокислотой, например, M или L;
Где Xb20 может являться, например, E или Q;
Где Xb21 может являться, например, R или T;
Где Xb22 может являться, например, L или S; и
где вариабельный участок тяжелой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:29.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:32 (16B5 VH consensus3);
Xb1VQLXb2QSGAEXb3Xb4KPGAXb5VXb6Xb7SCXb8Xb9SGFNIKDIYMHWVXb10QXb11PXb12Xb13GLEWXb14GRIDPAYGNTKYDPKFQGXb15Xb16TITADTSXb17Xb18TAYXb19Xb20LSSLXb21SEDTAVYYCARRYDTAMDYWGQGTXb22VTVSS;
Где Xb1 может являться, например, Q или E;
Где Xb2 может являться, например, V или Q;
Где Xb3 может являться, например, V или L;
Где Xb4 может являться, например, K или V;
Где Xb5 может являться, например, T или S;
Где Xb6 может являться, например, K или R;
Где Xb7 может являться, например, I или L;
Где Xb8 может являться, например, K или T;
Где Xb9 может являться, например, V или T;
Где Xb10 может являться, например, Q или K;
Где Xb11 может являться, например, A или R;
Где Xb12 может являться, например, G или E;
Где Xb13 может являться, например, K или Q;
Где Xb14 может являться, например, M или I;
Где Xb15 может являться, например, R или K;
Где Xb16 может являться, например, V или A;
Где Xb17 может являться, например, T или S;
Где Xb18 может являться, например, D или N;
Где Xb19 может являться, например, M или L;
Где Xb20 может являться, например, E или Q;
Где Xb21 может являться, например, R или T;
Где Xb22 может являться, например, L или S; и
где вариабельный участок тяжелой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:29.
В дополнительном специфическом воплощении изобретения гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них), может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:34 (21B12 VL consensus1):
DIVMXcQSPXSLAVSXGEXXTXXCKSSQSLLYSSNQKNYLAWYQQXPGQXPKLLIYWASTRESGVPDRFXGSGSGTDFTLTISSXXAEDXAVYYCQQYYIYPRTFGXGTKLEIK;
причем, по меньшей мере, одна из аминокислот, обозначенных буквой X, заменена в сравнении с соответствующей аминокислотой полипептидного набора SEQ ID NO.:33 (мышиный 21B12 VL). Аминокислотная замена может быть консервативной или неконсервативной. В соответствии с изобретением аминокислотная замена может быть консервативной.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:35 (21B12 VL consensus2):
DIVMXc1QSPXc2SLAVSXc3GEXc4Xc5TXc6Xc7CKSSQSLLYSSNQKNYLAWYQQXc8PGQXc9PKLLIYWASTRESGVPDRFXc10GSGSGTDFTLTISSXc11Xc12AEDXc13AVYYCQQYYIYPRTFGXc14GTKLEIK;
Где Xc1 может являться нейтральной гидрофильной аминокислотой, например, T или S;
Где Xc2 может являться, например, D или S;
Где Xc3 может являться гидрофобной аминокислотой, например, L или V;
Где Xc4 может являться основной аминокислотой, например, R или K;
Где Xc5 может являться гидрофобной аминокислотой, например, A или V;
Где Xc6 может являться гидрофобной аминокислотой, например, I или M;
Где Xc7 может являться, например, N или S;
Где Xc8 может являться основной аминокислотой, например, K или R;
Где Xc9 может являться, например, P или S;
Где Xc10 может являться нейтральной гидрофильной аминокислотой, например, S или T;
Где Xc11 может являться гидрофобной аминокислотой, например, L или V;
Где Xc12 может являться основной аминокислотой, например, Q или K;
Где Xc13 может являться гидрофобной аминокислотой, например, V или L;
Где Xc14 может являться, например, Q или G; и
где вариабельный участок легкой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:33.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:36 (21B12 VL consensus3):
DIVMXc1QSPXc2SLAVSXc3GEXc4Xc5TXc6Xc7CKSSQSLLYSSNQKNYLAWYQQXc8PGQXc9PKLLIYWASTRESGVPDRFXc10GSGSGTDFTLTISSXc11Xc12AEDXc13AVYYCQQYYIYPRTFGXc14GTKLEIK;
Где Xc1 может являться, например, T или S;
Где Xc2 может являться, например, D или S;
Где Xc3 может являться, например, L или V;
Где Xc4 может являться, например, R или K;
Где Xc5 может являться, например, A или V;
Где Xc6 может являться, например, I или M;
Где Xc7 может являться, например, N или S;
Где Xc8 может являться, например, K или R;
Где Xc9 может являться, например, P или S;
Где Xc10 может являться, например, S или T;
Где Xc11 может являться, например, L или V;
Где Xc12 может являться, например, Q или K;
Где Xc13 может являться, например, V или L;
Где Xc14 может являться, например, Q или G; и
где вариабельный участок легкой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:33.
В следующем приблизительном воплощении изобретения гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них), может включать вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:38 (21B12 VH consensus1);
QXQLVQSGXELKKPGXXVKXSCKASGYTFTNYGMHWVXQAPGXGLXWMGWINTYTGEPTYADDFKGRFXFSLXTSXSTAYLQIXXLKXEDTAXYXCARDGFLYFFDYWGQGTXXTVSS;
причем, по меньшей мере, одна из аминокислот, обозначенных буквой X, заменена в сравнении с соответствующей аминокислотой полипептидного набора SEQ ID NO.:37 (мышиный 21B12 VH). Аминокислотная замена может быть консервативной или неконсервативной. В соответствии с изобретением аминокислотная замена может быть консервативной.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:39 (21B12 VH consensus2);
QXd1QLVQSGXd2ELKKPGXd3Xd4VKXd5SCKASGYTFTNYGMHWVXd6QAPGXd7GLXd8WMGWINTYTGEPTYADDFKGRFXd9FSLXd10TSXd11STAYLQIXd12Xd13LKXd14EDTAXd15YXd16CARDGFLYFFDYWGQGTXd17Xd18TVSS;
Где Xd1 может являться гидрофобной аминокислотой, например, V или I;
Где Xd2 может являться, например, S или P;
Где Xd3 может являться, например, A или E;
Где Xd4 может являться нейтральной гидрофильной аминокислотой, например, S или T;
Где Xd5 может являться гидрофобной аминокислотой, например, V или I;
Где Xd6 может являться основной аминокислотой, например, R или K;
Где Xd7 может являться основной аминокислотой, например, Q или K;
Где Xd8 может являться, например, E или K;
Где Xd9 может являться гидрофобной аминокислотой, например, V или A;
Где Xd10 может являться кислой аминокислотой, например, D или E;
Где Xd11 может являться гидрофобной аминокислотой, например, V или A;
Где Xd12 может являться, например, S или N;
Где Xd13 может являться, например, S или N;
Где Xd14 может являться, например, A или N;
Где Xd15 может являться, например, V или T;
Где Xd16 может являться ароматической аминокислотой, например, Y или F;
Где Xd17 может являться, например, L или T;
Где Xd18 может являться гидрофобной аминокислотой, например, V или L; и
где вариабельный участок тяжелой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:37.
Гуманизированное или гибридное антитело (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:40 (21B12 VH consensus3):
QXd1QLVQSGXd2ELKKPGXd3Xd4VKXd5SCKASGYTFTNYGMHWVXd6QAPGXd7GLXd8WMGWINTYTGEPTYADDFKGRFXd9FSLXd10TSXd11STAYLQIXd12Xd13LKXd14EDTAXd15YXd16CARDGFLYFFDYWGQGTXd17Xd18TVSS;
Где Xd1 может являться, например, V или I;
Где Xd2 может являться, например, S или P;
Где Xd3 может являться, например, A или E;
Где Xd4 может являться, например, S или T;
Где Xd5 может являться, например, V или I;
Где Xd6 может являться, например, R или K;
Где Xd7 может являться, например, Q или K;
Где Xd8 может являться, например, E или K;
Где Xd9 может являться, например, V или A;
Где Xd10 может являться, например, D или E;
Где Xd11 может являться, например, V или A;
Где Xd12 может являться, например, S или N;
Где Xd13 может являться, например, S или N;
Где Xd14 может являться, например, A или N;
Где Xd15 может являться, например, V или T;
Где Xd16 может являться, например, Y или F;
Где Xd17 может являться, например, L или T;
Где Xd18 может являться, например, V или L; и
где вариабельный участок тяжелой цепи может содержать, по меньшей мере, одну аминокислотную замену в сравнении с SEQ ID NO.:37.
В более специфическом воплощении, гуманизированное или гибридное антитело может содержать вариабельный участок тяжелой цепи с последовательностью SEQ ID NO.:7 или SEQ ID NO.:17.
В еще более специфическом воплощении, изобретение включает гуманизированное или гибридное антитело, которое может содержать тяжелую цепь с последовательностью SEQ ID NO.:9 или SEQ ID NO.:19.
В гуманизированном или гибридном антителе по данному изобретению может присутствовать тяжелая цепь или вариабельный регион тяжелой цепи, определенные в данном документе и комплементарная легкая цепь или вариабельный регион легкой цепи.
С другой стороны, в гуманизированном или гибридном антителе по данному изобретению может присутствовать легкая цепь или вариабельный регион легкой цепи, определенные в данном документе и комплементарная тяжелая цепь или вариабельный регион тяжелой цепи.
Гуманизированное или гибридное антитело согласно настоящему изобретению может содержать аминокислотные остатки каркасной области легкой цепи натурального человеческого антитела, как описано в данном документе и определяющую комплементарность область легкой цепи, выбранную, например, из группы, состоящей из: CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:4, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:5 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:6 или определяющую комплементарность область тяжелой цепи, выбранную из группы, состоящей из CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:14, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:15 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:16 и их комбинаций.
В следующем воплощении гуманизированное или гибридное антитело может содержать аминокислотные остатки каркасной области легкой цепи натурального человеческого антитела, как описано в данном документе и, по меньшей мере, две определяющие комплементарность области легкой цепи (CDRL), выбранные из группы, состоящей из: CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:4, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:5 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:6 или, по меньшей мере, две определяющие комплементарность области тяжелой цепи, выбранные из группы, состоящей из CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:14, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:15 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:16 и их комбинаций.
В еще одном воплощении гуманизированное или гибридное антитело может содержать аминокислотные остатки каркасной области легкой цепи натурального человеческого антитела, как описано в данном документе и CDRL1, обладающую аминокислотной последовательностью SEQ ID NO.:4, CDRL2, обладающую аминокислотной последовательностью SEQ ID NO.:5 и CDRL3, обладающую аминокислотной последовательностью SEQ ID NO.:6 или CDRL1, обладающую аминокислотной последовательностью SEQ ID NO.:14, CDRL2, обладающую аминокислотной последовательностью SEQ ID NO.:15 и CDRL3, обладающую аминокислотной последовательностью SEQ ID NO.:16 и их комбинации.
В более частном воплощении, гуманизированное или гибридное антитело может содержать вариабельный участок легкой цепи с последовательностью SEQ ID NO.:8 или SEQ ID NO.:18.
В еще более частном воплощении, гуманизированное или гибридное антитело согласно изобретению, может содержать вариабельный участок легкой цепи с последовательностью SEQ ID NO.:10 или SEQ ID NO.:20.
Иные специфические воплощения изобретения охватывают гуманизированное антитело, содержащее вариабельный участок тяжелой цепи с последовательностью SEQ ID NO.:7 или SEQ ID NO.:17 и вариабельный участок легкой цепи с последовательностью SEQ ID NO.:8 или SEQ ID NO.:18.
Дополнительное специфическое воплощение изобретения охватывает гуманизированное антитело, содержащее тяжелую цепь с последовательностью SEQ ID NO.:9 и легкую цепь с последовательностью SEQ ID NO.:10.
Дополнительное специфическое воплощение изобретения охватывает гуманизированное антитело, содержащее тяжелую цепь с последовательностью SEQ ID NO.:19 и легкую цепь с последовательностью SEQ ID NO.:20.
Настоящее изобретение относится, в следующем аспекте, к антителу или его антигенсвязывающему фрагменту, способным к специфическому связыванию с кластерином, которые могут быть выбраны из группы, состоящей из:
антитела или его антигенсвязывающего фрагмента, имеющего вариабельный регион легкой цепи, по меньшей мере, на 80% идентичный (например, на 85%, 90%, 95%, 99%) последовательности SEQ ID NO.:25 и/или вариабельный регион тяжелой цепи, по меньшей мере, на 80% идентичный (например, на 85%, 90%, 95%, 99%) последовательности SEQ ID NO.:29, причем в антителе или антигенсвязывающем фрагменте может присутствовать, например, по меньшей мере, одна аминокислотная замена в сравнении с SEQ ID NO.:25 или SEQ ID NO.:29 и аминокислотная замена может быть, например, вне области, определяющей комплементарность (CDR); и
антитела или его антигенсвязывающего фрагмента, имеющего вариабельный регион легкой цепи, по меньшей мере, на 80% идентичный (например, на 85%, 90%, 95%, 99%) последовательности SEQ ID NO.:33 и/или вариабельный регион тяжелой цепи, по меньшей мере, на 80% идентичный (например, на 85%, 90%, 95%, 99%) последовательности SEQ ID NO.:37, причем в антителе или антигенсвязывающем фрагменте может присутствовать, по меньшей мере, одна аминокислотная замена в сравнении с SEQ ID NO.:33 или SEQ ID NO.:37 и аминокислотная замена может быть, например, вне области, определяющей комплементарность (CDR).
В соответствии с настоящим изобретением, по меньшей мере, одна аминокислотная замена может присутствовать, например, в вариабельном регионе легкой цепи.
В соответствии с настоящим изобретением, по меньшей мере, одна аминокислотная замена может присутствовать, например, в вариабельном регионе тяжелой цепи.
Аминокислотная замена может быть консервативной или неконсервативной. В более специфическом воплощении аминокислотная замена может быть консервативной.
В соответствии с воплощением изобретения антитела и антигенсвязывающие фрагменты по настоящему изобретению, связываются с человеческим кластерином. В соответствии с другим воплощением изобретения антитела и антигенсвязывающие фрагменты по настоящему изобретению, связываются с мышиным кластерином. Антитела и антигенсвязывающий фрагмент по настоящему изобретению могут также связываться с природным или синтетическим вариантом мышиного или человеческого кластерина. Подобный вариант может, к примеру, обладать аминокислотной последовательностью, по меньшей мере, на 75% идентичной последовательности человеческого или мышиного кластерина.
Определяющие комплементарность регионы (CDR) SEQ ID NO.:29 (идентичные SEQ ID NO. 30, 31, 32 и 7) были идентифицированы при помощи определений Kabat и Chothia. Соответствующие последовательности определяющих комплементарность регионов идентифицированы следующим образом: CDR1 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:1, CDR2 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:2, а CDR3 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:3.
Более короткие версии SEQ ID NO:1, 2 и 3 были представлены в международной заявке PCT/CA2006/001505, поданной 13 сентября 2006 (т.е., 1505 заявка) и опубликованной WO2007/030930. В данной патентной заявке определяющие комплементарность регионы последовательности SEQ ID NO.:29 (соответствует SEQ ID NO.:23 в заявке ‘1505) были идентифицированы при помощи поискового ПО IMGT/V, реализующего определения IMGT. Соответствующие последовательности идентифицированы следующим образом: CDR1 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:44, CDR2 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:45, а CDR3 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:46.
При использовании в данном документе, термин «аминокислотная замена … снаружи определяющего комплементарность региона (CDR)» по отношению к SEQ ID NO.:29, в общем, относится к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:1, 2 и 3. В некоторых воплощениях данный термин, альтернативно, может относиться к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:44, 45 и 46.
Определяющие комплементарность регионы (CDR) SEQ ID NO.:25 (идентичные SEQ ID NO. 26, 27, 28 и 8), были идентифицированы при помощи определений Kabat и Chothia. Соответствующие последовательности определяющих комплементарность регионов идентифицированы следующим образом: CDR1 вариабельного региона легкой цепи соответствует SEQ ID NO.:4, CDR2 вариабельного региона легкой цепи соответствует SEQ ID NO.:5, а CDR3 вариабельного региона легкой цепи соответствует SEQ ID NO.:6.
Более короткие версии последовательностей SEQ ID NO. 4, 5 и 6 были представлены в международной заявке No. PCT/CA2006/001505, поданной 13 сентября 2006 (т.е., 1505 заявка) и опубликованной под No. WO2007/030930. В данной патентной заявке определяющие комплементарность регионы последовательности SEQ ID NO.:25 (соответствует SEQ ID NO.:12 в заявке ‘1505) были идентифицированы при помощи поискового ПО IMGT/V, реализующего определения IMGT. Соответствующие последовательности определяющих комплементарность регионов идентифицированы следующим образом: CDR1 вариабельного региона легкой цепи соответствует SEQ ID NO.:47, CDR2 вариабельного региона легкой цепи соответствует SEQ ID NO.:48, а CDR3 вариабельного региона легкой цепи соответствует SEQ ID NO.:49.
При использовании в данном документе, термин «аминокислотная замена … снаружи определяющего комплементарность региона (CDR)» по отношению к SEQ ID NO.:25, в общем, относится к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:4, 5 и 6. В некоторых воплощениях данный термин, альтернативно, может относиться к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:47, 48 и 49.
Определяющие комплементарность регионы (CDR) SEQ ID NO.:37 (идентичные SEQ ID NO. 38, 39, 40 и 17), были идентифицированы при помощи определений Kabat и Chothia. Соответствующие последовательности определяющих комплементарность регионов идентифицированы следующим образом: CDR1 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:11, CDR2 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:12, а CDR3 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:13.
Более короткие версии SEQ ID NO:11, 12 и 13 были представлены в международной заявке No. PCT/CA2006/001505, поданной 13 сентября 2006 (т.е., 1505 заявка) и опубликованной под No. WO2007/030930. В данной патентной заявке, определяющие комплементарность регионы последовательности SEQ ID NO.:37 (соответствует SEQ ID NO.:22 в заявке ‘1505), были идентифицированы при помощи поискового ПО IMGT/V, реализующего определения IMGT. Соответствующие последовательности идентифицированы следующим образом: CDR1 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:50, CDR2 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:51, а CDR3 вариабельного региона тяжелой цепи соответствует SEQ ID NO.:52.
При использовании в данном документе, термин «аминокислотная замена … снаружи определяющего комплементарность региона (CDR)» по отношению к SEQ ID NO.:37, в общем, относится к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:11, 12 и 13. В некоторых воплощениях данный термин, альтернативно, может относиться к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:50, 51 и 52.
Определяющие комплементарность регионы (CDR) SEQ ID NO.:33 (идентичные SEQ ID NO. 34, 35, 36 и 18), были идентифицированы при помощи определений Kabat и Chothia. Соответствующие последовательности определяющих комплементарность регионов идентифицированы следующим образом: CDR1 вариабельного региона легкой цепи соответствует SEQ ID NO.:14, CDR2 вариабельного региона легкой цепи соответствует SEQ ID NO.:15, а CDR3 вариабельного региона легкой цепи соответствует SEQ ID NO.:16.
Более короткие версии последовательностей SEQ ID NO. 14, 15 и 16 были представлены в международной заявке PCT/CA2006/001505, поданной 13 сентября 2006 (т.е., 1505 заявка) и опубликованной WO2007/030930. В данной патентной заявке, определяющие комплементарность регионы последовательности SEQ ID NO.:33 (соответствует SEQ ID NO.:11 в заявке ‘1505), были идентифицированы при помощи поискового ПО IMGT/V, реализующего определения IMGT. Соответствующие последовательности определяющих комплементарность регионов идентифицированы следующим образом: CDR1 вариабельного региона легкой цепи соответствует SEQ ID NO.:53, CDR2 вариабельного региона легкой цепи соответствует SEQ ID NO.:54, а CDR3 вариабельного региона легкой цепи соответствует SEQ ID NO.:55.
При использовании в данном документе, термин «аминокислотная замена … снаружи определяющего комплементарность региона (CDR)» по отношению к SEQ ID NO.:33, в общем, относится к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:14, 15 и 16. В некоторых воплощениях данный термин, альтернативно, может относиться к аминокислотам, окружающим (расположенным снаружи) SEQ ID NO.:53, 54 и 55.
Гуманизированное антитело по настоящему изобретению (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, выбранный из группы, состоящей из SEQ ID NO.:7, SEQ ID NO.:26 или SEQ ID NO.:27 и вариабельный регион тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO.:8, SEQ ID NO.:29 и SEQ ID NO.:30.
Гибридное антитело по настоящему изобретению (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, выбранный из группы, состоящей из SEQ ID NO.:7, SEQ ID NO.:26 и SEQ ID NO.:27 и вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:28.
Альтернативно, гибридное антитело по настоящему изобретению (или любой антигенсвязывающий фрагмент, полученный из них), может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:25 и вариабельный регион тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO.:8, SEQ ID NO.:29 и SEQ ID NO.:30.
Гуманизированное антитело по настоящему изобретению (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, выбранный из группы, состоящей из SEQ ID NO.:18, SEQ ID NO.:32 и SEQ ID NO.:33 и вариабельный регион тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO.:17, SEQ ID NO.:35 и SEQ ID NO.:36.
Гибридное антитело по настоящему изобретению (или любой антигенсвязывающий фрагмент, полученный из них) может включать вариабельный регион легкой цепи, выбранный из группы, состоящей из SEQ ID NO.:18, SEQ ID NO.:32 или SEQ ID NO.:33 и вариабельный регион тяжелой цепи, содержащий SEQ ID NO.:34.
Альтернативно, гибридное антитело по настоящему изобретению (или любой антигенсвязывающий фрагмент, полученный из них), может включать вариабельный регион легкой цепи, содержащий SEQ ID NO.:31 и вариабельный регион тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO.:17, SEQ ID NO.:35 и SEQ ID NO.:36.
Иное примерное воплощение гуманизированного антитела или антигенсвязывающего фрагмента по настоящему изобретению включает, например, антитело или антигенсвязывающий фрагмент с вариабельный регионом легкой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:26, SEQ ID NO.:27, SEQ ID NO.:28 или SEQ ID NO.:8.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:26», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111 или, по меньшей мере, 112 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:26» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:26, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:26, например, последовательность, включающую аминокислотные остатки от 6 до 108, от 5 до 109, от 13 до 103, от 9 до 111 последовательности SEQ ID NO.:26 и так далее.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:27», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111 или, по меньшей мере, 112 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:27» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:27, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:27, например, последовательность, включающую аминокислотные остатки от 7 до 109, от 12 до 104, от 22 до 113, от 18 до 112 последовательности SEQ ID NO.:27 и так далее.
Термины «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:28» и «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:8» имеют аналогичные значения.
В соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, вариабельный регион легкой цепи, определенный в SEQ ID NO.:8.
Также, в соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, легкую цепь, определенную в SEQ ID NO.:10.
Гуманизированное антитело или антигенсвязывающий фрагмент по изобретению включает (или далее включает), например, вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:30, 31, 32 или 7.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:30», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116 или, по меньшей мере, 117 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:30» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:30, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:30, например, последовательность, включающую аминокислотные остатки от 1 до 108, от 2 до 112, от 11 до 113, от 7 до 109 последовательности SEQ ID NO.:30 и так далее.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:31», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116 или, по меньшей мере, 117 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:31» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:31, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:31, например, последовательность, включающую аминокислотные остатки от 6 до 109, от 8 до 113, от 1 до 108, от 2 до 115 последовательности SEQ ID NO.:31 и так далее.
Термины «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:32» и «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:7» имеют аналогичные значения.
В соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, вариабельный регион тяжелой цепи, определенный в SEQ ID NO.:7.
Также, в соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, тяжелую цепь, определенную в SEQ ID NO.:9.
В соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например,
а. вариабельный регион легкой цепи, который может содержать по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:26 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:30, SEQ ID NO.:31, SEQ ID NO.:32 или SEQ ID NO.:7;
б. вариабельный регион легкой цепи, который может содержать по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:27 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:30, SEQ ID NO.:31, SEQ ID NO.:32 или SEQ ID NO.:7;
в. вариабельный регион легкой цепи, который может содержать по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:28 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:30, SEQ ID NO.:31, SEQ ID NO.:32 или SEQ ID NO.:7; или
г. вариабельный регион легкой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:8 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:30, SEQ ID NO.:31, SEQ ID NO.:32 или SEQ ID NO.:7;
В соответствии с более специфическим воплощением изобретения, вариабельный регион легкой цепи может содержать, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:8, вариабельный регион тяжелой цепи может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:7.
В соответствии с еще более специфическим воплощением изобретения, вариабельный регион легкой цепи может соответствовать последовательности SEQ ID NO.:8, а вариабельный регион тяжелой цепи может соответствовать последовательности SEQ ID NO.:7.
Иными примерными воплощениями гуманизированных антител или антигенсвязывающих фрагментов согласно изобретению, являются те, которые могут включать вариабельный регион легкой цепи, содержащий, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:34, 35, 36 или 18.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:34», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 или, по меньшей мере, 113 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:34» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:34, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:34, например, последовательность, включающую аминокислотные остатки от 6 до 103, от 11 до 106, от 1 до 106, от 3 до 110, от 5 до 107 последовательности SEQ ID NO.:34 и так далее.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:35», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 или, по меньшей мере, 113 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:35» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:35, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:35, например, последовательность, включающую аминокислотные остатки от 9 до 106, от 10 до 113, от 1 до 109, от 20 до 110, от 7 до 107 последовательности SEQ ID NO.:35 и так далее.
Термины «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:36» и «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:18» имеют аналогичные значения.
В соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, вариабельный регион легкой цепи, определенный в SEQ ID NO.:18.
Также, в соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, легкую цепь, определенную в SEQ ID NO.:20.
Гуманизированное антитело или антигенсвязывающий фрагмент по изобретению включает (или далее включает), например, вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:38, 39, 40 или 17.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:38», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117 или, по меньшей мере, 118 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:38» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:38, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:38, например, последовательность, включающую аминокислотные остатки от 6 до 111, от 1 до 114, от 12 до 109, от 5 до 113, от 10 до 107 последовательности SEQ ID NO.:38 и так далее.
При использовании в данном документе, термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:39», также, включает термины «по меньшей мере, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117 или, по меньшей мере, 118 последовательных аминокислот». Термин «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:39» охватывает любую возможную последовательность, содержащую, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:39, в особенности те последовательности, которые включают 3 определяющих комплементарность региона последовательности SEQ ID NO.:39, например, последовательность, включающую аминокислотные остатки от 3 до 109, от 1 до 115, от 1 до 110, от 22 до 116, от 20 до 115 последовательности SEQ ID NO.:39 и так далее.
Термины «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:40» и «по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:17» имеют аналогичные значения.
В соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, вариабельный регион тяжелой цепи, определенную в SEQ ID NO.:17.
Также, в соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например, тяжелую цепь, определенную в SEQ ID NO.:19. В соответствии с настоящим изобретением, антитело или антигенсвязывающий фрагмент могут включать, например,
а. вариабельный регион легкой цепи, который может содержать по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:34 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:38, SEQ ID NO.:39, SEQ ID NO.:40 или SEQ ID NO.:17;
б. вариабельный регион легкой цепи, который может содержать по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:35 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:38, SEQ ID NO.:39, SEQ ID NO.:40 или SEQ ID NO.:17;
в. вариабельный регион легкой цепи, который может содержать по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:36 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:38, SEQ ID NO.:39, SEQ ID NO.:40 или SEQ ID NO.:17; или
г. вариабельный регион легкой цепи, который может содержать по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:18 и вариабельный регион тяжелой цепи, который может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:38, SEQ ID NO.:39, SEQ ID NO.:40 или SEQ ID NO.:17.
В соответствии с более специфическим воплощением изобретения, вариабельный регион легкой цепи может содержать, по меньшей мере, 90 последовательных аминокислот последовательности SEQ ID NO.:18, вариабельный регион тяжелой цепи может содержать, по меньшей мере, 90 последовательных аминокислот любой из последовательностей SEQ ID NO.:17.
В соответствии с еще более специфическим воплощением изобретения, вариабельный регион легкой цепи может соответствовать последовательности SEQ ID NO.:18, а вариабельный регион тяжелой цепи может соответствовать последовательности SEQ ID NO.:17.
Разумеется, легкая цепь или тяжелая цепь, либо их вариабельные области, описанные в данном документе, также, могут содержать сигнальный пептид. Такой сигнальный пептид может происходить из оригинальной последовательности, либо может быть сконструирован таким образом, чтобы оптимизировать локализацию полипептида в клетке. Разумеется, желаемые сигнальные пептиды могут позволять секрецию полипептида (например, быть отщепляемыми).
Гуманизированное или гибридное антитело по настоящему изобретению может содержать константную область, предпочтительно, человеческую. Хотя могут быть выбраны и иные подтипы, гуманизированное или гибридное антитело может содержать аминокислотные остатки константной области иммуноглобулинов подтипов IgG1, IgG2 или IgG3.
Настоящее изобретение, также, в ином аспекте, относится к антигенсвязывающему фрагменту, который включает вариабельный регион легкой цепи (или ее фрагмент) и вариабельный регион тяжелой цепи (или ее фрагмент), которые могут содержать нечеловеческие аминокислотные последовательности области, определяющей комплементарность и человеческие аминокислотные последовательности каркасной области.
Антигенсвязывающий фрагмент по настоящему изобретению может связываться с кластерином и, более предпочтительно, может обладать более высокой аффинностью, нежели антигенсвязывающий фрагмент нечеловеческого родительского антитела.
Было показано, что антигенсвязывающий фрагмент связывается с рекомбинантным мономерным кластерином с аффинностью в 1,7×10-8 M ± 2,97×10-9 и более.
В примерном воплощении, антигенсвязывающий фрагмент может содержать аминокислотные остатки каркасной области тяжелой цепи натурального человеческого антитела, как описано в данном документе и определяющую комплементарность область тяжелой цепи (CDRH), выбранную из группы, состоящей из: CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:1, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:2 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:3 или определяющую комплементарность область тяжелой цепи, выбранной из группы, состоящей из CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:11, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:12 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:13.
В ином приблизительном воплощении изобретения, антигенсвязывающий фрагмент может содержать аминокислотные остатки каркасной области тяжелой цепи натурального человеческого антитела, как описано в данном документе и, по меньшей мере, две определяющие комплементарность области тяжелой цепи (CDRH), выбранные из группы, состоящей из: CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:1, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:2 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:3 или, по меньшей мере, две определяющие комплементарность области тяжелой цепи, выбранные из группы, состоящей из CDRH1, обладающей аминокислотной последовательностью SEQ ID NO.:11, CDRH2, обладающей аминокислотной последовательностью SEQ ID NO.:12 и CDRH3, обладающей аминокислотной последовательностью SEQ ID NO.:13.
В еще одном приблизительном воплощении изобретения, Антигенсвязывающий фрагмент может содержать аминокислотные остатки каркасной области тяжелой цепи натурального человеческого антитела, как описано в данном документе и CDRH1, обладающую аминокислотной последовательностью SEQ ID NO.:1, CDRH2, обладающую аминокислотной последовательностью SEQ ID NO.:2 и CDRH3, обладающую аминокислотной последовательностью SEQ ID NO.:3 или CDRH1, обладающую аминокислотной последовательностью SEQ ID NO.:11, CDRH2, обладающую аминокислотной последовательностью SEQ ID NO.:12 и CDRH3, обладающую аминокислотной последовательностью SEQ ID NO.:13.
В более частном воплощении, антигенсвязывающий фрагмент может содержать вариабельный участок тяжелой цепи с последовательностью SEQ ID NO.:7 или SEQ ID NO.:17 (или их фрагменты).
В следующем примерном воплощении, антигенсвязывающий фрагмент может содержать аминокислотные остатки каркасной области легкой цепи натурального человеческого антитела, как описано в данном документе и, определяющую комплементарность область легкой цепи (CDRL), выбранную из группы, состоящей из: CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:4, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:5 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:6 или определяющую комплементарность область легкой цепи, выбранную из группы, состоящей из CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:14, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:15 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:16.
В еще одном воплощении, антигенсвязывающий фрагмент может содержать аминокислотные остатки каркасной области легкой цепи натурального человеческого антитела, как описано в данном документе и, по меньшей мере, две определяющие комплементарность области легкой цепи (CDRL), выбранные из группы, состоящей из: CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:4, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:5 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:6 или, по меньшей мере, две определяющие комплементарность области легкой цепи, выбранные из группы, состоящей из CDRL1, обладающей аминокислотной последовательностью SEQ ID NO.:14, CDRL2, обладающей аминокислотной последовательностью SEQ ID NO.:15 и CDRL3, обладающей аминокислотной последовательностью SEQ ID NO.:16.
В еще одном примерном воплощении, антигенсвязывающий фрагмент может содержать аминокислотные остатки каркасной области легкой цепи натурального человеческого антитела, как описано в данном документе и CDRL1, обладающую аминокислотной последовательностью SEQ ID NO.:4, CDRL2, обладающую аминокислотной последовательностью SEQ ID NO.:5 и CDRL3, обладающую аминокислотной последовательностью SEQ ID NO.:6 или CDRL1, обладающую аминокислотной последовательностью SEQ ID NO.:14, CDRL2, обладающую аминокислотной последовательностью SEQ ID NO.:15 и CDRL3, обладающую аминокислотной последовательностью SEQ ID NO.:16.
В более специфическом воплощении, антигенсвязывающий фрагмент может содержать вариабельный участок легкой цепи с последовательностью SEQ ID NO.:8 или SEQ ID NO.:18 (или их фрагменты).
В соответствии с настоящим изобретением, антигенсвязывающий фрагмент может включать, например, фрагмент Fab, фрагмент F(ab’)2, фрагмент Fd, фрагмент Fv, фрагмент dAb.
Предпочтительно, чтобы антигенсвязывающий фрагмент был, например, фрагментом Fab, фрагментом F(ab’)2.
Настоящее изобретение, также, охватывает изолированное антитело, содержащее аминокислотную последовательность антигенсвязывающего фрагмента, описанную в данном документе. Изолированное антитело, также, может содержать константную область.
Вариантные антитела и антигенсвязывающие фрагменты
Хотя замещения определяющих комплементарность областей в антителах грызунов на человеческие области, определяющие комплементарность в человеческих каркасных областях, иногда достаточно для достижения высокой антигенсвязывающей аффинности (Jones, P.T. et al., Nature 321:522-525 (1986); Verhoeyen, M. et al., Science 239:1534-1536 (1988)), в других случаях необходимо, дополнительно, заменить один (Riechmann, L. et al., Nature 332:323-327 (1988)) или несколько (Queen, C. et al., Proc. Natl. Acad. Sci. USA 86:10029-10033 (1989)) остатков в каркасных областях. До сих пор существует непредсказуемость результатов в области гуманизирования антител. К примеру, в патентной заявке США No. 7537931, при попытке перенести определяющую комплементарность область мышиного антитела в человеческое антитело, была утрачена способность к связыванию с антигеном.
Если процесс гуманизирования не дает гуманизированного или гибридного антитела с желаемыми характеристиками (например, специфичностью, аффинностью и т.д.), то может потребоваться заместить аминокислотные остатки нечеловеческой каркасной области на остатки человеческой каркасной области.
Настоящее изобретение, таким образом, охватывает варианты гуманизированных или гибридных антител или антигенсвязывающих фрагментов, описанных в данном документе. К вариантам антител или антигенсвязывающих фрагментов относятся те гуманизированные или гибридные антитела, либо антигенсвязывающие фрагменты, описанные в данном документе, у которых изменена аминокислотная последовательность. К примеру, вариантные антитела или антигенсвязывающие фрагменты, охватываемые настоящим изобретением, включают вариабельный регион легкой цепи и вариабельный регион тяжелой цепи, которые могут содержать нечеловеческие аминокислотные последовательности области, определяющей комплементарность и человеческие аминокислотные последовательности каркасной области натурального человеческого антитела и, далее, содержат, по меньшей мере, одну аминокислотную замену (предпочтительно, в каркасной области).
К вариантам антител или антигенсвязывающих фрагментов, охватываемым настоящим изобретением, относятся, к примеру, те, которые обладают сходными или улучшенными характеристиками в сравнении с гуманизированными или гибридными антителами или антигенсвязывающими фрагментами, но несущие, по меньшей мере, одно аминокислотное отличие относительно гуманизированного или гибридного антитела, описанного в данном документе.
Вариантные антитела или антигенсвязывающие фрагменты, охватываемые настоящим изобретением, могут содержать вставку, делецию, аминокислотную замену (консервативную или неконсервативную). В некоторых вариантах, таким образом, может быть удалена, по меньшей мере, одна аминокислота из последовательности, а на ее место может быть внедрен другой аминокислотный остаток.
Заместительному мутагенезу могут подвергаться гипервариабельные регионы (CDR), каркасные области или, даже, константные области. Консервативные замещения могут осуществляться путем обмена аминокислоты одной из групп, перечисленных ниже (группы от 1 до 6) на другую аминокислоту из той же группы.
Иные примерные воплощения консервативных замещений показаны в Таблице 1A под заголовком «предпочтительные замены». Если подобное замещение приводит к нежелательному свойству, то может быть произведена более существенная замена, приведенная под заголовком «примерные замены» в Таблице 1A, либо описанная ниже, согласно классам аминокислот, после чего продукт может быть подвергнут проверке.
Примеры замещений, определяемых как «консервативные замены», приведены в Таблице 1A. Если подобное замещение приводит к нежелательному свойству, то может быть произведен иной тип замены, приведенный под заголовком «примерные замены» в Таблице 1A, либо замена, описанная ниже, согласно классам аминокислот, после чего продукт может быть подвергнут проверке.
Существенные модификации функции или иммунологической идентичности могут осуществляться путем выбора замещений, которые существенно отличаются во влиянии на поддержание (a) структуры полипептидного скелета в области замещения, например, складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в целевой области, либо (c) массы боковой цепи. Природные аминокислоты классифицированы в группы, основываясь на свойствах боковой цепи:
(группа 1) гидрофобные: норлейцин, метионин (Met), аланин (Ala), валин (Val), лейцин (Leu), изолейцин (Ile)
(группа 2) нейтральные гидрофильные: Цистеин (Cys), Серин (Ser), Треонин (Thr)
(группа 3) кислые: Аспарагиновая кислота (Asp), Глутаминовая кислота (Glu)
(группа 4) основные: Аспарагин (Asn), Глутамин (Gln), Гистидин (His), Лизин (Lys), Аргинин (Arg)
(группа 5) остатки, влияющие на ориентацию цепи: Глицин (Gly), Пролин (Pro); и
(группа 6) ароматические: Триптофан (Trp), Тирозин (Tyr), Фенилаланин (Phe)
Неконсервативное замещение заключается в замене члена одного класса на члена другого класса.
Замещение аминокислот
норлейцин
Ala, Phe
норлейцин
Вариация аминокислотной последовательности вариантного антитела или антигенсвязывающего фрагмента может включать добавление, делецию, вставку, замещение аминокислоты и т.д., одну и более модификаций скелета или боковой цепи одной и более аминокислот, добавление группы или иной молекулы к одной и более аминокислот (в боковые цепи или скелет).
Вариантное антитело или антигенсвязывающий фрагмент могут обладать значительным сходством и/или идентичностью аминокислотных последовательностей в сравнении с аминокислотной последовательностью оригинального антитела или антигенсвязывающего фрагмента. Степень сходства двух последовательностей определяется на процентном количестве совпадений (одинаковых аминокислот) и консервативных замен.
При определении процентного совпадения каркасной области в сравнении с другой каркасной областью, аминокислотные последовательности областей, определяющих комплементарность, не должны браться в расчет. Процентное совпадение одной каркасной области в сравнении с другой, предпочтительно, определяется для всей каркасной области, а не только для каркаса.
В общем, степень сходства и идентичности вариабельных цепей определяется при помощи программы секвенирования Blast2 (Tatiana A. Tatusova, Thomas L. Madden (1999), "Blast 2 sequences - a new tool for comparing protein and nucleotide sequences", FEMS Microbiol Lett. 174:247-250) с использованием настроек по умолчанию, т.е., программа blastp, матрица BLOSUM62 (open gap 11 и extension gap penalty 1; gapx dropoff 50, expect 10.0, word size 3) и активированных фильтров.
Процентная идентичность учитывает аминокислоты, одинаковые в сравнении с оригинальным пептидом и способные занимать те же самые или сходные положения.
Процентное сходство учитывает идентичные аминокислоты и аминокислоты, замещенные консервативно в сравнении с оригинальным пептидом и способные занимать те же самые или сходные положения.
Варианты по настоящему изобретению, таким образом, включают последовательности, по меньшей мере, на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичные оригинальной последовательности или участку оригинальной последовательности.
Примерные воплощения вариантов включают последовательности, по меньшей мере, на 81% идентичные последовательности, описанной в данном документе и на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% подобные с оригинальной последовательностью или участком оригинальной последовательности.
Иные примерные воплощения вариантов включают последовательности, по меньшей мере, на 82% идентичные последовательности, описанной в данном документе и на 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% подобные с оригинальной последовательностью или участком оригинальной последовательности.
Последующие примерные воплощения вариантов включают последовательности, по меньшей мере, на 85% идентичные последовательности, описанной в данном документе и на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% подобные с оригинальной последовательностью или участком оригинальной последовательности.
Иные примерные воплощения вариантов включают последовательности, по меньшей мере, на 90% идентичные последовательности, описанной в данном документе и на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% подобные с оригинальной последовательностью или участком оригинальной последовательности.
Дополнительные примерные воплощения вариантов включают последовательности, по меньшей мере, на 95% идентичные последовательности, описанной в данном документе и на 95%, 96%, 97%, 98%, 99% или 100% подобные с оригинальной последовательностью или участком оригинальной последовательности.
Последующие примерные воплощения вариантов включают последовательности, по меньшей мере, на 97% идентичные последовательности, описанной в данном документе и на 97%, 98%, 99% или 100% подобные с оригинальной последовательностью или участком оригинальной последовательности.
Для краткости, заявителем в таблице 1В представлены примерные воплощения индивидуальных вариантов, охватываемых изобретением и содержащих указанную процентную идентичность и процентную схожесть последовательностей. Символ «X» понимается как охватывание варианта.
Настоящее изобретение, таким образом, охватывает гуманизированное или гибридное антитело, в котором вновь внедрены нечеловеческие аминокислотные остатки каркасной области или в котором произведены иные типы модифицирования аминокислот. Аминокислоты, выбранные для оптимизации характеристик антитела включают те аминокислоты, которые вовлечены в связывание с антигеном. Примеры подобных аминокислот представлены на фигуре 2.
В примерном воплощении, гуманизированное или гибридное антитело согласно настоящему изобретению может, таким образом, содержать от одного до двадцати одного аминокислотных остатков нечеловеческой каркасной области в вариабельном регионе тяжелой цепи (обратные мутации).
В ином примерном воплощении, гуманизированное или гибридное антитело согласно настоящему изобретению может, таким образом, содержать от одного до двенадцати аминокислотных остатков нечеловеческой каркасной области в вариабельном регионе легкой цепи (обратные мутации).
При использовании в данном документе, термин «от одного до двадцати» включает все конкретные значения и интервалы, например, 1, 2, 3, и так далее до 20; от 1 до 20; от 1 до 19; от 1 до 18; от 1 до 17; от 1 до 16; от 1 до 15 и так далее; от 2 до 20; от 2 до 19; от 2 до 18; от 2 до 17 и так далее; от 3 до 20; от 3 до 19; от 3 до 18 и так далее; от 4 до 20; от 4 до 19; от 4 до 18; от 4 до 17; от 4 до 16 и так далее; от 5 до 20; от 5 до 19; от 5 до 18; от 5 до 17 и так далее и т.п.
Аналогично, при использовании в данном документе, термин «от одного до двенадцати» включает все конкретные значения и интервалы, например, 1, 2, 3, и так далее до 12; от 1 до 12; от 1 до 11; от 1 до 10 и так далее; от 2 до 12; от 2 до 11, от 2 до 10; от 2 до 9; от 2 до 8 и так далее; от 3 до 12; от 3 до 11; от 3 до 10; от 3 до 9 и так далее; от 4 до 12; от 4 до 11 и так далее; от 5 до 12; от 5 до 11; от 5 до 10; от 5 до 9; от 5 до 8; от 5 до 7; и так далее и т.п.
Аналогичные термины следует толковать подобным образом.
Изобретение охватывает или использует аминокислотную последовательность, обладающую желаемой % идентичностью с другой аминокислотной последовательностью, например, «каркасная область легкой цепи натурального человеческого антитела, обладающая, по меньшей мере, 70% идентичностью с каркасной областью легкой цепи нечеловеческого родительского антитела» или «каркасная область тяжелой цепи натурального человеческого антитела, обладающая, по меньшей мере, 70% идентичностью с каркасной областью тяжелой цепи нечеловеческого родительского антитела».
Термин «каркасная область легкой цепи натурального человеческого антитела, обладающая, по меньшей мере, 70% идентичностью с каркасной областью легкой цепи нечеловеческого родительского антитела» охватывает каркасные области легкой цепи натурального человеческого антитела, обладающие 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с каркасной областью легкой цепи нечеловеческого родительского антитела. % идентичность, предпочтительно, определяется для каркасных областей целиком (исключая области, определяющие комплементарность).
Как указано выше по отношению к вариантам, термин «каркасная область легкой цепи натурального человеческого антитела, обладающая, по меньшей мере, 70% идентичностью с каркасной областью легкой цепи нечеловеческого родительского антитела» охватывает каркасные области легкой цепи, обладающие 70% идентичностью с каркасной областью легкой цепи нечеловеческого родительского антитела и, также, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с каркасной областью легкой цепи нечеловеческого родительского антитела.
Термин «каркасная область тяжелой цепи натурального человеческого антитела, обладающая, по меньшей мере, 70% идентичностью с каркасной областью тяжелой цепи нечеловеческого родительского антитела» охватывает каркасные области тяжелой цепи натурального человеческого антитела, обладающие 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с каркасной областью тяжелой цепи нечеловеческого родительского антитела.
Как указано выше по отношению к вариантам, термин «каркасная область тяжелой цепи натурального человеческого антитела, обладающая, по меньшей мере, 70% идентичностью с каркасной областью тяжелой цепи нечеловеческого родительского антитела» охватывает каркасные области тяжелой цепи, обладающие 70% идентичностью с каркасной областью тяжелой цепи нечеловеческого родительского антитела и, также, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с каркасной областью тяжелой цепи нечеловеческого родительского антитела.
Получение антител из клеток
Антитела, описанные в данном документе, могут быть получены по ряду способов, известных специалистам в данной отрасли (способы с использованием рекомбинантной ДНК, химический синтез и т.д.).
Чтобы экспрессировать антитела, нуклеотидные последовательности, кодирующие любые легкую и тяжелую цепи иммуноглобулинов, описанные в данном документе, могут быть внедрены в вектор экспрессии, например, в вектор, содержащий элементы транскрипционного и трансляционного контроля внедренной кодирующей последовательности для конкретного носителя. Данные элементы могут включать регуляторные последовательности, например, энхансеры, конститутивные и индуцируемые промоторы, а также 5’- и 3’- нетранслируемые регионы. Для конструирования подобных векторов экспрессии могут применяться способы, известные специалистам в данной отрасли. К данным способам относятся техники с использованием рекомбинантной ДНК in vitro, синтетические техники, генетическая рекомбинация in vivo.
Для экспрессии полипептида или РНК из нуклеотидных последовательностей, кодирующих любые легкую и тяжелую цепи иммуноглобулинов, описанные в данном документе, может использоваться множество систем вектор-клетка-носитель, известных специалистам в данной отрасли. К ним относится, но не ограничиваясь перечисленным, использование микроорганизмов, например, бактерий, трасформированных рекомбинантными бактериофаговыми, плазмидными, космидными ДНК векторами экспрессиями; дрожжей, трансформированных векторами экспрессии дрожжей; клеток насекомых, инфицированных бакуловирусными векторами; клеток растений, трансформированных вирусными или бактериальными векторами экспрессии; клеток животных. Для долгосрочного получения рекомбинантных белков в системах клеток млекопитающих, можно прибегать к стабильной экспрессии в клеточных линиях. К примеру, нуклеотидные последовательности, кодирующие одну из легких и тяжелых иммуноглобулиновых цепей, описанные в данном документе, могут быть трансформированы в клеточные линии при помощи векторов экспрессии, которые могут содержать вирусные приемы репликации и/или эндогенные элементы экспрессии, а также селектируемый или видимый маркерный ген в том же или отдельном векторе. Выбор вектора или клетки не ограничивает изобретение. В определенных воплощениях данного изобретения, нуклеотидные последовательности, кодирующие любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе, могут быть сшиты с раздельными векторами экспрессии, каждая цепочка будет экспрессироваться отдельно. В ином воплощении данного изобретения, обе нуклеотидные последовательности, кодирующие любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе, могут быть сшиты с одним вектором экспрессии и экспрессироваться совместно.
Альтернативно, РНК и/или полипептид могут экспрессироваться из вектора, содержащего нуклеотидные последовательности, которые кодируют любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе, при помощи систем транскрипции in vitro или спаренных систем транскрипции и трансляции in vitro.
В общем, клетки-носители, содержащие нуклеотидные последовательности, которые могут кодировать любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе и/или экспрессирующие полипептид, закодированный нуклеотидными последовательностями, которые могут кодировать любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе, либо их участок, могут идентифицироваться по множеству процедур, известных в отрасли. Данные процедуры включают, не ограничиваясь перечисленным, ДНК/ДНК или ДНК/РНК гибридизацию, ПЦР-амплификацию, способы белковых биопроб или иммунопроб, включающие мембранные техники, техники в растворах или чиповые технологии по детектированию и/или количественному определению нуклеиновых кислот или аминокислотных последовательностей. Иммунологические способы для детектирования и измерения экспрессии полипептидов, использующие специфические поликлональные или моноклональные антитела, известны в отрасли. Примерами таких технологий являются способы иммуноферментного анализа (ELISA), способы радиоиммунного анализа (RIA), сортировка флуоресцентно-активированных клеток (FACS). Специалисты в данной отрасли могут легко приспособить данные технологии к настоящему изобретению.
Клетки-хозяева, содержащие нуклеотидные последовательности, кодирующие любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе, могут культивироваться в условиях, подходящих для транскрипции соответствующей РНК и/или экспрессии полипептида в клеточной культуре. Полипептид, продуцируемый клеткой, может секретироваться или может удерживаться внутри клетки, в зависимости от последовательности и/или используемого вектора. В приблизительном воплощении, векторы экспрессии, содержащие нуклеотидные последовательности, кодирующие любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе, могут быть сконструированы таким образом, чтобы содержать сигнальные последовательности, вызывающие прямую секрецию полипептида через мембрану прокариотной или эукариотной клетки.
Примерными воплощениями нуклеиновых кислот, кодирующих вариабельный регион тяжелой цепи, служат SEQ ID NO.:21 и SEQ ID NO.:22.
Примерными воплощениями нуклеиновых кислот, кодирующих вариабельный регион легкой цепи, служат SEQ ID NO.:23 и SEQ ID NO.:24.
Вследствие свойственной генетическому коду вырожденности, иные последовательности ДНК, кодирующие такую же, практически такую же или функционально эквивалентную аминокислотную последовательность, могут продуцироваться и использоваться, например, для экспрессирования полипептида, закодированного нуклеотидной последовательностью, способной кодировать любые легкую и тяжелую иммуноглобулиновые цепи, описанные в данном документе. Нуклеотидные последовательности по настоящему изобретению могут быть сконструированы при помощи способов, известных в отрасли и предназначенных для изменения нуклеотидных последовательностей для множества целей, включая, но не ограничиваясь перечисленным, модификацию клонируемого, процессируемого и/или экспрессию генного продукта. Для конструирования нуклеотидных последовательностей могут применяться перестановка ДНК путем случайной фрагментации и ПЦР-восстановления фрагментов генов и синтетических олигонуклеотидов. К примеру, для введения мутаций, формирующих новые сайты рестрикции, изменяющих схемы гликозилирования, изменяющих кодоновые предпочтения, дающих расщепленные варианты и так далее, может использоваться олигонуклеотидно-опосредованный сайт-направленный мутагенез.
Также, может выбираться штамм клеток-носителей по их способности модулировать экспрессии внедренных последовательностей или процессировать экспрессируемый полипептид желаемым образом. К таким модификациям полипептида относятся, не ограничиваясь перечисленным, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование, ацилирование. В примерном воплощении, могут быть желательными антитела, содержащие конкретные структуры или схемы гликозилирования. Для установления мишени белка, его структуры и/или активности, может использоваться послетрансляционный процессинг, во время которого разрезается «препро»-форма полипептида. В продаже, у Американской коллекции типовых культур (ATCC), доступны различные клетки-носители, имеющие специфические клеточные комплексы и характерные механизмы послетрансляционного процессинга (например, CHO, HeLa, MDCK, HEK293, W138), которые могут быть выбраны для корректного модифицирования и процессинга экспрессируемого полипептида.
Специалистами в данной отрасли может быть оценено то, что в любой из перечисленных выше систем клеток-носителей, натуральная, модифицированная или рекомбинантная последовательность нуклеиновой кислоты может быть связана с гетерологической последовательностью с формированием, при трансляции, слитого полипептида, содержащего гетерологические полипептидные фрагменты. Подобные гетерологические полипептидные фрагменты могут облегчать очистку слитых полипептидов на доступных в продаже аффинных матрицах. К таким фрагментам относятся, не ограничиваясь перечисленным, глутатион-S-трансфераза (GST), белок, связывающий мальтозу, тиоредоксин, белок, связывающий кальмодулин, 6-His (His), FLAG, c-myc, гемагглютинин (HA), а также эпитопы антител, например, эпитопы моноклональных антител.
В последующем аспекте, настоящее изобретение относится к полинуклеотиду, который может содержать нуклеотидную последовательность, кодирующую слитый белок. Слитый белок может содержать партнерский белок (например, HA, Fc, и т.д.), слитый с полипептидом (например, полной легкой цепью, полной тяжелой цепью, вариабельными областями, определяющими комплементарность областями и т.д.), описанным в данном документе.
Специалистам в отрасли понятно, что нуклеиновая кислота и полипептидная последовательность могут быть синтезированы, целиком или частично, при помощи известных в отрасли химических или ферментных способов. К примеру, пептидный синтез может проводиться по различным твердофазным техникам и с использованием различного оборудования, например, синтезатор пептидов ABI 431A (PE Biosystems) может применяться для автоматического синтеза. При желании, аминокислотная последовательность может модифицироваться при синтезе и/или комбинироваться с другими последовательностями иных белков, с получением вариантного белка.
Если доступен лишь один вариабельный фрагмент тяжелой или легкой цепи, то антитело или антигенсвязывающий фрагмент могут быть восстановлены путем скрининга библиотеки комплементарных вариабельных фрагментов по способам, известным в отрасли (Portolano et al. The Journal of Immunology (1993) 150:880-887, Clarkson et al., Nature (1991) 352:624-628). Таким образом, сведений только об одном вариабельном регионе аминокислотной последовательности (тяжелой или легкой цепи), зачастую, достаточно для восстановления полной последовательности антитела, обладающего специфичностью к желаемому антигену. Нуклеиновые кислоты, кодирующие вариабельный регион легкой или тяжелой цепи антитела, могут быть полезны при идентификации комплементарной цепи, при присоединении которой образуется антигенсвязывающий фрагмент или антитело, обладающие достаточной антигенсвязывающей специфичностью. Одноцепочечная нуклеиновая кислота (например, олиго-) или его комплемент с высокой степенью идентичности последовательности с нуклеиновой кислотой, кодирующей вариабельный регион легкой цепи или вариабельный регион тяжелой цепи антитела, может быть полезна для его детектирования или для детектирования иных последовательностей нуклеиновых кислот с высокой степенью идентичности.
Также, в дополнительном аспекте, настоящее изобретение охватывает изолированные нуклеиновые кислоты, кодирующие вариабельный регион легкой цепи и/или вариабельный регион тяжелой цепи гуманизированного антитела, гибридного антитела или антигенсвязывающий фрагмент, описанные в данном документе или изолированное антитело, описанное в данном документе.
В еще одном аспекте, настоящее изобретение охватывает вектор или конструкцию, содержащую (изолированную) нуклеиновую кислоту, описанную в данном документе. В соответствии с данным изобретением, вектор может являться, к примеру, вектором экспрессии млекопитающего, бактериальным вектором экспрессии и т.д.
Настоящее изобретение, также, охватывает изолированную клетку, содержащую изолированную нуклеиновую кислоту, описанную в данном документе или вектор, описанный в данном документе. Также, охватываются изолированные клетки, экспрессирующие антитело или антигенсвязывающий фрагмент согласно настоящему изобретению. К пригодным для этого клеткам, к примеру, относятся клетки млекопитающих, бактериальные клетки и т.д.
Еще один аспект изобретения относится к способу получения гуманизированного или гибридного анти-кластеринового антитела, который может включать введение нечеловеческой определяющей комплементарность области тяжелой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином в вариабельный регион тяжелой цепи каркасной области натурального человеческого антитела.
Еще один аспект изобретения относится к способу получения гуманизированного или гибридного анти-кластеринового антитела, который может включать трансформирование клетки при помощи нуклеиновой кислоты, кодирующей вариабельный фрагмент тяжелой цепи (или полностью тяжелую цепь), содержащий нечеловеческой определяющей комплементарность области тяжелой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином и вариабельный регион тяжелой цепи каркасной области натурального человеческого антитела. Способ, также, может включать трансформирование клетки при помощи нуклеиновой кислоты, кодирующей комплементарный вариабельный регион легкой цепи (или полностью легкую цепь).
В ином аспекте, изобретение относится к способу получения гуманизированного или гибридного анти-кластеринового антитела, который может включать экспрессирование вариабельного фрагмента тяжелой цепи (или полностью тяжелой цепи), содержащего аминокислотные остатки нечеловеческой определяющей комплементарность области тяжелой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином и аминокислотные остатки вариабельного региона тяжелой цепи каркасной области натурального человеческого антитела. Способ, также, может включать экспрессирование комплементарного вариабельного региона легкой цепи (или полностью легкой цепи).
Вариабельный регион тяжелой цепи натурального человеческого антитела, который может быть выбрана для гуманизирования, может иметь следующие характеристики: a) трехмерную структуру, схожую или идентичную (наложимую) со структурой тяжелой цепи нечеловеческого антитела, b) каркасную область, обладающую, по меньшей мере, 70%-й идентичностью с аминокислотной последовательностью тяжелой цепи нечеловеческого антитела и/или; c) аминокислотные остатки (определенное количество) определяющей комплементарность области тяжелой цепи (например, всех трех), одинаковые или практически одинаковые с аминокислотными остатками нечеловеческой определяющей комплементарность области тяжелой цепи.
Способ, таким образом, может содержать введение аминокислотных остатков нечеловеческой области тяжелой цепи, определяющей комплементарность, по меньшей мере, двух областей, определяющих комплементарность нечеловеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела. Вариабельный регион тяжелой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, по меньшей мере, два региона, определяющие комплементарность нечеловеческого антитела.
Способ может, предпочтительно, содержать введение аминокислотных остатков нечеловеческой области тяжелой цепи, определяющей комплементарность, во все три области, определяющие комплементарность. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, три области, определяющие комплементарность нечеловеческого антитела. Вариабельный регион тяжелой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, все три региона, определяющие комплементарность нечеловеческого антитела.
Способ, таким образом, включает введение нечеловеческих определяющих комплементарность областей, содержащих аминокислотные последовательности SEQ ID NO.:1, SEQ ID NO.:2 и SEQ ID NO.:3. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:1, SEQ ID NO.:2 и SEQ ID NO.:3. Вариабельный регион тяжелой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:1, SEQ ID NO.:2 и SEQ ID NO.:3.
Способ, также, включает введение нечеловеческих определяющих комплементарность областей, содержащих аминокислотные последовательности SEQ ID NO.:11, SEQ ID NO.:12 и SEQ ID NO.:13. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:11, SEQ ID NO.:12 и SEQ ID NO.:13. Вариабельный регион тяжелой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:11, SEQ ID NO.:12 и SEQ ID NO.:13.
Альтернативно, более короткие версии упомянутых выше областей, определяющих комплементарность, могут быть введены в каркасную область вариабельного региона тяжелой цепи человеческого антитела.
Способ по настоящему изобретению может, далее, включать введение нечеловеческой определяющей комплементарность области легкой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином в вариабельный регион легкой цепи каркасной области натурального человеческого антитела.
Способ по настоящему изобретению может, далее, включать экспрессию нуклеиновой кислоты, кодирующей вариабельный регион легкой цепи (или полностью легкую цепь), содержащую нечеловеческую определяющую комплементарность область легкой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином и аминокислоты вариабельного региона легкой цепи каркасной области натурального человеческого антитела. Способ, также, может включать трансформирование клетки при помощи нуклеиновой кислоты, кодирующей комплементарный вариабельный регион тяжелой цепи (или полностью тяжелую цепь).
В ином аспекте, изобретение относится к способу получения гуманизированного или гибридного анти-кластеринового антитела, который может включать экспрессирование кодирующей вариабельный фрагмент легкой цепи (или полностью тяжелую цепь), содержащий нечеловеческой определяющей комплементарность области легкой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином и вариабельный регион легкой цепи каркасной области натурального человеческого антитела. Способ, также, может включать экспрессирование комплементарного вариабельного региона тяжелой цепи (или полностью тяжелой цепи).
Вариабельный регион легкой цепи натурального человеческого антитела, который может быть выбран для гуманизирования, может иметь следующие характеристики: a) трехмерную структуру, схожую или идентичную (наложимую) со структурой легкой цепи нечеловеческого антитела, b) каркасную область, обладающую, по меньшей мере, 70%-й идентичностью с аминокислотной последовательностью легкой цепи нечеловеческого антитела и/или; c) (определенное количество) аминокислотные остатки определяющей комплементарность области легкой цепи (например, всех трех), одинаковые или практически одинаковые с аминокислотными остатками нечеловеческой определяющей комплементарность области легкой цепи.
Способ, таким образом, может содержать введение аминокислотных остатков нечеловеческой области легкой цепи, определяющей комплементарность, по меньшей мере, двух областей, определяющих комплементарность нечеловеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела.
Способ может, предпочтительно, содержать введение аминокислотных остатков нечеловеческой области легкой цепи, определяющей комплементарность, во все три области, определяющие комплементарность. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, три области, определяющие комплементарность нечеловеческого антитела. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, все три области, определяющие комплементарность нечеловеческого антитела.
Способ, таким образом, включает введение нечеловеческих определяющих комплементарность областей, содержащих аминокислотные последовательности SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6.
Способ, также, включает введение нечеловеческих определяющих комплементарность областей, содержащих аминокислотные последовательности SEQ ID NO.:14, SEQ ID NO.:15 и SEQ ID NO.:16. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:14, SEQ ID NO.:15 и SEQ ID NO.:16. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:14, SEQ ID NO.:15 и SEQ ID NO.:16.
Альтернативно, более короткие версии упомянутых выше областей, определяющих комплементарность, могут быть введены в каркасную область вариабельного региона тяжелой цепи человеческого антитела.
В дополнительном аспекте, изобретение относится к способу получения гуманизированного или гибридного анти-кластеринового антитела, который может включать введение аминокислотных остатков нечеловеческой определяющей комплементарность области тяжелой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином в вариабельный регион тяжелой цепи каркасной области натурального человеческого антитела и введение аминокислотных остатков нечеловеческой определяющей комплементарность области легкой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином в вариабельный регион легкой цепи каркасной области натурального человеческого антитела.
В дополнительном аспекте, изобретение относится к способу получения гуманизированного или гибридного анти-кластеринового антитела, который может включать экспрессию нуклеиновой кислоты, кодирующей аминокислотные остатки нечеловеческой определяющей комплементарность области тяжелой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином и вариабельного региона тяжелой цепи каркасной области натурального человеческого антитела и экспрессию нуклеиновой кислоты, кодирующей аминокислотные остатки нечеловеческой определяющей комплементарность области легкой цепи нечеловеческого антитела, способного к специфическому связыванию с кластерином и вариабельный регион легкой цепи каркасной области натурального человеческого антитела.
Вариабельный регион тяжелой цепи натурального человеческого антитела, который может быть выбран для гуманизирования, может иметь следующие характеристики: a) содержать каркасную область, на 70% идентичную по аминокислотной последовательности с каркасной областью тяжелой цепи нечеловеческого антитела, b) иметь аминокислотные остатки (определенное количество) в области, определяющей комплементарность тяжелой цепи (например, во всех трех областях, определяющих комплементарность), одинаковые или практически одинаковые с аминокислотными остатками области, определяющей комплементарность нечеловеческой тяжелой цепи, а вариабельный регион легкой цепи натурального человеческого антитела, который может быть выбран для гуманизирования, может иметь следующие характеристики: a) содержать каркасную область, на 70% идентичную по аминокислотной последовательности с каркасной областью легкой цепи нечеловеческого антитела, b) иметь аминокислотные остатки (определенное количество) в области, определяющей комплементарность легкой цепи (например, во всех трех областях, определяющих комплементарность), одинаковые или практически одинаковые с аминокислотными остатками области, определяющей комплементарность нечеловеческой легкой цепи. Предпочтительно, чтобы вариабельная(ые) область(и) натурального человеческого антитела обладала трехмерной структурой, схожей или идентичной (наложимой) с вариабельной(ыми) областью(ями) нечеловеческого антитела.
В соответствии с настоящим изобретением, способ может содержать введение аминокислотных остатков нечеловеческой области тяжелой цепи, определяющей комплементарность, по меньшей мере, двух областей, определяющих комплементарность нечеловеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела. Вариабельный регион тяжелой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела.
Альтернативно, способ может содержать введение аминокислотных остатков нечеловеческой области тяжелой цепи, определяющей комплементарность, во все три области, определяющие комплементарность. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, три области, определяющие комплементарность нечеловеческого антитела. Вариабельный регион тяжелой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, все три области, определяющие комплементарность нечеловеческого антитела.
Также, в соответствии с настоящим изобретением, способ может включать введение аминокислотных остатков нечеловеческой области легкой цепи, определяющей комплементарность, в, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, по меньшей мере, две области, определяющие комплементарность нечеловеческого антитела.
Альтернативно, способ может содержать введение аминокислотных остатков нечеловеческой области легкой цепи, определяющей комплементарность, во все три области, определяющие комплементарность. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать, три региона, определяющие комплементарность нечеловеческого антитела. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать, все три региона, определяющие комплементарность нечеловеческого антитела.
При помощи способа, описанного в данном документе, определяющие комплементарность области, содержащие аминокислотные последовательности SEQ ID NO.:1, SEQ ID NO.:2 и SEQ ID NO.:3, предпочтительно, импортированные в вариабельный регион тяжелой цепи натурального человеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:1, SEQ ID NO.:2 и SEQ ID NO.:3. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:1, SEQ ID NO.:2 и SEQ ID NO.:3.
При помощи способа, описанного в данном документе, определяющие комплементарность области, содержащие аминокислотные последовательности SEQ ID NO.:11, SEQ ID NO.:12 и SEQ ID NO.:13, предпочтительно, импортированные в вариабельный регион тяжелой цепи натурального человеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:11, SEQ ID NO.:12 и SEQ ID NO.:13. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:11, SEQ ID NO.:12 и SEQ ID NO.:13.
При помощи способа, описанного в данном документе, определяющие комплементарность области, содержащие аминокислотные последовательности SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6, предпочтительно, импортированные в вариабельный регион легкой цепи натурального человеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6.
При помощи способа, описанного в данном документе, определяющие комплементарность области, содержащие аминокислотные последовательности SEQ ID NO.:14, SEQ ID NO.:15 и SEQ ID NO.:16, предпочтительно, импортированные в вариабельный регион легкой цепи натурального человеческого антитела. Нуклеиновая кислота, используемая для создания гуманизированных или гибридных антител может, таким образом, кодировать SEQ ID NO.:14, SEQ ID NO.:15 и SEQ ID NO.:16. Вариабельный регион легкой цепи, экспрессируемый для создания гуманизированных или гибридных антител может, таким образом, содержать SEQ ID NO.:14, SEQ ID NO.:115 и SEQ ID NO.:16.
В ином аспекте, настоящее изобретение относится к способу получения гуманизированного или гибридного антитела, который может включать трансформацию клетки-носителя нуклеиновой кислотой, кодирующей вариабельный регион тяжелой цепи, описанный в данном документе.
Примерными воплощениями подходящих вариабельных областей тяжелой цепи служат те области нечеловеческого антитела, которые могут содержать три области, определяющие комплементарность, обладающие аминокислотными последовательностями SEQ ID NO.:1, SEQ ID NO.:2 и SEQ ID NO.:3 и каркасную область тяжелой цепи натурального человеческого антитела, обладающую, по меньшей мере, 70% идентичностью с каркасной областью тяжелой цепи нечеловеческого антитела. Предпочтительно, натуральное человеческое антитело может содержать (определенное количество) аминокислотные остатки области тяжелой цепи, определяющей комплементарность, одинаковые или практически одинаковые с остатками области, определяющей комплементарность (например, всех трех областей, определяющей комплементарность) нечеловеческой тяжелой цепи.
Примерными воплощениями подходящих вариабельных регионов тяжелой цепи служат те области нечеловеческого антитела, которые могут содержать три региона, определяющих комплементарность, обладающие аминокислотными последовательностями SEQ ID NO.:11, SEQ ID NO.:12 и SEQ ID NO.:13 и каркасную область тяжелой цепи натурального человеческого антитела, обладающую, по меньшей мере, 70% идентичностью с каркасной областью тяжелой цепи нечеловеческого антитела. Предпочтительно, натуральное человеческое антитело может содержать (определенное количество) аминокислотные остатки области тяжелой цепи, определяющей комплементарность, одинаковые или практически одинаковые с остатками области, определяющей комплементарность (например, всех трех областей, определяющей комплементарность) нечеловеческой тяжелой цепи.
Способ по настоящему изобретению может, далее, содержать трансформирование клетки-носителя при помощи нуклеиновой кислоты, кодирующей комплементарную легкую цепь.
При необходимости, комплементарная легкая цепь может кодироваться той же нуклеиновой кислотой, которая кодирует тяжелую цепь.
Подобная комплементарная легкая цепь может содержать вариабельный регион легкой цепи, который может содержать три области, определяющие комплементарность, обладающие аминокислотными последовательностями SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6 и каркасную область легкой цепи натурального человеческого антитела, обладающую, по меньшей мере, 70% идентичностью с каркасной областью легкой цепи нечеловеческого антитела. Предпочтительно, натуральное человеческое антитело может содержать (определенное количество) аминокислотные остатки области легкой цепи, определяющей комплементарность, одинаковые или практически одинаковые с остатками области, определяющей комплементарность (например, всех трех областей, определяющей комплементарность) нечеловеческой легкой цепи.
Подобная комплементарная легкая цепь может содержать вариабельный регион легкой цепи, который может содержать три области, определяющие комплементарность, обладающие аминокислотными последовательностями SEQ ID NO.:14, SEQ ID NO.:15 и SEQ ID NO.:16 и каркасную область легкой цепи натурального человеческого антитела, обладающую, по меньшей мере, 70% идентичностью с каркасной областью легкой цепи нечеловеческого антитела. В предпочтительном воплощении, натуральное человеческое антитело может содержать (определенное количество) аминокислотные остатки области легкой цепи, определяющей комплементарность, одинаковые или практически одинаковые с остатками области, определяющей комплементарность (например, всех трех областей, определяющей комплементарность) нечеловеческой легкой цепи.
В еще одном аспекте, настоящее изобретение относится к способу получения гуманизированного или гибридного антитела, который может включать трансформацию клетки-носителя нуклеиновой кислотой, кодирующей вариабельный регион легкой цепи.
Примерные воплощения подходящего вариабельного региона легкой цепи являются теми вариабельными областями, которые могут содержать три области, определяющие комплементарность, обладающие аминокислотными последовательностями SEQ ID NO.:4, SEQ ID NO.:5 и SEQ ID NO.:6 и каркасную область легкой цепи натурального человеческого антитела, обладающую, по меньшей мере, 70% идентичностью с каркасной областью легкой цепи нечеловеческого антитела. Предпочтительно, натуральное человеческое антитело содержит (определенное количество) аминокислотные остатки области легкой цепи, определяющей комплементарность, одинаковые или практически одинаковые с остатками области, определяющей комплементарность (например, всех трех областей, определяющей комплементарность) нечеловеческой легкой цепи.
Примерные воплощения подходящего вариабельного региона легкой цепи являются теми вариабельными областями, которые могут содержать три области, определяющие комплементарность, обладающие аминокислотными последовательностями SEQ ID NO.:14, SEQ ID NO.:15 и SEQ ID NO.:16 и каркасную область легкой цепи натурального человеческого антитела, обладающую, по меньшей мере, 70% идентичностью с каркасной областью легкой цепи нечеловеческого антитела. Предпочтительно, натуральное человеческое антитело содержит (определенное количество) аминокислотные остатки области легкой цепи, определяющей комплементарность, одинаковые или практически одинаковые с остатками области, определяющей комплементарность (например, всех трех областей, определяющей комплементарность) нечеловеческой легкой цепи.
Способ по настоящему изобретению может, далее, содержать трансформирование клетки-носителя при помощи нуклеиновой кислоты, кодирующей комплементарную тяжелую цепь.
При необходимости, комплементарная тяжелая цепь может кодироваться той же нуклеиновой кислотой, которая кодирует легкую цепь.
Фармацевтические композиции антител и их использование
В ином аспекте, настоящее изобретение относится к фармацевтической композиции, которая может содержать, к примеру, гуманизированное или гибридное антитело, описанное в данном документе, антигенсвязывающий фрагмент, описанный в данном документе, изолированное антитело, описанное в данном документе и фармацевтически приемлемый носитель.
В других аспектах, изобретение относится к использованию изолированного антитела или антигенсвязывающего фрагмента, описанного в данном документе, с терапевтической или диагностической целью.
В другом аспекте изобретение относится к комбинированной терапии, включающей фармацевтическую композицию, описанную в данном документе и химиотерапевтический препарат.
В соответствии с настоящим изобретением, фармацевтическая композиция может вводиться (или быть вводимой) одновременно с химиотерапевтическим препаратом.
Также, в соответствии с настоящим изобретением, фармацевтическая композиция и химиотерапевтический препарат могут вводиться (или быть вводимыми) с различными временными интервалами.
Далее, в соответствии с настоящим изобретением, химиотерапевтический препарат может быть конъюгирован с антителом или антигенсвязывающим фрагментом.
Помимо активных компонентов, фармацевтическая композиция может содержать фармацевтически приемлемые носители, включая воду, фосфатно-солевой буферный раствор, растворы солей, желатина, масла, спирты, иные вспомогательные компоненты, способствующие получению препаратов активного вещества, которые можно использовать фармацевтически. В других случаях, такие препараты могут быть стерилизованы.
При использовании в данном документе, термин «фармацевтическая композиция» обозначает терапевтически эффективное количество препарата вместе с фармацевтически приемлемыми растворителями, консервантами, растворителями, эмульгаторами, адъювантами и/или носителями. Термин «терапевтически эффективное количество», при использовании в данном документе, обозначает такое количество, которое обеспечивает терапевтический эффект при определенном состоянии и режиме ввода. Такие композиции могут являться жидкостями, лиофилизированными или иным образом высушенными составами, включать растворители с различным буферным содержимым (например, трис-HCl., ацетаты, фосфаты), pH и ионной силой, добавки, например, альбумин или желатин для предотвращения абсорбции к поверхностям, ПАВ (например, Твин-20, Твин-80, Pluronic F68, соли желчных кислот). Растворители (например, глицерин, полиэтиленгликоль), антиоксиданты (например, аскорбиновую кислоту, натрия метабисульфит), консерванты (например, тимеросал, бензиловый спирт, парабены), вещества, придающие объем и корректоры тоничности (например, лактозу, маннитол), ковалентно присоединенные полимеры, например, полиэтиленгликоль, сшитый с белком, комплексы с ионами металлов; материалы могут быть внедрены в конкретные препараты полимерных соединений, например, полимолочную кислоту, полигликолевую кислоту, гидрогели и т.д., либо в липосомы, микроэмульсии, мицеллы, униламеллярные или мультиламеллярные пузырьки, тени эритроцитов, сферопласты. При использовании таких композиций можно регулировать агрегатное состояние, растворимость, стабильность, скорость высвобождения in vivo, скорость клиренса in vivo. Композиции с контролируемым или поддерживаемым высвобождением вещества включают формы в липофильных депо (например, жирных кислотах, восках, маслах). Также, изобретение охватывает композиции с частицами, покрытыми полимерами (например, полоксамерами или полоксаминами). Иные воплощения композиций по изобретению охватывают формы с защитными покрытиями, ингибиторами протеаз или усилителями проникновения по различным путям введения, включая парентеральный, легочный, назальный, оральный, вагинальный, ректальный пути. В одном воплощении, фармацевтическая композиция вводится парентерально, параканцерально, трансмукозально, трансдермально, внутримышечно, внутривенно, внутрикожно, подкожно, интраперитонеально, интравентрикулярно, интракраниально и внутрь опухоли.
Далее, при использовании в данном документе, термин «фармацевтически приемлемый носитель» или «фармацевтический носитель», являются известными в отрасли и включают, но не ограничиваясь перечисленным, 0,01-0,1 M или 0,05 M фосфатный буфер или 0,8% физраствор. Также, такие фармацевтически приемлемые носители могут являться водными или неводными растворами, суспензиями, эмульсиями. Примерами неводных растворителей служат пропиленгликоль, полиэтиленгликоль, растительные масла, например, оливковое, инъекционные органические эфиры, например, этилолеат. Водные носители включают воду, спирто-водные растворы, эмульсии или суспензии, включая физиологический раствор и буферные среды. Носители для парентерального введения включают раствор натрия хлорида, декстрозный раствор Рингера, раствор декстрозы и натрия хлорид, лактатный раствор Рингера или жирные масла. Носители для внутривенного введения включают жидкости и растворы для возмещения питательных веществ, электролитов, например, основанные на декстрозном растворе Рингера и тому подобное. Также, в составе могут присутствовать консерванты и иные добавки, например, антимикробные средства, антиоксиданты, хелатирующие агенты, инертные газы и тому подобное.
Фармацевтические композиции, используемые в рамках данного изобретения, могут вводиться рядом путей, включая, но не ограничиваясь перечисленным, прием внутрь, введение внутривенно, внутримышечно, внутриартериально, интрамедуллярно, интратекально, внутрисуставно, трансдермально, подкожно, интраперитонеально, интраназально, энтерально, местно, сублингвально, ректально.
Термин «лечение» для целей данной публикации, относится и к терапии и к профилактическим мерам, имеющими целью предотвратить или замедлить (уменьшить) целевое патологическое состояние или нарушение. К нуждающимся в терапии причисляют тех пациентов, у которых уже развилось нарушение, а также тех, которые предрасположены к нему или те, которые нуждаются в его профилактике.
Антитела и антигенсвязывающие фрагменты могут применяться для лечения различных заболеваний. В определенных случаях, антитела или антигенсвязывающие фрагменты могут взаимодействовать с клетками, экспресирующими интересующий антиген и индуцирующими иммунулогическую реакцию посредством опосредованной антителами клеточной цитотоксичности. В других случаях, антитела или фрагменты могут блокировать взаимодействие антигена с его белковыми партнерами. В иных случаях, антитела или фрагменты могут секвестировать антиген.
«Химиотерапевтический агент» - соединение, использующееся для лечения рака. Примерами химиотерапевтических препаратов служат алкилирующие препараты, например, тиотепа и циклофосфамид; алкилсульфонаты, например, бусульфан, импросульфан и пипосульфан; азиридины, например, бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфамид и триметилолмеламин; азотистые иприты, например, хлорамбуцил, хломафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретамина оксида гидрохлорид, мелфалан, новэмбихин, фенестрин, преднимустин, трофосфамид, уромустин; производные нитрозомочевины, например, кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики например, аклациномицины, актиномицин, отрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, например, метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, например, деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, например, флударабин, 6-меркаптопурин, тиампирин, тиогуанин; аналоги пиримидина, наример, анцитабин, азацитидине, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, например, калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; ингибиторы синтеза гормонов надпочечников, например, аминоглютетимид, митотан, трилостан; заместители фолиевой кислоты, например, фолиниевая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновая кислота; амсакрин; бестрабуцид; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфомитин; эллиптиния ацетат; этоглюцид; галлия нитрат; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK7; разоксан; сизофиран; спирогерманий; тенуазониевая кислота; триазиквон; 2,2“,2“=-трихлотриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксаны, например, паклитаксел и доцетаксел; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, например, цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; зелода; ибандронат; CPT-11; ингибитор тоопоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота; эсперамицины; капецитабин; фармацевтически приемлемые соли, кислоты, производные любого из перечисленного выше. Также в это определение включены антигормональные агенты, которые действуют таким образом, чтобы регулировать или ингибировать гормональное воздействие на опухоли, например, антиэстрогены, включая, к примеру, тамоксифен, ралоксифен, ингибиторы ароматазы 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон, торемифен (фарестон); антиандрогены, например, флутамид, нилутамид, бикалутамид, леупролид, гозерелин; фармацевтически приемлемые соли, кислоты, производные любого из перечисленного выше.
Конъюгаты антител
Антитело или антигенсвязывающий фрагмент по настоящему изобретению может быть конъюгирован с детектируемым фрагментом (например, для целей детектирования или диагностики) или с терапевтическим фрагментом (для терапевтических целей, например, с химиотерапевтическим агентом).
Под «детектируемым фрагментом» понимается фрагмент, детектируемый спектроскопическими, биохимическими, иммунохимическими, химическими и/или иными физическими способами. Детектируемый фрагмент может быть связан напрямую или не напрямую (например, через сшивающий агент, в том числе, но не ограничиваясь перечисленным, DOTA (1,4,7,10-тетраазоциклододекан-1,4,7,10-тетрауксусная кислота) или NHS (N-гидроксисукцинимид)) с антителами и их антигенсвязывающими фрагментами согласно настоящему изобретению при помощи способов, известных в отрасли. Может использоваться множество детектируемых фрагментов, в зависимости от требуемых чувствительности, легкости конъюгации, стабильности и доступного оборудования. Подходящие детектируемые фрагменты включают, не ограничиваясь перечисленным, флуоресцентные метки, радиоактивные метки (например, не ограничиваясь перечисленным, 125I, In111, Tc99, I131 и позитрон-эмитирующие изотопы для позитронно-эмиссионных сканирующих томографов и т.д.), метки для ядерного магнитного резонанса, люминесцентные метки, хемилюминесцентные метки, хромофорные метки, ферментные метки (к примеру, не ограничиваясь перечисленным, пероксидазу хрена, щелочную фосфатазу и т.д.), квантовые точки и/или наночастицы. Детектируемый фрагмент может вызывать и/или производить детектируемый сигнал, что позволяет осуществить его детектирование.
В ином примерном воплощении изобретения, антитело или его антигенсвязывающий фрагмент могут быть связаны (модифицированы) с терапевтическим фрагментом (например, препаратом, цитотоксическим фрагментом).
В примерном воплощении, антитела и антигенсвязывающие фрагменты могут содержать химиотерапевтический агент или цитотоксический агент. К примеру, антитела и антигенсвязывающие фрагменты могут быть конъюгированы с химиотерапевтическим агентом или цитотоксическим агентом. Помимо приведенных в иных местах настоящей заявки, к таким терапевтическим или цитотоксическим агентам относятся, не ограничиваясь перечисленным, иттрий-90, скандий-47, рений-186, иод-131, иод-125, а также множество иных агентов, известных специалистам в данной отрасли (например, лютеций (например, Lu177), висмут (например, Bi213), медь (например, Cu67)). В иных случаях, химиотерапевтический или цитотоксический агент может содержать, среди прочих, известных специалистам в данной отрасли, 5-фторурацил, адриамицин, иринотекан, таксаны, псевдомонадный эндотоксин, рицин и иные токсины.
Альтернативно, для осуществления способов по настоящему изобретению и способов, известных в отрасли, антитело или антигенсвязывающий фрагмент по настоящему изобретению (конъюгированный и неконъюгированный), могут использоваться в комбинации со второй молекулой (например, с вторичным антителом и т.д.), которая способна специфически связываться с антителом или антигенсвязывающим фрагментом по настоящему изобретению и которая может нести желаемую детектируемую, диагностическую или терапевтическую группу.
Терапевтические методики
В дальнейшем аспекте, изобретение относится к способу уменьшения роста раковых клеток, экспрессирующих кластерин или уменьшения объема опухоли, содержащей клетки, экспрессирующие кластерин. Способ может включать, например, введение нуждающемуся млекопитающему анти-кластеринового антитела, например, поликлонального антитела, моноклонального антитела, химерного антитела, гуманизированного антитела, изолированного человеческого антитела, гибридного антитела или его фрагмента.
Способ, далее, может включать введение химиотерапевтического препарата.
Настоящее изобретение, также, относится в дополнительном аспекте к способу лечения заболеваний, ассоциированных с повышенной экспрессией или секрецией кластерина. Способ может включать введение гуманизированного или гибридного антитела, описанного в данном документе, антигенсвязывающего фрагмента, описанного в данном документе или изолированного антитела, описанного в данном документе, млекопитающему, испытывающему в этому необходимость.
К млекопитающему, испытывающему необходимость в введении, способному получить благоприятный эффект от данного терапевтического способа, может быть отнесено млекопитающее с карциномой, млекопитающее с повышенным уровнем кластерина плазмы или крови, млекопитающее, у которого выявлены или подозревается присутствие клеток, способных к эпителиально-мезенхимальному переходу, млекопитающее с заболеванием, связанным с повышенным уровнем кластерина (пре-кластерина или секретируемого кластерина) или с экспрессией, либо секрецией кластерина (включая кластерин крови или плазмы) и т.д.
В другом аспекте изобретение относится к использованию гуманизированного или гибридного антитела, описанного в данном документе, антигенсвязывающего фрагмента, описанного в данном документе или изолированного антитела, описанного в данном документе, при производстве лекарственного препарата для терапии заболевания, связанного с экспрессией или секрецией кластерина.
Наборы и анализы
В еще одном аспекте настоящее изобретение предоставляет набор, включающий флакон или флаконы, которые могут содержать, к примеру, гуманизированное или гибридное антитело, описанное в данном документе, антигенсвязывающий фрагмент, описанный в данном документе, изолированное антитело, описанное в данном документе. Набор может использоваться для целей детектирования или терапевтических целей.
В ином примерном воплощения набор может включать изолированную нуклеиновую кислоту, описанную в данном документе или вектор, описанный в данном документе. Подобный набор может быть пригоден для выявления комплементарных нуклеиновых кислот, экспрессирующих кодируемый ими белок или чего-либо иного.
Настоящее изобретение, также, относится к способу детектирования кластерина (пре-кластерина и секретируемого кластерина) при контактировании образца, содержащего кластерин или образца, в котором предполагается присутствие кластерина, с гуманизированным или гибридным антителом, описанным в данном документе, антигенсвязывающим фрагментом, описанным в данном документе, изолированным антителом, описанным в данном документе. Детектирование производится на оборудовании, оснащенном датчиками, способными выявить связывание антигена с антителом (например, на BIAcoreTM, считывающем устройстве для микропланшетов, спектрофотометре и т.д.). Подобное оборудование может быть сопряжено с компьютером.
При использовании в данном документе термин «трехмерная структура, сходная с или наложимая на» в применении к вариабельному региону означает, что, при использовании компьютерной модели, определенный вариабельный регион имеет конформацию, способную соединяться со связывающим участком антигена таким же способом, что и иная вариабельная область. Вариабельные области называют наложимыми, если на компьютерном представлении, аминокислоты одного вариабельного региона занимают такие же положения в пространстве, что и аминокислоты другой вариабельной области.
При использовании в данном документе, термин «моделированная вариабельная область» обозначает компьютерное представление вариабельной области, полученной из известных трехмерных структур близкородственных вариабельных областей антител.
При использовании в данном документе, термин «нечеловеческий» охватывает, без ограничений, грызунов (напр., мышей, крыс и т.д.), кроликов, нечеловекообразных обезьян и т.д.
При использовании в данном документе, термин «аминокислоты нечеловеческой области, определяющей комплементарность» обозначает, что аминокислотные остатки области, определяющей комплементарность, происходят не от человека, обычно от грызуна, например, мыши.
При использовании в данном документе, термин «нечеловеческое родительское антитело» охватывает антитела, полученные не от людей и используемые в качестве исходного материала для процедур гуманизирования.
При использовании в данном документе, термин «трансформация клетки-носителя» включает ряд техник, известных в отрасли, предназначенных для переноса или внедрения желаемой нуклеиновой кислоты в клетку-носитель. К таким техникам относятся, не ограничиваясь перечисленным, трансфекция, инфекция, липофекция, инъекция, трансдукция, нуклеофекция, электропорация, сонопорация, тепловой шок, магнитофекция и т.д.
Термин «импортирование» касательно нечеловеческих областей, определяющих комплементарность легких или тяжелых цепей, охватывает физические и компьютерные способы, например, технологии клонирования, химического синтеза нуклеиновых кислот или белков, компьютерное генерирование гуманизированных антител и т.д. При использовании в данном документе, термин «практически одинаковый» касательно количества аминокислот, означает, что допустима вариация в +/- 3 аминокислоты, либо, предпочтительно, в +/- 2 аминокислоты, либо, еще более предпочтительно, в +/- 1 аминокислоту.
Пример 1- Гуманизирование анти-кластериновых мышиных моноклональных антител
3D-моделирование вариабельных областей мышиного 16B5 моноклонального антитела
Данное задание было выполнено мутированием 3 остатков легкой цепи и 7 остатков тяжелой цепи в доступных кристаллических структурах двух различных мышиных антител (коды Protein Data Bank (PDB) 1Q9Q и 1TY7, соответственно) с последующим соединением легкой и тяжелой цепей посредством совмещения шаблонных структур. Часть петли CDR-H3 основывалась на структуре другого антитела (код PDB 1UJ3, гуманизированное антитело), которое тоже обладает высоким сходством в последовательности с тяжелой цепью 16B5 но, в отличие от мышиной шаблонной структуры, имеет такую же длину петли CDR-H3. Результирующая структура была уточнена с целью минимизации энергии при помощи силового поля AMBER и использовалась в последующем анализе. В данном случае ожидалось высокое качество полученной гомологической модели, с высокой степенью гомологичности мышиной последовательности 16В5 с доступными структурными шаблонами. Сравнимые результаты были получены в параллельных контрольных экспериментах по гомологическому моделированию, в которых авторами производилось моделирование вариабельного региона мышиного 16В5 при помощи обычных программ моделирования 3D-гомологии Modeller или Composer, либо специализированного для 3D-моделирования гомологии антител ПО, типа WAM. Сведения о моделированных вариабельных областях мышиного антитела 16B5 приведены на фиг. 1.
Определение характеристик исходных донорских (мышиных) последовательностей 16B5 и моделированной структуры
Данный этап проводился, чтобы оценить индекс соответствия человеческой структуре, установить границы областей, определяющих комплементарность, определить канонические остатки, межцепочечную упаковку (поверхностные остатки вариабельных областей тяжелой и легкой цепей (VH/VL)), упаковку вариабельных/константных областей (поверхностные остатки VH/CH и VL/CL), необычные остатки каркасной области, сайты потенциального N- и O- гликозилирования, скрытые остатки, остатки зоны Вернье, близость к определяющим комплементарность областям. Для оценивания этих характеристик использовались ресурсы, доступные в интернете и локальное ПО.
Выбор наилучших каркасных областей легкой и тяжелой цепей для мышиных определяющих комплементарность регионов
Выбор наилучших каркасных областей легкой и тяжелой цепей осуществлялся путем стандартного сравнения гомологии последовательностей относительно локальной копии базы человеческих зародышевых линий (VBASE), относительно других библиотек последовательностей (Genbank и SwissProt), а также набора человеческих каркасных консенсусных последовательностей. Для определения совпадений последовательностей с наибольшей гомологией в каркасной области (исключая, таким образом, определяющие комплементарность области), и с поддержанием длины петель определяющих комплементарность областей, был произведен поиск BLAST. Структуры человеческих или гуманизированных вариабельных последовательностей, наиболее сходных с вариабельными последовательностями 16В5, идентифицированные в PDB, были наложены на моделированную структуру вариабельного региона16В5 для сравнения структур. Несколько наиболее последовательностей подобных человеческих каркасных областей были отобраны, чтобы оценить аминокислотную вариабельность в позициях, пригодных для мутирования, а также, чтобы собрать набор подходящих каркасных последовательностей в случае утраты аффинности после гуманизирования. Наиболее близкие человеческие каркасные области были выровнены относительно мышиных последовательностей 16В5, см. фиг. 2.
Идентификация мышиных каркасных остатков, которые могут влиять на конформацию и связывание антигена
Идентификация мышиных каркасных остатков, которые могут влиять на конформацию и связывание антигена, является важным шагом, при котором определяются аминокислотные остатки, которые должны быть мутированы, чтобы в наибольшей мере соответствовать человеческим последовательностям. Данные остатки являются основными кандидатами для обратных мутаций к мышиным последовательностям в случае утраты аффинности. Этот этап гуманизирования наиболее сложен и непредсказуем, особенно в отсутствие экспериментальной структуры комплекса антиген-антитело. Данный этап основывается на идентификации остатков одной или большего количества следующих категорий: канонических, CDR-H3, зоны Вернье, необычных, близких к CDR (в пределах 5 ангстрем), межцепочечной упаковки, сайтов гликозилирования. Данные остатки могут оказывать прямое и косвенное влияние на антигенсвязывающие сайты и аффинность. Для получения финальных гуманизированных последовательностей анти-кластеринового моноклонального антитела 16B5 потребовалось ввести 13 мутаций в каркасную область легкой цепи и 22 мутации в каркасную область тяжелой цепи относительно мышиных последовательностей, не затрагивая области, определяющие комплементарность. Неожиданностью явилось то, что при тщательном структурном и сравнительном анализе последовательностей, была выявлена высокая вероятность сохранения антигенсвязывающей аффинности при введении всех этих мутаций, что обеспечивает наибольшую степень гуманизирования, которую позволяют способы прививки областей, определяющих комплементарность (т.е., 100%, исключая области, определяющие комплементарность). 3D-моделирование разработанного гуманизированного антитела подтверждает данное предсказание. Авторами были идентифицированы кандидатные остатки для обратных мутаций, включая остатки, близкие к области, определяющей комплементарность (3 в легкой цепи и 9 в тяжелой цепи в пределах 5 Å от областей, определяющих комплементарность), один легкоцепочечный остаток, контактирующий с тяжелой цепью, а также несколько скрытых остатков (и, как следствие, вероятно, не иммуногенных), которые могут быть конвертированы обратно в соответствующие мышиным последовательностям (4 в легкой цепи и 6 в тяжелой цепи). Мутированные остатки и кандидатные остатки для обратных мутаций показаны на фигуре 1 и фигуре 2.
Дополнительный структурный анализ
До передачи гуманизированной последовательности на рекомбинантную экспрессию, был выполнен дополнительный структурный анализ, который включал выбор сигнального пептида, выбор изотипа, анализ структурной совместимости в областях сочленений вариабельных и константных регионов. Помимо этого, сравнительный анализ межцепочечной упаковки и упаковки вариабельных и константных областей у мышиного и гуманизированного антитела показал, что в случае гуманизирования 16В5, допустимо образовывать гибридные антитела путем комбинирования гуманизированных и химерных (с мышиными вариабельными областями) цепей, например, мышиное/мышиное (M/M), мышиное/гуманизированное (M/H), гуманизированное/мышиное (H/M) и гуманизированное/гуманизированное (H/H) при спаривании легких/тяжелых цепей. Для анти-кластериновых антител был выбран человеческий изотип IgG2. Человеческий изотип IgG2 не несет выраженных эффекторных функций, что свойственно для блокирующих антител, описанных в данном документе. Помимо этого, человеческий изотип IgG2 в меньшей степени подвержен протеолитическому разрезанию, что обеспечивает большую стабильность этих антител in vivo.
3D-моделирование вариабельных областей мышиного 21B12 моноклонального антитела
Моделирование мышиного анти-кластеринового антитела 21B12 проводилось аналогично 16B5. Полученное гуманизированное антитело 21B12 было на 100% гуманизировано и обладало 18 мутациями в тяжелой цепи и 14 мутациями в легкой цепи. Мутированные остатки и кандидатные остатки для обратных мутаций показаны на фигуре 7 и фигуре 8.
Пример 2. Кинетический анализ анти-кластериновых антител
Целью данных исследований было определить кинетические параметры анти-кластериновых антител. В частности, определить, влияет ли гуманизирование моноклональных анти-кластериновых антител 16B5 и 21B12 на кинетические параметры их связывания с человеческим кластерином. С этой целью был выполнен кинетический анализ с использованием BIAcore 3000. Человеческий кластерин был иммобилизован на сенсорном чипе. Антитела полной длины или фрагменты Fab были инжектированы для взаимодействия с иммобилизированным кластерином. В данном примере описывается работа с антителом 16B5, антитело 21B12 подготавливалось и анализировалось аналогичным образом.
Иммобилизация кластерина
Во всех экспериментах BIAcore в качестве подвижного буфера использовался буфер HBST (10мМ Hepes pH 7,4, 135 мМ NaCl, 3,4 мМ ЭДТА, 0,005% Твин-20). Рекомбинантный мономерный кластерин был иммобилизован на чипе CM3 способом спаривания с нормальным амином на потоке 5 мкл/мин. Поверхность была активирована 35 мкл смеси 50мМ N-гидроксисукцинимида и 0,2M дихлорэтана. Кластерин в 10мМ натрий-ацетатном растворе с pH 4,5 инжектировали до захвата нужного количества (ниже 60RU). Непрореагировавшие эфиры были деактивированы 35 мкл 1M этаноламина гидрохлорида-NaOH с pH8,5. Контрольная поверхность была подготовлена аналогичным образом путем инжектирования смеси N-гидроксисукцинимида и 0,2M дихлорэтана и этаноламина.
Приготовление гуманизированных анти-кластериновых антител IgG2
Векторы экспрессии, содержащие кДНК, кодирующую легкие и тяжелые цепи иммуноглобулинов, были экспрессированы в 293 клетках с использованием способов временной трансфекции, известных в отрасли. Зрелый IgG2 собирался из среды, не содержащей сыворотки, на которой росли клетки, благодаря сигнальным пептидам, внедренным на N-концах обеих иммуноглобулиновых цепей. Рост клеток продолжался 5 дней после трансфекции, по истечении которых культуральная среда была отобрана для выделения IgG2 химерных моноклональных антител. Белок был очищен при помощи Protein-A агарозы согласно рекомендациям производителя (Sigma-Aldrich Canada Ltd., Оуквилль, Онтарио).
Получение мышиных 16B5 и HH 16B5 Fab
Мышиный иммуноглобулин 16B5 IgG был обработан папаином в молярном соотношении 1:100 4 часа при комнатной температуре. Ферментация была остановлена путем добавления ингибитора папаина E64 в молярном соотношении 4:1. Фрагменты Fab были отделены от фрагментов Fc путем хроматографии на колонке 1 мл HiTrap Protein G. Фрагменты Fab были элюированы из колонки 0,1 M раствором глицина с pH 2,7. Уровень pH тут же нейтрализовывался путем сбора элюата фракциями по 1 мл в пробирки с 100 мкл 2 M Трис с pH 9. Фракции, содержащие Fab, были объединены и концентрированы на центрифужном концентраторе Amicon Ultra 4 с порогом отсечения по молекулярной массе, равным 30 кДа. Образцы были пропущены через эксклюзионную колонку Superose 12 (10×300 мм) в 20 мМ HEPES, pH 7,5, 200 мМ NaCl, чтобы разделить фракции Fab и F(ab’)2. Фракции, содержащии Fab, были объединены и концентрированы на центрифужном концентраторе Amicon Ultra 4 с порогом отсечения по молекулярной массе, равным 30 кДа.
Получение HH 16B5 Fab осуществлялось по той же схеме, что и мышиного Fab, за исключением того, что ферментация проводилась 20 часов при комнатной температуре, а фрагменты Fab и Fc разделялись на колонке HiTrap Protein A, а не HiTrap Protein G. Продолжительность ферментации была увеличена на основании результатов маломасштабного испытания по удалению F(ab’)2. Эксклюзионный профиль показал, что при большей длительности ферментации уменьшалось, хотя и не полностью, содержание фрагментов F(ab’)2. Protein A использовался вместо Protein G, чтобы избежать воздействия низкого pH на фрагменты Fab, которое требуется для их элюирования из Protein G. Фрагменты Fab продвигались через колонку Protein A, а фрагменты Fc ею удерживались. Эксклюзионная сепарация проводилась в фосфатно-солевом буфере, а не буфере HEPES. Аналогичные способы использовались для получения фрагментов 21B12.
Кинетический анализ мышиных 16B5, HH16B5 и Fab
Кинетический анализ проводился на потоке 50 мкл/мин. Антитела с полной длиной (мышиные или гуманизированные) или Fab были разбавлены буфером HBST. Интервал концентраций составлял 1,953-31,25 нМ для антител с полной длиной и 15,625-250 нМ для Fab. Раствор с каждым уровнем концентрации инжектировали над кластерином и контрольной поверхностью в течение 5 минут, затем осуществляли диссоциирующую отмывку 5 минут. Перед каждой инжекцией антител, поверхность кластерина регенерировали 50 мкл 20 мМ HCl.
Кинетический анализ антител, связывающихся с кластерином
На фигуре 3 представлены результаты, полученные при определении кинетических параметров анти-кластериновых антител полной длины 16В5 и Fab.
Кинетические параметры гуманизированного антитела с полной длиной 16B5 (HH16B5) очень подобны с кинетическими параметрами мышиного антитела полной длины (16B5), что позволяет сделать вывод о том, что гуманизирование не влияет на связываемость антитела с кластерином. Однако, кинетические параметры гуманизированного 16B5 Fab (HH16B5 Fab) несколько лучше, нежели кинетические параметры Fab мышиного антитела (16B5 Fab), что также позволяет сделать вывод о том, что гуманизирование не влияет на связываемость антитела с кластерином. Величина KD взаимодействия между иммобилизированным человеческим кластерином и мышиным 16B5 или гуманизированным 16B5 находится в интервале небольших нМ. Способ в развитии может использоваться для сравнения кинетических параметров во время процесса гуманизирования анти-кластериновых антител.
На фигуре 9 представлены результаты, полученные при определении кинетических параметров анти-кластериновых антител полной длины 21В12 и Fab. Как уже было сказано для 16B5, для гуманизированных 21B12 (HH21B12) были определены показатели связывания, аналогичные параметрам родительского мышиного антитела 21B12. Величина KD взаимодействия между иммобилизированным человеческим кластерином и мышиным 21B12 или гуманизированным 21B12 находится в интервале небольших нМ. Способ в развитии может использоваться для сравнения кинетических параметров во время процесса гуманизирования анти-кластериновых антител.
Пример 3. Биологическая активность h16B5 в клеточных анализах
Данные исследования были произведены, чтобы сравнить биологическую активность h16B5 с активностью мышиного 16B5. Для тестирования h16B5 использовались два анализа, при помощи которых ранее было показано, что блокирование кластерина моноклональным антителом может уменьшать миграцию и инвазию раковых клеточных линий.
Для тестирования активности анти-кластериновых антител на миграцию раковых клеток, использовался стандартный тест затяжения ран, или тест царапины. Анализ заключался в выращивании с высокой плотностью клеток линии мышиной карциномы EMT6 с последующим нанесением раны, процарапывая слой клеток. В момент времени 0, видна широкая обнаженная область, быстро затягивающаяся при инкубировании клеток при 37°C 15ч (см. фиг. 4 вверху слева). При инкубировании клеток в присутствии либо поликлональных анти-кластериновых антител, доступных в продаже (C-18, Santa Cruz Biotech, Санта-Круз, Калифорния), либо мышиных антител 16B5, выделенных из оригинальной гибридомы, отмечалось понижение количества клеток в обнаженной области (см. фиг. 4 сверху справа, с метками доступные в продаже и гибридома 16B5). При инкубировании поврежденного слоя клеток EMT6 с химерным 16B5 (см. фиг. 4, снизу, метка MM), гибридным антителом, содержащим химерную легкую цепь и гуманизированную тяжелую цепь (см. фиг. 4, снизу, метка MH), гибридным антителом, содержащим химерную тяжелую цепь с гуманизированной легкой цепью (см. фиг. 4, снизу, метка HM), либо полностью гуманизированным 16B5 (см. фиг. 4, снизу, метка HH), также отмечалось блокирование миграции клеток в обнаженную область. Гуманизированное антитело 16В5 было наиболее эффективным ингибитором. Дополнительно, способность химерных и гибридных мышиных-человеческих антител ингибировать миграцию показывает, что взаимодействие с кластерином во всех случаях одинаково, независимо от того, какая иммуноглобулиновая цепь содержится в антителе 16В5.
Далее, авторами было определено, может ли h16B5 влиять на инвазивное поведение и рост других клеточных линий, например, линий клеток предстательной железы человека PC3 и DU145, секретирующих эндогенный кластерин в различном количестве. При посеве в матригеле (фиг. 5, сверху слева), клеточная линия опухоли PC3 образовывала звездчатую структуру с лучами, внедряющимися в матригель, что коррелирует с ее повышенной инвазивностью (Thompson et al., 1992). При обработке h16B5 (фиг. 5, сверху справа), звездчатость существенно уменьшалась, что позволяет предположить, что секреция кластерина дает свой вклад в инвазивность клеток PC3. Клетки DU145 не образовывали звездчатых структур аналогично клеткам PC3, а формировали шарообразные структуры на матригеле (фиг. 5, снизу слева), которые в присутствии h16B5 образовывались в меньшем количестве и меньших размеров (фиг. 5, снизу справа). Эти результаты показывают, что способность h16B5 уменьшать инвазивность раковых клеточных линий сравнима с исходными мышиными 16B5 и что гуманизирование не влияет на способность взаимодействовать с секретируемым кластерином и блокировать его активность.
Были получены опухоли, происходящие из 4 различных человеческих линий клеток поджелудочной железы, далее их зафиксировали в формалине, залили парафином и разрезали на слои. Чтобы определить, экспрессируют ли опухоли данного вида рака кластерин, производился иммуногистохимический анализ с антителами h16B5. Опухоли происходили из Aspc-1, BxPC-3, PANC-1 и MiaPaCa-2, все из которых происходили от пациентов с раком поджелудочной железы (ATCC, Манассас, Вирджиния). Залитые парафином образцы эпителиальных опухолей поджелудочной железы были помещены на предметные стекла и зафиксированы в течение 15 минут при 50°C. Депарафинизацию проводили путем 2-кратной обработки ксилолом с последующей дегидратацией 5-минутными промываниями в 100%, 80% и 70% этаноле. Стекла были промыты 2 раза фосфатно-солевым буфером в течение 5 минут и обработаны антигенизвлекающим раствором (цитрат-ЭДТА), чтобы выявить антиген. Эндогенные пероксид-реактивные виды были удалены инкубированием стекол с H2O2 в метаноле, блокирование было выполнено инкубированием стекол с блокирующим раствором без сыворотки (Dakocytomation) в течение 20 минут при комнатной температуре. Первичное моноклональное антитело (контрольный IgG или h16B5) было добавлено на уровне 5 мкг/мл 1 ч при комнатной температуре. H16B5-реактивный кластерин был выявлен путем инкубирования с биотинилированным человеческим анти-каппа антителом, а затем обработкой третичным антителом, конъюгированным со стрептавидин-пероксидазой хрена. Положительное окрашивание осуществлялось путем обработки предметных стекол субстратом диаминобензидина-пероксида водорода не менее 5 минут с последующим контрастным окрашиванием гематоксилином. Как показано на фиг. 11, все четыре опухоли прокрасились позитивно по экспрессированию кластерина (см фиг. 11 справа). Интересно, что в опухолях, устойчивых к химиотерапии (PANC-1 и MisPaCa-2), был отмечен самый высокий уровень секреции кластерина. Клеточная линия PANC-1 была культивирована и выращена на матригеле аналогично линиям рака предстательной железы (см. выше). Клетки были стимулированы TGFβ, индуктором эпителиально-мезенхимального перехода и фактором роста, обусловливающим миграцию клеток по мембране в матригель (см. фиг. 12, сверху справа). При обработке стимулированных клеток антителами h16B5, наблюдалось выраженное ингибирование миграции (фиг. 12, снизу справа). Это свидетельствует о том, что h16B5 может блокировать миграцию клеток рака поджелудочной железы, а также, что антитело имеет потенциал для терапевтической активности при данном виде рака.
Пример 4. Биологическая активность h16B5 в животных моделях рака
Данные исследования были проведены, чтобы измерить эффективность h16B5 in vivo на моделях человеческого рака. Сообщалось о том, что антисмысловые олигонуклеотиды и малые интерферирующие РНК к кластерину индуцируют апоптоз и чувствительность к химиотерапии in vitro для ксенотрансплантатов рака предстательной железы [1-4]. Использованная модельная система содержала линию клеток рака предстательной железы человека DU145, нечувствительную к андрогенам и представляющую собой одну из наиболее полно охарактеризованных моделей данного заболевания. Мышам с ТКИМ в бок вводили по 2 миллиона клеток подкожно, опухоли выращивали до размера, примерно, 100 мм3. Начиная с 1 дня, вводили h16B5 интраперитонеально в дозировке 5 мг/кг, начиная с 4 дня, вводили интраперитонеально таксотер (TxT) в дозировке 10 мг/мг. h16B5 вводили два раза в неделю, а TxT вводили один раз в неделю. Как показано на фиг. 6, рост опухолей (первичных) существенно замедлялся у животных, получавших лечение с h16B5, в сравнении с контрольными. Этот эффект наблюдался как в группе монотерапии (при сравнении контрольной группы с h16B5, Р=0,0104), так и в группе комбинированной с TxT терапии (при сравнении TxT с h16B5+TxT, Р=0,0395). Этот результат свидетельствует о том, что блокирование кластерина при помощи h16B5 приводит к уменьшению роста новообразований и увеличивает чувствительность опухолей к TxT.
Второе моделированное исследование рака предстательной железы было проведено с другой опухолевой моделью, путем введения клеток рака предстательной железы PC-3. Клетки PC-3 также нечувствительны к гормонам, однако, согласно литературным данным, более инвазивны, нежели клетки DU145. Как было описано выше, клетки были имплантированы подкожно мышам с ТКИН, лечение начиналось по достижении опухолями объема в ~100 мм3 (назначенный день 1). h16B5 вводился интраперитонеально на день 1 в дозировке 5 мг/кг и далее два раза в неделю, TxT вводился интраперитонеально однократно на день 5, в дозировке 10 мг/кг. Схема введений TxT была изменена, поскольку было выяснено, что клетки PC-3 существенно более чувствительны к данному химиотерапевтическому препарату в сравнении с опухолями DU145.
Результаты исследования представлены на фиг. 10. Как и ранее, было отмечено, что опухоли у животных, получавших только h16B5, давали практически немедленный ответ к антителам, в сравнении с животными, не получавшими h16B5. К 43 дню терапии размеры опухолей в группе терапии h16B5 были на 37% меньше, чем в контрольной. Также, контролировалась выживаемость. Было определено, что ко дню смерти всех животных в контрольной группе (день 43), более 60% мышей оставались живыми в группе терапии AB-16B5. Увеличение общей выживаемости составляло 47% у животных, получавших h16B5.
Отмечалось цитотоксическое влияние TxT на клетки рака предстательной железы, однако, опухоли восстанавливались спустя, примерно, 18 дней после инъекции. Рост новообразований в группе приема TxT был даже более выраженным, нежели в группе приема AB-16B5 (см. день 50, фиг. 10). Однако, при назначении h16B5 в комбинации с TxT, наблюдалось существенное замедление скорости роста опухолей, в результате опухоли были на 41% меньше, чем в группе, получавшей только TxT. В присутствии h16B5 увеличивалась выживаемость животных. При совокупном рассмотрении, результаты данных исследований in vivo показывают, что гуманизированное антитело h16B5, ингибирующее функцию секретируемого опухолями кластерина, может существенно замедлять рост новообразований.
Пример 5. Ингибирование интернализации секретируемого кластерина раковыми клетками при помощи H16B5.
Результаты, приведенные выше, показывают, что индуцирование эпителиально-мезенхимального перехода (ЭМП) приводит к секреции кластерина раковыми клетками. Дополнительно, согласно нашим данным, кластерин, который секретируется этими раковыми клетками, является мощным индуктором ЭМП. Данные открытия позволяют предположить, что секретируемый кластерин вызывает данный эффект либо косвенно, путем взаимодействия с иными ассоциированными с опухолями факторами в межклеточном матриксе, либо прямо, путем взаимодействия с рецептором на поверхности раковых клеток. Хотя секретируемый кластерин, присутствующий в нормальной сыворотке, может связываться со множеством разных белков, например, с членами каскада реакций комплемента, лептином, различными аполипопротеинами, вопрос присутствия белковых партнеров для секретируемого кластерина в раковых клетках или в микросреде опухоли остается практически неизученным. В литературных источниках по данному вопросу, присутствует, например, отчет Jo и сотрудников (Jo et al., 2008), показавших, что секретируемый опухолью кластерин связывается с ИФР-1 в стрессовых условиях, вызванных сывороточной депривацией. Помимо этого, кластерин, содержащийся в клеточных линиях рака предстательной железы, способен взаимодействовать с белком COMMD1 (Zoubeidi et al., 2010). Данное взаимодействие приводило к увеличению активации пути ядерного фактора каппа-В, что, в свою очередь, способствовало выживанию клеток рака предстательной железы. Эти данные прояснили способы, по которым секретируемый кластерин может оказывать влияние на образование опухолей, однако молекулярный механизм, по которому он ускоряет ЭМП, остается неустановленным.
Чтобы начать исследования этого вопроса, были произведены клеточные эксперименты, в которых определялось, взаимодействует ли секретируемый кластерин с раковыми клетками напрямую или посредством других секретируемых факторов в межклеточном пространстве. Чтобы это измерить, секретируемый кластерин был помечен флуоресцентно и инкубирован с клетками мышиной карциномы молочной железы BRI-JM01. Было установлено, что после примерно 24 часов обработки, флуоресцентный сигнал обнаруживался внутри клеток. Анализ этих клеток с короткими временными интервалами показал, что секретируемый кластерин, помеченный флуоресцентной меткой, был захвачен клетками (см. фиг. 13). Как было продемонстрировано, захват со временем увеличивается, что согласуется с версией о рецептор-обусловленном эндоцитозном пути. Далее, пунктат и перинуклеарное окрашивание через 24 часа (см. белые стрелки на фиг. 13) соответствуют картине, наблюдаемой для белков, которые захватываются эндосомальным путем. Аналогичные результаты наблюдались с клетками рака предстательной железы человека DU145.
Далее проверялось, может ли h16B5 блокировать захват секретируемого кластерина. Клетки были обработаны секретируемым кластерином -Alexa480 в присутствии либо h16B5, либо изотипного контроля IgG. Как показано на фиг. 14, захват секретируемого кластерина клетками JM01 блокировался после добавления h16B5. У клеток, обработанных контролем IgG продолжало наблюдаться внутреннее перинуклеарное окрашивание секретируемого кластерина (см. белые стрелки на фиг. 14).
Данные результаты в совокупности показывают, что интернализация секретируемого кластерина может быть ингибирована путем добавления h16B5, что может быть одним из механизмов ингибирования антителом ЭМП, вызванного секретируемым кластерином в раковых клетках.
Описанные эксперименты могут выполнены с целью определения того, как специфические мутации аминокислотной последовательности антитела (напр., в вариабельной(ых) области(ях), константной области, каркасной области или определяющей комплементарность области(ях)) могут влиять на биологическую активность антитела. К примеру, в каркасную область вариабельной легкой цепи или вариабельной тяжелой цепи h16B5 (или мышиного 16В5) могут быть внедрены одна и более мутаций, далее рост опухоли может оцениваться так, как описано в данном документе.
Связывание вариантных антител и антигенсвязывающих фрагментов с человеческим или мышиным кластерином может определяться при помощи ряда способов, известных в отрасли, например, ИФА (ELISA), вестерн-блоттингом, поверхностным плазмонным резонансом и т.д.
Пример 6. связывание анти-кластериновых антител с вариантами кластерина.
Антитела и антигенсвязывающие фрагменты по настоящему изобретению, связываются как с человеческим, так и с мышиным кластерином. Данные два белка на 77% идентичны по аминокислотной последовательности и на 89% одинаковы (см. фиг. 15). При сравнении аминокислотных последовательностей мышиной и человеческой форм, можно понять, что антитело, вероятно, связывается линейным или конформационным эпитопом, присутствующими в обоих белках. Ожидается, что антитела и антигенсвязывающие фрагменты могут быть способными связываться с иными природными вариантами и синтетическими вариантами кластерина (включая рекомбинантные белки), имеющими, по меньшей мере, 75% (например, 85%, 90%, 95%, 99%, 100%) идентичность в аминокислотной последовательности с человеческим или мышиным кластерином. Например, антитела и антигенсвязывающие фрагменты могут связываться с вариантом кластерина, обладающим аминокислотной последовательностью, содержащей SEQ ID NO.:56 (где + обозначает аминокислотную замену, например, консервативную аминокислотную замену) или SEQ ID NO:57.
В настоящем изобретении показано, что мишенью анти-кластериновых антител является кластерин, экспрессируемый в человеческих опухолях. Чтобы продемонстрировать взаимодействие анти-кластериновых антител, например, h16B5, с мышиным опухолевым кластерином, были приготовлены замороженные срезы опухоли молочной железы мыши 4T1, которые затем были инкубированы с h16B5. Замороженные срезы были зафиксированы холодным ацетоном в течение 10 минут, неспецифическое связывание было заблокировано реактивом, поставляемым в составе набора, доступного в продаже (Dako Canada, Inc., Берлингтон, Онтарио). H16B5 был инкубирован со срезами мышиной опухоли в течение 1 часа при концентрации 5 мкг/мл. После отмывки было произведено специфическое окрашивание путем инкубирования с анти-человеческим IgG, конъюгированным с пероксидазой хрена. Контрольный образец был обработан идентичным образом, с человеческим изотипным контролем IgG. Как показано на фиг. 16, h16B5 детектировало мышиный кластерин в опухолях 4T1 (см. справа, метка 4T1-AB-16B5), о чем свидетельствовало коричневое окрашивание после воздействия пероксидазы хрена. Контрольное антитело не обнаружило антигенов (см. слева, метка 4T1-ctl). Это свидетельствует о том, что анти-кластериновые антитела, например, h16B5, взаимодействуют с мышиным кластерином, который экспрессируется в мышиных опухолях. Помимо это, в других иммунофлуоресцентных исследованиях было показано, что h16B5 детектирует мышиный кластерин, экспрессируемый в клетках BRI-JM01 - другой клеточной линии карциномы молочной железы мыши.
Связывание антител и антигенсвязывающих фрагментов по настоящему изобретению с природным или синтетическими вариантами кластерина могут быть изучены и иными способами, известными в отрасли, например, описанными выше способами.
Ген CLU консервативен у человека, шимпанзе, собаки, коровы, мыши, крысы, курицы и данио-рерио. Тестирование антител и антигенсвязывающих фрагментов в данных моделях охватывается настоящим изобретением.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ:
SEQ ID NO:1
16B5 CDRH1: GFNIKDIYMH
SEQ ID NO.:2
16B5 CDRH2: RIDPAYGNTKYDPKFQG
SEQ ID NO.:3
16B5 CDRH3: RYDTAMDY
SEQ ID NO.:4
16B5 CDRL1: KSSQSLLNSRTRKNYLA
SEQ ID NO.:5
16B5 CDRL2: WASTRES
SEQ ID NO.:6
16B5 CDRL3: KQSYNLWT
SEQ ID NO.:7
16B5 Гуманизированный вариабельный регион тяжелой цепи
QVQLVQSGAEVKKPGATVKISCKVSGFNIKDIYMHWVQQAPGKGLEWMGRIDPAYGNTKYDPKFQGRVTITADTSTDTAYMELSSLRSEDTAVYYCARRYDTAMDYWGQGTLVTVSS
SEQ ID NO.:8
16B5 Гуманизированный вариабельный регион легкой цепи
DIVMTQSPDSLAVSLGERATINCKSSQSLLNSRTRKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCKQSYNLWTFGQGTKLEIK
SEQ ID NO.:9
Полная последовательность тяжелой цепи иммуноглобулинов h16B5
QVQLVQSGAEVKKPGATVKISCKVSGFNIKDIYMHWVQQAPGKGLEWMGRIDPAYGNTKYDPKFQGRVTITADTSTDTAYMELSSLRSEDTAVYYCARRYDTAMDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO.:10
Полная последовательность легкой цепи иммуноглобулинов h16B5
DIVMTQSPDSLAVSLGERATINCKSSQSLLNSRTRKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCKQSYNLWTFGQGTKLEIKVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO.:11
21B12 CDRH1: GYTFTNYGMH
SEQ ID NO.:12
21B12 CDRH2: WINTYTGEPTYADDFKG
SEQ ID NO.:13
21B12 CDRH3: DGFLYFFDY
SEQ ID NO.:14
21B12 CDRL1: KSSQSLLYSSNQKNYLA
SEQ ID NO.:15
21B12 CDRL2: WASTRES
SEQ ID NO.:16
21B12 CDRL3: QQYYIYPRT
SEQ ID NO.:17
21B12 Гуманизированный вариабельный регион тяжелой цепи
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMHWVRQAPGQGLEWMGWINTYTGEPTYADDFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARDGFLYFFDYWGQGTLVTVSS
SEQ ID NO.:18
21B12 Гуманизированный вариабельный регион легкой цепи
DIVMTQSPDSLAVSLGERATINCKSSQSLLYSSNQKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQYYIYPRTFGQGTKLEIK
SEQ ID NO.:19
Полная последовательность тяжелой цепи иммуноглобулинов h21B12
QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGMHWVRQAPGQGLEWMGWINTYTGEPTYADDFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARdGFLYFFDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO.:20
Полная последовательность легкой цепи иммуноглобулинов h21B12
DIVMTQSPDSLAVSLGERATINCKSSQSLLYSSNQKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQYYIYPRTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO.:21
Полная нуклеотидная последовательность тяжелой цепи h16B5
ATGGACTGGACCTGGCGGATCCTGTTCCTGGTGGCCGCTGCTACCGGCACCCACGCCCAGGTGCAGCTGGTGCAGTCTGGCGCCGAGGTGAAGAAGCCTGGCGCCACCGTCAAGATCAGCTGCAAGGTGTCCGGCTTCAACATCAAGGACATCTACATGCACTGGGTGCAGCAGGCTCCAGGCAAGGGACTGGAGTGGATGGGCCGGATCGACCCTGCCTACGGCAACACCAAGTACGACCCTAAGTTCCAGGGCCGGGTGACCATCACCGCCGACACCTCCACCGACACCGCCTACATGGAACTGTCCTCCCTGCGGTCCGAGGACACCGCCGTGTACTACTGCGCCCGGAGATACGACACCGCCATGGATTACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCCGCTTCCACCAAGGGCCCATCGGTCTTCCCCCTGGCGCCCTGCTCCAGGAGCACCTCCGAGAGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCTCTGACCAGCGGCGTGCACACCTTCCCAGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAACTTCGGCACCCAGACCTACACCTGCAACGTAGATCACAAGCCCAGCAACACCAAGGTGGACAAGACAGTTGAGCGCAAATGTTGTGTCGAGTGCCCACCGTGCCCAGCACCACCTGTGGCAGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACGTGCGTGGTGGTGGACGTGAGCCACGAAGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCACGGGAGGAGCAGTTCAACAGCACGTTCCGTGTGGTCAGCGTCCTCACCGTTGTGCACCAGGACTGGCTGAACGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGGCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAACCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACACCTCCCATGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTAAATGA
SEQ ID NO.:22
Полная нуклеотидная последовательность тяжелой цепи h21B12
ATGGACTGGACCTGGCGGATCCTGTTTCTGGTGGCCGCTGCTACCGGCACACACGCCCAGGTGCAGCTGGTGCAGTCCGGCTCCGAGCTGAAGAAACCTGGCGCCTCCGTGAAGGTGTCCTGCAAGGCCTCCGGCTACACCTTCACCAACTACGGCATGCACTGGGTGCGCCAGGCACCTGGACAGGGACTGGAATGGATGGGCTGGATCAACACCTACACCGGCGAGCCTACCTACGCCGACGACTTCAAGGGCAGATTCGTGTTCTCCCTGGACACCTCCGTGTCCACCGCCTACCTGCAGATCTCCTCCCTGAAGGCCGAGGACACCGCCGTGTACTACTGCGCCAGGGACGGCTTCCTGTACTTCTTCGACTACTGGGGCCAGGGCACCCTGGTGACCGTGTCCTCTGCCTCCACCAAGGGCCCTTCCGTGTTCCCTCTGGCCCCTTGCTCCCGGTCCACCTCTGAGTCTACCGCCGCTCTGGGCTGCCTGGTGAAGGACTACTTCCCTGAGCCTGTGACAGTGTCCTGGAACTCTGGCGCCCTGACCTCTGGCGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGGCCTGTACTCCCTGTCCTCCGTGGTGACAGTGCCTTCCTCCAACTTCGGCACCCAGACCTACACCTGCAACGTGGACCACAAGCCTTCCAACACCAAGGTGGACAAGACCGTGGAGCGGAAGTGCTGCGTGGAGTGCCCTCCTTGTCCTGCTCCTCCTGTGGCTGGCCCTAGCGTGTTCCTGTTCCCTCCTAAGCCTAAGGACACCCTGATGATCTCCCGGACCCCTGAAGTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGACCCTGAGGTGCAGTTCAATTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCTCGGGAGGAACAGTTCAACTCCACCTTCCGGGTGGTGTCCGTGCTGACCGTGGTGCACCAGGACTGGCTGAACGGCAAAGAATACAAGTGCAAGGTGTCCAACAAGGGCCTGCCTGCCCCTATCGAAAAGACCATCTCTAAGACCAAGGGCCAGCCTCGCGAGCCTCAGGTGTACACCCTGCCTCCCTCCCGCGAGGAAATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAGGGCTTCTACCCTTCCGATATCGCCGTGGAGTGGGAGTCTAACGGCCAGCCTGAGAACAACTACAAGACCACCCCTCCTATGCTGGACTCCGACGGCTCCTTCTTCCTGTACAGCAAGCTGACAGTGGACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGTCCCTGTCTCCTGGCAAGTGA
SEQ ID NO.:23
Полная нуклеотидная последовательность легкой цепи h16B5
ATGGTGCTGCAGACCCAGGTGTTCATCTCCCTGCTGCTGTGGATCTCCGGCGCCTACGGCGACATCGTGATGACCCAGTCCCCCGACTCCCTGGCCGTGTCCCTGGGCGAGAGAGCCACCATCAACTGCAAGTCCTCCCAGTCCCTGCTGAACTCCCGGACCCGGAAGAACTACCTGGCCTGGTATCAGCAGAAGCCTGGCCAGCCTCCTAAGCTGCTGATCTACTGGGCCTCCACCCGGGAGTCCGGCGTGCCTGACCGGTTCTCCGGCTCCGGCAGCGGCACCGACTTCACCCTGACCATCAGCTCCCTGCAGGCCGAGGACGTGGCCGTGTACTACTGCAAGCAGTCCTACAACCTGTGGACCTTCGGCCAGGGCACCAAGCTGGAGATCAAGCGGACTGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGTTAG
SEQ ID NO.:24
Полная нуклеотидная последовательность легкой цепи h21B12
ATGGTGCTGCAGACCCAGGTGTTCATCTCCCTGCTGCTGTGGATCTCTGGCGCCTACGGCGACATCGTGATGACCCAGTCCCCCGACTCTCTGGCTGTGTCCCTGGGCGAGCGGGCCACCATCAACTGCAAGTCCTCCCAGTCCCTGCTGTACTCCTCCAACCAGAAGAACTACCTGGCCTGGTATCAGCAGAAGCCTGGCCAGCCTCCTAAGCTGCTGATCTACTGGGCCTCCACCCGGGAATCTGGCGTGCCTGACCGGTTCTCCGGCTCTGGCTCCGGCACCGACTTCACCCTGACCATCAGCTCCCTGCAGGCCGAGGACGTGGCCGTGTACTACTGCCAGCAGTACTACATCTACCCTCGGACCTTCGGCCAGGGCACCAAGCTGGAAATCAAGCGGACCGTGGCCGCTCCTTCCGTGTTCATCTTCCCCCCTTCCGACGAGCAGCTGAAGTCCGGCACCGCCTCTGTGGTGTGCCTGCTGAACAACTTCTACCCCCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCAGGAATCCGTCACCGAGCAGGACTCCAAGGACTCTACCTACTCCCTGTCCTCCACCCTGACCCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGCGAAGTGACCCACCAGGGCCTGTCCTCTCCCGTGACCAAGTCCTTCAACCGGGGCGAGTGCTGA
SEQ ID NO.:25 (мышиный 16B5 VL)
DIVMSQSPSSLAVSAGEKVTMSCKSSQSLLNSRTRKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYYCKQSYNLWTFGGGTKLEFK
SEQ ID NO.:26 (h16B5 VL consensus1)
DIVMXQSPXSLAVSXGEXXTXXCKSSQSLLNSRTRKNYLAWYQQKPGQXPKLLIYWASTRESGVPDRFXGSGSGTDFTLTISSXQAEDXAVYYCKQSYNLWTFGXGTKLEXK;
X является аминокислотной заменой в сравнении с соответствующей аминокислотой полипептидного набора SEQ ID NO.:25.
SEQ ID NO.:27 (h16B5 VL consensus2)
DIVMXa1QSPXa2SLAVSXa3GEXa4Xa5TXa6Xa7CKSSQSLLNSRTRKNYLAWYQQ
KPGQXa8PKLLIYWASTRESGVPDRFXa9GSGSGTDFTLTISSXa10QAEDXa11AVYY
CKQSYNL-WTFGXa12GTKLEXa13K
Xa1 -это нейтральная гидрофильная аминокислота, например, T или S;
Xa2 - это D или S;
Xa3 - это гидрофобная аминокислота, например, L или A;
Xa4 - это основная аминокислота, например, R или K;
Xa5 - это гидрофобная аминокислота, например, A или V;
Xa6 - это гидрофобная аминокислота, например, I или M;
Xa7 - это N или S;
Xa8 - это P или S;
Xa9 - это нейтральная гидрофильная аминокислота, например, S или T;
Xa10 - это гидрофобная аминокислота, например, L или V;
Xa11 - это гидрофобная аминокислота, например, V или L;
Xa12 - это Q или G; и
Xa13 - это I или F.
SEQ ID NO.:28 (h16B5 VL consensus3)
DIVMXa1QSPXa2SLAVSXa3GEXa4Xa5TXa6Xa7CKSSQSLLNSRTRKNYLAWYQQ
KPGQXa8PKLLIYWASTRESGVPDRFXa9GSGSGTDFTLTISSXa10QAEDXa11AVYY
CKQSYNL-WTFGXa12GTKLEXa13K
Xa1 - это T или S; Xa2 - это D или S; Xa3 - это L или A; Xa4 - это R или K; Xa5 - это A или V; Xa6 - это I или M; Xa7 - это N или S; Xa8 - это P или S; Xa9 - это S или T; Xa10 - это L или V; Xa11 - это V или L; Xa12 - это Q или G; и Xa13 - это I или F.
SEQ ID NO.:29 (мышиный 16B5 VH)
EVQLQQSGAELVKPGASVRLSCTTSGFNIKDIYMHWVKQRPEQGLEWIGRIDPAYGNTKYDPKFQGKATITADTSSNTAYLQLSSLTSEDTAVYYCARRYDTAMDYWGQGTSVTVSS
SEQ ID NO.:30 (h16B5 VH consensus1)
XVQLXQSGAEXXKPGAXVXXSCXXSGFNIKDIYMHWVXQXPXXGLEWXGRIDPAYGNTKYDPKFQGXXTITADTSXXTAYXXLSSLXSEDTAVYYCARRYDTAMDYWGQGTXVTVSS;
X является аминокислотной заменой в сравнении с соответствующей аминокислотой полипептидного набора SEQ ID NO.:29.
SEQ ID NO.:31 (h16B5 VH consensus2)
Xb1VQLXb2QSGAEXb3Xb4KPGAXb5VXb6Xb7SCXb8Xb9SGFNIKDIYMHWVXb10QXb11PXb12Xb13GLEWXb14GRIDPAYGNTKYDPKFQGXb15Xb16TITADTSXb17Xb18TAYXb19Xb20LSSLXb21SEDTAVYYCARRYDTAMDYWGQGTXb22VTVSS;
Xb1 - это Q или E;
Xb2 - это V или Q;
Xb3 - это гидрофобная аминокислота, например, V или L;
Xb4 - это K или V;
Xb5 - это нейтральная гидрофильная аминокислота, например, T или S;
Xb6 - это основная аминокислота, например, K или R;
Xb7 - это гидрофобная аминокислота, например, I или L;
Xb8 - это K или T;
Xb9 - это V или T;
Xb10 - это основная аминокислота, например, Q или K;
Xb11 - это A или R;
Xb12 - это G или E;
Xb13 - это основная аминокислота, например, K или Q;
Xb14 - это гидрофобная аминокислота, например, M или I;
Xb15 - это основная аминокислота, например, R или K;
Xb16 - это гидрофобная аминокислота, например, V или A;
Xb17 - это нейтральная гидрофильная аминокислота, например, T или S;
Xb18 - это например, D или N;
Xb19 - это гидрофобная аминокислота, например, M или L;
Xb20 - это E или Q;
Xb21 - это R или T; и
Xb22 - это L или S.
SEQ ID NO.:32 (h16B5 VH consensus3)
Xb1VQLXb2QSGAEXb3Xb4KPGAXb5VXb6Xb7SCXb8Xb9SGFNIKDIYMHWVXb10QXb11PXb12Xb13GLEWXb14GRIDPAYGNTKYDPKFQGXb15Xb16TITADTSXb17Xb18TAYXb19Xb20LSSLXb21SEDTAVYYCARRYDTAMDYWGQGTXb22VTVSS;
Xb1 - это Q или E; Xb2 - это V или Q; Xb3 - это V или L; Xb4 - это K или V; Xb5 - это T или S; Xb6 - это K или R; Xb7 - это I или L; Xb8 - это K или T; Xb9 - это V или T; Xb10 - это Q или K; Xb11 - это A или R; Xb12 - это G или E; Xb13 - это K или Q; Xb14 - это M или I; Xb15 - это R или K; Xb16 - это V или A; Xb17 - это T или S; Xb18 - это D или N; Xb19 - это M или L; Xb20 - это E или Q; Xb21 - это R или T; и Xb22 - это L или S.
SEQ ID NO.:33 (мышиный 21B12 VL)
DIVMSQSPSSLAVSVGEKVTMSCKSSQSLLYSSNQKNYLAWYQQRPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVKAEDLAVYYCQQYYIYPRTFGGGTKLEIK
SEQ ID NO.:34 (h21B12 VL consensus1)
DIVMXcQSPXSLAVSXGEXXTXXCKSSQSLLYSSNQKNYLAWYQQXPGQXPKLLIYWASTRESGVPDRFXGSGSGTDFTLTISSXXAEDXAVYYCQQYYIYPRTFGXGTKLEIK
X является аминокислотной заменой в сравнении с соответствующей аминокислотой полипептидного набора SEQ ID NO.:33.
SEQ ID NO.:35 (h21B12 VL consensus2)
DIVMXc1QSPXc2SLAVSXc3GEXc4Xc5TXc6Xc7CKSSQSLLYSSNQKNYLAWY
QQXc8PGQXc9PKLLIYWASTRESGVPDRFXc10GSGSGTDFTLTISSXc11Xc12AE
DXc13AVYYCQQYYIYPRTFGXc14GTKLEIK;
Xc1 - это нейтральная гидрофильная аминокислота, например, T или S;
Xc2 - это D или S;
Xc3 - это гидрофобная аминокислота, например, L или V;
Xc4 - это основная аминокислота, например, R или K;
Xc5 - это гидрофобная аминокислота, например, A или V;
Xc6 - это гидрофобная аминокислота, например, I или M;
Xc7 - это N или S;
Xc8 - это основная аминокислота, например, K или R;
Xc9 - это P или S;
Xc10 - это нейтральная гидрофильная аминокислота, например, S или T;
Xc11 - это гидрофобная аминокислота, например, L или V;
Xc12 - это основная аминокислота, например, Q или K;
Xc13 - это гидрофобная аминокислота, например, V или L; и
Xc14 - это Q или G.
SEQ ID NO.:36 (h21B12 VL consensus3)
DIVMXc1QSPXc2SLAVSXc3GEXc4Xc5TXc6Xc7CKSSQSLLYSSNQKNYLAWYQQ
Xc8PGQXc9PKLLIYWASTRESGVPDRFXc10GSGSGTDFTLTISSXc11Xc12AE
DXc13AVYYCQQYYIYPRTFGXc14GTKLEIK;
Xc1 - это T или S; Xc2 - это D или S; Xc3 - это L или V; Xc4 - это R или K; Xc5 - это A или V; Xc6 - это I или M; Xc7 - это N или S; Xc8 - это K или R; Xc9 - это P или S; Xc10 - это S или T; Xc11 - это L или V; Xc12 - это Q или K; Xc13 - это V или L; и Xc14 - это Q или G.
SEQ ID NO.:37 (мышиный 21B12 VH)
QIQLVQSGPELKKPGETVKISCKASGYTFTNYGMHWVKQAPGKGLKWMGWINTYTGEPTYADDFKGRFAFSLETSASTAYLQINNLKNEDTATYFCARDGFLYFFDYWGQGTTLTVSS
SEQ ID NO:38 (h21B12 VH consensus1)
QXQLVQSGXELKKPGXXVKXSCKASGYTFTNYGMHWVXQAPGXGLXWMGWINTYTGEPTYADDFKGRFXFSLXTSXSTAYLQIXXLKXEDTAXYXCARDGFLYFFDYWGQGTXXTVSS
X является аминокислотной заменой в сравнении с соотвествующей аминокислотой полипептидного набора SEQ ID NO.:37.
SEQ ID NO:39 (h21B12 VH consensus2)
QXd1QLVQSGXd2ELKKPGXd3Xd4VKXd5SCKASGYTFTNYGMHWVXd6QAPGXd7GLXd8WM
GWINTYTGEPTYADDFKGRFXd9FSLXd10TSXd11STAYLQIXd12Xd13LKXd14ED
TAXd15YXd16CARDGFLYFFDYWGQGTXd17Xd18TVSS;
Xd1 - это гидрофобная аминокислота, например, V или I;
Xd2 - это S или P;
Xd3 - это A или E;
Xd4 - это нейтральная гидрофильная аминокислота, например, S или T;
Xd5 - это гидрофобная аминокислота, например, V или I;
Xd6 - это основная аминокислота, например, R или K;
Xd7 - это основная аминокислота, например, Q или K;
Xd8 - это E или K;
Xd9 - это гидрофобная аминокислота, например, V или A;
Xd10 - это кислая аминокислота, например, D или E;
Xd11 - это гидрофобная аминокислота, например, V или A;
Xd12 - это S или N;
Xd13 - это S или N;
Xd14 - это A или N;
Xd15 - это V или T;
Xd16 - это ароматическая аминокислота, например, Y или F;
Xd17 - это L или T; и
Xd18 - это гидрофобная аминокислота, например, V или L.
SEQ ID NO:40 (h21B12 VH consensus3)
QXd1QLVQSGXd2ELKKPGXd3Xd4VKXd5SCKASGYTFTNYGMHWVXd6QAPGXd7GLXd8WM
GWINTYTGEPTYADDFKGRFXd9FSLXd10TSXd11STAYLQIXd12Xd13LKXd14ED
TAXd15YXd16CARDGFLYFFDYWGQGTXd17Xd18TVSS;
Xd1 - это V или I; Xd2 - это S или P; Xd3 - это A или E; Xd4 - это S или T; Xd5 - это V или I; Xd6 - это R или K; Xd7 - это Q или K; Xd8 - это E или K; Xd9 - это V или A; Xd10 - это D или E; Xd11 - это V или A; Xd12 - это S или N; Xd13 - это S или N; Xd14 - это A или N; Xd15 - это V или T; Xd16 - это Y или F; Xd17 - это L или T; и Xd18 - это V или L.
SEQ ID NO.: 41 (человеческая модель 16B5VL)
DIVMTQSPDSLAVSLGERATINCKSSQSVLYSSNSKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQYYSTPYSFGQGTKLEIK
SEQ ID NO.: 42 (человеческая модель 16B5VH)
QVQLVQSGAEVKKPGATVKISCKVSGYTFTDYYMHWVQQAPGKGLEWMGLVDPEDGETIYAEKFQGRVTITADTSTDTAYMELSSLRSEDTAVYYCARIPLFGRDHWGQGTLVTVSR
SEQ ID NO.: 43 (человеческая модель 21B12VL)
DIVMTQSPDSLAVSLGERATINCKSSQSVLYSSNSKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQYYSTPYS FGQGTKLEIK
SEQ ID NO.: 58 (человеческая модель 21B12VH)
QVQLVQSGSELKKPGASVKVSCKASGYTFTSYAMNWVRQAPGQGLEWMGWINTNTGNPTYAQGFTGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARDWGQGTLVTVSSVATIDENWFDP
SEQ ID NO:44
16B5 CDRH1: GFNIKDIY
SEQ ID NO:45
16B5 CDRH2: IDPAYGNT
SEQ ID NO:46
16B5 CDRH3: X1X2RYDTAMDY
X1 - это A;
X2- это R;
или X1 и X2 находятся вне CDRH3
SEQ ID NO.:47
16B5 CDRL1: QSLLNSRTRKNY
16B5 CDRL2: WAS
SEQ ID NO.:49
16B5 CDRL3: KQSYNLWT
SEQ ID NO.:50
21B12 CDRH1: GYTFTNYG
SEQ ID NO.:51
21B12 CDRH2: INTYTGEP
SEQ ID NO.:52
21B12 CDRH3: X3X4DGFLYFFDY
X3 - это A;
X4- это R;
или X3 и X4 находятся вне CDRH3
SEQ ID NO.:53
21B12 CDRL1: QSLLYSSNQKNY
21B12 CDRL2: WAS
SEQ ID NO.:55
21B12 CDRL3: QQYYIYPRT
Литература
1. Gleave, M.E., et al., Use of antisense oligonucleotides targeting the antiapoptotic gene, clusterin/testosterone-repressed prostate message 2, to enhance androgen sensitivity and chemosensitivity in prostate cancer. Urology, 2001. 58(2 Suppl 1): p. 39-49.
2. Trougakos, I.P., et al., Silencing expression of the clusterin/apolipoprotein j gene in human cancer cells using small interfering RNA induces spontaneous apoptosis, reduced growth ability, and cell sensitization to genotoxic and oxidative stress. Cancer Res, 2004. 64(5): p. 1834-42.
3. Gleave, M. and H. Miyake, Use of antisense oligonucleotides targeting the cytoprotective gene, clusterin, to enhance androgen- and chemo-sensitivity in prostate cancer. World J Urol, 2005. 23(1): p. 38-46.
4. Springate, C.M., et al., Efficacy of an intratumoral controlled release formulation of clusterin antisense oligonucleotide complexed with chitosan containing paclitaxel or docetaxel in prostate cancer xenograft models. Cancer Chemother Pharmacol, 2005. 56(3): p. 239-47.
5. Jo, H., Jia, Y., et al., Cancer cell-derived clusterin modulates the phosphatidylinositol-3’-kinase-Akt pathway through attenuation of insulin-like growth factor 1 during serum deprivation. Mol. Cell. Biol. 2008. 28:4285-4299.
6. Zoubeidi, A., ettinger, S. et al., Clusterin facilitates COMMD1 and I-kappaB degradation to enhance NF-kappaB activity in prostate cancer cells. Mol. Cancer Res. 2010, 8:119-130.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2013 |
|
RU2668161C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2007 |
|
RU2498999C2 |
| РЕКОМБИНАНТНЫЕ IL4-АНТИТЕЛА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С ДЕЙСТВИЕМ IL4 | 1994 |
|
RU2162711C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО | 2008 |
|
RU2538709C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО 5D3HU, СВЯЗЫВАЮЩЕЕСЯ С ОПУХОЛЕВЫМ АНТИГЕНОМ PRAME, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ АНТИТЕЛА | 2020 |
|
RU2761876C1 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО 6H8HU, СВЯЗЫВАЮЩЕЕСЯ С ОПУХОЛЕВЫМ АНТИГЕНОМ PRAME, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ АНТИТЕЛА | 2020 |
|
RU2768737C1 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ (Fab), СВЯЗЫВАЮЩИЕСЯ С ИНТЕРФЕРОНОМ- γ ЧЕЛОВЕКА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КЛЕТКА, ТРАНСФОРМИРОВАННАЯ ФРАГМЕНТОМ ДНК, И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО АНТИТЕЛА И АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА | 2013 |
|
RU2539752C2 |
| АНТИТЕЛО К CLDN18.2 И ЕГО ПРИМЕНЕНИЯ | 2018 |
|
RU2797709C2 |














































































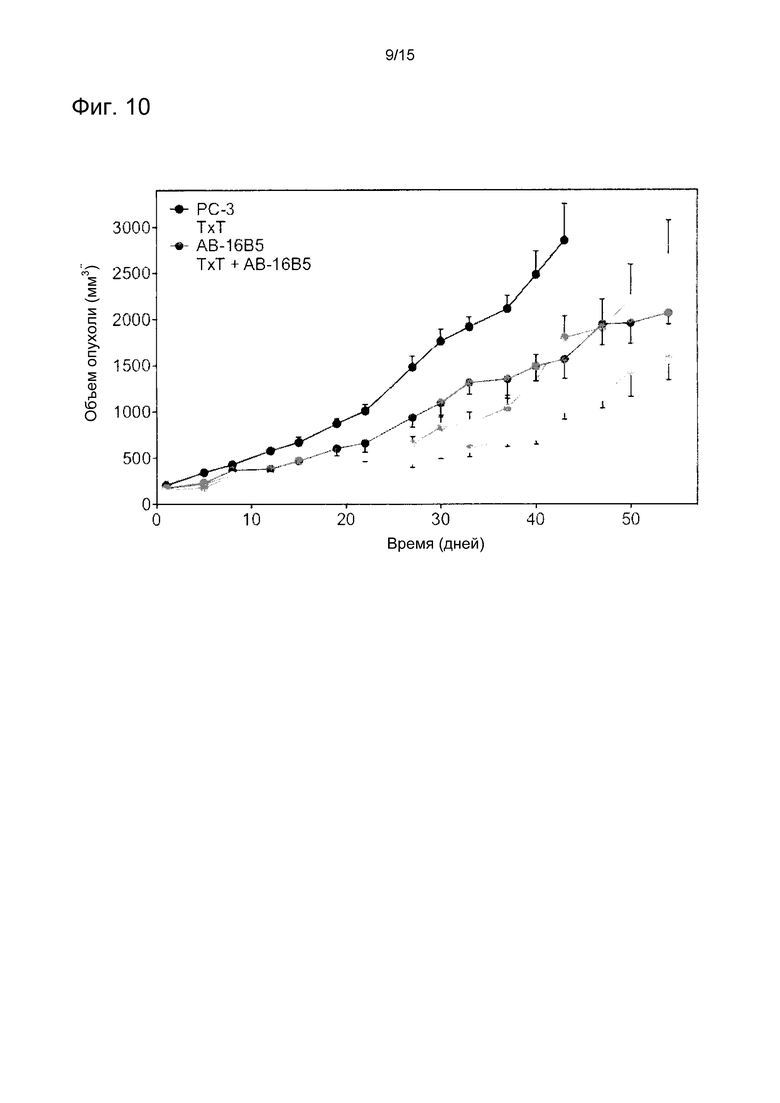






Данное изобретение относится к иммунологии. Предложено антитело, связывающее кластерин, и его антигенсвязывающий фрагмент. Описаны нуклеиновые кислоты, кодирующие вариабельные области антитела, экспрессионный вектор; клетка; набор и способ получения антитела или его антигенсвязывающего фрагмента. Также описана фармацевтическая композиция для снижения роста злокачественной клетки или снижения объема опухолевых клеток; комбинация для лечения рака, содержащая фармацевтическую композицию и химиотерапевтическое средство; способ снижения роста злокачественной клетки или снижения объема опухолевых клеток; способ лечения карциномы; набор для применения в лечении или детектировании злокачественной опухоли; применение антитела или его антигенсвязывающего фрагмента для уменьшения объема опухоли. Антитело по настоящему изобретению является гуманизированной формой мышиного антитела 16B5 и обладает примерно равной с ним аффинностью связывания с кластерином. Данное изобретение может найти дальнейшее применение в терапии заболеваний, ассоциированных с кластерином. 14 н. и 14 з.п. ф-лы, 16 ил., 1 табл., 6 пр.
1. Изолированное антитело или его антигенсвязывающий фрагмент, включающие вариабельную область легкой цепи, как указано в SEQ ID NO: 8, и вариабельную область тяжелой цепи, как указано в SEQ ID NO: 7, где указанное антитело или его антигенсвязывающий фрагмент связывают кластерин.
2. Изолированное антитело или его антигенсвязывающий фрагмент по п.1, где указанное антитело содержит аминокислоты константной области.
3. Изолированное антитело или его антигенсвязывающий фрагмент по п.2, где указанные аминокислоты константной области взяты из антитела человека.
4. Изолированное антитело или его антигенсвязывающий фрагмент по п.1, содержащие константную область IgG2 человека.
5. Изолированное антитело или его антигенсвязывающий фрагмент по п.1, где указанный антигенсвязывающий фрагмент представляет собой scFv, Fab, Fab' или (Fab')2.
6. Изолированное антитело или его антигенсвязывающий фрагмент по п.1, конъюгированные с цитотоксической частью или с поддающейся детекции частью.
7. Изолированное антитело или его антигенсвязывающий фрагмент по любому из пп.1-6, где антитело включает легкую цепь, указанную в SEQ ID NO: 10, и тяжелую цепь, указанную в SEQ ID NO: 9.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-6 для применения в лечении или детектировании злокачественной опухоли, содержащей опухолевые клетки, экспрессирующие кластерин или вариант кластерина, или для предотвращения или лечения метастазов.
9. Изолированная нуклеиновая кислота, кодирующая
(a) вариабельную область легкой цепи, как указано в SEQ ID NO: 8; или
(b) вариабельную область легкой цепи, как указано в SEQ ID NO: 10.
10. Изолированная нуклеиновая кислота по п.9, где последовательность указанной нуклеиновой кислоты указана в SEQ ID NO: 23.
11. Изолированная нуклеиновая кислота, кодирующая
(a) вариабельную область тяжелой цепи, как указано в SEQ ID NO: 7; или
(b) вариабельную область тяжелой цепи, как указано в SEQ ID NO: 9.
12. Изолированная нуклеиновая кислота по п.11, где последовательность указанной нуклеиновой кислоты указана в SEQ ID NO: 21.
13. Изолированная нуклеиновая кислота, кодирующая
(a) вариабельную область легкой цепи, как указано в SEQ ID NO: 8, и вариабельную область тяжелой цепи, как указано в SEQ ID NO: 7; или
(b) вариабельную область легкой цепи, как указано в SEQ ID NO: 10, и вариабельную область тяжелой цепи, как указано в SEQ ID NO: 9.
14. Изолированная нуклеиновая кислота по п.13, где указанная нуклеиновая кислота содержит последовательность, указанную в SEQ ID NO: 23, и последовательность, указанную в SEQ ID NO: 21.
15. Экспрессионный вектор, содержащий нуклеиновую кислоту по любому из пп.9-14.
16. Выделенная клетка для экспрессии антитела или его антигенсвязывающего фрагмента по любому из пп.1-7, содержащая: (i) нуклеиновые кислоты по любому из пп.9-14, кодирующие тяжелую и легкую цепи антитела или кодирующие вариабельные области тяжелой и легкой цепей антитела; или (ii) векторы по п.15, включающие нуклеиновые кислоты из (i).
17. Фармацевтическая композиция для снижения роста злокачественной клетки, экспрессирующей кластерин, или снижения объема опухолевых клеток, секретирующих или экспрессирующих кластерин, содержащая терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента и фармацевтически приемлемый носитель, где указанное антитело или его антигенсвязывающий фрагмент включают вариабельную область легкой цепи, как указано в SEQ ID NO: 8, и вариабельную область тяжелой цепи, как указано в SEQ ID NO: 7, где указанные антитело или его антигенсвязывающий фрагмент связывают кластерин.
18. Фармацевтическая композиция по п.17, где указанное антитело или его антигенсвязывающий фрагмент включают легкую цепь, указанную в SEQ ID NO: 10, и тяжелую цепь, указанную в SEQ ID NO: 9.
19. Комбинация для лечения рака, содержащая фармацевтическую композицию по п.17 или 18 и химиотерапевтическое средство.
20. Комбинация по п.19, где указанное химиотерапевтическое средство содержит таксан.
21. Способ снижения роста злокачественной клетки, экспрессирующей кластерин, или снижения объема опухолевых клеток, секретирующих или экспрессирующих кластерин, причем способ включает введение антитела или его антигенсвязывающего фрагмента по любому из пп.1-7 млекопитающему, нуждающемуся в этом.
22. Способ лечения карциномы, причем способ включает введение антитела или его антигенсвязывающего фрагмента по любому из пп.1-7 млекопитающему, нуждающемуся в этом.
23. Способ по п.21 или 22, дополнительно включающий введение химиотерапевтического средства.
24. Набор для применения в лечении или детектировании злокачественной опухоли, содержащей опухолевые клетки, экспрессирующие кластерин или вариант кластерина, или для предотвращения или лечения метастазов, содержащий флакон или флаконы, содержащие антитело или его антигенсвязывающий фрагмент по любому из пп.1-7 или фармацевтическую композицию по п.17 или 18.
25. Набор для получения анти-кластеринового антитела или его антигенсвязывающего фрагмента, содержащий флакон или флаконы, содержащие: (i) нуклеиновые кислоты по любому из пп.9-14, кодирующие тяжелую и легкую цепи антитела или кодирующие вариабельные области тяжелой и легкой цепей антитела; или (ii) векторы по п.15, включающие нуклеиновые кислоты из (i).
26. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-7 для уменьшения объема опухоли, содержащей клетки, экспрессирующие или секретирующие кластерин.
27. Способ получения анти-кластеринового антитела или его антигенсвязывающего фрагмента, включающий экспрессирование (а) вариабельной области легкой цепи, указанной в SEQ ID NO: 8, и (b) вариабельной области тяжелой цепи, указанной в SEQ ID NO: 7.
28. Способ по п.27, где указанные антитело или его антигенсвязывающий фрагмент содержат (а) легкую цепь, указанную в SEQ ID NO: 10, и (b) тяжелую цепь, указанную в SEQ ID NO: 9.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| SAFFER H | |||
| et al | |||
| Способ нагрева эквипотенциального катода в электронных вакуумных реле | 1921 |
|
SU266A1 |
| LENFERINK A.E.G | |||
| et al., "Transcriptome profiling of a TGF-β-induced epithelial-to-mesenchymal transition reveals extracellular clusterin as a target for therapeutic antibodies", Oncogene, 2010, published online 23.11.2009, 29(6), 831-844 | |||
| CHOWDHURY PS, VASMATZIS G | |||
| "Engineering scFvs for improved stability" | |||
| Methods Mol Biol, 2003; 207, стр.241-247 | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| МОИСЕЕНКО В.М | |||
| "Моноклональные антитела в лечении злокачественных опухолей", Практическая онкология, 2003, Т | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2017-08-03—Публикация
2010-11-24—Подача