Область техники, К КОТОРОЙ ОТНОСИТСЯ изобретениЕ
Настоящее изобретение относится к гуманизированным антителам против SIRPα и использованию этих антител в лечении рака, необязательно, в сочетании с противораковыми терапевтическими средствами.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
С конца 1990-х годов терапевтические антитела, которые узнают антигены на опухолевых клетках, доступны для лечения рака. Эти терапевтические антитела могут действовать против злокачественных клеток разными способами. Сигнальные пути, инициируемые связыванием антитела с его мишенью на злокачественных клетках, приводят к ингибированию клеточной пролиферации или к апоптозу. Fc-область терапевтического антитела может инициировать комплементзависимую цитотоксичность (CDC), антителозависимую клеточную цитотоксичность (ADCC) и/или антителозависимый клеточный фагоцитоз (ADCP). Другим возможным механизмом может быть зависимая от антитела индукция T-клеточного (CD8+ и/или CD4+) противоопухолевого ответа (антителозависимое представление антигена (ADAP); DiLillo and Ravetch Cell 2015, 161(5), 1035-1045; Bournazos and Ravetch Immunity 2017, 47(2), 224-233). Это происходит через Fc-рецепторы, экспрессируемые на антигенпредставляющих клетках, таких как, например, дендритные клетки. Однако терапевтические антитела часто недостаточно эффективны в виде монотерапии. Одна из возможностей повышения эффективности терапевтических антител связана с усилением ADCC и/или ADCP. Например, это было выполнено путем повышения аффинности Fc-области для Fcγ-рецепторов, например, за счет аминокислотных замен (Richards et al. Mol. Cancer Ther. 2008, 7(8), 2517-2527) или за счет изменения гликозилирования Fc-области (Hayes et al. J. Inflamm. Res. 2016, 9, 209-219).
Другим способом усиления ADCC и/или ADCP терапевтического антитела является объединение терапевтического антитела с антагонистическим антителом против сигнального регуляторного белка α (SIRPα) или анти-CD47 антителом (WO2009/131453). Когда CD47 - экспрессия которого, как установлено, повышена в, и/или на, человеческих опухолях по меньшей мере нескольких видов - связывается с ингибирующим иммунорецептором SIRPα, экспрессируемым на моноцитах, макрофагах, дендритных клетках и нейтрофилах, SIRPα передает ингибирующий сигнал, который предотвращает разрушение раковых клеток путем фагоцитоза или другого зависимого от Fc-рецептора механизма разрушения клеток, присущего иммунным эффекторным клеткам. Один из механизмов, посредством которого анти-CD47 или анти-SIRPα антитела предположительно действуют, включает блокирование ингибирующей сигнализации, создаваемой по оси CD47-SIRPα, что приводит к усилению ADCC и/или ADCP, и/или ADAP (Tjeng et al. Proc Natl Acad Sci USA 2013, 110(27), 11103-11108; Liu et al. Nature Med. 2015, 21(10), 1209-1215).
Большинство клинических исследований, относящихся к взаимодействию CD47-SIRPα, были сосредоточены на анти-CD47 антителах в качестве как монотерапии, так и терапии в сочетании с терапевтическим антителом (Weiskopf. Eur. J. Cancer 2017, 76, 100-109; Advani et al. N. Engl. J. Med. 2018, 379(18), 1711-1721). Количество исследований, посвященных анти-CD47 антителам в качестве противораковых лекарственных средств, растет, несмотря на тот факт, что CD47 широко экспрессируется на поверхности клеток в большинстве нормальных тканей.
Ни одно клиническое исследование не было посвящено противораковой монотерапии или комбинированной терапии с использованием анти-SIRPα антител. Большинство исследований анти-SIRPα антител представляют собой механистические исследования взаимодействия CD47-SIRPα и были проведены с использованием мышиных анти-SIRPα антител; например, мышиные 12C4 и 1.23A, по сообщениям, приводят к усилению опосредованной нейтрофилами ADCC трастузумаб-опсонизированных клеток SKBR3 (Zhao et al. PNAS 2011, 108(45), 18342-18347). В WO2015/138600 описано мышиное антитело против человеческого SIRPα KWAR23 и его химерный Fab-фрагмент, которые, как сообщалось, приводят к усилению опосредованного цетуксимабом фагоцитоза in vitro. Гуманизированное KWAR23 с Fc-фрагментом человеческого IgG1, имеющим мутацию N297A, описано в WO2018/026600. В WO2013/056352 описано IgG4 29AM4-5 и другие IgG4 антитела против человеческого SIRPα. IgG4 29AM4-5, вводимое три раза в неделю в течение четырех недель в дозе 8 мг/кг, приводило к уменьшению лейкозного приживления первичных человеческих клеток острого миелоидного лейкоза (AML), введенных инъекций в правое бедро мышам NOD scid гамма (NSG). В WO2017/178653 описано химерное анти-SIRPα антитело HEFLB, которое связывает SIRPα1 и SIRPαBIT, но не SIRPγ. Однако, хотя антитело сохраняет связывание с SIRPαBIT при гуманизации, оно перестает связывать SIRPα1. Поскольку, например, 51,3% представителей белой европеоидной расы имеют по меньшей мере 1 аллель SIRPα1, их иммунные клетки (по меньшей мере частично в случае гетерозиготности) не реагируют на антитело, связывающее только SIRPαBIT (Treffers et al. Eur J Immunol. 2018, 48(2), 344-354). В WO2018/057669 описаны гуманизированные куриные анти-SIRPα антитела против домена 1 человеческого SIRPα1 и/или человеческого SIRPαBIT. В WO2018/107058 описано, что мышиные анти-SIRPα антитела 3F9 и 9C2 не связывают SIRPβ1v1, и сделан вывод о том, что, следовательно, эти антитела являются SIRPα-специфическими, с равновесными константами связывания 1,0×10-8 и 8,0×10-8 M, соответственно. В WO2018/190719 описаны гуманизированные анти-SIRPα антитела, которые также связывают человеческий SIRPγ, но не связывают человеческий SIRPβ1.
Человеческий SIRPα является в высокой степени полиморфным в его NH2-концевом лиганд-связывающем домене (Takenaka et al. Nature Immun. 2007, 8(12), 1313-1323): SIRPαBIT (v1) и SIRPα1 (v2) являются двумя наиболее распространенными и наиболее различающимися (различаются 13 остатков) полиморфными формами, и показатели их аффинности для CD47 являются очень схожими (Hatherley et al. J. Biol. Chem. 2014, 289(14), 10024-10028; Treffers et al. Eur J Immunol. 2018, 48(2), 344-354). Другими биохимически охарактеризованными представителями семейства человеческого SIRP являются SIRPβ1, который не связывает CD47 и имеет по меньшей мере два полиморфных варианта (SIRPβ1v1 и SIRPβ1v2), и SIRPγ, который экспрессируется на T-клетках и активированных NK-клетках и связывает CD47 с примерно в 10 раз более низкой аффинностью, чем SIRPα (van Beek et al. J Immunol. 2005, 175(12), 7781-7). Взаимодействие CD47-SIRPγ вовлечено в контакт между антигенпредставляющими клетками и T-клетками, соответственно, с костимуляцией T-клеточной активации и стимуляцией T-клеточной пролиферации (Piccio et al. Blood 2005, 105, 2421-2427). Кроме того, взаимодействия CD47-SIRPγ играют определенную роль в трансэндотелиальной миграции T-клеток (Stefanidakis et al. Blood 2008, 112, 1280-1289).
Недостатком анти-SIRPα антител, известных в данной области, является то, что они либо (i) не специфичны для человеческого SIRPα, поскольку они связываются с другими представителями семейства человеческого SIRP, такими как человеческий SIRPγ, что может приводить к нежелательным побочным эффектам, либо (ii) они слишком ограничены в своей специфичности, связывая лишь один из аллельных вариантов SIRPα - например, SIRPαBIT или SIRPα1 - что делает их менее подходящими для моно- или комбинированной терапии, поскольку часть популяции людей имеет аллельный вариант SIRPα, который анти-SIRPα антитело не связывает. Например, антитела предшествующего уровня техники KWAR23, SE5A5, 29AM4-5 и 12C4 являются неспецифическими, поскольку они также связывают человеческий SIRPγ, что может отрицательно влиять на T-клеточную пролиферацию и рекрутинг. И наоборот, мАт 1.23A, например, является слишком специфическим и узнает только полиморфный вариант SIRPα1 человеческого SIRPα, но не вариант SIRPαBIT, который является преобладающим по меньшей мере в популяции людей белой европеоидной расы (Zhao et al. PNAS 2011, 108(45), 18342-18347; Treffers et al. Eur J Immunol. 2018, 48(2), 344-354). Кроме того, гуманизированное антитело HEFLB, описанное в WO2017/178653, является слишком специфическим, поскольку данное антитело не связывает SIRPα1 (измерения методом ППР; смотри раздел «Примеры») и не стимулирует противоопухолевую активность иммунных эффекторных клеток от носителей SIRPα1, даже в случае присутствия одного аллеля SIRPαBIT (Фигура 3).
Только в опубликованном позже WO2018/210793 описано несколько антагонистических химерных анти-SIRPα антител, которые демонстрируют специфическое связывание с двумя преобладающими полиморфными вариантами SIRPα, SIRPαBIT и SIRPα1, которые не связывают SIRPγ и которые приводят к усилению ADCC терапевтических антител (антитела 2-9). В Таблице 1 в WO2018/210793 приведены гуманизированные варианты для двух из химерных антител (антитела 10-16).
В заключение, в данной области все-еще сохраняется потребность в новых и усовершенствованных анти-SIRPα антителах, которые полезны в противораковой терапии, либо отдельно, либо в сочетании с дополнительным терапевтическим противораковым антителом. Более конкретно, сохраняется потребность в антагонистических анти-SIRPα антителах, которые не имеют, имеют низкое или пониженное связывание с человеческим SIRPγ, что уменьшает риск нежелательных побочных эффектов, и в анти-SIRPα антителах, которые связывают как человеческий SIRPα1, так и человеческий SIRPαBIT, полиморфные варианты, что делает их подходящими для большой части популяции людей, которые имеют гетерозиготы SIRPα1/SIRPαBIT, гомозиготы SIRPαBIT и гомозиготы SIRPα1. Существует потребность в анти-SIRPα антителах с такими характеристиками, которые также уменьшают ингибирующую, то есть, SHP-1 и/или SHP-2-опосредованную сигнализацию SIRPα. Такие антитела подходят для использования в противораковой терапии, либо отдельно, либо, предпочтительно, в сочетании с терапевтическим противораковым антителом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к гуманизированным антителам против SIRPα, которые подходят для использования в противораковой терапии отдельно или, предпочтительно, в сочетании с таким видом противораковой терапии, как терапевтическое противораковое антитело.
В первом аспекте настоящее изобретение относится к гуманизированному анти-SIRPα антителу, или его антигенсвязывающему фрагменту, содержащему определяющие комплементарность области тяжелой цепи (HCDR) и определяющие комплементарность области легкой цепи (LCDR) HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, где антитело, или его антигенсвязывающий фрагмент, содержит:
a. HCDR1, содержащую SEQ ID NO:36;
b. HCDR2, содержащую SEQ ID NO:44;
c. HCDR3, содержащую SEQ ID NO:45;
d. LCDR1, содержащую SEQ ID NO:39;
e. LCDR2, содержащую SEQ ID NO:40; и
f. LCDR3, содержащую SEQ ID NO:41.
В предпочтительном варианте осуществления анти-SIRPα антитело, или его антигенсвязывающий фрагмент, имеет одно или более свойств из группы, состоящей из следующего: (a) анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPα1 с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно по меньшей мере 10-11 M, в анализе поверхностного плазмонного резонанса (ППР) (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPα1, приведенного в SEQ ID NO:51; (b) анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPαBIT с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно по меньшей мере 10-11 M, в анализе ППР (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPαBIT, приведенного в SEQ ID NO:52; (c) анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает SIRPα яванского макака с аффинностью связывания, составляющей по меньшей мере 10-8 M, предпочтительно по меньшей мере 10-9 M, в анализе ППР (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена SIRPα яванского макака, приведенного в SEQ ID NO:56; (d) анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не связывает человеческий SIRPγ при измерении методом T-клеточного связывания с использованием проточной цитометрии, предпочтительно с использованием окрашивания и активированной флуоресценцией сортировки клеток (FACS); (e) анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не связывает человеческий SIRPγ в анализе ППР (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPγ, приведенного в SEQ ID NO:55; и (f) анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не является иммуногенным при определении IL-2 методом иммуноферментных пятен (ELISpot) и/или в анализе T-клеточной пролиферации.
В предпочтительном варианте осуществления гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент: (a) связывает человеческий SIRPα1 с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно по меньшей мере 10-11 M, в анализе ППР (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPα1, приведенного в SEQ ID NO:51; (b) связывает человеческий SIRPαBIT с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно по меньшей мере 10-11 M, в анализе ППР (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPαBIT, приведенного в SEQ ID NO:52; (c) блокирует связывание CD47 с SIRPα1 и SIRPαBIT, предпочтительно в анализе диссоциации от иммобилизованного CD47 методом ППР (предпочтительно BiaCore™), более предпочтительно как описано в Примере 6; и (d) не связывает человеческий SIRPγ при измерении в анализе окрашивания и проточной цитометрии T-клеток, предпочтительно при окрашивании с активированной флуоресценцией сортировкой клеток (FACS).
В предпочтительном варианте осуществления изобретение относится к гуманизированному анти-SIRPα антителу, или его антигенсвязывающему фрагменту, в котором: (a) вариабельный домен тяжелой цепи антитела содержит 4 каркасные области тяжелой цепи, HFR1-HFR4, и 3 определяющие комплементарность области HCDR1-HCDR3, которые функционально связаны в следующем порядке HFR1-HCDR1-HFR2-HCDR2-HFR3-HCDR3-HFR4, где каждая из каркасных областей тяжелой цепи имеет по меньшей мере 90% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:8, или где HFR1-HFR4 отличаются от SEQ ID NO:8 одной или более аминокислотными заменами, как указано в Таблицах 8-11; и (b) вариабельный домен легкой цепи антитела содержит 4 каркасные области легкой цепи, LFR1-LFR4, и 3 определяющие комплементарность области LCDR1-LCDR3, которые функционально связаны в следующем порядке LFR1-LCDR1-LFR2-LCDR2-LFR3-LCDR3-LFR4, где каждая из каркасных областей легкой цепи имеет по меньшей мере 90% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:9, или где LFR1, LFR2 и/или LFR4 отличаются от SEQ ID NO:9 одной или более аминокислотными заменами, как указано в Таблицах 12-14.
В предпочтительном варианте осуществления гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению, содержит аминокислотную последовательность вариабельной области тяжелой цепи (HCVR) и вариабельной области легкой цепи (LCVR), где анти-SIRPα антитело, или его антигенсвязывающий фрагмент, содержит аминокислотную последовательность HCVR SEQ ID NO:8 и аминокислотную последовательность LCVR SEQ ID NO:9.
В предпочтительном варианте осуществления гуманизированное анти-SIRPα антитело по изобретению содержит модифицированную Fc-область, которая проявляет пониженное связывание с человеческим Fcα или Fcγ-рецептором в сравнении с таким же анти-SIRPα антителом, содержащим Fc-область дикого типа, предпочтительно, с понижением по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80, 90%, или понижением на 100%. В предпочтительном варианте осуществления модифицированная Fc-область человеческого IgG1 имеет аминокислотную замену в одном или более положениях, выбранных из группы, состоящей из L234, L235, G237, D265, D270, N297, A327, P328 и P329 в соответствии с нумерацией Eu. Более предпочтительно, модифицированная Fc-область человеческого IgG1 имеет аминокислотные замены: L234A и L235A; L234E и L235A; L234A, L235A и P329A; или L234A, L235A и P329G. Более предпочтительно, антитело имеет аминокислотные замены L234A и L235A или L234E и L235A. Наиболее предпочтительно, антитело имеет аминокислотные замены L234A и L235A. В предпочтительном варианте осуществления Fc-область человеческого IgG не имеет другие аминокислотные замены.
Во втором аспекте настоящее изобретение относится к фармацевтической композиции, содержащей гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению и фармацевтически приемлемый эксципиент.
В третьем аспекте настоящее изобретение относится к гуманизированному анти-SIRPα антителу, или его антигенсвязывающему фрагменту, по изобретению или фармацевтической композиции по изобретению для использования в качестве лекарственного препарата.
В четвертом аспекте настоящее изобретение относится к гуманизированному анти-SIRPα антителу, или его антигенсвязывающему фрагменту, по изобретению или фармацевтической композиции по изобретению для использования в лечении рака, где лечение также включает введение терапевтического антитела, где рак предпочтительно представляет собой солидную опухоль или гематологическое злокачественное новообразование человека. Предпочтительно, терапевтическое антитело направлено против связанной с мембраной мишени на поверхности опухолевых клеток и содержит человеческую Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках.
В предпочтительном варианте осуществления солидную опухоль человека выбирают из группы, состоящей из (HER2-положительного) рака молочной железы, (EGFR-положительной) карциномы толстой кишки, (GD2-положительной) нейробластомы, меланомы, остеосаркомы, (CD20-положительных) B-клеточных лимфом, (CD38-положительной) множественной миеломы, (CD52-положительной) лимфомы, (CD33-положительного) острого миелоидного лейкоза (AML), хронического миелоидного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), острого лимфобластного лейкоза (ALL), неходжскинской лимфомы (NHL), включая фолликулярную лимфому (FL) и диффузную крупноклеточную B-клеточную лимфому (DLBCL), печеночно-клеточной карциномы, множественной миеломы (MM), рака мочевого пузыря, рака желудка, рака яичника, рака головы и шеи, рака поджелудочной железы, почечной карциномы, рака предстательной железы, печеночно-клеточной карциномы и рака легкого. В предпочтительном варианте лечение включает введение дополнительного противоракового терапевтического средства, такого как, например, направленное терапевтическое средство, предпочтительно иммунотерапевтическое средство.
В пятом аспекте настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению, где, предпочтительно, молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую по меньшей мере одну из HCVR и LCVR антитела, и где, предпочтительно, кодирующая нуклеотидная последовательность функционально связана с регуляторными последовательностями для экспрессии кодирующей нуклеотидной последовательности в клетке-хозяине.
В шестом аспекте настоящее изобретение относится к клетке-хозяину, содержащей молекулу нуклеиновой кислоты по изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Связывание антител с экспрессирующими SIRPγ человеческими CD3+ T-клетками методом проточной цитометрии. Данные представлены в виде средней интенсивности флуоресценции (СИФ) (Фигура 1a) и процентного содержания (%) положительных клеток (Фигура 1b). Символы представляют результаты измерения для двух здоровых индивидуумов.
Фигура 2. Сравнение ADCC, измеренной в % цитотоксичности только трастузумаба (Tmab), трастузумаба в сочетании с мышиным анти-SIRPα антителом 12C4 (mu12C4), трастузумаба в сочетании с антителом, в котором вариабельные области мышиного 12C4 привиты на константную область человеческого IgG1 (12C4huIgG1), и трастузумаба в сочетании с антителом, в котором вариабельные области мышиного 12C4 привиты на константную область человеческого IgG1, имеющую аминокислотные замены L234A и L235A (12C4huIgG1LALA; в настоящем документе также обозначаемым 12C4-LALA), с использованием клеток SKBR3 HER2-положительного рака молочной железы в качестве клеток-мишеней и человеческих нейтрофилов в качестве эффекторных клеток. Нейтрофилы получали от людей-доноров, имеющих два аллеля SIRPαBIT. Использовали возрастающие концентрации трастузумаба: 0, 0,05, 0,5 и 5 мкг/мл, соответственно, а также возрастающие концентрации каждого анти-SIRPα антитела (0,2, 2 и 20 мкг/мл, соответственно).
Фигура 3. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (Tmab; 10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителами предшествующего уровня техники в разных концентрациях (мкг/мл; кривые доза-ответ). Нейтрофилы получали от гетерозиготных доноров-людей, имеющих один аллель SIRPα1 и один аллель SIRPαBIT. Каждый отдельный донор нейтрофилов обозначен символом. Колонки представляют собой средние значения для всех доноров. В качестве контролей использовали необработанные клетки и клетки, обработанные 10 мкг/мл раствором трастузумаба. Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили с нейтрофилами, стимулированными O/N с G-CSF и IFNγ. Цитотоксичность измеряли в анализе цитотоксичности DELFIA.
Фигура 4. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (Tmab; 10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителами 1-6 по изобретению, имеющими константную область человеческого IgG1, имеющую аминокислотные замены L234A и L235A, в разных концентрациях (мкг/мл; кривые доза-ответ). Нейтрофилы получали от людей-доноров, имеющих один аллель SIRPα1 и один аллель SIRPαBIT. Каждый отдельный донор нейтрофилов обозначен символом. Колонки представляют собой средние значения для всех доноров. В качестве контролей использовали необработанные клетки и клетки, обработанные 10 мкг/мл раствором трастузумаба. Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили с нейтрофилами, стимулированными O/N с G-CSF и IFNγ. Цитотоксичность измеряли в анализе цитотоксичности DELFIA.
Фигура 5. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (Tmab; 10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителами 7-13 по изобретению, имеющими константную область человеческого IgG1, имеющую аминокислотные замены L234A и L235A, в разных концентрациях (мкг/мл; кривые доза-ответ). Нейтрофилы получали от людей-доноров, имеющих один аллель SIRPα1 и один аллель SIRPαBIT. Каждый отдельный донор нейтрофилов обозначен символом. Колонки представляют собой средние значения для всех доноров. Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили с нейтрофилами, стимулированными O/N с G-CSF и IFNγ. Цитотоксичность измеряли в анализе цитотоксичности DELFIA.
Фигура 6. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (Tmab; 10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителами предшествующего уровня техники в разных концентрациях (мкг/мл; кривые доза-ответ). Нейтрофилы получали от людей-доноров, имеющих два аллеля SIRPα1. Каждый отдельный донор нейтрофилов обозначен символом. Колонки представляют собой средние значения для всех доноров. В качестве контролей использовали необработанные клетки и клетки, обработанные 10 мкг/мл раствором трастузумаба. Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили с нейтрофилами, стимулированными в течение 100 мин GM-CSF, и цитотоксичность измеряли в анализе высвобождения 51Cr.
Фигура 7. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (Tmab; 10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителами 7-13 по изобретению, имеющими константную область человеческого IgG1, имеющую аминокислотные замены L234A и L235A, в разных концентрациях (мкг/мл; кривые доза-ответ). Нейтрофилы получали от людей-доноров, имеющих два аллеля SIRPα1. Каждый отдельный донор нейтрофилов обозначен символом. Колонки представляют собой средние значения для всех доноров. В качестве контролей использовали необработанные клетки и клетки, обработанные 10 мкг/мл раствором трастузумаба. Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили с нейтрофилами, стимулированными в течение 100 мин GM-CSF, и цитотоксичность измеряли в анализе высвобождения 51Cr.
Фигура 8. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (Tmab; 10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителами предшествующего уровня техники в разных концентрациях (мкг/мл; кривые доза-ответ). Нейтрофилы получали от людей-доноров, имеющих два аллеля SIRPαBIT. Каждый отдельный донор нейтрофилов обозначен символом. Колонки представляют собой средние значения для всех доноров. В качестве контролей использовали необработанные клетки и клетки, обработанные 10 мкг/мл раствором трастузумаба. Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили с нейтрофилами, стимулированными в течение 100 мин GM-CSF, и цитотоксичность измеряли в анализе высвобождения 51Cr.
Фигура 9. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (Tmab; 10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителами 1-6 по изобретению, имеющими константную область человеческого IgG1, имеющую аминокислотные замены L234A и L235A, в разных концентрациях (мкг/мл; кривые доза-ответ). Нейтрофилы получали от людей-доноров, имеющих два аллеля SIRPαBIT. Каждый отдельный донор нейтрофилов обозначен символом. Колонки представляют собой средние значения для всех доноров. В качестве контролей использовали необработанные клетки и клетки, обработанные 10 мкг/мл раствором трастузумаба. Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили с нейтрофилами, стимулированными в течение 100 мин GM-CSF, и цитотоксичность измеряли в анализе высвобождения 51Cr.
Фигура 10a-d. Связывание указанных анти-SIRPα антител с гранулоцитами (левые панели), CD14+ моноцитами (средние панели) и CD3+ T-клетками (правые панели) при определении методом проточной цитометрии в цельной крови репрезентативного здорового гетерозиготного SIRPα1/SIRPαBIT донора. Соответствующий контроль по изотипу для каждого анти-SIRPα антитела приведен в каждой графе. Данные представлены в виде средней интенсивности флуоресценции (СИФ).
Фигура 11. Связывание указанных анти-SIRPα антител с экспрессирующими SIRPγ человеческими CD3+ T-клетками, выделенными из лейкоцитарных пленок здорового донора, при определении методом проточной цитометрии. Соответствующий контроль по изотипу для каждого анти-SIRPα антитела приведен в каждой графе. Данные представлены в виде средней интенсивности флуоресценции (СИФ).
Фигура 12a. Рекрутинг SHP-1 к SIRPα, измеренный в виде относительных единиц люминесценции (ОЕЛ), с использованием клеток Jurkat с сигнализацией SIRPαBIT и клеток Jurkat E6.1 в качестве клеток с лигандом CD47, в отсутствие или в присутствии антитела 6 в диапазоне концентраций или контроля по изотипу. % максимального сигнала определяли следующим образом: (ОЕЛ/ОЕЛ максимальной стимуляции (без антитела) * 100). Результаты представлены в виде средних значений±SEM из двух независимых экспериментов.
Фигура 12b. Уровни эффективности указанных анти-SIRPα антител в концентрации 3,3 мкг/мл при ингибировании сигнализации SIRPαBIT, измеренные с использованием клеток Jurkat с сигнализацией SIRPαBIT и клеток Jurkat E6.1 в качестве клеток с лигандом CD47. Уровни эффективности рассчитывали следующим образом: 100% - значение «% максимального сигнала» соединения в концентрации 3,3 мкг/мл. Результаты представлены в виде средних значений±SEM из двух независимых экспериментов.
Фигура 13a-b. Опосредованная нейтрофилами ADCC в отношении трастузумаб-опсонизированных (10 мкг/мл) клеток SKBR3 в сочетании с анти-SIRPα антителом 6 по изобретению и указанными контрольными антителами. Нейтрофилы получали от людей-доноров, имеющих два аллеля SIRPαBIT, имеющих два аллеля SIRPα1 или имеющих один аллель SIRPαBIT и один аллель SIRPα1. Колонки представляют собой средние значения для всех доноров±SEM. В качестве контролей использовали необработанные клетки и клетки, обработанные 10 мкг/мл раствором трастузумаба. Для каждого антитела строили кривые доза-ответ, используя концентрации 10, 1, 0,1 и 0,01 мкг/мл (слева направо). Антитело 6 и контрольные антитела показаны на панели (a); контроли по изотипу показаны на панели (b). Данные нормализованы к ответу на трастузумаб (принятому за 100%). Эксперимент проводили, как указано в экспериментальном разделе 10.
Фигура 14a-b. Опосредованная нейтрофилами ADCC в отношении цетуксимаб-опсонизированных (5 мкг/мл) клеток A431 в сочетании с анти-SIRPα антителом 6 по изобретению и указанными контрольными антителами. Нейтрофилы получали от людей-доноров, имеющих два аллеля SIRPαBIT, имеющих два аллеля SIRPα1 или имеющих один аллель SIRPαBIT и один аллель SIRPα1. Колонки представляют собой средние значения для всех доноров. В качестве контролей использовали необработанные клетки и клетки, обработанные 5 мкг/мл раствором цетуксимаба. Для каждого антитела строили кривые доза-ответ, используя концентрации 10, 1, 0,1 и 0,01 мкг/мл (слева направо). Антитело 6 и контрольные антитела показаны на панели (a); контроли по изотипу показаны на панели (b). Данные нормализованы к ответу на цетуксимаб (принятому за 100%). Эксперимент проводили, как указано в экспериментальном разделе 10.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Используемый в настоящей спецификации термин «антитело» относится к моноклональному антителу (мАт), содержащему две тяжелые цепи и две легкие цепи. Антитела могут иметь любой изотип, например, IgA, IgE, IgG или IgM антитела. Антитела также могут иметь перекрестный изотип IgGA (Kelton et al. Chemistry and Biology, 2014, 21, 1603-1609). Предпочтительно, антитело представляет собой IgG антитело, например, IgG1, IgG2, IgG3 или IgG4 антитело, более предпочтительно IgG1 или IgG2 антитело. В настоящем документе термин «иммуноглобулин» (Ig) используют взаимозаменяемо с термином «антитело». Антитело по изобретению предпочтительно представляет собой гуманизированное или человеческое антитело.
Базовое 4-цепочечное антитело представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей (IgM антитело состоит из 5 базовых гетеротетрамерных единиц наряду с дополнительным полипептидом, называемым J-цепью, и, таким образом, имеет 10 антигенсвязывающих сайтов, в то время как секретируемые IgA антитела могут полимеризоваться, с образованием поливалентных структур, содержащих 2-5 базовых 4-цепочечных единиц наряду с J-цепью). В случае IgG 4-цепочечная единица, как правило, имеет молекулярную массу примерно 150000 Дальтон. Каждая L-цепь связана с H-цепью одной ковалентной дисульфидной связью, где две H-цепи связаны друг с другом одной или более дисульфидными связями в зависимости от изотипа H-цепи. Однако IgG могут быть лишены одной или более из дисульфидных связей, сохраняя где свою функцию. Каждая H и L-цепь также имеет регулярно разнесенные в пространстве внутрицепочечные дисульфидные связи. Каждая H-цепь имеет N-конец, вариабельный домен (VH), за которым следуют три константных домена (CH) для каждой из α и γ-цепей, и четыре CH-домена для изотипов µ и ε. Как правило, H-цепь содержит шарнирную область, как правило, между первой и второй константными областями. Каждая L-цепь имеет N-конец, вариабельный домен (VL), за которым следует константный домен (CL) на другом ее конце. VL выровнена с VH, и CL выровнена с первым константным доменом тяжелой цепи (CH1). Считается, что конкретные аминокислотные остатки образуют поверхность раздела между вариабельными доменами L-цепи и H-цепи. При спаривании VH и VL образуется один антигенсвязывающий сайт. Для информации о структуре и свойствах разных классов антител, смотри, например, Basic and Clinical Immunology, 8-е издание, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, page 71 and Chapter 6 (1994).
L-цепь у любого вида позвоночных животных может быть отнесена к одному из двух четко отличающихся видов, называемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (CH) иммуноглобулины могут быть отнесены к разным классам или изотипам. Существуют пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющих тяжелые цепи, обозначенные α, δ, ε, γ и µ, соответственно. Классы α и γ дополнительно разделены на подклассы на основании относительно незначительных различий в последовательности и функции CH, например, у человека экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Предпочтительно, антитело по изобретению представляет собой гуманизированное или человеческое антитело. Даже более предпочтительно, антитело представляет собой гуманизированное или человеческое IgG антитело, наиболее предпочтительно гуманизированное или человеческое IgG1 мАт. Антитело может иметь легкие цепи κ или λ, предпочтительно легкие цепи κ (например, приведенные в SEQ ID NO:26), то есть, гуманизированное или человеческое IgG1-κ антитело. Антитело по изобретению может содержать константную область, которая была генетически модифицирована, например, могли быть внесены одна или более мутаций, например, для увеличения периода полураспада и/или уменьшения эффекторной функции.
Используемые в настоящем документе термины «моноклональное антитело» и «мАт» относятся к антителу, полученному из популяции практически гомогенных антител, то есть, отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Определение «моноклональное» не означает, что антитело должно быть получено обязательно каким-либо конкретным методом. В данной области известно несколько методов получения моноклональных антител. Например, моноклональные антитела, используемые по настоящему изобретению, можно получать путем иммунизации животных смесью пептидов, представляющих нужный антиген. Затем B-лимфоциты можно выделять и проводить их слияние с клетками миеломы, или одиночные B-лимфоциты можно культивировать в течение нескольких дней в присутствии кондиционированной среды и питающих клеток. Супернатанты миеломы или B-лимфоцитов, содержащие продуцированные антитела, тестируют для отбора подходящих B-лимфоцитов или гибридом. Моноклональные антитела можно получать из соответствующих гибридом методом с использованием гибридом, впервые описанным Köhler et al. Nature 1975, 256, 495-497. Альтернативно, соответствующие B-клетки или лимфоциты можно лизировать, выделять РНК, проводить обратную транскрипцию и секвенировать. Антитела можно получать методами рекомбинантных ДНК в клетках бактерий, эукариотических клетках животных или клетках растений (смотри, например, патент США № 4816567).
Термин «вариабельная область», или «вариабельный домен», антитела относится к амино-концевым доменам тяжелой или легкой цепи антитела. Термин «вариабельные» отражает тот факт, что некоторые сегменты вариабельных доменов сильно отличаются по своей последовательности у разных антител. Вариабельный домен опосредует связывание антигена и определяет специфичность конкретного антитела для его конкретного антигена. Однако вариабельность не равномерно распределена на протяжении примерно 110 аминокислот вариабельных доменов. Вместо этого, вариабельные области состоят из относительно неизменных участков, называемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими областями с чрезвычайно сильной вариабельностью, называемыми «гипервариабельные области» (HVR) или «определяющие комплементарность области» (CDR), каждая из которых имеет длину примерно 9-12 аминокислот, однако может быть короче или длиннее, как, например, HCDR1 в мАт по настоящему изобретению, которая имеет длину 5 аминокислотных остатков. Каждый из вариабельных доменов тяжелой и легкой цепей природных антител содержит четыре FR, в значительной степени принимающие конфигурацию β-листа, соединенные тремя CDR, которые образуют петли, соединяющие, и в некоторых случаях образующие часть, структуры β-листа. Области CDR в каждой цепи удерживаются вместе в непосредственной близости за счет FR и, с CDR другой цепи, участвуют в образовании антигенсвязывающего сайта антител (смотри Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. 1991). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но осуществляют различные эффекторные функции, такие как участие антитела в ADCC и/или ADCP. Вариабельный домен тяжелой цепи можно называть «VH». Вариабельный домен легкой цепи можно называть «VL».
Используемый в настоящей спецификации термин «антигенсвязывающий фрагмент» включает Fab, Fab’, F(ab’)2, Fv, scFv и rIgG фрагменты при условии, что они проявляют нужную биологическую и/или иммунологическую активность. Термин «антигенсвязывающий фрагмент» также охватывает одноцепочечное (sc) антитело, однодоменное (sd) антитело, диатело или минитело. Например, при расщеплении антител папаином получают два идентичных антигенсвязывающих фрагмента, называемых «Fab»-фрагментами, и остаточный «Fc»-фрагмент, определение, отражающее способность с легкостью кристаллизоваться. Fab-фрагмент состоит из полной L-цепи наряду с доменом вариабельной области H-цепи (VH) и первым константным доменом одной тяжелой цепи (CH1). Каждый Fab-фрагмент является одновалентным в отношении связывания антигена, то есть, он имеет один антигенсвязывающий сайт. Обработка антитела пепсином приводит к получению одного большого F(ab’)2-фрагмента, который примерно соответствует двум связанным дисульфидными связями Fab-фрагментам, имеет двухвалентную антигенсвязывающую активность и все-еще способен перекрестно связывать антиген. Fab’-фрагменты отличаются от Fab-фрагментов наличием нескольких дополнительных остатков на C-конце домена CH1, включая один или более остатков цистеина из шарнирной области антитела. В настоящем документе Fab’-SH является обозначением для Fab’, в котором остаток(остатки) цистеина константных доменов несут свободную тиоловую группу. F(ab’)2-фрагменты антитела исходно были получены в виде пар Fab’-фрагментов, которые имеют между ними остатки цистеина шарнира. Также известны другие химические соединения фрагментов антитела. Fc-фрагмент содержит C-концевые части обеих H-цепей, удерживаемые вместе дисульфидными связями. Эффекторные функции антител определяются последовательностями в Fc-области, эта область также является фрагментом, узнаваемым Fc-рецепторами (FcR), находящимися на клетках некоторых типов. «Fv» представляет собой минимальный фрагмент антитела, который содержит полный сайт узнавания и связывания антигена. Этот фрагмент состоит из димера доменов вариабельной области одной тяжелой и одной легкой цепи в прочной нековалентной ассоциации. В одноцепочечных Fv (scFv) фрагментах один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны гибким пептидным линкером так, что тяжелая и легкая цепи могут связываться в «димерную» структуру, аналогичную структуре в двухцепочечных Fv-фрагментах. В результате сворачивания этих двух доменов возникают шесть гипервариабельных петель (3 петли из каждой из H и L-цепи), которые вносят аминокислотные остатки для связывания антигена и придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных для антигена) обладает способностью узнавать и связывать антиген, хотя и с более низкой аффинностью, чем целый сайт связывания. «Одноцепочечные Fv», также сокращенно называемые «sFv» или «scFv», представляют собой фрагменты антитела, которые содержат домены VH и VL антитела, связанные в одну полипептидную цепь. Предпочтительно, полипептид sFv также содержит полипептидный линкер между доменами VH и VL, который позволяет sFv образовывать структуру, необходимую для связывания антигена. Для обзора, посвященного sFv, смотри Pluckthun в: The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). «rIgG» означает восстановленный IgG, размером примерно 75000 Дальтон, и может быть получен путем избирательного восстановления только дисульфидных связей шарнирной области, например, с использованием мягкого восстанавливающего реагента, такого как 2-меркаптоэтиламин (2-MEA).
Термин «анти-SIRPα антитело», или «антитело, связывающее SIRPα», означает антитело, которое способно к связыванию SIRPα с достаточной аффинностью, так что антитело может быть использовано в качестве диагностического и/или терапевтического средства, направленного на SIRPα. Предпочтительно, степень связывания анти-SIRPα антитела с посторонним, не SIRP, белком составляет менее примерно 10% от связывания антитела с SIRPα при измерении, например, в радиоиммунном анализе (RIA), методом поверхностного плазмонного резонанса (ППР) или в твердофазном иммуноферментном анализе (ELISA). Связывание с посторонними мишенями также можно профилировать с использованием технологии клеточных микрочипов, такой как, например, Retrogenix™.
«Выделенное антитело» представляет собой антитело, которое было идентифицировано и отделено от, и/или извлечено из, компонента его естественного окружения. Примесные компоненты его естественного окружения представляют собой материалы, которые препятствовали бы терапевтическому использованию антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело будет очищено (1) до содержания более 95% по массе антитела при определении методом Лоури, и наиболее предпочтительно более 99% по массе, (2) до степени, достаточной для получения по меньшей мере остатков N-концевой или внутренней аминокислотной последовательности при использовании секвенатора с вращающимся стаканом, или (3) до гомогенности при SDS-ПААГ в восстанавливающих или не восстанавливающих условиях при окрашивании Кумасси голубым или, предпочтительно, при окрашивании серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент из естественного окружения антитела не будет присутствовать. Однако обычно выделенное антитело будет получено с использованием по меньшей мере одного этапа очистки.
«Аффинность связывания», как правило, означает силу общей суммы нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если нет иных указаний, используемый в настоящем документе термин «аффинность связывания» означает истинную аффинность связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). В настоящей спецификации аффинность связывания молекулы X для ее партнера Y означает равновесную константу диссоциации (также называемую «константой связывания»; KD) для конкретного взаимодействия антиген-антитело. KD представляет собой отношение скорости диссоциации (koff) к скорости ассоциации (kon). Следовательно, KD равна koff/kon, и ее выражают в виде молярной концентрации (M). Из этого следует, что чем меньше KD, тем сильнее аффинность связывания. Аффинность можно измерять обычными методами, известными в данной области, включая те, которые описаны в настоящем документе. Низкоаффинные антитела, как правило, связывают антиген медленно и легко диссоциируют, в то время как высокоаффинные антитела, как правило, связывают антиген быстрее и дольше остаются связанными. В данной области известны различные методы измерения аффинности связывания, любой из которых можно использовать для целей настоящего изобретения. Конкретные иллюстративные варианты осуществления описаны далее. Как правило, значения KD определяют методом поверхностного плазмонного резонанса (ППР), как правило, с использованием биосенсорной системы (например, BIAcore™) способами, известными в данной области (например, E.S. Day et al. Anal. Biochem. 2013, 440, 96-107), такими как, например, те, которые описаны в разделе «Примеры». Альтернативно, термин «аффинность связывания» также может означать концентрацию антитела, которая обеспечивает полумаксимальное связывание (EC50), ее определяют, например, в анализе ELISA или методом проточной цитометрии.
Антитело, «которое связывает» интересующий антиген или интересующие антигены, например, целевой антиген SIRPα, представляет собой антитело, которое связывает антиген с достаточной аффинностью, так что антитело может быть использовано в качестве терапевтического средства, направленного на клетку или ткань, экспрессирующую антиген(ы), и существенно не реагирует перекрестно с другими белками. Например, анти-SIRPα антитело по настоящему изобретению связывает человеческий SIRPα - то есть, по меньшей мере человеческий SIRPα1 и человеческий SIRPαBIT, предпочтительно, SIRPα яванского макака - и, возможно, SIRPβ1v1 и/или SIRPβ1v2, где оно не связывает SIRPγ или посторонние белки. В таких вариантах осуществления степень связывания антитела с «нецелевым» белком предпочтительно будет составлять менее примерно 10%, более предпочтительно менее примерно 5%, более предпочтительно менее примерно 2%, более предпочтительно менее примерно 1% от связывания антитела с его конкретным целевым белком, при определении в анализе активированной флуоресценцией сортировки клеток (FACS) или анализе радиоиммунопреципитации (RIPA). Что касается связывания антитела с целевой молекулой, термин «специфическое связывание», или «специфически связывает», или «является специфическим для», применительно к конкретному целевому полипептиду или эпитопу на конкретном целевом полипептиде означает связывание, которое значительно отличается от неспецифического взаимодействия. Специфическое связывание можно измерять, например, путем определения связывания молекулы в сравнении со связыванием контрольной молекулы, которая, как правило, представляет собой молекулу с аналогичной структурой, но не обладает активностью связывания. Например, специфическое связывание можно определять путем конкуренции с контрольной молекулой, которая аналогична мишени, например, избытком немеченой мишени. В данном случае, на специфичность связывания указывает то, что связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. Используемый в настоящем документе термин «специфическое связывание», или «специфически связывает», или «является специфическим для», применительно к конкретному целевому полипептиду(ам) или эпитопу(ам) на конкретном целевом полипептиде может относиться, например, к молекуле, имеющей величину KD для мишени (которую можно определять, как описано выше) по меньшей мере примерно 10-7 M, предпочтительно по меньшей мере примерно 10-8 M, более предпочтительно по меньшей мере примерно 10-9 M, даже более предпочтительно по меньшей мере примерно 10-10 M, даже более предпочтительно по меньшей мере примерно 10-11 M, даже более предпочтительно по меньшей мере примерно 10-12 M, или более, при определении методом ППР при 25°C.
В настоящей спецификации термин «низкая аффинность» используется взаимозаменяемо с выражениями «не связывает/не связывают» или «не связывается/не связываются с», и означает аффинность связывания между антителом и его антигеном с EC50 более 1500 нг/мл при определении в анализе ELISA, и/или в случае ограниченного, или отсутствия, специфического связывания между иммобилизованным антигеном и антителом предпочтительно при определении методом ППР при 25°C, например, когда KD между антителом и антигеном является выше, чем, например, 10-7 M, выше чем 10-6 M или даже выше, при определении методом ППР при 25°C.
Используемый в настоящем документе термин «высокая аффинность» означает аффинность связывания между антителом и его антигеном, когда KD, как правило, составляет менее 10-8 M, 10-9 M, 10-10 M, 10-11 M, или даже ниже, при определении методом ППР при 25°C, как описано в разделе «Примеры».
«Гуманизированные» формы не принадлежащих человеку антител (например, антител грызунов) представляют собой антитела (например, химерные не человеческие-человеческие антитела), которые содержат минимальные последовательности, происходящие из не принадлежащего человеку антитела. В данной области известны различные способы гуманизации не принадлежащих человеку антител. Например, антигенсвязывающие области CDR в вариабельных областях (VR) H-цепи (VH) и L-цепи (VL) происходят из антител биологического вида, отличного от человека, обычно мыши, крысы или кролика. Эти не принадлежащие человеку CDR объединяют с человеческими каркасными областями (FR1, FR2, FR3 и FR4) областей VH и VL таким образом, что функциональные свойства антител, такие как аффинность связывания и специфичность сохраняются, по меньшей мере частично. Избранные аминокислоты в человеческой области FR могут быть заменены на соответствующие исходные аминокислоты биологического вида, отличного от человека, для дальнейшего улучшения характеристик антитела, например, для повышения аффинности связывания, где с сохранением низкой иммуногенности. Альтернативно, не принадлежащие человеку антитела могут быть гуманизированы путем изменения их аминокислотной последовательности для увеличения сходства с вариантами антител, продуцируемыми естественным образом в организме человека. Например, избранные аминокислоты исходных FR биологического вида, отличного от человека, заменяют на соответствующие им человеческие аминокислоты для уменьшения иммуногенности, где с сохранением аффинности связывания антитела. Иллюстративным способом гуманизации не принадлежащих человеку антител является способ Winter и соавторов (Jones et al. Nature 1986, 321, 522-525; Riechmann et al. Nature 1988, 332, 323-327; Verhoeyen et al. Science 1988, 239, 1534-1536) путем замены CDR соответствующих последовательностей человеческого антитела.
Гуманизированные таким способом вариабельные области, как правило, объединяют с константными областями человеческого антитела. Как правило, гуманизированное антитело будет содержать два вариабельных домена, в которых все, или практически все, из CDR соответствуют таковым из не принадлежащего человеку иммуноглобулина, а все, или практически все, из FR имеют последовательности человеческого иммуноглобулина. Гуманизированное антитело, необязательно, будет также содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, из человеческого иммуноглобулина. Для дополнительной информации смотри Jones et al. Nature 1986, 321, 522-525; Riechmann et al. Nature 1988, 332, 323-327; и Presta. Curr. Op. Struct. Biol. 1992, 2, 593-596. Смотри также следующие обзорные статьи и цитируемые в них литературные источники: Vaswani and Hamilton. Ann. Allergy, Asthma and Immunol. 1998, 1, 105-115; Harris. Biochem. Soc. Transactions 1995, 23, 1035-1038; и Hurle and Gross. Curr. Op. Biotech. (1994), 5, 428-433.
Используемый в настоящем документе термин «гипервариабельная область», «HVR», означает области вариабельного домена антитела, которые являются гипервариабельными по своей последовательности и/или образуют петли с четкой структурой, которые ответственны за связывание антигена. Как правило, антитела содержат шесть гипервариабельных областей; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). Различные варианты разграничения гипервариабельных областей известны в данной области и включены в настоящий документ. Гипервариабельные области, как правило, содержат аминокислотные остатки из «определяющей комплементарность области», или «CDR», (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL, и около примерно 31-35 (H1), 50-65 (H2) и 95-102 (H3) в VH, в случае нумерации в соответствии с системой нумерации Kabat; Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991); и/или остатки из «гипервариабельной петли» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL, и 26-32 (H1), 52-56 (H2) и 95-101 (H3) в VH в случае нумерации в соответствии с системой нумерации Chothia; Chothia and Lesk. J. Mol. Biol. 1987, 196, 901-917); и/или остатки из «гипервариабельной петли»/CDR (например, остатки 27-38 (L1), 56-65 (L2) и 105-120 (L3) в VL, и 27-38 (H1), 56-65 (H2) и 105-120 (H3) в VH в случае нумерации в соответствии с системой нумерации IMGT; Lefranc et al. Nucl. Acids Res. 1999, 27, 209-212, Ruiz et al. Nucl. Acids Res. 2000, 28, 219-221). Необязательно, антитело имеет симметричные вставки в одной или более из следующих точек 28, 36 (L1), 63, 74-75 (L2) и 123 (L3) в VL, и 28, 36 (H1), 63, 74-75 (H2) и 123 (H3) в VH в случае нумерации в соответствии с системой нумерации Honneger и Plunkthun (Mol. Biol. 2001, 309, 657-670). В публикации Dondelinger et al. приведен обзор нескольких систем нумерации и вариантов их использования (Dondelinger et al. Frontiers in Immunology, 2018, 9, Art 2278). HVR/CDR антител и антигенсвязывающих фрагментов по изобретению предпочтительно определены и пронумерованы в соответствии с системой нумерации Kabat.
«Каркасные», или «FR», остатки представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, определение которым дано в настоящем документе.
Используемый в настоящем документе термин «блокирующее» антитело, или «антагонистическое» антитело, означает антитело, которое частично или полностью предотвращает связывание естественного лиганда. Например, анти-SIRPα блокирующее антитело предотвращает связывание CD47 с SIRPα. Предпочтительные блокирующие антитела, или антагонистические антитела, в значительной степени или полностью ингибируют биологическую активность антигена.
Термин «эпитоп» означает часть молекулы, которую связывает антигенсвязывающий белок, например, антитело. Термин охватывает любую детерминанту, способную к специфическому связыванию с антигенсвязывающим белком, например, антителом или T-клеточным рецептором. Эпитоп может быть непрерывным или прерывистым (например, в полипептиде аминокислотные остатки, которые не являются смежными в полипептидной последовательности, но которые в контексте молекулы - то есть, третичной структуры - связываются антигенсвязывающим белком). В конкретных вариантах осуществления эпитопы могут представлять собой миметики в том смысле, что они могут иметь трехмерную структуру, которая аналогична эпитопу, используемому для создания антигенсвязывающего белка, но где не содержать, или содержать лишь некоторые из аминокислотных остатков, присутствующих в эпитопе, используемом для создания антигенсвязывающего белка. Чаще всего эпитопы находятся на белках, но в некоторых случаях могут находиться на молекулах другого вида, например, нуклеиновых кислотах. Эпитопные детерминанты могут включать химически активные поверхностные группы молекул, такие как аминокислоты, сахарные боковые цепи, фосфорильные, сульфонильные или сульфатные группы, и могут иметь характерные трехмерные структурные характеристики и/или характерные характеристики заряда. Как правило, антитела, специфические для конкретного целевого антигена, будут предпочтительно узнавать эпитоп на целевом антигене в сложной смеси белков и/или макромолекул. Внеклеточный домен SIRPα может, например, содержать эпитопы в домене d1, d2 или d3.
В настоящем документе термин «Fc-область» используют для определения C-концевой области тяжелой цепи иммуноглобулина, включая последовательности Fc-областей дикого типа и вариантные Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи человеческого IgG, как правило, продолжается от аминокислотного остатка в положении Cys226, или Pro230, до C-конца цепи. C-концевой остаток лизина (остаток 447 в соответствии с системой нумерации EU) Fc-области может быть удален, например, в процессе продуцирования или очистки антитела, или в результате рекомбинантной модификации нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител с удаленными всеми остатками K447, популяции антител с не удаленными всеми остатками K447 и популяции антител, содержащие смесь антител, имеющих или не имеющих остаток K447.
«Функциональная Fc-область» обладает «эффекторной функцией» последовательности Fc-области дикого типа. Эффекторные функции антител варьируются в зависимости от типа антител. Иллюстративные «эффекторные функции» включают связывание компонента 1q комплемента (C1q); CDC; связывание Fc-рецептора; ADCC; ADCP; ADAP; понижающую регуляцию клеточных поверхностных рецепторов (например, B-клеточного рецептора; BCR) и активацию B-клеток. Для таких эффекторных функций, как правило, необходимо, чтобы Fc-область была объединена со связывающим доменом (например, вариабельным доменом антитела), и эти функции можно оценивать с использованием различных анализов, описанных, например, в разделе «Определения» настоящего документа.
«Последовательность Fc-области дикого типа» представляет собой аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в природе. Человеческие последовательности Fc-областей включают последовательность дикого типа Fc-области человеческого IgG1 (не-A и A аллотипов); последовательность дикого типа Fc-области человеческого IgG2; последовательность дикого типа Fc-области человеческого IgG3 и последовательность дикого типа Fc-области человеческого IgG4, а также их существующие в природе варианты.
«Вариантная Fc-область» содержит аминокислотную последовательность, которая отличается от последовательности Fc-области дикого типа вследствие по меньшей мере одной аминокислотной модификации, предпочтительно одной или более аминокислотных замен. Предпочтительно, вариантная Fc-область имеет по меньшей мере одну аминокислотную замену в сравнении с последовательностью Fc-области дикого типа или Fc-области исходного полипептида, например, от примерно одной до примерно десяти аминокислотных замен, и предпочтительно от примерно одной до примерно пяти аминокислотных замен в последовательности Fc-области дикого типа или Fc-области исходного полипептида. Описанная в настоящем документе Fc-область предпочтительно будет иметь по меньшей мере примерно 80% гомологию с последовательностью Fc-области дикого типа и/или Fc-области исходного полипептида, и наиболее предпочтительно по меньшей мере примерно 90% гомологию с ней, более предпочтительно по меньшей мере примерно 95% гомологию с ней.
Термин «антителозависимая опосредуемая клетками цитотоксичность» (также называемая «антителозависимой клеточной цитотоксичностью»), или «ADCC», означает форму цитотоксичности, в которой секретируемые Ig, связанные с Fc рецепторами (FcR), присутствующими на некоторых цитотоксических клетках (например, клетках - естественных киллерах (NK), нейтрофилах и моноцитах/макрофагах), позволяют этим цитотоксическим эффекторным клеткам специфически связываться с несущими антиген клетками-мишенями. NK-клетки экспрессируют только FcγRIIIA, в то время как моноциты экспрессируют FcγRI, FcγRIIA/B и FcγRIIIA. Нейтрофилы, которые являются наиболее распространенными лейкоцитами в человеческой крови, также опосредуют ADCC, и это, как правило, зависит от FcγRIIA (Zhao et al. Natl Acad Sci U S A. 2011, 108(45), 18342-7; Treffers et al. Eur J Immunol. 2018, 48(2), 344-354; Matlung et al. Cell Rep. 2018, 23(13), 3946-3959). Обобщенные данные по экспрессии FcR на гемопоэтических клетках приведены в Таблице 2 на странице 33 публикации Bruhns and Jönsson Immunol Rev. 2015, 268(1), 25-51. Для оценки активности ADCC интересующей молекулы можно проводить in vitro анализ ADCC, такой как тот, который описан в патенте США № 5500362 или 5821337, или такой как тот, который описан в разделе «Примеры». Полезные для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (МКПК), включающие смесь моноцитов и NK-клеток, или выделенные моноциты, нейтрофилы или NK-клетки. Альтернативно или дополнительно, активность ADCC интересующей молекулы можно оценивать in vivo, например, в животной модели, такой как та, которая описана в публикации Clynes et al. Proc. Natl. Acad. Sci. (USA) 1998, 95, 652-656, или в хорошо известных опухолевых моделях, таких как модель на B16F10, описанная в публикации Zhao et al., PNAS 2011, смотри выше. «Fc-рецептор», или «FcR», означает рецептор, который связывает Fc-область антитела. Предпочтительный FcR имеет последовательность дикого типа человеческого FcR. Кроме того, предпочтительный FcR представляет собой рецептор, который связывает IgG антитело (гамма-рецептор), и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы таких рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, но отличаются главным образом своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в его цитоплазматическом домене (смотри обзор M. в Daëron. Annu. Rev. Immunol. 1997, 15, 203-234). Обзор FcR приведен в публикациях Ravetch and Kinet. Annu. Rev. Immunol. 1991, 9, 457-492; Capel et al. Immunomethods 1994, 4, 25-34; и de Haas et al. J. Lab. Clin. Med. 1995, 126, 330-341. И другие FcR, включая те, которые будут идентифицированы в будущем, охвачены термином «FcR» в настоящем документе.
«Человеческие эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или более FcR и выполняют эффекторные функции. Предпочтительно, экспрессируют FcγRIIA (нейтрофилы или моноциты) или FcγRIIIA (NK-клетки или моноциты) и выполняют эффекторную функцию ADCC. Примеры человеческих лейкоцитов, которые опосредуют ADCC, включают МКПК, NK-клетки, моноциты, макрофаги и нейтрофилы, где нейтрофилы являются предпочтительными. Эффекторные клетки могут быть выделены из природного источника, например, из крови, предпочтительно из человеческой крови.
Используемый в настоящем документе термин «терапевтическое антитело» означает антитело, или его антигенсвязывающий фрагмент, как определено выше, которое подходит для лечения человека. Антитела, подходящие для лечения человека, имеют достаточное качество, безопасны и эффективны для лечения конкретных заболеваний человека. Качество можно оценивать с использованием установленных руководящих принципов Надлежащей производственной практики; безопасность и эффективность, как правило, оценивают с использованием руководящих принципов, установленных органами государственного регулирования и контроля оборота лекарственных средств, например, Европейским агентством по лекарственным средствам (EMA) или Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA). Эти руководящие принципы хорошо известны в данной области. В настоящей спецификации термин «терапевтическое антитело» не включает анти-SIRPα антитело. Используемый в настоящем документе термин «терапевтическое антитело» означает противораковое антитело, такое как, например, анти-CD20, анти-HER2, анти-GD2, анти-EGFR или анти-CD70 антитело.
«Идентичность последовательностей» и «сходство последовательностей» можно определять путем выравнивания двух аминокислотных последовательностей или двух нуклеотидных последовательностей с использованием алгоритмов глобального или локального выравнивания, в зависимости от длин двух последовательностей. Последовательности с одинаковыми длинами предпочтительно выравнивать с использованием алгоритмов глобального выравнивания (например, Нидлмана-Вунша), который оптимально выравнивает последовательности по всей длине, в то время как последовательности со значительно различающимися длинами предпочтительно выравнивать с использованием алгоритма локального выравнивания (например, Смита-Уотермана). Последовательности могут быть названы «практически идентичными» или «по существу идентичными», когда они (при оптимальном выравнивании, например, при помощи программ GAP или BESTFIT с использованием параметров по умолчанию) имеют по меньшей мере определенную минимальную процентную идентичность последовательностей (описанную ниже). В GAP использован алгоритм глобального выравнивания Нидлмана-Вунша для выравнивания двух последовательностей по всей их длине (полноразмерных), с максимизацией количества совпадений и минимизацией количества делеций. Глобальное выравнивание удобно использовать для определения идентичности последовательностей, когда две последовательности имеют одинаковые длины. Как правило, используют параметры по умолчанию GAP, со штрафом за внесение делеции=50 (нуклеотиды) / 8 (белки) и штрафом за продолжение делеции=3 (нуклеотиды) / 2 (белки). Для нуклеотидов используемой по умолчанию матрицей замен является nwsgapdna, и для белков используемой по умолчанию матрицей замен является Blosum62 (Henikoff & Henikoff. PNAS 1992, 89, 915-919). Выравнивание последовательностей и определение процентной идентичности последовательностей можно выполнять с использованием компьютерных программ, таких как пакет программ GCG Wisconsin, версии 10.3, доступный от Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752 USA, или с использованием программного обеспечения с открытым исходным кодом, такого как программа «needle» (в которой используется алгоритм Нидлмана-Вунша) или «water» (в которой используется алгоритм поиска локальной гомологии Смита-Уотермана) в EmbossWIN версии 2.10.0, с использованием тех же параметров, что и для GAP, выше, или с использованием установок по умолчанию (как для «needle», так и для «water», и для выравнивания как белков, так и ДНК, штраф по умолчанию за внесение делеции составляет 10,0, и штраф по умолчанию за продолжение делеции составляет 0,5; матрицами замен по умолчанию являются Blossum62 для белков и DNAFull для ДНК). Когда последовательности имеют значительно различающиеся общие длины, предпочтительно использовать локальное выравнивание, например, с использованием алгоритма Смита-Уотермана. Альтернативно, процентное сходство, или идентичность, можно определять путем поиска в общедоступных базах данных с использованием таких алгоритмов, как FASTA, BLAST и так далее.
После выравнивания двух аминокислотных последовательностей с использованием любой из описанных выше программ выравнивания рассчитывают % аминокислотную идентичность последовательности конкретной аминокислотной последовательности A относительно, с, или в сравнении с конкретной аминокислотной последовательностью B (альтернативно можно говорить, что конкретная аминокислотная последовательность A имеет, или заключает в себе, определенную % аминокислотную идентичность последовательности относительно, с, или в сравнении с конкретной аминокислотной последовательностью B) следующим образом: умножают на 100 частное от деления X/Y, где X представляет собой количество аминокислотных остатков, определенных как идентичные совпадения программой выравнивания последовательностей при выравнивании программой A и B, и Y представляет собой общее количество аминокислотных остатков в B. Следует понимать, что если длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, то % аминокислотная идентичность последовательности A относительно B не будет равна % аминокислотной идентичности последовательности B относительно A.
Необязательно, при определении степени сходства аминокислот можно учитывать так называемые «консервативные аминокислотные замены». Термин «консервативные аминокислотные замены» относится к взаимозаменяемости остатков, имеющих сходные боковые цепи. Например, группа аминокислотных остатков с алифатическими боковыми цепями включает глицин, аланин, валин, лейцин и изолейцин; группа аминокислот, имеющих алифатические гидроксильные боковые цепи, включает серин и треонин; группа аминокислот, имеющих амид-содержащие боковые цепи, включает аспарагин и глутамин; группа аминокислот, имеющих ароматические боковые цепи, включает фенилаланин, тирозин и триптофан; группа аминокислот, имеющих основные боковые цепи, включает лизин, аргинин и гистидин; и группа аминокислот, имеющих серосодержащие боковые цепи, включает цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин. Иллюстративными консервативными заменами для каждой из существующих в природе аминокислот являются следующие: ala на ser; arg на lys; asn на gln или his; asp на glu; cys на ser или ala; gln на asn; glu на asp; gly на pro; his на asn или gln; ile на leu или val; leu на ile или val; lys на arg, gln или glu; met на leu или ile; phe на met, leu или tyr; ser на thr; thr на ser; trp на tyr; tyr на trp или phe; и val на ile или leu.
Используемый в настоящем документе термин «нуклеотидная конструкция», или «нуклеотидный вектор», означает искусственно созданную молекулу нуклеиновой кислоты, полученную с использованием технологии рекомбинантных ДНК. Таким образом, термин «нуклеотидная конструкция» не включает существующие в природе молекулы нуклеиновой кислоты, хотя нуклеотидная конструкция может содержать (части) существующих в природе молекул нуклеиновой кислоты. Термины «экспрессионный вектор» или «экспрессионная конструкция» означают нуклеотидные последовательности, которые способны осуществлять экспрессию гена в клетках-хозяевах или организмах-хозяевах, совместимых с такими последовательностями. Эти экспрессионные векторы, как правило, включают по меньшей мере соответствующие последовательности регуляции транскрипции и, необязательно, 3'-сигналы терминации транскрипции. Дополнительные факторы, необходимые или полезные для осуществления экспрессии, также могут присутствовать, например, энхансерные элементы экспрессии. Экспрессионный вектор будет введен в подходящую клетку-хозяина и будет способен осуществлять экспрессию кодирующей последовательности в in vitro клеточной культуре клетки-хозяина. Экспрессионный вектор будет способен к репликации в клетке-хозяине или организме по изобретению.
Используемый в настоящем документе термин «промотор», или «последовательность регуляции транскрипции», означает фрагмент нуклеиновой кислоты, функция которого заключается в контроле транскрипции одной или более кодирующих последовательностей, который расположен выше по ходу транскрипции, чем сайт инициации транскрипции кодирующей последовательности, и структурно определяется наличием сайта связывания для ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и любых других последовательностей ДНК, включая, но без ограничения, сайты связывания факторов транскрипции, сайты связывания белков репрессоров и активаторов, а также любые другие нуклеотидные последовательности, которые, как известно специалисту в данной области, действуют прямо или косвенно, регулируя транскрипцию с промотора. «Конститутивный» промотор представляет собой промотор, который активен в большинстве тканей в большинстве физиологических условий и стадий развития. «Индуцируемый» промотор представляет собой промотор, который регулируется физиологическими условиями или стадией развития, например, путем использования химического индуктора.
Используемый в настоящем документе термин «функционально связанные» означает, что полинуклеотидные элементы связаны функциональными отношениями. Нуклеиновая кислота является «функционально связанной», когда имеет место ее функциональное отношение с другой нуклеотидной последовательностью. Например, последовательность регуляции транскрипции функционально связана с кодирующей последовательностью, если она влияет на транскрипцию кодирующей последовательности. «Функционально связанные» означает, что связанные последовательности ДНК, как правило, являются смежными, и, при необходимости связывания двух кодирующих белок областей, смежными и в одной рамке считывания.
Используемый в настоящем документе термин «ADC» означает цитотоксическое лекарственное средство, конъюгированное с терапевтическим антителом, или его антигенсвязывающим фрагментом, определение которым дано выше, через линкер. Антитело, или его антигенсвязывающий фрагмент, в ADC не является анти-SIRPα антителом. Как правило, цитотоксические лекарственные средства являются сильнодействующими, например, дуокармицин, калихеамицин, димер пирролобензодиазепина (PBD), производное майтанзиноида или ауристатина. Линкер может быть расщепляемым, например, содержать расщепляемый дипептид валин-цитруллин (vc) или валин-аланин (va), или не расщепляемым, например, сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC).
Антитела по изобретению или их фрагменты
В настоящее время отсутствуют одобренные для использования терапевтические средства, направленные на SIRPα, хотя показано, что SIRPα играет важную роль в механизмах избегания опухолями атак иммунной системы.
SIRPα (также известный как CD172 антиген-подобного семейства представитель A, CD172a, SHPS-1, MyD-1) является представителем семейства сигнальных регуляторных белков (SIRP), трансмембранных гликопротеинов с внеклеточными Ig-подобными доменами, находящихся на иммунных эффекторных клетках. CD47 (также известный как интегрин-ассоциированный белок, IAP) является лигандом SIRPα. NH2-концевой лиганд-связывающий домен SIRPα является высоко полиморфным (Takenaka et al. Nature Immun. 2007, 8(12), 1313-1323). Однако этот полиморфизм существенно не влияет на связывание с CD47. SIRPαBIT (v1) и SIRPα1 (v2) представляют собой две наиболее распространенные и наиболее различающиеся (13 отличающихся остатков) полиморфные формы (Hatherley et al. J. Biol. Chem. 2014, 289(14), 10024-10028). Кроме CD47, SIRPα также может быть связан сурфактантными белками (SP-A и SP-D; Gardai et al. 2003, Janssen et al. 2008, Fournier et al. 2012). Фактически, CD47 может связываться с доменом D1 SIRPα, в то время как SP-D может (одновременно) связываться с доменом D3 SIRPα. Подобно SIRPα, сурфактантные белки вовлечены во врожденные иммунные/воспалительные реакции, направленные, например, на апоптотические клетки и микроорганизмы, с участием макрофагов и/или нейтрофилов. Другими биохимически охарактеризованными представителями семейства SIRP у человека являются SIRPβ1 и SIRPγ. Номенклатура семейства SIRP описана в публикации van den Berg et al. J Immunology 2005, 175(12), 7788-9.
SIRPβ1 (также известный как CD172B) не связывает CD47 (van Beek et al. J. Immunol. 2005, 175(12), 7781-7787, 7788-7789), и известны по меньшей мере два полиморфных варианта SIRPβ1, SIRPβ1v1 (ENSP00000371018) и SIRPβ1v2 (ENSP00000279477). Хотя естественный лиганд SIRPβ1 пока неизвестен, in vitro исследования с использованием специфических анти-SIRPβ1 антител показали, что связывание SIRPβ1 стимулирует фагоцитоз в макрофагах путем индукции фосфорилирования тирозина в DAP12, Syk и SLP-76, и последующей активации каскада киназы легких цепей миозина MEK-MAPK (Matozaki et al. J. Biol. Chem. 2004, 279(28), 29450-29460). Человеческий SIRPβ1 экспрессируется в миелоидных клетках, таких как моноциты и гранулоциты, но не в лимфоцитах (Hayashi et al. J. of Biol Chem. 2004, 279(28); Dietrich et al. The Journal of Immunology 2000, 164, 9-12).
SIRPγ (также известный как CD172G) экспрессируется на T-клетках и активированных NK-клетках, и связывает CD47 с аффинностью, в 10 раз более низкой, чем SIRPα. Взаимодействие CD47-SIRPγ вовлечено в контакт между антигенпредставляющими клетками и T-клетками, с костимуляцией T-клеточной активации и стимуляцией T-клеточной пролиферации (Piccio et al. Blood 2005, 105, 2421-2427). Кроме того, взаимодействия CD47-SIRPγ играют определенную роль в трансэндотелиальной миграции T-клеток (Stefanidakis et al. Blood 2008, 112, 1280-1289). В WO2017/178653 раскрыто, что вследствие значительного сходства последовательностей между SIRPα и SIRPγ, в частности, в области, которая взаимодействует с CD47, анти-SIRPα антитела предшествующего уровня техники также связывают SIRPγ и проявляют нежелательные эффекты у человека, такие как ингибирование пролиферации T-клеток и ослабление иммунного ответа. Таким образом, анти-SIRPα антитело по изобретению, которое не связывает SIRPγ на T-клетках, предположительно будет вызывать меньшее, или не будет вызывать, ингибирование просачивания T-клеток и/или будет вызывать меньшее, или не будет вызывать, ингибирование трансэндотелиальной миграции T-клеток, в отличие от анти-SIRPα антитела, которое связывает SIRPγ на T-клетках.
Настоящее изобретение относится к антагонистическим анти-SIRPα антителам, которые демонстрируют специфическое связывание с по меньшей мере двумя преобладающими полиморфными вариантами человеческого SIRPα, SIRPαBIT и SIRPα1. Предпочтительно, анти-SIRPα антитела по изобретению имеют пониженную, низкую или, наиболее предпочтительно, не имеют, аффинность для человеческого SIRPγ (предпочтительно при измерении методом FACS с окрашиванием CD3+ T-клеток или методом поверхностного плазмонного резонанса (предпочтительно BiaCore™) в соответствии с разделом «Примеры»). Предпочтительно, анти-SIRPα антитела по изобретению имеют пониженную, или низкую, аффинность для человеческого SIRPβ1v1 и/или человеческого SIRPβ1v2. Предпочтительно, они усиливают ADCC и/или ADCP терапевтического антитела. В предпочтительном варианте осуществления анти-SIRPα антитело по изобретению также связывает SIRPα яванского макака.
Антагонистические антитела имеют аффинность для конкретного антигена, и связывание антитела с его антигеном ингибирует функцию агониста или обратного агониста на рецепторах. В данном случае предполагается, что связывание антагонистического анти-SIRPα антитела с SIRPα будет предотвращать связывание CD47 с SIRPα. Антагонистические анти-SIRPα антитела могут связываться в том же сайте, где связывается CD47, то есть, ортостерическом сайте, предотвращая связывание SIRPα с CD47 и, следовательно, ингибируя сигнализацию, которая отрицательно регулирует зависимое от Fc-рецептора действие иммунных эффекторных клеток. Альтернативно, антагонистические анти-SIRPα антитела могут связываться в непосредственной близости от сайта, в котором связывается CD47, предотвращая взаимодействие между CD47 и SIRPα за счет стерического препятствия. Альтернативно, антитело, связываясь отдаленно от сайта взаимодействия с CD47, может блокировать связывание CD47/SIRPα, например, за счет индукции невосприимчивой конформации. Без связи с конкретной теорией, предполагается, что блокирование связывания CD47 с SIRPα уменьшает или предотвращает каскад сигнализации SIRPα, предпочтительно на по меньшей мере 60%, более предпочтительно на по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, наиболее предпочтительно на по меньшей мере 80%, при измерении, как указано в разделе «Примеры» при концентрации анти-SIRPα антитела, составляющей 3,3 мкг/мл.
Если антитело связывает также и другие антигены помимо мишени, например, SIRPβ1v1, SIRPβ1v2 и SIRPγ, особенно когда антитело связывает эти антигены с высокой аффинностью, такие антигены могут действовать как поглотители антитела. Таким образом, предполагается, что вследствие минимизации нецелевого связывания антитела уменьшается любой эффект поглощения антитела, результатом чего может являться эффективность при более низкой дозе, или более выраженный эффект при той же дозе, в сравнении с антителом, которое в остальном имеет такие же характеристики.
В настоящее время роль SIRPβ1 плохо изучена. Таким образом, предпочтительно, если антитело по настоящему изобретению имеет относительно низкую аффинность связывания с обоими полиморфными вариантами (SIRPβ1v1 и SIRPβ1v2). Однако сообщалось, что активация SIRPα (сигнализация через иммунорецепторные тирозиновые ингибирующие мотивы, ITIM) и SIRPβ1 (сигнализация через иммунорецепторные тирозиновые активирующие мотивы, ITAM) оказывают противоположные эффекты на функцию иммунных эффекторных клеток, таких как макрофаги и PMN/нейтрофилы (van Beek et al. J. Immunol. 2005, 175(12), 7781-7787, 7788-7789). Кроме того, сообщалось, что приведение в действие мышиного рецептора SIRPβ1 стимулирует фагоцитоз в макрофагах (Hayashi et al. J. Biol. Chem. 2004, 279(28), 29450-29460). В публикации Liu et al. (J. Biol. Chem. 2005, 280 (43), 36132-36140) заявлено, что опосредованное антителом связывание SIRPβ1 приводило к усилению fMLP-управляемой трансэпителиальной миграции PMN. Без связи с конкретной теорией, вполне возможно, что анти-SIRPα блокирующие антитела, которые также связывают SIRPβ1, могут оказывать противоположные эффекты на SIRPα и SIRPβ1. Для достижения максимальной стимуляции противоопухолевого клеточного ответа необходимо, чтобы антитела стимулировали активность клеток врожденного иммунитета (например, PMN/нейтрофилов и/или макрофагов) путем блокирования SIRPα, но где влияли ограниченно, или не влияли, на функционирование SIRPβ1, и в то же время без блокирования клеток приобретенного иммунитета, то есть, T-клеток, за счет связывания SIRPγ.
Антитела по настоящему изобретению предпочтительно имеют все из следующих характеристик: (i) они способны блокировать связывание CD47 с SIRPαBIT и SIRPα1, (ii) они не связываются с человеческими CD3+ T-клетками, и (iii) они способны уменьшать сигнализацию SIRPα. Предпочтительно, они проявляют редуцированное или низкое связывание с SIRPβ1v1 и/или SIRPβ1v2 при измерении методом ППР. Напротив, известные анти-SIRPα антитела не сочетают все нужные характеристики в одном антителе: все из антител, способных блокировать связывание CD47 с SIRPαBIT и SIRPα1, также демонстрируют связывание с SIRPγ, в то время как HEFLB может блокировать SIRPαBIT без связывания с SIRPγ, но не обладает способностью к связыванию, тем более блокированию, SIRPα1. Некоторые другие антитела предшествующего уровня техники, которые способны связывать как SIRPα1, так и SIRPαBIT, без связывания SIRPγ, не способны блокировать связывание CD47 с SIRPα и, таким образом, не блокируют, или блокируют только при высокой концентрации IC50, сигнализацию SIRPα при измерении путем блокирования рекрутинга SHP-1. Несмотря на способность к связыванию и блокированию как SIRPα1, так и SIRPαBIT, SE5A5 не способно блокировать сигнализацию SIRPα при измерении путем блокирования рекрутинга SHP-1. Эти характеристики определяют, как описано или указано в разделе «Примеры».
В первом аспекте изобретение относится к антителу, или его антигенсвязывающему фрагменту, которое связывает SIRPα. Анти-SIRPα антитело по изобретению предпочтительно представляет собой выделенное антитело. Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению связывает SIRPα приматов, более предпочтительно человеческий SIRPα, наиболее предпочтительно по меньшей мере аллельные варианты SIRPα1 и SIRPαBIT. В предпочтительном варианте осуществления антитело, или его антигенсвязывающий фрагмент, имеет пониженное связывание в сравнении с антителами предшествующего уровня техники, более предпочтительно, связывает слабо, наиболее предпочтительно, не связывает, SIRPγ, предпочтительно при измерении методом FACS с окрашиванием человеческих CD3+ T-клеток, как описано в разделе «Примеры», или в экспериментах с использованием Biacore, как продемонстрировано в примерах. Предпочтительно, антитело, или его антигенсвязывающий фрагмент, усиливает ADCC и/или ADCP терапевтических антител. Предпочтительно, анти-SIRPα антитело по изобретению усиливает ADCC 10 мкг/мл трастузумаба при концентрации 0,1 мкг/мл анти-SIRPα антитела по меньшей мере в 1,2 раза; более предпочтительно по меньшей мере в 1,3 раза; более предпочтительно по меньшей мере в 1,4 раза; более предпочтительно по меньшей мере в 1,5 раза; более предпочтительно по меньшей мере в 1,6 раза; более предпочтительно по меньшей мере в 1,7 раза; более предпочтительно по меньшей мере в 1,8 раза; более предпочтительно по меньшей мере в 1,9 раза; более предпочтительно по меньшей мере в 2,0 раза; более предпочтительно по меньшей мере в 2,1 раза; более предпочтительно по меньшей мере в 2,2 раза; наиболее предпочтительно по меньшей мере в 2,3 раза в сравнении с используемым отдельно трастузумабом, при измерении в анализе DELFIA или высвобождения 51Cr, как описано в примерах.
Альтернативно, или в сочетании с любым из других вариантов осуществления настоящего изобретения, в предпочтительном варианте осуществления анти-SIRPα антитело по изобретению представляет собой гуманизированное или человеческое анти-SIRPα антитело, и антигенсвязывающий фрагмент по изобретению представляет собой антигенсвязывающий фрагмент, описанный выше в настоящем документе, из гуманизированного или человеческого анти-SIRPα антитела. Более предпочтительно, анти-SIRPα антитело по изобретению представляет собой гуманизированное анти-SIRPα антитело, и антигенсвязывающий фрагмент по изобретению получен из гуманизированного анти-SIRPα антитела.
Гуманизированное антитело по изобретению, или его антигенсвязывающий фрагмент, предпочтительно вызывает небольшой, или не вызывает, иммуногенный ответ против антитела у субъекта, которому вводят антитело или фрагмент. Исходное не принадлежащее человеку антитело, например, антитело грызуна, такое как мышиное или крысиное антитело, или кроличье антитело, или химерное не человеческое-человеческое антитело, потенциально может вызывать ответ в виде выработки человеческих антител против не принадлежащих человеку антител, в этом случае гуманизированное антитело по изобретению, или его антигенсвязывающий фрагмент, вызывает, и/или ожидается, что будет вызывать, у субъекта-хозяина иммуногенный ответ на значительно более низком уровне в сравнении с исходным не принадлежащим человеку антителом или в сравнении с химерным не человеческим-человеческим антителом. Предпочтительно, гуманизированное антитело вызывает, и/или ожидается, что будет вызывать, минимальный, или не будет вызывать, ответ в виде выработки человеческих антител против не принадлежащих человеку антител. Тестирование иммуногенности можно проводить известными в данной области способами, например, как описано в публикациях Baker et al. Immunogenicity of protein therapeutics 2010, 1(4), 314-322; Harding et al. MAbs 2010, 2(3), 256-265; или Joubert et al. PLoS.One 2016, 11(8), e0159328. Наиболее предпочтительно, антитело по изобретению вызывает ответ в виде выработки человеческих антител против не принадлежащих человеку антител животного, в частности, ответ в виде выработки человеческих антител против антител кролика (HARA), который находится на клинически приемлемом уровне, или ниже. Также важно, чтобы антитела были гуманизированными с сохранением высокой аффинности в отношении антигена и других полезных биологических свойств.
CDR можно определять с использованием подхода Kabat (в: Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD 1991, NIH publication no. 91-3242, pp. 662, 680, 689), Chothia (Chothia and Lesk. J. Mol. Biol. 1987, 196, 901-917; Antibody Engineering Vol. 2, Chapter 3, Martin, 2010, Kontermann and Dübel Eds. Springer-Verlag Berlin Heidelberg) или IMGT (Lefranc. The Immunologist 1999, 7, 132-136). В настоящем документе CDR тяжелой цепи и легкой цепи определены с использованием системы Kabat и представлены в списке последовательностей в виде SEQ ID NO, указанных в Таблице 1a. В контексте настоящего изобретения нумерацию Eu используют для указания положений в константных областях тяжелой цепи и легкой цепи антитела. Выражение «нумерация Eu» относится к индексу Eu, описанному в Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD 1991, NIH publication no. 91-3242, pp. 662, 680, 689.
В предпочтительном варианте осуществления настоящее изобретение относится к анти-SIRPα антителу, предпочтительно гуманизированному анти-SIRPα антителу, или его антигенсвязывающему фрагменту, содержащему определяющие комплементарность области тяжелой цепи (HCDR) и определяющие комплементарность области легкой цепи (LCDR) HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, выбранные из группы, состоящей из: (a) HCDR1, содержащей SHGIS (SEQ ID NO:36); HCDR2, содержащей TIGTGVITYFASWAKG (SEQ ID NO:44); HCDR3, содержащей GSAWNDPFDP (SEQ ID NO:45); LCDR1, содержащей QASQSVYGNNDLA (SEQ ID NO:39); LCDR2, содержащей LASTLAT (SEQ ID NO:40); LCDR3, содержащей LGGGDDEADNT (SEQ ID NO:41); (b) HCDR1, содержащей SYVMG (SEQ ID NO:30); HCDR2, содержащей IISSSGSPYYASWVNG (SEQ ID NO:31); HCDR3, содержащей VGPLGVDYFNI (SEQ ID NO:32); LCDR1, содержащей RASQSINSYLA (SEQ ID NO:33); LCDR2, содержащей SASFLYS (SEQ ID NO:34); LCDR3, содержащей QSWHYISRSYT (SEQ ID NO:35); (c) HCDR1, содержащей SHGIS (SEQ ID NO:36); HCDR2, содержащей TIGTGVITYYASWAKG (SEQ ID NO:37); HCDR3, содержащей GSAWNDPFDY (SEQ ID NO:38); LCDR1, содержащей QASQSVYGNNDLA (SEQ ID NO:39); LCDR2, содержащей LASTLAT (SEQ ID NO:40); LCDR3, содержащей LGGGDDEADNV (SEQ ID NO:46); (d) HCDR1, содержащей SHGIS (SEQ ID NO:36); HCDR2, содержащей TIGTGVITYYASWAKG (SEQ ID NO:37); HCDR3, содержащей GSAWNDPFDY (SEQ ID NO:38); LCDR1, содержащей QASQSVYGNNDLA (SEQ ID NO:39); LCDR2, содержащей LASTLAT (SEQ ID NO:40); LCDR3, содержащей LGGGDDEADNT (SEQ ID NO:41); и (e) HCDR1, содержащей SHGIS (SEQ ID NO:36); HCDR2, содержащей TIGTGGITYYASWAKG (SEQ ID NO:42); HCDR3, содержащей GSAWNDPFDI (SEQ ID NO:43); LCDR1, содержащей QASQSVYGNNDLA (SEQ ID NO:39); LCDR2, содержащей LASTLAT (SEQ ID NO:40); LCDR3, содержащей LGGGDDEADNT (SEQ ID NO:41). Более предпочтительно, анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, содержит HCDR и LCDR, выбранные из группы, состоящей из: (a) HCDR1, содержащей SHGIS (SEQ ID NO:36); HCDR2, содержащей TIGTGVITYFASWAKG (SEQ ID NO:44); HCDR3, содержащей GSAWNDPFDP (SEQ ID NO:45); LCDR1, содержащей QASQSVYGNNDLA (SEQ ID NO:39); LCDR2, содержащей LASTLAT (SEQ ID NO:40); LCDR3, содержащей LGGGDDEADNT (SEQ ID NO:41); и (b) HCDR1, содержащей SYVMG (SEQ ID NO:30); HCDR2, содержащей IISSSGSPYYASWVNG (SEQ ID NO:31); HCDR3, содержащей VGPLGVDYFNI (SEQ ID NO:32); LCDR1, содержащей RASQSINSYLA (SEQ ID NO:33); LCDR2, содержащей SASFLYS (SEQ ID NO:34); LCDR3, содержащей QSWHYISRSYT (SEQ ID NO:35).
Альтернативно или в сочетании с любым из предшествующих вариантов осуществления, в предпочтительном варианте осуществления анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению имеет одно или более из следующих функциональных свойств.
Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPα1 с KD ниже 10-9 M, более предпочтительно с KD ниже 10-10 M, даже более предпочтительно с KD ниже 10-11 M, при анализе методом поверхностного плазмонного резонанса (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPα1, приведенного в SEQ ID NO:51. Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPαBIT с KD ниже 10-9 M, более предпочтительно с KD ниже 10-10 M, даже более предпочтительно с KD ниже 10-11 M при анализе методом поверхностного плазмонного резонанса (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPαBIT, приведенного в SEQ ID NO:52. Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает SIRPα яванского макака с KD ниже 10-7 M, более предпочтительно с KD ниже 10-8 M, даже более предпочтительно с KD ниже 10-9 M при анализе методом поверхностного плазмонного резонанса (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена SIRPα яванского макака, приведенного в SEQ ID NO:56. Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не связывает в поддающейся обнаружению степени человеческий SIRPγ при измерении методом FACS с окрашиванием CD3+ T-клеток, как описано в разделе «Примеры». Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не связывает человеческий SIRPγ при анализе методом поверхностного плазмонного резонанса (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPγ, приведенного в SEQ ID NO:55. Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не является иммуногенным при определении в анализе IL-2 ELIspot и/или анализе T-клеточной пролиферации. Предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPβ1v2 с умеренной или низкой аффинностью при анализе методом поверхностного плазмонного резонанса (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPβ1v2, приведенного в SEQ ID NO:54. Предпочтительно, KD является выше 10-10 M, более предпочтительно выше 10-9 M. Предпочтительно, в сочетании с умеренной или низкой аффинностью связывания SIRPβ1v2, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает SIRPβ1v1 с KD выше 10-11 M, более предпочтительно выше 3×10-11 M, даже более предпочтительно выше 10-10 M, даже более предпочтительно выше 10-9 M при анализе методом поверхностного плазмонного резонанса (предпочтительно BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPβ1v1, приведенного в SEQ ID NO:53. Эти анализы описаны или указаны в разделе «Примеры».
Альтернативно или в сочетании с любым из предшествующих вариантов осуществления, в предпочтительном варианте осуществления изобретение относится к анти-SIRPα антителу, или его антигенсвязывающему фрагменту, описанному выше в настоящем документе, где антитело специфически связывает как человеческий SIRPαBIT, так и человеческий SIRPα1, и не связывает в поддающейся обнаружению степени человеческий SIRPγ при анализе методом окрашивания CD3+ T-клеток и/или ППР, оба из которых описаны в разделе «Примеры». В одном из вариантов осуществления анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPαBIT с KD ниже 10-9 M, более предпочтительно с KD ниже 10-10 M, даже более предпочтительно с KD ниже 10-11 M; и связывает человеческий SIRPα1 с KD ниже 10-8 M, более предпочтительно с KD ниже 10-9 M, более предпочтительно с KD ниже 10-10 M, даже более предпочтительно с KD ниже 10-11 M, где KD измеряют методом ППР при 25°C (смотри Примеры). Предпочтительно, анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, связывает SIRPγ с KD выше 10-8 M, более предпочтительно с KD выше 10-7 M, более предпочтительно с KD выше 10-6 M, даже более предпочтительно с KD выше 10-5 M, наиболее предпочтительно, если связывание не может быть обнаружено, где KD измеряют методом ППР при 25°C (смотри Примеры).
Альтернативно или в сочетании с любым из предшествующих вариантов осуществления, в предпочтительном варианте осуществления анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению: (a) связывает человеческий SIRPα1 с KD ниже 10-8 M, более предпочтительно с KD ниже 10-9 M, более предпочтительно с KD ниже 10-10 M, даже более предпочтительно с KD ниже 10-11 M, при анализе методом поверхностного плазмонного резонанса (ППР; предпочтительно с использованием BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPα1, приведенного в SEQ ID NO:51 (смотри Примеры); (b) связывает человеческий SIRPαBIT с KD ниже 10-9 M, более предпочтительно с KD ниже 10-10 M, даже более предпочтительно с KD ниже 10-11 M в анализе ППР (предпочтительно с использованием BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPαBIT, приведенного в SEQ ID NO:52 (смотри Примеры); (c) блокирует связывание CD47 с SIRPα1 и SIRPαBIT, предпочтительно в анализе диссоциации от иммобилизованного CD47 методом ППР (предпочтительно с использованием BiaCore™), более предпочтительно, как описано в Примере 6; и (d) не связывает в поддающейся обнаружению степени человеческий SIRPγ при измерении методом проточной цитометрии, предпочтительно методом активированной флуоресценцией сортировки клеток (FACS) с окрашиванием CD3+ T-клеток, и/или ППР, оба из которых описаны в разделе «Примеры». Предпочтительно, в сочетании с предшествующим вариантом осуществления анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPβ1v2 с умеренной или низкой аффинностью в анализе ППР (предпочтительно с использованием BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPβ1v2, приведенного в SEQ ID NO:54. Предпочтительно, KD является выше 10-10 M, более предпочтительно выше 10-9 M. Предпочтительно, в сочетании со связыванием SIRPβ1v2 с умеренной или низкой аффинностью, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает SIRPβ1v1 с KD выше 10-11 M, более предпочтительно выше 3×10-11 M, даже более предпочтительно выше 10-10 M, даже более предпочтительно выше 10-9 M в анализе ППР (предпочтительно с использованием BiaCore™) при 25°C с использованием внеклеточного домена человеческого SIRPβ1v1, приведенного в SEQ ID NO:53. Эти анализы описаны или указаны в разделе «Примеры».
Альтернативно или в сочетании с любым из предшествующих вариантов осуществления, в предпочтительном варианте осуществления изобретение относится к анти-SIRPα антителу, или его антигенсвязывающему фрагменту, по изобретению, в котором: (a) вариабельный домен тяжелой цепи антитела содержит 4 каркасные области тяжелой цепи, HFR1-HFR4, и 3 определяющие комплементарность области HCDR1-HCDR3, которые функционально связаны в следующем порядке: HFR1-HCDR1-HFR2-HCDR2-HFR3-HCDR3-HFR4, где каждая из каркасных областей тяжелой цепи имеет по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или предпочтительно имеет 100% аминокислотную идентичность с любой аминокислотной последовательностью каркаса из SEQ ID NO:1, 3-6, 8, 10-15, или в котором HFR1-HFR4 отличаются от любой из SEQ ID NO:1, 3-6, 8, 10-15 одной или более аминокислотными заменами, как указано в Таблицах 8-11; и (b) вариабельный домен легкой цепи антитела содержит 4 каркасные области легкой цепи, LFR1-LFR4, и 3 определяющие комплементарность области LCDR1-LCDR3, которые функционально связаны в следующем порядке: LFR1-LCDR1-LFR2-LCDR2-LFR3-LCDR3-LFR4, где каждая из каркасных областей легкой цепи имеет по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или предпочтительно имеет 100% аминокислотную идентичность с любой аминокислотной последовательностью каркаса из SEQ ID NO:2, 7 или 9, или в котором LFR1, LFR2 и/или LFR4 отличаются от любой из SEQ ID NO:2, 7 или 9 одной или более аминокислотными заменами, как указано в Таблицах 12-14. В предпочтительном варианте осуществления изобретение относится к анти-SIRPα антителу, или его антигенсвязывающему фрагменту, по изобретению, в котором: (a) вариабельный домен тяжелой цепи антитела содержит 4 каркасные области тяжелой цепи, HFR1-HFR4, и 3 определяющие комплементарность области HCDR1-HCDR3, которые функционально связаны в следующем порядке: HFR1-HCDR1-HFR2-HCDR2-HFR3-HCDR3-HFR4, где каждая из каркасных областей тяжелой цепи имеет по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или предпочтительно имеет 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO 8, или в котором HFR1-HFR4 отличаются от SEQ ID NO 8 одной или более аминокислотными заменами, как указано в Таблицах 8-11; и (b) вариабельный домен легкой цепи антитела содержит 4 каркасные области легкой цепи, LFR1-LFR4, и 3 определяющие комплементарность области LCDR1-LCDR3, которые функционально связаны в следующем порядке: LFR1-LCDR1-LFR2-LCDR2-LFR3-LCDR3-LFR4, где каждая из каркасных областей легкой цепи имеет по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или предпочтительно имеет 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO 9, или в котором LFR1, LFR2 и/или LFR4 отличаются от SEQ ID NO 9 одной или более аминокислотными заменами, как указано в Таблицах 12-14.
Предпочтительно, аминокислотные остатки, которые находятся в каждом положении (в соответствии с нумерацией Kabat) из FR1, FR2, FR3 и FR4 вариабельного домена тяжелой цепи, представляют собой остатки, указанные в Таблицах 8-11 для FR1, FR2, FR3 и FR4, соответственно, или их консервативные аминокислотные замены, и аминокислотные остатки, которые находятся в каждом положении (в соответствии с нумерацией Kabat) из FR1, FR2 и FR4 вариабельного домена легкой цепи, предпочтительно представляют собой остатки, указанные в Таблицах 12-14 для FR1, FR2 и FR4, соответственно, или их консервативные аминокислотные замены. Однако более предпочтительно, каркасный аминокислотный остаток для любого положения в каркасной области выбирают из аминокислотных остатков, показанных в соответствующем положении в Таблицах 8-14.
Анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению, предпочтительно содержит HCDR, LCDR, а также каркасные области тяжелой цепи и легкой цепи, выбранные из группы, состоящей из: (a) HCDR1, содержащей SEQ ID NO:36; HCDR2, содержащей SEQ ID NO:44; HCDR3, содержащей SEQ ID NO:45; LCDR1, содержащей SEQ ID NO:39; LCDR2, содержащей SEQ ID NO:40; LCDR3, содержащей SEQ ID NO:41; HFR1-HFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:8, или HFR1-HFR4, отличающихся от SEQ ID NO:8 одной или более аминокислотными заменами, как указано в Таблицах 8-11; LFR1-LFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:9, или LFR1, LFR2 и/или LFR4, отличающихся от SEQ ID NO:9 одной или более аминокислотными заменами, как указано в Таблицах 12-14; (b) HCDR1, содержащей SEQ ID NO:30; HCDR2, содержащей SEQ ID NO:31; HCDR3, содержащей SEQ ID NO:32; LCDR1, содержащей SEQ ID NO:33; LCDR2, содержащей SEQ ID NO:34; LCDR3, содержащей SEQ ID NO:35; HFR1-HFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с любой каркасной аминокислотной последовательностью из SEQ ID NO:1, 3, 4, 5, 14 или 15, или HFR1-HFR4, отличающихся от любой из SEQ ID NO:1, 3, 4, 5, 14 или 15 одной или более аминокислотными заменами, как указано в Таблицах 8-11; LFR1-LFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:2, или LFR1, LFR2 и/или LFR4, отличающихся от SEQ ID NO:2 одной или более аминокислотными заменами, как указано в Таблицах 12-14; (c) HCDR1, содержащей SEQ ID NO:36; HCDR2, содержащей SEQ ID NO:37; HCDR3, содержащей SEQ ID NO:38; LCDR1, содержащей SEQ ID NO:39; LCDR2, содержащей SEQ ID NO:40; LCDR3, содержащей SEQ ID NO:46; HFR1-HFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотными последовательностями каркаса SEQ ID NO:6 или 13, или HFR1-HFR4, отличающихся от SEQ ID NO:6 или 13 одной или более аминокислотными заменами, как указано в Таблицах 8-11; LFR1-LFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:7, или LFR1, LFR2 и/или LFR4, отличающихся от SEQ ID NO:7 одной или более аминокислотными заменами, как указано в Таблицах 12-14; (d) HCDR1, содержащей SEQ ID NO:36; HCDR2, содержащей SEQ ID NO:37; HCDR3, содержащей SEQ ID NO:38; LCDR1, содержащей SEQ ID NO:39; LCDR2, содержащей SEQ ID NO:40; LCDR3, содержащей SEQ ID NO:41; HFR1-HFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотными последовательностями каркаса SEQ ID NO:6, 10 или 11, или HFR1-HFR4, отличающихся от любой из SEQ ID NO:6, 10 или 11 одной или более аминокислотными заменами, как указано в Таблицах 8-11; LFR1-LFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:9, или LFR1, LFR2 и/или LFR4, отличающихся от SEQ ID NO:9 одной или более аминокислотными заменами, как указано в Таблицах 12-14; и (e) HCDR1, содержащей SEQ ID NO:36; HCDR2, содержащей SEQ ID NO:42; HCDR3, содержащей SEQ ID NO:43; LCDR1, содержащей SEQ ID NO:39; LCDR2, содержащей SEQ ID NO:40; LCDR3, содержащей SEQ ID NO:41; HFR1-HFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:12, или HFR1-HFR4, отличающихся от SEQ ID NO:12 одной или более аминокислотными заменами, как указано в Таблицах 8-11; LFR1-LFR4, имеющих по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:9, или LFR1, LFR2 и/или LFR4, отличающихся от SEQ ID NO:9 одной или более аминокислотными заменами, как указано в Таблицах 12-14. Более предпочтительно, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по изобретению, содержит: (a) HCDR1, содержащую SEQ ID NO:36; HCDR2, содержащую SEQ ID NO:44; HCDR3, содержащую SEQ ID NO:45; LCDR1, содержащую SEQ ID NO:39; LCDR2, содержащую SEQ ID NO:40; и LCDR3, содержащую SEQ ID NO:41; где (i) HFR1-HFR4 имеют по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:8, или HFR1-HFR4 отличаются от SEQ ID NO:8 одной или более аминокислотными заменами, как указано в Таблицах 8-11; и (ii) LFR1-LFR4 имеют по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% или наиболее предпочтительно 100% аминокислотную идентичность с аминокислотной последовательностью каркаса SEQ ID NO:9, или LFR1, LFR2 и/или LFR4 отличаются от SEQ ID NO:9 одной или более аминокислотными заменами, как указано в Таблицах 12-14.
Альтернативно или в сочетании с предшествующим вариантом осуществления, в предпочтительном варианте осуществления каркасные замены ограничены остатками, приведенными в Таблицах 8-14. Таким образом, предпочтительно, если отсутствуют замены в других участках в каркасных областях, и также предпочтительно, если замены ограничены остатками, приведенными в Таблицах 8-14, или их консервативными аминокислотными заменами.
Альтернативно или в сочетании с предшествующим вариантом осуществления, в предпочтительном варианте осуществления анти-SIRPα антитело по настоящему изобретению, или его антигенсвязывающий фрагмент, содержит HCVR и LCVR, выбранные из группы, состоящей из: (a) HCVR с аминокислотной последовательностью SEQ ID NO:8; LCVR с аминокислотной последовательностью SEQ ID NO:9; (b) HCVR с аминокислотной последовательностью SEQ ID NO:1; LCVR с аминокислотной последовательностью SEQ ID NO:2; (c) HCVR с аминокислотной последовательностью SEQ ID NO:3; LCVR с аминокислотной последовательностью SEQ ID NO:2; (d) HCVR с аминокислотной последовательностью SEQ ID NO:4; LCVR с аминокислотной последовательностью SEQ ID NO:2; (e) HCVR с аминокислотной последовательностью SEQ ID NO:5; LCVR с аминокислотной последовательностью SEQ ID NO:2; (f) HCVR с аминокислотной последовательностью SEQ ID NO:6; LCVR с аминокислотной последовательностью SEQ ID NO:7; (g) HCVR с аминокислотной последовательностью SEQ ID NO:10; LCVR с аминокислотной последовательностью SEQ ID NO:9; (h) HCVR с аминокислотной последовательностью SEQ ID NO:6; LCVR с аминокислотной последовательностью SEQ ID NO:9; (i) HCVR с аминокислотной последовательностью SEQ ID NO:11; LCVR с аминокислотной последовательностью SEQ ID NO:9; (j) HCVR с аминокислотной последовательностью SEQ ID NO:12; LCVR с аминокислотной последовательностью SEQ ID NO:9; (k) HCVR с аминокислотной последовательностью SEQ ID NO:13; LCVR с аминокислотной последовательностью SEQ ID NO:7; (l) HCVR с аминокислотной последовательностью SEQ ID NO:14; LCVR с аминокислотной последовательностью SEQ ID NO:2; и (m) HCVR с аминокислотной последовательностью SEQ ID NO:15; LCVR с аминокислотной последовательностью SEQ ID NO:2. Более предпочтительно, анти-SIRPα антитело по настоящему изобретению, или его антигенсвязывающий фрагмент, содержит HCVR и LCVR, выбранные из группы, состоящей из: (a) HCVR с аминокислотной последовательностью SEQ ID NO:8 и LCVR с аминокислотной последовательностью SEQ ID NO:9; (b) HCVR с аминокислотной последовательностью SEQ ID NO:1 и LCVR с аминокислотной последовательностью SEQ ID NO:2; (c) HCVR с аминокислотной последовательностью SEQ ID NO:3 и LCVR с аминокислотной последовательностью SEQ ID NO:2; (d) HCVR с аминокислотной последовательностью SEQ ID NO:4 и LCVR с аминокислотной последовательностью SEQ ID NO:2; (e) HCVR с аминокислотной последовательностью SEQ ID NO:5 и LCVR с аминокислотной последовательностью SEQ ID NO:2; (f) HCVR с аминокислотной последовательностью SEQ ID NO:14 и LCVR с аминокислотной последовательностью SEQ ID NO:2; и (g) HCVR с аминокислотной последовательностью SEQ ID NO:15 и LCVR с аминокислотной последовательностью SEQ ID NO:2. Наиболее предпочтительно, анти-SIRPα антитело по настоящему изобретению, или его антигенсвязывающий фрагмент, содержит HCVR с аминокислотной последовательностью SEQ ID NO:8 и LCVR с аминокислотной последовательностью SEQ ID NO:9.
Помимо связывания как с человеческим (hu)SIRPαBIT, так и с (hu)SIRPα1, антитела по изобретению также могут связывать SIRPα яванского макака (cy), что позволяет проводить in vivo исследования в релевантной животной модели. Аффинность антитела по изобретению для SIRPα других биологических видов также не исключена.
Без связи с конкретной теорией, считается, что антитело, или его антигенсвязывающий фрагмент, по изобретению может действовать следующим образом. Антитело по изобретению может связывать тот же сайт, с которым связывается CD47, предотвращая связывание SIRPα с CD47 и, следовательно, ингибируя сигнализацию, которая отрицательно регулирует зависимое от Fc-рецептора действие иммунных эффекторных клеток.
Анти-SIRPα антитела, или их антигенсвязывающие фрагменты, по изобретению предпочтительно являются более специфическими, чем известные анти-SIRPα антитела, и демонстрируют превосходную аффинность как для человеческого SIRPαBIT, так и для человеческого SIRPα1, где они имеют пониженную, более предпочтительно низкую аффинность, даже более предпочтительно не имеют поддающуюся обнаружению аффинность для человеческого SIRPγ, предпочтительно при измерении с использованием окрашивания человеческих CD3+ T-клеток, как описано в разделе «Примеры».
В некоторых вариантах осуществления анти-SIRPα антитело по изобретению содержит константную область легкой цепи и/или тяжелой цепи антитела. Можно использовать любые константные области антитела, известные в данной области. Константная область легкой цепи может представлять собой, например, константную область легкой цепи каппа- или лямбда-типа, например, константную область легкой цепи каппа- или лямбда-типа человека. Константная область тяжелой цепи может представлять собой, например, константную область тяжелой цепи альфа-, дельта-, эпсилон-, гамма- или мю-типа, например, константную область тяжелой цепи альфа-, дельта-, эпсилон-, гамма- или мю-типа человека. В одном варианте осуществления константная область легкой или тяжелой цепи представляет собой фрагмент, производное, вариант или мутеин природной константной области.
В одном конкретном варианте осуществления анти-SIRPα антитело по изобретению содержит Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках. Такое анти-SIRPα антитело может быть подходящим для монотерапии SIRPα-положительных опухолей, предпочтительно, почечноклеточного рака или меланомы, поскольку оно может индуцировать ADCC и/или ADCP (Yanagita et al. JCI Insight 2017, 2(1), e89140). Без связи с конкретной теорией, считается, что уничтожение раковых клеток таким антителом происходит, по меньшей мере частично, за счет ADCC. Человеческие иммунные эффекторные клетки имеют различные активирующие Fc-рецепторы, которые при связывании инициируют фагоцитоз, трогоцитоз, высвобождение перфорина и гранзима, высвобождение цитокинов, ADCC, ADCP, ADAP и/или другие механизмы. Примерами таких рецепторов являются Fcγ-рецепторы, например, FcγRI (CD64), FcγRIIA (CD32a), FcγRIIIA (CD16a), FcγRIIIB (CD16b), FcγRIIC (CD32c) и Fcα-рецептор FcαRI (CD89). Антитела различных природных изотипов связываются с рядом таких рецепторов. Например, IgG1 связывается с FcγRI, FcγRIIA, FcγRIIC, FcγRIIIA, FcγRIIIB; IgG2 связывается с FcγRIIA, FcγRIIC, FcγRIIIA; IgG3 связывается с FcγRI, FcγRIIA, FcγRIIC, FcγRIIIA, FcγRIIIB; IgG4 связывается с FcγRI, FcγRIIA, FcγRIIC, FcγRIIIA; и IgA связывается с FcαRI.
В предпочтительном варианте осуществления анти-SIRPα антитело по изобретению содержит Fc-область изотипа IgA или IgG. Более предпочтительным является анти-SIRPα антитело, содержащее Fc-область изотипа IgG1, IgG2, IgG3 или IgG4; изотип IgG1, IgG2 или IgG4 является даже более предпочтительным. Наиболее предпочтительным является анти-SIRPα антитело, содержащее Fc-область изотипа IgG1, предпочтительно с последовательностью SEQ ID NO:24.
Хотя анти-SIRPα антитела, содержащие Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках, подходят для лечения видов рака, экспрессирующих CD47, комбинированной терапией с терапевтическим антителом, in vitro эксперименты по ADCC химерного анти-SIRPα IgG1 антитела в сочетании с терапевтическим антителом (трастузумабом), содержащим человеческую Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках (то есть, антителами, которые способны индуцировать ADCC и/или ADCP), не продемонстрировали усиление ADCC, как ожидалось на основании более ранних результатов с использованием мышиных антител (Фигура 2). Без связи с конкретной теорией, считается, что может иметь место эффект Курландера (Kurlander J Immunol 1983, 131(1), 140-147) для анти-SIRPα антитела, которое может конкурировать с терапевтическим антителом (в данном случае трастузумабом) за связывание с активирующим Fc-рецептором на иммунной эффекторной клетке (в данном случае нейтрофильном гранулоците). Таким образом, Fc-хвост анти-SIRPα может связываться в cis-положении с Fc-рецептором на соответствующей фагоцитарной иммунной эффекторной клетке, например, гранулоците, макрофаге или дендритной клетке, тем самым уменьшая или предотвращая ADCC и/или ADCP, и/или ADAP. Следовательно, уменьшение связывания Fc-области анти-SIRPα антитела с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках, например, вследствие модификации Fc-хвоста, как показано, повышает эффективность ADCC терапевтического антитела (трастузумаба; Фигура 2). Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к анти-SIRPα антителу, которое проявляет пониженное связывание с, и/или низкую аффинность для активации, Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках, и которое может быть эффективно использовано в комбинированной терапии с терапевтическим антителом, как более подробно описано в разделе «Использование антител по изобретению или их фрагментов». Такое анти-SIRPα антитело может содержать природную Fc-область, которая имеет низкую аффинность для Fc-рецептора, как, например, Fc IgG4 или IgG2, или такое анти-SIRPα антитело может содержать модифицированную Fc-область, в которой одна или более аминокислот были заменены другой аминокислотой(ами) в сравнении с аналогичной не модифицированной Fc-областью. Альтернативно, ферментативное дегликозилирование уменьшает связывание Fc с Fc-гамма-рецепторами, без необходимости в аминокислотных мутациях. Пониженное связывание в данном контексте означает, что аффинность анти-SIRPα антитела, содержащего модифицированную Fc-область, для активирующих Fc-рецепторов, меньше, чем аффинность анти-SIRPα антитела с теми же вариабельными областями, содержащего аналогичную не модифицированную Fc-область. Предпочтительно, аффинность уменьшается по меньшей мере в 2 раза, предпочтительно по меньшей мере в 3 раза, предпочтительно по меньшей мере в 4 раза, предпочтительно по меньшей мере в 5 раз, предпочтительно по меньшей мере в 10 раз, предпочтительно по меньшей мере в 50 раз, предпочтительно по меньшей мере в 100 раз, предпочтительно по меньшей мере в 1000 раз. Аффинность связывания антител с активирующими Fc-рецепторами, как правило, измеряют с использованием ППР или проточной цитометрии методами, известными в данной области, например, методом, описанным в публикации Harrison et al. in J. Pharm. Biomed. Anal. 2012, 63, 23-28. Анти-SIRPα антитела, проявляющие пониженное связывание или низкую аффинность для человеческого Fcα или Fcγ-рецептора, в сочетании с терапевтическим антителом являются особенно эффективными в клеточном уничтожении раковых клеток в результате усиления ADCC и/или ADCP, и/или ADAP иммунных эффекторных клеток. Как правило, Fc-область анти-SIRPα антитела по изобретению модифицирована для уменьшения связывания с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках.
В предпочтительном варианте осуществления анти-SIRPα антитело по изобретению содержит модифицированную Fc-область, которая проявляет пониженное связывание, или низкую аффинность, предпочтительно отсутствие связывания, с человеческим Fcα или Fcγ-рецептором. Например, связывание IgG1 с Fcγ-рецептором может быть уменьшено путем замены одной или более аминокислот IgG1, выбранных из группы, состоящей из L234, L235, G237, D265, D270, N297, A327, P328 и P329 (нумерация Eu); связывание IgG2 может быть уменьшено путем внесения, например, одной или более из следующих аминокислотных замен: V234A, G237A, P238S, H268A, V309L, A330S и/или P331S; или H268Q, V309L, A330S и/или P331S (аналог нумерации для Eu нумерации IgG1) (Vafa et al. Methods 2014, 65, 114-126); связывание IgG3 может быть уменьшено путем внесения, например, аминокислотных замен L234A и L235A, или аминокислотных замен L234A, L235A и P331S (Leoh et al. Mol. Immunol. 2015, 67, 407-415); и связывание IgG4 может быть уменьшено путем внесения, например, аминокислотных замен S228P, F234A и/или L235A (аналог нумерации для Eu нумерации IgG1) (Parekh et al. mAbs 2012, 4(3), 310-318). Связывание IgA с Fcα-рецептором может быть уменьшено путем внесения, например, одной или более из аминокислотных замен L257R, P440A, A442R, F443R и/или P440R (последовательная нумерация, Pleass et al. J. Biol. Chem. 1999, 271(33), 23508-23514).
Предпочтительно, анти-SIRPα антитело по изобретению содержит модифицированную Fc-область, которая проявляет пониженное связывание, или низкую аффинность, предпочтительно отсутствие связывания, с человеческим Fcα или Fcγ-рецептором в сравнении с таким же анти-SIRPα антителом, содержащим Fc-область дикого типа. Более предпочтительно, модифицированная Fc-область представляет собой Fc-область изотипа IgG. Даже более предпочтительно, модифицированная Fc-область представляет собой Fc-область изотипа IgG1, IgG2 или IgG4. В предпочтительном варианте осуществления анти-SIRPα антитело по изобретению содержит модифицированную Fc-область человеческого IgG1, имеющую одну или более аминокислотных замен в одном или более положениях, выбранных из группы, состоящей из L234, L235, G237, D265, D270, N297, A327, P328 и P329 (нумерация Eu).
В предпочтительном варианте осуществления анти-SIRPα антитело по изобретению содержит модифицированную Fc-область человеческого IgG1, имеющую одну или более аминокислотных замен, выбранных из группы, состоящей из L234A, L234E, L235A, G237A, D265A, D265E, D265N, D270A, D270E, D270N, N297A, N297G, A327Q, P328A, P329A и P329G. Более предпочтительно, одну или более аминокислотных замен выбирают из группы, состоящей из L234A, L234E, L235A, G237A, D265A, D265E, D265N, N297A, P328A, P329A и P329G. Альтернативно, предпочтительно, одну или более аминокислотных замен выбирают из группы, состоящей из L234A, L234E, L235A, G237A, D265A, D265E, D265N, D270A, D270E, D270N, A327Q, P328A, P329A и P329G. Даже более предпочтительно, анти-SIRPα антитело по изобретению содержит модифицированную Fc-область человеческого IgG1, имеющую одну или более аминокислотных замен, выбранных из группы, состоящей из L234A, L234E, L235A, G237A, D265A, D265E, D265N, P328A, P329A и P329G. В предпочтительном варианте осуществления модифицированная Fc-область человеческого IgG1 имеет аминокислотные замены: (i) L234A и L235A; (ii) L234E и L235A; (iii) L234A, L235A и P329A; или (iv) L234A, L235A и P329G. Более предпочтительно, модифицированная Fc-область человеческого IgG1 имеет аминокислотные замены: (i) L234A и L235A; или (ii) L234E и L235A. Наиболее предпочтительно, модифицированная Fc-область человеческого IgG1 имеет аминокислотные замены L234A и L235A. В сочетании с любым из предшествующих вариантов осуществления, в предпочтительном варианте осуществления модифицированная Fc-область IgG1 не имеет аминокислотную замену N297A или N297G. Более предпочтительно, модифицированная Fc-область IgG1 не имеет аминокислотную замену в положении N297. Таким образом, предпочтительно, если аминокислотный остаток в положении 297 в соответствии с нумерацией Eu представляет собой аспарагин. Анти-SIRPα антитело по данному варианту осуществления предпочтительно содержит модифицированную Fc-область изотипа IgG1, имеющую SEQ ID NO:25 (с мутациями L234A и L235A, показанными в положениях 117 и 118).
Получение и очистка антител по изобретению или их фрагментов
Анти-SIRPα антитела по изобретению, или их антигенсвязывающие фрагменты, можно получать любым из множества общепринятых методов. Их, как правило, получают в рекомбинантных экспрессионных системах с использованием любого метода, известного в данной области. Смотри, например, Shukla and Thömmes (Trends in Biotechnol. 2010, 28(5), 253-261), Harlow and Lane. Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1988, и Sambrook and Russell. Molecular Cloning: A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, NY, 2001. Любую экспрессионную систему, известную в данной области, можно использовать для получения рекомбинантных полипептидов по изобретению. Как правило, клетки-хозяева трансформируют рекомбинантным экспрессионным вектором, который содержит ДНК, кодирующую нужный полипептид.
Таким образом, в одном аспекте изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую анти-SIRPα антитело по изобретению или его антигенсвязывающий фрагмент. Одна нуклеотидная последовательность кодирует полипептид, содержащий по меньшей мере вариабельный домен легкой цепи анти-SIRPα антитела по изобретению; другая нуклеотидная последовательность кодирует полипептид, содержащий по меньшей мере вариабельный домен тяжелой цепи анти-SIRPα антитела по изобретению. Таким образом, в предпочтительном варианте осуществления молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую по меньшей мере одну из HCVR и LCVR антитела. Предпочтительная молекула нуклеиновой кислоты представляет собой экспрессионный вектор, в котором нуклеотидные последовательности, кодирующие полипептиды антитела по изобретению, функционально связаны с последовательностями регуляции экспрессии, такими как, например, промотор и лидерная последовательность (также называемая сигнальным пептидом, сигнальной последовательностью, направляющим сигналом, сигналом локализации, последовательностью локализации, транзитным пептидом или лидерным пептидом), для экспрессии кодирующей нуклеотидной последовательности в клетке-хозяине. Предпочтительная лидерная последовательность для тяжелой цепи приведена в SEQ ID NO:28. Предпочтительная лидерная последовательность для легкой цепи приведена в SEQ ID NO:29. Другая подходящая лидерная последовательность для использования по настоящему изобретению, приведена в SEQ ID NO:27.
В другом аспекте изобретение относится к клетке-хозяину, содержащей молекулу нуклеиновой кислоты, описанную выше в данном разделе. Клетка предпочтительно представляет собой выделенную клетку или культивируемую клетку. В число клеток-хозяев, которые могут быть использованы, входят клетки прокариот, дрожжей или высших эукариот. Прокариоты включают грамотрицательные или грамположительные микроорганизмы, например, Escherichia coli или бациллы. Клетки высших эукариот включают клетки насекомых и стабилизированные линии клеток млекопитающих. Примеры подходящих линий клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (CHO), линию клеток COS-7 почки обезьяны (Gluzman et al. Cell 1981, 23, 175), клетки 293 человеческой эмбриональной почки (HEK), клетки L, клетки C127, клетки 3T3, клетки HeLa, линию клеток почки новорожденного хомяка (BHK) и линию клеток CVI/EBNA, полученную из линии клеток CVI почки африканской зеленой мартышки, описанную в публикации McMahan et al. EMBO J. 1991, 10, 2821. Соответствующие клонирующие и экспрессионные векторы для использования с клетками-хозяевами бактерий, грибов, дрожжей и млекопитающих, например, описаны в публикации Pouwels et al. (Cloning Vectors: A Laboratory Manual, Elsevier, New York, 1985).
Трансформированные клетки можно культивировать в условиях, которые стимулируют экспрессию полипептида. Таким образом, в одном аспекте изобретение относится к способу получения анти-SIRPα антитела по изобретению, или его антигенсвязывающего фрагмента, включающему этап культивирования клетки, содержащей по меньшей мере один экспрессионный вектор, описанный в настоящем документе, в условиях, способствующих экспрессии полипептида, и, необязательно, извлечение полипептида.
Анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, можно извлекать общепринятыми методами очистки белков, включая, например, хроматографию на гидроксиапатите, электрофорез в геле, диализ, аффинную хроматографию (такую как, например, хроматография на белок A-сефарозе, белок G-сефарозе), ионообменную хроматографию (такую как, например, анионообменная хроматография, катионообменная хроматография, смешанная хроматография) или хроматографию гидрофобного взаимодействия (смотри, например, Low et al. J. Chromatography B 2007, 848, 48-63; Shukla et al. J. Chromatography B 2007, 848, 28-39). Аффинная хроматография включает аффинную хроматографию с использованием лигандов CaptureSelect™, которые представляют собой уникальный раствор для аффинной очистки на основе фрагментов однодоменных антител (VHH) верблюдовых (смотри, например, Eifler et al. Biotechnology Progress 2014, 30(6), 1311-1318). Полипептиды, предусмотренные для использования по настоящему изобретению, включают практически гомогенные полипептиды рекомбинантного анти-SIRPα антитела, практически свободные от примесных эндогенных материалов.
Модификация(и) аминокислотной последовательности анти-SIRPα антитела по изобретению, или его антигенсвязывающего фрагмента, также предусмотрена. Например, может быть желательным увеличение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают путем внесения соответствующих изменений нуклеотидов в кодирующую антитело нуклеиновую кислоту, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки, и/или замены остатков в аминокислотных последовательностях антитела, или его антигенсвязывающего фрагмента. Любое сочетание делеций, вставок и замен можно производить для получения конечной конструкции, при условии, что конечная конструкция обладает нужными характеристиками. Аминокислотные изменения также могут приводить к изменениям посттрансляционного процессинга антитела, или его антигенсвязывающего фрагмента, таким как изменение количества или положения сайтов гликозилирования.
Вставки в аминокислотную последовательность включают амино- и/или карбокси-концевые слитые фрагменты, имеющие диапазон длин от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие варианты антитела, или его антигенсвязывающего фрагмента, со вставками включают продукт слияния с ферментом или полипептидом, который увеличивает время полураспада в сыворотке антитела или антигенсвязывающего фрагмента.
Другим видом варианта является вариант с аминокислотной заменой. Эти варианты имеют по меньшей мере один аминокислотный остаток в антителе, или его антигенсвязывающем фрагменте, который заменен другим остатком. Такой заместительный мутагенез антител, или их антигенсвязывающих фрагментов, включает изменения FR, описанные выше, а также изменения для уменьшения связывания Fc-области с Fc-рецептором с целью предотвращения активации рецептора, как описано выше.
В другом виде аминокислотного варианта антитела изменен исходный паттерн гликозилирования антитела, или его антигенсвязывающего фрагмента. Под изменением понимают делецию одного или более углеводных фрагментов в антителе, или его антигенсвязывающем фрагменте, и/или добавление одного или более сайтов гликозилирования, которые отсутствуют в антителе, или его антигенсвязывающем фрагменте. Гликозилирование полипептидов, как правило, бывает либо N-связанным, либо O-связанным. N-связанное гликозилирование означает присоединение углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту кроме пролина, являются последовательностями узнавания для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование означает присоединение одного из моносахаридов или производных моносахаридов N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин. Добавление сайтов гликозилирования в антитело удобно осуществлять путем изменения аминокислотной последовательности так, чтобы она содержала одну или более из вышеописанных трипептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение также можно производить путем добавления, или замены на, одного или более остатков серина или треонина в последовательность исходного антитела (для сайтов O-связанного гликозилирования). Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотной последовательности антитела, получают различными способами, известными в данной области. Эти способы включают, но без ограничения, выделение из природного источника (в случае природных вариантов аминокислотной последовательности) или получение путем олигонуклеотид-опосредованного (или сайт-направленного) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученного варианта или неизмененного варианта антитела или его антигенсвязывающего фрагмента.
Композиции, содержащие антитела по изобретению или их фрагменты
В другом аспекте изобретение относится к фармацевтической композиции, содержащей анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, или его фармацевтическое производное или пролекарство, совместно с одним или более фармацевтически приемлемыми эксципиентами, такими как, например, фармацевтически приемлемый носитель, адъювант или среда. Предпочтительно, изобретение относится к фармацевтической композиции, содержащей анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, и фармацевтически приемлемый эксципиент.
Такая фармацевтическая композиция предназначена для введения субъекту. Фармацевтическая композиция по изобретению может быть использована в способах лечения, описанных далее в настоящем документе, путем введения эффективного количества композиции субъекту, который нуждается в этом. Используемый в настоящем документе термин «субъект» относится ко всем животным, классифицируемым как млекопитающие, и охватывает, но без ограничения, приматов и людей. Субъект предпочтительно является человеком.
Используемый в настоящем документе термин «фармацевтически приемлемый эксципиент» должен охватывать любые, и все, растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие абсорбцию средства, и тому подобное, совместимые с фармацевтическим введением (смотри, например, Handbook of Pharmaceutical Excipients, Rowe et al. Eds. 7-е издание, 2012, www.pharmpress.com). Использование таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением тех случаев, когда общепринятые среды или средства несовместимы с активным соединением, их использование в композиции предусмотрено. Приемлемые эксципиенты, включая носители или стабилизаторы, нетоксичны для реципиентов в используемых дозах и концентрациях, и включают буферы, такие как фосфат, цитрат, ацетат, гистидин и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметэтония хлорид; бензалкония хлорид, бензэтония хлорид; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы) и/или неионные сурфактанты, такие как полисорбат (например, твин™), полоксамер (например, плюроники™), гидроксипропил-β-циклодекстрин или полиэтиленгликоль (ПЭГ).
Дополнительные активные соединения также можно включать в фармацевтическую композицию по изобретению. Таким образом, в конкретном варианте осуществления фармацевтическая композиция по изобретению также может содержать более одного активного соединения, необходимого для лечения конкретного состояния, предпочтительно соединения с дополняющими активностями, которые не влияют отрицательно друг на друга. Эффективное количество такого другого активного средства зависит, в числе прочего, от количества анти-SIRPα антитела по изобретению, или его антигенсвязывающего фрагмента, присутствующего в фармацевтической композиции, вида заболевания или нарушения, или лечения и так далее.
В одном из вариантов осуществления анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, готовят с носителями, которые будут защищать указанное соединение от быстрой элиминации из организма, например, в виде препарата с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки, например, липосомы. Можно использовать биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких препаратов известны специалистам в данной области. Липосомные суспензии, включая направленные липосомы, также можно использовать в качестве фармацевтически приемлемых носителей. Их можно получать способами, известными специалистам в данной области, например, как описано в патенте США № 4522811 или WO2010/095940.
Путь введения анти-SIRPα антитела по изобретению, или его антигенсвязывающего фрагмента, может быть пероральным, парентеральным, ингаляционным или топическим. Используемый в настоящем документе термин «парентеральный» путь введения включает внутривенное, внутриартериальное, в лимфатические узлы, внутрибрюшинное, внутримышечное, подкожное, ректальное или вагинальное введение. Внутривенные формы парентерального введения являются предпочтительными. «Системное введение» означает пероральное, внутривенное, внутрибрюшинное и внутримышечное введение. Количество антитела, необходимое для терапевтического или профилактического эффекта, будет, безусловно, варьироваться в зависимости от выбранного антитела, природы и степени тяжести подвергаемого лечению состояния, а также от субъекта. Кроме того, антитело можно вводить путем импульсной инфузии, например, с убывающими дозами антитела. Предпочтительно, введение доз выполняют путем инъекций, наиболее предпочтительно внутривенных или подкожных инъекций, частично в зависимости от того, является ли введение кратковременным или постоянным.
Таким образом, в конкретном варианте осуществления фармацевтическая композиция по изобретению может находиться в форме, подходящей для парентерального введения, такой как стерильные растворы, суспензии или лиофилизированные препараты в подходящей стандартной лекарственной форме. Фармацевтические композиции, подходящие для инъекционного введения, включают стерильные водные растворы (в случае водорастворимы препаратов) или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий непосредственно перед введением. В случае внутривенного введения подходящие носители включают физиологический солевой раствор, бактериостатическую воду, кремофор EM (BASF, Parsippany, NJ) или фосфатно-солевой буфер (PBS). Во всех случаях композиция должна быть стерильной и должна быть жидкой, чтобы ее легко можно было вводить шприцем. Она должна быть стабильной в условиях производства и хранения, и должна быть защищена от загрязнения микроорганизмами, такими как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, фармацевтически приемлемый полиол, такой как глицерин, пропиленгликоль, жидкий полиэтиленгликоль, а также их подходящие смеси. Надлежащую текучесть можно поддерживать, например, за счет использования такого покрытия, как лецитин, путем поддержания необходимого размера частиц в случае дисперсии и путем использования сурфактантов. Действие микроорганизмов можно предотвращать с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и тому подобного. Во многих случаях в композицию будет предпочтительно включать изотонические средства, например, сахара, полиспирты, такие как маннит или сорбит, или хлорид натрия.
Продолжительной абсорбции инъекционных композиций можно добиваться путем включения в композицию средства, замедляющего абсорбцию, например, алюминия моностеарата или желатина.
Стерильные инъекционные растворы можно получать путем включения активного соединения (например, полипептида или антитела) в необходимом количестве в соответствующий растворитель с одним, или с сочетанием ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии готовят путем включения активного соединения в стерильный носитель, который содержит базовую дисперсионную среду и необходимые другие ингредиенты из тех, которые перечислены выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами получения являются вакуумная сушка и лиофилизация, с получением порошка активного ингредиента плюс любой дополнительный нужный ингредиент из его ранее стерилизованного фильтрованием раствора.
В конкретном варианте осуществления указанную фармацевтическую композицию вводят внутривенным (в/в) или подкожным (п/к) путем введения. Можно использовать соответствующие эксципиенты, такие как наполнители, буферные средства или сурфактанты. Указанные препараты получают стандартными способами получения парентерально вводимых композиций, как хорошо известно в данной области и описано более подробно в различных литературных источниках, включая, например, Remington: The Science and Practice of Pharmacy. Allen Ed. 22nd edition, 2012, www.pharmpress.com).
Особенно предпочтительно формулировать фармацевтические композиции, а именно, парентеральные композиции, в стандартной лекарственной форме для легкости введения и для единообразия доз. Используемый в настоящем документе термин «стандартная лекарственная форма» означает физически дискретные единицы, подходящие для однократного введения дозы субъекту, получающему лечение; каждая единица содержит заранее определенное количество активного соединения (анти-SIRPα антитела по изобретению или его антигенсвязывающего фрагмента), рассчитанное для оказания желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификации для стандартных лекарственных форм по изобретению продиктованы и напрямую зависят от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, а также ограничений, принятых в области изготовления такого активного соединения для лечения индивидуумов.
Как правило, эффективное вводимое количество анти-SIRPα антитела по изобретению будет зависеть от относительной эффективности выбранного соединения, степени тяжести заболевания, подвергаемого лечению, и массы тела больного. Однако активные соединения, как правило, вводят один или более раз в сутки, например, 1, 2, 3 или 4 раза в сутки, с типичными суммарными суточными дозами в диапазоне от 0,001 до 1000 мг/кг массы тела/сутки, предпочтительно от примерно 0,01 до примерно 100 мг/кг массы тела/сутки, наиболее предпочтительно от примерно 0,05 до 10 мг/кг массы тела/сутки. Руководства для выбора соответствующих доз антител доступны (смотри, например, Wawrzynczak (1996) Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK; Kresina (ed.) (1991) Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, N.Y.; Bach (ed.) (1993) Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, N.Y.; Baert et al. (2003) New Engl. J. Med. 1999, 348, 601-608; Milgrom et al. New Engl. J. Med. 1999, 341, 1966-1973; Slamon et al. New Engl. J. Med. 2001, 344, 783-792; Beniaminovitz et al. New Engl. J. Med. 2000, 342, 613-619; Ghosh et al. New Engl. J. Med. 2003, 348, 24-32; Lipsky et al. New Engl. J. Med. 2000, 343, 1594-1602).
Соответствующую дозу определяет клиницист, например, с использованием параметров или факторов, которые, как известно или предполагается в данной области, влияют на лечение или предположительно будут влиять на лечение. Как правило, введение доз начинают с количества, которое намного меньше оптимальной дозы, и увеличивают с небольшими приращениями до достижения желаемого или оптимального эффекта относительно любых отрицательных побочных эффектов. Важные диагностические показатели включают симптомы, например, воспаления, или уровень продуцируемых воспалительных цитокинов. Антитела, или фрагменты антител, можно вводить путем непрерывной инфузии, или отдельными дозами с интервалами, например, один день, одна неделя, либо 1-7 раз в неделю. Альтернативно, антитела, или фрагменты антител, можно вводить один раз в день, через день, 2-3 раза в неделю, раз в 2 недели, раз в 3 недели, раз в 6 недель. Предпочтительным протоколом введения доз является протокол, включающий максимальную дозу или частоту введения доз, которые позволяют избегать значительных нежелательных побочных эффектов. Суммарная или средняя недельная доза, как правило, составляет по меньшей мере 0,05 мкг/кг массы тела, как правило, по меньшей мере 0,2 мкг/кг, как правило, по меньшей мере 0,5 мкг/кг, как правило, по меньшей мере 1 мкг/кг, более конкретно по меньшей мере 10 мкг/кг, чаще всего, по меньшей мере 100 мкг/кг, предпочтительно по меньшей мере 0,2 мг/кг, более предпочтительно по меньшей мере 1,0 мг/кг, наиболее предпочтительно по меньшей мере 2,0 мг/кг, оптимально по меньшей мере 10 мг/кг, более оптимально по меньшей мере 25 мг/кг, и наиболее оптимально по меньшей мере 50 мг/кг (смотри, например, Yang et al. New Engl. J. Med. 2003 349, 427-434; Herold et al. New Engl. J. Med. 2002, 346, 1692-1698; Liu et al. J. Neurol. Neurosurg. Psych. 1999, 67, 451-456; Portielje et al. Cancer Immunol. Immunother. 2003, 52, 133-144). Предпочтительно, суммарная или средняя недельная доза находится в диапазоне от 0,001 до 100 мг/кг массы тела, предпочтительно от примерно 0,01 до примерно 50 мг/кг массы тела, предпочтительно от примерно 0,05 до примерно 30 мг/кг массы тела, наиболее предпочтительно от примерно 0,1 до 10 мг/кг массы тела.
Фармацевтические композиции могут быть заключены в контейнер, пакет или дозатор, совместно с инструкциями по введению.
Анти-SIRPα антитела по настоящему изобретению, или их антигенсвязывающие фрагменты, предпочтительно используют в сочетании с терапевтическим антителом, как более подробно описано в следующем разделе, и, возможно, в сочетании с другими лекарственными средствами. Терапевтическое антитело может составлять часть той же композиции, или быть предоставлено в виде отдельной композиции для введения в одно и то же время, или в другое время. Альтернативно или в сочетании с любым из предшествующих вариантов осуществления, любые другие лекарственные средства могут составлять часть той же композиции, или быть предоставлены в виде отдельной композиции для введения в одно и то же время, или в другое время.
Предпочтительно, фармацевтическая композиция по изобретению имеет форму лиофилизированной таблетки (лиофилизированных порошков), которую необходимо растворять (то есть, восстанавливать) (в водной среде) перед внутривенным введением, или форму замороженного (водного) раствора, который необходимо размораживать перед введением. Наиболее предпочтительно, фармацевтическая композиция имеет форму лиофилизированной таблетки. Соответствующие фармацевтически приемлемые эксципиенты для включения в фармацевтическую композицию (перед лиофилизацией) по настоящему изобретению включают буферные растворы (например, цитрат, ацетат, гистидин или сукцинат, содержащий соли, в воде), лиопротекторы (например, сахарозу, трегалозу), модифицирующие тоничность средства (например, хлорид натрия), сурфактанты (например, полисорбат или гидроксипропил-β-циклодекстрин) и наполнители (например, маннит, глицин). Эксципиенты, используемые для лиофилизированных белковых препаратов, выбирают на основании их способности предотвращать денатурацию белка в процессе лиофилизации, а также при хранении.
Использование антител по изобретению или их фрагментов
Анти-SIRPα антитела, их антигенсвязывающие фрагменты и фармацевтические композиции по изобретению будут полезны в лечении заболеваний, состояний и нарушений, при которых экспрессируется SIRPα или при которых экспрессируются SIRPα и CD47, предпочтительно избыточно экспрессируются, в частности, в лечении CD47-экспрессирующего рака.
Таким образом, в следующем аспекте настоящее изобретение относится к анти-SIRPα антителу по изобретению, или его антигенсвязывающему фрагменту, или фармацевтической композиции по изобретению для использования в качестве лекарственного препарата.
В другом аспекте настоящее изобретение относится к анти-SIRPα антителу по изобретению, или его антигенсвязывающему фрагменту, или фармацевтической композиции по изобретению для использования в лечении рака, предпочтительно в лечении CD47-экспрессирующего рака.
Установлено, что CD47 экспрессируется на человеческих опухолях нескольких видов, включая острый миелоидный лейкоз (AML), рак молочной железы, хронический миелоидный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL), острый лимфобластный лейкоз (ALL), неходжскинскую лимфому (NHL), в том числе фолликулярную лимфому (FL) и диффузную крупноклеточную B-клеточную лимфому (DLBCL), печеночно-клеточную карциному, множественную миелому (MM), рак мочевого пузыря, рак толстого кишечника, рак желудка, рак яичника, рак головы и шеи, нейробластому, меланому, остеосаркому, рак поджелудочной железы, почечную карциному, рак предстательной железы, печеночно-клеточную карциному, рак легкого и другие солидные опухоли (Chao et al. Curr Opin Immunol. 2012, 24(2), 225-232; Chao et al. Cell 2010, 142(5), 699-713; Rösner et al. Mol Cancer Ther. 2018). Увеличение экспрессии было обнаружено в некоторых из этих опухолей в сравнении с их нормальными клеточными аналогами (Russ et al. Blood Rev. 2018, doi: 10.1016/j.blre.2018.04.005). Было выдвинуто предположение, что - наряду с другими гипотетическими механизмами CD47 - повышение регуляции CD47 в опухолевых клетках позволяет опухолям уклоняться от надзора врожденной иммунной системы путем избегания фагоцитоза (Chao et al. Curr Opin Immunol. 2012, 24(2), 225-232).
Интересно, что Yanagita с соавторами сообщали, что клетки почечноклеточного рака и меланомы человека в высокой степени экспрессируют SIRPα (Yanagita et al. JCI Insight 2017, 2(1), e89140). Кроме того, экспрессия SIRPα была обнаружена на некоторых клетках нейробластомы и при остром миелоидном лейкозе (AML). Sosale с соавторами сообщали об экспрессии SIRPα на клетках карциномы легкого и глиобластомы (Sosale et al. Mol.Ther.Способы Clin.Dev. 2016, 3, 16080). Chen с соавторами сообщали об экспрессии SIRPα на клетках астроцитомы и глиобластомы (Chen et al. Cancer Res 2004, 64(1), 117-127). Клетки мезотелиомы и B-клеточной лимфомы также могут быть SIRPα-положительными. Таким образом, в другом аспекте настоящее изобретение относится к анти-SIRPα антителу по изобретению, или его антигенсвязывающему фрагменту, или фармацевтической композиции по изобретению для использования в лечении заболевания, состояния или нарушения, при котором экспрессируется SIRPα, в частности, в лечении SIRPα-экспрессирующего рака, такого как, например, почечноклеточный рак и меланома человека, но также и при аутоиммунном заболевании, например, при ревматоидном артрите, рассеянном склерозе и, возможно, гранулематозе с полиангиитом (GPA), микроскопическом полиангиите (MPA) и обыкновенной пузырчатке (PV). Анти-SIRPα антитела также могут повышать эффективность другого антитела при заболеваниях, используют ли это последнее антитело для устранения патогенных, или инфицированных клеток. В случае SIRPα-экспрессирующей опухоли, анти-SIRPα антитело по изобретению, содержащее человеческую Fc-область дикого типа, может быть подходящим в качестве монотерапии. В одном варианте осуществления изобретение относится к анти-SIRPα антителу, содержащему Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках, для использования в лечении SIRPα-положительных солидных опухолей и гематологических злокачественных новообразований у человека, предпочтительно почечноклеточного рака или злокачественной меланомы. Предпочтительно, Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках, имеет изотип IgA или IgG. Более предпочтительным является анти-SIRPα антитело, содержащее Fc-область изотипа IgG1, IgG2, IgG3 или IgG4; даже более предпочтительным является изотип IgG1, IgG2 или IgG4. Наиболее предпочтительным является анти-SIRPα антитело, содержащее Fc-область изотипа IgG1.
Как указано выше, анти-SIRPα антитела по изобретению, или их антигенсвязывающие фрагменты, в которых, предпочтительно, эффекторная функция Fc частично или полностью нарушена, могут быть использованы для улучшения эффекторных функций - например, для повышения ADCC - терапевтического антитела. Предпочтительно, рак, который предстоит лечить таким антителом по изобретению, или его антигенсвязывающим фрагментом, и терапевтическим антителом, не экспрессирует SIRPα. Такой способ лечения предпочтительно объединяют с одним или более дополнительными видами противораковой терапии. Обнаружено, что анти-SIRPα антитело, содержащее модифицированную Fc-область, которая проявляет пониженное связывание с человеческим Fcα или Fcγ-рецептором в сравнении с таким же анти-SIRPα антителом, содержащим Fc-область дикого типа, как описано выше в настоящем документе, повышает in vitro ADCC терапевтического антитела при использовании нейтрофилов в качестве эффекторных клеток. Антитела 1-13, описанные в разделе «Примеры», демонстрируют зависимое от дозы возрастание in vitro ADCC при использовании нейтрофилов от гетерозиготных SIRPα1/SIRPαBIT доноров. Предпочтительными антителами являются антитела, которые повышают in vitro ADCC при использовании нейтрофилов в максимальной степени, где предпочтительно с отсутствием признаков иммуногенности in vitro в анализе T-клеточной пролиферации и/или IL-2 ELIspot. Наиболее предпочтительными являются антитела 1-6, 12 и 13, предпочтительно антитело 6.
Предпочтительно, терапевтическое антитело представляет собой антитело, одобренное органами государственного регулирования и контроля оборота лекарственных средств, такими как Европейское агентство по лекарственным средствам (EMA) или Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA). Можно сверяться с электронной системой базы данных большинства органов государственного регулирования и контроля для установления того, одобрено ли антитело для использования в области медицины.
Как правило, терапевтическое антитело для использования в сочетании с анти-SIRPα антителом по изобретению (предпочтительно, с пониженным связыванием его Fc-области), или его антигенсвязывающим фрагментом, представляет собой моноспецифическое или биспецифическое антитело, или фрагмент антитела, содержащее по меньшей мере одну из HCVR и LCVR, связывающуюся с мишенью, выбранной из группы, состоящей из аннексина A1, AMHR2, AXL, BCMA, B7H3, B7H4, CA6, CA9, CA15-3, CA19-9, CA27-29, CA125, CA242, CCR2, CCR4, CCR5, CD2, CD4, CD16, CD19, CD20, CD22, CD27, CD30, CD33, CD37, CD38, CD40, CD44, CD47, CD52, CD56, CD70, CD74, CD79, CD98, CD115, CD123, CD138, CD203c, CD303, CD333, CEA, CEACAM, CLCA-1, CLL-1, c-MET, Cripto, CTLA-4, DLL3, EGFL, EGFR, EPCAM, EPh (например, EphA2 или EPhB3), рецептора эндотелина B (ETBR), FAP, FcRL5 (CD307), FGF, FGFR (например, FGFR3), FOLR1, фукозил-GM1, GCC, GD2, GPNMB, gp100, HER2, HER3, HMW-MAA, интегрина α (например, αvβ3 и αvβ5), IGF1R, IL1RAP, каппа-антигена миеломы, TM4SF1 (или антигена L6), Lewis A-подобного углевода, Lewis X, Lewis Y, LIV1, мезотелина, MUC1, MUC16, NaPi2b, нектина 4, PD-1, PD-L1, рецептора пролактина, PSMA, PTK7, SLC44A4, STEAP-1, антигена 5T4 (или TPBG, трофобластного гликопротеина), TF (тканевого фактора), антигена Томсона-Фриденрайха (TF-Ag), Tag72, TNF, TNFR, TROP2, VEGF, VEGFR и VLA.
Неограничивающими примерами видов рака, которые экспрессируют такую мишень, являются: (HER2-положительный) рак молочной железы, (EGFR-положительная) карцинома толстой кишки, (GD2-положительная) нейробластома, меланома, остеосаркома, (CD20-положительные) B-клеточные лимфомы, (CD38-положительная) множественная миелома, (CD52-положительная) лимфома и (CD33-положительный) острый миелоидный лейкоз (AML).
Предпочтительным является моноспецифическое терапевтическое антитело. Более предпочтительным является терапевтическое антитело против связанной с мембраной мишени на поверхности опухолевых клеток.
В предпочтительном варианте осуществления терапевтическое антитело против связанной с мембраной мишени на поверхности опухолевых клеток содержит человеческую Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках. Посредством связывания с этими активирующими Fc-рецепторами, описанными выше в настоящем документе, терапевтическое антитело, содержащее человеческую Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках, может индуцировать ADCC и/или ADCP. Терапевтические антитела изотипов IgG, IgE или IgA человека содержат человеческую Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках.
Предпочтительным терапевтическим антителом для использования по изобретению является терапевтическое антитело изотипа IgG или IgA. Более предпочтительным является терапевтическое антитело изотипа IgG, например, IgG1, IgG2, IgG3 и IgG4 антитела. Даже более предпочтительным является терапевтическое антитело изотипа IgG1 или IgG2. Наиболее предпочтительным является терапевтическое антитело изотипа IgG1.
Подходящие терапевтические антитела для использования в сочетании с анти-SIRPα антителом по изобретению, или его антигенсвязывающим фрагментом, включают алемтузумаб (например, для лечения рассеянного склероза), обинутузумаб (например, для лечения CLL, FL), офатумумаб (например, для лечения MM), даратумумаб (например, для лечения MM), трастузумаб (например, для лечения избыточно экспрессирующего HER-2 рака молочной железы, рака желудка, аденокарциномы гастроэзофагеального соединения), динутуксимаб (например, для лечения нейробластомы у педиатрических пациентов), панитумумаб, цетуксимаб (например, для лечения рака головы и шеи, колоректального рака), ритуксимаб, офатумумаб (например, для лечения NHL, CLL, FL, DLBCL), ублитуксимаб, маргетуксимаб, пертузумаб, велтузумаб, брентуксимаб, элотузумаб, ибритумомаб, ифаботузумаб, фарлетузумаб, отиертузумаб, каротуксимаб, эпратузумаб, инебилизумаб, лумретузумаб, могамулизумаб, лейкотуксимаб, изатуксимаб, опортузумаб, энситуксимаб, цемиплимаб, ниволумаб, пембролизумаб, дурвалумаб, авелумаб, атезолизумаб, спартализумаб, тислелизумаб, камрелизумаб, синтилимаб, цемиплимаб. Такие терапевтические антитела также могут быть предоставлены в виде части конъюгата антитело-лекарственное средство (ADC). Подходящие ADC для использования в сочетании с анти-SIRPα антителом по изобретению, или его антигенсвязывающим фрагментом, включают, но без ограничения, трастузумаб дуокармазин, трастузумаб дерукстекан, трастузумаб эмтансин, гемтузумаб озагомицин, инотузумаб озагомицин, полатузумаб ведотин, наратуксимаб эмтансин, ибритутомаб тиуксетан и брентуксимаб ведотин.
Антитела по изобретению, или их антигенсвязывающие фрагменты, и терапевтическое антитело могут находиться в одном и том же препарате, или могут быть введены в разных препаратах. Введение может быть одновременным или последовательным, и может быть выполнено в любом порядке.
Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к анти-SIRPα антителу по изобретению, или его антигенсвязывающему фрагменту, для использования в лечении солидных опухолей и гематологических злокачественных новообразований у человека в сочетании с использованием терапевтического антитела против связанной с мембраной мишени на поверхности опухолевых клеток, содержащего человеческую Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках, где анти-SIRPα антитело содержит модифицированную Fc-область, которая проявляет пониженное связывание с человеческим Fcα или Fcγ-рецептором в сравнении с таким же анти-SIRPα антителом, содержащим Fc-область дикого типа, предпочтительно модифицированную Fc-область человеческого IgG1, имеющую одну или более аминокислотных замен в положениях, выбранных из группы, состоящей из: L234, L235, G237, D265, D270, N297, A327, P328 и P329 (нумерация Eu).
Альтернативно или в сочетании с любым из других вариантов осуществления, в одном из вариантов осуществления настоящее изобретение относится к использованию анти-SIRPα антитела по изобретению, или его антигенсвязывающего фрагмента, или фармацевтической композиции по изобретению для производства лекарственного препарата для лечения заболевания, состояния или нарушения, при котором экспрессируется, предпочтительно избыточно экспрессируется, CD47, в частности, для лечения рака. Для иллюстративных неограничивающих примеров рака, который можно лечить в соответствии с изобретением, смотри выше в настоящем документе. В предпочтительном варианте осуществления анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, или фармацевтическая композиция по изобретению предназначены для одновременного или последовательного введения с терапевтическим антителом, описанным выше.
Альтернативно или в сочетании с любым из других вариантов осуществления, в одном из вариантов осуществления настоящее изобретение относится к использованию анти-SIRPα антитела по изобретению, или его антигенсвязывающего фрагмента, или фармацевтической композиции по изобретению для производства лекарственного препарата для лечения SIRPα-экспрессирующего рака, такого как почечноклеточный рак или меланома человека. В предпочтительном варианте осуществления анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, или фармацевтическая композиция по изобретению предназначены для одновременного или последовательного введения с терапевтическим антителом, описанным выше.
Альтернативно или в сочетании с любым из других вариантов осуществления, в одном из вариантов осуществления настоящее изобретение относится к способу лечения рака, в частности, рака, опухолевые клетки которого экспрессируют CD47 или SIRPα, включающему введение субъекту, который нуждается в указанном лечении, терапевтически эффективного количества анти-SIRPα антитела по изобретению, или его антигенсвязывающего фрагмента, или фармацевтической композиции по изобретению. В конкретном варианте осуществления указанный рак представляет собой рак, характеризующийся тем, что его опухолевые клетки экспрессируют CD47, потенциально избыточно экспрессируют CD47. Для иллюстративных неограничивающих примеров CD47-экспрессирующих видов рака, который можно лечить в соответствии с изобретением, смотри выше в настоящем документе. В альтернативном варианте осуществления SIRPα-экспрессирующий рак представляет собой почечноклеточный рак или меланому, или нейробластому, или острый миелоидный лейкоз (AML) человека.
Предпочтительно, если анти-SIRPα антитело по изобретению, или его антигенсвязывающий фрагмент, или композиция по изобретению ингибирует рост опухолевых клеток, экспрессирующих CD47, при использовании в сочетании с терапевтическим антителом. «Ингибирование роста опухолевых клеток, экспрессирующих CD47» или «ингибирование роста» означает, что достигается измеримое ингибирование роста раковых клеток (экспрессирующих или избыточно экспрессирующих CD47). Предпочтительные ингибирующие рост анти-SIRPα антитела ингибируют рост CD47-экспрессирующих опухолевых клеток на более чем 20%, предпочтительно от примерно 20% до примерно 50%, и даже более предпочтительно, на более чем 50% (например, от примерно 50% до примерно 100%) в сравнении с соответствующим контролем, где контроль, как правило, представляет собой опухолевые клетки, не обработанные тестируемым антителом. В одном варианте осуществления ингибирование роста можно измерять при концентрации антитела от примерно 0,1 до 30 мг/мл или от примерно 0,5 нМ до 200 нМ в клеточной культуре, где ингибирование роста определяют через 1-10 дней после воздействия антитела на опухолевые клетки. Ингибирование роста опухолевых клеток in vivo можно определять различными способами, например, как описано в EP2474557B1. Антитело является ингибирующим рост in vivo, если введение анти-SIRPα антитела в дозе от примерно 1 мг/кг до примерно 100 мг/кг массы тела приводит к уменьшению размера опухоли или пролиферации опухолевых клеток в течение срока от примерно 5 дней до 3 месяцев после первого введения антитела, предпочтительно в течение срока от примерно 5 дней до 30 дней.
Антитело, которое «вызывает гибель клеток», представляет собой антитело, которое делает жизнеспособные клетки нежизнеспособными. Клетка представляет собой клетку, которая экспрессирует CD47. Гибель клеток in vitro можно определять в отсутствие комплемента и иммунных эффекторных клеток, чтобы отличать гибель клеток, вызванную ADCC. Таким образом, анализ на гибель клеток можно проводить с использованием инактивированной нагреванием сыворотки (то есть, в отсутствие комплемента) в отсутствие иммунных эффекторных клеток. Для определения того, способно ли антитело вызывать гибель клеток, можно оценивать утрату целостности мембраны на основании поглощения пропидий иодида (PI), трипанового синего (смотри Moore et al. Cytotechnology 1995; 17, 1-11) или 7-AAD в сравнении с необработанными клетками, или утрату жизнеспособности клеток (восстановление тетразолия, восстановление резазурина, маркеры протеазы и определение АТФ).
Выражение «терапевтически эффективное количество» означает количество, эффективное для лечения рака, как было определено ранее; указанное количество может представлять собой количество, достаточное для вызывания желаемого ответа, или для ослабления симптома или признака, например, метастазирования или прогрессирования, размера или роста первичной опухоли. Терапевтически эффективное количество для конкретного субъекта может варьироваться в зависимости от таких факторов, как состояние, которое подвергают лечению, общее состояние здоровья субъекта, способ, путь и доза введения, а также степень тяжести побочных эффектов. Критерии оценки ответа описаны (RECIST; Eisenhauer et al. European Journal of Cancer 2009; 45, 228-247; Schwartz et al. European Journal of Cancer 2016; 62, 138-145; Cheson et al. Journal of Clinical Oncology 2003; 21(24), 4642-4649; Moghbel et al. Journal of Nuclear Medicine 2016, 57(6), 928-935; литературные источники включены посредством ссылки в полном объеме). Предпочтительно, эффект приведет к стазу опухоли (то есть, без уменьшения, но с сохранением существующего состояния), уменьшению числа лезий или уменьшению размера опухоли на по меньшей мере примерно 10%, предпочтительно по меньшей мере 20%, 30%, 50%, 70% или даже 90%, или более, в сравнении с исходным размером опухоли, предпочтительно уменьшению на по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% суммы диаметров целевых лезий, принимая за основу исходную сумму диаметров. В случае использования сочетания терапевтически эффективное количество пропорционально сочетанию компонентов, и эффект не ограничен только отдельными компонентами. Терапевтически эффективное количество будет модулировать симптомы предпочтительно на по меньшей мере примерно 10%; предпочтительно на по меньшей мере примерно 20%; предпочтительно на по меньшей мере примерно 30%; или более предпочтительно на по меньшей мере примерно 50%. Альтернативно, модуляция миграции будет означать, что затронута миграция или направленная миграция клеток разных типов. Это приведет, например, к статистически значимым и поддающимся количественной оценке изменениям числа затронутых клеток. Это может представлять собой уменьшение числа целевых клеток, которые привлечены в течение определенного периода времени или в целевую область. Также можно проводить мониторинг степени прогрессирования, размера, распространения или роста первичной опухоли.
В предпочтительном варианте осуществления настоящее изобретение относится к анти-SIRPα антителу, или его антигенсвязывающему фрагменту, или фармацевтической композиции, описанным выше в настоящем документе, для использования в лечении заболевания, состояния или нарушения, при котором экспрессируется CD47, в частности, рака, более конкретно, солидной опухоли или гематологического новообразования у человека, в сочетании с использованием терапевтического антитела и также в сочетании с одним или более другими видами противораковой терапии. Соответствующие другие виды противораковой терапии включают, но без ограничения, хирургическую операцию, химиотерапию, лучевую терапию, гормональную терапию и направленную терапию низкомолекулярными соединениями, такими как, например, ингибиторы ангиогенеза. Анти-SIRPα антитело, или его антигенсвязывающий фрагмент, или фармацевтическая композиция, описанные выше в настоящем документе, могут быть предназначены для одновременного или последовательного использования в лечении солидных опухолей и гематологических злокачественных новообразований у человека в сочетании с использованием одного или более других видов противораковой терапии. В частности, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, или фармацевтическая композиция, описанные выше в настоящем документе, могут быть предназначены для использования в лечении солидных опухолей и гематологических злокачественных новообразований у человека после использования одного или более других видов противораковой терапии.
Предпочтительно, настоящее изобретение относится к анти-SIRPα антителу, или его антигенсвязывающему фрагменту, или фармацевтической композиции, описанным выше в настоящем документе, для использования в лечении заболевания, состояния или нарушения, при котором экспрессируется CD47, в сочетании с использованием одного или более дополнительных противораковых терапевтических соединений. Используемый в настоящем документе термин «противораковое терапевтическое соединение» не должен включать терапевтическое антитело. Определение терапевтического антитела приведено выше в настоящем документе. Таким образом, анти-SIRPα антитело, или его антигенсвязывающий фрагмент, или фармацевтическая композиция, описанные выше в настоящем документе, предпочтительно в сочетании с терапевтическим антителом, определение которому дано выше, могут быть предназначены для использования в лечении солидных опухолей и гематологических злокачественных новообразований у человека до, после или одновременно с использованием одного или более других противораковых терапевтических соединений.
Соответствующие противораковые терапевтические соединения включают цитотоксическое средство, то есть, вещество, которое ингибирует или предотвращает функцию клеток и/или вызывает гибель клеток. Термин должен охватывать химиотерапевтические средства, то есть, химические соединения, полезные для лечения рака, радиоактивные терапевтические средства, например, радиоактивные изотопы, гормональные терапевтические средства, направленные терапевтические средства и иммунотерапевтические средства. Соответствующие химиотерапевтические средства включают алкилирующие средства, такие как азотистые иприты, нитрозомочевина, тетразины и азиридины; антиметаболиты, такие как антифолаты, фторпиримидины, аналоги дезоксинуклеозидов и тиопурины; средства, направленные против микротрубочек, такие как алкалоиды барвинка и таксаны; ингибиторы топоизомеразы I и II; а также цитотоксические антибиотики, такие как антрациклины и блеомицины. Например, режим химиотерапии может быть выбран из группы, состоящей из CHOP (циклофосфамид, доксорубицин (также называемый гидроксилдаунорубицином), винкристин (также называемый онковином) и преднизон), ICE (идарубицин, цитарабин и этопозид), митоксантрона, цитарабина, DVP (даунорубицин, винкристин и преднизон), ATRA (полностью транс-ретиноевая кислота), идарубицина, режима химиотерапии Холзера, ABVD (блеомицин, декарбазин, доксорубицин и винкристин), CEOP (циклофосфамид, эпирубицин, винкристин и преднизолон), 2-CdA (2-хлордезоксиаденозин), FLAG и IDA (флударабин, цитарабин, филгастрим и идарубицин) (с использованием, или без использования, последующего лечения G-CSF (гранулоцитарный колониестимулирующий фактор) или GM-CSF), VAD (винкристин, доксорубицин и дексаметазон), M и P (мелфалан и преднизон), C (циклофосфамид) еженедельно, ABCM (адриамицин, блеомицин, циклофосфамид и митомицин C), MOPP (мехлорэтамин, винкристин, преднизон и прокарбазин) и DHAP (дексаметазон, цитарабин и цисплатин). Предпочтительным режимом химиотерапии является CHOP. Соответствующие радиоактивные терапевтические средства включают радиоизотопы, такие как 131I-метайодбензилгуанидин (MIBG), 32P в виде фосфата натрия, хлорид 223Ra, хлорид 89Sr и диаминтетраметиленфосфонат 153Sm (EDTMP). Соответствующие средства, используемые в качестве гормональных терапевтических средств, включают ингибиторы синтеза гормонов, например, ингибиторы ароматазы, и аналоги GnRH; а также антагонисты рецепторов гормонов, например, селективные модуляторы рецепторов эстрогенов и антиандрогены. Описанное в настоящем документе направленное терапевтическое средство представляет собой терапевтическое средство, которое служит препятствием для специфических белков, вовлеченных в образование опухолей и пролиферацию клеток, и может представлять собой низкомолекулярное лекарственное средство; либо пептид или пептидное производное. Примеры направленных низкомолекулярных лекарственных средств включают ингибиторы mTOR, такие как эверолимус, темсиролимус и рапамицин; ингибиторы киназы, такие как иматиниб, дазатиниб и нилотиниб; ингибиторы VEGF, такие как сорафениб и регорафениб; и ингибиторы EGFR/HER2, такие как гефитиниб, лапатиниб и эрлотиниб. Примеры пептидов или пептидных производных, являющихся направленными терапевтическими средствами, включают ингибиторы протеасом, такие как бортезомиб и карфилзомиб. Иммунотерапевтические средства включают средства, которые индуцируют, усиливают или подавляют иммунный ответ, такие как цитокины (IL-2 и IFN-α); иммуномодулирующие имидные лекарственные средства, такие как талидомид, леналидомид и помалидомид; терапевтические противораковые вакцины, такие как талимоген лахерпарепвек; клеточные иммунотерапевтические средства, такие как вакцины на основе дендритных клеток, адоптивные T-клетки и модифицированные химерным антигенным рецептором T-клетки); или иммунотоксины, такие как моксетумомаб пасудотокс.
Любые из вышеупомянутых терапевтических методов можно использовать для любого субъекта, который нуждается в такой терапии, включая, например, млекопитающих, предпочтительно приматов, в том числе, например, отличных от людей приматов, и наиболее предпочтительно, людей.
В настоящем документе и в формуле изобретения глагол «включать», и его вариации, используют в неограничивающем смысле для указания на то, что объекты, перечисленные после этого слова, включены, но не указанные конкретно объекты не исключены. Кроме того, ссылка на элемент в единственном числе не исключает возможность того, что присутствует более, чем один элемент, если только из контекста явно не следует, что присутствует один, и только один, из элементов. Таким образом, форма единственного числа термина, как правило, означает «по меньшей мере один».
Все патенты и литературные источники, цитированные в настоящей спецификации, включены посредством ссылки в полном объеме.
Следующие далее примеры приведены исключительно с целью иллюстрации, и никоим образом не предназначены для ограничения объема настоящего изобретения.
Примеры
1. Временная экспрессия антител
a) Получение конструкций кДНК и экспрессионных векторов
Каждая из аминокислотных последовательностей вариабельной области тяжелой цепи (HCVR) антител была соединена на N-конце с лидерной последовательностью (SEQ ID NO:28 для антител 1-13), и на C-конце с константным доменом HC LALA человеческого IgG1 в соответствии с SEQ ID NO:25 (in silico). Каждая из аминокислотных последовательностей HCVR антител 12C4, 12C4-LALA, 29AM4-5-LALA или KWAR23-LALA была соединена на N-конце с лидерной последовательностью HAVT20 (SEQ ID NO:27) и на C-конце с константным доменом HC LALA человеческого IgG1 в соответствии с SEQ ID NO:25 или HC дикого типа человеческого IgG1 (SEQ ID NO:24). KWAR23 имеет стандартный константный домен тяжелой цепи адалимумаба, но с отсутствием мутации LALA. Тяжелая цепь HEFLB относится к типу IgG4 и была использована с последовательностью SEQ ID NO:42, приведенной в WO 2017/178653. Полученные аминокислотные последовательности были обратно транслированы в последовательность кДНК, кодон-оптимизированную для экспрессии в человеческих клетках (Homo sapiens). Аналогично, последовательность кДНК для конструкции LC (вариабельная область легкой цепи; LCVR) была получена путем соединения последовательностей лидерной последовательности (SEQ ID NO:29 для антител 1-13, SEQ ID NO:27 для 12C4, 12C4-LALA, 29AM4-5-LALA, KWAR23, KWAR23-LALA и (гуманизированного) HEFLB) с LCVR антител 1-13, 12C4, 12C4-LALA, 29AM4-5-LALA, KWAR23, KWAR23-LALA и (гуманизированного) HEFLB на N-конце, и на C-конце с константной областью легкой цепи κ человеческого антитела (SEQ ID NO:26). Использовали последовательности HCVR и LCVR в соответствии с Таблицей 1a-c. Анти-SIRPα антитело SE5A5 (мышиное IgG1κ) было получено от компании Biolegend (San Diego, USA; очищенное антитело против CD172a/b человека (анти-SIRPα/β антитело)). Конструкции кДНК и экспрессионные векторы для сравнительных анти-SIRPα антител, приведенных в Таблице 1c, и контролей по изотипу, приведенных в Таблице 1d, были получены аналогичным образом.
В Таблице 1a представлены (i) аминокислотные последовательности HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3 (SEQ ID NO), которые содержатся в тяжелой цепи и легкой цепи в каждом из гуманизированных анти-SIRPα антител 1-13, и (ii) аминокислотные последовательности каждой из HCVR и LCVR, включающие области CDR гуманизированных анти-SIRPα антител 1-13.
В Таблице 1b представлены HC и LC контрольных антител.
*HEFLB представляет собой IgG4 антитело, следовательно, вариабельный домен тяжелой цепи связан не с остовом IgG1, а с последовательностью Fc IgG4 (WO 2017/178653).
В Таблице 1c представлены аминокислотные последовательности HC и LC дополнительных сравнительных анти-SIRPα антител. Эти антитела были выбраны из WO2018/190719, WO2018/057669, WO2019/023347, WO2018/107058 и WO01/40307.
Все последовательности HC и LC контрольных антител содержат в качестве лидерной последовательности лидерную последовательность HAVT20 с SEQ ID NO:27. Лидерная последовательность экспрессируется и необходима для транспортировки из клетки, во время этого процесса она отделяется.
В Таблице 1d приведен список контрольных по изотипу антител
*iso7 было получено от компании BioLegend (каталожный № 400102).
b) Конструирование вектора и стратегия клонирования
Для экспрессии цепей антитела использовали экспрессионный вектор млекопитающих (pcDNA3.4; ThermoFisher), который содержит экспрессионную кассету CMV: TKpA. Конечные векторы, содержащие экспрессионную кассету либо HC, либо LC (CMV:HC: TKpA и CMV:LC: TKpA, соответственно), переносили и размножали в клетках E. coli NEB 5-α. Крупномасштабное производство конечных экспрессионных векторов для трансфекции осуществляли с использованием наборов Maxi- или Megaprep kits (Qiagen).
c) Временная экспрессия в клетках млекопитающих
Коммерчески доступные клетки Expi293F (Thermo Fisher) трансфицировали экспрессионными векторами с использованием реагента для трансфекции ExpiFectamine в соответствии с инструкциями производителя следующим образом: 75×107 клеток высевали в 300 мл среды FortiCHO, 300 мкг экспрессионного вектора объединяли с 800 мкл реагента для трансфекции ExpiFectamine и добавляли к клеткам. Через день после трансфекции к культуре добавляли 1,5 мл энхансера 1 и 15 мл энхансера 2. Через шесть дней после трансфекции супернатант клеточной культуры собирали центрифугированием при 4000 g в течение 15 мин и фильтровали осветленный сбор с использованием ПЭС фильтровальных колб/фильтров MF 75 (Nalgene). Антитела очищали аффинной хроматографией.
2. Связывание и специфичность антител
Экспериментальный раздел
Анализ методом поверхностного плазмонного резонанса (ППР): Анализ аффинности выполняли путем анализа одного цикла кинетики на приборе поверхностного плазмонного резонанса (система BiaCore™ T200, GE Life Sciences) при 25°C. Биотинилированные антигены SIRP (SEQ ID NO:51-56) были иммобилизованы на поверхности чипа, подходящего для биотинилированных молекул (Sensor Chip CAP, GE Life Sciences) путем инжекции 5 мкг/мл антигена SIRP в подвижном буфере (10 мМ HEPES буфер, pH 7,4, с 150 мМ NaCl, 3 мМ ЭДТА и 0,005% об/об раствором полиоксиэтилен (20) сорбитан монолаурата (сурфактант P20)) в течение 60 сек со скоростью 10 мкл/мин после инжекции разведенных 20x (в подвижном буфере) реагентов Biotin CAPture (GE Life Sciences) в течение 60 сек со скоростью 10 мкл/мин. Базовая стабилизация была установлена на 1 мин, после чего проводили инжекцию анти-SIRP антитела в пяти возрастающих концентрациях в подвижном буфере. Для каждого этапа использовали время ассоциации 150 сек, с последующим временем диссоциации 600 сек только после максимальной концентрации, во всех случаях со скоростью потока 30 мкл/мин. Регенерацию выполняли с использованием раствора 6 M гуанидин-HCl, 0,25 M NaOH (120 сек со скоростью потока 30 мкл/мин). На наблюдаемых сенсорограммах было выполнено двойное вычитание пустых проб с использованием проточного канала с иммобилизованным не анти-SIRP (пустая проба) контролем и инжекцией подвижного буфера. Проводили подгонку сенсограмм к модели Ленгмюра 1:1 для всех протестированных анти-SIRP антител. Кинетические параметры (скорость ассоциации [ka], скорость диссоциации [kd] и константу связывания, также называемую равновесной константой диссоциации или аффинностью связывания [KD]), рассчитывали с использованием программного обеспечения для оценки BiaCore™ T200 (v3.1).
Анализ методом проточной цитометрии: клетки U937 (линия человеческих моноцитарных клеток), эндогенно экспрессирующие человеческий антиген SIRPαBIT, и клетки, полученные из не рекомбинантного субклона, которые были подвергнуты скринингу и выделены из клеток яичника китайского хомяка CHO-S (ExpiCHO-S), экспрессирующие каждый из человеческих антигенов SIRPα1, SIRPαBIT или cySIRPα (100000 клеток/лунку в 96-луночном планшете), промывали три раза ледяным буфером для FACS (1x PBS (LONZA), содержащий 0,1% об/масс БСА (Sigma-Aldrich, St. Louis, MO) и 0,02% об/масс NaN3 (Sigma-Aldrich)), с последующим добавлением каждого из первичных мАт в диапазоне концентраций (50 мкл/лунку), разбавленных в ледяном буфере для FACS. После инкубации в течение 30 мин при 4°C клетки промывали три раза ледяным буфером для FACS и добавляли 50 мкл/лунку вторичных мАт (для человеческих антител AffiniPure F(ab’)2-фрагмент антител козы против человеческих IgG-APC, разведение 1:6000, Jackson Immuno Research, и для мышиных антител AffiniPure Fab-фрагмент антител козы против мышиных IgG (H+L)-Alexa Fluor 488, разведение 1:1000, Jackson Immuno Research). Через 30 мин при 4°C клетки промывали дважды и ресуспендировали в 150 мкл буфера для FACS. Интенсивность флуоресценции определяли методом проточной цитометрии (BD FACSVerse, Franklin Lakes, NJ) и представляли в виде средней интенсивности флуоресценции (СИФ-средняя) для клеток U937 и средней интенсивности флуоресценции (СИФ-средняя) для клеток ExpiCHO-S. Проводили подгонку кривых методом нелинейной регрессии с использованием уравнения сигмоидальной кривой доза-ответ с переменным наклоном (четырехпараметрической) в GraphPad Prism (версия 7.02 для Windows, GraphPad, San Diego, CA). Значения EC50 рассчитывали в виде концентрации в размерности мкг/мл, которая приводила к ответу на половине расстояния между основанием и верхом кривой, при использовании 4-параметрической подгонки логистической кривой.
Результаты
Анализ ППР: Значения KD (то есть, константы связывания, также называемой «равновесной константой диссоциации» или «аффинностью связывания») для связывания с человеческим SIRPα1 (huSIRPα1), человеческим SIRPαBIT (huSIRPαBIT), SIRPα яванского макака (cySIRPα), человеческим SIRPγ (huSIRPγ), человеческим SIRPβ1v1 (huSIRPβ1v1) и человеческим SIRPβ1v2 (huSIRPβ1v2) антител 1-13 и контрольных антител приведены в Таблице 2. Антитела 1-13 связывают как huSIRPαBIT, так и huSIRPα1, и не связывают huSIRPγ. Некоторые из антител 1-13, например, антитело 6, иногда демонстрирует слабое связывание с SIRPγ, но с очень низким значением единиц ответа (ЕО), что, по-видимому, не имеет значения, как показано в экспериментах по связыванию клеток в приведенных ниже примерах. Гуманизированное HEFLB узнает только вариант huSIRPαBIT, но не huSIRPα1 и huSIRPγ, и cySIRPα. Антитела KWAR23, 29AM4-5, SE5A5 и 12C4 связывают все варианты SIRP, включая huSIRPγ.
Таблица 2. Аффинность связывания (KD, M) анти-SIRPα антител с человеческим SIRPα1, человеческим SIRPαBIT, человеческим SIRPγ, человеческим SIRPβ1v1, человеческим SIRPβ1v2 и SIRPα яванского макака, измеренная методом ППР
Значения KD для huSIRPα1 и huSIRPαBIT получали с использованием серии концентраций 1,56-6,25-25-100-400 нг/мл. Значения KD для cySIRPα, huSIRPγ, huSIRPβ1v1 и huSIRPβ1v2 получали с использованием серии концентраций 6,25-25-100-400-1600 нг/мл. н/о: нет ответа или ниже порога отсечения 10 единиц ответа (ЕО) для рассчитанного Rmax. Когда значение <1,0E-11 M приведено в виде значения KD, для образца невозможно было провести точное определение, поскольку аффинность находится за пределами диапазона технических характеристик прибора или рассчитанное значение KD составляло примерно 1,0E-11 M, но наблюдалось поверхностное насыщение. Значение KD <1,0E-11 M означает высокую аффинность. # означает, что имела место неоптимальная подгонка к модели Ленгмюра 1:1.
Анализ методом проточной цитометрии: Связывание различных антител с huSIRPα1, huSIRPαBIT и/или cySIRPα, экспрессируемыми на клетках, определяли методом проточной цитометрии. Связывание представлено в виде значений EC50, то есть, концентрации антител в размерности мкг/мл, которая приводит к ответу на половине расстояния между основанием и верхом кривой, приведенных в Таблице 3. Антитела 1-13 связывают huSIRPαBIT (либо временно экспрессируемый в клетках ExpiCHO-S, либо эндогенно экспрессируемый в клетках U937) и huSIRPα1. Антитела 1-4, 6, 12, 13 связывают cySIRPα в низком диапазоне концентраций (мкг/мл). Эти антитела также связываются, с тем же диапазоном значений EC50 (низкие значения мкг/мл), с клетками U937, эндогенно экспрессирующими huSIRPαBIT. Контрольные антитела KWAR23, KWAR23huIgG1LALA, 12C4huIgG1LALA, 12ChuIgG1, 29AM4-5huIgG1LALA и HEFLB демонстрируют аналогичное связывание с huSIRPαBIT, экспрессируемым на клетках U937. HEFLB не связывает huSIRPα1 и cySIRPα.
Таблица 3. Клеточный анализ связывания анти-SIRPα антител с клетками U937, эндогенно экспрессирующими человеческий SIRPαBIT, и с клетками ExpiCHO-S, временно трансфицированными либо человеческим SIRPα1, человеческим SIRPαBIT, либо SIRPα яванского макака
EC50 (мкг/мл)
EC50 (мкг/мл)
EC50 (мкг/мл)
EC50 (мкг/мл)
3. Связывание человеческого SIRPγ - FACS-окрашивание T-клеток
Экспериментальный раздел
Анализ методом проточной цитометрии: Мононуклеарные клетки периферической крови (МКПК) выделяли из свежей крови здоровых людей с использованием градиента перколла. Клетки промывали в HEPES+ буфере (132 мМ NaCl, 6 мМ KCl, 1 мМ CaCl2, 1 мМ MgSO4, 1,2 мМ фосфат калия, 20 мМ HEPES, 5,5 мМ глюкоза и 0,5% (масс/об) человеческий сывороточный альбумин, pH 7,4) и ресуспендировали в концентрации 1×106/мл в буфере для FACS (буфер PBS+человеческий альбумин 1% масс/об, человеческий альбуман 200 г/мл, Sanquin Plasma Products B.V., Amsterdam, Netherlands), осаждали центрифугированием и ресуспендировали в PBS+20% нормальной козьей сыворотки (NGS). Затем клетки (200000 клеток/лунку в 96-луночном планшете) инкубировали в присутствии тестируемых антител или в контрольных условиях только со вторичными антителами (вторичные антитела козы против человеческих IgG, Alexa 633, F(ab’)2-фрагмент, разведение 1:1000, Jackson Immuno Research, и вторичные антитела козы против мышиных IgG, Alexa 633, F(ab’)2-фрагмент, разведение 1:250, Invitrogen) в течение 30 мин на льду. После этого клетки промывали буфером для FACS и ресуспендировали в смеси антитела против человеческого CD3, FITC (разведение 1:100, Invitrogen), с соответствующим вторичным антителом (либо против человеческих, либо против мышиных антител) и инкубировали в течение 30 мин в темноте на льду. Затем клетки промывали буфером для FACS, ресуспендировали в 150 мкл буфера для FACS, определяли интенсивность флуоресценции методом проточной цитометрии (LSRII HTS или LSRFortessa, BD Biosciences, CA, USA) и представляли в виде средней интенсивности флуоресценции (СИФ-средняя) и процентной доли положительных клеток.
Результаты
Связывание антител с SIRPγ-экспрессирующими CD3+ T-клетками показано на Фигуре 1 (средняя интенсивность флуоресценции (Фигура 1a); процентная доля положительных клеток (Фигура 1b)). Все контрольные антитела, за исключением гуманизированного HEFLB, связывали SIRPγ. Антитела 1-13 не связывали человеческие CD3+ T-клетки, это подтверждало отсутствие связывания SIRPγ в клеточном окружении.
4. Определение характеристик сравнительных анти-SIRPα антител
Экспериментальный раздел
Анализ методом проточной цитометрии: клетки U937 (линия человеческих моноцитарных клеток), эндогенно экспрессирующие человеческий антиген SIRPαBIT, и клетки, полученные из не рекомбинантного субклона, которые были подвергнуты скринингу и выделены из клеток яичника китайского хомяка CHO-S (ExpiCHO-S), временно экспрессирующие человеческий антиген SIRPα1 или SIRPαBIT (100000 клеток/лунку в 96-луночном планшете), промывали дважды ледяным буфером для FACS (1x PBS (LONZA), содержащий 0,1% об/масс БСА (Sigma-Aldrich, St. Louis, MO) и 0,02% об/масс NaN3 (Sigma-Aldrich)), с последующим добавлением каждого из первичных мАт в диапазоне концентраций (50 мкл/лунку), разбавленных в ледяном буфере для FACS. После инкубации в течение 30 мин при 4°C клетки промывали дважды ледяным буфером для FACS. Затем добавляли 50 мкл/лунку вторичного мАт (AffiniPure™ F(ab’)2-фрагмент антитела козы против человеческих IgG-APC, разведение 1:6000, Jackson Immuno Research). Через 30 мин при 4°C клетки промывали дважды и ресуспендировали в 150 мкл буфера для FACS. Интенсивность флуоресценции определяли методом проточной цитометрии с использованием FACSVerse (BD Biosciences) и представляли в виде средней интенсивности флуоресценции (СИФ-средняя) для клеток U937 и средней интенсивности флуоресценции (СИФ-средняя) для клеток ExpiCHO-S. Проводили подгонку кривых методом нелинейной регрессии с переменным наклоном (четырехпараметрической) в GraphPad Prism (версия 7.02 для Windows, GraphPad, San Diego, CA). Значения EC50 рассчитывали в виде концентрации в размерности мкг/мл, которая приводила к ответу на половине расстояния между основанием и верхом кривой, при использовании 4-параметрической подгонки логистической кривой.
Анализ методом поверхностного плазмонного резонанса (ППР): Анализ аффинности выполняли путем анализа одного цикла кинетики на приборе BiaCore™ T200 (GE life Sciences) при 25°C. AVI-маркированные биотинилированные антигены SIRP были иммобилизованы с использованием набора Biotin CAPture (GE life Sciences). Покрытую стрептавидином поверхность готовили путем инжекции реагента Biotin CAPture. Затем биотинилированные варианты SIRP вводили инжекцией в подвижном буфере (10 мМ HEPES буфер, pH 7,4, с 150 мМ NaCl, 3 мМ ЭДТА и 0,005% об/об раствором сурфактанта P20) до уровня захвата примерно 40-50 единиц ответа (ЕО). После 1-мин стабилизации базовой линии вводили инжекцией анти-SIRPα антитела в пяти возрастающих концентрациях, с временем ассоциации 150 сек. Диссоциацию наблюдали в течение 600 сек, в обоих случаях скорость потока составляла 30 мкл/мин. Диапазон концентраций был выбран вокруг ожидаемого значения KD. Регенерацию проводили в соответствии с протоколом производителя раствором 6 M гуанидин-HCl, 0,25 M NaOH. На наблюдаемых сенсорограммах было выполнено двойное вычитание пустых проб с использованием (связанного реагента Biotin CAPture) контрольного проточного канала и инжекции подвижного буфера. Проводили подгонку сенсограмм к модели Ленгмюра 1:1 для всех протестированных анти-SIRP антител. Кинетические параметры (ka, kd и KD) рассчитывали с использованием программного обеспечения для оценки BiaCore™ T200 (v3.1). huSIRPβ1v1 и huSIRPβ1v2 тестировали в их мономерной форме. Расчетные значения KD находились в диапазоне тестируемых концентраций. Когда значение <1,0E-11 приведено в виде значения KD, аффинность невозможно было точно определить, поскольку кинетические параметры находились за пределами технических характеристик приборов.
Результаты
Анализ методом проточной цитометрии: Сравнение связывания антител против SIRPα с huSIRPα1 и huSIRPαBIT, экспрессируемыми на клетках, проводили методом проточной цитометрии. Связывание представлено в виде значений EC50 в Таблице 4. Все протестированные в данном эксперименте антитела связывали huSIRPαBIT (либо временно экспрессируемый в клетках ExpiCHO-S, либо эндогенно экспрессируемый в клетках U937) и huSIRPα1. При том, что большинство антител демонстрировали значение EC50 в низком диапазоне концентраций (мкг/мл), AB115-LALA, 3F9-LALA и 7H9-LALA демонстрировали значение EC50, превышающее 1 мкг/мл, при связывании с клетками U937. Кроме того, 3F9-LALA связывает huSIRPα1 и huSIRPαBIT, экспрессируемые на клетках ExpiCHO-S, с величиной EC50, превышающей 1 мкг/мл. Следует отметить, что соответствующие контроли по изотипу не связывались ни с одними из этих клеток.
Таблица 4. Клеточный анализ связывания анти-SIRPα антител с клетками U937, эндогенно экспрессирующими человеческий SIRPαBIT, и с клетками ExpiCHO-S, временно трансфицированными либо человеческим SIRPα1, либо человеческим SIRPαBIT.
EC50 (мкг/мл)
EC50 (мкг/мл)
EC50 (мкг/мл)
Анализ ППР: Сравнение избирательности анти-SIRPα антител в отношении вариантов человеческого SIRPβ, β1v1 и β1v2, проводили методом ППР, и результаты приведены в Таблице 5. За исключением 3F9-LALA, все антитела узнавали huSIRPβ1v1. Все протестированные антитела связывают huSIRPβ1v2, где антитело 6 имеет самое высокое значение KD и, следовательно, самую низкую аффинность. Следует отметить, что соответствующие контроли по изотипу не связывают huSIRPβ1v1 и huSIRPβ1v2.
Таблица 5. Аффинность связывания (KD, M) анти-SIRPα антител с человеческим SIRPβ1v1 и человеческим SIRPβ1v2, измеренная методом ППР.
5. Связывание анти-SIRPα антител с первичными клетками: гранулоцитами, моноцитами и T-клетками
Экспериментальный раздел
Анализ методом проточной цитометрии, окрашивание цельной крови: Обработанные гепарином образцы цельной крови получали от здоровых доноров (банк крови Sanquin, Nijmegen, the Netherlands) и хранили в течение ночи при комнатной температуре. Образцы цельной крови лизировали 1X лизирующим раствором BD FACS™ (349202, BD Biosciences)) в течение 15 мин при комнатной температуре и промывали буфером для FACS (PBS, содержащий 0,1% БСА и 2 мМ ЭДТА). 1,5×105 клеток на лунку окрашивали при помощи 50 мкл на лунку анти-SIRPα антител (в диапазоне концентраций, начиная с 10 мкг/мл или 90 мкг/мл с 3,16x разведением) в 96-луночных планшетах для микротитрования (353910, Falcon) в течение 30 мин при 4°C. После промывания буфером для FACS клетки инкубировали с коктейлем из разведенного 1:800 клона UCHT1 антитела против человеческого CD3-PB (558117, BD Biosciences), разведенного 1:800 клона MφP9 антитела против человеческого CD14-FITC (345784, BD Biosciences) и разведенного 1:6000 APC-меченого F(ab’)2 вторичного антитела козы против человеческих IgG (109-136-098, Jackson ImmunoResearch) в буфере для FACS в течение 30 мин при 4°C. После промывания буфером для FACS клетки смешивали на вихревой мешалке во избежание агрегации клеток, инкубировали с 50 мкл на лунку фиксирующего буфера BD Cytofix™ (4,2% ПФА) (554655, BD Biosciences) в течение 15 мин при комнатной температуре и промывали перед анализом. Образцы собирали при помощи FACSVerse (BD Biosciences) и анализировали с использованием программного обеспечения FlowJo (BD Biosciences). Гранулоциты были гейтированы на основании FSC-A/SSC-A, с последующим гейтированием по CD14-. T-клетки и моноциты сначала были гейтированы на основании FSC-A/SSC-A. Затем T-клетки были идентифицированы как CD3+CD14- клетки, и моноциты как CD14+CD3- клетки.
Анализ методом проточной цитометрии, связывание с выделенными T-клетками: T-клетки выделяли методом отрицательной селекции (11344D Dynabeads Untouched Human T Cell Kit, ThermoFisher Scientific) из мононуклеарных клеток периферической крови (МКПК) здоровых людей (банк крови Sanquin, Nijmegen, the Netherlands). Клетки промывали в HEPES+ буфере (132 мМ NaCl, 6 мМ KCl, 1 мМ CaCl2, 1 мМ MgSO4, 1,2 мМ фосфат калия, 20 мМ HEPES, 5,5 мМ глюкоза и 0,5% (масс/об) человеческий сывороточный альбумин, pH 7,4) и ресуспендировали в концентрации 1×106/мл в буфере для выделения (буфер PBS+1% масс/об человеческий альбумин, человеческий альбуман 200 г/мл, Sanquin Plasma Products B.V., Amsterdam, Netherlands), осаждали центрифугированием и ресуспендировали в буфере для FACS (1x PBS (LONZA), содержащий 0,1% об/масс БСА (Sigma-Aldrich, St. Louis, MO) и 0,02% об/масс NaN3 (Sigma-Aldrich)). Клетки (100000 клеток/лунку в 96-луночном планшете) промывали ледяным буфером для FACS, с последующим добавлением каждого из первичных мАт в диапазоне концентраций (50 мкл/лунку), разведенного в ледяном буфере для FACS. После инкубации в течение 30 мин при 4°C клетки промывали два раза ледяным буфером для FACS; затем добавляли 50 мкл/лунку вторичного антитела (для человеческих антител AffiniPure F(ab’)2-фрагмент антител козы против человеческих IgG-APC, разведение 1:6000, Jackson Immuno Research, и для мышиных антител AffiniPure Fab-фрагмент антител козы против мышиных IgG (H+L)-Alexa Fluor 488, разведение 1:1000, Jackson Immuno Research). Через 30 мин при 4°C клетки промывали дважды и ресуспендировали в 150 мкл буфера для FACS. Интенсивность флуоресценции определяли методом проточной цитометрии с использованием FACSVerse (BD Biosciences) и представляли в виде средней интенсивности флуоресценции (СИФ-средняя). Проводили подгонку кривых методом нелинейной регрессии с переменным наклоном (четырехпараметрической) в GraphPad Prism (версия 7.02 для Windows, GraphPad, San Diego, CA). Значения EC50 рассчитывали в виде концентрации в размерности мкг/мл, которая приводила к ответу на половине расстояния между основанием и верхом кривой, при использовании 4-параметрической подгонки логистической кривой.
Результаты
Анализ методом проточной цитометрии, окрашивание цельной крови: Связывание различных анти-SIRPα антител с первичными клетками определяли методом проточной цитометрии. Кривые доза-ответ для клеток репрезентативного здорового гетерозиготного SIRPα1/SIRPαBIT донора представлены на Фигуре 10a-d. Следует отметить, что точная высота ответа не обязательно является характеристикой анти-SIRPα антитела, поскольку она также может зависеть от вторичного антитела. Напротив, значения EC50 не зависят от обнаруживающего антитела, следовательно, их можно сравнивать. Сводная информация по значениям EC50 приведена в Таблице 6. Все антитела связывают гранулоциты и моноциты гетерозиготных SIRPαBIT/ SIRPα1 доноров, хотя точные значения EC50 варьируются. За исключением HEFLB, все антитела также связывают гранулоциты и CD14+ моноциты гомозиготного SIRPα1 донора с варьирующими значениями EC50. Эти данные согласуются с данными ППР и клеточного анализа, приведенными в Таблицах 2 и 3, где HEFLB также не связывает SIRPα1. Циркулирующие CD3+ T-клетки в человеческой крови не экспрессируют SIRPα или SIRPβ, экспрессируют только SIRPγ и, следовательно, связывание CD3+ T-клеток можно интерпретировать как связывание SIRPγ. При том, что большинство антител связывают CD3+ T-клетки, антитело 6, AB3-LALA, 3F9-LALA, 7H9-LALA и HEFLB не связывают CD3+ T-клетки. В этом анализе окрашивания цельной крови AB136-LALA связывает T-клетки при более высоких концентрациях антитела. Это, очевидно, согласуется с приведенными в WO2018/057669 данными о том, что Ab136 связывает SIRPγ, но с низким значением KD.
Таблица 6. Клеточный анализ связывания анти-SIRPα антител с гранулоцитами, CD14+ моноцитами и CD3+ T-клетками в цельной крови здоровых гетерозиготных SIRPα1/SIRPαBIT доноров (α1/αBIT) или гомозиготного SIRPα1/SIRPα1 донора (α1/α1).
>10=EC50 >10 мкг/мл
# = исключено, приводило к аномальному профилю связывания
^ = наблюдалась кривая зависимости ответа от дозы; однако значения ниже, чем у контроля по изотипу
* = неполная кривая (насыщение не достигнуто)
~ = неоднозначная подгонка
Анализ методом проточной цитометрии, связывание с выделенными T-клетками: Для подтверждения SIRPγ-зависимого связывания T-клеток разными антителами с использованием другого подхода выделенные первичные T-клетки (в отсутствие SIRPα- или SIRPβ-положительных миелоидных клеток) окрашивали панелью антител. Результаты представлены на Фигуре 11. При том, что большинство антител связывают T-клетки, антитела 6, AB3-LALA, 3F9-LALA, 7H9-LALA, SE5A5 и HEFLB не связывают T-клетки. Опять-таки, AB136-LALA демонстрирует связывание при высоких концентрациях антитела.
Таким образом, описанные выше примеры показывают, что аффинность антитела 6 для huSIRPβ1v2 ниже, чем аффинность любого из сравнительных протестированных анти-SIRPα антител в обширной панели, указанной выше. Кроме того, аффинность не связывающего T-клетки антитела 6 для SIRPβ1v1 была сопоставима с аффинностью AB136-LALA, 7H9-LALA и HEFLB, которые также имеют низкую/не имеют аффинность для SIRPγ, и была ниже, чем аффинность у AB3 и SE5A5, которые также имеют низкую/не имеют аффинность для SIRPγ.
В совокупности результаты показывают, что антитело 6 обладает высокой способностью связывания с обоими аллелями SIRPα, в то же время демонстрируя очень низкое связывание, или отсутствие такового, с другими не ингибирующими представителями семейства SIRP: SIRPβ1v1, SIRPβ1v2 и SIRPγ.
6. Способность к блокированию CD47
Экспериментальный раздел
Способность к блокированию CD47: Для оценки способности анти-SIRPα антител блокировать связывание либо SIRPα1, либо SIRPαBIT, с CD47, SIRPα1 или SIRPαBIT преинкубировали с анти-SIRPα антителом, а затем тестировали диссоциацию от иммобилизованного CD47. Вкратце, AVI-маркированный биотинилированный CD47-Fc был иммобилизован с использованием набора Biotin CAPture (GE life Sciences). Покрытую стрептавидином поверхность готовили путем инжекции реагента Biotin CAPture. Затем биотинилированный CD47-Fc вводили инжекцией в подвижном буфере (10 мМ HEPES буфер, pH 7,4, с 150 мМ NaCl, 3 мМ ЭДТА и 0,005% об/об сурфактантом P20) до уровня захвата примерно 1000 ЕО. Смесь, содержащую пятикратный молярный избыток антитела и либо 10 мкг/мл SIRPα1, либо 10 мкг/мл SIRPαBIT, преинкубировали в течение 30 мин при температуре окружающей среды и вводили инжекцией над поверхностью с CD47-Fc в течение 120 сек со скоростью 5 мкл/мин. Диссоциацию наблюдали в течение 300 сек, затем проводили регенерацию с использованием смеси 6 M гуанидин-HCl, 0,25 M NaOH (3:1) в соответствии с инструкциями производителя. Определение блокирующего/не блокирующего антитела выполняли путем визуальной оценки после вычитания двойного контрольного значения.
Результаты
Способность к блокированию CD47: Способность направленных на SIRPα антител блокировать связывание CD47 изучали методом ППР (Таблица 7). При том, что большинство антител, включая антитело 6, блокируют взаимодействие CD47-SIRPαBIT и CD47-SIRPα1, AB3-LALA, AB136-LALA, 3F9-LALA и 7H9-LALA не блокируют взаимодействие CD47-SIRPαBIT и CD47-SIRPα1, и, следовательно, являются не блокирующими. Кроме того, HEFLB блокирует только взаимодействие CD47-SIRPαBIT, но не взаимодействие CD47-SIRPα1, что согласуется с отсутствием узнавания SIRPα1 антителом HEFLB.
Таблица 7. Определение блокирования анти-SIRPα антителами взаимодействий CD47-SIRPαBIT и CD47-SIRPα1.
7. Способность к блокированию рекрутинга SHP-1
Экспериментальный раздел
Сигнализацию SIRPαBIT анализировали с использованием технологии комплементации ферментных фрагментов PathHunter от DiscoverX®. В данном анализе дефицитные по CD47 клетки Jurkat генетически модифицировали для избыточной экспрессии SIRPαBIT+, маркированного Prolink (PK), и ферментного акцептора (EA), слитого с доменом SH2 сигнального белка SHP-1. Когда эти клетки Jurkat с сигнализацией SIRPαBIT инкубируют с клетками, экспрессирующими CD47 (клетки с лигандом CD47), SHP-1 и SIRPαBIT взаимодействуют, что приводит к комплементации PK и EA. В результате образуется активный фермент β-галактозидаза, который может расщеплять субстрат, с генерированием хемилюминесцентного сигнала. Данную систему можно использовать для изучения способности направленных на SIRPα антител препятствовать рекрутингу SHP-1 к SIRPα. Клетки Jurkat с сигнализацией SIRPαBIT инкубировали с анти-SIRPα антителом в диапазоне концентраций в сочетании с клетками с лигандом CD47. Клетки Jurkat E6.1 использовали в качестве клеток с лигандом CD47, и анализ проводили в формате 384-луночного планшета. Сначала в каждую лунку добавляли 12,5 мкл суспензии клеток Jurkat с сигнализацией SIRPαBIT (0,8 миллионов клеток/мл), с последующим добавлением 2,5 мкл (11x концентрированного) раствора анти-SIRPα антитела в диапазоне концентраций. Анализ начинали путем добавления 12,5 мкл суспензии клеток с лигандом CD47 при EC80 (1,6 миллионов клеток Jurkat E6.1/мл). Планшеты инкубировали в течение 4 часов в условиях 37°C и 5% CO2. После инкубации добавляли 2 мкл 2x разбавленных реагентов A (DiscoverX detection kit, в PBS, содержащем 0,1% БСА). Планшеты инкубировали 30 мин на шейкере (300 об/мин) в темноте при комнатной температуре. Затем добавляли 10 мкл 2x разбавленных реагентов B (DiscoverX detection kit, в PBS, содержащем 0,1% БСА). Планшеты инкубировали в течение 1 часа на шейкере (300 об/мин) в темноте при комнатной температуре. Люминесценцию измеряли со временем интеграции 0,1 сек/лунку с использованием системы Envision® (Perkin Elmer). Все клеточные суспензии готовили в среде для высевания клеток (DiscoverX), антитела разводили в PBS, содержащем 0,1% БСА (Sigma). Графики анализировали с использованием программы GraphPad Prism 8. % максимального сигнала определяли следующим образом: (относительные единицы люминесценции (ОЕЛ)/ОЕЛ при максимальной стимуляции (без антитела) * 100). Уровни эффективности рассчитывали следующим образом: 100% - «% максимального сигнала» соединения в концентрации 3,3 мкг/мл.
Результаты
Активация SIRPα приводит к хорошо охарактеризованному ингибирующему сигнальному каскаду. После связывания CD47 иммунорецепторные тирозиновые ингибирующие мотивы (ITIM) цитоплазматического домена SIRPα становятся фосфорилированными, что приводит к рекрутингу и активации Src-гомологичный домен 2-содержащей фосфатазы-1 (SHP-1). SHP-1 опосредует ингибирующую сигнализацию за счет белкового дефосфорилирования определенных субстратов, включая активирующие FcγR. Это ведет к затуханию иммунного ответа. Способность направленных на SIRPα антител к ингибированию SIRPα-опосредуемой сигнализации исследовали с использованием дефицитных по CD47 клеток Jurkat с сигнализацией SIRPαBIT. При инкубации этих клеток с CD47-содержащими клетками Jurkat E6.1 рекрутинг SHP-1 к SIRPαBIT приводит к генерации хемилюминесцентного сигнала. Антитело 6 способно противодействовать данному сигналу зависимым от дозы образом (Фигура 12a). Другие направленные на SIRPα антитела были протестированы в фиксированной дозе (3,3 мкг/мл) на их способность противодействовать сигнализации SIRPαBIT (Фигура 12b). За исключением SE5A5, эффективность ингибирования сигнализации SIRPαBIT является аналогичной у всех блокирующих CD47-SIRPα антител (показано белыми столбиками). Не блокирующие антитела AB3-LALA, AB136-LALA, 3F9-LALA и 7H9-LALA (показаны черными столбиками) демонстрируют более низкую эффективность, или отсутствие эффективности, ингибирования сигнала в сравнении с блокирующими антителами, и, следовательно, по всей видимости являются менее способными, или неспособными, противодействовать опосредованной SIRPα сигнализации.
В совокупности результаты показывают, что антитело 6 блокирует связывание CD47 с обоими аллелями SIRPα и, в отличие от не блокирующих антител, это приводит к высокой степени ингибирования последующей сигнализации.
8. Антителозависимая клеточная цитотоксичность (ADCC)
Экспериментальный раздел
Анализ цитотоксичности DELFIA® (не радиоактивный анализ): Нейтрофилы доноров, гетерозиготных по SIRPα1 и SIRPαBIT, выделяли и культивировали методом, описанным в публикации Zhao et al. PNAS 2011, 108(45), 18342-18347. Свежевыделенные нейтрофилы культивировали в течение ночи с человеческим G-CSF (10 нг/мл) и IFNγ (50 нг/мл). Антителозависимую клеточную цитотоксичность (ADCC) определяли с использованием анализа цитотоксичности с не радиоактивным европием-ТДА (EuTDA) (DELFIA®, PerkinElmer). Клетки SKBR3 (человеческая линия клеток HER2-положительного рака молочной железы) использовали в качестве клеток-мишеней и метили бис(ацетоксиметил)2,2':6',2''-терпиридин-6,6''-дикарбоксилатом) (реагент BATDA, DELFIA) в течение 5 мин при 37°C. После 2 промываний PBS 5×103 клеток-мишеней на лунку инкубировали в культуральной среде IMDM с добавлением 10% (об/об) эмбриональной бычьей сыворотки с ультранизким содержанием IgG (FBS, Gibco) в течение 4 часов в условиях 37°C и 5% CO2 в 96-луночном планшете с U-образным дном совместно с нейтрофилами при соотношении эффекторных клеток и мишеней, составляющем 50:1, в присутствии соответствующих антител. После инкубации супернатант собирали и добавляли к раствору европия (DELFIA, PerkinElmer), и флуоресценцию европия 2,2':6',2"-терпиридин-6,6"-дикарбоновой кислоты (EuTDA) определяли на спектрофлуориметре (Envision, PerkinElmer). Цитотоксичность, в процентах, рассчитывали по формуле: [(экспериментальное высвобождение - спонтанное высвобождение) / (полное высвобождение - спонтанное высвобождение)] x 100%. Для всех вариантов измерения проводили в двойном и/или тройном повторе.
Анализ высвобождения 51Cr (радиоактивный анализ):
Нейтрофилы доноров, гомозиготных либо по SIRPα1, либо по SIRPαBIT, выделяли методом, описанным в публикации Zhao et al. PNAS 2011, 108(45), 18342-18347. Для всех экспериментов с высвобождением 51Cr, за исключением тех, которые представлены на Фигуре 2, свежевыделенные нейтрофилы культивировали в течение 100 мин с человеческим GM-CSF в концентрации 10 нг/мл. Антителозависимую клеточную цитотоксичность (ADCC) определяли с использованием анализа высвобождения 51Cr. Клетки SKBR3 (человеческая линия клеток рака молочной железы) использовали в качестве клеток-мишеней и метили 100 мкКи 51Cr (Perkin-Elmer) в течение 90 мин при 37°C. После 2 промываний PBS 5×103 клеток-мишеней на лунку инкубировали в культуральной среде IMDM с добавлением 10% (об/об) эмбриональной бычьей сыворотки в течение 4 часов в условиях 37°C и 5% CO2 в 96-луночном планшете с U-образным дном совместно с нейтрофилами при соотношении эффекторных клеток и мишеней, составляющем 50:1, в присутствии соответствующих антител. После инкубации супернатант собирали и анализировали радиоактивность в гамма-счетчике (Wallac). Цитотоксичность, в процентах, рассчитывали по формуле: [(экспериментальное высвобождение - спонтанное высвобождение) / (полное высвобождение - спонтанное высвобождение)] x 100%. Для всех вариантов измерения проводили в двойном и/или тройном повторе.
Результаты
Гуманизация 12C4 приводила к потере ADCC, которая была восстановлена за счет уменьшения эффекторной функции константной области IgG1:
На Фигуре 2 представлены результаты анализа ADCC в виде цитотоксичности, %, измеренной в анализе высвобождения 51Cr. Цитотоксичность, %, измеренная на клетках SKBR3 с использованием нейтрофилов от гомозиготных по SIRPαBIT доноров в качестве эффекторных клеток и только трастузумаба, является более низкой, чем цитотоксичность, %, трастузумаба в сочетании с мышиным антителом 12C4 (mu12C4). Трастузумаб в сочетании с антителом, в котором вариабельные области 12C4 привиты на константную область человеческого IgG1 (12C4huIgG1), проявлял сходную цитотоксичность, %, в сравнении с одним только трастузумабом при низких концентрациях 12C4huIgG1. При более высоких концентрациях 12C4huIgG1 наблюдалось уменьшение цитотоксичности, %. Трастузумаб в сочетании с антителом, в котором вариабельные области 12C4 привиты на константную область человеческого IgG1, имеющую аминокислотные замены L234A и L235A (12C4huIgG1LALA), демонстрировал повышенную цитотоксичность, %, в сравнении с цитотоксичностью, %, одного только трастузумаба, и повышенную цитотоксичность, %, в сравнении с сочетанием 0,2 мкг/мл 12C4huIgG1 и трастузумаба.
Зависимое от дозы увеличение опосредованной трастузумабом ADCC:
ADCC/цитотоксичность, в процентах, трастузумаба (10 мкг/мл) в присутствии антител 1-13 - имеющих константную область человеческого IgG1, имеющую аминокислотные замены L234A и L235A (LALA) - или в присутствии контрольного антитела, в разных концентрациях (мкг/мл; кривые доза-ответ) в отношении клеток SRBR3 HER2-положительного рака молочной железы показана на Фигурах 3-9. При использовании антител 1-13 ADCC возрастала в зависимости от дозы в случае гетерозиготных SIRPα1/SIRPαBIT доноров (Фигуры 4 и 5), где наблюдалось зависимое от дозы уменьшение при использовании 12C4huIgG1, четкий эффект отсутствовал при использовании гуманизированного HEFLB, минимальные эффекты наблюдались при использовании KWAR23huIgG1 и SE5A5, и зависимое от дозы увеличение наблюдалось при использовании контрольного антитела KWAR23-LALA в случае гетерозиготных доноров (Фигура 3). Антитела 7-13 и контрольные антитела также тестировали в случае гомозиготных по SIRPα1 или SIRPαBIT доноров (Фигуры 6-9). Все антитела, судя по всему, демонстрировали более вариабельные результаты.
9. Иммуногенность
CD4+ T-клеточные эпитопы являются важными факторами иммуногенности (антитела против лекарственных средств) in vivo. Использовали ex vivo T-клеточный анализ для обнаружения T-клеточных ответов против T-клеточных эпитопов в анти-SIRPα антителе 6. Антитело 6 было отправлено в Abzena (Cambridge, UK) для оценки иммуногенности с использованием EpiScreen™ динамического T-клеточного анализа с целью выяснения их способности индуцировать CD4+ T-клеточные ответы. МКПК от группы из 50 здоровых доноров, представляющих европейскую и североамериканскую популяцию (на основании аллотипов HLA), инкубировали с тестируемыми образцами. T-клеточные ответы определяли с использованием анализа пролиферации (поглощение [3H]-тимидина) и анализа секреции цитокинов (IL-2 ELISpot). В сочетании анализов T-клеточной пролиферации и IL-2 ELISpot было установлено, что антитело 6 является не иммуногенным.
10. Антителозависимая клеточная цитотоксичность (ADCC); сравнительный пример
Экспериментальный раздел
Человеческие нейтрофилы от доноров, гомозиготных либо по SIRPα1, либо по SIRPαBIT, или гетерозиготных по обоим аллелям, выделяли методом, описанным в публикации Zhao et al. PNAS 2011, 108(45), 18342-18347. Затем нейтрофилы стимулировали гранулоцитарно-моноцитарным колониестимулирующим фактором (GM-CSF, Peprotech) в концентрации 10 нг/мл в течение 30 мин. Антителозависимую клеточную цитотоксичность (ADCC) определяли с использованием анализа высвобождения 51Cr (PerkinElmer) методом, описанным в публикации Zhao et al. PNAS 2011, 108(45), 18342-18347. Вкратце, клетки SKBR3 (человеческая линия клеток рака молочной железы) или A431 (линия клеток эпидермоидной карциномы кожи) использовали в качестве клеток-мишеней и метили 100 мкКи 51Cr (Perkin-Elmer) в течение 90 мин при 37°C. После 2 промываний PBS 5×103 клеток-мишеней на лунку опсонизировали при помощи трастузумаба (конечная концентрация для SKBR3 10 мкг/мл) или цетуксимаба (конечная концентрация для A431 5 мкг/мл) и инкубировали в культуральной среде IMDM с добавлением 20% (об/об) эмбриональной бычьей сыворотки (ЭБС) с низким содержанием IgG в течение 4 часов в условиях 37°C и 5% CO2 в 96-луночных планшетах с U-образным дном совместно с нейтрофилами при соотношении эффекторных клеток и мишеней, составляющем 50:1, в присутствии антител с концентрациями в диапазоне зависимости ответа от дозы, которые представлены на Фигурах 13-14. После инкубации супернатант собирали, переносили в LumaPlates (Perkin Elmer) и анализировали на радиоактивность в счетчике MicroBeta (Perkin Elmer). Цитотоксичность, в процентах, рассчитывали по формуле: [(экспериментальное высвобождение - спонтанное высвобождение) / (полное высвобождение - спонтанное высвобождение)] x 100%. Для всех вариантов измерения проводили в двойном и/или тройном повторе.
Результаты
Антителозависимая клеточная цитотоксичность (ADCC): Эффект анти-SIRPα антител тестировали в экспериментах ADCC с использованием GM-CSF-активированных первичных человеческих нейтрофилов в качестве эффекторных клеток и разных сочетаний направленных на раковые клетки терапевтических антител и опухолевых клеток-мишеней (Фигуры 13a-b, 14a-b). Последние включали HER2-экспрессирующие клетки SKBR3 рака молочной железы в сочетании с трастузумабом (Фигура 13) и EGFR-экспрессирующие клетки A431 карциномы в сочетании с цетуксимабом (Фигура 14). Результаты показали, что антитело 6 было способно усиливать ADCC нейтрофилов в обоих сочетаниях направленных на раковые клетки антител и раковых клеток-мишеней. Аналогичные результаты были получены для некоторых других анти-SIRPα антител, но не для, например, 40A-1, 40A-2, 3F9-LALA, 7H9-LALA, 12C4, 29AM4-5-LALA, SE5A5.
В совокупности результаты свидетельствуют о том, что антитело 6 является единственным антителом с относительно низкой аффинностью, или без нее, для не ингибирующих представителей семейства SIRP, SIRPβ1v1, SIRPβ1v2 и SIRPγ, которое в функциональных анализах эффективно ингибирует последующую сигнализацию, в то же время обеспечивая повышенную ADCC в случае обоих генотипов SIRPαBIT и SIRPα1.
Списки последовательностей, у антител 1-13 подчеркнуты аминокислотные последовательности CDR1, CDR2 и CDR3 в аминокислотных последовательностях вариабельных областей (VR) тяжелой цепи (HC) и легкой цепи (LC) (остатки VR определены по системе Kabat; нумерация последовательностей является последовательной, не в соответствии с нумерацией Kabat)
SEQ ID NO:1 (HCVR; мАт 1)
1 VQLVESGGRL GQPGTPLTLS CTVSGFSLSS YVMGWFRQAP GKGLEYIGII
51 SSSGSPYYAS WVNGRFTISK TSTTMDLKMN SLRSEDTATY FCARVGPLGV
101 DYFNIWGPGT LVTVSS
SEQ ID NO:2 (LCVR; мАт 1, 2, 3, 4, 12, 13)
1 DIQMTQSPSS LSASVGDRVT ITCRASQSIN SYLAWYQQKP GKAPKLLIYS
51 ASFLYSGVPS RFSGSGSGTD FTLTISSLQP EDFATYYCQS WHYISRSYTF
101 GQGTKVEIK
SEQ ID NO:3 (HCVR; мАт 2)
1 VQLVESGGRL VQPGTPLTLS CTVSGFSLSS YVMGWFRQAP GKGLEYIGII
51 SSSGSPYYAS WVNGRFTISK TSTTMDLKMN SLRSEDTATY FCARVGPLGV
101 DYFNIWGPGT LVTVSS
SEQ ID NO:4 (HCVR; мАт 3)
1 VQLVESGGRL GQPGTSLTLS CTVSGFSLSS YVMGWFRQAP GKGLEYIGII
51 SSSGSPYYAS WVNGRFTISK TSTTMDLKMN SPTTEDTATY FCARVGPLGV
101 DYFNIWGPGT LVTVSS
SEQ ID NO:5 (HCVR; мАт 4)
1 VQLVESGGRL GQPGTSLTLS CTVSGFSLSS YVMGWFRQAP GKGLEYIGII
51 SSSGSPYYAS WVNGRFTISK TSTTMDLKMN SLRSEDTATY FCARVGPLGV
101 DYFNIWGPGT LVTVSS
SEQ ID NO:6 (HCVR; мАт 5, 8)
1 RQLVESGGGL VQPGGSLRLS CAASGFSLSS HGISWVRQAP GKGLEYIGTI
51 GTGVITYYAS WAKGRFTGSK TSSTAYLQMT SLRAEDTAVY YCARGSAWND
101 PFDYWGQGTL VTVSS
SEQ ID NO:7 (LCVR; мАт 5, 11)
1 DIEMTQSPSS VSASVGDRVT LTCQASQSVY GNNDLAWYQQ KPGQAPKLLI
51 YLASTLATGV PSRFSGSGSG TDFTLTISSL QPEDFATYYC LGGGDDEADN
101 VFGGGTKVEI K
SEQ ID NO:8 (HCVR; мАт 6)
1 RQLVESGGGL VQPGGSLRLS CTASGFSLSS HGISWVRQAP GKGLEYIGTI
51 GTGVITYFAS WAKGRFTGSK TSSTAYMELS SLRSEDTAVY FCARGSAWND
101 PFDPWGQGTL VTVSS
SEQ ID NO:9 (LCVR; мАт 6, 7, 8, 9, 10)
1 DIVMTQSPSS LSASVGDRVT ITCQASQSVY GNNDLAWYQQ KPGQAPKLLI
51 YLASTLATGV PSRFSGSGSG TDFTLTISSL QPEDFATYYC LGGGDDEADN
101 TFGQGTKVEI K
SEQ ID NO:10 (HCVR; мАт 7)
1 RQLVESGGGL VQPGGSLRLS CAASGFSLSS HGISWVRQAP GKGLEWVGTI
51 GTGVITYYAS WAKGRFTGSK TSSTAYLQMT SLRAEDTAVY YCARGSAWND
101 PFDYWGQGTL VTVSS
SEQ ID NO:11 (HCVR; мАт 9)
1 RQLVESGGGL VQPGGSLRLS CAASGFSLSS HGISWVRQAP GKGLEWVGTI
51 GTGVITYYAS WAKGRFTGSK TSSTAYLQMT SLRSEDTAVY YCARGSAWND
101 PFDYWGQGTL VTVSS
SEQ ID NO:12 (HCVR; мАт 10)
1 RQLVESGGGL VQPGGSLRLS CAASGFSLSS HGISWVRQAP GKGLEWVGTI
51 GTGGITYYAS WAKGRFTGSK TSSTAYMELS SLRAEDTAVY YCARGSAWND
101 PFDIWGQGTL VTVSS
SEQ ID NO:13 (HCVR; мАт 11)
1 RQLVESGGGL VQPGGSLRLS CAASGFSLSS HGISWVRQAP GKGLEWVGTI
51 GTGVITYYAS WAKGRFTGSK TSSTAYLQMT SLRAEDTAVY YCARGSAWND
101 PFDYWGQGTL VTVSS
SEQ ID NO:14 (HCVR; мАт 12)
1 QSVEESGGRL GQPGTPLTLS CTVSGFSLSS YVMGWFRQAP GKGLEYIGII
51 SSSGSPYYAS WVNGRFTISK TSTTMDLKMN SLRSEDTATY FCARVGPLGV
101 DYFNIWGPGT LVTVSS
SEQ ID NO:15 (HCVR; мАт 13)
1 VQLVESGGRL VQPGTPLTLS CTVSGFSLSS YVMGWFRQAP GKGLEYIGII
51 SSSGSPYYAS WVNGRFTISK TSTTMDLKMN SPTTEDTATY FCARVGPLGV
101 DYFNIWGPGT LVTVSS
SEQ ID NO:16 (HC; 12C4)
1 EVKLEESGGG LMQPGGSMKL SCVASGFTFS NYWMNWVRQS PEKGLEWVAE
51 IRLKSNNYAT HYAESVKGRF TISRDDSKSS VYLQMNNLRA EDTGIYYCIR
101 DYDYDAYFDY WGQGTTLTVS SASTKGPSVF PLAPSSKSTS GGTAALGCLV
151 KDYFPEPVTV SWNSGALTSG VHTFPAVLQS SGLYSLSSVV TVPSSSLGTQ
201 TYICNVNHKP SNTKVDKKVE PKSCDKTHTC PPCPAPELLG GPSVFLFPPK
251 PKDTLMISRT PEVTCVVVDV SHEDPEVKFN WYVDGVEVHN AKTKPREEQY
301 NSTYRVVSVL TVLHQDWLNG KEYKCKVSNK ALPAPIEKTI SKAKGQPREP
351 QVYTLPPSRD ELTKNQVSLT CLVKGFYPSD IAVEWESNGQ PENNYKTTPP
401 VLDSDGSFFL YSKLTVDKSR WQQGNVFSCS VMHEALHNHY TQKSLSLSPG
451 K
SEQ ID NO:17 (LC; 12C4)
1 DIVLTQSPAS LAVSLGQRAT ISCRASKSVS TSGYNYMYWY QQKPGQPPKL
51 LIYLASNLES GVPARFSGSG SGTDFTLNIH PVEEEDAATY YCQHSGELPY
101 TFGGGTKLEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV
151 QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV
201 THQGLSSPVT KSFNRGEC
SEQ ID NO:18 (HC; 29AM4-5-LALA)
1 EVQLVESGGG LVQPGGSLRL SCAASGFNIS YYFIHWVRQA PGKGLEWVAS
51 VYSSFGYTYY ADSVKGRFTI SADTSKNTAY LQMNSLRAED TAVYYCARFT
101 FPGLFDGFFG AYLGSLDYWG QGTLVTVSSA STKGPSVFPL APSSKSTSGG
151 TAALGCLVKD YFPEPVTVSW NSGALTSGVH TFPAVLQSSG LYSLSSVVTV
201 PSSSLGTQTY ICNVNHKPSN TKVDKKVEPK SCDKTHTCPP CPAPEAAGGP
251 SVFLFPPKPK DTLMISRTPE VTCVVVDVSH EDPEVKFNWY VDGVEVHNAK
301 TKPREEQYNS TYRVVSVLTV LHQDWLNGKE YKCKVSNKAL PAPIEKTISK
351 AKGQPREPQV YTLPPSRDEL TKNQVSLTCL VKGFYPSDIA VEWESNGQPE
401 NNYKTTPPVL DSDGSFFLYS KLTVDKSRWQ QGNVFSCSVM HEALHNHYTQ
451 KSLSLSPGK
SEQ ID NO:19 (LC; 29AM4-5-LALA)
1 DIQMTQSPSS LSASVGDRVT ITCRASQSVS SAVAWYQQKP GKAPKLLIYS
51 ASSLYSGVPS RFSGSRSGTD FTLTISSLQP EDFATYYCQQ AVNWVGALVT
101 FGQGTKVEIK RTVAAPSVFI FPPSDEQLKS GTASVVCLLN NFYPREAKVQ
151 WKVDNALQSG NSQESVTEQD SKDSTYSLSS TLTLSKADYE KHKVYACEVT
201 HQGLSSPVTK SFNRGEC
SEQ ID NO:20 (HC; 12C4-LALA)
1 EVKLEESGGG LMQPGGSMKL SCVASGFTFS NYWMNWVRQS PEKGLEWVAE
51 IRLKSNNYAT HYAESVKGRF TISRDDSKSS VYLQMNNLRA EDTGIYYCIR
101 DYDYDAYFDY WGQGTTLTVS SASTKGPSVF PLAPSSKSTS GGTAALGCLV
151 KDYFPEPVTV SWNSGALTSG VHTFPAVLQS SGLYSLSSVV TVPSSSLGTQ
201 TYICNVNHKP SNTKVDKKVE PKSCDKTHTC PPCPAPEAAG GPSVFLFPPK
251 PKDTLMISRT PEVTCVVVDV SHEDPEVKFN WYVDGVEVHN AKTKPREEQY
301 NSTYRVVSVL TVLHQDWLNG KEYKCKVSNK ALPAPIEKTI SKAKGQPREP
351 QVYTLPPSRD ELTKNQVSLT CLVKGFYPSD IAVEWESNGQ PENNYKTTPP
401 VLDSDGSFFL YSKLTVDKSR WQQGNVFSCS VMHEALHNHY TQKSLSLSPG
451 K
SEQ ID NO:21 (LC; 12C4-LALA)
1 DIVLTQSPAS LAVSLGQRAT ISCRASKSVS TSGYNYMYWY QQKPGQPPKL
51 LIYLASNLES GVPARFSGSG SGTDFTLNIH PVEEEDAATY YCQHSGELPY
101 TFGGGTKLEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV
151 QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV
201 THQGLSSPVT KSFNRGEC
SEQ ID NO:22 (HC; KWAR23-LALA)
1 EVQLQQSGAE LVKPGASVKL SCTASGFNIK DYYIHWVQQR TEQGLEWIGR
51 IDPEDGETKY APKFQDKATI TADTSSNTAY LHLSSLTSED TAVYYCARWG
101 AYWGQGTLVT VSSASTKGPS VFPLAPSSKS TSGGTAALGC LVKDYFPEPV
151 TVSWNSGALT SGVHTFPAVL QSSGLYSLSS VVTVPSSSLG TQTYICNVNH
201 KPSNTKVDKK VEPKSCDKTH TCPPCPAPEA AGGPSVFLFP PKPKDTLMIS
251 RTPEVTCVVV DVSHEDPEVK FNWYVDGVEV HNAKTKPREE QYNSTYRVVS
301 VLTVLHQDWL NGKEYKCKVS NKALPAPIEK TISKAKGQPR EPQVYTLPPS
351 RDELTKNQVS LTCLVKGFYP SDIAVEWESN GQPENNYKTT PPVLDSDGSF
401 FLYSKLTVDK SRWQQGNVFS CSVMHEALHN HYTQKSLSLS PGK
SEQ ID NO:23 (LC; KWAR23-LALA)
1 QIVLTQSPAI MSASPGEKVT LTCSASSSVS SSYLYWYQQK PGSSPKLWIY
51 STSNLASGVP ARFSGSGSGT SYSLTISSME AEDAASYFCH QWSSYPRTFG
101 AGTKLELKRT VAAPSVFIFP PSDEQLKSGT ASVVCLLNNF YPREAKVQWK
151 VDNALQSGNS QESVTEQDSK DSTYSLSSTL TLSKADYEKH KVYACEVTHQ
201 GLSSPVTKSF NRGEC
SEQ ID NO:24 (константная область HC человеческого IgG1 антитела)
1 ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV
51 HTFPAVLQSS GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKKVEP
101 KSCDKTHTCP PCPAPELLGG PSVFLFPPKP KDTLMISRTP EVTCVVVDVS
151 HEDPEVKFNW YVDGVEVHNA KTKPREEQYN STYRVVSVLT VLHQDWLNGK
201 EYKCKVSNKA LPAPIEKTIS KAKGQPREPQ VYTLPPSRDE LTKNQVSLTC
251 LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW
301 QQGNVFSCSV MHEALHNHYT QKSLSLSPGK
SEQ ID NO:25 (LALA мутант константной области HC человеческого IgG1 антитела (мутации подчеркнуты)
1 ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV
51 HTFPAVLQSS GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKKVEP
101 KSCDKTHTCP PCPAPEAAGG PSVFLFPPKP KDTLMISRTP EVTCVVVDVS
151 HEDPEVKFNW YVDGVEVHNA KTKPREEQYN STYRVVSVLT VLHQDWLNGK
201 EYKCKVSNKA LPAPIEKTIS KAKGQPREPQ VYTLPPSRDE LTKNQVSLTC
251 LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW
301 QQGNVFSCSV MHEALHNHYT QKSLSLSPGK
SEQ ID NO:26 (константная область κ LC человеческого антитела)
1 RTVAAPSVFI FPPSDEQLKS GTASVVCLLN NFYPREAKVQ WKVDNALQSG
51 NSQESVTEQD SKDSTYSLSS TLTLSKADYE KHKVYACEVT HQGLSSPVTK
101 SFNRGEC
SEQ ID NO:27 (лидерная последовательность HAVT20, 12C4/12C4-LALA/29AM4-5 LALA/KWAR23/KWAR23-LALA/HEFLB)
1 MACPGFLWAL VISTCLEFSM A
SEQ ID NO:28 (лидерная последовательность тяжелых цепей мАт 1-13)
1 MGWTLVFLFL LSVTAGVHS
SEQ ID NO:29 (лидерная последовательность легких цепей мАт 1-13)
1 MVSSAQFLGL LLLCFQGTRC
SEQ ID NO:30 (HCDR1; мАт 1, 2, 3, 4, 12 и 13)
1 SYVMG
SEQ ID NO:31 (HCDR2; мАт 1, 2, 3, 4, 12 и 13)
1 IISSSGSPYY ASWVNG
SEQ ID NO:32 (HCDR3; мАт 1, 2, 3, 4, 12 и 13)
1 VGPLGVDYFN I
SEQ ID NO:33 (LCDR1; мАт 1, 2, 3, 4, 12 и 13)
1 RASQSINSYL A
SEQ ID NO:34 (LCDR2; мАт 1, 2, 3, 4, 12 и 13)
1 SASFLYS
SEQ ID NO:35 (LCDR3; мАт 1, 2, 3, 4, 12 и 13)
1 QSWHYISRSY T
SEQ ID NO:36 (HCDR1; мАт 5-11)
1 SHGIS
SEQ ID NO:37 (HCDR2; мАт 5, 7, 8, 9, 11)
1 TIGTGVITYY ASWAKG
SEQ ID NO:38 (HCDR3; мАт 5, 7, 8, 9, 11)
1 GSAWNDPFDY
SEQ ID NO:39 (LCDR1; мАт 5-11)
1 QASQSVYGNN DLA
SEQ ID NO:40 (LCDR2; мАт 5-11)
1 LASTLAT
SEQ ID NO:41 (LCDR3; мАт 6-10)
1 LGGGDDEADN T
SEQ ID NO:42 (HCDR2; мАт 10)
1 TIGTGGITYY ASWAKG
SEQ ID NO:43 (HCDR3; мАт 10)
1 GSAWNDPFDI
SEQ ID NO:44 (HCDR2; мАт 6)
1 TIGTGVITYF ASWAKG
SEQ ID NO:45 (HCDR3; мАт 6)
1 GSAWNDPFDP
SEQ ID NO:46 (LCDR3; мАт 5, 11)
1 LGGGDDEADN V
SEQ ID NO:47 (HC; KWAR23)
1 EVQLQQSGAE LVKPGASVKL SCTASGFNIK DYYIHWVQQR TEQGLEWIGR
51 IDPEDGETKY APKFQDKATI TADTSSNTAY LHLSSLTSED TAVYYCARWG
101 AYWGQGTLVT VSSAKTTAPS VYPLAPVCGD TTGSSVTLGC LVKGYFPEPV
151 TLTWNSGSLS SGVHTFPAVL QSDLYTLSSS VTVTSSTWPS QSITCNVAHP
201 ASSTKVDKKI EPRGPTIKPC PPCKCPAPNL LGGPSVFIFP PKIKDVLMIS
251 LSPIVTCVVV DVSEDDPDVQ ISWFVNNVEV HTAQTQTHRE DYNSTLRVVS
301 ALPIQHQDWM SGKEFKCKVN NKDLPAPIER TISKPKGSVR APQVYVLPPP
351 EEEMTKKQVT LTCMVTDFMP EDIYVEWTNN GKTELNYKNT EPVLDSDGSY
401 FMYSKLRVEK KNWVERNSYS CSVVHEGLHN HHTTKSFSRT PGK
SEQ ID NO:48 (LC; KWAR23)
1 QIVLTQSPAI MSASPGEKVT LTCSASSSVS SSYLYWYQQK PGSSPKLWIY
51 STSNLASGVP ARFSGSGSGT SYSLTISSME AEDAASYFCH QWSSYPRTFG
101 AGTKLELKRA DAAPTVSIFP PSSEQLTSGG ASVVCFLNNF YPKDINVKWK
151 IDGSERQNGV LNSWTDQDSK DSTYSMSSTL TLTKDEYERH NSYTCEATHK
201 TSTSPIVKSF NRNEC
SEQ ID NO:49 (HC; HEFLB)
1 EVQLVQSGAE VKKPGESLRI SCKASGYSFT SYWVHWVRQM PGKGLEWMGN
51 IDPSDSDTHY SPSFQGHVTL SVDKSISTAY LQLSSLKASD TAMYYCVRGG
101 TGTLAYFAYW GQGTLVTVSS ASTKGPSVFP LAPCSRSTSE STAALGCLVK
151 DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSSLGTKT
201 YTCNVDHKPS NTKVDKRVES KYGPPCPPCP APEFLGGPSV FLFPPKPKDT
251 LMISRTPEVT CVVVDVSQED PEVQFNWYVD GVEVHNAKTK PREEQFNSTY
301 RVVSVLTVLH QDWLNGKEYK CKVSNKGLPS SIEKTISKAK GQPREPQVYT
351 LPPSQEEMTK NQVSLTCLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS
401 DGSFFLYSRL TVDKSRWQEG NVFSCSVMHE ALHNHYTQKS LSLSPGK
SEQ ID NO:50 (LC; HEFLB)
1 DVVMTQSPLS LPVTLGQPAS ISCRSSQSLV HSYGNTYLYW FQQRPGQSPR
51 LLIYRVSNRF SGVPDRFSGS GSGTDFTLKI SRVEAEDVGV YYCFQGTHVP
101 YTFGGGTKVE IKRTVAAPSV FIFPPSDEQL KSGTASVVCL LNNFYPREAK
151 VQWKVDNALQ SGNSQESVTE QDSKDSTYSL SSTLTLSKAD YEKHKVYACE
201 VTHQGLSSPV TKSFNRGEC
SEQ ID NO:51 (человеческий SIRPα1, внеклеточный домен 1-370, Avi-FXa-Fc-метка)
MEPAGPAPGRLGPLLCLLLAASCAWSGVAGEEELQVIQPDKSVSVAAGESAILHCTVTSLIPVGPIQWFRGAGPARELIYNQKEGHFPRVTTVSESTKRENMDFSISISNITPADAGTYYCVKFRKGSPDTEFKSGAGTELSVRAKPSAPVVSGPAARATPQHTVSFTCESHGFSPRDITLKWFKNGNELSDFQTNVDPVGESVSYSIHSTAKVVLTREDVHSQVICEVAHVTLQGDPLRGTANLSETIRVPPTLEVTQQPVRAENQVNVTCQVRKFYPQRLQLTWLENGNVSRTETASTVTENKDGTYNWMSWLLVNVSAHRDDVKLTCQVEHDGQPAVSKSHDLKVSAHPKEQGSNTAAENTGSNERNGGGLNDIFEAQKIEWHEIEGRDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:52 (человеческий SIRPαBIT, внеклеточный домен 1-370, Avi-FXa-Fc-метка)
MEPAGPAPGRLGPLLCLLLAASCAWSGVAGEEELQVIQPDKSVLVAAGETATLRCTATSLIPVGPIQWFRGAGPGRELIYNQKEGHFPRVTTVSDLTKRNNMDFSIRIGNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPSAPVVSGPAARATPQHTVSFTCESHGFSPRDITLKWFKNGNELSDFQTNVDPVGESVSYSIHSTAKVVLTREDVHSQVICEVAHVTLQGDPLRGTANLSETIRVPPTLEVTQQPVRAENQVNVTCQVRKFYPQRLQLTWLENGNVSRTETASTVTENKDGTYNWMSWLLVNVSAHRDDVKLTCQVEHDGQPAVSKSHDLKVSAHPKEQGSNTAAENTGSNERNGGGLNDIFEAQKIEWHEIEGRDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:53 (человеческий SIRPβ1v1, внеклеточный домен, Avi-FXa-Fc-метка)
MPVPASWPHLPSPFLLMTLLLGRLTGVAGEDELQVIQPEKSVSVAAGESATLRCAMTSLIPVGPIMWFRGAGAGRELIYNQKEGHFPRVTTVSELTKRNNLDFSISISNITPADAGTYYCVKFRKGSPDDVEFKSGAGTELSVRAKPSAPVVSGPAVRATPEHTVSFTCESHGFSPRDITLKWFKNGNELSDFQTNVDPAGDSVSYSIHSTARVVLTRGDVHSQVICEIAHITLQGDPLRGTANLSEAIRVPPTLEVTQQPMRAENQANVTCQVSNFYPRGLQLTWLENGNVSRTETASTLIENKDGTYNWMSWLLVNTCAHRDDVVLTCQVEHDGQQAVSKSYALEISAHQKEHGSDITHEAALAPTAPLGGGLNDIFEAQKIEWHEIEGRDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:54 (человеческий SIRPβ1v2, внеклеточный домен, Avi-FXa-Fc-метка)
MPVPASWPHLPSPFLLMTLLLGRLTGVAGEEELQVIQPDKSISVAAGESATLHCTVTSLIPVGPIQWFRGAGPGRELIYNQKEGHFPRVTTVSDLTKRNNMDFSIRISNITPADAGTYYCVKFRKGSPDHVEFKSGAGTELSVRAKPSAPVVSGPAARATPQHTVSFTCESHGFSPRDITLKWFKNGNELSDFQTNVDPAGDSVSYSIHSTAKVVLTREDVHSQVICEVAHVTLQGDPLRGTANLSETIRVPPTLEVTQQPVRAENQVNVTCQVRKFYPQRLQLTWLENGNVSRTETASTLTENKDGTYNWMSWLLVNVSAHRDDVKLTCQVEHDGQPAVSKSHDLKVSAHPKEQGSNTAPGPALASAAPLGGGLNDIFEAQKIEWHEIEGRDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:55 (человеческий SIRPγ, внеклеточный домен, Avi-FXa-Fc-метка)
MPVPASWPHPPGPFLLLTLLLGLTEVAGEEELQMIQPEKLLLVTVGKTATLHCTVTSLLPVGPVLWFRGVGPGRELIYNQKEGHFPRVTTVSDLTKRNNMDFSIRISSITPADVGTYYCVKFRKGSPENVEFKSGPGTEMALGAKPSAPVVLGPAARTTPEHTVSFTCESHGFSPRDITLKWFKNGNELSDFQTNVDPTGQSVAYSIRSTARVVLDPWDVRSQVICEVAHVTLQGDPLRGTANLSEAIRVPPTLEVTQQPMRVGNQVNVTCQVRKFYPQSLQLTWSENGNVCQRETASTLTENKDGTYNWTSWFLVNISDQRDDVVLTCQVKHDGQLAVSKRLALEVTVHQKDQSSDATPKGQDNSADIQHSGGRSSLEGPRFEGKPIPNPLLGLDSTRTGGGGLNDIFEAQKIEWHEIEGRDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:56 (SIRPα яванского макака, внеклеточный домен, Avi-FXa-Fc-метка)
MEPAGPAPGRLGPLLCLLLTASCAWSGVLGEEELQVIQPEKSVSVAAGDSATLNCTVSSLIPVGPIQWFRGAGPGRELIYNLKEGHFPRVTAVSDPTKRNNMDFSIRISNITPADAGTYYCVKFRKGSPDVELKSGAGTELSVRAKPSAPVVSGPAVRATAEHTVSFTCESHGFSPRDITLKWFKNGNELSDVQTNVDPAGKSVSYSIRSTARVLLTRRDVHSQVICEVAHVTLQGDPLRGTANLSEAIRVPPFLEVTQQSMRADNQVNVTCQVTKFYPQRLQLTWLENGNVSRTEMASALPENKDGTYNWTSWLLVNVSAHRDDVKLTCQVEHDGQPAVNKSFSVKVSAHPKEQGSNTAAENTGTNERNGGGLNDIFEAQKIEWHEIEGRDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:57 (HC; 1H9; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAQVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWITWVKQAPGQGLEWIGDIYPGSGSTNHIEKFKSKATLTVDTSISTAYMELSRLRSDDTAVYYCATGYGSSYGYFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYASTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:58 (LC; 1H9; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADIQMTQSPSSLSASVGDRVTITCRASENIYSYLAWYQQKPGKAPKLLIYTAKTLAEGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQHQYGPPFTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:59 (HC; 40A-1; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAQVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWITWVKQAPGQGLEWIGDIYPGSGSTNHIEKFKSKATLTVDTSISTAYMELSRLRSDDTAVYYCATGYGSSYGYFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYASTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:60 (LC; 40A-1; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADIQMTQSPSSLSASVGDRVTITCRASQDIGSRLNWLQQKPGKAPKRLIYATSSLDSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQYASSPFTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:61 (HC; 40A-2; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAEVQLVQSGAEVVKPGASVKLSCKASGSTFTSYWMHWVKQAPGQGLEWIGAIYPVNSDTTYNQKFKGKATLTVDKSASTAYMELSSLRSEDTAVYYCTRSFYYSLDAAWFVYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:62 (LC; 40A-2; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADIQMTQSPSSLSASVGDRVTITCRASQDIGSRLNWLQQKPGKAPKRLIYATSSLDSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQYASSPFTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:63 (HC; AB3-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAAVTLDESGGGLQTPGGALSLVCKASGFIFSDYGMNWVRQAPGKGLEFVAQITSGSRTYYGAAVKGRATISRDNRQSTVKLQLNNLRAEDTGIYFCARDFGSGVGSIDAWGNGTEVIVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:64 (LC; AB3-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAALTQPASVSANLGGTVKITCSGSRGRYGWYQQRSPGSAPVTVIYRDNQRPSNIPSRFSSSTSGSTSTLTITGVQADDESVYFCGSYDGSIDIFGAGTTLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:65 (HC; AB25-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADVQLVESGGGVVRPGESLRLSCEASGFTFSSNAMSWVRQAPGKGLEWVAGISSGSDTYYGDSVKGRLTISRDNSKNILYLQMNSLTAEDTAVYYCARETWNHLFDYWGLGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:66 (LC; AB25-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMASYELTQPPSVSVSPGQTARITCSGGSYSSYYYAWYQQKPGQAPVTLIYSDDKRPSNIPERFSGSSSGTTVTLTISGVQAEDEADYYCGGYDQSSYTNPFGGGTKLTVLRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:67 (HC; AB115-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAVQLVESGGGVVRPGESLRLSCAASGFSFSSYAMNWVRQAPGEGLEWVSRINSGGGGTDYAESVKGRFTISRDNSENTLYLQMNSLRAEDTAVYYCAKQYDWNSFFDYWGLGALVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:68 (LC; AB115-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAETVLTQSPATLSVSPGERATLSCRASQTVGSKLAWHQQKPGQAPRLLIYDATNRATGISDRFSGSGSGTDFTLTISSLQTEDSAVYYCQQYYYWPPYRFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:69 (HC; AB119-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAVQLLESGGGVVQPGGSLRLSCAASGFSFSNFAMTWVRQAPGEGLEWVSTIGSGDTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDSTVSWSGDFFDYWGLGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:70 (LC; AB119-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAEIVLTQSPATLSVSPGERATFSCRASQNVKNDLAWYQQRPGQAPRLLIYAARIRETGIPERFSGSGSGTEFTLTITSLQSEDFAVYYCQQYYDWPPFTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:71 (HC; AB136-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADVQLVESGGGVVRPGESLRLSCAASGFTFSSYDMNWVRQAPGEGLEWVSLISGSGEIIYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKENNRYRFFDDWGLGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:72 (LC; AB136-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAETVLTQSPGTLTLSPGERATLTCRASQSVYTYLAWYQEKPGQAPRLLIYGASSRATGIPDRFSGSGSGTEFTLTISSLQSEDFAVYYCQQYYDRPPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:73 (HC; 3F9-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMAEVKLVESGGGLVKPGGSLKLSCAASGFTFSSYAMSWVRQTPEKRLEWVATISDYGGSYTYYPDSVKGRFTISRDNAKYTLYLQMSSLRSEDTALYYCARPPYDDYYGGFAYWGQGTLVTVSAASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:74 (LC; 3F9-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADIVLTQSPASLAVSLGQRATISCRASKSVSSSGYSYMHWYQQKPGQPPKLLIYLASNLESGVPARFSGSGSGTDFTLNIHPVEEEDAATYYCQHNRELPCTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:75 (HC; 7H9-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADVQLQESGPGLVKPSQSLSLTCTVTGFSISRGYDWHWIRHFPGNILEWMGYITYSGISNYNPSLKSRISITHDTSKNHFFLRLNSVTAEDTATYYCARGGGAWFTYWGQGTLVTVSAASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:76 (LC; 7H9-LALA; включая лидерную последовательность [подчеркнута]; константную область [курсив])
MACPGFLWALVISTCLEFSMADIVMTQSPATLSVTPGDRVSLSCRASQSISDSLHWYHQKSHESPRLLIKYASQSISGIPSRFSAGGSGSDFTLTINSVEPEDVGVYYCQNGHSLPWTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
Таблица 8. Примеры замен аминокислотных остатков в FR1 тяжелой цепи
R
Q
S
V
E
G
G
G
P
R
A
A
Таблица 9. Примеры замен аминокислотных остатков в FR2 тяжелой цепи
V
W
V
Таблица 10. Примеры замен аминокислотных остатков в FR3 тяжелой цепи
G
S
A
Y
M
Q
E
L
T
S
P
T
T
A
V
Y
Таблица 11. Примеры замен аминокислотных остатков FR4 в тяжелой цепи
Q
Таблица 12. Примеры замен аминокислотных остатков в FR1 легкой цепи
E
V
V
L
Таблица 13. Примеры замен аминокислотных остатков в FR2 легкой цепи
Q
Таблица 14. Примеры замен аминокислотных остатков в FR4 легкой цепи
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-SIRPα АНТИТЕЛА | 2018 |
|
RU2771174C2 |
| АНТИТЕЛО, НАЦЕЛЕННОЕ НА CD47, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2832773C1 |
| АНТИ-CD47 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2693078C2 |
| Выделенное биспецифическое антитело, которое специфически связывается с CD47 и PD-L1 | 2021 |
|
RU2815823C2 |
| АНТИТЕЛО К SIRPα И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2822496C1 |
| АНТИТЕЛА ПРОТИВ СИГНАЛ-РЕГУЛЯТОРНОГО БЕЛКА АЛЬФА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2771964C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К CD47 и PD-L1 | 2020 |
|
RU2779652C2 |
| СПОСОБ ПОЛИПЕПТИДНОЙ МОДИФИКАЦИИ ДЛЯ ОЧИСТКИ ПОЛИПЕПТИДНЫХ МУЛЬТИМЕРОВ | 2010 |
|
RU2606264C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ CEACAM5 И CD47 | 2019 |
|
RU2798246C2 |
| АНТИТЕЛО ПРОТИВ SIRPα | 2019 |
|
RU2791002C2 |
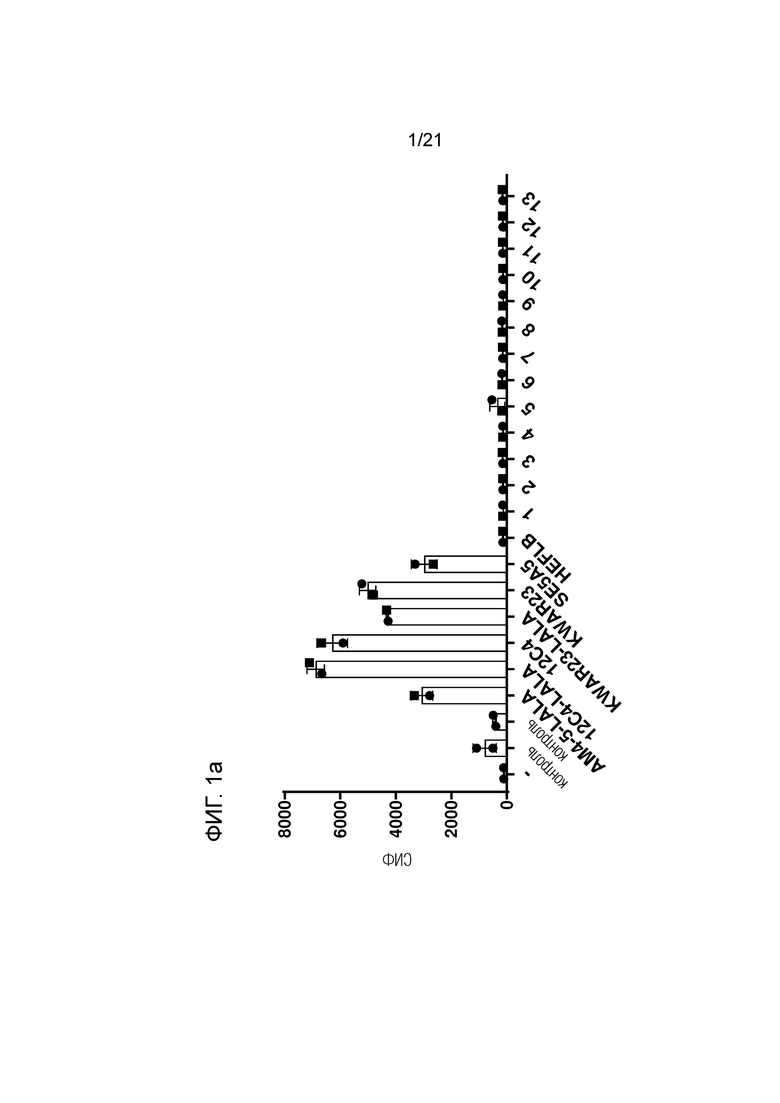
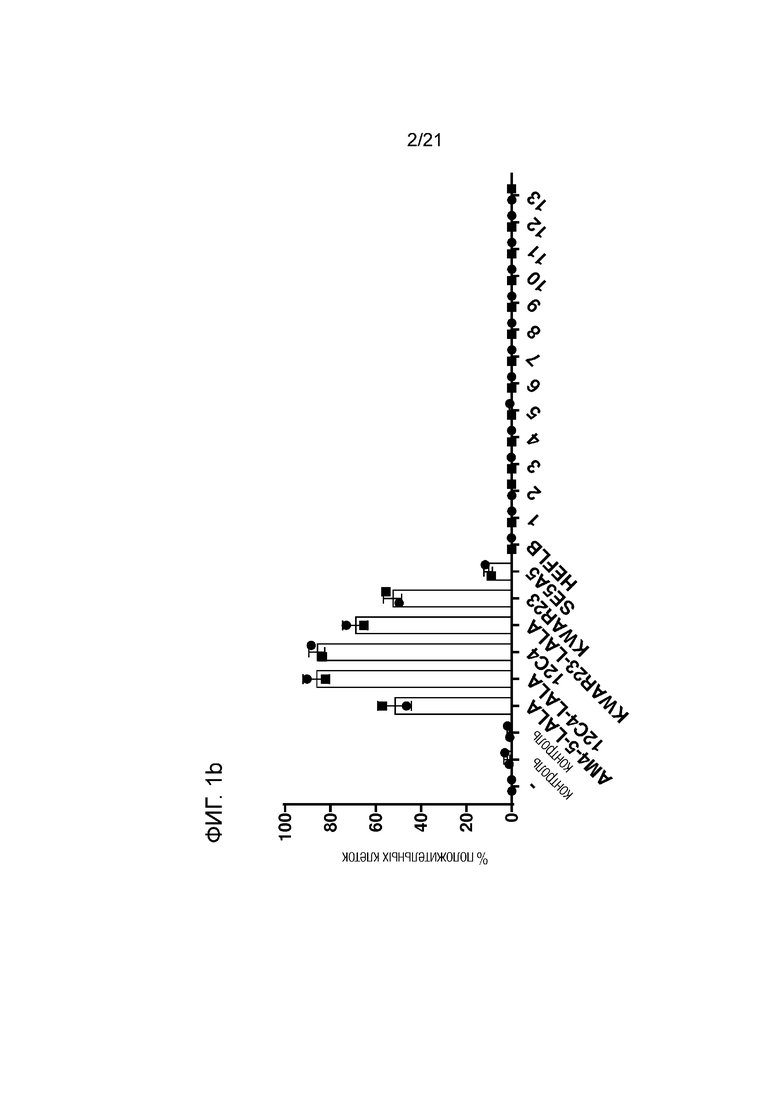
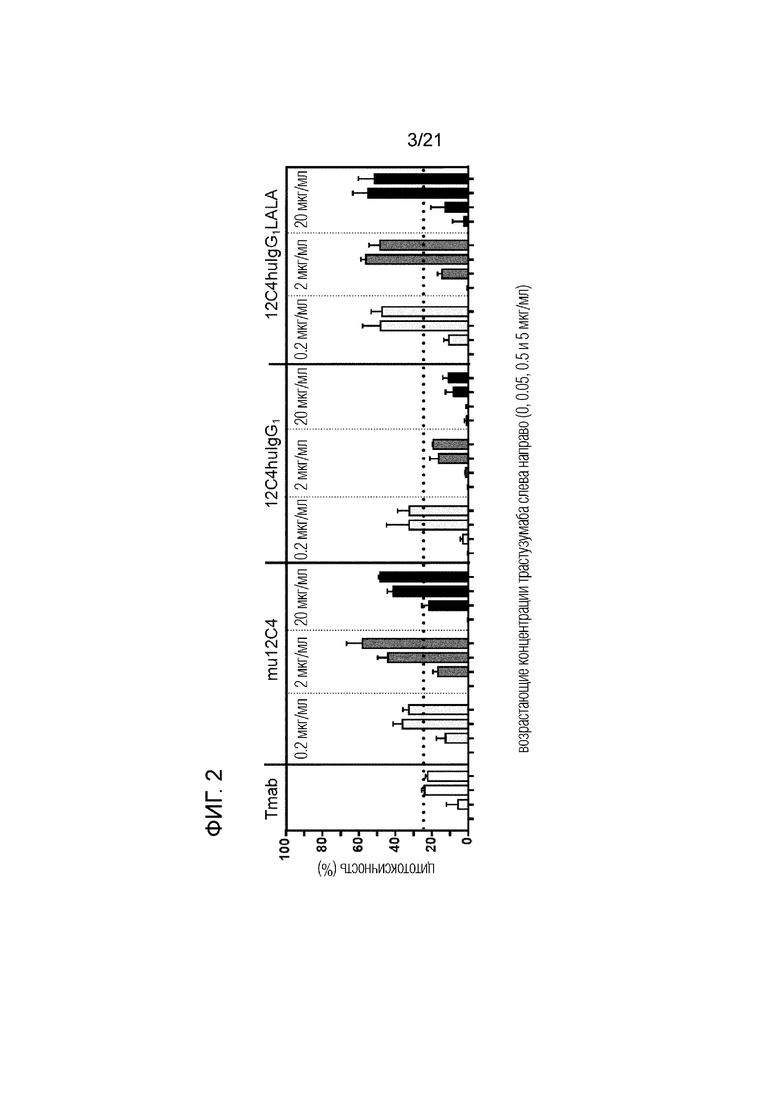
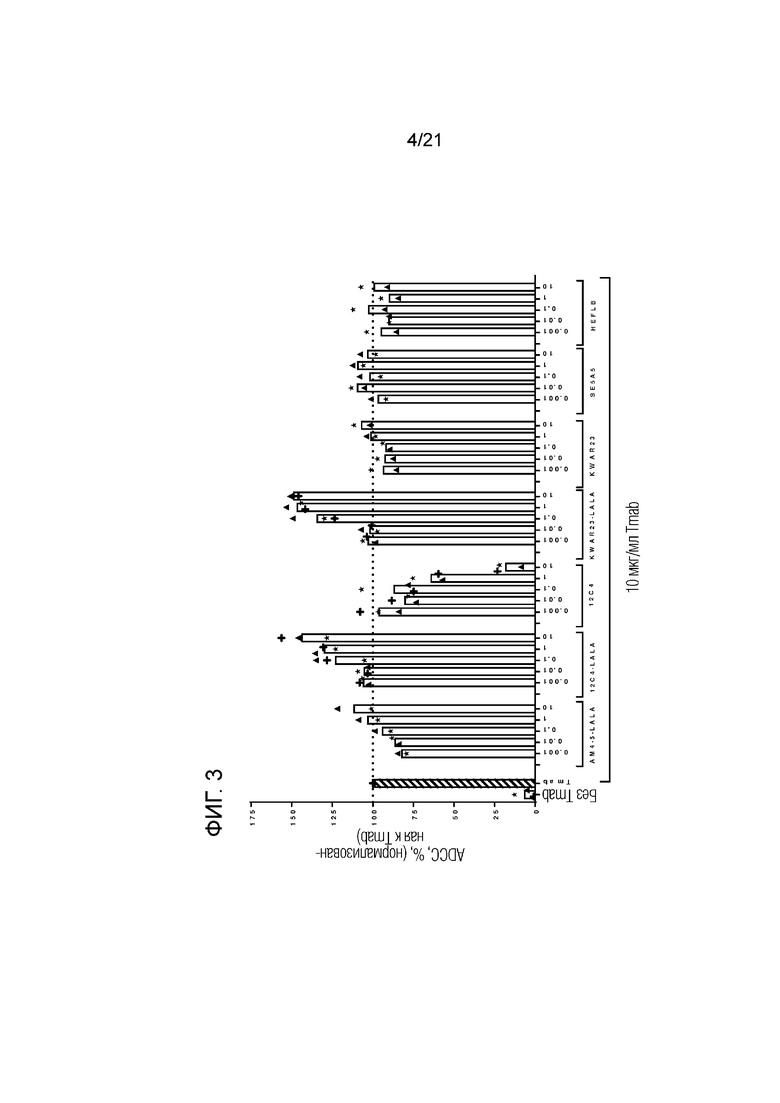
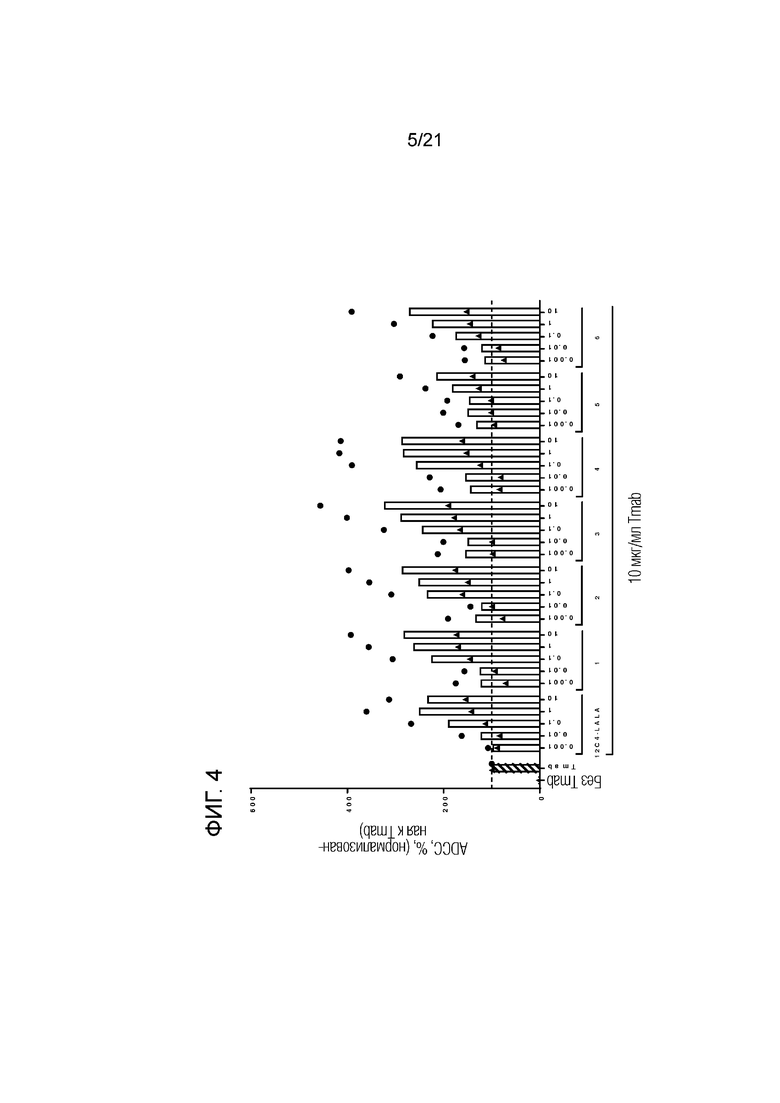

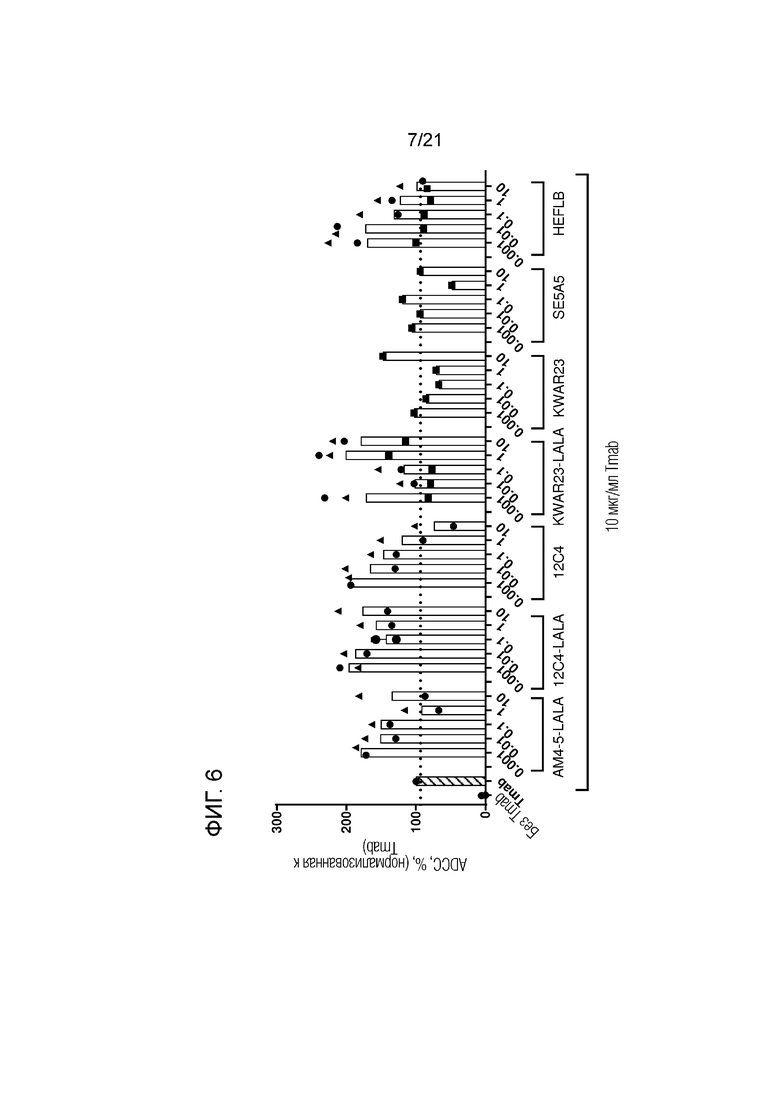
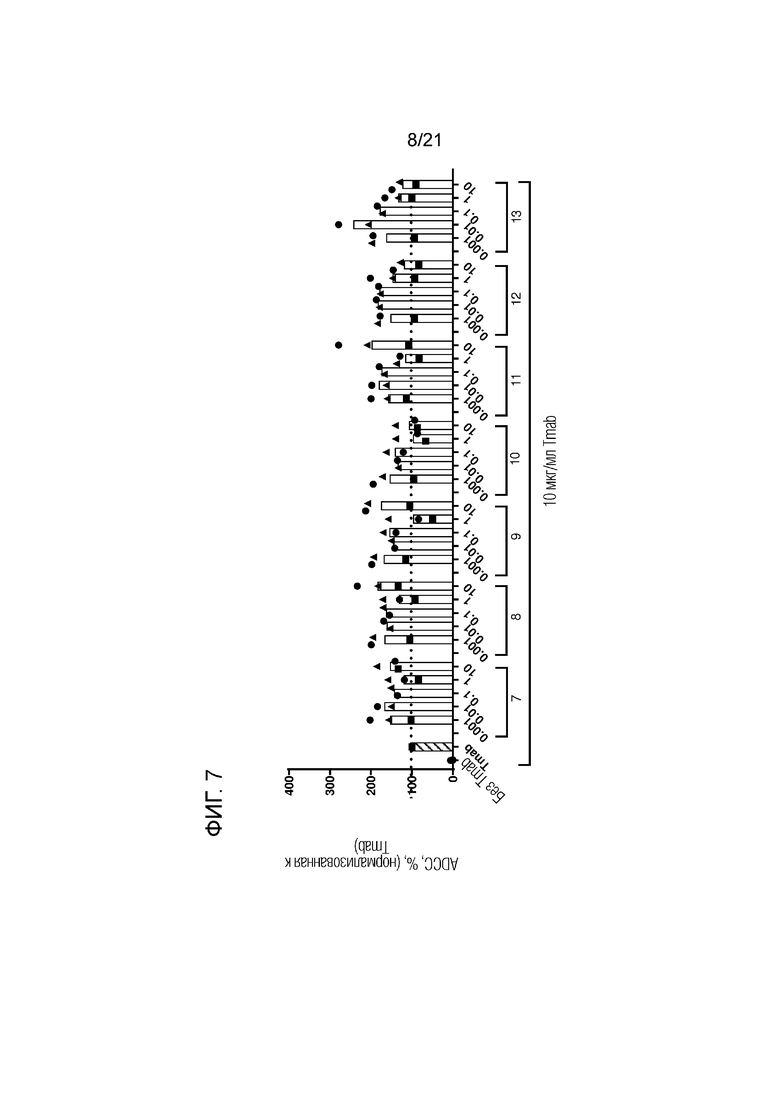
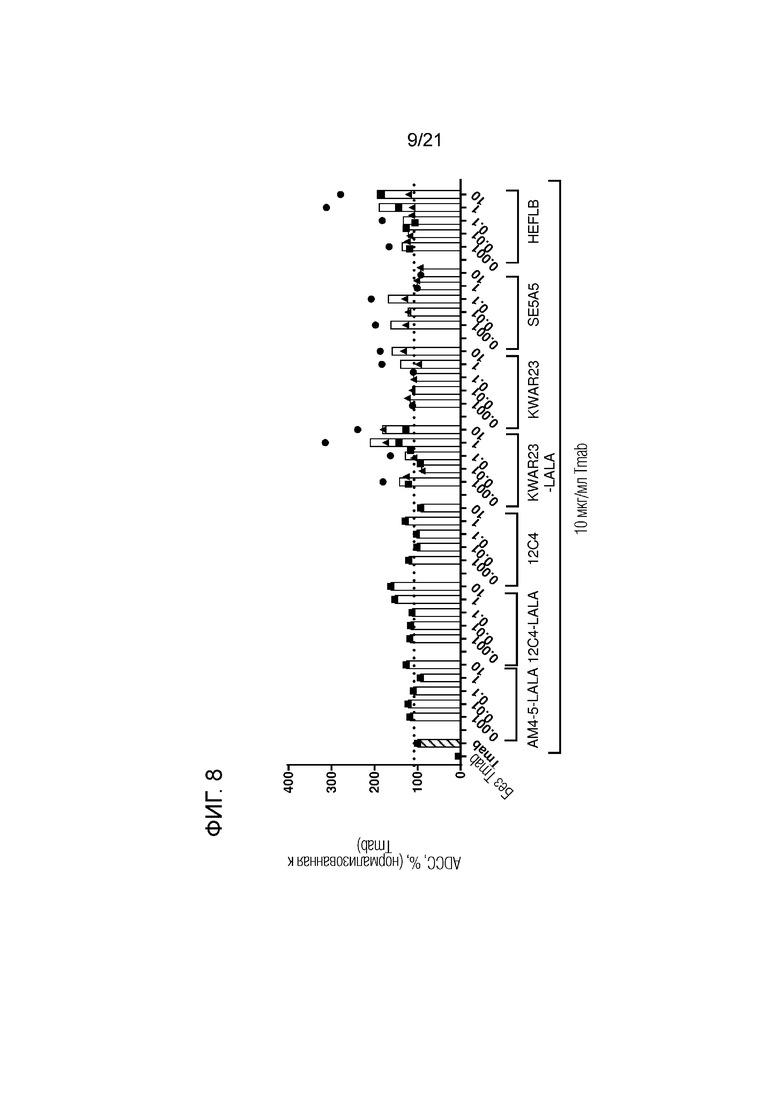
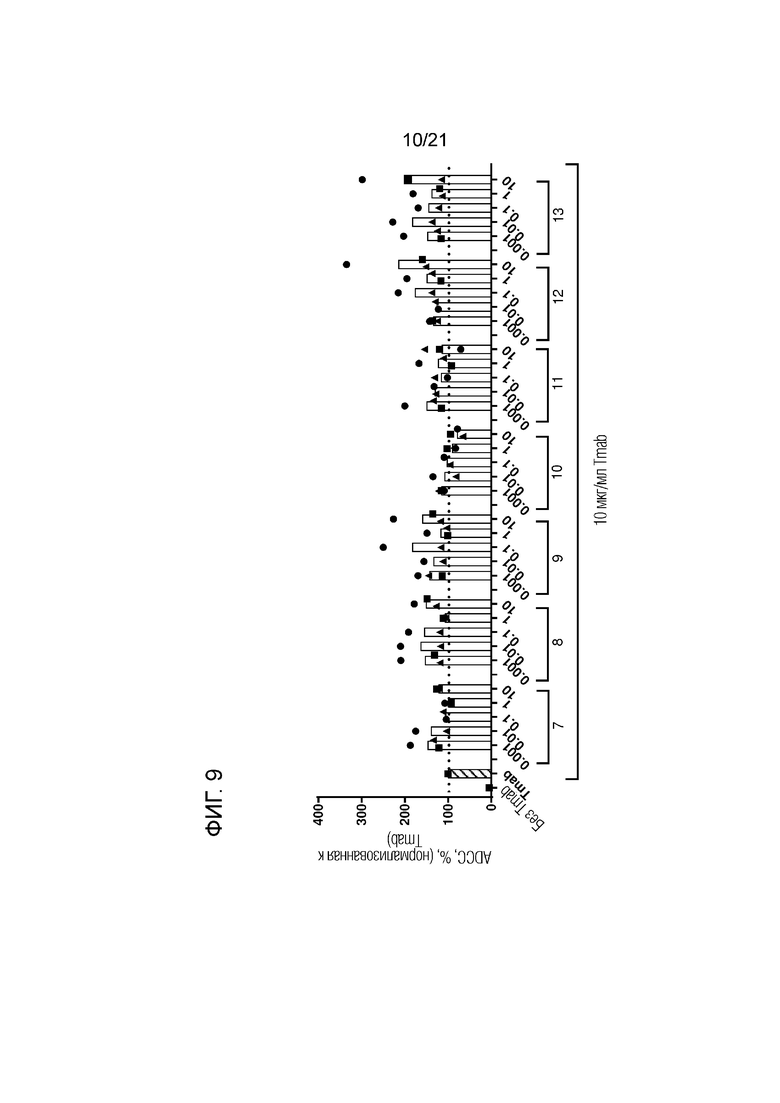
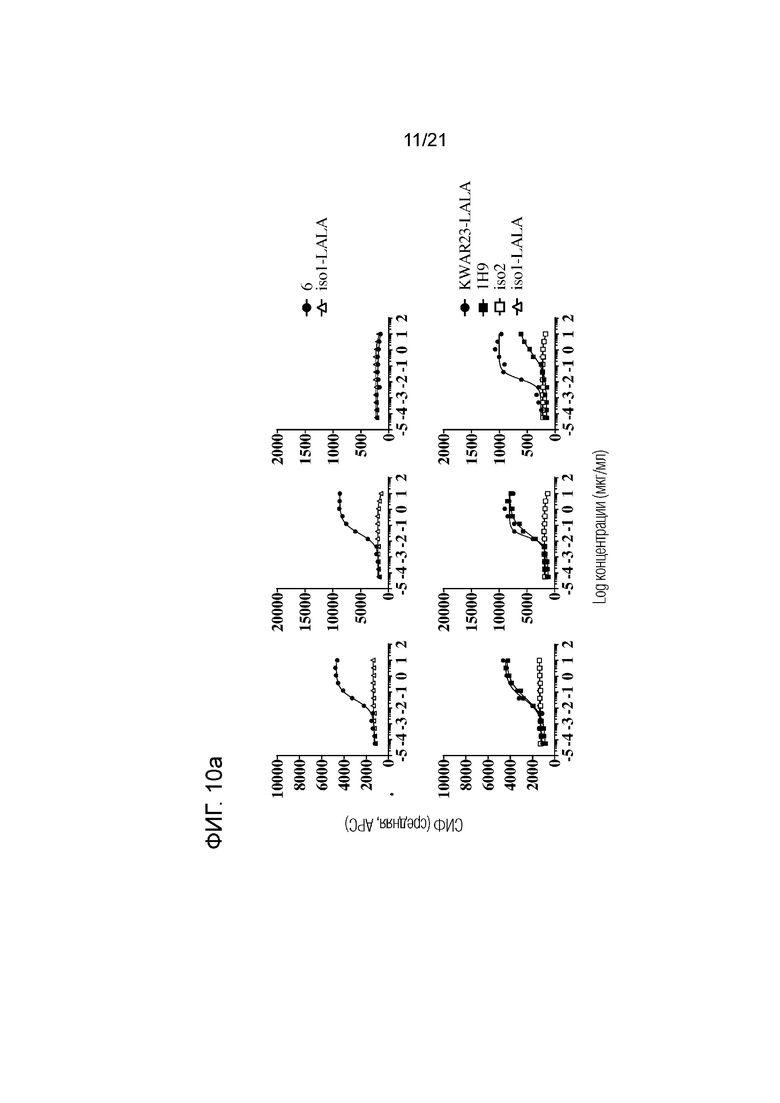
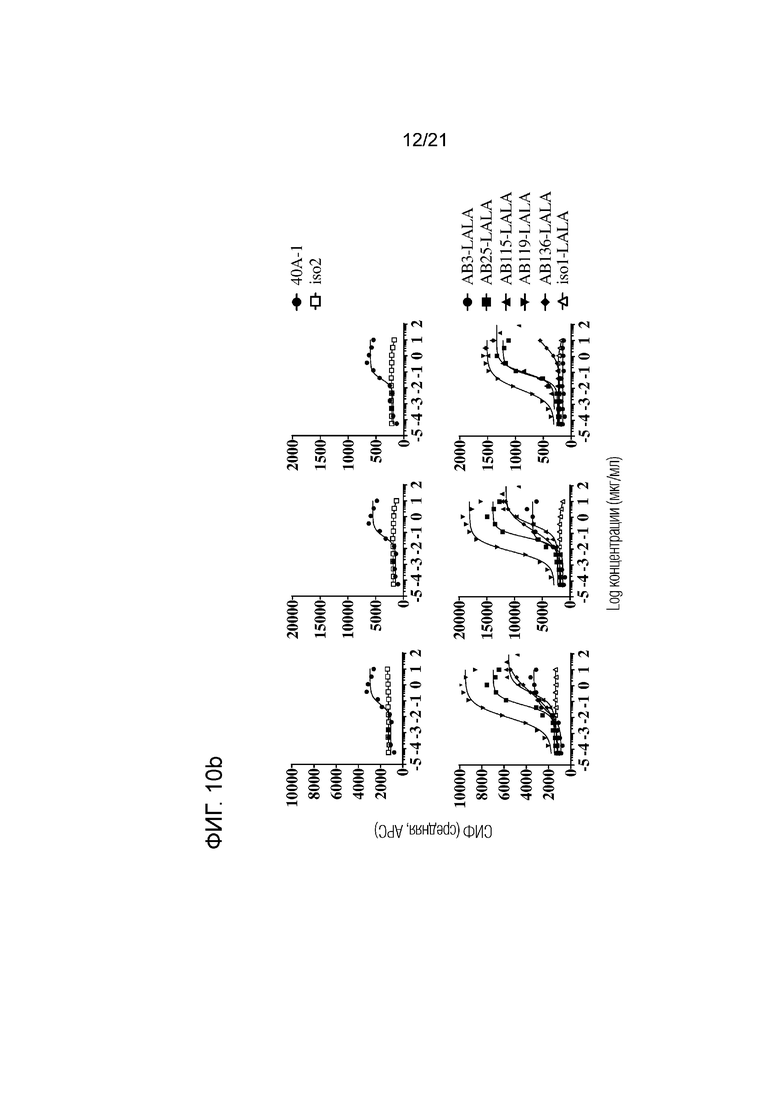
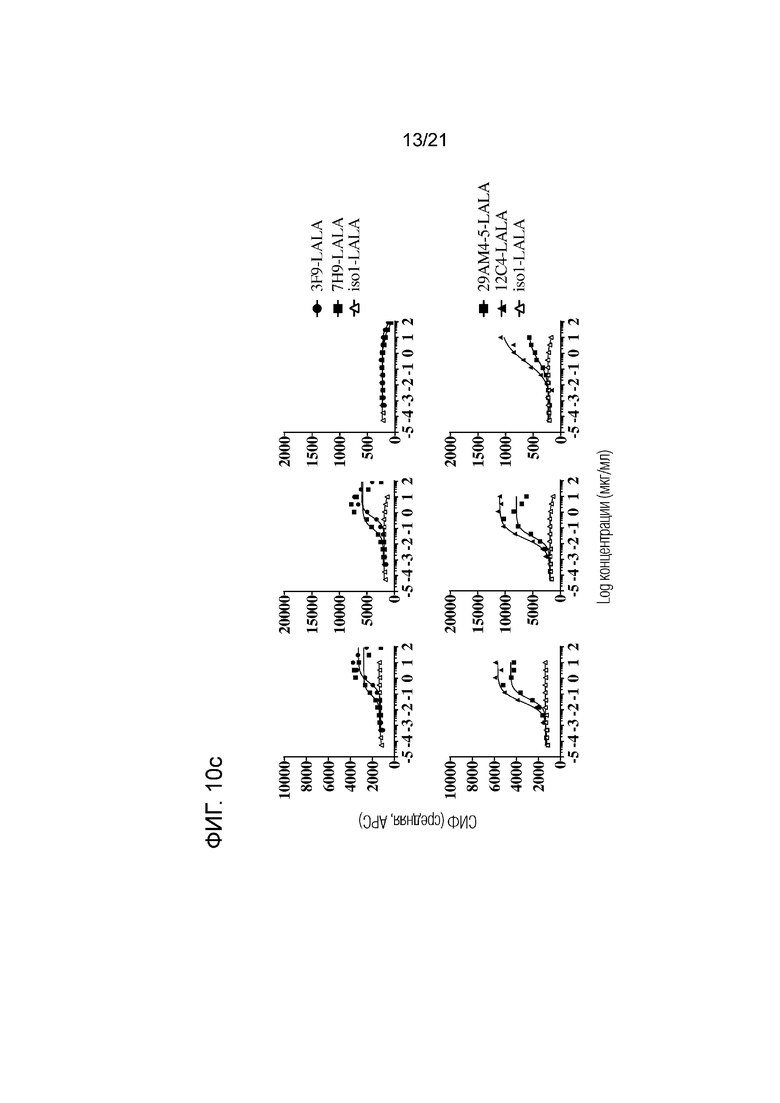
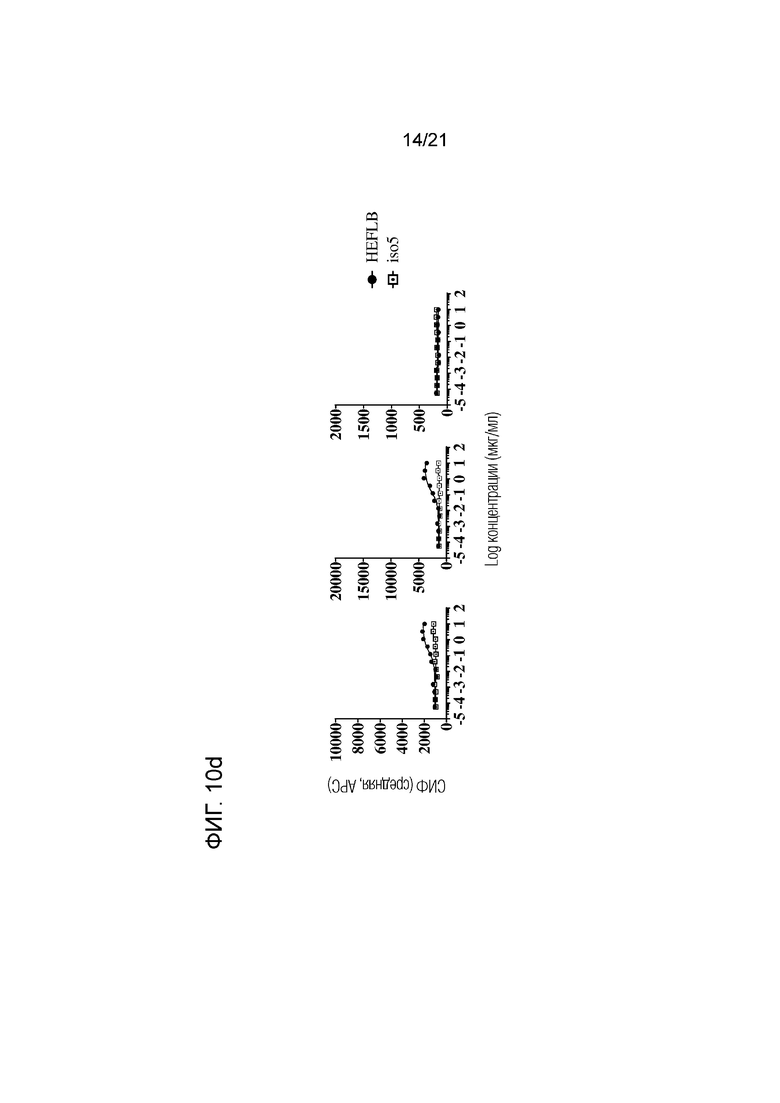
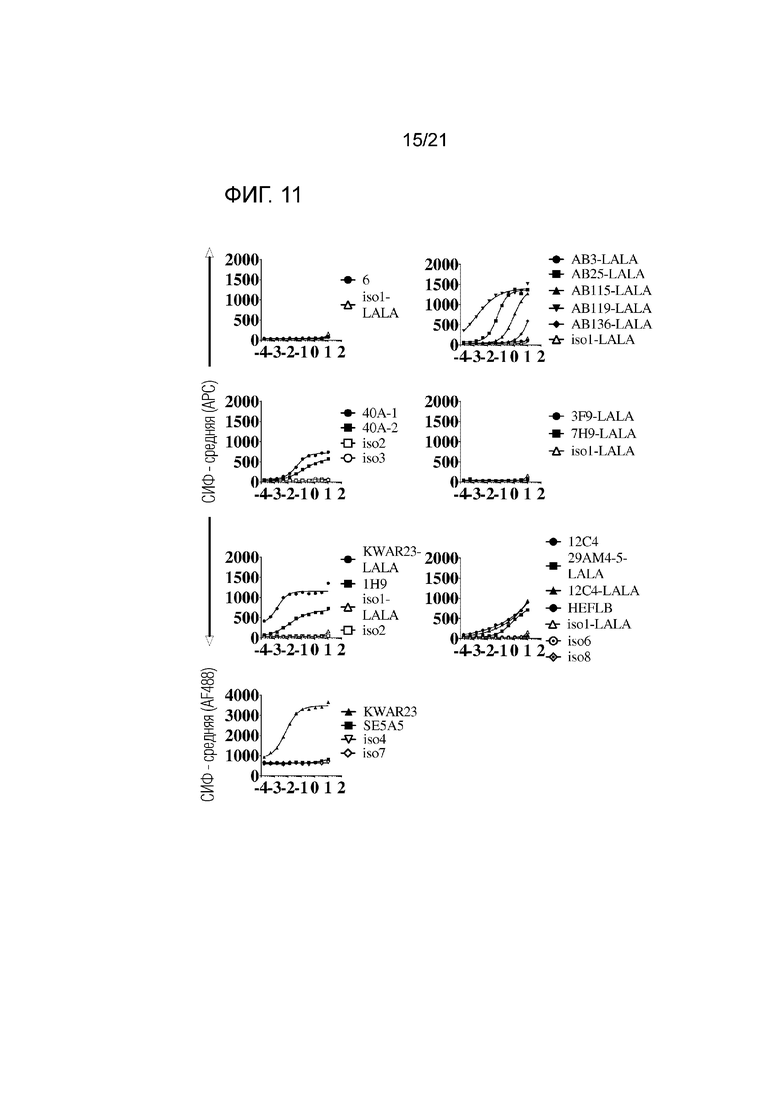
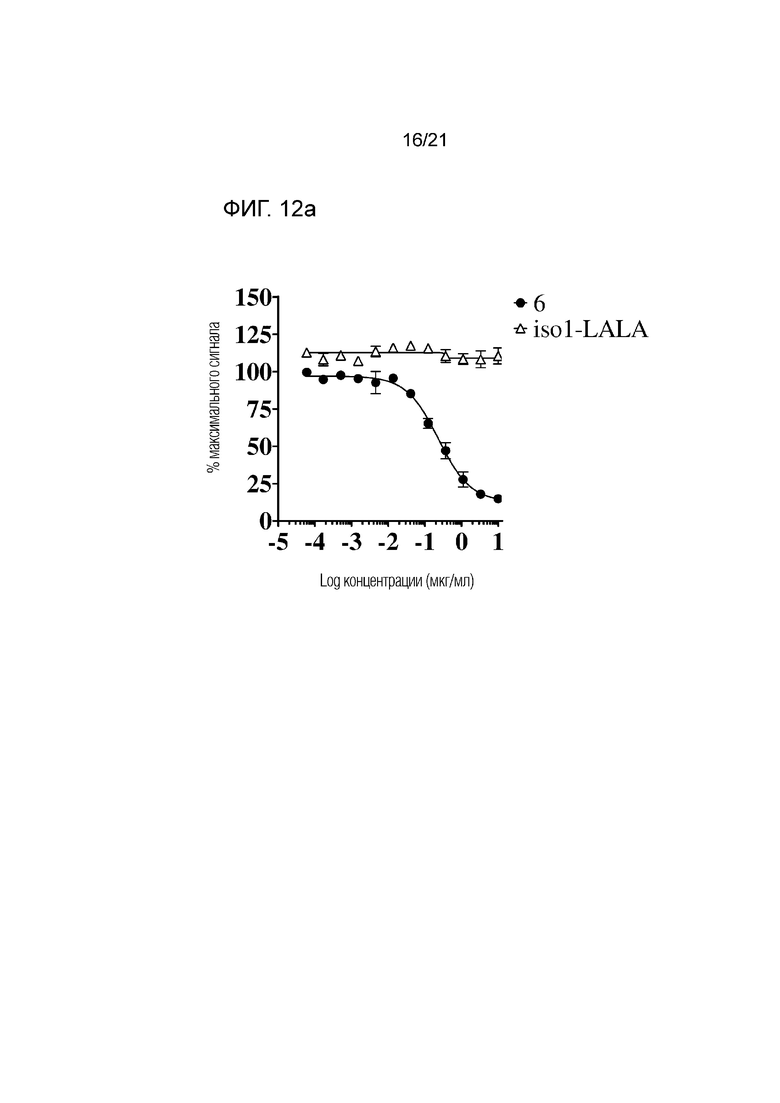
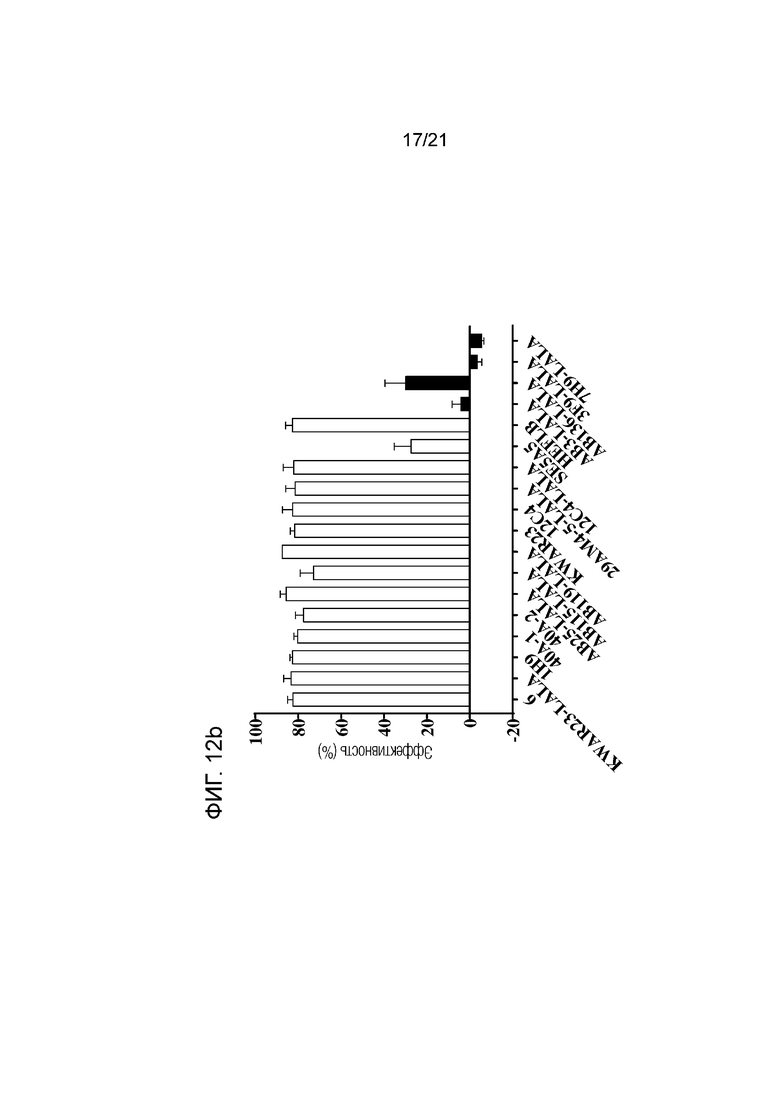
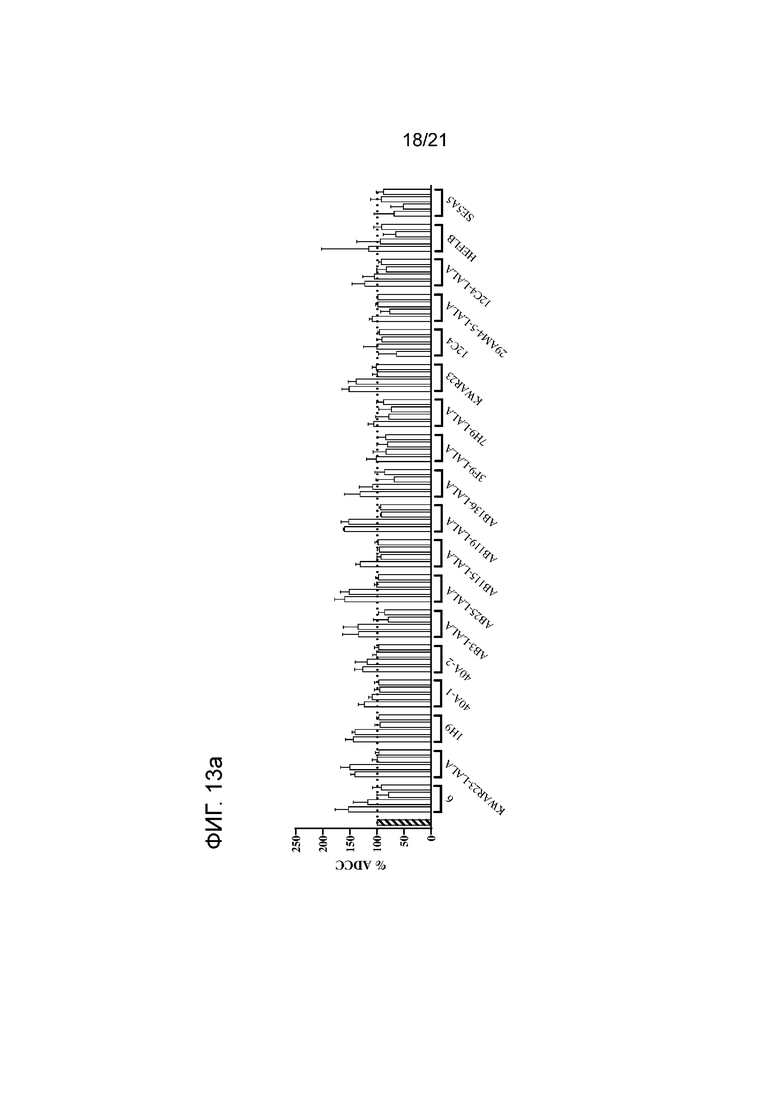
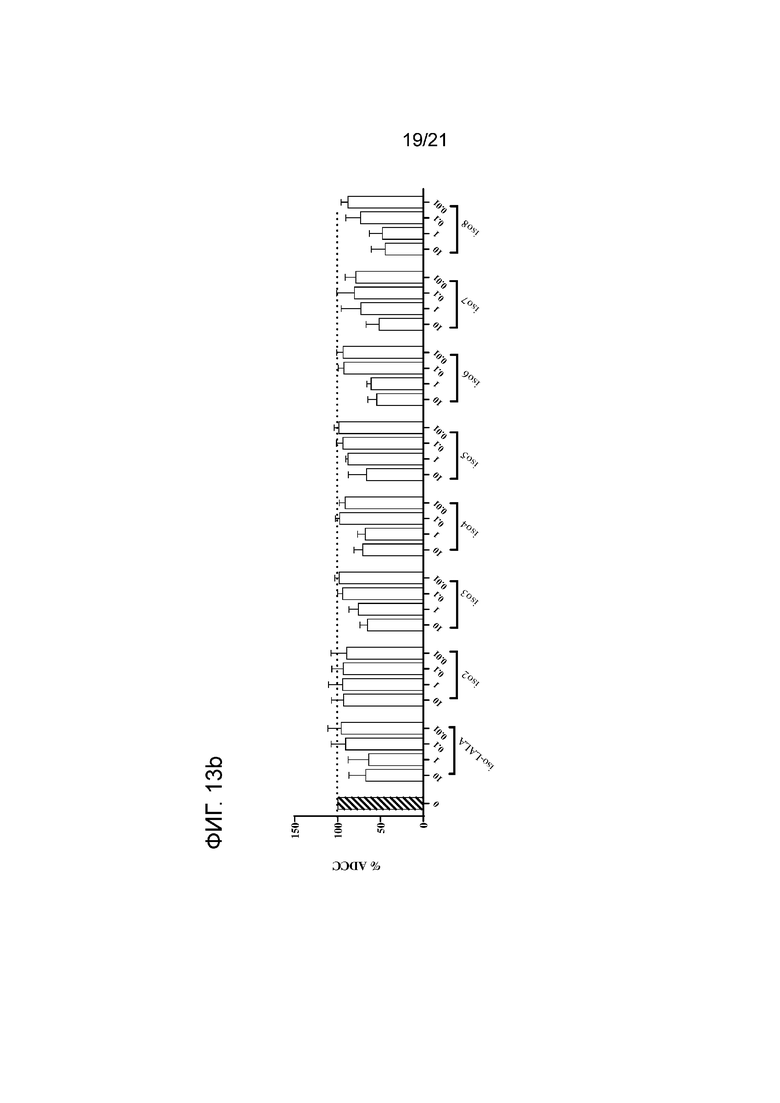
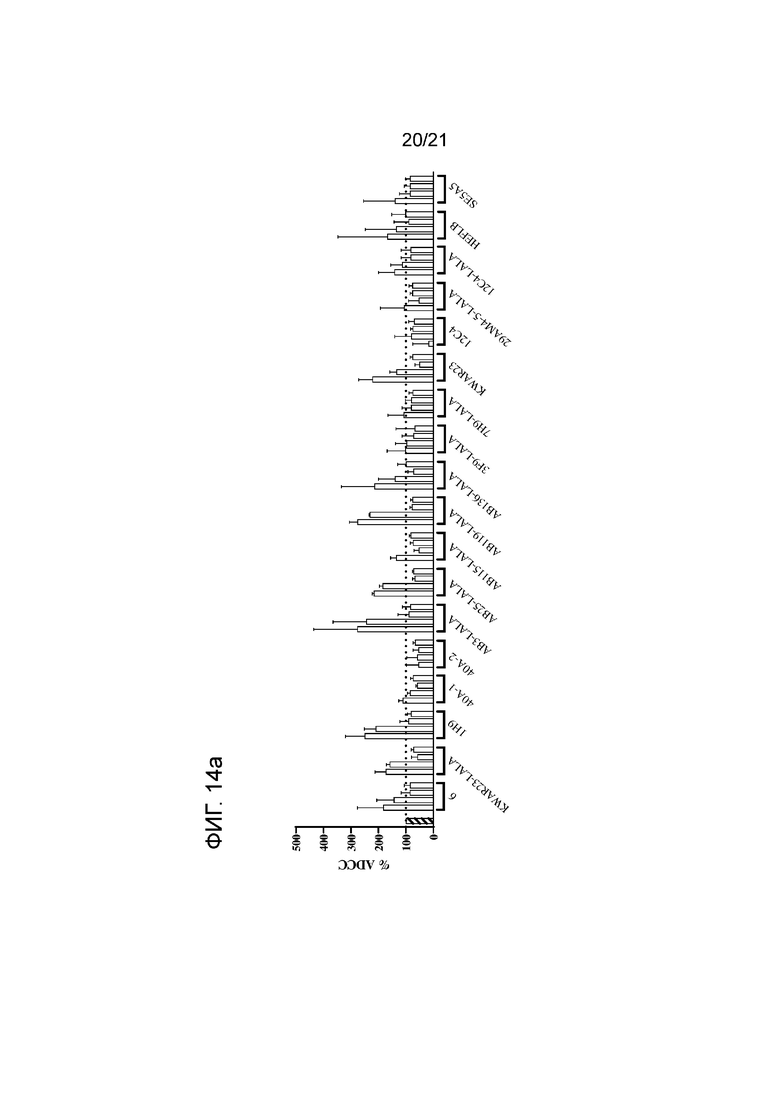
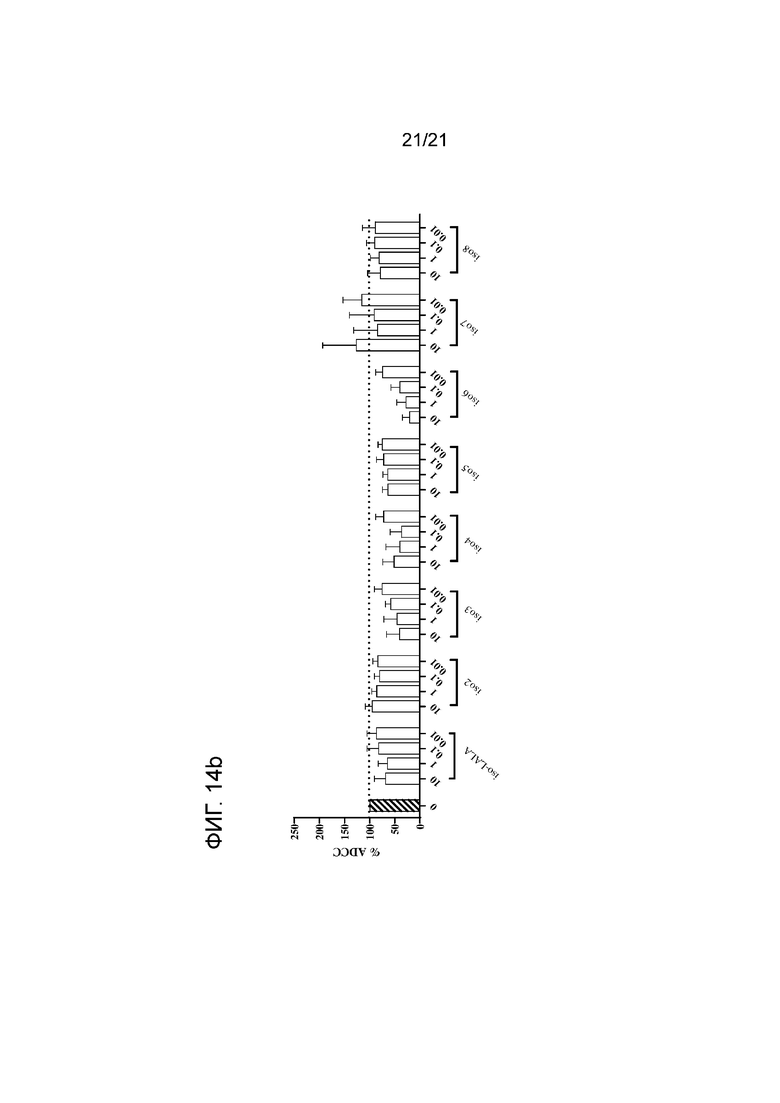
Изобретение относится к области биотехнологии. Предложены гуманизированное антитело против SIRPα или его антигенсвязывающий фрагмент. Также предложены кодирующая антитело молекула нуклеиновой кислоты, клетка-хозяин для получения антитела, содержащая указанную молекулу нуклеиновой кислоты. Изобретение также относится к использованию гуманизированных анти-SIRPα антител в лечении солидных опухолей и гематологических злокачественных новообразований у человека, необязательно, в сочетании с дополнительными противораковыми терапевтическими средствами. Изобретение может быть использовано в противораковой терапии. 5 н. и 16 з.п. ф-лы, 14 ил., 17 табл.
1. Гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент, содержащее определяющие комплементарность области тяжелой цепи (HCDR) и определяющие комплементарность области легкой цепи (LCDR) HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, где антитело, или его антигенсвязывающий фрагмент, содержит:
a. HCDR1, содержащую SEQ ID NO:36;
b. HCDR2, содержащую SEQ ID NO:44;
c. HCDR3, содержащую SEQ ID NO:45;
d. LCDR1, содержащую SEQ ID NO:39;
e. LCDR2, содержащую SEQ ID NO:40; и
f. LCDR3, содержащую SEQ ID NO:41.
2. Гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент по п. 1, где анти-SIRPα антитело, или его антигенсвязывающий фрагмент, имеет одно или более свойств из группы, состоящей из следующего:
a. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPα1 с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно, по меньшей мере 10-11 M, при анализе методом поверхностного плазмонного резонанса при 25°C с использованием внеклеточного домена человеческого SIRPα1 с последовательностью SEQ ID NO:51;
b. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPαBIT с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно, по меньшей мере 10-11 M, при анализе методом поверхностного плазмонного резонанса при 25°C с использованием внеклеточного домена человеческого SIRPαBIT с последовательностью SEQ ID NO:52;
c. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает SIRPα яванского макака с аффинностью связывания, составляющей по меньшей мере 10-8 M, предпочтительно, по меньшей мере 10-9 M, при анализе методом поверхностного плазмонного резонанса при 25°C с использованием внеклеточного домена SIRPα яванского макака с последовательностью SEQ ID NO:56;
d. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не связывает человеческий SIRPγ при измерении методом T-клеточного связывания с использованием проточной цитометрии, предпочтительно, с использованием окрашивания и активированной флуоресценцией сортировки клеток;
e. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не связывает человеческий SIRPγ при анализе методом поверхностного плазмонного резонанса при 25°C с использованием внеклеточного домена человеческого SIRPγ с последовательностью SEQ ID NO:55; и
f. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не является иммуногенным при определении IL-2 методом иммуноферментных пятен (ELISpot) и/или в анализе T-клеточной пролиферации.
3. Гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по п. 1 или 2, где:
a. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPα1 с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно, по меньшей мере 10-11 M, при анализе методом поверхностного плазмонного резонанса при 25°C с использованием внеклеточного домена человеческого SIRPα1 с последовательностью SEQ ID NO:51;
b. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, связывает человеческий SIRPαBIT с аффинностью связывания, составляющей по меньшей мере 10-10 M, предпочтительно, по меньшей мере 10-11 M, при анализе методом поверхностного плазмонного резонанса при 25°C с использованием внеклеточного домена человеческого SIRPαBIT с последовательностью SEQ ID NO:52;
c. блокирует связывание CD47 с SIRPα1 и SIRPαBIT в анализе диссоциации от иммобилизованного CD47 методом поверхностного плазмонного резонанса; и
d. анти-SIRPα антитело, или его антигенсвязывающий фрагмент, не связывает человеческий SIRPγ при измерении в анализе окрашивания и проточной цитометрии T-клеток, предпочтительно, при окрашивании с активированной флуоресценцией сортировкой клеток.
4. Гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по любому из предшествующих пунктов, где:
a. вариабельный домен тяжелой цепи антитела содержит 4 каркасные области тяжелой цепи, HFR1-HFR4, и 3 определяющие комплементарность области HCDR1-HCDR3, которые функционально связаны в следующем порядке: HFR1-HCDR1-HFR2-HCDR2-HFR3-HCDR3-HFR4, где каждая из каркасных областей тяжелой цепи по меньшей мере на 90% идентична аминокислотной последовательности каркаса SEQ ID NO:8, или где HFR1-HFR4 отличаются от SEQ ID NO:8 одной или более аминокислотными заменами, как указано в Таблицах 8-11; и
b. вариабельный домен легкой цепи антитела содержит 4 каркасные области легкой цепи, LFR1-LFR4, и 3 определяющие комплементарность области LCDR1-LCDR3, которые функционально связаны в следующем порядке: LFR1-LCDR1-LFR2-LCDR2-LFR3-LCDR3-LFR4, где каждая из каркасных областей легкой цепи по меньшей мере на 90% идентична аминокислотной последовательности каркаса SEQ ID NO:9, или где LFR1, LFR2 и/или LFR4 отличаются от SEQ ID NO:9 одной или более аминокислотными заменами, как указано в Таблицах 12-14.
5. Гуманизированное анти-SIRPα антитело, или его антигенсвязывающий фрагмент, по любому из предшествующих пунктов, содержащее вариабельную область тяжелой цепи (HCVR) и вариабельную область легкой цепи (LCVR), где антитело, или его антигенсвязывающий фрагмент, содержит аминокислотную последовательность HCVR SEQ ID NO:8 и аминокислотную последовательность LCVR SEQ ID NO:9.
6. Гуманизированное анти-SIRPα антитело по любому из предшествующих пунктов, содержащее модифицированную Fc-область, которая проявляет пониженное связывание с человеческим Fcα или Fcγ-рецептором в сравнении с таким же анти-SIRPα антителом, содержащим Fc-область дикого типа.
7. Гуманизированное анти-SIRPα антитело по любому из предшествующих пунктов, содержащее модифицированную Fc-область человеческого IgG1 с аминокислотной заменой в одном или более положениях, выбранных из группы, состоящей из L234, L235, G237, D265, D270, N297, A327, P328 и P329 в соответствии с нумерацией Eu.
8. Гуманизированное анти-SIRPα антитело по п. 7, содержащее аминокислотные замены L234A и L235A; L234E и L235A; L234A, L235A и P329A; или L234A, L235A и P329G.
9. Фармацевтическая композиция для применения в качестве лекарственного средства для лечения рака, содержащая гуманизированное анти-SIRPα антитело по любому из пп. 1-8, или его антигенсвязывающий фрагмент по любому из пп. 1-5, и фармацевтически приемлемый эксципиент.
10. Гуманизированное анти-SIRPα антитело по любому из пп. 1-8, или его антигенсвязывающий фрагмент по любому из пп. 1-5, для применения в качестве лекарственного препарата.
11. Молекула нуклеиновой кислоты для экспрессии кодирующей нуклеотидной последовательности в клетке-хозяине, где молекула содержит нуклеотидную последовательность, кодирующую гуманизированное анти-SIRPα антитело по любому из пп. 1-8, или его антигенсвязывающий фрагмент по любому из пп. 1-5.
12. Молекула нуклеиновой кислоты по п. 11, где молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую по меньшей мере одну из HCVR и LCVR антитела.
13. Молекула нуклеиновой кислоты по п. 11 или 12, где кодирующая нуклеотидная последовательность функционально связана с регуляторными последовательностями для экспрессии кодирующей нуклеотидной последовательности в клетке-хозяине.
14. Клетка-хозяин для получения антитела по любому из пп. 1-8, где клетка содержит молекулу нуклеиновой кислоты по любому из пп. 11-13.
15. Применение гуманизированного анти-SIRPα антитела по любому из пп. 1-8, его антигенсвязывающего фрагмента по любому из пп. 1-5 или фармацевтической композиции по п. 9 для получения лекарственного средства для лечения рака, где лечение также включает введение терапевтического антитела.
16. Применение по п. 15, где рак представляет собой солидную опухоль или гематологическое злокачественное новообразование у человека.
17. Применение по любому из пп. 15 или 16, где терапевтическое антитело направлено против связанной с мембраной мишени на поверхности опухолевых клеток и содержит человеческую Fc-область, которая связывается с активирующими Fc-рецепторами, присутствующими на человеческих иммунных эффекторных клетках.
18. Применение по любому из пп. 15-17, где связанная с мембраной мишень выбрана из группы, состоящей из аннексина A1, AMHR2, AXL, BCMA, B7H3, B7H4, CA6, CA9, CA15-3, CA19-9, CA27-29, CA125, CA242, CCR2, CCR4, CCR5, CD2, CD4, CD16, CD19, CD20, CD22, CD27, CD30, CD33, CD37, CD38, CD40, CD44, CD47, CD52, CD56, CD70, CD74, CD79, CD98, CD115, CD123, CD138, CD203c, CD303, CD333, CEA, CEACAM, CLCA-1, CLL-1, c-MET, Cripto, CTLA-4, DLL3, EGFL, EGFR, EPCAM, EPh, рецептора эндотелина B (ETBR), FAP, FcRL5 (CD307), FGF, FGFR, FOLR1, фукозил-GM1, GCC, GD2, GPNMB, gp100, HER2, HER3, HMW-MAA, интегрина α, IGF1R, IL1RAP, антигена каппа-миеломы, TM4SF1, Льюис А-подобного углевода, Льюис X, Льюис Y, LIV1, мезотелина, MUC1, MUC16, NaPi2b, нектин-4, PD-1, PD-L1, рецептора пролактина, PSMA, PTK7, SLC44A4, STEAP-1, антигена 5T4, тканевого фактора (TF), антигена Томсена-Фриденрайха (TF -Ag), Tag72, TNF, TNFR, TROP2, VEGF, VEGFR и VLA.
19. Применение по п. 16, где солидная опухоль человека выбрана из группы, состоящей из (HER2-положительного) рака молочной железы, (EGFR-положительной) карциномы толстой кишки, (GD2-положительной) нейробластомы, меланомы, остеосаркомы, (CD20-положительных) B-клеточных лимфом, (CD38-положительной) множественной миеломы, (CD52-положительной) лимфомы, (CD33-положительного) острого миелоидного лейкоза (AML), хронического миелоидного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), острого лимфобластного лейкоза (ALL), неходжскинской лимфомы (NHL), включая фолликулярную лимфому (FL) и диффузную крупноклеточную B-клеточную лимфому (DLBCL), печеночно-клеточной карциномы, множественной миеломы (MM), рака мочевого пузыря, рака желудка, рака яичника, рака головы и шеи, рака поджелудочной железы, почечной карциномы, рака предстательной железы, печеночно-клеточной карциномы и рака легкого.
20. Применение по любому из пп. 15-19, где лечение включает введение дополнительного противоракового терапевтического соединения.
21. Применение по п. 20, где дополнительное противораковое терапевтическое соединение представляет собой направленное терапевтическое средство, предпочтительно, иммунотерапевтическое средство.
| WO 2013056352 A1, 25.04.2013 | |||
| US 2017073414 A1, 16.03.2017 | |||
| LIU Y | |||
| et al., Functional Elements on SIRPa IgV Domain Mediate Cell Surface Binding to CD47, JOURNAL OF MOLECULAR BIOLOGY, 2006, vol | |||
| Станок для нарезания зубьев на гребнях | 1921 |
|
SU365A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Аппарат с мешалками для концентрации руд по методу всплывания | 1913 |
|
SU680A1 |
| РАТНИКОВА Н.М | |||
| и др., Рецептор CD47 как приоритетная мишень для противораковой терапии, МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, 2017, Том 51, | |||
Авторы
Даты
2024-01-25—Публикация
2019-11-15—Подача