Область, к которой относится изобретение
Настоящее изобретение относится к слитым белкам и вирусоподобным частицам (VLP), полезным в медицине и ветеринарии. Изобретение относится также к слитому белку, включающему полипептид, представляющий интерес, трансмембранный домен и полипептид gag ВИЧ и их функционально эквивалентные варианты. Изобретение относится, кроме того, к полинуклеотидам, векторам, клеткам-хозяевам и VLP частицам, экспрессирующим или презентирующим указанные слитые белки, и к фармацевтическим композициям, иммуногенным или вакцинным композициям, содержащим указанные слитые белки, полинуклеотиды, векторы, клетки-хозяева и VLP, и их применению в лечении и профилактике инфекционных заболеваний.
Предпосылки создания изобретения
Вирусоподобные частицы (VLP) представляют собой отличную вакцинную платформу, которая зарекомендовала себя как эффективная против безоболочечных вирусов, таких как вирус гепатита B (HBV), человеческий папилломавирус (HPV) или вирус гепатита E (HEV). См. Lua L, et al., Biotechnol. Bioeng. 2014; 111:425-440. В этих случаях VLP содержат один капсидный белок, который продуцируется в прокариотических или эукариотических клеточных системах для спонтанного образования VLP с отличными иммуногенными результатами. Успех и универсальность VLP продуцирующих платформ подсказали идею исследовать более сложные конструкции. Некоторые примеры могут включать получение VLP с презентацией гетерологичного антигена путем внедрения экзогенных последовательностей в вирусные капсидные белки и образование оболочечных VLP, которые содержат липидный бислой, происходящий из клетки-продуцента VLP, и показывают более высокую гетерогенность, чем у безоболочечных VLP. См. Bryant M, et al., Proc. Natl. Acad. Sci. USA 1990; 87:523-527 и Visciano M, et al., Vaccine 2011; 29(31):4903-4912.
Исследование вакцин против вируса иммунодефицита человека (ВИЧ) также приблизилось к VLP технологии. Что касается других ретровирусов, ВИЧ частицы представляют собой оболочечные структуры, образованные путем мультимеризации структурных белков Gag на внутренней стороне цитоплазматической мембраны инфицированных клеток через миристоилирование их N-конца. См. Bryant, 1990, выше. В процессе почкования Gag полимеры инкорпорируют геномную вирусную РНК, различные вирусные ферменты и вспомогательные белки и рекрутируют экспрессируемые на клеточной поверхности оболочечные гликопротеиновые комплексы для обеспечения инфекционности. Однако хорошо известно, что экспрессия ретровирусного гена gag является достаточной для продукции VLP структур, лишенных инфекционности. См. Visciano, 2011, выше и Cervera L, et al., J. Biotechnol. 2013; 166:152-165. Эти оголенные Gag VLP могут быть модифицированы либо для включения белков или РНК, чтобы действовать в качестве векторов доставки, либо для включения белков на их поверхности, чтобы действовать в качестве вакцинных препаратов. См. Visciano, 2011, выше.
За последние годы несколько групп разработали способ получения VLP с оболочкой, уделяя особое внимание исследованиям вакцин против ВИЧ. См. Visciano, 2011 и Cervera, 2013, выше. Однако оптимальное генерирование оболочечных VLP не является единственной трудностью в этих подходах. Второй серьезной проблемой является сложность гликопротеина оболочки ВИЧ (Env). См. Mao Y, et al., Nat. Struct. Mol. Biol. 2012; 19: 893-899. Этот большой гликопротеин содержит две субъединицы gp120 и gp41, способные генерировать нейтрализующие и ненейтрализующие антитела. Несмотря на многочисленные подходы к переконструированию имитаторов белков, которые действуют как иммуногены для индукции нейтрализующих антител против Env, было достигнуто мало положительных результатов. См. Mao, 2012, выше. Тем не менее, несмотря на усилия, предпринятые до настоящего времени, в данной области все еще существует настоятельная потребность в новых способах введения антигенных эпитопов в VLP соединения, а также в разработке VLP, полезных для индукции иммунного ответа против определенных антигенных эпитопов.
Сущность изобретения
В первом аспекте настоящее изобретение относится к слитому белку, который включает в направлении от N- к C-концу:
(a) полипептид представляющий интерес, или его функционально эквивалентный вариант,
(b) трансмембранный домен или его функционально эквивалентный вариант, и
(c) полипептид gag ВИЧ или его функционально эквивалентный вариант.
В дополнительном аспекте изобретение относится к полинуклеотиду, кодирующему слитый белок в соответствии с изобретением.
Еще в одном аспекте изобретение относится к вектору, включающкему полинуклеотид в соответствии с изобретением.
В другом аспекте изобретение направлено на клетку-хозяин, включающую слитый белок или вектор в соответствии с изобретением.
Еще в одном аспекте изобретение относится к способу получения VLP, нагруженной иммуногенным полипептидом, включающему:
(a) экспрессию в клетке слитого белка в соответствии с изобретением, и
(b) выделение VLP из внеклеточной среды.
Кроме того, настоящее изобретение относится к вирусоподобной частице, включающей слитый белок в соответствии с изобретением или полученной с использованием способа по изобретению.
Еще в одном аспекте изобретение относится к фармацевтической композиции, включающей слитый белок, полинуклеотид, вектор, клетку-хозяин или вирусоподобную частицу в соответствии с изобретением или их комбинацию.
В другом аспекте изобретение направлено на слитый белок, полинуклеотид, вектор, клетку-хозяин, вирусоподобную частицу или фармацевтическую композицию в соответствии с изобретением или их комбинацию для применения в медицине.
Еще в одном аспекте изобретение относится к слитому белку, полинуклеотиду, вектору, клетке-хозяину, вирусоподобной частице или фармацевтической композиции в соответствии с изобретением или их комбинации для применения в лечении или профилактике заболевания, вызванного инфекцией, или опухоли у субъекта. В альтернативной форме этого аспекта изобретение относится к способу лечения или профилактики заболевания, вызванного инфекцией, или опухоли у субъекта, который включает введение субъекту терапевтически эффективного количества слитого белка, полинуклеотида, вектора, клетки-хозяина, вирусоподобной частицы или фармацевтической композиции в соответствии с изобретением или их комбинации. В другой альтернативной форме этого аспекта изобретение относится к применению слитого белка, полинуклеотида, вектора, клетки-хозяина, вирусоподобной частицы или фармацевтической композиции в соответствии с изобретением или их комбинации для получения лекарственного средства для лечения или профилактики заболевания, вызванного инфекцией, или опухоли у субъекта.
Кроме того, настоящее изобретение относится к набору, включающему слитый белок, полинуклеотид, вектор, клетку-хозяин, вирусоподобную частицу или фармацевтическую композицию в соответствии с изобретением или их комбинацию.
Краткое описание чертежей
Фиг. 1. Различные белковые и VLP препараты, используемые для анализов иммуногенности. gp41-происходящий белок (MIN), охватывающий HR2, MPER и TM области gp41 гликопротеина, экспрессировали в E. coli, 6xHis метку включали в конструкцию на C-конце белка для очистки. Оголенные VLP получали путем трансфекции gag ВИЧ-1 кодирующей плазмиды в HEK-293T клетках. Эти оголенные VLP экспонируют человеческие белки, происходящие из мембраны клетки-продуцента (светло-серые элементы на поверхности VLP). Альтернативно, MIN-VLPs получали путем ко-трансфекции той же самой gag экспрессирующей плазмиды с плазмидой, кодирующей белок MIN, который содержит весь цитоплазматический хвост gp41. Белок MIN инкорпорирован на поверхности VLPs. Конечный VLP препарат получали путем экспрессии варианта белка MIN, не содержащего цитоплазматический хвост, слитого с последовательностью gag (начинающейся с остатка 2). Ожидают, что образовавшиеся VLP будут демонстрировать высокую плотность MPER эпитопов на их поверхности (gag:gp41 стехиометрия 1:1).
Фиг. 2. Характеристика и иммуногенность растворимого MIN и MIN-VLPs, полученных путем ко-трансфекции. (A) Растворимый белок MIN экспрессировали в E. coli и очищали до гомогенности Ni2+ аффинной и гель-фильтрационной хроматографией. Конечный препарат содержал одну 17 кДа полосу. Маркеры молекулярной массы показаны слева. (B) Иммуногенность препаратов растворимого MIN испытывали на C57BL/6 мышах. Показаны данные ELISA относительно белка MIN для сывороток (1/100 разведение) от контрольных животных или животных, иммунизированных MIN (50 мкг/доза) с фосфатом алюминия или без него. (C) HEK-293T клетки, стабильно трансфицированные для экспрессии Env гликопротеина (NL4.3 изолят, клон K) (справа), GAG (клон G1F2), MIN (клон, 4.2E6) или обоих Gag и MIN (слева, клон 4G2A), окрашивали для определения экспрессии MPER эпитопов на клеточной поверхности и внутриклеточной экспрессии CA-p24 белка (Gag). Нетрансфицированные клетки HEK-293T использовали в качестве отрицательного контроля. Показан анализ методом проточной цитометрии. (D) Клеточные осадки и супернатанты от клеток HEK-293T G1F2 (экспрессирующие Gag) и HEK-293T 4G2A (ко-экспрессирующие Gag и MIN) анализировали методом вестерн-блот с использованием анти-p24 антитела (верхнее) и анти-MPER антитела 2F5 (нижнее). (E) Параллельно, иммуногенность MIN-VLP препаратов испытывали на C57BL/6 мышах. Показаны данные ELISA относительно белка MIN для сывороток (1/100 разведение) от контрольных животных или животных, иммунизированных MINVLP (50 мкг общее количество белка/доза) с фосфатом алюминия или без него.
Фиг. 3. Характеристика MINGAG VLP. (A) HEK-293T клетки трансфицировали плазмидой pcDNA3.1/MINGAG-3.7, кодирующей слитый белок MINGAG, плазмидой pcDNA3.1 GAG, кодирующей полноразмерный gag, или пустой pcDNA3.1 плазмидой. Через 24 часа клетки окрашивали на клеточной поверхности анти-MPER антителами 2F5 (вверху) или 10E8 (внизу) и внутриклеточно окрашивали анти-p24 антителом Kc57. Ко-экспрессия обоих антигенов Gag и MPER явно наблюдалась в обоих случаях. (B) Супернатанты от трансфицированных клеток собирали и анализировали методом вестерн-блот с поликлональным анти-Gag антителом (слева) и анти-MPER антителом 2F5 (справа). Маркеры молекулярной массы показаны для сравнения. (C) Супернатанты также анализировали на общее содержание p24 до и после фильтрации через устройство с отсечением по молекулярной массе 300 кДа. Значения представляют общее содержание p24 (относительно диаметра графика) и фракции частиц (VLP-ассоциированных, светло-серые), и показан фильтруемый (в свободной форме, темно-серый) материал. (D) Супернатант анализировали на диаметр частиц с использованием Nanosight. Препараты оголенных VLP (вверху) или MINGAG VLP (внизу) анализировали в трех или четырех параллельных анализах, соответственно, показывающих сопоставимые результаты. Каждая линия соответствует отдельным определениям.
Фиг. 4. Иммуногенность MINGAG VLP у мышей. (A) Анти-MIN IgG в зависимости от времени у мышей, иммунизированных оголенными VLP или MINGAG VLP с адъювантом фосфатом алюминия или без него (+ADJ). (B) Уровень анти-Gag IgG после умерщвления у мышей, иммунизированных оголенными VLP или MINGAG VLP с адъювантом фосфатом алюминия или без него. (C) Анализ методом электронной микроскопии необработанных (вверху) и обработанных фосфатом алюминия (внизу) VLP, используемых для иммунизации. (D) Нейтрализующая активность сывороток (1/100 разведение) и очищенных IgG (100 мкг/мл) от умерщвленных животных анализировали в TZM-b1 клетках против указанных вирусов. Показана инфекционность NL43 и BaL в присутствии сывороток или IgG индивидуальных животных.
Фиг. 5. Пептид/VLP иммунизация у мышей. (A) Анти-MIN IgGs в зависимости от времени у мышей, иммунизированных четырьмя дозами KLH-MPER и четырьмя дозами MINGAG VLP или контрольными KLH и оголенными VLP. (B) Картирование анти-MIN IgG ответов у иммунизированных мышей. Данные показывают реактивность сыворотки, полученной от индивидуальных животных, против ряда 15-мерных перекрывающихся пептидов, которые охватывают HR2 и MPER последовательности gp41, как описано в способах. (C) Нейтрализующую активность сывороток от умерщвленных животных (1/100 разведение) анализировали в TZM-b1 клетках против указанных вирусов. Показана инфекционность вирусов в присутствии сывороток индивидуальных животных. Звездочки показывают статистичскую значимость.
Фиг. 6. MINGAG VLP иммунизация у кроликов. (A) Анти-T-20 и анти-C34 IgGs в зависимости от времени у кроликов, иммунизированных двумя дозами оголенных VLP или MINGAG VLP. (B) Картирование анти-MIN IgG ответов у иммунизированных кроликов. Данные показывают реактивность образцов сыворотки, полученных от иммунизированных животных против ряда 15-мерных перекрывающихся пептидов, которые охватывают HR2 и MPER последовательности gp41, как описано в способах. (C) Нейтрализующую активность очищенных IgG (100 мкг/мл) и IgG-истощенной сыворотки от умерщвленных животных анализировали в TZM-bl клетках против указанных вирусов. Показана инфекционность вирусов в присутствии IgG индивидуальных животных. Звездочки показывают статистичскую значимость.
Фиг. 7. Эффект кодон-оптимизации на экспрессию VLP. Репрезентативные точечные диаграммы HEK-293T клеток, трансфицированных пустой плазмидой (вверху слева), GAG экспрессирующей плазмидой (дикого типа, вверху справа), MINGAG плазмидой 3.7 (неоптимизированная, внизу слева) и кодон-оптимизированным вариантом MINGAG (внизу справа). Клетки окрашивали через 24 часа после трансфекции анти-MPER антителом 2F5 и анти-GAG антителом Kc57 (внутриклеточное окрашивание). Кодон-оптимизация существенно повышала экспрессию как MPER, так и GAG.
Фиг. 8. Иммунизация мышей ДНК, кодирующей самоупаковывающиеся VLP, индуцирует анти-Gag и анти-gp41 гуморальные ответы. Анти-GAG (верхняя панель) и анти-MIN (нижняя панель) IgG ответы в зависимости от времени у мышей, иммунизированных четырьмя дозами оголенной ДНК (с использованием пустого, GAG-кодирующего и MINGAG-кодирующего векторов pVAX1.
Фиг. 9. Эффект различных линкеров, расположенных между MIN и GAG, на антигенность и продукцию VLP. MINGAG слитые белки с G4S, без линкера или с AEAAAKA или APAPAPA линкерами, экспрессировали в клетках HEK-293T. (A) Через 48 часов после трансфекции клетки окрашивали указанными анти-MPER антителами (2F5, 10E8 и 4E10) и анти-GAG антителом Kc57. Процент MPER+ клеток в ряду GAG+ событий представлен как показатель экспонирования эпитопов. (B) Продукцию VLP измеряли методом ELISA в супернатантах трансфицированных клеток и нормализовали к MINGAG G4S конструкции.
Фиг. 10. Эффект различных TM последовательностей, расположенных между внеклеточными gp41 последовательностями и GAG, на антигенность и продукцию VLP. MINGAG слитые белки с gp41 TM дикого типа, CD22 TM человека, CD36 TM человека, CD44 TM человека или R696A-мутированным gp41 TM экспрессировали в HEK-293T клетках. (A) Через 48 часов после трансфекции клетки окрашивали указанными анти-MPER антителами (2F5, 10E8 и 4E10) и анти-GAG антителом Kc57. Процент MPER+ клеток в ряду GAG+ событий представлен как показатель экспонирования эпитопов. (B) Продукцию VLP измеряли методом ELISA в супернатантах трансфицированных клеток и нормализовали к MINGAG (TM дикого типа) конструкции.
Фиг. 11. Экспрессия коротких эпитопов, встроенных на поверхности VLPs. MINGAG слитый белок, в котором 2F5 эпитоп был заменен HCV-нейтрализующим эпитопом, экспрессировали в HEK-293T клетках. (A) Схема слитого белка. (B) Через 48 часов после трансфекции клетки окрашивали указанными анти-MPER антителами (2F5, 10E8 и 4E10) или анти-HCV антителом AP33 в комбинации с анти-GAG антителом Kc57. Показаны точечные диаграммы, полученные методом проточной цитометрии. (C) Продукцию VLP измеряли методом ELISA в супернатантах трансфицированных клеток и нормализовали к MINGAG конструкции.
Фиг. 12. Экспрессия крупных антигенов на поверхности VLPs. Слитый белок MINGAG, в котором внеклеточные последовательности gp41 были заменены различными антигенами, экспрессировали в HEK-293T клетках. (A) Схема слитых белков. (B) Через 48 часов после трансфекци клетки окрашивали указанными антителами в комбинации с анти-GAG антителом Kc57. Показаны точечные диаграммы, полученные методом проточной цитометрии. (C) Продукцию VLP измеряли методом ELISA в супернатантах трансфицированных клеток и нормализовали к MINGAG конструкции.
Депонирование микроорганизмов
Плазмида pcDNA3.l/MINGAG-3.7 была депонирована 25 июля 2012 года под номером доступа DSM 26214 в DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen, Inhoffenstraβe 7 B, D-38124 Braunschweig, Federal Republic of Germany.
Перечень последовательностей
Нуклеиново- и аминокислотные последовательности, представленные в прилагаемом перечне последовательностей, показаны с использованием стандартных буквенных аббревиатур и кодов, традиционно используемых в данной области. Показана только одна нить последовательности каждой нуклеиновой кислоты, но комплементарная нить предполагается как включенная при любой ссылке на показанную нить. Прилагаемый перечень последовательностей является неотъемлемой частью настоящего изобретения.
Подробное описание изобретения
Одним из основных ограничений генерации антител является плохое включение представляющих интерес антигенов в VLPs in vitro. Настоящее изобретение описывает новые VLP с использованием основанных на gp41 и других белков, которые включают трансмембранный домен, слитый с gag, для преодоления этого ограничения. Эта конструкция, раскрытая в настоящем изобретении: (i) делает возможной локализацию этих белков в мембранах, (ii) поддерживает способность Gag к самоупаковке VLP, (iii) демонстрирует повышенную поверхностную плотность gp4l и (iv) улучшает правильное пространственное представление антигенов, таким образом (v) усиливает иммуногенные ответы на указанные антигены. Результаты ясно демонстрируют повышенную иммуногенность VLP по изобретению.
1. Определения общих терминов и формулировок
Термин “СПИД” в контексте настоящей заявки относится к симптоматической фазе ВИЧ-инфекции и включает как синдром приобретенного иммунодефицита (обычно известный как СПИД), так и “ARC” или СПИД-ассоциированный комплекс. См. Adler M, et al., Brit. Med. J. 1987; 294:1145-1147. Иммунологические и клинические проявления СПИДа хорошо известны в данной области и включают, например, оппортунистические инфекции и раковые заболевания, возникающие в результате иммунодефицита.
Термин “аллерген” в контексте настоящей заявки относится к пептиду, полипептиду или белку, к которому субъект чувствителен и который может вызывать иммунную реакцию (например, экстракты аллергенов пыльцы, насекомые, пища или продукты питания; компоненты, присутствующие в слюне, царапины или укусы насекомых; растительные компоненты).
Термин “аминокислота” в контексте настоящей заявки относится к природным и синтетическим аминокислотам, а также к аминокислотным аналогам и аминокислотным миметикам, которые функционируют аналогично природным аминокислотам. Аминокислоты могут быть указаны в настоящей заявке либо их общеизвестными трехбуквенными символами, либо однобуквенными символами, рекомендованными IUPAC-IUB Biochemical Nomenclature Commission. Подобным образом, нуклеотиды также могут обозначаться их общепринятыми однобуквенными кодами.
Термин “кодон-оптимизированный” в контексте настоящей заявки относится к изменению кодонов в нуклеиновых кислотах, чтобы отразить типичное использование кодонов организмом-хозяином для улучшения экспрессии эталонного полипептида без изменения его аминокислотной последовательности. В данной области техники известно несколько способов и программных средств для оптимизации кодонов. См. Narum D, et al., Infect. Immun. 2001; 69(12):7250-7253), Outchkourov N, et al., Protein Expr. Purif. 2002; 24 (1): 18-24, Feng L, et al., Biochemistry 2000; 39(50):15399-15409 и Humphreys D, et al., Protein Expr. Purif. 2000; 20 (2): 252-264.
Термин “включающий” или “включает” в контексте настоящей заявки раскрывает также “состоящий из”, в соответствии с общепринятой патентной практикой.
Термины “Env” или “gp160”, в контексте настоящей заявки относятся к гликопротеину, обладающему либо антигенной специфичностью, либо биологической функцией белка внешней оболочки (Env) ВИЧ и включающему две субъединицы, гликопротеины gp120 и gp41. Иллюстративные последовательности полипептидов gp160 дикого типа (wt) являются доступными. См. GenBank номера доступа AAB05604 и AAD12142.
Термин “эпитоп” в контексте настоящей заявки относится к той части данного иммуногенного вещества, которая является мишенью для антитела (то есть связывается антителом) или рецептора клеточной поверхности иммунной системы субъекта, вызывающей иммунный ответ против указанного иммуногенного вещества, как определяют любыми способами, известными в данной области. Кроме того, эпитоп может быть определен как часть иммуногенного вещества, которая распознается гуморальным или клеточным ответом, и, в частности, ответом антитела или Т-клеточным ответом у субъекта, что определяется любым способом, доступным в данной области. Эпитоп может быть частью любого иммуногенного вещества, такого как белок, полинуклеотид, полисахарид, органическое или неорганическое химическое вещество или любая их комбинация. Термин “эпитоп” может также использоваться взаимозаменяемо с “антигенной детерминантой” или “сайтом антигенной детерминанты”.
Термины “экспрессировать”, “экспрессирует” или “экспрессия” в контексте настоящей заявки относятся к транскрипции молекулы нуклеиновой кислоты и, необязательно, ее трансляции. Типично, транскрипция и трансляция кодирующей последовательности приводит к продукции полипептида, такого как слитые белки по изобретению.
Выражение “функционально эквивалентный вариант” в контексте настоящей заявки относится к: (i) полипептиду, полученному в результате модификации, делеции или вставки однойили более аминокислот, и который по существу сохраняет активность своего эталонного полипептида, и (ii) полинуклеотиду, полученному в результате модификации, делеции или вставки одногоили более оснований, и который по существу сохраняет активность полипептида, экспрессируемого эталонной нуклеиновой кислотой. Функционально эквивалентные варианты, рассматриваемые в контексте настоящего изобретения, включают полипептиды, которые демонстрируют по меньшей мере 60%, 70%, 80%, 85%, 90%, 92%, 94%, 96%, 98%, 99% сходство или идентичность с последовательностями SEQ ID NO: 1-2, 5, 15-28, 30, 32, 34, 36 и 38 и которые сохраняют по существу эквивалентную способность индуцировать образование VLP в случае варианта gag полипептида или сохраняют способность встраиваться в плазматическую мембрану в случае функционально эквивалентного варианта полипептида gp41 ВИЧ. Функционально эквивалентные варианты, рассматриваемые в контексте настоящего изобретения, включают также полинуклеотиды, которые демонстрируют по меньшей мере 60%, 70%, 80%, 85%, 90%, 92%, 94%, 96%, 98%, 99% сходство или идентичность с последовательностями SEQ ID NO: 3-4, 6-14, 29, 31, 33, 35 и 37 и которые при экспрессии сохраняют по существу эквивалентную способность индуцировать образование VLP в случае варианта gag полипептида или сохраняют способность встраиваться в плазматическую мембрану в случае функционально эквивалентного варианта полипептида gp41 ВИЧ. Степень идентичности или сходства между двумя полипептидами или двумя полинуклеотидами определяют с использованием компьютерных алгоритмов и методов, которые широко известны в данной области. Идентичность и сходство между двумя последовательностями аминокислот предпочтительно определяют с использованием алгоритма BLASTP. См. Altschul S, et al., “BLAST Manual” (NCBI NLM NIH, Bethesda, MD, USA, 2001).
Термин “слитый белок” в контексте настоящей заявки относится к белкам, полученным генно-инженерными методами, которые состоят из двух или более функциональных доменов, происходящих из разных белков. Слитый белок может быть получен обычными способами (например, путем генной экспрессии нуклеотидной последовательности, кодирующей указанный слитый белок в подходящей клетке).
Термин “полипептид gag” в контексте настоящей заявки относится к первичному белковому продукту гена gag ВИЧ, который обеспечивает базовую физическую инфраструктуру вируса и который процессируется вирусной протеазой в процессе созревания до МА (матриксный белок, p17), CA (капсидный белок, p24), SP1 (спейсерный пептид 1, p2), NC (нуклеокапсидный белок, p7), SP2 (спейсерный пептид 2, p1) и белка P6.
Термин “gp41” в контексте настоящей заявки относится к гликопротеину gp41 оболочки вируса-1 иммунодефицита человека. Gp41 представляет собой субъединицу, которая образует гликопротеин Env ВИЧ-1 вместе с gp120. Env представляет собой тример, состоящий из трех внешних субъединиц (gp120) и трех трансмембранных субъединиц (gp41). Внеклеточный фрагмент белка gp41 содержит три основных функциональных области: слитый пептид (FP), N-концевой гептадный повтор (HR1) и C-концевой гептадный повтор (HR2). Области HR1 и HR2 содержат несколько подобных лейциновой молнии мотивов, которые имеют тенденцию к образованию спиральных структур. См. Peisajovich S, Shai Y, Biochem. Biophys. Acta 2003; 1614:122-129;  T, et al., FEBS Lett. 2000; 477:145-149; Chan D, et al., Cell 1997; 89:263-273. Нуклеиновокислотные и аминокислотные последовательности большого количества gp-41 ВИЧ являются широкодоступными. См. базу данных последовательностей ВИЧ, http://www.hiv.lanl.gov/content/sequence/HIV/mainpage.html, июль 2017 г.
T, et al., FEBS Lett. 2000; 477:145-149; Chan D, et al., Cell 1997; 89:263-273. Нуклеиновокислотные и аминокислотные последовательности большого количества gp-41 ВИЧ являются широкодоступными. См. базу данных последовательностей ВИЧ, http://www.hiv.lanl.gov/content/sequence/HIV/mainpage.html, июль 2017 г.
Термин “gp120” в контексте настоящей заявки относится к гликопротеину, обладающему либо антигенной специфичностью, либо биологической функцией белка внешней оболочки (env) ВИЧ. “Белок gp120” представляет собой молекулу, происходящую из gp120 области полипептида Env. Аминокислотная последовательность gp120 включает приблизительно 511 аминокислот. Gp120 представляет собой сильно N-гликозилированный белок с кажущейся молекулярной массой 120 кДа. Gpl20 содержит пять относительно консервативных доменов (C1-C5), перемежающихся с пятью вариабельными доменами (V1-V5). Вариабельные домены содержат существенные аминокислотные замены, вставки и делеции. “Полипептид gp120” включает как отдельные субъединицы, так и мультимеры. Часть gp41 заякорена в (и охватывает) мембранном бислое вириона, в то время как сегмент gp120 выступает в окружающую среду. Связывающийся с рецептором домен gp120 локализован в N-концевой половине белка. Затем следует область, богатая пролином (PRR), которая ведет себя либо как шарнир, либо как триггер для установления сообщения между связыванием с рецептором и механизмом слияния. С-конец gp120 является высококонсервативным и взаимодействует с gp41. См. GenBank номера доступа AAB05604 и AAD12142.
Термины “гептадный повтор 2” или “HR2” в контексте настоящей заявки относится, но не ограничиваются этим, к области гептадного повтора, расположенной на карбокси-конце внеклеточной части gp41 дикого типа. См. Eggink D, et al., J. Virol. 2008; 82 (13):6678-6688. Гептадный повтор представляет собой мотив, в котором гидрофобная аминокислота повторяется через каждые семь остатков. Такие мотивы обозначены как a - g. См. Lupas A, Trends Biochem. Sci. 1996; 21:375-382. Гептадные повторы, которые содержат гидрофобные или нейтральные остатки в положениях a и d, могут образовывать альфа-спирали и способны взаимодействовать с другими гептадными повторами, образуя суперспирали. См. Chambers P, et al., J. Gen. Virol. 1990; 71:3075-3080, и Lupas, 1996, выше.
Термин “ВИЧ” в контексте настоящей заявки включает ВИЧ-1 и ВИЧ-2, ВИОЧ и ВИО. “ВИЧ-1” означает вирус иммунодефицита человека типа 1. ВИЧ-1 включает, но не ограничивается этим, внеклеточные вирусные частицы и формы ВИЧ-1, ассоциированные с ВИЧ-1-инфицированными клетками. Вирус ВИЧ-1 может представлять собой любой из известных основных подтипов (классы A, B, C, D E, F, G и H) или далекий подтип (группа O), включая лабораторные штаммы и первичные изоляты. “ВИЧ-2” означает вирус иммунодефицита человека типа 2. Штаммы ВИЧ-1 включают, но не ограничиваются этим, штаммы ВИЧ-1JR-FL, ВИЧ-1DH123, ВИЧ-1Gun-1, ВИЧ-189.6, и ВИЧ-1HXB2. ВИЧ-2 включает, но не ограничивается этим, внеклеточные вирусные частицы и формы ВИЧ-2, ассоциированные с ВИЧ-2-инфицированными клетками. Термин “ВИО” относится к вирусу иммунодефицита обезьян, который является ВИЧ-подобным вирусом, который инфицирует обезьян, шимпанзе и других отличных от человека приматов. ВИО включает, но не ограничивается этим, внеклеточные вирусные частицы и формы ВИО, ассоциированные с ВИО-инфицированными клетками.
Термин “воздействие ВИЧ” в контексте настоящей заявки относится к контакту неинфицированного субъекта с субъектом, имеющим ВИЧ-инфекцию или СПИД, или к контакту с жидкостями организма от такого ВИЧ-инфицированного субъекта, когда такие жидкости от инфицированного субъекта контактируют со слизистой оболочкой, порезом или ссадиной в ткани (например, укол иглой, незащищенный половой акт) или с другой поверхностью неинфицированного субъекта таким образом, чтобы вирус мог передаваться от инфицированного субъекта или жидкостей организма инфицированного субъекта неинфицированному субъекту.
Термин “ВИЧ инфекция” в контексте настоящей заявки относится к признакам присутствия вируса ВИЧ у индивидуума, включая бессимптомную серопозитивность, СПИД-ассоциированный комплекс (ARC) и синдром приобретенного иммунодефицита (СПИД).
Термин “ВИЧ-1JR-FL” в контексте настоящей заявки относится к штамму ВИЧ-1, первоначально выделенному из ткани головного мозга больного СПИДом, взятой при вскрытии и совместно культивированной с активированными лектином нормальными РВМС человека.
Термины “клетка-хозяин” и “рекомбинантная клетка-хозяин”, используемые взаимозаменяемо, относятся к клетке, в которую была введена нуклеиновая кислота или вектор по изобретению. Термин “клетка-хозяин” и “рекомбинантная клетка-хозяин” включает также потомство или потенциальное потомство такой клетки. Поскольку определенные модификации могут происходить в последующих поколениях либо в результате мутации, либо влияния окружающей среды, такое потомство может фактически не быть идентичным родительской клетке, но все же может быть включено в объем термина, как он используется в настоящей заявке.
Термины “идентичный” или процент “идентичности” в контексте двух или более нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют определенный процент нуклеотидов или аминокислотных остатков, которые являются одинаковыми при сравнении и выравнивании (с введением гэпов, если необходимо) для максимального соответствия, не учитывая какие-либо консервативные аминокислотные замены как часть идентичности последовательностей. Процент идентичности можно измерить с использованием программы или алгоритмов сравнения последовательностей или путем визуальной оценки. В данной области техники известны различные алгоритмы и программы, которые можно использовать для получения выравниваний аминокислотных или нуклеотидных последовательностей. Примеры алгоритмов, подходящих для определения сходства последовательностей, включают, но не ограничиваются этим, алгоритмы BLAST, Gapped BLAST и BLAST 2.0, WU-BLAST-2, ALIGN и ALIGN-2. См. Altschul S, et al., Nuc. Acids Res. 1977; 25:3389-3402, Altschul S. et al., J. Mol. Biol. 1990; 215:403-410, Altschul S. et al., Meth. Enzymol. 1996; 266: 460-480, Karlin S. et al., Proc. Natl. Acad. Sci. США 1990; 87:2264-2268, Karlin S. et al., Proc. Natl. Acad. Sci. США 1993; 90:5873-5877, Genentech Corp, South San Francisco, CA, US, https://blast.ncbi.nlm.nih.gov/Blast.cgi, July 2017. Методы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для сравнения можно осуществить, например, при помощи алгоритма локальной гомологии Смита-Уотермана, алгоритма выравнивания для определения гомологии Нидлмана-Вунша, метода поиска сходства Пирсона-Липмана, при помощи компьютерных реализаций этих алгоритмов или выравнивания вручную и визуальной оценки. См. Smith T, et al., Adv. Appl. Math. 1981; 2:482-489, Needleman S, et al., J. Mol. Biol. 1970; 48:443-453, Pearson W, et al., Lipman D, Proc. Natl. Acad. Sci. USA 1988; 85:2444-2448, программы GAP, BESTFIT, FASTA и TFASTA, Wisconsin Genetics Software Package, Genetics Computer Group, Madison, WI, USA; Ausubel F, et al., Eds., “Short Protocols in Molecular Biology”, 5th Ed. (John Wiley и Sons, Inc., New York, NY, USA, 2002).
Термин “иммуногенная композиция” в контексте настоящей заявки относится к фармацевтической композиции, способной вызывать гуморальный (например, антитела) или клеточный (например, цитотоксические Т-клетки) иммунный ответ у субъекта против специфического иммуногена.
Термин “иммуногенный полипептид” в контексте настоящей заявки относится к полипептиду из патогенного организма, опухолевого маркера или аллергена, который при введении субъекту может вызывать защитный иммунный ответ против этого организма, опухолевого маркера или аллергена.
Термин “иммунологически функциональный эквивалент” в контексте настоящей заявки относится к варианту полипептида, который сохраняет по существу эквивалентную способность индуцировать иммунный ответ у субъекта в качестве эталонного полипептида. Термин “иммунологически функциональный эквивалент” хорошо известен в данной области и более подробно определен в настоящей заявке. Иммунологически функциональные эквиваленты могут увеличивать антигенность полипептида, поддерживать такой же уровень антигенности, как у эталонного полипептида, или лишь незначительно снижать антигенность полипептида так, чтобы он сохранял свою полезность в качестве антигена в иммуногенной композиции.
Термин “инфекционное заболевание” в контексте настоящей заявки относится к заболеваниям, вызываемым патогенами, такими как вирусы, бактерии, грибы, простейшие и паразиты.
Термин “набор” в контексте настоящей заявки относится к продукту, содержащему различные реагенты, необходимые для осуществления применений и способов в соответствии с изобретением, который упакован так, чтобы обеспечить его транспортировку и хранение. Материалы, подходящие для упаковки компонентов набора, включают хрусталь, пластик (например, полиэтилен, полипропилен, поликарбонат), бутыли, флаконы, бумагу или конверты.
Термин “KLH” в контексте настоящей заявки относится к большому, состоящему из нескольких субъединиц, несущему кислород металлопротеину, который обнаружен в гемолимфе гигантского брюхоногого моллюска, Megathura crenulata, вида моллюсков, обитающих у побережья Калифорнии, от залива Монтерей до острова Асунсьон в Южной Калифорнии.
Термины “линкерная область” или “линкер” в контексте настоящей заявки относятся к любому гетерологичному полипептиду длиной по меньшей мере 1, 2, 3, 4 или 5 или более аминокислот, который при вставке между первой и второй областью обеспечивает функциональную связь, соединяющую обе области, и при этом каждая область может сохранять свои функциональные и иммунологические свойства.
Термины “проксимальная к мембране внешняя область” или “MPER” в контексте настоящей заявки относятся, но не ограничиваются этим, к высококонсервативной области эктодомена gp41, примыкающей к вирусной мембране.
Термины “нейтрализующее антитело” или “nAb” в контексте настоящей заявки означают любое антитело или антиген-связывающий фрагмент, который связывается с внеклеточной молекулой (например, с белком или доменом белка на поверхности патогенного вируса или бактерии) и вмешивается в способность патогена инфицировать клетку или модулирует его активность. В контексте настоящего изобретения патоген предпочтительно представляет собой ВИЧ и, более конкретно, белок gp120 вирусной оболочки ВИЧ. В частности, термин “ВИЧ-нейтрализующее антитело” относится к нейтрализующему антителу со сродством к CD4 связывающему сайту gp120, такому как IgGb12. Термин “нейтрализующие антитела” включает подкласс bnAbs. Термин “широко нейтрализующее антитело” или “bnAb” в контексте настоящей заявки подразумевает антитело, полученное любым способом, которое при доставке в эффективной дозе может использоваться в качестве терапевтического средства для профилактики или лечения ВИЧ-инфекции или СПИДа против более более 7 штаммов ВИЧ, предпочтительно более 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более штаммов ВИЧ.
Термины “NL4-3” и “BaL” в контексте настоящей заявки относятся к двум различным изолятам ВИЧ, обычно используемым в лаборатории. Изолят NL4-3 был клонирован из провирусов NY5 и LAV. См. Adachi A et al., J. Virol. 1986; 59:284-291. Изолят BaL был получен из первичной культуры слипшихся клеток, выращенных из эксплантированной легочной ткани. См. Gartner S, et al., Science 1986; 233:215-219.
Термины “нуклеиновая кислота”, “полинуклеотид” и “нуклеотидная последовательность”, используемые в настоящей заявке взаимозаменяемо, относятся к любой полимерной форме нуклеотидов любой длины, состоящей из рибонуклеотидов или дезоксирибонуклеотидов. Термины включают как одноцепочечные, так и двухцепочечные полинуклеотиды, а также модифицированные полинуклеотиды (например, метилированные, защищенные). Как правило, нуклеиновая кислота представляет собой “кодирующую последовательность”, которая в контексте настоящей заявки относится к последовательности ДНК, которая транскрибируется и транслируется в полипептид в клетке-хозяине, когда находится под контролем соответствующих регуляторных последовательностей. Границы кодирующей последовательности определяются старт-кодоном на 5'(амино) конце и стоп-кодоном трансляции на 3' (карбокси) конце. Кодирующая последовательность может включать, но не ограничивается этим, прокариотические последовательности, кДНК из эукариотической мРНК, последовательности геномной ДНК из эукариотической (например, млекопитающего) ДНК и даже синтетические последовательности ДНК. Последовательность терминации транскрипции обычно расположена к 3' концу относительно кодирующей последовательности.
Термин “функционально связанный” в контексте настоящей заявки означает, что представляющая интерес нуклеотидная последовательность связана с регуляторной последовательностью (последовательностями) таким образом, чтобы обеспечивать экспрессию нуклеотидной последовательности (например, в системе транскрипции/трансляции in vitro или в клетке-хозяине, когда вектор вводят в клетку-хозяин). См. Auer H, Nature Biotechnol. 2006; 24:41-43.
Выражения “парентеральное введение” и “вводимый парентерально” в контексте настоящей заявки означают способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включают, без ограничения, внутривенные, внутримышечные, внутриартериальные, интратекальные, интракапсулярные, интраорбитальные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, субкутикулярные, интраартикулярные, субкапсулярные, субарахноидальные, интраспинальные, эпидуральные и интрастернальные инъекции и инфузии.
Выражение “мононуклеарная клетка периферической крови” или аббревиатура “РВМС” относятся к любой клетке периферической крови, имеющей круглое ядро. Эти клетки состоят из лимфоцитов (т.е. Т-клеток, В-клеток, NK-клеток) и моноцитов.
Выражение “фармацевтически приемлемый носитель” в контексте настоящей заявки включает все возможные растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические агенты и агенты, замедляющие абсорбцию, которые физиологически совместимы со слитыми белками, полинуклеотидами, векторами, клетками-хозяевами или VLP в соответствии с изобретением.
Термин “фармацевтическая композиция” в контексте настоящей заявки относится к комбинации по меньшей мере одного слитого белка, полинуклеотида, вектора, клетки-хозяина или VLP по изобретению и по меньшей мере одного другого ингредиента, включая, но не ограничиваясь этим, фармацевтически приемлемый носитель, что делает комбинацию подходящей для введения субъекту. Термин “фармацевтическая композиция” включает, но не ограничивается этим, иммуногенные и вакцинные композиции.
Термины “полипептид”, “пептид” и “белок” используются в настоящей заявке взаимозаменяемо для обозначения полимера из аминокислотных остатков, который может содержать более одного аминокислотного остатка (например, дипептид, трипептид, олигопептид). Эти термины применимы к аминокислотным полимерам, в которых одинили более аминокислотных остатков представляют собой искусственный химический миметик соответствующей природной аминокислоты, а также к природным аминокислотным полимерам и не встречающемуся в природе аминокислотному полимеру.
Термины “предотвращать”, “предотвращающий” и “профилактика” в контексте настоящей заявки относятся к ингибированию заражения или уменьшению возникновения заболевания у субъекта. Профилактика может быть полной (например, полное отсутствие патологических клеток у субъекта). Профилактика также может быть частичной, такой как, например, снижение встречаемости патологических клеток у субъекта. Профилактика также относится к снижению восприимчивости к клиническому состоянию. В контексте настоящего изобретения термины “предотвращать”, “предотвращающий” и “профилактика” конкретно относятся к предотвращению или уменьшению вероятности ВИЧ инфекции у субъекта, находящегося под воздействием ВИЧ.
Выражение “продукт, получаемый в результате процессинга белка Env” в контексте настоящей заявки относится к любому из белков, полученных в результате процессинга белка gp160.
Термин “рекомбинантная бактерия” в контексте настоящей заявки относится к любой бактерии, модифицированной введением гетерологичной ДНК. Бактерия “дикого типа” или “контрольная” включает бактерию, обнаруженную в ее естественном состоянии без генетических манипуляций или по существу идентичную рекомбинантной бактерии, но не экспрессирующую одинили более белков, кодируемых гетерологичной ДНК (например, содержит плазмиду без кодирующей последовательности гетерологичного полипептида, представляющего интерес). Предполагается, что термин включает потомство бактерии, первоначально модифицированной введением гетерологичной ДНК.
Выражение “жесткие условия гибридизации” в контексте настоящей заявки относится к условиям, при которых зонд будет гибридизоваться с его субпоследовательностью-мишенью, обычно в сложной смеси нуклеиновой кислоты, но не с другими последовательностями.
Термин “субъект” в контексте настоящей заявки относится к индивидууму, растению или животному, такому как человек, примат, не являющийся человеком (например, шимпанзе и другие виды обезьян); сельскохозяйственные животные, такие как птицы, рыбы, кролики, козы, овцы, свиньи, крупный рогатый скот и лошади; домашние животные, такие как собаки и кошки; лабораторные животные, включая грызунов, таких как мыши, крысы и морские свинки. Термин не обозначает конкретный возраст или пол. Термин “субъект” охватывает эмбрион и плод. В предпочтительном варианте осуществления субъектом является человек.
Термин “по существу эквивалентный” в контексте настоящей заявки относится к вариантам, которые способны генерировать иммунный ответ, который отличается от иммунного ответа, генерируемого нативной областью не более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95%.
Термин “терапевтическое средство” в контексте настоящей заявки относится к атому, молекуле или соединению, используемому для лечения или профилактики заболевания. Примеры терапевтических средств включают, но не ограничиваются этим, эпитопы, антигены, иммуногены, антитела, фрагменты антител, лекарственные средства, цитотоксические агенты, проапоптотические агенты, токсины, нуклеазы (например, ДНКазы и РНКазы), гормоны, иммуномодуляторы, хелаторы, фотоактивные агенты или красители, антиангиогенные средства, химиотерапевтические средства, цитокины, хемокины, пролекарства, ферменты, связывающиеся белки, пептиды или их комбинации.
Термин “терапевтически эффективное количество” в контексте настоящей заявки относится к дозе или количеству слитого белка, полинуклеотида, вектора, клетки-хозяина, VLP, фармацевтической композиции или иммуногенной или вакцинной композиции по изобретению или их комбинации, которое вызывает терапевтический ответ или желаемый эффект у субъекта.
Термины “трансмембранный домен” и “ТМ домен” в контексте настоящей заявки относятся к аминокислотной последовательности приблизительно гидрофобных остатков со случайным полярным остатком интегральных белков, которые проходят через мембрану.
Выражение “трансмембранный домен полипептида gp41 ВИЧ” в контексте настоящей заявки относится к области полипептида gp41, которая внедряется в плазматическую мембрану после того, как gp41 приобретает свою нативную топологию.
Термины “лечить” и “лечение” в контексте настоящей заявки относятся к введению слитого белка, полинуклеотида, вектора, клетки-хозяина, VLP, фармацевтической композиции, иммуногенной или вакцинной композиции по изобретению или их комбинации для контроля прогрессирования заболевания после появления его клинических признаков. Под контролем прогрессирования заболевания подразумеваются полезные или желательные клинические результаты, которые включают, но не ограничиваются этим, уменьшение симптомов, уменьшение продолжительности заболевания, стабилизацию патологических состояний (в частности, чтобы избежать дальнейшего ухудшения), задержку прогрессирования заболевания, улучшение патологического состояния и ремиссию (как частичную, так и полную). Контроль прогрессирования заболевания также включает увеличение выживаемости по сравнению с ожидаемой выживаемостью, если лечение не применялось. В контексте настоящего изобретения термины “лечить” и “лечение” конкретно относятся к прекращению или замедлению инфекции и разрушения здоровых CD4+ Т-клеток у ВИЧ-инфицированного субъекта. Это также относится к прекращению и замедлению появления симптомов приобретенного иммунодефицитного заболевания, таких как крайне низкое количество CD4+ Т-клеток и повторные инфекции оппортунистическими патогенами. Полезные или желательные клинические результаты включают, но не ограничиваются этим, увеличение абсолютного количества наивных CD4+ Т-клеток (диапазон 10-3520), увеличение процента CD4+ Т-клеток по сравнению с общим количеством циркулирующих иммунных клеток (диапазон 1-50%) или увеличение количества CD4+ Т-клеток в процентах от нормального количества CD4+ Т-клеток у неинфицированного субъекта (диапазон 1-161%). “Лечение” также может означать продление выживаемости инфицированного субъекта по сравнению с ожидаемой выживаемостью, если субъект не получает какого-либо целевого лечения ВИЧ.
Термины “вакцина” и “вакцинная композиция” в контексте настоящей заявки относятся к иммуногенной композиции для введения субъекту in vivo для защиты от заболевания, в частности, от бактериального или вирусного заболевания.
Термин “вектор” в контексте настоящей заявки относится к молекуле нуклеиновой кислоты, линейной или циклической, которая включает нуклеиновую кислоту по изобретению, функционально связанную с дополнительными сегментами, которые обеспечивают ее автономную репликацию в клетке-хозяине, или в соответствии с кассетой экспрессии, содержащей молекулу нуклеиновой кислоты.
Термины “вектор на основе вирусоподобных частиц” и “VLP” в контексте настоящей заявки относятся к неинфекционным частицам, напоминающим вирусы, которые не содержат какого-либо вирусного генетического материала. VLP являются результатом экспрессии вирусных структурных белков, таких как капсидные белки, и их самосборки.
2. Слитые белки
В первом аспекте настоящее изобретение относится к слитому белку, который включает в направлении от N- к C-концу:
(a) полипептид, представляющий интерес, или его функционально эквивалентный вариант,
(b) трансмембранный домен или его функционально эквивалентный вариант, и
(c) полипептид gag ВИЧ или его функционально эквивалентный вариант.
В предпочтительном варианте осуществления представляющий интерес полипептид включает терапевтическое средство, область терапевтического средства или его функционально эквивалентный вариант. Примеры терапевтических средств включают, но не ограничиваются этим, эпитопы, антигены, иммуногены, антитела, фрагменты антител, лекарственные средства, цитотоксические средства, проапоптотические средства, токсины, нуклеазы (например, ДНКазы и РНКазы), гормоны, иммуномодуляторы, хелаторы, фотоактивные средства или красители, антиангиогенные средства, химиотерапевтические средства, цитокины, хемокины, пролекарства, ферменты, связывающиеся белки, пептиды или область такого средства. Предпочтительно терапевтическое средство представляет собой эпитоп, антиген, иммуноген или его функционально эквивалентный вариант. В другом варианте осуществления представляющий интерес полипептид включает комбинацию одного или более терапевтических средств, их областей или функционально эквивалентных вариантов. Примеры таких комбинаций включают, но не ограничиваются этим, представляющий интерес полипептид, включающий два или более терапевтических средств различного происхождения (например, вирусный антиген/бактериальный антиген, опухолевый маркер/бактериальный антиген) или одного и того же происхождения (например, два или более антигенов одного и того же патогена).
Предпочтительно, полипептид gag ВИЧ или его функционально эквивалентный вариант происходит из ВИЧ-1HXB2. Полная последовательность полипептида gag из HXB2 имеет номер доступа P04585-1 в базе данных UniProt (6 июля 2016 г.) и включает последовательность SEQ ID NO: 1. Предпочтительно функциональные эквивалентные варианты полипептида gag ВИЧ показывают по меньшей мере 60% 70%, 80%, 90%, 95%, 97%, 98% или 99% от активности образования его эталонного полипептида. В данной области известно несколько методик оценки активности образования функционально эквивалентных вариантов VLP в соответствии с изобретением.
Соответственно, функционально эквивалентный вариант полипептида gag ВИЧ демонстрирует степень сходства по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% относительно аминокислотной последовательности соответствующего нативного полипептида gag ВИЧ, при условии сохранения способности белка образовывать VLP. Предпочтительно сходство существует в области длиной по меньшей мере около 25 аминокислот или нуклеотидов или, более предпочтительно, в области длиной 50-100 аминокислот или нуклеотидов. Указанием на то, что две нуклеиновокислотные последовательности или полипептиды по существу идентичны, является то, что полипептид, кодируемый первой нуклеиновой кислотой, является иммунологически перекрестно реактивным с антителами, индуцированными против полипептида, кодируемого второй нуклеиновой кислотой, как описано ниже. Таким образом, полипептид обычно считается по существу идентичным второму полипептиду, например, когда два пептида отличаются только консервативными заменами. Степень сходства между двумя пептидами можно определить с использованием компьютерных алгоритмов и методов, которые хорошо известны специалистам в данной области. Идентичность между двумя аминокислотными последовательностями двух пептидов предпочтительно определяют с использованием алгоритма BLASTP. См. Altschul, S, et al., “BLAST Manual”, (NCBI NLM NIH Bethesda, Md. 20894, Altschul S, et al., J., 1990, Mol. Biol. 215:403-410). В предпочтительном варианте осуществления степень идентичности функционально эквивалентного варианта в отношении gag определяют по полной последовательности варианта, gag или обоих.
В предпочтительном варианте осуществления полипептид gag ВИЧ или его функционально эквивалентный вариант не содержит последовательность миристоилирования. Миристоилирование представляет собой модификацию липидирования, когда миристоильная группа, образованная из миристиновой кислоты, ковалентно связана амидной связью с альфа-аминогруппой N-концевого глицинового остатка. В полипептиде gag HIV глицин, чувствительный к миристоилированию, представляет собой глицин в положении 2 SEQ ID NO: 1. Первый метионин удаляется посредством механизма клетки-хозяина. Предпочтительно, чтобы функционально эквивалентный вариант gag HIV, не содержащий последовательность миристоилирования, включал последовательность SEQ ID NO: 2.
Любой однопроходный трансмембранный белок можно использовать в настоящем изобретении. Примеры включают, но не ограничиваются этим, трансмембранный домен CD22 (SEQ ID NO: 18), CD36 (SEQ ID NO: 19), CD44 (SEQ ID NO: 20) и R696A мутант Env ВИЧ-1 (SEQ ID №: 31). Способность последовательности к образованию трансмембранного домена можно оценить при помощи различных анализов, известных в данной области.
В предпочтительном варианте осуществления трансмембранный домен представляет собой трансмембранный домен полипептида gp41 ВИЧ или его функционально эквивалентного варианта.
В конкретном варианте осуществления трансмембранная область полипептида gp41 ВИЧ включает последовательность SEQ ID NO: 17
Слитый белок по изобретению включает иммуногенный полипептид, расположенный на N-конце полипептида gag ВИЧ, или функционально эквивалентный вариант.
Иммунодоминантный полипептид может включать одинили более эпитопов. Обычно, но не всегда, такой иммунодоминантный полипептид или эпитопы являются высокоиммуногенными при испытании в соответствии со способами, известными специалистам в данной области.
Белки или пептиды, способные индуцировать иммунный ответ, могут представлять собой рекомбинантные белки или пептиды, идентичные или сходные с природными антигенами конкретного микроорганизма.
В предпочтительном варианте осуществления представляющий интерес полипептид включает иммуногенный полипептид. Предпочтительно иммуногенный полипептид представляет собой полипептид, способный (подходящий или предназначенный для) индуцировать иммунный ответ против инфекционного заболевания у субъекта, такого как заболевание, вызываемое патогенными микроорганизмами (например, вирусом, бактериями, грибами, микоплазмами, эндо и эктопаразитами). Предпочтительно субъектом является человек, домашнее или сельскохозяйственное животное. Более предпочтительно субъектом является человеком.
Вирусные патогены включают, но не ограничиваются этим, РНК-вирусы; ДНК-вирусы; аденовирусы (например, мастаденовирус, авиаденовирус); вирусы герпеса (например, вирус простого герпеса 1, вирус простого герпеса 2, вирус простого герпеса 5, вирус простого герпеса 6); левивирусы (например, левивирус, энтеробактерии фазы MS2, аллолевирус); поксивирусы (например, хондропоксвирусы, парапоксвирус, авипоксвирус, каприпоксвирус, лепорипоксвирус, суипоксвирус, вирус контагиозного моллюска, энтомопоксвирусы); паповавирусы (например, полиомавирус, папилломавирус); парамиксовирусы (например, парамиксовирус, вирус парагриппа 1, морбилливирус (например, вирус кори), рубулавирус (например, вирус эпидемического паротита); пневмовирусы (например, пневмовирус, человеческий RSV); метапневмовирус (например, птичий пневмовирус, человеческий метапневмовирус), пикорнавирусы (например, энтеровирус, риновирус, гепатовирус (например, вирус гепатита A человека), кардиовирус, аптовирус), реовирусы (например, ортореовирус, орбивирус, ротавирус, циповирус, фидживирус, фитореовирус, оризавирус), ретровирусы (например, ретровирусы млекопитающих типа B, ретровирусы млекопитающих типа C, птичьи ретровирусы типа C, группа ретровирусов типа D, BLV-HTLV ретровирусы, лентивирус (например, ВИЧ-1, ВИЧ-2, спумавирус)), флавивирусы (например, вирус гепатита C), гепаднавирусы (например, вирус гепатита B), тогавирусы (например, альфа-вирус (такой как вирус Синдбис и рубивирус, такой как вирус краснухи), рабдовирусы (например, везикуловирус, лиссавирус, эфемерный вирус, циторабдовирус, неклеорабдовирус), аренавирусы (например, аренавирус, вирус лимфоцитарного хориоменингита, вирус Иппай, вирус Ласса); и коронавирусы (например, коронавирус, торовирус); Цитомегаловирус (мононуклеоз); вирус денге (лихорадка денге, шоковый синдром); вирус Эпштейна-Барр (мононуклеоз, лимфома Беркитта); Т-клеточный лимфотропный вирус человека типа 1 (Т-клеточный лейкоз); грипп A, B и C (респираторные заболевания); вирус японского энцефалита (пневмония, энцефалопатия); полиовирус (паралич); риновирус (простуда); вирус краснухи (пороки развития плода); вирус коровьей оспы (генерализованная инфекция); вирус желтой лихорадки (желтуха, почечная и печеночная недостаточность); и вирус ветряной оспы (ветрянка). Примеры антигенов этих вирусных патогенов включают поверхностный антиген гепатита В, ротавирусные антигены, такие как VP4 и VP7, антигены вируса гриппа, такие как гемагглютинин или нуклеопротеин, и антиген тимидинкиназы простого герпеса.
Вирусные патогены также включают антигены ВИЧ, способные генерировать ВИЧ-специфический иммунный ответ. Антигены ВИЧ включают, но не ограничиваются этим, пептиды, происходящие из ранних регуляторных белков ВИЧ, включая белки Tat, Rev и Nef ВИЧ (например, Nef-V3) или другие белки ВИЧ, такие как Gag, Pol, Env, Vif, Vpr и Vpu. В частности, пептидные эпитопы этих белков представляют собой такие, которые способны генерировать нейтрализующие антитела. Различные CTL/CD8+ и T-хелпер/CD4+ эпитопы ВИЧ известны в данной области и рассматриваются для применения в композициях, эффективных для генерирования ВИЧ-специфического иммунного ответа и рассматриваются для использования в слитых белках, VLP и фармацевтических композициях по изобретению. См. Korber B, et al., Eds., “HIV Molecular Immunology”, (Los Alamos National Laboratory, Los Alamos, NM, USA, 2006/2007).
Примеры специфических вирусных патогенов, имеющих важное значение в ветеринарии, включают, но не ограничиваются этим, вирус классической чумы свиней, PCV2 (цирковирус свиней второго типа) и вирус псевдобешенства (болезнь Ауески) (свиньи); BHV-1 (вирус герпеса 1 типа крупного рогатого скота) (крупный рогатый скот); вирус лошадиного гриппа и WNV (вирус Западного Нила) (лошади); вирус птичьего гриппа (например, H5N1, HKN3), HTV (вирус герпеса индеек), MDV (вирус болезни Марека) и IBDV (вирус инфекционной бурсальной болезни) и NVD (вирус болезни Ньюкасла) (домашняя птица); вирус кошачьего лейкоза и вирус бешенства (кошки); и собачий коронавирус, вирус собачьей чумы, собачий парвовирус и вирус IHN (собаки).
Бактериальные патогены включают, но не ограничиваются этим, Actinornyces israelli, Bacillus anthracis, Bacteroides spp., Bordetella pertussis, Borrelia burgdorferi, Brucella spp., Campylobacter spp., Campylobacter jejuni, Chlamydia spp., Chlamydia trachomatis, Clostridium botulinum, Clostridium perfringers, Clostridium tetani, Corynebacterium dipththeriae, Enterococcus spp., Erysipelothrix rhusiopathiae, Escherichia coli, энтерогеморрагическую E. coli, энтеротоксигенную E. coli, Fusobacterium nucleatum, Haemophilus influenzae типа B и нетипируемую, Helicobacter pylori, Klebsiella pneumoniae, Legionella pneumophila, Leptospira spp. Listeria monocytogenes, Mycobacterium spp. (например, M. avium, M. gordonae, M. racellulare, M. kansaii, M. leprae, M. tuberculosis), Mycobacterium tuberculosis, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurella spp., Pasturella multocida, Pneumococcus spp., Pseudomonas aeruginosa, Rickettsia spp., Salmonella spp., Shigella spp., Staphylococcus aureus, Streptococcus spp., Streptococcus (анаэробные виды), Streptococcus (группа вириданс), Streptococcus agalactiae (Streptococcus Группа B), Streptococcus B, Streptococcus bovis, Streptococcus faecalis, Streptobacillus moniliformis, Streptococcus mutans, Streptococcus pneumoniae, Streptococcus pyogenes, бета-гемолитический Streptococcus Группы A, Treponema pallidum, Treponema pertenue, Vibrio cholera и Yersinia pestis.
Примеры конкретных бактериальных патогенов, являющихся важными в ветеринарии, включают, но не ограничиваются этим, Actinobacillus pleuropneumoniae и Lawsonia intracellularis (свиньи); Anaplasma centrale, Anaplasma marginale, Brucella abortus, Brucella melitensis и Ehrlichia ruminantium (крупный рогатый скот); Streptococcus equi (лошади); Chlamydophila abortus (овцы); Bordetella avium, Mycoplasma gallisepticum, Mycoplasma synoviae и Salmonella spp. (домашняя птица); Aeromonas salmonicida, Vibrio anguillarum и Yersinia ruckeri (рыбы); и Porphyromonas gulae, Porphyromonas denticanis и Porphyromonas salivosa (собаки).
Патогенные грибы включают, но не ограничиваются этим, род Aspergillus, Blastomyces, Candida, Coccidiodes, Cryptococcus, Histoplasma, Phycomyces, Tinea corporis, Tinea unguis, Sporothrix schenckii и Pneumocystis carinii. Конкретные примеры патогенных грибов включают, но не ограничиваются этим, Blastomyces dermatitidis, Candida albicans, Chlamydia trachomatis, Coccidioides immitis, Cryptococcus neoformans и Histoplasma capsulatum.
Патогенные паразиты включают, но не ограничиваются этим, род Dirofilaria, Leishmania, Plasmodium, Schistosoma, Toxoplasma и Tripanosoma. Конкретные примеры патогенных паразитов включают, но не ограничиваются этим, Dirofilaria immitis, Leishmania major, Leishmania donovani, Leishmania infantum, Leishmania braziliensis, Leishmania panamensis, Leishmania mexicana, Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale Plasmodium vivax, Toxoplasma gondii, Tripanosoma brucei и Tripanosoma cruzi. Примеры специфических антигенов для этих патогенных паразитов включают Plasmodium spp. циркумспорозоитный антиген, Plasmodium spp. мерозоитный поверхностный антиген и Leishmania spp. gp63.
Примеры конкретных патогенных грибов и паразитов, которые являются важными в ветеринарии, включают, но не ограничиваются этим, Babesia bigemina, Babesia bovis, Dictyocaulus viviparous, Fasciola gigantica, Fasciola hepatica, Neospora caninum, Theileria annulata, Theileria hirci и Theileria parva (крупный рогатый скот); Sarcocystis neurona (лошади); Toxoplasma gondii (овцы); Eimeria spp.(кокцидиоз), Eimeria maxima и Eimeria tenella (домашняя птица); и Babesia canis, Giardia duodenalis и Leishmania donovani (собаки).
В другом предпочтительном варианте осуществления иммуногенный полипептид представляет собой полипептид, ассоциированный с опухолями или раком (“опухолевые маркеры”), способный (подходящий или предназначенный для) к индукции или модуляции иммунного ответа против опухолевой или раковой клетки. Поэтому слитые белки в соответствии с изобретением можно использовать для лечения или профилактики рака путем стимуляции антиген-специфического иммунного ответа против опухолевого антигена.
Более тысячи белков по-разному экспрессируются при раковых заболеваниях человека и, таким образом, могут служить опухолевыми маркерами. Такие белки играют роль в связанных с раком процессах, включая, но не ограничиваясь этим, ангиогенез, апоптоз, дифференцировку клеток, передачу сигналов клетки, гематопоэз, гормональный контроль и иммунные реакции. Примеры опухолевых маркеров включают, но не ограничиваются этим, карциноэмбриональный антиген (СЕА) как для злокачественного плеврального выпота, так и для перитонеальной диссеминации при раке; рецептор 2 эпидермального фактора роста человека (HER-2/neu) для рака молочной железы стадии IV; антиген опухоли мочевого пузыря при уротелиальной карциноме; тиреоглобулин для метастазов рака щитовидной железы; α-фетопротеин для гепатоцеллюлярной карциномы; простата-специфический антиген (PSA) для рака предстательной железы; раковый антиген 125 (CA 125) для немелкоклеточного рака легкого; раковый антиген 19.9 (CA 19.9) для рака поджелудочной железы; раковый антиген 15.3 (CA 15.3) для рака молочной железы; комбинация лептина, пролактина, остеопонтина и инсулиноподобного фактора роста II (IGF-II) для рака яичников; комбинация CD98, фасцина, секретируемой цепи полимерного рецептора иммуноглобулина (sPIgR) и 14-3-3 эта белков для рака легких; тропонин I для инфаркта миокарда и натрийуретический пептид B-типа для застойной сердечной недостаточности.
Другие общеизвестные опухолевые маркеры включают рецептор эстрогена/рецептор прогестерона (ER/PR), HER-2/neu и рецептор эпидермального фактора роста (EGFR) для рака молочной железы и тканевой ингибитор металлопротеиназ (TIMP-1)-ассоциированного и сывороточный HER2-положительного рака молочной железы; онкоген Kirsten Ras (KRAS) и член A семейства 1 UDP-глюкуронозилтрансфераз (UGT1A1) для колоректального рака; HER-2/neu для рака желудка, c-KIT, CD20 антиген, CD30 и факторы, взаимодействующие с PAPOLA и слитым белком CPSF1-рецептор альфа тромбоцитарного фактора роста (FIP1L1-PDGRF альфа), и рецептор фактора роста тромбоцитов PDGFR) для желудочно-кишечной стромальной опухоли (GIST); филадельфийская хромосома (BCR/ABL)/ PML/RAR альфа и киназа анапластической лимфомы (TPMT/UGT1A1/ALK EGFR) для лейкоза/лимфомы; KRAS/EGFR для рака легких и BRAF и S100 для меланомы.
Другие примеры опухолевых маркеров включают опухолевые супрессоры, которые потеряны при раке, такие как ген рака молочной железы 1 (BRCA1), ген рака молочной железы 2 (BRCA2); РНК, такая как мРНК, микроРНК; белки, обнаруженные в жидкостях или тканях организма, такие как специфический антиген простаты и CA-125; биомаркеры на основе генов и белков; и неспецифические биомаркеры, такие как гликозаминогликаны в жидкостях организма; щелочная фосфатаза и гидроксипролин в моче при поражении скелета; экскреция гиалуроновой кислоты и гидроксипролин в моче при заболевании костей, и их комбинации.
Опухолевые маркеры, ассоциированные с важными в ветеринарии злокачественными новообразованиями, такими как злокачественная меланома у собак (CMM), наиболее распространенная опухоль ротовой полости у собак и плоскоклеточная карцинома глаз у крупного рогатого скота, также могут быть презентированы с использованием слитых белков и VLP по изобретению.
В другом предпочтительном варианте осуществления иммуногенный полипептид представляет собой полипептид, способный (подходящий или предназначенный для) к индукции иммунного ответа против аллергена.
Неограничивающие иллюстративные примеры аллергенов включают, но не ограничиваются этим, белковые экстракты пыльцы деревьев и цветов (например, Lolium perenne, Poa pratense, Phleum pratense, Cynodon dactylon, Festuca pratensis, Dactylis glomerata, Secale cereale, Hordeum vulgare, Avena sativa, Triticum sativa, Artemisia vulgaris, Chenopodium album, Plantago lanceolata, Taraxacum vulgare, Parietaria judaica, Salsola kali, Urtica dioica, Olea europea, Platanus spp., Cupressus spp), белковые экстракты насекомых (например, Dermatophagoides pteronyssinus, Dermatophagoides farinae, Acari spp. (например, Acarus siro), Blomia tropicalis, Euroglyphus maynei, Glyciphagus domesticus, Lepidoglyphus destructor, Tyrophagus putrescentiae), белковые экстракты грибов или клеток кожи животных (например, Penicillium spp., Alternaria alternata, Cladosporium herbarum, клетки кожи собак, клетки кожи кошек, клетки кожи лошадей) и белковые экстракты пищи или пищевых продуктов.
В предпочтительном варианте осуществления иммуногенный полипептид происходит из белка вируса. Предпочтительно вирус представляет собой ВИЧ.
В предпочтительном варианте осуществления иммуногенный полипептид не содержит эпитоп из полипептида gag ВИЧ.
В другом предпочтительном варианте осуществления иммуногенный полипептид происходит из Env белка вируса ВИЧ или является продуктом процессинга Env белка.
В предпочтительном варианте осуществления последовательность Env белка ВИЧ включает SEQ ID NO: 21 или ее функционально эквивалентный вариант.
В предпочтительном варианте осуществления продукт, являющийся результатом процессинга Env белка, представляет собой gp41 или функционально эквивалентный вариант.
Функционально эквивалентные варианты полипептида gp41 имеют предпочтительно по меньшей мере 60%, 70%, 80%, 90%, 95%, 97%, 98% или 99% активности образования их эталонного полипептида. Специалистам в данной области известны некоторые методы детекции образования VLP из функционального варианта полипептида gag ВИЧ.
В предпочтительном варианте осуществления последовательность gp41 варианта включает SEQ ID NO: 5 и включает HR2 область и MPER область gp41.
В другом предпочтительном варианте осуществления размер иммуногенного полипептида составляет меньше чем 90 аминокислот, меньше чем 80 аминокислот, меньше чем 70 аминокислот или меньше чем 60 аминокислот.
В другом предпочтительном варианте осуществления иммуногенный полипептид включает от N-конца к C-концу:
(a) HR2 область полипептида gp41 ВИЧ или его функционально эквивалентного варианта, и
(b) MPER область полипептида gp41 ВИЧ или его функционально эквивалентного варианта.
Последовательности HRl и HR2 gp41 хорошо известны в данной области техники. В предпочтительном варианте осуществления HR2 область включает SEQ ID NO: 22. Предпочтительно MPER область включает SEQ ID NO: 23, в частном случае HXB2 Env белка.
Поскольку возможны модификации и изменения в структуре областей, образующих варианты gp41 в соответствии с изобретением, с получением при этом молекул, имеющих подобные или желательные характеристики, такие функциональные эквиваленты также включены в объем настоящего изобретения.
Для целей настоящего изобретения полипептид, который является полезным в качестве антигена в иммуногенной композиции (то есть обладает достаточной “иммуногенной активностью”), может быть идентифицирован любым способом, хорошо известным в данной области для измерения способности данного полипептида запускать образование антител, специфических для указанного полипептида, при введении в организм хозяина. Способность данного варианта полипептида по изобретению быть иммунологически эквивалентным вариантом можно определить с использованием стандартных анализов нейтрализации, где потенциальный вариант инокулируют испытываемому животному и полученные антитела испытывают на их способность к нейтрализации инфицирования восприимчивых клеток штаммами ВИЧ.
Иммунологически функциональные эквиваленты иммуногенного полипептида по изобретению могут быть получены путем модификации полипептида. Указанные модификации могут представлять собой, без ограничения, аминокислотные замены, делеции, усечения, полипептидные фрагменты, слияния с другими полипептидами, вставки или любую их комбинацию. Соответственно, иммунологически функциональные эквиваленты иммуногенного полипептида показывают степень идентичности в отношении аминокислотной последовательности, показанной для соответствующей области в нативном иммуногенном полипептиде, по меньшей мере, 50%, 55%, 60%, 65%, 70%, 75. %, 80%, 85%, 90%, 95%, 96%, 97%, 98% или по меньшей мере 99%, при условии сохранения иммуногенной активности эталонного полипептида. Предпочтительно идентичность существует по всей области, длина которой составляет по меньшей мере около 25 аминокислот или нуклеотидов, или, более предпочтительно, по всей области, длина которой составляет по меньшей мере около 50-100 аминокислот или нуклеотидов. Указанием на то, что две нуклеиновокислотные последовательности или полипептиды по существу идентичны, является то, что полипептид, кодируемый первой нуклеиновой кислотой, является иммунологически перекрестно реактивным с антителами, индуцированными против полипептида, кодируемого второй нуклеиновой кислотой, как описано ниже. Таким образом, полипептид типично по существу идентичен второму полипептиду, например, когда два пептида отличаются только консервативными заменами. Степень идентичности между двумя пептидами можно определить с использованием компьютерных алгоритмов и методов, которые хорошо известны специалистам в данной области. Идентичность между двумя аминокислотными последовательностями двух пептидов предпочтительно определяют с использованием алгоритма BLASTP. См. Altschul, S. et al., “BLAST Manual”, (NCBI NLM NIH Bethesda, Md. 20894, Altschul, S., et al., J., 1990, Mol. Biol. 215:403-410).
В качестве примера модификаций, которые, как предполагается, находятся в пределах объема настоящего изобретения, некоторые аминокислоты могут быть заменены другими аминокислотами в полипептидной структуре без заметной потери способности к взаимодействию и связыванию структуры, такой как, например, эпитоп антигена, который распознается и связывается антителом. Поскольку именно способность к взаимодействию и природа полипептида определяют его биологическую (например, иммунологическую) функциональную активность, некоторые аминокислотные замены возможны в аминокислотной последовательности (или в кодирующей последовательности ДНК, которая ее обусловливает) с получением при этом полипептида с сопоставимыми свойствами. Различные изменения могут быть внесены в аминокислотные последовательности антигенов по настоящему изобретению без заметной потери иммуногенной активности.
В данной области техники известно, что для осуществления функционально эквивалентных аминокислотных замен можно учитывать гидропатический индекс аминокислот. Важность гидропатического аминокислотного индекса для придания интерактивной биологической функции полипептиду хорошо известна в данной области. См. Kyte J, et al., J. Mol. Biol. 1982; 15(1):105-132. Известно, что некоторые аминокислоты могут заменять другие аминокислоты, имеющие сходный гидропатический индекс или оценку, и при этом сохранять сходную биологическую активность. При осуществлении изменений на основе гидропатического индекса замена аминокислотами, гидропатические индексы которых находятся в пределах плюс или минус 2, является предпочтительной, особенно предпочтительными являются те, гидропатические индексы которых находятся в пределах плюс или минус 1, и еще более предпочтительны те, гидропатические индексы которых находятся в пределах плюс или минус 0,5. Каждой аминокислоте был присвоен гидропатический индекс на основе ее гидрофобности и характеристик заряда; они являются следующими: изолейцин (+4,5), валин (+4,2), лейцин (+3,8), фенилаланин (+2,8), цистеин/цистин (+2,5), метионин (+1,9), аланин (+1,8), глицин (-0,4), треонин (-0,7), серин (-0,8), триптофан (-0,9), тирозин (-1,3), пролин (-1,6), гистидин (-3,2), глутамат (-3,5), глутамин (-3,5), аспартат (-3,5), аспарагин (-3,5), лизин (-3,9) и аргинин (-4,5).
Также, в данной области известно, что замену аналогичными аминокислотами можно эффективно осуществить на основе их гидрофильности; в частности, когда созданный таким образом иммунологически функциональный эквивалентный полипептид предназначен для использования в иммунологических вариантах осуществления, например, как в некоторых вариантах осуществления настоящего изобретения. Наибольшая локальная средняя гидрофильность белка, обусловленная гидрофильностью соседних аминокислот, коррелирует с его иммуногенностью и антигенностью. См. Hopp T, US4554101. При осуществлении изменений на основе сходных значений гидрофильности предпочтительной является замена аминокислотами, значения гидрофильности которых находятся в пределах плюс или минус 2, особенно предпочтительными являются аминокислоты со значениями в пределах плюс или минус 1, а те, значения которых находятся в пределах плюс или минус 0,5, являются еще более предпочтительными. Следующие значения гидрофильности были присвоены аминокислотным остаткам: аргинин (+3,0), лизин (+3,0), аспартат (+3,0 плюс или минус 1), глутамат (+3,0 плюс или минус 1), серин (+0,3), аспарагин (+0,2), глутамин (+0,2), глицин (0), треонин (-0,4), пролин (-0,5 плюс или минус 1), аланин (-0,5), гистидин (-0,5), цистеин (-1,0), метионин (-1,3), валин (-1,5), лейцин (-1,8), изолейцин (-1,8), тирозин (-2,3), фенилаланин (-2,5) и триптофан (-3,4).
В данной области техники хорошо известно, что, когда, что некоторые остатки показаны как особенно важные для иммунологических или структурных свойств белка или пептида, такие как, например, остатки в областях связывания или эпитопах, такие остатки, как правило, не могут быть заменены. Таким образом, функциональные эквиваленты определяются в настоящем изобретении как те полипептиды, которые сохраняют значительный уровень их нативной иммунологической активности. Как правило, чем короче длина молекулы, тем меньше изменений можно внести в молекулу, не влияя на ее функцию. Более длинные домены могут иметь промежуточное количество изменений. В полноразмерном белке будет наиболее допустимым большее количество изменений. Однако следует принять во внимание, что некоторые молекулы или домены, которые сильно зависят от их структуры, могут выдержать лишь незначительную модификацию или вообще никакой.
Иммунологически эквивалентные варианты также могут быть получены путем экспрессии из нуклеиновокислотных последовательностей, которые по существу идентичны молекуле, кодирующей области в нативном иммуногенном полипептиде, или их комплементы гибридизуются друг с другом в жестких условиях, как описано ниже, при условии, что иммуногенная активность полипептида, кодируемого указанными нуклеиновыми кислотами, сохраняется.
Жесткие условия зависят от последовательности и будут разными в разных обстоятельствах. Более длинные последовательности специфически гибридизуются при более высоких температурах. См. Tijssen S, “Overview of principles of hybridization and the strategy of nucleic acid assays”, Laboratory Techniques in Biochemistry and Molecular Biology (Elsevier Science Publishers B.V., Amsterdam, NL 1993). Как правило, жесткие условия выбирают так, чтобы они были примерно на 5-10°С ниже, чем температура плавления (Tm) для конкретной последовательности при определенной ионной силе и рН. Tm означает температуру (при определенной ионной силе, pH и концентрации нуклеиновых кислот), при которой 50 процентов зондов, комплементарных мишени, гибридизуются с последовательностью-мишенью в равновесии (поскольку последовательности-мишени присутствуют в избытке, при Tm 50 процентов зондов заняты при равновесии). Жесткие условия будут такими, в которых концентрация соли составляет менее чем около 1,0 М ионов натрия, типично концентрация ионов натрия (или других солей) около 0,01-1,0 М при рН от 7,0 до 8,3 и температуре по меньшей мере около 30°С для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере около 60°С для длинных зондов (например, более 50 нуклеотидов). Жесткие условия также могут достигаться при добавлении дестабилизирующих агентов, таких как формамид. Для гибридизации в условиях высокой жесткости положительный сигнал по меньшей мере в два раза превышает фоновый, предпочтительно в 10 раз больше фоновой гибридизации. Примеры условий высокой жесткости или жесткой гибридизации включают: 50% формамида, 5xSSC и 1% SDS, инкубируемые при 42°C, или 5xSSC и 1% SDS, инкубируемые при 65°C, с промывкой в 0,2xSSC и 0,1% SDS при 65°C.
Специалистам в данной области будет понятно, что различные компоненты, которые образуют часть слитого белка в соответствии с настоящим изобретением, могут быть функционально связаны непосредственно или опосредованно через линкерную область.
В предпочтительном варианте осуществления слитый белок по изобретению дополнительно включает по меньшей мере один линкер. Предпочтительно линкер включает глициновые остатки, и более предпочтительно глициновые и сериновые остатки. Еще более предпочтительно линкер включает три глициновых остатка и один сериновый остаток. Предпочтительно линкер включает последовательности SEQ ID NO: 24 или SEQ ID NO: 25. Более предпочтительно линкерная последовательность выбрана из группы, состоящей из последовательностей SEQ ID NO: 24 и SEQ ID NO: 25.
В другом предпочтительном варианте осуществления слитый белок по изобретению дополнительно включает метку, которая может быть использована для детекции или для очистки варианта gp41 с использованием реагентов, демонстрирующих специфическое сродство к указанным меткам. Подходящие метки для детекции/очистки включают hexa-his (металл-хелатный фрагмент), hexa-hat GST (глутатион-S-трансфераза) глутатион аффинную метку, кальмодулин-связывающий пептид (СВР), strep-tag, целлюлоза-связывающий домен, мальтоза-связывающий белок, S-пептидную метку, хитин-связывающую метку, иммунореактивные эпитопы, эпитопные метки, E2tag, HA эпитопную метку, Myc эпитоп, FLAG эпитоп, AU1 и AU5 эпитопы, GIu-GIu эпитоп, KT3 эпитоп, IRS эпитоп, Btag эпитоп, протеинкиназа-C эпитоп, VSV эпитоп или любую другую меткуа, при условии, что метка не влияет на стабильность белка или иммуногенность связаного с ним антигена.
Несколько типов аминокислотных последовательностей могут быть добавлены к слитым белкам по изобретению для достижения различных целей, таких как, например, облегчение их обработки или мониторинг их экспрессии. Добавление этих пептидных последовательностей к слитому белку по изобретению не влияет на их функциональные или иммуногенные способности.
В предпочтительном варианте осуществления линкерная последовательность включает последовательности SEQ ID NO: 26, SEQ ID NO: 27 или SEQ ID NO: 28. Предпочтительно линкерная последовательность выбрана из группы, состоящей из последовательностей SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28.
В другом предпочтительном варианте осуществления слитый белок в соответствии с изобретением включает последовательность SEQ ID NO: 29.
3. Нуклеиновые кислоты, векторы и клетки-хозяева
а) Нуклеиновые кислоты
В дополнительном аспекте изобретение относится к полинуклеотиду, кодирующему слитый белок в соответствии с изобретением.
В предпочтительном варианте осуществления полинуклеотид в соответствии с изобретением включает последовательность SEQ ID NO: 9.
В предпочтительном варианте осуществления последовательность полинуклеотида в соответствии с изобретением является кодон-оптимизированной в соответствии с хозяином, выбранным для ее экспрессии. В другом предпочтительном варианте осуществления кодон-оптимизированная последовательность, кодирующая иммуногенный полипептид в соответствии с изобретением, включает последовательность SEQ ID NO: 11. В дополнительном предпочтительном варианте осуществления кодон-оптимизированная последовательность, кодирующая полипептид gag ВИЧ в соответствии с изобретением, включает последовательность SEQ ID NO:13.
Специалистам в данной области известны многие способы и программные средства для оптимизации кодонов. Кодон-оптимизированные нуклеиновые кислоты для применения в соответствии с настоящим изобретением можно получить путем замены кодонов нуклеиновой кислоты, кодирующей иммуноген, кодонами, присутствующими с высокой повторяемостью в геноме выбранного хозяина (например, “гуманизированные” кодоны, кодоны, которые часто встречаются в высокоэкспрессируемых генах человека).
В предпочтительном варианте осуществления кодон-оптимизированный полинуклеотид в соответствии с изобретением (т.е. человеческий) включает последовательность SEQ ID NO: 15.
Полинуклеотид по настоящему изобретению может быть функционально связан с любым промотором или энхансером, способным направлять экспрессию нуклеиновой кислоты после введения в клетку-хозяин. Промотор представляет собой ряд нуклеиновокислотных контрольных последовательностей, который направляет транскрипцию нуклеиновой кислоты. Промотор включает необходимые нуклеиновокислотные последовательности (которые могут быть) вблизи сайта начала транскрипции, как в случае промотора полимеразы II типа (TATA элемент). Промотор также может включать дистальные энхансерные или репрессорные элементы, которые могут быть расположены на расстоянии до несколько тысяч пар оснований от сайта начала транскрипции. Включены как конститутивные, так и индуцибельные промоторы.
Полинуклеотиды в соответствии с изобретением могут быть включены в вектор в целях клонирования, осуществления других лабораторных манипуляций, получения рекомбинантных пептидов или доставки генов.
b) Векторы
Еще в одном аспекте изобретение относится к вектору, включающему полинуклеотид в соответствии с изобретением.
Специалистам в данной области будет понятно, что не существует никаких ограничений, что касается типа вектора, который можно использовать с настоящим изобретением. Вектор может представлять собой клонирующий вектор, подходящий для репродукции и для получения полинуклеотидов, генные конструкции или векторы экспрессии, включенные в некоторые гетерологичные организмы. Таким образом, подходящие векторы в соответствии с настоящим изобретением включают прокариотические векторы экспрессии (например, pUC18, pUC19, Bluescript и их производные), mp18, mp19, pBR322, pMB9, CoIEl, pCRl, RP4, фаги и “челночные” векторы (например, pSA3 и pAT28), дрожжевые векторы экспрессии (например, векторы типа 2-мкм плазмид), интегрированные плазмиды, YEP векторы, центромерные плазмиды и т.п., векторы экспрессии на основе клеток насекомых (например, векторы pAC серии и pVL серии), растительные векторы экспрессии, такие как векторы экспрессии в растениях (например, векторы серии pIBI, pEarleyGate, pAVA, pCAMBIA, pGSA, pGWB, pMDC, pMY, pORE), и эукариотические векторы экспрессии на основе вирусных векторов (например, аденовирусов, вирусов, ассоциированных с аденовирусами, а также ретровирусов и лентивирусов), а также не-вирусные векторы, такие как pSilencer 4.1-CMV (Ambion, Applied Biosystems, Foster City, CA, USA), pcDNA3, pcDNA3.1/hyg pHCMV/Zeo, pCR3.1, pEFl/His, pIND/GS, pRc/HCMV2, pSV40/Zeo2, pTRACER-HCMV, pUB6/V5-His, pVAXl, pZeoSV2, pCI, pSVL и pKSV-10, pBPV-1, pML2d и pTDTl. В предпочтительном варианте осуществления вектор представляет собой pcDNA3.1.
В конкретных вариантах осуществления вектор представляет собой вектор экспрессии, который может включать регуляторный элемент, такой как немедленно-ранний ген цитомегаловируса hCMV, ранний промотор аденовируса SV40, поздний промотор аденовируса SV40, lac система, TAC система, TRC система, области главного оператора и промотора фага, контрольные области белка оболочки fd, промотор для 3-фосфоглицераткиназы, промоторы кислой фосфатазы или промоторы факторов скрещивания дрожжей. Примеры векторов включают, но не ограничиваются этим, бактериальные искусственные хромосомы, космиды, дрожжевые искусственные хромосомы, фаг, плазмиды, липидные векторы и вирусные векторы (например, ретровирусные). Подходящие векторы экспрессии для слитого белка были описаны ранее. См. Kayman, US5643756.
с) Клетки-хозяева
В другом аспекте изобретение направлено на клетку-хозяин, включающую слитые белки в соответствии с изобретением, полинуклеотиды, кодирующие их, или векторы, включающие указанные полинуклеотиды.
Клетки, являющиеся подходящими в настоящем изобретении, включают, без ограничения, клетки млекопитающих, растений, насекомых, грибов и бактерий. Бактериальные клетки включают, но не ограничиваются этим, грам-положительные бактериальные клетки, такие как виды из рода Bacillus, Streptomyces и Staphylococcus, и грам-отрицательные бактериальные клетки, такие как клетки рода Escherichia и Pseudomonas. Клетки грибов предпочтительно включают дрожжевые клетки, такие как Saccharomyces, Pichia pastoris и Hansenula polymorpha. Клетки насекомых включают, но не ограничиваются этим, клетки дрозофилы и клетки Sf9. Растительные клетки включают, среди прочих, клетки культурных растений, таких как злаковые, лекарственные, декоративные или луковичные растения. Клетки млекопитающих включают, но не ограничиваются этим, клетки яичников китайского хомячка(CHO), такие как CHO-Kl (ATCC номер доступа CCL-61), DG44 (Chasin L, et al., Som. Cell Mol. Genet. 1986; 12:555-556; и Kolkekar A, et al., Biochemistry 1997; 36:10901-10909), CHO-Kl Tet-On (Clontech, Mountain View, CA, USA), CHO, обозначенные как ECACC 85050302 (CAMR, Salisbury, Wiltshire, UK), CHO клон 13 (GEIMG, Genova, IT), CHO клон B (GEIMG, Genova, IT), CH0-K1/SF, обозначенные как ECACC 93061607 (CAMR, Salisbury, Wiltshire, UK), RR-CHOKl, обозначенные как ECACC 92052129 (CAMR, Salisbury, Wiltshire, UK), CHO клетки, отрицательные для дигидрофолатредуктазы (CHO/-DHFR, Urlaub G, et al., Proc. Natl. Acad. Sci. USA 1980; 77:4216-4220), SV40-трансформированные клетки почки обезьяны CVl (COS, COS-7, ATCC номер доступа CRL-1651); клетки почки эмбриона человека (HEK-293, HEK-293T клетки); клетки почки новорожденного хомяка (BHK, ATCC номер доступа CCL-IO); клетки почки обезьяны (CVl, ATCC номер доступа CCL-70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC номер доступа CRL-1587; VERO, ATCC номер доступа CCL-81); мышиные клетки Сертоли (TM4, Mather J, Biol. Reprod. 1980; 23:243-251); клетки цервикальной карциномы человека (HELA, ATCC номер доступа CCL-2); клетки почки собаки (MDCK, ATCC номер доступа CCL-34); клетки легкого человека (W138, ATCC номер доступа CCL-75); клетки гепатомы человека (HEP-G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC номер доступа CCL-51); клетки печени серой крысы (BRL 3A, ATCC номер доступа CRL- 1442); TRI клетки (Mather J, Ann. NY Acad. Sci. 1982, 383:44-68); MCR 5 клетки и FS4 клетки. Предпочтительно используемые клетки-хозяева представляют собой HEK-293T клетки.
В предпочтительном варианте осуществления клетка-хозяин в соответствии с изобретением представляет собой рекомбинантную бактерию.
В предпочтительном варианте осуществления бактерия представляет собой грам-отрицательную бактериальную клетку, и предполагается, что этот термин включает все факультативные грам-отрицательные клетки семейства Enterobacteriaceace, такие как Escherichia spp., Shigella spp., Citrobacter spp., Salmonella spp., Klebsiella spp., Enterobacter spp., Erwinia spp., Kluyvera spp., Serratia spp., Cedecea spp., Morganella spp., Hafhia spp., Edwardsiella spp., Providencia spp., Proteus и Yersinia spp.
Все термины и варианты осуществления, описанные выше в связи со слитыми белками по изобретению, равным образом применимы к полинуклеотидам, векторам или клеткам-хозяевам в соответствии с изобретением.
4. Способ получения VLPs
Еще в одном аспекте изобретение относится к способу получения VLP, нагруженной полипептидом, представляющим интерес, включающему:
(a) экспрессию в клетке слитого белка в соответствии с изобретением, и
(b) выделение VLP из внеклеточной среды.
Первая стадия способа в соответствии с изобретением включает преобразование клетки-хозяина при помощи вектора, включающего полинуклеотид в соответствии с изобретением. Указанное преобразование можно осуществить обычными способами, которые хорошо известны средним специалистам в данной области. Когда хозяин является прокариотическим, таким как E. coli, компетентные клетки, которые способны к поглощению ДНК, можно получить из клеток, собранных после экспоненциальной фазы роста и затем обработанных CaCl2 способом с использованием процедур, хорошо известных в данной области техники. Альтернативно, можно использовать MgCl2 или RbCl. Преобразование также можно осуществить после образования протопласта клетки-хозяина, если желательно, или путем электропорации.
Когда хозяином является эукариот, можно использовать такие способы трансфекции ДНК, как копреципитаты фосфата кальция, традиционные механические процедуры, такие как микроинъекция, электропорация, вставка плазмиды, включенной в липосомы, или вирусные векторы. Эукариотические клетки также могут быть ко-трансформированы полинуклеотидными последовательностями, кодирующими иммуногенный gp120 полипептид, и второй чужеродной молекулой ДНК, кодирующей селектируемый фенотип, такой как ген тимидинкиназы простого герпеса. Другой способ включает использование эукариотического вирусного вектора, такого как вирус обезьян 40 (SV40) или папилломавирус крупного рогатого скота, для транзиентного инфицирования или трансформации эукариотических клеток и экспрессии белка.
Клеточную культуру следует поддерживать в подходящих условиях, обеспечивающих возможность экспрессии полинуклеотида в соответствии с изобретением.
Вторая стадия способа в соответствии с изобретением включает выделение VLP из внеклеточной среды, например, путем центрифугирования и фильтрации через 0,45 мкм фильтры.
В случае VLP, полученных с использованием слитых белков в соответствии с изобретением, VLP характеризуются тем, что содержат вирусный капсид, заключенный в липидную оболочку, при этом липидная оболочка происходит из клетки, образующей VLP.
В другом аспекте изобретение относится к вирусоподобной частице, включающей слитый белок в соответствии с изобретением или полученной с использованием способа в соответствии с изобретением.
Все термины и варианты осуществления, описанные выше, равным образом применимы к способу получения VLP в соответствии с изобретением и к VLP в соответствии с изобретением.
5. Фармацевтические композиции
Еще в одном аспекте изобретение относится к фармацевтической композиции, включающей слитый белок, полинуклеотид, вектор, клетку-хозяин или вирусоподобную частицу в соответствии с изобретением или их комбинацию.
Фармацевтическая композиция в соответствии с изобретением может также включать фармацевтически приемлемый носитель.
Фармацевтически приемлемый носитель по существу нетоксичен для реципиентов в используемых дозировках и концентрациях и совместим с другими ингредиентами композиции. Например, носитель для композиции, содержащей полипептиды, обычно не включает окислители и другие соединения, которые известны как вредные для полипептидов. Подходящие носители включают, но не ограничиваются этим, воду, декстрозу, глицерин, физиологический раствор, этанол и их комбинации. Носитель может содержать дополнительные агенты, такие как смачивающие агенты или эмульгаторы, рН-буферные агенты или адъюванты, которые повышают эффективность композиции.
Фармацевтическую композицию по изобретению можно вводить любым способом, известным специалистам в данной области, таким как внутримышечная, подкожная или внутривенная инъекция и пероральное, назальное или анальное введение. См. Banga A, “Parenteral Controlled Delivery of Therapeutic Peptides and Proteins” в Therapeutic Peptides and Proteins (Technomic Publishing Co., Inc., Lancaster, PA, USA, 1995). Представляющий интерес полипептид по изобретению может быть представлен в виде имплантата, масляной инъекции или в виде системы частиц для продления его терапевтических преимуществ (например, усиления иммуногенного ответа). Система частиц может представлять собой микрочастицу, микрокапсулу, микросферу, нанокапсулу или подобную частицу. См. Banga, 1995, выше. Предпочтительно фармацевтические композиции по изобретению вводят парентерально.
Фармацевтические композиции по изобретению можно сформулировать в виде стандартной лекарственной формы, подходящей для индивидуального введения точных доз. Терапевтически эффективное количество фармацевтической композиции можно вводить в виде разовой дозыили более доз, например, ежедневно, в течение курса лечения или как часть протокола профилактики. В конкретных неограничивающих примерах частота введения фармацевтической композиции по изобретению включает схемы введения по меньшей мере раз в день, по меньшей мере раз в неделю и по меньшей мере раз в месяц. Специалисты в данной области могут изменять дозы, частоту и способ введения фармацевтической композиции в зависимости от потребностей субъекта и следуя протоколам, применяемым в медицине и ветеринарии.
Терапевтически эффективное количество фармацевтической композиции по изобретению может зависеть от тяжести заболевания и возраста, массы тела, общего состояния субъекта и других клинических факторов, таких как чувствительность субъекта к представляющему интерес полипептиду. Таким образом, окончательное определение подходящего режима лечения осуществляется лечащим врачом. Типично, дозы, используемые in vitro, могут быть полезны как руководство для определения количеств, полезных для введения фармацевтической композиции in situ, и животные модели можно использовать для определения эффективных доз для лечения конкретных расстройств. См. Gilman R, et al., Eds., Goodman and Gilman's: The Pharmacological Basis of Therapeutics, 8th Ed. (Pergamon Press, New York, NY, US, 1990), и Gennaro A, Ed., Remington's Pharmaceutical Sciences, 18th Ed. (Mack Publishing Co., Easton, PA, US, 1990). Типично, доза находится в диапазоне от около 0,1 мкг/кг массы тела до около 100 мг/кг массы тела. Другие подходящие диапазоны включают дозы от около 1 мкг/кг до 10 мг/кг массы тела. В одном примере доза составляет от около 1,0 мкг до около 50 мг, например, от 1 мкг до 1 мг, такая как 1 мг пептида на субъекта.
а) Иммуногенные или вакцинные композиции
В предпочтительном варианте осуществления фармацевтическая композиция в соответствии с изобретением представляет собой иммуногенную или вакцинную композицию. Указанная иммуногенная или вакцинная композиция включает терапевтически эффективное количество слитого белка, полинуклеотида, вектора, клетки-хозяина или вирусоподобной частицы в соответствии с изобретением или их комбинации.
Иммуногенная или вакцинная композиция в соответствии с изобретением может также включать фармацевтически приемлемый носитель и другие эксципиенты, такие как адъювант. Примеры адъюванта, который можно использовать с иммуногенными или вакцинными композициями в соответствии с изобретением, включают, но не ограничиваются этим, AlK(SO4)2, AlNa(SO4)2, AlNH4(SO4), диоксид кремния, квасцы, Al(OH)3, Ca3(PO4)2, каолин, углерод, гидроксид алюминия, мурамилдипептиды, N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-DMP), N-ацетил-норнурамил-L-аланил-D-изоглутамин (CGP 11687, также обозначаемый как nor-MDP), N-ацетилмурамуил-L-аланил-D-изоглутаминил-L-аланин-2-(1'2'-дипальмитоил-sn-глицеро-3-гидроксфосфорилокси)-этиламин (CGP 19835A, также обозначаемый как MTP-PE), RIBI (MPL+TDM+CWS) в 2% сквален/Tween-80® эмульсии, липополисахариды и их различные производные, включая липид A, полный адъювант Фрейнда (FCA), неполные адъюванты Фрейнда, адъювант Merck 65, полинуклеотиды (например, поли IC и поли AU кислоты), воск D из Mycobacterium tuberculosis, вещества, обнаруженные в Corynebacterium parvum, Bordetella pertussis и членах рода Brucella spp., Titermax, ISCOMS, Quil A, ALUN, производные липида A, производные холерного токсина, HSP производные, LPS производные, синтетические пептидные матрицы или GMDP, интерлейкин 1, интерлейкин 2, Монтанид ISA-51 и QS-21, CpG олигонуклеотид, поли I:C и GM-CSF. См. Hunter, US5554372, и Jager, WO1997028816. Носитель в форме частиц на основе синтетического полимера, как было показано, действует как адъювант для усиления иммунного ответа, в дополнение к обеспечению контролируемого высвобождения. Соли алюминия также можно использовать в качестве адъювантов для обеспечения иммунного ответа.
В предпочтительном варианте осуществления иммуногенная или вакцинная композиция в соответствии с изобретением включает терапевтически эффективное количество вирусоподобных частиц в соответствии с изобретением и не содержит адъювант. В более предпочтительном варианте осуществления иммуногенная или вакцинная композиция в соответствии с изобретением по существу не содержит фосфат алюминия.
Иммуногенные или вакцинные композиции по изобретению можно вводить в любое время, когда желателен их терапевтический эффект (например, уменьшение признаков, симптомов или результатов лабораторных анализов инфекции ВИЧ-1). Как правило, доза является достаточной для лечения или ослабления симптомов или признаков заболевания, не вызывая неприемлемую токсичность для субъекта. Можно использовать системное или местное введение. Иммуногенные или вакцинные композиции можно вводить субъекту в соответствии с прайм/буст протоколом, при этом после первого введения композиции следует по меньшей мере одно второе введение в другое время с использованием такой же или другой дозы для усиления или поддержания иммунного ответа субъекта против представляющего интерес полипептида (т.е. иммуногена).
Все термины и варианты осуществления, описанные выше, равным образом применимы к иммуногенной композиции или вакцинной композиции в соответствии с изобретением.
6. Терапевтические методы
В другом аспекте изобретение направлено на слитый белок, полинуклеотид, вектор, клетку-хозяин, вирусоподобную частицу или фармацевтическую композицию в соответствии с изобретением или их комбинацию для применения в медицине. В предпочтительном варианте осуществления слитый белок, полинуклеотид, вектор, клетка-хозяин, вирусоподобная частица или фармацевтическая композиция в соответствии с изобретением или их комбинация предназначены для применения в лечении человека. В другом предпочтительном варианте осуществления слитый белок, полинуклеотид, вектор, клетка-хозяин, вирусоподобная частица или фармацевтическая композиция в соответствии с изобретением или их комбинация предназначены для применения в ветеринарии.
Еще в одном аспекте изобретение относится к слитому белку, полинуклеотиду, вектору, клетке-хозяину, вирусоподобной частице или фармацевтической композиции в соответствии с изобретением или их комбинации для применения в лечении или профилактике заболевания, вызванного инфекцией, или опухоли у субъекта. В предпочтительном варианте осуществления субъект представляет собой человека. В другом предпочтительном варианте осуществления субъект представляет собой сельскохозяйственное или домашнее животное. В альтернативной форме этого аспекта изобретение относится к способу лечения или профилактики заболевания, вызванного инфекцией, или опухоли у субъекта, который включает введение терапевтически эффективного количества слитого белка, полинуклеотида, вектора, клетки-хозяина, вирусоподобной частицы или фармацевтической композиции в соответствии с изобретением или их комбинации субъекту. В другой альтернативной форме этого аспекта изобретение относится к применению слитого белка, полинуклеотида, вектора, клетки-хозяина, вирусоподобной частицы или фармацевтической композиции в соответствии с изобретением или их комбинации для получения лекарственного средства для лечения или профилактики заболевания, вызванного инфекцией, или опухоли у субъекта.
В дополнительном аспекте изобретение относится к слитому белку, полинуклеотиду, вектору, клетке-хозяину, вирусоподобной частице или фармацевтической композиции в соответствии с изобретением или их комбинации для применения в доставке терапевтических средств к клеткам или в диагностике.
В предпочтительном варианте осуществления полипептид, представляющий интерес, представляет собой полипептид ВИЧ. В более предпочтительном варианте осуществления полипептид ВИЧ включает MPER область gp41 или ее функционально эквивалентный вариант. Предпочтительно субъектом является человек, шимпанзе, макак или бабуин. Более предпочтительно субъектом является человек.
Другие заболевания, которые можно лечить или предотвратить с использованием слитых белков, полинуклеотидов, векторов, клеток-хозяев, вирусоподобных частиц или фармацевтических композиций по изобретению, или их комбинаций, включают инфекционные заболевания, вызываемые вирусами, бактериями, грибами, простейшими и паразитами. Примеры вируса или вирусных инфекций, которые можно лечить или предотвращать с использованием слитых белков, полинуклеотидов, векторов, клеток-хозяев, вирусоподобных частиц или фармацевтических композиций по изобретению или их комбинаций включают, но не ограничиваются этим, аденовирус, цитомегаловирус, вирус Эпштейна-Барр, вирус Ханта, лихорадку денге, гепатит А, гепатит В, гепатит С, простой герпес типа I, простой герпес типа II, вирус иммунодефицита человека (ВИЧ), вирус папилломы человека (ВПЧ), грипп, корь, эпидемический паротит, паповавирус, полиовирус, респираторно-синцитиальный вирус, чуму крупного рогатого скота, риновирус, ротавирус, краснуху, вирус SARS, оспу и вирусный менингит. Примеры подходящих бактерий или бактериальных инфекций включают, но не ограничиваются этим, Bacillus antracis, Borrelia burgdorferi, Campylobacter jejuni, Chlamydia trachomatis, Clostridium botulinum, Clostridium tetani, Diptheria spp., E. coli, Legionella spp., Helicobacter pylori, Mycobacterium rickettsia, Mycoplasma nesisseria, Pertussis spp., Pseudomonas aeruginosa, S. pneumonia, Streptococcus spp., Staphylococcus spp., Vibria cholerae и Yersinia pestis. Примеры подходящих грибов или грибковых инфекций включают, но не ограничиваются этим, Aspergillus fumigatus, Blastomyces dermatitidis, Candida albicans, Coccidioides immitis, Cryptococcus neoformans, Histoplasma capsulatum и Penicillium marneffei. Примеры подходящих простейших и паразитов или грибковых или протозойных и паразитарных инфекций включают, но не ограничиваются этим, Chlamydia spp., Leishmania spp., Plasmodium spp. (например, малярия), Rickettsia spp. и Trypanosoma spp.
Слитые белки, полинуклеотиды, векторы, клетки-хозяева, вирусоподобные частицы или фармацевтические композиции по изобретению или их комбинации также могут быть полезны для противодействия патогенам, вовлеченным в биотерроризм, таким как, например, Botulinum toxin, Bacillus anthracis, Clostridium perfringens, Bacillus subtilus, Bacillus thuringiensis, вирус геморрагического конъюнктивита (энтеровирус 70) и ротавирус.
Слитые белки, полинуклеотиды, векторы, клетки-хозяева, вирусоподобные частицы или фармацевтические композиции по изобретению или их комбинации также могут быть полезны для лечения или профилактики хронических состояний, таких как болезнь Альцгеймера, болезнь Паркинсона и ревматоидный артрит, или других состояний, таких как аллергия и опухоли. Пример последнего применения может включать химерный белок, одновременно включая антитела или фрагмент антител против опухолевых маркеров или радиоактивные элементы для лучевой терапии. Слитые белки в соответствии с настоящим изобретением и происходящие из них или индуцированные ими антитела также можно использовать для диагностики фертильности и беременности или таких заболеваний, как рак толстой кишки, легких, молочной железы и предстательной железы. Эти слитые белки также можно использовать для мониторинга и контроля злоупотребления лекарственными средствами или хода терапевтического лечения.
Настоящее изобретение также относится к предотвращению или уменьшению симптомов, ассоциированных с ВИЧ-инфекцией. Они включают симптомы, ассоциированные с минорной симптоматической фазой ВИЧ-инфекции, включая, например, опоясывающий лишай, кожную сыпь и инфекцию ногтей, язвы в полости рта, рецидивирующую инфекцию носа и горла и потерю веса. Кроме того, дополнительные симптомы, ассоциированные с основной симптоматической фазой ВИЧ-инфекции, включают, например, молочницу в полости рта и влагалища (Candida), постоянную диарею, потерю веса, постоянный кашель, реактивированный туберкулез и рецидивирующие инфекции герпеса, такие как простой герпес (herpes simplex). Симптомы полностью развившегося СПИДа, которые можно лечить в соответствии с настоящим изобретением, включают, например, диарею, тошноту и рвоту, молочницу и язвы во рту, постоянные рецидивирующие вагинальные инфекции и рак шейки матки, персистирующую генерализованную лимфаденопатию (PGL), тяжелые кожные инфекции, бородавки и стригущий лишай, респираторные инфекции, пневмонию, особенно Pneumocystis carinii pneumonia (PCP), опоясывающий лишай (или herpes zoster), проблемы с нервной системой, такие как боли, онемение или “булавки и иголки” в руках и ногах, неврологические нарушения, саркому Капоши, лимфому, туберкулез и другие оппортунистические инфекции.
Слитые белки, полинуклеотиды, векторы, клетки-хозяева, вирусоподобные частицы и фармацевтические композиции по изобретению или их комбинации могут индуцировать экспрессию антител у субъекта. В одном варианте осуществления антитела являются нейтрализующими антителами (т.е. nAbs). В предпочтительном варианте осуществления слитые белки, полинуклеотиды, векторы, клетки-хозяева, вирусоподобные частицы и фармацевтические композиции по изобретению или их комбинации используют для предотвращения ВИЧ-инфекции или СПИДа у неинфицированного субъекта при воздействии ВИЧ.
Слитые белки в соответствии с изобретением могут также иметь множество применений в разведении домашних и сельскохозяйственных животных и рыб. Эти слитые белки можно использовать для получения иммуногенных или вакцинных композиций против ретровирусов животных, таких как вирус лейкоза кошек (FeLV), а также против невирусных патогенов, таких как Brucella spp., бактериального агента, вызывающего много проблем у крупного рогатого скота, или против Piscirickettsia salmonis, которая поражает в основном при коммерческом разведеним лосося. Другими возможными применениями слитых белков по изобретению являются получение вакцин против Mycoplasma hyopneumoniae, пневмонического агента, который вызывает большие потери у свиней. Также можно было бы использовать слитые белки по изобретению для модуляции экспрессии некоторых гормонов для повышения скорости роста и продукции молока у сельскохозяйственных животных, или чтобы сделать их мясо более постным. Примером этих нетрадиционных показаний может быть использование этих веществ для иммунокастрации сельскохозяйственных животных, таких как свиньи.
Типично, нейтрализующие антитела, используемые в способе по настоящему изобретению, связываются с поверхностью патогена и ингибируют или уменьшают инфицирование патогеном по меньшей мере на 99%, 95%, 90%, 85%, 80%, 75%, 70%, 60%, 50%, 45%, 40%, 35%, 30%, 25%, 20% или 10% по сравнению с инфицированием патогеном в отсутствие указанного антитела(антител) или в присутствии отрицательного контроля. Тогда можно осуществить испытания nAb, чтобы определить, являются ли они широко нейтрализующими (то есть bnAbs), используя любой из способов, представленных в настоящей заявке. Если nAb или bnAb были выработаны у животного отличного от человека, CDRs или полную последовательность можно перенести из нечеловеческого каркаса в человеческий каркас для генерирования антитела, подходящего для введения человеку. Методы определения, является ли антитело nAb, были описаны в данной области. См. Li M, et al., J. Virol. 2005; 79:10108-10125, Wei X, et al., Nature 2003; 422:307-312, и Montefiori D, Curr. Protoc. Immunol. 2005; Jan, Chapter 12: Unit 12.11. Эти методы основаны на определении снижения экспрессии репортерного гена после одного раунда вирусной инфекции с использованием рецептивной клеточной линии с использованием вируса, который кодирует репортерный ген.
В другом предпочтительном варианте осуществления слитый белок, полинуклеотид, вектор, клетка-хозяин или вирусоподобная частица предназначены для применения в соответствии с изобретением, где субъекта предварительно лечат конъюгатом, включающим иммуногенный полипептид, образующий часть слитого белка, объединенного с носителем.
В предпочтительном варианте осуществления иммуногенный полипептид соответствует любой области полипептида gp41 ВИЧ или его функционально эквивалентного варианта. Предпочтительно область представляет собой MPER область. Более предпочтительно MPER область включает SEQ ID NO: 23.
В другом предпочтительном варианте осуществления носитель представляет собой KLH (гемоцианин лимфы улитки).
7. Наборы
В следующем аспекте настоящее изобретение относится к наборам, включающим по меньшей мере один из слитых белков, полинуклеотидов, векторов, клеток-хозяев, вирусоподобных частиц или фармацевтических композиций по изобретению или их комбинацию. Компоненты наборов в соответствии с изобретением необязательно могут быть упакованы в подходящие контейнеры и маркированы для их предполагаемого использования, включая лечение или профилактику инфекционных заболеваний. В одном варианте осуществления инфекционное заболевание представляет собой ВИЧ, СПИД или связанные с ними заболевания или состояния. Компоненты наборов могут храниться в одно- или многодозовых контейнерах в виде водного, предпочтительно стерильного, раствора или в виде лиофилизированной, предпочтительно стерильной, композиции для восстановления. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик, и могут иметь стерильное отверстие для доступа (например, контейнер может представлять собой мешок для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). Наборы могут включать дополнительные контейнеры, включающие фармацевтически приемлемый носитель. Они могут дополнительно включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая, но не ограничиваясь этим, буферы, разбавители, фильтры, иглы, шприцы, культуральную среду для однойили более подходящих клеток-хозяев или другие активные средства. Наборы могут содержать инструкции, обычно включаемые в коммерческие упаковки для терапевтических продуктов, которые содержат информацию, например, о показаниях, применении, дозировке, изготовлении, введении, противопоказаниях, или предупреждения, касающиеся использования таких терапевтических продуктов.
Все публикации, указанные в настоящей заявке, включены во всей полноте посредством ссылки. Изобретение, описанное выше в общих чертах, легче будет понять со ссылкой на следующие примеры, которые представлены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения, если не указано иное.
Общие процедуры
1. Векторы экспрессии для небольших gp41-происходящих белков, gag и слитых белков
Экспрессирующая плазмида млекопитающего pMIN, кодирующая небольшой белок, содержащий C-концевую область HR2, MPER и TM домен, была описана ранее. См. Molinos-Albert L, et al., Retrovirology 2014, 11:44. Также была создана подобная плазмида pMINFULL, кодирующая gp41-происходящий белок, который содержит последовательность MIN и цитоплазматический хвост gp41. См. Фиг. 1. Последовательность MIN клонировали в pET-21D+вектор экспрессии (Novagen, Merck KGaA, Darmstadt, DE) для продукции рекомбинантных белков в E. coli.
Последовательности Gag амплифицировали из pGag-EGFP плазмиды, которая кодирует Rev-независимый белок Gag ВИЧ-1, слитый в рамке с усиленным GFP. Плазмида была получена из NIH AIDS Reagent Program (Cat No. 11468). См. Dhillon A, et al., J. Virol. 2007; 81:6548-6562. Ампликон gag субклонировали в рамке в плазмиду pcDNA3.1MIN для получения плазмиды pcDNA3.1/MINGAG-3.7, которая кодирует слитый белок MINGAG. Плазмиду pGAG, кодирующую полную последовательность Gag, получали путем вырезания кодирующей последовательности gag из плазмиды pGag-EGFP и субклонирования в плазмиду pcDNA3.1 (Invitrogen, Carlsbad, CA, USA; Cat. Nos. K4900-01, K4900-40) См. Фиг. 1. Все реакции амплификации осуществляли с использованием метода ДНК-полимеразы Platinum™ Taq с высокой точностью (Thermo Fisher Scientific, Waltham, MA, USA) в термоциклере 2720 (Applied Biosystems, Foster City, CA, USA). Все плазмиды секвенировали для подтверждения ожидаемой последовательности и инсерционных сайтов.
2. Пептиды, gp41-происходящие белки и VLP
Использовали пептиды C34, T-20 и MPER (последовательность HXB2) и гемоцианин лимфы улитки (KLH) и MPER, связанный с KLH (KLH-MPER) (Thermo Fisher Scientific, Waltham, MA, USA). Перекрывающиеся 15-мерные пептиды, охватывающие HR2 и MPER области gp41, были любезно предоставлены C. Brander (IrsiCaixa, Badalona, ES). Белок MIN, содержащий С-концевую 6xHis метку, продуцировали в штамме E. coli BL21 DE3 (Invitrogen, Thermo Fisher Scientific, Waltham, MA, USA). См. Фиг. 1А. Тельца включения получали из 1 л бактериального экстракта культуры и солюбилизировали с использованием 8 М раствора мочевины. Высокочистый белок получали при помощи металл-аффинной хроматографии на основе никеля (GE Healthcare, Inc., Stamford, CT, USA) и гель-фильтрации с использованием колонки Sephacryl S-200 HR (GE Healthcare, Inc., Stamford, CT, USA) ,
VLP получали путем трансфекции различных производных клеток HEK-293T в соответствии с масштабом получения. Для стабильной трансфекции клетки HEK-293T трансфицировали при помощи pMINFULL и pGAG, pGAG или pcDNA3.1/MINGAG-3.7 с использованием набора для трансфекции клеток млекопитающих calphos (Clontech®, Takara Bio Inc., Otsu, JP) и отбирали трансфицированные клетки с использованием генетицина плюс гигромицин, гигромицина или генетицина, соответственно.
Учитывая низкий выход VLP MINGAG, осуществляли крупномасштабное получение вирусоподобных частиц GAG и MINGAG в разных условиях. Большие количества экспрессирующей плазмиды pcDNA3.1/MINGAG-3.7 получали с использованием наборов maxiprep (Qiagen NV, Venlo, NL) и использовали для транзиентной трансфекции клеток HEK-293T. Gag VLP получали в колбе для культивирования объемом 1 л, тогда как MINGAG VLP получали в 5-л мешке. Через 48 часов после трансфекции супернатанты собирали, подвергали ультрафильтрации, концентрировали (до 1 л в случае MINGAG) и подвергали ультрацентрифугированию. Оба препарата содержали большое количество gag белка, как было определено при помощи анализа отслеживания наночастиц (NTA, NanoSight Ltd., Malvern, GB) и электронной микроскопии.
3. Исследования антигенности
Для оценки экспонирования антигенов на поверхности VLP клетки HEK-293T трансфицировали слитыми белками, включающими представляющий интерес внеклеточный эпитоп и полную последовательность gag ВИЧ. Через 24 часа после трансфекции клетки собирали и окрашивали специфическими антителами против антигенов клеточной поверхности (анти-gp41 антителами 2F5, 4E10 или 10E8 или специфическими антителами против других представляющих интерес белков), после промывки избытка антитела клетки фиксировали и пермеабилизировали с использованием наборов FIX и PERMR® для фиксации клеток и пермеабилизации клеток (Thermo Fisher Scientific, Waltham, MA, USA) и окрашивали внутриклеточно анти-gag антителом Kc57 (Beckman Coulter, Brea CA, USA). После конечной промывки клетки анализировали в проточном цитометре LSRII (BD Biosciences, San Jose, CA, USA). Частоту клеточно-поверхностный антиген-положительных клеток среди GAG-положительных клеток использовали в качестве показателя антигенной стимуляции.
4. Исследования иммуногенности
Самок C57BL/6 мышей (Harlan Sprague Dawley Inc., Indianapolis, IN, USA) возраста 6-8 недель использовали для протоколов иммунизации мышей. Группы мышей (5 мышей на группу) иммунизировали подкожно при помощи 50 мкг рекомбинантных белков или VLPs с 3-недельными интервалами. Образцы крови собирали путем пункции максиллярной артерии до иммунизации и через 3 недели. Мышей наблюдали ежедневно для регистрации изменений массы тела.
Для иммунизации кроликов 3-4-месячных новозеландских белых кроликов инокулировали подкожно различными иммуногенами. Контрольную группу кроликов (n=4) примировали полной gag ДНК и оголенными VLP и иммунизировали два раза на неделе 0 и 3 оголенными VLP. Вторую группу кроликов (n=4) примировали ДНК, кодирующей иммуноген HTI, полным gag ВИЧ и полным генами env ВИЧ и затем иммунизированн на неделе 0 и 3 при помощи MINGAG VLP. См. Mothe B, et al., J. Transl. Med. 2011; 9:208. Сыворотку собирали на неделе 1, 3, 4 и при умерщвлении.
Все эксперименты с использованием животных и условий содержания животных осуществляли в соответствии с существующими требованиями и правилами.
5. Твердофазные иммуноферментные анализы (ELISA)
Пептиды C34, T20, MPER, перекрывающиеся 15-мерные gp41 пептиды или рекомбинантный белок GAG или MIN использовали для покрытия 96-луночных иммунопланшетов Maxisorp Nunc (Thermo Fisher Scientific, Waltham, MA, USA). После блокирования планшеты инкубировали при помощи 100 мкл предварительно разбавленных образцов плазмы в течение ночи при 4°C. Планшеты затем промывали и дозировали 100 мкл конъюгированного с пероксидазой хрена (HRP) F(ab)2 козлиного анти-мышиного IgG (Fc specific, Jackson ImmunoResearch Labs, Inc., West Grove, PA, USA) в течение одного часа при комнатной температуре. Планшеты проявляли с использованием 100 мкл O-фенилендиамин дигидрохлоридного (OPD) субстрата (Sigma-Aldrich, Saint Louis, MO, USA) и реакцию останавливали при помощи 100 мкл 4N H2SO4. Оптическую плотность измеряли при 492 нм для специфического сигнала и при 620 нм для фона.
6. Вирусы и анализы нейтрализации
ВИЧ-2 химеры были получены в контексте полноразмерного молекулярного клона p7312A ВИЧ-2 (GenBank номер доступа L36874). Векторы экспрессии для ВИЧ-2 дикого типа (p7312A) и ВИЧ-2 химер, содержащих MPER gp41 ВИЧ-1 (p7312A-C1), 2F5 (p7312A-C3) или 4E10 эпитопы (p7312A-C4), были любезно предоставлены G.M. Shawn (University of Pennsylvania). См. Dhillon, 2007, выше. Псевдовирусы генерировали путем трансфекции плазмид в HEK-293T клетки. Через 24 часа после трансфекции супернатанты собирали, фильтровали через 0,45 мкм фильтр и вирусные штаммы замораживали при -80°C.
ВИЧ-1 изоляты NL4,3, BaL, AC10 и SVPB16 генерировали как псевдовирусы с использованием Env экспрессирующих плазмид и pSG3 вектора, как было описано ранее. См.  S, et al., Vaccine 2011, 29:5250-5259. Нейтрализацию бесклеточного вируса образцами плазмы испытывали в стандартном анализе на основе TZM-bl. См.
S, et al., Vaccine 2011, 29:5250-5259. Нейтрализацию бесклеточного вируса образцами плазмы испытывали в стандартном анализе на основе TZM-bl. См.  S, 2011, выше. Vaccine 2011, 29:5250-5259. Вкратце, в 96-луночном культуральном планшете 100 мкл предварительно разбавленных образцов плазмы предварительно инкубировали с 50 мкл исходного раствора псевдовирусов, используя 200 TCID50, при 37°C, в течение 1 часа. Затем добавляли 100 мкл, содержащие 10000 TZM-bl клеток-мишеней с репортерным геном люциферазы, на лунку. Планшеты культивировали при 37°C и 5% CO2 в течение 48 часов. 2F5, 4E10 и IgGb12 (Polymun Scientific GmbH, Klosterneuburg, AT) и анти-CD4 клон SK3 (BD Biosciences Corp., Franklin Lakes, NJ, USA) использовали в качестве контролей. Образцы плазмы инактивировали (56°C, 30 минут) перед анализом. Репортерные TZM-bl клетки обрабатывали декстраном (Sigma-Aldrich, Saint Louis, MO, USA) для усиления инфекционности. Люциферазный субстрат Britelite Plus (PerkinElmer, Inc., Waltham, MA, USA) использовали для считывания ВИЧ инфекционности.
S, 2011, выше. Vaccine 2011, 29:5250-5259. Вкратце, в 96-луночном культуральном планшете 100 мкл предварительно разбавленных образцов плазмы предварительно инкубировали с 50 мкл исходного раствора псевдовирусов, используя 200 TCID50, при 37°C, в течение 1 часа. Затем добавляли 100 мкл, содержащие 10000 TZM-bl клеток-мишеней с репортерным геном люциферазы, на лунку. Планшеты культивировали при 37°C и 5% CO2 в течение 48 часов. 2F5, 4E10 и IgGb12 (Polymun Scientific GmbH, Klosterneuburg, AT) и анти-CD4 клон SK3 (BD Biosciences Corp., Franklin Lakes, NJ, USA) использовали в качестве контролей. Образцы плазмы инактивировали (56°C, 30 минут) перед анализом. Репортерные TZM-bl клетки обрабатывали декстраном (Sigma-Aldrich, Saint Louis, MO, USA) для усиления инфекционности. Люциферазный субстрат Britelite Plus (PerkinElmer, Inc., Waltham, MA, USA) использовали для считывания ВИЧ инфекционности.
Пример 1
Создание VLP, презентирующих эпитопы MPER ВИЧ
Белок MIN был выбран из-за его высокой экспрессии и подходящего экспонирования MPER на клеточной поверхности трансфицированных клеток. См. Molinos-Albert, 2014, выше. В качестве первого подхода к испытанию его потенциальной иммуногенности были получены как рекомбинантный белок MIN, так и VLP, содержащие выбранный белок MIN. См. Фиг. 1. Что касается рекомбинантного белка MIN, продуцирование осуществляли в E.coli, и белок был очищен до гомогенности, показывая ожидаемую молекулярную массу 17 кДа. См. Фиг. 2А. Иммуногенность рекомбинантного белка MIN анализировали на мышах C57BL/6. Животные, иммунизированные рекомбинантным препаратом MIN (3 дозы по 20 мкг каждая), показали IgG, реактивные против этого белка. Реакционная способность этих IgG увеличивалась благодаря присутствию фосфата алюминия в качестве адъюванта. См. Фиг. 2B.
Что касается VLP, цитоплазматический домен gp41 был добавлен к последовательности MIN (конструкция MINFULL), чтобы увеличить взаимодействие с Gag в процессе почкования VLP. HEK-293T клеточный клон, стабильно экспрессирующий белки MINFULL и GAG ВИЧ-1, отбирали в соответствии с экспрессией белка и продукцией VLP. Отобранный клон (4G2A) показал экспонирование MPER на клеточной поверхности и содержание внутриклеточного GAG, сопоставимое с GAG-экспрессирующим клеточным клоном HEK-293T, выбранным параллельно и не экспресирующим gp41. См. Фиг. 2B. Супернатанты из этих клонов содержали gag белок преимущественно в форме с высокой молекулярной массой (> 300 кДа), что говорит о правильном образовании VLP. Это наблюдение было дополнительно подтверждено вестерн-блот анализом центрифугированных VLP и клеточных лизатов, которые содержали белок GAG в контрольных клетках и оба белка GAG и GP41 в клетках, ко-экспрессирующих MINFULL и GAG. См. Фиг. 2C. В анализах иммуногенности мыши C57BL/6, иммунизированные MIN-VLPs (три дозы, каждая с общим содержанием белка 10 мкг) в присутствии или в отсутствие адъюванта (фосфат алюминия), показали незначительный анти-gp41 IgG ответ по сравнению с контрольными животными, хотя можно было легко обнаружить высокую реактивность против белков клеточной поверхности HEK-293T и антигена GAG ВИЧ-1. См. Фиг. 2E. Кроме того, ни у какого животного, иммунизированного рекомбинантным белком MIN или VLP, не было обнаружено никакой существенной анти-ВИЧ-1 нейтрализующей активности при анализе против мини-панели из четырех вирусов (т.е. NL4-3, BaL, AC-10 и SVBP16).
Пример 2
Сконструированные VLP: самоупаковывающиеся gp41-gag слитые белки
Принимая во внимание низкое количество белка MIN, включенного в VLP, и низкое число пиков Env, зарегистрированных в вирионах ВИЧ, было выдвинуто предположение, что плохое включение белка MIN в VLPs может быть ограничивающим фактором в вышеописанном подходе. Затем было рассмотрено, может ли увеличение плотности эпитопов MPER на поверхности VLP повысить ее иммуногенный потенциал. См. Фиг. 2C, Zhu P et al., Nature 2006, 441:847-885. Чтобы проверить эту гипотезу, была сконструирована плазмида экспрессии (pcDNA3.1/MINGAG-3.7), кодирующая слитый белок, охватывающий HR2, MPER и TM область gp41, слитую с белком GAG ВИЧ. Плазмиду pcDNA3.1/MINGAG-3.7, контрольную pcDNA3.1GAG и пустую плазмиду трансфицировали в клетки HEK-293T, и экспрессию gp41 и Gag эпитопов анализировали либо проточной цитометрией, либо вестерн-блоттингом. Фиг. 3А показывает специфическое окрашивание клеточной поверхности с использованием двух анти-MPER антител (10E8 и 2F5) Gag+ клеток в HEK-293T культурах, трансфицированных конструкцией MINGAG. MPER окрашивание клеточной поверхности отсутствует в GAG-трансфицированных клетках, что свидетельствует о том, что белок MINGAG правильно экспрессируется и достигает клеточной поверхности. Дальнейшее подтверждение правильной экспрессии было получено в вестерн-блот анализах клеточных лизатов, показывающих экспрессию главного белка, распознаваемого анти-gag антителами, с кажущейся молекулярной массой 65 кДа и 57 кДа в клетках, трансфицированных MINGAG и Gag, соответственно. Те же самые лизаты показали 65 кДа и второй белок при обнаружении с антителом 2F5. См. Фиг. 3B.
Высвобождение VLP трансфицированными клетками оценивали с помощью ELISA в очищенном супернатанте, собранном через 48 часов после трансфекции. Хотя продукция VLP была в 8 раз ниже для конструкции MINGAG, чем для оголенных VLP, оба белка показали сходные уровни материала в форме частиц, что свидетельствует о правильном генерировании частиц. См. Фиг. 3C. Дальнейшая характеризация диаметра частиц при помощи Nanosight показала аналогичный средний диаметр: 160±40 нм для оголенных VLP и 170±50 нм для MINGAG VLP (среднее значение +/- SD от четырех экспериментов). См. Фиг. 3D.
Пример 3
Иммуногенность VLP-Gag и VLP-MinGag у мышей
Испытывали иммуногенность MINGAG VLP у мышей C57BL/6. Пять животных в группе получали инъекцию 200 мкл препарата оголенных или MINGAG VLP с использованием или без фосфата алюминия в качестве адъюванта. Иммуногены получали, поддерживая одинаковую концентрацию антигена Gag между группами, где единственным отличием было присутствие или отсутствие фрагмента MIN в MINGAG VLP. Соответственно, всем животным вводили четыре дозы (с интервалом в 3 недели) 32 нг gag антигена.
Временная динамика анти-gp41 IgG ответов (измеренные с использованием MIN антигена) показала высокую и специфическую иммуногенность в обеих группах, иммунизированных MINGAG, с более быстрым выявлением у животных, которым добавляли адъювант, но с более высокими конечными уровнями у животных, иммунизированных только VLP. См. Фиг. 4А. И наоборот, анти-p24-Gag IgG, которые были одинаковым у животных, иммунизированных оголенными или MINGAG-VLP, были выше в обеих группах животных, которым добавляли адъювант. См. Фиг. 4B. Испытывали, может ли усиливающий эффект адъюванта на анти-Gag ответы и ингибиторный эффект на анти-gp41 ответы быть связан с нежелательными эффектами на структуру VLP. Электронная микроскопия показала, что обработанные фосфатом алюминия VLP теряют нативную структуру, что позволяет предположить, что высвобождение GAG содержимого может объяснить эти результаты. См. Фиг. 4C.
Эти результаты показывают, что препарат MINGAG VLP является иммуногенным, так как некоторые из животных, иммунизированных этим препаратом, могут демонстрировать сильный IgG ответ. Однако никакой существенной нейтрализующей активности не наблюдали ни в сыворотках, ни в очищенных IgG, полученных от контрольных или иммунизированных животных, против двух лабораторно адаптированных вирусов (т.е. NL43 и BaL). См. Фиг. 4D.
Для усиления ответа на MPER полученного авторами изобретения белка MINGAG была разработана вторая процедура иммунизации, в которой животных иммунизировали пептидами MPER, связанными с KLH (четыре дозы через каждые три недели), до иммунизации VLP (в соответствии с протоколом иммунизации, описанным выше) в отсутствие адъюванта. Снова, все животные показали сходные анти-Gag ответы, тогда как только животные, иммунизированные MINGAG, показали сильные анти-gp41 IgG ответы. См. Фиг. 5А. Картирование анти-gp41 IgG ответов показало две основные иммуногенные области, одна из которых охватывает область HR2, а вторая находится в последовательности MPER, перекрывающейся с эпитопом 2F5. См. Фиг 5B. Соответственно, низкую, но значительную нейтрализующую активность наблюдали в сыворотках от животных, иммунизированных MINGAG VLP, по сравнению с контрольными мышами. См. Фиг. 5C. Нейтрализацию наблюдали в отношении BaL, AC10 и SVBP16 изолятов ВИЧ (все подтипа B), и она была специфически вызвана иммунизацией, поскольку сохранялась в IgG фракции сывороток и отсутствовала в преиммунных сыворотках.
Пример 4
Иммуногенность VLP-Gag и VLP-MinGag у кроликов
Подход, аналогичный Примеру 3, использовали для испытания иммуногенности MINGAG VLP на кроликах. VLP вводили путем инъекции (две дозы MINGAG VLP) в отсутствие адъювантов и животных примировали ДНК gag и env. Все животные генерировали значительные анти-gp41 IgG ответы (как измерено по пептиду T-20 и пептидам C34), которые картировали в последовательности HR2 и MPER иммуногенного белка, с некоторым перекрытием с нейтрализующим эпитопом 2F5. См. Фиг. 6A и 6В. И опять, низкую, но значительную нейтрализующую активность наблюдали в сыворотках животных, иммунизированных MINGAG VLP, по сравнению с контрольными кроликами. Нейтрализация наблюдалась против изолята NL4-3, сохранялась в IgG фракции и была специфической, так как не было обнаружено значительной активности против псевдотипированных вирусов VSV. См. (Фиг. 6C).
Пример 5
Кодон оптимизация повышает продукцию VLP
Кодон-оптимизированный (cop) вариант нуклеотидных последовательностей, кодирующих белок GAG и слитый белок MINGAG, клонировали в pcDNA3.1 векторы с получением плазмид pcDNA3.1/GAGcop и pcDNA3.1/MINGAGcop. Транзиентная трансфекция HEK-293T клеток исходной pcDNA3.1/MINGAG-3.7 и новой кодон-оптимизированной pcDNA3.1/MINGAGcop приводила к значительной более высокой экспрессии кодон-оптимизированного варианта. См. Фиг. 7. Уровень экспрессии обоих GAG и MPER был в 5-10 раз выше в кодон-оптимизированном варианте.
Пример 6
Последовательности ДНК, кодирующие MINGAGcop, являются иммуногенными у мышей
Более высокая экспрессия кодон-оптимизированных слитых белков MINGAGcop вызвала необходимость исследования иммуногенности оголенной ДНК в мышиных моделях. pVax™ векторы экспрессии (Thermo Fisher Scientific, Waltham, MA, USA), кодирующие слитый белок MINGAG, белок GAG и пустой pVax вектор конструировали, очищали с использованием набора EndoFree Plasmid Giga Kit (Qiagen NV, Venlo, NL) и вводили путем инъекции мышам C57BL/6. Использовали пять животных на группу, которым вводили 100 мкг каждой плазмиды, четыре раза с 3-недельными интервалами.
Ответы анти-gp41 IgG в зависимости от времени (измеренные с использованием MIN антигена) показали специфическую иммуногенность исключительно в pVaxMINGAGcop-иммунизированной группе. См. Фиг. 8. Наоборот, анти-p24-Gag IgG были обнаружены у животных, иммунизированных pVAXGAGcop и pVaxMINGAGcop. См. Фиг. 8. Взятые вместе, эти данные показывают, что ДНК вакцинация индуцирует экспрессию GAG и MINGAG in vivo, способную вызывать гуморальный ответ.
Пример 7
Линкерные последовательности являются важными для антигенности
Общая структура слитых белков в соответствии с изобретением включает небольшую линкерную область между TM и GAG последовательностями. Оценивали, влияют ли изменения в этой небольшой линкерной последовательности на экспрессию и продукцию VLP. Для этого были получены различные варианты кодон-оптимизированного pcDNA3.1/MINGAGcop, содержащего последовательности GGGS (SEQ ID: 12), никакого линкера, линкер аланин/глутаминовая кислота и лизин (SEQ ID NO:27) или линкер аланин/пролин (SEQ ID NO: 28). См. Фиг. 9. Результаты показывают, что на экспрессию трех различных эпитопов gp41 на поверхности (определяемая антителами 2F5, 4E10 и 10E8) оказывала существенное влияние линкерная последовательность. См. Фиг. 9A. Линкер GGGS (G3S) показал наивысший уровень экспрессии 4E10 и 10E8 антигенных сайтов. Интересно то, что никаких существенных эффектов на уровень продукции VLP (как определяли по содержанию GAG в культуральных супернатантах) не наблюдали. См. Фиг. 9B.
Пример 8
TM последовательности являются важными для антигенности и продукции
Подобным образом, анализировали эффект TM последовательности путем замены TM области ВИЧ на:
(a) TM область молекулы CD22 человека (SEQ ID NO: 18),
(b) TM область молекулы CD36 человека (SEQ ID NO: 19),
(c) TM область молекулы CD44 человека (SEQ ID NO: 20) или
(d) R696A мутант Env ВИЧ-1 (SEQ ID NO: 31).
Оценивали экспрессию эпитопов 2F5, 4E10 и 10E8, а также продукцию VLP.
Различные TM последовательности сильно влияли на экспонирование соответствующих эпитопов MPER. По сравнению с TM gp41 дикого типа, последовательности CD22 и CD36 заметно снижали экспрессию антигенных сайтов (преимущественно 4E10 и 10E8 эпитопов), тогда как обе TM CD44 и мутантная TM gp41 последовательности существенно повышали экспонирование эпитопов. Этот эффект, в частности, наблюдали для антигенного сайта 4E10, указывая на то, что последние конструкции предлагают лучшее и более сбалансированное экспонирование MPER, чем конструкция MINGAGcop дикого типа. См. Фиг. 10A.
Кроме того, при оценке продукции VLP и по сравнению с конструкцией MINGAGcop дикого типа, CD22, CD36 и CD44 конструкции не имели никакого эффекта на выход VLP, в то же время более высокий выход наблюдали для мутантной последовательности gp41 TM, продукция которой была в 1,5 раз выше, чем продукция, наблюдаемая для сравнительной MINGAGcop. См. Фиг. 10B.
Пример 9
Самоупаковывающиеся VLP на основе GAG могут содержать встроенные гетерологичные небольшие эпитопы
Чтобы продемонстрировать способность слитых белков MIN/GAG экспонировать различные эпитопы, нейтрализующий эпитоп белка Е2 HCV прививали во внеклеточный фрагмент MIN. 2F5 эпитоп MIN/GAGcop (аминокислоты 655-667 gp41) был заменен пептидом KQNIQLINTNGSWH, соответствующим аминокислотам 408-421 последовательности E2 HCV, для генерирования химерного белка MINHCVGAG. Нуклеотидную последовательность клонировали в вектор pcDNA3.1 и экспрессировали в клетках HEK-293T. Фиг. 11А показывает ко-экспрессию GAG и HCV в трансфицированных клетках, демонстрируя экспонирование эпитопов. Кроме того, gp41 2F5 эпитоп отсутствовал, в то время как 4E10 и 10E8 эпитопы (соответствующие C-концевому фрагменту MPER) были подходящим образом экспонированы. Поэтому VLP на основе MINGAG можно использовать для экспонирования небольших эпитопов с высокой плотностью на их поверхности. Прививка HCV эпитопа на MINGAGcop VLPs не влияла на выход VLP в супернатанте трансфицированных клеток. См. Фиг. 11B.
Пример 10
Универсальность самоупаковывающихся VLP на основе GAG: аккомодация различных сигнальных пептидов, больших антигенов и последовательностей TM
Была продемонстрирована способность внешней иммуногенной части слитого белка на основе GAG к аккомодации антигенов, отличных от ВИЧ. Было выбрано несколько антигенов, относящихся к различным сильно различающимся патологиям:
(i) Внешний белок HCV был выбран в качестве примера вирусной (не-ВИЧ) инфекции. Конструировали мозаичный белок, содержащий несколько фрагментов HCV Е2 последовательностей, включая проксимальную к мембране последовательность гептадных повторов и мутированную HCV Е2 TM область, и сливали с GAG ВИЧ-1 для создания последовательность-оптимизированного слитого белка HCVE2/GAGcop (SEQ ID NO: 33)
(ii) Белок внешней поверхности A (OspA, uniprot P0CL66) бактерии Borrelia burgdorferi (штамм ATCC 35210 / B31 / CIP 102532 / DSM 4680), этиологический агент болезни Лайма. Последовательность сигнального пептида ospA (остатки 1-16) заменяли сигнальным пептидом (Uniprot Q8TDQ0) человеческого иммуноглобулинового Т-клеточного муцинового рецептора TIM-3 и сливали с ospA aa 17-273, эту конструкцию помещали перед CD44 TM для генерирования последовательность-оптимизированного слитого белка ospA/GAGcop (SEQ ID NO: 37)
(iii) Белок человеческого иммуноглобулинового Т-клеточного муцинового рецептора TIM-3 (Uniprot Q8TDQ0). TIM-3 является членом семейства иммунорегуляторов контрольных точек и участвует в Т-клеточном ответе на патогены и опухоли. Внеклеточные и TM области последовательностей TIM_3 человека помещали перед последовательностью GAG для генерирования последовательность-оптимизированного слитого белка TIM-3/GAGcop (SEQ ID NO: 39)
Диаграмма этих конструкций показана на Фиг. 12А. Все три конструкции клонировали в векторы pcDNA3.1 и использовали для трансфекции клеток HEK-293T. Внутриклеточные GAG и экспрессированные на клеточной поверхности иммуногенные последовательности анализировали методом проточной цитометрии. Фиг. 12В показывает, что экспрессия всех выбранных антигенов была сопоставима с экспрессией, наблюдаемой для исходной конструкции MINGAGcop. Фиг. 12C показывает, что продукция всех VLP, несущих различные антигены, аналогична или выше, чем продукция MINGAGcop VLP.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> FUNDACIУN PRIVADA DE INSTITUT DE RECERCA DE LA SIDA-CAIXA
<120> Вирусоподобные частицы с высокоплотным покрытием для индукции
экспресии антител
<130> P13141PC00
<150> EP16382364.4
<151> 2016-07-27
<160> 38
<170> PatentIn version 3.5
<210> 1
<211> 500
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> ПЕПТИД
<222> (1)..(500)
<223> Последовательность полипептида gag ВИЧ (изолят HXB2) (aa)
<400> 1
Met Gly Ala Arg Ala Ser Val Leu Ser Gly Gly Glu Leu Asp Arg Trp
1 5 10 15
Glu Lys Ile Arg Leu Arg Pro Gly Gly Lys Lys Lys Tyr Lys Leu Lys
20 25 30
His Ile Val Trp Ala Ser Arg Glu Leu Glu Arg Phe Ala Val Asn Pro
35 40 45
Gly Leu Leu Glu Thr Ser Glu Gly Cys Arg Gln Ile Leu Gly Gln Leu
50 55 60
Gln Pro Ser Leu Gln Thr Gly Ser Glu Glu Leu Arg Ser Leu Tyr Asn
65 70 75 80
Thr Val Ala Thr Leu Tyr Cys Val His Gln Arg Ile Glu Ile Lys Asp
85 90 95
Thr Lys Glu Ala Leu Asp Lys Ile Glu Glu Glu Gln Asn Lys Ser Lys
100 105 110
Lys Lys Ala Gln Gln Ala Ala Ala Asp Thr Gly His Ser Asn Gln Val
115 120 125
Ser Gln Asn Tyr Pro Ile Val Gln Asn Ile Gln Gly Gln Met Val His
130 135 140
Gln Ala Ile Ser Pro Arg Thr Leu Asn Ala Trp Val Lys Val Val Glu
145 150 155 160
Glu Lys Ala Phe Ser Pro Glu Val Ile Pro Met Phe Ser Ala Leu Ser
165 170 175
Glu Gly Ala Thr Pro Gln Asp Leu Asn Thr Met Leu Asn Thr Val Gly
180 185 190
Gly His Gln Ala Ala Met Gln Met Leu Lys Glu Thr Ile Asn Glu Glu
195 200 205
Ala Ala Glu Trp Asp Arg Val His Pro Val His Ala Gly Pro Ile Ala
210 215 220
Pro Gly Gln Met Arg Glu Pro Arg Gly Ser Asp Ile Ala Gly Thr Thr
225 230 235 240
Ser Thr Leu Gln Glu Gln Ile Gly Trp Met Thr Asn Asn Pro Pro Ile
245 250 255
Pro Val Gly Glu Ile Tyr Lys Arg Trp Ile Ile Leu Gly Leu Asn Lys
260 265 270
Ile Val Arg Met Tyr Ser Pro Thr Ser Ile Leu Asp Ile Arg Gln Gly
275 280 285
Pro Lys Glu Pro Phe Arg Asp Tyr Val Asp Arg Phe Tyr Lys Thr Leu
290 295 300
Arg Ala Glu Gln Ala Ser Gln Glu Val Lys Asn Trp Met Thr Glu Thr
305 310 315 320
Leu Leu Val Gln Asn Ala Asn Pro Asp Cys Lys Thr Ile Leu Lys Ala
325 330 335
Leu Gly Pro Ala Ala Thr Leu Glu Glu Met Met Thr Ala Cys Gln Gly
340 345 350
Val Gly Gly Pro Gly His Lys Ala Arg Val Leu Ala Glu Ala Met Ser
355 360 365
Gln Val Thr Asn Ser Ala Thr Ile Met Met Gln Arg Gly Asn Phe Arg
370 375 380
Asn Gln Arg Lys Ile Val Lys Cys Phe Asn Cys Gly Lys Glu Gly His
385 390 395 400
Thr Ala Arg Asn Cys Arg Ala Pro Arg Lys Lys Gly Cys Trp Lys Cys
405 410 415
Gly Lys Glu Gly His Gln Met Lys Asp Cys Thr Glu Arg Gln Ala Asn
420 425 430
Phe Leu Gly Lys Ile Trp Pro Ser Tyr Lys Gly Arg Pro Gly Asn Phe
435 440 445
Leu Gln Ser Arg Pro Glu Pro Thr Ala Pro Pro Glu Glu Ser Phe Arg
450 455 460
Ser Gly Val Glu Thr Thr Thr Pro Pro Gln Lys Gln Glu Pro Ile Asp
465 470 475 480
Lys Glu Leu Tyr Pro Leu Thr Ser Leu Arg Ser Leu Phe Gly Asn Asp
485 490 495
Pro Ser Ser Gln
500
<210> 2
<211> 358
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> ПЕПТИД
<222> (1)..(358)
<223> Полипептид gag ВИЧ без последовательности миристоилирования (aa)
<400> 2
Met Val His Gln Ala Ile Ser Pro Arg Thr Leu Asn Ala Trp Val Lys
1 5 10 15
Val Val Glu Glu Lys Ala Phe Ser Pro Glu Val Ile Pro Met Phe Ser
20 25 30
Ala Leu Ser Glu Gly Ala Thr Pro Gln Asp Leu Asn Thr Met Leu Asn
35 40 45
Thr Val Gly Gly His Gln Ala Ala Met Gln Met Leu Lys Glu Thr Ile
50 55 60
Asn Glu Glu Ala Ala Glu Trp Asp Arg Val His Pro Val His Ala Gly
65 70 75 80
Pro Ile Ala Pro Gly Gln Met Arg Glu Pro Arg Gly Ser Asp Ile Ala
85 90 95
Gly Thr Thr Ser Thr Leu Gln Glu Gln Ile Gly Trp Met Thr Asn Asn
100 105 110
Pro Pro Ile Pro Val Gly Glu Ile Tyr Lys Arg Trp Ile Ile Leu Gly
115 120 125
Leu Asn Lys Ile Val Arg Met Tyr Ser Pro Thr Ser Ile Leu Asp Ile
130 135 140
Arg Gln Gly Pro Lys Glu Pro Phe Arg Asp Tyr Val Asp Arg Phe Tyr
145 150 155 160
Lys Thr Leu Arg Ala Glu Gln Ala Ser Gln Glu Val Lys Asn Trp Met
165 170 175
Thr Glu Thr Leu Leu Val Gln Asn Ala Asn Pro Asp Cys Lys Thr Ile
180 185 190
Leu Lys Ala Leu Gly Pro Ala Ala Thr Leu Glu Glu Met Met Thr Ala
195 200 205
Cys Gln Gly Val Gly Gly Pro Gly His Lys Ala Arg Val Leu Ala Glu
210 215 220
Ala Met Ser Gln Val Thr Asn Ser Ala Thr Ile Met Met Gln Arg Gly
225 230 235 240
Asn Phe Arg Asn Gln Arg Lys Ile Val Lys Cys Phe Asn Cys Gly Lys
245 250 255
Glu Gly His Thr Ala Arg Asn Cys Arg Ala Pro Arg Lys Lys Gly Cys
260 265 270
Trp Lys Cys Gly Lys Glu Gly His Gln Met Lys Asp Cys Thr Glu Arg
275 280 285
Gln Ala Asn Phe Leu Gly Lys Ile Trp Pro Ser Tyr Lys Gly Arg Pro
290 295 300
Gly Asn Phe Leu Gln Ser Arg Pro Glu Pro Thr Ala Pro Pro Glu Glu
305 310 315 320
Ser Phe Arg Ser Gly Val Glu Thr Thr Thr Pro Pro Gln Lys Gln Glu
325 330 335
Pro Ile Asp Lys Glu Leu Tyr Pro Leu Thr Ser Leu Arg Ser Leu Phe
340 345 350
Gly Asn Asp Pro Ser Ser
355
<210> 3
<211> 1497
<212> ДНК
<213> Вирус иммунодефицита человека
<220>
<221> ген
<222> (1)..(1497)
<223> Gag ВИЧ, кодирующая полипептид gag без
последовательности миристоилирования (nt)
<400> 3
ggtgcgagag cgtcagtatt aagcggggga gaattagatc gatggggaaa aattcggtta
60
aggccagggg gaaagaagaa gtacaagcta aagcacatcg tatgggcaag cagggagcta
120
gaacgattcg cagttaatcc tggcctgtta gaaacatcag aaggctgtag acaaatactg
180
ggacagctac aaccatccct tcagacagga tcagaggagc ttcgatcact atacaacaca
240
gtagcaaccc tctattgtgt gcaccagcgg atcgagatca aggacaccaa ggaagcttta
300
gacaagatag aggaagagca aaacaagtcc aagaagaagg cccagcaggc agcagctgac
360
acaggacaca gcaatcaggt cagccaaaat taccctatag tgcagaacat ccaggggcaa
420
atggtacatc aggccatatc acctagaact ttaaatgcat gggtaaaagt agtagaagag
480
aaggctttca gcccagaagt gatacccatg ttttcagcat tatcagaagg agccacccca
540
caggacctga acacgatgtt gaacaccgtg gggggacatc aagcagccat gcaaatgtta
600
aaagagacca tcaatgagga agctgcagaa tgggatagag tgcatccagt gcatgcaggg
660
cctattgcac caggccagat gagagaacca aggggaagtg acatagcagg aactactagt
720
acccttcagg aacaaatagg atggatgaca aataatccac ctatcccagt aggagagatc
780
tacaagaggt ggataatcct gggattgaac aagatcgtga ggatgtatag ccctaccagc
840
attctggaca taagacaagg accaaaagaa ccctttagag actatgtaga ccggttctat
900
aaaactctaa gagctgagca agcttcacag gaggtaaaaa attggatgac agaaaccttg
960
ttggtccaaa atgcgaaccc agattgtaag accatcctga aggctctcgg cccagcggct
1020
acactagaag aaatgatgac agcatgtcag ggagtaggag gacccggcca taaggcaaga
1080
gttttggctg aagcaatgag ccaagtaaca aattcagcta ccataatgat gcagagaggc
1140
aattttagga accaaagaaa gattgttaag tgtttcaatt gtggcaaaga agggcacaca
1200
gccagaaatt gcagggcccc taggaaaaag ggctgttgga aatgtggaaa ggaaggacac
1260
caaatgaaag attgtactga gagacaggct aattttttag ggaagatctg gccttcctac
1320
aagggaaggc cagggaattt tcttcagagc agaccagagc caacagcccc accagaagag
1380
agcttcaggt ctggggtaga gacaacaact ccccctcaga agcaggagcc gatagacaag
1440
gaactgtatc ctttaacttc cctcagatca ctctttggca acgacccctc gtcacaa
1497
<210> 4
<211> 263
<212> ДНК
<213> Вирус иммунодефицита человека
<220>
<221> ген
<222> (1)..(263)
<223> Вариант gp41 белка Min (HR2+ MPER+TM) (nt)
<400> 4
atgatttgga ataacatgac ctggatggag tgggacagag aaattaacaa ttacacaagc
60
ttaatacact ccttaattga agaatcgcaa aaccagcaag aaaagaatga acaagaatta
120
ttggaattag ataaatgggc aagtttgtgg aattggttta acataacaaa ttggctgtgg
180
tacataaaat tattcataat gatagtagga ggcttggtag gtttaagaat agtttttgct
240
gtactttcta tagtgaatag agc
263
<210> 5
<211> 87
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> ПЕПТИД
<222> (1)..(87)
<223> Вариант gp41 (aa)
<400> 5
Met Ile Trp Asn Asn Met Thr Trp Met Glu Trp Asp Arg Glu Ile Asn
1 5 10 15
Asn Tyr Thr Ser Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln
20 25 30
Gln Glu Lys Asn Glu Gln Glu Leu Leu Glu Leu Asp Lys Trp Ala Ser
35 40 45
Leu Trp Asn Trp Phe Asn Ile Thr Asn Trp Leu Trp Tyr Ile Lys Leu
50 55 60
Phe Ile Met Ile Val Gly Gly Leu Val Gly Leu Arg Ile Val Phe Ala
65 70 75 80
Val Leu Ser Ile Val Asn Arg
85
<210> 6
<211> 12
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(12)
<223> Глициновый линкер (nt)
<400> 6
ggtggcggtg gc
12
<210> 7
<211> 27
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(27)
<223> Частичный полилинкер, происходящий из
pcDNA™3.1D/V5-His-TOPO® (Invitrogen) (nt)
<400> 7
aagggtcaag acaattctgc agatatc
27
<210> 8
<211> 108
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(108)
<223> Векторная последовательность,
включающая V5-эпитоп, 6xHis метку и стоп-кодон (nt)
<400> 8
ggcggccgct cgagtctaga gggcccgcgg ttcgaaggta agcctatccc taaccctctc
60
ctcggtctcg attctacgcg taccggtcat catcaccatc accattga
108
<210> 9
<211> 1908
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(1908)
<223> MINGAG3.7 слитый белок (nt)
<400> 9
atgatttgga ataacatgac ctggatggag tgggacagag aaattaacaa ttacacaagc
60
ttaatacact ccttaattga agaatcgcaa aaccagcaag aaaagaatga acaagaatta
120
ttggaattag ataaatgggc aagtttgtgg aattggttta acataacaaa ttggctgtgg
180
tacataaaat tattcataat gatagtagga ggcttggtag gtttaagaat agtttttgct
240
gtactttcta tagtgaatag agctggtggc ggtggcaagg gtcaagacaa ttctgcagat
300
atcggtgcga gagcgtcagt attaagcggg ggagaattag atcgatgggg aaaaattcgg
360
ttaaggccag ggggaaagaa gaagtacaag ctaaagcaca tcgtatgggc aagcagggag
420
ctagaacgat tcgcagttaa tcctggcctg ttagaaacat cagaaggctg tagacaaata
480
ctgggacagc tacaaccatc ccttcagaca ggatcagagg agcttcgatc actatacaac
540
acagtagcaa ccctctattg tgtgcaccag cggatcgaga tcaaggacac caaggaagct
600
ttagacaaga tagaggaaga gcaaaacaag tccaagaaga aggcccagca ggcagcagct
660
gacacaggac acagcaatca ggtcagccaa aattacccta tagtgcagaa catccagggg
720
caaatggtac atcaggccat atcacctaga actttaaatg catgggtaaa agtagtagaa
780
gagaaggctt tcagcccaga agtgataccc atgttttcag cattatcaga aggagccacc
840
ccacaggacc tgaacacgat gttgaacacc gtggggggac atcaagcagc catgcaaatg
900
ttaaaagaga ccatcaatga ggaagctgca gaatgggata gagtgcatcc agtgcatgca
960
gggcctattg caccaggcca gatgagagaa ccaaggggaa gtgacatagc aggaactact
1020
agtacccttc aggaacaaat aggatggatg acaaataatc cacctatccc agtaggagag
1080
atctacaaga ggtggataat cctgggattg aacaagatcg tgaggatgta tagccctacc
1140
agcattctgg acataagaca aggaccaaaa gaacccttta gagactatgt agaccggttc
1200
tataaaactc taagagctga gcaagcttca caggaggtaa aaaattggat gacagaaacc
1260
ttgttggtcc aaaatgcgaa cccagattgt aagaccatcc tgaaggctct cggcccagcg
1320
gctacactag aagaaatgat gacagcatgt cagggagtag gaggacccgg ccataaggca
1380
agagttttgg ctgaagcaat gagccaagta acaaattcag ctaccataat gatgcagaga
1440
ggcaatttta ggaaccaaag aaagattgtt aagtgtttca attgtggcaa agaagggcac
1500
acagccagaa attgcagggc ccctaggaaa aagggctgtt ggaaatgtgg aaaggaagga
1560
caccaaatga aagattgtac tgagagacag gctaattttt tagggaagat ctggccttcc
1620
tacaagggaa ggccagggaa ttttcttcag agcagaccag agccaacagc cccaccagaa
1680
gagagcttca ggtctggggt agagacaaca actccccctc agaagcagga gccgatagac
1740
aaggaactgt atcctttaac ttccctcaga tcactctttg gcaacgaccc ctcgtcacaa
1800
ggcggccgct cgagtctaga gggcccgcgg ttcgaaggta agcctatccc taaccctctc
1860
ctcggtctcg attctacgcg taccggtcat catcaccatc accattga
1908
<210> 10
<211> 50
<212> ДНК
<213> Homo sapiens
<220>
<221> sig_пептид
<222> (1)..(50)
<223> GM-CSF сигнальный пептид (nt)
<400> 10
atgtggctgc agtctctgct gctgctgggc accgtggcct gcagcatcag
50
<210> 11
<211> 259
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(259)
<223> Кодон-оптимизированный MIN белок (nt)
<400> 11
catctggaac cacaccacct ggatggaatg ggacagagag atcaacaact acaccagcct
60
gatccactcc ctgatcgagg aaagccagaa ccagcaggaa aagaacgaac aggaactgct
120
ggaactggac aagtgggcca gcctgtggaa ctggttcaac atcaccaact ggctgtggta
180
catcaagctg ttcatcatga tcgtgggcgg cctcgtgggc ctgagaatcg tgtttgccgt
240
gctgagcatc gtgaaccgg
259
<210> 12
<211> 15
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(15)
<223> GS линкер
<400> 12
ggaggcggag gatcc
15
<210> 13
<211> 1497
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(1497)
<223> Кодон-оптимизированный GAGHXB2 cop (nt)
<400> 13
ggcgctagag cttctgtgct gtctgggggc gaactggata gatgggagaa gatccggctg
60
cggcctggcg gcaagaagaa gtacaagctg aagcacatcg tgtgggcctc cagagagctg
120
gaaagattcg ccgtgaaccc cggcctgctg gaaaccagcg agggctgcag acagatcctg
180
ggacagctgc agcccagcct gcagaccgga agcgaggaac tgcggagcct gtacaacacc
240
gtggccacac tgtattgcgt gcaccagcgg atcgagatca aggacaccaa agaggccctg
300
gacaagatcg aggaagaaca gaacaagtct aagaagaagg cccagcaggc tgccgccgat
360
accggccact ctaatcaggt gtcccagaac taccccatcg tgcagaacat ccagggccag
420
atggtgcatc aggccatcag ccccagaacc ctgaacgcct gggtcaaggt ggtggaagag
480
aaggccttta gccccgaagt gatccccatg ttcagcgccc tgtctgaggg cgccacaccc
540
caggacctga acaccatgct gaacacagtg ggcggacacc aggccgccat gcagatgctg
600
aaagagacaa tcaacgaaga ggccgccgag tgggacagag tgcaccctgt gcatgccgga
660
cctatcgccc ctggccagat gagagagccc agaggctctg atatcgccgg caccaccagc
720
accctgcagg aacagatcgg ctggatgacc aacaaccccc ccatccccgt gggcgagatc
780
tacaagcggt ggatcatcct gggcctgaac aagattgtgc ggatgtacag ccccacctcc
840
atcctggaca tccggcaggg ccccaaagag cccttcagag actacgtgga ccggttctac
900
aagaccctga gagccgagca ggccagccag gaagtgaaga attggatgac cgagacactg
960
ctggtgcaga acgccaaccc cgactgcaag accatcctga aggccctggg acctgccgcc
1020
accctggaag agatgatgac agcctgtcag ggcgtgggag gcccaggcca caaagctaga
1080
gtgctggccg aggccatgag ccaagtgacc aactccgcca ccattatgat gcagcggggc
1140
aacttccgga accagcggaa gatcgtgaag tgcttcaact gcggcaaaga gggccacacc
1200
gcccggaatt gcagagcccc cagaaagaaa ggctgctgga agtgtggaaa agaggggcac
1260
cagatgaagg actgcaccga gcggcaggcc aacttcctgg gcaagatctg gcctagctac
1320
aagggcagac ccggcaattt cctgcagagc agacccgagc ctaccgcccc tcccgaggaa
1380
agctttagaa gcggcgtgga aaccaccacc cccccacaga agcaggaacc catcgacaaa
1440
gagctgtacc ccctgaccag cctgagaagc ctgttcggca acgaccccag cagccag
1497
<210> 14
<211> 1827
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(1827)
<223> MINGAGHXB2 cop (nt)
<400> 14
atgtggctgc agtctctgct gctgctgggc accgtggcct gcagcatcag catctggaac
60
cacaccacct ggatggaatg ggacagagag atcaacaact acaccagcct gatccactcc
120
ctgatcgagg aaagccagaa ccagcaggaa aagaacgaac aggaactgct ggaactggac
180
aagtgggcca gcctgtggaa ctggttcaac atcaccaact ggctgtggta catcaagctg
240
ttcatcatga tcgtgggcgg cctcgtgggc ctgagaatcg tgtttgccgt gctgagcatc
300
gtgaaccggg gaggcggagg atccggcgcg cgcgcgagcg tgctgagcgg cggcgaactg
360
gatcgctggg aaaaaattcg cctgcgcccg ggcggcaaaa aaaaatataa actgaaacat
420
attgtgtggg cgagccgcga actggaacgc tttgcggtga acccgggcct gctggaaacc
480
agcgaaggct gccgccagat tctgggccag ctgcagccga gcctgcagac cggcagcgaa
540
gaactgcgca gcctgtataa caccgtggcg accctgtatt gcgtgcatca gcgcattgaa
600
attaaagata ccaaagaagc gctggataaa attgaagaag aacagaacaa aagcaaaaaa
660
aaagcgcagc aggcggcggc ggataccggc catagcaacc aggtgagcca gaactatccg
720
attgtgcaga acattcaggg ccagatggtg catcaggcga ttagcccgcg caccctgaac
780
gcgtgggtga aagtggtgga agaaaaagcg tttagcccgg aagtgattcc gatgtttagc
840
gcgctgagcg aaggcgcgac cccgcaggat ctgaacacca tgctgaacac cgtgggcggc
900
catcaggcgg cgatgcagat gctgaaagaa accattaacg aagaagcggc ggaatgggat
960
cgcgtgcatc cggtgcatgc gggcccgatt gcgccgggcc agatgcgcga accgcgcggc
1020
agcgatattg cgggcaccac cagcaccctg caggaacaga ttggctggat gaccaacaac
1080
ccgccgattc cggtgggcga aatttataaa cgctggatta ttctgggcct gaacaaaatt
1140
gtgcgcatgt atagcccgac cagcattctg gatattcgcc agggcccgaa agaaccgttt
1200
cgcgattatg tggatcgctt ttataaaacc ctgcgcgcgg aacaggcgag ccaggaagtg
1260
aaaaactgga tgaccgaaac cctgctggtg cagaacgcga acccggattg caaaaccatt
1320
ctgaaagcgc tgggcccggc ggcgaccctg gaagaaatga tgaccgcgtg ccagggcgtg
1380
ggcggcccgg gccataaagc gcgcgtgctg gcggaagcga tgagccaggt gaccaacagc
1440
gcgaccatta tgatgcagcg cggcaacttt cgcaaccagc gcaaaattgt gaaatgcttt
1500
aactgcggca aagaaggcca taccgcgcgc aactgccgcg cgccgcgcaa aaaaggctgc
1560
tggaaatgcg gcaaagaagg ccatcagatg aaagattgca ccgaacgcca ggcgaacttt
1620
ctgggcaaaa tttggccgag ctataaaggc cgcccgggca actttctgca gagccgcccg
1680
gaaccgaccg cgccgccgga agaaagcttt cgcagcggcg tggaaaccac caccccgccg
1740
cagaaacagg aaccgattga taaagaactg tatccgctga ccagcctgcg cagcctgttt
1800
ggcaacgatc cgagcagcca gtgatga
1827
<210> 15
<211> 173
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> ПЕПТИД
<222> (1)..(173)
<223> gp41 внеклеточная область (aa)
<400> 15
Ala Val Gly Ile Gly Ala Leu Phe Leu Gly Phe Leu Gly Ala Ala Gly
1 5 10 15
Ser Thr Met Gly Ala Ala Ser Met Thr Leu Thr Val Gln Ala Arg Gln
20 25 30
Leu Leu Ser Gly Ile Val Gln Gln Gln Asn Asn Leu Leu Arg Ala Ile
35 40 45
Glu Ala Gln Gln His Leu Leu Gln Leu Thr Val Trp Gly Ile Lys Gln
50 55 60
Leu Gln Ala Arg Ile Leu Ala Val Glu Arg Tyr Leu Lys Asp Gln Gln
65 70 75 80
Leu Leu Gly Ile Trp Gly Cys Ser Gly Lys Leu Ile Cys Thr Thr Ala
85 90 95
Val Pro Trp Asn Ala Ser Trp Ser Asn Lys Ser Leu Glu Gln Ile Trp
100 105 110
Asn His Thr Thr Trp Met Glu Trp Asp Arg Glu Ile Asn Asn Tyr Thr
115 120 125
Ser Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln Gln Glu Lys
130 135 140
Asn Glu Gln Glu Leu Leu Glu Leu Asp Lys Trp Ala Ser Leu Trp Asn
145 150 155 160
Trp Phe Asn Ile Thr Asn Trp Leu Trp Tyr Ile Lys Leu
165 170
<210> 16
<211> 23
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> TRANSMEM
<222> (1)..(23)
<223> gp41 трансмембранная последовательность (aa)
<400> 16
Trp Leu Trp Tyr Ile Lys Leu Phe Ile Met Ile Val Gly Gly Leu Val
1 5 10 15
Gly Leu Arg Ile Val Phe Ala
20
<210> 17
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> TRANSMEM
<222> (1)..(19)
<223> CD22 трансмембранная последовательность (aa)
<400> 17
Val Ala Val Gly Leu Gly Ser Cys Leu Ala Ile Leu Ile Leu Ala Ile
1 5 10 15
Cys Gly Leu
<210> 18
<211> 22
<212> Белок
<213> Homo sapiens
<220>
<221> TRANSMEM
<222> (1)..(22)
<223> CD36 трансмембранная последовательность
<400> 18
Leu Leu Gly Leu Ile Glu Met Ile Leu Leu Ser Val Gly Val Val Met
1 5 10 15
Phe Val Ala Phe Met Ile
20
<210> 19
<211> 21
<212> Белок
<213> Homo sapiens
<220>
<221> TRANSMEM
<222> (1)..(21)
<223> CD44 трансмембранная последовательность (aa)
<400> 19
Trp Leu Ile Ile Leu Ala Ser Leu Leu Ala Leu Ala Leu Ile Leu Ala
1 5 10 15
Val Cys Ile Ala Val
20
<210> 20
<211> 856
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> ПЕПТИД
<222> (1)..(856)
<223> Env белок gp160 ВИЧ (изолят HXB2) (aa)
<400> 20
Met Arg Val Lys Glu Lys Tyr Gln His Leu Trp Arg Trp Gly Trp Arg
1 5 10 15
Trp Gly Thr Met Leu Leu Gly Met Leu Met Ile Cys Ser Ala Thr Glu
20 25 30
Lys Leu Trp Val Thr Val Tyr Tyr Gly Val Pro Val Trp Lys Glu Ala
35 40 45
Thr Thr Thr Leu Phe Cys Ala Ser Asp Ala Lys Ala Tyr Asp Thr Glu
50 55 60
Val His Asn Val Trp Ala Thr His Ala Cys Val Pro Thr Asp Pro Asn
65 70 75 80
Pro Gln Glu Val Val Leu Val Asn Val Thr Glu Asn Phe Asn Met Trp
85 90 95
Lys Asn Asp Met Val Glu Gln Met His Glu Asp Ile Ile Ser Leu Trp
100 105 110
Asp Gln Ser Leu Lys Pro Cys Val Lys Leu Thr Pro Leu Cys Val Ser
115 120 125
Leu Lys Cys Thr Asp Leu Lys Asn Asp Thr Asn Thr Asn Ser Ser Ser
130 135 140
Gly Arg Met Ile Met Glu Lys Gly Glu Ile Lys Asn Cys Ser Phe Asn
145 150 155 160
Ile Ser Thr Ser Ile Arg Gly Lys Val Gln Lys Glu Tyr Ala Phe Phe
165 170 175
Tyr Lys Leu Asp Ile Ile Pro Ile Asp Asn Asp Thr Thr Ser Tyr Lys
180 185 190
Leu Thr Ser Cys Asn Thr Ser Val Ile Thr Gln Ala Cys Pro Lys Val
195 200 205
Ser Phe Glu Pro Ile Pro Ile His Tyr Cys Ala Pro Ala Gly Phe Ala
210 215 220
Ile Leu Lys Cys Asn Asn Lys Thr Phe Asn Gly Thr Gly Pro Cys Thr
225 230 235 240
Asn Val Ser Thr Val Gln Cys Thr His Gly Ile Arg Pro Val Val Ser
245 250 255
Thr Gln Leu Leu Leu Asn Gly Ser Leu Ala Glu Glu Glu Val Val Ile
260 265 270
Arg Ser Val Asn Phe Thr Asp Asn Ala Lys Thr Ile Ile Val Gln Leu
275 280 285
Asn Thr Ser Val Glu Ile Asn Cys Thr Arg Pro Asn Asn Asn Thr Arg
290 295 300
Lys Arg Ile Arg Ile Gln Arg Gly Pro Gly Arg Ala Phe Val Thr Ile
305 310 315 320
Gly Lys Ile Gly Asn Met Arg Gln Ala His Cys Asn Ile Ser Arg Ala
325 330 335
Lys Trp Asn Asn Thr Leu Lys Gln Ile Ala Ser Lys Leu Arg Glu Gln
340 345 350
Phe Gly Asn Asn Lys Thr Ile Ile Phe Lys Gln Ser Ser Gly Gly Asp
355 360 365
Pro Glu Ile Val Thr His Ser Phe Asn Cys Gly Gly Glu Phe Phe Tyr
370 375 380
Cys Asn Ser Thr Gln Leu Phe Asn Ser Thr Trp Phe Asn Ser Thr Trp
385 390 395 400
Ser Thr Glu Gly Ser Asn Asn Thr Glu Gly Ser Asp Thr Ile Thr Leu
405 410 415
Pro Cys Arg Ile Lys Gln Ile Ile Asn Met Trp Gln Lys Val Gly Lys
420 425 430
Ala Met Tyr Ala Pro Pro Ile Ser Gly Gln Ile Arg Cys Ser Ser Asn
435 440 445
Ile Thr Gly Leu Leu Leu Thr Arg Asp Gly Gly Asn Ser Asn Asn Glu
450 455 460
Ser Glu Ile Phe Arg Pro Gly Gly Gly Asp Met Arg Asp Asn Trp Arg
465 470 475 480
Ser Glu Leu Tyr Lys Tyr Lys Val Val Lys Ile Glu Pro Leu Gly Val
485 490 495
Ala Pro Thr Lys Ala Lys Arg Arg Val Val Gln Arg Glu Lys Arg Ala
500 505 510
Val Gly Ile Gly Ala Leu Phe Leu Gly Phe Leu Gly Ala Ala Gly Ser
515 520 525
Thr Met Gly Ala Ala Ser Met Thr Leu Thr Val Gln Ala Arg Gln Leu
530 535 540
Leu Ser Gly Ile Val Gln Gln Gln Asn Asn Leu Leu Arg Ala Ile Glu
545 550 555 560
Ala Gln Gln His Leu Leu Gln Leu Thr Val Trp Gly Ile Lys Gln Leu
565 570 575
Gln Ala Arg Ile Leu Ala Val Glu Arg Tyr Leu Lys Asp Gln Gln Leu
580 585 590
Leu Gly Ile Trp Gly Cys Ser Gly Lys Leu Ile Cys Thr Thr Ala Val
595 600 605
Pro Trp Asn Ala Ser Trp Ser Asn Lys Ser Leu Glu Gln Ile Trp Asn
610 615 620
His Thr Thr Trp Met Glu Trp Asp Arg Glu Ile Asn Asn Tyr Thr Ser
625 630 635 640
Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln Gln Glu Lys Asn
645 650 655
Glu Gln Glu Leu Leu Glu Leu Asp Lys Trp Ala Ser Leu Trp Asn Trp
660 665 670
Phe Asn Ile Thr Asn Trp Leu Trp Tyr Ile Lys Leu Phe Ile Met Ile
675 680 685
Val Gly Gly Leu Val Gly Leu Arg Ile Val Phe Ala Val Leu Ser Ile
690 695 700
Val Asn Arg Val Arg Gln Gly Tyr Ser Pro Leu Ser Phe Gln Thr His
705 710 715 720
Leu Pro Thr Pro Arg Gly Pro Asp Arg Pro Glu Gly Ile Glu Glu Glu
725 730 735
Gly Gly Glu Arg Asp Arg Asp Arg Ser Ile Arg Leu Val Asn Gly Ser
740 745 750
Leu Ala Leu Ile Trp Asp Asp Leu Arg Ser Leu Cys Leu Phe Ser Tyr
755 760 765
His Arg Leu Arg Asp Leu Leu Leu Ile Val Thr Arg Ile Val Glu Leu
770 775 780
Leu Gly Arg Arg Gly Trp Glu Ala Leu Lys Tyr Trp Trp Asn Leu Leu
785 790 795 800
Gln Tyr Trp Ser Gln Glu Leu Lys Asn Ser Ala Val Ser Leu Leu Asn
805 810 815
Ala Thr Ala Ile Ala Val Ala Glu Gly Thr Asp Arg Val Ile Glu Val
820 825 830
Val Gln Gly Ala Cys Arg Ala Ile Arg His Ile Pro Arg Arg Ile Arg
835 840 845
Gln Gly Leu Glu Arg Ile Leu Leu
850 855
<210> 21
<211> 41
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> ПЕПТИД
<222> (1)..(41)
<223> HR2 область (aa)
<400> 21
Met Ile Trp Asn Asn Met Thr Trp Met Glu Trp Asp Arg Glu Ile Asn
1 5 10 15
Asn Tyr Thr Ser Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln
20 25 30
Gln Glu Lys Asn Glu Gln Glu Leu Leu
35 40
<210> 22
<211> 22
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> MPER область (aa)
<400> 22
Glu Leu Asp Lys Trp Ala Ser Leu Trp Asn Trp Phe Asn Ile Thr Asn
1 5 10 15
Trp Leu Trp Tyr Ile Lys
20
<210> 23
<211> 4
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(4)
<223> GS линкер (aa)
<400> 23
Gly Gly Gly Ser
1
<210> 24
<211> 13
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> Линкер (aa)
<400> 24
Gly Gly Gly Gly Lys Gly Gln Asp Asn Ser Ala Asp Ile
1 5 10
<210> 25
<211> 12
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> Линкер (aa)
<400> 25
Gly Ser Ala Gly Ser Ala Ala Gly Ser Gly Glu Phe
1 5 10
<210> 26
<211> 7
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(7)
<223> Линкер (aa)
<400> 26
Ala Glu Ala Ala Ala Lys Ala
1 5
<210> 27
<211> 7
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(7)
<223> Линкер (aa)
<400> 27
Ala Pro Ala Pro Ala Pro Ala
1 5
<210> 28
<211> 635
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(635)
<223> MINGAG3.7 слитый белок (aa)
<400> 28
Met Ile Trp Asn Asn Met Thr Trp Met Glu Trp Asp Arg Glu Ile Asn
1 5 10 15
Asn Tyr Thr Ser Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln
20 25 30
Gln Glu Lys Asn Glu Gln Glu Leu Leu Glu Leu Asp Lys Trp Ala Ser
35 40 45
Leu Trp Asn Trp Phe Asn Ile Thr Asn Trp Leu Trp Tyr Ile Lys Leu
50 55 60
Phe Ile Met Ile Val Gly Gly Leu Val Gly Leu Arg Ile Val Phe Ala
65 70 75 80
Val Leu Ser Ile Val Asn Arg Ala Gly Gly Gly Gly Lys Gly Gln Asp
85 90 95
Asn Ser Ala Asp Ile Gly Ala Arg Ala Ser Val Leu Ser Gly Gly Glu
100 105 110
Leu Asp Arg Trp Gly Lys Ile Arg Leu Arg Pro Gly Gly Lys Lys Lys
115 120 125
Tyr Lys Leu Lys His Ile Val Trp Ala Ser Arg Glu Leu Glu Arg Phe
130 135 140
Ala Val Asn Pro Gly Leu Leu Glu Thr Ser Glu Gly Cys Arg Gln Ile
145 150 155 160
Leu Gly Gln Leu Gln Pro Ser Leu Gln Thr Gly Ser Glu Glu Leu Arg
165 170 175
Ser Leu Tyr Asn Thr Val Ala Thr Leu Tyr Cys Val His Gln Arg Ile
180 185 190
Glu Ile Lys Asp Thr Lys Glu Ala Leu Asp Lys Ile Glu Glu Glu Gln
195 200 205
Asn Lys Ser Lys Lys Lys Ala Gln Gln Ala Ala Ala Asp Thr Gly His
210 215 220
Ser Asn Gln Val Ser Gln Asn Tyr Pro Ile Val Gln Asn Ile Gln Gly
225 230 235 240
Gln Met Val His Gln Ala Ile Ser Pro Arg Thr Leu Asn Ala Trp Val
245 250 255
Lys Val Val Glu Glu Lys Ala Phe Ser Pro Glu Val Ile Pro Met Phe
260 265 270
Ser Ala Leu Ser Glu Gly Ala Thr Pro Gln Asp Leu Asn Thr Met Leu
275 280 285
Asn Thr Val Gly Gly His Gln Ala Ala Met Gln Met Leu Lys Glu Thr
290 295 300
Ile Asn Glu Glu Ala Ala Glu Trp Asp Arg Val His Pro Val His Ala
305 310 315 320
Gly Pro Ile Ala Pro Gly Gln Met Arg Glu Pro Arg Gly Ser Asp Ile
325 330 335
Ala Gly Thr Thr Ser Thr Leu Gln Glu Gln Ile Gly Trp Met Thr Asn
340 345 350
Asn Pro Pro Ile Pro Val Gly Glu Ile Tyr Lys Arg Trp Ile Ile Leu
355 360 365
Gly Leu Asn Lys Ile Val Arg Met Tyr Ser Pro Thr Ser Ile Leu Asp
370 375 380
Ile Arg Gln Gly Pro Lys Glu Pro Phe Arg Asp Tyr Val Asp Arg Phe
385 390 395 400
Tyr Lys Thr Leu Arg Ala Glu Gln Ala Ser Gln Glu Val Lys Asn Trp
405 410 415
Met Thr Glu Thr Leu Leu Val Gln Asn Ala Asn Pro Asp Cys Lys Thr
420 425 430
Ile Leu Lys Ala Leu Gly Pro Ala Ala Thr Leu Glu Glu Met Met Thr
435 440 445
Ala Cys Gln Gly Val Gly Gly Pro Gly His Lys Ala Arg Val Leu Ala
450 455 460
Glu Ala Met Ser Gln Val Thr Asn Ser Ala Thr Ile Met Met Gln Arg
465 470 475 480
Gly Asn Phe Arg Asn Gln Arg Lys Ile Val Lys Cys Phe Asn Cys Gly
485 490 495
Lys Glu Gly His Thr Ala Arg Asn Cys Arg Ala Pro Arg Lys Lys Gly
500 505 510
Cys Trp Lys Cys Gly Lys Glu Gly His Gln Met Lys Asp Cys Thr Glu
515 520 525
Arg Gln Ala Asn Phe Leu Gly Lys Ile Trp Pro Ser Tyr Lys Gly Arg
530 535 540
Pro Gly Asn Phe Leu Gln Ser Arg Pro Glu Pro Thr Ala Pro Pro Glu
545 550 555 560
Glu Ser Phe Arg Ser Gly Val Glu Thr Thr Thr Pro Pro Gln Lys Gln
565 570 575
Glu Pro Ile Asp Lys Glu Leu Tyr Pro Leu Thr Ser Leu Arg Ser Leu
580 585 590
Phe Gly Asn Asp Pro Ser Ser Gln Gly Gly Arg Ser Ser Leu Glu Gly
595 600 605
Pro Arg Phe Glu Gly Lys Pro Ile Pro Asn Pro Leu Leu Gly Leu Asp
610 615 620
Ser Thr Arg Thr Gly His His His His His His
625 630 635
<210> 29
<211> 72
<212> ДНК
<213> Вирус иммунодефицита человека
<220>
<221> ген
<222> (1)..(72)
<223> Мутантный трансмембранный домен R696A ВИЧ (nt)
<400> 29
ctgttcatca tgatcgtcgg cggcctcgtt ggactggcca ttgtgtttgc cgtgctgagc
60
atcgtgaaca ga
72
<210> 30
<211> 24
<212> Белок
<213> Вирус иммунодефицита человека
<220>
<221> TRANSMEM
<222> (1)..(24)
<223> Мутантный трансмембранный домен R696A ВИЧ (aa)
<400> 30
Leu Phe Ile Met Ile Val Gly Gly Leu Val Gly Leu Ala Ile Val Phe
1 5 10 15
Ala Val Leu Ser Ile Val Asn Arg
20
<210> 31
<211> 1830
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(1830)
<223> HCV привитый слитый белок MINGAG (включающий
HR2 область gp41 ВИЧ, нейтрализующий HCV эпитоп XX,
c-концевой фрагмент MPER gp41 ВИЧ TM gp41 ВИЧ, GGGGS
линкер и GAG последовательность без сигнала миристоилирования
(nt)
<400> 31
atgtggctgc aatctctgct gctgctgggc acagtggcct gcagcatcag catctggaat
60
cacaccacct ggatggaatg ggaccgcgag atcaacaact acaccagcct gatccacagc
120
ctgattgagg aaagccagaa ccagcaagag aagcagaaca tccagctgat caacaccaac
180
ggcagctggc acagcctgtg gaactggttc aacatcacca actggctgtg gtacatcaag
240
ctgttcatca tgatcgtcgg cggcctcgtg ggcctgagaa ttgtgtttgc cgtgctgagc
300
atcgtgaaca gaggtggcgg aggatccggc gctagagctt ctgtgctgtc tgggggcgaa
360
ctggatagat gggagaagat ccggctgcgg cctggcggca agaagaagta caagctgaag
420
cacatcgtgt gggcctccag agagctggaa agattcgccg tgaaccccgg cctgctggaa
480
accagcgagg gctgcagaca gatcctggga cagctgcagc ccagcctgca gaccggaagc
540
gaggaactgc ggagcctgta caacaccgtg gccacactgt attgcgtgca ccagcggatc
600
gagatcaagg acaccaaaga ggccctggac aagatcgagg aagaacagaa caagtctaag
660
aagaaggccc agcaggctgc cgccgatacc ggccactcta atcaggtgtc ccagaactac
720
cccatcgtgc agaacatcca gggccagatg gtgcatcagg ccatcagccc cagaaccctg
780
aacgcctggg tcaaggtggt ggaagagaag gcctttagcc ccgaagtgat ccccatgttc
840
agcgccctgt ctgagggcgc cacaccccag gacctgaaca ccatgctgaa cacagtgggc
900
ggacaccagg ccgccatgca gatgctgaaa gagacaatca acgaagaggc cgccgagtgg
960
gacagagtgc accctgtgca tgccggacct atcgcccctg gccagatgag agagcccaga
1020
ggctctgata tcgccggcac caccagcacc ctgcaggaac agatcggctg gatgaccaac
1080
aaccccccca tccccgtggg cgagatctac aagcggtgga tcatcctggg cctgaacaag
1140
attgtgcgga tgtacagccc cacctccatc ctggacatcc ggcagggccc caaagagccc
1200
ttcagagact acgtggaccg gttctacaag accctgagag ccgagcaggc cagccaggaa
1260
gtgaagaatt ggatgaccga gacactgctg gtgcagaacg ccaaccccga ctgcaagacc
1320
atcctgaagg ccctgggacc tgccgccacc ctggaagaga tgatgacagc ctgtcagggc
1380
gtgggaggcc caggccacaa agctagagtg ctggccgagg ccatgagcca agtgaccaac
1440
tccgccacca ttatgatgca gcggggcaac ttccggaacc agcggaagat cgtgaagtgc
1500
ttcaactgcg gcaaagaggg ccacaccgcc cggaattgca gagcccccag aaagaaaggc
1560
tgctggaagt gtggaaaaga ggggcaccag atgaaggact gcaccgagcg gcaggccaac
1620
ttcctgggca agatctggcc tagctacaag ggcagacccg gcaatttcct gcagagcaga
1680
cccgagccta ccgcccctcc cgaggaaagc tttagaagcg gcgtggaaac caccaccccc
1740
ccacagaagc aggaacccat cgacaaagag ctgtaccccc tgaccagcct gagaagcctg
1800
ttcggcaacg accccagcag ccagtgatga
1830
<210> 32
<211> 608
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(608)
<223> HCV привитый слитый белок MINGAG (включающий
HR2 область gp41 ВИЧ, нейтрализующий HCV эпитоп XX,
c-концевой фрагмент MPER gp41 ВИЧ TM gp41 ВИЧ, GGGGS линкер и
GAG последовательность без сигнала миристоилирования (aa)
<400> 32
Met Trp Leu Gln Ser Leu Leu Leu Leu Gly Thr Val Ala Cys Ser Ile
1 5 10 15
Ser Ile Trp Asn His Thr Thr Trp Met Glu Trp Asp Arg Glu Ile Asn
20 25 30
Asn Tyr Thr Ser Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln
35 40 45
Gln Glu Lys Gln Asn Ile Gln Leu Ile Asn Thr Asn Gly Ser Trp His
50 55 60
Ser Leu Trp Asn Trp Phe Asn Ile Thr Asn Trp Leu Trp Tyr Ile Lys
65 70 75 80
Leu Phe Ile Met Ile Val Gly Gly Leu Val Gly Leu Arg Ile Val Phe
85 90 95
Ala Val Leu Ser Ile Val Asn Arg Gly Gly Gly Gly Ser Gly Ala Arg
100 105 110
Ala Ser Val Leu Ser Gly Gly Glu Leu Asp Arg Trp Glu Lys Ile Arg
115 120 125
Leu Arg Pro Gly Gly Lys Lys Lys Tyr Lys Leu Lys His Ile Val Trp
130 135 140
Ala Ser Arg Glu Leu Glu Arg Phe Ala Val Asn Pro Gly Leu Leu Glu
145 150 155 160
Thr Ser Glu Gly Cys Arg Gln Ile Leu Gly Gln Leu Gln Pro Ser Leu
165 170 175
Gln Thr Gly Ser Glu Glu Leu Arg Ser Leu Tyr Asn Thr Val Ala Thr
180 185 190
Leu Tyr Cys Val His Gln Arg Ile Glu Ile Lys Asp Thr Lys Glu Ala
195 200 205
Leu Asp Lys Ile Glu Glu Glu Gln Asn Lys Ser Lys Lys Lys Ala Gln
210 215 220
Gln Ala Ala Ala Asp Thr Gly His Ser Asn Gln Val Ser Gln Asn Tyr
225 230 235 240
Pro Ile Val Gln Asn Ile Gln Gly Gln Met Val His Gln Ala Ile Ser
245 250 255
Pro Arg Thr Leu Asn Ala Trp Val Lys Val Val Glu Glu Lys Ala Phe
260 265 270
Ser Pro Glu Val Ile Pro Met Phe Ser Ala Leu Ser Glu Gly Ala Thr
275 280 285
Pro Gln Asp Leu Asn Thr Met Leu Asn Thr Val Gly Gly His Gln Ala
290 295 300
Ala Met Gln Met Leu Lys Glu Thr Ile Asn Glu Glu Ala Ala Glu Trp
305 310 315 320
Asp Arg Val His Pro Val His Ala Gly Pro Ile Ala Pro Gly Gln Met
325 330 335
Arg Glu Pro Arg Gly Ser Asp Ile Ala Gly Thr Thr Ser Thr Leu Gln
340 345 350
Glu Gln Ile Gly Trp Met Thr Asn Asn Pro Pro Ile Pro Val Gly Glu
355 360 365
Ile Tyr Lys Arg Trp Ile Ile Leu Gly Leu Asn Lys Ile Val Arg Met
370 375 380
Tyr Ser Pro Thr Ser Ile Leu Asp Ile Arg Gln Gly Pro Lys Glu Pro
385 390 395 400
Phe Arg Asp Tyr Val Asp Arg Phe Tyr Lys Thr Leu Arg Ala Glu Gln
405 410 415
Ala Ser Gln Glu Val Lys Asn Trp Met Thr Glu Thr Leu Leu Val Gln
420 425 430
Asn Ala Asn Pro Asp Cys Lys Thr Ile Leu Lys Ala Leu Gly Pro Ala
435 440 445
Ala Thr Leu Glu Glu Met Met Thr Ala Cys Gln Gly Val Gly Gly Pro
450 455 460
Gly His Lys Ala Arg Val Leu Ala Glu Ala Met Ser Gln Val Thr Asn
465 470 475 480
Ser Ala Thr Ile Met Met Gln Arg Gly Asn Phe Arg Asn Gln Arg Lys
485 490 495
Ile Val Lys Cys Phe Asn Cys Gly Lys Glu Gly His Thr Ala Arg Asn
500 505 510
Cys Arg Ala Pro Arg Lys Lys Gly Cys Trp Lys Cys Gly Lys Glu Gly
515 520 525
His Gln Met Lys Asp Cys Thr Glu Arg Gln Ala Asn Phe Leu Gly Lys
530 535 540
Ile Trp Pro Ser Tyr Lys Gly Arg Pro Gly Asn Phe Leu Gln Ser Arg
545 550 555 560
Pro Glu Pro Thr Ala Pro Pro Glu Glu Ser Phe Arg Ser Gly Val Glu
565 570 575
Thr Thr Thr Pro Pro Gln Lys Gln Glu Pro Ile Asp Lys Glu Leu Tyr
580 585 590
Pro Leu Thr Ser Leu Arg Ser Leu Phe Gly Asn Asp Pro Ser Ser Gln
595 600 605
<210> 33
<211> 2202
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(2202)
<223> HCV E2 белок, слитый с GAG (HCVE2/GAGcop), включающий
мозаичную HCV E2 конструкцию TM HCVE2, мутированную по RxxxA,
GS линкер и последовательность GAG ВИЧ без сигнала
миристоилирования (nt)
<400> 33
atgttcagcc atctgccttt cgactgcgtg ctgctgctcc tgcttctgct gctgacaaga
60
agccagctga tcaacaccaa cggcagctgg cacatcaaca gcacagccct gaactgcaac
120
gagagcctga ataccggatg gctggccggc ctgttctacc agcacaagtt caatagcagc
180
ggctgccccg agagactggc cagctgtgga tcttctggct gctggcacta ccctccaaga
240
ccttgtggaa tcgtgcccgc caagtctgtg tgtggccctg tgtactgctt caccccatct
300
ccagtggtcg tgggcaccac cgatagatct ggcgccccaa catatagctg gggagccaac
360
gacaccgacg tgttcgtgct gaacaatacc agacctcctc tcggcaattg gttcggctgc
420
acctggatga acagcaccgg cttcacaaaa gtgtgcggag cccctccatg tggcagctcc
480
ggctgtagct ttaccacact gcctgctctg agcaccggcc tgattcatct gcaccagaac
540
atcgtggacg tgcagtacct gtacggcgtg ggaagctcta ttgccagctg ggccatcaag
600
tgggagtacg tggtgctgct gtttctgctc ctggccgatg ccgccgtgtg tagctgtctg
660
tggatgatgc tgctgatctc ccaggccgaa gctggatccg gcgctagagc ttctgtgctg
720
tctgggggcg aactggatag atgggagaag atccggctgc ggcctggcgg caagaagaag
780
tacaagctga agcacatcgt gtgggcctcc agagagctgg aaagattcgc cgtgaacccc
840
ggcctgctgg aaaccagcga gggctgcaga cagatcctgg gacagctgca gcccagcctg
900
cagaccggaa gcgaggaact gcggagcctg tacaacaccg tggccacact gtattgcgtg
960
caccagcgga tcgagatcaa ggacaccaaa gaggccctgg acaagatcga ggaagaacag
1020
aacaagtcta agaagaaggc ccagcaggct gccgccgata ccggccactc taatcaggtg
1080
tcccagaact accccatcgt gcagaacatc cagggccaga tggtgcatca ggccatcagc
1140
cccagaaccc tgaacgcctg ggtcaaggtg gtggaagaga aggcctttag ccccgaagtg
1200
atccccatgt tcagcgccct gtctgagggc gccacacccc aggacctgaa caccatgctg
1260
aacacagtgg gcggacacca ggccgccatg cagatgctga aagagacaat caacgaagag
1320
gccgccgagt gggacagagt gcaccctgtg catgccggac ctatcgcccc tggccagatg
1380
agagagccca gaggctctga tatcgccggc accaccagca ccctgcagga acagatcggc
1440
tggatgacca acaacccccc catccccgtg ggcgagatct acaagcggtg gatcatcctg
1500
ggcctgaaca agattgtgcg gatgtacagc cccacctcca tcctggacat ccggcagggc
1560
cccaaagagc ccttcagaga ctacgtggac cggttctaca agaccctgag agccgagcag
1620
gccagccagg aagtgaagaa ttggatgacc gagacactgc tggtgcagaa cgccaacccc
1680
gactgcaaga ccatcctgaa ggccctggga cctgccgcca ccctggaaga gatgatgaca
1740
gcctgtcagg gcgtgggagg cccaggccac aaagctagag tgctggccga ggccatgagc
1800
caagtgacca actccgccac cattatgatg cagcggggca acttccggaa ccagcggaag
1860
atcgtgaagt gcttcaactg cggcaaagag ggccacaccg cccggaattg cagagccccc
1920
agaaagaaag gctgctggaa gtgtggaaaa gaggggcacc agatgaagga ctgcaccgag
1980
cggcaggcca acttcctggg caagatctgg cctagctaca agggcagacc cggcaatttc
2040
ctgcagagca gacccgagcc taccgcccct cccgaggaaa gctttagaag cggcgtggaa
2100
accaccaccc ccccacagaa gcaggaaccc atcgacaaag agctgtaccc cctgaccagc
2160
ctgagaagcc tgttcggcaa cgaccccagc agccagtgat ga
2202
<210> 34
<211> 732
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(732)
<223> HCV E2 белок, слитый с GAG (HCVE2/GAGcop), включающий
мозаичную HCV E2 конструкцию TM HCVE2, мутированную по RxxxA,
GS линкер и последовательность GAG ВИЧ без сигнала
миристоилирования (aa)
<400> 34
Met Phe Ser His Leu Pro Phe Asp Cys Val Leu Leu Leu Leu Leu Leu
1 5 10 15
Leu Leu Thr Arg Ser Gln Leu Ile Asn Thr Asn Gly Ser Trp His Ile
20 25 30
Asn Ser Thr Ala Leu Asn Cys Asn Glu Ser Leu Asn Thr Gly Trp Leu
35 40 45
Ala Gly Leu Phe Tyr Gln His Lys Phe Asn Ser Ser Gly Cys Pro Glu
50 55 60
Arg Leu Ala Ser Cys Gly Ser Ser Gly Cys Trp His Tyr Pro Pro Arg
65 70 75 80
Pro Cys Gly Ile Val Pro Ala Lys Ser Val Cys Gly Pro Val Tyr Cys
85 90 95
Phe Thr Pro Ser Pro Val Val Val Gly Thr Thr Asp Arg Ser Gly Ala
100 105 110
Pro Thr Tyr Ser Trp Gly Ala Asn Asp Thr Asp Val Phe Val Leu Asn
115 120 125
Asn Thr Arg Pro Pro Leu Gly Asn Trp Phe Gly Cys Thr Trp Met Asn
130 135 140
Ser Thr Gly Phe Thr Lys Val Cys Gly Ala Pro Pro Cys Gly Ser Ser
145 150 155 160
Gly Cys Ser Phe Thr Thr Leu Pro Ala Leu Ser Thr Gly Leu Ile His
165 170 175
Leu His Gln Asn Ile Val Asp Val Gln Tyr Leu Tyr Gly Val Gly Ser
180 185 190
Ser Ile Ala Ser Trp Ala Ile Lys Trp Glu Tyr Val Val Leu Leu Phe
195 200 205
Leu Leu Leu Ala Asp Ala Ala Val Cys Ser Cys Leu Trp Met Met Leu
210 215 220
Leu Ile Ser Gln Ala Glu Ala Gly Ser Gly Ala Arg Ala Ser Val Leu
225 230 235 240
Ser Gly Gly Glu Leu Asp Arg Trp Glu Lys Ile Arg Leu Arg Pro Gly
245 250 255
Gly Lys Lys Lys Tyr Lys Leu Lys His Ile Val Trp Ala Ser Arg Glu
260 265 270
Leu Glu Arg Phe Ala Val Asn Pro Gly Leu Leu Glu Thr Ser Glu Gly
275 280 285
Cys Arg Gln Ile Leu Gly Gln Leu Gln Pro Ser Leu Gln Thr Gly Ser
290 295 300
Glu Glu Leu Arg Ser Leu Tyr Asn Thr Val Ala Thr Leu Tyr Cys Val
305 310 315 320
His Gln Arg Ile Glu Ile Lys Asp Thr Lys Glu Ala Leu Asp Lys Ile
325 330 335
Glu Glu Glu Gln Asn Lys Ser Lys Lys Lys Ala Gln Gln Ala Ala Ala
340 345 350
Asp Thr Gly His Ser Asn Gln Val Ser Gln Asn Tyr Pro Ile Val Gln
355 360 365
Asn Ile Gln Gly Gln Met Val His Gln Ala Ile Ser Pro Arg Thr Leu
370 375 380
Asn Ala Trp Val Lys Val Val Glu Glu Lys Ala Phe Ser Pro Glu Val
385 390 395 400
Ile Pro Met Phe Ser Ala Leu Ser Glu Gly Ala Thr Pro Gln Asp Leu
405 410 415
Asn Thr Met Leu Asn Thr Val Gly Gly His Gln Ala Ala Met Gln Met
420 425 430
Leu Lys Glu Thr Ile Asn Glu Glu Ala Ala Glu Trp Asp Arg Val His
435 440 445
Pro Val His Ala Gly Pro Ile Ala Pro Gly Gln Met Arg Glu Pro Arg
450 455 460
Gly Ser Asp Ile Ala Gly Thr Thr Ser Thr Leu Gln Glu Gln Ile Gly
465 470 475 480
Trp Met Thr Asn Asn Pro Pro Ile Pro Val Gly Glu Ile Tyr Lys Arg
485 490 495
Trp Ile Ile Leu Gly Leu Asn Lys Ile Val Arg Met Tyr Ser Pro Thr
500 505 510
Ser Ile Leu Asp Ile Arg Gln Gly Pro Lys Glu Pro Phe Arg Asp Tyr
515 520 525
Val Asp Arg Phe Tyr Lys Thr Leu Arg Ala Glu Gln Ala Ser Gln Glu
530 535 540
Val Lys Asn Trp Met Thr Glu Thr Leu Leu Val Gln Asn Ala Asn Pro
545 550 555 560
Asp Cys Lys Thr Ile Leu Lys Ala Leu Gly Pro Ala Ala Thr Leu Glu
565 570 575
Glu Met Met Thr Ala Cys Gln Gly Val Gly Gly Pro Gly His Lys Ala
580 585 590
Arg Val Leu Ala Glu Ala Met Ser Gln Val Thr Asn Ser Ala Thr Ile
595 600 605
Met Met Gln Arg Gly Asn Phe Arg Asn Gln Arg Lys Ile Val Lys Cys
610 615 620
Phe Asn Cys Gly Lys Glu Gly His Thr Ala Arg Asn Cys Arg Ala Pro
625 630 635 640
Arg Lys Lys Gly Cys Trp Lys Cys Gly Lys Glu Gly His Gln Met Lys
645 650 655
Asp Cys Thr Glu Arg Gln Ala Asn Phe Leu Gly Lys Ile Trp Pro Ser
660 665 670
Tyr Lys Gly Arg Pro Gly Asn Phe Leu Gln Ser Arg Pro Glu Pro Thr
675 680 685
Ala Pro Pro Glu Glu Ser Phe Arg Ser Gly Val Glu Thr Thr Thr Pro
690 695 700
Pro Gln Lys Gln Glu Pro Ile Asp Lys Glu Leu Tyr Pro Leu Thr Ser
705 710 715 720
Leu Arg Ser Leu Phe Gly Asn Asp Pro Ser Ser Gln
725 730
<210> 35
<211> 2406
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(2406)
<223> Borrelia OspA белок, слитый с GAG ВИЧ(ospA/GAGcop),
включающий человеческий сигнальный пептид (из TIM-3)
17-273 последовательность ospA, CD44 TM человека, GS линкер
и последовательность GAG ВИЧ без сигнала миристоилирования (nt)
<400> 35
atgttcagcc atctgccttt cgactgcgtg ctgctgctcc tgcttctgct gctgaccaga
60
tcctgcaagc agaacgtgtc cagcctggac gagaagaaca gcgtgtccgt tgatctgccc
120
ggcgagatga aggtgctggt gtccaaagag aaaaacaagg acgggaagta cgacctgatc
180
gccaccgtgg acaagctgga actgaagggc accagcgaca agaacaatgg cagcggagtg
240
ctggaaggcg tgaaggccga taagagcaaa gtgaagctga ccatcagcga cgacctgggc
300
cagaccacac tggaagtgtt caaagaggac ggcaagaccc tggtgtctaa gaaagtgacc
360
agcaaggaca agagcagcac cgaggaaaag ttcaacgaga agggcgaagt gtccgagaag
420
atcatcacca gagccgacgg caccagactc gagtacacag gcatcaagtc cgacggcagc
480
ggcaaggcca aagaggtgct gaaaggctac gtgctcgagg gcacactgac cgccgagaaa
540
acaaccctgg tggtcaaaga gggcaccgtc acactgagca agaacatcag caagagcggc
600
gaggtgtccg tcgagctgaa cgatacagat agcagcgccg ccaccaagaa aaccgccgcc
660
tggaatagcg gcacaagcac cctgacaatc accgtgaaca gcaaaaagac caaggacctg
720
gtgttcacca aagaaaacac catcaccgtg cagcagtacg acagcaacgg caccaaactg
780
gaaggcagcg ccgtggaaat caccaagctg gatgagatca agaacgccct gaagtggctg
840
atcatcctgg ccagtctgct ggccctggct ctgattctgg ccgtgtgtat tgctgtggga
900
tccggcgcta gagcttctgt gctgtctggg ggcgaactgg atagatggga gaagatccgg
960
ctgcggcctg gcggcaagaa gaagtacaag ctgaagcaca tcgtgtgggc ctccagagag
1020
ctggaaagat tcgccgtgaa ccccggcctg ctggaaacca gcgagggctg cagacagatc
1080
ctgggacagc tgcagcccag cctgcagacc ggaagcgagg aactgcggag cctgtacaac
1140
accgtggcca cactgtattg cgtgcaccag cggatcgaga tcaaggacac caaagaggcc
1200
ctggacaaga tcgaggaaga acagaacaag tctaagaaga aggcccagca ggctgccgcc
1260
gataccggcc actctaatca ggtgtcccag aactacccca tcgtgcagaa catccagggc
1320
cagatggtgc atcaggccat cagccccaga accctgaacg cctgggtcaa ggtggtggaa
1380
gagaaggcct ttagccccga agtgatcccc atgttcagcg ccctgtctga gggcgccaca
1440
ccccaggacc tgaacaccat gctgaacaca gtgggcggac accaggccgc catgcagatg
1500
ctgaaagaga caatcaacga agaggccgcc gagtgggaca gagtgcaccc tgtgcatgcc
1560
ggacctatcg cccctggcca gatgagagag cccagaggct ctgatatcgc cggcaccacc
1620
agcaccctgc aggaacagat cggctggatg accaacaacc cccccatccc cgtgggcgag
1680
atctacaagc ggtggatcat cctgggcctg aacaagattg tgcggatgta cagccccacc
1740
tccatcctgg acatccggca gggccccaaa gagcccttca gagactacgt ggaccggttc
1800
tacaagaccc tgagagccga gcaggccagc caggaagtga agaattggat gaccgagaca
1860
ctgctggtgc agaacgccaa ccccgactgc aagaccatcc tgaaggccct gggacctgcc
1920
gccaccctgg aagagatgat gacagcctgt cagggcgtgg gaggcccagg ccacaaagct
1980
agagtgctgg ccgaggccat gagccaagtg accaactccg ccaccattat gatgcagcgg
2040
ggcaacttcc ggaaccagcg gaagatcgtg aagtgcttca actgcggcaa agagggccac
2100
accgcccgga attgcagagc ccccagaaag aaaggctgct ggaagtgtgg aaaagagggg
2160
caccagatga aggactgcac cgagcggcag gccaacttcc tgggcaagat ctggcctagc
2220
tacaagggca gacccggcaa tttcctgcag agcagacccg agcctaccgc ccctcccgag
2280
gaaagcttta gaagcggcgt ggaaaccacc acccccccac agaagcagga acccatcgac
2340
aaagagctgt accccctgac cagcctgaga agcctgttcg gcaacgaccc cagcagccag
2400
tgatga
2406
<210> 36
<211> 800
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(800)
<223> Borrelia OspA слитый с GAG ВИЧ (ospA/GAGcop),
включающий человеческий сигнальный пептид (из TIM-3) 17-273
последовательность ospA, CD44 TM человека, GS линкер и
последовательность GAG ВИЧ без сигнала миристоилирования (aa)
<400> 36
Met Phe Ser His Leu Pro Phe Asp Cys Val Leu Leu Leu Leu Leu Leu
1 5 10 15
Leu Leu Thr Arg Ser Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys
20 25 30
Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu Val Ser
35 40 45
Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr Val Asp
50 55 60
Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser Gly Val
65 70 75 80
Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr Ile Ser
85 90 95
Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp Gly Lys
100 105 110
Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser Thr Glu
115 120 125
Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile Thr Arg
130 135 140
Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp Gly Ser
145 150 155 160
Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Val Leu Glu Gly Thr Leu
165 170 175
Thr Ala Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val Thr Leu
180 185 190
Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu Asn Asp
195 200 205
Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn Ser Gly
210 215 220
Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys Asp Leu
225 230 235 240
Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp Ser Asn
245 250 255
Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu Asp Glu
260 265 270
Ile Lys Asn Ala Leu Lys Trp Leu Ile Ile Leu Ala Ser Leu Leu Ala
275 280 285
Leu Ala Leu Ile Leu Ala Val Cys Ile Ala Val Gly Ser Gly Ala Arg
290 295 300
Ala Ser Val Leu Ser Gly Gly Glu Leu Asp Arg Trp Glu Lys Ile Arg
305 310 315 320
Leu Arg Pro Gly Gly Lys Lys Lys Tyr Lys Leu Lys His Ile Val Trp
325 330 335
Ala Ser Arg Glu Leu Glu Arg Phe Ala Val Asn Pro Gly Leu Leu Glu
340 345 350
Thr Ser Glu Gly Cys Arg Gln Ile Leu Gly Gln Leu Gln Pro Ser Leu
355 360 365
Gln Thr Gly Ser Glu Glu Leu Arg Ser Leu Tyr Asn Thr Val Ala Thr
370 375 380
Leu Tyr Cys Val His Gln Arg Ile Glu Ile Lys Asp Thr Lys Glu Ala
385 390 395 400
Leu Asp Lys Ile Glu Glu Glu Gln Asn Lys Ser Lys Lys Lys Ala Gln
405 410 415
Gln Ala Ala Ala Asp Thr Gly His Ser Asn Gln Val Ser Gln Asn Tyr
420 425 430
Pro Ile Val Gln Asn Ile Gln Gly Gln Met Val His Gln Ala Ile Ser
435 440 445
Pro Arg Thr Leu Asn Ala Trp Val Lys Val Val Glu Glu Lys Ala Phe
450 455 460
Ser Pro Glu Val Ile Pro Met Phe Ser Ala Leu Ser Glu Gly Ala Thr
465 470 475 480
Pro Gln Asp Leu Asn Thr Met Leu Asn Thr Val Gly Gly His Gln Ala
485 490 495
Ala Met Gln Met Leu Lys Glu Thr Ile Asn Glu Glu Ala Ala Glu Trp
500 505 510
Asp Arg Val His Pro Val His Ala Gly Pro Ile Ala Pro Gly Gln Met
515 520 525
Arg Glu Pro Arg Gly Ser Asp Ile Ala Gly Thr Thr Ser Thr Leu Gln
530 535 540
Glu Gln Ile Gly Trp Met Thr Asn Asn Pro Pro Ile Pro Val Gly Glu
545 550 555 560
Ile Tyr Lys Arg Trp Ile Ile Leu Gly Leu Asn Lys Ile Val Arg Met
565 570 575
Tyr Ser Pro Thr Ser Ile Leu Asp Ile Arg Gln Gly Pro Lys Glu Pro
580 585 590
Phe Arg Asp Tyr Val Asp Arg Phe Tyr Lys Thr Leu Arg Ala Glu Gln
595 600 605
Ala Ser Gln Glu Val Lys Asn Trp Met Thr Glu Thr Leu Leu Val Gln
610 615 620
Asn Ala Asn Pro Asp Cys Lys Thr Ile Leu Lys Ala Leu Gly Pro Ala
625 630 635 640
Ala Thr Leu Glu Glu Met Met Thr Ala Cys Gln Gly Val Gly Gly Pro
645 650 655
Gly His Lys Ala Arg Val Leu Ala Glu Ala Met Ser Gln Val Thr Asn
660 665 670
Ser Ala Thr Ile Met Met Gln Arg Gly Asn Phe Arg Asn Gln Arg Lys
675 680 685
Ile Val Lys Cys Phe Asn Cys Gly Lys Glu Gly His Thr Ala Arg Asn
690 695 700
Cys Arg Ala Pro Arg Lys Lys Gly Cys Trp Lys Cys Gly Lys Glu Gly
705 710 715 720
His Gln Met Lys Asp Cys Thr Glu Arg Gln Ala Asn Phe Leu Gly Lys
725 730 735
Ile Trp Pro Ser Tyr Lys Gly Arg Pro Gly Asn Phe Leu Gln Ser Arg
740 745 750
Pro Glu Pro Thr Ala Pro Pro Glu Glu Ser Phe Arg Ser Gly Val Glu
755 760 765
Thr Thr Thr Pro Pro Gln Lys Gln Glu Pro Ile Asp Lys Glu Leu Tyr
770 775 780
Pro Leu Thr Ser Leu Arg Ser Leu Phe Gly Asn Asp Pro Ser Ser Gln
785 790 795 800
<210> 37
<211> 2187
<212> ДНК
<213> Синтетическая
<220>
<221> ген
<222> (1)..(2187)
<223> Человеческий TIM-3 белок, слитый с GAG ВИЧ (TIM-3/GAGcop),
включающий человеческий сигнальный пептид (из TIM-3) полные
внеклеточную и TM последовательности человеческого TIM-3,
GGGGS линкер и последовательность GAG ВИЧ без сигнала
миристоилирования (nt)
<400> 37
atgttcagcc atctgccttt cgactgcgtg ctgctgctcc tgcttctgct gctgaccaga
60
tccagcgagg tcgagtacag agccgaagtg ggccagaatg cctacctgcc ttgcttctac
120
acaccagccg ctccaggcaa tctggtgcct gtgtgttggg gaaaaggcgc ctgtcctgtg
180
ttcgagtgcg gcaacgttgt gctgagaacc gacgagcggg acgtgaacta ctggaccagc
240
agatactggc tgaacggcga cttcagaaag ggcgacgtgt ccctgaccat cgagaatgtg
300
acactggccg acagcggcat ctactgctgc agaatccaga ttcctggcat catgaacgac
360
gagaagttca acctgaagct ggtcatcaag cccgccaaag tgacccctgc tcctaccaga
420
cagagagact tcaccgccgc ctttccacgg atgctgacca caagaggaca cggccctgcc
480
gagacacaga cacttggaag cctgcctgac atcaatctga cccagatcag caccctggcc
540
aacgagctga gagatagcag actggctaat gacctgagag acagcggcgc caccatccgg
600
atcggcatct atatcggagc cggcatctgt gccggactgg ccctggctct tattttcgga
660
gcactgatcg gaggcggcgg atccggcgct agagcttctg tgctgtctgg gggcgaactg
720
gatagatggg agaagatccg gctgcggcct ggcggcaaga agaagtacaa gctgaagcac
780
atcgtgtggg cctccagaga gctggaaaga ttcgccgtga accccggcct gctggaaacc
840
agcgagggct gcagacagat cctgggacag ctgcagccca gcctgcagac cggaagcgag
900
gaactgcgga gcctgtacaa caccgtggcc acactgtatt gcgtgcacca gcggatcgag
960
atcaaggaca ccaaagaggc cctggacaag atcgaggaag aacagaacaa gtctaagaag
1020
aaggcccagc aggctgccgc cgataccggc cactctaatc aggtgtccca gaactacccc
1080
atcgtgcaga acatccaggg ccagatggtg catcaggcca tcagccccag aaccctgaac
1140
gcctgggtca aggtggtgga agagaaggcc tttagccccg aagtgatccc catgttcagc
1200
gccctgtctg agggcgccac accccaggac ctgaacacca tgctgaacac agtgggcgga
1260
caccaggccg ccatgcagat gctgaaagag acaatcaacg aagaggccgc cgagtgggac
1320
agagtgcacc ctgtgcatgc cggacctatc gcccctggcc agatgagaga gcccagaggc
1380
tctgatatcg ccggcaccac cagcaccctg caggaacaga tcggctggat gaccaacaac
1440
ccccccatcc ccgtgggcga gatctacaag cggtggatca tcctgggcct gaacaagatt
1500
gtgcggatgt acagccccac ctccatcctg gacatccggc agggccccaa agagcccttc
1560
agagactacg tggaccggtt ctacaagacc ctgagagccg agcaggccag ccaggaagtg
1620
aagaattgga tgaccgagac actgctggtg cagaacgcca accccgactg caagaccatc
1680
ctgaaggccc tgggacctgc cgccaccctg gaagagatga tgacagcctg tcagggcgtg
1740
ggaggcccag gccacaaagc tagagtgctg gccgaggcca tgagccaagt gaccaactcc
1800
gccaccatta tgatgcagcg gggcaacttc cggaaccagc ggaagatcgt gaagtgcttc
1860
aactgcggca aagagggcca caccgcccgg aattgcagag cccccagaaa gaaaggctgc
1920
tggaagtgtg gaaaagaggg gcaccagatg aaggactgca ccgagcggca ggccaacttc
1980
ctgggcaaga tctggcctag ctacaagggc agacccggca atttcctgca gagcagaccc
2040
gagcctaccg cccctcccga ggaaagcttt agaagcggcg tggaaaccac caccccccca
2100
cagaagcagg aacccatcga caaagagctg taccccctga ccagcctgag aagcctgttc
2160
ggcaacgacc ccagcagcca gtgatga
2187
<210> 38
<211> 727
<212> Белок
<213> Синтетическая
<220>
<221> ПЕПТИД
<222> (1)..(727)
<223> Человеческий TIM-3 белок, слитый с GAG ВИЧ (TIM-3/GAGcop),
включающий человеческий сигнальный пептид (из TIM-3)
полные внеклеточную и TM последовательности человеческого TIM-3,
GGGGS линкер и последовательность GAG ВИЧ без сигнала
миристоилирования (aa)
<400> 38
Met Phe Ser His Leu Pro Phe Asp Cys Val Leu Leu Leu Leu Leu Leu
1 5 10 15
Leu Leu Thr Arg Ser Ser Glu Val Glu Tyr Arg Ala Glu Val Gly Gln
20 25 30
Asn Ala Tyr Leu Pro Cys Phe Tyr Thr Pro Ala Ala Pro Gly Asn Leu
35 40 45
Val Pro Val Cys Trp Gly Lys Gly Ala Cys Pro Val Phe Glu Cys Gly
50 55 60
Asn Val Val Leu Arg Thr Asp Glu Arg Asp Val Asn Tyr Trp Thr Ser
65 70 75 80
Arg Tyr Trp Leu Asn Gly Asp Phe Arg Lys Gly Asp Val Ser Leu Thr
85 90 95
Ile Glu Asn Val Thr Leu Ala Asp Ser Gly Ile Tyr Cys Cys Arg Ile
100 105 110
Gln Ile Pro Gly Ile Met Asn Asp Glu Lys Phe Asn Leu Lys Leu Val
115 120 125
Ile Lys Pro Ala Lys Val Thr Pro Ala Pro Thr Arg Gln Arg Asp Phe
130 135 140
Thr Ala Ala Phe Pro Arg Met Leu Thr Thr Arg Gly His Gly Pro Ala
145 150 155 160
Glu Thr Gln Thr Leu Gly Ser Leu Pro Asp Ile Asn Leu Thr Gln Ile
165 170 175
Ser Thr Leu Ala Asn Glu Leu Arg Asp Ser Arg Leu Ala Asn Asp Leu
180 185 190
Arg Asp Ser Gly Ala Thr Ile Arg Ile Gly Ile Tyr Ile Gly Ala Gly
195 200 205
Ile Cys Ala Gly Leu Ala Leu Ala Leu Ile Phe Gly Ala Leu Ile Gly
210 215 220
Gly Gly Gly Ser Gly Ala Arg Ala Ser Val Leu Ser Gly Gly Glu Leu
225 230 235 240
Asp Arg Trp Glu Lys Ile Arg Leu Arg Pro Gly Gly Lys Lys Lys Tyr
245 250 255
Lys Leu Lys His Ile Val Trp Ala Ser Arg Glu Leu Glu Arg Phe Ala
260 265 270
Val Asn Pro Gly Leu Leu Glu Thr Ser Glu Gly Cys Arg Gln Ile Leu
275 280 285
Gly Gln Leu Gln Pro Ser Leu Gln Thr Gly Ser Glu Glu Leu Arg Ser
290 295 300
Leu Tyr Asn Thr Val Ala Thr Leu Tyr Cys Val His Gln Arg Ile Glu
305 310 315 320
Ile Lys Asp Thr Lys Glu Ala Leu Asp Lys Ile Glu Glu Glu Gln Asn
325 330 335
Lys Ser Lys Lys Lys Ala Gln Gln Ala Ala Ala Asp Thr Gly His Ser
340 345 350
Asn Gln Val Ser Gln Asn Tyr Pro Ile Val Gln Asn Ile Gln Gly Gln
355 360 365
Met Val His Gln Ala Ile Ser Pro Arg Thr Leu Asn Ala Trp Val Lys
370 375 380
Val Val Glu Glu Lys Ala Phe Ser Pro Glu Val Ile Pro Met Phe Ser
385 390 395 400
Ala Leu Ser Glu Gly Ala Thr Pro Gln Asp Leu Asn Thr Met Leu Asn
405 410 415
Thr Val Gly Gly His Gln Ala Ala Met Gln Met Leu Lys Glu Thr Ile
420 425 430
Asn Glu Glu Ala Ala Glu Trp Asp Arg Val His Pro Val His Ala Gly
435 440 445
Pro Ile Ala Pro Gly Gln Met Arg Glu Pro Arg Gly Ser Asp Ile Ala
450 455 460
Gly Thr Thr Ser Thr Leu Gln Glu Gln Ile Gly Trp Met Thr Asn Asn
465 470 475 480
Pro Pro Ile Pro Val Gly Glu Ile Tyr Lys Arg Trp Ile Ile Leu Gly
485 490 495
Leu Asn Lys Ile Val Arg Met Tyr Ser Pro Thr Ser Ile Leu Asp Ile
500 505 510
Arg Gln Gly Pro Lys Glu Pro Phe Arg Asp Tyr Val Asp Arg Phe Tyr
515 520 525
Lys Thr Leu Arg Ala Glu Gln Ala Ser Gln Glu Val Lys Asn Trp Met
530 535 540
Thr Glu Thr Leu Leu Val Gln Asn Ala Asn Pro Asp Cys Lys Thr Ile
545 550 555 560
Leu Lys Ala Leu Gly Pro Ala Ala Thr Leu Glu Glu Met Met Thr Ala
565 570 575
Cys Gln Gly Val Gly Gly Pro Gly His Lys Ala Arg Val Leu Ala Glu
580 585 590
Ala Met Ser Gln Val Thr Asn Ser Ala Thr Ile Met Met Gln Arg Gly
595 600 605
Asn Phe Arg Asn Gln Arg Lys Ile Val Lys Cys Phe Asn Cys Gly Lys
610 615 620
Glu Gly His Thr Ala Arg Asn Cys Arg Ala Pro Arg Lys Lys Gly Cys
625 630 635 640
Trp Lys Cys Gly Lys Glu Gly His Gln Met Lys Asp Cys Thr Glu Arg
645 650 655
Gln Ala Asn Phe Leu Gly Lys Ile Trp Pro Ser Tyr Lys Gly Arg Pro
660 665 670
Gly Asn Phe Leu Gln Ser Arg Pro Glu Pro Thr Ala Pro Pro Glu Glu
675 680 685
Ser Phe Arg Ser Gly Val Glu Thr Thr Thr Pro Pro Gln Lys Gln Glu
690 695 700
Pro Ile Asp Lys Glu Leu Tyr Pro Leu Thr Ser Leu Arg Ser Leu Phe
705 710 715 720
Gly Asn Asp Pro Ser Ser Gln
725
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные слитого с Fc белка с высокой двойной активностью: противовирусной активностью в отношении ВИЧ и иммуномодулирующей активностью | 2018 |
|
RU2774782C2 |
| ИММУНОГЕНЫ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИЧ | 2013 |
|
RU2721274C2 |
| ГЕННАЯ ТЕРАПИЯ ГИПОФОСФАТЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 23 | 2020 |
|
RU2815545C2 |
| Вакцина против герпеса | 2019 |
|
RU2731073C1 |
| МУТАНТНЫЙ БЕЛОК F RSV И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807742C1 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО | 2016 |
|
RU2744843C2 |
| Конструкции для направленного редактирования генов и способы с их применением | 2020 |
|
RU2832109C2 |
| МУЛЬТИВАЛЕНТНЫЕ PD-L1-СВЯЗЫВАЮЩИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2816646C2 |
| ХИМЕРНЫЕ БЕЛКИ НА ОСНОВЕ TIGIT И LIGHT | 2018 |
|
RU2775490C2 |
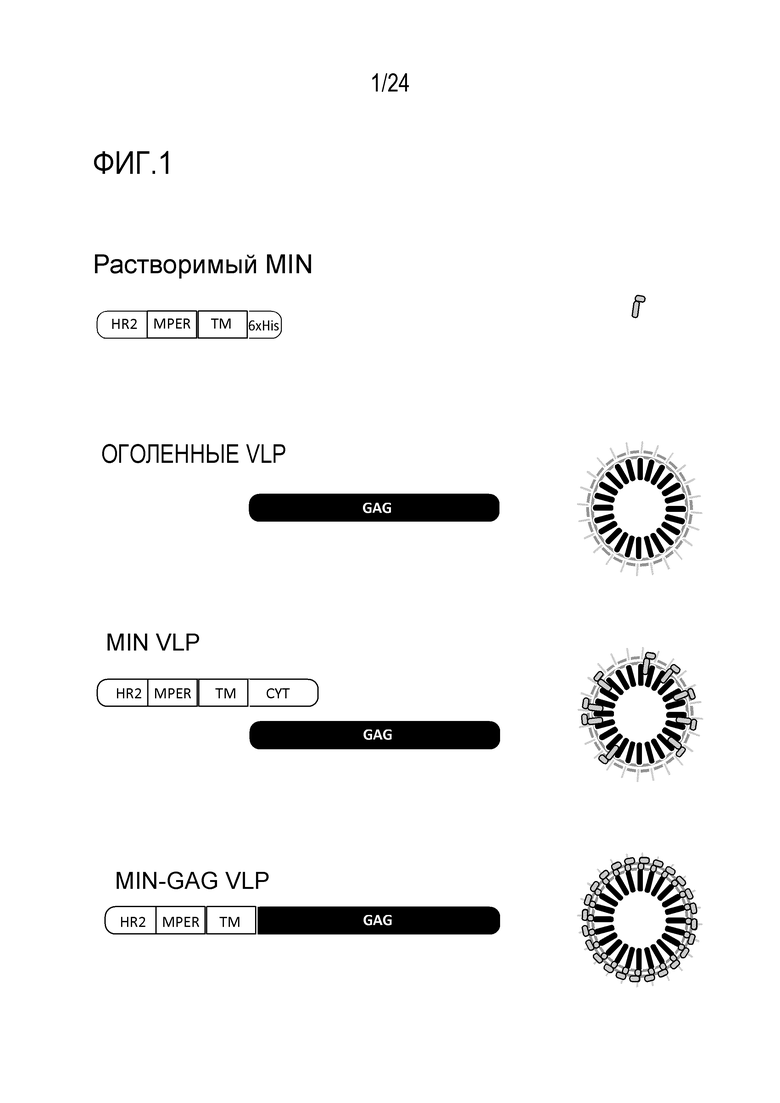


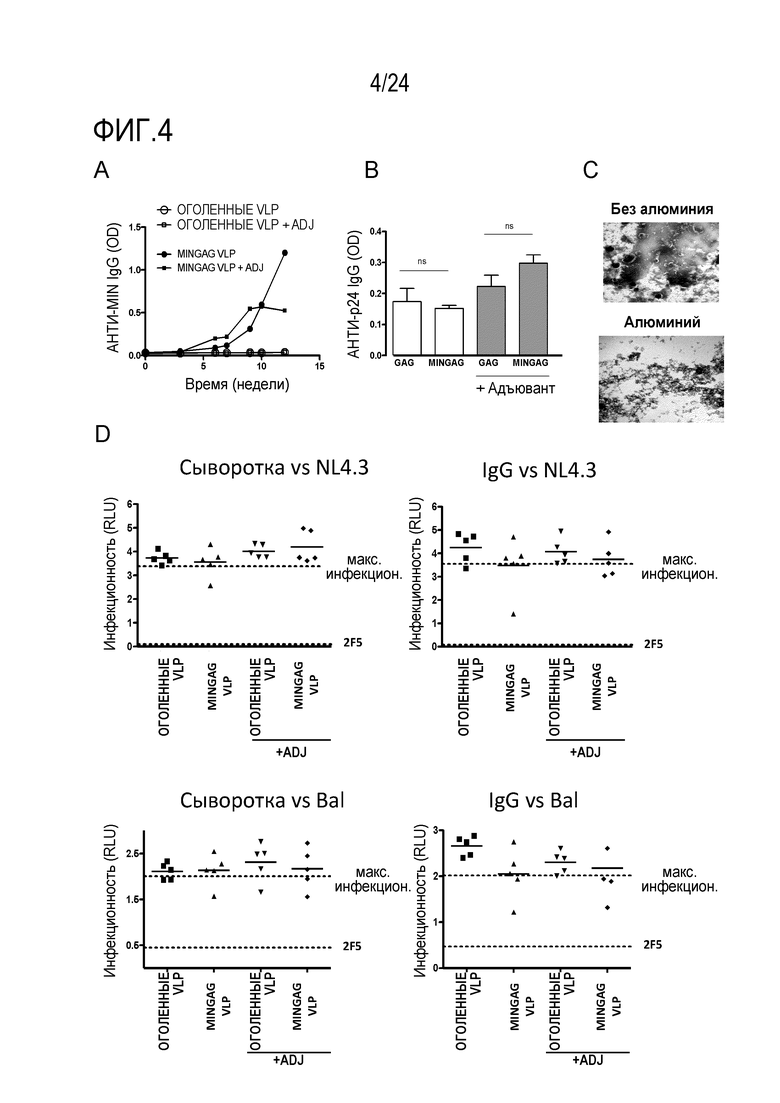
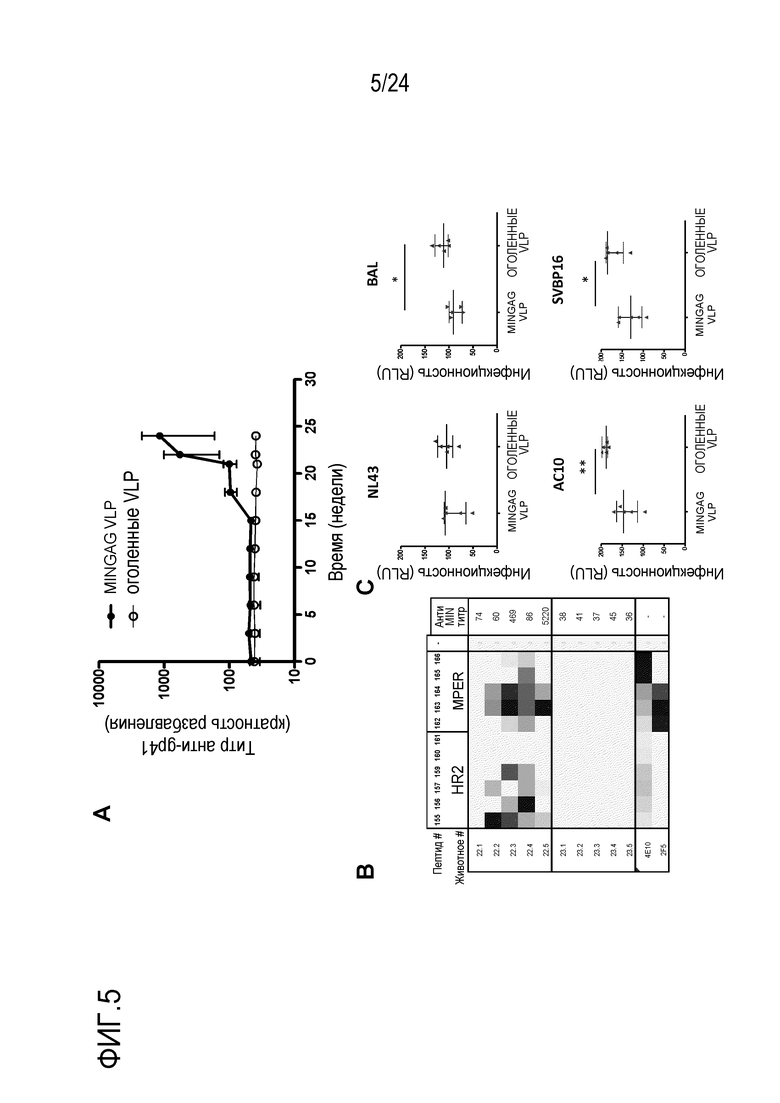

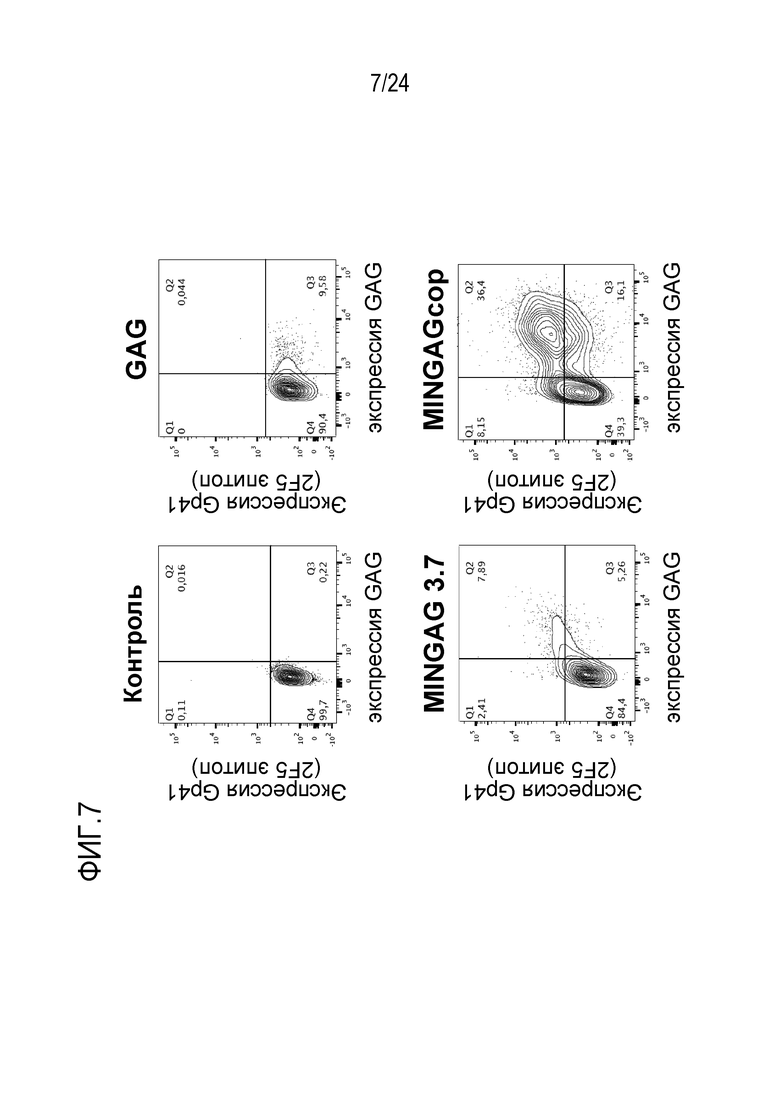
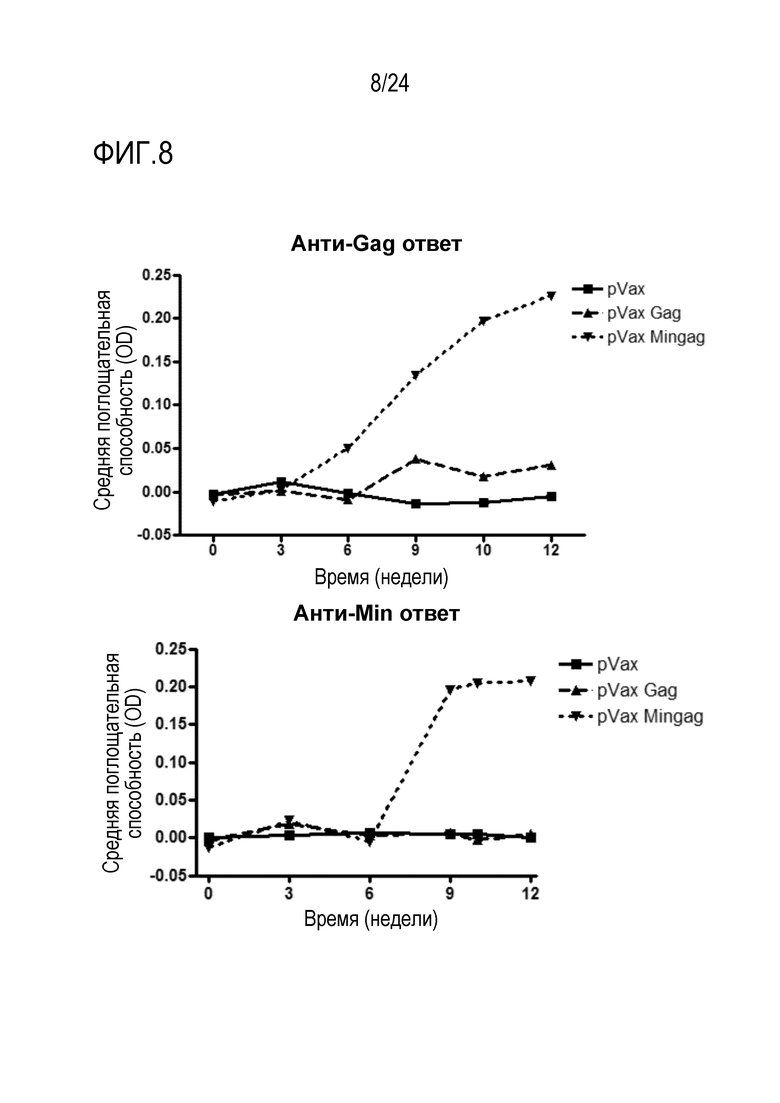
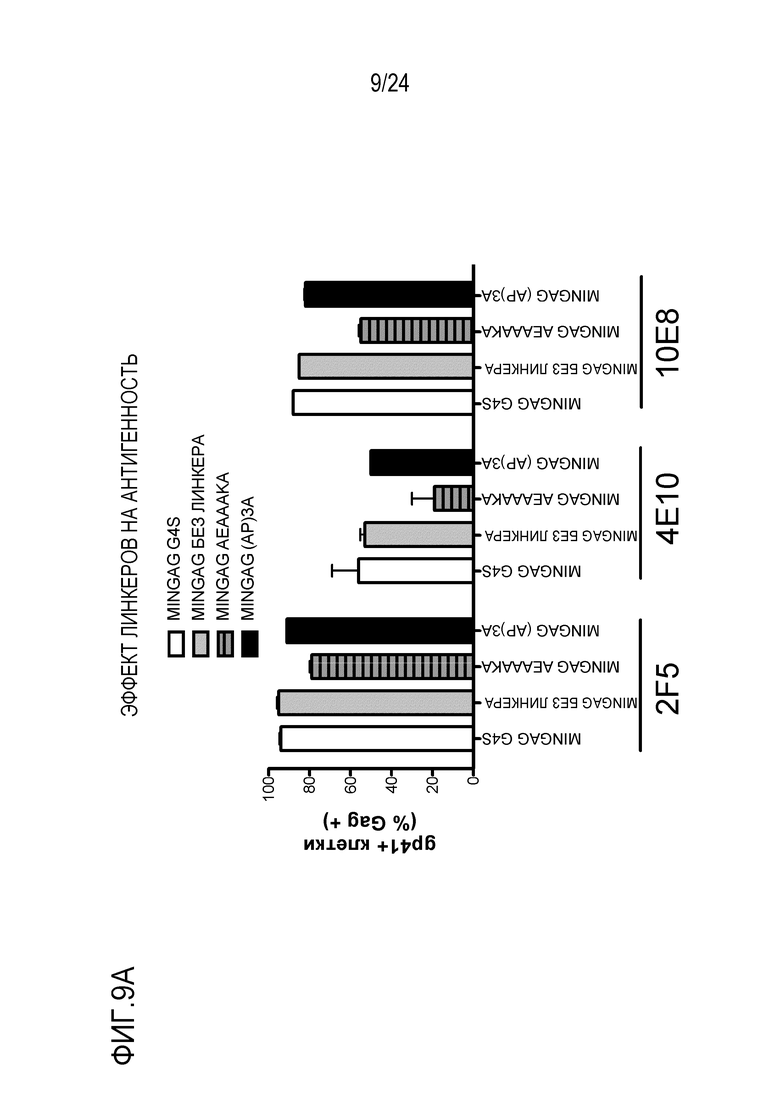
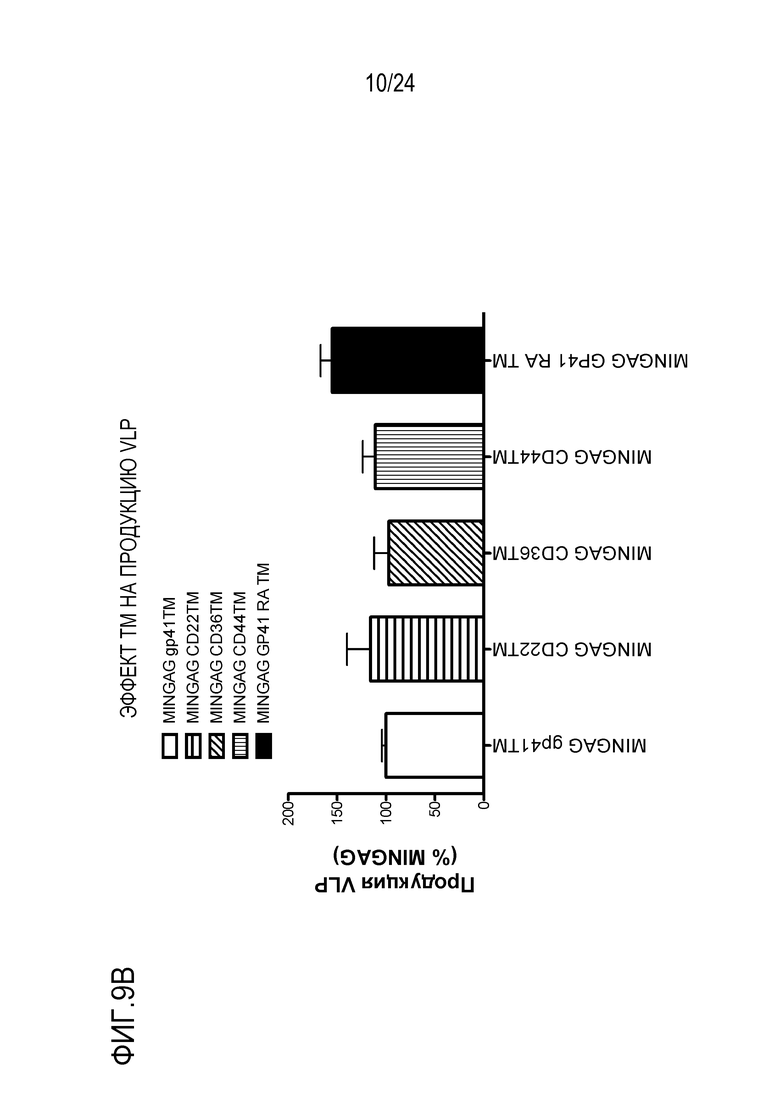



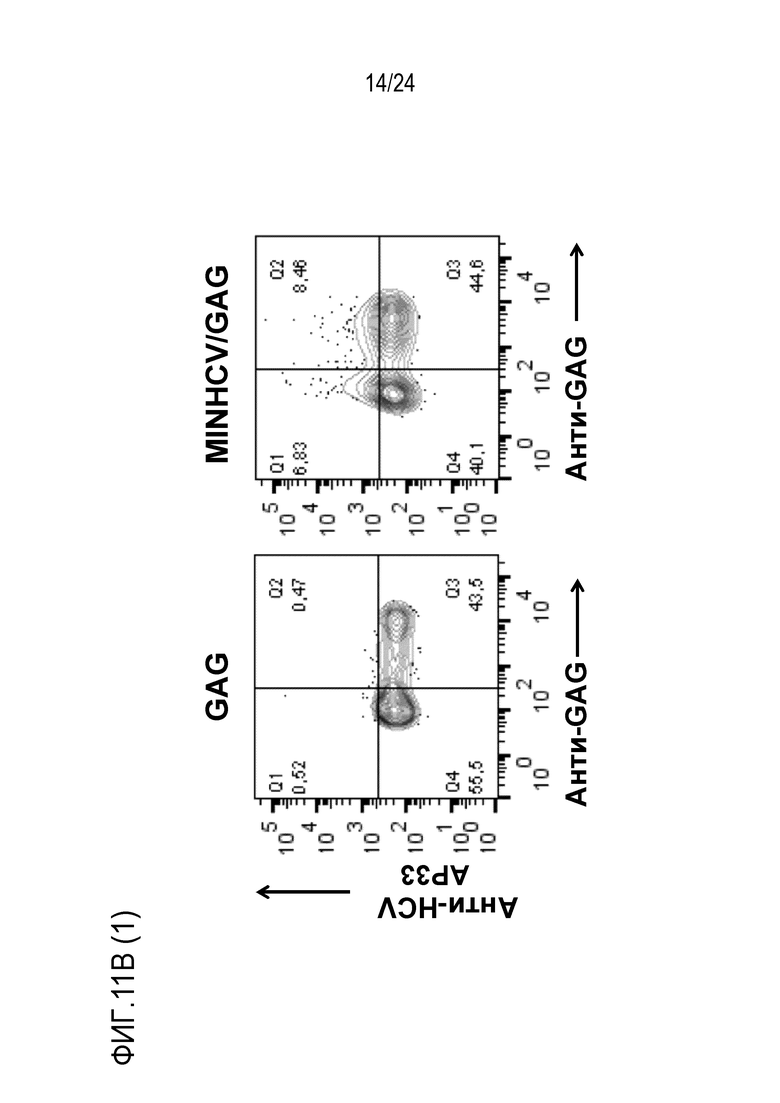


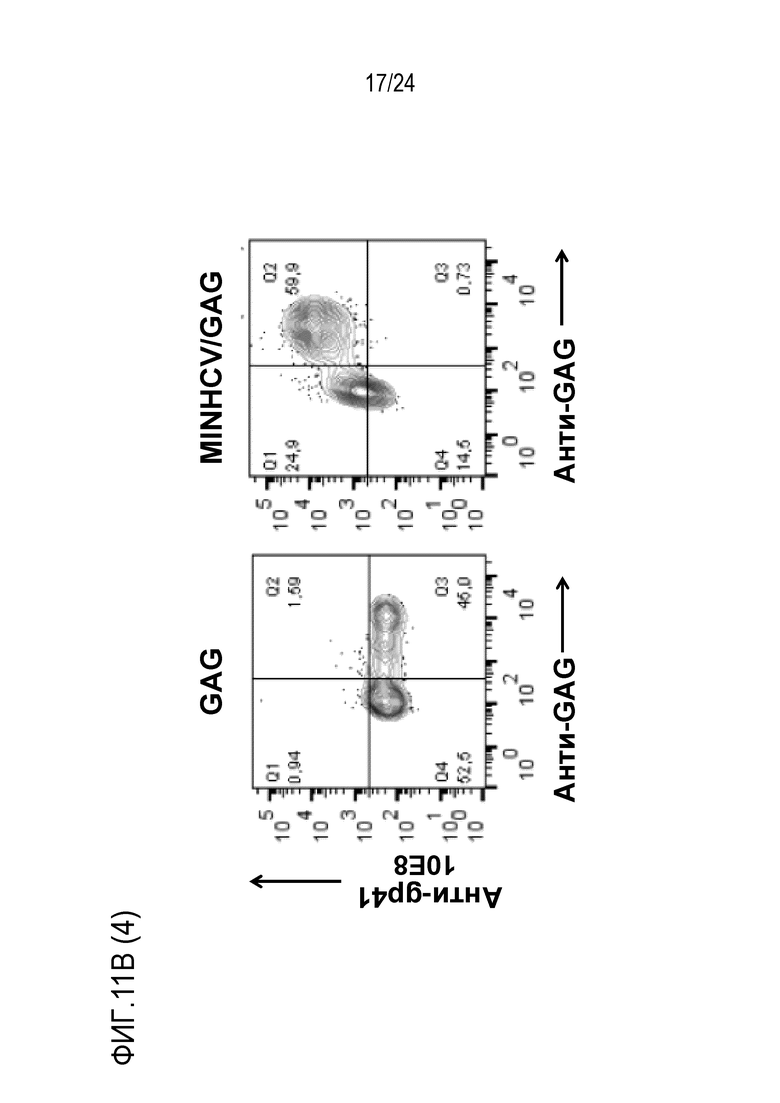







Изобретение относится к области биотехнологии. Предложен слитый белок для лечения или профилактики заболевания, вызванного патогеном или опухолью, у субъекта. Слитый белок включает иммуногенный полипептид, представляющий интерес, трансмембранный домен и полипептид gag ВИЧ или их функционально эквивалентные варианты. Изобретение также относится к полинуклеотиду, экспрессионному вектору, клетке-хозяину и вирусоподобной частице, экспрессирующим или презентирующим указанный слитый белок. Кроме того, раскрыты фармацевтические и иммуногенные композиции, содержащие слитые белки, полинуклеотиды, векторы или вирусоподобные частицы по изобретению, а также их применение в медицине и ветеринарии. Изобретение обеспечивает формирование вирусоподобных частиц с высокой и специфической иммуногенностью. 9 н. и 13 з.п. ф-лы, 24 ил., 10 пр.
1. Слитый белок для лечения или профилактики заболевания, вызванного патогеном или опухолью, у субъекта, где указанный слитый белок включает в направлении от N- к C-концу:
- иммуногенный полипептид, представляющий интерес, содержащий по меньшей мере один полипептид из вируса, бактерий, грибов, простейших, паразита, аллергена или опухолевого маркера,
- трансмембранный домен, содержащий: (a) трансмембранный домен (i) полипептида gp41 ВИЧ (SEQ ID NO: 16), (b) R696A мутант Env ВИЧ-1 (SEQ ID NO: 30) или (c) функционально эквивалентные варианты (a) и (b), где указанный функционально эквивалентный вариант имеет по меньшей мере 80% идентичности последовательности трансмембранным доменам (a) и (b) и по существу сохраняет их способность встраиваться в плазматическую мембрану, и
- полипептид gag ВИЧ (SEQ ID NO: 1) или его функционально эквивалентный вариант, имеющий по меньшей мере 80% идентичности последовательности полипептиду gag ВИЧ и по существу сохраняющий его активность по образованию вирусоподобной частицы.
2. Слитый белок по п. 1, где функционально эквивалентные варианты (a) и (b) имеют по меньшей мере 90% идентичности последовательности трансмембранным доменам (a) и (b), и где функционально эквивалентный вариант полипептида gag ВИЧ имеет по меньшей мере 90% идентичности последовательности полипептиду gag ВИЧ.
3. Слитый белок по п. 2, где функционально эквивалентные варианты (a) и (b) имеют по меньшей мере 95% идентичности последовательности трансмембранным доменам (a) и (b), и где функционально эквивалентный вариант полипептида gag ВИЧ имеет по меньшей мере 95% идентичности последовательности полипептиду gag ВИЧ.
4. Слитый белок по любому из пп. 1-3, где полипептид, представляющий интерес, трансмембранный домен и полипептид gag ВИЧ или их функционально эквивалентые варианты соединены линкером.
5. Слитый белок по любому из предшествующих пунктов, где полипептид gag ВИЧ или его функционально эквивалентный вариант не содержит последовательность миристоилирования.
6. Слитый белок по любому из предшествующих пунктов, где линкер включает глициновые остатки, предпочтительно линкер включает глициновые остатки и сериновые остатки, более предпочтительно линкер включает три глициновых остатка и один сериновый остаток, еще более предпочтительно линкер включает последовательности SEQ ID NO: 23 или SEQ ID NO: 24.
7. Слитый белок по п. 6, где вирус представляет собой ВИЧ.
8. Слитый белок по п. 7, где полипептид, представляющий интерес, происходит из белка env ВИЧ или продукта, являющегося результатом процессинга белка env ВИЧ, предпочтительно белок env ВИЧ представляет собой gp41 ВИЧ.
9. Слитый белок по п. 8, где полипептид, представляющий интерес, включает в направлении от N- к C-концу:
(a) гептадный повтор 2 полипептида gp41 ВИЧ или его функционально эквивалентного варианта, имеющего по меньшей мере 50% идентичности и по существу сохраняющего его иммуногенную активность, и
(b) проксимальную к мембране область полипептида gp41 ВИЧ или его функционально эквивалентного варианта, имеющего по меньшей мере 50% идентичности и по существу сохраняющего его иммуногенную активность.
10. Слитый белок по п. 9, включающий последовательность SEQ ID NO: 28.
11. Полинуклеотид, кодирующий слитый белок по любому из пп. 1-10.
12. Полинуклеотид по п. 11, включающий последовательность SEQ ID NO: 9.
13. Полинуклеотид по п. 12, последовательность которого является кодон-оптимизированной для экспрессии в организме человека, домашних или сельскохозяйственных животных.
14. Экспрессионный вектор, включающий полинуклеотид по любому из пп. 11-13.
15. Клетка-хозяин для получения слитого белка по любому из пп. 1-10, где указанная клетка-хозяин включает экспрессионный вектор по п. 14.
16. Способ получения вирусоподобной частицы, содержащей слитый белок по любому из пп. 1-10, включающий стадии:
(a) экспрессии в клетке слитого белка по любому из пп. 1-10 и
(b) выделения VLPs из внеклеточной среды.
17. Вирусоподобная частица для лечения или профилактики заболевания, вызванного патогеном или опухолью, у субъекта, где указанная вирусоподобная частица включает слитый белок по любому из пп. 1-10 или где указанная вирусоподобная частица получена с использованием способа по п. 16.
18. Фармацевтическая композиция для лечения или профилактики заболевания, вызванного патогеном или опухолью у субъекта, включающая терапевтически эффективное количество слитого белка по любому из пп. 1-10, полинуклеотида по любому из пп. 11-13, экспрессионного вектора по п. 14 или вирусоподобной частицы по п. 17.
19. Иммуногенная композиция, включающая терапевтически эффективное количество вирусоподобной частицы по п. 17.
20. Иммуногенная композиция по п. 19, где композиция по существу не содержит фосфат алюминия.
21. Применение слитого белка по любому из пп. 1-10, полинуклеотида по любому из пп. 11-13, экспрессионного вектора по п. 14, вирусоподобной частицы по п. 17, фармацевтической композиции по п. 18 или иммуногенной композиции по п. 19 или 20 в лечении или профилактике заболевания, вызванного патогеном, или опухоли у субъекта, где патоген или опухоль содержат полипептид, представляющий интерес, или его область, предпочтительно полипептид, представляющий интерес, представляет собой полипептид ВИЧ, и инфекция представляет собой ВИЧ-инфекцию, и более предпочтительно полипептид ВИЧ включает проксимальную к мембране внешнюю область gp41 или его функционально эквивалентного варианта, имеющего по меньшей мере 50% идентичности и сохраняющего его иммуногенную активность.
22. Применение по п. 21, где субъекта предварительно лечат конъюгатом, включающим полипептид, представляющий интерес, образующий часть слитого белка, объединенного с носителем, предпочтительно носитель представляет собой KLH.
| WO 2012055985 A1, 03.05.2012 | |||
| KUCZKOWSKA K | |||
| et al., Lactobacillus plantarum displaying CCL3 chemokine in fusion with HIV-1 Gag derived antigen causes increased recruitment of T cells, Microb Cell Fact, 2015, 14:169 | |||
| ZHOU W | |||
| et al., Identification of a Membrane-Binding Domain within the Amino-Terminal Region of Human Immunodeficiency Virus Type 1 |
Авторы
Даты
2024-02-09—Публикация
2017-07-26—Подача