Данное изобретение относится к способу получения векторов, которые являются пригодными, после их трансфекции в эукариотические клетки, нацеленным образом ингибировать образование одного или нескольких белков посредством РНК-интерференции, а также подобным векторам.
Обнаруженная недавно возможность ингибирования экспрессии генов основана на создании двухцепочечных молекул РНК. При помощи этих двухцепочечных РНК (dsRNA) можно с высокой эффективностью и более быстро, чем с использованием любого другого способа, нацеленным образом выключать отдельные гены без нарушения образования белков соседних генов. Лежащий в основе принцип назван РНК-интерференцией. dsRNA-последовательность, обуславливающую этот феномен, называют siRNA (малой интерферирующей РНК).
siRNA не препятствует считыванию гена, но включает присущий клетке механизм, который парализует считываемые с гена мРНК и таким образом препятствует образованию соответствующего белка (посттранскрипционный сайленсинг гена).
Этот нацеленный распад мРНК приводится в действие короткими siRNA-молекулами с длиной 19-23 РНК-оснований, которые являются гомологичными мРНК-мишени, превращение которой в белок должно подавляться. Эти siRNA-молекулы собираются специальными эндорибонуклеазами в клеточный комплекс РНК-белок, называемый “RISC” (РНК-индуцированные комплексами сайленсинга). При создании этих комплексов обе РНК-цепи расплетаются друг от друга, вследствие чего возникают так называемые активированные RISC, которые в каждом случае содержат отдельную цепь siRNA-молекулы. Активированные RISC, которые содержат антисмысловую цепь, которая комплементарна мРНК-мишени, связываются с ней, и эндонуклеаза комплекса РНК-белок обеспечивает последовательность-специфический распад мРНК.
siRNA может создаваться экспериментально в клетке или посредством введения извне. В первом случае, это удается через синтетически полученные siRNA-молекулы, которые могут вводиться как in vitro, так и in vivo.
Однако эти способы имеют технические границы. Наряду с общей нестабильностью синтетических siRNA в среде, а также в клетке, ингибирование посредством синтетических siRNA в принципе возможно лишь временно, и многие клетки (например, нейронные клетки) могут трансфицироваться только очень неэффективно. Исследования, которые основываются на трансфекции синтетических siRNA, ограничены, поэтому, как правило, как в отношении времени 1-5 днями, так и в отношении специфичности типов клеток. Кроме того, высокая стоимость получения и большая продолжительность получения являются невыгодными.
Во-вторых, siRNA могут создаваться в клетке при помощи векторов. При этом речь идет о вирусных векторах или векторах на основе плазмид, которые только в клетке посредством экспрессии приводят к образованию siRNA-последовательностей. Преимущества в сравнении с трансфекцией синтетическими siRNA заключается в более стабильной и, при необходимости, более регулируемой транскрипции, соответствующей siRNA-последовательности.
Однако векторы на основе плазмид, наряду с низкой эффективностью трансфекции, имеют также дорогостоящий процесс получения. Так, необходимым является отбор стабильных клонов. В этом, часто затяжном процессе, который может длиться в течение месяцев, часто возникают многочисленные потенциальные трудности, которые свойственны экспериментам по клонированию. Для подтверждения продукта необходимо секвенирование, которое также является трудоемким и дорогостоящим.
Кроме того, векторы на основе плазмид содержат гены устойчивости к антибиотикам, которые необходимы для отбора. По этой причине подобные векторы не пригодны для применения в живых организмах. Возможная рекомбинация с повсюду встречающимися в организме бактериями таит в себе риск увеличивающегося возникновения устойчивых к антибиотикам бактерий. Распространение устойчивости к антибиотикам является веской проблемой и недопустимо.
Поскольку вирусные векторы способны к эффективной и нацеленной трансфекции, они обладают преимуществом в сравнении с синтетическими siRNA-молекулами, а также векторами на основе плазмид.
Однако для терапевтического применения подобные вирусные векторы применимы только с оговоркой. Здесь также рекомбинация вирусных последовательностей с природно-встречающимися вирусами представляет неотъемлемый риск в отношении безопасности, так как следует опасаться создания новых, патогенных гибридных вирусов. Кроме того, их получение также является трудоемким и дорогостоящим.
Поскольку ингибирование лишь экспрессии только одного генного продукта при использовании систем экспрессии связано с множеством осложнений, само собой разумеется, что одновременное выключение экспрессии нескольких генных продуктов в клетке или ткани должно достигаться явно более сложно и, следовательно, более трудно.
Одну из главных проблем при множественном ингибировании экспрессии генов при помощи РНК-интерференции, в случае применения нескольких независимых конструкций, представляет небольшая вероятность того, что только одна клетка трансфицируется только одной конструкцией. Эта небольшая вероятность повышается с обратной зависимостью от количества применяемых конструкций. Однако часто для определенных геннотерапевтических подходов требуется контролируемое одновременное ингибирование экспрессии генов.
Существуют множество способов, которые делают возможной котрансфекцию множественных РНК в одной клетке. Самым простым способом является котрансфекция двух независимых экспрессионных конструкций (далее называемых векторами). Другой способ состоит в трансфекции одним вектором, который несет две независимые экспрессионные кассеты. Подобные конструкции могут также использоваться для создания siRNA.
Однако при обеих возможностях существует опасность, что транскрипты значительно отличаются в отношении количества, процессинга, полупериода существования и эффективности трансляции и, следовательно, в отношении количества экспрессируемых белков, так что их применение отличается неэффективностью и плохой воспроизводимостью.
Поэтому применение подобных систем экспрессии приводило бы также к различно эффективной транскрипции siRNA, вследствие чего достигалось бы в конечном счете разное ингибирование соответствующих генов.
Конструирование ди- и полицистронных РНК с использованием элементов IRES (внутреннего сайта вхождения рибосом) предоставляет дополнительную возможность для коэкспрессии нескольких генов. Они делают возможной инициацию трансляции независимо от кэп-структуры мРНК посредством элементов последовательности. Впервые элементы IRES были обнаружены в мРНК пикорнавируса (Pelletier und Sonenberg, 1988, Nature 334: 320-325, Jang et al., 1988, Journal Virology 62: 2636-2643).
Для конструирования бицистронных векторов используют чаще всего элементы IRES полиовируса и EMCV (вируса энцефаломиокардиа) (Dirks et al., 1993, Gene 128: 247-249). Невыгодным образом их эффективность в сильной степени варьируется в зависимости от используемой клеточной линии (Borman et al., 1997, Nucleic Acids Res. 25: 925-932).
Большинство доступных бицистронных экспрессионных кассет состоят из селектируемого маркера или репортерного гена, которые расположены на 3'-стороне элемента IRES и MCS (сайта множественного клонирования) для встраивания желаемого гена (Dirks et al., 1993, Gene 128: 247-249). Известны также три- и полицистронные системы экспрессии с использованием элементов IRES (Zitvogel et al., 1994, Hum Gene Ther 5: 1493-1506, Fusseneg- ger et al., 1998a, Nature Biotechnol. 16: 468-472, Mielke et al., 2000, Gene 254. 1-8).
Однако для терапевтического применения вирусные элементы IRES применимы только с оговоркой. Рекомбинация вирусных последовательностей с природно-встречающимися вирусами также и здесь предоставляет риск безопасности, так как следует опасаться создания новых, патогенных гибридных вирусов.
Мультицистронные векторы могут быть также сконструированы присоединением единиц транскрипции без элементов IRES. Во-первых, желаемые гены могут быть клонированы в плазмидный вектор и, во-вторых, выделенные из плазмид экспрессионные кассеты могут быть присоединены через ДНК-линкер к линейным мультицистронным векторам (Tsang et al., 1997, Bio Techniques 22: 68).
Однако исследования скоростей экспрессии линейных цис-присоединенных генов показали сильное отрицательное влияние на транскрипцию подобным образом расположенных экспрессионных кассет (Esperet et al., 2000, J Biol Chem 275: 25831-25839).
Плазмидные векторы для экспрессии множественных генов отличаются от обычных плазмидных векторов количеством клонированных единиц транскрипции. При этом для этих единиц транскрипции могут использоваться промоторы или поли(А)-последовательности того же самого или отличающегося происхождения.
Недостаток, который обнаруживается при использовании отличающихся промоторов, состоит в том, что эти промоторы различаются по их силе и, следовательно, скорости экспрессии отдельных генов могут варьироваться, в то время как использование тех же самых промоторов может приводить к образованию вторичных структур ДНК, которые могут вследствие этого иметь потерю функции этих промоторов.
Общим для вышеупомянутых векторов для экспрессии множественных генов является то, что они основаны либо на плазмидах, либо на вирусных векторах. Наряду со всеми описанными недостатками существующих множественно кодирующих векторов, они имеют дополнительно недостатки векторов этого рода. Недостатки вирусных векторов, к которым относятся нестабильность аттенуированного вакцинного штамма, и недостатки плазмидных ДНК-векторов, которые с их применением создают сопутствующее расширение границ устойчивости к антибиотикам (подробно описанные в EP 0941318 B1), достаточно известны.
Поэтому были бы желательны системы экспрессии для siRNA, которые также способны к стимуляции ингибирования генной экспрессии нескольких генов. Наибольшую проблему при решении этой постановки вопроса предоставляет соединение (линкер) последовательностей для получения siRNA, которое гарантирует в каждом случае достаточную транскрипцию для ингибирования экспрессии генов этими последовательностями.
Один способ для присоединения ДНК-фрагментов при помощи элементов присоединения ДНК известен из литературы. Seeman описывает DNA-последовательности для исследования природно-встречающихся разветвлений, так называемых структур Холлидея (структур с перекрещивающимися цепями), которые постулируются как топологические особые формы В-ДНК при торсионном напряжении (Seeman: 1982, J Theor Biol 99: 237-247; Annu. Rev. Biophys. Biomol. Struct. 1998. 27:225-248). Применение этих структур ограничивалось до сих пор короткими сегментами олигонуклеотидов для исследования структурных форм ДНК.
Из DE 10048417 A1 известно полифункциональное соединение (связывание), которое описывает конъюгацию двух реакционноспособных групп при помощи линкера. В качестве биологических веществ, которые могут быть связаны таким образом, упоминаются также нуклеиновые кислоты, однако примеры показывают только применения этого изобретения для конъюгации пептидов. Другой подход включения нескольких генов для эффективной экспрессии в клетках описаны в WO 01/87348 A2. Нуклеиновые кислоты должны присоединяться ковалентными связями к супрамолекулярным структурам, так называемым дендримерам.
Следующая возможность получения векторов для siRNA показана на сайте http://www.ambion.com. Этот способ позволяет избежать вышеупомянутых недостатков. Однако этот способ получения также является продолжительным и вследствие ряда необходимых стадий амплификации соответствующих последовательностей при помощи ПЦР (полимеразной цепной реакции) очень склонным к ошибкам. Возможность получения как нежелательных, так и незаметных мутаций, которые не потенцируются процессом ПЦР, является очень высокой. Таким образом, здесь также необходимы контрольные секвенирования, которые удлиняют процесс получения и способствуют повышенным затратам.
На основании этого состояния уровня техники задачей данного изобретения является подходящий способ in vitro или in vivo синтеза одной или нескольких определенных siRNA-последовательностей, полученные этим способом экспрессионные конструкции, а также набор для проведения этого синтеза.
Эта задача решается признаками независимых пунктов формулы изобретения.
Согласно изобретению предлагается экспрессионная конструкция, которая состоит из первой структуры ДНК с замкнутыми концами (шпильками), у которой отдельная цепь из дезоксирибонуклеотидов укладывается обратно в двухцепочечную область таким образом, что эта область на одном конце имеет липкий выступ, а на другом, противолежащем конце образующие двойную цепь отдельные цепи связаны одноцепочечной петлей друг с другом, второй структуры ДНК с замкнутыми концами, которая построена аналогично первой структуре с замкнутыми концами, и одной Т-образной ДНК-структуры с тремя двухцепочечными ДНК-плечами, которые связаны через структуры Холлидея, причем по меньшей мере одно плечо содержит подлежащие транскрипции последовательности и отдельные цепи этого двухцепочечного плеча ДНК на конце, который находится напротив соединения с другими плечами, связаны друг с другом одноцепочечной ДНК-петлей, причем одно плечо имеет подходящую последовательность терминации, а другое плечо имеет последовательность промотора.
Вышеописанные компоненты представляют собой основные компоненты конструкции этого изобретения. Данное изобретение относится также к экспрессионным конструкциям, которые имеют эти компоненты, но они происходят из других комбинаций ДНК-структур.
Кроме того, предлагается экспрессионная конструкция для нацеленного ингибирования генной экспрессии при помощи РНК-интерференции, которая имеет первую структуру ДНК с замкнутыми концами, при которой отдельная цепь из дезоксирибонуклеотидов укладывается обратно в двухцепочечную область таким образом, что эта область имеет один конец с липким выступом, а на противолежащем конце имеет образующие двойную цепь отдельные цепи, связанные одноцепочечной петлей друг с другом, затем вторую структуру ДНК с замкнутыми концами, которая построена аналогично первой концевой структуре шпильки, двухцепочечная и одноцепочечная область которой состоит из подлежащей транскрипции последовательности, а также подходящей последовательности промотора и подходящей обращенно-комплементарной последовательности терминации, которые находятся между обеими вышеописанными концевыми структурами шпилек в двухцепочечной цепи ДНК.
Подобная экспрессионная конструкция имеет только одну двухцепочечную копию создаваемой siRNA. Создание siRNA при наличии только одной копии является возможным с этой конструкцией, так как подлежащие транскрипции последовательности считываются РНК-полимеразой через одноцепочечную петлю и транскрибируются. Это было бы невозможным с двухцепочечной плазмидой.
Для обеих экспрессионных конструкций по данному изобретению предусматривается, что несколько Т-образных или линейных ДНК-структур на одном конце связаны линкером посредством структур Холлидея. В этом случае предусматривается, что транскрибируемые последовательности кодируют идентичные или различные гены. Под линкером следует понимать олигонуклеотиды для соединения экспрессионных ДНК-кассет. Линкер в соответствии с данным изобретением состоит из двух или более цепей, как должно иллюстрироваться в следующем примере для линкера, образованного из трех олигонуклеотидов, которые связаны с тремя экспрессионными кассетами на связанных друг с другом цепях А, В и С: 5'-конец А имеет комплементарную 3'-концу В последовательность и образует двойную цепь, тогда как 3'-конец А спаривается с 5'-концом С и, наконец, 5'-конец В спаривается с 3'-концом С. Этот род соединения двойных цепей ДНК обозначается также как структура Холлидея (F.W. Stahl: Genetics. 1994 Oct; 138(2): 241-6), которая обладает преимуществом, заключающимся в том, что используются исключительно природно-встречающиеся структурные элементы для соединения экспрессионных кассет, что может оказаться особенно предпочтительным при применении этого изобретения для медицинских целей по токсикологическим причинам.
Используемые для ДНК-разветвлений последовательности олигодезоксинуклеотидов выбирают таким образом, что, например, при гибридизации с 5'-концами олигонуклеотида создается в каждом случае состоящий из четырех оснований выступающий, липкий конец. Последовательности липких концов могут быть различными для каждого плеча одного разветвления, но могут и не быть различными. Т-образные или линейные ДНК-структуры имеют комплементарный липкому концу выступ. За счет этого становится возможным нацеленное лигирование экспрессионных кассет на отдельные «плечи» этого разветвления.
Образованные таким образом экспрессионные кассеты этого изобретения пригодны для нацеленного, множественного ингибирования генной экспрессии различных генов. На основе идентичного строения Т-образных структур, которые в случае необходимости содержат необходимые для создания siRNA последовательности, создаются в равной степени сильные siRNA. Количество генов, экспрессия белков которых ингибируется, зависит от количества связанных друг с другом через линкер Т-образных структур.
Предпочтительно, в одном альтернативном варианте осуществления экспрессионной конструкции этого изобретения липкие концы отдельных компонентов для направленного соединения с другими компонентами выбирают специфически и различным образом. Благодаря этому становится возможным нацеленное создание желаемой экспрессионной конструкции.
Экспрессионная конструкция ДНК, которая содержит последовательности для создания одной или нескольких siRNA, может нацеленным образом трансфицировать клетки.
Под трансфекцией следует понимать внесение последовательностей нуклеиновых кислот при помощи биологических, химических или физических способов в клетку, вследствие чего происходит продолжительная или транзиторная (преходящая) экспрессия кодируемых этими последовательностями каталитически эффективных РНК-транскриптов в трансфицированной клетке.
Экспрессионные конструкции этого изобретения имеют в одном усовершенствованном варианте осуществления ковалентно связанные один или несколько пептидов, белков, углеводов, антител или стероидов. Следующим объектом данного изобретения являются способы получения экспрессионных конструкций, которые после их трансфекции в эукариотические клетки ингибируют образование определенных белков нацеленным образом посредством РНК-интерференции.
Для линейных экспрессионных конструкций предусмотрен способ, начинающийся на стадии опыта а) смешиванием двойной цепи ДНК, которая содержит единственную копию с длиной 19-23 основания последовательности гена или ее обращенно-комплементарную последовательность, а также сигнал терминации для РНК-полимераз, и замкнута на одном ее конце последовательностью в виде петли с длиной 8-12 оснований, которую выбирают таким образом, что противолежащие основания ни в одном случае не являются комплементарными друг другу и фланкирующие отдельные цепи ДНК связаны с двойной цепью ДНК, которая на другом конце имеет короткую выступающую отдельную цепь ДНК, с олигодезоксинуклеотидом, который на конце имеет короткие выступающие концы одноцепочечной ДНК в стадии опыта b), и в стадии опыта с) с промотором с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 5'-конец промотора может спариваться с олигодезоксинуклеотидом в виде шпильки или с двойной цепью из 10-1000 оснований, а одноцепочечный 3'-конец этого промотора комплементарен одноцепочечному концу описанной в а) двойной цепи ДНК, и, наконец, лигированием этих ДНК-фрагментов в стадии опыта d), а также последующей очисткой полученных векторов в последней стадии е). Необязательно, способ получения линейных экспрессионных конструкций данного изобретения построен таким образом, что перед добавлением олигодезоксинуклеотида в виде шпильки на стадии опыта с) добавляют двойную цепь ДНК с длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 3'-конец может спариваться с одноцепочечным 5'-концом промотора, а одноцепочечный 5'-конец комплементарен одноцепочечному 3'-концу олигодезоксинуклеотида в виде шпильки.
Для получения Т-образных экспрессионных конструкций, которые после их трансфекции в эукариотические клетки нацеленным образом ингибируют образование определенных белков посредством РНК-интерференции, предусмотрен способ, начинающийся на стадии опыта а) смешиванием Т-образной двойной цепи ДНК, которая содержит единственную копию с длиной 19-23 основания последовательности гена в направлении 5'-3', а также сигнал терминации для РНК-полимераз и замкнута на одном ее конце последовательностью в виде петли с длиной 8-12 оснований, которую выбирают таким образом, что противолежащие основания ни в одном случае не являются комплементарными друг другу и фланкирующие двухцепочечные области, таким образом, связаны друг с другом двумя отдельными цепями ДНК, и на другом конце имеет две короткие выступающие отдельные цепи ДНК, с одним олигодезоксинуклеотидом, последовательность которого комплементарна обеим коротким выступающим отдельным цепям ДНК и образует два коротких выступающих конца одноцепочечной ДНК, в стадии b) с одним олигодезоксинуклеотидом в виде шпильки, который на конце имеет короткие выступающие концы одноцепочечной ДНК, и в стадии с) с дополнительным олигодезоксинуклеотидом в виде шпильки, который на конце имеет короткие выступающие концы одноцепочечной ДНК, комплементарные Т-образной двойной цепи ДНК из а), и в стадии опыта d) с промотором с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 5'-конец промотора может спариваться с олигодезоксинуклеотидом в виде шпильки из b), а одноцепочечный 3'-конец промотора комплементарен одноцепочечному 5'-концу Т-образной двойной ДНК, с последующим лигированием ДНК-фрагментов в стадии опыта е), причем эта конструкция может быть получена также без двойной цепи ДНК с длиной 10-1000 оснований, а также последующей очисткой полученных векторов в следующей стадии f).
Этот способ получения имеет место в соответствии с данным изобретением после стадии опыта с) добавление двойной цепи ДНК с длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 3'-конец может спариваться с одноцепочечным 5'-концом промотора, а одноцепочечный 5'-конец комплементарен одноцепочечному 3'-концу олигодезоксинуклеотида в виде шпильки из стадии опыта b), и/или добавление двойной цепи ДНК с длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 5'-конец может спариваться с одноцепочечным 3'-концом Т-образной двойной цепи ДНК, а одноцепочечный 3'-конец комплементарен одноцепочечному 5'-концу олигодезоксинуклеотида в виде шпильки из стадии опыта с). В одном предпочтительном варианте осуществления предусмотрен способ, при котором промотор является частью бактериально амплифицированной плазмиды, которую перед смешиванием компонентов вырезают при помощи рестрикционной эндонуклеазы (рестриктазы), которая узнает фланкирующий промотор на плазмиде сайт разрезания, который не присутствует на полученной молекуле.
В основном в качестве промоторов предлагаются те промоторы, которые являются функциональными в клетках-мишенях, т.е. клетках, в которых должна ингибироваться экспрессия. Предпочтительно, эти промоторы являются происходящими из человека промоторами, если клетки или ткани человека трансфицируют экспрессионными конструкциями в соответствии с данным изобретением. Однако они могут также иметь, например, вирусное, бактериальное или паразитарное происхождение или происходить из других видов, чем виды-мишени. При этом в качестве промотора рассматриваются, в частности, но не только, U6-промотор человека, Н1-промотор человека, U6-промотор мыши, CMV-промотор и 7SK-промотор.
Кроме того, предусматривается, что в случае применения промотора в виде части бактериально амплифицируемой плазмиды стадию лигирования выполняют в присутствии рестрикционной эндонуклеазы, при помощи которой этот промотор был вырезан из плазмиды.
В одном варианте осуществления перед заключительной стадией очистки проводят расщепление реакционной смеси при помощи специфической для 3'- или 5'-концов ДНК экзонуклеазы.
При способе данного изобретения двойная цепь ДНК, которую добавляют в начале смешивания, происходит из отжига частично самокомплементарного олигодезоксинуклеотида или двух комплементарных олигодезоксинуклеотидов. Отжиг может происходить также сначала в реакционной смеси, так что в начале способа данного изобретения добавляют только одноцепочечные комплементарные олигодезоксинуклеотиды.
Последовательность олигодезоксинуклеотидов в одном предпочтительном варианте осуществления выбирают таким образом, что полученные в результате шпильки в их двухцепочечной области имеют последовательность узнавания для одной рестрикционной эндонуклеазы.
Последующая очистка полученных при помощи способа данного изобретения векторов происходит предпочтительно либо при помощи хроматографии, либо при помощи гель-электрофореза.
Если промотор применяют в виде части бактериально амплифицируемой плазмиды в способе получения по данному изобретению, то речь при этом идет в случае рестрикционной эндонуклеазы, при помощи которой промотор может быть вырезан из этой плазмиды, о ферменте группы рестрикционных эндонуклеаз класса II, предпочтительно из группы BbsI, BbvI, BbvII, BpiI, BplI, BsaI, BsmAI, BsmBI, BsmFI, BspMI, Eam1104I, EarI, Eco31I, Esp3I, FokI, HgaI, SfaNI или их изошизомерах.
Следующим объектом данного изобретения является набор для проведения способа в соответствии с данным изобретением, содержащий по меньшей мере один промотор, олигодезоксинуклеотид в форме шпильки и ферменты. В случае ферментов речь идет о лигазах, рестрикционных эндонуклеазах, рестрикционных экзонуклеазах, киназах и полимеразах или их выбранных комбинациях, в форме смеси ферментов. Дополнительно этот набор может содержать еще в зависимости от варианта осуществления средство для проведения ферментативных реакций, а также средство для очистки полученных векторов. В наборе может содержаться промотор в виде части плазмиды, из которой он может быть вырезан с использованием подходящей рестрикционной эндонуклеазы.
Кроме того, предусмотрен набор, который делает возможным синтез множественных RNAi-экспрессионных конструкций, которые содержат описанную Т-образную структуру. При этом к уже упомянутым компонентам в наборе должна содержаться также еще Т-образная структура, у которой в двухцепочечное плечо с транскрибируемой последовательностью может быть введена желаемая последовательность.
Поскольку используется линкер со структурами Холлидея, экспрессионные конструкции данного изобретения для нацеленного ингибирования генной экспрессии при помощи РНК-интерференции, пригодны для ингибирования генной экспрессии нескольких генов. На основе специального синтеза конструкций по данному изобретению транскрибируемые последовательности для образования siRNA в той же степени считывались РНК-полимеразой.
Количество генов, которые ингибируются после трансфекции конструкции множественного ингибирования, зависит от количества двухцепочечных плеч, которые содержит линкер.
Что касается данного изобретения, ни котрансфекция двух отдельных векторов, ни описанный в DE 10048417 А1 способ химического связывания друг с другом генных последовательностей вместе с необходимыми регуляторными элементами (промотором, поли(А)-сигналом) не являются очевидным уровнем техники. Правда, при котрансфекции с использованием липофекции различные векторы также приводятся в пространственную близость относительно друг друга, однако лежащий в его основе принцип этого способа является другим. Кроме того, в результате описанной химической конъюгации экспрессионных конструкций возникают невыгодным образом структуры с явно большей молекулярной массой, которые, как известно, более трудно включить в клетки. То же самое относится к описанному в WO 01/87348 А2 способу для создания содержащего нуклеиновые кислоты дендримера. Кроме того, описанный способ для создания дендримеров является многостадийным и дорогостоящим способом получения.
Следующим объектом данного изобретения является лекарственное средство, предпочтительно вакцина, которое содержит одну из экспрессионных конструкций этого изобретения. Подобные лекарственные средства могут применяться в случае человека и животного локально и системно и пригодны для лечения инфекций, например, инфекций герпесвирусов, папилломавирусов или лентивирусов, для лечения нарушений обмена веществ, таких как, например, болезнь Паркинсона или муковисцидоз, для лечения сердечно-сосудистых заболеваний, для лечения раковых заболеваний, таких как, например, карциномы, меланомы или саркомы, для лечения дополнительных заболеваний, таких как, например, дегенерация желтого пятна, и для лечения воспалений, повреждений или хирургического вмешательства, таких как, например, повреждения спинного мозга, головного мозга или других органов.
Дополнительные предпочтительные решения описаны в остальных зависимых пунктах формулы изобретения; изобретение описывается более подробно при помощи примеров осуществления и последующих фигур; показаны:
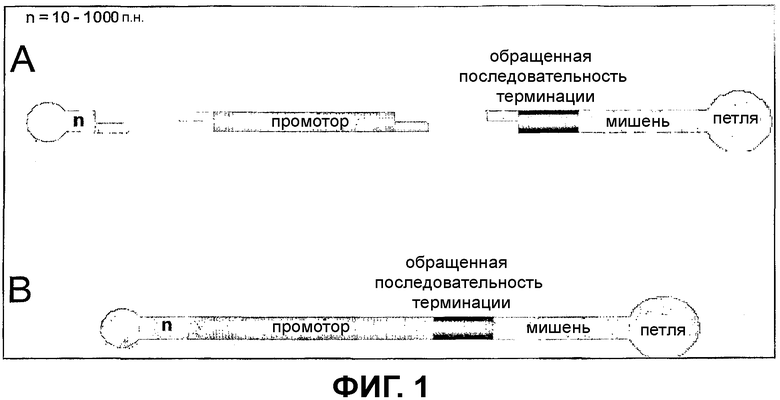
Фиг.1 - Компоненты линейных siRNA-векторов
Фиг.2 - Компоненты Т-образных siRNA-векторов
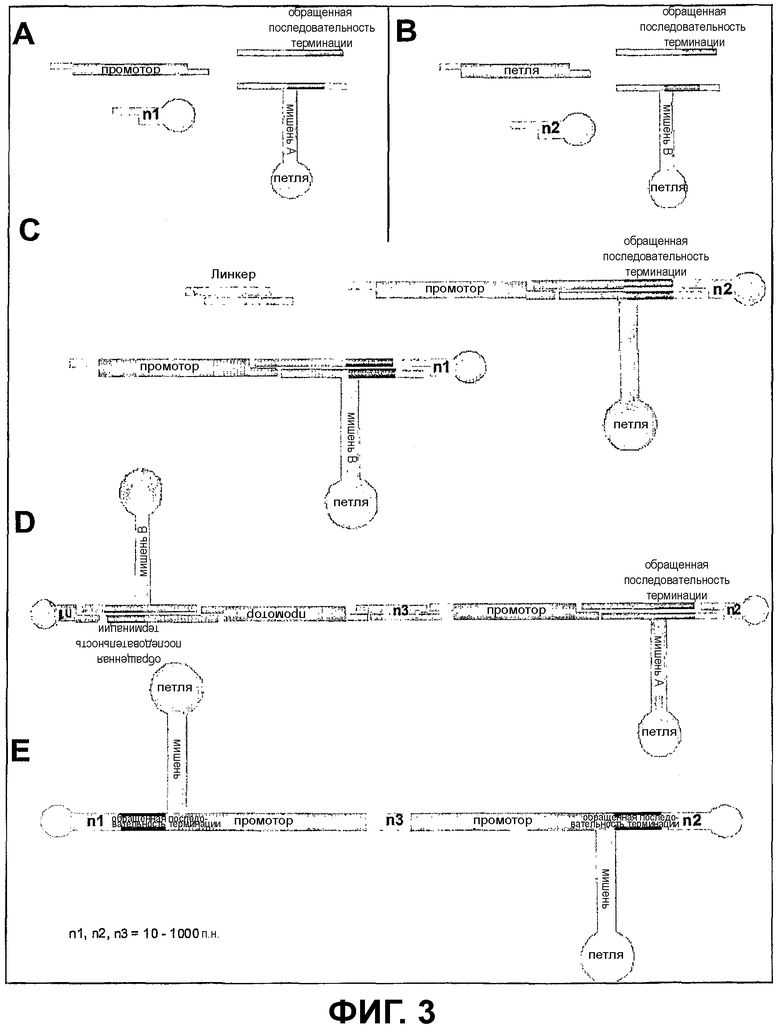
Фиг.3 - Компоненты Т-образных ди-siRNA-векторов
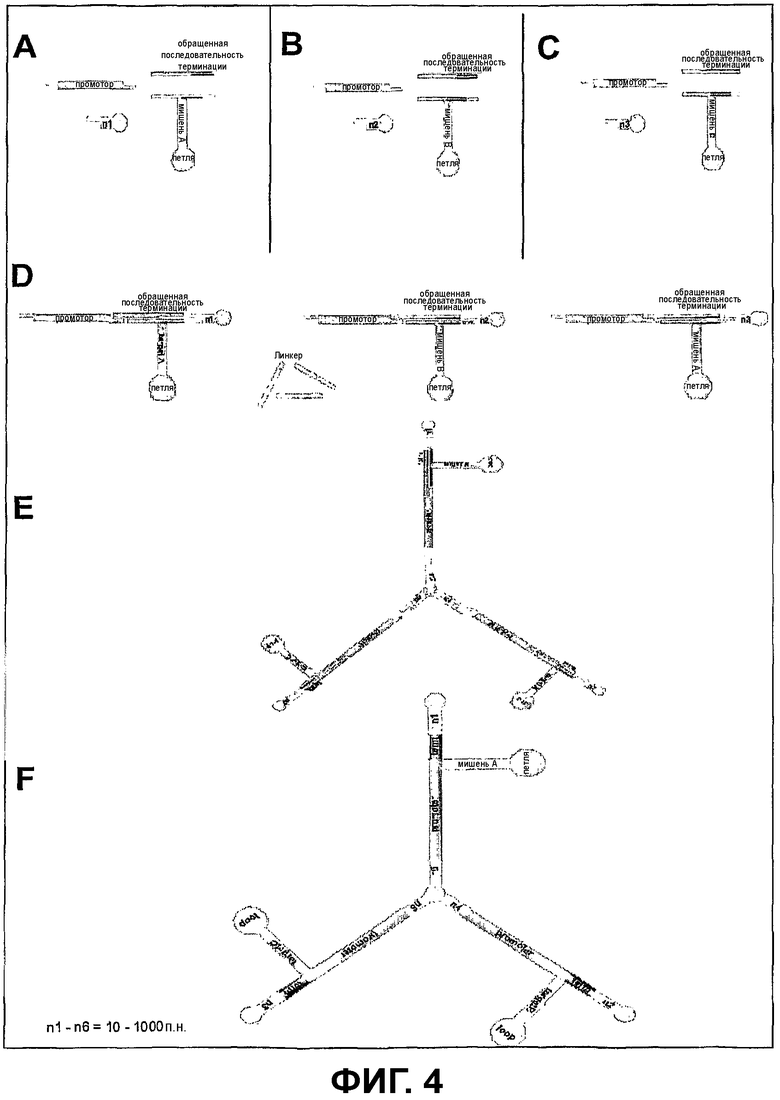
Фиг.4 - Компоненты Т-образных тройных siRNA-векторов
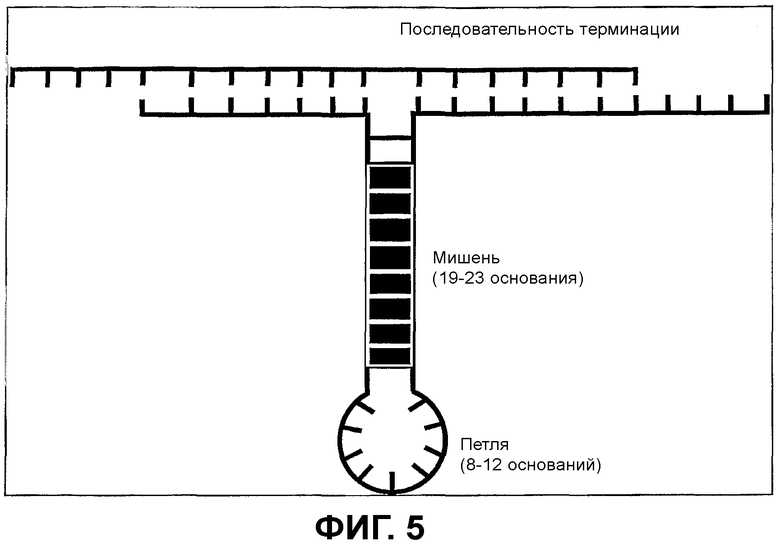
Фиг.5 - Подробное представление петли последовательности-мишени Т-образных конструкций
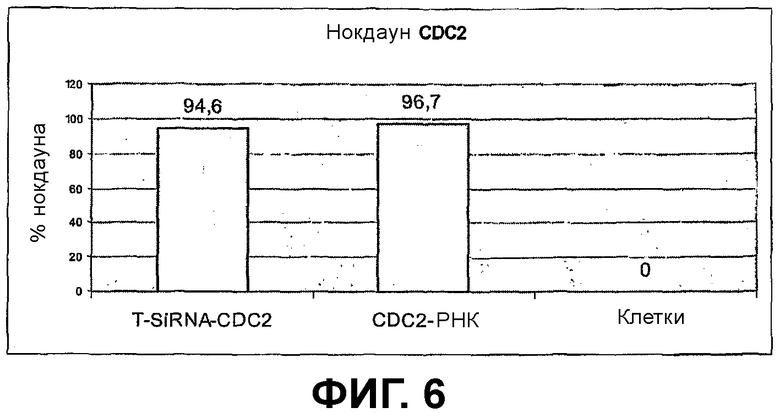
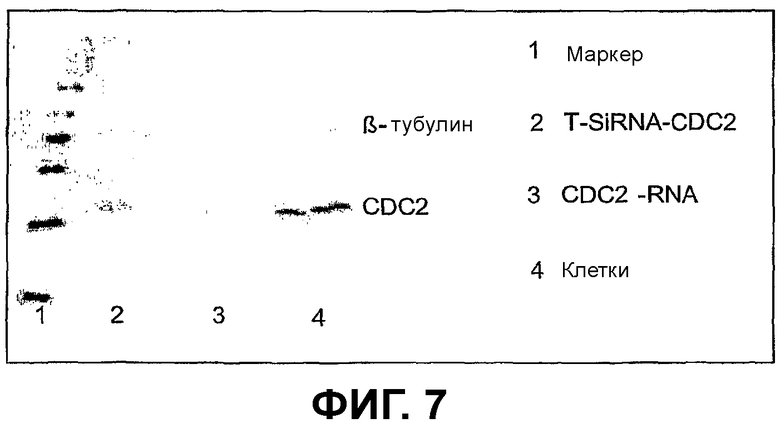
Фиг.6/7 - Экспериментальные результаты сравнения экспрессионного Т-образного siRNA-вектора (Т-siRNA-CDC2) с синтетической РНК (CDC2-РНК), которые содержат идентичные последовательности-мишени.
Фиг.1: показывает компоненты линейных siRNA-векторов.
А: Используемая в способе siRNA-последовательность, которая гомологична мРНК-мишени. Эта последовательность состоит из смысловой и антисмысловой области (мишени), последовательности-петли с длиной 8-12 оснований и обращенно-комплементарной последовательности терминации. Эта siRNA-последовательность может состоять из отдельных ODN-фрагментов, которые должны быть при помощи ферментной смеси отожжены, лигированы и необязательно фосфорилированы, она может также находиться в виде полного ODN-фрагмента.
Кроме того, представлены компоненты, которые лигируют с использованием фермента лигазы с ODN-фрагментом. При этом речь идет о последовательности промотора с соответствующими комплементарными выступами и олигодинуклеотиде в форме шпильки, комплементарный и единственный в своем роде выступ из 4 оснований, который приводит к тому, что возникает ковалентно замкнутый линейный вектор, который состоит из промотора, последовательности-мишени и последовательности терминации и замкнут на концах в форме шпильки.
Между промотором и окончательным олигонуклеотидом может быть встроена двойная цепь ДНК с длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК.
В: готовый для трансфекции конечный продукт.
Фиг.2: показывает компоненты Т-образных siRNA-векторов.
А: Используемая в способе siRNA-последовательность, которая гомологична мРНК-мишени. Эта последовательность состоит из смысловой или антисмысловой области (мишени), последовательности-петли с длиной 8-12 оснований и последовательности терминации. Эта siRNA-последовательность может состоять из отдельных ODN-фрагментов, которые должны быть при помощи ферментной смеси отожжены, лигированы и необязательно фосфорилированы, она может также находиться в виде полного ODN-фрагмента.
В/С: Кроме того, представлены компоненты, которые лигируют с использованием фермента лигазы с ODN-фрагментом. При этом речь идет о последовательности промотора с соответствующими комплементарными выступами и об олигодинуклеотидах в форме шпильки, комплементарные и единственные в своем роде выступы из 4 оснований, которые приводят к тому, что возникает ковалентно замкнутый вектор, который состоит из промотора, смысловой петли или антисмысловой петли и последовательности терминации и замкнут на концах в форме шпильки.
Между промотором и окончательным олигонуклеотидом, а также между последовательностью терминации и окончательным олигонуклеотидом может быть встроена двойная цепь ДНК с длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК.
D: готовый для трансфекции конечный продукт.
Фиг.3: показывает компоненты Т-образных мульти-siRNA-векторов (ди-конструкция).
А/В/С/D: Используемые в способе siRNA-последовательности, которые гомологичны мРНК-мишени. Эти две последовательности состоят из смысловой или антисмысловой области (мишень А, мишень В), последовательности-петли с длиной 8-12 оснований и последовательности терминации. Эти siRNA-последовательности могут состоять из отдельных ODN-фрагментов, которые должны быть при помощи ферментной смеси отожжены, лигированы и необязательно фосфорилированы, они могут также находиться в виде полного ODN-фрагмента. Кроме того, представлены компоненты, которые лигируют с использованием фермента лигазы с ODN-фрагментом. При этом речь идет о последовательности промотора с соответствующими комплементарными выступами, о линкере с двойной цепью ДНК и об олигодинуклеотидах в форме шпильки, комплементарные и единственные в своем роде выступы из 4 оснований, которые приводят к тому, что возникает ковалентно замкнутый вектор, который состоит из промотора, смысловой петли или антисмысловой петли и последовательности терминации и замкнут на концах в форме шпильки.
Между промотором и окончательным олигонуклеотидом, а также между последовательностью терминации и окончательным олигонуклеотидом, а также в каждом случае между линкером и промотором может быть встроена двойная цепь ДНК с длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК.
Е: готовый для трансфекции конечный продукт.
Фиг.4: показывает компоненты Т-образных мульти-siRNA-векторов (три-конструкция).
А/В/С/D/Е: Используемые в способе siRNA-последовательности, которые гомологичны мРНК-мишени. Эти три последовательности состоят из смысловой или антисмысловой области (мишень А, мишень В), последовательности-петли с длиной 8-12 оснований и последовательности терминации. Эти siRNA-последовательности могут состоять из отдельных ODN-фрагментов, которые должны быть при помощи ферментной смеси отожжены, лигированы и необязательно фосфорилированы, они могут также находиться в виде полного ODN-фрагмента. Кроме того, представлены компоненты, которые лигируют с использованием фермента лигазы с ODN-фрагментом. При этом речь идет о последовательности промотора с соответствующими комплементарными выступами, о линкере с двойной цепью ДНК и о олигодинуклеотидах в форме шпильки, комплементарные и единственные в своем роде выступы из 4 оснований, которые приводят к тому, что возникает ковалентно замкнутый вектор, который состоит из промотора, смысловой петли или антисмысловой петли и последовательности терминации и замкнут на концах в форме шпильки.
Между промотором и окончательным олигонуклеотидом, а также между последовательностью терминации и окончательным олигонуклеотидом, а также в каждом случае между линкером и промотором может быть встроена двойная цепь ДНК с длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК.
F: готовый для трансфекции конечный продукт.
Фиг.5: показывает подробное изображение петли последовательности-мишени Т-образных конструкций.
Фиг.6: показывает результаты эксперимента, в котором Т-образный экспрессионный siRNA-вектор (Т-siRNA-CDC2) сравнивают с синтетической РНК (CDC2-РНК), которые содержат идентичные последовательности-мишени.
мРНК СВС2 определяли при помощи количественной ПЦР реального времени после трансфекции клеток HeLa. Использовали: полученный по способу данного изобретения Т-образный siRNA-вектор, который содержит последовательность-мишень CDC2, синтетическую РНК той же самой последовательности-мишени СDC2 и необработанные клетки. Показатели представляют средние величины, которые были рассчитаны из многократных определений. В случае необработанных клеток не наблюдали ингибирования мРНК СDC2, как и ожидалось. В противоположность этому, обработанные как Т-образным siRNA-вектором, так и синтетической РНК клетки, показали значимо более низкое количество мРНК. Оно снижалось до 96,7% в сравнении с положительным контролем (необработанные клетки).
Фиг.7 показывает результаты эксперимента, в котором Т-образный экспрессионный siRNA-вектор (Т-siRNA-CDC2) сравнивают с синтетической РНК (CDC2-РНК), которые содержат идентичные последовательности-мишени.
Белок СВС2 определяли при помощи Вестерн-блота после трансфекции клеток HeLa. Использовали: полученный по способу данного изобретения Т-образный siRNA-вектор, который содержит последовательность-мишень CDC2, синтетическую РНК той же самой последовательности-мишени СDC2 и необработанные клетки. В качестве внутреннего стандарта использовали β-тубулин. В случае необработанных клеток (полоса 4) не наблюдали ингибирования мРНК СDC2, как и ожидалось. В противоположность этому, показали обработанные как Т-образной siRNA-конструкцией (полоса 2), так и синтетической РНК клетки (полоса 3) значимо более низкое количество белка CDC2.
Пример 1: Получение Т-образного siRNA-вектора для ингибирования экспрессии CDC2.
Кодирующий siRNA CDC2 вектор получали следующим образом.
Два ODN-фрагмента для CDC2 нагревали при 90°С в течение 3 минут и отжигали медленным охлаждением. Посредством этого получали кодирующую CDC2 последовательность:
SEQ ID NO:1: TGGGGTCAGCTCGTTACTCTCTC
При этом 19 оснований образуют смысловую цепь, следующие 4 основания (подчеркнутые) образуют начало последовательности петли.
Фосфорилирование PN-киназой происходило сразу после этого. Для получения 10 мкг конечного продукта использовали 3,9 микрограммов CDC2. После добавления 5,2 микрограммов H1-промотора (SEQ ID NO:2), а также 5'-фосфорилированного олигодезоксинуклеотида в виде шпильки (SEQ ID NO:3 и 4):
SEQ ID NO: 2: ATATTTGCAT GTCGCTATGT GTTCTGGGAA ATCACCATAA ACGTGAAATG TCTTTGGATT TGGGAATCTT ATAAGTTCTGT ATGAGAGCAC AGATAGGG
SEQ ID NO: 3: 5'-PH-GGG AAA GCT TAG TTT TCT AAG CTT-3' (1,3 мкг) и
SEQ ID NO: 4: 5'-PH-GTT GGA ATT CAG TTT TCT GAA TTC-3' (1,3 мкг)
эти отдельные фрагменты лигировали с использованием фермента T7-ДНК-лигазы. Полученную смесь нуклеиновых кислот обрабатывали ферментом T7-ДНК-полимеразой. Конечный продукт, экспрессирующий siRNALuc вектор, очищали колоночной хроматографией и предоставляли для трансфекции.
| название | год | авторы | номер документа |
|---|---|---|---|
| Двухцепочечная РНК, способная снижать экспрессию мутантного аллеля с.607GA гена GNAO1 человека | 2022 |
|
RU2816137C1 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ХАНТИНГТОНА | 2015 |
|
RU2711147C2 |
| РЕГУЛИРОВАНИЕ ПРОДУКТИВНЫХ ПРИЗНАКОВ У ПТИЦ | 2008 |
|
RU2518681C2 |
| АЛЛОГЕННОЕ ПРОТИВООПУХОЛЕВОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО | 2004 |
|
RU2354694C2 |
| ЛЕЧЕНИЕ HBV ИНФЕКЦИИ | 2011 |
|
RU2620966C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ БОКОВОГО АМИОТРОФИЧЕСКОГО СКЛЕРОЗА (ALS) | 2015 |
|
RU2716422C2 |
| ОПОСРЕДОВАННОЕ РНКi ИНГИБИРОВАНИЕ Rho-КИНАЗЫ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2006 |
|
RU2432165C2 |
| ДНК-ВЕКТОРЫ С ЗАМКНУТЫМИ КОНЦАМИ, ПОЛУЧАЕМЫЕ ПУТЕМ БЕСКЛЕТОЧНОГО СИНТЕЗА, И СПОСОБ ПОЛУЧЕНИЯ зкДНК-ВЕКТОРОВ | 2019 |
|
RU2820586C2 |
| iPHK-ОПОСРЕДОВАННОЕ ИНГИБИРОВАНИЕ СВЯЗАННЫХ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ АЛЬФА СОСТОЯНИЙ | 2007 |
|
RU2469090C2 |
| НУКЛЕАЗА PaCas9 | 2018 |
|
RU2706298C1 |


Изобретение относится к области генетической инженерии и может быть использовано в практических целях для ингибирования в клетках продукции целевых белков. Предложены экспрессионные ДНК-конструкции, включающие Т-образную ДНК-структуру с фрагментом (размером от 19 до 23 оснований) последовательности гена-мишени, подлежащим транскрипции с образованием siPHK, которые обеспечивают нацеленное ингибирование его экспрессии в клетке посредством РНК-интерференции. Описан способ получения ДНК-конструкций по изобретению, который не включает ПЦР-стадий и является несложной трехстадийной процедурой, проводимой в одном реакционном сосуде. 3 н. и 11 з.п. ф-лы, 7 ил.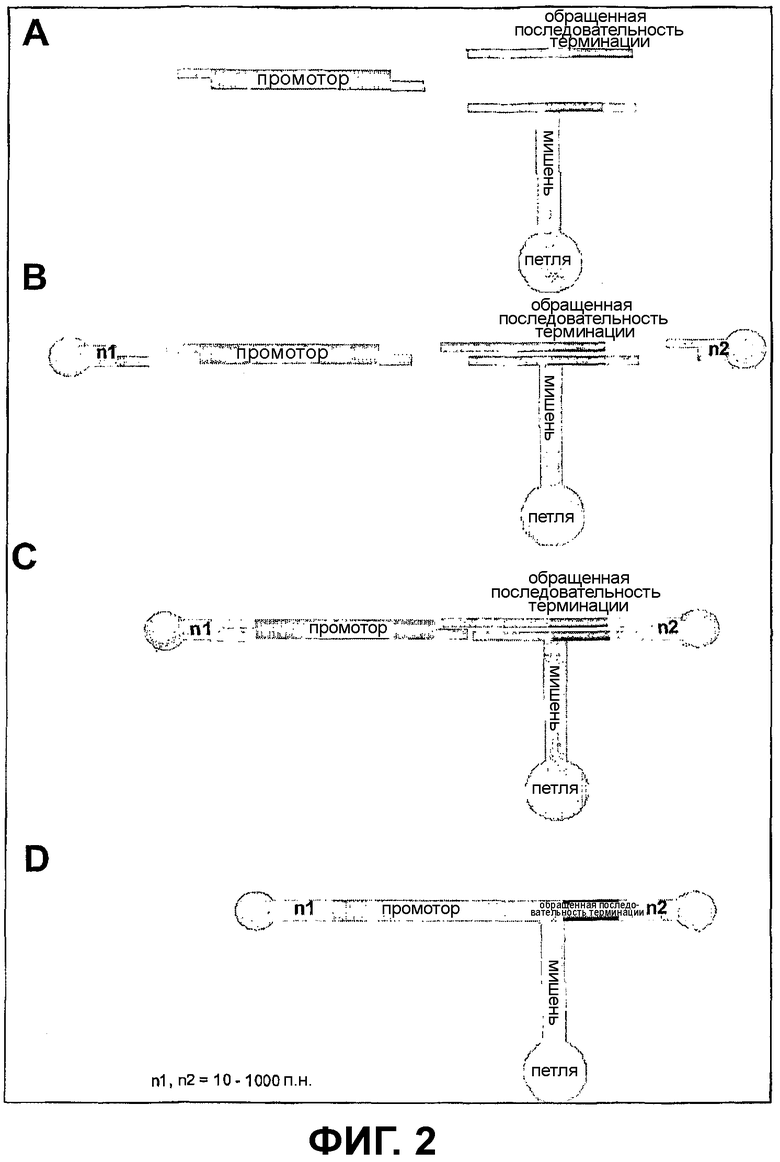
1. Экспрессионная конструкция ДНК для нацеленного ингибирования экспрессии гена с использованием РНК-интерференции, состоящая из следующих компонентов:
а) первой концевой структуры ДНК с петлей-шпилькой, в которой отдельная цепь дезоксирибонуклеотидов укладывается обратно на себя с образованием двухцепочечной области таким образом, что эта область на одном конце имеет липкий выступ, а на противолежащем конце одноцепочечную петлю,
б) второй концевой структуры ДНК с петлей-шпилькой, которая построена аналогично первой концевой структуре ДНК с петлей-шпилькой,
с) одной Т-образной ДНК-структуры с тремя двухцепочечными ДНК-плечами, которые связаны друг с другом через структуры Холлидея, причем
(i) одно плечо содержит подлежащую транскрипции последовательность, которая является единственной копией длиной 19-23 основания последовательности гена в направлении 5'-3', и отдельные цепи этого двухцепочечного плеча ДНК на конце, который находится напротив соединения с другими плечами, связаны друг с другом одноцепочечной ДНК-петлей, и
(ii) оба других плеча имеют липкие концы, причем одно плечо имеет подходящую последовательность терминации, а другое плечо имеет подходящую последовательность промотора.
2. Экспрессионная конструкция ДНК по п.1, в которой липкие концы отдельных компонентов для нацеленного соединения с другими компонентами выбраны специфическими и отличными.
3. Экспрессионная конструкция ДНК для нацеленного ингибирования экспрессии гена по п.1, в которой защита от расщепления экзонуклеазами достигается использованием короткой одноцепочечной области из 3-8 дезоксинуклеотидов, которая ковалентно связывает друг с другом две цепи линейной двухцепочечной области.
4. Экспрессионная конструкция ДНК для нацеленного ингибирования экспрессии гена по п.1, в которой короткая одноцепочечная область ковалентно связана с одним или несколькими пептидами, белками, углеводами, антителами или стероидами.
5. Способ получения экспрессионной конструкции ДНК для нацеленного ингибирования экспрессии гена, отличающийся следующими стадиями способа:
а) смешивание Т-образной двойной цепи ДНК, которая содержит подлежащую транскрипции последовательность, которая является единственной копией длиной 19-23 основания последовательности гена в направлении 5'-3', а также сигнал терминации для РНК-полимераз и замкнута на одном ее конце последовательностью в виде петли длиной 8-12 оснований, которую выбирают таким образом, что противолежащие основания ни в одном случае не являются комплементарными друг другу и фланкирующие двухцепочечные области связаны друг с другом двумя отдельными цепями ДНК, а на другом конце имеет две короткие выступающие отдельные цепи ДНК, и одного олигодезоксинуклеотида, последовательность которого комплементарна обеим коротким выступающим отдельным цепям ДНК и образует два коротких выступающих конца одноцепочечной ДНК, с
(i) одним олигодезоксинуклеотидом в виде шпильки, который на конце имеет короткие выступающие концы одноцепочечной ДНК,
(ii) дополнительным дезоксинуклеотидом в виде шпильки, который на конце имеет короткие выступающие концы одноцепочечной ДНК, комплементарные Т-образной двойной цепи ДНК, и
(iii) двуцепочечной ДНК, содержащей промотор с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 5'-конец промотора может спариваться с олигодезоксинуклеотидом в виде шпильки из (i), а одноцепочечный 3' -конец промотора комплементарен одноцепочечному 5' -концу Т-образной двойной ДНК,
b) последующее лигирование ДНК-фрагментов, и
c) последующая очистка полученных экспрессионных конструкций.
6. Способ получения по п.5, в котором компонент iii) представляет собой двойную цепь ДНК с длиной 10-1000 оснований (=n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 3' -конец может спариваться с одноцепочечным 5' -концом промотора, а одноцепочечный 5' -конец комплементарен одноцепочечному 3' -концу олигодезоксинуклеотида в виде шпильки (i), и/или добавляют двойную цепь ДНК длиной 10-1000 оснований (= n) некодирующей последовательности с короткими выступающими концами одноцепочечной ДНК, причем одноцепочечный 5'-конец может спариваться с одноцепочечным 3'-концом Т-образной двойной цепи ДНК, а одноцепочечный 3'-конец комплементарен одноцепочечному 5' -концу олигодезоксинуклеотида в виде шпильки (ii).
7. Способ по п.5, в котором промотор является частью бактериально амплифицируемой плазмиды и перед смешиванием соответствующих компонентов был вырезан рестрикционной эндонуклеазой, которая узнает интерфейс, фланкирующий промотор на плазмиде, который не присутствует на экспрессионной конструкции, подлежащей синтезу.
8. Способ по п.5, в котором соответствующая стадия лигирования происходит в присутствии рестрикционной эндонуклеазы, с помощью которой промотор был вырезан из плазмиды.
9. Способ по п.5, в котором перед окончательной стадией очистки осуществляют расщепление реакционной смеси с использованием специфической исключительно в отношении 3' или 5'-концов ДНК экзонуклеазы.
10. Способ по одному из пп.7-9, в котором рестрикционная эндонуклеаза представляет собой фермент группы рестрикционных эндонуклеаз класса II, предпочтительно фермент из группы BbsI, BbvI, BbvII, BpiI, BplI, BsaI, BsmAI, BsmBI, BsmFI, BspMI, Eam1104I, EarI, Есо31I, Esp3I, FokI, HgaI, SfaNI или их изошизомеров.
11. Способ по п.5, в котором при смешивании компонентов добавляют двойную цепь ДНК, которую получают из частичного отжига частично самокомплементарного олигодезоксинуклеотида или по меньшей мере двух олигодезоксинуклеотидов.
12. Способ по п.5, в котором олигодезоксинуклеотиды в форме шпильки в их двухцепочечной области имеют последовательность узнавания для рестрикционной эндонуклеазы.
13. Способ по п.5, в котором очистку осуществляют с использованием хроматографии и/или гель-электрофореза.
14. Набор для получения экспрессионной конструкции по п.1, содержащий по меньшей мере два олигонуклеотида, подходящих для образования концевых структур с петлей-шпилькой, Т-образную ДНК-структуру, которая содержит подлежащие транскрипции последовательности, а также ферменты и средства для проведения ферментных стадий, таких как лигирование, сплайсинг, деградация ДНК и очистка.
| US 6451593 B1, 17.09.2002 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2011-01-27—Публикация
2006-11-22—Подача