Область техники, к которой относится изобретение
Настоящее изобретение относится к способам регулирования признаков, особенно продуктивных признаков, у птиц, таких как куры. В частности, изобретение относится к доставке in ovo молекулы дцРНК (dsRNA), особенно молекул миРНК (siRNA), для регулирования продуктивных признаков у имеющих коммерческое значение птиц.
Предшествующий уровень техники
Человек изменял фенотипические характеристики домашних животных путем селекции племенного поголовья на протяжении многих поколений с тех пор, как животные были одомашнены. Это привело к усовершенствованию количественных параметров продуктивности, таких как размеры тела и мышечная масса. Многие инновации последнего времени в области регулирования продуктивных признаков домашней птицы и/или повышения устойчивости к патогенам были сфокусированы на трансгенных подходах, однако многих потребителей беспокоит использование генетически модифицированных организмов.
Поставщики кур нуждались в эффективном экономичном способе определения пола однодневных цыплят. Различные поставщики использовали определение пола цыплят путем исследования клоаки и путем исследования оперения, однако данные способы оказались крайне экономически невыгодными, поскольку требовали значительных затрат времени и труда при разделении цыплят мужского и женского пола. Использование зондов (US 5508165) также является дорогостоящей процедурой и нецелесообразно с экономической точки зрения. Другим способом определения пола цыплят является просвечивание анальных областей цыплят (US 4417663), однако это тоже дорого и требует затрат времени, поскольку каждого цыпленка берут в руки для проведения процедуры. Используют экспертов, способных определять пол цыпленка по оперению, но такие эксперты обходятся дорого, и определение пола по оперению занимает много времени.
Существует потребность в способах регулирования продуктивных признаков у домашней птицы, которые не приведут к трансформации генома птицы, но могут быть интенсифицированы в процессе осуществления.
Сущность изобретения
Авторы настоящего изобретения с удивлением обнаружили, что введение подходящей молекулы нуклеиновой кислоты, содержащей двухцепочечную область, в яйцо птицы может модифицировать фенотип развивающегося эмбриона.
Таким образом, в первом аспекте настоящее изобретение относится к способу изменения признака у птицы, включающему введение в яйцо птицы по меньшей мере одной молекулы нуклеиновой кислоты, содержащей двухцепочечную область, где молекула нуклеиновой кислоты приводит к уменьшению уровня по меньшей мере одной молекулы РНК и/или белка в яйце.
В другом аспекте настоящее изобретение относится к способу изменения признака у птицы, включающему введение в яйцо птицы по меньшей мере одной молекулы РНК, содержащей двухцепочечную область, где молекула РНК приводит к уменьшению уровня по меньшей мере одной молекулы РНК и/или белка в яйце и где способ не включает электропорацию яйца.
В следующем аспекте настоящее изобретение относится к способу изменения признака у птицы, включающему введение в яйцо птицы по меньшей мере одной молекулы РНК, содержащей двухцепочечную область (дцРНК), где молекула РНК приводит к уменьшению уровня по меньшей мере одной молекулы РНК и/или белка в яйце и где молекулу РНК вводят в воздушный мешок, желточный мешок или аллантоисную жидкость хориона.
В предпочтительном варианте осуществления молекула нуклеиновой кислоты представляет собой дцРНК. Более предпочтительно, дцРНК представляет собой миРНК (siRNA) или мшРНК (shRNA).
В следующем предпочтительном варианте осуществления признак представляет собой продуктивный признак. Примеры продуктивных признаков включают, но не ограничиваются ими, мышечную массу или пол.
В одном из вариантов осуществления продуктивный признак представляет собой пол, и молекула нуклеиновой кислоты уменьшает уровень белка, кодируемого геном DMRT1.
В одном из вариантов осуществления продуктивный признак представляет собой пол, и молекула нуклеиновой кислоты уменьшает уровень белка, кодируемого геном WPKCI (ASW).
В другом варианте осуществления продуктивный признак представляет собой мышечную массу, и молекула нуклеиновой кислоты уменьшает уровень белка, кодируемого геном миостатина.
Предпочтительно, молекулу нуклеиновой кислоты вводят инъекцией.
Птица может принадлежать к любому виду класса Aves. Примеры включают, но не ограничиваются ими, кур, уток, индеек, гусей, бентамок и перепелок. В особенно предпочтительном варианте осуществления птица представляет собой курицу.
В следующем аспекте настоящее изобретение относится к птице, полученной при помощи способа по изобретению.
В другом аспекте настоящее изобретение относится к курице, полученной при помощи способа по изобретению.
В еще одном аспекте настоящее изобретение относится к выделенной и/или экзогенной молекуле нуклеиновой кислоты, содержащей двухцепочечную область, которая уменьшает уровень по меньшей мере одной молекулы РНК и/или белка при введении в яйцо птицы.
Предпочтительно, молекула нуклеиновой кислоты представляет собой молекулу дцРНК. Более предпочтительно, дцРНК представляет собой миРНК или мшРНК.
В одном из вариантов осуществления молекула нуклеиновой кислоты уменьшает уровень белка, кодируемого геном DMRT1 или геном миостатина.
Также предложен вектор, кодирующий молекулу нуклеиновой кислоты, или одну ее цепочку, по изобретению. Такие векторы можно использовать в клетке-хозяине или бесклеточной экспрессионной системе для получения молекул нуклеиновой кислоты, полезных для способа по изобретению.
В другом аспекте настоящее изобретение относится к клетке-хозяину, содержащей экзогенную молекулу нуклеиновой кислоты или одну ее цепочку по изобретению и/или вектор по изобретению.
В другом аспекте настоящее изобретение относится к композиции, содержащей молекулу нуклеиновой кислоты или одну ее цепочку по изобретению, вектор по изобретению и/или клетку-хозяина по изобретению.
В следующем аспекте настоящее изобретение относится к яйцу птицы, содержащему молекулу нуклеиновой кислоты или одну ее цепочку по изобретению, вектор по изобретению и/или клетку-хозяина по изобретению.
В другом аспекте настоящее изобретение относится к набору, содержащему молекулу нуклеиновой кислоты или одну ее цепочку по изобретению, вектор по изобретению, клетку-хозяина по изобретению и/или композицию по изобретению.
Очевидно, что предпочтительные признаки и характеристики одного аспекта применимы ко многим другим аспектам изобретения.
На протяжении всего описания слово «содержать» или его вариации, такие как «содержит» или «содержащий», следует понимать как включение указанного элемента, числа или этапа либо группы элементов, чисел или этапов, но не исключение любого другого элемента, числа или этапа либо группы элементов, чисел или этапов.
Далее в данном документе изобретение описано при помощи следующих не ограничивающих примеров со ссылками на сопроводительные фигуры.
Краткое описание сопроводительных рисунков
Фигура 1 - ПЦР экспрессионных полигенных кластеров мшРНК. Схематичное изображение стратегии ПЦР, используемой для получения экспрессионных векторов мшРНК. В ПЦР использовали прямые праймеры в паре с обратными праймерами, с включением всех компонентов мшРНК. Все конечные продукты ПЦР состояли из промотора U6 кур, смысловой последовательности мшРНК, петли, антисмысловой последовательности мшРНК, последовательности терминации и сайта XhoI.
Фигура 2 - Тестирование выбранных молекул мшРНК на нокдаун экспрессии слитого гена EGFP-Dmrt1. Средняя интенсивность флуоресценции для каждого состояния трансфекции выражена относительно pEGFP-Dmrt1. Планки погрешностей отражают стандартную ошибку, вычисленную для каждого отдельного эксперимента, выполненного в трех повторах.
Фигура 3 - Тестирование выбранных молекул мшРНК на нокдаун экспрессии слитого гена EGFP-Gdf8. Клетки DF1 трансфицировали: панель 1, только pEGFP-C; панель 2, только транскрипционная слитая конструкция pEGFP-Gdf8; панели 3-6 pEGFP-Gdf8 либо с pshEGFP либо с экспрессионными плазмидами мшРНК, специфических для Gdf8, pshGdf8-258, pshGdf8-913 и pshGdf8-1002. Микроскопическое исследование выполняли с использованием флуоресцентного микроскопа Leica DM LB (Leica Microsystems, Germany) и изображения фиксировали при 50× увеличении, используя цветную цифровую камеру Leica DC300F (Leica Microsystems, Germany) и программное обеспечение для обработки изображений Photoshop 7.0 (Adobe®).
Ключ к списку последовательностей
SEQ ID №:1 - куриный миостатин (Genbank NM_001001461).
SEQ ID №:2 - нуклеотидная последовательность, кодирующая куриный миостатин (Genbank NM_001001461).
SEQ ID №:3 - частичная последовательность куриного белка DMRT1 (Genbank AF 123456).
SEQ ID №:4 - частичная нуклеотидная последовательность, кодирующая куриный DMRT1 (Genbank AF123456).
SEQ ID №:5 - куриный WPKCI (ASW) (Genbank AF148455).
SEQ ID №:6 - нуклеотидная последовательность, кодирующая куриный WPKCI (ASW) (Genbank AF148455).
SEQ ID №: 7 - нуклеотидная последовательность промотора U6-1 кур.
SEQ ID №: 8 - нуклеотидная последовательность промотора U6-3 кур.
SEQ ID №: 9 - нуклеотидная последовательность промотора U6-4 кур.
SEQ ID №: 10 - нуклеотидная последовательность промотора 7SK кур.
SEQ ID №№ 11-98 и 113-122 - последовательности РНК, применимые по изобретению.
SEQ ID №№ 99-112 - олигонуклеотидные праймеры.
Подробное описание изобретения
Общие методы и определения
Если специально не указано иное, все технические и научные термины, используемые в данном документе, следует воспринимать как имеющие общепринятое в данной области значение (например, в культуре клеток, молекулярная генетика, биология птиц, РНК-интерференция и биохимия).
Если специально не указано иное, получение рекомбинантных белков, культивирование клеток и иммунологические методы, используемые по настоящему изобретению, являются стандартными методами, хорошо известными специалистам в данной области. Такие методы описаны и разъяснены в таких литературных источниках, как J. Perbal, A Practical Guide to Molecular Cloning, John Wiley and Sons (1984), J. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1989), T. A. Brown (издатель), Essential Molecular Biology: A Practical Approach, тома 1 и 2, IRL Press (1991), D.M. Glover and B.D. Hames (издатели), DNA Cloning: A Practical Approach, тома 1-4, IRL Press (1995 и 1996) и F.M. Ausubel et al. (издатели), Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience (1988, включая все переиздания до настоящего времени), Ed Harlow and David Lane (издатели).
Термин «птичий» в данном документе относится к любым видам, подвидам или родам организмов из таксономического класса Aves, таким как, но не ограничиваясь ими, куры, индейки, утки, гуси, перепелки, фазаны, попугаи, вьюрки, ястребы, вороны и бескилевые птицы, включая страуса эму и казуара. Термин охватывает различные известные породы Gallus gallus (куры), например, белый леггорн, бурый леггорн, полосатый плимутрок, суссекс, нью-гемпшир, род-айленд, австралорп, корниш, минорка, амрокс, калифорнийская серая, итальянские куропаточные, а также породы индеек, фазанов, перепелок, уток, страусов и другой домашней птицы, обычно разводимой в коммерчески значимых количествах.
В данном документе термин «яйцо» означает оплодотворенную яйцеклетку, отложенную птицей. Как правило, птичьи яйца состоят из твердой овальной внешней скорлупы, «яичного белка» или альбумина, яичного желтка и различных тонких мембран. Кроме того, «in ovo» означает «в яйце».
Термины «уменьшает», «уменьшение» или их вариации в данном документе означают ощутимое уменьшение количества целевой РНК и/или целевого белка в яйце по сравнению с яйцом того же вида птиц, более предпочтительно, рода или породы птиц, и даже более предпочтительно, той же самой птицы, которой не вводили нуклеиновую кислоту, как определено в данном документе. Термин также относится к ощутимому снижению активности целевого белка. Предпочтительно, уменьшение уровня целевой РНК и/или целевого белка составляет по меньшей мере примерно 10%. Более предпочтительно, уменьшение составляет по меньшей мере примерно 20%, 30%, 40%, 50%, 60%, 80%, 90% и, даже более предпочтительно, примерно 100%.
В данном документе фраза «молекула нуклеиновой кислоты приводит к уменьшению» или ее вариации означают присутствие молекулы нуклеиновой кислоты в яйце, которое вызывает деградацию гомологичных молекул РНК в яйце в результате процесса, известного в данной области как «РНК-интерференция» или «выключение гена». Кроме того, молекула нуклеиновой кислоты напрямую приводит к уменьшению и не транскрибируется in ovo, вызывая желаемый эффект.
«По меньшей мере одна молекула РНК» может представлять собой любой тип РНК, присутствующий в яйце птиц и/или продуцируемый им. Примеры включают, но не ограничиваются ими, мРНК, кяРНК (snRNA), микроРНК и тРНК.
В данном документе термин «продуктивный признак» относится к любому фенотипическому признаку птиц, который имеет коммерческую ценность, такому как мышечная масса, пол и пищевая ценность.
В данном документе термин «мышечная масса» означает вес мышечной ткани. Увеличение мышечной массы можно определять путем взвешивания всей мышечной ткани птицы, которая высижена из яйца, обработанного, как описано в данном документе, по сравнению с птицей из того же вида птиц, более предпочтительно, рода или породы птиц, и даже более предпочтительно, с той же птицей, которой не вводили нуклеиновую кислоту, как указано в данном документе. Альтернативно, специфические мышцы, такие как мышцы грудки и/или лап, можно использовать для выявления увеличения мышечной массы. Предпочтительно, способы по изобретению увеличивают мышечную массу по меньшей мере примерно на 1%, 2,5%, 5%, 7,5% и, даже более предпочтительно, примерно на 10%.
«Вариант» молекулы нуклеиновой кислоты по изобретению включает молекулы варьирующих размеров и/или с одним или большим количеством отличающихся нуклеотидов, но которые все еще можно использовать для выключения целевого гена. Например, варианты могут содержать дополнительные нуклеотиды (например, 1, 2, 3, 4 или более) либо меньшее количество нуклеотидов. Кроме того, несколько нуклеотидов могут быть заменены без влияния на способность нуклеиновой кислоты выключать целевой ген. В одном из вариантов осуществления вариант содержит дополнительные 5' и/или 3' нуклеотиды, которые гомологичны соответствующей целевой молекуле РНК и/или которые повышают стабильность молекулы нуклеиновой кислоты. В другом варианте осуществления молекулы нуклеиновой кислоты имеют не более чем 4, более предпочтительно, не более чем 3, более предпочтительно, не более чем 2 и, даже более предпочтительно, не более чем 1 различие в нуклеотидах по сравнению с предложенной в данном документе последовательностью. В следующем варианте осуществления молекулы нуклеиновой кислоты имеют не более чем 2, и более предпочтительно, не более чем 1, внутренних дополнительных и/или делетированных нуклеотидов по сравнению с последовательностями, предложенными в данном документе.
Под «выделенной молекулой нуклеиновой кислоты» авторы изобретения понимают молекулу нуклеиновой кислоты, которая, по меньшей мере частично, отделена от молекулы нуклеиновой кислоты, с которой она ассоциирована или связана в своем естественном состоянии. Предпочтительно, выделенная молекула нуклеиновой кислоты по меньшей мере на 60% свободна, предпочтительно, по меньшей мере на 75% свободна и наиболее предпочтительно, по меньшей мере на 90% свободна от других компонентов, с которыми она ассоциирована в естественном состоянии. Кроме того, термин «полинуклеотид» в данном документе используется взаимозаменяемо с термином «нуклеиновая кислота».
Термин «экзогенный» в контексте молекулы нуклеиновой кислоты означает молекулу нуклеиновой кислоты, присутствующую в клетке или в бесклеточной экспрессионной системе в измененных количествах. Предпочтительно, клетка представляет собой клетку, которая обычно не содержит данную молекулу нуклеиновой кислоты. Однако клетка может представлять собой клетку, которая содержит экзогенную молекулу нуклеиновой кислоты вследствие повышенного количества молекулы нуклеиновой кислоты. Экзогенная молекула нуклеиновой кислоты по изобретению включает молекулы нуклеиновой кислоты, которые не были отделены от других компонентов рекомбинантной клетки или бесклеточной экспрессионной системы, в которой они присутствуют, и молекулы нуклеиновой кислоты, продуцируемые в таких клетках или бесклеточных системах, которые затем очищают, по меньшей мере, от некоторых других компонентов.
Выключение генов (Gene silencing)
Термины «РНК-интерференция», «РНКи» или «выключение генов», в основном, относятся к процессу, при котором молекула двухцепочечной РНК (дцРНК) (dsRNA) уменьшает экспрессию последовательности нуклеиновой кислоты, с которой молекула двухцепочечной РНК обладает существенной или полной гомологией. Однако недавно показано, что выключения гена можно достичь, используя двухцепочечные молекулы не-РНК (смотрите, например, US 20070004667).
РНК-интерференция (РНКи) особенно полезна для специфического ингибирования продукции конкретной РНК и/или белка. Хотя и без намерения ограничиваться теорией, Waterhouse et al. (1998) предложили модель для механизма, посредством которого дцРНК (дуплексную РНК) можно использовать для уменьшения продукции белка. Данная методика основана на присутствии молекул дцРНК, которые содержат последовательность, которая в основном идентична мРНК интересующего гена или его части, в данном случае мРНК, кодирующей полипептид по изобретению. Удобно получать дцРНК с одного промотора в рекомбинантном векторе или клетке-хозяине, где смысловые и антисмысловые последовательности фланкированы посторонней последовательностью, которая позволяет смысловым и антисмысловым последовательностям гибридизоваться с образованием молекулы дцРНК с посторонней последовательностью, образующей петлевую структуру. Разработка и получение подходящих молекул дцРНК для настоящего изобретения вполне находится в компетенции специалиста в данной области, особенно принимая во внимание Waterhouse et al. (1998), Smith et al. (2000), WO 99/32619, WO 99/53050, WO 99/49029 и WO 01/34815.
Настоящее изобретение охватывает молекулы нуклеиновой кислоты, содержащие и/или кодирующие двухцепочечные области для выключения генов. Молекулы нуклеиновой кислоты, как правило, представляют собой РНК, но могут представлять собой ДНК, химически модифицированные нуклеотиды и не нуклеотиды.
Двухцепочечные области должны быть длиной по меньшей мере 19 последовательных нуклеотидов, например примерно 19-23 нуклеотида, либо могут быть длиннее, например 30 или 50 нуклеотидов или 100 нуклеотидов или более. Можно использовать полноразмерную последовательность, соответствующую полному транскрипту гена. Предпочтительно, они составляют примерно от 19 примерно до 23 нуклеотидов в длину.
Степень идентичности двухцепочечной области молекулы нуклеиновой кислоты целевому транскрипту должна составлять по меньшей мере 90% и, более предпочтительно, 95-100%. Процент идентичности молекулы нуклеиновой кислоты определяют при помощи GAP (Needleman and Wunsch, 1970) анализа (программа GCG) со штрафом за создание разрыва в последовательности = 5 и со штрафом за удлинение разрыва = 0,3. Предпочтительно, две последовательности выравнивают по всей их длине.
Безусловно, молекула нуклеиновой кислоты может содержать посторонние последовательности, которые могут служить для стабилизации молекулы.
Термин «малая интерферирующая РНК» или «миРНК» в данном документе означает молекулу нуклеиновой кислоты, которая содержит рибонуклеотиды, способные ингибировать или регулировать в сторону уменьшения экспрессию генов, например, опосредуя РНКи специфическим для последовательности образом, в которой двухцепочечная область составляет менее 50 нуклеотидов в длину, предпочтительно, примерно от 19 примерно до 23 нуклеотидов в длину. Например, миРНК может представлять собой молекулу нуклеиновой кислоты, содержащую самокомплементарные смысловую и антисмысловую области, где антисмысловая область содержит нуклеотидную последовательность, которая является комплементарной нуклеотидной последовательности в целевой молекуле нуклеиновой кислоты или ее части, а смысловая область имеет нуклеотидную последовательность, соответствующую целевой последовательности нуклеиновой кислоты или ее части. Молекула миРНК может быть собрана из двух отдельных олигонуклеотидов, где одна цепочка представляет собой смысловую цепочку, а другая представляет собой антисмысловую цепочку, где антисмысловая и смысловая цепочки являются самокомплементарными.
В данном документе термин миРНК предназначен быть эквивалентным другим терминам, используемым для описания молекул нуклеиновой кислоты, которые способны опосредовать специфичную для последовательности РНКи, например, микроРНК (микроРНК), малая [короткая] шпилечная РНК (мшРНК), малый [короткий] интерферирующий олигонуклеотид, малая [короткая] интерферирующая нуклеиновая кислота (миНК) (siNA), малый интерферирующий модифицированный олигонуклеотид, химически модифицированная миРНК, посттранскипционная выключающая ген РНК (птвгРНК) (ptgsRNA) и другие. Кроме того, как используют в данном документе, термин РНКи предназначен быть эквивалентным другим терминам, используемым для описания специфической для последовательности РНК-интерференции, таким как посттранскипционное выключение гена, трансляционное ингибирование или эпигенетика. Например, молекулы миРНК по изобретению можно использовать для эпигенетического выключения генов как на посттранскипционном уровне, так и на претранскрипционном уровне. В не ограничивающем примере эпигенетическая регуляция экспрессии гена при помощи молекул миРНК по изобретению может происходить в результате опосредованной миРНК модификации структуры хроматина для изменения экспрессии гена.
Предпочтительные молекулы малой интерферирующей РНК («миРНК») содержат нуклеотидную последовательность, которая идентична примерно 19-23 последовательным нуклеотидам целевой мРНК. В одном из вариантов осуществления изобретения последовательность целевой мРНК начинается с динуклеотида AA, имеет содержание GC примерно 30-70% (предпочтительно, 30-60%, более предпочтительно, 40-60%, и более предпочтительно, примерно 45%-55%) и не обладает высоким процентом идентичности с любой нуклеотидной последовательностью, отличной от целевой последовательности, в геноме птицы (предпочтительно, кур), которой ее будут вводить, например, как определяют стандартным поиском BLAST.
Под «мшРНК» или «малой шпилечной РНК» подразумевают молекулу миРНК, где менее чем примерно 50 нуклеотидов, предпочтительно, примерно от 19 примерно до 23 нуклеотидов образуют пары оснований с комплементарной последовательностью, расположенной на той же молекуле РНК, и где указанная последовательность и комплементарная последовательность разделены не спаренной областью из по меньшей мере примерно 4-15 нуклеотидов, которая образует одноцепочечнную петлю над «стеблевой» структурой, созданной двумя областями комплементарных оснований. Примерами последовательностей одноцепочечных петель являются 5' UUCAAGAGA 3' и 5' UUUGUGUAG 3'.
В мшРНК включены двойные или двухпальцевые и многопальцевые шпилечные дцРНК, в которых молекула РНК содержит две или более такие структуры типа «стебель с петлей», разделенные одноцепочечными спейсерными областями.
Существуют устоявшиеся критерии для проектирования миРНК (смотрите, например, Elbashire et al., 2001; Amarzguioui et al., 2004; Reynolds et al., 2004). Подробности можно найти на сайтах некоторых коммерческих поставщиков, таких как Ambion, Dharmacon, GenScript и OligoEngine. Как правило, следует получать и проводить скрининг ряда миРНК для сравнения их эффективности.
После проектирования дцРНК для использования в способе по настоящему изобретению можно получать любым способом, известным в данной области, например путем in vitro транскрипции, рекомбинантными или синтетическими методами. миРНК можно получать in vitro с использованием рекомбинантного фермента, такого как РНК-полимераза T7, и олигонуклеотидных матриц ДНК, либо можно получать in vivo, например, в культивируемых клетках. В предпочтительном варианте осуществления молекулу нуклеиновой кислоты получают синтетическими методами.
Кроме того, описаны стратегии для получения шпилечных миРНК из векторов, содержащих, например, промотор РНК-полимеразы III. Сконструированы различные векторы для получения шпилечных миРНК в клетках-хозяевах с использованием промотора либо H1-РНК, либо кяU6 (snU6) РНК (смотри SEQ ID №№ 7-9). Молекулу РНК, описанную выше (например, первая часть, связывающая последовательность и вторая часть), можно функционально связывать с таким промотором. При транскрибировании РНК-полимеразой III первая и вторая части образуют дуплексный стебель шпильки, а связывающая последовательность образует петлю. Вектор pSuper (OligoEngines Ltd., Seattle, Wash) также можно использовать для получения миРНК.
Для улучшения свойств молекул нуклеиновой кислоты по изобретению можно вводить модификации или аналоги нуклеотидов. Улучшенные свойства включают повышенную устойчивость к нуклеазе и/или повышенную способность проникать через клеточные мембраны. Соответственно, термины «молекула нуклеиновой кислоты» и «двухцепочечная молекула РНК» охватывают синтетически модифицированные основания, такие как, но не ограничиваясь ими, инозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил-, 2-пропил- и другие алкиладенины, 5-галоурацил, 5-галоцитозин, 6-азацитозин и 6-азатимин, псевдоурацил, 4-тиурацил, 8-галоаденин, 8-аминоаденин, 8-тиоладенин, 8-тиолалкиладенины, 8-гидроксиладенин и другие 8-замещенные аденины, 8-галогуанины, 8-аминогуанин, 8-тиолгуанин, 8-тиоалкилгуанины, 8-гидроксилгуанин и другие замещенные гуанины, другие аза- и деазааденины, другие аза- и деазагуанины, 5-трифторметилурацил и 5-трифторцитозин.
Признаки. Конкретные продуктивные признаки и ответственные за них гены
Способы по изобретению можно использовать для изменения любого признака у видов птиц, особенно признаков, определяемых или подвергающихся влиянию в то время, когда эмбрион развивается в яйце. Предпочтительными признаками, которые можно изменять, являются пол и мышечная масса.
В одном из вариантов осуществления продуктивным признаком является пол, и молекула нуклеиновой кислоты уменьшает уровень белка, кодируемого геном DMRT1. DMRT1 являлся первой молекулой, вовлеченной в определение пола, которая демонстрирует консервативность последовательности среди таксонометрических типов. Птичий гомолог DMRT1 находится на Z (половой) хромосоме кур и дифференциально экспрессируется в генитальном гребне куриных эмбрионов мужского и женского пола (Raymond et al., 1999; Smith et al., 1999). До настоящего времени DMRT1 является одним из немногочисленных генов, вовлеченных в определение пола у млекопитающих, который, по всей видимости, имеет строго гонадный паттерн экспрессии (Raymond et al., 1999).
Примеры молекул нуклеиновой кислоты, которые можно использовать для уменьшения уровня куриного белка DMRT1, включают, но не ограничиваются ими, те, которые содержат по меньшей мере одну из следующих нуклеотидных последовательностей:
CCAGUUGUCAAGAAGAGCA (SEQ ID №:11)
GGAUGCUCAUUCAGGACAU (SEQ ID №:12)
CCCUGUAUCCUUACUAUAA (SEQ ID №:13)
GCCACUGAGUCUUCCUCAA (SEQ ID №:14)
CCAGCAACAUACAUGUCAA (SEQ ID №:15)
CCUGCGUCACACAGAUACU (SEQ ID №:16)
GGAGUAGUUGUACAGGUUG (SEQ ID №:17)
GACUGGCUUGACAUGUAUG (SEQ ID №:18)
AUGGCGGUUCUCCAUCCCU (SEQ ID №:19)
или вариант любой из них.
В особенно предпочтительном варианте осуществления молекулы нуклеиновой кислоты, которые можно использовать для уменьшения уровня куриного белка DMRT1, содержат последовательность GCCACUGAGUCUUCCUCAA (SEQ ID №: 14) или ее вариант.
Следующим примером гена, который может являться мишенью воздействия для изменения пола как продуктивного признака, является ген WPKCI. Показано, что птичий ген WPKCI высококонсервативно расположен на хромосоме W птиц и активно экспрессируется в курином эмбрионе женского пола перед началом гонадной дифференциации. Предполагают, что WPKCI может играть роль в дифференциации женских гонад, интерферируя с функцией PKCI или проявляя свою уникальную функцию в ядре (Hori et al., 2000). Этот ген также идентифицирован как ASW (птичий специфичный для пола W-связанный) (O'Neill et al., 2000).
В другом варианте осуществления продуктивным признаком является мышечная масса, и молекула нуклеиновой кислоты уменьшает уровень белка, кодируемого геном миостатина. Миостатин, также называемый «фактором роста и дифференциации 8» (GDF8), представляет собой недавно открытый член суперсемейства TGFβ. Показано, что мРНК и белок миостатина экспрессируется в скелетной мышце, сердце и молочной железе. Целевое разрушение гена миостатина у мышей и мутация в третьем экзоне гена миостатина у массивного крупного рогатого скота породы бельгийская голубая, у которого экспрессируется нефункциональный белок миостатин, приводит к увеличению мышечной массы. Таким образом, миостатин является отрицательным регулятором роста скелетных мышц.
Примеры молекул нуклеиновой кислоты, которые можно использовать для уменьшения уровня куриного белка миостатина, включают, но не ограничиваются ими, те, которые содержат по меньшей мере одну из следующих нуклеотидных последовательностей:
AAGCUAGCAGUCUAUGUUU (SEQ ID №:20)
GCUAGCAGUCUAUGUUUAU (SEQ ID №:21)
CGCUGAAAAAGACGGACUG (SEQ ID №:22)
AAAGACGGACUGUGCAAUG (SEQ ID №:23)
AGACGGACUGUGCAAUGCU (SEQ ID №:24)
UGCUUGUACGUGGAGACAG (SEQ ID №:25)
UACAAAAUCCUCCAGAAUA (SEQ ID №:26)
AAUCCUCCAGAAUAGAAGC (SEQ ID №:27)
UCCUCCAGAAUAGAAGCCA (SEQ ID №:28)
UAGAAGCCAUAAAAAUUCA (SEQ ID №:29)
GCCAUAAAAAUUCAAAUCC (SEQ ID №:30)
AAAUUCAAAUCCUCAGCAA (SEQ ID №:3l)
AUUCAAAUCCUCAGCAAAC (SEQ ID №:32)
AUCCUCAGCAAACUGCGCC (SEQ ID №:33)
ACUGCGCCUGGAACAAGCA (SEQ ID №:34)
CAAGCACCUAACAUUAGCA (SEQ ID №:35)
GCACCUAACAUUAGCAGGG (SEQ ID №:36)
CAUUAGCAGGGACGUUAUU (SEQ ID №:37)
GCAGCUUUUACCCAAAGCU (SEQ ID №:38)
UUCCUGCAGUGGAGGAGCU (SEQ ID №:39)
CUGAUUGAUCAGUAUGAUG (SEQ ID №:40)
GACGAUGACUAUCAUGCCA (SEQ ID №:41)
CCGAGACGAUUAUCACAAU (SEQ ID №:42)
UGCCUACGGAGUCUGAUUU (SEQ ID №:43)
AUGGAGGGAAAACCAAAAU (SEQ ID №:44)
AACCAAAAUGUUGCUUCUU (SEQ ID №:45)
CCAAAAUGUUGCUUCUUUA (SEQ ID №:46)
AAUGUUGCUUCUUUAAGUU (SEQ ID №:47)
UGUUGCUUCUUUAAGUUUA (SEQ ID №:48)
GUUUAGCUCUAAAAUACAA (SEQ ID №:49)
AAUACAAUAUAACAAAGUA (SEQ ID №:50)
UACAAUAUAACAAAGUAGU (SEQ ID №:51)
UAUAACAAAGUAGUAAAGG (SEQ ID №:52)
CAAAGUAGUAAAGGCACAA (SEQ ID №:53)
AGUAGUAAAGGCACAAUUA (SEQ ID №:54)
AGGCACAAUUAUGGAUAUA (SEQ ID №:55)
UUAUGGAUAUACUUGAGGC (SEQ ID №:56)
GUCCAAAAACCUACAACGG (SEQ ID №:57)
AAACCUACAACGGUGUUUG (SEQ ID №:58)
ACCUACAACGGUGUUUGUG (SEQ ID №:59)
CGGUGUUUGUGCAGAUCCU (SEQ ID №:60)
GCCCAUGAAAGACGGUACA (SEQ ID №:61)
AGACGGUACAAGAUAUACU (SEQ ID №:62)
GAUAUACUGGAAUUCGAUC (SEQ ID №:63)
UUCGAUCUUUGAAACUUGA (SEQ ID №:64)
ACUUGACAUGAACCCAGGC (SEQ ID №:65)
CCCAGGCACUGGUAUCUGG (SEQ ID №:66)
GACAGUGCUGCAAAAUUGG (SEQ ID №:67)
AAUUGGCUCAAACAGCCUG (SEQ ID №:68)
UUGGCUCAAACAGCCUGAA (SEQ ID №:69)
ACAGCCUGAAUCCAAUUUA (SEQ ID №:70)
UCCAAUUUAGGCAUCGAAA (SEQ ID №:71)
UUUAGGCAUCGAAAUAAAA (SEQ ID №:72)
AUAAAAGCUUUUGAUGAGA (SEQ ID №:73)
AAGCUUUUGAUGAGACUGG (SEQ ID №:74)
GCUUUUGAUGAGACUGGAC (SEQ ID №:75)
GAUGGAUUGAACCCAUUUU (SEQ ID №:76)
CCCAUUUUUAGAGGUCAGA (SEQ ID №:77)
ACGGUCCCGCAGAGAUUUU (SEQ ID №:78)
CGGAAUCCCGAUGUUGUCG (SEQ ID №:79)
UCCAGUCCCAUCCAAAAGC (SEQ ID №:80)
GCUUUUGGAUGGGACUGGA (SEQ ID №:81)
AAGAUACAAAGCCAAUUAC (SEQ ID №:82)
GAUACAAAGCCAAUUACUG (SEQ ID №:83)
AGCCAAUUACUGCUCCGGA (SEQ ID №:84)
UUACUGCUCCGGAGAAUGC (SEQ ID №:85)
UGCGAAUUUGUGUUUCUAC (SEQ ID №:86)
CAGGUGAGUGUGCGGGUAU (SEQ ID №:87)
AUACCCGCACACUCACCUG (SEQ ID №:88)
GCAAAUCCCAGAGGUCCAG (SEQ ID №:89)
AUCCCAGAGGUCCAGCAGG (SEQ ID №:90)
GAUGUCCCCUAUAAACAUG (SEQ ID №:91)
ACAUGCUGUAUUUCAAUGG (SEQ ID №:92)
UGGAAAAGAACAAAUAAUA (SEQ ID №:93)
AAGAACAAAUAAUAUAUGG (SEQ ID №:94)
GAACAAAUAAUAUAUGGAA (SEQ ID №:95)
CAAAUAAUAUAUGGAAAGA (SEQ ID №:96)
AUAAUAUAUGGAAAGAUAC (SEQ ID №:97)
UAUAUGGAAAGAUACCAGC (SEQ ID №:98)
CCAGAAUAGAAGCCAUAAA (SEQ ID №:113)
GCACAAUUAUGGAUAUACU (SEQ ID №:114)
GUACAAGAUAUACUGGAAU (SEQ ID №:115)
CCUAUAAACAUGCUGUAUU (SEQ ID №:116)
GCGAAUUUGUGUUUCUACA (SEQ ID №:117)
GAGUAUUGAUGUGAAGACA (SEQ ID №:118)
CCUCCAGAAUAGAAGCCAU (SEQ ID №:119)
GGUCAGAGUUACAGACACA (SEQ ID №:120)
CAGUGGAUUUCGAAGCUUU (SEQ ID №:121)
CAACGGUGUUUGUGCAGAU (SEQ ID №:122)
или вариант любой из них.
В особенно предпочтительном варианте осуществления молекулы нуклеиновой кислоты, которые можно использовать для уменьшения уровня куриного белка миостатина, содержат последовательность CAGGUGAGUGUGCGGGUAU (SEQ ID №:87) или ее вариант.
Векторы и клетки-хозяева
Настоящее изобретение также относится к вектору, кодирующему молекулу нуклеиновой кислоты, содержащую двухцепочечную область или ее одну цепочку, по настоящему изобретению. Предпочтительно, вектор представляет собой экспрессионный вектор, способный экспрессировать открытую рамку(ки) считывания, кодирующую дцРНК, в клетке-хозяине и/или бесклеточной системе. Клетка-хозяин может представлять собой клетку любого типа, такие как, но не ограничиваясь ими, клетки бактерий, грибов, растений или животных.
Как правило, вектор по изобретению содержит промотор, функционально связанный с открытой рамкой считывания, кодирующей молекулу нуклеиновой кислоты по изобретению или ее цепочку.
В данном документе термин «промотор» означает последовательность нуклеиновой кислоты, которая способна направлять транскрипцию функционально связанной молекулы нуклеиновой кислоты и включает, например, промоторы РНК-полимеразы II и РНК-полимеразы III. Данное определение также охватывает такие регуляторные элементы транскрипции (например, энхансеры), которых достаточно для осуществления зависимой от промотора экспрессии гена, контролируемой специфическим для клеточного типа, специфическим для ткани или временным образом, либо которые индуцируются внешними агентами или сигналами.
В данном документе «функционально связанный» означает функциональную взаимосвязь между двумя или более сегментами нуклеиновой кислоты (например, ДНК). Как правило, это означает функциональную взаимосвязь регуляторного элемента транскрипции с транскрибируемой последовательностью. Например, промотор функционально связан с кодирующей последовательностью, такой как открытая рамка считывания, кодирующая двухцепочечную молекулу РНК, описанную в данном документе, если он стимулирует или модулирует транскрипцию кодирующей последовательности в соответствующей клетке. В основном, промоторные регуляторные элементы транскрипции, которые функционально связаны с транскрибируемой последовательностью, физически расположены рядом с транскрибируемой последовательностью, то есть они действуют в цис-положении. Однако некоторые регуляторные элементы транскрипции, такие как энхансеры, не обязательно должны физически находиться рядом или неподалеку от кодирующих последовательностей, транскрипцию которых они усиливают.
Под «промотором РНК-полимеразы III» или «промотором РНК-пол III» или «промотором полимеразы III» или «промотором пол III» понимают любой промотор беспозвоночных, позвоночных или млекопитающих, например кур, людей, мышей, свиней, крупного рогатого скота, приматов, обезьян и так далее, который в природе в клетке связывается или взаимодействует с РНК-полимеразой III для транскрибирования его функционально связанного гена либо его любого варианта, природного или созданного искусственно, который будет взаимодействовать в выбранной клетке-хозяине с РНК-полимеразой III для транскрибирования функционально связанной последовательности нуклеиновой кислоты. Под промотором U6 (например, U6 кур, U6 человека, U6 мыши), промотором H1 или промотором 7SK понимают любой промотор беспозвоночных, позвоночных или млекопитающих либо полиморфный вариант или мутант, существующий в природе, для взаимодействия с РНК-полимеразой III для транскрибирования продукта его родственной РНК, то есть РНК U6, РНК H1 или РНК 7SK, соответственно. Примеры подходящих промоторов включают cU6-1 (SEQ ID №:7), cU6-3 (SEQ ID №:8), cU6-4 (SEQ ID №:9) и c7SK (SEQ ID №:10).
Если в качестве клетки-хозяина используют E. coli, не существует никаких ограничений, за исключением того, что вектор должен иметь «ori» для амплификации и массовой продукции вектора в E. coli (например, JM109, DH5α, HB101 или XL1Blue) и маркерный ген для отбора трансформированных клеток E. coli (например, ген устойчивости к лекарственному средству, отбираемый при помощи лекарственного средства, такого как ампициллин, тетрациклин, канамицин или хлорамфеникол). Например, можно использовать векторы серии M13, векторы серии pUC, pBR322, pBluescript, pCR-Script и тому подобные. pGEM-T, pDIRECT, pT7 и тому подобные также можно использовать для субклонирования и вырезания гена, кодирующего дцРНК, так же, как и векторы, описанные выше.
Что касается экспрессионных векторов для использования в E. coli, то такие векторы включают JM109, DH5α, HB101 или XL1Blue, вектор должен иметь промотор, такой как промотор lacZ, промотор araB или промотор T7, который может эффективно способствовать экспрессии нужного гена в E. coli. Другими примерами векторов являются «QIAexpress system» (Qiagen), pEGFP и pET (для данного вектора в качестве хозяина предпочтительно использовать BL21, штамм, экспрессирующий РНК-полимеразу T7).
Помимо векторов для E. coli, вектор, например, может представлять собой экспрессионный вектор млекопитающих (например, pcDNA3 (Invitrogen), pEGF-BOS, pEF и pCDM8), экспрессионный вектор из клеток насекомых (например, «бакуловирусная экспрессионная система Bac-to-BAC» (GibcoBRL) и pBacPAK8), экспрессионный вектор из растений (например, pMH1 и pMH2), экспрессионный вектор из вирусов животных (например, pHSV, pMV и pAdexLcw), экспрессионный вектор из ретровирусов (например, pZIPneo), экспрессионный вектор из дрожжей (например, набор «Pichia Expression Kit» (Invitrogen), pNV11 и SP-Q01), экспрессионный вектор из Bacillus subtilis (например, pPL608 и pKTH50).
Для того чтобы экспрессировать молекулы нуклеиновой кислоты в клетках животных, таких как клетки CHO, COS, Vero и NIH3T3, вектор должен иметь промотор, необходимый для экспрессии в таких клетках, например промотор SV40, промотор MMLV-LTR, промотор EF1α, промотор CMV и так далее, и, более предпочтительно, он имеет маркерный ген для отбора трансформантов (например, ген устойчивости к лекарственному средству, отбираемый при помощи лекарственного средства (например, неомицина, G418 и так далее)).
Примеры векторов с такими характеристиками включают pMAM, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
Молекулы нуклеиновой кислоты, содержащие двухцепочечную область, по настоящему изобретению можно экспрессировать в животных, например, путем встраивания открытой рамки(ок) считывания, кодирующей(их) нуклеиновую кислоту, в соответствующий вектор и введения вектора ретровирусным способом, липосомным способом, катионно-липосомным способом, аденовирусным способом и так далее. Используемые векторы включают, но не ограничиваются ими, аденовирусные векторы (например, pAdexlcw) и ретровирусные векторы (например, pZIPneo). Общие способы манипуляций с генами, такие как встраивание нуклеиновых кислот по изобретению в вектор, можно осуществлять общепринятыми методами.
Настоящее изобретение также относится к клетке-хозяину, в которую введена экзогенная молекула нуклеиновой кислоты, как правило, в векторе по настоящему изобретению. Клетку-хозяина по данному изобретению можно использовать в качестве, например, продуцирующей системы для продуцирования или экспрессии молекулы нуклеиновой кислоты. Для продукции in vitro можно использовать эукариотические клетки или прокариотические клетки.
Полезными эукариотическими клетками-хозяевами могут являться клетки животных, растений или грибов. В качестве животных клеток можно использовать клетки млекопитающих, такие как клетки CHO, COS, 3T3, миеломы, почки новорожденного хомячка (BHK), HeLa или клетки Vero, клетки MDCK, клетки DF1, клетки амфибий, такие как ооциты Xenopus, или клетки насекомых, такие как клетки Sf9, Sf21 или Tn5. Можно использовать клетки CHO, лишенные гена DHFR (dhfr-CHO), или CHO K-1. Вектор можно вводить в клетку-хозяина, например, при помощи кальций-фосфатного способа, ДЭАЭ-декстранового способа, катионно-липосомного способа DOTAP (Boehringer Mannheim), электропорации, липофекции и так далее.
Полезные прокариотические клетки включают клетки бактерий, такие как E. coli, например, JM109, DH5a и HB101, или Bacillus subtilis.
Для клеток млекопитающих можно использовать культуральную среду, такую как DMEM, MEM, RPMI-1640 или IMDM. Культуральную среду можно использовать с сывороточной добавкой, такой как фетальная телячья сыворотка ((FCS), или без нее. Значения pH культуральной среды предпочтительно составляют примерно от 6 до 8. Как правило, клетки культивируют примерно при 30-40°C в течение примерно 15-200 час, и культуральную среду при необходимости можно заменять, аэрировать или перемешивать.
Композиции
Настоящее изобретение также относится к композициям, содержащим молекулу нуклеиновой кислоты, содержащую двухцепочечную область, которые можно вводить в яйцо птиц. Композиция, содержащая молекулу нуклеиновой кислоты, содержащую двухцепочечную область, может включать фармацевтически приемлемый носитель, делающий композицию пригодной для введения.
Подходящие фармацевтические носители, эксципиенты и/или разбавители включают, но не ограничиваются ими, лактозу, сахарозу, порошковый крахмал, порошковый тальк, целлюлозные сложные эфиры алкановых кислот, стеарат магния, оксид магния, кристаллическую целлюлозу, метилцеллюлозу, карбоксиметилцеллюлозу, желатин, глицерин, альгинат натрия, антибактериальные средства, противогрибковые средства, гуммиарабик, аравийскую камедь, натриевые и кальциевые соли фосфорной и серной кислот, поливинилпирролидон и/или поливиниловый спирт, физиологический раствор и воду. В одном из вариантов осуществления носитель, эксципиент и/или разбавитель представляет собой фосфатно-солевой буферный раствор или воду.
Композиция может также содержать способствующее трансфекции средство. Способствующие трансфекции средства, используемые для облегчения поглощения нуклеиновых кислот живой клеткой, хорошо известны в данной области. Реагенты, усиливающие трансфекцию, включают химические семейства типа поликатионов, дендримеров, ДЭАЭ-декстран, блок-сополимеры и катионные липиды. Предпочтительно, способствующее трансфекции средство представляет собой содержащее липид соединение (или препарат), создающее положительно заряженную гидрофильную область и ацильную гидрофобную область, делающие возможной самосборку в водном растворе в пузырьки, известные как мицеллы или липосомы, а также как липополиамины.
Очевидно, что можно использовать любую общепринятую среду или средство, при условии, что они не являются несовместимыми с композициями или способами по изобретению.
Введение
Введение молекулы нуклеиновой кислоты, содержащей двухцепочечную область (включая композицию, содержащую молекулу нуклеиновой кислоты, содержащую двухцепочечную область), обычно осуществляют путем инъекции в яйцо, и, как правило, путем инъекции в воздушный мешок. Несмотря на то, что воздушный мешок является предпочтительным путем введения in ovo, введение инъекцией можно проводить и в другие области, такие как желточный мешок или аллантоисная жидкость хориона. Если мишенью для введения является не воздушный мешок, показатели вылупляемости могут незначительно снижаться, хотя и не обязательно, в коммерчески неприемлемых масштабах. Механизм введения не является критичным для осуществления на практике настоящего изобретения, хотя предпочтительно, чтобы игла не вызывала чрезмерного повреждения яйца или тканей и органов развивающегося эмбриона или внезародышевых мембран, окружающих эмбрион.
Если продуктивным признаком является пол, предпочтительно вводить молекулу нуклеиновой кислоты в течение четырех дней с момента отложения яйца.
Как правило, подходящим является шприц для подкожных инъекций, снабженный иглой примерно 22 калибра. Способ по настоящему изобретению хорошо приспособлен для использования с автоматическим устройством для инъекций, таким как описанное в US 4903635, US 5056464, US 5136979 и US 20060075973.
Молекулу нуклеиновой кислоты вводят в эффективном количестве, достаточном для того, чтобы по меньшей мере до некоторой степени изменить намеченный признак. Что касается пола, изменение можно выявлять, сравнивая соответствующее число образцов, обработанных способом по настоящему изобретению, с таким же количеством необработанных образцов. Статистически значимое различие в половой принадлежности птиц между двумя группами будет указывать на то, что введено эффективное количество. Другие способы определения эффективного количества для изменения пола или других признаков, находятся в компетенции специалистов в данной области.
Предпочтительно, в яйцо вводят примерно от 1 нг до 100 мкг, более предпочтительно, примерно от 100 нг до 1 мкг нуклеиновой кислоты. Более того, предпочтительно вводить нуклеиновую кислоту в объеме примерно от 1 мкл до 1 мл, более предпочтительно, примерно от 10 мкл до 500 мкл.
ПРИМЕРЫ
Пример 1 - Идентификация молекул мшРНК для снижения продукции белка DMRT1 у кур
Выбор последовательностей мшРНК, нацеленных на DMRT1
Используя разработанный Ambion указатель мишени для миРНК (www.ambion.com/techlib/misc/siRNA finder.html), авторы настоящего изобретения выбрали 30 предсказанных последовательностей миРНК для Dmrt1. Затем 30 последовательностей миРНК подвергали скринингу для отбора мшРНК (таблица 1). Существует несколько алгоритмов, подходящих для отбора потенциальных последовательностей миРНК для специфических целевых генов. Однако показано, что многие из этих предсказанных миРНК не действуют эффективно при процессировании из экспрессированных мшРНК. Taxman et al. (2006) специально разработали алгоритм для предсказания эффективных молекул мшРНК, и авторы изобретения создали собственную модификацию алгоритма для улучшения предсказания мшРНК. Авторы изобретения применили модифицированный алгоритм Taxman к 30 выбранным миРНК так, чтобы выбрать последовательности для тестирования в качестве мшРНК для специфического нокдауна экспрессии гена Dmrt1.
При использовании алгоритма Taxman существует четыре критерия. Три из этих критериев рассчитывают, исходя из максимального числа в 4 балла. Данными критериями являются: 1) C или G на 5'-конце последовательности = 1 балл, A или T на 5'-конце = -1 балл; 2) A или T на 3'-конце = 1 балл, C или G на 3'-конце = -1 балл; 3) 5 или более A или T в семи 3'-основаниях = 2 балла, 4 A или T в семи 3'-основаниях = 1 балл. Предпочтительными являются последовательности мшРНК с максимальным количеством баллов. Четвертый критерий основан на расчете свободной энергии 6 центральных оснований последовательности мшРНК (основания 6-11 смысловой цепочки, гибридизованные с основаниями 9-14 антисмысловой цепочки). Предпочтительными являются мшРНК с ΔG>-12,9 ккал/моль центрального дуплекса. Модификацией алгоритма Taxman является использование иных параметров свободной энергии для предсказания стабильности дуплекса РНК, как описано Freier et al. (1986). Основываясь на алгоритме, авторы изобретения выбрали 6 последовательностей миРНК, предложенных указателем мишени для миРНК, в качестве потенциально эффективных мшРНК для проверки их способности осуществлять нокаут экспрессии гена Dmrt1. Выбранные последовательности выделены жирным шрифтом в таблице 1 и их 5'- 3' последовательность представлена в таблице 2. Эти 6 последовательностей использовали для конструирования плазмид ddРНКи (ddRNAi) для экспрессии 6 мшРНК.
Конструирование плазмид ddРНКи для экспрессии выбранных мшРНК
Промоторы cU6-1 (GenBank входящий номер DQ531567) и cU6-4 (DQ531570) куриной полимеразы III использовали в качестве матриц для конструирования экспрессионных плазмид ddРНКи для выбранных мшРНК для dmrt1 и контроля (EGFP или постороннего белка) посредством одностадийной ПЦР (фигура 1). В ПЦР для конструирования плазмид мшРНК использовали праймер TD175 в паре с TH346 (для мшDmrt1-346), TH461 (мшDmrt1-461), TH566 (мшDmrt1-566), TH622 (мшDmrt1-622), TH697 (мшDmrt1-697), TH839 (мшDmrt1-839) или TD195 (мшEGFP) (смотри таблицу 3 для последовательности праймера и деталей относительно специфических амплифицированных мшРНК). Обратные праймеры в каждой ПЦР конструировали так, чтобы они содержали последние 20 нт (нуклеотидов) каждой промоторной последовательности, смысловую последовательность мшРНК, петлю и антисмысловую последовательность мшРНК, и очищали ВЭЖХ. Полноразмерные амплифицированные продукты экспрессионного полигенного кластера лигировали в pGEM-T Easy и затем секвенировали. Конечные экспрессионные плазмиды мшРНК, использованные в анализах нокаута генов, получили названия pshDmrt1-346, pshDmrt1-461, pshDmrt1-566, pshDmrt1-622, pshDmrt1-697, pshDmrt1-839 и pshEGFP. Также сконструировали постороннюю контрольную плазмиду cU6-1 и использовали ее как проверочную для сравнения в анализах экспрессии генов (смотри ниже). Для этой проверочной плазмиды прямой праймер TD135 использовали в паре с обратным праймером TD149, содержащим последние 20 нт промотора U6-1 кур и все другие компоненты посторонней мшРНК. Продукт ПЦР лигировали в pGEM-T Easy и секвенировали.
Выбор по алгоритму последовательностей мшРНК, нацеленных на Dmrt1
баллы
баллы
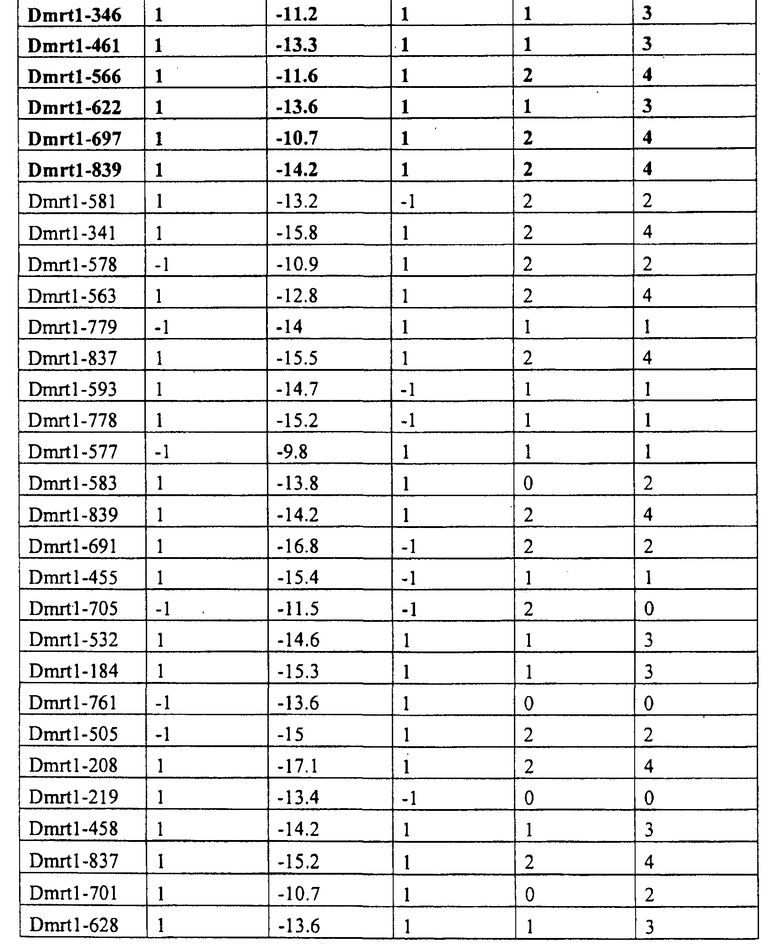
Последовательность мшРНК для Dmrt1
Последовательность и детали использованных праймеров
характеристика

Каждую плазмиду для ddРНКи конструировали таким образом, чтобы начало каждой последовательности мшРНК находилось в положении +1 природных транскриптов мяРНК (snRNA) U6. Сайт для фермента рестрикции XhoI создавали ниже по ходу транскрипции от сигнала терминации, чтобы иметь возможность скрининга на полноразмерные продукты мшРНК, встроенной в pGEM-T Easy. Все окончательные экспрессионные векторы мшРНК состояли из какого-либо из полноразмерных промоторов U6 кур, смысловой последовательности мшРНК, последовательности петли, антисмысловой последовательности мшРНК, последовательности терминации и сайта XhoI. Последовательность петли, используемая во всех мшРНК, представляла собой 5' UUCAAGAGA 3'.
Тестирование выбранных мшРНК на нокаут экспрессии гена
Dmrt1
Для тестирования мшРНК на выключение Dmrt1 использовали анализ на экспрессию репортерного гена. Репортерный ген представлял собой транскрипционный слитый ген из гена Dmrt1, встроенного ниже по ходу транскрипции от 3' конца гена улучшенного зеленого флуоресцентного белка (EGFP) в pEGFP-C (Clontech). Репортерную плазмиду конструировали следующим образом: кДНК Dmrt1 обратно транскрибировали из общей РНК, выделенной из 4-дневного эмбриона, и клонировали в сайт множественного клонирования pCMV-Script (Stratagene). Вставку Dmrt1 удаляли из клонирующего вектора в виде фрагмента NotI - EcoRI и клонировали ниже по ходу транскрипции от гена EGFP в pEGFP-C (Clontech). Полученную плазмиду назвали pEGFP-Dmrt1. Данную плазмиду трансфицировали в клетки DF-1 кур и экспрессию транскрипционного слитого гена подтверждали, измеряя флуоресценцию EGFP методом проточной цитометрии, как описано ниже. Клетки DF-1 представляют собой стабильную клеточную линию куриных эмбриональных фибробластов, происходящую из эмбриона EV-0 (ATCC, CRL-12203), и, таким образом, представляют собой модельную систему для изучения in ovo эффектов РНКи молекул.
Анализы на выключение гена Dmrt1 проводили путем совместной трансфекции клеток DF-1 репортерной плазмидой pEGFP-Dmrt1 и каждой из плазмид ddРНКи, экспрессирующих специфичные для Dmrt1 и контрольные мшРНК. Эксперименты по совместной трансфекции проводили следующим образом: клетки DF-1 (ATCC CRL-12203, куриные фибробласты) поддерживали во влажной атмосфере, содержащей 5% CO2 при 37°C, в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 4,5 г/л глюкозу, 1,5 г/л бикарбонат натрия, 10% фетальную телячью сыворотку (FCS), 2 мМ L-глютамин с добавлением пенициллина (100 ед/мл) и стрептомицина (100 мкг/мл). Клетки DF1 пересеивали по мере необходимости, используя 0,25% (масс./об.) смесь трипсин-этилендиаминтетрауксусная кислота (EDTA).
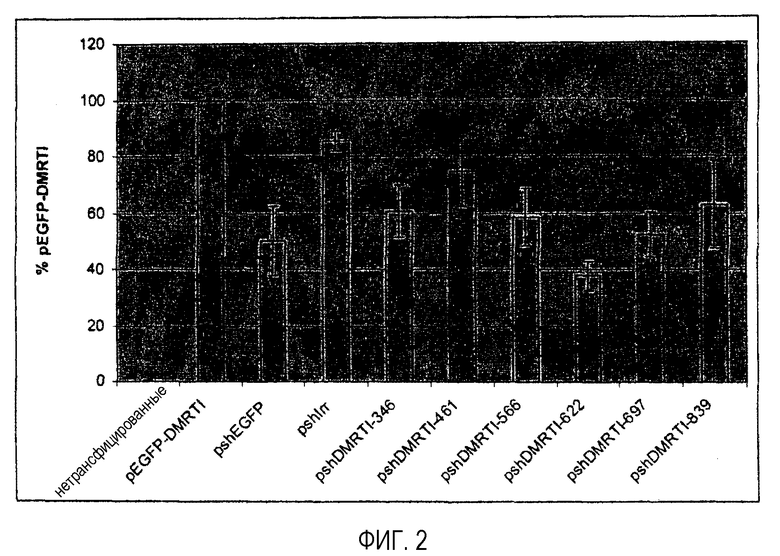
Совместную трансфекцию плазмид pEGFP-Dmrt1 и ddРНКи для анализов на выключение слитого гена EGFP-Dmrt1 проводили в клетках DF-1, выращенных до 80-90% конфлюэнтности, в 24-луночных планшетах для культивирования (Nunc) с целью проведения анализа методом проточной цитометрии. Клетки трансфицировали в общей сложности 1 мкг плазмидной ДНК на лунку, используя реагент для трансфекции Lipofectamine™2000 (Invitrogen). Экспрессию EGFP анализировали в трансфицированных клетках DF-1 через 60 часов после трансфекции, используя проточно-цитометрический анализ трансфекций, выполненный в трех повторах. Клетки обрабатывали трипсином, используя 100 мкл 0,25% смеси трипсин-EDTA, осаждали при 2000 об/мин в течение 5 минут, промывали один раз в 1 мл холодного фосфатно-солевого буферного раствора-A (PBSA) (Oxoid), два раза - в 1 мл промывочного раствора FACS (PBSA + 1% FCS) и ресуспендировали в 250 мкл промывочного раствора FACS. Проточно-цитометрический анализ образцов проводили в клеточном сортере с активацией флуоресценции FACScalibur (Becton Dickinson). Сбор данных и расчет средних значений интенсивности флуоресценции (MFI) для образцов совместной трансфекции в трех повторах выполняли при помощи программного обеспечения CELLQuest (Becton Dickinson). Результаты анализа на выключение гена представлены на фигуре 2. pshEGFP использовали в качестве положительного контроля. Известно, что мшРНК, экспрессированная с данной плазмиды, эффективно нацелена на область EGFP слитого транскрипта, и, как показано, снижает репортерную флуоресценцию примерно на 50%. По сравнению с отрицательным контролем, представляющим собой постороннюю мшРНК, экспрессированную с pshIrr, установлено, что специфичные для Dmrt1 молекулы мшРНК подавляют экспрессию репортерного гена в различной степени. мшDmrt1-622 индуцировала максимальное выключение гена, составляющее примерно 60%.
Пример 2 - Идентификация молекул мшРНК для снижения продукции белка миостатина у кур
Выбор последовательностей мшРНК, мишенью которых является миостатин (Gdf8)
Используя разработанный Ambion указатель мишеней для миРНК (www.ambion.com/techlib/misc/siRNA finder.html), идентифицировали 79 предсказанных последовательностей миРНК для Gdf8 (таблица 4). Дополнительные последовательности миРНК, оптимизированные при помощи алгоритма Taxman, приведены в таблице 5. Авторы изобретения выбрали 3 из этих последовательностей (Gdf8-258, Gdf8-913 и Gdf8-1002) для конструирования плазмид ddРНКи для экспрессии мшРНК (выделены жирным шрифтом в таблице 4).
Конструирование плазмид ddРНКи для экспрессии выбранных мшРНК
Промотор cU6-1 (GenBank входящий номер DQ531567) куриной полимеразы III использовали в качестве матрицы для конструирования экспрессионных плазмид ddРНКи для выбранных мшРНК для Gdf8 и cEGFP посредством одностадийной ПЦР (фигура 1). В ПЦР для конструирования плазмид мшРНК использовали праймер TD135 в паре с DS304 (для мшGdf8-253), DS305 (мшGdf8-913), DS306 (мшGdf8-1002) или TD148 (мшEGFP) (смотри таблицу 6 для последовательности праймера и деталей относительно специфических амплифицированных мшРНК). Обратные праймеры в каждой ПЦР конструировали так, чтобы они содержали последние 20 нт каждой промоторной последовательности, смысловую последовательность мшРНК, петлю и антисмысловую последовательность миРНК, и проводили очистку методом ВЭЖХ. Полноразмерные амплифицированные продукты экспрессионного полигенного кластера лигировали в pGEM-T Easy и затем секвенировали. Конечные экспрессионные плазмиды мшРНК, использованные в анализах нокаута генов, получили названия pshGdf8-253, pshGdf8-913, pshGdf8-1002 и pshEGFP.
Последовательность мшРНК для Gdf8


Последовательность миРНК для миостатина, оптимизированная при помощи алгоритма Taxman

Каждую плазмиду для ddРНКи конструировали таким образом, чтобы начало каждой последовательности мшРНК находилось в положении +1 природных транскриптов мяРНК (snRNA) U6. Сайт для фермента рестрикции XhoI создавали ниже по ходу транскрипции от сигнала терминации, чтобы иметь возможность скрининга на полноразмерные продукты мшРНК, встроенной в pGEM-T Easy. Все окончательные экспрессионные векторы мшРНК состояли из полноразмерного промотора U6 кур, смысловой последовательности мшРНК, последовательности петли, антисмысловой последовательности мшРНК, последовательности терминации и сайта XhoI. Последовательность петли, используемая во всех мшРНК, представляла собой 5' UUCAAGAGA 3'.
Последовательность и детали использованных праймеров
характеристика

Тестирование выбранных мшРНК на нокаут экспрессии гена Gdf8
Для тестирования трех выбранных мшРНК на выключение гена Gdf8 использовали анализ на экспрессию репортерного гена. Репортерный ген представлял собой транскрипционный слитый ген из гена Gdf8, встроенного ниже по ходу транскрипции от 3' конца гена улучшенного зеленого флуоресцентного белка (EGFP) в pEGFP-C (Clontech). Репортерную плазмиду конструировали следующим образом: кДНК Gdf8 обратно транскрибировали из общей РНК, выделенной из 7-дневного эмбриона, и клонировали в сайт множественного клонирования pGEM-T Easy (Promega). Вставку Gdf8 удаляли из клонирующего вектора в виде фрагмента NotI и клонировали ниже по ходу транскрипции от гена EGFP в pEGFP-C (Clontech). Полученную плазмиду назвали pEGFP-Gdf8. Данную плазмиду трансфицировали в клетки DF-1 кур и экспрессию транскрипционного слитого гена подтверждали, измеряя флуоресценцию EGFP методом проточной цитометрии, как описано ниже.
Анализы на выключение гена Gdf8 проводили путем совместной трансфекции клеток DF-1 репортерной плазмидой pEGFP-Gdf8 и каждой из плазмид ddРНКи, экспрессирующих специфичные для Gdf8 или EGFP и контрольные мшРНК. Эксперименты по совместной трансфекции проводили следующим образом: клетки DF-1 (ATCC CRL-12203, куриные фибробласты) поддерживали во влажной атмосфере, содержащей 5% CO2 при 37°C, в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 4,5 г/л глюкозу, 1,5 г/л бикарбонат натрия, 10% фетальную телячью сыворотку (FCS), 2 мМ L-глютамин с добавлением пенициллина (100 ед/мл) и стрептомицина (100 мкг/мл). Клетки DF1 пересеивали по мере необходимости, используя 0,25% (масс./об.) смесь трипсин-этилендиаминтетрауксусная кислота (EDTA).
Совместную трансфекцию плазмид pEGFP-Gdf8 и ddРНКи для анализов на выключение слитого гена EGFP-Gdf8 проводили в клетках DF-1, выращенных до 80-90% конфлюэнтности, в 8-луночных предметных стеклах (Nunc) с целью проведения анализа методом флуоресцентной микроскопии. Клетки трансфицировали в общей сложности 1 мкг плазмидной ДНК на лунку, используя реагент для трансфекции Lipofectamine™2000 (Invitrogen). Экспрессию EGFP анализировали в трансфицированных клетках DF-1 через 60 часов после трансфекции следующим образом: совместно трансфицированные клетки в 8-луночных предметных стеклах промывали PBSA, обрамление предметных стекол удаляли и покровные стекла помещали на монослой клеток. Микроскопическое исследование проводили при помощи флуоресцентного микроскопа Leica DM LB (Leica Microsystems, Germany) и изображения фиксировали при 50× увеличении, используя цветную цифровую камеру Leica DC300F (Leica Microsystems, Germany) и программное обеспечение для обработки изображений Photoshop 7.0 (Adobe®). Результаты представлены на фигуре 3. мшGdf8-1002 очень эффективно выключала экспрессию слитого транскрипта и, вследствие этого, представляет собой превосходного кандидата для выключения природного транскрипта Gdf8.
Специалистам в данной области следует признать, что возможно осуществлять многочисленные вариации и/или модификации изобретения, представленного в конкретных вариантах осуществления, без изменения сущности и объема изобретения, описанного широко. Вследствие этого настоящие варианты осуществления следует рассматривать во всех отношениях как иллюстративные, а не ограничивающие.
По настоящей заявке испрашивается приоритет по US 60/943708, поданной 13 июня 2007 г., полное содержание которой включено в данный документ посредством ссылки.
Полное содержание всех публикаций, обсуждаемых или приведенных в качестве ссылки, включено в данный документ.
Любое обсуждение документов, актов, материалов, устройств, изделий и тому подобного, включенное в настоящее описание, предназначено исключительно для целей создания контекста для настоящего изобретения. Это не следует воспринимать как признание того, что любое или все из перечисленного является частью предшествующего уровня техники, либо представляет собой общие знания в области, относящейся к настоящему изобретению, существующие до даты приоритета каждого пункта формулы изобретения данной заявки.
ЛИТЕРАТУРА
Amarzguioui et al. (2004) Biochem Biophys Res Commun 316: 1050-1058.
Elbashire et al. (2001) Nature 411: 494-498.
Hori et al. (2000) Mol Biol Cell 11: 3645-3660.
Freier et al. (1986) Proc Natl Acad Sci USA 83: 9373-9377.
Needleman and Wunsch (1970) J Mol Biol 48: 443-453.
O'Neill et al. (2000) Dev Genes Evol 210: 243-249.
Raymond et al. (1999) Dev Biol. 215: 208-220.
Reynolds et al. (2004) Nat. Biotech., 22: 326-330.
Smith et al. (1999) Nature 402: 601-602.
Smith et al. (2000) Nature 407: 319-320.
Taxman et al. (2006) BMC Biotechnol, Jan 24, 6: 7.
Waterhouse et al. (1998) Proc Natl Acad Sci USA 95: 13959-13964.
































Изобретение относится к области биотехнологии. Предложен способ изменения признака пола у птиц. Способ предусматривает введение в яйцо птицы молекулы РНК. Вводимая молекула РНК содержит двухцепочечную область и приводит к уменьшению в яйце уровня молекулы РНК и/или белка, вовлеченных в определение пола у птиц. Изобретение может быть использовано в птицеводстве. 6 з.п. ф-лы, 3 ил., 6 табл., 2 пр.
1. Способ изменения признака у птицы, включающий введение в яйцо птицы по меньшей мере одной молекулы РНК, содержащей двухцепочечную область (дцРНК), где молекула РНК приводит к уменьшению уровня в яйце по меньшей мере одной молекулы РНК и/или белка, вовлеченных в определение пола, и где способ не включает электропорацию яйца, и где признак представляет собой пол.
2. Способ изменения признака у птицы, включающий введение в яйцо птицы по меньшей мере одной молекулы РНК, содержащей двухцепочечную область (дцРНК), где молекула РНК приводит к уменьшению уровня в яйце по меньшей мере одной молекулы РНК и/или белка, вовлеченных в определение пола, и где молекулу РНК вводят в воздушный мешок, желточный мешок или аллантоисную жидкость хориона, и где признак представляет собой пол.
3. Способ по п.1 или 2, где дцРНК представляет собой миРНК или мшРНК.
4. Способ по п.1 или 2, где молекула нуклеиновой кислоты уменьшает уровень белка, кодируемого геном DMRT1.
5. Способ по п.4, где молекула нуклеиновой кислоты содержит по меньшей мере одну нуклеотидную последовательность, выбранную из:
CCAGUUGUCAAGAAGAGCA (SEQ ID №:11)
GGAUGCUCAUUCAGGACAU (SEQ ID №:12)
CCCUGUAUCCUUACUAUAA (SEQ ID №:13)
GCCACUGAGUCUUCCUCAA (SEQ ID №:14)
CCAGCAACAUACAUGUCAA (SEQ ID №:15)
CCUGCGUCACACAGAUACU (SEQ ID №:16)
GGAGUAGUUGUACAGGUUG (SEQ ID №:17)
GACUGGCUUGACAUGUAUG (SEQ ID №:18)
AUGGCGGUUCUCCAUCCCU (SEQ ID №:19),
или вариант любой из них.
6. Способ по любому из пп.1, 2 или 5, где молекулу нуклеиновой кислоты вводят инъекцией.
7. Способ по любому из пп.1, 2 или 5, где птицу выбирают из кур, уток, индеек, гусей, бентамок и перепелок.
| RAO M | |||
| et al., "In vivo comparative study of RNAi methodologies by in ovo electroporation in the chick embryo", Dev Dyn | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| DAI F | |||
| et al., "RNAi-induced targeted silencing of developmental control genes during chicken embryogenesis", Dev Biol | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| (реферат) | |||
| BOURIKAS D | |||
| et al., "New tools for gene | |||
Авторы
Даты
2014-06-10—Публикация
2008-06-12—Подача