Уровень техники
Это изобретение относится к трициклическим соединениям. Эти соединения имеют селективную ингибирующую активность в отношении кислотной помпы. Настоящее изобретение также относится к фармацевтической композиции, способу лечения и применению, включающим указанные производные, для лечения болезненных состояний, опосредуемых активностью, модулирующей кислотную помпу; в частности, активностью ингибирующей кислотную помпу.
Было четко установлено, что ингибиторы протонной помпы (PPI) являются пролекарствами, которые в результате катализируемой кислотой химической перегруппировки приобретают способность ингибировать H+/K+-АТФазу за счет ковалентного связывания с ее остатками Цистеина (Sachs, G. et. al., Digestive Diseases and Sciences, 1995, 40, 3S-23S; Sachs et. al., Annu Rev Pharmacol Toxicol, 1995, 35, 277-305.). Однако в отличие от PPI антагонисты кислотной помпы ингибируют секрецию кислоты через механизм обратимого калий-конкурентного ингибирования H+/K+-АТФазы. SCH28080 является одним из таких обратимых ингибиторов и был тщательно изучен. Другие более новые средства (ревапразан, сорапразан, AZD-0865 и CS-526) находятся в фазе клинических испытаний, подтверждающих их эффективность у человека (Pope, A.; Parsons, M., Trends in Pharmacological Sciences, 1993,14, 323-5; Vakil, N., Alimentary Pharmacology and Therapeutics, 2004, 19, 1041-1049.). В целом обнаружено, что антагонисты кислотной помпы могут быть использованы для лечения различных заболеваний, включая желудочно-кишечные заболевания, желудочно-пищеводные заболевания, гастроэзофагеальную рефлюксную болезнь (GERD), ларингофарингеальную рефлюксную болезнь, язвенную болезнь, язву желудка, язву двенадцатиперстной кишки, язвы, вызванные нестероидными противовоспалительными лекарственными средствами (NSAID), гастрит, инфекцию Helicobacter pylori, диспепсию, функциональную диспепсию, синдром Zollinger-Ellison, неэрозионную рефлюксную болезнь (NERD), висцеральную боль, рак, изжогу, тошноту, эзофагит, дисфагию, гиперсаливацию, нарушения дыхательных путей или астму (в дальнейшем указанные как ”Заболевания APA”; Kiljander, Toni O, American Journal of Medicine, 2003, 115 (Suppl. 3A), 65S-71S; Ki-Baik Hahm et al., J. Clin. Biochem. Nutr., 2006, 38, (1), 1-8.).
WO 04/87701 относится к некоторым соединениям, таким как трициклические производные бензимидазола, в качестве антагонистов кислотной помпы.
Существует потребность в новых антагонистах кислотной помпы, которые являлись бы хорошими кандидатами в качестве лекарственного средства и восполнили бы невыполненные PPI потребностям для лечения заболеваний. В частности, предпочтительные соединения должны прочно связываться с кислотной помпой, демонстрируют при этом низкое сродство к другим рецепторам, и показывать функциональную активность в качестве ингибиторов кислотной секреции в желудке. Они должны хорошо всасываться из желудочно-кишечного тракта, быть метаболически стабильными и обладать благоприятными фармакокинетическими свойствами. Они должны быть нетоксичными. Кроме того, идеальный кандидат лекарственного средства должен существовать в физической форме, которая является стабильной, негигроскопичной и легкой в обращении.
Сущность изобретения
В рамках изобретения было установлено, что новый класс трициклических соединений, имеющих замещенную алкильную группу в положении 1, демонстрирует ингибирующую активность в отношении кислотной помпы и хорошую биодоступность как кандидата лекарственного средства, и таким образом эти соединения могут быть использованы для лечения болезненных состояний, опосредуемых ингибирующей активностью в отношении кислотной помпы, таких как Заболевания APA.
Настоящее изобретение относится к соединению следующей формулы (I):
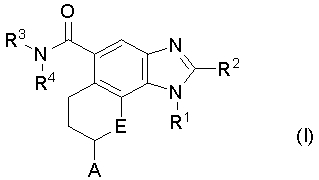
или к его фармацевтически приемлемой соли, в которой;
R1 обозначает C1-C6 алкил, незамещенный или замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы, гидрокси-замещенного C3-C7 циклоалкила, гидрокси-C1-C6 алкил-замещенного C3-C7 циклоалкила, арила, гидрокси-замещенного арила, гетероарила и галоген-замещенного гетероарила;
R2 обозначает атом водорода или C1-C6 алкил, незамещенный или замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы и C1-C6 алкокси-группы;
R3 и R4 независимо обозначают атом водорода, или C1-C6 алкил, C3-C7 циклоалкил или гетероарил, незамещенный или замещенный 1-3 заместителями, независимо выбранными из группы, состоящей из дейтерия, атома галогена, гидроксильной группы, C1-C6 алкокси-группы и C3-C7 циклоалкила; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют 4-6-членную гетероциклическую группу, незамещенную или замещенную 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы, C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила;
А обозначает арил или гетероарил, незамещенный или замещенный 1-5 заместителями, независимо выбранными из группы, состоящей из атома галогена, C1-C6 алкила, гидрокси-C1-C6 алкила, C1-C6 алкокси-замещенный C1-C6 алкил, -NR5SO2R6 и -CONR7R8;
R5, R7 и R8 независимо обозначают атом водорода или C1-C6 алкил;
R6 обозначает C1-C6 алкил; и
E обозначает атом кислорода или NH.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, как описано здесь, вместе с фармацевтически приемлемым носителем для указанного соединения.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, как описано здесь, дополнительно содержащей другое фармакологически активное средство (средства).
Кроме того, настоящее изобретение относится к способу лечения состояния, опосредуемого модулирующей кислотную помпу активностью у млекопитающего, включая человека, который включает введение млекопитающему терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано здесь.
Примеры состояний, установленных модулирующей кислотную помпу активностью включают, но не ограничены ими, Заболевания APA.
Далее, настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, как описано здесь, для получения лекарственного средства для лечения состояния, опосредуемого ингибирующей кислотную помпу активностью.
Далее, настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для применения в медицине.
Предпочтительно, настоящее изобретение также относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, как описано здесь, для получения лекарственного средства для лечения заболеваний, выбранных из Заболеваний APA.
Соединения согласно настоящему изобретению могут демонстрировать хорошему ингибирующую кислотную помпу активность, низкую токсичность, хорошее всасывание, хорошее распределение, хорошую растворимость, низкое белок-связывающее сродство кроме белков кислотной помпы, низкое взаимодействие с другими лекарственными средствами и хорошую метаболическую стабильность.
Подробное описание изобретения
В соединениях согласно настоящему изобретению:
Если R2, R3, R4, R5, R6, R7, R8 и заместители 4-7-членной гетероциклической группы и A представляют собой C1-C6 алкил, этот C1-C6 алкил, может быть группой с прямой или разветвленной цепью, имеющей от одного до шести атомов углерода, и примеры включают, но не ограничены ими, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, 1-этилпропил и гексил. Из них C1-C2 алкил является более предпочтительным; метил является еще более предпочтительным.
Если R3 и R4 обозначают C3-C7 циклоалкил, они обозначают циклоалкильную группу, имеющую от трех до семи атомов углерода, и примеры включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Из них предпочтительным является C3-C5 циклоалкил; циклопропил является более предпочтительным.
Если заместители R1, R3 и R4 представляют собой C1-C6 алкокси, они обозначают атом кислорода, замещенный указанным C1-C6 алкилом, и примеры включают, но не ограничены ими, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси и гексилокси. Из них предпочтительным является C1-C4 алкокси; C1-C2 алкокси является более предпочтительным; метокси является еще более предпочтительным.
Если R3 и R4, вместе с атомом азота, к которому они присоединены, образуют 4-7-членную гетероциклическую группу, эта 4-7-членная гетероциклическая группа представляет собой насыщенную гетероциклическую группу, имеющую от трех до шести кольцевых атомов, выбранных из атома углерода, атома азота, атома серы и атома кислорода, кроме указанного атома азота, и примеры включают, но не ограничены ими, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, пиперидил, пиперазинил, гексагидроазепинил, гексагидродиазепинил, морфолино, тиоморфолино и гомоморфолино. Из них предпочтительными являются азетидинил, пирролидинил, морфолино и гомоморфолино; морфолино является более предпочтительным.
Если заместитель 4-7-членной гетероциклической группы или A представляет собой гидрокси-C1-C6 алкил, он представляет собой указанный C1-C6 алкил, замещенный гидроксильной группой, и примеры включают, но не ограничены ими, гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 2-гидроксипропил, 2-гидрокси-1-метилэтил, 4-гидроксибутил, 3-гидроксибутил, 2-гидроксибутил, 3-гидрокси-2-метилпропил, 3-гидрокси-1-метилпропил, 5-гидроксипентил и 6-гидроксигексил. Из них, предпочтительным является гидрокси-C1-C3 алкил; гидроксиметил является более предпочтительным.
Если A и заместители R1 представляют собой арил, они могут представлять собой фенил, нафтил или антраценил. Из них предпочтительным является фенил.
Если заместители R3, R4 и A обозначают атом галогена, они могут быть атомом фтора, хлора, брома или йода. Из них предпочтительными являются атом фтора и атом хлора.
Если заместитель R1 представляет собой гидрокси-замещенный арил, эта гидрокси-замещенная арильная группа представляет собой арильную группу, которая замещена гидроксильной группой (группами), а арильная группа является такой, как указанная выше. Примеры включают, но не ограничены ими, 2-гидроксифенил, 3-гидроксифенил, 4-гидроксифенил, 2,3-дигидроксифенил, 2,4-дигидроксифенил, 3,5-дигидроксифенил, 1-гидроксинафтил, 2-гидроксинафтил, 1-гидроксиантраценил. Из них предпочтительным является 3-гидроксифенил.
Если A, R3, R4 или заместители R1 представляют собой гетероарил, они представляют собой 5-6-членное кольцо, содержащее по меньшей мере один гетероатом, выбранный из N, O и S, и примеры включают, но не ограничены ими, 2-тиенил, 2-тиазолил, 4-тиазолил, 2-фурил, 2-оксазолил, 1-пиразолил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиразинил и 2-пиримидинил. Из них предпочтительным является гетероарил, содержащий по меньшей мере один атом азота; 2-тиазолил, 4-тиазолил и 1-пиразолил являются более предпочтительными для заместителя R1; 2-пиридил, 3-пиридил и 4-пиридил являются более предпочтительными для A.
Если заместитель R1 представляет собой гидрокси-замещенный C3-C7 циклоалкил, этой гидрокси-замещенный C3-C7 циклоалкил представляет собой C3-C7 циклоалкил, замещенный гидроксильной группой (группами), причем C3-C7 циклоалкил является таким, как указанный выше. Примеры гидрокси-замещенного C3-C7 циклоалкила включают, но не ограничены ими, 1-гидроксициклопропил, 2-гидроксициклопропил, 1-гидроксициклобутил, 2-гидроксициклобутил, 2,3-дигидроксициклобутил 2-гидроксициклопентил, 3-гидроксициклопентил, 1-гидроксициклогексил, 2-гидроксициклогексил, 3-гидроксициклогексил, 4-гидроксициклогексил, 2,4-дигидроксициклогексил, 3,5-дигидроксициклогексил, 1-гидроксициклогептил, 2-гидроксициклогептил, 3-гидроксициклогептил и 4-гидроксициклогептил. Из них предпочтительным является гидрокси-замещенный C3-C5 циклоалкил; 1-гидроксициклопропил является более предпочтительным.
Если заместитель R1 представляет собой гидрокси-C1-C6 алкил-замещенный C3-C7 циклоалкил, этот гидрокси-C1-C6 алкил-замещенный C3-C7 циклоалкил обозначает C3-C7 циклоалкил, замещенный гидрокси-C1-C6 алкильной группой (группами), причем гидрокси-C1-C6 алкил и C3-C7 циклоалкил являются такими, как указанные выше. Примеры гидрокси-C1-C6 алкил-замещенного C3-C7 циклоалкила включают, но не ограничены ими, 1-гидроксиметилциклопропил, 1-(2-гидроксиэтил)-циклопропил, 2-гидроксиметилциклопропил, 1-гидроксиметилциклобутил, 2-гидроксиметилциклобутил, 2,3-бис(гидроксиметил)циклобутил, 1-гидроксиметилциклопентил, 2-гидроксиметилциклопентил, 3-гидроксиметилциклопентил, 1-гидроксиметилциклогексил, 2-гидроксиметилциклогексил, 3-гидроксиметилциклогексил, 4-гидроксиметилциклогексил, 1-гидроксиметилциклогептил, 2-гидроксиметилциклогептил, 3-гидроксиметилциклогептил и 4-гидроксиметилциклогептил. Из них предпочтительным является гидрокси-C1-C3 алкил-замещенный C3-C5 циклоалкил; 1-гидроксиметилциклопропил и 1-(2-гидроксиэтил)-циклопропил являются более предпочтительными.
Если заместитель R1 представляет собой замещенный галогеном гетероарил, этот замещенный галогеном гетероарил представляет собой гетероарил, замещенный атомом (атомами) галогена, и атом галогена и гетероарил являются такими, как указанные выше. Примеры замещенного галогеном гетероарила включают, но не ограничены ими, 4-фтор-2-тиенил, 4-фтор-2-тиазолил, 2-фтор-4-тиазолил, 4-фтор-2-фурил, 4-фтор-2-оксазолил, 4-фтор-1-пиразолил, 4-фтор-2-пиридил, 5-фтор-3-пиридил, 3-фтор-4-пиридил, 3,4-дифтор-2-пиридил, 3,5-дифтор-2-пиридил, 5-фтор-2-пиразил, 5-фтор-2-пиримидинил, 4-хлор-2-тиенил, 4-хлор-2-тиазолил, 2-хлор-4-тиазолил, 4-хлор-2-фурил, 4-хлор-2-оксазолил, 4-хлор-1-пиразолил, 4-хлор-2-пиридил, 5-хлор-3-пиридил, 3-хлор-4-пиридил, 3,4-дихлор-2-пиридил, 3,5-дихлор-2-пиридил, 5-хлор-2-пиразил и 5-хлор-2-пиримидинил. Из них предпочтительным является 3,5-дифтор-2-пиридил.
Если заместитель A представляет собой C1-C6 алкокси-замещенный C1-C6 алкил, этот C1-C6 алкокси-замещенный C1-C6 алкил представляет собой C1-C6 алкил, замещенный C1-C6 алкокси-группой (группами) и C1-C6 алкокси и C1-C6 алкил являются такими, как указанные выше. Примеры C1-C6 алкокси-замещенного C1-C6 алкила включают, но не ограничены ими, метоксиметил, 2-метоксиэтил, 3-метоксипропил, 4-метоксибутил, 5-метоксипентил, 6-метоксигексил, 1-этоксиметил, 2-этоксиэтил, 3-этоксипропил, 4-этоксибутил, 5-этоксипентил. Из них предпочтительным является C1-C3 алкокси-замещенный C1-C3 алкил; метоксиметил является более предпочтительным.
Если заместители 4-6-членной гетероциклической группы представляют собой C1-C6 ацильную группу, она представляет собой карбонильную группу, замещенную атомом водорода или указанной C1-C5 алкильной группой, и примеры включают, но не ограничены ими, формил, ацетил, пропионил, бутирил, пентаноил и гексаноил. Из них предпочтительным является C2-C6 ацил, и более предпочтительным является ацетил.
Термин "лечение" в рамках изобретения относится к лечебному, паллиативному и профилактическому лечению, включая обращение, облегчение, ингибирование развития или предотвращение нарушения или состояния, к которому такой термин относится, или одного или более симптомов такого нарушения или состояния.
Предпочтительные классы соединений согласно настоящему изобретению составляют соединения формулы (I) или их фармацевтически приемлемые соли, как описано здесь, в которых:
(a) R1 обозначает C1-C6 алкил, замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы, гидрокси-замещенного C3-C7 циклоалкила, гидрокси-C1-C6 алкил-замещенного C3-C7 циклоалкила, арила, гидрокси-замещенного арила, гетероарила и галоген-замещенного гетероарила;
(b) R1 обозначает C1-C6 алкил, замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы или гетероарила;
(c) R1 обозначает C1-C6 алкил, замещенный гидроксильной группой, C1-C6 алкокси-группой или гетероарилом;
(d) R1 обозначает C2-C3 алкил, замещенный гидроксильной группой, C1-C3 алкокси-группой, изоксазолом, тиазолилом или пиразолилом;
(e) R1 обозначает C2-C3 алкил, замещенный гидроксильной группой, метокси-группой или изоксазолом;
(f) R2 обозначает C1-C6 алкил, являющийся незамещенным или замещенным 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы и C1-C6 алкокси-группы;
(g) R2 обозначает C1-C6 алкил;
(h) R2 обозначает C1-C3 алкил;
(i) R2 обозначает метил;
(j) R3 и R4 независимо обозначают атом водорода или C1-C6 алкил, C3-C7 циклоалкил или гетероарил, являющийся незамещенным или замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из дейтерия, атома галогена, гидроксильной группы, C1-C6 алкокси-группы и C3-C7 циклоалкила;
(k) R3 и R4 независимо обозначают C1-C6 алкил, являющийся незамещенным или замещенным одним заместителем, выбранным из группы, состоящей из гидроксильной группы и C1-C6 алкокси-группы или -CD3;
(l) R3 и R4 независимо обозначают атом водорода, C1-C3 алкил, являющийся незамещенным или замещенным гидроксильной группой или -CD3;
(m) R3 и R4 независимо обозначают атом водорода, метил, -CD3 или 2-гидроксиэтил;
(n) R3 и R4 независимо обозначают метил, -CD3 или 2-гидроксиэтил;
(o) R3 и R4, вместе с атомом азота, к которому они присоединены, образуют 4-6-членную гетероциклическую группу, являющуюся незамещенной или замещенной 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы, C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила;
(p) R3 и R4, вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперазинил или морфолино, являющиеся незамещенными или замещенными 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы, C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила;
(q) R3 и R4, вместе с атомом азота, к которому они присоединены, образуют пиперазинил или морфолино, являющиеся незамещенными или замещенными 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы и гидрокси-C1-C3 алкила;
(r) R3 и R4, вместе с атомом азота, к которому они присоединены, образуют морфолино;
(s) A обозначает арил, являющийся незамещенным или замещенным 1-5 заместителями, независимо выбранными из группы, состоящей из атома галогена, C1-C6 алкила, гидрокси-C1-C6 алкила, C1-C6 алкокси-замещенный C1-C6 алкил, -NR5SO2R6 и -CONR7R8;
(t) A обозначает арил, являющийся незамещенным или замещенным 1-5 заместителями, выбранными из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и гидрокси-C1-C6 алкила;
(u) A обозначает арил, являющийся незамещенным или замещенным 1-2 заместителями, выбранными из группы, состоящей из атома водорода, атома фтора, метила и гидроксиметила;
(v) A обозначает арил, являющийся незамещенным или замещенным атомом галогена;
(w) A обозначает фенил, являющийся незамещенным или замещенным атомом фтора;
(x) R5 обозначает атом водорода или C1-C6 алкил;
(y) R5 обозначает атом водорода или метил;
(z) R6 обозначает C1-C4 алкил;
(aa) R6 обозначает метил
(bb) R7 обозначает атом водорода или C1-C6 алкил;
(cc) R7 обозначает атом водорода или метил;
(dd) R8 обозначает атом водорода или C1-C6 алкил;
(ее) R8 обозначает атом водорода или метил;
(ff) E обозначает атом кислорода.
Из этих классов соединений также предпочтительна любая комбинация от (a) до (ff).
Предпочтительными соединениями согласно настоящему изобретению являются соединения формулы (I) или их фармацевтически приемлемые соли, как описано здесь, в которых:
(A) R1 обозначает C1-C6 алкил, замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы и гетероарила; R2 обозначает C1-C6 алкил; R3 и R4 независимо обозначают атом водорода или C1-C6 алкил, являющийся незамещенным или замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из дейтерия, гидроксильной группы и C1-C6 алкокси-группы; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют 4-6-членную гетероциклическую группу, являющуюся незамещенной или замещенной 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы, C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила; A обозначает арил, являющийся незамещенным или замещенным 1-5 заместителями, независимо выбранными из группы, состоящей из атома галогена, C1-C6 алкила, гидрокси-C1-C6 алкила, C1-C6 алкокси-замещенного C1-C6 алкила, -NR5SO2R6 и -CONR7R8; R5, R7 и R8 независимо обозначают атом водорода или C1-C6 алкил; и R6 обозначает C1-C6 алкил; и E обозначает атом кислорода;
(B) R1 обозначает C1-C6 алкил, замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы или гетероарила; R2 обозначает C1-C6 алкил; R3 и R4 независимо обозначают атом водорода, C1-C3 алкил, являющийся незамещенным или замещенным гидроксильной группой или -CD3; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперазинил или морфолино, являющиеся незамещенными или замещенными 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы, C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила; A обозначает арил, являющийся незамещенным или замещенным 1-5 заместителями, независимо выбранными из группы, состоящей из атома галогена, C1-C6 алкила, гидрокси-C1-C6 алкила, C1-C6 алкокси-замещенного C1-C6 алкила, -NR5SO2R6 и -CONR7R8; R5, R7 и R8 независимо обозначают атом водорода или C1-C6 алкил; и R6 обозначает C1-C6 алкил; и E обозначает атом кислорода;
(C) R1 обозначает C1-C6 алкил, замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы или гетероарила; R2 обозначает C1-C6 алкил; R3 и R4 независимо обозначают атом водорода, C1-C3 алкил, являющийся незамещенным или замещенным гидроксильной группой или -CD3; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперазинил или морфолино, являющиеся незамещенными или замещенными 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы, C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила; A обозначает арил, являющийся незамещенным или замещенным 1-5 заместителями, выбранными из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и гидрокси-C1-C6 алкила;
(D) R1 обозначает C1-C6 алкил, замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы или гетероарила; R2 обозначает метил; R3 и R4 независимо обозначают атом водорода, метил, -CD3 или 2-гидроксиэтил; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют азетидинил, пирролидинил, пиперазинил или морфолино, являющиеся незамещенными или замещенными 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы, C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила; A обозначает арил, являющийся незамещенным или замещенным 1-5 заместителями, выбранными из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и гидрокси-C1-C6 алкила;
(E) R1 обозначает C1-C6 алкил, замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, C1-C6 алкокси-группы или гетероарила; R2 обозначает метил; R3 и R4 независимо обозначают атом водорода, метил, -CD3 или 2-гидроксиэтил; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют пиперазинил или морфолино, являющиеся незамещенными или замещенными 1-2 заместителями, выбранными из группы, состоящей из гидроксильной группы, оксогруппы и гидрокси-C1-C3 алкила; C1-C6 алкила, C1-C6 ацила и гидрокси-C1-C6 алкила; A обозначает арил, являющийся незамещенным или замещенным 1-5 заместителями, выбранными из группы, состоящей из атома водорода, атома галогена, C1-C6 алкила и гидрокси-C1-C6 алкила;
(F) R1 обозначает C1-C6 алкил, замещенный гидроксильной группой, C1-C6 алкокси-группой или гетероарилом; R2 обозначает C1-C6 алкил; R3 и R4 независимо обозначают атом водорода, метил, -CD3 или 2-гидроксиэтил; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют морфолино; A обозначает арил, являющийся незамещенным или замещенным атомом галогена; и E обозначает атом кислорода.
Соединения формулы (I), содержащие один или более асимметрических атомов углерода, могут существовать в форме двух или более стереоизомеров.
В рамки настоящего изобретения входят все стереоизомеры и геометрические изомеры соединений формулы (I), включая соединения, показывающие более одного типа изомерии, и смеси одного или более из них. Также в рамки изобретения входят соли присоединения с кислотой, в которых противоион оптически активен, например, D-лактат или L-лизин, или рацемат, DL-тартрат или DL-аргинин.
Один вариант осуществления изобретения относится к соединению, выбранному из группы, состоящей из следующих соединений:
(-)-1-(2-метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
(-)-8-(4-фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
8-(4-фторфенил)-1-(3-гидроксипропил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
8-(4-фторфенил)-1-(изоксазол-3-илметил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
N,N-ди[2H3]метил-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
8-(4-фторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[8,7-d]имидазол-5-карбоксамид;
(8-(4-фторфенил)-1-(2-метоксиэтил)-2-метил-1,6,7,8-тетрагидрохромено[8,7-d]имидазол-5-ил)(морфолино)метанон
или к его фармацевтически приемлемой соли.
Фармацевтически приемлемые соли соединения формулы (I) включают соли присоединения с кислотой (включая дисоли).
Подходящие соли присоединения с кислотой получают из кислот, которые образуют нетоксичные соли. Примеры включают ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат, цитрат, цикламат, эдисилат, эзилат, формиат, фумарат, глуцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинофоат.
Для обзора подходящих солей, см. “Handbook of Pharmaceutical Salts: Properties, Selection, and Use” by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена путем смешивания растворов соединения формулы (I) и желаемой кислоты или основания, в зависимости от случая. Соль может быть осаждена из раствора и собрана фильтрацией или может быть получена выпариванием растворителя. Степень ионизации в соли может варьировать от полностью ионизированной до почти неионизированной.
Фармацевтически приемлемые соли соединений по изобретению включают как сольватированные, так и несольватированные формы. Термин "сольват" используется здесь для описания молекулярного комплекса, включающего соединение по изобретению и одну или более фармацевтически приемлемых молекул растворителя, например, этанола. Термин 'гидрат' используется, когда указанным растворителем является вода.
Фармацевтически приемлемые сольваты в соответствии с изобретением включают гидраты и сольваты, в которых растворитель кристаллизации может быть изотопически замещен, например, D2O, d6-ацетон, d6-ДМСО.
В рамки изобретения входят комплексы, такие как клатраты, комплексы включения лекарственное средство-хозяин, в которых, в отличие от указанных сольватов, лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также в рамки изобретения входят комплексы лекарственного средства, содержащие два или более органических и/или неорганических компонента, которые могут быть в стехиометрических или нестехиометрических количествах. Полученные комплексные соединения могут быть ионизированы, частично ионизированы или неионизированы. Для обзора таких комплексных соединений, см. J Pharm Sci, 64 (8), 1269-1288 by Haleblian (August 1975).
Соединения формулы (I) могут существовать в одной или более кристаллических форм. Эти полиморфы, включая их смеси, также включены в рамки настоящего изобретения.
Соединения формулы (I), содержащие один или более асимметрических атомов углерода, могут существовать в форме двух или более стереоизомеров.
В рамки настоящего изобретения входят все стереоизомеры соединений формулы (I), включая соединения, показывающие более одного типа изомерии, и смеси одного или более из них.
Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченные соединения формулы (I), в которых один или более атомов заменены атомами, имеющими тот же самый атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа, обычно существующих в природе.
Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P, и серы, такие как 35S.
Некоторые изотопно-меченные соединения формулы (I), например, которые включают радиоактивный изотоп, могут быть использованы в исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, то есть 3H, и углерод-14, то есть 14C, является особенно подходящими для этой цели ввиду легкости их включения и наличия средств обнаружения.
Замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может предоставить определенные терапевтические преимущества, следующие из их большей метаболической стабильности, например, увеличенного периода полураспада in vivo или меньших необходимых доз, и следовательно может быть предпочтительным при некоторых обстоятельствах.
Замещение с позитрон-испускающими изотопами, такими как 11C, 18F, 15O и 13N, может быть полезным в исследованиях методом Позитронной Эмиссионной томографии (ПЭТФ) для изучения заполнения рецептора субстратом.
Изотопно-меченные соединения формулы (I) могут быть получены обычными методиками, известными специалисту, или способами, аналогичными описанным в сопутствующих примерах и примерах получения, с использованием подходящих изотопно-меченных реактивов вместо немеченного реактива, используемого ранее.
Все соединения формулы (I) могут быть получены в соответствии с процедурами, описанными в общих способах, представленных ниже, или особыми способами, описанными в разделе примеров и в разделе примеров получения, или их обычными модификациями. Настоящее изобретение также охватывает любой один или более этих способов получения соединений формулы (I), в дополнение к любым используемым там новым промежуточным соединениям.
Общий синтез
Соединения согласно настоящему изобретению могут быть получены различными способами, известными в области получения соединений этого типа, например как показано в следующем Способе A и B.
Если не указано иное, R1, R2, R3, R4, R5, R6, R7, R8, A и E в следующих способах являются такими, как определены выше. Все исходные материалы в следующих общих способах синтеза могут быть коммерчески доступными или полученными обычными способами, известными специалисту, такими как описанные в WO 2004054984, раскрытие которого включено в настоящее описание путем ссылки.
Способ A
Этот способ иллюстрирует получение соединений формулы (Ia), в которой E обозначает атом кислорода.
Схема реакции A
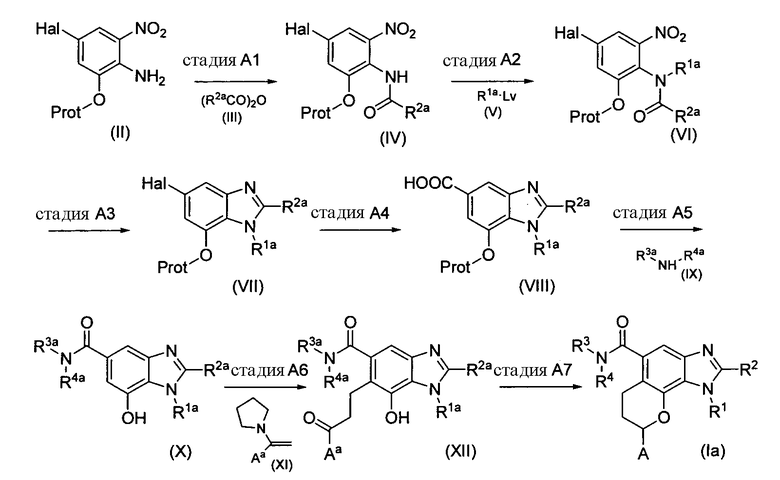
В Схеме Реакции A R1, R2, R3, R4 и A имеют значения, как определено выше; Hal обозначает атом галогена, предпочтительно атом брома; Lv обозначает удаляемую группу; R1a обозначает R1 как определено выше или R1, в котором гидроксильная группа защищена защитной группой для гидроксильной группы; R2a обозначает R2 как определено выше или R2, в котором гидроксильная группа защищена защитной группой для гидроксильной группы; R3a обозначает R3 как определено выше или R3, в котором гидроксильная группа защищена защитной группой для гидроксильной группы; R4a обозначает R4 как определено выше или R4, в котором гидроксильная группа защищена защитной группой для гидроксильной группы; Aa обозначает А как определено выше или А, в котором гидроксильная группа защищена защитной группой для гидроксильной группы, Prot обозначает защитную группу для гидроксильной группы; и то же самое относится к дальнейшему описанию.
Термин “удаляемая группа” в рамках изобретения обозначает группу, способную к замещению нуклеофильными группами, такими как гидроксильная группа или амины и примеры таких удаляемых групп включают атом галогена, алкилсульфонилокси, галогеналкилсульфонилокси и фенилсульфонилокси. Из них предпочтительными являются атом брома, атом хлора, метилсульфонилокси, трифторметилсульфонилокси и 4-метилфенилсульфонилокси.
Термин "защитные группы для гидроксильной группы" в рамках изобретения обозначает защитную группу, способную к отщеплению различными средствами с получением гидроксильной группы, такими как гидрогенолиз, гидролиз, электролиз или фотолиз, и такие защитные группы для гидроксильной группы описаны в Protective Groups in Organic Synthesis, T. W. Greene et al. (John Wiley & Sons, 1999). Такими группами являются, например, C1-C6 алкоксикарбонил, C1-C6 алкилкарбонил, три-C1-C6 алкилсилил или три-C1-C6 алкиларилсилил, и C1-C6 алкокси C1-C6 алкил. Подходящие защитные группы для гидроксильной группы включают ацетил и трет-бутилдиметилсилил.
(Стадия A1)
На этой стадии соединение (IV) получают формированием амида аминогруппы соединения формулы (II), которое является коммерчески доступным или может быть получено способами, описанными в WO 2004054984, с ангидридом кислоты (III).
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворять реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорметан и 1,2-дихлорэтан; простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; карбоновые кислоты, такие как уксусная кислота; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; из этих растворителей предпочтительной является уксусная кислота.
Реакция может быть выполнена в присутствии кислоты. Также нет никакого специфического ограничения по природе используемых кислот, и любая кислота, обычно используемая в реакциях этого типа, может также использоваться здесь. Примеры таких кислот включают: кислоты, такие как соляная кислота, серная кислота или бромистоводородная кислота; сульфоновые кислоты, такие как метансульфоновая кислота или толуолсульфоновая кислота. Из них предпочтительной является серная кислота.
Реакция может быть выполнена в присутствии или в отсутствие основания. Также нет никакого специфического ограничения по природе используемых оснований, и любое основание, обычно используемое в реакциях этого типа, может также использоваться здесь. Примеры таких оснований включают: амины, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO), и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Из них предпочтительной является реакция в отсутствии основания.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя, и исходных материалов. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 100°C. Время, требуемое для реакции, может также широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 5 минут до приблизительно 24 часов обычно достаточен.
(Стадия A2)
На этой стадии соединение формулы (VI) получают нуклеофильным замещением соединения формулы (IV) соединением формулы (V).
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; нитрилы, такие как ацетонитрил и бензонитрил; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из этих растворителей предпочтительным является N,N-диметилформамид.
Реакцию проводят в присутствии основания. Также нет никакого специфического ограничения по природе используемых оснований, и любое основание, обычно используемое в реакциях этого типа, может также использоваться здесь. Примеры таких оснований включают: гидриды щелочного металла, такие как гидрид лития, гидрид натрия и гидрид калия; и амиды щелочного металла, такие как амид лития, амид натрия, амид калия, литийдиизопропиламид, калийдиизопропиламид, натрийдиизопропиламид, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия. Из них предпочтительным является гидрид натрия.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, реакцию предпочтительно проводят при температуре от приблизительно -20°C до приблизительно 80°C. Время, требуемое для реакции, может также широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 30 минут до приблизительно 24 часов обычно достаточен.
(Стадия A3)
На этой стадии соединение формулы (VII) получают восстановлением и циклизацией соединения формулы (VI).
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; карбоновые кислоты, такие как уксусная кислота; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол; нитрилы, такие как ацетонитрил и бензонитрил; Из этих растворителей предпочтительной является уксусная кислота.
Реакцию проводят в присутствии восстановителя. Также нет никакого специфического ограничения по природе используемых восстановителей, и любой восстановитель, обычно используемый в реакциях этого типа, может также использоваться здесь. Примеры таких восстановителей включают: комбинацию металлов, таких как цинк и железо, и кислот, таких как соляная кислота, уксусная кислота и комплекс уксусная кислота-хлорид аммония; комбинацию источника водорода, такого как газообразный водород, и формиата аммония, и катализатора, такого как палладий на угле, платина и никель Ренея. Из них предпочтительной является комбинация железа и уксусной кислоты или комбинация газообразного водорода и палладия на угле.
Реакция может быть осуществлена в присутствии кислоты. Также нет никакого специфического ограничения по природе используемых кислот, и любая кислота, обычно используемая в реакциях этого типа, может также использоваться здесь. Примеры таких кислот включают: кислоты, такие как соляная кислота, серная кислота или бромистоводородная кислота; карбоновые кислоты, такие как уксусная кислота; сульфоновые кислоты, такие как метансульфоновая кислота или толуолсульфоновая кислота. Из них предпочтительной является уксусная кислота.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако в общем температура реакции предпочтительно составляет от приблизительно 0°C до приблизительно 120°С. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 30 минут до приблизительно 24 часов обычно достаточен.
(Стадия A4)
На этой стадии соединение формулы (VIII) получают замещением атома галогена соединения формулы (VII) цианидом металла (A4a) с последующим гидролизом (A4b).
(A4a) Замещение атома галогена
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорметан и 1,2-дихлорэтан; простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, 1-метилпирролидин-2-он и триамид гексаметилфосфорной кислоты; из этих растворителей предпочтительным является N,N-диметилформамид.
Реакцию проводят в присутствии цианида металла. Нет никакого специфического ограничения по природе используемого цианида металла, и любой цианид металла, обычно используемый в реакциях этого типа, может также использоваться здесь. Примеры таких цианидов металла включают: цианид цинка (II), цианид меди (I), цианид калия и цианид натрия; Из них предпочтительным является цианид цинка (II).
Реакцию проводят в присутствии или в отсутствие катализатора на основе палладия. Нет никакого специфического ограничения по природеиспользуемого катализатора на основе палладия, и любой катализатор на основе палладия, обычно используемый в реакциях этого типа, может также использоваться здесь. Примеры таких катализаторов на основе палладия включают: металлический палладий, хлорид палладия, ацетат палладия (II), трис(дибензилиденацетон)дипалладийхлороформ, аллилпалладийхлорид, [1,2-бис(дифенилфосфино)этан]палладийдихлорид, бис(три-o-толилфосфин)палладийдихлорид, бис(трифенилфосфин)палладийдихлорид, тетракис(трифенилфосфин)палладий, дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий, или катализатор, полученный в растворе путем добавления лиганда в реакционный раствор. Лиганд, добавленный в реакционный раствор, может быть фосфорным лигандом, таким как трифенилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, бис(2-дифенилфосфинофенил)эфир, 2,2'-бис(дифенилфосфино)-1,1'-бинафтол, 1,3-бис(дифенилфосфино)пропан, 1,4-бис(дифенилфосфино)бутан, три-o-толилфосфин, 2-дифенилфосфино-2'-метокси-1,1'-бинафтил или 2,2-бис(дифенилфосфино)-1,1'-бинафтил. Из них предпочтительным является тетракис(трифенилфосфин)палладий.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, реакцию предпочтительно проводят при температуре от приблизительно 50°C до приблизительно 150°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 30 минут до приблизительно 24 часов обычно достаточен.
В этой реакции микроволновой реактор может использоваться, чтобы ускорить реакцию. В случае использования микроволнового реактора и герметизированной трубки, реакция может протекать при температуре от приблизительно 50°C до приблизительно 180°C, и время реакции может составлять от приблизительно 5 минут до приблизительно 12 часов.
(A4b) Гидролиз
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол, пропанол, 2-пропанол, бутанол и этиленгликоль; сульфоксиды, такие как диметилсульфоксид и сульфолан; воду; или смеси этих растворителей. Из этих растворителей предпочтительными являются метанол, этанол, тетрагидрофуран или этиленгликоль.
Реакция может быть осуществлена в присутствии основания. Также нет никакого специфического ограничения по природе используемых оснований, и любое основание, обычно используемое в реакциях этого типа, может также использоваться здесь. Примеры таких оснований включают: гидроксиды щелочного металла, такие как гидроксид лития, гидроксид натрия и гидроксид калия; карбонаты щелочного металла, такие как карбонат лития, карбонат натрия и карбонат калия. Из них предпочтительными являются гидроксид калия, гидроксид лития или гидроксид натрия.
Реакция может быть осуществлена в присутствии кислоты. Также нет никакого специфического ограничения по природе используемых кислот, и любая кислота, обычно используемая в реакциях этого типа, может также использоваться здесь. Примеры таких кислот включают: карбоновые кислоты, такие как уксусная кислота или пропионовая кислота; кислоты, такие как соляная кислота, серная кислота или бромистоводородная кислота. Из них предпочтительныма соляная кислота.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако в общем предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 150°C, время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 60 минут до приблизительно 24 часов обычно достаточен.
В этой реакции микроволновой реактор может использоваться, чтобы ускорить реакцию. В случае использования микроволнового реактора и герметизированной трубки, реакция может протекать при температуре от приблизительно 50°C до приблизительно 180°C, и время реакции может составлять от приблизительно 5 минут до приблизительно 12 часов.
(Стадия A5)
На этой стадии соединение (X) получают амидированием соединения формулы (VIII) соединением формулы (IX), которое является коммерчески доступным или описано в J. Org. Chem., 5935 (1990) и Canadian Journal of Chemistry, 2028 (1993).
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорметан и 1,2-дихлорэтан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; нитрилы, такие как ацетонитрил и бензонитрил; сульфоксиды, такие как диметилсульфоксид и сульфолан; или смеси этих растворителей. Из них предпочтительным является N,N-диметилформамид.
Реакцию проводят в присутствии основания. Также нет никакого специфического ограничения по природе используемых оснований, и любое основание, обычно используемое в реакциях этого типа, может также использоваться здесь. Примеры таких оснований включают: амины, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, DBN, DABCO и DBU. Из них предпочтительными являются триэтиламин или диизопропилэтиламин.
Реакцию проводят в присутствии конденсирующего средства. Также нет никакого специфического ограничения по природе используемых конденсирующих средств, и любое конденсирующее средство, обычно используемое в реакциях этого типа, может также использоваться здесь. Примеры таких конденсирующих средств включают: соль 2-галоген-1-низший алкилпиридиния, такую как 2-хлор-1-метилпиридиниййодид и 2-бром-1-этилпиридинийтетрафторборат (ВЕР); диарилфосфорилазиды, такие как дифенилфосфорилазид (DPPA); хлорформиаты, такие как этилхлорформиат и изобутилхлорформиат; фосфороцианидаты, такие как диэтилфосфороцианидат (DEPC); производные имидазола, такие как N,N'-карбонилдиимидазол (CDI); производные карбодиимида, такие как N,N'-дициклогексилкарбодиимид (DCC) и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDCI); соли иминия, такие как 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат (HBTU) и тетраметилфторформамидиний гексафторфосфат (TFFH); и соли фосфония, такие как бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат (ВОР) и бром-трис-пирролидино-фосфоний гексафторфосфат (PyBrop). Из них предпочтительными являются EDCI или HBTU.
На этой стадии могут использоваться такие реактивы, как 4-(N,N-диметиламино)пиридин (DMAP) и 1-гидроксибензотриазол (HOBt). Из них предпочтительным является HOBt.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако в общем предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 80°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 30 минут до приблизительно 48 часов обычно достаточен.
После этой реакции Prot1 может быть подвергнут реакции удаления защитной группы следующим образом.
(Удаление защитной группы Prot)
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол; карбоновая кислота, такая как уксусная кислота или муравьиная кислота. Из этих растворителей предпочтительным является метанол.
Реакцию осуществляют в присутствии катализатора на основе палладия в атмосфере газообразного водорода. Нет никакого специфического ограничения по природе используемого катализатора на основе палладия, и любой катализатор на основе палладия, обычно используемый в реакциях этого типа, может также использоваться здесь. Примеры таких катализаторов на основе палладия включают: металлический палладий, палладий на угле, гидроксид палладия. Из них предпочтительными являются палладий на угле или гидроксид палладия.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако в общем предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 100°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
(Стадия A6)
На этой стадии соединение (XII) получают Реакцией Манниха соединения формулы (X) с солью Эшенмозера (N,N-диметилметилениминиййодид) (A6a) с последующей реакцией сочетания с соединением формулы (XI) (A6b). Соединение формулы (XI) коммерчески доступно или может быть получено способами, описанными в J.. Chem. Soc., 1994, 116, 5985-5986.
(A6a) Реакция Манниха
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорметан и 1,2-дихлорэтан; простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид и сульфолан. Из этих растворителей предпочтительными являются N,N-диметилформамид или дихлорметан.
Реакцию проводят в присутствии или в отсутствие основания. Также нет никакого специфического ограничения по природе используемых оснований, и любое основание, обычно используемое в реакциях этого типа, может также использоваться здесь. Примеры таких оснований включают: гидроксиды щелочного металла, такие как гидроксид лития, гидроксид натрия и гидроксид калия; карбонаты щелочного металла, такие как карбонат лития, карбонат натрия и карбонат калия; гидрокарбонаты щелочного металла, такие как гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия. Из них предпочтительным является карбонат калия.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно -20°C до приблизительно 100°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
(A6b) реакция сочетания с соединением формулы (XI)
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; нитрилы, такие как ацетонитрил и бензонитрил; сульфоксиды, такие как диметилсульфоксид и сульфолан; кетоны, такие как ацетон и диэтилкетон. Из этих растворителей предпочтительным является толуол.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 150°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
(Стадия A7)
На этой стадии соединение (Ia) получают восстановлением соединения формулы (XII) (A7a) с последующей реакцией циклизации (A7b).
(A7a) восстановление
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорметан и 1,2-дихлорэтан; простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; сульфоксиды, такие как диметилсульфоксид и сульфолан; спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол; или смеси этих растворителей. Из них предпочтительными являются метанол или тетрагидрофуран.
Реакцию проводят в присутствии восстановителя. Также нет никакого специфического ограничения по природе используемых восстановителей, и любой восстановитель, обычно используемый в реакциях этого типа, может также использоваться здесь. Примеры таких восстановителей включают: боргидриды металлов, такие как боргидрид натрия, боргидрид лития и цианоборгидрид натрия; гидриды, такие как литий-алюминийгидрид и диизобутилалюминийгидрид; и борановые реагенты, такие как комплекс боран-тетрагидрофуран, комплекс боран-диметилсульфид (BMS) и 9-борабицикло[3.3.1]нонан (9-BBN). Из них предпочтительным является боргидрид натрия.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 80°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 8 часов будет обычно достаточным.
(A7b) реакция циклизации
Реакция может быть осуществлена в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан и петролейный эфир; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорметан и 1,2-дихлорэтан; простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; нитрилы, такие как ацетонитрил и бензонитрил. Из них предпочтительными являются тетрагидрофуран или толуол.
Реакция может быть осуществлена в присутствии конденсирующего средства. Также нет никакого специфического ограничения по природе используемых конденсирующих средств, и любое конденсирующее средство, обычно используемое в реакциях этого типа, может также использоваться здесь. Примеры таких конденсирующих средств включают: эфиры азодикарбоновой кислоты и ди-низшего алкила, такие как диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD) и ди-трет-бутилазодикарбоксилат (DTAD); азодикарбоксамиды, такие как N,N,N',N'-тетраизопропилазодикарбоксамид (TIPA), 1,1'-(азодикарбонил)дипиперидин (ADDP) и N,N,N',N'-тетраметилазодикарбоксамид (TMAD); фосфораны, такие как (цианометилен)трибутилфосфоран (CMBP) и (цианометилен)триметилфосфоран (CMMP). Из них предпочтительными являются DIAD или ADDP.
Фосфиновые реактивы, такие как трифенилфосфин, триметилфосфин и трибутилфосфин, могут использоваться на этой стадии. Из них предпочтительными являются трифенилфосфин или трибутилфосфин.
Альтернативно, неорганические кислоты, такие как сульфоновая кислота и фосфорная кислота, и вода могут использоваться в качестве растворителя и конденсирующего реагента. Из них предпочтительным является водный раствор фосфорной кислоты.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 100°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
Введение защитной группы для гидроксильной группы
В случае, когда R1, R2, R3, R4 или A имеют гидроксильную группу, в случае необходимости, реакция может быть осуществлена с введением защитной группы для гидроксильной группы.
Введение защитной группы для гидроксильной группы может быть осуществлено на соответствующей стадии перед реакцией, на которой затрагивают гидроксильную группу.
Эта реакция описана подробно T. W. Greene et al., Protective Groups in Organic Synthesis, 369-453, (1999), раскрытие которого включено в настоящее описание путем ссылки. Следующее описание иллюстрирует типичную реакцию, включающую защитную трет-бутилдиметилсилильную группу.
Например, когда защитной группой для гидроксильной группы является "трет-бутилдиметилсилил", эту стадию проводят, вводя в реакцию с желаемым галогенидом защитной группы для гидроксильной группы в инертном растворителе в присутствии основания.
Примеры подходящих растворителей включают: галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорметан и 1,2-дихлорэтан; простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; или смеси этих растворителей. Из них предпочтительными являются тетрагидрофуран или N,N-диметилформамид.
Примеры галогенида защитной группы для гидроксильной группы, который может быть использован в указанной реакции, включают триметилсилилхлорид, триэтилсилилхлорид, трет-бутилдиметилсилилхлорид, ацетилхлорид, которые являются предпочтительными.
Примеры основания включают гидроксиды щелочного металла, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочного металла, такие как карбонат лития, карбонат натрия и карбонат калия, и органические амины, такие как триэтиламин, трибутиламин, N-метилморфолин, пиридин, имидазол, 4-диметиламинопиридин, пиколин, диметилпиридин, этилметилпиридин, DBN и DBU. Из них предпочтительными являются триэтиламин, имидазол или пиридин. После использования органического амина в жидкой форме, он также служит растворителем, когда используется в большом избытке.
Реакция введения защитной группы может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 100°C. Время, требуемое для реакции, также может измениться широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
Стадия удаления защитной группы
В случае, если R1a, R2a, R3a, R4a или Aa имеют защищенную гидроксильную группу, осуществляют последующую реакцию удаления защитной группы, чтобы привести к гидроксильной группе. Эта реакция описана подробно T. W. Greene et al., Protective Groups in Organic Synthesis, 369-453, (1999), раскрытие которого включено в настоящее описание путем ссылки. Следующее описание иллюстрирует типичную реакцию, включающую защитную трет-бутилдиметилсилильную группу.
Удаление гидроксильных групп осуществляют с использованием кислоты, такой как уксусная кислота, гидрофторида, комплекса гидрофторид-пиридин или иона фтора, такого как тетрабутиламмонийфторид (TBAF).
Реакцию удаления защитной группы обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают, но не ограничены ими: спирт, такой как метанол, этанол или смеси этих растворителей.
Реакция удаления защитной группы может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 100°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
Способ B
Этот способ иллюстрирует получение соединений формулы (Ia), в которой E обозначает NH.
Схема реакции B
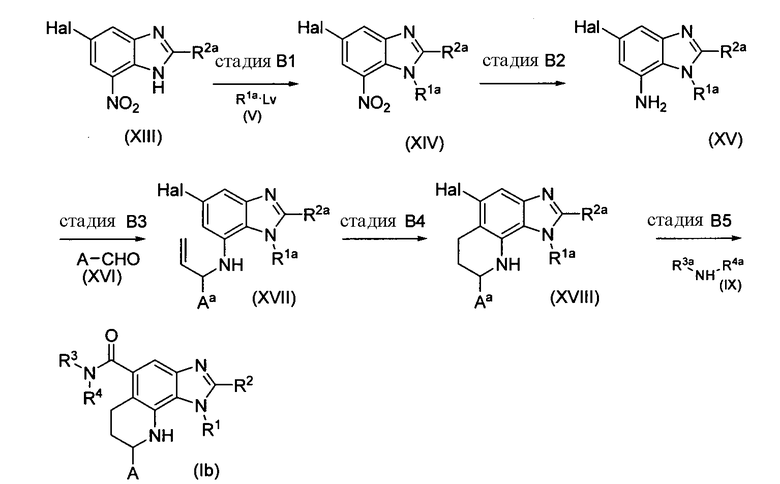
(Стадия B1)
На этой стадии соединение (XIV) получают нуклеофильным замещением соединения формулы (XIII), которое является коммерчески доступным или может быть получено способами, описанными в WO 2004087701, соединением формулы (V). Реакция может быть выполнена в тех же самых условиях, как описано на Стадии A2 Способа A.
(Стадия B2)
На этой стадии соединение (XV) получают восстановлением соединения формулы (XIV). Реакция может быть выполнена в тех же самых условиях, как описано на Стадии A3 Способа A.
(Стадия B3)
На этой стадии соединение (XVII) получают формированием имина соединения формулы (XV) с соединением формулы (XVI) (B3a), с последующей реакцией с винилмагнийбромидом (B3b).
(B3a) формирование имина
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; нитрилы, такие как ацетонитрил и бензонитрил; сульфоксиды, такие как диметилсульфоксид и сульфолан; или смеси этих растворителей. Из них предпочтительным является толуол.
Реакция может быть осуществлена в присутствии кислоты. Также нет никакого специфического ограничения по природе используемых кислот, и любая кислота, обычно используемая в реакциях этого типа, может также использоваться здесь. Примеры таких кислот включают: кислоты, такие как соляная кислота, серная кислота или бромистоводородная кислота; сульфоновые кислоты, такие как метансульфоновая кислота или толуолсульфоновая кислота; карбоновые кислоты, такие как уксусная кислота. Из них предпочтительной является толуолсульфоновая кислота.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 100°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 5 минут до приблизительно 24 часов будет обычно достаточным.
(B3b) реакция с винилмагнийбромидом
Реакция может быть осуществлена в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: алифатические углеводороды, такие как гексан, гептан и петролейный эфир; простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол и толуол;. Из них предпочтительным является тетрагидрофуран.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно -78°C до приблизительно 100°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
(Стадия B4)
На этой стадии соединение (XVIII) получают перегруппировкой амино-Claisen соединения формулы (XVII) с помощью нагревания (B4a) с последующей циклизацией (B4b).
(B4a) перегруппировка амино-Claisen
Реакцию обычно и предпочтительно проводят в присутствии растворителя. Нет никакого специфического ограничения по природе используемого растворителя, при условии, что он не имеет никакого неблагоприятного эффекта на реакцию или используемые реактивы и что он может растворить реактивы, по меньшей мере до некоторой степени. Примеры подходящих растворителей включают: простые эфиры, такие как простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и ксилол; или смеси этих растворителей этого. Из них предпочтительным является толуол.
Реакция может быть осуществлена в присутствии кислоты. Также нет никакого специфического ограничения по природе используемых кислот, и любая кислота, обычно используемая в реакциях этого типа, может также использоваться здесь. Примеры таких кислот включают: кислоты, такие как соляная кислота, серная кислота или бромистоводородная кислота; сульфоновые кислоты, такие как метансульфоновая кислота или толуолсульфоновая кислота; кислоту Льюиса, такую как трифторид бора-диэтилэфират или хлорид цинка. Из них предпочтительной является толуолсульфоновая кислота.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 150°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 48 часов будет обычно достаточным.
(B4b) циклизация
Реакцию обычно и предпочтительно проводят в присутствии неорганических кислот, таких как сульфоновая кислота и фосфорная кислота, и воды. И то, и другое может использоваться как растворитель и конденсирующий реагент. Из них предпочтительным является водный раствор фосфорной кислоты.
Реакция может иметь место при различных температурах, и точная температура реакции не является критической для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные материалы. Однако, в общем, предпочтительно осуществлять реакцию при температуре от приблизительно 0°C до приблизительно 100°C. Время, требуемое для реакции, также может широко варьировать в зависимости от многих факторов, особенно от температуры реакции и природы исходных материалов и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 10 минут до приблизительно 24 часов будет обычно достаточным.
(Стадия B5)
На этой стадии соединение формулы (Ib) получают преобразованием атома галогена в карбоксильную группу в соединении формулы (XVIII) с последующим амидированием соединением формулы (IX). Реакция может быть осуществлена в тех же самых условиях, как описано на Стадиях A4 и A5 Способа A.
Получение/выделение индивидуальных энантиомеров может быть осуществлено обычными методиками, такими как хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ) и суперкритическая жидкостная хроматография (SFC).
Альтернативно, способ оптического разделения рацемата (или рацемического предшественника) может быть соответственно выбран из обычных процедур, например, предпочтительной кристаллизации или разделения диастереомерных солей между основной группой соединения формулы (I) и подходящей оптически активной кислотой, такой как винная кислота.
Соединения формулы (I) и промежуточные соединения в указанных способах получения могут быть выделены и очищены в соответствии с обычными процедурами, такими как дистилляция, перекристаллизация или хроматографическая очистка.
Соединения по изобретению, предназначенные для фармацевтического применения, могут использоваться в форме кристаллических или аморфных продуктов. Они могут быть получены, например, в форме твердых шариков, порошков или пленок такими способами, как осаждение, кристаллизация, сушка сублимацией, сушка распылением или сушка упариванием. С этой целью может использоваться высушивание с использованием микроволн или волн высокой частоты.
Они могут вводится индивидуально или в комбинации с одним или более другими соединениями по изобретению или в комбинации с одним или более другими лекарственными средствами (или в виде любой их комбинации). Обычно их вводят в форме фармацевтической композиции или состава в сочетании с одним или более фармацевтически приемлемыми носителями или эксципиентами. Термин "носитель" или "эксципиент" используется здесь для описания любого ингредиента, отличного от соединения(й) по изобретению. Выбор носителя или эксципиента будет в большой степени зависеть от таких факторов, как специфический способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы.
Фармацевтические композиции, подходящие для доставки соединений согласно настоящему изобретению, и способы их получения являются очевидными для специалиста. Такие композиции и способы их получения могут быть найдены, например, в 'Remington's Pharmaceutical Sciences', 19th Edition (Mack Publishing Company, 1995).
ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ
Соединения по изобретению могут вводиться перорально. Пероральное введение может включать проглатывание, так, чтобы соединение поступило в желудочно-кишечный тракт, или может быть использовано щечное или подъязычное введение, при котором соединение поступает в кровоток непосредственно изо рта.
Составы, подходящие для перорального введения, включают твердые составы, такие как, например, таблетки, капсулы, содержащие макрочастицы, жидкости или порошки, таблетки для рассасывания (включая заполненные жидкостью), жевательные резинки, мульти- и нано-макрочастицы, гели, твердый раствор, липосому, пленки (включая мукоадгезивные), суппозитории, спреи и жидкие составы.
Жидкие составы включают, например, суспензии, растворы, сиропы и эликсиры. Такие составы могут использоваться как наполнители в мягких или твердых капсулах и обычно включать носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более эмульгаторов и/или суспендирующих агентов. Жидкие составы могут также быть получены восстановлением твердого вещества, например, из пакетика.
Соединения по изобретению могут также использоваться в быстрорастворимых, быстроразлагаемых лекарственных формах, таких как описанные в Expert Opinion in Therapeutic Patents, 11 (6), 981-986 by Liang and Chen (2001).
Для лекарственных форм в виде таблетки, в зависимости от дозы, лекарственное средство может составлять от приблизительно 1 вес.% до приблизительно 80 вес.% от массы лекарственной формы, более обычно от приблизительно 5 вес.% до приблизительно 60 вес.% от массы лекарственной формы. В дополнение к лекарственному средству, таблетки обычно содержат дезинтегрирующее средство. Примеры дезинтеграторов включают гликолят крахмала натрия, натрийкарбоксиметилцеллюлозу, кальцийкарбоксилметилцеллюлозу, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, низший алкил-замещенную гидроксипропилцеллюлозу, крахмал, предварительно желатинированный крахмал и альгинат натрия. Обычно дезинтегрирующее средство составляет от приблизительно 1 вес.% до приблизительно 25 вес.%, предпочтительно от приблизительно 5 вес.% до приблизительно 20 вес.% от массы лекарственной формы.
Связующие компоненты обычно используют, чтобы придать когезивные качества составу таблетки. Подходящие связующие компоненты включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно желатинированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводный и т.п.), маннит, ксилит, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу, крахмал и двуосновный дигидрат фосфата кальция.
Таблетки могут также в случае необходимости включать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. В случае их присутствия, поверхностные активные вещества могут составлять от приблизительно 0,2 вес.% до приблизительно 5 вес.% от массы таблетки, и глиданты может составлять от приблизительно 0,2 вес.% до приблизительно 1 вес.% от массы таблетки.
Таблетки также обычно содержат лубриканты, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Лубриканты обычно составляют от приблизительно 0,25 вес.% до приблизительно 10 вес.%, предпочтительно от приблизительно 0,5 вес.% до приблизительно 3 вес.% от массы таблетки.
Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы, консерванты и средства, маскирующие вкус.
Примеры таблеток содержат до приблизительно 80% лекарственного средства, от приблизительно 10 вес.% до приблизительно 90 вес.% связующих компонентов, от приблизительно 0 вес.% до приблизительно 85 вес.% разбавителей, от приблизительно 2 вес.% до приблизительно 10 вес.% дезинтегрирующего средства и от приблизительно 0,25 вес.% до приблизительно 10 вес.% лубрикантов.
Смеси для таблеток могут быть прессованы непосредственно или с использованием валков с получением таблеток. Смеси для таблеток или части смесей могут альтернативно подвергнуты влажному, сухому гранулированию или гранулированию из расплава, заморозке расплава или экструзии перед таблетированием. Конечный состав может включать один или более слоев и может иметь или не иметь покрытие; он также может быть инкапсулирован.
Состав таблеток обсуждается в “Pharmaceutical Dosage Forms: Tablets, Vol. 1”, by H. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X).
Твердые составы для перорального введения могут быть составлены для немедленного и/или модифицированного высвобождения. Составы модифицированного высвобождения включают отсроченное, замедленное, импульсное, контролируемое, нацеливаемое и запрограммированное высвобождение.
Подходящие составы модифицированного высвобождения в целях изобретения описаны в патенте США 6106864. Детали других подходящих технологий высвобождения, таких как высокоэнергетическая дисперсия и осмотические и покрытые частицы могут быть найдены в Verma et al, Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Использование жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298.
ПАРЕНТЕРАЛЬНОЕ ВВЕДЕНИЕ
Соединения по изобретению могут также вводиться непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие средства для парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, внутриоболочковое, внутрижелудочковое, интрауретральное, надчревное, внутричерепное, внутримышечное и подкожное. Подходящие устройства для парентерального введения включают игольчатые (включая микроиглу) инжекторы, инжекторы без иглы и методики инфузии.
Парентеральные составы обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные средства (предпочтительно с рН от приблизительно 3 до приблизительно 9), но, для некоторых применений, они могут быть более предпочтительно составлены как стерильный неводный раствор или как высушенная форма для использования в сочетании с подходящим носителем, таким как стерильная апирогенная вода.
Получение парентеральных составов в стерильных условиях, например, лиофилизацией, может быть легко осуществлено с использованием стандартных фармацевтических методик, известны специалисту.
Растворимость соединений формулы (I), используемых для получения парентеральных растворов, может быть увеличена при помощи подходящих методик получения состава, таких как включение агентов, повышающих растворимость.
Составы для парентерального введения могут быть составлены для немедленного и/или модифицированного высвобождения. Составы модифицированного высвобождения включают отсроченное, замедленное, импульсное, контролируемое, нацеливаемое и запрограммированное высвобождение. Таким образом, соединения по изобретению могут быть составлены в твердой, полутвердой форме, или в форме тиксотропной жидкости для введения в форме имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких составов включают покрытые лекарственным средством стенты и микросферы PGLA.
ТОПИЧЕСКОЕ ВВЕДЕНИЕ
Соединения по изобретению могут также вводиться топически в кожу или слизистую оболочку, то есть кожно или чрескожно. Типичные составы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, пластинки, имплантаты, губки, волокна, бандажи и микроэмульсии. Могут также использоваться липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители проникновения - см., например, J Pharm Sci, 88 (10), 955-958 by Finnin and Morgan (October 1999).
Другие средства топического введения включают доставку электропорацией, ионтофорезом, фонофорезом, сонофорезом и инъекцией микроиглой или без иглы (например, Powderject ™, Bioject ™ и т.д.).
Составы для топического введения могут быть составлены для немедленного и/или модифицированного высвобождения. Составы модифицированного высвобождения включают отсроченное, замедленное, импульсное, контролируемое, нацеливаемое и запрограммированное высвобождение.
ВВЕДЕНИЕ ИНГАЛЯЦИЕЙ/ИНТРАНАЗАЛЬНОЕ ВВЕДЕНИЕ
Соединения по изобретению могут также вводиться интраназально или ингаляцией, обычно в форме сухого порошка (индивидуально, в форме смеси, например, в сухой смеси с лактозой, или как смесь компонентов в форме частиц, например, в смеси с фосфолипидами, такими как фосфатидилхолин) из сухого порошкового ингалятора или в форме аэрозольного спрея из герметичного контейнера, насоса, распылителя, пульверизатора (предпочтительно пульверизатора с использованием электрогидродинамических устройств с получением тонкодисперсного аэрозоля) или небулайзера, с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального использования порошок может включать биоадгезивное средство, например хитозан или циклодекстрин.
Герметичная емкость, насос, спрей, распылитель или небулайзер содержат раствор или суспензию соединения (соединений) по изобретению, включающую, например, этанол, водный раствор этанола или подходящее альтернативное средство для диспергирования, солюбилизации или замедления высвобождения действующего начала, пропеллент(ы) в качестве растворителя и, в случае необходимости, поверхностно-активное вещество, такое как сорбитан триолеат, олеиновая кислота или олигомолочная кислота.
До использования в составе в форме сухого порошка или суспензии, лекарственное средство измельчают до размера, подходящего для доставки ингаляцией (обычно менее 5 микрон). Это может быть достигнуто любым подходящим способом измельчения, таким как размалывание спиральной струи, размалыванием струи кипящего слоя, обработка суперкритической жидкости с получением наночастиц, гомогенизация при высоком давлении или сушка распылением.
Капсулы (изготовленные, например, из желатина или HPMC), пузырьки и картриджи для использования в ингаляторе или инсуффляторе могут содержать порошковое соединение соединения по изобретению, подходящую основу порошка, такую как лактоза или крахмал, и модификатор свойств, такой как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, предпочтительно в последней форме. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящий состав раствора для использования в пульверизаторе с использованием электрогидродинамических устройств с получением тонкодисперсного аэрозоля может содержать от приблизительно 1 мкг до приблизительно 20 мг соединения по изобретению на одно срабатывание, и объем срабатывания может варьировать от приблизительно 1 мкл до приблизительно 100 мкл. Типичный состав может включать соединение формулы (I), пропиленгликоль, стерилизованную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут использоваться вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
Подходящие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия, могут быть добавлены к составам по изобретению, предназначенным для введения ингаляцией/интраназального введения. Составы для введения ингаляцией/интраназального введения могут быть составлены для немедленного и/или модифицированного высвобождения с использованием, например, сополимера DL-молочной и гликолевой кислоты (PGLA). Составы модифицированного высвобождения включают отсроченное, замедленное, импульсное, контролируемое, нацеливаемое и запрограммированное высвобождение.
В случае сухих порошковых ингаляторов и аэрозолей единица дозировки определяется посредством клапана, который выдает отмеренное количество. Единицы в соответствии с изобретением обычно устроены так, чтобы выдавать отмеренную дозу или "затяжку", содержащую от приблизительно 1 до приблизительно 100 мкг соединения формулы (I). Полная суточная доза обычно находится в диапазоне от приблизительно 50 мкг до приблизительно 20 мг, которые могут вводиться в виде единственной дозы или, чаще, как разделенные дозы в течение дня.
РЕКТАЛЬНОЕ/ИНТРАВАГИНАЛЬНОЕ ВВЕДЕНИЕ
Соединения по изобретению могут вводиться ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Масло какао является традиционной основой суппозитория, но могут использоваться различные подходящие альтернативы.
Составы для ректального/вагинального введения могут быть составлены для немедленного и/или модифицированного высвобождения. Составы модифицированного высвобождения включают отсроченное, замедленное, импульсное, контролируемое, нацеливаемое и запрограммированное высвобождение.
ДРУГИЕ ТЕХНОЛОГИИ
Соединения по изобретению могут быть скомбинированы с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или полиэтиленгликоль-содержащие полимеры, для улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или стабильности для использования в любом из указанных способов введения.
Например, обнаружено, что комплексы лекарственное средство-циклодекстрин в целом могут быть использованы для большинства лекарственных форм и путей введения. Могут использоваться как комплексы включения, так и комплексы невключения. Как альтернатива, чтобы направить комплексообразование с лекарственным средством, циклодекстрин может использоваться как вспомогательная добавка, то есть, как носитель, разбавитель или солюбилизатор. Обычно в этих целях используют альфа-, бета- и гамма-циклодекстрины, примеры которых могут быть найдены в WO 91/11172, WO 94/02518 и WO 98/55148.
НАБОР ЧАСТЕЙ
Поскольку может быть желательно вводить комбинацию активных соединений, например, для лечения специфического заболевания или состояния, в рамках настоящего изобретения две или более фармацевтических композиций, по меньшей мере одна из которых содержит соединение в соответствии с изобретением, могут быть скомбинированы в форме набора, подходящего для совместного введения композиций.
Таким образом, набор по изобретению включают две или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит соединение формулы (I) в соответствии с изобретением, и средства для раздельного хранения указанных композиций, такие как контейнер, разделенный баллон или разделенный пакет из фольги. Примером такого набора является обычная прозрачная упаковка, используемая для упаковки таблеток, капсул и т.п.
Набор по изобретению является особенно подходящим для введения различных лекарственных форм, например пероральной и парентеральной, для введения отдельных композиций в различные интервалы времени введения или для титрования отдельных композиций друг против друга. Для обеспечения комплекса набор обычно включает указания по введению и может поставляться вместе с так называемой памяткой.
ДОЗИРОВКА
Для введения человеку, полная суточная доза соединений по изобретению находится обычно в диапазоне от приблизительно 0,05 мг до приблизительно 500 мг и зависит, конечно, от способа введения, предпочтительно в диапазоне от приблизительно 0,1 мг до приблизительно 400 мг и более предпочтительный в диапазоне от приблизительно 0,5 мг до приблизительно 300 мг. Например, пероральное введение может потребовать полной суточной дозы от приблизительно 1 мг до приблизительно 300 мг, в то время как внутривенное введение может требовать только от приблизительно 0,5 мг до приблизительно 100 мг. Полная суточная доза может вводиться в виде единственной дозы или нескольких разделенных доз.
Эти дозировки приведены в расчете на среднего человека, имеющего массу тела от приблизительно 65 кг до приблизительно 70 кг. Врач будет в состоянии легко определить дозы для пациентов, масса тела которых находится вне этого диапазона, таких как младенцы и лица пожилого возраста.
КОМБИНАЦИИ
Как обсуждалось выше, соединение по изобретению показывает ингибирующую активность в отношении кислотной помпы. Антагонист кислотной помпы согласно настоящему изобретению может быть предпочтительно скомбинирован с другим фармакологически активным соединением, или с двумя или более других фармакологически активных соединений, особенно для лечения гастроэзофагеальной рефлюксной болезни. Например, антагонист кислотной помпы, особенно соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше, может вводиться одновременно, последовательно или отдельно в комбинации с одним или более средствами, выбранными из:
(i) антагонистов рецептора гистамина H2, например ранитидина, лафутидина, низатидина, циметидина, фамотидина и роксатидина;
(ii) ингибиторов протонной помпы, например омепразола, эзомепразола, пантопразола, рабепразола, тенатопразола, илапразола и лансопразола;
(iii) пероральных антацидных смесей, например Maalox®, Aludrox® и Gaviscon®;
(iv) мукопротективных средств, например полапрецинка, экабета натрия, ребамипида, тепренона, цетраксата, сукральфата, хлорпиллин-меди и плаунотола;
(i) противожелудочных средств, например вакцины антигастрина, итриглумида и Z-360;
(ii) антагонистов 5-HT3, например доласетрона, палоносетрона, алосетрона, азасетрона, рамосетрона, митразапина, гранисетрона, трописетрона, E-3620, ондасетрона и индисетрона;
(iii) агонистов 5-HT4, например тегасерода, мосаприда, цинитаприда и окстриптана;
(iv) слабительных, например Trifyba®, Fybogel®, Konsyl®, Isogel®, Regulan®, Celevac® и Normacol®;
(i) агонистов ГАМКВ, например баклофена и AZD-3355;
(ii) антагонистов ГАМКВ, например GAS-360 и SGS-742;
(iii) блокаторов кальциевых каналов, например аранидипина, лацидипина, фалодипина, азелнидипина, клинидипина, ломеризина, дилтиазема, галлопамила, эфонидипина, низолдипина, амлодипина, лерканидипина, бевантолола, никардипина, исрадипина, бенидипина, верапамила, нитрендипина, барнидипина, пропафенона, манидипина, бепридила, нифедипина, нилвадипина, нимодипина и фасудила;
(i) антагонистов допамина, например метоклопрамида, домперидона и левосульпирида;
(ii) антагонистов тахикинина (NK), особенно антагонистов NK-3, NK-2 и NK-1, например непадутанта, саредутанта, тальнетанта, (αR, 9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7H-[1,4]диазоцино[2,1-g][1,7]нафтридин-6-13-диона (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3H-1,2,4-триазол-3-она (МК-869), ланепитанта, дапитанта и 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидина (2S, 3S);
(iii) средств против инфекции Helicobacter pylori, например кларитромицина, рокситромицина, рокитамицина, флуритромицина, телитромицина, амоксициллина, ампициллина, темоциллина, бакампициллина, аспоксициллина, сультамициллина, пиперациллина, ленампициллина, тетрациклина, метронидазола, цитрат висмута и субсалицилата висмута;
(i) ингибиторов синтазы оксида азота, например GW-274150, тиларгинина, P54, гуанидиноэтилдисульфида и нитрофлурбипрофена;
(ii) антагонистов ваниллоидного рецептора 1, например AMG-517 и GW-705498;
(iii) антагонистов мускариновых рецепторов, например троспиума, солифенацина, толтеродина, тиотропиума, циметропиума, окситропиума, ипратропиума, тихизиума, далифенацина и имидафенацина;
(iv)антагонистов кальмомодулина, например скваламина и DY-9760;
(i) агонистов калиевых каналов, например пинацидила, тилизолола, никорандила, NS-8 и ретигабина;
(ii) агонистов бета-1, например добутамина, денопамина, ксамотерола, денопамина, докарпамина и ксамотерола;
(iii) агонистов бета-2, например сальбутамола, тербуталина, арформотерола, мелуадрина, мабутерола, ритодрина, фенотерола, кленбутерола, формотерола, прокатерола, тулобутерола, пирбутерола, бамбутерола, тулобутерола, допексамина и левосальбутамола;
(i) бета-агонистов, например изопротереноло и тербуталина;
(ii) агонистов альфа 2, например клонидина, медетомидина, лофексидина, моксонидина, тизанидина, гуанфацина, гуанабенза, талипексола и дексмедетомидина;
(iii) антагонистов эндотелина, например бонсетана, атрасентана, амбрисентана, клазосентана, ситаксентана, фандосентана и дарусентана;
(i) агонистов опиоидов µ, например морфина, фентанила и лоперамида;
(ii) антагонистов опиоидов µ, например налоксона, бупренорфина и алвимопана;
(iii) агонистов мотилина, например эритромицина, митемцинала, SLV-305 и атилмотина;
(iv) агонистов грелина, например капроморелина и TZP-101;
(v) стимуляторов высвобождения AchE, например Z-338 и KW-5092;
(vi) антагонистов CCK-B, например итриглумида, YF-476 и S-0509;
(i) антагонистов глюкагона, например NN-2501 и A-770077;
(ii) пиперациллина, ленампициллина, тетрациклина, метронидазола, цитрата висмута и субсалицилата висмута;
(iii) антагонистов глюкагоноподобного пептида-1 (GLP-1), например PNU-126814;
(iv) антагонистов активируемых кальцием калиевых каналов малой проводимости 3 (SK-3), например апамина, дехалиниума, атракуриума, панкурониума и тубокурарина.
(v) антагонистов mGluR5, например ADX-10059 и AFQ-056;
(vi) агонистов 5-HT3, например пумосетрага (DDP733);
(vii) агонистов mGluR8, например (S)-3,4-DCPG и mGluR8-A.
Способ оценки биологических активностей:
Ингибирующую кислотную помпу активность и другие биологические активности соединений по изобретению определяли в соответствии со следующими процедурами. Символы имеют их обычные значения: мл (миллилитр(ы)), мкл (микролитр(ы)), кг (килограмм(ы)), г (грамм(ы)), мг (миллиграмм(ы)), мкг (микрограмм(ы)), пмоль (пикомоль), ммоль (миллимоль), М (молярная масса (м3/моль)), мМ (миллимолярная масса), мкM (микромолярная масса), колич. (количественный выход), нм (нанометр(ы)), мин (минута(ы)), Cat# (номер по каталогу), мВ (милливольт(ы)), мс (миллисекунда(ы)), i.p. (внутрибрюшинно).
Получение желудочных везикул из свежих свиных желудков
Везикулы из свиных желудков пузырьки для тестов по ингибированию Н+/K+-АТФаза желудка свиньи получали из слизистой оболочки свежих свиных желудков гомогенизацией в покрытом политетрафторэтиленом (Teflone®) гомогенизаторе в 0,25 М сахарозы при 4°C. Сырой осадок удаляли центрифугированием при 20000 g в течение 30 мин. Затем супернатант центрифугировали при 100000 g в течение 30 мин. Полученный осадок повторно суспендировали в 0,25 М сахарозы и затем подвергали центрифугированию в градиенте плотности при 132000 g в течение 90 мин. Желудочные везикулы собирали с внутренней поверхности на слое 0,25 М сахарозы, содержащем 7% FicollTM PM400 (Amersham Biosciences). Эту процедуру выполняли в холодной.
Ингибирование Н + /K + -АТФазы желудка свиньи с истечением ионов
Ингибирование Н+/K+-АТФазы желудка свиньи с истечением ионов измеряли согласно модифицированному способу, описанному в Biochemical Pharmacology, 1988, 37, 2231-2236.
Изолированные везикулы лиофилизировали и затем хранили в морозильнике до использования. Для ферментного теста лиофилизированные пузырьки ресуспендировали с 3 мМ MgSO4, содержащим 40 мМ бис-трис (рН 6,4 при 37°C).
Ферментную реакцию осуществляли, инкубируя 5 мМ KCl, 3 мМ Na2ATФ, 3 мМ MgSO4 и 1.0 мг ресуспендированных везикул в течение 30 минут при 37°C в конечном объеме 60 мл реакционной смеси (40 мМ бис-трис, рН 6,4) с тестируемым соединением или без тестируемого соединения. Ферментную реакцию останавливали, добавляя 10%-ный додецилсульфат натрия (SDS). Высвобожденный неорганический фосфат из АТФ детектировали инкубацией со смесью 1 части 35 мМ тетрагидрата молибдата аммония в 15 мМ гидрата ацетата цинка и 4 частей 10%-ной аскорбиновой кислоты (рН 5,0), приводящей к фосфомолибдату, который имеет оптическую плотность при 750 нм. Все соединения из примеров показали мощную ингибирующую активность.
Результаты значений IC50 ингибирующей активности для соединений следующих примеров показаны в таблице.
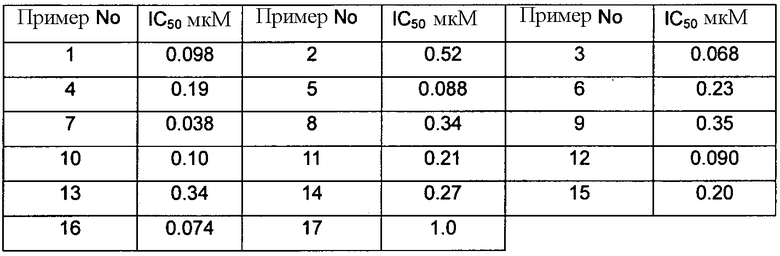
Все протестированные соединения показали антагонистическую активность в отношении кислотной помпы.
Ингибирование Н + /K + -АТФазы желудка свиньи без истечения ионов
Ингибирование Н+/K+-АТФазы желудка свиньи без истечения ионов измеряли согласно модифицированному способу, описанному в Biochemical Pharmacology, 1988, 37, 2231-2236.
Изолированные везикулы лиофилизировали и затем хранили в морозильнике до использования. Для ферментного теста лиофилизированные пузырьки ресуспендировали с 3 мМ MgSO4, содержащим 5 мМ Трис (рН 7,4 при 37°C).
Ферментную реакцию осуществляли, инкубируя 150 мМ KCl, 3 мМ Na2ATФ, 3 мМ MgSO4, 15 мM валиномицина и 3,0 мг везикул в течение 30 минут при 37°C в конечном объеме 60 мл реакционной смеси (5 мM Трис, рН 7,4) с тестируемым соединением или без тестируемого соединения. Ферментную реакцию останавливали, добавляя 10%-ный SDS. Высвобожденный неорганический фосфат из АТФ детектировали инкубацией со смесью 1 части 35 мМ тетрагидрата молибдата аммония в 15 мМ гидрата ацетата цинка и 4 частей 10%-ной аскорбиновой кислоты (рН 5,0), приводящей к фосфомолибдату, который имеет оптическую плотность при 750 нм.
Ингибирование Na + /K + -АТФазы почки собаки
Порошкообразную Na+/K+-АТФазу почки собаки (Sigma) ресуспендировали с 3 мМ MgSO4, содержащим 40 мМ Трис (рН 7,4 при 37°C). Ферментную реакцию осуществляли, инкубируя 100 мМ NaCl, 2 мМ KCl, 3 мМ Na2ATP, 3 мМ MgSO4 и 12 мг фермента в течение 30 минут при 37°C в конечном объеме 60 мл реакционной смеси (40 мМ Трис, рН 7,4) с тестируемым соединением или без тестируемого соединения. Ферментную реакцию останавливали, добавляя 10%-ный SDS. Высвобожденный неорганический фосфат из АТФ детектировали инкубацией со смесью 1 части 35 мМ тетрагидрата молибдата аммония в 15 мМ гидрата ацетата цинка и 4 частей 10%-ной аскорбиновой кислоты (рН 5,0), приводящей к фосфомолибдату, который имеет оптическую плотность при 750 нм.
Ингибирование кислотной секреции у крысы с перфузией просвета желудка
Кислотную секрецию у крысы с перфузией просвета желудка измеряли согласно Watanabe et al. [Watanabe K et al., J. Physiol. (Paris) 2000; 94: 111-116].
Самцов крыс Sprague-Dawley, 8 недель, лишенных пищи в течение 18 часов перед экспериментом со свободным доступом к воде, анестезировали уретаном (1,4 г/кг, внутрибрюшинно) и трахеотомизировали. После средней лапаротомии двойную канюлю из полиэтилена вставляли в кардиальный отдел желудка, и желудок подвергали перфузии солевым раствором (37°C, рН 5,0) из расчета 1 мл/мин. Продукцию кислоты в перфузате определяли с интервалами 5 минут титрованием с 0,02 М NaOH при рН 5,0. После определения базовой кислотной секреции в течение 30 минут, кислотную секрецию стимулировали непрерывной внутривенной инфузией пентагастрина (16 мкг/кг/ч). Тестируемые соединения вводили внутривенным болюсным вливанием или интрадуоденальным введением после того, как стимулируемая кислотная секреция достигла фазы плато. После введения проверяли кислотную секрецию.
Активность оценивали либо по ингибированию общей секреции кислоты от 0 часов до 1,5 или 3,5 часов после введения, либо по максимальному ингибированию после введения.
Ингибирование кислотной секреции в желудке собаки с мешочком Heidenhain
Использовались самцов гончей, имеющих массу тела от 7 до 15 кг, с мешочком Heidenhain [Heidenhain R: Arch Ges Physiol. 1879; 19: 148-167]. Животным давали восстановиться после хирургической операции в течение по меньшей мере трех недель перед экспериментами. Животных содержали в 12-часовом ритме свет-темнота, размещали отдельно. Они получали стандартную пищу один раз в день в 11:00 и водопроводную воду ad libitum, и их выдерживали натощак в течение ночи перед экспериментом со свободным доступом к воде. Образцы желудочного сока собирали в течение эксперимента самотеком через дренаж каждые 15 мин. Кислотность в желудочном соке измеряли титрованием до конечного результата рН 7,0. Кислотную секрецию стимулировали непрерывной внутривенной инфузией гистамина (80 мкг/кг/ч). Пероральное или внутривенное введение болюса тестируемых соединений осуществляли спустя 90 минут после начала инфузии гистамина. После введения проверяли кислотную секрецию. Активность оценивали по максимальному ингибированию относительно соответствующего контрольного значения.
Связывание дофетилида человека
Трансфицированные геном специфических калиевых каналов сердца человека (HERG) клетки HEK293S были получены и выращены в лаборатории. Клеточная паста из клеток HEK-293, экспрессирующих продукт HERG может быть суспендирована в 10-кратном объеме 50 мМ буфера Трис, рН 7,5, при 25°C с 2М HCl, содержащей 1 мМ MgCl2, 10 мМ KCl. Клетки гомогенизировали, используя гомогенизатор Polytron (на максимальной мощности в течение 20 секунд) и центрифугировали при 48000 g в течение 20 минут при 4°C. Осадок повторно суспендировали, гомогенизировали и центрифугировали еще раз тем же самым образом. Полученный супернатант отбрасывали, и конечный осадок повторно суспендировали (10-кратный объем 50 мМ буфера Трис) и гомогенизировали при максимальной мощности в течение 20 секунд. Мембранный гомогенат разделяли на аликвоты и сохраняли при -80°C до использования. Аликвоту использовали для определения концентрации белка, используя набор Protein Assay Rapid Kit (wako) и устройство для считывания планшетов Spectra max (Wallac). Все рабочие, сток-растворы и оборудование всегда сохраняли на льду. Для тестов на насыщенность эксперименты проводили в полном объеме 200 мкл. Насыщенность определяли, инкубируя 36 мкл [3H]-дофетилида и 160 мкл мембранных гомогенатов (20-30 мкг белков на лунку) в течение 60 минут при температуре окружающей среды в отсутствие или в присутствии 10 мкM дофетилида в конечных концентрациях (4 мкл) для общего или неспецифического связывания, соответственно. Все инкубации завершали быстрой вакуумной фильтрацией через фильтровальную бумагу из стекловолокна PEI, используя клеточный комбайн Skatron, с последующей двукратной промывкой 50 мМ буфера Трис (рН 7,4 при 25°C). Рецептор-связанную радиоактивность определяли количественно подсчетом жидкостной сцинтилляции, используя счетчик Packard LS.
Для конкурентного теста соединения разбавляли на 96-луночных планшетах из полипропилена как 4-точечные разведения в полу-log формате. Все разбавления сначала осуществляли в ДМСО и затем переносили в 50 мМ буфера Трис (рН 7,4 при 25°C), содержащего 1 мМ MgCl2, 10 мМ KCl, так, чтобы конечная концентрация ДМСО была равной 1%. Соединения распределяли в трех экземплярах в тестовых планшетах (4 мкл). Лунки общего связывания и неспецифического связывания устанавливали в 6 лунках как носитель и 10 мкM дофетилида в конечной концентрации, соответственно. Меченый лиганд получали в 5,6x конечной концентрации, и этот раствор добавляли к каждой лунке (36 мкл). Тест инициировали добавлением шариков YSi поли-L-лизина SPA (50 мкл, 1 мг/лунка) и мембран (110 мкл, 20 мкг/лунка). Инкубацию продолжали в течение 60 минут при температуре окружающей среды. Планшеты инкубировали в течение еще 3 часов при температуре окружающей среды для того, чтобы дать шарикам закрепиться. Рецептор-связанную радиоактивность определяли количественно подсчетом с помощью счетчиков планшетов Wallac MicroBeta.
Период полураспада в микросомах печени человека (HLM)
Тестируемые соединения (1 мкM) инкубировали с 1 мМ MgCl2, 1 мМ НАДФ+, 5 мМ изолимонной кислоты, 1 ед./мл дегидрогеназы изолимонной кислоты и 0,8 мг/мл HLM в 100 мМ фосфатного буфера (рН 7,4) при 37°C в некотором числе 384-луночных планшетов. В несколько моментов времени планшеты удаляли из термостата, и реакцию завершали с двумя инкубационными объемами ацетонитрила. Концентрацию соединения в супернатанте измеряли системой LC/MS/MS. Значение внутреннего клиренса вычисляли, используя следующие уравнения:
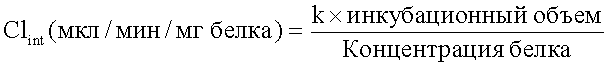
где k = - наклон In (концентрация) vs. время (мин-1)
Тест фиксации потенциала hERG
Для определения потенциала соединений в отношении ингибирования канала hERG, клонированной копии быстро инактивирующего отсроченного ректификатора тока калия (IKr).
Клетки HEK293, стабильно экспрессирующие канал hERG, использовались в исследованиях электрофизиологии фиксации потенциала целой клетки при температуре окружающей среды (26,5-28,5°C). Методология для стабильной трансфекции этого канала в клетках HEK293 может быть найдена в литературных источниках (Zhou et al., 1998, Biophysical Journal, 74, pp230-241). Растворами, используемыми для экспериментирования, были стандартный внеклеточный раствор следующего состава (мМ); NaCl, 137; KCl, 4; CaCl2, 1,8; MgCl2, 1; Глюкоза, 10; HEPES, 10; рН 7,4±0,05 с NaOH/HCl; и стандартный внутриклеточный раствор следующего состава (мМ); KCl, 130; MgCl2, 1; HEPES, 10; EGTA, 5; MgATФ, 5; рН 7,2±0,05 с KOH. Используемый протокол напряжения был разработан и составлен таким образом, чтобы активировать канал hERG и позволить осуществить измерение блокирование канала лекарственным средством, и был следующим. Сначала мембранный потенциал меняли с исходного потенциала -80 мВ до +30 мВ в течение 1 с. Затем осуществляли снижение напряжения со скоростью 0,5 мВ/мс назад к исходному потенциалу -80 мВ, и измеряли пиковый ток, направленный наружу, наблюдаемый в течение реполяризации. Этот протокол повторяли каждые 4 секунды (0,25 Гц). После установления стабильного базового периода в присутствии носителя (0,1 об.% ДМСО), четыре увеличивающихся концентрации тестируемого соединения вводили последовательно в кювету, пока реакция не достигла равновесия или 10 минут (в зависимости от того, что наступит раньше). 10 мкмоль/л дофетилида использовали в конце каждого эксперимента в качестве внутреннего положительного контроля и для определения максимальной блокировки.
Биодоступность у крыс
Использовали взрослых крыс линии Sprague-Dawley. За один-два дня до экспериментов всех крыс катетеризовали в правую яремную вену под анастезией. Канюля выходила наружу на задней поверхности шеи. Пробы крови (0,2-0,3 мл) забирали из яремной вены с интервалами вплоть до 24 часов после внутривенного или перорального введения тестируемого соединения. Образцы замораживали до анализа. Биодоступность оценивали, вычисляя показатели между областью под кривой изменения плазменной концентрации (AUC) после перорального введения или внутривенного введения.
Биодоступность у собак
Использовали взрослых собак гончей породы. Пробы крови (0,2-0,5 мл) забирали из головной вены с интервалами вплоть до 24 часов после внутривенного или перорального введения тестируемого соединения. Образцы замораживали до анализа. Биодоступность оценивали, вычисляя показатели между областью под кривой изменения плазменной концентрации (AUC) после перорального введения или внутривенного введения.
Связывание с белком плазмы
Связывание с белком тестируемого соединения (1 мкM) измеряли способом равновесного диализа, используя оборудование типа 96-луночных планшетов. Spectra-Por®, мембраны из регенерированной целлюлозы (сокращение молекулярной массы 12000-14000, 22 мм × 120 мм) пропитывали в течение ночи в дистиллированной воде, затем в течение 20 минут в 30%-ном этаноле, и наконец в течение 15 минут в буфере для диализа (фосфатный буферный солевой раствор Дульбекко, pH 7,4). Использовали замороженную плазму человека, крыс Sprague-Dawley и собак гончей породы. Собирали оборудование для диализа и добавляли 150 мкл дополненной соединением плазмы к одной стороне каждой лунки и 150 мкл буфера для диализа к другой стороне каждой лунки. После инкубации в течение 4 часов при 37°C при 150 об/мин собирали аликвоты плазмы и буфера. Соединение в плазме и буфере экстрагировали 300 мкл ацетонитрила, содержащего внутренние стандартные соединения для анализа. Концентрацию соединения определяли анализом LC/MS/MS.
Фракцию несвязанного соединения вычисляли следующим уравнением:
fu = 1-{([плазма]экв - [буфер]экв )/([плазма]экв)},
где [плазма]экв и [буфер]экв обозначают концентрации соединения в плазме и буфере соответственно.
Примеры
Следующие примеры приведены только для дальнейшей иллюстрации и не предназначены для ограничения раскрытого здесь изобретения. Если не указано иное, в следующих примерах общие экспериментальные условия являются следующими: все операции проводили при комнатной температуре, или температуре окружающей среды, то есть в диапазоне 18-25°C; выпаривание растворителя осуществляли, используя роторный испаритель при пониженном давлении с температурой ванны до 60°C; реакции проверяли тонкослойной хроматографией (TLC), и времена реакции даются только для иллюстрации; температура плавления (Т. пл.) является нескорректированной (полиморфизм может приводить к различным температурам плавления); структура и чистота всех выделенных соединений гарантировались по меньшей мере одной из следующих методик: TLC (предварительно покрытые силикагелем Merck 60 F254 планшеты TLC или предварительно покрытые гелем Merck NH2 (силикагель с аминным покрытием) F254s планшеты TLC), масс-спектрометрия, спектры ядерного магнитного резонанса (ЯМР), спектры инфракрасного излучения (IR) или микроанализ. Выходы приведены только в иллюстративных целях. Флэш-хроматографию проводили, используя Biotage KP-SIL (40-63 мкм), Biotage KP-NH (силикагель с аминным покрытием) (40-75 мкM), аминогель Fuji Silysia (30-50 мм) или силикагель Wako 300HG (40-60 мкM). Микроволновые реакции проводили, используя Personal Chemistry EmrysTM Optimizer или Biotage InitiatorTM. Препаративную TLC осуществляли, используя предварительно покрытые силикагелем Merck 60 F254 планшеты TLC (толщиной 0,5 или 1,0 мм). Все данные по массе были получены в виде данных масс-спектрального анализа с низким разрешением (ESI) с использованием ZMDTM или ZQTM (Waters) и масс-спектрометра. Данные ЯМР были определены при 270 МГц (спектрометр JEOL JNM-LA 270) или 300 МГц (спектрометр JEOL JNM-LA300) с использованием в качестве растворителя дейтеризованного хлороформа (99,8%) или диметилсульфоксида (99,9%), если не указано иное, относительно тетраметилсилана (TMS) в качестве внутреннего стандарта, в частях на миллион (ppm); обычные используемые сокращения: s=синглет, d=дублет, m=мультиплет, dd=дублет дублетов, sep=септет, br.s=уширенный синглет, br.d=уширенный дублет и т.д. Спектры IR измеряли трансформирующим инфракрасным спектрофотометром Фурье (Shimazu FTIR-8300). Вращения плоскости поляризации измеряли, используя Цифровой Поляриметр P-1020 (JASCO Corporation).
Пример 1
1-(2-Метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
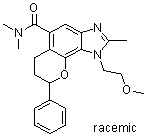
СТАДИЯ 1: N-[2-(Бензилокси)-4-бром-6-нитрофенил]ацетамид
К раствору 2-(бензилокси)-4-бром-6-нитроанилина (33,0 г, 102 ммоль, WO 2004054984) и уксусного ангидрида (14,5 мл, 153 ммоль) в уксусной кислоте (90 мл) при 70°C добавляли концентрированную серную кислоту (2 капли). Смесь перемешивали при 70°C в течение 20 минут. После охлаждения до температуры окружающей среды добавляли воду (800 мл), и сформированный осадок собирали фильтрацией и промывали простым диизопропиловым эфиром, получая целевое соединение в форме твердого вещества коричневого цвета (30,9 г, 83%).
1H ЯМР (CDCl3, 270 MГц) δ: 7,69 (д, J=2,0 Гц, 1H), 7,56 (уш.с, 1H), 7,47-7,38 (м, 5H), 7,34 (д, J=2,0 Гц, 1H), 5,14 (с, 2H), 2,16 (с, 3H) ppm.
MS (ESI) m/z: 365 (M+H)+.
СТАДИЯ 2: N-[2-(Бензилокси)-4-бром-6-нитрофенил]-N-(2-метоксиэтил)ацетамид
К суспензии гидрида натрия (60%-ая дисперсия в минеральном масле, 1,78 г, 44,5 ммоль) в N,N-диметилформамиде (100 мл) при 0°C за 10 минут добавляли по каплям раствор N-[2-(бензилокси)-4-бром-6-нитрофенил]ацетамида (13,5 г, 37,1 ммоль, Стадия 1) в N,N-диметилформамиде. После перемешивания при 0°C в течение 20 минут добавляли 1-бром-2-метоксиэтан (7,21 г, 51,9 ммоль), и смесь перемешивали при 50°C в течение 2 часов. После охлаждения до температуры окружающей среды смесь лили на воду, и водный слой экстрагировали смесью этилацетат/толуол (3:1). Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью гексан/этилацетат (3:1), получая целевое соединение в форме твердого вещества серого цвета (12,1 г, 77%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,70 (д, J=2,6 Гц, 1H), 7,45-7,32 (м, 6H), 5,22-5,10 (м, 2H), 4,23-4,13 (м, 1H), 3,51-3,34 (м, 2H), 3,24-3,13 (м, 1H), 3,09 (с, 3H), 1,89 (с, 3H) ppm. (также наблюдались сигналы других ротамеров),
MS (ESI) m/z: 423 (M+H)+.
СТАДИЯ 3: 7-(Бензилокси)-5-бром-1-(2-метоксиэтил)-2-метил-1H-бензимидазол
Смесь N-[2-(бензилокси)-4-бром-6-нитрофенил]-N-(2-метоксиэтил)ацетамида (11,7 г, 27,7 ммоль, Стадия 2) и железного порошка (7,74 г, 139 ммоль) в уксусной кислоте (150 мл) нагревали с обратным холодильником при перемешивании в течение 5 часов. После охлаждения до температуры окружающей среды смесь фильтровали через Целит и фильтрат концентрировали в вакууме. Остаток лили на воду, и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали солевым раствором, высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью гексан/этилацетат (градиент элюирования от 2:1 до 1:1), получая целевое соединение в форме твердого вещества светло-зеленого цвета (9,74 г, 93%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,47-7,37 (м, 6H), 6,89 (д, J=1,3 Гц, 1H), 5,14 (с, 2H), 4,39 (т, J=5,3 Гц, 2H), 3,57 (т, J=5,3 Гц, 2H), 3,16 (с, 3H), 2,57 (с, 3H) ppm.
СТАДИЯ 4: 7-(Бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-карбонитрил
Смесь 7-(бензилокси)-5-бром-1-(2-метоксиэтил)-2-метил-1H-бензимидазола (1,00 г, 2,66 ммоль, Стадия 3), цианида цинка (376 мг, 3,20 ммоль) и тетракис(трифенилфосфин)палладия (154 мг, 0,13 ммоль) в N,N-диметилформамиде (15 мл) перемешивали при 90°C в течение 3 часов в атмосфере газообразного азота. После охлаждения до температуры окружающей среды смесь лили на насыщенный водный раствор карбоната калия (100 мл), и водный слой экстрагировали этилацетатом. Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаточное твердое вещество промывали смесью этилацетат/простой диизопропиловый эфир (1:2), получая целевое соединение в форме твердого вещества белого цвета (648 мг, 76%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,67 (уш.с, 1H), 7,45-7,38 (м, 5H), 6,96 (уш.с, 1H), 5,19 (с, 2H), 4,45 (т, J=5,3 Гц, 2H), 3,60 (т, J=4,6 Гц, 2H), 3,19 (с, 3H), 2,61 (с, 3H) ppm.
MS (ESI) m/z: 322 (M+H)+.
СТАДИЯ 5: 7-(Бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-карбоновая кислота
Раствор 7-(бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-карбонитрила (549 мг, 1,71 ммоль, Стадия 4) и гидроксида калия (85%, 564 мг, 8,54 ммоль) в этиленгликоле (10 мл) перемешивали при 135°C в течение 5 часов. После охлаждения до температуры окружающей среды добавляли 2 моль/л соляной кислоты, пока рН раствора не достиг величины приблизительно 3. Сформированный осадок собирали фильтрацией, получая целевое соединение в форме твердого вещества серого цвета (530 мг, 91%).
1H ЯМР (ДМСО-d 6, 270 МГц) δ: 7,77 (уш.с, 1H), 7,56-7,49 (м, 2H), 7,47-7,33 (м, 4H), 5,30 (с, 2H), 4,47 (т, J=5,3 Гц, 2H), 3,60 (т, J=5,3 Гц, 2H), 3,17 (с, 3H), 2,52 (с, 3H) ppm. (COOH не наблюдался),
MS (ESI) m/z: 341 (M+H)+, 339 (M-H)-.
СТАДИЯ 6: 7-(бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилат
К суспензии 7-(бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-карбоновой кислоты (10,0 г, 29,4 ммоль, Стадия 5) в метаноле при температуре окружающей среды добавляли по каплям тионилхлорид (8,57 мл, 118 ммоль), и смесь нагревали с обратным холодильником при перемешивании в течение 2 часов. После охлаждения до температуры окружающей среды растворитель выпаривали в вакууме. Остаток лили на насыщенный водный раствор гидрокарбоната натрия, и водный слой экстрагировали дихлорметаном. Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток суспендировали в простом диизопропиловом эфире (100 мл), и осадок собирали фильтрацией, получая целевое соединение в форме твердого вещества серого цвета (9,22 г, 85%).
1H ЯМР (CDCl3, 270 МГц) δ: 8,06 (с, 1H), 7,51 (с, 1H), 7,48-7,35 (м, 5H), 5,23 (с, 2H), 4,45 (т, J=5,3 Гц, 2H), 3,94 (с, 3H), 3,61 (т, J=5,3 Гц, 2H), 3,17 (с, 3H), 2,60 (с, 3H) ppm.
MS (ESI) m/z: 355 (M+H)+.
СТАДИЯ 7: 7-гидрокси-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилат
Смесь 7-(бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилата (9,21 г, 26,0 ммоль, Стадия 6) и 10% палладия на угле (500 мг) в метаноле (150 мл) перемешивали в атмосфере газообразного водорода (4 атм) в течение 5 часов. Полученную смесь фильтровали через Целит, и фильтрат концентрировали в вакууме. Остаток суспендировали в простом диизопропиловом эфире (150 мл), и осадок собирали фильтрацией, получая целевое соединение в форме твердого вещества серого цвета (6,35 г, 92%).
1H ЯМР (CDCl3, 270 МГц) δ: 10,31 (уш.с, 1H), 7,62 (с, 1H), 7,24 (с, 1H), 4,49 (т, J=4,6 Гц, 2H), 3,83 (с, 3H), 3,68 (т, J=5,3 Гц, 2H), 3,21 (с, 3H) ppm.
MS (ESI) m/z: 266 (M+H)+, 264 (M-H) -.
СТАДИЯ 8: 6-[(диметиламино)метил]-7-гидрокси-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилат
Целевое соединение получали в форме твердого вещества белого цвета с выходом 42% из 7-гидрокси-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилата (3,00 г, Стадия 7) тем же самым образом, как на Стадии 3 Примера 5.
1H ЯМР (CDCl3, 270 МГц) δ: 7,72 (с, 1H), 4,54 (т, J=5,3 Гц, 2H), 4,24 (с, 2H), 3,88 (с, 3H), 3,76 (т, J=5,3 Гц, 2H), 3,27 (с, 3H), 2,59 (с, 3H), 2,38 (с, 6H) ppm. (ОН не наблюдался),
MS (ESI) m/z: 322 (M+H)+, 320 (M-H) -.
СТАДИЯ 9: 7-гидрокси-1-(2-метоксиэтил)-2-метил-6-(3-оксо-3-фенилпропил)-1H-бензимидазол-5-метилкарбоксилат
Смесь 6-[(диметиламино)метил]-7-гидрокси-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилата (2,04 г, 6,35 ммоль, Стадия 8) и 1-(1-фенилвинил)пирролидина (1,43 г, 8,25 ммоль, J. Chem. Soc., 1994, 116, 5985-5986.) в толуоле (80 мл) перемешивали при 100°C в течение 3 часов. После охлаждения до температуры окружающей среды растворитель удаляли в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью дихлорметан/метанол (30:1), получая целевое соединение в форме аморфного вещества коричневого цвета (2,08 г, 82%).
1H ЯМР (CDCl3, 270 МГц) δ: 9,72 (с, 1H), 8,03 (д, J=7,2 Гц, 2H), 7,95 (с, 1H), 7,59 (т, J=7,9 Гц, 1H), 7,46 (т, Гц J=7,9, 2H), 4,61 (т, J=5,3 Гц, 2H), 3,92 (с, 3H), 3,83-3,73 (м, 4H), 3,41 (т, J=5,3 Гц, 2H), 3,29 (с, 3H), 2,60 (с, 3H) ppm.
MS (ESI) m/z: 397 (M+H)+, 395 (M-H) -.
СТАДИЯ 10: 7-гидрокси-6-(3-гидрокси-3-фенилпропил)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилат
К раствору 7-гидрокси-1-(2-метоксиэтил)-2-метил-6-(3-оксо-3-фенилпропил)-1H-бензимидазол-5-метилкарбоксилата (2,08 г, 5,25 ммоль, Стадия 9) в этаноле (50 мл) при температуре окружающей среды добавляли боргидрид натрия (298 мг, 7,87 ммоль). После перемешивания при той же самой температуре в течение 4 часов выпаривали растворитель, и остаток лили на насыщенный водный раствор гидрокарбоната натрия, и водный слой экстрагировали этилацетатом. Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью дихлорметан/метанол (20:1), получая целевое соединение в форме аморфного вещества коричневого цвета (2,08 г, 99%).
1H ЯМР (CDCl3, 270 МГц) d: 8,56 (уш, 1H), 7,88 (уш.с, 1H), 7,35-7,25 (м, 5H), 4,66 (дд, J=3,3 и 11,2 Гц, 1H), 4,63-4,45 (м, 2H), 3,85 (с, 3H), 3,80-3,71 (м, 2H), 3,31 (с, 3H), 3,40-3,20 (м, 2H), 2,58 (с, 3H), 2,40-2,24 (м, 1H), 2,17-2,02 (м, 1H) ppm. (ОН не наблюдался),
MS (ESI) m/z: 399 (M+H)+, 397 (M-H) -.
СТАДИЯ 11: 1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-метилкарбоксилат
Суспензию 7-гидрокси-6-(3-гидрокси-3-фенилпропил)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-метилкарбоксилата (2,00 г, 5,01 ммоль, Стадия 10) в 85%-ной фосфорной кислоте (40 мл) перемешивали при 80°C в течение 20 минут. После охлаждения до температуры окружающей среды смесь лили на воду со льдом (300 мл), и раствор нейтрализовывали 10 н. водным раствором гидроксида натрия. Водный слой экстрагировали дихлорметаном. Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью этилацетат/метанол (градиент элюирования от этилацетата до 20:1), получая целевое соединение в форме твердого вещества светло-коричневого цвета (1,47 г, 77%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,96 (с, 1H), 7,46-7,35 (м, 5H), 5,14 (дд, J=2,0 и 10,6 Гц, 1H), 4,50-4,39 (м, 2H), 3,90 (с, 3H), 3,65-3,58 (м, 2H), 3,39-3,31 (м, 2H), 3,17 (с, 3H), 2,59 (с, 3H), 2,39-2,28 (м, 1H), 2,20-2,04 (м, 1H) ppm.
MS (ESI) m/z: 381 (M+H)+.
СТАДИЯ 12: 1-(2-Метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоновая кислота
Смесь 1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-метилкарбоксилата (1,37 г, 3,61 ммоль, Стадия 11), водного раствора 2 моль/л гидроксида натрия (3,60 мл, 7,21 ммоль) и этанола (20 мл) перемешивали при 80°C в течение 2 часов. После охлаждения до температуры окружающей среды добавляли 2 моль/л соляной кислоты (3,60 мл, 7,21 ммоль), и сформированный осадок собирали фильтрацией, получая целевое соединение в форме твердого вещества белого цвета (1,28 г, 96%).
1H ЯМР (ДМСО-d 6, 300 МГц) δ: 12,52 (с, 1H), 7,69 (с, 1H), 7,52-7,32 (м, 5H), 5,24 (д, J=8,8 Гц, 1H), 4,45-4,38 (м, 2H), 3,62-3,55 (м, 2H), 3,26-3,18 (м, 2H), 3,13 (с, 3H), 2,34-2,22 (м, 1H), 2,09-1,92 (м, 1H) ppm.
MS (ESI) m/z: 367 (M+H)+, 365 (M-H) -.
СТАДИЯ 13: 1-(2-Метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
К раствору 1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоновой кислоты (200 мг, 0,55 ммоль, Стадия 12), триэтиламина (0,30 мл, 2,18 ммоль), и O-бензотриазол-1-ил-N,N,N',N'-тетраметилуронийгексафторфосфата (228 мг, 0,60 ммоль) в N,N-диметилформамиде (5 мл) при 0°C добавляли диметиламингидрохлорид (49 мг, 0,60 ммоль). После перемешивания при температуре окружающей среды в течение 12 часов, смесь лили на воду, и водный слой экстрагировали дихлорметаном. Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью дихлорметан/метанол (20:1), получая целевое соединение в форме аморфного вещества белого цвета (215 мг, колич.).
1H ЯМР (CDCl3, 300 МГц) δ: 7,45-7,35 (м, 5H), 7,14 (с, 1H), 5,16 (дд, J=2,2 и 10,3 Гц, 1H), 4,52-4,35 (м, 2H), 3,69-3,58 (м, 2H), 3,18 (с, 3H), 3,15 (с, 3H), 3,2-2,7 (м, 2H), 2,90 (с, 3H), 2,58 (с, 3H), 2,40-2,10 (м, 2H) ppm.
MS (ESI) m/z: 394 (M+H)+.
Пример 2
(+)-1-(2-Метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид и
Пример 3
(-)-1-(2-Метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
Фракцию 1 (68 мг) и фракцию 2 (68 мг) получали из рацемического 1-(2-метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамида (200 мг, Стадия 13 в Примере 1) ВЭЖХ следующим образом.
Условия выделения
Колонка: CHIRALPAK AD-H (20 мм × 250 мм, DAICEL)
Мобильная фаза: н-гексан/Этанол/Диэтиламин (90/10/0,1)
Объемная скорость потока: 20 мл/мин
(+)-1-(2-Метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид (фракция 1)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D 25=+54,3° (c=0,31, Метанол)
время удерживания: 33 минуты
(-)-1-(2-Метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид (фракция 2)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D 25=-59,1° (c=0,30, Метанол)
время удерживания: 39 минут
Пример 4
N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
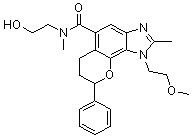
Целевое соединение получали в форме твердого вещества белого цвета в количественном выходе из 1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоновой кислоты (200 мг, 0,55 ммоль, Стадия 12 Примера 1) и 2-(метиламино)этанола (45 мг, 0,60 ммоль) тем же самым образом, как на Стадии 13 Примера 1.
1H ЯМР (CDCl3, 300 МГц) δ: 7,48-7,33 (м, 5H), 7,14 (с, 1H), 5,16 (д, J=10,3 Гц, 1H), 4,50-4,40 (м, 2H), 3,98-3,89 (м, 2H), 3,72-3,60 (м, 2H), 3,26-3,15 (м, 2H), 3,2-2,7 (м, 2H), 3,19 (с, 3H), 2,96 (с, 3H), 2,59 (с, 3H), 2,35-1,80 (м, 2H) ppm. (ОН не наблюдался),
MS (ESI) m/z: 424 (M+H)+.
Пример 5
8-(4-Фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
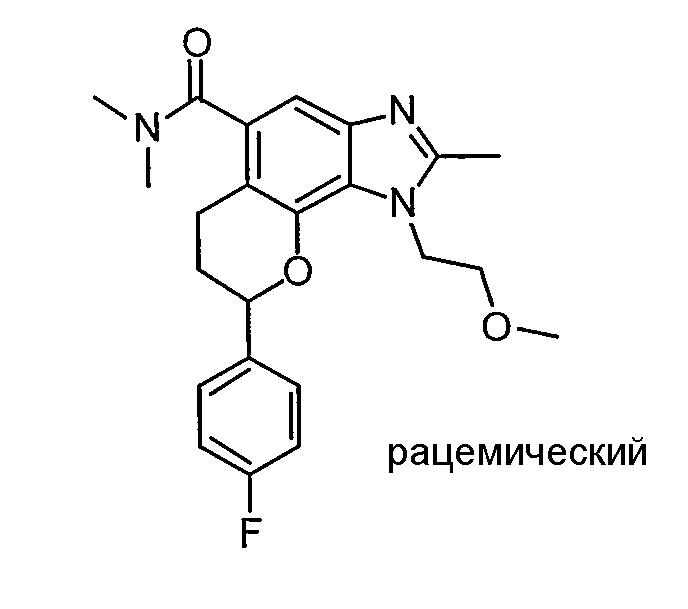
СТАДИЯ 1: 7-(Бензилокси)-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамид
Смесь 7-(бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-карбоновой кислоты (520 мг, 1,53 ммоль, Стадия 5 Примера 1), диметиламингидрохлорида (374 мг, 4,58 ммоль), 1-[3-(диметиламино)пропил]-3-этилкарбодиимида гидрохлорида (498 мг, 2,60 ммоль), 1-гидроксибензотриазолгидрата (413 мг, 3,06 ммоль) и триэтиламина (0,64 мл, 4,58 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при температуре окружающей среды в течение 1 дня. Смесь лили на воду, и водный слой экстрагировали этилацетатом. Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью дихлорметан/метанол (10:1), получая целевое соединение в форме твердого вещества белого цвета (524 мг, 93%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,46-7,33 (м, 6H), 6,94 (уш.с, 1H), 5,20 (с, 2H), 4,44 (т, J=5,3 Гц, 2H), 3,61 (т, J=5,3 Гц, 2H), 3,17 (с, 3H), 3,09 (уш.с, 6H), 2,59 (с, 3H) ppm.
MS (ESI) m/z: 368 (M+H)+.
Стадия 2: 7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамид
Смесь 7-(бензилокси)-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамида (483 мг, 1,31 ммоль, Стадия 1) и 10% палладия на угле (50 мг) в этаноле (30 мл) перемешивали в атмосфере газообразного водорода в течение 19 часов. Полученную смесь фильтровали через Целит, и фильтрат концентрировали в вакууме, получая целевое соединение в форме твердого вещества белого цвета (347 мг, 95%).
1H ЯМР (CDCl3, 300 МГц) δ: 9,57 (уш.с, 1H), 7,14 (д, J=1,5 Гц, 1H), 6,93 (д, J=1,5 Гц, 1H), 4,43 (т, J=5,1 Гц, 2H), 3,64 (т, J=5,1 Гц, 2H), 3,20 (с, 3H), 3,15 (уш.с, 3H), 3,05 (уш.с, 3H), 2,53 (с, 3H) ppm.
MS (ESI) m/z: 278 (M+H)+.
СТАДИЯ 3: 6-[(Диметиламино)метил]-7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамид
К перемешиваемому раствору 7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамида (1,0 г, 3,6 ммоль, Стадия 2) и карбоната калия (748 мг, 5,4 ммоль) в N,N-диметилформамиде (36 мл) при 0°C добавляли N,N-диметилметилениминиййодид (867 мг, 4,7 ммоль). После перемешивания при той же самой температуре в течение 4 часов реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном. Объединенный органический слой промывали солевым раствором, высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на NH-геле с элюированием смесью этилацетат/метанол (30:1), получая целевое соединение (855 мг, 71%) в форме аморфного вещества белого цвета.
1H ЯМР (CDCl3, 270 МГц) δ: 6,97 (с, 1H), 4,51 (т, J=5,3 Гц, 2H), 3,65-3,82 (уш.с, 2H), 3,75 (т, J=5,3 Гц, 2H), 3,27 (с, 3H), 3,14 (с, 3H), 2,88 (с, 3H), 2,58 (с, 3H), 2,36 (с, 6H) ppm. (ОН не наблюдался),
MS (ESI) m/z: 335 (M+H)+.
СТАДИЯ 4: 6-[3-(4-Фторфенил)-3-оксопропил]-7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамид
Целевое соединение получали в форме аморфного вещества коричневого цвета с 86%-ным выходом из 6-[(диметиламино)метил]-7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамида (648 мг, 1,94 ммоль, Стадия 3) и 1-[1-(4-фторфенил)винил]пирролидина (556 мг, 2,91 ммоль, WO 9940091) тем же самым образом, как на Стадии 9 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 9,38 (с, 1H), 8,05 (дд, J=8,6, 5,3 Гц, 2H), 7,10 (т, J=8,6 Гц, 2H), 7,06 (с, 1H), 4,57 (т, J=5,3 Гц, 2H), 3,79 (т, J=5,3 Гц, 2H), 3,30 (с, 3H), 3,18 (с, 3H), 2,87 (с, 3H), 2,58 (с, 3H) ppm. (2×CH2 не наблюдались),
MS (ESI) m/z: 428 (M+H)+, 426 (M-H) -.
СТАДИЯ 5: 6-[3-(4-Фторфенил)-3-гидроксипропил]-7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамид
Целевое соединение получали в форме аморфного вещества коричневого цвета с 87%-ным выходом из 6-[3-(4-фторфенил)-3-оксопропил]-7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамида (713 мг, 1,67 ммоль, Стадия 4) тем же самым образом, как на Стадии 10 Примера 1.
1H ЯМР (CDCl3, 300 МГц) δ: 7,26 (м, 2H), 6,94 (т, J=8,8 Гц, 2H), 6,94 (с, 1H), 4,55-4,42 (м, 3H), 3,72 (уш.с, 2H), 3,31 (с, 3H), 3,10 (с, 3H), 2,79 (с, 3H), 2,51 (с, 3H) ppm. (2×CH2 и 2×ОН не наблюдались),
MS (ESI) m/z: 430 (M+H)+, 428 (M-H) -.
СТАДИЯ 6: 8-(4-Фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
Целевое соединение получали в форме твердого вещества белого цвета с 93%-ным выходом из 6-[3-(4-фторфенил)-3-гидроксипропил]-7-гидрокси-1-(2-метоксиэтил)-N,N,2-триметил-1H-бензимидазол-5-карбоксамида (273 мг, 0,636 ммоль, Стадия 5) тем же самым образом, как на Стадии 11 Примера 1.
1H ЯМР (CDCl3, 300 МГц) δ: 7,40 (дд, J=8,8, 5,1 Гц, 2H), 7,14 (с, 1H), 7,11 (т, J=8,8 Гц, 2H), 5,12 (дд, J=10,3, 2,2 Гц, 1H), 4,48-4,33 (м, 2H), 3,64-3,57 (м, 2H), 3,2-2,7 (м, 2H), 3,19 (с, 3H), 3,15 (с, 3H), 2,90 (с, 3H), 2,57 (с, 3H), 2,29-2,11 (м, 2H) ppm.
MS (ESI) m/z: 412 (M+H)+.
Пример 6
(+)-8-(4-Фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид и
Пример 7
(-)-8-(4-Фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
Фракцию 1 (73 мг) и фракцию 2 (73 мг) получали из рацемического 8-(4-фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамида (183 мг, СТАДИЯ 6 в Примере 5) ВЭЖХ следующим образом.
Условия выделения
Колонка: CHIRALCEL OJ-H (20 мм × 250 мм, DAICEL)
Мобильная фаза: н-гексан/2-пропанол/Диэтиламин (88/12/0.1)
Объемная скорость потока: 18,9 мл/мин
(-)-8-(4-Фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид (фракция 1)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D 24=-44,7° (c=0,31, Метанол)
время удерживания: 11 минут
(+)-8-(4-Фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид (фракция 2)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D 24=+44,0° (c=0,30, Метанол)
время удерживания: 18 минут
Пример 8
8-(4-Фторфенил)-1-(3-гидроксипропил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
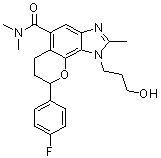
СТАДИЯ 1: 4-(Бензилокси)-6-бром-2-метил-1H-бензимидазол
Смесь N-[2-(бензилокси)-4-бром-6-нитрофенил]ацетамида (120 г, 329 ммоль, Стадия 1 Примера 1) и железного порошка (55,1 г, 986 ммоль) в уксусной кислоте (500 мл) нагревали с обратным холодильником при перемешивании в течение 6 часов. После охлаждения до температуры окружающей среды смесь фильтровали через Целит, и фильтрат концентрировали в вакууме. Остаток разбавляли этилацетатом (1,5 л). Полученные осадки фильтровали через Целит и промывали этилацетатом (500 мл). Фильтрат концентрировали в вакууме, и остаток разбавляли этилацетатом (200 мл). К органической смеси добавляли солевой раствор, полученные белые осадки собирали фильтрацией и промывали водой (200 мл) и простым диэтиловым эфиром (200 мл). Твердое вещество белого цвета растворяли в смеси дихлорметан/метанол (10:1, 1,0 л), высушивали над сульфатом магния и концентрировали. Твердое вещество растирали с простым диэтиловым эфиром (300 мл), собирали фильтрацией и высушивали в вакууме, получая целевое соединение в форме твердого вещества белого цвета (54,7 г, 53%).
1H ЯМР (ДМСО-d 6, 270 МГц) δ: 7,63-7,28 (м, 7H), 5,38 (с, 2H), 2,69 (с, 3H) ppm. (NH не наблюдался),
MS (ESI) m/z: 317 (M+H)+, 315 (M-H)-.
СТАДИЯ 2: 4-(Бензилокси)-6-бром-2-метил-1-[(4-метилфенил)сульфонил]-1Н-бензимидазол
К суспензии 4-(бензилокси)-6-бром-2-метил-1H-бензимидазола (79,2 г, 250 ммоль, Стадия 1) в N,N-диметилформамиде (500 мл) при 0°C добавляли гидрид натрия (60% в минеральном масле, 12,0 г, 300 ммоль). После перемешивания при температуре окружающей среды в течение 20 минут реакционную смесь охлаждали до 0°C. К смеси при 0°C добавляли 4-метилбензолсульфонилхлорид (47,6 г, 250 ммоль), и реакционную смесь перемешивали при температуре окружающей среды в течение 30 минут. Смесь гасили водой, и белые осадки собирали фильтрацией, промывали простым диизопропиловым эфиром и высушивали в вакууме при 70°C в течение 7 часов, получая целевое соединение в форме твердого вещества белого цвета (116 г, 98%).
1H ЯМР (ДМСО-d 6, 270 МГц) δ: 7,98 (д, J=8,1 Гц, 2H), 7,64 (д, J=1,9 Гц, 1H), 7,53-7,34 (м, 7H), 7,22 (д, J=1,9 Гц, 1H), 5,28 (с, 2H), 2,74 (с, 3H), 2,38 (с, 3H) ppm.
MS (ESI) m/z: 471 (M+H)+, 469 (M-H)-.
СТАДИЯ 3: 4-(Бензилокси)-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамид
Смесь 4-(бензилокси)-6-бром-2-метил-1-[(4-метилфенил)сульфонил]-1Н-бензимидазола (53,0 г, 112 ммоль, Стадия 2) и тетракис(трифенилфосфин)палладия (25,9 г, 22,4 ммоль) в растворе 2 моль/л диметиламина в тетрагидрофуране (580 мл) перемешивали при 65°C в атомсфере газообразного монооксида углерода (1 атм) в течение 32 часов. Смесь охлаждали до температуры окружающей среды и разбавляли этилацетатом. Органическую смесь промывали насыщенным водным раствором хлорида аммония и солевым раствором, высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на силикагеле с элюированием смесью гексан/этилацетат (градиент элюирования от 1:2 до 1:3), получая целевое соединение в форме твердого вещества белого цвета (21,8 г, 42%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,80 (д, J=8,1 Гц, 2H), 7,70 (с, 1H), 7,45 (д, J=8,1 Гц, 2H), 7,40-7,22 (м, 5H), 6,86 (с, 1H), 5,32 (с, 2H), 3,11 (уш.с, 3H), 2,89 (уш.с, 3H), 2,81 (с, 3H), 2,40 (с, 3H) ppm.
MS (ESI) m/z: 464 (M+H)+.
СТАДИЯ 4: 4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамид
Смесь 4-(бензилокси)-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамида (29,0 г, 62,6 ммоль, Стадия 3) и 10% палладия на угле (6,0 г) в тетрагидрофуране (200 мл) перемешивали в атмосфере газообразного водорода (1 атм) при температуре окружающей среды в течение 24 часов. Добавляли еще 4,0 г 10%-ного палладия на угле, и смесь перемешивали в атмосфере газообразного водорода (1 атм) при температуре окружающей среды в течение дополнительных 6 часов. Полученную смесь фильтровали через Целит, и фильтрат концентрировали в вакууме, получая целевое соединение в форме твердого вещества белого цвета (23,0 г, 98%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,82 (д, J=8,1 Гц, 2H), 7,63 (с, 1H), 7,31 (д, J=8,1 Гц, 2H), 6,92 (с, 1H), 3,14 (уш.с, 3H), 3,01 (уш.с, 3H), 2,79 (с, 3H), 2,40 (с, 3H) ppm. (-ОН не наблюдался),
MS (ESI) m/z: 374 (M+H)+, 372 (M-H)-.
СТАДИЯ 5: 5-[(Диметиламино)метил]-4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамид
К раствору 4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамида (1,00 г, 2,68 ммоль, Стадия 4) в дихлорметане (50 мл) при температуре окружающей среды добавляли N,N-диметилметилениминиййодид (545 мг, 2,95 ммоль) и смесь перемешивали при 40°C в течение 15 часов. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия. Смесь экстрагировали дихлорметаном. Органический слой высушивали над сульфатом натрия и концентрировали в вакууме, получая целевое соединение в форме аморфного вещещства желтого цвета (1,04 г, 90%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,78 (д, J=8,6 Гц, 2H), 7,35 (с, 1H), 7,32-7,24 (м, 2H), 3,83-3,56 (уш, 2H), 3,17 (с, 3H), 2,87 (с, 3H), 2,77 (с, 3H), 2,40 (с, 3H), 2,36 (с, 6H) ppm. (ОН не наблюдался),
MS (ESI) m/z: 431 (M+H)+, 429 (M-H)-.
СТАДИЯ 6: 5-[3-(4-Фторфенил)-3-оксопропил]-4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамид
Целевое соединение получали в форме твердого вещества коричневого цвета с 52%-ным выходом из 5-[(диметиламино)метил]-4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамида (1,15 г, Стадия 5) и 1-[1-(4-фторфенил)винил]пирролидина (766 мг, WO 9940091) тем же самым образом, как на Стадии 9 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 8,02 (дд, J=8,8, 5,1 Гц, 2H), 7,79 (д, J=8,1 Гц, 2H), 7,44 (с, 1H), 7,34-7,24 (м, 2H), 7,08 (дд, J=8,8, 8,8 Гц, 2H), 3,18 (с, 3H), 2,87 (с, 3H), 2,76 (с, 3H), 2,39 (с, 3H) ppm. (ОН и 2×CH2 не наблюдались),
MS (ESI) m/z: 524 (M+H)+, 522 (M-H)-.
СТАДИЯ 7: 5-[3-(4-Фторфенил)-3-гидроксипропил]-4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамид
Целевое соединение получали в форме твердого вещества коричневого цвета с 64%-ным выходом из 5-[3-(4-фторфенил)-3-оксопропил]-4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамида (300 мг, Стадия 6) тем же самым образом, как на Стадии 10 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 7,82 (д, J=8,6 Гц, 2H), 7,43 (с, 1H), 7,35-7,23 (м, 4H), 6,95 (дд, J=8,9, 8,9 Гц, 2H), 3,17 (с, 3H), 2,85 (с, 3H), 2,76 (с, 3H), 2,41 (с, 3H) ppm. (CH, 2×CH2 и 2×ОН не наблюдались),
MS (ESI) m/z: 526 (M+H)+, 524 (M-H)-.
СТАДИЯ 8: 8-(4-Фторфенил)-N,N,2-триметил-3,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
Целевое соединение получали в форме коричневого масла с 43%-ным выходом из 5-[3-(4-фторфенил)-3-гидроксипропил]-4-гидрокси-N,N,2-триметил-1-[(4-метилфенил)сульфонил]-1H-бензимидазол-6-карбоксамида (192 мг, Стадия 7) тем же самым образом, как на Стадии 11 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 7,43 (дд, J=8,6, 5,3 Гц, 2H), 7,40-7,19 (уш, 3H), 3,14 (с, 3H), 2,92-2,84 (уш, 3H), 2,59 (с, 3H) ppm. (CH, 2×CH2 и NH не наблюдались),
MS (ESI) m/z: 354 (M+H)+, 352 (M-H)-.
СТАДИЯ 9: 1-(3-{[трет-бутил(диметил)силил]окси}пропил)-8-(4-фторфенил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
К раствору 8-(4-фторфенил)-N,N,2-триметил-3,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамида (52,0 мг, 0,147 ммоль, Стадия 8) в N,N-диметилформамиде (1,5 мл) при 0°C добавляли гидрид натрия (7,1 мг, 0,18 ммоль), и смесь перемешивали при 0°C в течение 30 минут. Затем к смеси при 0°C добавляли (3-бромпропокси)(трет-бутил)диметилсилан (48,4 мг, 0,191 ммоль). Смеси давали нагреться до температуры окружающей среды, перемешивали в течение 4 часов и оставляли при той же самой температуре на ночь. Реакционную смесь гасили насыщенным водным раствором хлорида аммония. Смесь экстрагировали этилацетатом. Объединенные органические слои промывали водой и солевым раствором. Их высушивали над сульфатом натрия и концентрировали в вакууме. Остаток очищали препаративной TLC, элюируя смесью гексан/этилацетат (1:1 и затем 1:4), получая целевое соединение в форме коричневого масла (35,5 мг, 46%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,41 (дд, J=8,6, 5,3 Гц, 2H), 7,16-7,06 (м, 3H), 5,11 (дд, J=10,2, 2,3 Гц, 1H), 4,31 (т, J=7,3 Гц, 2H), 3,41 (т, J=5,3 Гц, 2H), 3,2-2,7 (м, 2H), 3,15 (с, 3H), 2,90 (с, 3H), 2,57 (с, 3H), 2,37-2,02 (м, 2H), 1,90 (тт, J=6,6, 6,6 Гц, 2H), 0,88 (с, 9H),-0,01 (с, 6H) ppm.
MS (ESI) m/z: 526 (M+H)+.
СТАДИЯ 10: 8-(4-Фторфенил)-1-(3-гидроксипропил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
К раствору 1-(3-{[трет-бутил(диметил)силил]окси}пропил)-8-(4-фторфенил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамида (35 мг, 0,067 ммоль, Стадия 9) в тетрагидрофуране добавляли 1 M раствор тетрабутиламмонийфторида в тетрагидрофуране (0,1 мл). Смесь перемешивали при температуре окружающей среды в течение 2,5 часов. Реакционную смесь гасили насыщенным водным раствором хлорида аммония. Смесь экстрагировали этилацетатом. Объединенные органические слои промывали водой и солевым раствором, высушивали над сульфатом натрия и концентрировали в вакууме. Остаток очищали препаративной TLC, элюируя смесью дихлорметан/метанол (20:1). Полученный продукт растирали в гексане, получая целевое соединение в форме твердого вещества светло-желтого цвета (8,6 мг, 31%).
1H ЯМР (CDCl3, 270 МГц) δ: 7,43 (дд, J=9,2, 5,3 Гц, 2H), 7,16-7,06 (м, 3H), 5,12 (дд, J=10,2, 2,3 Гц, 1H), 4,35 (т, J=6,9 Гц, 2H), 3,46 (т, J=5,6 Гц, 2H), 3,2-2,7 (м, 2H), 3,15 (с, 3H), 2,90 (с, 3H), 2,57 (с, 3H), 2,37-2,06 (м, 2H), 2,02-1,88 (м, 2H) ppm. (ОН не наблюдался),
MS (ESI) m/z: 412 (M+H)+.
Пример 9
8-(4-Фторфенил)-1-(изоксазол-3-илметил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
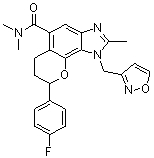
СТАДИЯ 1: 3-(Бромметил)изоксазол
К раствору изоксазол-3-илметанола (100 мг, 1,01 ммоль, EP 87953) в дихлорметане (10 мл) при 0°C добавляли трибромид фосфора (820 мг, 3,03 ммоль). Смесь перемешивали при температуре окружающей среды в течение 3 часов. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия. Смесь экстрагировали дважды дихлорметаном. Объединенный органический слой высушивали над сульфатом натрия и концентрировали N,N-диметилформамидом (1,0 мл) в вакууме, получая целевое соединение в форме раствора в N,N-диметилформамиде.
СТАДИЯ 2: 8-(4-Фторфенил)-1-(изоксазол-3-илметил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
К раствору 8-(4-фторфенил)-N,N,2-триметил-3,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамида (50,0 мг, 0,141 ммоль, Стадия 8 Примера 8) в N,N-диметилформамиде (1,4 мл) при 0°C добавляли гидрид натрия (6,7 мг, 0,17 ммоль), и смесь перемешивали при 0°C в течение 30 минут. Затем к смеси при 0°C добавляли раствор 3-(бромметил)изоксазола в N,N-диметилформамиде (1,0 мл, Стадия 1). Смеси давали нагреться до температуры окружающей среды, перемешивали в течение 4 часов и оставляли при той же самой температуре на ночь. Реакционную смесь гасили насыщенным водным раствором хлорида аммония. Смесь экстрагировали дважды этилацетатом. Объединенный органический слой промывали водой и солевым раствором, высушивали над сульфатом натрия и концентрировали в вакууме. Остаток очищали препаративной TLC, элюируя смесью гексан/этилацетат (1:1, дважды), затем дихлорметан/метанол (20:1, дважды), получая целевое соединение в форме твердого вещества светло-желтого цвета (23,5 мг, 38%).
1H ЯМР (CDCl3, 270 МГц) δ: 8,31 (д, J=1,5 Гц, 2H), 7,31 (дд, J=8,8, 5,1 Гц, 2H), 7,17 (с, 1H), 7,06 (дд, J=8,4, 8,4 Гц, 1H), 6,03 (д, J=1,5 Гц, 1H), 5,66 (д, J=16,1 Гц, 1H), 5,57 (д, J=16,1 Гц, 1H), 5,13 (дд, J=10,3, 2,2 Гц, 1H), 3,2-2,7 (м, 2H), 3,16 (с, 3H), 2,91 (с, 3H), 2,57 (с, 3H), 2,35-2,02 (м, 2H) ppm.
MS (ESI) m/z: 435 (M+H)+.
Пример 10
N,N-ди[ 2 H 3 ]метил-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
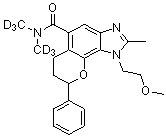
Смесь 1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоновой кислоты (200 мг, 0,55 ммоль, Стадия 12 Примера 1), N,N-ди[2H3]метиламингидрохлорида (96 мг, 1,09 ммоль), N,N-диизопропилэтиламина (0,38 мл, 2,18 ммоль), 1-[3-(диметиламино)пропил]-3-этилкарбодиимидгидрохлорида (157 мг, 0,82 ммоль) и 1-гидроксибензотриазолгидрата (125 мг, 0,82 ммоль) в 1-метил-2-пирролидиноне (3 мл) перемешивали при температуре окружающей среды в течение 8 часов. Затем смесь лили на воду (30 мл), и водный слой экстрагировали этилацетатом. Объединенный органический слой высушивали над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на колонках на NH-геле с элюированием смесью дихлорметан/метанол (20:1), получая целевое соединение в форме аморфного вещества белого цвета (175 мг, 80%).
1H ЯМР (CDCl3, 300 МГц) δ: 7,44-7,34 (м, 5H), 7,13 (с, 1H), 5,15 (дд, J=2,6 и 10,6 Гц, 1H), 4,50-4,35 (м, 2H), 3,68-3,56 (м, 2H), 3,2-2,7 (м, 2H), 3,18 (с, 3H), 2,57 (с, 3H), 2,35-2,10 (м, 2H).
MS (ESI) m/z: 400 (M+H)+.
Пример 11
8-(2,4-дифторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
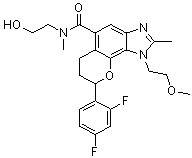
СТАДИЯ 1: 7-(Бензилокси)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамид
Целевое соединение получали в форме аморфного вещества белого цвета с 99%-ным выходом из 7-(бензилокси)-1-(2-метоксиэтил)-2-метил-1H-бензимидазол-5-карбоновой кислоты (5,00 г, 14,7 ммоль, Стадия 5 Примера 1) и 2-(метиламино)этанола (1,21 г, 16,2 ммоль) тем же самым образом, как на Стадии 13 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 7,43-7,39 (м, 6H), 6,97 (бакалавр наук, 1H), 5,20 (с, 2H), 4,45 (т, J=5,1 Гц, 2H), 3,98-3,81 (м, 2H), 3,81-3,75 (м, 2H), 3,61 (т, J=5,1 Гц, 2H), 3,18 (с, 3H), 3,12 (с, 3H), 2,60 (с, 3H) ppm. (ОН не наблюдался),
MS (ESI) m/z: 398 (M+H)+.
СТАДИЯ 2: 7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамид
Целевое соединение получали в форме желтого масла в количественном выходе из 7-(бензилокси)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамида (1,15 г, 2,89 ммоль, Стадия 1) тем же самым образом, как на Стадии 7 Примера 1.
1H ЯМР (ДМСО-d 6, 270 МГц) δ: 7,50-6,99 (м, 1H), 6,81 (с, 1H), 4,61-4,31 (м, 2H), 4,04-3,37 (м, 6H), 3,27 (с, 3H), 3,09 (с, 3H), 2,58 (с, 3H) ppm. (2×ОН не наблюдались),
MS (ESI) m/z: 308 (M+H)+
СТАДИЯ 3: 6-[(Диметиламино)метил]-7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамид
Целевое соединение получали в форме бесцветного масла с 45%-ным выходом из 7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамида (500 мг, 1,63 ммоль, Стадия 2) тем же самым образом, как на Стадии 3 Примера 5.
1H ЯМР (CDCl3, 270 МГц) δ: 6,99 (с, 1H), 4,61-4,43 (м, 2H), 4,43-3,54 (м, 9H), 3,28 (с, 3H), 2,94 (с, 2H), 2,58 (с, 3H), 2,36 (с, 6H) ppm. (2×ОН не наблюдались),
MS (ESI) m/z: 365 (M+H)+. 363 (M-H)-.
СТАДИЯ 4: 1-[1-(2,4-дифторфенил)винил]пирролидин
К раствору 1-(2,4-дифторфенил)этанона (10,0 г, 64,0 ммоль) и пирролидина (32,1 мл, 384 ммоль) в гексане (150 мл) по каплям при 0°C за 15 минут добавляли тетрахлорид титана (3,86 мл, 35,2 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 24 часов и фильтровали. Фильтрат упаривали в вакууме, получая светло-желтое масло, которое дистиллировали при пониженном давлении (0,3 мм рт.ст., 90-120°C), получая целевое соединение в форме светло-желтого масла (4,90 г, 36%).
1H ЯМР (CDCl3, 300 МГц) δ: 7,33-7,25 (м, 1H), 6,91-6,76 (м, 2H), 3,81 (с, 1H), 3,68 (с, 1H), 3,11-2,98 (м, 4H), 1,92-1,78 (м, 4 H) ppm.
СТАДИЯ 5: 6-[3-(2,4-дифторфенил)-3-оксопропил]-7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамид
Целевое соединение получали в форме твердого вещества белого цвета с 40%-ным выходом из 6-[(диметиламино)метил]-7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамида (1,16 г, 3,19 ммоль, Стадия 3) и 1-[1-(2,4-дифторфенил)винил]пирролидина (1,00 г, 4,78 ммоль, Стадия 4) тем же самым образом, как на Стадии 9 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 9,10 (уш.с, 1H, О), 7,96 (д, J=8,1 Гц, 1H), 7,07 (с, 1H), 7,02-6,74 (м, 2H), 4,67-4,42 (м, 2H), 4,03-3,80 (м, 8H), 3,31 (с, 3H), 2,92 (с, 3H), 2,59 (с, 3H) ppm. (CH2 и ОН не наблюдались),
MS (ESI) m/z: 476 (M+H)+, 474 (M-H).
СТАДИЯ 6: 6-[3-(2,4-дифторфенил)-3-гидроксипропил]-7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамид
Целевое соединение получали в форме твердого вещества белого цвета в количественном выходе из 6-[3-(2,4-дифторфенил)-3-оксопропил]-7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамид (617 мг, 1,30 ммоль, Стадия 5) тем же самым образом, как на Стадии 10 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 7,67-7,38 (м, 1H), 7,12 (с, 1H), 6,95-6,47 (м, 2H), 4,99-4,70 (м, 1H), 4,70-4,29 (м, 2H), 4,07-3,88 (м, 2H), 4,07-2,80 (м, 8H), 3,42 (с, 3H), 2,92 (с, 3H), 2,57 (с, 3H) ppm. (3×ОН не наблюдались),
MS (ESI) m/z: 478 (M+H)+, 476 (M-H) -.
СТАДИЯ 7: 8-(2,4-дифторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
Целевое соединение получали в форме твердого вещества белого цвета с 64%-ным выходом из 6-[3-(2,4-дифторфенил)-3-гидроксипропил]-7-гидрокси-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1H-бензимидазол-5-карбоксамида (640 мг, 0,21 ммоль, Стадия 6) тем же самым образом, как на Стадии 11 Примера 1.
1H ЯМР (CDCl3, 270 МГц) δ: 9,72 (с, 1H), 8,03 (д, J=7,2 Гц, 2H), 7,95 (с, 1H), 7,59 (т, J=7,9 Гц, 1H), 7,46 (т, Гц J=7,9, 2H), 4,61 (т, J=5,3 Гц, 2H), 3,92 (с, 3H), 3,83-3,73 (м, 4H), 3,41 (т, J=5,3 Гц, 2H), 3,29 (с, 3H), 2,60 (с, 3H) ppm.
MS (ESI) m/z: 460 (M+H)+.
Пример 12
(-)-8-(2,4-дифторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид и
Пример 13
(+)-8-(2,4-дифторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид
Фракцию 1 (158 мг) и фракцию 2 (148 мг) получали из рацемического 8-(2,4-дифторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамида (356 мг, СТАДИЯ 7 в Примере 11) хиральным SFC следующим образом.
Условия выделения
Прибор: Berger MultiGram II™ (Mettler-Toledo)
Колонка: DAICEL CHIRALPAK AD-H (20 мм×250 мм, DAICEL)
Температура колонки: 35°C
Давление на выходе: 100 бар
Мобильная фаза: CO2/0,1% Диэтиламин в 2-пропаноле (80/20)
Объемная скорость потока: 40 мл/мин.
(-)-8-(2,4-дифторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид (фракция 1)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D21=-22,9° (c=0,21, Метанол)
время удерживания: 10 минут.
(+)-8-(2,4-дифторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид (фракция 2)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D21=+24,8° (c=0,23, Метанол)
время удерживания: 12 минут.
Следующие Примеры 14 и 15 были получены из 1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоновой кислоты (Стадия 12 Примера 1) и различных соответствующих аминов согласно процедуре, описанной на Стадии 13 Примера 1.
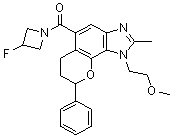
1H ЯМР (CDCl3, 300 МГц) δ: 7,51-7,33 (м, 5H), 7,22 (с, 1H), 5,33 (ответвление д, J=56,5 Гц, 1H), 5,15 (дд, J=11,0, 2,2 Гц, 1H), 4,58-4,02 (м, 6H), 3,66-3,57 (м, 2H), 3,22-2,97 (м, 2H), 3,18 (с, 3H), 2,58 (с, 3H), 2,33-2,22 (м, 1H), 2,20-2,04 (м, 1H) ppm.
MS (ESI) m/z: 424 (M+H)+.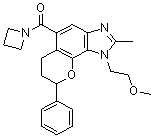
1H ЯМР (CDCl3, 300 МГц) δ: 7,50-7,32 (м, 5H), 7,21 (с, 1H), 5,15 (дд, J=11,0, 2,2 Гц, 1H), 4,49-4,39 (м, 2H), 4,29-3,93 (м, 4H), 3,66-3,58 (м, 2H), 3,26-2,95 (м, 2H), 3,17 (с, 3H), 2,57 (с, 3H), 2,38-2,25 (м, 3H), 2,18-2,04 (м, 1H) ppm.
MS (ESI) m/z: 406 (M+H)+.
Пример 16
(-)-5-(Азетидин-1-илкарбонил)-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол и
Пример 17
(+)-5-(Азетидин-1-илкарбонил)-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол
Фракцию 1 (86 мг) и фракцию 2 (82 мг) получали из рацемического 5-(азетидин-1-илкарбонил)-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазола (230 мг, Пример 15) ВЭЖХ следующим образом.
Условия выделения
Колонка: CHIRALCEL OD-H (20 мм×250 мм, DAICEL)
Мобильная фаза: н-гексан/Этанол/Диэтиламин (85/15/0.1)
Объемная скорость потока: 20 мл/мин.
(-)-5-(Азетидин-1-илкарбонил)-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол (фракция 1)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D21=-23,5° (c=0,21, Метанол)
время удерживания: 15,7 минут.
(+)-5-(Азетидин-1-илкарбонил)-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол (фракция 2)
1H ЯМР: данные спектра были идентичны таковым рацемата
вращение плоскости поляризации: [α]D21=+25,0° (c=0,20, Метанол)
время удерживания: 21,7 минуты.
Все публикации, включая, но не ограничиваясь ими, выданные патенты, заявки на патент и журнальные статьи, процитированные в этой заявке, полностью включены в настоящее описание путем ссылки.
Хотя изобретение было описано выше в отношении раскрытых вариантов осуществления, специалисту будет понятно, что специфически детализированные эксперименты только иллюстрируют изобретение. Следует понимать, что различные модификации могут быть сделаны без отхода от духа изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТАГОНИСТ КИСЛОТНОГО НАСОСА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ПАТОЛОГИЧЕСКИМ НАРУШЕНИЕМ МОТОРИКИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2010 |
|
RU2586276C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ЛЕЙКОЗОВ | 2019 |
|
RU2804709C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ Е3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2666530C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ E3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2781452C2 |
| ПРОИЗВОДНОЕ ДИГИДРОПИРИДАЗИН-3,5-ДИОНА | 2014 |
|
RU2662832C2 |
| ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2815314C2 |
| ПРОИЗВОДНЫЕ 1-N-ФЕНИЛАМИНО-1Н-ИМИДАЗОЛА И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2365586C2 |
| ИНГИБИТОРЫ β-ЛАКТАМАЗ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2753401C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2015 |
|
RU2733400C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
Изобретение относится к соединениям формулы (I) или к их фармацевтически приемлемым солям, в которой: R1, R2, R3, R4, А и Е имеют значения, указанные в формуле изобретения, и к фармацевтической композиции, содержащей эти соединения, и способу лечения и применению, для лечения состояния, опосредуемого антагонистической активностью в отношении кислотной помпой, таких как, желудочно-кишечное заболевание, желудочно-пищеводное заболевание, гастроэзофагеальная рефлюксная болезнь (GERD), ларингофарингеальная рефлюксная болезнь, язвенная болезнь, язва желудка, язва двенадцатиперстной кишки, NSAID-индуцированные язвы, гастрит, инфекция Helicobacter pylori, диспепсия, функциональная диспепсия, синдром Zollinger-Ellison, неэрозионная рефлюксная болезнь (NERD), висцеральная боль, рак, изжога, тошнота, эзофагит, дисфагия, гиперсаливация, нарушения дыхательных путей или астма. 4 н. и 5 з.п. ф-лы, 1 табл.
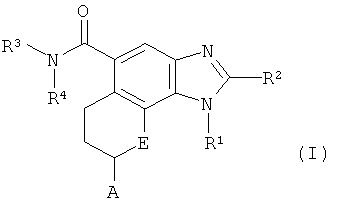
1. Соединение формулы (I):

или его фармацевтически приемлемая соль, в которой:
R1 обозначает С1-С6 алкил, незамещенный или замещенный 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, С1-С6 алкоксигруппы, или изоксазолила;
R2 обозначает атом водорода или С1-С6 алкил;
R3 и R4 независимо обозначают атом водорода, или С1-С6 алкил, незамещенный или замещенный 1-3 заместителями, независимо выбранными из группы, состоящей из дейтерия, гидроксильной группы и С1-С6 алкоксигруппы; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют 4-6-членную гетероциклическую группу, незамещенную или замещенную 1-2 атомами фтора;
А обозначает фенил, незамещенный или замещенный 1-5 атомами галогена; и
Е обозначает атом кислорода.
2. Соединение или фармацевтически приемлемая соль по п.1, в котором
R2 обозначает С1-С6 алкил.
3. Соединение или фармацевтически приемлемая соль по п.1, в котором
R1 обозначает С1-С6 алкил, замещенный гидроксильной группой, С1-С6 алкоксигруппой или изоксазолилом;
R2 обозначает С1-С6 алкил;
R3 и R4 независимо обозначают атом водорода, метил, -CD3 или 2-гидроксиэтил; или R3 и R4, вместе с атомом азота, к которому они присоединены, образуют морфолино.
4. Соединение по п.1, которое выбрано из следующих соединений:
(-)-1-(2-метоксиэтил)-N,N,2-триметил-8-фенил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
(-)-8-(4-фторфенил)-1-(2-метоксиэтил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено [7,8-d]имидазол-5-карбоксамид;
8-(4-фторфенил)-1-(3-гидроксипропил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
8-(4-фторфенил)-1-(изоксазол-3-илметил)-N,N,2-триметил-1,6,7,8-тетрагидрохромено[7,8-d]имидазол-5-карбоксамид;
N,N-ди[2Н3]метил-1-(2-метоксиэтил)-2-метил-8-фенил-1,6,7,8-тетрагидрохромено [7,8-d]имидазол-5-карбоксамид;
8-(4-фторфенил)-N-(2-гидроксиэтил)-1-(2-метоксиэтил)-N,2-диметил-1,6,7,8-тетрагидрохромено[8,7-d]имидазол-5-карбоксамид;
или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция для лечения состояния, опосредуемого ингибирующей кислотную помпу активностью, у млекопитающего, включая человека, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-4 и фармацевтически приемлемый носитель.
6. Способ лечения состояния, опосредуемого ингибирующей кислотную помпу активностью, у млекопитающего, включая человека, который включает введение млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп.1-4.
7. Способ по п.6, в котором указанное состояние представляет собой желудочно-кишечное заболевание, желудочно-пищеводное заболевание, гастроэзофагеальную рефлюксную болезнь (GERD), ларингофарингеальную рефлюксную болезнь, язвенную болезнь, язву желудка, язву двенадцатиперстной кишки, NSAID-индуцированные язвы, гастрит, инфекцию Helicobacter pylori, диспепсию, функциональную диспепсию, синдром Zollinger-Ellison, неэрозионную рефлюксную болезнь (NERD), висцеральную боль, рак, изжогу, тошноту, эзофагит, дисфагию, гиперсаливацию, нарушения дыхательных путей или астму.
8. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1-4, для получения лекарственного средства для лечения состояния, опосредуемого ингибирующей кислотную помпу активностью.
9. Применение по п.8, в котором указанное состояние представляет собой желудочно-кишечное заболевание, желудочно-пищеводное заболевание, гастроэзофагеальную рефлюксную болезнь (GERD), ларингофарингеальную рефлюксную болезнь, язвенную болезнь, язву желудка, язву двенадцатиперстной кишки, NSAID-индуцированные язвы, гастрит, инфекцию Helicobacter pylori, диспепсию, функциональную диспепсию, синдром Zollinger-Ellison, неэрозионную рефлюксную болезнь (NERD), висцеральную боль, рак, изжогу, тошноту, эзофагит, дисфагию, гиперсаливацию, нарушения дыхательных путей или астму.
| WO 2006037759 А1, 13.04.2006 | |||
| WO 2004087701 А1, 14.10.2004 | |||
| ПРОИЗВОДНЫЕ ПИРАНОБЕНЗОКСАДИАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ. | 1989 |
|
RU2054007C1 |
| ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРРОЛА, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1994 |
|
RU2128649C1 |
Авторы
Даты
2011-02-20—Публикация
2007-09-17—Подача