Область изобретения
Настоящее изобретение относится к бифункциональным соединениям, которые могут найти применение в качестве модуляторов мишеневого убиквитинирования, особенно, ингибиторов различных полипептидов и других белков, которые деградируются и/или иным образом ингибируются бифункциональными соединениями в соответствии с настоящим изобретением. В частности, настоящее изобретение относится к соединениям, которые содержат на одном конце лиганд VHL, который связывается с убиквитин лигазой VHL E3 (указываемый в данном документе как связывающая убиквитин лигазу лигандная группа  ) и на другом конце группу, которая связывает белок-мишень (указываемая как мишеневая группа белка/полипептида или группа
) и на другом конце группу, которая связывает белок-мишень (указываемая как мишеневая группа белка/полипептида или группа  ), таким образом, что мишеневый белок/полипептид находится в непосредственной близости от убиквитин лигазы, чтобы осуществить деградацию (и ингибирование) этого белка. Настоящее изобретение демонстрирует широкий спектр фармакологической активности, связанной с соединением в соответствии с настоящим изобретением, в соответствии с деградацией/ингибированием мишеневых полипептидов.
), таким образом, что мишеневый белок/полипептид находится в непосредственной близости от убиквитин лигазы, чтобы осуществить деградацию (и ингибирование) этого белка. Настоящее изобретение демонстрирует широкий спектр фармакологической активности, связанной с соединением в соответствии с настоящим изобретением, в соответствии с деградацией/ингибированием мишеневых полипептидов.
Связанные заявки и поддержка грантом
По данной заявке испрашивается приоритет в соответствии с предварительной заявкой US61/585769 с идентичным заголовком, поданной 12 января 2011 г., полное содержание которой включено в данное описание путем ссылки.
Данное изобретение было разработано при поддержке правительственного гранта № AI084140 Национального института здоровья. Правительство имеет определенные права на данное изобретение.
Предпосылки изобретения
E3 убиквитин лигазы (среди которых более 600 являются известными у человека)1 придают субстрату специфичность к убиквитинированию и являются более привлекательными терапевтическими мишенями, чем обычные протеасомные ингибиторы3,4, из-за их специфичности к некоторым белковым субстратам. Хотя разработка лигандов E3 лигазы оказалась сложной, частично из-за того, что они должны прерывать белок-белковое взаимодействие,5 в последних разработках представлены специфические лиганды, которые связываются с этими лигазами. Белок-белковые взаимодействия, как известно, являются затрудненной целью для использования небольших молекул из-за участия больших контактных поверхностей и неглубоких бороздок или плоских поверхностей. С другой стороны, большинство препаратов из небольших молекул связывают ферменты или рецепторы в жестких и четко определенных карманах.6 С момента открытия нутлинов, первой небольшой молекулы ингибиторов E3 лигазы,7 были сообщения о дополнительных соединениях, мишенью которых являются ингибиторы апоптозных белков (IAP),8,9 SCFMet30,10 и SCFCdc4,11, однако, данная область остается недостаточно развитой.
Одной E3 лигазой с вызывающими интерес терапевтическими возможностями является супрессор опухолей фон Гиппель-Линдау (VHL), субъединица распознавания субстрата Е3 лигазным комплексом VCB, который также состоит из элонгинов B и C, Cul2 и Rbx1.12 Основной субстрат VHL представляет собой фактор 1α, индуцируемый гипоксией, (HIF-1α), фактор транскрипции, который активирует гены, такие как проангиогенный фактор роста VEGF и индуцирующий красные кровяные тельца цитокин эритропоэтин, в ответ на низкий уровень кислорода. В то время как HIF-1α конститутивно экспрессируется, его внутриклеточные уровни сохраняются очень низкими в нормоксических условиях посредством гидроксилирования его белками, имеющими домен пролил гидроксилазы, (PHD), и последующего опосредованного VHL убиквитинилирования (фиг. 1).
Используя рациональный дизайн, авторы разработали первые лиганды фон Гиппеля Линдау (VHL) из небольших молекул, субъединицу распознавания субстрата Е3 лигазой VCB, важной мишени при злокачественном новообразовании, хронической анемии и ишемии.2 Авторы также получили кристаллические структуры VHL с разработанным ими самым мощным лигандом, 15, подтверждая, что соединение имитирует режим связывания фактора транскрипции HIF-1α, основного субстрата VHL.
Из предыдущих биохимических и структурных исследований связывания гидроксилированного пептида HIF с VHL стало ясно, что гидроксипролин играет важную роль в обеспечении этого взаимодействия белок:белок. Как следствие этой работы, авторы настоящего изобретения разработали поляризационный флуоресцентный (FP) анализ связывания гидроксилированный пептид HIF:VHL, с помощью которого авторы проанализировали >120 соединений, имеющих центральный гидроксипролиновый остаток, окруженный непептидными фрагментами. В продолжение этого исследования, в настоящий момент авторы изобретения разработали сокристаллические структуры комплекса VHL с семью из предпочтительных соединений. Анализ этих связанных лигандом структур дает возможность осуществить дизайн/синтез следующего поколения лигандов VHL, которые связываются со связывающимися фрагментами белка, давая бифункциональные соединения в соответствии с настоящим изобретением.
Основным мотивом настоящего изобретения является потребность в небольшой молекуле E3 лигазного лиганда для разработанной авторами технологии PROTAC (Proteolysis Targeting Chimera). Эта технология подводит белки-мишени/полипептиды к E3 лигазам для убиквитинилирования и последующей протеасомной деградации. В нескольких доказывающих правильность концепции экспериментах авторы настоящего изобретения продемонстрировали полезность этого подхода с использованием короткой пептидной последовательности от HIF, которая связывается с VHL. Для того чтобы получить более "лекарственно-подобный" PROTAC, авторы изобретения заменили пептид HIF на "небольшую молекулу" лиганда VHL, обеспечивая тем самым средства для рекруитирования белков к Е3 лигазам для убиквитинилирования и деградации, и, в конце концов, предложили возможность лечения на основе этой деградации белка.
Объекты изобретения
Объект изобретения касается соединений, которые рекруитируют эндогенные белки к E3 убиквитин лигазе для деградации.
Дополнительным объектом изобретения является получение соединений, которые модулируют деградацию белка в организме пациента или субъекта и могут быть использованы для лечения заболевания или состояния, которые модулированы посредством деградированного белка.
Другим объектом изобретения является получение фармацевтических композиций, основанных на вышеописанных модуляторах, особенно, включая ингибиторы, для терапевтического лечения пациента или субъекта, предпочтительно включая пациента или субъекта человека.
Также объектом изобретения являются способы определения связывающих белок фрагментов, которые присоединяются к представляющим интерес белкам.
Еще одним объектом изобретения являются способы идентификации эндогенных белков в биологической системе, особенно, включая систему человека, которые связываются со связывающими белок фрагментами в соединениях в соответствии с настоящим изобретением.
И еще одним объектом изобретения являются способы идентификации эффектов деградации представляющих интерес белков в биологической системе с использованием соединений в соответствии с настоящим изобретением.
Еще одним объектом изобретения являются способы лечения пациентов, где деградация белков-мишеней обеспечивает предполагаемый терапевтический эффект.
Еще одним объектом изобретения являются соединения и композиции, которые могут быть использованы в первом медицинском применении.
Еще одним объектом изобретения являются соединения и/или композиции, которые могут быть использованы при лечении пациентов, когда деградация белков-мишеней обеспечивает предполагаемый терапевтический эффект.
Любой один или несколько из этих и/или других объектов изобретения могут быть легко поняты при обычном ознакомлении с представленным далее описанием изобретения.
Краткое описание фигур
На фигуре 1 показано: (A) Аккумуляция HIF-1α приводит к регуляции транскрипции генов, участвующих в гипоксическом ответе, таких как эритропоэтин и VEGF. (B) В нормоксических условиях HIF-1α гидроксилируется, распознается VHL, убиквитинилируется и деградируется протеасомой, предотвращая регуляцию транскрипции генов.
Фигура 2. С помощью WaterLOGS ЯМР-спектроскопии показано связывание 3, но не L-Hyp или NAc-Hyp-NMe, с VHL.
На фигуре 3 представлено графическое изображение, показывающее ключевое взаимодействие между 15 и VHL.
На фигуре 4 показана сокристаллическая 2,9 Å структура 15 (самые светлые серые углероды), связанная с VHL, указывается, что ее связывание имитирует связывание пептида HIF-1α (светлые серые углероды, pdb 1LM817).
На фигуре 5 показаны кристаллические структуры V54BC apo (A) и в комплексе с 15 (B). Плотность электронов (2F0-FC), размещенных вокруг остатков сайта связывания Hyp (палки, желтые углероды) и сохраненные молекулы воды (красные точки), и 15 (палочки, циановые углероды) показаны синим и оконтурены при 1,2σ. Поверхность белка показана зеленым при 50% прозрачности.
На фигурах 6-12A и B показана активность отдельных соединений в соответствии с настоящим изобретением в описанном анализе поляризации/смещения VHL. Соединения в соответствии с настоящим изобретением указаны под своим номером вверху каждого графика. Контрольное соединение представлено на фигуре 15B и служит в качестве минимальной поляризации (максимальное смещение) для целей сравнения. Процент ингибирования, как представлено, был определен путем нормализации до максимальной и минимальной поляризации, и изображен графически относительно log [VL]. Значения IC50 были определены с использованием Prism 5 для каждой репликации (n=9), которые затем были усреднены для определения среднего IC50 и стандартной ошибки среднего (SEM).
На фигуре 13 (наряду с таблицей 2 - таблицей сродства) представлено множество соединений по примерам в соответствии с настоящим изобретением.
На фигуре 14 представлено множество предпочтительных соединений из представленных в таблице 2 в соответствии с настоящим изобретением.
На фигуре 15 представлен еще ряд соединений в соответствии с настоящим изобретением и их активность. Большинство соединений являются активными в концентрациях ниже 100 мкМ.
На фигуре 16 представлено множество предпочтительных соединений из представленных на фигуре 15 в соответствии с настоящим изобретением.
На фигуре 17 представлены восемь особенно предпочтительных соединений из представленных на фигуре 15 в соответствии с настоящим изобретением.
На фигуре 18 представлены шесть предпочтительных соединений в соответствии с настоящим изобретением, которые содержат связывающие фрагменты белка-мишени эстрогена, присоединенные к предпочтительным связывающим фрагментам лиганд убиквитина.
На фигуре 19 показан класс предпочтительных соединений в соответствии с настоящим изобретением.
Краткое описание изобретения
Настоящее изобретение основано на открытии того, что белок убиквитинового пути убиквитинилирует белок-мишень, как только белок убиквитинового пути и белок-мишень располагаются в непосредственной близости от химерной конструкции, которая связывает белок убиквитинового пути и белок-мишень. Соответственно, настоящее изобретение относится к композиции, которая приводит к убиквитинилированию выбранного белка-мишени. Настоящее изобретение относится также к библиотеке композиций и ее применению.
В одном варианте осуществления настоящее изобретение относится к композиции, которая может быть использована для регуляции активности белка. Композиция содержит связывающий фрагмент белка убиквитинового пути (предпочтительно, для E3 убиквитин лигазы, отдельно или в комплексе с E2 убиквитин конъюгирующим ферментом, который ответственен за перенос убиквитина к белкам-мишеням) согласно определенной химической структуре, и фрагмент белка-мишени, которые соединены вместе, предпочтительно посредством линкера, где связывающий фрагмент белка убиквитинового пути распознает белок убиквитинового пути, и мишеневый фрагмент распознает белок-мишень, и где связывающий фрагмент белка убиквитинового пути связывается с мишеневым фрагментом.
В другом варианте осуществления настоящее изобретение относится к библиотеке соединений. Библиотека содержит более одного соединения, где каждая композиция имеет формулу A-B, где A представляет собой связывающий фрагмент белка убиквитинового пути (предпочтительно фрагмент E3 убиквитин лигазы, как описано иным образом в данном документе), и B представляет собой связывающий белок элемент библиотеки молекул, где A связан (предпочтительно посредством линкерной группы) с B, и где связывающий фрагмент белка убиквитинового пути распознает белок убиквитинового пути, в частности, E3 убиквитин лигазу. В конкретном варианте осуществления изобретения библиотека содержит конкретный распознающий убиквитинилирование пептид VHL для E3 убиквитин лигазы (связывающий фрагмент белка убиквитинового пути, как описано иным образом в данном документе) со случайными связывающими элементами белков-мишеней (например, библиотека химических соединений). Как таковой, белок-мишень не определен заранее, и этот метод может быть использован для определения активности предполагаемого связывающего элемента белка и его фармакологического значения в качестве мишени при деградации убиквитин лигазой.
В еще другом варианте осуществления настоящее изобретение относится к способу скрининга библиотеки по настоящему изобретению для идентификации соединения, содержащего мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией клетки. Способ включает инкубирование клетки с пулом элементов из библиотеки; контроль за заранее установленной функцией клеток; определение пула элементов, которые изменяют заданную функцию клетки; инкубирование клетки с композицией из идентифицированного пула элементов; контроль за заранее установленной функцией клетки; и идентификацию композиции, которая изменяет заданную функцию клетки, где идентифицированная композиция содержит мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией.
В другом варианте осуществления настоящее изобретение относится к способу скрининга библиотеки по настоящему изобретению для идентификации композиции, содержащей мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией клетки. Способ включает инкубирование клетки с каждой композицией из библиотеки; контроль за заранее установленной функцией клетки; идентификацию композиции, которая изменяет заданную функцию клетки; где идентифицированная композиции содержит мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией.
В еще другом варианте осуществления настоящее изобретение относится к способу идентификации белка-мишени, связанного с заранее определенной функцией клетки. Способ включает инкубирование клетки с композицией из библиотеки по настоящему изобретению; контроль за заранее установленной функцией клетки; идентификацию композиции, которая изменяет заданную функцию клетки; идентификацию белка-мишени, который присоединяется к идентифицированной композиции, где белок-мишень связан с заранее определенной функцией клетки.
В еще другом варианте осуществления настоящее изобретение относится к способу идентификации белка-мишени, связанного с заранее определенной функцией клетки. Способ включает инкубирование клетки с пулом объектов из библиотеки по настоящему изобретению; контроль за заранее установленной функцией клеток; идентификацию пула элементов, которые изменяют заданную функцию клетки; инкубирование клетки с композицией из идентифицированного пула элементов; контроль за заранее установленной функцией клеток; идентификацию композиции, которая изменяет заданную функцию клетки; и идентификацию белка-мишени, который присоединяется к идентифицированной композиции, где белок-мишень связан с заранее определенной функцией клетки.
В еще другом варианте осуществления настоящее изобретение относится к способу убиквитинилирования/деградации белка-мишени в клетке. Способ включает введение бифункциональной композиции, содержащей связывающий фрагмент белка убиквитинового пути и мишеневый фрагмент, предпочтительно соединенные посредством линкерной группы, как иным образом описано в данном документе, где связывающий фрагмент белка убиквитинового пути присоединен к мишеневему фрагменту, и где связывающий фрагмент белка убиквитинового пути распознает белок убиквитинового пути (например, убиквитин лигазу, предпочтительно E3 убиквитин лигазу) и мишеневый фрагмент распознает белок-мишень, так что деградация белка-мишени будет проходить, когда белок-мишень располагается в непосредственной близости от убиквитин лигазы, что приводит к деградации/ингибированию действия белка-мишени и контролю уровней белка. Контроль уровней белка, достигаемый настоящим изобретением, обеспечивает лечение заболевания или состояния, которые модулированы посредством белка-мишени, путем понижения уровня этого белка в клетках организма пациента.
В другом варианте осуществления настоящее изобретение относится к способу лечения пациента, при необходимости этого, страдающего заболеванием или состоянием, модулированным посредством белка, где деградация указанного белка будет приводить к терапевтическому действию на данного пациента, способ включает введение пациенту, при необходимости этого, эффективного количества соединения в соответствии с настоящим изобретением, необязательно в комбинации с другим биологически активным агентом. Заболевание или состояние может представлять собой заболевание, вызванное микробиологическим агентом или другим экзогенным агентом, таким как вирус, бактерии, грибки, простейшие или другие микробы, или может быть заболеванием, которое вызвано избыточной экспрессией белка, что приводит к заболеванию и/или состоянию.
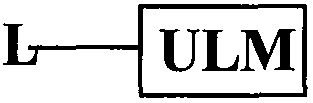
В одном варианте осуществления настоящее изобретение относится к соединению, представленному химической структурой:
 ,
,
где L представляет собой линкерную группу, и
 представляет собой связывающий фрагмент убиквитин лигазы, где указанная линкерная группа, кроме того, необязательно связана с группой
представляет собой связывающий фрагмент убиквитин лигазы, где указанная линкерная группа, кроме того, необязательно связана с группой  .
.
В другом варианте осуществления настоящее изобретение относится к соединению, которое содержит группу  , соответствующую общей структуре:
, соответствующую общей структуре:
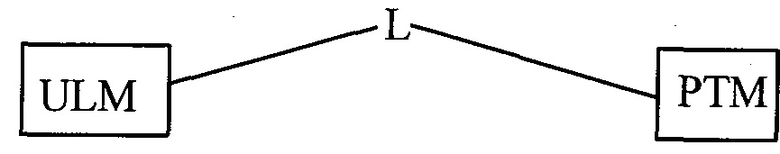 ,
,
где  представляет собой связывающий фрагмент убиквитин лигазы; предпочтительно лиганд, который связывает убиквитин лигазу, предпочтительно E3 убиквитин лигазу;
представляет собой связывающий фрагмент убиквитин лигазы; предпочтительно лиганд, который связывает убиквитин лигазу, предпочтительно E3 убиквитин лигазу;
 представляет собой химический фрагмент (фрагмент белка-мишени), который присоединяется к белку-мишени или полипептиду, который разрушается убиквитин лигазой, и химически связан с группой
представляет собой химический фрагмент (фрагмент белка-мишени), который присоединяется к белку-мишени или полипептиду, который разрушается убиквитин лигазой, и химически связан с группой  непосредственно или посредством линкера L, или
непосредственно или посредством линкера L, или  альтернативно представляет собой группу
альтернативно представляет собой группу  , которая также является связывающим фрагментом убиквитин лигазы, которая может быть такой же или отличающейся от группы
, которая также является связывающим фрагментом убиквитин лигазы, которая может быть такой же или отличающейся от группы  и присоединена к группе
и присоединена к группе  непосредственно или посредством линкерной группы; и
непосредственно или посредством линкерной группы; и
L представляет собой линкерный фрагмент, который может либо присутствовать, либо отсутствовать, и химически (ковалентно) связывает  и
и  ,
,
или его фармацевтически приемлемой соли, энантиомеру, стереоизомеру, сольвату или полиморфу.
В соответствии с некоторыми аспектами настоящего изобретения, когда группа  представляет собой группу
представляет собой группу  , соединение напоминает димерное соединение, где оба конца соединения содержат связывающий фрагмент убиквитин лигазы, как иным образом описано в данном документе.
, соединение напоминает димерное соединение, где оба конца соединения содержат связывающий фрагмент убиквитин лигазы, как иным образом описано в данном документе.
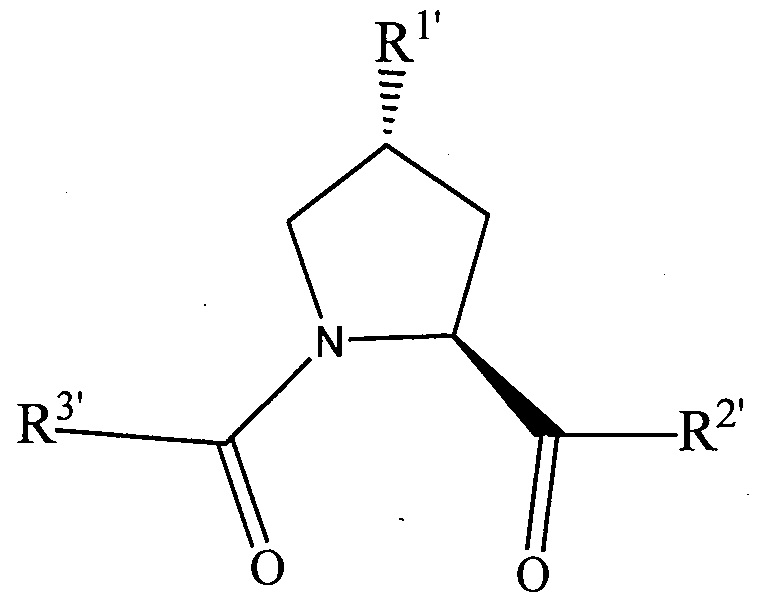
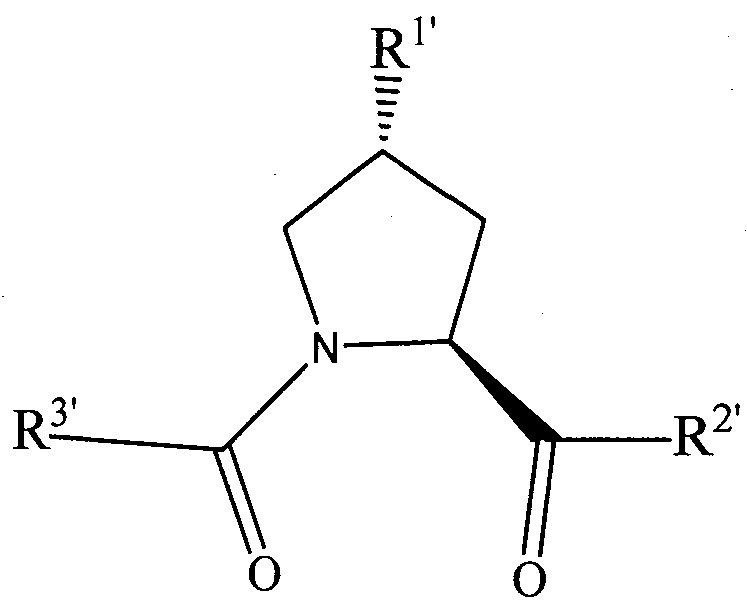
Согласно предпочтительным аспектам изобретения  и, когда присутствует,
и, когда присутствует,  , каждый, независимо представляют собой группу, соответствующую химической структуре:
, каждый, независимо представляют собой группу, соответствующую химической структуре:
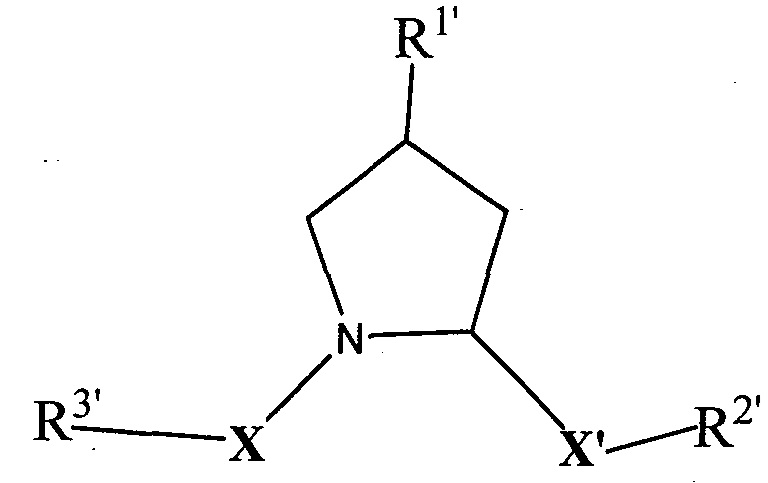 ,
,
где R1′ представляет собой необязательно замещенную C1-C6 алкильную группу, необязательно замещенный -(CH2)nOH, необязательно замещенный -(CH2)nSH, необязательно замещенную (CH2)n-O-(C1-C6)алкильную группу, необязательно замещенную (CH2)n-WCOCW-(C0-C6)алкильную группу, содержащую эпоксидную группу WCOCW, где каждый W независимо обозначает H или C1-C3 алкильную группу, необязательно замещенный -(CH2)nCOOH, необязательно замещенный -(CH2)nC(O)-(C1-C6 алкил), необязательно замещенный -(CH2)nNHC(O)-Rl, необязательно замещенный -(CH2)nC(O)-NR1R2, необязательно замещенный -(CH2)nOC(O)-NR1R2, -(CH2O)nH, необязательно замещенный -(CH2)nOC(O)-(C1-C6 алкил), необязательно замещенный -(CH2)nC(O)-O-(C1-C6 алкил), необязательно замещенный -(CH2O)nCOOH, необязательно замещенный -(OCH2)nO-(C1-C6 алкил), необязательно замещенный -(CH2O)nС(O)-(C1-C6 алкил), необязательно замещенный -(OCH2)nNHC(O)-R1, необязательно замещенный -(CH2O)nC(O)-NR1R2, -(CH2CH2O)nH, необязательно замещенный -(CH2CH2O)nCOOH, необязательно замещенный -(OCH2CH2)nO-(C1-C6 алкил), необязательно замещенный -(CH2CH2O)nC(O)-(C1-C6 алкил), необязательно замещенный -(OCH2CH2)nNHC(O)-Rl, необязательно замещенный -(CH2CH2O)nC(O)-NR1R2, необязательно замещенный -SO2RS, необязательно замещенный S(O)RS, NO2, CN или галоген (F, Cl, Br, I, предпочтительно F или Cl);
R1 и R2, каждый, независимо представляют собой H или C1-C6 алкильную группу, которая необязательно может быть замещена одной или двумя гидроксильными группами или до трех группами галогена (предпочтительно фтора);
RS представляет собой C1-C6 алкильную группу, необязательно замещенную арильную, гетероарильную или гетероциклическую группу или группу -(CH2)mNR1R2,
X и X′, каждый, независимо представляют собой C=O, C=S, -S(O), S(O)2, (предпочтительно X и X′ оба представляют собой C=O);
R2′ представляет собой необязательно замещенную -(CH2)n-(C=O)u(NR1)v(SO2)wалкильную группу, необязательно замещенную группу -(CH2)n-(C=O)u(NR1)v(SO2)wNR1NR2N, необязательно замещенный -(CH2)n-(C=O)u(NR1)v(SO2)w-арил, необязательно замещенный -(CH2)n-(C=O)u(NR1)v(SO2)w-гетероарил, необязательно замещенный -(CH2)n-(C=O)vNR1(SO2)w-гетероцикл, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-алкил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -NR1-(CH2)n-(C=O)u(NR1)v(SO2)w-арил, необязательно замещенный -NR1-(CH2)n-(C=O)u(NR1)v(SO2)w-гетероарил или необязательно замещенный -NR1-(CH2)n-(C=O)vNR1(SO2)w-гетероцикл, необязательно замещенную -XR2′-алкильную группу; необязательно замещенную -XR2′-арильную группу; необязательно замещенную -XR2′-гетероарильную группу; необязательно замещенную -XR2′-гетероциклильную группу; необязательно замещенную;
R3′ представляет собой необязательно замещенный алкил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-алкил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-C(O)NR1R2, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-арил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-гетероарил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-гетероцикл, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-алкил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-арил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-гетероарил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-гетероцикл, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-алкил, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-арил, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-гетероарил или необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-гетероцикл; -(CH2)n-(V)n′-(CH2)n-(V)n′-алкильную группу, необязательно замещенную -(CH2)n-(V)n′-(CH2)n-(V)n′-арильную группу, необязательно замещенную -(CH2)n-(V)n′-(CH2)n-(V)n′-гетероарильную группу, необязательно замещенную -(CH2)n-(V)n′-(CH2)n-(V)n′-гетероциклильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-алкильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-арильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-гетероарильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-гетероциклильную группу, необязательно замещенную -XR3′-алкильную группу; необязательно замещенную -XR3′-арильную группу; необязательно замещенную -XR3′-гетероарильную группу; необязательно замещенную -XR3′-гетероциклильную группу; необязательно замещенную;
где R1N и R2N, каждый, независимо представляют собой H, C1-C6 алкил, который необязательно замещен одной или двумя гидроксильными группами и до трех группами галогена, или необязательно замещенную -(CH2)n-арильную, -(CH2)n-гетероарильную или -(CH2)n-гетероциклильную группу;
V представляет собой O, S или NR1;
R1 имеет значения, указанные выше;
R1 и R1′, каждый, независимо представляют собой H или C1-C6 алкильную группу;
XR2′ и XR3′, каждый, независимо представляют собой необязательно замещенный -(CH2)n-, -(CH2)n-CH(XV)=CH(XV)- (цис или транс), -(CH2)n-CH≡CH-, -(CH2CH2O)n- или C3-C6 циклоалкильную группу, где Xv представляет собой H, галоген или C1-C3 алкильную группу, которая является необязательно замещенной;
каждый m обозначает независимо 0, 1, 2, 3, 4, 5, 6;
каждый m′ обозначает независимо 0 или 1;
каждый n независимо обозначает 0, 1, 2, 3, 4, 5, 6;
каждый n′ обозначает независимо 0 или 1;
каждый u обозначает независимо 0 или 1;
каждый v обозначает независимо 0 или 1;
каждый w обозначает независимо 0 или 1; и
где любой один или несколько из R1′, R2′, R3′, X и X′ в  модифицированы с целью ковалентного присоединения к группе
модифицированы с целью ковалентного присоединения к группе  посредством линкерной группы, когда
посредством линкерной группы, когда  не представляет собой
не представляет собой  , или когда
, или когда  представляет собой
представляет собой  , один или несколько из R1′, R2′, R3′, X и X′ из каждого
, один или несколько из R1′, R2′, R3′, X и X′ из каждого  и
и  модифицированы для ковалентного присоединения друг к другу напрямую или посредством линкерной группы,
модифицированы для ковалентного присоединения друг к другу напрямую или посредством линкерной группы,
или его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В альтернативных вариантах осуществления настоящего изобретения  и, когда присутствует,
и, когда присутствует,  , каждый, независимо представляют собой группу, соответствующую химической структуре:
, каждый, независимо представляют собой группу, соответствующую химической структуре:
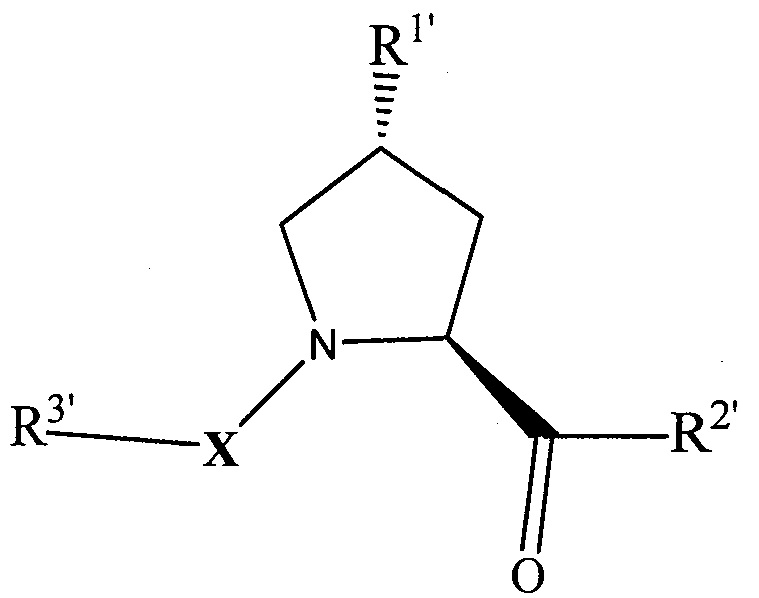 ,
,
где каждый из R1′, R2′, R3′ являются таким, как описано выше, и X представляет собой группу C=O, C=S, -S(O) или группу S(O)2, более предпочтительно группу C=O, и
где любой один или несколько из R1′, R2′, R3′ модифицированы для присоединения к линкерной группе, которая, кроме того, ковалентно связана с группой  , когда группа
, когда группа  не представляет собой группу
не представляет собой группу  , или, когда
, или, когда  представляет собой группу
представляет собой группу  , любой один или несколько из R1′, R2′, R3′ в каждом из
, любой один или несколько из R1′, R2′, R3′ в каждом из  и
и  модифицированы для ковалентного присоединения друг к другу либо непосредственно, либо посредством линкерной группы, или его фармацевтически приемлемая соль, энантиомер, диастереомер, сольват или полиморф.
модифицированы для ковалентного присоединения друг к другу либо непосредственно, либо посредством линкерной группы, или его фармацевтически приемлемая соль, энантиомер, диастереомер, сольват или полиморф.
В соответствии с еще дополнительными предпочтительными аспектами настоящего изобретения  и, когда присутствует,
и, когда присутствует,  , каждый, независимо соответствуют химической структуре:
, каждый, независимо соответствуют химической структуре:
 ,
,
где любой один или несколько из R1′, R2′, R3′ модифицированы с целью присоединения к линкерной группе, которая, кроме того, ковалентно связана с группой  , когда группа
, когда группа  не представляет собой группу
не представляет собой группу  , или, когда
, или, когда  представляет собой группу
представляет собой группу  , любой один или несколько из R1′, R2′, R3′ в каждом из
, любой один или несколько из R1′, R2′, R3′ в каждом из  и
и  модифицированы для ковалентного присоединения друг к другу либо непосредственно, либо посредством линкерной группы, или его фармацевтически приемлемая соль, энантиомер, диастереомер, сольват или полиморф.
модифицированы для ковалентного присоединения друг к другу либо непосредственно, либо посредством линкерной группы, или его фармацевтически приемлемая соль, энантиомер, диастереомер, сольват или полиморф.
Согласно другим предпочтительным аспектам настоящего изобретения R1′ представляет собой предпочтительно гидроксильную группу или группу, которая может быть метаболизирована до гидроксильной или карбоксильной группы, так что соединение представляет собой пролекарственную форму активного соединения. Примеры предпочтительных групп R1′ включают, например, -(CH2)nOH, (CH2)n-O-(C1-C6)алкильную группу, -(CH2)nCOOH, -(CH2O)nH, необязательно замещенный -(CH2)nOC(O)-(C1-C6 алкил) или необязательно замещенный -(CH2)nC(O)-O(C1-C6 алкил), где n обозначает 0 или 1. Когда R1′ представляет собой или содержит группу карбоновой кислоты, гидроксильную группу или аминогруппу, тогда гидроксильная группа, группа карбоновой кислоты или аминогруппа (каждая из которых может быть необязательно замещена) могут быть далее химически модифицированы с обеспечением ковалентного связывания с линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
X и X′, когда присутствуют, предпочтительно представляют собой группу C=O, C=S, -S(O) или группу S(O)2, более предпочтительно группу C=O.
R2′ предпочтительно представляет собой необязательно замещенный -NR1-T-арил, необязательно замещенную -NR1-T-гетероарильную группу или необязательно замещенный -NR1-T-гетероцикл, где R1 представляет собой H или CH3, предпочтительно H, и T представляет собой необязательно замещенную -(CH2)n-группу, где каждая одна из метиленовых групп может быть необязательно замещена одним или двумя заместителями, предпочтительно выбранными из галогена, боковой цепи аминокислоты, как иным образом описано в данном документе, или C1-C3 алкильной группы, предпочтительно одной или двумя метильными группами, которые могут быть необязательно замещены; и n обозначает от 0 до 6, часто 0, 1, 2 или 3, предпочтительно 0 или 1. Альтернативно, T также может представлять собой -(CH2O)n-группу, -(OCH2)n-группу, -(CH2CH2O)n-группу, -(OCH2CH2)n-группу, все из указанных групп необязательно замещены.
Предпочтительные арильные группы для R2′ включают необязательно замещенные фенильные или нафтильные группы, предпочтительно фенильные группы, где фенильная группа необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ), галоген (предпочтительно F или Cl), амин, моноалкил- или диалкиламин (предпочтительно диметиламин), F, Cl, OH, COOH, C1-C6 алкил, предпочтительно CH3, CF3, OMe, OCF3, NO2 или CN группа (каждая из которых может быть замещена в орто-, мета- и/или пара-положении фенильного кольца, предпочтительно пара-), или необязательно замещенная фенильная группа (фенильная группа, в свою очередь, предпочтительно замещена линкерной группой, присоединенной к группе
), галоген (предпочтительно F или Cl), амин, моноалкил- или диалкиламин (предпочтительно диметиламин), F, Cl, OH, COOH, C1-C6 алкил, предпочтительно CH3, CF3, OMe, OCF3, NO2 или CN группа (каждая из которых может быть замещена в орто-, мета- и/или пара-положении фенильного кольца, предпочтительно пара-), или необязательно замещенная фенильная группа (фенильная группа, в свою очередь, предпочтительно замещена линкерной группой, присоединенной к группе  , включая группу
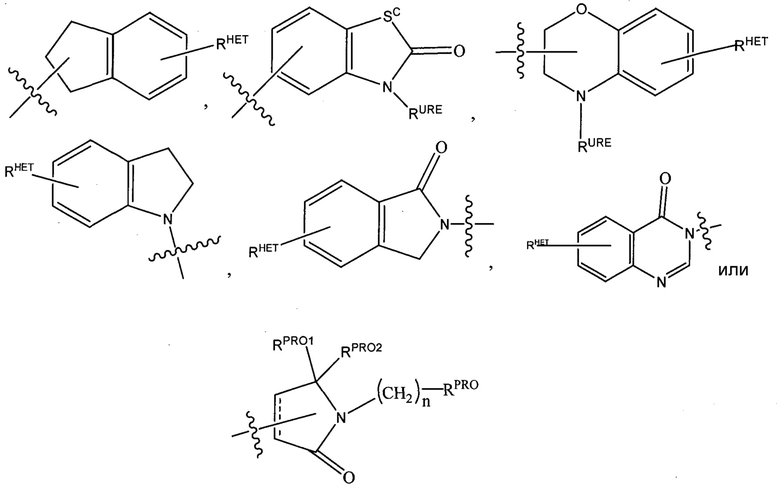
, включая группу  ) и/или, по меньшей мере, одной из групп F, Cl, OH, COOH, CH3, CF3, OMe, OCF3, NO2 или CN (в орто-, мета- и/или пара-положениях фенильного кольца, предпочтительно пара-), нафтильной группой, которая необязательно может быть замещена, необязательно замещенным гетероарилом, предпочтительно необязательно замещенным изоксазолом, включая метилимидазол, необязательно замещенным оксазолом, включая метилзамещенный оксазол, необязательно замещенным тиазолом, включая метилзамещенный тиазол, необязательно замещенным изотиазолом, включая метилзамещенный изотиазол, необязательно замещенным пирролом, включая метилзамещенный пиррол, необязательно замещенным имидазолом, включая метилзамещенный изотиазол, необязательно замещенным бензимидазолом или метоксибензилимидазолом, необязательно замещенным оксимидазолом или метилоксимидазолом, необязательно замещенной диазольной группой, включая метилдиазольную группу, необязательно замещенной триазольной группой, включая метилзамещенную триазольную группу, необязательно замещенной пиридиновой группой, включая галоген- (предпочтительно F), или метилзамещенной пиридиновой группой или оксапиридиновой группой (где пиридиновая группа присоединена к фенильной группе посредством атома кислорода), необязательно замещенным фураном, необязательно замещенным бензофураном, необязательно замещенным дигидробензофураном, необязательно замещенным индолом, индолизином или азаиндолизином (2-, 3- или 4-азаиндолизин), необязательно замещенным хинолином, необязательно замещенной группой, соответствующей химической структуре:
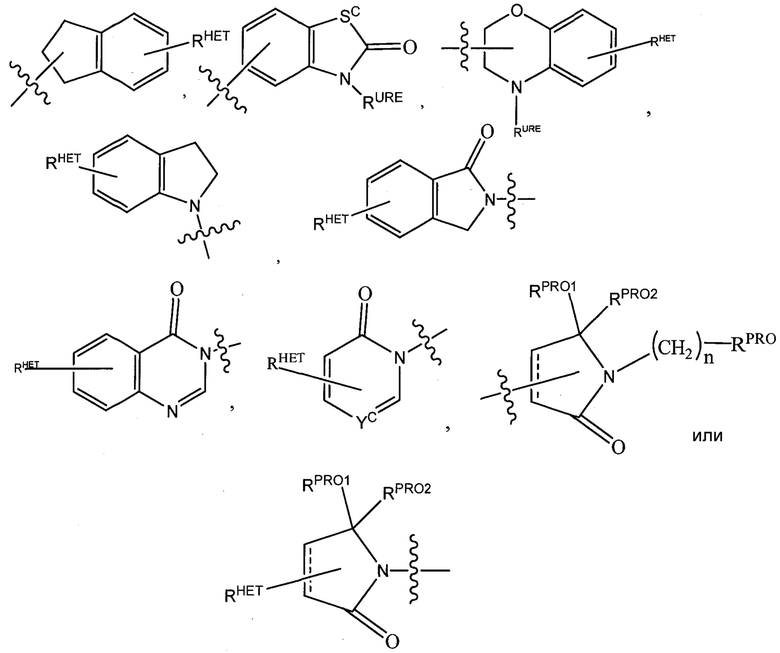
) и/или, по меньшей мере, одной из групп F, Cl, OH, COOH, CH3, CF3, OMe, OCF3, NO2 или CN (в орто-, мета- и/или пара-положениях фенильного кольца, предпочтительно пара-), нафтильной группой, которая необязательно может быть замещена, необязательно замещенным гетероарилом, предпочтительно необязательно замещенным изоксазолом, включая метилимидазол, необязательно замещенным оксазолом, включая метилзамещенный оксазол, необязательно замещенным тиазолом, включая метилзамещенный тиазол, необязательно замещенным изотиазолом, включая метилзамещенный изотиазол, необязательно замещенным пирролом, включая метилзамещенный пиррол, необязательно замещенным имидазолом, включая метилзамещенный изотиазол, необязательно замещенным бензимидазолом или метоксибензилимидазолом, необязательно замещенным оксимидазолом или метилоксимидазолом, необязательно замещенной диазольной группой, включая метилдиазольную группу, необязательно замещенной триазольной группой, включая метилзамещенную триазольную группу, необязательно замещенной пиридиновой группой, включая галоген- (предпочтительно F), или метилзамещенной пиридиновой группой или оксапиридиновой группой (где пиридиновая группа присоединена к фенильной группе посредством атома кислорода), необязательно замещенным фураном, необязательно замещенным бензофураном, необязательно замещенным дигидробензофураном, необязательно замещенным индолом, индолизином или азаиндолизином (2-, 3- или 4-азаиндолизин), необязательно замещенным хинолином, необязательно замещенной группой, соответствующей химической структуре:
 ,
,
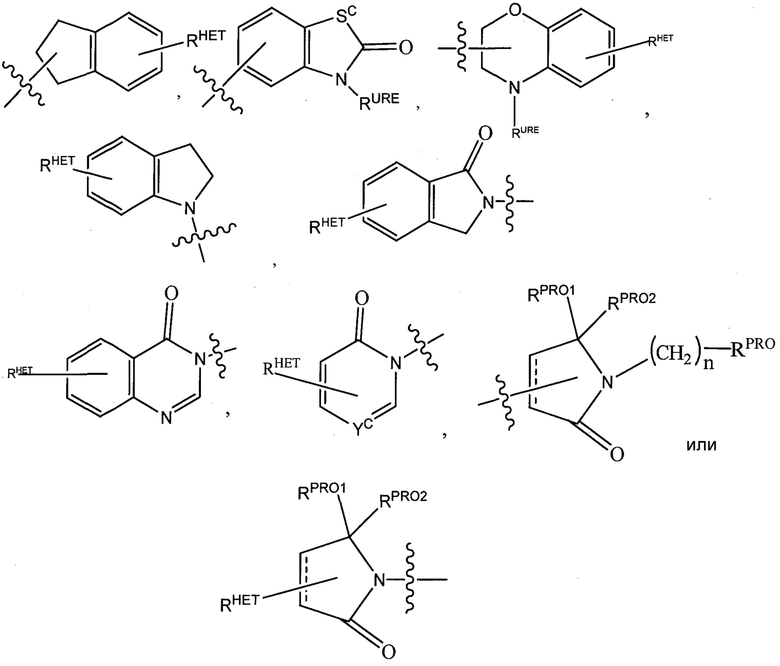
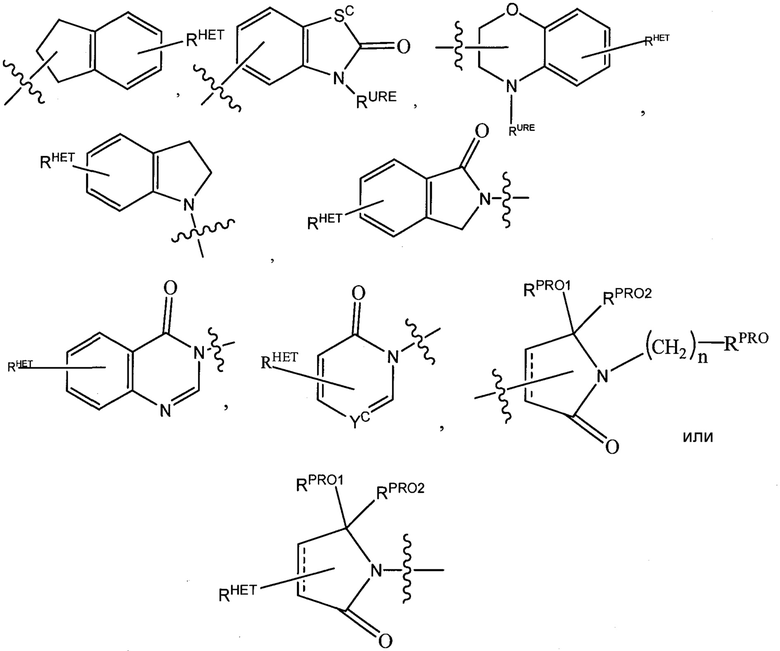
где Sc представляет собой CHRSS, NRURE или O;
RHET представляет собой H, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RSS представляет собой H, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенный -C(O)(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена);
RURE представляет собой H, C1-C6 алкил (предпочтительно H или C1-C3 алкил) или -C(O)(C1-C6 алкил), где каждая из указанных групп необязательно замещена одной или двумя гидроксильными группами или до трех атомами галогена, предпочтительно группами фтора, или необязательно замещенной фенильной группой, необязательно замещенным гетероарилом или необязательно замещенным гетероциклом, предпочтительно, например, пиперидином, морфолином, пирролидином, тетрагидрофураном;
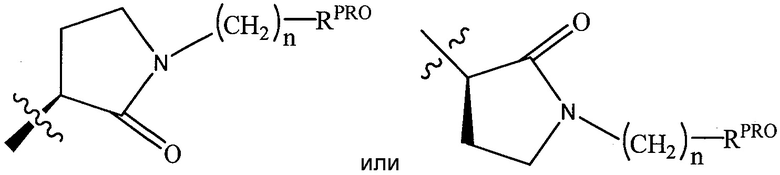
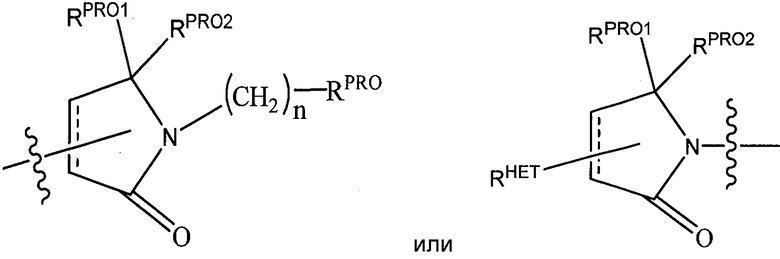
RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную (фенильную или нафтильную), гетероарильную или гетероциклильную группу, выбранные из группы, включающей оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин (каждый, предпочтительно замещенный C1-C3 алкильной группой, предпочтительно метильной или группой галогена, предпочтительно F или Cl), бензофуран, индол, индолизин, азаиндолизин;
RPRO1 и RPRO2, каждый, независимо представляют собой H, необязательно замещенную C1-C3 алкильную группу или вместе образуют кетогруппу; и
каждый n независимо обозначает 0, 1, 2, 3, 4, 5 или 6 (предпочтительно 0 или 1), или
необязательно замещенный гетероцикл, предпочтительно тетрагидрофуран, тетрагидротиен, пиперидин, пиперазин или морфолин (где каждая из указанных групп, когда замещена, предпочтительно замещена метилом или галогеном (F, Br, Cl),
где каждая из указанных групп может быть необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
Согласно некоторым предпочтительным аспектам 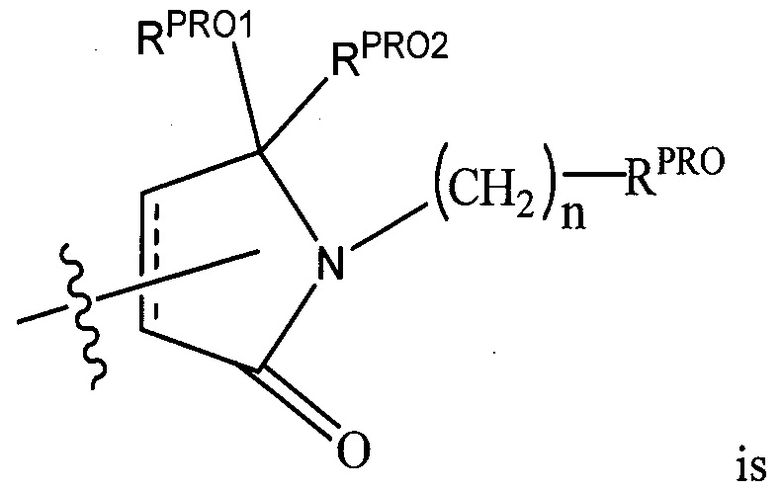 представляет собой группу
представляет собой группу
 ,
,
где RPRO и n являются такими, как указано выше.
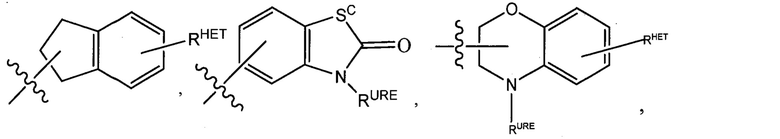
Предпочтительные гетероарильные группы для R2′ включают необязательно замещенный хинолин (который может быть присоединен к фармакофору или замещен на любом атоме углерода хинолинового кольца), необязательно замещенный индол, необязательно замещенный индолизин, необязательно замещенный азаиндолизин, необязательно замещенный бензофуран, включая необязательно замещенный бензофуран, необязательно замещенный изоксазол, необязательно замещенный тиазол, необязательно замещенный изотиазол, необязательно замещенный тиофен, необязательно замещенный пиридин (2-, 3- или 4-пиридин), необязательно замещенный имидазол, необязательно замещенный пиррол, необязательно замещенный диазол, необязательно замещенный триазол, тетразол, необязательно замещенный оксимидазол или группу, соответствующую химической структуре:
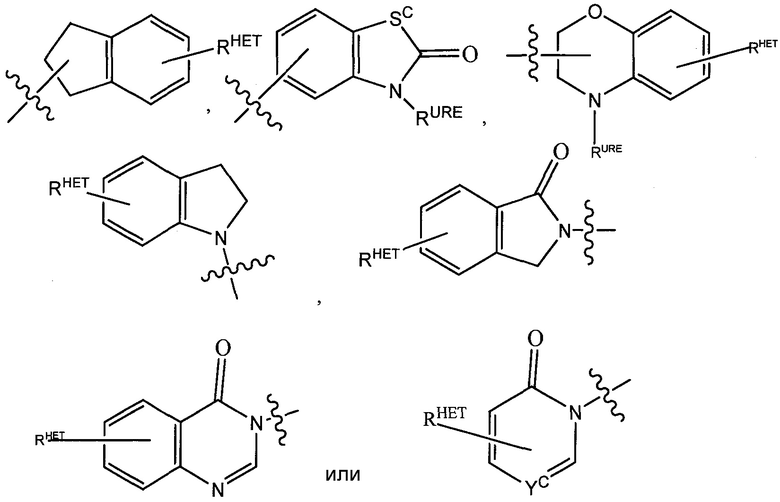 ,
,
где Sc представляет собой CHRSS, NRURE или O;
RHET представляет собой H, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RSS представляет собой H, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена), необязательно замещенный O-(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенный -C(O)(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена);
RURE представляет собой H, C1-C6 алкил (предпочтительно H или C1-C3 алкил) или -C(O)(C1-C6 алкил), где каждая из указанных групп необязательно замещена одной или двумя гидроксильными группами или до трех атомами галогена, предпочтительно группами фтора, или необязательно замещенный гетероцикл, например, пиперидин, морфолин, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, каждый из которых необязательно замещен, и
YC представляет собой N или C-RYC, где RYC представляет собой H, OH, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил),
где каждая из может быть необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
Предпочтительные гетероциклильные группы для R2′ включают тетрагидрофуран, тетрагидротиен, тетрагидрохинолин, пиперидин, пиперазин, пирролидин, морфолин, оксан или тиан, где каждая из указанных групп может быть необязательно замещена, или группу, соответствующую химической структуре:
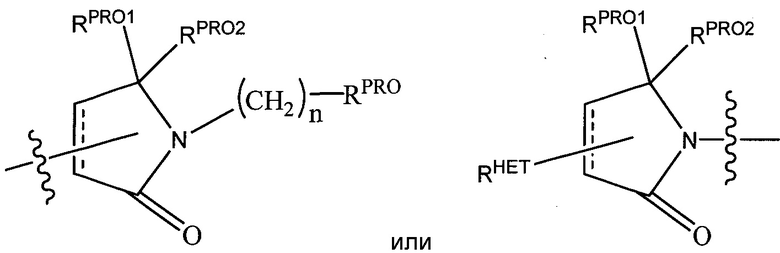 .
.
Предпочтительно, группу 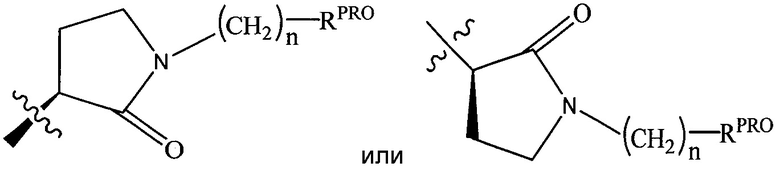 ,
,
где RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную, замещенную гетероарильную или гетероциклильную группу;
RPRO1 и RPRO2, каждый, независимо представляют собой H, необязательно замещенную C1-C3 алкильную группу или вместе образуют кетогруппу, и
каждый n независимо обозначает 0, 1, 2, 3, 4, 5 или 6 (часто 0 или 1), где каждая из указанных групп может быть необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
Предпочтительные заместители R2′ для использования по настоящему изобретению также включают, в частности (и без ограничения конкретным описанным соединением), заместители R2′, которые можно найти при описании соединений в данном документе (которое включает конкретные соединения, раскрытые в настоящем описании, и фигуры, которые прилагаются). Каждый из этих заместителей R2′ может быть использован в сочетании с любым числом заместителей R3′, которые также раскрыты в данном документе.
R3′ представляет собой, предпочтительно, необязательно замещенный -T-арил, необязательно замещенный -T-гетероарил, необязательно замещенный -T-гетероцикл, необязательно замещенный -NR1-T-арил, необязательно замещенный -NR1-T-гетероарил или необязательно замещенный -NR1-T-гетероцикл, где R1 представляет собой H или C1-C3 алкильную группу, предпочтительно H или CH3, T представляет собой необязательно замещенную -(CH2)n-группу, где каждая одна из метиленовых групп может быть необязательно замещена одним или двумя заместителями, предпочтительно выбранными из галогена, C1-C3 алкильной группы или боковой цепи аминокислоты, как иным образом описано в данном документе, предпочтительно метилом, который может быть необязательно замещен; и n обозначает от 0 до 6, часто 0, 1, 2 или 3, предпочтительно 0 или 1. Альтернативно, T также может представлять собой -(CH2O)n-группу, -(OCH2)n-группу, -(CH2CH2O)n-группу, -(OCH2CH2)n-группу, где каждая из указанных групп является необязательно замещенной.
Предпочтительные арильные группы для R3′ включают необязательно замещенные фенильные или нафтильные группы, предпочтительно фенильные группы, где фенильная или нафтильная группа необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ) и/или галоген (предпочтительно F или Cl), амин, моноалкил- или диалкиламин (предпочтительно диметиламин), амидогруппа (предпочтительно группа -(CH2)m-NR1C(O)R2, где m, R1 и R2 такие, как указано выше), галоген (часто F или Cl), OH, CH3, CF3, OMe, OCF3, NO2, CN или группа S(O)2RS (RS представляет собой C1-C6 алкильную группу, необязательно замещенную арильную, гетероарильную или гетероциклильную группу или группу -(CH2)mNR1R2), каждая из которых может быть замещена в орто-, мета- и/или пара-положениях фенильного кольца, предпочтительно пара-), или арил (предпочтительно фенил), гетероарил или гетероцикл. Предпочтительно, указанный заместитель фенильная группа представляет собой необязательно замещенную фенильную группу (то есть, заместитель фенильная группа, в свою очередь, предпочтительно замещен, по меньшей мере, одним из F, Cl, OH, SH, COOH, CH3, CF3, OMe, OCF3, NO2, CN или линкерной группой, к которой присоединена группа
) и/или галоген (предпочтительно F или Cl), амин, моноалкил- или диалкиламин (предпочтительно диметиламин), амидогруппа (предпочтительно группа -(CH2)m-NR1C(O)R2, где m, R1 и R2 такие, как указано выше), галоген (часто F или Cl), OH, CH3, CF3, OMe, OCF3, NO2, CN или группа S(O)2RS (RS представляет собой C1-C6 алкильную группу, необязательно замещенную арильную, гетероарильную или гетероциклильную группу или группу -(CH2)mNR1R2), каждая из которых может быть замещена в орто-, мета- и/или пара-положениях фенильного кольца, предпочтительно пара-), или арил (предпочтительно фенил), гетероарил или гетероцикл. Предпочтительно, указанный заместитель фенильная группа представляет собой необязательно замещенную фенильную группу (то есть, заместитель фенильная группа, в свою очередь, предпочтительно замещен, по меньшей мере, одним из F, Cl, OH, SH, COOH, CH3, CF3, OMe, OCF3, NO2, CN или линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ), где замещение происходит в орто-, мета- и/или пара-положениях фенильного кольца, предпочтительно пара-), нафтильную группу, которая может быть необязательно замещена, включая описанное выше, необязательно замещенный гетероарил (предпочтительно необязательно замещенный изоксазол, включая метилзамещенный изоксазол, необязательно замещенный оксазол, включая метилзамещенный оксазол, необязательно замещенный тиазол, включая метилзамещенный тиазол, необязательно замещенный пиррол, включая метилзамещенный пиррол, необязательно замещенный имидазол, включая метилимидазол, бензилимидазол или метоксибензилимидазол, оксимидазол или метилоксимидазол, необязательно замещенная диазольная группа, включая метилдиазольную группу, необязательно замещенная триазольная группау, включая метилзамещенную триазольную группу, пиридиновая группа, включая галоген- (предпочтительно F) или метилзамещенную пиридиновую группу, или оксапиридиновая группа (где пиридиновая группа присоединена к фенильной группе через кислород), или необязательно замещенный гетероцикл (тетрагидрофуран, тетрагидротиофен, пирролидин, пиперидин, морфолин, пиперазин, тетрагидрохинолин, оксан или тиан). Каждая из арильной, гетероарильной или гетероциклильной группы может быть необязательно замещена линкерной группой, к которой присоединена группа
), где замещение происходит в орто-, мета- и/или пара-положениях фенильного кольца, предпочтительно пара-), нафтильную группу, которая может быть необязательно замещена, включая описанное выше, необязательно замещенный гетероарил (предпочтительно необязательно замещенный изоксазол, включая метилзамещенный изоксазол, необязательно замещенный оксазол, включая метилзамещенный оксазол, необязательно замещенный тиазол, включая метилзамещенный тиазол, необязательно замещенный пиррол, включая метилзамещенный пиррол, необязательно замещенный имидазол, включая метилимидазол, бензилимидазол или метоксибензилимидазол, оксимидазол или метилоксимидазол, необязательно замещенная диазольная группа, включая метилдиазольную группу, необязательно замещенная триазольная группау, включая метилзамещенную триазольную группу, пиридиновая группа, включая галоген- (предпочтительно F) или метилзамещенную пиридиновую группу, или оксапиридиновая группа (где пиридиновая группа присоединена к фенильной группе через кислород), или необязательно замещенный гетероцикл (тетрагидрофуран, тетрагидротиофен, пирролидин, пиперидин, морфолин, пиперазин, тетрагидрохинолин, оксан или тиан). Каждая из арильной, гетероарильной или гетероциклильной группы может быть необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
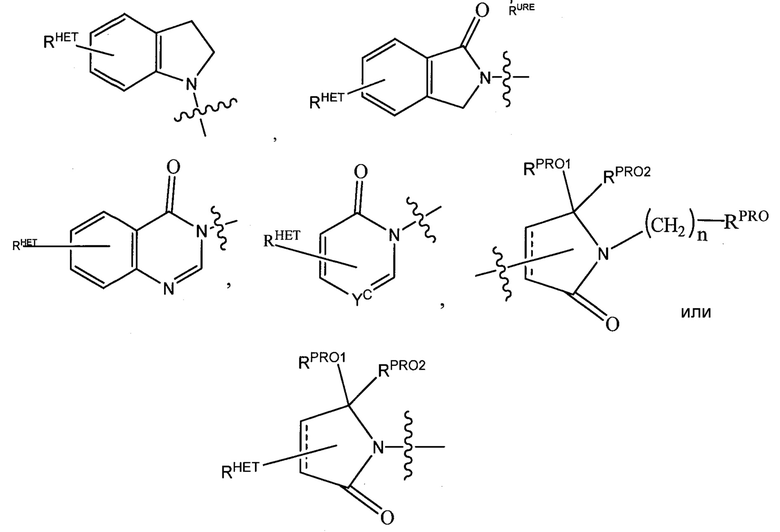
Предпочтительные гетероарильные группы для R3′ включают необязательно замещенный хинолин (который может быть присоединен к фармакофору или замещен на любом атоме углерода хинолинового кольца), необязательно замещенный индол (включая дигидроиндол), необязательно замещенный индолизин, необязательно замещенный азаиндолизин (2-, 3- или 4-азаиндолизин), необязательно замещенный бензимидазол, бензодиазол, бензоксофуран, необязательно замещенный имидазол, необязательно замещенный изоксазол, необязательно замещенный оксазол (предпочтительнометилзамещенный), необязательно замещенный диазол, необязательно замещенный триазол, тетразол, необязательно замещенный бензофуран, необязательно замещенный тиофен, необязательно замещенный тиазол (предпочтительно метил и/или тиолзамещенный), необязательно замещенный изотиазол, необязательно замещенный триазол (предпочтительно 1,2,3-триазол, замещенный метильной группой, триизопропилсилильной группой, необязательно замещенной -(CH2)m-O-C1-C6 алкильной группой или необязательно замещенной -(CH2)m-C(O)-O-C1-C6 алкильной группой), необязательно замещенный пиридин (2-, 3- или 4-пиридин) или группу, соответствующую химической структуре:
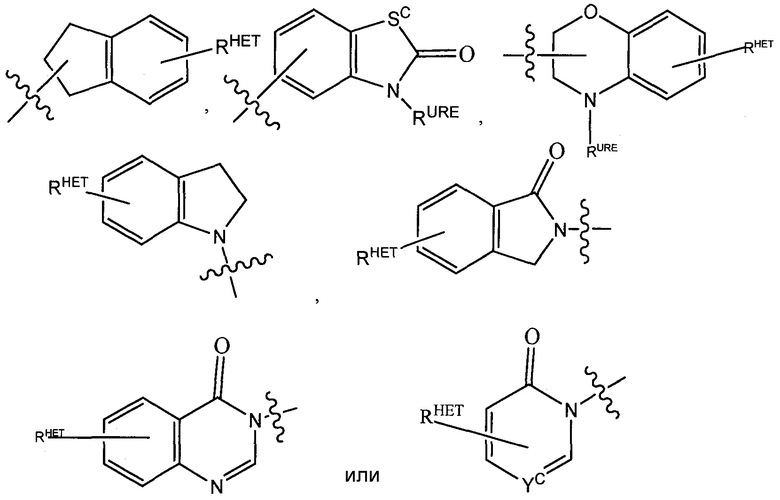 ,
,
где Sc представляет собой CHRSS, NRURE или O;
RHET представляет собой H, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RSS представляет собой H, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена), необязательно замещенный O-(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенный -C(O)(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена);
RURE представляет собой H, C1-C6 алкил (предпочтительно H или C1-C3 алкил) или -C(O)(C1-C6 алкил), где каждая из групп необязательно замещена одной или двумя гидроксильными группами или до трех атомами галогена, предпочтительно группами фтора, или необязательно замещенный гетероцикл, например, пиперидин, морфолин, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, каждый из которых необязательно замещен, и
Yc представляет собой N или C-RYC, где RYC представляет собой H, OH, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил). Каждая из указанных гетероарильных групп может быть необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
Предпочтительные гетероциклические группы для R3′ включают тетрагидрохинолин, пиперидин, пиперазин, пирролидин, морфолин, тетрагидрофуран, тетрагидротиофен, оксан и тиан, где каждая из групп может быть необязательно замещена, или группу, соответствующую химической структуре:
 .
.
Предпочтительно, группу 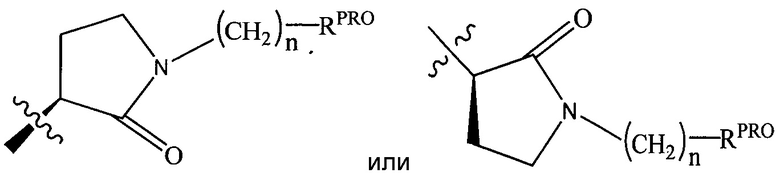 , где RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную (фенильную или нафтильную), гетероарильную или гетероциклильную группу, выбранную из группы, включающей оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин, (каждый предпочтительно замещен C1-C3 алкильной группой, предпочтительно метильной, или группой галогена, предпочтительно F или Cl), бензофуран, индол, индолизин, азаиндолизин;
, где RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную (фенильную или нафтильную), гетероарильную или гетероциклильную группу, выбранную из группы, включающей оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин, (каждый предпочтительно замещен C1-C3 алкильной группой, предпочтительно метильной, или группой галогена, предпочтительно F или Cl), бензофуран, индол, индолизин, азаиндолизин;
RPRO1 и RPRO2, каждый, независимо представляют собой H, необязательно замещенную C1-C3 алкильную группу или вместе образуют кетогруппу, и
каждый n обозначает 0, 1, 2, 3, 4, 5 или 6 (предпочтительно 0 или 1), где каждая из указанных гетероциклильных групп может быть необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
Предпочтительные заместители R3′ для использования по настоящему изобретению также включают, в частности (и без ограничения конкретным описанным соединением), заместители R3′, которые можно найти при описании соединений в данном документе (которое включает конкретные соединения, раскрытые в настоящем описании, и фигуры, которые прилагаются). Каждый из этих заместителей R3′ может быть использован в сочетании с любым числом заместителей R2′, которые также раскрыты в данном документе.
В некоторых альтернативных предпочтительных вариантах осуществления изобретения, R2′ представляет собой необязательно замещенную -NR1-XR2′-алкильную группу, -NR1-XR2′-арильную группу; необязательно замещенную группу -NR1-XR2′-HET, необязательно замещенную группу -NR1-XR2′-арил-HET или необязательно замещенную группу -NR1-XR2′-HET-арил;
где R1 представляет собой H или C1-C3 алкильную группу (предпочтительно H);
XR2′ представляет собой необязательно замещенный -(CH2)n-, -(CH2)n-CH(Xv)=CH(Xv)- (цис или транс), -(CH2)n-CH≡CH-, -(CH2CH2O)n- или C3-C6 циклоалкильную группу;
где Xv представляет собой H, галоген или C1-C3 алкильную группу, которая необязательно замещена одной или двумя гидроксильными группами или до трех группами галогена;
алкил представляет собой необязательно замещенную C1-C10 алкильную (предпочтительно C1-C6 алкильную) группу (в некоторых предпочтительных вариантах осуществления изобретения алкильная группа имеет на конце группу галогена, часто Cl или Br);
арил представляет собой необязательно замещенную фенильную или нафтильную группу (предпочтительно фенильную группу); и
HET представляет собой необязательно замещенный оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, бензофуран, индол, индолизин, азаиндолизин, хинолин (когда замещены, каждый предпочтительно замещен C1-C3 алкильной группой, предпочтительно метильной или группой галогена, предпочтительно F или Cl) или группу, соответствующую химической структуре:
 ,
,
где Sc представляет собой CHRSS, NRURE или O;
RHET представляет собой H, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RSS представляет собой H, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенный -C(O)(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена);
RURE представляет собой H, C1-C6 алкил (предпочтительно H или C1-C3 алкил) или -C(O)(C1-C6 алкил), где каждая из указанных групп необязательно замещена одной или двумя гидроксильными группами или до трех атомами галогена, предпочтительно группами фтора, или необязательно замещенный гетероцикл, например, пиперидин, морфолин, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, каждый из которых необязательно замещен, и
YC представляет собой N или C-RYC, где RYC представляет собой H, OH, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную (фенильную или нафтильную), гетероарильную или гетероциклильную группу, выбранные из группы, включающей оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин, (каждый, предпочтительно замещенный C1-C3 алкильной группой, предпочтительно метильной или группой галогена, предпочтительно F или Cl), бензофуран, индол, индолизин, азаиндолизин;
RPRO1 и RPRO2, каждый, независимо представляют собой H, необязательно замещенную C1-C3 алкильную группу или вместе образуют кетогруппу; и
каждый n независимо обозначает 0, 1, 2, 3, 4, 5 или 6 (предпочтительно 0 или 1). Каждая из указанных групп может быть необязательно замещена линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
В некоторых альтернативных предпочтительных вариантах осуществления по настоящему изобретению, R3′ представляет собой необязательно замещенную группу -(CH2)n-(V)n′-(CH2)n-(V)n′-RS3′, необязательно замещенную группу -(CH2)n-N(R1′)(C=O)m′-(V)n′-RS3′, необязательно замещенную -XR3′-алкильную группу, необязательно замещенную -XR3′-арильную группу; необязательно замещенную группу -XR3′-HET, необязательно замещенную группу -XR3′-арил-HET или необязательно замещенную -XR3′-HET-арильную группу,
где RS3′ представляет собой необязательно замещенную алкильную группу (C1-C10, предпочтительно C1-C6 алкил), необязательно замещенную арильную группу или группу HET;
R1′ представляет собой H или C1-C3 алкильную группу (предпочтительно H);
V представляет собой O, S или NR1′;
XR3′ представляет собой -(CH2)n-, -(CH2CH2O)n-, -(CH2)n-CH(Xv)=CH(Xv)- (цис или транс), -(CH2)n-CH≡CH- или C3-C6 циклоалкильную группу, все необязательно замещенные;
где Xv представляет собой H, галоген или C1-C3 алкильную группу, которая необязательно замещена одной или двумя гидроксильными группами или до трех группами галогена;
алкил представляет собой необязательно замещенную C1-C10 алкильную (предпочтительно C1-C6 алкильную) группу (в некоторых предпочтительных вариантах осуществления изобретения, алкильная группа имеет на конце группу галогена, часто Cl или Br);
арил представляет собой необязательно замещенную фенильную или нафтильную группу (предпочтительно фенильную группу); и
HET представляет собой необязательно замещенный оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, бензофуран, индол, индолизин, азаиндолизин, хинолин (когда замещены, каждый предпочтительно замещен C1-C3 алкильной группой, предпочтительно метильной или группой галогена, предпочтительно F или Cl), или группу, соответствующую химической структуре:
 ,
,
где Sc представляет собой CHRSS, NRURE или O;
RHET представляет собой H, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RSS представляет собой H, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена), необязательно замещенную группу O(C1-C6 алкил) (предпочтительно замещенную одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную группу -C(O)(C1-C6 алкил) (предпочтительно замещенную одной или двумя гидроксильными группами или до трех группами галогена);
RURE представляет собой H, C1-C6 алкил (предпочтительно H или C1-C3 алкил) или -C(O)(C0-C6 алкил), где каждая из указанных групп необязательно замещена одной или двумя гидроксильными группами или до трех атомами галогена, предпочтительно группами фтора, или необязательно замещенный гетероцикл, например, пиперидин, морфолин, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, каждый из которых необязательно замещен, и
YC представляет собой N или C-RYC, где RYC представляет собой H, OH, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную (фенильную или нафтильную), гетероарильную или гетероциклильную группу, выбранные из группы, включающей оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин, (каждый предпочтительно замещен C1-C3 алкильной группой, предпочтительно метилом или группой галогена, предпочтительно F или Cl), бензофуран, индол, индолизин, азаиндолизин;
RPRO1 и RPRO2, каждый, независимо представляют собой H, необязательно замещенную C1-C3 алкильную группу или вместе образуют кетогруппу, и
каждый n независимо обозначает 0, 1, 2, 3, 4, 5 или 6 (предпочтительно 0 или 1);
каждый m′ обозначает 0 или 1; и
каждый n′ обозначает 0 или 1,
где каждое из указанных соединений, предпочтительно на алкильной, арильной или Het группах, замещено линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
В альтернативных вариантах осуществления изобретения, R3′ представляет собой -(CH2)n-арил, -(CH2CH2O)n-арил, -(CH2)n-HET или -(CH2CH2O)n-HET;
где арил представляет собой фенил, который необязательно замещен одним или двумя заместителями, где указанный(ые) заместитель(и) предпочтительно выбран(ы) из -(CH2)nOH, C1-C6 алкила, который, в свою очередь, необязательно замещен CN, галогена (до трех групп галогена), OH, -(CH2)nO(C1-C6)алкила, амина, моно- или ди-(C1-C6 алкил)амина, где алкильная группа на амине необязательно замещена 1 или 2 гидроксильными группами или до трех группами галогена (предпочтительно F, Cl), или указанная арильная группа замещена -(CH2)nOH, -(CH2)n-O-(C1-C6)алкилом, -(CH2)n-O-(CH2)n-(C1-C6)алкилом, -(CH2)n-C(O)(C0-C6)алкилом, -(CH2)n-C(O)O(C0-C6)алкилом, -(CH2)n-OC(O)(C0-C6)алкилом, амином, моно- или ди -(C1-C6 алкил)амином, где алкильная группа на амине необязательно замещена 1 или 2 гидроксильными группами или до трех группами галогена (предпочтительно F, Cl), CN, NO2, необязательно замещенной -(CH2)n-(V)m′-CH2)n-(V)m′-(C1-C6)алкильной группой, группой -(V)m′-(CH2CH2O)n-RPEG, где V представляет собой O, S или NR1′, R1′ представляет собой H или C1-C3 алкильную группу (предпочтительно H) и RPEG представляет собой H или C1-C6 алкильную группу, которая необязательно замещена (включая необязательно замещена карбоксильной группой), или указанная арильная группа необязательно замещена гетероциклом, включая гетероарил, выбранный из группы, включающей оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин, бензофуран, индол, индолизин, азаиндолизин (когда замещены, каждый предпочтительно замещен C1-C3 алкильной группой, предпочтительно метильной или группой галогена, предпочтительно F или Cl), или группу, соответствующую химической структуре:
 ,
,
где Sc представляет собой CHRSS, NRURE или O;
RHET представляет собой H, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RSS представляет собой H, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенный -C(O)(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена);
RURE представляет собой H, C1-C6 алкил (предпочтительно H или C1-C3 алкил) или -C(O)(C1-6 алкил), где каждая из групп необязательно замещена одной или двумя гидроксильными группами или до трех атомами галогена, предпочтительно группами фтора, или необязательно замещенный гетероцикл, например, пиперидин, морфолин, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, каждый из которых необязательно замещен, и
YC представляет собой N или C-RYC, где RYC представляет собой H, OH, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную (фенильную или нафтильную), гетероарильную или гетероциклильную группу, выбранные из группы, включающей оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин (каждый предпочтительно замещенный C1-C3 алкильной группой, предпочтительно метильной или группой галогена, предпочтительно F или Cl), бензофуран, индол, индолизин, азаиндолизин;
RPRO1 и RPRO2, каждый, независимо представляют собой H, необязательно замещенную C1-C3 алкильную группу или вместе образуют кетогруппу;
HET представляет собой предпочтительно оксазол, изоксазол, тиазол, изотиазол, имидазол, диазол, оксимидазол, пиррол, пирролидин, фуран, дигидрофуран, тетрагидрофуран, тиен, дигидротиен, тетрагидротиен, пиридин, пиперидин, пиперазин, морфолин, хинолин (каждый, предпочтительно замещенный C1-C3 алкильной группой, предпочтительно метилом или группой галогена, предпочтительно F или Cl), бензофуран, индол, индолизин, азаиндолизин или группу, соответствующую химической структуре:
 ,
,
где Sc представляет собой CHRSS, NRURE или O;
RHET представляет собой H, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RSS представляет собой H, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенный -C(O)(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена);
RURE представляет собой H, C1-C6 алкил (предпочтительно H или C1-C3 алкил) или -C(O)(C1-6 алкил), где каждая из указанных групп необязательно замещена одной или двумя гидроксильными группами или до трех атомами галогена, предпочтительно группами фтора, или необязательно замещенный гетероцикл, например, пиперидин, морфолин, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, каждый из которых необязательно замещен, и
Yc представляет собой N или C-RYC, где RYC представляет собой H, OH, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный C1-C6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена (например, CF3)), необязательно замещенный O(C1-C6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или до трех группами галогена) или необязательно замещенную ацетиленовую группу -C≡C-Ra, где Ra представляет собой H или C1-C6 алкильную группу (предпочтительно C1-C3 алкил);
RPRO представляет собой H, необязательно замещенный C1-C6 алкил или необязательно замещенную арильную, гетероарильную или гетероциклильную группу;
RPRO1 и RPRO2, каждый, независимо представляют собой H, необязательно замещенную C1-C3 алкильную группу или вместе образуют кетогруппу,
каждый m′ независимо обозначает 0 или 1, и
каждый n независимо обозначает 0, 1, 2, 3, 4, 5 или 6 (предпочтительно 0 или 1),
где каждое из указанных соединений, предпочтительно на указанных арильных или HET группах, замещено линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
В еще одних предпочтительных вариантах осуществления изобретения, соединения включают такие, которые соответствуют химической структуре:
 ,
,
где R1′ представляет собой OH или группу, которая метаболизируется в организме пациента или субъекта до OH;
R2′ представляет собой -NH-CH2-арил-HET (предпочтительно фенил, непосредственно присоединенный к метилзамещенному тиазолу);
R3′ представляет собой группу -CHRCR3′-NH-C(O)-R3P1 или группу -CHRCR3′-R3P2;
где RCR3′ представляет собой C1-C4 алкильную группу, предпочтительно метил, изопропил или трет-бутил;
R3P1 представляет собой C1-C3 алкил (предпочтительно метил), необязательно замещенную оксетановую группу (предпочтительно метил замещенная), группу -(CH2)nOCH3, где n обозначает 1 или 2 (предпочтительно 2), или группу 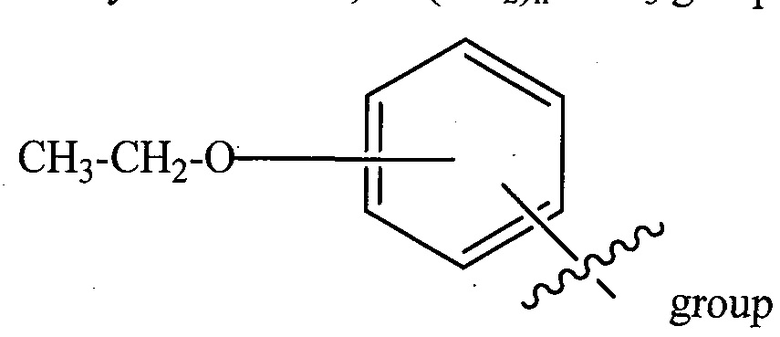 (группа этилового эфира, предпочтительно мета-замещенная в фенильной группе), морфолинo группу (присоединенную к карбонилу по 2- или 3-положению;
(группа этилового эфира, предпочтительно мета-замещенная в фенильной группе), морфолинo группу (присоединенную к карбонилу по 2- или 3-положению;
R3P2 представляет собой группу 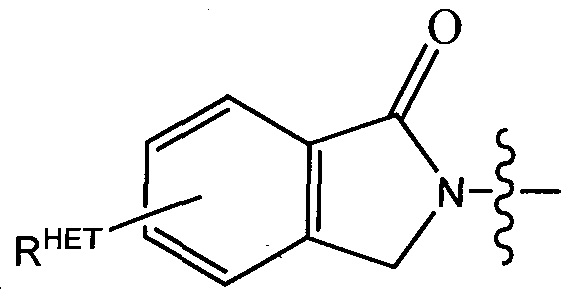 ,
,
где арил представляет собой фенил;
HET представляет собой необязательно замещенный тиазол или изотиазол; и
RHET представляет собой H или группу галогена (предпочтительно H),
или их фармацевтически приемлемые соли, стереоизомеры, сольваты или полиморфы, где каждое из указанных соединений замещено линкерной группой, к которой присоединена группа  (включая группу
(включая группу  ).
).
В альтернативных вариантах осуществления изобретения группы  для введения в соединения в соответствии с настоящим изобретением включают:
для введения в соединения в соответствии с настоящим изобретением включают:
 ,
,
где X представляет собой Cl, F, C1-C3 алкил (предпочтительно метил) или гетероцикл (предпочтительно необязательно замещенный гетероцикл, включая определения выше для R3′);
R1 и R2, каждый, независимо представляют собой H, C1-C3 алкил (предпочтительно метил) или фенил, и каждое из указанных соединений замещено линкерной группой или линкерной группой, к которой присоединена группа  , или
, или
их фармацевтически приемлемые соли, энантиомеры, диастереомеры, сольваты или полиморфы.
Дополнительные предпочтительные группы  для введения в соединения в соответствии с настоящим изобретением включают:
для введения в соединения в соответствии с настоящим изобретением включают:
 ,
,
где n обозначает 0 или 1;
R представляет собой линкер или линкер, присоединенный к группе  ,
,
X представляет собой H, F, Cl, C1-C3 алкил (предпочтительно метил) или гетероцикл (предпочтительно необязательно замещенный гетероцикл, особенно, включая водорастворимый гетероцикл, такой как морфолино группа, включая определенные выше для R3′), или
его фармацевтически приемлемую соль, энантиомер, диастереомер, сольват или полиморф.
Дополнительные предпочтительные группы  для введения в соединения в соответствии с настоящим изобретением включают, например:
для введения в соединения в соответствии с настоящим изобретением включают, например:
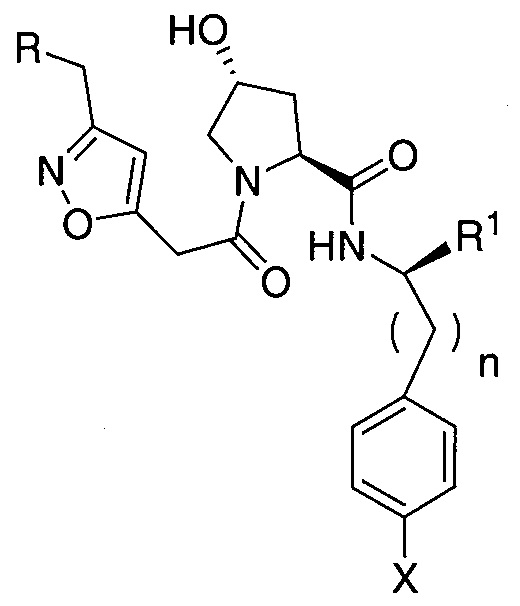 ,
,
где n обозначает 0 или 1;
R представляет собой линкер или линкер, присоединенный к группе  , связанной с группой
, связанной с группой  через амидную, сложноэфирную, группу простого эфира или карбаматную группу;
через амидную, сложноэфирную, группу простого эфира или карбаматную группу;
R1 представляет собой C1-C3 алкил (необязательно замещенный одной или двумя гидроксильными группами) или -C(O)NR3R4, где R3 и R4, каждый, независимо представляют собой H, C1-C3 алкил (предпочтительно метил), фенил или гетероцикл (включая гетероцикл, такой как морфолино, пиперазин или другая группа, которая повышает растворимость в воде),
X представляет собой H, F, Cl, C1-C3 алкил (предпочтительно метил) или гетероцикл (предпочтительно необязательно замещенный гетероцикл, включая водорастворимый гетероцикл, включая определенные выше для R3′), или его фармацевтически приемлемую соль, энантиомер, диастереомер, сольват или полиморф.
Еще одни предпочтительные группы  для введения в соединения в соответствии с настоящим изобретением включают, например,
для введения в соединения в соответствии с настоящим изобретением включают, например,
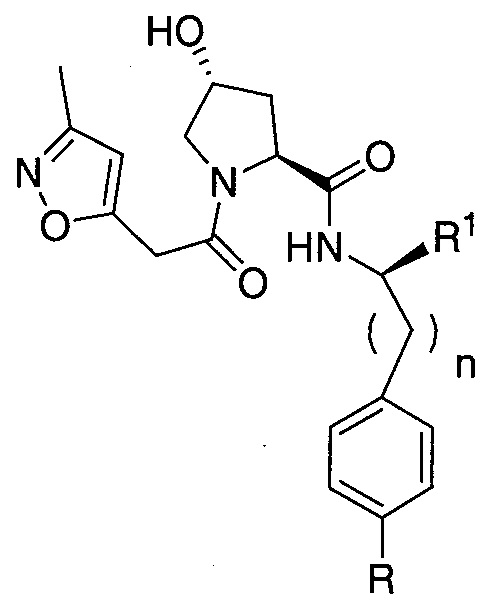 ,
,
где n обозначает 0 или 1;
R1 представляет собой линкер или линкер, присоединенный к группе  , связанной с группой
, связанной с группой  через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу (предпочтительно, необязательно замещенный гетероцикл, включая определенные выше для R3′);
через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу (предпочтительно, необязательно замещенный гетероцикл, включая определенные выше для R3′);
R представляет собой H, F, Cl, C1-C3 алкил (необязательно замещенный одной или двумя гидроксильными группами, предпочтительно метилом), -O-C(O)NR3R4 или -C(O)NR3R4, где каждый из R3 и R4 независимо представляет собой H, C1-C3 алкил (предпочтительно метил), фенил или гетероцикл, включая водорастворимый гетероцикл, или
его фармацевтически приемлемую соль, энантиомер, диастереомер, сольват или полиморф.
Еще одни предпочтительные группы  для введения в соединения в соответствии с настоящим изобретением включают, например:
для введения в соединения в соответствии с настоящим изобретением включают, например:
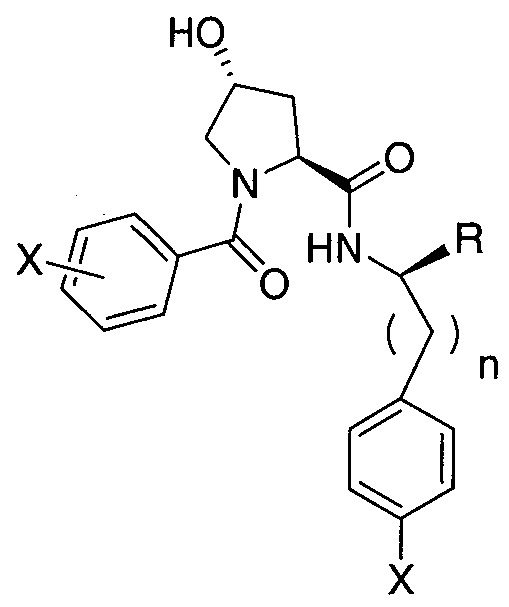 ,
,
где n обозначает 0 или 1;
R представляет собой линкер или линкер, присоединенный к группе  , связанной с группой
, связанной с группой  через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу; и
через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу; и
каждый X независимо представляет собой H, F, Cl, C1-C3 алкил (необязательно замещенный одной или двумя гидроксильными группами, предпочтительно метилом), гетероцикл (предпочтительно, необязательно замещенный гетероцикл, включая водорастворимый гетероцикл, и/или как определено выше для R3′), -O-C(O)NR3R4 или -C(O)NR3R4, где каждый из R3 и R4 независимо представляет собой H, C1-C3 алкил (предпочтительно метил) или фенил, или
его фармацевтически приемлемую соль, энантиомер, диастереомер, сольват или полиморф.
И еще дополнительные предпочтительные группы  для введения в соединения в соответствии с настоящим изобретением включают, например:
для введения в соединения в соответствии с настоящим изобретением включают, например:
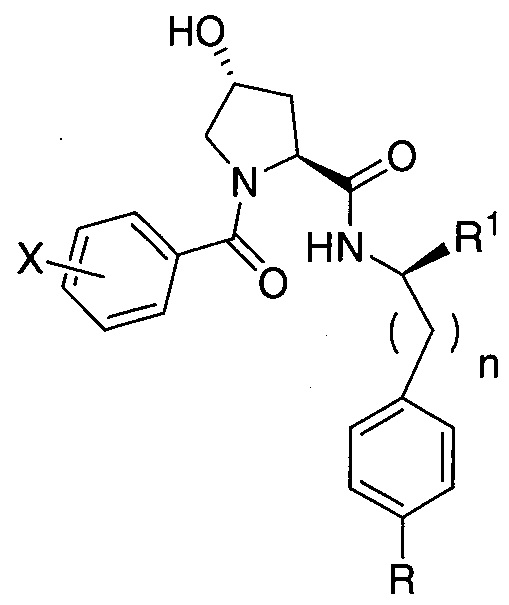 ,
,
где n обозначает 0 или 1;
R представляет собой линкер или линкер, присоединенный к группе  , связанной с группой
, связанной с группой  через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу;
через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу;
R1 представляет собой C1-C3 алкил, который необязательно замещен одной или двумя гидроксильными группами, -O-C(O)NR3R4 или -C(O)NR3R4, где каждый из R3 и R4 независимо представляет собой H, C1-C3 алкил (предпочтительно метил) или фенил; и
X независимо представляет собой H, F, Cl, C1-C3 алкил (необязательно замещенный одной или двумя гидроксильными группами, предпочтительно метилом) или гетероцикл (предпочтительно, необязательно замещенный гетероцикл, включая водорастворимый гетероцикл, и/или как определено выше для R3′), или его фармацевтически приемлемую соль, энантиомер, диастереомер, сольват или полиморф.
И еще дополнительные предпочтительные группы  для введения в соединения в соответствии с настоящим изобретением включают, например:
для введения в соединения в соответствии с настоящим изобретением включают, например:
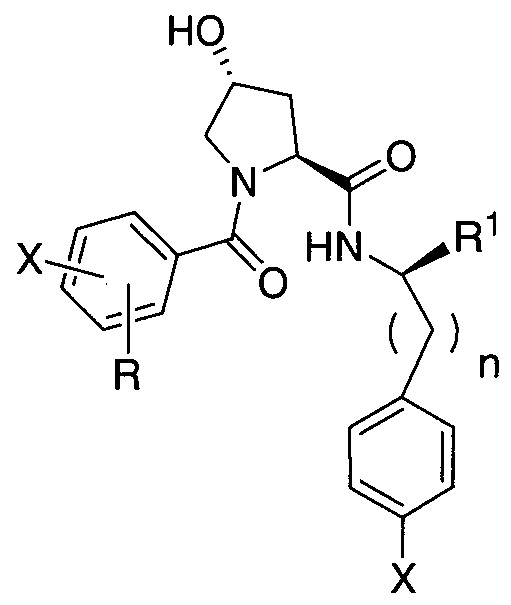 ,
,
где n обозначает 0 или 1;
R представляет собой линкер или линкер, присоединенный к группе  , связанной с группой
, связанной с группой  через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу;
через амидную, сложноэфирную, группу простого эфира, карбаматную или гетероциклильную группу;
R1 представляет собой H, C1-C3 алкил, который необязательно замещен одной или двумя гидроксильными группами, -O-C(O)NR3R4 или -C(O)NR3R4, где каждый из R3 и R4 независимо представляет собой H, C1-C3 алкил (предпочтительно метил) или фенил; и
каждый Х независимо представляет собой H, F, Cl, C1-C3 алкил (необязательно замещенный одной или двумя гидроксильными группами, предпочтительно метилом) или гетероцикл (предпочтительно, необязательно замещенный гетероцикл, включая водорастворимый гетероцикл и/или включая определенные выше для R3′),
или его фармацевтически приемлемую соль, энантиомер, диастереомер, сольват или полиморф.
Согласно дополнительному варианту осуществления изобретения, особенно предпочтительные соединения согласно настоящему изобретению могут соответствовать одной или нескольким химическим структурам, представленным на фигуре 19 настоящего документа:
когда любой один или несколько из R1PC, R2PC, R3PC, R4PC, R5PC, R6PC, R7PC, R8PC, R9PC, R10РС, R11PC, R12PC, R13PC и R14PC представляют собой группу  ,
,
когда L представляет собой линкерную группу и  представляет собой группу белка-мишени, или
представляет собой группу белка-мишени, или
их фармацевтически приемлемые соли, энантиомеры, диастереомеры, сольваты или полиморфы.
В предпочтительных вариантах осуществления изобретения не более чем два из R1PC, R2PC, R3PC, R4PC, R5PC, R6PC, R7PC, R8PC, R9PC, R10РС, R11PC, R12PC, R13PC и R14PC представляют собой группу  , и другие из групп R1PC, R2PC, R3PC, R4PC, R5PC, R6PC, R7PC, R8PC, R9PC, R10РС, R11PC, R12PC, R13PC и R14PC независимо представляют собой H или группу CH3, часто H.
, и другие из групп R1PC, R2PC, R3PC, R4PC, R5PC, R6PC, R7PC, R8PC, R9PC, R10РС, R11PC, R12PC, R13PC и R14PC независимо представляют собой H или группу CH3, часто H.
Некоторые предпочтительные варианты осуществления изобретения касаются соединений, соответствующих химической структуре:
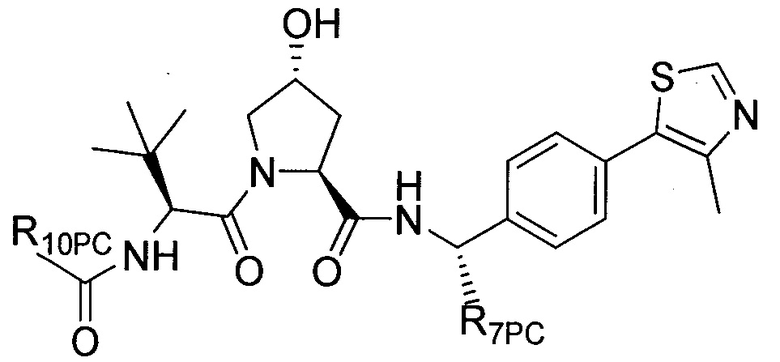 ,
,
где R7PC и R10РС, каждый, независимо представляют собой группу  или H, или их фармацевтически приемлемых солей, энантиомеров, диастереомеров, сольватов или полиморфов. Предпочтительно, либо R7PC, либо R10РС представляет собой группу
или H, или их фармацевтически приемлемых солей, энантиомеров, диастереомеров, сольватов или полиморфов. Предпочтительно, либо R7PC, либо R10РС представляет собой группу  , и другой из R7PC и R10РС представляет собой H.
, и другой из R7PC и R10РС представляет собой H.
В других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
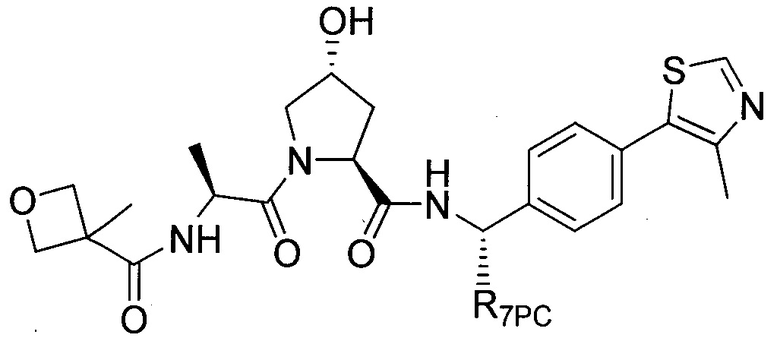 ,
,
где R7PC представляет собой группу  , или
, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
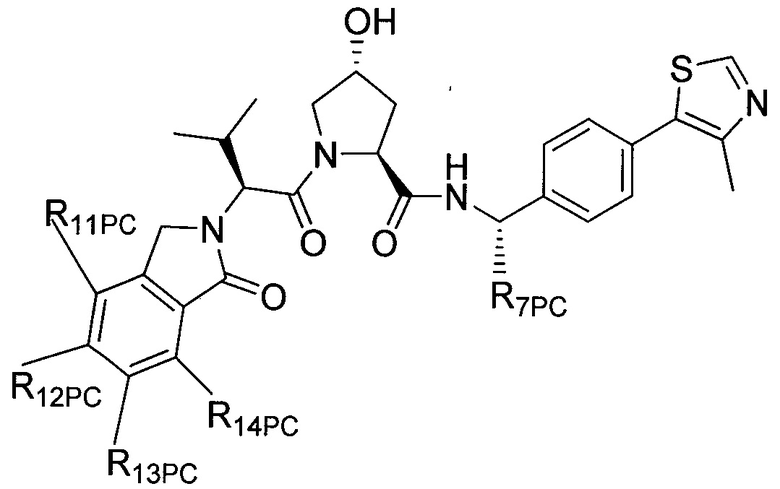 ,
,
где R7PC, R11PC, R12PC, R13PC и R14PC, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC, R11PC, R12PC, R13PC и R14PC представляет собой группу  , и другие группы представляют собой H, или
, и другие группы представляют собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
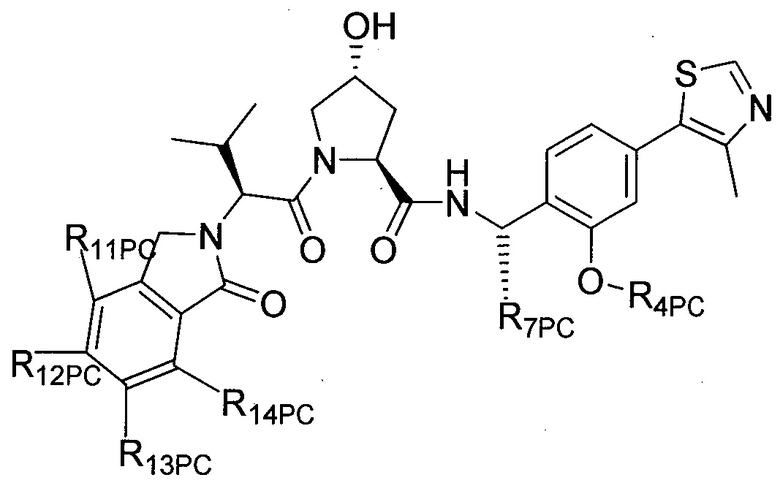 ,
,
где R4PC, R7PC, R11PC, R12PC, R13PC и R14PC, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, любой из R4PC, R7PC, R11PC, R12PC или один из R13PC и R14PC представляет собой группу  , и другие группы представляют собой H, или
, и другие группы представляют собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
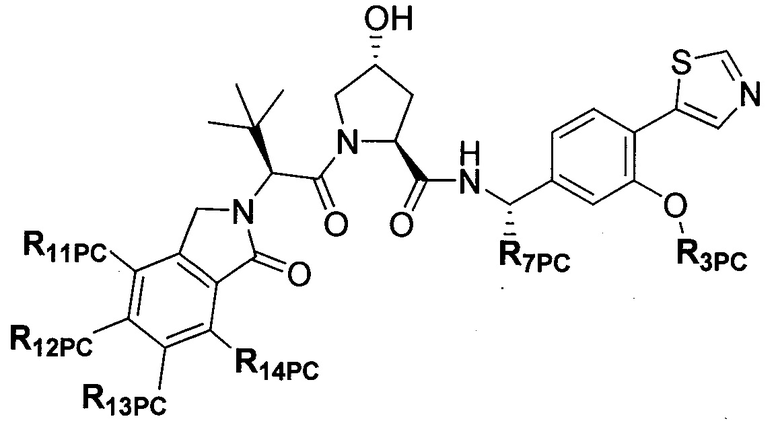 ,
,
где R3PC, R7PC, R11PC, R12PC, R13PC и R14PC, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R3PC, R7PC, R11PC, R12PC, R13PC и R14PC представляет собой группу  , и другие группы представляют собой H, или
, и другие группы представляют собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
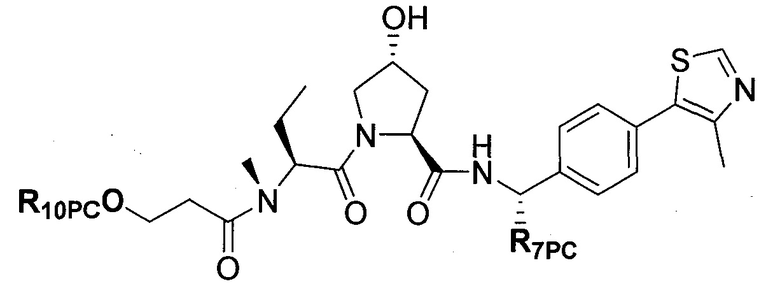 ,
,
где R7PC и R10РС, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R10РС представляет собой группу  , и другая группа представляет собой H, или
, и другая группа представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
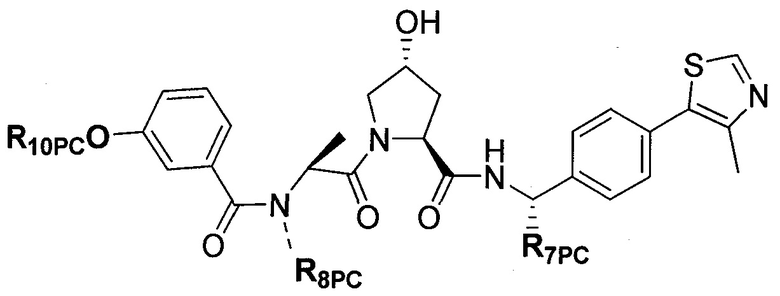 ,
,
где R7PC и R10РС, каждый, независимо представляют собой группу  или H, и R8PC представляет собой H или CH3, или
или H, и R8PC представляет собой H или CH3, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R10РС представляет собой группу  , и другая группа представляет собой H, и R8PC представляет собой H, или
, и другая группа представляет собой H, и R8PC представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
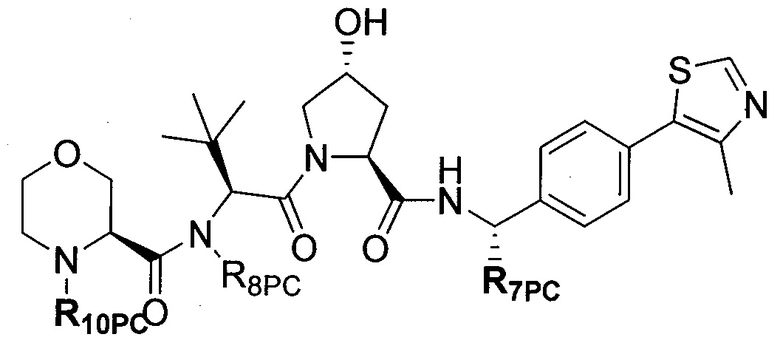 ,
,
где R7PC и R10РС, каждый, независимо представляют собой группу  или H, и R8PC представляет собой H или CH3, или
или H, и R8PC представляет собой H или CH3, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R10PC представляет собой группу  , и другая группа представляет собой H, и R8PC представляет собой H, или
, и другая группа представляет собой H, и R8PC представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
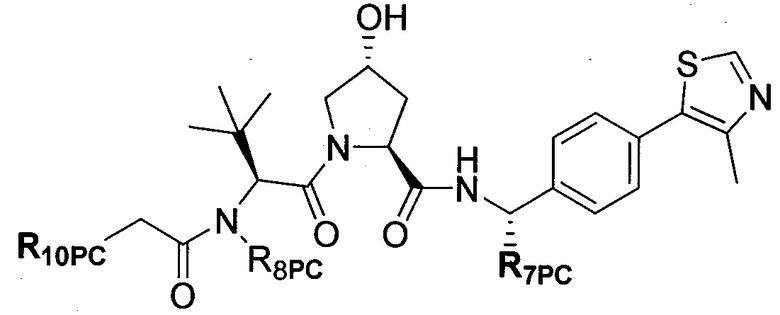 ,
,
где R7PC и R10РС, каждый, независимо представляют собой группу  или H, и R8PC представляет собой H или CH3, или
или H, и R8PC представляет собой H или CH3, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R10РС представляет собой группу  , и другая группа представляет собой H, и R8PC представляет собой H, или
, и другая группа представляет собой H, и R8PC представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
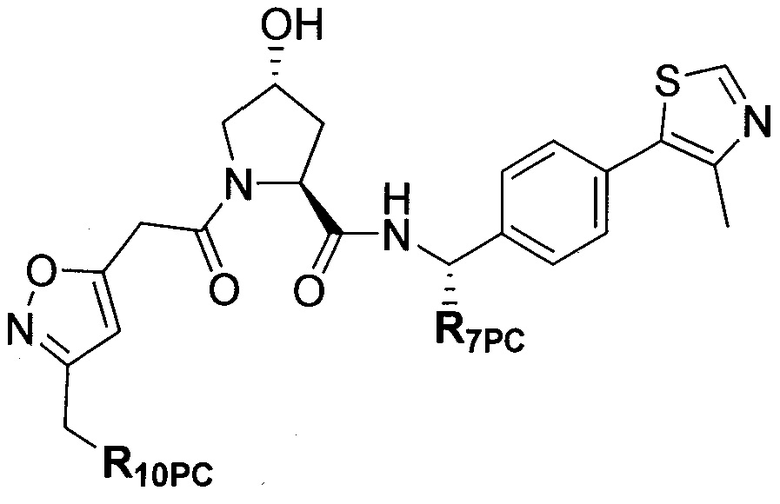 ,
,
где R7PC и R10РС, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R10РС представляет собой группу  , и другая группа представляет собой H, или
, и другая группа представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
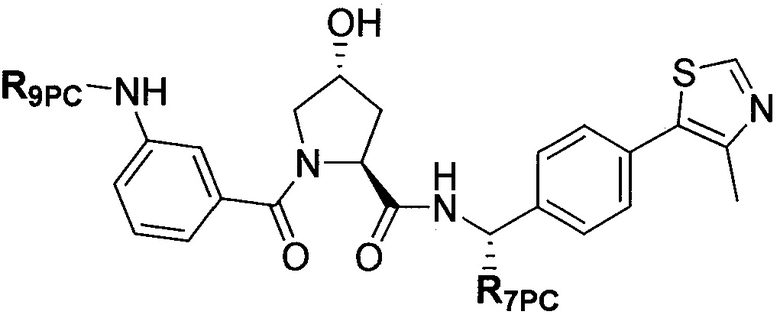 ,
,
где R7PC и R9PC, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, одна из групп R7PC и R9PC представляет собой группу  , и другая группа представляет собой H, или
, и другая группа представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
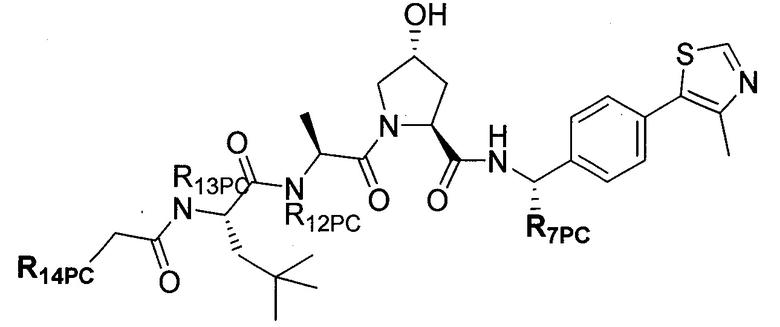 ,
,
где R7PC и R14PC, каждый, независимо представляют собой группу  или H, и каждый из R12PC и R13PC представляет собой H или CH3, или
или H, и каждый из R12PC и R13PC представляет собой H или CH3, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, одна из групп R7PC и R14PC представляет собой группу  , и другая из групп R7PC и R14PC представляет собой H, и каждый из R12PC и R13PC представляет собой H, или
, и другая из групп R7PC и R14PC представляет собой H, и каждый из R12PC и R13PC представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
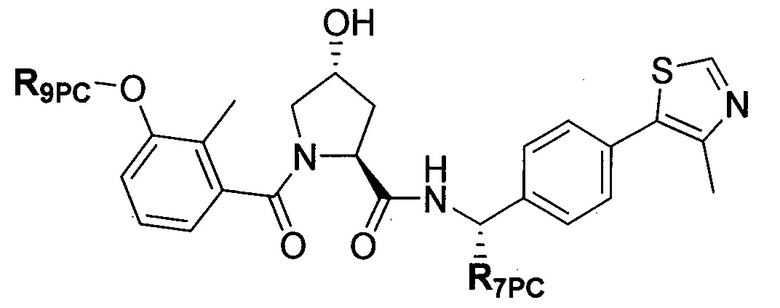 ,
,
где R7PC и R9PC, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R9PC представляет собой группу  , и другая группа представляет собой H, или
, и другая группа представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
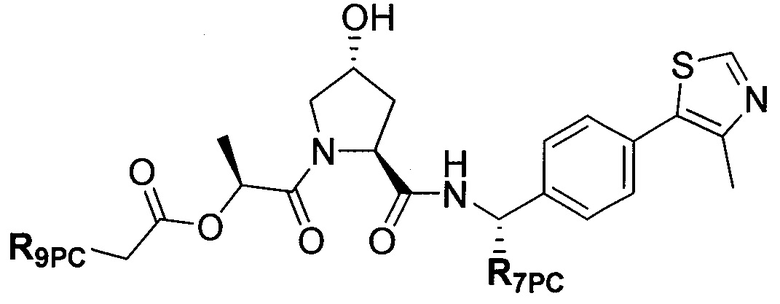 ,
,
где R7PC и R9PC, каждый, независимо представляют собой группу  или H, или
или H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R9PC представляет собой группу  , и другая группа представляет собой H, или
, и другая группа представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В еще других предпочтительных вариантах осуществления изобретения соединение имеет химическую структуру:
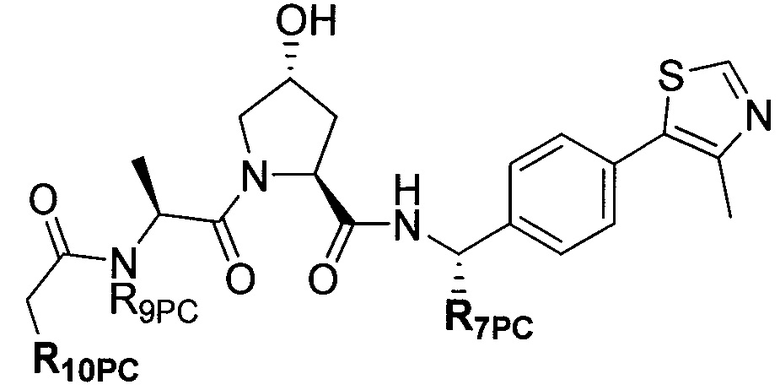 ,
,
где R7PC и R10РС, каждый, независимо представляют собой группу  или H, и R9PC представляет собой H или CH3, или
или H, и R9PC представляет собой H или CH3, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф. Предпочтительно, один из R7PC и R10РС представляет собой группу  , и другая группа представляет собой H, и R9PC представляет собой H, или
, и другая группа представляет собой H, и R9PC представляет собой H, или
его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В вышеуказанных вариантах осуществления линкерная группа может быть любой линкерной группой, описанной выше, далее обозначает предпочтительно полиэтиленгликолевую группу, в интервале размеров от примерно 1 до примерно 12 звеньев этиленгликоля, между 1 и примерно 10 звеньями этиленгликоля, между примерно 2 и примерно 6 звеньями этиленгликоля, между примерно 2 и 5 звеньями этиленгликоля, между примерно 2 и 4 звеньями этиленгликоля.
В предпочтительных вариантах осуществления изобретения линкерная группа L представляет собой группу:
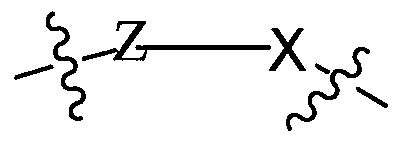 ,
,
где Z представляет собой группу, которая соединяет  с X; и
с X; и
X представляет собой группу, связывающую Z с группой  (включая группу
(включая группу  ).
).
В предпочтительных аспектах Z отсутствует (связь), представляет собой группу -(CH2)i-O, -(CH2)i-S, -(CH2)i-N-R, -(CH2)i-X1Y1, где X1Y1 образует амидную группу, или уретановую группу, сложноэфирную или сложную тиоэфирную группу, или группу 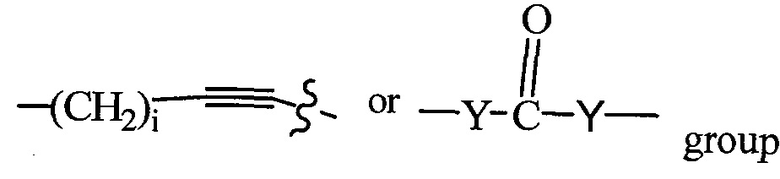 или
или 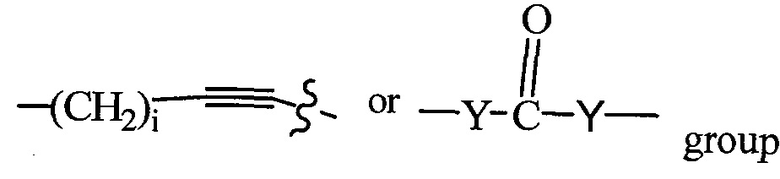 ,
,
каждый R представляет собой H, или C1-C3 алкил, алканоильную группу или гетероциклическую группу (включая водорастворимую гетероциклическую группу, предпочтительно группу морфолино, пиперидин или пиперазин, для усиления растворимости линкерной группы;
каждый Y независимо представляет собой связь, O, S или N-R;
и каждый i независимо обозначает от 0 до 100, от 1 до 75, от 1 до 60, от 1 до 55, от 1 до 50, от 1 до 45, от 1 до 40, от 2 до 35, от 3 до 30, от 1 до 15, от 1 до 10, от 1 до 8, от 1 до 6 или 1, 2, 3, 4 или 5.
В предпочтительных аспектах X представляет собой группу  ,
,
где каждый D независимо представляет собой связь (отсутствует), представляет собой
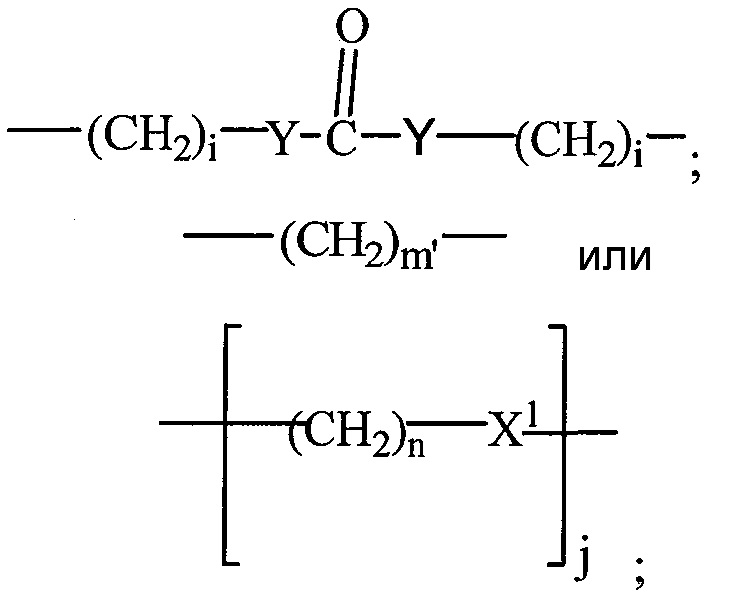
j обозначает от 1 до 100, от 1 до 75, от 1 до 60, от 1 до 55, от 1 до 50, от 1 до 45, от 1 до 40, от 2 до 35, от 3 до 30, от 1 до 15, от 1 до 10, от 1 до 8, от 1 до 6 или 1, 2, 3, 4 или 5;
k обозначает от 1 до 100, от 1 до 75, от 1 до 60, от 1 до 55, от 1 до 50, от 1 до 45, от 1 до 40, от 2 до 35, от 3 до 30, от 1 до 15, от 1 до 10, от 1 до 8, от 1 до 6 или 1, 2, 3, 4 или 5; предпочтительно k представляет собой 1, 2, 3, 4 или 5;
m′ представляет собой от 1 до 100, от 1 до 75, от 1 до 60, от 1 до 55, от 1 до 50, от 1 до 45, от 1 до 40, от 2 до 35, от 3 до 30, от 1 до 15, от 1 до 10, от 1 до 8, от 1 до 6 или 1, 2, 3, 4 или 5;
n представляет собой от 1 до 100, от 1 до 75, от 1 до 60, от 1 до 55, от 1 до 50, от 1 до 45, от 1 до 40, от 2 до 35, от 3 до 30, от 1 до 15, от 1 до 10, от 1 до 8, от 1 до 6 или 1, 2, 3, 4 или 5;
X1 представляет собой O, S или N-R, предпочтительно O;
Y имеет значения, указанные выше; и
 представляет собой связывающую группу (которая может быть связью), которая соединяет Z с X, когда они имеются в линкерной группе.
представляет собой связывающую группу (которая может быть связью), которая соединяет Z с X, когда они имеются в линкерной группе.
В предпочтительных аспектах  представляет собой связь (отсутствует), гетероцикл, включая водорастворимый гетероцикл, такой как пиперизинильная группа или другая группа, или группу
представляет собой связь (отсутствует), гетероцикл, включая водорастворимый гетероцикл, такой как пиперизинильная группа или другая группа, или группу
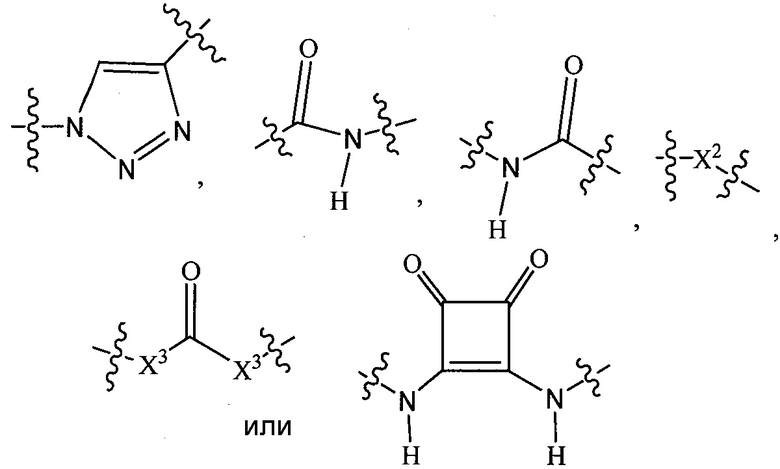 ,
,
где X2 представляет собой O, S, NR4, S(O), S(O)2, -S(O)2O, -OS(O)2 или OS(O)2O;
X3 представляет собой O, S, CHR4, NR4; и
R4 представляет собой H или C1-C3 алкильную группу, которая является необязательно замещенной одной или двумя гидроксильными группами, или
его фамацевтически приемлемая соль, энантиомер или стереомер.
В альтернативных предпочтительных аспектах линкерная группа представляет собой (поли)этиленгликоль, содержащий между 1 и примерно 100 звеньев этиленгликоля, между примерно 1 и примерно 50 звеньев этиленгликоля, между 1 и примерно 25 звеньев этиленгликоля, между примерно 1 и 10 звеньями этиленгликоля, между 1 и примерно 8 звеньями этиленгликоля и 1 и 6 звеньями этиленгликоля, между 2 и 4 звеньями этиленгликоля.
В альтернативных предпочтительных аспектах  представляет собой группу
представляет собой группу  или амидную группу.
или амидную группу.
Хотя группа  и группа
и группа  (включая группу
(включая группу  ) могут быть ковалентно связаны с линкерной группой посредством любой группы, которая является подходящей и химически стабильной по отношению к линкеру, в предпочтительных аспектах настоящего изобретения линкер независимо ковалентно присоединен к группе
) могут быть ковалентно связаны с линкерной группой посредством любой группы, которая является подходящей и химически стабильной по отношению к линкеру, в предпочтительных аспектах настоящего изобретения линкер независимо ковалентно присоединен к группе  и группе
и группе  (включая группу
(включая группу  ), предпочтительно посредством амида, сложного эфира, сложного тиоэфира, кетогруппы, карбамата (уретана) или простого эфира, каждая из указанных групп может быть в любом месте группы
), предпочтительно посредством амида, сложного эфира, сложного тиоэфира, кетогруппы, карбамата (уретана) или простого эфира, каждая из указанных групп может быть в любом месте группы  и группы
и группы  (включая группу
(включая группу  ) для обеспечения максимального связывания группы
) для обеспечения максимального связывания группы  с убиквитин лигазой и группой
с убиквитин лигазой и группой  на мишеневом белке, который должен быть деградирован. (Отмечается, что в некоторых аспектах, когда группа
на мишеневом белке, который должен быть деградирован. (Отмечается, что в некоторых аспектах, когда группа  представляет собой группу
представляет собой группу  , мишеневым белком для деградации может быть сама убиквитин лигаза). Согласно некоторым предпочтительным аспектам линкер может быть присоединен к необязательно замещенной алкильной, алкиленовой, алкеновой или алкиновой группе, арильной группе или гетероциклической группе на группах
, мишеневым белком для деградации может быть сама убиквитин лигаза). Согласно некоторым предпочтительным аспектам линкер может быть присоединен к необязательно замещенной алкильной, алкиленовой, алкеновой или алкиновой группе, арильной группе или гетероциклической группе на группах  и
и  .
.
Согласно предпочтительным аспектам изобретения группа  представляет собой группу, которая присоединена к белкам-мишеням. Мишени для группы
представляет собой группу, которая присоединена к белкам-мишеням. Мишени для группы  являются различными по виду и выбраны из белков, которые экспрессируют в клетке, так что, по меньшей мере, часть последовательностей обнаруживается в клетке и может связываться с группой
являются различными по виду и выбраны из белков, которые экспрессируют в клетке, так что, по меньшей мере, часть последовательностей обнаруживается в клетке и может связываться с группой  . Термин "белок" включает олигопептидные и полипептидные последовательности достаточной длины, чтобы они могли связываться с группой
. Термин "белок" включает олигопептидные и полипептидные последовательности достаточной длины, чтобы они могли связываться с группой  в соответствии с настоящим изобретением. Любые белки в эукариотической системе или микробной системе, включая вирус, бактерии или грибок, как иным образом описано в данном документе, являются мишенями для убиквитинилирования, опосредованного соединениями в соответствии с настоящим изобретением. Предпочтительно, белок-мишень представляет собой белок эукариот. В некоторых аспектах связывающая белок группа представляет собой галогеналкан (предпочтительно C1-C10 алкильную группу, которая замещена, по меньшей мере, одной группой галогена, предпочтительно группой галогена на самом конце алкильной группы (то есть, подальше от линкера или группы
в соответствии с настоящим изобретением. Любые белки в эукариотической системе или микробной системе, включая вирус, бактерии или грибок, как иным образом описано в данном документе, являются мишенями для убиквитинилирования, опосредованного соединениями в соответствии с настоящим изобретением. Предпочтительно, белок-мишень представляет собой белок эукариот. В некоторых аспектах связывающая белок группа представляет собой галогеналкан (предпочтительно C1-C10 алкильную группу, которая замещена, по меньшей мере, одной группой галогена, предпочтительно группой галогена на самом конце алкильной группы (то есть, подальше от линкера или группы  ), которая может ковалентно связываться с ферментом дегалогеназой в организме пациента или субъекта или в диагностическом анализе.
), которая может ковалентно связываться с ферментом дегалогеназой в организме пациента или субъекта или в диагностическом анализе.
Группы  в соответствии с настоящим изобретением включают, например, любой фрагмент, который специфически связывается с белком (связывается с белком-мишенью), и включают, среди множества других, следующие неограничивающие примеры фрагментов белков-мишеней небольших молекул: ингибиторы Hsp90, ингибиторы киназ, ингибиторы MDM2, соединения, нацеленные на человеческие белки BET, содержащие бромодомен, ингибиторы HDAC, ингибиторы человеческой лизин-метилтрансферазы, ингибиторы ангиогенезиса, иммуносупрессивные соединения и соединения, нацеленные на арил-гидрокарбоновый рецептор (AHR). Композиции, описанные далее, иллюстрируют некоторые из членов этих девяти видов связывающих фрагментов белков-мишеней небольших молекул. Такие связывающие фрагменты белков-мишеней небольших молекул также включают фармацевтически приемлемые соли, энантиомеры, сольваты и полиморфы этих композиций, а также другие небольшие молекулы, которые могут предназначаться для рассматриваемого белка. Эти связывающие фрагменты соединены со связывающим фрагментом убиквитин лигазы, предпочтительно через линкер, для того чтобы предоставить белок-мишень (к которому присоединен фрагмент белка-мишени) в непосредственной близости от убиквитин лигазы для убиквитинилирования и деградации.
в соответствии с настоящим изобретением включают, например, любой фрагмент, который специфически связывается с белком (связывается с белком-мишенью), и включают, среди множества других, следующие неограничивающие примеры фрагментов белков-мишеней небольших молекул: ингибиторы Hsp90, ингибиторы киназ, ингибиторы MDM2, соединения, нацеленные на человеческие белки BET, содержащие бромодомен, ингибиторы HDAC, ингибиторы человеческой лизин-метилтрансферазы, ингибиторы ангиогенезиса, иммуносупрессивные соединения и соединения, нацеленные на арил-гидрокарбоновый рецептор (AHR). Композиции, описанные далее, иллюстрируют некоторые из членов этих девяти видов связывающих фрагментов белков-мишеней небольших молекул. Такие связывающие фрагменты белков-мишеней небольших молекул также включают фармацевтически приемлемые соли, энантиомеры, сольваты и полиморфы этих композиций, а также другие небольшие молекулы, которые могут предназначаться для рассматриваемого белка. Эти связывающие фрагменты соединены со связывающим фрагментом убиквитин лигазы, предпочтительно через линкер, для того чтобы предоставить белок-мишень (к которому присоединен фрагмент белка-мишени) в непосредственной близости от убиквитин лигазы для убиквитинилирования и деградации.
Всякий белок, который может быть присоединен к фрагменту белка-мишени или группе  и подвергнут воздействию или деградированию с помощью убиквитин лигазы, является белком-мишенью в соответствии с настоящим изобретением. Обычно белки-мишени могут включать, например, структурные белки, рецепторы, ферменты, белки поверхности клеток, белки, имеющие отношение к функции встраивания в клетку, включая белки, участвующие в каталитической активности, активности ароматазы, двигательной активности, деятельности геликазы, метаболических процессах (анаболизм и катаболизм), антиоксидантной активности, протеолизе, биосинтезе, белки с киназной активностью, оксидоредуктазной активностью, трансферазной активностью, гидролазной активностью, лиазной активностью, изомеразной активностью, лигазной активностью, регулирующей ферментативной активностью, активностью сигнальной трансдукции, активностью в отношении структуры молекул, связывающей активностью (белок, липид, карбогидрат), рецепторной активностью, подвижностью клеток, мембранным слиянием, клеточной коммуникацией, регулированием биологических процессов, развитием, дифференцировкой клеток, реакцией на раздражитель, поведенческие белки, белки клеточной адгезии, белки, участвующие в смерти клеток, белки, участвующие в транспорте (включая белок с активностью транспортера, транспорта ядер, активностью ионного транспортера, активностью транспортера каналов, активностью носителя, пермеазной активностью, секреторной активностью, активностью транспортера электронов, патогенезе, шаперон регулирующей активностью, связывающей нуклеиновые кислоты активностью, регулирующей транскрипцию активностью, активностью внеклеточной организации и биогенеза, регулирующей трансляцию активностью. Представляющие интерес белки могут включать белки из эукариотов и прокариотов, включая человека в качестве объекта лекарственной терапии, других животных, включая домашних животных, микробов для определения мишеней для антибиотиков и других противомикробных препаратов, и растения, и даже вирусы, среди многих других.
и подвергнут воздействию или деградированию с помощью убиквитин лигазы, является белком-мишенью в соответствии с настоящим изобретением. Обычно белки-мишени могут включать, например, структурные белки, рецепторы, ферменты, белки поверхности клеток, белки, имеющие отношение к функции встраивания в клетку, включая белки, участвующие в каталитической активности, активности ароматазы, двигательной активности, деятельности геликазы, метаболических процессах (анаболизм и катаболизм), антиоксидантной активности, протеолизе, биосинтезе, белки с киназной активностью, оксидоредуктазной активностью, трансферазной активностью, гидролазной активностью, лиазной активностью, изомеразной активностью, лигазной активностью, регулирующей ферментативной активностью, активностью сигнальной трансдукции, активностью в отношении структуры молекул, связывающей активностью (белок, липид, карбогидрат), рецепторной активностью, подвижностью клеток, мембранным слиянием, клеточной коммуникацией, регулированием биологических процессов, развитием, дифференцировкой клеток, реакцией на раздражитель, поведенческие белки, белки клеточной адгезии, белки, участвующие в смерти клеток, белки, участвующие в транспорте (включая белок с активностью транспортера, транспорта ядер, активностью ионного транспортера, активностью транспортера каналов, активностью носителя, пермеазной активностью, секреторной активностью, активностью транспортера электронов, патогенезе, шаперон регулирующей активностью, связывающей нуклеиновые кислоты активностью, регулирующей транскрипцию активностью, активностью внеклеточной организации и биогенеза, регулирующей трансляцию активностью. Представляющие интерес белки могут включать белки из эукариотов и прокариотов, включая человека в качестве объекта лекарственной терапии, других животных, включая домашних животных, микробов для определения мишеней для антибиотиков и других противомикробных препаратов, и растения, и даже вирусы, среди многих других.
В еще других вариантах осуществления изобретения группа  представляет собой галогеналкильную группу, где указанная алкильная группа обычно варьирует по длине от примерно 1 или 2 атомов углерода до примерно 12 атомов углерода, часто примерно от 2 до 10 атомов углерода по длине, часто от примерно 3 атомов углерода до примерно 8 атомов углерода по длине, более часто от примерно 4 атомов углерода до примерно 6 атомов углерода по длине. Галогеналкильные группы обычно представляют собой линейные алкильные группы (хотя также могут использоваться разветвленные алкильные группы) и имеют на конце, по меньшей мере, одну группу галогена, предпочтительно одну группу галогена, часто одну хлоридную группу. Галогеналкильные группы
представляет собой галогеналкильную группу, где указанная алкильная группа обычно варьирует по длине от примерно 1 или 2 атомов углерода до примерно 12 атомов углерода, часто примерно от 2 до 10 атомов углерода по длине, часто от примерно 3 атомов углерода до примерно 8 атомов углерода по длине, более часто от примерно 4 атомов углерода до примерно 6 атомов углерода по длине. Галогеналкильные группы обычно представляют собой линейные алкильные группы (хотя также могут использоваться разветвленные алкильные группы) и имеют на конце, по меньшей мере, одну группу галогена, предпочтительно одну группу галогена, часто одну хлоридную группу. Галогеналкильные группы  для применения по настоящему изобретению предпочтительно представлены химической структурой -(CH2)v-галоген, где v обозначает любое целое число от 2 до примерно 12, часто от примерно 3 до примерно 8, более часто от примерно 4 до примерно 6. Галоген может быть любым галогеном, однако, предпочтительно представляет собой, Cl или Br, более часто Cl.
для применения по настоящему изобретению предпочтительно представлены химической структурой -(CH2)v-галоген, где v обозначает любое целое число от 2 до примерно 12, часто от примерно 3 до примерно 8, более часто от примерно 4 до примерно 6. Галоген может быть любым галогеном, однако, предпочтительно представляет собой, Cl или Br, более часто Cl.
В еще других вариантах осуществления изобретения, группа  представляет собой группу
представляет собой группу
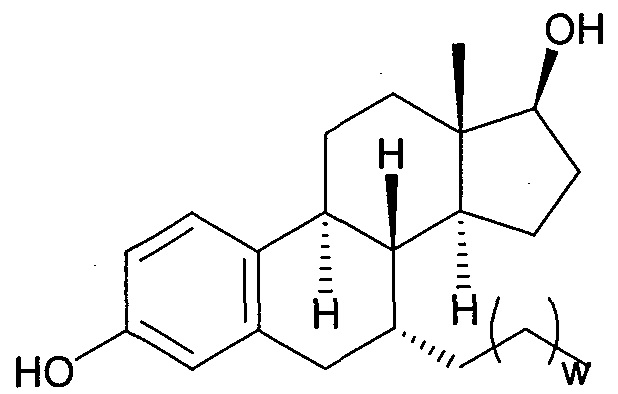 , где w обозначает от 0 до 3, предпочтительно 1 или 2. Указанная группа селективно связывается с эстрогенными рецепторами и это может быть использовано при лечении заболеваний, которые модулированы эстрогенными рецепторами, и, в частности, среди прочих, злокачественных новообразований, таких как рак груди, эндометриальный рак, рак яичников и рак матки.
, где w обозначает от 0 до 3, предпочтительно 1 или 2. Указанная группа селективно связывается с эстрогенными рецепторами и это может быть использовано при лечении заболеваний, которые модулированы эстрогенными рецепторами, и, в частности, среди прочих, злокачественных новообразований, таких как рак груди, эндометриальный рак, рак яичников и рак матки.
Настоящее изобретение может быть использовано при лечении ряда заболеваний и/или состояний, включая любое заболевание и/или состояние, при которых у белков нарушена регуляция, и где для пациента будет благоприятной деградация белков.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей эффективное количество соединения, указанного выше, в комбинации с фармацевтически приемлемым носителем, добавкой или инертным наполнителем, и, необязательно, дополнительным биологически активным агентом.
В альтернативных аспектах настоящее изобретение относится к способу лечения заболевания путем деградации белка или полипептида, посредством которых заболевание или состояние модулировано, заключающемуся во введении указанному пациенту или субъекту эффективного количества, по меньшей мере, одного соединения из описанных в настоящем документе выше, необязательно в комбинации с дополнительным биологически активным агентом. Способ в соответствии с настоящим изобретением может быть использован для лечения большого числа заболеваний или состояний, включая злокачественное новообразование, посредством введения эффективного количества, по меньшей мере, одного соединения из описанных в настоящем документе.
Подробное описание изобретения
Для описания настоящего изобретения используются следующие термины. В тех случаях, когда термин конкретно не определен, этот термин имеет принятое специалистами в данной области значение и означает, что этот термин в данном контексте используется для описания настоящего изобретения.
Если представлен диапазон значений, то следует понимать, что каждое промежуточное значение, до десятых долей единицы нижнего предела, если из контекста явно не следует иное (так как в случае группы, содержащей некоторое число атомов углерода, в этом случае предусмотрено каждое число атомов углерода, попадающее в указанный интервал), между верхней и нижней границами этого диапазона и любые другие указанные или промежуточные значения в этом установленном интервале охватываются настоящим изобретением. Верхние и нижние пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны, что также входит в объем изобретения, с учетом любого конкретно исключенного предела в указанном диапазоне. Когда указано, что диапазон включает один или оба предела, диапазоны, исключающие любое из обоих включенных пределов, также входят в объем изобретения.
Термин "соединение", как он используется в настоящем документе, если не указано иное, относится к любому конкретному химическому соединению, раскрытому в данном документе, и включает таутомеры, изомеры положения, геометрические изомеры и, где это применимо, стереоизомеры, включая оптические изомеры (энантиомеры) и другие стереоизомеры (диастереомеры), а также их фармацевтически приемлемые соли и производные (включая формы пролекарств), когда это применимо в контексте. Согласно его использованию в контексте, термин "соединение" обычно относится к единственному соединение, но также может включать другие соединения, такие как стереоизомеры, изомеры положения и/или оптические изомеры (включая рацемические смеси), а также конкретные энантиомеры или энантиомерно обогащенные смеси раскрытых соединений. Термин относится также, в данном контексте, к пролекарственным формам соединений, которые должны быть модифицированы для облегчения введения и доставки соединений к месту проявления их активности. Отмечается, что при описании настоящих соединений, среди прочих, описано множество заместителей и связанных с ними вариантов. Специалисту в данной области понятно, что молекулы, которые описаны в настоящем документе, представляют собой стабильные соединения, как это обычно предусматривается далее. Когда показана связь  , то в контексте показанного соединения представлены как двойная связь, так и одинарная связь.
, то в контексте показанного соединения представлены как двойная связь, так и одинарная связь.
Термин "пациент" или "субъект" используется в описании для обозначения животного, предпочтительно человека или одомашненного животного, которому проводят лечение, включая профилактическое лечение, с помощью композиций в соответствии с настоящим изобретением. При лечении таких инфекций, состояний или заболеваний, которые являются специфическими для конкретного животного, такого как пациент-человек, термин "пациент" относится к конкретным животным, включая домашних животных, таких как собаки или кошки, или сельскохозяйственных животных, таких как лошадь, корова, овца и т.д. В основном, в настоящем изобретении термин "пациент" относится к пациенту-человеку, если другое не указано или не подразумевается из контекста использования термина.
Термин "эффективный" используется для описания количества соединения, композиции или компонента, которое, при использовании в контексте его предназначения, приводит в предполагаемому результату. Термин «эффективный» охватывает все другие термины, относящееся к эффективному количеству или эффективным концентрациям, которые иным образом описаны или использованы в настоящей заявке.
Термин "VCB E3 убиквитин лигаза", "Гиппель-Линдау E3 убиквитин лигаза" или "убиквитин лигаза" используется для описания участка связывания с мишеневым(ыми) ферментом(ами) фрагментов убиквитин лигазы в бифункциональных (химерных) соединениях в соответствии с настоящим изобретением. VCB E3 представляет собой белок, который в комбинации с E2 убиквитин-конъюгирующим ферментом вызывает присоединение убиквитина к лизину на белке-мишени; E3 убиквитин лигаза выявляет специфические белковые субстраты для деградации протеасомой. Так, E3 убиквитин лигаза отдельно или в комплексе с E2 убиквитин конъюгирующим ферментом ответственна за перемещение убиквитина к белкам-мишеням. Обычно убиквитин лигаза участвует в полиубиквитинилировании, таким образом, что второй убиквитин присоединяется к первому, третий присоединяется ко второму и так далее. Полиубиквитинилирование помечает белки для деградации протеасомой. Однако имеются несколько случаев убиквитинилирования, которые ограничиваются моноубиквитинилированием, при котором только один убиквитин добавляется убиквитин лигазой к молекуле субстрата. Моноубиквитинилированные белки не являются мишенью для протеасомы для деградации, но вместо этого может быть изменена их клеточная локализация или функция, например, посредством связывания с другими белками, которые имеют домены, способные к связыванию с убиквитином. Еще больше осложняет дело, что различные лизины на убиквитине могут быть мишенями для E3 с образованием цепей. Наиболее распространенным лизином является Lys48 на цепи убиквитина. Это лизин, используемый для образования полиубиквитина, который распознается протеасомой.
Термин "фрагмент белка-мишени" или PTM используется для описания небольшой молекулы, которая присоединяется к белку-мишени или другому белку или полипептиду, представляющему интерес, и размещается/представлена таким образом, чтобы белок или полипептид был поблизости от убиквитин лигазы, чтобы могла происходить деградация белка или полипептида убиквитин лигазой. Неограничивающие примеры небольших молекул, связывающихся с фрагментами белка-мишени, включают, среди множества других, ингибиторы Hsp90, ингибиторы киназы, ингибиторы MDM2, соединения, нацеленные на человеческие белки BET, содержащие бромодомен, ингибиторы HDAC, ингибиторы человеческой лизин метилтрансферазы, ингибиторы ангиогенезиса, иммуносупрессивные соединения и соединения, нацеленные на арил-гидрокарбоновый рецептор (AHR). Композиции, описанные далее, иллюстрируют некоторые члены этих девяти типов небольших молекул белка-мишени.
Фрагменты белка-мишени, в соответствии с настоящим изобретением, включают, например, ингибиторы галоалкан галогеназы, ингибиторы Hsp90, ингибиторы киназы, ингибиторы MDM2, соединения, нацеленные на человеческие белки BET, содержащие бромодомен, ингибиторы HDAC, ингибиторы человеческой лизин метилтрансферазы, ингибиторы ангиогенезиса, иммуносупрессивные соединения и соединения, нацеленные на арил-гидрокарбоновый рецептор (AHR). Композиции, описанные далее, иллюстрируют некоторые члены этих типов связывающих фрагментов небольших молекул белка-мишени. Такие связывающие фрагменты небольших молекул белка-мишени также включают фармацевтически приемлемые соли, энантиомеры, сольваты и полиморфы этих композиций, а также другие небольшие молекулы, которые могут направлять представляющий интерес белок. Ссылки, которые цитируются ниже, включены в данный документ в качестве ссылок во всей их полноте.
I. Ингибиторы белка теплового шока 90 (HSP90):
Игибиторы HSP90, как используется в настоящем документе, включают, но этим не ограничиваются:
1. Ингибиторы Hsp90, указанные в работе Vallee, et al., "Tricyclic Series of Heat Shock Protein 90 (HSP90) Inhibitors Part I: Discovery of Tricyclic Imidazo[4,5-C]Pyridines as Potent Inhibitors of the HSP90 Molecular Chaperone (2011) J.Med.Chem. 54: 7206, включая
YKB
N-[4-(3H-ИМИДАЗО[4,5-C]ПИРИДИН-2-ИЛ)-9H-ФЛУОРЕН-9-ИЛ]-СУКЦИНАМИД:
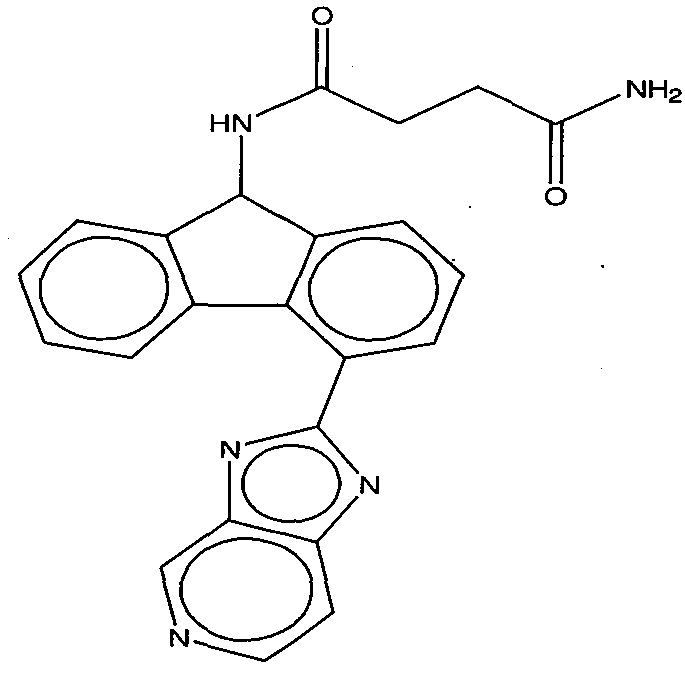 ,
,
дериватизированный, где линкерная группа L или группа  присоединена через концевую амидную группу;
присоединена через концевую амидную группу;
2. Ингибитор Hsp90 p54 (модифицированный):
p54
8-[(2,4-диметилфенил)сульфанил]-3-пент-4-ин-1-ил-3H-пурин-6-амин:
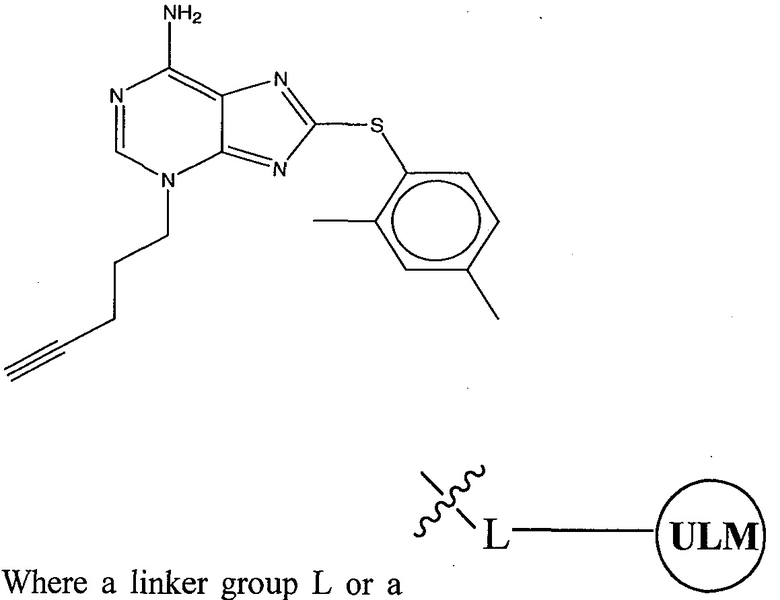 ,
,
где линкерная группа L или группа  присоединена через концевую ацетиленовую группу;
присоединена через концевую ацетиленовую группу;
3. Ингибиторы Hsp90 (модифицированные), указанные в работе Brough, et al., "4,5-Diarylisoxazole HSP90 Chaperone Inhibitors: Potential Therapeutic Agents for the Treatment of Cancer", J.MED.CHEM. vol: 51, pag:196 (2008), включая соединение 2GJ (5-[2,4-(ДИГИДРОКСИ-5-(1-МЕТИЛЭТИЛ)ФЕНИЛ]-N-ЭТИЛ-4-[4-(МОРФОЛИН-4-ИЛМЕТИЛ)ФЕНИЛ]ИЗОКСАЗОЛ-3-КАРБОКСАМИД), имеющие структуру:
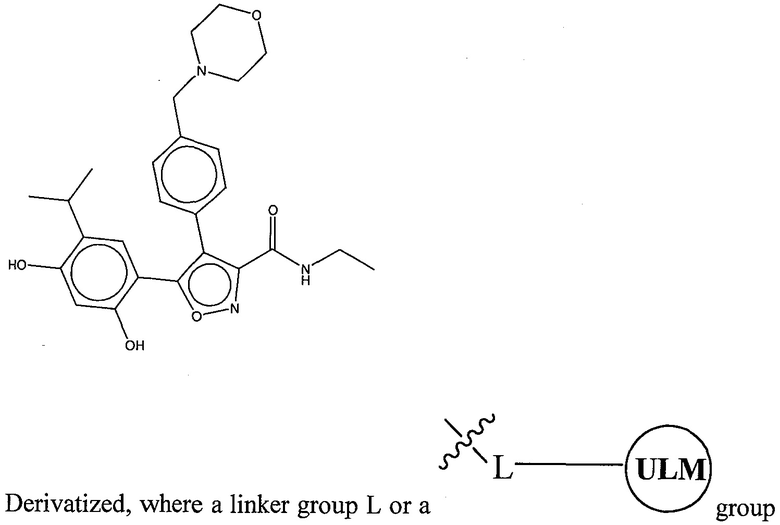 ,
,
дериватизированный, где линкерная группа L или группа  присоединена через амидную группу (по амино или алкильной группе на амине);
присоединена через амидную группу (по амино или алкильной группе на амине);
4. Ингибиторы Hsp90 (модифицированные), указанные в работе Wright, et al., Structure-Activity Relationships in Purine-Based Inhibitor Binding to HSP90 Isoforms, Chem Biol. 2004 Jun; 11(6):775-85, включая ингибитор Hsp90 PU3, имеющие структуру:
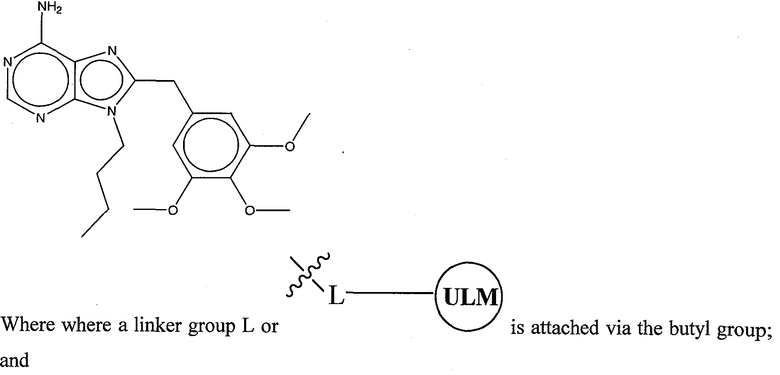 ,
,
где линкерная группа L или группа  присоединена через бутильную группу; и
присоединена через бутильную группу; и
5. Ингибитор Hsp90 Гелданамицин ((4E,6Z,8S,9S,10E,12S,13R,14S,16R)-13-гидрокси-8,14,19-триметокси-4,10,12,16-тетраметил-3,20,22-триоксо-2-азабицикло[16.3.1] (дериватизированный) или любые его производные (например, 17-алкиламино-17-дезметоксигелданамицин ("17-AAG") или 17-(2-диметиламиноэтил)амино-17-дезметоксигелданамицин ("17-DMAG")) (дериватизированный, где линкерная группа L или группа  присоединена через амидную группу).
присоединена через амидную группу).
II. Ингибиторы киназы и фосфатазы:
Ингибиторы киназы, как используется в настоящем документе, включают, но этим не ограничиваются:
1. Производное ингибитора тирозинкиназы Эрлотиниб:
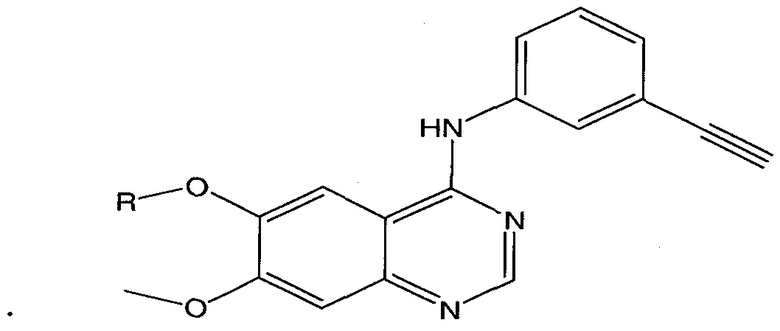 ,
,
где R представляет собой линкерную группу L или группу  , присоединенную через группу простого эфира;
, присоединенную через группу простого эфира;
2. Ингибитор киназы Сунитаниб (дериватизированный):
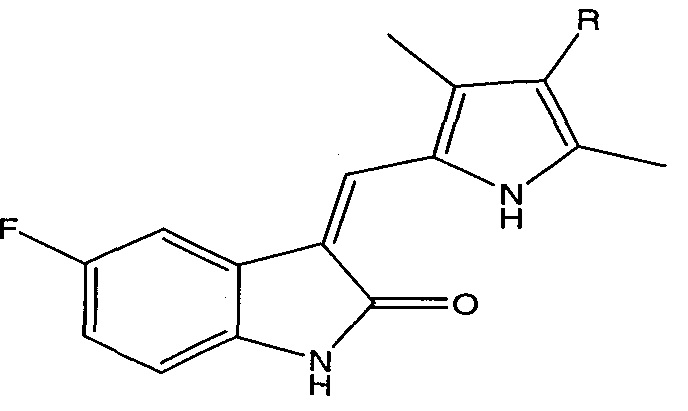 ,
,
(дериватизированный, где R представляет собой линкерную группу L или группу  , присоединенную к пиррольной группе);
, присоединенную к пиррольной группе);
3. Ингибитор киназы Сорафениб (дериватизированный):
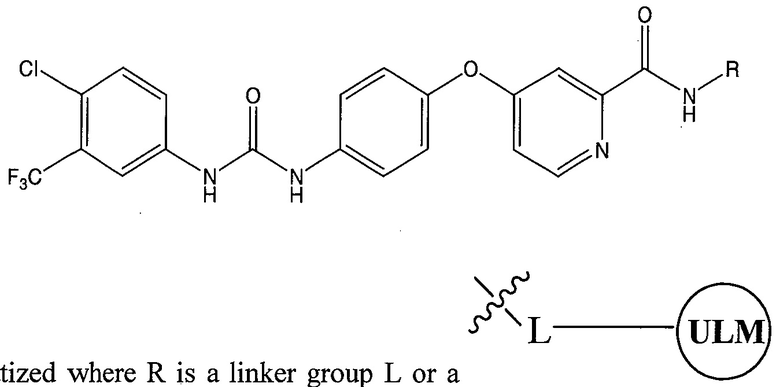 ,
,
(дериватизированный, где R представляет собой линкерную группу L или группу  , присоединенную к фенильной группе);
, присоединенную к фенильной группе);
4. Ингибитор киназы Дезатиниб (дериватизированный):
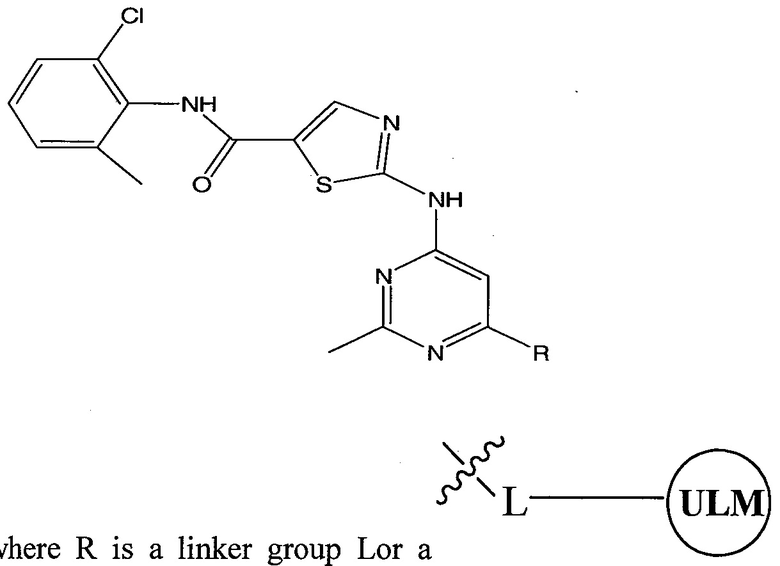
(дериватизированный, где R представляет собой линкерную группу L или группу  , присоединенную к группе пиримидина);
, присоединенную к группе пиримидина);
5. Ингибитор киназы лапатиниб (дериватизированный):
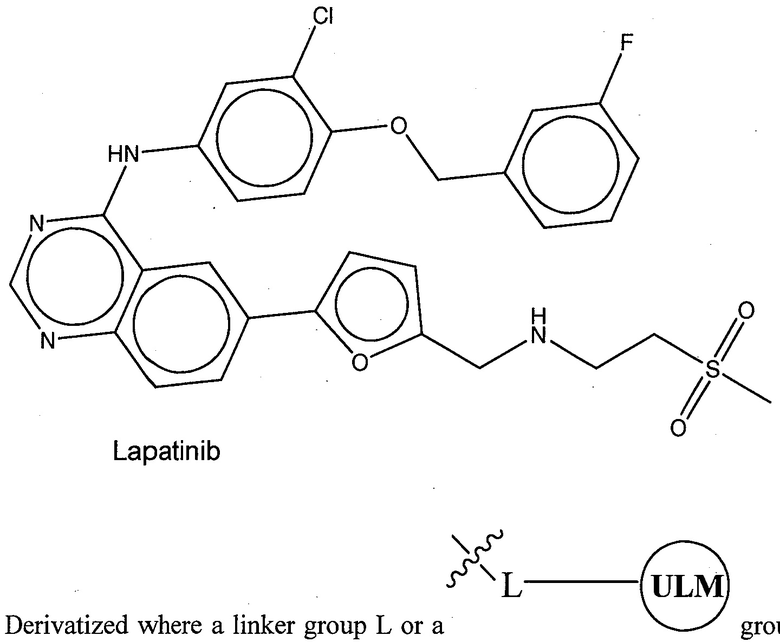 ,
,
дериватизированный, где линкерная группа L или группа  присоединена через концевой метилсульфонил метильной группы;
присоединена через концевой метилсульфонил метильной группы;
6. Ингибитор киназы U09-CX-5279 (дериватизированный):
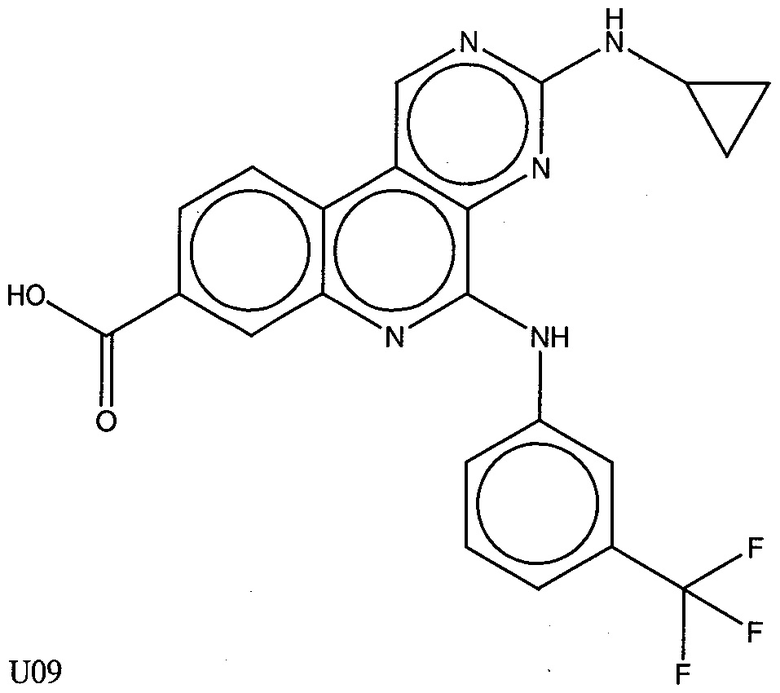 ,
,
CX-5279
3-(циклопропиламино)-5-{[3-(трифторметил)фенил]амино}пиримидо[4,5-c]хинолин-8-карбоновая кислота,
дериватизированный, где линкерная группа L или группа  присоединена через амин (анилин), карбоновую кислоту или амин в положении альфа к циклопропильной группе, или циклопропильную группу;
присоединена через амин (анилин), карбоновую кислоту или амин в положении альфа к циклопропильной группе, или циклопропильную группу;
7. Ингибиторы киназ, указанные в работе Millan, et al., Design и Synthesis of Inhaled P38 Inhibitors for the Treatment of Chronic Obstructive Pulmonary Disease, J. MED. CHEM. vol:54, pag:7797 (2011), включая ингибиторы киназ Y1W и Y1X (дериватизированные), имеющие структуры:
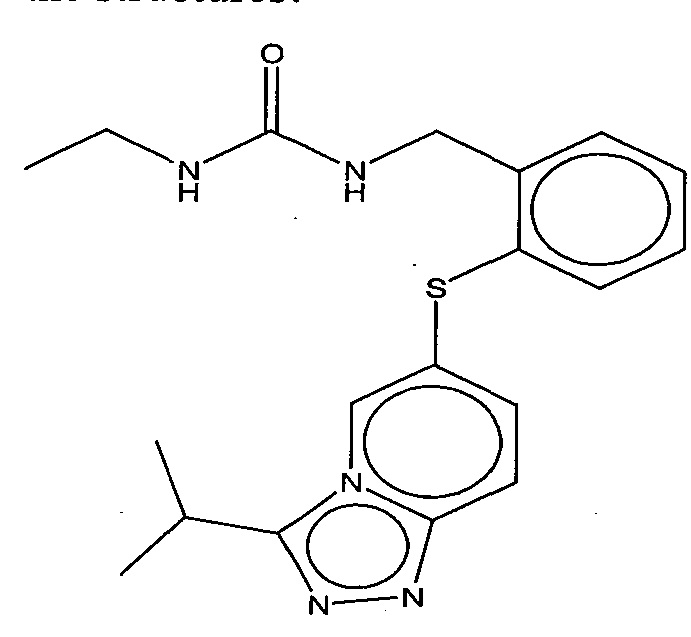
YIX
1-этил-3-(2-{[3-(1-метилэтил)[1,2,4]триазолo[4,3-a]пиридин-6-ил]сульфанил}бензил)мочевина,
дериватизированная, где линкерная группа L или группа  присоединена через пропильную группу;
присоединена через пропильную группу;
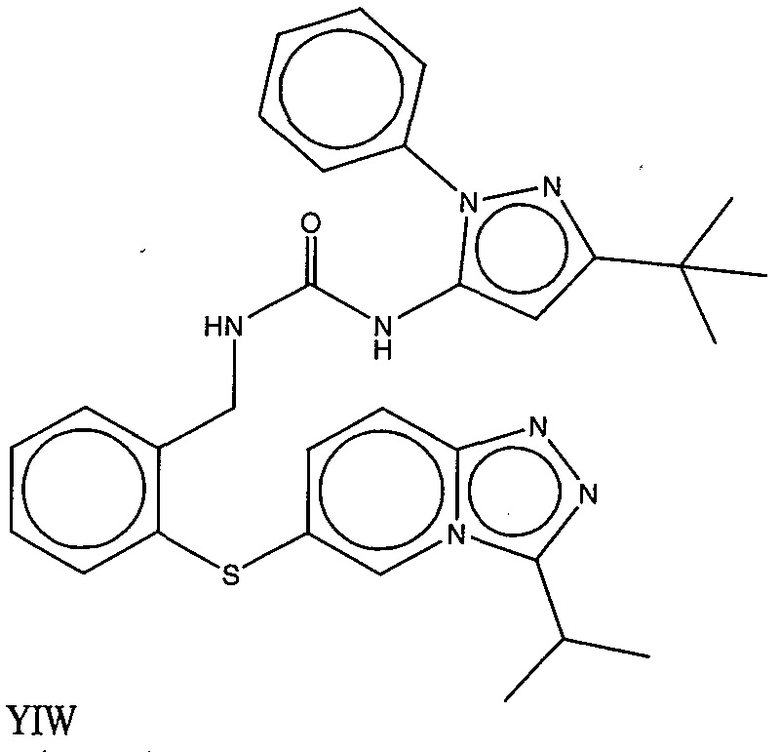
1-(3-трет-бутил-1-фенил-1H-пиразол-5-ил)-3-(2-{[3-(1-метилэтил)[1,2,4]триазолo[4,3-a]пиридин-6-ил]сульфанил}бензил)мочевина,
дериватизированная, где линкерная группа L или группа  присоединена предпочтительно посредством либо пропильной группы, либо бутильной группы;
присоединена предпочтительно посредством либо пропильной группы, либо бутильной группы;
8. Ингибиторы киназ, указанные в работе Schenkel, et al., Discovery of Potent and Highly Selective Thienopyridine Janus Kinase 2 Inhibitors J. Med. Chem., 2011, 54(24), pp-8450, включая соединения 6TP и 0TP (дериватизированные), имеющие структуры:
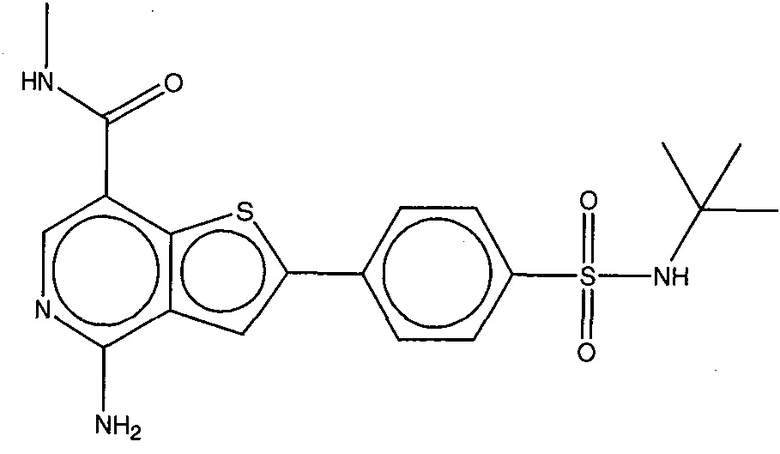
6TP
4-амино-2-[4-(трет-бутилсульфамоил)фенил]-N-метилтиено[3,2-c]пиридин-7-карбоксамид
Тиенопиридин 19
дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через концевую метильную группу, связанную с амидной группой;
присоединена предпочтительно через концевую метильную группу, связанную с амидной группой;
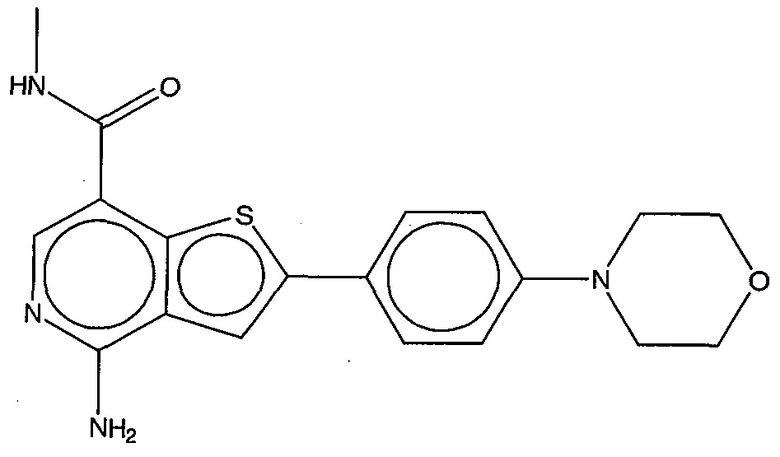
0TP
4-амино-N-метил-2-[4-(морфолин-4-ил)фенил]тиено[3,2-c]пиридин-7-карбоксамид
Тиенопиридин 8
дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через концевую метильную группу, связанную с амидной группой;
присоединена предпочтительно через концевую метильную группу, связанную с амидной группой;
9. Ингибиторы киназ, указанные в работе Van Eis, et al., "2,6-Naphthyridines as potent and selective inhibitors of the novel protein kinase C isozymes", Biorg. Med. Chem. Lett. 2011 Dec 15; 21(24):7367-72, включая ингибитор киназы 07U, имеющие структуру:
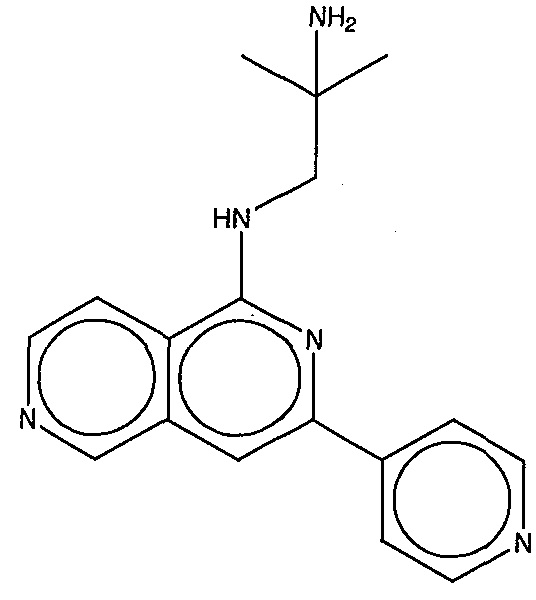
07U
2-метил-N~1~-[3-(пиридин-4-ил)-2,6-нафтиридин-1-ил]пропан-1,2-диамин
дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через вторичный амин или концевую аминогруппу;
присоединена предпочтительно через вторичный амин или концевую аминогруппу;
10. Ингибиторы киназ, указанные в работе Lountos, et al., "Structural Characterization of Inhibitor Complexes with Checkpoint Kinase 2 (Chk2), a Drug Target for Cancer Therapy", J.STRUCT.BIOL. vol: 176, pag:292 (2011), включая ингибитор киназы YCF, имеющий структуру:
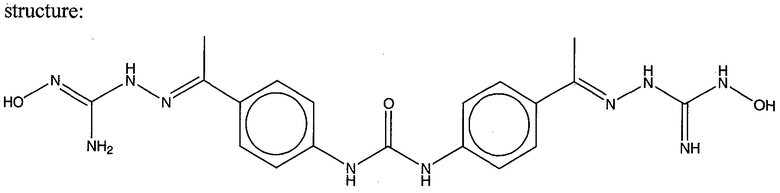
дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через любую концевую гидроксильную группу;
присоединена предпочтительно через любую концевую гидроксильную группу;
11. Ингибиторы киназ, указанные в работе Lountos, et al., "Structural Characterization of Inhibitor Complexes with Checkpoint Kinase 2 (Chk2), a Drug Target for Cancer Therapy", J.STRUCT.BIOL. vol:176, pag:292 (2011), включая ингибиторы киназ XK9 и NXP (дериватизированные), имеющие структуры:
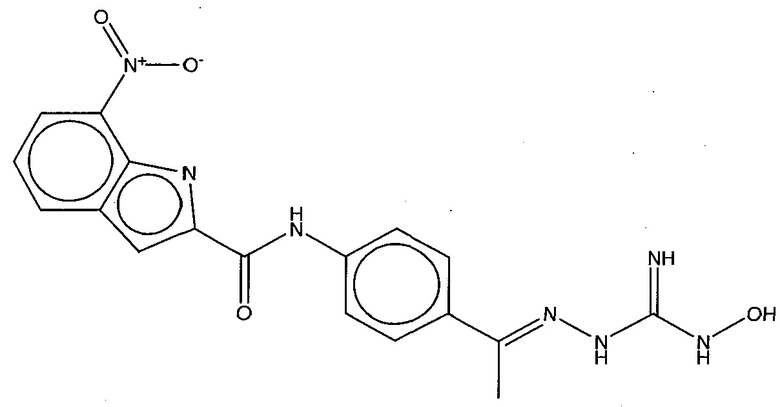
XK9
N-{4-[(1E)-N-(N-гидроксикарбамимидоил)этангидразоноил]фенил}-7-нитро-1H-индол-2-карбоксамид
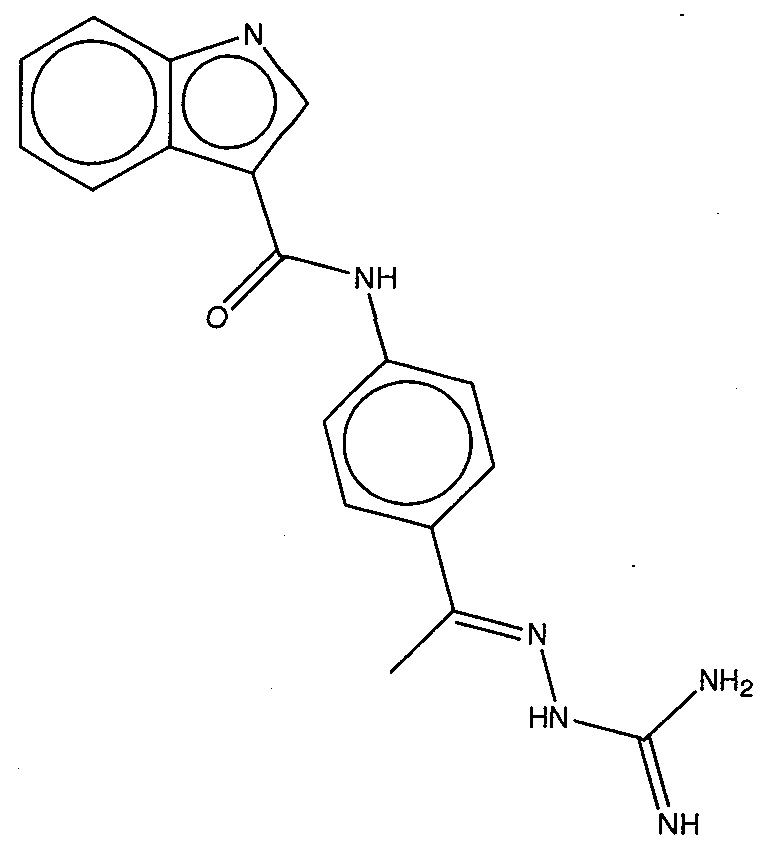
NXP
N-{4-[(1E)-N-КАРБАМИМИДОИЛЭТАНГИДРАЗОНОИЛ]ФЕНИЛ}-1H-ИНДОЛ-3-КАРБОКСАМИД
дериватизированный, где линкерная группа L или группа 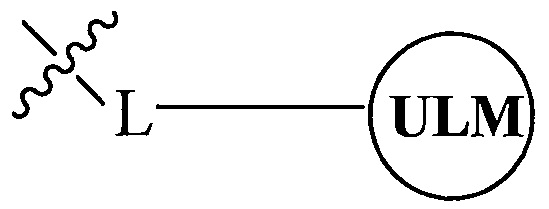 присоединены предпочтительно через концевую гидроксильную группу (XK9) или гидразоновую группу (NXP);
присоединены предпочтительно через концевую гидроксильную группу (XK9) или гидразоновую группу (NXP);
12. Ингибитор киназы Афатиниб (дериватизированный) (N-[4-[(3-хлор-4-фторфенил)амино]-7-[[(3S)-тетрагидро-3-фуранил]окси]-6-хиназолинил]-4(диметиламино)-2-бутенамид) (дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через алифатическую аминогруппу);
присоединена предпочтительно через алифатическую аминогруппу);
13. Ингибитор киназы Фостаматиниб (дериватизированный) ([6-({5-фтор-2-[(3,4,5-триметоксифенил)амино]пиримидин-4-ил}амино)-2,2-диметил-3-оксо-2,3-дигидро-4H-пиридо[3,2-b]-l,4-оксазин-4-ил]метил динатрий фосфат гексагидрат) (дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через метокси группу);
присоединена предпочтительно через метокси группу);
14. Ингибитор киназы Гефитиниб (дериватизированный) (N-(3-хлор-4-фтор-фенил)-7-метокси-6-(3-морфолин-4-илпропокси)хиназолин-4-амин) (дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через метокси или эфирную группу);
присоединена предпочтительно через метокси или эфирную группу);
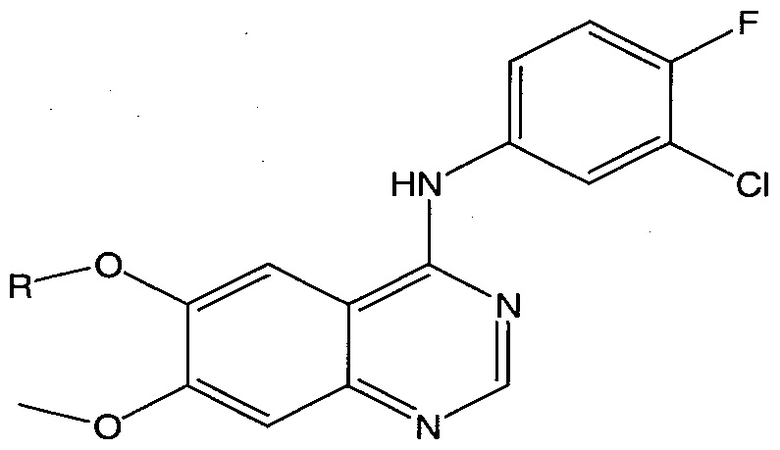
15. Ингибитор киназы Ленватиниб (дериватизированный) (4-[3-хлор-4-(циклопропилкарбамоиламино)фенокси]-7-метокси-хинолин-6-карбоксамид) (дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через циклопропильную группу);
присоединена предпочтительно через циклопропильную группу);
16. Ингибитор киназы Вандетаниб (дериватизированный) (N-(4-бром-2-фторфенил)-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хиназолин-4-амин) (дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через метокси или гидроксильную группу); и
присоединена предпочтительно через метокси или гидроксильную группу); и
17. Ингибитор киназы Вемурафениб (дериватизированный) (пропан-1-сульфоновая кислота {3-[5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфенил}амид) (дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через сульфонилпропильную группу);
присоединена предпочтительно через сульфонилпропильную группу);
18. Ингибитор киназы Гливек (дериватизированный):
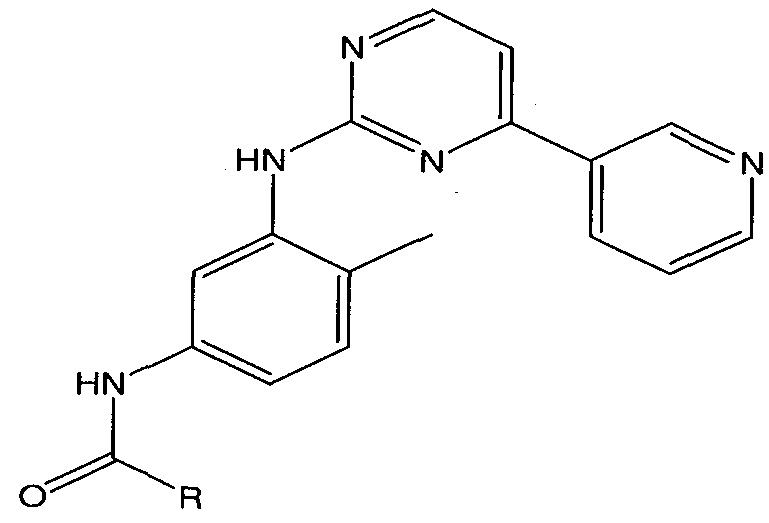
(дериватизированный, где R как линкерная группа L или группа  , которые присоединены предпочтительно через амидную группу или аминогруппу анилина);
, которые присоединены предпочтительно через амидную группу или аминогруппу анилина);
19. Ингибитор киназы Пазопаниб (дериватизированный) (ингибитор VEGFR3):
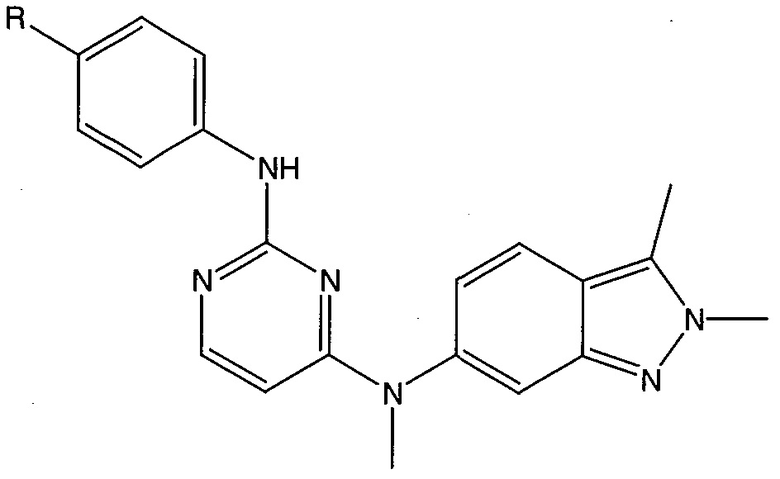
(дериватизированный, где R представляет собой линкерную группу L или группу  , присоединенные предпочтительно к фенильному фрагменту или через аминогруппу анилина);
, присоединенные предпочтительно к фенильному фрагменту или через аминогруппу анилина);
20. Ингибитор киназы AT-9283 (дериватизированный) ингибитор киназы семейства Aurora:
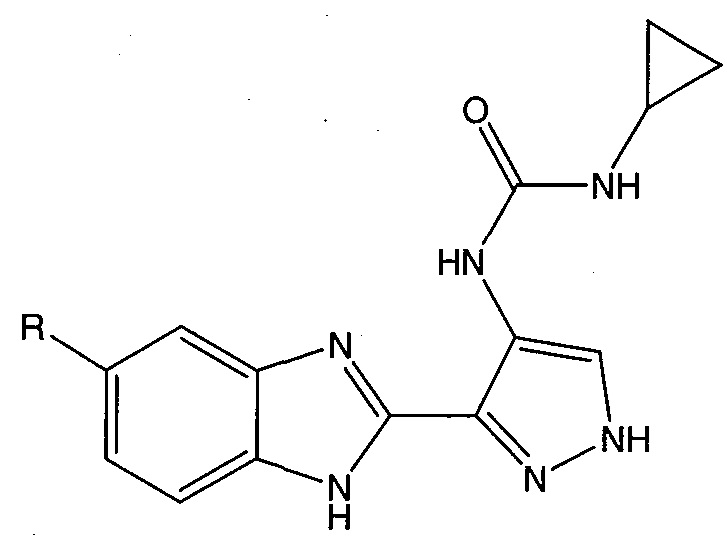
(где R представляет собой линкерную группу L или группу  , которые присоединены предпочтительно к фенильной группе;
, которые присоединены предпочтительно к фенильной группе;
21. Ингибитор киназы TAE684 (дериватизированный) ингибитор ALK:
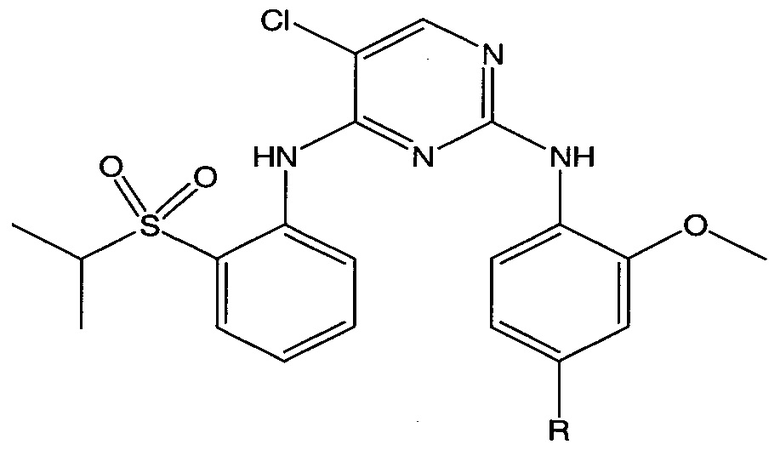
(где R представляет собой линкерную группу L или группу  , которые присоединены предпочтительно к фенильной группе);
, которые присоединены предпочтительно к фенильной группе);
22. Ингибитор киназы Нилотаниб (дериватизированный) ингибитор Abl:
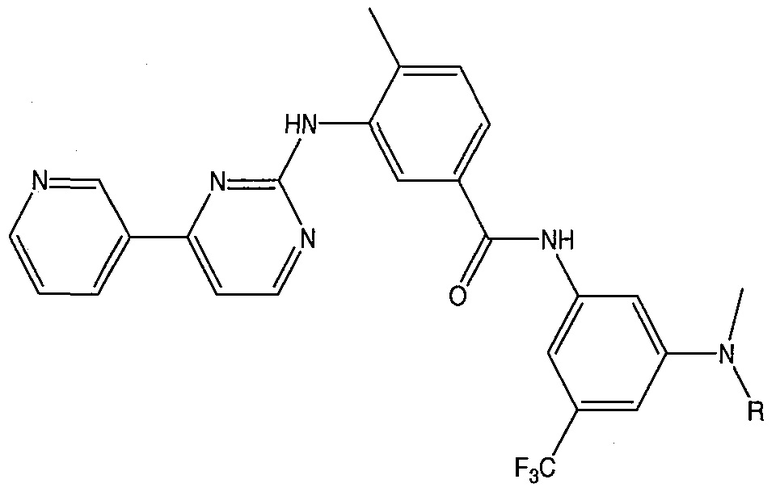
(дериватизированный, где R представляет собой линкерную группу L или группу  , которые присоединены предпочтительно к фенильной группе или к аминогруппе анилина);
, которые присоединены предпочтительно к фенильной группе или к аминогруппе анилина);
27. Ингибитор киназы NVP-BSK805 (дериватизированный) ингибитор JAK2:
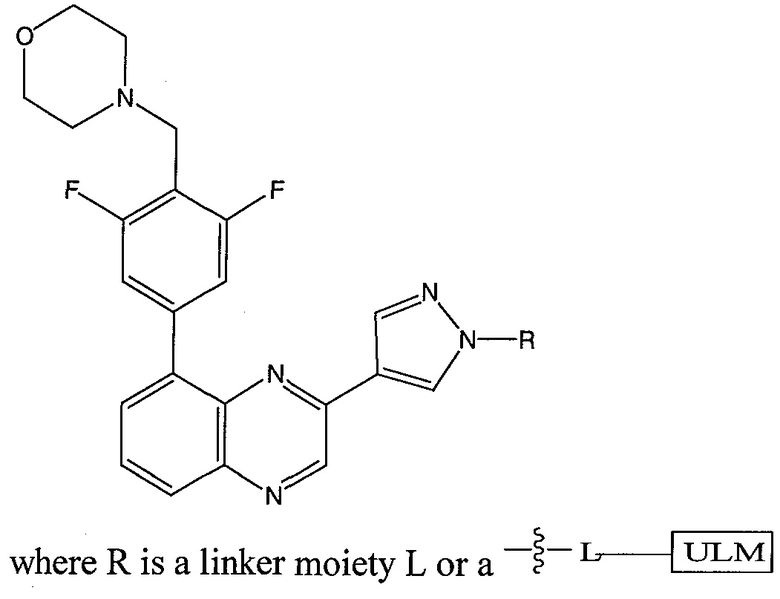
(дериватизированный, где R представляет собой линкерную группу L или группу  , которые присоединены предпочтительно к фенильной группе или к диазольной группе);
, которые присоединены предпочтительно к фенильной группе или к диазольной группе);
28. Ингибитор киназы Кризотиниб дериватизированный ингибитор Alk:
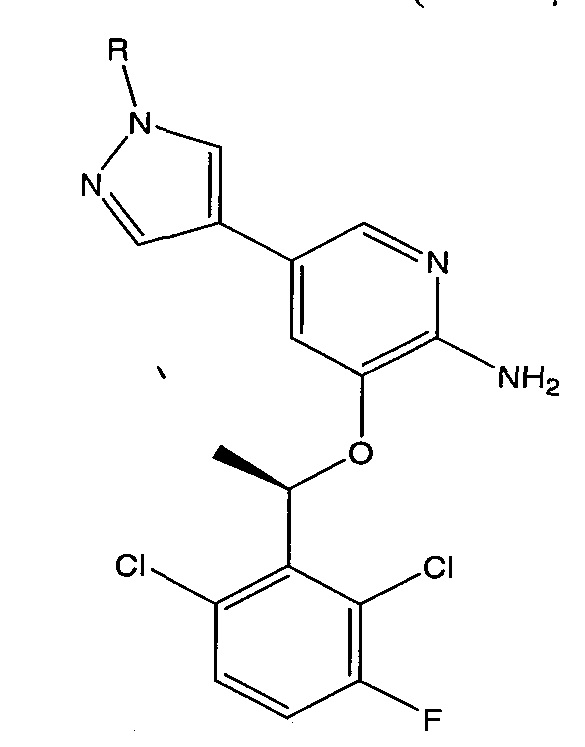
(дериватизированный, где R представляет собой линкерную группу L или группу  , которые присоединены предпочтительно к фенильной группе или к диазольной группе);
, которые присоединены предпочтительно к фенильной группе или к диазольной группе);
29. Ингибитор киназы JNJ (дериватизированный) ингибитор FMS:
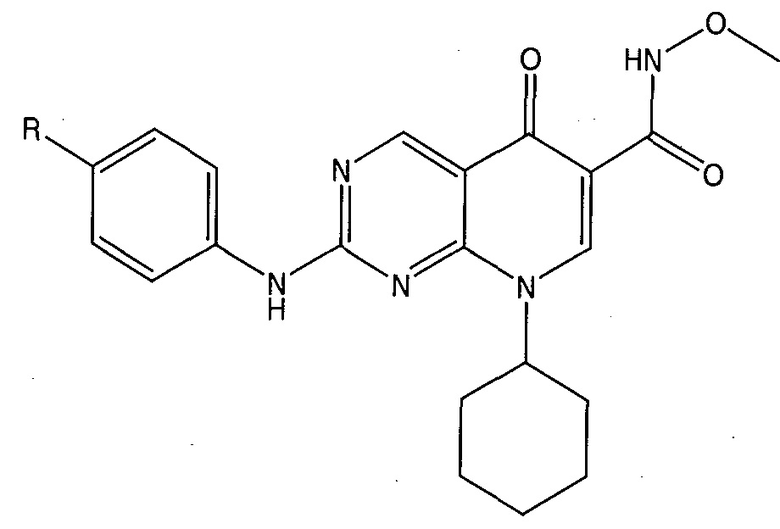
(дериватизированный, где R представляет собой линкерную группу L или группу  , которые присоединены предпочтительно к фенильной группе);
, которые присоединены предпочтительно к фенильной группе);
30. Ингибитор киназы Форетиниб (дериватизированный) ингибитор Met:
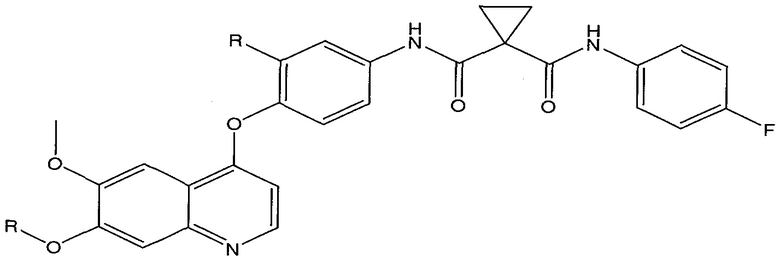
(дериватизированный, где R представляет собой линкерную группу L или группу  , которые присоединены к фенильной группе или к гидроксильной или группе простого эфира на хинолиновой группе);
, которые присоединены к фенильной группе или к гидроксильной или группе простого эфира на хинолиновой группе);
31. Аллостерический ингибитор протеинтирозинфосфатазы PTPIB (дериватизированный):
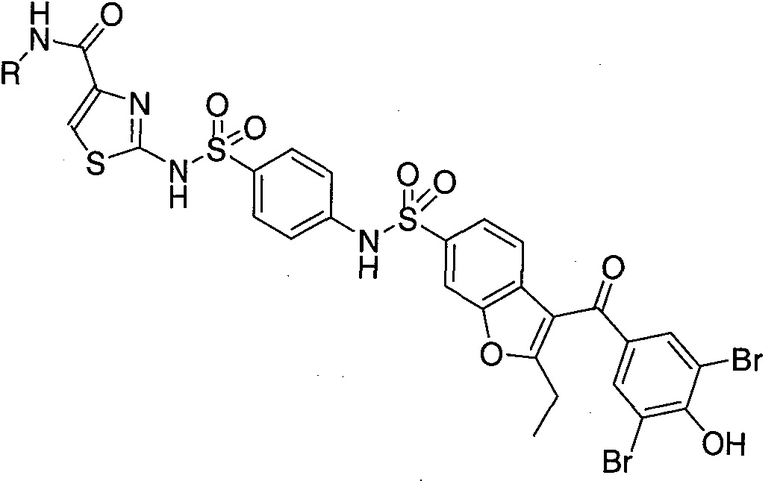 ,
,
дериватизированный, где линкерная группа L или группа  предпочтительно присоединены к R, как указано.
предпочтительно присоединены к R, как указано.
32. Ингибитор SHP-2 домен тирозинфосфатазы (дериватизированный):
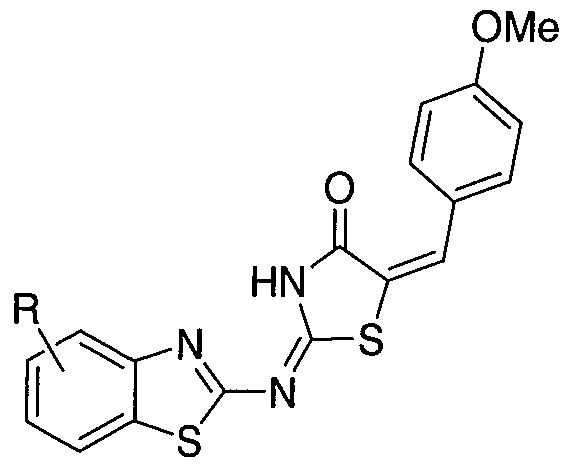 ,
,
дериватизированный, где линкерная группа L или группа  присоединены предпочтительно к R.
присоединены предпочтительно к R.
33. Ингибитор киназы (дериватизированный) BRAF (BRAFV600E)/MEK:
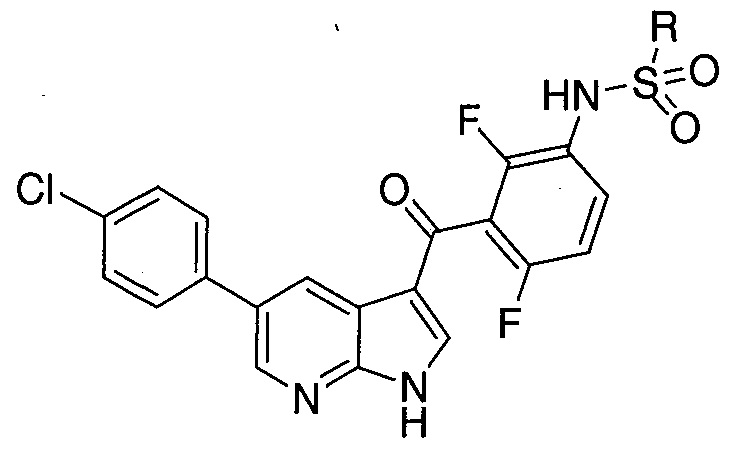
дериватизированный, где линкер L или группа  присоединены предпочтительно к R.
присоединены предпочтительно к R.
34. Ингибитор (дериватизированный) тирозинкиназы ABL:

(дериватизированный, где «R» обозначает сайт присоединения линкерной группы L или группы  на пиперазиновой группе).
на пиперазиновой группе).
III. Ингибиторы MDM2:
Ингибиторы MDM2, как используется в настоящем документе, включают, но этим не ограничиваются:
1. Ингибиторы MDM2, указанные в работах Vassilev, et al., In vivo activation of the p53 pathway by small-molecule antagonists of MDM2, SCIENCE vol:303, pag:844-848 (2004), и Schneekloth, et al., Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics, Bioorg. Med. Chem. Lett. 18 (2008) 5904-5908, включая (или дополнительно) соединения нутлин-3, нутлин-2 и нутлин-1 (дериватизированные), описанные выше, а также их производные и аналоги:
(дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через метокси группу или гидроксильную группу);
присоединена предпочтительно через метокси группу или гидроксильную группу);
(дериватизированный, где линкерная группа L или группа  присоединена предпочтительно через метокси группу или гидроксильную группу);
присоединена предпочтительно через метокси группу или гидроксильную группу);
(дериватизированный, где линкерная группа L или группа  присоединена через метокси группу или гидрокси группу); и
присоединена через метокси группу или гидрокси группу); и
2. Транс-4-йод-4′-боранил-халкон:
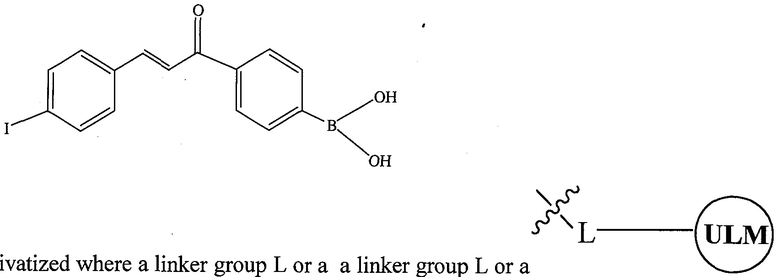
(дериватизированный, где линкерная группа L или группа  присоединена через гидрокси группу).
присоединена через гидрокси группу).
IV. Соединения, нацеленные на человеческие белки BET, содержащие бромодомен:
Соединения, нацеленные на человеческие белки BET, содержащие бромодомен, включают, но этим не ограничиваются, соединения, ассоциированные с мишенями, как описано далее, где "R" обозначает сайт присоединения линкерной группы L или группы  :
:
1.
Белки-мишени: Brd2, Brd3, Brd4
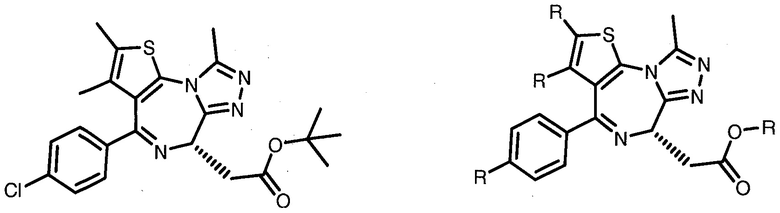
JQl, Filippakopoulos et al. Selective inhibition of BET.bromodomains. Nature (2010)
2.
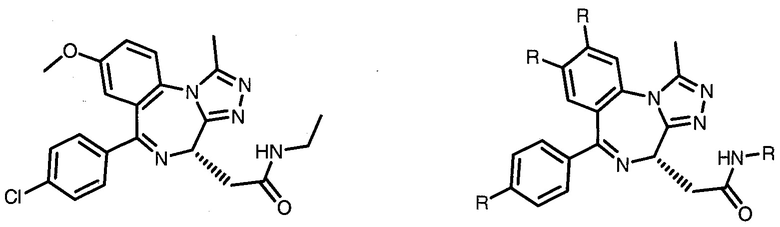
I-BET, Nicodeme et al. Suppression of inflammation by a synthetic histone mimic. Nature (2010), Chung et al. Discovery и Characterization of Small Molecule Inhibitors of the BET Family Bromodomains. Journal of medicinal chemistry (2011)
3.

4d, Hewings et al. 3,5-Dimethylisoxazoles Act As Acetyl-lysine-mimetic Bromodomain Ligands. J. Med. Chem. (2011) vol. 54(19) pp. 6761-70
4.
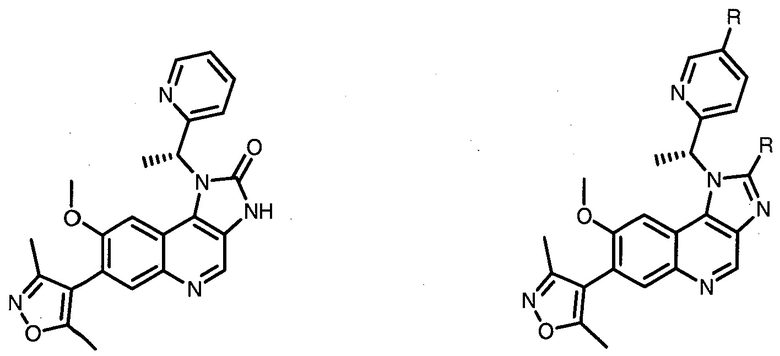
I-BET151, Dawson et al. Inhibition of BET recruitment to chromatin as an effective treatment for MLL-fusion leukaemia. Nature (2011)
(где R в каждом случае обозначает сайт присоединения линкерной группы L или группы  ).
).
V. Ингибиторы HDAC:
Ингибиторы HDAC (дериватизированные) включают, но этим не ограничиваются:
1.
Finnin, M.S. et al. Structures of a histone deacetylase homologue bound to the TSA и SAHA inhibitors. Nature 401, 188-193 (1999).
(Дериватизированные, где "R" обозначает сайт присоединения линкерной группы L или группы  ); и
); и
2. Соединения, представленные формулой (I) в PCТ WO0222577 ("DEACETYLASE INHIBITORS") (дериватизированные, где линкерная группа L или группа  присоединена через гидроксильную группу).
присоединена через гидроксильную группу).
VI. Ингибиторы человеческой лизин метилтрансферазы:
Ингибиторы человеческой лизин метилтрансферазы включают, но этим не ограничиваются:
1.
BIX-01294
Chang et al. Structural basis for G9a-like protein lysine methyltransferase inhibition by BIX-01294. Nat Struct Mol Biol (2009) vol. 16(3) pp. 312-7
(Дериватизированные, где "R" обозначает сайт присоединения линкерной группы L или группы  );
);
2.
UNC0224
Liu F, Chen X, Allali-Hassani A, et al. Discovery of a 2,4-diamino-7-aminoalkoxyquinazoline as a potent and selective inhibitor of histone lysine methyltransferase G9a. J Med Chem 2009; 52(24):7950-3
(Дериватизированные, где "R" обозначает возможный сайт присоединения линкерной группы L или группы  );
);
3. Азацитидин (дериватизированный) (4-амино-1-β-D-рибофуранозил-1,3,5-триазин-2(1H)-он)
(дериватизированный, где линкерная группа L или группа  присоединена через гидрокси или амино группы); и
присоединена через гидрокси или амино группы); и
4. Децитабин (дериватизированный) (4-амино-1-(2-деокси-b-D-эритро-пентофуранозил)-1,3,5-триазин-2(1H)-он) (дериватизированный, где линкерная группа L или группа  присоединена либо через гидрокси группу, либо через аминогруппу).
присоединена либо через гидрокси группу, либо через аминогруппу).
VII. Ингибиторы ангиогенезиса:
Ингибиторы ангиогенезиса включают, но этим не ограничиваются:
1. GA-1 (дериватизированный) и его производные и аналоги, имеющий структуру(ы) и связанный с линкерами, как описано в работе Sakamoto, et al., Development of Protacs to target cancer-promoting proteins for ubiquitination and degradation, Mol Cell Proteomics 2003 Dec; 2(12):1350-8;
2. Эстрадиол (дериватизированный), который может связываться с линкерной группой L или группой  , как это главным образом описано в работе Rodriguez-Gonzalez, et al., Targeting steroid hormone receptors for ubiquitination and degradation in breast and prostate cancer, Oncogene (2008) 27, 7201-7211;
, как это главным образом описано в работе Rodriguez-Gonzalez, et al., Targeting steroid hormone receptors for ubiquitination and degradation in breast and prostate cancer, Oncogene (2008) 27, 7201-7211;
3. Эстрадиол, тестостерон (дериватизированный) и родственные производные, включая, но этим не ограничиваясь, DHT и его производные и аналоги, имеющие структуру(ы) и связанные с линкерной группой L или группой  , как это главным образом описано в работе Sakamoto, et al., Development of Protacs to target cancer-promoting proteins for ubiquitination and degradation, Mol Cell Proteomics 2003 Dec; 2(12):1350-8; и
, как это главным образом описано в работе Sakamoto, et al., Development of Protacs to target cancer-promoting proteins for ubiquitination and degradation, Mol Cell Proteomics 2003 Dec; 2(12):1350-8; и
4. Овалицин, фумагиллин (дериватизированный) и его производные и аналоги, имеющие структуру(ы) и связанные с линкерной группой L или группой  , как это главным образом описано в работе Sakamoto, et al., Protacs: chimeric molecules that target proteins to the Skpl-Cullin-F box complex for ubiquitination and degradation Proc Natl Acad Sci USA. 2001 Jul 17; 98(15):8554-9 и в патенте Соединенных Штатов Америки № 7208157.
, как это главным образом описано в работе Sakamoto, et al., Protacs: chimeric molecules that target proteins to the Skpl-Cullin-F box complex for ubiquitination and degradation Proc Natl Acad Sci USA. 2001 Jul 17; 98(15):8554-9 и в патенте Соединенных Штатов Америки № 7208157.
VIII. Иммуносупрессивные соединения:
Иммуносупрессивные соединения включают, но этим не ограничиваются:
1. AP21998 (дериватизированный), имеющий структуру(ы) и связанный с линкерной группой L или группой  , как это главным образом описано в работе Schneekloth, et al., Chemical Genetic Control of Protein Levels: Selective in Vivo Targeted Degradation, J. AM. CHEM. SOC. 2004, 126, 3748-3754;
, как это главным образом описано в работе Schneekloth, et al., Chemical Genetic Control of Protein Levels: Selective in Vivo Targeted Degradation, J. AM. CHEM. SOC. 2004, 126, 3748-3754;
2. Глюкокортикоиды (например, гидрокортизон, преднизон, преднизолон и метилпреднизолон) (дериватизированный, где линкерная группа L или группа  присоединена, например, к какому-нибудь из гидроксилов) и белокметазон дипропионат (дериватизированный, где линкерная группа L или группа
присоединена, например, к какому-нибудь из гидроксилов) и белокметазон дипропионат (дериватизированный, где линкерная группа L или группа  присоединена, например, к пропионату);
присоединена, например, к пропионату);
3. Метотрексат (дериватизированный, где линкерная группа L или группа  может быть присоединена, например, к какому-нибудь из концевых гидроксилов);
может быть присоединена, например, к какому-нибудь из концевых гидроксилов);
4. Циклоспорин (дериватизированный, где линкерная группа L или группа  может быть присоединена, например, к какой-нибудь из бутильных групп);
может быть присоединена, например, к какой-нибудь из бутильных групп);
5. Такролимус (FK-506) и рапамицин (дериватизированные, где линкерная группа L или группа  может быть присоединена, например, к одной из метокси групп); и
может быть присоединена, например, к одной из метокси групп); и
6. Актиномицины (дериватизированные, где линкерная группа L или группа  может быть присоединена, например, к одной из изопропильных групп).
может быть присоединена, например, к одной из изопропильных групп).
IX. Сединения, нацеленные на арил-гидрокарбоновый рецептор (AHR):
Соединения, нацеленные на арил-гидрокарбоновый рецептор (AHR), включают, но этим не ограничиваются:
1. Апигенин (дериватизированный таким образом, что связан с линкерной группой L или группой  , как в основном описано в работе Lee, et al., Targeted Degradation of Aryl Hydrocarbon Receptor by the PROTAC Approach: A Useful Chemical Genetic Tool, ChemBioChem Volume 8, Issue 17, pages 2058-2062, November 23, 2007); и
, как в основном описано в работе Lee, et al., Targeted Degradation of Aryl Hydrocarbon Receptor by the PROTAC Approach: A Useful Chemical Genetic Tool, ChemBioChem Volume 8, Issue 17, pages 2058-2062, November 23, 2007); и
2. SR1 и LGC006 (дериватизированный таким образом, что линкерная группа L или группа  присоединены), как описано в работе Boitano, et al., Aryl Hydrocarbon Receptor Antagonists Promote the Expansion of Human Hematopoietic Stem Cells, Science 10 September 2010: Vol. 329 no. 5997 pp. 1345-1348.
присоединены), как описано в работе Boitano, et al., Aryl Hydrocarbon Receptor Antagonists Promote the Expansion of Human Hematopoietic Stem Cells, Science 10 September 2010: Vol. 329 no. 5997 pp. 1345-1348.
X. Соединения, нацеленные на рецептор RAF (киназа):
 PLX4032
PLX4032
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ).
).
XI. Соединения, нацеленное на FKBP:
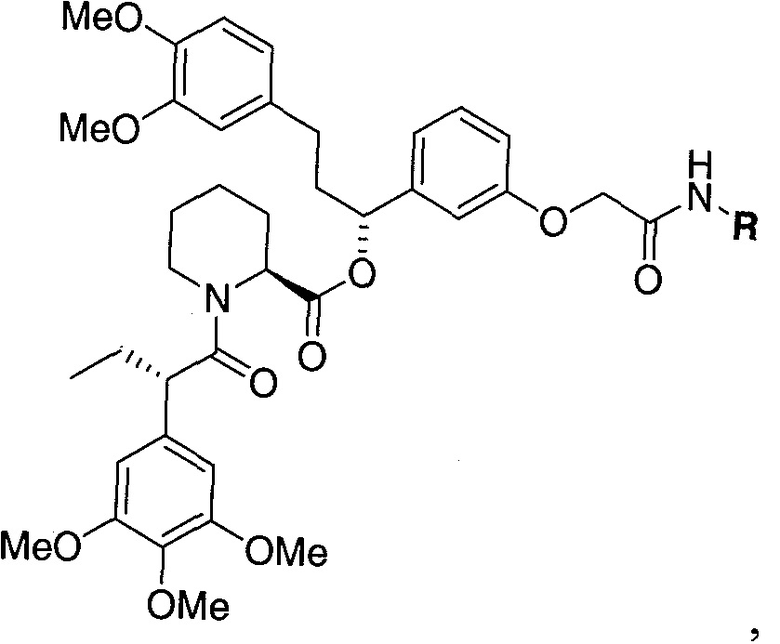
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ).
).
XII. Соединения, нацеленные на андрогенный рецептор (AR)
1. Лиганд RU59063 (дериватизированный) андрогенного рецептора:
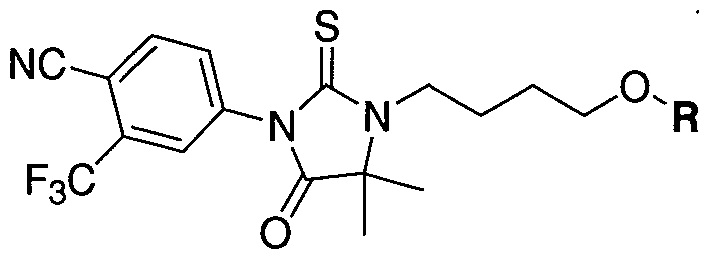
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ).
).
2. Лиганд SARM (дериватизированный) андрогенного рецептора:
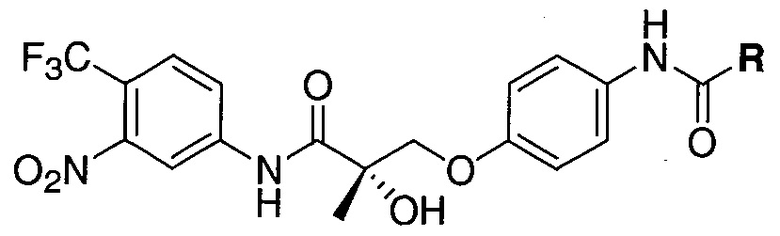
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ).
).
3. Лиганд андрогенного рецептора DHT (дериватизированный):
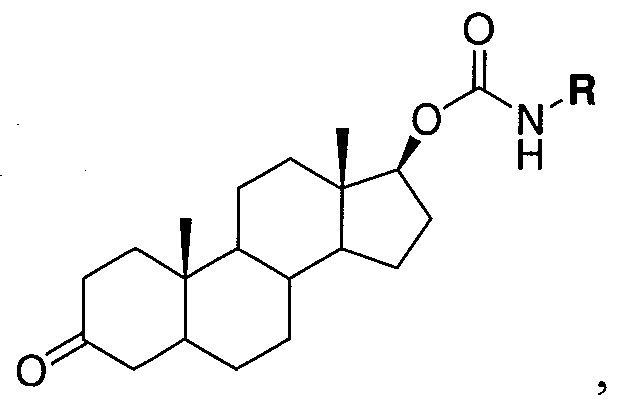
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ).
).
XIII. Соединения, нацеленные на рецептор эстрогена (ER) ICI-182780
1. Лиганд рецептора эстрогена:
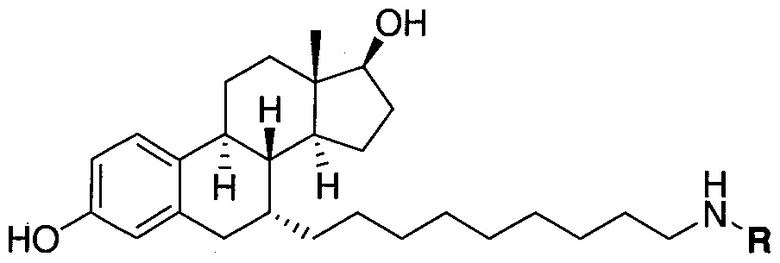
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ).
).
XIV. Соединение, нацеленное на рецептор тироидного гормона (TR)
1. Лиганд рецептора тироидного гормона (дериватизированный):
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы , и MOMO обозначает метоксиметокси группу).
, и MOMO обозначает метоксиметокси группу).
XV. Соединения, нацеленные на протеазу ВИЧ
1. Ингибитор протеазы ВИЧ (дериватизированный):
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ). Смотри, J. Med. Chem. 2010, 53, 521-538.
). Смотри, J. Med. Chem. 2010, 53, 521-538.
2. Ингибитор протеазы ВИЧ:
(дериватизированный, где «R» обозначает возможный сайт присоединения для линкерной группы L или группы ). Смотри, J. Med. Chem. 2010, 53, 521-538.
). Смотри, J. Med. Chem. 2010, 53, 521-538.
XVI. Соединения, нацеленные на интегразу ВИЧ
1. Ингибитор интегразы ВИЧ (дериватизированный):
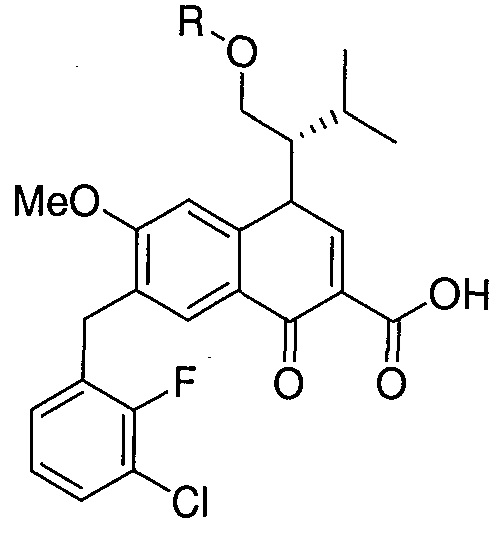
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ). Смотри, J. Med. Chem. 2010, 53, 6466.
). Смотри, J. Med. Chem. 2010, 53, 6466.
2. Ингибитор интегразы ВИЧ (дериватизированный):
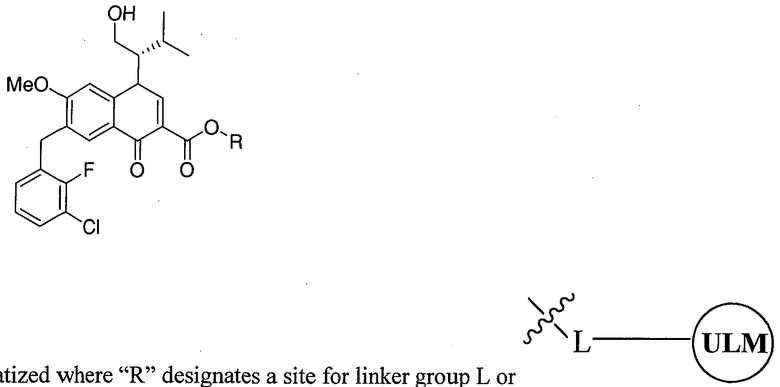
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ). Смотри, J. Med. Chem. 2010, 53, 6466.
). Смотри, J. Med. Chem. 2010, 53, 6466.
XVII. Соединения, нацеленные на протеазу HCV
1. Ингибиторы протеазы HCV (дериватизированный):
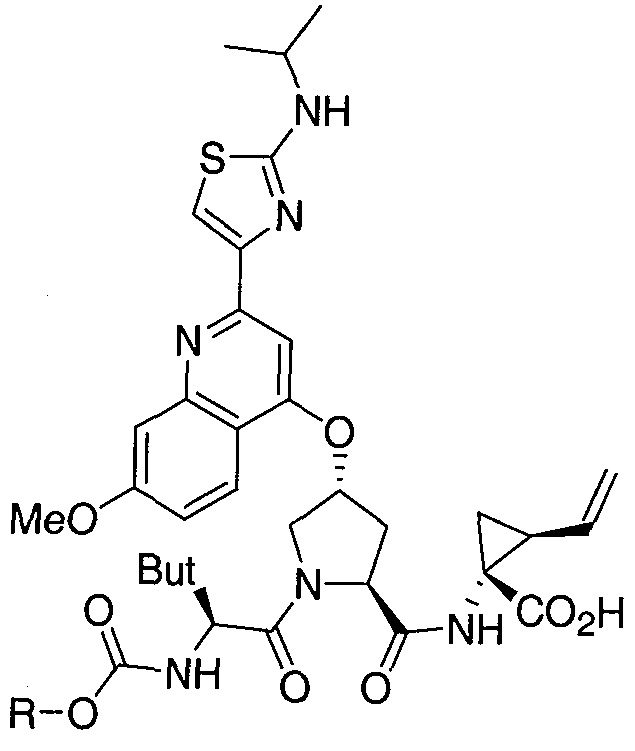
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ).
).
XVIII. Соединения, нацеленные на ацил-белок тиоэстеразу-1 и -2 (APTl и APT2)
1. Ингибитор APTl и APT2 (дериватизированный):
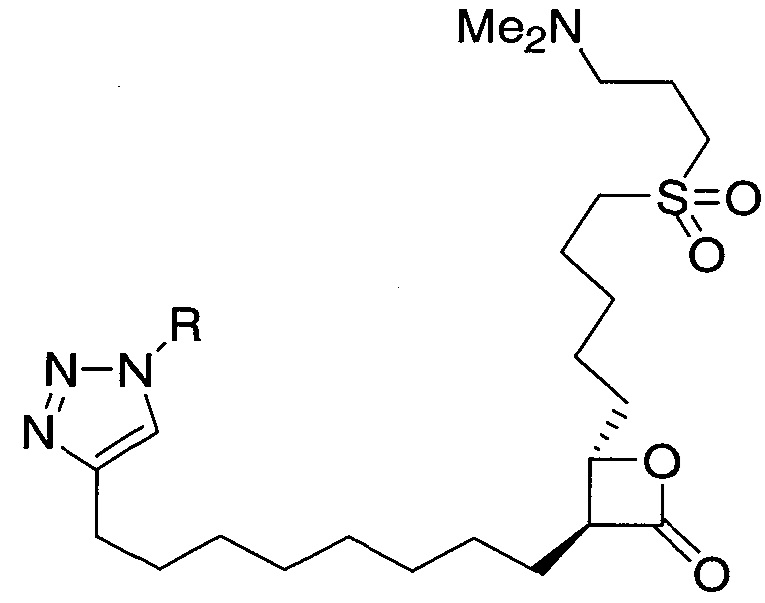
(дериватизированный, где «R» обозначает сайт присоединения для линкерной группы L или группы ). Смотри, Angew. Chem. Int. Ed. 2011, 50, 9838-9842, где L представляет собой линкерную группу, иным образом описанную в данном документе, и указанная группа
). Смотри, Angew. Chem. Int. Ed. 2011, 50, 9838-9842, где L представляет собой линкерную группу, иным образом описанную в данном документе, и указанная группа  иным образом описана в данном документе, так что
иным образом описана в данном документе, так что  связывает группу
связывает группу  с группой
с группой  , как иным образом описано в данном документе.
, как иным образом описано в данном документе.
Термин "белок-мишень" используется для описания белка или полипептида, которые являются мишенью для связывания с соединением в соответствии с настоящим изобретением и далее для деградации убиквитин лигазой. Такие небольшие молекулы связывающих фрагментов белка-мишени также включают фармацевтически приемлемые соли, энантиомеры, сольваты и полиморфы указанных композиций, а также другие небольшие молекулы, которые могут предназначаться для рассматриваемого белка. Эти связывающие фрагменты связаны с группой  посредством линкерной группы L.
посредством линкерной группы L.
Белки-мишени, которые могут быть присоединены к фрагменту белка-мишени и быть деградированы лигазой, к которой присоединен связывающий фрагмент убиквитин лигазы, включают структурные белки, рецепторы, ферменты, белки поверхности клеток, белки, имеющие отношение к функции встраивания в клетку, включая белки, участвующие в каталитической активности, активности ароматазы, двигательной активности, деятельности геликазы, метаболических процессах (анаболизм и катаболизм), антиоксидантной активности, протеолизу, биосинтезу, белки с киназной активностью, оксидоредуктазной активностью, трансферазной активностью, гидролазной активностью, лиазной активностью, изомеразной активностью, лигазной активностью, регулирующей ферментативной активностью, активностью сигнальной трансдукции, активностью в отношении структуры молекул, связывающей активностью (белок, липид, карбогидрат), рецепторной активностью, подвижностью клеток, мембранным слиянием, клеточной коммуникацией, регулированием биологических процессов, развитием, дифференцировкой клеток, реакцией на раздражитель, поведенческие белки, белки клеточной адгезии, белки, участвующие в смерти клеток, белки, участвующие в транспорте (включая белок с активностью транспортера, транспорта ядер, активностью ионного транспортера, активностью транспортера каналов, активностью носителя, пермеазной активностью, секреторной активностью, активностью транспортера электронов, патогенеза, шаперон регулирующей активностью, связывающей нуклеиновые кислоты активностью, регулирующей транскрипцию активностью, активностью внеклеточной организации и биогенеза, регулирующей трансляцию активностью. Представляющие интерес белки могут включать белки из эукариторв и прокариотов, включая, среди многочисленных других, микробы, вирусы, грибки и паразиты, включая людей, микробы, вирусы, грибки и паразиты, в качестве мишеней для лекарственной терапии, других животных, включая домашних животных, микробов для определения мишеней для антибиотиков и других противомикробных препаратов, и растения, и даже вирусы, среди многих других.
Более конкретно, многими целями для лекарств при лечении человека являются белки-мишени, с которыми может быть связан фрагмент белка-мишени и включены в соединения по настоящему изобретению. К ним относятся белки, которые могут быть использованы для восстановления функции при многочисленных полигенных заболеваниях, включая, например, В7.1 и B7, TINFRlm, TNFR2, NADPH оксидазу, BclIBax и другие партнеры в пути апоптоза, рецептор C5a, редуктазу HMG-CoA, PDE фосфодиэстеразу типа V, PDE IV фосфодиэстеразу типа 4, PDEI, PDEII, PDEIII, ингибитор сквален циклазы, CXCR1, CXCR2, синтазу оксида азота (NO), циклооксигеназу 1, циклооксигеназу 2, рецепторы 5HT, допаминовые рецепторы, G белки, то есть Gq, рецепторы гистамина, 5-липоксигеназу, триптазу серин протеазу, тимидилат синтазу, пурин нуклеозид фосфорилазу, GAPDH трипаносомный, гликоген фосфорилазу, карбонангидразу, хемокиновые рецепторы, JAW STAT, RXR и подобный, ВИЧ 1 протеазу, ВИЧ 1 интегразу, грипп, нейраминидазу, гепатит B обратную транскриптазу, натриевый канал, мульти лекарственно устойчивый (MDR), белок P-гликопротеин (и MRP), тирозинкиназу, CD23, CD124, тирозинкиназу p56 lck, CD4, CD5, рецептор IL-2, рецептор IL-1, TNF-альфаR, ICAM1, Cat+ каналы, VCAM, VLA-4 интегрин, селектины, CD40/CD40L, невокинины и рецепторы, инозин монофосфат дегидрогеназу, p38 MAP киназу, RaslRaflMEWERK путь метаболизма, интерлейкин-1 преобразующий фермент, каспазу, HCV, NS3 протеазу, HCV NS3 RNA геликазу, глицинамид рибонуклеотид формил трансферазу, риновирусную 3C протеазу, вирус простого герпеса 1 типа (HSV-I), протеазу, цитомегаловирусную (CMV) протеазу, поли(ADP-рибоза) полимеразу, циклинзависимые киназы, фактор роста эндотелия сосудов, рецептор окситоцина, ингибитор переноса белков через микросомы, ингибитор транспорта желчных кислот, ингибиторы 5 альфа редуктазы, ангиотензин 11, рецептор глицина, рецептор обратного захвата норадреналина, рецепторы эндотелина, нейропептид Y и рецептор, рецепторы эстрогена, рецепторы андрогена, рецепторы аденозина, аденозинкиназу и AMP деаминазу, пуринергические рецепторы (P2Y1, P2Y2, P2Y4, P2Y6, P2X1-7), фарнезилтрансферазы, геранилгеранил трансферазу, TrkA рецептор для NGF, бета-амилоид, тирозинкиназу Flk-IIKDR, рецептор витронектина, рецептор интегрина, Her-21 neu, ингибитор теломеразы, цитозольной фосфолипазы A2 и EGF рецептор тирозинкиназы. Дополнительные белки-мишени включают, например, экдизон 20-монооксигеназу, ионный канал GABA воротный хлоридный канал, ацетилхолинэстеразу, белок потенциалзависимого натриевого канала, выбрасывающий кальций канал и хлоридные каналы. Помимо того, дополнительные белки-мишени включают ацетил-CoA карбоксилазу, аденилосукцинат синтазу, протопорфириноген оксидазу и енолпирувилшикимат-фосфат синтазу.
Ферменты галогеналкан дегалогеназы представляют собой другую цель конкретных соединений в соответствии с настоящим изобретением. Соединения в соответствии с настоящим изобретением, которые содержат хлоралкан пептид связывающие фрагменты (C1-C12, часто примерно C1-C10, алкилгалогеновые группы), могут быть использованы для ингибирования и/или деградации ферментов галогеналкан дегалогеназы, которые используются в слитых белках или связанных диагностических белках, как описано в PCT/US 2012/063401, поданной 6 декабря, 2011, и опубликованной как WO 2012/078559 14 июня, 2012, содержание которой включено в данный документ в виде ссылки.
Эти различные белки-мишени могут быть использованы в скрининговых исследованиях, которые идентифицируют фрагменты соединения, которые связываются с белком, и путем введения фрагмента в соединения в соответствии с настоящим изобретением, уровень активности белка может быть изменен для конечного терапевтического результата.
Термин "заболевание или состояние" используется для описания какого-либо заболевания или состояния, где происходит дисрегуляция белка (то есть, количество белка, экспрессированного в организме пациента, повышается) и где деградация одного или более белков в организме пациента может обеспечить успешное лечение или облегчение симптомов пациенту, нуждающемуся в этом. В некоторых случаях заболевание или состояние может быть вылечена
Заболевания или состояния, которые могут быть подвергнуты лечению с использованием соединений в соответствии с настоящим изобретением, включают, например, астму, аутоиммунные заболевания, такие как рассеянный склероз, различные раки, цилиопатию, волчью пасть, диабет, болезнь сердца, гипертензию, воспалительное заболевание кишечника, умственную отсталость, расстройства настроения, ожирение, аномальную рефракцию, бесплодие, синдром Ангельмана, болезнь Канавана, глютеновую болезнь, болезнь Шарко-Мари-Тута, кистозный фиброз, мышечную дистрофию Дюшенна, гемохроматоз, гемофилию, синдром Клайнфельтера, нейрофиброматоз, фенилкетонурию, поликистоз почек, (PKDl) или 4 (PKD2) синдром Прадера-Вилли, серповидноклеточную анемию, болезнь Тея-Сакса, синдром Тернера.
Еще заболевания или состояния, которые могут быть подвергнуты лечению с использованием соединений в соответствии с настоящим изобретением, включают болезнь Альцгеймера, боковой амиотрофический склероз (болезнь Лу Герига, нервную анорексию, тревожное расстройство, атеросклероз, синдром дефицита внимания и гиперактивности, аутизм, биполярное расстройство, синдром хронической усталости, хроническую обструктивную болезнь легких, болезнь Крона, ишемическую болезнь сердца, деменцию, депрессию, сахарный диабет 1 типа, сахарный диабет 2 типа, эпилепсию, синдром Гийена-Барре, синдром раздраженного кишечника, красную волчанку, метаболический синдром, рассеянный склероз, инфаркт миокарда, ожирение, обсессивно-компульсивное расстройство, паническое расстройство, болезнь Паркинсона, псориаз, ревматоидный артрит, саркоидоз, шизофрению, инсульт, облитерирующий тромбоангиит, синдром Туретта, васкулит.
Еще дополнительные заболевания или состояния, которые могут быть подвергнуты лечению с использованием соединений в соответствии с настоящим изобретением, включают ацерулоплазминемию, ахондрогенез типа II, ахондроплазию, акроцефалию, болезнь Гоше типа 2, острую интермиттирующую порфирию, болезнь Канавана, аденоматозный полипоз толстой кишки, дефицит ALA-дегидратазы, дефицит аденилсукцинат лиазы, адреногенитальный синдром, адренолейкодистрофию, ALA-D порфирию, дефицит ALA-дегидратазы, алкаптонурию, болезнь Александра, алкаптонурический охроноз, дефицит альфа 1-антитрипсина, ингибитор альфа-1 протеиназы, эмфизему, боковой амиотрофический склероз синдром Алстрома, болезнь Александра, несовершенный амелогенез, дефицит ALA-дегидратазы, болезнь Андерсона-Фабри, синдром андрогенной нечувствительности, анемию диффузной ангиокератомы тела, ангиоматоз сетчатки (болезнь фон Гиппеля-Линдау) синдром Аперта, арахнодактилию (синдром Марфана), синдром Стиклера, Arthrochalasis multiplex congenita (синдром Элерса-Данлоса # типа артрохалазии), атаксию телеангиэктазии, синдром Ретта, первичную легочную гипертензию, болезнь Сандхоффа, нейрофиброматоз II типа, синдром сморщенных кожных покровов Бира-Стевенсона, средиземноморскую лихорадку, семейный, синдром Бенджамина, бета-талассемию двусторонний слуховой нейрофиброматоз (нейрофиброматоз типа II), тромбофилию V фактор Лейдена, синдром Блоха-Сульцбергера (incontinentia pigmenti), синдром Блума, X-хромосомную сидеробластную анемию, синдром Бонневи-Ульриха (синдром Тернера), болезнь Бурневилля (клубневый склероз), прионное заболевание, синдром Берта-Хогга-Дубе, болезнь хрупких костей (несовершенный остеогенез), синдром широкого I пальца кистей и стоп (синдром Рубинштейна-Тейби), бронзовый диабет/пигментный цирроз печени (гемохроматоз), бульбоспинальную мышечную атрофию (болезнь Кеннеди), синдром Бюргера-Грютца (дефицит липопротеинлипазы), хроническую гранулематозную болезнь (ХГБ), кампомелическую дисплазию, недостаточность биотинидазы, кардиомиопатию (синдром Нунан), синдром Cri du Chat, CAVD (врожденное отсутствие семявыносящих протоков), кардиофациальный синдром Кайлера (CBAVD), CEP (врожденную эритропоэтическую порфирию), кистозный фиброз, врожденный гипотиреоз, врожденную хондродистрофию (ахондроплазию), отоспондиломегаэпифизарную дисплазию, синдром Леш-Найхена, галактоземию, синдром Элерса-Данлоса, летальную дисплазию, синдром Коффина-Лоури, синдром Коккейна, (семейный аденоматозный полипоз), врожденную эритропоэтическую порфирию, врожденную болезнь сердца, метгемоглобинемию/врожденную метгемоглобинемию, ахондроплазию, X-хромосомную сидеробластную анемию, заболевания соединительной ткани, синдром конотрункальной аномалии лица, анемию Кули (бета-талассемия), болезнь накопления меди (болезнь Вильсона), нарушение транспорта меди (болезнь Менкеса), наследственную копропорфирию, синдром Каудена, черепно-лицевой дизартроз (синдром Крузона), болезнь Крейтцфельда-Якоба (прионное заболевание), синдром Коккейна, синдром Каудена, синдром Куршманна-Баттена-Штейнерта (миотоническая дистрофия), синдром сморщенных кожных покровов Бира-Стевенсона, первичную гипероксалурию, спондилоэпифизарную дисплазию (тип Страдвик), мышечную дистрофию типа Дюшенна и Беккера (DBMD), синдром Ашера, дегенеративные нервные заболевания, включая синдром де Груши и синдром Дежерин-Соттаса, отклонения в развитии, дистальную спинальную мышечную атрофию V типа, синдром андрогенной нечувствительности, диффузный глобоидноклеточный склероз (болезнь Краббе), синдром Ди Джорджа, дефицит рецепторов дигидротестостерона, синдром андрогенной нечувствительности, синдром Дауна, карликовость, дефицит эритроид 5-аминолевулинат синтетазы при эритропоэтической порфирии, эритропоэтическую порфирию, эритропоэтическую протопорфирию, эритропоэтическую уропорфирию, атаксию Фридрейха, семейный пароксизмальный полисерозит, позднюю кожную порфирию, семейную чувствительную к давлению невропатию, первичную легочную гипертензию (PPH), фиброкистоз поджелудочной железы, cиндром хрупкой Х-хромосомы, галактоземию, генетические нарушения головного мозга (неонатальный гемохроматоз), синдром Гренблада-Страндберга (псевдоксантома эластическая), болезнь Гюнтера (врожденная эритропоэтическая порфирия), гемохроматоз, синдром Халлгрена, серповидно-клеточную анемию, гемофилию, гепатоэритропоэтическую порфирию (HEP), болезнь Хиппель-Линдау (болезнь фон Гиппеля-Линдау), болезнь Хантингтона, синдром прогерии Хатчинсона-Гилфорда (прогерия), гиперандрогенизм, гипохондроплазию, гипохромную анемию, заболевания иммунной системы, включая тяжелый комбинированный иммунодефицит, связанный с X-хромосомой, синдром Инсли-Эстли, синдром Джексона-Вейсса, синдром Жубера, синдром Леш-Найхена, синдром Джексона-Вейсса, заболевания почек, включая гипероксалурию, синдром Клайнфельтера, дисплазию Книста, деменцию лакунарную, ахондрогенез типа Лангера-Салдино, атаксию телеангиэктазия, синдром Линча, дефицит лизил-гидроксилазы, болезнь Мачадо-Джозефа, нарушения обмена веществ, включая дисплазию Книста, синдром Марфана, двигательные расстройства, синдром Моуота-Вилсона, кистозный фиброз, синдром Мюнке, множественный нейрофиброматоз, синдром Нэнси-Инсли, хондродисплазию Нэнси-Суини, болезнь Нимана-Пика, синдром Ноака (синдром Пфайффера), болезнь Ослера-Вебера-Рандю, синдром Пейтца-Егерса, поликистоз почек, полиоссальную фиброзную остеодисплазию (синдром Маккьюна-Олбрайта), синдром Пейтца-Егерса, синдром Прадера-Лабхарта-Вилли, гемохроматоз, синдром первичной гиперурикемии (синдром Леша-Нихена), первичную легочную гипертензию, первичную старческую дегенеративную деменцию, прионное заболевание, прогерию (синдром прогерии Хатчинсона Гилфорда), прогрессивную хорею, хроническую наследственную (Хантингтон) (болезнь Хантингтона), прогрессирующую мышечную атрофию, спинальную мышечную атрофию, пропионовую ацидемию, протопорфирию, проксимальную миотоническую дистрофию, пульмонарную артериальную гипертензию, PXE (псевдоксантому эластическую), Rb (ретинобластому), болезнь Реклингхаузена (нейрофиброматоз типа I), периодический полисерозит, расстройства сетчатки, ретинобластому, синдром Ретта, RFALS типа 3, синдром Рикера, синдром Райли-Дея, синдром Русси-Леви, тяжелую ахондроплазию с задержкой развития и папиллярно-пигментную дистрофию кожи (SADDAN), синдром Ли-Фраумени, саркому, рак груди, лейкемию и синдром надпочечников (SBLA), туберозный склероз (клубневый склероз), SDAT, врожденную SED (врожденную спондилоэпифизарную дисплазию), SED Страдвика (спондилоэпифизарную дисплазию, тип Страдвика), SEDc (врожденную спондилоэпифизарную дисплазию) SEMD, тип Страдвика (спондилоэпифизарную дисплазию, тип Страдвик), синдром Shprintzen, расстройства пигментации кожи, синдром Смита-Лемли-Опица, Южно-Африканскую генетическую порфирию (смешанную порфирию), детский нарастающий наследственный спастический паралич, речевые и коммуникативные расстройства, сфинголипидоз, болезнь Тея-Сакса, спиноцеребеллярную атаксию, синдром Стиклера, инсульт, синдром андрогенной нечувствительности, дефицит тетрагидробиоптерина, бета-талассемию, заболевание щитовидной железы, нейропатию Tomaculous (наследственная нейропатия со склонностью к параличам от сдавливания) cиндром Тричера Коллинза, синдром трипло-Х (triple X syndrome), Трисомию 21 (синдром Дауна), Трисомию X, синдром VHL (болезнь фон Гиппеля-Линдау), ухудшение зрения и слепоту (синдром Алстрома), болезнь Вролика, синдром Ваарденбурга, синдром Warburg Sjo Fledelius, синдром Вейссенбахера-Цвеймюллера, синдром Вольфа-Хиршхорна, периодическую болезнь Вольфа, синдром Вейссенбахера-Цвеймюллера и пигментная сухость кожи, среди прочих.
Термин "неоплазия" или "злокачественное новообразование" используется во всем описании для обозначения патологического процесса, который приводит к образованию и росту раковых или злокачественных новообразований, то есть аномальной ткани, которая растет путем клеточной пролиферации, часто быстрее, чем нормально, и продолжает расти после раздражителей, которые инициировали прекращение нового роста. Злокачественные новообразования показывают частичное или полное отсутствие структурной организации и функциональной координации с нормальной тканью и наиболее проникают в окружающие ткани, метастазируют в нескольких местах и, скорее всего, повторяются после попытки удаления, и вызывают смерть больного, если не проводить адекватного лечения. Как используется в настоящем документе, термин "неоплазия" используется для описания всех раковых заболеваний и включает или охватывает патологический процесс, связанный со злокачественными гематогенными, асцитическими и солидными опухолями. Примерами злокачественых новообразований, которые можно лечить настоящими соединениями либо отдельно, либо в комбинации, по меньшей мере, с одним дополнительным противораковым агентом, включают плоскоклеточную карциному, базально-клеточную карциному, аденокарциному, гепатоцеллюлярную карциному и карциному почечных клеток, рак мочевого пузыря, кишечника, молочной железы, шейки матки, толстой кишки, пищевода, головы, почек, печени, легких, шеи, яичников, поджелудочной железы, простаты и желудка; лейкозы; доброкачественные и злокачественные лимфомы, особенно лимфому Беркитта и неходжкинскую лимфому; доброкачественные и злокачественные меланомы; миелопролиферативные заболевания; саркомы, включая саркому Эвинга, гемангиосаркомы, саркому Капоши, липосаркому, миосаркомы, периферическую нейроэпителиому, синовиальную саркому, глиомы, астроцитомы, олигодендроглиомы, эпендимомы, глиобластомы, нейробластомы, ганглионевромы, ганглиоглиомы, медуллобластомы, опухоли клеток шишковидной железы Юинга, менингиому, менингиому, менингеальную саркому, нейрофиброму и шванному; рак толстой кишки, рак молочной железы, рак предстательной железы, рак шейки матки, рак матки, рак легкого, рак яичников, рак яичек, рак щитовидной железы, астроцитому, рак пищевода, рак поджелудочной железы, рак желудка, рак печени, рак толстой кишки, меланому; карциносаркому, болезнь Ходжкина, опухоль Вильмса и тератокарциному.
Кроме того, злокачественные новообразования, которые можно лечить с использованием соединений в соответствии с настоящим изобретением, включают, например, острый лимфобластный лейкоз Т-линии (T-ОЛЛ), лимфобластную лимфому Т-линии (T-LL), периферийную Т-клеточную лимфому, Т-клеточную лейкемию взрослых, Pre-B ОЛЛ, лимфомы Pre-B, большую B-клеточную лимфому, лимфому Беркитта, В-клеточный ОЛЛ, острый лимфобластный лейкоз (ОЛЛ), положительный по филадельфийской хромосоме и ХМЛ положительный по филадельфийской хромосоме.
Термин "биологически активный агент" используется для описания агента, иного, чем соединение в соответствии с настоящим изобретением, который используется в комбинации с настоящими соединениями в качестве агента с биологической активностью, способствующей осуществлению планируемого лечения, ингибированию и/или предотвращению/профилактике, для которых используются настоящие соединения. Предпочтительные биологически активные агенты для использования в данном контексте включают такие агенты, которые обладают фармакологической активностью, аналогичной той, для которой используются или вводятся настоящие соединения, и включают, например, противораковые агенты, противовирусные агенты, особенно, включая анти-ВИЧ агенты и анти-HCV агенты, противомикробные агенты, противогрибковые агенты и т.д.
Термин "дополнительный противораковый агент" используется для описания противоракового агента, который может быть объединен с соединениями в соответствии с настоящим изобретением для лечений злокачественного новообразования. Указанные агенты включают, например, эверолимус, трабектедин, абраксан, TLK 286, AV-299, DN-101, пазопаниб, GSK690693, RTA 744, ON 0910.Na, AZD 6244 (ARRY-142886), AMN-107, TKI-258, GSK461364, AZD 1152, энзастаурин, вандетаниб, ARQ-197, MK-0457, MLN8054, PHA-739358, R-763, ингибитор FLT-3, ингибитор VEGFR, ингибитор EGFR TK, ингибитор киназы семейства aurora, модулятор PIK-1, ингибитор Bcl-2, ингибитор HDAC, ингибитор c-MET, ингибитор PARP, ингибитор Cdk, ингибитор EGFR TK, ингибитор IGFR-TK, анти-HGF-антитела, ингибиторы киназы PI3, ингибитор AKT, ингибитор JAK/STAT, ингибитор контрольной точки-1 или 2, ингибитор киназы фокальной адгезии, ингибитор киназы MAP-киназ (mek), антитела-ловушки VEGF, пеметрексед, эрлотиниб, дазатаниб, нилотиниб, декатаниб, панитумумаб, амрубицин, ореговомаб, Lep-etu, нолатрексед, azd2171, батабулин, офатумумаб, занолимумаб, эндотекарин, тетрандрин, рубитекан, тесмилифен, облимерсен, тицилимумаб, ипилимумаб, госсипол, Bio 111, 131-I-TM-601, ALT-110, BIO 140, CC 8490, циленгитид, гиматекан, IL13-PE38QQR, INO 1001, IpdR1 KRX-0402, лукантон, LY 317615, нейрадиаб, витеспан, Rta 744, Sdx 102, талампанел, атрасентан, Xr 311, ромидепсин, ADS-100380, сунитиниб, 5-фторурацил, вориностат, этопозид, гемцитабин, доксорубицин, липосомный доксорубицин, 5'-дезокси-5-фторуридин, винкристин, темозоломид, ZK-304709, селициклиб; PD0325901, AZD-6244, капецитабин, гептагидрат динатриевой соли N-[4-[2-(2-амино-4,7-дигидро-4-оксо-1H-пирроло[2,3-d]пиримидин-5-ил)этил]бензоил]-L-глутаминовой кислоты, камптотецин, ПЭГ-меченный иринотекан, тамоксифен, цитрат торемифена, анастразол, эксеместан, летрозол, DES (диэтилстилбестрол), эстрадиол, эстроген, конъюгированный эстроген, бевацизумаб, IMC-1C11, CHIR-258, 3-[5-(метилсульфонилпиперадинметил)индолил]хинолон, ваталаниб, AG-013736, AVE-0005, ацетатную соль [D-Ser(But)6,Azgly10](pyro-Glu-His-Trp-Ser-Tyr-D-Ser(But)-Leu-Arg-Pro-Azgly-NH2 ацетат [C59H84N18O14-(C2H4O2)x, где x= от 1 до 2,4], ацетат госерелина, ацетат лейпролида, памоат трипторелина, ацетат медроксипрогестерона, капроат гилроксипрогестерона, ацетат мегестрола, ралоксифен, бикалутамид, флутамид, нилутамид, ацетат мегестрола, CP-724714; TAK-165, HKI-272, эрлотиниб, лапатаниб, канертиниб, ABX-EGF-антитело, эрбитукс, EKB-569, PKI-166, GW-572016, лонафарниб, BMS-214662, типифарниб; амифостин, NVP-LAQ824, субероиланилидгидроксамовую кислоту, вальпроевую кислоту, трихостатин A, FK-228, SU11248, сорафениб, KRN951, аминоглутетимид, амсакрин, анагрелид, L-аспарагиназу, вакцины на основе бациллы Кальметта-Герена (BCG), адриамицин, блеомицин, бусерелин, бусульфан, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, клодронат, ципротерон, цитарабин, дакарбазин, дактиномицин, даунорубицин, диэтилстилбестрол, эпирубицин, флударабин, флудрокортизон, флуоксиместерон, флутамид, гливек, гемцитабин, гидрокстмочевину, идарубицин, ифосфамид, иматиниб, лейпролид, левамизол, ломустин, мехлорэтамин, мелфалан, 6-меркаптопурин, месну, метотрексат, митомицин, митотан, митоксантрон, нилутамид, октреотид, оксалиплатин, памидронат, пентостатин, пликамицин, порфимер, прокарбазин, ралтитрексед, ритуксимаб, стрептозоцин, тенипозид, тестостерон, талидомид, тиогуанин, тиотепу, третиноин, виндезин, 13-цис-ретиноевую кислоту, фенилаланинмустард, урацил мустард, эстрамустин, алтретамин, флоксуридин, 5-дезоксиуридин, цитозинарабинозид, 6-меркаптопурин, дезоксикоформицин, кальцитриол, валрубицин, митрамицин, винбластин, винорелбин, топотекан, разоксин, маримастат, COL-3, неовастат, BMS-275291, скваламин, эндостатин, SU5416, SU6668, EMD121974, интерлейкин-12, IM862, ангиостатин, витаксин, дролоксифен, идоксифен, спиронолактон, финастерид, цимитидин, трастузумаб, денилейкин дифтитокс, гефитиниб, бортезимиб, паклитаксел, не содержащий кремофор паклитаксел, доцетаксел, эпитилон B, BMS-247550, BMS-310705, дролоксифен, 4-гидрокситамоксифен, пипендоксифен, ERA-923, арзоксифен, фулвестрант, аколбифен, лазофоксифен, идоксифен, TSE-424, HMR-3339, ZK186619, топотекан, PTK787/ZK 222584, VX-745, PD 184352, рапамицин, 40-O-(2-гидроксиэтил)-рапамицин, темсиролимус, AP-23573, RAD001, ABT-578, BC-210, LY294002, LY292223, LY292696, LY293684, LY293646, вортманнин, ZM336372, L-779450, ПЭГ-филграстим, дарбепоэтин, эритропоэтин, колониестимулирующий фактор гранулоцитов, золендронат, преднизон, цетуксимаб, колониестимулирующий фактор гранулоцитов-макрофагов, гистрелин, пегилированный интерферон альфа-2a, интерферон альфа-2a, пегилированный интерферон альфа-2b, интерферон альфа-2b, азацитидин, ПЭГ-L-аспарагиназу, леналидомид, гемтузумаб, гидрокортизон, интерлейкин-11, декстразоксан, алемтузумаб, полностью трансретиноевую кислоту, кетоконазол, интерлейкин-2, мегестрол, иммуноглобулин, азотистый иприт, метилпреднизолон, ибритгумомаб тиуксетан, андрогены, децитабин, гексаметилмеламин, бексаротен, тозитумомаб, трехокись мышьяка, кортизон, эдитронат, митотан, циклоспорин, липосомный даунорубицин, аспарагиназу Эдвина, стронций 89, касопитант, нетупитант, антагонисты рецептора NK-1, палоносетрон, апрепитант, дифенгидрамин, гидроксизин, метоклопрамид, лоразепам, алпразолам, галоперидол, дроперидол, дронабинол, дексаметазон, метилпреднизолон, прохлорперазин, гранисетрон, ондансетрон, доласетрон, трописетрон, пегфилграстим, эритропоэтин, эпоэтин альфа и дарбепоэтин альфа и их смеси.
Термин "анти-ВИЧ агент" или "дополнительный анти-ВИЧ агент" включает, например, нуклеозидные ингибиторы обратной транскриптазы (NRTI), другие ненуклеозидные ингибиторы обратной транскриптазы (то есть те, которые не являются репрезентативными по настоящему изобретению), ингибиторы протеазы, ингибиторы слияния, примеры соединений которых, среди прочих, могут включать, например, 3TC (Ламивудин), AZT (Зидовидин), (-)-FTC, ddI (Диданозин), ddC (зальцитабин), абакавир (ABC), тенофовир (PMPA), D-D4FC (Реверсет), D4T (Ставудин), Рацивир, L-FddC, L-FD4C, NVP (Невирапин), DLV (Делавирдин), EFV (Эфавиренц), SQVM (Саквинавир мезилат), RTV (Ритонавир), IDV (Индинавир), SQV (Саквинавир), NFV (Нелфинавир), APV (Ампренавир), LPV (Лопинавир), ингибиторы слияния, такие как T20, среди прочих, фузеон и их смеси, включая анти-ВИЧ соединения, которые в настоящее время проходят клинические испытания или разработку.
Другие анти-ВИЧ агенты, которые могут быть использованы при совместном введении с соединениями в соответствии с настоящим изобретением, включают, например, другие NNRTI (то есть иные, чем NNRTF в соответствии с настоящим изобретением) могут быть выбраны из группы, включающей невирапин (BI-R6-587), делавирдин (U-90152S/T), эфавиренц (DMP-266), UC-781 (N-[4-хлор-3-(3-метил-2-бутенилокси)фенил]-2-метил-3-фуранкарботиамид), этравирин (TMC125), Тровирдин (Ly300046.HCl), MKC-442 (эмивирин, коактинон), HI-236, HI-240, HI-280, HI-281, рилпивирин (TMC-278), MSC-127, HBY 097, DMP266, Байкалин (TJN-151) ADAM-II (метил 3′,3′-дихлор-4′,4″-диметокси-5′,5″-бис(метоксикарбонил)-6,6-дифенилгексеноат), метил 3-бром-5-(1-5-бром-4-метокси-3-(метоксикарбонил)фенил)гепт-1-енил)-2-метоксибензоат (алкенилдиарилметановый аналог, Адам аналог), 5C13PhS-2Indo1CONH2 (5-хлор-3-(фенилсульфинил)-2′-индолкарбоксамид), AAP-BHAP (U-104489 или PNU-104489), Каправирин (AG-1549, S-1153), атевирдин (U-87201E), ауринтрикарбоновую кислоту (SD-095345), 1-[(6-циано-2-индоил)карбонил]-4-[3-(изопропиламино)-2-пиридинил]пиперазин (пиперазин 1 пиридин 4 индолил производное), 1-[5-[[N-(метил)метилсульфониламино]-2-индолилкарбонил-4-[3-(изопропиламино)-2-пиридинил]пиперазин (пиперазин 1 пиридин 5 индолил производное), 1-[3-(этиламино)-2-[пиридинил]-4-[(5-гидрокси-2-индолил)карбонил]пиперазин, 1-[(6-Формил-2-индолил)карбонил]-4-[3-(изопропиламино)-2-пиридинил]пиперазин, 1-[[5-(метилсульфонилокси)-2-индолил)карбонил]-4-[3-(изопропиламино)-2-пиридинил]пиперазин, U88204E, бис(2-нитрофенил)сульфон (NSC 633001), Каланолид A (NSC675451), Каланолид B, 6-бензил-5-метил-2-(циклогексилокси)пиримидин-4-он (DABO-546), DPC 961, E-EBU, E-EBU-dm, E-EPSeU, E-EPU, Фоскарнет (Фоскавир), HEPT (1-[(2-гидроксиэтокси)метил]-6-(фенилтио)тимин), HEPT-M (1-[(2-гидроксиэтокси)метил]-6-(3-метилфенил)тио)тимин), HEPT-S (1-[(2-гидроксиэтокси)метил]-6-(фенилтио)-2-тиотимин), Инофиллум P, L-737126, Michellamine A (NSC650898), Michellamine B (NSC649324), Michellamine F, 6-(3,5-диметилбензил)-1-[(2-гидроксиэтокси)метил]-5-изопропилурацил, 6-(3,5-диметилбензил)-1-(этоксиметил)-5-изопропилурацил, NPPS, E-BPTU (NSC 648400), Олтипраз (4-метил-5-(пиразинил)-3H-1,2-дитиол-3-тион), N-{2-(2-хлор-6-фторфенетил]-N′-(2-тиазолил)тиомочевина (PETT Cl, F производное), N-{2-(2,6-дифторфенетил]-N′-[2-(5-бромпиридил)]тиомочевину (PETT производное), N-{2-(2,6-дифторфенетил]-N′-[2-(5-метилпиридил)]тиомочевину (PETT пиридильное производное), N-[2-(3-фторфуранил)этил]-N′-[2-(5-хлорпиридил)]тиомочевину, N-[2-(2-фтор-6-этоксифенетил)]-N′-[2-(5-бромпиридил)]тиомочевину, N-(2-фенетил)-N′-(2-тиазолил)тиомочевину (LY-73497), L-697639, L-697593, L-697661, 3-[2-(4,7-дифторбензоксазол-2-ил)этил}-5-этил-6-метил(пиридин-2(1H)-тион (производное 2-пиридинона), 3-[[(2-метокси-5,6-диметил-3-пиридил)метил]амин]-5-этил-6-метил(пиридин-2(1H)-тион (2-пиридинон 3 пирид 3MeNH производное), R82150, R82913, R87232, R88703, R89439 (Ловирид), R90385, S-2720, Сурамин натрий, TBZ (тиазолобензимидазол, NSC 625487), Тиазолоизоиндол-5-он, (+)(R)-9b-(3,5-диметилфенил-2,3-дигидротиазоло[2,3-a]изоиндол-5(9bH)-он, Тивирапин (R86183), UC-38 и UC-84, среди прочих.
Термин "фармацевтически приемлемая соль" используется в описании для обозначения, где это применимо, солевой формы одного или нескольких соединений, описанных в настоящем документе, которые предложены для увеличения растворимости соединения в желудочных соках желудочно-кишечного тракта пациента для способствования растворения и биодоступности соединений. Фармацевтически приемлемые соли включают полученные с фармацевтически приемлемыми неорганическими или органическими основаниями и кислотами, где это применимо. Подходящие соли включают соли, полученные с щелочными металлами, такими как калий и натрий, щелочноземельными металлами, такими как кальций, магний, и соли аммония, среди многочисленных других кислот и оснований, хорошо известных в фармацевтической области. Соли натрия и калия являются особенно предпочтительными в качестве солей нейтрализации фосфатов в соответствии с настоящим изобретением.
Термин "фармацевтически приемлемое производное" используется в описании для обозначения любой фармацевтически приемлемой пролекарственной формы (такой как сложноэфирная, амидная, другая пролекарственная группа), которая при введении пациенту обеспечивает непосредственно или косвенно настоящее соединение или его активный метаболит по настоящему соединению.
Термин "независимо" используется в настоящем документе, чтобы показать, что переменная, которая применяется независимо, меняется независимо от применения к применению.
Термин "углеводород" будет обозначать соединение, которое содержит углерод и водород и которое может быть полностью насыщенным, частично ненасыщенным или ароматическим, и включает арильные группы, алкильные группы, алкенильные группы и алкинильные группы.
Термин "алкил" будет обозначать в своем контексте линейный, разветвленный или циклический полностью насыщенный углеводородный радикал или алкильную группу, предпочтительно C1-C10, более предпочтительно C1-C6, альтернативно C1-C3 алкильную группу, которая может быть необязательно замещена. Примерами алкильных групп являются, среди прочих, метил, этил, н-бутил, втор-бутил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, изопропил, 2-метилпропил, циклопропил, циклопропилметил, циклобутил, циклопентил, циклопентилэтил, циклогексилэтил и циклогексил. В некоторых предпочтительных вариантах осуществления изобретения, соединения в соответствии с настоящим изобретением, которые могут быть использованы для ковалентного связывания с ферментами дегалогеназы. Указанные соединения обычно содержат побочную цепь (часто связанную через полиэтиленгликолевую группу), заканчивающуюся алкильной группой с заместителем галогеном (часто хлором или бромом) на своем конце, что приводит к ковалентному связыванию соединения, содержащего такую группу, с белком. Термин "алкенил" относится к линейным, разветвленным или циклическим C1-C10 (предпочтительно C2-C6) углеводородным радикалам, содержащим, по меньшей мере, одну связь C=C. Термин "алкинил" относится к линейным, разветвленным или циклическим C2-C10 (предпочтительно C2-C6) углеводородным радикалам, содержащим, по меньшей мере, одну связь C≡C. Термин "алкилен", когда используется, относится к -(CH2)n-группе (n обозначает целое число, обычно 0-6), которая может быть необязательно замещена. Когда она замещена, алкиленовая группа предпочтительно замещена на одной или нескольких метиленовых группах C1-C6 алкильной группой (включая циклопропильную группу или трет-бутильную группу), более предпочтительно метильной группой, но также может быть замещена одной или несколькими группами галогенов, предпочтительно от 1 до 3 группами галогенов или одной или двумя гидроксильными группами, O(C1-C6 алкил) группами или боковыми цепями аминокислот, как иным образом описано в данном документе. В некоторых вариантах осуществления изобретения, алкиленовая группа может быть замещена уретановой или алкокси группой (или другой группой), которая далее замещена цепочкой полиэтиленгликолевой группы (состоящей из от 1 до 10, предпочтительно от 1 до 6, часто от 1 до 4 звеньев этиленгликоля), которая замещена (предпочтительно, но не исключительно, на конце цепочки полиэтиленгликолевой группы) алкильной цепью, замещенной одной группой галогена, предпочтительно группой хлора. В еще других вариантах осуществления изобретения, алкиленовая (часто метиленовая) группа может быть замещена группой боковой цепи аминокислоты, такой как группа боковой цепи природной или неприродной аминокислоты, например, аланина, β-аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, цистина, глутаминовой кислоты, глутамина, глицина, фенилаланина, гистидина, изолейцина, лизина, лейцина, метионина, пролина, серина, треонина, валина, триптофана или тирозина.
Термин "незамещенный" будет обозначать замещенный только атомами водорода. Диапазон атомов углерода, который включает C0, означает, что углерод отсутствует и заменен на H. Таким образом, диапазон атомов углерода, который представляет собой C0-C6, включает атомы углерода 1, 2, 3, 4, 5 и 6, и для C0 вместо углерода представлен H. Термин "замещенный" или "необязательно замещенный" будет обозначать независимо (то есть, когда встречается более чем один заместитель, каждый заместитель независим от других заместителей) один или несколько заместителей (независимо, вплоть до пяти заместителей, предпочтительно вплоть до трех заместителей, часто 1 или 2 заместителя на группе в соединении в соответствии с настоящим изобретением, и могут включать заместители, которые сами по себе могут быть дополнительно замещены) на атоме углерода (или азота) в каком-либо положении молекулы в контексте, и включает в качестве заместителей гидроксил, тиол, карбоксил, циано (C≡N), нитро (NO2), галоген (предпочтительно, 1, 2 или 3 галогена, особенно алкил, особенно метильную группу, такую как трифторметил), алкильную группу (предпочтительно C1-C10; более предпочтительно C1-C6), арил (особенно фенил и замещенный фенил, например, бензил или бензоил), алкокси группу (предпочтительно C1-C6 алкил или арил, включая фенил и замещенный фенил), простой тиоэфир (C1-C6 алкил или арил), ацил (предпочтительно C1-C6 ацил), сложный эфир или сложный тиоэфир (предпочтительно C1-C6 алкил или арил), включая алкиленовый сложный эфир (так что присоединение происходит скорее по алкиленовой группе, а не по сложноэфирной функциональной группе, которая предпочтительно замещена C1-C6 алкильной или арильной группой), предпочтительно C1-C6 алкил или арил, галоген (предпочтительно F или Cl), амин (включая пяти- или шестичленный циклический алкиленамин, кроме того, включая C1-C6 алкиламин или C1-C6 диалкиламин, алкильные группы которого могут быть замещены одной или двумя гидроксильными группами) или необязательно замещенную группу -N(C0-C6 алкил)C(O)(C1-C6 алкил) (которая может быть необязательно замещена цепочкой полиэтиленгликолевой группы, к которой, кроме того, присоединена алкильная группа, содержащая один атом галоген, предпочтительно хлор заместитель), гидразин, амидо, который предпочтительно замещен одной или двумя C1-C6 алкильными группами (включая карбоксамид, который необязательно замещен одной или двумя C1-C6 алкильными группами), алканол (предпочтительно C1-C6 алкил или арил) или алкановая кислота (предпочтительно C1-C6 алкил или арил). Заместители в соответствии с настоящим изобретением могут включать, например, группы -SiR1R2R3, где каждый из R1 и R2 имеет значения, иным образом описанные в данном документе, и R3 представляет собой H или C1-C6 алкильную группу, предпочтительно R1, R2, R3 в данном контексте представляют собой C1-C3 алкильную группу (включая изопропильную или трет-бутильную группу). Каждая из вышеописанных групп может быть напрямую связана с замещенной группой или, альтернативно, заместитель может быть присоединен к замещенной группе (предпочтительно в случае арильной или гетероарильной группы) посредством необязательно замещенной группы -(CH2)m- или, альтернативно, необязательно замещенной -(OCH2)m-, -(OCH2CH2)m- или -(CH2CH2O)m- группы, которые могут быть замещены каким-либо одним или несколькими из вышеописанных заместителей. Алкиленовые группы -(CH2)m- или -(CH2)n-группы или другие цепочки, такие как цепочки этиленгликоля, как указано выше, могут быть замещены где-либо в цепи. Предпочтительные заместители алкиленовых групп включают галоген или C1-C6 (предпочтительно C1-C3) алкильные группы, которые могут быть необязательно замещены одной или двумя гидроксильными группами, одной или двумя группами простого эфира (O-C1-C6 группы), до трех группами галогена (предпочтительно F) или боковой цепью аминокислоты, как иным образом описано в данном документе, и необязательно замещенные амидные (предпочтительно карбоксамид-замещенные, как описано выше) или уретановые группы (часто с одним или двумя C0-C6 алкильными заместителями, которые могут быть дополнительно замещенными). В некоторых вариантах осуществления изобретения алкиленовая группа (часто одна метиленовая группа) замещена одной или двумя необязательно замещенными C1-C6 алкильными группами, предпочтительно C1-C4 алкильными группами, наиболее часто метильными или O-метильными группами или боковой цепью аминокислоты, как иным образом описано в данном документе. В настоящем изобретении группа в молекуле может быть необязательно замещена вплоть до пяти заместителями, предпочтительно вплоть до трех заместителями. Наиболее часто, в настоящем изобретении группа, которая является замещенной, замещена одним или двумя заместителями.
Термин "замещенный" (каждый заместитель является независимым от любого другого заместителя) также будет обозначать в своем контексте использование C1-C6 алкила, C1-C6 алкокси, галогена, амидо, карбоксамидо, сульфона, включая сульфонамид, кето, карбокси, C1-C6 сложный эфир (оксиэфир или карбонилэфир), C1-C6 кето, уретан-O-C(O)-NR1R2 или -N(R1)-C(O)-O-R1, нитро, циано и амин (особенно, включая C1-C6 алкилен-NR1R2, моно- или ди-C1-C6 алкилзамещенные амины, которые могут быть необязательно замещены одной или двумя гидроксильными группами). Каждая из этих групп содержит, если не указано иное, в контексте, от 1 до 6 атомов углерода. В некоторых вариантах осуществления изобретения предпочтительные заместители будут включать, например, -NH-, -NHC(O)-, -O-, =O, -(CH2)m- (здесь m и n обозначают в контексте 1, 2, 3, 4, 5 или 6), -S-, -S(O)-, SO2-или -NH-C(O)-NH-, -(CH2)nOH, -(CH2)nSH, -(CH2)nCOOH, C1-C6 алкил, -(CH2)nO-(C1-C6 алкил), -(CH2)nC(O)-(C1-C6 алкил), -(CH2)nOC(O)-(C1-C6 алкил), -(CH2)nC(O)O-(C1-C6 алкил), -(CH2)nNHC(O)-R1, -(CH2)nC(O)-NR1R, -(OCH2)nOH, -(CH2O)nCOOH, C1-C6 алкил, -(OCH2)nO-(C1-C6алкил), -(CH2O)nC(O)-(C1-C6 алкил), -(OCH2)nNHC(O)-R1, -(CH2O)nC(O)-NR1R2, -S(O)2-RS, -S(O)-RS (RS представляет собой C1-C6 алкил или группу -(CH2)m-NR1R2), NO2, CN или галоген (F, Cl, Br, I, предпочтительно F или Cl), в зависимости от контекста использования заместителя. R1 и R2, каждый, в объеме контекста, представляют собой H или C1-C6 алкильную группу (которая может быть необязательно замещена одной или двумя гидроксильными группами или до трех группами галогена, предпочтительно фтором). Термин "замещенный" будет также обозначать, в химическом контексте описанного соединения и используемого заместителя, необязательно замещенную арильную или гетероарильную группу или необязательно замещенную гетероциклическую группу, как иным образом описано в данном документе. Алкиленовые группы также могут быть замещены, как описано иным образом в данном документе, предпочтительно, необязательно замещенными C1-C6 алкильными группами (метил, этил или гидроксиметил или гидроксиэтил являются предпочтительными, обеспечивая таким образом хиральный центр), боковой группой аминокислоты, как иным образом описано в данном документе, амидогруппой, описанной в настоящем документе выше, или уретановой группой O-C(O)-NR1R2, где R1 и R2 являются такими, как иным образом описано в данном документе, хотя множество других групп также могут быть использованы в качестве заместителей. Различные необязательно замещенные группы могут быть замещены 3 или более заместителями, предпочтительно не более чем 3 заместителями и предпочтительно 1 или 2 заместителями. Отмечается, что в случаях, когда в соединении в определенном положении молекулы требуется замещение (в основном, из-за валентности), но заместитель не указан, тогда заместитель представляет собой или описывается или понимается как Н, если контекст заместителя не предполагает другого.
Термин "арил" или "ароматический", в контексте, относится к замещенному (как иным образом описано в настоящем документе) или незамещенному моновалентному ароматическому радикалу, содержащему единственное кольцо (например, бензол, фенил, бензил) или конденсированные кольца (например, нафтил, антраценил, фенантренил и т.д.) и могут быть присоединены к соединению в соответствии с настоящим изобретением по любому возможному стабильному положению на кольце(ах) или как иным образом указано в представленных химических структурах. Другие примеры арильной группы, в контексте, могут включать гетероциклические ароматические кольцевые системы "гетероарильных" групп, имеющих один или несколько атомов азота, кислорода или серы в кольце (моноциклическом), таком как имидазол, фурил, пиррол, фуранил, тиен, тиазол, пиридин, пиримидин, пиразин, триазол, оксазол, или конденсированные кольцевые системы, такие как индол, хинолин, индолизин, азаиндолизин, бензофуразан и т.д., среди прочих, которые могут быть необязательно замещены, как описано выше. Гетероарильные группы, которые могут быть упомянуты, включают азотсодержащие гетероарильные группы, такие как пиррол, пиридин, пиридон, пиридазин, пиримидин, пиразин, пиразол, имидазол, триазол, триазин, тетразол, индол, изоиндол, индолизин, азаиндолизин, пурин, индазол, хинолин, дигидрохинолин, тетрагидрохинолин, изохинолин, дигидроизохинолин, тетрагидроизохинолин, хинолизин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, птеридин, имидазопиридин, имидазотриазин, пиразинопиридазин, акридин, фенантридин, карбазол, карбазолин, пиримидин, фенантролин, фенацен, оксадиазол, бензимидазол, пирролопиридин, пирролопиримидин и пиридопиримидин; содержащие серу ароматические гетероциклы, такие как тиофен и бензотиофен; содержащие кислород ароматические гетероциклы, такие как фуран, пиран, циклопентапиран, бензофуран и изобензофуран; и ароматические гетероциклы, содержащие 2 или более гетероатомов, выбранных из азота, серы и кислорода, такие как, среди прочих, тиазол, тиадиазол, изотиазол, бензоксазол, бензотиазол, бензотиадиазол, фенотиазин, изоксазол, фуразан, феноксазин, пиразолоксазол, имидазотиазол, тиенофуран, фуропиррол, пиридоксазин, фуропиридин, фуропиримидин, тиенопиримидин и оксазол, каждый из которых может быть необязательно замещен.
Термин "гетероцикл" относится к циклической группе, которая содержит, по меньшей мере, один гетероатом, то есть O, N или S, и может быть ароматическим (гетероарил) или неароматическим. Так, гетероарильные группы объединены под определением гетероцикл, в зависимости от контекста их использования. Примеры гетероарильных групп описаны в настоящем документе выше. Примеры неароматических гетероциклических групп для использования в настоящем изобретении включают, например, среди прочих, пирролидинил, пирролинил, пиперидинил, пиперазинил, N-метилпиперазинил, пиразолидинил, имидазолидинил, морфолинил, тетрагидропиранил, азетидинил, оксетанил, оксатиоланил, пиридон, 2-пирролидон, этиленмочевину, 1,3-диоксолан, 1,3-диоксан, 1,4-диоксан, фталимид и сукцинимид, как описано в настоящем документе.
Термины "лечение", "лечить" или "подвергать лечению" и т.д., как используется в настоящем документе, относятся к какому-либо действию, обеспечивающему благоприятное воздействие на пациента, которому могут быть введены настоящие соединения, включая лечение любого заболевания или состояния, которые модулированы белком, с которым связываются настоящие соединения. Заболевания или состояния, включая злокачественное новообразование, которые можно лечить с использованием соединений в соответствии с настоящим изобретением, перечислены выше.
Термин "совместное введение" или "комбинационная терапия" будет обозначать, что, по меньшей мере, два соединения или композиции вводятся пациенту в одно и то же время, таким образом, чтобы в данный момент времени у пациента обнаруживались эффективные количества или концентрации каждого из двух или более соединений. Хотя соединения в соответствии с настоящим изобретением могут быть совместно введены пациенту в одно и то же время, термин охватывает введение двух или более агентов, как в одно и то же время, так и в различное время, обеспечивая эффективные концентрации всех совместно вводимых соединений или композиций у субъекта в данное время. В некоторых предпочтительных аспектах настоящего изобретения одно или несколько настоящих соединений, описанных выше, вводятся совместно в комбинации, по меньшей мере, с одним дополнительным биологически активным агентом, особенно, включая противораковый агент. В частности, в предпочтительных аспектах изобретения совместное введение соединений приводит к синергетическому терапевтическому эффекту, включая противораковую терапию.
Фармацевтические композиции, содержащие комбинации эффективного количества, по меньшей мере, одного бифункционального соединения, в соответствии с настоящим изобретением, и одного или нескольких соединений, иным образом описанных в настоящем документе, все в эффективном количестве, в комбинации с фармацевтически эффективным количеством носителя, добавки или инертного наполнителя, представляют следующий аспект настоящего изобретения.
Настоящее изобретение включает, где это применимо, композиции, содержащие фармацевтически приемлемые соли, в частности, соли добавления кислот или оснований соединений по настоящему изобретению. Кислоты, которые используются для получения фармацевтически приемлемых кислотно-аддитивных солей вышеуказанного основного соединения, используемые в данном изобретении, представляют собой такие, которые образуют нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармакологически приемлемые анионы, такие как соли, среди многочисленных других, гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [то есть, 1,1′-метилен-бис-(2-гидрокси-3-нафтоат)].
Фармацевтически приемлемые соли добавления оснований также могут использоваться для получения фармацевтически приемлемых солевых форм соединений или производных в соответствии с настоящим изобретением. Химические основания, которые могут быть использованы в качестве реагентов для получения солей фармацевтически приемлемых оснований с настоящими соединениями, являющимися кислотными по природе, представляют собой такие, которые образуют нетоксичные соли оснований с такими соединениями. Такие нетоксичные соли оснований включают, но этим не ограничиваются, производные таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, кальция, цинка и магния), аммония, или водорастворимые соли добавления аминов, таких как N-метилглюкамин-(меглумин), и соли низшего алканоламмония и другого основания фармацевтически приемлемых органических аминов, среди прочих.
Соединения по настоящему изобретению могут быть введены, в соответствии с настоящим изобретением, единой или разделенными дозами пероральным, парентеральным или местным способами. Введение активного соединения может быть в диапазоне от непрерывного (внутривенное капельное) до нескольких пероральных введений в день (например, четыре раза в сутки), и может включать пероральное, местное, парентеральное, внутримышечное, внутривенное, подкожное, трансдермальное (которое может включать усиливающий проницаемость агент), буккальное, сублингвальное введение и с помощью суппозиториев, помимо других путей введения. Для повышения биодоступности соединения при пероральном пути введения также могут быть использованы пероральные таблетки с кишечным покрытием. Наиболее эффективные дозированные формы будут зависеть от фармакокинетики конкретного выбранного агента, а также от тяжести заболевания у пациента. Также может быть использовано введение соединений в соответствии с настоящим изобретением в виде спреев, туманов или аэрозолей для интраназального, интратрахеального или пульмонарного введения. Настоящее изобретение, таким образом, также относится к фармацевтическим композициям, содержащим эффективное количество соединения в соответствии с настоящим изобретением необязательно в комбинации с фармацевтически приемлемым носителем, добавкой или инертным наполнителем. Соединения в соответствии с настоящим изобретением могут быть введены в формах немедленного высвобождения, промежуточного высвобождения или задерживаемого или контролируемого высвобождения. Формы задерживаемого или контролируемого высвобождения предпочтительно вводятся перорально, но также в виде суппозиториев и трансдермальных или других местных форм. Также могут быть использованы внутримышечные инъекции в липосомальной форме для контролируемого или задерживаемого высвобождения соединения в месте инъекции.
Композиции по настоящему изобретению могут быть приготовлены обычным способом с использованием одного или нескольких фармацевтически приемлемых носителей, и также могут быть введены в виде препаратов с контролируемым высвобождением. Фармацевтически приемлемые носители, которые могут быть использованы в данных фармацевтических композициях, включают, но этим не ограничиваются, ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферирующие вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов с насыщенными растительными жирными кислотами, воду, соли или электролиты, такие как проламин сульфат, динатрий гидрофосфат, калий гидрофосфат, хлорид натрия, соли цинка, коллоидный кремнезем, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий карбоксиметилцеллюлозу, полиакрилаты, воск, полиэтилен-полиоксипропилен блок-сополимеры, полиэтиленгликоль и ланолин.
Композиции по настоящему изобретению могут быть введены перорально, парентерально, путем ингаляции, местно, ректально, назально, трансбуккально, вагинально или через имплантированный резервуар. Термин "парентеральный", как используется в настоящем документе, включает подкожную, внутривенную, внутримышечную, внутрисуставную, внутрисиновиальную, внутригрудинную, интратекальную, внутрипеченочную, в очаг поражения и внутричерепную инъекцию или инфузию. Предпочтительно, композиции вводят перорально, внутрибрюшинно или внутривенно.
Стерильные инъекционные формы композиции по данному изобретению могут представлять собой водную или масляную суспензию. Эти суспензии могут быть получены в соответствии с методами, известными в данной области, с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, таком как раствор в 1,3-бутандиоле. Приемлемыми носителями и растворителями, которые могут быть использованы, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. В этих целях может быть использовано любое мягкое жирное масло, включая синтетические моно- или диглицериды. Для приготовления препаратов для инъекций могут быть использованы жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, а также природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно их полиоксиэтилированные производные. Эти масляные растворы или суспензии могут также содержать разбавитель или диспергатор длинноцепочечного спирта, такие как указанные в Ph. Helv (Фармакопея Швейцарии), или подобный спирт.
Фармацевтические композиции по данному изобретению могут быть введены перорально в любой перорально приемлемой лекарственной форме, включая, но не ограничиваясь ими, капсулы, таблетки, суспензии или водные растворы. В случае таблеток для перорального применения носители, которые являются широко используемыми, включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул пригодные разбавители включают лактозу и высушенный кукурузный крахмал. Когда для перорального применения требуются водные суспензии, активный ингредиент комбинируют с эмульгирующими и суспендирующими агентами. При желании, также могут быть добавлены некоторые подсластители, ароматизаторы или красители.
Альтернативно, фармацевтические композиции по данному изобретению можно вводить в виде суппозиториев для ректального введения. Они могут быть получены путем смешивания агента с подходящим не раздражающим инертным наполнителем, который является твердым при комнатной температуре, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли.
Фармацевтические композиции по данному изобретению также могут быть введены местно. Подходящие препараты для местного применения могут быть легко получены для каждого участка применения или органа. Местное применение для нижнего отдела кишечника может быть осуществлено с помощью ректальных суппозиториев (смотри выше) или подходящих клизм. Также могут быть использованы подходящие для местного применения пластыри.
Для местного применения фармацевтические композиции могут быть приготовлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для введения местно соединений по данному изобретению включают, но этим не ограничиваются, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульсифицированный воск и воду. В некоторых предпочтительных аспектах изобретения соединения могут быть нанесены на стент, который хирургическим путем имплантирован пациенту для ингибирования или снижения вероятности окклюзии, происходящей в стенте пациента.
Альтернативно, фармацевтические композиции могут быть приготовлены в виде подходящего лосьона или крема, содержащих активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителях. Подходящие носители включают, но этим не ограничиваются, минеральное масло, моностеарат сорбита, полисорбат 60, цетиловые эфиры воска, стеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
Для офтальмологического применения фармацевтические композиции могут быть приготовлены в виде микронизированных суспензий в изотоническом, стерильном физиологическом растворе с установленным рН или, предпочтительно, в виде растворов в изотоническом, стерильном физиологическом растворе с установленным рН, либо с консервантом, либо без него, таким как бензилалконий хлорид. Альтернативно, для офтальмологического применения фармацевтические композиции могут быть приготовлены в виде мази, такой как вазелин.
Фармацевтические композиции по данному изобретению также могут быть введены в виде назального аэрозоля или путем ингаляции. Такие композиции получают в соответствии с методами, хорошо известными в области фармацевтических препаратов, и они могут быть получены в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, усилителей абсорбции для повышения биодоступности, фторуглеродов и/или других обычных солюбилизирующих или диспергирующих агентов.
Количество соединения в фармацевтической композиции по настоящему изобретению, которое может быть объединено с материалами носителя для приготовления единичной дозированной формы, будет меняться в зависимости от хозяина и заболевания, которое лечат, конкретного пути введения. Предпочтительно, композиции должны быть приготовлены с содержанием от примерно 0,05 миллиграмм до примерно 750 миллиграмм или выше, более предпочтительно от примерно 1 миллиграмм до примерно 600 миллиграмм, и даже более предпочтительно от примерно 10 миллиграмм до примерно 500 миллиграмм, активного ингредиента, отдельно или в комбинации, по меньшей мере, с одним другим соединением в соответствии с настоящим изобретением.
Следует также учесть, что конкретная доза и режим лечения для любого конкретного пациента будут зависеть от множества факторов, включая активность конкретного соединения, возраст, массу тела, общее состояние здоровья, пол, питание, время введения, скорость экскреции, комбинацию лекарств и заключение лечащего врача, и тяжесть лечимого конкретного заболевания или состояния.
Пациент или субъект, при необходимости лечения с использованием соединения в соответствии с настоящим изобретением, может получать лечение путем введения пациенту (субъекту) эффективного количества соединения в соответствии с настоящим изобретением, включая его фармацевтически приемлемые соли, сольваты или полиморфы, необязательно в фармацевтически приемлемом носителе или разбавителе, либо отдельно, либо в комбинации с другими известными средствами, стимулирующими эритропоэз, как это иным образом описано в настоящем документе.
Указанные соединения могут быть введены любым подходящим способом, например, перорально, парентерально, внутривенно, внутрикожно, подкожно или местно, включая трансдермально, в виде жидкости, крема, геля, или твердом виде, или в виде аэрозоля.
Активное соединение вводят в фармацевтически приемлемый носитель или разбавитель в количестве, достаточном для доставки пациенту терапевтически эффективного количества до нужного показателя, не вызывая серьезных токсических эффектов у проходящего лечение пациента. Предпочтительная доза активного соединения для всех упомянутых в данном документе состояний находится в интервале от примерно 10 нг/кг до 300 мг/кг, предпочтительно от 0,1 до 100 мг/кг в сутки, более обычно от 0,5 до примерно 25 мг на килограмм массы тела реципиента/пациента в сутки. Обычная доза для местного применения будет в интервале 0,01-5% масс./масс. в подходящем носителе.
Соединение обычно вводят в виде любой приемлемой единичной дозированной формы, включая, но этим не ограничиваясь, в форме, содержащей менее чем 1 мг, от 1 мг до 3000 мг, предпочтительно от 5 до 500 мг активного ингредиента на единичную дозированную форму. Часто удобной является пероральная дозировка примерно в 25-250 мг.
Активный ингредиент предпочтительно вводят для достижения пиковой концентрации активного соединения в плазме, составляющей примерно 0,00001-30 мМ, предпочтительно примерно 0,1-30 мкМ. Это может быть достигнуто, например, путем внутривенной инъекции раствора или препарата активного ингредиента, необязательно в физиологическом растворе, или в водной среде, или введением в виде болюса активного ингредиента. Пероральное введение является также подходящим для достижения эффективной концентрации активного агента в плазме.
Концентрация активного соединения в лекарственной композиции будет зависеть от показателей абсорбции, распределения, инактивации и выделения препарата, а также от других факторов, известных специалистам в данной области. Следует отметить, что величины доз также меняются в зависимости от тяжести состояния, которое необходимо облегчить. Следует также учесть, что для любого конкретного субъекта конкретные режимы дозирования должны быть скорректированы с течением времени в соответствии с индивидуальной потребностью и в соответствии с профессиональным суждением лица, назначающего или осуществляющего наблюдение за введением композиции, и что диапазоны концентраций, указанных в настоящем документе, даны только для примеров и не предназначены для ограничения объема или практического воплощения заявленной композиции. Активный ингредиент может быть введен сразу или может быть разделен на несколько меньших доз, подлежащих введению через изменяющиеся промежутки времени.
Пероральные композиции, как правило, включают в себя инертный разбавитель или пищевой носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для целей перорального терапевтического введения, активное соединение или его пролекарственное производное могут быть объединены с инертными наполнителями и использоваться в виде таблеток, пастилок или капсул. В качестве части композиции могут входить фармацевтически совместимые связывающие агенты и/или вспомогательные лекарственные средства.
Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ингредиентов или соединения аналогичного характера: связующее, такое как микрокристаллическая целлюлоза, трагакант или желатин; инертный наполнитель, такой как крахмал или лактоза; диспергирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния или Sterotes; вещество, придающее скользкость, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор. Когда стандартной дозированной формой является капсула, она может содержать, в дополнение к материалам выше перечисленного типа, жидкий носитель, такой как жирное масло. Кроме этого, стандартные дозированные формы могут содержать другие разнообразные материалы, которые меняют физическую форму дозированной единицы, например, оболочки из сахара, шеллака или энтеросолюбильных веществ.
Активное соединение или его фармацевтически приемлемая соль могут вводиться в виде компонента эликсира, суспензии, сиропа, капсулы, жевательной резинки и тому подобного. Сироп может содержать, в дополнение к активным соединениям, сахарозу в качестве подсластителя и некоторые консерванты, красители и окрашивающие средства и ароматизаторы.
Активное соединение или его фармацевтически приемлемые соли также могут быть смешаны с другими активными материалами, которые не уменьшают желательного действия, или с материалами, которые поддерживают желательное действие, такими как стимулирующие эритропоэз агенты, включая EPO и дарбапоэтин альфа, среди прочих. В некоторых предпочтительных аспектах изобретения, одно или несколько соединений в соответствии с настоящим изобретением вводятся совместно с другим биологически активным агентом, таким как агент, стимулирующий эритропоэз, или лекарственный агент, включая антибиотик, как иным образом описано в данном документе.
Растворы или суспензии, используемые для парентерального, внутрикожного, подкожного или местного применения, могут включать в себя следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические разбавители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты; и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть помещен в ампулы, одноразовые шприцы или содержащие множество доз пузырьки, изготовленные из стекла или пластика.
В случае внутривенного введения предпочтительными носителями являются физиологический солевой раствор или фосфатный солевой буфер (ФСБ).
В одном варианте осуществления изобретения активные соединения готовят с носителями, которые будут предохранять соединения от быстрого вывода их из организма, например, в форме с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Могут быть использованы поддающиеся биоразложению биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Способы получения таких составов будут очевидны специалистам в данной области.
Липосомальные суспензии также могут служить фармацевтически приемлемыми носителями. Они могут быть получены методами, известными специалистам в данной области, например, как описано в патенте США № 4522811 (который включен здесь в качестве ссылки во всей своей полноте). Например, липосомные составы могут быть получены путем растворения подходящего(их) липида(ов) (такого как стеароилфосфатидилэтаноламин, стеароилфосфатидилхолин, арахадоилфосфатидилхолин и холестерин) в неорганическом растворителе, который затем выпаривают, оставляя на поверхности сосуда тонкую пленку высушенного липида. Затем в сосуд помещают водный раствор активного соединения. Сосуд затем вращают вручную для освобождения липидного материала от стенок сосуда и для измельчения липидных агрегатов, образуя, таким образом, липосомальную суспензию.
Общие синтетические подходы
Далее описана общая схема синтеза производных ULM. Вкратце, соединения по настоящему изобретению синтезируют в соответствии с общей схемой жидкофазного синтеза (представлена ниже) и/или общей схемой I, которая относится к фазовому синтезу соединений в соответствии с настоящим изобретением. Первоначально гидроксил-защищенное карбокси-замещенное (и защищенное) пирролидиновое соединение подвергают взаимодействию с карбоновой кислотой, содержащей реагент, который вводит карбонильную группу в амин пирролидинового кольца с образованием амидной группы. Альтернативно, пирролидиновый амин может быть защищен, и группа карбоновой кислоты может быть конденсирована с нуклеофильной группой по правой стороне фрагмента с получением амида на правой части пирролидиновой группы. Левый и правый фрагменты, которые будут конденсированы по, соответственно, аминогруппе и группе карбоновой кислоты пирролидиновой группы, предпочтительно получают перед конденсацией на пирролидиновой группе, однако могут быть применимы и другие подходы для введения группы в пирролидиновый фрагмент. Отдельные компоненты, которые объединяют для получения группы ULM, могут быть получены с использованием защитных групп на предпочтительных функциональных группах группы ULM, которые могут быть удалены таким образом, чтобы дать взаимодействовать и ковалентно связывать линкерную группу, которую получают для присоединения группы PTM, к которой уже присоединена связанная белком группа. Или группа PTM может быть далее подвергнута взаимодействию с образованием ковалентной связи с группой PTM, которая может также может включать группу ULM, как иным образом описано в данном документе. Таким образом, содержащий карбоновую кислоту левый фрагмент может быть конденсирован по аминогруппе пирролина, образуя таким образом амидную группу с левым фрагментом R1, как показано далее. На карбоксильной группе любое количество нуклеофильных (предпочтительно, содержащих амин) правых фрагментов (предварительно синтезированных) может быть конденсировано по карбоксильной группе с получением амидной группы с правым фрагментом R2, как изображено ниже. Образование предварительно синтезированных групп для конденсации по аминогруппе и/или карбоксильной группе пирролидина протекает легко. Практически любое соединение может быть легко синтезировано с помощью этого подхода. Также может быть использован твердофазный синтетический способ и использованы аналогичные способы, применяемые в жидкофазном синтезе, главное различие состоит в том, что гидроксильная группа может быть связана с твердой подложкой, в то время как проводятся другие стадии синтеза. Общие синтетические способы являются применимыми практически для всех соединений по настоящему изобретению с легко осуществимыми модификациями, согласующимися с возможностью химического синтеза, как используется непосредственно или адаптированно на основе конкретного изучения примеров, которые следуют далее.
Схема 1: Жидкофазный синтез производных UML в соответствии с настоящим изобретением
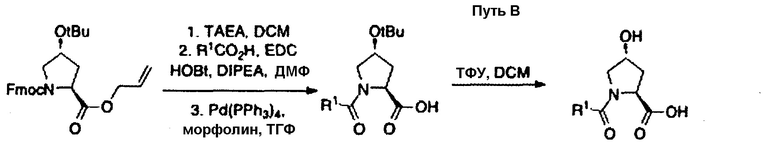
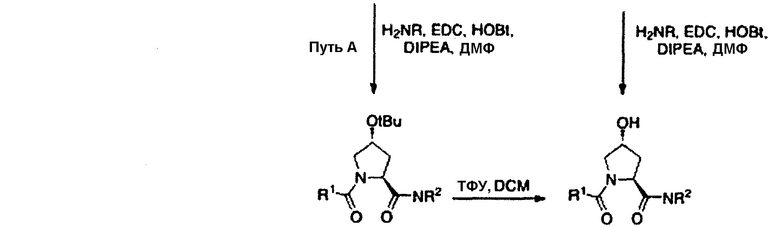
Схема 2: Твердофазный синтез соединений в соответствии с настоящим изобретением
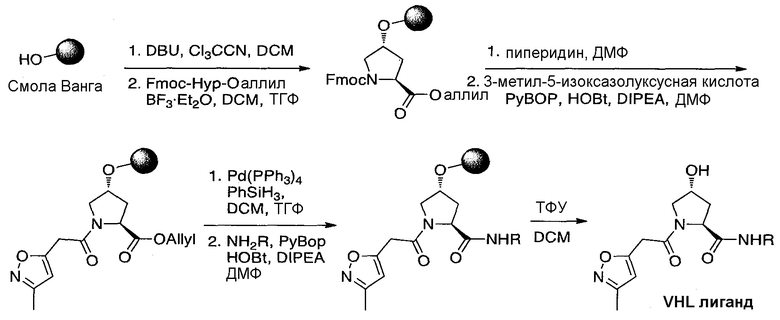
Альтернативный общий способ твердофазного синтеза лигандов VHL в соответствии с настоящим изобретением (подробности которого представлены во второй группе примеров) описан далее:
Синтетические подходы к синтезу соединений для скрининга связывающих белок-мишень элементов (PTM) и фрагментов лиганда убиквитинилирования (ULM) по настоящему изобретению
Двумя основными способами, которые используются в комбинаторной химии для идентификации фрагментов PTM и фрагментов ULM, являются твердофазный и жидкофазный способы. Используя эти способы, комбинаторные соединения создаются либо путем жидкофазного синтеза, либо получая соединения, ковалентно связанные с частицами твердой фазы. Как только фрагменты идентифицированы, они могут быть модифицированы с помощью соответствующей группы (электрофильной и/или нуклеофильной) и конденсированы с линкерными группами для получения бифункциональных соединений в соответствии с настоящим изобретением.
Твердофазные способы
Твердофазные способы основывались на исследованиях, описанных в работе Fruchtel, et al. 1996, Angew. Chem. Int. Ed. Engl. 35, 17-42; которая включена в виде ссылки во все своей полноте.
Твердофазный синтез облегчает проведение многостадийных реакций и приводит реакцию к завершению, поскольку избыток реагентов может быть добавлен, а затем легко промыт после каждый стадии реакции. Другим ключевым фактором в пользу твердофазного синтеза является то, что он дает возможность использовать сплит-синтез, метод, разработанный в 1982 году. Сплит-синтез дает огромные связанные с подложкой библиотеки, в которых каждая частица твердой фазы удерживает одно соединение, или растворимые библиотеки, полученные путем отщепления соединения от твердой подложки. Например, в методе сплит-синтеза, если имеются стадии добавления 3 соединений к 10 соединениям, используемым на каждой стадии, то есть 10 контейнерам для указанных соединений. Это даст 103 соединений. Кроме того, если предполагается осуществить все стадии реакции, включенные в синтез 10000 соединений, посредством твердофазных способов с использования трехстадийных синтезов, может потребоваться только около 22 контейнеров для синтеза и около 66 стадий жидкой обработки по сравнению с 10000 контейнерами и 30000 стадиями при жидкой обработке. При объединении этих преимуществ твердофазного синтеза со сплит-синтезом достигается значительный уровень синергии.
Жидкофазные способы
Жидкофазный синтез является предпочтительным для многих конструкций библиотек в связи с широким диапазоном органических реакций, доступных для жидкофазного синтеза, методов, используемых традиционно большинством химиков в органических синтезах, а продукты в растворе могут быть более легко идентифицированы стандартными анализами лекарственных средств и охарактеризованы. Проблемой для жидкофазного синтеза одной молекулы в то же время является конечная очистка, которая может быть не только дорогостоящей, но и длительной. Обычно хроматография является первым излюбленным средством, поскольку она обычно работает. Кроме того, проблемы, связанные с синтезом в растворе, усугубляются при попытке создать десятки тысяч соединений для создания библиотеки или "книгу" для библиотеки.
При создании библиотек соединений были разработаны многочисленные способы, приводящие к широкому распространению использования больших библиотек химических веществ для легкой возможности обнаружения потенциальных кандидатов в лекарства. Создание библиотек химических соединений, которые являются свободными в растворе, обычно составляет цель большей части фармацевтической промышленности. Эта цель обусловлена природой многих мишеней лекарственных препаратов и соответствующих анализов. Кроме того, конструкция и полезность библиотек химических соединений, как правило, играют вспомогательную роль, но разработка эталонов соединений в растворе создает основу библиотеки химических соединений. Таким образом, главные преимущества способов твердофазного синтеза, как правило, не полностью реализованы в контексте нынешних усилий по разработке лекарственных препаратов. Основным выводом из этого является интерес не к связыванию соединения с целевым лекарственным средством, но показать, что активность целевого лекарственного средства меняется, для чего обычно требуется наличие свободного соединения в растворе. Дальнейшие проблемы с библиотеками соединений на твердой фазе возникают из опасений потенциального влияния линкера и пространственных эффектов на соединения, связанные с твердой фазой.
Таким образом, способы разработки соединений, которые связываются мишеневыми молекулами, известны в данной области. Кроме того, оптимизация первоначально разработанных соединений хорошо известна в данной области, где аффинность улучшена путем создания пула связанного соединения посредством селективного комбинаторного химического подхода.
Настоящее изобретение касается механизма для преодоления этих проблем при разработке лекарственных средств и небольших молекул.
Добавление связывающего фрагмента убиквитин лигазы (ULM)
В настоящий момент в процессе разработки соединений по настоящему изобретению был идентифицирован связывающий элемент белка-мишени соединений по изобретению. Эти оптимальные связывающие молекулы затем подвергают дальнейшему синтезу, чтобы добавить связывающий фрагмент убиквитин лигазы (ULM), основываясь на описании настоящей заявки.
Альтернативный подход к созданию связывающего элемента белка-мишени основан на жидкофазном скрининге. В таком примере соединения (доступны либо посредством синтеза, природные продукты или полученные от компаний, таких как ArQule (www.arqule.com), Pharmacopiea (www.pharmacopiea) и Cerep (www.cerep.com) получают и добавляют к представляющим интерес белкам-мишеням, и затем несвязанные соединения удаляют. Фракцию связанного белка далее подвергают анализу ГХ/МС для идентификации молекул. Таким образом, скрининг жидкой фазы осуществляется быстро и легко для соединений в растворе. Есть множество дополнительные путей определения лигандного связывания, включая, например, среди прочих, определение изменений в Tm белке при лигандном связывании.
Скрининг на связывающие элементы белка-мишени
Сначала выбирают белок-мишень, например, фермент или белок, участвующий в том или ином биологическом процессе. Белок-мишень для настоящего изобретения берут из различных областей, где для достижения модулирования биологической системы в эукариотических организмах используются небольшие молекулы. Примерами таких областей являются противовирусные, противомикробные, антипаразитарные или другие целевые лекарственные средства для пациента-человека, которые могут быть весьма разнообразными, и т.д.
Белок-мишень затем либо очищают от естественного источника, чтобы получить достаточно материала для скрининга, либо экспрессируют посредством рекомбинантных способов для получения достаточного материала для скрининга.
Белок-мишень затем метят либо обнаруживаемыми напрямую образцами, такими как радиоактивная, электрохемилюминесцентная и хемилюминесцентная или флуоресцентная метка, либо обнаруживаемыми косвенно образцами, такими как фермент или частица. Альтернативно, белок-мишень метят антителом или эквивалентом со связывающей активностью.
Следующим шагом является создание библиотеки соединений для скрининга. Типичный размер библиотеки, которую подвергают скринингу, составляет от 1000 до 1000000. Они могут быть доступны от ряда компаний, которые хорошо известны в данной области. Эти библиотеки соединений используются для скрининга связывания белка-мишени. В идеале, соединения приобретают уже связанными с твердой фазой или подвергают скринингу на связывание непосредственно с иммобилизованным белком-мишенью, используя способы, описанные далее для скрининга.
Также можно создавать библиотеку химических соединений с различной возможностью связывания молекул, присоединенных к твердой фазе, следуя обычным способам, получая соединения с различными возможностями. Оптимальными способами конструирования библиотеки химических соединений являются использование способов сплит-синтеза, связанного с твердой фазой (как указано выше). Библиотеку создают с использованием серии твердофазных синтезов, которые дают возможность различным компиляциям, которые образуют основу библиотеки. Библиотеку подвергают скринингу в виде библиотеки или в виде компиляций. Как правило, можно взять продукты сплит-синтеза и пул твердой фазы и использовать это в качестве основы для скрининга.
К пулу бусин, используемых в качестве твердой фазы для синтеза, добавляют смесь буфера, детергентов, солей и блокирующих агентов, таких как сывороточный альбумин или другие белки. Эту стадию добавления буфера используют для блокировки бусин или твердой фазы таким образом, чтобы не происходило какое-либо значительное неспецифическое связывание выбранного белка-мишени. После этой стадии блокирования бусины промывают и и затем добавляют белок-мишень, либо меченый, либо нет. Бусины или твердую фазу затем инкубируют, давая осуществиться присоединению связывающих элементов белка-мишени к белку-мишени. После инкубирования мишеневую молекулу к бусине или твердофазные бусины промывают и затем сразу определяют связывание меченого белка-мишени. В альтернативном формате, если белок-мишень был мечен косвенно определяемой меткой, такой как фермент, бусины могли быть затем помещены в реакционный раствор субстрата для обнаружения присутствия ферментной метки. В случае ферментной метки субстраты для этих способов обнаружения были основаны на нерастворимых хромогенных продуктах. В случае, когда белок-мишень не был мечен и были доступны антитело или эквивалент, бусины подвергают другой реакции связывания, где антитела или эквивалент были мечены, либо непосредственно, либо косвенно, как это предлагается для мечения белка-мишени. На этой стадии возможно также не использовать меченое антитело или эквивалент, а добавить еще одну стадию, где используется меченое антитело или эквивалент. Эти дополнительные стадии могут быть определены с помощью тех же стандартных способов, известных в данной области, как это предлагается для непосредственно меченого белка-мишени.
После этих стадий серии бусин идентифицируются, и эти бусины выбирают из набора бусин и подвергают анализу, чтобы определить структуру связывающей молекулы, которая способна связывать белок-мишень, как в этом примере. Это достигается за счет использования анализа ГХ/МС или посредством молекулярных тэгов, используемых при создании библиотеки, как описано выше. Альтернативно, пул, который является положительным, переделывают, создавая подпул для скрининга и дальнейшего повторного синтеза и разделяя различные соединения пула до одного соединения, представленного в одной лунке для анализа, позволяющего определить активное соединение.
Этот метод может быть повторен и/или адаптирован для идентификации связывающего фрагмента пептида-мишени (PTM) практически любого белка-мишени.
Скрининг связывающих молекул из библиотек химических соединений
Стадия скрининга для конкретных молекул по изобретению осуществляется легко, так как желаемой является только связывающая активность, а не специфическое модулирование белка-мишени, как это требуется при традиционной разработке лекарственных средств.
Библиотеку соединений для скрининга можно купить. Типичный размер библиотеки, которая может быть подвергнута скринингу, составляет от 1000 до 1000000. Они доступны от ряда компаний. Эти библиотеки соединений используются для скрининга связывания белка-мишени. В идеале, соединения приобретают уже связанными с твердой фазой или подвергают скринингу на связывание непосредственно с иммобилизованным белком-мишенью, используя способы, описанные далее для скрининга.
Также можно создавать библиотеку химических соединений из от 1000 до 100000 соединений, содержащихся на твердой фазе, используя способы сплит-синтеза, как описано выше. Библиотека может быть создана с помощью ряда химических способов, приводящих в результате к получению пула твердой фазы, используемого в процессе синтеза, который образует основу элементов, составляющих библиотеку. Кроме того, на заключительной стадии химического связывания, используемого для создания различных элементов, твердофазные пулы хранятся в подпулах в библиотеках. Эти так называемые элементы и подпулы образуют основу для скрининга, поскольку они включают не только пулы соединений, но и известную стадию химического связывания, используемую в синтезе.
Библиотека может быть затем подвергнута скринингу с использованием двух подходов. В обоих случаях твердую фазу из библиотеки химических соединений, подвергаемых скринингу, инкубируют с аналитическим буфером с блокирующими агентами, такими как, например, белки (то есть BSA, желатин), поливинилпирролидон, фиколл, гепарин, детергенты (то есть SDS, Твин, NP40, Тритон Х-100). Эта стадия инкубирования предназначена для блокирования неспецифических сайтов связывания на твердой фазе, используемой при создании библиотеки, и позволяет определить случаи специфического связывания. Эта начальная инкубация не является признанной стадией в данной области в различных анализах связывания, таких как ELISA, саузерн, вестерн и т.д. После этой инкубации с блокирующими агентами, далее к буферу добавляется представляющий интерес белок, который обычно имеет тот же состав, что и в процессе стадии блокирования, но также может быть модифицирован с помощью меньшего количества дополнительных блокирующих агентов или без них, за исключением детергентов, которые обычно всегда присутствуют в реакции связывания.
В одном из способов скрининга элементы после блокирующей стадии затем подвергают связыванию с очищенным белком-мишенью. Твердую фазу с этого ингибирования затем промывают и подвергают второй стадии связывания с меченым реагентом, который соединяется с последовательностью тэга, добавляемой к подъединицам рецепторов в процессе рекомбинантной инженерии для экспрессии подъединиц рецепторов. Обычно антитело к этому тэгу распознает последовательность тэгов; примерами, которые обычно используются, являются myc, flag и их эпитопы. После инкубирования с тэг специфическими связывающими образцами присутствие меченых связывающих образцов определяется по присутствию метки, которой является, как правило, фермент, такой как щелочная фосфатаза или пероксидаза. На стадии определения обычно используют нерастворимый хромогенный субстрат, который легко определяется визуально или с помощью систем анализа изображений.
В альтернативном способе также могут быть использованы и подвергнуты скринингу растворимые субстраты с использованием ELISA эталонов, визуально или другими спектрофотометрическими методами. В своей простейшей форме различные элементы из библиотеки подвергаются скринингу визуально для поиска бусин, которые приобрели цвет в связи с действием ферментов на хромогенный субстрат. Эти окрашенные бусины показывают, что субъединицы рецепторов связываются с одним из соединений в группе элементов, следующей стадией является определение того, имеют ли так называемые положительные группы элементов специфическое связывание, или является ли связывание просто тэг связывающим реагентом или некоторой неспецифической активацией хромогенного субстрата. Для достижения этого, положительные элементы подвергают скринингу со стадией неспецифического связывания с подъединицей рецептора. Если эти позитивные элементы теперь становятся отрицательным или показывают значительно сниженные сигналы в терминах положительных твердых фаз со смесью, тогда они рассматриваются как действительно положительные хиты при скрининге. Эти действительно положительные элементы затем подвергали повторному синтезу. В этом повторном синтезе первоначальные химические стадии создания специфической связывающей молекулы являются неизвестными, только последняя стадия химического связывания в синтезе соединения является известной, поскольку она является последней химической стадией по конструированию группы элементов. В процессе повторного синтеза положительную часть химической стадии осуществляют перед последним химическим связыванием, как и в начальном синтезе, но твердую фазу не подвергают пулу и сплиту для окончательного химического связывания, но поддерживают как отдельные пулы, затем подвергают стадии химического связывания, известного для этой части. Результаты этого повторного синтеза приводят к получению новой серии пулов твердофазных соединений, для которых две последние стадии химического связывания являются известными. Эти новые серии пулов твердофазных соединений подвергают скринингу, как в начальном скрининге, и положительные пулы проверяют, как раньше, на специфичность связывания с установленными положительными пулами. Положительный(ые) пул(ы) теперь позволяют повторный синтез пула(ов) с последними двумя стадиями для получения соединения, которое специфически связывается с субъединицей рецептора. Положительные пулы затем подвергают тому же циклу повторного синтеза и скринингу, как уже описано выше, но две последние стадии химического связывания узнавания пулов поддерживаются отдельно перед последней стадией узнавания. Таким способом синтез специфического соединения, способного связываться с субъединицей рецептора, является допустимым из библиотеки химических соединений и идентифицируемым.
В альтернативном способе положительная твердая фаза удаляется из скрининга и собирается. Затем ее подвергают реакции расщепления, при этом с твердой фазы удаляется специфическое химическое соединение с последующим анализом различных химических веществ с использованием ГХ для выделения индивидуальных соединений с последующим МС анализом для определения молекулярной массы. Эта информация, связанная с используемыми способами синтеза, используется для определения идентичности соединений. После определения этих различных кандидатных молекул специфического связывания, их затем повторно синтезируют и подвергают анализу связывания, чтобы проверить, являются ли они специфическими соединениями, которые приводят к положительным твердым фазам.
Скрининг связывающего фрагмента убиквитин лигаза
Данный скрининг касается следующих способов и протоколов, известных в данной области техники, позволяющих идентифицировать соединения в соответствии с настоящим изобретением, которые связываются с убиквитин лигазой. Эти соединения, уже здесь идентифицированные, образуют основу для разработки соединений по изобретению. Эти соединения затем подвергают дальнейшему синтезу на основе использования линкерной группы, применяемой в разработке твердофазного химического продукта. К этой линкерной группе добавляются различные связывающие фрагменты убиквитин лигазы и/или связывающие фрагменты белка, обычно посредством реакций конденсации или других реакций для связывания лиганда со связывающим фрагментом убиквитин лигазы или связывающим фрагментом белка. Эти реакции хорошо известны в данной области. Дериватизация линкерной группы является хорошо известной в данной области и может представлять собой введение нуклеофильной группы (например, спиртовой, амино, тиоловой или другой нуклеофильной группы) или электрофильной группы (например, сложноэфирной, карбокислотной, ацилгалогенидной, галогеновой и т.д.) либо на один, либо на оба конца линкерной группы, которые могут быть использованы для конденсации соответственно модифицированной группы ULM и/или группы PTM c линкером с образованием ковалентной связи. На последней стадии образуются соединения по изобретению. Соединения по изобретению далее подвергают анализу, чтобы определить, какое из соединений скрининга библиотеки химических соединений, с каким отдельным элементом связывающего фрагмента убиквитин лигазы способно действовать наиболее эффективно при мишеневом убиквитинилировании и/или деградации белка-мишени. Связывающий фрагмент убиквитин лигазы может быть определен способами, как иным образом описано в разделе примеров далее. Кроме того, соединения по изобретению могут быть исследованы на системах культур тканей млекопитающих, где белок-мишень экспрессирует либо неизмененным, либо в виде сконструированного фрагмента. На такой системе культур тканей млекопитающих соединения, воздействующие на уровень белка-мишени, определяются путем использования тэг последовательности, которая может быть сконструирована при рекомбинантной экспрессии белка-мишени в процессе конструирования тестовой системы культур тканей млекопитающих соединения. Тэг последовательность используется для определения уровней белков-мишеней в процессе инкубирования с потенциальными соединениями скрининга и синтезированных, как описано выше. Этот анализ тэг последовательности может быть в виде иммуноблоттинга или посредством ELISA, например. Другие тэги, которые являются ценными для использования, представляют собой такие, которые основаны на зеленом флуоресцентном белке, который позволяет анализировать уровни белка в живых клетках и/или организмах.
Соединения, которые показывают оптимальную активность в тест-системах, будут затем образовывать основу для следующего этапа разработки лекарственных средств. На следующем этапе эти выбранные соединения подвергают общепризнанному пути разработки лекарственных средств. Путь разработки лекарственных средств определяет потенциальную ценность соединения путем оценки ряда факторов, включая биодоступность; токсикологию, фармакологию и эффективность на животных моделях, перед тем как соединения будут признаны возможными для тестирования на человеке.
Контроль уровней белка
Данное изобретение относится также к способу контроля уровней белка в клетке. Он основан на применении соединений по изобретению, которые известны как взаимодействующие со специфическим белком-мишенью, так что деградация белка-мишени in vivo будет приводить к контролю количества белка в биологической системе, предпочтительно к конкретному терапевтическому успеху.
Следующие примеры используются для более полного раскрытия описания настоящего изобретения, но не должны рассматриваться как ограничивающие настоящее изобретение каким-либо образом.
Примеры
Первый сет
Первоначально авторы данного изобретения высказали предположение, что низкомолекулярные ингибиторы взаимодействия VHL/HIF-1α могли бы быть рационально сконструированы с использованием гидроксипролина (Hyp) в качестве исходной точки, поскольку остаток Hyp564 на HIF-1α осуществляет ключевые взаимодействия с VHL14 и имеет ключевое значение для HIF-1α связывания15. Авторы данного изобретения использовали de-novo (разработанное с нуля) программное обеспечение BOMB для проведения селекции возможных гидроксипролиновых аналогов.16 Соединения 1 и 2 были синтезированы для исследования перспективных конструктивных свойств фрагмента изоксазола, ориентированного для взаимодействия с кристаллографической водой, наблюдаемой в структуре VHL, связанной с HIF пептидом (549-582)14, и бензильной группой, расположенной вдоль боковой цепи Tyr98. Их способность связываться с VHL измеряли по конкуренции флуоресцентного пептида HIF-1α с помощью флуоресцентной поляризации (FP).17 Оба были способны вытеснять флуоресцентный пептид даже при высокой концентрации (таблица 1A). В то время как меньший 3 не смог полностью вытеснить флуоресцентный пептид, наблюдали связывание с VHL посредством WaterLOGSY и разницы переноса насыщения (STD) ЯМР. Поскольку наблюдали связывание не только с гидроксипролином, это дает основание полагать, что авторы данного изобретения идентифицировали минимальный фармакофор (смотри фигуру 2).

Обнадеженные этими начальными результатами, авторы данного изобретения стремились повысить сродство предложенных ими лигандов VHL путем модификации бензиламинового фрагмента 1 при сохранении метил-изоксазольного фрагмента. Для того чтобы синтезировать аналоги быстро, авторы данного изобретения разработали твердофазный синтез, который включает прикрепление Fmoc-Hyp-OАллил к смоле Ванга.18 Снятие защиты с Fmoc, связывание с 3-метил-5-изоксазолуксусной кислотой, последующее снятие защиты сложного аллилового эфира, связывание с различными аминами и дальнейшее расщепление трифторуксусной кислотой приводит к быстрому образованию лигандов VHL (схема 1).19,20 Затем эти лиганды исследуются на предмет их способности связывать VHL, используя HIF анализ замещения пептида FP.
Включение различных галогенированных бензиламинов показало, что пара-замещение дает наибольшее сродство, и это были только небольшие различия сродства между хлоридами и бромидами, хотя соответствующий фторид был менее эффективным. Авторы изобретения также обнаружили, что замещение электроноакцепторными группами, такими как эфиры, нитрогруппы, нитрилы и кетоны, обеспечивает более мощные лиганды, чем замещение электронодонорными метокси и трет-бутиловыми заместителями. Молекулярное моделирование динамики показало, что Arg107 является гибким, и можно устроить громоздкие группы в пара-положении. Соответственно, авторы изобретения рассматривали крупные гетероциклические заместители в пара-положении бензиламинового фрагмента и синтезировали 15, который показал связывание со значением IC50 равным 4,1 мкΜ (таблица 2, далее).
Поляризационный флуоресцентный анализ
Способность VHL лигандов конкурировать за сайт связывания HIF-1α на VCB определялась посредством сравнительного поляризационного флуоресцентного анализа, как описано в литературе (Buckley et al. JACS, 2012, 134, 4465-1468).
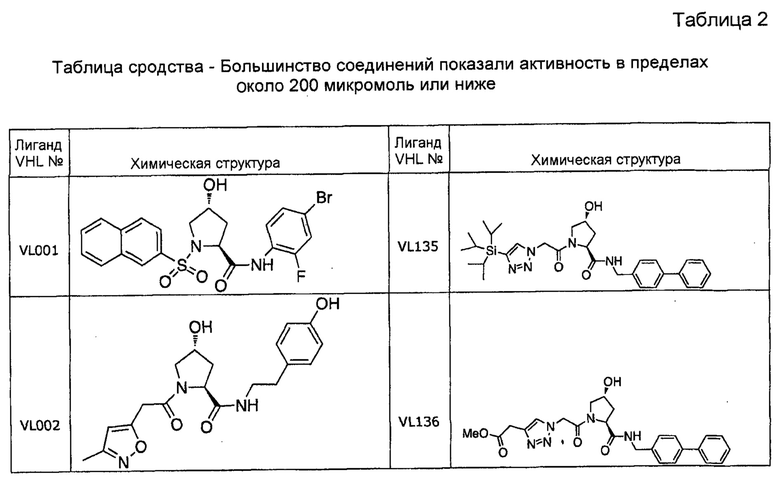
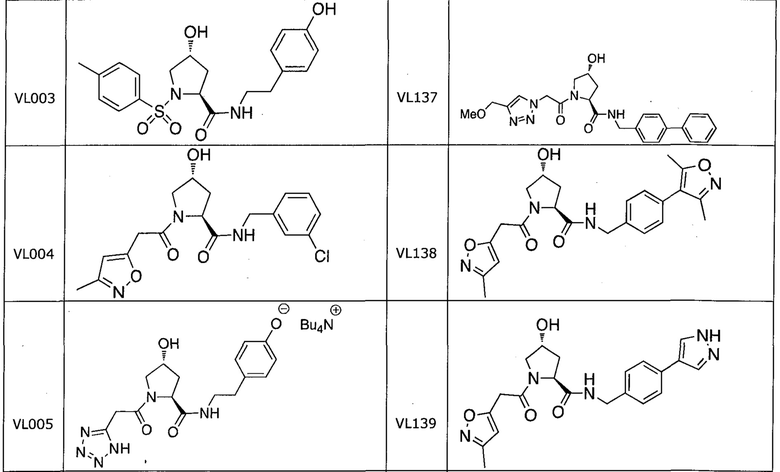
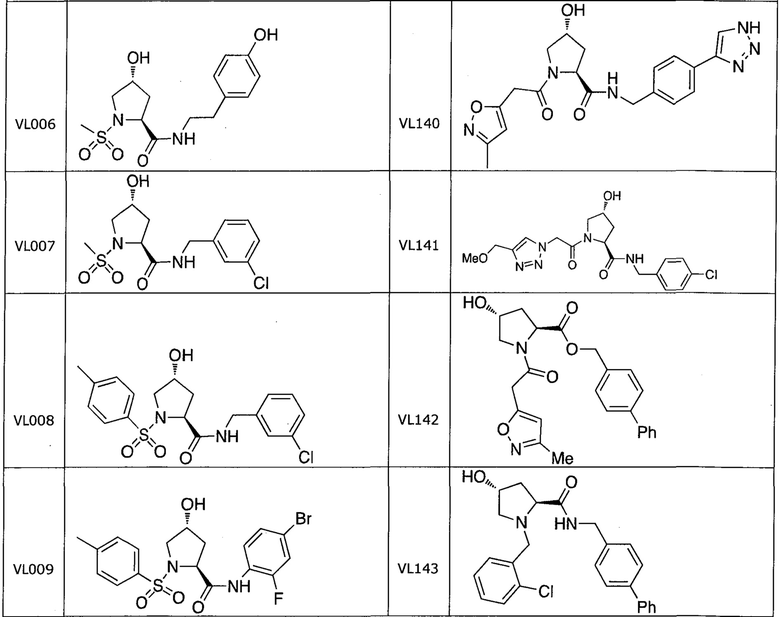
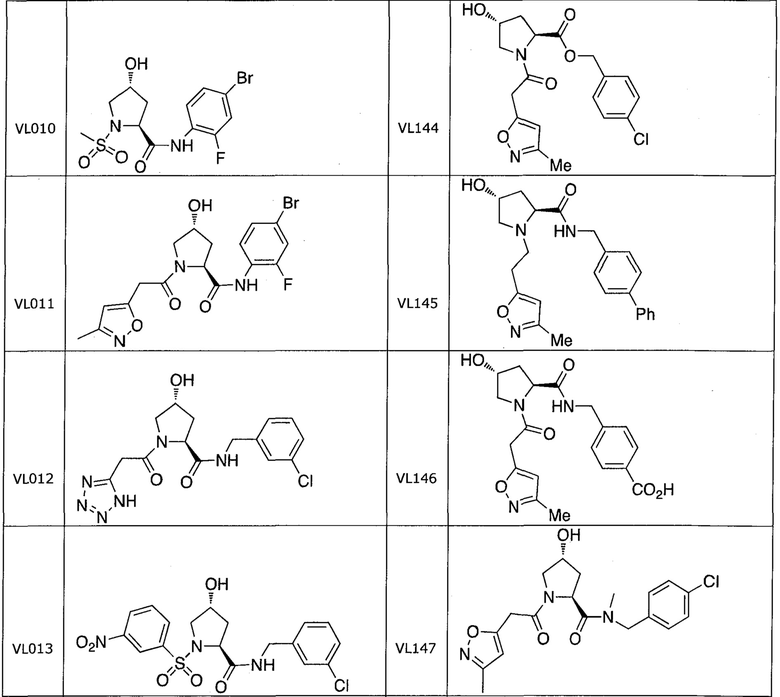
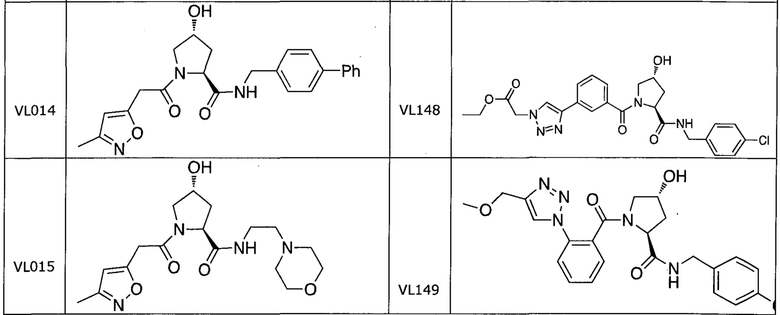
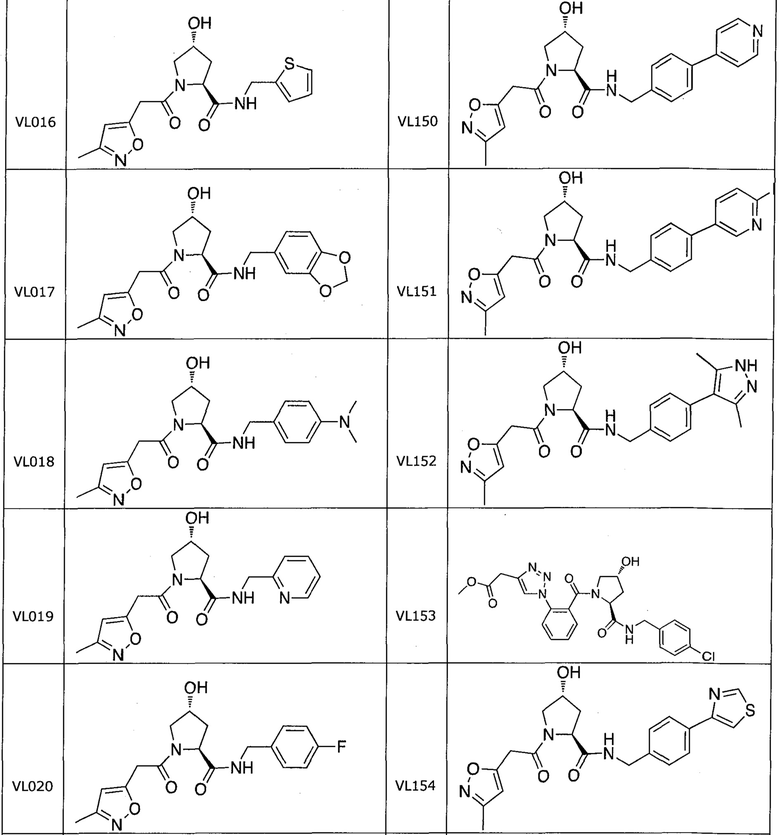
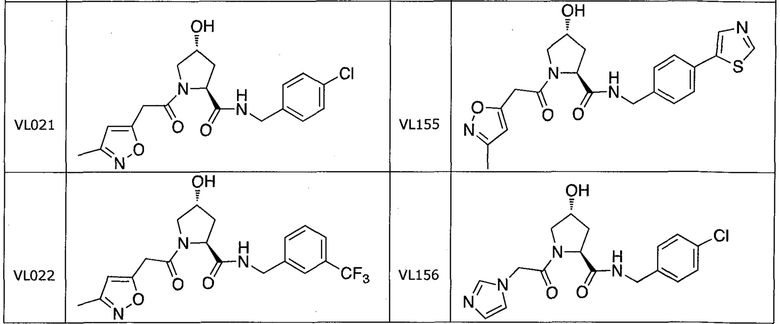
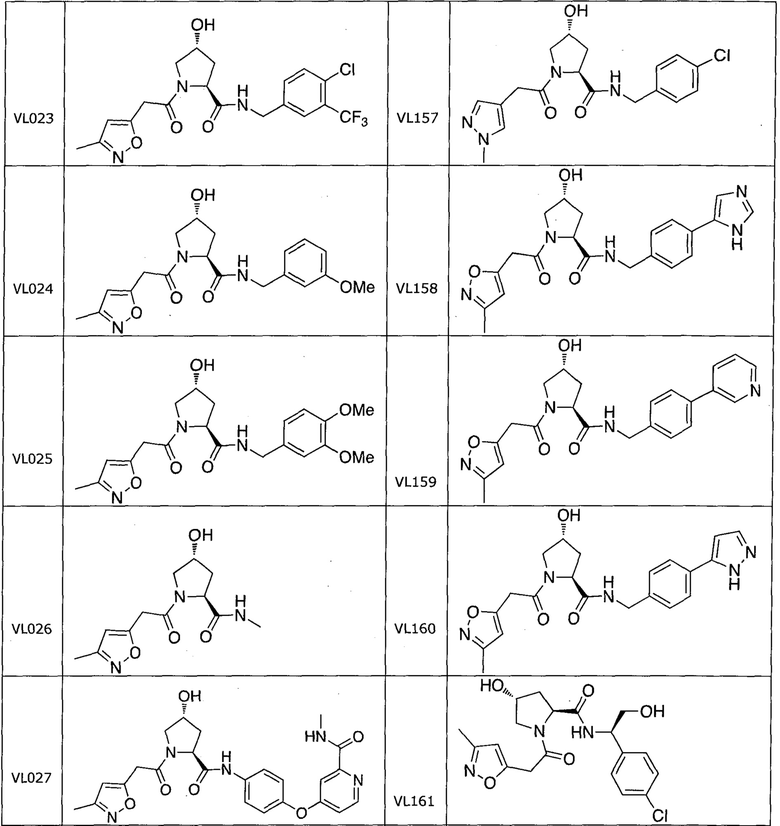
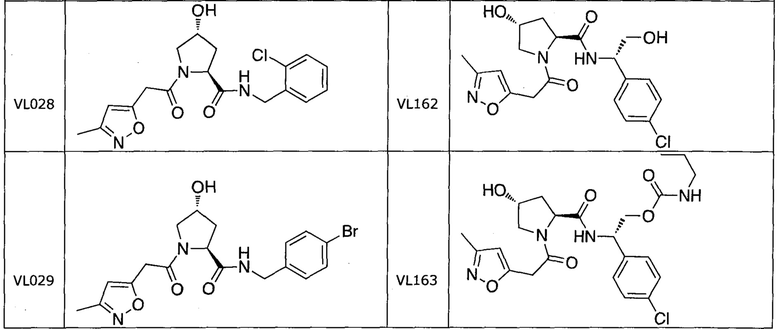
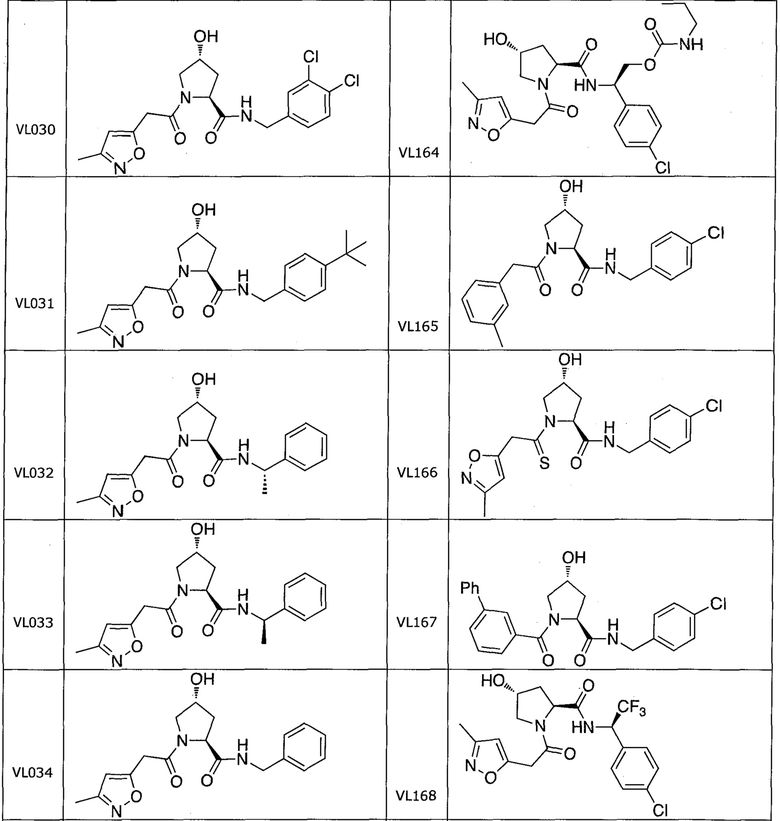
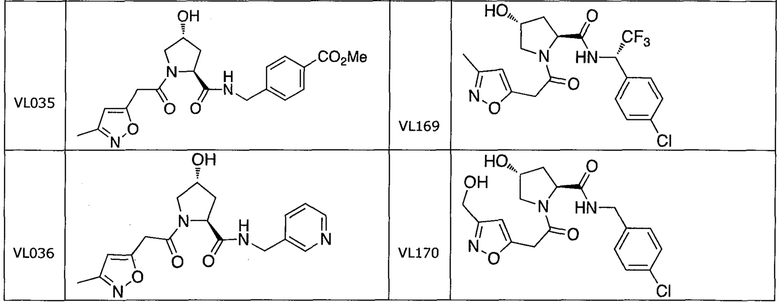
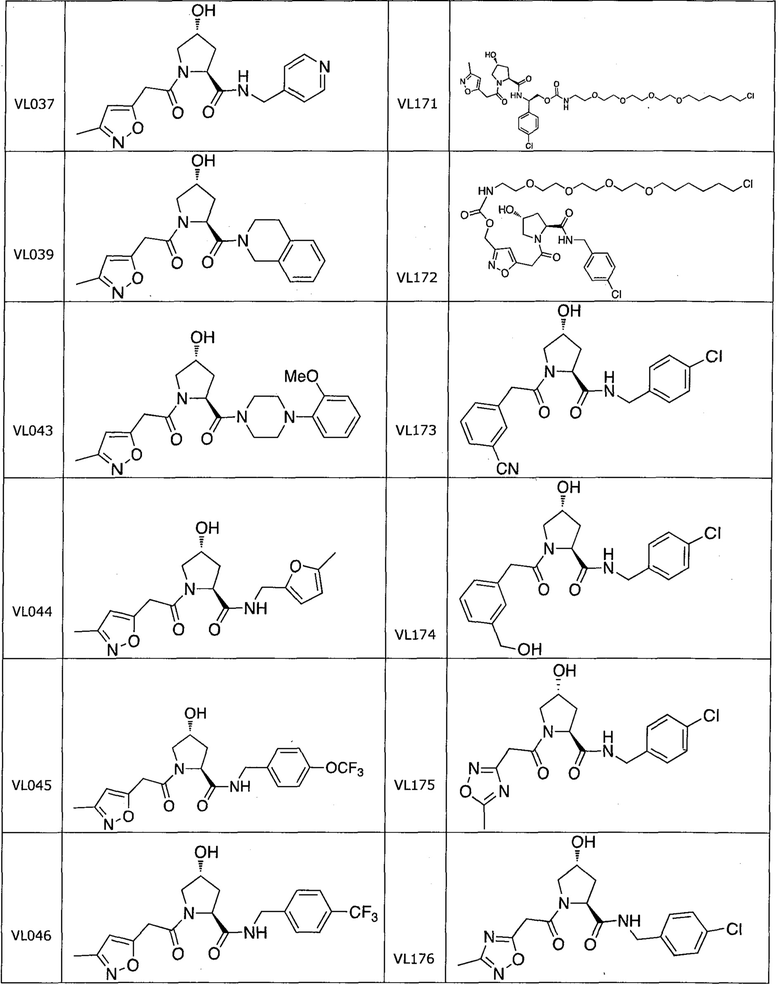
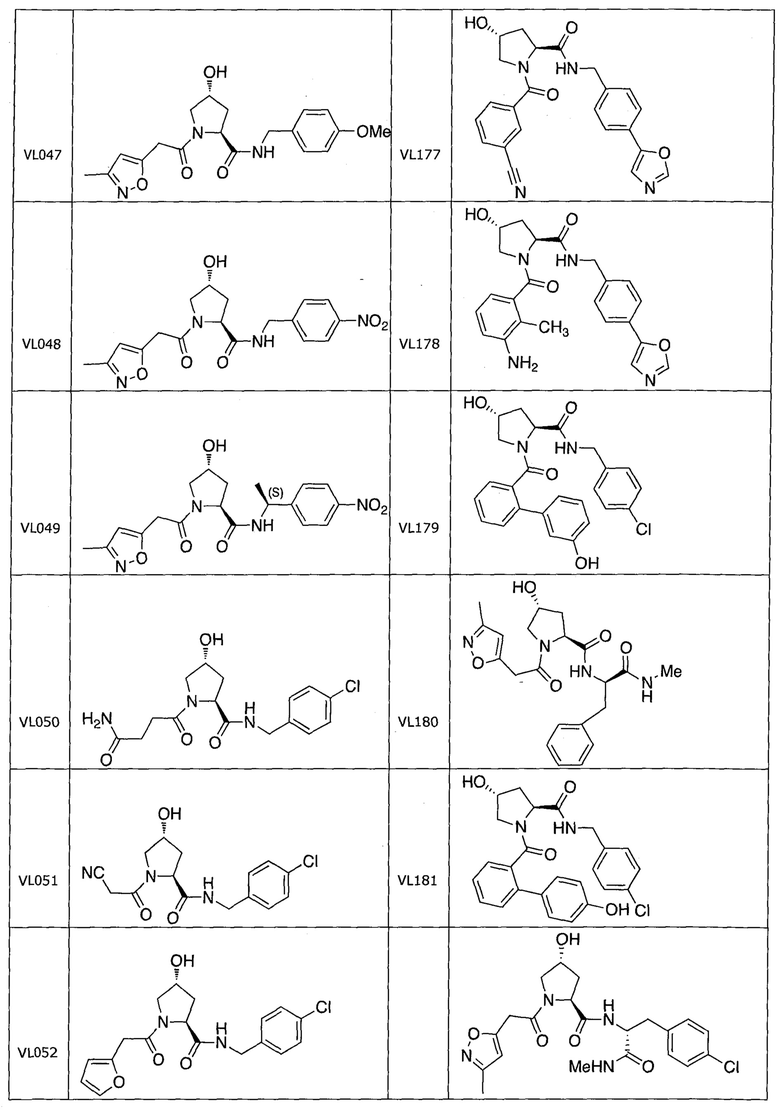
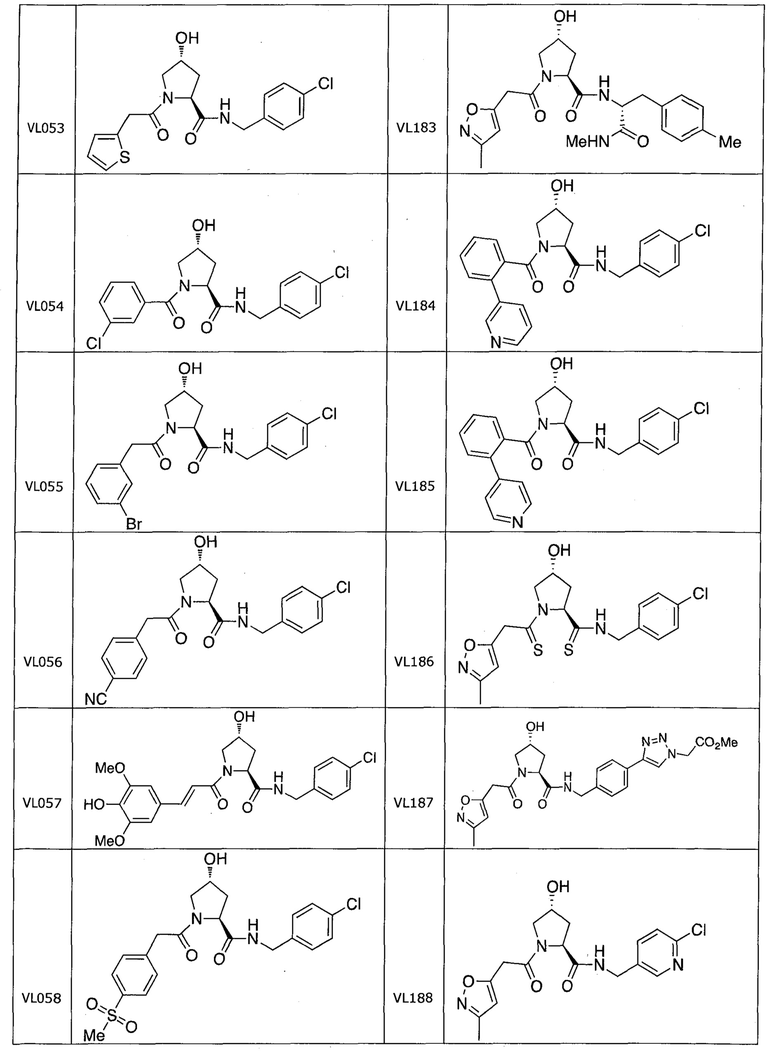
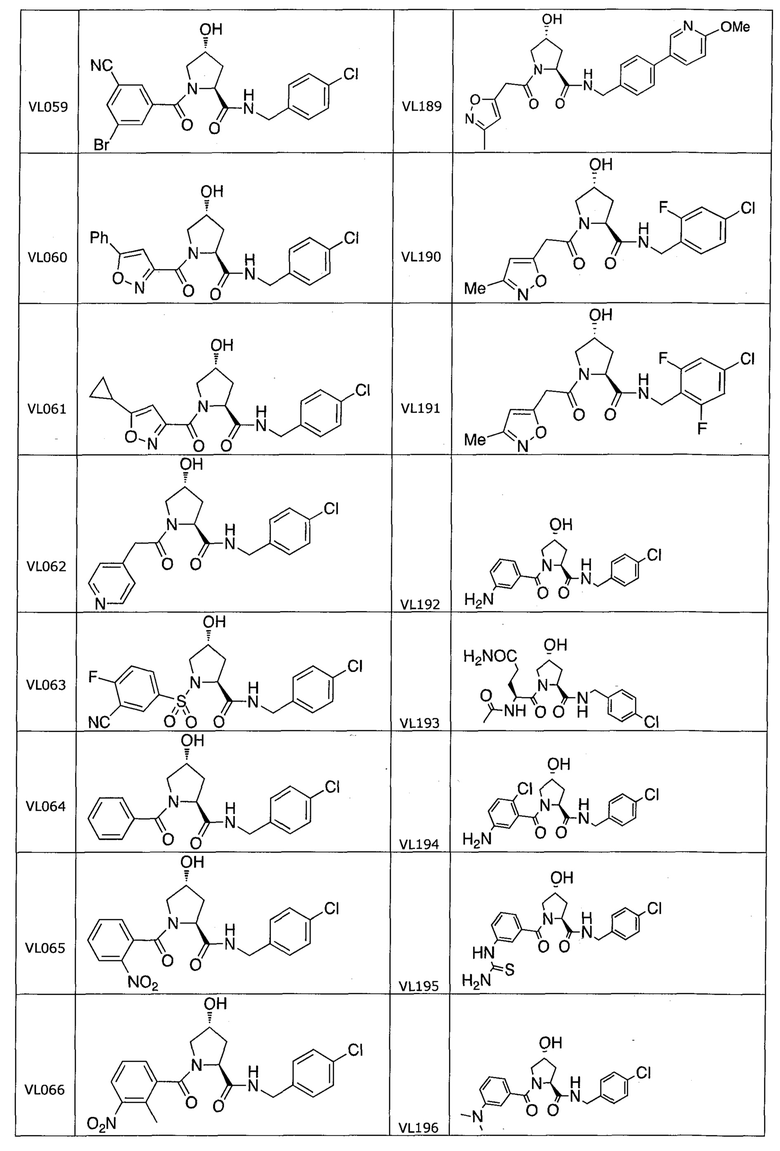
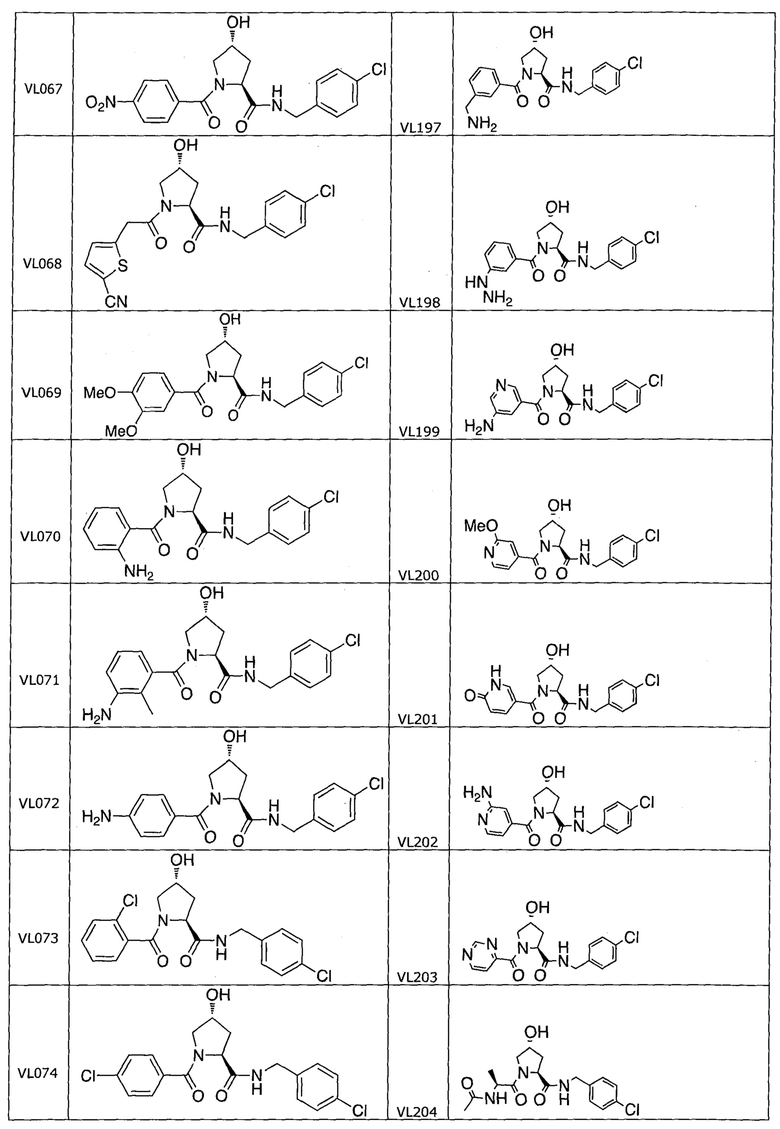
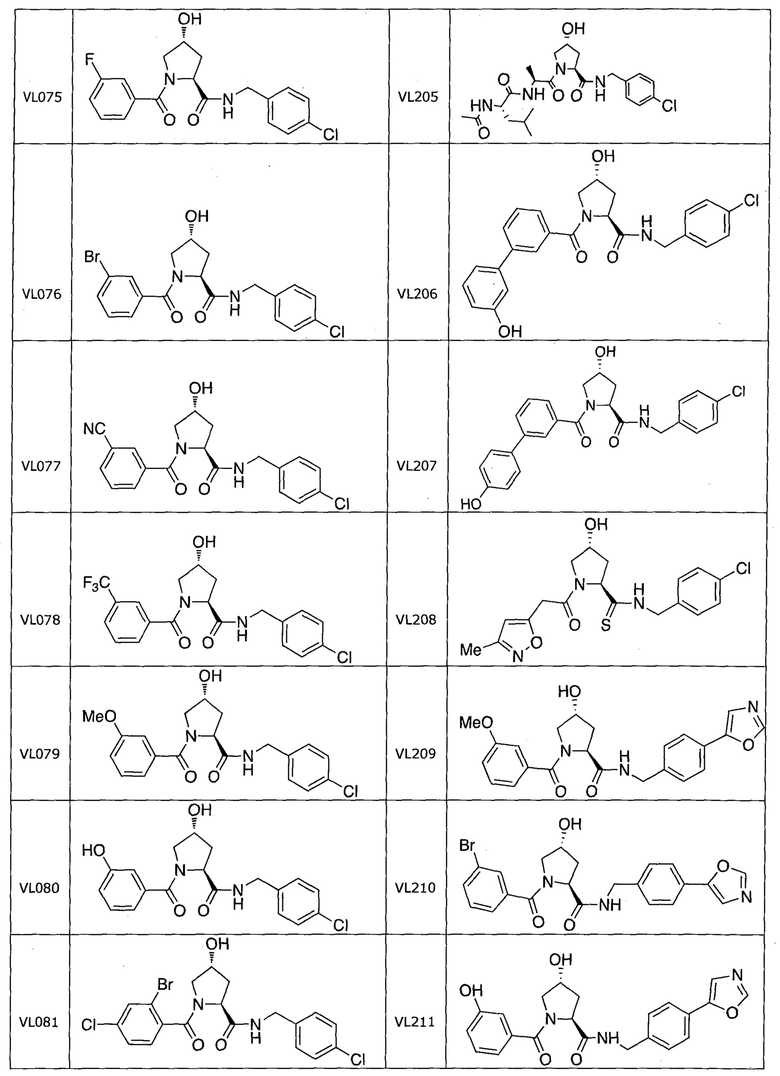
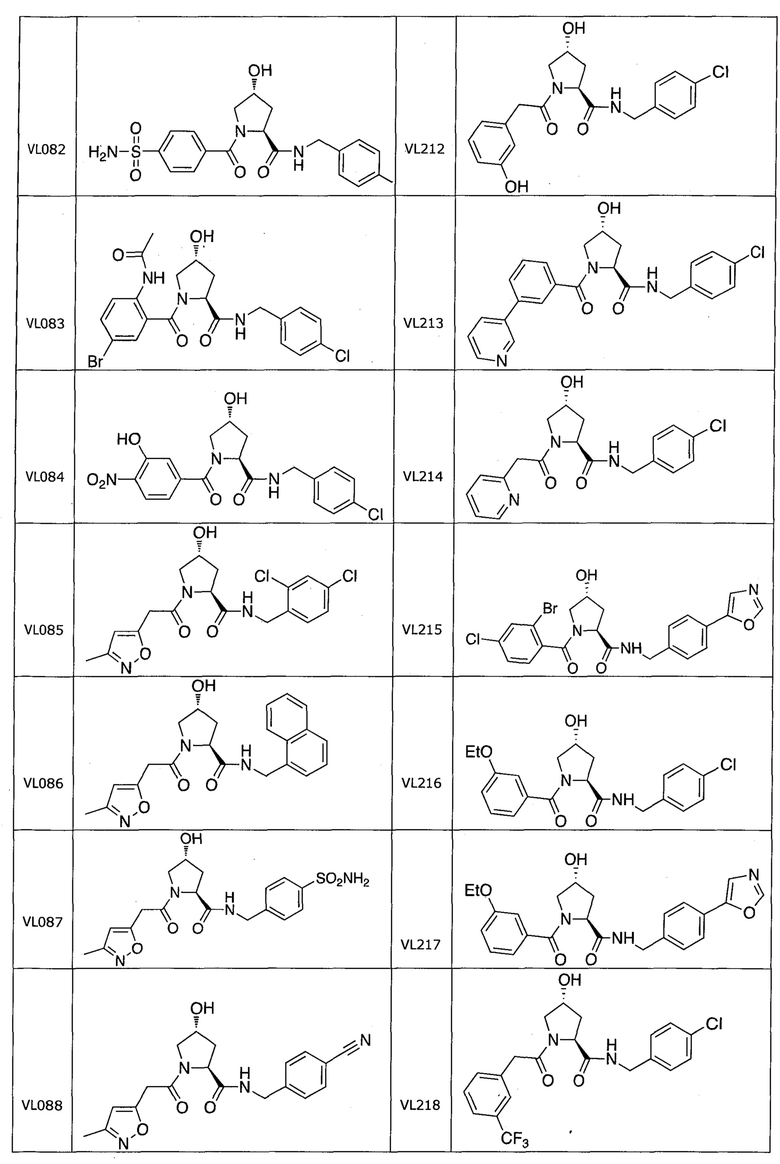
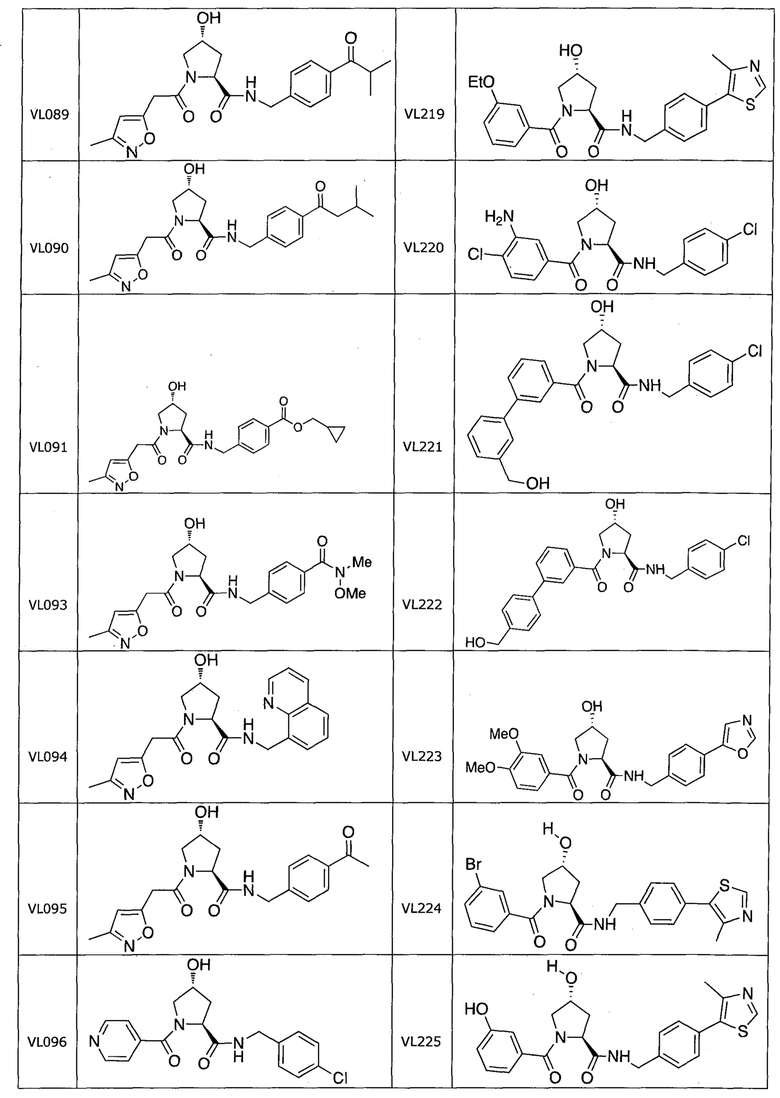

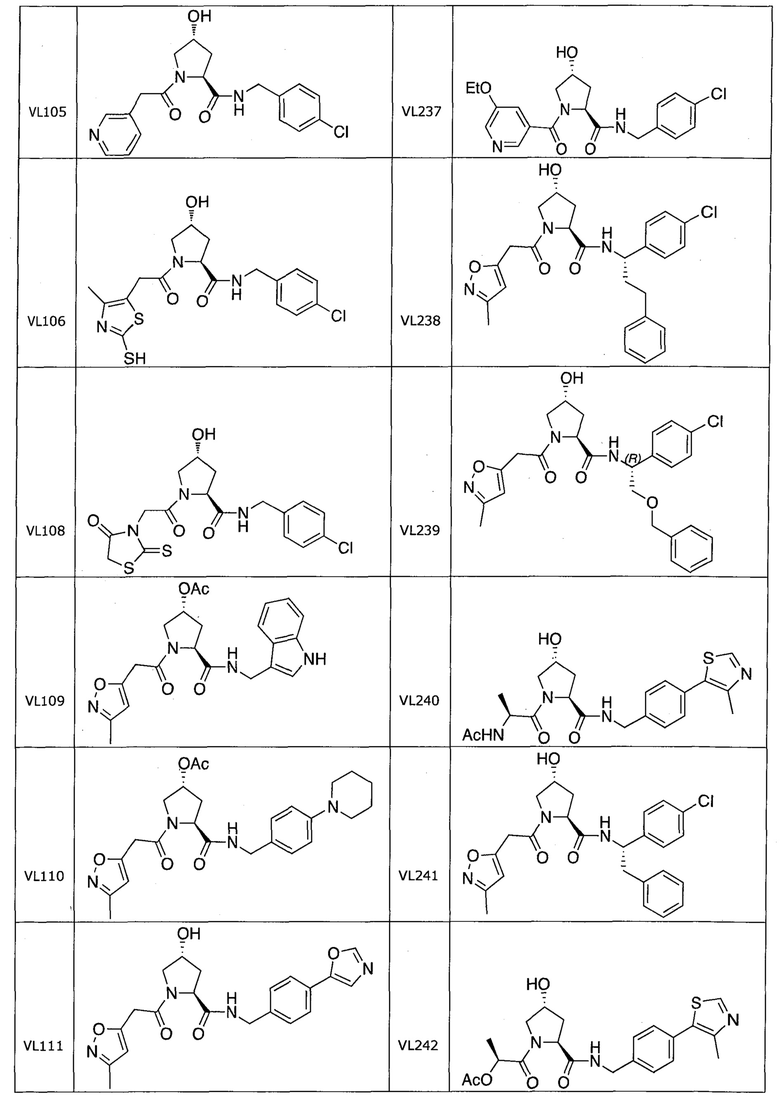
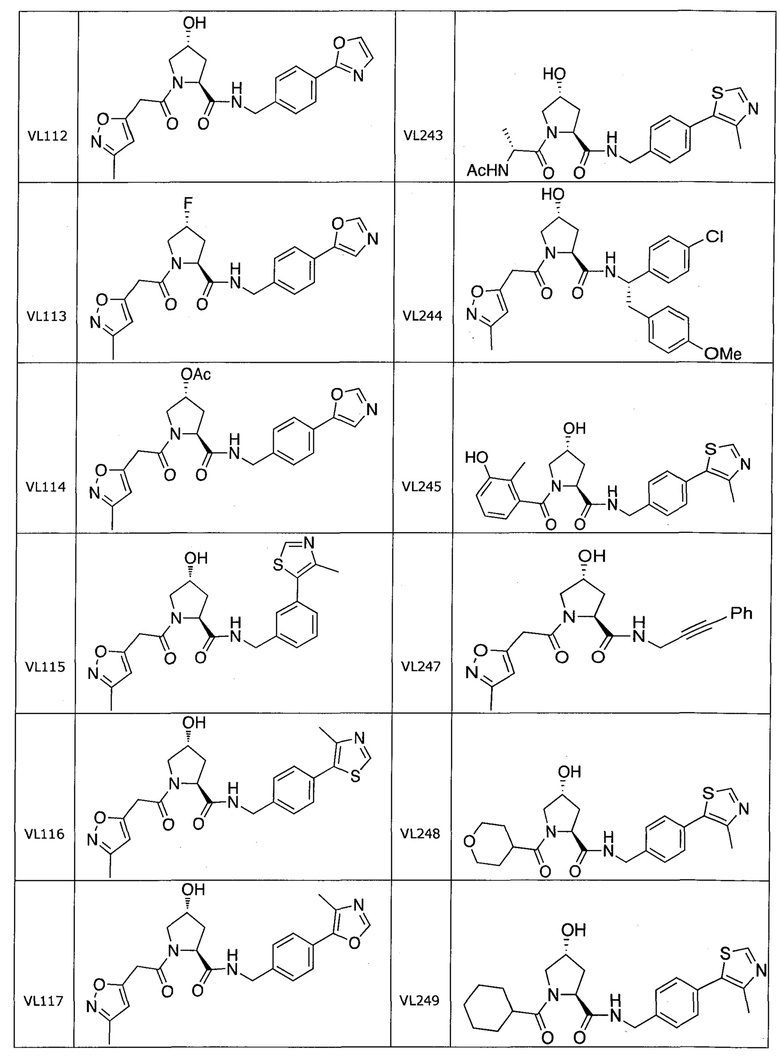
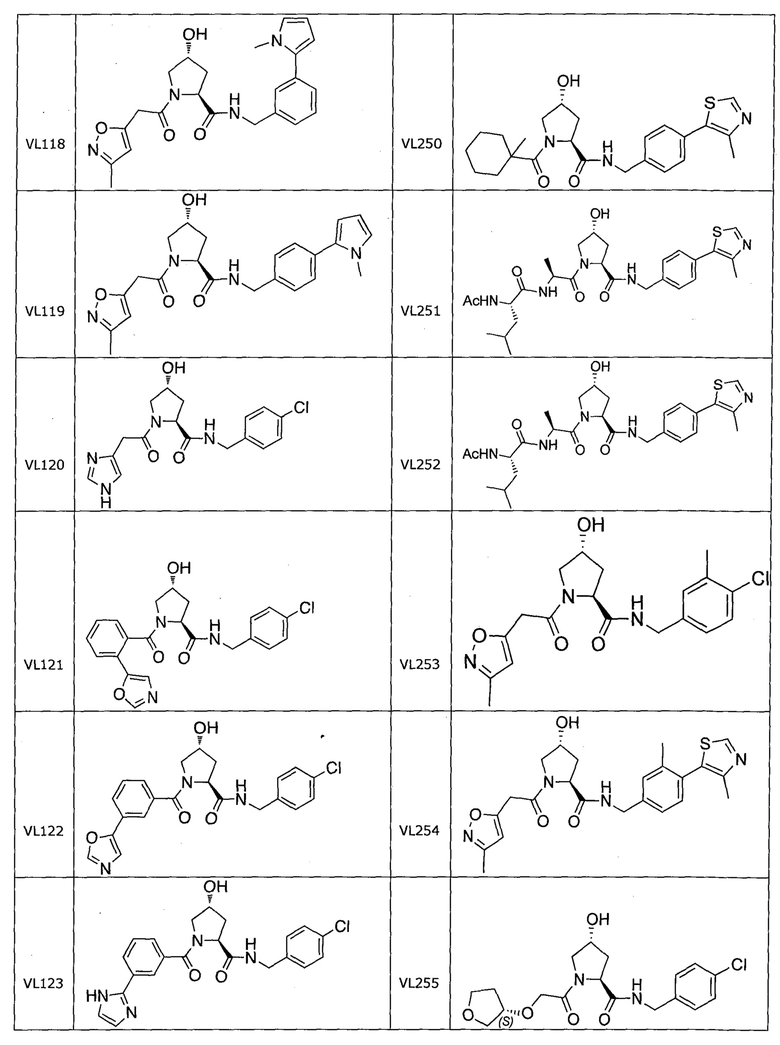
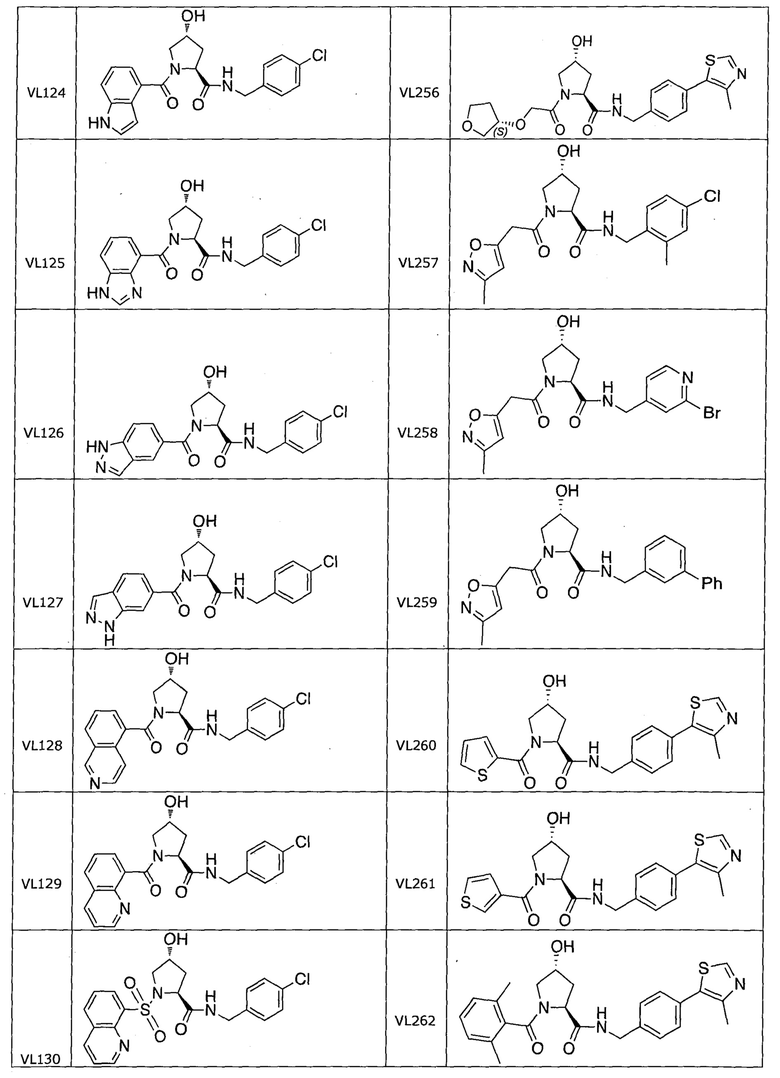
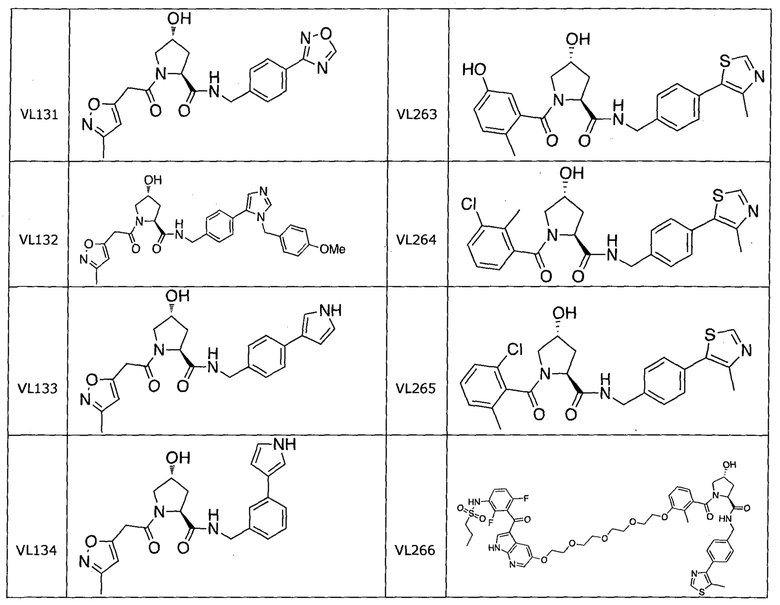
Способы синтеза
Общие методы синтеза
Все реакции осуществляли в высушенной в печи или на огне стеклянной посуде, снабженной резиновыми перегородками при положительном давлении азота, если не указано иное. Чувствительные к воздуху и влаге жидкости переносили с помощью шприца или канюли. ТГФ перегоняли над натрий/бензофеноном. Дихлорметан перегоняли над гидридом кальция. Аналитическую тонкослойную хроматографию (ТСХ) проводили с использованием стеклянных пластин, предварительно покрытых силикагелем (0,25 мм). ТСХ визуализировали облучением ультрафиолетовым светом (УФ) или KMnO4. Колоночную флэш-хроматографию проводили, используя силикагель 60 (230-400 меш, Merck) с указанными растворителями.
Спектр 1H и 13C регистрировали на ЯМР спектрометрах Bruker Avance DPX-500 или Bruker Avance DPX-400. Спектр 1H ЯМР были представлены следующим образом: химический сдвиг, мультиплетность (с = синглет, д = дублет, т = триплет, кв = квартет, м = мультиплет, ушир. = широкий), интегрирование и константа связывания (J) в Герцах (Гц). Химические сдвиги 1H ЯМР регистрировали относительно CDCl3 (7,26 м.д.), d6-ДМСО (2,50 м.д.) и d4-MeOD (3,31 м.д.). 13C ЯМР регистрировали относительно центральной линии CDCl3 (77,16 м.д.), d6-ДМСО (39,52 м.д.) и d4-MeOD (49,00 м.д.). В большинстве случаев регистрировались только пики основного ротамера. Масс-спектр получали с использованием спектрометра Perkin-Elmer API 150 EX. Анализ MALDI-TOF очищенных образцов проводили на Voyager-DE-PRO 6268 (Applied Biosystems) с использованием циано-4-гидроксикоричной кислоты. Если не указано иное, ВЭЖХ проводили с использованием системы доставки растворителей Dynamax SD200, присоединенной к детектору Dynamax UV-1 Absorbance Detector с препаративной колонкой YMC-Pack ODS-AM (250×20 мм, размер частиц 5 мкм, размер пор матриц 12 нм). Линейный градиент MeCN в H2O от 20% до 100% MeCN, с постоянным 0,1% ТФУ в течение 40 минут.
Общие способы химического синтеза
Предложены следующие восемь (8) общих химических синтетических способов (способы A-F и твердофазные синтезы A и B, описанные далее) для синтеза многочисленных соединений согласно настоящему изобретению, которые представлены в таблице 2, таблице аффинности, выше. Каждый способ представлен со ссылкой на конкретное соединение, подробные детали синтеза которого представлены выше. Все пронумерованные соединения могут быть синтезированы относительно легко, используя напрямую способы, которые изложены далее. В некоторых случаях для некоторых предпочтительных вариантов осуществления представлено больше подробностей синтеза, чтобы предоставить такие сведения, которые могут служить в качестве модели для синтеза ряда других соединений, описанных в данном документе.
A
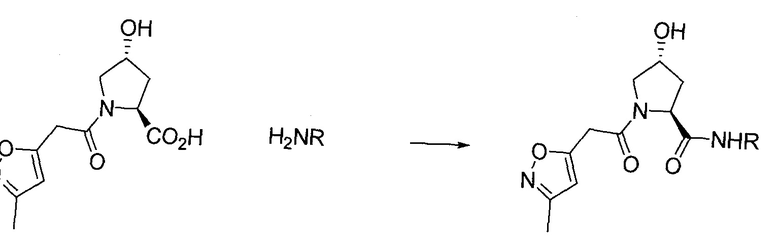 .
.
В качестве примера смотри синтез соединения VL133 из таблицы II, представленной далее.
B
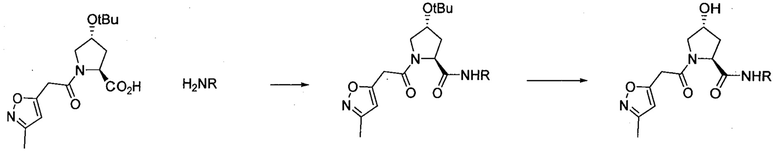 .
.
Смотри общий синтез VL116 из таблицы II с защитной гидроксильной группой.
C
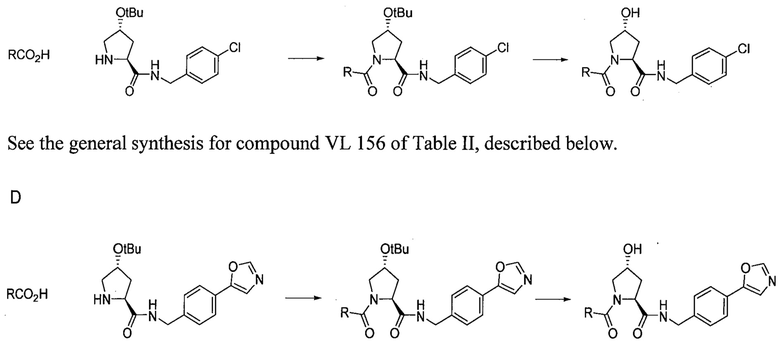 .
.
Смотри общий синтез соединения VL156 из таблицы II, описанной далее.
D
 .
.
Смотри общий синтез соединения VL217 из таблицы II, описанной далее.
E
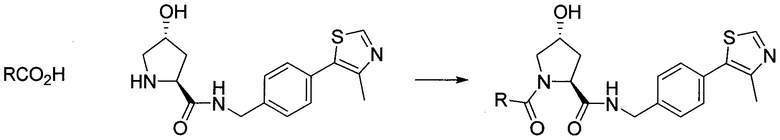 .
.
Смотри общий синтез VL219 из таблицы II, описанной далее.
F
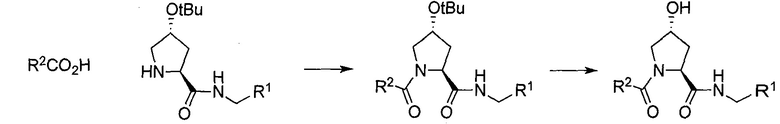 .
.
Способ F включает способы C, D и E и представляет собой общий способ, который осуществляют с помощью коммерчески доступных аминов.
Следуя общим способам синтеза, представленным далее и как описано выше, следующие соединения были синтезированы по аналогии.
 .
.
(2S,4R)-1-((9H-флуорен-9-ил)метил) 2-аллил 4-(трет-бутокси)пирролидин-l,2-дикарбоксилат (Fmoc-Hyp(OtBu)-Oаллил)
 .
.
Fmoc-Hyp(OtBu)OH (24,9 г, 60,8 ммоль, 1 экв.) растворяли в ДМФ (300 мл) при комнатной температуре. Добавляли бикарбонат натрия (12,8 г, 152 ммоль, 2,5 экв.), затем аллилбромид (25,3 мл, 300 ммоль, 4,9 экв.). Реакционный сосуд был оснащен воздушным конденсатором, и реакционную смесь нагревали при 50°C в течение 20 часов. Затем охлаждали до комнатной температуры, разбавляли EtOAc, промывали водной 1M HCl, насыщенным бикарбонатом натрия, водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и конденсировали.15 Очистка с помощью колоночной хроматографии (от 15 до 33% EtOAc/гексан) давала Fmoc-Hyp(OtBu)Oаллил (23,42 г, 52,1 ммоль, 86%) в виде масла светло-желтого цвета. 1H ЯМР (500 MГц, CDCl3) δ 7,76 (т, J= 6,3 Гц, 2H), 7,63-7,54 (м, 2H), 7,43-7,37 (м, 2H), 7,31 (т, J= 7,0 Гц, 2H), 5,99-5,79 (м, 1H), 5,39-5,18 (м, 2H), 4,66 (д, J= 5,6 Гц, 1H), 4,63-4,13 (м, 6H), 3,81 (ддд, J= 16,6, 10,7, 6,2 Гц, 1H), 3,48-3,33 (м, 1H), 2,31-2,18 (м, 1H), 2,18-2,08 (м, 1H), 1,21 (д, J= 11,6 Гц, 9H). 13C ЯМР (126 MГц, CDCl3) (смесь ротамеров) δ 172,49, 155,01, 154,49, 144,31, 144,18, 144,06, 143,84, 141,44, 141,41, 141,36, 131,91, 131,74, 127,80, 127,76, 127,20, 127,16, 125,31, 125,28, 125,11, 120,08, 120,05, 118,93, 118,61, 74,29, 69,37, 68,48, 67,73, 65,86, 58,09, 57,79, 54,01, 53,52, 47,40, 47,28, 38,90, 37,87, 28,41, 28,37. MS (ESI) 450,5 (M+H).
(2S,4R)-1-((9H-флуорен-9-ил)метил) 2-аллил 4-гидроксипирролидин-l,2-дикарбоксилат (Fmoc-Hyp(OH)-Oаллил)
 .
.
Fmoc-Hyp(OtBu)-Oаллил (23,42 г, 52,1 ммоль) растворяли в DCM (306 мл) при комнатной температуре. Добавляли ТФУ (54 мл, 15% об./об.) и раствор перемешивали в течение 13 часов. Раствор выливали в воду, нейтрализовали путем медленного добавления насыщенного водного раствора бикарбоната натрия и экстрагировали два раза DCM и один раз EtOAc. Объединенные органические слои сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 30 до 80% EtOAc/гексан) давала Fmoc-Hyp(OH)-Oаллил в виде масла желтоватого цвета (16,7 г, 42,4 ммоль, 81%). Спектры 1H и 13C ЯМР соответствовали таковым в литературе.16
 .
.
Fmoc-Hyp(OWang)-Oаллил
 .
.
Смоле Ванга (12,1 г, нагрузка 1,1 ммоль/г, 13,3 ммоль, 1 экв.) давали набухать в DCM (90 мл) в стеклянном реакционном сосуде и охлаждали до температуры 4°C. Добавляли трихлорацетонитрил (20 мл, 200 ммоль, 15 экв.), затем добавляли DBU (3 мл, 20 ммоль, 1,5 экв.) 3 порциями в течение 3 минут, встряхивали вручную в реакционном сосуде в промежутке между добавлениями. Реакционный сосуд раскачивали при 4°C в течение 1 часа, затем промывали DCM, ДМСО, ТГФ (THF), затем два раза DCM при комнатной температуре.17 Затем добавляли раствор Fmoc-Hyp(OH)-Oаллил (26,15 г, 66,5 ммоль, 5 экв.) в DCM (40 мл) и ТГФ (40 мл), и встряхивали в течение 30 минут и затем промывали два раза DCM, три раза DCM и затем два раза MeOH, затем DCM. Начальные промывки DCM конденсировали и очищали с помощью колоночной хроматографии (33% до 80% EtOAc) для удаления исходного продукта Fmoc-Hyp(OH)-Oаллил (21,51 г, 54,67 ммоль, 82%). Смолу сушили на воздухе, затем сушили в вакууме с получением 15,5 г Fmoc-Hyp(OWang)-Oаллила.18 Загрузку смолы оценивали как 0,53 ммоль/г на основе определения массы.
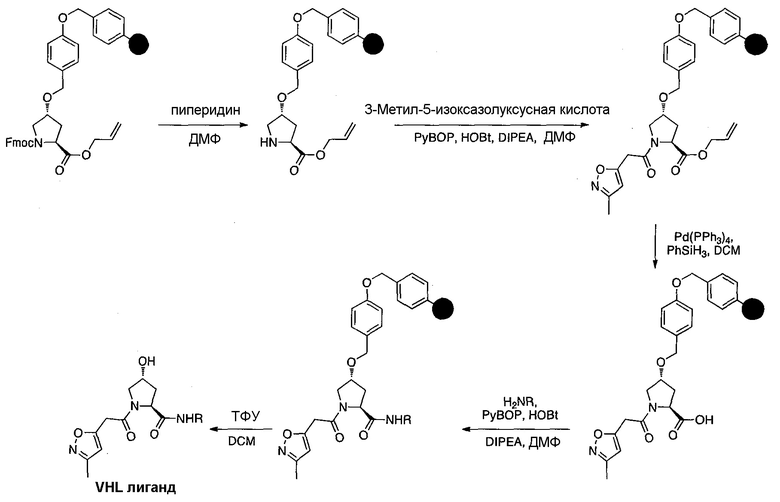
Общий способ твердофазного синтеза A
Смоле Fmoc-Hyp(OWang)-Oаллил (1 экв.) давали набухать в ДМФ, затем подвергали взаимодействию с 20%-ым пиперидином в ДМФ в течение 30 минут. Затем смолу промывали один раз пиперидином, и опять подвергали взаимодействию с 20%-ым пиперидином в течение 30 минут для уверенности в полном удалении защитных групп. Затем смолу промывали два раза ДМФ и один раз MeOH, затем DCM. Полученный свободный амин затем конденсировали с 3-метил-5-изоксазолуксусной кислотой (4 экв.), PyBOP (4 экв.), HOBt (4 экв.) и DIPEA (7 экв.) в ДМФ в течение 4 часов. Затем смолу промывали три раза ДМФ и два раза MeOH, затем DCM. Затем смоле давали набухнуть в свежеперегнанном DCM и подвергали взаимодействию с Pd(PPh3)4 (0,1 экв.) и PhSiH3 (10 экв.) в течение 30 минут. Затем смолу промывали один раз DCM, и опять подвергали взаимодействию с Pd(PPh3)4 (0,1 экв.) и PhSiH3 (10 экв.) в перегнанном DCM в течение 30 минут, после чего смолу промывали два раза ДМФ и один раз MeOH, затем DCM. Полученную карбоновую кислоту затем конденсировали с соответствующим амином (или солью соответствующего амина), RNH2 (4 экв.) c PyBOP (4 экв.), HOBt (4 экв.) и DIPEA (7 экв. для свободных аминов, 8 экв. для солей аминов) в ДМФ в течение 4 часов. Затем смолу промывали 5 раз с помощью ДМФ, три раза MeOH и 5 раз с помощью DCM. Затем смолу подвергали взаимодействию с 20% ТФУ в DCM в течение 2 часов. Реакционную смесь затем сушили и смолу промывали DCM. Конденсация при пониженном давлении и очистка с помощью колоночной хроматографии (от 1% до 10% 0,5M NH3 в смеси MeOH/DCM или от 1% до 10% MeOH в DCM) давали желаемый лиганд VHL.
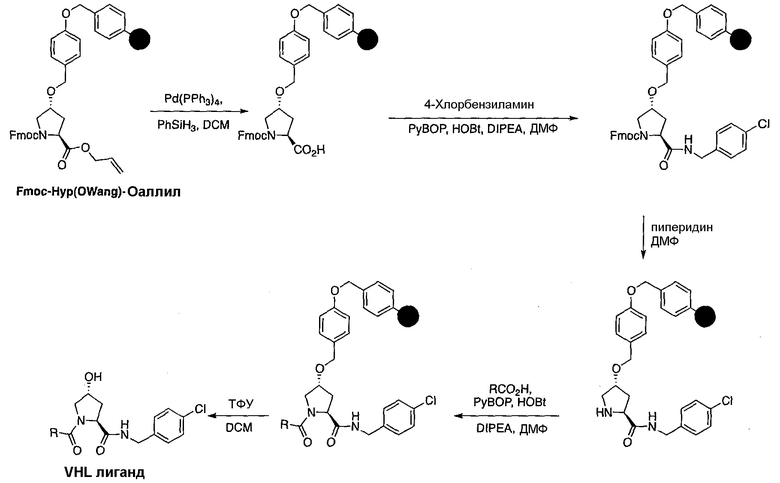
Общий способ твердофазного синтеза B
Вкратце, смоле Fmoc-Hyp-(OWang)-Oаллила (1 экв.) давали набухнуть в свежеперегнанном DCM и подвергали взаимодействию с Pd(PPh3)4 (0,1 экв.) и PhSiH3 (10 экв.) в течение 30 минут. Затем смолу промывали один раз DCM и опять подвергали взаимодействию с Pd(PPh3)4 (0,1 экв.) и PhSiH3 (10 экв.) в перегнанном DCM в течение 30 минут, после чего смолу промывали два раза ДМФ и один раз MeOH, затем DCM. Полученную карбоновую кислоту затем конденсировали с 4-хлорбензиламином (4 экв.), PyBOP (4 экв.), HOBt (4 экв.) и DIPEA (7 экв.) в ДМФ в течение 4 часов. Затем смолу подвергали взаимодействию с 20%-ым пиперидином в ДМФ в течение 30 минут. Затем смолу промывали один раз ДМФ и опять подвергали взаимодействию с 20%-ым пиперидином в течение 30 минут для уверенности в полном удалении защитных групп. Затем смолу конденсировали с соответствующей карбоновой кислотой (RCO2H, 4 экв.), PyBOP (4 экв.), HOBt (4 экв.) и DIPEA (7 экв.) в ДМФ в течение 4 часов. Затем смолу промывали 4 раза с помощью ДМФ и два раза метанолом, затем DCM. Затем смолу подвергали взаимодействию с 20% ТФУ в DCM в течение 2 часов. Реакционную смесь затем сушили и смолу промывали DCM. Конденсация при пониженном давлении, и очистка с помощью колоночной хроматографии (от 1% до 10% 0,5M NH3 в смеси MeOH/DCM или от 1% до 10% MeOH в DCM) давала желаемый лиганд VHL. Выходы рассчитывали на основе загрузки смолы, которая была оценена на основе изменения ее массы.
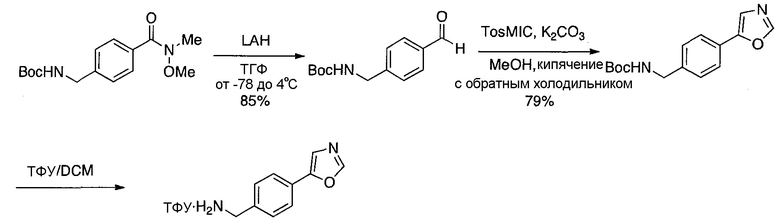 .
.
трет-бутил 4-(метокси(метил)карбамоил)бензилкарбамат (Boc-Amb-N(OMe)Me)
Boc-Amb-OH (2,55 г, 10,16 ммоль, 1 экв.) растворяли в DCM (68 мл) и охлаждали до температуры 4°C на ледяной бане. Добавляли EDC (2,34 г, 12,2 ммоль, 1,2 экв.), HOBt (1,65 г, 12,2 ммоль, 1,2 экв.) и DIPEA (6,2 мл, 35,6 ммоль, 3,5 экв.). Раствор перемешивали в течение 30 минут и затем добавляли гидрохлорид Ν,Ο-диметилгидроксиламина (1,09 г, 11,2 ммоль, 1,1 экв.). Раствор медленно нагревали до комнатной температуры и спустя 21 час выливали в насыщенный солевой раствор с небольшим количеством хлороформа для разрушения образующейся эмульсии. После разделения водный слой экстрагировали два раза EtOAc. Объединенный органический слой сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 40 до 75% EtOAc/гексан) приводила к получению бесцветного масла (2,45 г, 8,33 ммоль, 82%). 1H ЯМР (500 MГц, CDCl3) δ 7,65 (д, J=8,2 Гц, 2H), 7,31 (д, J=8,1 Гц, 2H), 4,88 (с, 1H), 4,36 (д, J=5,1 Гц, 2H), 3,55 (с, 3H), 3,35 (д, J=4,7 Гц, 3H), 1,47 (с, 9H). 13C ЯМР (126 MГц, CDCl3) δ 169,77, 156,04, 141,79, 133,21, 128,76, 127,03, 79,87, 61,20, 44,50, 33,88, 28,55. MS (ESI) 295,2 (M+H).
трет-бутил 4-формилбензилкарбамат (Boc-Amb-H)
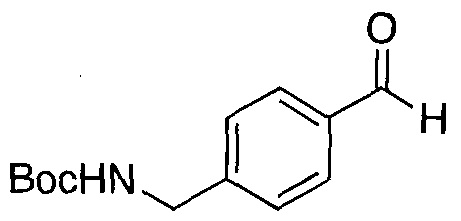 .
.
Boc-Amb-N(OMe)Me (2,45 г, 8,33 ммоль, 1 экв.) растворяли в ТГФ (83 мл) и охлаждали до температуры -78°C на бане сухой лед/ацетон. Добавляли литийалюминийгидрид (0,41 г, 10,83 ммоль, 1,3 экв.) 2 порциями в течение 5 минут. Спустя 50 минут суспензию нагревали до 4°C на ледяной бане. Спустя 3,5 часа реакция была завершена согласно данным ТСХ (минимальная обработка 10%-ым бисульфатом калия и EtOAc, 50% EtOAc/гексан), и реакцию гасили путем медленного добавления 10%-го бисульфата калия при температуре 4°C. Смесь нагревали до комнатной температуры и перемешивали в течение 30 минут. Большую часть ТГФ удаляли при пониженном давлении, и смесь разбавляли водой и экстрагировали три раза EtOAc. Объединенный органический слой промывали один раз насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 40 до 50% EtOAc/гексан) давала Boc-Amb-H в виде твердого вещества белого цвета (1,66 г, 7,1 ммоль, 85%). 1H ЯМР (500 MГц, CDCl3) δ 9,96 (с, 1H), 7,81 (д, J=8,2 Гц, 2H), 7,41 (д, J=8,0 Гц, 2H), 5,12 (с, 1H), 4,37 (д, J=5,6 Гц, 2H), 1,44 (с, 9H). 13C ЯМР (126 MГц, CDCl3) δ 191,94, 156,03, 146,30, 135,62, 130,14, 127,78, 79,92, 44,44, 28,46. MS (ESI) 235,9 (M+H), 180,2 (M-tBu).
трет-бутил 4-(оксазол-5-ил)бензилкарбамат
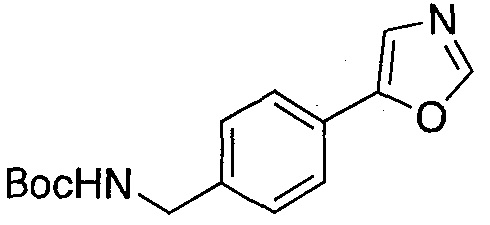 .
.
К MeOH (7,8 мл) при комнатной температуре добавляли карбонат калия (0,13 г, 0,94 ммоль, 1,2 экв.) и толуолсульфонилметилизоцианид (0,184 г, 0,94 ммоль, 1,2 экв.). Круглодонную колбу снабжали обратным холодильником и нагревали при температуре 45°C. Спустя 15 минут добавляли Boc-Amb-H (0,1835 г, 0,78 ммоль, 1 экв.) и смесь нагревали при температуре 75°C в течение 3 часов и затем охлаждали до комнатной температуры. MeOH удаляли при пониженном давлении, и сырой продукт вновь суспендировали в EtOAc и смеси 1:2 насыщенного карбоната натрия с водой и разделяли. Водный слой затем экстрагировали один раз EtOAc. Объединенный органический слой сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 20 до 35% EtOAc/гексан) приводила к получению твердого вещества белого цвета. 1H ЯМР (400 MГц, CDCl3) δ 7,91 (с, 1H), 7,62 (д, J=8,3 Гц, 2H), 7,35 (затененный д, 2H), 7,34 (затененный с, 1), 4,88 (с, 1H), 1,47 (с, 9H). 13C ЯМР (126 MГц, CDCl3) δ 156,02, 151,40, 150,47, 139,78, 128,01, 126,84, 124,67, 121,47, 79,68, 44,38, 28,47. MS (ESI) 275,5 (M+H).
Трифторацетатная соль (4-(оксазол-5-ил)фенил)метанамина
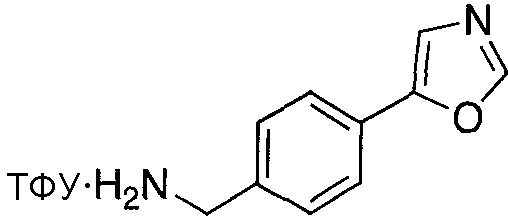 .
.
К раствору трет-бутил 4-(оксазол-5-ил)бензилкарбамата (1,09 г) в DCM (40 мл) при комнатной температуре добавляли ТФУ (4 мл). Раствор перемешивали в течение 16 часов и концентрировали при пониженном давлении с получением трифторацетатной соли (4-(оксазол-5-ил)фенил)метанамина (1,984 г) в виде твердого вещества кремового цвета, который использовали без дополнительной очистки. 1H ЯМР (400 MГц, MeOD) δ 8,29 (с, 1H), 7,83 (д, J=8,4 Гц, 2H), 7,60 (с, 1H), 7,56 (д, J=8,5 Гц, 2H), 4,16 (с, 2H). MS (ESI) 175,3 (M-CF3CO2-).
(2S,4R)-N-(3-хлорбензил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид (VL4)
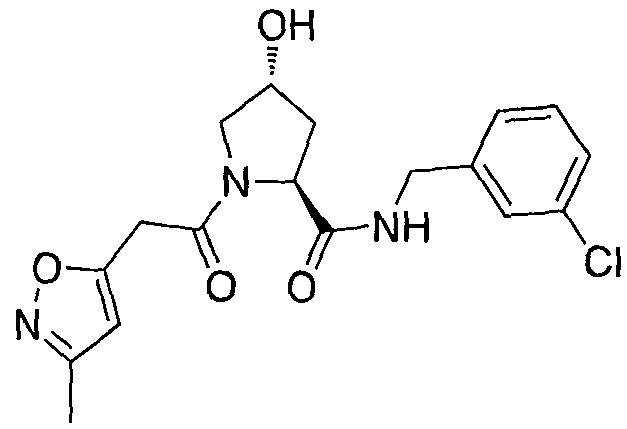 .
.
VL4 был синтезирован в соответствии с общим способом F в виде твердого вещества белого цвета. 1H ЯМР (500 MГц, MeOD): δ 8,684 (1H, с); 7,33-7,23 (4H, м); 6,24 (1H, с); 4,56-4,53 (1H, t, J=8 Гц); 4,51-4,50 (1H, м); 4,39-4,37 (2H, м); 3,96-3,92 (2H, м); 3,81-3,78 (1H, дд, J=9 Гц, 4 Гц); 3,64-3,62 (1H, м); 2,28-2,24 (4H, м); 2,09-2,04 (1H, м). 13C ЯМР (125 MГц, MeOD): δ 174,56, 168,67, 167,68, 161,58, 142,25, 135,35, 131,04, 128,43, 128,19, 126,76, 105,37, 70,86, 60,78, 56,96, 43,60, 39,33, 33,90, 11,21. MS (ESI) 378,2 (M+H).
(2S,4R)-4-гидрокси-N-(4-гидроксифенетил)-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид (VL2)
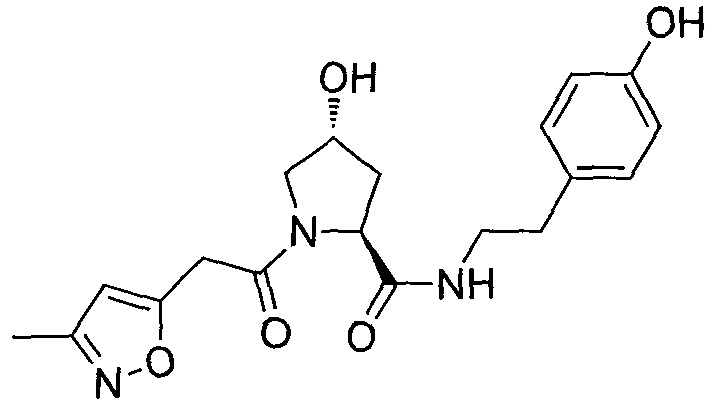 .
.
VL2 был синтезирован в соответствии с общим способом F. 1H ЯМР (500 MГц, MeOD) δ 8,33 & 8,13 (ввиду наличия ротамеров, оба с, 1H), 7,02 (д, J=8,3 Гц, 2H), 6,69 & 6,65 (ввиду наличия ротамеров, оба д, J=8,3 Гц, 2H), 6,22 & 6,10 (ввиду наличия ротамеров, оба с, 1H), 4,43 (д, J=7,7 Гц, 2H), 3,89 (д, J=4,7 Гц, 2H), 3,74 (дд, J=11,0, 4,3 Гц, 1H), 3,57 (д, 7=11,0 Гц, 1H), 3,42-3,36 (м, 2H), 2,73-2,63 (м, 2H), 2,25 (с, 3H), 2,16-2,12 (м, 1H), 1,96-1,91 (м, 1H). 13C ЯМР (звездочка обозначает сигналы не основного ротамера, 125 MГц, MeOD) δ 174,2, 174,1, *173,9, *173,8, *169,0, 168,6, 167,6, *167,4, 161,6, *161,5, *157,0, 156,9, *131,2, 130,8, *116,2, 116,1, *105,6, 105,4, 70,7, *69,2, *61,0, *60,9, 60,7, 60,6, 56,9, *56,2, 42,4, 42,3, *42,0, *41,9, 41,5, 39,3, 35,5, *35,3, 33,9, *32,9, 11,2. MS (ESI) [M+H] 374,1, [2M+Na] 769,6.
(2S,4R)-4-гидрокси-N-метил-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид (VL26)
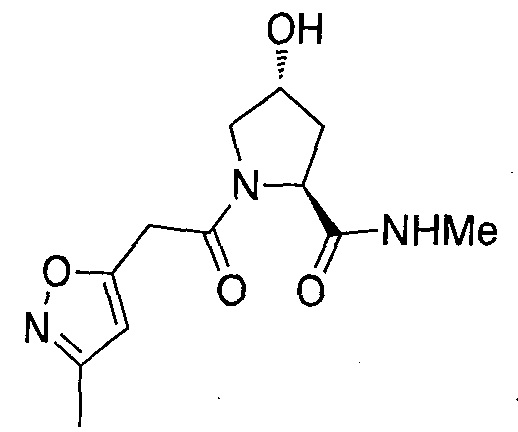 .
.
VL26 был синтезирован в соответствии с общим способом F и был выделен в виде бесцветного масла (28 мг, 0,105 ммоль, 80%). 1H ЯМР (500 MГц, MeOD) δ 6,23 (с, 1H), 4,47 (дт, J=16,3, 5,2 Гц, 2H), 3,91 (д, J=5,7 Гц, 2H), 3,78 (дд, J=10,9, 4,2 Гц, 1H), 3,61 (дд, J=11,0, 1,8 Гц, 1H), 2,73 (с, 3H), 2,26-2,18 (м, 4H), 2,05 (дд, J=8,3, 4,7 Гц, 1H). 13C ЯМР (126 MГц, MeOD) δ 174,82, 168,66, 167,67, 161,58, 105,40, 70,79, 60,67, 56,91, 39,30, 33,89, 26,35, 11,20. MS (ESI) 291,1 (M+Na), 268,7 (M+H).
VL34
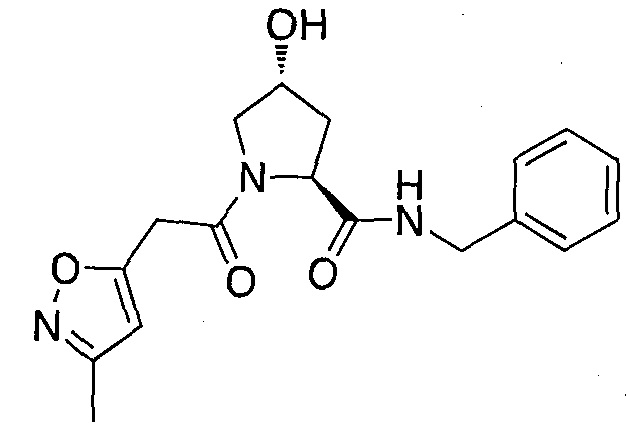 .
.
VL34 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,3 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (14,7 мг). 1H ЯМР (400 MГц, MeOD) δ 7,31 (дд, J=5,9, 5,1 Гц, 4H), 7,27-7,17 (м, 1H), 6,23 (с, 1H), 4,55 (т, J=8,0 Гц, 1H), 4,50 (с, 1H), 4,39 (с, 2H), 3,92 (д, J=1,8 Гц, 2H), 3,80 (дд, J=10,9, 4,3 Гц, 1H), 3,61 (дд, J=7,3, 5,5 Гц, 1H), 2,33-2,19 (м, 4H), 2,12-2,03 (м, 1H). 13C ЯМР (101 MГц, MeOD) δ 174,29, 168,68, 167,68, 161,60, 139,73, 129,51, 128,40, 128,14, 105,36, 70,84, 60,73, 56,97, 44,05, 39,36, 33,95, 11,21. MS (ESI) 344,3 (M+H), 366,2 (M+Na).
VL28
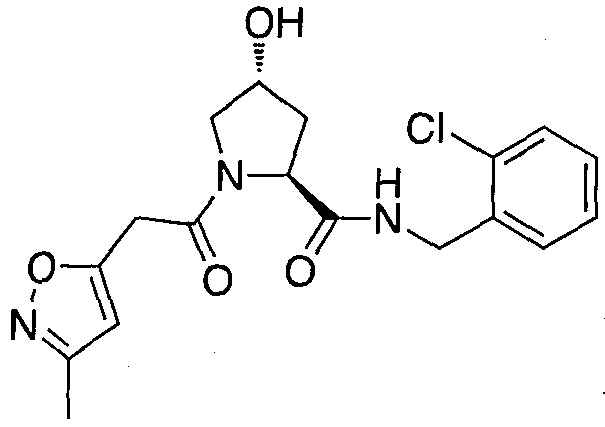 .
.
VL28 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,3 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества желтого цвета (19,1 мг). 1H ЯМР (500 MГц, MeOD) δ 8,66 (т, J=5,5 Гц, 1H), 7,48-7,34 (м, 2H), 7,31-7,21 (м, 2H), 6,23 (с, 1H), 4,58 (т, J=8,0 Гц, 1H), 4,48 (кв.д, J=15,8, 5,9 Гц, 3H), 3,99-3,87 (м, 2H), 3,80 (дд, J=10,9, 4,3 Гц, 1H), 3,66-3,60 (м, 1H), 2,31-2,22 (м, 4H), 2,09 (ддд, J=13,0, 8,2, 4,7 Гц, 1H). 13C ЯМР (126 MГц, MeOD) δ 174,60, 168,72, 167,65, 161,59, 136,79, 134,01, 130,29, 130,08, 129,67, 128,21, 105,37, 70,84, 60,74, 56,96, 42,08, 39,34, 33,95, 11,22. MS (ESI) 378,3 (M+H).
VL21
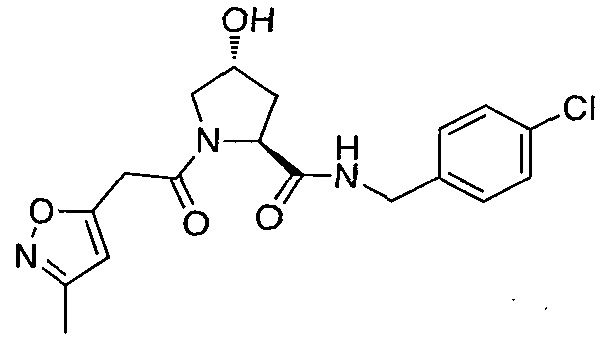 .
.
VL21 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,2 ммоль), используя общий способ твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (15,9 мг). 1H ЯМР (500 MГц, MeOD) δ 8,65 (с, 1H), 7,32-7,26 (м, 4H), 6,22 (с, 1H), 4,58-4,47 (м, 2H), 4,43-4,32 (м, 2H), 3,92 (д, J=4,2 Гц, 2H), 3,80 (дд, J=10,9, 4,3 Гц, 1H), 3,66-3,58 (м, 1H), 2,30-2,22 (м, 4H), 2,08 (дд, J=8,3, 4,7 Гц, 1H). 13C ЯМР (126 MГц, MeOD) δ 174,48, 168,71, 167,66, 161,60, 138,67, 133,85, 129,99, 129,53, 105,37, 70,85, 60,80, 56,99, 43,45, 39,33, 33,95, 11,20. MS (ESI) 378,4 (M+H).
VL20
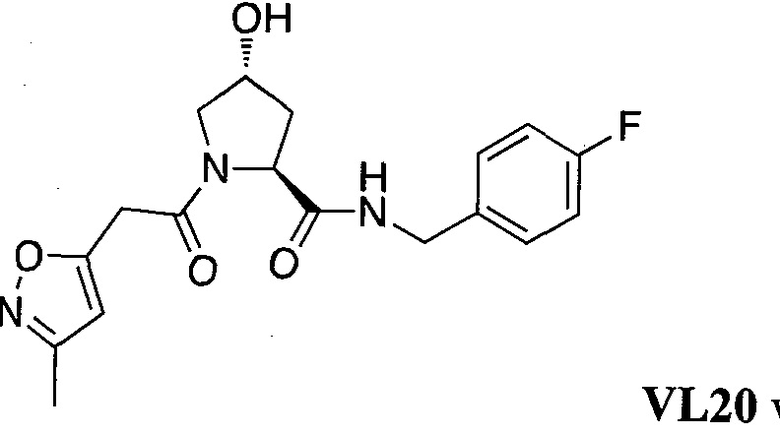 .
.
VL20 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,15 ммоль), используя общий способ твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (9,9 мг). 1H ЯМР (400 MГц, MeOD) δ 8,64 (т, J=5,6 Гц, 1H), 7,37-7,26 (м, 2H), 7,07-6,99 (м, 2H), 6,23 (с, 1H), 4,57-4,47 (м, 2H), 4,37 (дд, J=8,4, 5,8 Гц, 2H), 3,93 (д, J=3,0 Гц, 2H), 3,80 (дд, J=11,0, 4,2 Гц, 1H), 3,66-3,58 (м, 1H), 2,28-2,22 (м, 4H), 2,08 (дд, J=8,3, 4,7 Гц, 1H). 13C ЯМР (126 MГц, MeOD) δ 174,31, 168,69, 167,67, 163,44 (д, J=243,5 Гц), 161,60, 135,78, 130,27 (д, J=8,1 Гц), 116,09 (д, J=21,6 Гц), 105,37, 70,85, 60,75, 56,99, 43,32, 39,33, 33,95, 11,20. MS (ESI) 362,3 (M+H).
VL29
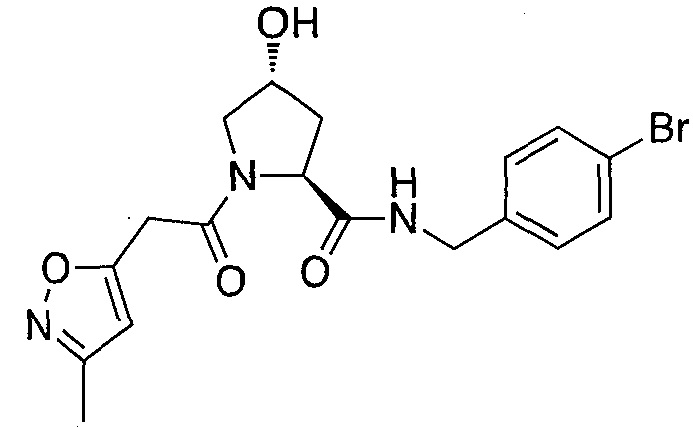 .
.
VL29 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,3 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества светло-желтого цвета (16,4 мг). 1H ЯМР (400 MГц, MeOD) δ 7,45 (дкв, J=9,0, 2,2 Гц, 2H), 7,23 (д, J=8,5 Гц, 2H), 6,22 (с, 1H), 4,58-4,47 (м, 2H), 4,35 (дт, J=18,9, 15,4 Гц, 2H), 3,92 (д, J=2,6 Гц, 2H), 3,80 (дд, J=10,9, 4,2 Гц, 1H), 3,63 (д, J=11,0 Гц, 1H), 2,30-2,21 (м, 4H), 2,11-2,02 (м, 1H). 13C ЯМР (101 MГц, MeOD) δ 174,41, 168,71, 167,66, 161,61, 139,15, 132,55, 130,32, 121,77, 105,37, 70,85, 60,75, 56,99, 43,37, 39,33, 33,94, 11,22. MS (ESI) 424,1 (M+H).
VL31
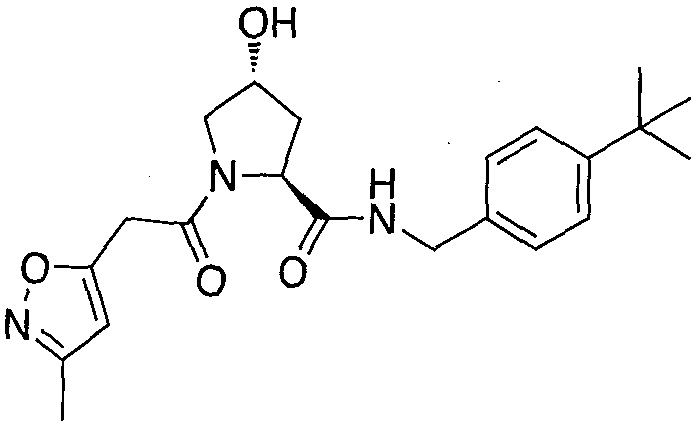 .
.
VL31 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,3 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (19,8 мг). 1H ЯМР (500 MГц, MeOD) δ 8,56 (с, 1H), 7,35 (д, J=8,2 Гц, 2H), 7,22 (д, J=8,2 Гц, 2H), 6,24 (с, 1H), 4,53 (дд, J=18,3, 10,3 Гц, 2H), 4,36 (д, J=5,7 Гц, 2H), 3,92 (д, J=3,0 Гц, 2H), 3,80 (дд, J=10,9, 4,2 Гц, 1H), 3,62 (д, J=11,1 Гц, 1H), 2,29-2,21 (м, 4H), 2,12-2,02 (м, 1H), 1,29 (д, J=7,9 Гц, 9H). 13C ЯМР (126 MГц, MeOD) δ 174,29, 168,67, 167,68, 161,59, 151,18, 136,67, 128,19, 126,39, 105,38, 70,83, 60,77, 56,97, 43,88, 39,37, 35,28, 33,95, 31,79, 31,74, 11,23. MS (ESI) 400,5 (M+H).
VL47
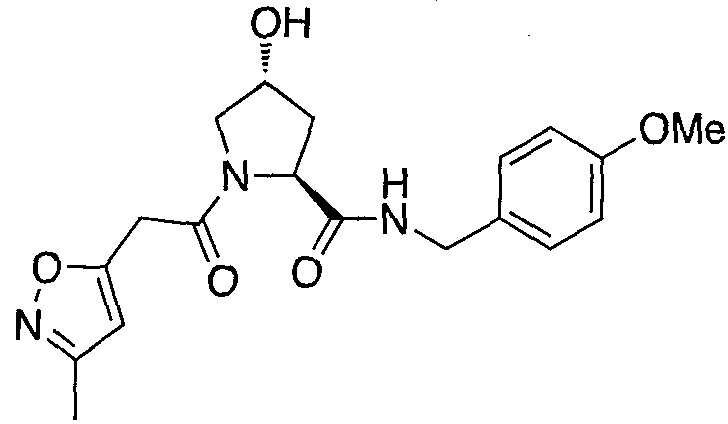 .
.
VL47 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,156 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (9,1 мг). 1H ЯМР (500 MГц, MeOD) δ 7,22 (дд, J=8,4, 3,9 Гц, 2H), 6,86 (дд, J=8,8, 2,2 Гц, 2H), 6,22 (с, 1H), 4,63-4,45 (м, 2H), 4,37-4,26 (м, 2H), 3,92 (д, J=2,6 Гц, 2H), 3,83-3,70 (м, 4H), 3,61 (д, J=11,2 Гц, 1H), 2,28-2,20 (м, 4H), 2,06 (ддд, J=13,0, 8,1, 4,7 Гц, 1H). 13C ЯМР (126 MГц, MeOD) δ 174,13, 168,66, 167,68, 161,60, 160,39, 131,67, 129,76, 114,89, 105,37, 70,83, 60,74, 56,97, 55,67, 43,57, 39,34, 33,95, 11,21. MS (ESI) 374,5 (M+H).
VL35
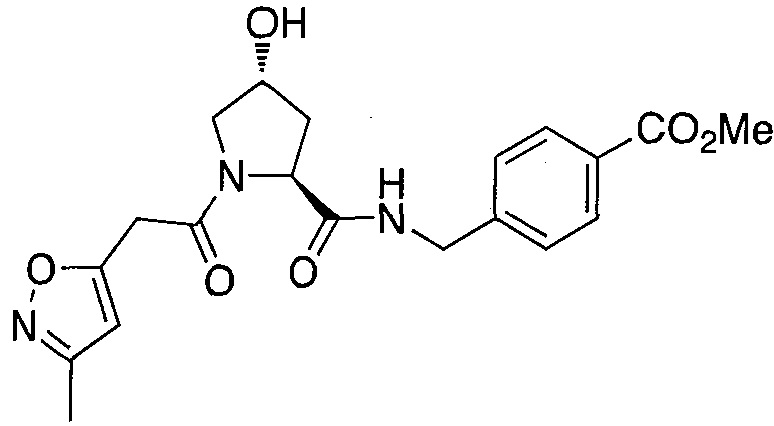 .
.
VL35 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,156 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (14,1 мг). 1H ЯМР (500 MГц, ДМСО) δ 7,90-7,85 (м, 2H), 7,39 (д, J=8,4 Гц, 2H), 6,23 (с, 1H), 5,17 (с, 1H), 4,37 (дд, J=17,9, 10,4 Гц, 4H), 3,88 (с, 2H), 3,84 (с, 3H), 3,70 (дд, J=10,5, 4,6 Гц, 1H), 3,47 (дд, J=10,4, 2,5 Гц, 1H), 2,20 (д, J=10,2 Гц, 3H), 2,11-2,03 (м, 1H), 1,92 (ддд, J=12,5, 7,2, 4,9 Гц, 1H). 13C ЯМР (126 MГц, ДМСО) δ 171,66, 166,66, 166,10, 165,66, 159,35, 145,22, 129,08, 127,99, 127,06, 103,94, 68,62, 58,76, 55,20, 52,02, 41,49, 38,17, 32,73, 10,95. MS (ESI) 402,6 (M+H).
VL48
 .
.
VL48 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,156 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (11,4 мг). 1H ЯМР (400 MГц, MeOD) δ 8,28-8,05 (м, 2H), 7,55 (д, J=8,8 Гц, 2H), 6,23 (с, 1H), 4,64-4,36 (м, 4H), 3,94 (д, J=3,8 Гц, 2H), 3,81 (дд, J=10,9, 4,2 Гц, 1H), 3,65 (дт, J=11,0, 1,7 Гц, 1H), 2,34-2,21 (м, 4H), 2,09 (тд, J=8,5, 4,2 Гц, 1H) 13C ЯМР (101 MГц, MeOD) δ 174,70, 168,79, 167,65, 161,63, 148,48, 147,72, 129,13, 124,56, 105,40, 70,88, 60,79, 57,03, 43,41, 39,32, 33,94, 11,20. MS (ESI) 389,3 (M+H), 411,4 (M+Na).
VL88
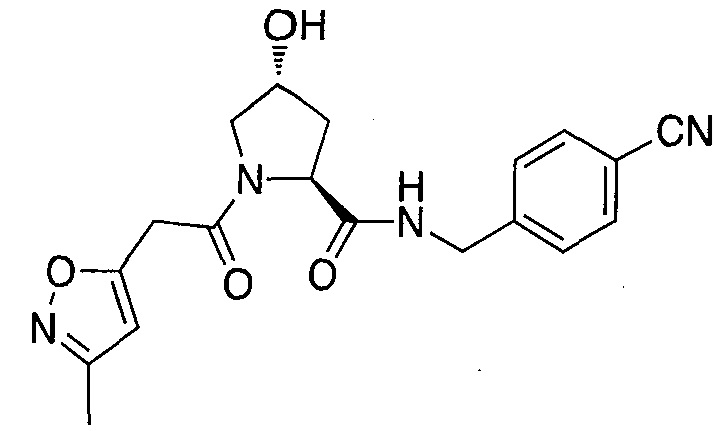 .
.
VL88 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,156 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде прозрачного масла (8,0 мг). 1H ЯМР (500 MГц, MeOD) δ 8,77 (с, 1H), 7,58 (дд, J=88,0, 8,1 Гц, 4H), 6,23 (д, J=4,4 Гц, 1H), 4,61-4,33 (м, 4H), 3,93 (д, J=9,7 Гц, 2H), 3,83-3,74 (м, 1H), 3,63 (дд, J=10,4, 9,0 Гц, 1H), 2,33-2,27 (м, 1H), 2,26 (д, J=3,7 Гц, 3H), 2,15-2,03 (м, 1H), 13C ЯМР (126 MГц, MeOD) δ 175,33, 168,76, 167,64, 161,61, 145,83, 133,39, 129,12, 1 19,74, 111,79, 105,28, 70,87, 70,87, 59,32, 57,02, 43,61, 38,79, 33,94, 11,21, 11,19. MS (ESI) 391,2 (M+Na).
VL95
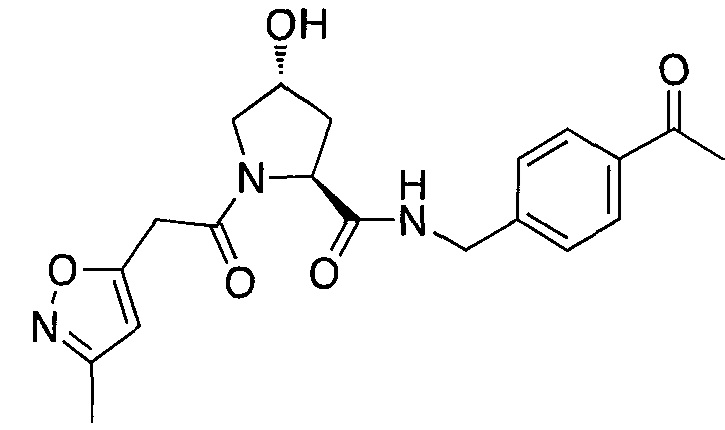 .
.
VL95 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,156 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (23 мг). 1H ЯМР (400 MГц, MeOD) δ 8,71 (с, 1H), 7,96-7,91 (м, 2H), 7,43 (д, J=8,5 Гц, 2H), 6,22 (с, 1H), 4,56 (т, J=8,0 Гц, 1H), 4,49 (ддд, J=18,6, 8,6, 4,1 Гц, 3H), 3,91 (с, 2H), 3,80 (дд, J=10,9, 4,2 Гц, 1H), 3,65-3,58 (м, 1H), 2,58 (д, J=1,6 Гц, 3H), 2,28-2,22 (м, 4H), 2,10 (дд, J=8,3, 4,7 Гц, 1H). 13C ЯМР (101 MГц, MeOD) δ 200,08, 174,34, 168,43, 167,36, 161,39, 145,50, 136,96, 129,62, 128,28, 105,26, 70,65, 60,57, 56,83, 43,72, 39,14, 33,87, 26,73, 11,30. MS (ESI) 386,0 (M+H).
VL111
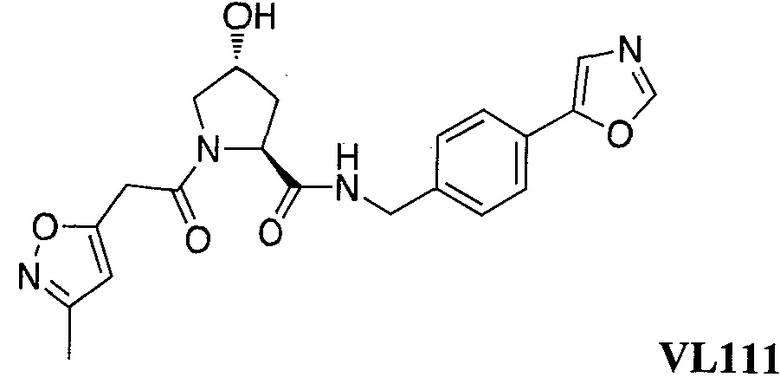 .
.
VL111 был синтезирован из Fmoc-Hyp(OWang)-Oаллила (0,2 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества белого цвета (18,2 мг). 1H ЯМР (500 MГц, MeOD) δ 8,23 (с, 1H), 7,68 (д, J=8,1 Гц, 2H), 7,49 (с, 1H), 7,41 (д, J=8,1 Гц, 2H), 6,23 (с, 1H), 4,59-4,37 (м, 4H), 3,93 (д, J=3,4 Гц, 2H), 3,81 (дд, J=10,9, 4,1 Гц, 1H), 3,63 (д, J=11,0 Гц, 1H), 2,32-2,17 (м, 4H), 2,09 (ддд, J=13,0, 8,0, 4,6 Гц, 1H). 13C ЯМР (126 MГц, MeOD) δ 174,43, 168,72, 167,67, 161,60, 153,14, 152,75, 140,78, 129,06, 127,74, 125,61, 121,81, 105,37, 70,86, 60,78, 57,00, 43,72, 39,35, 33,96, 11,20. MS (ESI) 411,3 (M+H).
VL116 Правый фрагмент (характерный синтез по способу B)
 .
.
2-(триметилсилил)этил 4-бромбензилкарбамат
 .
.
Гидрохлорид 4-бромбензиламина (354 мг, 1,59 ммоль, 1 экв.) растворяли в ДМФ (6,4 мл) и воде (2,1 мл) и перемешивали при комнатной температуре. Затем добавляли триэтиламин (0,33 мл, 2,39 ммоль, 1,5 экв.) и TeocOSu (454 мг, 1,75 ммоль, 1,1 экв.). Через 12 часов смесь разбавляли EtOAc, промывали 1M HCl, насыщенным бикарбонатом натрия, водой и насыщенным солевым раствором. Органический слой затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 10 до 20% EtOAc/гексан) приводила к получению бесцветного масла (0,4158 г, 1,26 ммоль, 79%). 1H ЯМР (500 MГц, CDCl3) δ 7,48-7,43 (м, 2H), 7,17 (д, J=8,1 Гц, 2H), 4,94 (с, 1H), 4,31 (д, J=6,0 Гц, 2H), 4,23-4,15 (м, 2H), 1,04-0,93 (м, 2H), 0,04 (с, 9H). 13C ЯМР (126 MГц, CDCl3) δ 156,91, 137,95, 131,88, 129,32, 121,43, 63,53, 44,53, 17,92-1,32. MS (ESI) 354,1 (M+H).
2-(триметилсилил)этил 4-(4-метилтиазол-5-ил)бензилкарбамат
 .
.
2-(Триметилсилил)этил 4-бромбензилкарбамат (132 мг, 0,4 ммоль, 1 экв.), 4-метилтиазол-5-карбоновую кислоту (114,5 мг, 0,8 ммоль, 2 экв.), гидрат тетрабутиламмония хлорида (118 мг, 0,4 ммоль, 1 экв.), карбонат цезия (196 мг, 0,6 ммоль, 1,5 экв.) и Pd(P(tBu)3)2 (40,8 мг, 0,08 ммоль, 0,2 экв.) растворяли в ДМФ (4 мл).1 Реакционную смесь нагревали при температуре 170°C в микроволновом реакторе в течение 16 минут. Смесь затем охлаждали до комнатной температуры, разбавляли EtOAc и промывали три раза насыщенным солевым раствором, один раз насыщенным бикарбонатом натрия, водой и затем насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 10 до 35% EtOAc/гексан) приводила к получению бесцветного масла (61,7 мг, 0,177 ммоль, 44%). 1H ЯМР (400 MГц, CDCl3) δ 8,67 (с, 1H), 7,43-7,37 (м, 2H), 7,34 (д, J=8,1 Гц, 2H), 5,09 (с, 1H), 4,39 (д, J=6,0 Гц, 2H), 4,28-4,02 (м, 2H), 2,52 (с, 3H), 1,10-0,90 (м, 2H), 0,14-0,09 (м, 9H). 13C ЯМР (101 MГц, CDCl3) δ 156,98, 150,42, 148,66, 138,76, 131,67, 131,18, 129,66, 127,89, 63,46, 44,71, 17,90, 16,18-1,34. MS (ESI) 349,0 (M+H).
(4-(4-метилтиазол-5-ил)фенил)метанамин
 .
.
2-(Триметилсилил)этил 4-(4-метилтиазол-5-ил)бензилкарбамат (51,8 мг, 0,149 ммоль, 1 экв.) растворяли в ацетонитриле (6 мл) при комнатной температуре. Добавляли одномолярный раствор тетрабутиламмония фторида в ТГФ (0,45 мл, 0,45 ммоль, 3 экв.) и раствор перемешивали в течение 24 часов. Смесь концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 0,5 до 4% 0,5н NH3(MeOH)/DCM) давала масло светло-желтого цвета (27,2 мг, 0,133 ммоль, 89%). 1H ЯМР (500 MГц, MeOD) δ 8,87 (с, 1H), 7,44 (с, 4H), 3,85 (с, 2H), 2,47 (с, 3H). 13C ЯМР (126 MГц, MeOD) δ 152,77, 149,07, 143,63, 133,42, 131,46, 130,49, 129,05, 46,23, 15,79. MS (ESI) 205,0 (M+H).
Альтернативный путь:
4-Бромбензонитрил (5,1 г, 28 ммоль, 1 экв.), 4-метилтиазол (5,56 г, 56 ммоль, 2 экв.), ацетат калия (5,5 г, 56 ммоль, 2 экв.), ацетат палладия(II) (63 мг, 0,28 ммоль, 1 моль%) растворяли в диметилацетамиде и перемешивали в атмосфере аргона. (CITE JOC, 2009, 74, 1179) Смесь нагревали при температуре 150°C и перемешивали в течение 19 часов, затем разбавляли 500 мл EtOAc и промывали 4 раза с помощью 300 мл воды. Первую промывку затем вновь экстрагировали 300 мл EtOAc и затем промывали 4 раза с помощью 100 мл воды. Объединенный органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением твердого вещества бежевого цвета (5,55 г, 27,7 ммоль, 99%), что соответствовало зарегистрированным спектральным данным.[8] Твердый продукт затем растворяли в MeOH (280 мл) и охлаждали до температуры 4°C. Добавляли хлорид кобальта (9,9 г, 41,6 ммоль, 1,5 экв.), затем медленно по частям добавляли боргидрид натрия (5,2 г, 139 ммоль, 5 экв.), что сопровождалось сильным выделением пузырьков. Спустя 90 минут реакцию гасили путем добавления воды и гидроксида аммония. Смесь экстрагировали 4 раза с помощью хлороформа и очищали с помощью колоночной хроматографии (от 10 до 30% 0,5M NH3 (MeOH)/DCM) с получением темного масла (4,12 г, 20,2 ммоль, 73%).
Общий синтез в растворимой фазе
(2S,4R)-аллил 4-(трет-бутокси)пирролидин-2-карбоксилат
 .
.
(2S,4R)-1-((9H-Флуорен-9-ил)метил) 2-аллил 4-(трет-бутокси)пирролидин-l,2-дикарбоксилат (7,0 г, 15,57 ммоль, 1 экв.) растворяли в DCM (156 мл) и охлаждали до температуры 4°C. Добавляли трис(2-аминоэтил)амин (5,8 мл, 38,9 ммоль, 2,5 экв.) и раствор перемешивали в течение 1 часа при температуре 4°C и 4,5 часов при комнатной температуре. Смесь затем смешивали с силикагелем (примерно 20 г) и концентрировали при пониженном давлении, и очищали с помощью колоночной хроматографии (от 1 до 5% 0,5н NH3 (MeOH)/DCM) с получением непрозрачного масла (3,44 г, 15,1 ммоль, 97%). 1H ЯМР (400 MГц, MeOH) δ 6,03-5,88 (м, 1H), 5,25 (дкв, J=17,2, 1,8 Гц, 1H), 5,09 (дкв, J=10,5, 1,6 Гц, 1H), 4,33-4,23 (м, 1H), 4,06 (дт, J=5,1, 1,6 Гц, 2H), 3,86 (т, J=8,0 Гц, 1H), 3,18 (дд, J=11,4, 5,7 Гц, 1H), 2,70 (дд, J=11,4, 3,8 Гц, 1H), 2,00 (дд, J=8,0, 5,0 Гц, 2H), 1,19 (с, 9H). 13C ЯМР (101 MГц, MeOH) δ 175,89, 138,93, 114,88, 74,93, 72,93, 63,97, 59,77, 55,44, 40,18, 28,65. MS (ESI) 228,0 (M+H).
(2S,4R)-аллил 4-(трет-бутокси)-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксилат
 .
.
(2S,4R)-Аллил 4-(трет-бутокси)пирролидин-2-карбоксилат (0,148 г, 0,65 ммоль, 1 экв.) растворяли в ДМФ (6,5 мл) и охлаждали до температуры 4°C. Добавляли 2-(3-метилизоксазол-5-ил)уксусную кислоту (0,12 г, 0,85 ммоль, 1,3 экв.), EDC (0,163 г, 0,85 ммоль, 1,3 экв.), HOBt (0,123 г, 0,91 ммоль, 1,4 экв.) и DIPEA (0,283 мл, 1,63 ммоль, 2,5 экв.), и раствору давали медленно нагреться до комнатной температуры. Через 12 часов смесь выливали в насыщенный солевой раствор и экстрагировали четыре раза с помощью EtOAc. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 1 до 3% MeOH/DCM) давала масло светло-желтого цвета (0,2008 г, 0,573 ммоль, 88%). 1H ЯМР (500 MГц, CDCl3) δ 6,17 (с, 1H), 5,95-5,85 (м, 1H), 5,29 (ддд, J=13,8, 11,7, 1,3 Гц, 2H), 4,69-4,55 (м, 3H), 4,40-4,32 (м, 1H), 3,84-3,75 (м, 3H), 3,37 (дд, J=10,0, 4,7 Гц, 1H), 2,27 (с, 3H), 2,15 (ддд, J=18,5, 12,0, 5,9 Гц, 2H), 1,18 (с, 9H). 13C ЯМР ЯМР (126 MГц, CDCl3) δ 171,87, 165,94, 165,63, 160,30, 131,84, 118,72, 104,04, 74,53, 69,55, 65,98, 57,96, 54,53, 37,31, 33,58, 28,35, 11,62. MS (ESI) 351,5 (M+H).
(2S,4R)-4-(трет-бутокси)-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновая кислота
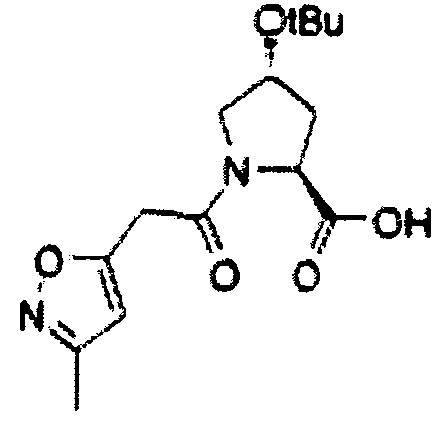 .
.
(2S,4R)-Аллил 4-(трет-бутокси)-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксилат (1,67 г, 4,77 ммоль, 1 экв.) при комнатной температуре растворяли в ТГФ (48 мл). Затем добавляли Pd(PPh3)4 (0,55 г, 0,48 ммоль, 0,1 экв.) и морфолин (4,2 мл, 48 ммоль, 10 экв.). Через 35 минут раствор концентрировали при пониженном давлении, вновь растворяли в DCM и промывали четыре раза с помощью 1M HCl (водн.). Водный слой затем вновь экстрагировали один раз DCM. Объединенный органический слой затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 1 до 20% MeOH/DCM) давала твердый продукт желтого цвета (1,27 г, 4,1 ммоль, 86%). 1H ЯМР (500 MГц, MeOH) δ 6,23 (с, 1H), 4,47 (т, J=6,0 Гц, 2H), 3,94-3,80 (м, 3H), 3,48 (дд, J=10,6, 3,8 Гц, 1H), 2,28-2,11 (м, 5H), 1,21 (с, 9H). 13C ЯМР (126 MГц, MeOH) δ 175,53, 168,41, 167,68, 161,59, 105,25, 75,57, 71,00, 59,36, 55,81, 38,49, 33,88, 28,48, 11,20. MS (ESI) 311,2 (M+H).
Основная методика общего способа B (с защитой гидроксильной группы): VL116
(2S,4R)-4-(трет-бутокси)-1-(2-(3-метилизоксазол-5-ил)ацетил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
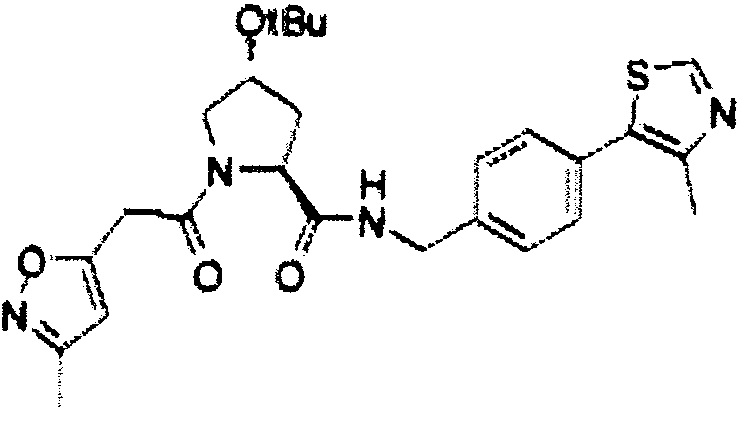 .
.
(2S,4R)-4-(трет-Бутокси)-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновую кислоту (53,7 мг, 0,173 ммоль, 1,3 экв.), (4-(4-метилтиазол-5-ил)фенил)метанамин (27,2 мг, 0,133 ммоль, 1 экв.), EDC (33,2 мг, 0,173 ммоль, 1,3 экв.) и HOBt (23,4 мг, 0,173 ммоль, 1,3 экв.) растворяли в ДМФ (3,5 мл) при температуре 4°C. Добавляли DIPEA (0,07 мл, 0,4 ммоль, 3 экв.), и раствору давали медленно нагреться до комнатной температуры. Спустя 19 часов смесь выливали в насыщенный солевой раствор и экстрагировали четыре раза с помощью EtOAc. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 1 до 5% MeOH/DCM) приводила к получению бесцветного масла (58,1 мг, 0,117 ммоль, 88%). 1H ЯМР (400 MГц, CDCl3) δ 8,67 (с, 1H), 7,42-7,27 (м, 5H), 6,06 (с, 1H), 4,69 (дд, J=8,4, 2,6 Гц, 1H), 4,59-4,35 (м, 3H), 3,82-3,71 (м, 3H), 3,34 (дд, J=9,9, 6,3 Гц, 1H), 2,59-2,46 (м, 4H), 2,25 (с, 3H), 1,91 (дд, J=8,2, 4,4 Гц, 1H), 1,25-1,14 (м, 9H). 13C ЯМР (101 MГц, CDCl3) δ 170,70, 167,35, 165,30, 160,24, 150,42, 148,59, 138,09, 131,74, 131,05, 129,66, 127,85, 104,19, 74,48, 70,02, 59,12, 54,20, 43,25, 35,59, 33,49, 28,38, 16,19, 11,57. MS (ESI) 497,4 (M+H).
(2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид (VL116)
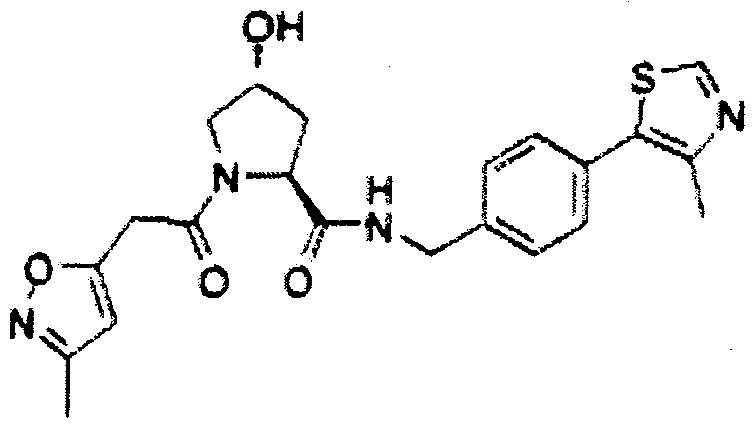 .
.
(2S,4R)-4-(трет-Бутокси)-1-(2-(3-метилизоксазол-5-ил)ацетил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид (58,1 мг, 0,117 ммоль) растворяли в DCM (8 мл). Добавляли ТФУ (2 мл, 20% об./об.) и раствор перемешивали в течение 12 часов при комнатной температуре, после чего его концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 1 до 10% 0,5н NH3 (MeOH)/DCM) приводила к получению бесцветного масла (28,4 мг, 0,065 ммоль, 56%). 1H ЯМР (400 MГц, MeOH) δ 8,87 (д, J=2,1 Гц, 1H), 7,50-7,34 (м, 4H), 6,23 (с, 1H), 4,57 (т, J=8,0 Гц, 1H), 4,54-4,38 (м, 3H), 3,93 (д, J=2,4 Гц, 2H), 3,81 (дд, J=10,9, 4,3 Гц, 1H), 3,63 (дд, J=7,2, 5,5 Гц, 1H), 2,46 (д, J=8,8 Гц, 3H), 2,33-2,20 (м, 4H), 2,10 (ддд, J=13,1, 8,2, 4,7 Гц, 1H). 13C ЯМР (101 MГц, MeOH) δ 174,43, 168,71, 167,66, 161,58, 152,83, 149,04, 140,14, 133,39, 131,56, 130,43, 128,88, 105,39, 70,86, 60,78, 57,00, 43,65, 39,36, 33,96, 15,81, 11,22. MS (ESI) 441,3 (M+H).
Основная методика общего способа A: VL133
(2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновая кислота
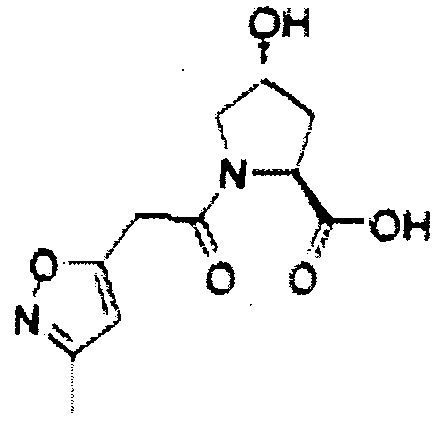 .
.
(2S,4R)-4-(трет-Бутокси)-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновую кислоту (124,9 мг, 0,4 ммоль, 1 экв.) при комнатной температуре растворяли в DCM (18 мл). Добавляли ТФУ (2 мл, 10%) и раствор перемешивали в течение 12 часов. Затем концентрировали при пониженном давлении и очищали с помощью колоночной хроматографии (от 4 до 20% MeOH/DCM) с получением масла желтого цвета (99,7 мг, 0,39 ммоль, 98%). 1H ЯМР (500 MГц, MeOD) δ 6,24 (с, 1H), 4,55-4,46 (м, 2H), 3,89 (д, J=28,3 Гц, 2H), 3,77 (дд, J=10,9, 4,3 Гц, 1H), 3,62 (д, J=11,0 Гц, 1H), 2,36-2,22 (м, 4H), 2,10 (ддд, J=13,1, 8,0, 4,8 Гц, 1H). 13C ЯМР (126 MГц, CDCl3) δ 175,33, 168,51, 167,61, 161,61, 105,28, 70,86, 59,33, 56,60, 38,78, 33,85, 11,20. MS (ESI) 255,1 (M+H).
(2S,4R)-N-(4-(1H-пиррол-3-ил)бензил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид (VL133)
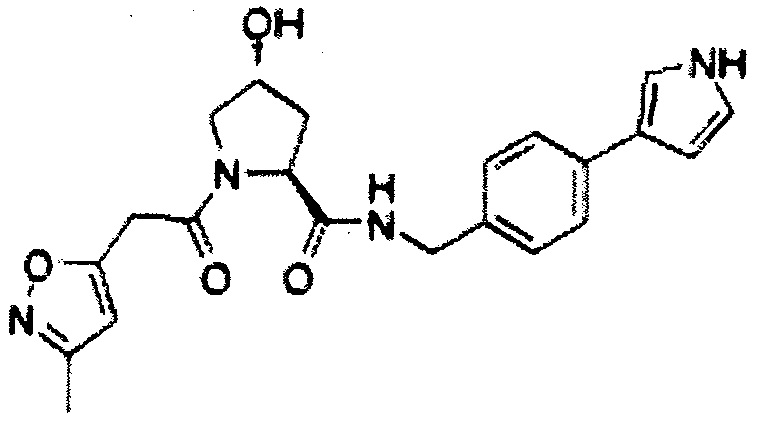 .
.
(2S,4R)-4-Гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновую кислоту (52,6 мг, 0,207 ммоль, 1,3 экв.), (4-(1H-пиррол-3-ил)фенил)метанамин (27,3 мг, 0,159 ммоль, 1 экв.), EDC (39,7 мг, 0,207 ммоль, 1,3 экв.) и HOBt (28 мг, 0,207 ммоль, 1,3 экв.) растворяли в ДМФ (4,1 мл) и охлаждали до температуры 4°C. Добавляли DIPEA (0,083 мл, 0,477 ммоль, 3 экв.) и раствору давали медленно нагреться до комнатной температуры. Через 16 часов смесь выливали в полунасыщенный хлорид натрия (водный) и экстрагировали 3 раза с помощью EtOAc. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Очистка с помощью колоночной хроматографии (от 1 до 10% 0,5н NH3 (MeOH)/DCM) давала твердое вещество не совсем белого цвета (41,5 мг, 0,102 ммоль, 64%). 1H ЯМР (400 MГц, ДМСО) δ 8,40 (д, J=6,0 Гц, 1H), 7,52-7,39 (м, 2H), 7,22-7,12 (м, 3H), 6,82-6,72 (м, 1H), 6,41 (д, J=1,7 Гц, 1H), 6,24 (с, 1H), 5,17 (д, J=3,9 Гц, 1H), 4,31 (ддд, J=17,1, 13,7, 6,4 Гц, 4H), 3,88 (с, 2H), 3,75-3,65 (м, 1H), 3,52-3,41 (м, 1H), 2,18 (д, J=18,0 Гц, 3H), 2,12-1,99 (м, 1H), 1,94-1,85 (м, 1H). 13C ЯМР (101 MГц, ДМСО) δ 171,36, 166,69, 165,54, 159,38, 135,66, 134,68, 127,20, 124,21, 123,00, 118,86, 114,71, 105,22, 103,99, 68,61, 58,76, 55,18, 41,63, 38,27, 32,78, 11,00. MS (ESI) 431,5 (M+Na).
Для дальнейшей ссылки смотри следующие статьи и приведенные там ссылки:
(1) Buckley DL et al. J. Am. Chem. Soc 2012, 134, 4465-4468.
(2) Van Molle I et al. A Chemistry & Biology 2012, 19, 1300-1312.
(3) Buckley, D Angew. Chem. Int. Ed., 2012, 51, 11463-11467.
(4) Buckley, D. L. et al. Angew. Chem. 2012, 124, 11630-11634.
Примеры. Вторая часть
VL50
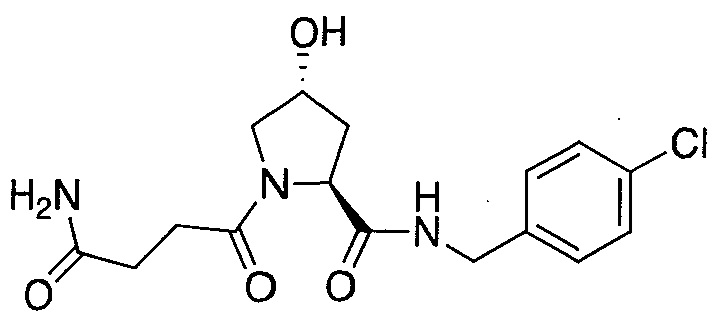 .
.
VL50 был синтезирован из смолы Fmoc-Hyp(OWang)-Oаллила (0,156 ммоль) в соответствии с общим способом твердофазного синтеза B. Выделяли в виде твердого вещества белого цвета (29,8 мг, 0,084 ммоль, 54%). 1H ЯМР (400 MГц, CD3OD): δ 7,34-7,27 (м, 4H); 5,43-5,35 (м, 4H); 3,81-3,78 (дд, J=8 Гц, 4 Гц, 1H); 3,61-3,57 (м, 1H); 2,65-2,61 (м, 2H); 2,57-2,51 (м, 2H); 2,28-2,21 (м, 1H); 2,08-2,02 (м, 1H). 13C ЯМР (100 MГц, CD3OD): δ 177,53, 174,74, 173,76, 138,75, 133,76, 129,96, 129,49, 70,71, 60,55, 56,47, 43,25, 39,33, 30,97, 30,64. MS (ESI) 354,2 (M+H).
VL52
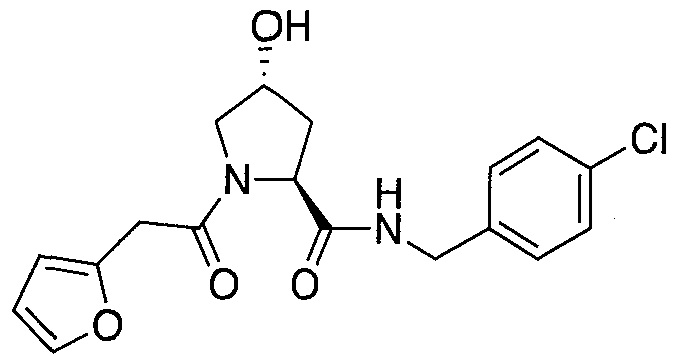 .
.
VL52 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,156 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (7,7 мг, 0,021 ммоль, 14%). 1H ЯМР (500 MГц, CD3OD): δ 7,41 (д, J=2 Гц, 1H); 7,30 (с, 4H); 6,35-6,34 (дд, J=3 Гц, 2 Гц, 1H); 6,26-6,25 (д, J=3 Гц, 1H); 4,49-4,32 (м, 4H); 3,82-3,73 (м, 3H); 3,65-2,62 (м, 1H); 2,23-2,22 (м, 1H); 2,09-2,06 (м, 1H). 13C ЯМР (125 MГц, CD3OD): δ 174,54, 170,58, 149,67, 143,24, 138,68, 133,84, 129,98, 129,53, 111,50, 108,98, 70,88, 60,75, 56,95, 43,31, 39,24, 35,58. MS (ESI) 365,2 (M+H), 385,3 (M+Na).
VL73
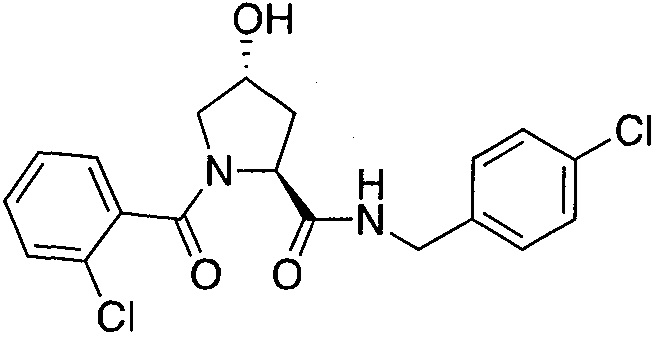 .
.
VL73 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде прозрачного масла (38,9 мг, 0,099 ммоль, 55%). 1H ЯМР (500 MГц, CD3OD) δ 7,51-6,99 (м, 8H), 4,72 (т, J=8,2, 1H), 4,55-4,33 (м, 3H), 3,60 (дд, J=3,7, 11,3, 1H), 3,19 (дд, J=1,5, 11,3, 1H), 2,36-2,25 (м, 1H), 2,21-2,03 (м, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,03, 169,66, 138,62, 137,31, 133,87, 132,12, 130,92, 130,48, 129,98, 129,56, 129,16, 128,53, 70,64, 60,38, 43,39, 39,25, 24,21. MS (ESI) 395,3 (M+H).
VL64
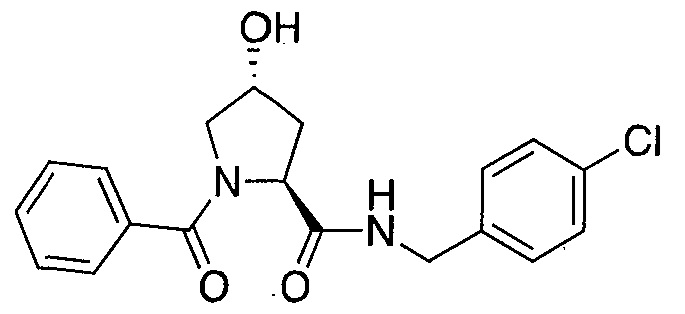 .
.
VL64 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,156 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (27,5 мг, 0,077 ммоль, 49%). 1H ЯМР (500 MГц, CD3OD) δ 7,66-7,59 (м, 2H), 7,54-7,22 (м, 7H), 4,75 (т, J=8,6, 1H), 4,55-4,33 (м, 3H), 3,85 (дд, J=3,0, 11,5, 1H), 3,43 (д, J=11,5, 1H), 2,38-2,26 (м, 1H), 2,14-2,05 (м, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,72, 172,78, 138,73, 137,14, 133,83, 131,74, 129,93, 129,55, 129,49, 128,56, 71,04, 60,85, 59,80, 43,34, 39,28. MS (ESI) 359,1 (M+H).
VL69
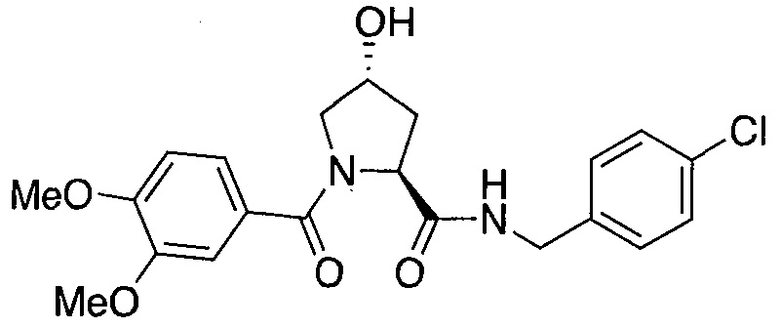 .
.
VL69 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,156 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (26,1 мг, 0,62 ммоль, 40%). 1H ЯМР (500 MГц, ДМСО) δ 7,30 (дт, J=8,2, 25,1, 4H), 7,20 (дд, J=1,7, 8,3, 1H), 7,13 (д, J=1,7, 1H), 7,01 (д, J=8,4, 1H), 4,98 (с, 1H), 4,56 (т, J=8,6, 1H), 4,29 (д, J=2,6, 2H), 3,76 (дд, J=15,5, 30,6, 7H), 3,36 (д, J=11,1, 1H), 2,14 (дд, J=7,7, 12,8, 1H), 1,96-1,83 (м, 1H). 13C ЯМР (126 MГц, ДМСО) δ 171,91, 168,82, 150,39, 148,08, 138,70, 131,10, 128,68, 128,09, 121,00, 111,44, 110,75, 99,56, 68,90, 59,33, 59,30, 58,68, 55,57, 41,17, 38,01. MS (ESI) 418,8 (M+H).
VL70
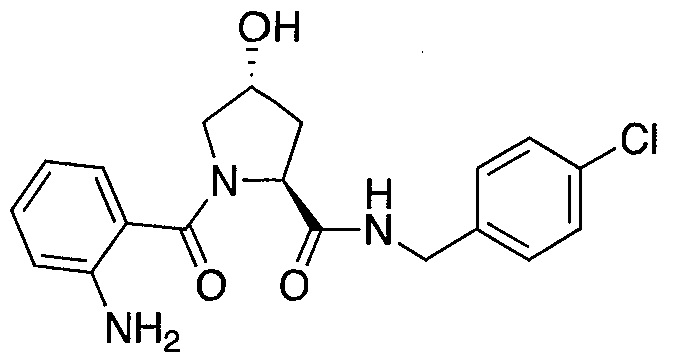 .
.
VL70 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,156 ммоль) в соответствии с общим способом твердофазного синтеза B. Он был выделен в виде бесцветного масла (31,1 мг, 0,083 ммоль, 53%). 1H ЯМР (500 MГц, CD3OD) δ 7,38-7,17 (м, 6H), 6,85-6,73 (м, 2H), 4,76 (т, J=8,5, 1H), 4,53-4,31 (м, 3H), 3,85 (дд, J=3,2, 11,6, 1H), 3,37 (д, J=11,6, 1H), 2,50-2,24 (м, 1H), 2,08 (ддд, J=4,3, 9,1, 13,3, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,72, 172,14, 145,18, 138,67, 133,87, 132,18, 129,97, 129,56, 128,80, 122,39, 118,87, 117,94, 71,01, 60,29, 58,54, 43,40, 39,40. MS (ESI) 374,5 (M+H).
VL71
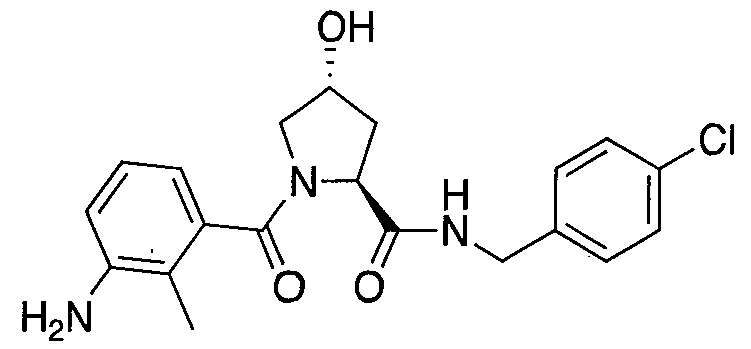 .
.
VL71 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,156 ммоль) в соответствии с общим способом твердофазного синтеза B. Он был выделен в виде бесцветного масла (31,1 мг, 0,080 ммоль, 51%). 1H ЯМР (500 MГц, CD3OD) δ 7,40-7,32 (м, 4H), 7,24 (т, J=7,6, 1H), 7,09 (д, J=7,9, 1H), 7,03 (д, J=7,1, 1H), 4,74 (т, J=8,2, 1H), 4,59-4,33 (м, 3H), 3,54 (д, J=11,0, 1H), 3,20 (д, J=11,2, 1H), 2,35 (дд, J=8,7, 12,4, 1H), 2,26 (с, 3H), 2,14 (дд, J=4,3, 9,3, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,37, 172,44, 140,91, 139,29, 138,69, 133,84, 129,93, 129,55, 128,37, 124,30, 121,45, 120,64, 70,73, 60,11, 43,36, 39,44, 13,89. MS (ESI) 388,1, 390,3 (M+H).
VL72
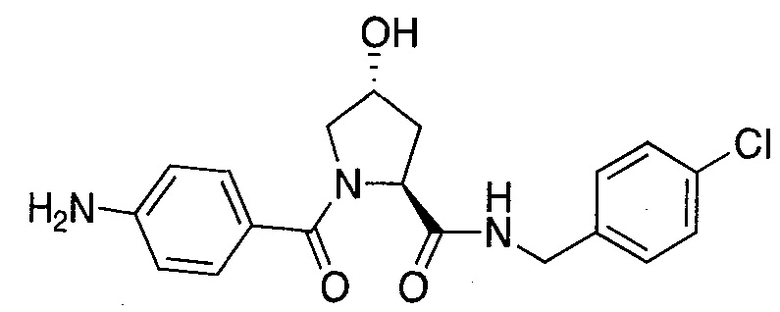 .
.
VL72 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,156 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде масла желтого цвета (31,3 мг, 0,084 ммоль, 54%). 1H ЯМР (500 MГц, CD3OD) δ 7,48 (д, J=8,3, 2H), 7,30 (с, 4H), 6,79 (д, J=8,3, 2H), 4,79-4,69 (м, 1H), 4,53-4,29 (м, 3H), 3,95-3,83 (м, 1H), 3,54 (д, J=11,4, 1H), 2,35-2,24 (м, 1H), 2,07 (ддд, J=3,9, 10,1, 13,5, 1H). 13C ЯМР (126 MГц, CD3OD) δ 175,03, 173,02, 149,95, 138,75, 133,80, 130,79, 129,91, 129,54, 126,23, 115,89, 71,16, 61,03, 60,12, 43,31, 39,16. MS (ESI) 375,0 (M+H).
VL74
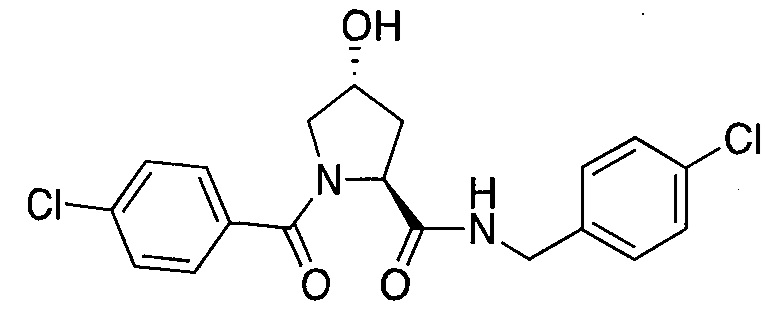 .
.
VL74 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (36,3 мг, 0,092 ммоль, 51%). 1H ЯМР (500 MГц, CD3OD) δ 7,67-7,56 (м, 2H), 7,52-7,44 (м, 2H), 7,34-7,28 (м, 4H), 4,74 (дд, J=7,7, 9,6, 1H), 4,55-4,30 (м, 3H), 3,85 (дд, J=3,5, 11,4, 1H), 3,42 (д, J=11,4, 1H), 2,37-2,28 (м, 1H), 2,15-2,05 (м, 1H). 13C ЯМР (126 MГц, CD3OD) 6 174,59, 171,54, 138,69, 137,75, 135,66, 133,84, 130,38, 129,92, 129,70, 129,55, 71,04, 60,92, 59,75, 43,34, 39,29. MS (ESI) 394,6 (M+H).
VL75
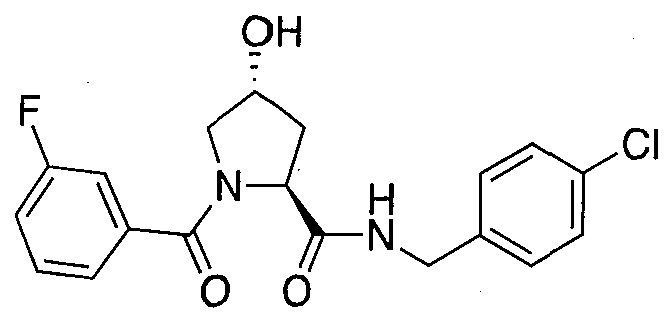 .
.
VL75 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (25,0 мг, 0,066 ммоль, 37%). 1H ЯМР (500 MГц, CD3OD) δ 7,64-6,87 (м, 8H), 4,73 (дд, J=7,7, 9,6, 1H), 4,54-4,31 (м, 3H), 3,84 (дд, J=3,5, 11,5, 1H), 3,42 (д, J=11,4, 1H), 2,33 (ддд, J=1,6, 7,6, 13,0, 1H), 2,13-2,05 (м, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,64, 171,20, 163,83 (д, J=246,5), 139,35, 138,72, 133,86, 131,60, 129,94, 129,56, 124,51, 118,51 (д, J=21,3), 115,56 (д, J=23,4), 71,02, 60,94, 59,70, 43,47, 39,31. MS (ESI) 377,4 (M+H).
VL76
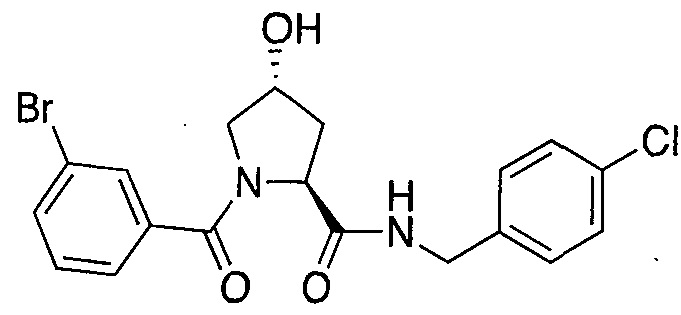 .
.
VL76 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (29,6 мг, 0,067 ммоль, 38%). 1H ЯМР (400 MГц, CD3OD) δ 7,82 (с, 1H), 7,70-7,58 (м, 2H), 7,40 (т, J=7,9, 1H), 7,36-7,18 (м, 4H), 4,73 (дд, J=7,9, 9,4, 1H), 4,53-4,31 (м, 3H), 3,82 (дт, J=5,2, 10,4, 1H), 3,40 (д, J=11,4, 1H), 2,33 (дд, J=7,6, 13,2, 1H), 2,09 (ддд, J=4,1, 9,7, 13,7, 1H). 13C ЯМР (101 MГц, CD3OD) δ 174,53, 170,95, 139,22, 138,68, 134,68, 133,85, 131,56, 131,44, 129,92, 129,56, 127,31, 123,35, 71,02, 60,90, 59,70, 43,33, 39,31. MS (ESI) 439,4 (M+H).
VL77
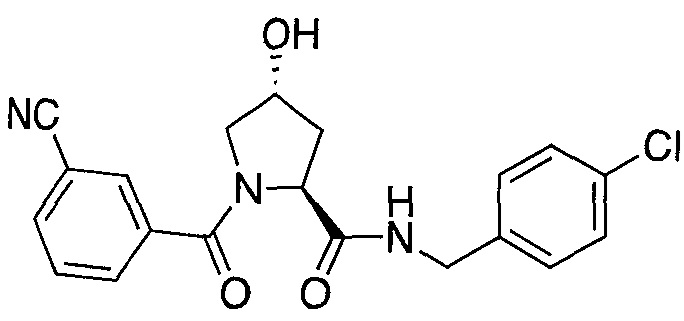 .
.
VL77 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (31,0 мг, 0,081 ммоль, 45%). 1H ЯМР (500 MГц, ДМСО) δ 8,07 (т, J=1,4, 1H), 8,01-7,95 (м, 1H), 7,93-7,88 (м, 1H), 7,69 (т, J=7,8, 1H), 7,40-7,23 (м, 4H), 4,56 (дд, J=8,3, 16,4, 1H), 4,30 (дд, J=8,1, 15,4, 3H), 3,79 (дд, J=3,6, 11,0, 1H), 3,24 (д, J=11,0, 1H), 2,23-2,15 (м, 1H), 1,92 (ддд, J=4,2, 9,3, 13,2, 1H). 13C ЯМР (126 MГц, ДМСО) δ 171,51, 167,29, 138,64, 137,27, 133,88, 132,29, 131,16, 131,08, 129,73, 128,68, 128,15, 118,25, 111,40, 68,82, 59,39, 59,36, 58,28, 38,19. MS (ESI) 383,8 (M+H).
VL79
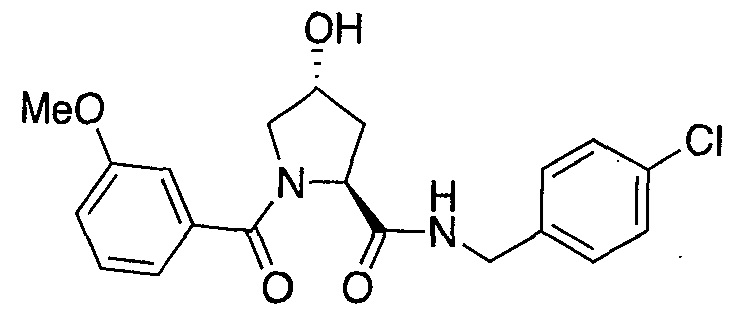 .
.
VL79 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (34,9 мг, 0,090 ммоль, 50%). 1H ЯМР (500 MГц, CD3OD) δ 7,41-7,15 (м, 6H), 7,08-6,90 (м, 2H), 4,73 (дд, J=7,7, 9,6, 1H), 4,54-4,31 (м, 3H), 3,87-3,74 (м, 4H), 3,43 (д, J=11,5, 1H), 2,37-2,27 (м, 1H), 2,14-2,05 (м, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,72, 172,59, 161,07, 138,72, 138,40, 133,83, 130,67, 129,93, 129,56, 120,58, 117,52, 113,77, 71,01, 60,82, 59,80, 55,87, 43,33, 39,29. MS (ESI) 389,0 (M+H).
VL80
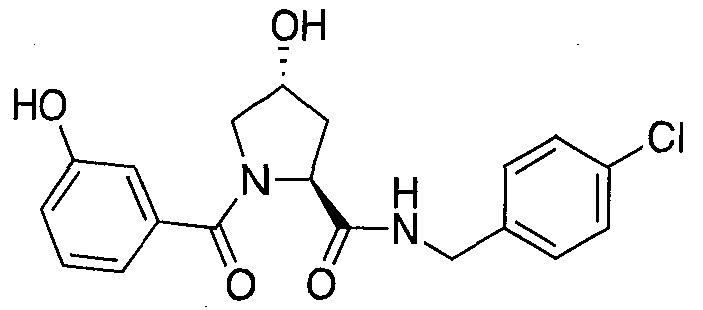 .
.
VL80 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде твердого вещества белого цвета (41,2 мг, 0,110 ммоль, 61%). 1H ЯМР (500 MГц, CD3OD) δ 7,36-6,76 (м, 8H), 4,72 (дд, J=7,8, 9,4, 1H), 4,53-4,31 (м, 3H), 3,82 (дд, J=3,5, 11,6, 1H), 3,45 (д, J=11,6, 1H), 2,34-2,27 (м, 1H), 2,14-2,03 (м, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,81, 172,77, 158,73, 138,74, 138,36, 133,83, 130,64, 129,93, 129,56, 119,39, 118,62, 115,26, 71,01, 60,81, 59,80, 43,46, 39,24. MS (ESI) 375,4 (M+H).
VL81
 .
.
VL81 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,18 ммоль) в соответствии с общим способом твердофазного синтеза B. Он был выделен в виде бесцветного масла (42,9 мг, 0,091 ммоль, 50%). 1H ЯМР (500 MГц, CD3OD) δ 7,77-7,27 (м, 6H), 7,04 (д, J=8,3, 1H), 4,71 (т, J=8,2, 1H), 4,56-4,30 (м, 3H), 3,59 (дд, J=3,7, 11,2, 1H), 3,17 (д, J=11,3, 1H), 2,37-2,25 (м, 1H), 2,19-2,09 (м, 1H). 13C ЯМР (126 MГц, CD3OD) δ 173,87, 169,41, 138,18, 137,15, 133,71, 130,60, 130,36, 130,00, 129,69, 129,56, 129,40, 120,48, 70,62, 69,41, 60,48, 43,53, 39,23. MS (ESI) 472,1 (M+H).
VL96
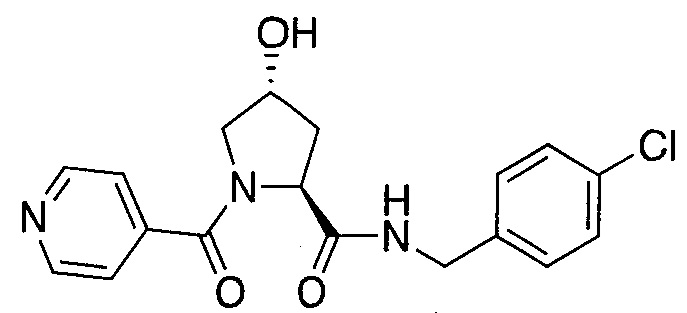 .
.
VL96 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,155 ммоль) в соответствии с общим способом твердофазного синтеза B. Его выделяли в виде масла светло-желтого цвета (36,6 мг, 0,102 ммоль, 66%). 1H ЯМР (500 MГц, CD3OD) δ 8,81 (с, 1H), 8,66 (дд, J=4,6, 1,5 Гц, 2H), 7,60 (дд, J=4,5, 1,6 Гц, 2H), 7,32-7,25 (м, 4H), 4,70 (дд, J=9,3, 7,9 Гц, 1H), 4,46 (дд, J=15,3, 6,3 Гц, 1H), 4,39 (с, 1H), 4,33 (дд, J=15,4, 5,5 Гц, 1H), 3,78 (дд, J=11,4, 3,5 Гц, 1H), 3,27 (дт, J=3,2, 1,6 Гц, 1H), 2,31 (дд, J=13,2, 7,6 Гц, 1H), 2,08 (ддд, J=13,5, 9,6, 4,2 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,32, 169,63, 150,65, 145,83, 138,68, 133,88, 129,96, 129,56, 123,32, 70,99, 60,88, 59,33, 43,49, 39,33. MS (ESI) 360,5 (M+H).
VL112
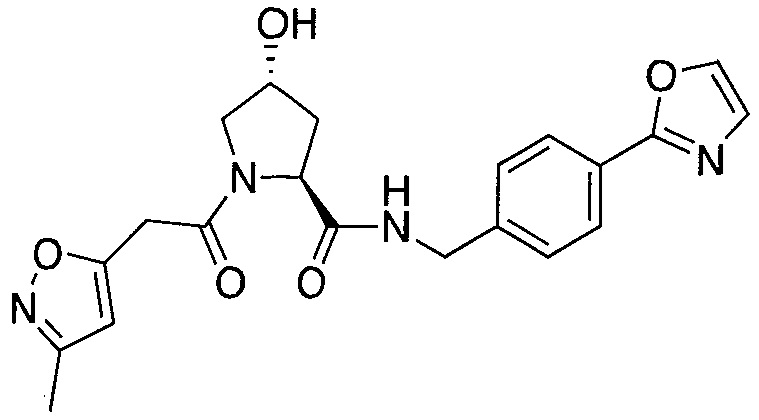 .
.
VL112 был синтезирован из Fmoc-Hyp(OWang)-Oаллильной смолы (0,2 ммоль) в соответствии с общим способом твердофазного синтеза A. Его выделяли в виде твердого вещества кремового цвета (22,6 мг, 0,055 ммоль, 28%) . 1H ЯМР (500 MГц, CD3OD) δ 7,98 (д, J=7,1 Гц, 3H), 7,46 (д, J=8,0 Гц, 2H), 7,28 (с, 1H), 6,23 (с, 1H), 4,62-4,39 (м, 4H), 3,93 (д, J=2,9 Гц, 2H), 3,81 (дд, J=10,9, 4,1 Гц, 1H), 3,64 (д, J=11,0 Гц, 1H), 2,33-2,17 (м, 4H), 2,15-2,04 (м, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,50, 168,72, 167,68, 163,41, 161,60, 142,96, 140,75, 129,45, 128,96, 127,53, 127,15, 105,36, 70,87, 60,78, 56,99, 43,72, 39,36, 33,95, 11,20. MS (ESI) 410,9 (M+H).
VL115
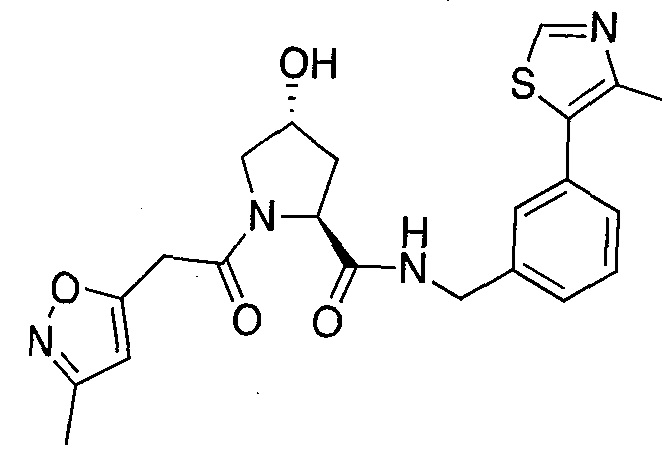 .
.
VL115 был синтезирован в соответствии с общим способом B. 1H ЯМР (500 MГц, CD3OD) δ 8,87 (с, 1H), 7,46-7,40 (м, 2H), 7,36 (дд, J=8,8, 4,3 Гц, 2H), 6,20 (с, 1H), 4,55 (т, J=8,0 Гц, 1H), 4,50 (д, J=6,3 Гц, 1H), 4,48-4,42 (м, 2H), 3,92 (д, J=4,5 Гц, 2H), 3,80 (дд, J=10,9, 4,3 Гц, 1H), 3,62 (д, J=11,0 Гц, 1H), 2,48 (д, J=10,2 Гц, 3H), 2,31-2,21 (м, 4H), 2,08 (ддд, J=13,0, 8,2, 4,7 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,48, 168,60, 167,70, 161,57, 152,92, 149,26, 140,81, 133,50, 133,09, 130,13, 129,24, 129,09, 128,34, 105,35, 70,86, 60,75, 56,95, 43,81, 39,38, 33,92, 15,87, 11,23. MS (ESI) 441,4 (M+H).
VL154
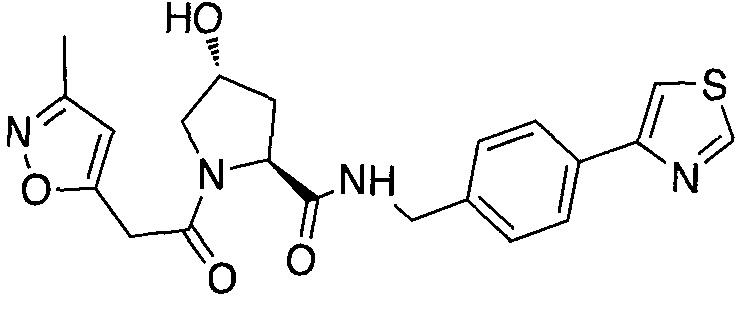 .
.
VLl 54 был синтезирован в соответствии с общим способом B. 1H ЯМР (500 MГц, CD3OD) δ 8,95 (с, 1H), 8,44 (т, J=5,6, 1H), 7,84 (д, J=8,2, 2H), 7,70 (д, J=1,9, 1H), 7,35 (д, J=8,2, 2H), 6,19 (с, 1H), 4,56 (т, J=7,9, 1H), 4,51 (с, 1H), 4,43 (д, J=5,7, 2H), 3,87 (с, 2H), 3,78 (дд, J=10,9, 4,3, 1H), 3,58 (д, J=10,8, 1H), 2,24 (затененный с, 4H), 2,16-2,07 (м, 1H); 13C ЯМР (126 MГц, CD3OD) δ 176,66, 170,98, 169,94, 164,15, 159,72, 157,62, 142,33, 136,89, 131,58, 130,33, 117,00, 108,05, 73,36, 63,27, 59,60, 46,75, 41,78, 36,80, 14,39; ТСХ: (EtOAC) Rf=0,5; ЖХМС (ESI) 427,6 (M+H)+.
VL155
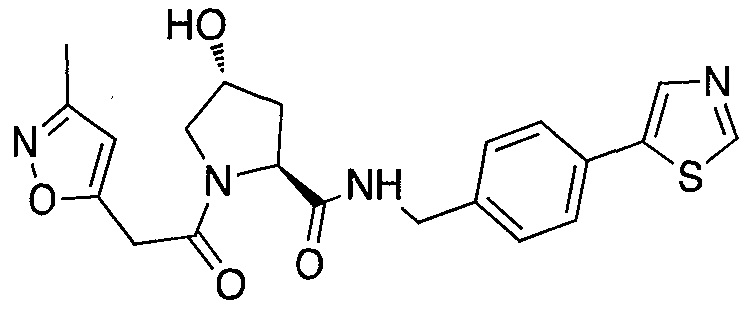 .
.
VL155 был синтезирован в соответствии с общим способом B. 1H ЯМР (500 MГц, CD3OD) δ 8,87 (д, J=5,2, 1H), 8,54 (т, J=5,7, 1H), 8,07 (с, 1H), 7,56 (д, J=8,2, 2H), 7,36 (д, J=8,2, 2H), 6,20 (с, 1H), 4,56 (т, J=8,0, 1H), 4,51 (с, 1H), 4,42 (кв.д, J=5,5, 15,5, 2H), 3,78 (дт, J=9,2, 18,5, 1H), 3,60 (д, J=11,1, 1H), 2,28-2,21 (м, 4H), 2,10 (ддд, J=4,7, 8,0, 13,0, 1H). 13C ЯМР ЯМР (126 MГц, CD3OD) δ 176,72, 171,03, 169,98, 164,12, 142,98, 142,96, 133,45, 132,34? 131,86, 130,07, 108,02, 100,0, 73,37, 63,29, 59,60, 46,52, 41,81, 36,74, 14,27. ТСХ: (EtOAC) Rf=0,5; ЖХМС (ESI) 427,4 (M+H)+.
VL118
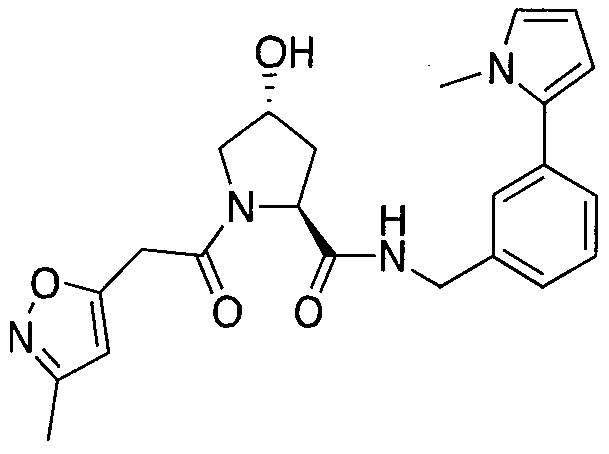 .
.
VL118 был синтезирован в соответствии с общим способом A. 1H ЯМР (500 MГц, CD3OD) δ 7,37-7,31 (м, 2H), 7,27 (д, J=7,7 Гц, 1H), 7,22 (д, J=7,5 Гц, 1H), 6,74-6,68 (м, 1H), 6,20 (с, 1H), 6,14 (дд, J=3,5, 1,8 Гц, 1H), 6,10-6,05 (м, 1H), 4,55 (т, J=8,0 Гц, 1H), 4,49 (с, 1H), 4,45-4,39 (м, 2H), 3,89 (т, J=8,4 Гц, 1H), 3,79 (дд, J=10,9, 4,3 Гц, 1H), 3,67-3,55 (м, 5H), 2,26-2,22 (м, 4H), 2,07 (ддд, J=13,0, 8,1, 4,7 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,35, 168,57, 167,66, 161,57, 139,94, 135,44, 135,24, 129,58, 128,35, 128,22, 126,62, 124,93, 109,56, 108,54, 105,37, 70,84, 60,72, 56,91, 44,04, 39,36, 35,34, 33,88, 11,23. MS (ESI) 422,8 (M+H).
VL119
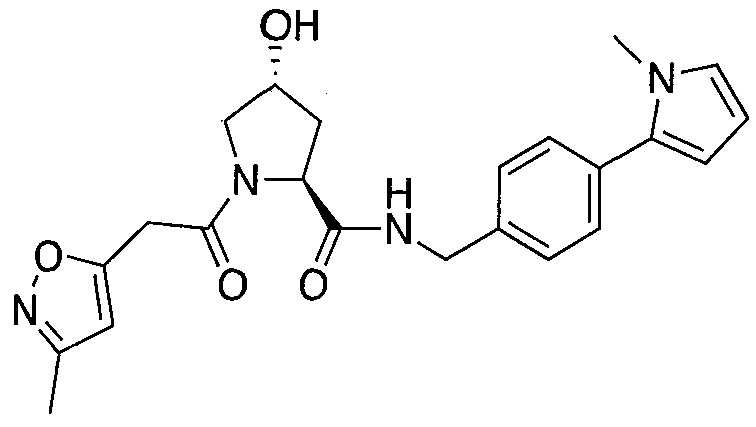 .
.
VL119 был синтезирован в соответствии с общим способом A. 1H ЯМР (500 MГц, CD3OD) δ 7,38-7,30 (м, 4H), 6,76-6,67 (м, 1H), 6,23 (с, 1H), 6,10 (дд, J=3,5, 1,8 Гц, 1H), 6,09-6,05 (м, 1H), 4,56 (т, J=8,1 Гц, 1H), 4,51 (с, 1H), 4,47-4,39 (м, 2H), 3,93 (д, J=3,0 Гц, 2H), 3,81 (дд, J=10,9, 4,3 Гц, 1H), 3,63 (кв., J=5,8 Гц, 4H), 2,31-2,22 (м, 4H), 2,10 (ддд, J=13,0, 8,1, 4,7 Гц, 1H). 13C ЯМР (101 MГц, ~1:1 CD3OD:CDCl3) δ 172,63, 167,39, 166,19, 160,68, 136,80, 132,70, 129,06, 128,99, 127,75, 124,09, 108,75, 107,93, 104,62, 69,88, 59,64, 56,15, 43,36, 37,98, 35,19, 33,53, 11,37. MS (ESI) 423,6 (M+H).
VL131
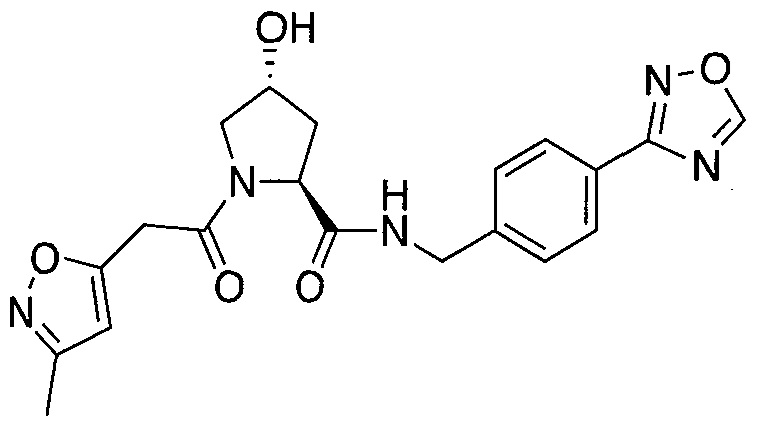 .
.
VL131 был синтезирован в соответствии с общим способом B. 1H ЯМР (400 MГц, CD3OD) δ 9,02 (д, J=5,2 Гц, 1H), 8,02 (д, J=8,4 Гц, 2H), 7,41 (д, J=8,4 Гц, 2H), 6,17 (с, 1H), 4,52-4,38 (м, 4H), 3,84 (с, 2H), 3,76 (дд, J=10,8, 4,3 Гц, 1H), 3,56 (д, J=9,5 Гц, 1H), 2,30-2,18 (м, 4H), 2,14 (тд, J=8,1, 3,9 Гц, 1H). 13C ЯМР (101 MГц, CD3OD) δ 173,25, 167,86, 167,57, 166,44, 166,18, 160,85, 142,53, 128,33, 128,14, 125,56, 104,77, 70,04, 59,87, 56,31, 43,52, 38,30, 33,60, 11,39. MS (ESI) 413,3 (M+H).
VL138
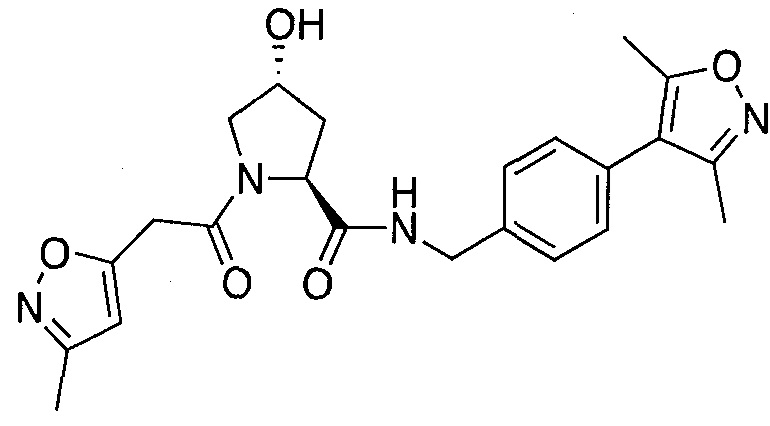 .
.
VL138 был синтезирован в соответствии с общим способом B. 1H ЯМР (400 MГц, CD3OD) δ 7,42 (д, J=8,2 Гц, 2H), 7,32-7,24 (м, 2H), 6,24 (с, 1H), 4,69-4,33 (м, 5H), 3,94 (д, J=3,0 Гц, 1H), 3,82 (дд, J=10,9, 4,3 Гц, 1H), 3,64 (д, J=11,1 Гц, 1H), 2,38 (с, 3H), 2,31-2,24 (м, 4H), 2,23 (с, 3H), 2,10 (ддд, J=13,1, 8,2, 4,7 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,41, 168,72, 167,67, 166,87, 161,59, 160,02, 139,46, 130,38, 129,37, 128,89, 117,72, 105,38, 70,87, 60,78, 57,01, 43,74, 39,37, 33,97, 11,38, 11,20, 10,66. MS (ESI) 438,6 (M+H).
VL139
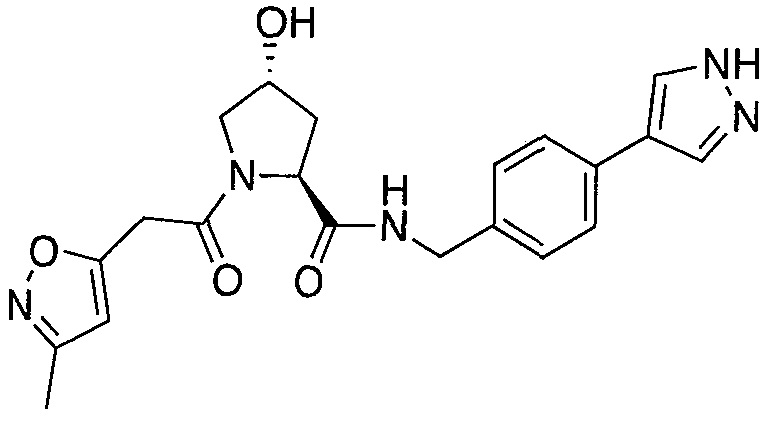 .
.
VL139 был синтезирован в соответствии с общим способом B. 1H ЯМР (400 MГц, ~1:1 CD3OD:CDCl3) δ 7,89 (с, 2H), 7,49 (д, J=8,1 Гц, 2H), 7,28 (д, J=7,9 Гц, 2H), 6,20 (с, 1H), 4,54 (дд, J=17,4, 9,5 Гц, 2H), 4,39 (д, J=5,3 Гц, 2H), 3,93-3,46 (м, 4H), 2,32-2,16 (м, 4H), 2,16-2,05 (м, 1H). 13C ЯМР (126 MГц, ~1:1 CD3OD:CDCl3) δ 173,80, 168,23, 167,21, 161,29, 137,35, 132,66, 129,24, 128,77, 126,60, 126,48, 105,16, 70,53, 60,42, 56,73, 43,71, 39,00, 33,85, 11,30. MS (ESI) 410,0 (M+H).
VL152
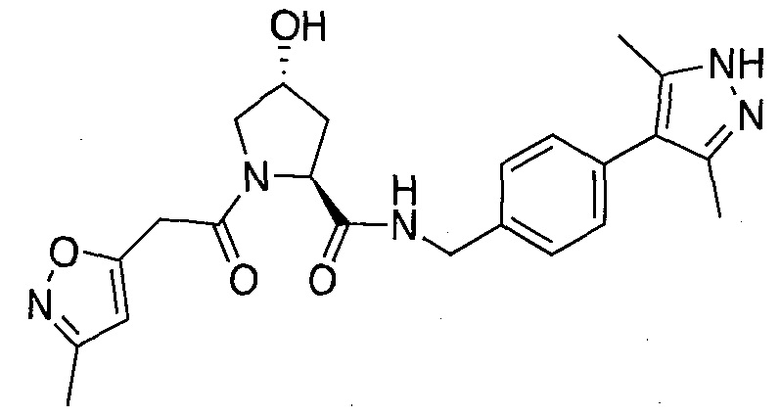 .
.
VL152 был синтезирован в соответствии с общим способом B. 1H ЯМР (400 MГц, CD3OD) δ 7,38 (д, J=8,2 Гц, 2H), 7,25 (д, J=8,2 Гц, 2H), 6,17 (д, J=55,2 Гц, 1H), 4,65-4,30 (м, 4H), 4,05-3,72 (м, 3H), 3,64 (д, J=11,1 Гц, 1H), 2,32-2,19 (м, 10H), 2,10 (ддд, J=13,1, 8,2, 4,7 Гц, 1H). 13C ЯМР (101 MГц, CD3OD) 6 174,37, 168,72, 167,67, 161,59, 143,18, 138,27, 132,85, 130,54, 129,12, 128,64, 105,40, 70,86, 60,78, 57,01, 43,80, 39,38, 33,96, 11,21, 11,07. MS (ESI) 438,5 (M+H).
VL158
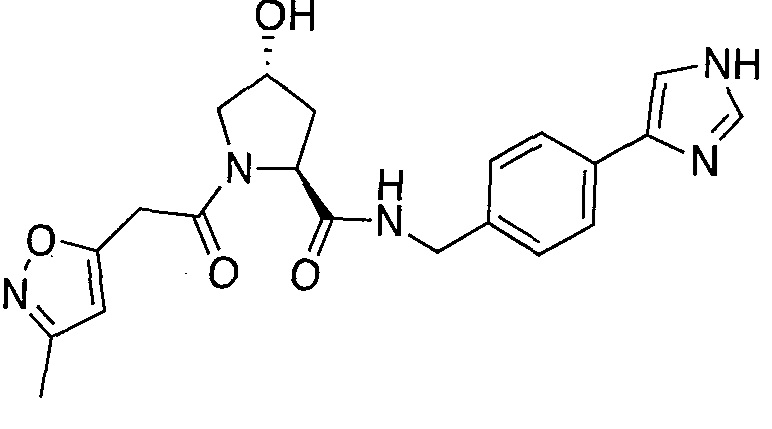 .
.
VL158 был синтезирован в соответствии с общим способом B. 1H ЯМР (500 MГц, CD3OD) δ 8,03 (с, 1H), 7,62 (т, J=8,7 Гц, 2H), 7,43 (д, J=6,6 Гц, 1H), 7,33 (т, J=6,5 Гц, 2H), 6,19 (с, 1H), 4,62-4,48 (м, 2H), 4,48-4,32 (м, 2H), 3,93-3,68 (м, 3H), 3,58 (с, 1H), 2,29-2,19 (м, 4H), 2,11 (ддд, J=13,0, 8,0, 4,8 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 173,59, 168,01, 166,92, 161,11, 138,84, 135,95, 130,48, 129,06, 128,64, 125,89, 116,23, 105,04, 70,35, 60,24, 56,60, 43,56, 38,76, 33,78, 11,33. MS (ESI) 410,1 (M+H).
VL160
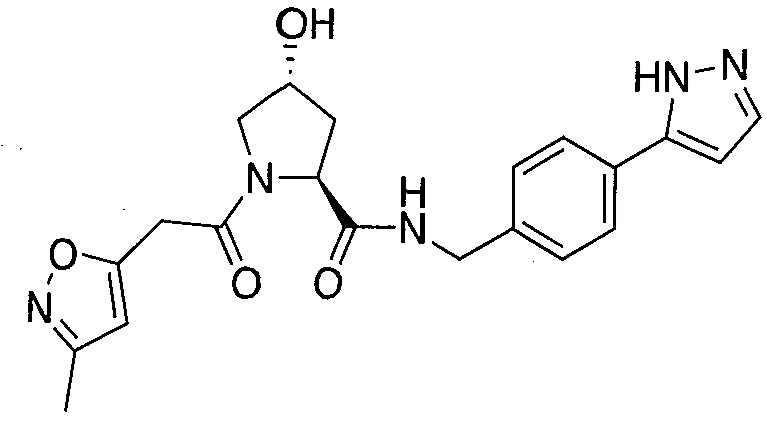 .
.
VL160 был синтезирован в соответствии с общим способом B. 1H ЯМР (500 MГц, CD3OD) δ 7,68 (д, J=8,1 Гц, 2H), 7,63 (с, 1H), 7,33 (д, J=8,0 Гц, 2H), 6,63 (с, 1H), 6,19 (с, 1H), 4,54 (т, J=8,0 Гц, 1H), 4,47 (с, 1H), 4,38 (д, J=4,6 Гц, 2H), 3,89 (д, J=3,1 Гц, 2H), 3,78 (дд, J=10,9, 4,3 Гц, 1H), 3,60 (д, J=11,1 Гц, 1H), 2,28-2,14 (м, 4H), 2,06 (ддд, J=13,0, 8,1, 4,7 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,32, 168,69, 167,67, 161,61, 139,59, 132,31, 129,33, 128,86, 127,00, 126,87, 105,49, 105,38, 70,84, 60,78, 56,97, 43,80, 39,35, 33,95, 11,19. MS (ESI) 409,2 (M+H), 431,8 (M+Na).
(2S,4R)-(9H-флуорен-9-ил)метил 4-(трет-бутокси)-2-((4-хлорбензил)карбамоил)пирролидин-1-карбоксилат
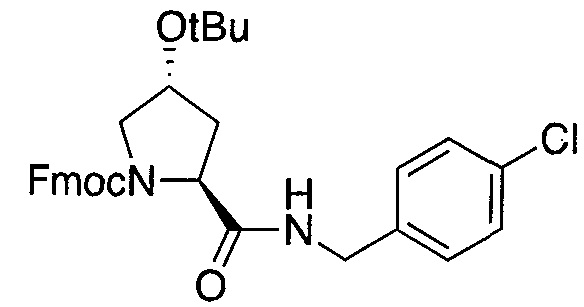 .
.
Fmoc-Hyp(OtBu)-OH (1,23 г, 3 ммоль, 1 экв.) растворяли в DCM (15 мл) и охлаждали до температуры 4°C. Затем добавляли EDC (0,69 г, 3,6 ммоль, 1,2 экв.) и HOBt (0,49 г, 3,6 ммоль, 1,2 экв.). Через 20 минут добавляли 4-хлорбензиламин (0,48 мл, 3,9 ммоль, 1,3 экв.) и раствору давали медленно нагреться до комнатной температуры. Через 15 часов смесь разбавляли EtOAc и промывали 1M HCl, бикарбонатом натрия, водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 25 до 100% EtOAc/гексан) давала белую пену (1,42 г, 2,66 ммоль, 89%). 1H ЯМР (400 MГц, CDCl3) δ 7,77 (д, J=7,2 Гц, 2H), 7,57 (с, 2H), 7,40 (т, J=7,3 Гц, 2H), 7,31 (т, J=7,3 Гц, 2H), 7,17 (дд, J=27,2, 19,5 Гц, 4H), 4,58-3,94 (м, 7H), 3,60 (д, J=6,7 Гц, 1H), 3,31 (д, J=6,6 Гц, 1H), 2,50 (с, 1H), 1,96 (с, 1H), 1,28-1,10 (м, 9H). 13C ЯМР (101 MГц, CDCl3) δ 171,54, 156,13, 143,74, 141,32, 136,81, 133,02, 128,79, 128,71, 127,83, 127,12, 125,04, 120,07, 74,15, 69,63, 67,87, 59,17, 53,26, 47,10, 42,72, 36,34, 28,31. MS (ESI) 534,8 (M+H).
(2S,4R)-4-(трет-бутокси)-N-(4-хлорбензил)пирролидин-2-карбоксамид
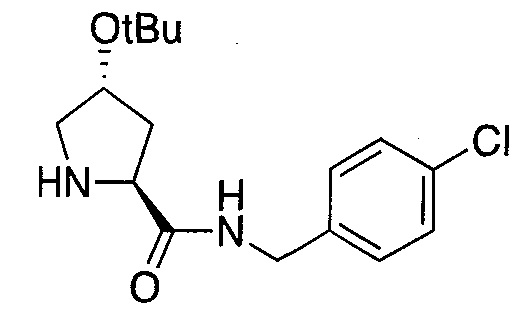 .
.
(2S,4R)-(9H-Флуорен-9-ил)метил 4-(трет-бутокси)-2-((4-хлорбензил)карбамоил)пирролидин-1-карбоксилат (0,5 г, 0,94 ммоль, 1 экв.) растворяли в DCM (15 мл) и охлаждали до температуры 4°C. Медленно, по каплям добавляли трис(2-аминоэтил)амин (0,35 мл, 2,34 ммоль, 2,5 экв.). Через 30 минут реакционную смесь нагревали до комнатной температуры и перемешивали в течение дополнительных 14 часов. Ее непосредственно помещали на колонку с силикагелем и очищали с помощью колоночной хроматографии (от 1 до 7% 0,5н метанольный аммония/DCM) с получением твердого вещества белого цвета (0,2871 г, 0,92 ммоль, 98%). 1H ЯМР (400 MГц, CD3OD) δ 7,27 (дд, J=20,1, 8,4 Гц, 4H), 4,35 (с, 2H), 4,22 (с, 1H), 3,84 (т, J=8,0 Гц, 1H), 3,08 (дд, J=11,4, 5,1 Гц, 1H), 2,76 (дд, J=11,4, 2,8 Гц, 1H), 2,14-1,98 (м, 1H), 1,97-1,81 (м, 1H), 1,17 (с, 9H). 13C ЯМР (126 MГц, CD3OD) δ 176,48, 138,81, 133,83, 130,00, 129,52, 74,76, 73,37, 60,80, 55,61, 43,04, 40,76, 28,67.
Общий способ C: Типичная методика: VL156
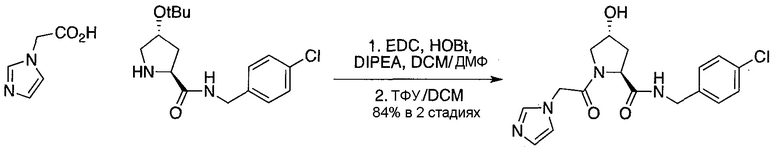

1H-Имидазол-1-илуксусную кислоту (20,6 мг, 0,163 ммоль, 1,3 экв.), EDC (31,2 мг, 0,163 ммоль, 1,3 экв.) и HOBt (22 мг, 0,163 ммоль, 1,3 экв.) растворяли в DCM (2,5 мл) и ДМФ (0,4 мл) при комнатной температуре в 1 мензурке. После перемешивания в течение 15 минут добавляли DIPEA (0,055 мл, 0,313 ммоль, 2,5 экв.), затем через 30 минут (2S,4R)-4-(трет-бутокси)-N-(4-хлорбензил)пирролидин-2-карбоксамид (38,9 мг, 0,125 ммоль, 1 экв.). Смесь перемешивали в течение 14 часов, затем разбавляли EtOAc и промывали насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 1 до 10% MeOH/DCM) приводила к получению твердого вещества белого цвета, которое использовали непосредственно на следующей стадии. 1H ЯМР (400 MГц, CD3OD) δ 7,65 (с, 1H), 7,28 (тд, J=10,9, 8,4 Гц, 4H), 7,06 (д, J=43,6 Гц, 2H), 4,99 (дд, J=38,1, 17,1 Гц, 2H), 4,51 (т, J=6,6 Гц, 2H), 4,35 (кв., J=15,4 Гц, 2H), 3,86 (дд, J=10,2, 5,6 Гц, 1H), 3,45 (дд, J=10,3, 4,1 Гц, 1H), 2,22-2,02 (м, 2H), 1,21 (д, J=13,8 Гц, 9H). MS (ESI) 419,7 (M+H).
Твердое вещество белого цвета растворяли в DCM (9 мл) при комнатной температуре. Добавляли ТФУ (1 мл) и смесь перемешивали в течение 12 часов и конденсировали. Очистка с помощью колоночной хроматографии (от 1 до 20% 0,5н аммиака в метаноле/DCM) приводила к получению твердого вещества белого цвета (39,8 мг, 0,11 ммоль, 88% за 2 стадии). 1H ЯМР (400 MГц, CD3OD) δ 8,73 (с, 1H), 7,47 (д, J=16,9 Гц, 2H), 7,26 (с, 4H), 5,25 (дд, J=37,5, 16,9 Гц, 2H), 4,56 (т, J=7,9 Гц, 2H), 4,44-4,27 (м, 2H), 3,82 (дд, J=10,8, 4,1 Гц, 1H), 3,63 (д, J=10,8 Гц, 1H), 2,36-2,22 (м, 1H), 2,07 (ддд, J=13,1, 8,3, 4,6 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,14, 166,34, 138,56, 138,20, 133,87, 129,97, 129,49, 124,55, 121,47, 70,94, 61,00, 55,75, 51,33, 43,35, 39,21. MS (ESI) 364,8 (M+H).
VL120
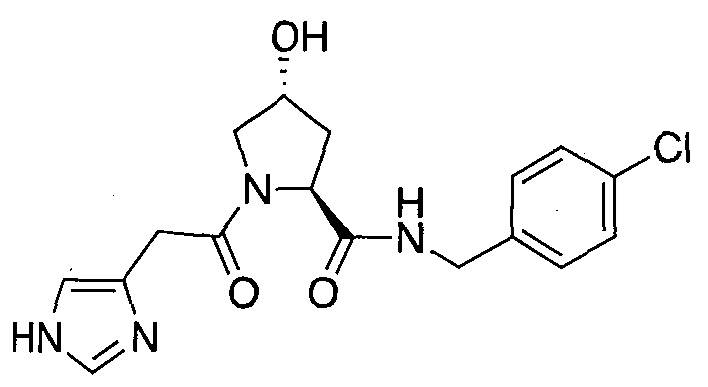 .
.
VL120 был синтезирован в соответствии с общим способом C. 1H ЯМР (500 MГц, CD3OD) δ 8,67 (д, J=1,2 Гц, 1H), 7,36 (с, 1H), 7,29 (д, J=9,2 Гц, 4H), 4,62-4,47 (м, 2H), 4,47-4,24 (м, 2H), 3,87 (ддд, J=18,3, 15,1, 10,8 Гц, 3H), 3,66 (д, J=11,0 Гц, 1H), 2,37-2,20 (м, 1H), 2,07 (ддд, J=13,1, 8,4, 4,6 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,56, 169,45, 138,62, 135,15, 133,89, 129,98, 129,72, 129,52, 118,80, 70,89, 60,70, 56,84, 43,35, 39,46, 31,70. MS (ESI) 362,3 (M+H).
VL157
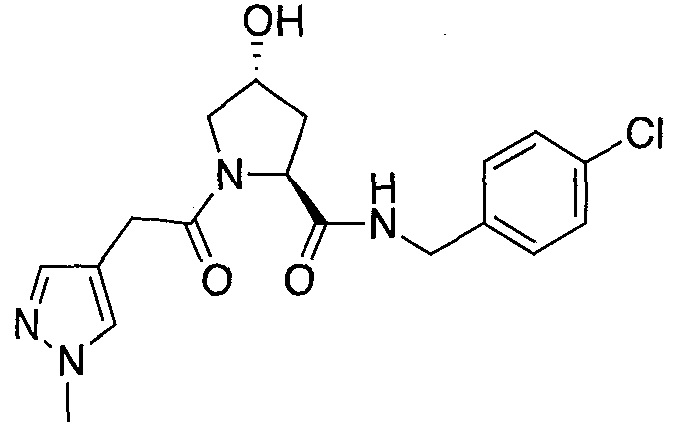 .
.
VL157 был синтезирован в соответствии с общим способом C. 1H ЯМР (500 MГц, CD3OD) δ 7,49 (с, 1H), 7,39 (с, 1H), 7,34-7,22 (м, 4H), 4,52 (т, J=8,1 Гц, 1H), 4,50-4,45 (м, 1H), 4,37 (дт, J=22,8, 15,4 Гц, 2H), 3,87-3,80 (м, 3H), 3,77 (дд, J=11,0, 4,2 Гц, 1H), 3,66-3,52 (м, 3H), 2,30-2,18 (м, 1H), 2,04 (ддд, J=13,1, 8,3, 4,7 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 174,67, 172,70, 140,18, 138,71, 133,81, 131,62, 129,95, 129,51, 115,17, 70,91, 60,65, 56,93, 43,29, 39,28, 38,76, 31,51. MS (ESI) 377,0 (M+H).
VL173
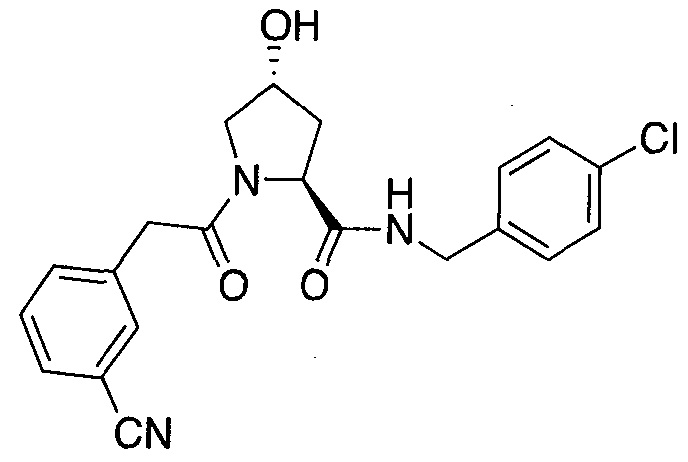 .
.
VL173 был синтезирован в соответствии с общим способом C. 1H ЯМР (400 MГц, CDCl3/CD3OD) δ 7,63-7,53 (м, 3H); 7,49 (д, J=7,6 Гц, 1H); 7,26 (кв., J=8,3 Гц, 4H); 4,60-4,51 (м, 2H); 4,42-4,32 (м, 2H); 3,84-3,75 (м, 3H); 3,59 (д, J=11,3 Гц, 1H); 3,42-3,32 (м, 1H); 2,29-2,19 (м, 1H); 2,17-2,08 (м, 1H). 13C ЯМР (100 MГц, CDCl3/CD3OD) δ 173,4, 170,7, 137,4, 136,8, 134,8, 133,6, 131,1, 129,9, 129,3, 129,0, 119,2, 112,7, 70,1, 59,8, 56,3, 43,0, 41,1, 38,4. ТСХ (10% MeOH в CH2Cl2), Rf 0,38 (УФ, CAM), MS (ESI+): вычислено для C21H21N3O3Cl [M+H]+ 398,1, найдено 398,2.
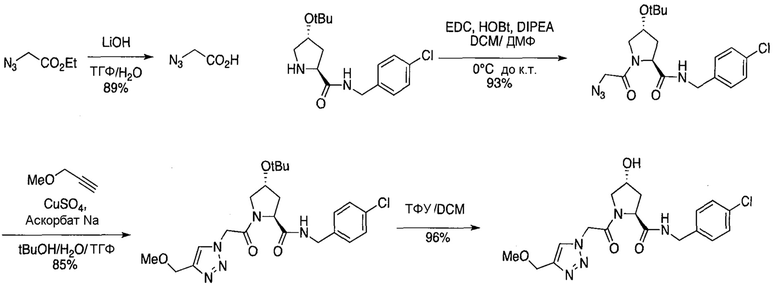
Азидоуксусная кислота
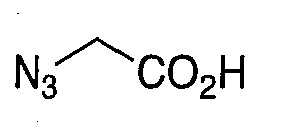
К раствору этилазидоацетата (530 мг, 4,107 ммоль) в ТГФ-H2O (12 мл/12 мл) при комнатной температуре добавляли LiOH·H2O (345 мг, 8,214 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 час, упаривали и разбавляли H2O (10 мл), охлаждали до температуры 0°C, и устанавливали pH равным 4 с помощью 1н HCl. Полученную смесь экстрагировали два раза диэтиловым эфиром, промывали насыщенным солевым раствором, сушили над безводным Na2SO и упаривали. Концентрат очищали с помощью хроматографии на короткой колонке (элюируя сначала 100% гексаном, с градиентом до 2% этилацетата в гексане) на силикагеле с получением азидоуксусной кислоты 1 (372 мг, 89%) в виде масла бледно-желтого цвета. 1H ЯМР (500 MГц, CDCl3) δ 9,73 (ушир. с, 1H), 3,97 (с, 2H). 13C ЯМР (125 MГц, CD3OD) δ 174,2, 50,0.
(2S,4R)-1-(2-азидоацетил)-4-(трет-бутокси)-N-(4-хлорбензил)пирролидин-2-карбоксамид
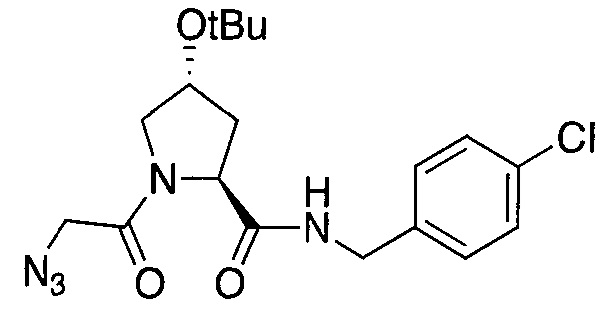 .
.
К раствору азидоуксусной кислоты (32 мг, 0,315 ммоль) в CH2Cl2-ДМФ (1,5 мл/1,5 мл)) при комнатной температуре добавляли (2S,4R)-4-(трет-бутокси)-N-(4-хлорбензил)пирролидин-2-карбоксамид (93 мг, 0,300 ммоль), DIPEA (0,19 мл, 1,080 ммоль) и HOBt (48 мг, 0,360 ммоль). Смесь охлаждали до температуры 0°C, и затем к смеси добавляли EDC (69 мг, 0,360 ммоль) при температуре 0°C. Реакционной смеси давали нагреться до комнатной температуры, перемешивали при комнатной температуре в течение 17 час и охлаждали до температуры 0°C. Полученную смесь гасили H2O (5 мл) и экстрагировали два раза этилацетатом. Объединенные экстракты промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали. Концентрат очищали с помощью колоночной хроматографии (элюируя сначала 5% этилацетатом в гексане, градиируя до 40% этилацетата в гексане) на силикагеле с получением связанного продукта (110 мг, 93%). 1H ЯМР (400 MГц, CDCl3) δ 7,31 (ушир. с, 1H), 7,27 (д, J=8,5 Гц, 2H), 7,18 (д, J=8,5 Гц, 2H), 4,66 (дд, J=8,4, 2,2 Гц, 1H), 4,58-4,52 (м, 1H), 4,41 (дд, J=15,1, 6,1 Гц, 1H), 4,30 (дд, J=15,1, 5,8 Гц, 1H), 3,87 (дд, J=16,0, 16,0 Гц, 1H), 3,84 (дд, J=16,0, 16,0 Гц, 1H), 3,61 (дд, J=9,8, 7,0 Гц, 1H), 3,14 (дд, J=9,8, 6,4 Гц, 1H), 2,50 (ддд, J=12,6, 6,3, 2,3 Гц, 1H), 1,86 (дт, J=12,6, 8,2 Гц, 1H), 1,19 (с, 9H). 13C ЯМР (100 MГц, CDCl3) δ 170,3, 167,4, 162,5, 136,5, 133,1, 128,8, 128,7, 74,3, 69,9, 59,0, 52,7, 50,9, 42,8, 36,4, 35,1, 31,4, 28,2. MS (ESI) [M+H]+ 394,3.
(2S,4R)-4-(трет-бутокси)-N-(4-хлорбензил)-1-(2-(4-(метоксиметил)-1H-l,2,3-триазол-1-ил)ацетил)пирролидин-2-карбоксамид
 .
.
К раствору метилпропаргилового эфира (7 мг, 0,067 ммоль) и (2S,4R)-1-(2-азидоацетил)-4-(трет-бутокси)-N-(4-хлорбензил)пирролидин-2-карбоксамида (25 мг, 0,0636 ммоль) в трет-BuOH-H2O (1:1, 1 мл) и ТГФ (1 мл) при комнатной температуре добавляли CuSO4-5H2O (1,5 мг, 0,006 ммоль) и аскорбат натрия (1,0 M в H2O, 2 капли). Реакционную смесь перемешивали при комнатной температуре в течение 19 час и упаривали. Остаток разбавляли H2O (5 мл) и смесь экстрагировали три раза этилацетатом. Объединенные экстракты промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Сырой остаток очищали с помощью флэш-хроматографии на силикагеле с получением желаемого триазола (25 мг, 85%). lЯМР (500 МГц, CD3OD) δ 7,91 (с, 1H), 7,30-7,22 (м, 4H), 5,43 (д, J=16,8 Гц, 1H), 5,34 (д, J=16,7 Гц, 1H), 4,54 (с, 2H), 4,53-4,49 (м, 2H), 4,37 (д, J=15,4 Гц, 1H), 4,31 (д, J=15,4 Гц, 1H), 3,90 (дд, J=10,3, 5,6 Гц, 1H), 3,49 (дд, J=10,4, 4,3 Гц, 1H), 3,37 (с, 3H), 2,19-2,13 (м, 1H), 2,11-2,07 (м, 1H), 1,22 (с, 9H). 13C ЯМР (звездочка обозначает сигналы не основного ротамера, 125 MГц, CD3OD) δ 174,1, *173,4, *166,9, 166,7, 145,7, *138,6, 138,5, *134,2, 133,8, *130,4, 129,9, *129,7, 129,5, 126,7, 75,6, *75,5, 71,1, *69,2, 66,3, *66,2, 60,8, *60,3, 58,4, *58,3, *55,5, 54,8, 52,6, *51,9, *43,7, 43,3, *41,1, 38,7, 28,5. MS (ESI) [M+H]+ 464,2.
VL141
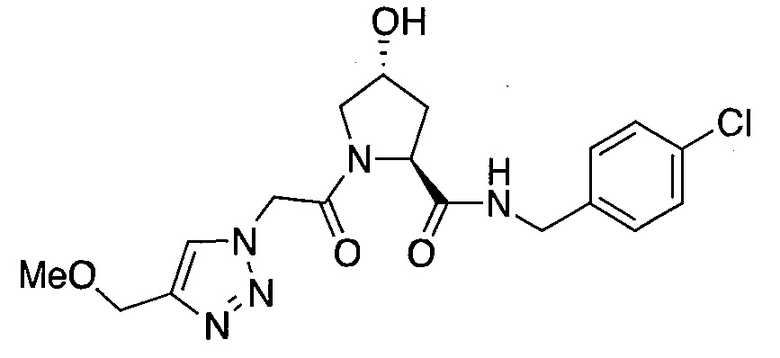 .
.
В перемешиваемый раствор соответствующего трет-бутилового эфира (22 мг, 0,0475 ммоль) в CH2Cl2 (1,5 мл) при температуре 0°C добавляли ТФУ (0,2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 час и концентрировали. Остаток подвергали хроматографии (элюируя сначала 100% CH2Cl2, градиируя до 7% CH3OH в CH2Cl2) на силикагеле с получением соединения 5 (18,5 мг, 96%). 1H ЯМР (500 MГц, CD3OD/CDCl3=2:1) δ 8,83 & 8,46 (ввиду наличия ротамеров, оба т, J=5,7 Гц, 1H), 7,85 & 7,76 (ввиду наличия ротамеров, оба с, 1H), 7,23 (д, J=8,5 Гц, 2H), 7,18 (д, J=8,5 Гц, 2H), 5,36 (д, J=16,6 Гц, 1H), 5,27 (д, J=16,6 Гц, 1H), 4,54 (с, 2H), 4,54-4,50 (м, 2H), 4,33 & 4,32 (ввиду наличия ротамеров, оба с, 2H), 3,77 (дд, J=10,8, 4,2 Гц, 1H), 3,60 (д, J=10,8 Гц, 1H), 3,37 & 3,36 (ввиду наличия ротамеров, оба с, 3H), 2,26-2,21 (м, 1H), 2,09-2,04 (м, 1H). 13C ЯМР (звездочка обозначает сигналы не основного ротамера, 125 MГц, CD3OD/CDCl3=2:1) d *173,4, 173,3, *166,2, 165,9, 145,2, 137,5, *133,9, 133,5, 129,9, 129,4, 129,1, 126,0, *125,9, 70,4, *68,5, 66,0, *65,9, *60,4, 60,3, 58,4, *58,3, *56,1, 55,4, 52,2, *51,5, *43,2, 43,1, *41,1, 38,4. MS (ESI) [M+H]+ 408,3. ТСХ (10% MeOH в CH2Cl2), Rf 0,48 (УФ, CAM).
VL167
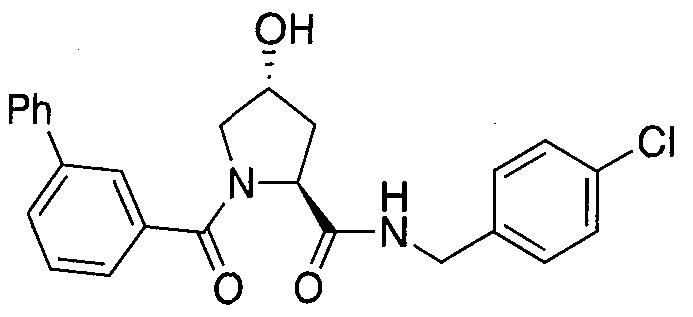 .
.
VL167 был синтезирован в соответствии с общим способом C. lH ЯМР (500 MГц, CDCl3) δ 7,86 (с, 1H), 7,71 (д, J=9,5 Гц, 1H), 7,61 (д, J=7,4 Гц, 2H), 7,56 (д, J=7,6 Гц, 1H), 7,51 (д, J=7,6 Гц, 1H), 7,42 (дд, J=7,4, 7,4 Гц, 2H), 7,38-7,30 (м, 2H), 7,30-7,26 (м, 3H), 4,66-4,42 (м, 2H), 4,42-4,27 (м, 2H), 3,85 (дд, J=11,4, 3,5 Гц, 1H), 3,49 (д, J=11,4 Гц, 1H), 2,33-2,29 (м, 1H), 2,15-2,09 (м, 1H). 13C ЯМР (звездочка обозначает сигналы не основного ротамера, 125 MГц, CDCl3) d 172,5, 170,6, 162,7, 140,7, 139,3, 136,4, 135,6, 131,9, 128,2, *128,1, 128,0, 127,9, 127,6, *127,5, 126,8, 126,1, *126,0, 125,2, 125,1, 68,9, *67,4, *60,2, 58,7, 57,8, 41,5, *39,5, 37,2, 35,2, 30,0. MS (ESI) [M+H]+ 435,5.
VL216
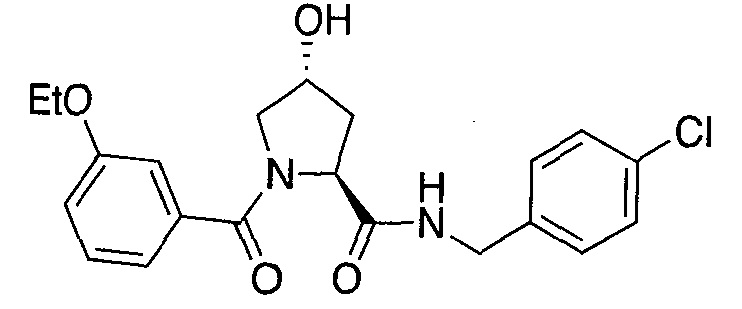 .
.
VL216 был синтезирован в соответствии с общим способом C.
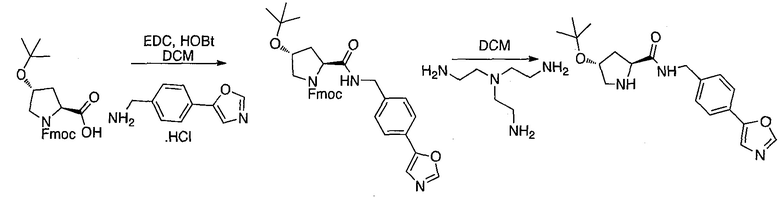
(2S,4R)-(9H-флуорен-9-ил)метил 4-(трет-бутокси)-2-((4-(оксазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилат
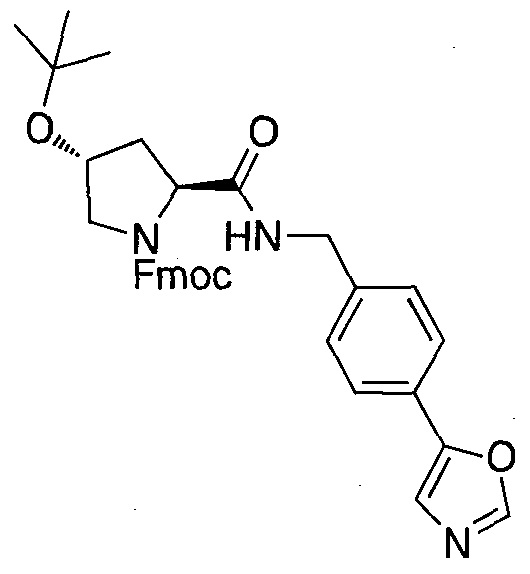 .
.
В круглодонную колбу с перемешиваемой мешалкой помещали (2S,4R)-1-(((9H-флуорен-9-ил)метокси)карбонил)-4-(трет-бутокси)пирролидин-2-карбоновую кислоту (0,587, 1,4 ммоль 1,0 эквив.), EDC (380 мг, 2,0 ммоль, 1,4 эквив.), HOBt (310 мг, 2,0 ммоль, 1,4 эквив.) и (4-(оксазол-5-ил)фенил)метанамин (250 мг, 1,4 ммоль, 1,0 эквив.). При перемешивании в течение 18 час реакционную смесь разбавляли 25 мл DCM и промывали лимонной кислотой (2×50 мл) и насыщенным NaHCO3 (2×50 мл). Органический слой сушили над Na2SO4, затем упаривали, очищали посредством хроматографии на силикагеле (DCM до 2% MeOH (0,5н NH3) с получением 515 мг (65%-ный выход) продукта в виде вязкого масла. 1H ЯМР (400 MГц, CDCl3) δ 7,89 (с, 1H), 7,85-7,70 (м, 2H), 7,68-7,49 (м, 4H), 7,47-7,37 (м, 2H), 7,35-7,20 (м, 5H), 4,54-4,35 (м, 4H), 4,35-4,14 (м, 2H), 3,72-3,58 (м, 1H), 3,49-3,27 (м, 1H), 2,53 (с, 1H), 2,00 (дд, J=8,1, 20,2, 1H), 1,25 (с, 9H); ТСХ: (9:1 DCM:MeOH (0,5н NH3)) Rf=0,5; ЖХМС (ESI) 565,9 (M+H)+.
(2S,4R)-1-(3-этоксибензоил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
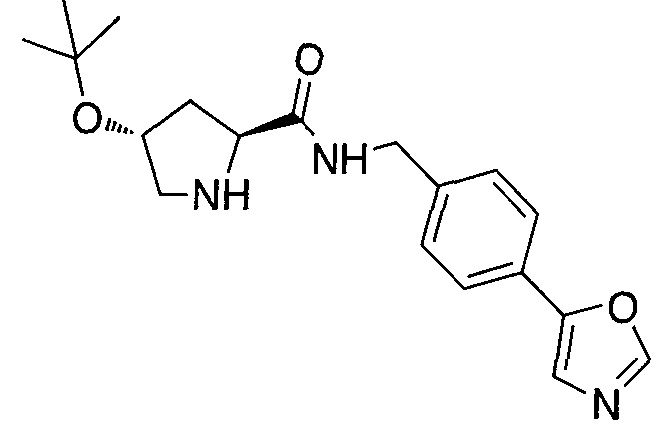 .
.
К (2S,4R)-(9H-флуорен-9-ил)метил 4-(трет-бутокси)-2-((4-(оксазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилату (2,5 г, 3,61 ммоль, 1,0 эквив.) в 36 мл DCM помещали трис(2-аминоэтил)амин моль, 9,0 ммоль, 2,5 эквив.). (400 при перемешивании в течение 3 час мутную смесь разбавляли силикагелем и упаривали. Продукт затем сушили, помещая на колонку с силикагелем, и очищали (DCM до 5% MeOH (0,5н NH3) в DCM) с получением 820 мг (67%-ный выход) в виде твердого вещества белого цвета. 1H ЯМР (501 MГц, CDCl3) δ 8,02 (с, 1H), 7,90 (с, 1H), 7,60 (д, J=8,1, 2H), 7,33-7,29 (м, 3H), 4,44 (д, J=6,1, 2H), 4,21-4,07 (м, 1H), 3,97 (дд, J=7,2, 8,7, 1H), 2,87 (д, J=11,6, 1H), 2,80 (дд, J=4,3, 11,6, 1H), 2,17 (дд, J=10,2, 12,4, 1H), 2,11-1,94 (м, 1H), 1,16 (с, 9H); 13C ЯМР (126 MГц, CDCl3) δ 174,88, 151,27, 150,40, 139,33, 128,07, 126,79, 124,63, 121,43, 73,65, 72,30, 59,95, 54,97, 42,51, 39,27, 28,38; ТСХ: (9:1 DCM MeOH (0,5н NH3)) Rf=0,42; ЖХМС (ESI) 344,2 (M+H)+.
1H ЯМР (400 MГц, CD3OD) δ 7,42-7,28 (м, 4H), 7,28-7,12 (м, 2H), 7,10-6,77 (м, 2H), 4,71 (дт, J=30,7, 15,3 Гц, 1H), 4,58-4,30 (м, 3H), 4,18-3,92 (м, 2H), 3,87-3,77 (м, 1H), 3,44 (д, J=11,4 Гц, 1H), 2,38-2,24 (м, 1H), 2,15-2,03 (м, 1H), 1,55-1,23 (м, 3H). 13C ЯМР (126 MГц, CD3OD) δ 174,72, 172,63, 160,34, 138,72, 138,35, 133,82, 130,65, 130,11, 129,92, 129,55, 120,47, 118,08, 114,27, 113,89, 71,01, 64,71, 60,81, 59,80, 43,33, 39,29, 15,09. MS (ESI) 403,2 (M+H).
Общий способ D: Типичная методика:
VL217

(2S,4R)-4-(трет-бутокси)-1-(3-этоксибензоил)-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамид
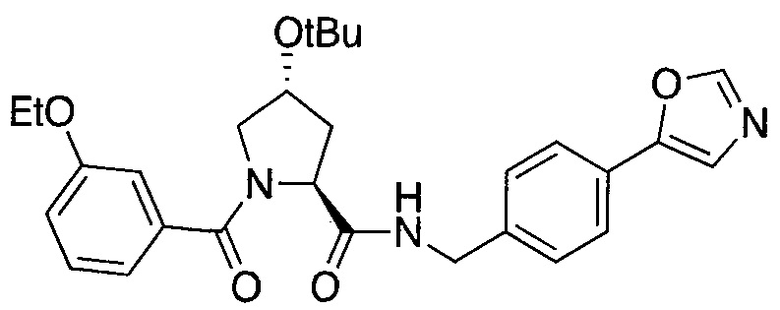 .
.
3-Этоксибензойную кислоту (13,3 мг, 0,08 ммоль, 1 экв.), EDC (16,9 мг, 0,088 ммоль, 1,1 экв.) и HOBt (11,9 мг, 0,88 ммоль, 1,1 экв.) растворяли в DCM (0,8 мл) при комнатной температуре. Добавляли DIPEA (0,0279 мл, 0,16 ммоль, 2 экв.), затем (2S,4R)-4-(трет-бутокси)-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамид (33,0 мг, 0,096 ммоль, 1,2 экв.). Раствор перемешивали в течение 21 часа, затем разбавляли EtOAc и промывали 10%-ой лимонной кислотой, насыщенным бикарбонатом натрия и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 1 до 5% MeOH/DCM) приводила к получению бесцветного масла (36,1 мг, 0,073 ммоль, 92%). 1H ЯМР (400 MГц, CDCl3) δ 7,90 (с, 1H), 7,61 (дд, J=16,6, 6,9 Гц, 3H), 7,38-7,27 (м, 4H), 6,98 (дд, J=16,0, 6,4 Гц, 3H), 4,92 (дд, J=8,3, 4,7 Гц, 1H), 4,48 (д, J=6,0 Гц, 2H), 4,43-4,31 (м, 1H), 4,03 (кв., J=7,0 Гц, 2H), 3,61 (дд, J=10,9, 5,7 Гц, 1H), 3,31 (дд, J=10,9, 4,4 Гц, 1H), 2,73-2,55 (м, 1H), 2,05-1,92 (м, 1H), 1,40 (т, J=7,0 Гц, 3H), 1,13 (с, 9H). MS (ESI) 492,4 (M+H).
VL217
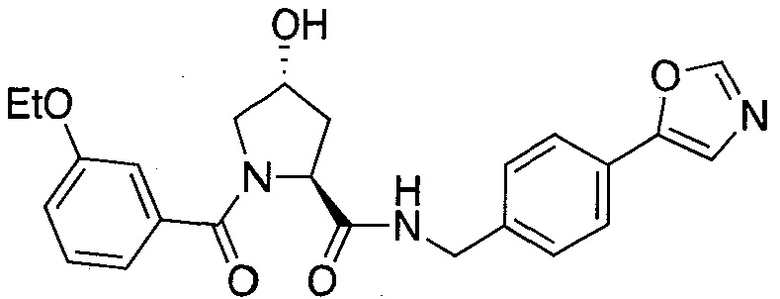 .
.
(2S,4R)-4-(трет-Бутокси)-1-(3-этоксибензоил)-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамид (36,1 мг, 0,073 ммоль, 1 экв.) растворяли в DCM (9 мл) при комнатной температуре. Добавляли ТФУ (1 мл) и раствор перемешивали в течение 13 часов, затем конденсировали. Очистка с помощью колоночной хроматографии (от 1 до 10% MeOH/DCM) приводила к получению бесцветного масла (22,9 мг, 0,053 ммоль, 72%). 1H ЯМР (400 MГц, CD3OD) δ 8,24 (д, J=12,0 Гц, 1H), 7,65 (дд, J=28,0, 8,3 Гц, 2H), 7,47 (дд, J=18,8, 10,6 Гц, 3H), 7,23 (ддд, J=9,4, 4,6, 4,1 Гц, 3H), 7,09-6,87 (м, 2H), 4,75 (дд, J=9,6, 7,7 Гц, 1H), 4,48 (дд, J=49,7, 15,5 Гц, 3H), 4,06 (кв., J=7,0 Гц, 2H), 3,84 (дд, J=11,5, 3,5 Гц, 1H), 3,44 (д, J=11,5 Гц, 1H), 2,42-2,29 (м, 1H), 2,21-2,05 (м, 1H), 1,36 (дт, J=24,0, 7,0 Гц, 3H). 13C ЯМР (101 MГц, CD3OD) δ 174,78, 172,66, 160,35, 153,14, 152,74, 140,85, 138,38, 130,66, 129,00, 127,71, 125,62, 121,77, 120,50, 118,08, 114,30, 71,02, 64,71, 60,85, 59,82, 43,72, 39,32.
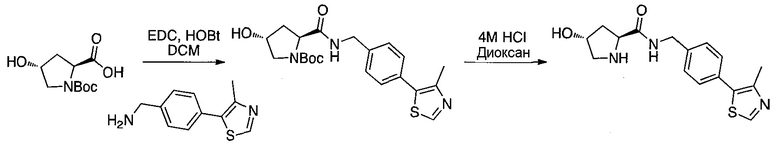
(2S,4R)-трет-бутил 4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилат
 .
.
(2S,4R)-1-(трет-Бутоксикарбонил)-4-гидроксипирролидин-2-карбоновую кислоту (366 мг, 1,58 ммоль, 1 эквив.) растворяли в 15 мл ДМФ и добавляли EDC (380 мг, 2,0 ммоль, 1,3 эквив.) и HOBt (310 мг, 2,0 ммоль, 1,5 эквив.), после 5 минут перемешивания добавляли (4-(4-метилтиазол-5-ил)фенил)метанамин (325 мг, 1,58 ммоль, 1 эквив.). При перемешивании в течение 15 час реакционную смесь разбавляли 25 мл EtOAc и промывали 25 мл насыщенного солевого раствора (2×), затем 25 мл насыщенного NaHCO3 (2×). Органический слой упаривали с получением 650 мг (98%-ный выход) продукта в виде масла желтого цвета. 1H ЯМР (400 MГц, CDCl3) δ 8,67 (с, 1H), 7,43-7,29 (м, 4H), 4,49 (д, J=16,7 Гц, 4H), 3,51 (дд, J=11,0, 4,7 Гц, 2H), 2,61-2,45 (м, 4H), 2,03 (д, J=7,4 Гц, 2H), 1,42 (с, 9H). ТСХ: (9:1 DCM:MeOH (0,5н NH3)) Rf=0,20; MS (ESI) 417,5 (M+H)+.
(2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
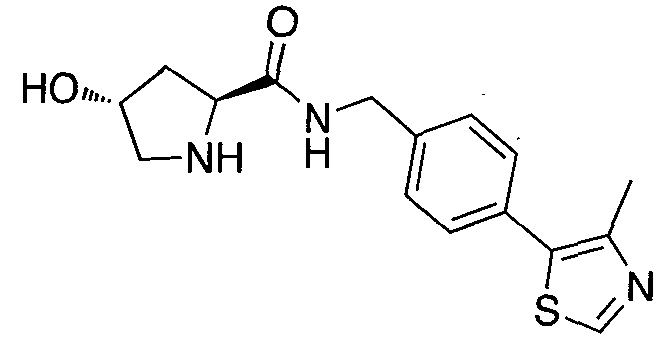 .
.
К (2S,4R)-трет-бутил 4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилату (650 мг, 1,40 ммоль, 1 эквив.) в круглодонной колбе помещали 9 мл 4M HCl в диоксане (36 ммоль, 26 эквив.). Реакционную смесь оставляли перемешиваться в течение 1 часа, после чего в течение 1 часа происходило выделение пузырьков N2, и легколетучие продукты удаляли в вакууме. Полученное вязкое масло промывали растворением в воде и промывкой 50 мл EtOAC. Водный слой затем подщелачивали до pH 12 с помощью 1M NaOH и затем экстрагировали 50 мл EtOAc (3×). Органический слой сушили и упаривали с получением 250 мг (79%-ный выход) продукта в виде вязкого масла коричневого цвета. 1H ЯМР (501 MГц, CDCl3) δ 8,66 (с, 1H), 8,18 (т, J=6,0, 1H), 7,38 (д, J=8,1, 2H), 7,30 (д, J=8,1, 2H), 4,48-4,37 (м, 3H), 4,08 (т, J=8,4, 1H), 3,02 (д, J=13,3, 1H), 2,79 (дд, J=3,2, 12,3, 1H), 2,51 (с, 3H), 2,33 (дд, J=8,6, 13,9, 1H), 2,03-1,87 (м, 1H); 13C ЯМР (126 MГц, CDCl3) δ 174,89, 150,35, 148,46, 138,30, 131,54, 130,95, 129,51, 127,92, 72,90, 59,72, 55,35, 42,53, 39,98, 16,06; ТСХ: (9:1 DCM:MeOH) Rf=0,1; ЖХМС (ESI) 317,4 (M+H)+.
Общий способ E: Типичная методика: VL219
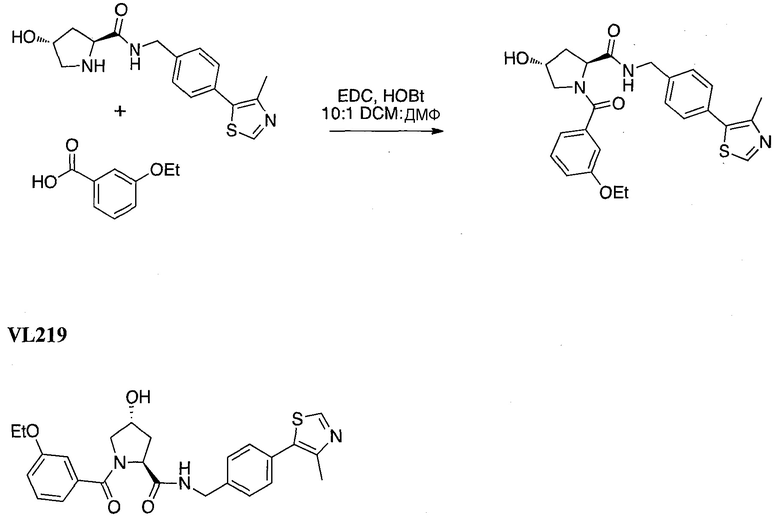
3-Этоксибензойную кислоту (17 мг, 0,1 ммоль, 1 эквив.) растворяли в 1 мл 10:1 DCM:ДМФ и добавляли EDC (25 мг, 0,13 ммоль 1,3 эквив.) и HOBt (21 мг, 0,13 ммоль, 1,3 эквив.). Спустя 5 минут перемешивания добавляли (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид (31 мг, 0,095 ммоль, 1 эквив.). При перемешивании в течение 18 час реакционную смесь разбавляли 15 мл EtOAc и промывали 25 мл 10%-ой водной лимонной кислотой и 25 мл насыщенного NaHCO3. Органический слой сушили над Na2SO4 и концентрировали в вакууме. Полученное масло очищали путем хроматографии на силикагеле (DCM до 9% MeOH (0,5н NH3) в DCM) с получением 25 мг (56%-ный выход) продукта в виде твердого вещества белого цвета. 1H ЯМР (501 MГц, CD3OD) δ 8,87 (с, 1H), 7,51-7,42 (м, 4H), 7,37 (т, J=8,1, 1H), 7,23-7,14 (м, 2H), 7,05 (дд, J=2,2, 8,4, 1H), 4,79 (дд, J=7,7, 9,5, 1H), 4,63-4,40 (м, 3H), 4,08 (кв., J=7,0, 2H), 3,86 (дт, J=3,8, 7,6, 1H), 3,47 (д, J=11,5, 1H), 2,47 (с, 3H) 2,36 (дд, J=7,6, 13,2, 1H), 2,14 (ддд, J=5,3, 10,2, 16,4, 1H), 1,41 (т, J=7,0, 3H); 13C ЯМР (126 MГц, CD3OD) δ 174,74, 172,64, 160,34, 152,78, 149,05, 140,21, 138,40, 133,39, 131,55, 130,65, 130,44, 128,83, 120,49, 118,07, 114,32, 71,02, 64,71, 60,83, 59,81, 43,67, 39,30, 15,79, 15,06; ТСХ: (9:1 DCM:MeOH (0,5н NH3)) Rf=0,25; ЖХМС (ESI) 466,1(M+H)+.
VL210
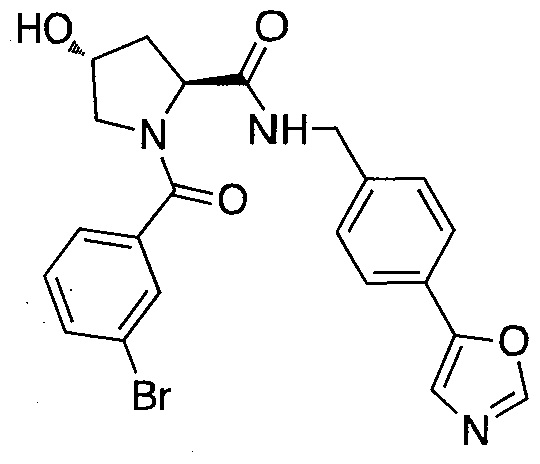 .
.
VL210 был синтезирован в соответствии с общим способом D. 1H ЯМР (500 MГц, CD3OD) δ 8,23 (с, 1H), 7,82 (т, J=1,7, 1H), 7,73-7,58 (м, 4H), 7,49-7,33 (м, 4H), 4,76 (дд, J=7,6, 9,6, 1H), 4,59-4,32 (м, 3H), 3,84 (дд, J=3,5, 11,4, 1H), 3,41 (д, J=11,3, 1H), 2,43-2,30 (м, 1H), 2,18-2,07 (м, 1H); 13C ЯМР (126 MГц, CD3OD) δ 173,14, 169,54, 151,35, 139,41, 137,87, 133,28, 130,18, 130,01, 127,92, 127,61, 126,31, 125,93, 124,23, 121,93, 120,36, 69,62, 59,53, 58,30, 42,31, 37,95; ЖХМС (ESI) 471,5 (M+H)+.
VL224
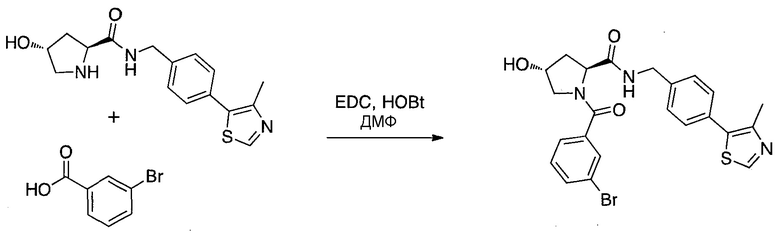 .
.
VL224 был синтезирован в соответствии с общим способом E. 1H ЯМР (501 MГц, CD3OD) δ 8,87 (с, 1H), 7,83 (д, J=1,5, 1H), 7,67 (д, J=7,1, 1H), 7,61 (д, J=6,7, 1H), 7,48-7,36 (м, 5H), 4,77 (т, J=8,5, 1H), 4,60-4,39 (затененный м, 3H), 3,90-3,78 (м, 1H), 3,42 (д, J=11,4, 1H), 2,47 (с, 3H), 2,41-2,30 (м, 1H), 2,19-2,06 (м, 1H); 13C ЯМР (126 MГц, CD3OD) δ 173,15, 169,55, 151,41, 147,64, 138,77, 137,85, 133,26, 132,78, 131,98, 130,16, 130,02, 129,05, 127,43, 125,91, 121,93, 69,64, 59,53, 58,32, 42,27, 37,94, 14,41; ТСХ: (9:1 DCM:MeOH (0,5н NH3)) Rf=0,7; ЖХМС (ESI) 499,8 (M+H)+.
VL215
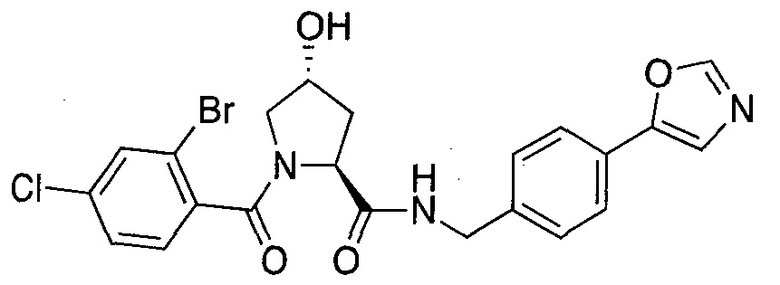 .
.
VL215 был синтезирован в соответствии с общим способом D. 1H ЯМР (501 MГц, CD3OD) δ 8,24 (дд, J=13,4, 7,1 Гц, 1H), 7,87-7,58 (м, 3H), 7,58-7,31 (м, 4H), 7,16 (с, 1H), 4,73 (д, J=7,8 Гц, 1H), 4,63-4,50 (м, 1H), 4,49-4,29 (м, 2H), 3,80 (д, J=10,5 Гц, 1H), 3,60 (с, 1H), 2,31 (с, 1H), 2,17 (с, 1H). 13C MR (126 MГц, CD3OD) δ 179,37, 169,61, 153,12, 152,75, 140,72, 138,21, 137,16, 133,72, 130,38, 129,70, 129,40, 129,08, 127,76, 125,63, 121,80, 70,64, 60,46, 58,42, 43,80, 39,27. MS (ESI) 504,2 (M+H).
VL228
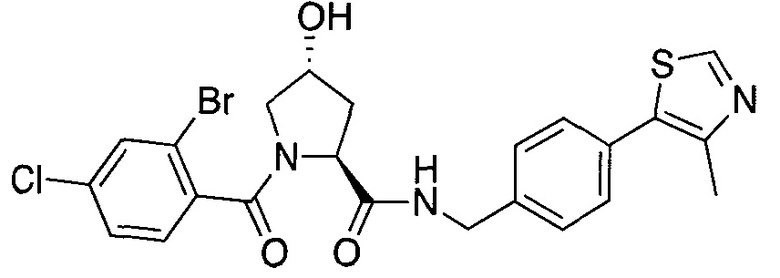 .
.
VL228 был синтезирован в соответствии с общим способом E. 1H ЯМР (400 MГц, CD3OD) δ 8,88 (д, J=9,3 Гц, 1H), 7,75 (д, J=1,9 Гц, 1H), 7,48 (ддд, J=13,9, 8,4, 4,1 Гц, 5H), 7,17 (д, J=8,3 Гц, 1H), 4,74 (т, J=8,2 Гц, 1H), 4,63-4,33 (м, 3H), 3,61 (дд, J=11,3, 3,8 Гц, 1H), 3,18 (д, J=11,3 Гц, 1H), 2,49 (д, J=9,6 Гц, 3H), 2,33 (ддд, J=7,8, 4,8, 2,1 Гц, 1H), 2,19 (ддд, J=11,9, 7,8, 4,6 Гц, 1H). 13C ЯМР (126 MГц, CD3OD) δ 173,93, 169,45, 152,84, 149,07, 140,11, 138,21, 137,17, 133,73, 131,62, 130,53, 130,48, 130,39, 129,52, 129,41, 128,93, 70,65, 60,48, 58,39, 43,75, 39,26, 15,81. MS (ESI) 534,4 (M+H).
VL177
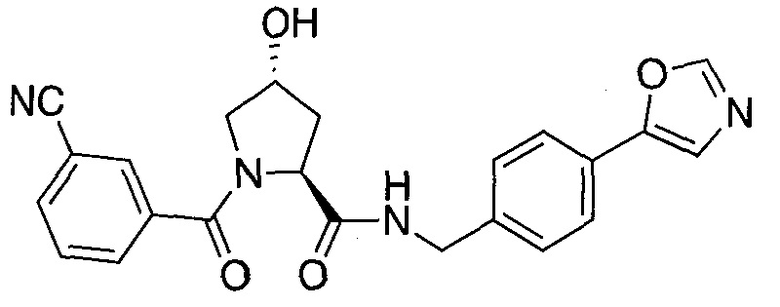 .
.
VL177 был синтезирован в соответствии с общим способом D. 1H ЯМР (500 MГц, CDCl3/CD3OD) δ 7,89 (с, 1H); 7,84 (с, 1H); 7,80-7,75 (м, 2H); 7,69 (д, J=7,8 Гц, 1H); 7,57-7,48 (м, 3H); 7,31 (д, J=8,1 Гц, 2H); 4,76 (т, J=8,3 Гц, 1H); 4,49-4,39 (м, 3H); 3,72 (дд, J=11,2, 3,5 Гц, 1H); 3,36 (д, J=11,2 Гц, 1H); 2,93 (с, 1H); 2,31 (ддд, J=13,2, 8,8, 4,4 Гц, 1H); 2,21 (дд, J=13,5, 7,8 Гц, 1H). 13C ЯМР (125 MГц, CDCl3/CD3OD) δ 171,8, 169,0, 151,5, 150,6, 138,9, 137,0, 133,9, 131,9, 131,3, 129,5, 128,1, 126,7, 124,7, 121,1, 117,9, 112,7, 69,9, 59,3, 58,5, 43,3, 37,4. ТСХ (10% MeOH в CH2Cl2), Rf=0,17 (УФ, CAM), MS (ESI+): вычислено для C23H21N4О4 [M+H]+ 417,2, найдено 417,1.
VL226
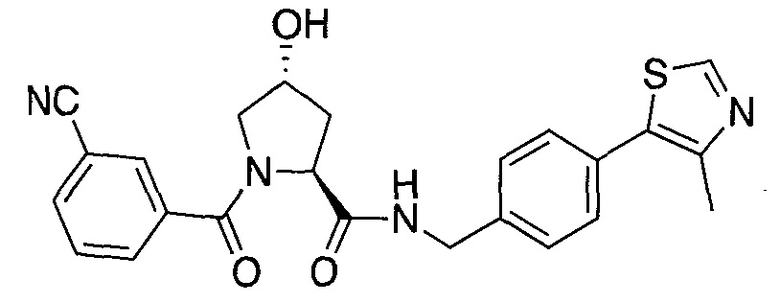 .
.
VL226 был синтезирован в соответствии с общим способом E. 1H ЯМР (500 MГц, CDCl3/CD3OD) δ 8,65 (с, 1H); 7,84 (с, 1H); 7,74 (дд, J=13,3, 7,8 Гц, 2H); 7,53 (т, J=7,8 Гц, 1H); 7,40-7,28 (м, 5H); 4,92 (т, J=8,1 Гц, 1H); 4,53 (с, 1H); 4,48 (д, J=5,9 Гц, 2H); 3,72 (дд, J=11,3, 3,5 Гц, 1H); 3,52-3,44 (м, 1H); 2,85 (ушир.с, 1H); 2,67-2,56 (м, 1H); 2,48 (с, 3H); 2,21 (дд, J=13,5, 7,8 Гц, 1H). 13C ЯМР (125 MГц, CDCl3/CD3OD) δ 170,8, 169,4, 150,5, 148,6, 138,0, 137,0, 134,1, 131,9, 131,4, 129,7, 129,6, 127,0, 118,0, 113,0, 70,4, 59,1, 58,6, 43,5, 36,8, 16,2. ТСХ (10% MeOH в CH2Cl2), Rf=0,32 (УФ, CAM), MS (ESI+): вычислено для C24H23N4O3S [M+H]+ 447,2, найдено 447,0.
VL211
 .
.
VL211 был синтезирован в соответствии с общим способом D. 1H ЯМР (500 MГц, CD3OD) δ 8,11 (с, 1H), 7,58 (дд, J=23, 8,2, 2H), 7,42-7,30 (м, 3H), 7,16 (т, J=7,9, 1H), 6,96 (д, J=7,7, 1H), 6,92 (с, 1H), 6,80 (дд, J=2,3, 8,1, 1H), 4,65 (т, J=8,6, 1H), 4,47-4,26 (м, 3H), 3,71 (дт, J=4,0, 8,0, 1H), 3,36 (д, J=11,6, 1H), 2,32-2,16 (м, 1H), 2,08-1,94 (м, 1H); 13C ЯМР (126 MГц, CD3OD) δ 174,74, 172,77, 158,71, 153,14, 152,70, 140,83, 138,38, 130,62, 128,98, 127,69, 125,62, 121,75, 119,39, 118,61, 115,27, 71,01, 60,77, 59,79, 43,73, 39,25; ТСХ: (9:1 DCM:MeOH), Rf=0,15; ЖХМС (ESI) 408,3 (M+H)+.
VL225
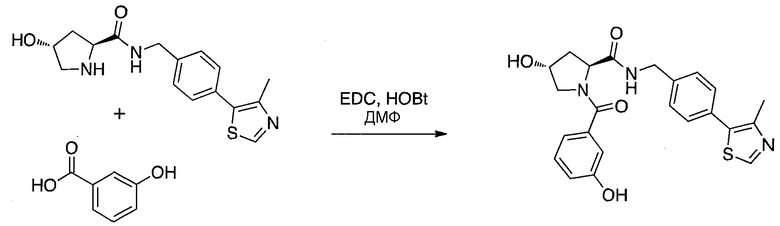 .
.
VL225 был синтезирован в соответствии с общим способом E. 1H ЯМР (501 MГц, CD3OD) δ 8,86 (с, 1H), 7,49-7,34 (м, 4H), 7,27 (т, J=7,8, 1H), 7,11-7,00 (м, 2H), 6,93-6,84 (м, 1H), 4,77 (т, J=8,5, 1H), 4,57-4,38 (м, 3H), 3,84 (дд, J=3,3, 11,5, 1H), 3,47 (д, J=11,5, 1H), 2,46 (с, 3H), 2,34 (дд, J=7,1, 12,5, 1H), 2,18-2,06 (м, 1H); 13C ЯМР ЯМР (126 MГц, CD3OD) δ 173,35, 171,36, 157,31, 151,39, 147,62, 138,81, 136,95, 130,12, 129,21, 129,04, 127,62, 127,41, 117,97, 117,19, 113,84, 69,61, 59,37, 58,41, 42,24, 37,85, 14,37; ТСХ: (9:1 DCM:MeOH) Rf=0,3; ЖХМС (ESI) 437,0 (M+H)+.
VL178
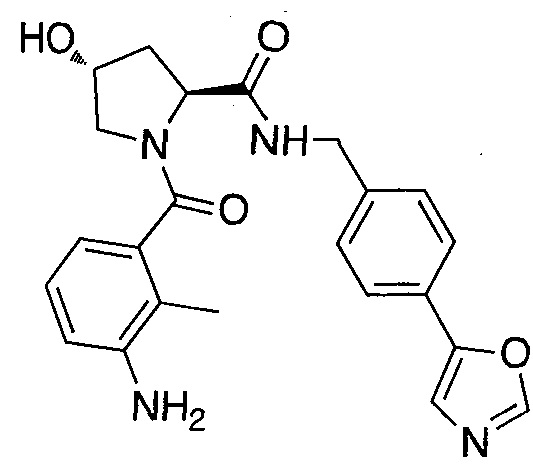 .
.
VL178 был синтезирован в соответствии с общим способом D. 1H ЯМР (400 MГц, CD3OD) δ 8,84 (т, J=5,9, 1H), 8,26 (д, J=5,9, 1H), 7,73 (д, J=8,3, 2H), 7,55-7,45 (м, 3H), 7,06 (т, J=7,8, 1H), 6,86-6,76 (м, 1H), 6,68 (д, J=7,3, 1H), 4,75 (т, J=8,4, 1H), 4,66-4,35 (м, 3H), 3,55 (дд, J=3,5, 11,6, 1H), 3,24 (д, J=11,4, 1H), 2,41-2,26 (м, 1H), 2,21-2,10 (м, 4H); 13C ЯМР (126 MГц, CD3OD) δ 173,21, 172,03, 151,32, 145,03, 139,46, 137,30, 130,95, 127,61, 126,53, 126,29, 124,22, 123,96, 120,35, 116,31, 115,97, 74,46, 69,35, 58,72, 42,46, 38,02, 23,61; ЖХМС (ESI) 420,4 (M+H)+.
VL229
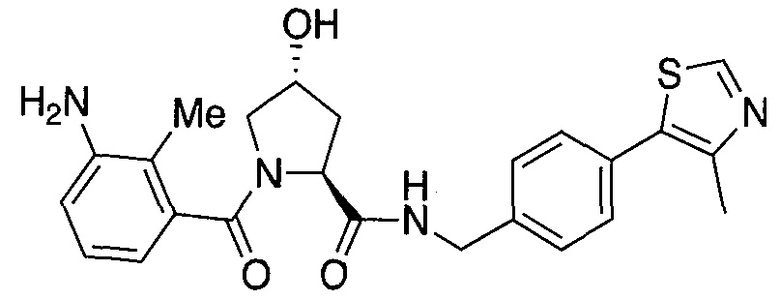 .
.
(2S,4R)-4-Гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид (24 мг, 0,0756 ммоль, 1 экв.), 3-амино-2-метилбензойную кислоту (13 мг, 0,083 ммоль, 1,1 экв.), EDC (16 мг, 0,083 ммоль, 1,1 экв.) и HOBt (11 мг, 0,083 ммоль, 1,1 экв.) растворяли в ДМФ (0,76 мл) при комнатной температуре. DIPEA (0,02 мл, 0,113 ммоль, 1,5 экв.) добавляли и раствор перемешивали в течение 17 часов. Раствор затем распределяли между 1M NaOH и EtOAc, разделяли и экстрагировали два раза EtOAc. Объединенный органический слой сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 1 до 10% 0,5н аммиак в метаноле/DCM) приводила к получению твердого вещества белого цвета (20,5 мг, 0,045 ммоль, 60%). 1H ЯМР (501 MГц, CD3OD) δ 8,87 (т, J=6,6 Гц, 1H), 7,45 (дт, J=20,5, 7,7 Гц, 4H), 7,03 (т, J=7,6 Гц, 1H), 6,78 (д, J=7,8 Гц, 1H), 6,65 (с, 1H), 4,74 (т, J=8,1 Гц, 1H), 4,67-4,34 (м, 3H), 3,53 (д, J=11,3 Гц, 1H), 3,21 (д, J=9,3 Гц, 1H), 2,48 (д, J=3,1 Гц, 3H), 2,32 (д, J=7,6 Гц, 1H), 2,14 (дд, J=31,4, 20,5 Гц, 4H). 13C ЯМР (126 MГц, CD3OD) δ 174,56, 173,67, 152,89, 152,81, 149,04, 147,80, 140,23, 138,57, 133,44, 131,54, 130,46, 128,86, 127,83, 117,01, 116,36, 70,77, 69,66, 60,09, 43,70, 39,41, 15,81, 13,92. MS (ESI) 450,6 (M+H), 473,4 (M+Na).
Для следующей отсылки смотри следующие статьи и ссылки, цитированные далее:
(1) Buckley DL et al. J. Am. Chem. Soc 2012, 134, 4465-4468.
(2) Van Molle I et al. A Chemistry & Biology 2012, 19, 1300-1312.
(3) Buckley, D Angew. Chem. Int. Ed., 2012, 51, 11463-11467.
(4) Buckley, D. Let al. Angew. Chem. 2012, 124, 11630-11634.
Примеры соединений 165-266 в таблице химического сходства II
Следующие соединения были синтезированы в соответствии с установленным общим способом, очищены стандартными хроматографическими способами и охарактеризованы данными 1H и 13C ЯМР и МС, подтверждающими желаемые структуру.
VL165:
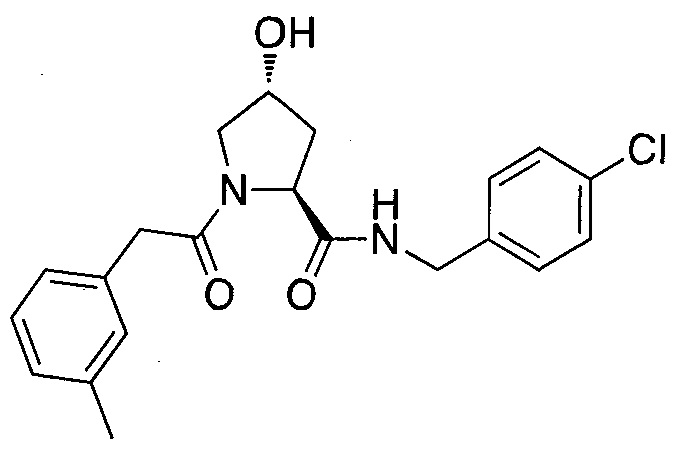 .
.
VL165 был синтезирован в соответствии с общим способом B.
L168 & 169
Хиральный фрагмент амина RHS был синтезирован с использованием способа, описанного Surya Prakash, G.K.; Mandal, M.; Olah, G. A. Angew. Chem. Int. Ed. 2001, 40, 589-690.
VL168
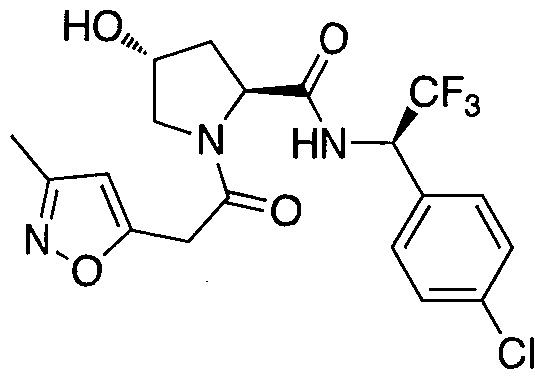 .
.
VL168 был синтезирован в соответствии с общим способом F.
VL169
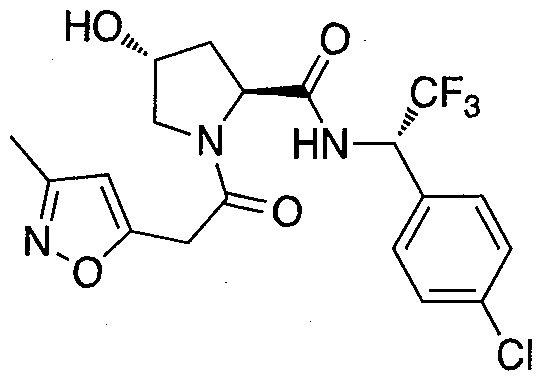 .
.
VL169 был синтезирован в соответствии с общим способом F.
VL174
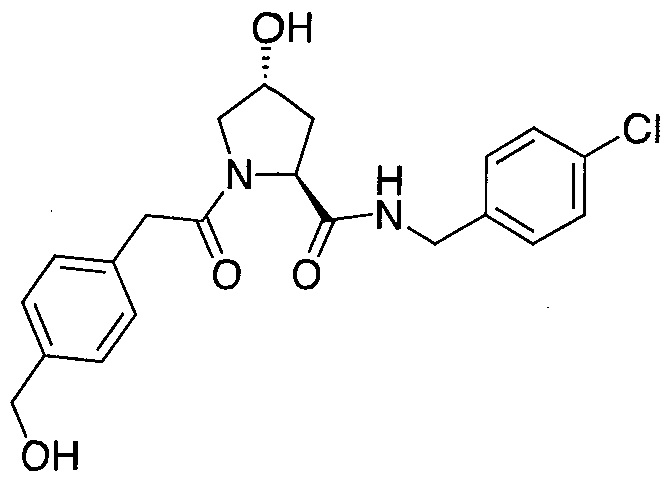 .
.
VL174 Общий способ C
VL175: Общий способ C
 .
.
VL170: Общий способ C
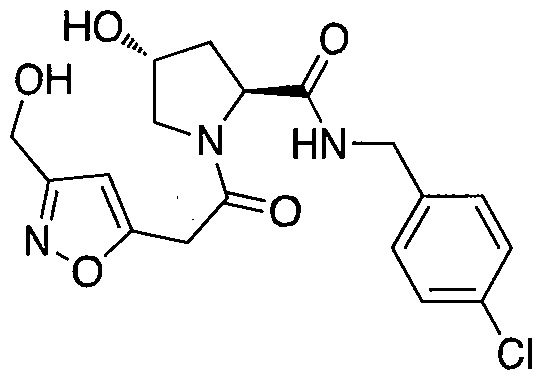 .
.
VL190: Общий способ B
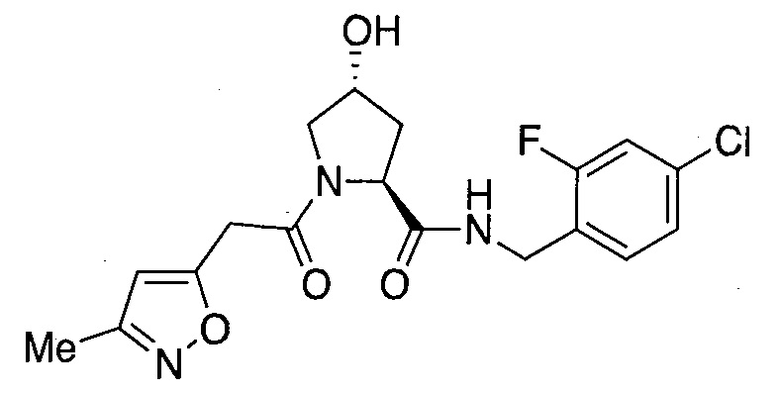 .
.
VL191: Общий способ B
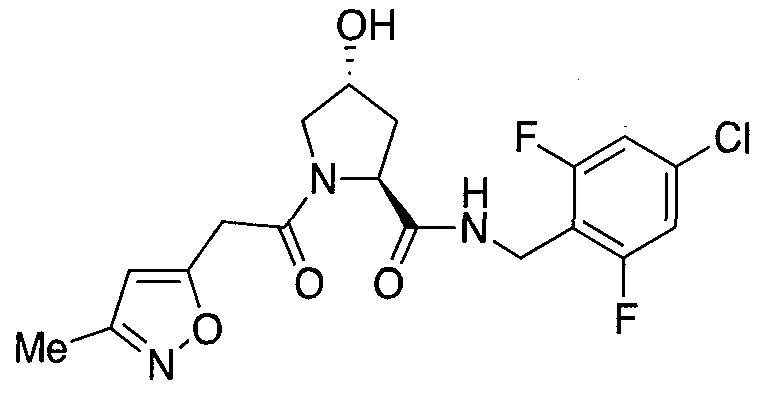 .
.
VL182: Общий способ B
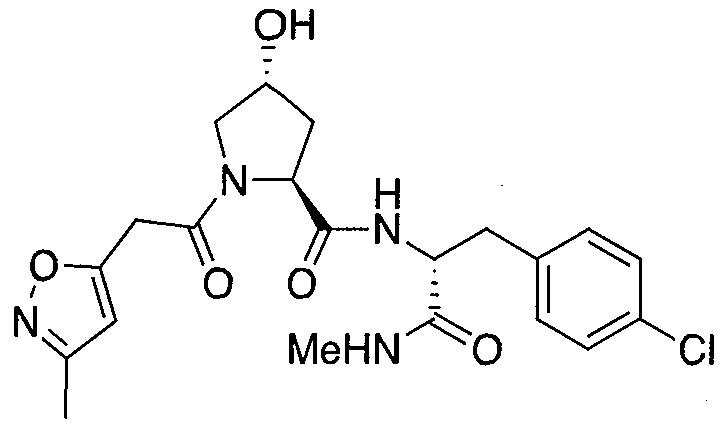 .
.
VL183: Общий способ B
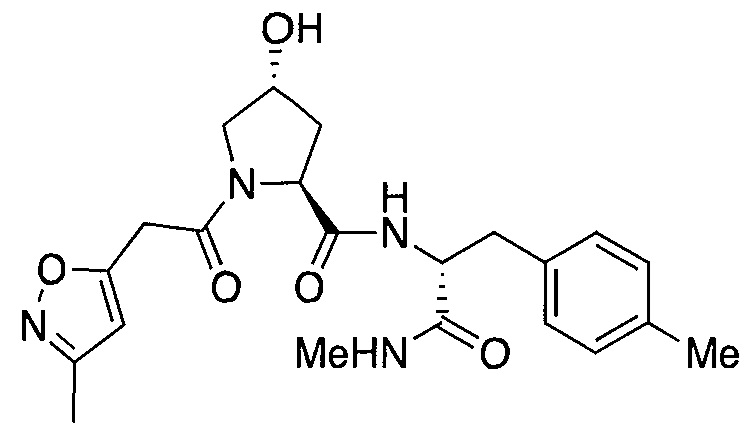 .
.
VL184: Общий способ С
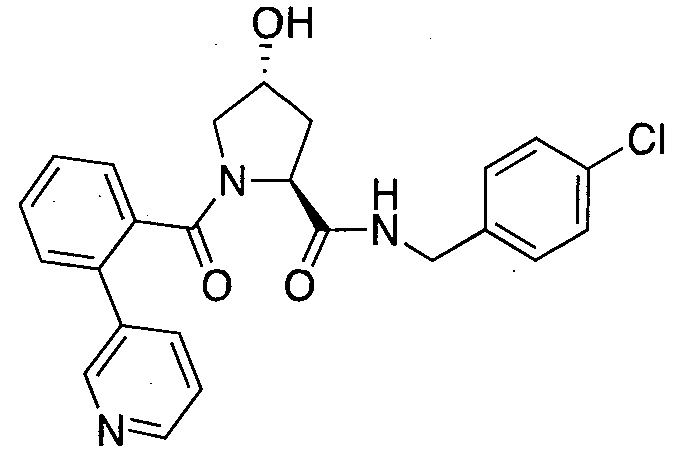 .
.
VL185: Общий способ С
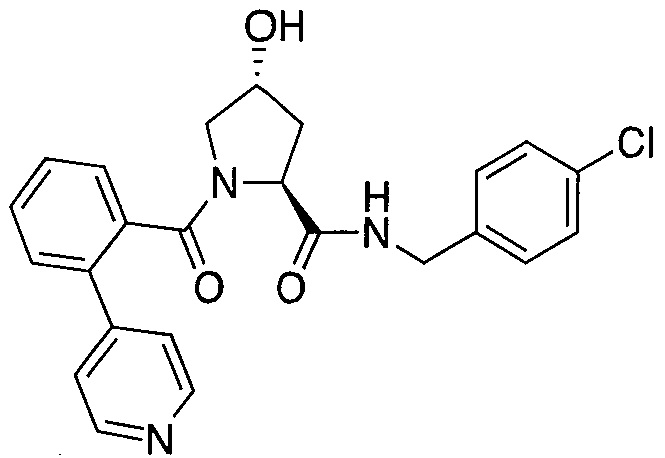 .
.
VL187: Общий способ B
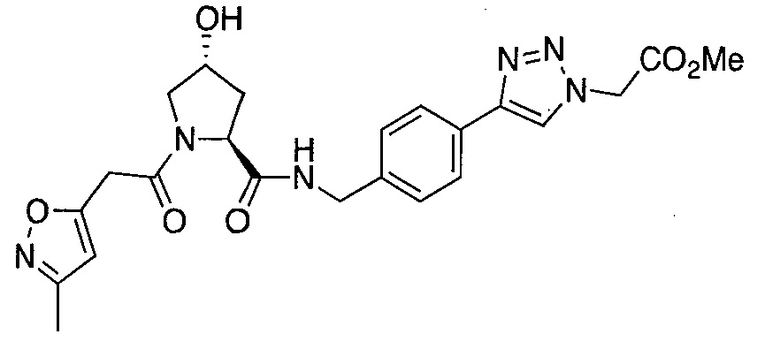 .
.
VL188: Общий способ B
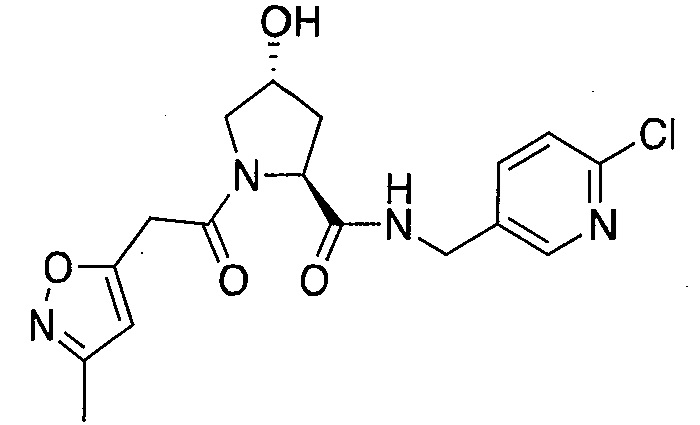 .
.
VL189: Общий способ B
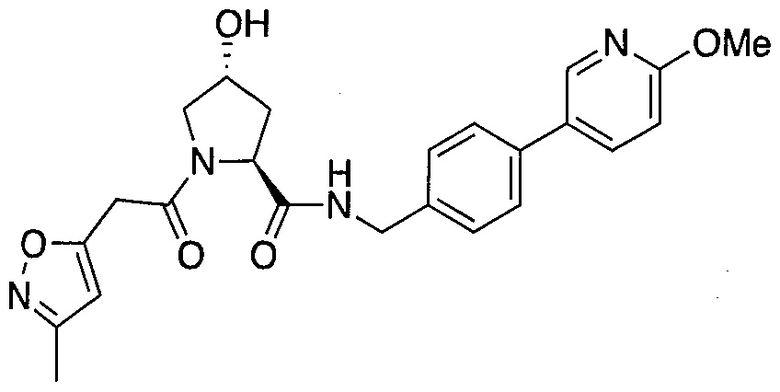 .
.
VL192-VL205: Общий способ твердофазного синтеза B
VL206: Общий способ С
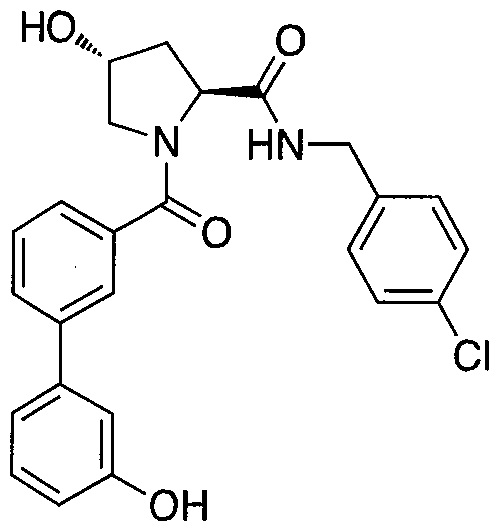 .
.
VL207: Общий способ C
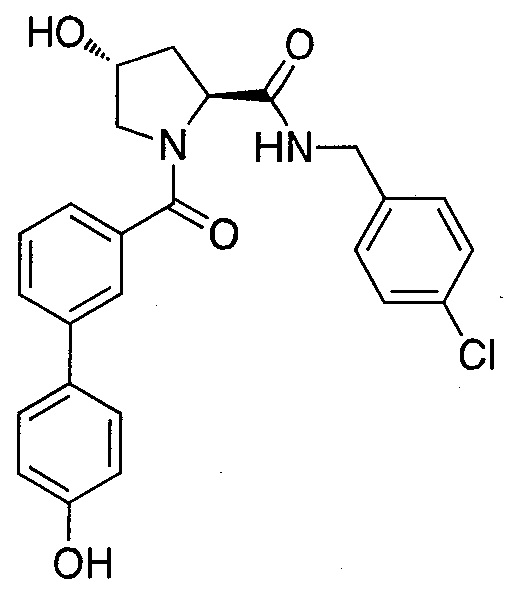 .
.
VL212: Общий способ C
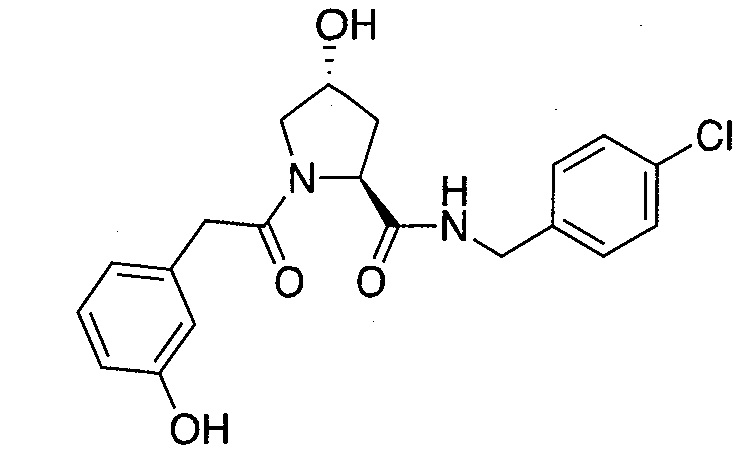 .
.
VL214: Общий способ C
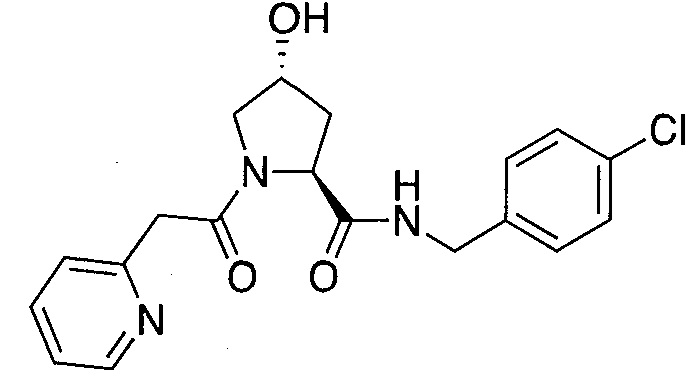 .
.
VL218: Общий способ C
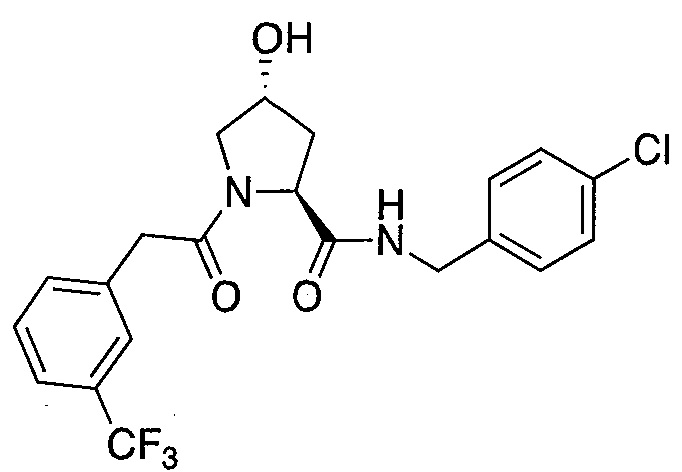 .
.
VL220: Общий способ C
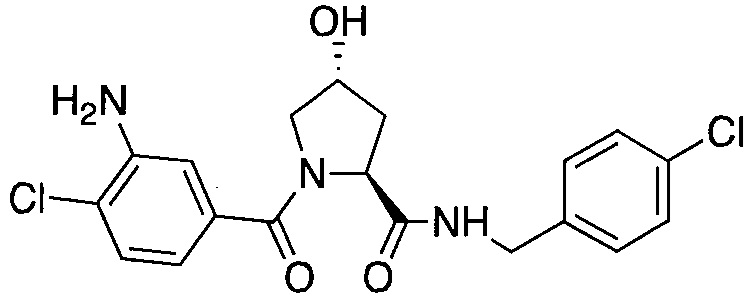 .
.
VL221: Общий способ C
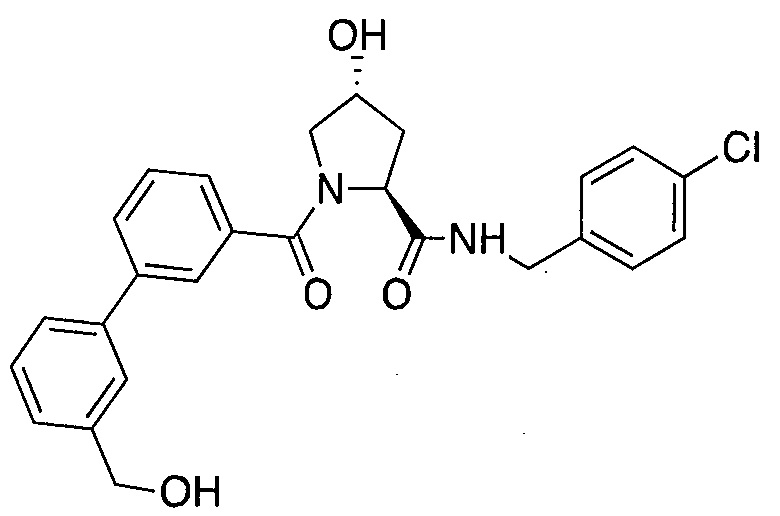 .
.
VL222: Общий способ C
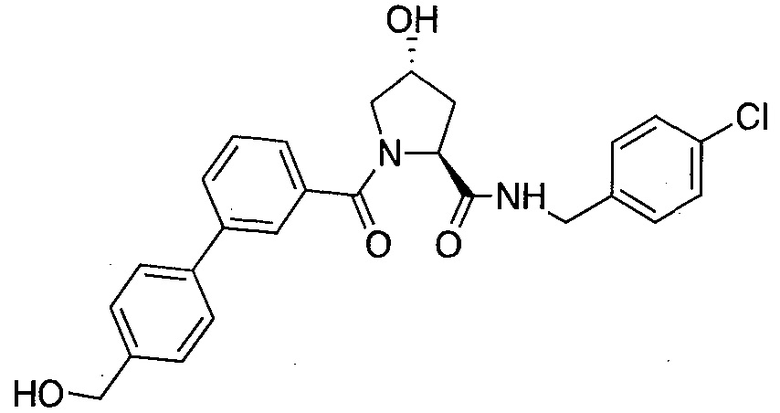 .
.
VL255: Общий способ C
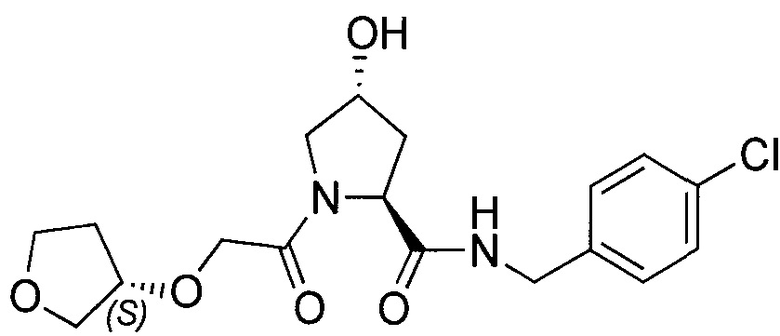 .
.
VL256: Общий способ E
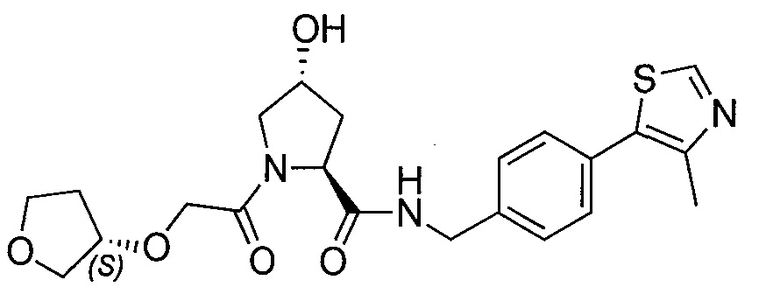 .
.
VL213: Общий способ C
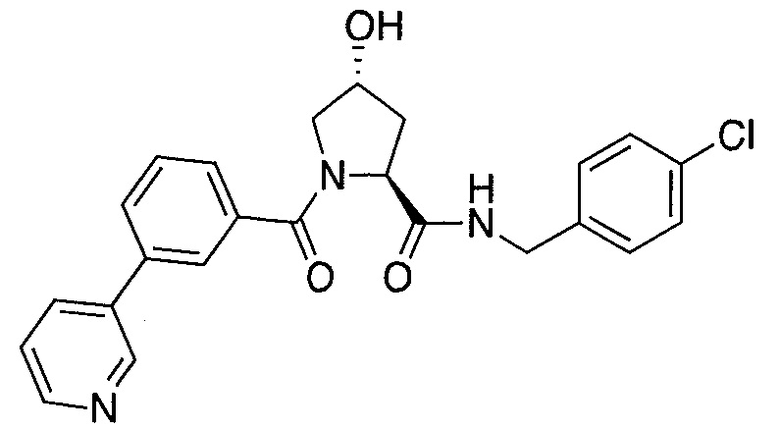 .
.
VL223: Общий способ D
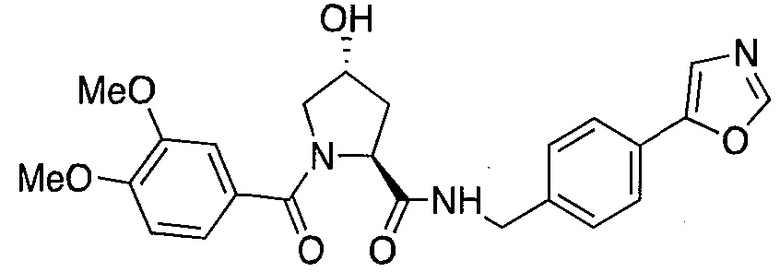 .
.
VL230: Общий способ D
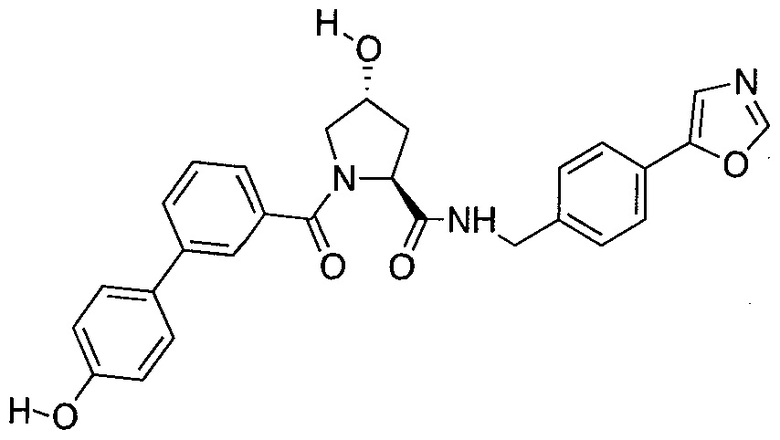 .
.
VL231: Общий способ E
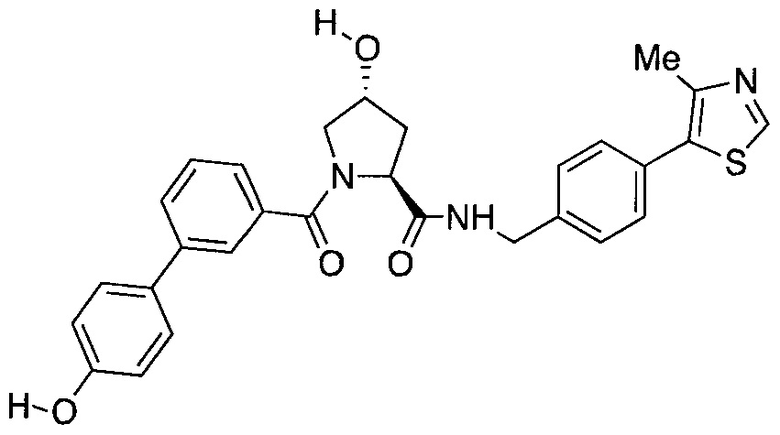 .
.
VL238: Общий способ B
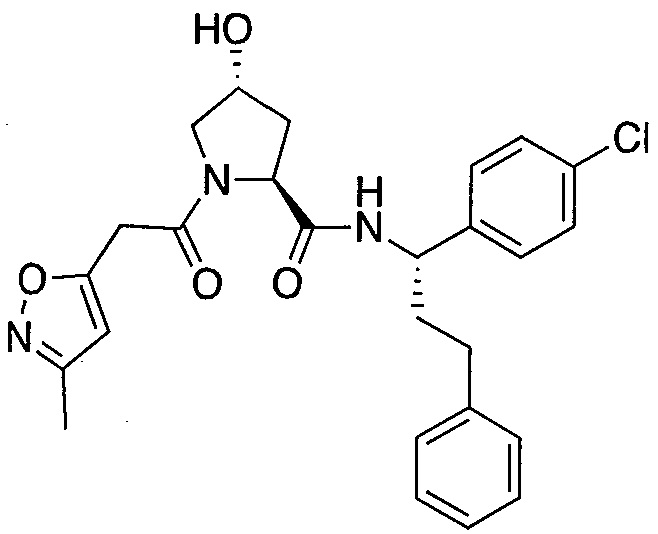 .
.
VL240: Общий способ Е
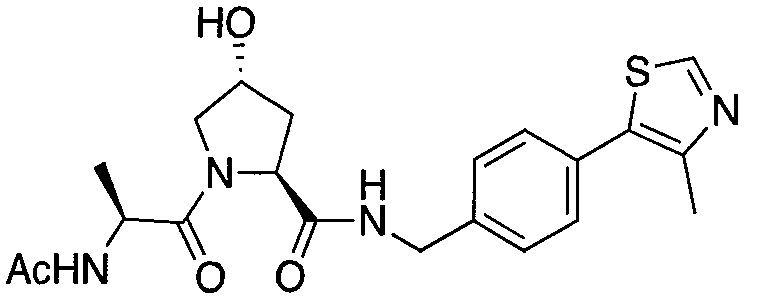 .
.
VL241: Общий способ В
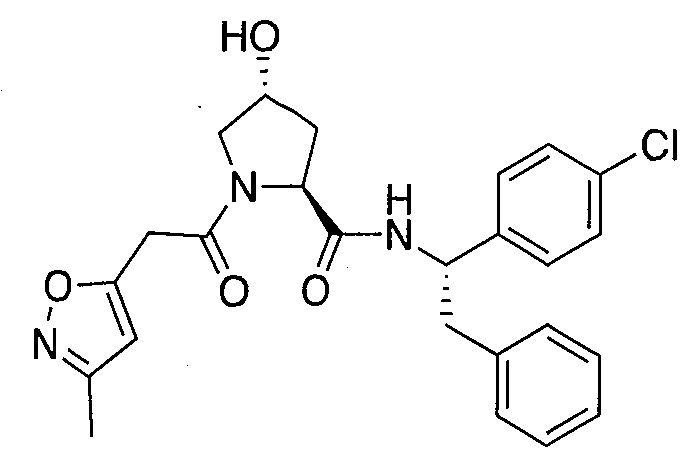
VL242: Общий способ E
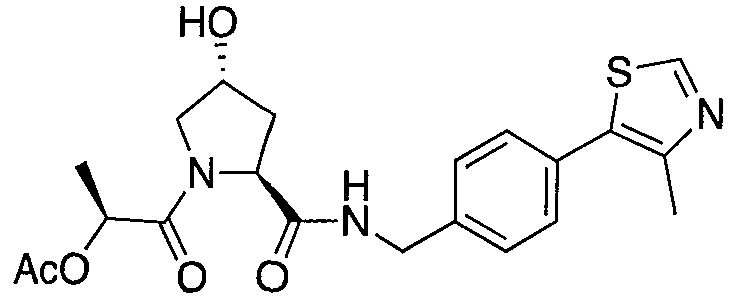 .
.
VL243: Общий способ E
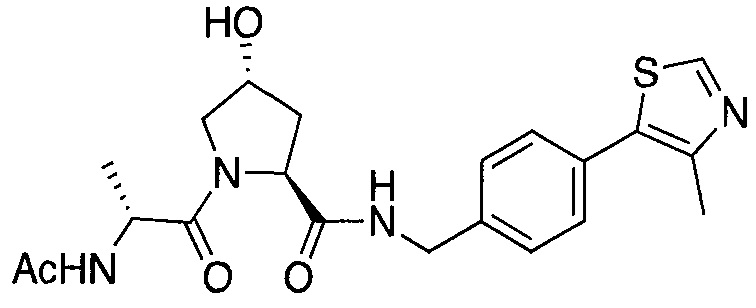 .
.
VL244: Общий способ B
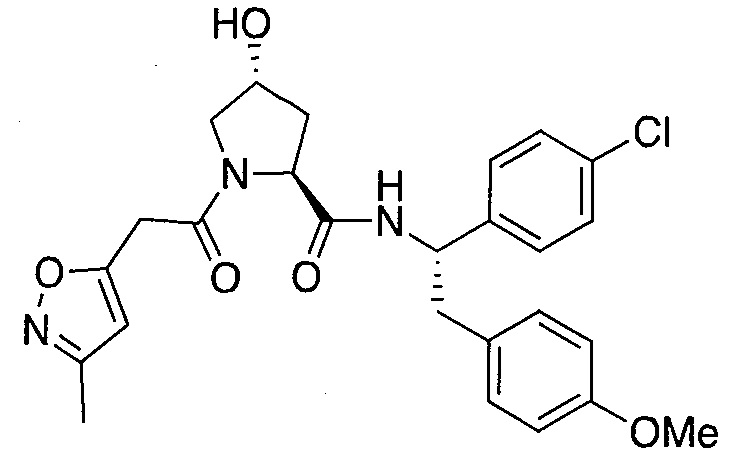 .
.
VL245: Общий способ E
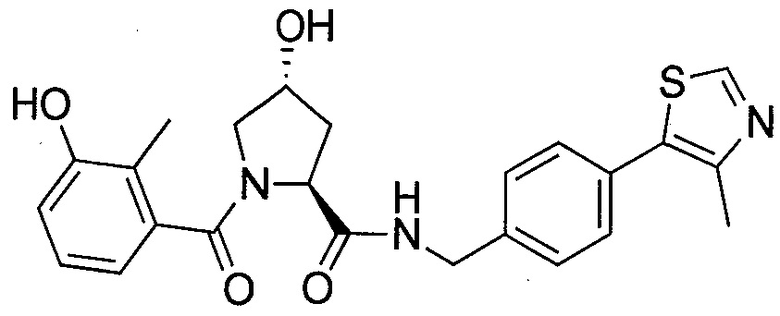 .
.
3-Гидрокси-2-метилбензойную кислоту (26,3 мг, 0,173 ммоль, 1,1 экв.), EDC (33,2 мг) и HOBt (23,4 мг) растворяли в DCM (0,8 мл) и ДМФ (0,1 мл) при температуре 4°C. Через 10 минут добавляли (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид (0,5 мл 100 мг/мл раствора в DCM) и смесь нагревали до комнатной температуры. Спустя 21 час смесь разбавляли 10 мл полунасыщенного раствора хлорида натрия и экстрагировали три раза 10 мл EtOAc. Объединенный органический слой сушили над сульфатом натрия, фильтровали и конденсировали. Очистка с помощью колоночной хроматографии (от 1 до 10% MeOH/DCM) приводила к получению твердого вещества белого цвета (29,2 мг, 0,0647, 41%). 1H ЯМР (400 MГц, MeOD) δ 8,93-8,82 (м, 1H), 7,55-7,36 (м, 4H), 7,10 (т, J=7,8 Гц, 1H), 6,83 (дд, J=10,3, 7,9 Гц, 2H), 4,76 (т, J=8,4 Гц, 1H), 4,66-4,38 (м, 3H), 3,56 (дд, J=11,6, 3,6 Гц, 1H), 3,22 (д, J=11,6 Гц, 1H), 2,54-2,47 (м, 3H), 2,41-2,31 (м, 1H), 2,19 (дт, J=11,3, 10,9 Гц, 4H). 13C ЯМР (126 MГц, MeOD) δ 174,50, 173,09, 157,22, 152,89, 152,80, 149,01, 140,21, 139,18, 133,42, 131,52, 130,44, 128,85, 127,94, 117,84, 116,42, 70,73, 69,62, 60,12, 43,69, 39,38, 15,79, 12,70. MS (ESI) 452,5 (M+H).
VL247: Общий способ C
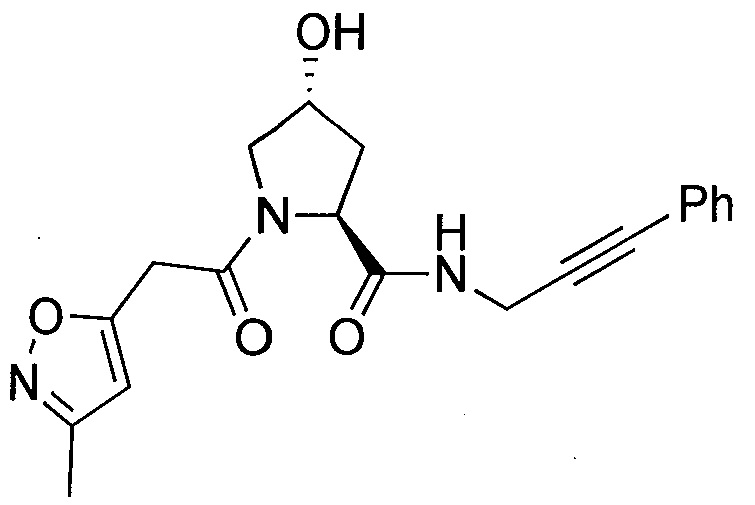 .
.
VL248: Общий способ E
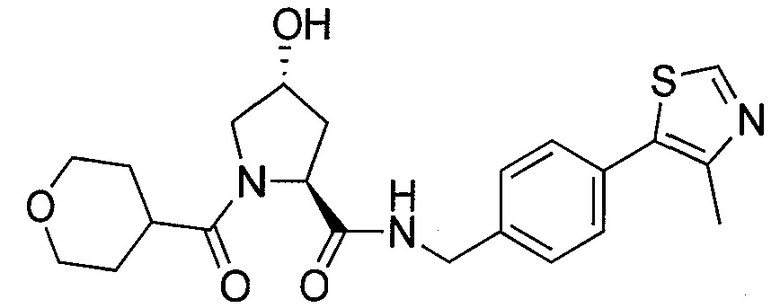 .
.
VL249: Общий способ E
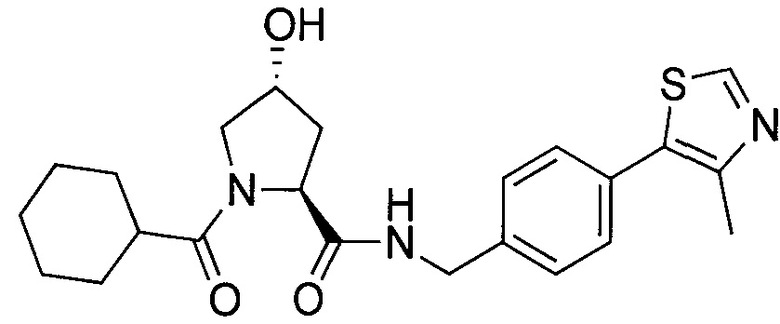 .
.
VL250: Общий способ E
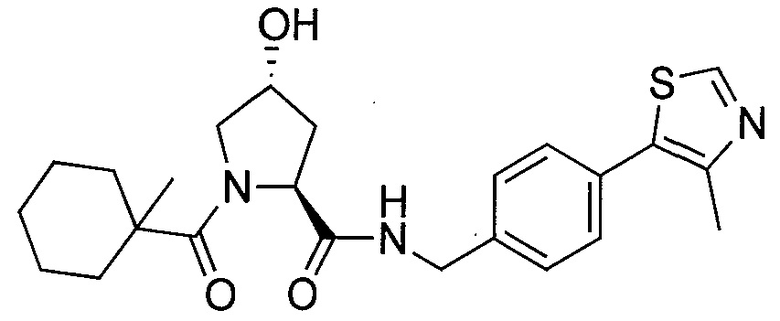 .
.
VL253: Общий способ C
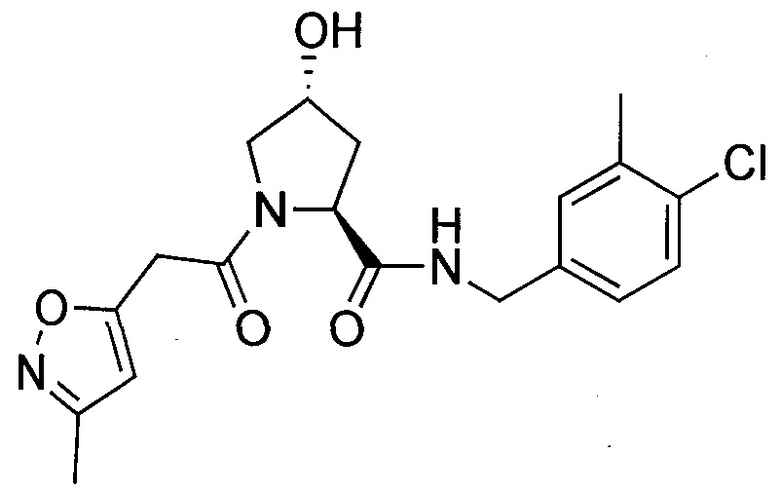 .
.
VL254: Общий способ C
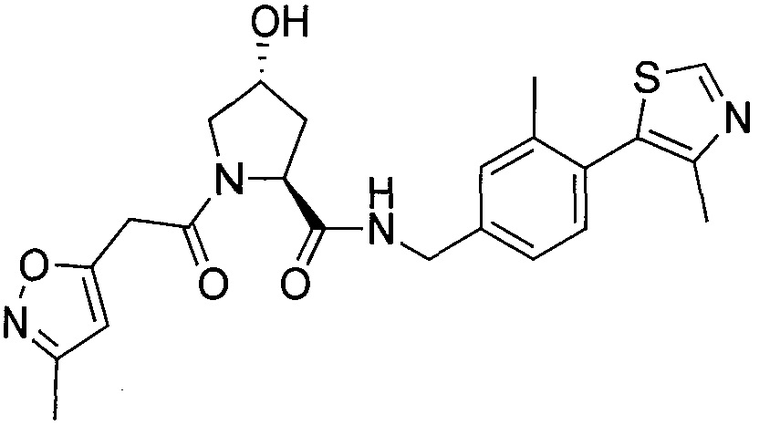 .
.
VL257: Общий способ C
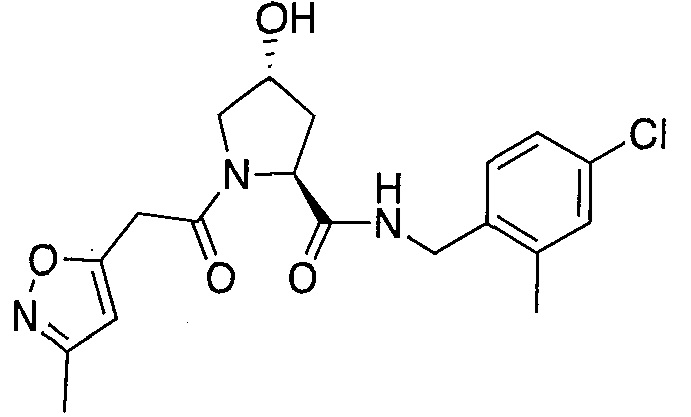 .
.
VL258: Общий способ C
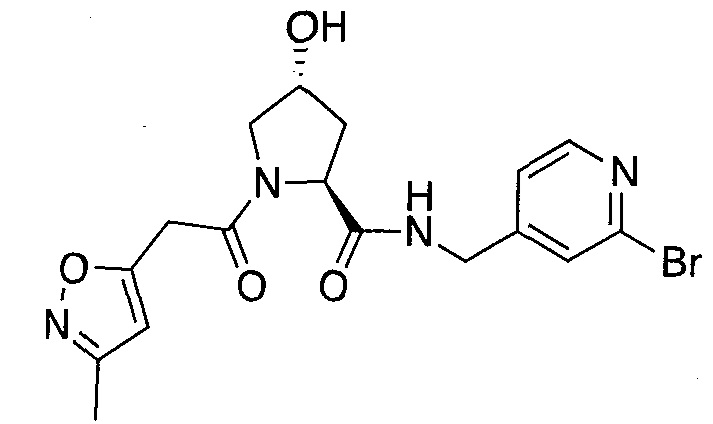 .
.
VL259: Общий способ C
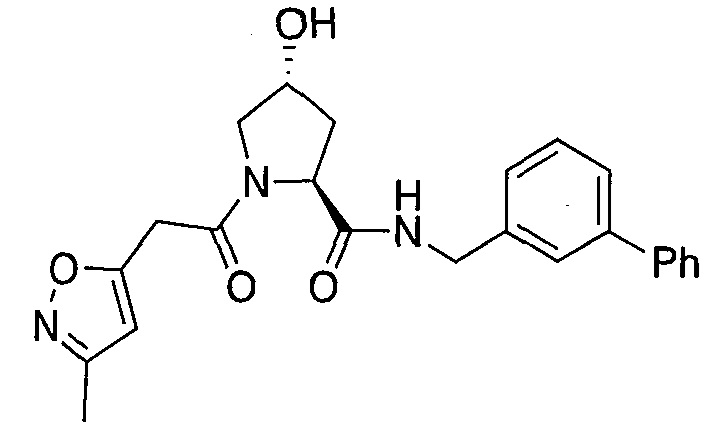 .
.
VL260: Общий способ E
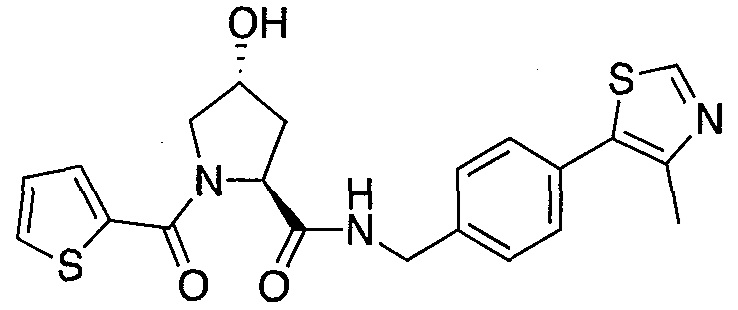 .
.
VL261 : Общий способ E
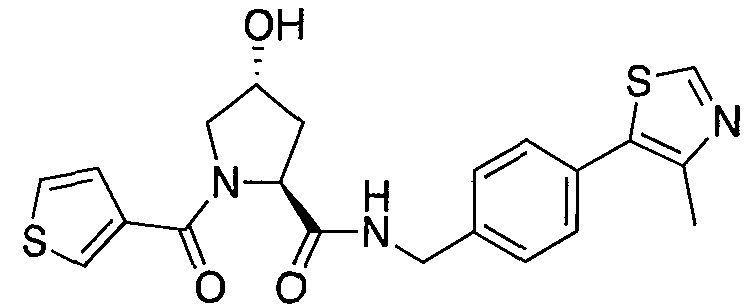 .
.
VL262: Общий способ E
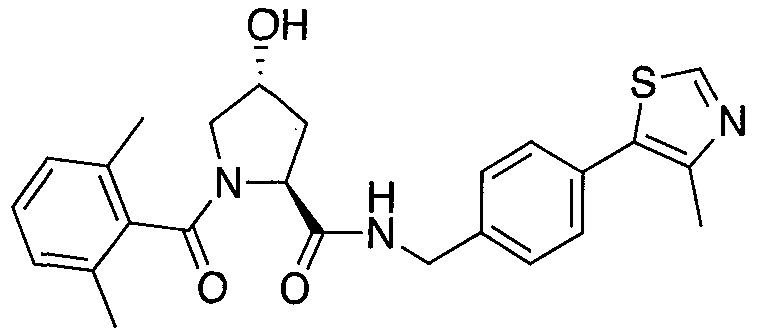 .
.
VL263: Общий способ E
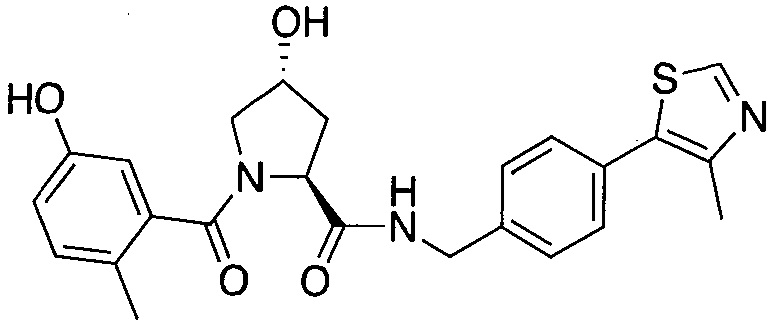 .
.
VL264: Общий способ E
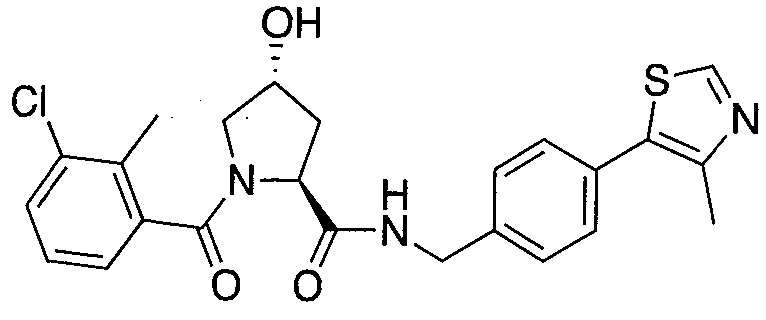 .
.
VL265: Общий способ E
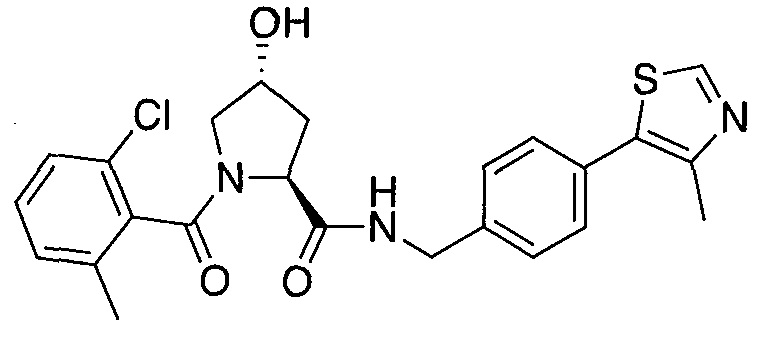 .
.
VL251
(2S,4R)-1-((S)-2-((S)-2-ацетамидо-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
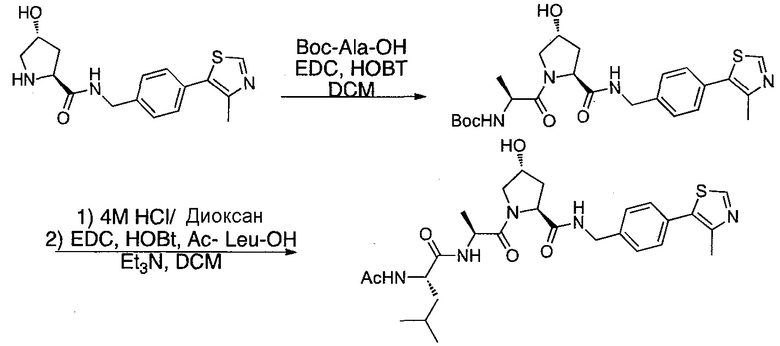
трет-бутил ((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)карбамат
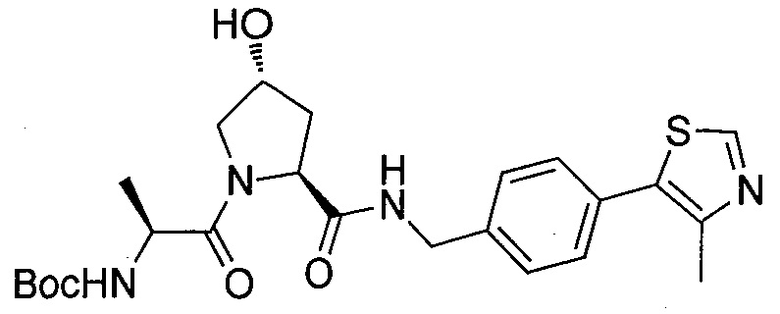 .
.
Boc-Ala-OH (189 мг, 1,0 ммоль) растворяли в 10 мл DCM и добавляли EDC (248 мг, 1,2 ммоль) и HOBt (202 мг, 1,3 ммоль), после 5 минут перемешивания добавляли (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид (317 мг, 1,0 ммоль). При перемешивании в течение 18 час реакционную смесь разбавляли 10 мл DCM и промывали 10 мл 10% водной лимонной кислоты, затем 5 мл насыщенного NaHCO3. Смесь упаривали и очищали путем хроматографии на силикагеле (градиент DCM/MeOH) с получением 210 мг (43%-ный выход) продукта в виде твердого вещества белого цвета. 1H ЯМР (501 MГц, CDCl3) δ 8,65 (с, 1H), 7,58 (с, 1H), 7,31 (д, J=8,1, 2H), 7,26 (д, J=8,0, 2H), 5,44 (д, J=7,4, 1H), 4,66 (т, J=7,6, 1H), 4,52 (с, 1H), 4,39 (м, 3H), 3,78 (д, J=10,9, 1H), 3,59 (д, J=7,0, 1H), 2,47 (с, 3H), 2,30 (с, 1H), 2,10 (с, 1H), 1,54-1,31 (м, 9H), 1,26 (д, J=6,9, 3H); 13C ЯМР (126 MГц, CDCl3) δ 173,1, 171,2, 155,5, 150,5, 148,2, 138,2, 130,7, 129,4, 127,6, 80,1, 70,1, 58,8, 55,2, 48,0, 42,3, 36,5, 28,3, 18,0, 16,0; ЖХМС (ESI) 489,4 (M+H)+.
VL251
(2S,4R)-1-((S)-2-((S)-2-ацетамидо-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
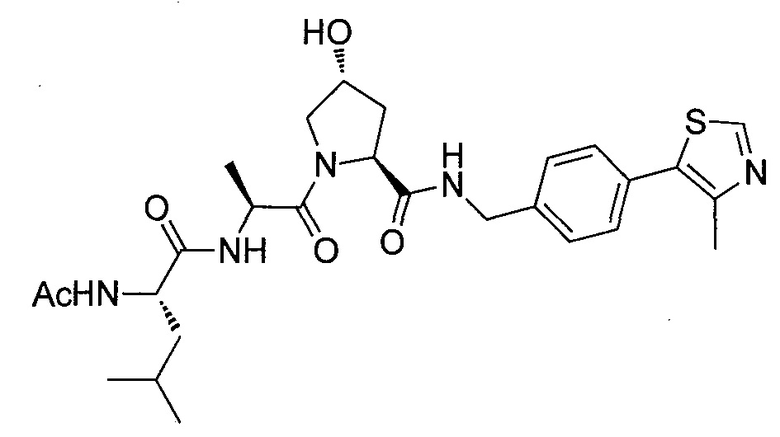 .
.
Boc-Ala-Hyp-бензил тиазол (116 мг, 0,225 ммоль) растворяли в 1 мл DCM и добавляли 2,3 мл 4M HCl в диоксане. При перемешивании в течение одного часа в смесь барботировали газообразный азот в течение 15 минут, и оставшиеся летучие вещества удаляли на роторном испарителе. Полученную пену затем растворяли в 5 мл 1:1 DCM:ДМФ и добавляли EDC (56 мг, 0,29 ммоль), HOBt (45 мг, 0,29 ммоль) и Ac-Leu-OH (43 мг, 0,25 ммоль). После перемешивания в течение 5 минут добавляли триэтиламин. При перемешивании в течение 18 час реакционную смесь разбавляли 10 мл EtOAc и промывали 10 мл 10%-ой водной лимонной кислотой, затем 5 мл насыщенного NaHCO3. Водный слой затем вновь экстрагировали 2×10 мл DCM. Органические слои объединяли, и смесь упаривали и очищали путем хроматографии на силикагеле (градиент DCM/MeOH) с получением 35 мг (29%-ный выход) продукта в виде твердого вещества белого цвета. 1H ЯМР (501 MГц, CDCl3) δ 8,68 (с, 1H), 8,05 (с, 1H), 7,70 (с, 1H), 7,36 (д, J=7,3, 2H), 7,28 (д, J=8,6, 2H), 6,50 (с, 1H), 4,85-4,73 (м, 2H), 4,68 (с, 1H), 4,59 (с, 1H), 4,40 (д, J=32,4, 2H), 3,84 (д, J=10,7, 1H), 3,70 (д, J=10,5, 1H), 2,51 (с, 3H), 2,30 (с, 1H), 2,21 (с, 1H), 1,85 (с, 3H), 1,59 (с, 1H), 1,50 (с, 2H), 1,34 (д, J=6,7, 3H), 0,86 (т, J=6,7, 6H); 13C ЯМР (126 MГц, CDCl3) δ 172,1, 172,0, 171,2, 170,8, 150,4, 148,4, 138,1, 129,5, 129,4, 127,8, 110,0, 70,36, 58,9, 55,5, 51,8, 46,9, 43,1, 41,8, 36,9, 24,7, 23,2, 23,1, 21,8, 17,9, 16,0; ЖХМС (ESI) 545,1 (M+H)+.
VL252
(2S,4R)-1-((S)-2-((S)-2-амино-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
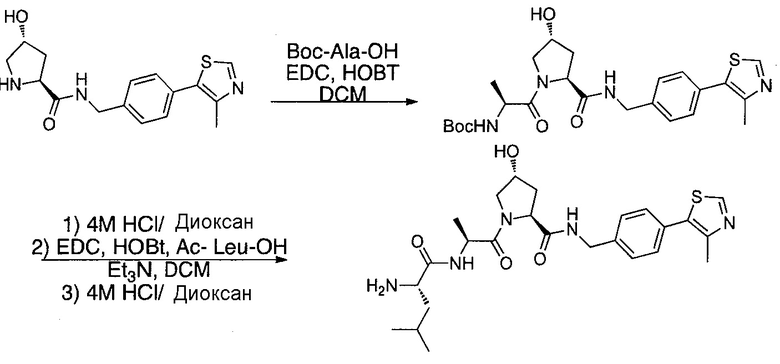 .
.
Boc-Ala-Hyp-бензил тиазол (116 мг, 0,225 ммоль) растворяли в 1 мл DCM и добавляли 2,3 мл 4M HCl в диоксане. При перемешивании в течение одного часа в смесь барботировали газообразный азот в течение 15 минут, и оставшиеся летучие проодукты удаляли на роторном испарителе. Полученную пену затем растворяли в 5 мл 1:1 DCM:ДМФ и добавляли EDC (56 мг, 0,29 ммоль), HOBt (45 мг, 0,29 ммоль) и Boc-Leu-OH (62 мг, 0,25 ммоль). После перемешивания в течение 5 минут добавляли триэтиламин. При перемешивании в течение 18 час реакционную смесь разбавляли 10 мл EtOAc и промывали 10 мл 10%-ой водной лимонной кислотой, затем 5 мл насыщенного NaHCO3. Органические слои объединяли, и смесь концентрировали с получением 55 мг (40%-ный выход) продукта в виде твердого вещества белого цвета. ЖХМС (ESI) 602,0 (M+H)+. После подтверждения с помощью масс-спектроскопии продукт растворяли в 2 мл 1:1 DCM:MeOH и добавляли 3 мл 4M HCl в диоксане. При перемешивании в течение 45 минут реакцию гасили 5 мл 0,5н аммиака в метаноле. Растворители упаривали и очищали путем хроматографии на силикагеле (градиент DCM/MeOH (0,5н NH3)) с получением 50 мг чистого продукта в виде твердого вещества белого цвета. 1H ЯМР (501 MГц, CDCl3) δ 8,25 (с, 1H), 6,91 (дд, J=7,3, 18,0, 4H), 4,17 (д, J=7,5, 2H), 4,06 (д, J=22,4, 2H), 3,95 (д, J=15,3, 1H), 3,56-3,42 (м, 2H), 3,24 (д, J=7,8, 1H), 2,05 (с, 3H), 1,86-1,77 (м, 1H), 1,77-1,65 (м, 1H), 1,35-1,19 (м, 2H), 1,13 (с, 1H),0,93 (д, J=6,8, 3H), 0,50 (дд, J=6,3, 9,8, 6H); 13C ЯМР (126 MГц, CDCl3) δ 171,6, 171,5, 150,3, 147,7, 137,9, 131,4, 130,1, 129,0, 127,3, 109,9, 69,7, 58,6, 55,11, 46,9, 42,5, 36,7, 24,1, 22,4, 22,2, 16,2, 15,3; ЖХМС (ESI) 502,0 (M+H)+.
VL253: Общий способ C
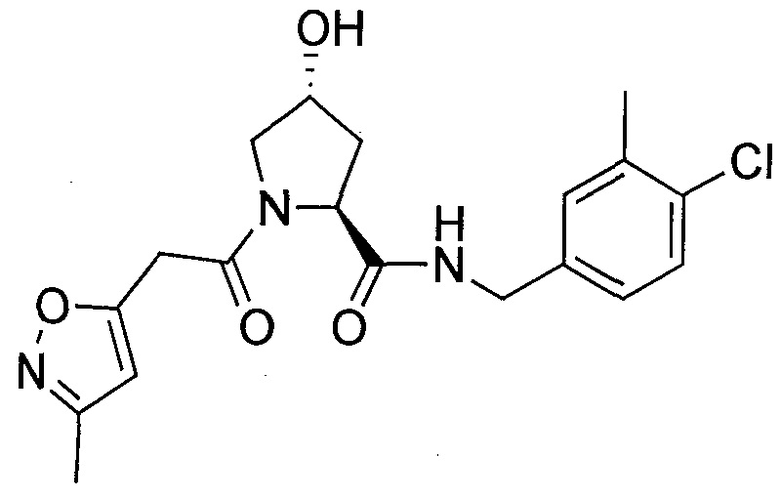 .
.
VL254: Общий способ C
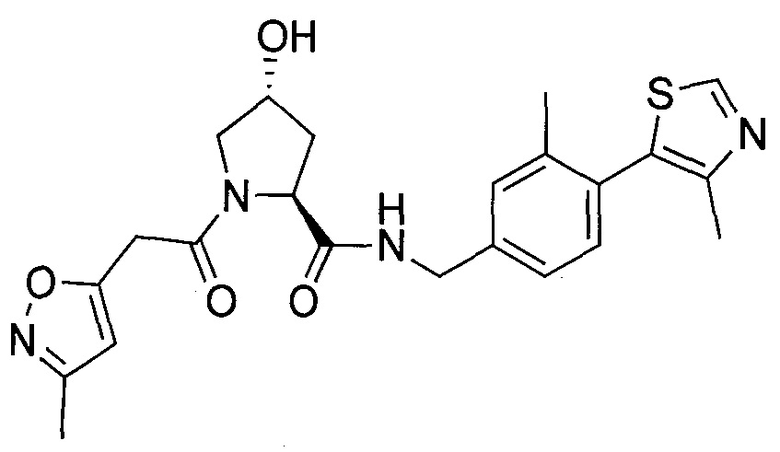 .
.
VL257: Общий способ C
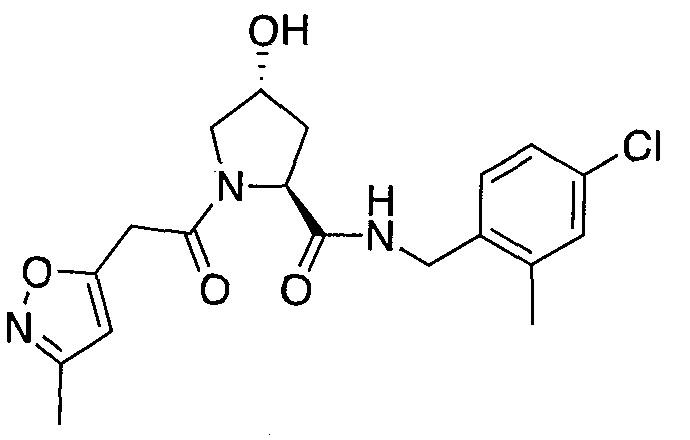 .
.
VL258: Общий способ C
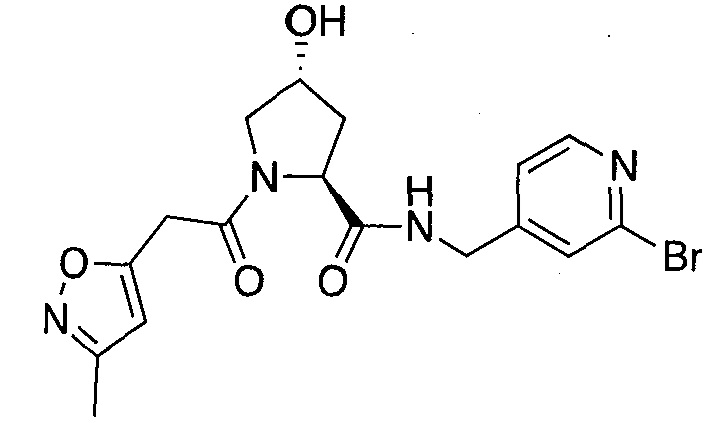 .
.
VL259: Общий способ C
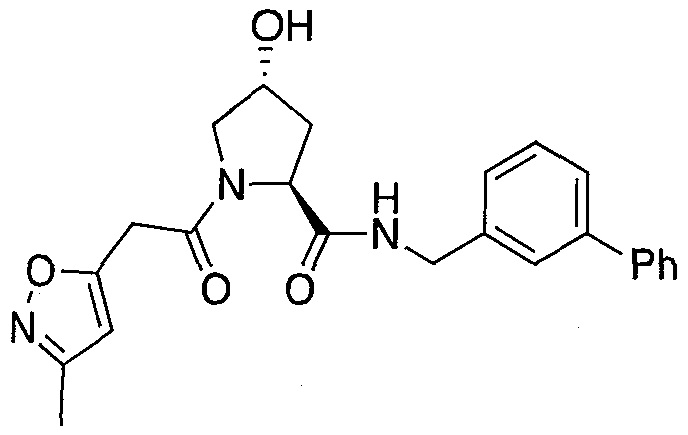 .
.
VL260: Общий способ E
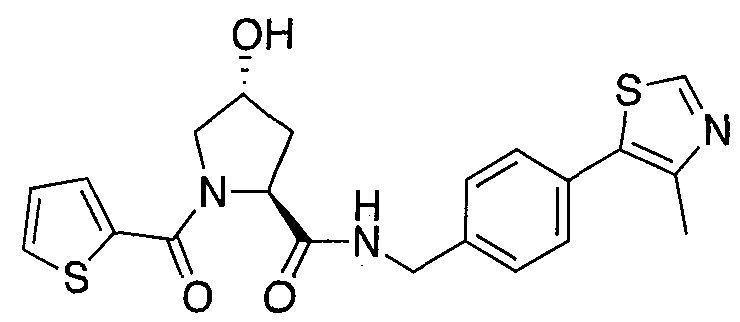 .
.
VL261: Общий способ E
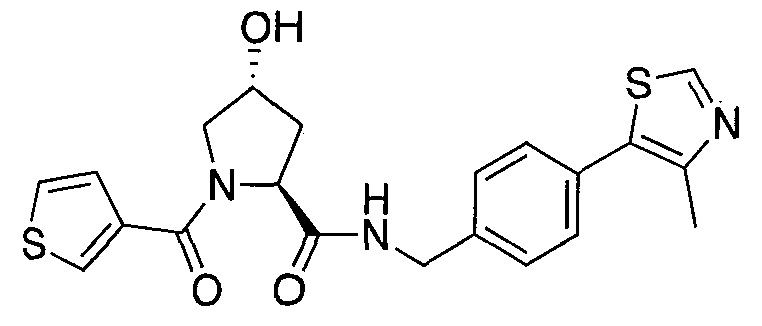 .
.
VL262: Общий способ E
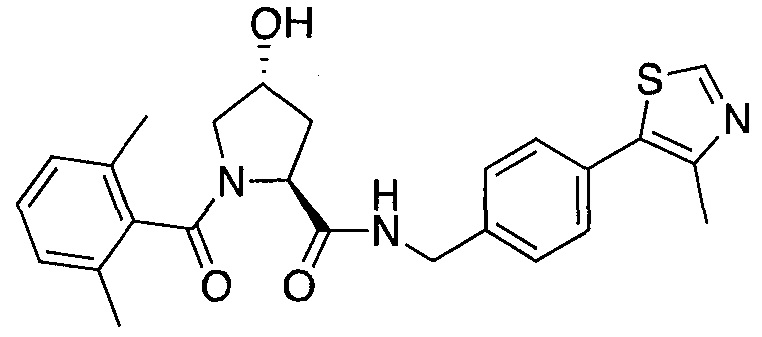 .
.
VL263: Общий способ E
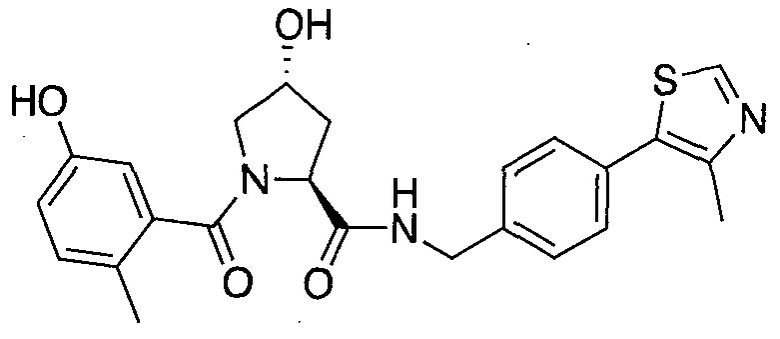 .
.
VL264: Общий способ E
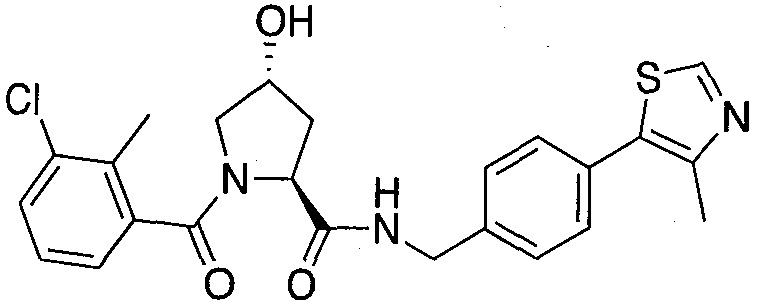 .
.
VL265: Общий способ E
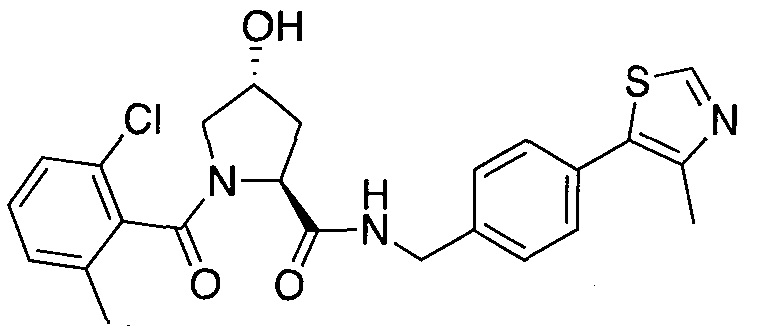 .
.
Примеры соединений фигуры 15
Для синтеза и/или характеристики соединений в соответствии с настоящим изобретением были использованы следующие указанные методы
Метод ЖХМС :
Анализ осуществляли на колонке Acquity UPLC BEH C18 (50 мм × 2,1 мм внутренний диаметр, 1,7 мкм упаковочный диаметр) при температуре 40°C.
Используемыми растворителями являлись:
A=0,1% об./об. раствор муравьиной кислоты в воде.
B=0,1% об./об. раствор муравьиной кислоты в ацетонитриле.
Используемый градиент был следующим:
УФ определение представляло собой средний сигнал при длине волны от 210 нм до 350 нм и масс-спектр регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительной и отрицательной ионизации электрораспылением.
Ниже показаны подвижные фазы и градиенты, используемые, когда соединения подвергались очистке путем масс-направленной автопрепаративной ВЭЖХ.
Масс-направленная автопрепаративная ВЭЖХ (модификатор муравьиная кислота)
Анализ ВЭЖХ осуществляли на колонке Sunfire C18 (150 мм × 30 мм внутренний диаметр, 5 мкм упаковочный диаметр) при комнатной температуре.
Используемыми растворителями являлись:
A=0,1% об./об. раствор муравьиной кислоты в воде.
B=0,1% об./об. раствор муравьиной кислоты в ацетонитриле.
Масс-направленная автопрепаративная ВЭЖХ (модификатор трифторуксусная кислота)
Анализ ВЭЖХ осуществляли на колонке Sunfire C18 (150 мм × 30 мм внутренний диаметр, 5 мкм упаковочный диаметр) при комнатной температуре.
Используемыми растворителями являлись:
A=0,1% об./об. раствор трифторуксусной кислоты в воде.
B=0,1% об./об. раствор трифторуксусной кислоты в ацетонитриле.
Масс-направленная автопрепаративная ВЭЖХ (модификатор бикарбонат аммония)
Анализ ВЭЖХ осуществляли на колонке XBridge C18 (150 мм × 30 мм внутренний диаметр, 5 мкм упаковочный диаметр) при комнатной температуре.
Используемыми растворителями являлись:
A=10 мМ бикарбонат аммония в воде с установленным с помощью аммиачного раствора pH, равным 10.
B=ацетонитрил.
Для каждой из масс-направленных автопрепаративных очисток, независимо от используемого модификатора, используемый градиент зависел от времени удерживания конкретного соединения, подвергаемого очистке, что регистрировалось аналитической ЖХ-МС, и был следующим:
Для соединений со временем удерживания согласно аналитической ЖХМС менее 0,6 минут был использован следующий ингредиент:
Для соединений со временем удерживания согласно аналитической ЖХМС в интервале между 0,6 и 0,9 минутами был использован следующий ингредиент:
Для соединений со временем удерживания согласно аналитической ЖХМС в интервале между 0,9 и 1,2 минутами был использован следующий ингредиент:
Для соединений со временем удерживания согласно аналитической ЖХМС в интервале между 1,2 и 1,4 минутами был использован следующий ингредиент:
УФ определение представляло собой средний сигнал при длине волны от 210 нм до 350 нм и масс-спектр регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительной и отрицательной ионизации электрораспылением.
Химические названия были образованы с использованием версии ACD Name Pro версия 6.02 от фирмы Advanced Chemistry Development, Inc.
Примеры
(2S,4R)-1-(2-этоксибензоил)-4-гидрокси-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамид
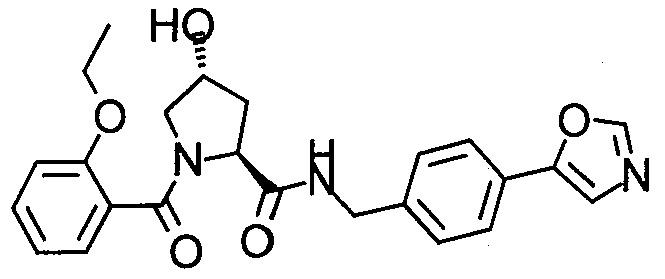 .
.
Раствор 2-этоксибензойной кислоты (коммерчески доступная, например, от фирмы Aldrich) (29 мг, 0,17 ммоль), (2S,4R)-4-гидрокси-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамида (50 мг, 0,17 ммоль) и DIPEA (0,061 мл, 0,35 ммоль) в ДМФ (1 мл) обрабатывали HATU (80 мг, 0,21 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Продукт затем подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (38 мг, 0,087 ммоль, 50%-ный выход). ЖХМС RT=0,72 мин, ES+ve m/z 436 [M+H]+.
Используя способ, аналогичный способу получения (2S,4R)-1-(2-этоксибензоил)-4-гидрокси-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамида, получали следующие соединения:
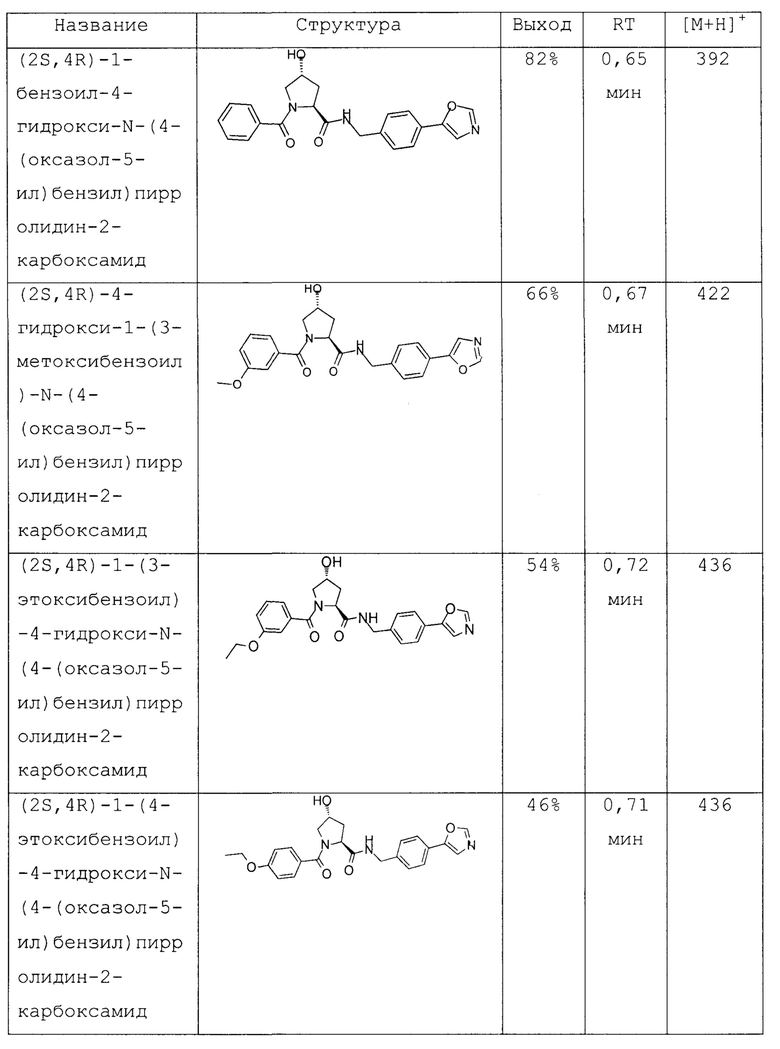
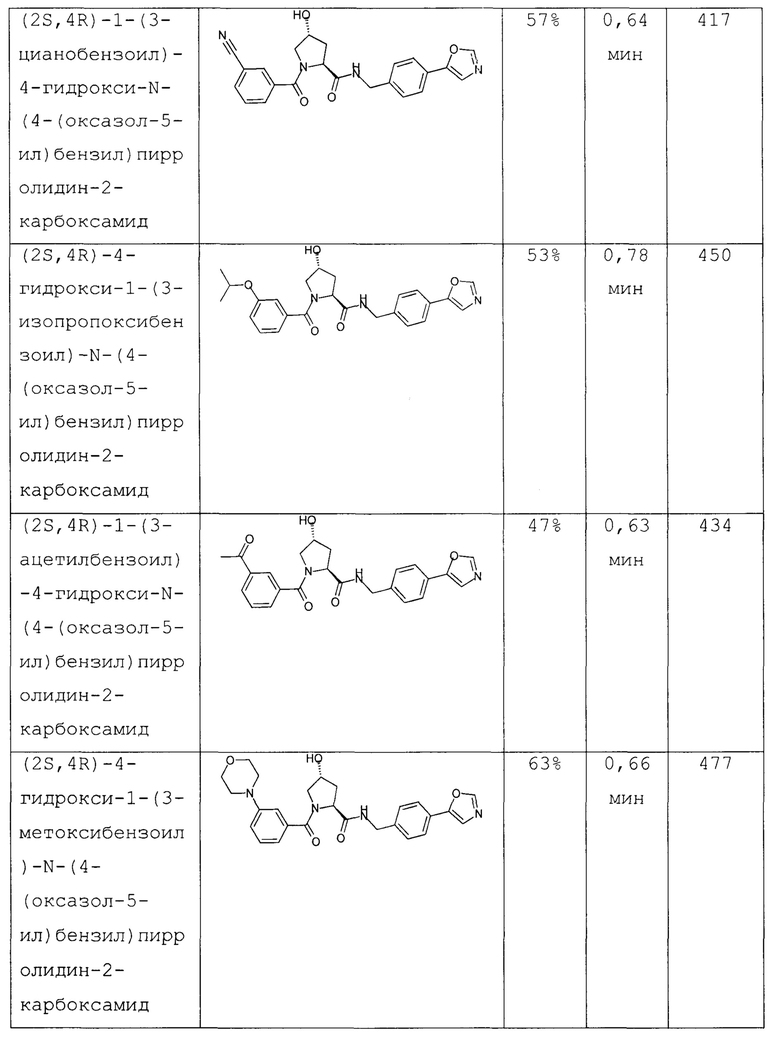
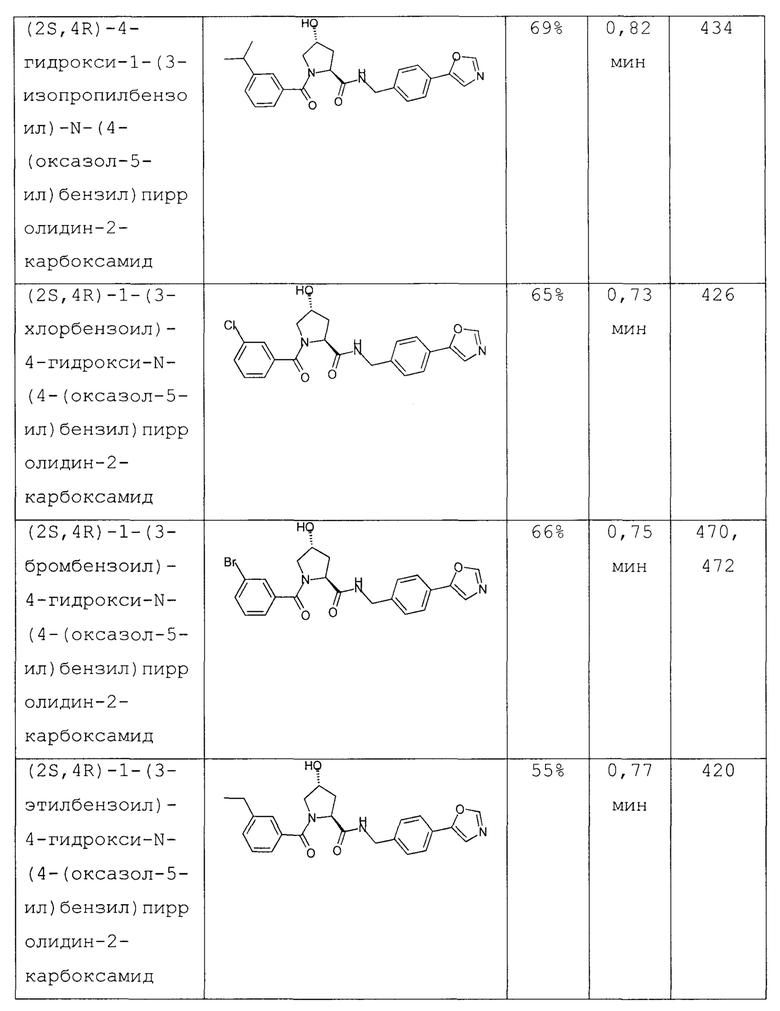
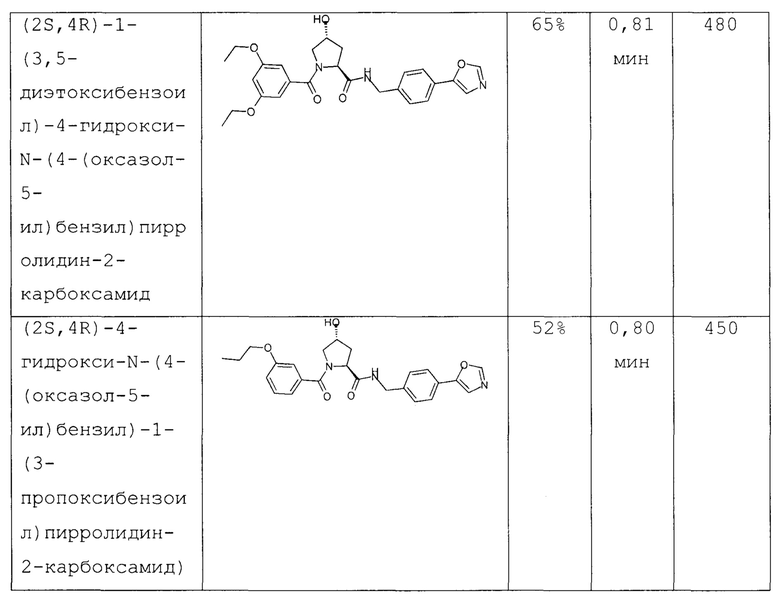
(S)-1-((2S,4R)-4-гидрокси-2-((4-(оксазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил ацетат и (2S,4R)-4-гидрокси-1-((S)-2-гидроксипропаноил)-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамид
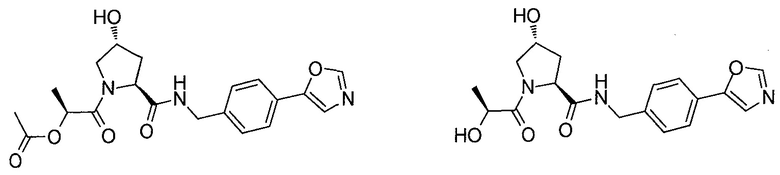 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамида (60 мг, 0,19 ммоль) и (S)-2-ацетоксипропановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (25 мг, 0,19 ммоль) в ДМФ (1,2 мл) обрабатывали DIPEA (0,13 мл, 0,74 ммоль) и затем HATU (85 мг, 0,22 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Половину реакционной смеси затем подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением (S)-1-((2S,4R)-4-гидрокси-2-((4-(оксазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил ацетата (21 мг, 0,052 ммоль, 28%-ный выход). ЖХМС RT=0,58 мин, ES+ve m/z 402 [M+H]+.
Оставшуюся половину реакционной смеси обрабатывали аммиаком (2M раствор в метаноле) (2 мл), герметически закрывали и оставляли стоять в течение 1 дня. Раствор далее упаривали досуха, и продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением (2S,4R)-4-гидрокси-1-((S)-2-гидроксипропаноил)-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамида (18 мг, 0,050 ммоль, 27%-ный выход). ЖХМС RT=0,53 мин, ES+ve m/z 360 [M+H]+.
(2S,4R)-бензил 4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксилат
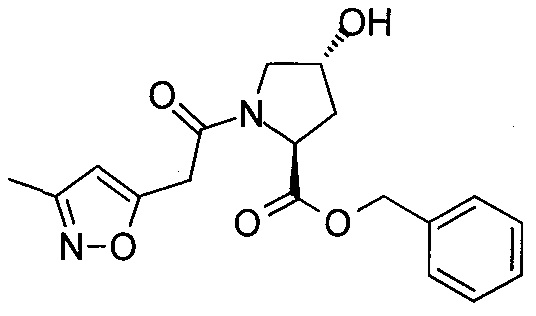 .
.
Охлаждаемую льдом смесь 2-(3-метилизоксазол-5-ил)уксусной кислоты (коммерчески доступная, например, от фирмы Aldrich) (0,91 г, 6,4 ммоль) и гидрохлорида (2S,4R)-бензил 4-гидроксипирролидин-2-карбоксилата (1,67 г, 6,5 ммоль) в ДМФ (9 мл) обрабатывали DIPEA (3,4 мл, 19 ммоль) и затем HATU (2,56 г, 6,7 ммоль) в течение 20 минут. Смесь перемешивали при охлаждении в течение 30 минут и затем в течение ночи при комнатной температуре. Смесь затем обрабатывали насыщенным водным раствором бикарбоната натрия (50 мл), экстрагировали дихлорметаном (4×60 мл), и объединенную органическую фазу фильтровали через гидрофобную фритту и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (100 g
г картридж) с использованием градиентного элюирования от 0% до 15% метанола в дихлорметане с получением указанного в заголовке соединения (2,3 г, 6,7 ммоль, количественный). ЖХМС RT=0,75 мин, ES+ve m/z 345 [M+H]+.
(2S,4R)-N-((3,4-дигидро-2H-бензо[b][l,4]оксазин-2-ил)метил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид
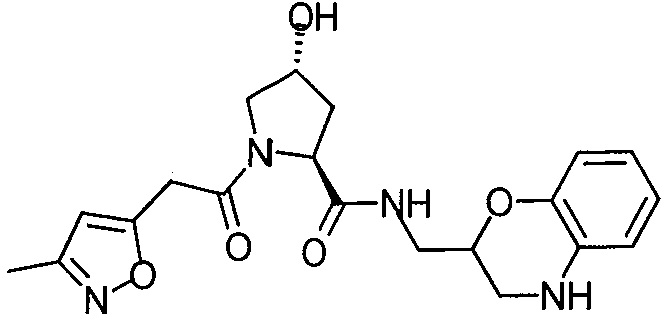 .
.
Раствор (2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновой кислоты (90 мг, 0,35 ммоль), (3,4-дигидро-2H-бензо[b][l,4]оксазин-2-ил)метанамина (коммерчески доступный, например, от фирмы Fluorochem) (58 мг, 0,35 ммоль) и DIPEA (0,155 мл, 0,89 ммоль) в ДМФ (2 мл) обрабатывали HATU (139 мг, 0,37 ммоль) и перемешивали в течение 1 часа. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (84 мг, 0,21 ммоль, 60%-ный выход) ЖХМС RT=0,61 мин, ES+ve m/z 401 [M+H]+.
(2S,4R)-N-(4-хлорбензил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид
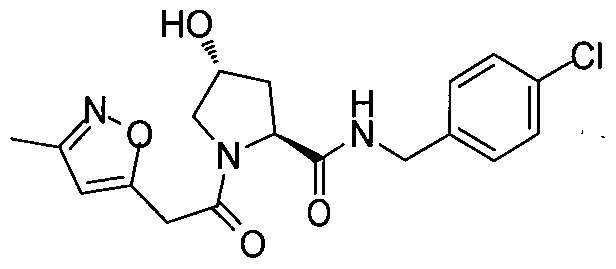 .
.
Раствор (4-хлорфенил)метанамина (коммерчески доступный, например, от фирмы Aldrich) (0,021 мл, 0,17 ммоль) и (2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновой кислоты (40 мг, 0,16 ммоль) в ДМФ (1 мл) обрабатывали DIPEA (0,082 мл, 0,47 ммоль), затем HATU (66 мг, 0,17 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (24 мг, 0,064 ммоль, 40%-ный выход). ЖХМС RT=0,73 мин, ES+ve m/z 378 [M+H]+.
(2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)-N-(4-(2-оксо-2,3-дигидробензо[d]оксазол-5-ил)бензил)пирролидин-2-карбоксамид
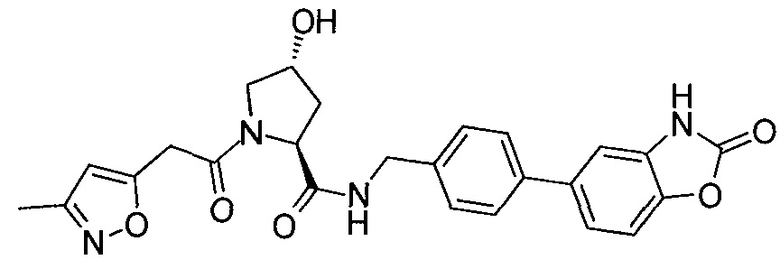 .
.
Смесь (2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновой кислоты (60 мг, 0,24 ммоль) и гидрохлорида 5-(4-(аминометил)фенил)бензо[d]оксазол-2(3H)-она (65 мг, 0,24 ммоль) в ДМФ (1,6 мл) обрабатывали DIPEA (0,124 мл, 0,71 ммоль) и HATU (99 мг, 0,26 ммоль), и смесь перемешивали в течение 30 минут. Продукт затем подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (64 мг, 0,13 ммоль, 57%-ный выход). ЖХМС RT=0,70 мин, ES+ve m/z 477 [M+H]+.
(2S,4R)-N-(1-(бензофуран-2-ил)этил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид
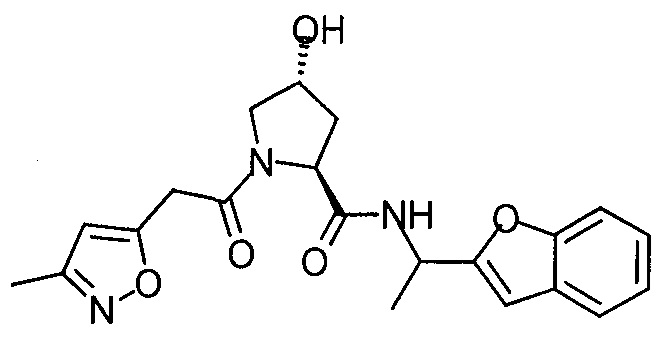 .
.
Перемешиваемый раствор (2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновой кислоты (90 мг, 0,35 ммоль), 1-(бензофуран-2-ил)этанамина (коммерчески доступный, например, от фирмы Enamine) (57 мг, 0,35 ммоль) и DIPEA (0,155 мл, 0,89 ммоль) в ДМФ (2 мл) обрабатывали HATU (139 мг, 0,37 ммоль). Через 1 час продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (91 мг, 0,21 ммоль, 65%-ный выход) ЖХМС RT=0,79 мин, ES+ve m/z 398 [M+H]+.
(2S,4R)-N-([1,1′-бифенил]-4-илметил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид
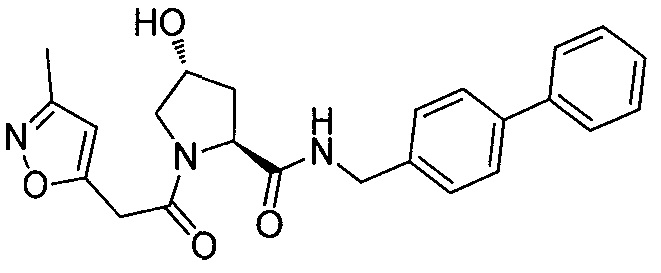 .
.
Перемешиваемую смесь (2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновую кислоту (30 мг, 0,12 ммоль) и [1,1′-бифенил]-4-илметанамин (коммерчески доступный, например, от фирмы Aldrich) (22 мг, 0,12 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,08 мл, 0,47 ммоль) и затем HATU (49 мг, 0,13 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (40 мг, 81%-ный выход). ЖХМС RT=0,86 мин, ES+ve m/z 420 [M+H]+.
Используя способ, аналогичный способу получения (2S,4R)-N-([1,1′-бифенил]-4-илметил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамида, получали следующие соединения:
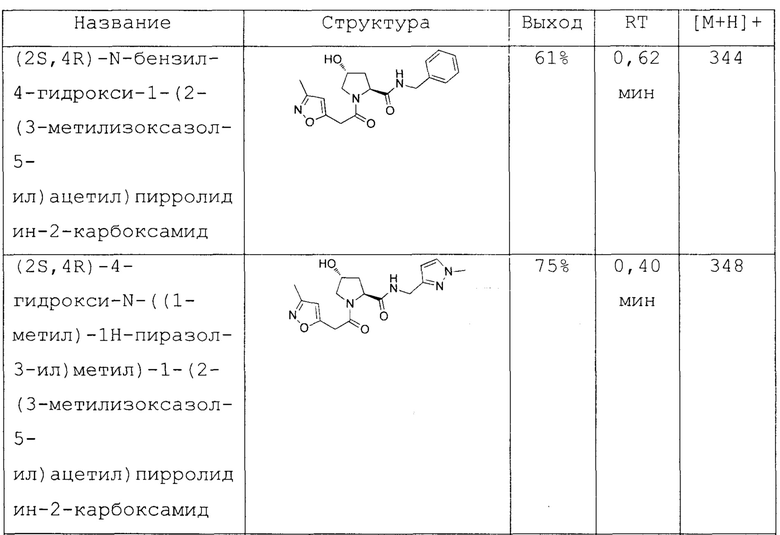
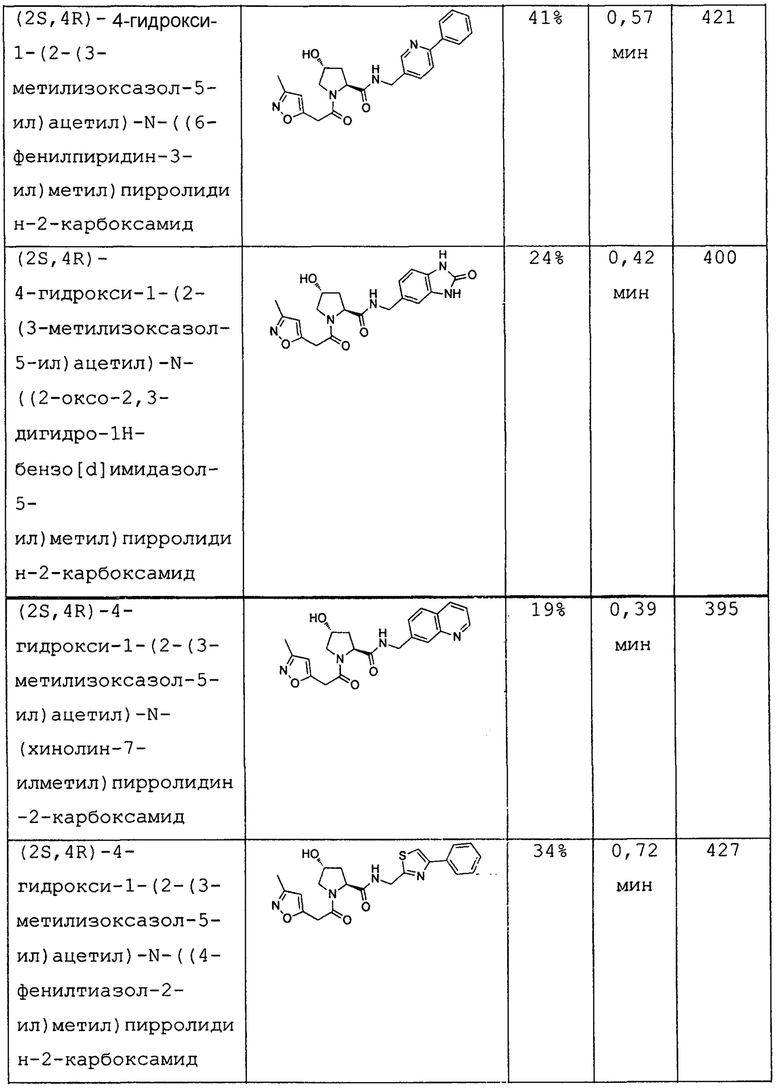
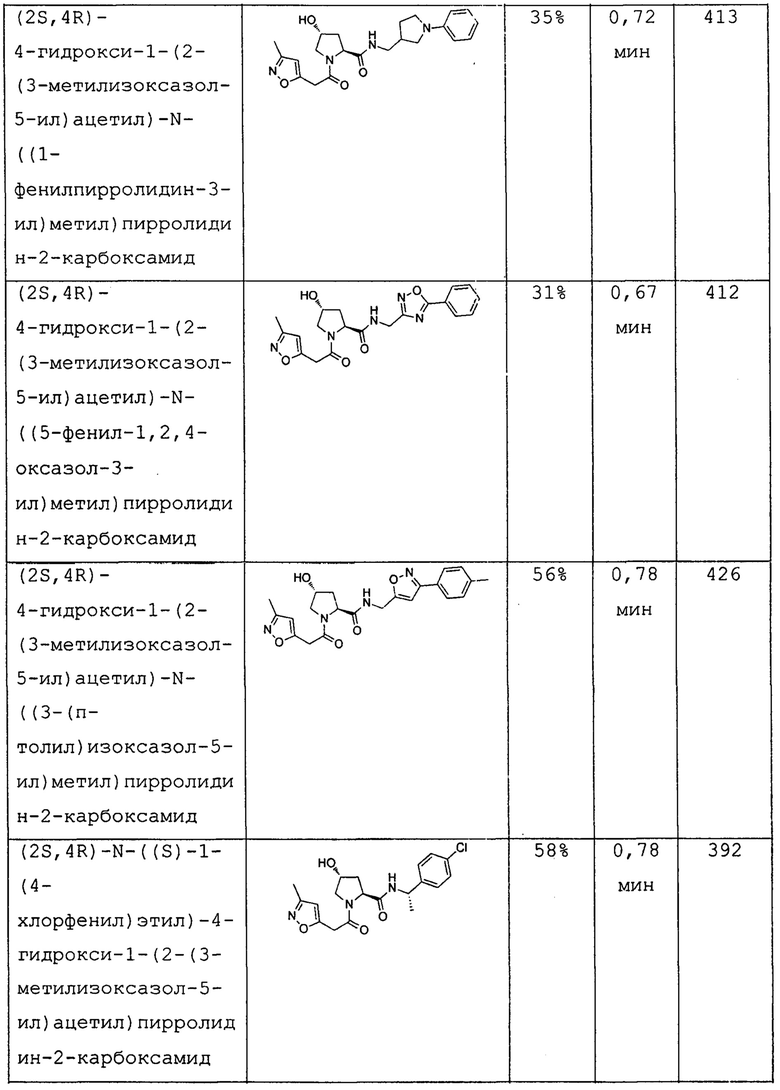
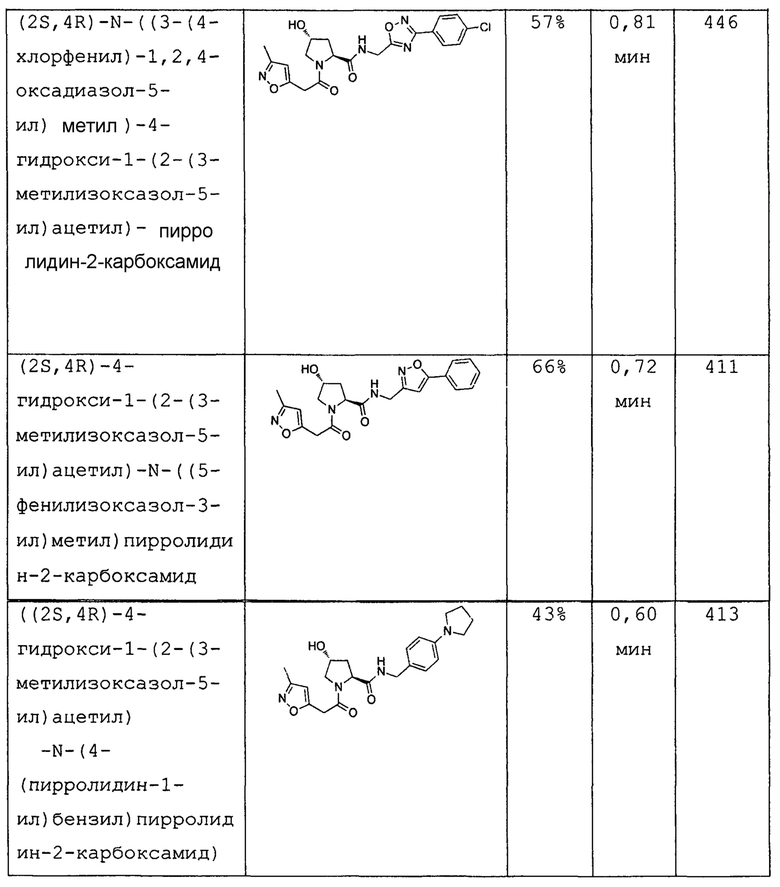
(2S,4R)-1-((S)-2-ацетамидопропаноил)-4-гидрокси-N-фенетилпирролидин-2-карбоксамид
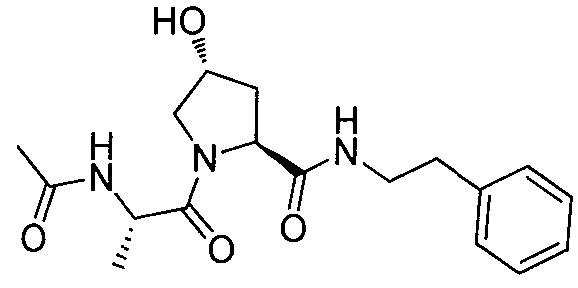 .
.
Перемешиваемую смесь (2S,4R)-1-((S)-2-ацетамидопропаноил)-4-гидроксипирролидин-2-карбоновой кислоты (24 мг, 0,10 ммоль) и 2-фенилэтанамина (коммерчески доступный, например, от фирмы Aldrich) (0,012 мл, 0,10 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,07 мл, 0,39 ммоль) и затем HATU (45 мг, 0,12 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматической препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (25 мг, 72%-ный выход). ЖХМС RT=0,56 мин, ES+ve m/z 348 [M+H]+.
Используя способ, аналогичный способу получения (2S,4R)-1-((S)-2-ацетамидопропаноил)-4-гидрокси-N-фенетилпирролидин-2-карбоксамида, получали следующие соединения:
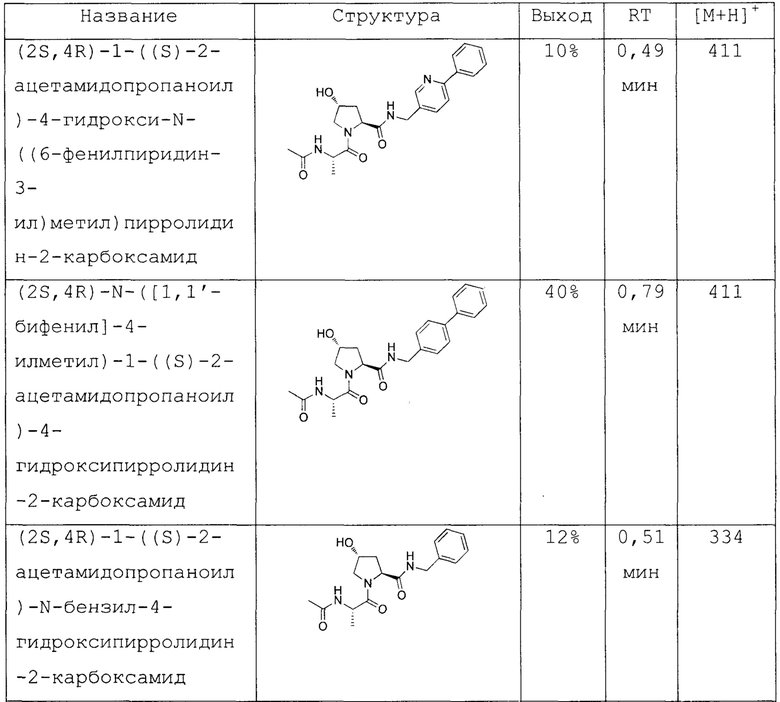
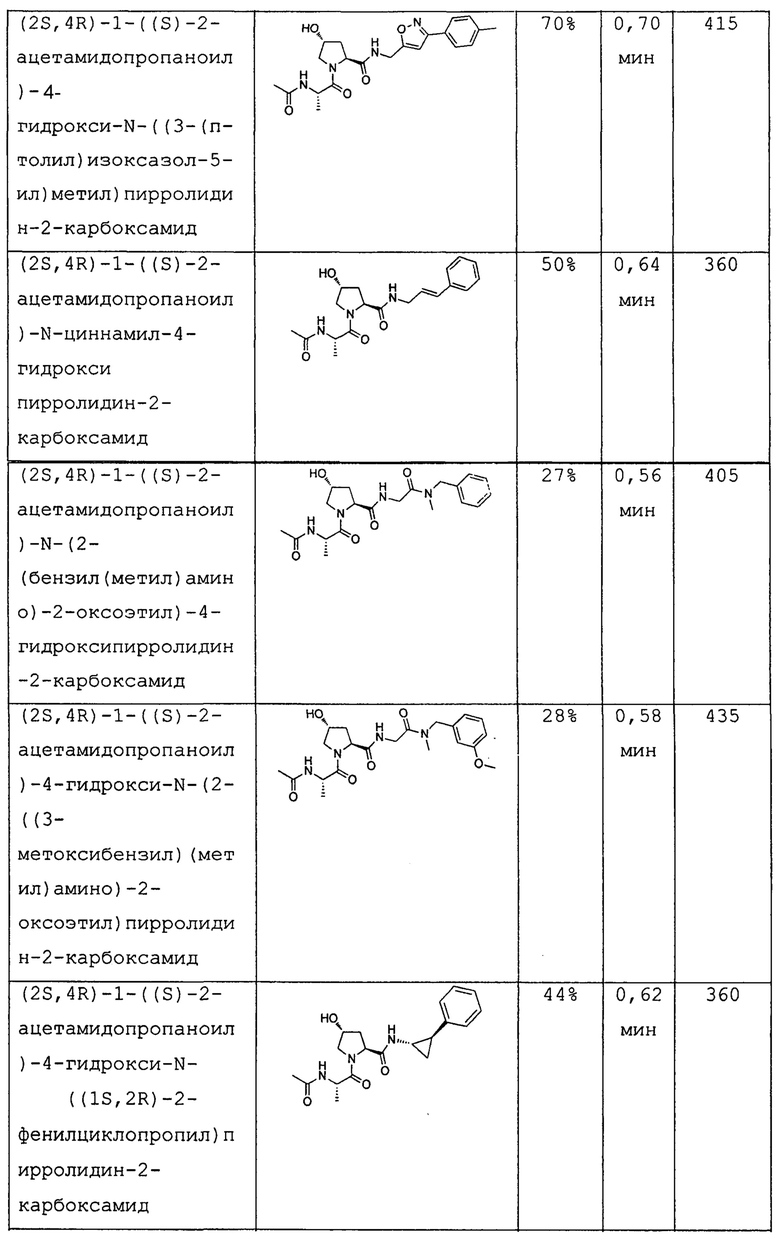
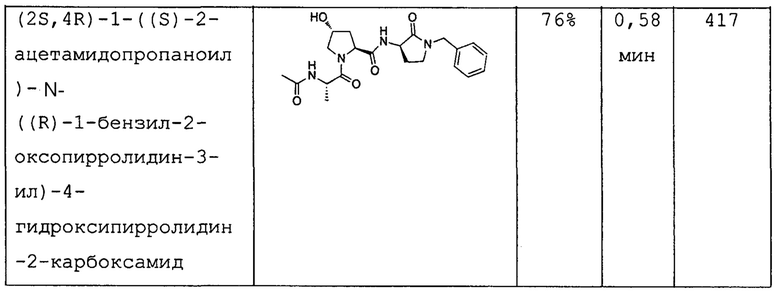
(S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил ацетат и (2S,4R)-1-ацетил-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
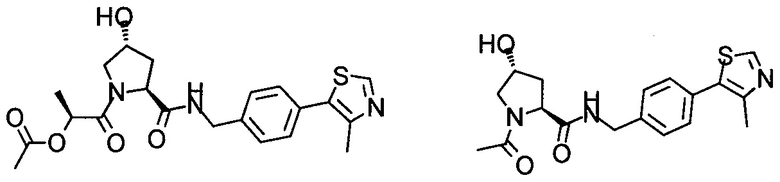 .
.
Охлаждаемую льдом смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (31 мг, 0,088 ммоль) и (S)-2-ацетоксипропановую кислоту (коммерчески доступную, например, от фирмы Aldrich) (8 мкл, 0,09 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,074 мл, 0,42 ммоль). Затем по частям в течение 10 минут добавляли HATU (34 мг, 0,088 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Продукты разделяли и очищали с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением (S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил ацетата (15 мг, 0,035 ммоль, 41%-ный выход) ЖХМС RT=0,64 мин, ES+ve m/z 432 [M+H]+ и (2S,4R)-1-ацетил-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (9 мг, 0,025 ммоль, 30%-ный выход) ЖХМС RT=0,57 мин, ES+ve m/z 360 [M+H]+.
(2S,4R)-1-(2-(цианометил)бензоил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
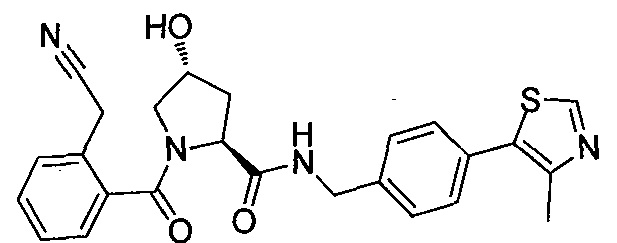 .
.
Перемешиваемую смесь (2S,4R)-4-гидрокси-N-(4-(тиазол-5-ил)бензил)пирролидин-2-карбоксамида (50 мг, 0,17 ммоль) и 2-(цианометил)бензойной кислоты (коммерчески доступная, например, от фирмы Aldrich) (29 мг, 0,18 ммоль) в ДМФ (0,7 мл) обрабатывали DIPEA (0,086 мл, 0,49 ммоль) и затем HATU (69 мг, 0,18 ммоль), и смесь перемешивали при комнатной температуре в течение 10 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (31 мг, 0,067 ммоль, 41%-ный выход). ЖХМС RT=0,73 мин, ES+ve m/z 461 [M+H]+.
Используя способ, аналогичный способу получения (2S,4R)-1-(2-(цианометил)бензоил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида, получали следующие соединения:
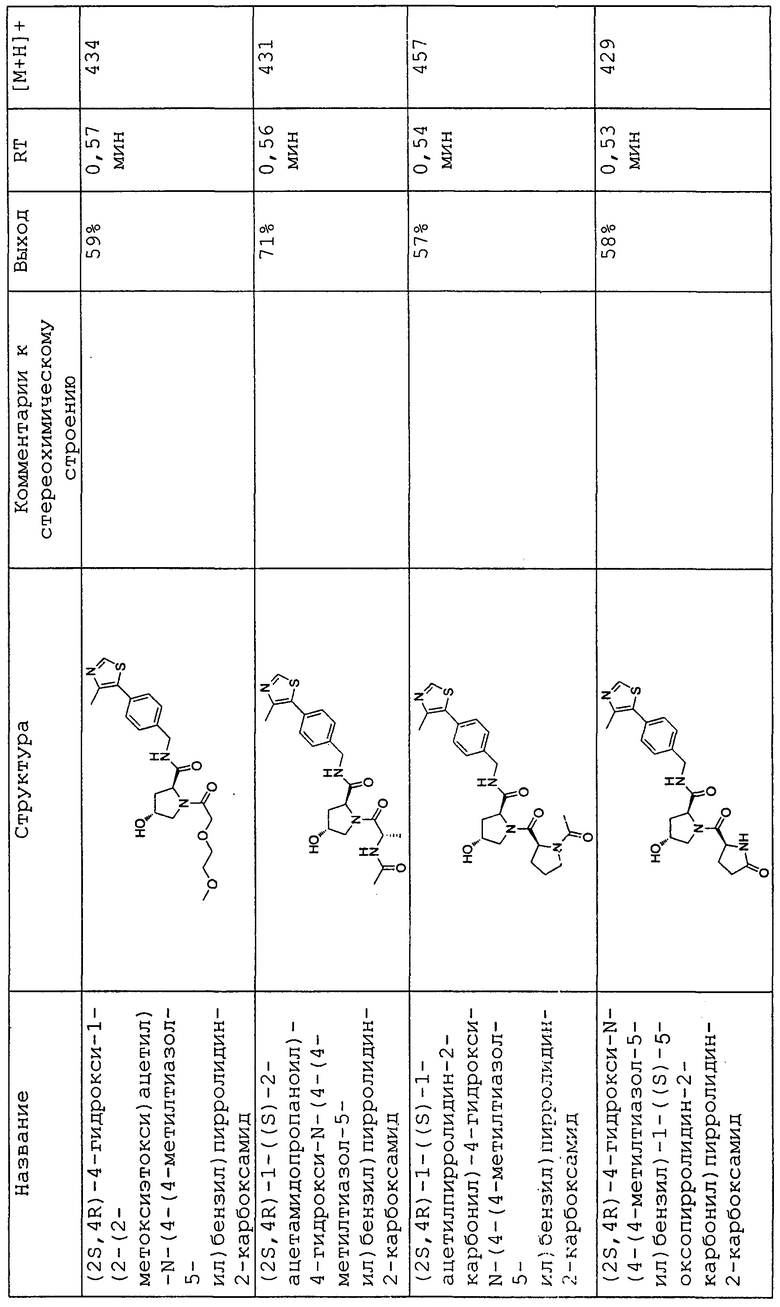
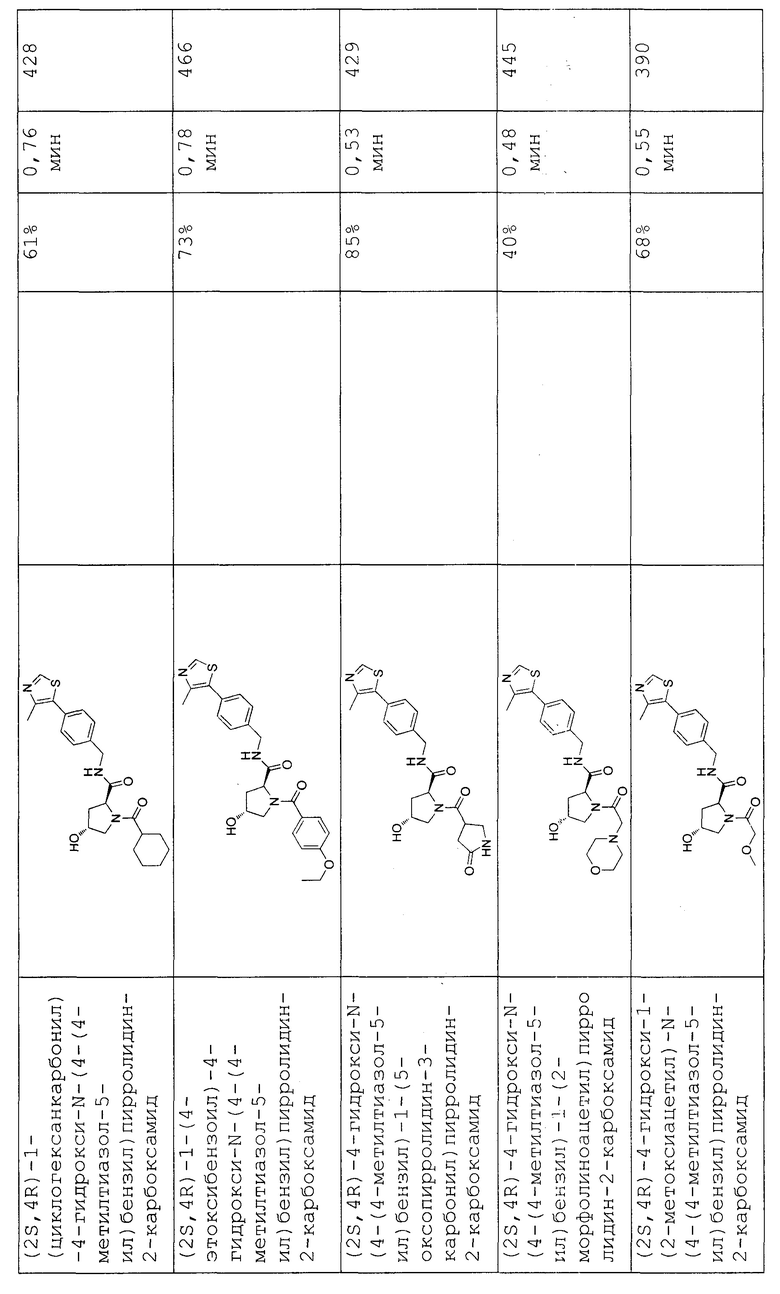
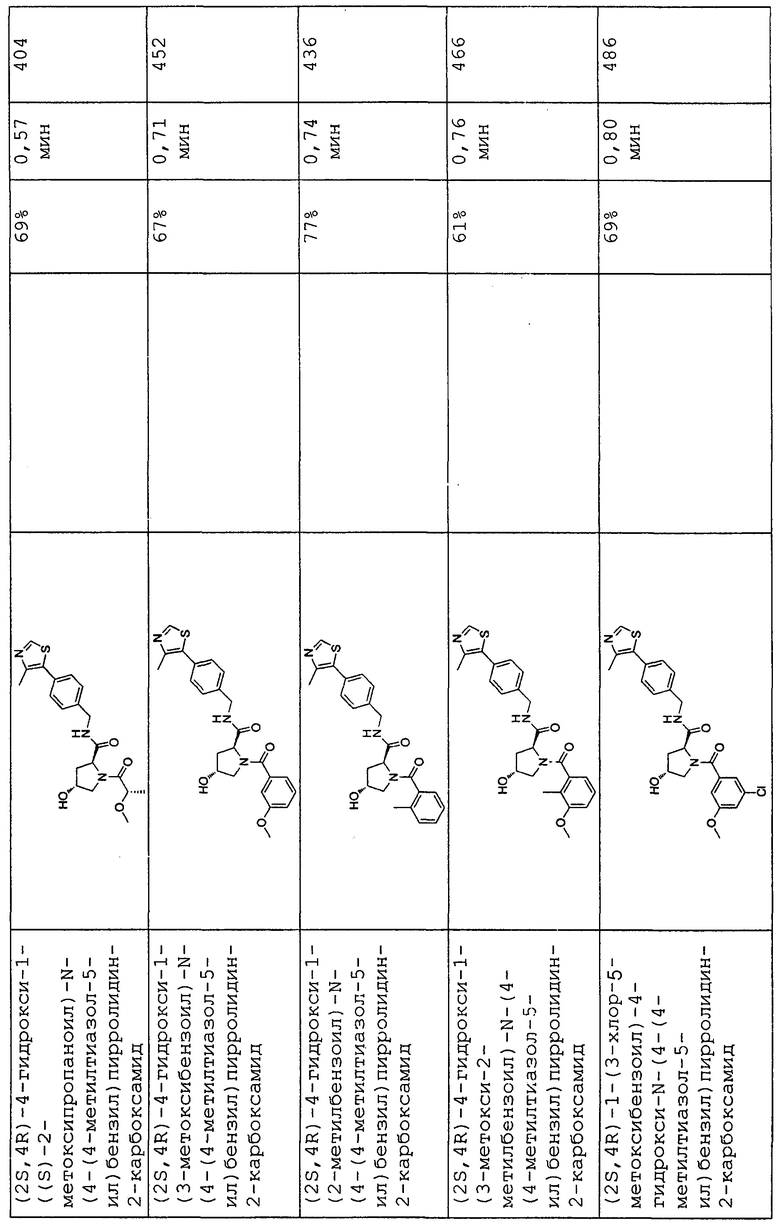

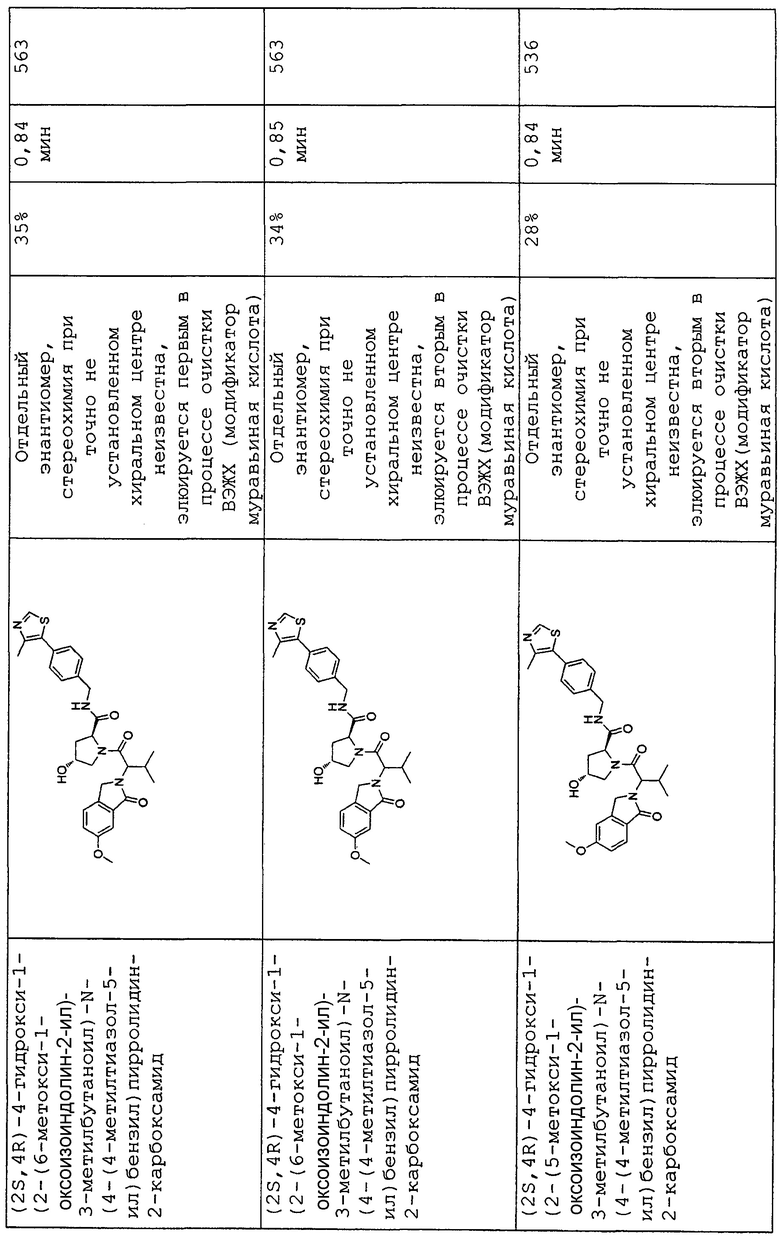
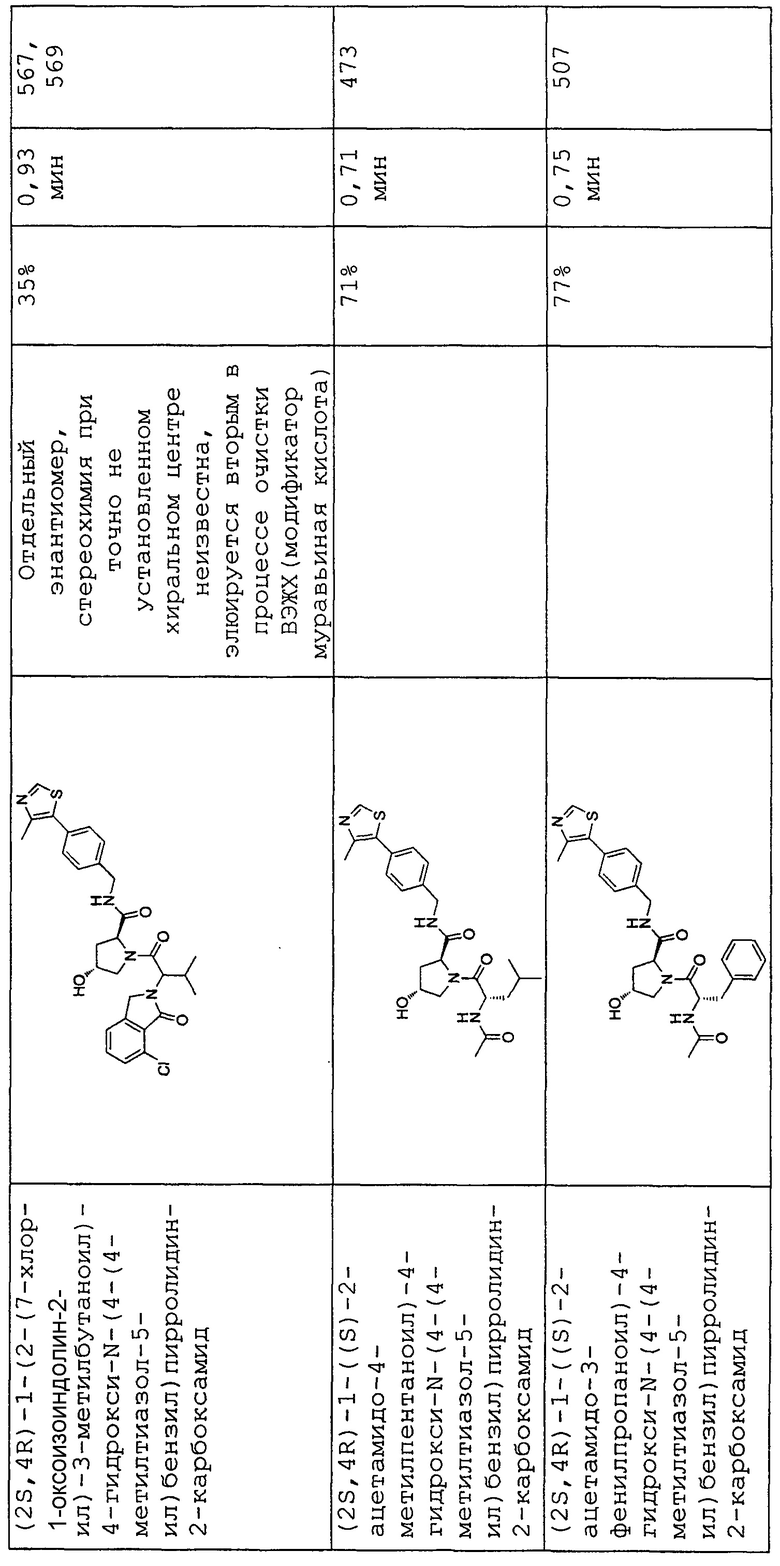
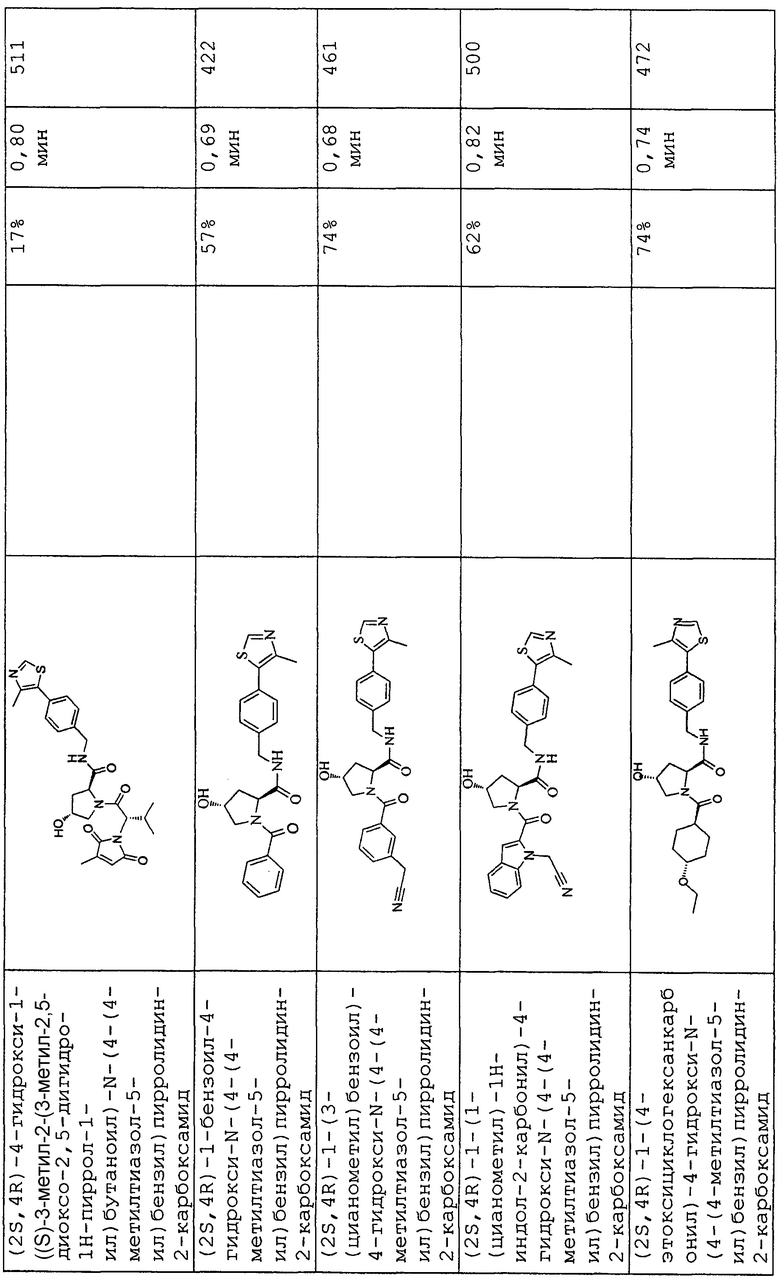
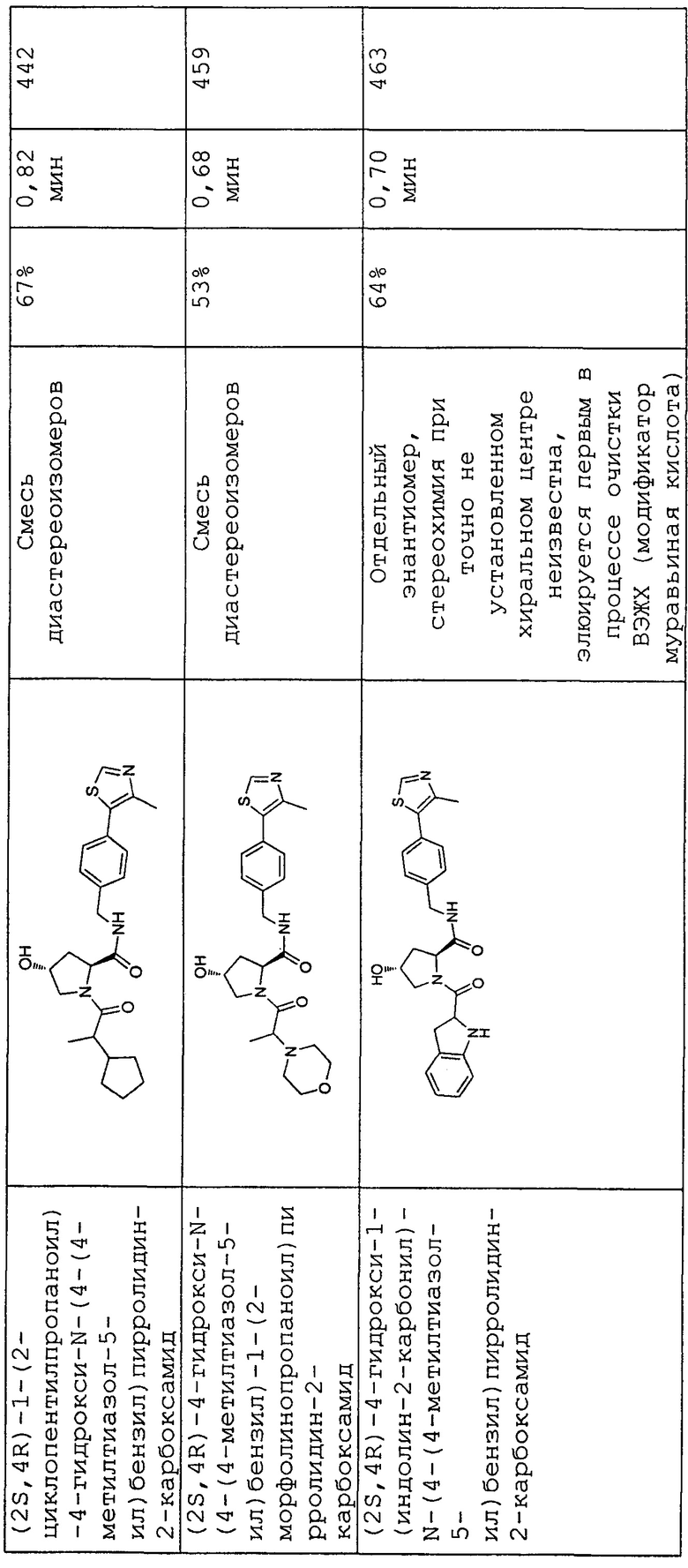
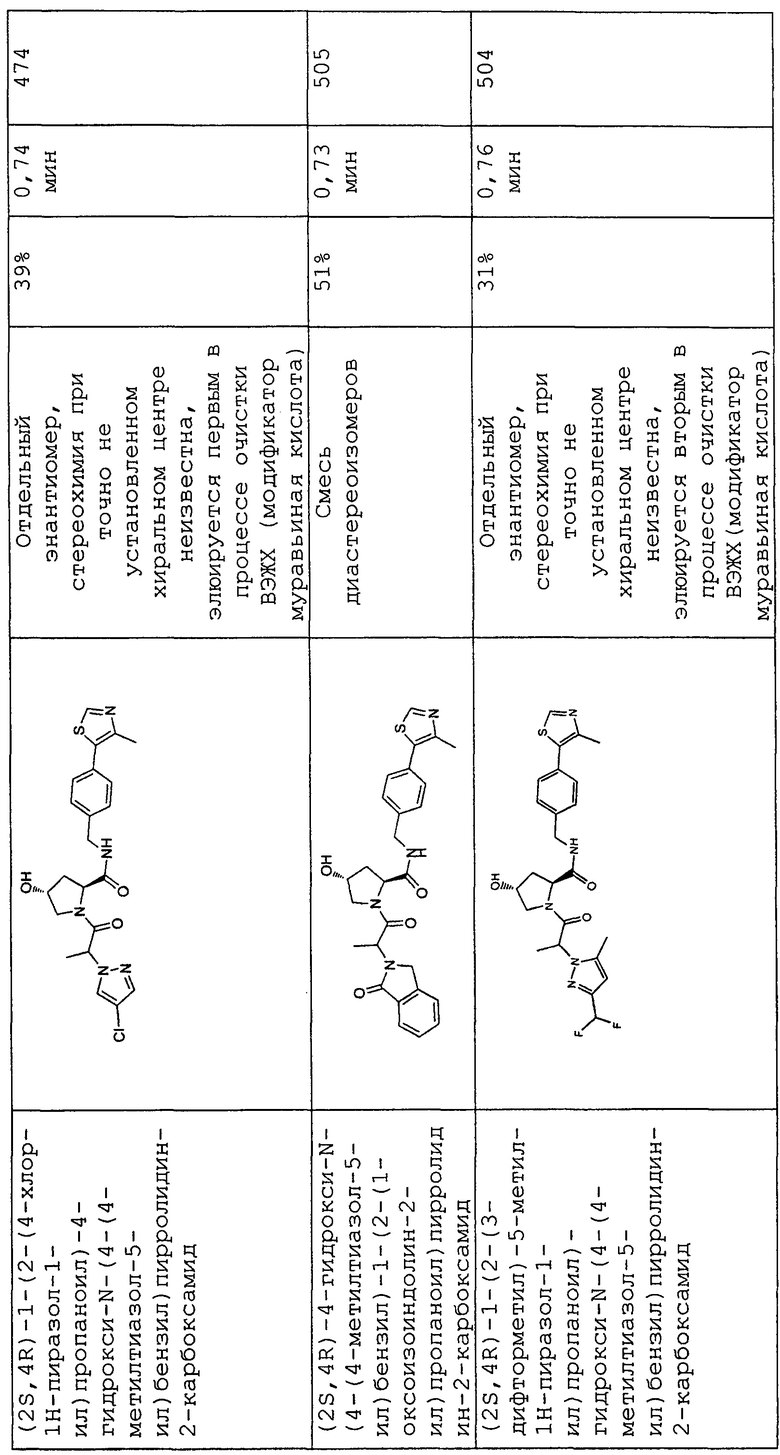
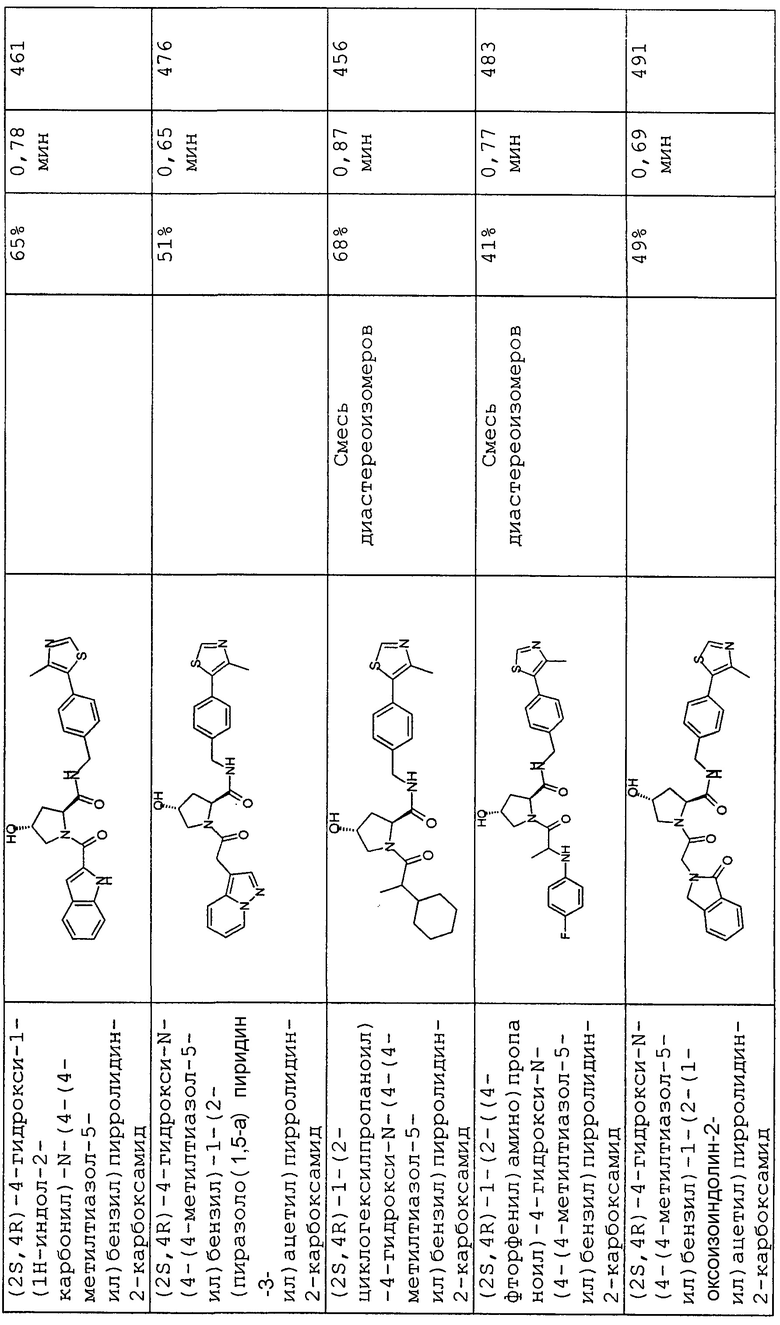
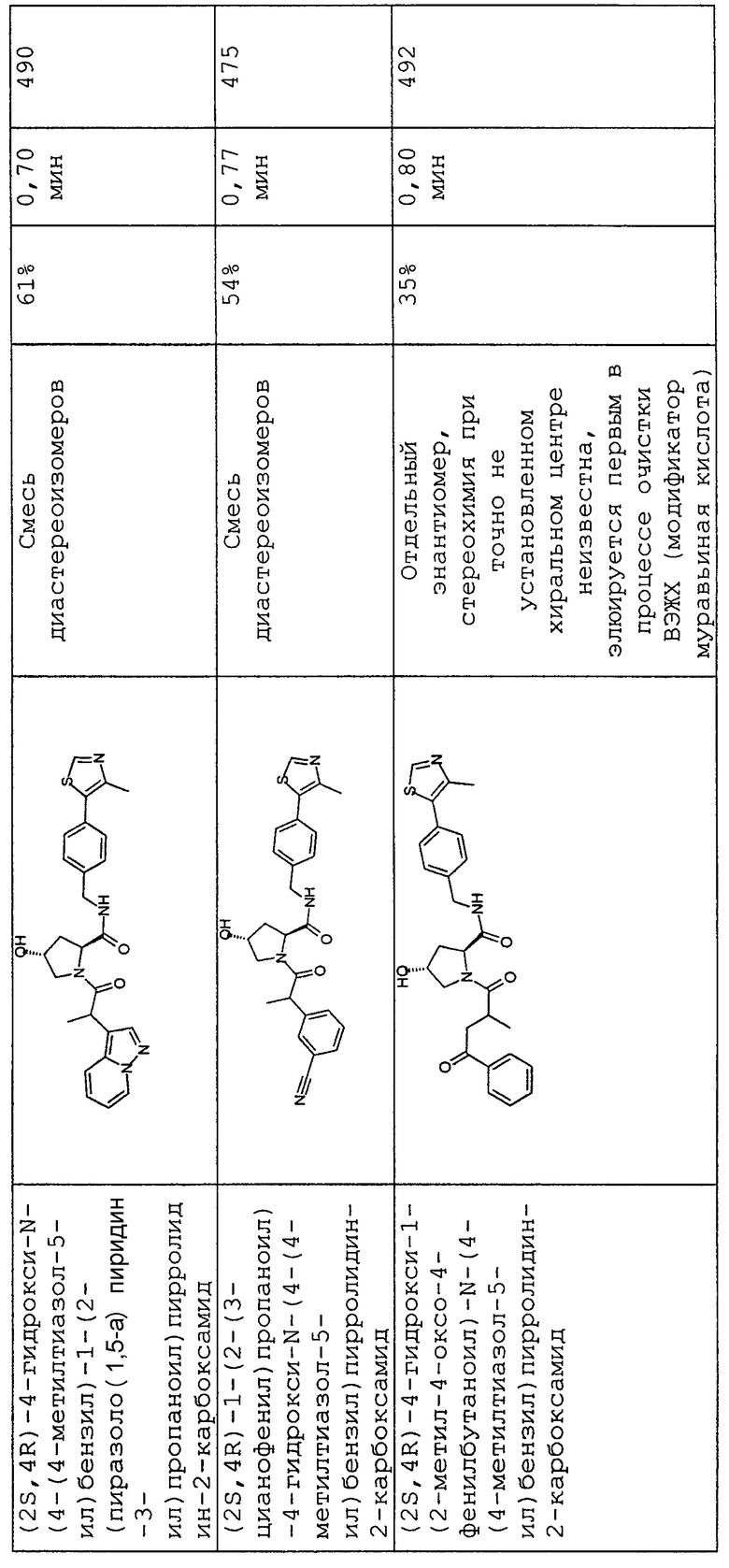
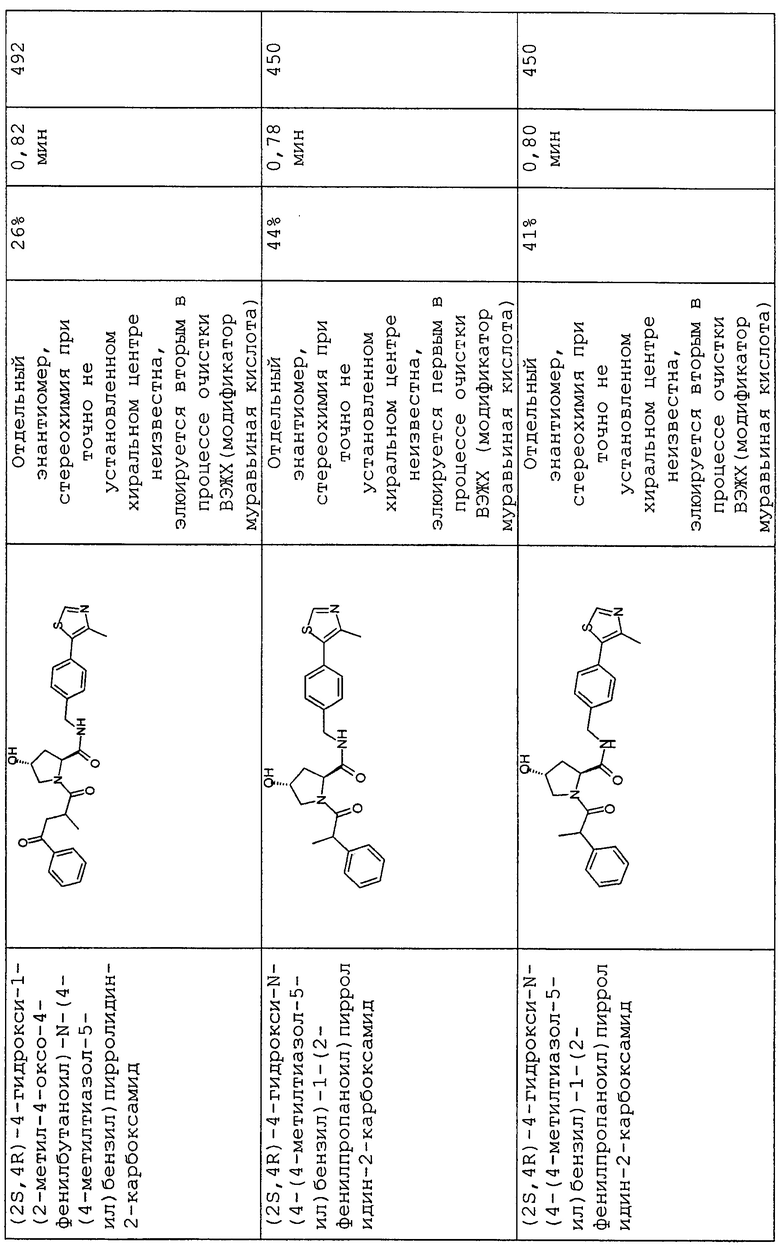
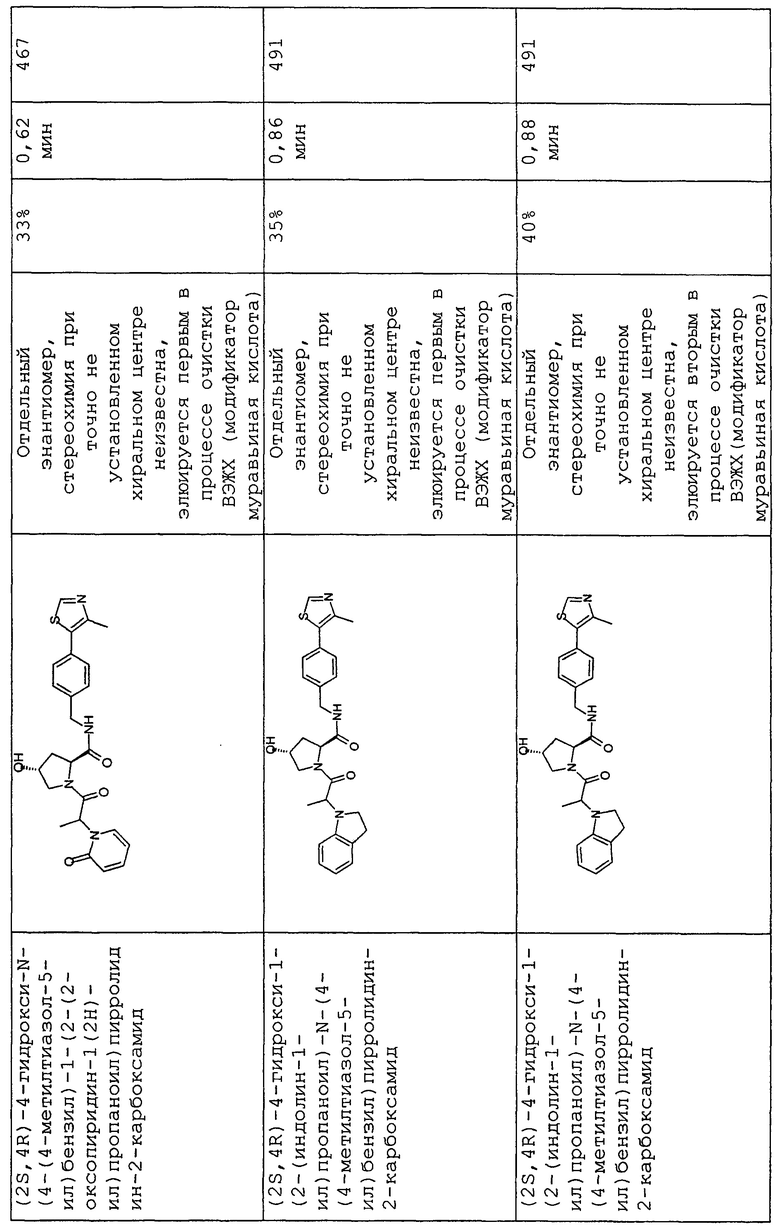
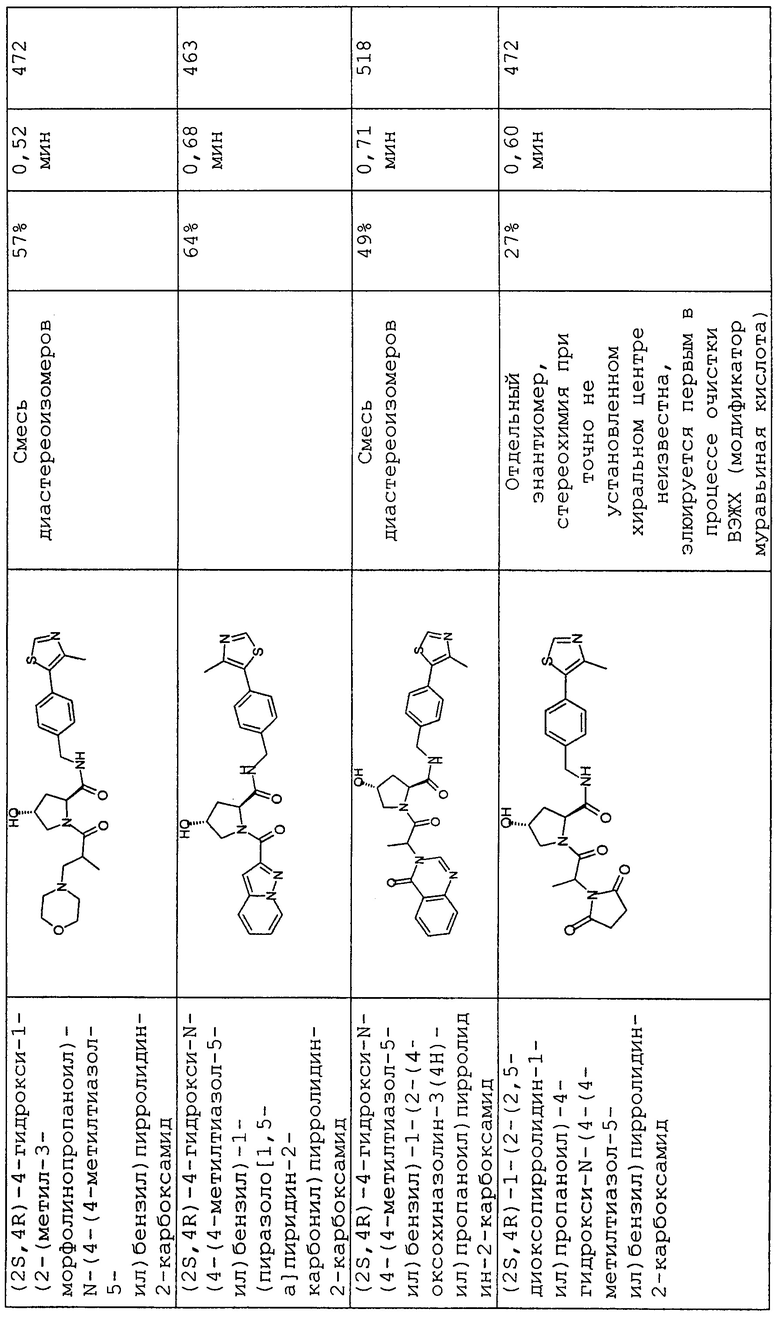
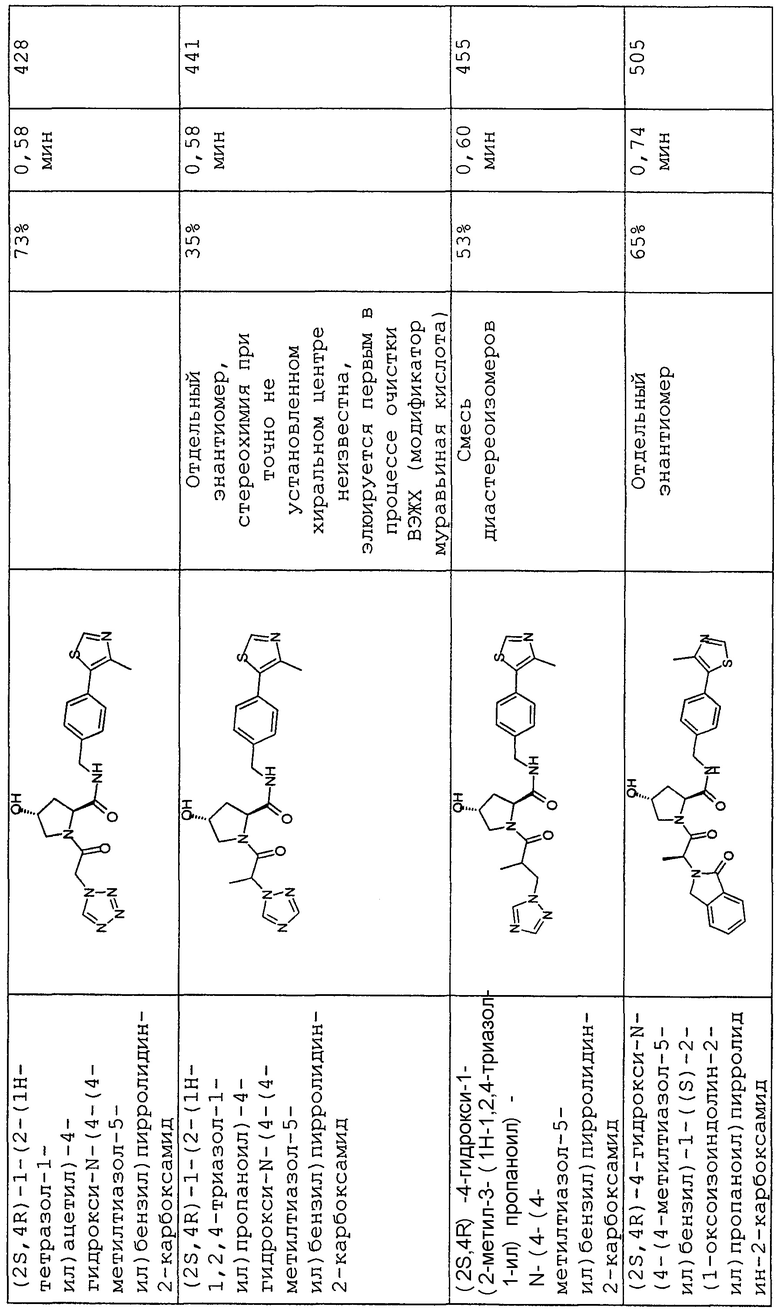
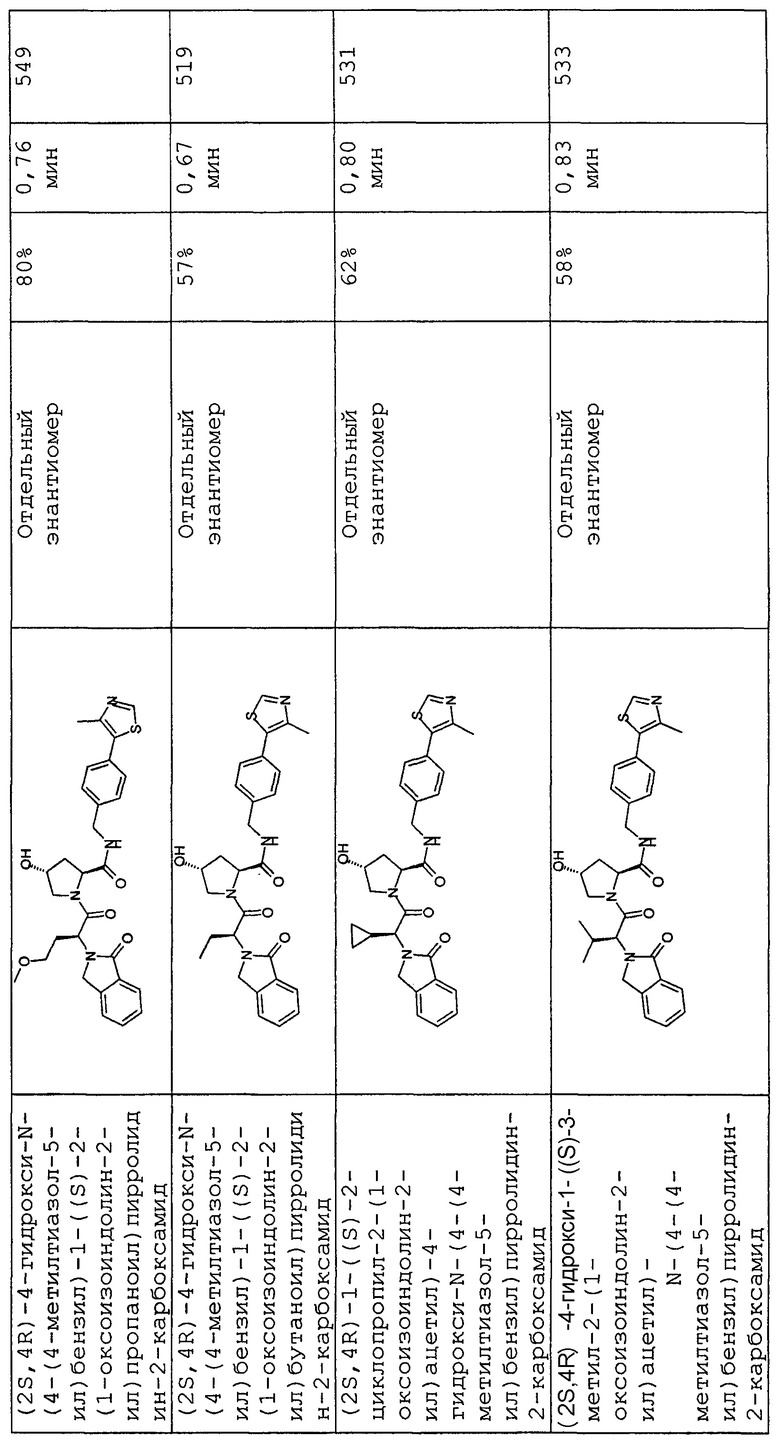
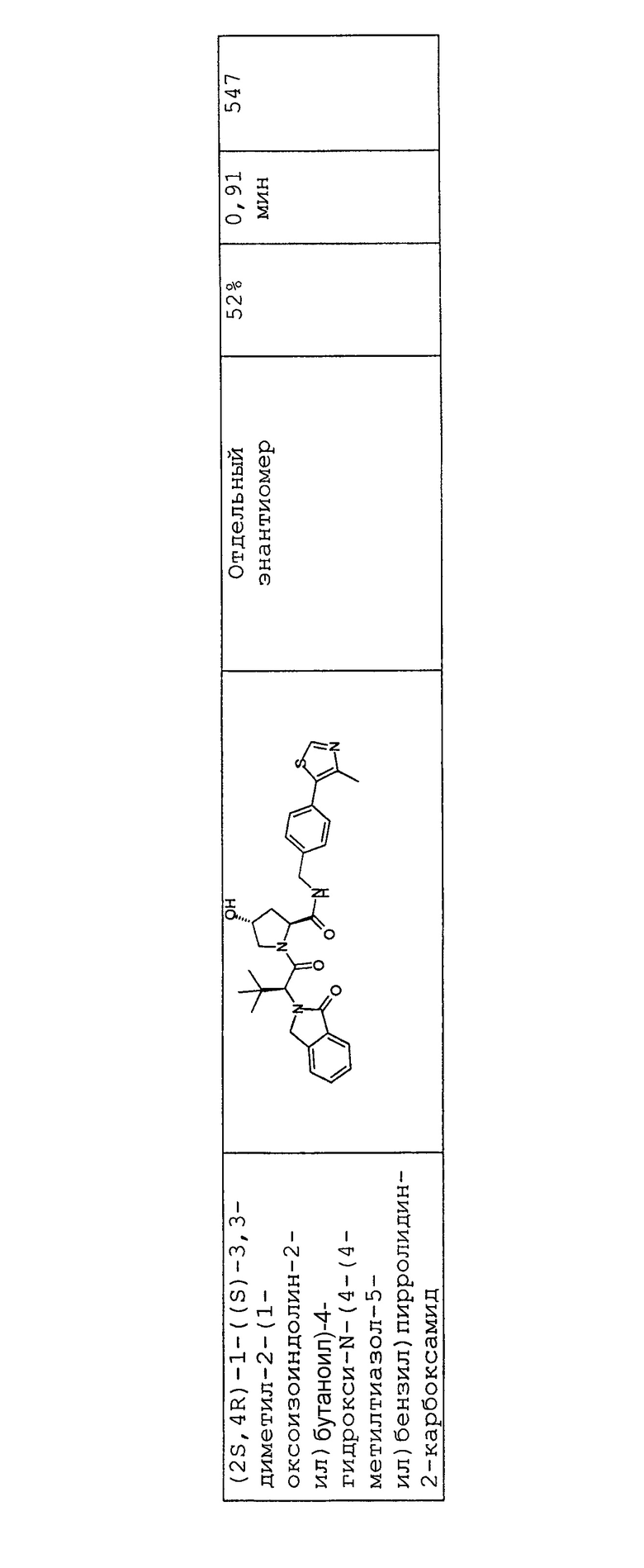
3-(2-(2-(2-(3-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбонил)фенокси)этокси)этокси)этокси)пропановая кислота
 .
.
Охлаждаемую льдом смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (682 мг, 2,2 ммоль), 3-((14,14-диметил-12-оксо-3,6,9,13-тетраоксапентадецил)окси)бензойной кислоты (778 мг, 2,0 ммоль), DIPEA (1,36 мл, 7,8 ммоль) в ДМФ (12 мл) обрабатывали HATU (817 мг, 2,2 ммоль). Смеси давали нагреться до комнатной температуры и перемешивали в течение 30 минут, затем обрабатывали водой (70 мл) и экстрагировали этилацетатом (3×70 мл). Объединенную органическую фазу промывали насыщенным водным раствором бикарбоната натрия (100 мл), водой (100 мл), насыщенным солевым раствором (100 мл), сушили над сульфатом магния, фильтровали и упаривали досуха. Сырой продукт растворяли в дихлорметане (6 мл) и обрабатывали ТФУ (2,0 мл). Через 1 час реакционную смесь упаривали досуха, и продукт очищали с помощью флэш-хроматографии (60 г C18 картридж) с использованием градиентного элюирования от 10 до 95% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (568 мг, 45%-ный выход). ЖХМС RT=0,73 мин, ES+ve m/z 642 [M+H]+.
(2S,4R)-4-гидрокси-1-(3-(2-метоксиэтокси)бензоил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
 .
.
Смесь (2S,4R)-4-гидрокси-1-(3-гидроксибензоил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (55 мг, 0,13 ммоль) и карбоната калия (55 мг, 0,40 ммоль) в ДМФ (0,8 мл) обрабатывали 1-бром-2-метоксиэтаном (коммерчески доступный, например, от фирмы Aldrich) (0,024 мл, 0,25 ммоль) и перемешивали при температуре 50°C в течение 2,5 часов. Добавляли еще 1-бром-2-метоксиэтан (0,024 мл, 0,25 ммоль) и смесь перемешивали при температуре 50°C в течение ночи. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (41 мг, 0,083 ммоль, 66%-ный выход) ЖХМС RT=0,74 мин, ES+ve m/z 496 [M+H]+
(2S,4R)-4-гидрокси-1-(3-(2-(2-метоксиэтокси)этокси)бензоил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
 .
.
Смесь (2S,4R)-4-гидрокси-1-(3-гидроксибензоил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (55 мг, 0,13 ммоль) и карбоната калия (55 мг, 0,40 ммоль) в ДМФ (0,8 мл) обрабатывали 1-бром-2-(2-метоксиэтокси)этаном (коммерчески доступный, например, от фирмы Aldrich) (0,034 мл, 0,25 ммоль), и реакционную смесь перемешивали при температуре 50°C в течение 2,5 часов. Добавляли еще 1-бром-2-(2-метоксиэтокси)этан (0,034 мл, 0,25 ммоль) и смесь перемешивали при температуре 50°C в течение ночи. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (40 мг, 0,074 ммоль, 59%-ный выход) ЖХМС RT=0,74 мин, ES+ve m/z 540 [M+H]+.
(2S,4R)-1-((S)-2-((S)-2-ацетамидо-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
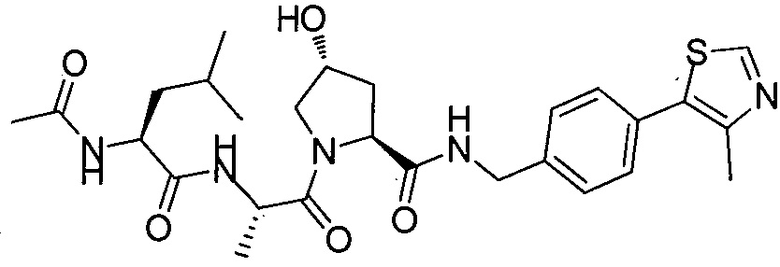 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-1-((S)-2-аминопропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (50 мг, 0,12 ммоль) и (S)-2-ацетамидо-4-метилпентановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (22 мг, 0,12 ммоль) в ДМФ (0,7 мл) обрабатывали DIPEA (0,062 мл, 0,35 ммоль) и затем HATU (49 мг, 0,13 ммоль), и смесь перемешивали при комнатной температуре в течение 10 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (42 мг, 0,077 ммоль, 66%-ный выход). ЖХМС RT=0,68 мин, ES+ve m/z 544 [M+H]+.
(2S,4R)-1-((S)-2-ацетамидо-3-метилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
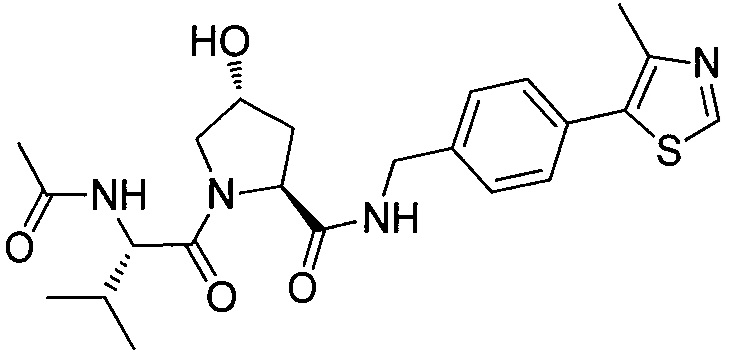 .
.
Раствор трет-бутил ((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3-метил-1-оксобутан-2-ил)карбамата (120 мг, 0,23 ммоль) в дихлорметане (2 мл) и обрабатывали 4M соляной кислотой в 1,4-диоксане (1 мл). Смесь перемешивали при комнатной температуре в течение 30 минут и далее упаривали досуха. Остаток растворяли в ДМФ (1 мл) и обрабатывали триэтиламином (0,08 мл, 0,58 ммоль), затем уксусным ангидридом (0,02 мл, 0,21 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Продукт подвергали очистке с помощью масс-направленной автоматической препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (53 мг, 49%-ный выход). ЖХМС RT=0,65 мин, ES+ve m/z 460 [M+H]+.
Используя способ, аналогичный способу получения (2S,4R)-1-((S)-2-ацетамидо-3-метилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида, получали следующие соединения:
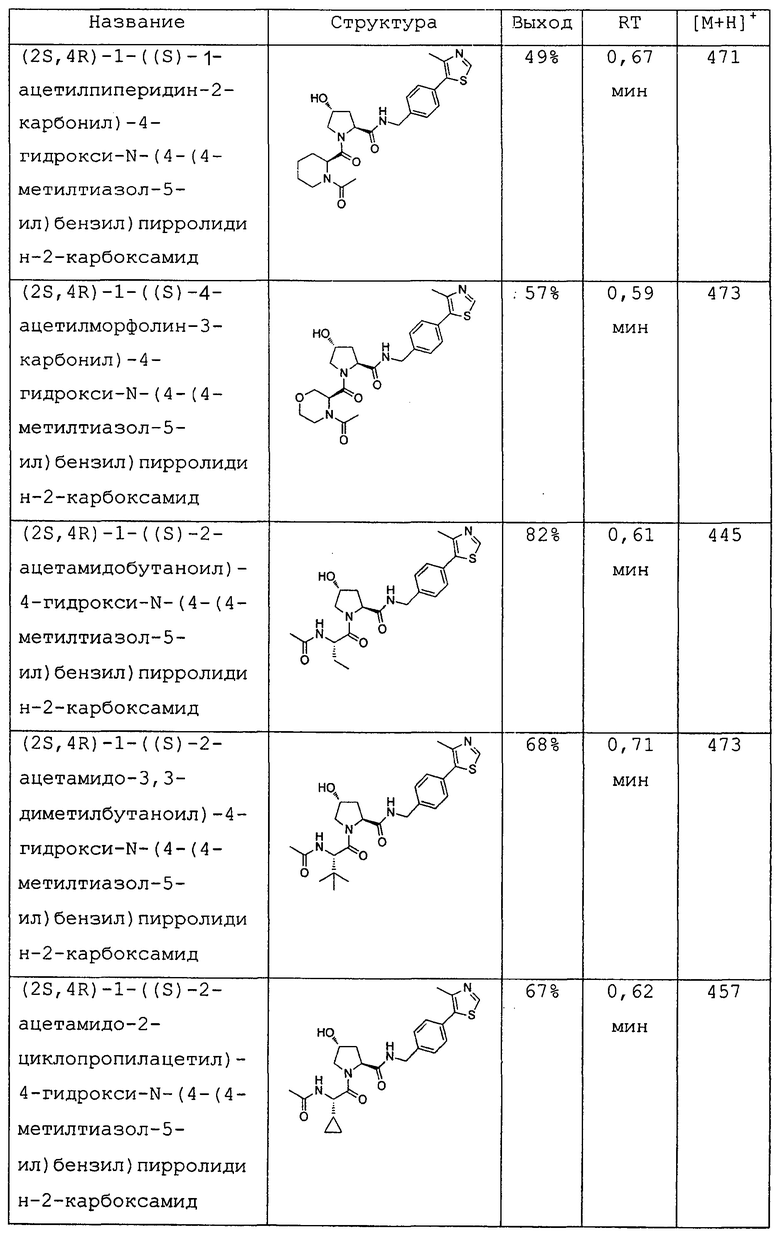
(2S,4R)-1-((S)-2-(3-этокси-N-метилбензамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
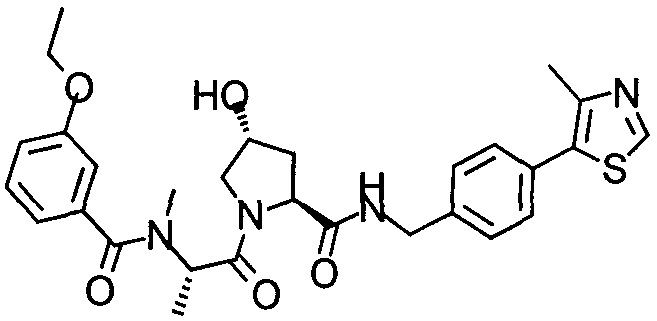 .
.
Смесь (2S,4R)-4-гидрокси-1-((S)-2-(метиламино)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (20 мг, 0,05 ммоль), DIPEA (0,043 мл, 0,25 ммоль) и 3-этокси бензойной кислоты (коммерчески доступная, например, от фирмы Aldrich) (8 мг, 0,05 ммоль) в ДМФ (1 мл) обрабатывали HATU (19 мг, 0,05 ммоль) и смесь перемешивали в течение 20 минут. Продукт очищали с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (14 мг, 0,025 ммоль, 50%-ный выход). ЖХМС RT=0,82 мин, ES+ve m/z 551 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-(3-метоксипропанамидо)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
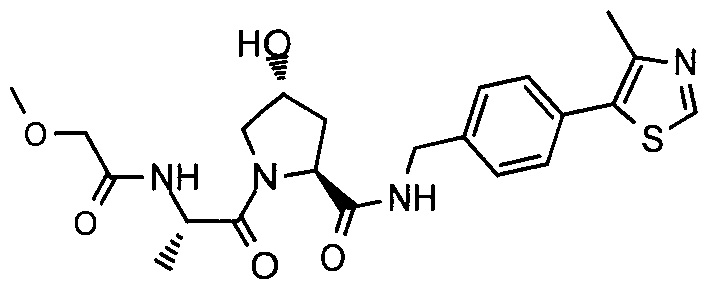 .
.
Раствор смеси гидрохлорида (2S,4R)-1-((S)-2-аминопропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (107 мг, 0,25 ммоль), 3-метоксипропионовой кислоты (коммерчески доступная, например, от фирмы Aldrich) (0,028 мл, 0,30 ммоль) и DIPEA (0,2 мл, 1,15 ммоль) в сухом ДМФ (3 мл) обрабатывали HATU (115 мг, 0,30 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. Смесь помещали на предварительно промытый метанолом аминопропиловый картридж для твердофазной экстракции (2 г), который элюировали метанолом (3 объема колонки). Полученный элюент упаривали досуха, и продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (57 мг, 0,12 ммоль, 48%-ный выход). ЖХМС RT=0,62 мин, ES+ve m/z 475 [M+H]+.
(2S,4R)-4-гидрокси-1-(2-(3-метоксипропанамидо)-2-метилпропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
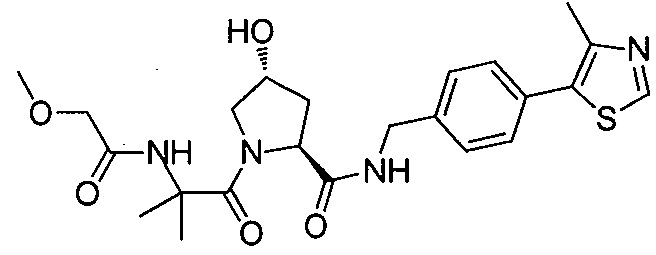 .
.
Раствор смеси (2S,4R)-1-(2-амино-2-метилпропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (95 мг, 0,24 ммоль), 3-метоксипропионовой кислоты (0,028 мл, 0,30 ммоль) и DIPEA (0,2 мл, 1,15 ммоль) в сухом ДМФ (3 мл) обрабатывали HATU (115 мг, 0,30 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Смесь помещали на предварительно промытый метанолом аминопропиловый картридж для твердофазной экстракции (NH2), который элюировали метанолом (3 объема колонки). Полученный элюент упаривали досуха, и продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (45 мг, 0,09 ммоль, 37%-ный выход). ЖХМС RT=0,68 мин, ES+ve m/z 489 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-(2-метоксиацетамидо)-3-метилбутаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
 .
.
Смесь гидрохлорида (2S,4R)-1-((S)-2-амино-3-метилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (20 мг, 0,044 ммоль), 2-метоксиуксусной кислоты (3 мкл, 0,039 ммоль) и DIPEA (0,035 мл, 0,20 ммоль) в ДМФ (1 мл) обрабатывали HATU (18 мг, 0,047 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (14 мг, 0,029 ммоль, 73%-ный выход). ЖХМС RT=0,70 мин, ES+ve m/z 489 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-(2-метокси-N-метилацетамидо)-3-метилбутаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
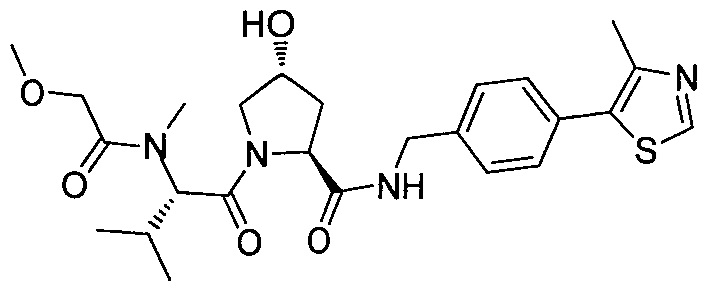 .
.
Смесь гидрохлорида (2S,4R)-4-гидрокси-1-((S)-3-метил-2-(метиламино)бутаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (19 мг, 0,041 ммоль), 2-метоксиуксусной кислоты (3 мкл, 0,039 ммоль) и DIPEA (0,035 мл, 0,20 ммоль) в ДМФ (1 мл) обрабатывали HATU (18 мг, 0,047 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (16 мг, 0,032 ммоль, 81%-ный выход). ЖХМС RT=0,70 мин, ES+ve m/z 503 [M+H]+.
(2S,4R)-1-((S)-2-(N,3-диметилоксетан-3-карбоксамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
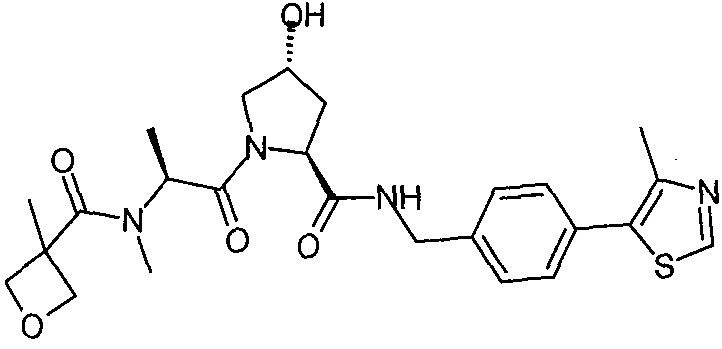 .
.
Смесь (2S,4R)-4-гидрокси-1-((S)-2-(метиламино)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (15 мг, 0,037 ммоль), DIPEA (0,032 мл, 0,18 ммоль) и 3-метилоксетан-3-карбоновой кислоты (коммерчески доступная, например, от фирмы Fluorochem) (3 мкл, 0,037 ммоль) в ДМФ (1 мл) обрабатывали HATU (14 мг, 0,037 ммоль), и смесь перемешивали в течение 1 часа. Продукт очищали с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (9 мг, 0,019 ммоль, 51%-ный выход). ЖХМС RT=0,62 мин, ES+ve m/z 501 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-(3-метилоксетан-3-карбоксамидо)пропаноил)--N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
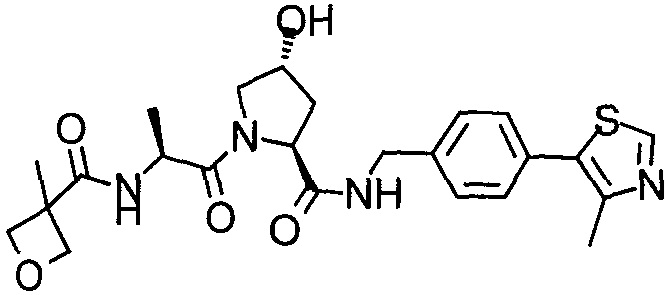 .
.
Перемешиваемую смесь (2S,4R)-1-((S)-2-аминопропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (21 мг, 0,043 ммоль), DIPEA (0,043 мл, 0,25 ммоль) и 3-метилоксетан-3-карбоновой кислоты (коммерчески доступная, например, от фирмы Fluorochem) (6 мг, 0,05 ммоль) в ДМФ (2 мл) обрабатывали HATU (19 мг, 0,05 ммоль) и перемешивали в течение 30 минут. Продукт очищали с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (14 мг, 0,029 ммоль, 60%-ный выход). ЖХМС RT=0,59 мин, ES+ve m/z 487 [M+H]+.
(2S,4R)-1-((S)-2-(3-этоксибензамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
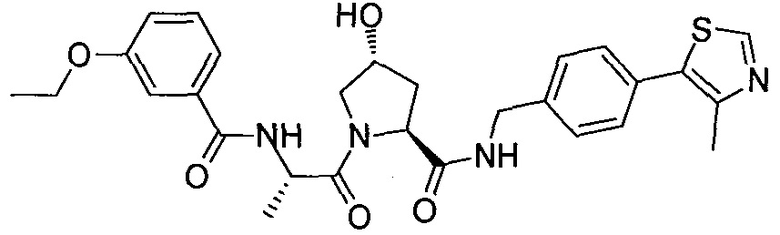 .
.
Перемешиваемую смесь 3-этоксибензойной кислоты (коммерчески доступная, например, от фирмы Aldrich) (20 мг, 0,12 ммоль) и гидрохлорида (2S,4R)-1-((S)-2-аминопропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (56 мг, 0,13 ммоль) в ДМФ (3,2 мл) обрабатывали DIPEA (0,063 мл, 0,36 ммоль) и затем HATU (50 мг, 0,13 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт затем подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (36 мг, 0,067 ммоль, 56%-ный выход). ЖХМС RT=0,80 мин, ES+ve m/z 537 [M+H]+.
(2S,4R)-N-((lH-индол-3-ил)метил)-4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоксамид
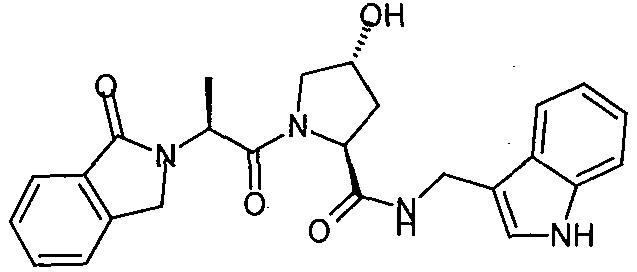 .
.
Раствор (2S,4R)-4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоновой кислоты (10 мг, 0,031 ммоль), DIPEA (0,038 мл, 0,22 ммоль) и (lH-индол-3-ил)метанамина (коммерчески доступный, например, от фирмы Fluorochem) (6 мг, 0,041 ммоль) в ДМФ (0,8 мл) обрабатывали HATU (15 мг, 0,039 ммоль) и перемешивали в течение 1 часа. Продукт очищали с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (3,1 мг, 6,9 мкмоль, 22%-ный выход). ЖХМС RT=0,75 мин, ES+ve m/z 447 [M+H]+.
(2S,4R)-N-((R)-2,3-дигидробензофуран-3-ил)-4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоксамид и (2S,4R)-N-((S)-2,3-дигидробензофуран-3-ил)-4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоксамид
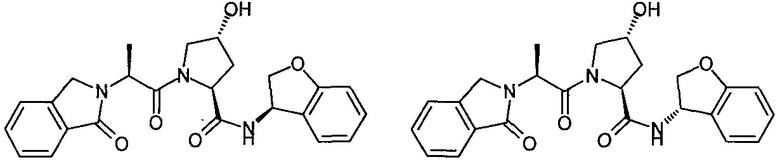 .
.
Смесь 2,3-дигидробензофуран-3-амина (коммерчески доступный, например, от фирмы Chem-Impex International, Inc.) (13 мг, 0,094 ммоль) и (2S,4R)-4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоновой кислоты (25 мг, 0,079 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,055 мл, 0,31 ммоль) и затем HATU (33 мг, 0,086 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт смеси подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанных в заголовке соединений: Изомер 1 (элюируется первым) (12 мг, 0,027 ммоль, 35%-ный выход). ЖХМС RT=0,73 мин, ES+ve m/z 436 [M+H]+. Изомер 2 (элюируется вторым) (13 мг, 0,030 ммоль, 38%-ный выход). ЖХМС RT=0,74 мин, ES+ve m/z 436 [M+H]+.
Используя способ, аналогичный способу получения двух диастереоизомеров (2S,4R)-N-(2,3-дигидробензофуран-3-ил)-4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоксамида, получали следующие соединения:
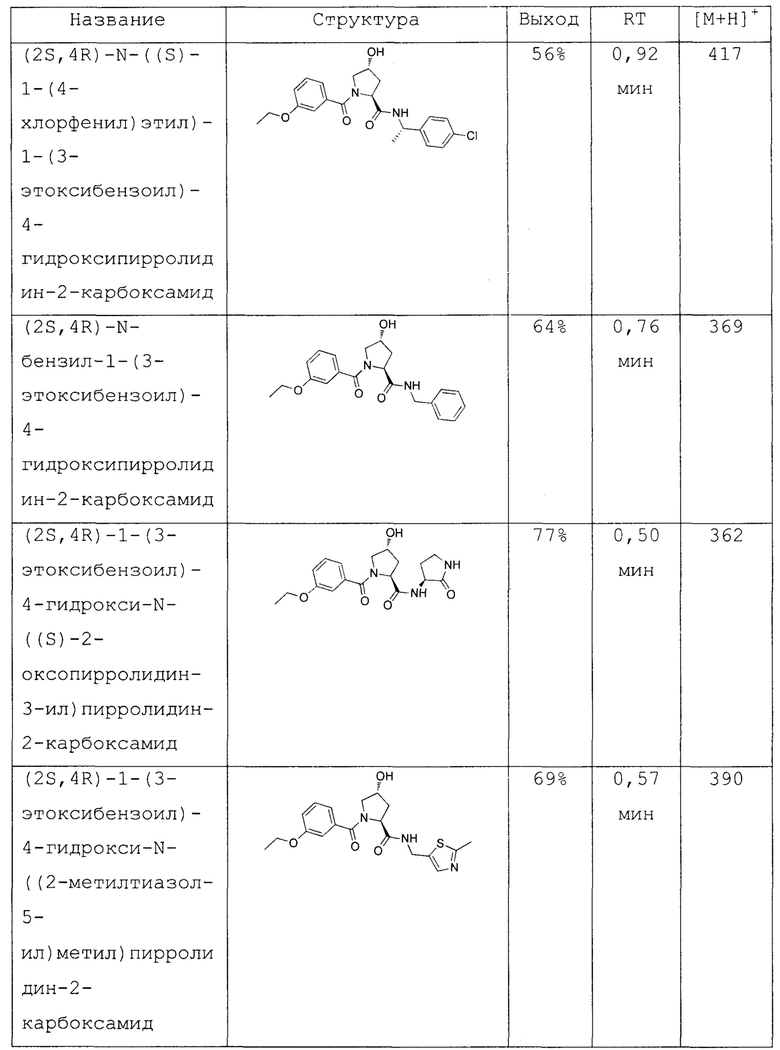
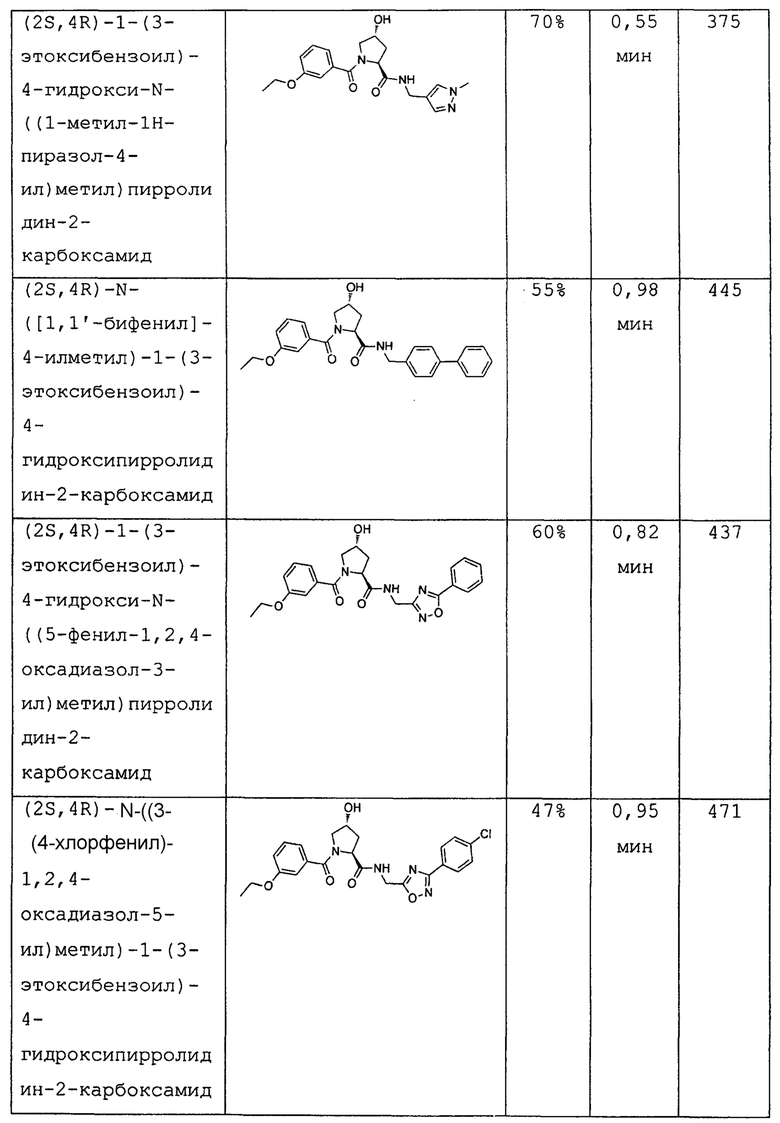
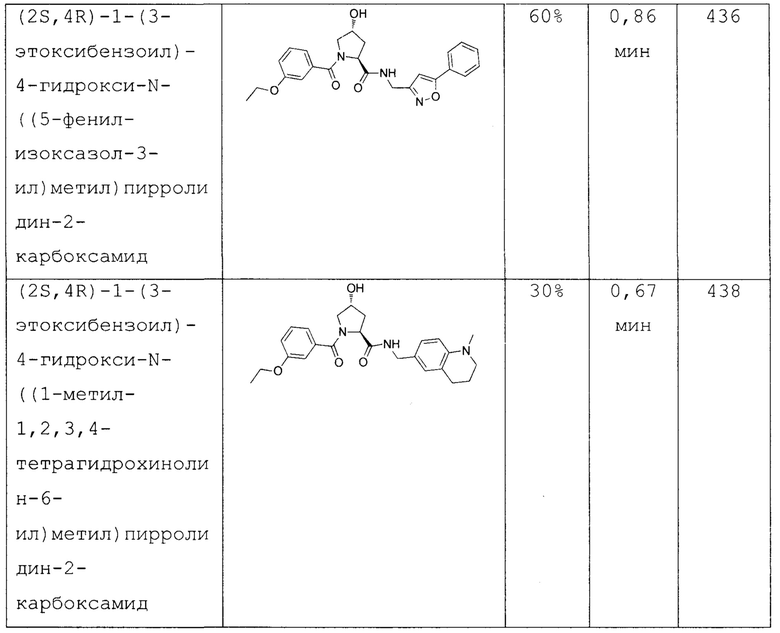
(2S,4R)-4-гидрокси-N-(2-гидрокси-4-(4-метилтиазол-5-ил)бензил)-1-((S)-3-метил-2-(1-оксоизоиндолин-2-ил)бутаноил)пирролидин-2-карбоксамид
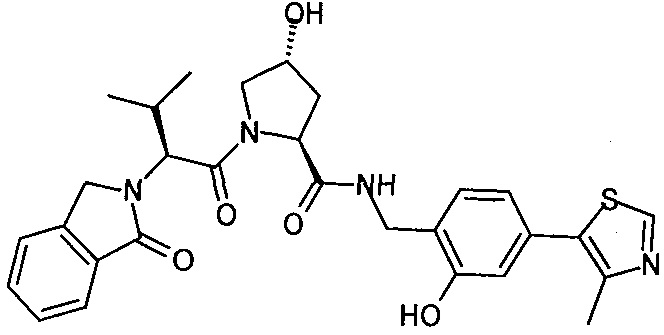 .
.
Смесь гидрохлорида (2S,4R)-4-гидрокси-N-(2-гидрокси-4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (125 мг, 0,34 ммоль) и (S)-3-метил-2-(1-оксоизоиндолин-2-ил)бутановой кислоты (83 мг, 0,36 ммоль) в ДМФ (1,6 мл) обрабатывали DIPEA (0,24 мл, 1,4 ммоль) и HATU (140 мг, 0,37 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (120 мг, 0,22 ммоль, 65%-ный выход). ЖХМС RT=0,81 мин, ES+ve m/z 549 [M+H]+.
(2S,4R)-4-гидрокси-N-(2-гидрокси-4-(4-метилтиазол-5-ил)бензил)-1-((R)-3-метил-2-(1-оксоизоиндолин-2-ил)бутаноил)пирролидин-2-карбоксамид
 .
.
Смесь гидрохлорида (2S,4R)-4-гидрокси-N-(2-гидрокси-4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (65 мг, 0,18 ммоль) и (R)-3-метил-2-(1-оксоизоиндолин-2-ил)бутановой кислоты (43 мг, 0,19 ммоль) в ДМФ (1,6 мл) обрабатывали DIPEA (0,123 мл, 0,70 ммоль) и HATU (74 мг, 0,19 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (64 мг, 0,12 ммоль, 66%-ный выход). ЖХМС RT=0,80 мин, ES+ve m/z 549 [M+H]+.
трет-бутил ((S)-1-((2R,4S)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)(метил)карбамат
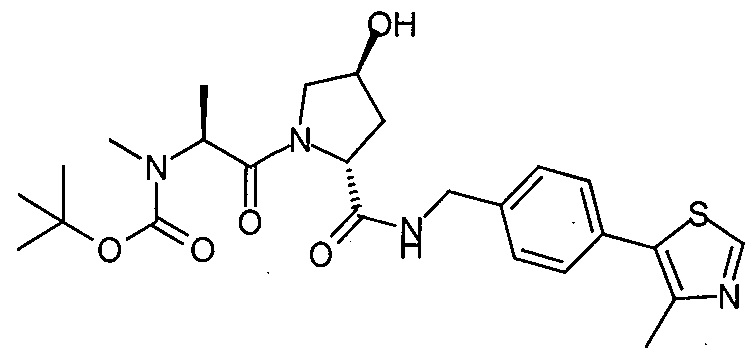 .
.
Перемешиваемую смесь (S)-2-((трет-бутоксикарбонил)(метил)амино)пропановой кислоты (115 мг, 0,57 ммоль) и гидрохлорида (2R,4S)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (200 мг, 0,57 ммоль) в ДМФ (0,7 мл) обрабатывали DIPEA (0,4 мл, 2,3 ммоль) и затем HATU (215 мг, 0,57 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (146 мг, 0,29 ммоль, 51%-ный выход). ЖХМС RT=0,84 мин, ES+ve m/z 503 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-(3-метокси-N-метилпропанамидо)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
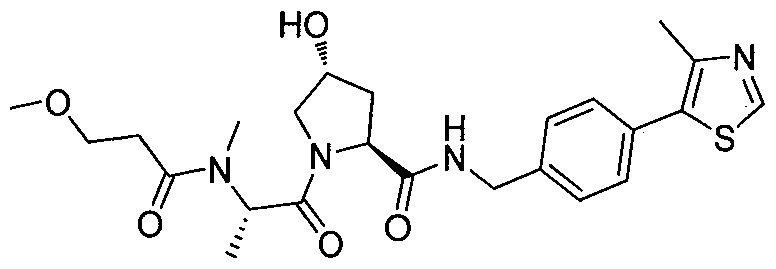 .
.
Перемешиваемую смесь (2S,4R)-4-гидрокси-1-((S)-2-(метиламино)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (50 мг, 0,12 ммоль) и 3-метоксипропановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (0,013 мл, 0,14 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,087 мл, 0,50 ммоль) и затем HATU (52 мг, 0,14 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (43 мг, 71%-ный выход). ЖХМС RT=0,61 мин, ES+ve m/z 489 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-((2-метоксиэтил)(метил)амино)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
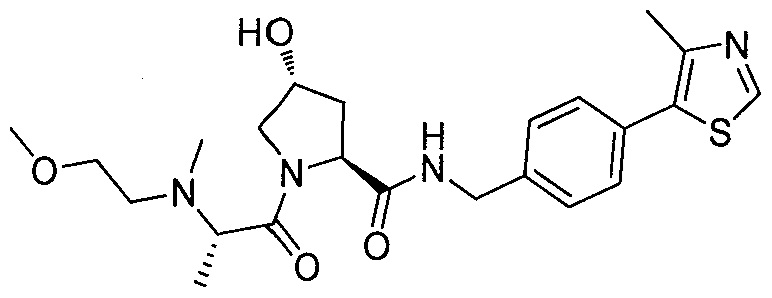 .
.
Перемешиваемую смесь 1-бром-2-метоксиэтана (коммерчески доступный, например, от фирмы Aldrich) (0,013 мл, 0,14 ммоль) и (2S,4R)-4-гидрокси-1-((S)-2-(метиламино)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (50 мг, 0,12 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,054 мл, 0,31 ммоль), и смесь перемешивали при температуре 85°C в течение 18 часов. Реакционную смесь охлаждали, и продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор бикарбонат аммония) с получением указанного в заголовке соединения (44 мг, 77%-ный выход). ЖХМС RT=0,51 мин, ES+ve m/z 461 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-4-(2-метоксиацетил)морфолин-3-карбонил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
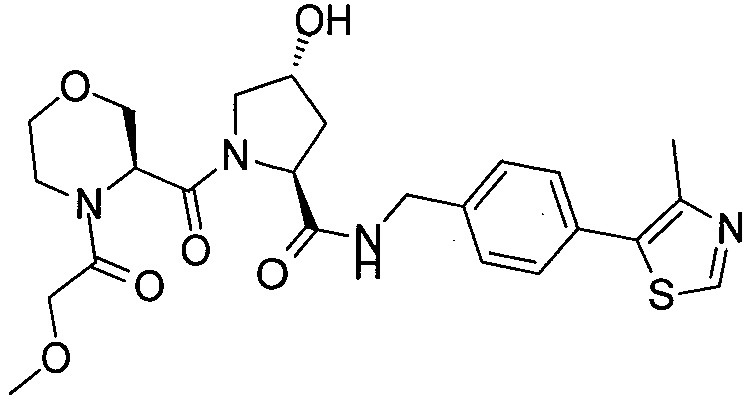 .
.
Смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)-1-((S)-морфолин-3-карбонил)пирролидин-2-карбоксамида (19 мг, 0,041 ммоль), 2-метоксиуксусной кислоты (3 мкл, 0,039 ммоль) и DIPEA (0,035 мл, 0,20 ммоль) в ДМФ (1 мл) обрабатывали HATU (18 мг, 0,047 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (13 мг, 0,026 ммоль, 66%-ный выход). ЖХМС RT=0,60 мин, ES+ve m/z 503 [M+H]+.
(2S,4R)-N-(4-(2,4-диметилтиазол-5-ил)бензил)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксамид
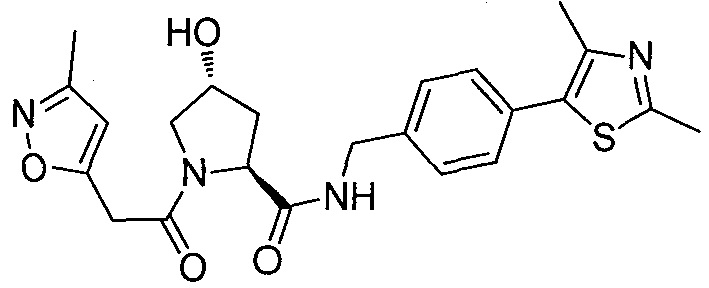 .
.
Перемешиваемую смесь (2S,4R)-N-(4-(2,4-диметилтиазол-5-ил)бензил)-4-гидроксипирролидин-2-карбоксамида (30 мг, 0,09 ммоль) и 2-(3-метилизоксазол-5-ил)уксусной кислоты (коммерчески доступная, например, от фирмы Aldrich) (13 мг, 0,09 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,063 мл, 0,36 ммоль) и затем HATU (41 мг, 0,11 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматической препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (26 мг, 63%-ный выход). ЖХМС RT=0,66 мин, ES+ve m/z 455 [M+H]+.
(2S,4R)-1-((S)-2-ацетамидопропаноил)-N-(4-(2,4-диметилтиазол-5-ил)бензил)-4-гидроксипирролидин-2-карбоксамид
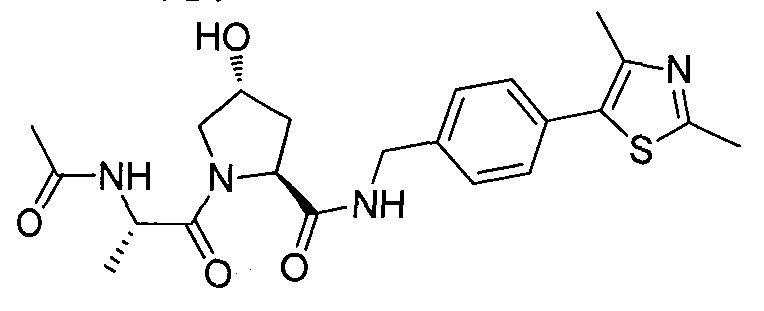 .
.
Перемешиваемую смесь (2S,4R)-N-(4-(2,4-диметилтиазол-5-ил)бензил)-4-гидроксипирролидин-2-карбоксамида (30 мг, 0,09 ммоль) и (S)-2-ацетамидопропановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (12 мг, 0,09 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,063 мл, 0,36 ммоль) и затем HATU (41 мг, 0,11 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (30 мг, 75%-ный выход). ЖХМС RT=0,58 мин, ES+ve m/z 445 [M+H]+.
(2S,4R)-N-(4-бромбензил)-1-(3-этоксибензоил)-4-гидроксипирролидин-2-карбоксамид
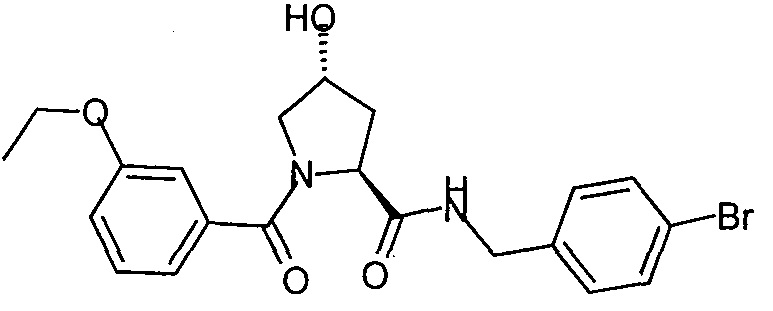 .
.
Охлаждаемую льдом смесь (2S,4R)-1-(3-этоксибензоил)-4-гидроксипирролидин-2-карбоновой кислоты (73 мг, 0,26 ммоль) и гидрохлорида (4-бромфенил)метанамина (коммерчески доступный, например, от фирмы Aldrich) (58 мг, 0,26 ммоль) в ДМФ (0,5 мл) обрабатывали раствором DIPEA (0,145 мл, 0,83 ммоль) в ДМФ (1 мл) и затем HATU (105 мг, 0,28 ммоль) и перемешивали в течение ночи при комнатной температуре. Продукт затем подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (62 мг, 53%-ный выход). ЖХМС RT=0,90 мин, ES+ve m/z 447, 449 [M+H]+.
(2S,4R)-N-([1,1'-бифенил]-4-илметил)-1-(3-этоксибензоил)-4-гидроксипирролидин-2-карбоксамид
 .
.
Смесь (2S,4R)-1-(3-этоксибензоил)-4-гидроксипирролидин-2-карбоновой кислоты (30 мг, 0,11 ммоль) и [1,1′-бифенил]-4-илметанамина (коммерчески доступный, например, от фирмы Aldrich) (20 мг, 0,11 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,075 мл, 0,43 ммоль) и затем HATU (45 мг, 0,12 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (26 мг, 55%-ный выход). ЖХМС RT=0,98 мин, ES+ve m/z 445 [M+H]+.
Используя способ, аналогичный способу получения (2S,4R)-N-([1,1′-бифенил]-4-илметил)-1-(3-этоксибензоил)-4-гидроксипирролидин-2-карбоксамида, получали следующие соединения:
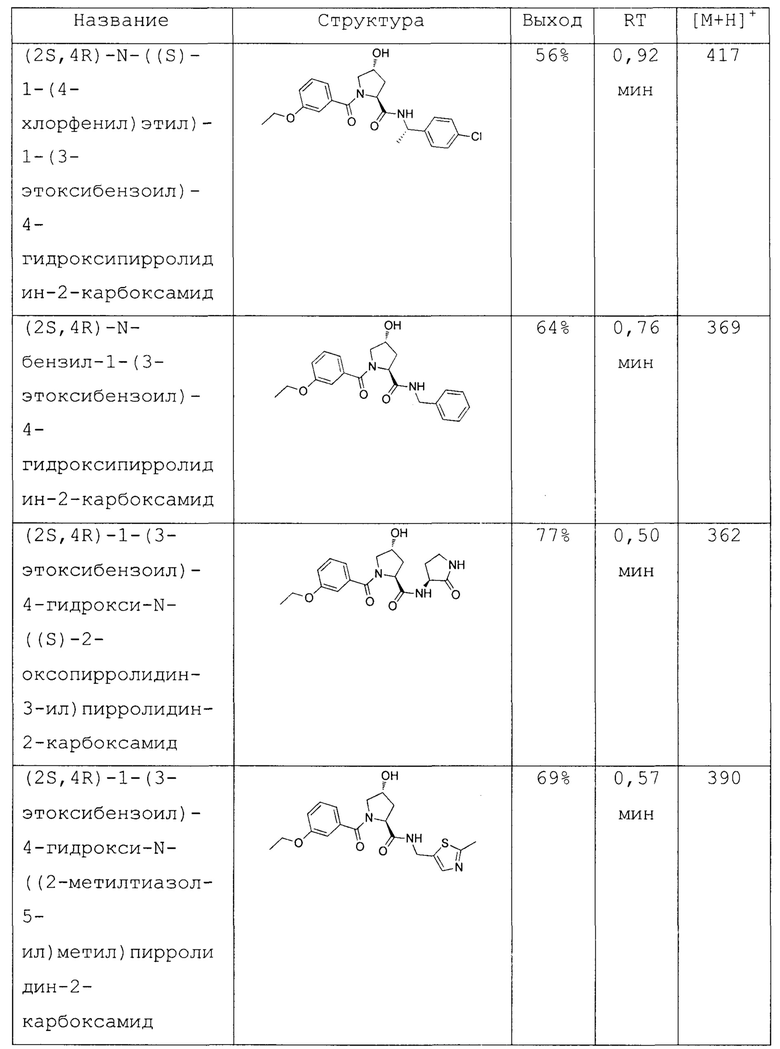
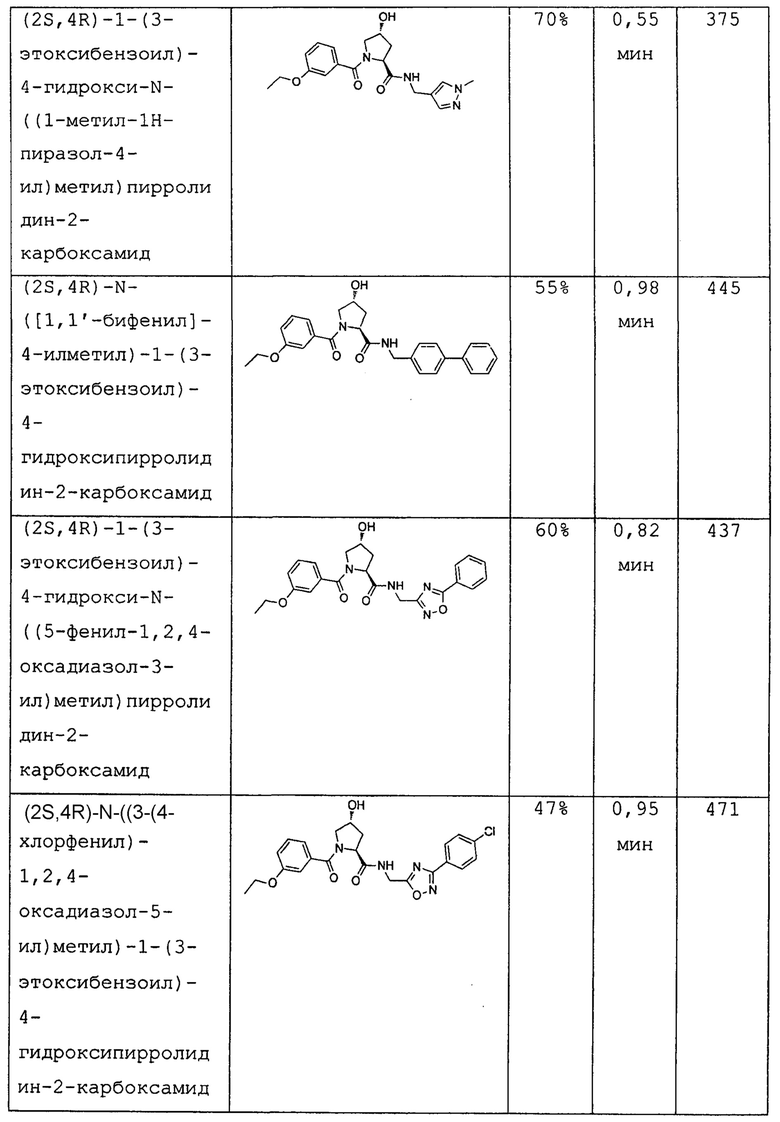
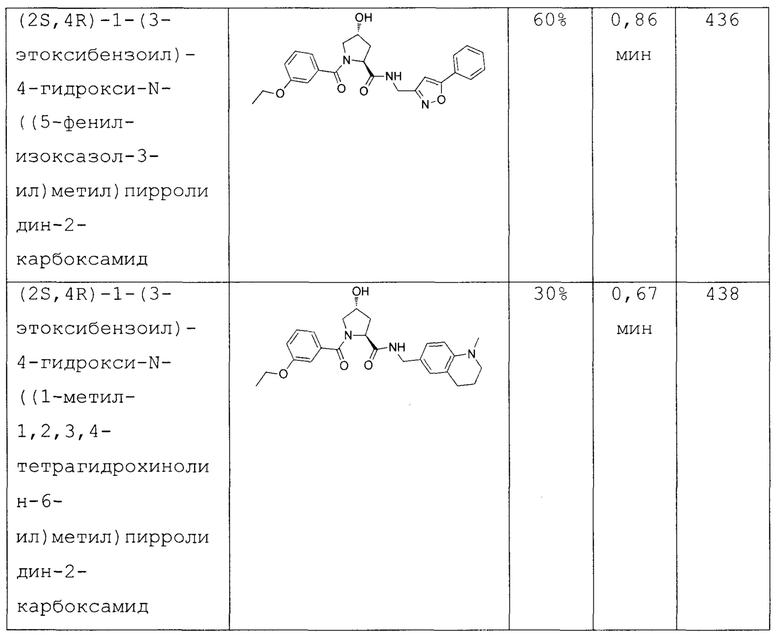
(2S,4R)-4-гидрокси-1-(2-(3-метоксипропанамидо)ацетил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
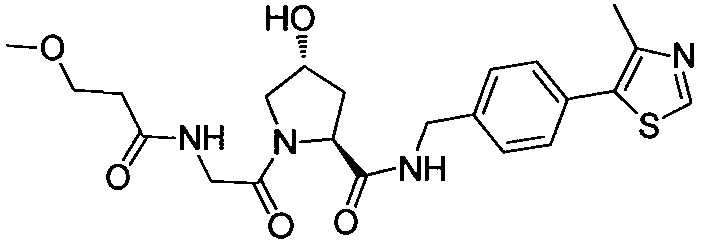 .
.
Смесь (2S,4R)-1-(2-аминоацетил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (134 мг, 0,33 ммоль) и 3-метоксипропановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (37 мг, 0,36 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,23 мл, 1,3 ммоль) и затем HATU (136 мг, 0,36 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (36 мг, 24%-ный выход). ЖХМС RT=0,56 мин, ES+ve m/z 461 [M+H]+.
(2S,4R)-1-((S)-3,3-диметил-2-(3-метилоксетан-3-карбоксамидо)бутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
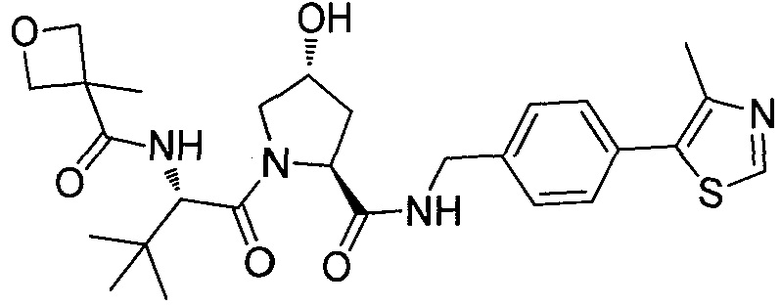 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-1-((S)-2-амино-3,3-диметилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (20 мг, 0,04 ммоль) и 3-метилоксетан-3-карбоновой кислоты (коммерчески доступная, например, от фирмы Chemgenx) (5 мг, 0,04 ммоль) в ДМФ (0,6 мл) обрабатывали DIPEA (0,03 мл, 0,17 ммоль) и затем HATU (20 мг, 0,05 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (18 мг, 80%-ный выход). ЖХМС RT=0,76 мин, ES+ve m/z 529 [M+H]+.
Используя способ, аналогичный способу получения (2S,4R)-1-((S)-3,3-диметил-2-(3-метилоксетан-3-карбоксамидо)бутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид, получали следующие соединения:
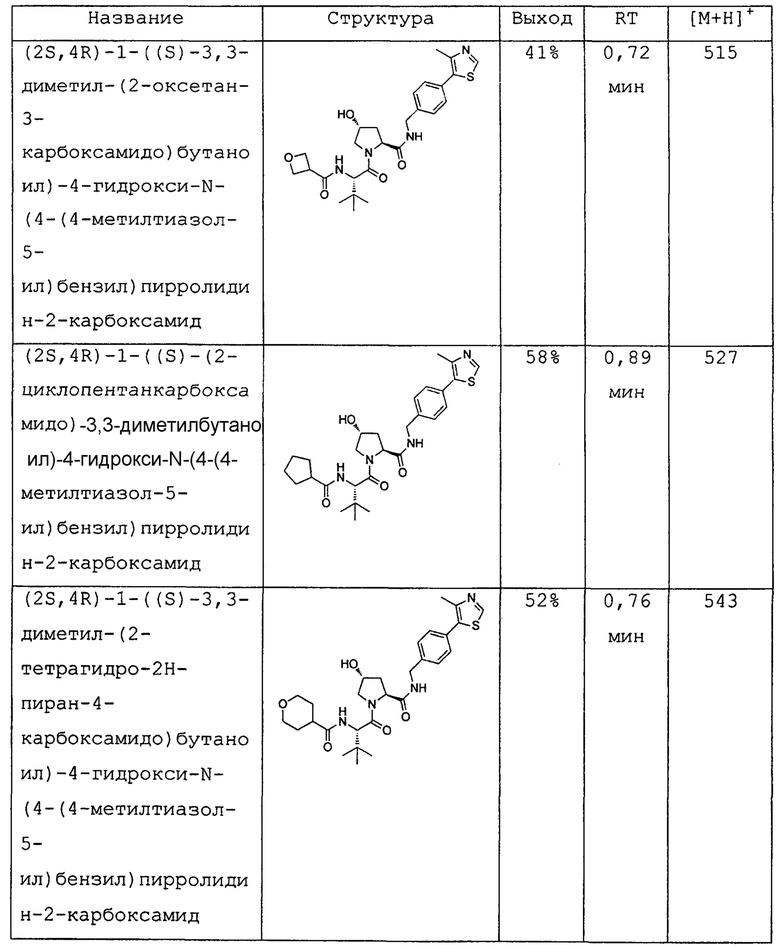
гидрохлорид (S)-N-((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-ил)морфолин-3-карбоксамида
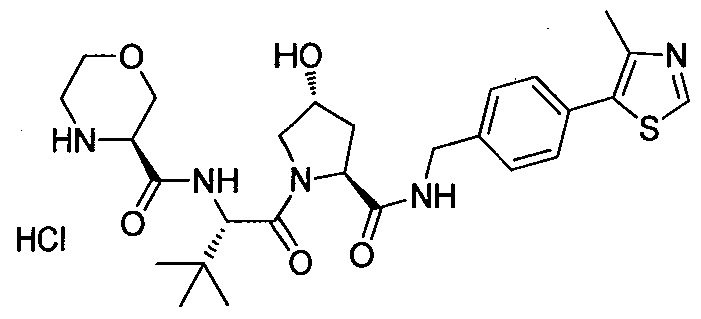 .
.
Смесь (2S,4R)-1-((S)-2-амино-3,3-диметилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (40 мг, 0,086 ммоль) и (S)-4-(трет-бутоксикарбонил)морфолин-3-карбоновой кислоты (коммерчески доступная, например, от фирмы Astatech, Inc.) (20 мг, 0,086 ммоль) в ДМФ (0,6 мл) обрабатывали DIPEA (0,06 мл, 0,35 ммоль) и затем HATU (40 мг, 0,10 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением промежуточного Boc-защищенного продукта. Промежуточный продукт затем растворяли в смеси дихлорметана (1 мл) и метанола (0,5 мл) и обрабатывали 4M соляной кислотой в 1,4-диоксане (0,4 мл, 1,6 ммоль). После перемешивания при комнатной температуре в течение 1 часа смесь упаривали досуха с получением указанного в заголовке соединения (31 мг, 62%-ный выход). ЖХМС RT=0,60 мин, ES+ve m/z 544 [M+H]+.
Используя способ, аналогичный способу получения гидрохлорида (S)-N-((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-ил)морфолин-3-карбоксамида, получали следующие соединения:
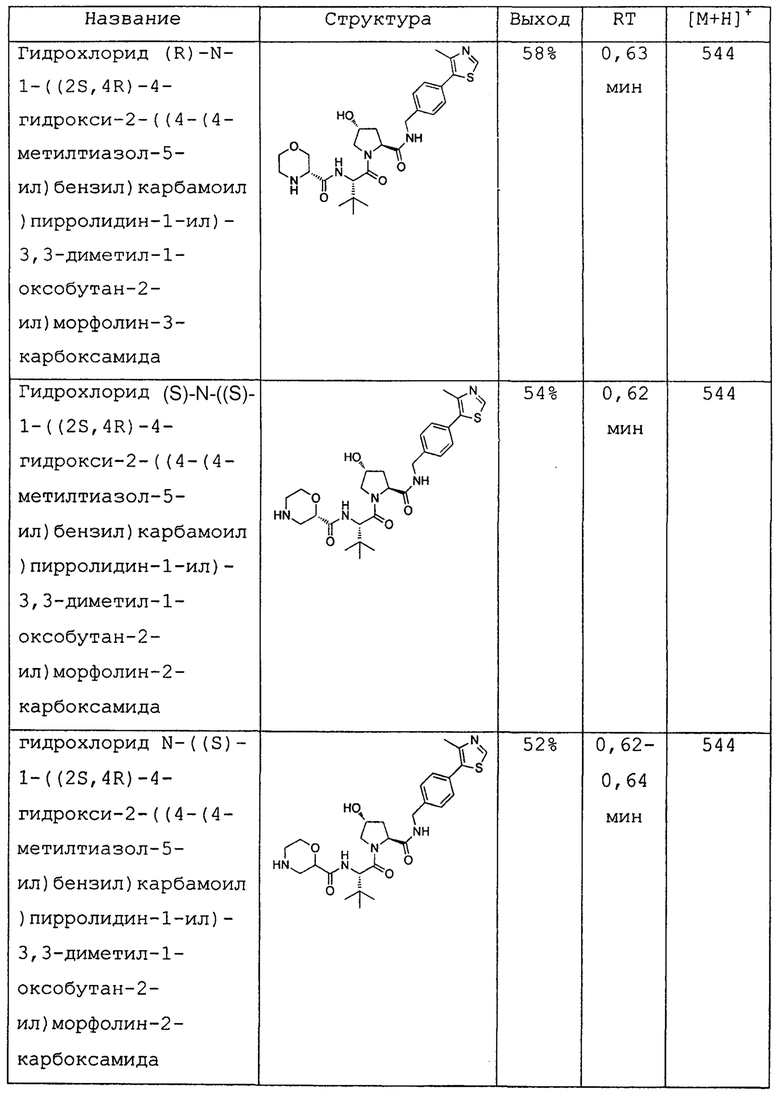
трет-бутил 4-((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)пиперазин-1-карбоксилат и трет-бутил 4-((R)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)пиперазин-1-карбоксилат
 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (100 мг, 0,28 ммоль) и 2-(4-(трет-бутоксикарбонил)-2-оксопиперазин-1-ил)пропановой кислоты (85 мг, 0,31 ммоль) в ДМФ (0,8 мл) обрабатывали DIPEA (0,20 мл, 1,13 ммоль) и затем HATU (129 мг, 0,34 ммоль) и затем перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматической препаративной ВЭЖХ (модификатор бикарбонат аммония) с получением указанных в заголовке соединений: Изомер 1 (элюируется первым) (48 мг, 30%-ный выход). ЖХМС RT=0,85 мин, ES+ve m/z 572 [M+H]+. Изомер 2 (элюируется вторым) (51 мг, 32%-ный выход). ЖХМС RT=0,86 мин, ES+ve m/z 572 [M+H]+.
гидрохлорид (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)-1-((S)-2-(пиперазин-1-ил)пропаноил)пирролидин-2-карбоксамида и гидрохлорид (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)-1-((R)-2-(пиперазин-1-ил)пропаноил)пирролидин-2-карбоксамида
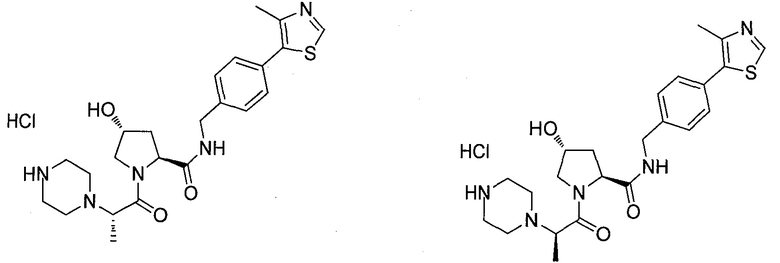 .
.
Изомер 1 и изомер 2 трет-бутил 4-(1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)пиперазин-1-карбоксилата (48 мг, 0,08 ммоль) отдельно растворяли в смеси дихлорметана (0,3 мл) и метанола (0,1 мл) и обрабатывали 4M соляной кислотой в 1,4-диоксане (0,3 мл, 1,2 ммоль), соответственно. После перемешивания при комнатной температуре в течение 1 часа реакционные смеси упаривали досуха с получением указанных в заголовке соединений в виде гидрохлоридных солей. Изомер 1 (42 мг, 99%-ный выход). ЖХМС RT=0,62 мин, ES+ve m/z 472 [M+H]+. Изомер 2 (42 мг, 99%-ный выход). ЖХМС RT=0,60 мин, ES+ve m/z 472 [M+H]+.
(S)-N-((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-ил)-4-(2-метоксиэтил)морфолин-2-карбоксамид
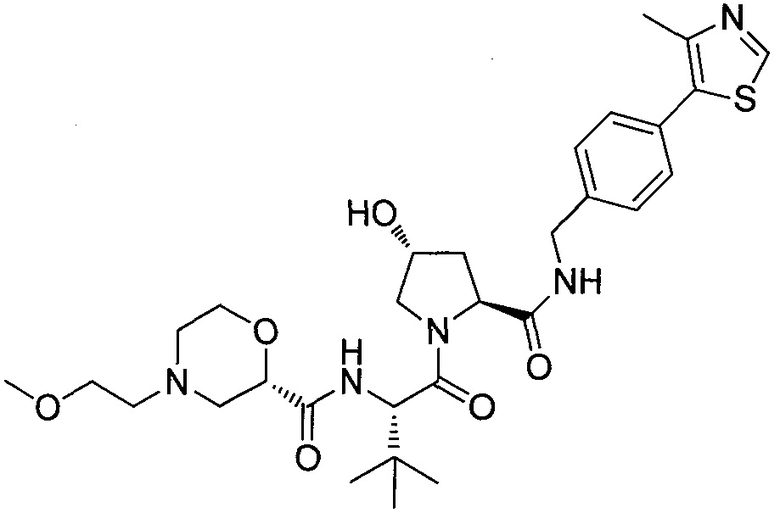 .
.
Смесь 1-бром-2-метоксиэтана (4 мкл, 0,04 ммоль), гидрохлорида (S)-N-((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-ил)морфолин-2-карбоксамида (20 мг, 0,04 ммоль) и DIPEA (0,019 мл, 0,11 ммоль) в ДМФ (0,5 мл) перемешивали при температуре 85°C в течение 6 часов. Охлажденный продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор бикарбонат аммония) с получением указанного в заголовке соединения (9 мг, 41%-ный выход). ЖХМС RT=0,88 мин, ES+ve m/z 602 [M+H]+.
Используя способ, аналогичный способу получения (S)-N-((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3,3-диметил-1-оксобутан-2-ил)-4-(2-метоксиэтил)морфолин-2-карбоксамида, получали следующие соединения:
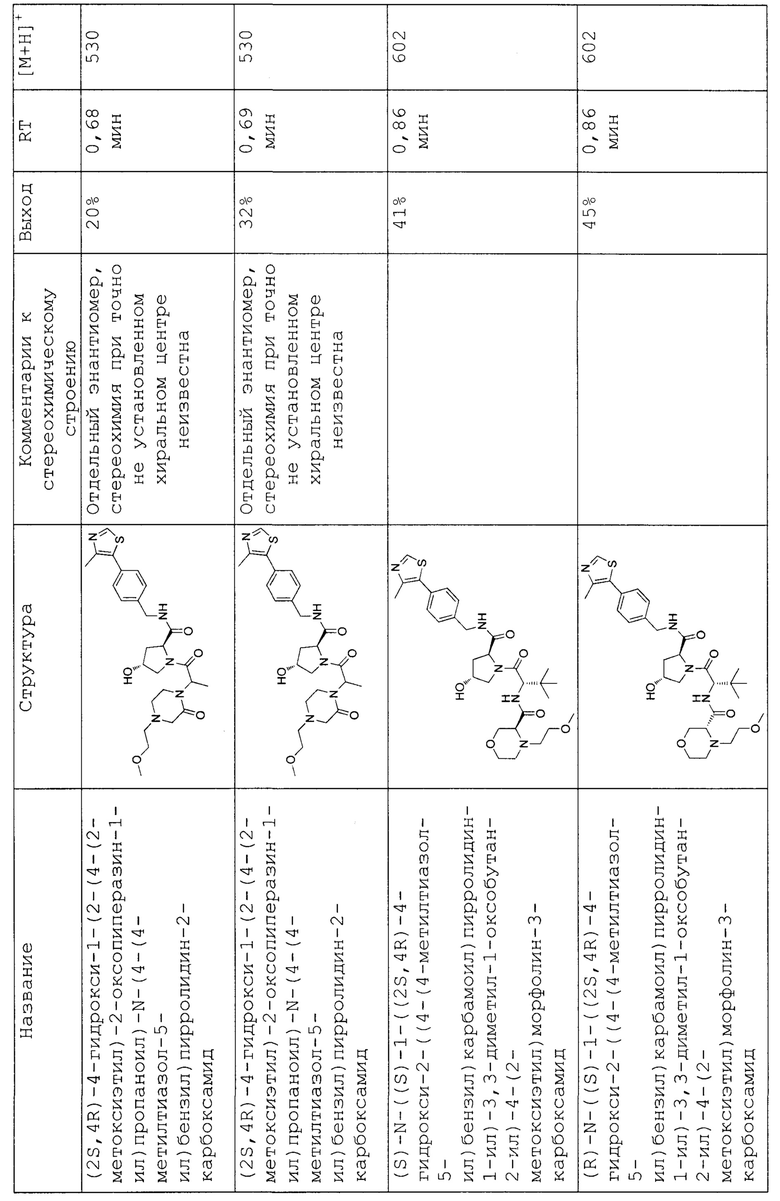
Метил 4-(((S)-1-(((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)амино)-4-метил-1-оксопентан-2-ил)амино)-4-оксобутаноат
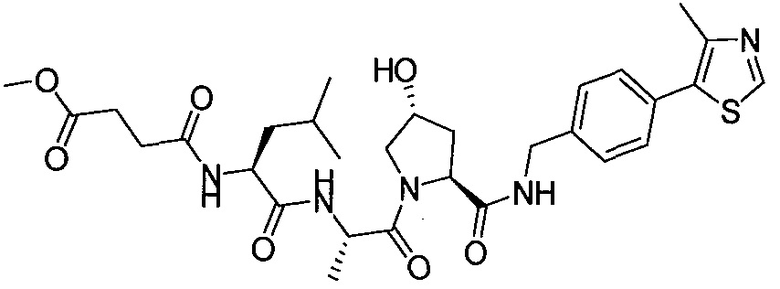 .
.
Смесь гидрохлорида (2S,4R)-1-((S)-2-((S)-2-амино-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (102 мг, 0,19 ммоль), DIPEA (0,165 мл, 0,95 ммоль) и 4-метокси-4-оксобутановой кислоты (коммерчески доступной, например, от фирмы Aldrich) (25 мг, 0,19 ммоль) в ДМФ (2 мл) обрабатывали HATU (64 мг, 0,17 ммоль), и смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли насыщенный солевой раствор (10 мл) и продукт экстрагировали этилацетатом (20 мл). Органическую фазу промывали насыщенным солевым раствором (2×20 мл), сушили с использованием гидрофобной фритты и упаривали досуха. Продукт очищали с помощью обращенно-фазовой хроматографии на силикагеле с использованием градиентного элюирования от 5% до 70% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (73 мг, 0,12 ммоль, 63%-ный выход). ЖХМС RT=0,74 мин, ES+ve m/z 616 [M+H]+.
4-(3-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбонил)фенокси)бутановой кислота
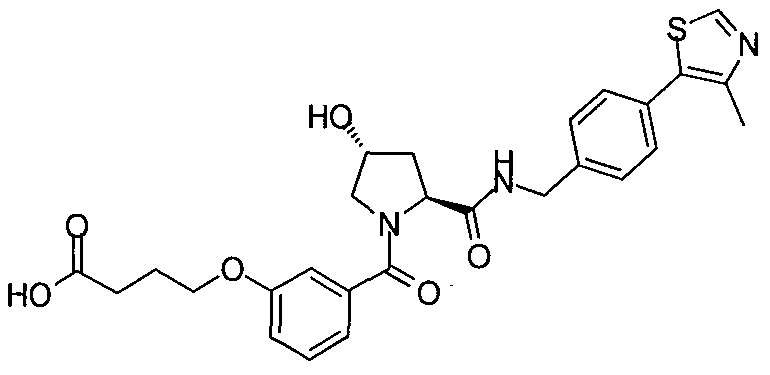 .
.
Раствор трет-бутил 4-(3-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбонил)фенокси)бутаноата (130 мг, 0,22 ммоль) в дихлорметане (3 мл) обрабатывали ТФУ (0,5 мл, 6,5 ммоль) и перемешивали при комнатной температуре в течение 5 часов. Растворитель упаривали досуха, и продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (65 мг, 0,12 ммоль, 55%-ный выход). ЖХМС RT=0,70 мин, ES+ve m/z 524 [M+H]+.
4-(((S)-1-(((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)амино)-4-метил-1-оксопентан-2-ил)амино)-4-оксобутановой кислоты
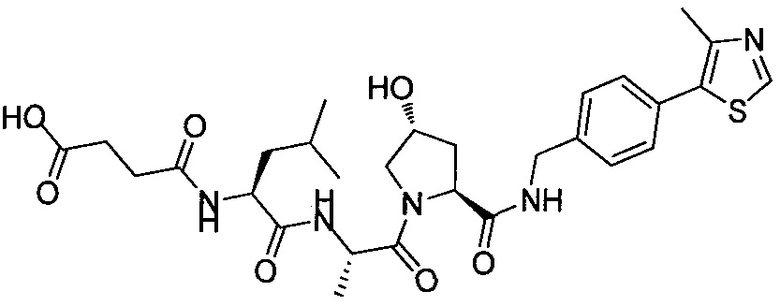 .
.
Раствор метил 4-(((S)-1-(((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-1-оксопропан-2-ил)амино)-4-метил-1-оксопентан-2-ил)амино)-4-оксобутаноата (73 мг, 0,12 ммоль) в метаноле (3 мл) обрабатывали водным раствором гидроксида натрия (2M, 0,6 мл, 1,2 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь упаривали досуха, и продукт очищали с помощью обращенно-фазовой хроматографии на силикагеле с использованием градиентного элюирования от 5% до 60% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (53 мг, 0,088 ммоль, 74%-ный выход). ЖХМС RT=0,69 мин, ES+ve m/z 602 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-((S)-2-(2-метоксиацетамидо)-4-метилпентанамидо)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
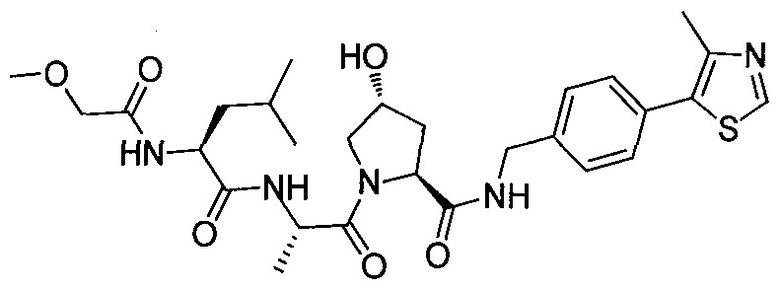 .
.
Смесь гидрохлорида (2S,4R)-1-((S)-2-((S)-2-амино-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (30 мг, 0,056 ммоль), 2-метоксиуксусной кислоты (коммерчески доступная, например, от фирмы Aldrich) (4,3 мкл, 0,056 ммоль) и DIPEA (0,05 мл, 0,29 ммоль) в ДМФ (1 мл) обрабатывали HATU (25 мг, 0,066 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (18 мг, 0,031 ммоль, 56%-ный выход). ЖХМС RT=0,73 мин, ES+ve m/z 574 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-((S)-2-(3-метоксипропанамидо)-4-метилпентанамидо)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
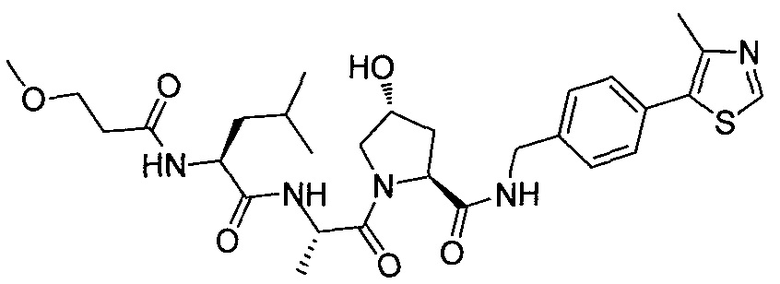 .
.
Смесь гидрохлорида (2S,4R)-1-((S)-2-((S)-2-амино-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (30 мг, 0,056 ммоль), 3-метоксипропановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (5,2 мкл, 0,056 ммоль) и DIPEA (0,05 мл, 0,29 ммоль) в ДМФ (1 мл) перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (20 мг, 0,034 ммоль, 61%-ный выход). ЖХМС RT=0,72 мин, ES+ve m/z 588 [M+H]+.
(2S,4R)-1-(6-цианопиридин-2-ил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
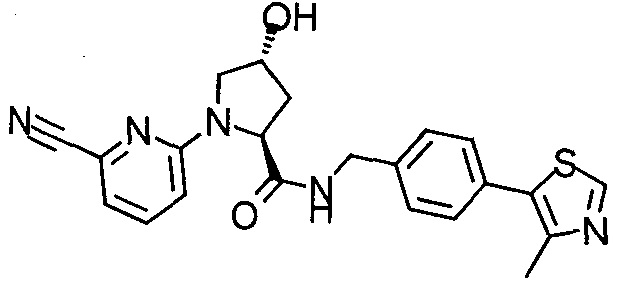 .
.
Смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (58 мг, 0,16 ммоль) и 6-фторпиколинонитрила (коммерчески доступный, например, от фирмы Aldrich) (20 мг, 0,16 ммоль) в ДМСО (1 мл) обрабатывали DIPEA (0,10 мл, 0,57 ммоль), герметично закрывали и нагревали в микроволновом реакторе Biotage "Initiator" при температуре 100°C в течение 60 минут. Продукт очищали с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (23 мг, 0,055 ммоль, 34%-ный выход). ЖХМС RT=0,74 мин, ES+ve m/z 420 [M+H]+.
Промежуточные соединения
4-(оксазол-5-ил)бензонитрил
 .
.
Смесь 4-формилбензонитрила (коммерчески доступный, например, от фирмы Aldrich) (5,32 г, 41 ммоль), 1-((изоцианометил)сульфонил)-4-метилбензола (коммерчески доступный, например, от фирмы Aldrich) (8,83 г, 45 ммоль) и карбоната калия (7,3 г, 53 ммоль) в метаноле (200 мл) перемешивали при комнатной температуре в течение 80 минут. Смесь далее упаривали досуха; остаток обрабатывали насыщенным водным раствором бикарбоната натрия (100 мл) и экстрагировали дихлорметаном (3×100 мл). Объединенные органические продукты промывали насыщенным солевым раствором (75 мл), пропускали через гидрофобную фритту и затем упаривали досуха с получением указанного в заголовке соединения (7,19 г, 42 ммоль, количественный). ЖХМС RT=0,48 мин, ES+ve m/z 171 [M+H]+.
(4-(оксазол-5-ил)фенил)метанамин
 .
.
В атмосфере азота охлаждаемую льдом смесь 4-(оксазол-5-ил)бензонитрила (900 мг, 5,29 ммоль) и гексагидрата хлорида кобальта(II) (коммерчески доступный, например, от фирмы Aldrich) (1,8 г, 7,9 ммоль) в метаноле (50 мл) обрабатывали порциями в течение 5 минут боргидридом натрия (1 г, 26 ммоль). Смесь перемешивали в течение 30 минут и затем обрабатывали водой (50 мл) и концентрированным водным аммиаком (20 мл). Смесь экстрагировали хлороформом (3×150 мл), объединенные органические продукты упаривали досуха, и продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 30% метанола в дихлорметане (+0,1% триэтиламин) с получением указанного в заголовке соединения (580 мг, 3,3 ммоль, 63%-ный выход). ЖХМС RT=0,35 мин, ES+ve m/z 175 [M+H]+.
(2S,4R)-трет-бутил 4-гидрокси-2-((4-(оксазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилат
 .
.
К перемешиваемому раствору (2S,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-карбоновой кислоты (0,66 г, 2,9 ммоль) в сухом ДМФ (20 мл) добавляли (4-(оксазол-5-ил)фенил)метанамин (0,5 г, 2,87 ммоль) и DIPEA (1 мл, 5,7 ммоль). Этот раствор затем охлаждали льдом и добавляли HATU (1,09 г, 2,9 ммоль). Реакционную смесь перемешивали при охлаждении в течение дополнительного часа, затем обрабатывали водой (30 мл) и экстрагировали этилацетатом (3×100 мл). Объединенную органическую фазу промывали насыщенным водным раствором бикарбоната натрия (60 мл), насыщенным солевым раствором (60 мл), сушили над сульфатом магния, фильтровали и упаривали досуха. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 25% метанола в дихлорметане с получением указанного в заголовке соединения (758 мг, 1,96 ммоль, 68%-ный выход). ЖХМС RT=0,73 мин, ES+ve m/z 388 [M+H]+.
гидрохлорид (2S,4R)-4-гидрокси-N-(4-(оксазол-5-ил)бензил)пирролидин-2-карбоксамида
 .
.
Раствор (2S,4R)-трет-бутил 4-гидрокси-2-((4-(оксазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилата (2,74 г, 7,1 ммоль) в метаноле (10 мл) и дихлорметане (15 мл) обрабатывали соляной кислотой (4M в 1,4-диоксане) (8,8 мл, 35 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. Смесь упаривали досуха. Остаток суспендировали в метаноле, фильтровали и сушили в вакууме с получением указанного в заголовке соединения (2,24 г, 6,9 ммоль, 98%-ный выход). ЖХМС RT=0,44 мин, ES+ve m/z 288 [M+H]+.
(2S,4R)-трет-бутил 2-((4-бромбензил)карбамоил)-4-гидроксипирролидин-1-карбоксилат
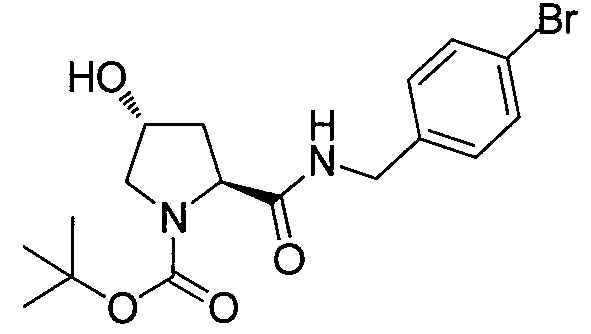 .
.
Охлаждаемую льдом смесь (2S,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-карбоновой кислоты (коммерчески доступная, например, от фирмы Aldrich) (7,95 г, 34 ммоль) и (4-бромфенил)метанамина (коммерчески доступный, например, от фирмы Fluorochem) (6,4 г, 34 ммоль) в ДМФ (200 мл) обрабатывали DIPEA (18 мл, 103 ммоль) и затем HATU (14,4 г, 38 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Смесь обрабатывали водой (200 мл) и экстрагировали этилацетатом (2×200 мл). Объединенную органическую фазу промывали насыщенным водным раствором бикарбоната натрия (2×300 мл), водой (100 мл), насыщенным солевым раствором (200 мл), сушили над сульфатом магния и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (750 г силикагелевый картридж) с использованием градиентного элюирования от 0% до 10% метанола в дихлорметане с получением указанного в заголовке соединения (12,9 г, 94%-ный выход). ЖХМС RT=0,87 мин, ES+ve m/z 401 [M+H]+.
(2S,4R)-трет-бутил 4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилат
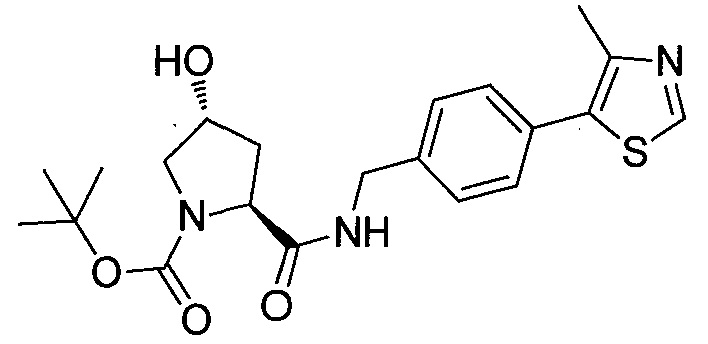 .
.
В атмосфере азота смесь (2S,4R)-трет-бутил 2-((4-бромбензил)карбамоил)-4-гидроксипирролидин-1-карбоксилата (12,9 г, 32 ммоль), 4-метилтиазола (коммерчески доступный, например, от фирмы Aldrich) (5,9 мл, 65 ммоль), ацетата палладия(II) (коммерчески доступный, например, от фирмы Aldrich) (0,145 г, 0,65 ммоль) и ацетата калия (6,34 г, 65 ммоль) в N-метил-2-пирролидоне (80 мл) перемешивали при температуре 120°C в течение 18 часов. После охлаждения до комнатной температуры добавляли воду (100 мл) и продукт экстрагировали этилацетатом (4×300 мл). Объединенную органическую фазу промывали насыщенным солевым раствором (5×200 мл), сушили над сульфатом магния и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (750 г силикагелевый картридж) с использованием градиентного элюирования от 0% до 10% метанола в дихлорметане с получением указанного в заголовке соединения (8,0 г, 59%-ный выход). ЖХМС RT=0,75 мин, ES+ve m/z 418 [M+H]+.
гидрохлорид (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида
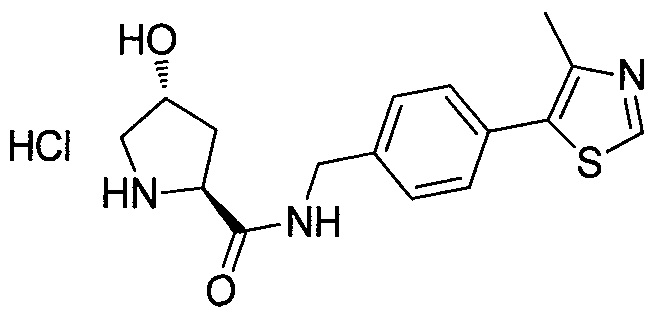 .
.
Раствор (2S,4R)-трет-бутил 4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилата (8 г, 19 ммоль) в смеси метанола (30 мл) и дихлорметана (20 мл) обрабатывали 4M соляной кислотой в 1,4-диоксане (8 мл, 32 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель упаривали досуха, и остаток растирали в дихлорметане, фильтровали и сушили в вакууме с получением указанного в заголовке соединения (6,7 г, 99%-ный выход). ЖХМС RT=0,51 мин, ES+ve m/z 318 [M+H]+.
(2S,4R)-1-(3-этоксибензоил)-4-гидроксипирролидин-2-карбоновая кислота
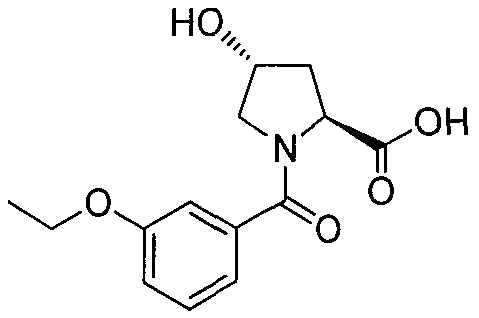 .
.
3-Этоксибензойную кислоту (коммерчески доступная, например, от фирмы Aldrich) (4 г, 24 ммоль) растворяли в тионилхлориде (24 мл, 329 ммоль) и перемешивали при температуре 60°C в течение 1 часа и затем при температуре 50°C в течение 18 часов. После охлаждения до комнатной температуры смесь упаривали досуха, и остаток обрабатывали диэтиловым эфиром (5 мл). Смесь затем охлаждали льдом и обрабатывали раствором гидрохлорида (2S,4R)-4-гидроксипирролидин-2-карбоновой кислоты (коммерчески доступный, например, от фирмы Aldrich) (4,44 г, 27 ммоль) в 1M водном растворе гидроксида натрия (27 мл, 27 ммоль). Реакционную смесь нагревали при комнатной температуре и перемешивали в течение 18 часов. Смесь разделяли; водную фазу промывали в диэтиловом эфире и затем подкисляли 2M водным раствором соляной кислоты. Продукт экстрагировали диэтиловым эфиром (2×70 мл), и объединенную эфирную фазу упаривали досуха. Продукт очищали с помощью флэш-хроматографии (340 г C18 картридж) с использованием градиентного элюирования от 10 до 30% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (3,5 г, 52%-ный выход). ЖХМС RT=0,55 мин, ES+ve m/z 280 [M+H]+.
(2S,4R)-бензил 1-((S)-2-ацетамидопропаноил)-4-гидроксипирролидин-2-карбоксилат
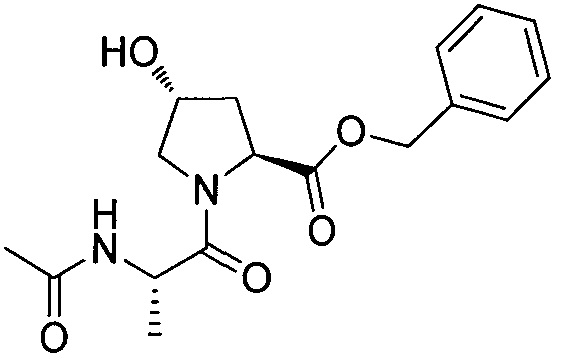 .
.
Охлаждаемую льдом смесь (S)-2-ацетамидопропановой кислоты (коммерчески доступной, например, от фирмы Aldrich) (2,80 г, 21 ммоль) и гидрохлорида (2S,4R)-бензил 4-гидроксипирролидин-2-карбоксилата (коммерчески доступный, например, от фирмы Aldrich) (5 г, 19 ммоль) в ДМФ (5 мл) обрабатывали DIPEA (14 мл, 78 ммоль), затем HATU (8,11 г, 21 ммоль) в течение 10 мин. Смесь нагревали при комнатной температуре и перемешивали в течение 1 часа, затем обрабатывали насыщенным водным раствором бикарбоната натрия (30 мл) и перемешивали в течение 5 мин. Смесь затем экстрагировали этилацетатом (3×100 мл), и объединенную органическую фазу промывали водой (100 мл), насыщенным солевым раствором (100 мл), сушили над сульфатом магния и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (330 г силикагелевый картридж) с использованием градиентного элюирования от 0 до 10% метанола в дихлорметане с получением указанного в заголовке соединения (2,0 г, 31%-ный выход). ЖХМС RT=0,63 мин, ES+ve m/z 335 [M+H]+.
(2S,4R)-1-((S)-2-ацетамидопропаноил)-4-гидроксипирролидин-2-карбоновая кислота
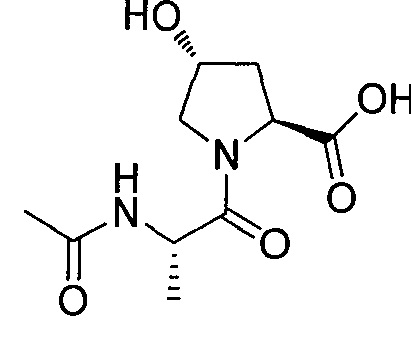 .
.
Раствор (2S,4R)-бензил-1-((S)-2-ацетамидопропаноил)-4-гидроксипирролидин-2-карбоксилата (2 г, 6,0 ммоль) в этаноле (10 мл) добавляли в колбу, содержащую палладий на углероде (1,27 г, 1,2 ммоль) (10%, тип Дегусса) в атмосфере азота. Колбу заполняли водородом, и раствор перемешивали при комнатной температуре в течение 2 часов. Катализатор удаляли путем фильтрации через целит, и фильтрат упаривали при пониженном давлении с получением указанного в заголовке соединения (1,37 г, 94%-ный выход). ЖХМС RT=0,28 мин, ES+ve m/z 244 [M+H]+.
(2S,4R)-4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоновая кислота
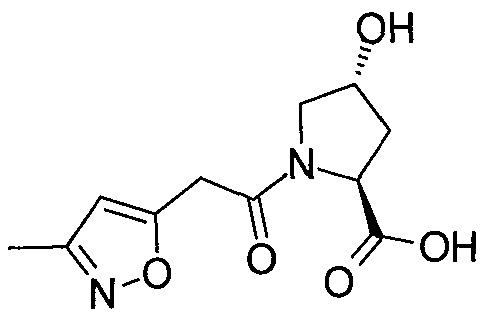 .
.
В атмосфере азота раствор (2S,4R)-бензил 4-гидрокси-1-(2-(3-метилизоксазол-5-ил)ацетил)пирролидин-2-карбоксилата (2,3 г, 6,7 ммоль) в этаноле (60 мл) добавляли к палладию на углероде (0,071 г, 0,67 ммоль) (10%, тип Дегусса) и затем перемешивали в атмосфере водорода. Через 2 часа смесь фильтровали через целит. Фильтрат упаривали досуха, и остаток растирали в циклогексане и сушили в вакууме с получением твердого вещества белого цвета. Продукт очищали с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор ТФУ) с получением указанного в заголовке соединения (650 мг, 2,6 ммоль, 38%-ный выход). ЖХМС RT=0,38 мин, ES+ve m/z 255 [M+H]+.
(2S,4R)-метил 4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоксилат
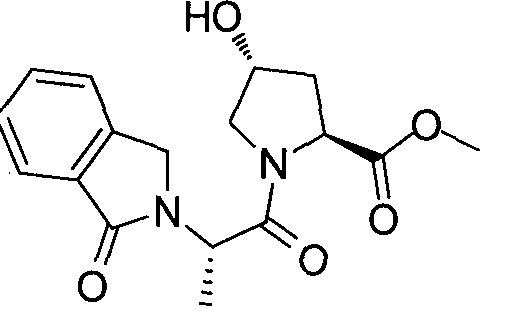 .
.
Смесь гидрохлорида (2S,4R)-метил 4-гидроксипирролидин-2-карбоксилата (коммерчески доступный, например, от фирмы Aldrich) (1,77 г, 9,8 ммоль) и (S)-2-(1-оксоизоиндолин-2-ил)пропановую кислоту (2 г, 9,8 ммоль) в ДМФ (4 мл) обрабатывали DIPEA (5,11 мл, 29 ммоль) и затем HATU (4,08 г, 10,7 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Смесь обрабатывали насыщенным водным раствором бикарбоната натрия (100 мл) и экстрагировали этилацетатом (2×200 мл). Объединенную органическую фазу промывали водой (100 мл), насыщенным солевым раствором (100 мл), сушили над сульфатом магния и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (120 г C18 картридж) с использованием градиентного элюирования от 10% до 50% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (1,0 г, 31%-ный выход). ЖХМС RT=0,60 мин, ES+ve m/z 333 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоновая кислота
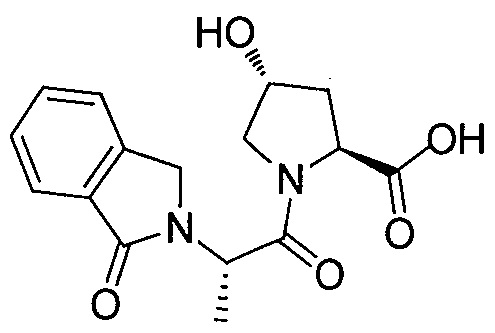
Раствор (2S,4R)-метил 4-гидрокси-1-((S)-2-(1-оксоизоиндолин-2-ил)пропаноил)пирролидин-2-карбоксилата (1 г, 3,0 ммоль) в метаноле (2 мл) обрабатывали 2M водным раствором гидроксида натрия (5 мл, 10 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов, затем подкисляли 2M водным раствором соляной кислоты (6 мл). Смесь далее упаривали до примерно половины первоначального объема и затем охлаждали льдом. Образовавшийся осадок отфильтровывали и сушили в вакууме с получением указанного в заголовке соединения (615 мг, 64%-ный выход). ЖХМС RT=0,51 мин, ES+ve m/z 319 [M+H]+.
Метил 3-(4-(трет-бутокси)-4-оксобутокси)бензоат
 .
.
Раствор метил 3-гидроксибензоата (коммерчески доступный, например, от фирмы Aldrich) (1 г, 6,6 ммоль) и K2CO3 (1,82 г, 13,2 ммоль) в ДМФ (10 мл) обрабатывали трет-бутил 4-бромбутаноатом (коммерчески доступный, например, от фирмы Aldrich) (2,2 г, 9,9 ммоль), и смесь перемешивали при температуре 60°C в течение 16 часов. Добавляли дополнительную аликвоту K2CO3 (1,82 г, 13,2 ммоль) и трет-бутил 4-бромбутаноат (2,2 г, 9,9 ммоль) и смесь нагревали при температуре 60°C в течение дополнительных 6 часов. Смесь охлаждали до комнатной температуры и распределяли между этилацетатом (50 мл) и водой (50 мл). Органическую фазу промывали насыщенным солевым раствором (2×50 мл), сушили (гидрофобная фритта) и упаривали досуха. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метил трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (1,4 г, 4,8 ммоль, 72%-ный выход). ЖХМС RT=1,26 мин, ES+ve m/z 312 [M+H]+.
3-(4-(трет-бутокси)-4-оксобутокси)бензойная кислота
 .
.
Смесь метил 3-(4-(трет-бутокси)-4-оксобутокси)бензоата (1,4 г, 4,8 ммоль) и водного раствора гидроксида натрия (2M, 4,8 мл, 9,6 ммоль) в метаноле (10 мл) перемешивали при комнатной температуре в течение 5 часов. Метанол удаляли при пониженном давлении (без нагревания), и водную фазу подкисляли до pH 3 насыщенным водным раствором лимонной кислоты. Продукт экстрагировали этилацетатом (60 мл), и органический экстракт промывали насыщенным солевым раствором (20 мл), сушили с использованием гидрофобной фритты и упаривали досуха. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 25% метанола в дихлорметане с получением указанного в заголовке соединения (625 мг, 2,2 ммоль, 47%-ный выход). ЖХМС RT=1,06 мин, ES+ve m/z 279 [M-H]-.
метил 3-((14,14-диметил-12-оксо-3,6,9,13-тетраоксапентадецил)окси)бензоат
 .
.
Охлаждаемую льдом смесь трет-бутил 3-(2-(2-(2-гидроксиэтокси)этокси)этокси)пропаноата (коммерчески доступный, например, от фирмы Aldrich) (2,0 г, 7,2 ммоль), трифенилфосфина (2,3 г, 8,6 ммоль) и метил 3-гидроксибензоата (коммерчески доступный, например, от фирмы Aldrich) (1,2 г, 7,9 ммоль) в ТГФ (40 мл) обрабатывали по каплям в течение 5 минут диизопропил азодикарбоксилатом (1,68 мл, 8,6 ммоль). Смесь нагревали при комнатной температуре и перемешивали в течение 18 часов. Смесь далее упаривали досуха и очищали с помощью флэш-хроматографии на колонке (100 г силикагелевый картридж) с использованием градиентного элюирования от 0 до 100% метил трет-бутилового эфира в циклогексане в течение 40 минут с получением указанного в заголовке соединения (2,53 г, 85%-ный выход). ЖХМС RT=1,14 мин, ES+ve m/z 430 [M+NH4]+.
3-((14,14-диметил-12-оксо-3,6,9,13-тетраоксапентадецил)окси)бензойная кислота
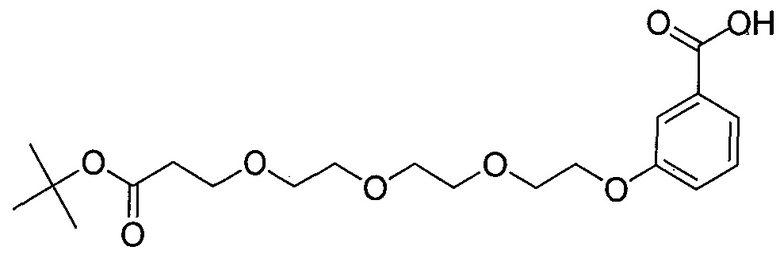 .
.
Раствор метил 3-((14,14-диметил-12-оксо-3,6,9,13-тетраоксапентадецил)окси)бензоата (2,53 г, 4,9 ммоль) в метаноле (25 мл) обрабатывали 1M водным раствором гидроксида натрия (0,3 г, 7,6 ммоль) в воде (7 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Медленно добавляли уксусную кислоту (0,45 мл, 7,9 ммоль) и смесь упаривали досуха и очищали с помощью флэш-хроматографии (100 г силикагелевый картридж) с использованием градиентного элюирования от 0% до 15% метанола в дихлорметане (+1% триэтиламин) с получением указанного в заголовке соединения (1,37 г, 70%-ный выход). ЖХМС RT=0,99 мин, ES+ve m/z 399 [M+H]+.
трет-бутил ((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3-метил-1-оксобутан-2-ил)карбамат
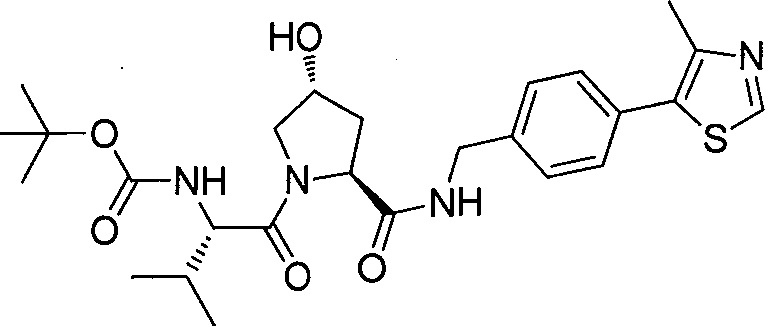 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (125 мг, 0,35 ммоль) и (S)-2-((трет-бутоксикарбонил)амино)-3-метилбутановой кислоты (коммерчески доступной, например, от фирмы Aldrich) (77 мг, 0,35 ммоль) в ДМФ (0,9 мл) обрабатывали DIPEA (0,22 мл, 1,3 ммоль) и затем HATU (134 мг, 0,35 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (120 мг, 72%-ный выход). ЖХМС RT=0,87 мин, ES+ve m/z 517 [M+H]+.
Используя способ, аналогичный способу получения трет-бутил-((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3-метил-1-оксобутан-2-ил)карбамата, получали следующие соединения:
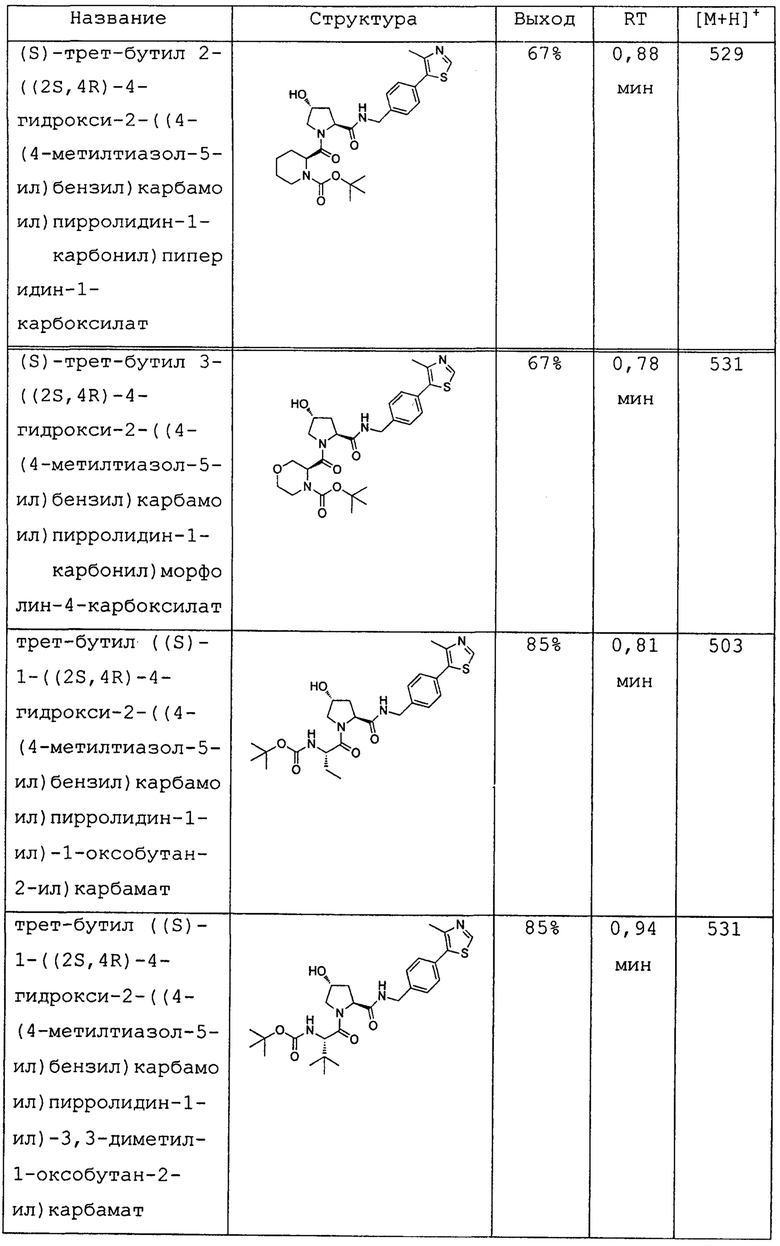
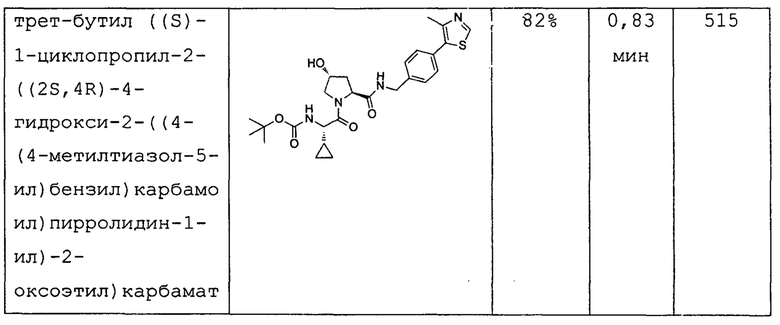
(2S,4R)-1-(2-аминоацетил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
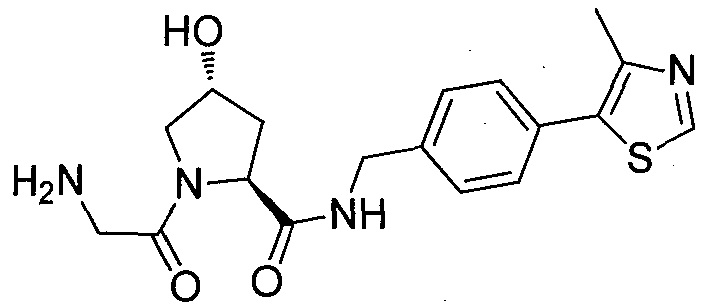 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (100 мг, 0,28 ммоль) и 2-((трет-бутоксикарбонил)амино)уксусной кислоты (коммерчески доступной, например, от фирмы Aldrich) (49 мг, 0,28 ммоль) в ДМФ (3 мл) обрабатывали DIPEA (0,20 мл, 1,1 ммоль) и затем HATU (118 мг, 0,31 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли воду (20 мл) и продукт экстрагировали этилацетатом (3×20 мл). Объединенную органическую фазу промывали насыщенным водным раствором бикарбоната натрия (20 мл), водой (20 мл), насыщенным солевым раствором (20 мл), фильтровали через гидрофобную фритту и упаривали досуха. Остаток затем растворяли в дихлорметане (3 мл) и обрабатывали ТФУ (1 мл, 13 ммоль). После перемешивания при комнатной температуре в течение 10 минут реакционную смесь упаривали досуха. Остаток растворяли в минимальном количестве метанола и затем помещали на предварительно промытый (метанол) аминопропиловый картридж для твердофазной экстракции (5 г). Колонку элюировали метанолом (3 объема), и фракции, содержащие продукт, упаривали досуха с получением указанного в заголовке соединения (104 мг, 99%-ный выход). ЖХМС RT=0,44 мин, ES+ve m/z 375 [M+H]+.
(2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)-1-((S)-морфолин-3-карбонил)пирролидин-2-карбоксамид
 .
.
Раствор (S)-трет-бутил 3-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбонил)морфолин-4-карбоксилата (115 мг, 0,22 ммоль) в дихлорметане (0,5 мл) обрабатывали ТФУ (0,5 мл), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Смесь упаривали досуха, и остаток затем растворяли в минимальном количестве смеси метанол:дихлорметан (1:1) и помещали на предварительно промытый (метанол) аминопропиловый картридж для твердофазной экстракции (2 г). Колонку элюировали метанолом (3 объема), и фракции, содержащие продукт, упаривали при пониженном давлении с получением указанного в заголовке соединения (89 мг, 94%-ный выход). ЖХМС RT=0,47 мин, ES+ve m/z 431 [M+H]+.
гидрохлорид (2S,4R)-4-гидрокси-1-((S)-3-метил-2-(метиламино)бутаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида
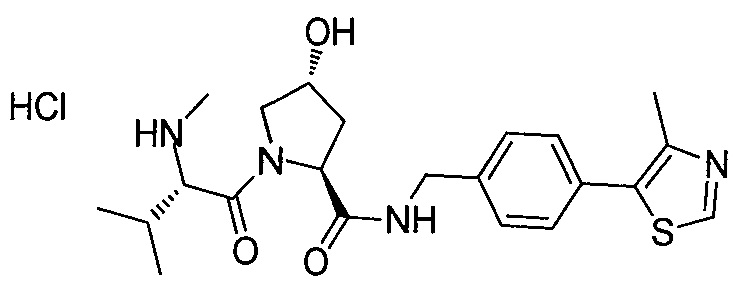 .
.
Смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (100 мг, 0,28 ммоль), (S)-2-((трет-бутоксикарбонил)(метил)амино)-3-метилбутановой кислоты (коммерчески доступной, например, от фирмы Aldrich) (65 мг, 0,28 ммоль) и DIPEA (0,247 мл, 1,41 ммоль) в ДМФ (2 мл) обрабатывали HATU (118 мг, 0,31 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Промежуточный Boc-защищенный продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота). Очищенный промежуточный продукт растворяли в смеси метанол:дихлорметан (1:1, 3 мл), обрабатывали хлористоводородной кислотой в 1,4-диоксане (4M, 3 мл, 12 ммоль) и оставляли стоять в течение 1 часа. Смесь далее упаривали досуха с получением указанного в заголовке соединения (107 мг, 0,23 ммоль, 81%-ный выход). ЖХМС RT=0,55 мин, ES+ve m/z 431 [M+H]+.
гидрохлорид (2S,4R)-1-((S)-2-амино-3-метилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида
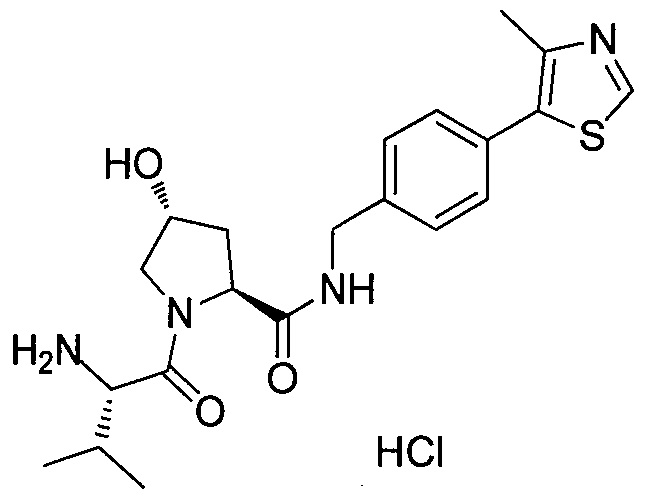 .
.
Раствор трет-бутил ((S)-1-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-ил)-3-метил-1-оксобутан-2-ил)карбамата (287 мг, 0,56 ммоль) в ТГФ (5 мл) обрабатывали 4M соляной кислотой в 1,4-диоксане (10 мл) и перемешивали при комнатной температуре в течение 2 часов. Смесь упаривали досуха с получением указанного в заголовке соединения (224 мг, 0,49 ммоль, количественный). ЖХМС RT=0,55 мин, ES+ve m/z 417 [M+H]+.
гидрохлорид (2S,4R)-1-((S)-2-амино-3,3-диметилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида
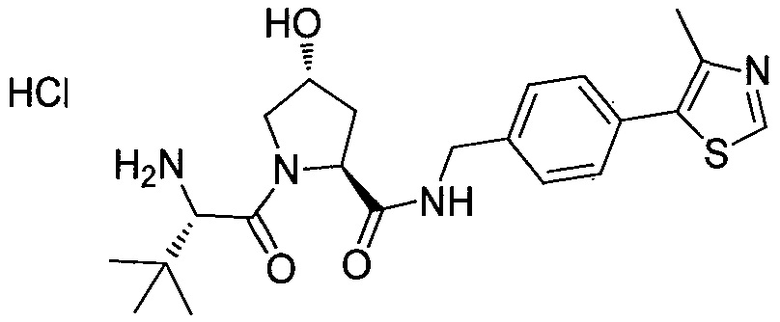 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (70 мг, 0,20 ммоль) и (S)-2-((трет-бутоксикарбонил)амино)-3,3-диметилбутановой кислоты (коммерчески доступной, например, от фирмы Fluka) (50 мг, 0,22 ммоль) в ДМФ (1 мл) обрабатывали DIPEA (0,14 мл, 0,79 ммоль) и затем HATU (90 мг, 0,24 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением промежуточного Boc-защищенного продукта. Промежуточный продукт затем растворяли в смеси дихлорметана (0,5 мл) и метанола (0,1 мл) и обрабатывали 4M соляной кислотой в 1,4-диоксане (0,25 мл, 1,0 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь упаривали досуха, и остаток растирали до твердого вещества в дихлорметане и сушили в вакууме с получением указанного в заголовке соединения (76 мг, 82%-ный выход). ЖХМС RT=0,58 мин, ES+ve m/z 431 [M+H]+.
гидрохлорид (2S,4R)-1-((S)-2-((S)-2-амино-4-метилпентанамидо)пропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида
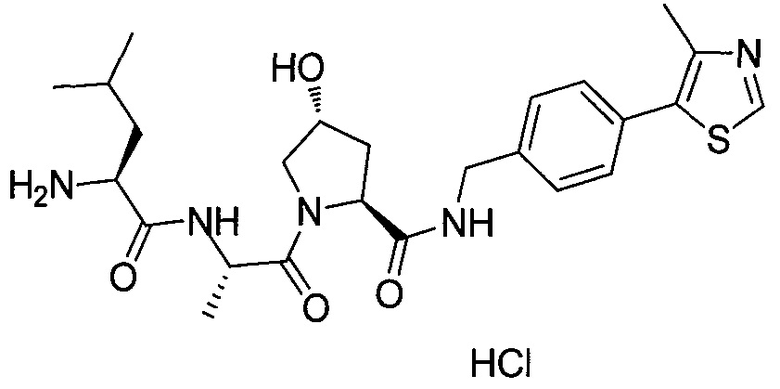 .
.
Раствор смеси гидрохлорида (2S,4R)-1-((S)-2-аминопропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (507 мг, 1,2 ммоль), DIPEA (0,868 мл, 4,97 ммоль) и (S)-2-((трет-бутоксикарбонил)амино)-4-метилпентановой кислоты (коммерчески доступной, например, от фирмы Aldrich) (230 мг, 0,99 ммоль) в ДМФ (5 мл) обрабатывали HATU (416 мг, 1,1 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Добавляли воду (50 мл), и продукт экстрагировали этилацетатом (50 мл). Органическую фазу промывали насыщенным солевым раствором (2×50 мл), сушили с использованием гидрофобной фритты и упаривали досуха. Остаток растворяли в смеси метанол:дихлорметан (1:1,15 мл), обрабатывали хлористоводородной кислотой в 1,4-диоксане (4M, 5 мл, 20 ммоль) и перемешивали при комнатной температуре в течение 3 часов. Смесь упаривали досуха, и остаток суспендировали в дихлорметане (10 мл), подвергали воздействию ультразвуком, фильтровали и сушили в вакууме с получением указанного в заголовке соединения (280 мг, 0,56 ммоль, 56%-ный выход). ЖХМС RT=0,55 мин, ES+ve m/z 502 [M+H]+.
(2S,4R)-трет-бутил 2-((4-(2,4-диметилтиазол-5-ил)бензил)карбамоил)-4-гидроксипирролидин-1-карбоксилат
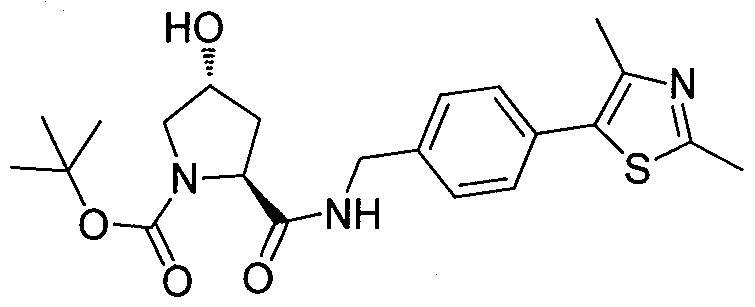 .
.
В атмосфере азота смесь (2S,4R)-трет-бутил 2-((4-бромбензил)карбамоил)-4-гидроксипирролидин-1-карбоксилата (200 мг, 0,50 ммоль), 2,4-диметилтиазола (коммерчески доступный, например, от фирмы Avocado) (113 мг, 1,0 ммоль), ацетата палладия(II) (коммерчески доступный, например, от фирмы Aldrich) (2 мг, 10 мкмоль) и ацетата калия (98 мг, 1,0 ммоль) в N-метил-2-пирролидоне (2 мл) перемешивали при температуре 120°C в течение 18 часов. Охлажденную смесь обрабатывали водой (25 мл), и продукт экстрагировали этилацетатом (4×30 мл). Объединенную органическую фазу промывали насыщенным солевым раствором (5×20 мл), фильтровали через гидрофобную фритту и упаривали досуха. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (142 мг, 66%-ный выход). ЖХМС RT=0,77 мин, ES+ve m/z 432 [M+H]+.
гидрохлорид (2S,4R)-N-(4-(2,4-диметилтиазол-5-ил)бензил)-4-гидроксипирролидин-2-карбоксамида
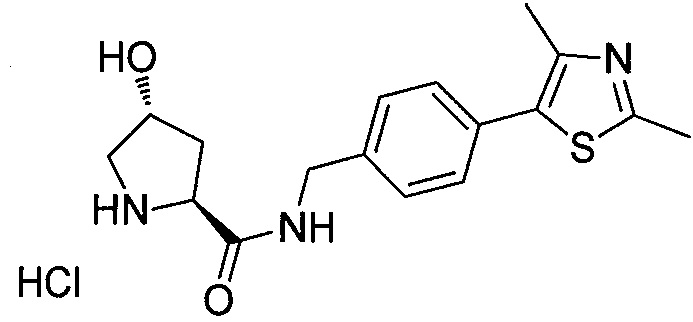 .
.
Раствор (2S,4R)-трет-бутил 2-((4-(2,4-диметилтиазол-5-ил)бензил)карбамоил)-4-гидроксипирролидин-1-карбоксилата (142 мг, 0,33 ммоль) в смеси метанола (0,5 мл) и дихлорметана (1,5 мл) обрабатывали 4M соляной кислотой в 1,4-диоксане (0,63 мл, 2,5 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Растворитель упаривали досуха, и остаток растирали до твердого вещества в диэтиловом эфире и сушили в вакууме с получением указанного в заголовке соединения (120 мг, 99%-ный выход). ЖХМС RT=0,49 мин, ES+ve m/z 332 [M+H]+.
(S)-3-метил-2-(3-метил-2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)бутановая кислота
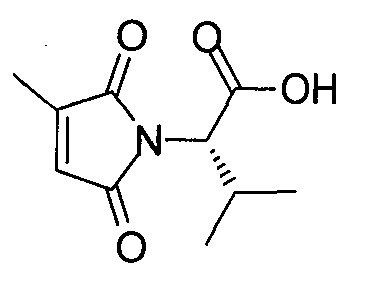 .
.
Смесь 3-метилфуран-2,5-диона (коммерчески доступный, например, от фирмы Aldrich) (0,12 мл, 1,3 ммоль) и (S)-2-амино-3-метилбутановой кислоты (коммерчески доступной, например, от фирмы Apollo Scientific) (150 мг, 1,3 ммоль) в уксусной кислоте (1 мл) герметически закрывали и нагревали в микроволновом реакторе Biotage "Initiator" при температуре 120°C в течение 1 часа. Смесь упаривали досуха с получением указанного в заголовке соединения (253 мг, 94%-ный выход). ЖХМС RT=0,75 мин, ES+ve m/z 212 [M+H]+
бензил 2-(3-оксоморфолино)пропаноат
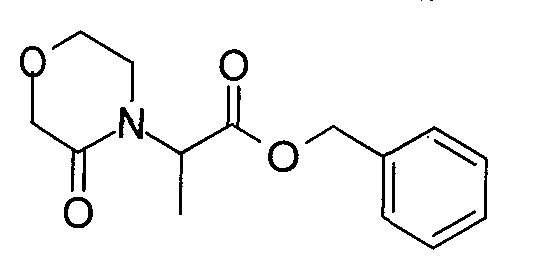 .
.
В атмосфере азота охлаждаемый льдом раствор морфолин-3-она (коммерчески доступный, например, от фирмы Aldrich) (100 мг, 1,0 ммоль) в ДМФ (2 мл) обрабатывали гидридом натрия (60% масс./масс. в минеральном масле) (40 мг, 1,0 ммоль). Спустя 5 минут добавляли бензил 2-бромпропаноат (коммерчески доступный, например, от фирмы Aldrich) (240 мг, 1,0 ммоль), и смесь перемешивали при охлаждении в течение 30 минут и затем при комнатной температуре в течение дополнительных 18 часов. Реакционную смесь осторожно обрабатывали насыщенным водным раствором бикарбоната натрия (10 мл) и затем экстрагировали этилацетатом (2×40 мл). Объединенную органическую фазу промывали насыщенным солевым раствором (25 мл), фильтровали через гидрофобную фритту и упаривали досуха. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (105 мг, 40%-ный выход). ЖХМС RT=0,80 мин, ES+ve m/z 264 [M+H]+.
2-(3-оксоморфолинo)пропановая кислота
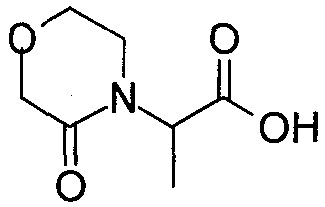 .
.
В атмосфере азота раствор бензил 2-(3-оксоморфолинo)пропаноата (90 мг, 0,34 ммоль) в этаноле (3 мл) добавляли в колбу, содержащую палладий на углероде (36 мг, 0,034 ммоль) (10%, тип Дегусса). Колбу затем заполняли водородом, и смесь перемешивали при комнатной температуре в течение 1 часа. Катализатор удаляли путем фильтрования через целит, и фильтрат упаривали при пониженном давлении с получением указанного в заголовке соединения (55 мг, 93%-ный выход). ЖХМС RT=0,33 мин, ES+ve m/z 174 [M+H]+.
трет-бутил 4-(1-(бензилокси)-1-оксопропан-2-ил)-3-оксопиперазин-1-карбоксилат
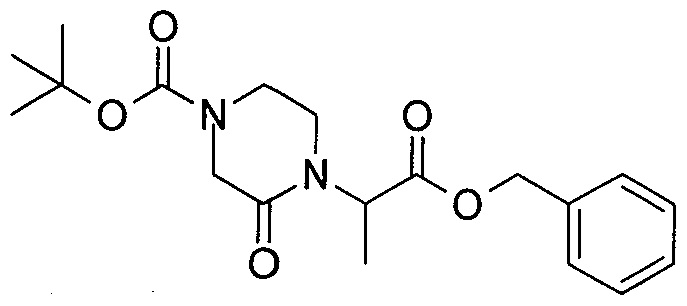 .
.
В атмосфере азота охлаждаемый льдом раствор трет-бутил 3-оксопиперазин-1-карбоксилата (коммерчески доступный, например, от фирмы Aldrich) (200 мг, 1,0 ммоль) в ДМФ (4 мл) обрабатывали гидридом натрия (60% масс./масс. в минеральном масле) (44 мг, 1,1 ммоль). Спустя 5 минут добавляли бензил 2-бромпропаноат (коммерчески доступный, например, от фирмы Aldrich) (255 мг, 1,05 ммоль). Смесь перемешивали при температуре 0°C в течение 30 минут и затем при комнатной температуре в течение дополнительных 18 часов. Смесь осторожно обрабатывали насыщенным водным раствором бикарбоната натрия (20 мл) и затем экстрагировали этилацетатом (2×40 мл). Объединенную органическую фазу промывали насыщенным солевым раствором (25 мл), фильтровали через гидрофобную фритту и упаривали досуха. Продукт очищали с помощью флэш-хроматографии на колонке (20 г силикагелевый картридж) с использованием градиентного элюирования от 0% до 100% этилацетата в циклогексане с получением указанного в заголовке соединения (230 мг, 64%-ный выход). ЖХМС RT=1,05 мин, ES+ve m/z 363 [M+H]+.
2-(4-(трет-бутоксикарбонил)-2-оксопиперазин-1-ил)пропановая кислота
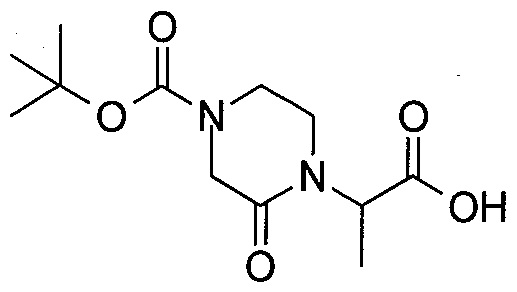 .
.
В атмосфере азота раствор трет-бутил 4-(1-(бензилокси)-1-оксопропан-2-ил)-3-оксопиперазин-1-карбоксилата (230 мг, 0,64 ммоль) в этаноле (3 мл) добавляли в колбу, содержащую палладий на углероде (68 мг, 0,063 ммоль) (10%, тип Дегусса). Колбу заполняли водородом, и смесь перемешивали при комнатной температуре в течение 1 часа. Катализатор удаляли путем фильтрации через целит, и фильтрат упаривали при пониженном давлении с получением указанного в заголовке соединения (171 мг, 99%-ный выход). ЖХМС RT=0,62 мин, ES+ve m/z 290 [M+H]+.
трет-бутил 4-(2-оксо-2,3-дигидробензо[d]оксазол-5-ил)бензилкарбамат
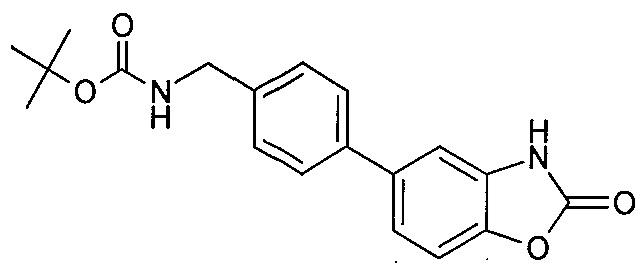 .
.
В атмосфере азота смесь (4-(((трет-бутоксикарбонил)амино)метил)фенил)бороновой кислоты (коммерчески доступной, например, от фирмы Aldrich) (387 мг, 1,54 ммоль), 5-бромбензо[d]оксазол-2(3H)-она (коммерчески доступный, например, от фирмы Aldrich) (300 мг, 1,40 ммоль) и карбоната натрия (446 мг, 4,21 ммоль) в ДМФ (4 мл) обрабатывали дихлор[1,1′-бис(дифенилфосфино)ферроцен]палладием(II) (коммерчески доступный, например, от фирмы Aldrich) (72 мг, 0,098 ммоль), затем герметически закрывали и нагревали в микроволновом реакторе Biotage "Initiator" при температуре 110°C в течение 1 часа. Охлажденную смесь продуктов обрабатывали дихлорметаном (50 мл) и водой (10 мл). Смесь разделяли, и органическую фракцию упаривали досуха. Продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (178 мг, 0,52 ммоль, 37%-ный выход). ЖХМС RT=1,03 мин, ES+ve m/z 341 [M+H]+.
гидрохлорид 5-(4-(аминометил)фенил)бензо[d]оксазол-2(3H)-он
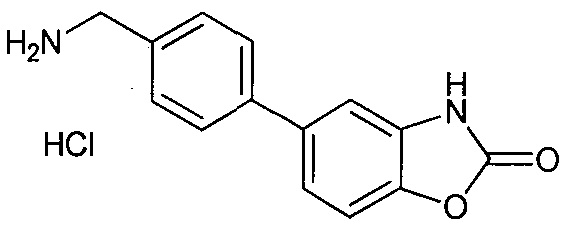 .
.
Раствор трет-бутил 4-(2-оксо-2,3-дигидробензо[d]оксазол-5-ил)бензилкарбамата (130 мг, 0,38 ммоль) в ТГФ (10 мл) обрабатывали хлористоводородной кислотой (4M в 1,4-диоксане) (1 мл, 4 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. Смесь обрабатывали диэтиловым эфиром (40 мл); образовавшийся осадок отфильтровывали и сушили в вакууме с получением указанного в заголовке соединения (87 мг, 0,31 ммоль, 82%-ный выход). ЖХМС RT=0,49 мин, ES+ve m/z 241 [M+H]+.
(2S,4R)-4-гидрокси-1-(3-гидроксибензоил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
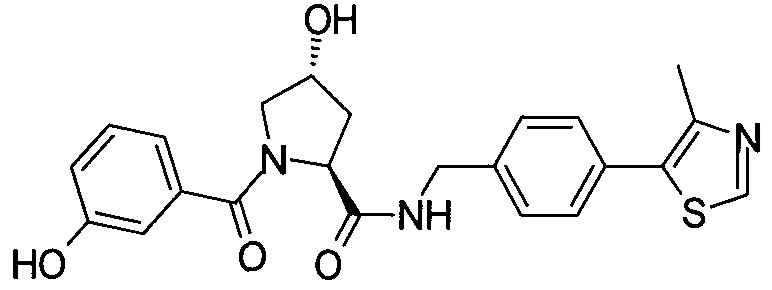 .
.
Охлаждаемый льдом раствор гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (217 мг, 0,61 ммоль), 3-гидроксибензойной кислоты (85 мг, 0,61 ммоль) и DIPEA (0,321 мл, 1,84 ммоль) в ДМФ (4 мл) обрабатывали по частям HATU (240 мг, 0,63 ммоль) в течение 1 минуты и затем перемешивали при комнатной температуре в течение 1 часа. Смесь обрабатывали насыщенным водным раствором бикарбоната натрия (20 мл) и экстрагировали этилацетатом (3×20 мл). Объединенную органическую фазу промывали насыщенным солевым раствором (3×30 мл), фильтровали через гидрофобную фритту и затем упаривали досуха. Продукт очищали с помощью флэш-хроматографии (50 г силикагелевый картридж) с использованием градиентного элюирования от 0 до 25% метанола в дихлорметане с получением указанного в заголовке соединения (234 мг, 0,53 ммоль, 87%-ный выход). ЖХМС RT=0,49 мин, ES+ve m/z 241 [M+H]+.
(S)-2-(1-оксоизоиндолин-2-ил)пропановая кислота
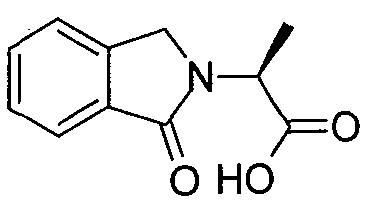 .
.
Смесь фталальдегида (коммерчески доступный, например, от фирмы Aldrich) (4 г, 30 ммоль) и (S)-2-аминопропановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (2,39 г, 27 ммоль) в ацетонитриле (150 мл) нагревали при температуре кипения с обратным холодильником в течение 5 часов, затем давали охладиться до комнатной температуры и оставляли стоять в течение ночи. Полученный кристаллический осадок отфильтровывали, промывали ацетонитрилом и сушили в вакууме с получением указанного в заголовке соединения (4,46 г, 22 ммоль, 73%-ный выход). ЖХМС RT=0,59 мин, ES+ve m/z 206 [M+H]+.
Используя способ, аналогичный способу получения (S)-2-(1-оксоизоиндолин-2-ил)пропановой кислоты, получали следующие соединения:
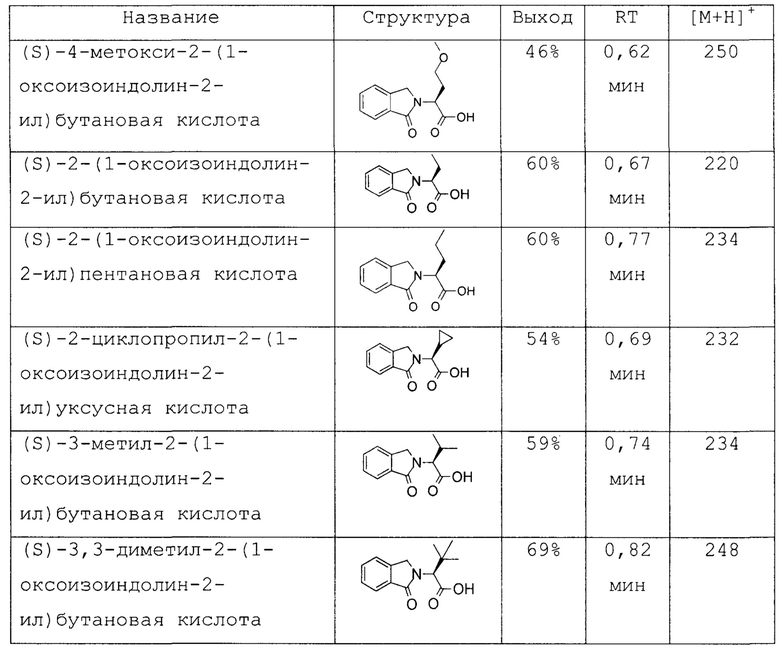
Этил 2-(5-метокси-1-оксоизоиндолин-2-ил)-3-метилбутаноат
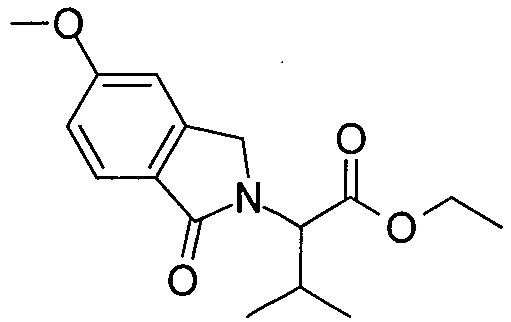 .
.
В атмосфере азота охлаждаемый льдом раствор 5-метоксиизоиндолин-1-она (коммерчески доступный, например, от фирмы Chem Impex) (105 мг, 0,64 ммоль) в ДМФ (2,5 мл) обрабатывали гидридом натрия (60% масс./масс. в минеральном масле) (31 мг, 0,77 ммоль). Смесь нагревали при комнатной температуре, обрабатывали этил 2-бром-3-метилбутаноатом (коммерчески доступный, например, от фирмы Alfa Aesar) (135 мг, 0,64 ммоль), перемешивали при комнатной температуре в течение 2 часов и затем нагревали до температуры 70°C в течение дополнительных 18 часов. Смесь затем охлаждали льдом и обрабатывали дополнительным количеством гидрида натрия (60% масс./масс. в минеральном масле) (31 мг, 0,77 ммоль), затем этил 2-бром-3-метилбутаноатом (135 мг, 0,64 ммоль) и перемешивали при температуре 70°C в течение дополнительных 24 часов. Охлажденную смесь затем осторожно обрабатывали насыщенным водным раствором хлорида аммония (20 мл), и продукт экстрагировали этилацетатом (2×25 мл). Объединенную органическую фазу промывали водой (20 мл), насыщенным солевым раствором (20 мл), фильтровали через гидрофобную фритту и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (20 г силикагелевый картридж) с использованием градиентного элюирования от 0% до 50% этилацетата в циклогексане с получением указанного в заголовке соединения (44 мг, 23%-ный выход). ЖХМС RT=1,01 мин, ES+ve m/z 292 [M+H]+.
Этил 2-(6-метокси-1-оксоизоиндолин-2-ил)-3-метилбутаноат
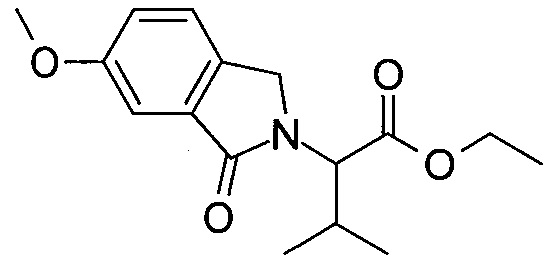 .
.
В атмосфере азота охлаждаемый льдом раствор 6-метоксиизоиндолин-1-она (коммерчески доступный, например, от фирмы Astatech) (105 мг, 0,64 ммоль) в ДМФ (2,5 мл) обрабатывали гидридом натрия (60% масс./масс. в минеральном масле) (31 мг, 0,77 ммоль), и смесь оставляли нагреваться до комнатной температуры. Смесь затем обрабатывали этил 2-бром-3-метилбутаноатом (коммерчески доступный, например, от фирмы Alfa Aesar) (135 мг, 0,64 ммоль), и смесь перемешивали в течение 18 часов, затем осторожно обрабатывали насыщенным водным раствором хлорида аммония (20 мл). Продукт экстрагировали этилацетатом (2×25 мл), и объединенную органическую фазу промывали водой (20 мл), насыщенным солевым раствором (20 мл), фильтровали через гидрофобную фритту и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (20 г силикагелевый картридж) с использованием градиентного элюирования от 0 до 50% этилацетата в циклогексане с получением указанного в заголовке соединения (40 мг, 21%-ный выход). ЖХМС RT=1,03 мин, ES+ve m/z 292 [M+H]+.
2-(6-метокси-1-оксоизоиндолин-2-ил)-3-метилбутановая кислота
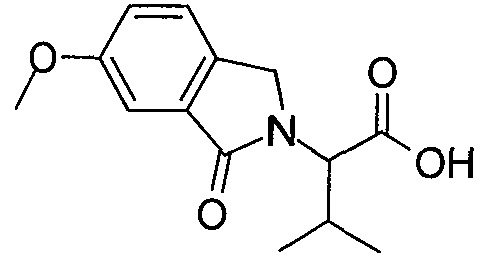 .
.
Раствор этил 2-(6-метокси-1-оксоизоиндолин-2-ил)-3-метилбутаноата (40 мг, 0,14 ммоль) в этаноле (0,4 мл) обрабатывали 2M водным раствором гидроксида натрия (0,20 мл, 0,41 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь упаривали досуха, обрабатывали водой (10 мл) и подкисляли до pH 3, используя 2M водный раствор соляной кислоты. Продукт экстрагировали этилацетатом (2×10 мл), и объединенную органическую фазу фильтровали через гидрофобную фритту и упаривали досуха с получением указанного в заголовке соединения (34 мг, 94%-ный выход). ЖХМС RT=0,80 мин, ES+ve m/z 264 [M+H]+.
2-(5-метокси-1-оксоизоиндолин-2-ил)-3-метилбутановая кислота
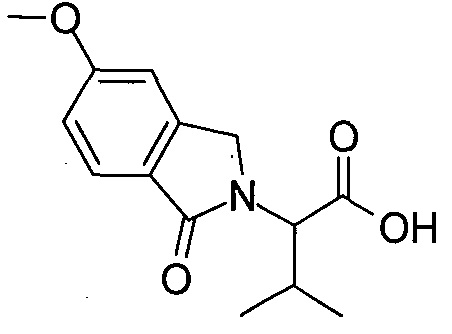 .
.
Раствор этил 2-(5-метокси-1-оксоизоиндолин-2-ил)-3-метилбутаноата (40 мг, 0,14 ммоль) в этаноле (0,4 мл) обрабатывали 2M водным раствором гидроксида натрия (0,20 мл, 0,41 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь далее упаривали досуха; остаток обрабатывали водой (10 мл) и подкисляли до pH 3, используя 2M водный раствор соляной кислоты. Продукт экстрагировали этилацетатом (2×10 мл), и объединенную органическую фазу фильтровали через гидрофобную фритту и упаривали досуха с получением указанного в заголовке соединения (33 мг, 93%-ный выход). ЖХМС RT=0,76 мин, ES+ve m/z 264 [M+H]+.
Этил 2-(7-хлор-1-оксоизоиндолин-2-ил)-3-метилбутаноат
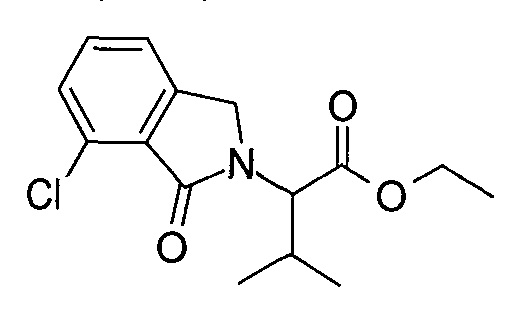 .
.
В атмосфере азота охлаждаемый льдом раствор 7-хлоризоиндолин-1-она (коммерчески доступный, например, от фирмы JW Pharm) (150 мг, 0,90 ммоль) в ДМФ (2,5 мл) обрабатывали гидридом натрия (60% масс./масс. в минеральном масле) (50 мг, 1,25 ммоль). Смеси давали нагреться до комнатной температуры, затем обрабатывали этил 2-бром-3-метилбутаноатом (коммерчески доступный, например, от фирмы Alfa Aesar) (187 мг, 0,90 ммоль) и перемешивали в течение 5 часов. Смесь затем охлаждали льдом, обрабатывали дополнительным количеством гидрида натрия (60% масс./масс. в минеральном масле) (50 мг, 1,25 ммоль) и этил 2-бром-3-метилбутаноатом (187 мг, 0,90 ммоль), и смесь перемешивали при комнатной температуре в течение еще 24 часа. Смесь затем осторожно обрабатывали насыщенным водным раствором хлорида аммония (20 мл), и продукт экстрагировали этилацетатом (2×25 мл). Объединенную органическую фазу промывали водой (20 мл), насыщенным солевым раствором (20 мл), фильтровали через гидрофобную фритту и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (20 г силикагелевый картридж) с использованием градиентного элюирования от 0 до 50% этилацетата в циклогексане с получением указанного в заголовке соединения (40 мг, 15%-ный выход). ЖХМС RT=1,07 мин, ES+ve m/z 296 [M+H]+.
2-(7-хлор-1-оксоизоиндолин-2-ил)-3-метилбутановая кислота
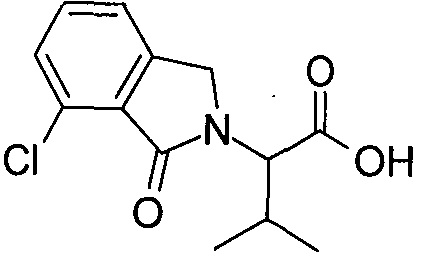 .
.
Раствор этил 2-(7-хлор-1-оксоизоиндолин-2-ил)-3-метилбутаноата (40 мг, 0,14 ммоль) в этаноле (0,4 мл) обрабатывали 2M водным раствором гидроксида натрия (0,22 мл, 0,45 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь далее упаривали досуха, обрабатывали водой (10 мл) и затем подкисляли до pH 3, используя 2M водный раствор соляной кислоты. Продукт экстрагировали этилацетатом (2×10 мл), и объединенную органическую фазу фильтровали через гидрофобную фритту и упаривали досуха с получением указанного в заголовке соединения (34 мг, 94%-ный выход). ЖХМС RT=0,82 мин, ES+ve m/z 268 [M+H]+.
2-гидрокси-4-(4-метилтиазол-5-ил)бензонитрил
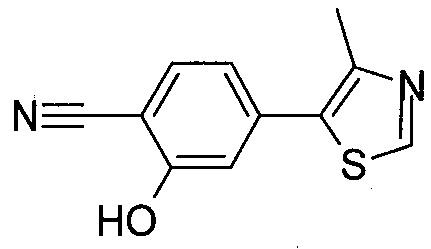 .
.
В атмосфере азота смесь 4-бром-2-гидроксибензонитрила (коммерчески доступный, например, от фирмы Fluorochem) (15 г, 76 ммоль), 4-метилтиазола (коммерчески доступный, например, от фирмы Aldrich) (14 мл, 152 ммоль), ацетата калия (14,9 г, 152 ммоль) и ацетата палладия(II) (0,34 г, 1,52 ммоль) в 1-метил-2-пирролидоне (125 мл) нагревали при температуре 110°C в течение 3 часов. Смесь затем охлаждали до температуры 50°C, выливали в воду (300 мл) и экстрагировали этилацетатом (3×350 мл). Объединенную органическую фракцию фильтровали, и фильтрат затем промывали насыщенным солевым раствором (3×400 мл), фильтровали через гидрофобную фритту и упаривали досуха. Остаток вновь упаривали из толуола, затем из диэтилового эфира и затем суспендировали в метаноле до твердого осадка желтого цвета, который отфильтровывали. Фильтрат упаривали досуха и суспендировали в охлажденном льдом метаноле с получением второй порции твердого продукта желтого цвета. Объединенный твердый продукт сушили в вакууме с получением указанного в заголовке соединения (12 г, 56 ммоль, 73%-ный выход). ЖХМС RT=0,75 мин, ES+ve m/z 217 [M+H]+.
2-(Аминометил)-5-(4-метилтиазол-5-ил)фенол
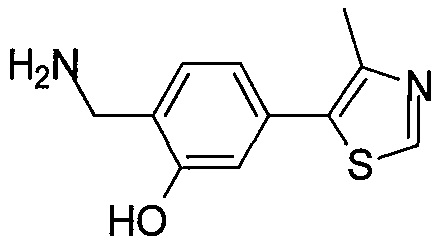 .
.
Охлаждаемый льдом раствор 2-гидрокси-4-(4-метилтиазол-5-ил)бензонитрила (12 г, 56 ммоль) в ТГФ (550 мл) обрабатывали по каплям литийалюминийгидридом (1M в ТГФ, 140 мл, 140 ммоль) в течение 5 минут. Полученную смесь затем нагревали при температуре 50°C в течение 30 минут и добавляли дополнительное количество литийалюминийгидрида (1M в ТГФ, 20 мл, 20 ммоль). Спустя дополнительные 30 минут смесь охлаждали на ледяной бане и обрабатывали осторожно водой (14 мл), затем водным раствором гидроксида натрия (4M, 42 мл, 168 ммоль) и, в заключении, водой (14 мл). После стояния в течение 3 дней смесь фильтровали, и отфильтрованный твердый продукт промывали ТГФ. Объединенный фильтрат упаривали досуха, и остаток переводили во взвесь в смеси дихлорметан:метанол (4:1) с целитом (примерно 20 г) и фильтровали. Отфильтрованный твердый продукт промывали три раза с помощью смеси дихлорметан/метанол (4:1), и объединенный фильтрат упаривали досуха. Продукт очищали с помощью флэш-хроматографии (330 г силикагелевый картридж) с использованием градиентного элюирования от 0 до 15% метанола в дихлорметане (+1% триэтиламин) с получением указанного в заголовке соединения (6,2 г, 28 ммоль, 51%-ный выход). ЖХМС RT=0,41 мин, ES+ve m/z 221 [M+H]+.
(2S,4R)-трет-бутил 4-гидрокси-2-((2-гидрокси-4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-l-карбоксилат
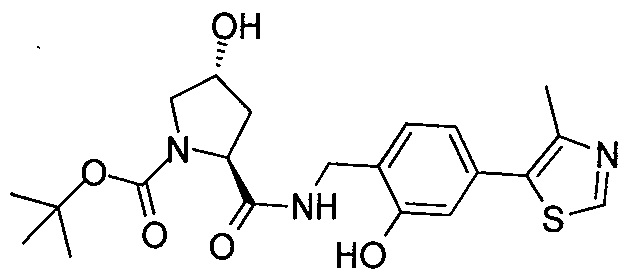 .
.
Охлаждаемый льдом раствор 2-(аминометил)-5-(4-метилтиазол-5-ил)фенола (3,05 г, 13,8 ммоль) и (2S,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-карбоновой кислоты (2,94 мл, 13,8 ммоль) в ДМФ (35 мл) обрабатывали DIPEA (7,25 мл, 42 ммоль), затем HATU (5,79 г, 15,2 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Смесь обрабатывали насыщенным водным раствором бикарбоната натрия (50 мл) и экстрагировали этилацетатом (3×80 мл). Объединенную органическую фазу промывали насыщенным солевым раствором (60 мл), фильтровали через гидрофобную фритту и упаривали досуха. Продукт очищали с помощью флэш-хроматографии (330 г силикагелевый картридж) с использованием градиента от 0 до 15% метанола в дихлорметане с получением указанного в заголовке продукта (4,8 г, 11 ммоль, 80%-ный выход). ЖХМС RT=0,76 мин, ES+ve m/z 434 [M+H]+.
гидрохлорид (2S,4R)-4-гидрокси-N-(2-гидрокси-4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида
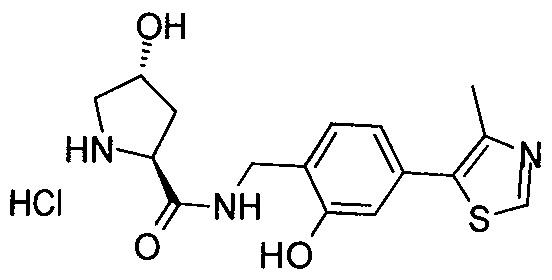 .
.
Раствор (2S,4R)-трет-бутил 4-гидрокси-2-((2-гидрокси-4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбоксилата (4,8 г, 11 ммоль) в смеси дихлорметан:метанол 20:1 (50 мл) обрабатывали хлористоводородной кислотой (4M в 1,4-диоксане) (35 мл, 140 ммоль), и смесь перемешивали в течение ночи при комнатной температуре. Смесь далее упаривали досуха, и твердый продукт суспендировали в дихлорметане и фильтровали. Отфильтрованный твердый продукт промывали дополнительным количеством дихлорметана и сушили в вакууме с получением указанного в заголовке соединения (4 г, 10,8 ммоль, 98%-ный выход). ЖХМС RT=0,46 мин, ES+ve m/z 334 [M+H]+.
гидрохлорид (2S,4R)-1-((S)-2-аминопропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида
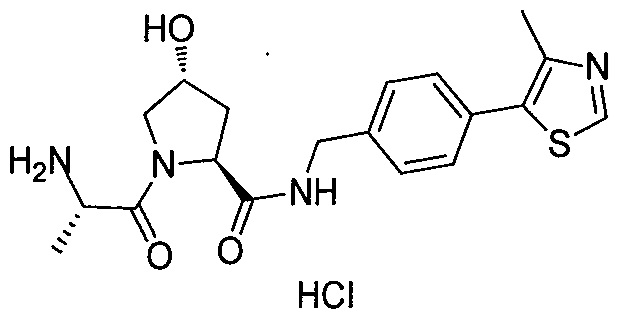 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (100 мг, 0,28 ммоль), (S)-2-((трет-бутоксикарбонил)амино)пропановой кислоты (коммерчески доступный, например, от фирмы Aldrich) (64 мг, 0,34 ммоль) и DIPEA (0,197 мл, 1,13 ммоль) в сухом ДМФ (3 мл) обрабатывали HATU (129 мг, 0,34 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Смесь затем распределяли между этилацетатом (30 мл) и водой (30 мл), и органическую фазу промывали насыщенным солевым раствором (30 мл), сушили (гидрофобная фритта) и упаривали досуха. Остаток растворяли в метаноле и помещали на предварительно промытый метанолом аминопропиловый картридж для твердофазной экстракции (2 г), элюируя метанолом (3 объема колонки). Полученный элюент упаривали досуха, и остаток растворяли в смеси дихлорметан:метанол (1:1, 8 мл) и обрабатывали хлористоводородной кислотой (4M в 1,4-диоксане) (1 мл, 4 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов и затем упаривали досуха с получением указанного в заголовке соединения (107 мг, 0,25 ммоль, 89%-ный выход). ЖХМС RT=0,51 мин, ES+ve m/z 389 [M+H]+.
(2S,4R)-1-(2-амино-2-метилпропаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
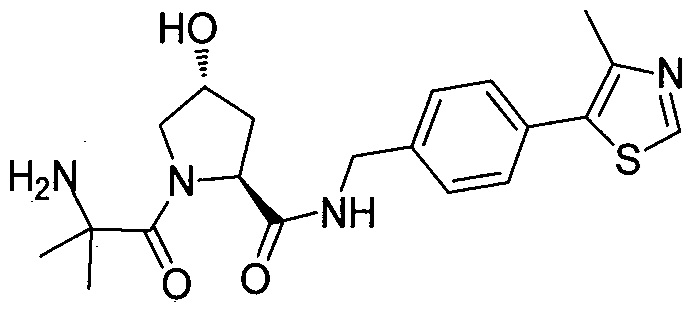 .
.
Раствор смеси гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (100 мг, 0,28 ммоль), 2-((трет-бутоксикарбонил)амино)-2-метилпропановой кислоты (коммерчески доступная, например, от фирмы Aldrich) (69 мг, 0,34 ммоль) и DIPEA (0,197 мл, 1,13 ммоль) в сухом ДМФ (3 мл) обрабатывали HATU (129 мг, 0,34 ммоль, перемешивали при комнатной температуре в течение 30 минут и затем распределяли между этилацетатом (30 мл) и водой (30 мл). Органическую фазу промывали насыщенным солевым раствором (30 мл), сушили (гидрофобная фритта) и упаривали досуха. Остаток растворяли в метаноле и помещали на предварительно промытый метанолом аминопропиловый картридж для твердофазной экстракции (2 г), элюируя метанолом. Полученный элюент упаривали досуха, и остаток растворяли в смеси дихлорметан:метанол (1:1, 8 мл) и обрабатывали 4M хлористоводородной кислотой в 1,4-диоксане (1 мл, 4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов и затем упаривали досуха. Остаток суспендировали в дихлорметане (4 мл) и обрабатывали ТФУ (1 мл), и смесь перемешивали при комнатной температуре в течение 4 часов. Смесь упаривали досуха, и остаток растворяли в метаноле и помещали на предварительно промытый метанолом сернокислотный картридж для твердофазной экстракции (2 г) и элюировали метанолом (3 объема колонки) и затем аммиаком в метаноле (2M, 3 объема колонки). Фракции, содержащие продукт, упаривали досуха с получением указанного в заголовке соединения (95 мг, 0,24 ммоль, 84%-ный выход). ЖХМС RT=0,53 мин, ES+ve m/z 403 [M+H]+.
(2S,4R)-4-гидрокси-1-((S)-2-(метиламино)пропаноил)-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
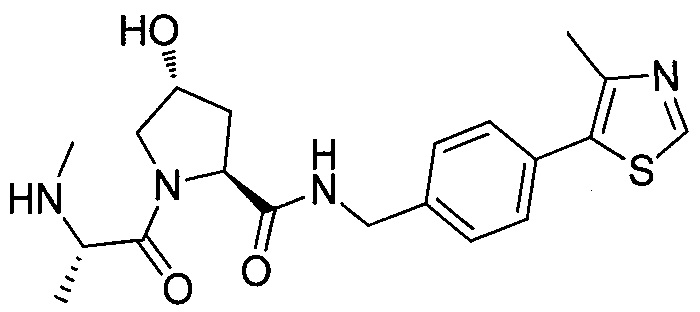 .
.
Перемешиваемую смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (120 мг, 0,34 ммоль) и (S)-2-((трет-бутоксикарбонил)(метил)амино)пропановой кислоты (коммерчески доступна, например, от фирмы Aldrich) (76 мг, 0,37 ммоль) в ДМФ (2 мл) обрабатывали DIPEA (0,24 мл, 1,36 ммоль) и затем HATU (155 мг, 0,41 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Сырой продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением промежуточного Boc-защищенного продукта. Промежуточный продукт суспендировали в дихлорметане (0,5 мл) и обрабатывали ТФУ (0,5 мл). Смесь перемешивали при комнатной температуре в течение 1 часа и далее упаривали досуха. Остаток растворяли в минимальном количестве смеси метанол:дихлорметан (1:1) и затем помещали на предварительно промытый (метанол) аминопропиловый картридж для твердофазной экстракции (5 г). Колонку элюировали метанолом (3 объема), и фракции, содержащие продукт, объединяли и упаривали досуха с получением указанного в заголовке соединения (103 мг, 75%-ный выход). ЖХМС RT=0,47 мин, ES+ve m/z 403 [M+H]+.
гидрохлорид (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)-1-((S)-морфолин-3-карбонил)пирролидин-2-карбоксамида
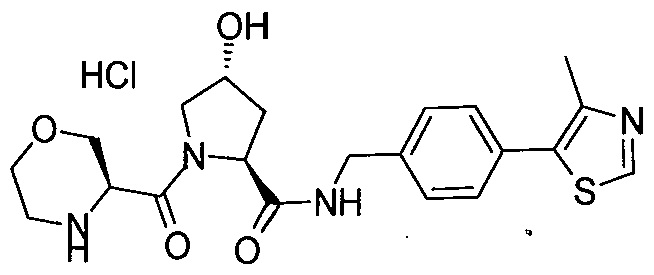 .
.
Смесь гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (100 мг, 0,28 ммоль), (S)-4-(трет-бутоксикарбонил)морфолин-3-карбоновую кислоту (коммерчески доступную, например, от фирмы Astatech) (65 мг, 0,28 ммоль) и DIPEA (0,247 мл, 1,41 ммоль) в ДМФ (2 мл) обрабатывали HATU (118 мг, 0,311 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Промежуточный Boc-защищенный продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота). Промежуточный продукт растворяли в смеси метанол:дихлорметан (1:1, 3 мл), обрабатывали хлористоводородной кислотой в 1,4-диоксане (4M, 3 мл, 12 ммоль) и оставляли стоять в течение 1 часа. Смесь упаривали досуха с получением указанного в заголовке соединения (110 мг, 0,24 ммоль, 83%-ный выход). ЖХМС RT=0,50 мин, ES+ve m/z 431/432 [M+H]+.
трет-бутил 4-(3-((2S,4R)-4-гидрокси-2-((4-(4-метилтиазол-5-ил)бензил)карбамоил)пирролидин-1-карбонил)фенокси)бутаноат
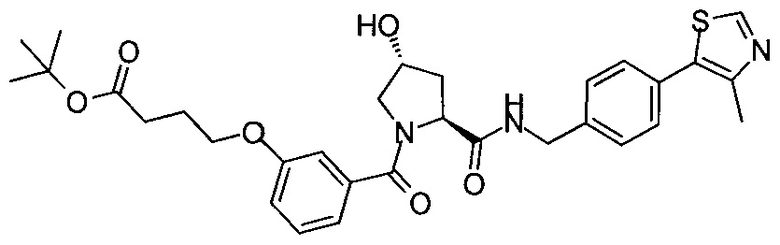 .
.
Раствор смеси 3-(4-(трет-бутокси)-4-оксобутокси)бензойной кислоты (95 мг, 0,34 ммоль), гидрохлорида (2S,4R)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (100 мг, 0,28 ммоль) и DIPEA (0,2 мл, 1,15 ммоль) в сухом ДМФ (3 мл) обрабатывали HATU (129 мг, 0,34 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Смесь помещали на аминопропиловый картридж для твердофазной экстракции и элюировали метанолом (3 объема колонки). Полученный элюент упаривали досуха, и продукт подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (130 мг, 0,22 ммоль, 79%-ный выход). ЖХМС RT=0,98 мин, ES+ve m/z 580 [M+H]+.
Пример- VHL Protac (английская аббревиатура названия, которое можно перевести на русский язык как «химерные молекулы, осуществляющие нацеливание для протеолиза»), которые связывают рецептор эстрогена (Protact эстрогенов)
Сокращения:
DCM: дихлорметан.
DIPEA: N,N-диизопропилэтиламин.
ДМФ: N,N-диметилформамид.
HATU: 2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат.
ВЭЖХ: высокоэффективная жидкостная хроматография.
ЖХМС: жидкостная хроматография-масс-спектрометрия.
мин: минуты.
RT: время удерживания.
t-Bu: трет-бутоксид.
ТФУ: трифторуксусная кислота.
ТГФ: тетрагидрофуран.
Метод ЖХМС:
Анализ осуществляли на колонке Acquity UPLC BEH C18 (50 мм×2,1 мм внутренний диаметр, 1,7 мкм упаковочный диаметр) при температуре 40°C.
Используемыми растворителями являлись:
A=0,1% об./об. раствор муравьиной кислоты в воде.
B=0,1% об./об. раствор муравьиной кислоты в ацетонитриле.
Используемый градиент был следующим:
УФ определение представляло собой средний сигнал при длине волны от 210 нм до 350 нм, и масс-спектр регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительной и отрицательной ионизации электрораспылением.
Ниже показаны подвижные фазы и градиенты, используемые, когда соединения подвергались очистке путем масс-направленной автопрепаративной ВЭЖХ.
Масс-направленная автопрепаративная ВЭЖХ (модификатор муравьиная кислота)
Анализ ВЭЖХ осуществляли на колонке Sunfire C18 (150 мм × 30 мм внутренний диаметр, 5 мкм упаковочный диаметр) при комнатной температуре.
Используемыми растворителями являлись:
A=0,1% об./об. раствор муравьиной кислоты в воде.
B=0,1% об./об. раствор муравьиной кислоты в ацетонитриле.
Масс-направленная автопрепаративная ВЭЖХ (модификатор трифторуксусная кислота)
Анализ ВЭЖХ осуществляли на колонке Sunfire C18 (150 мм × 30 мм внутренний диаметр, 5 мкм упаковочный диаметр) при комнатной температуре.
Используемыми растворителями являлись:
A=0,1% об./об. раствор трифторуксусной кислоты в воде.
B=0,1% об./об. раствор трифторуксусной кислоты в ацетонитриле.
Масс-направленная автопрепаративная ВЭЖХ (модификатор бикарбонат аммония)
Анализ ВЭЖХ осуществляли на колонке XBridge C18 (150 мм × 30 мм внутренний диаметр, 5 мкм упаковочный диаметр) при комнатной температуре.
Используемыми растворителями являлись:
A=10 мМ бикарбонат аммония в воде с устанавленным с помощью аммиачного раствора pH, равным 10.
B=ацетонитрил.
Для каждой из масс-направленных автопрепаративных очисток, независимо от используемого модификатора, используемый градиент зависел от времени удерживания конкретного соединения, подвергаемого очистке, что регистрировалось аналитической ЖХ-МС, и был следующим:
Для соединений со временем удерживания согласно аналитической ЖХМС менее 0,6 минут был использован следующий градиент:
Для соединений со временем удерживания согласно аналитической ЖХМС в интервале между 0,6 и 0,9 минут был использован следующий градиент:
Для соединений со временем удерживания согласно аналитической ЖХМС в интервале между 0,9 и 1,2 минут был использован следующий градиент:
Для соединений со временем удерживания согласно аналитической ЖХМС в интервале между 1,2 и 1,4 минут был использован следующий градиент:
Для соединений со временем удерживания согласно аналитической ЖХМС больше чем 1,4 минуты (ЖХМС, метод A) или больше чем 3,6 минуты (ЖХМС, метод B) был использован следующий градиент
УФ определение представляло собой средний сигнал при длине волны от 210 нм до 350 нм, и масс-спектр регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительной и отрицательной ионизации электрораспылением.
Химические названия были образованы с использованием версии ACD Name Pro версия 6.02 от фирмы Advanced Chemistry Development, Inc.
(8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
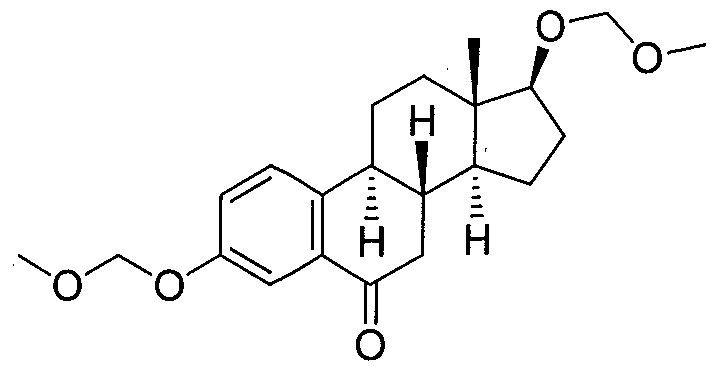 .
.
(8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он может быть получен в соответствии со способом, описанным Xiang-Rong Jiang, J. Walter Sowell, Bao Ting Zhu, Steroids, 2006, 71, 334-342. (doi: 10.1016/j.steroids.2005.11.008).
15-Бром-1-фенил-2,5,8,11-тетраоксапентадекан
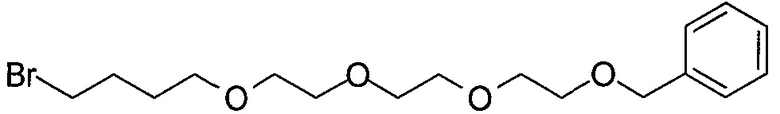 .
.
К суспензии гидрида натрия, 60% масс./масс. в минеральном масле (0,250 г, 6,24 ммоль) в ДМФ (2 мл), добавляли раствор 2-(2-(2-(бензилокси)этокси)этокси)этанола (1 г, 4,16 ммоль) (коммерчески доступный, например, от фирмы Fluorochem) в ДМФ (2 мл) при температуре 0°C. После перемешивания в течение 25 минут к смеси по каплям добавляли 1,4-дибромбутан (коммерчески доступный, например, от фирмы Aldrich) (4,04 г, 18,73 ммоль), растворенный в ДМФ (2 мл). Реакционную смесь перемешивали в атмосфере азота в течение 2,5 часов. Дополнительную аликвоту гидрида натрия, 60% масс./масс. в минеральном масле (0,250 г, 6,24 ммоль), добавляли и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 минут. Добавляли окончательную аликвоту гидрида натрия, 60% масс./масс. в минеральном масле (0,250 г, 6,24 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем оставляли стоять в течение уикенда. Реакционную смесь фильтровали через целит, и твердый продукт промывали DCM. Фильтрат распределяли между DCM (30 мл) и водой (30 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (711 мг, 1,89 ммоль, 46%-ный выход). ЖХМС RT=1,16 мин, ES+ve m/z 375,2/377,1 [M+H]+.
15-Йод-1-фенил-2,5,8,11-тетраоксапентадекан
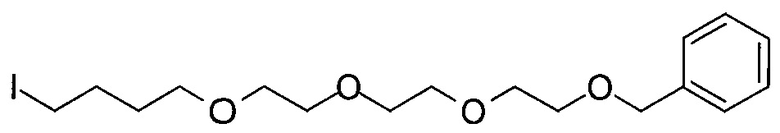 .
.
Смесь 15-бром-l-фенил-2,5,8,11-тетраоксапентадекана (711 мг, 1,894 ммоль) и йодида натрия (568 мг, 3,79 ммоль) в ацетоне (10 мл) нагревали в условиях кипячения с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры. Смесь фильтровали через целит, и твердый продукт промывали ацетоном. Растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате (30 мл) и промывали водой (30 мл) и насыщенным солевым раствором (2×30 мл). Органический экстракт сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении с получением указанного в заголовке соединения (759 мг, 1,797 ммоль, 95%-ный выход). ЖХМС RT=1,23 мин, ES+ve m/z 440,0 [M+NH4]+.
(7S,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7-(1-фенил-2,5,8,11-тетраоксапентадекан-15-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
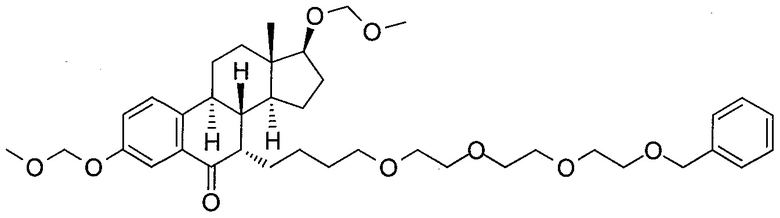 .
.
Раствор KOtBu в ТГФ (1M, 1,282 мл, 1,282 ммоль) добавляли к охлаждаемому раствору (0°C) (8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (240 мг, 0,641 ммоль) в безводном ТГФ (2 мл). Реакционную смесь перемешивали при температуре 0°C в течение 45 минут и затем охлаждали до температуры -78°C. Добавляли по каплям раствор 15-йод-1-фенил-2,5,8,11-тетраоксапентадекана (789 мг, 1,868 ммоль) в ТГФ (1 мл). Раствор перемешивали при температуре -78°C в течение 2 минут, оставляли нагреваться до температуры 0°C и перемешивали в течение 1,5 часов при этой же температуре. Реакционную смесь распределяли между водой (30 мл) и этилацетатом (30 мл). Органический экстракт сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% этилацетата в циклогексане с получением указанного в заголовке соединения (234 мг, 0,350 ммоль, 55%-ный выход). ЖХМС RT=1,48 мин, ES+ve m/z 669,3 [M+H]+, 686,4 [M+NH4]+.
(7S,8R,9S,13S,14S,17S)-3,17-Дигидрокси-13-метил-7-(1-фенил-2,5,8,11-тетраоксапентадекан-15-ил)-7,8,9,11,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
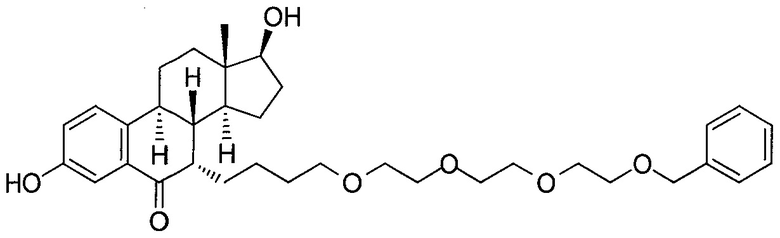 .
.
Раствор водной HCl (6M, 2,3 мл, 13,80 ммоль) добавляли к раствору (7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7-(1-фенил-2,5,8,11-тетраоксапентадекан-15-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (234 мг, 0,350 ммоль) в ТГФ (2,3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Добавляли воду (30 мл) и продукт экстрагировали этилацетатом (50 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении с получением указанного в заголовке соединения (200 мг, 0,344 ммоль, 98%-ный выход). ЖХМС RT=1,07 мин, ES+ve m/z 581,3 [M+H]+, 598,3 [M+NH4]+.
(7R,8R,9S,13S,14S,17S)-13-Метил-7-(1-фенил-2,5,8,11-тетраоксапентадекан-15-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диол
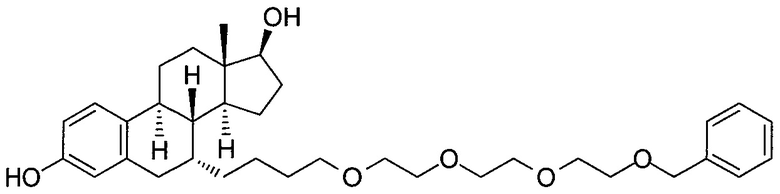 .
.
Триэтилсилан (коммерчески доступный, например, от фирмы Aldrich) (0,550 мл, 3,44 ммоль) добавляли к раствору (7S,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7-(1-фенил-2,5,8,11-тетраоксапентадекан-15-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он (200 мг, 0,344 ммоль) в ТФУ (2 мл, 26,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 16 часов. Смесь распределяли между этилацетатом (30 мл) и насыщенным солевым раствором (30 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Остаток растворяли в MeOH (5 мл) и обрабатывали водным NaOH (2M, 5 мл, 10,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель удаляли при пониженном давлении. Остаток распределяли между этилацетатом (30 мл) и раствором 10%-ой лимонной кислоты (30 мл). Органический экстракт промывали насыщенным солевым раствором (30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью обращенно-фазовой хроматографии с использованием градиентного элюирования от 5% до 95% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (150 мг, 0,265 ммоль, 77%-ный выход). ЖХМС RT=1,18 мин, ES+ve m/z 567,3 [M+H]+, 584,3 [M+NH4]+.
15-((7R,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-1-фенил-2,5,8,11-тетраоксапентадекан
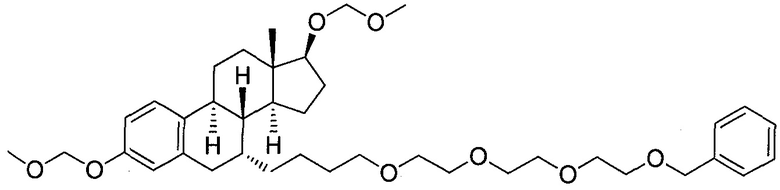 .
.
В сосуд помещали (7S,8R,9S,13S,14S,17S)-13-метил-7-(1-фенил-2,5,8,11-тетраоксапентадекан-15-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диол (150 мг, 0,265 ммоль) и DIPEA (0,555 мл, 3,18 ммоль) в ТГФ (10 мл). Сосуд герметически закрывали, раствор охлаждали до температуры 0°C и добавляли хлор(метокси)метан (коммерчески доступный, например, от фирмы Aldrich) (0,2 мл, 2,63 ммоль). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 1 часа и нагревали при температуре 70°C в течение 40 часов. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь распределяли между этилацетатом (100 мл) и водой (100 мл). Органический экстракт промывали насыщенным солевым раствором (2×50 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (122 мг, 0,186 ммоль, 70%-ный выход). ЖХМС RT=1,60 мин, ES+ve m/z 672,5 [M+NH4]+.
2-(2-(2-(4-((7R,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этокси)этанол
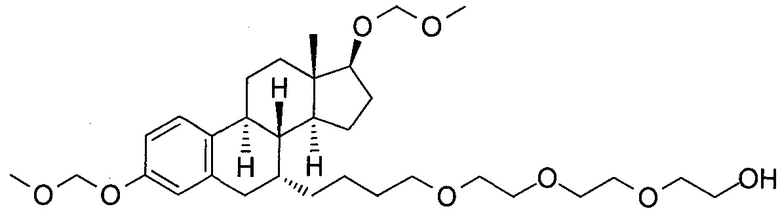 .
.
Смесь 15-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-1-фенил-2,5,8,11-тетраоксапентадекана (115 мг, 0,176 ммоль) и 10% масс./масс. палладия на углероде (100 мг, 0,094 ммоль) в этаноле (4 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 1,5 часов. Палладий на углероде фильтровали через целит, и фильтрат упаривали при пониженном давлении. Остаток распределяли между этилацетатом (15 мл) и насыщенным солевым раствором (15 мл). Органический экстракт сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении с получением указанного в заголовке соединения (81 мг, 0,143 ммоль, 82%-ный выход). ЖХМС RT=1,36 мин, ES+ve m/z 582,4 [M+NH4]+.
Трет-бутил 16-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12-тетраоксагексадекан-1-оат
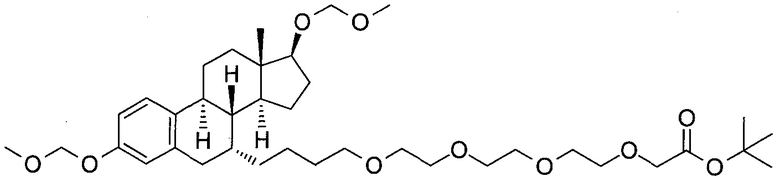 .
.
Гидрид натрия, 60% масс./масс. в минеральном масле (10 мг, 0,250 ммоль), добавляли к охлаждаемому раствору (0°C) 2-(2-(2-(4-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этокси)этанола (81 мг, 0,143 ммоль) в ДМФ (2 мл). Реакционную смесь перемешивали при этой температуре в течение 10 минут и добавляли трет-бутил 2-бромацетат (коммерчески доступный, например, от фирмы Aldrich) (32 мкл, 0,217 ммоль). Реакционную смесь перемешивали при температуре 0°C в течение 1 часа и при комнатной температуре в течение дополнительных 2 часов. Реакционную смесь распределяли между этилацетатом (30 мл) и водой (30 мл). Органический слой промывали насыщенным солевым раствором (30 мл), сушили (гидрофобная фритта) и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (60 мг, 0,88 ммоль, 62%-ный выход). ЖХМС RT=1,57 мин, ES+ve m/z 696,5 [M+N¾]+.
16-((7R,8R,9S,13S,14S,17S)-3,17-Дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12-тетраоксагексадекан-1-овая кислота
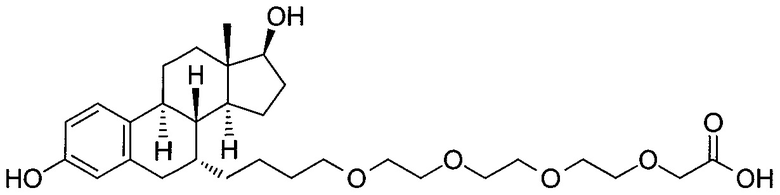 .
.
Трет-бутил 16-((7R,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12-тетраоксагексадекан-1-оат (133 мг, 0,196 ммоль) растворяли в ТГФ (1,5 мл) и обрабатывали водной HCl (6M, 1,5 мл, 9,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 8 часов. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматической препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (60 мг, 0,112 ммоль, 57%-ный выход). ЖХМС RT=0,89 мин, ES+ve m/z 535,3 [M+H]+, 552,3 [M+NH4]+.
(2S,4R)-1-((S)-19-((7R,8R,9S,13S,14S,17S)-3,17-Дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-2-изопропил-4-оксо-6,9,12,15-тетраокса-3-азанонадекан-1-оил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
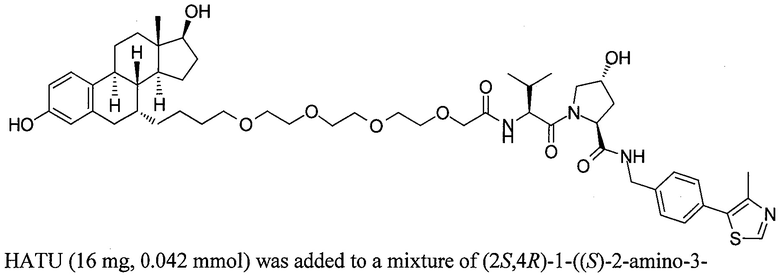 .
.
К смеси гидрохлорида (2S,4R)-1-((S)-2-амино-3-метилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (25 мг, 0,055 ммоль), 16-((7S,8R,9S,13S,4S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12-тетраоксагексадекан-1-овой кислоты (15 мг, 0,028 ммоль) и DIPEA (0,05 мл, 0,286 ммоль) в ДМФ (1 мл) добавляли HATU (16 мг, 0,042 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (20 мг, 0,021 ммоль, 76%-ный выход). ЖХМС RT=0,99 мин, ES+ve m/z 933,3 [M+H]+.
(2S,4R)-1-((S)-2-(Трет-бутил)-19-((7R,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-4-оксо-6,9,12,15-тетраокса-3-азанонадекан-1-оил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
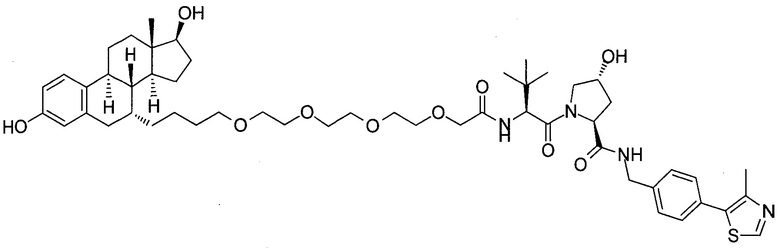 .
.
К смеси гидрохлорида (2S,4R)-1-((S)-2-амино-3,3-диметилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (25 мг, 0,054 ммоль), 16-((7S,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12-тетраоксагексадекан-1-овой кислоты (23 мг, 0,043 ммоль) и DIPEA (0,040 мл, 0,229 ммоль) в ДМФ (1 мл) добавляли HATU (22 мг, 0,058 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (26 мг, 0,027 ммоль, 64%-ный выход). ЖХМС RT=1,02 мин, ES+ve m/z 947,8 [M+H]+.
((2-(2-(4-Бромбутокси)этокси)этокси)метил)бензол
 .
.
К суспензии гидрида натрия, 60% масс./масс. в минеральном масле (0,92 г, 22,9 ммоль) в ДМФ (5 мл), добавляли раствор 2-(2-(бензилокси)этокси)этанола (коммерчески доступный, например, от фирмы Aldrich) (2,74 мл, 15,29 ммоль) в ДМФ (5 мл) при температуре 0°C. После перемешивания в течение 25 мин к смеси добавляли по каплям 1,4-дибромбутан (коммерчески доступный, например, от фирмы Aldrich) (14,9 г, 68,8 ммоль), растворенный в ДМФ (5 мл). Реакционную смесь нагревали при комнатной температуре и перемешивали в атмосфере азота в течение 2,5 часов. Добавляли дополнительную аликвоту гидрида натрия, 60% масс./масс. в минеральном масле (0,92 г, 22,9 ммоль), и реакционную смесь перемешивали при температуре 0°C в течение 30 минут и при комнатной температуре в течение 30 минут. Добавляли конечную аликвоту гидрида натрия, 60% масс./масс. в минеральном масле (0,92 г, 22,9 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем оставляли стоять в течение ночи. Реакционную смесь фильтровали через целит, и твердый продукт промывали DCM. Фильтрат распределяли между DCM (30 мл) и водой (30 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 80% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (3 г, 9,06 ммоль, 59%-ный выход). ЖХМС RT=1,19 мин, ES+ve m/z 331,2/333,2 [M+H]+.
((2-(2-(4-Йодбутокси)этокси)этокси)метил)бензол
 .
.
Смесь ((2-(2-(4-бромбутокси)этокси)этокси)метил)бензола (3 г, 9,06 ммоль) и йодида натрия (2,72 г, 18,11 ммоль) в ацетоне (10 мл) нагревали в условиях кипячения с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры. Смесь фильтровали через целит, и твердый продукт промывали ацетоном. Растворитель удаляли при пониженном давлении, и остаток растворяли в этилацетате (30 мл) и промывали водой (30 мл) и насыщенным солевым раствором (2×30 мл). Органический экстракт сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 50% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (3,1 г, 8,2 ммоль, 90%-ный выход). ЖХМС RT=1,25 мин, ES+ve m/z 379,2 [M+H]+.
(7S,8R,9S,13S,14S,17S)-7-(4-(2-(2-(Бензилокси)этокси)этокси)бутил)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
 .
.
Раствор KOtBu в ТГФ (1M, 3,2 мл, 3,2 ммоль) добавляли к охлаждаемому раствору (0°C) (8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (600 мг, 1,6 ммоль) в безводном ТГФ (6 мл). Реакционную смесь перемешивали при температуре 0°C в течение 45 минут и затем охлаждали до температуры -78°C. Добавляли по каплям раствор ((2-(2-(4-йодбутокси)этокси)этокси)метил)бензола (910 мг, 2,4 ммоль) в ТГФ (3 мл). Раствор перемешивали при температуре -78°C в течение 2 минут, затем оставляли нагреваться до температуры 0°C и перемешивали в течение 1,5 часов при этой же температуре. Реакционную смесь распределяли между водой (30 мл) и этилацетатом (30 мл). Органический экстракт разделяли, сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 50% этилацетата в циклогексане с получением указанного в заголовке соединения (450 мг, 0,72 ммоль, 45%-ный выход). ЖХМС RT=1,49 мин, ES+ve m/z 625,5 [M+H]+.
(7S,8R,9S,13S,14S,17S)-7-(4-(2-(2-(Бензилокси)этокси)этокси)бутил)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
 .
.
Раствор водной HCl (6M, 4,6 мл, 27,6 ммоль) добавляли к раствору (7S,8R,9S,13S,14S,17S)-7-(4-(2-(2-(бензилокси)этокси)этокси)бутил)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (470 мг, 0,752 ммоль) в ТГФ (4,6 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли воду (30 мл) и продукт экстрагировали этилацетатом (50 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении с получением указанного в заголовке соединения (390 мг, 0,727 ммоль, 97%-ный выход). ЖХМС RT=1,08 мин, ES+ve m/z 537,2 [M+H]+, 554,2 [M+NH4]+.
(7R,8R,9S,13S,14S,17S)-7-(4-(2-(2-(Бензилокси)этокси)этокси)бутил)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диол
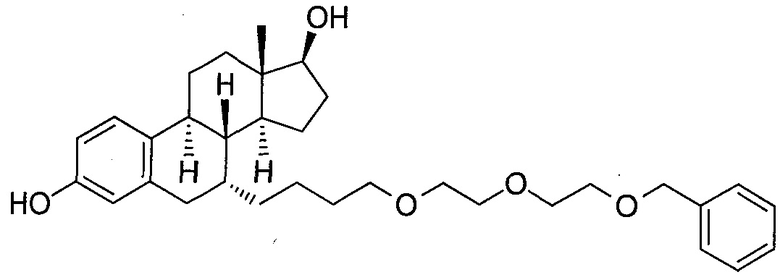 .
.
Триэтилсилан (коммерчески доступный, например, от фирмы Aldrich) 1,161 мл, 7,27 ммоль) добавляли к раствору (7S,8R,9S, 13S,14S,17S)-7-(4-(2-(2-(бензилокси)этокси)этокси)бутил)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (390 мг, 0,727 ммоль) в ТФУ (4,2 мл, 54,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 18 часов. Смесь распределяли между этилацетатом (50 мл) и насыщенным солевым раствором (50 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), насыщенным бикарбонатом натрия (30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Остаток растворяли в MeOH (10 мл) и обрабатывали водным NaOH (2M, 5 мл, 10,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли при пониженном давлении. Остаток распределяли между этилацетатом (30 мл) и водным HCl раствором (1M, 20 мл). Органический экстракт промывали насыщенным солевым раствором (20 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью обращенно-фазовой хроматографии с использованием градиентного элюирования от 5% до 95% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (270 мг, 0,517 ммоль, 71%-ный выход). ЖХМС RT=1,18 мин, ES+ve m/z 523,5 [M+H]+, 540,5 [M+NH4]+.
(7R,8R,9S,13S,14S,17S)-7-(4-(2-(2-(Бензилокси)этокси)этокси)бутил)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен
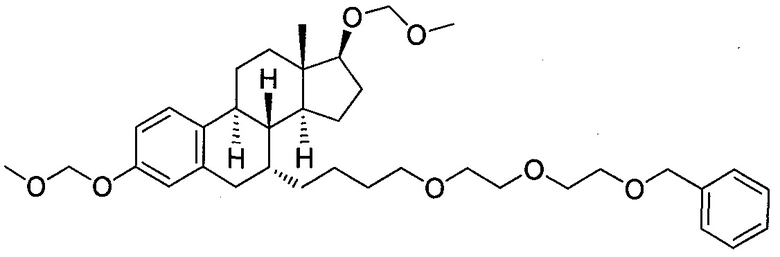 .
.
Хлор(метокси)метан (коммерчески доступный, например, от фирмы Aldrich) (0,390 мл, 5,14 ммоль) добавляли к охлаждающему (0°C) раствору (7S,8R,9S,13S,14S,17S)-7-(4-(2-(2-(бензилокси)этокси)этокси)бутил)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диола (270 мг, 0,517 ммоль) и DIPEA (1,083 мл, 6,20 ммоль) в ТГФ (16 мл). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 1 часа и затем нагревали при температуре 70°C в течение 40 часов. Реакционную смесь охлаждали до температуры 0°C, добавляли дополнительное количество DIPEA (0,271 мл, 1,550 ммоль) и хлор(метокси)метан (0,098 мл, 1,291 ммоль). Реакционную смесь нагревали при температуре 70°C и перемешивали в течение еще 24 часов. Реакционную смесь охлаждали до комнатной температуры и распределяли между этилацетатом (100 мл) и водой (100 мл). Органический экстракт промывали насыщенным солевым раствором (2×50 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (220 мг, 0,36 ммоль, 70%-ный выход). ЖХМС RT=1,62 мин, ES+ve m/z 628,6 [M+NH4]+.
2-(2-(4-((7R,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этанол
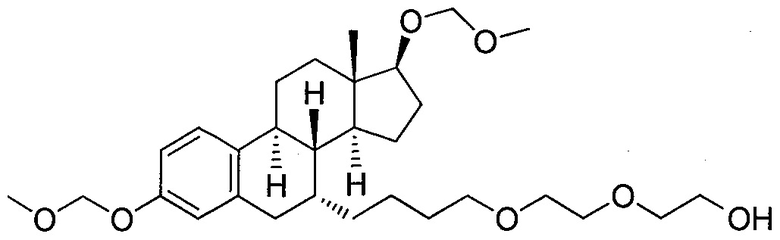 .
.
Смесь (7R,8R,9S,13S,14S,17S)-7-(4-(2-(2-(бензилокси)этокси)этокси)бутил)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрена (220 мг, 0,36 ммоль) и 10% масс./масс. палладия на углероде (100 мг, 0,094 ммоль) в этаноле (4 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 1 часа. Палладий на углероде фильтровали через целит, промывали этанолом (50 мл), и фильтрат упаривали при пониженном давлении с получением указанного в заголовке соединения (186 мг, 0,357 ммоль, 99%-ный выход) ЖХМС RT=1,36 мин, ES+ve m/z 521,5 [M+H]+, 538,5 [M+NH4]+.
Трет-бутил 2-(2-(2-(4-((7R,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этокси)ацетат
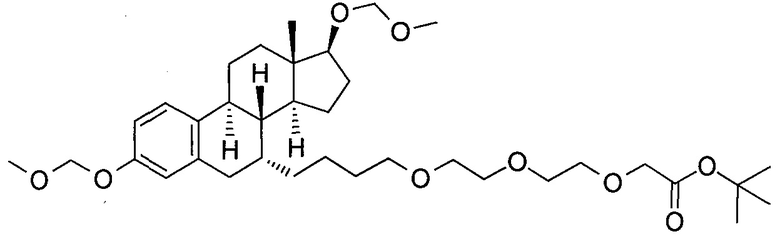 .
.
Гидрид натрия, 60% масс./масс. минеральное масло (25,0 мг, 0,625 ммоль), добавляли к охлаждаемому раствору (0°C) 2-(2-(4-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этанола (186 мг, 0,357 ммоль) в ДМФ (4,5 мл). Реакционную смесь перемешивали при температуре 0°C в течение 10 минут и добавляли трет-бутил 2-бромацетат (коммерчески доступный, например, от фирмы Aldrich) (79 мкл, 0,536 ммоль). Реакционную смесь перемешивали при температуре 0°C в течение 1 часа и при комнатной температуре в течение еще 6 часов. Реакционную смесь охлаждали до температуры 0°C и добавляли дополнительное количество гидрида натрия, 60% масс./масс. в минеральном масле (15,72 мг, 0,393 ммоль), затем трет-бутил 2-бромацетат (0,053 мл, 0,357 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение еще 18 часов. Реакционную смесь распределяли между этилацетатом (30 мл) и водой (30 мл). Органический слой разделяли, промывали насыщенным солевым раствором (30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (90 мг, 0,142 ммоль, 40%-ный выход). ЖХМС RT=1,56 мин, ES+ve m/z 652,6 [M+NH4]+, 657,5 [M+Na]+.
2-(2-(2-(4-((7R,8R,9S,13S,14S,17S)-3,17-Дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этокси)уксусная кислота
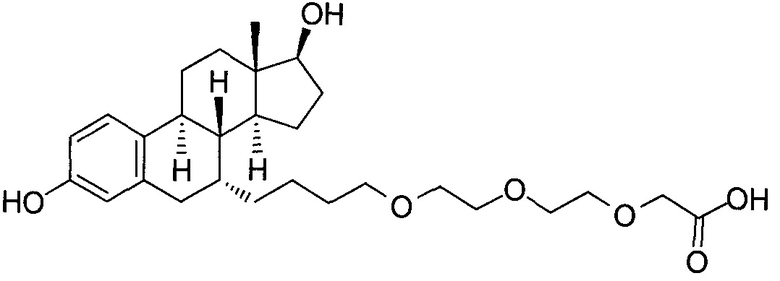 .
.
Трет-бутил 2-(2-(2-(4-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этокси)ацетат (80 мг, 0,126 ммоль) растворяли в ТГФ (1 мл) и обрабатывали водной HCl (6M, 1 мл, 6,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматической препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (23 мг, 0,047 ммоль, 37%-ный выход). ЖХМС RT=0,89 мин, ES+ve m/z 491,4 [M+H]+.
(2S,4R)-1-((S-16-((7R,8R,9S,13S,145,17S)-3,17-Дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-2-изопропил-4-оксо-6,9,12-триокса-3-азагексадекан-1-оил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
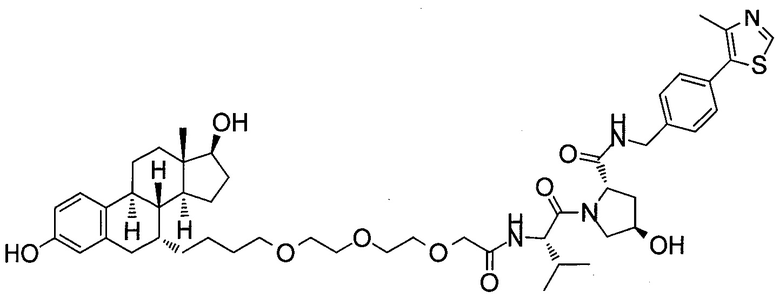 .
.
К смеси гидрохлорида (2S,4R)-1-((S)-2-амино-3-метилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (23 мг, 0,05 ммоль), 2-(2-(2-(4-((7S,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)бутокси)этокси)этокси)уксусной кислоты (10 мг, 0,02 ммоль) и DIPEA (0,04 мл, 0,20 ммоль) в ДМФ (0,8 мл) добавляли HATU (12 мг, 0,03 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (15 мг, 0,017 ммоль, 84%-ный выход). ЖХМС RT=0,98 мин, ES+ve m/z 889,7 [M+H]+.
18-Бром-1-фенил-2,5,8,11,14-пентаоксаоктадекан
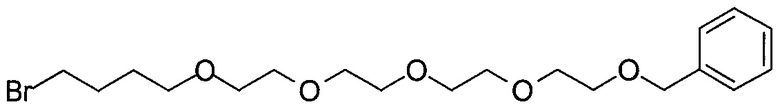 .
.
К суспензии гидрида натрия, 60% масс./масс. в минеральном масле (0,85 г, 21,3 ммоль) в ДМФ (8 мл) добавляли раствор l-фенил-2,5,8,11-тетраоксатридекан-13-ола (коммерчески доступный, например, от фирмы TCI Europe Fine Chemicals) (4,0 г, 14,2 ммоль) в ДМФ (8 мл) при температуре 0°C. После перемешивания в течение 25 минут к смеси по каплям добавляли 1,4-дибромбутан (коммерчески доступный, например, от фирмы Aldrich) (7,62 мл, 63,8 ммоль), растворенный в ДМФ (8 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в атмосфере азота в течение 30 минут. Добавляли дополнительную аликвоту гидрида натрия, 60% масс./масс. в минеральном масле (0,85 г, 21,3 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительную аликвоту гидрида натрия, 60% масс./масс. в минеральном масле (0,85 г, 21,3 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли конечную аликвоту гидрида натрия, 60% масс./масс. в минеральном масле (0,43 г, 10,6 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали через целит, и твердый продукт промывали DCM. Фильтрат распределяли между DCM (50 мл) и водой (50 мл). Органический экстракт промывали насыщенным солевым раствором (2×50 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 85% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (3,93 г, 9,37 ммоль, 63%-ный выход). ЖХМС RT=1,16 мин, ES+ve m/z 419,3/421,2 [M+H]+.
18-Йод-1-фенил-2,5,8,11,14-пентаоксаоктадекан
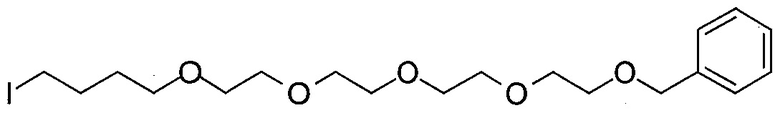 .
.
Смесь 18-бром-1-фенил-2,5,8,11,14-пентаоксаоктадекана (2,08 г, 4,91 ммоль) и йодида натрия (1,47 г, 9,82 ммоль) в ацетоне (10 мл) нагревали в условиях кипячения с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали через целит, и твердый продукт промывали ацетоном. Растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате (30 мл) и промывали водой (30 мл) и насыщенным солевым раствором (2×30 мл). Органический экстракт сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении с получением указанного в заголовке соединения (759 мг, 1,80 ммоль, 95%-ный выход). ЖХМС RT=1,21 мин, ES+ve m/z 467,0 [M+H]+, 484,0 [M+NH4]+.
(7S,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7-(1-фенил-2,5,8,11,14-пентаоксаоктадекан-18-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
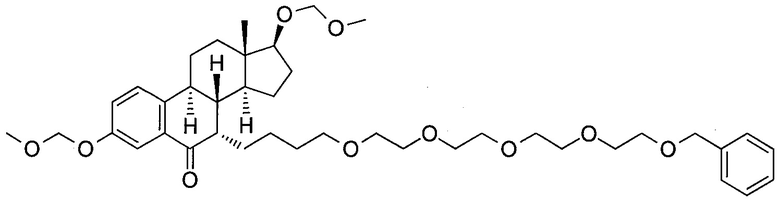 .
.
Раствор KOtBu в ТГФ (1M, 5,34 мл, 5,34 ммоль) добавляли к охлаждаемому раствору (0°C) (8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (1 г, 2,67 ммоль) в безводном ТГФ (10 мл). Реакционную смесь перемешивали при температуре 0°C в течение 45 минут и затем охлаждали до температуры -78°C. Добавляли по каплям 18-йод-1-фенил-2,5,8,11,14-пентаоксаоктадекан (1,87 г, 4,01 ммоль) в ТГФ (5 мл). Раствор перемешивали при температуре -78°C в течение 2 минут, оставляли нагреваться до температуры 0°C и перемешивали в течение 1,5 часов при этой же температуре. Реакционную смесь распределяли между водой (50 мл) и этилацетатом (2×50 мл). Органические экстракты сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% этилацетата в циклогексане с получением указанного в заголовке соединения (883 мг, 1,24 ммоль, 46%-ный выход). ЖХМС RT=1,47 мин, ES+ve m/z 713,5 [M+H]+.
(7S,8R,9S,13S,14S,17S)-3,17-Дигидрокси-13-метил-7-(1-фенил-2,5,8,11,14-пентаоксаоктадекан-18-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
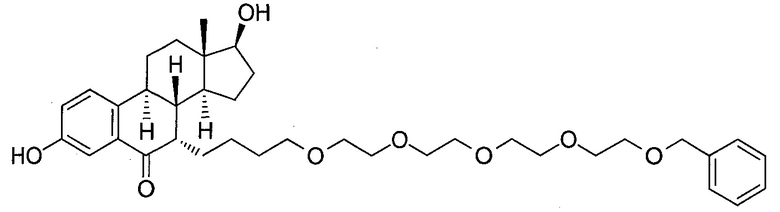 .
.
Раствор водной HCl (6M, 9,2 мл, 55,2 ммоль) добавляли к раствору (7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7-(1-фенил-2,5,8,11,14-пентаоксаоктадекан-18-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (883 мг, 1,24 ммоль) в ТГФ (9,2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли воду (30 мл) и продукт экстрагировали этилацетатом (50 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении с получением указанного в заголовке соединения (772 мг, 1,23 ммоль, 99%-ный выход). ЖХМС RT=1,06 мин, ES+ve m/z 625,3 [M+H]+, 642,3 [M+NH4]+.
(7R,8R,9S,13S,14S,17S)-13-Метил-7-(1-фенил-2,5,8,11,14-пентаоксаоктадекан-18-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диол
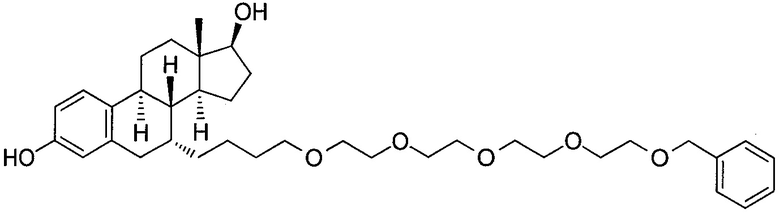 .
.
Триэтилсилан (коммерчески доступный, например, от фирмы Aldrich) (2,0 мл, 12,9 ммоль) добавляли к раствору (7S,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7-(1-фенил-2,5,8,11,14-пентаоксаоктадекан-18-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (830 мг, 1,29 ммоль) в ТФУ (8,5 мл, 110 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 16 часов. Смесь распределяли между этилацетатом (50 мл) и насыщенным солевым раствором (50 мл). Органический экстракт промывали насыщенным солевым раствором (2×50 мл), насыщенным бикарбонатом натрия (50 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Остаток растворяли в MeOH (10 мл) и обрабатывали водным NaOH (2M, 10 мл, 20,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли при пониженном давлении. Остаток распределяли между этилацетатом (40 мл) и 1M HCl раствором (20 мл). Органический экстракт промывали насыщенным солевым раствором (20 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью обращенно-фазовой хроматографии с использованием градиентного элюирования от 5% до 90% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (375 мг, 0,614 ммоль, 47%-ный выход). ЖХМС RT=1,17 мин, ES+ve m/z 611,5 [M+H]+, 628,6 [M+NH4]+.
18-((7R,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-1-фенил-2,5,8,11,14-пентаоксаоктадекан
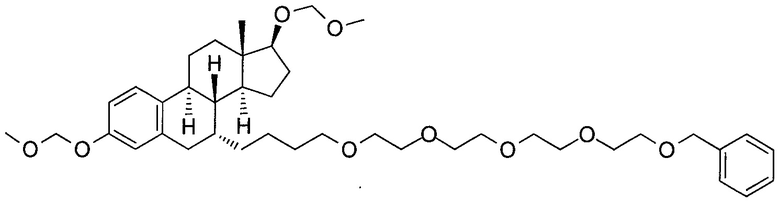 .
.
Хлор(метокси)метан (коммерчески доступный, например, от фирмы Aldrich) (0,5 мл, 6,58 ммоль) добавляли к охлаждаемому (0°C) раствору (7S,8R,9S,13S,14S,17S)-13-метил-7-(1-фенил-2,5,8,11,14-пентаоксаоктадекан-18-ил)-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диола (375 мг, 0,614 ммоль) и DIPEA (1,5 мл, 8,59 ммоль) в ТГФ (20 мл). Реакционную смесь нагревали до комнатной температуры, перемешивали в течение 1 часа и нагревали при температуре 70°C в течение 72 часов. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь распределяли между этилацетатом (100 мл) и водой (100 мл). Органический экстракт промывали насыщенным солевым раствором (2×50 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (357 мг, 0,51 ммоль, 72%-ный выход). ЖХМС RT=1,60 мин, ES+ve m/z 716,7 [M+NH4]+, 721,7 [M+Na]+.
16-((7R,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12-тетраоксагексадекан-1-ол
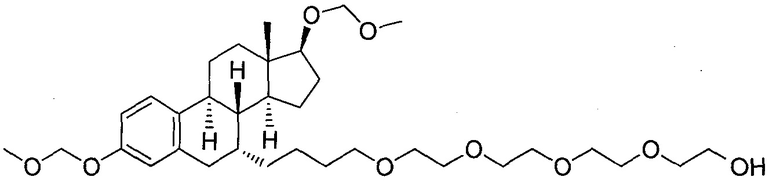 .
.
Смесь 18-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-1-фенил-2,5,8,11,14-пентаоксаоктадекана (357 мг, 0,444 ммоль) и 10% масс./масс. палладия на углероде (157 мг, 0,148 ммоль) в этаноле (5 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 1,5 часов. Палладий на углероде фильтровали через целит, и фильтрат упаривали при пониженном давлении с получением указанного в заголовке соединения (300 мг, 0,41 ммоль, 93%-ный выход) ЖХМС RT=1,37 мин, ES+ve m/z 609,6 [M+H]+, 631,6 [M+Na]+.
Трет-бутил 19-((7R,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12,15-пентаоксанонадекан-1-оат
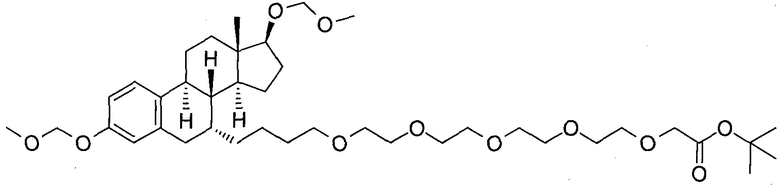 .
.
Гидрид натрия, 60% масс./масс. в минеральном масле (30 мг, 0,75 ммоль), добавляли к охлаждаемому раствору (0°C) 16-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12-тетраоксагексадекан-1-ола (300 мг, 0,43 ммоль) в ДМФ (5 мл). Реакционную смесь перемешивали при этой температуре в течение 10 минут и добавляли трет-бутил 2-бромацетат (0,095 мл, 0,643 ммоль). Реакционную смесь перемешивали при температуре 0°C в течение 1 часа и затем при комнатной температуре в течение дополнительных 18 часов. Реакционную смесь распределяли между этилацетатом (30 мл) и водой (30 мл). Водный слой экстрагировали дополнительным количеством этилацета (2×30 мл), и объединенные органические слои промывали насыщенным солевым раствором (2×30 мл), сушили (гидрофобная фритта) и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (177 мг, 0,245 ммоль, 57%-ный выход). ЖХМС RT=1,58 мин, ES+ve m/z 740,6 [M+NH4]+, 745,6 [M+Na]+.
19-((7R,8R,9S,13S,14S,17S)-3,17-Дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12,15-пентаоксанонадекан-1-овая кислота
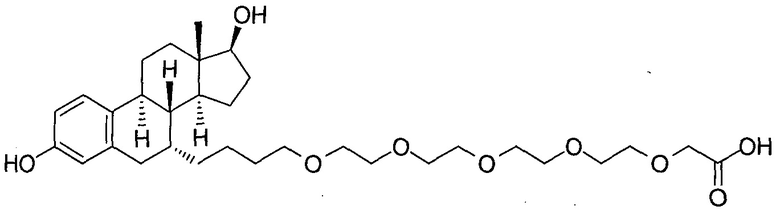 .
.
Трет-бутил 19-((7R,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12,15-пентаоксанонадекан-1-оат (177 мг, 0,189 ммоль) растворяли в ТГФ (2 мл) и обрабатывали водной HCl (6M, 2 мл, 12,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 7 часов. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматической препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (64 мг, 0,111 ммоль, 59%-ный выход). ЖХМС RT=0,92 мин, ES+ve m/z 579,4 [M+H]+, 596,5 [M+NH4]+.
(2S,4R)-1-((S)-22-((7S,8R,9S,13S,14S,17S)-3,17-Дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-2-изопропил-4-оксо-6,9,12,15,18-пентаокса-3-азадокозан-1-оил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
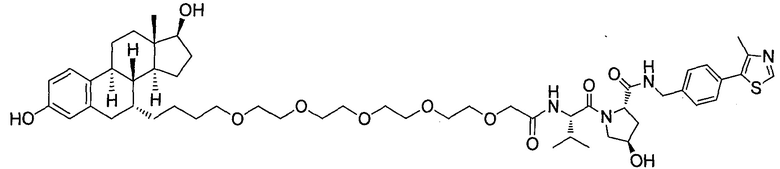 .
.
HATU (16 мг, 0,04 ммоль) добавляли к смеси гидрохлорида (2S,4R)-1-((S)-2-амино-3-метилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (25 мг, 0,06 ммоль), 19-((7R,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12,15-пентаоксанонадекан-1-овой кислоты (16 мг, 0,03 ммоль) и DIPEA (0,048 мл, 0,28 ммоль) в ДМФ (0,8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (17,7 мг, 0,018 ммоль, 65%-ный выход). ЖХМС RT=0,99 мин, ES+ve m/z 977,4 [M+H]+.
(2S,4R)-1-((S)-2-(трет-бутил)-22-((7R,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,H,12,13,14,15,16,l7-декагидро-6H-циклопента[a]фенантрен-7-ил)-4-оксо-6,9,12,15,18-пентаокса-3-азадокозан-1-оил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
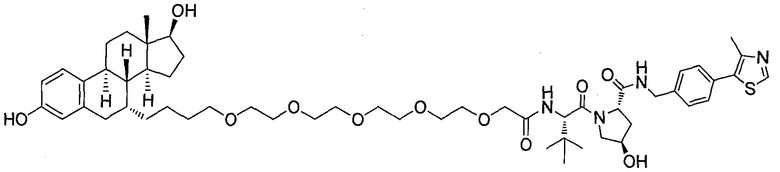 .
.
HATU (16 мг, 0,04 ммоль) добавляли к смеси гидрохлорида (2S,4R)-1-((S)-2-амино-3,3-диметилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (25 мг, 0,05 ммоль), 19-((7R,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-3,6,9,12,15-пентаоксанонадекан-1-овой кислоты (16 мг, 0,03 ммоль) и DIPEA (0,048 мл, 0,28 ммоль) в ДМФ (0,8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (17,5 мг, 0,017 ммоль, 63%-ный выход). ЖХМС RT=1,03 мин, ES+ve m/z 991,4 [M+H]+.
(7S,8R,9S,13S,14S,17S)-7-(5-(Бензилокси)пентил)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-он
 .
.
Раствор KOtBu в ТГФ (1M, 4,81 мл, 4,81 ммоль) добавляли к охлаждаемому раствору (0°C) (8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (900 мг, 2,403 ммоль) в безводном ТГФ (10 мл). Реакционную смесь перемешивали при температуре 0°C в течение 45 минут и затем охлаждали до температуры -78°C. Добавляли по каплям (((5-йодпентил)окси)метил)бензол (может быть получен в соответствии со способом, описанным в J. Chem. Soc, Perkin Trans. 1 1990, 129-132) (2,193 г, 7,21 ммоль) в ТГФ (0,5 мл). Раствор перемешивали при температуре -78°C в течение 2 минут и давали нагреться до комнатной температуры, и перемешивали в течение 1 часа при этой же температуре. Реакционную смесь распределяли между водой (70 мл) и этилацетатом (70 мл). Органический экстракт сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Промежуточный продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 50% этилацетата в циклогексане. Остаток растворяли в ТГФ (16 мл) и добавляли водную HCl (6M, 16 мл, 96 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь распределяли между этилацетатом (20 мл) и водой (20 мл). Органический экстракт сушили (гидрофобная фритта) и концентрировали при пониженном давлении. Продукт очищали с помощью обращенно-фазовой хроматографии с использованием градиентного элюирования от 5% до 85% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (487 мг, 1,053 ммоль, 44%-ный выход). ЖХМС RT=1,16 мин, ES+ve m/z 463,4 [M+H]+.
(7S,8R,9S,13S,14S,17S)-7-(5-(Бензилокси)пентил)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диол
 .
.
Триэтилсилан (1,681 мл, 10,53 ммоль) добавляли к раствору (7S,8R,9S,13S,14S,17S)-7-(5-(бензилокси)пентил)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-6-она (487 мг, 1,053 ммоль) в ТФУ (6 мл, 78 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 16 часов. Смесь распределяли между этилацетатом (30 мл) и насыщенным солевым раствором (30 мл). Органический экстракт промывали насыщенным солевым раствором (2×30 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Остаток растворяли в MeOH (4 мл) и обрабатывали водным NaOH (2M, 4 мл, 8,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель удаляли при пониженном давлении. Остаток распределяли между этилацетатом (30 мл) и водой (30 мл). Органический экстракт промывали насыщенным солевым раствором (30 мл), сушили (гидрофобная фритта) и концентрировали при пониженном давлении. Продукт очищали с помощью обращенно-фазовой хроматографии с использованием градиентного элюирования от 10% до 95% ацетонитрила (+0,1% муравьиной кислоты) в воде (+0,1% муравьиной кислоты) с получением указанного в заголовке соединения (410 мг, 0,914 ммоль, 87%-ный выход). ЖХМС RT=1,30 мин, ES+ve m/z 449,1 [M+H]+.
(7R,8R,9S,13S,14S,17S)-7-(5-(Бензилокси)пентил)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен
 .
.
Хлор(метокси)метан (0,7 мл, 9,22 ммоль) добавляли к раствору (7S,8R,9S,13S,14S,17S)-7-(5-(бензилокси)пентил)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-3,17-диола (410 мг, 0,914 ммоль) и DIPEA (2 мл, 11,45 ммоль) в ТГФ (8 мл). Реакционный сосуд герметично закрывали, помещали в атмосферу азота и нагревали при температуре 70°C в течение 2 дней. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь распределяли между этилацетатом (50 мл) и насыщенным солевым раствором (50 мл). Органический экстракт промывали насыщенным солевым раствором (2×50 мл), сушили с использованием гидрофобной фритты и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (474 мг, 0,883 ммоль, 97%-ный выход). ЖХМС RT=1,72 мин, ES+ve m/z 554,5 [M+NH4]+.
5-((7R,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)пентан-1-ол
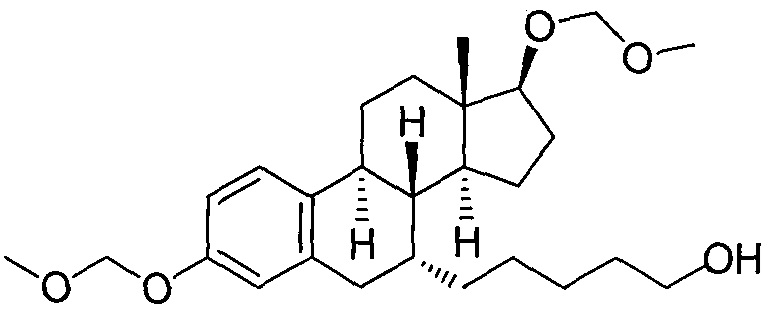 .
.
Смесь (7S,8R,9S,13S,14S,17S)-7-(5-(бензилокси)пентил)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрена (474 мг, 0,883 ммоль) и 10% масс./масс. палладия на углероде (100 мг, 0,094 ммоль) в этаноле (5 мл) и метилового трет-бутилового эфира (2 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 1,5 часов. Палладий фильтровали через целит, и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (371 мг, 0,831 ммоль, 94%-ный выход). ЖХМС RT=1,39 мин, ES+ve m/z 447,5 [M+H]+ (слабая ионизация).
5-((7S,8R,9S,13S,14S,17S)-3,17-Бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)пентил 4-метилбензолсульфонат
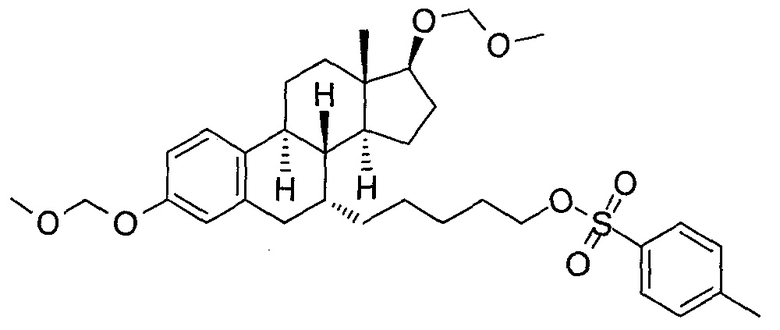 .
.
4-Метилбензол-1-сульфонилхлорид (400 мг, 2,098 ммоль) добавляли к 5-((7S,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)пентан-1-олу (371 мг, 0,831 ммоль) в пиридине (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь распределяли между этилацетатом (30 мл) и водной HCl (2M, 30 мл). Органический экстракт промывали насыщенным Na2CO3 (30 мл), насыщенным солевым раствором (30 мл), сушили (гидрофобная фритта) и концентрировали при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле с использованием градиентного элюирования от 0% до 100% метилового трет-бутилового эфира в циклогексане с получением указанного в заголовке соединения (401 мг, 0,667 ммоль, 80%-ный выход). ЖХМС RT=1,60 мин, ES+ve m/z 623,4 [M+Na]+.
Трет-бутил 18-((7R,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-13-метил-4,7,10-триокса-13-азаоктадекан-1-оат, соль муравьиной кислоты
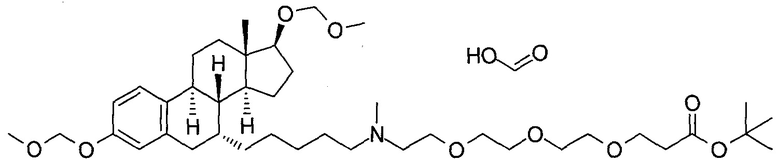 .
.
В сосуд для микроволнового воздействия помещали 5-((7R,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)пентил 4-метилбензолсульфонат (100 мг, 0,166 ммоль), трет-бутил 5,8,11-триокса-2-азатетрадекан-14-оат (может быть получен в соответствии со способом, описанным в WO2012054110A2) (145 мг, 0,499 ммоль) и DIPEA (0,291 мл, 1,664 ммоль) в ТГФ (2 мл). Сосуд герметически закрывали и помещали в атмосферу азота, используя ввакуумную откачку. Реакционную смесь нагревали при температуре 75°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (102 мг, 0,133 ммоль, 80%-ный выход). ЖХМС RT=1,22 мин, ES+ve m/z 720,6 [M+H]+.
18-((7R,8R,9S,13S,14S,17S)-3,17-Дигидро-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-13-метил-4,7,10-триокса-13-азаоктадекан-1-овая кислота, соль муравьиной кислоты
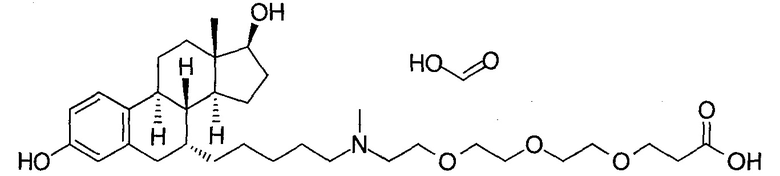 .
.
Трет-бутил 18-((7R,8R,9S,13S,14S,17S)-3,17-бис(метоксиметокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-13-метил-4,7,10-триокса-13-азаоктадекан-1-оат, соль муравьиной кислоты (100 мг, 0,131 ммоль) растворяли в ТГФ (1 мл) и обрабатывали водной HCl (6M, 1 мл, 6,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь сразу подвергали очистке с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота) с получением указанного в заголовке соединения (24 мг, 0,039 ммоль, 30%-ный выход). ЖХМС RT=0,74 мин, ES+ve m/z 576,5 [M+H]+.
(2S,4R)-1-((S)-2-(Трет-бутил)-21-((7R,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-16-метил-4-оксо-7,10,13-триокса-3,16-диазагеникозан-1-оил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамид
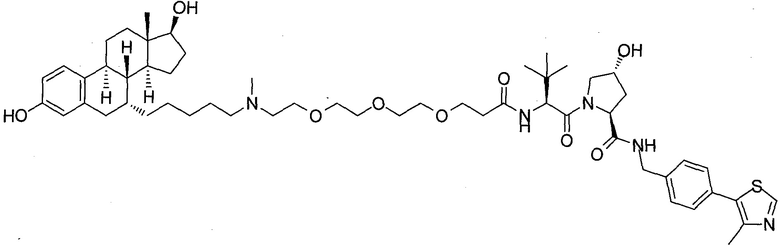 .
.
HATU (13 мг, 0,034 ммоль) добавляли к смеси гидрохлорида (2S,4R)-1-((S)-2-амино-3,3-диметилбутаноил)-4-гидрокси-N-(4-(4-метилтиазол-5-ил)бензил)пирролидин-2-карбоксамида (13 мг, 0,028 ммоль), 18-((7R,8R,9S,13S,14S,17S)-3,17-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6H-циклопента[a]фенантрен-7-ил)-13-метил-4,7,10-триокса-13-азаоктадекан-1-овой кислоты, соли муравьиной кислоты (12 мг, 0,019 ммоль) и DIPEA (0,03 мл, 0,172 ммоль) в ДМФ (0,8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь сразу подвергали двум очисткам с помощью масс-направленной автоматизированной препаративной ВЭЖХ (модификатор муравьиная кислота, затем модификатор карбонат аммония) с получением указанного в заголовке соединения (13 мг, 0,013 ммоль, 68%-ный выход). ЖХМС RT=0,84 мин, ES+ve m/z 988,8 [M+H]+.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ И СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ БЕЛКОВ-МИШЕНЕЙ И ДРУГИХ ПОЛИПЕПТИДОВ С ПОМОЩЬЮ Е3 УБИКВИТИН ЛИГАЗЫ | 2013 |
|
RU2666530C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ДЛЯ УЛУЧШЕННОГО РАСЩЕПЛЕНИЯ БЕЛКОВ-МИШЕНЕЙ | 2016 |
|
RU2782063C2 |
| МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СООТВЕТСТВУЮЩИЕ СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2805511C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| ОКСАДИАЗОЛЫ В КАЧЕСТВЕ АГОНИСТОВ МУСКАРИНОВОГО РЕЦЕПТОРА M1 И/ИЛИ M4 | 2019 |
|
RU2817018C2 |
| НИТРИЛСОДЕРЖАЩИЕ ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ | 2021 |
|
RU2820150C2 |
| НИТРИЛСОДЕРЖАЩИЕ ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ | 2021 |
|
RU2786722C1 |
| КОНДЕНСИРОВАННОЕ ХИНОЛИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2384571C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ВЗАИМОДЕЙСТВИЯ/АКТИВАЦИИ PD1/PD-L1 | 2019 |
|
RU2777980C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С NTRK | 2016 |
|
RU2744974C2 |
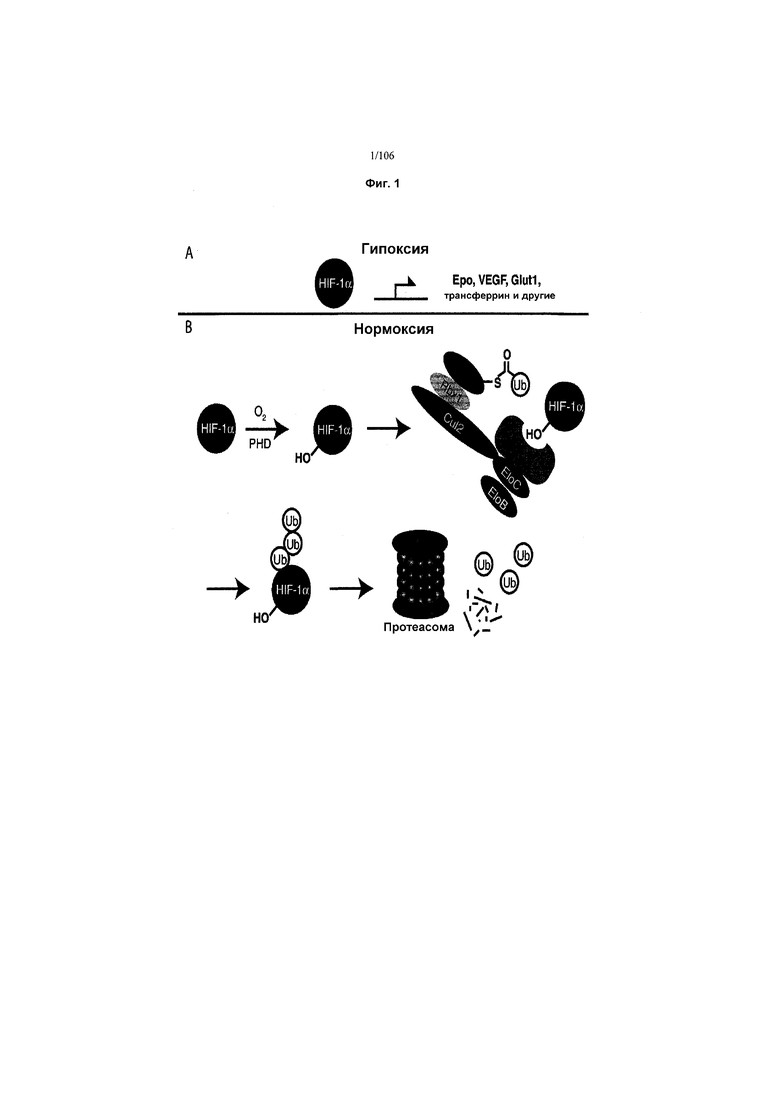
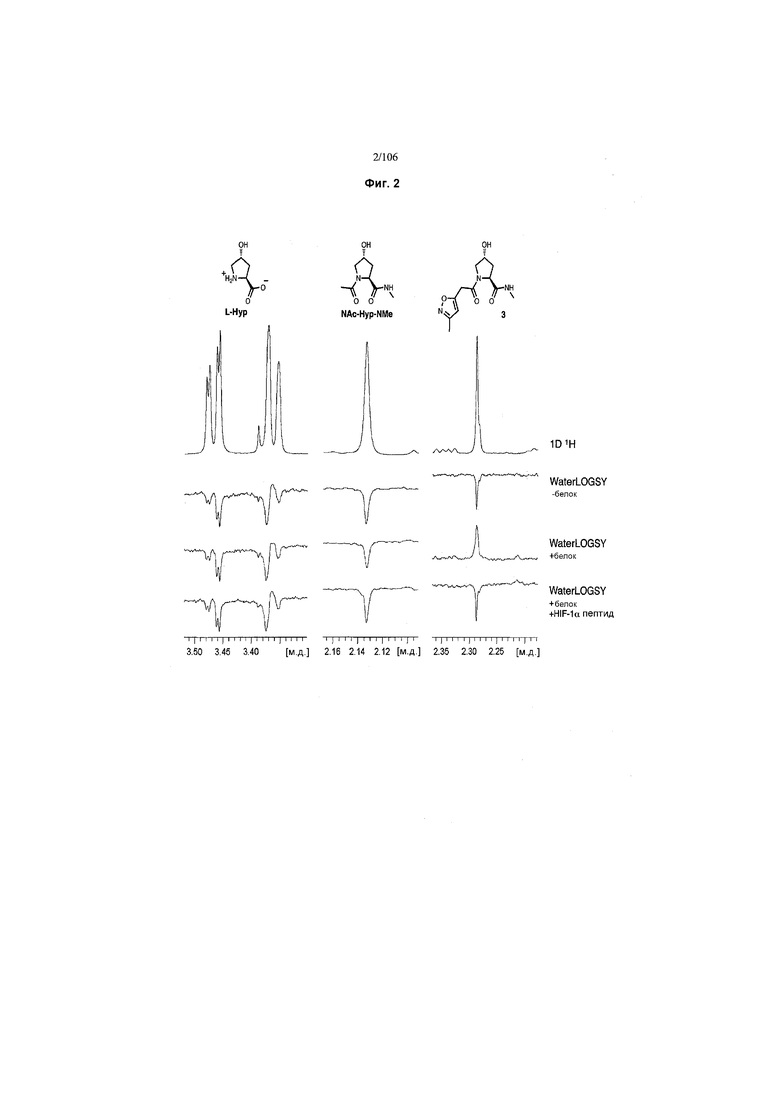
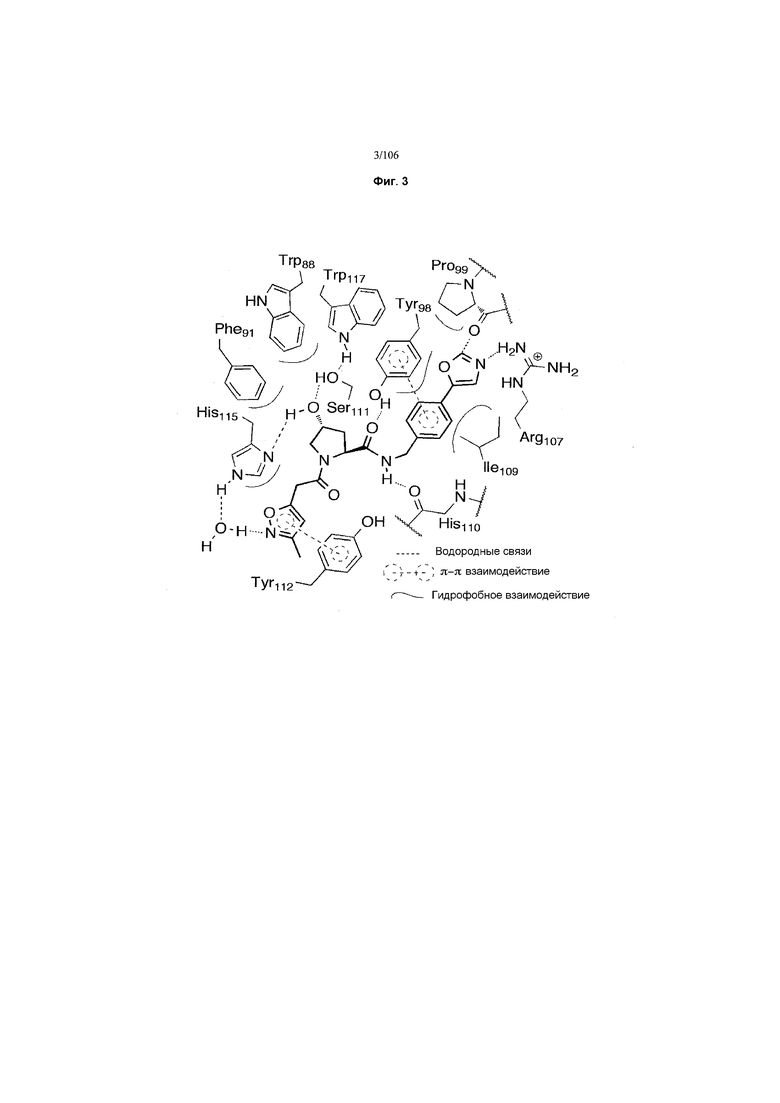

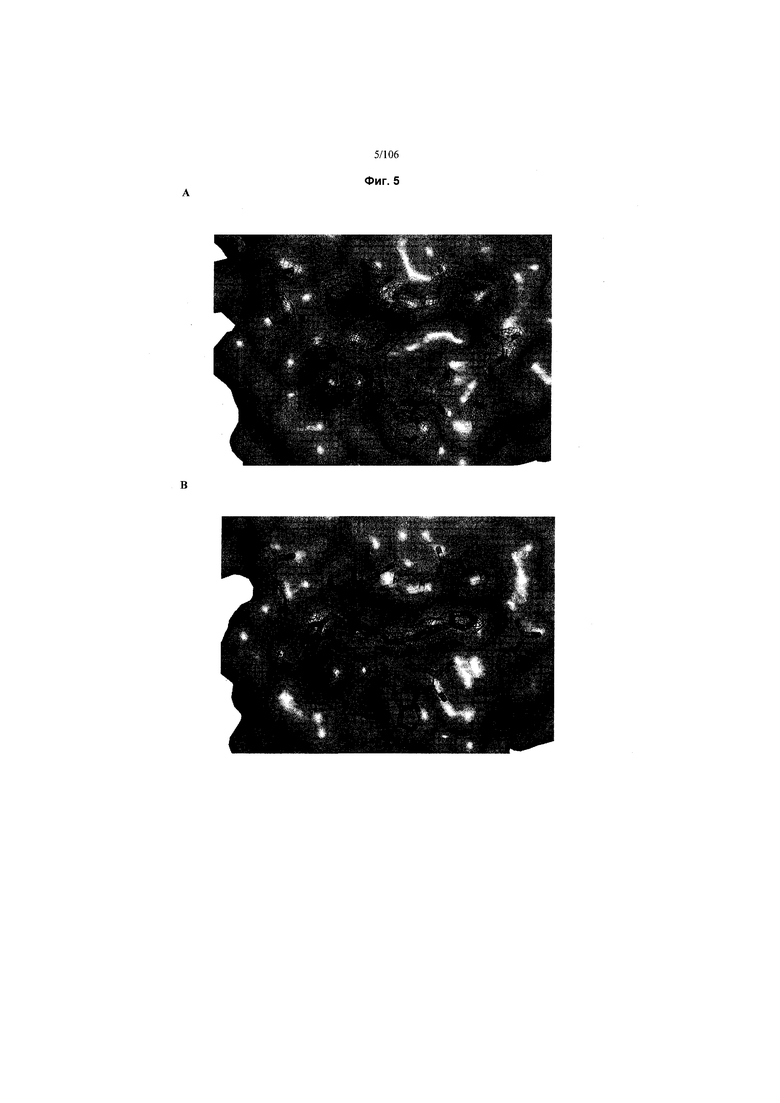
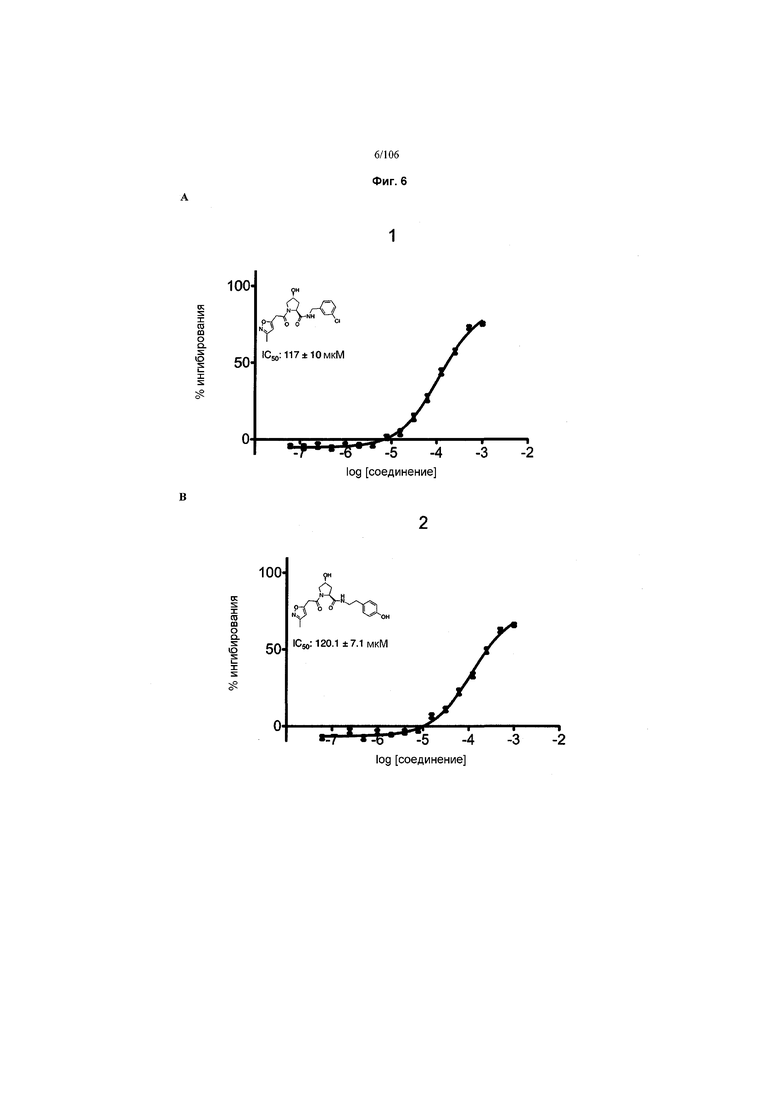
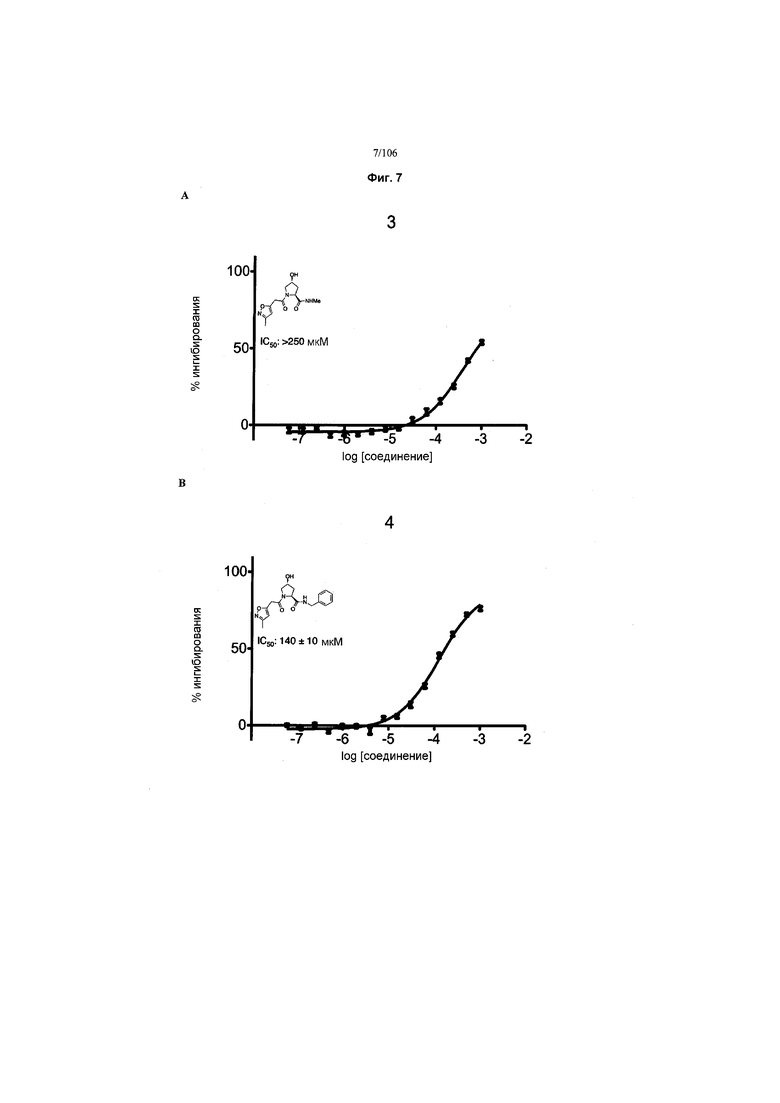
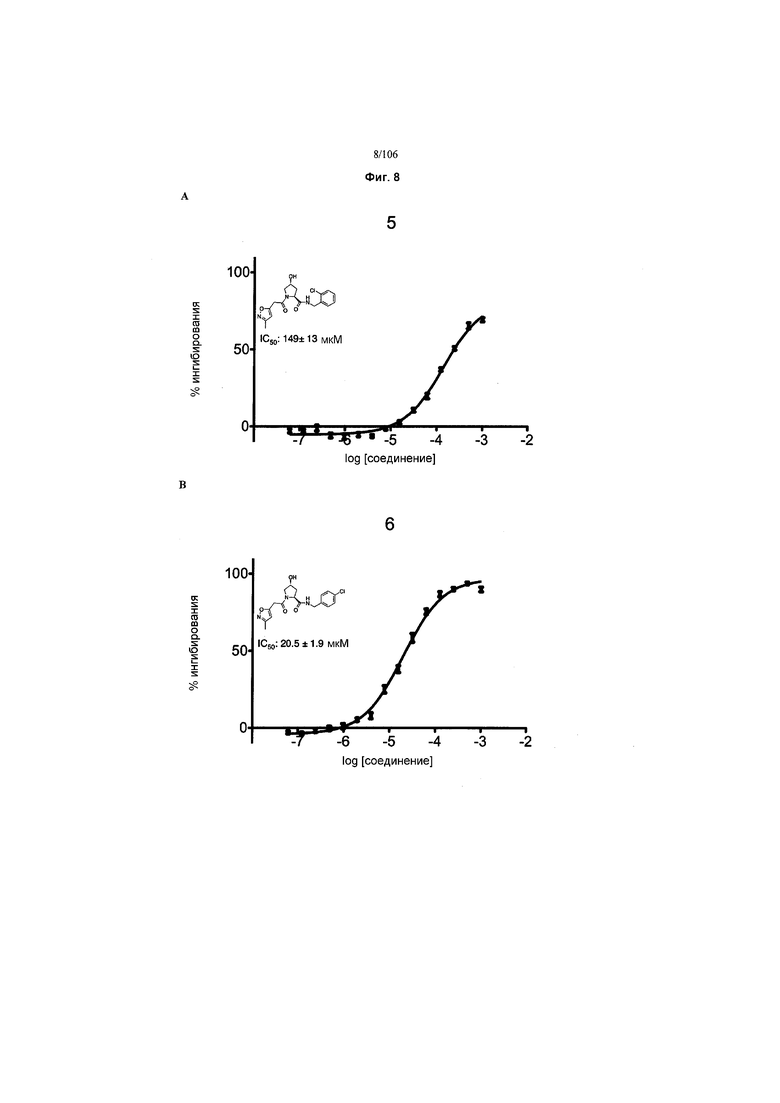
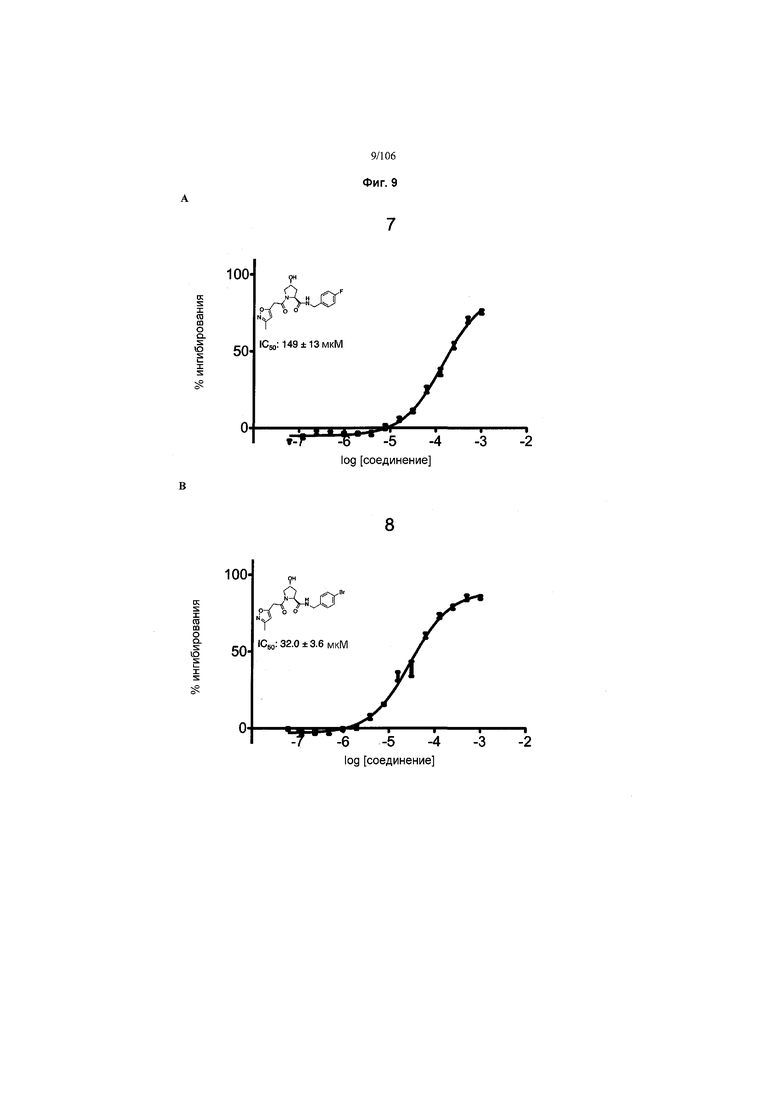
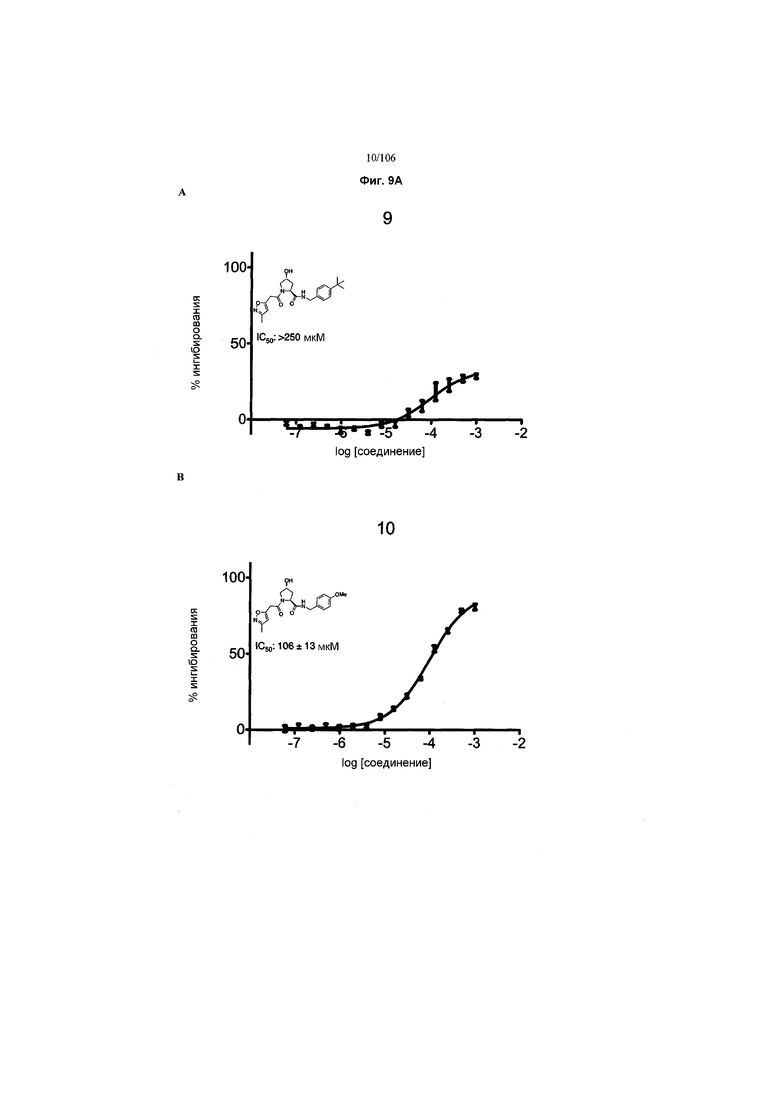
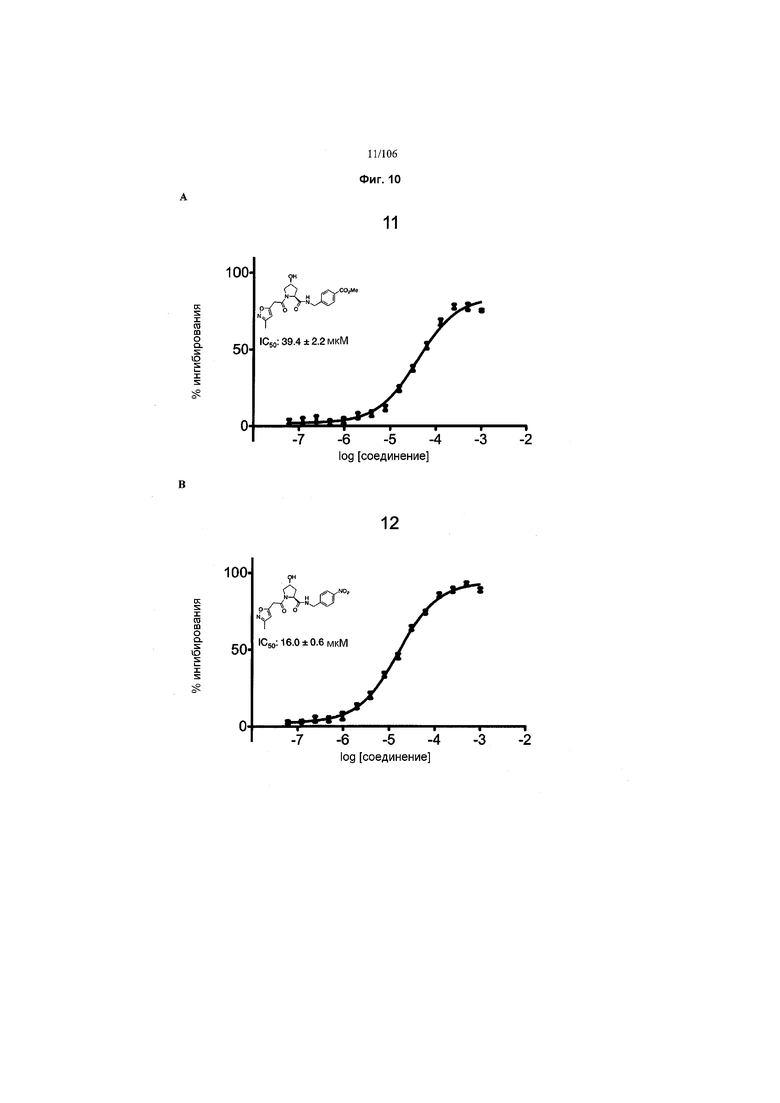
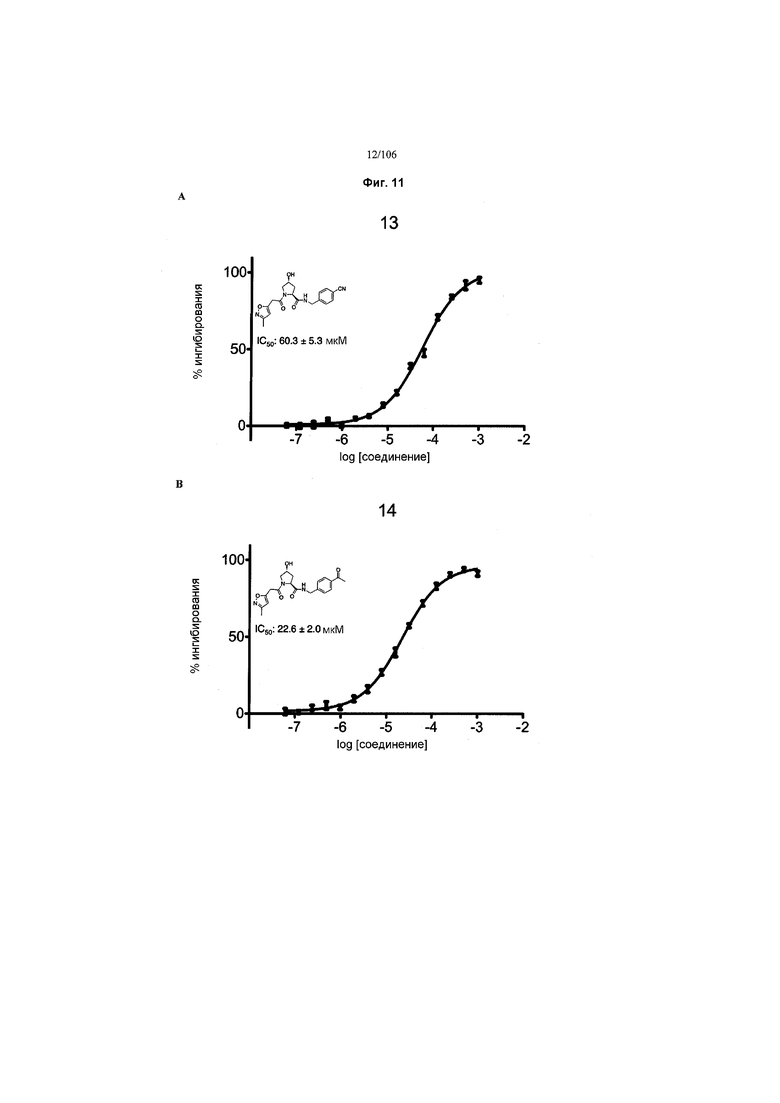
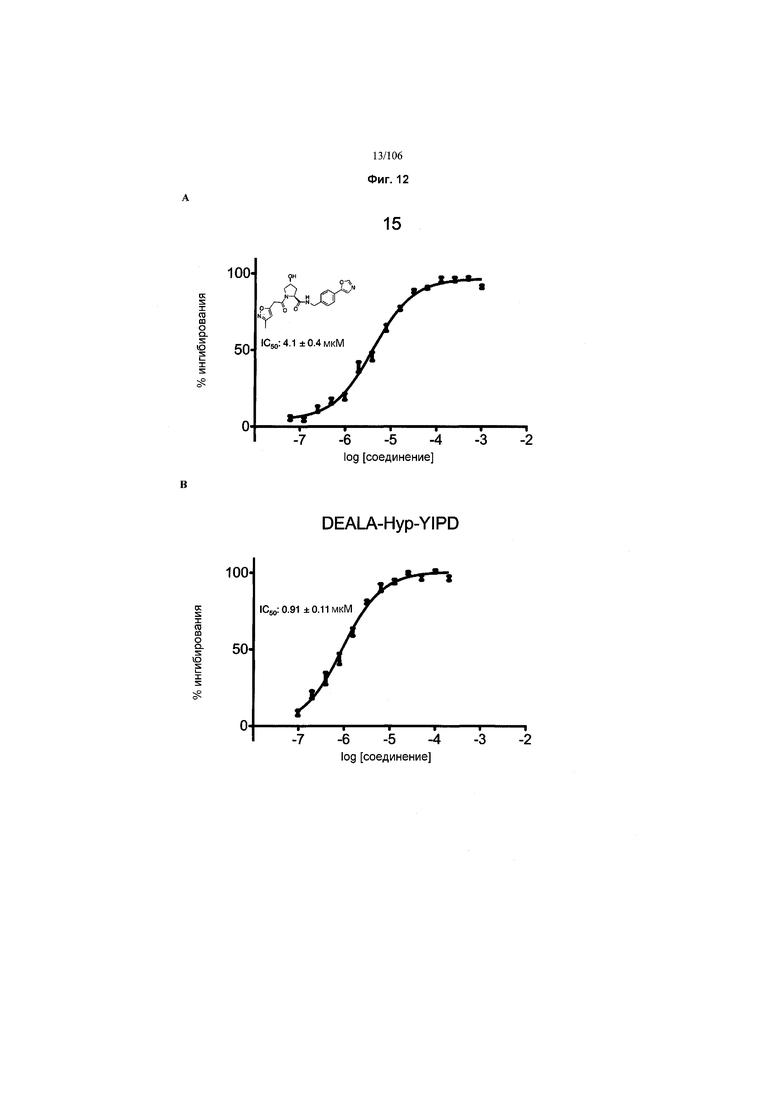
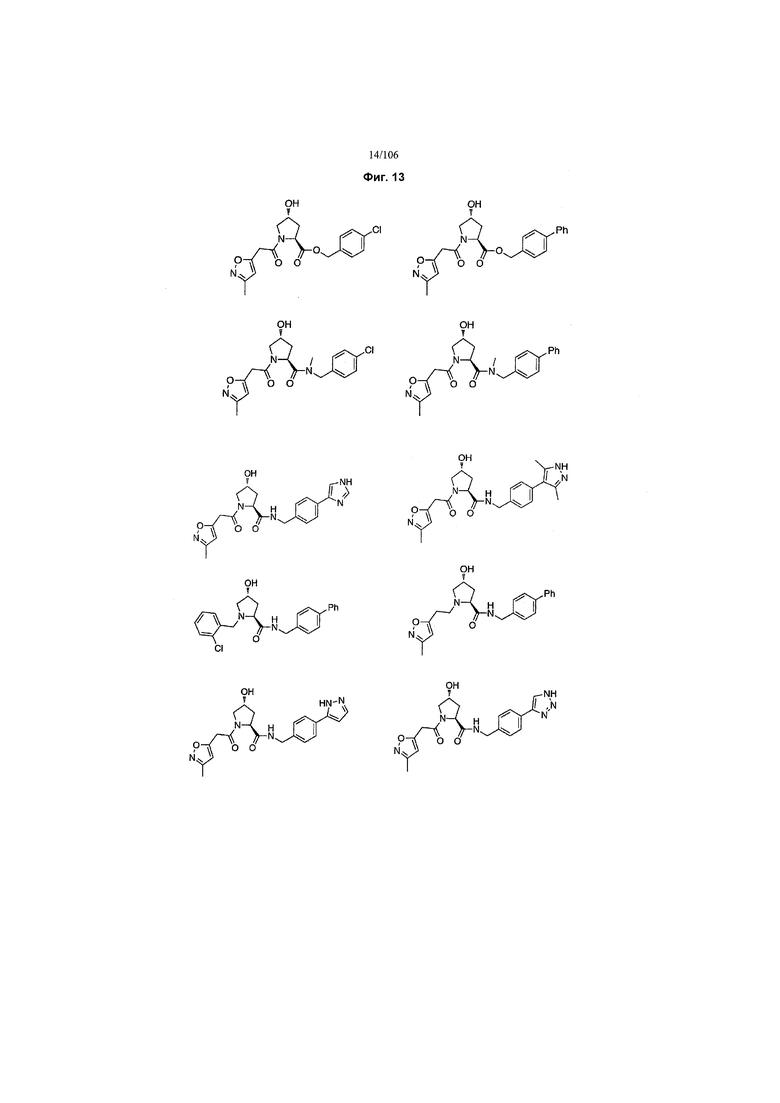

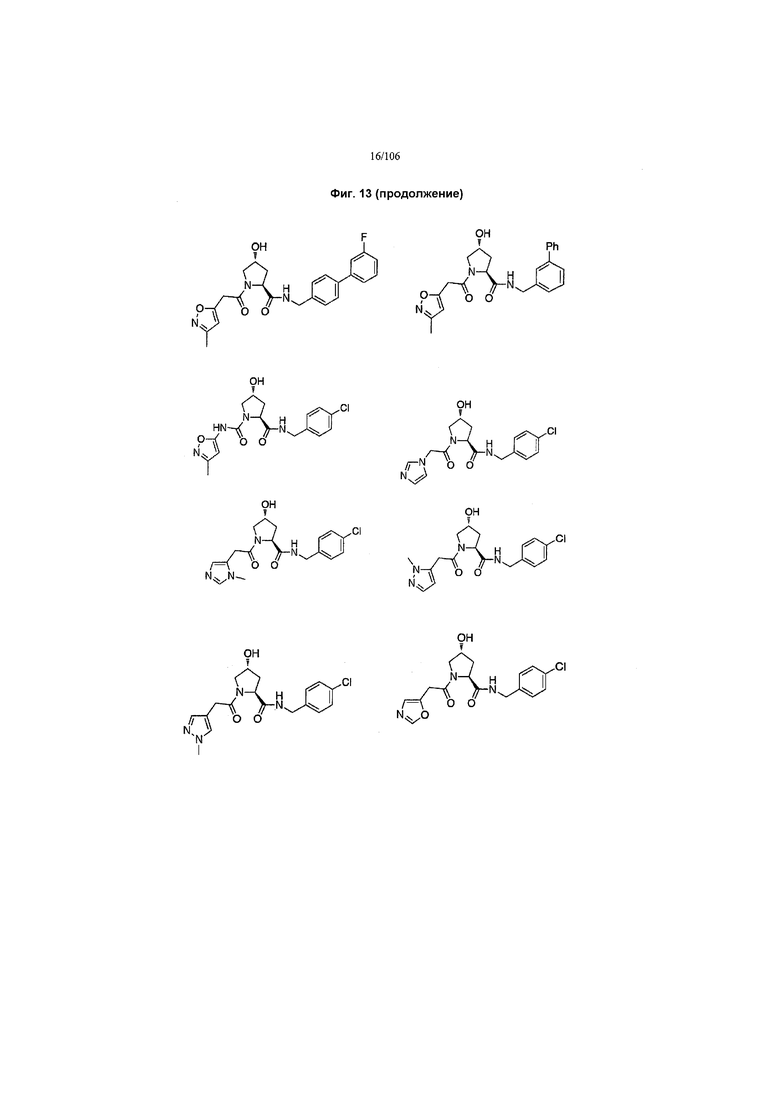
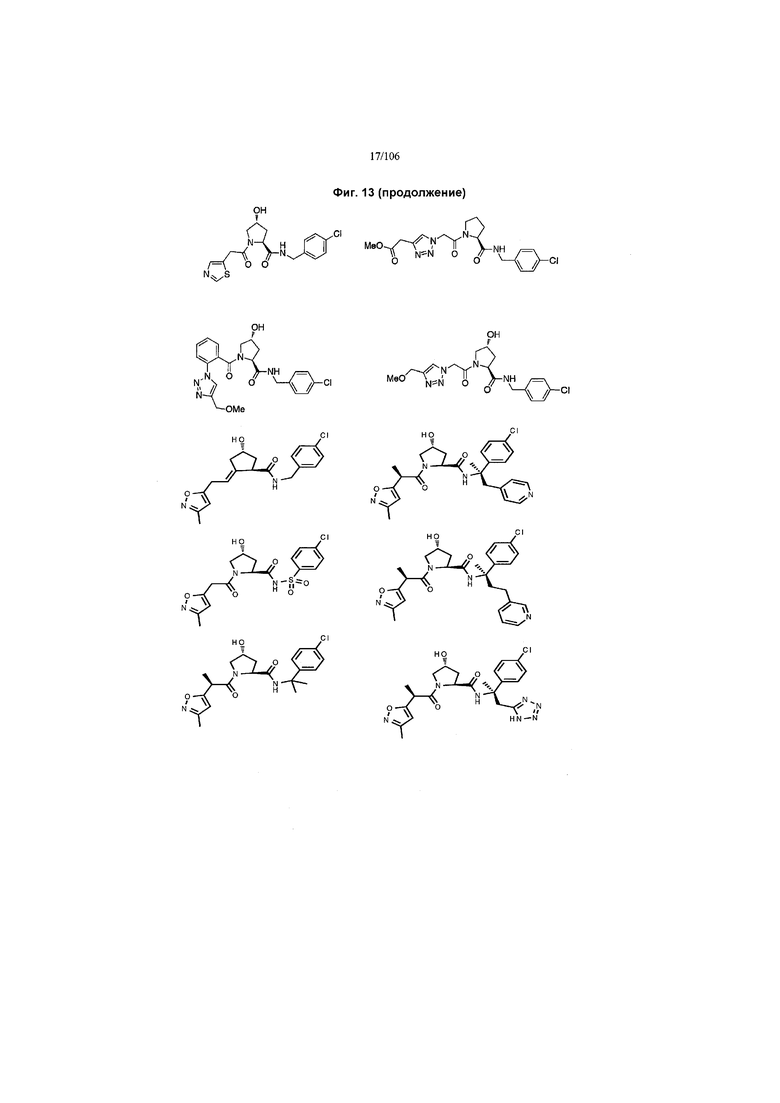


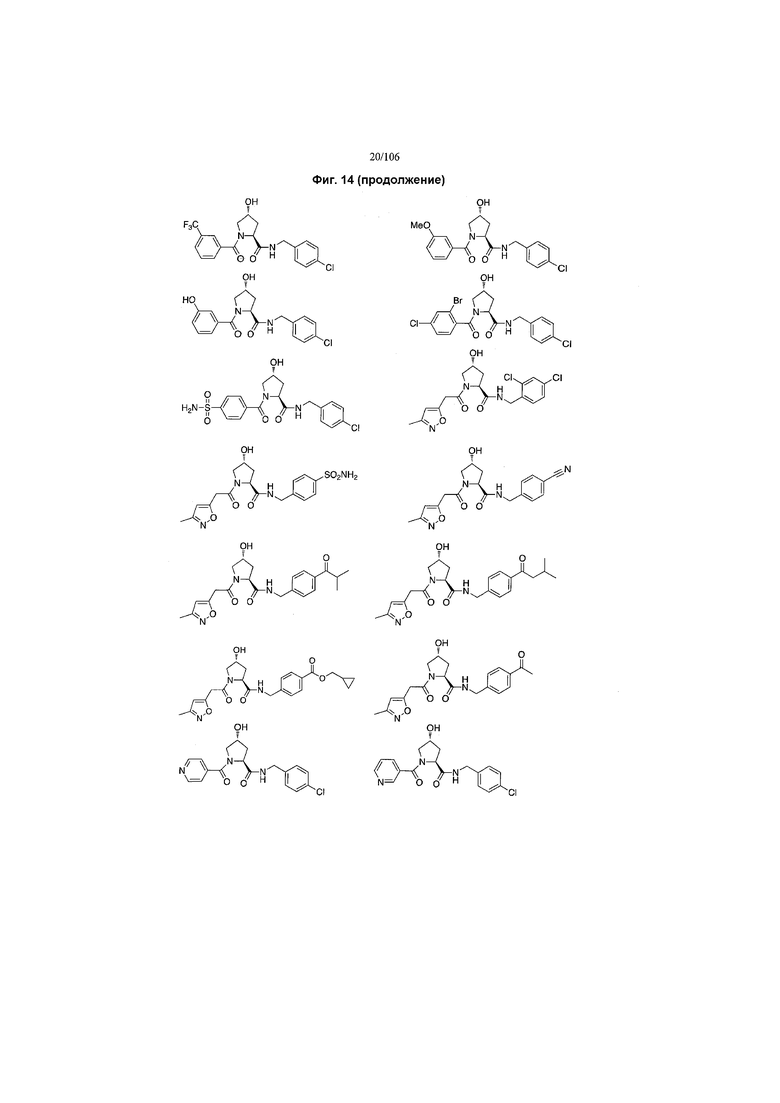
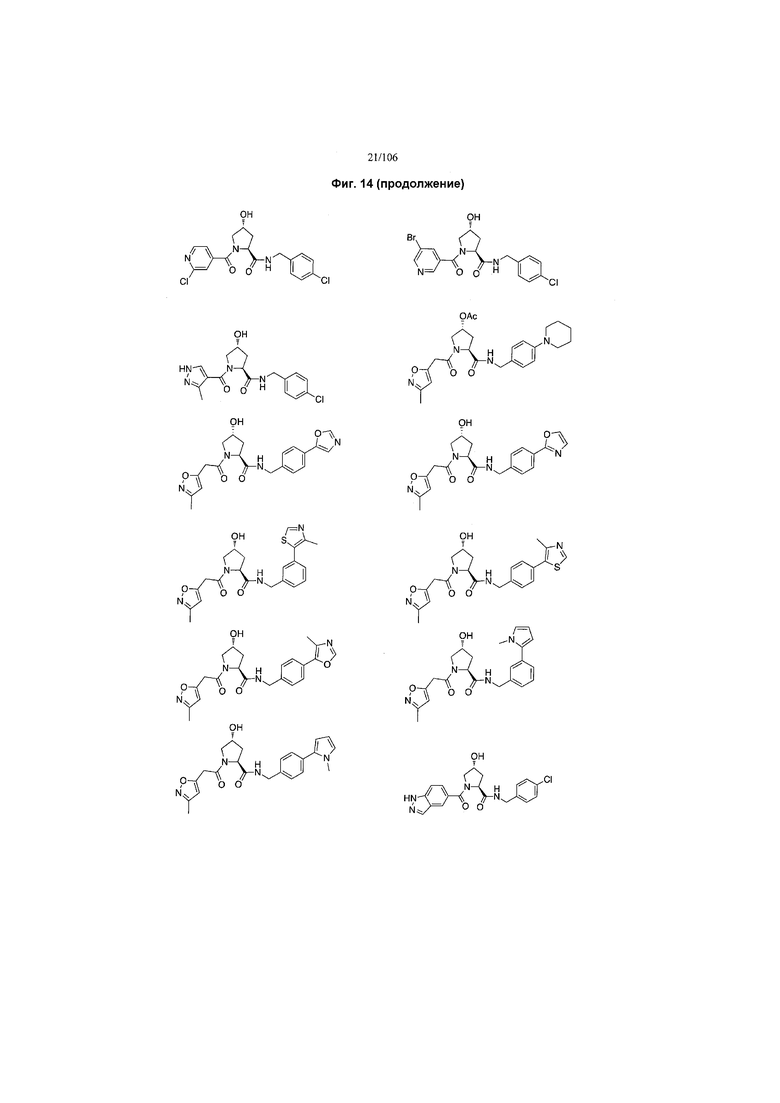
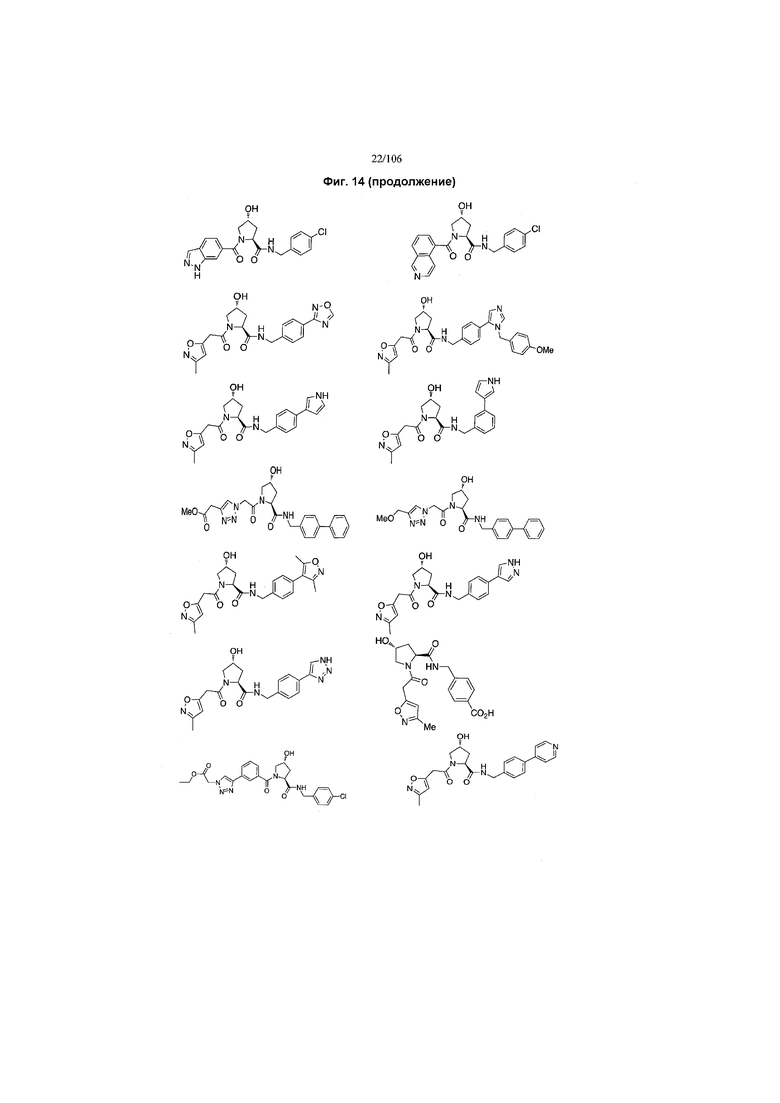
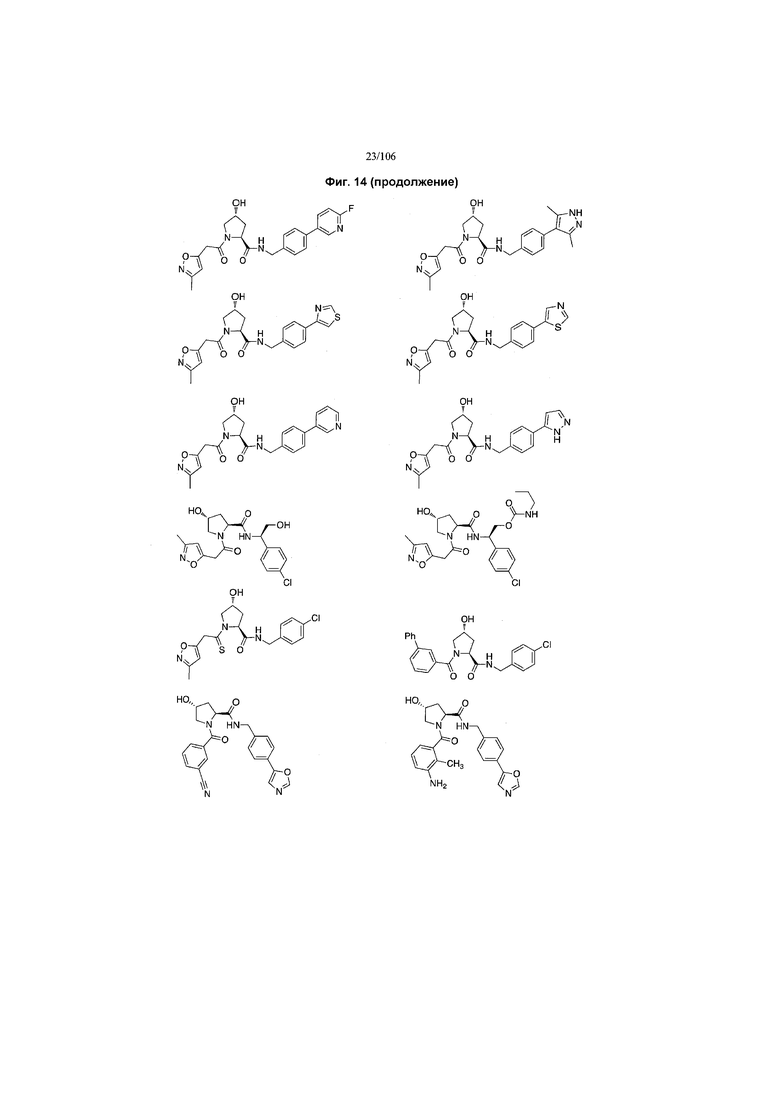

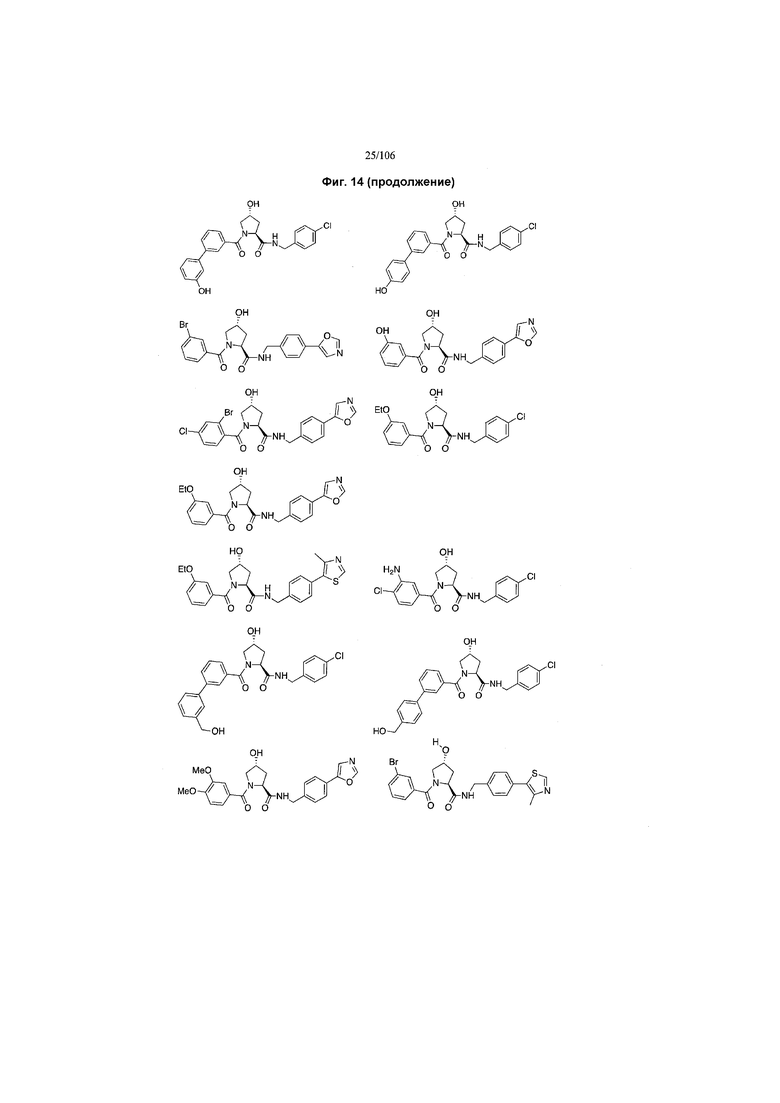



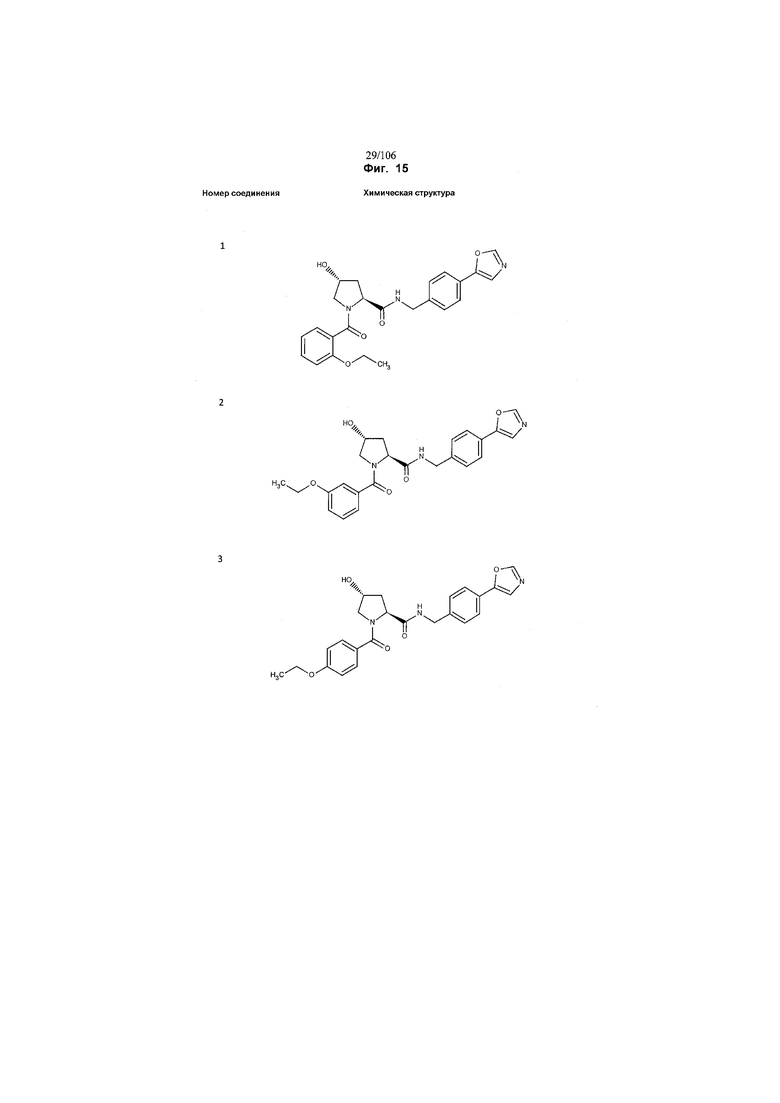

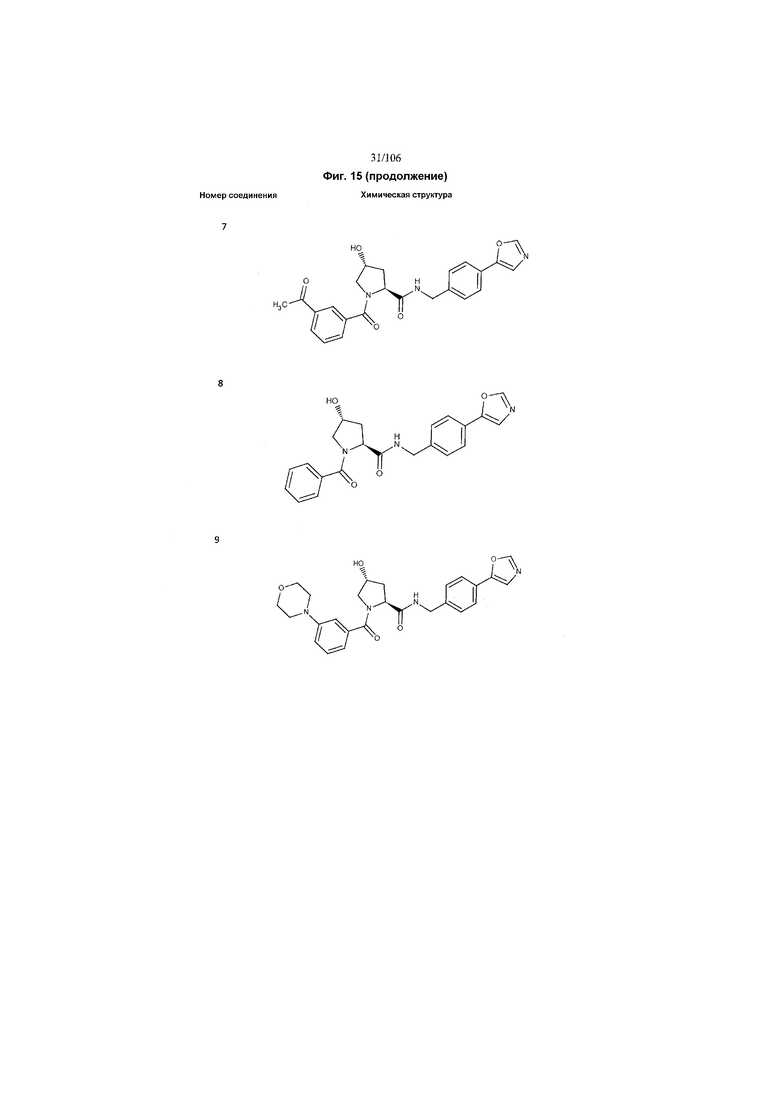
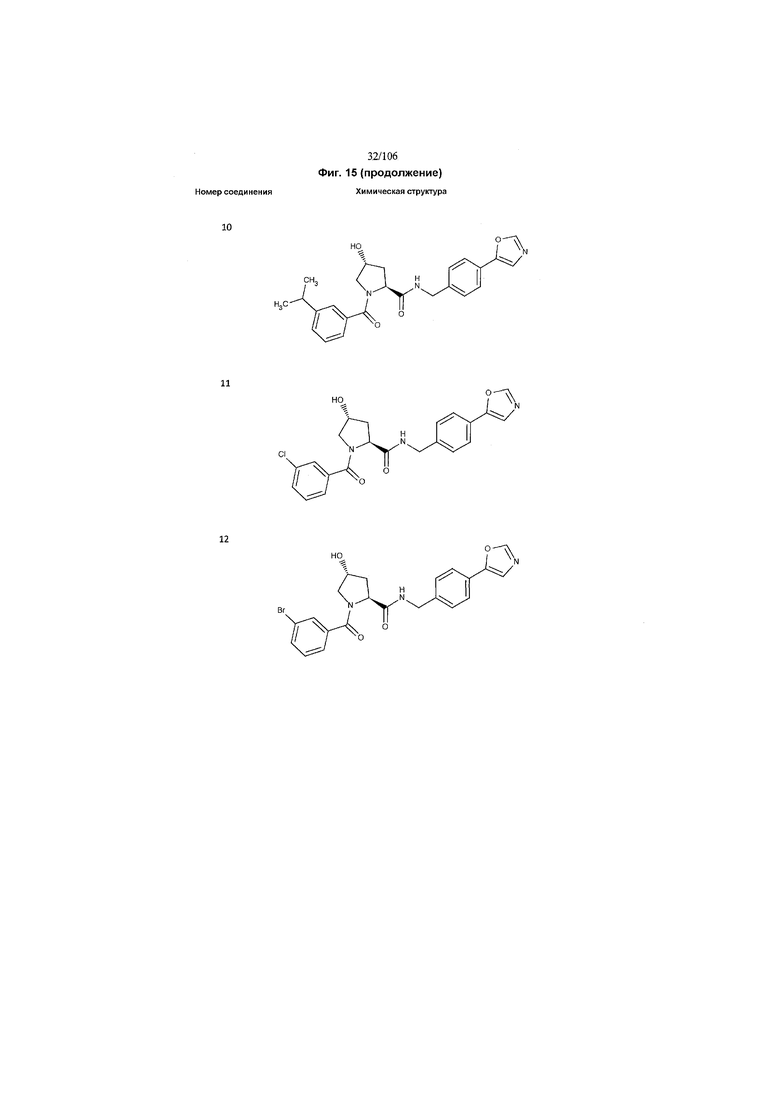
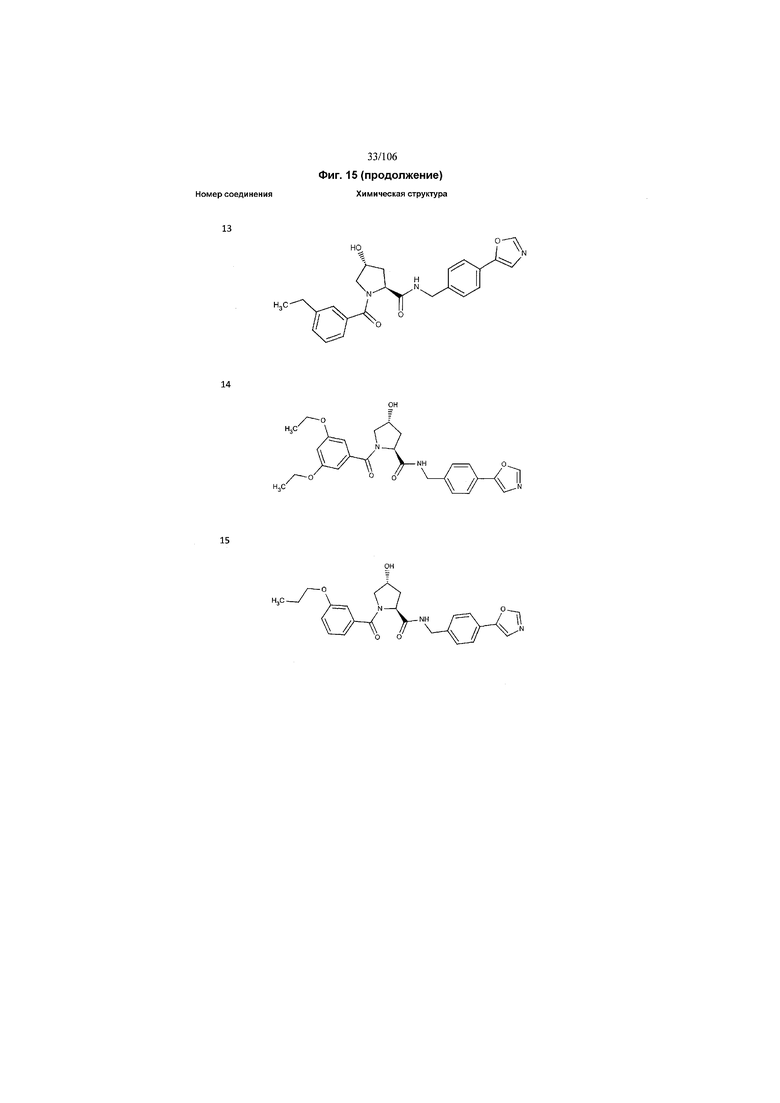
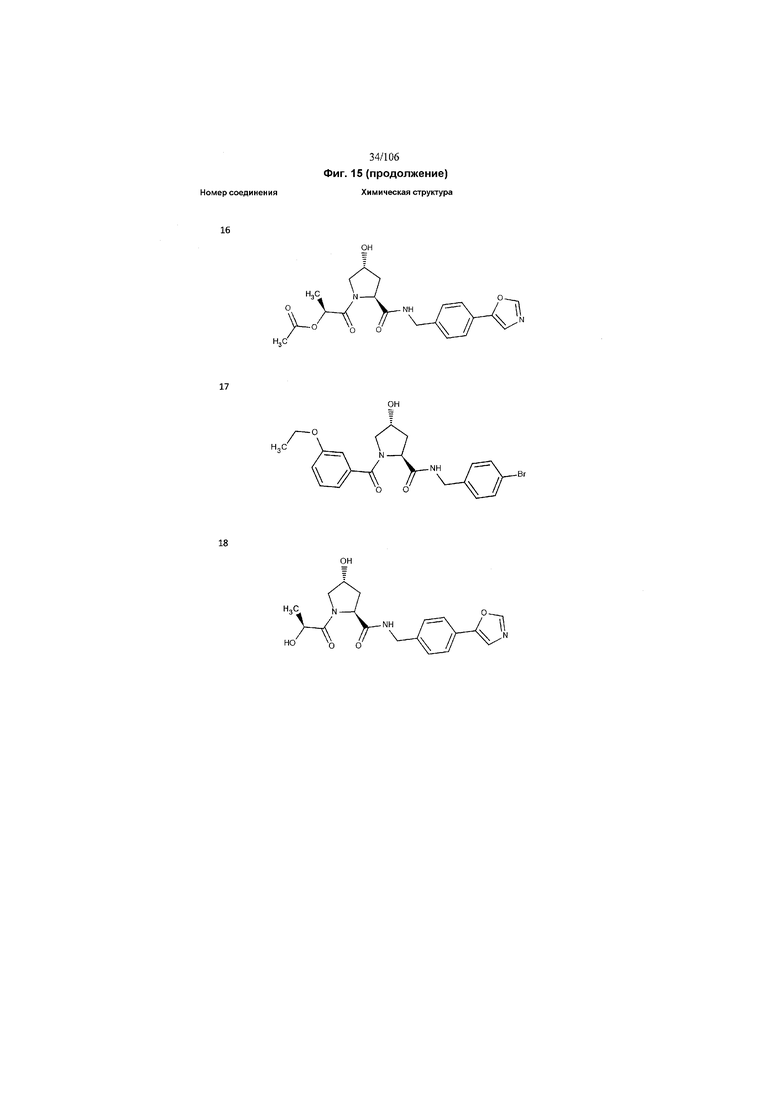
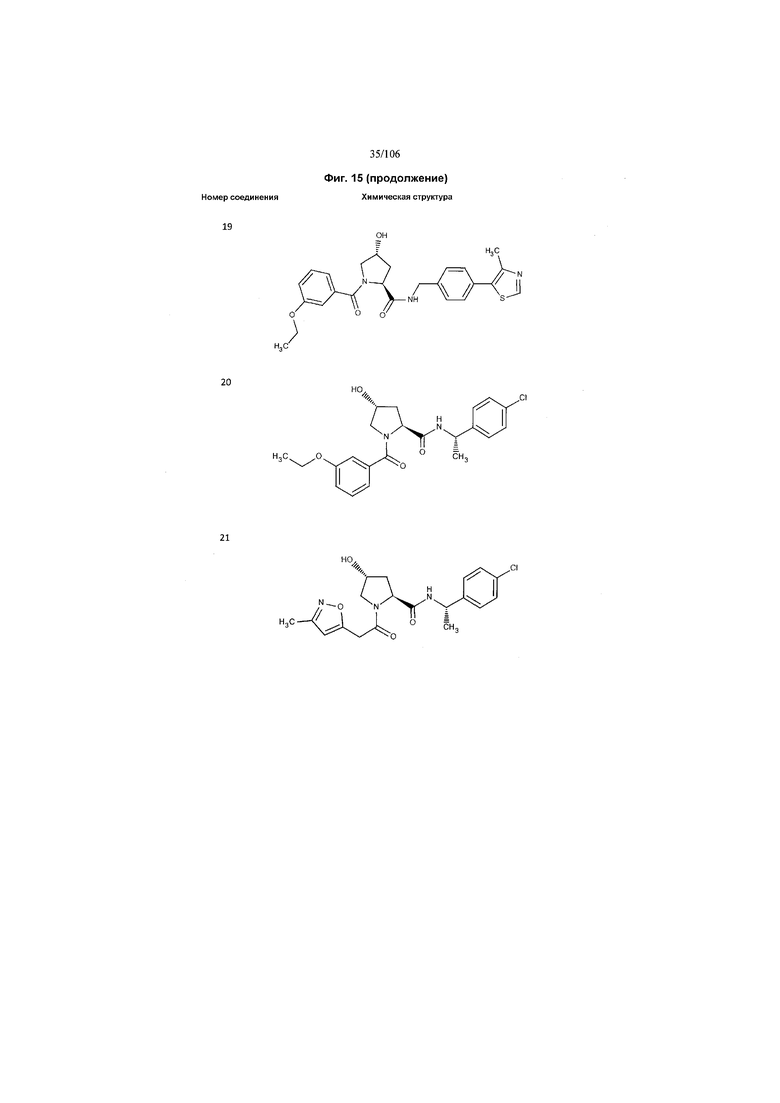
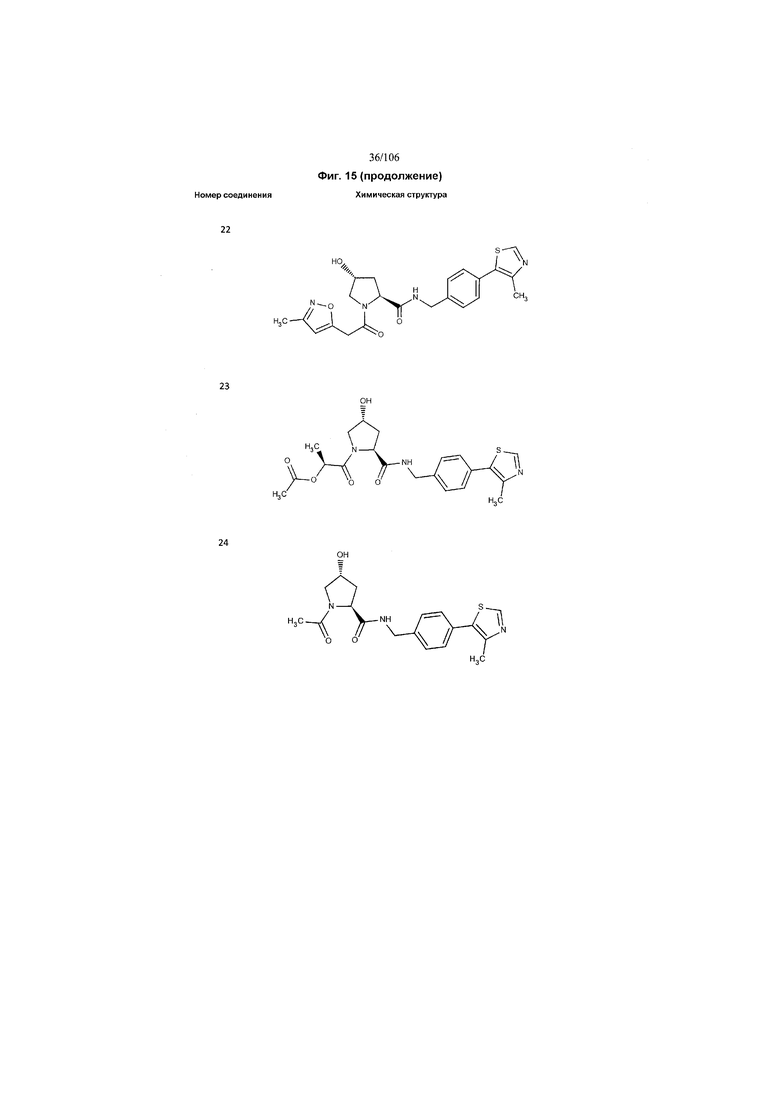
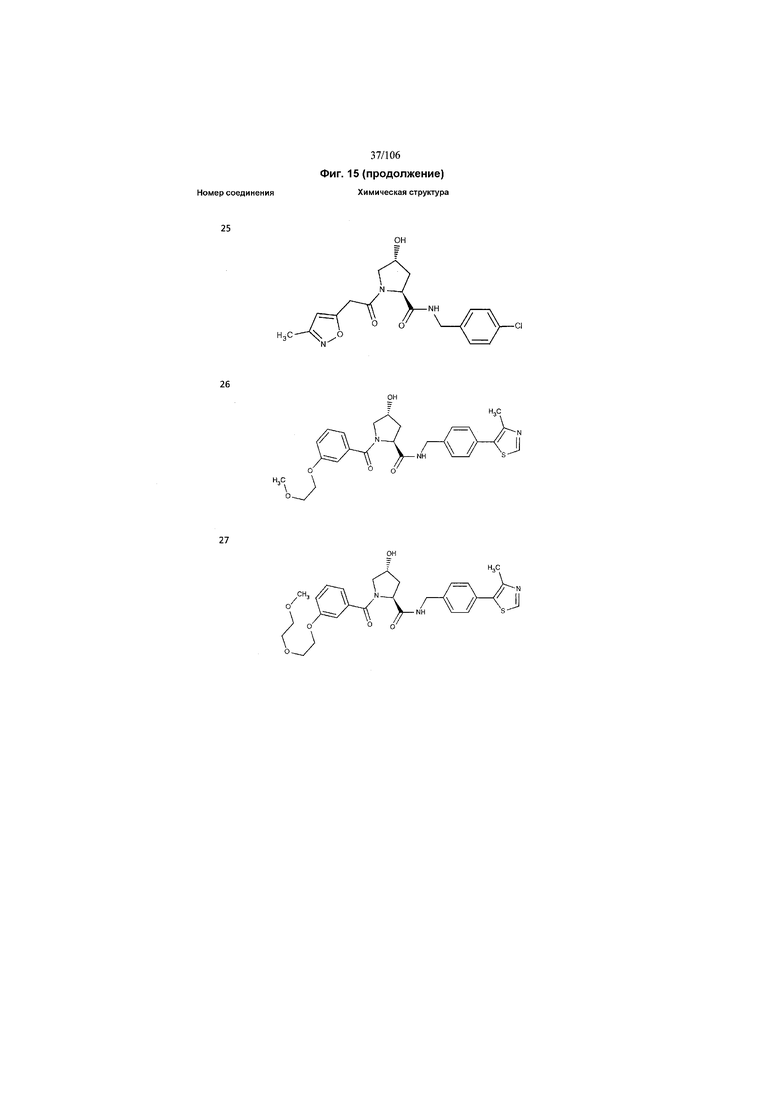
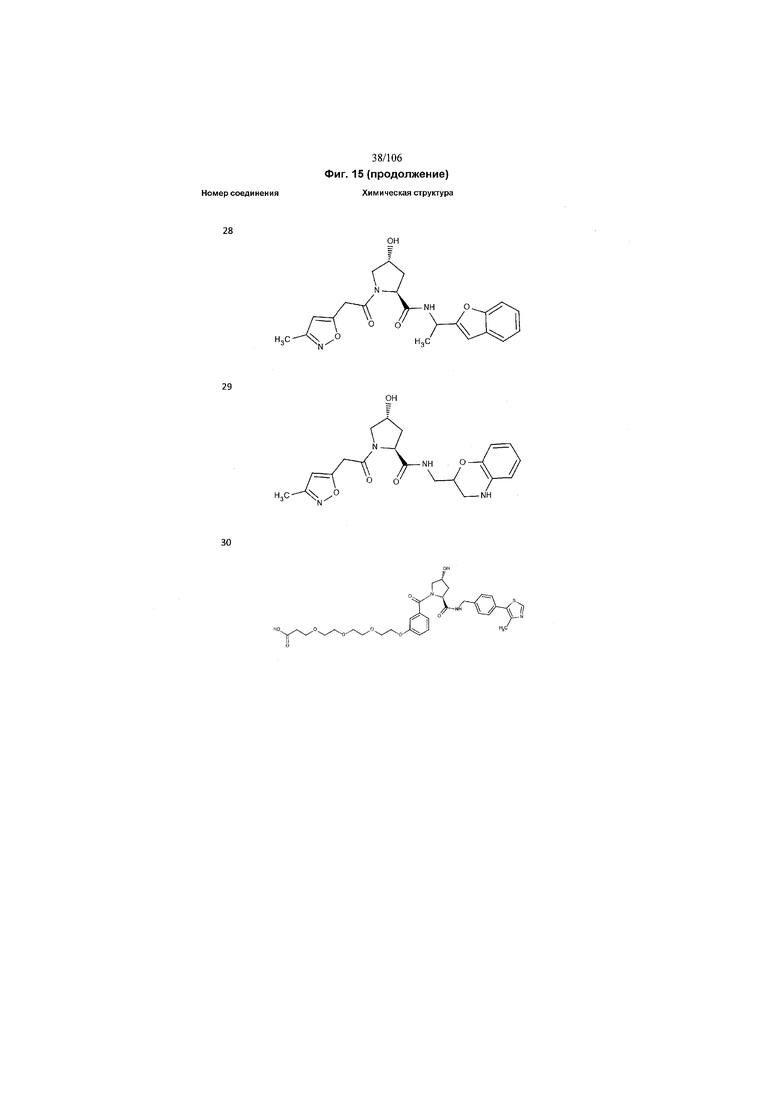

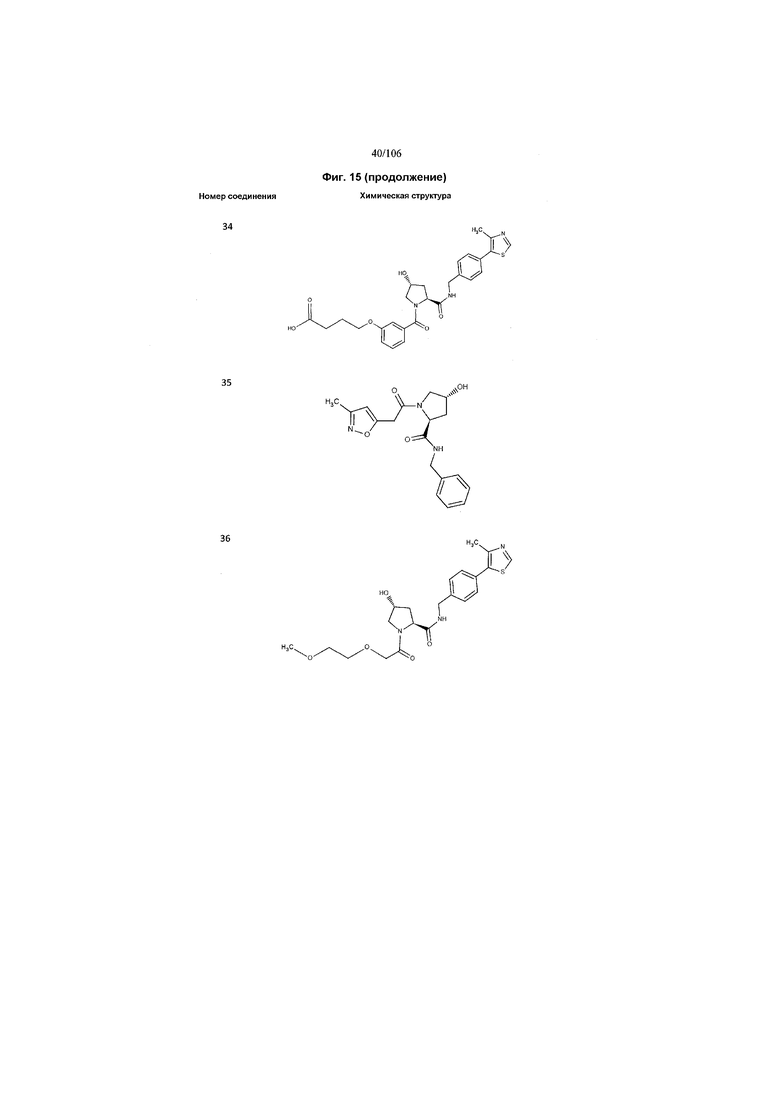
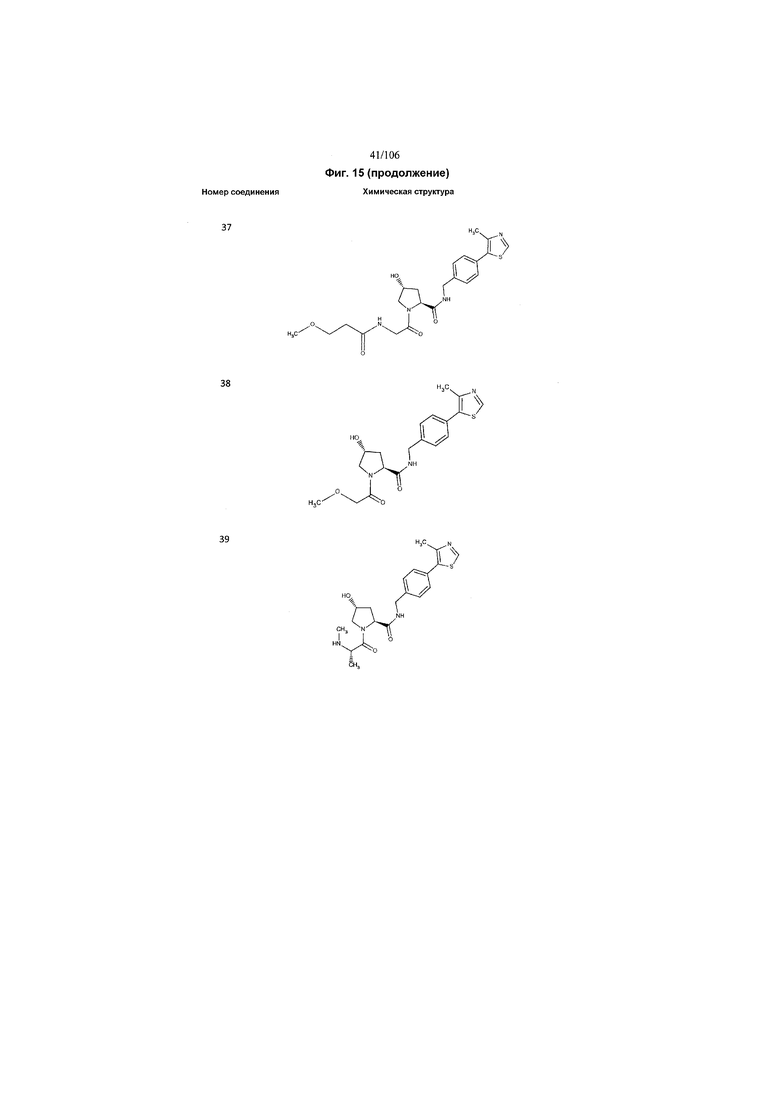
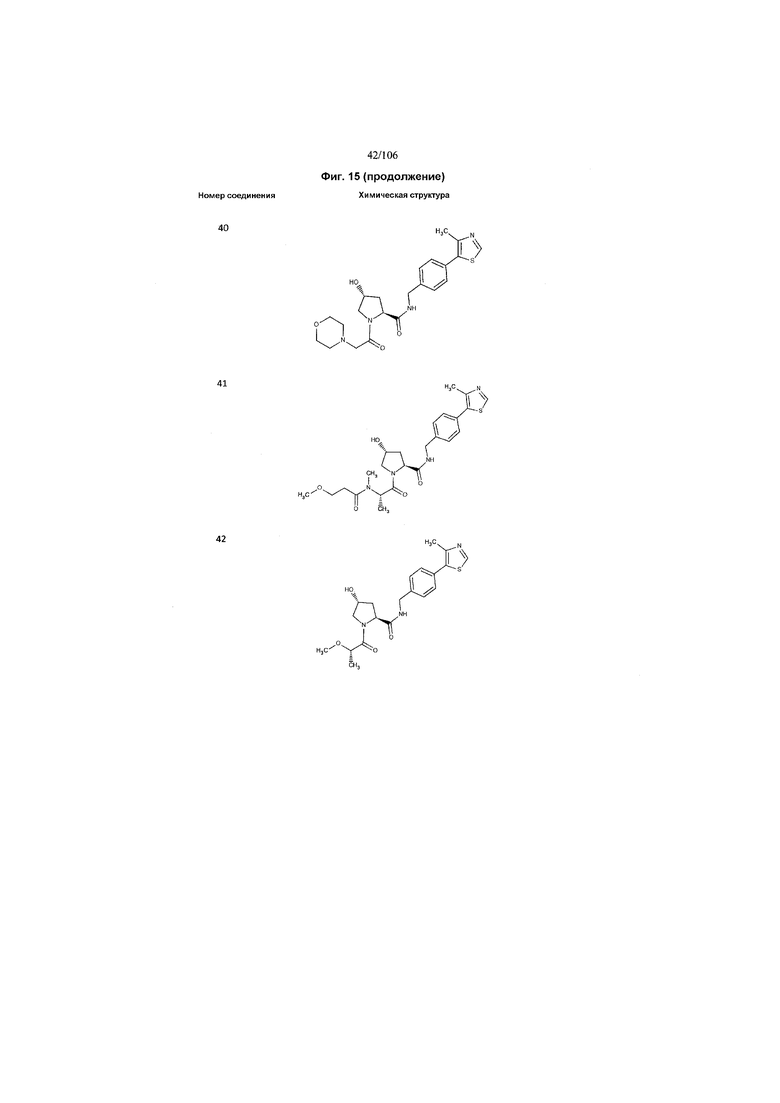
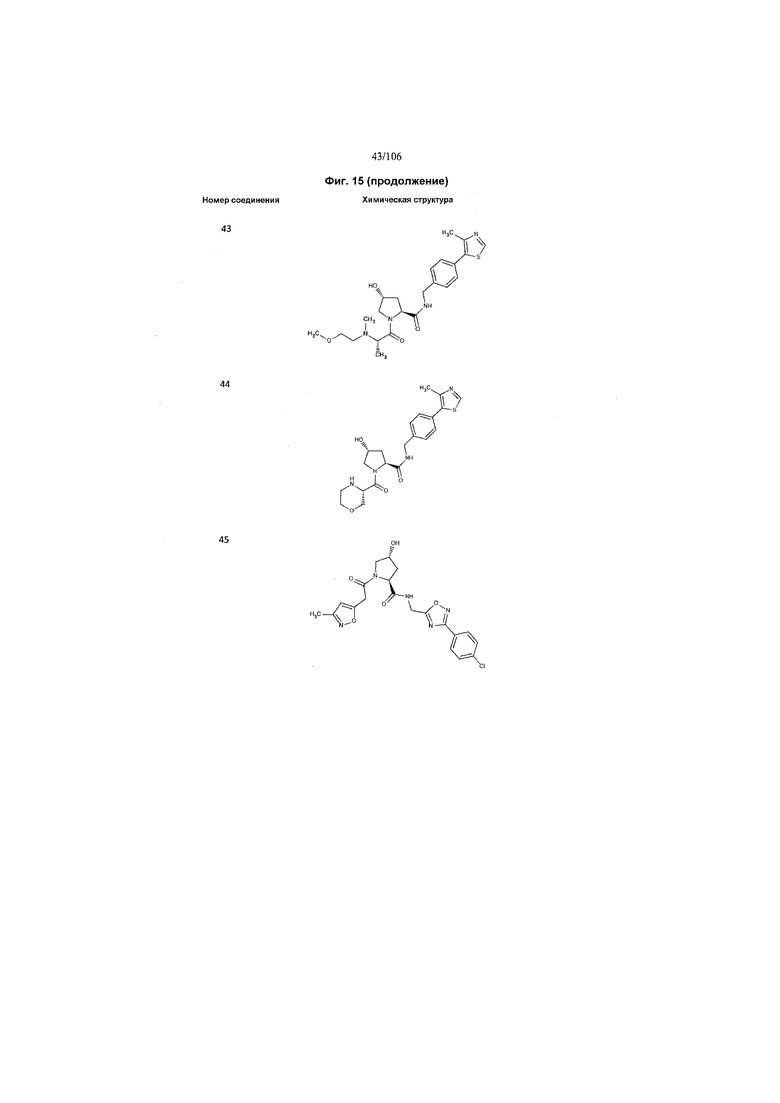
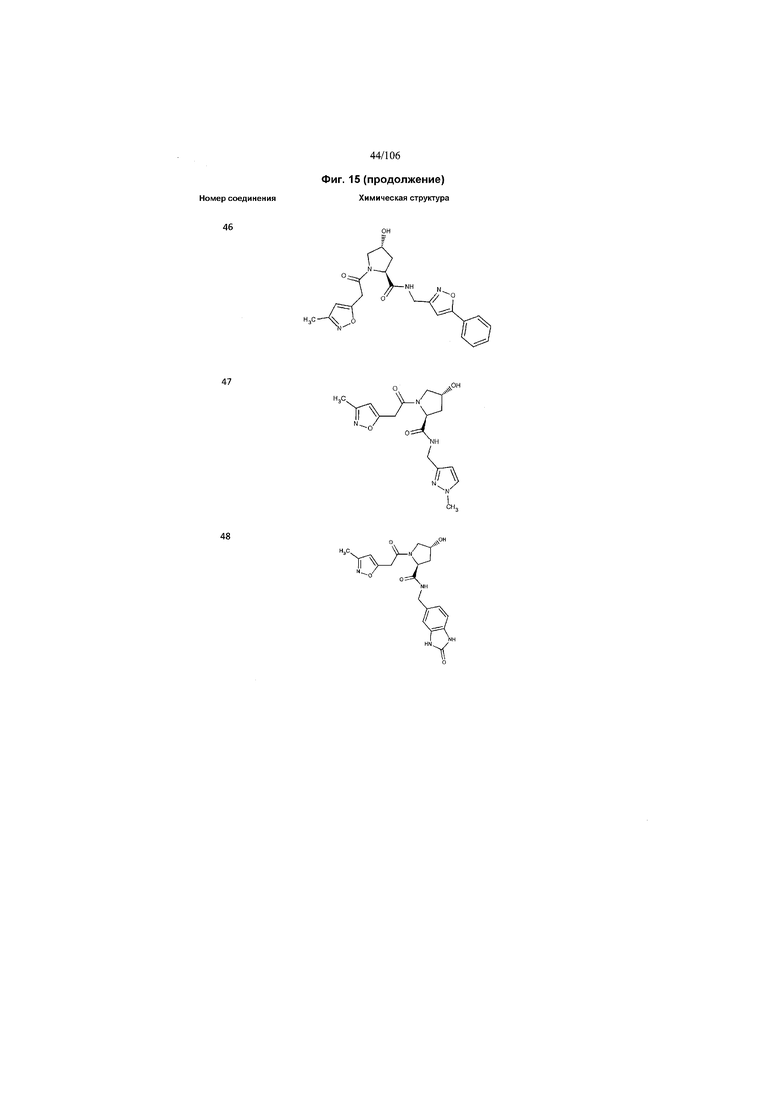
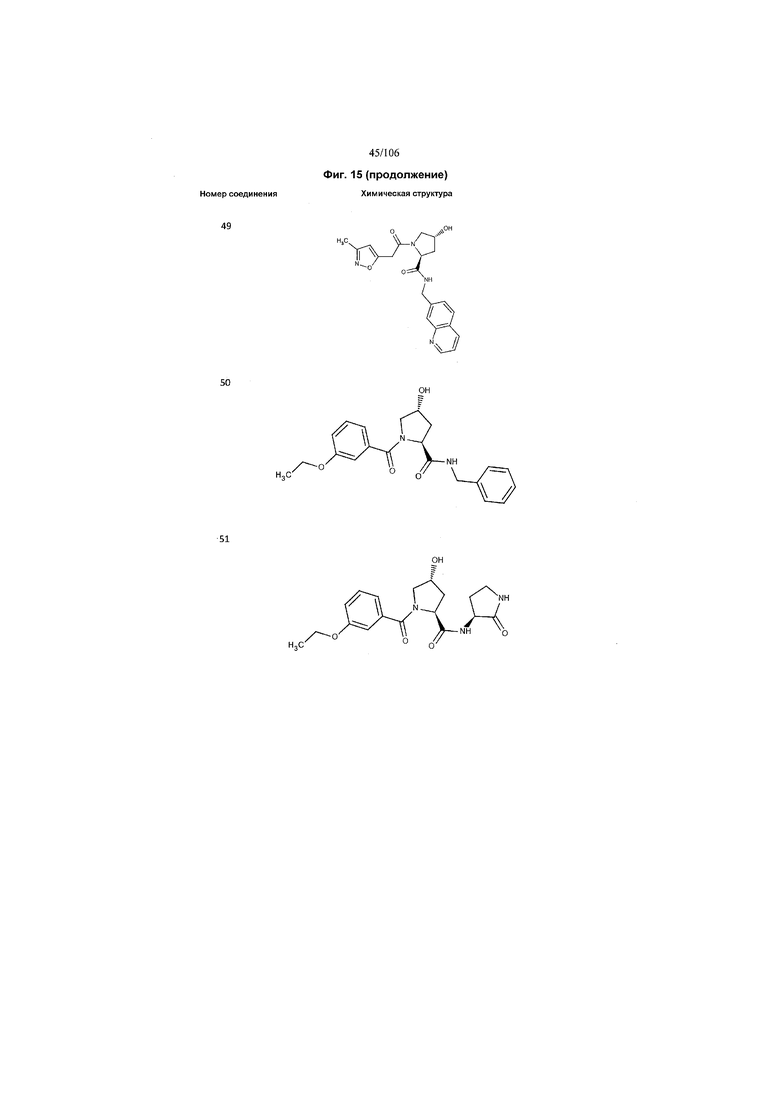
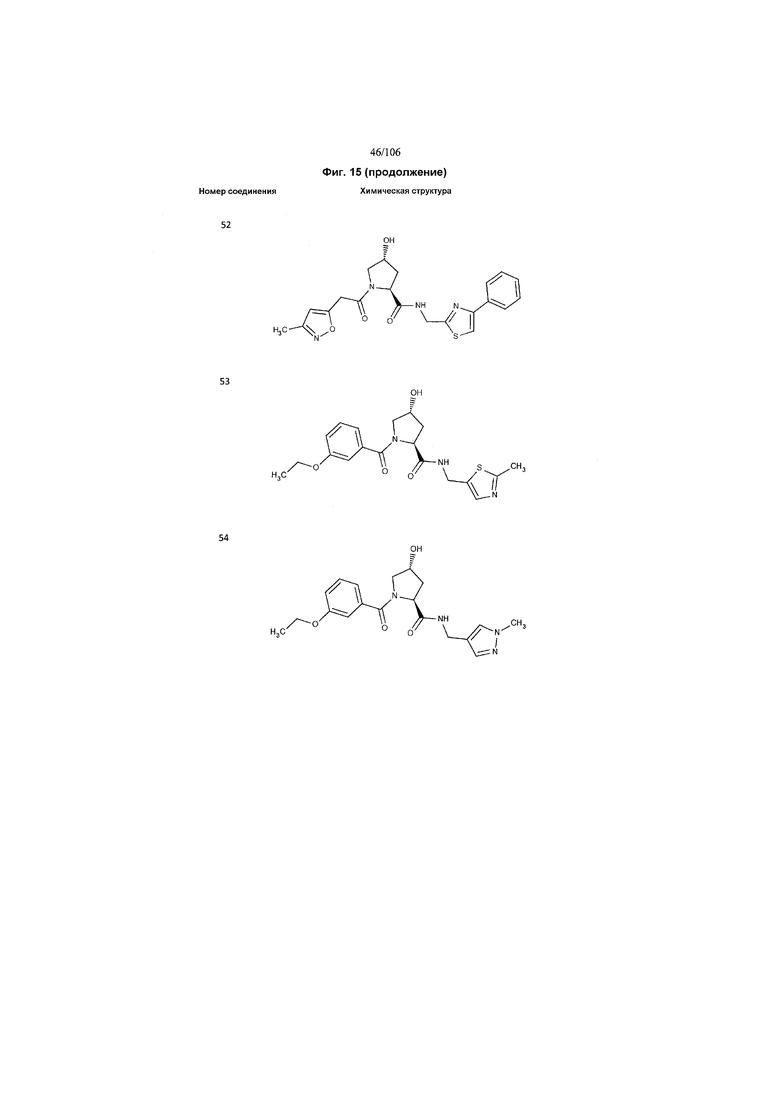
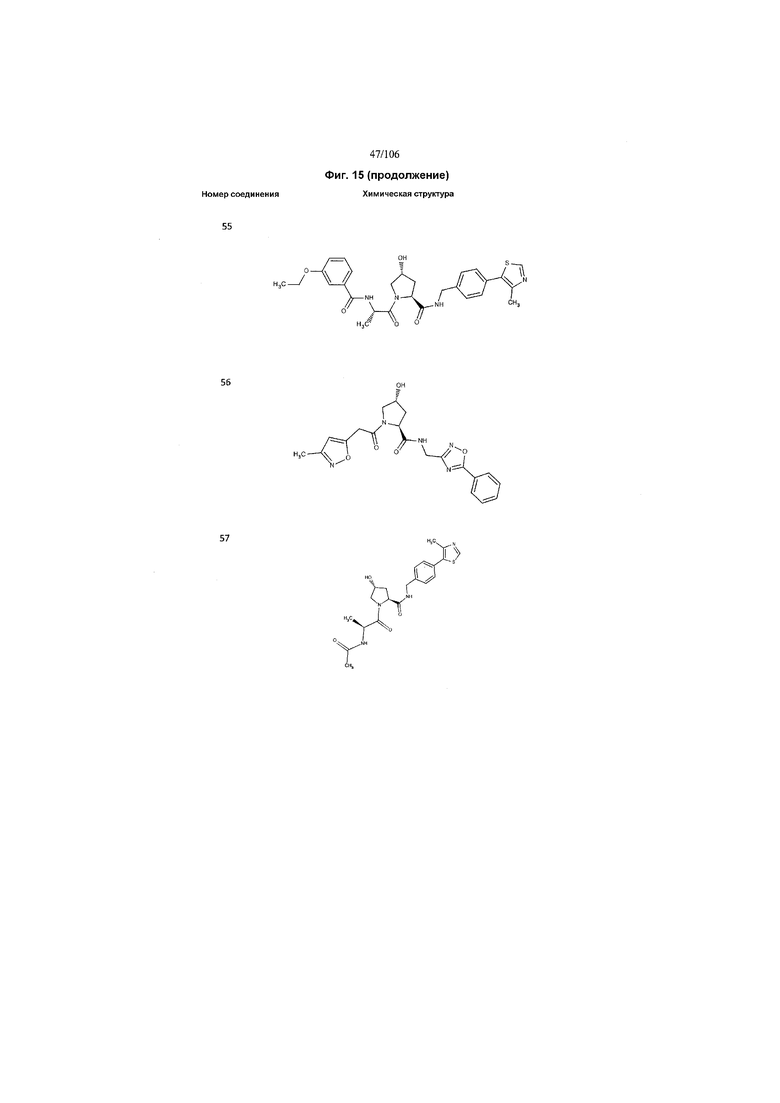
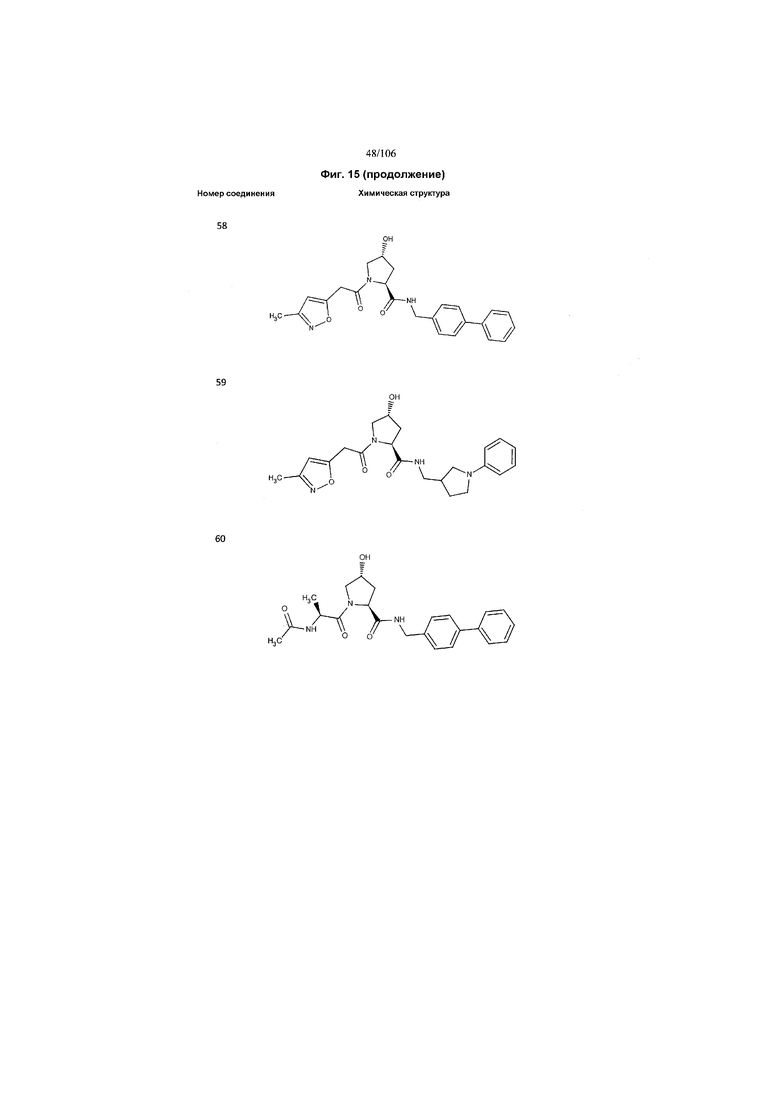
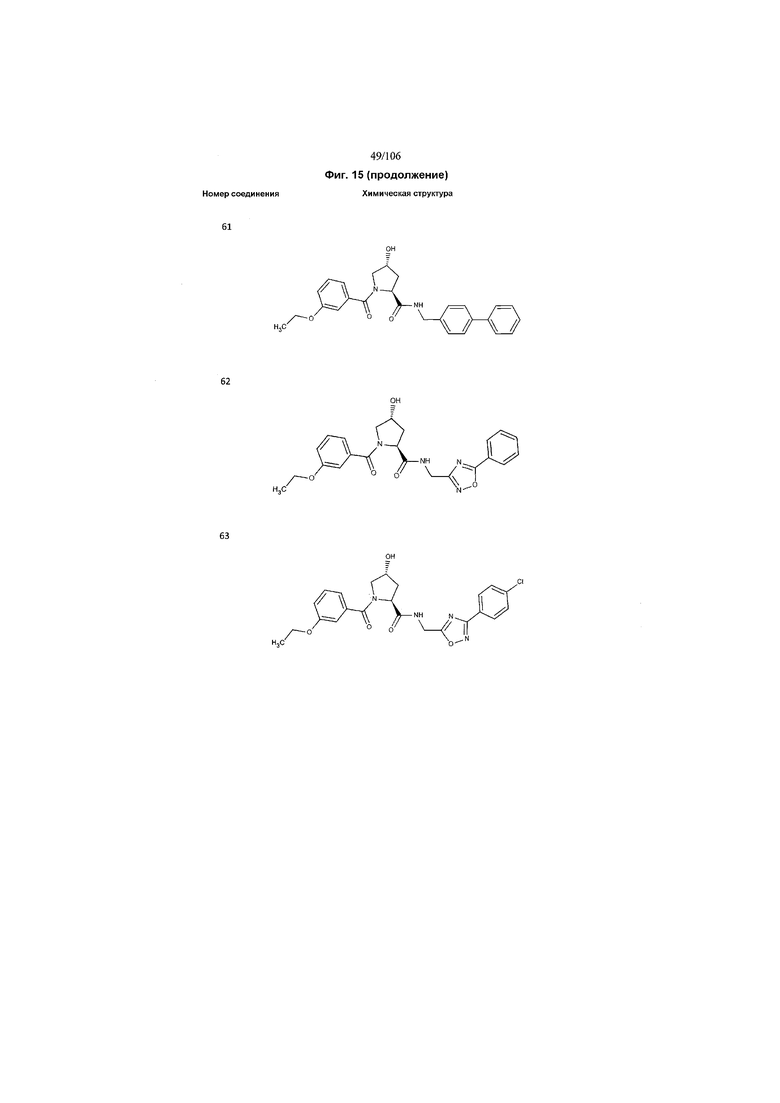

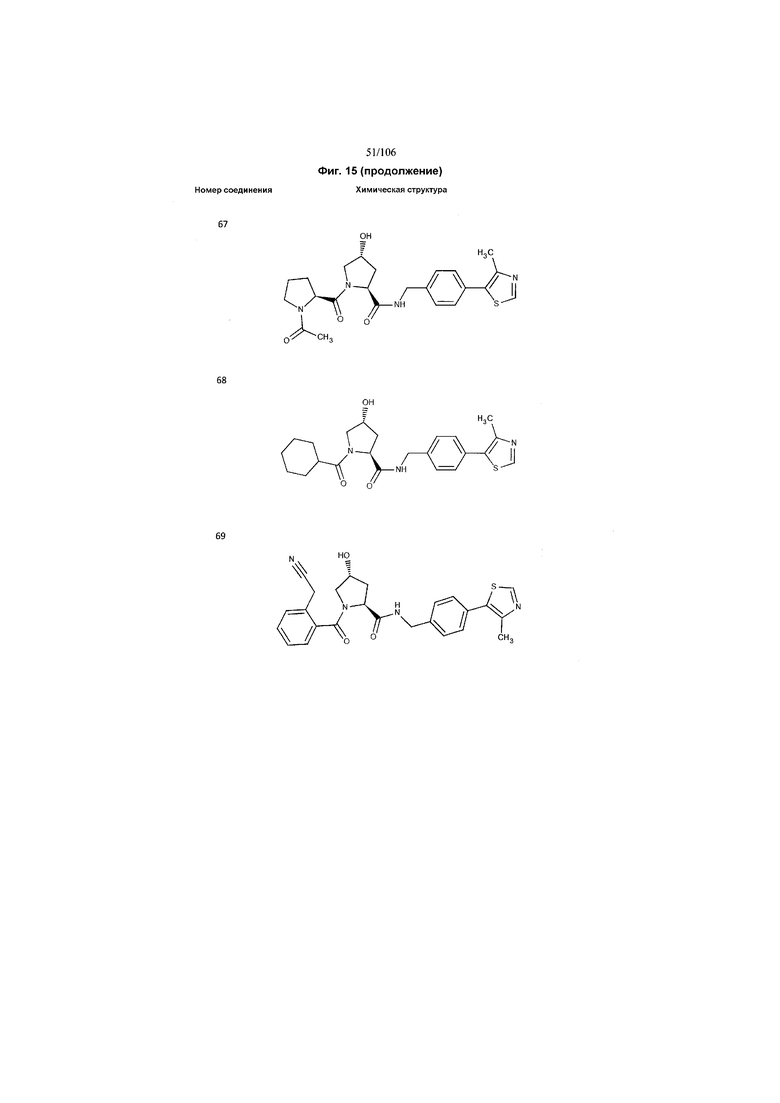
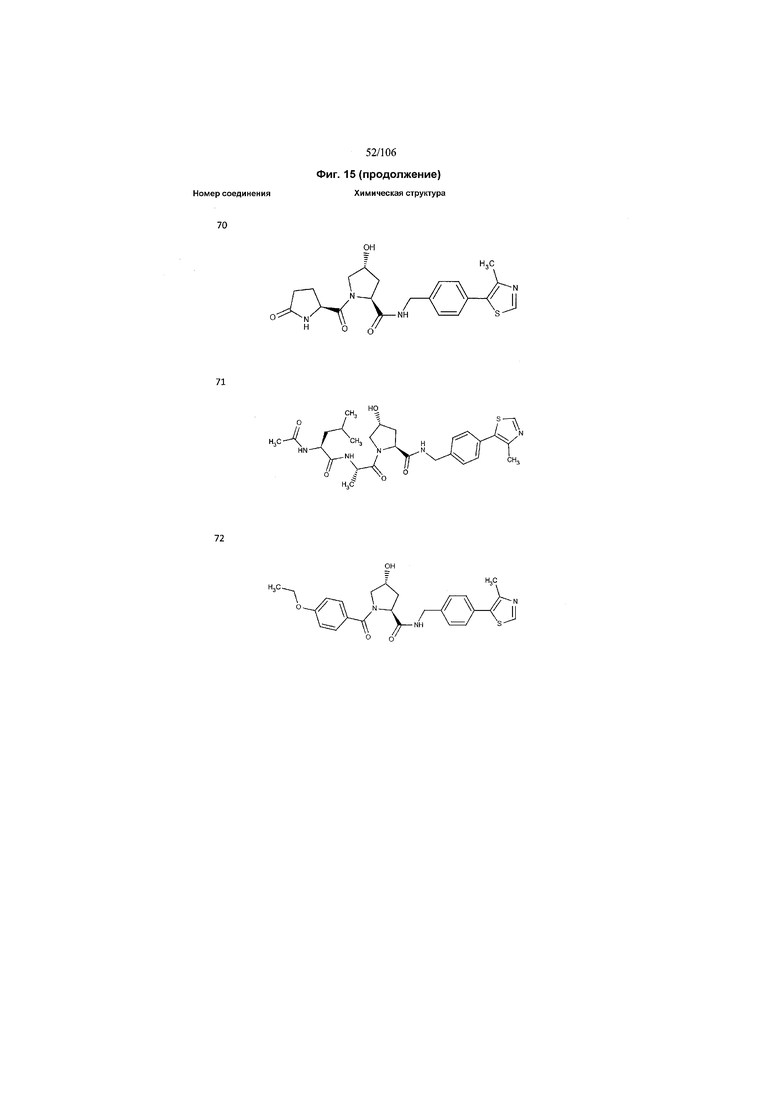
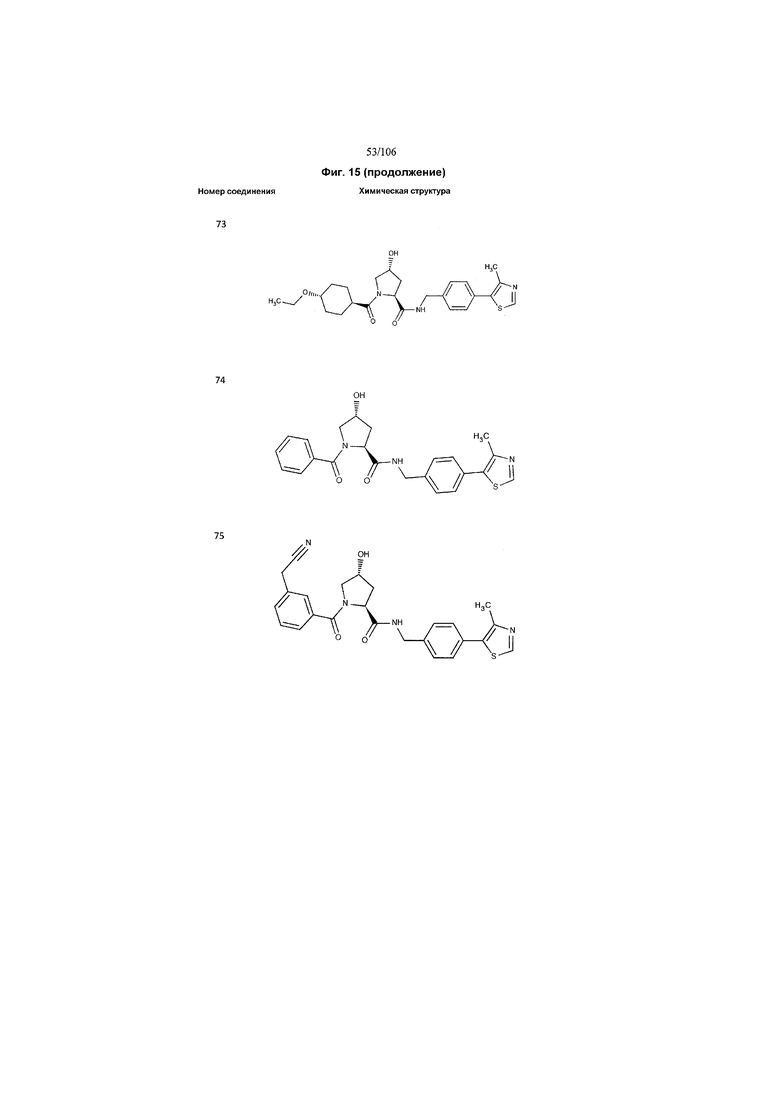
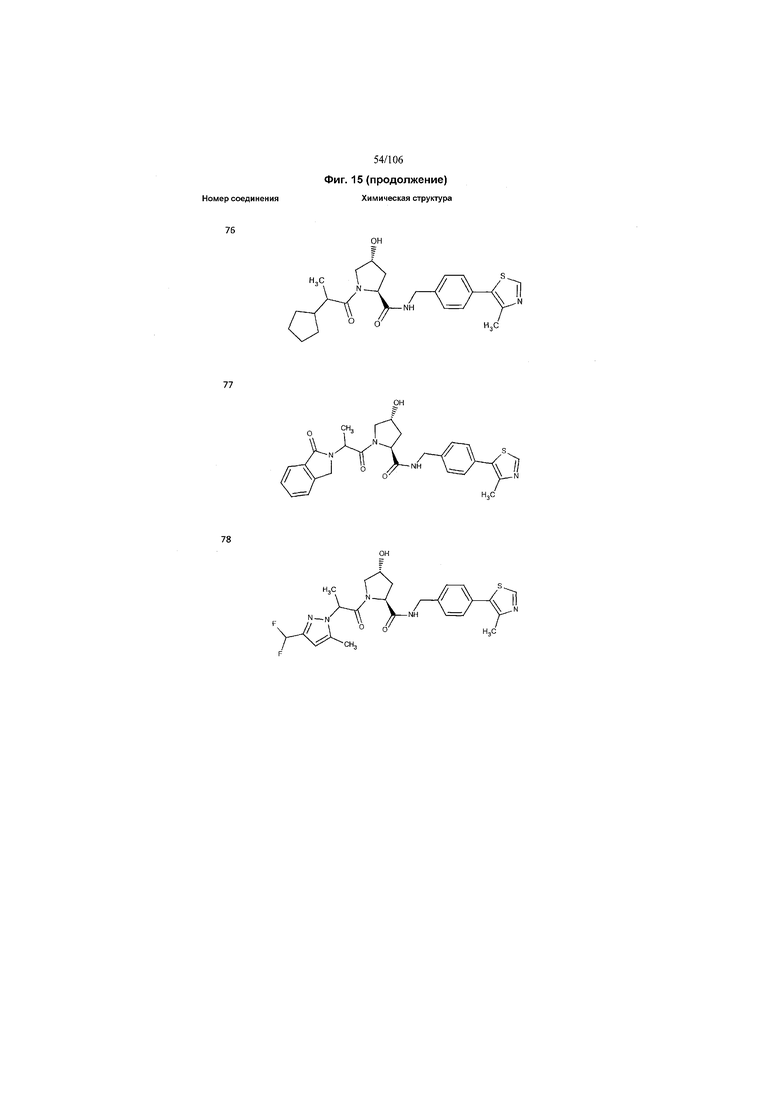
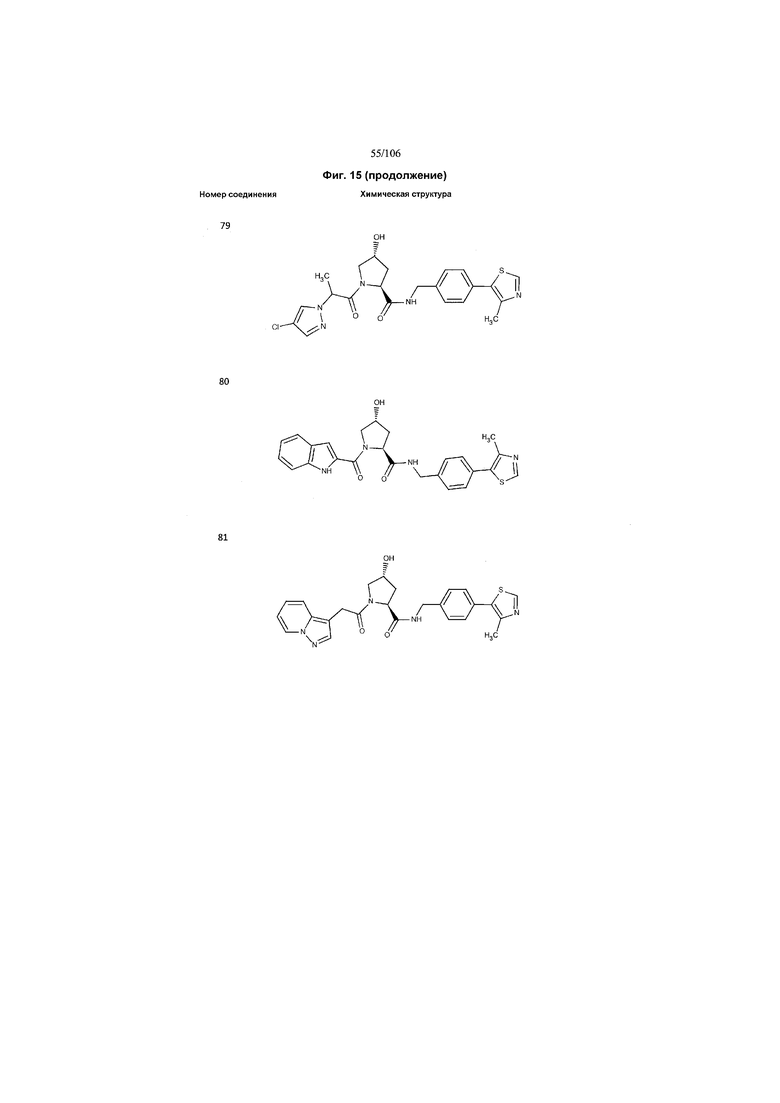
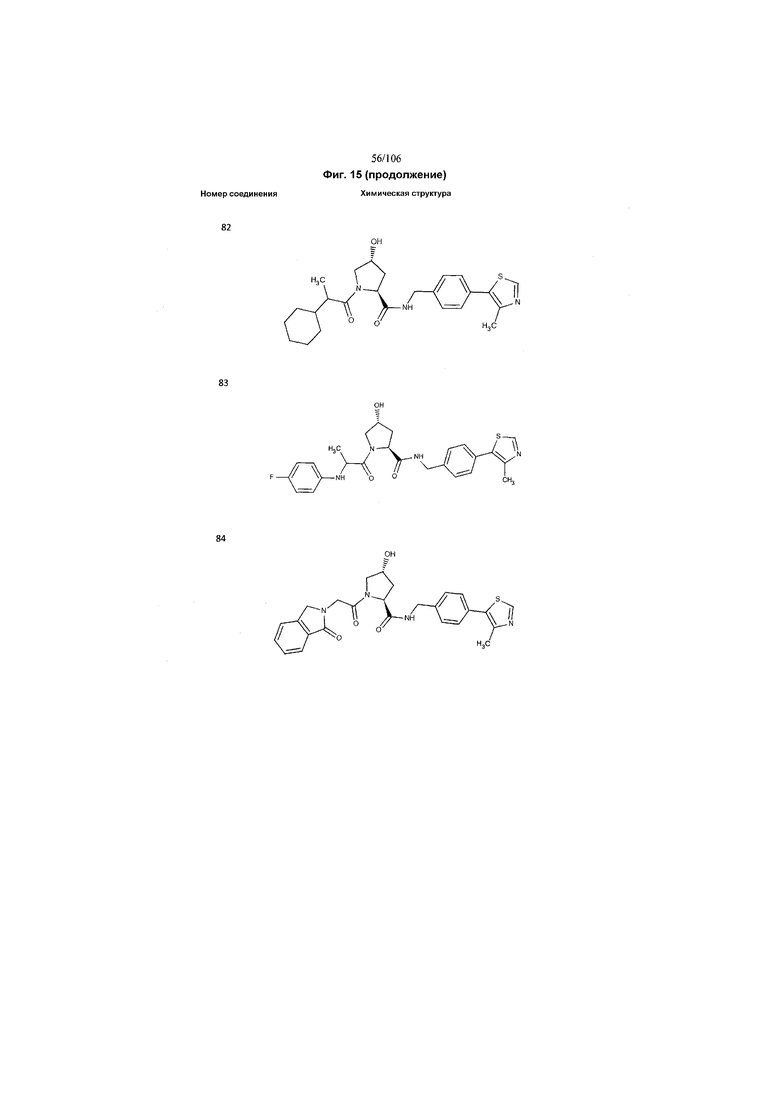
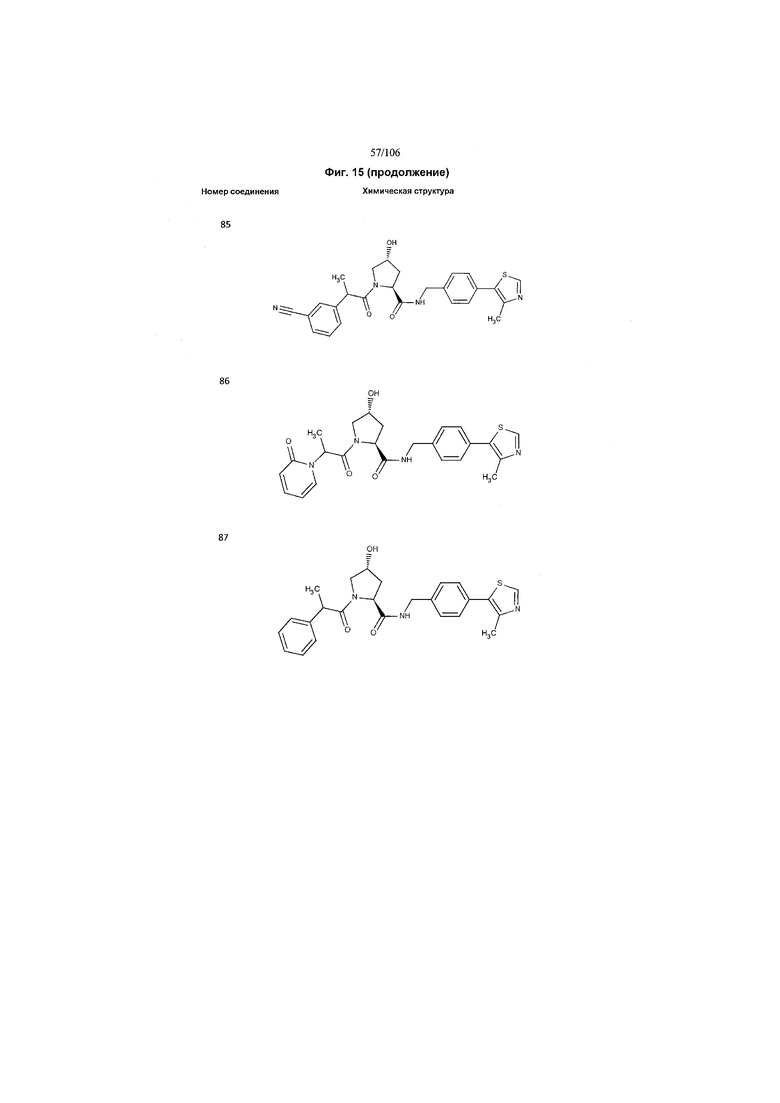
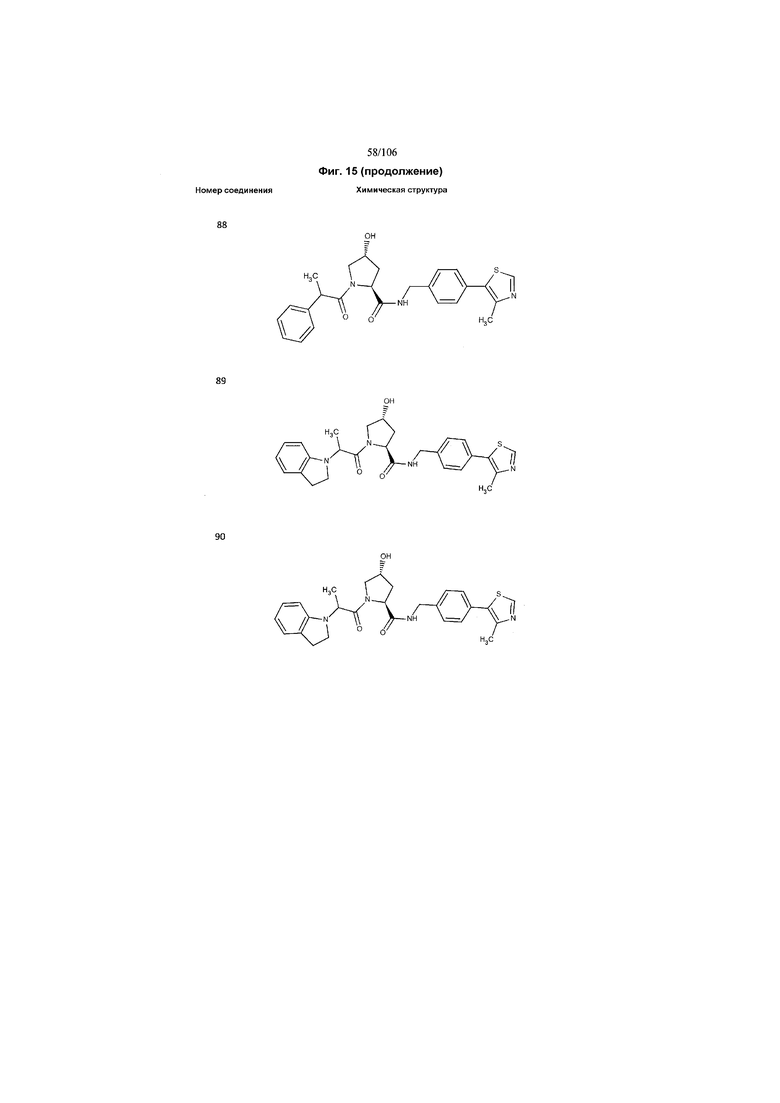
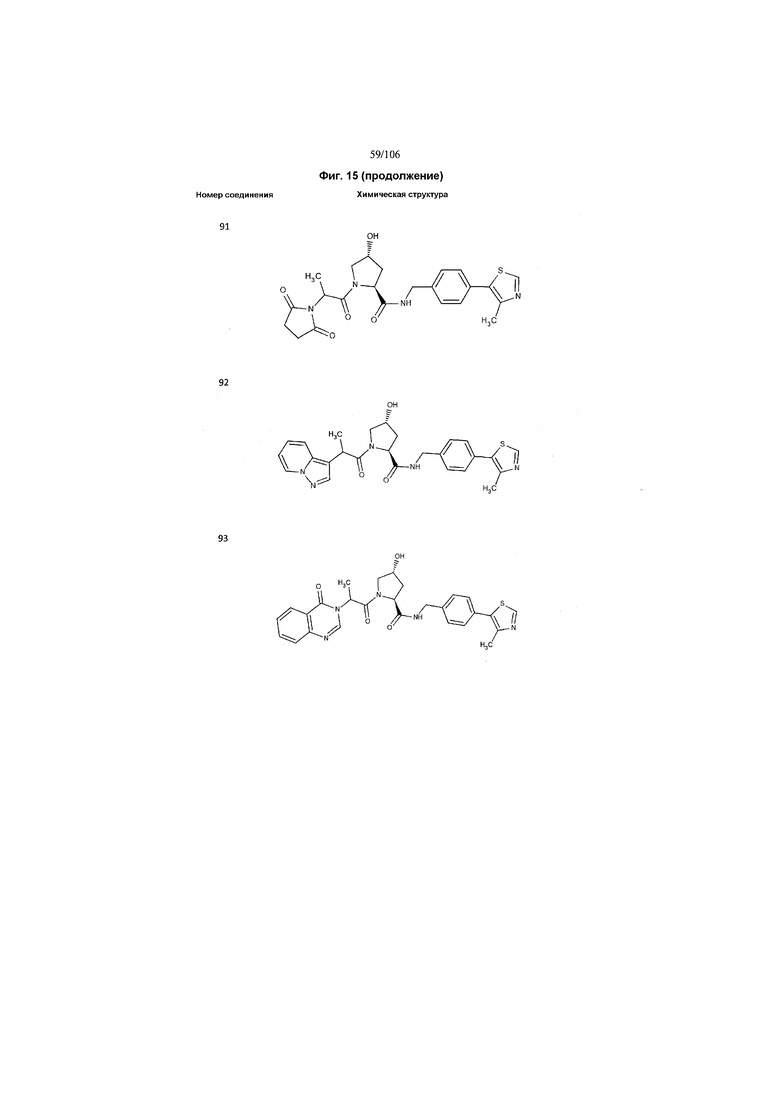
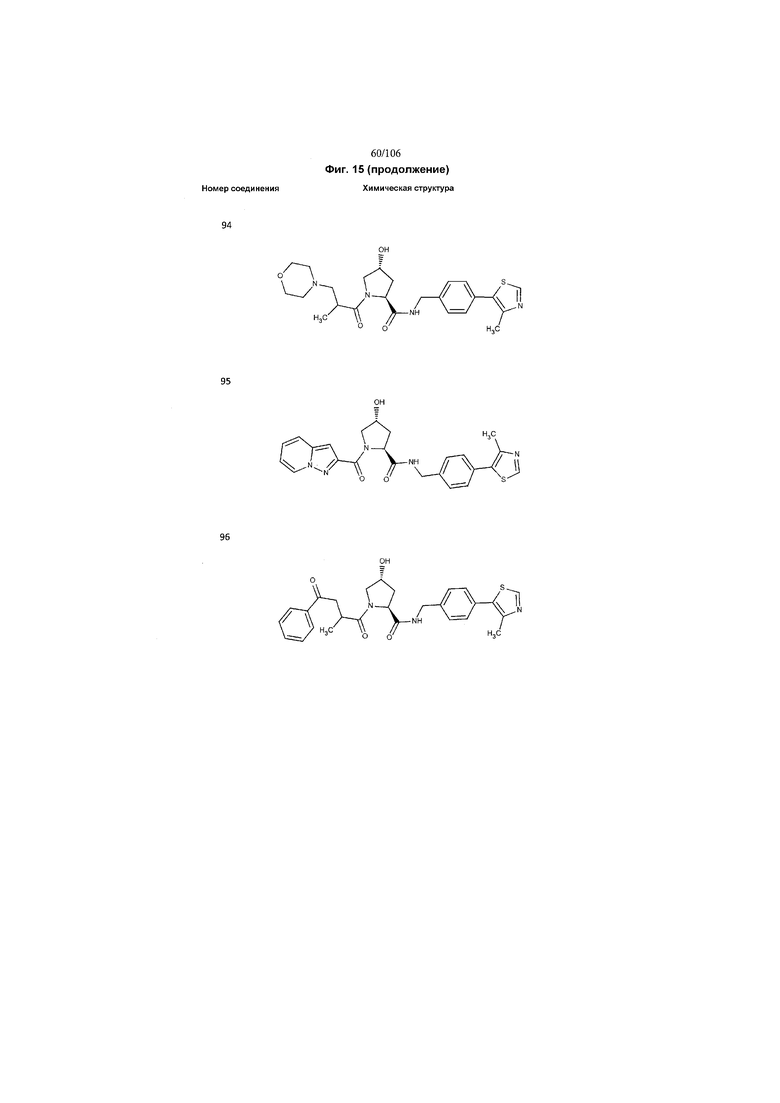
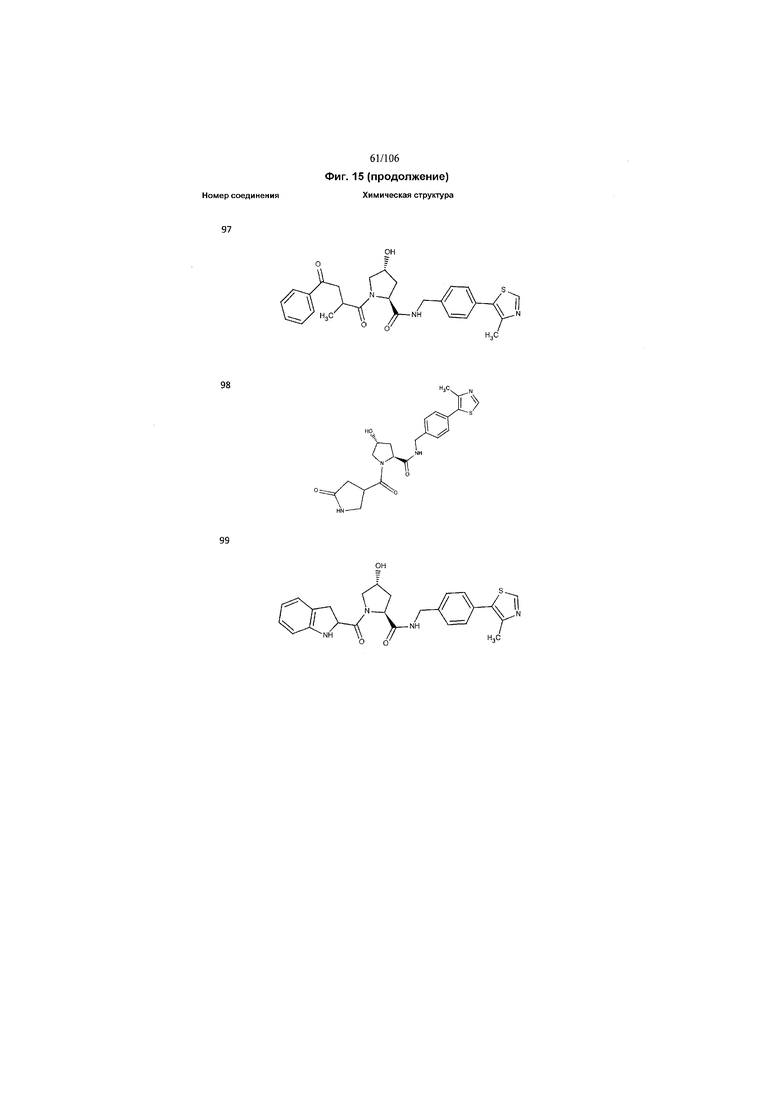
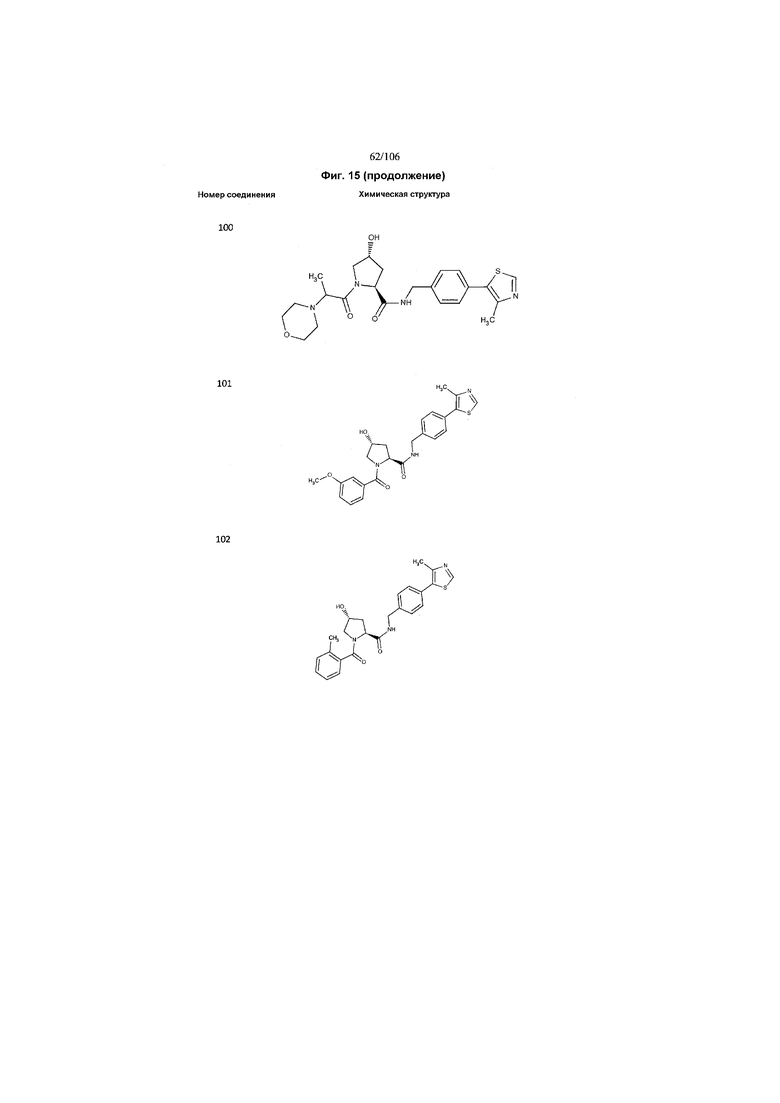
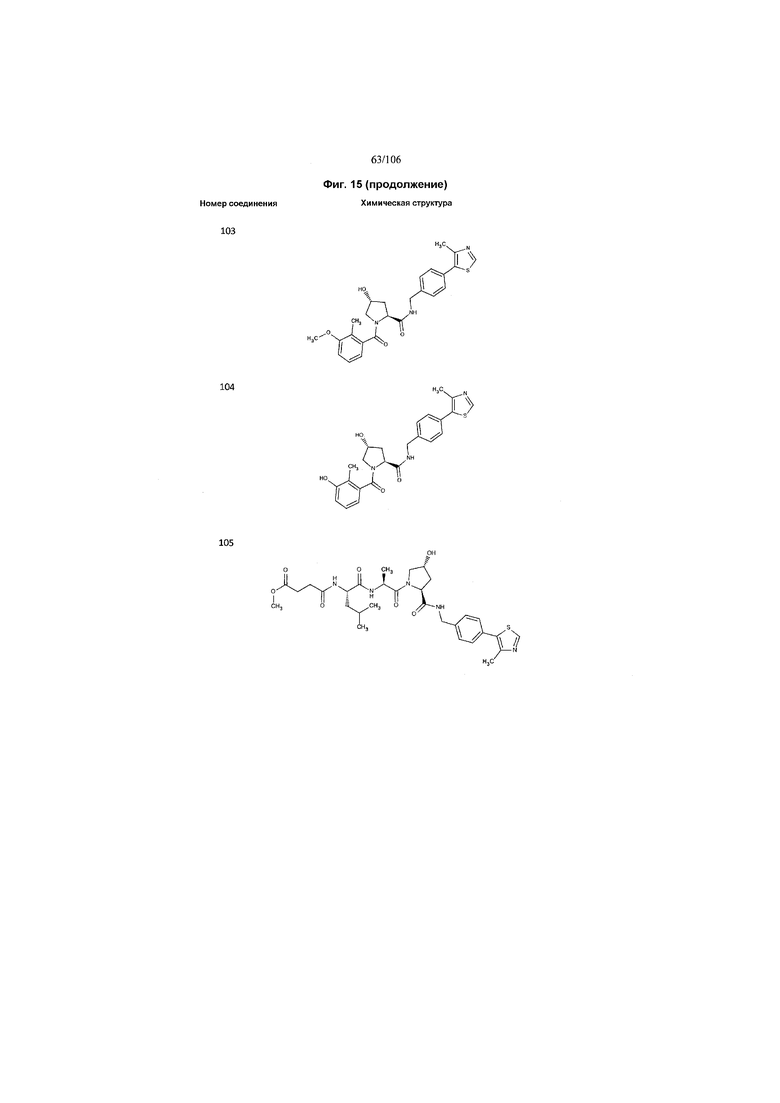
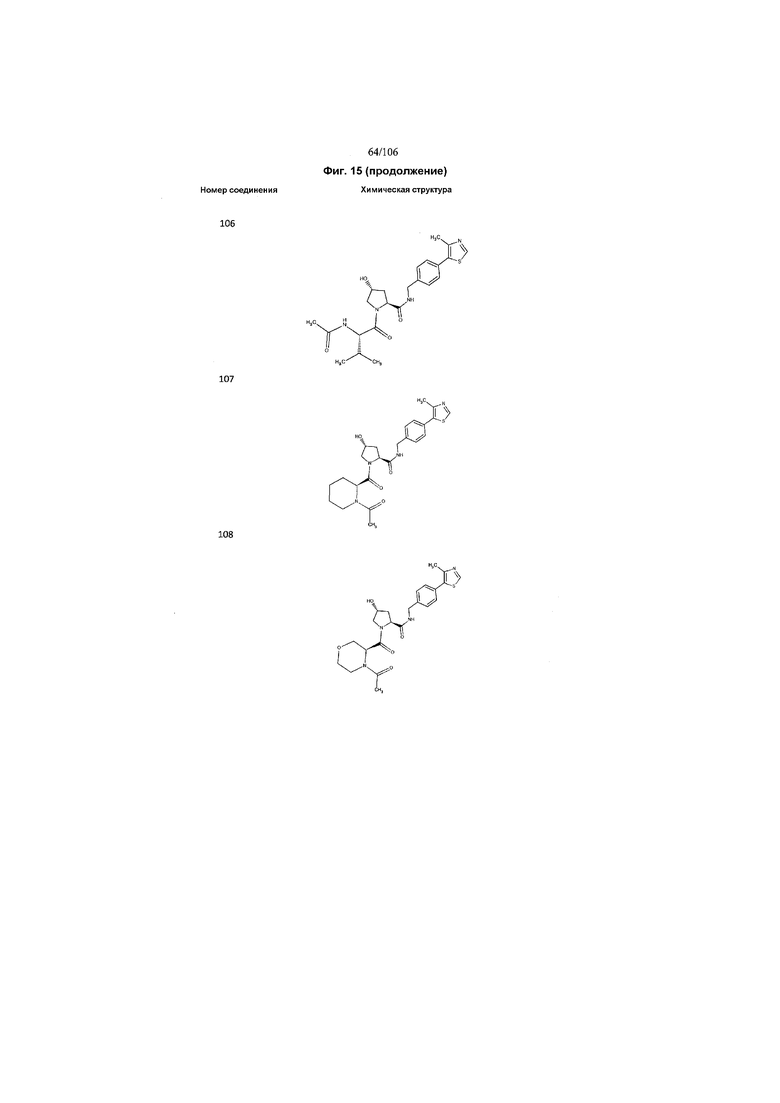
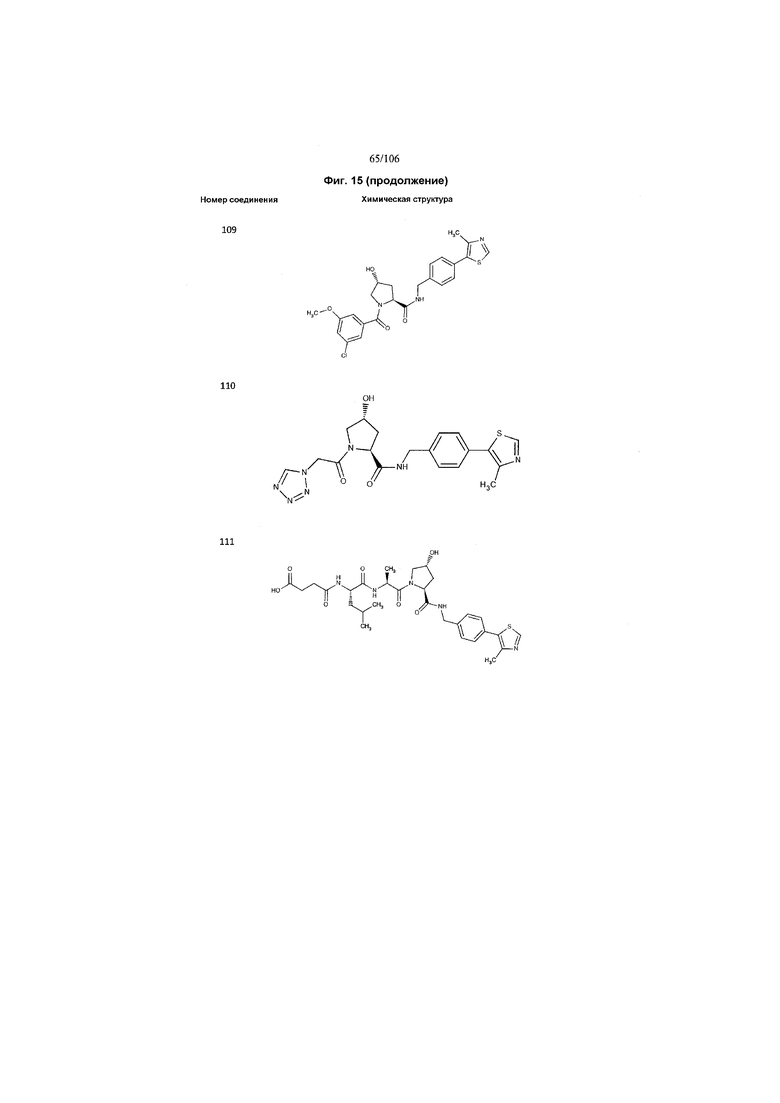
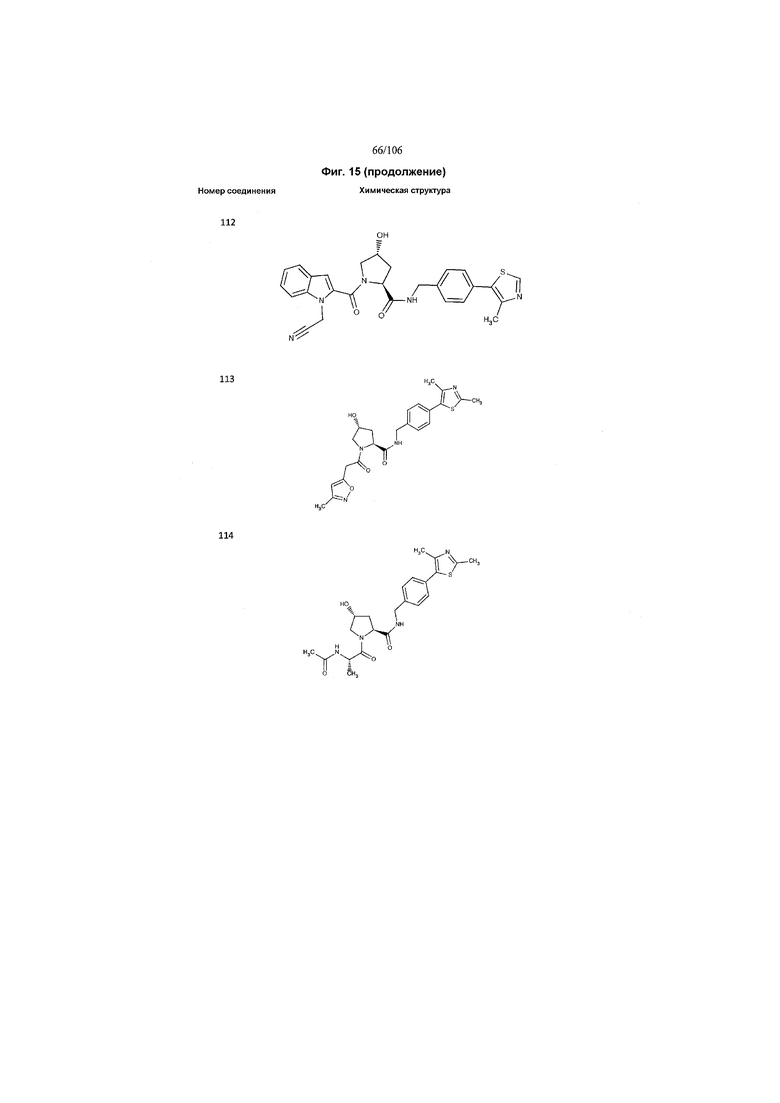
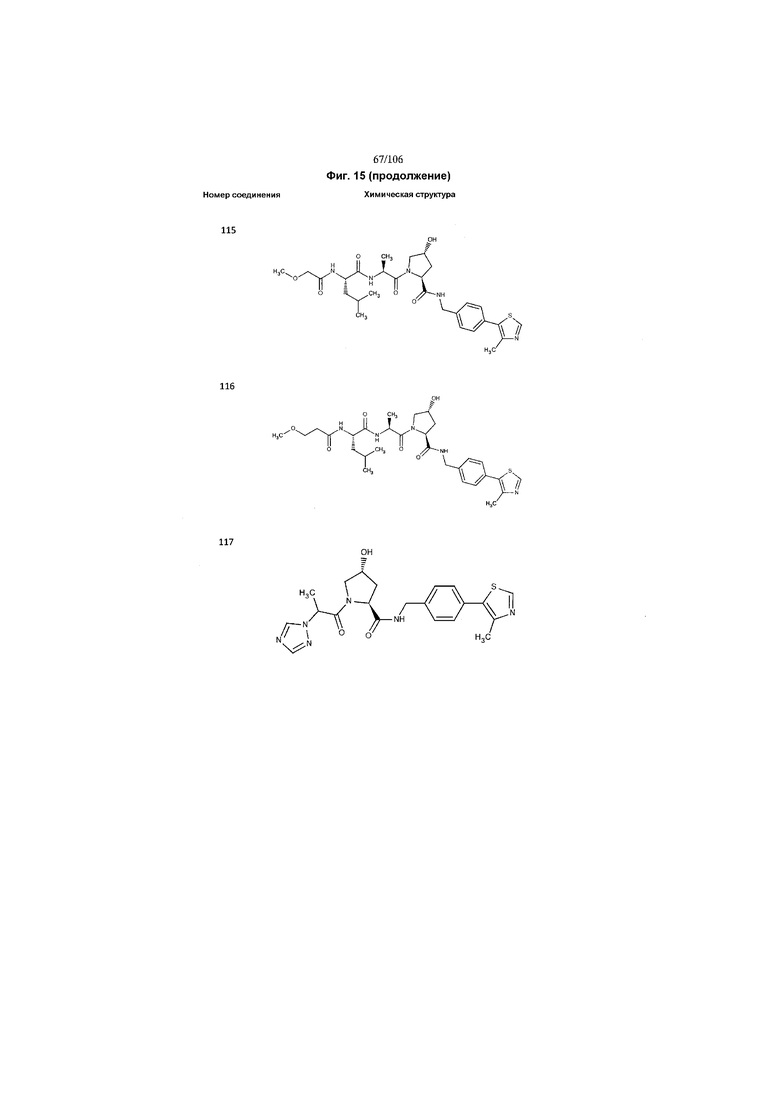

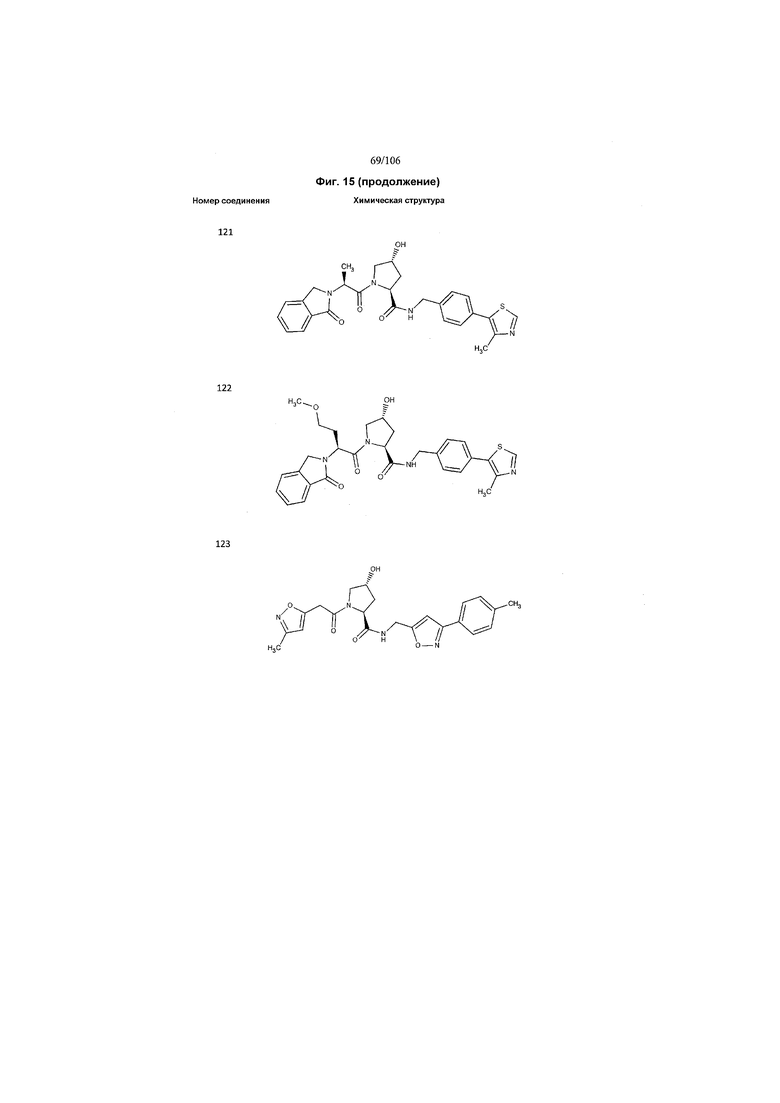
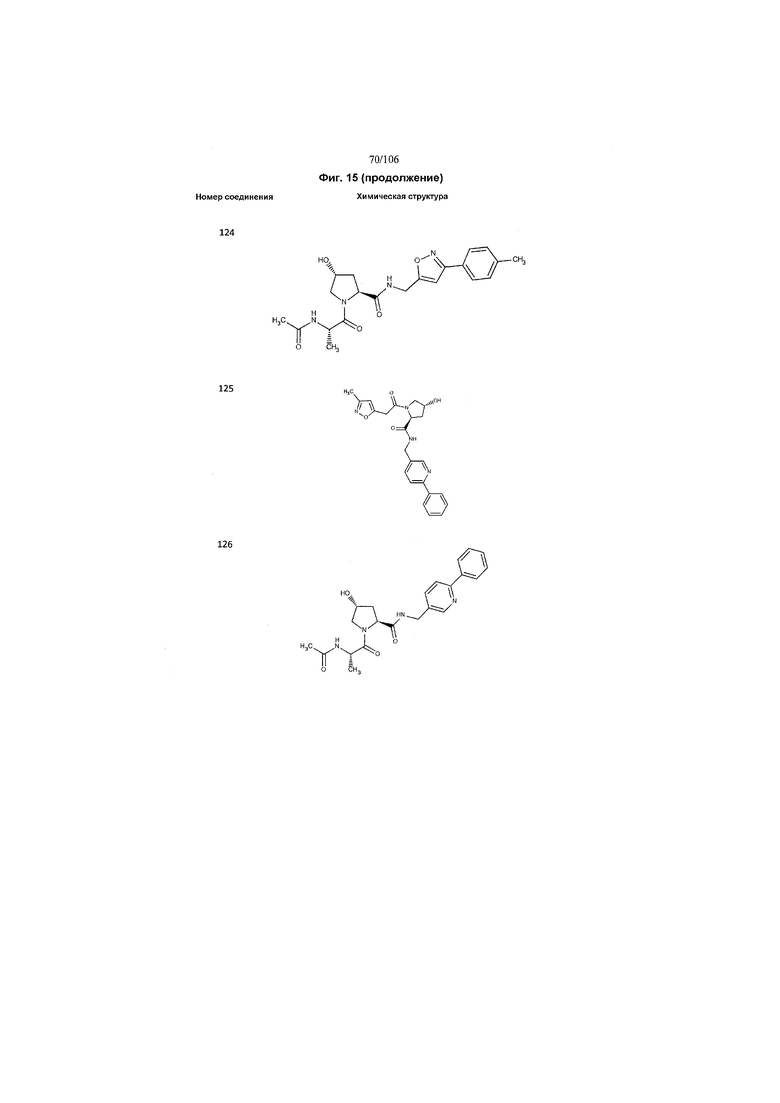
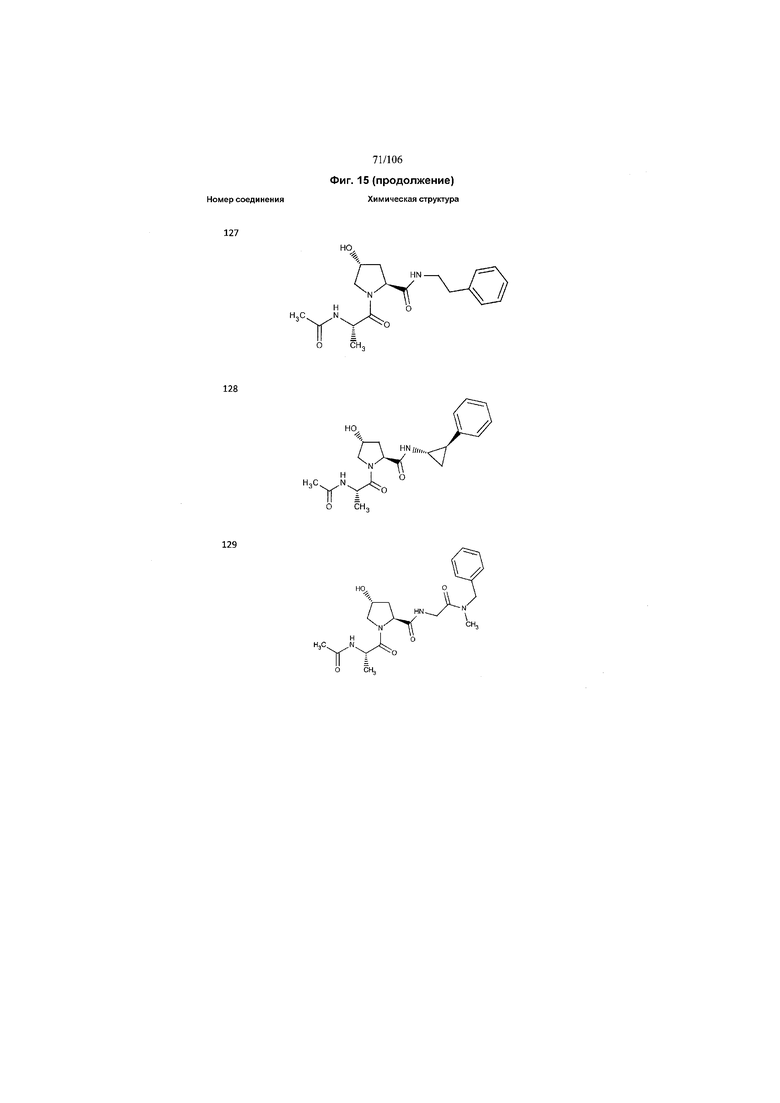
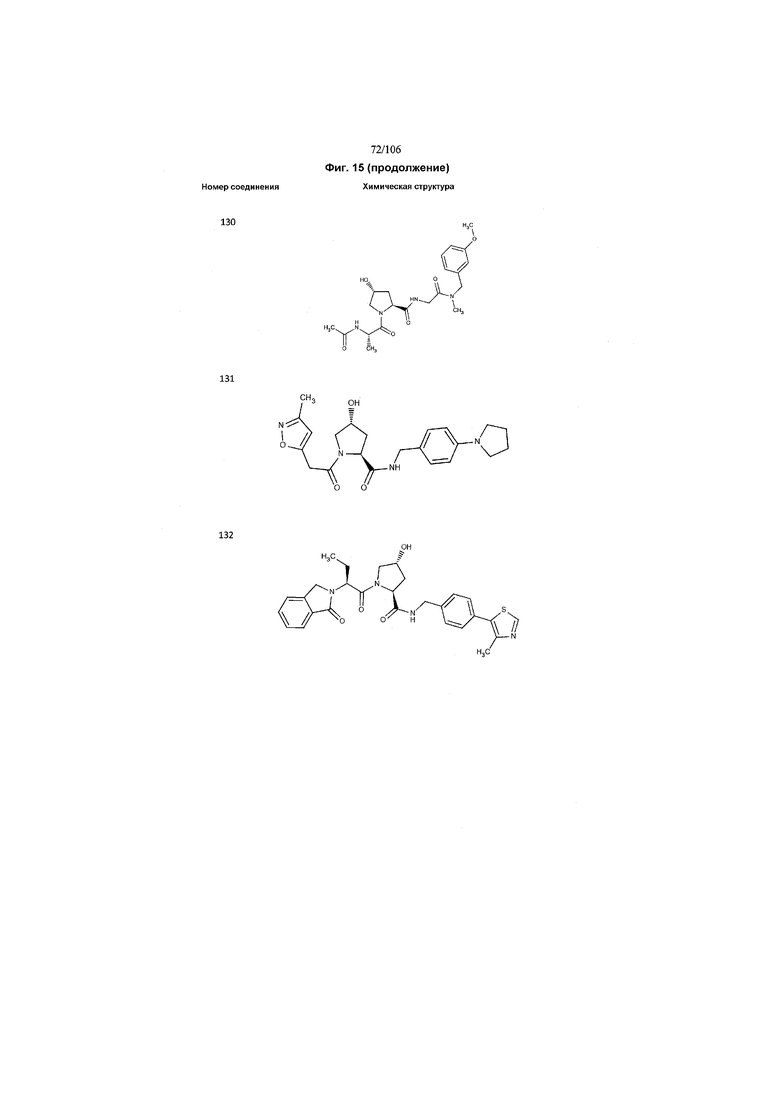
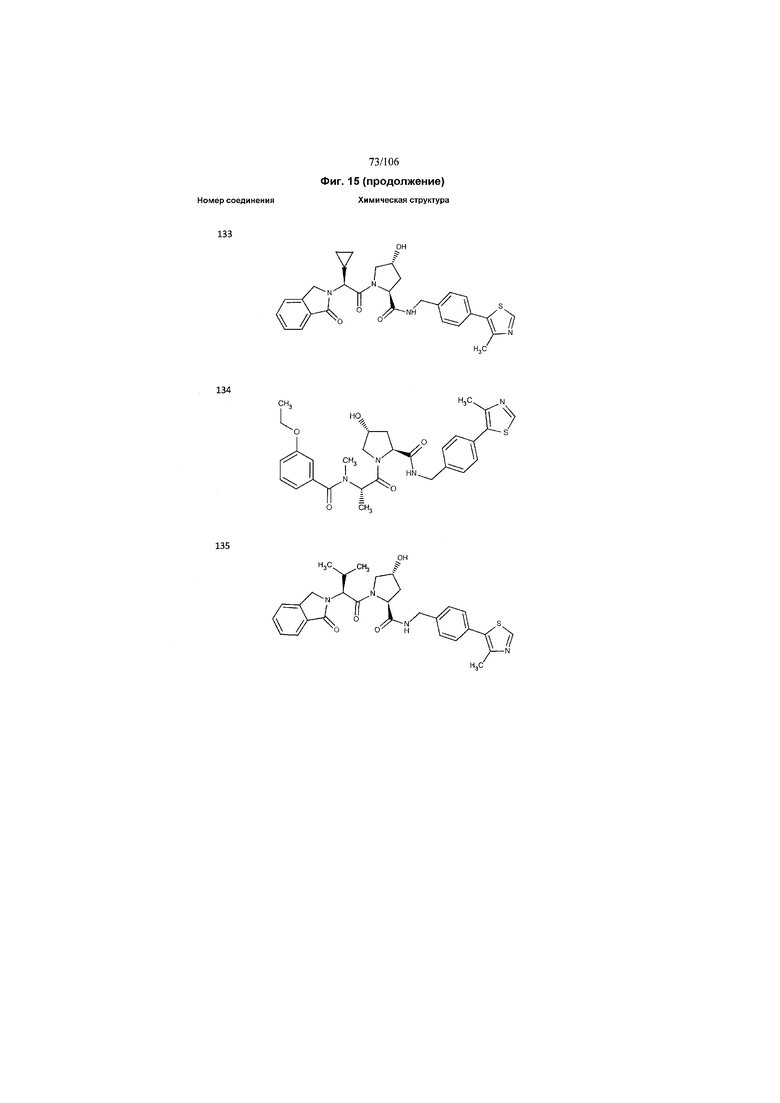
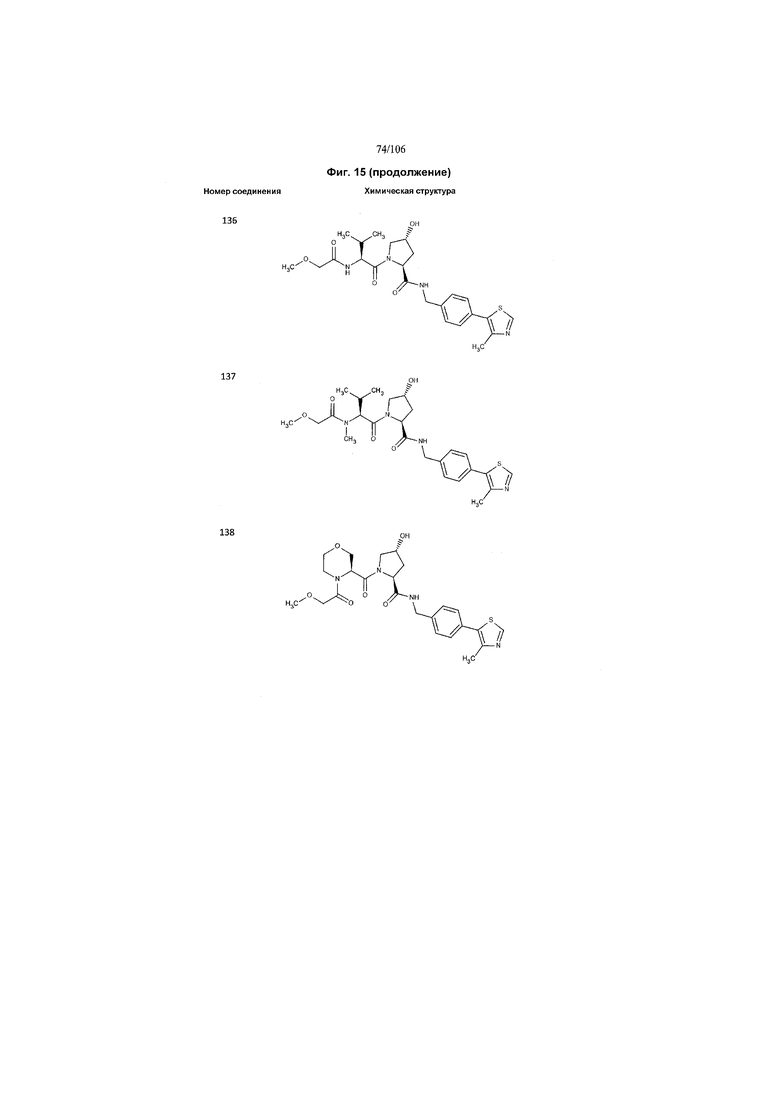

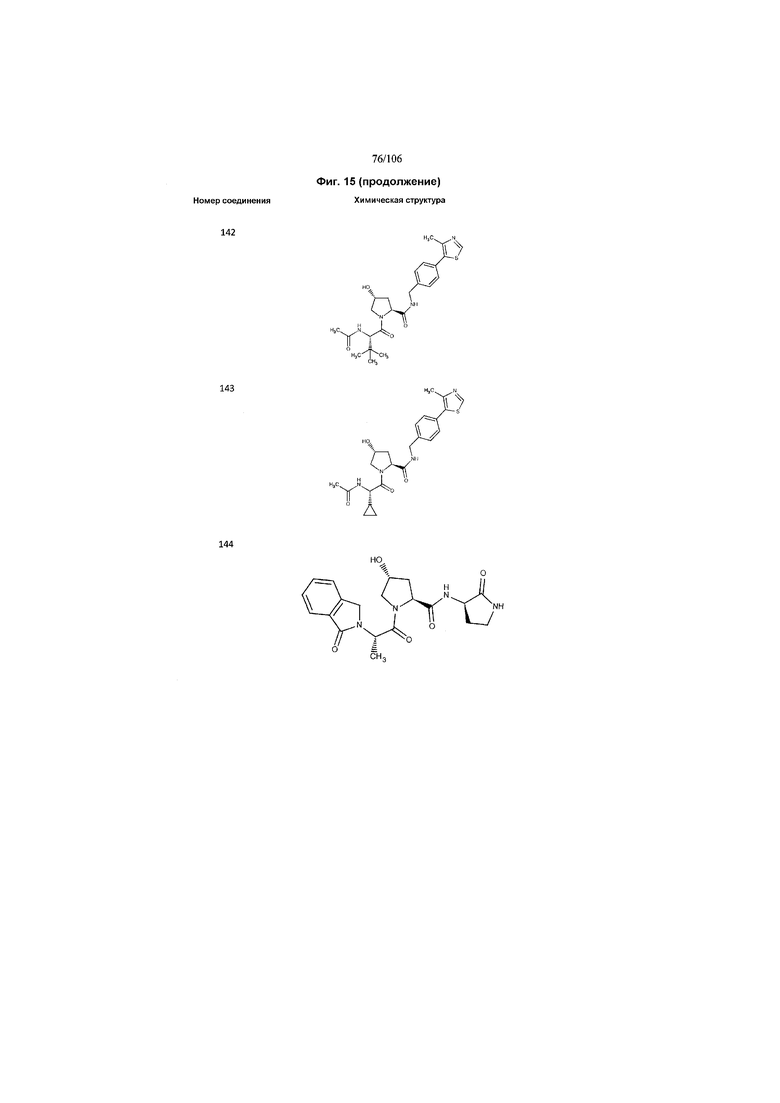
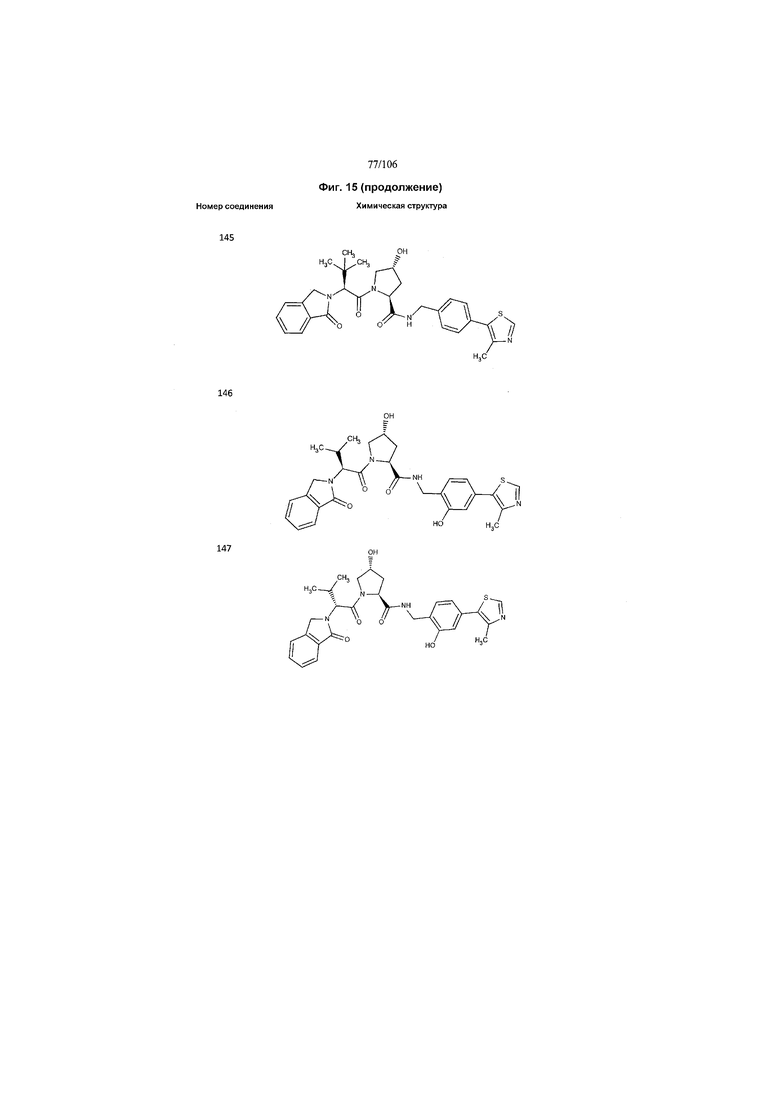
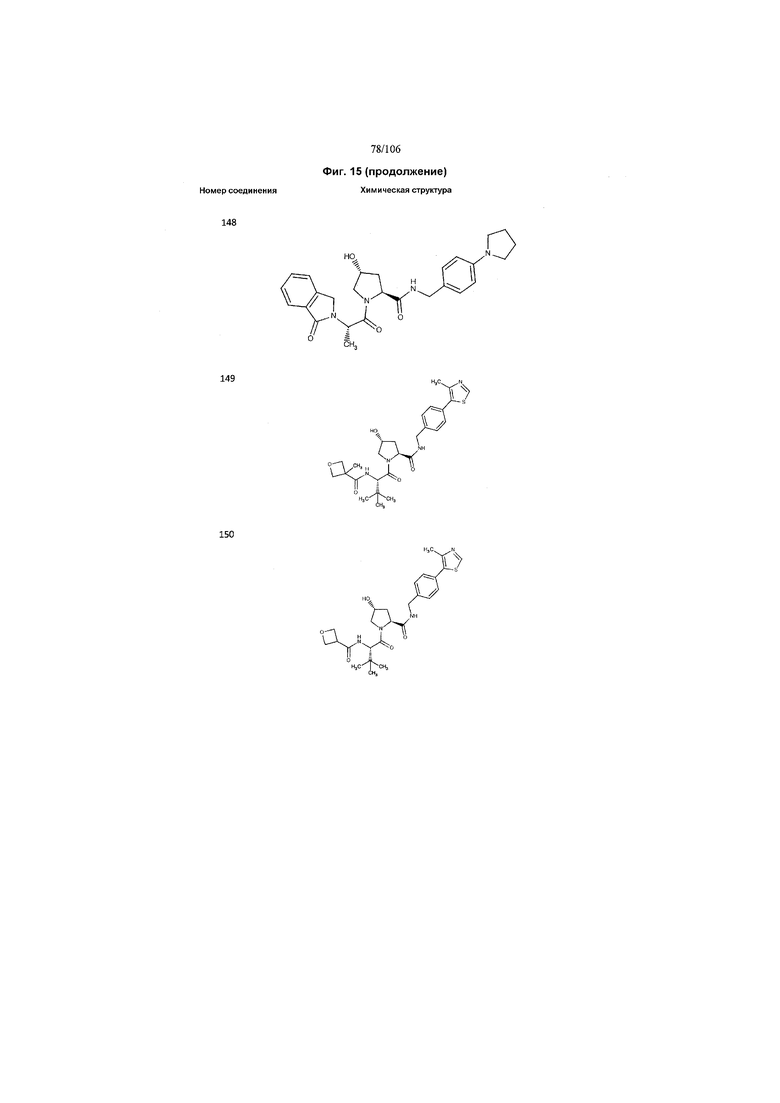
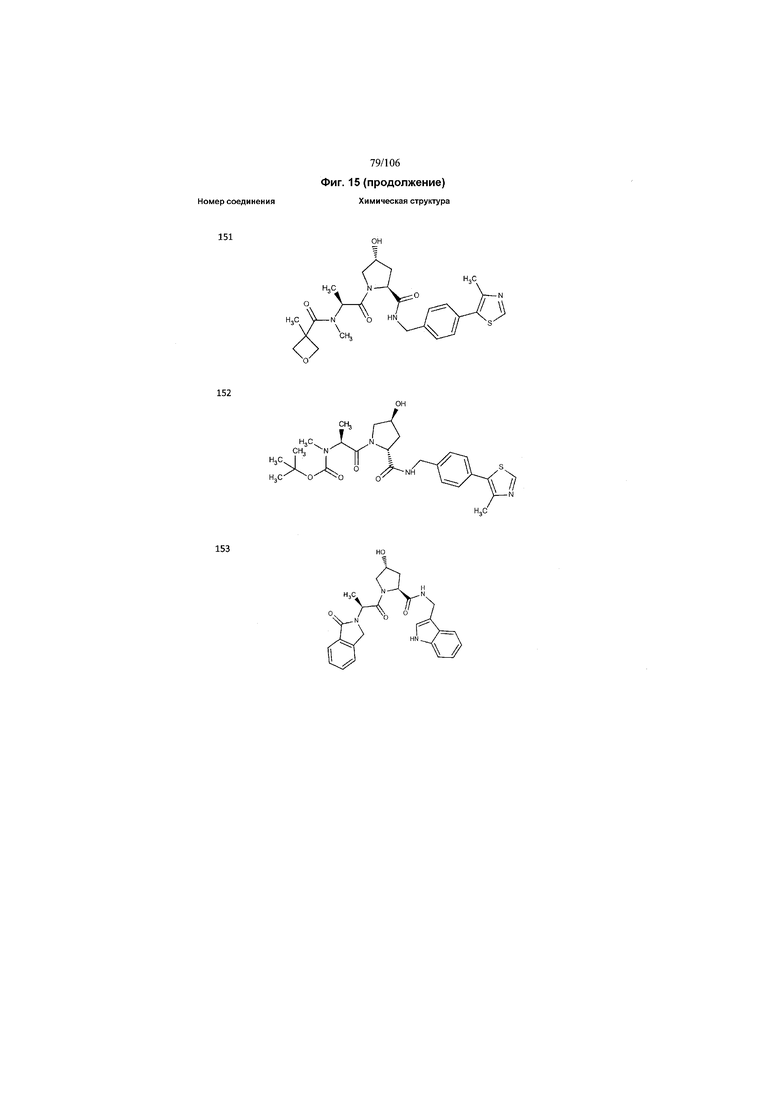
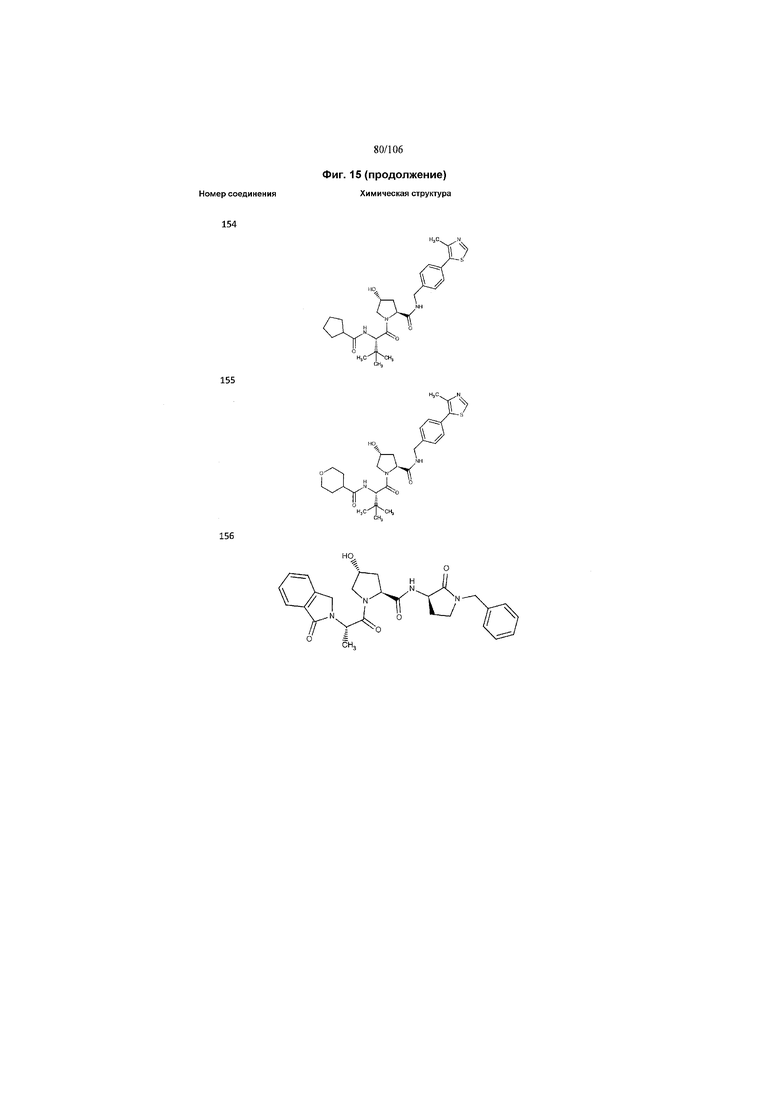
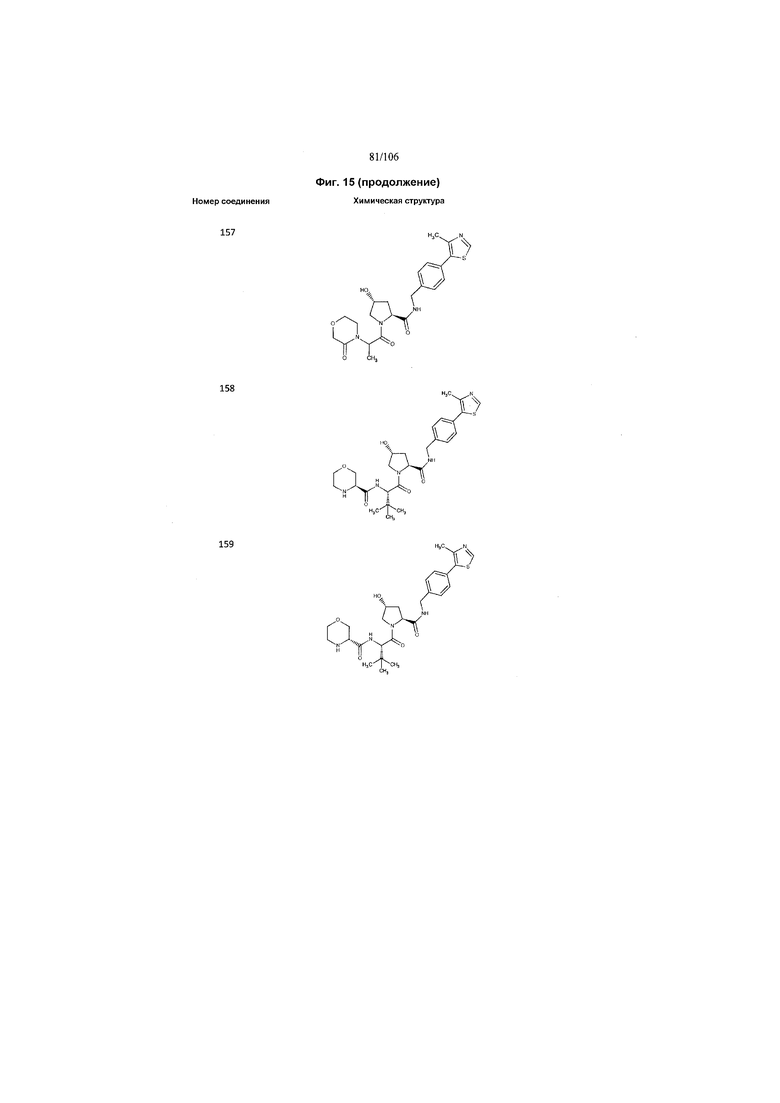
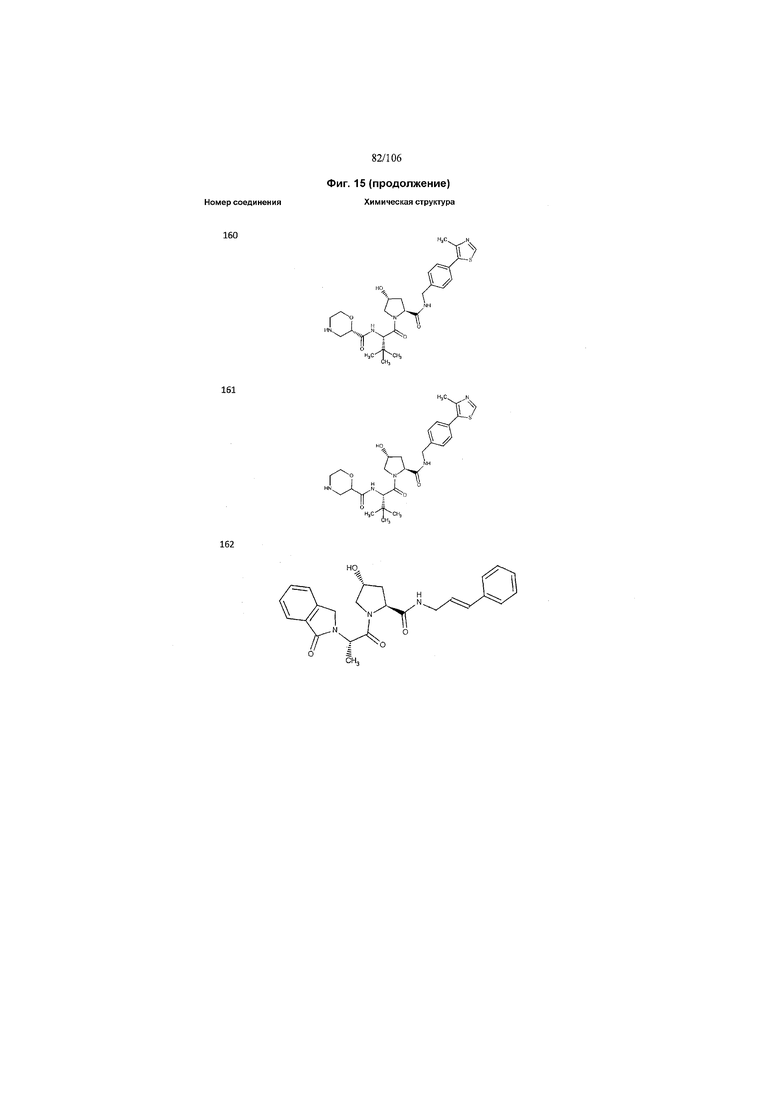
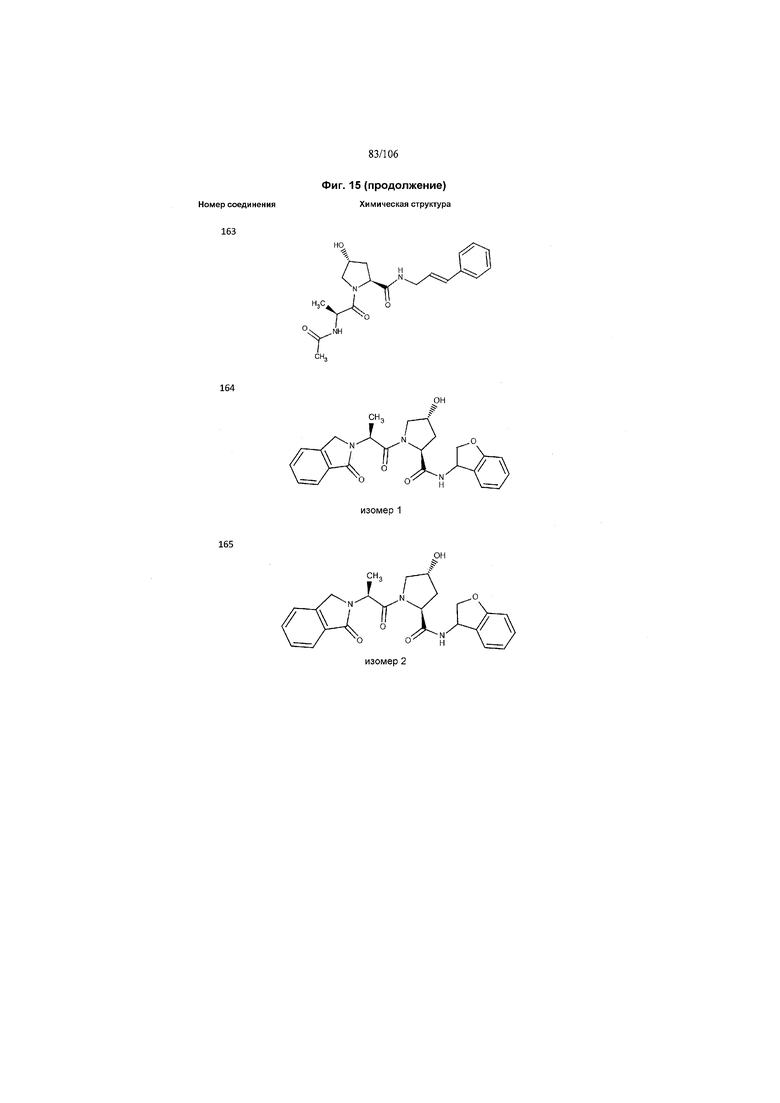
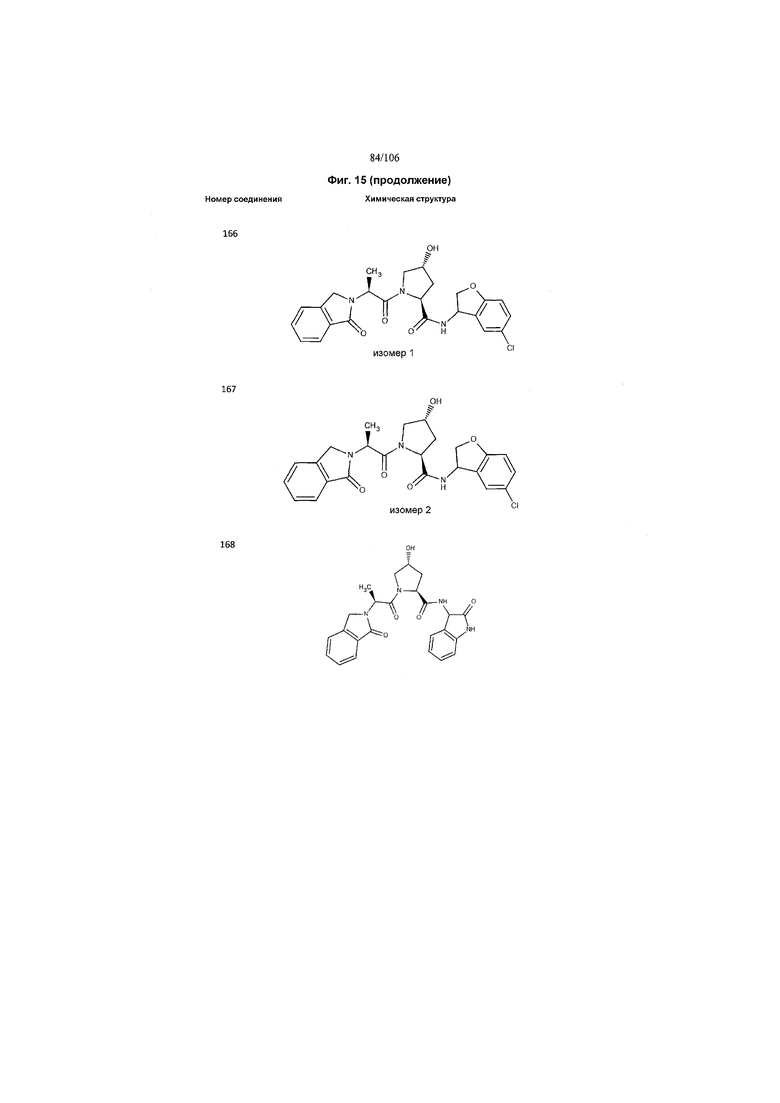
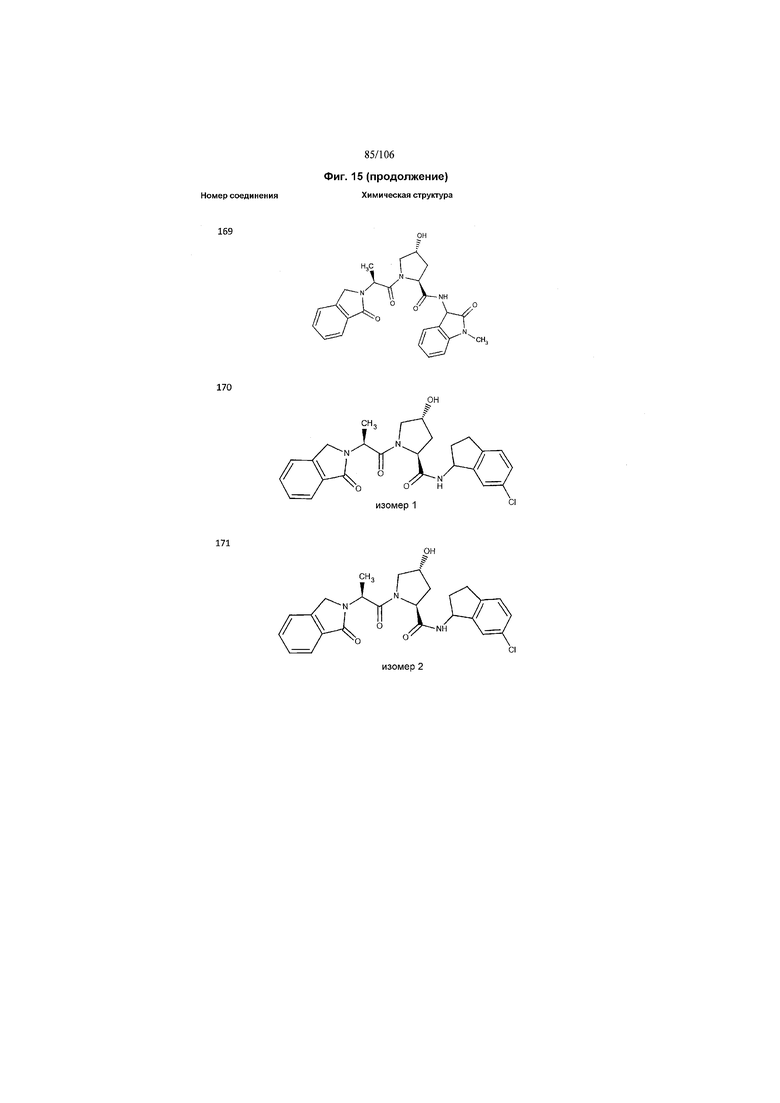
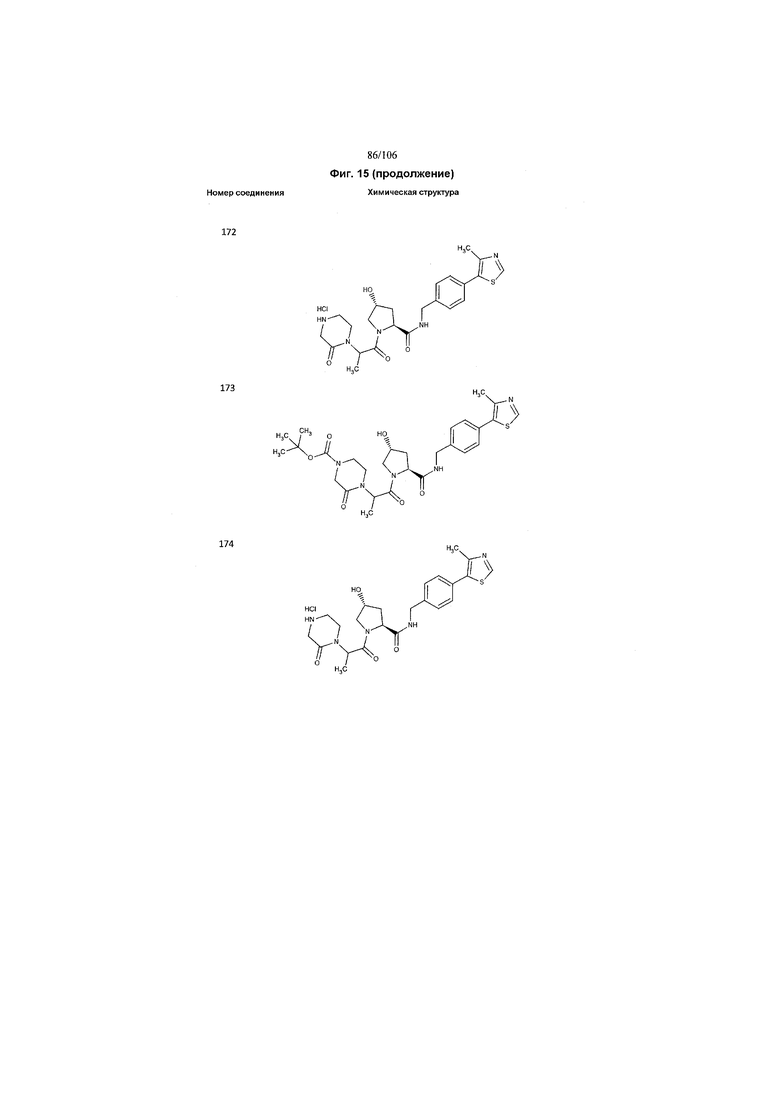
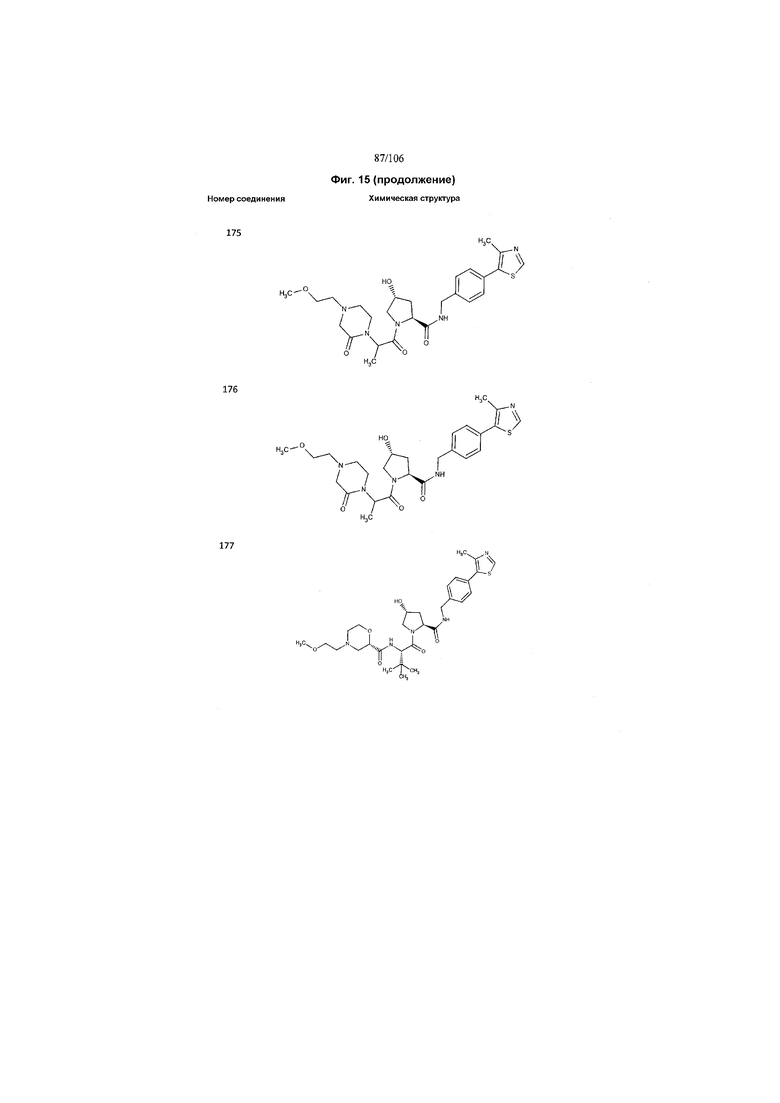

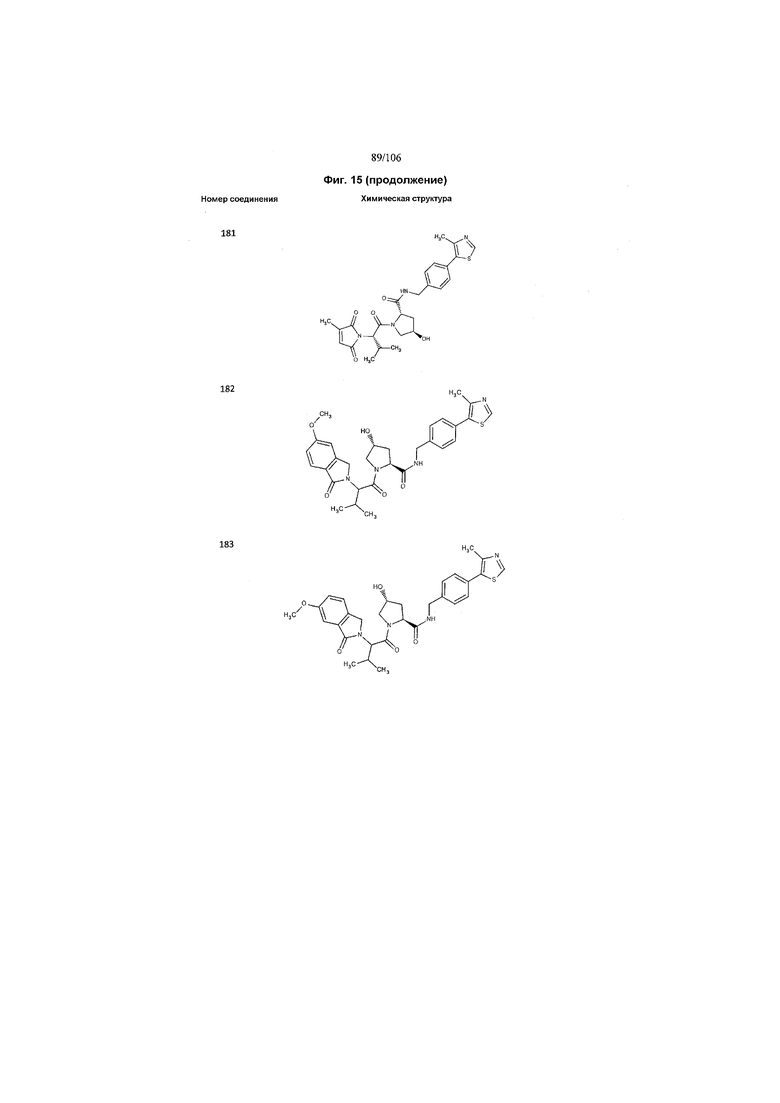
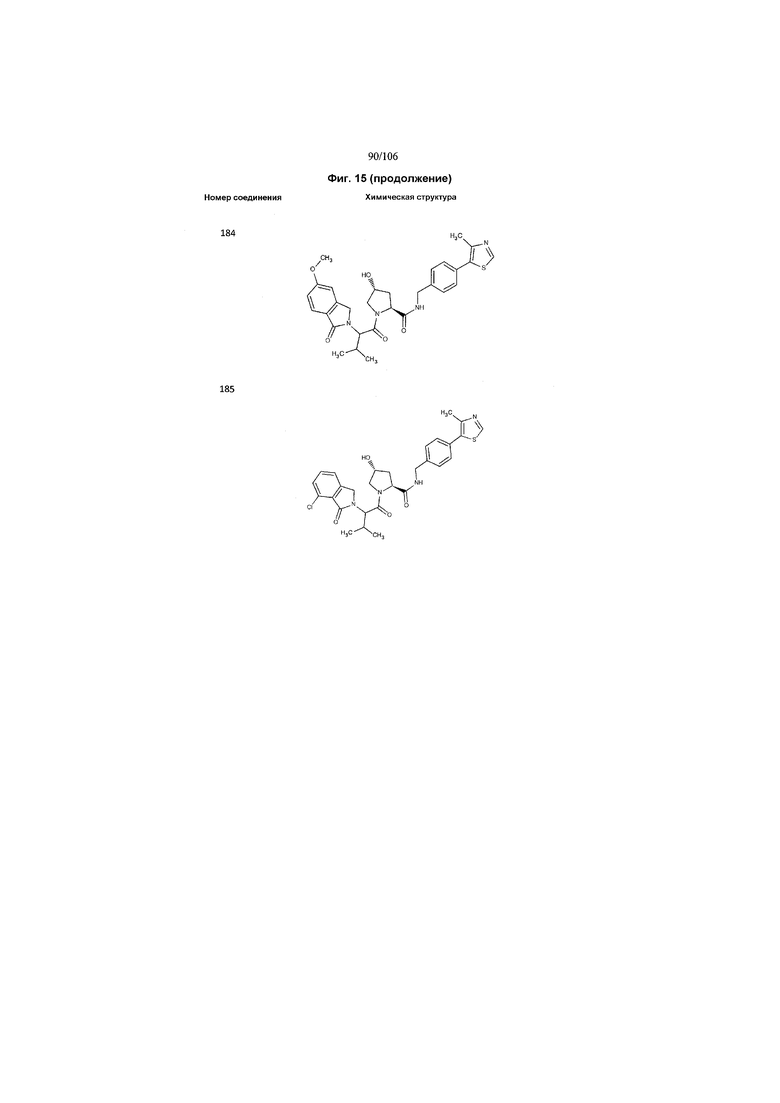

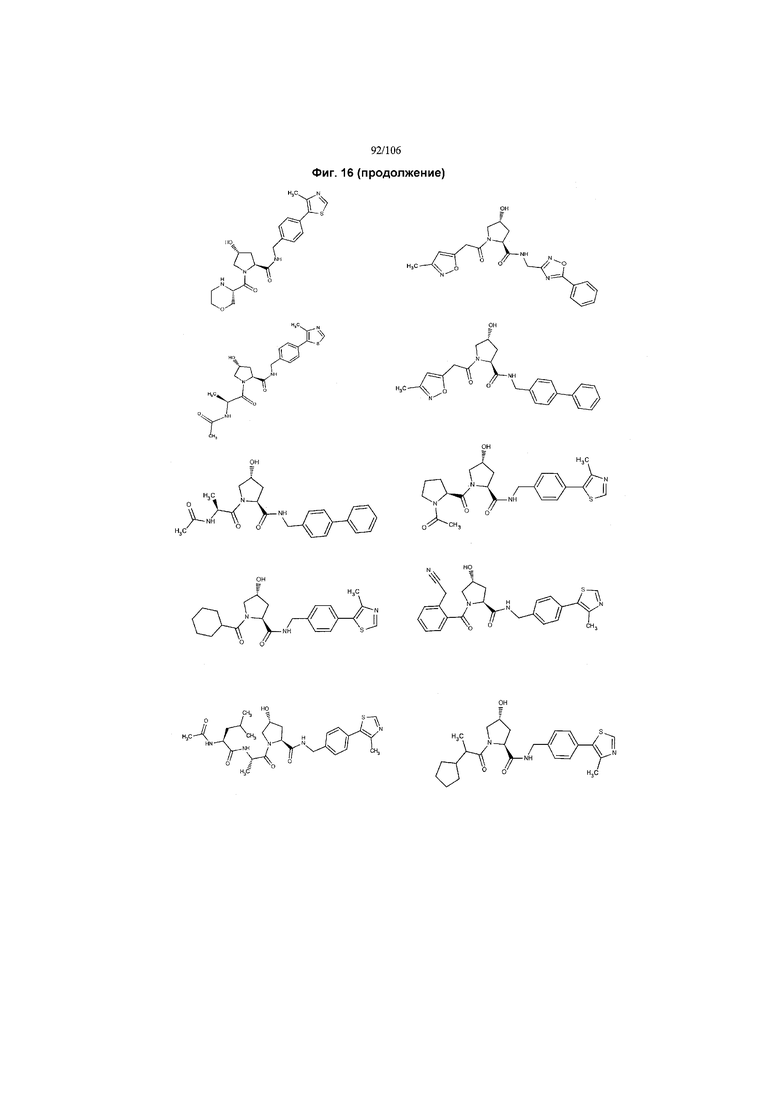
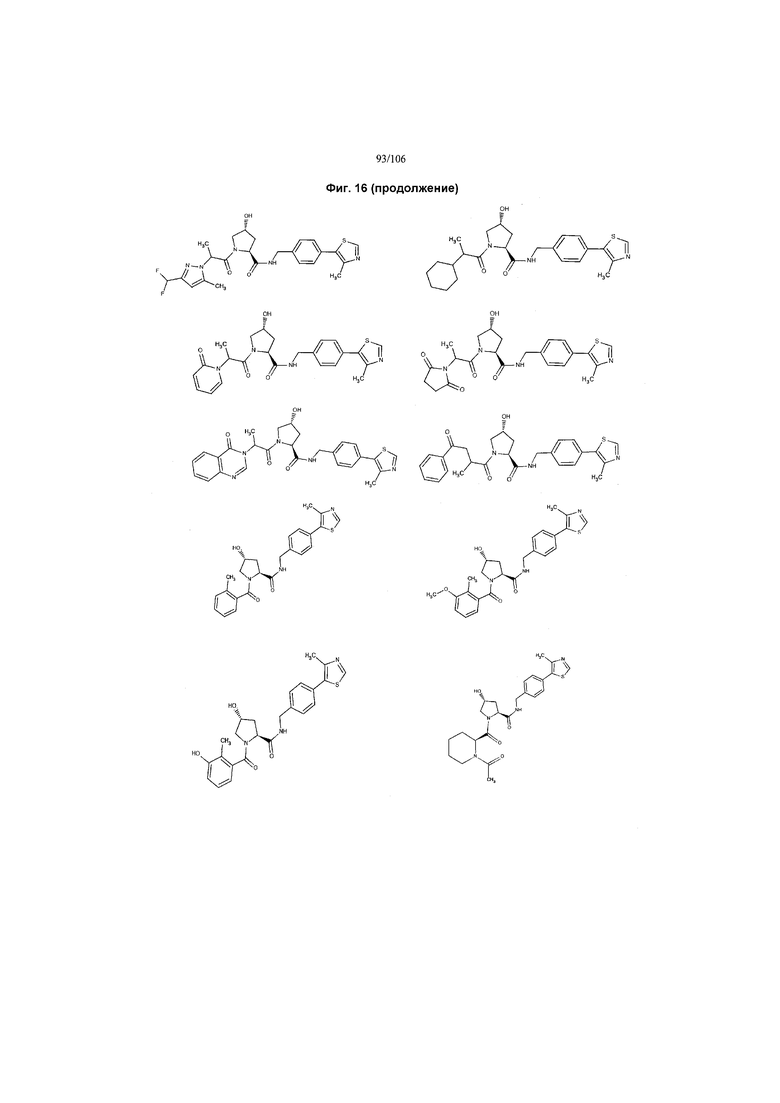
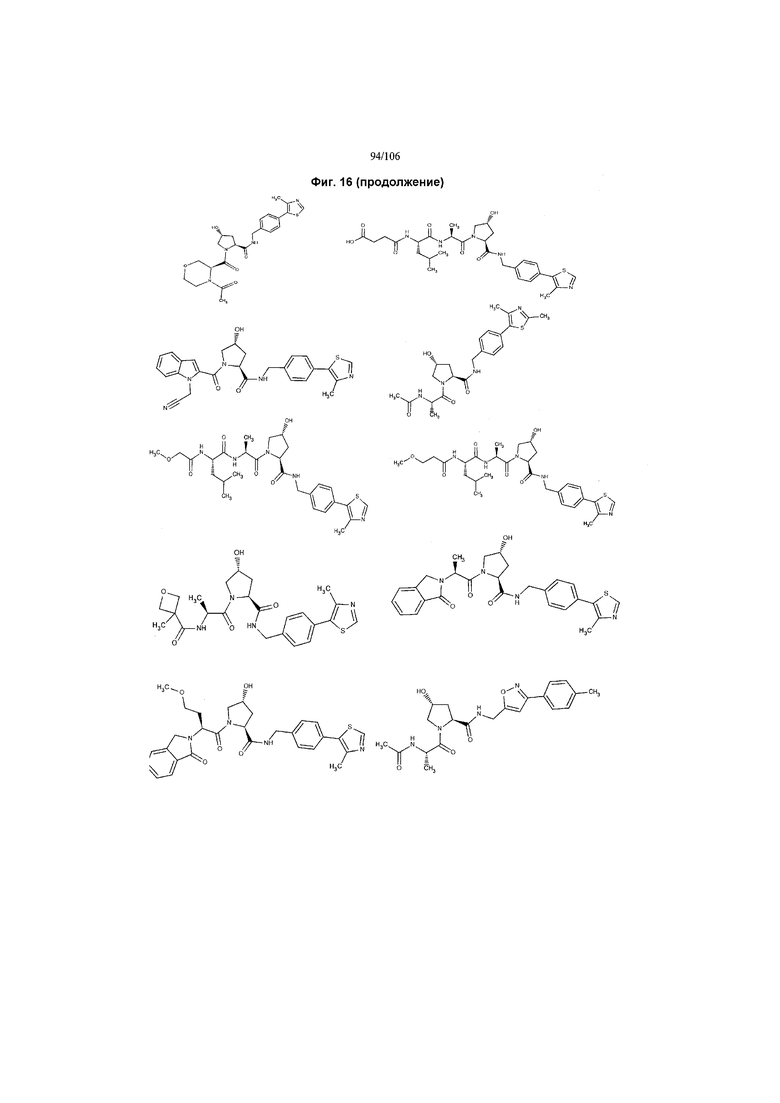
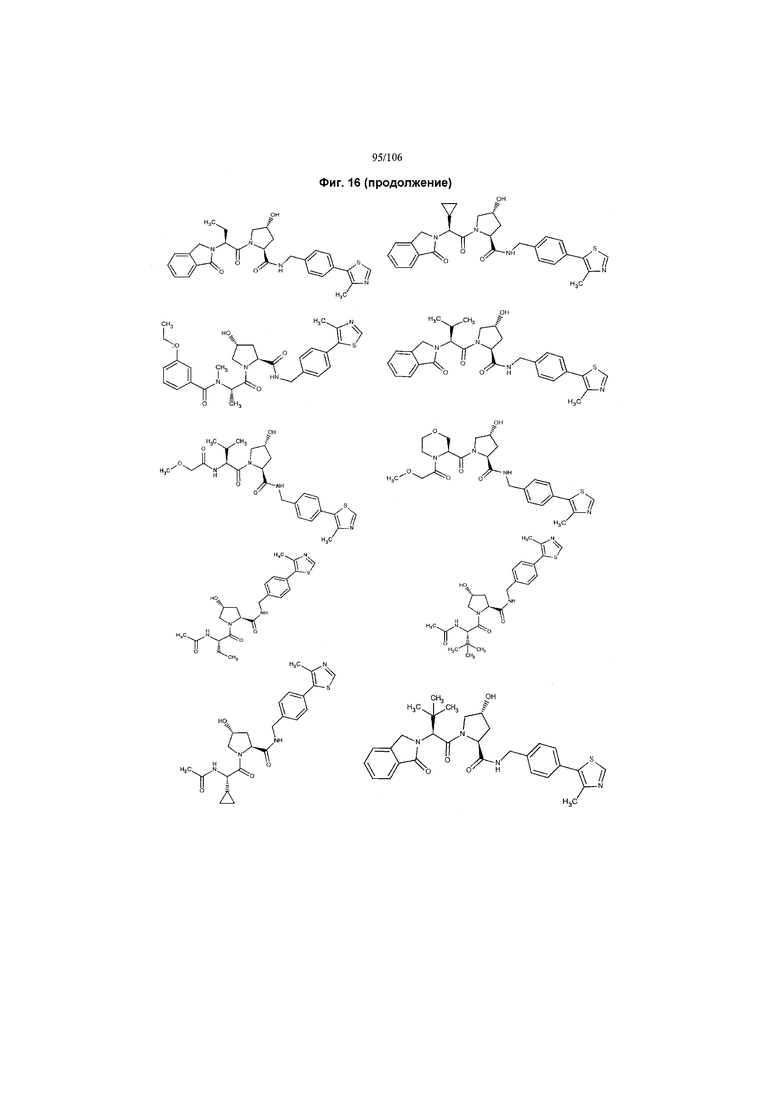
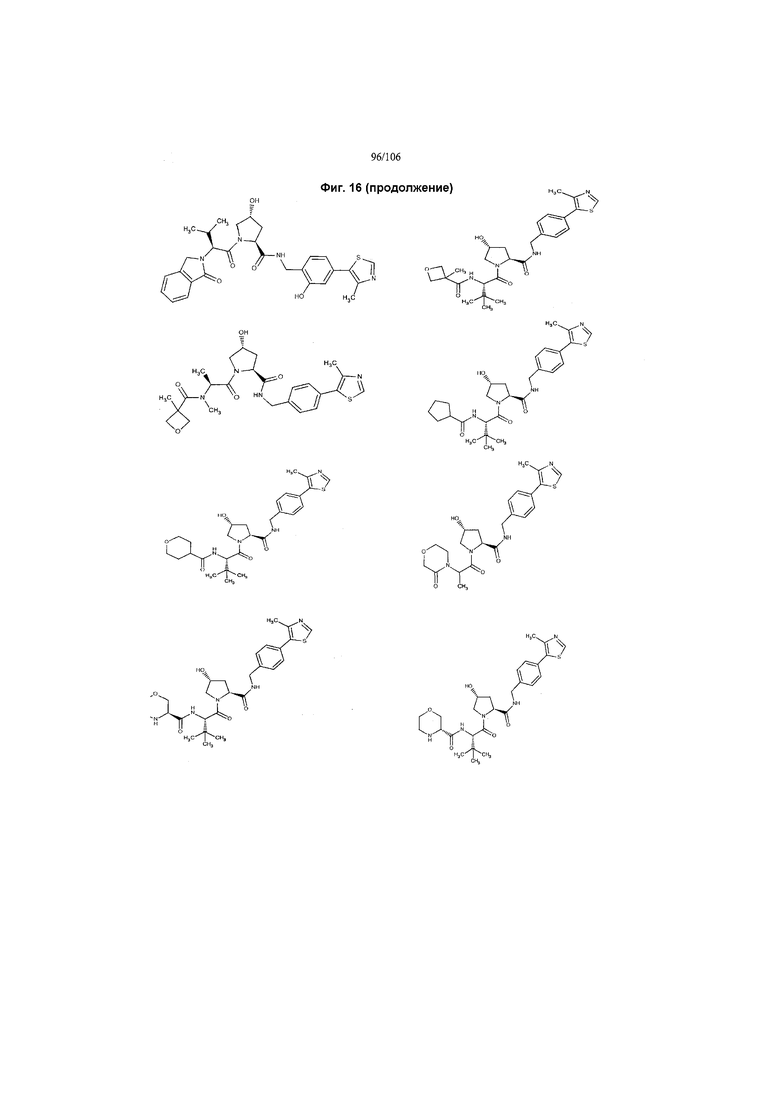
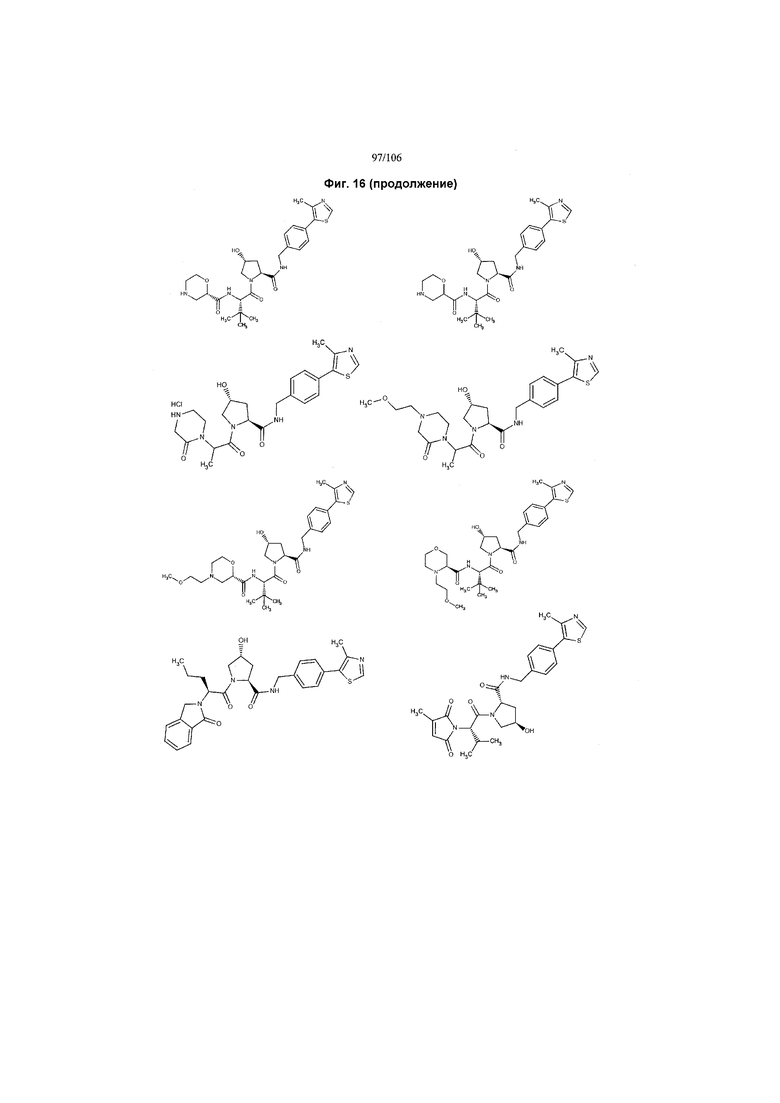
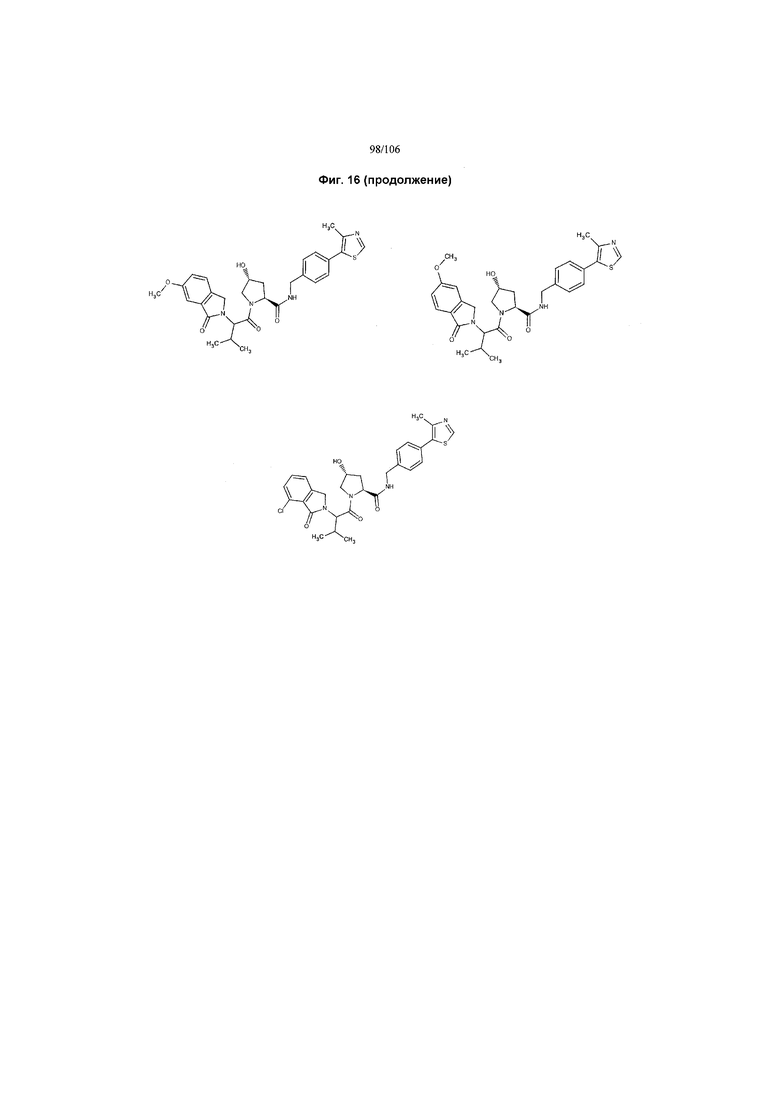
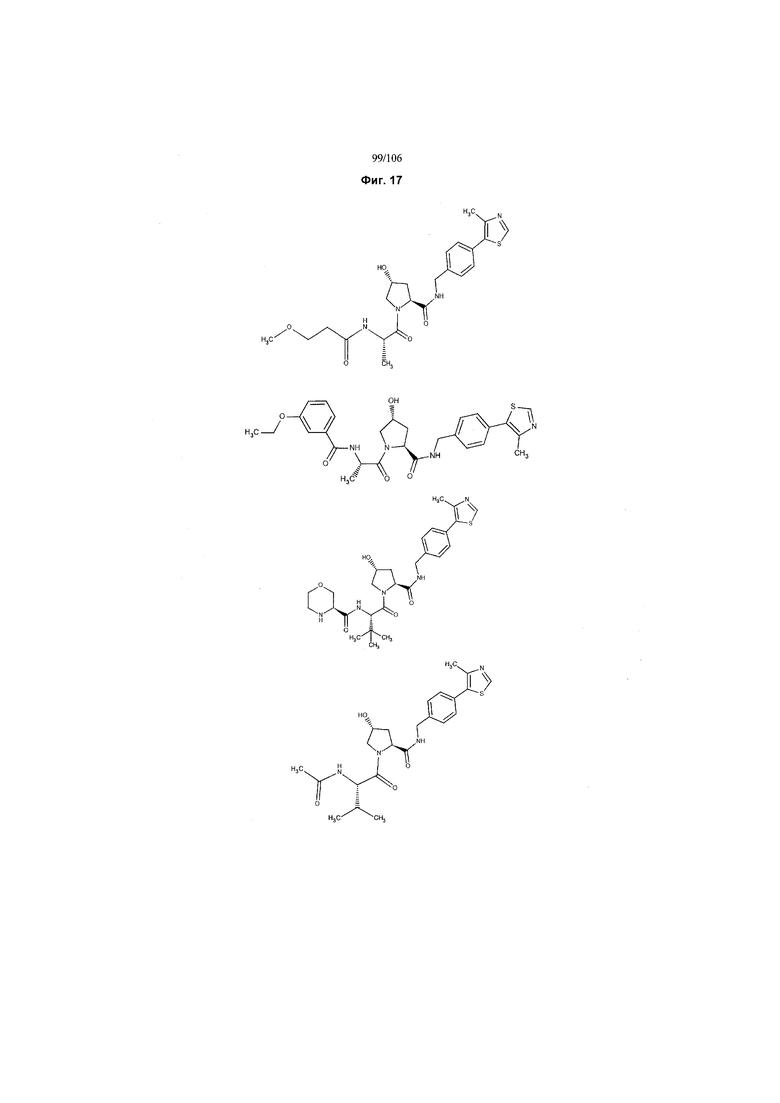
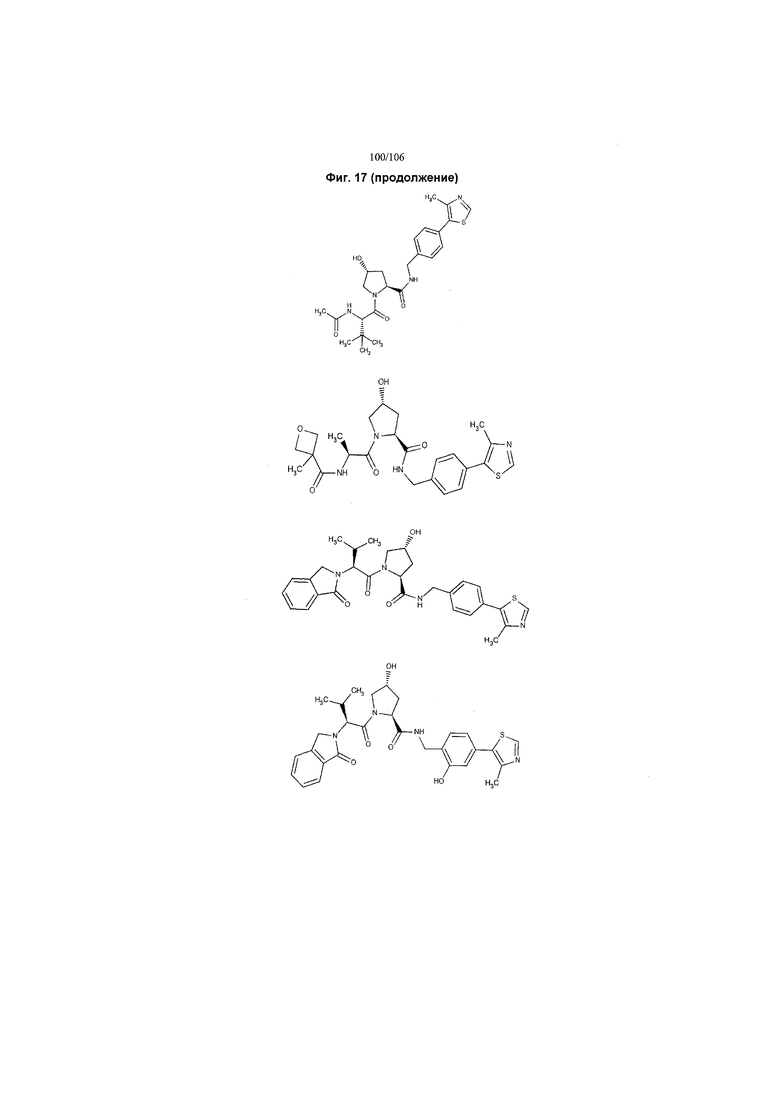
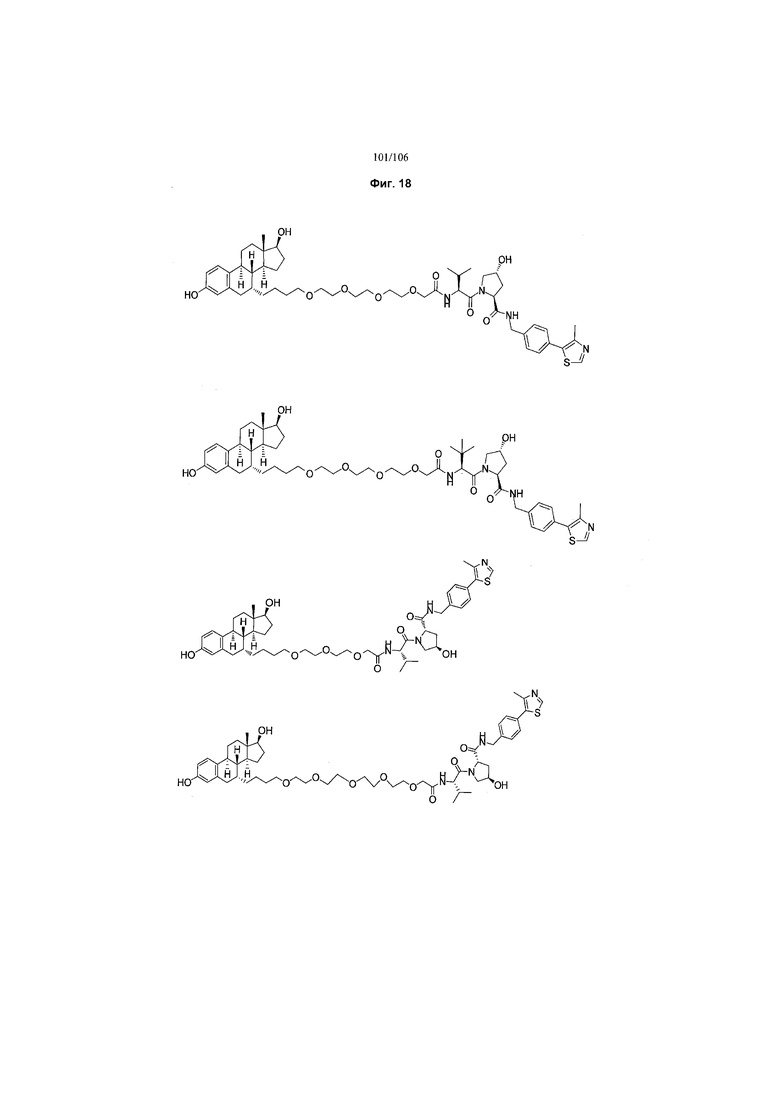
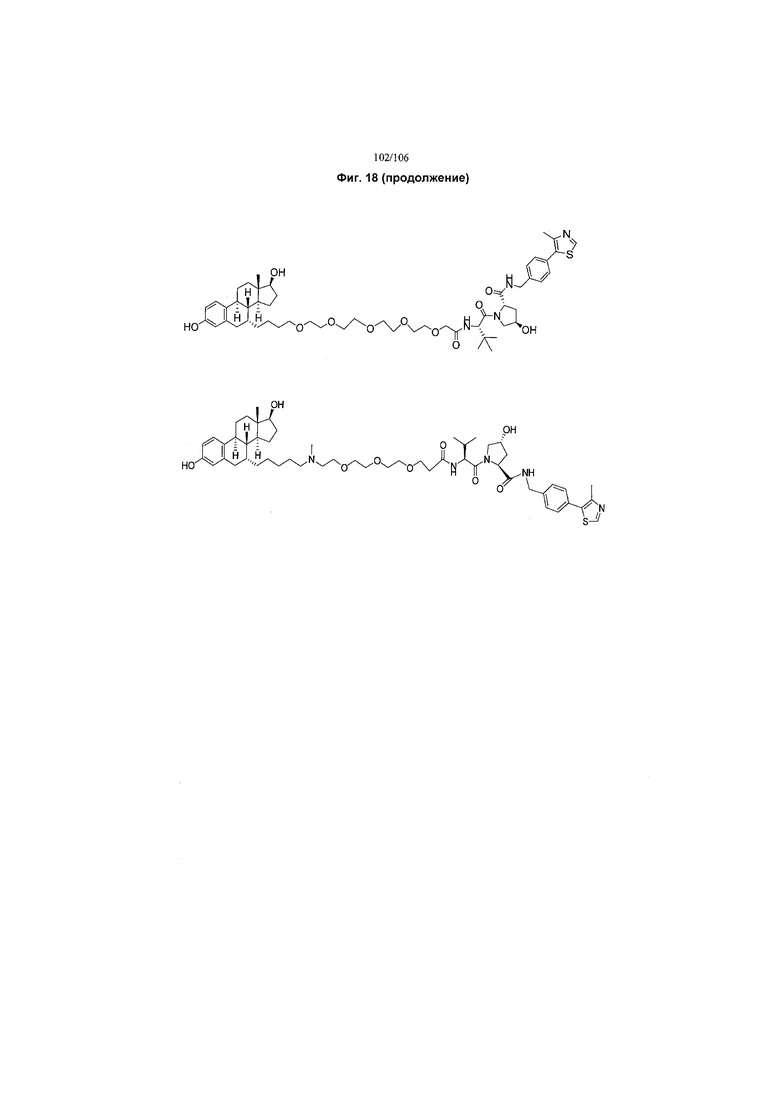
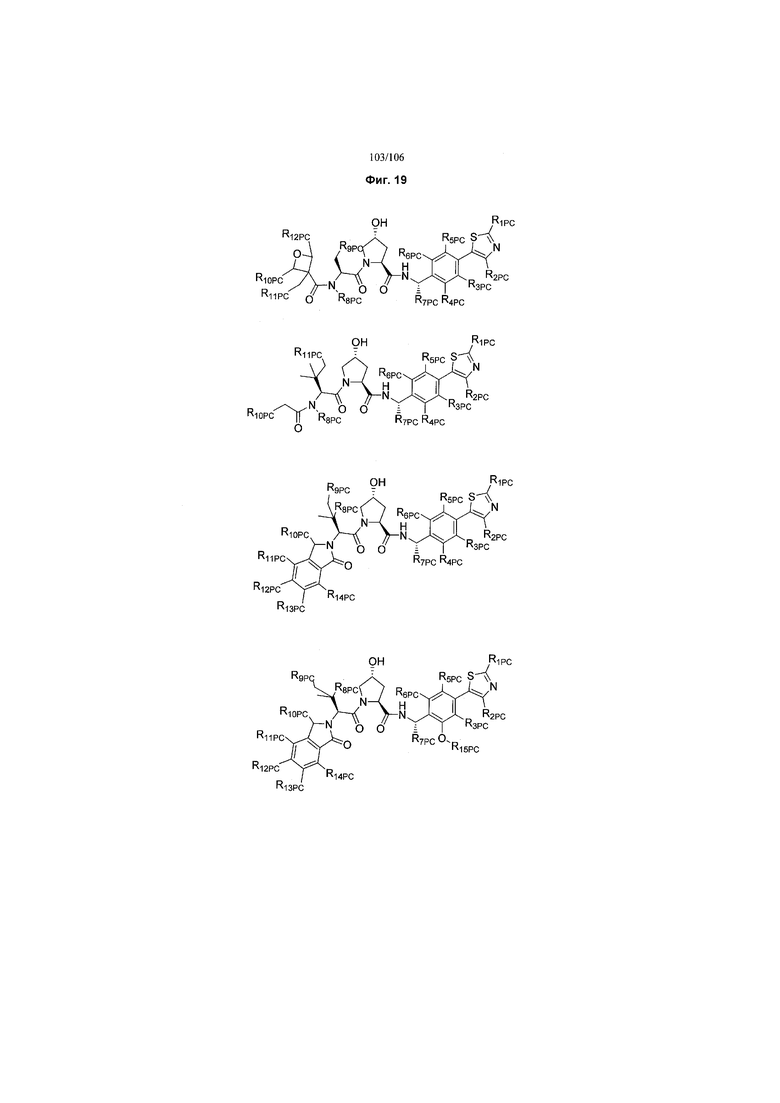
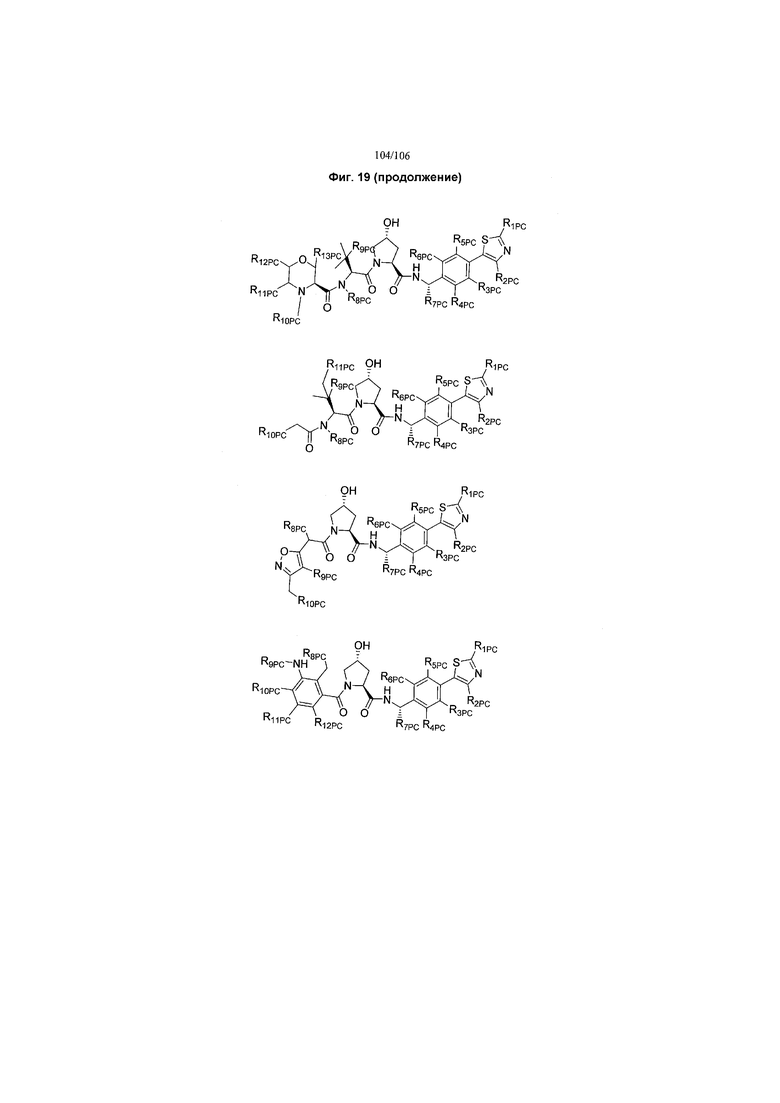
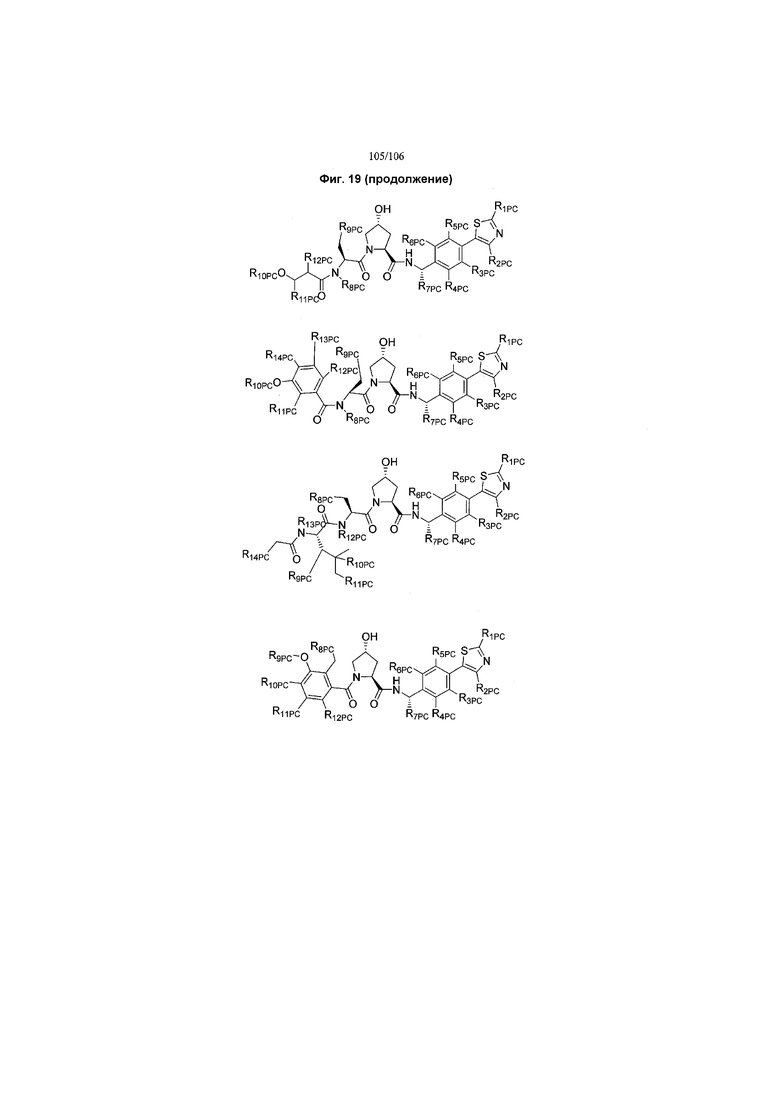
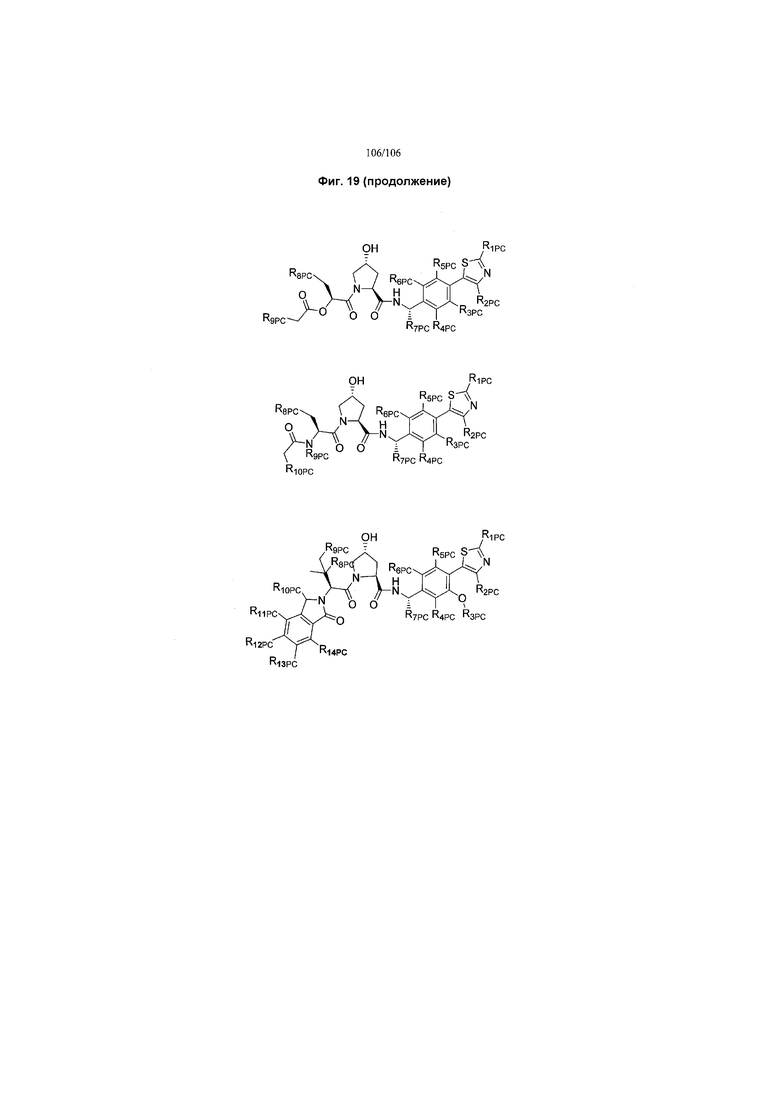
Изобретение относится к бифункциональным соединениям, представленным химической структурой: PTM-L-ULM, где PTM представляет собой небольшую молекулу нацеливающего на белок фрагмента, которая связывается с внутриклеточным белком-мишенью, выбранным из группы, состоящей из киназы фокальной адгезии, тирозинкиназы, рецептора эстрогена, андрогенного рецептора, белка BET, содержащего бромодомен, Ras, Raf и рецептора эпидермального фактора роста; L представляет собой химическую линкерную группу, связывающую ULM с PTM; и ULM представляет собой небольшую молекулу связывающего фрагмента убиквитин лигазы E3 Von Hippel Lindau (VHL). 2 н. и 14 з.п. ф-лы, 19 ил., 2 табл., 1 пр.
1. Соединение, представленное химической структурой
PTM-L-ULM,
где PTM представляет собой небольшую молекулу нацеливающего на белок фрагмента, которая связывается с внутриклеточным белком-мишенью, выбранным из группы, состоящей из киназы фокальной адгезии, тирозинкиназы, рецептора эстрогена, андрогенного рецептора, белка BET, содержащего бромодомен, Ras, Raf и рецептора эпидермального фактора роста;
L представляет собой химическую линкерную группу, связывающую ULM с PTM; и
ULM представляет собой небольшую молекулу связывающего фрагмента убиквитин лигазы E3 Von Hippel Lindau (VHL), представленную химической структурой
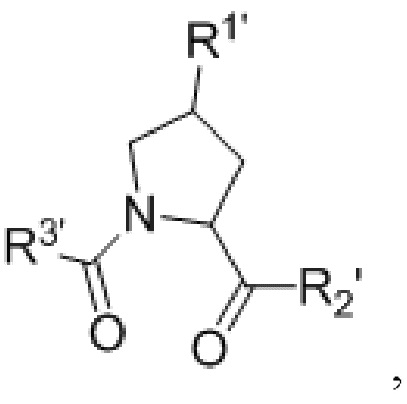
где R1' представляет собой -OH;
R2' выбран из группы, состоящей из необязательно замещенной NR1-XR2'-арил-HET группы и необязательно замещенной -NR1-XR2'-HET-арильной группы;
где HET представляет собой необязательно замещенный заместитель, выбранный из группы, состоящей из оксазола, изоксазола, тиазола, изотиазола, имидазола, диазола, оксимидазола, пиррола, пиролидина, фурана, дигидрофурана, тетрагидрофурана, тиена, дигидротиена, тетрагидротиена, пиридина, пиперидина, пиперазина, морфолина, бензофуран, индол, индолизин, азаиндолизин и хинолона, где замена HET независимо выбрана из группы, состоящей из C1-C3 алкила и галогена;
или HET представляет собой 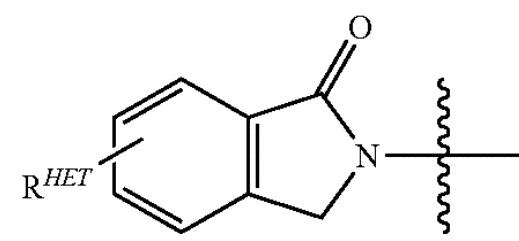 , где RHET выбран из группы, состоящей из H, CN, NO2, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного -O(C1-C6 алкила) и необязательно замещенного -C≡C-Ra, где Ra выбран из группы, состоящей из H и C1-C6 алкила;
, где RHET выбран из группы, состоящей из H, CN, NO2, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного -O(C1-C6 алкила) и необязательно замещенного -C≡C-Ra, где Ra выбран из группы, состоящей из H и C1-C6 алкила;
R1 представляет собой H или C1-C3 алкильную группу;
XR2' выбран из группы, состоящей из -(CH2)n- группы, и необязательно замещенной -(CH2)n-C(XV)=CH(XV)-группы, где в XR2' n представляет собой целое число от 1 до 6;
R3' выбран из группы, состоящей из:
(a) необязательно замещенной -(CH2)n-N(R1')(C=O)m'-(V)n'-RS3' группы, необязательно замещенной -XR3'-арил-HET группы или необязательно замещенной -XR3'-HET-арильной группы;
где HET, как определено в R3', представляет собой необязательно замещенный заместитель, выбранный из группы, состоящей из оксазола, тиазола, изотиазола, имидазола, диазола, оксимидазола, пиррола, пиролидина, фурана, дигидрофурана, тетрагидрофурана, тиена, дигидротиена, тетрагидротиена, пиридина, пиперидина, пиперазина, морфолина, бензофурана, индола, индолизина, азаиндолизина и хинолона, где замена HET независимо выбрана из группы, состоящей из C1-C3 алкила и галогена;
или HET, как определено в R3', представляет собой  ,
,
где RHET выбран из группы, состоящей из H, CN, NO2, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного -O(C1-C6 алкила) и необязательно замещенного -C≡C-Ra, где Ra выбран из группы, состоящей из H и C1-C6 алкила; и
(b) необязательно замещенный -XR3'-HET, где HET, как определено в R3', представляет собой
 ,
,
где RHET выбран из группы, состоящей из H, CN, NO2, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного -O(C1-C6 алкила) и необязательно замещенного -C≡C-Ra, где Ra выбран из группы, состоящей из H и C1-C6 алкила;
XR3' представляет собой необязательно замещенный C1-C6 алкил, необязательно замещенный арильной группой или HET группой;
каждый R1' независимо представляет собой H или C1-C3 алкил;
V представляет собой O, S или NR1';
XR3' выбран из группы, состоящей из необязательно замещенного -(CH2)n-, необязательно замещенного -(CH2CH2O)n-, необязательно замещенного -(CH2)n-C(Xv)=CH(Xv)- и необязательно замещенного C3-C6 циклоалкила;
Xv представляет собой H, галоген или C1-C3 алкил, который необязательно замещен одной или двумя гидроксильными группами или вплоть до трех галогеновых групп;
арил представляет собой необязательно замещенную фенильную или необязательно замещенную нафтильную группу;
где алкил или арил, как определено в RS3', независимо необязательно замещен по меньшей мере одним, выбранным из группы, состоящей из галогена, циано, нитро, -ОН, C1-C6 алкила, необязательно замещенного по меньшей мере одним галогеном, C1-C6 алкила, необязательно замещенного по меньшей мере одним OH, C1-C6 алкокси, необязательно замещенного по меньшей мере одним галогеном, -(CH2)nSH, -S(C1-C6 алкилом), -S(=O)(C1-C6 алкилом), -S(=O)2(C1-C6 алкилом), -S(=O)2NH2, -S(=O)2NH(C1-C6 алкилом), -S(=O)2N(C1-C6 алкил)(C1-C6 алкилом), -NHNH2, -NH2, -NH(C1-C6 алкила, необязательно замещенного 1-2 OH), -N(C1-C6 алкила, необязательно замещенного 1-2 OH)(C1-C6 алкила, необязательно замещенного 1-2 OH), -NHC(=O)O(C1-C6 алкила), -N(C1-C6 алкил)C(=O)O(C1-C6 алкила), -CHO, -(CH2)nC(=O)OH, -(CH2)nC(=O)O(C1-C6 алкила), -C(=O)S(C1-C6 алкила), -(CH2)nC(=O)NH2, -(CH2)nC(=O)NH(C1-C6 алкила), -(CH2)nC(=O)N(C1-C6 алкила)(C1-C6 алкила), -(CH2)nC(=O)(C1-C6 алкила), -OC(=O)NH2, -OC(=O)NH(C1-C6 алкила), -OC(=O)N(C1-C6 алкила)(C1-C6 алкила), -(CH2)nNHC(=О)(С1-С6 алкила), -(CH2)nN(C1-C6 алкила)C(=O)(C1-C6 алкила), бензила и ароматического заместителя, выбранного из группы, состоящей из фенила, нафтила, хинолинила, индолила, диазолила, триазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, имидазолила, пирролила, фурила, индолила, изоиндолила, индолизинила, пиридинила, пиримидинила, бензимидазолила, бензодиазолила, бензоксофурила, бензофурила и тиофенила; где ароматический заместитель независимо необязательно замещен по меньшей мере одним, выбранным из группы, состоящей из C1-C6 алкила и галогена;
где HET, как определено в RS3', представляет собой необязательно замещенный заместитель, выбранный из группы, состоящей из оксазола, тиазола, изотиазола, имидазола, диазола, оксимидазола, пиррола, пиролидина, фурана, дигидрофурана, тетрагидрофурана, тиена, дигидротиена, тетрагидротиена, пиридина, пиперидина, пиперазин, морфолин, бензофуран, индола, индолизина, азаиндолизина и хинолона, где замена HET независимо выбрана из группы, состоящей из C1-C3 алкила и галогена, или HET, как определено в R2', представляет собой  , где RHET выбрана из группы состоящий из H, CN, NO2, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного -O(C1-C6 алкила) и необязательно замещенного -C≡C-Ra, где Ra выбран из группы, состоящей из H и C1-C6 алкила;
, где RHET выбрана из группы состоящий из H, CN, NO2, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного -O(C1-C6 алкила) и необязательно замещенного -C≡C-Ra, где Ra выбран из группы, состоящей из H и C1-C6 алкила;
каждый n независимо обозначает 0, 1, 2, 3, 4, 5 или 6;
m' представляет собой 0 или 1;
каждый n' представляет собой независимо 0 или 1;
и группа ULM ковалентно связана через группу R2' или группу R3' с линкерной группой, которой присоединена к группе PTM,
или его фармацевтически приемлемая соль или стереоизомер.
2. Соединение по п.1, где R2' представляет собой необязательно замещенную группу NR1-XR2'-арил-HET.
3. Соединение по п.2, где HET представляет собой необязательно замещенный оксазол или тиазол.
4. Соединение по п.3, где группа HET замещена C1-C3 алкилом.
5. Соединение по п.1, где R3' представляет собой необязательно замещенную группу -XR3'-HET.
6. Соединение по п.5, где n обозначает 1 или 2.
7. Соединение по п.6, где группа -(CH2)n- в XR3' замещена C1-C6 алкилом.
8. Соединение по п.5, где HET представляет собой необязательно замещенный оксазол или изоксазол.
9. Соединение по п.8, где оксазол или изоксазол замещен C1-C3 алкилом.
10. Соединение по п.1, где ULM выбрана из группы, включающей:
 ,
,  ,
,
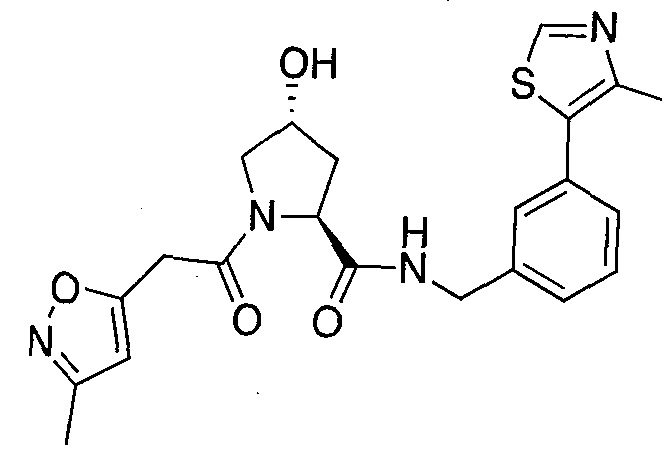 ,
, 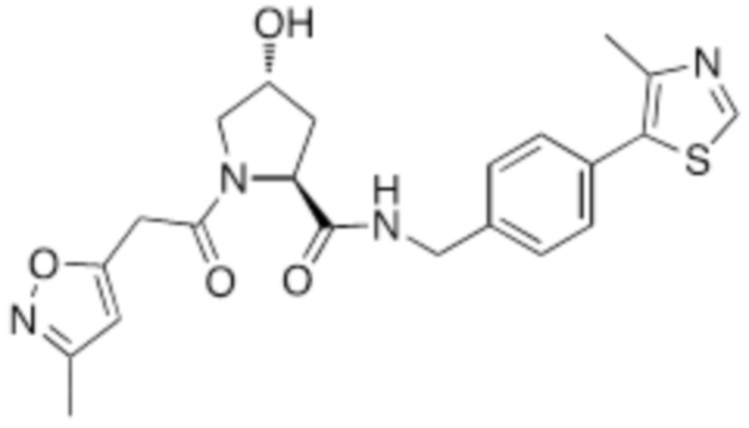 ,
,
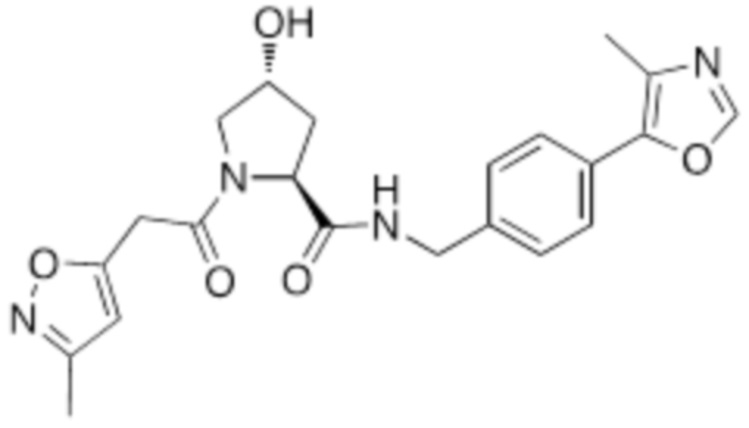 ,
, 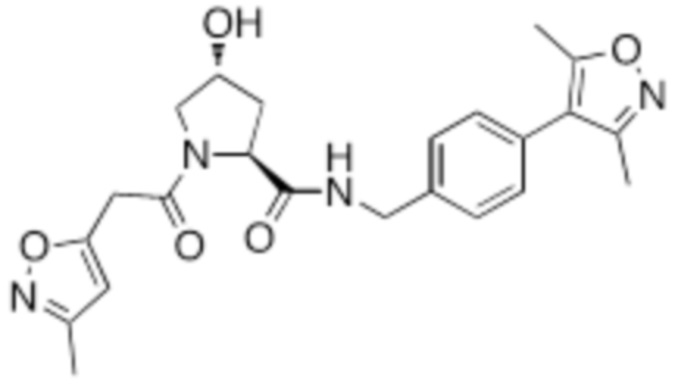 ,
,
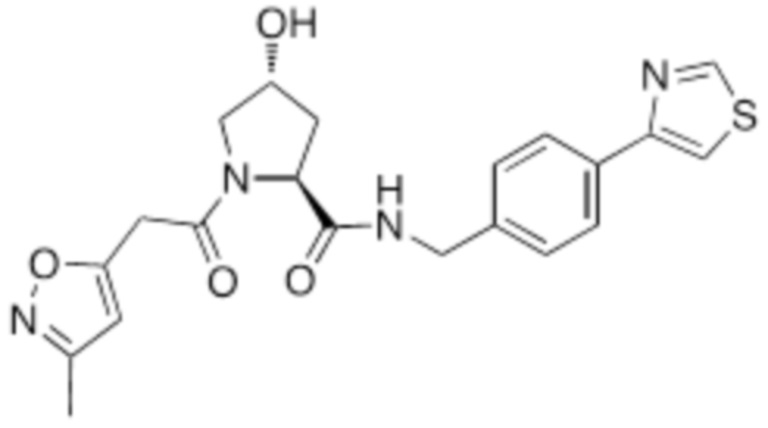 ,
, 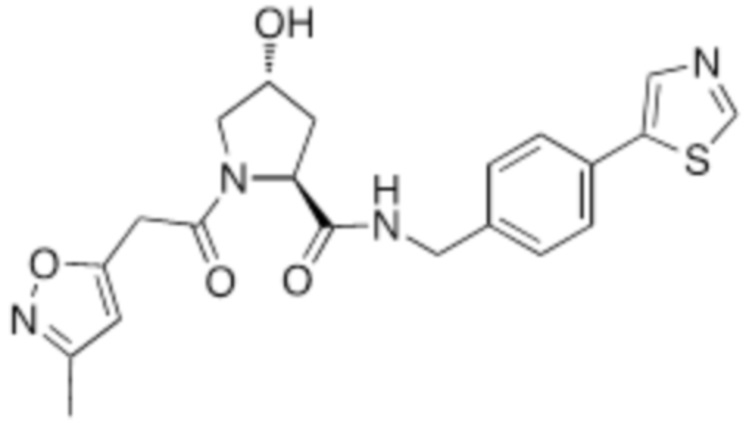 ,
,
и 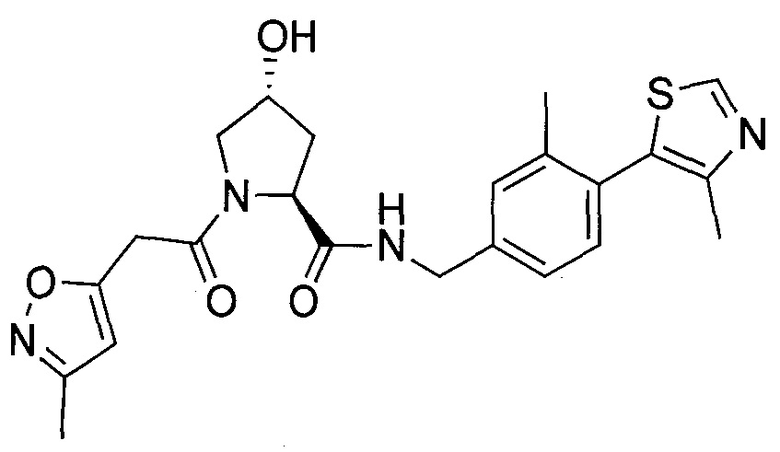 , где ULM модифицирована для ковалентного связывания с группой PTM через линкерную группу L,
, где ULM модифицирована для ковалентного связывания с группой PTM через линкерную группу L,
или его фармацевтически приемлемая соль, энантиомер или диастереомер.
11. Соединение по п.1, где ULM имеет структуру
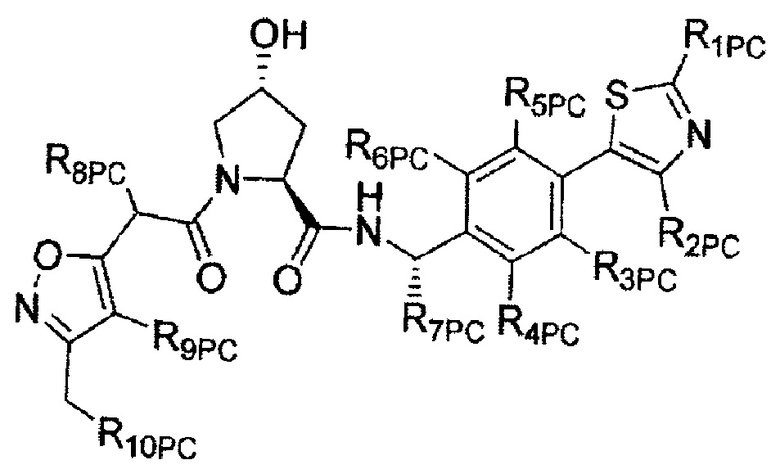 ,
,
где каждый из R1PC, R2PC, R3PC, R4PC, R5PC, R6PC, R8PC, R9PC, R10PC, R11PC, R12PC, R13PC и R14PC независимо представляет собой H, необязательно замещенный алкил или группу  ;
;
где R7PC представляет собой H или группу  ;
;
и где L представляет собой химическую линкерную группу и PTM представляет собой нацеливающий на фрагмент белок, или его фармацевтически приемлемая соль, энантиомер или диастереомер.
12. Соединение по п.1, представленное химической структурой
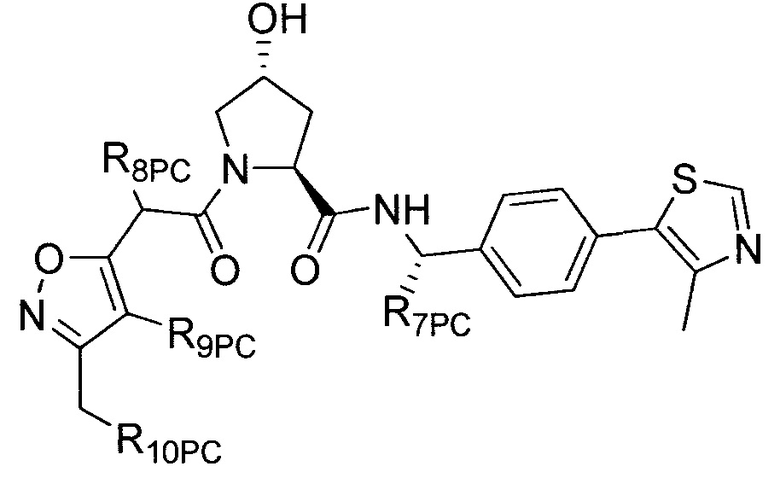 ,
,
где R7PC, R8PC, R9PC, R10PC, каждый, независимо представляют собой H или группу  , или
, или
его фармацевтически приемлемая соль, энантиомер или диастереомер.
13. Соединение по п.1, где линкерная группа представляет собой необязательно замещенную группу, содержащую от 1 до 10 этиленгликолевых звеньев.
14. Соединение по п.1, где группа PTM выбрана из группы, состоящей из:
дериватизированного эрлотиниба 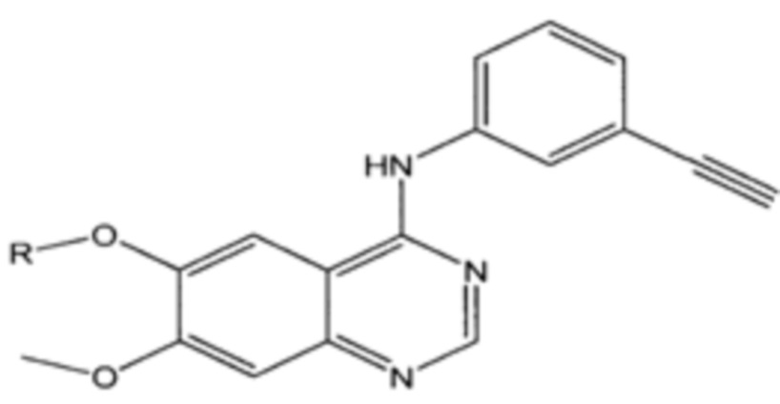 ,
,
где R представляет собой группу  ;
;
дериватизированного сунитиниба 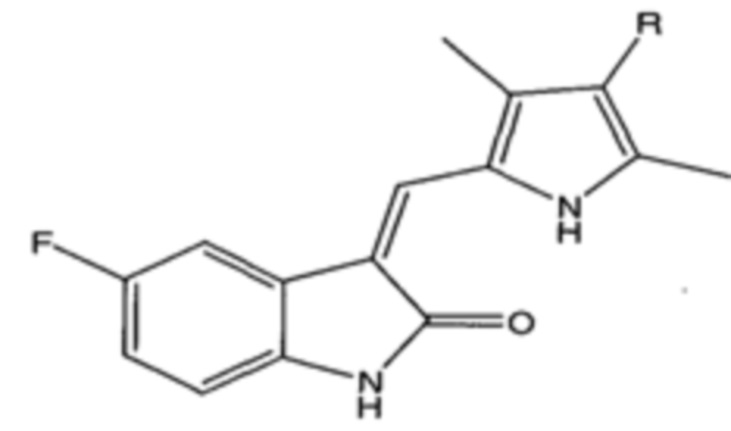 ,
,
где R представляет собой группу  ;
;
дериватизированного сорафениба
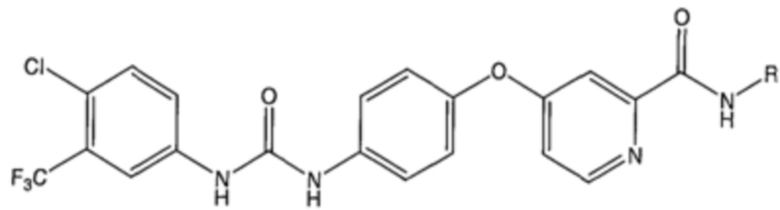 ,
,
где R представляет собой группу  ;
;
дериватизированного дазатиниба 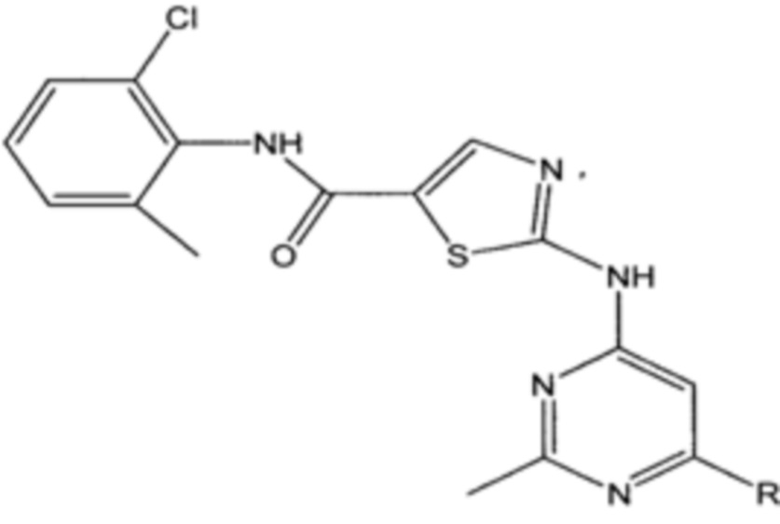
где R представляет собой группу  ;
;
дериватизированного лапатиниба
 ,
,
где группа  присоединена через концевой метил сульфонилметильной группы;
присоединена через концевой метил сульфонилметильной группы;
дериватизированного U09-CX-5279
 ,
,
где группа  присоединена через аминогруппу анилина, группу карбоновой кислоты или циклопропильную группу;
присоединена через аминогруппу анилина, группу карбоновой кислоты или циклопропильную группу;
дериватизированного Y1X  ,
,
где группа  присоединена через пропильную группу;
присоединена через пропильную группу;
дериватизированного Y1W  ,
,
где группа  присоединена через пропильную группу или трет-бутильную группу;
присоединена через пропильную группу или трет-бутильную группу;
дериватизированного 6TP 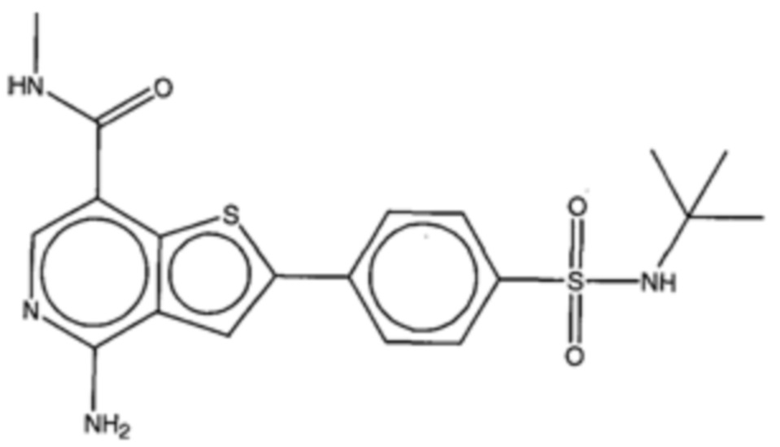 ,
,
где группа  присоединена через концевую метильную группу к амидной группе;
присоединена через концевую метильную группу к амидной группе;
дериватизированного OTP 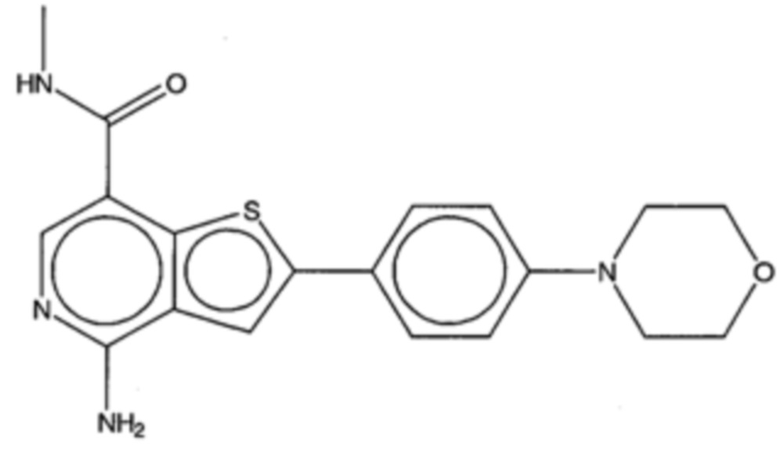 ,
,
где группа  присоединена через концевую метильную группу к амидной группе;
присоединена через концевую метильную группу к амидной группе;
дериватизированного афатиниба, где группа  присоединена через алифатическую аминогруппу;
присоединена через алифатическую аминогруппу;
дериватизированного фостаматиниба, где группа  присоединена через метоксигруппу;
присоединена через метоксигруппу;
дериватизированного гефитиниба 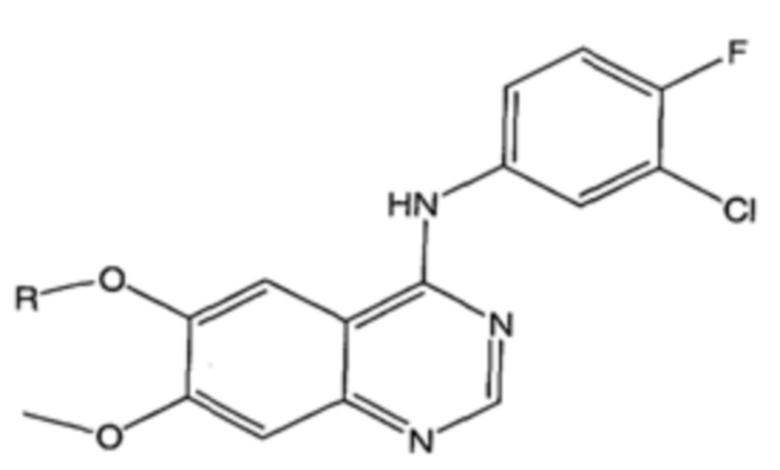 ,
,
где группа  присоединена через метоксигруппу или группу простого эфира;
присоединена через метоксигруппу или группу простого эфира;
дериватизированного ленватиниба, где группа  присоединена через циклопропильную группу;
присоединена через циклопропильную группу;
дериватизированного вандетаниба, где группа  присоединена через метоксигруппу или гидроксильную группу;
присоединена через метоксигруппу или гидроксильную группу;
дериватизированного вемурафениба, где группа  присоединена через сульфонилпропильную группу;
присоединена через сульфонилпропильную группу;
дериватизированного иматиниба  ,
,
где R представляет собой группу  ;
;
дериватизированного пазопаниба 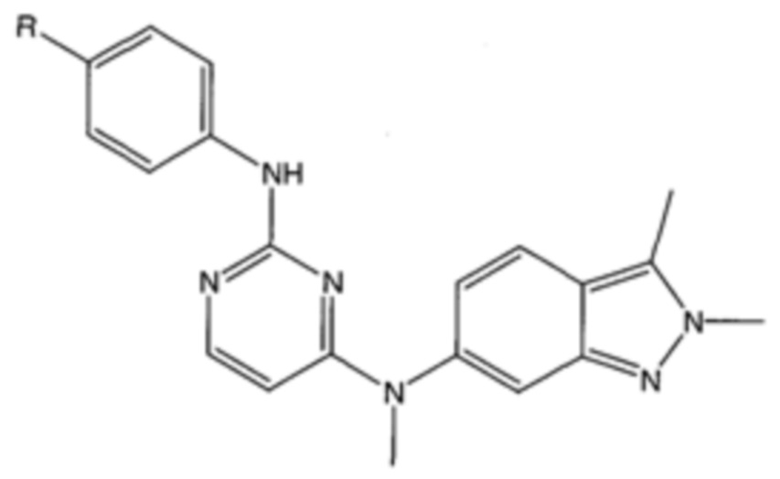 ,
,
где R представляет собой группу  ;
;
дериватизированного TAE684 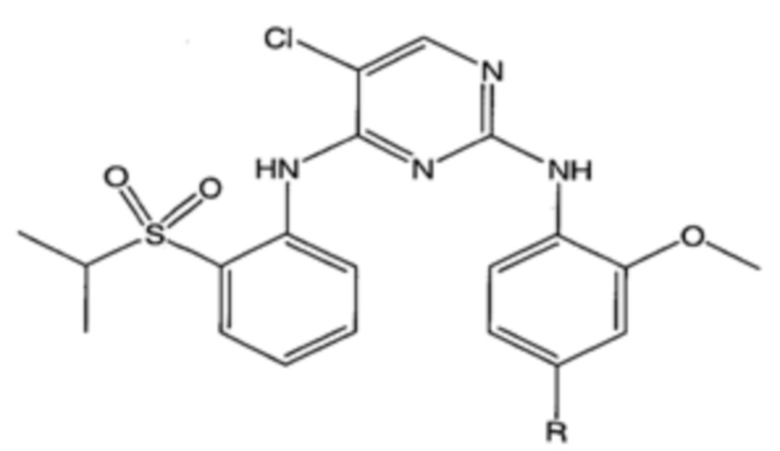 ,
,
где R представляет собой группу  ;
;
дериватизированного нилотиниба 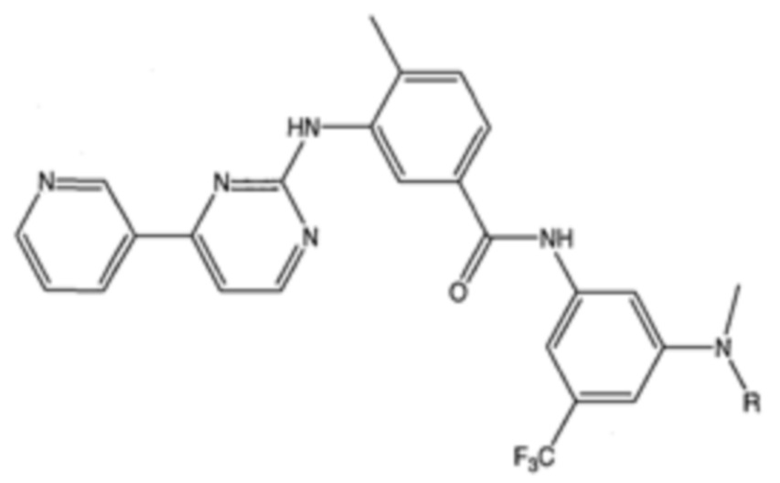 ,
,
где R представляет собой группу  ;
;
дериватизированного NVP-BSK805 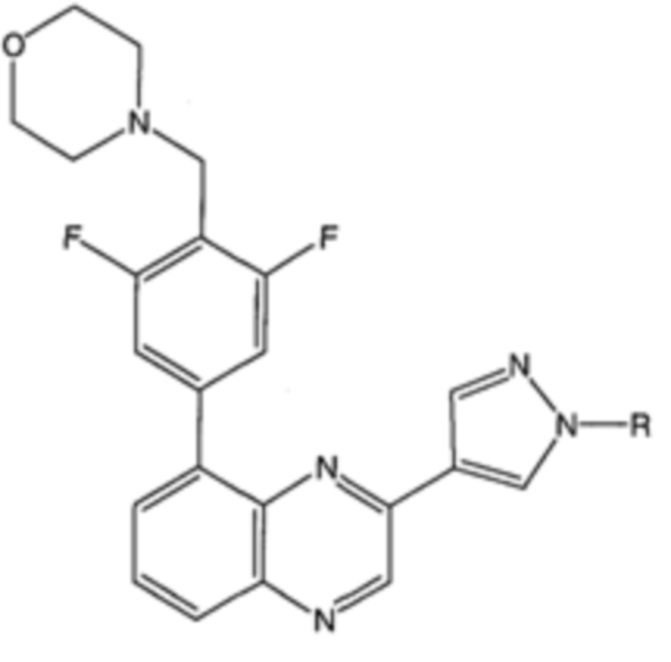 ,
,
где R представляет собой группу  ;
;
дериватизированного кризотиниба  ,
,
где R представляет собой группу  ;
;
дериватизированного 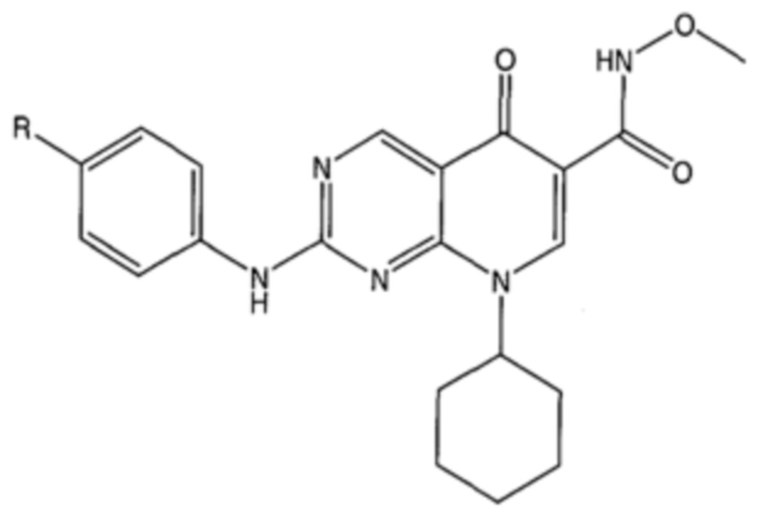 ,
,
где R представляет собой группу  ;
;
дериватизированного форетиниба
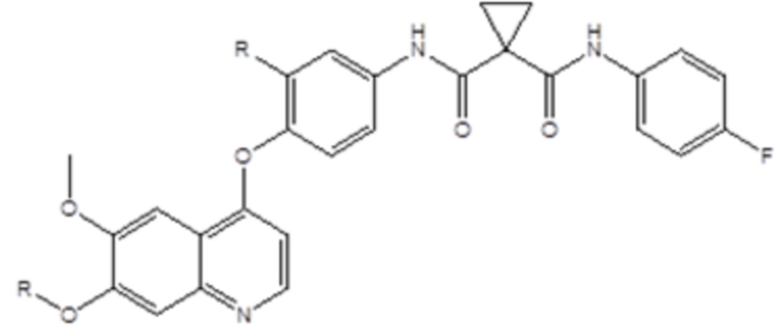 ,
,
где R представляет собой группу  ;
;
дериватизированного PTP1B 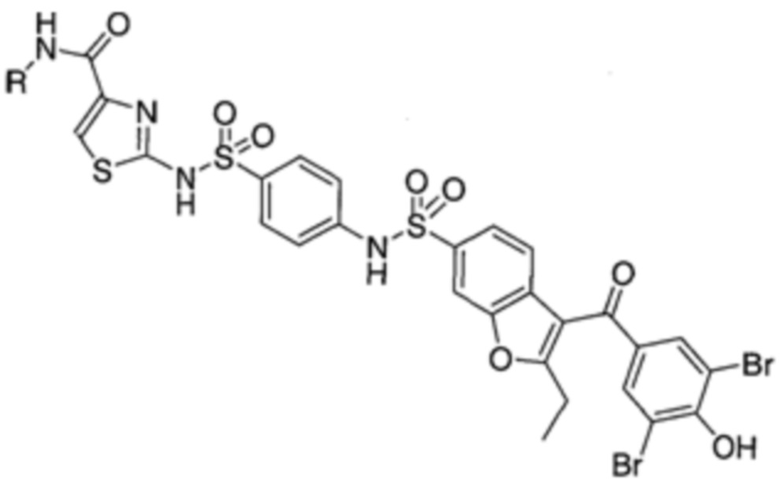 ,
,
где R представляет собой группу  ;
;
дериватизированного ингибитора домена SHP-2 тирозинфосфатазы
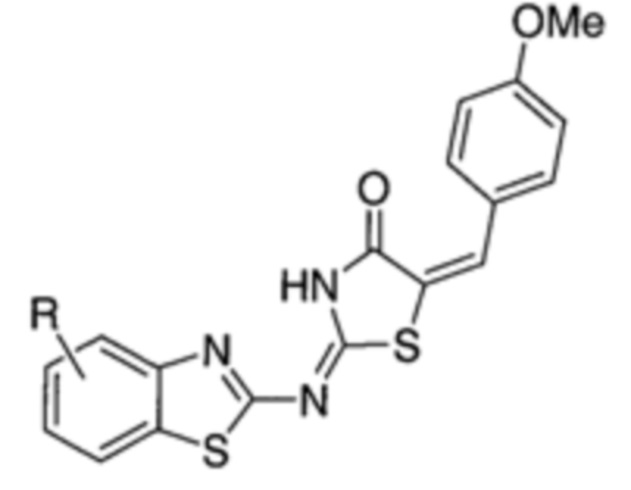 ,
,
где R представляет собой группу  ;
;
дериватизированного ингибитора тирозинкиназы ABL
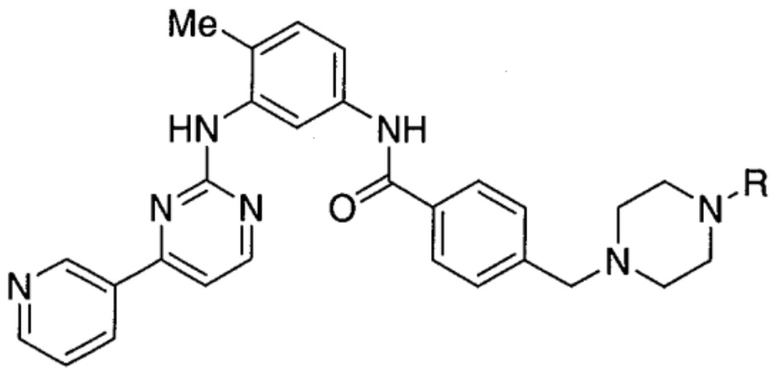 ,
,
где R представляет собой группу  ;
;
дериватизированного транс-4-йод-4'-боранил-халкона, где группа  присоединена через гидроксильную группу;
присоединена через гидроксильную группу;
дериватизированного соединения, нацеленного на человеческий белок BET, содержащий бромодомен, Brd2, Brd3, Brd4, выбранное из группы, включающей:
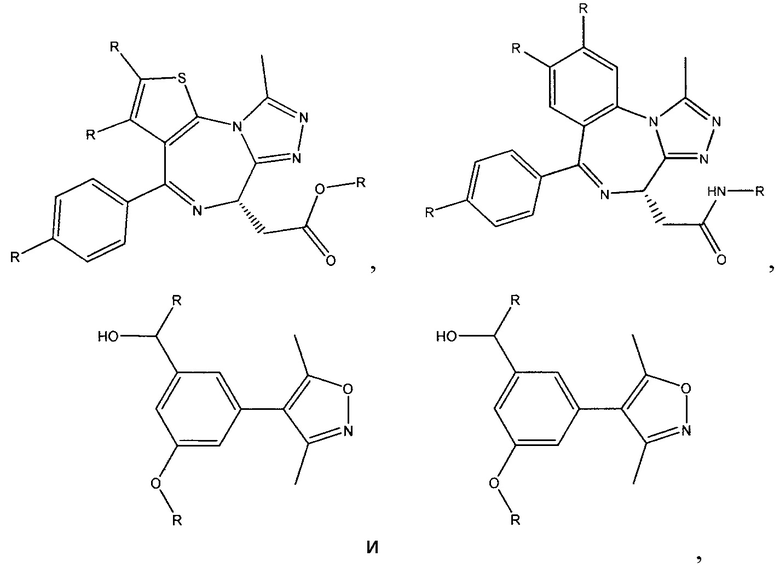
где один R представляет собой группу  , а другой R представляет собой H или метил;
, а другой R представляет собой H или метил;
дериватизированного эстрадиола, к которому присоединена группа  ;
;
дериватизированного дигидрокситестостерона, к которому присоединена группа  ;
;
дериватизированного PLX4032  ,
,
где R представляет собой группу  ;
;
дериватизированное соединение, нацеленное на FKBP, соответствующее химической структуре
 ,
,
где R представляет собой группу  ;
;
дериватизированного соединения, нацеленного на андрогенный рецептор (AR), соответствующего химической структуре
 ,
,
где R представляет собой группу  ;
;
дериватизированного лиганда андрогенного рецептора SARM, соответствующего химической структуре
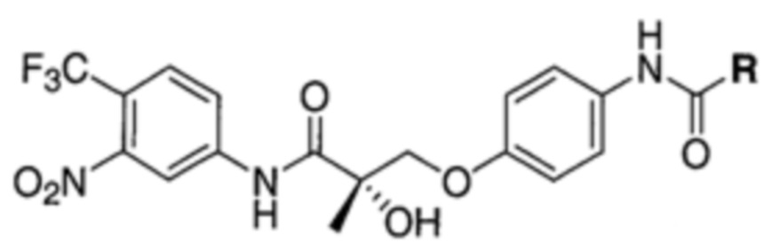 ,
,
где R представляет собой группу  ;
;
дериватизированного лиганда андрогенного рецептора DHT, соответствующего химической структуре
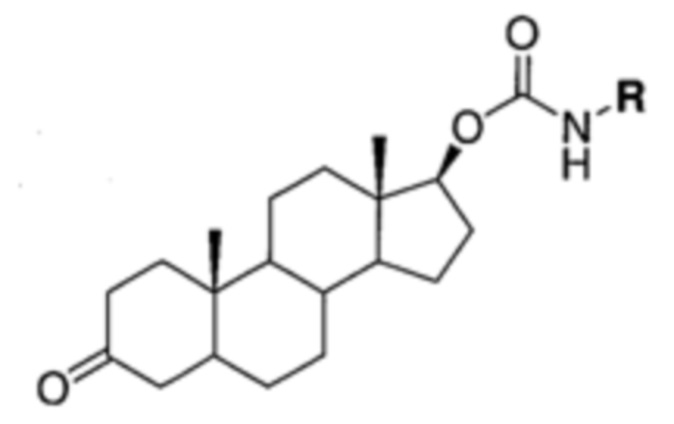 ,
,
где R представляет собой группу  ;
;
дериватизированного соединения, нацеленного на рецептор эстрогена (ER), соответствующего химической структуре
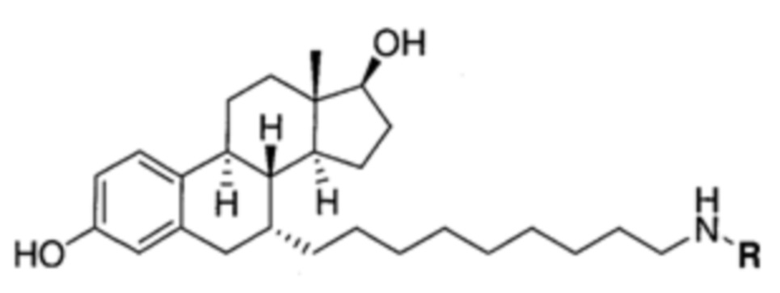 ,
,
где R представляет собой группу  .
.
15. Фармацевтическая композиция, содержащая эффективное количество соединения по п.1 в комбинации с фармацевтически приемлемым носителем, добавкой или инертным наполнителем и, необязательно, в дополнительной комбинации с дополнительным биологически активным агентом для применения при лечении заболевания или состояния у пациента, в котором разрегулированная активность белка отвечает за заболевание или состояние.
16. Соединение по п. 1, в котором L представляет собой по меньшей мере один член, выбранный из группы, состоящей из -(CH2)i-O-, -(CH2-CH2-O)i-, -(CH2)i-S-, -(CH2)i-NR-, -(CH2)i-X1Y1-,  ,
, 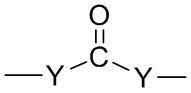 ,
, 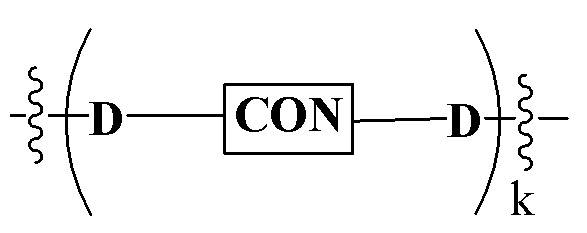 и любой их комбинации, где каждый i представляет собой независимо от 0 до 100;
и любой их комбинации, где каждый i представляет собой независимо от 0 до 100;
R представляет собой H, C1-C3 алкил, алканольную группу или гетероциклическую группу;
Y представляет собой независимо связь, O, S или N-R;
X1Y1 образует амидную группу, уретановую группу, сложноэфирную или сложную тиоэфирную группу;
D представляет собой независимо связь (отсутствует),  ,
,  или
или 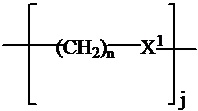 ,
,
j представляет собой целое число от 1 до 100;
k представляет собой целое число от 1 до 100;
m' представляет собой целое число от 1 до 100;
n представляет собой целое число от 1 до 100;
X1 представляет собой O, S или N-R; и
CON представляет собой связь (отсутствует), пиперазиниловую группу, необязательно замещенную алкиленовую группу, гетероцикл, 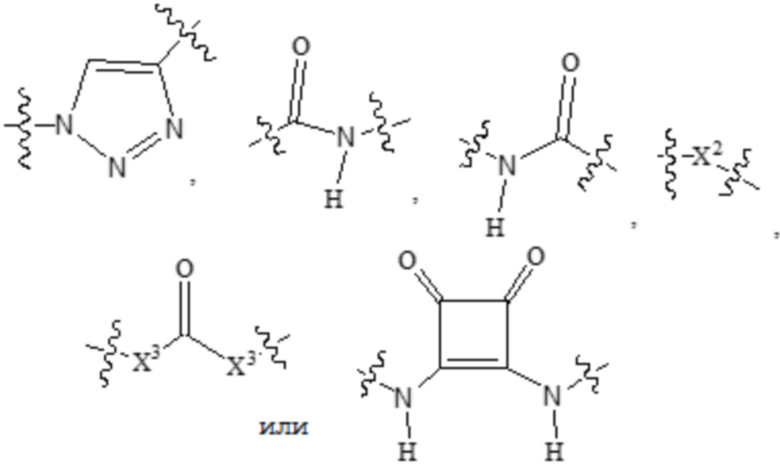 ,
,
X2 представляет собой O, S, NR4, S(O), S(O)2, -S(O)2O, -OS(O)2 или OS(O)2O;
X3 представляет собой O, S, CHR4 или NR4; и
R4 представляет собой H или C1-C3 алкильную группу, которая необязательно замещена одной или двумя гидроксильными группами.
| WO 2008011392 A2, 24.01.2008 | |||
| WO 2011008260 A2, 20.01.2011 | |||
| WO 2000050445 A1, 31.08.2000 | |||
| WO 2010107485 A1, 23.09.2010 | |||
| KEDRA CYRUS ET AL, "Jostling for position: optimizing linker location in the design of estrogen receptor-targeting PROTACs", CHEMMEDCHEM, 2010, vol | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2022-10-12—Публикация
2013-01-11—Подача