Данное изобретение относится к новым растворимым в воде пролекарствам, или их фармацевтически приемлемым солям, или их гидратам или сольватам. Данное изобретение также относится к фармацевтическим композициям, которые содержат указанные вещества, или жидким препаративным формам, которые содержат указанные вещества в водных растворах.
Камптотецины, таксаны, противораковые нуклеотиды и подобные им активны против множества раковых клеток и, таким образом, потенциально полезны в качестве терапевтических агентов, таких как противораковые агенты (патентные документы 1 и 2). Многие из этих соединений являются липофильными и из-за низкой растворимости в воде их применение для инъекций (парентеральное введение) иногда ограничено (патентный документ 1).
Растворимые в воде пролекарства были изучены при попытке солюбилизировать такие липофильные фармацевтические агенты в воде (не патентный документ 1 и патентный документ 1).
[патентный документ 1] WO 03/043631
[патентный документ 2] WO 03/045952
[не патентный документ 1] Shan et al., J. Pharm. Sci., 86(7), 765-767, 1997
Проблемы, решаемые данным изобретением
Большинство растворимых в воде пролекарств липофильных фармацевтических агентов превращаются в их активную форму после введения, в основном, с помощью ферментов. Однако такое превращение происходит через определенный период времени после введения и варьируется в зависимости от вида агента и пациента, таким образом, имеется препятствие для развития указанных пролекарств. Поэтому существует острая необходимость в развитии растворимых в воде пролекарств, которые могут вводиться парентерально, которые не зависят от ферментного превращения и демонстрируют незначительные межвидовые и индивидуальные различия.
Более того, в некоторых случаях скорость и эффективность превращения пролекарства в его активную форму в крови являются недостаточными, и поэтому существует необходимость в сокращении срока, необходимого для увеличения концентрации фармацевтических агентов в крови.
Более конкретно, объектом данного изобретения являются растворимые в воде пролекарства, которые могут быть введены парентерально, и превращение которых в активную форму не зависит от ферментов или имеет незначительные межвидовые и индивидуальные отличия, и которые демонстрируют превосходную скорость и эффективность превращения.
Способы решения проблем
При проведении обширных исследований, направленных на решение указанной выше проблемы, авторы данного изобретения обнаружили, что пролекарства соединений, имеющих солюбилизирующие боковые цепи определенной структуры, демонстрируют превосходную растворимость в воде, и что их межвидовые и индивидуальные различия незначительны благодаря быстрому химическому превращению в активную форму. Таким образом, было получено данное изобретение. Данное изобретение особенно полезно для применения к нерастворимым в воде фармацевтическим агентам, таким как камптотецин, которые содержат вторичную спиртовую гидроксильную группу или третичную спиртовую гидроксильную группу.
Более конкретно, данное изобретение включает:
<1> растворимое в воде пролекарство, представленное формулой (1), или его фармацевтически приемлемую соль, или их гидрат или сольват,
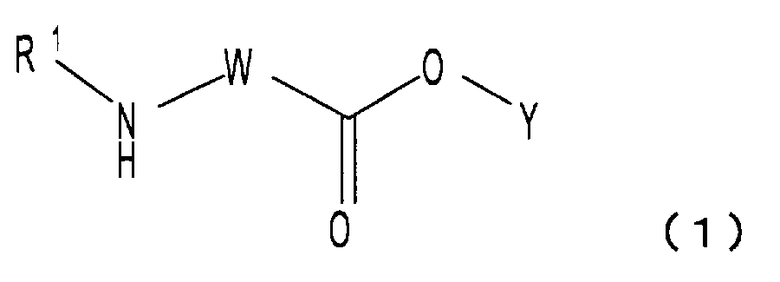
(где R1 является атомом водорода или C1-C6-алкильной группой;
W является двухвалентной группой, содержащей третичную аминогруппу или сульфонильную группу;
Y является остатком соединения, представленного Y-OH, имеющего спиртовую гидроксильную группу);
<2> растворимое в воде пролекарство по п.1 или его фармацевтически приемлемую соль, или их гидрат или сольват, где растворимое в воде пролекарство представлено формулой (2):
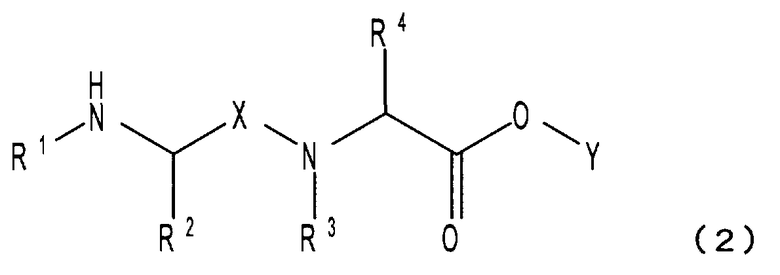
[где R1 и Y такие, как определены для формулы (1);
X является C=O или C1-C3-алкиленовой группой;
R2 и R4, каждый независимо, является атомом водорода, C1-C6-алкильной группой или боковой цепью аминокислоты; и
R3 является C1-C6-алкильной группой];
<3> растворимое в воде пролекарство по п.2, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R1 является атомом водорода, метильной группой или этильной группой;
<4> растворимое в воде пролекарство по пп. 2 или 3, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R2 является атомом водорода или метильной группой;
<5> растворимое в воде пролекарство по любому из пп. 2-4, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R3 является C1-C3-алкильной группой;
<6> растворимое в воде пролекарство по любому из пп. 2-5, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R4 является водородом или метильной группой;
<7> растворимое в воде пролекарство по п.1 или его фармацевтически приемлемую соль, или их гидрат или сольват, где растворимое в воде пролекарство представлено формулой (3):
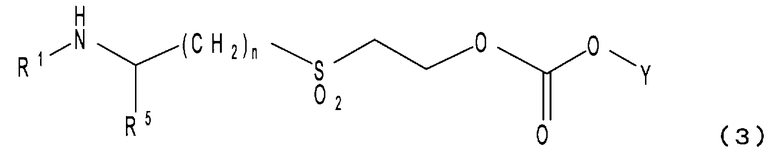
[где R1 и Y такие, как определены для формулы (1);
n равно целому числу от 1 до 6; и
R5 является атомом водорода или -COOR6 (где R6 является атомом водорода или C1-C6-алкильной группой)];
<8> растворимое в воде пролекарство по п.7, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R1 является атомом водорода, метильной группой или этильной группой;
<9> растворимое в воде пролекарство по пп. 7 или 8, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором n равно 1 и R5 является атомом водорода или -COOR6 (где R6 является атомом водорода или C1-C6-алкильной группой);
<10> растворимое в воде пролекарство по пп. 7 или 8, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором n равно целому числу от 2 до 6 и R5 является атомом водорода;
<11> растворимое в воде пролекарство по любому из пп. 1-10, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором гидроксильной группой (-OH) группы Y-OH является вторичная или третичная спиртовая гидроксильная группа;
<12> растворимое в воде пролекарство по любому из пп. 1-11, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором Y-OH является нерастворимым соединением;
<13> растворимое в воде пролекарство по любому из пп. 1-12, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором Y-OH является камптотецином, азольным противогрибковым агентом, таксаном или противораковым нуклеотидом;
<14> растворимое в воде пролекарство по любому из пп. 1-13, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором Y является группой, представленной формулой (4):

[где
* указывает на место связывания;
m равно либо 0, либо 1;
R11 является атомом водорода, атомом галогена или C1-C6-алкильной группой;
R12 является атомом водорода, атомом галогена, C1-C6-алкильной группой или гидроксильной группой;
R13 является атомом водорода, аминогруппой, нитрогруппой или (диметиламино)метильной группой;
R14 является атомом водорода, C1-C6-алкильной группой, (4-метилпиперазинил)метильной группой или (трет-бутоксиимино)метильной группой;
R13 и R14, и R11 и R12, могут, соответственно, быть связаны друг с другом с образованием 5- или 6-членного кольца, где 5- или 6-членное кольцо может содержать от 1 до 2 гетероатомов и может иметь от 1 до 3 заместителей, выбранных из группы А, перечисленной ниже, где заместители из группы А могут также иметь от 1 до 3 заместителей, выбранных из группы В, перечисленной ниже:
Группа A: C1-C10-алкильная группа, аминогруппа, моно-C1-C8-алкиламиногруппа, ди-C1-C8-алкиламиногруппа, C1-C8-алкоксигруппа, C1-C8-алкилтиогруппа и группа, представленная X= (где X является атомом кислорода или атомом серы);
Группа B: C1-C6-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C6-алкиламиногруппа, ди-C1-C6-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C6-алкоксигруппу, атом галогена, аминогруппу, моно-C1-C6-алкиламиногруппу и ди-C1-C6-алкиламиногруппу)];
<15> растворимое в воде пролекарство по п.14, или его фармацевтически приемлемую соль, или их гидрат или сольват, где Y является группой, представленной формулой (5):
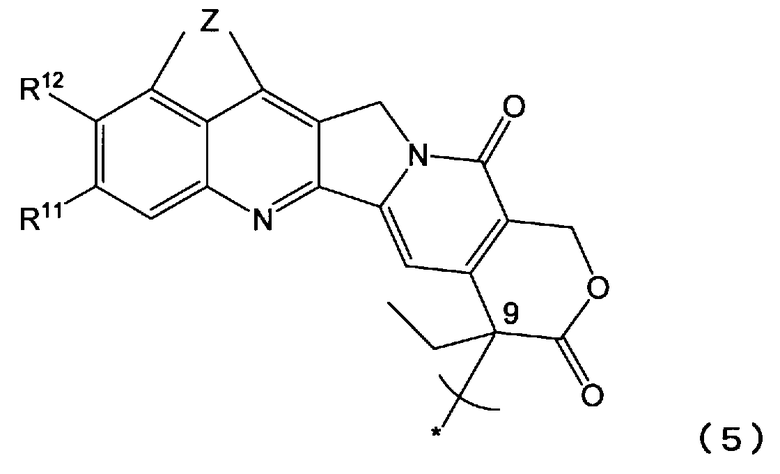
{где * указывает на место связывания;
R11 и R12 такие, как определены в п.14; и
Z является -NH-C(=X)-N(R21)- или -N=C(R22)-N(R21)-
[где R21 является атомом водорода или C1-C10-алкильной группой, которая может иметь 1-3 заместителя, выбранных из группы В, перечисленной ниже:
Группа B: C1-C6-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C6-алкиламиногруппа, ди-C1-C6-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C6-алкоксигруппу, атом галогена, аминогруппу, моно-C1-C6-алкиламиногруппу и ди-C1-C6-алкиламиногруппу);
R22 является атомом водорода, аминогруппой или C1-C6-алкильной группой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, C1-C6-алкоксигруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, C1-C6-алкилтиогруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, моно-C1-C6-алкиламиногруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, или ди-C1-C6-алкиламиногруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже:
Группа C: C1-C6-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C6-алкоксигруппу, аминогруппу, моно-C1-C6-алкиламиногруппу и ди-C1-C6-алкиламиногруппу); и
X является атомом кислорода или атомом серы]};
<16> растворимое в воде пролекарство по п.15, или его фармацевтически приемлемую соль, или их гидрат или сольват, где Y является группой, представленной формулой (6):
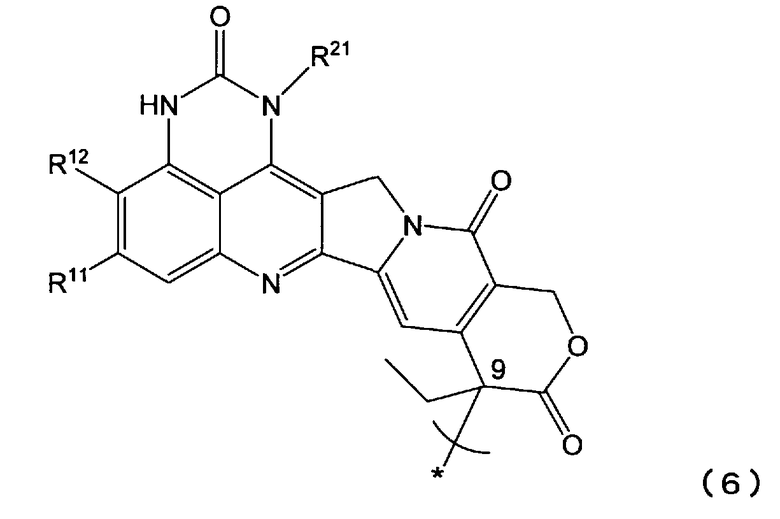
[где * указывает на место связывания; и
R11, R12 и R21 такие, как определены в п.15];
<17> растворимое в воде пролекарство по п.16, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R11 и R12 являются атомами водорода; и
R21 является атомом водорода или C1-C8-алкильной группой, которая может иметь заместитель, выбранный из группы D, описанной ниже:
Группа D: C1-C3-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C3-алкиламиногруппа, ди-C1-C3-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C3-алкоксигруппу и атом галогена);
<18> растворимое в воде пролекарство по пп. 16 или 17, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором Y является остатком соединения (Y-OH), включающим, по крайней мере, одну спиртовую гидроксильную группу, где соединение выбирают из группы, включающей:
a) (9S)-1-бутил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
b) (9S)-9-этил-9-гидрокси-1-[2-(4-морфолино)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
c) (9S)-1-[3-(диметиламино)пропил]-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
d) (9S)-9-этил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
e) (9S)-9-этил-9-гидрокси-1-[2-(пиридин-2-ил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
f) (9S)-9-этил-1-гептил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
g) (9S)-9-этил-9-гидрокси-1-пропил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
h) (9S)-9-этил-9-гидрокси-1-[2-(пиридин-3-ил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
i) (9S)-9-этил-9-гидрокси-1-(3-фенилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
j) (9S)-9-этил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
k) (9S)-9-этил-1-гексил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
l) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
m) (9S)-9-этил-9-гидрокси-1-[2-(4-метоксифенил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
n) (9S)-1-бензил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
o) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
p) (9S)-1,9-диэтил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
q) (9S)-1-[2-(4-хлорфенил)этил]-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
r) (9S)-9-этил-1-[2-(4-фторфенил)этил]-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
s) (9S)-9-этил-9-гидрокси-1-(1-метилэтил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион и
t) (9S)-1-(3,3-диметилбутил)-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
<19> растворимое в воде пролекарство по п.15, или его фармацевтически приемлемую соль, или их гидрат или сольват, где Y является группой, представленной формулой (7):
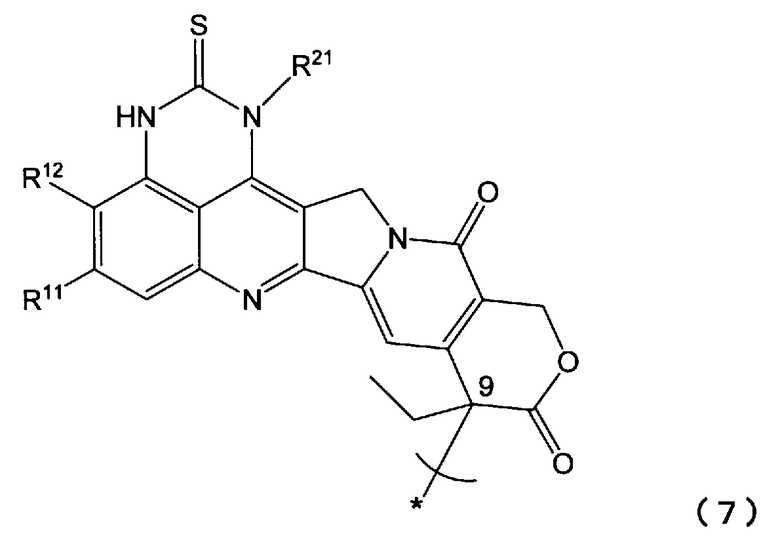
[где * указывает на место связывания; и
R11, R12 и R21 такие, как определены в п.15];
<20> растворимое в воде пролекарство по п.19, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R11 и R12 являются атомами водорода; и
R21 является атомом водорода или C1-C8-алкильной группой, которая может иметь заместитель, выбранный из группы D, описанной ниже:
Группа D: C1-C3-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C3-алкиламиногруппа, ди-C1-C3-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C3-алкоксигруппу и атом галогена);
<21> растворимое в воде пролекарство по пп. 19 или 20, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором Y является остатком соединения (Y-OH), включающим, по крайней мере, одну спиртовую гидроксильную группу, где соединение выбирают из группы, включающей:
a) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2(3H)тион-10,13(9H,15H)дион;
b) (9S)-9-этил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2(3H)тион-10,13(9H,15H)дион и
c) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2(3H)тион-10,13(9H,15H)дион;
<22> растворимое в воде пролекарство по п.15, или его фармацевтически приемлемую соль, или их гидрат или сольват, где Y является группой, представленной формулой (8):
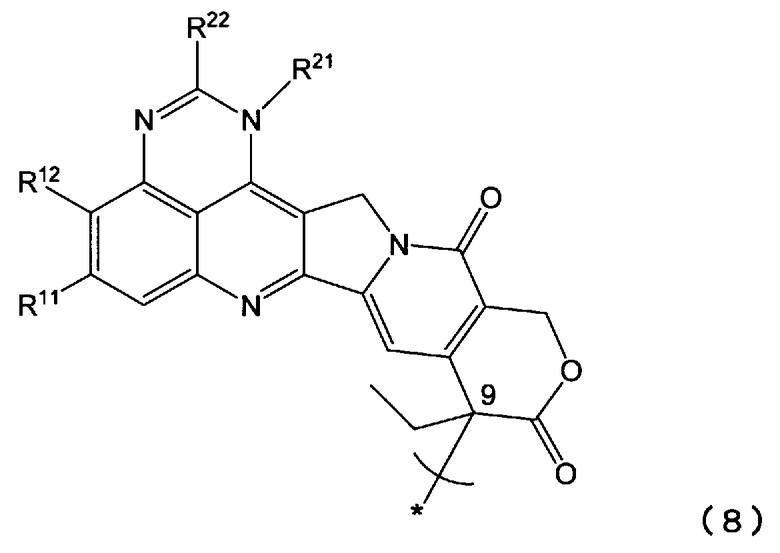
[где * указывает на место связывания; и
R11, R12, R21 и R22 такие, как определены в п.15];
<23> растворимое в воде пролекарство по п.22, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором R11 является атомом водорода;
R12 является атомом водорода или C1-C3-алкильной группой;
R21 является атомом водорода или C1-C8-алкильной группой, которая может иметь заместитель, выбранный из группы D, описанной ниже; и
R22 является атомом водорода, аминогруппой или C1-C6-алкильной группой, которая может иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже, C1-C6-алкоксигруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже, C1-C6-алкилтиогруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже, моно-C1-C6-алкиламиногруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже, или ди-C1-C6-алкиламиногрупой, которая может иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже:
Группа D: C1-C3-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C3-алкиламиногруппа, ди-C1-C3-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C3-алкоксигруппу и атом галогена);
<24> растворимое в воде пролекарство по пп. 22 или 23, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором Y является остатком соединения (Y-OH), включающим, по крайней мере, одну спиртовую гидроксильную группу, где соединение выбирают из группы, включающей:
a) (9S)-1-бутил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
b) (9S)-9-этил-9-гидрокси-1-[2-(4-морфолино)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
c) (9S)-9-этил-9-гидрокси-1-пропил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
d) (9S)-1-бензил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
e) (9S)-9-этил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
f) (9S)-2,9-диэтил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
g) (9S)-9-этил-9-гидрокси-1-(3-фенилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
h) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
i) (9S)-2,9-диэтил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
j) (9S)-2,9-диэтил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
k) (9S)-9-этил-1-гептил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1'2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
l) (9S)-9-этил-9-гидрокси-1-метил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
m) (9S)-9-этил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
n) (9S)-9-этил-1-гексил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
o) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
p) (9S)-1,9-диэтил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
q) (9S)-9-этил-9-гидрокси-1-[2-(4-метоксифенил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
r) (9S)-1-[2-(4-хлорфенил)этил]-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
s) (9S)-9-этил-1-[2-(4-фторфенил)этил]-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
t) (9S)-9-этил-1-[2-(4-фторфенил)этил]-9-гидрокси-2-метил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
u) (9S)-9-этил-9-гидрокси-1-(1-метилэтил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
v) (9S)-1-(3,3-диметилбутил)-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
w) (9S)-9-этил-9-гидрокси-2-метокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
x) (9S)-2,9-диэтил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
y) (9RS)-9-этил-9-гидрокси-4-метил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
z) (9S)-9-этил-9-гидрокси-1-(2-гидроксиэтил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
aa) (9S)-9-этил-9-гидрокси-1-(2-гидроксиэтил)-2-метил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
bb) (9S)-9-этил-9-гидрокси-2-метил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
cc) (9S)-2,9-диэтил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
dd) (9S)-9-этил-9-гидрокси-1-пентил-2-пропил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ee) (9S)-9-этил-9-гидрокси-2-гидроксиметил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ff) (9S)-9-этил-9-гидрокси-2-гидроксиметил-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
gg) (9S)-9-этил-9-гидрокси-2-гидроксиметил-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
hh) (9S)-2-хлорметил-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ii) (9S)-2-аминометил-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
jj) (9S)-9-этил-9-гидрокси-1-пентил-2-трифторметил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
kk) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-2-метилтио-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ll) (9S)-9-этил-2-этилтио-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
mm) (9S)-2-(диметиламино)-9-этил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион; и
nn) (9S)-2-(бутиламино)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
<25> растворимое в воде пролекарство по п.13, или его фармацевтически приемлемую соль, или их гидрат или сольват, в котором азольным противогрибковым агентом является триазол;
<26> растворимое в воде пролекарство по п.25, или его фармацевтически приемлемую соль, или их гидрат или сольват, содержащее, по крайней мере, один триазол, выбранный из группы, включающей:
a) 2-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил]-4-[4-(2,2,3,3-тетрафторпропокси)фенил]-3(2H,4H)-1,2,4-триазолон;
b) (+)-2-(2,4-дифторфенил)-3-метил-1-(1H-1,2,4-триазол-1-ил)-3-(6-(1H-1,2,4-триазол-1-ил)пиридазин-3-илтио)бутан-2-ол;
c) (2R)-2-(2,4-дифторфенил)-1-[3-[(E)-4-(2,2,3,3-тетрафторпропокси)стирил]-(1,2,4-триазол-1-ил)-3-(1,2,4-триазол-1-ил)]пропан-2-ол;
d) dl-трео-2-(2,4-дифторфенил)-3-метилсульфонил-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол;
e) (-)-4-[4-[4-[4-[[5-(2,4-дифторфенил)-5-(1H-1,2,4-триазол-1-илметил)тетрагидрофуран-3-ил]метокси]фенил]пиперазинил]фенил]-2-[(1S,2S)-1-этил-2-гидроксипропил]-3H-1,2,4-триазол-3-он;
f) (2R,3R)-3-[4-(4-цианофенил)тиазол-2-ил]-2-(2,4-дифторфенил)-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол;
g) 3-метил-3-метилтио-1-(1,2,4-триазол-1-ил)-2-(трифторметилфенил)бутан-2-ол;
h) (2R,3R)-3-[4-(4-цианофенил)тиазол-2-ил]-1-(1H-1,2,4-триазол-1-ил)-2-(2,4,5-трифторфенил)бутан-2-ол;
i) (2R,3R)-3-[4-(4-цианофенил)тиазол-2-ил]-2-(3-фторфенил)-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол и
j) (2R,3R)-3-[4-(4-цианофенил)тиазол-2-ил]-2-(2,5-дифторфенил)-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол;
<27> растворимое в воде пролекарство по п.1, представленное формулой (1), или его фармацевтически приемлемую соль, или их гидрат или сольват, содержащее, по крайней мере, одно растворимое в воде пролекарство, выбранное из группы, включающей:
(a) (9S)-9-этил-9-{[метил-(2-метиламиноэтил)амино]ацетокси}-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(b) (9S)-9-этил-9-(глицилсаркозилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(c) (9S)-9-{[(2-аминоэтил)метиламино]ацетокси}-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(d) (9S)-9-этил-9-(саркозилсаркозилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(e) (9S)-9-[2-(2-аминоэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(f) (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-иловый эфир (аминоацетилметиламино)уксусной кислоты;
(g) (9S)-9-{2-[(R-2-амино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(h) (9S)-9-{2-[(R-2-амино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(i) (9S)-9-этил-9-(N-метилаланил-N-метилаланилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион и
(j) (9S)-9-этил-9-(саркозил-N-метилаланилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
<28> фармацевтическую композицию, содержащую растворимое в воде пролекарство по любому из пп. 1-27, или его фармацевтически приемлемую соль, или их гидрат или сольват в качестве эффективного ингредиента;
<29> терапевтический агент для расстройств пролиферации клетки, содержащий растворимое в воде пролекарство по любому из пп. 14-24, или его фармацевтически приемлемую соль, или их гидрат или сольват в качестве эффективного ингредиента;
<30> терапевтический агент по п.29, где расстройством пролиферации клеток является рак;
<31> терапевтический агент по п.30, где раком является твердая опухоль;
<32> терапевтический агент по пп. 30 или 31, где раком является рак кишечника, рак легких, рак груди, рак желудка, рак шейки матки и/или рак мочевого пузыря;
<33> противогрибковый агент, содержащий растворимое в воде пролекарство по любому из пп. 25-27, или его фармацевтически приемлемую соль, или их гидрат или сольват, в качестве эффективного ингредиента; и
<34> применение соединения, представленного формулой (9), для производства растворимого в воде пролекарства, представленного формулой (2), его фармацевтически приемлемой соли, их гидрата или сольвата:
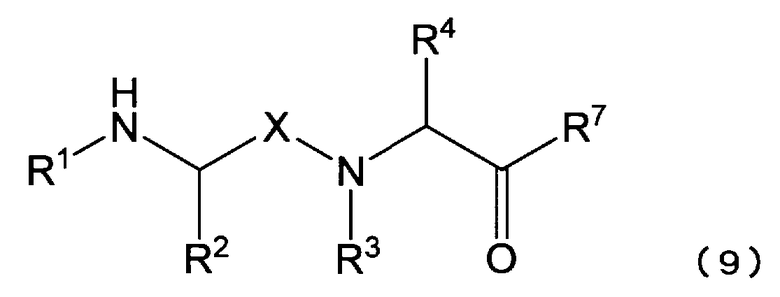
[где X является C=O или C1-C3-алкиленовой группой;
R1 является атомом водорода или C1-C6-алкильной группой;
атом азота, связанный с R1, может быть защищен защитной группой;
R2 и R4, каждый независимо, является атомом водорода, C1-6-алкильной группой или боковой цепью аминокислоты;
R3 является C1-C6-алкильной группой; и
R7 является атомом галогена или группой, представленной OR8 (где R8 является атомом водорода или C1-C6-алкильной группой)],

(где Y является остатком соединения, представленного Y-OH, который содержит спиртовую гидроксильную группу; и
X, R1, R2, R3 и R4 такие, как определены для формулы (9));
<35> способ получения соединения, представленного формулой (2);

(где X является C=O или C1-C3-алкиленовой группой;
R1 является атомом водорода или C1-C6-алкильной группой;
R2 и R4, каждый независимо, является атомом водорода, C1-6-алкильной группой или боковой цепью аминокислоты;
R3 является C1-C6-алкильной группой;
Y является остатком соединения, представленного Y-OH, который содержит спиртовую гидроксильную группу), где способ включает стадии:
взаимодействия соединения, представленного формулой (9)

[где X, R1, R2, R3 и R4 такие, как определены для формулы (2);
R7 является атомом галогена или группой, представленной OR8 (где R8 является атомом водорода или C1-C6-алкильной группой); и
атом азота, связанный с R1, может быть защищен защитной группой]
с соединением, представленным Y-OH, которое содержит спиртовую гидроксильную группу, с получением соединения, представленного формулой (2);
<36> соединение, представленное формулой (9), его фармацевтически приемлемую соль, или их гидрат или сольват:

[где X является C=O или C1-C3-алкиленовой группой;
R1 является атомом водорода или C1-C6-алкильной группой;
атом азота, связанный с R1, может быть защищен защитной группой;
R2 и R4, каждый независимо, является атомом водорода, C1-6-алкильной группой или боковой цепью аминокислоты;
R3 является C1-C6-алкильной группой; и
R7 является атомом галогена или группой, представленной OR8 (где R8 является атомом водорода или C1-C6-алкильной группой)].
В данном описании термин «алкильная группа» относится к одновалентной группе, которую получают удалением одного атома водорода из алифатического углеводорода и которая частично состоит из гидрокарбильной или углеводородной структуры, включающей атомы водорода и углерода, и не содержит гетероатом или ненасыщенную связь углерод-углерод в основной цепи. Алкильная группа может иметь прямую или разветвленную цепь.
Термин «C1-C3-алкильная группа» относится к алкильной группе, содержащей от 1 до 3 атомов углерода, термин «C1-C6-алкильная группа» относится к алкильной группе, содержащей от 1 до 6 атомов углерода, термин «C1-C8-алкильная группа» относится к алкильной группе, содержащей от 1 до 8 атомов углерода, и термин «C1-C10-алкильная группа» относится к алкильной группе, содержащей от 1 до 10 атомов углерода.
Конкретные примеры алкильной группы включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, изобутильную группу, пентильную группу, изопентильную группу, 2,3-диметилпропильную группу, гексильную группу, 2,3-диметилгексильную группу, 1,1-диметилпентильную группу, гептильную группу и октильную группу.
В данном описании термин «алкиленовая группа» относится к двухвалентной группе, полученной удалением второго атома водорода из алкильной группы, описанной выше, и примеры алкиленовой группы предпочтительно включают C1-C3-алкиленовую группу, более предпочтительно включают C1-C2-алкиленовую группу. Конкретные примеры алкиленовой группы включают метиленовую группу, 1,2-этиленовую группу, 1,1-этиленовую группу, 1,3-пропиленовую группу, тетраметиленовую группу, пентаметиленовую группу и гексаметиленовую группу.
В данном описании термин «алкоксигруппа» относится к -O-R' группе, в которой R' является алкильной группой, определенной выше. Примеры «C1-C6-алкоксигруппы» включают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, пентоксигруппу, 3-метилбутоксигруппу и 2,2-диметилпропоксигруппу.
В данном описании термин «алкилтиогруппа» относится к -S-R' группе, в которой в которой R' является алкильной группой, определенной выше. Примеры «C1-C8-алкилтиогруппы» включают метилтиогруппу, этилтиогруппу, пропилтиогруппу, бутилтиогруппу, пентилтиогруппу, гексилтиогруппу, гептилтиогруппу и октилтиогруппу.
В данном описании термин «гидроксигруппа» относится к HO-группе.
В данном описании термин «атом галогена» относится к атому фтора, атому хлора, атому брома или атому иода.
В данном описании термин «аминогруппа» относится к NH2-группе и включает аминогруппы, защищенные формилом, ацетилом, тритилом, трет-бутоксикарбонилом, бензилом, бензилоксикарбонилом и такими защитными группами, которые хорошо известны в данной области техники. Предпочтительной аминогруппой является NH2-.
В данном описании термин «моноалкиламиногруппа» относится к -NH-R' группе, в которой R' является алкильной группой, определенной выше, и включает аминогруппы, защищенные формилом, ацетилом, тритилом, трет-бутоксикарбонилом, бензилом, бензилоксикарбонилом и такими защитными группами, которые хорошо известны в данной области техники. Примеры «моно-C1-C6-алкиламиногруппы» предпочтительно включают N-метиламиногруппу, N-этиламиногруппу, N-пропиламиногруппу, N-изопропиламиногруппу, N-бутиламиногруппу, N-(1-метилпропил)аминогруппу, N-(2-метилпропил)аминогруппу и N-пентиламиногруппу, более предпочтительно включают N-этиламиногруппу, N-пропиламиногруппу и N-бутиламиногруппу.
В данном описании термин «диалкиламиногруппа» относится к -NR'R'' группе, в которой R' и R'', каждый независимо, является алкильной группой, определенной выше. Примеры «ди-C1-C6-алкиламиногруппы» предпочтительно включают N,N-диметиламиногруппу, N,N-диэтиламиногруппу, N,N-дипропиламиногруппу, N,N-диизопропиламиногруппу, N,N-дибутиламиногруппу, N-метил-N-этиламиногруппу и N-метил-N-пропиламиногруппу, более предпочтительно включают N,N-диметиламиногруппу и N,N-диэтиламиногруппу.
В данном описании термин «третичная аминогруппа» относится к группе, в которой все атомы водорода аминогруппы замещены.
В данном описании термин «сульфонильная группа» относится к группе, представленной -SO2-.
В данном описании термин «спиртовой остаток» относится к части, представленной Y, в спирте, представленном Y-OH.
В данном описании термин «C3-C7-циклоалкильная группа» относится к 3-7-членному кольцу, которое не содержит гетероатом в кольце. Примеры «циклоалкильной группы» предпочтительно включают циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу и циклогептильную группу и более предпочтительно включают циклопентильную группу и циклогексильную группу.
В данном описании термин «гетероцикл» относится к 3-10-членному кольцу, включающему один или более гетероатома, выбранного из N, S и O. Предпочтительные примеры таких колец включают оксазолильную группу, тиазолильную группу, 4,5-дигидроксазолильную группу, 4,5-дигидротиазолильную группу, фурильную группу, пирролильную группу, тиенильную группу, имидазолильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиразинильную группу, пиримидинильную группу, триазинильную группу, оксадиазолильную группу, тиадиазолильную группу, пирролидинильную группу, тетрагидротиенильную группу, тетрагидрофурильную группу, морфолинильную группу, пиперидильную группу, пиперазинильную группу и 1-метилпиперазинильную группу и более предпочтительно включают имидазолильную группу, пиридильную группу, морфолинильную группу и пирролидинильную группу.
В данном описании термин «арильное кольцо» относится к ароматической карбоциклической группе, или более предпочтительно к 6-10-членному ароматическому кольцу или частично ароматическому кольцу, и их примеры включают фенильное, нафтильное и тетрагидронафтильное кольца, более предпочтительно фенильное и нафтильное кольца и наиболее предпочтительно фенильные кольца.
В данном описании термин «фенил-C1-C8-алкильная группа» относится к группе, в которой один из атомов водорода C1-C8-алкильной группы замещен фенильной группой.
В данном описании термин «гетероциклическая-C1-C8-алкильная группа» относится к группе, в которой один из атомов водорода C1-C8-алкильной группы замещен гетероциклом.
В данном описании термин «алкоксифенил-C1-C8-алкильная группа» относится к группе, в которой один из атомов водорода C1-C8-алкильной группы замещен алкоксифенильной группой. Термин «алкоксифенильная группа» относится к группе, в которой один из атомов водорода фенильной группы замещен алкоксигруппой.
В данном описании термин «галогенфенил-C1-C8-алкильная группа» относится к группе, в которой один из атомов водорода C1-C8-алкильной группы замещен атомом галогена.
Термин «фармацевтически приемлемая соль» относится к обычной соли растворимого в воде пролекарства, представленного формулой (1), которую получают с подходящей нетоксичной органической или неорганической кислотой, или органическим или неорганическим основанием, и которая сохраняет биологическую эффективность и характеристики пролекарства.
Примеры соли, полученной с кислотой, включают соли, полученные из неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота; и соли, полученные из органических кислот, таких как п-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, яблочная кислота, молочная кислота и фумаровая кислота.
Примеры солей с основанием включают соли, полученные из гидроксида калия, гидроксида натрия, гидроксида аммония и гидроксида четвертичного аммония, такого как гидроксид тетраметиламмония.
Растворимое в воде пролекарство в соответствии с данным изобретением может абсорбировать влагу, абсорбировать воду или образовывать гидраты, если его выдерживать в атмосферных условиях, и такие гидраты также включены в объем данного изобретения.
Далее, растворимое в воде пролекарство в соответствии с данным изобретением может абсорбировать определенные другие типы растворителей, с получением сольватов, и такие сольваты также включены в объем данного изобретения.
Примеры «боковой цепи аминокислоты» в данном описании включают боковые цепи природных аминокислот и боковые цепи искусственных аминокислот.
Примеры «боковых цепей природных аминокислот» предпочтительно включают боковые цепи существующих в природе аминокислот, такие как метильная группа, изопропильная группа, 2-метилпропильная группа, 1-метилпропильная группа, бензильная группа, индол-3-илметильная группа, 2-(метилтио)этильная группа, 4-аминобутильная группа и 3-аминопропильная группа, более предпочтительно боковые цепи природных липофильных аминокислот, такие как метильная группа, 2-метилпропильная группа, бензильная группа и индол-3-илметильная группа.
Примеры «боковых цепей искусственных аминокислот» предпочтительно включают C5-C12-алкильные группы, циклоалкилметильные группы, замещенные или незамещенные арилметильные группы, (циклоалкилтио)метильные группы и алкилтио-(CH2)r-, где r равно целому числу 1 или 2.
Примеры «C5-C12-алкильной группы» включают прямые или разветвленные алкильные группы, включающие от 5 до 12 атомов углерода; и более предпочтительно C8-C12-прямые алкильные группы, такие как н-октильная группа, нонильная группа, децильная группа, ундецильная группа и додецильная группа.
Примеры «алкилтио-(CH2)r-» включают алкилтиометильные группы или алкилтиоэтильные группы, включающие прямые или разветвленные алкильные цепи, содержащие от 2 до 10 атомов углерода, такие как этилтиометильная группа, этилтиоэтильная группа, н-пропилтиометильная группа, н-бутилтиометильная группа, н-пентилтиометильная группа, н-октилтиометильная группа, н-нонилтиометильная группа, н-децилтиометильная группа и трет-бутилтиометильная группа; и более предпочтительно этилтиоэтильная группа, н-пропилтиометильная группа и н-бутилтиометильная группа.
Примеры «замещенной или незамещенной арилметильной группы» предпочтительно включают 4-фенилбензильную группу, нафто-2-илметильную группу, [4-(4-гидроксифенокси)фенил]метильную группу и (4-низший-алкоксифенил)метильную группу (термин «низший алкокси» относится к прямой или разветвленной алкильной цепи, содержащей от 1 до 6 атомов углерода, предпочтительные примеры включают метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу и изопропоксигруппу). Наиболее предпочтительные варианты «замещенной или незамещенной арилметильной группы» включают 4-фенилбензильную группу, нафто-2-илметильную группу, (4-метоксифенил)метильную группу и [4-(4-гидроксифенокси)фенил]метильную группу.
В данном описании термин «нерастворимое соединение» относится ко всем соединениям, нерастворимым в воде, и их примеры включают соединения, растворимость которых в дистиллированной воде предпочтительно составляет 0,1 мг/ил или менее (растворимость соответствует характеристикам, представленным в “Japanese Pharmacopoeia, 14th edition, Ggeneric Rule 23”). Примеры таких соединений включают камптотецины, азольные противогрибковые агенты, таксаны и противораковые нуклеотиды.
В данном описании термин «солюбилизирующие боковые цепи» относится к группе, которая связывается с «Y», или, например, в уравнении (1) он относится к «R1-NH-W-CO-O-».
В данном описании термин «активная форма» относится к соединению (Y-O-), которое получают гидролизом растворимого в воде пролекарства, его фармацевтически приемлемой соли или их гидрата или сольвата.
Термин «таксаны» в соответствии с данным изобретением относится к таксолу [Front. Biotechnol. Pharm. (2000), 1, 336-348], таксотеру [J. Med. Aromat. Plant Sci. (2001), 22/4A-23/lA 4-5], IDN 5109 [Chirality, (2000), 12(5/6), 431-441], BMS 188797 [Clinical Cancer Research. 5 (suppl.), 3859, Nov 1999] и BMS184476 [J. Clinical Oncology 19: 2493-2503, 1 May 2001].
В данном описании термин «камптотецины» [(a) Cancer Chemotherapy and Biotherapy: Principle and Practice, 2nd edition, Lippincott-Ravenmeans, p.463-484, (b) Biochim. Biophys. Acta (1998), 1400(1-3), 107-119] относится к любому соединению, содержащему основную цепь камптотецина, такому как камптотецин, SN-38, 9-аминокамптотецин, 9-нитрокамптотецин и BN-80915 [Anti-cancer Drugs (2001), 12(1), 9-19].
В данном описании термин «противораковые нуклеозиды» относятся к производным цитидина [Cancer Chemotherapy and Biotherapy: Principle and Practice, 2nd edition, Lippincott-Ravenmeans, p.213-233], таким как DFDC (гемцитабин), DMDC [Clin. Cancer Res. (2000), 6(6), 2288-2294], FMDC [Curr. Opin. Invest. Drugs (PharmaPress Ltd.) (2000), 1(1), 135-140], Ara-C, децитабин, [IDrugs (2000), 3(12), 1525-1533], троксацитабин [Clin. Cancer Res. (2000), 6(4), 1574-1588], 2'-циано-2'-деоксицитидин (CNDAC), 3'-этинилцитидин (TAS106) [Jpn. J. Cancer Res. (2001), 92(3), 343-351], 5-фтор-5'-деоксицитидин [Bioorg. Med. Chem. Lett., (2000), 8, 1697-1706] и 5-винил-5'-деоксицитидин, или к производным аденозина [Cancer Chemotherapy and Biotherapy: Principle and Practice, 2nd edition, Lippincott-Ravenmeans, p.235-252], таким как флударабин и кладрибин.
В данном описании термин «расстройство пролиферации клеток» относится к расстройству, вызываемому дефектом системы трансдукции внутриклеточного сигнала, или механизма трансдукции сигнала определенного белка, примеры включают такие расстройства, которые вызывают рак.
Среди пролекарств в соответствии с данным изобретением, представленных формулой (1), примерами предпочтительных соединений являются следующие.
Среди растворимых в воде пролекарств, представленных формулой (1), предпочтительны соединения, представленные формулой (2) или (3).
В соединениях, представленных формулой (2), R1 предпочтительно является атомом водорода, метильной группой или этильной группой; и более предпочтительно атомом водорода или метильной группой; и особенно предпочтительно атомом водорода.
X предпочтительно является карбонильной группой или метиленовой группой, более предпочтительно карбонильной группой.
R2 предпочтительно является атомом водорода или метильной группой.
R4 предпочтительно является атомом водорода или метильной группой.
R3 предпочтительно является C1-C3-алкильной группой, более предпочтительно метильной группой или этильной группой и особенно предпочтительно метильной группой.
Примеры предпочтительных сочетаний Х и R1 - R4, которые составляют солюбилизирующую боковую цепь соединения, представленного формулой (2), показаны ниже, но данное изобретение не должно рассматриваться как ограниченное ими.

В таблице 1 примеры соединений формулы (2), которые включают солюбилизирующие боковые цепи, предпочтительно включают соединения со ссылочными номерами 1, 2, 3 и 4, более предпочтительно такие, которые включают солюбилизирующие боковые цепи, со ссылочными номерами 1 и 2.
Если присутствуют такие солюбилизирующие боковые цепи, даже если Y-OH является нерастворимым соединением, оно может быть превращено в соединение, имеющее хорошую растворимость в воде. Например, такое растворимое в воде пролекарство может стабильно существовать в течение длительного периода времени в растворе при pH 4 или ниже; но при pH 5 или выше, особенно в физиологических условиях при pH 7-8, активная форма, полученная из вторичной или третичной спиртовой гидроксильной группы, может быть количественно и быстро диссоциирована в течение короткого периода времени.
В соединении, представленном формулой (3), R1 предпочтительно является атомом водорода, метильной группой или этильной группой; и более предпочтительно атомом водорода или метильной группой; особенно предпочтительно атомом водорода.
В уравнении (3) n предпочтительно равно от 1 до 3, более предпочтительно 1.
Если n равно 1, R5 предпочтительно является атомом водорода или -COOR6 (R6 является C1-C3-алкильной группой) и более предпочтительно атомом водорода, -COOCH3 или -COOC2H5.
Если n равно от 2 до 6, R5 предпочтительно является атомом водорода.
Примеры предпочтительных сочетаний n, R1 и R5, которые составляют солюбилизирующую боковую цепь соединения, представленного формулой (3), показаны ниже, но данное изобретение не должно рассматриваться как ограниченное ими.

В таблице 2 примеры соединений формулы (3), которые включают солюбилизирующую боковую цепь, предпочтительно включают соединения со ссылочными номерами 1, 2, 3, 4, 5 и 6, более предпочтительно соединения со ссылочными номерами 1, 3 и 4.
Если присутствуют такие солюбилизирующие боковые цепи, даже если Y-OH является нерастворимым соединением, оно может быть превращено в соединение, имеющее хорошую растворимость в воде. Например, такое растворимое в воде пролекарство может стабильно существовать в течение длительного периода времени в растворе при pH 4 или ниже; но при pH 5 или выше, особенно в физиологических условиях при pH 7-8, активная форма, полученная из вторичной или третичной спиртовой гидроксильной группы, может быть количественно и быстро диссоциирована в течение короткого периода времени.
В данном изобретении Y в формуле (1) представляет собой остаток соединения, представленного Y-OH, который содержит спиртовую гидроксильную группу.
Гидроксильная группа Y-OH предпочтительно является вторичной или третичной спиртовой гидроксильной группой. Такое соединение Y-OH может быть нерастворимым соединением, но даже если оно нерастворимое, оно будет иметь хорошую растворимость в воде при присоединении указанной выше группы. Более того, растворимое в воде пролекарство может стабильно существовать в течение длительного периода времени в растворе при pH 4 или ниже; но при pH 5 или выше, особенно в физиологических условиях при pH 7-8, активная форма (Y-O-), производная из спиртовой гидроксильной группы, может быть количественно и быстро диссоциирована в течение короткого периода времени.
Соединение Y-OH, включенное в указанную выше формулу в соответствии с данным изобретением, которое может быть присоединено к солюбилизирующей группе, особенно не ограничено, пока оно является соединением, содержащим спиртовую гидроксильную группу, предпочтительно вторичную или третичную спиртовую гидроксильную группу, более предпочтительно третичную спиртовую гидроксильную группу.
Примеры таких соединений предпочтительно включают камптотецины, азольные противогрибковые агенты, таксаны и противораковые нуклеотиды.
Камптотецины
Примеры групп, полученных из камптотецинов, включают группы, представленные Y, показанные ниже.
Указанный Y представляет собой группу, представленную формулой (4):

где * указывает на место связывания;
m равно либо 0, либо 1;
R11 является атомом водорода, атомом галогена или C1-C6-алкильной группой;
R12 является атомом водорода, атомом галогена, C1-C6-алкильной группой или гидроксильной группой;
R13 является атомом водорода, аминогруппой, нитрогруппой или (диметиламино)метильной группой;
R14 является атомом водорода, C1-C6-алкильной группой, (4-метилпиперазинил)метильной группой или (трет-бутоксиимино)метильной группой; и
R13 и R14, и R11 и R12, могут, соответственно, быть связаны друг с другом с образованием 5- или 6-членного кольца, где 5- или 6-членное кольцо может содержать от 1 до 2 гетероатомов и может иметь от 1 до 3 заместителей, выбранных из группы А, перечисленной ниже, где заместители из группы А могут также иметь от 1 до 3 заместителей, выбранных из группы В, перечисленной ниже:
Группа A: C1-C10-алкильная группа, аминогруппа, моно-C1-C8-алкиламиногруппа, ди-C1-C8-алкиламиногруппа, C1-C8-алкоксигруппа, C1-C8-алкилтиогруппа и группа, представленная X= (где X является атомом кислорода или атомом серы);
Группа B: C1-C6-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C6-алкиламиногруппа, ди-C1-C6-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C6-алкоксигруппу, атом галогена, аминогруппу, моно-C1-C6-алкиламиногруппу и ди-C1-C6-алкиламиногруппу).
В группе, представленной формулой (4), стереохимия атома углерода, к которому присоединен атом кислорода, полученный из спиртовой гидроксильной группы, предпочтительно имеет S-конфигурацию.
Предпочтительный вариант соединений, представленных формулой (4), включает соединения, в которых R11 предпочтительно является атомом водорода, R12 предпочтительно является атомом водорода или гидроксильной группой, R13 является атомом водорода или (диметиламино)метильной группой и R14 является атомом водорода или этильной группой.
Примеры соединений, представленных формулой (4), включают следующие соединения:
4(S)-этил-4-гидрокси-1H-пирано[3',4':6,7]индолизино[1,2-b]хинолин-3,14(4H,12H)дион(камптотецин);
9-аминокамптотецин;
9-нитрокамптотецин;
5(R)-этил-9,10-дифтор-1,4,5,13-тетрагидро-5-гидрокси-3H,15H-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15-дион (BN-80915) и
7-этил-10-гидроксикамптотецин (SN-38).
Другой предпочтительный вариант соединений, представленных формулой (4), включает соединения, в которых указанный Y представлен общей формулой (5):

где * указывает на место связывания;
R11 и R12 имеют такие же значения, как R11 и R12, определенные для формулы (4), соответственно;
и
Z является -NH-C(=X)-N(R21)- или -N=C(R22)-N(R21)-.
Где R21 является атомом водорода или C1-C10-алкильной группой, которая может иметь 1-3 заместителя, выбранных из группы В, перечисленной ниже:
Группа B: C1-C6-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C6-алкиламиногруппа, ди-C1-C6-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C6-алкоксигруппу, атом галогена, аминогруппу, моно-C1-C6-алкиламиногруппу и ди-C1-C6-алкиламиногруппу);
R22 является атомом водорода, аминогруппой или C1-C6-алкильной группой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, C1-C6-алкоксигруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, C1-C6-алкилтиогруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, моно-C1-C6-алкиламиногруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже, или ди-C1-C6-алкиламиногруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы С, перечисленной ниже:
Группа C: C1-C6-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C6-алкоксигруппу, аминогруппу, моно-C1-C6-алкиламиногруппу и ди-C1-C6-алкиламиногруппу); и
X является атомом кислорода или атомом серы.
Далее, предпочтительные примеры соединений, в которых Y представлен формулой (5), включают соединения, которые содержат Y, представленный формулами (6), (7) или (8).
Указанный выше Y представляет собой растворимое в воде пролекарство, представленное формулой (6) ниже.

R11, R12 и R21 такие, как определены в формулах (4) и (5).
В формуле (6) R11 и R12 предпочтительно являются атомами водорода.
R21 является атомом водорода или C1-C8-алкильной группой, которая может иметь заместитель, выбранный из группы D, описанной ниже:
Группа D: C1-C3-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C3-алкиламиногруппа, ди-C1-C3-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C3-алкоксигруппу и атом галогена).
Более предпочтительно R21 является C1-C8-алкильной группой, фенил-C1-C8-алкильной группой, гетероциклической C1-C8-алкильной группой, алкоксифенил-C1-C8-алкильной группой или галогенированной фенил-C1-C8-алкильной группой.
Еще более предпочтительно R21 является метильной группой, этильной группой, н-пропильной группой, 1-метилэтильной группой, н-бутильной группой, 1,1-диметилэтильной группой, 2-метилпропильной группой, 2,2-диметилпропильной группой, н-пентильной группой, 3-метилбутильной группой, 2-н-гексильной группой, 3,3-диметилбутильной группой, н-гептильной группой, н-октильной группой, бензильной группой, фенетильной группой, 2-(диметиламино)этильной группой, 2-(4-морфолино)этильной группой, 3-(диметиламино)пропильной группой, 2-(пиридин-2-ил)этильной группой, 2-(пиридин-3-ил)этильной группой, 2-(4-метоксифенил)этильной группой, 2-(4-хлорфенил)этильной группой, 2-(4-фторфенил)этильной группой или 3-фенилпропильной группой.
Примеры таких соединений, представленных формулой (6), включают те, в которых Y является остатком соединения (Y-OH), содержащим, по крайней мере, одну спиртовую гидроксильную группу (например, в положении 9), где соединение выбирают из группы, включающей:
а) (9S)-1-бутил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
b) (9S)-9-этил-9-гидрокси-1-[2-(4-морфолино)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
с) (9S)-1-[3-(диметиламино)пропил]-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
d) (9S)-9-этил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
e) (9S)-9-этил-9-гидрокси-1-[2-(пиридин-2-ил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
f) (9S)-9-этил-1-гептил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
g) (9S)-9-этил-9-гидрокси-1-пропил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
h) (9S)-9-этил-9-гидрокси-1-[2-(пиридин-3-ил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
i) (9S)-9-этил-9-гидрокси-1-(3-фенилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
j) (9S)-9-этил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
k) (9S)-9-этил-1-гексил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
l) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
m) (9S)-9-этил-9-гидрокси-1-[2-(4-метоксифенил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
n) (9S)-1-бензил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
o) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
p) (9S)-1,9-диэтил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
q) (9S)-1-[2-(4-хлорфенил)этил]-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
r) (9S)-9-этил-1-[2-(4-фторфенил)этил]-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
s) (9S)-9-этил-9-гидрокси-1-(1-метилэтил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион и
t) (9S)-1-(3,3-диметилбутил)-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион.
Среди них более предпочтительными являются следующие соединения:
a) (9S)-1-бутил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
b) (9S)-9-этил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
c) (9S)-9-этил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
d) (9S)-9-этил-1-гексил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
e) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
f) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
g) (9S)-1-[2-(4-хлорфенил)этил]-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион;
h) (9S)-9-этил-1-[2-(4-фторфенил)этил]-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион и
i) (9S)-1-(3,3-диметилбутил)-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2,10,13(3H,9H,15H)трион.
Указанный выше Y представляет собой соединение, представленное формулой (7) ниже.

R11, R12 и R21 такие, как определены в формулах (4) и (5).
В формуле (7) R11 и R12 предпочтительно являются атомами водорода.
R21 предпочтительно является атомом водорода или C1-C8-алкильной группой, которая может иметь заместитель, выбранный из группы D, описанной ниже:
Группа D: C1-C3-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C3-алкиламиногруппа, ди-C1-C3-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C3-алкоксигруппу и атом галогена).
Более предпочтительно R21 является фенильной группой или C1-C6-алкильной группой, еще более предпочтительно фенильной группой, 3-метилбутильной группой или н-пентильной группой.
Примеры таких соединений, представленных формулой (7), включают те, в которых Y является остатком соединения (Y-OH), содержащим, по крайней мере, одну спиртовую гидроксильную группу (например, в положении 9), где соединение выбирают из группы, включающей:
a) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2(3H)тион-10,13(9H,15H)дион;
b) (9S)-9-этил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2(3H)тион-10,13(9H,15H)дион и
c) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-2(3H)тион-10,13(9H,15H)дион.
Соединения, в которых Y представлен формулой (8), такие, как описаны ниже.

R11, R12, R21 и R22 имеют те же значения, что R11, R12, R21 и R22, соответственно, в формулах (4) и (5).
В формуле (8)
(i) R11 предпочтительно является атомом водорода.
(ii) R12 предпочтительно является атомом водорода или C1-C3-алкильной группой и более предпочтительно является атомом водорода или метильной группой.
(iii) R21 предпочтительно является атомом водорода или C1-C8-алкильной группой, которая может иметь заместитель, выбранный из группы D, описанной ниже:
Группа D: C1-C3-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C3-алкиламиногруппа, ди-C1-C3-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C3-алкоксигруппу и атом галогена).
(iv) Более предпочтительно R21 является метильной группой, этильной группой, н-пропильной группой, 1-метилэтильной группой, н-бутильной группой, 1,1-диметилэтильной группой, 2-метилпропильной группой, 2,2-диметилпропильной группой, н-пентильной группой, 3-метилбутильной группой, 2-н-гексильной группой, 3,3-диметилбутильной группой, н-гептильной группой, н-октильной группой, бензильной группой, фенетильной группой, 2-(диметиламино)этильной группой, 2-(4-морфолино)этильной группой, 3-(диметиламино)пропильной группой, 2-(пиридин-2-ил)этильной группой, 2-(пиридин-3-ил)этильной группой, 2-(4-метоксифенил)этильной группой, 2-(4-хлорфенил)этильной группой, 2-(4-фторфенил)этильной группой или 3-фенилпропильной группой.
(v) R22 предпочтительно является атомом водорода, аминогруппой, C1-C6-алкильной группой, С1-С6-алкоксигруппой, С1-С6-алкилтиогруппой, которые могут иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже, моно-C1-C6-алкиламиногруппой, которая может иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже, или ди-C1-C6-алкиламиногрупой, которая может иметь от 1 до 3 заместителей, выбранных из группы D, описанной ниже:
Группа D: C1-C3-алкоксигруппа, гидроксигруппа, атом галогена, аминогруппа, моно-C1-C3-алкиламиногруппа, ди-C1-C3-алкиламиногруппа, C3-C7-циклоалкильная группа, гетероцикл и арильное кольцо (которое может иметь от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, C1-C3-алкоксигруппу и атом галогена).
(vi) Более предпочтительно R22 является атомом водорода, метильной группой, этильной группой, пропильной группой, гидроксиметильной группой, аминометильной группой, (метиламино)метильной группой, (диметиламино)метильной группой, хлорметильной группой, трифторметильной группой, фенильной группой, 2-пиридильной группой, метоксигруппой, этоксигруппой, метилтиогруппой, этилтиогруппой, метиламиногруппой, бутиламиногруппой или диметиламиногруппой.
Согласно указанным выше (i)-(vi) предпочтительные варианты по возможности могут быть объединены. Примеры разрешенных сочетаний включают (i), (ii), (iii) и (v); (i), (ii), (iii) и (vi); (i), (ii), (iv) и (v); и (i), (ii), (iv) и (vi).
Примеры таких соединений, представленных формулой (8), включают те, в которых Y является остатком соединения (Y-OH), содержащим, по крайней мере, одну спиртовую гидроксильную группу (например, в положении 9), где соединение выбирают из группы, включающей:
a) (9S)-1-бутил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
b) гидрохлорид (9S)-9-этил-9-гидрокси-1-[2-(4-морфолино)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона;
c) (9S)-9-этил-9-гидрокси-1-пропил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
d) (9S)-1-бензил-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
e) (9S)-9-этил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
f) (9S)-2,9-диэтил-9-гидрокси-1-фенетил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
g) (9S)-9-этил-9-гидрокси-1-(3-фенилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
h) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
i) (9S)-2,9-диэтил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
j) (9S)-2,9-диэтил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
k) (9S)-9-этил-1-гептил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1'2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
l) (9S)-9-этил-9-гидрокси-1-метил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
m) (9S)-9-этил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
n) (9S)-9-этил-1-гексил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
o) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
p) (9S)-1,9-диэтил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
q) (9S)-9-этил-9-гидрокси-1-[2-(4-метоксифенил)этил]-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
r) (9S)-1-[2-(4-хлорфенил)этил]-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
s) (9S)-9-этил-1-[2-(4-фторфенил)этил]-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
t) (9S)-9-этил-1-[2-(4-фторфенил)этил]-9-гидрокси-2-метил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
u) (9S)-9-этил-9-гидрокси-1-(1-метилэтил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
v) (9S)-1-(3,3-диметилбутил)-9-этил-9-гидрокси-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
w) (9S)-9-этил-9-гидрокси-2-метокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
x) (9S)-2,9-диэтил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
y) (9RS)-9-этил-9-гидрокси-4-метил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
z) (9S)-9-этил-9-гидрокси-1-(2-гидроксиэтил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
aa) (9S)-9-этил-9-гидрокси-1-(2-гидроксиэтил)-2-метил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
bb) (9S)-9-этил-9-гидрокси-2-метил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
cc) (9S)-2,9-диэтил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
dd) (9S)-9-этил-9-гидрокси-1-пентил-2-пропил-1H,12H-пирано[3'',4'':6',7]индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ee) (9S)-9-этил-9-гидрокси-2-гидроксиметил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ff) (9S)-9-этил-9-гидрокси-2-гидроксиметил-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
gg) (9S)-9-этил-9-гидрокси-2-гидроксиметил-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
hh) (9S)-2-хлорметил-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ii) (9S)-2-аминометил-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
jj) (9S)-9-этил-9-гидрокси-1-пентил-2-трифторметил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
kk) (9S)-9-этил-9-гидрокси-1-(3-метилбутил)-2-метилтио-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
ll) (9S)-9-этил-2-этилтио-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
mm) гидрохлорид (9S)-2-(диметиламино)-9-этил-9-гидрокси-1-(2-метилпропил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона и
nn) гидрохлорид (9S)-2-(бутиламино)-9-этил-9-гидрокси-1-(3-метилбутил)-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона.
Среди указанных выше камптотецинов особенно предпочтительные примеры включают следующие соединения:
4(S)-этил-4-гидрокси-1H-пирано[3',4':6,7]индолизино[1,2-b]хинолин-3,14(4H,12H)дион(камптотецин);
5(R)-этил-9,10-дифтор-1,4,5,13-тетрагидро-5-гидрокси-3H,15H-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15-дион (BN-80915);
o) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
bb) (9S)-9-этил-9-гидрокси-2-метил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион и
ee) (9S)-9-этил-9-гидрокси-2-гидроксиметил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион.
Азольные противогрибковые агенты
Если Y является остатком, полученным из азольного противогрибкового агента, примеры азольных противогрибковых агентов включают триазолы.
Примеры таких азольных противогрибковых агентов включают, по крайней мере, одно соединение, выбранное из группы, включающей:
(2R,3R)-3-{4-(4-цианофенил)тиазол-2-ил}-2-(2,5-дифторфенил)-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол;
2-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил]-4-[4-(2,2,3,3-тетрафторпропокси)фенил]-3(2H,4H)-1,2,4-триазолон;
(+)-2-(2,4-дифторфенил)-3-метил-1-(1H-1,2,4-триазол-1-ил)-3-(6-(1H-1,2,4-триазол-1-ил)пиридазин-3-илтио)бутан-2-ол;
(2R)-2-(2,4-дифторфенил)-1-[3-[(E)-4-(2,2,3,3-тетрафторпропокси)стирил]-(1,2,4-триазол-1-ил)-3-(1,2,4-триазол-1-ил)]пропан-2-ол;
dl-трео-2-(2,4-дифторфенил)-3-метилсульфонил-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол;
(-)-4-[4-[4-[4-[[5-(2,4-дифторфенил)-5-(1H-1,2,4-триазол-1-илметил)тетрагидрофуран-3-ил]метокси]фенил]пиперазинил]фенил]-2-[(1S,2S)-1-этил-2-гидроксипропил]-3H-1,2,4-триазол-3-он;
(2R,3R)-3-[4-(4-цианофенил)тиазол-2-ил]-2-(2,4-дифторфенил)-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол;
3-метил-3-метилтио-1-(1,2,4-триазол-1-ил)-2-(трифторметилфенил)бутан-2-ол,
(2R,3R)-3-[4-(4-цианофенил)тиазол-2-ил]-1-(1H-1,2,4-триазол-1-ил)-2-(2,4,5-трифторфенил)бутан-2-ол и
(2R,3R)-3-[4-(4-цианофенил)тиазол-2-ил]-2-(3-фторфенил)-1-(1H-1,2,4-триазол-1-ил)бутан-2-ол.
Среди растворимых в воде пролекарств в соответствии с данным изобретением примеры соединений, которые получены из камптотецинов, включают следующие:
(a) (9S)-9-этил-9-{[метил-(2-метиламино-этил)амино]ацетокси}-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(b) (9S)-9-этил-9-(глицилсаркозилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(c) (9S)-9-{[(2-аминоэтил)метиламино]ацетокси}-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(d) (9S)-9-этил-9-(саркозилсаркозилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(e) (9S)-9-[2-(2-аминоэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(f) (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-иловый эфир (аминоацетилметиламино)уксусной кислоты;
(g) (9S)-9-{2-[(R-2-амино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(h) (9S)-9-{2-[(R-2-амино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион;
(i) (9S)-9-этил-9-(N-метилаланил-N-метилаланилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион и
(j) (9S)-9-этил-9-(саркозил-N-метилаланилокси)-1-пентил-1H,12H-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион.
Растворимые в воде пролекарства в соответствии с данным изобретением предпочтительно являются соединениями (b), (d), (e) и (h), более предпочтительно соединениями (b) и (e).
Краткое описание чертежей
На фиг.1 представлен график, демонстрирующий процентные изменения в превращении соединения 2А в лактон и карбоксилат в сыворотке человека в течение времени.
На фиг.2 представлен график, демонстрирующий процентные изменения в превращении соединения 2А в лактон и карбоксилат в сыворотке мыши в течение времени.
На фиг.3 представлен график, демонстрирующий процентные изменения в превращении соединения 2А в лактон и карбоксилат в сыворотке обезьяны в течение времени.
На фиг.4 представлен график, демонстрирующий процентные изменения в превращении соединения 2А в лактон и карбоксилат в сыворотке собаки в течение времени.
На фиг.5 представлен график, демонстрирующий оставшийся процент (%) соединения 2А при каждом значении рН (стабильность рН) после определенных периодов времени.
На фиг.6 представлен график, демонстрирующий процентные изменения в превращении ссылочного соединения 2 в лактон и карбоксилат в сыворотке человека в течение времени.
На фиг.7 представлен график, демонстрирующий процентные изменения в превращении ссылочного соединения 2 в лактон и карбоксилат в сыворотке мыши в течение времени.
Наилучший способ осуществления данного изобретения
В данном изобретении соединения, представленные формулой (1), могут быть получены с применением следующих методов, но методы получения соединений в соответствии с данным изобретением не должны рассматриваться как ограниченные представленными. Хотя все растворимые в воде пролекарства в соответствии с данным изобретением являются новыми соединениями, они могут быть получены хорошо известными химическими способами с применением коммерчески доступных исходных материалов, или материалов, синтезированных стандартными методами, при необходимости.
В представленных ниже способах получения R1, R2, R3, R4, X, Y, R5, n, R7 и R8 имеют те же значения, что и R1, R2, R3, R4, X, Y, R5, n, R7 и R8, соответственно, определенные в формулах (2), (3) и (9). Р1 является аминозащитной группой, Р2 является остатком карбонилирующего реагента, и Hal является атомом галогена (например, атомом хлора, атомом брома или атомом иода).
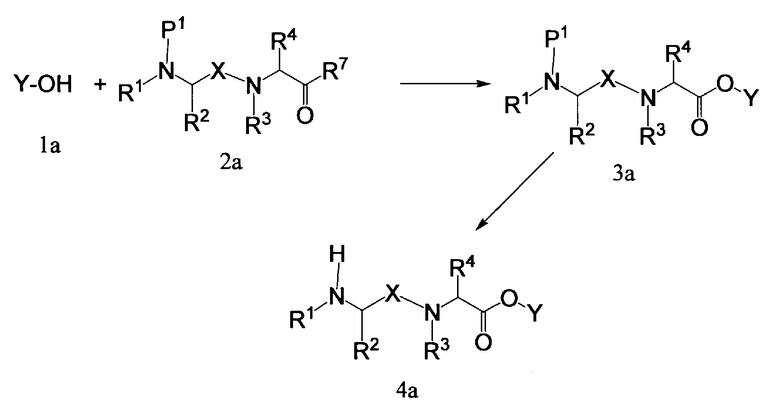
Способ реакции 1-1
Способ реакции 1-2
Способ реакции 1
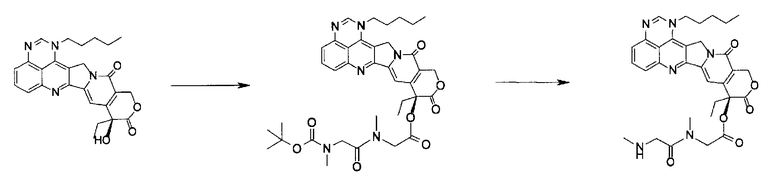
Способ реакции 1 является примером получения растворимого в воде пролекарства, включающего третичную аминогруппу в солюбилизирующей боковой цепи.
Растворимое в воде пролекарство, представленное формулой (2), может быть легко получено, например, ацилированием вторичной или третичной гидроксильной группы в Y-OH.
Получение соединения 3а
Как показано в способе реакции 1-1, сложный эфир (3а) может быть получен взаимодействием вторичного или третичного спирта (1а) с подходящим соединением (2а) в подходящем растворителе в присутствии связующего агента. Примеры соединения 2а включают карбоновую кислоту (R7=OH), карбоксилат (R7=OR8) и соединение галогенида ацила (R7=атом галогена:атом хлора или подобный), где предпочтительной является карбоновая кислота.
Y-OH может быть получено коммерчески или известными способами (WO 03/045952, WO 03/043631 и т.д.).
Если соединение (2a) является дипептидом (X=CO) карбоновой кислоты или производным пептида (X=CH2), производное аминокислоты, применяемое для получения такого соединения (2a), является коммерчески доступным или может быть получено известными способами, описанными в литературе (например, J. Am. Chem. Soc. 2000, 122, 762-766; J. Org. Chem, 1998, 5240; Tetrahedron Asymmetry, 1995, 1741; Tetrahedron Asymmetry, 1998, 4249). Карбоновая кислота может быть превращена в сложный эфир карбоксилата (R7=OR8) или соединение галогенида ацила (R7=атом галогена) известными методами.
Далее, производное дипептида может быть получено стандартными методами химии пептидов, хорошо известными специалистам в данной области техники [см. “The Practice of Peptide Synthesis” by M. Bodansky and A. Bodansky, 2nd edition, 1994 (Springer-Verlag)].
Примеры растворителей, применяемых в указанной выше реакции сочетания, включают метиленхлорид, этилацетат, тетрагидрофуран, ацетонитрил, хлороформ, диоксан и диметилформамид.
Примеры связующих агентов включают гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, дициклогексилкарбодиимид, BOP, HBTU, TNTU, PyBroPTM, PyBOPTM, TBTU, TSTU и HOBt [см. The Combinatorial Chemistry Catalog, Feb., 1997; Novabiochem., где представлены коммерчески доступные связующие агенты].
Получение соединения 4a
Хотя получение соединения 4а зависит от типа соответствующей карбоновой кислоты, обычно предпочтительна соответствующая карбоновая кислота (2a) с защищенной аминогруппой. Реакцию сочетания продолжают удалением защитной группы из соединения (3a) с получением растворимого в воде пролекарства, представленного соединением (4a).
С полученного растворимого в воде пролекарства, содержащего амино-защитную группу, снимают защиту, например, как показано в способе 1-2.
Реакция сочетания и выбор аминозащитной группы P1 в способах 1-1 и 1-2 могут быть проведены с применением известных методов (см. “The Practice of Peptide Synthesis” by M. Bodansky and A. Bodansky, 2nd edition, 1994 (Springer-Verlag); “Protective Groups in Organic Synthesis” by Theodora Greene, 1999 (Wiley-Interscience)).
Примеры аминозащитных групп включают следующие:
Карбаматы (в виде R 1 R 2 NX)
Метилоксикарбонильная группа, 9-флуоренилметилоксикарбонильная группа, 9-(2-сульфо)флуоренилметилоксикарбонильная группа, 9-(2,7-дибром)флуоренилметилоксикарбонильная группа, 4-метоксифенацилоксикарбонильная группа, этилоксикарбонильная группа, 2,2,2-трихлорэтилоксикарбонильная группа, 2-триметилсилилэтилоксикарбонильная группа, фенетилоксикарбонильная группа, 1-(1-адамантил)-1-метилэтилоксикарбонильная группа, 2-хлорэтилоксикарбонильная группа, 2-бромэтилоксикарбонильная группа, 2-иодэтилоксикарбонильная группа, 2,2-дихлорэтилоксикарбонильная группа, 2,2-дибромэтилоксикарбонильная группа, 2,2,2-трихлорэтилоксикарбонильная группа, 2,2,2-трибромэтилоксикарбонильная группа, 1,1-диметил-2-хлорэтилоксикарбонильная группа, 1,1-диметил-2-бромэтилоксикарбонильная группа, 1,1-диметил-2,2-дибромэтилоксикарбонильная группа, 1,1-диметил-2,2,2-трихлорэтилоксикарбонильная группа, 1-метил-1-(4-бифенилил)этилоксикарбонильная группа, 1-(3,5-ди-трет-бутилфенил)-1-метилэтилоксикарбонильная группа, 2-(2'-пиридил)этилоксикарбонильная группа, 2-(4'-пиридил)этилоксикарбонильная группа, 2-(N,N-дициклогексилкарбоксамид)этилоксикарбонильная группа, трет-бутилоксикарбонильная группа, 1-адамантилоксикарбонильная группа, винилоксикарбонильная группа, аллилоксикарбонильная группа, 1-изопропилаллилоксикарбонильная группа, циннамилоксикарбонильная группа, 4-нитроциннамилоксикарбонильная группа, 8-хинолилоксикарбонильная группа, пиперидинилоксикарбонильная группа, бензилоксикарбонильная группа, п-метоксибензилоксикарбонильная группа, п-нитробензилоксикарбонильная группа, п-хлорбензилоксикарбонильная группа, п-бромбензилоксикарбонильная группа, п-цианобензилоксикарбонильная группа, o-нитробензилоксикарбонильная группа, 2,4-дихлорбензилоксикарбонильная группа, 4-метилсульфинилбензилоксикарбонильная группа, 9-антрилметилоксикарбонильная группа, дифенилметилоксикарбонильная группа, 2-метилтиоэтилоксикарбонильная группа, 2-метилсульфонилэтилоксикарбонильная группа, 2-(п-толуолсульфонил)этилоксикарбонильная группа, [2-(1,3-дитианил)]метилоксикарбонильная группа, 4-метилтиофенилоксикарбонильная группа, 2,4-диметилтиофенилоксикарбонильная группа, 2-фосфиноэтилоксикарбонильная группа, 2-трифенилфосфониоизопропилоксикарбонильная группа, 1,1-диметил-2-цианоэтилоксикарбонильная группа, м-хлор-п-ацетилбензилоксикарбонильная группа, п-(дигидроксиборил)бензилоксикарбонильная группа, 5-бензизоксазолилметилоксикарбонильная группа, 2-(трифторметил)-6-хромонилметилоксикарбонильная группа, м-нитрофенилоксикарбонильная группа, 3,5-диметоксибензилоксикарбонильная группа, 3,4-диметокси-6-нитробензилоксикарбонильная группа и фенил(o-нитрофенил)метилоксикарбонильная группа;
Мочевины
Пиперидинилкарбонильная группа, п-толуолсульфониламинокарбонильная группа и фениламинотиокарбонильная группа;
Другие
трет-Амилоксикарбонильная группа, бензилтиокарбонильная группа, циклобутилоксикарбонильная группа, циклопентилоксикарбонильная группа, циклогексилоксикарбонильная группа, циклопропилметилоксикарбонильная группа, п-децилоксибензилоксикарбонильная группа, диизопропилметилоксикарбонильная группа, 2,2-диметоксикарбонилвинилоксикарбонильная группа, o-(N,N-диметилкарбоксамид)бензилоксикарбонильная группа, 1,1-диметил-3-(N,N-диметилкарбоксамид)пропилоксикарбонильная группа, 1,1-диметилпропинилоксикарбонильная группа, ди(2-пиридил)метилоксикарбонильная группа, 2-фуранилметилоксикарбонильная группа, изоборнилоксикарбонильная группа, изобутилоксикарбонильная группа, изоникотинилоксикарбонильная группа, п-(п'-метоксифенилазо)бензилоксикарбонильная группа, 1-метилциклобутилоксикарбонильная группа, 1-метилциклогексилоксикарбонильная группа, 1-метил-1-циклопропилметилоксикарбонильная группа, 1-метил-1-(3,5-диметоксифенил)этилоксикарбонильная группа, 1-метил-1-(п-фенилазофенил)этилоксикарбонильная групп, 1-метил-1-фенилэтилоксикарбонильная группа, 1-метил-1-(4-пиридил)этилоксикарбонильная группа, п-(фенилазо)бензилоксикарбонильная группа, 2,4,6-три-трет-бутилфенилоксикарбонильная группа, 4-(триметиламмоний)бензилоксикарбонильная группа и 2,4,6-триметилбензилоксикарбонильная группа; и
Амиды (в виде R 1 R 2 NX)
Формильная группа, ацетильная группа, хлорацетильная группа, трихлорацетильная группа, трифторацетильная группа, фенилацетильная группа, 3-фенилпропионильная группа, пиколиноильная группа, бензоильная группа, п-фенилбензоильная группа, o-нитрофенилацетильная группа, o-нитрофеноксиацетильная группа, ацетоацетильная группа, (N-дитиобензилоксикарбониламино)ацетильная группа, 3-(п-гидроксифенил)пропионильная группа, 3-(o-нитрофенил)пропионильная группа, 2-метил-2-(o-нитрофенокси)пропионильная группа, 2-метил-2-(o-фенилазофенокси)пропионильная группа, 4-хлорбутирильная группа, 3-метил-3-нитробутирильная группа, o-нитроциннамоильная группа, o-нитробензоильная группа и o-(бензоилоксиметил)бензоильная группа.
Удаление аминозащитной группы после реакции сочетания может проводиться методами, хорошо известными специалистам в данной области техники, такими как методы с применением трифторуксусной кислоты для удаления Boc-группы, пиперидина для удаления Fmoc-группы и фторида тетрабутиламмония для удаления 2-(триметилсилил)этоксикарбонильной (Teoc), триметилсилилэтильной и трет-бутилдиметилсилильной групп и каталитического гидрирования для удаления Cbz-группы.
Способ реакции 2-1
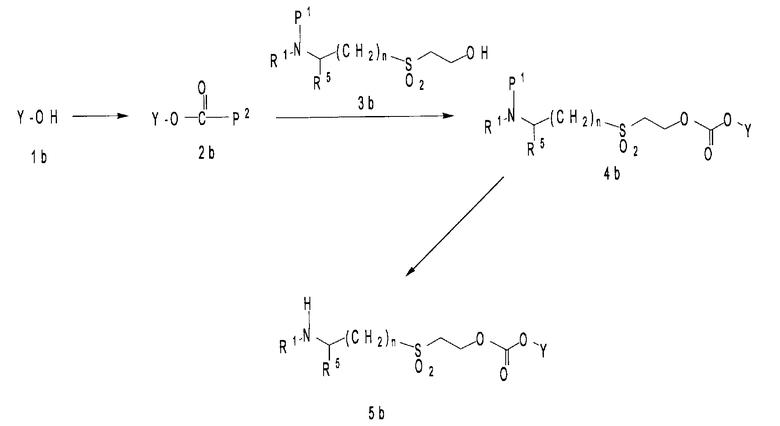
Способ реакции 2-2

Способ реакции 2
Способ реакции 2 является примером метода получения растворимых в воде пролекарств, солюбилизирующая часть которых содержит сульфонильную группу.
Получение соединения 2b
Первый спирт (1b) карбонилируют с получением соединения (2b). Карбонилирование гидроксильной группы осуществляют взаимодействием спирта (1b) с соответствующим карбонинирующим агентом в подходящем растворителе.
Примеры растворителей, которые могут применяться, включают метиленхлорид, этилацетат, тетрагидрофуран, ацетонитрил, хлороформ, диоксан и диметилформамид.
Примеры применяемого карбонилирующего агента включают хлорформиат п-нитрофенила, карбонилдиимидазол и фосгены.
Обычно реакцию проводят при температуре приблизительно от -10°C до 25°C в течение приблизительно от 1 до 24 часов.
Получение соединения 3b
Соединение 3b, содержащее солюбилизирующую боковую цепь, может быть получено известным методом (Tetrahedron (1999), 55: 6623-6634).
Защита аминогруппы в спирте (3b) может быть проведена с применением известных методов (см. The Practice of Peptide Synthesis, M. Bodansky, and A. Bodansky/2nd edition, 1994 (Springer-Verlag)).
Получение соединения 4b
Затем спирт (3b), содержащий соответствующую защищенную аминогруппу, может быть подвергнут взаимодействию с карбонилированным соединением (2b) в присутствии подходящего растворителя, с получением карбоната с защищенной аминогруппой (4b).
Примеры применяемых растворителей включают метиленхлорид, этилацетат, тетрагидрофуран, ацетонитрил, хлороформ, диоксан и диметилформамид.
Обычно реакцию проводят при температуре приблизительно от 15°C до 25°C в течение приблизительно от 2 до 48 часов.
Получение соединения 5b
Удалением аминозащитной группы карбоната (4b) известными методами получают соединение (5b). Удаление аминозащитной группы может быть проведено с применением известных методов, как показано в реакции 1. Примеры включают применение трифторуксусной кислоты для удаления Boc-группы, пиперидина для удаления Fmoc-группы и фторида тетрабутиламмония для удаления 2-(триметилсилил)этоксикарбонильной (Teoc), триметилсилилэтильной и трет-бутилдиметилсилильной групп и каталитическое гидрирование для удаления Cbz-группы.
В реакции 2-2 показан конкретный пример получения.
Реакция 3-1
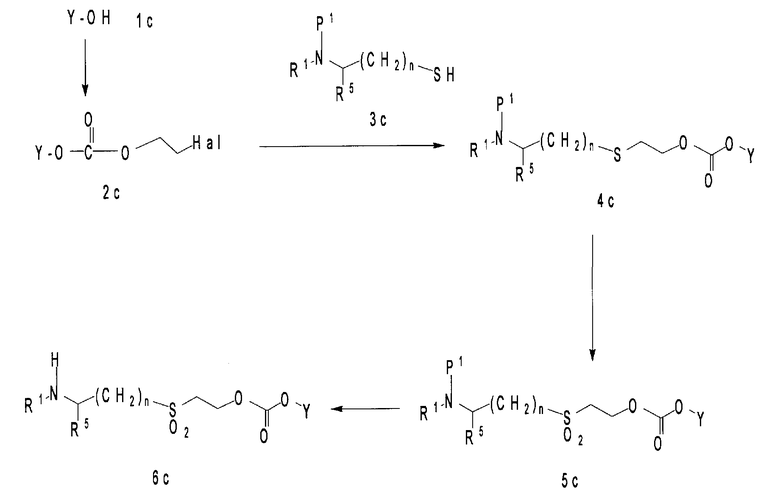
Реакция 3-2
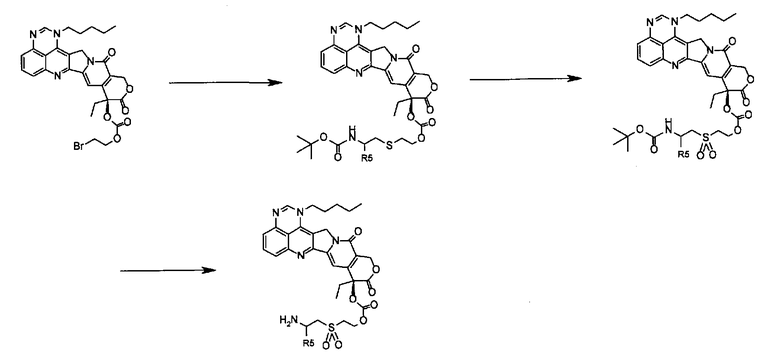
Реакция 3
Реакция 3 является другим примером способов получения растворимых в воде пролекарств, солюбилизирующая боковая цепь которых содержит сульфонильную группу.
Получение соединения 2c
Сначала получают 2-галогенированный этилкарбонат (2c) из спирта (1c).
Превращение гидроксильной группы спирта (1c) в 2-галогенированный этилкарбонат (2) может быть осуществлено взаимодействием с коммерчески доступным хлорформиатом в подходящем растворителе.
Примеры применяемого растворителя включают метиленхлорид, этилацетат, тетрагидрофуран, ацетонитрил, хлороформ, диоксан и диметилформамид.
Обычно реакцию проводят при температуре приблизительно от -10°C до 25°C в течение приблизительно от 1 до 24 часов.
Получение соединения 3c
Соединение тиола 3c, содержащее солюбилизирующую боковую цепь, может быть получено из коммерчески доступного продукта, или может быть получено известными методами (Tetrahedron, 1999, 55, 6623-6634; and J. Org. Chem. 1995, 60, 8105-8109).
Защита аминогруппы в соединении тиола (3c) может быть проведена известными методами (см. The Practice of Peptide Synthesis, M. Bodansky, and A. Bodansky/2nd edition, 1994 (Springer-Verlag)).
Получение соединения 4c
Затем может быть получен карбонат с защищенной аминогруппой (4c) взаимодействием соответствующего соединения тиола с защищенной аминогруппой (3c) с 2-галогенированным этилкарбонатом (2c) в подходящем растворителе в присутствии основания.
Примеры применяемых растворителей включают метиленхлорид, этилацетат, тетрагидрофуран, ацетонитрил, хлороформ, диоксан, диметилформамид, метанол и этанол.
Примеры применяемых оснований включают триэтиламин, диизопропилэтиламин, карбонат калия и карбонат натрия.
Обычно реакцию проводят при температуре приблизительно от 15°C до 100°C в течение приблизительно от 1 до 24 часов.
Получение соединения 5c
Далее может быть получено соединение 5c с применением известных методов, взаимодействием соединения 4c с окисляющим в перекисное соединение реагентом.
Примеры применяемых окисляющих в перекисное соединение реагентов включают оксон, перекись водорода и м-хлорпербензойную кислоту.
Обычно реакцию проводят при температуре приблизительно от -10°C до 100°C в течение приблизительно от 1 до 24 часов.
Получение соединения 6c
Соединение (6c) может быть получено удалением аминозащитной группы соединения 5c с применением известных методов. Удаление аминозащитной группы может быть проведено с применением известных методов, как в реакции 1. Примеры включают применение трифторуксусной кислоты для удаления Boc-группы, пиперидина для удаления Fmoc-группы и фторида тетрабутиламмония для удаления 2-(триметилсилил)этоксикарбонильной (Teoc), триметилсилилэтильной и трет-бутилдиметилсилильной групп и удаление Cbz-группы каталитическим гидрированием.
Реакция 3-2 является конкретным примером получения.
Представленное выше иллюстрирует примеры способов получения растворимых в воде пролекарств в соответствии с данным изобретением. Выделение и очистка целевых соединений, указанных в реакциях 1-3, может быть проведено с применением стандартных химических операций, таких как экстрагирование, концентрация, удаление растворителя, кристаллизация, фильтрация, перекристаллизация и различные виды хроматографии.
Растворимые в воде пролекарства в соответствии с данным изобретением, представленные формулами (1)-(8), и их фармацевтически приемлемые соли, гидраты и сольваты, включают все стереоизомеры растворимых в воде пролекарств, указанных выше (например, энантиомеры и диастереомеры, включая цис- и транс-геометрические изомеры), рацематы изомеров и другие смеси. Растворимые в воде пролекарства в соответствии с данным изобретением, представленные формулами (1)-(8), включают, в частности, стереоизомеры.
Растворимые в воде пролекарства в соответствии с данным изобретением, представленные формулами (1)-(8), и их фармацевтически приемлемые соли, гидраты и сольваты могут существовать в различных таутомерных формах, таких как кето и енольные формы, и иминовые и енаминовые формы, или смеси обеих. Таутомеры существуют в виде смесей таутомеров в растворе. В твердой форме обычно один из таутомеров преобладает. Данное изобретение включает все таутомеры соединений в соответствии с данным изобретением, включая случаи, для которых описан только один из таутомеров.
Далее, данное изобретение включает атропизомеры в соответствии с данным изобретением. Атропизомеры относятся к растворимым в воде пролекарствам, представленным формулами (1)-(8), которые могут быть разделены на изомеры с ограниченным вращением.
Такие изомеры могут быть выделены стандартными методами, основанными на различиях в физико-химических свойствах. Например, рацемические соединения могут быть разделены на пространственно чистые изомеры стандартными методами оптического разделения, такими как оптическое разделение преобразованием в диастереомерные соли с применением оптически активной кислоты, такой как винная кислота. Диастереомерные смеси могут быть разделены с применением фракционной кристаллизации и различных методик хроматографии (например, тонкослойной хроматографии, хроматографии на колонке и газовой хроматографии).
Если растворимые в воде пролекарства в соответствии с данным изобретением могут быть получены в свободной форме, они могут быть получены в виде солей или превращены в их гидраты или сольваты стандартными методами.
Альтернативно, если соединения в соответствии с данным изобретением получают в виде солей, гидратов или сольватов, такие соединения могут быть превращены в свободную форму стандартными методами.
Растворимые в воде пролекарства в соответствии с данным изобретением, представленные формулами (1)-(8), и их фармацевтически приемлемые соли, гидраты и сольваты обладают хорошей растворимостью в воде и, так как они быстро превращаются в активную форму химическим превращением, их межвидовые и индивидуальные различия малы.
В частности, данное изобретение очень полезно при применении к нерастворимым фармацевтическим агентам, которые содержат спиртовую гидроксильную группу, или предпочтительно вторичную или третичную спиртовую гидроксильную группу.
Например, растворимые в воде пролекарства в соответствии с данным изобретением могут легко солюбилизировать профилактические или терапевтические агенты для расстройств пролиферации клеток, такие как камптотецины, таксаны и противораковые нуклеотиды; или нерастворимые соединения, которые применяют в качестве противогрибковых агентов, такие как азольные противогрибковые агенты. Поэтому фармацевтические композиции, содержащие растворимые в воде пролекарства, представленные формулами (1)-(8), в соответствии с данным изобретением, или фармацевтически приемлемые соли, гидраты или сольваты, полученные из этих нерастворимых соединений, в качестве активных ингредиентов являются подходящими противогрибковыми агентами, или профилактическими или терапевтическими агентами для расстройств пролиферации клеток.
Примером указанного выше расстройства пролиферации клеток является рак. Примеры рака включают рак кишечника, рак легких, рак груди, рак желудка, рак шейки матки, рак мочевого пузыря и подобные.
Далее, данное изобретение относится к профилактическим или терапевтическим методам для расстройств пролиферации клеток или грибковых заболеваний. Данное изобретение также относится к способам, включающим стадию введения терапевтически эффективного количества растворимого в воде пролекарства, представленного формулами (1)-(8), или его фармацевтически приемлемой соли, гидрата или сольвата пациенту при необходимости таковой профилактики или лечения. Эти способы особенно полезны для лечения расстройств пролиферации клеток, включая рак и твердые опухоли, такие как рак кишечника, рак легких, рак груди, рак желудка, рак шейки матки и рак мочевого пузыря.
При применении фармацевтической композиции в соответствии с данным изобретением в качестве терапевтического агента или профилактического агента для расстройств пролиферации клеток, или в качестве противогрибкового агента, способ введения предпочтительно включает парентеральное (внутривенное, внутримышечное или подкожное) введение, местное (капельное) введение и ингаляции (пероральный или назальный спрей). Тип введения предпочтительно включает, например, водные пероральные растворы и суспензии и парентеральные растворы, загружаемые в подходящий контейнер, который подходит для дозированного введения в маленьких количествах. Далее, тип введения может быть адаптирован к различным способам введения, включая те, которые обеспечивают контролируемое выделение композиции, такие как подкожную трансплантацию.
Фармацевтические композиции в соответствии с данным изобретением предпочтительно применяют в виде водных жидких композиций. Более конкретно, водные жидкие композиции в соответствии с данным изобретением содержат растворимые в воде пролекарства, представленные формулами (1)-(8), и их фармацевтически приемлемые соли, гидраты и сольваты.
Применяемые водные растворы включают фосфатный буфер, физиологический раствор и различные другие растворы для вливания.
pH водного раствора предпочтительно равен 4 или менее, более предпочтительно 3 или менее, еще более предпочтительно от 2 до 3, и при таком рН растворимые в воде пролекарства, представленные формулами (1)-(8), и их фармацевтически приемлемые соли, гидраты и сольваты могут стабильно существовать в растворе в течение длительного периода времени. С другой стороны, предпочтительно при рН 5 или выше, или более предпочтительно при физиологических условиях рН 7-8, активные формы, полученные из спиртовых гидроксильных групп, могут быстро и количественно разлагаться в течение короткого периода времени.
Поэтому, например, если водную жидкую композицию, которая особенно эффективна при применении в виде инъекции, вводят при значении рН 4 или менее, более предпочтительно 3 или менее, еще более предпочтительно в интервале от 2 до 3, ее активная форма может быстро разлагаться в крови.
Композиции в водном растворе получают хорошо известным методом с применением добавок, таких как стабилизаторы, вкусовые добавки и разбавители.
Примеры стабилизаторов включают сложные эфиры параоксибензойной кислоты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; хлорид бензалкония; фенолы, такие как фенол и крезол; тимерозал; дегидроуксусную кислоту и сорбиновую кислоту.
Примеры вкусовых добавок включают широко применяемые подсластители, подкислители и вкусовые добавки.
Далее, примеры растворителей, применяемых для получения жидких агентов, включают этанол, фенол, хлоркрезол, очищенную воду и дистиллированную воду.
Примеры поверхностно-активных веществ или эмульгаторов включают полисорбат 80, стеарат полиоксила 40 и лауромакроголь.
При применении фармацевтических композиций в соответствии с данным изобретением в качестве терапевтического агента или профилактического агента для расстройств пролиферации клеток, или в качестве противогрибкового агента, количества растворимых в воде пролекарств, представленных формулами (1)-(8), или их фармацевтически приемлемых солей, гидратов или сольватов будут различаться в зависимости от симптомов, возраста, массы тела, относительного состояния здоровья пациента, наличия других вводимых агентов, способа введения и подобных.
Например, активный ингредиент (растворимое в воде пролекарство) может вводиться пациенту (теплокровному животному, особенно человеку) в эффективной дозе; например, суточной дозе предпочтительно от 0,1 до 1000 мг на кг массы тела, более предпочтительно от 10 до 800 мг на кг массы тела, при применении парентерального агента. Обычно его вводят один раз в день или несколькими частями в течение дня в зависимости от симптомов.
Не существует ограничений по концентрации растворимых в воде пролекарств, представленных формулами (1)-(8), или их фармацевтически приемлемых солей, гидратов или сольватов, в водном растворе, концентрации различаются в зависимости от продолжительности и типа заболевания, но предпочтительный диапазон составляет от (1) мкM до (500) мкM.
Все представленные здесь ссылки на известный уровень техники включены в описание в качестве ссылок.
Примеры
Далее данное изобретение проиллюстрировано конкретными примерами, но не ограничено ими.
ЯМР-анализ проводят с применением JEOL JNM-EX270 (270 МГц), JNMGSX400 (400 МГц) или JNM-A500 (500 МГц). Данные ЯМР указывают в ч/млн (частях на миллион) и дают относительно фиксированного сигнала дейтерия в том же растворителе.
Данные масс-спектра получают с применением JEOL JMS-DX303 или JMS-SX/SX102A.
Данные масс-спектрометров, оборудованных инструментом для высокоэффективной жидкостной хроматографии, получают с применением микромассы (Micromass, ZMD), оборудованной инструментом для высокоэффективной жидкостной хроматографии с градиентом Waters 996-600E, или микромассы (Finnigan, Navigator), оборудованной инструментом для высокоэффективной жидкостной хроматографии с градиентом Agilent 1100 (Agilent Technologies).
Для реакций органического синтеза применяют коммерчески доступные реагенты без дальнейшей очистки.
В примерах комнатная температура означает температуру в интервале от приблизительно 20 до 25°C.
Все безводные реакции проводят в атмосфере азота. Концентрацию или удаление растворителя при пониженном давлении проводят на роторном испарителе, если не указано иначе.
Соединения получают таким образом, чтобы их функциональные группы были защищены защитными группами, при необходимости, и защитные группы удаляют после получения защищенной формы целевой молекулы. Выбор защитных групп и их присоединение и отсоединение проводят, например, методами, описанными в “Greene and Wuts, Protective Group in Organic Synthesis/2nd edition, John Wiley & Sons, 1991”.
Высокоэффективную жидкостную хроматографию проводят при одних из следующих двух условий.
Условия 1 высокоэффективной жидкостной хроматографии
Колонка: Combi ODS (ODS, 5 мкм, 4,6 мм В.Д.×50 мм, Wako Pure Chemicals), COSMOSIL (ODS, 5 мкм, 4,6 мм В.Д.×50 мм, Nakalai Tesque) или Inertsil C18 (ODS, 5 мкм, 4,6 мм В.Д.×50 мм, GL Science).
Подвижная фаза: (растворитель A) вода, содержащая 0,01% трифторуксусной кислоты, и (растворитель B) ацетонитрил, содержащий 0,01% трифторуксусной кислоты.
Метод элюирования: ступенчатое градиентное элюирование в растворителе В: от 10% до 95% (3,5 минуты), от 95% до 10% (1 минута) и 10% (0,5 минуты)
Скорость потока: 4,0 мл/минуту
Условия 2 высокоэффективной жидкостной хроматографии
Колонка: Combi ODS (ODS, 5 мкм, 4,6 мм В.Д.×50 мм, Wako Pure Chemicals), COSMOSIL (ODS, 5 мкм, 4,6 мм В.Д.×50 мм, Nakalai Tesque) или Inertsil C18 (ODS, 5 мкм, 4,6 мм В.Д.×50 мм, GL Science).
Подвижная фаза: (растворитель A) вода, содержащая 0,01% трифторуксусной кислоты, и (растворитель B) ацетонитрил, содержащий 0,01% трифторуксусной кислоты.
Метод элюирования: ступенчатое градиентное элюирование в растворителе В: от 30% до 35% (0,2 минуты), от 35% до 98% (3,3 минуты), от 98% до 30% (1 минута) и 30% B (0,5 минуты)
Скорость потока: 4,0 мл/минуту
Пример 1
Гидрохлорид (9S)-9-этил-9-{[метил-(2-метиламиноэтил)амино]ацетокси}-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 1A)
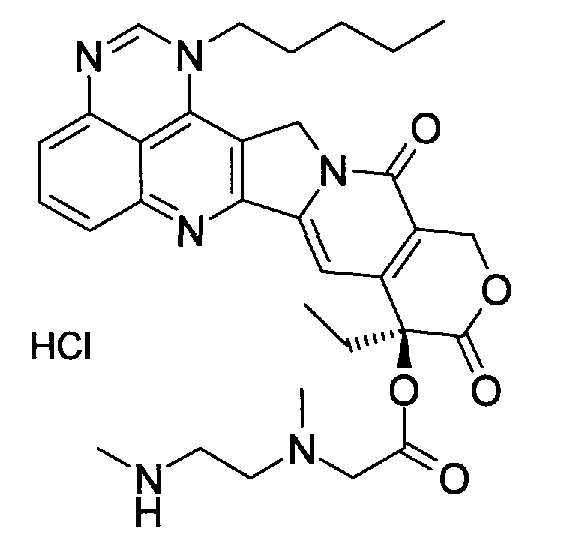
Способ 1-A
Бензиловый эфир {[2-(трет-бутоксикарбонилметиламино)этил]метиламино}уксусной кислоты
854 мг (4,54 ммоль) трет-бутилового эфира метил-(2-метиламиноэтил)карбаминовой кислоты, который является известным веществом (J. Med. Chem., 2000, 43, 3093), растворяют в метиленхлориде (50 мл), и затем к этому раствору добавляют бензил 2-бромацетат (1,0 мл, 6,35 ммоль), и смесь перемешивают при комнатной температуре в течение приблизительно 24 часов.
После завершения реакции реакционный раствор концентрируют и полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат = 5:1 до 3:1) с получением 534,3 мг (35%) бензилового эфира {[2-(трет-бутоксикарбонилметиламино)этил]метиламино}уксусной кислоты в виде бесцветного вязкого масла.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 1,42 (9H, с), 2,40 (3H, с), 2,65 (2H, т, J=7,1 Гц), 2,82 (3H, с), 3,20-3,38 (2H, м), 3,34 (2H, с), 5,13 (2H, с), 7,24-7,38 (5H, м).
ESI (ЖХ-МС положительный тип) m/z 337 (M+H).
Способ 1-B
{[2-(трет-Бутоксикарбонилметиламино)этил]метиламино}уксусная кислота
534,3 мг (1,59 ммоль) бензилового эфира {[2-(трет-бутоксикарбонилметиламино)этил]метиламино}уксусной кислоты, полученного в способе 1-A, растворяют в метаноле (20 мл) и затем добавляют 51 мг 5% палладия на угле, смесь перемешивают в течение 1 часа в атмосфере водорода при комнатной температуре. Нерастворимые вещества удаляют фильтрацией и фильтрат концентрируют с получением 391,1 мг (100%) {[2-(трет-бутоксикарбонилметиламино)этил]метиламино}уксусной кислоты в виде бесцветного вязкого масла.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 1,43 (9H, с), 2,72 (3H, с), 2,87 (3H, с), 2,95-3,10 (2H, м), 3,45 (2H, с), 3,31-3,63 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 247 (M+H)
Способ 1-C
(9S)-9-({[2-(трет-Бутоксикарбонилметиламино)этил]метиламино}ацетокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
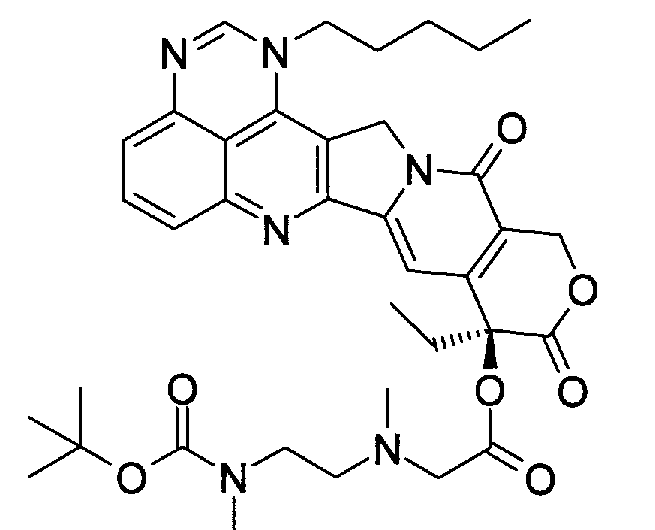
391 мг (1,59 ммоль) {[2-(трет-бутоксикарбонилметиламино)этил]метиламино}уксусной кислоты, полученной в способе 1-B, 279 мг (0,61 ммоль) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (полученного в примере 2.15 WO 03/045952), 525 мг (2,74 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 224 мг (1,83 ммоль) 4-диметиламинопиридина растворяют в метиленхлориде (15 мл) и затем перемешивают при комнатной температуре в течение четырех часов.
Реакционный раствор промывают 0,15 н. водной хлористоводородной кислотой, сушат над сульфатом натрия и затем растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 30:0 до 10:1) дает 136,4 мг (33%) (9S)-9({[2-(трет-бутоксикарбонилметиламино)этил]метиламино}ацетокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде аморфного вещества желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 0,85-0,95 (6H, м), 1,27-1,50 (4H, м), 1,40 (9H, с), 1,70-1,84 (2H, м), 2,03-2,30 (2H, м), 2,39 (3H, с), 2,58-2,70 (2H, м), 2,80 (3H, с), 3,18-3,36 (2H, м), 3,48 (2H, с), 3,81 (2H, т, J=7,3 Гц), 5,21 (2H, с), 5,37 (1H, д, J=17,3 Гц), 5,64 (1H, д, J=17,3 Гц), 7,07 (1H, с), 7,14 (1H, дд, J=1,3, 7,3 Гц), 7,38 (1H, с), 7,53-7,70 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 687 (M+H).
Способ 1-D
Гидрохлорид (9S)-9-этил-9-{[метил-(2-метиламиноэтил)амино]ацетокси}-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона
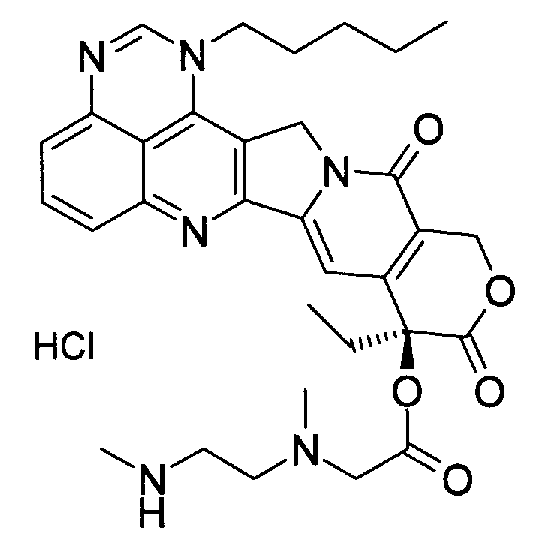
136,4 мг (0,20 ммоль) (9S)-9-({[2-(трет-бутоксикарбонилметиламино)этил]метиламино}ацетокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, полученного в способе 1-C, растворяют в 1 н. растворе хлористоводородной кислоты - уксусной кислоты (3 мл) и затем перемешивают при комнатной температуре в течение 2,5 часов.
К реакционному раствору добавляют этилацетат, раствор перемешивают при комнатной температуре в течение 30 минут и полученное твердое вещество собирают фильтрацией и получают 102,7 мг (74%) гидрохлорида (9S)-9-этил-9-{[метил-(2-метиламиноэтил)амино]ацетокси}-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 1A) в виде твердого вещества желтовато-красного цвета.
1H-ЯМР (270 МГц, CD3OD) δ (м.д.): 0,99 (3H, т, J=6,9 Гц), 1,09 (3H, т, J=7,4 Гц), 1,40-1,62 (4H, м), 1,88-2,02 (2H, м), 2,15-2,31 (2H, м), 2,75 (3H, с), 2,96-3,06 (3H, м), 3,39-3,62 (4H, м), 4,25 (2H, т, J=7,9 Гц), 4,44-4,60 (1H, м), 4,87-5,03 (1H, м), 5,53 (2H, с), 5,54 (1H, д, J=17,2 Гц), 5,67 (1H, д, J=17,2 Гц), 7,55 (1H, д, J=7,3 Гц), 7,96-8,17 (3H, м), 8,33 (1H, с).
ESI (ЖХ-МС положительный тип) m/z 587 (M+H).
Пример 2
Гидрохлорид (9S)-9-этил-9-(глицилсаркозилокси)-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион (соединение 2A)
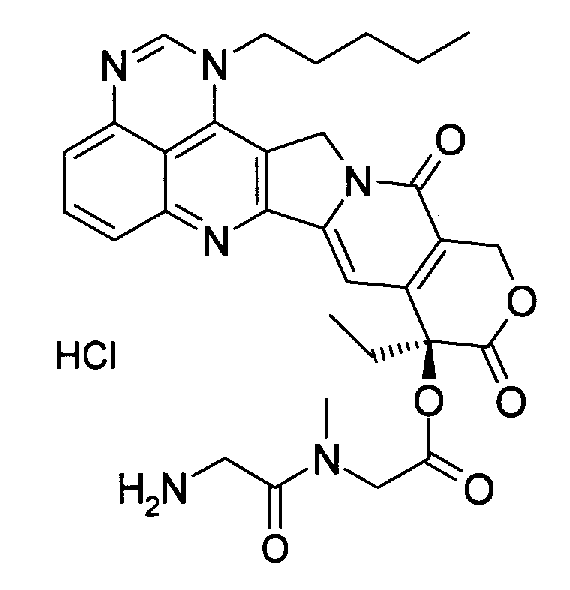
Способ 2-A
(9S)-9-{[N-(трет-Бутоксикарбонил)глицил]саркозилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
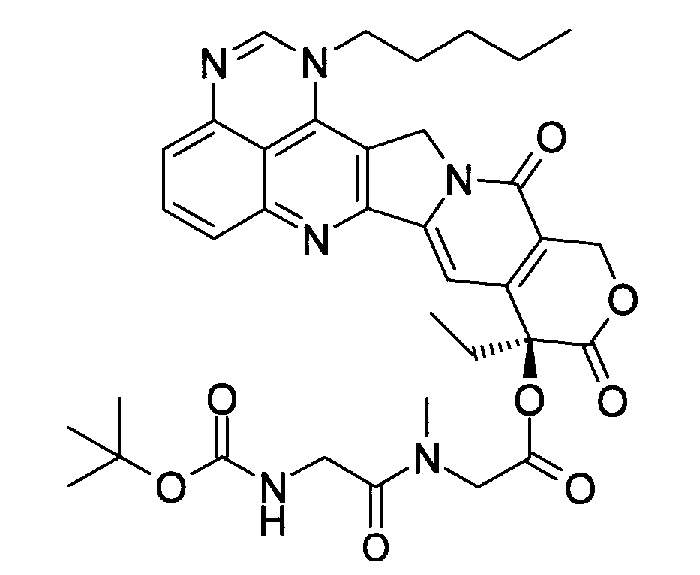
1,4 г (5,67 ммоль) [N-(трет-бутоксикарбонил)глицил]саркозина, который является известным веществом (Helvetica Chimica Acta, 1991, 74, 197), 1,3 г (2,84 ммоль) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, 2,2 г (11,34 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 1,4 г (11,34 ммоль) 4-диметиламинопиридина растворяют в метиленхлориде (50 мл) и затем перемешивают при комнатной температуре в течение 1,5 часов.
Реакционный раствор промывают 0,2 н. водной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия, затем сушат над сульфатом натрия и затем растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 100:1 до 30:1) дает 1,34 г (69%) (9S)-9-{[N-(трет-бутоксикарбонил)глицил]саркозилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде аморфного вещества желтовато-красного цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.):
Ротамер A* 0,86-1,04 (6H, м), 1,24-1,53 (4H, м), 1,38 (9H, с), 1,70-1,90 (2H, м), 2,03-2,36 (2H, м), 3,04 (3H, с), 3,83 (2H, т, J=7,1 Гц), 3,96-4,05 (2H, м), 4,12 (1H, д, J=17,7 Гц), 4,57 (1H, д, J=17,7 Гц), 5,21 (2H, с), 5,38 (1H, д, J=17,3 Гц), 5,46-5,56 (1H, м), 5,66 (1H, д, J=17,3 Гц), 7,10-7,21 (2H, м), 7,40 (1H, с), 7,60-7,75 (2H, м);
Ротамер B* 0,86-1,04 (6H, м), 1,24-1,53 (4H, м), 1,38 (9H, с), 1,70-1,90 (2H, м), 2,03-2,36 (2H, м), 3,02 (3H, с), 3,83 (2H, т, J=7,1 Гц), 3,90-3,96 (2H, м), 4,12 (1H, д, J=17,7 Гц), 4,57 (1H, д, J=17,7 Гц), 5,24 (2H, с), 5,38 (1H, д, J=17,3 Гц), 5,46-5,56 (1H, м), 5,68 (1H, д, J=17,3 Гц), 7,10-7,21 (2H, м), 7,40 (1H, с), 7,60-7,75 (2H, м).
*Соотношение двух ротамеров А и В приблизительно 5:1.
ESI (ЖХ-МС положительный тип) m/z 687 (M+H).
Способ 2-B
Гидрохлорид (9S)-9-этил-9-(глицилсаркозилокси)-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона
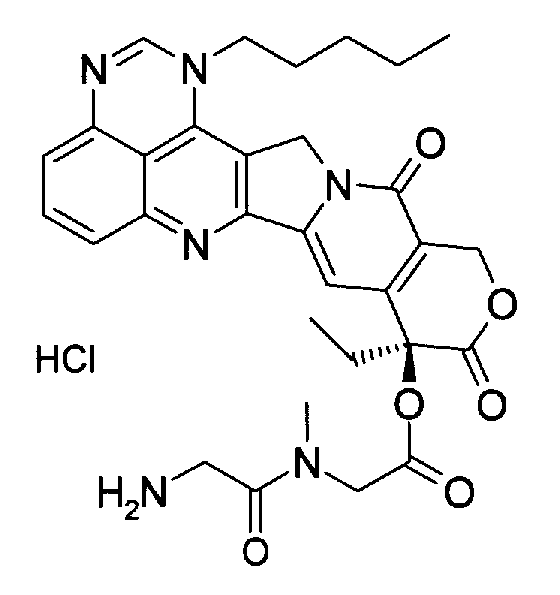
1,33 г (1,94 ммоль) (9S)-9-{[N-(трет-бутоксикарбонил)глицил]саркозилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, полученного в способе 2-A, растворяют в 1 н. растворе хлористоводородной кислоты - уксусной кислоты (15 мл) и затем перемешивают при комнатной температуре в течение 2 часов 45 минут.
К реакционному раствору добавляют этилацетат, затем раствор перемешивают при комнатной температуре в течение 30 минут, полученное твердое вещество собирают фильтрацией и получают 1,28 г (100%) соли хлористоводородной кислоты (9S)-9-этил-9-(глицилсаркозилокси)-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 2A) в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CD3OD) δ (м.д.):
Ротамер A* 0,99 (3H, т, J=7,1 Гц), 1,03 (3H, т, J=7,6 Гц), 1,34-1,58 (4H, м), 1,90-2,00 (2H, м), 2,14-2,30 (2H, м), 3,11 (3H, с), 3,99 (2H, с), 4,25 (2H, т, J=7,3 Гц), 4,56 (1H, д, J=17,9 Гц), 4,57 (1H, д, J=17,9 Гц), 5,51 (1H, д, J=17,4 Гц), 5,52 (2H, с), 5,61 (1H, д, J=17,4 Гц), 7,52-7,57 (1H, м), 7,89 (1H, с), 7,80 (1H, д, J=8,2 Гц), 8,10 (1H, т, J=8,2 Гц), 8,38 (1H, с);
Ротамер B* 0,99 (3H, т, J=7,1 Гц), 1,08 (3H, т, J=7,3 Гц), 1,34-1,58 (4H, м), 1,90-2,00 (2H, м), 2,14-2,30 (2H, м), 3,08 (3H, с), 3,90 (1H, д, J=16,5 Гц), 4,02 (1H, д, J=16,5 Гц), 4,25 (2H, т, J=7,3 Гц), 4,62 (1H, д, J=18,8 Гц), 4,76 (1H, д, J=18,8 Гц), 5,52 (2H, с), 5,53 (1H, д, J=16,9 Гц), 5,65 (1H, д, J=16,9 Гц), 7,52-7,57 (1H, м), 8,03 (1H, д, J=8,2 Гц), 8,10 (1H, т, J=8,2 Гц), 8,19 (1H, с), 8,34 (1H, с).
*Соотношение двух ротамеров А и В приблизительно 3:2.
ESI (ЖХ-МС положительный тип) m/z 587 (M+H).
Пример 3
Гидрохлорид (9S)-9-{[(2-аминоэтил)метиламино]ацетокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 3A)
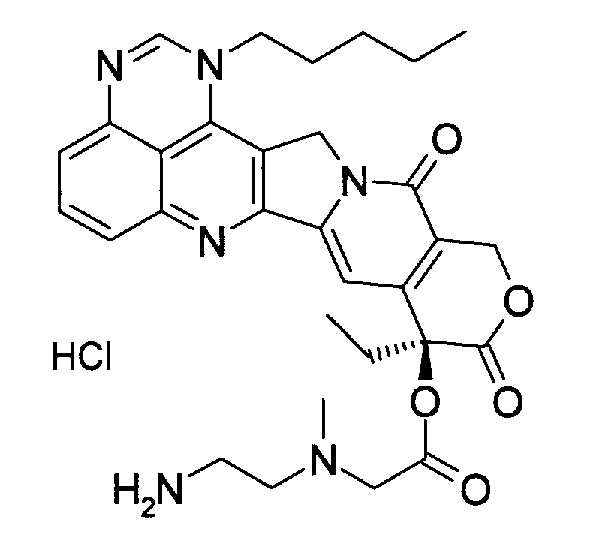
Способ 3-A
Бензиловый эфир {[2-(трет-бутоксикарбониламино)этил]метиламино}уксусной кислоты
500 мг (1,42 ммоль) р-толуолсульфоната бензилового эфира саркозина, 478 мг (2,13 ммоль) бромида 2-(трет-бутоксикарбониламино)этила и 0,25 мл (2,13 ммоль) диизопропилэтиламина растворяют в метиленхлориде (10 мл) и затем перемешивают при комнатной температуре в течение приблизительно трех дней. После завершения реакции реакционный раствор концентрируют и полученный остаток очищают хроматографией на колонке с силикагелем (этилацетат), с получением 175 мг (38%) бензилового эфира {[2-(трет-бутоксикарбониламино)этил]метиламино}уксусной кислоты в виде бесцветного вязкого масла.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 1,44 (9H, с), 2,37 (3H, с), 2,63 (2H, т, J=6,0 Гц), 3,20 (2H, шир.кв), 3,33 (2H, с), 5,15 (1H, шир.с), 5,16 (2H, с), 7,32-7,39 (5H, м).
ESI (ЖХ-МС положительный тип) m/z 323 (M+H).
Способ 3-B
{[2-(трет-Бутоксикарбониламино)этил]метиламино}уксусная кислота

162 мг (0,5 ммоль) бензилового эфира {[2-(трет-бутоксикарбониламино)этил]метиламино}уксусной кислоты, полученного в способе 3-А, растворяют в метаноле (5 мл) и затем добавляют 5% палладий на угле, реакционную смесь перемешивают в атмосфере водорода при комнатной температуре в течение одного часа. После фильтрования нерастворимого материала фильтрат концентрируют с получением 116 мг (100%) {[2-(трет-бутоксикарбониламино)этил]метиламино}уксусной кислоты в виде бесцветного вязкого масла.
1H-ЯМР (270 МГц, CD3OD) δ (м.д.): 1,45 (9H, с), 2,91 (3H, с), 3,22 (2H, т, J=6,3 Гц), 3,41 (2H, т, J=6,3 Гц), 3,63 (2H, с).
ESI (ЖХ-МС положительный тип) m/z 233 (M+H).
Способ 3-C
(9S)-9-({[2-(трет-Бутоксикарбониламино)этил]метиламино}ацетокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
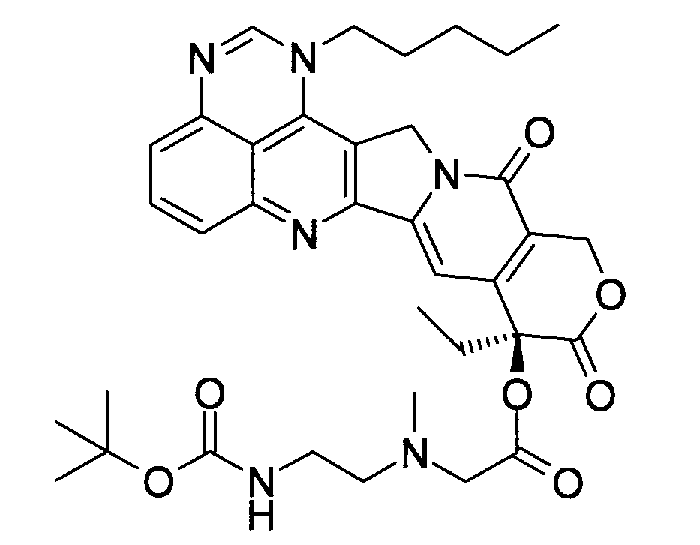
112 мг (0,48 ммоль) {[2-(трет-бутоксикарбониламино)этил]метиламино}уксусной кислоты, полученной в способе 3-В, 157 мг (0,34 ммоль) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, 197 мг (1,03 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 83 мг (0,68 ммоль) 4-диметиламинопиридина растворяют в метиленхлориде (10 мл) и затем перемешивают при комнатной температуре в течение трех часов.
Реакционный раствор промывают 0,3 н. водным раствором хлористоводородной кислоты, сушат над безводным сульфатом натрия и затем растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 50:1) дает 61 мг (27%) (9S)-9-({[2-(трет-бутоксикарбониламино)этил]метиламино}ацетокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде вязкого масла желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 0,88-1,00 (6H, м), 1,32-1,53 (4H, м), 1,42 (9H, с), 1,73-1,86 (2H, м), 2,08-2,36 (2H, м), 2,39 (3H, с), 2,63 (2H, т, J=5,9 Гц), 3,20 (2H, шир.кв), 3,46 (2H, с), 3,82 (2H, т, J=7,1 Гц), 5,21 (1H, шир.с), 5,22 (2H, с), 5,40 (1H, д, J=17,2 Гц), 5,67 (1H, д, J=17,2 Гц), 7,10 (1H, с), 7,14 (1H, шир.д), 7,40 (1H, шир.с), 7,58-7,70 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 673 (M+H).
Способ 3-D
Гидрохлорид (9S)-9-{[(2-аминоэтил)метиламино]ацетокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона
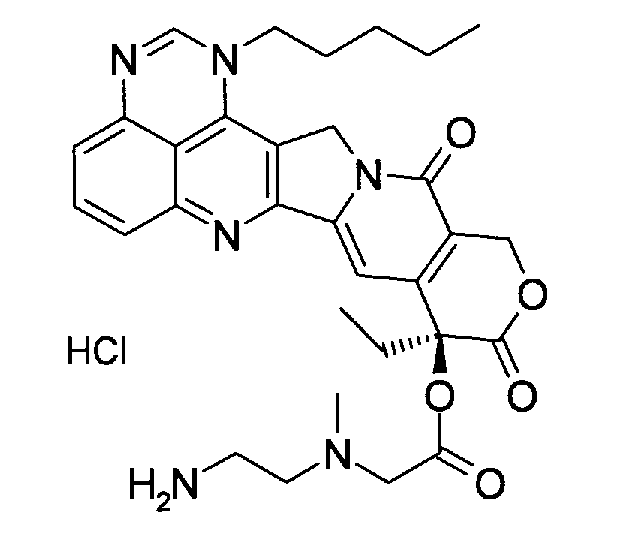
58 г (0,086 ммоль) (9S)-9-({[2-(трет-бутоксикарбониламино)этил]метиламино}ацетокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, полученного в способе 3-С, растворяют в 1 н. растворе хлористоводородной кислоты - уксусной кислоты (2 мл) и затем перемешивают при комнатной температуре в течение четырех часов.
К реакционному раствору добавляют этилацетат, раствор перемешивают при комнатной температуре в течение 30 минут и полученное твердое вещество собирают фильтрацией с получением 54 мг (93%) гидрохлорида (9S)-9-{[(2-аминоэтил)метиламино]ацетокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 3A) в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CD3OD) δ (м.д.): 0,99 (3H, т, J=6,9 Гц), 1,09 (3H, т, J=7,3 Гц), 1,39-1,62 (4H, м), 1,88-2,02 (2H, м), 2,16-2,30 (2H, м), 3,07 (3H, с), 3,37-3,61 (4H, м), 4,25 (2H, шир.т), 4,62 (1H, д, J=17,5 Гц), 5,05 (1H, д, J=17,5 Гц), 5,52 (2H, с), 5,53 (1H, д, J=17,5 Гц), 5,67 (1H, д, J=17,5 Гц), 7,55 (1H, шир.д), 7,98-8,16 (3H, м), 8,32 (1H, с).
ESI (ЖХ-МС положительный тип) m/z 573 (M+H).
Пример 4
Гидрохлорид (9S)-9-этил-9-(саркозилсаркозилокси)-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 4A)
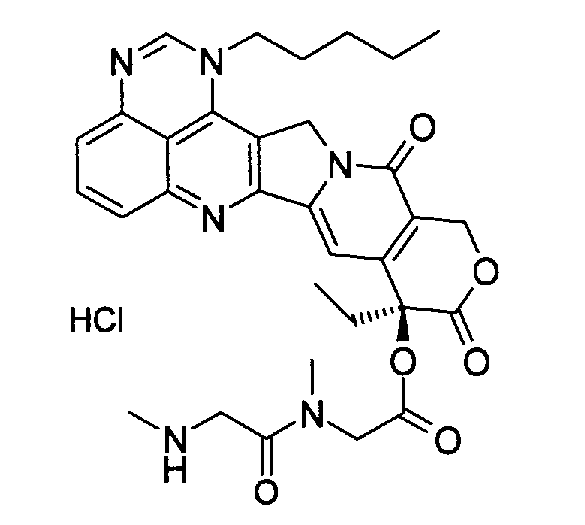
Способ 4-A
(9S)-9-{[N-трет-Бутоксикарбонил)саркозил]саркозилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
113 мг (0,44 ммоль) [N-(трет-бутоксикарбонил)саркозил]саркозина, который является известным веществом, 100 мг (0,22 ммоль) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, 125 мг (0,65 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 53 мг (0,44 ммоль) 4-диметиламинопиридина растворяют в метиленхлориде (6 мл) и затем перемешивают при комнатной температуре в течение 3,5 часов.
Реакционный раствор промывают 0,25 н. водной хлористоводородной кислотой и водным раствором гидрокарбоната натрия, сушат над безводным сульфатом натрия и затем растворитель отгоняют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (метиленхлорид:метанол = 50:1), с получением 103 мг (68%) (9S)-9-{[N-трет-бутоксикарбонил)саркозил]саркозилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде аморфного вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ (м.д.): 0,88-1,02 (6H, м), 1,25-1,51 (13H, м), 1,73-1,82 (2H, м), 2,11-2,32 (2H, м), 2,84 (3H, м), 3,02 (3H, м), 3,80 (2H, шир.т), 3,92-4,29 (3H, м), 4,58-4,71 (1H, м), 5,12-5,70 (4H, м), 7,04-7,19 (2H, м), 7,39 (1H, м), 7,55-7,68 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 701 (M+H).
Способ 4-B
Гидрохлорид (9S)-9-этил-9-(саркозилсаркозилокси)-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона
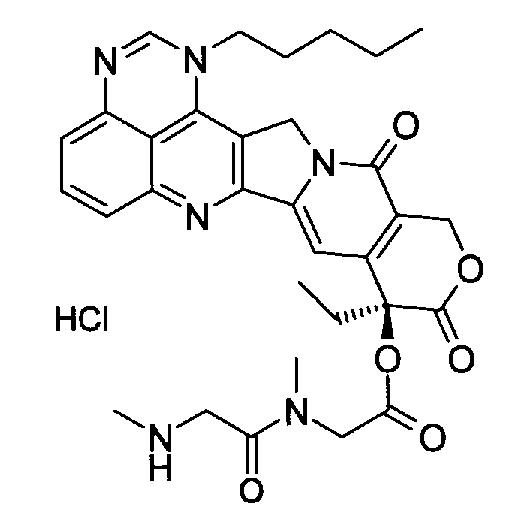
98 мг (0,14 ммоль) (9S)-9-{[N-трет-бутоксикарбонил)саркозил]саркозилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, полученного в способе 4-А, растворяют в 1 н. растворе хлористоводородной кислоты - уксусной кислоты (3 мл) и затем перемешивают при комнатной температуре в течение двух часов.
К реакционному раствору добавляют этилацетат, затем раствор перемешивают при комнатной температуре в течение 30 минут и полученное твердое вещество собирают фильтрацией с получением 67 мг (71%) гидрохлорида (9S)-9-этил-9-(саркозилсаркозилокси)-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 4A) в виде твердого вещества желтого цвета.
1H-ЯМР (270М Гц, CD3OD) δ (м.д.): 0,96-1,11 (6H, м), 1,40-1,62 (4H, м), 1,87-2,01 (2H, м), 2,15-2,31 (2H, м), 2,71 (3H, с), 3,10 (3H, м), 4,05-4,15 (2H, м), 4,24 (2H, шир.т), 4,55-4,70 (2H, м), 5,46-5,70 (4H, м), 7,52 (1H, м), 7,81-8,15 (3H, м), 8,34 (1H, м).
ESI (ЖХ-МС положительный тип) m/z 601 (M+H).
Пример 5
Гидрохлорид (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-илового эфира (аминоацетилметиламиноуксусной кислоты (соединение 5A)
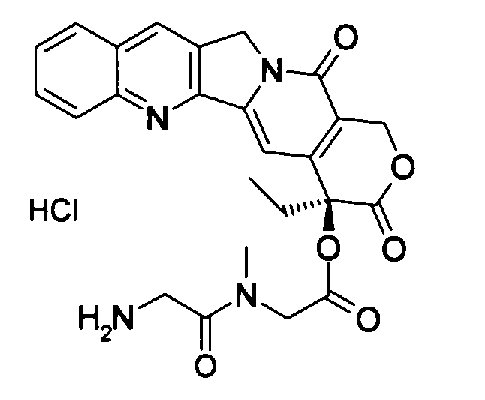
Способ 5-A
(S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-иловый эфир (трет-бутоксикарбониламиноацетилметиламино)уксусной кислоты
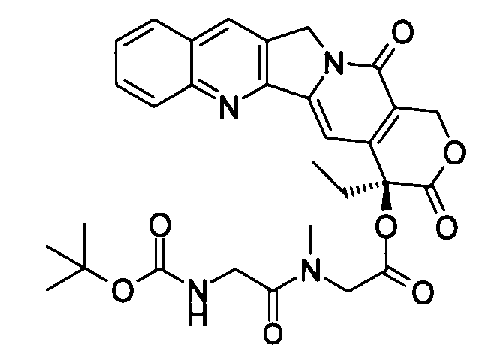
441 мг (1,93 ммоль) N-(трет-бутоксикарбонил)глицил]саркозина, 250 мг (0,77 ммоль) камптотецина, 343 мг (1,93 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 87 мг (0,77 ммоль) 4-диметиламинопиридина растворяют в метиленхлориде (130 мл) и затем перемешивают при комнатной температуре в течение 15 часов.
Реакционный раствор промывают 0,3 н. водной хлористоводородной кислотой и гидрокарбонатом натрия и сушат над безводным сульфатом натрия, затем растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 30:1) дает 410 мг (99%) (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-илового эфира (трет-бутоксикарбониламиноацетилметиламино)уксусной кислоты в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 1,00 (3H, т, J=7,6 Гц), 1,35 (9H, с), 2,08-2,34 (2H, м), 3,05 (3H, с), 3,90-4,24 (3H, м), 4,61 (1H, м), 5,28 (2H, шир.с), 5,40 (1H, д, J=17,2 Гц), 5,47 (1H, шир.с), 5,69 (1H, д, J=17,2 Гц), 7,30 (1H, с), 7,68 (1H, шир.т), 7,84 (1H, шир.т), 7,93 (1H, шир.д), 8,29 (1H, шир.д), 8,40 (1H, с).
FAB-МС (положительный тип) m/z 577 (M+H).
Способ 5-B
Гидрохлорид (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-илового эфира (аминоацетилметиламино)уксусной кислоты
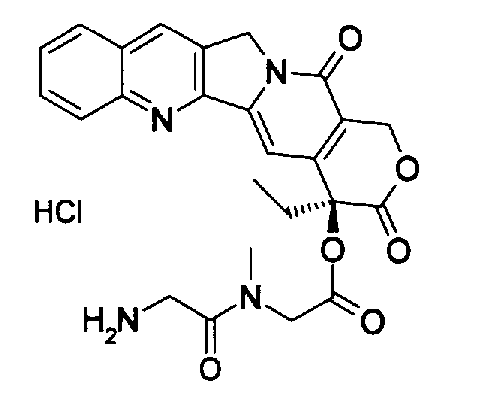
39 мг (0,068 ммоль) (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-илового эфира (трет-бутоксикарбониламиноацетилметиламино)уксусной кислоты, полученного в способе 5-А, растворяют в 1 н. растворе хлористоводородной кислоты - этилацетата (2 мл) и затем перемешивают при комнатной температуре в течение четырех часов.
К реакционному раствору добавляют этилацетат, раствор перемешивают при комнатной температуре в течение 30 минут и полученное твердое вещество собирают фильтрацией с получением 28 мг (82%) гидрохлорида (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1H-2-окса-6,12a-диазадибензо[b,h]флуорен-4-илового эфира (аминоацетилметиламино)уксусной кислоты (соединение 5А) в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, ДМСО-d6) δ (м.д.): 0,92 (3H, т, J=7,3 Гц), 2,11-2,24 (2H, м), 2,92-2,98 (3H, м), 3,90 (2H, м), 4,40-4,78 (2H, м), 5,30 (2H, шир.с), 5,40-5,60 (2H, м), 7,18-7,27 (1H, м), 7,75 (1H, шир.т), 7,89 (1H, шир.т), 8,12-8,28 (2H, м), 8,25 (шир.с), 8,72 (1H, с).
ESI (ЖХ-МС положительный тип) m/z 477 (M+H).
Пример 6
Соль трифторуксусной кислоты (9S)-9-{2-[(R-2-амино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 6A)
Способ 6-A
(9S)-9-(2-Бромэтоксикарбонилокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
620 мг (1,35 ммоль) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, 0,29 мл (2,70 ммоль) хлорформиата 2-бромэтила, 0,47 мл (2,70 ммоль) диизопропилэтиламина и 165 мг (1,35 ммоль) 4-диметиламинопиридина растворяют в метиленхлориде (20 мл) и затем перемешивают при комнатной температуре в течение приблизительно 24 часов.
Реакционный раствор промывают 0,3 н. водной хлористоводородной кислотой, сушат над безводным сульфатом натрия и затем растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (этилацетат) дает 681 мг (83%) (9S)-9-(2-бромэтоксикарбонилокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 0,93 (3H, т, J=7,3 Гц), 1,00 (3H, т, J=7,6 Гц), 1,31-1,54 (4H, м), 1,72-1,86 (2H, м), 2,08-2,35 (2H, м), 3,50 (2H, т, J=6,2 Гц), 3,83 (2H, т, J=7,3 Гц), 4,41 (2H, т, J=6,2 Гц), 5,23 (2H, с), 5,37 (1H, д, J=17,0 Гц), 5,68 (1H, д, J=17,0 Гц), 7,16 (1H, шир.д), 7,22 (1H, с), 7,40 (1H, с), 7,59-7,71 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 609, 611 (M+H).
Способ 6-B
(9S)-9-{2-[(R-2-трет-Бутоксикарбониламино-2-метоксикарбонил)этансульфанил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
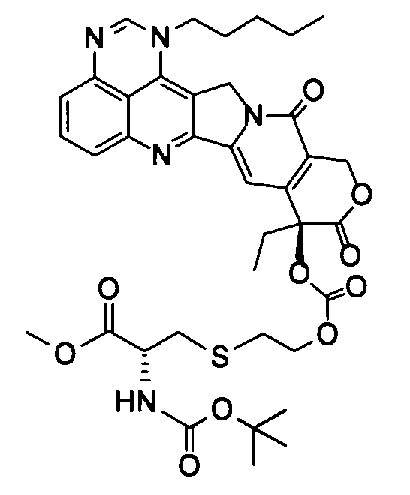
50 мг (0,082 ммоль) (9S)-9-(2-бромэтоксикарбонилокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, полученного в способе 6-А, 58 мг (0,25 ммоль) метилового эфира трет-бутоксикарбонилцистеина и 34 мг (0,25 ммоль) карбоната калия перемешивают в ацетонитриле (2 мл) при комнатной температуре в течение шести часов.
После добавления к реакционной смеси метиленхлорида раствор промывают 0,3 н. водной хлористоводородной кислотой, сушат над безводным сульфатом натрия и затем растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 50:1) дает 51 мг (82%) (9S)-9-{2-[(R-2-трет-Бутоксикарбониламино-2-метоксикарбонил)этансульфанил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 0,93 (3H, т, J=7,0 Гц), 0,98 (3H, т, J=7,6 Гц), 1,30-1,54 (4H, м), 1,41 (9H, с), 1,68-1,86 (2H, м), 2,05-2,34 (2H, м), 2,78 (2H, т, J=6,8 Гц), 2,89-3,05 (2H, м), 3,71 (3H, с), 3,82 (2H, т, J=7,3 Гц), 4,23 (2H, т, J=6,8 Гц), 4,46 (1H, м), 5,23 (2H, с), 5,37 (1H, д, J=17,0 Гц), 5,42 (1H, м), 5,67 (1H, д, J=17,0 Гц), 7,17 (1H, шир.д), 7,22 (1H, с), 7,40 (1H, с), 7,60-7,70 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 764 (M+H).
Способ 6-C
(9S)-9-{2-[(R-2-трет-Бутоксикарбониламино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
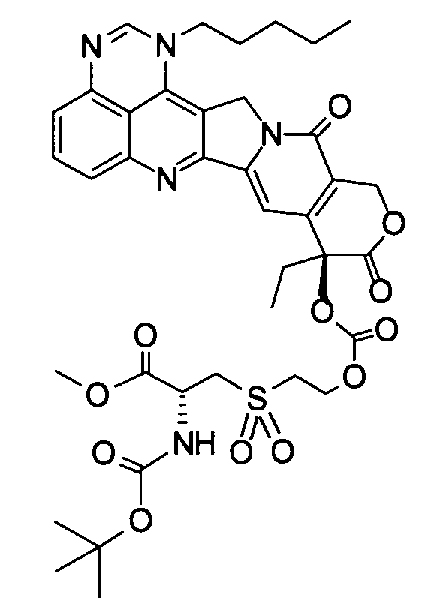
98 мг (0,13 ммоль) (9S)-9-{2-[(R-2-трет-бутоксикарбониламино-2-метоксикарбонил)этансульфанил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, полученного в способе 6-В, и 158 мг (0,26 ммоль) OxoneTM перемешивают в метаноле (5 мл) при комнатной температуре в течение 2,5 часов.
К реакционной смеси добавляют метиленхлорид, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 40:1) дает 93 мг (92%) (9S)-9-{2-[(R-2-трет-бутоксикарбониламино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде твердого вещества желтого цвета.
ESI (ЖХ-МС положительный тип) m/z 796 (M+H).
Способ 6-D
Трифторацетат (9S)-9-{2-[(R-2-амино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона
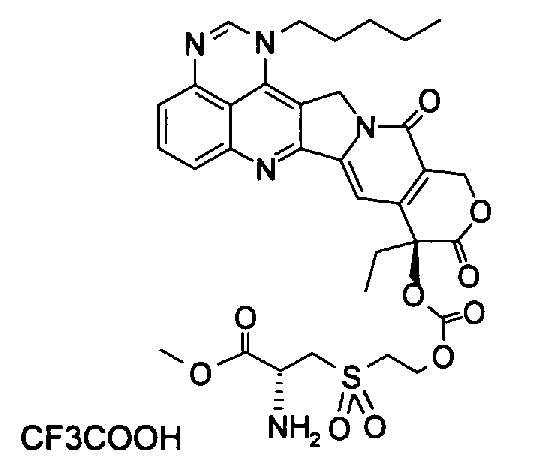
93 мг (0,12 ммоль) (9S)-9-{2-[(R-2-трет-бутоксикарбониламино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона растворяют в трифторуксусной кислоте (3 мл) и затем перемешивают при комнатной температуре в течение одного часа.
К реакционному раствору добавляют диэтиловый эфир и перемешивают при комнатной температуре в течение 10 минут. Полученное твердое вещество собирают фильтрацией с получением 88 мг (94%) трифторацетата (9S)-9-{2-[(R-2-амино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 6A) в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CD3OD) δ (м.д.): 0,95 (3H, т, J=7,3 Гц), 1,03 (3H, т, J=7,3 Гц), 1,37-1,56 (4H, м), 1,76-1,92 (2H, м), 2,10-2,28 (2H, м), 3,69-4,05 (6H, м), 3,90 (3H, с), 4,48-4,82 (3H, м), 5,35 (2H, с), 5,48 (1H, д, J=16,8 Гц), 5,64 (1H, д, J=16,8 Гц), 7,13 (1H, шир.д) , 7,28 (1H, с), 7,56 (1H, д, J=8,3 Гц), 7,71 (1H, м), 7,80 (1H, с).
ESI (ЖХ-МС положительный тип) m/z 696 (M+H).
Пример 7
Гидрохлорид (9S)-9-{2-[(R-2-амино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 7A)
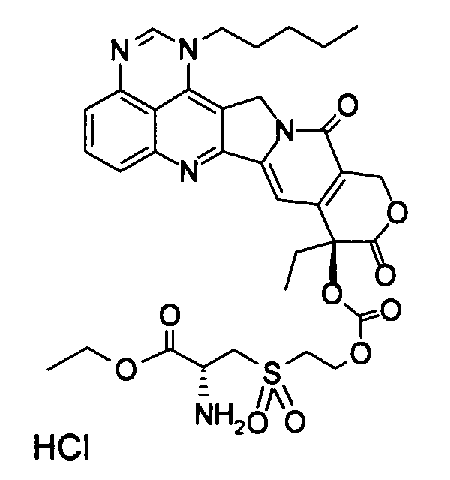
Способ 7-A
(9S)-9-{2-[(R-2-трет-Бутоксикарбониламино-2-этоксикарбонил)этансульфанил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
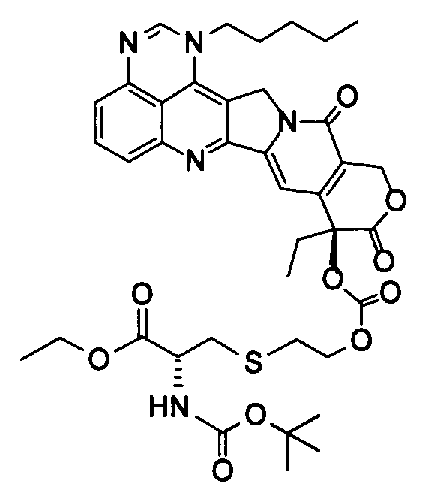
270 мг (0,44 ммоль) (9S)-9-(2-бромэтоксикарбонилокси)-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, 333 мг (1,33 ммоль) этилового эфира трет-бутоксикарбонилцистеина и 184 мг (1,33 ммоль) карбоната калия перемешивают в ацетонитриле (10 мл) при комнатной температуре в течение 20 часов.
После добавления к реакционной смеси метиленхлорида смесь промывают 0,3 н. водной хлористоводородной кислотой, сушат над безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 50:1) дает 159 мг (46%) (9S)-9-{2-[(R-2-трет-бутоксикарбониламино-2-этоксикарбонил)этансульфанил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде масла желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 0,93 (3H, т, J=7,3 Гц), 0,97 (3H, т, J=7,3 Гц), 1,25 (3H, т, J=7,3 Гц), 1,32-1,53 (4H, м), 1,41 (9H, с), 1,73-1,85 (2H, м), 2,05-2,35 (2H, м), 2,79 (2H, т, J=6,9 Гц), 2,88-3,05 (2H, м), 3,83 (2H, т, J=7,3 Гц), 4,09-4,28 (4H, м), 4,43 (1H, м), 5,23 (2H, с), 5,37 (1H, д, J=17,2 Гц), 5,43 (1H, м), 5,67 (1H, д, J=17,2 Гц), 7,17 (1H, шир.д), 7,21 (1H, с), 7,40 (1H, с), 7,60-7,70 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 778 (M+H).
Способ 7-B
(9S)-9-{2-[(R-2-трет-Бутоксикарбониламино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
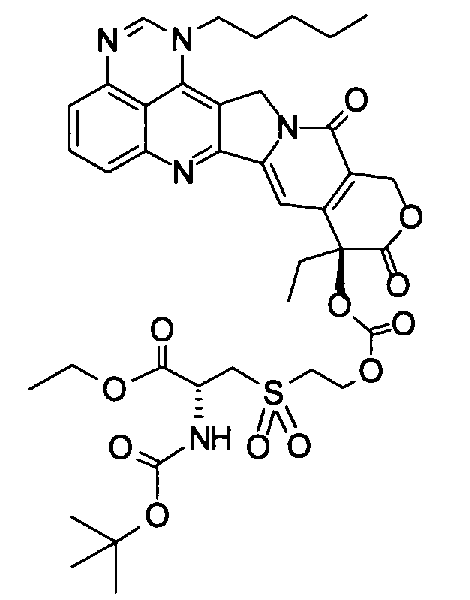
159 мг (0,20 ммоль) (9S)-9-{2-[(R-2-трет-бутоксикарбониламино-2-этоксикарбонил)этансульфанил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона и 252 мг (0,41 ммоль) OxoneTM перемешивают в метаноле (8 мл) при комнатной температуре в течение двух часов.
К реакционной смеси добавляют метиленхлорид, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 40:1) дает 141 мг (88%) (9S)-9-{2-[(R-2-трет-бутоксикарбониламино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 0,93 (3H, т, J=6,9 Гц), 0,99 (3H, т, J=7,6 Гц), 1,29 (3H, т, J=7,3 Гц), 1,32-1,55 (4H, м), 1,45 (9H, с), 1,72-1,87 (2H, м), 2,07-2,32 (2H, м), 3,25-3,52 (2H, м), 3,73 (2H, м), 3,84 (2H, т, J=7,3 Гц), 4,23 (2H, кв, J=7,3 Гц), 4,55 (2H, шир.т), 4,71 (1H, м), 5,25 (2H, с), 5,37 (1H, д, J=17,2 Гц), 5,69 (1H, д, J=17,2 Гц), 5,76 (1H, д, J=7,9 Гц), 7,18 (1H, шир.д), 7,19 (1H, с), 7,40 (1H, с), 7,61-7,72 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 810 (M+H).
Способ 7-C
Гидрохлорид (9S)-9-{2-[R-2-амино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона
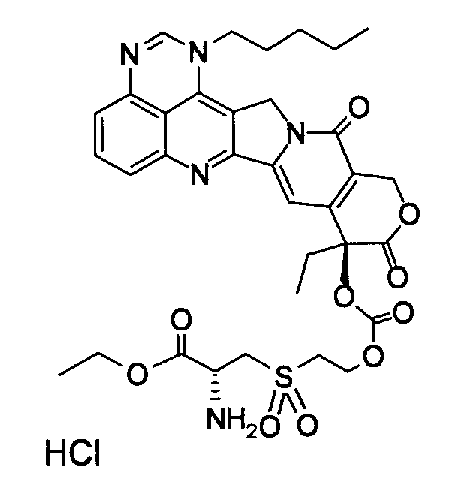
140 мг (0,17 ммоль) (9S)-9-{2-[(R-2-трет-бутоксикарбониламино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона растворяют в 1 н. растворе хлористоводородной кислоты - уксусной кислоты (5 мл) и перемешивают при комнатной температуре в течение одного часа.
К реакционной смеси добавляют этилацетат и перемешивают при комнатной температуре в течение 30 минут. Полученное твердое вещество собирают фильтрацией с получением 127 мг (94%) гидрохлорида (9S)-9-{2-[R-2-амино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 7A) в виде твердого вещества желтого цвета.
1H-ЯМР (400 МГц, CD3OD) δ (м.д.): 0,99 (3H, т, J=7,6 Гц), 1,04 (3H, т, J=7,2 Гц), 1,36 (3H, т, J=7,2 Гц), 1,40-1,60 (4H, м), 1,92-2,00 (2H, м), 2,10-2,25 (2H, м), 3,70-3,86 (3H, м), 4,10 (1H, дд, J=15,2, 4,0 Гц), 4,25 (2H, т, J=8,0 Гц), 4,36 (2H, кв, J=7,6 Гц), 4,60 (2H, т, J=5,2 Гц), 4,77 (1H, м), 5,52 (1H, д, J=16,8 Гц), 5,54 (2H, с), 5,65 (1H, д, J=16,8 Гц), 7,54 (1H, д, J=7,6 Гц), 7,83 (1H, с), 7,91 (1H, д, J=8,0 Гц), 8,09 (1H, шир.т), 8,38 (1H, с).
ESI (ЖХ-МС положительный тип) m/z 710 (M+H).
Пример 8
Гидрохлорид (9S)-9-[2-(2-аминоэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 8A)
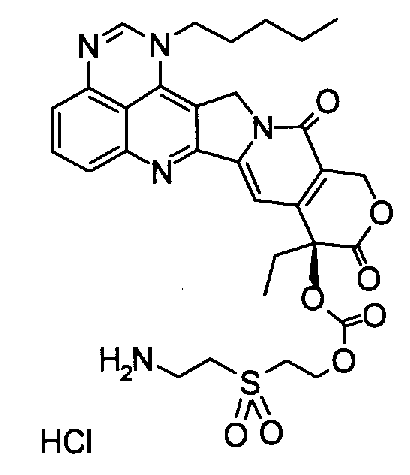
Способ 8-A
(9S)-9-[2-(2-трет-Бутоксикарбониламиноэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)дион
825 мг (1,8 ммоль) (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, 543 мг (2,7 ммоль) хлорформиата п-нитрофенила, 0,47 мл (2,7 ммоль) диизопропилэтиламина и 220 мг (1,8 ммоль) 4-диметиламинопиридина растворяют в метиленхлориде (16 мл) на льду и затем перемешивают при комнатной температуре в течение трех часов. Затем к этому раствору добавляют 1,6 г (6,3 ммоль) 2-(2-трет-бутоксикарбониламиноэтансульфонил)этанола (Tetrahedron, 55 (1999), 6623-6634) и полученную смесь перемешивают при комнатной температуре в течение приблизительно 24 часов.
Реакционный раствор промывают 0,3 н. водной хлористоводородной кислотой, сушат над безводным сульфатом натрия и растворитель отгоняют при пониженном давлении. Очистка полученного остатка хроматографией на колонке с силикагелем (метиленхлорид:метанол = 30:1) дает 550 мг (42%) (9S)-9-[2-(2-трет-бутоксикарбониламиноэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ (м.д.): 0,94 (3H, т, J=7,3 Гц), 1,00 (3H, т, J=7,3 Гц), 1,33-1,55 (4H, м), 1,43 (9H, с), 1,73-1,86 (2H, м), 2,07-2,31 (2H, м), 3,20-3,49 (4H, м), 3,70 (2H, м), 3,84 (2H, т, J=7,3 Гц), 4,57 (2H, шир.т), 5,25 (2H, с), 5,37 (1H, д, J=17,2 Гц), 5,45 (1H, м), 5,69 (1H, д, J=17,2 Гц), 7,15-7,20 (2H, м), 7,41 (1H, с), 7,61-7,73 (2H, м).
ESI (ЖХ-МС положительный тип) m/z 738 (M+H).
Способ 8-B
Гидрохлорид (9S)-9-[2-(2-аминоэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона
530 мг (0,72 ммоль) (9S)-9-[2-(2-трет-бутоксикарбониламиноэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона, полученного в способе 8-А, растворяют в 1 н. растворе хлористоводородной кислоты - уксусной кислоты (10 мл) и перемешивают при комнатной температуре в течение одного часа.
К реакционной смеси добавляют этилацетат и перемешивают при комнатной температуре в течение 30 минут, полученное твердое вещество собирают фильтрацией с получением 480 мг (94%) гидрохлорида (9S)-9-[2-(2-аминоэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (соединение 8A) в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CD3OD) δ (м.д.): 0,94-1,05 (6H, м), 1,40-1,61 (4H, м), 1,90-2,04 (2H, м), 2,07-2,28 (2H, м), 3,48-3,81 (6H, м), 4,25 (2H, шир.т), 4,55 (2H, м), 5,51 (1H, д, J=17,2 Гц), 5,53 (2H, с), 5,65 (1H, д, J=17,2 Гц), 7,52 (1H, д, J=7,6 Гц), 7,90 (1H, с), 7,93 (1H, д, J=8,6 Гц), 8,08 (1H, шир.т), 8,35 (1H, с).
ESI (ЖХ-МС положительный тип) m/z 638 (M+H).
Тестовый пример 1
Определяют процент превращения соединения 2А, полученного в примере 2, в активированную форму в сыворотке человека, мыши, обезьяны и собаки. Активированная форма находится в быстром равновесии между формой лактона и формой карбоксилата, которое измеряется отдельно.
Соединение 2A инкубируют при температуре 37°C в концентрации 50 мкM в сыворотке человека, мыши, обезьяны и собаки. Инкубацию прерывают в определенное время (0, 30, 60, 120 и 360 минут) и образцы анализируют ВЭЖХ после обработки с удалением белков.
Условия для проведения анализа ВЭЖХ:
Условия ВЭЖХ
Колонка: Develosil C30-UG-3, 3 мкм, 50×4,6 мм В.Д.
Температура колонки: постоянная температура приблизительно 25°C
Подвижная фаза: A: 10 мM фосфатный буфер (pH 4,7)
B: ацетонитрил/B (мин): 90/10(0)→90/10(0,4)→40/60(6)→2/98(8)→90/10(9)→90/10(15)
Скорость потока: 1,0 мл/мин
Определение: датчик матрицы фотодиодов, длина волны определения 350 нм
Впрыскиваемое количество: 30 мкл
Результаты показаны в таблице 3 и на фиг.1-4. Результаты показывают, что растворимое в воде пролекарство в соответствии с данным изобретением (соединение 2А) быстро превращается в форму лактона в сыворотке человека, мыши, обезьяны и собаки, подтверждая отсутствие видовых различий. На 360 минуте инкубации равновесие лактон-карбоксилат сдвигается по направлению к форме карбоксилата. Наибольшее количество карбоксилата найдено в сыворотке человека, приблизительно такое же количество найдено в сыворотке мыши и обезьяны, и немногим меньшее количество найдено в сыворотке собаки, по сравнению с сывороткой мыши и обезьяны.
В общем, камптотецины в растворе находятся в быстром равновесии между структурой, в которой карбонил, находящийся в положении 3, образует 6-членный циклический сложный эфир с кислородом в положении 2, и его структурой с раскрытым кольцом. Форма лактона относится к первым условиям, и форма карбоксилата относится к последним условиям.
форма лактона
форма карбоксилата
93,4
6,6
43,5
56,5
20,2
79,8
9,8
90,2
8,8
91,2
форма лактона
форма карбоксилата
90,6
9,4
67,9
32,1
50,6
49,4
34,4
65,6
24,5
75,5
форма лактона
форма карбоксилата
93,3
6,7
57,5
42,5
38,8
61,2
24,7
75,3
20,7
79,3
форма лактона
форма карбоксилата
93,9
6,1
73,2
26,8
55,7
44,3
39,5
60,5
33,9
66,1
Тестовый пример 2
Определяют стабильность соединения 2А при различных значениях рН. Данное соединение помещают в буферы с различными рН в концентрации 25 мкМ. После инкубации при температуре 25°C в течение 0, 3 и 6 часов соединение анализируют ВЭЖХ.
Буферы, применяемые при каждом рН, показаны ниже.
рH 2,0: 50 мМ HCl-KCl буфер
рH 3,0: 50 мМ цитратный буфер
рH 4,0: 50 мМ цитратный буфер
рH 5,0: 50 мМ сукцинатный буфер
pH 6,5: 50 мМ фосфатный буфер
pH 7,4: 50 мМ фосфатный буфер
Условия для проведения анализа ВЭЖХ:
Условия ВЭЖХ
Колонка: Develosil C30-UG-3, 3 мкм, 50×4,6 мм В.Д.
Температура колонки: постоянная температура приблизительно 25°C
Подвижная фаза: A: 10 мM фосфатный буфер (pH 4,7)
B: ацетонитрил (мин): 90/10(0)→90/10(0,4)→40/60(6)→2/98(8)→90/10(9)→90/10(15)
Скорость потока: 1,0 мл/мин
Определение: датчик матрицы фотодиодов, длина волны определения 350 нм
Впрыскиваемое количество: 30 мкл
Результаты показаны в таблице 4 на фиг.5. Результаты показывают, что соединение в соответствии с данным изобретением, представленное соединением 2А, является стабильным при значениях рН вплоть до рН 3, и его стабильность слегка снижается при рН 4 (96,1% через 6 часов).
Значения при pH 6,5 и pH 7,4 уже достигают 0% через 3 и 6 часов инкубации. Более того, подтверждается, что это соединение химически превращается в форму лактона и форму карбоксилата в зависимости от рН.
Тестовый пример 3
Растворимость растворимого в воде пролекарства, полученного в примерах (соединения 1A-8A) в дистиллированной воде, сравнивают с растворимостью (9S)-9-этил-9-гидрокси-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона (типовое соединение в патентном документе 2: ссылочное соединение 1).
Результаты показаны в таблице 5. Обнаружено, что растворимость растворимых в воде пролекарств в соответствии с данным изобретением значительно улучшена по сравнению со ссылочным соединением 1.
Тестовый пример 4
Парентеральное введение растворимых в воде пролекарств камптотецина, представленных указанными выше формулами (2) и (3), в мышиную модель рака толстой кишки показывает сильную активность ингибирования роста рака для широкого диапазона дозирования. Таким образом, эти пролекарства полезны в качестве противоопухолевых агентов. Пример противоопухолевой активности показан ниже.
Определения противоопухолевого действия
Противоопухолевое действие определяют для характерных примеров группы соединений в соответствии с данным изобретением. Имеющих опухоль мышей получают подкожной трансплантацией колонии клеток рака толстой кишки человека HCT116, полученной из American Type Culture Collection (Virginia, USA) в правый бок голых мышей BALB/c, полученных от Charles River Japan, и применяют их для определения противоопухолевого действия.
После недельного карантина полученных голых мышей подвергают подкожной трансплантации 5×106 HCT116 клеток в правый бок. Мышей с размером опухоли, достигшим 200 мм3 или около того, применяют для эксперимента.
Соединения растворяют в 1 мМ физиологического раствора с цитратным буфером, pH 4, и вводят внутривенно. Введение осуществляют один раз в неделю в течение трех недель, всего три введения. Противоопухолевое действие определяют как ингибирование роста опухоли (ИРО) с применением следующего уравнения.
Ингибирование роста опухоли (ИРО) (%)={(1-изменение среднего объема опухоли в группе, получающей лечение лекарственным средством/изменение среднего объема опухоли в контрольной группе)×100}
Результаты показаны в таблице 6.
1,9
3,75
7,5
15
30
60
52
72
74
85
97
110
1,9
3,75
7,5
15
30
60
53
55
61
78
96
106
Тестовый пример 5
Определяют количество соединения 2A, полученного в примере 2, превратившееся в активированную форму в сыворотке человека, крысы, мыши, обезьяны и собаки. Активированная форма находится в быстром равновесии между формой лактона и формой карбоксилата, которое измеряется отдельно.
Соединение 2A инкубируют при температуре 37°C в концентрации 50 мкM в сыворотке человека, мыши, крысы, обезьяны и собаки. Инкубацию прерывают в определенное время (0, 30, 60, 120 и 360 минут) и образцы анализируют ВЭЖХ после обработки с удалением белков.
Условия для проведения анализа ВЭЖХ:
Условия ВЭЖХ
Колонка: Develosil C30-UG-3, 3 мкм, 35×4,6 мм В.Д.
Температура колонки: постоянная температура приблизительно 25°C
Подвижная фаза: A: 10 мM фосфатный буфер (pH 4,7)
B: ацетонитрил/B (мин): 90/10(0)→90/10(0,4)→40/60(6)→2/98(8)→90/10(9)→90/10(15)
Скорость потока: 1,0 мл/мин
Определение: датчик матрицы фотодиодов, длина волны определения 350 нм
Впрыскиваемое количество: 30 мкл
Результаты показаны в таблице 7. Результаты показывают, что растворимое в воде пролекарство в соответствии с данным изобретением (соединение 2А) быстро превращается в форму лактона в сыворотке человека, мыши, крысы, обезьяны и собаки, подтверждая отсутствие видовых различий. На 360 минуте инкубации равновесие лактон-карбоксилат сдвигается по направлению к форме карбоксилата. Наибольшее количество карбоксилата найдено в сыворотке человека, приблизительно такое же количество найдено в сыворотке мыши и обезьяны, и немногим меньшее количество найдено в сыворотке собаки, по сравнению с сывороткой мыши и обезьяны.
В общем, камптотецины в растворе находятся в быстром равновесии между структурой, в которой карбонил, находящийся в положении 3, образует 6-членный циклический сложный эфир с кислородом в положении 2, и его структурой с раскрытым кольцом. Форма лактона относится к первым условиям, и форма карбоксилата относится к последним условиям.
форма лактона
форма карбоксилата
100
0
69,9
30,1
41,8
58,2
19,1
80,9
10,5
89,5
форма лактона
форма карбоксилата
94,8
5,2
82,0
18,0
64,9
35,1
49,5
50,5
39,8
60,2
форма лактона
форма карбоксилата
88,9
11,1
61,0
39,0
43,7
56,3
32,0
68,0
30,4
69,6
форма лактона
форма карбоксилата
98,5
1,5
78,4
21,6
55,1
44,9
35,5
64,5
25,9
74,1
форма лактона
форма карбоксилата
98,3
1,7
90,1
9,9
80,4
19,6
66,5
33,5
55,4
44,6
Сравнительный тестовый пример 1
По методике тестового примера 1 определяют количество (9S)-9-этил-9-(триптофил-γ-глутамилокси)-1-пентил-1H,12H-пирано[3”,4”:6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9H,15H)диона [типовое соединение (Q) а патентном документе 1: ссылочное соединение 2], превращенного в форму лактона и форму карбоксилата в течение времени в сыворотке человека и мыши.
Результаты тестирования сыворотки человека показаны на фиг.6, и результаты тестирования сыворотки мыши показаны на фиг.7. В обоих случаях степень превращения и эффективность являются незначительными и имеют место межвидовые различия.
Промышленная применимость
Растворимые в воде пролекарства в соответствии с данным изобретением и их фармацевтически приемлемые соли, гидраты или сольваты имеют эфирную цепь определенной структуры, которая отвечает за их превосходную растворимость в воде. Кроме того, растворимые в воде пролекарства в соответствии с данным изобретением быстро превращаются в активную форму химическим превращением, и это снижает межвидовые и индивидуальные различия. В частности, данное изобретение очень полезно для применения для нерастворимых фармацевтических агентов, таких как камптотецин, которые содержат спиртовую гидроксильную группу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕКСАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ, СПОСОБ ПОЛУЧЕНИЯ ГЕКСАЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ | 2002 |
|
RU2299212C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ ПРОТИВООПУХОЛЕВЫХ ЦЕЛЕВЫХ ФЕРМЕНТОВ | 2002 |
|
RU2319482C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОНЪЮГАТ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА, И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2840147C1 |
| АНТИ-HER2 КОНЪЮГАТ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2015 |
|
RU2683780C2 |
| АНТИ-HER2 КОНЪЮГАТ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2015 |
|
RU2794183C2 |
| ДИГИДРОПИРИДОФТАЛАЗИНОНОВЫЕ ИНГИБИТОРЫ ПОЛИ(АДФ-РИБОЗА)ПОЛИМЕРАЗЫ | 2009 |
|
RU2514937C2 |
| КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2013 |
|
RU2664465C2 |
| КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2013 |
|
RU2776489C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2021 |
|
RU2841377C1 |
| ГЕКСАЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 1992 |
|
RU2071476C1 |
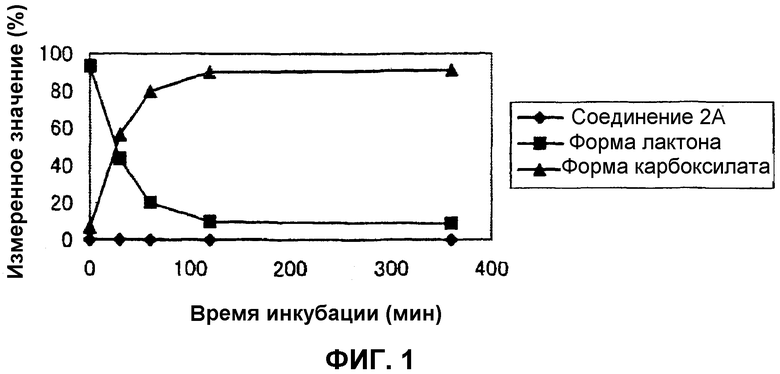
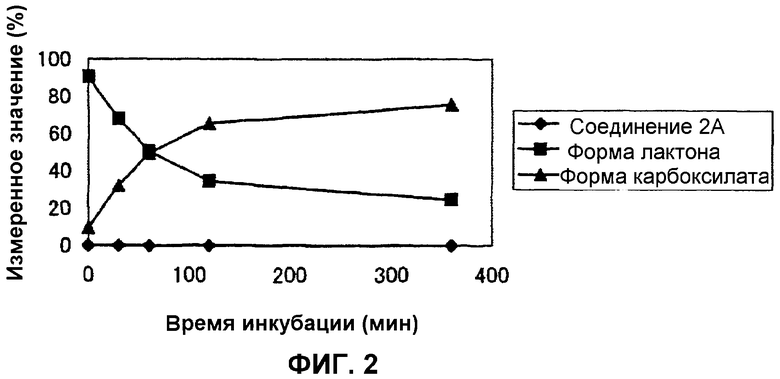
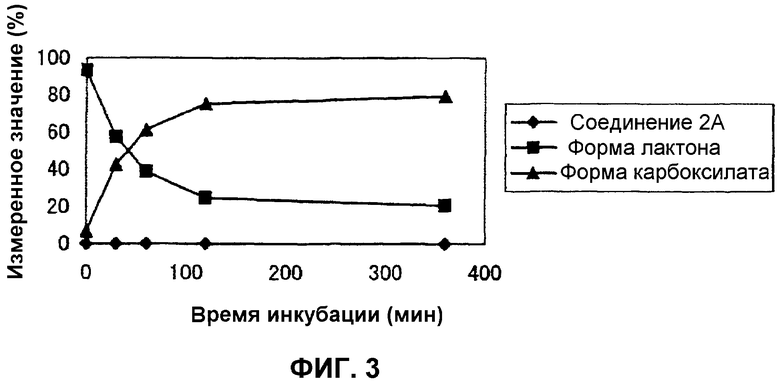
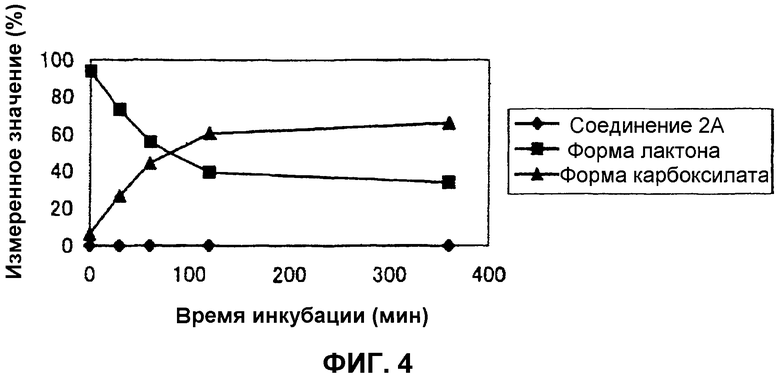
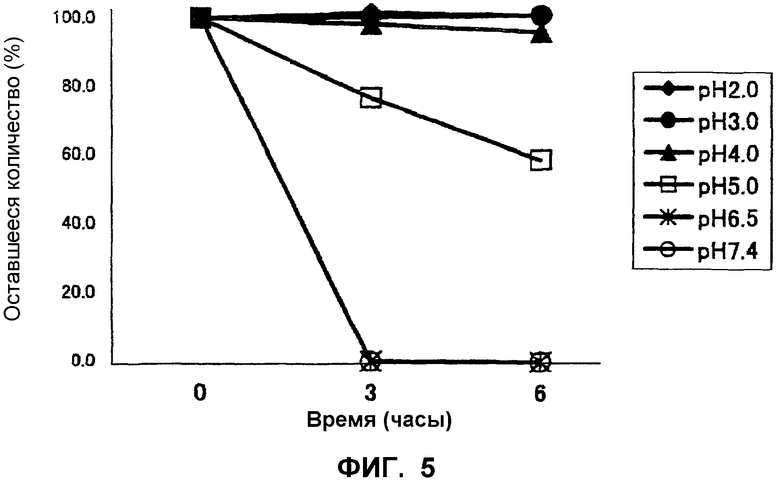
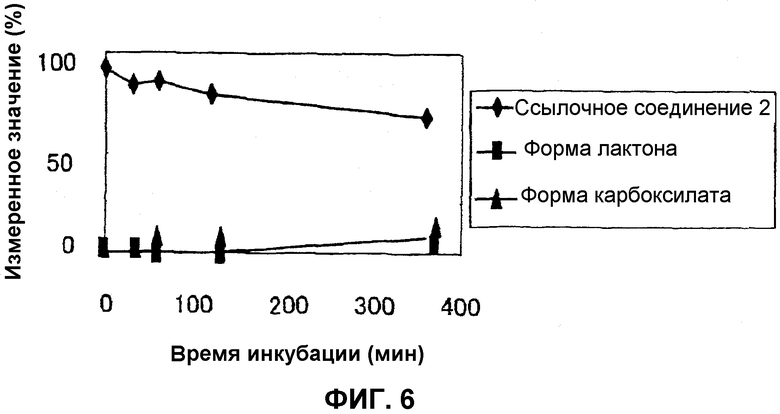
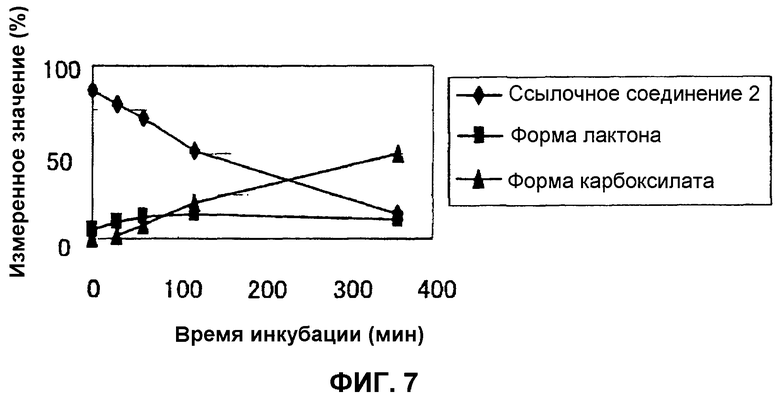
Настоящее изобретение относится к новым растворимым в воде пролекарствам, которые могут быть введены парентерально и которые демонстрируют высокую растворимость в воде, быстро превращаются в активную форму. Указанные пролекарства представлены формулой (2) или (3)
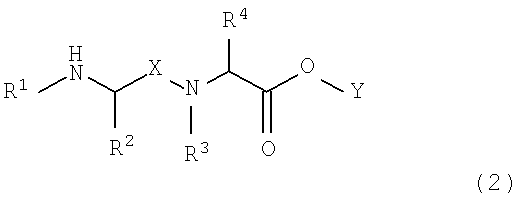
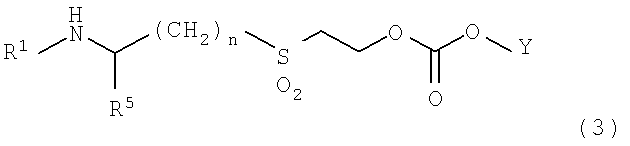
в которых в формуле (2) R1 является атомом водорода или С1-С6-алкильной группой; X является С=O или С1-С3 алкиленовой группой; R2 и R4 каждый независимо является атомом водорода, С1-С6 алкильной группой; и R3 является С1-С6 алкильной группой, а в формуле (3) R1 имеет значения, определенные в формуле (2); n является целым числом от 1 до 6; и R5 является атомом водорода или -COOR6 (где R6 является атомом водорода или С1-С6 алкильной группой), где в формуле (2) и (3) Y является группой, представленной формулой (5), которая указана в формуле изобретения. 3 н. и 9 з.п. ф-лы, 7 ил., 7 табл.
1. Растворимое в воде пролекарство, представленное формулой (2) или (3), или его фармацевтически приемлемая соль

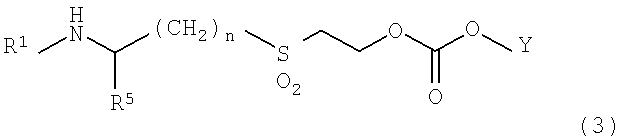
где в формуле (2)
R1 является атомом водорода или С1-С6-алкильной группой;
X является С=O или С1-С3 алкиленовой группой;
R2 и R4 каждый независимо является атомом водорода, С1-С6 алкильной группой; и
R3 является С1-С6 алкильной группой,
где в формуле (3)
R1 имеет значения, определенные в формуле (2);
n является целым числом от 1 до 6; и
R5 является атомом водорода или -COOR6 (где R6 является атомом водорода или С1-С6 алкильной группой),
где в формуле (2) и (3) Y является группой, представленной формулой (5):
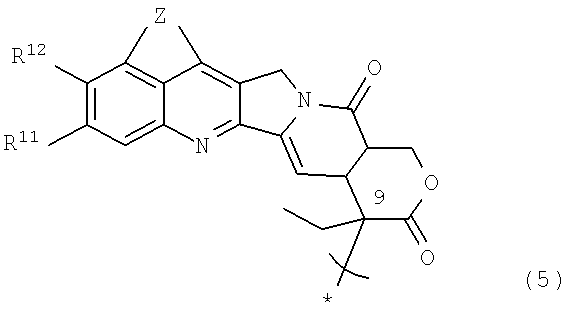
где * указывает на место связывания;
R11 и R12 означают атом водорода или вместе с атомами углерода, к которым они присоединены, вместе образуют 6-членное ароматическое кольцо; и
Z является -N=C(R22)-N(R21)-, где R22 является атомом водорода, R21 является C1-С10-алкильной группой.
2. Растворимое в воде пролекарство по п.1, или его фармацевтически приемлемая соль, в котором R1 является атомом водорода, метальной группой или этильной группой.
3. Растворимое в воде пролекарство по п.1 или 2, или его фармацевтически приемлемая соль, в котором R2 является атомом водорода или метальной группой.
4. Растворимое в воде пролекарство по п.1, или его фармацевтически приемлемая соль, в котором R3 является С1-С3-алкильной группой.
5. Растворимое в воде пролекарство по п.1, или его фармацевтически приемлемая соль, в котором R4 является водородом или метильной группой.
6. Растворимое в воде пролекарство по п.1 или 2, или его фармацевтически приемлемая соль, в котором n равно 1 и R5 является атомом водорода или -COOR6 (где R6 является атомом водорода или С1-С6-алкильной группой).
7. Растворимое в воде пролекарство по п.1 или 2, или его фармацевтически приемлемая соль, в котором n равно целому числу от 2 до 6 и R5 является атомом водорода.
8. Растворимое в воде пролекарство по п.1, или его фармацевтически приемлемая соль, в котором R11 является атомом водорода;
R12 является атомом водорода или С1-С3-алкильной группой;
R21 является С1-С8-алкильной группой; и
R22 является атомом водорода.
9. Растворимое в воде пролекарство по п.1, или его фармацевтически приемлемая соль, в котором Y представляет собой
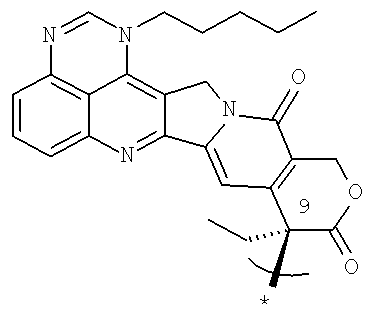
10. Растворимое в воде пролекарство или его фармацевтически приемлемая соль, содержащее, по крайней мере, одно растворимое в воде пролекарство, выбранное из группы, включающей:
(a) (9S)-9-этил-9-{[метил-(2-метиламиноэтил)амино]ацетокси}-1-пентил-1Н, 12Н-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9Н,15Н)дион;
(b) (9S)-9-этил-9-(глицилсаркозилокси)-1-пентил-1Н,12Н-пирано[3',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9Н,15Н)дион;
(c) (9S)-9-{[(2-аминоэтил)метиламино]ацетокси}-9-этил-1-пентил-1H,12Н-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9Н,15Н)дион;
(d) (9S)-9-этил-9-(саркозилсаркозилокси)-1-пентил-1H,12Н-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9Н,15Н)дион;
(е) (9S)-9-[2-(2-аминоэтансульфонил)этоксикарбонилокси]-9-этил-1-пентил-1Н,12Н-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9Н,15Н)дион;
(f) (S)-4-этил-3,13-диоксо-3,4,12,13-тетрагидро-1Н-2-окса-6,12а-диазадибензо[b,h]флуорен-4-иловый эфир (аминоацетилметиламино)уксусной кислоты;
(g) (9S)-9-{2-[(R-2-амино-2-метоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1Н,12Н-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9Н,15Н)дион;
(h) (9S)-9-{2-[(R-2-амино-2-этоксикарбонил)этансульфонил]этоксикарбонилокси}-9-этил-1-пентил-1H,12Н-пирано[3'',4'':6',7']индолизино[1',2':6,5]пиридо[4,3,2-de]хиназолин-10,13(9Н,15Н)дион.
11. Терапевтический агент, обладающий клеточным антипролиферативным действием, представляющий собой пролекарство по любому из пп.8-10 или его фармацевтически приемлемую соль.
12. Терапевтический агент по п.11, где раком является рак кишечника, рак легких, рак груди, рак желудка, рак шейки матки и/или рак мочевого пузыря.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ многоэлектродной сварки | 1974 |
|
SU506478A1 |
Авторы
Даты
2011-03-10—Публикация
2005-04-08—Подача