Область техники, к которой относится изобретение
Настоящее изобретение относится к конъюгату антитело-лекарственное средство, содержащему противоопухолевое лекарственное средство, конъюгированное через фрагмент линкерной структуры с антителом, способным обеспечивать направленную доставку лекарственного средства к опухолевым клеткам, при этом конъюгат применяют в качестве противоопухолевого лекарственного препарата.
Уровень техники
Конъюгат антитело-лекарственное средство (ADC), содержащий цитотоксическое лекарственное средство, конъюгированное с антителом, антиген которого экспрессируется на поверхности опухолевых клеток, и которое также связано с антигеном, способным к клеточной интернализации, позволяет селективно доставлять лекарственное средство в опухолевые клетки, и, предполагается, что в результате этого происходит аккумуляция лекарственного средства в опухолевых клетках и гибель опухолевых клеток (см., непатентные публикации 1-3). В качестве примера конъюгата антитело-лекарственное средство (ADC) может быть приведен милотарг (гемтузумаб озогамицин), одобренный в качестве терапевтического средства при остром миелолейкозе, в котором калихеамицин конъюгирован с анти-CD33 антителом. Кроме того, недавно был одобрен в качестве терапевтического средства при лимфоме Ходжкина и анапластической крупноклеточной лимфоме адцетрис (брентуксимаб ведотин), в котором ауристатин E конъюгирован с анти-CD30 антителом (см., непатентную публикацию 4). Лекарственные средства, содержавшиеся в конъюгатах антитело-лекарственное средство, которые были одобрены до настоящего времени, осуществляют направленную доставку лекарственного средства в ДНК или тубулин.
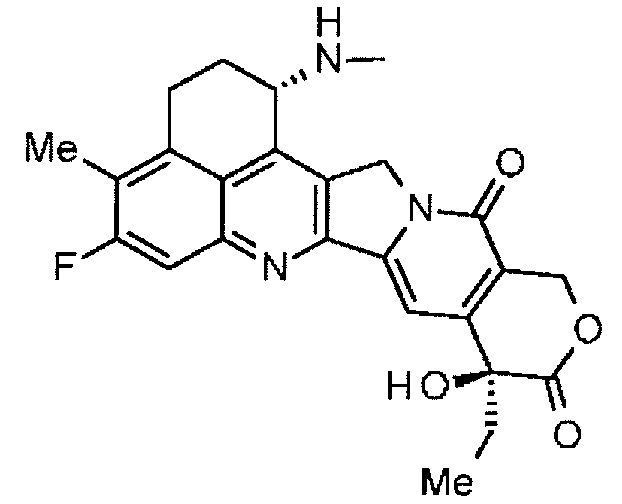
Что касается противоопухолевых средств, то известны низкомолекулярные соединения, производные камптотецина, соединения, которые ингибируют топоизомеразу I с проявлением противоопухолевого эффекта. Среди них, противоопухолевое соединение, представленное формулой ниже
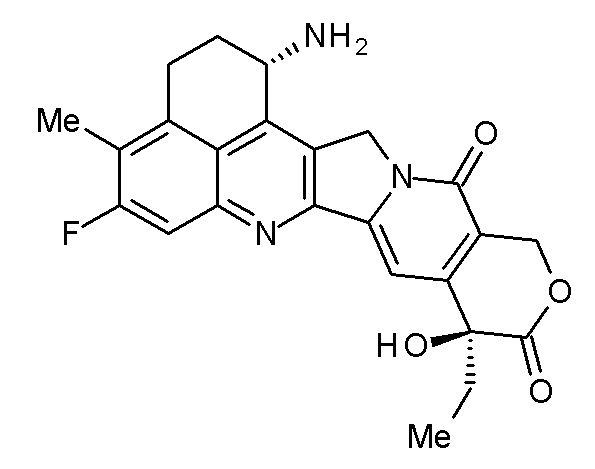
(эксатекан, химическое название: (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[де]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)дион) представляет собой водорастворимое производное камптотецина (патентная публикация 1 и 2). В отличие от иринотекана, применяемого в клинике в настоящее время, для эксатекана требуется активация ферментом. Кроме того, его ингибирующая активность в отношении топоизомеразы II выше, чем в случае SN-38, который является основным фармацевтически активным веществом препаратов иринотекана и топотекана, также используемых в клинике, и он проявляет более сильное разрушающее действие in vitro в отношении различных опухолевых клеток. В частности, он проявляет активность против опухолевых клеток, которые обладают резистентностью к SN-38 или другим подобным веществам вследствие экспрессии P-гликопротеина. Кроме того, в модели опухоли человека, подкожно трансплантируемой мышам, эксатекан проявляет мощный противоопухолевый эффект и уже прошел клинические испытания, но еще не доступен на рынке фармацевтических препаратов (см., непатентные публикации 5-10). Пока остается неясным, может или не может эксатекан оказывать эффективное воздействие в форме конъюгата антитело-лекарственное средство.
DE-310 представляет собой комплекс, в котором эксатекан конъюгирован с биоразлагаемым полимером карбоксиметилдекстран-полиспиртом через GGFG пептидный спейсер (патентная публикация 3). Превращая эксатекан в форму полимерного пролекарства, можно поддерживать сохранение на высоком уровне свойства крови, а также улучшать пассивную целенаправленную доставку в область опухоли вследствие повышенной проницаемости вновь образовавшихся кровеносных сосудов внутри опухоли и ретенции в тканях опухоли. В случае DE-310, в результате расщепления пептидного спейсера ферментом, эксатекан и эксатекан с глицином, соединенным с аминогруппой, непрерывно высвобождается в качестве основного активного вещества. Вследствие этого, улучшается фармакокинетика, и на основе доклинических исследований различных моделей оценки опухоли было обнаружено, что DE-310 обладает более высокой эффективностью, чем эксатекан, введенный в чистом виде, даже если доза эксатекана в форме DE-310 ниже, чем в случае введения эксатекана в чистом виде. Было проведено клиническое исследование препарата DE-310, и его эффективность была подтверждена на людях, причем в этом исследовании делалось предположение, что основное активное вещество накапливается в опухоли, а не в здоровых тканях, однако, также имеются данные, указывающие на то, что накопление DE-310 и основного активного вещества в опухоли сильно не отличается от накопления в здоровых тканях у людей, и, поэтому, пассивная целенаправленная доставка DE-310 у людей не наблюдается (см., непатентные публикации 11-14). В результате, DE-310 также не был внедрен в лечебную практику, но остается неясным вопрос о том, может или не может эксатекан эффективно выполнять функцию лекарственного средства, предназначенного для такой целенаправленной доставки.
В качестве соединения, имеющего отношение к DE-310, также известен комплекс, в котором структурный фрагмент, представленный -NH(CH2)4C(=O)-, вводят между -GGFG-спейсером и эксатеканом с образованием структуры -GGFG-NH(CH2)4C(=O)-, используемый в качестве спейсерной структуры, (патентная публикация 4). Однако противоопухолевое действие комплекса точно не известно.
Список цитируемой литературы
Патентные публикации
[Патентная публикация 1] Выложенный патент Японии № 5-59061.
[Патентная публикация 2] Выложенный патент Японии № 8-337584.
[Патентная публикация 3] Международная публикация № WO 1997/46260.
[Патентная публикация 4] Международная публикация № WO 2000/25825.
Непатентные публикации
[Непатентная публикация 1] Ducry, L., et al. Bioconjugate Chem. (2010) 21, 5-13; Antibody-Drug Conjugates: Linking cytotoxic payloads to monoclonal antibodies.
[Непатентная публикация 2] Alley, S.C., et al. Current Opinion in Chemical Biology (2010) 14, 529-537; Antibody-drug conjugates: targeted drug delivery for cancer.
[Непатентная публикация 3] Damle N.K. Expert Opin. Biol. Ther. (2004) 4, 1445-1452; Tumour-targeted chemotherapy with immunoconjugates of calicheamicin.
[Непатентная публикация 4] Senter P.D., et al. Nature Biotechnology (2012) 30, 631-637; The discovery and development of brentuximab vedotin for use in relapsed Hodgkin lymphoma and systemic anaplastic large cell lymphoma.
[Непатентная публикация 5] Kumazawa, E., Tohgo, A., Exp. Opin. Invest. Drugs (1998) 7, 625-632; Antitumour activity of DX-8 951f: a new camptothecin derivative.
[Непатентная публикация 6] Mitsui, I., Kumazawa, E., Hirota, Y., et al. Jpn J. Cancer Res. (1995) 86, 776-782; A new water-soluble camptothecin derivative, DX-8951f, exhibits potent antitumor activity against human tumors in vitro and in vivo.
[Непатентная публикация 7] Takiguchi, S., Tohgo, A., et al. Jpn J. Cancer Res. (1997) 88, 760-769; Antitumor effect of DX-8951, a novel camptothecin analog, on human pancreatic tumor cells and their CPT-11-resistant variants cultured in vitro and xenografted into nude mice.
[Непатентная публикация 8] Joto, N. et al. Int J Cancer (1997) 72, 680-686; DX-8951f, a water-soluble camptothecin analog, exhibits potent antitumor activity against a human lung cancer cell line and its SN-38-resistant variant.
[Непатентная публикация 9] Kumazawa, E. et al. Cancer Chemother. Pharmacol. (1998) 42, 210-220; Potent and broad antitumor effects of DX-8951f, a water-soluble camptothecin derivative, against various human tumors xenografted in nude mice.
[Непатентная публикация 10] De Jager, R., et al. Ann N Y Acad Sci (2000) 922, 260-273; DX-8951f: summary of phase I clinical trials.
[Непатентная публикация 11] Inoue, K. et al. Polymer Drugs in the Clinical Stage, Edited by Maeda et al. (2003), 145-153; CM-dextran-polyalcohol-camptothecin conjugate, DE-310 with a novel carrier system and its preclinical data.
[Непатентная публикация 12] Kumazawa, E. et al. Cancer Sci (2004) 95, 168-175; DE-310, a novel macromolecular carrier system for the camptothecin analog DX-8951f: Potent antitumor activities in various murine tumor models.
[Непатентная публикация 13] Soepenberg, O. et al. Clinical Cancer Research, (2005) 11, 703-711; Phase I and pharmacokinetic study of DE-310 in Patients with Advanced Solid Tumors.
[Непатентная публикация 14] Wente M. N. et al. Investigational New Drugs (2005) 23, 339-347; DE-310, a macromolecular prodrug of the topoisomerase-I-inhibitor exatecan (DX-8951), in patients with operable solid tumors.
Сущность изобретения
Техническая задача
При лечении опухоли с помощью антитела, неудовлетворительный противоопухолевый эффект может наблюдаться даже тогда, когда антитело распознает антиген и связывает опухолевые клетки, и существуют обстоятельства, при которых требуется более эффективное противоопухолевое антитело. Кроме того, многие противоопухолевые низкомолекулярные соединения имеют недостаток, связанный с их безопасностью, например, связанный с побочным эффектом и токсичностью, это свойственно даже соединениям, которые обладают отличным противоопухолевым действием, и, поэтому важной задачей остается достижение более высокого терапевтического эффекта за счет дополнительного повышения безопасности. Поэтому, задачей настоящего изобретения является создание противоопухолевого лекарственного средства, которое обладает высоким терапевтическим действием и которое характеризуется исключительными свойствами с точки зрения противоопухолевого действия и безопасности.
Способы решения задачи
Авторы изобретения считали, что если противоопухолевое соединение эксатекан превратить в конъюгат антитело-лекарственное средство путем конъюгирования при помощи фрагмента линкерной структуры с антителом, которое способно обеспечивать направленную доставку в опухолевые клетки, которое способно распознавать опухолевые клетки, способно связывать опухолевые клетки, способно к интернализации в опухолевых клетках, которое обладает активностью, приводящей к гибели опухолевых клеток, или характеризуется другими подобными свойствами, то противоопухолевое соединение может быть более надежно доставлено в опухолевые клетки с целью проявления его специфического противоопухолевого действия в опухолевых клетках, и за счет этого, несомненно, может быть достигнут противоопухолевый эффект, и можно также ожидать повышения активности антитела, приводящей к гибели опухолевых клеток, и может быть также уменьшена доза противоопухолевого соединения по сравнению с дозой при введении соединения в чистом виде, и, благодаря чему, может быть ослаблено воздействие противоопухолевого соединения на здоровые клетки, что позволяет достигать более высокой степени безопасности.
В связи с этим, авторы изобретения создали линкер со специфической структурой, смогли получить конъюгат антитело-лекарственное средство, в котором антитело и эксатекан конъюгированы друг с другом через линкер и продемонстрировали высокое противоопухолевое действие, оказываемое этим конъюгатом, в результате чего и было создано настоящее изобретение.
В частности, настоящее изобретение характеризуется приведенным ниже отличительным признаком.
[1] Конъюгат антитело-лекарственное средство, в котором противоопухолевое соединение, представленное следующей формулой:
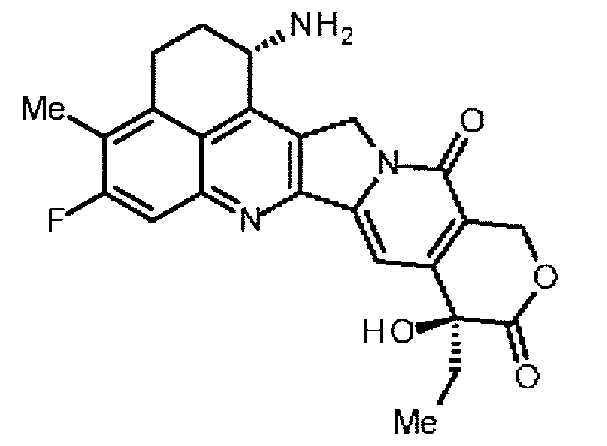
конъюгировано с антителом через линкер, имеющий структуру, представленную следующей формулой: -L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-.
В данном случае, антитело присоединено к концу L1, противоопухолевое соединение присоединено к концу Lc с помощью атома азота аминогруппы в положение 1 в качестве положения для соединения,
где
n1 представляет целое число от 0 до 6,
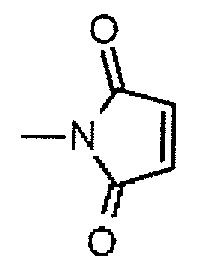
L1 представляет -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-, -CH2-C(=O)-NH-(CH2)n3-C(=O)-, -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- или -C(=O)-(CH2)n4-C(=O)-,
где n2 представляет целое число от 2 до 8, n3 представляет целое число от 1 до 8, n4 представляет целое число от 1 до 8,
L2 представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-, -S-(CH2)n6-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6, n6 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH, или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4-, или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
-(N-ли-3-диминицкус)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к L2 в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу, и когда L2 представляет собой -S-(CH2)n6-C(=O)-, L1 представляет собой -C(=O)- цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-.
Настоящее изобретение дополнительно характеризуется каждым из приведенных ниже отличительных признаков.
[2] Конъюгат антитело-лекарственное средство по пункту [1], где Lc представляет собой -C(=O)-.
[3] Конъюгат антитело-лекарственное средство по пункту [1] или [2], где связь между антителом и L1 является тиоэфирной связью, которая образуется на месте дисульфидной связи, присутствующей в шарнирной части антитела, дисульфидной связью, которая образуется на месте дисульфидной связи, присутствующей в шарнирной части антитела, или амидной связью, которая образуется на аминогруппе, присутствующей в боковой цепи аминокислоты, входящей в состав антитела, или на терминальной аминогруппе.
[4] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[3], где пептидный остаток в LP представляет собой аминокислотный остаток, включающий аминокислоту, выбранную из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты.
[5] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[3], где LP представляет собой пептидный остаток, состоящий из 4 аминокислот.
[6] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[3], где LP представляет собой -GGFG-.
[7] конъюгат антитело-лекарственное средство, где противоопухолевое соединение, представленное следующей формулой:
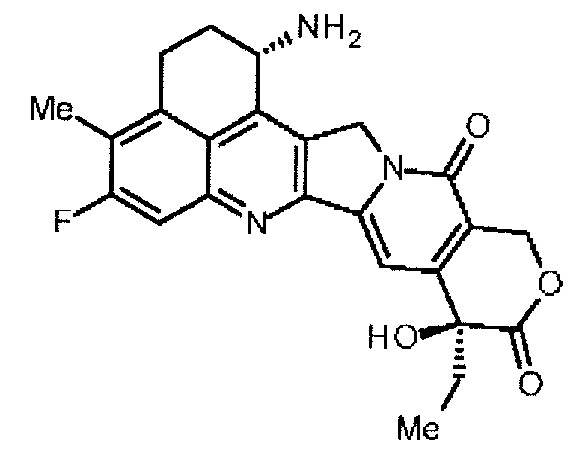
конъюгировано с антителом через линкер, имеющий структуру, представленную следующей формулой: -L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-.
В данном случае, антитело присоединено к концу L1, противоопухолевое соединение присоединено к концу Lc с помощью атома азота аминогруппы в положение 1 в качестве положения для соединения,
где
n1 представляет целое число от 0 до 6,
L1 представляет -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-, -CH2-C(=O)-NH-(CH2)n3-C(=O)-, -C(=O)- цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- или -C(=O)-(CH2)n4-C(=O)-,
где n2 представляет целое число от 2 до 8, n3 представляет целое число от 1 до 8, n4 представляет целое число от 1 до 8,
L2 представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-, -S-(CH2)n6-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6, n6 представляет целое число от 1 до 6,
LP представляет тетрапептидный остаток GGFG,
La представляет -O- или одинарную химическую связь,
Lb представляет -CR2(-R3)- или одинарную химическую связь,
где R2 и R3 каждый представляет атом водорода,
Lc представляет -C(=O)-,
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
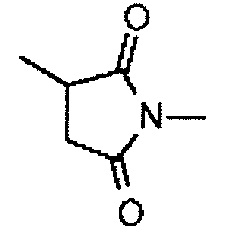 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
-(N-ли-3-диминицкус)- имеет структуру, представленную следующей формулой:
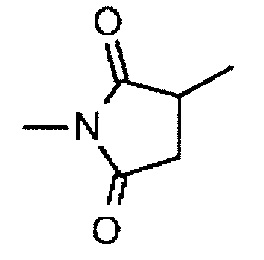 ,
,
которая присоединена к L2 в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу, и когда L2 представляет собой -S-(CH2)n6-C(=O)-, L1 представляет собой -C(=O)- цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-.
[8] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[7], где L1 представляет собой -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)- или -CH2-C(=O)-NH-(CH2)n3-C(=O)-.
[9] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[7], где L1 представляет собой -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-.
[10] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[7], где L1 представляет собой -C(=O)- цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- или -C(=O)-(CH2)n4-C(=O)-.
[11] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[9], где n2 представляет собой целое число от 2 до 5, и L2 представляет собой одинарную химическую связь.
[12] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[9], где n2 представляет собой целое число от 2 до 5, L2 представляет собой -NH-(CH2CH2O)n5-CH2-CH2-C(=O)-, и n5 равняется 2 или 4.
[13] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[12], где -NH-(CH2)n1-La-Lb-Lc- представляет собой подструктуру, имеющую длину цепи от 4 до 7 атомов.
[14] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[12], где -NH-(CH2)n1-La-Lb-Lc- представляет собой подструктуру, имеющую длину цепи в 5 или 6 атомов.
[15] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[14], где -NH-(CH2)n1-La-Lb-Lc- представляет собой
-NH-(CH2)3-C(=O)-,
-NH-CH2-O-CH2-C(=O)- или
-NH-(CH2)2-O-CH2-C(=O)-.
[16] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[15], где фрагмент лекарственное средство-линкерная структура представляет собой один фрагмент лекарственное средство-линкерная структура, выбранный из группы, состоящей из следующих фрагментов лекарственное средство-линкерная структура:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
где -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
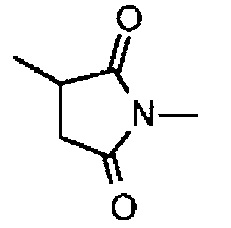 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
-(N-ли-3-диминицкус)- имеет структуру, представленную следующей формулой:
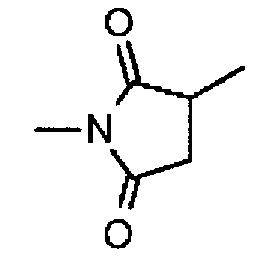 ,
,
которая присоединена к L2 в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу,
-(NH-DX) представляет группу, представленную следующей формулой:
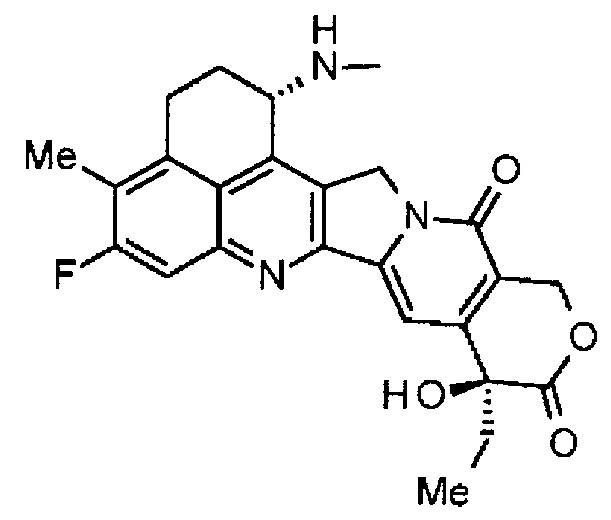 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения, и
-GGFG- представляет пептидный остаток -Gly-Gly-Phe-Gly-.
[17] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[9] и [11]-[14], где фрагмент лекарственное средство-линкерная структура, имеющий лекарственное средство, присоединенное к -L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-, представляет собой один фрагмент лекарственное средство-линкерная структура, выбранный из следующей группы:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
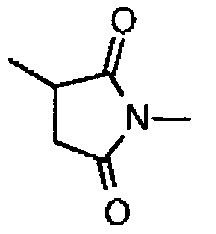 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1, и
-(NH-DX) представляет группу, представленную следующей формулой:
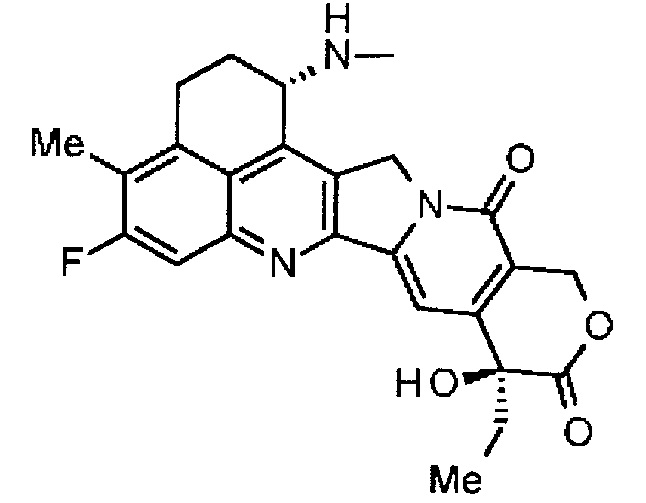 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[18] Конъюгат антитело-лекарственное средство, где противоопухолевое соединение, представленное следующей формулой:
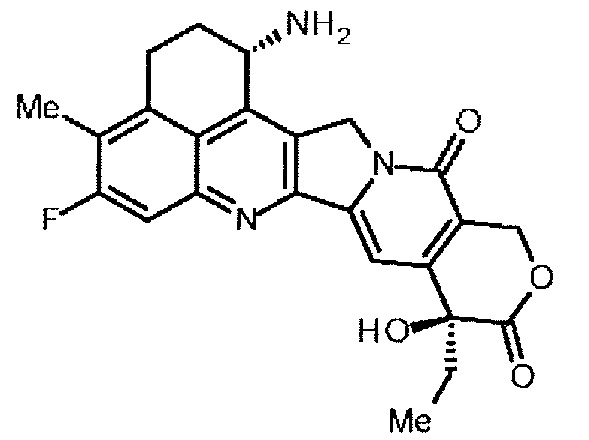
конъюгировано с антителом через линкер, имеющий структуру, представленную следующей формулой: -L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-.
В данном случае, антитело присоединено к концу L1, противоопухолевое соединение присоединено к концу Lc,
где
n1 представляет целое число от 0 до 6,
L1 представляет -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)- и присоединен к антителе через тиоэфирную связь, которая образуется на месте дисульфидной связи, присутствующей в шарнирной части антитела,
где n2 представляет целое число от 2 до 8,
L2 представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6,
LP представляет тетрапептидный остаток GGFG,
La представляет -O- или одинарную химическую связь,
Lb представляет -CR2(-R3)- или одинарную химическую связь,
где R2 и R3 каждый представляет атом водорода,
Lc представляет -C(=O)- и
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1.
[19] Конъюгат антитело-лекарственное средство по пункту [18], где
n2 равняется 2, L2 представляет собой -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-, n5 равняется 2, n1 равняется 3, и оба La и Lb представляют собой одинарные химические связи,
n2 равняется 5, L2 представляет собой одинарную химическую связь, n1 равняется 1, La представляет собой -O-, и Lb представляет собой -CR2(-R3)-, или
n2 равняется 5, L2 представляет собой одинарную химическую связь, n1 равняется 2, La представляет собой -O-, и Lb представляет собой -CR2(-R3)-.
[20] Конъюгат антитело-лекарственное средство по пункту [18] или [19], где n2 представляет собой целое число от 2 до 5, и L2 представляет собой одинарную химическую связь.
[21] Конъюгат антитело-лекарственное средство по пункту [18] или [19], где n2 представляет собой целое число от 2 до 5, L2 представляет собой -NH-(CH2CH2O)n5-CH2-CH2-C(=O)-, и n5 равняется 2 или 4.
[22] Конъюгат антитело-лекарственное средство по любому из пунктов [18]-[21], где -NH-(CH2)n1-La-Lb-Lc- представляет собой
-NH-(CH2)3-C(=O)-,
-NH-CH2-O-CH2-C(=O)- или
-NH-(CH2)2-O-CH2-C(=O)-.
[23] Конъюгат антитело-лекарственное средство по любому из пунктов [18]-[22], где фрагмент лекарственное средство-линкерная структура представляет собой один фрагмент лекарственное средство-линкерная структура, выбранный из группы, состоящей из следующих фрагментов лекарственное средство-линкерная структура:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1, и
-(NH-DX) представляет группу, представленную следующей формулой:
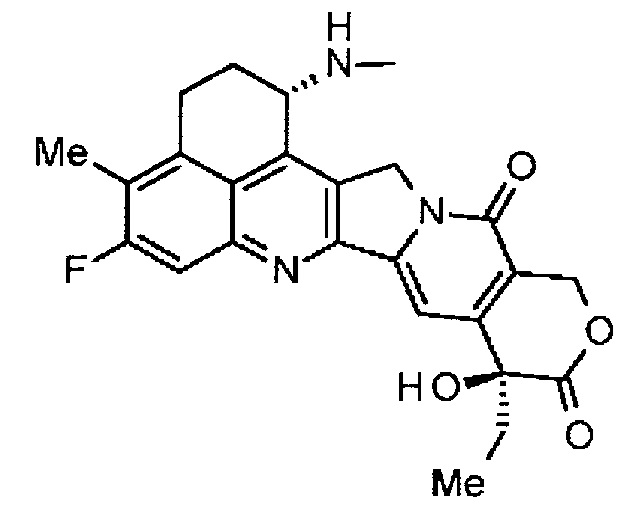 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[24] Конъюгат антитело-лекарственное средство по пункту [23], где фрагмент лекарственное средство-линкерная структура, имеющий лекарственное средство, присоединенное к -L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-, представляет собой один фрагмент лекарственное средство-линкерная структура, выбранный из следующей группы:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1, и
-(NH-DX) представляет группу, представленную следующей формулой:
где атом азота аминогруппы в положении 1 является положением присоединения.
[25] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[24], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 1 до 10.
[26] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[24], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 2 до 8.
[27] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[24], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 3 до 8.
[28] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[27], где антитело представляет собой антитело, обладающее одним или более из свойств, таких как распознавание клетки-мишени, связывание клетки-мишени, интернализация в клетке-мишени и повреждение клетки-мишени.
[29] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[27], где клетка, которая является мишенью для конъюгата антитело-лекарственное средство, представляет собой опухолевую клетку.
[30] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[27], где антитело представляет собой анти-A33 антитело, анти-B7-H3 антитело, анти-CanAg антитело, анти-CD20 антитело, анти-CD22 антитело, анти-CD30 антитело, анти-CD33 антитело, анти-CD56 антитело, анти-CD70 антитело, анти-CEA антитело, анти-Cripto антитело, анти-EphA2 антитело, анти-G250 антитело, анти-MUC1 антитело, анти-GPNMB антитело, анти-интегрин антитело, анти-PSMA антитело, анти-тенасцин-C антитело, анти-SLC44A4 антитело или анти-мезотелин антитело.
[31] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[27], где антитело представляет собой анти-B7-H3 антитело, анти-CD30 антитело, анти-CD33 антитело или анти-CD70 антитело.
[32] Конъюгат антитело-лекарственное средство по любому из пунктов [1]-[27], где антитело представляет собой анти-B7-H3 антитело.
[33] Лекарственное средство, содержащее конъюгат антитело-лекарственное средство по любому из пунктов [1]-[32], его соль или его гидрат.
[34] Противоопухолевое лекарственное средство и/или противораковое лекарственное средство, содержащее конъюгат антитело-лекарственное средство по любому из пунктов [1]-[32], его соль или его гидрат.
[35] Противоопухолевое лекарственное средство и/или противораковое лекарственное средство по пункту [34], которое применяют при лечении рака легких, рака почки, рака уротелия, колоректального рака, рака предстательной железы, мультиформной глиобластомы, рака яичников, рака поджелудочной железы, рака молочной железы, меланомы, рака печени, рака мочевого пузыря, рака желудка или рака пищевода.
[36] Фармацевтическая композиция, содержащая конъюгат антитело-лекарственное средство по любому из пунктов [1]-[32], его соль или его гидрат в качестве активного компонента, и фармацевтически приемлемый компонент, используемый в качестве вспомогательного вещества.
[37] Фармацевтическая композиция по пункту [36], которую применяют при лечении рака легких, рака почки, рака уротелия, колоректального рака, рака предстательной железы, мультиформной глиобластомы, рака яичников, рака поджелудочной железы, рака молочной железы, меланомы, рака печени, рака мочевого пузыря, рака желудка или рака пищевода.
[38] Способ лечения опухоли и/или рака, включающий введение конъюгата антитело-лекарственное средство по любому из пунктов [1]-[32], его соль или его гидрат.
[39] Промежуточное соединение лекарственное средство-линкер, представленное следующей формулой:
Q-(CH2)nQ-C(=O)-L2a-LP-NH-(CH2)n1-La-Lb-Lc-(NH-DX).
В этой формуле, Q представляет (малеимид-N-ил)-, HS-, X-CH2-C(=O)-NH- или (пирролидин-2,5-дион-N-ил)-O-C(=O)-,
X представляет атом брома или атом йода,
nQ представляет целое число от 2 до 8,
L2a представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот, выбранных из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты,
n1 представляет целое число от 0 до 6,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
(малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
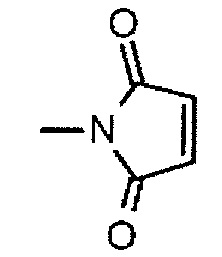 ,
,
где атом азота является положением присоединения,
(пирролидин-2,5-дион-N-ил) представляет собой группу, представленную следующей формулой:
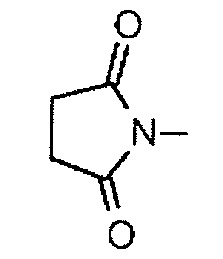 ,
,
где атом азота является положением присоединения, и -(NH-DX) представляет собой группу, представленную следующей формулой:
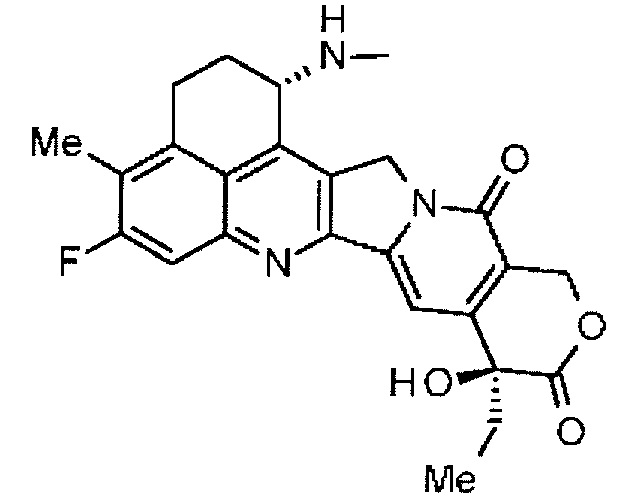 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[40] Промежуточное соединение лекарственное средство-линкер по пункту [39], где Lc представляет собой -C(=O)-.
[41] Промежуточное соединение лекарственное средство-линкер по пункту [39] или [40], где LP представляет собой пептидный остаток, состоящий из 4 аминокислот.
[42] Промежуточное соединение лекарственное средство-линкер по любому из пунктов [39]-[41], где LP представляет собой -GGFG-.
[43] Промежуточное соединение лекарственное средство-линкер по любому из пунктов [39]-[42], где -NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2-,
-NH-CH2CH2CH2-,
-NH-CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-CH2CH2-O-CH2-.
[44] Промежуточное соединение лекарственное средство-линкер по любому из пунктов [39]-[42], где -NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-(CH2)2-O-CH2-.
[45] Промежуточное соединение лекарственное средство-линкер по любому из пунктов [39]-[44], где nQ представляет собой целое число от 2 до 6.
[46] Промежуточное соединение лекарственное средство-линкер по пункту [43], где
Q представляет собой (малеимид-N-ил)-,
nQ представляет собой целое число от 2 до 5, и
L2a представляет собой одинарную химическую связь.
[47] Промежуточное соединение лекарственное средство-линкер по пункту [44], где
Q представляет собой (малеимид-N-ил)-,
nQ представляет собой целое число от 2 до 5, и
L2a представляет собой одинарную химическую связь.
[48] Промежуточное соединение лекарственное средство-линкер по любому из пунктов [39]-[42], где
Q представляет собой (малеимид-N-ил)-,
nQ представляет собой целое число от 2 до 5,
L2a представляет собой -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-,
n5 представляет собой целое число от 2 до 4, и
-NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2-,
-NH-CH2CH2CH2-,
-NH-CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-CH2CH2-O-CH2-.
[49] Промежуточное соединение лекарственное средство-линкер по пункту [48], где
n5 представляет собой целое число 2 или 4, и
-NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-CH2CH2-O-CH2-.
[50] Соединение из следующих соединений:
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX), или
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения,
X представляет атом галогена,
(пирролидин-2,5-дион-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и -(NH-DX) представляет собой группу, представленную следующей формулой:
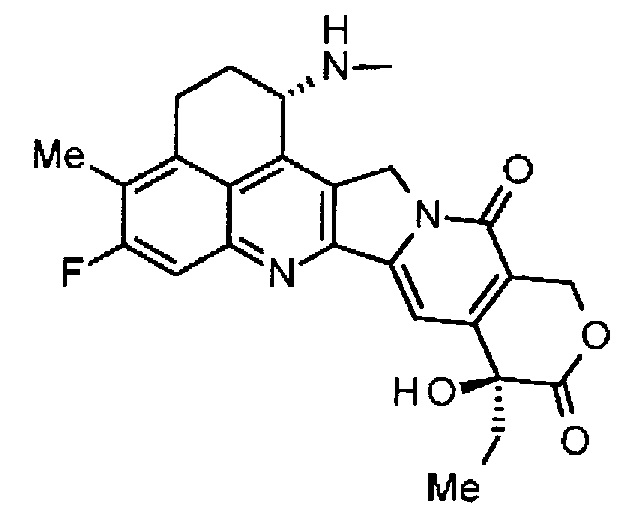 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[51] Соединение, выбранное из следующих соединений:
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX), или
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
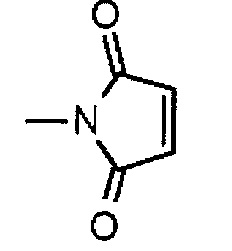 ,
,
где атом азота является положением присоединения, и -(NH-DX) представляет собой группу, представленную следующей формулой:
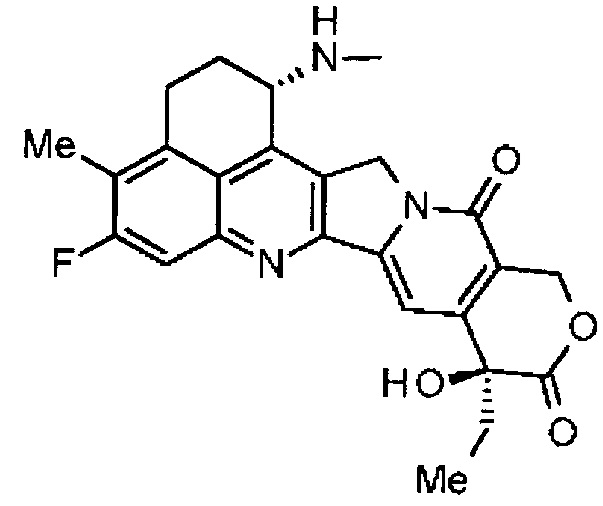 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[52] Соединение, выбранное из следующих соединений:
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX) или
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
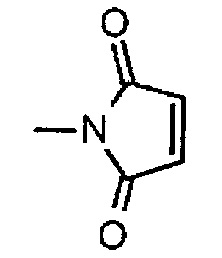 ,
,
где атом азота является положением присоединения, и -(NH-DX) представляет собой группу, представленную следующей формулой:
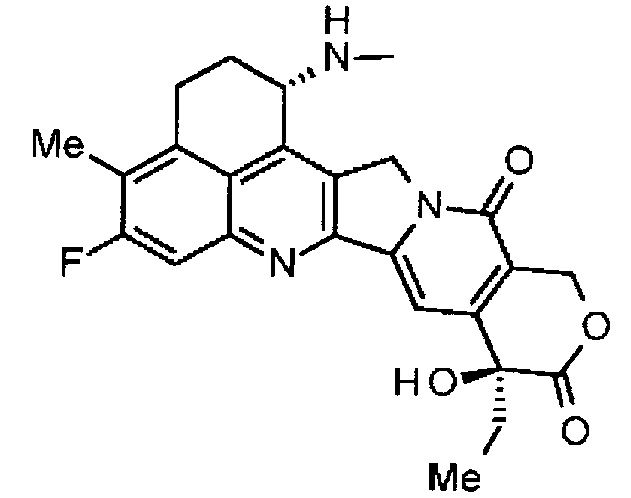 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[53] Соединение, выбранное из следующей группы:
NH2-CH2CH2-C(=O)-(NH-DX),
NH2-CH2CH2CH2-C(=O)-(NH-DX),
NH2-CH2-O-CH2-C(=O)-(NH-DX),
NH2-CHCH2-O-CH2-C(=O)-(NH-DX) и
HO-CH2-C(=O)-(NH-DX)
где -(NH-DX) представляет собой группу, представленную следующей формулой:
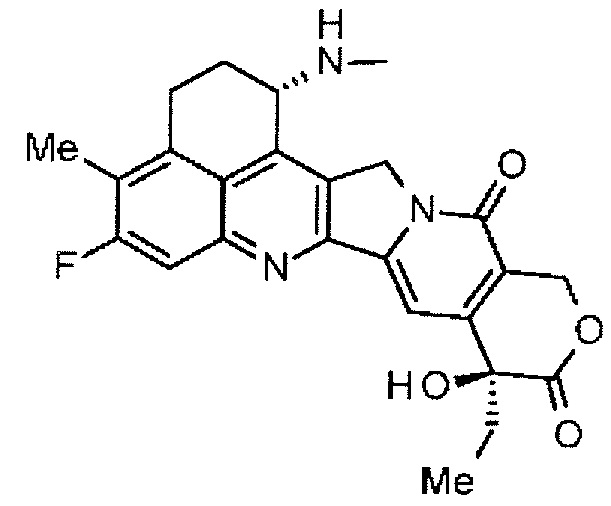 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[54] Соединение, представленное следующей формулой:
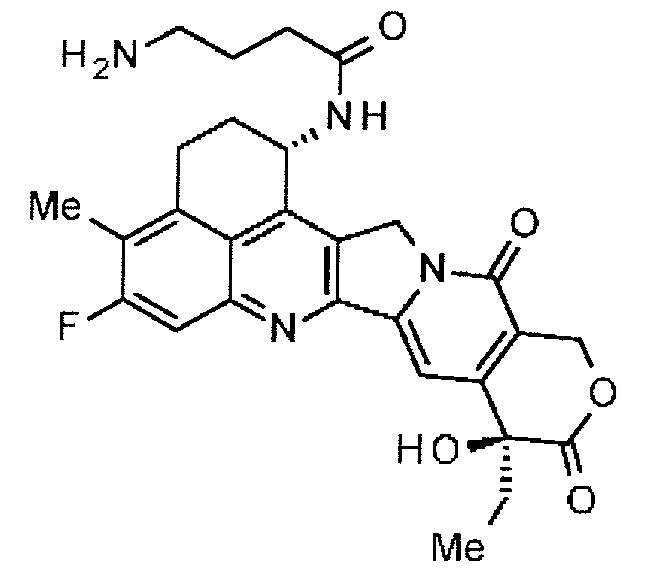 .
.
[55] Соединение, представленное следующей формулой:
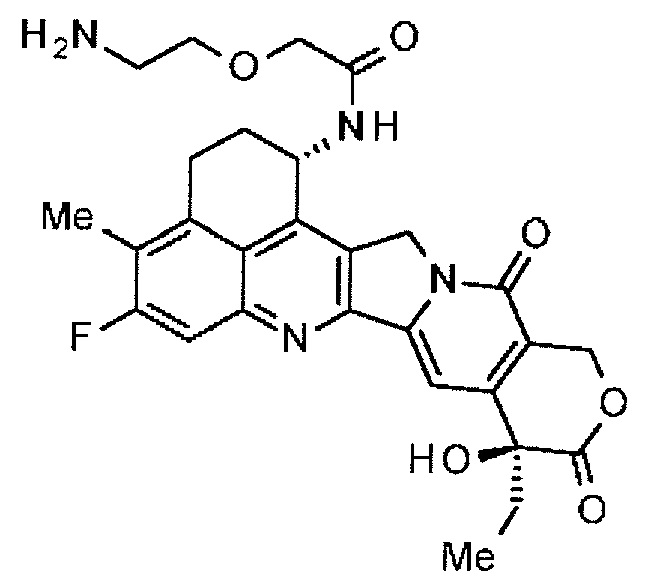 .
.
[56] Соединение, представленное следующей формулой:
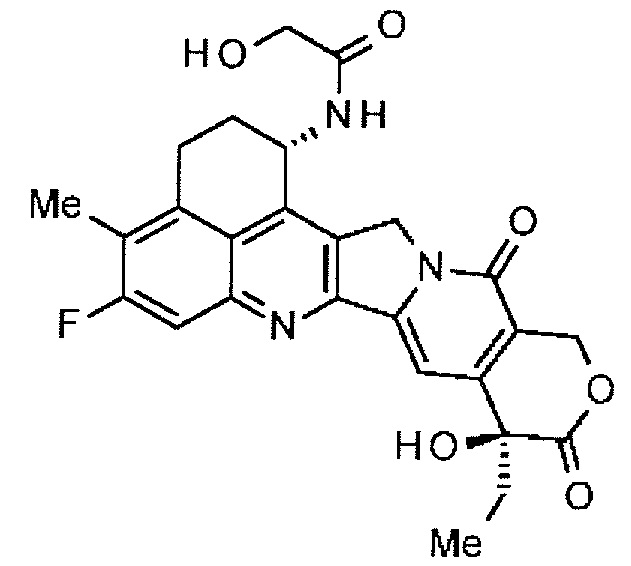 .
.
[57] Способ получения конъюгата антитело-лекарственное средство, включающий взаимодействие соединения, представленного следующей формулой:
Q-(CH2)nQ-C(=O)-L2a-LP-NH-(CH2)n1-La-Lb-Lc-(NH-DX)
с антителом или его реакционноспособным производным и конъюгирование фрагмента лекарственное средство-линкер с антителом с помощью способа формирования тиоэфирной связи на месте дисульфидной связи, присутствующей в шарнирной части антитела, или с помощью способа формирования амидной связи на месте аминогруппы, присутствующей в боковой цепи аминокислоты, входящей в состав антитела, или на концевой аминогруппе.
В этой формуле, Q представляет (малеимид-N-ил)-, HS-, X-CH2-C(=O)-NH- или (пирролидин-2,5-дион-N-ил)-O-C(=O)-,
X представляет атом брома или атом йода,
nQ представляет целое число от 2 до 8,
L2a представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот, выбранных из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты,
n1 представляет целое число от 0 до 6,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
(малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения,
(пирролидин-2,5-дион-N-ил) представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и -(NH-DX) представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[58] Способ получения по пункту [57], где способ конъюгирования фрагмента лекарственное средство-линкер с антителом представляет собой
способ восстановления антитела и последующего образования тиоэфирной связи путем реакции с соединением, в котором Q представляет собой малеимидильную группу или X-CH2-C(=O)-NH-,
способ образования амидной связи путем реакции с соединением, в котором Q представляет собой (пирролидин-2,5-дион-N-ил)-O-C(=O)-, или
способ реакции антитела с соединением, представленным формулой Q1-L1a-Q2
[где Q1 представляет (пирролидин-2,5-дион-N-ил)-O-C(=O)-, (3-сульфопирролидин-2,5-дион-N-ил)-O-C(=O)-, RQ-O-C(=N)- или O=C=N-,
L1a- представляет –цик.Гекс(1,4)-CH2-, алкиленовую группу, имеющую от 1 до 10 углеродных атомов, фениленовую группу, -(CH2)n4-C(=O)-, -(CH2)n4a-NH-C(=O)-(CH2)n4b- или -(CH2)n4a-NH-C(=O)- цик.Гекс(1,4)-CH2-,
Q2 представляет (малеимид-N-ил), атом галогена или -S-S-(2-пиридил),
RQ представляет алкильную группу, имеющую от 1 до 6 углеродных атомов, n4 представляет целое число от 1 до 8,
n4a представляет целое число от 0 до 6, n4b представляет целое число от 1 до 6,
(3-сульфопирролидин-2,5-дион-N-ил)- представляет собой группу, представленную следующей формулой:
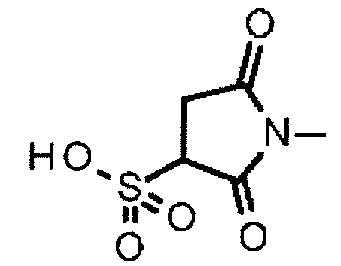 ,
,
где атом азота является положением присоединения, и эта сульфоновая кислота способна образовывать литиевую соль, натриевую соль или калиевую соль,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу, и (2-пиридил) представляет 2-пиридильную группу],
и последующей реакцией с соединением, в котором Q представляет собой SH, с образованием лекарственное средство-линкерная структура за счет амидной связи.
[59] Способ получения по пункту [57] или [58], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 1 до 10.
[60] Способ получения по пункту [57] или [58], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 2 до 8.
[61] Способ получения по пункту [57] или [58], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 3 до 8.
[62] Способ получения по любому из пунктов [57]-[61], где клетка, которая является мишенью для конъюгата антитело-лекарственное средство, представляет собой опухолевую клетку.
[63] Способ получения по любому из пунктов [57]-[61], где антитело представляет собой анти-A33 антитело, анти-B7-H3 антитело, анти-CanAg антитело, анти-CD20 антитело, анти-CD22 антитело, анти-CD30 антитело, анти-CD33 антитело, анти-CD56 антитело, анти-CD70 антитело, анти-CEA антитело, анти-Cripto антитело, анти-EphA2 антитело, анти-G250 антитело, анти-MUC1 антитело, анти-GPNMB антитело, анти-интегрин антитело, анти-PSMA антитело, анти-тенасцин-C антитело, анти-SLC44A4 антитело или анти-мезотелин антитело.
[64] Способ получения по любому из пунктов [57]-[61], где антитело представляет собой анти-B7-H3 антитело, анти-CD30 антитело, анти-CD33 антитело или анти-CD70 антитело.
[65] Способ получения по любому из пунктов [57]-[61], где антитело представляет собой анти-B7-H3 антитело.
[66] Конъюгат антитело-лекарственное средство, полученный с помощью способа получения по любому из пунктов [57]-[65].
[67] Конъюгат антитело-лекарственное средство, полученный путем образования тиоэфирной связи на месте сульфидной связи в шарнирной части антитела, где антитело подвергают обработке в восстановительных условиях и затем подвергают реакции с соединением, выбранным из группы соединений, приведенной ниже:
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX), или
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
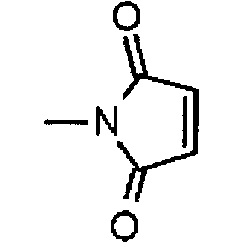 ,
,
где атом азота является положением присоединения, и -(NH-DX) представляет собой группу, представленную следующей формулой:
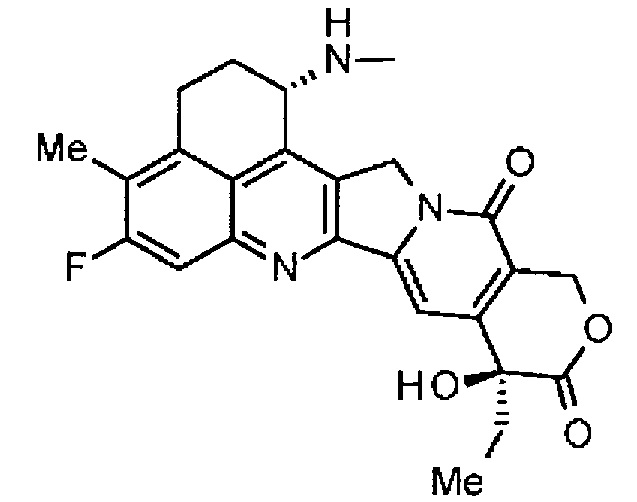 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[68] Конъюгат антитело-лекарственное средство, полученный путем образования тиоэфирной связи на месте сульфидной связи в шарнирной части антитела, где антитело подвергают обработке в восстановительных условиях и затем подвергают реакции с соединением, выбранным из группы соединений, приведенной ниже:
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX), или
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
В приведенных выше фрагментах, (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
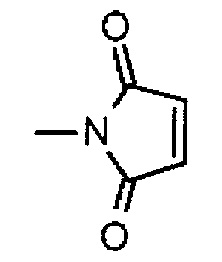 ,
,
где атом азота является положением присоединения, и -(NH-DX) представляет собой группу, представленную следующей формулой:
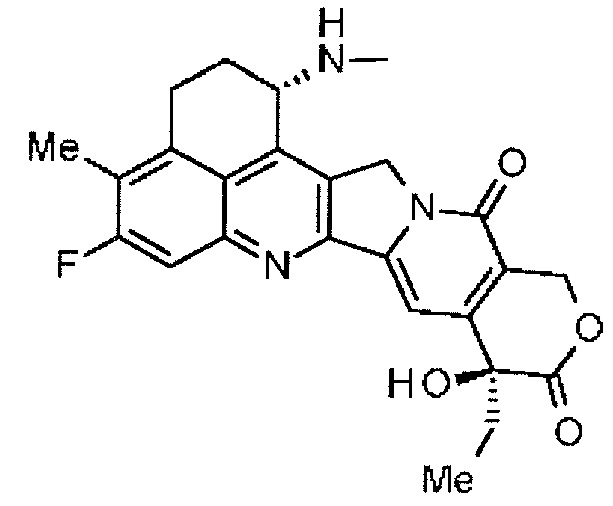 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
[69] Конъюгат антитело-лекарственное средство по пункту [67] или [68], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 1 до 10.
[70] Конъюгат антитело-лекарственное средство по пункту [67] или [68], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 2 до 8.
[71] Конъюгат антитело-лекарственное средство по пункту [67] или [68], где среднее число единиц выбранного одного фрагмента лекарственное средство-линкерная структура, конъюгированного с одним антителом, находится в диапазоне от 3 до 8.
[72] Конъюгат антитело-лекарственное средство по любому из пунктов [67]-[71], где клетка, которая является мишенью для конъюгата антитело-лекарственное средство, представляет собой опухолевую клетку.
[73] Конъюгат антитело-лекарственное средство по любому из пунктов [67]-[71], где антитело представляет собой анти-A33 антитело, анти-B7-H3 антитело, анти-CanAg антитело, анти-CD20 антитело, анти-CD22 антитело, анти-CD30 антитело, анти-CD33 антитело, анти-CD56 антитело, анти-CD70 антитело, анти-CEA антитело, анти-Cripto антитело, анти-EphA2 антитело, анти-G250 антитело, анти-MUC1 антитело, анти-GPNMB антитело, анти-интегрин антитело, анти-PSMA антитело, анти-тенасцин-C антитело, анти-SLC44A4 антитело или анти-мезотелин антитело.
[74] Конъюгат антитело-лекарственное средство по любому из пунктов [67]-[71], где антитело представляет собой анти-B7-H3 антитело, анти-CD30 антитело, анти-CD33 антитело или анти-CD70 антитело.
[75] Конъюгат антитело-лекарственное средство по любому из пунктов [67]-[71], где антитело представляет собой анти-B7-H3 антитело.
[76] Линкер, представленный следующей формулой:
-L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-
для получения конъюгата антитело-лекарственное средство, в котором лекарственное средство конъюгировано с антителом через линкер.
В приведенных выше фрагментах, L1 представляет собой положение присоединения для антитела, Lc представляет собой положение присоединения для противоопухолевого соединения,
где
n1 представляет целое число от 0 до 6,
L1 представляет -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-, -CH2-C(=O)-NH-(CH2)n3-C(=O)-, -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- или -C(=O)-(CH2)n4-C(=O)-,
где n2 представляет целое число от 2 до 8, n3 представляет целое число от 1 до 8, n4 представляет целое число от 1 до 8,
L2 представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-, -S-(CH2)n6-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6, n6 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
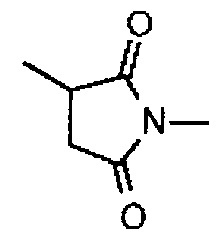 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
-(N-ли-3-диминицкус)- имеет структуру, представленную следующей формулой:
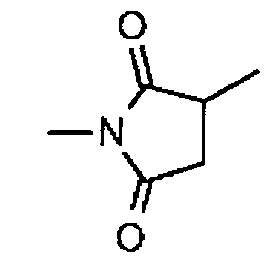 ,
,
которая присоединена к L2 в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу, и
когда L2 представляет собой -S-(CH2)n6-C(=O)-, L1 представляет собой -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-.
[77] Линкер по пункту [76], который выбирают из следующей группы, при условии, что левый конец является положением присоединения к антителу, а правый конец является положением присоединения к противоопухолевому соединению:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
[78] Линкер по пункту [76], который выбирают из следующей группы, при условии, что левый конец является положением присоединения к антителу, а правый конец является положением присоединения к противоопухолевому соединению:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
[79] Линкер по пункту [76], который выбирают из следующей группы, при условии, что левый конец является положением присоединения к антителу, а правый конец является положением присоединения к противоопухолевому соединению:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
[80] Линкер по пункту [76], который выбирают из следующей группы, при условии, что левый конец является положением присоединения к антителу, а правый конец является положением присоединения к противоопухолевому соединению:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
Положительные эффекты изобретения
С помощью конъюгата антитело-лекарственное средство, состоящего из противоопухолевого соединения эксатекан, конъюгированного с антителом через линкер со специфической структурой, может быть получен сильный противоопухолевый эффект и достигнута высокая безопасность при применении.
Краткое описание чертежей
[Фигура 1] На фигуре 1 приведена аминокислотная последовательность B7-H3 вариант 1 (SEQ ID NO: 1).
[Фигура 2] На фигуре 2 приведена аминокислотная последовательность B7-H3 вариант 2 (SEQ ID NO: 2).
[Фигура 3] На фигуре 3 приведена аминокислотная последовательность тяжелой цепи типа M30-H1 (SEQ ID NO: 9).
[Фигура 4] На фигуре 4 приведена аминокислотная последовательность тяжелой цепи типа M30-H2 (SEQ ID NO: 10).
[Фигура 5] На фигуре 5 приведена аминокислотная последовательность тяжелой цепи типа M30-H3 (SEQ ID NO: 11).
[Фигура 6] На фигуре 6 приведена аминокислотная последовательность тяжелой цепи типа M30-H4 (SEQ ID NO: 12).
[Фигура 7] На фигуре 7 приведена аминокислотная последовательность легкой цепи типа M30-L1 (SEQ ID NO: 13).
[Фигура 8] На фигуре 8 приведена аминокислотная последовательность легкой цепи типа M30-L2 (SEQ ID NO: 14).
[Фигура 9] На фигуре 9 приведена аминокислотная последовательность легкой цепи типа M30-L3 (SEQ ID NO: 15).
[Фигура 10] На фигуре 10 приведена аминокислотная последовательность легкой цепи типа M30-L4 (SEQ ID NO: 16).
[Фигура 11] На фигуре 11 приведена аминокислотная последовательность легкой цепи типа M30-L5 (SEQ ID NO: 17).
[Фигура 12] На фигуре 12 приведена аминокислотная последовательность легкой цепи типа M30-L6 (SEQ ID NO: 18).
[Фигура 13] На фигуре 13 приведена аминокислотная последовательность легкой цепи типа M30-L7 (SEQ ID NO: 19).
[Фигура 14] На фигуре 14 приведена аминокислотная последовательность тяжелой цепи M30 антитела (SEQ ID NO: 20).
[Фигура 15] На фигуре 15 приведена аминокислотная последовательность легкой цепи M30 антитела (SEQ ID NO: 21).
[Фигура 16] На фигуре 16 приведена нуклеотидная последовательность B7-H3 вариант 1 (SEQ ID NO: 26).
[Фигура 17] На фигуре 17 показано воздействие конъюгата антитело-лекарственное средство (2) на трансплантированные под кожу клетки меланомы человека линии A375. На чертеже, линия с незакрашенными ромбами иллюстрирует результаты для не подвергнутой лечению опухоли, линия с незакрашенными треугольниками иллюстрирует воздействие M30-H1-L4P антитела, и линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2).
[Фигура 18] На фигуре 18 показано воздействие конъюгата антитело-лекарственное средство (2) на трансплантированные под кожу клетки меланомы человека линии A375. Линия с незакрашенными ромбами иллюстрирует результаты для не подвергнутой лечению опухоли, линия с закрашенными квадратами иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), введенного при дозе 0,1 мг/кг, линия со знаками в виде X иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), введенного при дозе 0,3 мг/кг, линия с закрашенными треугольниками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), введенного при дозе 1 мг/кг, и линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), введенного при дозе 3 мг/кг.
[Фигура 19] На фигуре 19 показано воздействие конъюгата антитело-лекарственное средство (2) на трансплантированные под кожу клетки немелкоклеточного рака легкого человека линии Calu-6. Линия с незакрашенными ромбами иллюстрирует результаты для не подвергнутой лечению опухоли, линия с незакрашенными треугольниками иллюстрирует воздействие M30-H1-L4P антитела, и линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2).
[Фигура 20] На фигуре 20 показаны воздействия конъюгатов антитело-лекарственное средство (1), (13), (41) и (55) на трансплантированные под кожу клетки меланомы человека линии A375. На чертеже, линия с незакрашенными ромбами иллюстрирует результаты для не подвергнутой лечению опухоли, линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (1), линия с незакрашенными треугольниками иллюстрирует воздействие конъюгата антитело-лекарственное средство (13), линия со знаками в виде X иллюстрирует воздействие конъюгата антитело-лекарственное средство (41), и линия с незакрашенными квадратами иллюстрирует воздействие конъюгата антитело-лекарственное средство (55).
[Фигура 21] На фигуре 21 показаны воздействия конъюгатов антитело-лекарственное средство (13), (41) и (55) на трансплантированные под кожу клетки немелкоклеточного рака легкого человека линии Calu-6. Линия с незакрашенными ромбами иллюстрирует результаты для не подвергнутой лечению опухоли, линия с незакрашенными кружками иллюстрирует воздействие DE-310, линия с незакрашенными треугольниками иллюстрирует воздействие конъюгата антитело-лекарственное средство (13), линия со знаками в виде X иллюстрирует воздействие конъюгата антитело-лекарственное средство (41), и линия с незакрашенными квадратами иллюстрирует воздействие конъюгата антитело-лекарственное средство (55).
[Фигура 22] На фигуре 22 показаны воздействия конъюгатов антитело-лекарственное средство (17), (18), (19), (59), (60) и (61) на трансплантированные под кожу клетки меланомы человека линии A375. На чертеже, линия с закрашенными ромбами иллюстрирует результаты для не подвергнутой лечению опухоли, линия с закрашенными квадратами иллюстрирует воздействие конъюгата антитело-лекарственное средство (17), линия с незакрашенными квадратами иллюстрирует воздействие конъюгата антитело-лекарственное средство (18), линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (19), линия с закрашенными треугольникамии иллюстрирует воздействие конъюгата антитело-лекарственное средство (59), линия с незакрашенными треугольниками иллюстрирует воздействие конъюгата антитело-лекарственное средство (60), и линия со знаками в виде X иллюстрирует воздействие конъюгата антитело-лекарственное средство (61).
Описание вариантов осуществления
Конъюгат антитело-лекарственное средство настоящего изобретения представляет собой противоопухолевое лекарственное средство, в котором противоопухолевое антитело конъюгировано с противоопухолевым соединением с помощью фрагмента линкерной структуры, и далее он описывается более подробно.
Антитело
Антитело, используемое в конъюгате антитело-лекарственное средство настоящего изобретения, является иммуноглобулином и представляет собой молекулу, содержащую антигенсвязывающий центр, иммуноспецифически связывающий антиген. Класс антитела настоящего изобретения может быть любым из IgG, IgE, IgM, IgD, IgA и IgY, и предпочтительным является IgG. Субкласс антитела настоящего изобретения может быть любым из IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2, и предпочтительным является IgG1 или IgG2. Антитело может быть получено из любых биологических видов, и предпочтительные примеры биологических видов могут включать людей, крыс, мышей и кроликов. При получении антитела от видов, не относящихся к человеку, предпочтительно, чтобы антитело подвергали химеризации или гуманизации, используя хорошо известную методику. Антитело настоящего изобретения может представлять собой поликлональное антитело или моноклональное антитело и, предпочтительно, чтобы оно являлось моноклональным антителом.
Антитело настоящего изобретения может представлять собой антитело, которое способно целенаправленно воздействовать на опухолевые клетки. Так как антитело настоящего изобретения конъюгировано с обладающим противоопухолевым действием лекарственным средством с помощью линкера, предпочтительно, чтобы антитело обладало одним или более из свойств, таких как распознавание опухолевых клеток, связывание опухолевых клеток, интернализация в опухолевых клетках и повреждение опухолевых клеток.
Связывающая активность антитела в отношении опухолевых клеток может быть подтверждена способом проточной цитометрии. Интернализация антитела в опухолевых клетках может быть подтверждена (1) путем визуализации антитела, введенного в клетки, с помощью флуоресцентного микроскопа, используя вторичное антитело (флуоресцентно меченое), которое связывает терапевтическое антитело (Cell Death and Differentiation (2008) 15, 751-761), (2) путем измерения величины флуоресценции, введенной в клетки, используя вторичное антитело (флуоресцентно меченое), которое связывает терапевтическое антитело (Molecular Biology of the Cell, Vol. 15, 5268-5282, December 2004) или путем (3) исследования Mab-ZAP (моноклональное антитело-маркерный белок), используя иммунотоксин, связывающий терапевтическое антитело, при котором токсин высвобождается при введении в клетки, ингибируя клеточный рост (Bio Techniques 28: 162-165, January 2000).
Под противоопухолевым действием антитела подразумевают цитотоксическое действие или разрушающее действие в отношении опухолевых клеток, и оно может быть подтверждено in vitro путем определения ингибирующей активности в отношении клеточного роста. Например, культивируют линию опухолевых клеток, сверхэкспрессирующих белок-мишень для антитела, и добавляют антитело при различных концентрациях в культуральную систему для определения ингибирующей активности в отношении образования очага, колониеобразования и сфероидного роста. Противоопухолевое действие может быть подтверждено in vivo, например, путем введения антитела "голой" мыши с трансплантированными опухолевыми клетками, которые высоко экспрессируют белок-мишень, и определения изменений в опухолевой клетке. Так как лекарственное средство, превращенное в конъюгат антитело-лекарственное средство, оказывает противоопухолевое действие, более предпочтительно, но не обязательно, чтобы само по себе антитело также имело бы противоопухолевое действие. Для того чтобы лекарственное средство оказывало противоопухолевое действие, а также специфически и селективно повреждало опухолевые клетки, важно, а также и предпочтительно, чтобы антитело обладало бы свойством интернализации для миграции в опухолевые клетки.
Примеры такого антитела могут включать, но этим не ограничивая, анти-A33 антитело, анти-B7-H3 антитело, анти-CanAg антитело, анти-CD20 антитело, анти-CD22 антитело, анти-CD30 антитело, анти-CD33 антитело, анти-CD56 антитело, анти-CD70 антитело, анти-CEA антитело, анти-Cripto антитело, анти-EphA2 антитело, анти-G250 антитело, анти-MUC1 антитело, анти-GPNMB антитело, анти-интегрин антитело, анти-PSMA антитело, анти-тенасцин-C антитело, анти-SLC44A4 антитело и анти-мезотелин антитело.
Предпочтительно, чтобы антитело настоящего изобретения представляло собой анти-CD30 антитело, анти-CD33 антитело, анти-CD70 антитело или анти-B7-H3 антитело, и, более предпочтительно, анти-B7-H3 антитело.
Антитело настоящего изобретения может быть получено обычно применяемым в этой области науки способом, который включает иммунизирование животных полипептидом с антигенными свойствами и сбор, и очистку продуцируемых in vivo антител. Для людей, происхождение антигена не является ограничивающим фактором, и животные могут быть иммунизированы антигеном, полученным от не принадлежащего к человеческому роду животного, такого как мышь, крыса и другие подобные животные. В этом случае, может быть протестирована перекрестная отвечаемость антител, связывающих полученный гетерологичный антиген с человеческими антигенами, с целью выявления антитела, которое можно применять при заболевании у людей.
В качестве варианта, проводят слияние антитело-продуцирующих клеток, которые продуцируют антитела против антигена, с клетками миеломы в соответствии с хорошо известным в этой области науки способом (например, Kohler and Milstein, Nature (1975) 256, p. 495-497; и Kennet, R. ed., Monoclonal Antibodies, p. 365-367, Plenum Press, N.Y. (1980)) с образованием гибридом, из которых могут быть в свою очередь получены моноклональные антитела.
Антиген может быть получен из клеток-хозяина способом генной инженерии с продуцированием гена, кодирующего антигенный белок. В частности, приготавливают векторы, которые делают возможным экспрессию гена антигена, и переносят их в клетки-хозяина, в результате чего экспрессируется ген. Экспрессируемый таким образом ген может быть очищен.
Анти-CD30 антитело, анти-CD33 антитело и анти-CD70 антитело могут быть получены известным в этой области науки способом, описанным в патентных документах WO2002/043661, U.S. 5773001 и WO2006/113909, соответственно.
Предпочтительно, чтобы используемое в настоящем изобретении B7-H3 антитело представляло собой антитело, обладающее приведенными ниже свойствами.
(1) Антитело, обладающее следующими свойствами:
(a) специфического связывания с B7-H3,
(b) наличия антителозависимой клеточно-опосредованной фагоцитарной (ADCP) активности, и
(c) наличия противоопухолевого действия in vivo.
(2) Антитело по пункту (1), где B7-H3 представляет собой молекулу, включающую аминокислотную последовательность, представленную SEQ ID NO: 1 или 2.
(3) Антитело по пункту (1) или (2), где антитело имеет CDRH1, включающую аминокислотную последовательность, представленную SEQ ID NO: 3, CDRH2, включающую аминокислотную последовательность, представленную SEQ ID NO: 4, и CDRH3, включающую аминокислотную последовательность, представленную SEQ ID NO: 5, в качестве областей тяжелой цепи, определяющих комплементарность, и CDRL1, включающую аминокислотную последовательность, представленную SEQ ID NO: 6, CDRL2, включающую аминокислотную последовательность, представленную SEQ ID NO: 7, и CDRL3, включающую аминокислотную последовательность, представленную SEQ ID NO: 8, в качестве областей легкой цепи, определяющих комплементарность.
(4) Антитело по любому пункту из (1)-(3), где его константная область представляет собой полученную от человека константную область.
(5) Антитело по любому пункту из (1)-(4), где антитело представляет собой гуманизированное антитело.
(6) Антитело по пункту (5), где антитело имеет вариабельную область тяжелой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из (a) аминокислотной последовательности, описанной в позициях 20-141 аминокислоты в SEQ ID NO: 9, (b) аминокислотной последовательности, описанной в позициях 20-141 аминокислоты, в SEQ ID NO: 10, (c) аминокислотной последовательности, описанной в позициях 20-141 аминокислоты в SEQ ID NO: 11, (d) аминокислотной последовательности, описанной в позициях 20-141 аминокислоты в SEQ ID NO: 12, (e) аминокислотной последовательности, имеющей, по меньшей мере, 95% или более высокую гомологию для любой из последовательностей (a)-(d), и (f) аминокислотной последовательности, полученной из любой из последовательностей (a)-(d) путем делеций, замен или добавлений, по меньшей мере, одной аминокислоты, и вариабельную область тяжелой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из (g) аминокислотной последовательности, описанной в позициях 21-128 аминокислоты в SEQ ID NO: 13, (h) аминокислотной последовательности, описанной в позициях 21-128 аминокислоты в SEQ ID NO: 14, (i) аминокислотной последовательности, описанной в позициях 21-128 аминокислоты в SEQ ID NO: 15, (j) аминокислотной последовательности, описанной в позициях 21-128 аминокислоты в SEQ ID NO: 16, (k) аминокислотной последовательности, описанной в позициях 21-128 аминокислоты в SEQ ID NO: 17, (l) аминокислотной последовательности, описанной в позициях 21-128 аминокислоты в SEQ ID NO: 18, (m) аминокислотной последовательности, описанной в позициях 21-128 аминокислоты в SEQ ID NO: 19, (n) аминокислотной последовательности, имеющей, по меньшей мере, 95% или более высокую гомологию для любой из последовательностей (g)-(m), и (o) аминокислотной последовательности, полученной из любой из последовательностей (g)-(m) путем делеций, замен или добавлений, по меньшей мере, одной аминокислоты.
(7) Антитело по пункту (6), где антитело имеет вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранную из группы, состоящей из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 9, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 13, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 9, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 14, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 9, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 15, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 9, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 16, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 9, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 17, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 9, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 18, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 9, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 19, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 13, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 14, вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 15, и вариабельной области тяжелой цепи, включающей аминокислотную последовательность, описанную в позициях 20-141 аминокислоты в SEQ ID NO: 12, и вариабельной области легкой цепи, включающей аминокислотную последовательность, описанную в позициях 21-128 аминокислоты в SEQ ID NO: 16.
(8) Антитело по пункту (6) или (7), где антитело включает тяжелую цепь и легкую цепь, выбранную из группы, состоящей из тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 13, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 14, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 15, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 16, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 17, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 19, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 13, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 14, тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 15, и тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях 20-471 аминокислоты в SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях 21-233 в SEQ ID NO: 16.
(9) Антитело по любому пункту из (6)-(8), где антитело включает тяжелую цепь и легкую цепь, выбранную из группы, состоящей из тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 13, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 14, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 15, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 16, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 17, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 18, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 19, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 13, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 14, тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 15, и тяжелой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 12, и легкой цепи, включающей аминокислотную последовательность, представленную SEQ ID NO: 16.
(10) Антитело по пункту (8) или (9), где антитело не имеет аминокислоты на карбоксильном конце аминокислотной последовательности, представленной SEQ ID NO: 9 или 12, в тяжелой цепи.
(11) Антитело, полученное способом продуцирования антитела по любому пункту из (1)-(10), где способ включает стадии: культивирования клетки-хозяина, трансформированной в результате экспрессии вектора, содержащего полинуклеотид, кодирующий антитело; и сбора рассматриваемого антитела из культур, полученных на предыдущей стадии.
(12) Антитело по любому пункту из (1)-(11), где контролируется модификация гликана с целью повышения антитело-зависимой цитотоксической активности.
Далее описывается используемое в изобретении B7-H3 антитело.
Используемые в изобретении термины "рак" и "опухоль" являются взаимозаменяемыми.
Используемый в изобретении термин "ген" включает не только ДНК, но также его матричную РНК, его комплементарную ДНК и его комплементарную РНК.
Используемый в изобретении термин "полинуклеотид" имеет то же самое значение, что и нуклеиновая кислота, и также включает ДНК, РНК, зонды, олигонуклеотиды и праймеры.
Используемые в изобретении термины "полипептид" и "белок" являются взаимозаменяемыми.
Используемый в изобретении термин "клетка" также включает клетки животного индивидуума и культивированные клетки.
Используемый в изобретении термин "B7-H3" являются взаимозаменяемым с B7-H3 белком и, кроме того, относится к B7-H3 варианту 1 и/или B7-H3 варианту 2.
Используемый в изобретении термин "CDR" обозначает определяющую комплементарность область (CDR), и известно, что каждая тяжелая и легкая цепь молекулы антитела имеет три определяющих комплементарность области (CDR). Термином CDR также обозначают гипервариабельную область, и она присутствует в вариабельной области каждой тяжелой и легкой цепи антитела. Она является местом, которое имеет необычно высокую изменчивость ее первичной структуры, и имеется три отдельных CDR в первичной структуре каждой тяжелой и легкой полипептидной цепи. Что касается определяющих комплементарность областей антитела в этом изобретении, то определяющие комплементарность области антитела тяжелой цепи представлены CDRH1, CDRH2 и CDRH3 из амино-терминальной стороны аминокислотной последовательности тяжелой цепи, и определяющие комплементарность области легкой цепи представлены CDRL1, CDRL2 и CDRL3 из амино-терминальной стороны аминокислотной последовательности легкой цепи. Эти сайты находятся рядом друг с другом в третичной структуре и определяют специфичность антигена, с которым связывается антитело.
Используемое в изобретении выражение "гибридизацию осуществляют в строго соблюдаемых условиях" относится к способу, в котором гибридизацию проводят в условиях, при которых требуемый результат может быть достигнут путем проведения гибридизации при 68°C в выпускаемом промышленностью гибридизационном растворе ExpressHyb Hybridization Раствор (фирмы Clontech, Inc.) или путем проведения гибридизации при 68°C в присутствии от 0,7 до 1,0 М NaCl с использованием фильтра с иммобилизированной на нем ДНК, и затем промывки при 68°C, используя от 0,1 до 2х раствора SSC (1х SSC раствор состоит из 150 мМ NaCl и 15 мМ цитрата натрия), или в условиях, эквивалентных указанным выше.
1. B7-H3
В7-Н3 является представителем семейства B7, который экспрессирует на антигенпредставляющих клетках в качестве ко-стимулирующей молекулы, и, который, как полагают, воздействует на рецептор Т-клеток с повышением или подавлением иммунной активности.
В7-Н3 представляет собой белок, имеющий однопроходную трансмембранную структуру, и N-концевой внеклеточный домен В7-Н3 содержит два варианта. В7-Н3 вариант 1 (4Ig-В7-Н3) содержит V-подобный или С-подобный домен Ig в двух местах, соответственно, и Н3-В7 вариант 2 (2Ig-В7-Н3) содержит V-подобный или С-Ig-подобный домен в одном месте, соответственно.
Что касается использования В7-Н3 в настоящем изобретении, то В7-Н3 может быть непосредственно очищен от В7-Н3-экспрессирующих клеток человека или не относящегося к человеку млекопитающего (например, крысы или мыши) и использован, или из вышеописанных клеток может быть получена и использована фракция клеточных мембран. Кроме того, В7-Н3 может быть получен in vitro синтезом или продуцированием в клетке-хозяине с помощью генной инженерии. При генной инженерии, в частности, после того как В7-Н3 кДНК встраивают в вектор, способный экспрессировать B7-H3 кДНК, В7-Н3 может быть получен путем синтеза в растворе, содержащем фермент, субстрат и энергетическое вещество, необходимые для транскрипции и трансляции, или путем экспрессии В7-Н3 в другой прокариотической или эукариотически-трансформированной клетке-хозяине.
Аминокислотная последовательность открытой рамки считывания (ORF) гена человеческого В7-Н3 вариант 1 представлена последовательностью SEQ ID NO: 1 в списке последовательностей. Кроме того, последовательность SEQ ID NO: 1 приведена на фиг. 1.
Аминокислотная последовательность открытой рамки считывания (ORF) гена человеческого В7-Н3 вариант 2 представлена на SEQ ID NO: 2 в списке последовательностей. Кроме того, последовательность SEQ ID NO: 2 приведена на фиг. 2.
Кроме того, белок, который состоит из аминокислотной последовательности, в которой одна или несколько аминокислот замещены, удалены и/или добавлены в любую из описанных выше аминокислотных последовательностей В7-Н3, но также имеет биологическую активность, эквивалентную биологической активности белка, тоже относится к B7-H3.
Зрелый В7-Н3 вариант 1 человека, из которого была удалена сигнальная последовательность, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 27-534 аминокислотной последовательности, представленной SEQ ID NO: 1. Кроме того, зрелый B7-H3 вариант 2 человека, из которого была удалена сигнальная последовательность, соответствует аминокислотной последовательности, состоящей из аминокислотных остатков 27-316 аминокислотной последовательности, представленной SEQ ID NO: 2.
2. Получение анти-В7-Н3 антитела
Антитело против В7-Н3 по изобретению может быть получено путем иммунизации животного с помощью В7-Н3 или произвольного полипептида, выбранного из аминокислотной последовательности В7-Н3, и сбора и очистки антитела, полученного in vivo в соответствии с общеизвестной методикой. В случае человека, биологические виды B7-H3, используемые в качестве антигена, конкретно не ограничивают, и животное может быть иммунизировано с помощью B7-H3, полученного от животного, не относящегося к человеку, такого как мышь или крыса. В этом случае, антитело, которое можно применять при заболевании человека, может быть выбраны на основе анализа перекрестной реактивности между антителом, связывающим получаемый гетерологический B7-H3, и B7- H3 человека.
Кроме того, моноклональное антитело может быть получено из гибридомы, образованной путем слияния антитело-продуцирующих клеток, которые продуцируют антитело против В7-Н3, с клетками миеломы в соответствии с известным способом (например, Kohler and Milstein, Nature, (1975) 256, pp. 495-497; Kennet, R. ed., Monoclonal Antibodies, pp. 365-367, Plenum Press, N.Y. (1980)).
Используемый в качестве антигена В7-Н3 может быть получен путем экспрессии гена В7-Н3 в клетке-хозяине, используя способы генной инженерии.
В частности, получают вектор, способный экспрессировать ген В7-Н3, и полученный вектор трансфицируют в клетку-хозяина для экспрессии гена, а затем экспрессированный В7-Н3 очищают. Далее, конкретно описывается способ получения антитела против В7-Н3.
(1) Получение антигена
Примеры антигена, используемого для получения анти-В7-Н3 антитела, включают B7-H3, полипептид, состоящий из частичной аминокислотной последовательности, содержащей, по меньшей мере, 6 последовательных аминокислот из В7-Н3, и производное, полученное путем добавления к нему заданной аминокислотной последовательности или носителя.
B7-H3 может быть непосредственно очищен от тканей опухолей человека или опухолевых клеток и использован. Кроме того, В7-Н3 может быть получен путем его in vitro синтеза или путем его продуцирования в клетке-хозяине способом генной инженерии.
Что касается способов генной инженерии, в частности, после того как В7-Н3 кДНК встраивают в вектор, способный экспрессировать B7-H3 кДНК, В7-Н3 может быть получен путем синтеза в растворе, содержащем фермент, субстрат и энергетическое вещество, необходимые для транскрипции и трансляции, или путем экспрессии В7-Н3 в другой прокариотической или эукариотически-трансформированной клетке-хозяине.
Кроме того, антиген может быть также получен в виде секреторного белка путем экспрессии слитого белка, полученного путем лигирования внеклеточного домена В7-Н3, который является мембранным белком, с константной областью антитела в соответствующей системе "хозяин - векторная ДНК".
В7-Н3 кДНК может быть получен, например, так называемым способом ПЦР, в котором проводят полимеразную цепную реакцию (далее обозначаемую в тексте как "ПЦР") с использованием библиотеки кДНК, экспрессирующей В7-Н3 кДНК в качестве матрицы и праймеров, которые специфически амплифицируют В7-Н3 кДНК (см. Saiki, R. K., et al., Science, (1988) 239, pp. 487-489)).
Что касается in vitro синтеза полипептида, то, в качестве примера, но этим не ограничивая, может быть приведена система быстрой трансляции (РТС) фирмы Roche Diagnostics, Inc.
Примеры прокариотических клеток-хозяев включают Escherichia coli (кишечную палочку) и Bacillus subtilis (сенную палочку). Что касается трансформирования клеток-хозяев с помощью гена-мишени, то клетки-хозяева трансформируют с помощью плазмидного вектора, содержащего репликон, то есть источника репликации, произведенного от видов, совместимых с хозяином, и регуляторную последовательность. Кроме того, предпочтительно, чтобы вектор имел последовательность, способную придавать трансформированной клетке фенотипическую селективность.
Примеры эукариотических клеток-хозяев включают клетки позвоночных, клетки насекомых и дрожжевые клетки. В качестве клеток позвоночных часто используют, например, но этим не ограничивая, клетки обезьяны линии COS (Gluzman, Y., Cell, (1981) 23, pp. 175-182, ATCC CRL-1650), мышиные фибробласты NIH3T3 (АТСС CRL-1658) и дефицитные по дигидрофолат-редуктазе штаммы (Urlaub, G. and Chasin, L. A., Proc. Natl. Acad. Sci. USA (1980) 77, pp. 4126-4220) из клеток яичников китайского хомячка (клетки СНО; ATCC: CCL-61); и другие подобные клетки.
Полученный таким образом трансформант может быть подвергнут культивированию в соответствии с хорошо известной методикой, и в результате культивирования трансформанта получают внутриклеточно или внеклеточно целевой полипептид.
Подходящая среда, используемая для культивирования, может быть выбрана из различных обычно применяемых культуральных сред в зависимости от используемых клеток-хозяев. Если используется Escherichia coli (кишечная палочка), то может быть использована, например, среда Лурия-Бертани (LB) с добавлением, в случае необходимости, антибиотика, такого как ампициллин или IPMG.
Рекомбинантный белок, продуцируемый внутриклеточно или внеклеточно трансформантом в результате такого культивирования, может быть выделен и очищен любым из различных известных способов разделения, использующих физические или химические свойства белка.
Конкретные примеры способов включают обработку с помощью традиционного осадителя белка, ультрафильтрацию, различные виды жидкостной хроматографии, такие как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография и аффинная хроматографии, диализ и их комбинации.
Кроме того, путем присоединения хвоста из шести остатков гистидина к экспрессируемому рекомбинантному белку, белок может быть эффективно очищен аффинной хроматографии на колонке с ионами никеля. В качестве варианта, путем присоединения области IgG Fc к рекомбинантному экспрессируемому рекомбинантному белку, белок может быть эффективно очищен на колонке А.
Путем объединения вышеописанных способов, может быть легко получено большое количество целевого полипептида с высоким выходом и с высокой степенью чистоты.
(2) Получение анти-B7-H3 моноклонального антитела
Примеры антитела, специфически связывающего В7-Н3, включают моноклональное антитело, специфически связывающее В7-Н3, и способ получения антитела описан ниже.
Получение моноклонального антитела обычно требует проведения следующих стадий:
(а) очистки биополимера, используемого в качестве антигена;
(b) приготовления продуцирующих антитело клеток путем иммунизации животного инъекцией антигена, сбора крови, анализа крови на титр антитела с целью определения момента удаления селезенки;
(c) приготовления клеток миеломы (называемые в изобретении "миеломой");
(d) слияния продуцирующих антитело клеток с миеломой;
(e) скрининга группы гибридом, продуцирующих требуемое антитело;
(f) разделения гибридом на одноклеточные клоны (клонирование);
(g) необязательно, культивирования гибридомы или выращивания животного с имплантированной гибридомой для получения большого количества моноклонального антитела;
(h) исследования полученного таким образом моноклонального антитела на биологическую активность и специфичность связывания, или анализа этих же свойств в форме меченого реагента; и других подобных исследований.
Далее будет подробно описан способ получения моноклонального антитела в соответствии с приведенными выше стадиями, однако, этот способ не является ограничением для изобретения, и, например, кроме клеток селезенки и миеломы могут быть использованы другие продуцирующие антитело клетки.
(a) Очистка антигена
В качестве антигена может быть использован В7-Н3, полученный описанным выше способом, или его частичный пептид.
Кроме того, в качестве антигена могут быть также использованы мембранная фракция, полученная из рекомбинантных клеток, экспрессирующих B7-H3, или рекомбинантных клеток, экспрессирующих сами по себе B7-H3, а также неполный пептид белка настоящего изобретения, химически синтезированный с помощью способа, известного специалистам в этой области.
(b) Получение клеток, продуцирующих антитело
Антиген, полученный на стадии (а), смешивают с адъювантом, таким как полный или неполный адъювант Фрейнда или алюмокалиевые квасцы, и полученную смесь используют в качестве иммуногена для иммунизации экспериментального животного. В качестве экспериментального животного может быть использовано без особых проблем любое животное, используемое в известном способе производства гибридомы. В частности, могут быть использованы, например, мышь, крыса, коза, овцы, крупный рогатый скот, лошадь или другие подобные животные. Но, с точки зрения легкости получения клеток миеломы, которые подвергают слиянию с выделенными клетками, продуцирующими антитело, в качестве животных, которых подвергают иммунизированию, предпочтительно использовать мышь или крысу.
Кроме того, на используемый штамм мыши или крысы не накладывают каких-либо конкретных ограничений, и в случае мыши могут быть использованы различные штаммы, например, такие как A, AKR, BALB/c, BDP, BA, CE, C3H, 57BL, C57BL, C57L, DBA, FL, HTH, HT1, LP, NZB, NZW, RF, R III, SJL, SWR, WB, и 129 и другие подобные штаммы, а в случае крысы могут быть использованы, например, Wistar, Low, Lewis, Sprague, Dawley, ACI, BN, Fischer и другие подобные штаммы.
Эти мыши и крысы могут быть приобретены у фирм-производителей/фирм-дистрибьюторов экспериментальных животных, например, у фирмы CLEA Japan, Inc. и фирмы Charles River Laboratories Japan, Inc.
Среди них, с точки зрения совместимости при слиянии с описанными ниже клетками миеломы, в качестве животного, подвергаемого иммунизированию, являются особенно предпочтительными, в случае мыши, штамм BALB/c, а в случае крысы, штаммы Wistar и Low.
Кроме того, с точки зрения антигенной гомологии между людьми и мышами, для удаления аутоантител также предпочтительно использовать мышь, имеющую сниженную биологическую функцию, то есть мышь с аутоиммунным заболеванием.
Предпочтительно, чтобы возраст такой мыши или крысы в момент иммунизации составлял от 5 до 12 недель, более предпочтительно, от 6 до 8 недель.
Для иммунизации животного с помощью В7-Н3 или его рекомбинанта может быть использован известный способ, который подробно описан, например, в Weir, D. M., Handbook of Experimental Immunology Vol. I. II. III., Blackwell Scientific Publications, Oxford (1987), Kabat, E. A. and Mayer, M. M., Experimental Immunochemistry, Charles C Thomas Publisher Springfield, Illinois (1964) или других подобных публикациях.
Среди этих способов иммунизации, предпочтительным является описанный в изобретении специфический способ, осуществляемый, например, следующим образом.
А именно, сначала животному вводят внутрикожно или внутрибрюшинно фракцию мембранного белка, служащую в качестве антигена, или клетки, вызывающие экспрессию антигена.
Но для повышения эффективности иммунизации предпочтительно использовать комбинацию обоих способов введения, и путем внутрикожного введения первой половины дозы и внутрибрюшинного введения второй половины дозы или только внутрибрюшинного введения всей дозы может быть значительно повышена эффективность иммунизации.
Режим введения антигена может изменяться в зависимости от вида животного, подвергаемого иммунизации, индивидуальной особенности или других подобных факторов. Однако, обычно, предпочтительным является режим введения, при котором частота введения антигена составляет от 3 до 6 раз, и период дозирования составляет от 2 до 6 недель, и более предпочтительным является режим введения, при котором частота введения антигена составляет от 3 до 4 раз, и период дозирования составляет от 2 до 4 недель.
Кроме того, доза антигена может изменяться в зависимости от вида животного, индивидуальных особенностей и других подобных факторов, однако, как правило, устанавливают дозу от 0,05 до 5 мг, предпочтительно, приблизительно от 0,1 до 0,5 мг.
Повторную иммунизацию проводят через 1-6 недель, предпочтительно, через 2-4 недели, более предпочтительно, через 2-3 недели после введения антигена, как описано выше.
Доза антигена при проведении повторной иммунизации может изменяться в зависимости от типа или размера животного или других подобных факторов, однако, в случае, например, мыши, дозу, как правило, устанавливают от 0,05 до 5 мг, предпочтительно, от 0,1 до 0,5 мг, более предпочтительно, приблизительно от 0,1 до 0,2 мг.
Клетки или лимфоциты селезенки, включающие клетки, продуцирующие антитело, отбирают в асептических условиях у иммунизированных животных через 1-10 дней, предпочтительно, через 2-5 дней, более предпочтительно, через 2-3 дня, после повторной иммунизации. В это момент времени, измеряют титр антитела, и если в качестве источника получения клеток, продуцирующих антитело, используется животное, имеющее достаточно высокий титр антитела, то последующая процедура может быть проведена более эффективно.
Примеры используемого в изобретении способа измерения титра антитела включают, но этим не ограничивая, способ радиоиммунологического анализа (RIA) и иммуносорбентный ферментный анализ (ELISA).
Например, если используется способ ELISA, то измерение титра антитела может быть осуществлено в изобретении в соответствии с описанными ниже методиками.
Сначала, очищенный или частично очищенный антиген адсорбируют на поверхности твердой фазы, такой как 96-луночный планшет для способа ELISA, и на поверхность твердой фазы, не имеющей адсорбированного на ней антигена, наносят белок, не имеющий отношение к антигену, такой как бычий сывороточный альбумин (обозначаемый в тексте изобретения как "BSA"). После промывки поверхности, поверхность контактируют с последовательно разбавленным образцом (например, сывороткой мыши) в качестве первичного антитела для связывания антитела, содержащегося в образце, с антигеном.
Затем, в качестве вторичного антитела, добавляют меченное ферментом антитело против мышиного антитела и дают возможность образоваться связи с мышиным антителом. После промывки, добавляют субстрат для фермента и измеряют изменение оптической плотности, которое возникает в результате развития окрашивания, вызываемого деградацией субстрата, или других подобных свойств, и на основе измерения рассчитывают титр антитела.
Отделение клеток, продуцирующих антитело, от клеток или лимфоцитов селезенки иммунизированных животных может быть проведено в соответствии с известным способом (описанным, например, в Kohler et al., Nature (1975), 256, p. 495; Kohler et al., Eur. J. Immunol. (1977), 6, p. 511; Milstein et al., Nature (1977), 266, p. 550; Walsh, Nature (1977), 266, p. 495). Например, в случае клеток селезенки, может быть использован общий способ, в котором клетки, продуцирующие антитело, отделяют путем гомогенизации селезенки с получением клеток в результате фильтрации через сетку из нержавеющей стали и суспендирования клеток в минимальной эссенциальной среде Игла (MEM).
(c) Получение клеток миеломы (называемых в тексте изобретения "миеломой")
На миеломные клетки, используемые для клеточного слияния, не накладывают каких-либо конкретных ограничений, и подходящие клетки могут быть выбраны из известных клеточных линий. Тем не менее, с точки зрения удобства при выборе гибридомы из слитых клеток, предпочтительно использовать штамм, дефицитный по HGPRT (гипоксантин-гуанин фосфорибозилтрансферазе), процедура отбора которого уже была описана.
Более конкретно, примеры штамма, дефицитного по HGPRT, включают X63-Ag8(X63), NS1-ANS/1(NS1), P3X63-Ag8.U1(P3U1), X63-Ag8.653(X63.653), SP2/0-Ag14(SP2/0), MPC11-45.6TG1.7(45.6TG), FO, S149/5XXO, и BU.1, полученные от мышей; 210.RSY3.Ag.1.2.3 (Y3), полученный от крыс; и UC729-6, LICR-LOW-HMy2(HMy2) и 8226AR/NIP4-1(NP41), полученные от людей. Эти штаммы, дефицитные по HGPRT, могут быть приобретены, например, в Американской коллекции типовых культур (АТСС) или в других подобных научных фондах.
Эти клеточные штаммы пересевают в соответствующую среду, такую как среда 8-азагуанина [среда, полученная путем добавления 8-азагуанина к среде RPMI 1640, дополненной глутамином, 2-меркаптоэтанолом, гентамицином и фетальной телячьей сывороткой (обозначаемой в тексте изобретения как "FCS")], среда Дульбекко, модифицированная по способу Исков (обозначаемая в тексте изобретения как "IMDM") или среда Игла, модифицированная по способу Дульбекко (обозначаемая в тексте изобретения как "DMEM"). В этом случае, за 3-4 дня перед проведением слияния клеток, клетки пересевают в нормальную среду [например, в среду ASF104 (фирмы Ajinomoto Co., Ltd.), содержащую 10% FCS] для обеспечения слияния не менее чем 2×107 клеток в сутки.
(d) Cлияние клеток
Слияние клеток, продуцирующих антитело, и миеломных клеток может быть соответствующим образом осуществлено в соответствии с известным способом (Weir, D. M. Handbook of Experimental Immunology Vol. I. II. III., Blackwell Scientific Publications, Oxford (1987), Kabat, E. A. and Mayer, M. M., Experimental Immunochemistry, Charles C Thomas Publisher, Springfield, Illinois (1964), etc.), при таких условиях, при которых не сильно снижается выживаемость клеток.
В качестве такого способа может быть использован, например, химический способ, в котором клетки, продуцирующие антитело, и миеломные клетки смешивают в растворе, содержащем полимер, такой как полиэтиленгликоль, при высокой концентрации, физический способ, в котором используется электрическая стимуляция, или другие подобные способы. Из этих способов, ниже описан конкретный пример химического способа.
А именно, в случае, когда используют полиэтиленгликоль в растворе, содержащем полимер в высокой концентрации, клетки, продуцирующие антитело, и миеломные клетки смешивают в растворе полиэтиленгликоля, имеющего молекулярную массу от 1500 до 6000, более предпочтительно, от 2000 до 4000, при температуре от 30 до 40°С, предпочтительно, от 35 до 38°С, в течение от 1 до 10 минут, предпочтительно, от 5 до 8 минут.
(e) Отбор из группы гибридом
На способ отбора гибридом, полученных в результате описанного выше слияния клеток, не накладывают каких-либо конкретных ограничений. Обычно применяют способ отбора HAT (гипоксантин, аминоптерин, тимидин), описанный в публикации Kohler et al., Nature (1975), 256, p. 495; Milstein et al., Nature (1977), 266, p. 550.
Этот способ эффективен в тех случаях, когда гибридомы получают при использовании дефицитного по HGPRT штамма клеток миеломы, который не может выживать в присутствии аминоптерина.
А именно, при культивировании неслитых клеток и гибридом в среде HAT, могут селективно выживать и пролиферировать только гибридомы, устойчивые к действию аминоптерина.
(f) Разделение на одноклеточный клон (клонирование)
В качестве способа клонирования для гибридом может быть использован известный способ, такой как метилцеллюлозный способ, способ клонирования в мягкой агарозе или способ лимитирующих разведений (см., например, Barbara, B. M. and Stanley, M. S.: Selected Methods in Cellular Immunology, W. H. Freeman and Company, San Francisco (1980)). Среди этих способов особенно предпочтительным является способ трехмерного культивирования, такой как метилцеллюлдозный способ. Например, группу гибридом, полученных в результате слияния клеток, суспендируют в метилцеллюлозной среде, такой как ClonaCell-HY Selection Medium D (фирмы StemCell Technologies, inc., #03804), и культивируют. Затем образовавшиеся колонии гибридомы собирают, в результате чего могут быть получены моноклональные гибридомы. Собранные соответствующие колонии гибридомы культивируют, и гибридома, для которой было подтверждено, что она имеет стабильный титр антитела в полученной жидкости над осадком культуры гибридомы, выбирают в качестве штамма В7-Н3 гибридомы, продуцирующего моноклональное антитело.
Примеры полученного таким образом штамма гибридомы включают B7-H3 гибридому M30. В этом изобретении, антитело, продуцируемое В7-Н3 гибридомой M30, обозначается как "М30 антитело" или просто "M30".
Тяжелая цепь M30 антитела имеет аминокислотную последовательность, представленную SEQ ID NO: 20 в списке последовательностей. Кроме того, легкая цепь M30 антитела имеет аминокислотную последовательность, представленную SEQ ID NO: 21 в списке последовательностей. В тяжелой цепи, аминокислотная последовательность, представленная SEQ ID NO: 20 в списке последовательностей, аминокислотная последовательность, состоящая из аминокислотных остатков с 1 по 19, является сигнальной последовательностью, аминокислотная последовательность, состоящая из аминокислотных остатков с 20 по 141, является вариабельной областью, и аминокислотная последовательность, состоящая из аминокислотных остатков с 142 по 471, является константной областью. Кроме того, в легкой цепи, аминокислотная последовательность, представленная SEQ ID NO: 21 в списке последовательностей, аминокислотная последовательность, состоящая из аминокислотных остатков с 1 по 22, является сигнальной последовательностью, аминокислотная последовательность, состоящая из аминокислотных остатков с 23 по 130, является вариабельной областью, и аминокислотная последовательность, состоящая из аминокислотных остатков с 131 по 235, является константной областью.
(g) Получение моноклонального антитела путем культивирования гибридомы
Путем культивирования выбранной таким образом гибридомы может быть эффективно получено моноклональное антитело. Но перед культивированием предпочтительно проводить скрининг гибридомы, которая продуцирует требуемое моноклональное антитело.
Для такого скрининга может быть использован известный способ.
Измерение титра антитела в изобретении может быть проведено, например, способом ELISA, упомянутом в описанном выше пункте (b).
Гибридома, полученная описанным выше способом, может быть сохранена в замороженном состоянии в жидком азоте или в морозильнике при -80°C или ниже.
После завершения клонирования, среду HT заменяют на нормальную среду, и гибридому культивируют.
Культивирование в больших количествах осуществляют путем культивирования при вращении, используя большую культуральную колбу, или путем культивирования при постоянном перемешивании. Из надосадочной жидкости, полученной в результате крупномасштабного культивирования, может быть получено моноклональное антитело, которое специфически связывает белок изобретения, с помощью известного специалистам в данной области способа очистки, такого как гель-фильтрация.
Кроме того, гибридому вводят в брюшную полость мыши с тем же штаммом, что и у гибридомы (например, описанной выше мыши линии BALB/с), или мыши Nu/Nu для пролиферации гибридомы, в результате чего может быть получена асцитическая жидкость, содержащая большое количество моноклонального антитела изобретения.
В случае введения гибридомы в брюшную полость, большее количество асцита может быть получено, если за 3-7 дней до этого вводить минеральное масло, такое как 2,6,10,14-тетраметилпентадекан (пристан).
Например, сначала в брюшную полость мыши того же штамма, что и гибридома, вводят иммунодепрессант для инактивации Т-клеток. Через 20 дней после этого, клон гибридомных клеток 106-107 суспендируют в бессывороточной среде (0,5 мл), и суспензию вводят в брюшную полость мыши. Как правило, когда живот расширяется и заполняется асцитом, асцит собирают из брюшной полости мышей. С помощью этого способа может быть получено моноклональное антитело при концентрации, которая примерно в 100 раз или более выше, чем в культуральном растворе.
Полученное описанным выше способом моноклональные антитело может быть очищено способом, описанным, например, в справочнике Weir, D. M.: Handbook of Experimental Immunology Vol. I, II, III, Blackwell Scientific Publications, Oxford (1978).
Полученное таким образом моноклональное антитело имеет высокую антигенную специфичность в отношении В7-Н3.
(h) Исследование моноклонального антитела
Изотип и подкласс полученного таким образом моноклонального антитела могут быть определены следующим образом.
Прежде всего, примеры способа идентификации включают способ Оухтерлони, способ иммуносорбентного ферментного анализа (ELISA) и способ радиоиммунологического анализа (RIA).
Способ Оухтерлони является достаточно простым, но, когда концентрация моноклонального антитела является низкой, требуется проведение операции конденсации.
С другой стороны, путем использования способа ELISA или RIA, включающего непосредственную реакцию культуральной надосадочной жидкости с антигеном, адсорбированном на твердой фазе, и использование антител, соответствующих различным видам изотипов и подклассов иммуноглобулина, в качестве вторичных антител, может быть идентифицирован изотип и подкласс моноклонального антитела.
Кроме того, в качестве простого способа может быть также использован выпускаемый промышленностью набор для идентификации (например, набор Mouse Typer фирмы Bio-Rad Laboratories, Inc.) или другие подобные наборы.
Кроме того, количественное определение белка может быть выполнено способом Лоури-Фолина с расчетом на основе результатов измерения оптической плотности при 280 нм [1,4 (оптическая плотность при 280 нм)=1 мг/мл иммуноглобулина].
Кроме того, даже если моноклональное антитело получают отдельно и независимо путем проведения снова стадий (a)-(h) в пункте (2), то, тем не менее, можно получить антитело, имеющее цитотоксическую активность, эквивалентную цитотоксической активности антитела М30. В качестве одного примера такого антитело, можно привести пример антитела, которое связывает тот же самый эпитоп, что и антитело М30. M30 распознает эпитоп в домене IgC1 или IgC2, который является доменом в В7-Н3 внеклеточном домене, и связывает домен IgC1 или домен IgC2, или и тот и другой. Поэтому, в качестве эпитопа для антитела изобретения, примером может служить, в частности, эпитоп, присутствующий в IgC1 или IgC2 домене В7-Н3. Если вновь полученное моноклональное антитело связывает частичный пептид или частичную трет-ичную структуру, которые связывают и антитело M30, то на основании этого можно сделать вывод, что моноклональное антитело связывает тот же самый эпитоп, что и антитело М30. Кроме того, путем подтверждения того, что моноклональное антитело конкурирует с антителом М30 при связывании В7-Н3 (то есть моноклональное антитело ингибирует связывание антитела М30 с В7-Н3), можно сделать вывод, что моноклональное антитело связывает тот же самый эпитоп, что и антитело M30, даже если не была определена конкретная последовательность или структура эпитопа. Когда подтверждается, что моноклональное антитело связывает тот же самый эпитоп, что и антитело M30, то можно с большой долей вероятности ожидать, что моноклональное антитело будет обладать цитотоксической активностью, эквивалентной цитотоксической активности антитела М30.
(3) Другие антитела
Антитело изобретения включает не только описанное выше моноклональное антитело против В7-Н3, но также и рекомбинантное антитело, полученное путем искусственного модификации с целью уменьшения гетерологичной антигенности в отношении людей, такое как химерное антитело, гуманизированное антитело и человеческое антитело. Эти антитела могут быть получены известным способом.
Примером химерного антитела является антитело, в котором вариабельные и константные области антитела получают от различных видов, например, химерное антитело, в котором вариабельная область антитела, полученная от мыши или крысы, соединена с константной областью антитела, полученной от человека (см. Proc. Natl. Acad. Sci. USA, 81, 6851-6855 (1984)).
Примером гуманизированного антитела является антитело, полученное включением только определяющей комплементарность области (CDR) в антитело, полученное от человека (см. Nature (1986) 321, pp. 522-525), и антитело, полученное путем трансплантации части аминокислотных остатков каркаса, а также последовательностей CDR, в человеческое антитело с помощью способа CDR-трансплантации (WO 90/07861).
Однако для гуманизированного антитела не является конкретным ограничением гуманизированное антитело, полученное из антитела M30, но при условии, что гуманизированное антитело имеет все шесть типов CDR последовательностей антитела М30 и обладает противоопухолевым действием. Вариабельная область тяжелой цепи антитела M30 имеет CDRH1 (NYVMH), состоящую из аминокислотной последовательности, представленной SEQ ID NO: 3 в списке последовательностей, CDRH2 (YINPYNDDVKYNEKFKG), состоящей из аминокислотной последовательности, представленной SEQ ID NO: 4 в списке последовательностей, и CDRH3 (WGYYGSPLYYFDY), состоящей из аминокислотной последовательности, представленной SEQ ID NO: 5 в списке последовательностей. Кроме того, вариабельная область легкой цепи антитела M30 имеет CDRL1 (RASSRLIYMH), состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6 в списке последовательностей, CDRL2 (ATSNLAS), состоящей из аминокислотной последовательности, представленной SEQ ID NO: 7 в списке последовательностей, и CDRL3 (QQWNSNPPT), состоящей из аминокислотной последовательности, представленной SEQ ID NO: 8 в списке последовательностей.
В качестве примера гуманизированного антитела мышиного антитела М30 может быть приведена произвольная комбинация тяжелой цепи, включающая вариабельную область тяжелой цепи, состоящую из любой одной из (1) аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательностей SEQ ID NO: 9, 10, 11 или 12 в списке последовательностей, (2) аминокислотной последовательности, имеющей гомологию, по меньшей мере, 95% или более с описанной выше аминокислотной последовательностью (1), и (3) аминокислотной последовательности, в которой одна или несколько аминокислот в описанной выше аминокислотной последовательности (1) удалены, замещены или добавлены, и легкой цепи, включающая вариабельную область легкой цепи, состоящей из любой одной из (4) аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательностей SEQ ID NO: 13, 14, 15, 16, 17, 18 или 19 в списке последовательностей, (5) аминокислотной последовательности, имеющей гомологию, по меньшей мере, 95% или более с описанной выше аминокислотной последовательностью (4), и (6) аминокислотной последовательности, в которой одна или несколько аминокислот в описанной выше аминокислотной последовательности (4) удалены, замещены или добавлены.
Используемый в изобретении термин "несколько" означает число от 1 до 10, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3 или один или два.
Что касается замещения аминокислоты в этом изобретении, то предпочтительным является консервативное замещение аминокислоты. Консервативное замещение аминокислоты относится к замещению, происходящему внутри группы аминокислот, относящихся к боковым цепям аминокислот. Предпочтительными группами аминокислот являются следующие: кислотная группа (аспарагиновая кислота и глутаминовая кислота); основная группа (лизин, аргинин и гистидин); неполярная группа (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан); и незаряженное полярное семейство (глицин, аспарагин, глутамин, цистеин, серин, треонин и тирозин). Более предпочтительными группами аминокислот являются следующие: алифатическая гидроксильная группа (серин и треонин); амидосодержащая группа (аспарагин и глютамин); алифатическая группа (аланин, валин, лейцин и изолейцин); и ароматическая группа (фенилаланин, триптофан и тирозин). Такое замещение аминокислоты предпочтительно проводить внутри диапазона, при котором не ухудшаются свойства вещества с исходной аминокислотной последовательностью.
В качестве примера антитела, которое имеет предпочтительную комбинацию описанных выше тяжелой цепи и легкой цепи, можно привести антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 9, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 13; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 9, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 14; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 9 и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 15; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 9, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 16; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 9, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 17; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 9, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 9, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 19; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 12, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 13; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 12, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 14; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 12, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 15; и антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 до 141 последовательности SEQ ID NO: 12, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 128 последовательности SEQ ID NO: 16.
Кроме того, в качестве примера антитела, которое имеет более предпочтительную комбинацию описанных выше тяжелой цепи и легкой цепи, можно привести антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 13; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 14; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 15; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 16; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 17; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 19; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 13; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 14; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 15; и антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 20 по 471 последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности, состоящей из аминокислотных остатков с 21 по 233 последовательности SEQ ID NO: 16.
Кроме того, в качестве примера антитела, которое имеет другую более предпочтительную комбинацию описанных выше тяжелой цепи и легкой цепи, можно привести антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 13; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 14; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 15; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 16; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 17; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 18; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 19; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 13; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 14; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 15; и антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 12, и легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 16.
Путем объединения последовательности, имеющей высокую гомологию с вышеописанной аминокислотной последовательностью тяжелой цепи, с последовательностью, имеющей высокую гомологию с вышеописанной аминокислотной последовательностью легкой цепи, можно подобрать антитело, имеющее цитотоксическую активность, эквивалентную цитотоксической активности каждого из описанных выше антител. Такой гомологией обычно является гомология порядка 80% или более, предпочтительно, гомология порядка 90% или более, более предпочтительно, гомология порядка 95% или более, наиболее предпочтительно, гомология порядка 99% или более. Кроме того, путем объединения аминокислотной последовательности, в которой в аминокислотной последовательности тяжелой цепи или легкой цепи замещены, удалены или добавлены от одного до нескольких аминокислотных остатков, можно также подобрать антитело, имеющее цитотоксическую активность, эквивалентную цитотоксической активности каждого из описанных выше антител.
Гомология между двумя аминокислотными последовательностями может быть определена путем использования алгоритма Blast версии 2.2.2 с заданными по умолчанию параметрами (Altschul, Stephen F., Thomas L. Madden, Alejandro A. Schäffer, Jinghui Zhang, Zheng Zhang, Webb Miller, and David J. Lipman (1997), "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25: 3389-3402). Алгоритм Blast можно использовать также в режиме реального масштаба времени с помощью интернета на сайте www.ncbi.nlm.nih.gov/blast.
В аминокислотной последовательности тяжелой цепи, представленной SEQ ID NO: 9, 10, 11 или 12 в списке последовательностей, аминокислотная последовательность, состоящая из аминокислотных остатков с 1 по 19, представляет собой сигнальную последовательность, аминокислотная последовательность, состоящая из аминокислотных остатков с 20 по 141, представляет собой вариабельную область, аминокислотная последовательность, состоящая из аминокислотных остатков с 142 по 471, представляет собой константную область. Последовательности SEQ ID NO: 9, 10, 11 и 12 приведены на фигурах 3, 4, 5 и 6, соответственно. Кроме того, в аминокислотной последовательности легкой цепи, представленной SEQ ID NO: 13, 14, 15, 16, 17, 18 или 19 в списке последовательностей, аминокислотная последовательность, состоящей из аминокислотных остатков с 1 по 20, представляет собой сигнальную последовательность, аминокислотная последовательность, состоящая из аминокислотных остатков с 21 по 128, представляет собой вариабельную область, и аминокислотная последовательность, состоящая из аминокислотных остатков с 129 по 233, представляет собой константную область. Последовательности SEQ ID NO: 13, 14, 15, 16, 17, 18 и 19 приведены на фигурах 7, 8, 9, 10, 11, 12 и 13, соответственно.
Кроме того, антитело изобретения включает гуманизированное антитело, которое связывает тот же самый эпитоп, что и антитело М30. Анти-В7-Н3 гуманизированное антитело относится к гуманизированному антителу, имеющему только последовательность антитела, полученную из хромосомы человека. Анти-В7-Н3 гуманизированное антитело может быть получено с помощью способа, в котором используют продуцирующую гумантизированное антитело мышь, имеющую фрагмент хромосомы человека, включающий гены тяжелой и легкой цепи гуманизированного антитела (см. Tomizuka, K. et al., Nature Genetics (1997) 16, pp. 133-143; Kuroiwa, Y. et al., Nucl. Acids Res. (1998) 26, pp. 3447-3448; Yoshida, H. et al., Animal Cell Technology: Basic and Applied Aspects vol. 10, pp. 69-73 (Kitagawa, Y., Matuda, T. and Iijima, S. eds.), Kluwer Academic Publishers, 1999; Tomizuka, K. et al., Proc. Natl. Acad. Sci. USA (2000) 97, pp. 722-727, etc.).
Такая продуцирующая гумантизированное антитело мышь может быть специально создана следующим образом. Генетически модифицированное животное, у которого был разрушен локус тяжелой и легкой цепи гена эндогенного иммуноглобулина и вместо него был введен локус тяжелой и легкой цепи гена иммуноглобулина человека с помощью вектора дрожжевой искусственной хромосомы (YAC) или другим подобным образом, может быть создано путем получения нокаутного животного и трансгенного животного и скрещивания этих животных.
Кроме того, такие эукариотические клетки трансформируют способом рекомбинантной ДНК, в котором используются комплементарные ДНК, кодирующие каждую из такой тяжелой цепи и легкой цепи гуманизированного антитела и, предпочтительно, вектор, содержащий комплементарные ДНК, и трансформированные клетки, которые продуцируют рекомбинантное человеческое моноклональное антитело, культивируют, в результате чего из надосадочной жидкости культуры клеток может быть также получено антитело.
В изобретении, в качестве клеток хозяина могут быть использованы, например, эукариотические клетки, предпочтительно, клетки млекопитающих, таких как клетки яичника китайского хомячка (СНО), лимфоциты или клетки миеломы.
Кроме того, также известен способ получения гуманизированного антитела из фагового отображения, выбранного из библиотеки гуманизированных антител (см. Wormstone, I. M. et al., Investigative Ophthalmology & Visual Science. (2002) 43 (7), pp. 2301-2308; Carmen, S. et al., Briefings in Functional Genomics and Proteomics (2002), 1 (2), pp. 189-203; Siriwardena, D. et al., Ophthalmology (2002) 109 (3), pp. 427-431, etc.).
Например, может быть использован способ фагового отображения, в котором вариабельная область гуманизированного антитела экспрессируется на поверхности фага в виде одноцепочечного антитела (ScFv), и выбирают фаг, который связывает антиген (Nature Biotechnology (2005), 23, (9), стр. 1105-1116).
Путем анализа выбранного гена фага на основе связывания с антигеном может быть определена последовательность ДНК, кодирующая вариабельную область гуманизированного антитела, которое связано с антигеном.
Если определяют последовательность ДНК в ScFv, которая связывает антиген, то гуманизированное антитело может быть получено путем приготовления экспрессирующего вектора, содержащего эту последовательность, и введения вектора в подходящие клетки-хозяева с целью экспрессии гуманизированного антитела (WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438, WO 95/15388, Annu. Rev. Immunol. (1994) 12, pp. 433-455, Nature Biotechnology (2005) 23 (9), pp. 1105-1116).
Если вновь полученное гуманизированное антитело связывает частичный пептид или частичную трет-ичную структуру, которые связывает и антитело M30, то на основании этого можно сделать вывод, что гуманизированное антитело связывает тот же самый эпитоп, что и антитело М30. Кроме того, путем подтверждения того, что гуманизированное антитело конкурирует с антитело М30 при связывании В7-Н3 (то есть гуманизированное антитело ингибирует связывание антитела М30 с В7-Н3), можно сделать вывод, что гуманизированное антитело связывает тот же самый эпитоп, что и антитело M30, даже если не была определена конкретная последовательность или структура эпитопа. Когда подтверждается, что гуманизированное антитело связывается с тем же эпитопом, что и антитело М30, то можно с большой долей вероятности ожидать, что гуманизированное антитело будет обладать цитотоксической активностью, эквивалентной цитотоксической активности антитела М30.
Полученные описанным выше способом химерные антитела, гуманизированные антитела или человеческие антитела подвергают оценке на их способность связывать антиген с помощью известного способа или другого подобного способа, и в результате может быть выбрано предпочтительное антитело.
В качестве примера другого критерия оценки, использующегося для сравнения свойств антител, можно привести критерий стабильности антител. Способ дифференциальной сканирующей калориметрии (ДСК) позволяет быстро и точно измерить среднюю температуру термической денатурации (Tm), используемую в качестве удобного критерия относительной конформационной стабильности белков. Путем измерения значений Tm способом ДСК и сравнения этих значений можно выявить разницу в термической стабильности. Известно, что стабильность антител при хранении в некоторой степени зависит от их термической стабильности (Lori Burton, et. al., Pharmaceutical Development and Technology (2007) 12, pp. 265-273), и использование в качестве критерия термическую стабильность позволяет выбрать предпочтительное антитело. Примеры других критериев для выбора антител включают следующие: высокий выход при продуцировании в соответствующей клетке-хозяине и низкая способность к агрегации в водном растворе. Например, антитело, которое характеризуется самым высоким выходом, не всегда проявляет самую высокую термическую стабильность, и, поэтому, для того чтобы выбрать наиболее подходящее антитело для введения человеку, необходимо проводить комплексную оценку антител на основе описанных выше критериев.
Изобретение также включает в себя модифицированный вариант антитела. Модифицированный вариант относится к варианту, полученному путем химической или биологической модификации антитела изобретения. Примеры химически модифицированного варианта антитела включают химически модифицированные варианты в результате образования связи химического фрагмента со скелетом аминокислоты, химически модифицированные варианты в результате присоединения через атом азота или кислорода углеводной цепи и другие подобные варианты. Примеры биологически модифицированного варианта антитела включают биологически модифицированные варианты в результате посттрансляционной модификации (такой как, N-связанное или О-связанное гликозилирование, N-концевая или С-концевая обработка, деамидирование, изомеризация аспарагиновой кислоты или окисление метионина), и варианты, при которых остаток метионина был добавлен к N-концу в результате экспрессирования в прокариотической клетке-хозяине.
Кроме того, понятие модифицированного варианта антитела также включает в себя меченое антитело, применяемое для обнаружения или выделения антитела или антигена изобретения, например, меченое ферментом антитело, флуоресцентно-меченное антитело и аффинное меченое антитело. Такой модифицированный вариант антитела изобретения применяют с целью улучшения стабильности и ретенции в крови исходного антитела изобретения, снижения его антигенности, обнаружения или выделения такого антитела или антигена и для других подобных целей.
Кроме того, путем регулирования модификации гликана, который связан с антителом изобретения (путем гликозилирования, дефукозилирования и других подобных реакций), можно повысить антителозависимую клеточную цитотоксическую активность. Методика регулирования модификации гликана антител описана в патентных документах WO 99/54342, WO 00/61739, WO 02/31140 и других подобных документах. Но эта методика не является ограничением для применения других методик. Антитело изобретения также включает в себя антитело, в котором регулируется модификация гликана.
В случае, когда антитело получают сначала путем выделения гена антитела и затем введения гена в подходящую клетку-хозяина, может быть использовано сочетание подходящего хозяина и соответствующего экспрессирующего вектора. Конкретные примеры гена антитела включают комбинацию гена, кодирующего последовательность тяжелой цепи антитела, описанного в изобретении, и гена, кодирующего последовательность его легкой цепи. При трансформировании клетки-хозяина можно вставить ген, кодирующий последовательность тяжелой цепи, и ген, кодирующий последовательность легкой цепи, в один и тот же экспрессирующий вектор, или же каждый по отдельности в различные экспрессирующие векторы.
При применении в качестве клеток-хозяев эукариотических клеток, могут быть использованы клетки животных, клетки растений и эукариотические микроорганизмы. Примеры клеток животных включают клетки млекопитающих, например, клетки обезьяны линии COS (Gluzman, Y., Cell, (1981) 23, pp. 175-182, ATCC CRL-1650), мышиные фибробласты NIH3T3 (АТСС CRL-1658) и штаммы с дефицитом дигидрофолатредуктазы (Urlaub, G. and Chasin, L. A., Proc. Natl. Acad. Sci. USA (1980) 77, pp. 4126-4220) клеток яичников китайского хомячка (клетки СНО; ATCC: CCL-61).
Примером использования прокариотических клеток является применение Escherichia coli (кишечной палочки) и Bacillus subtilis (сенной палочки).
Антитело может быть получено путем введения требуемого гена антитела в эти клетки в результате трансформации и культивирования in vitro трансформированных таким образом клеток. В случае фрагментарно описанного выше способа культивирования, выход может иногда изменяться в зависимости от последовательности антитела, и, поэтому, среди антител, имеющих эквивалентно связывающую активность, использование критерия высокого выхода позволяет выбрать антитело, которое можно легко получать в качестве фармацевтического средства. Таким образом, антитело изобретения также включает в себя антитело, получаемое способом продуцирования антитела, отличающимся тем, что способ включает стадию культивирования трансформированной клетки-хозяина и стадию сбора требуемого антитела из продукта культивирования, полученного на стадии культивирования.
Известно, что удаляют лизиновый остаток на карбоксильном конце тяжелой цепи антитела, полученного в культивируемых клетках млекопитающих (Journal of Chromatography A, 705: 129-134 (1995)), и также известно, что удаляют два аминокислотных остатка (глициновый и лизиновый) на карбоксильном конце тяжелой цепи антитела, полученного в культивируемых клетках млекопитающих, и амидируют пролиновый остаток, вновь установленный на карбоксильном конца (Analytical Biochemistry, 360: 75-83 (2007)). Тем не менее, такое удаление и модификация последовательности тяжелой цепи не влияют на антигенсвязывающую аффинность и эффекторную функцию (активацию комплемента, антителозависимую клеточную цитотоксичность и другие подобные характеристики. Поэтому, настоящее изобретение также включает в себя антитело, подвергнутое такой модификации и удалению, и в качестве примера может быть приведен вариант антитела, при котором на карбоксильном конце тяжелой цепи были удалены одна или две аминокислоты, вариант антитела, полученный путем амидирования варианта антитела с удалением (например, тяжелая цепь, в которой пролиновый остаток на карбоксильном конце был подвергнут амидированию), и другие подобные варианты. Тип варианта удаления, характеризующийся удалением на карбоксильном конце тяжелой цепи антитела изобретения, не ограничивается приведенными выше вариантами, при условии, что сохраняются антигенсвязывающее сродство и эффекторная функция. Две тяжелые цепи, составляющие антитело изобретения, могут быть одного типа, выбранные из группы, состоящей из полноразмерной тяжелой цепи и описанного выше варианта удаления, или могут быть двух типов в выбранной из них комбинации. Соотношение количества каждого варианта удаления может зависеть от типа культивируемых клеток млекопитающих, которые продуцируют антитело изобретения, и условий культивирования, и в качестве примера может быть приведен случай, когда был удален один аминокислотный остаток на карбоксильном конце каждой из двух тяжелых цепей, являющихся основными компонентами антитела изобретения.
В качестве примеров изотипа антитела изобретения могут быть приведены IgG (IgG1, IgG2, IgG3, IgG4), и предпочтительными являются IgG1 или IgG2.
В качестве примеров функции антитела обычно могут быть приведены антигенсвязывающая активность, действие по нейтрализации активности антигена, действие по повышению активности антигена, антителозависимая клеточная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC). Функция антитела изобретения представляет собой активность связывания В7-Н3, предпочтительно, активность в отношении антителозависимого клеточно-опосредованного фагоцитоза (ADCP), более предпочтительно, цитотоксическая активность (противоопухолевое действие) в отношении опухолевой клетки, опосредствованная активностью в отношении ADCP. Кроме того, антитело изобретения помимо активности ADCP может обладать активностью ADCC и/или активностью CDC.
Полученное антитело может быть очищено до состояния гомогенности. Разделение и очистка антитела может быть осуществлена обычным способом разделения и очистки белков. Например, антитело может быть выделено и очищено путем соответствующего выбора и комбинирования способов колоночной хроматографии, фильтрации, ультрафильтрации, осаждения солью, диализа, препаративного электрофореза в полиакриламидном геле, электрофореза с изоэлектрическим фокусированием и других подобных способов (Strategies for Protein purification and Characterization: A Laboratory Course Manual, Daniel R. Marshak et al. eds., Cold Spring Harbor Laboratory Press (1996); Antibodies: A Laboratory Manual. Ed Harlow and David Lane, Cold Spring Harbor Laboratory (1988)), но эти способы не являются ограничениями для изобретения.
Примеры хроматографии включают аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-проникающую хроматографию, хроматографию с обращенной фазой и адсорбционную хроматографии.
Хроматография может быть осуществлена способом жидкостной хроматографии, таким как способ высокоэффективной жидкостной хроматографии (HPLC) или способ жидкостной экспресс-хроматографии белков (FPLC).
В качестве примеров колонки, используемой в аффинной хроматографии, могут быть приведены колонка с белком A и колонка с белком G. Например, в качестве примера колонки с белком A могут быть приведены колонки Hyper D, POROS, Sepharose FF (фирмы Pharmacia) и другие подобные колонки.
Кроме того, антитело может быть также очищено на основе связывания антитела с антигеном путем использования носителя с иммобилизованным на нем антигеном.
Противоопухолевое соединение
Далее описывается противоопухолевое соединение, которое преобразуют в конъюгат антитело-лекарственное средство настоящего изобретения. На противоопухолевое соединение не накладывают конкретных ограничений, при условии, что оно является соединением, обладающим противоопухолевым действием и имеющим заместительную группу или подструктуру, позволяющую соединяться с линкерной структурой. При разрушении части и всего линкера в опухолевых клетках, высвобождается фрагмент противоопухолевого соединения и оказывает противоопухолевое действие. Как только линкер разрушается в положении присоединения к лекарственному средству, противоопухолевое соединение высвобождается в форме свойственной ему структуры и оказывает свойственное ему противоопухолевое действие.
Примеры противоопухолевого соединения могут включать доксорубицин, даунорубицин, митомицин С, блеомицин, циклоцитидин, винкристин, винбластин, метотрексат, противоопухолевое средство на основе платины (цисплатин или его производные), таксол или его производные, и камптотецин или его производные (противоопухолевое средство, описанное в выложенном патенте Японии № 6-87746). В конъюгате антитело-лекарственное средство настоящего изобретения в качестве производного камптотецина может быть предпочтительно использован эксатекан (((1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]-пирано[3',4':6,7]индолизино[1,2-b]хинолин-10,13(9H,15H)дион; представленный следующей формулой.
 .
.
Несмотря на то, что эксатекан обладает сильным противоопухолевым действием, он еще не производится серийно промышленностью в качестве противоопухолевого лекарственного средства. Соединение может быть легко получено известным способом, и в качестве положения для его соединения с линкерной структурой может быть предпочтительно использована аминогруппа в положении 1. Кроме того, эксатекан может также высвобождаться в опухолевых клетках, когда к нему все еще присоединена часть линкера, и даже в этом случае он является эффективным соединением, которое проявляет сильное противоопухолевое действие.
Что касается конъюгата антитело-лекарственное средство, то ключевым фактором, оказывающим влияние на его эффективность и безопасность, является число конъюгированных молекул лекарственного средства на молекуле антитела. При получении конъюгата антитело-лекарственное средство необходимо определить условия проведения реакции, в частности, количества используемых для реакции исходных материалов и реагентов, для того чтобы иметь постоянное число конъюгированных молекул лекарственного средства, и, в данном случае, в отличие от химической реакции с низкомолекулярными соединениями, получают, как правило, смесь, содержащую различное число конъюгированных молекул лекарственного средства. Число молекул лекарственного средства, конъюгированных с молекулой антитела, выражают или указывают в виде среднего значения, то есть среднего числа конъюгированных молекул лекарственного средства. Если специально не указано иначе, то, как правило, число конъюгированных молекул лекарственного средства означает их среднее число, за исключением случая, когда речь идет о конъюгате антитело-лекарственное средство, имеющего конкретное число конъюгированных молекул лекарственного средства, который входит в смесь конъюгатов антитело-лекарственное средство, имеющих различное число конъюгированных молекул лекарственного средства. Число молекул эксатекана, конъюгированных с молекулой антитела, можно регулировать, и, в среднем, число конъюгированных молекул лекарственного средства с молекулой антитела может составлять приблизительно от 1 до 10 молекул эксатекана. Предпочтительно, чтобы это число составляло от 2 до 8, и более предпочтительно, от 3 до 8. Специалист в данной области может осуществить реакцию конъюгации требуемого числа молекул лекарственного средства с молекулой антитела на основе описанных в изобретении примеров, и в результате чего им может быть получено антитело, конъюгированное с регулируемым числом молекул эксатекана.
Так как эксатекан имеет структуру камптотецина, то по поводу него известно, что равновесие смещается в сторону образования структуры с замкнутым лактонным кольцом (замкнутым кольцом) в водной кислой среде (например, при рН 3 или около этого значения), и смещается в сторону образования структуры с открытым лактонным кольцом (открытым кольцом) в водной щелочной среде (например, при рН 10 или около этого значения). Кроме того, можно ожидать, что конъюгат лекарственного средства, в который вводят фрагмент эксатекана, соответствующий замкнутой кольцевой структуре и открытой кольцевой структуре, обладает одним и тем же противоопухолевым действием, и, само собой разумеется, что любой из этих конъюгатов входит в объем настоящего изобретения.
Линкерная структура
Применительно к конъюгату антитело-лекарственное средство настоящего изобретения, далее описывается линкерная структура для конъюгирования противоопухолевого лекарственного средства с антителом. Линкер имеет следующую структуру:
-L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-.
Антитело присоединено к концу L1 (конец напротив присоединения к L2), а противоопухолевое лекарственное средство присоединено к концу Lc (конец напротив присоединения к Lb).
n1 представляет целое число от 0 до 6 и, предпочтительно, представляет собой целое число от 1 до 5, и, более предпочтительно, от 1 до 3.
1. L1
L1 представляет собой фрагмент в линкере, представленный следующей структурой:
-(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-,
-CH2-C(=O)-NH-(CH2)n3-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- или
-C(=O)-(CH2)n4-C(=O)-.
В приведенных выше фрагментах, n2 представляет собой целое число от 2 до 8, n3 представляет собой целое число от 1 до 8, и n4 представляет собой целое число от 1 до 8.
В линкере, имеющем структуру, представленную с помощью -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)- для L1, "-(сукцинимид-3-ил-N)-" имеет структуру, представленную следующей формулой:
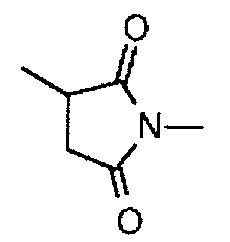 .
.
Положение 3 приведенной выше подструктуры является положением присоединения к антителу. Связь с антителом в положении 3 характеризуется как связь в результате образования тиоэфира. С другой стороны, атом азота в положении 1 фрагмента структуры соединен с углеродным атомом метилена, который присутствует в линкере, включающем эту структуру. В частности, -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-L2- представляет собой структуру, представленную следующей формулой (здесь, "антитело-S-" берет начало от антитела).
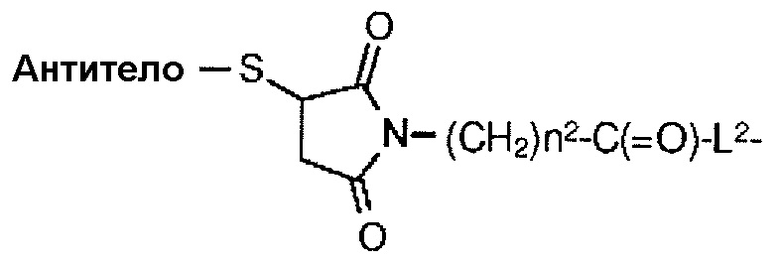 .
.
В этой формуле, n2 представляет собой целое число от 2 до 8, и, предпочтительно, от 2 до 5.
В линкере, имеющем структуру, представленную с помощью -CH2-C(=O)-NH-(CH2)n3-C(=O)- для L1, n3 представляет собой целое число от 1 до 8, предпочтительно, от 2 до 6. Этот линкер присоединен к антителу на его углеродном атоме концевого метилена и имеет следующую структуру для присоединения за счет образования тиоэфира, как и в случае предыдущего линкера (здесь, "антитело-S-" берет начало от антитела). Антитело-S-CH2-C(=O)-NH-(CH2)n3-C(=O)-L2-.
В линкере, имеющем структуру, представленную с помощью -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- для L1, "-(N-ли-3-диминицкус)-" имеет структуру, представленную следующей формулой:
 .
.
В этом фрагменте структуры, атом азота в положении 1 соединен с углеродным атомом метилена, присутствующего в линкерной структуре, включающей эту структуру. Углеродный атом в позиции 3 присоединен к концевому атому серы -S-(CH2)n6-C(=O)- для L2 в линкере. Этот фрагмент -S-(CH2)n6-C(=O)- для L2 в линкере образует объединенную линкерную структуру только с -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- для L1 в линкере. В приведенных выше фрагментах, "-цик.Гекс(1,4)-", содержащийся в линкере, представляет 1,4-циклогексиленовую группу. В линкере, -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- присоединен к антителу за счет образования амидной связи на его концевом карбонильном углероде (здесь, "антитело-NH-" берет начало от антитела).
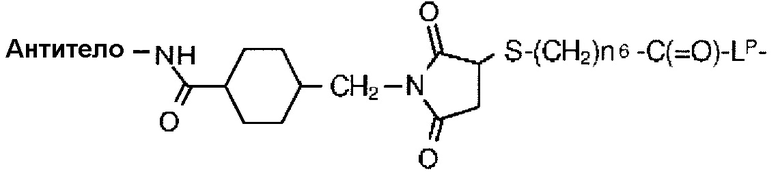 .
.
Аминогруппа антитела для образования этой амидной связи является концевой аминогруппой боковой цепи лизинового остатка в антителе или аминогруппой на N конце антитела. Указанный линкер структуры может соединяться за счет образования эфирной связи с гидроксильной группой аминокислоты в антителе, а не за счет амидной связи.
Структурный фрагмент "-цик.Гекс(1,4)-", содержащийся в указанном линкере, может представлять собой двухвалентную насыщенную циклическую алкиленовую группу, не являющуюся 1,4-циклогексиленовой группой, то есть, двухвалентную циклическую насыщенную углеводородную группу, такую как циклобутиленовая группа, циклопентиленовая группа, циклогепталеновая группа или циклоокталеновая группа, двухвалентную ароматическую углеводородную группу, такую как фениленовая группа или нафтиленовая группа, или 5- или 6-членную насыщенную, частично насыщенную или ароматическую двухвалентную гетероциклическую группу, содержащую 1 или 2 гетероатома. В качестве варианта, этот фрагмент может представлять собой двухвалентную алкиленовую группу, имеющую от 1 до 4 углеродных атомов. Присоединение к двухвалентной группе может возникать в смежных положениях или в положениях, которые не являются смежными.
В линкере, имеющем структуру, представленную с помощью -C(=O)-(CH2)n4-C(=O)- в качестве L1, n4 представляет собой целое число от 1 до 8, и, предпочтительно, от 2 до 6. Этот линкер присоединен также за счет образования амидной связи на его концевой карбонильной группе с аминогруппой антитела, как и в случае упомянутых выше линкеров (см. следующую формулу; в его структуре "антитело-NH-" берет начало от антитела).
Антитело-NH-C(=O)-(CH2)n4-C(=O)-L2-.
Конкретные примеры L1 в линкере могут включать
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-,
-CH2C(=O)NH-CH2-C(=O)-,
-CH2C(=O)NH-CH2CH2-C(=O)-,
-CH2C(=O)NH-CH2CH2CH2-C(=O)-,
-CH2C(=O)NH-CH2CH2CH2CH2-C(=O)-,
-CH2C(=O)NH-CH2CH2CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-,
-C(=O)-арил-CH2-(N-ли-3-диминицкус)-,
-C(=O)-цик.гет-CH2-(N-ли-3-диминицкус)-,
-C(=O)-CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-.
(Арил представляет собой двухвалентную ароматическую углеводородную группу, а цик.гет представляет собой двухвалентную циклическую гетероциклическую группу).
2. L2
L2 является линкером, представленным следующей структурой:
-NH-(CH2CH2O)n5-CH2-CH2-C(=O)- или
-S-(CH2)n6-C(=O)-,
L2 может отсутствовать, и в этом случае, L2 представляет собой одинарную химическую связь. В приведенных выше фрагментах, n5 представляет собой целое число от 1 до 6, и n6 представляет собой целое число от 1 до 6.
В линкере, имеющем структуру -NH-(CH2CH2O)n5-CH2-CH2-C(=O)- в качестве L2, n5 представляет собой целое число от 1 до 6, и, предпочтительно, от 2 до 4. Этот фрагмент в линкере присоединен к L1 в месте его концевой аминогруппы и присоединен к LP в месте его карбонильной группы на другом конце.
В линкере, имеющем структуру -S-(CH2)n6-C(=O)- в качестве L2, n6 представляет собой целое число от 1 до 6, и, предпочтительно, от 2 до 4.
Конкретные примеры L2 могут включать
-NH-CH2CH2O-CH2CH2-C(=O)-,
-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-,
-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-,
-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-,
-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-,
-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-.
Когда L2 представляет собой -S-(CH2)n6-C(=O)-, то объединяемый с ним L1 представляет собой -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-. Конкретные примеры -L1-L2- могут включать
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2CH2CH2CH2CH2-C(=O)-.
3. LP
Линкер LP представляет собой пептидный остаток, состоящий из от 2 до 7 аминокислот. В частности, он состоит из олигопептидного остатка, в котором от 2 до 6 аминокислот соединены пептидной связью. Линкер LP присоединен к L2 на его N конце и присоединен к аминогруппе -NH-(CH2)n1-La-Lb-Lc- фрагмента линкера на его C конце. На аминокислоту, из которой состоит LP, в линкере не накладывают конкретных ограничений, но, тем не менее, ее примеры включают L- или D-аминокислоту, предпочтительно, L-аминокислоту. И она может быть аминокислотой, имеющей структуру, такую как β-аланин, ε-аминокапроновая кислота или γ-аминомасляная кислота, помимо структуры α-аминокислоты, и, кроме того, она может быть искусственной аминокислотой, такой как N-метилированная аминокислота.
На аминокислотную последовательность LP не накладывают конкретных ограничений, но примеры аминокислоты, образующей LP, включают фенилаланин (Phe; F), тирозин (Tyr; Y), лейцин (Leu; L), глицин (Gly; G), аланин (Ala; A), валин (Val; V), лизин (Lys; K), цитруллин (Cit), серин (Ser; S), глутаминовую кислоту (Glu; E) и аспарагиновую кислоту (Asp; D). Среди них, предпочтительные примеры включают фенилаланин, глицин, валин, лизин, цитруллин, серин, глутаминовую кислоту и аспарагиновую кислоту. Выбирая тот или иной тип аминокислоты, можно регулировать свойства лекарственного средства, связанные с его высвобождением. Число аминокислот может составлять от 2 до 7.
Конкретные примеры LP могут включать
-GGF-,
-DGGF-,
-(D-)D-GGF-,
-EGGF-,
-GGFG-,
-SGGF-,
-KGGF-,
-DGGFG-,
-GGFGG-,
-DDGGFG-,
-KDGGFG-,
-GGFGGGF-
[в приведенных выше фрагментах, "(D-)D" представляет D-аспарагиновую кислоту].Особенно предпочтительные примеры LP для конъюгата антитело-лекарственное средство настоящего изобретения могут включать -GGFG-.
В структуре, представленной -NH-(CH2)n1- внутри линкера, n1 представляет собой целое число от 0 до 6 и, предпочтительно, представляет собой целое число от 1 до 5, и, более предпочтительно, от 1 до 3. Аминогруппа этого фрагмента присоединена к C концу в LP в линкере.
4. La
Линкер La представлен любой из структур -C(=O)-NH-, -NR1-(CH2)n7- и -O- или представляет собой одинарную химическую связь. В приведенных выше фрагментах, n7 представляет собой целое число от 1 до 6, R1 представляет собой атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет собой целое число от 1 до 4, и n9 представляет собой целое число от 1 до 6.
Амидная структура -C(=O)-NH- внутри линкера La присоединена к Lb на стороне его атома азота. В структурном фрагменте -NR1-(CH2)n7- внутри La, n7 представляет собой целое число от 1 до 6, и, предпочтительно, от 1 до 3. Этот фрагмент присоединен к Lb на стороне его метилена. R1 представляет собой атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов. Алкильная группа, имеющая от 1 до 6 углеродных атомов, может быть линейной или разветвленной. Ее примеры могут включать метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, 2-метилбутильную группу, неопентильную группу, 1-этилпропильную группу, гексильную группу, изогексильную группу, 4-метилпентильную группу, 3-метилпентильную группу, 2-метилпентильную группу, 1-метилпентильную группу, 3,3-диметилбутильную группу, 2,2-диметилбутильную группу, 1,1-диметилбутильную группу, 1,2-диметилбутильную группу, 1,3-диметилбутильную группу, 2,3-диметилбутильную группу и 2-этилбутильную группу. Из них предпочтительными являются метильная группа или этильная группа. Когда R1 имеет структуру, представленную с помощью -(CH2)n8-COOH, n8 представляет собой целое число от 1 до 4, и, предпочтительно, 1 или 2. Когда R1 имеет структуру, представленную с помощью -(CH2)n9-OH, n9 представляет собой целое число от 1 до 6, и, предпочтительно, 1 или 2. Предпочтительно, чтобы R1 представлял собой атом водорода, метильную группу, этильную группу, -CH2COOH, -CH2CH2-COOH или -CH2CH2-OH, и, более предпочтительно, атом водорода, метильную группу или -CH2COOH. Атом водорода является еще более предпочтительным. La фрагмент линкера может представлять собой -O- или одинарную химическую связь.
Линкер Lb представляет собой любую из структур -CR2(-R3)-, -O- и -NR4- или представляет собой одинарную химическую связь. В приведенных выше фрагментах, R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет собой атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет собой целое число от 0 до 6, nb представляет собой целое число от 1 до 4, и nc представляет собой целое число от 0 до 4. Когда na или nc равняется 0, R2 и R3 не являются одинаковыми.
Когда каждый из R2 и R3 представляет собой алкильную группу, считается, что эта алкильная группа определяется так же, как алкильная группа для R1. Когда R2 и R3 имеют структуру -(CH2)na-NH2, na представляет собой целое число от 0 до 6, и, предпочтительно, 0, или равняется от 3 до 5. Когда na равняется 0, R2 и R3 не являются одинаковыми. Когда R2 и R3 имеют структуру -(CH2)nb-COOH, nb представляет собой целое число от 1 до 4, и, предпочтительно, 1 или 2. Когда R2 и R3 имеют структуру -(CH2)nc-OH, nc представляет собой целое число от 0 до 4, и, предпочтительно, 1 или 2.
Предпочтительно, чтобы каждый из R2 и R3 представлял собой атом водорода, метильную группу, этильную группу, -NH2, -CH2CH2CH2NH2, -CH2CH2CH2CH2NH2, -CH2CH2CH2CH2CH2CH2NH2, -CH2COOH, -CH2CH2-COOH, -CH2OH или -CH2CH2-OH, и, более предпочтительно, атом водорода, метильную группу, -NH2, -CH2CH2CH2CH2NH2, -CH2COOH, -CH2CH2-COOH, -CH2OH и -CH2CH2-OH. Еще более предпочтительно, чтобы они представляли собой атомы водорода.
Когда R4 представляет собой алкильную группу, имеющую от 1 до 6 углеродных атомов, считается, что эта алкильная группа определяется так же, как алкильная группа для R1. Предпочтительно, чтобы R4 представлял собой атом водорода или метильную группу, и, более предпочтительно, атом водорода.
Конкретные примеры структуры, представленной с помощью -NH-(CH2)n1-La-Lb- в качестве линкера, могут включать
-NH-CH2-,
-NH-CH(-Me)-,
-NH-C(-Me)2-,
-NH-CH2-CHMe-,
-NH-CH(-CH2OH)-,
-NH-CH(-CH2COOH)-,
-NH-CH(-CH2CH2COOH)-,
-NH-CH(-CH2CH2CH2CH2NH2)-,
-NH-CH2CH2-,
-NH-CH2-O-CH2-,
-NH-CH2CH2-O-,
-NH-CH2CH2-O-CH2-,
-NH-CH2CH2C(-Me)2-,
-NH-CH2CH2NH-,
-NH-CH2CH2NH-CH2-,
-NH-CH2CH2NMe-CH2-,
-NH-CH2CH2NH-CH2CH2-,
-NH-CH2CH2NMe-CH2CH2-,
-NH-CH2CH2N(-CH2COOH)-CH2-,
-NH-CH2CH2N(-CH2CH2OH)-CH2-,
-NH-CH2CH2N(-CH2CH2OH)-CH2CH2-,
-NH-CH2CH2CH2C(=O)-NHCH(-CH2OH)-,
-NH-CH2CH2CH2C(=O)-NHCH(-CH2COOH)-,
-NH-CH2CH2CH2C(=O)-NHCH(-CH2CH2CH2CH2NH2)-,
-NH-CH2CH2CH2-,
-NH-CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH(NH2)-.
Из них, предпочтительные примеры могут включать
-NH-CH2-,
-NH-CH2-CH(Me)-,
-NH-CH(-CH2OH)-,
-NH-CH(-CH2CH2COOH)-,
-NH-CH2CH2-,
-NH-CH2-O-CH2-,
-NH-CH2CH2-O-,
-NH-CH2CH2-O-CH2-,
-NH-CH2CH2C(-Me)2-,
-NH-CH2CH2NH-,
-NH-CH2CH2NH-CH2-,
-NH-CH2CH2NMe-CH2-,
-NH-CH2CH2NMe-CH2CH2-,
-NH-CH2CH2N(-CH2COOH)-CH2-,
-NH-CH2CH2N(-CH2CH2OH)-CH2-,
-NH-CH2CH2N(-CH2CH2OH)-CH2CH2-,
-NH-CH2CH2CH2C(=O)-NHCH(-CH2OH)-,
-NH-CH2CH2CH2C(=O)-NHCH(-CH2COOH)-,
-NH-CH2CH2CH2-,
-NH-CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH2-.
Их более предпочтительные примеры могут включать
-NH-CH2-,
-NH-CH2CH2-,
-NH-CH2-O-CH2-,
-NH-CH2CH2-O-,
-NH-CH2CH2-O-CH2-,
-NH-CH2CH2NH-,
-NH-CH2CH2NH-CH2-,
-NH-CH2CH2N(-CH2COOH)-CH2-,
-NH-CH2CH2N(-CH2CH2OH)-CH2CH2-,
-NH-CH2CH2CH2C(=O)-NHCH(-CH2COOH)-,
-NH-CH2CH2CH2-,
-NH-CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH2-.
Их еще более предпочтительные примеры могут включать
-NH-(CH2)3-,
-NH-CH2-O-CH2- и
-NH-(CH2)2-O-CH2-.
6. Lc
Линкер Lc представляет собой -CH2- или -C(=O)-. Указанный линкер присоединен к противоопухолевому соединению. Более предпочтительно, чтобы Lc в линкере представлял собой -C(=O)-.
Предпочтительно, чтобы в линкере, длина цепи -NH-(CH2)n1-La-Lb-Lc составляла от 4 до 7 атомов, и, более предпочтительно, 5 или 6 атомов.
В отношении конъюгата антитело-лекарственное средство настоящего изобретения, когда его доставляют внутрь опухолевых клеток, линкерный фрагмент разрушается и производное лекарственного средства, имеющее структуру, представленную с помощью NH2-(CH2)n1-La-Lb-Lc-(NH-DX), высвобождается, оказывая противоопухолевое действие. Примеры противоопухолевого производного, оказывающего противоопухолевое действие в результате высвобождения из конъюгата антитело-лекарственное средство настоящего изобретения, включают противоопухолевое производное, имеющее структурный фрагмент, в котором структура линкера, представленная с помощью -NH-(CH2)n1-La-Lb-, соединена с Lc и имеет концевую аминогруппу, и, особенно предпочтительные примеры включают следующие структуры.
NH2-CH2CH2-C(=O)-(NH-DX),
NH2-CH2CH2CH2-C(=O)-(NH-DX),
NH2-CH2-O-CH2-C(=O)-(NH-DX),
NH2-CHCH2-O-CH2-C(=O)-(NH-DX).
При этом, в случае NH2-CH2-O-CH2-C(=O)-(NH-DX), было подтверждено, что, так как аминоацетальная структура в молекуле является нестабильной, она снова подвергается саморазрушению с высвобождением следующего фрагмента HO-CH2-C(=O)-(NH-DX). Эти соединения могут предпочтительно использоваться в качестве промежуточного соединения при получении конъюгата антитело-лекарственное средство настоящего изобретения.
Для конъюгата антитело-лекарственное средство настоящего изобретения, в котором в качестве лекарственного средства используют эксатекан, предпочтительно, чтобы осколок лекарственное средство-фрагмент линкерной структуры, имеющий следующую структуру [-L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-(NH-DX)], присоединялся к антителу. Среднее число конъюгированных осколков лекарственное средство-фрагмент линкерной структуры с молекулой антитела может составлять от 1 до 10. Предпочтительно, чтобы это число составляло от 2 до 8, и, более предпочтительно, от 3 до 8.
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
Более предпочтительными среди них являются следующие:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
Особенно предпочтительными являются следующие:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
В отношении линкерной структуры для конъюгирования антитела и лекарственного средства в конъюгат антитело-лекарственное средство настоящего изобретения, предпочтительный линкер может быть сформирован путем присоединения описанных выше предпочтительных структур, приведенных для каждой части линкера. Что касается линкерной структуры, то могут быть предпочтительно использованы следующие структуры. При этом левый конец структуры является положением соединения с антителом, а правый конец является положением соединения с лекарственным средством.
-(Сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
Более предпочтительными среди них являются следующие:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
Особенно предпочтительные включают следующие:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-.
Способ получения
Далее приводятся объяснения типичного способа получения конъюгата антитело-лекарственное средство настоящего изобретения или способа получения его промежуточного соединения. При этом далее описываются соединения с соответствующим номером, приводимым на каждой схеме реакции. В частности, их обозначают как "соединение формулы (1)", "соединение (1)" или другим подобным образом. Соединения с соответствующими номерами, отличающимися от этих номеров, также описываются аналогичным образом.
1. Способ получения 1
Конъюгат антитело-лекарственное средство, представленный формулой (1), в котором антитело соединено с линкерной структурой через тиоэфир, может быть получен, например, следующим способом.
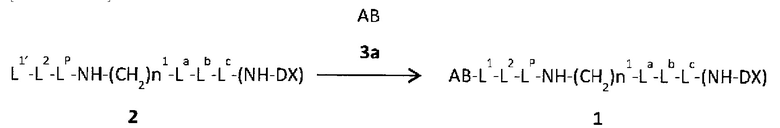
[На этой схеме, AB представляет антитело с сульфгидрильной группой, и L1' представляет линкерную структуру L1, в которой концевой линкер представляет собой малеимидильную группу (формула показана ниже)
(в этой формуле, атом азота является положением присоединения)
или концевой группой является галоген, и представляет группу, в которой -(сукцинимид-3-ил-N)- фрагмент в -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)- в L1 представляет собой малеимидильную группу или галоген-CH2C(=O)NH-(CH2)n3-C(=O)- группу, в которой концевой метилен в -CH2C(=O)NH-(CH2)n3-C(=O)- в L1 подвергнут галогенированию с образованием галогенацетамида. Кроме того, -(NH-DX) представляет структуру, представленную следующей формулой:
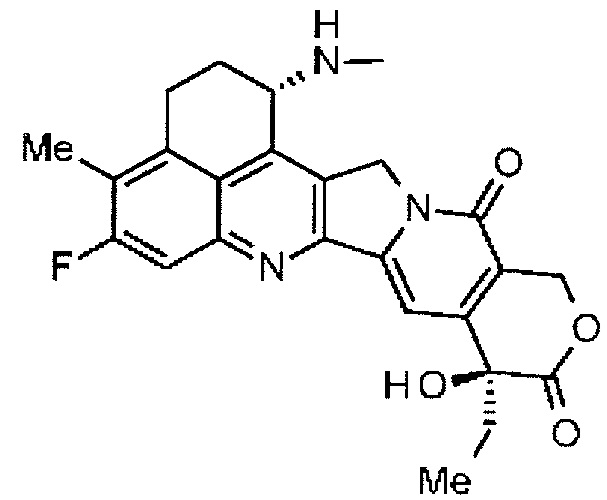
и представляет группу, которую получают путем удаления одного атома водорода аминогруппы в положении 1 эксатекана. Кроме того, соединение формулы (1) в приведенных выше фрагментах схемы реакции описана как структура, в которой один структурный фрагмент от лекарственного средства до линкерного конца соединяется с одним антителом. Однако это только описание, приведенное для простоты изложения, а, на самом деле, имеют место много случаев, при которых множество структурных фрагментов присоединены к одной молекуле антитела. То же самое относится и к объяснению способа получения, описанного ниже].
В частности, конъюгат антитело-лекарственное средство (1) может быть получен путем реакции соединения (2), которое может быть получено описанным ниже способом, с антителом (3a), имеющим сульфгидрильную группу.
Антитело (3a), имеющее сульфгидрильную группу, может быть получено хорошо известным способом (Hermanson, G.T, Bioconjugate Techniques, pp. 56-136, pp. 456-493, Academic Press (1996)). Примеры включают, но этим не ограничивая, реакцию реагента Трота с аминогруппой антитела; реакции N-сукцинимидил S-ацетилтиоалканоатов с аминогруппой антитела с последующей реакцией с гидроксиламином; реакцию антитела с N-сукцинимидил 3-(пиридилдитио)пропионатом и затем реакцию с восстановителем; реакцию антитела с восстановителем, таким как дитиотреитол, 2-меркаптоэтанол и трис(2-карбоксиэтил)фосфина гидрохлорид (TCEP), с целью восстановления дисульфидной связи в шарнирной части антитела для образования сульфгидрильной группы.
В частности, используя от 0,3 до 3 мольных эквивалентов TCEP в качестве восстановителя на моль дисульфида в шарнирной области антитела и осуществляя его реакцию с антителом в буферном растворе, содержащем хелатообразующий реагент, может быть получено антитело с частично или полностью восстановленным дисульфидом в шарнирной области антитела. Примеры хелатообразующего реагента включают этилендиаминтетрауксусную кислоту (EDTA) и диэтилентриаминпентауксусную кислоту (DTPA). Хелатообразующий реагент может быть использован при концентрации от 1 мM до 20 мM. Примеры буферного раствора, который может быть использован, включают раствор фосфата натрия, бората натрия или ацетата натрия. В качестве конкретного примера, антитело (3a), имеющее частично или полностью восстановленную сульфгидрильную группу, может быть получено путем реакции антитела с TCEP в течение от 1 до 4 часов при температуре от 4°C до 37°C.
При этом, путем проведения реакции добавления сульфгидрильной группы к фрагменту лекарственное средство-линкер, фрагмент лекарственное средство-линкер может быть конъюгирован за счет образования тиоэфирной связи.
Далее, используя от 2 до 20 мольных эквивалентов соединения (2) на моль антитела (3a), имеющего сульфгидрильную группу, может быть получен конъюгат антитело-лекарственное средство (1), в котором от 2 до 8 молекул лекарственного средства конъюгированы с одной молекулой антитела. В частности, для осуществления реакции достаточно добавление раствора, содержащего растворенное в нем соединение (2), к буферному раствору, содержащему антитело (3a), имеющее сульфгидрильную группу. В данном случае, примеры буферного раствора, который может быть использован, включают раствор ацетата натрия, фосфата натрия и бората натрия. Значение pH для проведения реакции составляет от 5 до 9, и, более предпочтительно проводить реакции при значении pH около 7. Примеры растворителя для растворения соединения (2) включают органический растворитель, такой как диметилсульфоксид (DMSO), диметилформамид (DMF), диметилацетамид (DMA) и N-метил-2-пиридон (NMP). Для осуществления реакции достаточно добавление раствора в органическом растворителе, содержащем растворенное в нем соединение (2) при концентрации от 1 до 20% по объему, к буферному раствору, содержащему антитело (3a), имеющее сульфгидрильную группу. Температура реакции составляет от 0 до 37°C, более предпочтительно, от 10 до 25°C, и время реакции составляет от 0,5 до 2 часов. Реакция может быть прервана путем деактивации реакционноспособности непрореагировавшего соединения (2) с помощью тиолсодержащего реагента. Примеры тиолсодержащего реагента включают цистеин и N-ацетил-L-цистеин (NAC). Более конкретно, реакция может быть прервана путем добавления от 1 до 2 мольных эквивалентов NAC к используемому соединению (2) и инкубации при комнатной температуре в течение от 10 до 30 минут.
Полученный конъюгат антитело-лекарственное средство (1) может быть подвергнут, после концентрирования, замене буфера, очистке и определению концентрации антитела и среднего числа конъюгированных молекул лекарственного средства на одну молекулу антитела с помощью известных описанных ниже способов, и идентификации конъюгата антитело-лекарственное средство (1).
Общий способ A: Концентрирование водного раствора антитела или конъюгата антитело-лекарственное средство
В центрифужный концентратор Amicon Ultra (номинальное отсечение по молекулярной массе (MWCO) 50000, фирмы Millipore Corporation) добавляли раствор антитела или конъюгата антитело-лекарственное средство, и раствор антитела или конъюгата антитело-лекарственное средство концентрировали путем центрифугирования (центрифугирование в течение от 5 до 20 минут при величине от 2000 G до 3800 G), используя центрифугу Allegra X-15R, фирмы Beckman Coulter, Inc.
Общий способ B: Определение концентрации антитела
Определение концентрации антитела проводили с помощью УФ детектора (Nanodrop 1000, фирмы Thermo Fisher Scientific Inc.) в соответствии с методикой, предлагаемой фирмой-производителем. В данном случае, использовали коэффициент поглощения при длине волны 280 нм, который отличался по величине для каждого антитела (от 1,3 млмг-1см-1 до 1,8 млмг-1см-1).
Общий способ C-1: Замена буфера для антитела
Колонку NAP-25 (номер по каталогу 17-0852-02 фирмы GE Healthcare Japan Corporation) с носителем Sephadex G-25 приводили в равновесие с фосфатным буфером (10 мМ, pH 6,0) (обозначается в описании изобретения как PBS6.0/EDTA), содержащим хлорид натрия (137 мМ) и этилендиаминтетрауксусную кислоту (EDTA, 5 мМ), в соответствии с методикой, предлагаемой фирмой-производителем. Водный раствор антитела загружали в количестве 2,5 мл в одну колонку NAP-25, и затем собирали фракцию (3,5 мл), элюируемую с помощью 3,5 мл PBS6.0/EDTA. Полученную фракцию концентрировали с помощью общего способа A. После определения концентрации антитела общим способом B, концентрацию антитела доводили до 10 мг/мл с помощью PBS6.0/EDTA.
Общий способ C-2: Замена буфера для антитела
Колонку NAP-25 (номер по каталогу 17-0852-02 фирмы GE Healthcare Japan Corporation) с носителем Sephadex G-25 приводили в равновесие с фосфатным буфером (50 мМ, pH 6,5) (обозначается в описании изобретения как PBS6.5/EDTA), содержащим хлорид натрия (50 мМ) и EDTA (2 мМ), в соответствии с методикой, предлагаемой фирмой-производителем. Водный раствор антитела загружали в количестве 2,5 мл в одну колонку NAP-25, и затем собирали фракцию (3,5 мл), элюируемую с помощью 3,5 мл PBS6.5/EDTA. Полученную фракцию концентрировали с помощью общего способа A. После определения концентрации антитела общим способом B, концентрацию антитела доводили до 20 мг/мл с помощью PBS6.5/EDTA.
Общий способ D-1: Очистка конъюгата антитело-лекарственное средство
Колонку NAP-25 приводили в равновесие с любым буфером, выбранным из производимого промышленностью фосфатного буфера (PBS7.4, номер по каталогу 10010-023, фирмы Invitrogen), буфера на основе фосфата натрия (10 мМ, pH 6,0; обозначаемого как PBS6.0), содержащего хлорид натрия (137 мМ), и ацетатного буфера, содержащего сорбит (5%) (10 мМ, pH 5,5; обозначаемого в описании изобретения как ABS). Полученный в результате реакции водный раствор конъюгата антитело-лекарственное средство загружали в количестве около 1,5 мл в колонку NAP-25, и затем собирали фракцию антитела, элюированную с помощью буфера в количестве, рекомендованном фирмой-производителем. Собранную фракцию снова загружали в колонку NAP-25 и, повторяя суммарно от 2 до 3 раз процесс гель-фильтрационной очистки элюируемой буфером фракции, получали конъюгат антитело-лекарственное средство, не содержащий неконъюгированного лекарственного средства, линкера и низкомолекулярных соединений (трис(2-карбоксиэтил)фосфина гидрохлорид (TCEP), N-ацетил-L-цистеин (NAC) и диметилсульфоксид).
Общий способ E: Определение концентрации антитела в конъюгате антитело-лекарственное средство и среднего числа конъюгированных молекул лекарственного средства на молекулу антитела.
Концентрация конъюгированного лекарственного средства в конъюгате антитело-лекарственное средство может быть рассчитана путем измерения УФ поглощения водного раствора конъюгата антитело-лекарственное средство при двух длинах волн 280 нм и 370 нм и затем проведения вычисления, проиллюстрированного ниже.
Так как суммарное поглощение при любой длине волны равно сумме поглощений каждого поглощающего свет химического соединения, которое присутствует в системе [аддитивность поглощения], то, когда молярные коэффициента поглощения антитела и лекарственного средства остаются одними и теми же до и после конъюгирования между антителом и лекарственным средством, концентрация антитела и концентрация лекарственного средства в конъюгате антитело-лекарственное средство выражаются следующими уравнениями:
A280=AD,280+AA,280=εD,280CD+εA,280CA уравнение (1),
A370=AD,370+AA,370=εD,370CD+εA,370CA уравнение (2).
В приведенных выше уравнениях, A280 представляет поглощение водного раствора конъюгата антитело-лекарственное средство при 280 нм, A370 представляет поглощение водного раствора конъюгата антитело-лекарственное средство при 370 нм, AA,280 представляет поглощение антитела при 280 нм, AA,370 представляет поглощение антитела при 370 нм, AD,280 представляет поглощение предшественника конъюгата при 280 нм, AD,370 представляет поглощение предшественника конъюгата при 370 нм, εA,280 представляет молярный коэффициент поглощения антитела при 280 нм, εA,370 представляет молярный коэффициент поглощения антитела при 370 нм, εD,280 представляет молярный коэффициент поглощения предшественника конъюгата при 280 нм, εD,370 представляет молярный коэффициент поглощения предшественника конъюгата при 370 нм, CA представляет концентрацию антитела в конъюгате антитело-лекарственное средство, и CD представляет концентрацию лекарственного средства в конъюгате антитело-лекарственное средство.
Что касается εA,280, εA,370, εD,280 и εD,370 в приведенных выше уравнениях, то используются ранее полученные значения (значение, полученное на основе расчета или измерения величины, полученной с помощью измерения УФ поглощения соединения). Например, величина εA,280 может быть оценена из аминокислотной последовательности антитела, используя известный способ расчета (Protein Science, 1995, vol. 4, 2411-2423). Величина εA,370 обычно равна нулю. Величины εD,280 и εD,370 могут быть получены, исходя из закона Ламберта-Бера (Поглощение = молярная концентрация × молярный коэффициент поглощения × длина кюветы), путем измерения поглощения раствора, в котором растворяют используемый предшественник конъюгата при конкретной молярной концентрации. Значения CA и CD могут быть получены путем измерения A280 и A370 водного раствора конъюгата антитело-лекарственное средство и решения системы уравнений (1) и (2), использую эти измеренные величины. Кроме того, путем деления CD на CA, может быть получено среднее число молекул конъюгированного лекарственного средства на молекулу антитела.
Соединение, представленное формулой (2) в способе получения 1, представляет собой любое соединение, представленное следующей формулой:
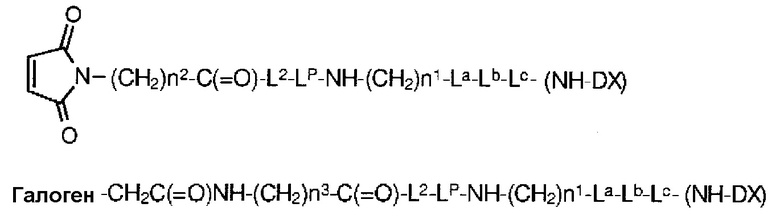 .
.
В этой формуле, n1, n2, n3, L2, LP, La, Lb, и Lc уже определены выше, и Lc является положением присоединения для лекарственного средства.
Предпочтительно, чтобы в промежуточном соединении, используемом для получения соединения настоящего изобретения, n2 представлял собой целое число от 2 до 5, L2 представлял собой -NH-(CH2CH2O)n5-CH2CH2-C(=O)- или одинарную химическую связь, n5 представлял собой целое число от 2 до 4, LP представлял собой GGFG, и -NH-(CH2)n1-La-Lb-Lc- представлял собой подструктуру -NH-CH2CH2-C(=O)-, NH-CH2CH2CH2-C(=O)-, -NH-CH2-O-CH2-C(=O)- или -NH-CH2CH2-O-CH2-C(=O)-. Предпочтительным галогеном является бром или йод. Конкретные примеры этих соединений могут включать следующие [в данном случае, (малеимид-N-ил) представляет малеимидильную группу (2,5-диоксо-2,5-дигидро-1H-пиррол-1-ильную группу)].
(Малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX)
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
В этой формуле, X представляет атом брома или атом йода. Предпочтительно, чтобы все эти соединения брома и йода могли бы использоваться в качестве промежуточных продуктов.
Для наработки достаточного количества конъюгата, при получении новых больших партий могут быть смешаны множество конъюгатов, полученных при одинаковых условиях с целью содержания в них эквивалентного числа молекул лекарственного средства (например, приблизительно ±1). В этом случае, среднее число молекул лекарственного средства находится в диапазоне между средними числами молекул лекарственного средства в конъюгатах до смешения.
2. Способ получения 2
Конъюгат антитело-лекарственное средство, представленный формулой (1), в котором антитело присоединено через амидную группу к линкеру и имеет тиоэфирную связь внутри линкера, в частности, структура, в которой -L1-L2- представляет собой -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-(CH2)n6-C(=O)-, может быть также получен следующим способом.
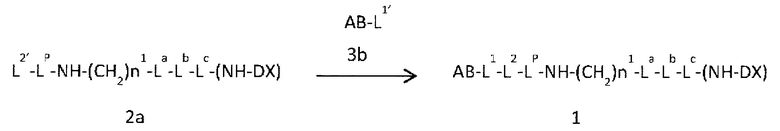 .
.
В этой схеме реакции, AB-L1' представляет группу, которая соединяет антитело и линкер L1 и, кроме того, конец L1 превращается в N-малеимидильную группу. Эта группа, в частности, имеет структуру, в которой -(N-ли-3-диминицкус)- в AB-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- превращается в малеимидильную группу. L2' представляет HS-(CH2)n6-C(=O)- группу, в которой конец представляет собой меркаптогруппу, и AB представляет антитело.
В частности, конъюгат антитело-лекарственное средство (1) может быть получен путем реакции соединения (2a), которое получают описанным ниже способом, с имеющим малеимидильную группу антителом (3b), которое присоединено к линкеру.
Антитело (3b), имеющее малеимидильную группу, может быть также получено известным способом (Hermanson, G.T, Bioconjugate Techniques, pp. 56-136, pp. 456-493, Academic Press (1996)). Примеры включают, но этим не ограничивая: бифункциональный линкер, такой как сукцинимидил-4-(N-малеимидoметил)циклогексан-1-карбоксилат (SMCC), который способен образовывать связь с аминогруппой или гидроксильной группой и имеет малеимидильную группу, и он способен взаимодействовать с аминогруппой лиганда с введением малеимидильной группы.
Например, можно предпочтительно использовать соединение, имеющее фрагмент с реакционноспособной аминогруппой и фрагмент с реакционноспособной тиольной группой, связанные через линкер. В данном случае, фрагмент с реакционноспособной аминогруппой может представлять собой активный эфир, имидный эфир или другой подобный фрагмент, а фрагмент с реакционноспособной тиольной группой может представлять собой малеимидил, ацетилгалогенид, алкилгалогенид, дитиопиридил или другой подобный фрагмент.
Что касается способа создания линкера с аминогруппой или гидроксильной группой аминокислоты, входящей в структуру антитела, в частности, через образование амидной связи с аминогруппой, то соединение, которое сначала реагирует с антителом, может являться соединением, представленным следующей формулой:
Q1-L1a-Q2.
[В этой формуле, Q1 представляет (пирролидин-2,5-дион-N-ил)-O-C(=O)-, (3-сульфопирролидин-2,5-дион-N-ил)-O-C(=O)-, RQ-O-C(=N)- или O=C=N-,
L1a- представляет -цик.Гекс(1,4)-CH2-, алкиленовую группу, имеющую от 1 до 10 углеродных атомов, фениленовую группу, -(CH2)n4-C(=O)-, -(CH2)n4a-NH-C(=O)-(CH2)n4b- или -(CH2)n4a-NH-C(=O)-цик.Гекс(1,4)-CH2-,
Q2 представляет (малеимид-N-ил), атом галогена или -S-S-(2-пиридил),
RQ представляет алкильную группу, имеющую от 1 до 6 углеродных атомов, n4 представляет целое число от 1 до 8, n4a представляет целое число от 0 до 6, и n4b представляет целое число от 1 до 6].
В приведенных выше фрагментах, RQ представляет целое алкильную группу, имеющую от 1 до 6 углеродных атомов, и, более предпочтительно, метильную группу или этильную группу.
Алкиленовая группа для L1a может представлять собой группу, имеющую от 1 до 10 углеродных атомов. Фениленовая группа может быть любой из орто, мета и пара-конфигураций и, более предпочтительной является пара- или мета-фениленовая группа.
Предпочтительные примеры L1a могут включать -цик.Гекс(1,4)-CH2-, -(CH2)5-NH-C(=O)-цик.Гекс(1,4)-CH2-, -(CH2)2-NH-C(=O)-CH2-, -(CH2)5-NH-C(=O)-(CH2)2-, -CH2-, -(CH2)2-, -(CH2)3-, -(CH2)5-, -(CH2)10-, -(пара-Ph)-, -(мета-Ph)-, -(пара-Ph)-CH(-CH3)-, -(CH2)3-(мета-Ph)- и -(мета-Ph)-NH-C(=O)-CH2-.
Предпочтительно, чтобы Q1 представлял собой (пирролидин-2,5-дион-N-ил)-O-C(=O)-, предпочтительно, чтобы Q2 представлял собой (малеимид-N-ил) или -S-S-(2-пиридил), в случае их использования для образования дисульфидной связи.
В приведенных выше фрагментах, (пирролидин-2,5-дион-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота служит в качестве положения для соединения, и (3-сульфопирролидин-2,5-дион-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и эта сульфоновая кислота способна образовывать литиевую соль, натриевую соль или калиевую соль, и, предпочтительно, натриевую соль,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу,
(малеимид-N-ил) является группой, представленной следующей формулой:
 ,
,
где атом азота является положением присоединения,
(2-пиридил) представляет 2-пиридильную группу, (пара-Ph) представляет пара-фениленовую группу и (мета-Ph) представляет мета-фениленовую группу.
Примеры такого соединения включают сульфосукцинимидил-4-(N-малеимидилметил)циклогексан-1-карбоксилат (сульфо-SMCC), N-сукцинимидил-4-(N-малеимидилметил)циклогексан-1-карбокси-(6-амидокапроат) (LC-SMCC), κ-малеимидила ундекановой кислоты N-сукцинимидиловый эфир (KMUA), γ-малеимидила масляной кислоты N-сукцинимидиловый эфир (GMBS), ε-малеимидила капроновой кислоты N-гидроксисукцинимидовый эфир (EMCS), м-малеимидилбензоил-N-гидроксисукцинимидовый эфир (MBS), N-(α-малеимидилацетокси)-сукцинимидовый эфир (AMAS), сукцинимидил-6-(β-малеимидилпропионамид)гексаноат (SMPH), N-сукцинимидил 4-(п-малеимидилфенил)бутират (SMPB), N-(п-малеимидилфенил)изоцианат (PMPI), N-сукцинимидил-4-(йодацетил)аминобензоат (SIAB), N-сукцинимидилйодацетат (SIA), N-сукцинимидилбромацетат (SBA), N-сукцинимидил 3-(бромацетамид)пропионат (SBAP), N-сукцинимидил-3-(2-пиридодитио)пропионат (SPDP) и сукцинимидилоксикарбонил-α-метил-α-(2-пиридилдитио)толуол (SMPT).
В частности, например, в результате взаимодействия от 2 до 6 эквивалентов SMCC с антителом (3) в фосфатном буфере с pH от 6 до 7 в течение от 1 до 6 часов при комнатной температуре, активированный эфир SMCC может реагировать с антителом с образованием антитела (3b), имеющего малеимидильную группу. Полученное антитело (3b) может быть очищено общим способом D-2, описанным ниже, и использовано для следующей реакции с соединением (2a).
Общий способ D-2: Очистка сукцинимидил 4-(N-малеимидилметил)циклогексан-1-карбоксилат (SMCC)-дериватизированного антитела
Колонку NAP-25 приводили в равновесие с PBS6.5/EDTA. В колонку NAP-25 загружали в количестве около 0,5 мл реакционный раствор, содержащий сукцинимидил 4-(N-малеимидилметил)циклогексан-1-карбоксилат (в описании изобретения обозначаемый как SMCC)-дериватизированное антитело и затем собирали фракцию антитела для очистки, элюируемую с помощью буфера в рекомендованном фирмой-производителем количестве.
Аминогруппа антитела для соединения с линкером может представлять собой, но этим не ограничивая, N-концевую аминогруппу и/или аминогруппу, принадлежащую лизиновому остатку. В качестве варианта, антитело может быть присоединено к линкеру за счет образования эфирной связи путем использования гидроксильной группы, принадлежащей сериновому остатку.
Реакция соединения (2a) с антителом (3b), присоединенным к линкеру, имеющим малеимидильную группу, может быть осуществлена таким же образом, как и в способе проведения реакции соединения (2) с антителом (3a), имеющим сульфгидрильную группу, упомянутом в способе получения 1.
Для полученного конъюгата антитело-лекарственное средство (1) может быть осуществлено концентрирование, замена буфера, очистка и идентификация конъюгата антитело-лекарственное средство (1) путем определения концентрации антитела и среднего числа конъюгированных молекул лекарственного средства на молекулу антитела таким же образом, как в способе получения 1.
Соединение, представленное формулой (3b) в способе получения 2, имеет следующую структуру (см. следующую формулу; в этой структуре, "антитело-NH-" берет начало от антитела).
 .
.
Соединение, которое является промежуточным соединением при получении конъюгата антитело-лекарственное средство настоящего изобретения и имеет приведенную выше структуру, описано ниже (в этой формуле, n представляет собой целое число от 1 до 10, предпочтительно, от 2 до 8, и, более предпочтительно, от 3 до 8).
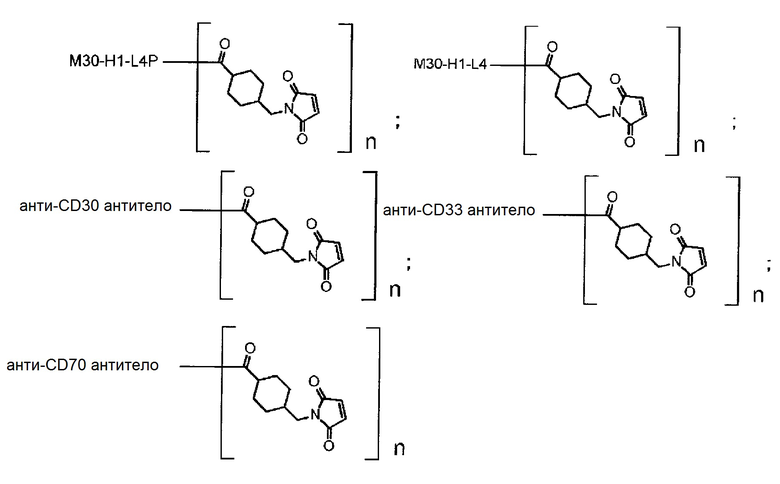
Кроме того, примеры соединения настоящего изобретения, в котором концевой группой является меркаптогруппа, могут включать следующие:
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
3. Способ получения 3
Конъюгат антитело-лекарственное средство, представленный формулой (1), в котором антитело конъюгировано с фрагментов лекарственное средство-линкер за счет амидной связи, может быть получено способом, описанным ниже. Например, что касается -C(=O)-(CH2)n4-C(=O)- для L1, то предпочтительно использовать его активный эфир L1', например, (пирролидин-2,5-дион-N-ил)-O-C(=O)-(CH2)n4-C(=O)-. Когда L2 представляет собой одинарную химическую связь, конъюгат антитело-лекарственное средство (1) может быть получен, например, следующим способом.
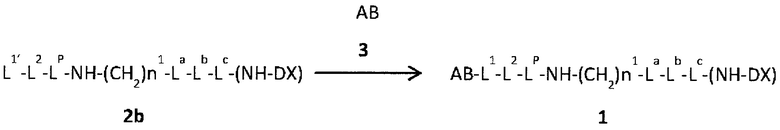 .
.
В частности, конъюгат антитело-лекарственное средство (1) может быть получен реакцией соединения (2b), которое можно получить описанным ниже способом, с антителом (3).
Соединение (2b) способно присоединяться к аминогруппе или гидроксильной группе антитела. Аминогруппа и гидроксильная группа антитела относятся к группам, уже описанным в способе получения 2, например, но этим не ограничивая, к N-концевой аминогруппе, содержащейся в антителе и/или аминогруппе, содержащейся в лизиновом остатке, и гидроксильной группе, содержащейся в сериновом остатке, соответственно.
Соединение (2b) представляет собой активный эфир, состоящий из N-гидроксисукцинимидиловой эфирной группы. В качестве варианта, могут быть использованы другие активные эфиры, например, сульфосукцинимидиловая эфирная группа, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, орто-нитрофениловый эфир, пара-нитрофениловый эфир, 2,4-динитрофенилоый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир и пентафторфениловый эфир.
Путем использования от 2 до 20 мольных эквивалентов соединения (2b) на моль антитела (3) в реакции соединения (2b) с антителом (3) может быть получен конъюгат антитело-лекарственное средство (1), в котором от 1 до 10 молекул лекарственного средства конъюгированы с одной молекулой антитела. В частности, раствор, содержащий растворенное в нем соединение (2b), может быть добавлен к буферному раствору, содержащему антитело (3), для проведения реакции с получением в результате конъюгата антитело-лекарственное средство (1). В данном случае, примеры буферного раствора, который может быть использован, включают раствор ацетата натрия, фосфата натрия и бората натрия. Значение pH для реакции может составлять от 5 до 9, и более предпочтительно проводить реакцию при значении pH около 7. Примеры растворителя для растворения соединения (2b) включают органический растворитель, такой как диметилсульфоксид (DMSO), диметилформамид (DMF), диметилацетамид (DMA) и N-метил-2-пиридон (NMP). Для проведения реакции достаточно, чтобы раствор в органическом растворителе, содержащий растворенное в нем соединение (2b), добавляли при концентрации от 1 до 20% по объему к буферному раствору, содержащему антитело (3). Температура реакции составляет от 0 до 37°C, более предпочтительно, от 10 до 25°C, и время реакции составляет от 0,5 до 20 часов.
Для полученного конъюгата антитело-лекарственное средство (1) может быть осуществлено концентрирование, замена буфера, очистка и идентификация конъюгата антитело-лекарственное средство (1) путем определения концентрации антитела и среднего числа конъюгированных молекул лекарственного средства на молекулу антитела таким же образом, как в способе получения 1.
Фрагмент (пирролидин-2,5-дион-N-ил)-O-C(=O)-(CH2)n4-C(=O)- в способе получения 3 имеет следующую структуру.
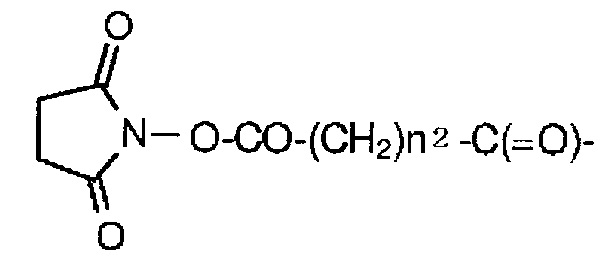 .
.
Примеры соединения настоящего изобретения, имеющего приведенную выше подструктуру, могут включать следующие:
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
4. Способ получения 4
Соединение, представленное формулой (2) или (2b) в качестве промежуточного соединения, используемого в предыдущем способе получения, и его фармакологически приемлемая соль могут быть получены, например, следующим способом.
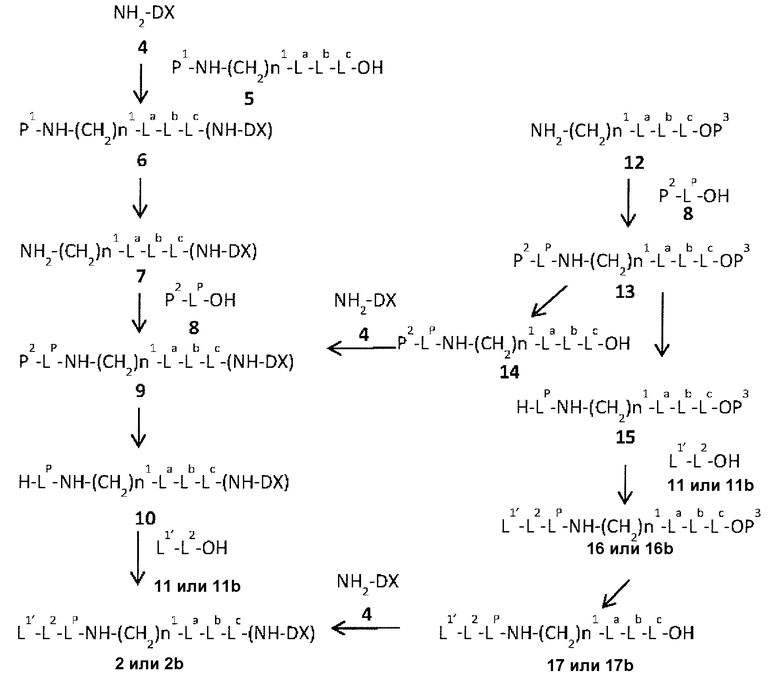
В этой формуле, Lc представляет собой -C(=O)- и присоединяется к -(NH-DX) с образованием амидной связи, L1' представляет L1 структуру, конец которой превращают в малеимидильную группу или галогенацетильную группу, или в (пирролидин-2,5-дион-N-ил)-O-C(=O)-(CH2)n4-C(=O)-, и каждый P1, P2 и P3 представляют защитную группу.
Соединение (6) может быть получено путем дериватизации карбоновой кислоты (5) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение и реакции его с NH2-DX [обозначающее эксатекан; химическое название: (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пирано[3',4':6,7]индолизино-[1,2-b]хинолин-10,13(9H,15H)-дион] (4) или его фармакологически приемлемой солью.
Для этой реакции могут быть использованы реагенты и условия проведения реакции, которые обычно применяют для синтеза пептидов. Существуют различные типы активного эфира. Например, он может быть получен реакцией фенолов, таких как п-нитрофенол, N-гидроксибензотриазол, N-гидроксисукцинимид или другие подобные фенолы, с карбоновой кислотой (5) при использовании конденсирующего реагента, такого как N,N'-дициклогексилкарбодиимид или 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид. Кроме того, активный эфир может быть также получен реакцией карбоновой кислоты (5) с пентафторфенилтрифторацетатом или другим подобным соединением; реакцией карбоновой кислоты (5) с 1-бензотриазолилокситрипирролидинофосфония гексафторфосфитом; реакцией карбоновой кислоты (5) с диэтилцитанофосфонатом (способом всаливания); реакцией карбоновой кислоты (5) с трифенилфосфином и 2,2'-дипиридилдисульфидом (способом Мукайямы); реакцией карбоновой кислоты (5) с производным триазина, таким как 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (DMTMM); или другим подобным способом. Кроме того, реакция может быть осуществлена, например, галогенангидридным способом, при котором карбоновую кислоту (5) обрабатывают галогенангидридом, таким как тионилхлорид и оксалилхлорид, в присутствии основания. В результате реакции активного эфира, смешанного галогенангидрила или галогенангидрида карбоновой кислоты (5) с соединением (4) в присутствии подходящего основания в инертном растворителе при температуре от -78°C до 150°C может быть получено соединение (6). (При этом термин "инертный растворитель" означает растворитель, который не препятствует протеканию реакции, для которой этот растворитель используется).
Конкретные примеры основания, используемого на каждой описанной выше стадии, включают карбонат щелочного металла или щелочноземельного металла, алкоксид щелочного металла, гидроксид или гидрид щелочного металла, в том числе карбонат натрия, карбонат калия, этоксид натрия, бутоксид калия, гидроксид натрия, гидроксид калия, гидрид натрия и гидрид калия, металлоорганическое основание, представленное алкиллитием, в том числе н-бутиллитий, диалкиламинолитий, в том числе диизопропиламид лития; металлоорганическое основание биссилиламина, в том числе бис(триметилсилил)амид лития; и органическое основание, в том числе пиридин, 2,6-лутидин, коллидин, 4-диметиламинопиридин, триэтиламин, N-метилморфолин, диизопропилэтиламин и диазабицикло[5.4.0]ундец-7-ен (DBU).
Примеры инертного растворителя, который используют для реакции настоящего изобретения, включают галогенированный углеводородный растворитель, такой как дихлорметан, хлороформ, и тетрахлорид углерода; эфирный растворитель, такой как тетрагидрофуран, 1,2-диметоксиэтан и диоксан; ароматический углеводородный растворитель, такой как бензол и толуол; и амидный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид и N-метилпирролидин-2-он. Помимо них, в зависимости от ситуации, может быть использован сульфоксидный растворитель, такой как диметилсульфоксид и сульфолан; и кетонный растворитель, такой как ацетон и метилэтилкетон.
Гидроксильная группа, карбоксильная группа, аминогруппа или другая подобная группа в La и Lb в соединении (6) может быть защищена с помощью описанной ниже защитной группы, которую обычно применяют в органическом синтезе. В частности, примеры защитной группы для гидроксильной группы включают алкоксиметильную группу, такую как метоксиметильная группа; арилметильную группу, такую как бензильная группа, 4-метоксибензильная группа и трифенилметильная группа; алканоильную группу, такую как ацетильная группа; ароильную группу, такую как бензоильная группа; и силильную группу, такую как трет-бутилдифенилсилильная группа. Карбоксильная группа может быть защищена, например, в виде эфира с алкильной группой, такой как метильная группа, этильная группа и трет-бутильная группа, аллильной группой или арилметильной группой, такой как бензильная группа. Аминогруппа может быть защищена с помощью защитной группы для аминогруппы, которую обычно используют в пептидном синтезе, например, алкоксикарбонильной группы, такой как трет-бутилоксикарбонильная группа, метоксикарбонильная группа и этоксикарбонильная группа; арилметильной группы, такой как аллилоксикарбонил, 9-флуоренилметилоксикарбонильная группа, бензилоксикарбонильная группа, параметоксибензилоксикарбонильная группа и пара- (или орто-)нитробензилоксикарбонильная группа; алканоильной группы, такой как ацетильная группа; арилметильной группы, такой как бензильная группа и трифенилметильная группа; ароильной группы, такой как бензоильная группа; и арилсульфонильной группы, такой как 2,4-динитробензолсульфонильная группа или ортонитробензолсульфонильная группа. Защита с помощью защитной группы или снятие защиты может быть осуществлено обычным хорошо известным способом.
Что касается защитной группы P1 для концевой аминогруппы соединения (6), то может быть использована защитная группа для аминогруппы, которую обычно используют в пептидном синтезе, например, трет-бутоксикарбонильная группа, 9-флуоренилметилоксикарбонильная группа и бензилоксикарбонильная группа. Примеры другой защитной группы для аминогруппы включают алканоильную группу, такую как ацетильная группа; алкоксикарбонильную группу, такую как метоксикарбонильная группа и этоксикарбонильная группа; арилметоксикарбонильную группу, такую как параметоксибензилоксикарбонильная группа и пара- (или орто-)нитробензилоксикарбонильная группа; арилметильную группу, такую как бензильная группа и трифенилметильная группа; ароильную группу, такую как бензоильная группа; и арилсульфонильную группу, такую как 2,4-динитробензолсульфонильная группа и ортонитробензолсульфонильная группа. Защитная группа P1 может быть выбрана в зависимости, например, от свойств соединения, имеющего аминогруппу, которую требуется защитить.
Путем удаления защитной группы P1 для концевой аминогруппы полученного соединения (6), может быть получено соединение (7). Реагенты и условия могут быть выбраны в зависимости от используемой защитной группы.
Соединение (9) может быть получено путем дериватизации содержащей пептидной карбоновой кислоты (8), имеющей N конец, защищенный с помощью P2, в активный эфир, смешанный ангидрид кислоты или другое подобное соединение и реакции его с полученным соединением (7). Условия проведения реакции, реагенты, основание и инертный растворитель, используемые для формирования пептидной связи между содержащей пептид карбоновой кислотой (8) и соединением (7) могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6). Защитная группа P2 может быть соответствующим образом выбрана из защитных групп, описанных для соединения (6), и выбор может быть основан, например, на свойствах соединения, имеющего аминогруппу, которую требуется защитить. Таким же способом, который обычно используют в синтезе пептидов с целью элонгации, то есть путем последовательного повторения реакции и удаления защиты с аминокислоты или пептида, входящего в состав содержащей пептид карбоновой кислоты (8), может быть также получено соединение (9).
В результате удаления P2 в качестве защитной группы для аминогруппы полученного соединения (9) может быть получено соединение (10). Реагенты и условия могут быть выбраны в зависимости от используемой защитной группы.
Можно получить соединение (2) или (2b) путем дериватизации карбоновой кислоты (11) или (11b) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение и реакции его с полученным соединением (10). Условия проведения реакции, реагенты, основание и инертный растворитель, используемые для образования пептидной связи между карбоновой кислотой (11) или (11b) и соединением (10) могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6).
Соединение (9) может быть также получено, например, следующим способом.
Соединение (13) может быть получено путем дериватизации содержащей пептид карбоновой кислоты (8), имеющей N конец, защищенный с помощью P2, в активный эфир, смешанный ангидрид кислоты или другое подобное соединение и его реакции с соединением амина (12), имеющим карбоксильную группу, защищенную с помощью P3, в присутствии основания. Условия проведения реакции, реагенты, основание и инертный растворитель, используемые для образования пептидной связи между содержащей пептид карбоновой кислотой (8) и соединением (12) могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6). Защитная группа P2 для аминогруппы соединения (13) может быть соответствующим образом выбрана из защитных групп, описанных для соединения (6). Что касается защитной группы P3 для карбоксильной группы, то может быть использована защитная группа, которая обычно применяется в качестве защитной группы для карбоксильной группы в органическом синтезе, в частности, при синтезе пептидов. В частности, она может быть соответствующим образом выбрана из защитных групп, описанных для соединения (6), например, эфиров с алкильной группой, такой как метильная группа, этильная группа или трет-бутил, аллильных эфиров и бензильных эфиров. В этом случае, необходимо, чтобы защитная группа для аминогруппы и защитная группа для карбоксильной группы могли быть удалены с помощью отличающихся способов или при отличающихся условиях. Например, типичный пример включает комбинацию, при которой P2 является трет-бутилоксикарбонильной группой и P3 является бензильной группой. Защитные группы могут быть выбраны из упомянутых выше защитных групп в зависимости, например, от свойств соединения, имеющего аминогруппу и карбоксильную группу, которые требуется защитить. Для удаления защитных групп, реагенты и условия могут быть выбраны в зависимости от используемой защитной группы.
Путем удаления защитной группы P3 для карбоксильной группы полученного соединения (13), может быть получено соединение (14). Реагенты и условия выбирают в зависимости от используемой защитной группы.
Соединение (9) может быть получено путем дериватизации полученного соединения (14) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение и его реакции с соединением (4) в присутствии основания. Для реакции, могут быть также использованы реагенты и условия, которые обычно применяют при синтезе пептидов, и условия проведения реакции, реагенты, основание и инертный растворитель, используемые для реакции, могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6).
Соединение (2) или (2b) может быть также получено, например, следующим способом.
В результате удаления защитной группы P2 для аминогруппы соединения (13), может быть получено соединение (15). Реагенты и условия выбирают в зависимости от используемой защитной группы.
Соединение (16) или (16b) может быть получено путем дериватизации производного карбоновой кислоты (11) или (11b) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение и его реакции с полученным соединением (15) в присутствии основания. Условия проведения реакции, реагенты, основание и инертный растворитель, используемые для образования амидной связи между содержащей пептид карбоновой кислотой (11) или (11b) и соединением (15) могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6).
В результате удаления защитной группы для карбоксильной группы полученного соединения (16) или (16b), может быть получено соединение (17) или (17b). Это удаление может быть проведено так же, как удаление защитной группы для карбоксильной группы для получения соединения (14).
Соединение (2) или (2b) может быть получено путем дериватизации соединения (17) или (17b) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение и его реакции с соединением (4) в присутствии основания. Для реакции, могут быть также использованы реагенты и условия, которые обычно применяют при синтезе пептидов, и условия проведения реакции, реагенты, основание и инертный растворитель, используемые для реакции, могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6).
5. Способ получения 5
Промежуточное соединение, представленное формулой (2), может быть также получено следующим способом.
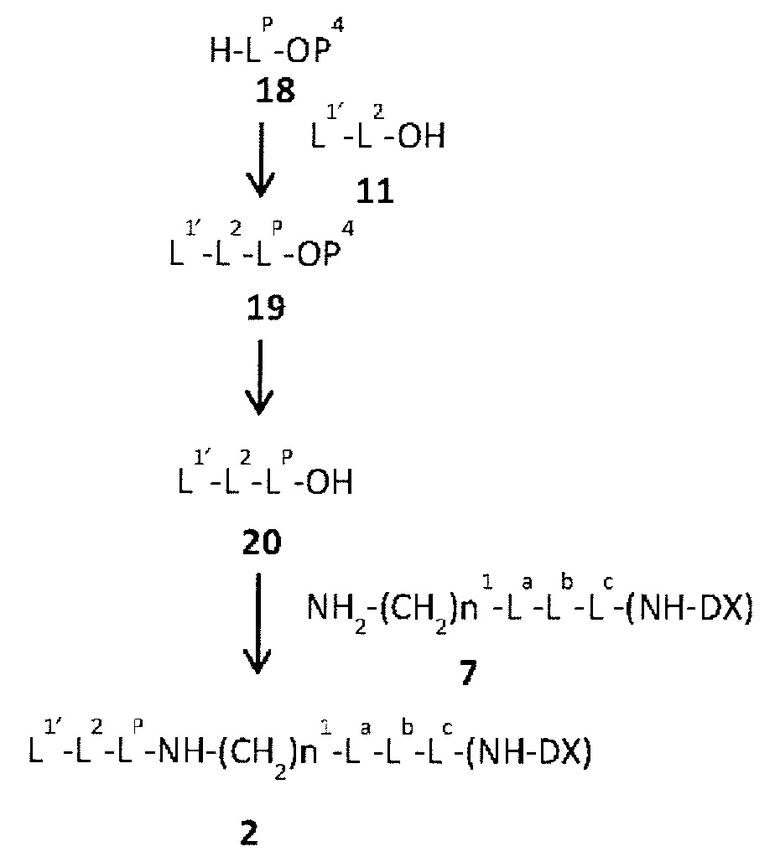 .
.
В этой схеме реакции, L1' соответствует L1, имеющему структуру, в которой конец превращают в малеимидильную группу или галогенацетильную группу, и P4 представляет защитную группу.
Соединение (19) может быть получено путем дериватизации соединения (11) в активный эфир, смешанный ангидрид кислоты или другое подобное соединение и его реакции с содержащей пептид карбоновой кислотой (18), имеющей C конец, защищенный с помощью P4, в присутствии основания. Условия проведения реакции, реагенты, основание и инертный растворитель, используемые для образования пептидной связи между содержащей пептид карбоновой кислотой (18) и соединением (11), могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6). Защитная группа P4 для карбоксильной группы соединения (18) может быть соответствующим образом выбрана из защитных групп, описанных для соединения (6).
В результате удаления защитной группы для карбоксильной группы полученного соединения (19), может быть получено соединение (20). Это удаление может быть осуществлено так же, как удаление защитной группы для карбоксильной группы при получении соединения (14).
Соединение (2) может быть получено путем дериватизации полученного соединения (20) в активный эфир, смешанный ангидрид кислоты или другое подобное соединение и его реакции с соединением (7). Для реакции, могут быть также использованы реагенты и условия, которые обычно применяют при синтезе пептидов, и условия проведения реакции, реагенты, основание и инертный растворитель, используемые для реакции, могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6).
6. Способ получения 6
Получение промежуточного соединения (2a), описанного в способе получения 2, в котором L2' соответствует L2, имеющему структуру, в которой конец превращают в меркаптоалканоильную группу, может быть осуществлено следующим способом.
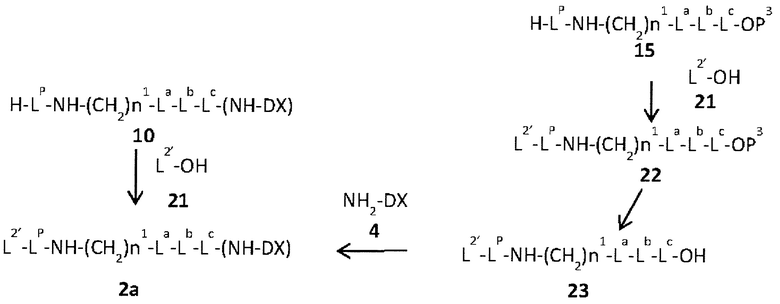
Соединение (2a) может быть получено путем дериватизации карбоновой кислоты (21), имеющей концевую меркаптогруппу, в активный эфир, смешанный ангидрид кислоты или другое подобное соединение и его реакции с соединением (10). Для реакции, могут быть также использованы реагенты и условия, которые обычно применяют при синтезе пептидов, и условия проведения реакции, реагенты, основание и инертный растворитель, используемые для реакции, могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (4).
Кроме того, соединение (23) может быть получено путем дериватизации соединения (21) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение, реакции его с соединением (15) и удаления защитной группы для карбоксильной группы полученного соединения (22).
Соединение (2a) может быть получено путем дериватизации соединения (23) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение и его реакции с соединением (4) в присутствии основания. Для реакции, могут быть также использованы реагенты и условия, которые обычно применяют при синтезе пептидов, и условия проведения реакции, реагенты, основание и инертный растворитель, используемые для реакции, могут быть соответствующим образом выбраны из уже описанных для синтеза соединения (6).
7. Способ получения 7
Далее подробно описан способ получения соединения (10c), имеющего n1=1, La=O, и Lb=CR2(-R3), при получении промежуточного соединения (10), описанного в способе получения 4. Соединение, представленное формулой (10c), его соль или сольват могут быть получены, например, следующим способом.
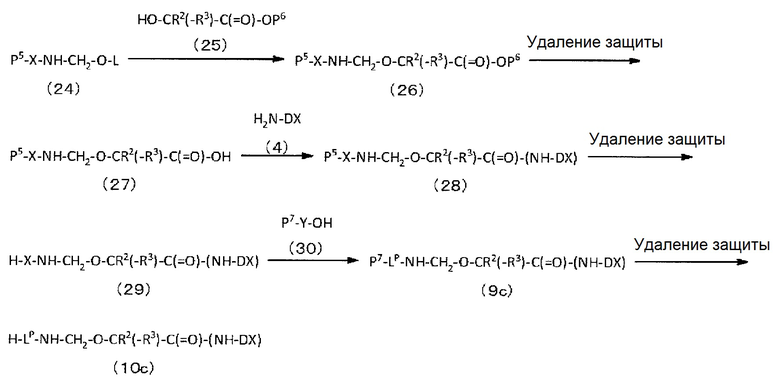
В этой схеме реакции, LP, R2 и R3 определены выше, L представляет ацетильную группу, атом водорода или другую подобную группу, X и Y каждый представляет олигопептид, состоящий из от 1 до 3 аминокислот, P5 и P7 каждый представляет защитную группу для аминогруппы, и P6 представляет защитную группу для карбоксильной группы.
Соединение, представленное формулой (24), может быть получено путем использования или применения способа, описанного в выложенном патенте Японии № 2002-60351 или в литературе (J. Org. Chem., Vol. 51, page 3196, 1986), и, при необходимости, путем удаления защитных групп или модификации функциональных групп. В качестве варианта, оно может быть также получено путем обработки альдегидом или кетоном аминокислоты с защищенной концевой аминогруппой или амида кислоты олигопептида с защищенной аминогруппой.
Путем реакции соединения (24) с соединением (25), имеющим гидроксильную группу при температуре, изменяющей при охлаждении до комнатной температуры, в инертном растворителе в присутствии кислоты или основания может быть получено соединение (26). Примеры кислоты, которая может быть использована, включают неорганическую кислоту, такую как фтористоводородная кислота, хлористоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и борная кислота; органическую кислоту, такую как уксусная кислота, лимонная кислота, паратолуолсульфоновая кислота и метансульфоновая кислота; и кислоту Льюиса, такую как тетрафторборат, хлорид цинка, хлорид олова, хлорид алюминия и хлорид железа. Паратолуолсульфоновая кислота является особенно предпочтительной. Что касается используемого основания, то может быть соответствующим образом выбрано и использовано любое из упомянутых выше оснований. Его предпочтительные примеры включают алкоксид щелочного металла, такой как трет-бутоксид калия, гидроксид щелочного металла, такой как гидроксид натрия и гидроксид калия; гидрид щелочного металла, такой как гидрид натрия и гидрид калия; металлоорганическое основание, представленное диалкиламинолитием, таким как диизопропиламид лития; и металлоорганическое основание биссилиламина, такое как бис(триметилсилил)амид лития. Примеры растворителя, используемого для реакции, включают эфирный растворитель, такой как тетрагидрофуран и 1,4-диоксан; и ароматический углеводородный растворитель, такой как бензол и толуол. Эти растворители могут быть приготовлены в виде смеси с водой. Кроме того, на защитную группу для аминогруппы, например, защитную группу P5, не накладывают конкретных ограничений, при условии, что она является группой, обычно используемой для защиты аминогруппы. Типичные примеры включают защитные группы для аминогруппы, которые описаны в способе получения 4. Однако, в данной реакции, защитная группа для аминогруппы, примером которой является группа P5, может быть расщепляемой. В этом случае, необходимо проводить реакцию с подходящим реагентом для защиты аминогруппы, если это требуется.
Соединение (27) может быть получено путем удаления защитной группы P6 в соединении (26). В данном случае, несмотря на то, что типичные примеры защитной группы для карбоксильной группы, например, группы P6, описаны в способе получения 4, тем не менее, в этом случае желательно, чтобы защитная группа P5 для аминогруппы и защитная группа P6 для карбоксильной группы являлись защитными группами, которые могут быть удалены с помощью отличающегося способа или при отличающихся условиях. Например, типичный пример включает комбинацию, при которой P5 является 9-флуоренилметилоксикарбонильной группой, а P6 является бензильной группой. Защитные группы могут быть выбраны в зависимости, например, от свойств соединения, имеющего аминогруппу и карбоксильную группу, которые требуется защитить. Для удаления защитных групп, реагенты и условия выбирают в зависимости от используемой защитной группы.
Соединение (29) может быть получено путем дериватизации карбоновой кислоты (27) в активный эфир, смешанный ангидрид кислоты, галогенангидрид или другое подобное соединение и его реакции с соединением (4) и его фармакологически приемлемой соли с получением соединения (28) и затем удаления защитной группы P5 в полученном соединении (28). Для реакции между соединением (4) и карбоновой кислотой (27) и реакции для удаления защитной группы P6, могут быть использованы такие же реагенты и условия реакции, как описанные для способа получения 4.
Соединение (10c) может быть получено путем реакции соединения (29) с аминокислотой с защищенной концевой аминогруппой или с олигопептидом (30) с защищенной аминогруппой с получением соединения (9c) и удаления защитной группы P7 в полученном соединении (9c). На защитную группу для аминогруппы, например, защитную группу P7, не накладывают конкретных ограничений, при условии, что она является группой, обычно используемой для защиты аминогруппы. Ее типичные примеры включают защитные группы для аминогруппы, которые описаны в способе получения 4. Для удаления защитной группы, реагенты и условия выбирают в зависимости от используемой защитной группы. Для реакции между соединением (29) и соединением (30), могут быть использованы реагенты и условия, которые обычно используют при синтезе пептидов. Соединение (10c), полученное упомянутым выше способом, может быть дериватизировано в соединение (1) настоящего изобретения с помощью описанного выше способа.
8. Способ получения 8
Далее подробно описан способ получения соединения (2c), имеющего n1=1, La=O и Lb=CR2(-R3), при получении промежуточного соединения (2), описанного в способе получения 4. Соединение, представленное формулой (2c), его соль или сольват могут быть получены, например, следующим способом.
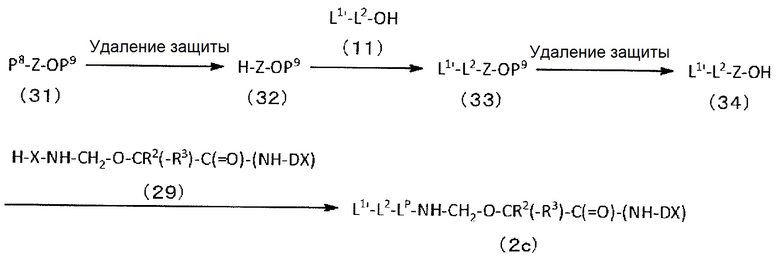
В этой схеме реакции, L1', L2, LP, R2 и R3 определены выше, Z представляет олигопептид, состоящий из от 1 до 3 аминокислот, P8 представляет защитную группу для аминогруппы, и P9 представляет защитную группу для карбоксильной группы.
Соединение (33) может быть получено путем удаления защитной группы P8 в аминокислоте или олигопептиде (31) с защищенной концевой аминогруппой и карбоксильной группой с получением соединения (32) и реакции полученной аминной формы (32) с соединением (11). На защитную группу для аминогруппы, примером которой является P8, не накладывают конкретных ограничений, при условии, что она является группой, обычно используемой для защиты аминогруппы. Типичные примеры включают защитные группы для аминогруппы, которые описаны в способе получения 4. Кроме того, для удаления защитной группы P8, реагенты и условия выбирают в зависимости от используемой защитной группы. Для реакции между соединением (32) и карбоновой кислотой (11) могут быть использованы такие же реагенты и реакционные условия, как описанные в способе получения 4.
Промежуточный продукт (2c) может быть получен путем удаления защитной группы P9 в соединении (33) с получением соединения (34) и реакции полученной карбоновой кислоты (34) с соединением (29). Типичные примеры защитной группы для карбоксильной группы, примером которой является группа P9, описаны в способе получения 4. Для проведения реакции ее удаления, могут быть использованы такие же реагенты и реакционные условия, как описанные для способа получения 4. Для реакции между соединением (29) и карбоновой кислотой (34), могут быть также использованы реагенты и условия реакции, которые обычно используют при синтезе пептидов. Соединение (2c), полученное упомянутым выше способом, может быть дериватизировано в соединение (1) настоящего изобретения описанным выше способом.
9. Способ получения 9
Далее подробно описан способ получения соединения (17c), имеющего n1=1, La=O, и Lb=CR2(-R3), при получении промежуточного соединения (17), описанного в способе получения 4. Соединение, представленное формулой (17c), его соль или сольват могут быть также получены, например, следующим способом.
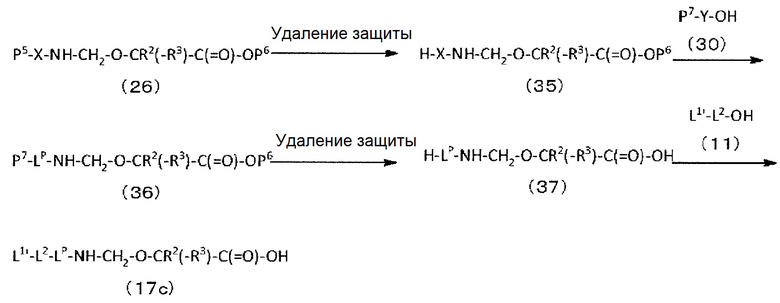
В этой схеме реакции, L1', L2, LP, R2, R3, X, Y, P5, P6 и P7 определены выше.
Соединение (36) может быть получено в результате удаления защитной группы P5 для аминогруппы в соединении (26) с защищенной концевой аминогруппой и карбоксильной группой с получением соединения (35) и реакции полученной аминной формы (35) с олигопептидом (30) с защищенной концевой аминогруппой или защищенной аминогруппой. На защитную группу для аминогруппы, примером которой является P5, не накладывают конкретных ограничений, при условии, что она является группой, обычно используемой для защиты аминогруппы. Типичные примеры включают защитные группы для аминогруппы, которые описаны в способе получения 4. Кроме того, для удаления защитной группы P5, реагенты и условия выбирают в зависимости от используемой защитной группы. В данном случае, несмотря на то, что типичные примеры защитной группы для карбоксильной группы, примером которой является группа P6, и защитной группы для аминогруппы, примером которой является группа P7, включают защитные группы для карбоксильной группы и аминогруппы, которые описаны в способе получения 4, тем не менее, желательно, чтобы защитная группа P6 для карбоксильной группы и защитная группа P7 для аминогруппы являлись защитными группами, которые могут быть удалены одним и тем же способом или при одних и тех же условиях. Например, типичный пример включает комбинацию, при которой P6 является бензиловой эфирной группой, и P7 является бензилоксикарбонильной группой.
Соединение (37) может быть получено путем удаления защитной группы P6 для карбоксильной группы в соединении (36) и защитной группы P7 для аминогруппы в соединении (36). Соединение (37) может быть также получено путем последовательного удаления защитной группы P6 для карбоксильной группы и защитной группы P7 для аминогруппы, или соединение (37) может быть получено путем одновременного удаления обеих защитных групп P6 и P7, которые могут быть удалены одним и тем же способом или при одних и тех же условиях.
Соединение (17c) может быть получено путем реакции полученного соединения (37) с соединением (11). Для реакции между соединением (37) и соединением (11), могут быть использованы такие же реагенты и условия реакции, как описанные для способа получения 4.
Далее описывается соединение, представленное следующей формулой:
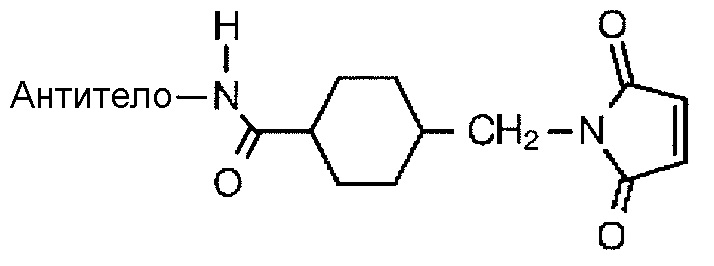
в качестве промежуточного продукта, применяемого для получения конъюгата антитело-лекарственное средство настоящего изобретения. Кроме того, группа соединений, представленных следующей формулой:
Q-(CH2)nQ-C(=O)-L2a-LP-NH-(CH2)n1-La-Lb-Lc-(NH-DX)
являются также соединениями, которые служат в качестве промежуточных продуктов, используемых для получения конъюгата антитело-лекарственное средство настоящего изобретения.
В частности, в приведенных выше фрагментах формулы, Q представляет собой (малеимид-N-ил)-, HS-, X-CH2-C(=O)-NH- или (пирролидин-2,5-дион-N-ил)-O-C(=O)-,
X представляет собой атом брома или атом йода,
nQ представляет собой целое число от 2 до 8,
L2a представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)- или одинарную химическую связь, где n5 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот,
n1 представляет целое число от 0 до 6,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
(малеимид-N-ил)- представляет собой группу, имеющую структуру, представленную следующей формулой:
(в этой формуле, атом азота является положением присоединения), (пирролидин-2,5-дион-N-ил)- представляет собой группу, имеющую структуру, представленную следующей формулой:
(в этой формуле, атом азота является положением присоединения), -(NH-DX) представляет собой группу, имеющую структуру, представленную следующей формулой:
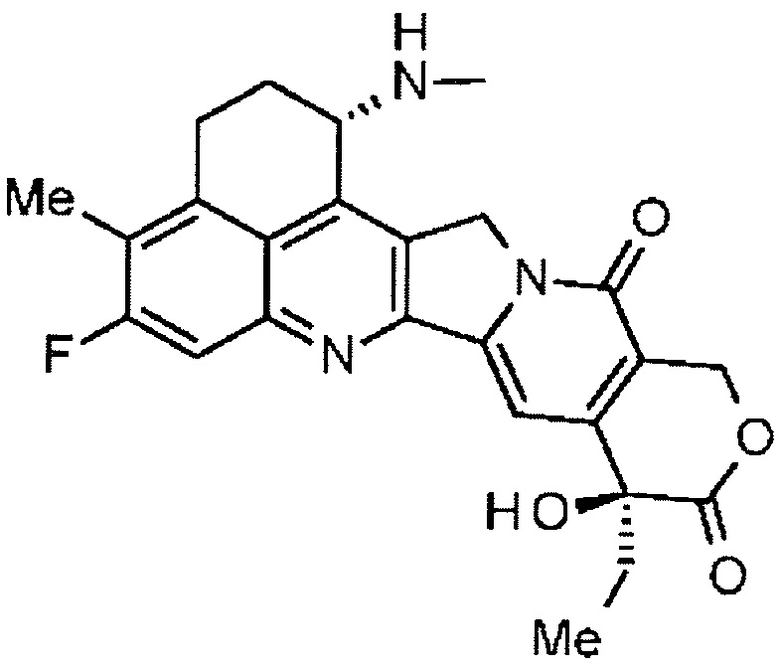
(в этой формуле, атом азота аминогруппы в положении 1 является положением присоединения).
Соединение, в котором Lc представляет собой -C(=O)-, является предпочтительным в качестве промежуточного продукта.
Что касается пептидного остатка в LP, то соединение аминокислотного остатка, состоящего из аминокислоты, выбранной из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты, является предпочтительным в качестве промежуточного продукта. Среди этих пептидных остатков, соединение, в котором LP представляет собой пептидный остаток, состоящий из 4 аминокислот, является предпочтительным в качестве промежуточного продукта. Более конкретно, соединение, в котором LP представляет собой -GGFG-, является предпочтительным в качестве промежуточного продукта.
Кроме того, что касается -NH-(CH2)n1-La-Lb-, то соединение -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2- является предпочтительным в качестве промежуточного продукта. Соединение NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-(CH2)2-O-CH2-C(=O)- является более предпочтительным.
Что касается nQ, то соединение, в котором nQ представляет собой целое число от 2 до 6, является предпочтительным в качестве промежуточного продукта.
Соединение, в котором L2a представляет собой одинарную химическую связь или n5 представляет собой целое число от 2 до 4, является предпочтительным в качестве промежуточного продукта.
Когда Q представляет собой (малеимид-N-ил)-, соединение, в котором nQ представляет собой целое число от 2 до 5, L2a представляет собой одинарную химическую связь, и -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта. Соединение, в котором -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является более предпочтительным. Соединение, в котором nQ представляет собой целое число, равное 2 или 5, является еще более предпочтительным.
Кроме того, когда Q представляет собой (малеимид-N-ил)-, соединение, в котором nQ представляет собой целое число от 2 до 5, L2a представляет собой -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-, n5 представляет собой целое число от 2 до 4, и -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта. Соединение, в котором n5 представляет собой целое число, равное 2 или 4, является более предпочтительным. Соединение, в котором -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является еще более предпочтительным.
Когда Q представляет собой HS-, соединение, в котором nQ представляет собой целое число от 2 до 5, L2a представляет собой одинарную химическую связь, и -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта. Соединение, в котором -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является более предпочтительным.
Когда Q представляет собой X-CH2-C(=O)-NH-, соединение, в котором X представляет собой атом брома, является предпочтительным в качестве промежуточного продукта. Соединение, в котором nQ представляет собой целое число от 2 до 8, является предпочтительным, кроме того, соединение, в котором L2a представляет собой одинарную химическую связь, является предпочтительным, и соединение, в котором -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта.
Когда Q представляет собой (пирролидин-2,5-дион-N-ил)-O-C(=O)-, соединение, в котором nQ представляет собой целое число от 2 до 5, L2a представляет собой одинарную химическую связь, и -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2-, -NH-CH2CH2CH2-, -NH-CH2CH2CH2CH2-, -NH-CH2CH2CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является предпочтительным в качестве промежуточного продукта. Соединение, в котором -NH-(CH2)n1-La-Lb- представляет собой -NH-CH2CH2CH2-, -NH-CH2-O-CH2- или -NH-CH2CH2-O-CH2-, является более предпочтительным.
Более конкретно, следующие соединения являются предпочтительными в качестве промежуточного продукта:
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
Br-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
При этом конъюгат антитело-лекарственное средство настоящего изобретения, когда его оставляют на воздухе или перекристаллизовывают, может абсорбировать влагу и содержать абсорбционную воду или превращаться в гидрат, и такое соединение и его соль, содержащие воду, также входят в объем настоящего изобретения.
Изобретение, меченое различными радиоактивными и нерадиоактивными изотопами, также входит в объем настоящего изобретения. Один или более атомов, образующих конъюгат антитело-лекарственное средство настоящего изобретения, могут содержать изотоп атома при соотношении, которое является несвойственным при его нахождении в природе. Примеры изотопа атома включают дейтерий (2H), тритий (3H), йод-125 (125I) и углерод-14 (14C). Кроме того, соединение настоящего изобретения может быть радиоактивномеченым с помощью радиоактивного изотопа, такого как тритий (3H), йод-125 (125I), углерод-14 (14C), медь-64 (64Cu), цирконий-89 (89Zr), йод-124 (124I), фтор-18 (18F), индий-111 (111I), углерод-11 (11C) и йод-131 (131I). Соединение, меченое радиоактивным изотопом, применяют в качестве терапевтического или профилактического средства, реагента для исследований, такого как реагент для анализа и реагент для диагностики, такой как in vivo диагностический визуализирующий реагент. Любой тип, даже не связанного с радиоактивностью, изотопного варианта конъюгата антитело-лекарственное средство настоящего изобретения входит в объем настоящего изобретения.
Лекарственные средства
Конъюгат антитело-лекарственное средство настоящего изобретения проявляет цитотоксическое действие в отношении опухолевых клеток, и, поэтому, он может быть использован в качестве лекарственного средства, в частности, в качестве противоракового терапевтического средства и/или профилактического средства.
Примеры типов рака, при которых применяется конъюгат антитело-лекарственное средство настоящего изобретения, включают рак легких, рак почки, рак уротелия, колоректальный рак, рак предстательной железы, мультиформную глиобластому, рак яичников, рак поджелудочной железы, рак молочной железы, меланому, рак печени, рак мочевого пузыря, рак желудка или рак пищевода, однако, эти примеры типов рака не являются ограничениями, при условии, что в опухолевых клетках, являющихся объектом лечения, существуют опухолевые клетки, экспрессирующие белок, который антитело в конъюгате антитело-лекарственное средство может распознать.
Предпочтительно, чтобы конъюгат антитело-лекарственное средство настоящего изобретения можно было вводить млекопитающему, но более предпочтительно, чтобы его можно было вводить человеку.
Вещества, применяемые в фармацевтической композиции, содержащей конъюгат антитело-лекарственное средство настоящего изобретения, могут быть соответствующим образом выбраны из фармацевтических вспомогательных веществ или из других подобных веществ, которые обычно используют в фармацевтике, с учетом дозы или концентрации при введении.
Конъюгат антитело-лекарственное средство настоящего изобретения может быть введен в виде фармацевтической композиции, содержащей, по меньшей мере, один фармацевтически подходящий ингредиент.
Например, упомянутая выше фармацевтическая композиция обычно содержит, по меньшей мере, один фармацевтический носитель (например, стерилизованную жидкость), например, воду и масло (минеральное масло и масло животного происхождения, растительного происхождения или синтетического происхождения (масло, например, может представлять собой арахисовое масло, соевое масло, минеральное масло, сезамовое масло или другое подобное масло)). Вода является наиболее часто используемым носителем, когда упомянутую выше фармацевтическую композицию вводят внутривенно. Физиологический раствор, водный раствор декстрозы и водный раствор глицерина могут также быть использованы в качестве жидкого носителя, в частности, для инъецируемого раствора. В фармацевтике является хорошо известной подходящая фармацевтическая среда. Если требуется, то упомянутая выше композиция может также содержать незначительное количество увлажняющего средства, эмульгатора или буферирующего величину pH вещества. Примеры подходящего фармацевтического носителя приводятся в "Remington's Pharmaceutical Sciences" by E. W. Martin. Лекарственные формы соответствуют способу введения.
Известны различные системы доставки лекарственных средств, и они могут быть использованы для введения конъюгата антитело-лекарственное средство настоящего изобретения. Примеры способов введения включают, но этим не ограничивая, внутрикожное, внутримышечное, внутрибрюшинное, внутривенное и подкожное введение. Введение может быть осуществлено, например, путем инъекции или болюсной инъекции. Согласно конкретному предпочтительному варианту осуществления, введение конъюгата антитело-лекарственное средство осуществляют путем инъекции. Парентеральное введение является предпочтительным способом введения.
Согласно типичному варианту осуществления, предлагается фармацевтическая композиция в качестве фармацевтической композиции, применяемой для внутривенного введения человеку с помощью традиционных способов. Обычно, композиция для внутривенного введения представляет собой раствор в стерильном и изотоническом водном буферном растворе. При необходимости, лекарственное средство может содержать солюбилизирующее вещество и местные анестетики для облегчения болевых ощущений в месте инъекции (например, лигнокаин). Обычно упомянутый выше ингредиент выпускается отдельно в виде либо лиофилизированного порошка, либо безводного концентрата, содержащегося в упаковке, которая представляет собой герметичную ампулу или пакетик, содержащие количество активного средства, или в виде смеси в виде единичной лекарственной формы. При введении лекарственного средства путем инъекции, оно может быть введено из специального инъекционного флакона, содержащего стерильную воду или стерильный физиологический раствор фармацевтической степени чистоты. При введении лекарственного средства путем инъекции, может прилагаться ампула со стерильной водой или стерильным физиологическим раствором для инъекции, для того чтобы смешивать упомянутые выше ингредиенты друг с другом перед введением.
Фармацевтическая композиция настоящего изобретения может представлять собой фармацевтическую композицию, содержащую только конъюгат антитело-лекарственное средство настоящего изобретения, или фармацевтическую композицию, содержащую конъюгат антитело-лекарственное средство и, по меньшей мере, одно противораковое средство помимо конъюгата. Конъюгат антитело-лекарственное средство настоящего изобретения может быть введен с другим противораковым средством. Соответственно, в результате этого, противораковое действие может быть усилено. Другое противораковое средство, используемое для этой цели, может быть введено индивидууму одновременно, раздельно или последовательно с конъюгатом антитело-лекарственное средство, и может быть введено с изменяющимся для каждого интервалом введения. Примеры противоракового средства включают, но этим не ограничивая, при условии, что это лекарственное средство обладает противоопухолевым действием, абраксан, карбоплатин, цисплатин, гемцитабин, иринотекан (CPT-11), паклитаксел, пеметрексед, сорафениб, винорелбин, лекарственные средства, описанные в международной публикации № WO 2003/038043, аналоги LH-RH (лейпрорелин, гозерелин или другие подобные средства), эстрамустина фосфат, антагонист эстрогена (тамоксифен, ралоксифен или другие подобные средства) и ингибитор ароматазы (анастрозол, летрозол, эксеместан и другие подобные средства).
Фармацевтическая композиция может быть приготовлена в виде лиофилизированной лекарственной формы или жидкой лекарственной формы в качестве формы, имеющей требуемый состав и требуемую чистоту. При приготовлении лиофилизированной лекарственной формы, она может представлять собой лекарственную форму, содержащую соответствующие вспомогательные вещества, которые используют в фармацевтике. То же самое и для жидкой лекарственной формы, она может быть приготовлена в виде жидкой лекарственной формы, содержащей различные вспомогательные вещества, которые используют в фармацевтике.
Состав и концентрация фармацевтической композиции может изменяться в зависимости от способа введения. Однако, конъюгат антитело-лекарственное средство, который содержится в фармацевтической композиции настоящего изобретения, может оказывать фармацевтическое действие даже при небольшой дозе, если конъюгат антитело-лекарственное средство имеет более высокую аффинность к антигену, то есть, более высокую аффинность (= более низкое значение Kd), выражаемую через константу диссоциации (то есть, значение Kd), к антигену. Поэтому, для определения дозы конъюгата антитело-лекарственное средство, доза может быть определена с учетом аффинности конъюгата антитело-лекарственное средство к антигену. Например, при введении конъюгата антитело-лекарственное средство настоящего изобретения человеку, может быть введено однократно или введено несколько раз приблизительно от 0,001 до 100 мг/кг с интервалом при одноразовом введении, составляющем от 1 до 180 дней.
Примеры
Далее настоящее изобретение конкретно описывается с помощью приведенных ниже примеров. Однако эти примеры не ограничивают настоящее изобретение. Более того, их ни в коей мере не следует интерпретировать в качестве ограничения. Кроме того, если специально не указано иное, то реагенты, растворители и исходные материалы, описанные в изобретении, могут быть приобретены у фирм-поставщиков и фирм-производителей.
Справочный пример 1. M30-H1-L4 антитело
Из гуманизированных антител для анти-B7-H3 антитела синтезировали известным способом антитело, состоящее из тяжелой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 20-471 в SEQ ID NO: 9, и легкой цепи, включающей аминокислотную последовательность, описанную в положениях аминокислот 21-233 в SEQ ID NO: 16, с получением гуманизированного анти-B7-H3 антитела, обозначаемого как M30-H1-L4 антитело (или просто обозначаемого как "M30-H1-L4").
Справочный пример 2. M30-H1-L4P антитело
Регулировали модификацию гликана, связанного с M30-H1-L4 антителом, полученным выше, путем дефукозилирования с помощью известного способа с получением антитела с регулированной модификацией гликана, обозначаемого как M30-H1-L4P антитело (или просто обозначаемого как "M30-H1-L4P").
Справочный пример 3. Анти-CD30 антитело
Анти-CD30 антитело получали в соответствии с методикой, приведенной в национальной публикации международной заявки на патент № 2005-506035. Его последовательность приведена в SEQ ID NO: 27 и 28.
Справочный пример 4. Анти-CD33 антитело
Анти-CD33 антитело получали в соответствии с методикой, приведенной в выложенном патенте Японии № 8-48637. Его последовательность приведена в SEQ ID NO: 29 и 30.
Справочный пример 5. Анти-CD70 антитело
Анти-CD70 антитело получали в соответствии с методикой, приведенной в национальной публикации международной заявки на патент № 2008-538292. Его последовательность приведена в SEQ ID NO: 31 и 32.
Пример 1. 4-Амино-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]-пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]бутанамид
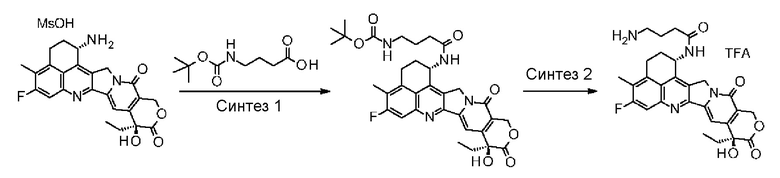
Синтез 1: Трет-бутил (4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)карбамат
4-(Трет-бутоксикарбониламино)бутановую кислоту (0,237 г, 1,13 ммоль) растворяли в дихлорметане (10 мл), добавляли N-гидроксисукцинимид (0,130 г, 1,13 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (0,216 г, 1,13 ммоль) и перемешивали в течение 1 часа. Реакционный раствор добавляли по каплям к раствору мезилата соединения (4) (0,500 г, 0,94 ммоль) и триэтиламина (0,157 мл, 1,13 ммоль) в N,N-диметилформамиде (10 мл) и перемешивали в течение 1 дня при комнатной температуре. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=8:2 (по объему)] с получением названного соединения (0,595 г, количественно).
1H-ЯМР (400 МГц, DMSO-d6) δ: 0,87 (3Н, т, J=7,2 Гц), 1,31 (9Н, с), 1,58 (1Н, т, J=7,2 Гц), 1,66 (2Н, т, J=7,2 Гц), 1,82-1,89 (2Н, м), 2,12-2,21 (3Н, м), 2,39 (3Н, с), 2,92 (2Н, т, J=6,5 Гц), 3,17 (2Н, с), 5,16 (1Н, d, J=18,8 Гц), 5,24 (1Н, д, J=18,8 Гц), 5,42 (2Н, с), 5,59-5,55 (1Н, м), 6,53 (1Н, с), 6,78 (1Н, т, J=6,3 Гц), 7,30 (1Н, с), 7,79 (1Н, д, J=11,0 Гц), 8,40 (1Н, д, J=8,6 Гц).
MS (APCI) m/z: 621 (М+Н)+.
Синтез 2: 4-Амино-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[de]-пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]бутанамид
Соединение (0,388 г, 0,61 ммоль), полученное в синтезе 1 выше, растворяли в дихлорметане (9 мл). Добавляли трифторуксусную кислоту (9 мл) и перемешивали в течение 4 часов. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-отделенный слой хлороформа:метанол:вода=7:3:1 (по объему)] с получением трифторацетата названного соединения (0,343 г, количественно). Присутствие этого соединения было подтверждено в опухоли мыши с инкорпорированным раком, которой вводили конъюгат антитело-лекарственное средство (13) или (14).
1H-ЯМР (400 МГц, DMSO-d6) δ: 0,87 (3Н, т, J=7,2 Гц), 1,79-1,92 (4Н, м), 2,10-2,17 (2Н, м), 2,27 (2Н, т, J=7,0 Гц), 2,40 (3Н, с), 2,80-2,86 (2Н, м), 3,15-3,20 (2Н, м), 5,15 (1Н, д, J=18,8 Гц), 5,26 (1Н, д, J=18,8 Гц), 5,42 (2Н, с), 5,54-5,61 (1Н, м), 6,55 (1Н, с), 7,32 (1Н, с), 7,72 (3Н, шир. с), 7,82 (1H, д, J=11,0 Гц), 8,54 (1H, д, J=8,6 Гц).
MS (APCI) m/z: 521 (M+H)+.
Пример 2. Конъюгат антитело-лекарственное средство (1)
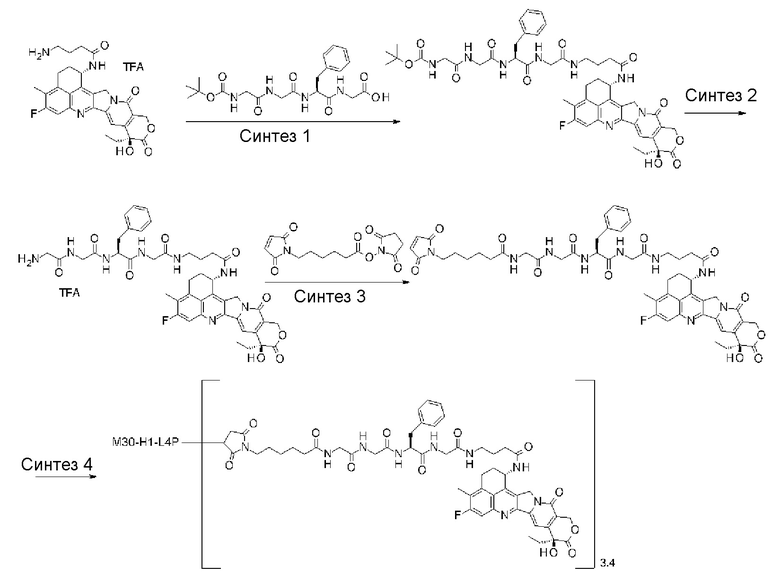
Синтез 1: N-(трет-бутоксикарбонил)глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)-глицинамид
N-(Трет-бутоксикарбонил)глицилглицил-L-фенилаланилглицин (0,081 г, 0,19 ммоль) растворяли в дихлорметане (3 мл), добавляли N-гидроксисукцинимид (0,021 г, 0,19 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (0,036 г, 0,19 ммоль) и затем перемешивали в течение 3,5 часов. Реакционный раствор добавляли по каплям к раствору соединения примера 1 (0,080 г, 0,15 ммоль) в N,N-диметилформамиде (1,5 мл) и перемешивали в течение 4 часов при комнатной температуре. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=8:2 (по объему)] с получением названного соединения (0,106 г, 73%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,36 (9H, с), 1,71 (2H, м), 1,86 (2H, т, J=7,8 Гц), 2,15-2,19 (4H, м), 2,40 (3H, с), 2,77 (1H, дд, J=12,7, 8,8 Гц), 3,02 (1H, дд, J=14,1, 4,7 Гц), 3,08-3,11 (2H, м), 3,16-3,19 (2H, м), 3,54 (2H, д, J=5,9 Гц), 3,57-3,77 (4H, м), 4,46-4,48 (1H, м), 5,16 (1H, д, J=19,2 Гц), 5,25 (1H, д, J=18,8 Гц), 5,42 (2H, с), 5,55-5,60 (1H, м), 6,53 (1H, с), 7,00 (1H, т, J=6,3 Гц), 7,17-7,26 (5H, м), 7,31 (1H, с), 7,71 (1H, т, J=5,7 Гц), 7,80 (1H, д, J=11,0 Гц), 7,92 (1H, т, J=5,7 Гц), 8,15 (1H, д, J=8,2 Гц), 8,27 (1H, т, J=5,5 Гц), 8,46 (1H, д, J=8,2 Гц).
MS (APCI) m/z: 939 (M+H)+.
Синтез 2: Глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-4-оксобутил)глицинамид трифторацетат
Соединение (1,97 г, 2,10 ммоль), полученное в синтезе 1 выше, растворяли в дихлорметане (7 мл). После добавления трифторуксусной кислоты (7 мл), перемешивали в течение 1 часа. Растворитель удаляли при пониженном давлении, и добавляли толуол для проведения азеотропной дистилляции. Полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-отделенный органический слой хлороформа:метанол:вода=7:3:1 (по объему)] с получением названного соединения (1,97 г, 99%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,71-1,73 (2H, м), 1,82-1,90 (2H, м), 2,12-2,20 (4H, м), 2,40 (3H, с), 2,75 (1H, дд, J=13,7, 9,4 Гц), 3,03-3,09 (3H, м), 3,18-3,19 (2H, м), 3,58-3,60 (2H, м), 3,64 (1H, д, J=5,9 Гц), 3,69 (1H, д, J=5,9 Гц), 3,72 (1H, д, J=5,5 Гц), 3,87 (1H, дд, J=16,8, 5,9 Гц), 4,50-4,56 (1H, м), 5,16 (1H, д, J=19,2 Гц), 5,25 (1H, д, J=18,8 Гц), 5,42 (2H, с), 5,55-5,60 (1H, м), 7,17-7,27 (5H, м), 7,32 (1H, с), 7,78-7,81 (2H, м), 7,95-7,97 (3H, м), 8,33-8,35 (2H, м), 8,48-8,51 (2H, м).
MS (APCI) m/z: 839 (M+H)+.
Синтез 3: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-4-оксобутил)глицинамид
К раствору соединения (337 мг, 0,353 ммоль), полученного в синтезе 2, в N,N-диметилформамиде (1,2 мл) добавляли триэтиламин (44,3 мл, 0,318 ммоль) и N-сукцинимидил 6-малеимидгексаноат (119,7 мг, 0,388 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=5:1 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (278,0 мг, 76%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,3 Гц), 1,12-1,22 (2H, м), 1,40-1,51 (4H, м), 1,66-1,76 (2H, м), 1,80-1,91 (2H, м), 2,05-2,21 (6H, м), 2,39 (3H, с), 2,79 (1H, дд, J=14,0, 9,8 Гц), 2,98-3,21 (5H, м), 3,55-3,77 (8H, м), 4,41-4,48 (1H, м), 5,15 (1H, д, J=18,9 Гц), 5,24 (1H, д, J=18,9 Гц), 5,40 (1H, д, J=17,1 Гц), 5,44 (1H, д, J=17,1 Гц), 5,54-5,60 (1H, м), 6,53 (1H, с), 6,99 (2H, с), 7,20-7,27 (5H, м), 7,30 (1H, с), 7,70 (1H, т, J=5,5 Гц), 7,80 (1H, д, J=11,0 Гц), 8,03 (1H, т, J=5,8 Гц), 8,08 (1H, т, J=5,5 Гц), 8,14 (1H, д, J=7,9 Гц), 8,25 (1H, т, J=6,1 Гц), 8,46 (1H, д, J=8,5 Гц).
MS (APCI) m/z: 1032 (M+H)+.
Синтез 4: Конъюгат антитело-лекарственное средство (1)
Восстановление антитела: приготавливали M30-H1-L4P антитело, полученное в справочном примере 2, с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанные в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,025 мл; 3,0 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации в течение 1 часа при 37°C.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,109 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 3 выше (0,039 мл; 4,6 эквивалентов на молекулу антитела), к описанному выше раствору при комнатной температуре, осуществляли перемешивание с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) при комнатной температуре в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем, добавляли водный раствор (0,008 мл), содержащий 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC), и перемешивали при комнатной температуре в течение еще 20 минут для прерывания реакции с фрагментом лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 13,02 мг/мл, выход антитела: 9,1 мг (73%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,4.
Пример 3. Конъюгат антитело-лекарственное средство (2)
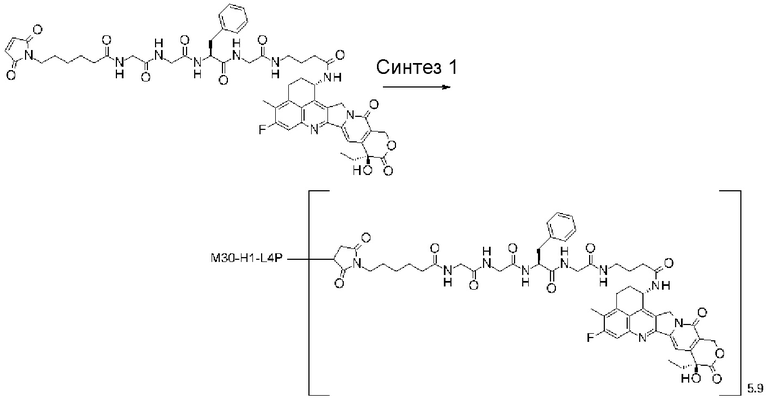
Синтез 1: Конъюгат антитело-лекарственное средство (2)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (4,0 мл) собирали в пробирку объемом 15 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,118 мл; 4,6 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,200 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации указанного выше раствора в течение 10 минут при 22°C, к нему добавляли диметилсульфоксидный раствор (0,236 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного в синтезе 3 примера 2, и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,00471 мл), содержащий 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC), и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 17,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,80 мг/мл, выход антитела: 26,1 мг (65%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,9.
Пример 4. Конъюгат антитело-лекарственное средство (3)
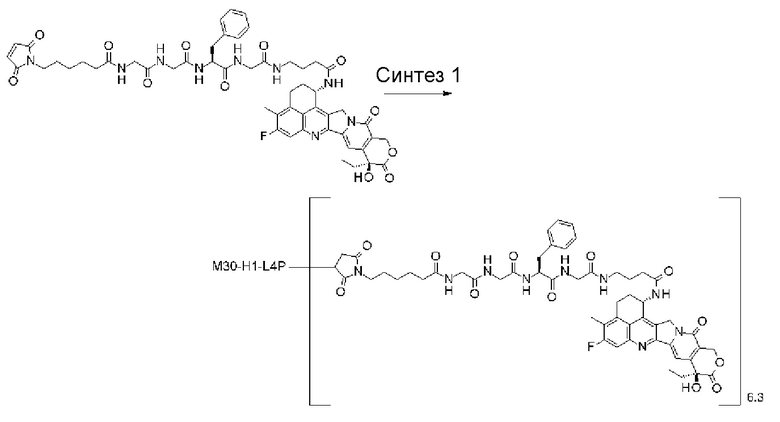
Синтез 1: Конъюгат антитело-лекарственное средство (3)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанные в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,051 мл; 6,0 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,067 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 3 примера 2 (0,085 мл; 10,0 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) при комнатной температуре в течение 60 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,013 мл), содержащий 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC), и перемешивали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,67 мг/мл, выход антитела: 10,02 мг (80%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,3.
Пример 5. Конъюгат антитело-лекарственное средство (4)
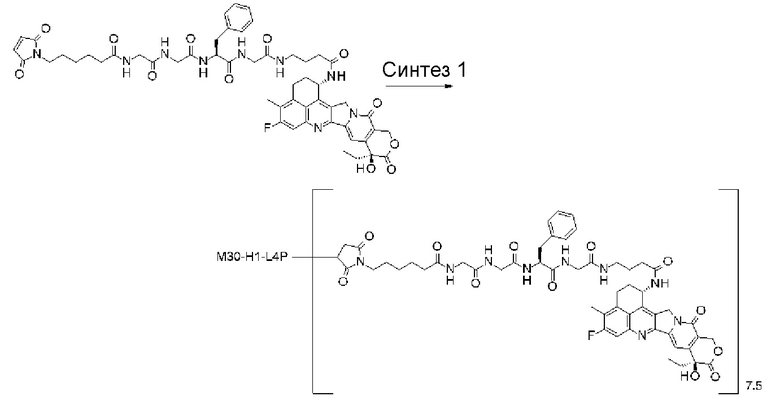
Синтез 1: Конъюгат антитело-лекарственное средство (4)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанный в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,051 мл; 6,0 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,025 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 3 примера 2 (0,127 мл; 15,0 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) при комнатной температуре в течение 60 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,019 мл), содержащий 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC), и перемешивали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,19 мг/мл, выход антитела: 7,14 мг (57%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,5.
Пример 6. Конъюгат антитело-лекарственное средство (5)
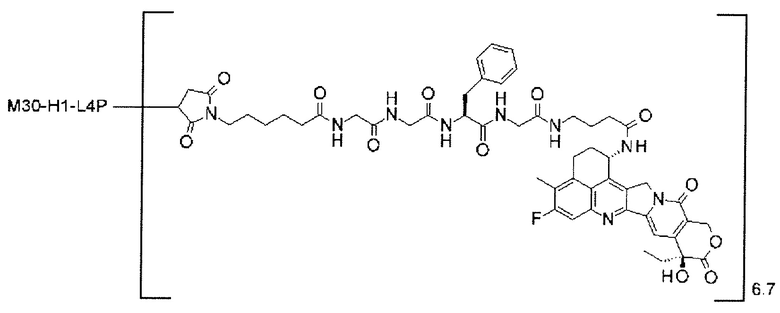
Смешивали почти все количества конъюгатов антитело-лекарственное средство, полученные в примерах 4 и 5. Раствор концентрировали с помощью общего способа A с получением названного конъюгата антитело-лекарственное средство.
Концентрация антитела: 10,0 мг/мл, выход антитела: 15,37 мг, и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,7.
Пример 7. Конъюгат антитело-лекарственное средство (6)
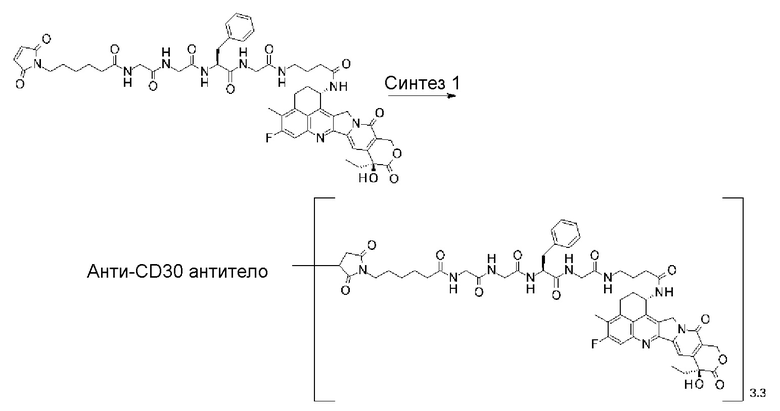
Синтез 1: Конъюгат антитело-лекарственное средство (6)
Восстановление антитела: анти-CD30 антитело, полученное в справочном примере 3, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,75 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 2 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0297 мл; 4,6 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации раствора при 22°C в течение 10 минут, к нему добавляли диметилсульфоксидный раствор (0,0593 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного в синтезе 3 примера 2, и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0119 мл; 18,4 эквивалентов на молекулу антитела), содержащий 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC), и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=270400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 0,99 мг/мл, выход антитела: 5,94 мг (59%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,3.
Пример 8. Конъюгат антитело-лекарственное средство (7)
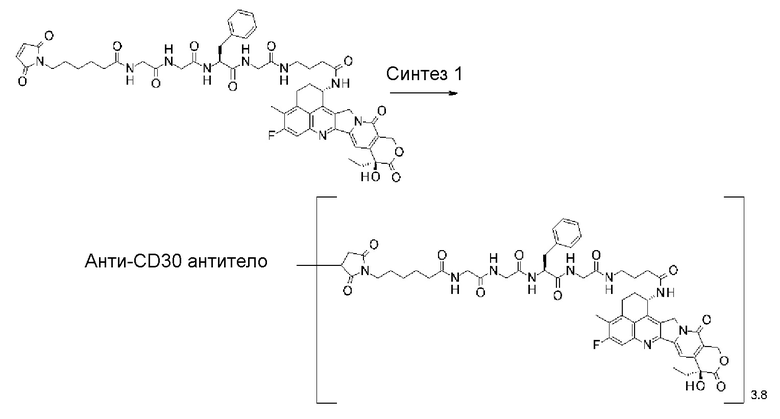
Синтез 1: Конъюгат антитело-лекарственное средство (7)
Восстановление антитела: анти-CD30 антитело, полученное в справочном примере 3, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,75) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 2 мл и добавляли к нему водный раствор 30 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0148 мл; 6,9 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации вышеуказанного раствора в течение 10 минут при 22°C, к нему добавляли диметилсульфоксидный раствор (0,0297 мл; 13,8 эквивалентов на молекулу антитела), содержащий 30 мМ соединения, полученного в синтезе 3 примера 2, и инкубировали в течение 40 минут при 22°C с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0178 мл; 27,6 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=270400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 0,99 мг/мл, выход антитела: 5,94 мг (59%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,8.
Пример 9. Конъюгат антитело-лекарственное средство (8)
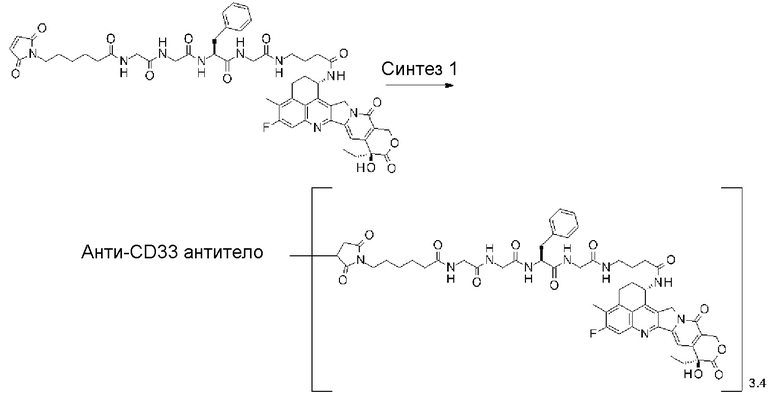
Синтез 1: Конъюгат антитело-лекарственное средство (8)
Восстановление антитела: анти-CD33 антитело, полученное в справочном примере 4, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,66) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 2 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0297 мл; 4,6 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации раствора в течение 10 минут при 22°C, к нему добавляли диметилсульфоксидный раствор (0,0593 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного в синтезе 3 примера 2, и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0119 мл; 18,4 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=256400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,06 мг/мл, выход антитела: 6,36 мг (64%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,4.
Пример 10. Конъюгат антитело-лекарственное средство (9)
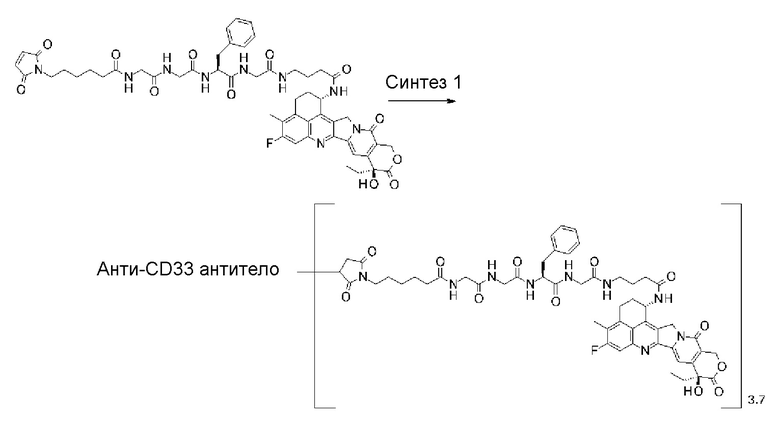
Синтез 1: Конъюгат антитело-лекарственное средство (9)
Восстановление антитела: анти-CD33 антитело, полученное в справочном примере 4, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,66) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 2 мл и добавляли к нему водный раствор 30 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0148 мл; 6,9 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации вышеуказанного раствора в течение 10 минут при 22°C, к нему добавляли диметилсульфоксидный раствор (0,0297 мл; 13,8 эквивалентов на молекулу антитела), содержащий 30 мМ соединения, полученного в синтезе 3 примера 2, и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0178 мл; 27,6 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=256400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 0,95 мг/мл, выход антитела: 5,70 мг (57%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,7.
Пример 11. Конъюгат антитело-лекарственное средство (10)
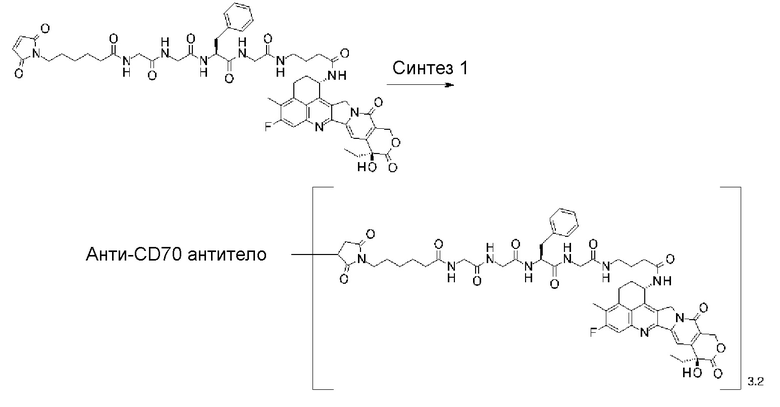
Синтез 1: Конъюгат антитело-лекарственное средство (10)
Восстановление антитела: анти-CD70 антитело, полученное в справочном примере 5, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,69) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 2 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0297 мл; 4,6 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации вышеуказанного раствора при 22°C в течение 10 минут, к нему добавляли диметилсульфоксидный раствор (0,0593 мл; 9,2 эквивалентов на молекулу антитела), содержащий 10 мМ соединения, полученного в синтезе 3 примера 2, и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0119 мл; 18,4 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=262400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,00 мг/мл, выход антитела: 6,00 мг (60%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,2.
Пример 12. Конъюгат антитело-лекарственное средство (11)
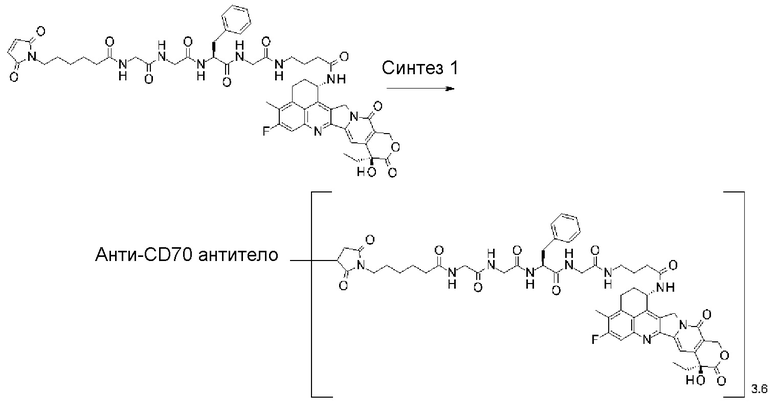
Синтез 1: Конъюгат антитело-лекарственное средство (11)
Восстановление антитела: анти-CD70 антитело, полученное в справочном примере 5, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,69) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 2 мл и добавляли к нему водный раствор 30 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0148 мл; 6,9 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации раствора при 22°C в течение 10 минут, к нему добавляли диметилсульфоксидный раствор (0,0297 мл; 13,8 эквивалентов на молекулу антитела), содержащий 30 мМ соединения, полученного в синтезе 3 примера 2, и инкубировали в течение 40 минут при 22°C с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0178 мл; 27,6 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=262400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 0,96 мг/мл, выход антитела: 5,76 мг (58%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,6.
Пример 13. Конъюгат антитело-лекарственное средство (12)
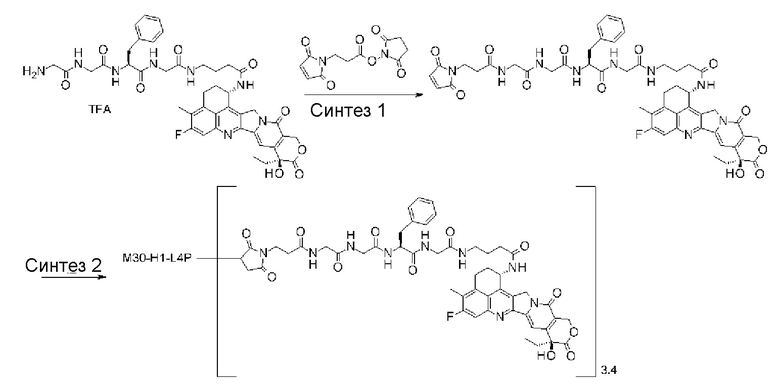
Синтез 1: N-[3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропаноил]глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-4-оксобутил)глицинамид
Соединение (80 мг, 0,084 ммоль), полученное в синтезе 2 примера 2, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя N-сукцинимидил 3-малеимидпропиоат (24,6 мг, 0,0924 ммоль) вместо N-сукцинимидил 6-малеимидгексаноата, с получением названного соединения в виде бледно-желтого твердого вещества (60,0 мг, 73%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,89 (3H, т, J=7,3 Гц), 1,70-1,78 (2H, м), 1,81-1,94 (2H, м), 2,12-2,23 (4H, м), 2,42 (3H, с), 2,81 (1H, дд, J=13,7, 9,8 Гц), 3,01-3,15 (3H, м), 3,16-3,23 (2H, м), 3,30-3,35 (1H, м), 3,58-3,71 (6H, м), 3,71-3,79 (1H, м), 4,44-4,51 (1H, м), 5,19 (1H, д, J=19,0 Гц), 5,27 (1H, д, J=19,0 Гц), 5,43 (1H, д, J=17,6 Гц), 5,47 (1H, д, J=17,6 Гц), 5,57-5,63 (1H, м), 6,56 (1H, с), 7,02 (2H, с), 7,17-7,22 (1H, м), 7,22-7,30 (5H, м), 7,34 (1H, с), 7,73 (1H, т, J=5,6 Гц), 7,83 (1H, д, J=10,7 Гц), 8,08 (1H, т, J=5,6 Гц), 8,15 (1H, д, J=7,8 Гц), 8,30 (2H, дт, J=18,7, 5,7 Гц), 8,49 (1H, д, J=8,8 Гц).
MS (APCI) m/z: 990 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (12)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 1 выше, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 4 примера 2.
Концентрация антитела: 12,16 мг/мл, выход антитела: 8,5 мг (68%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,4.
Пример 14. Конъюгат антитело-лекарственное средство (13)
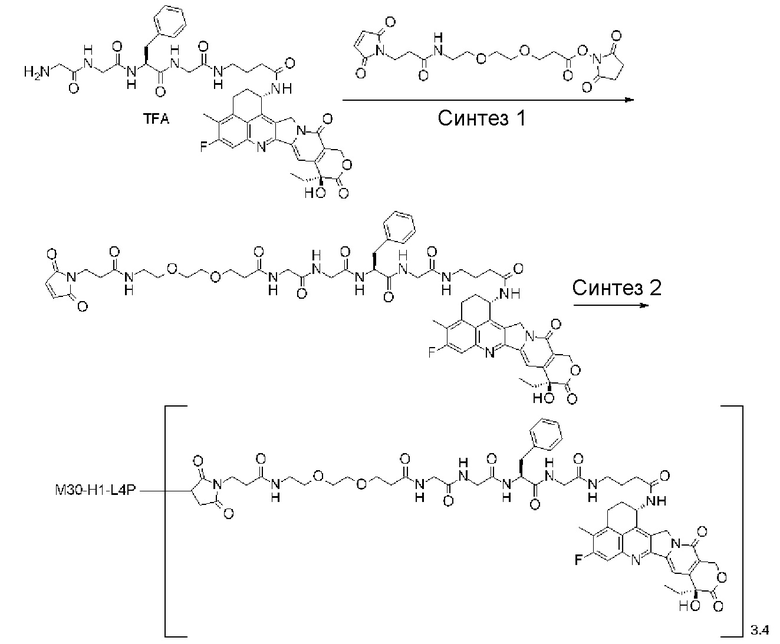
Синтез 1: N-{3-[2-(2-{[3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропаноил]амино}этокси)этокси]пропаноил}глицил-глицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
Соединение (100 мг, 0,119 ммоль), полученное в синтезе 2 примера 2, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя диизопропилэтиламин (20,8 мкл, 0,119 ммоль) вместо триэтиламина и N-сукцинимидил 3-(2-(2-(3-малеинимидпропанамид)этокси)этокси)пропаноат (50,7 мг, 0,119 ммоль) вместо N-сукцинимидил 6-малеимидгексаноата, с получением названного соединения в виде бледно-желтого твердого вещества (66,5 мг, 48%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,85 (3H, т, J=7,4 Гц), 1,65-1,74 (2H, м), 1,77-1,90 (2H, м), 2,07-2,19 (4H, м), 2,30 (2H, т, J=7,2 Гц), 2,33-2,36 (2H, м), 2,38 (3H, с), 2,76 (1H, дд, J=13,7, 9,8 Гц), 2,96-3,18 (9H, м), 3,42-3,44 (4H, м), 3,53-3,76 (10H, м), 4,43 (1H, тд, J=8,6, 4,7 Гц), 5,14 (1H, д, J=18,8 Гц), 5,23 (1H, д, J=18,8 Гц), 5,38 (1H, д, J=17,2 Гц), 5,42 (1H, д, J=17,2 Гц), 5,52-5,58 (1H, м), 6,52 (1H, с), 6,98 (2H, с), 7,12-7,17 (1H, м), 7,18-7,25 (4H, м), 7,29 (1H, с), 7,69 (1H, т, J=5,5 Гц), 7,78 (1H, д, J=11,3 Гц), 7,98-8,03 (2H, м), 8,11 (1H, д, J=7,8 Гц), 8,16 (1H, т, J=5,7 Гц), 8,23 (1H, т, J=5,9 Гц), 8,44 (1H, д, J=9,0 Гц).
MS (APCI) m/z: 1149 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (13)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 1, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 4 примера 2.
Концентрация антитела: 12,76 мг/мл, выход антитела: 8,9 мг (71%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,4.
Пример 15. Конъюгат антитело-лекарственное средство (14)
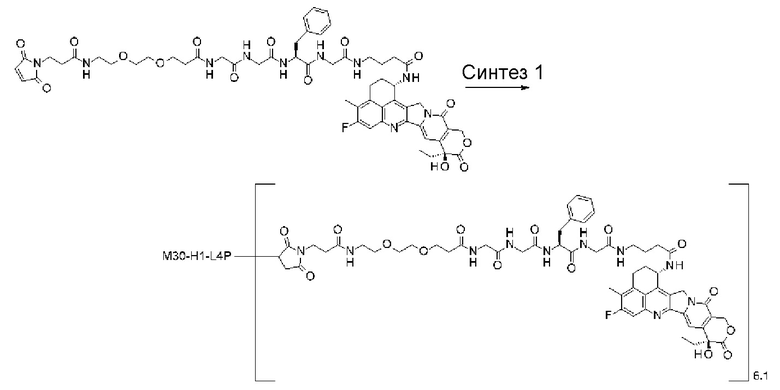
Синтез 1: Конъюгат антитело-лекарственное средство (14)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 1 примера 14, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 1 примера 4.
Концентрация антитела: 1,60 мг/мл, выход антитела: 9,60 мг (77%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,1.
Пример 16. Конъюгат антитело-лекарственное средство (15)
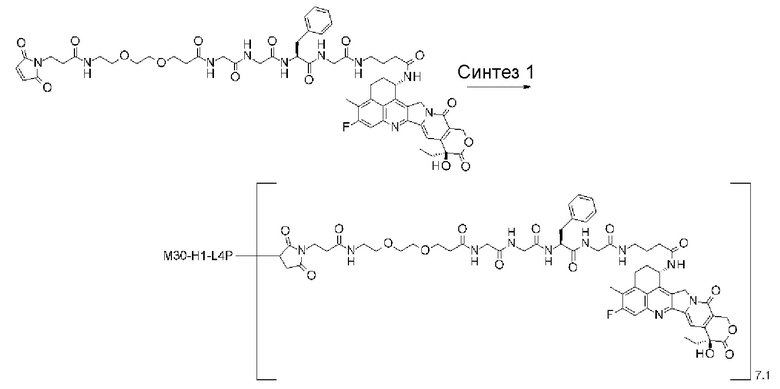
Синтез 1: Конъюгат антитело-лекарственное средство (15)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 1 примера 14, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 1 примера 5.
Концентрация антитела: 1,64 мг/мл, выход антитела: 9,84 мг (79%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,1.
Пример 17. Конъюгат антитело-лекарственное средство (16)
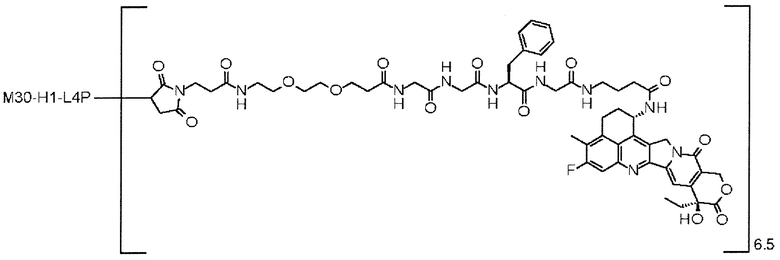
Смешивали практически все количества конъюгатов антитело-лекарственное средство, полученных в примерах 15 и 16. Раствор концентрировали с помощью общего способа A с получением названного конъюгата антитело-лекарственное средство.
Концентрация антитела: 10,0 мг/мл, выход антитела: 17,30 мг, и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,5.
Пример 18. Конъюгат антитело-лекарственное средство (17)
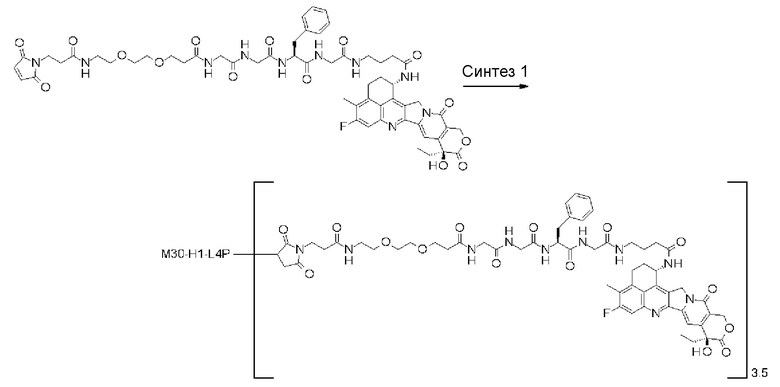
Синтез 1: Конъюгат антитело-лекарственное средство (17)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (100 мл, 1 г антитела) помещали в колбу объемом 250 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (2,43 мл; 3,6 эквивалентов на молекулу антитела) и затем водный раствор 1 М вторичного кислого фосфата калия (5 мл). После подтверждения того, что раствор имеет значение рН около 7,4 с помощью рН-метра, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (2,14 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (3,51 мл; 5,2 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, его перемешивали с помощью мешалки на водяной бане при 15°C в течение 130 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,547 мл) 100 мМ NAC и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: Упомянутый выше раствор подвергали ультрафильтрационной очистке, используя устройство для ультрафильтрации, состоящее из ультрафильтрационной мембраны (фирмы Merck Japan, Pellicon XL Cassette, Biomax 50 KDa), трубного насоса (фирмы Cole-Parmer International, MasterFlex Pump model 77521-40, Pump Head model 7518-00), и трубки (фирмы Cole-Parmer International, MasterFlex Tube L/S16). В частности, при добавлении к реакционному раствору по каплям ABS (суммарно 800 мл) в качестве буферного раствора для очистки, проводили ультрафильтрационную очистку для удаления неконъюгированных фрагментов лекарственное средство-линкер и других низкомолекулярных реагентов, заменяя также ABS на буферный раствор и затем концентрируя раствор, с получением около 70 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 14,5 мг/мл, выход антитела: 1,0 г (около 100%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,5.
Пример 19. Конъюгат антитело-лекарственное средство (18)
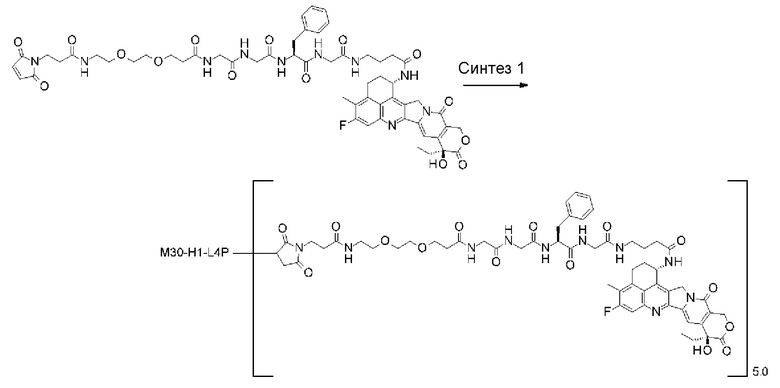
Синтез 1: Конъюгат антитело-лекарственное средство (18)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (5 мл, 50 мг антитела) помещали в пробирку объемом 15 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,135 мл; 4 эквивалентов на молекулу антитела). После подтверждения того, что раствор имеет значение рН около 7,4 с помощью рН-метра, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (0,064 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,219 мл; 6,5 эквивалентов на молекулу антитела) к упомянутому выше раствору, его инкубировали на водяной бане при 15°C в течение 90 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,033 мл; 9,8 эквивалентов на молекулу антитела) 100 мМ NAC и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 19 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 2,17 мг/мл, выход антитела: 41 мг (82%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,0.
Пример 20. Конъюгат антитело-лекарственное средство (19)
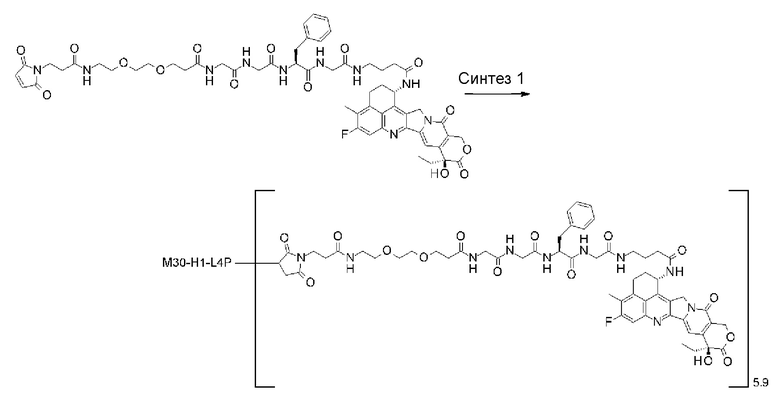
Синтез 1: Конъюгат антитело-лекарственное средство (19)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (4 мл, 40 мг антитела) помещали в пробирку объемом 15 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,140 мл; 5,2 эквивалентов на молекулу антитела). После подтверждения того, что раствор имеет значение рН около 7,4 с помощью рН-метра, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,232 мл; 8,6 эквивалентов на молекулу антитела), к упомянутому выше раствору, его инкубировали на водяной бане при 15°C в течение 90 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,035 мл; 12,9 эквивалентов на молекулу антитела) 100 мМ NAC и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 13 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 2,36 мг/мл, выход антитела: 31 мг (77%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,9.
Пример 21. Конъюгат антитело-лекарственное средство (20)
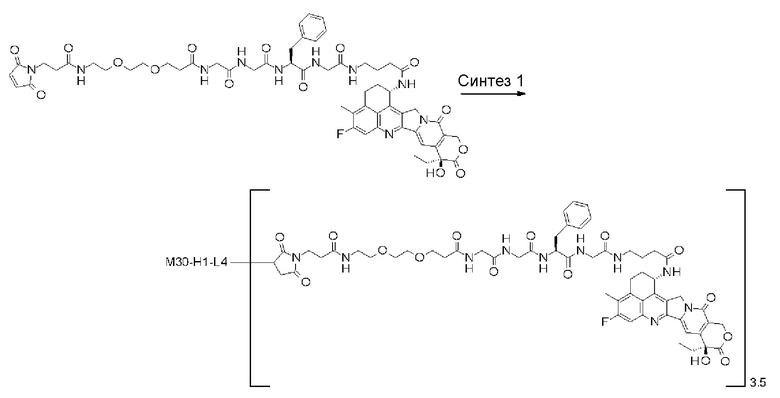
Синтез 1: Конъюгат антитело-лекарственное средство (20)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (1,25 мл, 12,5 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0287 мл; 3,4 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (0,0267 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,0439 мл; 5,2 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, его инкубировали на водяной бане при 15°C в течение 1 часа с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0066 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 10,0 мг/мл, выход антитела: 8,7 мг (70%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,5.
Пример 22. Конъюгат антитело-лекарственное средство (21)
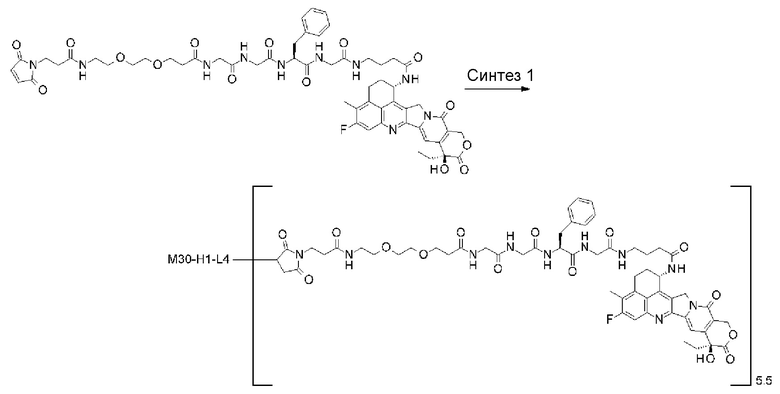
Синтез 1: Конъюгат антитело-лекарственное средство (21)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (1,25 мл, 12,5 мг антитело) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0439 мл; 5,2 эквивалентов на молекулу антитела) (0,0287 мл; 3,4 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащий 10 мМ соединения, полученного в синтезе 1 примера 14 (0,0726 мл; 8,6 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, его инкубировали на водяной бане при 15°C в течение 1 часа с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,011 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 10,0 мг/мл, выход антитела: 8,3 мг (66%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,5.
Пример 23. Конъюгат антитело-лекарственное средство (22)
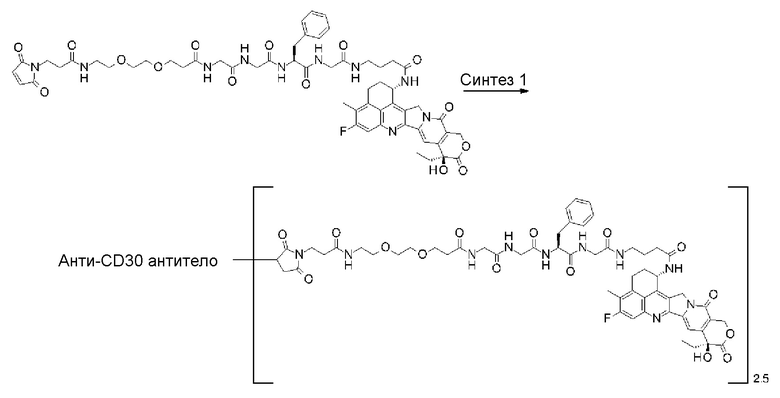
Синтез 1: Конъюгат антитело-лекарственное средство (22)
Восстановление антитела: анти-CD30 антитело, полученное в справочном примере 3, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,75 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0065 мл; 2,5 эквивалентов на молекулу антитела). Восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (0,0098 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,0116 мл; 4,5 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0017 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=270400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 0,86 мг/мл, выход антитела: 2,2 мг (54%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 2,5.
Пример 24. Конъюгат антитело-лекарственное средство (23)
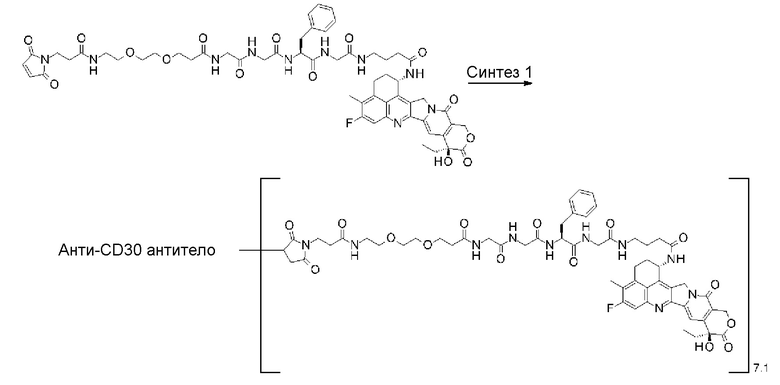
Синтез 1: Конъюгат антитело-лекарственное средство (23)
Восстановление антитела: анти-CD30 антитело, полученное в справочном примере 3, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,75 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,35 мл, 3,5 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0113 мл; 5 эквивалентов на молекулу антитела). Восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,0204 мл; 9 эквивалентов на молекулу антитела), и пропиленгликоля (фирмы Kanto Chemical Co., Inc., 0,18 мл) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0031 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=270400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 0,41 мг/мл, выход антитела: 1,0 мг (29%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,1.
Пример 25. Конъюгат антитело-лекарственное средство (24)
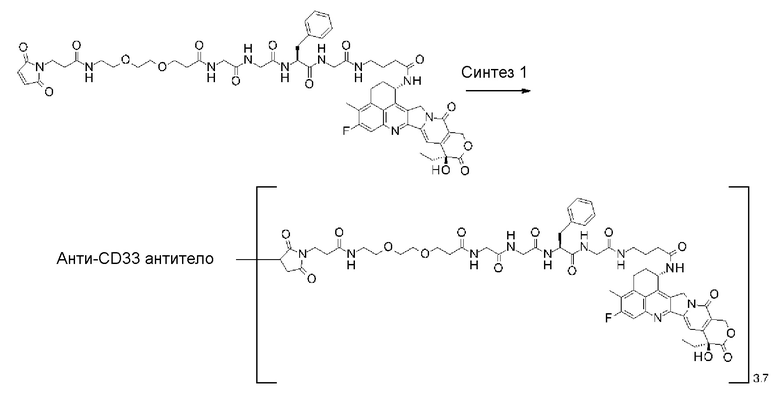
Синтез 1: Конъюгат антитело-лекарственное средство (24)
Восстановление антитела: анти-CD33 антитело, полученное в справочном примере 4, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,66 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0065 мл; 2,5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0058 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (0,0101 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,0116 мл; 4,5 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0017 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=256400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,25 мг/мл, выход антитела: 3,1 мг (78%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,7.
Пример 26. Конъюгат антитело-лекарственное средство (25)
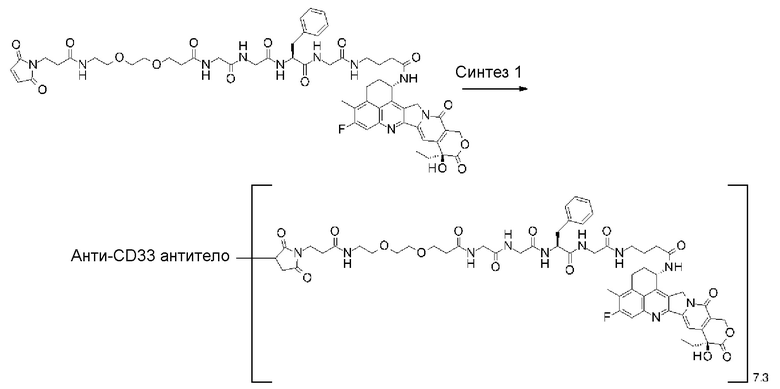
Синтез 1: Конъюгат антитело-лекарственное средство (25)
Восстановление антитела: анти-CD33 антитело, полученное в справочном примере 4, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,66 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0129 мл; 5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,006 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,0233 мл; 9 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0035 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=256400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,17 мг/мл, выход антитела: 2,9 мг (73%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,3.
Пример 27. Конъюгат антитело-лекарственное средство (26)
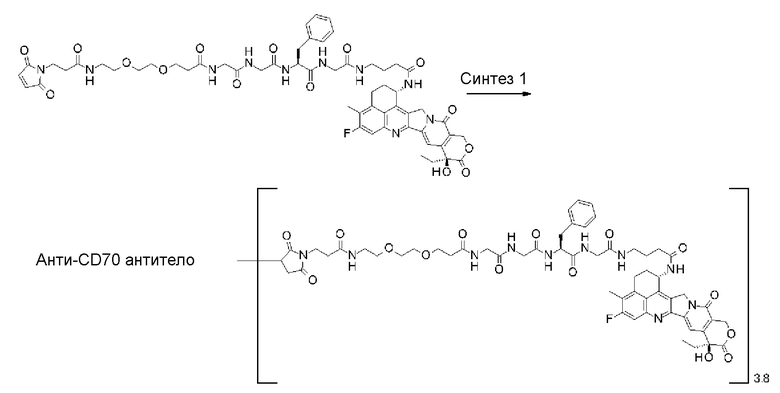
Синтез 1: Конъюгат антитело-лекарственное средство (26)
Восстановление антитела: анти-CD70 антитело, полученное в справочном примере 5, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,69 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0065 мл; 2,5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0058 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (0,0101 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 14 (0,0116 мл; 4,5 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0017 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=262400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,14 мг/мл, выход антитела: 2,9 мг (71%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,8.
Пример 28. Конъюгат антитело-лекарственное средство (27)
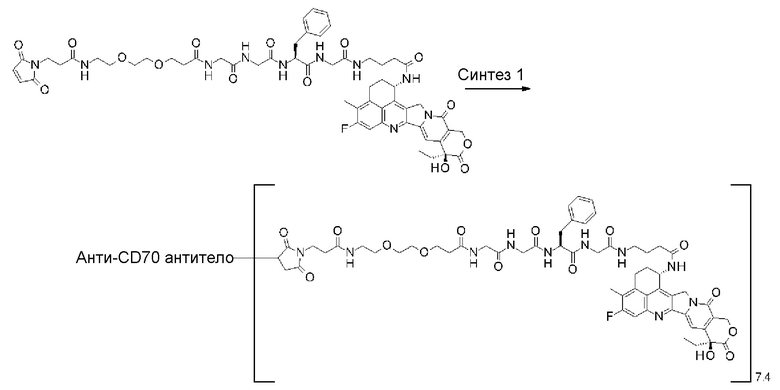
Синтез 1: Конъюгат антитело-лекарственное средство (27)
Восстановление антитела: анти-CD70 антитело, полученное в справочном примере 5, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,69 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0129 мл; 5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,006 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора (0,0233 мл; 9 эквивалентов на молекулу антитела) содержащего 10 мМ соединения, полученного в синтезе 1 примера 14, к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0035 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=262400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=4964 (измеренное значение) и εD,370=18982 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,13 мг/мл, выход антитела: 2,8 мг (71%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,4.
Пример 29. Конъюгат антитело-лекарственное средство (28)
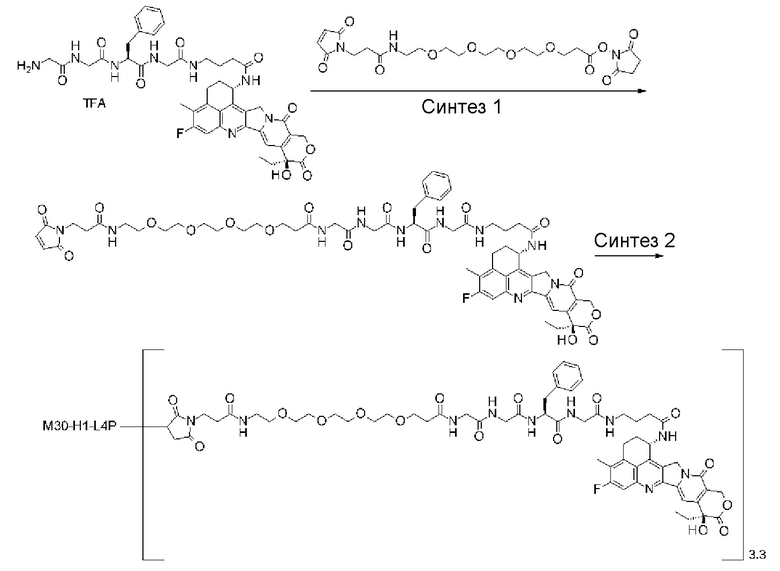
Синтез 1: N-[19-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-17-оксо-4,7,10,13-тетраоксо-16-азанонадекан-1-оил]глицил-глицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
Соединение (90 мг, 0,107 ммоль), полученное в синтезе 2 примера 2, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя диизопропилэтиламин (18,7 мкл, 0,107 ммоль) вместо триэтиламина и N-сукцинимидил 1-малеинимид-3-оксо-7,10,13,16-тетраокса-4-азанонадекан-19-оат (55,1 мг, 0,107 ммоль) вместо N-сукцинимидил 6-малеимидгексаноата с получением названного соединения в виде бледно-желтого твердого вещества (50 мг, 37%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,85 (3H, т, J=7,2 Гц), 1,64-1,74 (2H, м), 1,77-1,90 (2H, м), 2,06-2,19 (4H, м), 2,27-2,32 (2H, м), 2,33-2,37 (2H, м), 2,38 (3H, с), 2,72-2,80 (3H, м), 2,96-3,19 (6H, м), 3,39-3,48 (10H, м), 3,52-3,75 (10H, м), 4,39-4,48 (1H, м), 5,14 (1H, д, J=18,8 Гц), 5,23 (1H, д, J=18,8 Гц), 5,38 (1H, д, J=17,0 Гц), 5,42 (1H, д, J=17,0 Гц), 5,52-5,58 (1H, м), 6,52 (1H, с), 6,98 (1H, с), 7,13-7,24 (5H, м), 7,29 (1H, с), 7,69 (1H, т, J=5,5 Гц), 7,78 (1H, д, J=10,9 Гц), 7,98-8,03 (2H, м), 8,10 (1H, д, J=7,8 Гц), 8,16 (1H, т, J=5,7 Гц), 8,23 (1H, т, J=5,7 Гц), 8,44 (1H, д, J=8,6 Гц).
MS (APCI) m/z: 1237 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (28)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанный в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,025 мл; 3,0 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,102 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 1 (0,047 мл; 5,5 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 40 минут с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,009 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и перемешивали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 13,60 мг/мл, выход антитела: 9,5 мг (76%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,3.
Пример 30. Конъюгат антитело-лекарственное средство (29)
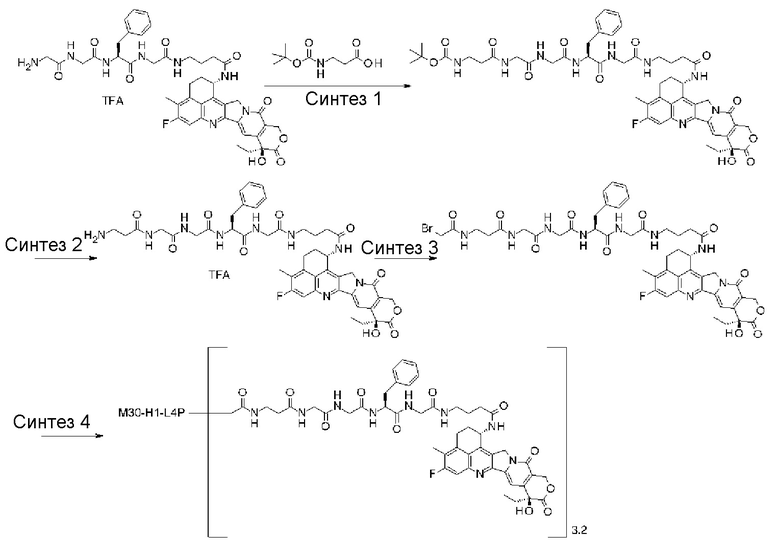
Синтез 1: N-(трет-бутоксикарбонил)-β-аланилглицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
Соединение (0,839 г, 1,00 ммоль), полученное в синтезе 2 примера 2, подвергали взаимодействию таким же образом, как в синтезе 1 примера 1, используя N-(трет-бутоксикарбонил)-β-аланин вместо 4-(трет-бутоксикарбониламино)бутановой кислоты. Полученный неочищенный продукт использовали в следующем синтезе без проведения очистки.
Синтез 2: β-Аланилглицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]-индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
Полученный неочищенный продукт в синтез 1 подвергали взаимодействию таким же образом, как в синтезе 2 примера 2, с получением названного соединения в виде бледно-желтого твердого вещества (0,610 г, 67%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,67-1,77 (2H, м), 1,79-1,92 (2H, м), 2,09-2,22 (4H, м), 2,40 (3H, с), 2,46-2,55 (2H, м), 2,82-2,73 (1H, м), 2,95-3,13 (5H, м), 3,14-3,21 (2H, м), 3,55-3,80 (6H, м), 4,44-4,52 (1H, м), 5,20 (2H, дд, J=35,0, 19,0 Гц), 5,42 (2H, с), 5,53-5,60 (1H, м), 6,54 (1H, с), 7,14-7,28 (5H, м), 7,31 (1H, с), 7,67 (2H, шир.с), 7,72-7,78 (1H, м), 7,80 (1H, д, J=11,0 Гц), 8,10-8,17 (2H, м), 8,29 (1H, т, J=5,9 Гц), 8,42 (1H, т, J=5,7 Гц), 8,47 (1H, д, J=8,6 Гц).
Синтез 3: N-(бромацетил)-β-аланилглицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
К дихлорметановому (4,5 мл) раствору 2-бромуксусной кислоты (96,3 мг, 0,693 ммоль) добавляли N-гидроксисукцинимид (79,7 мг, 0,693 ммоль) и 1,3-диизопропилкарбодиимид (0,107 мл, 0,693 ммоль) и перемешивали при комнатной температуре. Реакционный раствор добавляли к раствору соединения (473 мг, 0,462 ммоль), полученное в синтезе 2 выше, и триэтиламина (0,154 мл, 1,11 ммоль) в N,N-диметилформамиде (4,5 мл), при 0°C и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор очищали колоночной хроматографией на силикагеле [растворитель для элюирования: хлороформ-хлороформ:метанол=85:15 (по объему)]. Полученное твердое вещество промывали смешанным растворителем хлороформ:метанол:диэтиловый эфир с получением названного соединения в виде бледно-желтого твердого вещества (191 мг, 40%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,67-1,77 (2H, м), 1,79-1,92 (2H, м), 2,08-2,22 (4H, м), 2,33 (2H, т, J=7,0 Гц), 2,40 (3H, с), 2,74-2,83 (1H, м), 2,99-3,12 (3H, м), 3,14-3,21 (2H, м), 3,24-3,30 (2H, м), 3,56-3,77 (6H, м), 3,82 (2H, с), 4,41-4,51 (1H, м), 5,20 (2H, кв, J=18,9 Гц), 5,42 (2H, с), 5,54-5,60 (1H, м), 6,54 (1H, с), 7,15-7,27 (5H, м), 7,31 (1H, с), 7,69-7,74 (1H, м), 7,80 (1H, д, J=10,9 Гц), 8,06 (1H, т, J=5,7 Гц), 8,13 (1H, д, J=7,8 Гц), 8,21-8,34 (3H, м), 8,46 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 1030, 1032 (M+H)+.
Синтез 4: Конъюгат антитело-лекарственное средство (29)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанный в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,025 мл; 3,0 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,09 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 3 (0,059 мл; 7,0 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 40 минут с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,009 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и перемешивали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 13,9 мг/мл, выход антитела: 9,7 мг (78%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,2.
Пример 31. Конъюгат антитело-лекарственное средство (30)
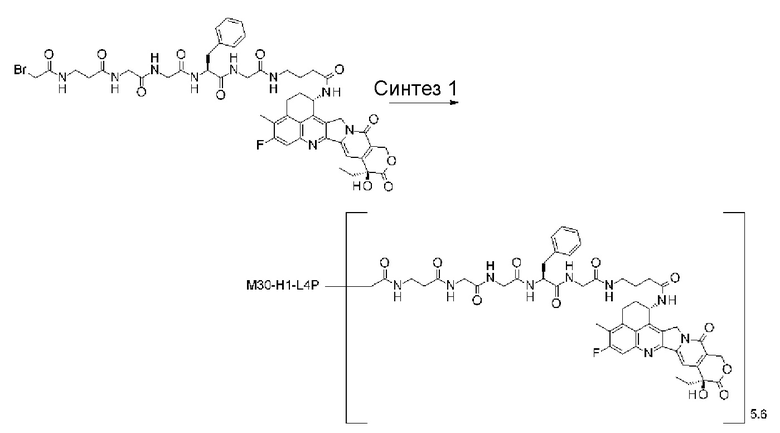
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 3 примера 30, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 1 примера 4.
Концентрация антитела: 1,94 мг/мл, выход антитела: 11,64 мг (93%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,6.
Пример 32. Конъюгат антитело-лекарственное средство (31)
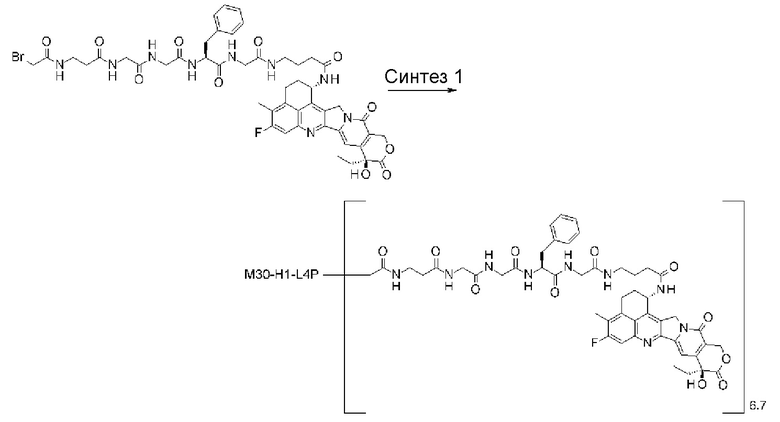
Синтез 1: Конъюгат антитело-лекарственное средство (31)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 3 примера 30, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 1 примера 5.
Концентрация антитела: 1,90 мг/мл, выход антитела: 11,40 мг (91%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,7.
Пример 33. Конъюгат антитело-лекарственное средство (32)
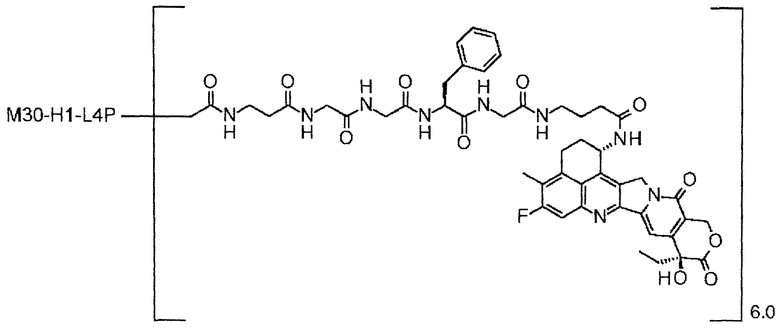
Смешивали практически все количества конъюгатов антитело-лекарственное средство, полученных в примерах 31 и 32, и раствор концентрировали с помощью общего способа A с получением названного конъюгата антитело-лекарственное средство.
Концентрация антитела: 10,0 мг/мл, выход антитела: 21,06 мг, и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,0.
Пример 34. Конъюгат антитело-лекарственное средство (33)
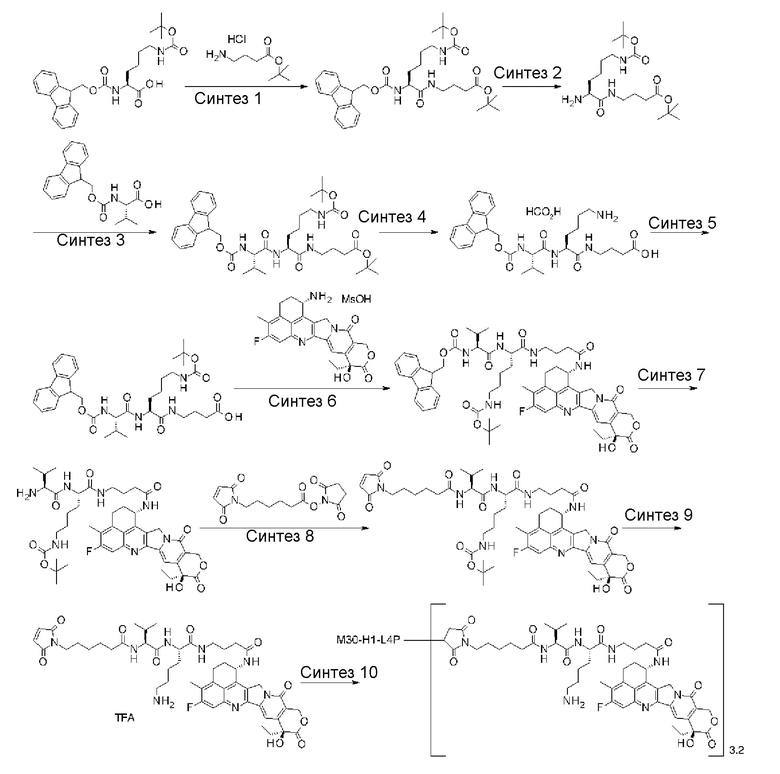
Синтез 1: Трет-бутил 4-({N6-(трет-бутоксикарбонил)-N2-[(9H-флуорен-9-илметокси)карбонил]-L-лизил}амино)бутаноат
К раствор Nε-(трет-бутоксикарбонил)-Nα-[(9H-флуорен-9-илметокси)карбонил]-L-лизина (1,00 г, 2,14 ммоль), N-гидроксисукцинимида (0,370 г, 3,20 ммоль) и гидрохлориду трет-бутилового эфира 4-аминобутановой кислоты (0,830 г, 4,27 ммоль) в N,N-диметилформамиде (10,0 мл) добавляли 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (0,610 г, 3,20 ммоль) и N,N-диизопропилэтиламин (0,410 мл, 2,35 ммоль) и перемешивали при комнатной температуре в течение 3 дней. Реакционный раствор разбавляли этилацетатом и промывали водным раствором 10% лимонной кислоты и насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, и затем органический слой сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением названного соединения в виде бесцветного твердого вещества (1,35 г, количественно).
1H-ЯМР (400 MГц, DMSO-d6) δ: 1,14-1,42 (4H, м), 1,36 (9H, с), 1,37 (9H, с), 1,48-1,67 (4H, м), 2,18 (2H, т, J=7,6 Гц), 2,84-2,93 (2H, м), 2,99-3,11 (2H, м), 3,84-3,94 (1H, м), 4,18-4,30 (3H, м), 6,76 (1H, т, J=5,4 Гц), 7,33 (2H, т, J=7,3 Гц), 7,39-7,45 (3H, м), 7,73 (2H, дд, J=7,3, 2,7 Гц), 7,85-7,92 (3H, м).
Синтез 2: Трет-бутил 4-{[N6-(трет-бутоксикарбонил)-L-лизил]амино}бутаноат
К раствору соединения (1,35 г, 2,22 ммоль), полученного в синтезе 1, в N,N-диметилформамиде (8,00 мл), добавляли пиперидин (2,00 мл) и перемешивали в течение 1,5 часов при комнатной температуре. Растворитель удаляли при пониженном давлении с получением смеси, содержащей названное соединение. Смесь использовали для следующей реакции без проведения дополнительной очистки.
Синтез 3: N-[(9H-флуорен-9-илметокси)карбонил]-L-валил-N6-(трет-бутоксикарбонил)-N-(4-трет-бутокси-4-оксобутил)-L-лизинамид
К раствору смеси (2,22 ммоль), полученной в синтезе 2 выше, в N,N-диметилформамиде (30,0 мл) добавляли N-[(9H-флуорен-9-илметокси)карбонил]-L-валин (1,13 г, 3,32 ммоль), N-гидроксисукцинимид (0,310 г, 2,66 ммоль) и 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (0,550 г, 2,88 ммоль) и перемешивали при комнатной температуре в течение 18 часов. Реакционный раствор разбавляли этилацетатом и промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, и затем органический слой сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=9:1 (по объему)] с получением названного соединения в виде бесцветного твердого вещества (0,363 г, 23%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,84 (6H, т, J=6,0 Гц), 1,12-1,64 (8H, м), 1,34 (9H, с), 1,38 (9H, с), 1,90-2,04 (1H, м), 2,17 (2H, т, J=7,3 Гц), 2,79-2,90 (2H, м), 2,99-3,09 (2H, м), 3,83-3,91 (1H, м), 4,08-4,44 (4H, м), 6,71 (1H, т, J=5,4 Гц), 7,32 (2H, т, J=7,3 Гц), 7,42 (3H, т, J=7,3 Гц), 7,74 (2H, т, J=7,0 Гц), 7,85-7,91 (4H, м).
MS (ESI) m/z: 709 (M+H)+.
Синтез 4: N-[(9H-флуорен-9-илметокси)карбонил]-L-валил-N-(3-карбоксипропил)-L-лизинамида формиат
К соединению (0,363 мг, 0,512 ммоль), полученному в синтезе 3 выше, добавляли муравьиную кислоту (10,0 мл) и перемешивали при комнатной температуре в течение 4 часов. Растворитель удаляли при пониженном давлении с получением названного соединения. Соединение использовали для следующей реакции без проведения дополнительной очистки.
Синтез 5: N-[(9H-флуорен-9-илметокси)карбонил]-L-валил-N6-(трет-бутоксикарбонил)-N-(3-карбоксипропил)-L-лизинамид
К суспензии соединения (0,512 ммоль), полученного в синтезе 4 выше, в 1,4-диоксане (5,00 мл) добавляли насыщенный водный раствор гидрокарбоната натрия (20,0 мл) и дитрет-бутилдикарбонат (0,178 мл, 0,769 ммоль) и перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор разбавляли этилацетатом и промывали водным раствором 10% лимонной кислоты и насыщенным солевым раствором, и затем органический слой сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением названного соединения в виде бесцветного твердого вещества (0,295 г, 88%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,84 (6H, т, J=6,7 Гц), 1,13-1,39 (4H, м), 1,35 (9H, с), 1,48-1,62 (4H, м), 1,91-2,04 (1H, м), 2,20 (2H, т, J=7,3 Гц), 2,80-2,89 (2H, м), 2,99-3,11 (2H, м), 3,87 (1H, дд, J=8,5, 6,7 Гц), 4,06-4,35 (4H, м), 6,71 (1H, т, J=6,0 Гц), 7,32 (2H, т, J=7,6 Гц), 7,39-7,46 (3H, м), 7,74 (2H, т, J=7,6 Гц), 7,83-7,94 (4H, м).
MS (ESI) m/z: 653 (M+H)+.
Синтез 6: N-[(9H-флуорен-9-илметокси)карбонил]-L-валил-N6-(трет-бутоксикарбонил)-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)-L-лизинамид
Мезилат соединения (4) (0,240 г, 0,452 ммоль) подвергали взаимодействию таким же образом, как в синтезе 1 примера 1, используя соединение (0,295 г, 0,452 ммоль), полученное в синтезе 5 выше, вместо 4-(трет-бутоксикарбониламино)бутановой кислоты с получением названного соединения в виде бледно-оранжевого твердого вещества (0,208 г, 43%).
MS (ESI) m/z: 1071 (M+H)+.
Синтез 7: L-Валил-N6-(трет-бутоксикарбонил)-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-4-оксобутил)-L-лизинамид
Соединение (0,208 г, 0,194 ммоль), полученное в синтезе 6 выше, подвергали взаимодействию таким же образом, как в синтезе 2, с получением смеси, содержащей названное соединение. Смесь использовали для следующей реакции без проведения дополнительной очистки.
Синтез 8: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]-L-валил-N6-(трет-бутоксикарбонил)-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-4-оксобутил)-L-лизинамид
Смесь (0,194 ммоль), полученную в синтезе 7 выше, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, с получением названного соединения в виде бледно-желтого твердого вещества (0,133 г, 56%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,77 (6H, т, J=5,7 Гц), 0,87 (3H, т, J=7,3 Гц), 1,14-1,71 (10H, м), 1,35 (9H, с), 1,77-1,95 (3H, м), 2,02-2,23 (7H, м), 2,40 (3H, с), 2,84 (3H, кв, J=6,4 Гц), 3,05 (2H, д, J=6,7 Гц), 3,17 (2H, с), 3,26-3,39 (3H, м), 4,01-4,16 (2H, м), 5,15 (1H, д, J=18,7 Гц), 5,24 (1H, д, J=18,7 Гц), 5,36-5,48 (2H, м), 5,51-5,60 (1H, м), 6,52 (1H, с), 6,72 (1H, т, J=6,0 Гц), 6,99 (2H, с), 7,31 (1H, с), 7,71-7,85 (5H, м), 8,41 (1H, д, J=9,1 Гц).
MS (ESI) m/z: 1041 (M+H)+.
Синтез 9: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]-L-валил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)-L-лизинамид трифторацетат
К раствору соединения (0,110 мг, 0,106 ммоль), полученного в синтезе 8 выше, в дихлорметане (10,0 мл) добавляли трифторуксусную кислоту (4,00 мл) и перемешивали в течение 5 часов при комнатной температуре. Растворитель удаляли при пониженном давлении с получением названного соединения в виде бледно-желтого твердого вещества (70,0 мг, 64%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,76-0,81 (6H, м), 0,87 (3H, т, J=7,3 Гц), 1,12-1,31 (4H, м), 1,39-1,56 (8H, м), 1,57-1,74 (3H, м), 1,79-1,96 (3H, м), 2,06-2,18 (7H, м), 2,40 (3H, с), 2,70-2,80 (2H, м), 3,01-3,10 (2H, м), 3,13-3,22 (2H, м), 4,04 (1H, т, J=7,6 Гц), 4,10-4,20 (1H, м), 5,15 (1H, д, J=18,7 Гц), 5,24 (1H, д, J=18,7 Гц), 5,36-5,47 (2H, м), 5,52-5,60 (1H, м), 6,53 (1H, с), 7,00 (2H, с), 7,32 (1H, с), 7,61 (3H, шир.с), 7,75-7,88 (4H, м), 8,43 (1H, д, J=8,5 Гц).
MS (ESI) m/z: 941 (M+H)+.
Синтез 10: Конъюгат антитело-лекарственное средство (33)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 9 выше, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 2 примера 29.
Концентрация антитела: 12,0 мг/мл, выход антитела: 8,4 мг (67%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,2.
Пример 35. Конъюгат антитело-лекарственное средство (34)
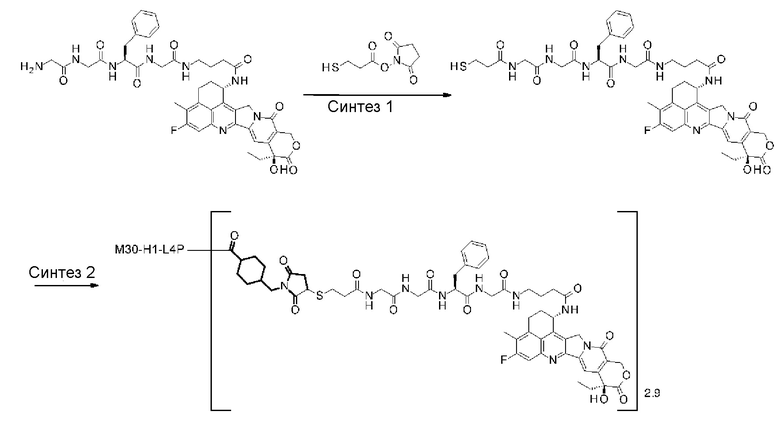
Синтез 1: N-(3-сульфанилпропаноил)глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-4-оксобутил)глицинамид
Соединение (84,0 мг, 0,100 ммоль), полученное в синтезе 2 примера 2, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя N-сукцинимидил 3-меркаптопропионат вместо N-сукцинимидил 6-малеимидгексаноата, с получением названного соединения в виде бледно-желтого твердого вещества (61,2 мг, 66%).
1H-ЯМР (DMSO-D6) δ: 0,87 (3H, т, J=7,4 Гц), 1,77-1,66 (2H, м), 1,79-1,92 (2H, м), 2,07-2,24 (4H, м), 2,31-2,47 (3H, м), 2,40 (3H, с), 2,59-2,69 (2H, м), 2,78 (1H, дд, J=13,7, 9,8 Гц), 2,98-3,13 (3H, м), 3,14-3,23 (2H, м), 3,54-3,79 (6H, м), 4,40-4,50 (1H, м), 5,20 (2H, дд, J=36,8, 19,2 Гц), 5,36-5,47 (2H, м), 5,52-5,63 (1H, м), 6,54 (1H, с), 7,14-7,28 (5H, м), 7,31 (1H, с), 7,68-7,74 (1H, м), 7,80 (1H, д, J=10,9 Гц), 8,03-8,09 (1H, м), 8,13 (1H, д, J=7,8 Гц), 8,19-8,29 (2H, м), 8,46 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 927 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (34)
Дериватизация антитела с помощью SMCC: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 20 мг/мл путем замены среды на PBS6.5/EDTA, используя общий способ C-2 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1). Раствор (0,25 мл) помещали в пробирку объемом 1,5 мл и добавляли к нему раствор (0,0063 мл; что соответствует приблизительно 2,55 эквивалентам на молекулу антитела), содержащий 27,6 мМ сукцинимидил-4-(N-малеимидoметил)циклогексан-1-карбоксилата (SMCC, Thermo Fisher Scientific Inc.), в DMSO при комнатной температуре и подвергали взаимодействию при комнатной температуре в течение 2 часов. Этот реакционный раствор подвергали очистке, используя общий способ D-2, с получением 0,7 мл раствора, содержащего около 5 мг SMCC-дериватизированного антитела.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления DMSO (0,045 мл) и раствора, содержащего 10 мМ соединения, полученного в синтезе 1 (0,015 мл; что соответствует 2,4 эквивалентов на молекулу антитела), в DMSO к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 16 часов с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом.
Очистка: упомянутый выше раствор подвергали очистке, используя общий метод D-1 (ABS использовали в качестве буферного раствора), с получением 3,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 3,85 мг/мл, выход антитела: 0,8 мг (16%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 2,9.
Пример 36. Конъюгат антитело-лекарственное средство (35)
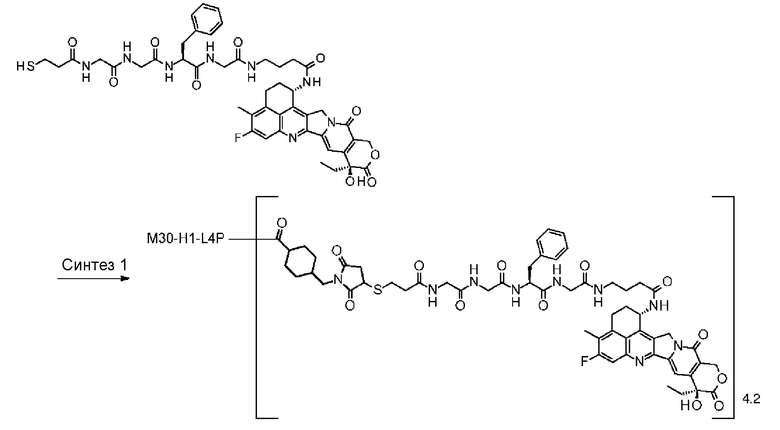
Синтез 1: Конъюгат антитело-лекарственное средство (35)
Дериватизация антитела с помощью SMCC: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 20 мг/мл путем замены среды на PBS6.5/EDTA, используя общий способ C-2 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1). Раствор (0,25 мл) помещали в пробирку объемом 1,5 мл, и добавляли к нему раствор (0,0125 мл; что соответствует приблизительно 5,1 эквивалентам на молекулу антитела), содержащий 27,6 мМ сукцинимидил-4-(N-малеимидoметил)циклогексан-1-карбоксилата (SMCC, Thermo Fisher Scientific Inc.), в DMSO при комнатной температуре и подвергали взаимодействию при комнатной температуре в течение 2 часов. Этот реакционный раствор подвергали очистке, используя общий способ D-2, с получением 0,7 мл раствора, содержащего около 5 мг SMCC-дериватизированного антитела.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления DMSO (0,03 мл) и раствора, содержащего 10 мМ соединения, полученного в синтезе 1 примера 35 (0,03 мл; что соответствует приблизительно 4,8 эквивалентам на молекулу антитела) в DMSO к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 16 часов с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), с получением 3,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 2,43 мг/мл, выход антитела: 0,5 мг (10%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 4,2.
Пример 37. Конъюгат антитело-лекарственное средство (36)
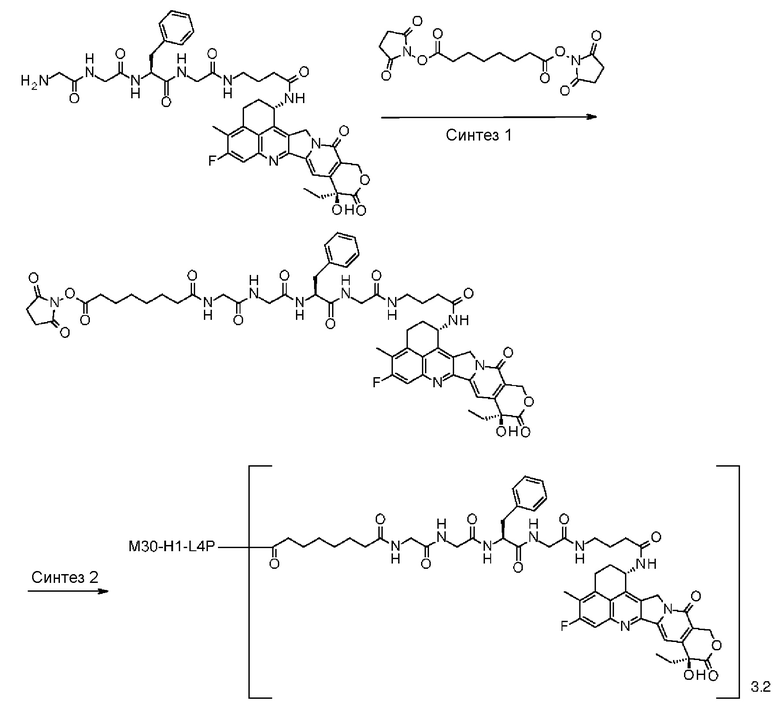

Синтез 1: N-{8-[(2,5-диоксопирролидин-1-ил)окси]-8-оксооктаноил}глицилглицил-L-фенилаланил-N-(4-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-4-оксобутил)глицинамид
Соединение (84,0 мг, 0,100 ммоль), полученное в синтезе 2 примера 2, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя ди(N-сукцинимидил)суберат вместо N-сукцинимидил 6-малеимидгексаноата, с получением названного соединения в виде бледно-желтого твердого вещества (77,1 мг, 71%).
1H-ЯМР (DMSO-D6) δ: 0,87 (3H, т, J=7,2 Гц), 1,21-1,38 (4H, м), 1,43-1,50 (2H, м), 1,55-1,63 (2H, м), 1,68-1,76 (2H, м), 1,80-1,91 (2H, м), 2,07-2,22 (6H, м), 2,40 (3H, с), 2,60-2,67 (2H, м), 2,76-2,84 (5H, м), 2,97-3,22 (5H, м), 3,56-3,76 (6H, м), 4,40-4,50 (1H, м), 5,20 (2H, кв, J=18,8 Гц), 5,37-5,48 (2H, м), 5,53-5,62 (1H, м), 6,54 (1H, с), 7,15-7,28 (5H, м), 7,31 (1H, с), 7,71 (1H, т, J=5,5 Гц), 7,80 (1H, д, J=10,9 Гц), 8,04 (1H, т, J=5,9 Гц), 8,09 (1H, т, J=5,9 Гц), 8,14 (1H, д, J=7,8 Гц), 8,26 (1H, т, J=5,9 Гц), 8,47 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 1092 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (36)
Конъюгирование антитела с фрагментом лекарственное средство-линкер: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 20 мг/мл путем замены среды на PBS6.5/EDTA, используя общий способ C-2 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1). Раствор (0,25 мл) помещали в пробирку объемом 1,5 мл и добавляли к нему раствор, содержащий 10 мМ соединения, полученного в синтезе 1 выше (0,025 мл; что соответствует приблизительно 3,7 эквивалентам на молекулу антитела), в DMSO при комнатной температуре, и перемешивали при комнатной температуре в течение 16 часов, используя роторный встряхиватель пробирок (MTR-103, фирмы AS ONE Corporation), с целью конъюгирования фрагмента лекарственное средство-линкер с антителом.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), с получением 3,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 6,25 мг/мл, выход антитела: 1,3 мг (26%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,2.
Пример 38. Конъюгат антитело-лекарственное средство (37)
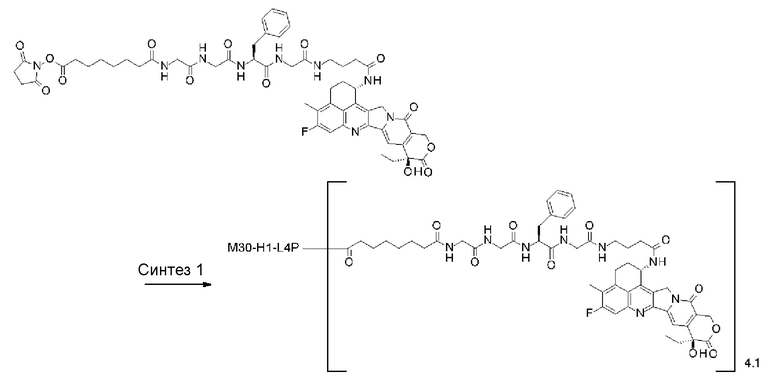
Синтез 1: Конъюгат антитело-лекарственное средство (37)
Конъюгирование антитела с фрагментом лекарственное средство-линкер: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 20 мг/мл путем замены среды на PBS6.5/EDTA, используя общий способ C-2 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1). Раствор (0,5 мл) помещали в пробирку объемом 1,5 мл и затем добавляли DMSO (0,025 мл) и раствор, содержащий 10 мМ соединения, полученного в синтезе 1 примера 37 (0,025 мл; что соответствует приблизительно 7,4 эквивалентов на молекулу антитела) в DMSO при комнатной температуре, и перемешивали при комнатной температуре в течение 16 часов, используя роторный встряхиватель пробирок (MTR-103, фирмы AS ONE Corporation), с целью конъюгирования фрагмента лекарственное средство-линкер с антителом.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), с получением 3,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 4,36 мг/мл, выход антитела: 0,9 мг (18%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 4,1.
Пример 39. Конъюгат антитело-лекарственное средство (38)
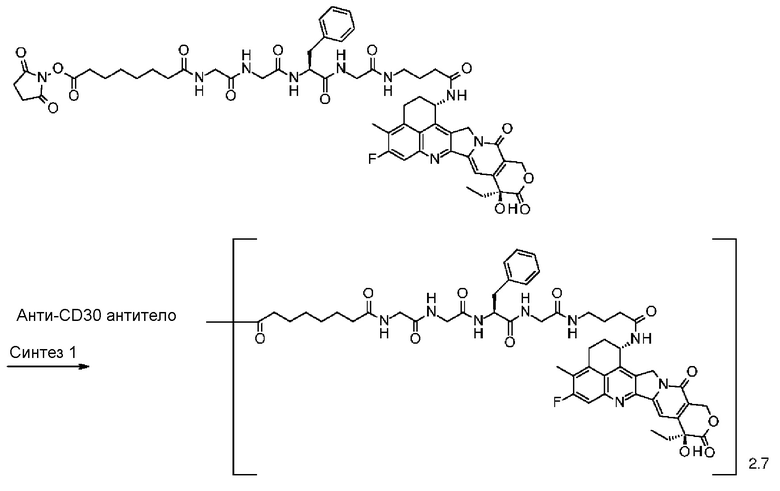
Синтез 1: Конъюгат антитело-лекарственное средство (38)
Конъюгирование антитела с фрагментом лекарственное средство-линкер: анти-CD30 антитело, полученное в справочном примере 3, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.5/EDTA, используя общий способ C-2 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,75 млмг-1см-1). Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл, затем добавляли DMSO (0,017 мл) и раствор, содержащий 10 мМ соединения, полученного в синтезе 1 примера 37 (0,023 мл; что соответствует 9 эквивалентам на молекулу антитела) в DMSO при комнатной температуре, и перемешивали при комнатной температуре в течение 4 часов, используя роторный встряхиватель пробирок (MTR-103, фирмы AS ONE Corporation), с целью конъюгирования фрагмента лекарственное средство-линкер с антителом.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=270400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=2670 (измеренное значение) и εD,370=15820 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 0,55 мг/мл, выход антитела: 1,4 мг (34%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 2,7.
Пример 40. Конъюгат антитело-лекарственное средство (39)
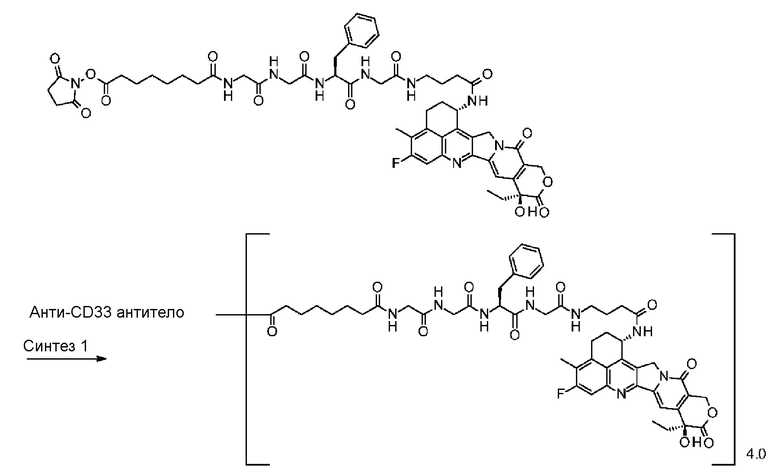
Синтез 1: Конъюгат антитело-лекарственное средство (39)
Конъюгирование антитела с фрагментом лекарственное средство-линкер: анти-CD33 антитело, полученное в справочном примере 4, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.5/EDTA, используя общий способ C-2 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,66 млмг-1см-1). Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и затем добавляли DMSO (0,017 мл) и раствор, содержащий 10 мМ соединения, полученного в синтезе 1 примера 37 (0,023 мл; что соответствует 9 эквивалентам на молекулу антитела), в DMSO при комнатной температуре, и перемешивали при комнатной температуре в течение 4 часов, используя роторный встряхиватель пробирок (MTR-103, фирмы AS ONE Corporation), с целью конъюгирования фрагмента лекарственное средство-линкер с антителом.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=256400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=2670 (измеренное значение) и εD,370=15820 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 0,93 мг/мл, выход антитела: 2,3 мг (58%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 4,0.
Пример 41. Конъюгат антитело-лекарственное средство (40)
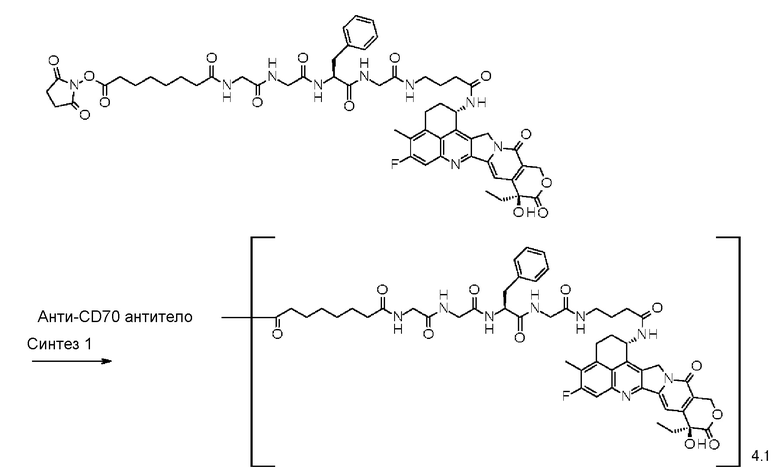
Синтез 1: Конъюгат антитело-лекарственное средство (40)
Конъюгирование антитела с фрагментом лекарственное средство-линкер: анти-CD70 антитело, полученное в справочном примере 5, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.5/EDTA, используя общий способ C-2 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,69 млмг-1см-1). Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл, затем добавляли DMSO (0,017 мл) и раствор, содержащий 10 мМ соединения, полученного в синтезе 1 примера 37 (0,023 мл; что соответствует 9 эквивалентам на молекулу антитела), в DMSO при комнатной температуре, и перемешивали при комнатной температуре в течение 4 часов, используя роторный встряхиватель пробирок (MTR-103, фирмы AS ONE Corporation), с целью конъюгирования фрагмента лекарственное средство-линкер с антителом.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=262400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=2670 (измеренное значение) и εD,370=15820 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,04 мг/мл, выход антитела: 2,6 мг (65%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 4,1.
Пример 42. 2-(2-Аминоэтокси)-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]ацетамид
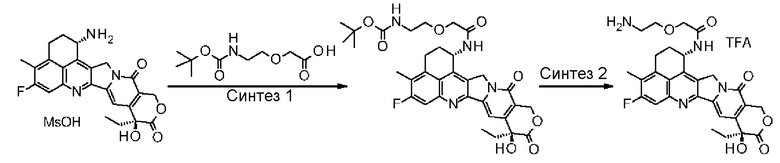
Синтез 1: Трет-бутил [2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)этил]карбамат
Мезилат соединения (4) (3,10 г, 5,47 моль) подвергали взаимодействию таким же образом, как в синтезе 1 примера 1, используя {2-[(трет-бутоксикарбонил)амино]этокси}уксусную кислоту (J. Med. Chem., 1992, vol. 35, pp. 2928) (1,55 г, 6,01 ммоль) вместо 4-(трет-бутоксикарбониламино)бутановой кислоты, с получением названного соединения в виде бледно-желтого твердого вещества (2,56 г, 73%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,3 Гц), 1,26 (9H, с), 1,81-1,91 (2H, м), 2,13-2,22 (2H, м), 2,40 (3H, с), 3,08-3,26 (4H, м), 3,43-3,53 (2H, м), 4,00 (1H, д, J=15,1 Гц), 4,05 (1H, д, J=15,1 Гц), 5,14 (1H, д, J=18,7 Гц), 5,22 (1H, д, J=18,7 Гц), 5,40 (1H, д, J=16,6 Гц), 5,44 (1H, д, J=16,6 Гц), 5,59-5,66 (1H, м), 6,53 (1H, с), 6,86 (1H, т, J=5,4 Гц), 7,31 (1H, с), 7,79 (1H, д, J=10,9 Гц), 8,49 (1H, д, J=9,1 Гц).
MS (APCI) m/z: 637 (M+H)+.
Синтез 2: 2-(2-Аминоэтокси)-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]ацетамид
Соединение (1,50 г, 2,36 моль), полученное в синтезе 1 выше, подвергали взаимодействию таким же образом, как в синтезе 2 примера 1, с получением трифторгидрохлорида названного соединения в виде бледно-желтого твердого вещества (1,50 г, количественно). Было подтверждено присутствие этого соединения в опухоли мыши с инкорпорированным раком, которой вводили конъюгат антитело-лекарственное средство (41).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,5 Гц), 1,81-1,92 (2H, м), 2,15-2,23 (2H, м), 2,41 (3H, с), 3,05 (2H, т, J=5,1 Гц), 3,15-3,23 (2H, м), 3,71 (2H, т, J=5,1 Гц), 4,10 (2H, с), 5,19 (1H, д, J=18,7 Гц), 5,24 (1H, д, J=18,7 Гц), 5,43 (2H, с), 5,58-5,66 (1H, м), 6,55 (1H, с), 7,33 (1H, с), 7,73-7,84 (4H, м), 8,55 (1H, д, J=9,1 Гц).
MS (APCI) m/z: 537 (M+H)+.
Пример 43. Конъюгат антитело-лекарственное средство (41)
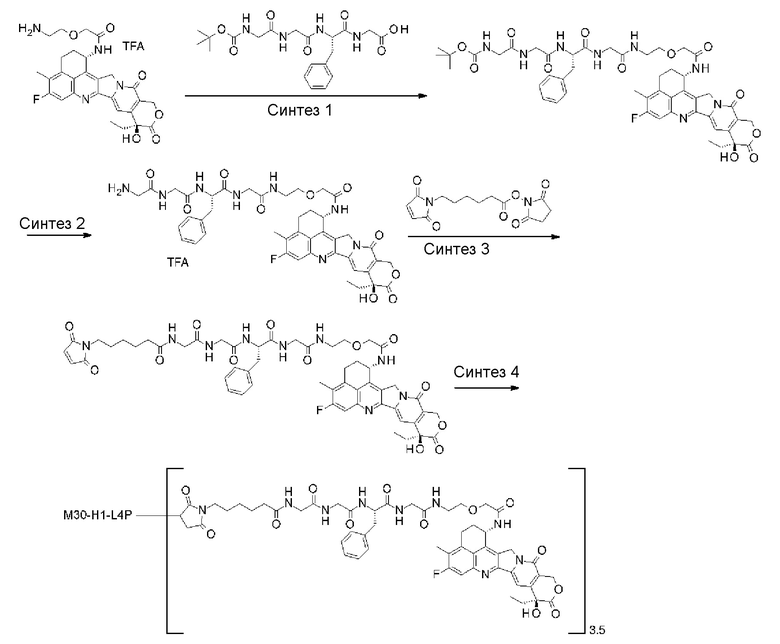
Синтез 1: N-(Трет-бутоксикарбонил)глицил-глицил-L-фенилаланил-N-[2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]-пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)этил]глицинамид
Соединение (554 мг, 0,85 ммоль) примера 42 подвергали взаимодействию таким же образом, как в синтезе 1 примера 2, с получением названного соединения (775 мг, 95%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,85 (3H, т, J=7,3 Гц), 1,36 (9H, с), 1,78-1,89 (2H, м), 2,13-2,22 (2H, м), 2,39 (3H, с), 2,71 (1H, дд, J=13,4, 9,8 Гц), 2,95 (1H, дд, J=13,4, 4,3 Гц), 3,09-3,23 (1H, м), 3,23-3,32 (2H, м), 3,40-3,62 (8H, м), 3,73 (1H, дд, J=16,5, 5,5 Гц), 4,03 (2H, с), 4,39-4,47 (1H, м), 5,17 (1H, д, J=18,9 Гц), 5,25 (1H, д, J=18,9 Гц), 5,41 (1H, д, J=16,8 Гц), 5,45 (1H, д, J=16,8 Гц), 5,57-5,64 (1H, м), 6,54 (1H, с), 6,99 (1H, т, J=5,8 Гц), 7,13-7,26 (5H, м), 7,31 (1H, с), 7,76-7,82 (2H, м), 7,90 (1H, т, J=5,2 Гц), 8,13 (1H, д, J=7,9 Гц), 8,27 (1H, т, J=5,8 Гц), 8,49 (1H, д, J=8,5 Гц).
MS (APCI) m/z: 955 (M+H)+.
Синтез 2: Глицил-глицил-L-фенилаланил-N-[2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-2-оксоэтокси)этил]глицинамид трифторацетат
Соединение (630 мг, 0,659 ммоль), полученное в синтезе 1 выше, подвергали взаимодействию таким же образом, как в синтезе 2 примера 2, с получением названного соединения (588 мг, 92%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,86 (3H, т, J=7,3 Гц), 1,79-1,90 (2H, м), 2,13-2,22 (2H, м), 2,39 (3H, с), 2,71 (1H, дд, J=13,4, 10,1 Гц), 2,99 (1H, дд, J=13,4, 4,3 Гц), 3,09-3,23 (1H, м), 3,24-3,32 (3H, м), 3,41-3,71 (7H, м), 3,86 (1H, дд, J=16,8, 5,8 Гц), 4,04 (2H, с), 4,52 (1H, тд, J=9,0, 4,1 Гц), 5,17 (1H, д, J=18,9 Гц), 5,25 (1H, д, J=18,9 Гц), 5,41 (1H, д, J=16,5 Гц), 5,45 (1H, д, J=16,5 Гц), 5,56-5,65 (1H, м), 6,55 (1H, с), 7,13-7,26 (5H, м), 7,32 (1H, с), 7,80 (1H, д, J=11,0 Гц), 7,87-8,01 (4H, м), 8,29-8,36 (2H, м), 8,46-8,55 (2H, м).
MS (APCI) m/z: 855 (M+H)+.
Синтез 3: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицил-глицил-L-фенилаланил-N-[2-(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-2-оксоэтокси)этил]глицинамид
Соединение (240 мг, 0,247 ммоль), полученное в синтезе 2 выше, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, с получением названного соединения (162 мг, 62%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,86 (3H, т, J=7,6 Гц), 1,13-1,22 (2H, м), 1,40-1,51 (4H, м), 1,78-1,90 (2H, м), 2,09 (2H, т, J=7,6 Гц), 2,14-2,21 (2H, м), 2,39 (3H, с), 2,74 (1H, дд, J=13,6, 9,7 Гц), 2,96 (1H, дд, J=13,6, 4,5 Гц), 3,08-3,24 (1H, м), 3,24-3,30 (1H, м), 3,33-3,40 (4H, м), 3,47-3,68 (7H, м), 3,72 (1H, дд, J=16,6, 5,7 Гц), 4,03 (2H, с), 4,42 (1H, тд, J=8,6, 4,2 Гц), 5,17 (1H, д, J=18,7 Гц), 5,25 (1H, д, J=18,7 Гц), 5,40 (1H, д, J=17,2 Гц), 5,44 (1H, д, J=17,2 Гц), 5,57-5,64 (1H, м), 6,52 (1H, с), 6,99 (2H, с), 7,13-7,25 (5H, м), 7,31 (1H, с), 7,74-7,81 (2H, м), 7,99 (1H, т, J=5,7 Гц), 8,03-8,11 (2H, м), 8,22 (1H, т, J=5,7 Гц), 8,47 (1H, д, J=9,1 Гц).
MS (APCI) m/z: 1048 (M+H)+.
Синтез 4: Конъюгат антитело-лекарственное средство (41)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 3, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 2 примера 29.
Концентрация антитела: 12,0 мг/мл, выход антитела: 8,4 мг (67%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,5.
Пример 44. Конъюгат антитело-лекарственное средство (42)
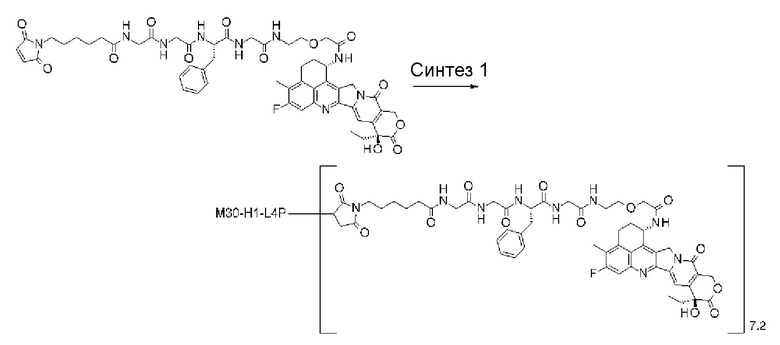
Синтез 1: Конъюгат антитело-лекарственное средство (42)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 3 примера 43, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 1 примера 5.
Концентрация антитела: 0,83 мг/мл, выход антитела: 4,98 мг (40%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,2.
Пример 45. Конъюгат антитело-лекарственное средство (43)
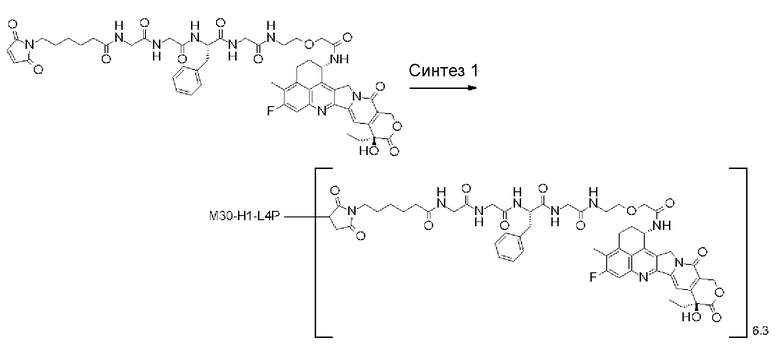
Синтез 1: Конъюгат антитело-лекарственное средство (43)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 3 примера 43, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 1 примера 4.
Концентрация антитела: 1,06 мг/мл, выход антитела: 6,36 мг (51%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,3.
Пример 46. Конъюгат антитело-лекарственное средство (44)
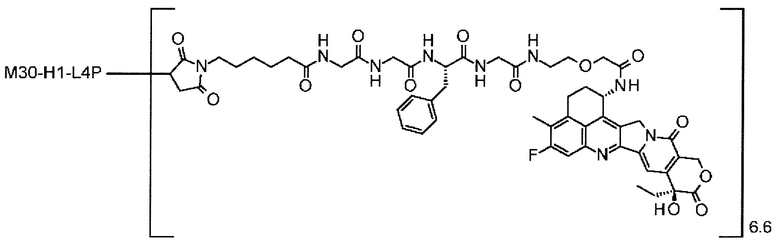
Смешивали практически все количества конъюгатов антитело-лекарственное средство, полученных в примерах 44 и 45. Раствор концентрировали с помощью общего способа A с получением названного конъюгата антитело-лекарственное средство.
Концентрация антитела: 10,0 мг/мл, выход антитела: 10,21 мг, и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,6.
Пример 47. Конъюгат антитело-лекарственное средство (45)
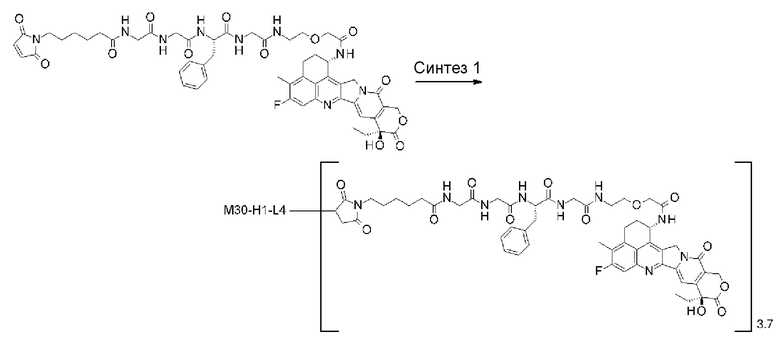
Синтез 1: Конъюгат антитело-лекарственное средство (45)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (1,25 мл, 12,5 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0287 мл; 3,4 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (0,0267 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 3 примера 43 (0,0439 мл; 5,2 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, его инкубировали на водяной бане при 15°C в течение 1 часа с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0066 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5193 (измеренное значение) и εD,370=20347 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 10,0 мг/мл, выход антитела: 9,3 мг (74%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,7.
Пример 48. Конъюгат антитело-лекарственное средство (46)
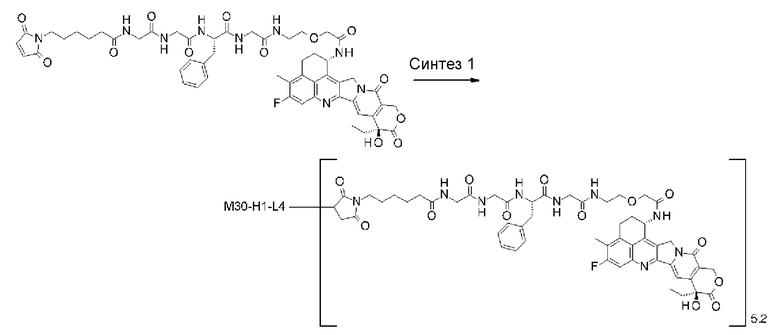
Синтез 1: Конъюгат антитело-лекарственное средство (46)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (1,25 мл, 12,5 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0439 мл; 5,2 эквивалентов на молекулу антитела) (0,0287 мл; 3,4 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора (0,0726 мл; 8,6 эквивалентов на молекулу антитела), содержащего 10 мМ соединения, полученного в синтезе 3 примера 43, к упомянутому выше раствору при комнатной температуре, его инкубировали на водяной бане при 15°C в течение 1 часа с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,011 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5193 (измеренное значение) и εD,370=20347 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 10,0 мг/мл, выход антитела: 7,8 мг (62%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,2.
Пример 49. N-[(1S,9S)-9-Этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-β-аланинамид
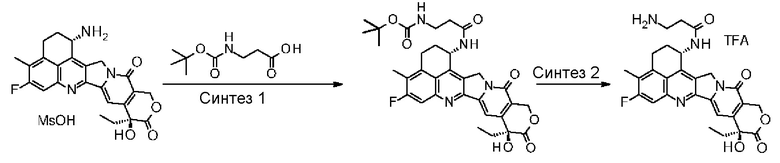
Синтез 1: Трет-бутил (3-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-3-оксопропил)карбамат
Мезмлат соединения (4) (500 мг, 0,941 ммоль) подвергали взаимодействию таким же образом, как в синтезе 1 примера 1, используя N-(трет-бутоксикарбонил)-β-аланин вместо 4-(трет-бутоксикарбониламино)бутановой кислоты, с получением названного соединения в виде желтовато-коричневого твердого вещества (616 мг, количественно).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,2 Гц), 1,29 (9H, с), 1,86 (2H, дт, J=15,1, 7,3 Гц), 2,04-2,22 (2H, м), 2,31 (2H, т, J=6,8 Гц), 2,40 (3H, с), 3,10-3,26 (4H, м), 5,15 (1H, д, J=18,8 Гц), 5,26 (1H, д, J=19,2 Гц), 5,42 (2H, дд, J=18,8, 16,4 Гц), 5,57 (1H, дт, J=8,5, 4,2 Гц), 6,53 (1H, с), 6,78 (1H, т, J=5,5 Гц), 7,30 (1H, с), 7,80 (1H, д, J=11,0 Гц), 8,46 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 607 (M+H)+.
Синтез 2: N-[(1S,9S)-9-Этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-β-аланинамид
Соединение, полученное в синтезе 1 выше, подвергали взаимодействию таким же образом, как в синтезе 2 примера 1, с получением трифторацетата названного соединения в виде желтого твердого вещества (499 мг, 86%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,2 Гц), 1,86 (2H, дквин, J=14,6, 7,2, 7,2, 7,2, 7,2 Гц), 2,06-2,27 (1H, м), 2,41 (3H, с), 2,46-2,57 (2H, м), 3,08 (2H, т, J=6,8 Гц), 3,14-3,24 (2H, м), 5,22 (1H, д, J=18,8 Гц), 5,29 (1H, д, J=18,8 Гц), 5,43 (2H, с), 5,58 (1H, дт, J=8,5, 4,5 Гц), 6,55 (1H, с), 7,32 (1H, с), 7,74 (3H, шир.с), 7,82 (1H, д, J=11,0 Гц), 8,67 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 507 (M+H)+.
Пример 50. Конъюгат антитело-лекарственное средство (47)
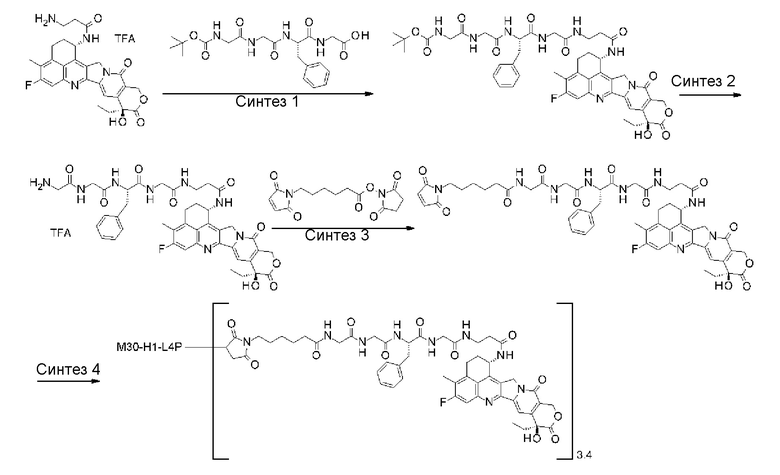
Синтез 1: N-(трет-бутоксикарбонил)глицил-глицил-L-фенилаланилглицил-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]-пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-β-аланинамид
Соединение (484 мг, 0,780 ммоль) примера 49 подвергали взаимодействию таким же образом, как в синтезе 1 примера 2, с получением названного соединения в виде бледно-желтого твердого вещества (626 мг, 87%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,27-1,42 (9H, м), 1,77-1,93 (2H, м), 2,06-2,22 (2H, м), 2,36 (2H, т, J=7,2 Гц), 2,40 (3H, д, J=1,6 Гц), 2,44-2,54 (2H, м), 2,76 (1H, дд, J=14,5, 10,2 Гц), 3,02 (1H, дд, J=13,9, 4,5 Гц), 3,12-3,22 (2H, м), 3,52 (6H, д, J=6,3 Гц), 4,42-4,54 (1H, м), 5,19 (1H, д, J=19,2 Гц), 5,26 (1H, д, J=18,4 Гц), 5,42 (1H, дд, J=18,4, 16,4 Гц), 5,57 (1H, дт, J=8,7, 4,4 Гц), 6,53 (1H, с), 6,98 (1H, т, J=5,9 Гц), 7,14-7,28 (5H, м), 7,31 (1H, с), 7,77-7,84 (1H, м), 7,91 (1H, т, J=5,5 Гц), 8,16 (1H, д, J=7,8 Гц), 8,27 (1H, т, J=5,1 Гц), 8,52 (1H, д, J=9,0 Гц).
Синтез 2: Глицил-глицил-L-фенилаланилглицил-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]-β-аланинамида трифторацетат
Соединение (624 мг, 0,675 ммоль), полученное в синтезе 1 выше, подвергали взаимодействию таким же образом, как в синтезе 2 примера 2, с получением названного соединения в виде желтого твердого вещества (626 мг, 92%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,86 (2H, тт, J=14,5, 7,2 Гц), 2,07-2,22 (2H, м), 2,36 (2H, т, J=7,2 Гц), 2,40 (3H, с), 2,44-2,54 (2H, м), 2,75 (1H, дд, J=13,7, 9,8 Гц), 3,04 (1H, дд, J=13,7, 4,3 Гц), 3,12-3,22 (2H, м), 3,58 (2H, д, J=4,7 Гц), 3,69 (3H, тд, J=11,2, 5,7 Гц), 3,87 (1H, дд, J=17,0, 5,7 Гц), 4,54 (1H, м, J=17,8, 4,5 Гц), 5,19 (1H, д, J=19,2 Гц), 5,26 (1H, д, J=18,8 Гц), 5,43 (2H, с), 5,51-5,60 (1H, м), 6,55 (1H, с), 7,14-7,29 (5H, м), 7,32 (1H, с), 7,81 (1H, д, J=10,9 Гц), 7,88 (1H, т, J=5,7 Гц), 7,97 (3H, шир.с), 8,29-8,38 (2H, м), 8,50 (1H, т, J=5,7 Гц), 8,55 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 825 (M+H)+.
Синтез 3: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-гексаноил]глицил-глицил-L-фенилаланилглицил-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]-β-аланинамид
Соединение (60,0 мг, 0,0646 ммоль), полученное в синтезе 2 выше, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, с получением названного соединения в виде твердого вещества (14,0 мг, 21%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,86 (3H, т, J=7,2 Гц), 1,12-1,22 (2H, м), 1,39-1,51 (4H, м), 1,79-1,91 (2H, м), 2,02-2,20 (2H, м), 2,07 (2H, т, J=7,4 Гц), 2,30-2,42 (4H, м), 2,40 (3H, с), 2,78 (1H, дд, J=14,1, 9,4 Гц), 3,02 (1H, дд, J=14,7, 4,9 Гц), 3,12-3,21 (2H, м), 3,26-3,42 (2H, м), 3,50-3,80 (6H, м), 4,40-4,51 (1H, м), 5,19 (1H, д, J=19,6 Гц), 5,26 (1H, д, J=19,2 Гц), 5,42 (2H, шир.с), 5,51-5,62 (1H, м), 6,53 (1H, с), 6,99 (2H, с), 7,13-7,28 (5H, м), 7,31 (1H, с), 7,74-7,84 (2H, м), 8,01 (1H, т, J=5,3 Гц), 8,06 (1H, т, J=5,7 Гц), 8,14 (1H, д, J=8,2 Гц), 8,25 (1H, т, J=5,7 Гц), 8,53 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 1018 (M+H)+.
Синтез 4: Конъюгат антитело-лекарственное средство (47)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 3 выше, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 4 примера 2.
Концентрация антитела: 12,27 мг/мл, выход антитела: 8,6 мг (69%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,4.
Пример 51. Конъюгат антитело-лекарственное средство (48)
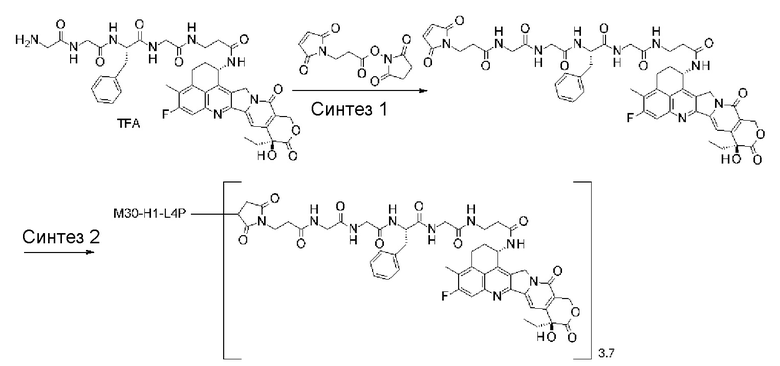
Синтез 1: N-[3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-пропаноил]глицил-глицил-L-фенилаланилглицил-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]-β-аланинамид
Соединение (60,0 мг, 0,0646 ммоль), полученное в синтезе 2 примера 50, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя N-сукцинимидил 3-малеимидпропионат вместо N-сукцинимидил 6-малеимидгексаноата, с получением названного соединения в виде бледно-желтого твердого вещества (36,0 мг, 57%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,86 (3H, т, J=7,4 Гц), 1,85 (2H, дт, J=14,4, 7,5 Гц), 2,05-2,22 (2H, м), 2,40 (3H, с), 2,30-2,44 (5H, м), 2,73-2,84 (1H, м), 3,02 (1H, дд, J=13,9, 4,5 Гц), 3,17 (3H, д, J=5,1 Гц), 3,26-3,40 (2H, м), 3,41-3,81 (6H, м), 4,40-4,51 (1H, м), 5,19 (1H, д, J=19,2 Гц), 5,26 (1H, д, J=18,8 Гц), 5,42 (2H, шир.с), 5,52-5,61 (1H, м), 6,53 (1H, с), 6,99 (2H, с), 7,13-7,28 (5H, м), 7,31 (1H, с), 7,80 (2H, д, J=10,2 Гц), 8,03 (1H, т, J=5,5 Гц), 8,12 (1H, д, J=8,2 Гц), 8,20-8,31 (2H, м), 8,52 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 976 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (48)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 1 выше, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 4 примера 2.
Концентрация антитела: 11,59 мг/мл, выход антитела: 8,1 мг (65%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,7.
Пример 52. Конъюгат антитело-лекарственное средство (49)
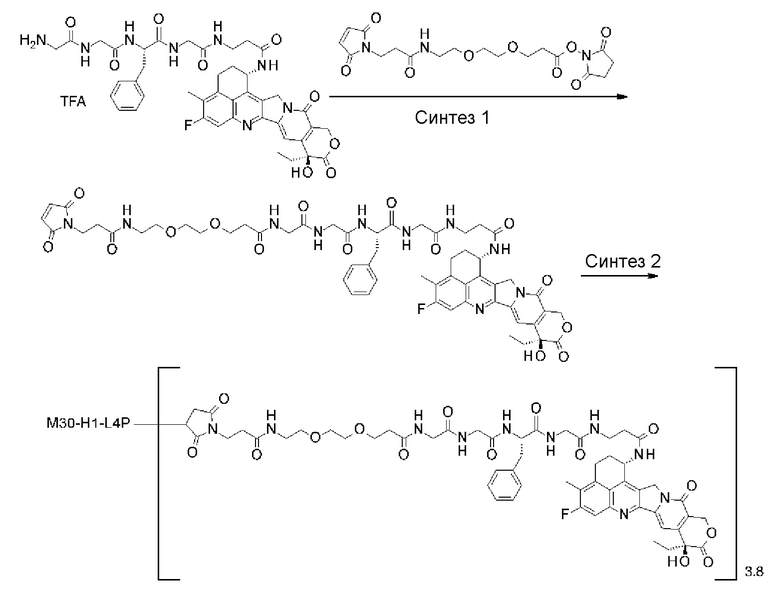
Синтез 1: N-{3-[2-(2-{[3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропаноил]амино})этокси]пропаноил}глицил-глицил-L-фенилаланилглицил-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-β-аланинамид
Соединение (60,0 мг, 0,0646 ммоль), полученное в синтезе 2 примера 50, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя N-сукцинимидил 3-(2-(2-(3-малеинимидпропанамид)этокси)этокси)пропаноат вместо N-сукцинимидил 6-малеимидгексаноата, с получением названного соединения в виде твердого вещества (23,0 мг, 31%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,86 (3H, т, J=7,4 Гц), 1,77-1,92 (2H, м), 2,07-2,21 (2H, м), 2,27-2,42 (6H, м), 2,40 (3H, с), 2,74-2,84 (1H, м), 2,97-3,06 (1H, м), 3,09-3,21 (4H, м), 3,25-3,39 (6H, м), 3,45 (4H, с), 3,50-3,80 (8H, м), 4,41-4,51 (1H, м), 5,19 (1H, д, J=18,4 Гц), 5,26 (1H, м, J=18,4 Гц), 5,42 (2H, шир.с), 5,51-5,61 (1H, м), 6,54 (1H, с), 7,00 (2H, с), 7,13-7,28 (5H, м), 7,31 (1H, с), 7,74-7,87 (2H, м), 7,93-8,07 (2H, м), 8,09-8,21 (2H, м), 8,26 (1H, шир.с), 8,54 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 1135 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (49)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 1 выше, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 2 примера 29.
Концентрация антитела: 14,50 мг/мл, выход антитела: 10,2 мг (82%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,8.
Пример 53. Конъюгат антитело-лекарственное средство (50)
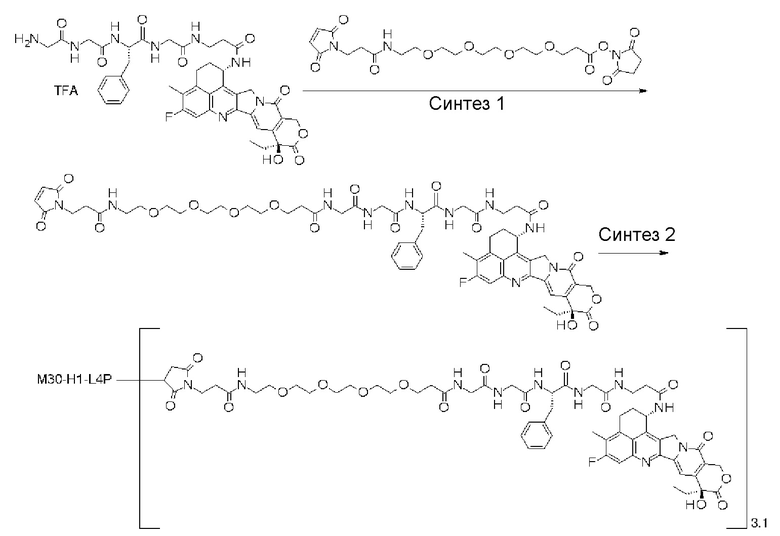
Синтез 1: N-[19-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-17-оксо-4,7,10,13-тетраокса-16-азанонадекан-1-оил]глицил-глицил-L-фенилаланилглицил-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-β-аланинамид
Соединение (60,0 мг, 0,0646 ммоль), полученное в синтезе 2 примера 50, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, используя N-сукцинимидил 1-малеинимид-3-оксо-7,10,13,16-тетраокса-4-азанонадеканоат вместо N-сукцинимидил 6-малеимидгексаноата, с получением названного соединения в виде твердого вещества (23,0 мг, 29%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,86 (3H, т, J=7,0 Гц), 1,85 (2H, тт, J=14,6, 7,1 Гц), 2,06-2,22 (2H, м), 2,40 (3H, с), 2,28-2,43 (6H, м), 2,78 (1H, дд, J=13,7, 9,4 Гц), 3,02 (1H, дд, J=14,1, 3,9 Гц), 3,09-3,22 (4H, м), 3,27-3,41 (4H, м), 3,47 (12H, д, J=8,6 Гц), 3,53-3,81 (10H, м), 4,41-4,51 (1H, м), 5,19 (1H, д, J=19,2 Гц), 5,26 (1H, д, J=18,8 Гц), 5,42 (2H, шир.с), 5,53-5,61 (1H, м), 6,54 (1H, с), 7,00 (2H, с), 7,12-7,29 (5H, м), 7,31 (1H, с), 7,74-7,85 (2H, м), 8,03 (2H, д, J=6,6 Гц), 8,11-8,21 (2H, м), 8,27 (1H, т, J=5,9 Гц), 8,54 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 1224 (M+H)+.
Синтез 2: Конъюгат антитело-лекарственное средство (50)
Используя M30-H1-L4P антитело, полученное в справочном примере 2, и соединение, полученное в синтезе 1 выше, получали названный конъюгат антитело-лекарственное средство таким же образом, как в синтезе 4 примера 2.
Концентрация антитела: 13,47 мг/мл, выход антитела: 9,4 мг (75%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,1.
Пример 54. Конъюгат антитело-лекарственное средство (51)
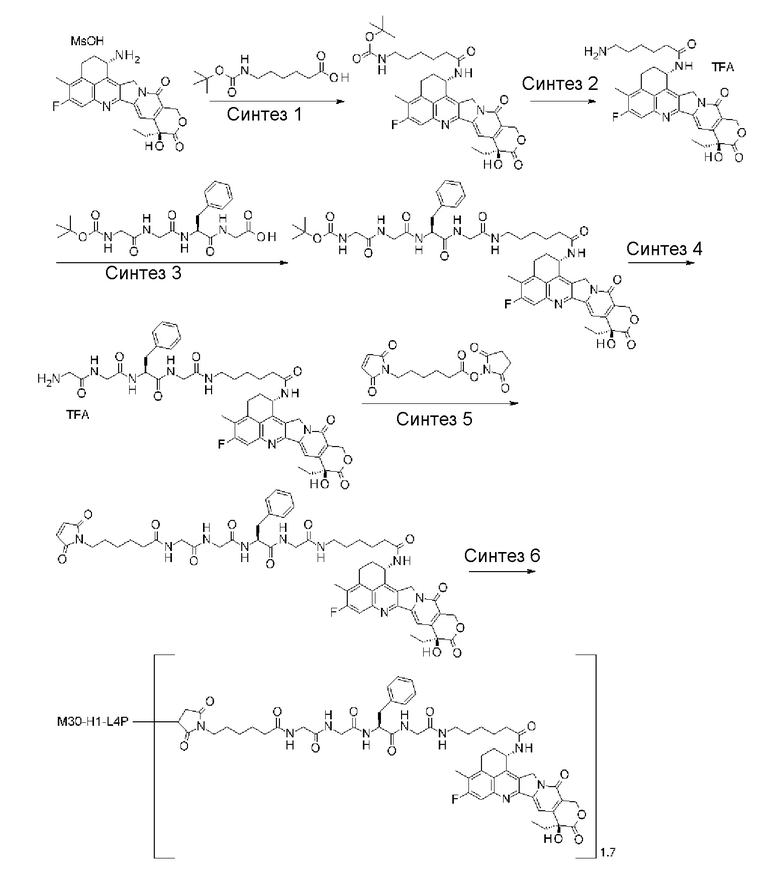
Синтез 1: Трет-бутил (6-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-6-оксогексил)карбамат
Мезилат соединения (4) (0,500 г, 0,882 ммоль) подвергали взаимодействию таким же образом, как в синтезе 1 примера 1, используя 6-(трет-бутоксикарбониламино)капроновую кислоту вместо 4-(трет-бутоксикарбониламино)бутановой кислоты, с получением названного соединения (0,620 г, количественно).
1H-ЯМР (DMSO-d6) δ: 0,83 (3H, т, J=7,8 Гц), 1,14-1,28 (2H, м), 1,31 (9H, с), 1,47-1,61 (2H, м), 1,75-1,89 (2H, м), 2,04-2,17 (4H, м), 2,35 (3H, с), 2,81-2,88 (2H, м), 3,09-3,16 (2H, м), 5,10 (1H, д, J=19,4 Гц), 5,16 (1H, д, J=19,4 Гц), 5,39 (2H, с), 5,48-5,55 (1H, м), 6,50 (1H, с), 6,73-6,78 (1H, м), 7,26 (1H, с), 7,74 (1H, д, J=10,9 Гц), 8,39 (1H, д, J=9,0 Гц).
Синтез 2: 6-Амино-N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]-пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]гексанамида трифторацетат
Соединение (0,397 г, 0,611 ммоль), полученное в синтезе 1 выше, подвергали взаимодействию таким же образом, как в синтезе 2 примера 1, с получением названного соединения (0,342 г, 84%).
1H-ЯМР (DMSO-d6) δ: 0,88 (3H, т, J=7,2 Гц), 1,31-1,41 (2H, м), 1,52-1,70 (4H, м), 1,80-1,94 (2H, м), 2,05-2,18 (2H, м), 2,21 (2H, т, J=7,4 Гц), 2,40 (3H, с), 2,81 (2H, т, J=7,4 Гц), 3,10-3,25 (2H, м), 3,33 (2H, шир.с), 5,18 (1H, д, J=19,8 Гц), 5,22 (1H, д, J=19,8 Гц), 5,41 (2H, д, J=16,6 Гц), 5,45 (2H, д, J=16,6 Гц), 5,53-5,60 (1H, м), 6,55 (1H, с), 7,32 (1H, с), 7,80 (1H, д, J=10,9 Гц), 8,49 (1H, д, J=9,2 Гц).
Синтез 3: N-(трет-бутоксикарбонил)глицил-глицил-L-фенилаланил-N-(6-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-6-оксогексил)глицинамид
Соединение (0,170 г, 0,516 ммоль), полученное в синтезе 2 выше, подвергали взаимодействию таким же образом, как в синтезе 1 примера 2, с получением названного соединения (0,225 г, 91%).
1H-ЯМР (DMSO-d6) δ: 0,88 (3H, т, J=7,4 Гц), 1,43-1,70 (6H, м), 1,87 (2H, тд, J=15,0, 7,4 Гц), 2,10-2,22 (3H, м), 2,28-2,37 (1H, м), 2,42 (3H, с), 2,78-2,85 (1H, м), 3,01-3,10 (3H, м), 3,15-3,22 (2H, м), 3,54-3,61 (5H, м), 3,62-3,69 (1H, м), 4,44-4,53 (1H, м), 5,17 (1H, д, J=19,2 Гц), 5,25 (1H, д, J=19,2 Гц), 5,45 (2H, с), 5,54-5,61 (1H, м), 6,55 (1H, с), 7,02 (1H, т, J=6,1 Гц), 7,11-7,28 (5H, м), 7,33 (1H, с), 7,63-7,69 (1H, м), 7,82 (1H, д, J=11,0 Гц), 7,90-7,96 (1H, м), 8,17 (1H, д, J=7,8 Гц), 8,28 (1H, т, J=5,5 Гц), 8,46 (1H, д, J=9,0 Гц).
Синтез 4: Глицил-глицил-L-фенилаланил-N-(6-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-6-оксогексил)глицинамид
Соединение (0,105 г, 0,108 ммоль), полученное в синтезе 3 выше, подвергали взаимодействию таким же образом, как в синтезе 2 примера 2, с получением названного соединения (0,068 мг, 65%).
1H-ЯМР (DMSO-d6) δ: 0,89 (3H, т, J=7,4 Гц), 1,15-1,67 (6H, м), 1,79-1,97 (2H, м), 2,08-2,24 (4H, м), 2,42 (3H, с), 2,76-2,82 (1H, м), 3,00-3,10 (5H, м), 3,19 (1H, с), 3,50-3,63 (2H, м), 3,64-3,76 (3H, м), 3,84-3,92 (1H, м), 4,51-4,59 (1H, м), 5,17 (1H, д, J=19,4 Гц), 5,24 (1H, д, J=19,4 Гц), 5,44 (2H, с), 5,53-5,61 (1H, м), 6,55 (1H, шир.с), 7,15-7,29 (5H, м), 7,33 (1H, с), 7,72-7,78 (1H, м), 7,82 (1H, д, J=11,0 Гц), 7,96-8,08 (2H, м), 8,30-8,38 (2H, м), 8,46-8,56 (2H, м).
Синтез 5: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-гексаноил]глицил-глицил-L-фенилаланил-N-(6-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-6-оксогексил)глицинамид
Соединение (58 мг, 0,060 ммоль), полученное в синтезе 4 выше, подвергали взаимодействию таким же образом, как в синтезе 3 примера 2, с получением названного соединения (39 мг, 62%).
1H-ЯМР (CD3OD) δ: 0,99 (3H, т, J=7,4 Гц), 1,27 (2H, тд, J=11,6, 6,1 Гц), 1,38-1,44 (2H, м), 1,50-1,63 (6H, м), 1,65-1,80 (2H, м), 1,89-1,98 (2H, м), 2,17-2,25 (3H, м), 2,26-2,36 (3H, м), 2,40 (3H, с), 2,95 (1H, дд, J=14,3, 9,2 Гц), 3,12 (1H, дд, J=13,7, 5,7 Гц), 3,15-3,25 (4H, м), 3,44 (2H, т, J=7,2 Гц), 3,65 (1H, д, J=17,2 Гц), 3,76 (1H, д, J=17,2 Гц), 3,79-3,86 (4H, м), 4,43 (1H, дд, J=8,9, 6,0 Гц), 5,10 (1H, д, J=18,9 Гц), 5,25 (1H, д, J=18,9 Гц), 5,35 (1H, д, J=16,6 Гц), 5,56 (1H, д, J=16,0 Гц), 5,60-5,64 (1H, м), 6,76 (2H, с), 7,12-7,24 (6H, м), 7,58 (1H, с), 7,60 (1H, д, J=10,9 Гц), 7,68 (1H, т, J=5,7 Гц).
MS (ESI) m/z: 1060 (M+H)+.
Синтез 6: Конъюгат антитело-лекарственное средство (51)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0147 мл; 2,3 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации раствора в течение 10 минут при 22°C, добавляли диметилсульфоксидный раствор, содержащий 10 мМ соединения, полученного в синтезе 5 (0,0295 мл; 4,6 эквивалентов на молекулу антитела), и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,00590 мл; 9,2 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (PBS7.4 использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 0,97 мг/мл, выход антитела: 5,82 мг (58%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 1,7.
Пример 55. Конъюгат антитело-лекарственное средство (52)
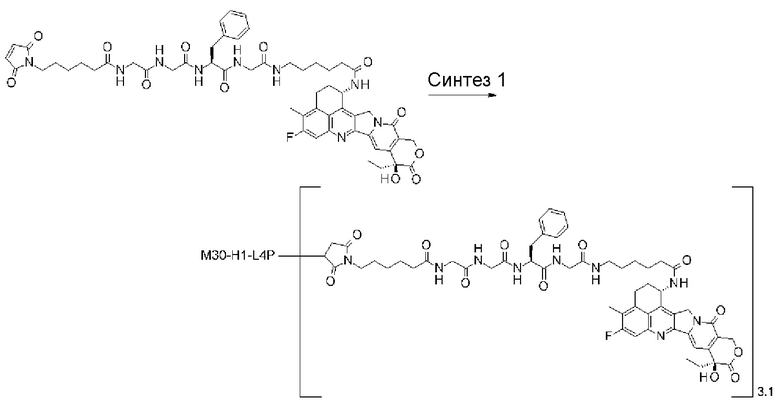
Синтез 1: Конъюгат антитело-лекарственное средство (52)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0295 мл; 4,6 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации вышеуказанного раствора в течение 10 минут при 22°C, добавляли к нему диметилсульфоксидный раствор, содержащий 10 мМ соединения, полученного в синтезе 5 примера 54 (0,0590 мл; 9,2 эквивалентов на молекулу антитела), и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0118 мл; 18,4 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (PBS7.4 использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 0,94 мг/мл, выход антитела: 5,64 мг (56%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,1.
Пример 56. Конъюгат антитело-лекарственное средство (53)
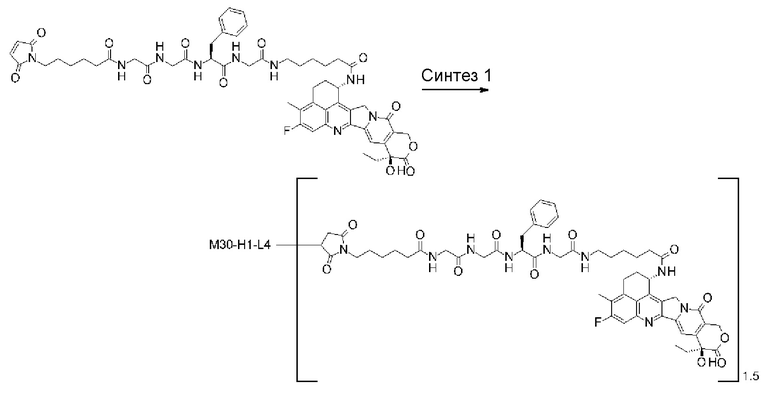
Синтез 1: Конъюгат антитело-лекарственное средство (53)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0147 мл; 2,3 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации вышеуказанного раствора при 22°C в течение 10 минут, добавляли к нему диметилсульфоксидный раствор, содержащий 10 мМ соединения, полученного в синтезе 5 примера 54 (0,0295 мл; 4,6 эквивалентов на молекулу антитела) и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,00590 мл; 9,2 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (PBS7.4 использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,22 мг/мл, выход антитела: 7,32 мг (73%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 1,5.
Пример 57. Конъюгат антитело-лекарственное средство (54)
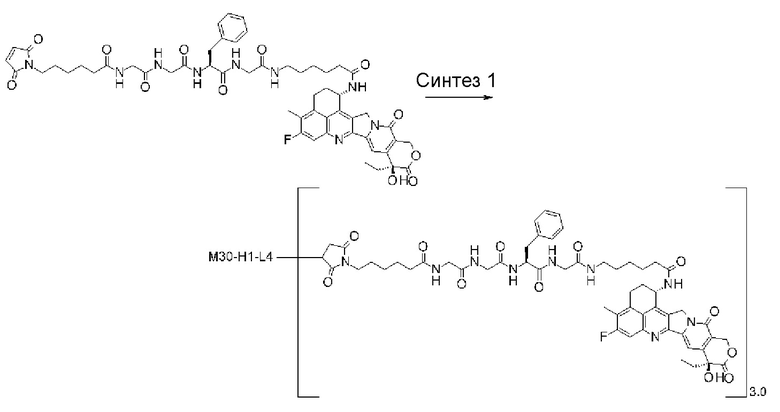
Синтез 1: Конъюгат антитело-лекарственное средство (54)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61) и общий способ C-1, описанный в способе получения 1. Раствор (1,0 мл) собирали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0295 мл; 4,6 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,050 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после инкубации вышеуказанного раствора в течение 10 минут при 22°C, добавляли к нему диметилсульфоксидный раствор, содержащий 10 мМ соединения, полученного в синтезе 5 примера 54 (0,0590 мл; 9,2 эквивалентов на молекулу антитела), и инкубировали при 22°C в течение 40 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0118 мл; 18,4 эквивалентов на молекулу антитела) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при 22°C в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (PBS7.4 использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,06 мг/мл, выход антитела: 6,36 мг (64%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,0.
Пример 58. Конъюгат антитело-лекарственное средство (55)
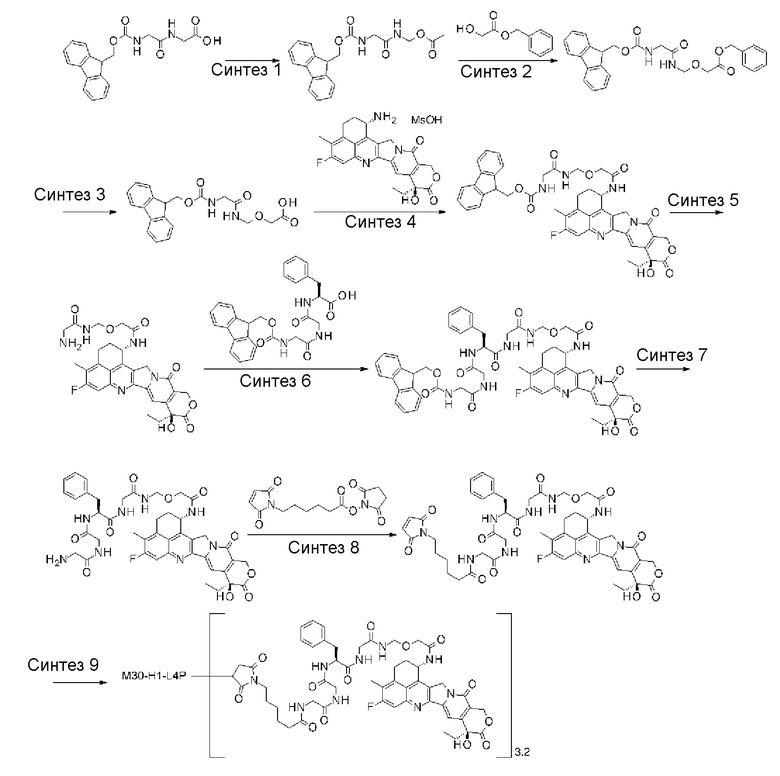
Синтез 1: ({N-[(9H-флуорен-9-илметокси)карбонил]глицил}амино)метилацетат
К смеси, содержащей N-9-флуоренилметоксикарбонилглицил-глицин (4,33 г, 12,2 ммоль), тетрагидрофуран (120 мл) и толуол (40,0 мл), добавляли пиридин (1,16 мл, 14,7 ммоль) и тетраацетат свинца (6,84 г, 14,7 ммоль) и кипятили с обратным холодильником в течение 5 часов. Затем реакционный раствор охлаждали до комнатной температуры, нерастворимые вещества удаляли фильтрацией через целит, и раствор концентрировали при пониженном давлении. Полученные остатки растворяли в этилацетате и промывали водой и насыщенным солевым раствором, и затем органический слой сушили над безводным сульфатом магния. После удаления растворителя при пониженном давлении, полученные остатки очищали колоночной хроматографией на силикагеле [гексан:этилацетат=9:1 (по объему)-этилацетат] с получением названного соединения в виде бесцветного твердого вещества (3,00 г, 67%).
1H-ЯМР (400 MГц, CDCl3) δ: 2,07 (3H, с), 3,90 (2H, д, J=5,1 Гц), 4,23 (1H, т, J=7,0 Гц), 4,46 (2H, д, J=6,6 Гц), 5,26 (2H, д, J=7,0 Гц), 5,32 (1H, brs), 6,96 (1H, шир.с), 7,32 (2H, т, J=7,3 Гц), 7,41 (2H, т, J=7,3 Гц), 7,59 (2H, д, J=7,3 Гц), 7,77 (2H, д, J=7,3 Гц).
Синтез 2: Бензил [({N-[(9H-флуорен-9-илметокси)карбонил]глицил}амино)метокси]ацетат
К раствору соединения (3,68 г, 10,0 ммоль), полученного в синтезе 1, и бензилгликолата (4,99 г, 30,0 ммоль) в тетрагидрофуране (40,0 мл) добавляли при 0°C трет-бутоксид калия (2,24 г, 20,0 ммоль) и перемешивали при комнатной температуре в течение 15 минут. К реакционному раствору добавляли этилацетат и воду при 0°C и экстрагировали этилацетатом и хлороформом. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении. Полученный остаток растворяли в диоксане (40,0 мл) и воде (10,0 мл), добавляли гидрокарбонат натрия (1,01 г, 12,0 ммоль) и 9-флуоренилметилхлороформиат (2,59 г, 10,0 ммоль) и перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении, и полученные остатки очищали колоночной хроматографией на силикагеле [гексан:этилацетат=100:0 (по объему)-0:100] с получением названного соединения в виде бесцветного маслянистого вещества (1,88 г, 40%).
1H-ЯМР (400 MГц, CDCl3) δ: 3,84 (2H, д, J=5,5 Гц), 4,24 (3H, т, J=6,5 Гц), 4,49 (2H, д, J=6,7 Гц), 4,88 (2H, д, J=6,7 Гц), 5,15-5,27 (1H, м), 5,19 (2H, с), 6,74 (1H, шир.с), 7,31-7,39 (7H, м), 7,43 (2H, т, J=7,4 Гц), 7,61 (2H, д, J=7,4 Гц), 7,79 (2H, д, J=7,4 Гц).
Синтез 3: [({N-[(9H-Флуорен-9-илметокси)карбонил]глицил}амино)метокси]уксусная кислота
Соединение (1,88 г, 3,96 ммоль), полученное в синтезе 2, растворяли в этаноле (40,0 мл) и этилацетате (20,0 мл). После добавления катализатора палладий на угле (376 мг), раствор перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Нерастворимые вещества удаляли фильтрацией через целит, и растворитель удаляли при пониженном давлении с получением названного соединения в виде бесцветного твердого вещества (1,52 г, количественно).
1H-ЯМР (400 MГц, DMSO-d6) δ: 3,62 (2H, д, J=6,3 Гц), 3,97 (2H, с), 4,18-4,32 (3H, м), 4,60 (2H, д, J=6,7 Гц), 7,29-7,46 (4H, м), 7,58 (1H, т, J=5,9 Гц), 7,72 (2H, д, J=7,4 Гц), 7,90 (2H, д, J=7,4 Гц), 8,71 (1H, т, J=6,5 Гц).
Синтез 4: 9H-Флуорен-9-илметил(2-{[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-2-оксоэтокси)метил]амино}-2-оксоэтил)карбамат
При охлаждении льдом, к раствору мезилата соединения (4) (0,283 г, 0,533 ммоль), N-гидроксисукцинимида (61,4 мг, 0,533 ммоль) и соединения (0,205 г, 0,533 ммоль), полученное в синтезе 3, в N,N-диметилформамиде (10,0 мл), добавляли N,N-диизопропилэтиламин (92,9 мкл, 0,533 ммоль) и N,N'-дициклогексилкарбодиимид (0,143 г, 0,693 ммоль) и перемешивали при комнатной температуре в течение 3 дней. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-отделенный органический слой хлороформа:метанол:вода=7:3:1 (по объему)] с получением названного соединения в виде бледно-коричневого твердого вещества (0,352 г, 82%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,81 (3H, т, J=7,4 Гц), 1,73-1,87 (2H, м), 2,06-2,20 (2H, м), 2,34 (3H, с), 3,01-3,23 (2H, м), 3,58 (2H, д, J=6,7 Гц), 3,98 (2H, с), 4,13-4,25 (3H, м), 4,60 (2H, д, J=6,7 Гц), 5,09-5,22 (2H, м), 5,32-5,42 (2H, м), 5,50-5,59 (1H, м), 6,49 (1H, с), 7,24-7,30 (3H, м), 7,36 (2H, т, J=7,4 Гц), 7,53 (1H, т, J=6,3 Гц), 7,66 (2H, д, J=7,4 Гц), 7,75 (1H, д, J=11,0 Гц), 7,84 (2H, д, J=7,4 Гц), 8,47 (1H, д, J=8,6 Гц), 8,77 (1H, т, J=6,7 Гц).
MS (ESI) m/z: 802 (M+H)+.
Синтез 5: N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]-пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
К раствору соединения (0,881 г, 1,10 ммоль), полученного в синтезе 4 выше, в N,N-диметилформамиде (11,0 мл) добавляли пиперидин (1,1 мл) и перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении с получением смеси, содержащей названное соединение. Смесь использовали для следующей реакции без проведения дополнительной очистки.
Синтез 6: N-[(9H-флуорен-9-илметокси)карбонил]глицил-глицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо-[de]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
При охлаждении льдом, к раствору смеси (0,439 ммоль), полученной в синтезе 5 выше, N-гидроксисукцинимида (0,101 г, 0,878 ммоль) и N-[(9H-флуорен-9-илметокси)карбонил]глицилглицил-L-фенилаланина (то есть, соединения, описанного в выложенном патенте Японии № 2002-60351) (0,440 г, 0,878 ммоль) в N,N-диметилформамиде (50,0 мл) добавляли N,N'-дициклогексилкарбодиимид (0,181 г, 0,878 ммоль) и перемешивали при комнатной температуре в течение 4 дней. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=9:1 (по объему)] с получением названного соединения в виде бледно-оранжевого твердого вещества (0,269 г, 58%).
MS (ESI) m/z: 1063 (M+H)+.
Синтез 7: Глицил-глицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
К раствору соединения (0,269 г, 0,253 ммоль), полученного в синтезе 6 выше, в N,N-диметилформамиде (4,00 мл) добавляли пиперидин (0,251 мл, 2,53 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении с получением смеси, содержащей названное соединение. Смесь использовали для следующей реакции без проведения дополнительной очистки.
Синтез 8: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицилглицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
К раствору соединения (0,253 ммоль), полученного в синтезе 7 выше, в N,N-диметилформамиде (10,0 мл) добавляли N-сукцинимидил 6-малеимидгексаноат (0,156 г, 0,506 ммоль) и перемешивали при комнатной температуре в течение 3 дней. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=9:1 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (0,100 г, 38%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,83 (3H, т, J=7,2 Гц), 1,09-1,21 (2H, м), 1,33-1,47 (4H, м), 1,75-1,90 (2H, м), 2,00-2,23 (4H, м), 2,36 (3H, с), 2,69-2,81 (1H, м), 2,94-3,03 (1H, м), 3,06-3,22 (2H, м), 3,23-3,74 (8H, м), 3,98 (2H, с), 4,39-4,50 (1H, м), 4,60 (2H, д, J=6,7 Гц), 5,17 (2H, с), 5,39 (2H, с), 5,53-5,61 (1H, м), 6,50 (1H, с), 6,96 (2H, с), 7,11-7,24 (5H, м), 7,28 (1H, с), 7,75 (1H, д, J=11,0 Гц), 7,97 (1H, т, J=5,7 Гц), 8,03 (1H, т, J=5,9 Гц), 8,09 (1H, д, J=7,8 Гц), 8,27 (1H, т, J=6,5 Гц), 8,48 (1H, д, J=9,0 Гц), 8,60 (1H, т, J=6,5 Гц).
MS (ESI) m/z: 1034 (M+H)+.
Синтез 9: Конъюгат антитело-лекарственное средство (55)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанный в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,025 мл; 3,0 эквивалента на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,109 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 выше (0,039 мл; 4,6 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 40 минут с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,008 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и перемешивали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A, описанного в способе получения 1.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 12,57 мг/мл, выход антитела: 8,8 мг (70%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,2.
Пример 59. Конъюгат антитело-лекарственное средство (56)
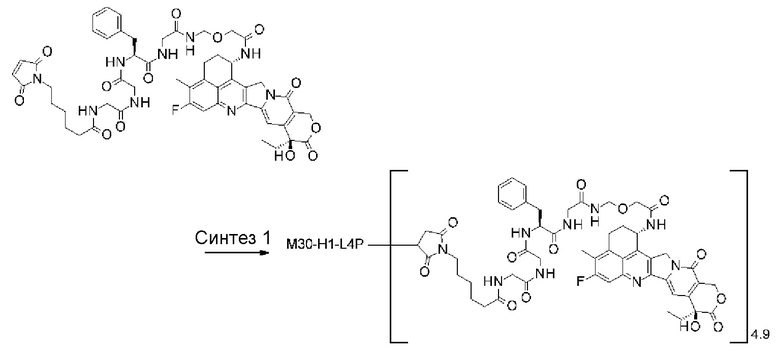
Синтез 1: Конъюгат антитело-лекарственное средство (56)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанный в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,051 мл; 6,0 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,067 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,085 мл; 10,0 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 60 минут с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,013 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и перемешивали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 1,33 мг/мл, выход антитела: 7,98 мг (64%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 4,9.
Пример 60. Конъюгат антитело-лекарственное средство (57)
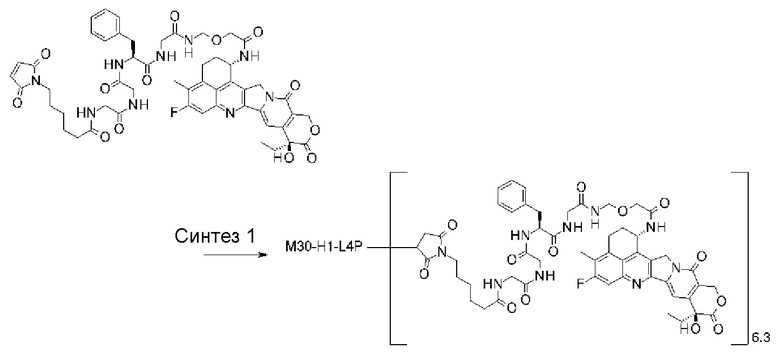
Синтез 1: Конъюгат антитело-лекарственное средство (57)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 2, приготавливали с концентрацией антитела 10 мг/мл путем замены среды на PBS6.0/EDTA, используя общий способ C-1 и общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1), описанный в способе получения 1. Раствор (1,25 мл) помещали в полипропиленовую пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,051 мл; 6,0 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксида (фирмы Sigma-Aldrich Co. LLC; 0,025 мл) и диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,127 мл; 15,0 эквивалентов на молекулу антитела), к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 60 минут с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,019 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и перемешивали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A описанный в способе получения 1.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5000 (измеренное среднее значение) и εD,370=19000 (измеренное среднее значение), были получены следующие характеристики.
Концентрация антитела: 0,91 мг/мл, выход антитела: 5,46 мг (44%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,3.
Пример 61. Конъюгат антитело-лекарственное средство (58)
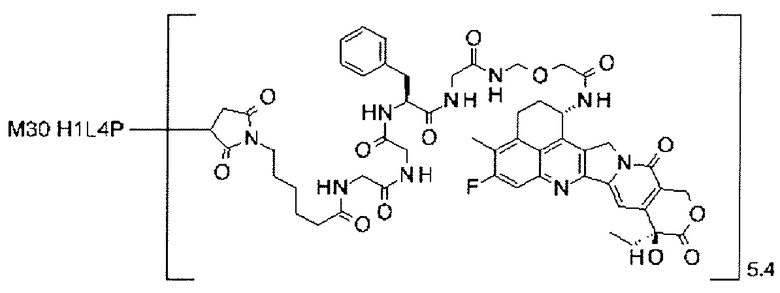
Смешивали практически все количества конъюгатов антитело-лекарственное средство, полученных в примерах 59 и 60. Раствор концентрировали с помощью общего способа A, описанного в способе получения 1, с получением названного конъюгата антитело-лекарственное средство.
Концентрация антитела: 10,0 мг/мл, выход антитела: 12,30 мг, и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,4.
Пример 62. Конъюгат антитело-лекарственное средство (59)
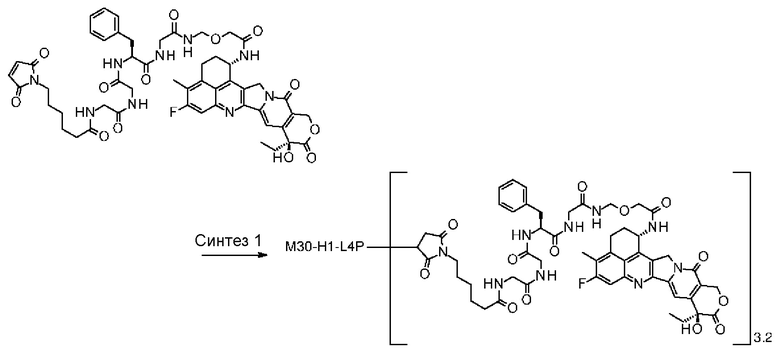
Синтез 1: Конъюгат антитело-лекарственное средство (59)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (100 мл, 1 г антитела) помещали в колбу объемом 250 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (2,43 мл; 3,6 эквивалентов на молекулу антитела) и затем водный раствор 1 М вторичного кислого фосфата калия (5 мл). После подтверждения того, что раствор имеет значение рН около 7,4 с помощью рН-метра, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (3,51 мл; 5,2 эквивалентов на молекулу антитела), и диметилсульфоксида (2,14 мл) к упомянутому выше раствору при комнатной температуре, его перемешивали на водяной бане при 15°C в течение 130 минут с помощью мешалки с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,547 мл) 100 мМ NAC и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер. Очистка: Упомянутый выше раствор подвергали ультрафильтрационной очистке, используя устройство для ультрафильтрации, состоящее из ультрафильтрационной мембраны (фирмы Merck Japan, Pellicon XL Cassette, Biomax 50 KDa), трубного насоса (фирмы Cole-Parmer International, MasterFlex Pump model 77521-40, Pump Head model 7518-00), и трубки (фирмы Cole-Parmer International, MasterFlex Tube L/S16). В частности, при добавлении к реакционному раствору по каплям ABS (суммарно 800 мл) в качестве буферного раствора для очистки, проводили ультрафильтрационную очистку для удаления неконъюгированных фрагментов лекарственное средство-линкер и других низкомолекулярных реагентов, заменяя также ABS на буферный раствор и затем концентрируя раствор, с получением около 70 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 14,2 мг/мл, выход антитела: 1,0 г (приблизительно 100%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,2.
Пример 63. Конъюгат антитело-лекарственное средство (60)
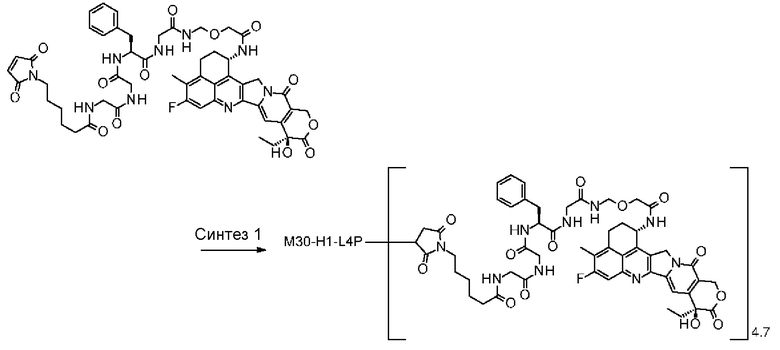
Синтез 1: Конъюгат антитело-лекарственное средство (60)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (5 мл, 50 мг антитела) помещали в пробирку объемом 15 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,075 мл; 4 эквивалентов на молекулу антитела). После подтверждения того, что раствор имеет значение рН около 7,0 с помощью рН-метра, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,219 мл; 6,5 эквивалентов на молекулу антитела), и диметилсульфоксида (0,064 мл) к упомянутому выше раствору, его инкубировали на водяной бане при 15°C в течение 90 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,033 мл; 9,8 эквивалентов на молекулу антитела) 100 мМ NAC и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 19 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 2,19 мг/мл, выход антитела: 42 мг (83%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 4,7.
Пример 64. Конъюгат антитело-лекарственное средство (61)
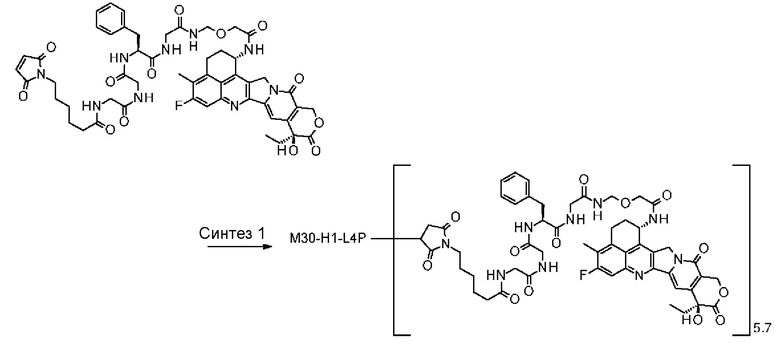
Синтез 1: Конъюгат антитело-лекарственное средство (61)
Восстановление антитела: M30-H1-L4P антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (4 мл, 40 мг антитела) помещали в пробирку объемом 15 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,14 мл; 5,2 эквивалентов на молекулу антитела). После подтверждения того, что раствор имеет значение рН около 7,0 с помощью рН-метра, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,232 мл; 8,6 эквивалентов на молекулу антитела) к упомянутому выше раствору, его инкубировали на водяной бане при 15°C в течение 60 минут с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,035 мл; 12,9 эквивалентов на молекулу антитела) 100 мМ NAC и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 13 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 2,03 мг/мл, выход антитела: 26 мг (66%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,7.
Пример 65. Конъюгат антитело-лекарственное средство (62)
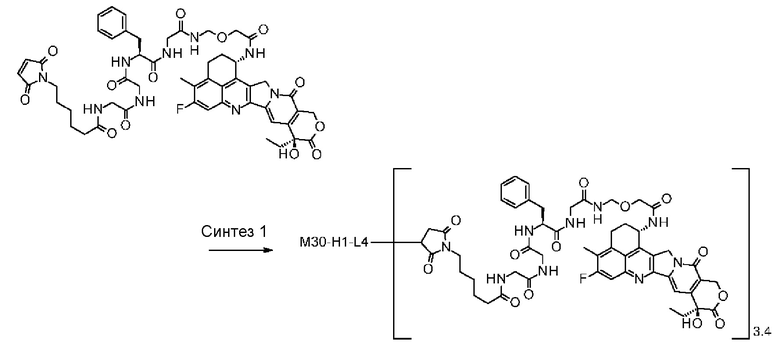
Синтез 1: Конъюгат антитело-лекарственное средство (62)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (1,25 мл, 12,5 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0287 мл; 3,4 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0439 мл; 5,2 эквивалентов на молекулу антитела), и диметилсульфоксида (0,0267 мл) к упомянутому выше раствору при комнатной температуре, его инкубировали на водяной бане при 15°C в течение 1 часа с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0066 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 10,0 мг/мл, выход антитела: 7,8 мг (62%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,4.
Пример 66. Конъюгат антитело-лекарственное средство (63)
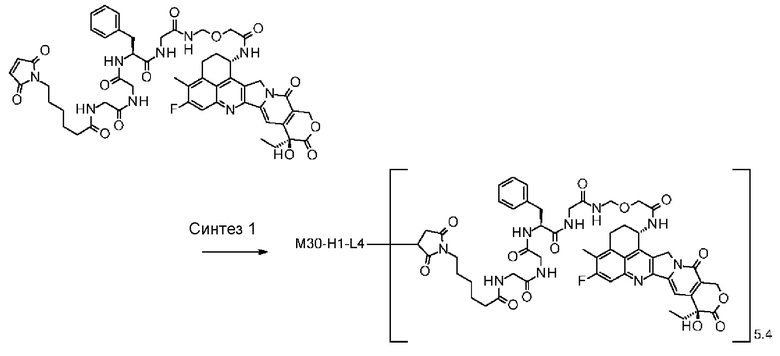
Синтез 1: Конъюгат антитело-лекарственное средство (63)
Восстановление антитела: M30-H1-L4 антитело, полученное в справочном примере 1, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,61 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (1,25 мл, 12,5 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0439 мл; 5,2 эквивалентов на молекулу антитела) (0,0287 мл; 3,4 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0625 мл). После подтверждения того, что раствор имеет величину рН 7,4±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0726 мл; 8,6 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, его инкубировали на водяной бане при 15°C в течение 1 часа с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,011 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 6 мл раствора, содержащего названный конъюгат антитело-лекарственное средство. После чего, раствор концентрировали с помощью общего способа A.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=235300 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 10,0 мг/мл, выход антитела: 7,3 мг (58%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 5,4.
Пример 67. Конъюгат антитело-лекарственное средство (64)
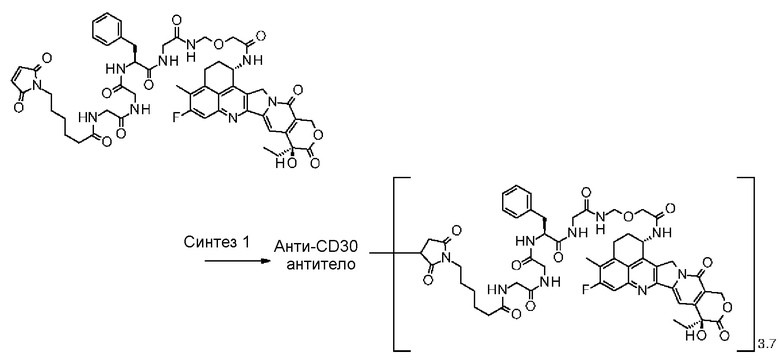
Синтез 1: Конъюгат антитело-лекарственное средство (64)
Восстановление антитела: анти-CD30 антитело, полученное в справочном примере 3, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.5/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,75 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0065 мл; 2,5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0058 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0116 мл; 4,5 эквивалентов на молекулу антитела), и диметилсульфоксида (0,0101 мл) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0017 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=270400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 0,96 мг/мл, выход антитела: 2,4 мг (60%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,7.
Пример 68. Конъюгат антитело-лекарственное средство (65)
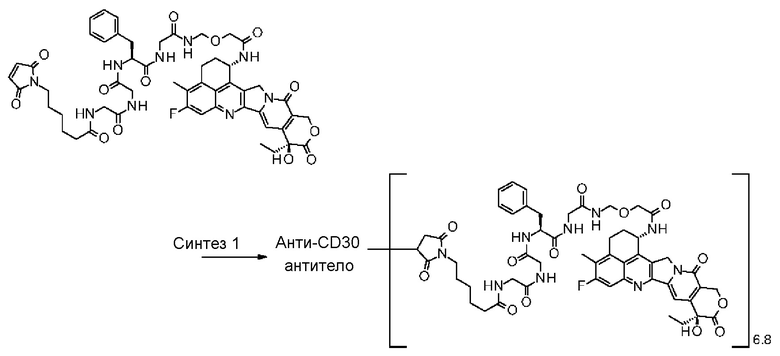
Синтез 1: Конъюгат антитело-лекарственное средство (65)
Восстановление антитела: анти-CD30 антитело, полученное в справочном примере 3, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,75 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0129 мл; 5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,006 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0233 мл; 9 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0035 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=270400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 0,39 мг/мл, выход антитела: 1,0 мг (24%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 6,8.
Пример 69. Конъюгат антитело-лекарственное средство (66)
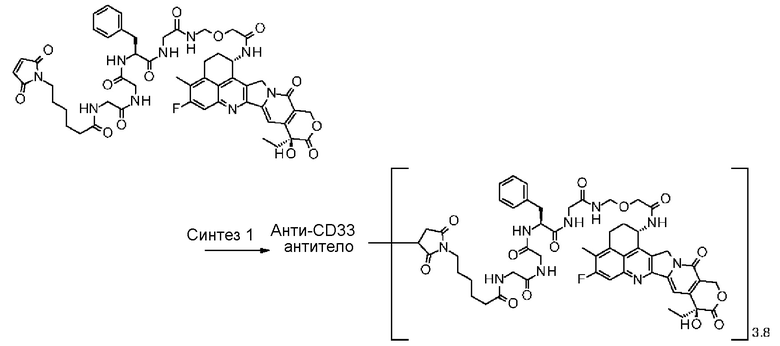
Синтез 1: Конъюгат антитело-лекарственное средство (66)
Восстановление антитела: анти-CD33 антитело, полученное в справочном примере 4, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,66 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0065 мл; 2,5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0058 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0116 мл; 4,5 эквивалентов на молекулу антитела), и диметилсульфоксида (0,0101 мл) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0017 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=256400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,19 мг/мл, выход антитела: 3,0 мг (74%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,8.
Пример 70. Конъюгат антитело-лекарственное средство (67)
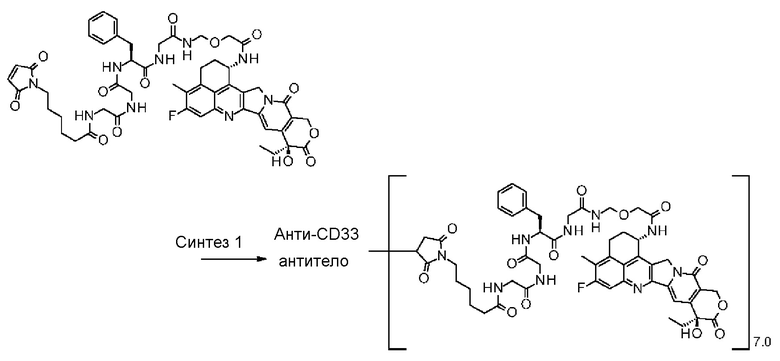
Синтез 1: Конъюгат антитело-лекарственное средство (67)
Восстановление антитела: анти-CD33 антитело, полученное в справочном примере 4, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,66 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0129 мл; 5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,006 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0233 мл; 9 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0035 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=256400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,24 мг/мл, выход антитела: 3,1 мг (78%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,0.
Пример 71. Конъюгат антитело-лекарственное средство (68)
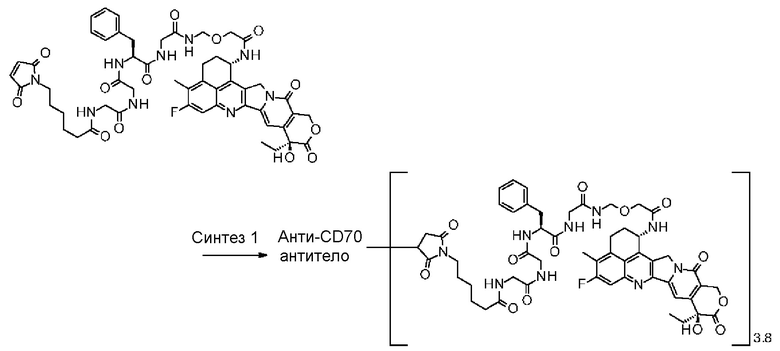
Синтез 1: Конъюгат антитело-лекарственное средство (68)
Восстановление антитела: анти-CD70 антитело, полученное в справочном примере 5, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,69 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0065 мл; 2,5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,0058 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0116 мл; 4,5 эквивалентов на молекулу антитела), и диметилсульфоксида (0,0101 мл) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0017 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=262400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,10 мг/мл, выход антитела: 2,8 мг (69%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 3,8.
Пример 72. Конъюгат антитело-лекарственное средство (69)
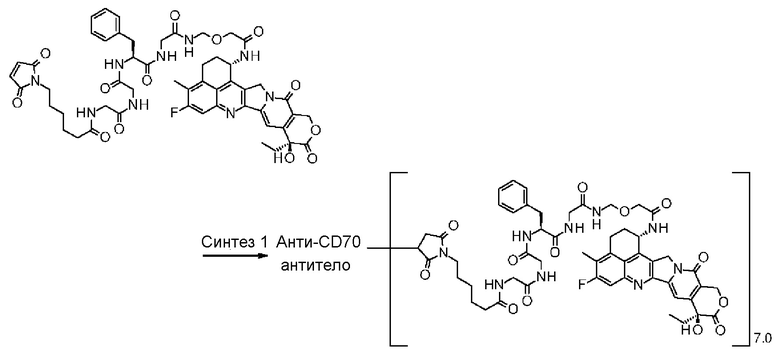
Синтез 1: Конъюгат антитело-лекарственное средство (69)
Восстановление антитела: анти-CD70 антитело, полученное в справочном примере 5, приготавливали с концентрацией антитела 10 мг/мл с помощью PBS6.0/EDTA, используя общий способ B (в качестве коэффициента поглощения при 280 нм использовали значение 1,69 млмг-1см-1) и общий способ C-1, описанный в способе получения 1. Раствор (0,4 мл, 4 мг антитела) помещали в пробирку объемом 1,5 мл и добавляли к нему водный раствор, содержащий 10 мМ TCEP (фирмы Tokyo Chemical Industry Co., Ltd.) (0,0129 мл; 5 эквивалентов на молекулу антитела), и водный раствор 1 M вторичного кислого фосфата калия (фирмы Nacalai Tesque, Inc; 0,006 мл). После подтверждения того, что раствор имеет величину рН 7,0±0,1, восстанавливали дисульфидную связь в шарнирной части антитела путем инкубации при 37°C в течение 1 часа.
Конъюгирование антитела с фрагментом лекарственное средство-линкер: после добавления диметилсульфоксидного раствора, содержащего 10 мМ соединения, полученного в синтезе 8 примера 58 (0,0233 мл; 9 эквивалентов на молекулу антитела) к упомянутому выше раствору при комнатной температуре, осуществляли перемешивание при комнатной температуре в течение 1 часа с помощью роторного встряхивателя пробирок (MTR-103, фирмы AS ONE Corporation) с целью конъюгирования фрагмента лекарственное средство-линкер с антителом. Затем добавляли водный раствор (0,0035 мл) 100 мМ NAC (фирмы Sigma-Aldrich Co. LLC) и инкубировали при комнатной температуре в течение еще 20 минут с целью прерывания реакции фрагмента лекарственное средство-линкер.
Очистка: упомянутый выше раствор подвергали очистке, используя общий способ D-1 (ABS использовали в качестве буферного раствора), описанный в способе получения 1, с получением 2,5 мл раствора, содержащего названный конъюгат антитело-лекарственное средство.
Физико-химические характеристики: используя общий способ E, описанный в способе получения 1 (в качестве значений коэффициента поглощения использовали следующие значения: εA,280=262400 (рассчитанное оценочное значение), εA,370=0 (рассчитанное оценочное значение), εD,280=5178 (измеренное значение) и εD,370=20217 (измеренное значение)), были получены следующие характеристики.
Концентрация антитела: 1,16 мг/мл, выход антитела: 2,9 мг (73%), и среднее число конъюгированных молекул лекарственного средства (n) на молекулу антитела: 7,0.
Пример 73. (Другой способ синтеза для соединения, получаемого с помощью синтеза 8 примера 58)
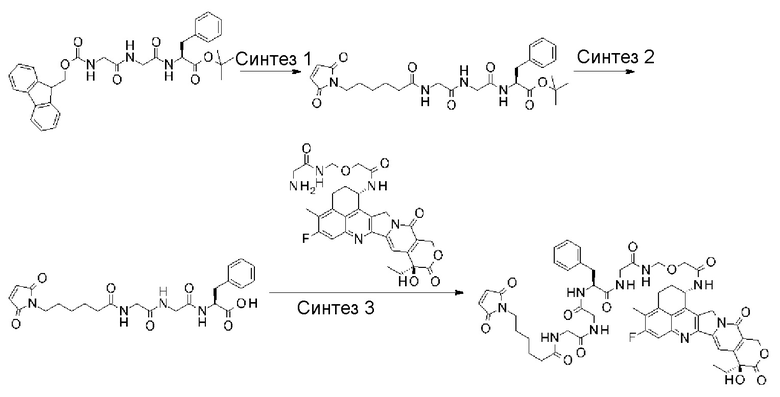
Синтез 1: Трет-бутил N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицил-глицил-L-фенилаланинат
При охлаждении льдом, к раствору трет-бутил N-[(9H-флуорен-9-илметокси)карбонил]глицил-глицил-L-фенилаланината (J. Pept. Res., 1999, vol. 53, pp. 393) (0.400 г, 0,717 ммоль) в THF (12,0 мл) добавляли 1,8-диазабицикло[5.4.0]-7-ундецен (0,400 мл) и перемешивали при комнатной температуре в течение 4 дней, и затем добавляли N-сукцинимидил 6-малеимидгексаноат (0,221 г, 0,717 ммоль) и перемешивали в течение 3 часов. Реакционный раствор разбавляли этилацетатом и промывали водным раствором 10% лимонной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, и затем органический слой сушили над безводным сульфатом магния. После удаления растворителя при пониженном давлении, полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=9:1 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (0,295 г, 78%).
1H-ЯМР (400 MГц, CDCl3) δ: 1,28-1,36 (2H, м), 1,41 (9H, с), 1,57-1,71 (4H, м), 2,23 (2H, т, J=7,6 Гц), 3,09 (2H, д, J=6,0 Гц), 3,51 (2H, т, J=7,6 Гц), 3,85-4,02 (4H, м), 4,69-4,78 (1H, м), 6,15 (1H, т, J=4,6 Гц), 6,33 (1H, д, J=7,3 Гц), 6,60 (1H, т, J=5,0 Гц), 6,68 (2H, с), 7,10-7,16 (2H, м), 7,22-7,31 (3H, м).
MS (ESI) m/z: 529 (M+H)+.
Синтез 2: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицил-глицил-L-фенилаланин
К раствору соединения (0,295 г, 0,558 ммоль), полученного в синтезе 1, в дихлорметане (8,00 мл) добавляли трифторуксусную кислоту (4,00 мл) и перемешивали при комнатной температуре в течение 18 часов. Растворитель удаляли при пониженном давлении с получением названного соединения в виде бледно-желтого твердого вещества (0,240 г, 91%).
1H-ЯМР (400 MГц, DMSO-d6) δ: 1,15-1,23 (2H, м), 1,40-1,53 (4H, м), 2,10 (2H, т, J=7,6 Гц), 2,88 (1H, дд, J=13,7, 8,9 Гц), 3,04 (1H, дд, J=13,7, 5,0 Гц), 3,35-3,43 (2H, м), 3,58-3,77 (4H, м), 4,41 (1H, тд, J=7,8, 5,0 Гц), 7,00 (2H, с), 7,16-7,31 (5H, м), 8,00 (1H, т, J=5,7 Гц), 8,06 (1H, т, J=5,7 Гц), 8,13 (1H, д, J=7,8 Гц).
Синтез 3: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-гексаноил]глицил-глицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
Соединение (0,572 г, 1,21 ммоль), полученное в синтезе 2, растворяли в дихлорметане (12,0 мл) и добавляли к нему N-гидроксисукцинимид (0,152 г, 1,32 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (0,253 г, 1,32 ммоль) и перемешивали в течение 1 часа. Реакционный раствор добавляли к раствору смеси (1,10 ммоль), полученной в синтезе 5 примера 58, в N,N-диметилформамиде (22,0 мл) и перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли водный раствор 10% лимонной кислоты и экстрагировали хлороформом. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=8:2 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (0,351 г, 31%). Данные инструментальных исследований соединения были идентичными данным для соединения, полученного в синтезе 8 примера 58.
Пример 74. (Другой способ синтеза для соединения, получаемого с помощью синтеза 8 примера 58)
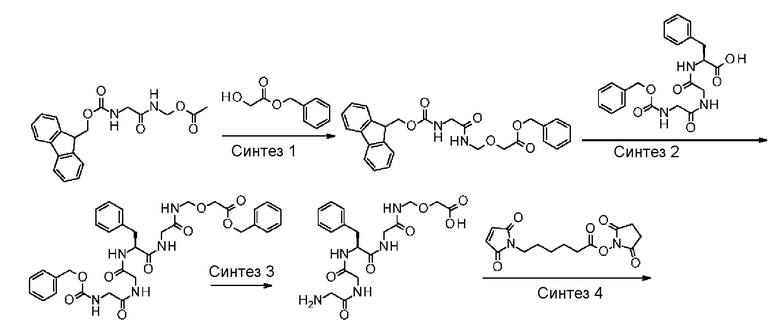
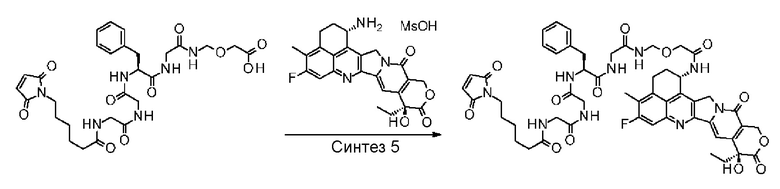
Синтез 1: Бензил [({N-[(9H-флуорен-9-илметокси)карбонил]глицил}амино)метокси]ацетат
К раствору соединения (7,37 г, 20,0 ммоль), полученного в синтезе 1, примера 58, в тетрагидрофуране (200 мл) добавляли при 0°C бензилгликолат (6,65 г, 40,0 ммоль) и моногидрат п-толуолсульфоновой кислоты (0,381 г, 2,00 ммоль) и перемешивали при комнатной температуре в течение 2 часов и 30 минут. К реакционному раствору добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [гексан:этилацетат=100:0 (по объему)-0:100] с получением названного соединения в виде бесцветного твердого вещества (6,75 г, 71%). Данные инструментальных исследований соединения были идентичными данным для соединения, полученного в синтезе 2 примера 58.
Синтез 2: N-[(Бензилокси)карбонил]глицил-глицил-L-фенилаланин-N-{[(2-(бензилокси)-2-оксоэтокси]метил}глицинамид
К раствору соединения (6,60 г, 13,9 ммоль), полученного в синтезе 1, в N,N-диметилформамиде (140 мл), добавляли при 0°C 1,8-диазабицикло[5.4.0]ундец-7-ен (2,22 г, 14,6 ммоль) и перемешивали при комнатной температуре в течение 15 минут. К реакционному раствору добавляли перемешенный заранее при комнатной температуре в течение 1 часа раствор N-[(бензилокси)карбонил]глицил-глицил-L-фенилаланина (6,33 г, 15,3 ммоль), N-гидроксисукцинимида (1,92 г, 16,7 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида (3,20 г, 16,7 ммоль) в N,N-диметилформамиде (140 мл) и перемешивали при комнатной температуре в течение 4 часов. К реакционному раствору добавляли 0,1 N хлористоводородную кислоту и экстрагировали хлороформом. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=8:2 (по объему)] с получением названного соединения в виде бесцветного твердого вещества (7,10 г, 79%).
1H-ЯМР (DMSO-D6) δ: 2,78 (1H, дд, J=13,9, 9,6 Гц), 3,05 (1H, дд, J=13,9, 4,5 Гц), 3,56-3,80 (6H, м), 4,15 (2H, с), 4,47-4,55 (1H, м), 4,63 (2H, д, J=6,6 Гц), 5,03 (2H, с), 5,15 (2H, с), 7,16-7,38 (15H, м), 7,52 (1H, т, J=5,9 Гц), 8,03 (1H, т, J=5,5 Гц), 8,17 (1H, д, J=8,2 Гц), 8,36 (1H, т, J=5,7 Гц), 8,61 (1H, т, J=6,6 Гц).
Синтез 3: Глицил-глицил-L-фенилаланил-N-[(карбоксиметокси)метил]глицинамид
К раствору соединения (7,00 г, 10,8 ммоль), полученного в синтезе 2, в N,N-диметилформамиде (216 мл) добавляли катализатор палладий на угле (7,00 г) и перемешивали в атмосфере водорода при комнатной температуре в течение 24 часов. Нерастворимые вещества удаляли фильтрацией через целит, и растворитель удаляли при пониженном давлении. Полученный остаток растворяли в воде, нерастворимые вещества удаляли фильтрацией через целит, и растворитель удаляли при пониженном давлении. Эти манипуляции повторяли два раза с получением названного соединения в виде бесцветного твердого вещества (3,77 г, 82%).
1H-ЯМР (DMSO-D6) δ: 2,84 (1H, дд, J=13,7, 9,8 Гц), 3,08 (1H, дд, J=13,7, 4,7 Гц), 3,50-3,72 (4H, м), 3,77-3,86 (2H, м), 3,87 (2H, с), 4,52-4,43 (1H, м), 4,61 (2H, д, J=6,6 Гц), 7,12-7,30 (5H, м), 8,43 (1H, т, J=5,9 Гц), 8,54 (1H, д, J=7,8 Гц), 8,70 (1H, т, J=6,3 Гц), 8,79 (1H, т, J=5,5 Гц).
Синтез 4: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицил-глицил-L-фенилаланил-N-[(карбоксиметокси)метил]глицинамид
К раствору соединения (3,59 г, 8,48 ммоль), полученного в синтезе 3, в N,N-диметилформамиде (85,0 мл) добавляли N-сукцинимидил 6-малеимидкапроновую кислоту (2,88 г, 9,33 ммоль) и триэтиламин (0,858 г, 8,48 ммоль) и перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли 0,1 N хлористоводородную кислоту и экстрагировали хлороформом и смешанным растворителем из хлороформа и метанола [хлороформ:метанол=4:1 (по объему)]. Полученный органический слой сушили над сульфатом натрия и фильтровали. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-отделенный органический слой хлороформа:метанол:вода=7:3: 1 (по объему)] с получением названного соединения в виде бесцветного твердого вещества (3,70 г, 71%).
1H-ЯМР (DMSO-D6) δ: 1,13-1,24 (2H, м), 1,42-1,53 (4H, м), 2,11 (2H, т, J=7,4 Гц), 2,80 (1H, дд, J=13,7, 9,8 Гц), 3,06 (1H, дд, J=13,9, 4,5 Гц), 3,37 (2H, т, J=7,2 Гц), 3,56-3,78 (6H, м), 3,97 (2H, с), 4,46-4,53 (1H, м), 4,61 (2H, д, J=6,3 Гц), 7,00 (2H, с), 7,15-7,29 (5H, м), 8,03-8,20 (3H, м), 8,32 (1H, т, J=5,9 Гц), 8,60 (1H, т, J=6,7 Гц).
Синтез 5: N-[6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил]глицил-глицил-L-фенилаланил-N-[(2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано[3',4':6,7]индолизино[1,2-b]-хинолин-1-ил]амино}-2-оксоэтокси)метил]глицинамид
К раствору мезилата соединения (4) (1,14 г, 2,00 ммоль) в N,N-диметилформамиде (40,0 мл) добавляли при 0°C триэтиламин (0,202 г, 2,00 ммоль), соединение (1,48 г, 2,40 ммоль), полученное в синтезе 4, и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (0,993 г, 3,00 ммоль), содержащий 16,4% воды, и перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=8:2 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (1,69 г, 82%). Данные инструментальных исследований соединения были идентичными данным для соединения, полученного в синтезе 8 примера 58.
Пример 75. N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-2-гидроксиацетамид
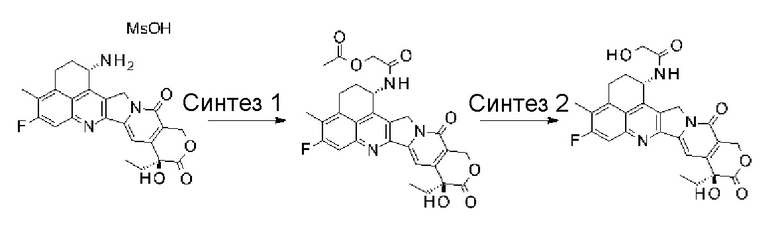
Синтез 1: 2-{[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]амино}-2-оксоэтилацетат
При охлаждении льдом, к суспензии мезилата соединения (4) (0,500 г, 0,941 ммоль) в N,N-диметилформамиде (20,0 мл) добавляли N,N-диизопропилэтиламин (0,492 мл, 2,82 ммоль) и ацетоксиацетилхлорид (0,121 мл, 1,13 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-отделенный органический слой хлороформа:метанол:вода=7:3: 1 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (0,505 г, количественно).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,4 Гц), 1,81-1,92 (2H, м), 2,08 (3H, с), 2,08-2,22 (2H, м), 2,41 (3H, с), 3,14-3,21 (2H, м), 4,51 (2H, дд, J=19,4, 14,7 Гц), 5,22 (2H, дд, J=40,1, 19,0 Гц), 5,43 (2H, с), 5,56-5,61 (1H, м), 6,53 (1H, с), 7,31 (1H, с), 7,81 (1H, д, J=11,0 Гц), 8,67 (1H, д, J=8,6 Гц).
MS (ESI) m/z: 536 (M+H)+.
Синтез 2: N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-2-гидроксиацетамид
К суспензии соединения (0,504 г, 0,941 ммоль), полученного в синтезе 1, в метаноле (50,0 мл) добавляли тетрагидрофуран (20,0 мл) и водный раствор 1 N гидроксида натрия (4,00 мл, 4,00 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакцию прерывали путем добавления 1 N хлористоводородной кислоты (5,00 мл, 5,00 ммоль), и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-отделенный органический слой хлороформа:метанол:вода=7:3:1 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (0,412 г, 89%). Присутствие этого соединения было подтверждено в опухоли мыши с инкорпорированным раком, которой вводили конъюгат антитело-лекарственное средство (55) или (56).
1H-ЯМР (400 MГц, DMSO-d6) δ: 0,87 (3H, т, J=7,3 Гц), 1,78-1,95 (2H, м), 2,09-2,28 (2H, м), 2,39 (3H, с), 3,07-3,27 (2H, м), 3,96 (2H, д, J=6,0 Гц), 5,11-5,26 (2H, м), 5,42 (2H, с), 5,46-5,54 (1H, м), 5,55-5,63 (1H, м), 6,52 (1H, с), 7,30 (1H, с), 7,78 (1H, д, J=10,9 Гц), 8,41 (1H, д, J=9,1 Гц). MS (ESI) m/z: 494 (M+H)+.
Пример 76. (Другой способ синтеза соединения примера 75)
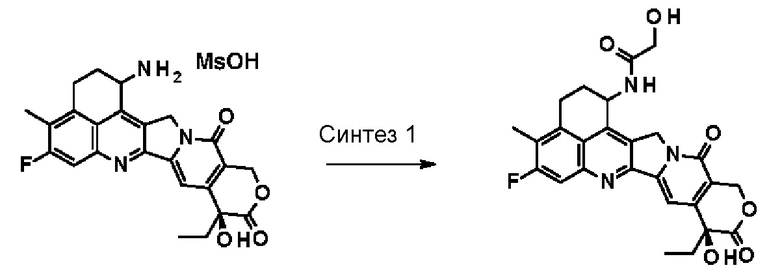
Синтез 1: N-[(1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[de]пирано-[3',4':6,7]индолизино[1,2-b]хинолин-1-ил]-2-гидроксиацетамид
Гликолевую кислоту (0,0201 г, 0,27 ммоль) растворяли в N,N-диметилформамиде (1,0 мл), добавляли N-гидроксисукцинимид (0,0302 г, 0,27 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (0,0508 г, 0,27 ммоль) и перемешивали в течение 1 часа. Реакционный раствор добавляли к суспензии N,N-диметилформамида (1,0 мл), к которому добавляли мезилат соединения (4) (0,1 г, 0,176 ммоль) и триэтиламин (0,025 мл, 0,18 ммоль), и перемешивали при комнатной температуре в течение 24 часов. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле [хлороформ-хлороформ:метанол=10:1 (по объему)] с получением названного соединения в виде бледно-желтого твердого вещества (0,080 г, 92%). Данные инструментальных исследований соединения были идентичными данным для соединения, полученного в синтезе 2 примера 75.
(Пример испытания 1). Получение вектора, экспрессирующего человеческий полноразмерный B7-H3 вариант 1
Комплементарную ДНК, кодирующую человеческий B7-H3 вариант 1, амплифицировали с помощью реакции ПЦР, используя в качестве матрицы комплементарную ДНК, синтезированную из суммарной РНК клеток LNCaP (Американская коллекция типовых культур: ATCC), и следующий набор праймеров:
праймер 1:
5'-ctatagggagacccaagctggctagcatgctgcgtcggcggggcag-3' (SEQ ID NO: 22) и
праймер 2:
5'-aacgggccctctagactcgagcggccgctcaggctatttcttgtccatcatcttctttgct gtcag-3' (SEQ ID NO: 23).
Затем полученный продукт ПЦР очищали, используя набор для очистки MagExtractor PCR & Gel clean up (фирмы Toyobo Co., Ltd.). Очищенный продукт затем расщепляли рестрикционными ферментами (NheI/NotI) и очищали, используя набор для очистки MagExtractor PCR & Gel clean up (фирмы Toyobo Co., Ltd.). ДНК плазмиду pcDNA3.1(+)(фирмы Life Technologies) расщепляли теми же самыми рестрикционными ферментами, что и упомянутые выше (NheI/NotI), и затем очищали, используя набор для очистки MagExtractor PCR & Gel clean up (фирмы Toyobo Co., Ltd.).
Эти растворы очищенных ДНК смешивали, затем добавляли к ним реагент для лигирования Ligation high (фирмы Toyobo Co., Ltd.) и инкубировали при 16°C в течение 8 часов с целью лигирования.
Компетентные клетки Escherichia coli DH5α (фирмы Life Technologies) трансформировали путем добавления полученного продукта реакции.
Полученные таким образом колонии подвергали прямому анализу колоний с помощью ПЦР, используя ПЦР праймеры и BGH обратный праймер для отбора перспективных клонов.
Полученные перспективные клоны культивировали в жидкой среде (LB/Amp), и плазмидную ДНК экстрагировали с помощью набора MagExtractor-Plasmid- (фирмы Toyobo Co., Ltd.).
Каждый полученный клон сравнивали с предоставляемой CDS последовательностью путем анализа секвенирования между
праймером 3 (праймер промотора CMV):
5'-cgcaaatgggcggtaggcgtg-3' (SEQ ID NO: 24) и
праймером 4 (BGH обратный праймер):
5'-tagaaggcacagtcgagg-3' (SEQ ID NO: 25)
с полученной плазмидной ДНК в качестве матрицы.
После подтверждения последовательности, полученный клон культивировали в 200 мл среды LB/Amp, и плазмидную ДНК экстрагировали, используя набор VioGene Plasmid Midi V-100.
Конструировали вектор в виде pcDNA3.1-B7-H3. Последовательность сайта открытой рамки считывания (ORF site) гена B7-H3 вариант 1, клонированного в вектор, показана в нуклеотидных положениях с 1 до 1602 последовательности SEQ ID NO: 26 (фигура 16) в списке последовательностей. Кроме того, аминокислотная последовательность для B7-H3 вариант 1 показана в последовательности SEQ ID NO: 1 в списке последовательностей.
(Пример испытания 2). Получение CCRF-CEM клеток, стабильно экспрессирующих ген B7-H3 вариант 1
Вектор pcDNA3.1-B7-H3, полученный в примере испытания 1, трансфицировали в CCRF-CEM клетки (ATCC) путем электропорации, используя аппарат для нуклеофекции Nucleofector II (фирмы Lonza group Ltd.). Затем клетки культивировали в течение двух ночей в среде RPMI1640 (фирмы Life Technologies), содержащей 10% фетальной бычьей сыворотки (FBS) (далее обозначаемой как 10% FBS-RPMI1640), при 37°C и 5% CO2.
После двухдневного культивирования, культура была помещена в среду 10% FBS-RPMI1640, содержащую 750 мкг/мл G418 (фирмы Life Technologies), с целью отбора CCRF-CEM клеток, в которые был стабильно интегрирован вектор pcDNA3.1-B7-H3.
После культивирования в течение одного месяца, проводили клонирование способом серийных разведений для получения одноклеточного клона. В частности, клетки, резистентные к G418, разбавляли до 10 клеток/мл, высевали в 96-луночном планшете при концентрации 100 мкл/лунка и культивировали, и пролиферирующие клетки извлекали из индивидуальных лунок.
Для подтверждения экспрессии B7-H3 в каждом извлеченном клоне использовали проточную цитометрии. В частности, каждый извлеченный клон промывали два раза с помощью PBS, содержащего 5% FBS, после чего суспендировали путем добавления PBS, содержащего 5% FBS и 10 мкг/мл M30, и выдерживали при 4°C в течение 30 минут. Клон промывали два раза с помощью PBS, содержащего 5% FBS, после чего суспендировали путем добавления фракции конъюгированного с флуоресцеином козьего IgG для мышиного IgG (полномолекулярного) (#55493, фирмы ICN Pharmaceuticals, Inc.), разбавленного в 1000 раз с помощью PBS, содержащего 5% FBS, и выдерживали при 4°C в течение 30 минут. Клон промывали два раза с помощью PBS, содержащего 5% FBS, после чего ресуспендировали в PBS, содержащем 5% FBS, и проводили анализ, используя проточный цитометр (FC500: фирмы Beckman Coulter, Inc.).
CCRF-CEM клетки, стабильно экспрессирующие ген B7-H3 вариант 1, полученные с помощью этих методик, обозначали как CEM_V1_3.1_2 клетки. Исходную линию CCRF-CEM клеток использовали в качестве клеточной линии, в которой отсутствовала экспрессия B7-H3.
(Пример испытания 3). Испытание на цитотоксичность (1) конъюгата антитело-лекарственное средство
Клетки CEM_V1_3.1_2, полученные в примере испытания 2, или Клетки CCRF-CEM (ATCC) культивировали в среде RPMI1640 (GIBCO), содержащей 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки CEM_V1_3.1_2 или клетки CCRF-CEM приготавливали, используя среду, так, чтобы их концентрация составляла 8×104 клеток/мл, и добавляли при концентрации 25 мкл/лунка в 96-луночный микропланшет для культивирования клеток, в который добавляли 65 мкл/лунка среды, и культивировали в течение ночи. На следующий день, M30-H1-L4 антитело, M30-H1-L4P антитело и конъюгат антитело-лекарственное средство, каждые разбавленные с помощью среды до 1000 нМ, 200 нМ, 40 нМ, 8 нМ, 1,6 нМ, 0,32 нМ и 0,064 нМ, добавляли при концентрации 10 мкл/лунка в микропланшет. В лунки, в которые не было добавлено испытуемого соединения, добавляли среду при концентрации 10 мкл/лунка. Клетки культивировали при 5% CO2 и 37°C в течение 3 дней. После культивирования, микропланшет вынимали из термостата и выдерживали при комнатной температуре в течение 30 минут. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и определяли величину излучения света, используя планшет-ридер (фирмы Perkin Elmer). Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a > b, которое соответствует 50% живых клеток.
Процент выживания клеток при каждой концентрации рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=10).
Конъюгаты антитело-лекарственное средство (5), (16), (21), (32), (44), (45), (46), (52) и (54) проявляли цитотоксическую активность порядка IC50<0,1 (нМ) в отношении клеток CEM_V1_3.1_2. Конъюгаты антитело-лекарственное средство (1), (12), (13), (20), (28), (29), (35), (36), (37), (41), (49) и (53) проявляли цитотоксическую активность порядка 0,1<IC50<1 (нМ) в отношении клеток. Конъюгаты антитело-лекарственное средство (33), (34), (47), (48), (50) и (51) проявляли цитотоксическую активность порядка 1<IC50<100 (нМ) в отношении клеток. С другой стороны, ни один из этих конъюгатов не проявлял цитотоксической активности в отношении клеток CCRF-CEM (>100 (нМ)). Ни M30-H1-L4 антитело, ни M30-H1-L4P антитело не проявляли цитотоксической активности в отношении и той, и другой линии клеток (>100 (нМ)).
(Пример испытания 4). Испытание на цитотоксичность (2) конъюгата антитело-лекарственное средство
Антиген-положительные клетки линии клеток SR (ATCC) или антиген-отрицательные клетки линии клеток Daudi (ATCC) культивировали в среде RPMI1640 (GIBCO), содержащей 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки SR или клетки Daudi приготавливали, используя среду, так, чтобы они имели концентрацию 2,8×104 клеток/мл, и добавляли при концентрации 90 мкл/лунка в 96-луночный микропланшет для культивирования клеток. Через два часа, анти-CD30 антитело и конъюгаты антитело-лекарственное средство (6) и (7), каждые разбавленные с помощью среды до 40 нМ, 8 нМ, 1,6 нМ, 320 пM, 64 пM, 12,8 пM и 2,6 пM, добавляли при концентрации 10 мкл/лунка в микропланшет. В лунки, в которые не добавляли испытуемого соединения, добавляли среду при концентрации 10 мкл/лунка. Клетки культивировали при 5% CO2 и 37°C в течение 3 дней. После культивирования, микропланшет вынимали из термостата и выдерживали при комнатной температуре в течение 30 минут. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и определяли величину излучения света, используя планшет-ридер (фирмы Perkin Elmer). Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a>b, которое соответствует 50% живых клеток.
Процент выживания клеток при каждой концентрации рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=12).
Конъюгаты антитело-лекарственное средство (6) и (7) проявляли цитотоксическую активность порядка IC50<0,01 (нМ) в отношении клеток SR. С другой стороны, конъюгаты антитело-лекарственное средство (6) и (7) не проявляли никакой цитотоксической активности в отношении клеток Daudi (>4,0 (нМ)). Анти-CD30 антитело не проявляло цитотоксической активности в отношении и тех, и других клеток (>4,0 (нМ)).
(Пример испытания 5). Испытание на цитотоксичность (3) конъюгата антитело-лекарственное средство
Антиген-положительные клетки линии клеток SR (ATCC) культивировали в среде RPMI1640 (GIBCO), содержащей 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки SR приготавливали, используя среду, так, чтобы они имели концентрацию 2,8×104 клеток/мл, и добавляли при концентрации 90 мкл/лунка в 96-луночный микропланшет для культивирования клеток. Через два часа, анти-CD30 антитело и конъюгаты антитело-лекарственное средство (22), (23), (38), (64) и (65), каждые разбавленные с помощью среды до 1000 нМ, 100 нМ, 10 нМ, 1 нМ, 100 пM, 10 пM и 1 пM, добавляли при концентрации 10 мкл/лунка в микропланшет. В лунки, в которые не добавляли испытуемого соединения, добавляли среду при концентрации 10 мкл/лунка. Клетки культивировали при 5% CO2 и 37°C в течение 6 дней. После культивирования, микропланшет вынимали из термостата и выдерживали при комнатной температуре в течение 30 минут. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и определяли величину излучения света, используя планшет-ридер (фирмы Perkin Elmer). Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a > b, которое соответствует 50% живых клеток.
Процент выживания клеток при каждой концентрации рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=12).
Конъюгаты антитело-лекарственное средство (23), (38), (64) и (65) проявляли цитотоксическую активность порядка IC50<0,01 (нМ) в отношении клеток SR. Конъюгат антитело-лекарственное средство (22) проявлял цитотоксическую активность порядка IC50<0,1 (нМ) в отношении клеток SR. Анти-CD30 антитело не проявляло цитотоксической активности в отношении клеток SR (>4,0 (нМ)).
(Пример испытания 6). Испытание на цитотоксичность (4) конъюгата антитело-лекарственное средство
Антиген-положительные клетки линии клеток HL-60 (ATCC) или антиген-отрицательные клетки линии клеток Raji (ATCC) культивировали в среде RPMI1640 (GIBCO), содержащей 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки HL-60 или клетки Raji приготавливали, используя среду, так, чтобы они имели концентрацию 8×104 клеток/мл, и добавляли при концентрации 25 мкл/лунка в 96-луночный микропланшет для культивирования клеток, в который было добавлено 65 мкл/лунка среды. Анти-CD33 антитело и конъюгаты антитело-лекарственное средство (8) и (9), каждые разбавленные с помощью среды до 1000 нМ, 200 нМ, 40 нМ, 8 нМ, 1,6 нМ, 0,32 нМ и 0,064 нМ, добавляли при концентрации 10 мкл/лунка в микропланшет. В лунки, в которые не добавляли испытуемого соединения, добавляли среду при концентрации 10 мкл/лунка. Клетки культивировали в течение 3 дней при 5% CO2 и 37°C. После культивирования, микропланшет вынимали из термостата и выдерживали при комнатной температуре в течение 30 минут. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и определяли величину излучения света, используя планшет-ридер (фирмы Perkin Elmer). Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a>b, которое соответствует 50% живых клеток.
Процент выживания клеток при каждой концентрации рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=5).
Конъюгаты антитело-лекарственное средство (8) и (9) проявляли цитотоксическую активность порядка IC50<0,1 (нМ) в отношении клеток HL-60. С другой стороны, конъюгаты антитело-лекарственное средство (8) и (9) не проявляли цитотоксической активности в отношении клеток Raji (>100 (нМ)). Анти-CD33 антитело не проявляло цитотоксической активности в отношении ни тех, ни других клеток (>100 (нМ)).
(Пример испытания 7). Испытание на цитотоксичность (5) конъюгата антитело-лекарственное средство
Антиген-положительные клетки клеточной линии NOMO-1 (HSRRB) культивировали в среде RPMI1640 (GIBCO), содержащей 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки NOMO-1 приготавливали, используя среду, так, чтобы они имели концентрацию 2,8×104 клеток/мл, и добавляли при концентрации 90 мкл/лунка в 96-луночный микропланшет для культивирования клеток. Через два часа, анти-CD33 антитело и конъюгаты антитело-лекарственное средство (24), (25) и (67), каждые разбавленные с помощью среды до 1000 нМ, 200 нМ, 40 нМ, 8 нМ, 1,6 нМ, 0,32 нМ и 0,064 нМ, добавляли при концентрации 10 мкл/лунка в микропланшет. В лунки, в которые не добавляли испытуемого соединения, добавляли среду при концентрации 10 мкл/лунка. Клетки культивировали при 5% CO2 и 37°C в течение 6 дней. После культивирования, микропланшет вынимали из термостата и выдерживали в течение 30 минут при комнатной температуре. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и определяли величину излучения света, используя планшет-ридер (фирмы Perkin Elmer). Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a>b, которое соответствует 50% живых клеток.
Процент выживания клеток при каждой концентрации рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=5).
Конъюгат антитело-лекарственное средство (25) проявлял цитотоксическую активность порядка IC50<0,1 (нМ) в отношении клеток NOMO-1. Конъюгаты антитело-лекарственное средство (24) и (67) проявляли цитотоксическую активность порядка 1<IC50<100 (нМ) в отношении клеток NOMO-1. Анти-CD33 антитело не проявляло цитотоксической активности в отношении клеток NOMO-1 (>100 (нМ)).
(Пример испытания 8). Испытание на цитотоксичность (6) конъюгата антитело-лекарственное средство
Антиген-положительные клетки клеточной линии U251 (ATCC) или антиген-отрицательные клетки клеточной линии MCF-7 (ATCC) культивировали в среде RPMI1640 (GIBCO), содержащей 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки U251 или клетки MCF-7 приготавливали, используя среду, так, чтобы они имели концентрацию 2,8×104 клеток/мл, и добавляли при концентрации 90 мкл/лунка в 96-луночный микропланшет для культивирования клеток, и культивировали в течение ночи. На следующий день, анти-CD70 антитело и конъюгаты антитело-лекарственное средство (10) и (11), каждые разбавленные с помощью среды до 1000 нМ, 200 нМ, 40 нМ, 8 нМ, 1,6 нМ, 0,32 нМ и 0,064 нМ, добавляли при концентрации 10 мкл/лунка в микропланшет. В лунки, в которые не добавляли испытуемого соединения, добавляли среду при концентрации 10 мкл/лунка. Клетки культивировали при 5% CO2 и 37°C в течение 6 дней. После культивирования, микропланшет вынимали из термостата и выдерживали при комнатной температуре в течение 30 минут. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и определяли величину излучения света, используя планшет-ридер (фирмы Perkin Elmer). Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a>b, которое соответствует 50% живых клеток.
Процент выживания клеток при каждой концентрации рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=12).
Конъюгаты антитело-лекарственное средство (10) и (11) проявляли цитотоксическую активность порядка IC50<1 (нМ) в отношении клеток U251. С другой стороны, конъюгаты антитело-лекарственное средство (10) и (11) не проявляли цитотоксической активности в отношении клеток MCF-7 (≥90 (нМ)). Анти-CD70 антитело не проявляло цитотоксической активности в отношении ни тех, ни других клеток (>100 (нМ)).
(Пример испытания 9) Испытание на цитотоксичность (7) конъюгата антитело-лекарственное средство
Антиген-положительные клетки линии клеток U251 (ATCC) культивировали в среде RPMI1640 (GIBCO), содержащей 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки U251 приготавливали, используя среду, так, чтобы они имели концентрацию 2,8×104 клеток/мл, и добавляли при концентрации 90 мкл/лунка в 96-луночный микропланшет для культивирования клеток. Через два часа, анти-CD70 антитело и конъюгаты антитело-лекарственное средство (26), (27), (40), (68) и (69), каждые разбавленные с помощью среду до 1000 нМ, 200 нМ, 40 нМ, 8 нМ, 1,6 нМ, 0,32 нМ и 0,064 нМ, добавляли при концентрации 10 мкл/лунка в микропланшет. В лунки, в которые не добавляли испытуемого соединения, добавляли среду при концентрации 10 мкл/лунка. Клетки культивировали при 5% CO2 и 37°C в течение 6 дней. После культивирования, микропланшет вынимали из термостата и выдерживали при комнатной температуре в течение 30 минут. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и определяли величину излучения света, используя планшет-ридер (фирмы Perkin Elmer). Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a > b, которое соответствует 50% живых клеток.
Процент выживания клеток при каждой концентрации рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=12).
Конъюгаты антитело-лекарственное средство (26), (27), (40) и (69) проявляли цитотоксическую активность порядка 1<IC50<10 (нМ) в отношении клеток U251. Конъюгат антитело-лекарственное средство (68) проявлял цитотоксическую активность порядка 10<IC50<100 (нМ) в отношении клеток U251. Анти-CD70 антитело не проявляло цитотоксической активности в отношении коеток U251 (>100 (нМ)).
(Пример испытания 10). Испытание на цитотоксичность (8) высвобождающегося лекарственного средства
Клетки A375 (ATCC) культивировали в среде DMEM (GIBCO), содержащией 10% фетальной бычьей сыворотки (MOREGATE) (далее называемой средой). Клетки A375 приготавливали, используя среду, так, чтобы они имели концентрацию 4×104 клеток/мл, и добавляли при концентрации 25 мкл/лунка в 96-луночный микропланшет для культивирования клеток (фирмы CORNING), в который было добавлено 65 мкл/лунка среды, и культивировали в тчение ночи. На следующий день, каждое испытуемое соединение, разбавленное с помощью DMSO до 1000 нМ, 200 нМ, 40 нМ, 8 нМ, 1,6 нМ, 0,32 нМ и 0,064 нМ, добавляли при концентрации 0,5 мкл/лунка в микропланшет. В лунки, в которое не было добавлено испытуемое соединение, добавляли DMSO при концентрации 0,5 мкл/лунка. Объем среды в каждой лунке доводили до 100 мкл путем добавления 10 мкл/лунка среды, и культивировали клетки в течение 6 дней при 5% CO2 и 37°C. После культивирования, микропланшет вынимали из термостата и выдерживали при комнатной температуре в течение 30 минут. В культуральный раствор добавляли равное количество реагента для определения жизнеспособности клеток CellTiter-Glo Luminescent Cell Viability Assay (фирмы Promega) и перемешивали. Затем микропланшет выдерживали при комнатной температуре в течение 10 минут, и измеряли величину излучения света, используя планшет-ридер. Значение IC50 рассчитывали по следующему уравнению:
IC50 (нМ)=антилогарифм((50-d)×(LOG10b-LOG10a)/(d-c)+LOG10b),
a: Концентрация a испытуемого соединения,
b: Концентрация b испытуемого соединения,
c: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации a,
d: Доля живых клеток, к которым было добавлено испытуемое соединение при концентрации b.
Концентрации a и b удовлетворяют требованию соотношения a>b, которое соответствует 50% живых клеток.
Процент выживания клеток рассчитывали по следующему уравнению:
Процент выживания клеток (%)=a/b×100,
a: Средняя величина излучения лунок, в которые было добавлено испытуемое соединение (n=2),
b: Средняя величина излучения лунок, в которые не было добавлено испытуемого соединения (n=10).
Соединение примера (75) и эксатекан проявляли цитотоксическую активность порядка 0,1<IC50<1 (нМ) в отношении клеток A375. Соединение примера (42) проявляло цитотоксическую активность порядка 1<IC50<10 (нМ) в отношении клеток A375. Соединение примера (1) проявляло цитотоксическую активность порядка 10<IC50<100 (нМ) в отношении клеток A375.
(Пример испытания 11). Испытание на противоопухолевую активность (1)
Мышь: перед использованием в эксперименте, самок в возрасте от 5 до 6 недель линии бестимусных мышей BALB/c (фирмы Charles River Laboratories Japan, Inc.) акклиматизировали в течение от 4 до 7 дней в условиях, не содержащих специфической патогенной микрофлоры. Мышей кормили стерилизованным твердым кормом (FR-2, фирмы Funabashi Farms Co., Ltd) и давали стерилизованную водопроводную воду (полученную путем добавления от 5 до 15 м.д. раствора гипохлорита натрия).
Исследование и формула для расчета: во всех исследованиях, измеряли два раза в неделю длинную ось и короткую ось опухоли, используя штангенциркуль с электронным цифровым отсчетом (CD-15C, фирмы Mitutoyo Corp.), и рассчитывали объем опухоли (мм3). Формула для расчета приведена ниже.
Объем опухоли (мм3)=1/2 × длинная ось (мм) × [короткая ось (мм)]2.
Все конъюгаты антитело-лекарственное средство разбавляли физиологическим раствором (фирмы Otsuka Pharmaceutical Factory, Inc.) и использовали при дозе 10 мл/кг для внутривенного введения в хвост каждой мыши. Меланомные клетки человека линии A375 приобретали у Американской коллекции типовых культур (ATCC). Суспендированные в физиологическом растворе 8×106 клеток подкожно трансплантировали в правую часть брюшной полости каждой самки линии бестимусных мышей (день 0), и мышей группировали случайным образом на день 11. M30-H1-L4P антитело и конъюгат антитело-лекарственное средство (2) каждый вводили внутривенно в дозе 10 мг/кг в хвост каждой мыши на день 11, 18 и 25.
Результаты приведены на фигуре 17. На чертеже, линия с незакрашенными ромбами представляет результаты для не подвергнутой лечению опухоли, линия с незакрашенными треугольниками иллюстрирует воздействие M30-H1-L4P антитела, и линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2).
Как видно из этих результатов, введение конъюгата антитело-лекарственное средство (2) заметно уменьшает объем опухоли, и после последнего введения последующий рост опухоли не отмечался. В отличие от этого, введение M30-H1-L4P антитела приводило к прогрессии роста опухоли.
Кроме того, у мышей, которые получали конъюгат антитело-лекарственное средство (2), не наблюдались такие характерные признаки, как потеря веса, что позволяло предположить, что конъюгат антитело-лекарственное средство (2) является малотоксичным и исключительно безопасным.
(Пример испытания 12). Испытание на противоопухолевую активность (2)
Меланомные клетки человека линии A375 приобретали у Американской коллекции типовых культур (ATCC). Суспендированные в физиологическом растворе 6×106 клеток подкожно трансплантировали в правую часть брюшной полости каждой самки линии бестимусных мышей (день 0), и мышей группировали случайным образом на день 18. Конъюгат антитело-лекарственное средство (2) вводили внутривенно при каждой дозе дозе (0,1, 0,3 и 1,3 мг/кг) в хвост каждой мыши на день 18, 25 и 32 по схеме один раз в неделю на протяжении трех недель.
Результаты приведены на фигуре 18. На чертеже, линия с незакрашенными ромбами представляет результаты для не подвергнутой лечению опухоли, линия с закрашенными квадратами иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), вводимого при дозе 0,1 мг/кг, линия с символами X иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), вводимого при дозе 0,3 мг/кг, линия с закрашенными треугольниками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), вводимого при дозе 1 мг/кг, и линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2), вводимого при дозе 3 мг/кг. Конъюгат антитело-лекарственное средство (2) проявлял зависимую от дозы эффективность с точки зрения уменьшения опухоли.
(Пример испытания 13). Испытание на противоопухолевую активность (3)
Клетки линии Calu-6 немелкоклеточного рака легкого у человека приобретали у Американской коллекции типовых культур (ATCC). Суспендированные в физиологическом растворе 5×106 клеток подкожно трансплантировали в правую часть брюшной полости каждой самки линии бестимусных мышей (день 0), и мышей группировали случайным образом на день 11. M30-H1-L4P антитело и конъюгат антитело-лекарственное средство (2) каждый вводили внутривенно в дозе 10 мг/кг в хвост каждой мыши на день 11, 18 и 25 по схеме один раз в неделю на протяжении трех недель.
Результаты приведены на фигуре 19. На чертеже, линия с незакрашенными ромбами представляет результаты для не подвергнутой лечению опухоли, линия с незакрашенными треугольниками иллюстрирует воздействие M30-H1-L4P антитела, и линия с незакрашенными кружками иллюстрирует воздействие конъюгата антитело-лекарственное средство (2). Введение конъюгата антитело-лекарственное средство (2) заметно уменьшает объем опухоли, и последующий рост опухоли после последнего введения не отмечался. В отличие от этого, введение M30-H1-L4P антитела приводило к прогрессии роста опухоли.
Кроме того, у мышей, которые получали конъюгат антитело-лекарственное средство (2) не наблюдались такие характерные признаки, как потеря веса, что позволяло предположить, что конъюгат антитело-лекарственное средство (2) является малотоксичным и исключительно безопасным.
(Пример испытания 14). Испытание на противоопухолевую активность (4)
Меланомные клетки человека линии A375 приобретали у Американской коллекции типовых культур (ATCC). Суспендированные в физиологическом растворе 8×106 клеток подкожно трансплантировали в правую часть брюшной полости каждой самки линии бестимусных мышей (день 0), и мышей группировали случайным образом на день 21. Конъюгаты антитело-лекарственное средство (1), (13), (41) и (55) каждый вводили внутривенно при дозе 10 мг/кг в хвост каждой мыши на день 21.
Результаты приведены на фигуре 20. На чертеже, линия с незакрашенными ромбами представляет результаты для не подвергнутой лечению опухоли, линия с незакрашенными кружками иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (1), линия с незакрашенными треугольниками иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (13), линия с символами X иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (41), и линия с незакрашенными квадратами иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (55). Введение конъюгата антитело-лекарственное средство (1), (13), (41) или (55) заметно уменьшает объем опухоли, и все эти конъюгаты антитело-лекарственное средство проявляют ингибирующее воздействие на рост опухоли.
Кроме того, у мышей, которые получали конъюгат антитело-лекарственное средство (1), (13), (41) или (55), не наблюдались такие характерные признаки, как потеря веса, что позволяло предположить, что конъюгаты антитело-лекарственное средство (1), (13), (41) и (55) являются малотоксичными и исключительно безопасными.
(Пример испытания 15). Испытание на противоопухолевую активность (5)
Клетки линии Calu-6 немелкоклеточного рака легкого у человека приобретали у Американской коллекции типовых культур (ATCC). Суспендированные в физиологическом растворе 5×106 клеток подкожно трансплантировали в правую часть брюшной полости каждой самки линии бестимусных мышей (день 0), и мышей группировали случайным образом на день 12. Конъюгаты антитело-лекарственное средство (13), (41) и (55) внутривенно вводили при дозе 10 мг/кг в хвост каждой мыши на день 12. В качестве контроля для сравнения, внутривенно вводили DE-310 при дозе 0,1 мг/кг в хвост каждой мыши на день 12. В данном случае, упомянутая выше доза конъюгата антитело-лекарственное средство была обусловлена количеством антитела в конъюгате, а упомянутая выше доза DE-310 обуславливалась количеством содержащимся в нем лекарственного средства. В связи с этим, количества лекарственных средств, содержавшихся в конъюгате антитело-лекарственное средство и DE-310, соответственно, соотносились друг к другу как 1:100. Это означает, что дозы конъюгата антитело-лекарственное средство и DE-310 были равными с точки зрения количеств содержавшихся в них лекарственных средств.
Результаты приведены на фигуре 21. На чертеже, линия с незакрашенными ромбами представляет результаты для не подвергнутой лечению опухоли, линия с незакрашенными кружками иллюстрирует воздействие DE-310, линия с незакрашенными треугольниками иллюстрирует воздействие конъюгата антитело-лекарственное средство (13), линия с символами X иллюстрирует воздействие конъюгата антитело-лекарственное средство (41), и линия с незакрашенными квадратами иллюстрирует воздействие конъюгата антитело-лекарственное средство (55). Введение конъюгата антитело-лекарственное средство (13), (41) или (55) заметно уменьшает объем опухоли, в то время как введение DE-310 не приводило к уменьшению объема опухоли.
Кроме того, у мышей, которые получали конъюгат антитело-лекарственное средство (13), (41) или (55), не наблюдались такие характерные признаки, как потеря веса, что позволяло предположить, что эти конъюгаты антитело-лекарственное средство являются малотоксичными и исключительно безопасными.
(Пример испытания 16). Испытание на противоопухолевую активность (6)
Меланомные клетки человека линии A375 приобретали у Американской коллекции типовых культур (ATCC). Суспендированные в физиологическом растворе 1×107 клеток подкожно трансплантировали в правую часть брюшной полости каждой самки линии бестимусных мышей (день 0), и мышей группировали случайным образом на день 11. Конъюгаты антитело-лекарственное средство (17), (18), (19), (59), (60) и (61) каждый внутривенно вводили при дозе 3 мг/кг в хвост каждой мыши на день 11 и 18 по схеме один раз в неделю в течение двух недель.
Результаты приведены на фигуре 22. На чертеже, линия с закрашенными ромбами представляет результаты для не подвергнутой лечению опухоли, линия с закрашенными квадратами иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (17), линия с незакрашенными треугольниками иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (18), линия с незакрашенными кружками иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (19), линия с закрашенными треугольниками иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (59), линия с незакрашенными квадратами иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (60), и линия с символами X иллюстрирует воздействие введенного конъюгата антитело-лекарственное средство (61).
Введение конъюгата антитело-лекарственное средство (17), (18), (19), (59), (60) или (61) заметно уменьшает объем опухоли, и все эти конъюгаты антитело-лекарственное средство проявляют ингибирующее воздействие на рост опухоли.
Кроме того, у мышей, которые получали конъюгат антитело-лекарственное средство (17), (18), (19), (59), (60) или (61), не наблюдались такие характерные признаки, как потеря веса, что позволяло предположить, что эти конъюгаты антитело-лекарственное средство являются малотоксичными и исключительно безопасными.
Свободный текст списка последовательностей
SEQ ID NO: 1 - Аминокислотная последовательность B7-H3 вариант 1.
SEQ ID NO: 2 - Аминокислотная последовательность B7-H3 вариант 2.
SEQ ID NO: 3 - Аминокислотная последовательность CDRH1 в M30 антителе.
SEQ ID NO: 4 - Аминокислотная последовательность CDRH2 в M30 антителе.
SEQ ID NO: 5 - Аминокислотная последовательность CDRH3 в M30 антителе.
SEQ ID NO: 6 - Аминокислотная последовательность CDRL1 в M30 антителе.
SEQ ID NO: 7 - Аминокислотная последовательность CDRL2 в M30 антителе.
SEQ ID NO: 8 - Аминокислотная последовательность CDRL3 в M30 антителе.
SEQ ID NO: 9 - Аминокислотная последовательность M30-H1-типа тяжелой цепи.
SEQ ID NO: 10 - Аминокислотная последовательность M30-H2-типа тяжелой цепи.
SEQ ID NO: 11 - Аминокислотная последовательность M30-H3-типа тяжелой цепи.
SEQ ID NO: 12 - Аминокислотная последовательность M30-H4-типа тяжелой цепи.
SEQ ID NO: 13 - Аминокислотная последовательность M30-L1-типа легкой цепи.
SEQ ID NO: 14 - Аминокислотная последовательность M30-L2-типа легкой цепи.
SEQ ID NO: 15 - Аминокислотная последовательность M30-L3-типа легкой цепи.
SEQ ID NO: 16 - Аминокислотная последовательность M30-L4-типа легкой цепи.
SEQ ID NO: 17 - Аминокислотная последовательность M30-L5-типа легкой цепи.
SEQ ID NO: 18 - Аминокислотная последовательность M30-L6-типа легкой цепи.
SEQ ID NO: 19 - Аминокислотная последовательность M30-L7-типа легкой цепи.
SEQ ID NO: 20 - Аминокислотная последовательность тяжелой цепи в M30 антителе.
SEQ ID NO: 21 - Аминокислотная последовательность легкой цепи в M30 антителе
SEQ ID NO: 22 - ПЦР праймер 1.
SEQ ID NO: 23 - ПЦР праймер 2.
SEQ ID NO: 24 - праймер промотора CMV: праймер 3.
SEQ ID NO: 25 - BGH обратный праймер: праймер 4.
SEQ ID NO: 26 - Нуклеотидная последовательность B7-H3 вариант 1.
SEQ ID NO: 27 - Аминокислотная последовательность тяжелой цепи в анти-CD30 антителе.
SEQ ID NO: 28 - Аминокислотная последовательность легкой цепи в анти-CD30 антителе.
SEQ ID NO: 29 - Аминокислотная последовательность тяжелой цепи в анти-CD33 антителе.
SEQ ID NO: 30 - Аминокислотная последовательность легкой цепи в анти-CD33 антителе.
SEQ ID NO: 31 - Аминокислотная последовательность тяжелой цепи в анти-CD70 антителе.
SEQ ID NO: 32 - Аминокислотная последовательность легкой цепи в анти-CD70 антителе.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2013 |
|
RU2776489C2 |
| КОНЪЮГАТ АНТИ-TROP2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2705367C2 |
| КОНЪЮГАТ АНТИ-TROP2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2021 |
|
RU2840864C2 |
| КОНЪЮГАТ АНТИ-HER3 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2711640C2 |
| КОНЪЮГАТ АНТИ-TROP2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2743077C2 |
| АНТИ-HER2 КОНЪЮГАТ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2015 |
|
RU2794183C2 |
| КОНЪЮГАТ АНТИ-HER3 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2802211C2 |
| АНТИ-HER2 КОНЪЮГАТ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2015 |
|
RU2683780C2 |
| КОНЪЮГАТ АНТИТЕЛО ПРОТИВ MUC1-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2019 |
|
RU2804703C2 |
| АНТИ-CDH6-АНТИТЕЛО И КОНЪЮГАТ АНТИ-CDH6-АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2018 |
|
RU2798285C2 |



















































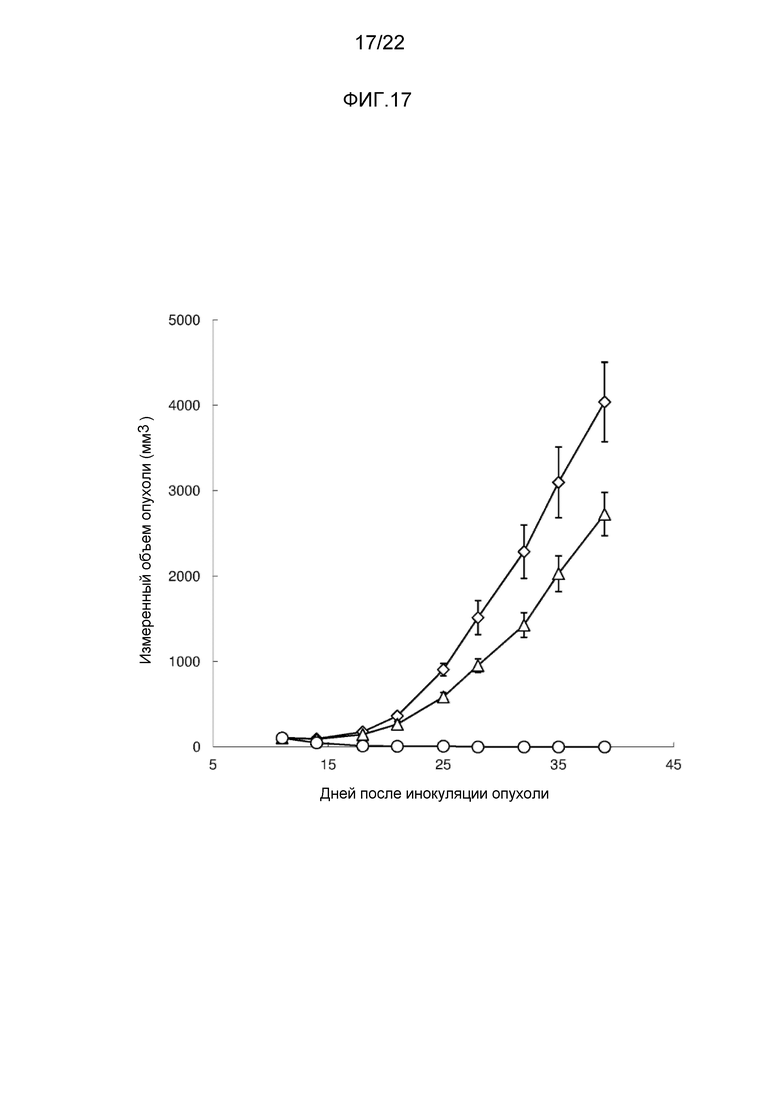
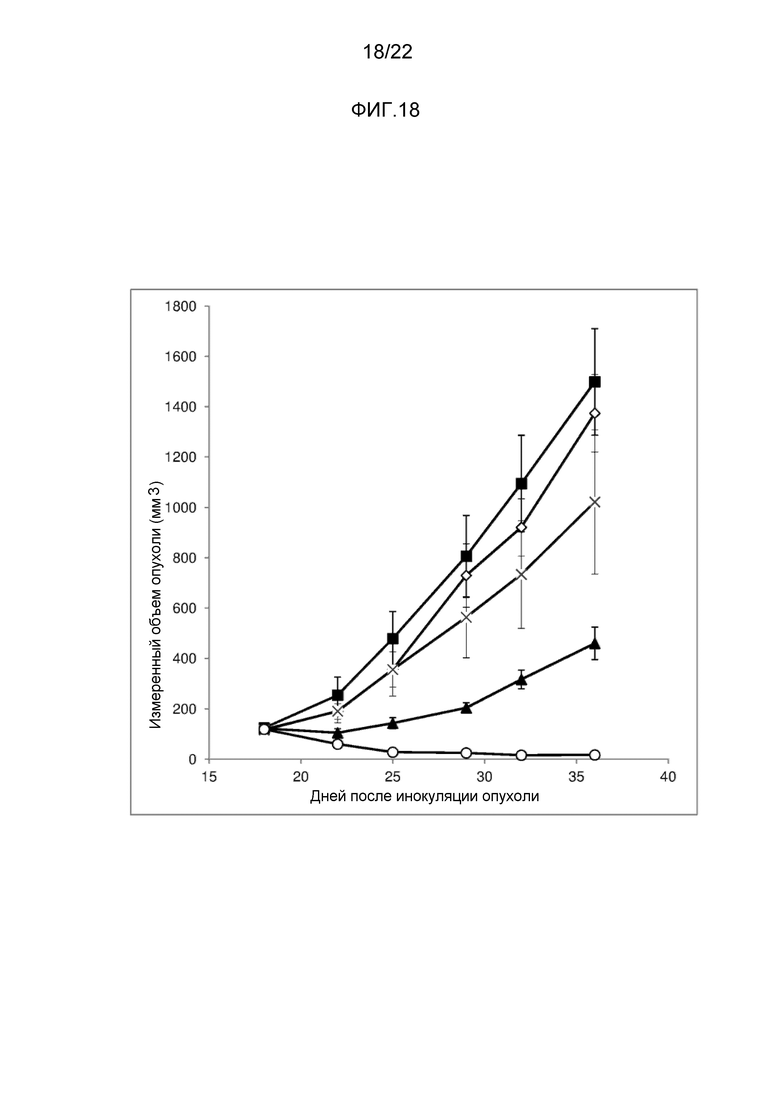
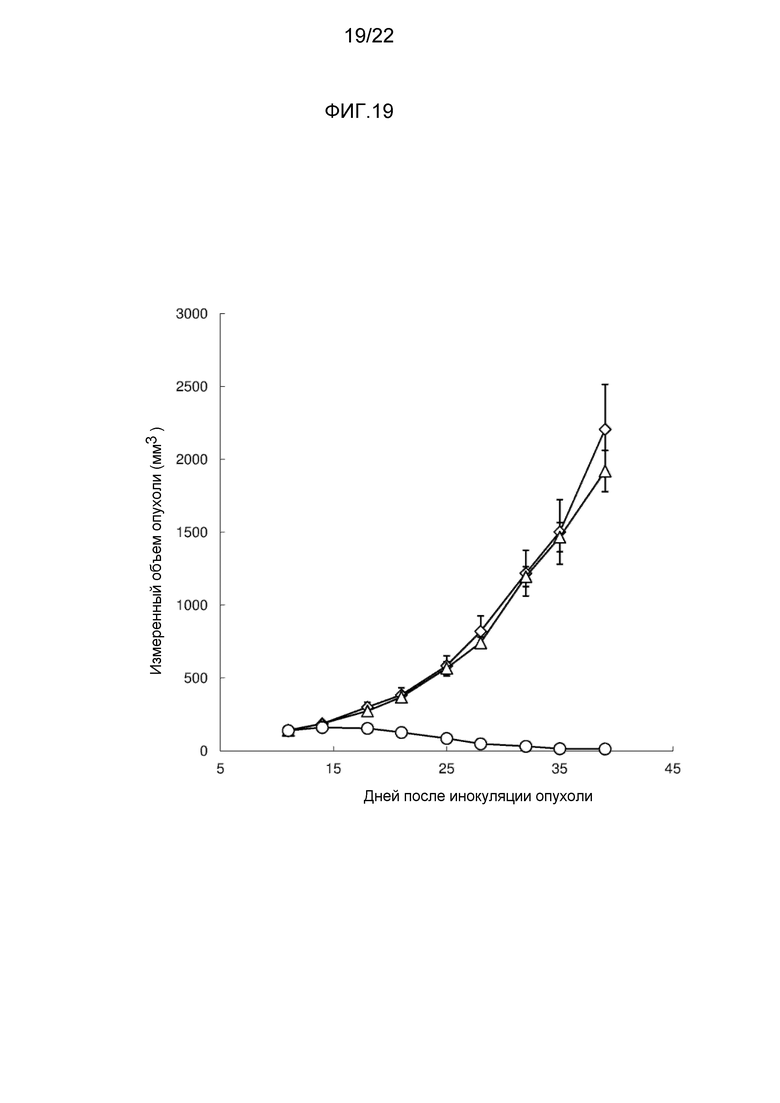
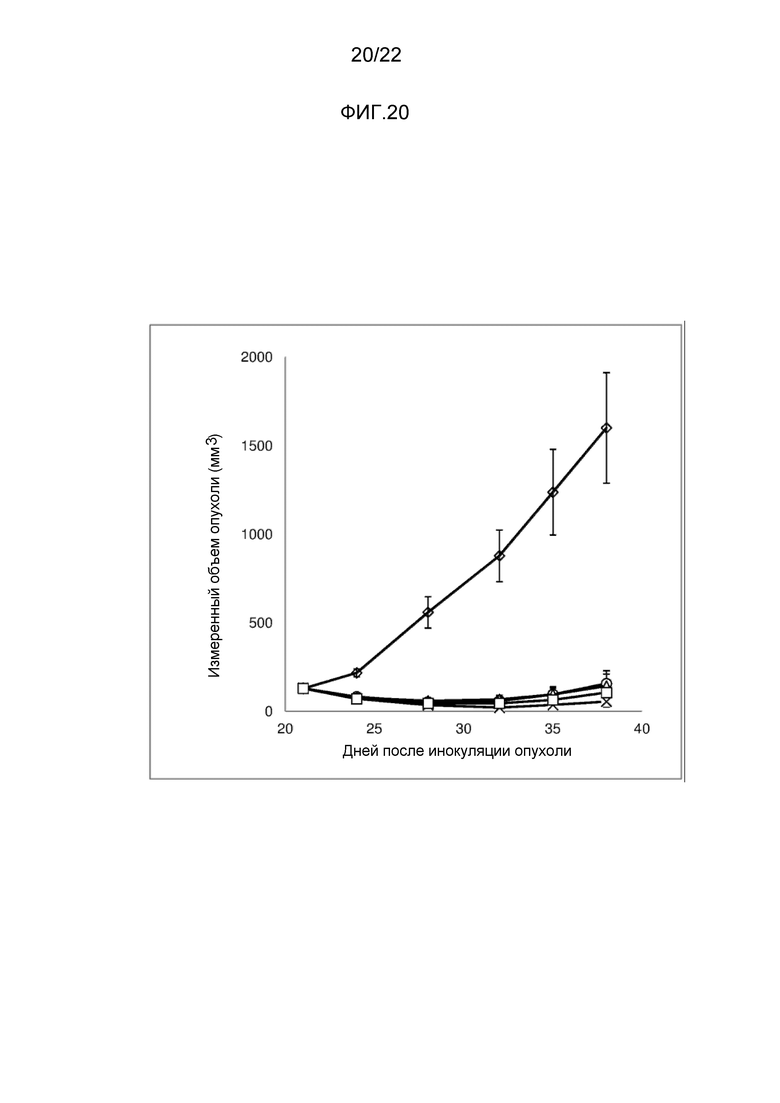
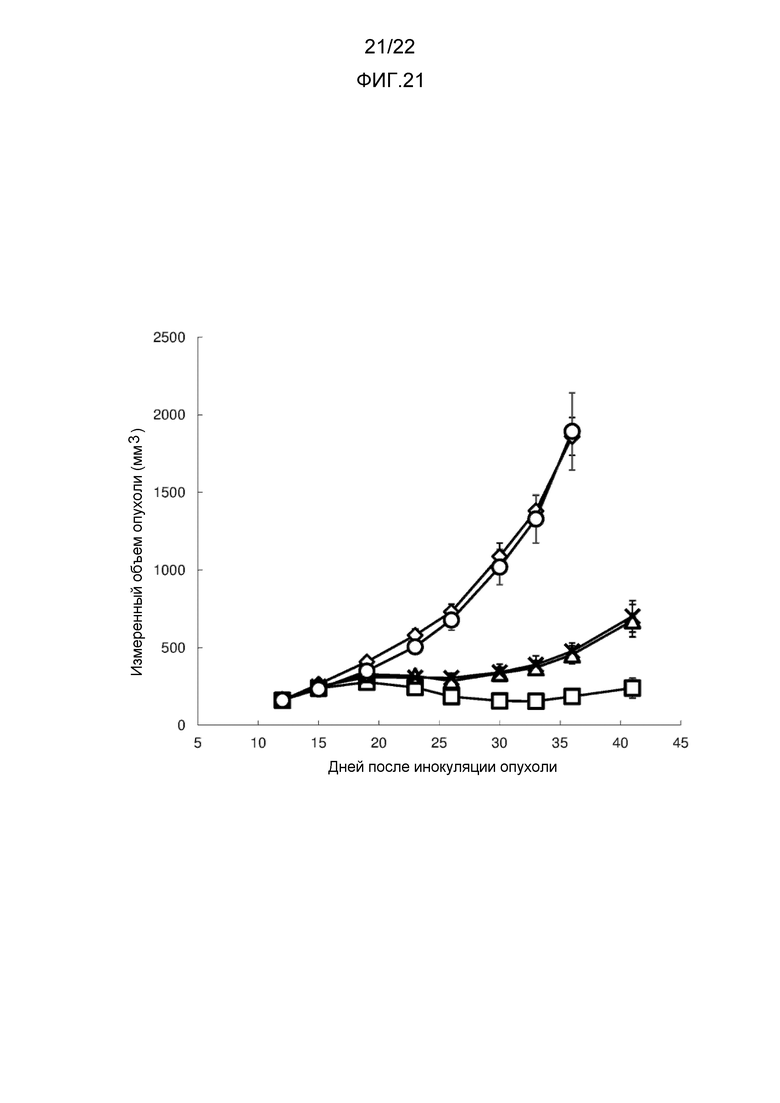
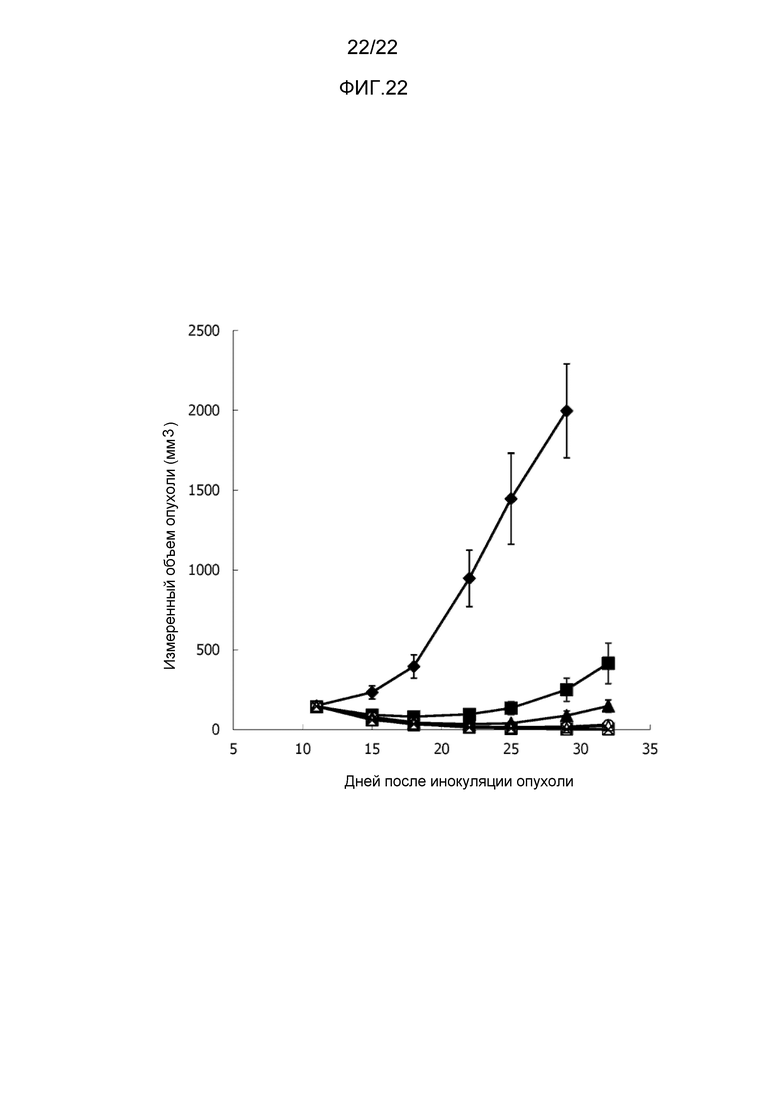
Изобретение относится к области биохимии. Описана группа изобретений, включающая конъюгат антитело-лекарственное средство для лечения опухоли и/или рака, лекарственное средство, противоопухолевое лекарственное средство и/или противораковое лекарственное средство, содержащие вышеуказанный конъюгат антитело-лекарственное средство, фармацевтическую композицию, способ лечения опухоли и/или рака, промежуточное соединение лекарственное средство-линкер, линкер для получения вышеуказанного конъюгата антитело-лекарственное средство. Конъюгат антитело-лекарственное средство содержит в себе противоопухолевое соединение, конъюгированное с антителом через линкер, имеющий структуру, представленную следующей формулой: -L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-, где антитело присоединено к концу L1, а противоопухолевое соединение присоединено к концу Lc с помощью атома азота аминогруппы в положение 1 в качестве положения для соединения. Предложенное изобретение расширяет арсенал средств с противоопухолевой активностью. 7 н. и 46 з.п. ф-лы, 22 ил., 75 пр.
1. Конъюгат антитело-лекарственное средство для лечения опухоли и/или рака, содержащий антитело, направленно воздействующее на опухоль и интернализирующее опухоль, и противоопухолевое соединение, где противоопухолевое соединение, представленное следующей формулой:
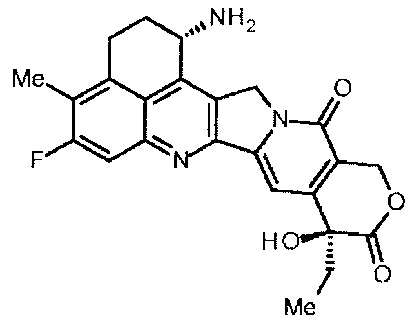 ,
,
конъюгировано с антителом через линкер, имеющий структуру, представленную следующей формулой:
-L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-,
где антитело присоединено к концу L1, противоопухолевое соединение присоединено к концу Lc с помощью атома азота аминогруппы в положение 1 в качестве положения присоединения,
где
n1 представляет целое число от 0 до 6,
L1 представляет -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-, -CH2-C(=O)-NH-(CH2)n3-C(=O)-, -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- или -C(=O)-(CH2)n4-C(=O)-,
где n2 представляет целое число от 2 до 8, n3 представляет целое число от 1 до 8, n4 представляет целое число от 1 до 8,
L2 представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-, -S-(CH2)n6-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6, n6 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
-(N-ли-3-диминицкус)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к L2 в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу, и когда L2 представляет собой -S-(CH2)n6-C(=O)-, L1 представляет собой -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-.
2. Конъюгат антитело-лекарственное средство по п. 1, где LP представляет собой пептидный остаток, включающий аминокислоту, выбранную из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты.
3. Конъюгат антитело-лекарственное средство по п. 1, где
LP представляет тетрапептидный остаток,
La представляет -O- или одинарную химическую связь,
Lb представляет -CR2(-R3)- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми, и
Lc представляет -C(=O)-.
4. Конъюгат антитело-лекарственное средство по п. 1, где
LP представляет тетрапептидный остаток GGFG,
La представляет -O- или одинарную химическую связь,
Lb представляет -CR2(-R3)- или одинарную химическую связь,
где R2 и R3 каждый представляет атом водорода, и
Lc представляет -C(=O)-.
5. Конъюгат антитело-лекарственное средство по п. 1, где L1 представляет собой -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)- или -CH2-C(=O)-NH-(CH2)n3-C(=O)-.
6. Конъюгат антитело-лекарственное средство по п. 1, где L1 представляет собой -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-.
7. Конъюгат антитело-лекарственное средство по п. 1, где L1 представляет собой -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3- диминицкус) или -C(=O)-(CH2)n4-C(=O)-.
8. Конъюгат антитело-лекарственное средство по любому из пп. 1-6, где n2 представляет собой целое число от 2 до 5, и L2 представляет собой одинарную химическую связь.
9. Конъюгат антитело-лекарственное средство по любому из пп. 1-6, где n2 представляет собой целое число от 2 до 5, L2 представляет собой -NH-(CH2CH2O)n5-CH2-CH2-C(=O)-, и n5 равняется 2 или 4.
10. Конъюгат антитело-лекарственное средство по любому из пп. 1-7, где следующая формула: -NH-(CH2)n1-La-Lb-Lc- представляет собой подструктуру, имеющую длину цепи от 4 до 7 атомов.
11. Конъюгат антитело-лекарственное средство по любому из пп. 1-7, где следующая формула: -NH-(CH2)n1-La-Lb-Lc- представляет собой подструктуру, имеющую длину цепи в 5 или 6 атомов.
12. Конъюгат антитело-лекарственное средство по любому из пп. 1-7, где следующая формула: -NH-(CH2)n1-La-Lb-Lc- представляет собой
-NH-(CH2)3-C(=O)-,
-NH-CH2-O-CH2-C(=O)- или
-NH-(CH2)2-O-CH2-C(=O)-.
13. Конъюгат антитело-лекарственное средство по п. 1, где структура лекарственного средства-линкера представляет собой одну структуру, выбранную из следующей группы:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
-C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-S-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
где -(NH-DX) представляет группу, представленную следующей формулой:
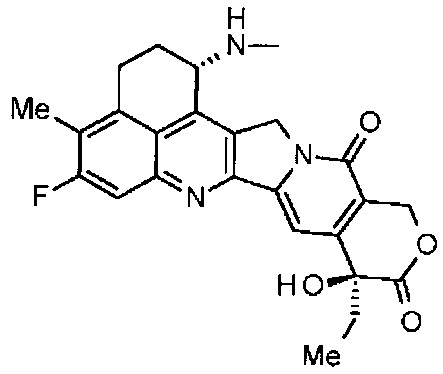 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения, и
-GGFG- представляет пептидный остаток -Gly-Gly-Phe-Gly-.
14. Конъюгат антитело-лекарственное средство по п. 1, где структура лекарственного средства-линкера представляет собой одну структуру, выбранную из следующей группы:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
где -(NH-DX) представляет группу, представленную следующей формулой:
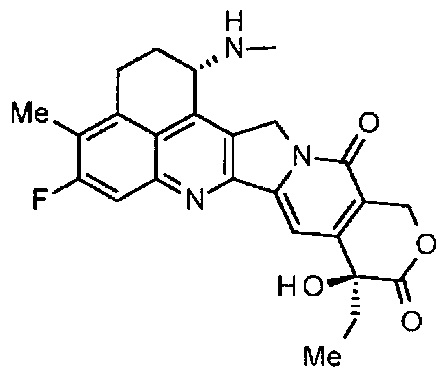 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
15. Конъюгат антитело-лекарственное средство по п. 14, где структура лекарственного средства-линкера представляет собой:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX).
16. Конъюгат антитело-лекарственное средство по п. 14, где структура лекарственного средства-линкера представляет собой:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX).
17. Конъюгат антитело-лекарственное средство по п. 14, где структура лекарственного средства-линкера представляет собой:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX).
18. Конъюгат антитело-лекарственное средство по п. 1, где среднее число единиц структуры лекарственное средство-линкер, конъюгированной с одной молекулой антитела, находится в диапазоне от 1 до 10.
19. Конъюгат антитело-лекарственное средство по п. 1, где среднее число единиц структуры лекарственное средство-линкер, конъюгированной с одной молекулой антитела, находится в диапазоне от 2 до 8.
20. Конъюгат антитело-лекарственное средство по п. 1, где среднее число единиц структуры лекарственное средство-линкер, конъюгированной с одной молекулой антитела, находится в диапазоне от 3 до 8.
21. Конъюгат антитело-лекарственное средство по п. 1, где антитело представляет собой анти-A33 антитело, анти-B7-H3 антитело, анти-CanAg антитело, анти-CD20 антитело, анти-CD22 антитело, анти-CD30 антитело, анти-CD33 антитело, анти-CD56 антитело, анти-CD70 антитело, анти-CEA антитело, анти-Cripto антитело, анти-EphA2 антитело, анти-G250 антитело, анти-MUC1 антитело, анти-GPNMB антитело, анти-интегрин антитело, анти-PSMA антитело, анти-тенасцин-C антитело, анти-SLC44A4 антитело или анти-мезотелин антитело.
22. Конъюгат антитело-лекарственное средство по п. 1, где антитело представляет собой анти-B7-H3 антитело, анти-CD30 антитело, анти-CD33 антитело или анти-CD70 антитело.
23. Конъюгат антитело-лекарственное средство по п. 1, где антитело представляет собой анти-B7-H3 антитело.
24. Конъюгат антитело-лекарственное средство по п. 23, где анти-B7-H3 антитело имеет CDRH1, содержащую аминокислотную последовательность, представленную SEQ ID NO: 3, CDRH2, содержащую аминокислотную последовательность, представленную SEQ ID NO: 4, и CDRH3, содержащую аминокислотную последовательность, представленную SEQ ID NO: 5, в качестве областей тяжелой цепи, определяющих комплементарность, и CDRL1, содержащую аминокислотную последовательность, представленную SEQ ID NO: 6, CDRL2, содержащую аминокислотную последовательность, представленную SEQ ID NO: 7, и CDRL3, содержащую аминокислотную последовательность, представленную SEQ ID NO: 8 в качестве областей легкой цепи, определяющих комплементарность.
25. Конъюгат антитело-лекарственное средство по п. 23, где анти-B7-H3 антитело имеет вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранные из группы, состоящей из
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 9, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 13,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 9, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 14,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 9, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 – 128, в SEQ ID NO: 15,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 9, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 16,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 9, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 17,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 9, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 18,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 9, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 19,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 12, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 13,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 12, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 14,
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 12, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 15, и
вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 141 в SEQ ID NO: 12, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 128 в SEQ ID NO: 16.
26. Конъюгат антитело-лекарственное средство по п. 23, где анти-B7-H3 антитело содержит тяжелую цепь и легкую цепь, выбранные из группы, состоящей из
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 9, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 13,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 9, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 14,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 9, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 15,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 9, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 16,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 9, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 17,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 9, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 18,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 9, легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 19,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 12, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 13,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 12, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 14,
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 12, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 15, и
тяжелой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 20 - 471 в SEQ ID NO: 12, и легкой цепи, содержащей аминокислотную последовательность, описанную в аминокислотных положениях 21 - 233 в SEQ ID NO: 16.
27. Конъюгат антитело-лекарственное средство по п. 26, где анти-B7-H3 антитело не содержит аминокислоту на карбоксильном конце аминокислотной последовательности, представленной SEQ ID NO: 9 или 12 в тяжелой цепи.
28. Лекарственное средство для лечения опухоли и/или рака, содержащее конъюгат антитело-лекарственное средство по п. 1, или его соль.
29. Противоопухолевое лекарственное средство и/или противораковое лекарственное средство, содержащее конъюгат антитело-лекарственное средство по п. 1, или его соль.
30. Противоопухолевое лекарственное средство и/или противораковое лекарственное средство по п. 29, которое применяют при лечении рака легких, рака почки, рака уротелия, колоректального рака, рака предстательной железы, мультиформной глиобластомы, рака яичников, рака поджелудочной железы, рака молочной железы, меланомы, рака печени, рака мочевого пузыря, рака желудка или рака пищевода.
31. Фармацевтическая композиция для лечения опухоли и/или рака, содержащая конъюгат антитело-лекарственное средство по п. 1, или его соль в качестве активного компонента, и фармацевтически приемлемый компонент, используемый в качестве вспомогательного вещества.
32. Способ лечения опухоли и/или рака, включающий введение конъюгата антитело-лекарственное средство по п. 1, или его соли.
33. Промежуточное соединение лекарственное средство-линкер для получения конъюгата антитело-лекарственное средство по п. 1, представленное следующей формулой:
Q-(CH2)nQ-C(=O)-L2a-LP-NH-(CH2)n1-La-Lb-Lc-(NH-DX),
где Q представляет (малеимид-N-ил)-, HS-, X-CH2-C(=O)-NH- или (пирролидин-2,5-дион-N-ил)-O-C(=O)-,
X представляет атом брома или атом йода,
nQ представляет целое число от 2 до 8,
L2a представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот, выбранных из фенилаланина, глицина, валина, лизина, цитруллина, серина, глутаминовой кислоты и аспарагиновой кислоты,
n1 представляет целое число от 0 до 6,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что, когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
(малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения,
(пирролидин-2,5-дион-N-ил) представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и
-(NH-DX) представляет собой группу, представленную следующей формулой:
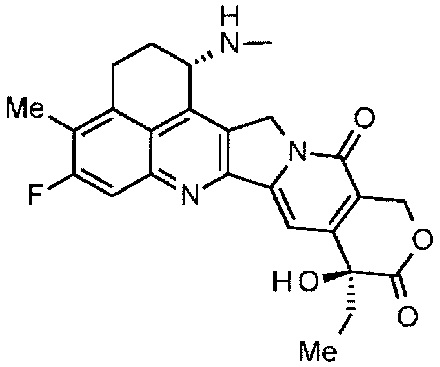 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
34. Промежуточное соединение лекарственное средство-линкер по п. 33, где Lc представляет собой -C(=O)-.
35. Промежуточное соединение лекарственное средство-линкер по п. 33, где LP представляет собой пептидный остаток, состоящий из 4 аминокислот.
36. Промежуточное соединение лекарственное средство-линкер по п. 33, где LP представляет собой -GGFG-.
37. Промежуточное соединение лекарственное средство-линкер по любому из пп. 33-36, где следующая формула: -NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2-,
-NH-CH2CH2CH2-,
-NH-CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-CH2CH2-O-CH2-.
38. Промежуточное соединение лекарственное средство-линкер по любому из пп. 33-36, где следующая формула: -NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-(CH2)2-O-CH2-.
39. Промежуточное соединение лекарственное средство-линкер по любому из пп. 33-36, где nQ представляет собой целое число от 2 до 6.
40. Промежуточное соединение лекарственное средство-линкер по п. 37, где
Q представляет собой (малеимид-N-ил)-,
nQ представляет собой целое число от 2 до 5, и
L2a представляет собой одинарную химическую связь.
41. Промежуточное соединение лекарственное средство-линкер по п. 38, где
Q представляет собой (малеимид-N-ил)-,
nQ представляет собой целое число от 2 до 5, и
L2a представляет собой одинарную химическую связь.
42. Промежуточное соединение лекарственное средство-линкер по любому из пп. 33-36, где
Q представляет собой (малеимид-N-ил)-,
nQ представляет собой целое число от 2 до 5,
L2a представляет собой -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-,
n5 представляет собой целое число от 2 до 4, и
-NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2-,
-NH-CH2CH2CH2-,
-NH-CH2CH2CH2CH2-,
-NH-CH2CH2CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-CH2CH2-O-CH2-.
43. Промежуточное соединение лекарственное средство-линкер по п. 42, где
n5 представляет собой целое число 2 или 4,
-NH-(CH2)n1-La-Lb- представляет собой
-NH-CH2CH2CH2-,
-NH-CH2-O-CH2- или
-NH-CH2CH2-O-CH2-.
44. Промежуточное соединение лекарственное средство-линкер по п. 33, где структура промежуточного соединения лекарственное средство-линкер является структурой, выбранной из группы:
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
X-CH2-C(=O)-NH-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
HS-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX), или
(пирролидин-2,5-дион-N-ил)-O-C(=O)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
где (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения,
X представляет атом галогена,
(пирролидин-2,5-дион-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и
-(NH-DX) представляет собой группу, представленную следующей формулой:
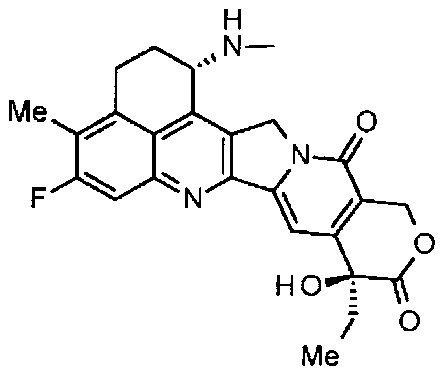 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
45. Промежуточное соединение лекарственное средство-линкер по п. 33, где структура промежуточного соединения лекарственное средство-линкер является структурой, выбранной из группы:
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX), или
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
где (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и
-(NH-DX) представляет собой группу, представленную следующей формулой:
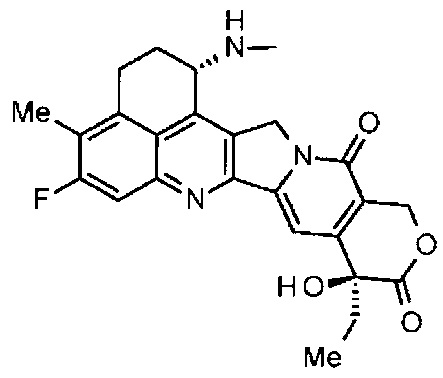 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
46. Промежуточное соединение лекарственное средство-линкер по п. 33, где структура промежуточного соединения лекарственное средство-линкер является структурой, выбранной из группы:
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX) или
(малеимид-N-ил)-CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
где (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и
-(NH-DX) представляет собой группу, представленную следующей формулой:
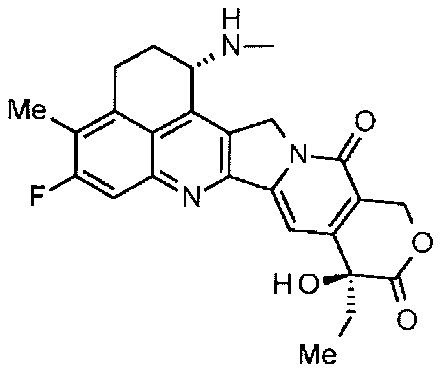 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
47. Промежуточное соединение лекарственное средство-линкер по п. 46, где структура промежуточного соединения лекарственное средство-линкер является следующей:
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-(NH-DX),
где (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и
-(NH-DX) представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
48. Промежуточное соединение лекарственное средство-линкер по п. 46, где структура промежуточного соединения лекарственное средство-линкер является следующей:
(малеимид-N-ил)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-(NH-DX),
где (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и
-(NH-DX) представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
49. Промежуточное соединение лекарственное средство-линкер по п. 46, где структура промежуточного соединения лекарственное средство-линкер является следующей:
(малеимид-N-ил)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-(NH-DX),
где (малеимид-N-ил)- представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота является положением присоединения, и
-(NH-DX) представляет собой группу, представленную следующей формулой:
 ,
,
где атом азота аминогруппы в положении 1 является положением присоединения.
50. Линкер для получения конъюгата антитело-лекарственное средство, представленный следующей формулой:
-L1-L2-LP-NH-(CH2)n1-La-Lb-Lc-
где L1 является положением присоединения для антитела, Lc является положением присоединения для противоопухолевого соединения,
где
n1 представляет целое число от 0 до 6,
L1 представляет -(сукцинимид-3-ил-N)-(CH2)n2-C(=O)-, -CH2-C(=O)-NH-(CH2)n3-C(=O)-, -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)- или -C(=O)-(CH2)n4-C(=O)-,
где n2 представляет целое число от 2 до 8, n3 представляет целое число от 1 до 8, n4 представляет целое число от 1 до 8,
L2 представляет -NH-(CH2-CH2-O)n5-CH2-CH2-C(=O)-, -S-(CH2)n6-C(=O)- или одинарную химическую связь,
где n5 представляет целое число от 1 до 6, n6 представляет целое число от 1 до 6,
LP представляет пептидный остаток, состоящий от 2 до 7 аминокислот,
La представляет -C(=O)-NH-, -NR1-(CH2)n7-, -O- или одинарную химическую связь,
где n7 представляет целое число от 1 до 6, R1 представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)n8-COOH или -(CH2)n9-OH, n8 представляет целое число от 1 до 4, n9 представляет целое число от 1 до 6,
Lb представляет -CR2(-R3)-, -O-, -NR4- или одинарную химическую связь,
где R2 и R3 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 углеродных атомов, -(CH2)na-NH2, -(CH2)nb-COOH или -(CH2)nc-OH, R4 представляет атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов, na представляет целое число от 0 до 6, nb представляет целое число от 1 до 4, nc представляет целое число от 1 до 4, при условии, что когда na равняется 0, R2 и R3 не являются одинаковыми,
Lc представляет -CH2- или -C(=O)-,
-(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
-(N-ли-3-диминицкус)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к L2 в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1,
цик.Гекс(1,4) представляет 1,4-циклогексиленовую группу, и когда L2 представляет собой -S-(CH2)n6-C(=O)-, L1 представляет собой -C(=O)-цик.Гекс(1,4)-CH2-(N-ли-3-диминицкус)-.
51. Линкер по п. 50, где структура линкера представляет собой одну структуру, выбранную из следующей группы:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
где -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1.
52. Линкер по п. 51, где структура линкера является следующей:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2-O-CH2-C(=O)-,
где -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1.
53. Линкер по п. 51, где структура линкера является следующей:
-(сукцинимид-3-ил-N)-CH2CH2CH2CH2CH2-C(=O)-GGFG-NH-CH2CH2-O-CH2-C(=O)-,
где -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1.
54. Линкер по п. 51, где структура линкера является следующей:
-(сукцинимид-3-ил-N)-CH2CH2-C(=O)-NH-CH2CH2O-CH2CH2O-CH2CH2-C(=O)-GGFG-NH-CH2CH2CH2-C(=O)-,
где -(сукцинимид-3-ил-N)- имеет структуру, представленную следующей формулой:
 ,
,
которая присоединена к антителу в ее положении 3 и присоединена к метиленовой группе в линкерной структуре, имея эту структуру на атоме азота в положении 1.
| ПРОИЗВОДНЫЕ КАМПТОТЕЦИНА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2450008C2 |
| Charlotte F | |||
| McDonagh et al | |||
| "Engineered antibody-drug conjugates with defined sites and stoichiometries of drug attachment", Protein Engineering, Design and Selection, V | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| АВТОМАТ ДЛЯ ПУСКА В ХОД ПОРШНЕВОЙ МАШИНЫ | 1920 |
|
SU299A1 |
| WO2006065533 A2 22.06.2006 | |||
| US 20080050310 A1 28.02.2008. | |||
Авторы
Даты
2018-08-17—Публикация
2013-10-10—Подача