Изобретение относится к области медицины, в частности онкологии, и может быть использовано для лечения онкологических больных и профилактики гнойно-септических осложнений после расширенных операций и химиолучевой терапии.
В настоящее время для целей адоптивной иммунотерапии используют лимфокин-активированные киллеры (ЛАК). Данные клетки образуются из NK-клеток (естественных киллеров) крови при инкубации последних с интерлейкином-2 (ИЛ-2). ЛАК, как и эффекторы врожденного иммунитета - NK-клетки и натуральные киллеры-Т-клетки (NK-T), оказывают избирательное цитотоксическое действие на трансформированные клетки, вызывая лизис опухолевых клеток-мишеней, и не влияют на нормальные клетки своего организма. В ряде работ показана клиническая эффективность ЛАК в сочетании с ИЛ-2 у онкологических больных. Для ИЛ-2/ЛАК-иммунотерапии используются препараты «Ронколейкин» (Биотех, Россия), «Пролейкин» (Chiron B.V., Голландия) [1-5]. Вместе с тем, наиболее многочисленными представителями врожденного иммунитета являются полиморфноядерные гранулоциты. Подобно натуральным киллерам, эти клетки экспрессируют на своей мембране антиген CD 16, (FcRIII), а также ряд молекул адгезии, в том числе CD58 (LFA-3) [6]. Гранулоциты составляют около 60% лейкоцитов. Они продуцируют множество цитотоксических молекул, включая различные протеазы и активные формы кислорода, и играют важную роль в формировании противоинфекционного иммунного ответа. Кроме того, гранулоциты, подобно NK и ЛАК, обладают цитотоксической активностью и способны лизировать клетки-мишени при непосредственном контакте с ними. Механизм цитотоксичности связывается с действием протеолитических ферментов и активных форм кислорода. Полиморфноядерные лейкоциты здоровых доноров и онкологических больных обладают низкой спонтанной киллерной активностью при испытании на NK-чувствительных клетках эритробластного лейкоза человека линии К-562. Однако при их активации (например, форбол миристат ацетатом) происходит значительное увеличение спонтанной цитотоксичности гранулоцитов [7, 9]. Гранулоциты, в отличие от NK-клеток, являются короткоживущими эффекторами врожденного иммунитета и подвергаются апоптозу в течение 2-3 дней. Однако на апоптоз нейтрофилов могут оказывать влияние различные факторы, в том числе некоторые цитокины. В частности, гранулоцитарно-макрофагальный колониестимулирующий фактор пролонгирует выживание гранулоцитов [8].
В качестве прототипа может рассматриваться метод получения ЛАК из NK-клеток периферической крови с использованием в качестве индуктора ИЛ-2. Недостатком этого метода является трудоемкость выделения лимфоцитов из крови, включающая в себя этап выделения NK на градиенте плотности и последующее удаление из культуры моноцитов и макрофагов, а также необходимость использования для приготовления градиента плотности нефармакопейного препарата (фикола). Кроме того, существующий метод не позволяет использовать противоопухолевую и противоинфекционную активность значительного количества гранулоцитов, присутствующих в образцах крови, предназначенных для выделения лимфоцитов, что особенно важно для онкологических больных, получающих стандартное лечение (химио- и лучевая терапия, расширенные мультиорганные операции). Применение ИЛ-2 для активации всех фракций лейкоцитов (включая и гранулоциты) нецелесообразно, так как при стандартном культивировании в течение 48-72 ч большинство нейтрофилов подвергнется апоптозу. Таким образом, существует потребность в разработке новых эффективных подходов для получения фракции активированных лейкоцитов с пролонгированным периодом жизни нейтрофилов, предназначенных для лечения онкологических заболеваний и профилактики гнойно-септических осложнений у онкологических больных.
Технический результат, на достижение которого направлено изобретение, заключается в устранении недостатков ближайшего аналога.
Настоящее изобретение обеспечивает метод получения активированных лейкоцитов, характеризующийся тем, что лейкоциты получены путем выделения из периферической крови и активированы Г-КСФ.
Способ получения активированных лейкоцитов (АЛ) предусматривает следующие стадии:
а) выделение лейкоцитов из крови пациента, нуждающегося в лечении, или крови донора;
б) инкубацию выделенных лейкоцитов с Г-КСФ для получения из них АЛ.
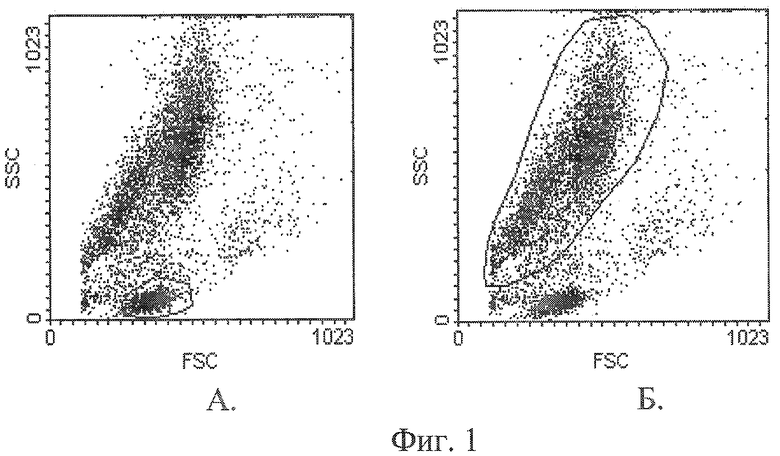
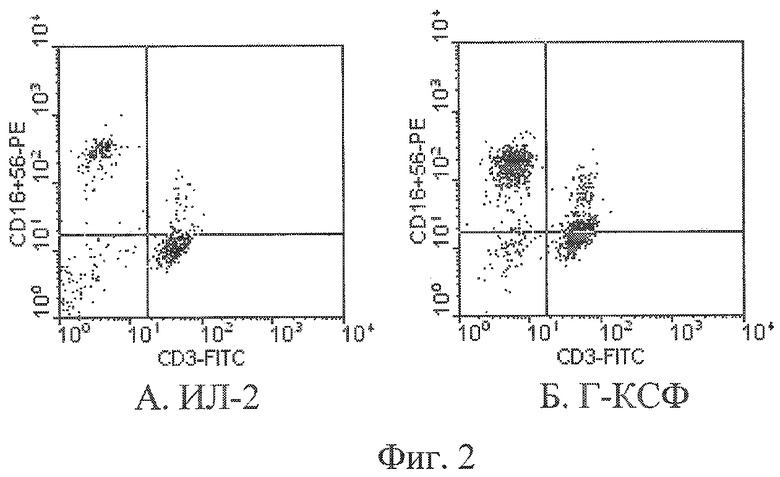
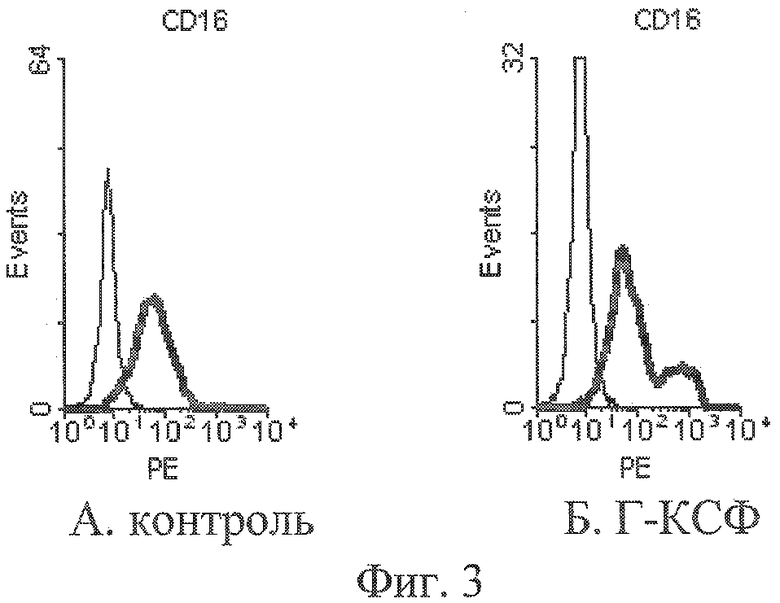
Сущность изобретения поясняется чертежами. На фиг.1 показано распределение лейкоцитов в координатах FSC и SSC; на фиг.2 - увеличение количества NK и NK-T-клеток в присутствии Г-КСФ и ИЛ-2; на фиг.3 - экспрессия CD16 на поверхности гранулоцитов в присутствии различных активаторов (фиг.1, регион 2).
Выделение лейкоцитов из периферической крови может быть осуществлено с использование раствора декстрана, в частности полиглюкина. Для предотвращения свертывания кровь стабилизируют обычно применяемыми для этих целей консервантами, например гепарином, цитратом натрия, ЭДТА.
Предлагаемый способ позволяет получать достаточное количество лейкоцитов из 50-100 мл периферической крови или из одной дозы лейкомассы донора, что значительно упрощает процедуру забора лейкоцитов, в отличие от проведения аппаратной сепарации крови.
Культивирование лейкоцитов происходит в среде RPMI или DMEM с 2-10% сыворотки пациента (или АВ сыворотки донора) в одноразовых пластиковых флаконах объемом 250 мл фирмы Costar или аналогичных флаконах других фирм. Для получения АЛ к среде добавляют Г-КСФ в конечной концентрации 500-5000 МЕ/мл. Лейкоциты культивируют в течение 48-72 ч в условиях СО2-инкубатора.
АЛ обладают высокой цитотоксической активностью по отношению к опухолевым клеточным линиям и характеризуются специфическими особенностями иммунофенотипа (CD16high, CD56high).
Предлагаемый вариант получения АЛ, в отличие от традиционных вариантов, обеспечивает ЛАК-активацию не только NK, но и других более многочисленных эффекторов врожденного иммунитета, таких как гранулоциты. Кроме того, инкубация лейкоцитов с Г-КСФ пролонгирует их время жизни и функциональную активность.
Лейкоциты выделяют из стабилизированной гепарином (25 ед/мл) периферической крови посредством смешивания с полиглюкином в течение 30 минут. Верхний (надэритроцитарный) слой лейкоцитов собирают и трехкратно отмывают в среде 199. После каждой отмывки в 10-кратном объеме среды клетки осаждают центрифугированием при 200g.
Лейкоциты подсчитывают, осаждают центрифугированием и ресуспендируют в среде RPMI 1640 с добавками (HEPES, L-глютамин, гентамицин) в концентрации 1 млн./мл, с добавлением 5% АВ сыворотки человека, Г-КСФ в концентрации 1000 МЕ/мл и инкубируют в СО2-инкубаторе в течение 72 ч.
NK-активность АЛ определяли на линии опухолевых клеток К-562 (NK-чувствительная линия клеток эритробластного лейкоза человека). Опухолевые клетки (1×104 в 1 мл) инкубировали в культуральной среде с АЛ и ЛАК (в соотношениях 1:5, 1:2, 1:1) в плоскодонных 96-луночных микропланшетах в течение 18 часов. Микропланшеты с клетками просматривались с помощью инвертоскопа Axiovert (Zeiss, Германия). Затем в лунки добавляли витальный краситель МТТ и по оптической плотности, измеряемой при помощи Multiscan MS, рассчитывали процент лизиса опухолевых клеток (процент цитотоксичности). Среднеэффективное соотношение клетки мишени/клетки эффекторы, при котором возникает гибель 50% опухолевых клеток (ER50), рассчитывали методом наименьших квадратов.
Как следует из данных таблицы 1, активированные Г-КСФ лейкоциты обладают боле высокой NK-активностью по сравнению с лейкоцитами, активированными ИЛ-2.
NK-активность активированных лейкоцитов (%)
Определение экспрессии поверхностных маркеров проводили при помощи моноклональных антител против соответствующих антигенов (Caltag Laboratories, США). Результаты учитывались методом проточной цитофлюорометрии на проточном цитометре FACScan (Becton Dickinson, США). На лимфоцитах исследовали уровни экспрессии маркеров Т-клеток CD3 и NK CD 16 и CD56. Гейт популяции клеток устанавливали на основе комбинации прямого и бокового светорассеяния и размера клеток. При учете результатов подсчитывались 10000 событий в гейте. Статистическая обработка результатов осуществлялась при помощи программного пакета WINMDI 2.8.
Суммарная популяция. А - выделена область лимфоцитов - регион 1. Б - выделена область гранулоцитов (фиг.1).
FSC - характеризует размер клеток.
SSC- характеризует гранулярность клеточной цитоплазмы.
Во всех случаях наблюдалась сходная картина распределения клеток в координатах малоуглового (FSC) и бокового (SSC) светорассеяния.
Как следует из данных таблицы 2 и фиг.2, в популяции активированных Г-КСФ лимфоцитов отмечается большее содержание NK-T-клеток (CD3+/CD16+56+) и NK (CD3-/CD16+56+) по сравнению с лимфоцитами, обработанными ИЛ-2.
Влияние различных цитокинов на экспрессию на поверхности лимфоцитов компонента Т-клеточного рецептора CD3 и маркеров NK CD16 и CD56
Судя по увеличению среднегеометрического распределения интенсивности флуоресценции (таблица 4, фиг.3), Г-КСФ способствовал повышению уровня экспрессии маркера CD16 на поверхности гранулоцитов. В присутствии Г-КСФ определялась субпопуляция клеток с повышенным уровнем экспрессии CD16.
Влияние Г-КСФ на уровень экспрессии поверхностных маркеров гранулоцитов
Этот факт свидетельствует об активации нейтрофилов Г-КСФ и о поддержании их жизнеспособности на протяжении 72 ч культивирования in vitro.
Для получения гранулоцитов на первом этапе из периферической крови на градиенте плотности фикола-урографина (1,077) выделяли лейкоциты. Мононуклеарные клетки, образовавшие после центрифугирования интерфазное кольцо, удаляли. Осевшие клетки ресуспендировали в среде 199 и трижды отмывали. Затем клетки ресуспендировали в полиглюкине и инкубировали в течение 30 минут до осаждения эритроцитов. Надэритроцитарный слой, содержащий гранулоциты, собирали и отмывали средой 199 от полиглюкина, а затем ресуспендировали в среде RPMI-1640 с добавками (HEPES, L-глютамин, гентамицин) в концентрации 1 млн./мл, с добавлением 5% АВ сыворотки человека, Г-КСФ в концентрации 1000 МЕ/мл и инкубируровали в СО2-инкубаторе в течение 72 ч. Микропланшеты с клетками просматривались с помощью инвертоскопа Axiovert (Zeiss, Германия). Затем в лунки добавляли витальный краситель МТТ и по оптической плотности, измеряемой на Multiscan MS, рассчитывали процент лизиса опухолевых клеток (процент цитотоксичности). Среднеэффективное соотношение клетки мишени/клетки эффекторы, при котором возникает гибель 50% опухолевых клеток (ER50), рассчитывали методом наименьших квадратов.
Согласно данным таблицы 5, инкубация с Г-КСФ приводит к увеличению NK-активности гранулоцитов, что свидетельствует о сохранении их жизнеспособности и функциональной активности при 72 ч инкубации и подтверждает их способность эффективно лизировать опухолевые клетки после активации Г-КСФ.
NK-активность гранулоцитов, активированных Г-КСФ (%)
Список литературы
1. Давыдов М.И., Нормантович В.А., Киселевский М.В., Волков С.М. и др. Адоптивная иммунотерапия при опухолевых плевритах: клинико-лабораторное исследование. - Российский онкологический журнал. 2000. - №6 - с.14-17.
2. Велижева Н.П., Лебединская Е.А., Жукова О.С., Лебединская О.В., Шубина И.Ж., Киселевский М.В. Противоопухолевая цитотоксическая активность лимфокин-активированных киллеров. Сибирский онкологический журнал. - 2008. - №1. - С.51-54.
3. Жукова О.С., Лебединская О.В., Киселевский М.В. Избирательная противоопухолевая активность ЛАК in vitro. Клеточные технологии в биологиии и медицине. 2007. - №1. - С.21-25.
4. Киселевский М.В., Блюменберг А.Г. Адоптивная иммунотерапия рака яичников. - Сборник статей, приуроченный к Европейской школе по онкологии. 2001. - с.164-176.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АКТИВАЦИИ ЦИТОТОКСИЧЕСКИХ ЛИМФОЦИТОВ ЧЕЛОВЕКА | 2015 |
|
RU2603079C2 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВИРОВАННЫХ МОНОНУКЛЕАРНЫХ ЛЕЙКОЦИТОВ | 2009 |
|
RU2402338C1 |
| Биомедицинский клеточный продукт для терапии злокачественных новообразований | 2023 |
|
RU2813531C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИТОТОКСИЧЕСКИХ ЛИМФОЦИТОВ С ПОМОЩЬЮ IFN-γ И TNF-α ДЛЯ АДОПТИВНОЙ ИММУНОТЕРАПИИ | 2023 |
|
RU2822876C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕПОНИРОВАННЫХ ЛИМФОКИН-АКТИВИРОВАННЫХ КИЛЛЕРОВ | 2009 |
|
RU2400238C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОГО ПРЕПАРАТА НА ОСНОВЕ АКТИВИРОВАННЫХ ЛИМФОЦИТОВ ИЗ ЛЕЙКОЦИТАРНЫХ ФИЛЬТРОВ | 2024 |
|
RU2835686C2 |
| Способ адоптивной иммунотерапии злокачественных опухолей | 2016 |
|
RU2613884C1 |
| Биомедицинский клеточный продукт со специфической противоопухолевой активностью, представленный популяциями лимфокин-активированных киллеров и анти-HER2 CAR-γδΤ-ОИЛ и анти-HER2 CAR-T-NK | 2022 |
|
RU2786210C1 |
| АУТОЛОГИЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2392946C2 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ ЦИТОТОКСИЧЕСКИМИ ЛИМФОЦИТАМИ | 2015 |
|
RU2596505C1 |
Изобретение относится к области медицины, в частности к онкологии. Для осуществления изобретения выделяют лейкоциты из стабилизированной гепарином периферической крови посредством смешивания с полиглюкином течение 30 мин, культивируют их в среде RPMI или DMEM с 2-10% сыворотки пациента (или АВ сыворотки крови). Затем к среде добавляют Г-КСФ в конечной концентрации 500-5000 МЕ/мл и лейкоциты культивируют в течение 48-72 ч в условиях СО2-инкубатора. Использование способа позволяет упростить выделение лимфоцитов из крови и использовать полученные активированные лейкоциты для лечения онкологических больных и профилактики гнойно-септических осложнений после расширенных операций и химиолучевой терапии. 1 з.п. ф-лы, 3 ил., 4 табл.
1. Способ получения активированных лейкоцитов, заключающийся в том, что выделенные из периферической крови лейкоциты культивируют в среде RPMI или DMEM с 2-10% сыворотки пациента (или АВ сыворотки донора), затем к среде добавляют Г-КСФ в концентрации 500-5000 МЕ/мл и лейкоциты культивируют в течение 48-72 ч в условиях СО2-инкубатора.
2. Способ по п.1, отличающийся тем, что лейкоциты выделяют из стабилизированной гепарином периферической крови посредством смешивания с полиглюкином течение 30 мин.
| ВЕЛИЖЕВА Н.П | |||
| и др | |||
| Противоопухолевая цитотоксическая активность лимфокин-активированных киллеров | |||
| Сибирский онкологический журнал | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| КОМБИНИРОВАННЫЙ КЛЕТОЧНЫЙ ТРАНСПЛАНТАТ НА ОСНОВЕ ЛИМФОКИНАКТИВИРОВАННЫХ КИЛЛЕРОВ И ДЕНДРИТНЫХ КЛЕТОК, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОНКОЛОГИЧЕСКИХ, ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЙ | 2006 |
|
RU2309753C1 |
| СПОСОБ КОМБИНИРОВАННОЙ ИММУНОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА | 2000 |
|
RU2197985C2 |
| СПОСОБ ИММУНОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА | 2004 |
|
RU2262941C2 |
| ЖУКОВА О.С | |||
| и др | |||
| Избирательная противоопухолевая активность ЛАК in vitro | |||
| Клеточные технологии в биологии и | |||
Авторы
Даты
2011-03-27—Публикация
2009-03-12—Подача