Техническая область
Изобретение относится к области фармации и касается применения икаритина для получения лекарственных средств, в частности для получения лекарственных средств, предназначенных для предотвращения или лечения геморрагических заболеваний.
Фоновая техника
Когда кровеносные сосуды человека повреждены, кровь может вытекать или просачиваться из кровеносных сосудов. В это время организм остановит кровотечение посредством ряда физиологических реакций, и этот процесс называется гемостазом. В процесс гемостаза вовлечено множество факторов и ряд сложных физиологических и биохимических реакций. Заболевание, характеризующееся спонтанным или постоянным кровотечением после повреждения сосудов, вызываемого нарушениями функции гемостаза, называется геморрагическими заболеваниями.
По этиологии и патогенезу геморрагические заболевания можно разделить на следующие основные виды: (1) Геморрагические заболевания, вызываемые дисфункцией тромбоцитов. Эти геморрагические заболевания представляют собой желудочно-кишечные кровотечения, вызываемые геморрагической трансформацией инфаркта мозга, приемом тромболитических или антитромботических лекарств при лечении инфаркта мозга, или геморрагические осложнения, вызываемые приемом тромболитических или антитромботических лекарств при лечении инфаркте миокарда. Геморрагическая трансформация инфаркта мозга представляет собой вторичную геморрагическую трансформацию ишемического инфаркта мозга, первичную геморрагическую трансформацию или бессимптомную геморрагическую трансформацию. Тромболитическая или антикоагулянтная терапия в настоящее время является эффективным методом лечения острого ишемического инфаркта, но одновременно растворение тромба может приводить и к целому ряду серьезных осложнений, таких как геморрагическая трансформация, что резко ограничивает ее клиническое применение. В настоящее время западная медицина может предотвращать и лечить различные осложнения после тромболитических лекарств или антикоагулянтов только из каждого отдельного звена или одного фактора и еще не достигла удовлетворительных лечебных эффектов. В настоящее время западная медицина может предотвращать и лечить различные осложнения, вызываемые приемом тромболитических лекарств или антикоагулянтов, только на основе одного симптома или одного фактора и еще не достигла удовлетворительных результатов. Очень важно искать эффективные методы лечения и рецепты, которые могут уменьшить или уменьшить устранить риск различных геморрагических трансформаций при растворении тромбоза, повысить краткосрочную и долгосрочную эффективность тромболитической терапии инфаркте. (2) Геморрагические заболевания, вызываемые аномалиями стенок кровеносных сосудов. Эти геморрагические заболевания представляют собой врожденные или наследственно-приобретенные геморрагические заболевания. Среди них к врожденным геморрагическим заболеваниям относятся наследственные геморрагические телеангиэктазии, семейная простая пурпура, врожденные заболевания соединительной ткани. (3) Геморрагические заболевания, вызываемые нарушением свертывания крови. Эти нарушения свертывания представляют собой врожденные или наследственно-приобретенные нарушения свертывания. Среди них врожденные нарушения свертывания крови относятся к гемофилии А, В и наследственному дефициту FXI; наследственному дефициту протромбина, FV, FVII, FX, наследственному дефициту и гипоксии фибриногена, наследственному дефициту и гипоксии FXII. К наследственным нарушениям свертывания относятся заболевания печени, дефицит витамина К, образование антител к факторам VIII и IX, уремическая коагулопатия и др. (4) Геморрагические заболевания, вызываемые антикоагулянтами и фибринолизом. Эти геморрагические заболевания, преимущественно представляют собой приобретенные теморрагические заболевания, вызываемые передозировкой гепарина или его фармацевтически приемлемой соли, передозировкой кумарина, повышением иммуноопосредованных антикоагулянтов, передозировкой тромболитических лекарств.
Эпимедиум - это высушенные стебли и листья растений барбарисового семейства коротконожковой горянки (Epimedium brevicornum Maxim), Эпимедиума сагиатум Максим (Epimedium sagiatum Maxim), Эпимедиума опушенного (Epimedium pubescens Maxim), корейской корянки (Epimedium koreanum Nakai). Клинически он в основном используется для лечения недосточности ян почек, мужской импотенции, частого мочеиспускания, бесплодия, ревматической артралгии, онемения и контрактуры конечностей, мышечной и костной слабости, затруднений при ходьбе, астмы и одышки.
Икаритин (IT) представляет собой полигидроксифлавоноидный мономерный компонент эпимедиума, растения рода эпимедиума барбарисового семейства. Фармакологические исследования показали, что икаритин обладает более сильным антиостеопорозным эффектом, чем другие флавоноидные гликозиды в эпимедиуме, и может стимулировать активность остеобластов и ингибировать активность остеокластов in vitro. В последние годы все большее внимание медицинских работников привлекают искарин и икаритин, являющиеся важными действующими веществами эпимедиума. Например, патентная заявка CN101637467A раскрывает применение икаритина в приготовлении лекарственных средств для лечения остеопороза. Патент US6399579 раскрывает применение икаритина для лечения сексуальной дисфункции.
Сущность изобретения
Заявитель обнаружил в процессе исследования, что икаритин может облегчить нарушения функции тромбоцитов, сокращать тромбопластиновое время, способствовать свертывания крови, и может использоваться для предотвращения и лечения нарушений функции тромбоцитов, вызываемых им геморрагических заболеваний, геморрагических заболеваний, вызываемых нарушением свертывания крови, геморрагических заболеваний, вызываемых аномалиями стенок кровеносных сосудов, или геморрагических заболеваний, вызываемых нарушениями антикоагулянтной активности и фибринолиза.
В одном аспекте в настоящей заявке предложено применение икаритина в приготовлении лекарственных средств, предназначенных для предотвращения или лечения заболеваний. Указанные заболевания представляют собой нарушения функции тромбоцитов, вызываемые им геморрагические заболевания, геморрагические заболевания, вызываемые нарушением свертывания крови, геморрагические заболевания, вызываемые аномалиями стенок кровеносных сосудов, или геморрагические заболевания, вызываемые антикоагулянтами и фибринолизом.
В одном варианте осуществления геморрагические заболевания, вызываемые дисфункцией тромбоцитов, представляют собой желудочно-кишечные кровотечения, вызываемые геморрагической трансформацией инфаркта мозга, приемом тромболитических или антитромботических лекарствпри лечении инфаркта мозга, или геморрагические осложнения, вызываемые приемом тромболитических или антитромботических лекарств при лечении инфаркте миокарда.
В одном варианте осуществления геморрагическая трансформация инфаркта мозга представляет собой вторичную геморрагическую трансформацию ишемического инфаркта мозга, первичную геморрагическую трансформацию или бессимптомную геморрагическую трансформацию;
В одном варианте осуществления вторичная геморрагическая трансформация представляет собой геморрагическую трансформацию, вызываемую приемом тромболитических лекарств, антитромботических лекарств и эндоваскулярной терапией;
В одном варианте осуществления тромболитические лекарства выбраны из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланоттеплазы; В одном варианте осуществления антитромботические лекарства представляют собой один или более из антикоагулянтных лекарств и антитромбоцитарных лекарств; В другом варианте осуществления антикоагулянтные лекарства выбраны из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли и рекомбинантного гирудина; В еще одном варианте осуществления антитромбоцитарные лекарства выбраны из аспирина, клопидогреля или тиклопидина.
В одном варианте осуществления первичная геморрагическая трансформация представляет собой спонтанную геморрагическую трансформацию после острого церебрального инфаркта.
В одном варианте осуществления тромболитические лекарства для лечения инфаркта миокарда или антитромботические лекарства, которые могут вызвать геморрагические осложнения, выбраны из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланотиплазы; Указанные антитромботические лекарства представляют собой лекарства для лечения в начальной стадии инфаркта миокарда и лекарства для предотвращения на этапах первичной и вторичной профилактики; указанные антитромботические лекарства представляют собой один или более из антикоагулянтных или антиагрегантных лекарств.
В одном варианте осуществления антиагрегантные лекарства выбраны из аспирина, клопидогрела или тиклопидина, а антикоагулянтные лекарства выбраны из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли, рекомбинантного гирудина;
В одном варианте осуществления геморрагические осложнения представляют собой одно или более из подкожных кровотечений, внутричерепных кровотечений, кровотечений из верхних отделов желудочно-кишечного тракта или кровотечений из десен.
В одном варианте осуществления тромболитические лекарства для лечения инфаркта миокарда или антитромботические лекарства, которые могут вызвать желудочно-кишечное кровотечение, представляют собой один или более из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланотиплазы; указанные антитромботические лекарства представляют собой один или более из антикоагулянтных или антиагрегантных лекарств.
В одном варианте осуществления нарушение функции тромбоцитов представляет собой нарушение активации тромбоцитов или агрегации, нарушение функции тромбоцитов представляет собой врожденные дефекты функции тромбоцитов или приобретенные дефекты функции тромбоцитов;
В одном варианте осуществления указанные врожденные дефекты функции тромбоцитов представляют собой наследственный синдром гигантских тромбоцитов, наследственный тромбоцитоз или врожденное заболевание соединительной ткани; указанные приобретенные дефекты функции тромбоцитов вызваны препаратом или заболеванием;
В одном варианте осуществления указанные лекарства представляют собой один или более из антибактериальных лекарств, противоопухолевых лекарств или гепарина, а указанные заболевания представляют собой один или более из уремии, диабета, нефротического синдрома, ишемической болезни сердца или лейкемии.
В одном варианте осуществления указанные геморрагические заболевания, вызываемые нарушением свертывания крови, представляют собой гемофилию.
В одном варианте осуществления указанная гемофилия представляет собой гемофилию, вызываемую генетическими факторами, или вторичную гемофилию; указанная вторичная гемофилия вызывается препаратом или аутоиммунным заболеванием.
В одном варианте осуществления аутоиммунные заболевания включают в себя (но не ограничиваются этим) заболевание печени, гемолиз, приобретенный иммунодефицит, синдром Эванса, хронический лимфоцитарный лейкоз, различные острые лейкозы, лимфому системную красную волчанку, ревматоидный артрит или гипертиреоз; Указанные заболевания печени относится к любому заболеванию печени, вызываемому хроническим персистирующим гепатитом и циррозом печени; указанные лекарства включают в себя (но не ограничиваются этим): алкилирующие агенты, антиметаболиты, цитотоксические агенты, хлоротиазиды и их синергисты.
В одном варианте осуществления гемофилия представляет собой любую из гемофилии А, гемофилии В или гемофилии С.
В одном варианте осуществления геморрагические заболевания, вызываемые антикоагулянтами и фибринолизом, представляют собой приобретенные заболевания, включают в себя (но не ограничиваются этим): теморрагические заболевания, вызываемые передозировкой гепарина или его фармацевтически приемлемой соли, передозировкой кумарина, повышением иммуноопосредованных антикоагулянтов, передозировкой тромболитических лекарств.
В примере действия лекарственных средств 1 результаты воздействия икаритина на активизацию тромбоцитов показали, что через 3 дней после введения икаритина и активизации периферической антикоагулированной крови у животных аденозиндифосфатом в тех же условиях во всех тромбоцитах, меченных CD61, экспрессия CD62p была значительно повышена, то есть повышалась скорость активации тромбоцитов при совместном приемом аденозиндифосфата, что достоверно отличалось от базового значения до введения. Предполагается, что в экспериментальных условиях внутрижелудочное введение икаритина могло значительно способствовать активации тромбоцитов, индуцированной аденозиндифосфатом (АДФ) в периферической антикоагулированной крови крыс.
Результаты воздействия икаритина на активность агрегации тромбоцитов in vitro показали, что икаритин в каждой концентрации оказывал эффект повышения активности агрегации тромбоцитов, индуцированной аденозиндифосфатом, причем стимулирующий эффект усиливался с увеличением концентрации, что указывает на то, что стимулирующее действие икаритина на аденозиндифосфат-индуцированную агрегацию тромбоцитов было дозозависимым.
В примере действия лекарственных средств 2 результаты воздействия икаритина на геморрагическую трансформацию после церебральной ишемии-реперфузии, индуцированной аспирином или клопидогрелом, показали, что икаритин может значительно ингибировать геморрагическую трансформацию после церебральной ишемии-реперфузии, индуцированной аспирином или клопидогрелем.
В примере действия лекарственных средств 3 результаты воздействия икаритина на время кровотечения у мышей, вызываемое гепарином натрия, показали, икаритин может значительно сократить время кровотечения у мышей, индуцированное гепарином натрия, оказывает прокоагулянтный эффект, не изменяя результаты общего анализа крови и четырех параметров свертываемости крови.
В примере действия лекарственных средств 4 результаты воздействия икаритина на время кровотечения у мышей, вызываемого аспирином, показали, что икаритин может значительно сократить время кровотечения у мышей, вызываемое аспирином.
В примерах действия лекарственных средств 5 и 6 результаты воздействия икаритина на тромболитический эффект тромболитических средств, и результаты воздействия икаритина на геморрагическую трансформацию, вызываемую тромболитическими средствами, показали, что икаритин может значительно улучшить геморрагическую трансформацию, вызываемую тромболитическими средствами, и, предотвращая геморрагическую трансформацию и уменьшая объем кровотечения, не влияет на тромболитическое действие тромболитических лекарств на тромб, и не влияет на результаты общего анализа крови. икаритин также оказывает значительное профилактическое и терапевтическое действие на геморрагическую трансформацию, вызываемую тромболитическими средствами, антикоагулянтами и антитромбоцитарными средствами. Помимо значительного профилактического и лечебного действия икаритина на геморрагическую трансформацию после инфаркта головного мозга, икаритин оказывает также значимое профилактическое и лечебное действие на возникновение геморрагического инфаркта, что может быть определено по данным первой КТ/МРТ головного мозга.
В примерах действия лекарственных средств 7,8 профилактического действия икаритина на желудочно-кишечное кровотечение, вызываемое аспирином, результаты профилактического действия икаритина на желудочное кровотечение, вызываемое тромболитическими средствами, показали, что икаритин может не только снижать возможность желудочно-кишечное кровотечение, вызываемое тромболитическими средствами, но и икаритин в высоких дозах оказывает значительное профилактическое действие на желудочно-кишечное кровотечение, вызываемое самим тромбозом, и все вышеперечисленные эффекты показали дозозависимую зависимость.
В примере действия лекарственных средств 9 действия икаритина на гемолитические осложнения, вызванные приемом тромболитических лекарств, показали, что икаритин может значительно снизить возможность геморрагических осложнений при инфаркте миокарда, вызванных тромболитическими средствами, совместное применение с тромболитическими средствами не влияет на тромболитический эффект тромболитических лекарств.
В примере действия лекарственных средств 10 действия икаритина на время кровотечения у мышей, страдающих гемофилией, вызываемой нокаутом фактора свертывания крови IX, показали, что икаритин может эффективно сокращать время кровотечения у мышей, страдающих гемофилией, вызываемой нокаутом фактора свертывания крови IX, И не было обнаружено существенной разницы в результатах общего анализа крови у мышей в каждых группах.
В примере действия лекарственных средств 11 действия икаритина на активированное частичное тромбопластиновое время у мышей, страдающих приобретенной гемофилией А, показали, что икаритин может значительно укорачивать активированное частичное тромбопластиновое время у пациентов с гемофилией, способствуя свертыванию крови у пациентов с гемофилией.
Икаритин оказывает значительное терапевтическое действие не только на гемофилию, вызываемую генетическими факторами, но и оказывает значительное терапевтическое действие на вторичную гемофилию.
При применении икаритина для предотвращения и лечения геморрагических заболеваний пути введения включают в себя желудочно-кишечные пути и парентеральные пути введения, а парентеральные пути введения включают в себя (но не ограничиваются этим): подкожную, внутрикожную, артериальную, внутривенную, мышечную, суставную, интратекальную, внутричерепную, внутригрудную, внутрибрюшинную инъекцию или инсталляцию, назальное, буккальное, подъязычное, трахеальное, уретральное, ректальное введение или местное введение поражений и т.д. Его можно принимать одновременно с другими лекарствами или заранее в качестве профилактического средства.
В дополнение к применению икаритина в приготовлении лекарственных лекарств, предназначенных для предотвращения и лечения геморрагических заболеваний, настоящее изобретение также обеспечивает применение в приготовлении лекарственных лекарств, используемых для лечения вышеупомянутых заболеваний, которые содержат икаритин и лекарственные вспомогательные вещества.
Лекарственные вспомогательные вещества, используемые в препаратах по настоящему изобретению, являются обычными вспомогательными веществами, известными специалистам в данной области.
Подходящие лекарственные вспомогательные вещества подробно описаны в "Компендиум лекарственных вспомогательных веществ" (стр.123, Сычуаньское научно-техническое издательство, опубликовано в 1993 г., под редакцией Ло Миншэн и Гао Тяньхуэй). Например, лекарственные вспомогательные вещества, обычно используемые при приготовлении микроэмульсии, включают в себя (но не ограничиваются этим): соевое масло, полиоксиэтилен-23-лауриловый эфир, 1,2-пропандиол, гидрогенизированные кокоглицериды, эфиры лауроилполиэтиленгликоля-32-глицерина, макрогол 3350, сафлоровое масло, хлопковое масло, моностеарат декаглицерина; обычно используемые лекарственные вспомогательные вещества при приготовлении каплевидных пилюлей включают в себя (но не ограничиваются этим): макрогол 6000, макрогол 1000; Обычно используемые лекарственные вспомогательные при приготовлении капсул включают в себя (но не ограничиваются этим):лактозу и кукурузный крахмал. Обычно используемые лекарственные вспомогательные вещества при приготовлении мягких жевательных капсул включают в себя (но не ограничиваются этим): глицериды со средней длиной цепи, полиоксиэтиленовое касторовое масло, 1,2-пропандиол и т.п.
Специалисты в данной области могут выбрать подходящие лекарственные вспомогательные вещества в соответствии с фактическими потребностями и приготовить лекарства по настоящему изобретению способами, известными в данной области. Такие лекарства включают в себя (но не ограничиваются этим): твердые вещества, жидкости, масляные растворы, эмульсии, гели, аэрозоли, ингалянты, спреи, капсулы, пилюли, пластыри, суппозитории и т.п.
Икаритин по настоящему изобретению может облегчить нарушения функции тромбоцитов, сокращать тромбопластиновое время, способствовать свертыванию крови и может использоваться для предотвращения и лечения нарушения функции тромбоцитов, вызываемых им геморрагических заболеваний, способствовать свертыванию крови и может использоваться для предотвращения и лечения нарушений функции тромбоцитов, вызываемых им геморрагических заболеваний, геморрагических заболеваний, вызываемые нарушением свертывания крови, геморрагических заболеваний, вызываемых аномалиями стенок кровеносных сосудов, или геморрагических заболеваний, вызываемых антикоагулянтами и фибринолизом.
Подробные варианты осуществления
Настоящее изобретение дополнительно описано ниже посредством конкретных вариантов осуществления, и настоящее изобретение не ограничивается следующими примерами.
Пример изготовления препарата 1. Микроэмульсия икаритина
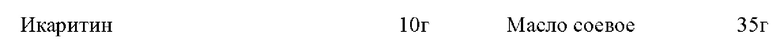
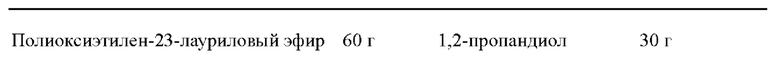
Процесс приготовления: взвесьте указанные в рецепте количества соевого масла, полиоксиэтилен-23-лаурилового эфира, 1,2-пропандиола, смешайте их и равномерно перемешайте, затем добавьте икаритин для растворения или обработайте ультразвуком для ускорения растворения, чтобы получить прозрачный раствор, представляющий собой микроэмульсию икаритина. Размер частиц измеряют с помощью лазерного анализатора размера частиц, и средний размер частиц составляет 15 нм.
Пример изготовления препарата 2. Микроэмульсия икаритина

Процесс приготовления: взвесьте указанные в рецепте количества глицерида гидрогенизированного кокосового масла, лауроилмакрогол-32-глицерида, 1,2-пропандиола, макрогола 3350, равномерно перемешайте после смешивания, затем добавьте икаритин для растворения, его также можно обработать ультразвуком для ускорения растворения, и получается прозрачный раствор, то есть препарат микроэмульсии икаритина. Размер частиц измеряют с помощью лазерного анализатора размера частиц, и средний размер частиц составляет 40 нм.
Пример изготовления препарата 3. Раствор икаритина для инъекций.

Процесс приготовления: добавьте икаритин к ПЭГ-400 в указанном количестве в рецепте, перемешайте до растворения, добавьте 0,9% раствор хлорида натрия до 10 л, равномерно перемешайте, добавьте 0,5% активированного угля для инъекций, перемешайте и декарбонизируйте, и получается раствор для инъекций.
Пример изготовления препарата 4. Раствор икаритина для инъекций

Процесс приготовления: равномерно смешайте предписанные количества в рецепте этанола и Твин-80, добавьте икаритин, размешайте до растворения, добавьте воду для инъекций до 10 л, равномерно размешайте, добавьте 0,5% активированного угля для инъекций, перемешайте и декарбонизируйте, и получается раствор для инъекций.
Пример изготовления препарата 5. Раствор икаритина для инъекций.

Процесс приготовления: добавьте икаритин в указанное количество этанола, перемешайте до растворения, добавьте воду для инъекций до 10 л, равномерно перемешайте, добавьте 0,5% активированного угля для инъекций, перемешайте и декарбонизируйте, и продукт будет получен.
Пример изготовления препарата 6. икаритин в пилюлях

Процесс приготовления: Взвесьте икаритин, прошедший через сито 100 меш, в предписанном количестве в рецепте, добавьте его к смешанному раствору, содержащему полиэтиленгликоль 6000 и полиэтиленгликоль 1000 в предписанных количествах в рецепте, который был нагрет и расплавлен на водяной бане, и перемешайте до полного смешения. Поместите в капельницу и получение пилюлей при температуре 95±2°С; капните в стеклянную конденсационную колонку, содержащую 4-6 мл метилсиликонового масла, выньте ее после формования пилюлей и абсорбируйте липкое метилсиликоновое масло абсорбирующей бумагой, и получается продукция.
Пример изготовления препарата 7. Кишечнорастворимая капсула икаритина


Процесс приготовления: взвесьте указанные в рецепте количества глицеридов со средней длиной цепи, касторового масла из полиоксиэтилена, 1,2-пропандиола и абсолютного этанола, смешайте их и равномерно перемешайте, затем добавьте икаритин для растворения или обработайте ультразвуком для ускорения растворения, при этом получается содержимое мягкой капсулы в виде микроэмульсии. Взвесьте указанные в рецепте количества желатина, глицерина и очищенной воды, равномерно смешайте их и вдавите в оболочки, а затем взвесьте указанные в рецепте количества Юдрагит Л30Д-55, триэтилцитрата, талька и очищенной воды и смешайте их, чтобы получить раствор для нанесения кишечнорастворимого покрытия. Содержимое мягкой капсулы содержимое мягкой капсулы в виде микроэмульсии, содержащей икаритин, обертывайте оболочкой для получения мягкой капсулы, и на мягкую капсулу нанесите кишечнорастворимое покрытие для приготовления кишечнорастворимой мягкой капсулы.
Пример изготовления препарата 8. Капсула икаритина

Процесс приготовления: 100 г икаритина, 120 г лактозы и 130 г кукурузного крахмала смешивают в миксере в течение 10-15 минут, добавляют 5 г стеарата магния и перемешивают в течение 1-3 минут, а затем упаковывают в 1000 оболочек капсулы.
Пример изготовления препарата 9. Таблетки икаритина


Процесс приготовления: равномерно смешайте икаритин, вспомогательные вещества, которые представляют собой микрокристаллическую целлюлозу и карбоксиметилкрахмал натрия, добавьте соответствующее количество крахмальной пульпы, чтобы сделать материал мягким, а затем пропустите через сито 16 меш для гранулирования. Влажные гранулы сушат при 60°С, сухие гранулы просеивают через сито 20 меш, а мелкий порошок в сухих гранулах просеивают, смешивают со стеаратом магния, а затем смешивают с сухими гранулами и прессуют в таблетки, каждая таблетка составляет около 260 мг, при этом получается препарат икаритина в таблетке.
Пример изготовления препарата 10, Инъекционный порошок икаритина

Процесс приготовления: Взвесьте сырье икаритина для инъекций в предписанном количестве в рецепте, добавьте соответствующее количество воды для инъекций для растворения. Затем добавьте предписанное количество предварительно стерилизованной и апирогенной смешанной глюкозы, добавьте воду для инъекций до предписанного объем 10 л. Добавьте к вышеуказанному лекарственному раствору 50 г активированного угля для инъекций, нагревайте при 60-80°С в течение 30 минут, фильтруйте через фильтровальную мембрану и собирайте фильтрат. Стерилизуйте и отфильтруйте вышеуказанный фильтрат с помощью стерилизующего фильтра под избыточным давлением по асептической методике, а затем фильтруйте через микропористую мембрану 0,22 мкМ. Проверьтефильтрат на содержание пирогенов и полуфабрикатов, после чего разливайте по флаконам. В специальном боксе сублимационной сушки предварительно заморозите при -40°С в течение 1,5-3,5 часов, сублимируйте под вакуумом для удаления 90% свободной влаги, а затем нагревайте и высушите (максимальная температура не должна превышать 35°С). После сушки вымораживанием получается инъекционный порошок икаритина.
Пример действия лекарственных средств 1. Влияние икаритина на активность тромбоцитов и агрегацию тромбоцитов in vitro
1. Влияние икаритина на активность тромбоцитов.
1.1 Животные для испытания
Крысы линии SD класса SPF массой 250-300 г, половина самок и самцов, самки крыс не беременны.
1.2 Обнаружение индуцированной тромбоцитов методом проточной цитометрии
Из глазницы крысы берите 0,5 мл крови и антикоагулируйте 3,8% раствором цитрата натрия (соотношение крови и антикоагулянта 9:1) для приготовления крови с низкой свертываемостью. У каждого животного берите по 50 мкл антикоагулированной кровидля определения фактора спонтанной активации тромбоцитов, берите еще 50 мкл крови с низкой свертываемостью, к ней добавьте аденозиндифосфат до конечной концентрации 10 мкмоль для активации. К двумя вышеуказанных антикоагулированных кровей добавьте по 1,0-1,5 мкл каждого из CD62pPE/Cy7 и CD61PE соответственно для двукратного мечения, чтобы пометить все тромбоциты с помощью CD61 и активированные тромбоциты с помощью CD62p. Возьмите 50 мкл крови с низкой свертываемостью, к ней добавьте аденозиндифосфат до конечной концентрации 10 мкмоль для активации. В качестве изотипических контролей используйте G2a-PE/Cy7 и G-PE, дважды помеченные внутрижелудочно. Указанные пробирки инкубируйте при 4°С в темноте в течение 20 мин, затем добавьте 0,5 мл 4% параформальдегида для фиксации в течение 10 мин. Возьмите 50 мкл фиксированного образца крови, добавьте 1 мл разбавителя, чтобы разбавить его, а затем проанализируйте его на проточном цитометре проточном цитометре. Популяции тромбоцитов определите на двухпараметрической диаграмме рассеяния CD61PE/бокового углового светорассеяния (SSC), подсчитывайте 5000 тромбоцитов, затем на диаграмме рассеяния CD61/CD62p подсчитывайте количество положительных клеток меченных CD61 и CD62p, коэффициент активации тромбоцитов (%) отражается как процент количества меченных CD62p по отношению к количеству меченных CD61.
1.3 Влияние икаритина на активность тромбоцитов у крыс, индуцированной аденозиндифосфатом
Берите 24 крысы, разделите на 3 группы по 8 крыс в каждой, которым введите внутрижелудочно 3, 6 и 18 мг/кг икаритина один раз в день в течение 3 дней подряд. Перед введением и через 20 мин после последнего введения из глазницы брали 1,0 мл крови, из которых 0,5 мл используйте для общего анализа крови и 0,5 мл используйте для приготовления крови с низкой свертываемостью. После обнаружения активности тромбоцитов вышеупомянутым методом проточной цитометрии проанализируйте на проточном цитометре, определите коэффициент активации, индуцированной аденозиндифосфатом до введения (базовое значение), возможность активации, индуцированной аденозиндифосфатом после введения, сравните их. В то же время перед введением берите 50 мкл антикоагулированной крови у крыс, без добавления аденозиндифосфата и таким же методом определите степени спонтанной активации антикоагулированной крови у крыс. Перед каждым забором крови животных не кормите в течение 16-24 ч.
1.4 Элементы экспериментов и экспериментальные результаты
(1) Влияние на активность тромбоцитов у крыс, индуцированной аденозиндифосфатом
Для индуцированной аденозиндифосфатом периферической антикоагулированной крови у крыс введением, по сравнению со скоростью спонтанной активации, доля активированных тромбоцитов во всех тромбоцитах, меченных CD61, была значительно увеличена, то есть экспрессия CD62p была значительно увеличена, что свидетельствует о том, что коэффициент активации тромбоцитов у крыс, индуцированной аденозиндифосфатом значительно повышена. Через 3 дня после введения икаритина и после активации периферической антикоагулированной крови у крыс аденозиндифосфатом на тех же условиях, экспрессия CD62p достоверно повышалась во всех тромбоцитах, меченных CD61, то есть повышалась коэффициент активации тромбоцитов, активированных аденозиндифосфатом, имеется значительная разница по сравнению с базовым значением до введения. Предполагается, что в Экспериментальных условиях внутрижелудочное введение икаритина может значительно способствовать активации тромбоцитов, индуцированной аденозиндифосфатом в периферической антикоагулированной крови у крыс. Более подробные сведения см. в Таблице 1.

(2) Результаты общего анализа крови
Не было существенной разницы в результатах общего анализа крови у крыс в группах икаритина в каждых дозах до и после введения, особенно в количестве тромбоцитов. Этот результат показывает, что икаритин не влияет количество тромбоцитов, при этом повышая активность тромбоцитов. Результаты представлены в таблице 2.
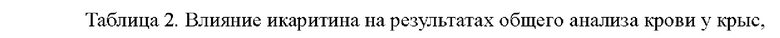
2. Влияние икаритина на активность агрегации тромбоцитов in vitro.
2.1 Метод испытания на повышение агрегационной активности тромбоцитов in vitro
После местной анестезии кроликов новокаином общую сонную артерию хирургическим путем отделите, возьмите кровь, антикоагулируйте 3,8% раствором цитрата натрия и центрифугируйте при 800 об/мин в течение 10 мин для приготовления обогащенной тромбоцитами плазмы (PRP), оставшуюся часть центрифугировали при 300 об/мин в течение 10 мин для приготовления обедненной тромбоцитами плазмы (РРР), чтоб производить испытание на активность агрегации тромбоцитов. Добавьте 265 мкл PRP и 30 мкл икаритина в пробирку для анализа (чтобы получить конечную концентрацию 0,1 ммоль/л, 0,5 ммоль/л и 5 ммоль/л соответственно), инкубируйте в течение 5 минут, добавьте 5 мкл аденозиндифосфата (в конечной концентрации 25 мкмоль/л) в качестве индуктора, наблюдайте и записывайте максимальную возможность агрегации в течение 5 мин. Используйте 1% диметилсульфоксид использовали в качестве маркера для наблюдения стимулирующего действия икаритина на активность агрегации тромбоцитов, индуцированную аденозиндифосфатом.
2.2 Экспериментальные результаты
Стимулирующее действие различных концентраций икаритина на активность агрегации тромбоцитов, индуцированной аденозиндифосфатом in vitro, показано в таблице 3. Из таблицы видно, что икаритин в каждой концентрации может способствовать агрегации тромбоцитов, индуцированной аденозиндифосфатом, этот эффект усиливался с увеличением концентрации, что указывало на то, что стимулирующее действие икаритина на активность агрегации тромбоцитов, индуцированную аденозиндифосфатом, было дозозависимым.
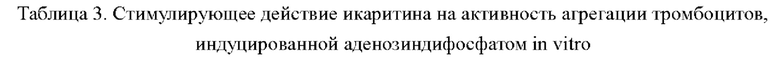

Пример действия лекарственных средств 2. Влияние икаритина на геморрагическую трансформацию после церебральной ишемии-реперфузии, индуцированную аспирином или клопидогрелем
1. Процесс испытания
1.1 Изготовление моделей и метод испытания
250 мышей-самцов линии ICR класса SPF, 150, ООО Цзинаньская компания по разведению подопытных животных Пэнюэ. Номер свидетельства на животное: №1107262011001201, №1107262011001347.
Мышей помещали на карантин на 3-7 дней после попадания в помещение, а в качестве подопытных животных отбирали здоровых (нерожавших самок) мышей. Основное содержание проверки в период карантина включают в себя, но не ограничивается: соответствие количественных и качественных показателей животных требованиям к испытанию; общее состояние животных; масса тела; животные, не соответствующие карантинным требованиям, в данном испытании не используются. Более подробные сведения см. в таблице 4.

Самцов мышей линии 1С в 5-недельном возрасте, выросли до 6-недельного возраста, разделили на контрольную группу, модельную группу, группу икаритина в дозе 3 мг/кг, группу икаритина в дозе 6 мг/кг, группу икаритина в дозе 12 мг/кг, группу икариина в дозе 12 мг/кг. С 1-го по 3-й день после группировки группам икаритина вводили 3, 6 и 12 мг/кг икаритина соответственно, а группе икариина 12 мг/кг икаритина один раз в день, другим группам вводили соответствующий растворитель внутрижелудочно; кроме контрольной группы, остальным группам вводили аспирин (100 мг/кг) или клопидогрел (15 мг/кг) внутрижелудочно один раз в день, объем внутрижелудочно составляет 10 мл/кг.
На третий день, через 10 мин после введения, мышей анестезировали внутрибрюшинным введением 70 мг/кг пентобарбитала натрия с последующей операцией церебральной ишемии-реперфузии (МСАО), ишемией в течение 1 ч и реперфузией в течение 23 ч.
24 часа после операции были конечной точкой испытания.
1.2 Экспериментальный показатель
Возможность кровотечения
Мышей анестезировали внутрибрюшинной инъекцией 70 мг/кг пентобарбитала натрия и отнимали мозговую ткань для регистрации кровотечения в мозг и расчета возможности кровотечения в мозг у мышей в каждых группах. Возможность кровотечения в мозг, % = количество животных с кровотечениями в мозг/количество выживших животных в каждых группах ×100,
2. Обработка данных
Все данные были введены в файл Excel, а статистический анализ был выполнен с помощью SPSS 17.0 и выражен как среднее значение ± стандартное отклонение (среднее ± стандартное отклонение). Испытательные данные были статистически проанализированы и сопоставлены с помощью однофакторного дисперсионного анализа и ttest.
3. Экспериментальные результаты
Влияние на возможность кровотечения
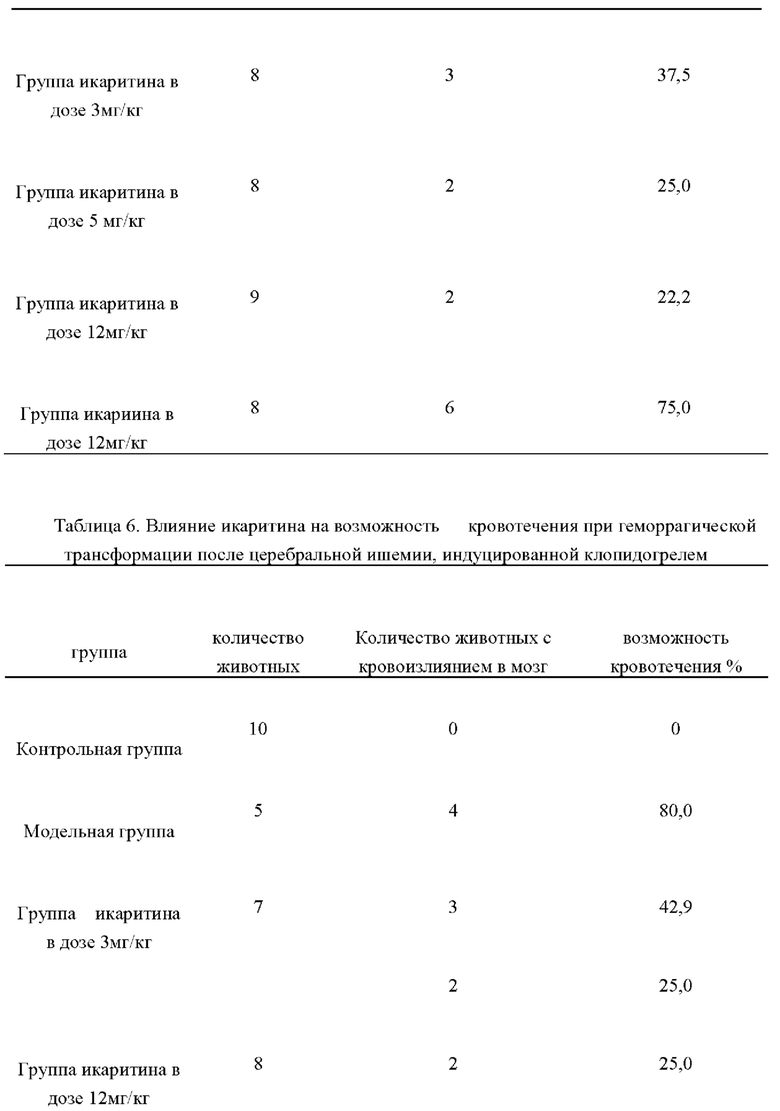
Экспериментальные результаты показали, что в модели геморрагической трансформации, индуцированной аспирином в сочетании с церебральной ишемией-реперфузией, возможность кровотечения в модельной группе составил 85,7%, возможность кровотечения значительно снизился после предварительного введения икаритина для профилактики, возможность кровотечения животных в группах икаритина в дозах 3 мг/кг, 6 мг/кг 12 мг/кг составил 37,5%, 25,0% и 22,2%, соответственно. возможность кровотечения не был значительно улучшен после предварительного введения икаритина для профилактики. Результаты представлены в таблице 5.
В модели геморрагической трансформации, вызываемой клопидогрелом в сочетании с церебральной ишемией-реперфузией, возможность кровотечения в модельной группе составил 80%, возможность кровотечения в группе икаритина в дозе 6 мг/кг и группе икаритина в дозе 12 мг/кг составила 42,9%, 25,0%, и 25,0% соответственно. Возможность кровотечения не был значительно улучшен, когда икаритин вводили заранее для профилактики. Результаты представлены в таблице 6.


В этом исследовании антитромбоцитарный препарат (аспирин или клопидогрель) в сочетании с церебральной ишемией-реперфузией был использован для успешного создания модели геморрагической трансформации в соответствии со справочной литературой.
В данном исследовании была успешно воспроизведена мышиная модель геморрагической трансформации, и возможность кровотечения был значительно увеличен. После предотвращения икаритином вышеперечисленные показатели значительно снизились, что свидетельствует о том, что икаритин может значительно ингибировать геморрагическую трансформацию после церебральной ишемии-реперфузии, индуцированной аспирином или клопидогрелем.
Пример действия лекарственных средств 3. Влияние икаритина на увеличенное время кровотечения у мышей, вызываемое гепарином натрия
1. Лекарство и его источники
Раствор гепарина натрия для инъекций
Источник: ООО Цзянсуская биохимическая фармацевтическая группа компаний Ваньбан
Номер партии: 51701106
Раствор сульфаметоксамина для инъекций
Источник: ОАО Шаньдунская фармацевтическая группа компаний Фанмин
Номер партии: 18060672
2. Подопытные животные и группировка
72 мыши в серии ICR в возрасте 5-6 недель, массовой 19-21 г, половина самок и самцов. Мышей помещали на карантин на 7 дней после входа в помещение, а в качестве подопытных животных отбирали здоровых мышей. Взвешивание производили в первый и последний дни карантина.
По массе тела в конце карантинного периода самцы и самки были разделены на шесть групп упрощенным случайным методом (кг, L, М, Ненормальная группа (С), модельная группа (V), группы икаритина в низкой, средней и высокой дозах (2, 6, 18 мг/кг, L, М, Н) и группа препарата положительного действия (200 мг/кг сульфоэтиламина, Р).
3. Предварительное введения и создание модели
После того, как группирование было завершено, нормальной группе и модельной группе вводили внутрижелудочно 10 мл/кг растворителя икаритина, который был получен путем добавления 12 г гипромеллозы Е5 и 0,1 г лаурилсульфата натрия к 1 л воды. Группам икаритина в каждых дозах вводили 2, 6 и 18 мг/кг икаритина внутрижелудочным введением один раз в день в течение пяти дней подряд; группе препарата положительного действия внутрибрюшинно вводили 200 мг/кг фенсульфа один раз в день в течение пяти дней подряд. Через час после последнего предварительного введения модельной группе и каждой группе введения вводили инъекционный раствор 150 ед/кг гепарина натрия через хвостовую вену для создания модели, а нормальной группе вводили инъекционный раствор 10 мл/кг хлорида натрия через хвостовую вену.
4. Экспериментальный показатель
4.1 Время кровотечения
Через 15 минут после создания время кровотечения у каждой мыши измеряли путем отсечения хвоста.
4.2 Результаты общего анализа крови и четырех параметров свертываемости крови
После тестирования времени кровотечения мышей анестезировали пентобарбиталом натрия, взяли кровь из брюшной кардинальной вены и проводили общий анализ крови и четырех параметров свертываемости крови (протромбиновое время, тромбопластиновое время, тромбиновое время и фибриноген).
5. Экспериментальные результаты
5.1 Время кровотечения
Время кровотечения у мышей в каждых группах показано в таблице 7.
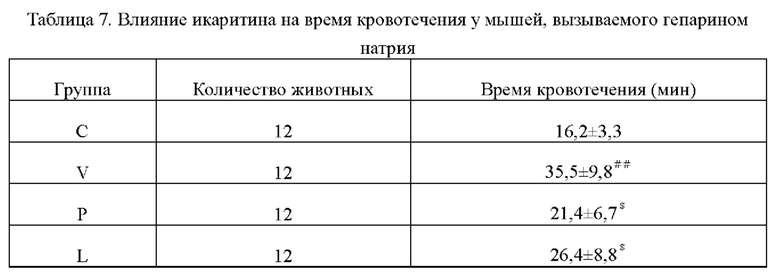

Из таблицы видно, что по сравнению с нормальной группой время кровотечения у мышей в модельной группе было значительно увеличено, что свидетельствует об успешном создании модели; по сравнению с модельной группой время кровотечения у мышей в каждых экспериментальных группах было значительно укорочено, что показывает, что икаритин может сократить время кровотечения у мышей с геморрагией. Время кровотечения сокращалось более значительно с увеличением дозы, что указывает на то, что прокоагулянтный эффект икаритина зависит от дозы. И группа высокой дозы имеет значительную разницу по сравнению с группой препарата положительного контроля, что указывает на то, что прокоагулянтный эффект икаритина лучше, чем у препарата положительного контроля.
5.2 Результаты общего анализа крови и четырех параметров свертываемости крови
Результаты общего анализа крови и четырех параметров свертываемости крови у мышей в каждых группах показаны в таблице 8 и таблице 9 соответственно.
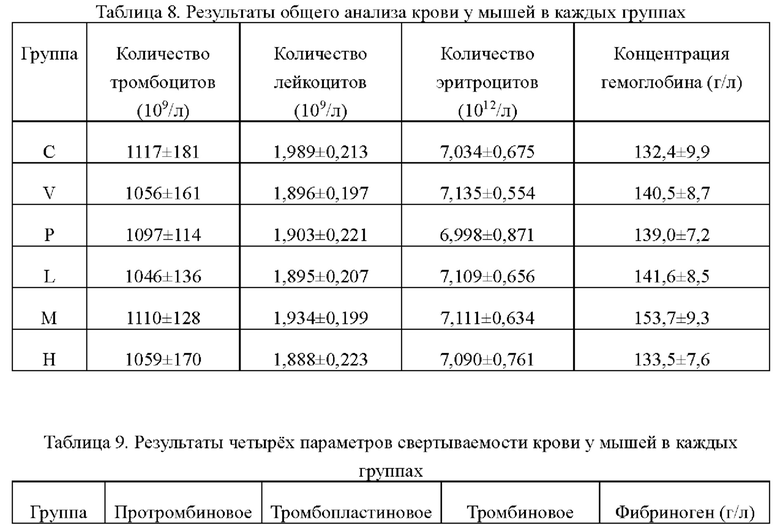
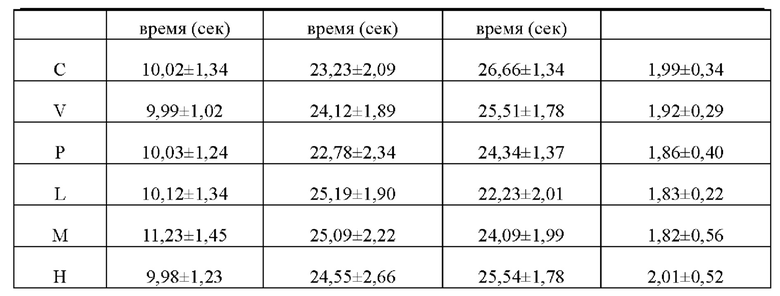
Из приведенной выше таблицы видно, что не было существенной разницы по результатам общего анализа крови и четырех параметров свертываемости крови у мышей в каждых группах, что указывает на то, что икаритин не оказывал существенного влияния на результаты общего анализа крови и четырех параметров свертываемости крови, когда он укорачивал увеличенное время кровотечения, вызываемое гепарином натрия.
Пример действия лекарственных средств 4. Влияние икаритина на вызываемое аспирином увеличенное время кровотечения у мышей
1. Лекарство и его источники
Аспирин
Источник: ООО Шаньтоуский фармацевтический комбинат Цзиньши
Номер партии: 1903012
Раствор сульфаметоксамина для инъекций
Источник: ОАО Шаньдунская фармацевтическая группа компаний Фанмин
Номер партии: 1905032
2. Подопытные животные и группировка
Взяли 96 мышей линии ICR в возрасте 5-6 недель, массовой 19-21 г, половина самок и самцов. Мышей помещали на карантин на 7 дней после входа в помещение, а в качестве подопытных животных отбирали здоровых мышей. Взвешивание производили в первый и последний дни карантина
По массе тела в конце карантинного периода самцы и самки были разделены на шесть групп упрощенным случайным методом, а именнонормальная группа (С), модельная группа (V), группы низкой, средней и высокой доз икаритина (2, 6, 18 мг/кг, L, М, Н) и Нормальная контрольная группа(200 мг/кг сульфоэтиламина, Р).
3. Предварительное введения и создание модели
После того, как группировка была завершена, нормальной группе и модельной группе вводили 10 мл/кг носителя икаритина путем внутрижелудочного введения, и группам икаритина в каждых дозах вводили 2, 6 и 18 мг/кг икаритина путем внутрижелудочного введения один раз в день в течение 5 дней подряд; нормальной контрольной группе внутрибрюшинно вводили инъекционный раствор 200 мг/кг фенсульфама один раз в день в течение пяти дней подряд. Через час после последнего предварительного введения модельной группе и каждым группам введения внутрижелудочно вводили 20 мг/кг аспирина для создания модели, а нормальной группе внутрижелудочно вводили равный объем физиологического раствора.
4. Определение времени кровотечения
После 15 минут создания модели время кровотечения у каждой мыши измеряют путем отсечения хвоста.
5. Экспериментальные результаты
Время кровотечения у мышей в каждых группах показано в таблице 10. По сравнению с нормальной группой время кровотечения у мышей в модельной группе было значительно увеличено, что указывает на то, что создание модели было успешным; по сравнению с модельной группой время кровотечения у мышей в каждых группах введения было значительно сокращено, что указывает на то, что икаритин может сократить кровотечение у мышей с кровотечением. При увеличении дозы время кровотечения сокращалось более значительно, что указывает на то, что прокоагулянтный эффект икаритина был дозозависимым, а группа в высокой дозе значительно отличалась от группы препарата положительного контроля, что указывает на что прокоагулянтный эффект икаритина был лучше, чем у препарата положительного контроля.
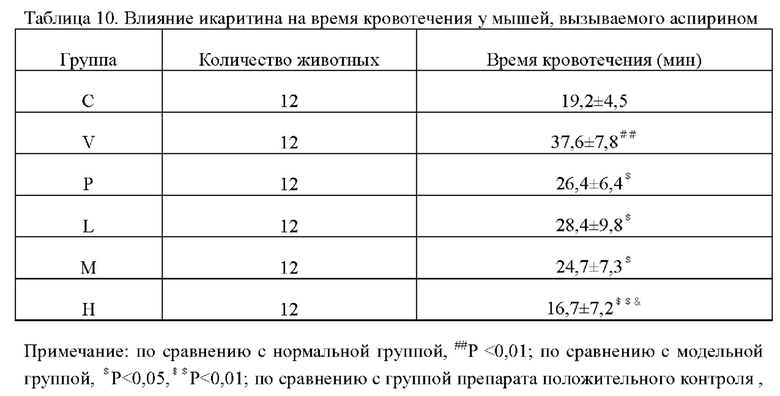

Пример действия лекарственных средств 5. Влияние икаритина на действие тромболитических лекарств
1. Создание модели тромбоза брюшной аорты крысы
Модель тромба брюшной аорты крыс создали следующим образом. Крыс анестезировали внутрибрюшинной инъекцией 1,5% пентобарбитала натрия в концентрации 40 мг/кг. На животе крысы выбривали шерсть для подготовки кожи и фиксировали крысы на планшете в положении лежа на спине. Кожу живота крысы надрезали, кровеносные сосуды и окружающие ткани выделяли, брюшную аорту обнажали и тщательно изолировали стеклянной мелкой иглой. Помесили полоску оловянной фольги размером 0,7 см × 1,5 см под брюшную аорту, затем оберните брюшную аорту полоской фильтровальной бумаги (0,5 см × 1,0 см), пропитанной 35% раствором FeCl3, и удалили полоску фильтровальной бумаги через 30 минут. Цвет стенки был явно потемневшим, под микроскопом можно было видеть образование эмболов в кровеносных сосудах, патологические срезы показали, что кровеносные сосуды заблокированы тромбом.
2. Группировка и введение животным
Крысы линии SD были случайным образом разделены на 3 группы в соответствии с массой тела, по 10 крыс в каждых группах, а именно модельная группа тромба, группа капсулы люмброкиназы и группа капсулы люмброкиназы + икаритина. Через 5 минут после создания модели капсулы люмброкиназы вводили инъекцией непосредственно через двенадцатиперстную кишку в дозе 30×104 ед/кг, икаритин вводили внутрижелудочным введением в дозе 18 мг/кг, а модельной группе тромба вводили равный объем дистиллированной воды.
3. Отбор пробы
Оба конца брюшной аорты пережимали гемостатическими щипцами, сегмент кровеносного сосуда в месте создания модели полностью удаляли, аккуратно вырезали и взвешивали сегмент кровеносного сосуда длиной 0,5 см, покрытый фильтровальной бумагой, а оставшийся сегмент кровеносного сосуда хранили в 10% формальдегиде.
4. Определение массы тромба у крыс.
Массу удаленного сегмента кровеносного сосуда взвешивали на электронных весах, и взвешивали кровеносный сосуд после удаления тромба.
Удаленный тромб высушивали в сушильном шкафу при 80°С, оставляли на ночь и взвешивали по сухой массе тромба.
5. Экспериментальные результаты
Масса тромба в каждых группах показана в таблице ниже. Из таблицы видно, что по сравнению с модельной группой масса тромба в группе люмброкиназы была значительно снижена, что свидетельствует о значительном тромболитическом эффекте люмброкиназы; по сравнению с группой люмброкиназы не было существенной разницы в массе тромба у крыс в группе люмброкиназы + икаритина, что указывает на то, что икаритин не влиял на действие растворения люмброкиназы на тромб крысы.

Пример действия лекарственных средств 6. Влияние икаритина на геморрагическую трансформацию, вызываемую тромболитическими средствами
1. Создание модели животных
Модель аутоиммунной тромбоэмболии средней мозговой артерии крыс создали по следующей методике: крыс анестезировали внутрибрюшинной инъекцией 10% гидрата хлорной кислоты при массе тела 350 мг/кг, в положении лежа на спине и фиксировали на операционном столе, а кожу была продезинфицирована в соответствии с процедурами асептической эксплуатации, разложили полотенец. На коже посередине шеи сделали разрез длиной 3,0 см, тупым путем отделили мышцы и подкожную клетчатку, а также правые двусторонние общие сонные артерии, наружные сонные артерии и внутренние сонные артерии, чтобы избежать повреждения блуждающего нерва, отделили сонную артерию изолировали до основания черепа, а наружную сонную артерию перевязывали в месте бифуркации билатеральных общих сонных артерий. С помощью шприца на 1 мл отбирали 0,1 мл артериальной крови из бедренной артерии крысы, вдохнули 4 единицы тромбина, полностью перемешали и дали постоять 8-10 мин, после свертывания крови вводили ее в венозную постоянную иглу 24G, чтобы получить эмбол длиной 1 см, а затем вставили ее в шприц с физиологическим раствором объемом 1-2 мл. Затем вводили иглу в двусторонние общие сонные артерии перед бифуркацией наружной сонной артерии и внутренней сонной артерии и вводили внутреннюю сонную артерию спереди и медиально примерно на 8-10 мм, вытащили стержень иглы, быстро вводили физиологический раствор в шприце во внутреннюю сонную артерию, затем перевязали и зашили. За исключением введения физиологического раствора вместо эмболов, остальные этапы хирургического вмешательства в группе ложнооперированных животных и в нормальной контрольной группе были такими же, как и в вышеуказанных модельных группах тромболитического препарата.
2. Критерии подопытных животных
Симптомы и признаки у крыс наблюдали через 2 ч после создания модели. Следующие симптомы и признаки указывают на успешное изготовление модели: симптом Горнера на ипсилатеральной стороне ишемии, поворот на контралатеральную сторону ишемии при ходьбе; опрокидывание на противоположную сторону; при поднятии и подвешивании хвоста крысы передняя конечность на противоположной стороне ишемии мозга согнута, приподнята, плечо приведено, локоть выпрямлен и т.д.
3. Группировка и введение животным
102 крысы были случайным образом разделены на группу ложнооперированных животных, группу тромболитического препарата rt-PA (группу тромболитического препарата), группу тромболитического препарата rt-PA + икаритина в низкой, средней и высокой дозах, из которых 18 крыс находились в группе ложнооперированных животных. Остальные группы по 21 животному в каждой. Животные в каждых группах были поровну разделены на разные временные точки умерщвления (через 3, 6 и 24 часа после приема тромболитического препарата), в каждой временной точке в группе ложнооперированных животных было по 6 животных, в остальных группах по 9 животных в каждых группах через 3 часа., и по 6 животных в каждых группах в другие временные точки. Еще 20 крыс брали в качестве запасных, в случае сбоя модели (гибель или 0 баллов) их случайным образом заменяли.
За исключением группы ложнооперированных животных, остальным группам вводили альтеплазу (rt-PA) (5 мг/кг, добавили стерилизованную воду для приготовления rt-PA до 1 л) через бедренную вену через 3 часа после создания модели. Группе ложнооперированных животных вводили равный объем физиологического раствора.
Группам лечения вводили лекарства дважды, а лекарства вводили внутрижелудочно сразу после создания модели и тромболитической терапии. Дозы составляли 2, 6 и 18 мг/кг соответственно. Группе ложнооперированных животных вводили равный объем физиологического раствора.
4. Метод наблюдения и измерения показателя
4.1 Сравнение общего состояния и результатов общего анализа крови
4.1.1 Сравнивали общее состояние крыс в группе ложнооперированных животных, группе тромболитического препарата и группе тромболитического препарата + икаритин.
4.1.2 Сделали общий анализ крови крыс в группе ложнооперированных животных, группе тромболитического препарата и группе тромболитического препарата + икаритина.
4.2 Определение объема (возможности) инфаркта головного мозга
За исключением группы ложнооперированных животных, по 3 крысы в каждых группах умерщвляли через 3 часа после приема тромболитического препарата, ткань мозга помещали в холодильник при температуре -20°С на 20 минут, а затем создали корональные срезы мозга толщиной 2 мм и погружали в 2% растворе тромбина в точке тромбинового времени С, темной водяной бане при температуре 37°С в течение 30 минут, помещали в 4% раствор параформальдегида на 24 часа, после фотографирования с помощью программного обеспечения для анализа изображений (Image-ProPlus6.0) определи объем инфаркта. Объем инфаркта = объем неишемизированного полушария - объем неинфарктной области ишемизированного полушария, объемная доля инфаркта представляла собой процент объема инфаркта (%) к общему объему неишемизированного полушария.
4.3 Определение объема кровотечения в мозг:
(1) Создание стандартной кривой
Брали еще 4 здоровые крысы и умертвили с помощью чрезмерной анестезии, проводили транскардиальную перфузию и взяли кровь. Брали 8 тканей полушарий головного мозга, добавляли по 0, 0,5, 1, 2, 4, 8, 16, 32, 50 мкл артериальной крови самцов крыс линии SD к ткани каждого полушария по очереди, затем добавляли PBS с рН=7,4 до общего объема 3 мл, Гомогенат лизировали ультразвуком в течение 30 с, центрифугировали при 13000 об/мин в течение 30 мин при 4°С. Взяли 0,8 мл реактива Драбкина и смешали с 0,2 мл супернатанта каждого образца, поместили его в темноту на 10 минут при комнатной температуре для измерения поглощения при длине волны 540 нм (поглощение образца без крови установлено равным 0). Взяв абсорбцию за ординату и объем крови в каждом образце за ось абсцисс, нарисовали стандартную кривую.
(2) Определение кровотечения в пораженное инфарктом полушарие
В ткань пораженного полушария крыс, перенесших инфаркт головного мозга, добавили PBS с рН 7,4 до общего объема 3 мл, гомогенизировали в течение 30 с, лизировали ультразвуком и центрифугируйте при 13000 об/мин в течение 30 мин. Смешали 0,8 мл реактива Драбкина с 0,2 мл супернатанта каждого образца и поместили в темноту при комнатной температуре на 10 минут для измерения оптической плотности при длине волны 540 нм (оптическая плотность образца бескровной ткани мозга была установлен на 0, и была измерена та же партия). Объем крови, соответствующий полученной абсорбции на стандартной кривой, является объемом кровотечения.
5. Статистическая обработка
Все испытательные данные были выражены как среднее значение ± стандартное отклонение и обработаны с помощью пакета статистических программ PASWStatisticsl7.0, Однофакторный дисперсионный анализ использовали для внутригруппового сравнения. Когда дисперсии равны, использовали тест LSD. При неравномерной дисперсии использовали непараметрический критерий тромбинового времени Данна ТЗ; Корреляционный анализ проводили с использованием двухстороннего коэффициента корреляции Пирсона «произведение-разность» с линейной корреляцией, и двустороннее значение Р<0,05 считалось статистически значимым.
6. Экспериментальные результаты
6.1 Сравнение общего состояния и результаты общего анализа крови
6.1.1 Сравнение общего состояния
Крысы в группе ложнооперированных животных были в хорошем психическом состоянии, цвет и блеск меха были нормальными.
По сравнению с таковыми до операции послеоперационное психическое состояние животных в группе тромболитического препарата, группе тромболитического препарата + икаритина было достоверно хуже, чем до операции, что проявлялось в виде: тусклого цвета волос, снижения спонтанной активности, относительно вялой реакции на внешние воздействия. Состояние животных в группе тромболитического препарата было худшим, а животные в группе тромболитического препарата + икаритина в высокой дозе имели лучшее психическое состояние.
6.1.2 Результаты общего анализа крови
Результаты общего анализа крови показали, что по сравнению с животными в группе тромболитического препарата + икаритин достоверной разницы в результатах общего анализа крови животных в группе тромболитического препарата не наблюдалось. По сравнению с животными в группе ложнооперированных животных не было выявлено существенных различий в результатах общего анализа крови животных в группе тромболитического препарата и группе тромболитического препарата + икаритина.
6.2 Определение объема (возможности) инфаркта головного мозга
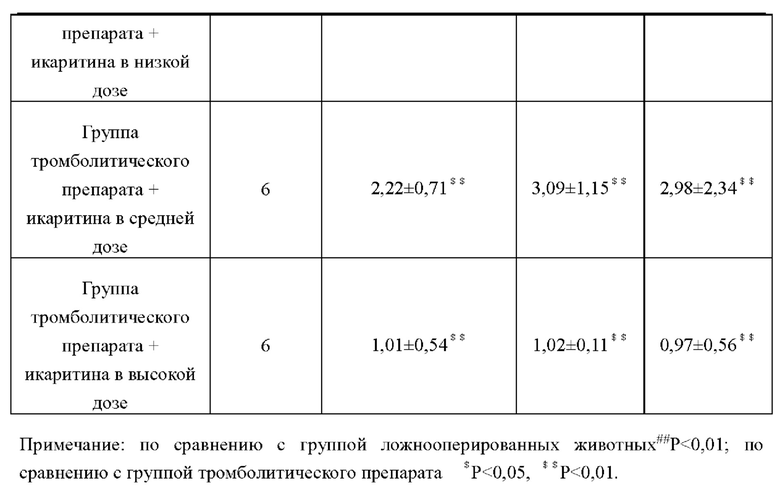
Окрашивание тромбином в точке тромбинового времени. С позволяет наблюдать масштабы церебральной ишемии. Результаты окрашивания: ткань головного мозга на стороне без инфаркта у крыс в группе ложнооперированных животных и других группах была равномерно красной, в то время как ткань мозга на стороне инфаркта была явно отечной, бледной, тусклой, а область инфаркта была бледной после окрашивания в точке тромбинового времени С. Результаты исследования показали, что объемная доля инфаркта головного мозга составила (38,84±3,67)%, измеренная через 3 часа после создания модели посредством запасных крыс, а окраска тромбином ткани головного мозга крыс в группе ложнооперированных животных в точке тромбинового времени С не изменилась. По сравнению с модельной группой окрашивание тромбином крыс в группе тромболитического препарата и группах тромболитического препарата + икаритина в каждых дозах показало, что бледная площадь области инфаркта была значительно уменьшена в точке тромбинового времени С. Результаты измерения объема церебрального инфаркта показали, что возможность уменьшения объема церебрального инфаркта в группе тромболитического препарата + икаритина в каждых дозах была аналогична группе тромболитиков. Результаты показывали, что икаритин не влияет на действие тромболитических препаратов.
6.3 Сравнение объема кровотечения в мозг у крыс в каждых группах в разные точки времени
Объем кровотечения в мозг у крыс в каждых группах в разные точки времени описано в таблице ниже. Из таблицы видно, что объем кровотечения в группе тромболитического препарата был значительно больше, чем в группе ложнооперированных животных, что указывает на то, что тромболитические лекарства вызывали геморрагическую трансформацию у крыс с инфарктом мозга, а объем кровотечения увеличивалась по сравнению с группой тромболитического препарата, объем кровотечения группе тромболитического препарата+икаритина в каждых дозах значительно уменьшался, а объем кровотечения не увеличивался при продление времени. Это показывает, что икаритин может эффективно предотвращать геморрагическую трансформацию, вызываемую тромболитическими средствами.
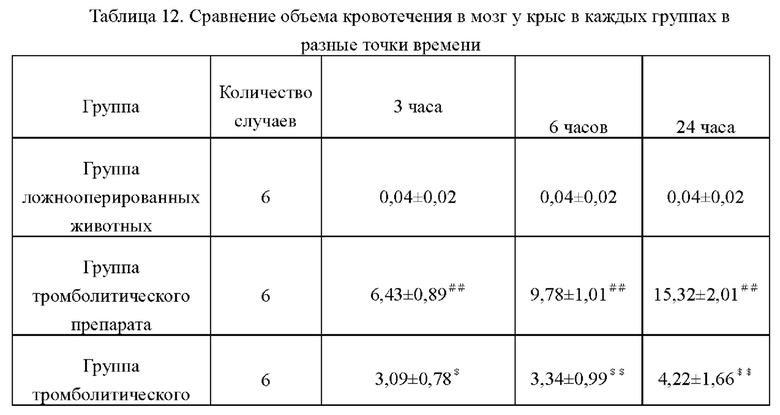
Пример действия лекарственных средств 7. Профилактическое действие икаритина на желудочно-кишечное кровотечение, вызываемое аспирином.
1. Создание модели и группировка
24 крысам линии SD вводили внутрижелудочно аспирин в дозе 500 мг/кг для создания модели желудочно-кишечного кровотечения, а другим 12 крысам линии SD вводили внутрижелудочно равный объем физиологического раствора в качестве препарата нормального контроля. Крыс с геморрагией для создания модели случайным образом разделили на модельную группу и группу икаритина. Группе икаритина вводили икаритин внутрижелудочно в дозе 18 мг/кг одновременно с создания модели, а модельной группе вводили такой же объем физиологического раствора внутрижелудочно.
2. Вскрытие и наблюдение за кровотечением из язвы слизистой оболочки желудка
Через 24 часа после внутрижелудочного введения анестезировали, умерщвляли, вскрывали крыс, наблюдали за кровотечениями, эрозиями и изъязвлениями на поверхности слизистой оболочки желудка крыс.
3. Экспериментальные результаты и обсуждение
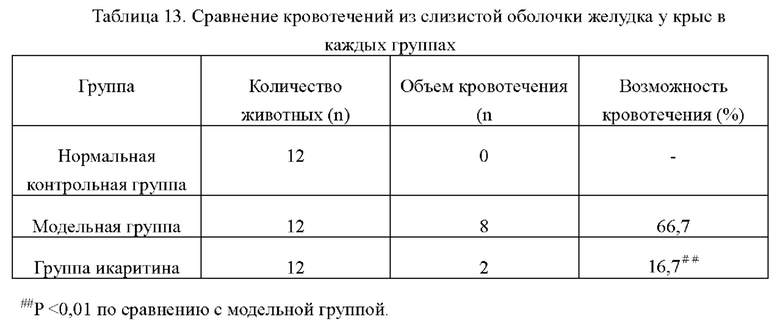
Возможность кровотечения из слизистой оболочки желудка в каждых группах представлена в таблице 13. Из таблицы видно, что в нормальной контрольной группе кровотечения отсутствуют, а возможность кровотечения в модельной группе составляет 66,7%, по сравнению с модельной группой кровотечение из слизистой оболочки желудка в группе икаритина было значительно легче, а возможность кровотечения была значительно ниже, чем в модельной группе, и такое снижение было статистически значимым (Р<0,01), что показывает, что икаритин может значительно снизить возможность желудочно-кишечного кровотечения, вызванного аспирином.
Пример действия лекарственных средств 8. Профилактическое действие икаритина на желудочные кровотечения, вызываемые тромболитическими средствами
1. Создание модели и группировка
120 крыс линии SD случайным образом разделили на группу ложнооперированных животных, модельную группу, группу урокиназы, группу икаритина в высокой дозе + урокиназы, группу икаритина в средней дозе + урокиназы, группу икаритина в низкой дозе + урокиназы, было по 20 крыс в каждых группах. Среди них группам икаритина в каждых дозах вводили внутрижелудочно за 4 дня до операции, и дозы составляли 2 мг/кг, 6 мг/кг, 18 мг/кг соответственно, группе ложнооперированных животных, модельной группе и группе урокиназы вводили внутрижелудочно равный объем физиологического раствора; за исключением группы ложнооперированных животных, остальным группам вводили с помощью катетера через регионарную артерию, доза урокиназы составляла 5000 ед/кг, концентрация составляла 200 ед/мкл, объем составляет 20 мкл, модельной группе и группам икаритина вводили через регионарную артерию равный объем физиологического раствора. Животную модель тромбоэмболической церебральной ишемии создали путем блокирования средней мозговой артерии линей связывания аутологичного тромба, и не удалили катетер.
2. Метод наблюдения и измерения показателя
2.1 Расчет возможности кровотечения
Через 24 ч после внутриартериального введения крыс каждой группы анестезировали и вскрывали, проверяли количество случаев кровотечения невооруженным глазом и световым микроскопом и рассчитывали отношение количества случаев кровотечения к общему количеству.
2.2 Патоморфологическое исследование тканей желудка:
Левое легкое и антральный отдел желудка были вырезаны, зафиксированы 100 г/л нейтральным раствором формальдегида, обезвожены, сделаны прозрачными, покрыты воском, залиты, сделаны срезы, окрашены, и патологические изменения наблюдались под световым микроскопом. Степень повреждения оценивали по степени гиперемии, отека тканей и дегенерации клеток от легкой до тяжелой: степень I- 0-25%, степень II - 26-50%, степень III степень 51-75%, степень IV>75% (см. кровотечение под микроскопом).
3. Экспериментальные результаты и обсуждение
3.1 Сравнение возможности кровотечения
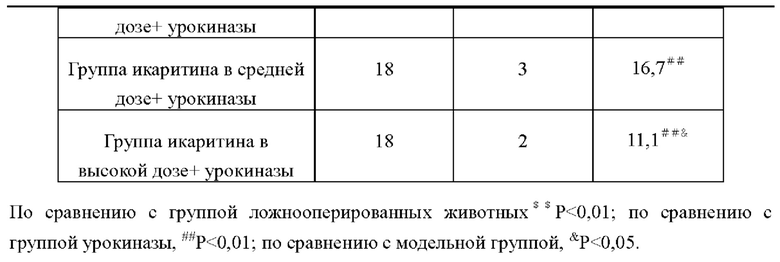
В таблице 14 показано сравнение возможности желудочного кровотечения в каждых группах. Из таблицы видно, что желудочное кровотечение произошло в модельной группе по сравнению с группой ложнооперированных животных, что указывает на то, что ишемия головного мозга может в определенной степени вызывать осложнения желудочного кровотечения; По сравнению с модельной группой частота кровотечений в группе урокиназы была достоверно выше, такая достоверная разница (Р<0,01) показала, что тромболитические препараты могли вызывать желудочно-кишечные кровотечения, осложненные тромболитической терапией по поводу тромботических заболеваний; По сравнению с группой урокиназы, возможность кровотечение у животных в группах урокиназы + икаритина, была значительно снижена, при этом достоверное различие (Р<0,01) указывало на то, что икаритин обладает эффектом снижения желудочно-кишечных кровотечений, вызванных тромболитическими препаратами, и этот эффект имеет дозозависимую зависимость.

3.2 Патологическое исследование тканей желудка
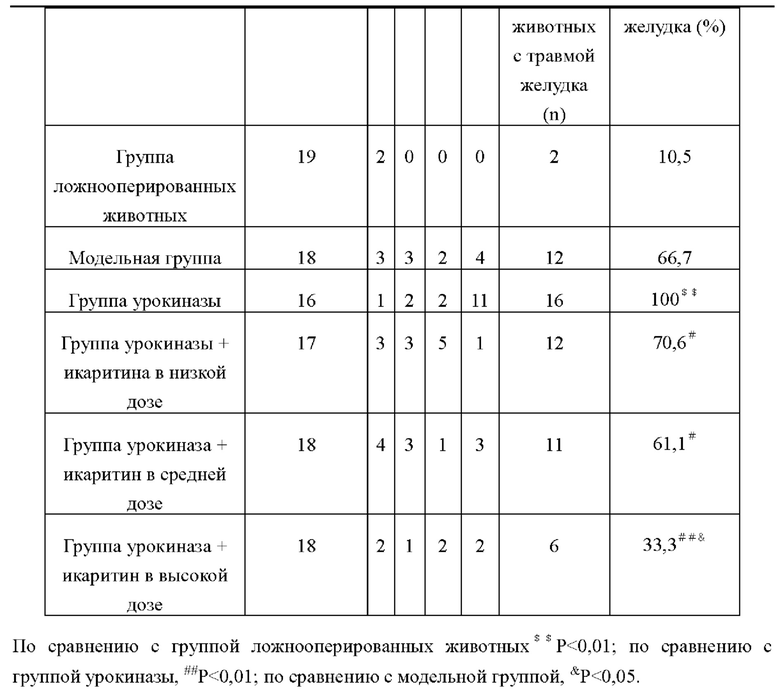
Результаты патологоанатомического наблюдения за тканью желудка крыс в каждых группах представлены в таблице 15. Из таблицы видно, что по сравнению с модельной группой возможность повреждения желудка в группе урокиназы была значительно выше, и имелась достоверная разница (Р<0,01), что указывает на то, что тромболитические лекарства при тромболитическом лечении тромболитических заболеваний могут вызвать такие осложнения, как гиперемия тканей желудка, отек, дегенерация клеток и даже кровотечение. По сравнению с группой урокиназы, возможность вышеуказанных осложнений значительно снижена в группах урокиназа+икаритин в каждых дозах, такая значительная разница (Р<0,01 или Р<0,05) доказала, что икаритин может уменьшить осложнения, вызванные тромболитическими препаратами, такие как гиперемия тканей желудочно-кишечного тракта, отек, дегенерация клеток и даже кровотечение. По сравнению с модельной группой возможность вышеперечисленных осложнений в группе урокиназа + икаритина в высокой дозе была значительно ниже. Приведенные выше результаты показали, что икаритин может не только снижать возможность желудочно-кишечных кровотечений, вызываемых тромболитическими средствами, но и, кроме того, он может облегчать такие симптомы, как гиперемии тканей желудочно-кишечного тракта, отек, дегенерации клеток, оказывает хороший восстановительный эффект при травмах пищеварительного тракта.
Кроме того, результаты сравнения с модельной группой показали, что икаритин также оказывает определенное профилактическое и лечебное действие при поражении пищеварительного тракта, вызываемом ишемическими заболеваниями.

Пример действия лекарственных средств 9. Влияние икаритина на геморрагические осложнения, вызываемые тромболитическими средствами
1. Создание модели
60 крыс-самцов линии Вистар (класса SPF) массой 220-260 г были случайным образом разделены на модельную группу инфаркта миокарда (Myocardial Infarction) и контрольную группу в соответствии с таблица случайных чисел, при этом 12 крыс в нормальной контрольной группе и 48 крыс в модельной группе. Крыс содержали, как обычно, в отдельных клетках, по 4 в каждой клетке. После записи нормальной электрокардиограммы крысам в модельной группе инфаркта миокарда подкожно вводили изопротеренол (ISO) 150 мг⋅кг-1d-1 в дозе 0,2 мл на 100 г массы тела крыс с интервалом 24 часа в течение 2 дней подряд. Нормальной контрольной группе подкожно вводили такое же количество (0,2 мл/100 г) физиологического раствора в течение 2 дней подряд. Электрокардиограмму проводили через 24 ч после второго подкожного введения изопротеренола. После анестезии крыс эфиром регистрировали электрокардиограмму в шести отведениях (от конечностей) до и после инъекции, измеряли частоту сердечных сокращений, наблюдали степень смещения зубца Q и сегмента ST и оценивали успешность модели: подъем сегмента ST в отведении II выше 0,2 мВ или образование зубца Q является признаком инфаркта миокарда.
2. Группировка и введение животным
В общей сложности было отобрано 36 крыс с моделью, которые случайным образом были разделены на модельную группу, группу тромболитического препарата и группу тромболитического препарата + икаритина в соответствии с таблицей случайных чисел. Группе тромболитического препарата вводили rt-PA в дозе 5 мг/кг через бедренную вену, группе тромболитического препарата + икаритина вводили тромболитический препарат в той же дозе, одновременно внутрижелудочно вводили икаритин (18 мг/кг), модельной группе вводили равный объем физиологического раствора через бедренную вену.
3. Экспериментальный показатель
3.1 Мониторинг ЭКГ у крыс в каждых группах
Крыс анестезировали ингаляцией эфира, и после того, как крысы входили в наркозное состояние, дыхание становилось стабильным, исчезал установочный рефлекс и болевые ощущения. Принимая положение на спине, зафиксировали крысу на испытательном стенде, подкожно вводили игольчатый электрод в конечности крысы (будьте осторожны, чтобы не ввести его в мышцу), методом отведений от конечностей сделали электрокардиограмму крыс, к правой верхней конечности подключили красную линию, к левей верхней конечности - желтую линию, к левой нижней конечности - зеленую линию, к правой нижней конечности - черную линии, включая электрокардиограф, скорость подачи бумаги составляет 50 мм/с, напряжение - 1 мВ, после электрокардиограммы животных возвращали в клетку.
3.2 Морфологическое наблюдение сердца у крыс в каждых группах
После последнего введения животных умерщвляли, укладывали на спину и фиксировали на крысиной доске, кожу стерилизовали 75%-ным спиртом, быстро вскрывали грудную клетку, разрезали кожу и подкожную клетчатку по средней линии грудины тканевыми ножницами, вырезано левое ребро грудины, перерезаны крупные сосуды для извлечения сердца, остаточная кровь в полости сердца отмыта 0,9% раствором натрия хлорида при 4°С, ушки левого и правого предсердий и оставшиеся крупные кровеносные сосуды отрезали и затем фильтровали насухо через фильтровальную бумагу. На электронных весах взвешивали вес тела крысы и значение веса сердца, взвешивали фактический вес сердца (влажный вес) и рассчитывали его отношение к весу тела (HWI=вес сердца/вес тела).
3.3 Наблюдение геморрагических осложнений у крыс в каждых группах
Кровоизлияние крыс в каждых группах наблюдали, в том числе подкожное кровоизлияние. Висцеральное кровоизлияние и внутричерепное кровоизлияние наблюдали после вскрытия.
4. Экспериментальные результаты и обсуждение
4.1 ЭКГ животных в каждых группах
В отличии от животных в контрольной группе, обнаружили патологические зубцы Q на крысах в модельной группе, что свидетельствовало об успешном создании модели; в отличии от животных в модельной группе патологические зубцы Q в группе тромболитического препарата и группе тромболитического аппарата + икаритина исчезли, указывая на то, тромболитические препараты могут значительно уменьшить симптомы инфаркта миокарда у крыс, икаритин не влияет на действие тромболитических препаратов.
4.2 Сравнение морфологической характеристики сердца у крыс в каждых группах
Морфологическую характеристику сердец у крыс в каждых группах наблюдали невооруженным глазом. По сравнению с животным и в контрольной группе объем сердца у животных в модельной группе был значительно увеличен, полость левого желудочка значительно расширена, а зона инфаркта миокарда уменьшилась, трансмуральный некроз миокарда в зоне инфаркта бледный, тонкого цвета. По сравнению с модельной группой степень увеличения объема сердца и степень трансмурального некроза миокарда у животных в группе тромболитического препарата и группе тромболитического препарата+икаритина имели были значительно ниже, чем в модельной группе. Масса сердца и отношение массы сердца к массе тела у крыс в каждых группах приведены в таблице ниже. Из таблицы видно, что между модельной группой и контрольной группой имеется достоверная разница в соотношении сердечных массы тела к массе тела (Р<0,01), что указывает на то, что создание модели было успешным; группа тромболитического препарата и группа тромболитического препарата + икаритин достоверно отличались от модельной группы (Р<0,01), достоверной разницы между группой тромболитического препарата и группой тромболитического препарата + икаритина не было, что свидетельствует о том, что тромболитический препарат мог значительно улучшать состояние крыса с инфарктом миокарда, а икаритин не влиял на действие тромболитического препарата.

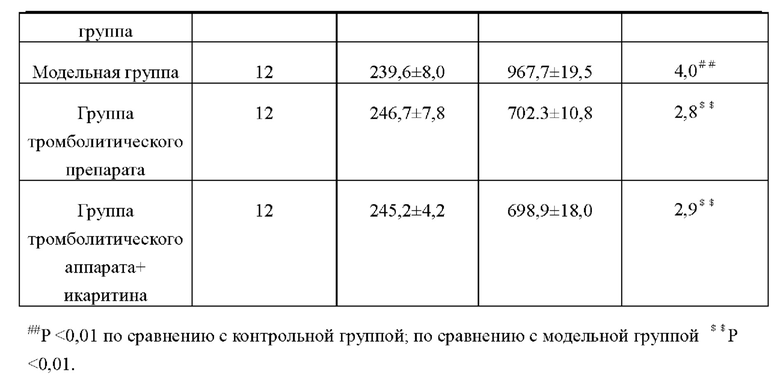
4.3 Сравнение геморрагических осложнений у крыс в экспериментальных группах
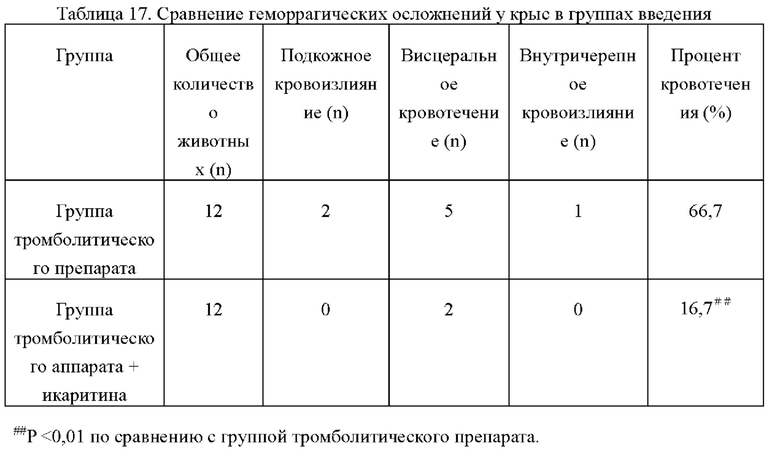
Из приведенной выше таблицы видно, что процент кровотечений в группе тромболитического препарата был значительно выше, чем в группе тромболитического препарата + икаритина, такая разница характеризуется статистической значимостью (Р<0,01). Результаты показали, что икаритин может значительно снизить возможность геморрагических осложнений, вызванных тромболитическими препаратами.
Пример действия лекарственных средств 10. Влияние икаритина на время кровотечения у мышей, страдающих гемофилией, вызываемой нокаутом фактора свертывания крови IX
1. Подопытные животные
Мыши, страдающие гемофилией, вызываемой нокаутом фактора свертывания крови IX, были предоставлены компанией ООО Пекинской генной биотехнологической компанией Байаосайту
2. Группировка животных и доза
40 мышей, страдающих гемофилией, вызываемой нокаутом фактора свертывания крови IX, были случайным образом разделены на четыре группы, по 10 мышей в каждой. Группам икаритина в низких, средних и высоких дозах (В, С, D) вводили внутрижелудочно икаритин в дозах 3 мг/кг и 6 мг/кг,18 мг/кг соответственно, один раз в день в течение 11 дней подряд. Нормальной контрольной группе (А) внутрижелудочно вводили равный объем физиологического раствора.
3. Экспериментальный показатель
3. Измерение времени кровотечения
Через час после последнего введения измеряли время кровотечения у каждой мыши путем отсечения хвоста.
3.2 Обычный анализ крови
После последнего определения времени кровотечения мышей анестезировали пентобарбиталом натрия, взяли кровь из брюшной кардинальной вены и проводили обычный анализ крови.
4. Экспериментальные результаты
4.1 Определение времени кровотечения
Время кровотечения у мышей в каждых группах показано в таблице ниже. Из таблицы видно, что по сравнению с контрольной группой время кровотечения у мышей в каждой дозовой группе икаритина было значительно сокращено со статистической значимостью (#Р<0,05 или # #Р<0,01), что указывает на то, что икаритин может эффективно сокращать время кровотечения у мышей, страдающих гемофилией, вызываемой нокаутом фактора свертывания крови IX.
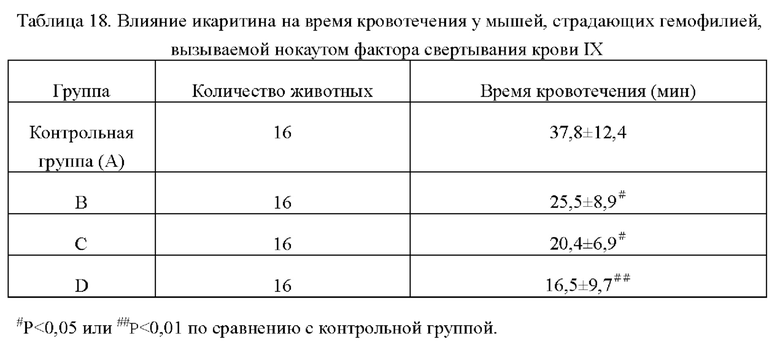
4.2 Результаты общего анализа крови
Не было существенной разницы между результатами общего анализа крови у мышей в каждой дозовой группе икаритина и в контрольной группе, что указывает на то, что икаритин сокращал время кровотечения у мышей, страдающих гемофилией, и не влиял на результаты общего анализа крови.
Пример действия лекарственных средств 11. Влияние икаритина на активированное частичное тромбопластиновое время при приобретенной гемофилии
1. Экспериментальные средства и животные
Определение активированного частичного тромбопластинового времени: набор приобретен у ООО шанхайской биотехнологической компании Тайян; плазма больных приобретенной гемофилией А предоставлена Народной больницей Линьи, здоровые новозеландские кролики, использованные в эксперименте, предоставлены китайской научно-исследовательской базой по животноводству и овцеводству Бинфэн.
2.Создание модели и введение животной модели приобретенной гемофилии А
24 здоровых новозеландских кролика были отобраны и случайным образом разделены на контрольную группу, модельную группу и группу лечения по 8 кроликов в каждой, каждый массовой около 1,5 кг. Животные содержались в клетках из нержавеющей стали при комнатной температуре 18-25°С. Животных в каждых группах посадили на обычную диету без какого-либо специального лечения. Через неделю кроликов анестезировали 2% пентобарбиталом (1,5 мл/кг) в краевой ушной вене, а затем выделяли и обнажали левую бедренную вену кролика для инъекции. Плазму пациентов с приобретенной гемофилией А (подтвержденной отделением гематологии Народной больницы Линьи) вводили внутривенно в модельной группе и группе лечения в дозе 2 мл/кг массы тела кролика, немедленно после инъекции группе лечения вводили икаритин внутрижелудочным введением в дозе 18 мг/кг, а модельной группе вводили такое же количество физиологического раствора внутрижелудочным введением; Кроликам в контрольной группе внутривенно вводили такое же количество нормальной плазмы человека, а кровь брали из краевой ушной вены за 30 мин до инъекции плазмы и через 30 мин, 60 мин, 90 мин и 120 мин после инъекции, плазмы соответственно. После коагуляции и центрифугирования при 3000 об/мин плазму отделяли.
3.Определение тромбопластинового времени и статистические методы
Взяли 0,1 мл кроличьей плазмы в соответствии с инструкцией по использованию набора реактивов, затем добавили 0,1 мл реагента тромбопластинового времени, после смешивания прогревали на тепловой ванне при 37°С в течение 2 минут, затем добавили 0,1 мл 0,025 М хлорида кальция, предварительно подогретого до 37°С, и сразу запускали секундомер для измерения каждого значения тромбопластинового времени в каждой точке времени, тромбиновое время измеряли дважды в каждой временной точке, а результаты усредняли.
Программное обеспечение SPSS 11.0 использовалось для статистического анализа данных. Данные выражали как среднее ± стандартное отклонение и проверяли на нормальность и однородность дисперсии. Сравнения между группами проводились с использованием t-критерия.
4. Экспериментальные результаты
Сравнение тромбопластинового времени в каждой точке времени в каждых группах представлено в таблице 19. Из таблицы видно, что достоверного изменения значения тромбопластинового времени у кроликов в контрольной группе до и после введения. По сравнению со значением тромбопластинового времени перед инъекцией в модельной группе тромбопластиновое время плазмы кроликов через 30 мин, 60 мин, 90 мин и 120 мин после инъекции было значительно увеличено, и увеличение тромбопластинового времени продемонстрировало тенденцию, зависящую от времени, тромбопластиновое время в каждых точках времени в группе лечения было значительно сокращено. Это показывает, что икаритин может значительно сократить активированное частичное тромбопластиновое время у пациентов с гемофилией и способствовать свертыванию крови у пациентов с гемофилией.
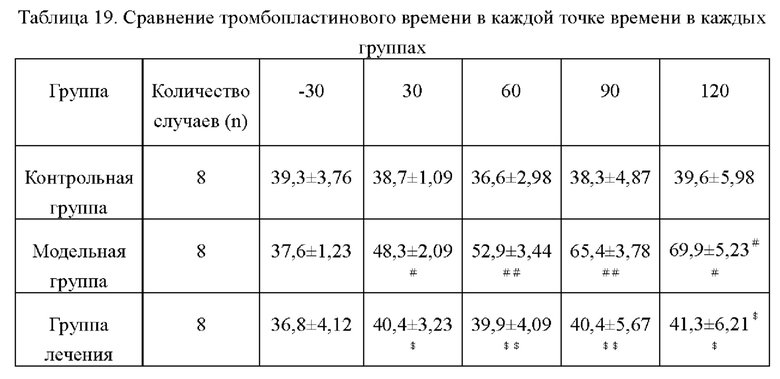
По сравнению с контрольной группой #Р<0,05, ##Р<0,01; по сравнению с модельной группой *Р<0,05, **Р<0,01.
| название | год | авторы | номер документа |
|---|---|---|---|
| КИТАЙСКАЯ ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ И ЦЕРЕБРОВАСКУЛЯРНЫХ ЗАБОЛЕВАНИЙ ИЛИ ДЕМЕНЦИИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2015 |
|
RU2674264C1 |
| СМЕСЬ ВЫСШИХ ПЕРВИЧНЫХ АЛИФАТИЧЕСКИХ СПИРТОВ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ЕЕ ОСНОВЕ | 1993 |
|
RU2163229C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ АТЕРОСКЛЕРОЗА | 2011 |
|
RU2468789C1 |
| Средство, обладающее антиагрегантной активностью | 2019 |
|
RU2696583C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2555335C9 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИКОАГУЛЯНТНОЙ (ИНГИБИТОР IIA ФАКТОРА), АНТИТРОМБОТИЧЕСКОЙ, ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЯМИ И СОДЕРЖАЩЕЕ 5,7-ДИ(ТИОФЕН-2-ИЛ)-4,5-ДИГИДРО-[1,2,4]ТРИАЗОЛО[1,5-а]ПИРИМИДИН | 2022 |
|
RU2798587C1 |
| ИСПОЛЬЗОВАНИЕ АКТИВИРОВАННОГО ФАКТОРА VII СВЕРТЫВАНИЯ КРОВИ ДЛЯ ЛЕЧЕНИЯ ОБШИРНЫХ КРОВОТЕЧЕНИЙ, ВЫЗВАННЫХ ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИЕЙ | 2001 |
|
RU2286796C2 |
| НАТРИЕВАЯ СОЛЬ 5-БРОМ-2-(АЛЬФА-ГИДРОКСИПЕНТИЛ)БЕНЗОЙНОЙ КИСЛОТЫ | 2014 |
|
RU2738374C1 |
| ИММОБИЛИЗИРОВАННЫЙ ПРОДУЦИРУЕМЫЙ БАКТЕРИЯМИ BACILLUS LICHENIFORMIS СУБТИЛИЗИН, ОБЛАДАЮЩИЙ ТРОМБОЛИТИЧЕСКИМ И АНТИКОАГУЛЯНТНЫМ СВОЙСТВАМИ | 2008 |
|
RU2416643C2 |
| ПРОИЗВОДНОЕ СЛОЖНОГО ЭФИРА ТИЕНОПИРИДИНА, СОДЕРЖАЩЕЕ ЦИАНОГРУППУ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ЕГО ПРИМЕНЕНИЕ И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2526624C2 |
Группа изобретений относится к области медицины, а именно к терапии и гематологии, и предназначена для предотвращения и лечения геморрагических заболеваний. Применяют икаритин для получения лекарственных средств, предназначенных для предотвращения и лечения геморрагических заболеваний, которые представляют собой нарушения функции тромбоцитов, вызываемые им геморрагические заболевания, геморрагические заболевания, вызываемые нарушением свертывания крови, геморрагические заболевания, вызываемые аномалиями стенок кровеносных сосудов, или геморрагические заболевания, вызываемые антикоагулянтами и фибринолизом, где указанные нарушения функции тромбоцитов представляют собой нарушение активации или агрегации тромбоцитов, и геморрагическое заболевание вызвано геморрагической трансформацией инфаркта мозга, желудочно-кишечным кровотечением, вызванным приемом тромболитических или антитромботических лекарств при лечении инфаркта мозга, или геморрагическими осложнениями, вызываемыми приемом тромболитических или антитромботических лекарств при лечении инфаркта миокарда. Также представлено применение икаритина в предотвращении или лечении геморрагического заболевания у пациента, включающее стадию введения икаритина в дозе 0,01-100 мг/кг пациенту. Использование группы изобретений обеспечивает эффективное предотвращение и лечение геморрагических заболеваний. 2 н. и 17 з.п. ф-лы, 19 табл., 21 пр.
1. Применение икаритина для получения лекарственных средств, предназначенных для предотвращения и лечения геморрагических заболеваний, отличающееся тем, что геморрагические заболевания представляют собой нарушения функции тромбоцитов, вызываемые им геморрагические заболевания, геморрагические заболевания, вызываемые нарушением свертывания крови, геморрагические заболевания, вызываемые аномалиями стенок кровеносных сосудов, или геморрагические заболевания, вызываемые антикоагулянтами и фибринолизом, где указанные нарушения функции тромбоцитов представляют собой нарушение активации или агрегации тромбоцитов, и геморрагическое заболевание вызвано геморрагической трансформацией инфаркта мозга, желудочно-кишечным кровотечением, вызванным приемом тромболитических или антитромботических лекарств при лечении инфаркта мозга, или геморрагическими осложнениями, вызываемыми приемом тромболитических или антитромботических лекарств при лечении инфаркта миокарда.
2. Применение по п.1 отличающееся тем, что геморрагическая трансформация инфаркта мозга представляет собой вторичную геморрагическую трансформацию ишемического инфаркта мозга, первичную геморрагическую трансформацию или бессимптомную геморрагическую трансформацию;
предпочтительно вторичная геморрагическая трансформация представляет собой геморрагическую трансформацию, вызываемую приемом тромболитических лекарств, антитромботических лекарств и применением одного или нескольких из методов эндоваскулярного лечения;
далее предпочтительно тромболитические лекарства выбраны из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланоттеплазы;
еще далее предпочтительно антитромботические лекарства представляют собой один или несколько из антикоагулянтных лекарств и антитромбоцитарных лекарств;
еще далее предпочтительно антикоагулянтные лекарства выбраны из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли и рекомбинантного гирудина;
еще далее предпочтительно антитромбоцитарные лекарства выбраны из аспирина, клопидогреля или тиклопидина;
предпочтительно первичная геморрагическая трансформация представляет собой спонтанную геморрагическую трансформацию после острого церебрального инфаркта.
3. Применение по п.1, отличающееся тем, что тромболитические лекарства для лечения инфаркта миокарда или антитромботические лекарства, которые могут вызвать геморрагические осложнения, выбраны из урокиназы, стрептокиназы, ретеплазы, фермента альтеплазы, тенектеплазы или ланоттеплазы;
указанные антитромботические лекарства представляют собой лекарства для лечения в начальной стадии инфаркта миокарда и лекарства для предотвращения на этапах первичной и
вторичной профилактики;
или антитромботические лекарства представляют собой один или несколько из антикоагулянтных лекарств или антитромбоцитарных лекарств;
предпочтительно антитромбоцитарные лекарства выбраны из аспирина, клопидогреля или тиклопидина, а антикоагулянтные лекарства выбраны из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли и рекомбинантного гирудина;
предпочтительно геморрагическое осложнение представляют собой один или несколько из подкожных кровотечений, внутричерепных кровотечений, кровотечений из верхних отделов желудочно-кишечного тракта или кровотечений из десен.
4. Применение по п.1, отличающееся тем, что тромболитические лекарства или антитромботические лекарства для лечения инфаркта мозга, которые могут вызвать желудочно-кишечные кровотечения, представляют собой один или несколько из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланоттеплазы; указанные антитромботические лекарства представляют собой один или несколько из антикоагулянтных или антиагрегантных лекарств;
предпочтительно указанные антиагрегантные лекарства выбраны из аспирина, клопидогреля или тиклопидина, а антикоагулянтные лекарства выбраны из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли и рекомбинантного гирудина.
5. Применение по п.1, отличающееся тем, что указанное нарушение функции тромбоцитов представляет собой врожденные дефекты функции тромбоцитов или приобретенные дефекты функции тромбоцитов,
предпочтительно врожденные дефекты функции тромбоцитов представляет собой наследственный синдром гигантских тромбоцитов, наследственную Тромбастению Гланцмана или врожденное заболевание соединительной ткани; указанный приобретенный дефекты функции тромбоцитов вызван препаратом или заболеванием;
еще более предпочтительно лекарства представляют собой один или несколько из антибактериальных средств, противоопухолевых средств или гепарина, а заболевание представляет собой один или несколько из уремии, диабета, нефротического синдрома, ишемической болезни сердца или лейкемии.
6. Применение по п.1, отличающееся тем, что геморрагические заболевания, вызываемые нарушениями свертывания крови, указанная гемофилия относится к любой из гемофилии А, гемофилии В или гемофилии С,
предпочтительно гемофилия представляет собой гемофилию, вызываемую генетическими факторами, или вторичную гемофилию,
еще далее предпочтительно указанная вторичная гемофилия вызвана лекарством или аутоиммунными заболеваниями;
далее предпочтительно аутоиммунные заболевания включают в себя (но не ограничиваются этим): заболевание печени, гемолиз, приобретенный иммунодефицит, синдром Эванса, хронический лимфоцитарный лейкоз, различные острые лейкозы, лимфому, системную красную волчанку, ревматоидный артрит, воспаление или гипертиреоз;
еще далее предпочтительно указанные заболевания печени вызваны хроническим персистирующим гепатитом и циррозом печени;
наиболее предпочтительно лекарства включают в себя (но не ограничиваются этим): алкилирующие агенты, антиметаболиты, цитотоксические агенты, хлоротиазиды и их синергисты.
7. Применение по п.1, отличающееся тем, что геморрагические заболевания, вызываемые указанными антикоагулянтами и фибринолизом, представляют собой приобретенные заболевания, включают в себя (но не ограничиваются этим): заболевания, вызываемые передозировкой гепарина, передозировкой кумарина, передозировкой иммунозависимых антикоагулянтов или передозировкой тромболитических лекарств.
8. Применение по любому из пп.1-7, отличающееся тем, что икаритин находится в фармацевтической композиции, представляющей собой инъекционный раствор, порошок для инъекций, капсулу, таблетку, микроэмульсию, каплевидную пилюлю или кишечнорастворимую мягкую капсулу.
9. Применение по любому из пп.1-7, отличающееся тем, что доза указанного препарата составляет 0,01-100 мг/кг.
10. Применение по п.9, отличающееся тем, что доза указанного препарата составляет 0,1-10 мг/кг.
11. Применение икаритина в предотвращении или лечении геморрагического заболевания у пациента, включающее стадию введения икаритина в дозе 0,01-100 мг/кг пациенту,
отличающееся тем, что геморрагическое заболевание представляет собой нарушение функции тромбоцитов и геморрагическое заболевание вызвано им, геморрагическое заболевание, вызываемое нарушением свертывания крови, геморрагическое заболевание, вызываемое аномалиями стенок кровеносных сосудов, геморрагическое заболевание, вызываемые антикоагулянтами и фибринолизом, где указанные нарушения функции тромбоцитов представляют собой нарушение активации или агрегации тромбоцитов, и геморрагическое заболевание вызвано геморрагической трансформацией инфаркта мозга, желудочно-кишечным кровотечением, вызванным приемом тромболитических или антитромботических лекарств при лечении инфаркта мозга, или геморрагическими осложнениями, вызываемыми приемом тромболитических или антитромботических лекарств при лечении инфаркта миокарда.
12. Применение по п.11, отличающееся тем, что геморрагическая трансформация инфаркта мозга представляет собой вторичную геморрагическую трансформацию ишемического инфаркта мозга, первичную геморрагическую трансформацию или бессимптомную геморрагическую трансформацию;
предпочтительно вторичная геморрагическая трансформация представляет собой геморрагическую трансформацию, вызываемую приемом тромболитических лекарств, антитромботических лекарств и применением одного или нескольких из методов эндоваскулярного лечения;
далее предпочтительно тромболитические лекарства выбраны из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланоттеплазы;
еще далее предпочтительно антитромботические лекарства представляют собой один или несколько из антикоагулянтных лекарств и антитромбоцитарных лекарств;
еще далее предпочтительно антикоагулянтные лекарства выбраны из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли и рекомбинантного гирудина;
еще далее предпочтительно антитромбоцитарные лекарства выбраны из аспирина, клопидогреля или тиклопидина; и
предпочтительно первичная геморрагическая трансформация представляет собой спонтанную геморрагическую трансформацию после острого церебрального инфаркта.
13. Применение по п.11, отличающееся тем, что тромболитические лекарства для лечения инфаркта миокарда или антитромботические лекарства, которые могут вызвать геморрагические осложнения, выбраны из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланоттеплазы;
указанные антитромботические лекарства представляют собой лекарства для лечения в начальной стадии инфаркта миокарда и лекарства для предотвращения на этапах первичной и вторичной профилактики;
или антитромботические лекарства представляют собой один или несколько из антикоагулянтных лекарств или антитромбоцитарных лекарств;
предпочтительно антитромбоцитарные лекарства выбраны из аспирина, клопидогреля или тиклопидина, а антикоагулянтные лекарства выбраны из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли и рекомбинантного гирудина; и
предпочтительно геморрагическое осложнение представляет собой один или несколько из подкожных кровотечений, внутричерепных кровотечений, кровотечений из верхних отделов желудочно-кишечного тракта или кровотечений из десен.
14. Применение по п.11, отличающееся тем, что тромболитические лекарства или антитромботические лекарства для лечения инфаркта мозга, которые могут вызвать желудочно-кишечные кровотечения, представляют собой один или несколько из урокиназы, стрептокиназы, ретеплазы, альтеплазы, тенектеплазы или ланоттеплазы; указанные антитромботические лекарства представляют собой один или несколько из антикоагулянтных или антиагрегантных лекарств; и
предпочтительно указанное антиагрегантное лекарство выбрано из аспирина, клопидогреля или тиклопидина, а антикоагулянтное лекарство выбрано из группы, состоящей из гепарина или его фармацевтически приемлемой соли, низкомолекулярного гепарина или его фармацевтически приемлемой соли и рекомбинантного гирудина.
15. Применение по п.11, отличающееся тем, что нарушение функции тромбоцитов представляет собой врожденные дефекты функции тромбоцитов или приобретенные дефекты функции тромбоцитов,
предпочтительно врожденные дефекты функции тромбоцитов представляет собой наследственный синдром гигантских тромбоцитов, наследственную Тромбастению Гланцмана или врожденное заболевание соединительной ткани; указанный приобретенный дефекты функции тромбоцитов вызван препаратом или заболеванием; и
еще более предпочтительно лекарство представляет собой один или несколько из антибактериальных средств, противоопухолевых средств или гепарина, а заболевание представляет собой один или несколько из уремии, диабета, нефротического синдрома, ишемической болезни сердца или лейкемии.
16. Применение по п.11, отличающееся тем, что геморрагические заболевания, вызываемые нарушениями свертывания крови, представляют собой гемофилию, и гемофилия относится к любой из гемофилии А, гемофилии В или гемофилии С,
предпочтительно гемофилия представляет собой гемофилию, вызываемую генетическими факторами, или вторичную гемофилию,
еще далее предпочтительно указанная вторичная гемофилия вызвана лекарством или аутоиммунными заболеваниями;
далее предпочтительно аутоиммунные заболевания включают в себя (но не ограничиваются этим): заболевание печени, гемолиз, приобретенный иммунодефицит, синдром Эванса, хронический лимфоцитарный лейкоз, различные острые лейкозы, лимфому, системную красную волчанку, ревматоидный артрит, воспаление или гипертиреоз;
еще далее предпочтительно указанные заболевания печени вызваны хроническим персистирующим гепатитом и циррозом печени;
и наиболее предпочтительно лекарства включают в себя (но не ограничиваются этим): алкилирующие агенты, антиметаболиты, цитотоксические агенты, хлоротиазиды и их синергисты.
17. Применение по п.11, отличающееся тем, что геморрагические заболевания, вызываемые указанными антикоагулянтами и фибринолизом, представляют собой приобретенные заболевания, вызванные факторами, которые включают в себя (но не ограничиваются этим): передозировку гепарина, передозировку кумарина, передозировку иммунозависимых антикоагулянтов или передозировку тромболитических лекарств.
18. Применение по любому из пп.11-17, отличающееся тем, что икаритин находится в фармацевтической композиции, представляющей собой инъекционный раствор, порошок для инъекций, капсулу, таблетку, микроэмульсию, каплевидную пилюлю или кишечнорастворимую мягкую капсулу.
19. Применение по любому из пп.11-17, отличающееся тем, что доза указанного препарата составляет 0,01-100 мг/кг.
| EP 3061452 A1, 31.08.2016 | |||
| CN 104546823 A, 29.04.2015 | |||
| Устройство для преобразования колебаний в реверсивное поступательное движение | 1987 |
|
SU1460482A1 |
| CN 103690524 A, 02.04.2014 | |||
| CN 105963293 A, 28.09.2016 | |||
| US 2003124117 A1, 03.07.2003. | |||
Авторы
Даты
2023-10-26—Публикация
2021-03-09—Подача