Изобретение относится к медицине, в частности к фармакологии и лекарственным средствам на основе ферментных препаратов, и может быть использовано в комплексной терапии ишемической болезни сердца, ишемических инсультов мозга, ревматоидных процессов и других заболеваний, сопровождающихся явлениями ишемии и тромбообразования.
Известны различные лекарственные препараты, применяемые для лечения ишемической болезни сердца и ишемических инсультов мозга. Как правило, в финальной стадии этих заболеваний основным патогенетическим фактором является образование внутрисосудистых тромбов. В современной медицинской практике для лечения острых инфарктов миокарда и ишемических инсультов мозга широкое распространение получили тромболитические лекарственные препараты, как средства этиотропной терапии. Известны фармацевтические препараты, такие как стрептаза, стрептокиназа, тканевой активатор плазминогена и фибринолизин (1). Все они напрямую или в результате активации противосвертывающей системы крови воздействуют на фибрин, приводя к его деструкции и, соответственно, лизису внутрисосудистого тромба. Несмотря на высокую терапевтическую эффективность прямых фибринолитиков, они обладают выраженным побочным действием, а именно они способны вызвать неконтролируемые и опасные кровотечения, так как истощают свертывающую систему крови (2). Кроме того, для таких препаратов, как стрептокиназа и ее аналогов (альтеплаза, стрептодеказа), сложно подобрать адекватную терапевтическую дозу, так как в организме человека имеется индивидуальный титр антител к стрептококку, приводящий к инактивации этих препаратов.
Известны лекарственные препараты, обладающие способностью снижать воспалительную реакцию. Из них наибольшее распространение получили нестероидные противовоспалительные препараты, такие как аспирин, индометацин, диклофенак натрия и т. д. (3). Известные фармацевтические препараты обладают существенными недостатками, а именно способностью вызывать повреждения желудка с развитием нестероидной гастропатии, геморрагиями и изъязвлениями слизистой желудочно-кишечного тракта.
Известны фармацевтические препараты, обладающие цитопротективными свойствами, такие как предуктал (кардиопротективное действие) и блокаторы H1 рецепторов (гастроцепин, ранитидин). Известные препараты обладают слабым цитопротективным действием и проявляют фармакологическое действие при длительном применении (4).
В настоящее время в научной и медицинской литературе нет данных по созданию фармацевтических композиций, обладающих многоцелевым синергичным воздействием на все патогенетические звенья ишемии, воспаления и тромбообразования в сочетании с цитопротективными свойствами.
Наиболее ближайшей к заявляемой композиции-прототипом является композиция для ферментативного гидролиза белков, содержащая следующие компоненты, мас. %: комплекс иммобилизованных на водорастворимом синтетическом полимере нейтральных и щелочных протеиназ из Bac. subtilis с активностью 12-750 ПЕ/г от 10 до 30, наполнитель - полиэтиленгликоль или гель полиэтиленгликоля с молекулярной массой 600-2000 кДа от 70 до 90 (патент РФ 2003346, кл. А 61 К 37/54, опубл. 30.11.93. Бюлл. 43-44).
Известная композиция представляет собой бесцветную вязкую жидкость без вкуса и запаха, растворимую в воде. Композиция предназначена для использования в медицине для гидролиза белков гнойно-некротических масс, преимущественно в хирургии и стоматологии.
Основным недостатком фармацевтической композиции-прототипа является отсутствие многоцелевого синергичного воздействия на ключевые патогенетические звенья ишемии, воспаления и тромбообразования в сочетании с цитопротективными свойствами. Имеющиеся в научно-медицинской литературе данные о противовоспалительных свойствах фармацевтической композиции-прототипа свидетельствуют о том, что эти свойства носят не прямой, а лишь опосредованный характер за счет гидролиза гнойно-некротических масс, поддерживающих воспаление в условиях инфицированных. Кроме того, фармацевтическая композиция-прототип содержит в качестве наполнителя и полимерного носителя для иммобилизации протеаз лишь полиэтиленгликоли, которые не обладают характерными для декстранов свойствами позитивно влиять на гемореологию в микроциркуляторном русле и которые не применяются с этой целью в современной медицинской практике. Полиэтиленгликоли являются также полимерами с достаточно низкой температурой плавления, и поэтому при лиофилизации фармацевтической композиции-прототипа не удается получить однородную пористую массу.
Технической задачей изобретения является получение фармацевтической композиции, обладающей многоцелевым синергичным действием на основные патогенетические звенья ишемии, воспаления и тромбообразования в сочетании с цитопротективными свойствами, а также способной при лиофилизации образовывать однородную, пористую массу.
Поставленная техническая задача достигается предлагаемой композицией, содержащей следующие компоненты, мас.%:
Протосубтилин Г3Х, или Г10Х, или Г20Х - 0,5-5,0
Полиэтиленоксид с молекулярной массой 400-20000 Да - 0,1-10,0
Декстран с молекулярной массой 10-70 кДа - 1,0-10,0
Буферная смесь - Остальное
Предлагаемая композиция облучается ионизирующим излучением, преимущественно гамма-излучением или потоком ускоренных электронов с энергией 2 МэВ в дозе 0,5-1,5 Мрад, для проведения иммобилизации протеаз, входящих в состав протосубтилина на полиэтиленоксиде и декстране.
Вводимый в состав предлагаемой композиции ферментный препарат протосубтилин Г3Х, или Г10Х, или Г20Х содержит комплекс нейтральных и щелочных протеаз из Bac. subtilis, который при воздействии ионизирующего излучения связывается с полиэтиленоксидом и декстраном, образуя иммобилизованную форму, обладающую тромболитическими, противовоспалительными и цитопротективными свойствами. При концентрации протосубтилина менее 0,5 мас.% протеолитическая активность получаемой композиции недостаточна для проведения эффективного фармакологического эффекта, а при концентрации протосубтилина свыше 5,0 мас. % возможны токсические реакции, связанные со специфическим действием протеаз на нативные белки сыворотки крови.
В качестве полимерных носителей для иммобилизации протеаз использована смесь водорастворимых полимеров: полиэтиленоксида и декстрана. Полиэтиленоксид дополнительно обладает функцией структурообразователя и наполнителя. Декстран дополнительно усиливает фармакологический эффект за счет позитивного влияния на реологические показатели крови в микроциркуляторном русле и снижения агрегации тромбоцитов и эритроцитов. Декстран выполняет также функцию структурообразователя, позволяющего проводить лиофилизацию всей композиции с образованием хорошо сформированной, однородной, пористой массы (таблетки). Полиэтиленоксид и декстран в заявляемой фармацевтической композиции оказывают синергичный эффект как на фармакологические свойства композиции, так и на ее способность к лиофилизации, что позволяет достичь поставленной технической задачи изобретения. Диапазон концентраций полиэтиленоксида и декстрана в заявляемой фармацевтической композиции подобран исходя из экспериментальных данных. При концентрации полиэтиленоксида менее 0,1%, а декстрана менее 1,0% заявляемые фармакологические эффекты композиции снижаются. При концентрации полиэтиленоксида более 10% не удается достичь лиофилизации композиции, так как полиэтиленоксиды имеют низкую температуру плавления и при лиофилизации не удается сформировать пористую, однородную массу (таблетку). При концентрации декстрана свыше 10% вязкость композиции резко увеличивается, что затрудняет ее инъекционное введение и также значительно ухудшает качество лиофилизации всей композиции.
Предлагаемую фармацевтическую композицию получают следующим образом:
готовят реакционную смесь путем растворения протосубтилина, преимущественно протосубтилина Г3Х и полиэтиленоксида (ПЭО) с молекулярной массой 400-20000 Да (преимущественно 1500 Да), в растворе декстрана с молекулярной массой 40-70 кДа (преимущественно 40 кДа) в 0,025 М натрий-фосфатном буферном растворе с рН 7,5-8,2. Полученную смесь очищают путем удаления балластных белков методом солевого осаждения и последующего фильтрования. Полученный раствор подвергают облучению гамма-лучами или потоком ускоренных электронов (с энергией 2,0 МэВ) в дозе 0,5-1,5 Мрад. После облучения раствор подвергают стерилизующей фильтрации и фасуют по 10 мл во флаконы вместимостью 15 мл. Затем раствор высушивают методом лиофилизации до остаточной влаги не более 2%.
В результате получают композицию, содержащую иммобилизованный на полиэтиленоксиде и декстране протеазный комплекс из Bac.subtilis. Протеолитическая активность полученной композиции в одном флаконе составляет от 500 до 1000,0 ПЕ/г. Композиция представляет пористую однородную массу слегка желтоватого цвета.
Для терапевтических целей используют раствор заявляемой композиции (условное название "Тромбовазим"), который готовят ex tempore, растворяя содержимое флакона в 10 мл стерильного изотонического раствора хлорида натрия или в 10 мл воды для инъекций.
Заявляемая композиция может быть получена другим способом, а именно раздельным изготовлением активного компонента (1 компонент), содержащего комплекс иммобилизованных на полиэтиленоксиде и декстране протеаз и растворителя - раствора полиэтиленоксида (2 компонент). Двухкомпонентный состав композиции позволяет варьировать активностью заявляемой фармацевтической композиции за счет изменения соотношения активный компонент - растворитель, что позволяет подбирать индивидуальные схемы лечения. Двухкомпонентную композицию получают следующим образом:
1 компонент (активное вещество)
готовят реакционную смесь путем растворения протосубтилина (преимущественно протосубтилина Г3Х) и полиэтиленоксида (ПЭО) с молекулярной массой 400-20000 Да (преимущественно 1500 Да), в растворе декстрана с молекулярной массой 40-70 кДа (преимущественно 40 кДа) в 0,025 М натрий-фосфатном буферном растворе с рН 7,5-8,2. Полученную смесь очищают путем удаления балластных белков методом солевого осаждения и последующего фильтрования. Полученный раствор подвергают облучению гамма-лучами или потоком ускоренных электронов (с энергией 2,0 МэВ) в дозе 1,0 Мрад. После облучения раствор подвергают стерилизующей фильтрации и фасуют по 10 мл во флаконы вместимостью 15 мл. Затем раствор высушивают методом лиофилизации до остаточной влаги не более 2%.
В результате получают 1 компонент композиции, содержащий иммобилизованный на полиэтиленоксиде и декстране протеазный комплекс из Bac. subtilis. Протеолитическая активность полученной композиции в одном флаконе составляет от 500 до 1000,0 ПЕ/г. Компонент 1 представляет собой пористую однородную массу слегка желтоватого цвета.
2 компонент (растворитель)
готовят раствор полиэтиленоксида (преимущественно полиэтиленоксида с молекулярной массой 1500 Да) в 0,025 М натрий-фосфатном буферном растворе с рН 7,5-8,2. Полученный раствор подвергают облучению гамма-лучами или потоком ускоренных электронов (с энергией 2,0 МэВ) в дозе 1,0 Мрад. После облучения раствор подвергают стерилизующей фильтрации и фасуют по 10 мл во флаконы вместимостью 15 мл.
В результате получают стерильный растворитель для 1 компонента заявляемой композиции. Растворитель представляет собой жидкость слегка желтоватого цвета.
Для терапевтических целей используют раствор заявляемой композиции (условное название "Тромбовазим"), который готовят ex tempore, растворяя содержимое флакона с 1 компонентом, содержащим иммобилизованные протеазы в 10 мл 2 компонента (растворителя).
При растворении ex tempore 1 компонента в растворителе (2 компонент) и последующей лиофилизации получают заявляемую фармацевтическую композицию.
Определяющим существенным отличием предлагаемой композиции от композиции-прототипа является то, что она дополнительно содержит декстран в качестве носителя для иммобилизации протеазного комплекса и наполнителя, позволяющего улучшить свойства лиофилизированной формы и достичь заявляемых фармакологических свойств.
Фармакологические свойства заявляемой композиции (условное название "Тромбовазим") проверены в лабораторных условиях in vitro и in vivo.
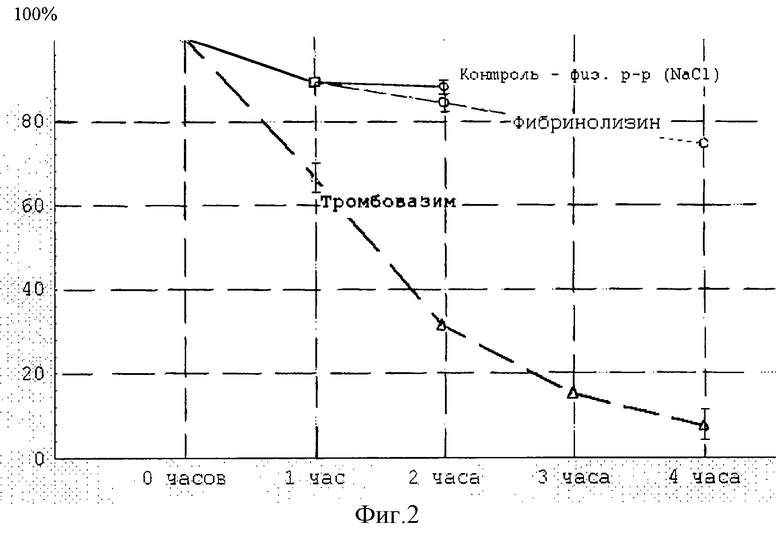
Тромболитические свойства композиции исследованы на модели лизиса тромба in vitro (фиг.1). Из фиг.1 следует, что "Тромбовазим" обладает резко выраженным тромболитическим действием, достоверно превосходящим в стандартной лечебной концентрации - 50 ФЕ/мл - фибринолизин (р<0,02), трипсин (р<0,01) и спонтанный лизис тромба в физиологическом растворе (р<0,01). Следует отметить, что с увеличением "возраста" тромба до 7 суток Тромболитические свойства "Тромбовазима" сохраняются (фиг.2), при этом фибринолизин практически не действует на 7-суточный тромб. В течение первых двух часов действие фибринолизина на тромб достоверно не отличается от спонтанного фонового лизиса в физиологическом растворе. К концу 4-го часа "Тромбовазим" полностью растворяет тромб, в то время как фибринолизин за это время лизирует только 20% массы "старого" тромба.
Известно, что фибринолизин является самым активным фибринолитиком (2), а такие препараты, как стрептокиназа, урокиназа, альтеплаза и тканевой активатор плазминогена, являются непрямыми фибринолитиками, и их тромболитическое действие опосредовано активацией системы фибринолиза и выработкой эндогенного фибринолизина, который и приводит к лизису сформировавшегося тромба (1).
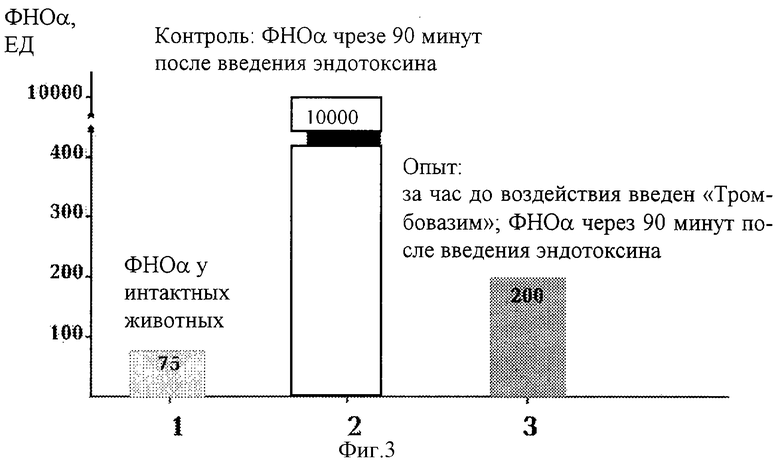
Противовоспалительные свойства заявляемой композиции исследованы на модели индукции одного из основных медиаторов воспаления - фактора некроза опухолей (ФНОα) у мышей линии СВА при эндотоксиновым шоке (фиг.3). Активность ФНОα измерялась биологическим способом с использованием линии клеток L 929 и выражалась в единицах действия (ЕД). На фиг.3 представлена активность ФНОα у интактных животных (1) и после введения эндотоксина (2). Введение "Тромбовазима" за 1 час до введения эндотоксина (3) снижает в 50 раз активность ФНОα, что доказывает противовоспалительные свойства тромбовазима.
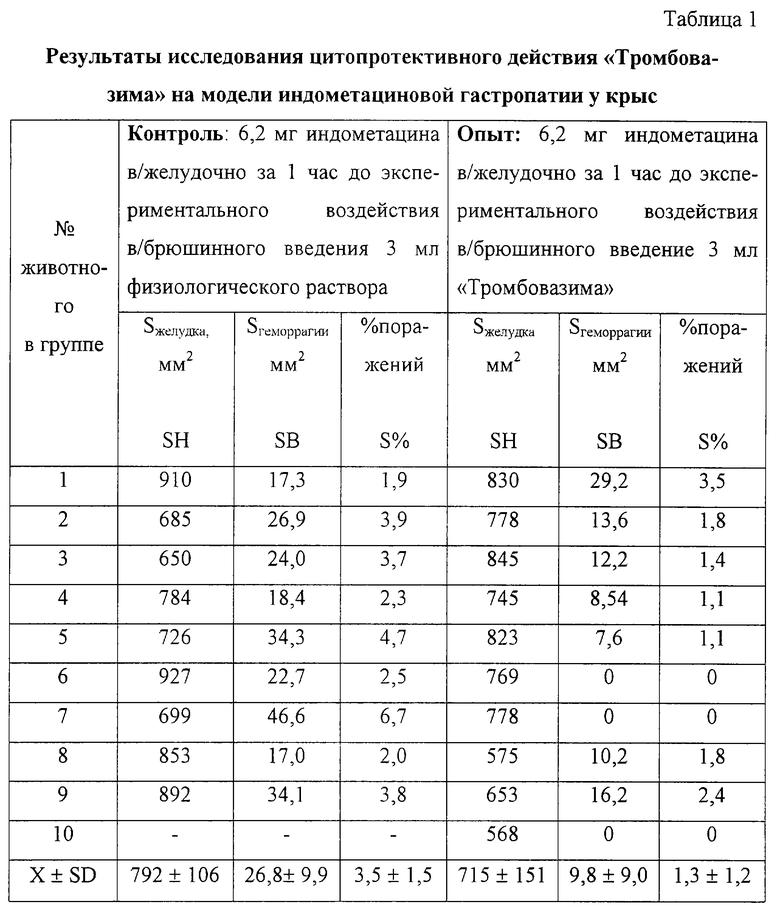
Цитопротективные свойства "Тромбовазима" изучены на модели индометапиновой гастропатии (таблица) и адреналинового миокардита у крыс (фиг.4).
Из представленной таблицы следует, что группы крыс, контрольная и опытная, сопоставимы по общей площади желудков (SH) - показатель не имел достоверного различия. Площадь кровоизлияний (SB) в группах достоверно различалась: в группе с предварительным введением "Тромбовазима" (опыт) SB в 3 раза меньше, чем в контроле (р<0,01). Такое же достоверное соотношение наблюдается при сравнении относительной площади поражения (S%). Таким образом, "Тромбовазим" обладает выраженным цитопротективным действием при индометациновом поражении слизистой желудка.
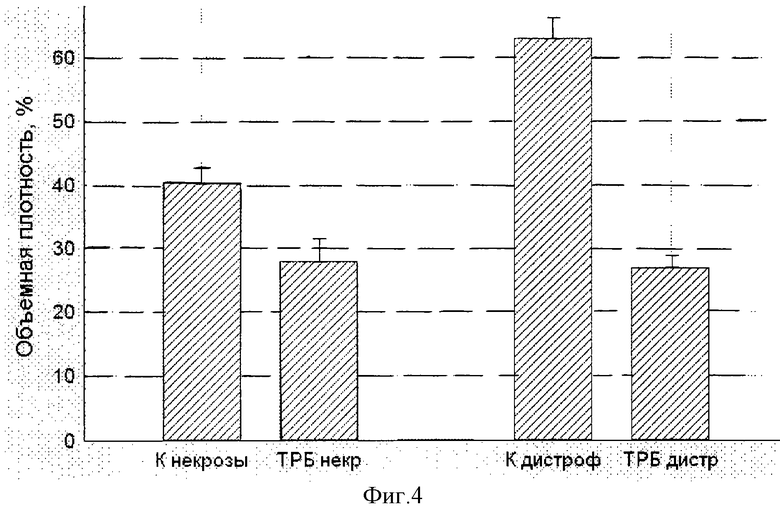
На фиг. 4 представлены данные гистологического морфометрического исследования объема некрозов и дистрофических изменений в миокарде у крыс с адреналиновым миокардитом. Объем поражений определялся планиметрически и выражался в % объемной плотности, которая равна отношению объема поражений к общему объему ткани, умноженной на 100%. После введения адреналина в группе контроля (К) в/брюшинно вводился изотонический раствор NaCl 1,0 мл 2 раз/сутки, а в опытной группе (ТРБ)-тромбовазим 1 мл 2 раза/сутки. Из представленных результатов следует, что после развития адреналинового миокардита лечение "Тромбовазимом" достоверно снижает количество некрозов в сердечной мышце к концу 3-х суток в 1,5 раза (ТРБ некр) в сравнении с контролем (К некрозы). Дистрофические изменения в сердечной мышце в группе опыта (ТРБ дистр) к концу 7-х суток достоверно в 2,5 раза меньше, чем в контрольной группе (К дистроф).
Результаты, представленные в таблице и на фиг. 4, доказывают, что "Тромбовазим" обладает выраженным кардиопротективным и цитопротективным действием. Достоверно проявляется защитный эффект "Тромбовазима" при специфической гастропатии, вызываемой нестероидными противовоспалительными препаратами, в частности индометацином, и лечебный эффект при остром адреналиновом миокардите, в патогенезе которого ключевую роль играет острая ишемия, некроз с развитием дистрофии миокарда.
В результате поиска по источникам патентной и научно-технической информации не выявлено сведений о фармацевтической композиции, обладающей тромболитическими, противовоспалительными и цитопротективными свойствами, аналогичной заявляемой.
Изобретение иллюстрируется следующими примерами приготовления конкретных рецептур заявляемой композиции.
Пример 1.
15 г полиэтиленоксида 1500 растворяют в 300 мл 10% декстрана с молекулярной массой 40 кДа в 0,025 М натрий-фосфатного буфера с рН 7,5, добавляют 6,3 г протосубтилина Г3Х, смесь перемешивают при температуре 18-20oС в течение 30 минут. Затем проводят осаждение балластных белков методом солевого осаждения. Для этого в смесь последовательно добавляют до полного растворения 1,3 г натрия фосфорнокислого двузамещенного до конечной концентрации 0,45% и 1,9 г хлорида кальция до конечной концентрации 0,63%. После растворения хлорида кальция в реакционной смеси выпадает осадок нерастворимого фосфата кальция, который адсорбирует балластные белки. Смесь выдерживают 12 часов при температуре от 4 до 8oС для полного осаждения балластных белков. Далее реакционную смесь фильтруют через бумажные фильтры ("белая лента"). Объем фильтрата составляет 300 мл. Полученный раствор подвергают облучению гамма-лучами в дозе 1,0 Мрад. После облучения раствор подвергают стерилизующей фильтрации, фасуют по 10 мл во флаконы емкостью 15 мл и лиофильно высушивают до остаточной влаги не более 2%. В результате получают композицию следующего состава, мас.%:
1. Протосубтилин Г3Х - 2,1
2. Декстран (молекулярная масса 40 кДа) - 10,0
3. Полиэтиленоксид 1500 - 5,0
4. 0,025 М Натрий-фосфатный буфер - 82,9
Протеолитическая активность композиции 850 ПЕ/г.
Пример 2.
15 г полиэтиленоксида 1500 растворяют в 300 мл 5% раствора декстрана с молекулярной массой 40 кДа в 0,025 М натрий-фосфатного буфера с рН 8,2, добавляют 6,0 г протосубтилина Г3Х, смесь перемешивают при температуре 18-20oС в течение 30 минут. Затем проводят осаждение балластных белков методом солевого осаждения. Для этого в смесь последовательно добавляют до полного растворения 1,3 г натрия фосфорнокислого двузамещенного до конечной концентрации 0,45% и 1,9 г хлорида кальция до конечной концентрации 0,63%. После растворения хлорида кальция в реакционной смеси выпадает осадок нерастворимого фосфата кальция, который адсорбирует балластные белки. Смесь выдерживают 12 часов при температуре 4-8oС для полного осаждения балластных белков. Далее реакционную смесь фильтруют через бумажные фильтры ("белая лента"). Объем фильтрата составляет 300 мл. Полученный раствор подвергают облучению гамма-лучами в дозе 1,0 Мрад. После облучения раствор подвергают стерилизующей фильтрации, фасуют по 10 мл во флаконы емкостью 15 мл и лиофильно высушивают до остаточной влаги не более 2%. В результате получают композицию следующего состава, мас.%:
1. Протосубтилин Г3Х - 2,0
2. Декстран (молекулярная масса 40 кДа) - 5,0
3. Полиэтиленоксид 150 - 5,0
4. 0,025 М Натрий-фосфатный буфер - 88,0
Протеолитическая активность композиции 800 ПЕ/г.
Пример 3.
0,5 г полиэтиленоксида 1500 растворяют в 300 мл 10% раствора декстрана с молекулярной массой 40 кДа в 0,025 М натрий-фосфатного буфера с рН 8,2, добавляют 5,7 г протосубтилина Г3Х, смесь перемешивают при температуре 18-20oС в течение 30 минут. Затем проводят осаждение балластных белков методом солевого осаждения. Для этого в смесь последовательно добавляют до полного растворения 1,3 г натрия фосфорнокислого двузамещенного до конечной концентрации 0,45% и 1,9 г хлорида кальция до конечной концентрации 0,63%. После растворения хлорида кальция в реакционной смеси выпадает осадок нерастворимого фосфата кальция, который адсорбирует балластные белки. Смесь выдерживают 12 часов при температуре 4-8oС для полного осаждения балластных белков. Далее реакционную смесь фильтруют через бумажные фильтры ("белая лента"). Объем фильтрата составляет 300 мл. Полученный раствор подвергают облучению гамма-лучами в дозе 1,0 Мрад. После облучения раствор подвергают стерилизующей фильтрации, фасуют по 10 мл во флаконы емкостью 15 мл и лиофильно высушивают до остаточной влаги не более 2%. В результате получают композицию следующего состава, мас.%:
1. Протосубтилин Г3Х - 1,9
2. Декстран (молекулярная масса 40 кДа) - 10,0
3. Полиэтиленоксид 1500 - 0,5
4. 0,025 М Натрий-фосфатный буфер - 87,6
Протеолитическая активность композиции 750 ПЕ/г.
Пример 4.
15 г полиэтиленоксида 4000 растворяют в 300 мл 5% раствора декстрана с молекулярной массой 40 кДа в 0,025 М натрий-фосфатного буфера с рН 8,2, добавляют 7,5 г протосубтилина Г10Х, смесь перемешивают при температуре 18-20oС в течение 30 минут. Затем проводят осаждение балластных белков методом солевого осаждения. Для этого в смесь последовательно добавляют до полного растворения 1,3 г натрия фосфорнокислого двузамещенного до конечной концентрации 0,45% и 1,9 г хлорида кальция до конечной концентрации 0,63%. После растворения хлорида кальция в реакционной смеси выпадает осадок нерастворимого фосфата кальция, который адсорбирует балластные белки. Смесь выдерживают 12 часов при температуре 4-8oС для полного осаждения балластных белков. Далее реакционную смесь фильтруют через бумажные фильтры ("белая лента"). Объем фильтрата составляет 300 мл. Полученный раствор подвергают облучению гамма-лучами в дозе 1,2 Мрад. После облучения раствор подвергают стерилизующей фильтрации, фасуют по 10 мл во флаконы емкостью 15 мл и лиофильно высушивают до остаточной влаги не более 2%. В результате получают композицию следующего состава, мас.%:
1. Протосубтилин Г10 X - 2,5
2. Декстран (молекулярная масса 40 кДа) - 5,0
3. Полиэтиленоксид 4000 - 5,0
4. 0,025 М Натрий-фосфатный буфер - 87,5
Протеолитическая активность композиции 500 ПЕ/г.
Пример 5.
15 г полиэтиленоксида 4000 растворяют в 300 мл 5% раствора декстрана (мол. масса 70 кДа) в 0,025 М натрий-фосфатного буфера с рН 8,2, добавляют 7,5 г протосубтилина Г10Х, смесь перемешивают при температуре 18-20oС в течение 30 минут. Затем проводят осаждение балластных белков методом солевого осаждения. Для этого в смесь последовательно добавляют до полного растворения 1,3 г натрия фосфорнокислого двузамещенного до конечной концентрации 0,45% и 1,9 г хлорида кальция до конечной концентрации 0,63%. После растворения хлорида кальция в реакционной смеси выпадает осадок нерастворимого фосфата кальция, который адсорбирует балластные белки. Смесь выдерживают 12 часов при температуре от 4 до 8oС для полного осаждения балластных белков. Далее реакционную смесь фильтруют через бумажные фильтры ("белая лента"). Объем фильтрата составляет 300 мл. Полученный раствор подвергают облучению гамма-лучами в дозе 0,8 Мрад. После облучения раствор подвергают стерилизующей фильтрации, фасуют по 10 мл во флаконы емкостью 15 мл и лиофильно высушивают до остаточной влаги не более 2%. В результате получают композицию следующего состава, мас.%:
1. Протосубтилин Г10Х - 2,5
2. Декстран (молекулярная масса 70 кДа) - 5,0
3. Полиэтиленоксид 4000 - 5,0
4. 0,025 М Натрий-фосфатный буфер - 87,5
Протеолитическая активность композиции 1000 ПЕ/г.
Пример 6.
Получение заявляемой композиции, состоящей из активного компонента и растворителя (двухкомпонентный состав).
1 компонент:
0,5 г полиэтиленоксида 1500 растворяют в 300 мл 10% раствора декстрана с молекулярной массой 40 кДа в 0,025 М натрий-фосфатного буфера с рН 8,2, добавляют 5,7 г протосубтилина Г3Х, смесь перемешивают при температуре 18-20oС в течение 30 минут. Затем проводят осаждение балластных белков методом солевого осаждения. Для этого в смесь последовательно добавляют до полного растворения 1,3 г натрия фосфорнокислого двузамещенного до конечной концентрации 0,45% и 1,9 г хлорида кальция до конечной концентрации 0,63%. После растворения хлорида кальция в реакционной смеси выпадает осадок нерастворимого фосфата кальция, который адсорбирует балластные белки. Смесь выдерживают 12 часов при температуре от 4 до 8oС для полного осаждения балластных белков. Далее реакционную смесь фильтруют через бумажные фильтры ("белая лента"). Объем фильтрата составляет 300 мл. Полученный раствор подвергают облучению гамма-лучами в дозе 1,0 Мрад. После облучения раствор подвергают стерилизующей фильтрации, фасуют по 10 мл во флаконы емкостью 15 мл и лиофильно высушивают до остаточной влаги не более 2%. В результате получают 1 компонент композиции следующего состава мас.%:
1. Протосубтилин Г3Х - 1,9
2. Декстран (молекулярная масса 40 кДа) - 10,0
3. Полиэтиленоксид 1500 - 0,5
4. 0,025 М Натрий-фосфатный буфер - 87,6
Протеолитическая активность 1 компонента композиции 750 ПЕ/г
2 компонент (растворитель):
15,0 г полиэтиленоксида 1500 растворяют в 300 мл 0,025 М натрий-фосфатного буфера с рН 8,2. Далее раствор фильтруют через бумажные фильтры ("белая лента"). Объем фильтрата составляет 300 мл. Полученный раствор подвергают облучению гамма-лучами в дозе 1,0 Мрад. После облучения раствор подвергают стерилизующей фильтрации, фасуют по 10 мл во флаконы емкостью 15 мл. В результате получают 2 компонент композиции следующего состава мас.%:
1. Полиэтиленоксид 1500 - 5,0
2. 0,025 М Натрий-фосфатный буфер - 95,0
При растворении 1 компонента в растворителе (2 компонент) и лиофилизации получают заявляемую фармацевтическую композицию.
Использование предлагаемой композиции позволит по сравнению с композицией-прототипом
- расширить область применения композиции для лечения заболеваний, сопровождающихся явлениями тромбообразования, воспаления и разрушением клеточной структуры тканей;
- расширить арсенал медикаментозных средств лечения ревматоидных заболеваний, ишемической болезни сердца, острых инфарктов миокарда и ишемических инсультов мозга.
Источники информации
1. Методические рекомендации по проведению ранних лечебных мероприятий пациентам с острым инфарктом миокарда. Сообщение Американского кардиологического Колледжа и Американской Ассоциации Сердца. Редакция В.И.Ганюкова. Новосибирск: 1998. 100 с.
2. Saunders W.B. Indications for Fibrinolytic Therapy Trialists Collaborative Group.//Lancet Ltd. 1994. Vol. 343. P. 311-322.
3. Насонов Е.Л., Цветкова B.C., Тов Н.Л. Селективные ингибиторы циклооксигеназы-2: новые перспективы лечения заболеваний человека // Тер. архив 1998. 5. С. 8-14.
4. Brottier L, Barat JL, Combe С et all. Therapeutic value of a cardioprotective agent in patients with severe ischaemic cardiomyopathy // Eur. Heart J. 1990. Vol. 11. P. 207-212.
Изобретение относится к медицине, в частности к фармацевтической промышленности. Фармацевтическая композиция содержит ферментный препарат протосубтилин Г3Х, или Г10Х, или Г20Х, полиэтиленоксид с молекулярной массой 400-20000 Да, декстран с молекулярной массой 10-70 кДа и буферную смесь с рН 7,5-8,2 при определенном содержании компонентов. Изобретение позволяет получить композицию, обладающую многоцелевым синергичным действием, а также способной при лиофилизации образовывать однородную, пористую массу. 1 з.п. ф-лы, 1 табл., 4 ил.
Протосубтилин Г3Х, или Г10Х, или Г20Х - 0,5-5,0
Полиэтиленоксид - 0,1-10,0
Декстран - 1,0-10,0
Буферная смесь - Остальное
2. Фармацевтическая композиция по п.1, отличающаяся тем, что в качестве буферной смеси используют 0,025 М натрий-фосфатный буфер с рН 7,5-8,2.
| RU 2003346 С1, 30.11.1993 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМОГО ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА | 1998 |
|
RU2137835C1 |
| Модифицированный террилитином декстран, обладающий фибринолитической активностью | 1976 |
|
SU730694A1 |
| СОСТАВ ДЛЯ КОНСЕРВАЦИИ БИОЛОГИЧЕСКИХ ТКАНЕЙ | 1993 |
|
RU2069952C1 |
| КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ КИШЕЧНОЙ ИНФЕКЦИИ, СПОСОБ НЕСПЕЦИФИЧЕСКОЙ СТИМУЛЯЦИИ ИМVУННОЙ СИСТЕМЫ, СПОСОБ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНОГО МАТЕРИАЛА В ВЕРХНИЕ ОТДЕЛЫ ТОНКОГО КИШЕЧНИКА | 1992 |
|
RU2113220C1 |
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И ДИФФЕРЕНЦИРОВКИ МЕГАКАРИОЦИТОВ | 1995 |
|
RU2158603C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГНОЙНО-НЕКРОТИЧЕСКИХ РАН (ВАРИАНТЫ) | 1997 |
|
RU2150936C1 |
Авторы
Даты
2003-10-10—Публикация
2001-12-26—Подача