Предпосылки создания изобретения
Настоящее изобретение относится к фармацевтической композиции и способу лечения с применением эсликарбазепина ацетата.
Эпилепсию, болевые состояния, такие как невралгия тройничного нерва, и аффективные мозговые нарушения, такие как биполярное расстройство, обычно лечат с помощью карбамазепина. Лечение с помощью карбамазепина, однако, может привести к серьезным побочным эффектам в результате образования токсических метаболитов. Для уменьшения тяжести этих побочных эффектов был создан окскарбазепин, но окскарбазепин имеет значительно сниженную эффективность. См., например, Almeida, L. & Soares-da-Silva, P., «Safety, Tolerability, and Pharmacokinetic Profile of BIA 2-093, a Novel Putative Antiepileptic, in a Rising Multiple-Dose Study in Young Healthy Humans», J. Clin. Pharmacol., 44, 906-918 (2004) (в настоящем описании именуется как «Almeida I»).
Таким образом, существует необходимость в фармацевтической композиции и способе лечения различных состояний или заболеваний, таких как, например, эпилепсия, невралгия тройничного нерва, и аффективные мозговые нарушения, которая имеет высокую эффективность и низкую частоту возникновения побочных эффектов.
Краткое изложение сущности изобретения
Эсликарбазепина ацетат, (S)-(-)-10-ацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид («BIA 2-093»), представляет собой новое лекарственное средство, разработанное в настоящее время, которое пригодно для лечения различных состояний, таких как, например, эпилепсия и аффективные мозговые нарушения, а также болевых состояний и нарушений деятельности нервной системы при дегенеративных и постишемических нарушениях. Несмотря на то, что химически схож с карбамазепином и окскарбазепином, считают, что эсликарбазепина ацетат не образует некоторых токсических метаболитов (таких как, например, эпоксиды) и избавлен от излишней продукции энантиомеров или диастереоизомеров метаболитов и конъюгатов, не теряя фармакологической активности. См. Benes et al., «Anticonvulsant and Sodium Channel-Blocking Properties of Novel 10,11-Dihydro-5H-dibenz[b,f]azepine-5-carboxamide Derivatives», J. Med. Chem., 42, 2582-2587 (1999).
Подобно карбамазепину и окскарбазепину, считают, что эсликарбазепина ацетат является ингибитором потенциалозависимых натриевых каналов (VGSC), который конкурентно взаимодействует с участком 2 неактивной формы натриевого канала. Аффинность для этой формы канала схожа с таковой карбамазепина, в то время как аффинность к находящейся в состоянии покоя форме канала приблизительно в 3 раза ниже, чем таковая карбамазепина. Этот профиль может означать усиленную ингибирующую селективность эсликарбазепина ацетата на быстро возбужденные нейроны относительно тех, которые показывают нормальную активность. См. Bonifacio et al., «Interaction of the Novel Anticonvulsant, BIA 2-093, with Voltage Gated Sodium Channels: Comparison with Carbamazepine», Epilepsia, 42, 600-608 (2001).
При оценке метаболического профиля эсликарбазепина ацетата, после хирального анализа, в микросомах печени крыс, собак, обезьян и человека, обнаружили S-(+)-энантиомер ликарбазепина, (S)-(+)-10,11-дигидро-10-гидрокси-5H-дибенз/b,f/азепин-5-карбоксамид (также известный как «эсликарбазепин»), а не R(-)-форму ликарбазепина, (R)-(-)-10,11-дигидро-10-гидрокси-5H-дибенз/b,f/азепин-5-карбоксамид (также известный как «R-ликарбазепин»).
Исследования, проведенные на людях, показали, что после перорального применения эсликарбазепина ацетат, по-видимому, быстро и широко метаболизируется до активного метаболита эсликарбазепина, и, в незначительной степени, до R-ликарбазепина. См. Silveira et al., «BIA 2-093 Pharmacokinetics in Healthy Elderly Subjects», Epilepsia, 45 (suppl. 3), 157 (2004). Например, концентрации в плазме крови исходного лекарственного средства (эсликарбазепина ацетат) систематически находились ниже предела количественного определения (LOQ) указанного исследования (10 нг/мл). См. Almeida I; Almeida, L. & Soares-da-Silva, P., «Safety, Tolerability and Pharmacokinetic Profile of BIA 2-093, a Novel Putative Antiepileptic Agent, during First Administration to Human», Drugs R&D, 4, 269-284 (2003) (в описании именуется как «Almeida II»). При использовании нехирального метода в указанном исследовании не различают эсликарбазепин и R-энантомер, и указанная смесь обозначается как «BIA 2-005» или «рацемический ликарбазепин».
Авторы указанного изобретения осуществили первые исследования применения препарата у человека, проведенные на здоровых добровольцах, результаты которых они описали в статьях Almeida I и Almeida II, обе включены посредством ссылки. В этих исследованиях здоровые люди получали однократные пероральные дозы эсликарбазепина ацетата, где дозы были в пределах от 20 мг до 1200 мг (см. Almeida II), и многократные суточные дозы эсликарбазепина ацетата в пределах от 200 мг два раза в день до 1200 мг один раз в день (см. Almeida I). В дальнейших исследованиях (еще не опубликованы) авторы указанного изобретения изучали более высокие дозы эсликарбазепина ацетата, в том числе, например, дозы в пределах до 2400 мг один раз в день. Эти исследования показали, что максимальная наблюдаемая концентрация BIA 2-005 в плазме крови (Cmax) была достигнута от приблизительно через 1 час до приблизительно через 4 час после введения дозы (tmax), степень системного воздействия BIA 2-005 была приблизительно пропорциональна дозе, и равновесная фаза концентраций BIA 2-005 в плазме крови была достигнута приблизительно через 4-5 дней. Средний почечный клиренс BIA 2-005 из плазмы крови составлял приблизительно 20-30 мл/мин, а общее количество BIA 2-005, восстановленного в моче, составляло приблизительно 20% и 40% в течение 12 час и 24 час после введения дозы соответственно.
Указанные исследования также показали, что видимый терминальный период полужизни BIA 2-005 находился в пределах от приблизительно 8 час до приблизительно 17 час. См., например, Almeida II.
В патенте США № 6296873 раскрыта система доставки замедленного высвобождения карбамазепина, который имеет период полужизни в пределах от 25 час до 85 час. Чтобы избежать отрицательных эффектов, в патенте США 6296873 заявлено, что указанный карбамазепин должен применяться в таблетированной форме вплоть до двух или более раз в день для медленного высвобождения указанного соединения для поддержания уровней концентраций между 4-12 мкг/мл. Для такой системы доставки необходима форма, которая способна доставить указанное соединение в течение длительного периода времени, например, таблетированная форма.
В одном аспекте настоящего изобретения его авторы неожиданно обнаружили повышенную эффективность эсликарбазепина ацетата при лечении различных состояний при применении его один раз в день, по сравнению с применением дважды в день. Это открытие особенно удивительно, потому что кажущийся период полужизни эсликарбазепина ацетата (tЅ = от приблизительно 8 до приблизительно 17 час) значительно короче, чем период полужизни карбамазепина (tЅ = от 25 до 85 час), соединения, которое обычно вводят 3-4 раза в день.
В другом аспекте настоящего изобретения его авторы также неожиданно обнаружили усиленное воздействие эсликарбазепина у человека после введения один раз в день эсликарбазепина ацетата по сравнению с введением два раза в день. Введение эсликарбазепина ацетата один раз в день, как ни удивительно, обеспечивает усиленное воздействие эсликарбазепина, по сравнению с той же дозой лекарственного средства, разделенной на два приема в день.
Краткое описание чертежей
Фиг.1: уменьшение, в процентном выражении, числа приступов в каждый период введения дозы относительно исходного уровня (400 мг один раз в день, против приема два раза в день и приема плацебо; 800 мг один раз в день, против приема два раза в день и приема плацебо; 1200 мг один раз в день, против приема два раза в день и приема плацебо).
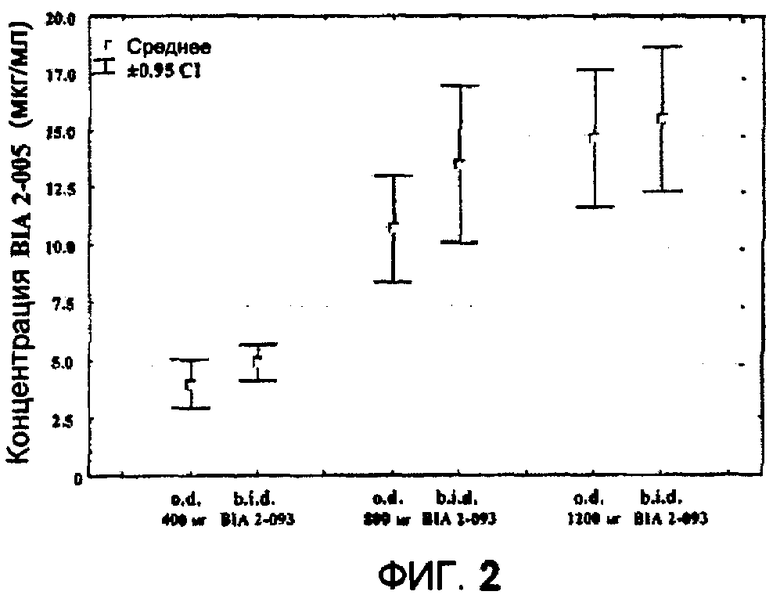
Фиг.2: средние значения (95% Cl) концентраций BIA 2-005 в плазме крови (мкг/мл) после суточной дозы BIA-2-093 400 мг, 800 мг и 1200 мг, вводимой один раз в день (o.d.) или два раза в день (b.i.d.).
Подробное описание изобретения
Изложенные выше и последующие аспекты и варианты осуществления, в том числе исследования, раскрытые в настоящем описании, описаны и проиллюстрированы только в качестве примеров, и не должны рассматриваться как ограничение диапазона указанного изобретения.
Один аспект настоящего изобретения относится к способу лечения, по меньшей мере, одного заболевания или состояния у нуждающегося в этом пациента, посредством введения фармацевтической композиции, содержащей эсликарбазепина ацетат в фармакологически эффективном количестве.
В одном примерном варианте осуществления настоящего изобретения указанная фармацевтическая композиция, содержащая эсликарбазепина ацетат, вводится один раз в день.
В другом варианте осуществления настоящего изобретения указанная фармацевтическая композиция вводится в дозе, предназначенной максимизировать суммарное воздействие эсликарбазепина, что определено по степени воздействия и продолжительности воздействия (Cmax и AUC0-τ).
В примерном варианте осуществления настоящего изобретения, по меньшей мере, одно заболевание или состояние, подвергающееся лечению, выбрано из, например, аффективных расстройств, шизоаффективных расстройств, биполярных расстройств, расстройств внимания, тревожных расстройств, невропатической боли и заболеваний, связанных с невропатической болью, сенсомоторных расстройств, вестибулярных нарушений и нарушений деятельности нервной системы при дегенеративных и постишемических нарушениях.
Примеры аффективных расстройств включают депрессию, предменструальное дистфорическое расстройство, послеродовую депрессию, постклимактерическую депрессию, нервную анорексию, нейрогенную булимию и депрессивные симптомы, связанные с нейродегенеративными процессами.
Способы, раскрытые в настоящем изобретении, могут быть использованы для лечения шизоаффективных расстройств, таких как, например, шизодепрессивные синдромы, шизофрения, критические психотические состояния, шизоманические синдромы, дисфорическое и агрессивное поведение, периодическое нарушение контроля или периодическая вспыльчивость и пограничное изменение личности.
Биполярные расстройства, которые можно лечить, применяя способы по настоящему изобретению, включают, например, биполярное расстройство или нестабильное биполярное расстройство с частыми флуктуациями (частые циклы), маниакально-депрессивные заболевания, острую манию, колебания настроения и маниакальные и гипоманиакальные приступы.
Примеры расстройств внимания включают синдром дефицита внимания с гиперактивностью и другие нарушения внимания, такие как, например, аутизм.
Тревожные расстройства могут включать такие состояния как, например, социальное тревожное расстройство, посттравматический стресс, паника, обсессивно-компульсивное расстройство, алкоголизм, абстинентные наркотические синдромы и патологические пристрастия.
Невропатическая боль и расстройства, связанные с невропатической болью, которые можно лечить, применяя способы по настоящему изобретению, включают, например, невропатическую боль и сопутствующую гипералгезию, в том числе тригеминальную, герпетическую, постгерпетическую и табетическую невралгию, диабетическую невропатическую боль, мигрени, головную боль напряжения, каузалгию, и деафферентационные синдромы, такие как, например, разрыв плечевого сплетения.
Примеры сенсомоторных нарушений включают синдром усталых ног, мышечную спастичность, гемифациальный спазм, ночную пароксизмальную дистонию, двигательные и чувствительные нарушения, связанные с ишемией головного мозга, болезнь Паркинсона и паркинсонические нарушения, двигательные нарушения, индуцированные приемом нейролептиков, позднюю дискинезию, эпизодические ночные блуждания и миотонию.
Примеры вестибулярных нарушений включают шум в ушах или другие заболевания, связанные с чувствительностью внутреннего уха/улитки, например, такие как утрата нейронов, потеря слуха, внезапная глухота, вертиго и болезнь Меньера.
В других иллюстративных вариантах осуществления, по меньшей мере, одно заболевание или состояние может быть выбрано из эпилепсии, биполярного расстройства и невралгии тройничного нерва.
Специалисту в уровне техники будет понятно, что эти состояния являются только иллюстративными, и из указанного раскрытия будет понятно, какие другие заболевания и состояния будут соответствовать области применения настоящего изобретения.
Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей эсликарбазепина ацетат и, по меньшей мере, один инертный фармацевтический наполнитель, по меньшей мере, одно вспомогательное вещество, по меньшей мере, один носитель, или их комбинации.
Еще один аспект настоящего изобретения относится к способу получения фармацевтической композиции, содержащей эсликарбазепина ацетат в сочетании, по меньшей мере, с одним наполнителем, по меньшей мере, с одним вспомогательным веществом, по меньшей мере, с одним носителем, или их комбинациями. Пригодные наполнители, носители и другие вспомогательные вещества, которые могут быть использованы в настоящем изобретении, известны специалисту в уровне техники, и без труда могут быть определены. Способы получения фармацевтических композиций также известны специалисту в уровне техники.
В одном иллюстративном варианте осуществления настоящего изобретения указанная фармацевтическая композиция может быть представлена в таблетированной форме и может содержать, по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель. Указанный, по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель, может быть выбран из, например, повидона, кроскармелозы натрия, стеарата магния, сахарина натрия, дигидрата гидроортофосфата кальция, лаурилсульфата натрия, ароматизирующих веществ и их комбинаций. Типичные таблетки могут быть сформированы с использованием грануляционных жидкостей, таких как, например, дистиллированная вода и этиловый спирт.
В другом иллюстративном варианте осуществления настоящего изобретения указанная фармацевтическая композиция может быть представлена в форме оральной суспензии и может содержать, по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель. Указанный, по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель может быть выбран из, например, ксантановой камеди, макрогола стеарата (например, Myrj 59 P, производимый UNIQEMA), метилпарабена, пропилпарабена, сахарина натрия, сорбита, буферов, ароматизирующих веществ и их комбинаций.
Другой аспект настоящего изобретения относится к способу уменьшения или снижения у пациента количества, продолжительности или частоты эпилептических припадков посредством введения в организм указанного пациента дозы фармацевтической композиции, содержащей эсликарбазепина ацетата в фармакологически эффективном количестве. В одном иллюстративном варианте осуществления настоящего изобретения указанный способ уменьшения у пациентов эпилептических припадков включает введение однократной суточной дозы фармацевтической композиции, содержащей фармакологически эффективное количество эсликарбазепина ацетата.
Настоящее изобретение также относится к способу увеличения воздействия эсликарбазепина на пациента посредством введения в организм пациента фармацевтической композиции, содержащей эсликарбазепина ацетат в количестве, эффективном для увеличения концентрации эсликарбазепина в плазме крови, в течение интервала между приемами лекарственного средства. В одном иллюстративном варианте осуществления воздействие эсликарбазепина может быть увеличено в результате доставки фармацевтической композиции способом, который минимизирует число ежедневных доз. В еще одном иллюстративном варианте осуществления настоящего изобретения способ увеличения воздействия эсликарбазепина на пациента включает введение в организм пациента однократной суточной дозы фармацевтической композиции, содержащей количество эсликарбазепина ацетата, эффективное для повышения концентрации эсликарбазепина в плазме крови в течение интервала между приемами лекарственного средства.
В еще одном иллюстративном варианте осуществления настоящего изобретения активный ингредиент указанной фармацевтической композиции может преимущественно состоять из эсликарбазепина ацетата.
В еще одном варианте осуществления настоящего изобретения эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем максимальную концентрацию эсликарбазепина в плазме крови (Cmax), больше чем приблизительно 7400 нг/мл. В других иллюстративных вариантах осуществления эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем Cmax эсликарбазепина больше, чем приблизительно 12000 нг/мл или больше, чем приблизительно 16100 нг/мл. В дополнительных иллюстративных вариантах осуществления эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем Cmax эсликарбазепина больше, чем приблизительно 22700 нг/мл, например, больше, чем приблизительно 36500 нг/мл, больше, чем приблизительно 45200 нг/мл или более.
В еще одном иллюстративном варианте осуществления эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем максимальную концентрацию эсликарбазепина в плазме крови (Cmax) вплоть до приблизительно 58800 нг/мл, или вплоть до приблизительно 67800 нг/мл. В еще одном иллюстративном варианте осуществления эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем максимальную концентрацию эсликарбазепина в плазме крови (Cmax) вплоть до приблизительно 885000 нг/мл, или вплоть до приблизительно 1000000 нг/мл.
Например, однократная суточная доза приблизительно 400 мг может быть введена в организм пациента, обеспечивая максимальную концентрацию эсликарбазепина в плазме крови (Cmax) больше, чем приблизительно 7400 нг/мл. В качестве еще одного примера, однократная суточная доза приблизительно 800 мг или приблизительно 1200 мг может быть введена в организм пациента, обеспечивая Cmax эсликарбазепина больше, чем приблизительно 16100 нг/мл, или больше, чем приблизительно 22700 нг/мл, соответственно. В других примерах, эсликарбазепина ацетат может быть введен в однократной суточной дозе выше, чем приблизительно 1200 мг, например, приблизительно 1800 мг или приблизительно 2400 мг, для обеспечения Cmax эсликарбазепина больше, чем приблизительно 36500 нг/мл, приблизительно 45200 нг/мл, соответственно.
В еще одном аспекте настоящего изобретения эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем площадь под кривой изменения концентрации (которая соответствует продолжительности системного воздействия) на протяжении интервала между приемами эсликарбазепина (AUC0-τ) более чем приблизительно 110000 нг•ч/мл. В других иллюстративных вариантах осуществления эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем AUC0-τ эсликарбазепина больше, чем приблизительно 240000 нг•ч/мл, или более чем 375000 нг•ч/мл, соответственно. В других примерах, эсликарбазепина ацетат может быть введен в организм пациента в количестве, обеспечивающем AUC0-τ эсликарбазепина больше, чем приблизительно 595000 нг•ч/мл, больше, чем 790000 нг•ч/мл, или более.
Например, однократная суточная доза приблизительно 400 мг может быть введена в организм пациента, обеспечивая площадь под кривой изменения концентрации (которая соответствует продолжительности системного воздействия) на протяжении интервала между приемами эсликарбазепина (AUC0-τ) более чем приблизительно 110000 нг•ч/мл. В других иллюстративных вариантах осуществления однократная суточная доза приблизительно 800 мг или приблизительно 1200 мг может быть введена в организм пациента, обеспечивая AUC0-τ эсликарбазепина более чем приблизительно 240000 нг•ч/мл, или больше, чем приблизительно 375000 нг•ч/мл, соответственно. В других примерах, эсликарбазепина ацетат может быть введен в однократной суточной дозе выше, чем приблизительно 1200 мг, такой как приблизительно 1800 мг, приблизительно 2400 мг или более, для обеспечения соответствующей AUC0-τ эсликарбазепина более чем приблизительно 595000 нг•ч/мл, более чем приблизительно 790000 нг•ч/мл или более.
В одном иллюстративном варианте осуществления настоящего изобретения вводимая однократная суточная доза может составлять, по меньшей мере, приблизительно 400 мг эсликарбазепина ацетата. В другом иллюстративном варианте осуществления однократная суточная доза может быть введена в лекарственной форме, включающей количество эсликарбазепина ацетата в пределах от приблизительно 800 мг до приблизительно 1200 мг. В других иллюстративных вариантах осуществления однократная суточная доза может быть введена в лекарственной форме, включающей количество эсликарбазепина ацетата более чем приблизительно 1200 мг, такое как приблизительно 1800 мг, приблизительно 2400 мг или более.
Указанная фармацевтическая композиция, содержащая эсликарбазепина ацетат, при желании может быть введена в организм посредством любого пути введения, известного специалисту в уровне техники, и может быть представлена в форме, выбранной, например, из таблеток или оральных суспензий, или других форм.
Согласно другому аспекту указанного изобретения обеспечено применение эсликарбазепина ацетата или его соли в сочетании, по меньшей мере, с одним другим противоэпилептическим лекарственным средством при изготовлении фармацевтической композиции для лечения эпилепсии, где указанная фармацевтическая композиция предназначена для введения один раз в день. Концентрация, по меньшей мере, одного другого противоэпилептического лекарственного средства значительно не уменьшена посредством однократной суточной дозы фармацевтической композиции, содержащей эсликарбазепина ацетат. Предпочтительно, указанное, по меньшей мере, одно другое противоэпилептическое лекарственное средство выбрано из вальпроата, ламотригина, топирамата и их комбинаций.
Согласно другому аспекту указанного изобретения обеспечена единичная доза фармацевтической композиции, содержащей от приблизительно 400 до 1200 мг эсликарбазепина ацетата. Указанная стандартная форма фармацевтической композиции пригодна для перорального введения для лечения вышеуказанных заболеваний, кроме эпилепсии, вплоть до максимальной дозы 1200 мг в день.
Используемое в настоящем описании понятие «приблизительно» означает, что число, измененное этим понятием можно считать приближением, которое может варьировать в зависимости от желаемых свойств или эффекта в конкретном применении, и, следовательно, следует считать, что охватывает диапазон, понятный специалисту в указанной области, для достижения желаемых или перечисленных свойств или эффекта.
Описанный в настоящем описании «способ лечения» относится к введению в организм пациента описанного соединения в любом количестве, эффективном для уменьшения последствий, противодействий или устранения заболевания или состояния, подвергающегося лечению, или их симптомов.
Описанный в настоящем описании «способ увеличения воздействия эсликарбазепина на организм пациента» относится к введению в организм пациента описанного соединения в любом количестве, эффективном для повышения концентрации эсликарбазепина в плазме крови пациента в течение интервала между введениями лекарственного средства. Это может быть, например, повышение через увеличение однократной суточной дозы относительно суточной дозы, принимаемой два раза в день.
Описанное в настоящем описании «уменьшение у пациента эпилептических припадков» относится к любому уменьшению числа, продолжительности или частоты эпилептических припадков у пациента, по сравнению с числом, продолжительностью или частотой эпилептических припадков, переживаемых пациентом без лечения.
«Фармакологически эффективное количество» эсликарбазепина ацетата в фармацевтической композиции, как описано в настоящем описании, относится к любому количеству, достаточному для обеспечения необходимой фармакологической активности.
Все эффективные количества, описанные в настоящем описании, будут изменяться в зависимости от различных хорошо известных и понятных факторов, таких, например, как состояние, подвергающееся лечению, и физиологических характеристик пациента, подвергающегося лечению. Соответственно, указанное эффективное количество будет зависеть от способности специалиста в уровне техники определить эти факторы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Следующее наглядно показывает, в качестве одного примера настоящего изобретения, определение и введение эффективного количества фармацевтической композиции, содержащей эсликарбазепина ацетат для лечения эпилепсии у пациентов, нуждающихся в этом. Эффективное количество фармацевтической композиции для лечения других заболеваний и/или состояний может быть определено специалистом в уровне техники на основании технологий и понятий, раскрытых в настоящем описании и известных в уровне техники.
Действия эсликарбазепина ацетата у людей исследовали, по меньшей мере, в следующих клинических испытаниях. В первом испытании контролируемое плацебо терапевтическое поисковое исследование: сравнивали однократное ежедневное применение и двукратное ежедневное применение у больных эпилепсией, невосприимчивых к стандартной противоэпилептической лекарственной терапии. Во втором испытании здоровые люди получали либо однократную суточную (o.d.) оральную дозу 900 мг эсликарбазепина ацетата, либо двукратную суточную (b.i.d.) дозу 450 мг эсликарбазепина ацетата. В третьем испытании здоровые люди получали однократные оральные дозы эсликарбазепина ацетата в пределах от 20 мг до 2400 мг, и повторные однократные суточные (o.d.) оральные дозы в пределах от 400 мг до 2400 мг эсликарбазепина ацетата.
Биоэквивалентность таблеток и суспензий для перорального применения была доказана при исследовании сравнительной биодоступности.
Исследование пациентов, больных эпилепсией
Это клиническое испытание было двойным слепым, рандомизированным, контролируемым плацебо исследованием, проведенным в 20 центрах в Хорватии, Чешской Республике, Германии, Литве и Польше. Поставленными целями указанного исследования были оценки эффективности и безопасности BIA 2-093 в качестве адъювантной терапии у пациентов с неподдающейся лечению частичной эпилепсией. Всего 143 пациента в возрасте 18-65 лет, по меньшей мере, с 4 частично проявляющимися припадками в месяц, несмотря на лечение с помощью 1 или 2 противоэпилептических лекарственных средств (AED) (например, фенитоин, вальпроат, примидон, фенобарбитал, ламотригин, габапептин, топирамат или клоназепам), были случайным образом отнесены в одну из трех групп: лечение с применением плацебо (n=47), BIA 2-093 один раз в день (n=50) или BIA 2-093 два раза в день (n=46), в течение 12 недель (плюс 1 неделя на сокращение дозы). В течение первых 4 недель суточная доза составляла 400 мг. Затем суточные дозы были увеличены до 800 мг (недели 5-8), и в итоге до 1200 мг (недели 9-12). Таблетки с содержанием эсликарбазепина ацетата 200 мг, 400 мг и 600 мг и таблетки плацебо были изготовлены BIAL (S. Mamede do Coronado, Portugal) в соответствии с правилами организации производства и контроля качества лекарственных средств. Исследование плазмы крови для определения концентрации BIA 2-005 осуществляли с помощью нехирального метода с использованием изократической жидкостной хроматографии (ЖХ) с отдельным квадрупольным масс-спектрометрическим определением (MS), как описано в настоящем описании. См., например, Almeida I и Almeida II.
Исследование здоровых добровольцев
Испытание A
Это фармакологическое испытание на человеке представляло собой исследование для изучения у здоровых людей фармакокинетики в стационарном состоянии эсликарбазепина ацетата, принимаемого один раз в день или два раза в день. Указанное исследование было одноцентровым, открытым, рандомизированным, двусторонне перекрестным испытанием, проведенным у 12 здоровых добровольцев (6 мужчин и 6 женщин), которое состояло из двух 8-дневных периодов лечения, разделенных по времени периодом вымывания 10-15 дней. На каждой стадии испытания указанные добровольцы получали ежедневно перорально дозу эсликарбазепина ацетата 900 мг один раз в день (o.d.) либо дозу эсликарбазепина ацетата 450 мг два раза в день (b.i.d.). Применяли таблетки с содержанием эсликарбазепина ацетата 450 мг, произведенные BIAL (S. Mamede do Coronado, Portugal) в соответствии с правилами организации производства и контроля качества лекарственных средств.
Образцы крови для исследования содержания лекарственного средства в плазме забирали в следующие моменты времени:
Фаза A:
перед введением дозы и через Ѕ, 1, 1Ѕ, 2, 3, 4, 6, 8, 12, 24, 36, 48, 72 и 96 час после введения дозы.
Фаза B:
с дня 5 по день 11 (включительно): перед ежедневной дозой (для определения «фоновой» концентрации);
день 12: перед введением дозы и через Ѕ, 1, 1Ѕ, 2, 3, 4, 6, 8, 12, 24, 36, 48, 72, 96 и 120 час после введения дозы.
Образцы крови забирали либо посредством прямой венопункции, либо через венозный катетер, в пробирки с литиевым гепарином и центрифугировали приблизительно при 1500 g в течение 10 мин при 4°С. Полученную плазму разделяли на 2 одинаковые аликвоты по 1 мл и хранили при -20°С до необходимого анализа.
Концентрации эсликарбазепина ацетата, эсликарбазепина и R-ликарбазепина в плазме крови определяли, используя изократическую жидкостную хроматографию (ЖХ) с отдельной детекцией на квадрупольном масс-спектрометре (МС).
Указанный способ включает добавление 500 мкл приблизительно 0,5 мкг/мл 10,11-дигидрокарбамазепина (внутренний стандарт, приготовленный в ацетонитрил:вода, 3:97, об./об.) к 250 мкл плазмы крови (центрифугированной при 1800 об./мин перед проведением анализа) в полипропиленовой пробирке. После перемешивания на вортексе в течение 10 с указанную смесь переносили в 96-луночный планшет для твердофазной экстракции Schleicher and Schuell C18/100 мг. Каждую лунку предварительно обрабатывали 800 мкл метанола, затем 800 мкл ацетонитрила и 800 мкл ацетонитрил:вода (3:97, об./об.) перед нанесением общего объема образца. Каждую полипропиленовую пробирку затем отмывали 500 мкл смеси ацетонитрил:вода (3:97, об./об.) и указанные промывочные жидкости переносили в соответствующую лунку. Указанные соединения элюировали на собирающий планшет с помощью 750 мкл ацетонитрила и указанный экстракт выпаривали досуха в присутствии азота без примеси кислорода, при 40°С. Все процедуры твердофазной экстракции выполняли с использованием системы Tomtec QUADRA 96® Model 320, и вакуум применяли на каждом этапе элюции. Полученный экстракт восстанавливали в 100 мкл смеси вода:метанол (90:10, об./об.) и перемешивали. Затем перед проведением анализа собирающий планшет центрифугировали приблизительно при 3000 об/мин (приблизительно при 4°С, в течение приблизительно 10 мин). Аликвоту полученного экстракта (10 мкл) вводили в систему ЖХ-МС.
Указанная система ЖХ-МС, использованная в указанном анализе, состояла из микронасоса Perkin Elmer серии 200, автоматического пробозаборника Perkin Elmer серии 200 и отдельного квадрупольного масс-спектрометра Perkin Elmer/Sciex API 150EX, оборудованного источником Turbo IonSpray®. Разделение обеспечивали, используя колонку LichroCART 250-4 ChiraDex (β-циклодекстрин, 5 мкм), предколонка колонки LichroCART 4-4 ChiraDex (β-циклодекстрин, 5 мкм), нагревательный элемент колонки Jones Chromatography 7971 до 50°C, подвижную фазу A (0,2 мM ацетат натрия, водный) и подвижную фазу B (0,2 мM ацетат натрия, MeOH). Указанный МС-детектор работал в режиме положительно заряженного иона с переходами масс для BIA 2-093, эсликарбазепина, R-ликарбазепина и внутреннего стандарта, равными 319,16 аем (200 мс), 277,08 аем (200 мс), 277,08 аем (200 мс) и 261,05 аем (200 мс) соответственно. Предел количественного определения указанного анализа составлял 10 нг/мл для эсликарбазепина ацетата и 100 нг/мл для эсликарбазепина и R-ликарбазепина.
Эсликарбазепина ацетат, (S)-(-)-10-ацетокси-10,11-дигидро-5H-дибенз/b,f/азепин-5-карбоксамид; эсликарбазепин, (S)-(+)-10,11-дигидро-10-гидрокси-5H-дибенз/b,f/азепин-5-карбоксамид; и R-ликарбазепин, (R)-(-)-10,11-дигидро-10-гидрокси-5H-дибенз/b,f/азепин-5-карбоксамид были синтезированы в химической лаборатории, BIAL, со степенью чистоты >99,5%. Внутренний стандарт, 10,11-дигидрокарбазепин поставлялся фирмой Sigma-Aldrich (St. Louis, MO).
Фармакокинетические параметры были получены в результате некомпартментного анализа с использованием программы WinNonlin (версия 4.0, Pharsight Corporation, Mountain View, California). Когда это целесообразно, следующие параметры были получены из каждых конкретных графиков концентрация в плазме крови - время: максимально наблюдаемая концентрация в плазме крови (Cmax) измеряемый период Cmax (tmax); площадь под кривой зависимости концентрации в плазме крови от времени (AUC) от нулевого момента времени до последнего момента забора образца (t), в который концентрации были одинаковы, или выше предела количественного определения (AUC0-τ), вычисленного по линейному правилу трапеций; AUC в течение интервала между приемами лекарственного средства (AUCτ), т.е. 24 час и 12 час в группах, принимающих лекарственное средство один раз в день и два раза в день, соответственно; AUC от начального момента времени до бесконечности (AUC0-∞), рассчитанные по формуле AUC0-τ+(Clast/λz), где Clast представляет собой последнюю измеряемую количественно концентрацию; видимая конечная константа скорости (λz) рассчитана по логарифмической регрессии конечного отрезка концентрации в плазме крови против кривой зависимости от времени; видимый конечный период полужизни (tЅ), вычислен из ln 2/λz.
В фармакокинетическом анализе использовали абсолютные моменты времени отбора проб.
Где AUC экстраполировали до бесконечности, оценивали процентное отношение экстраполированной области к общей области; при значении более чем 20% значение AUC помечали как недостоверное. Концентрации в плазме крови, ниже предела количественного определения указанного анализа (BLQ), принимали за ноль при проведении всех вычислений. Все вычисления проводили с использованием исходных данных. Значения tmax были представлены как номинальные моменты времени.
Сводная статистика для каждой группы и график времени отбора проб стали известны, в зависимости от ситуации, при использовании среднего геометрического значения, среднего арифметического значения, стандартного отклонения (SD), коэффициента вариаций (CV), медианы, минимального значения и максимального значения. Сравнения между группой более старших индивидуумов и более молодых индивидуумов, в отношении указанных однократного применения и многократного применения, основывались на дисперсионном анализе (односторонний дисперсионный анализ, ANOVA) логарифмически преобразованных параметров Cmax, AUCτ и AUC0-∞. Сравнение tmax между возрастными группами осуществлено, исходя из непараметрического подхода, с использованием знаковых рангов критериев Уилкоксона (Wilcoxon). Кроме того, различия логарифмически преобразованных параметров (Cmax, AUCτ и AUC0-∞) и их соответственных 95% доверительных интервалов (95% Сl), были подсчитаны между возрастными группами для приобретения формы соотношений в линейном масштабе. Были определены срединные значения и различия tmax между возрастными группами и 95% Сl. Все критерии достоверности были осуществлены на уровне р=0,05. Использовали пакет программ обработки статистических указанных SAS (версия 8.2, SAS Institute Inc, Cary, NC).
Испытание B
Это фармакологическое испытание на человеке представляло собой исследование для определения фармакокинетики эсликарбазепина ацетата, после однократного или многократного применения.
В этом исследовании объединены результаты трех двойных-слепых, рандомизированных, плацебо-контролируемых испытаний. Для оценки фармакокинетики эсликарбазепина ацетата после введения в организм однократных доз использовали однократные оральные дозы эсликарбазепина ацетата в пределах от 20 мг до 2400 мг, вводимые здоровым молодым мужчинам (6 человек на дозу). Фармакокинетику эсликарбазепина ацетата после многократных доз оценивали в результате введения многократных оральных доз в пределах от 400 мг до 2400 мг эсликарбазепина ацетата здоровым молодым мужчинам (6 человек на дозу) в течение 8 дней. Методы аналитических тестов и экспериментальные процедуры были аналогичны описанным выше для испытания А.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследования пациентов, больных эпилепсией
Исходные характеристики
На исходном уровне группы, подвергающиеся лечению, были гомогенными в отношении возраста, роста, веса и индекса массы тела. Все 143 пациента принадлежали к европеоидной расе. Что касается пола, было относительно больше пациентов-женщин в группе, получавшей лекарственное средство дважды в день, по сравнению с группой, получавшей лекарственное средство один раз в день и плацебо (65,2%, 56,0% и 57,4% соответственно); это различие не влияло значительно на результаты. Не было обнаружено значительных различий в числе используемых AED: соответственно 30,0%, 34,8% и 29,8% пациентов в группе, получавшей лекарственное средство один раз в день, два раза в день и плацебо, получали лечение с помощью 1 AED; остальные пациенты получали лечение с помощью 2 AED. Наиболее часто используемыми дополнительными AED были вальпроевая кислота (68,0%, 60,9% и 66,0% пациентов в группах, получавших лекарственное средство один раз в день, два раза в день и плацебо соответственно), топирамат (36,0%, 34,8% и 21,3%, соответственно) и ламотригин (30,0%, 28,3% и 31,9% соответственно).
На начальном уровне средняя продолжительность эпилепсии была 16,7, 19,5 и 20,0 лет в группах, получавших лекарственное средство один раз в день, два раза в день и плацебо соответственно. В отношении частоты возникновения припадков определенного типа, IA простой частичный, IB комплексный частичный и IC частичный, развивающиеся во вторичные генерализованные, присутствовали, соответственно, у 34,0%, 72,0% и 80,0% в группе, получавшей лекарственное средство один раз в день; 37,0%, 71,7% и 80,4% в группе, получавшей лекарственное средство два раза в день; и 27,7%, 80,9% и 72,3% в группе, получавшей плацебо. Среднее общее количество приступов в месяц перед началом исследования составляло 14,1, 13,6 и 11,8 в группах, получавших лекарственное средство один раз в день, два раза в день и плацебо соответственно.
Указанные эффективности
Количественное соотношение пациентов с 50% или большим уменьшением частоты приступов за период лечения по сравнению с исходным уровнем в устойчивой к лечению (ITT) группе людей (n=143) было первичным предельным значением эффективности. При дозировке 1200 мг/день (недели 9-12) соотношение реагирующих на лечение в группе, получающей лекарственное средство один раз в день (54%), было значительно выше (р=0,008), чем в группе, получающей плацебо (28%). Соотношение реагирующих на лечение в группе, получающей лекарственное средство один раз в день (54%), было также значительно выше, чем в группе, получающей лекарственное средство два раза в день (41%). При дозировке 800 мг/день (недели 5-8) соотношение реагирующих на лечение в группе, получающей лекарственное средство один раз в день (58%), было значительно выше (р<0,05), чем в группах, получающих лекарственное средство два раза в день (33%) и плацебо (38%). При этом уровне дозировки не было выявлено значимого различия между группами, получающими лекарственное средство два раза в день и плацебо.
Вторичные предельные значения включают уменьшение общей частоты приступов, количественное соотношение пациентов, у которых отсутствуют приступы, распределение реагирующих на лечение, сравнение режимов дозировки один раз в день и два раза в день, и общую оценку исследователей и пациентов.
Наибольшее уменьшение количества приступов было достигнуто при приеме один раз в день дозировок 1200 мг и 800 мг, и эти результаты в группе, принимающей лекарственное средство один раз в день, были лучше, чем таковые, полученные в группе, принимающей лекарственное средство два раза в день (фиг.1). Для всех дозировок (400 мг, 800 мг и 1200 мг), у пациентов, получающих эсликарбазепина ацетат один раз в день, наблюдали значительно большее уменьшение числа приступов по сравнению с пациентами, получавшими лекарственное средство два раза в день и получавшими плацебо.
Число приступов у пациентов, получавших 1200 мг и 800 мг эсликарбазепина ацетата один раз в день, уменьшилось на 59,5% и 55,8% соответственно. Для сравнения, число приступов у пациентов, получавших 1200 мг и 800 мг два раза в день, уменьшилось на 47,5% и 38,1% соответственно. У пациентов, получавших 400 мг эсликарбазепина ацетата один раз в день, наблюдали уменьшение числа приступов на 38,9%, почти в два раза больше, чем у пациентов, получавших 400 мг эсликарбазепина ацетата два раза в день (20,2%).
По окончании 12-недельного периода лечения 27,9% пациентов в группе, получавшей лекарственное средство один раз в день, избавились от приступов.
Кроме того, оценка эффективности исследователем (CGI - общее клиническое впечатление) и оценка переносимости пациентом была определена лучшей в группе, получавшей лекарственное средство один раз в день.
Фармакокинетические результаты
Образцы плазмы/сыворотки крови для определения «фоновых» (перед введением дозы) уровней BIA 2-005 и дополнительных AED собирали во время всех посещений, но V5 (посещение после исследования). Цель состояла в том, чтобы охарактеризовать действие эсликарбазепина ацетата на фармакокинетические свойства дополнительных AED (например, фенитоин, вальпроат, примидон, фенобарбитал, ламотригин, габапентин, топирамат и клоназепам). Средние значения фоновой концентрации BIA 2-005 в плазме крови представлены в таблице 1. Как показано на фиг.2, не было выявлено значимых различий в фоновых значениях (перед введением дозы) для BIA 2-005 между группами, получавшими лекарственное средство один раз в день и два раза в день.
после перорального введения эсликарбазепина ацетата
один раз в день (o.d.) и два раза в день (b.i.d.)
Результаты выражены в виде средних арифметических величин с соответствующими стандартными отклонениями (sd) в скобках.
У относительно небольшого числа пациентов, получавших фенитоин, примидон, фенобарбитал, габапентин и клоназепам указанное лечение препятствовало соответствующей характеристике возможного эффекта эсликарбазепина ацетата на фармакокинетические свойства этих дополнительных AED. Для вальпроата, ламотригина и топирамата, число пациентов было также небольшим, но был осуществлен поисковый анализ эффекта эсликарбазепина ацетата на фоновые значения этих дополнительных AED в крови. Среднее значение фоновых концентраций вальпроата в сыворотке крови не были значительно изменены в результате сопутствующего применения эсликарбазепина ацетата один раз в день (7,0%; 95% IC: -7,6, 36,2) или два раза в день (6,3%; 95% IC: -7,5, 20,1). В группе, получавшей плацебо, было отмечено значительное повышение уровней вальпроата в сыворотке крови (25,4%; 95% IC: 5,1, 45,8). В отношении ламотригина, его уровни в сыворотке крови были незначительно изменены в случае, когда к указанной терапии был добавлен эсликарбазепина ацетат один раз в день (-10,0%; 95% IC: -46,2, 26,2) или плацебо (12,6%; 95% IC: -12,6, 37,8). При применении эсликарбазепина ацетата два раза в день уровни ламотригина в сыворотке крови были значительно снижены (-46,7%; 95% IC: -69,7; -23,8). В отношении топирамата, его уровни в сыворотке крови были незначительно изменены в случае, когда к указанной терапии был добавлен эсликарбазепина ацетат один раз в день (-15,2%; 95% IC: -34,8, 4,4). При применении эсликарбазепина ацетата два раза в день уровни топирамата в сыворотке крови были значительно снижены (-32,4%; 95% IC: -49,5; -15,3). Специалисту в уровне техники будет понятно, значимо ли изменение уровней в сыворотки крови.
Исследование здоровых добровольцев
Испытание A
Фармакокинетические результаты
Было показано, что эсликарбазепина ацетат в основном метаболизируется до эсликарбазепина, в незначительной степени, до R-ликарбазепина. Состояние равновесной концентрации эсликарбазепина в плазме крови устанавливалось на 4-5 день применения в обеих группах.
После последней дозы в группе, получавшей лекарственное средство один раз в день, средние значения Cmax для эсликарбазепина и R-ликарбазепина составляли, соответственно, 22210 нг/мл и 674 нг/мл и наблюдались через (среднее значение tmax) 2,45 час и 9,42 час после введения лекарственного средства соответственно. Среднее значение AUC0-t для эсликарбазепина и R-ликарбазепина составляло 381601 нг•ч/мл и 19600 нг•ч/мл соответственно. В группе, принимавшей лекарственное средство два раза в день, значение Cmaх эсликарбазепина и R-ликарбазепина составляло 16667 нг/мл и 718 нг/мл соответственно, и достигалось через (среднее значение tmax) 2,09 час и 6,40 час после введения дозы лекарственного средства соответственно. Среднее значение AUC0-t для эсликарбазепина и R-ликарбазепина составляло 283014 нг•ч/мл и 19661 нг•ч/мл соответственно. После многократного применения эсликарбазепина ацетата в течение 8 дней было показано, что эсликарбазепин был основным метаболитом, представляя собой 95% и 96% общего системного воздействия лекарственного средства (как оценено по AUC0-24) у пациентов, получавших лекарственное средство один раз в день и два раза в день, соответственно. В таблицах 2 и 3 представлены фармакокинетические параметры эсликарбазепина и R-ликарбазепина в группах, принимавших лекарственное средство один раз в день и два раза в день, после последней дозы эсликарбазепина ацетата. Общее воздействие эсликарбазепина на организм здоровых добровольцев в группе, получавшей лекарственное средство один раз в день, неожиданно было, по меньшей мере, на 26% больше, чем в группе, принимавшей лекарственное средство два раза в день.
и R-ликарбазепина после многократного орального применения 900 мг эсликарбазепина ацетата один раз в день
и R-ликарбазепина после многократного орального применения 900 мг эсликарбазепина ацетата два раза в день
Испытание B
Фармакокинетические результаты
Как и в испытании А, эсликарбазепина ацетат главным образом метаболизировался до эсликарбазепина, и в незначительной степени до R-ликарбазепина. Состояние равновесной концентрации эсликарбазепина в плазме крови устанавливалось на 4-5 день применения в группе, принимавшей лекарственное средство один раз в день.
После последней дозы в группе, неоднократно получавшей лекарственное средство один раз в день, среднее значение Cmax для эсликарбазепина находилось в пределах от 8800 нг/мл (16,0% коэффициент вариаций, CV) для дозы эсликарбазепина ацетата 400 мг до 56500 нг/мл (20,0% CV) для дозы эсликарбазепина ацетата 2400 мг. Максимальная концентрация лекарственного средства в плазме крови для всех дозировок (среднее значение tmax) наблюдалась через 2-3,5 час. Средняя площадь под кривой изменения концентрации для интервала между приемами лекарственного средства 24 час, AUC0-24 ч варьировала от 126300 нг/мл для дозы эсликарбазепина ацетата 400 мг, принимаемой один раз в день, до 905900 нг/мл для дозы эсликарбазепина ацетата 2400 мг, принимаемой один раз в день. В таблицах 4 и 5 представлены фармакокинетические параметры эсликарбазепина и R-ликарбазепина после однократной дозы эсликарбазепина ацетата и фармакокинетические параметры после последней из повторных доз эсликарбазепина ацетата.
и R-ликарбазепина после однократной дозы эсликарбазепина ацетата
(n=6 человек на группу, получающую дозу)
ч (диапазон)
ч (% CV)
и R-ликарбазепина после последней дозы в 8-дневном режиме дозировки эсликарбазепина ацетата (n=6 человек на группу, получающую дозу)
Ч диапазон)
нг•ч/мл (% CV)
ч (% CV)
ОБСУЖДЕНИЕ ИССЛЕДОВАНИЯ
Было обнаружено, что применение эсликарбазепина ацетата один раз в день более эффективно, чем применение такой же общей дозы, разделенной на два приема в день, и, несомненно, более эффективно в отношении уменьшения эпилептических припадков по сравнению с применением плацебо. Показано, что применение эсликарбазепина ацетата в дозировках 800 мг и 1200 мг один раз в день является значительно более эффективным в отношении уменьшения эпилептических припадков, чем применение лекарственного средства два раза в день в дозах, обеспечивающих такую же общую суточную дозировку.
Показано, что эсликарбазепина ацетат в основном метаболизируется до эсликарбазепина и, в незначительной степени, до R-ликарбазепина. Эсликарбазепин представляет от 95% до 98% общего системного действия лекарственного средства (что оценено по AUC0-τ, т.е. AUC в течение интервала между приемами лекарственного средства), и таким образом, считают, что он в основном обеспечивает фармакологическое действие после приема эсликарбазепина ацетата. Систематически обнаруживали, что концентрации исходного лекарственного средства (эсликарбазепина ацетат) в плазме крови были ниже предела количественного определения. При многократном введении доз равновесные концентрации в плазме крови были достигнуты на 4-5 день применения лекарственного средства в обеих группах, соответствуя эффективному периоду полужизни порядка около 20-24 час.
Кинетический профиль эсликарбазепина в группе, принимавшей лекарственное средство один раз в день, существенно отличался от такового в группе, принимавшей лекарственное средство два раза в день, со статистическими расхождениями, выявленными для некоторых из оцененных фармакокинетических параметров (Cmax AUC0-τ и AUC0-∞), после многократного перорального применения эсликарбазепина ацетата. Фактически, общее воздействие эсликарбазепина на организм здоровых добровольцев из группы, принимавшей лекарственное средство один раз в день, неожиданно было, по меньшей мере, на 26% больше, чем в группе, принимавшей лекарственное средство два раза в день. Этот неожиданный результат находится в соответствии с найденным у больных эпилепсией, что применение эсликарбазепина ацетата один раз в день было более эффективно, чем применение такой же общей суточной дозы, разделенной на два приема в день. Хотя этот результат может означать, что повышенная клиническая эффективность может быть результатом увеличения количества (Cmax) и продолжительности (AUC) воздействия эсликарбазепина, причины такой увеличенной степени воздействия после применения один раз в день по сравнению с применением два раза в день, остаются необъясненными.
В дополнение к иллюстративным вариантам осуществления, описанным выше, дополнительные аспекты и варианты осуществления будут очевидны специалисту в уровне техники в результате изучения предшествующего описания. Специалисту в уровне техники будет понятно, что возможны некоторые модификации вышеописанного описания, и такие модификации находятся в диапазоне указанного изобретения. Вследствие этого имеется в виду, что следующая прилагаемая формула изобретения (в том числе любые ее исправления) и любые пункты, введенные впоследствии, должны быть интерпретированы таким образом, чтобы включать все таковые аспекты, варианты осуществления и модификации.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭСЛИКАРБАЗЕПИНА | 2008 |
|
RU2488397C2 |
| ЛЕЧЕНИЕ С ИСПОЛЬЗОВАНИЕМ АЦЕТАТА ЭСЛИКАРБАЗЕПИНА ИЛИ ЭСЛИКАРБАЗЕПИНА | 2012 |
|
RU2639120C2 |
| РАСТВОРИМЫЕ ДОЗИРОВАННЫЕ ФОРМЫ, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ЦЕФЕМА, ПРИЕМЛЕМЫЕ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ | 2008 |
|
RU2537237C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ДГЛК, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2714323C2 |
| МОДУЛЯТОРЫ АКТИВНОСТИ КОМПЛЕМЕНТА | 2016 |
|
RU2733720C2 |
| МОДУЛЯТОРЫ АКТИВНОСТИ КОМПЛЕМЕНТА | 2016 |
|
RU2769701C2 |
| Фармацевтическая композиция пролонгированного действия на основе 5-этокси-2-[2-(морфолино)-этилтио] бензимидазола дигидрохлорида и/или основания (Афобазола) | 2017 |
|
RU2694837C2 |
| ПРОЛЕКАРСТВА АМФЕТАМИНОВ С ЗАЩИТОЙ ОТ НЕПРАВИЛЬНОГО УПОТРЕБЛЕНИЯ | 2006 |
|
RU2445085C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ОТ HELICOBACTER PYLORI | 2014 |
|
RU2671400C2 |
| ТАКРОЛИМУС ДЛЯ УЛУЧШЕННОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ С ТРАНСПЛАНТАТАМИ | 2009 |
|
RU2574006C2 |
Предложено применение эсликарбазепина ацетата для изготовления фармацевтической композиции для лечения эпилепсии, включающей фармакологически эффективное количество эсликарбазепина ацетата, где указанная фармацевтическая композиция предназначена для введения один раз в день (и соответствующий способ лечения эпилепсии), а также применение эсликарбазепина ацетата для изготовления фармацевтической композиции, содержащей фармакологически эффективное количество эсликарбазепина ацетата для повышения воздействия эсликарбазепина на пациента, страдающего эпилепсией, где указанная фармацевтическая композиция предназначена для применения один раз в день (и соответствующий способ лечения). Показано уменьшение или ослабление эпилептических припадков у пациента в результате применения эсликарбазепина ацетата заявленным способом, а эффективность его приема 1 раз в день выше применения такой же общей дозы, разделенной на два приема (возможно, вследствие периода его полуэлиминации около 20-24 час). 4 н. и 46 з.п. ф-лы, 2 ил., 5 табл.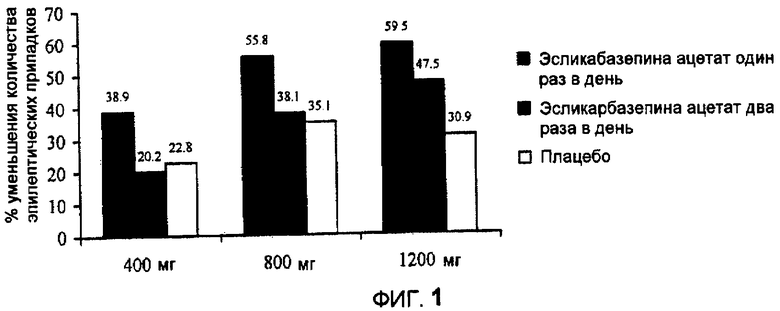
1. Применение эсликарбазепина ацетата для изготовления фармацевтической композиции для лечения эпилепсии, включающей фармакологически эффективное количество эсликарбазепина ацетата, где указанная фармацевтическая композиция предназначена для введения один раз в день.
2. Применение по п.1, где фармакологически приемлемое количество составляет 400 мг.
3. Применение по п.1, где фармакологически приемлемое количество составляет 800 мг.
4. Применение по п.1, где фармакологически приемлемое количество составляет 1200 мг.
5. Применение по п.1, где фармакологически эффективное количество вводят в количестве, обеспечивающем максимально наблюдаемую в плазме крови концентрацию Сmах эсликарбазепина более чем приблизительно 7400 нг/мл.
6. Применение по п.5, где фармакологически приемлемое количество вводят в количестве, обеспечивающем Сmах эсликарбазепина более чем приблизительно 12000 нг/мл.
7. Применение по п.1, где фармакологически приемлемое количество вводят в количестве, обеспечивающем площадь под кривой изменения концентрации AUC0-τ эсликарбазепина более чем приблизительно 111000 нг·ч/мл, где τ представляет собой интервал между приемами лекарственного средства.
8. Применение по п.7, где фармакологически приемлемое количество вводят в количестве, обеспечивающем AUC0-τ эсликарбазепина более чем приблизительно 140000 нг·ч/мл.
9. Применение по любому из предшествующих пунктов, где активный ингредиент в фармацевтической композиции по существу состоит из эсликарбазепина ацетата.
10. Применение по любому из пп.1-8, где фармацевтическая композиция изготовлена для орального введения.
11. Применение по любому из пп.1-8, где фармацевтическая композиция представлена в форме таблетки.
12. Применение по любому из пп.1-8, где фармацевтическая композиция представлена в форме суспензии для орального введения.
13. Применение по п.12, где фармацевтическая композиция включает, по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель.
14. Применение по п.13, где по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель выбирают из ксантановой камеди, макрогола стеарата, метилпарабена, пропилпарабена, сахарина натрия, сорбита, буферных растворов, ароматизирующих веществ и их комбинаций.
15. Применение по любому из пп.1-8, где фармацевтическая композиция включает дополнительно, по меньшей мере, одно противоэпилептическое лекарственное средство.
16. Применение по любому из пп.13-14, где фармацевтическая композиция включает дополнительно, по меньшей мере, одно противоэпилептическое лекарственное средство.
17. Применение по п.15, где, по меньшей мере, одно противоэпилептическое лекарственное средство выбрано из вальпроата, ламотригина, топирамата и их комбинаций.
18. Применение по п.16, где, по меньшей мере, одно противоэпилептическое лекарственное средство выбрано из вальпроата, ламотригина, топирамата и их комбинаций.
19. Применение эсликарбазепина ацетата для изготовления фармацевтической композиции, содержащей фармакологически эффективное количество эсликарбазепина ацетата для повышения воздействия эсликарбазепина на пациента, страдающего эпилепсией, где указанная фармацевтическая композиция предназначена для применения один раз в день.
20. Применение по п.19, где фармакологически приемлемое количество составляет 400 мг.
21. Применение по п.19, где фармакологически приемлемое количество составляет 800 мг.
22. Применение по п.19, где фармакологически приемлемое количество составляет 1200 мг.
23. Применение по любому из пп.19-22, где активный ингредиент в фармацевтической композиции по существу состоит из эсликарбазепина ацетата.
24. Применение по любому из пп.19-22, где указанное фармакологически приемлемое количество вводят в количестве, обеспечивающем максимально наблюдаемую в плазме крови концентрацию Сmах эсликарбазепина более чем приблизительно 7400 нг/мл.
25. Применение по любому из пп.19-22, где указанное фармакологически приемлемое количество вводят в количестве, обеспечивающем площадь под кривой изменения концентрации AUC0-τ эсликарбазепина более чем приблизительно 111000 нг·ч/мл, где τ представляет собой интервал между приемами лекарственного средства.
26. Применение по любому из пп.19-22, где фармацевтическая композиция изготовлена для орального введения.
27. Применение по любому из пп.19-22, где фармацевтическая композиция представлена в форме таблетки.
28. Применение по любому из пп.19-22, где фармацевтическая композиция представлена в форме суспензии для орального введения.
29. Применение по п.28, где фармацевтическая композиция включает, по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель.
30. Применение по п.29, где по меньшей мере, один наполнитель, вспомогательное вещество и/или носитель выбирают из ксантановой камеди, макрогола стеарата, метилпарабена, пропилпарабена, сахарина натрия, сорбита, буферных растворов, ароматизирующих веществ и их комбинаций.
31. Применение по любому из пп.19-22, где фармацевтическая композиция включает дополнительно, по меньшей мере, одно противоэпилептическое лекарственное средство.
32. Применение по п.30, где фармацевтическая композиция включает дополнительно, по меньшей мере, одно противоэпилептическое лекарственное средство.
33. Применение по п.31, где по меньшей мере, одно противоэпилептическое лекарственное средство выбрано из вальпроата, ламотригина, топирамата и их комбинаций.
34. Применение по п.32, где по меньшей мере, одно противоэпилептическое лекарственное средство выбрано из вальпроата, ламотригина, топирамата и их комбинаций.
35. Способ лечения эпилепсии, включающий введение пациенту один раз в сутки фармакологически эффективного количества фармацевтической композиции, содержащей эффективную дозу эсликарбазепина ацетата.
36. Способ по п.35, где фармакологически эффективное количество составляет 400 мг.
37. Способ по п.35, где фармакологически эффективное количество составляет 800 мг.
38. Способ по п.35, где фармакологически эффективное количество составляет 1200 мг.
39. Способ по п.35, где фармакологически эффективное количество вводят в количестве, обеспечивающем максимально наблюдаемую в плазме крови концентрацию Сmаx эсликарбазепина более чем приблизительно 7400 нг/мл.
40. Способ по п.39, где фармакологически эффективное количество вводят в количестве, обеспечивающем Сmах эсликарбазепина более чем приблизительно 12000 нг/мл.
41. Способ по п.35, где фармакологически эффективное количество вводят в количестве, обеспечивающем площадь под кривой изменения концентрации AUC0-τ эсликарбазепина более чем приблизительно 111000 нг·ч/мл, где τ представляет собой интервал между приемами лекарственного средства.
42. Способ по п.41, где указанное фармакологически эффективное количество вводят в количестве, обеспечивающем площадь под кривой изменения концентрации AUC0-τ эсликарбазепина более чем приблизительно 140000 нг·ч/мл.
43. Способ по любому из пп.35-42, где активный ингредиент фармацевтической композиции состоит по существу из эсликарбазепина ацетата.
44. Способ повышения воздействия эсликарбазепина у пациента, страдающего эпилепсией, включающий введение пациенту один раз в день фармакологически эффективного количества фармацевтической композиции, содержащей эффективную дозу эсликарбазепина ацетата.
45. Способ по п.44, где фармакологически эффективное количество составляет 400 мг.
46. Способ по п.44, где фармакологически эффективное количество составляет 800 мг.
47. Способ по п.44, где фармакологически эффективное количество составляет 1200 мг.
48. Способ по любому из пп.44-47, где указанный активный ингредиент фармацевтической композиции состоит по существу из эсликарбазепина ацетата.
49. Способ по любому из пп.44-47, где фармакологически эффективное количество вводят в количестве, обеспечивающем максимально наблюдаемую в плазме крови концентрацию Сmах эсликарбазепина более чем приблизительно 7400 нг/мл.
50. Способ по любому из пп.44-47, где фармакологически эффективное количество вводят в количестве, обеспечивающем площадь под кривой изменения концентрации AUC0-τ эсликарбазепина более чем приблизительно 111000 нг·ч/мл, где τ представляет собой интервал между приемами лекарственного средства.
| US5753646 А, 19.05.1998 | |||
| Реферат базы данных PubMed: ALMEIDA L | |||
| et al | |||
| Safety, tolerability and pharmacokinetic profile of BIA 2-093, a novel putative antiepileptic, in a rising multiple-dose study in young healthy humans | |||
| J | |||
| Clin | |||
| Pharmacol | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Реферат базы данных PubMed: ALMEIDA | |||
Авторы
Даты
2011-04-27—Публикация
2005-05-06—Подача