Эта заявка заявляет приоритет временной заявки США №60/974,194, поданной 21 сентября 2007, полное содержание которой введено в данную заявку в качестве ссылки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым дозированным формам соединений цефема, полезным для лечения бактериальных инфекций. Дозированные формы стабильны, демонстрируют улучшенную растворимость и являются особенно приемлемыми, например, для парентерального введения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Патент США №6,417,175 раскрывает производные фосфоноцефема, обладающие отличной антибактериальной активностью в отношении широкого спектра грамположительных и грамотрицательных бактерий. Эти соединения имеют общую формулу:
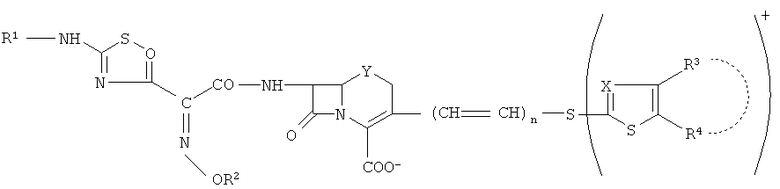
где R1-R4, Q, X, Y и n являются такими, как определено в данном патенте. Одно из таких соединений представляет собой 7β-[2(Z)-этоксиимино-2-(5-фосфоноамино-1,2,4-тиадиазол-3-ил)ацетамидо]-3-[4-(1-метил-4-пиридинио)-2-тиазолитио]-3-цефем-4-карбоксилат. Патент США №6,417,175 раскрывает способы получения этого соединения (смотри, например, Примеры 1, 2, 5 и 6), и в общем раскрывает композиции соединений, описанных в данном патенте.
Патент США №6,906,055 раскрывает соединения формулы:
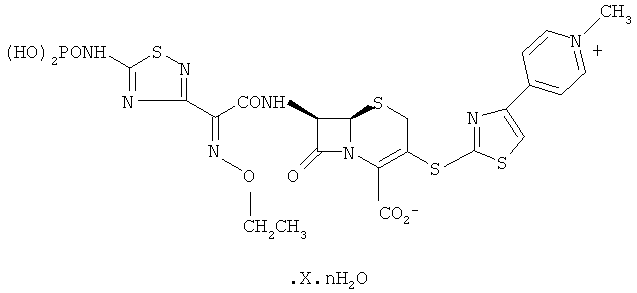
в которой X представляет собой CH3COOH, CH3CH2COOH или CH3CN, и n равно 0-5. Одно из таких соединений (в котором X представляет собой CH3COOH, а n равно 1) представляет собой (6R,7R)-7-[[2(Z)-этоксиимино-[5-(фосфоноамино)-1,2,4-тиадиазол-3-ил] ацетил]амино]-3-[[4-(1-метилпиридиний-4-ил)тиазол-2-ил]сульфанил]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоксилат моноацетат моногидрат, который также является известным как пиридиний, 4-[2-[[(6R,7R)-2-карбокси-7-[[2(Z)-этоксиимино-[5-(фосфоноамино)-1,2,4-тиадиазол-3-ил]ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]тио-4-тиазолил]-1-метил-, внутренняя соль, моноацетат, моногидрат (молекулярная формула C22H21N8O8PS4. C2H4O2. H2O, молекулярный вес 762,75). Наименование препарата по Справочнику национальных непатентованных названий США для этого соединения представляет собой цефтаролин фозамил.
Предложенное международное непатентованное название (WHO Drug Information, том 21, №2, 2007) цефтаролин фозамил относится к следующему соединению: 4-[2-[[(6R,7R)-2-карбокси-7-[[2(Z)-этоксиимино-[5-(фосфоноамино)-1,2,4-тиадиазол-3-ил]ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]тио-4-тиазолил]-1-метил-, внутрення соль. INN название цефтаролина фозамила относится к цефтаролину фозамилу, скорректированному на безводную, свободную от ацетата основу (молекулярная формула C22H21N8O8PS4, молекулярный вес 684,68)
При парентеральном введении (таком, как внутривенное, внутримышечное или подкожное введение), пролекарственные средства, такие, как 7β-[2(г)-этоксиимино-2-(5-фосфоноамино-1,2,4-тиадиазол-3 -ил)ацетамидо]-3-[4-(1-метил-4-пиридинио)-2-тиазолитио]-3-цефем-4-карбоксилат и цефтаролин фозамил (USAN и INN), превращаются с помощью жидкостей организма в активный антибактериальный остаток цефтаролина (молекулярная формула C22H22N8O5S4, молекулярный вес 604,71)
Антибактериальные соединения могут вводиться несколькими путями, включая парентеральный, например, с помощью внутривенных (ВВ) болюсов, ВВ инфузии и путем внутримышечной (ВМ) инъекции. Адсорбция лекарственного средства зависит от его биодоступности. Лекарственные средства, которые вводятся внутривенно, непосредственно поступают в системную циркуляцию и типично предполагаются как такие, которые являются на 100% биодоступными. Однако лекарственные средства, которые вводятся внутримышечно, могут проходить через одну или более биологических мембран для того, чтобы достичь системной циркуляции. Является желательным, чтобы все парентеральные дозированные формы обладали одинаковой биодоступностью (то есть, такой же площадью под кривой (AUC)) для всех парентеральных дозированных форм. Однако фармакокинетические профили для ВВ и ВМ композиций могут отличаться, и получение желаемых значений биодоступности (то есть, AUC) после внутримышечного введения является сложным. Например, перфузия (поток крови на 1 грамм ткани) в значительной мере влияет на капиллярную адсорбцию малых молекул при внутримышечном введении. Таким образом, сайт адсорбции может влиять на скорость адсорбции. Кроме того, адсорбция лекарственного средства после ВМ введения может быть отсроченной или неправильной для солей слаборастворимых оснований и кислот. В дополнение к этому, ВМ композиции или дозированная форма должны обладать достаточной растворимостью для того, чтобы обладать способностью к доставке требуемой дозы в малом инъекционном объеме с минимальным местным раздражением. Эти ограничения должны успешно преодолеваться при разработке композиции для ВМ введения. ВМ введение является необходимым в ряде случаев, например, на пунктах первой медицинской помощи и в интернатах для престарелых, где инфузия не является целесообразной.
Кроме того, для лекарственных средств с коротким периодом полураспада введение ВВ болюсов типично приводит к быстрому выведению лекарственного средства из системы пациента. Быстрая ВВ инфузия дозированной формы может быть желательной в некоторых случаях. Однако дозированная форма должна быть стабильной и совместимой с ВВ жидкостью (например, представлять собой 0,9% раствор хлорида натрия или 5% раствор сахара) для осуществления курса лечения. Таким образом, существует также потребность в разработке дозированных форм, обладающих улучшенной растворимостью, для применения при ВВ введении, когда введение больших объемов инфузионного раствора не является желательным, например, при ВВ введении младенцам, детям и пожилым людям.
В соответствии с этим все еще остается потребность в получении новых дозированных форм, содержащих соединения цефема, которые являются стабильными, биодоступными и демонстрируют приемлемые фармакокинетические параметры при введении, например, парентерально.
Заявителями были разработаны дозированные формы, содержащие соединения цефема, такого, как цефтаролин фозамил, обладающие повышенной растворимостью, которая является приемлемой для парентерального, например, ВВ и ВМ введений. Дозированные формы являются стабильными и демонстрируют отличные фармакокинетические параметры при введении, например, внутримышечно или внутривенно.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым дозированным формам соединений цефема, в которых активный агент обладает повышенной растворимостью. Дозированные формы являются особенно приемлемыми для парентерального (например, внутривенного и внутримышечного) введения.
В одном воплощении описываются дозированные формы, содержащие цефтаролин или его фармацевтически приемлемую соль и/или сольват, и/или пролекарственную форму и солюбилизирующий агент, где молярность солюбилизирующего агента в водном растворе дозированной формы является большей чем приблизительно 0,1 М.
В дополнительных воплощениях описываются дозированные формы, содержащие цефтаролин или его фармацевтически приемлемую соль и/или сольват, и/или пролекарственную форму, в которой активный агент обладает растворимостью, большей чем приблизительно 40 мг/мл.
В некоторых воплощениях дозированная форма включает пролекарственную форму цефтаролина, например, цефтаролин фозамил.
В дополнительных воплощениях описываются дозированные формы, содержащие от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, где единичная доза парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл.
В дополнительных воплощениях описываются дозированные формы, содержащие от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, где единичная доза ВВ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, и средним значением Cmax менее чем приблизительно 39500 нг/мл.
В дополнительных воплощениях описываются дозированные формы, содержащие от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, где единичная доза ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, средним значением Cmax менее чем приблизительно 39500 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
Описываются способы лечения при использовании растворимых дозированных форм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым дозированным формам соединений цефема, которые стабильны, демонстрируют улучшенную растворимость, и являются особенно приемлемыми для, например, парентерального (например, ВВ, ВМ) введения.
Цефтаролин представляет собой активное антибактериальное соединение, полезное для лечения широкого спектра грамположительных и грамотрицательных бактерий. Однако растворимость в воде цефтаролина ограничена (~2-3 мг/мл) и является, таким образом, слишком низкой для того, чтобы позволить непосредственное применение цефтаролина в композициях для парентерального введения. Например, максимальная дозировка цефтаролина, которая может быть введена из объема 100 мл пакета для ВВ инфузии, составляет только приблизительно 200-300 мг.
Цефтаролин фозамил, пролекарственная форма цефтаролина обладает более высокой растворимостью в воде (приблизительно 36 мг/мл). Несмотря на то, что растворимость пролекарственной формы является большей чем для активного остатка цефтаролина, растворимость в воде цефтаролина фозамила все же является недостаточной для того, чтобы позволить цефтаролину фозамилу использоваться непосредственно для ВМ введения, где вводимые объемы типично составляют 5 мл или менее на сайт введения. Например, максимальная дозировка цефтаролина фозамила, которая может вводиться внутримышечно при использовании 5 мл раствора, составляет только приблизительно 180 мг на сайт введения.
Заявители обнаружили, что могут быть получены высокорастворимые дозированные формы, содержащие соединения цефема, такого, как цефтаролин фозамил. Растворимые дозированные формы являются, таким образом, полезными для парентерального (как ВВ, так и ВМ) введения и позволяют вводить более высокие дозы активного ингредиента при использовании меньших объемов раствора. Дозированные формы включают соединение цефема, например, цефтаролин или его фармацевтически приемлемую соль и/или сольват, и/или пролекарственную форму в качестве активного агента и солюбилизирующий агент, где солюбилизирующий агент присутствует при молярности такой, что растворимость активного агента повышается. Например, растворимость активного агента повышается по сравнению с соответствующей дозированной формой, которая не содержит солюбилизирующего агента.
В одном аспекте настоящее изобретение относится к дозированным формам, содержащим цефтаролин или его фармацевтически приемлемую соль, и/или сольват, и/или пролекарственную форму (например, цефтаролин фозамил) и солюбилизирующий агент, где солюбилизирующий агент является присутствующим при молярности, большей чем приблизительно 0,1 М.
В дополнительных воплощениях солюбилизирующий агент является присутствующим при молярности, большей чем приблизительно 0,2 М, большей чем приблизительно 0,3 М, большей чем приблизительно 0,4 М, большей чем приблизительно 0,5 М, большей чем приблизительно 0,6 М, большей чем приблизительно 0,7 М, большей чем приблизительно 0,8 М, большей чем приблизительно 0,9 М, большей чем приблизительно 1,0 М, большей чем приблизительно 1,1 М, большей чем приблизительно 1,2 М, большей чем приблизительно 1,3 М, большей чем приблизительно 1,4 М, большей чем приблизительно 1,5 М, большей чем приблизительно 1,75 М, большей чем приблизительно 2,0 М, большей чем приблизительно 2,3 М или большей чем приблизительно 2,5 М.
В дополнительных воплощениях солюбилизирующий агент является присутсвующим при молярности приблизительно 0,5 М, приблизительно 0,6 М, приблизительно 0,7 М, приблизительно 0,8 М, приблизительно 0,9 М, приблизительно 1,0 М, приблизительно 1,1 М, приблизительно 1,2 М, приблизительно 1,3 М, приблизительно 1,4 М, приблизительно 1,5 М, приблизительно 1,6 М, приблизительно 1,7 М, приблизительно 1,8 М, приблизительно 1,9 М, приблизительно 2,0 М, приблизительно 2,3 М или приблизительно 2,5 М. Например, солюбилизирующий агент является присутствующим при молярности приблизительно 0,5 М, приблизительно 1,0 М, приблизительно 1,5 М, приблизительно 2,0 М или приблизительно 2,3 М.
Приемлемые солюбилизирующие агенты включают, но не ограничены, кислоты, такие, как карбоновые кислоты, аминокислоты. Например, солюбилизирующий агент может быть выбран из насыщенных карбоновых кислот, ненасыщенных карбоновых кислот, жирных кислот, кетокислот, ароматических карбоновых кислот, дикарбоновых кислот, трикарбоновых кислот, α-гидроксикислот, аминокислот и их комбинаций.
Специфические солюбилизирующие агенты, которые могут использоваться, включают, но не ограничены, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту, капроновую кислоту, энантовую кислоту, каприловую кислоту, пеларгоновую кислоту, каприновую кислоту, лауриновую кислоту, стеариновую кислоту, акриловую кислоту, докозагексаеновую кислоту, эйкозапентаеновую кислоту, пировиноградную кислоту, бензойную кислоту, салициловую кислоту, альдаровую кислоту, щавелевую кислоту, малоновую кислоту, яблочную кислоту, янтарную кислоту, глутаровую кислоту, адипиновую кислоту, лимонную кислоту, молочную кислоту, аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пралин, серин, треонин, триптофан, тирозин, валин и их комбинации (включая их соли и/или индивидуальные стереоизомеры, и/или смеси их стереоизомеров).
В некоторых воплощениях солюбилизирующий агент является выбранным из уксусной кислоты, ее солей и их комбинаций, (например, уксусная кислота/ацетат натрия), лимонной кислоты, ее солей и их комбинаций (например, лимонная кислота/цитрат натрия), DL аргинина, L-аргинина и гистидина. В одном воплощении солюбилизирующий агент представляет собой DL-аргинин. В одном воплощении солюбилизирующий агент представляет собой L-аргинин. В одном воплощении солюбилизирующий агент представляет собой уксусную кислоту/ацетат натрия. В одном воплощении солюбилизирующий агент представляет собой лимонную кислоту/цитрат натрия.
В дополнительных воплощениях растворимость активного агента в дозированной форме является большей чем приблизительно 40 мг/мл, такой, как большей чем приблизительно 50 мг/мл, большей чем приблизительно 75 мг/мл, большей чем приблизительно 100 мг/мл, большей чем приблизительно 125 мг/мл, большей чем приблизительно 150 мг/мл, большей чем приблизительно 175 мг/мл, большей чем приблизительно 200 мг/мл или большей чем приблизительно 250 мг/мл, при измерении, например, в воде при 25°С.
В дополнительных воплощениях растворимость активного агента в дозированной форме составляет от приблизительно 100 до приблизительно 250 мг/мл, от приблизительно 150 до приблизительно 250 мг/мл, от приблизительно 180 до приблизительно 200 мг/мл или от приблизительно 200 до приблизительно 250 мг/мл, при измерении, например, в воде при 25°С.
В некоторых воплощениях дозированная форма включает пролекарственную форму цефтаролина, например цефтаролин фозамил. Примеры приемлемых дозированных форм представлены в Таблицах 1-4.
а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина
а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина
а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина
а Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 530 мг цефтаролина
Дозированные формы могут быть получены, например, путем смешивания пролекарственной формы активного агента (например, цефтаролина фозамила) и солюбилизирующего агента (например, DL аргинина, L-аргинина, лимонной кислоты/цитрата натрия, уксусной кислоты/ацетата натрия) в устройстве для смешивания в условиях стерильности до получения однородной смеси. Предварительно простерилизованные флаконы могут потом заполняться приемлемым количеством стерильной смеси. Предварительно определенное количество стерильной смеси может потом смешиваться с растворителем, например, водой, физиологическим раствором, сахарным раствором в концентрации приблизительно 5-10% (например, раствором глюкозы, декстрозы) и их комбинацией перед введением. В дополнение к этому, раствор может замораживаться и оттаиваться перед дополнительной обработкой.
Солюбилизирующий агент может использоваться в твердой форме или в форме раствора. Если используется твердая форма, то солюбилизирующий агент и пролекарственная форма активного ингредиента (например, цефтаролин фозамил) могут смешиваться вместе так, как описано выше, после чего растворитель прибавляется перед парентеральным введением. Если используется форма раствора, то пролекарственная форма активного ингредиента (например, цефтаролин фозамил) может смешиваться с раствором солюбилизирующего агента перед осуществлением парентерального введения.
В дополнительных воплощениях дозированная форма включает от приблизительно 177 до приблизительно 2005 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы, например, от приблизительно 177 мг до приблизительно 1337 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы, например, от приблизительно 353 до приблизительно 891 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы, для дополнительного примера, от приблизительно 353 мг до приблизительно 668 мг цефтаролина или его фармацевтически приемлемой соли, и/или сольвата, и/или пролекарственной формы.
В дополнительных воплощениях дозированная форма включает от приблизительно 223 до приблизительно 2005 мг цефтаролина фозамила, например, от приблизительно 223 мг до приблизительно 1337 мг цефтаролина фозамила, например, от приблизительно 446 до приблизительно 891 мг цефтаролина фозамила, для дополнительного примера, от приблизительно 446 мг до приблизительно 668 мг цефтаролина фозамила. Например, цефтаролина фозамила (USAN) (молекулярная формула С22H21N8O8PaS4. C2H4O2. H2O, молекулярный вес 762,75).
В одном воплощении дозированная форма содержит приблизительно 223 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 446 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 557 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 668 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 891 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1114 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1337 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 2005 мг цефтаролина фозамила. Например, цефтаролина фозамила (USAN) (молекулярная формула C22H21N8O8PS4. C2H4O2. H2O, молекулярный вес 762,75).
В одном воплощении дозированная форма содержит приблизительно 200 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 400 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 500 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 600 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 800 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1000 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1200 мг цефтаролина фозамила. В одном воплощении дозированная форма содержит приблизительно 1800 мг цефтаролина фозамила. Например, цефтаролина фозамила (INN) (в пересчете на безводную, свободную от ацетата основу, молекулярная формула C22H21N8O8PS4, молекулярный вес 684,68).
В дополнительных воплощениях дозированная форма включает от приблизительно 177 до приблизительно 1589 мг цефтаролина, например, от приблизительно 177 мг до приблизительно 1060 мг цефтаролина, например, от приблизительно 353 до приблизительно 706 мг цефтаролина, для дополнительного примера, от приблизительно 353 мг до приблизительно 618 мг цефтаролина, для дополнительного примера, от приблизительно 353 мг до приблизительно 530 мг цефтаролина. В дополнительных воплощениях дозированная форма содержит приблизительно 177 мг цефтаролина, приблизительно 353 мг цефтаролина, приблизительно 442 мг цефтаролина, приблизительно 530 мг цефтаролина, приблизительно 618 мг цефтаролина, приблизительно 706 мг цефтаролина, приблизительно 883 мг цефтаролина, приблизительно 1060 мг цефтаролина или приблизительно 1589 мг цефтаролина. Например, цефтаролина, молекулярная формула C22H22N8O5S4, молекулярный вес 604,71.
В одном воплощении дозированная форма содержит приблизительно 668 мг цефтаролина фозамила (USAN). В одном воплощении дозированная форма содержит приблизительно 600 мг цефтаролина фозамила (INN).
В одном воплощении дозированная форма содержит приблизительно 446 мг цефтаролина фозамила (USAN). В одном воплощении дозированная форма содержит приблизительно 400 мг цефтаролина фозамила (INN).
В одном воплощении дозированная форма содержит приблизительно 530 мг цефтаролина.
В дополнительных воплощениях дозированная форма содержит приблизительно 353 мг цефтаролина.
В клиническом исследовании противоинфекционных лекарственных средств выбор дозы, режим дозирования, длительность терапии будут принимать во внимание биофармацевтические, фармакокинетические и фармакодинамические свойства противоинфекционного лекарственного средства/лекарственного продукта. Смотри, например, "Developing Antimicrobial Drugs - General Considerations for Clinical Trials," U.S. Department of Health и Human Services, Food и Drug Administration, Draft Guidance for Industry, July 1998.
Фармакодинамика может устанавливать связь между дозой противоинфекционного лекарственного средства и его противомикробной активностью. Сочетанная фармакокинетическая/фармакодинамическая (PK/PD) оценка включает соотнесение концентраций лекарственного средства в плазме крови с in-vitro чувствительностью микроорганизмов-мишеней и/или клиническими исходами. Обычно концентрации лекарственного средства в плазме крови являются связанными с минимальной ингибиторной концентрацией (MIC). Кроме того, профиль концентрация лекарственного средства-время может быть преобразован для получения единого измерения воздействия (например, площадь под кривой (AUC) или время выше минимальной ингибиторной концентрации (T>MIC)) и связываться с микробиологическим и/или клиническим выходом для определения оптимального режима дозирования. Выбор фармакодинамической переменной (например, AUC/MIC, пик концентрации в плазме крови (Cmax)/MIC, T>MIC) зависит от механизмов антимикробного эффекта.
AUC представляет собой меру общего воздействия антибиотического лекарственного средства на систему циркуляции в течение периода времени. Концентрация антибиотического средства в сыворотке и период времени, в течение которого концентрация антибиотического средства является выше MIC, считаются фармакокинетическими свойствами противомикробного средства. Продукт этих двух факторов представляется площадью под кривой концентрация в сыворотке крови-время (AUC). Таким образом, уничтожение бактерий представляет собой функцию AUC.
Для разработки антимикробного лекарственного средства дозированные формы, приемлемые для парентерального (например, ВМ) введения, должны иметь значения AUC, наблюдаемые после ВМ введения дозированной формы, подобные значениям AUC, которые наблюдаются для лекарственного средства, когда дозированная форма вводится внутривенно. Кроме того, должен быть соблюден приемлемый MIC критерий, для того, чтобы ВМ введение лекарственного средства было эффективным.
При парентеральном введении дозированные формы, описанные в данной заявке, обеспечивают следующие фармакокинетические параметры.
При внутримышечном введении наблюдается время максимальной концентрации в плазме крови (Tmax) для цефтаролина (активный остаток) у пациентов, представляющих собой людей, приблизительно 1 или более часов (например, приблизительно 1,5 или более часов). В дополнительных воплощениях наблюдают значение Tmax цефтаролина (активный остаток) у пациентов, представляющих собой людей, которое колеблется от приблизительно 1 до приблизительно 4 часов, например, от приблизительно 1 до приблизительно 3 часов, например, от приблизительно 1,5 до приблизительно 2 часов. В других воплощениях наблюдается значение Tmax для цефтаролина фозамила (пролекарственное средство) у пациентов, представляющих собой людей, приблизительно 0,05 или более часов. Время максимальной концентрации в плазме крови измеряется после окончания инфузии.
(a) В одном аспекте настоящее изобретение относится к дозированной форме, содержащей от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл.
(b) В одном воплощении дозированная форма включает от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 39500 нг/мл.
(c) В другом воплощении дозированная форма включает от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, и средним значением Cmax менее чем приблизительно 39500 нг/мл.
(d) В дополнительном воплощении дозированная форма включает от приблизительно 223 мг до приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, средним значением Cmax менее чем приблизительно 39500 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(e) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл.
(f) В одном воплощении дозированная форма включает приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 4900 нг/мл.
(g) В другом воплощении дозированная форма включает приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза длят ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, и средним значением Cmax менее чем приблизительно 4900 нг/мл.
(h) В дополнительном воплощении дозированная форма включает приблизительно 223 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 10650 нг час/мл, средним значением Cmax менее чем приблизительно 4900 нг/мл, и средним значением Тmax приблизительно 1 или более часов.
(i) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 21350 нг час/мл.
(j) В одном воплощении дозированная форма включает приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 9800 нг/мл.
(k) В другом воплощении дозированная форма включает приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 21350 нг час/мл, средним значением Cmax менее чем приблизительно 9800 нг/мл.
(l) В дополнительном воплощении дозированная форма включает приблизительно 446 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 21350 нг час/мл, средним значением Cmax менее чем приблизительно 9800 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(m) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 25800 нг час/мл.
(n) В одном воплощении дозированная форма включает приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 11100 нг/мл.
(o) В другом воплощении дозированная форма включает приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 25800 нг час/мл, и средним значением Cmax менее чем приблизительно 11100 нг/мл.
(p) В дополнительном воплощении дозированная форма включает приблизительно 557 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 25800 нг час/мл, средним значением Cmax менее чем приблизительно 11100 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(q) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 28800 нг час/мл.
(r) В одном воплощении дозированная форма включает приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 12000 нг/мл.
(s) В другом воплощении дозированная форма включает приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 28800 нг час/мл, и средним значением Cmax менее чем приблизительно 12000 нг/мл.
(t) В дополнительном воплощении дозированная форма включает приблизительно 668 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 28800 нг час/мл, средним значением Cmax менее чем приблизительно 12000 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(u) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 891 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 49000 нг час/мл.
(v) В одном воплощении дозированная форма включает приблизительно 891 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 17750 нг/мл.
(w) В другом воплощении дозированная форма включает приблизительно 891 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 49000 нг час/мл и средним значением Cmax менее чем приблизительно 17750 нг/мл.
(x) В дополнительном воплощении дозированная форма включает приблизительно 891 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 49000 нг час/мл, средним значением Cmax менее чем приблизительно 17750 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(y) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 1114 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 66000 нг час/мл.
(z) В одном воплощении дозированная форма включает приблизительно 1114 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 22500 нг/мл.
(aa) В другом воплощении дозированная форма включает приблизительно 1114 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 66000 нг час/мл, и средним значением Cmax менее чем приблизительно 22500 нг/мл.
(bb) В дополнительном воплощении дозированная форма включает приблизительно 1114 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 66000 нг час/мл, средним значением Cmax менее чем приблизительно 22500 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(cc) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 1337 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 79500 нг час/мл.
(dd) В одном воплощении дозированная форма включает приблизительно 1337 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 26500 нг/мл.
(ee) В другом воплощении дозированная форма включает приблизительно 1337 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 79500 нг час/мл, и средним значением Cmax менее чем приблизительно 26500 нг/мл.
(ff) В дополнительном воплощении дозированная форма включает приблизительно 1337 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 79500 нг час/мл, средним значением Cmax менее чем приблизительно 26500 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
(gg) В другом аспекте настоящее изобретение относится к дозированной форме, содержащей приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для парентерального введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 126000 нг час/мл.
(hh) В одном воплощении дозированная форма включает приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением Cmax менее чем приблизительно 39500 нг/мл.
(ii) В другом воплощении дозированная форма включает приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза длят ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 126000 нг час/мл и средним значением Cmax менее чем приблизительно 39500 нг/мл.
(jj) В дополнительном воплощении дозированная форма включает приблизительно 2005 мг цефтаролина фозамила (USAN), где единичная доза для ВМ введения дозированной формы обеспечивает получение in vivo профиля в плазме крови для цефтаролина, характеризующегося средним значением AUC0-∞ более чем приблизительно 126000 нг час/мл, средним значением Cmax менее чем приблизительно 39500 нг/мл, и средним значением Tmax приблизительно 1 или более часов.
В дополнительных воплощениях дозированная форма любого из воплощений, описанных выше (например, воплощений aa-jj), может включать соответствующее количество цефтаролина фозамила (INN) или цефтаролина.
Любой специалист признает, что доза приблизительно 223 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 200 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 177 мг цефтаролина.
Доза приблизительно 446 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 400 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 353 мг цефтаролина.
Доза приблизительно 557 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 500 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 442 мг цефтаролина.
Доза приблизительно 668 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 600 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 530 мг цефтаролина.
Доза приблизительно 891 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 800 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 706 мг цефтаролина.
Доза приблизительно 1114 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 1000 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 883 мг цефтаролина.
Доза приблизительно 1337 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 1200 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 1060 мг цефтаролина.
Доза приблизительно 2005 мг цефтаролина фозамила (USAN) является эквивалентной дозе приблизительно 1800 мг цефтаролина фозамила (INN), которая является эквивалентной дозе приблизительно 1589 мг цефтаролина.
В некоторых воплощениях дозированные формы обеспечивают такие фармакокинетические параметры при парентеральном введении. В одном воплощении дозированные формы обеспечивают такие фармакокинетические параметры при внутримышечном введении. В другом воплощении дозированные формы обеспечивают такие фармакокинетические параметры при внутривенном введении. Например, при внутримышечном введении в концентрации приблизительно 228 мг цефтаролина фозамила (INN)/мл. В другом примере, при внутримышечном введении в концентрации приблизительно 165 мг цефтаролина фозамила (INN)/мл. В другом примере, при внутривенном введении при концентрации от приблизительно 1,2 до приблизительно 12 мг цефтаролина фозамила (INN)/мл.
В одном воплощении дозированная форма включает цефтаролин фозамил и L-аргинин. В другом воплощении дозированная форма существенно состоит из цефтаролина фозамила и L-аргинина. В дополнительном воплощении дозированная форма состоит из цефтаролина фозамила и L-аргинина.
В одном воплощении дозированная форма включает цефтаролин фозамил и DL-аргинин. В другом воплощении дозированная форма существенно состоит из цефтаролина фозамила и DL-аргинина. В дополнительном воплощении дозированная форма состоит из цефтаролина фозамила и DL-аргинина.
В одном воплощении дозированная форма включает цефтаролин фозамил и уксусную кислоту/ацетат натрия. В другом воплощении дозированная форма существенно состоит из цефтаролина фозамила и уксусной кислоты/ацетата натрия. В дополнительном воплощении дозированная форма состоит из цефтаролина фозамила и уксусной кислоты/ацетата натрия.
В одном воплощении дозированная форма включает цефтаролин фозамил и лимонную кислоту/цитрат натрия. В другом воплощении дозированная форма существенно состоит из цефтаролина фозамила и лимонной кислоты/цитрата натрия. В дополнительном воплощении дозированная форма состоит из цефтаролина фозамила и лимонной кислоты/цитрата натрия.
В некоторых воплощениях дозированная форма представляет собой сухой порошок. В дополнительных воплощениях дозированная форма дополнительно включает растворитель, такой, как вода, физиологический раствор, раствор глюкозы или декстрозы в концентрации от приблизительно 5% до приблизительно 10%, и их комбинации.
В некоторых воплощениях дозированная форма включает приблизительно 668 мг цефтаролина фозамила и приблизительно 400 мг L-аргинина, приблизительно 668 мг цефтаролина фозамила и приблизительно 348 мг L-аргинина, приблизительно 668 мг цефтаролина фозамила и приблизительно 174 мг L-аргинина.
В некоторых воплощениях дозированная форма включает приблизительно 668 мг цефтаролина фозамила и приблизительно 400 мг DL-аргинина, приблизительно 668 мг цефтаролина фозамила и приблизительно 348 мг DL-аргинина, приблизительно 668 мг цефтаролина фозамила и приблизительно 174 мг DL-аргинина.
В некоторых воплощениях дозированная форма включает приблизительно 668 мг цефтаролина фозамила и приблизительно 164 мг уксусной кислоты/ацетата натрия, приблизительно 668 мг цефтаролина фозамила и приблизительно 120 мг уксусной кислоты/ацетата натрия, приблизительно 668 мг цефтаролина фозамила и приблизительно 82 мг уксусной кислоты/ацетата натрия.
В некоторых воплощениях дозированная форма включает приблизительно 668 мг цефтаролина фозамила и приблизительно 558 мг лимонной кислоты/цитрата натрия, приблизительно 668 мг цефтаролина фозамила и приблизительно 440 мг лимонной кислоты/цитрата натрия, приблизительно 668 мг цефтаролина фозамила и приблизительно 294 мг лимонной кислоты/цитрата натрия.
В некоторых воплощениях дозированная форма включает приблизительно 446 мг цефтаролина фозамила и приблизительно 267 мг L-аргинина, приблизительно 446 мг цефтаролина фозамила и приблизительно 230 мг L-аргинина, приблизительно 446 мг цефтаролина фозамила и приблизительно 116 мг L-аргинина.
В некоторых воплощениях дозированная форма включает приблизительно 446 мг цефтаролина фозамила и приблизительно 267 мг DL-аргинина, приблизительно 446 мг цефтаролина фозамила и приблизительно 230 мг DL-аргинина, приблизительно 446 мг цефтаролина фозамила и приблизительно 116 мг DL-аргинина.
В некоторых воплощениях дозированная форма включает приблизительно 446 мг цефтаролина фозамила и приблизительно 110 мг уксусной кислоты/ацетата натрия, приблизительно 446 мг цефтаролина фозамила и приблизительно 82 мг уксусной кислоты/ацетата натрия, приблизительно 446 мг цефтаролина фозамила и приблизительно 55 мг уксусной кислоты/ацетата натрия.
В некоторых воплощениях дозированная форма включает приблизительно 446 мг цефтаролина фозамила и приблизительно 374 мг лимонной кислоты/цитрата натрия, включает приблизительно 446 мг цефтаролина фозамила и приблизительно 293 мг лимонной кислоты/цитрата натрия, приблизительно 446 мг цефтаролина фозамила и приблизительно 197 мг лимонной кислоты/цитрата натрия.
В некоторых воплощениях лекарственное средство (цефтаролин) или его пролекарственная форма (например, цефтаролин фозамил) и солюбилизирующий агент находятся в форме твердого вещества (например, сухого порошка). В других воплощениях лекарственное средство или пролекарственное средство и солюбилизирующий агент находятся в форме раствора. В дополнительных воплощениях лекарственное средство (цефтаролин) или его пролекарственная форма (например, цефтаролин фозамил) и солюбилизирующий агент находятся в форме суспензионного раствора.
В некоторых воплощениях солюбилизирующий(ие) агент(ы) находится в жидкой форме. Лекарственное средство (цефтаролин) или его пролекарственная форма (например, цефтаролин фозамил) могут смешиваться с жидким солюбилизирующим агентом (либо с добавлением, либо без добавления дополнительного растворителя) перед парентеральным введением.
Способы лечения
Цефтаролин фозамил (USAN, молекулярная формула С22H21N8O8PS4. C2H4O2. H2O) и цефтаролин фозамил (INN, безводный, свободный от ацетата, молекулярная формула C22H21N8O8PS4, молекулярный вес 684,68) представляют собой N-фосфоноамино пролекарственные средства цефтаролина (молекулярная формула C22H22N8O5S4). Цефтаролин демонстрирует широкий спектр эффективности в отношении аэробных и некоторых анаэробных грамположительных и грамотрицательных бактерий. В частности, цефтаролин обладает отличной активностью в отношении многочисленных стафилококков, устойчивых к лекарственным средствам, включая Staphylococcus aureus (MSRA), резистентный к метициллину, S. aureus средней степени чувствительности к ванкомицину (VISA), резистентный к ванкомицину S. aureus (VSRA) и коагулаза-негативные стафилококки, резистентные к метициллину или обладающие средней степенью чувствительности к ванкомицину (MR-CoNS или VI-CoNS). Их in vitro антибактериальный спектр также включает этиологические патогены, вовлеченные в респираторные и другие внутрибольничные инфекции, такие, как стрептококковые (включая резистентный к пенициллину Streptococcus pneumoniae [PRSP]), резистентный к ампициллину Haemophilius influenzae, Monraxella catarrhalis, большинство патогенных кишечных бацилл, и отобранные анаэробные виды. Минимальная ингибирующая концентрация, которая ингибирует 90% микробных штаммов у данных видов (MIC90), обычно составляет ≤2 мг/мл. В соответствии с этим, дозированные формы настоящего изобретения могут использоваться для лечения широкого спектра бактериальных инфекций у пациентов, таких, как респираторные инфекции и инфекции мочевыводящих путей.
В дополнительном аспекте настоящее изобретение относится к способам лечения бактериальных инфекций путем введения пациенту, который нуждается в этом, дозированной формы в соответствии с одним или более воплощений, приведенных выше. В любом случае, в дополнительных воплощениях дозированная форма вводится парентерально (например, внутривенно, внутримышечно) в виде раствора или суспензии в растворителе, таком, как вода, физиологический раствор, сахарный раствор в концентрации от приблизительно 5% до приблизительно 10% (например, глюкозный, декстрозный) и их комбинации.
Определения
Если не указано иное, то все технические и научные термины, используемые в данной заявке, в общем случае имеют общепринятое значение для среднего специалиста в данной области техники, к которой принадлежит данное изобретение.
Термин "приблизительно" или "примерно", как используется в данной заявке, означает интервал приемлемой ошибки для частного значения, как определяется средним специалистом в данной области техники, которое будет зависеть от того, как измеряется или определяется значение, то есть от ограничений измерительной системы. Например, "приблизительно" может означать 1 или более чем 1 стандартное отклонение, в соответствии с практикой, существующей в данной области техники. Альтернативно, "приблизительно" может означать интервал вплоть до 20%, и предпочтительно вплоть до 10% от данного значения.
Термин "биодоступность" относится к степени, до которой активный ингредиент или активный остаток поглощается из лекарственного продукта и становится системно доступным.
Термин "эффективное количество" означает количество дозированной формы, которое при введении пациенту (например, млекопитающему) для лечения заболевания содержит достаточное количество активного ингредиента для того, чтобы осуществить такое лечение заболевания, чтобы достичь целей данного изобретения. Термин "эффективное количество" будет варьировать в зависимости от соединения, заболевания и его тяжести, от возраста, веса, физического состояния и чувствительности, и т.д. пациента, которого подвергают лечению.
Фармакокинетические параметры, описанные в данной заявке, включают площадь под кривой концентрация в плазме крови-время (AUC0-t и AUC0-∞), максимальную концентрацию в плазме крови (Cmax), и время максимальной концентрации в плазме крови (Tmax). Может также обеспечиваться конечный элиминационный период полувыведения (T1/2). Время максимальной концентрации, Tmax, определяется как время, соответствующее Cmax. Площадь под кривой концентрация в плазме крови-время вплоть до времени, соответствующего последней способной к измерению концентрации (AUC0-t), подсчитывают путем численного интегрирования при использовании линейной формулы трапеций, как приведено ниже:
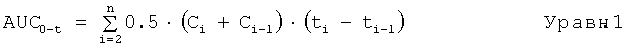
где Ci представляет собой концентрации мемантина в момент времени соответствующего взятия пробы ti, a n представляет собой число моментов времени вплоть до и включая последнюю концентрацию, которую можно измерить.
Конечный период полувыведения (T1/2) подсчитывают при использовании следующего уравнения:

где λz представляет собой константу конечной скорости элиминирования.
Площадь под кривой концентрация в плазме крови-время от времени 0 до бесконечности подсчитывают в соответствии со следующим уравнением:

где Clast представляет собой последнюю способную к измерению концентрацию.
Термины "лечить" и "лечение" относятся к одному из следующих:
(a) облегчение или ослабление, по крайней мере, одного симптома у субъекта, включая, например, аллергические и воспалительные расстройства, такие, как астма и COPD;
(b) облегчение или ослабление интенсивности и/или длительности проявления расстройства, испытываемого субъектом, включая, но не ограничиваясь, те, которые возникают в ответ на данный стимул (например, давление, повреждение ткани, низкая температура, и т.д.);
(c) купирование, отсрочку начала (то есть период перед клиническим проявлением расстройства) и/или снижение риска развития или усугубления расстройства.
Субъект или пациент, у которого введение терапевтического соединения представляет собой эффективный терапевтический режим для заболевания или расстройства, предпочтительно представляет собой человека, но может представлять собой животное, включая лабораторное животное в контексте лабораторных опытов или скрининга, или активности эксперимента. Таким образом, как это является понятным для среднего специалиста в данной области техники, способы, соединения и композиции в соответствии с настоящим изобретением являются особенно приемлемыми для введения любому животному, в частности млекопитающему, и включают, но без ограничения, людей, домашних животных, таких, как кошки или собаки, сельскохозяйственных животных, таких, как, но без ограничения, коровы, лошади, козы, овцы и свиньи, диких животных (либо живущих на воле, либо в зоопарках), лабораторных животных, таких, как мыши, крысы, кролики, козы, овцы, свиньи, собаки, коты и т.д., различные виды птиц, таких, как куры, индюки, певчие птицы и т.д., для ветеринарного медицинского применения.
Фармацевтически приемлемые соли включают те, которые получены путем реакции основного соединения, которое функционирует в качестве основания, с неорганической или органической кислотой с образованием соли, например солей соляной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, камфорсульфоновой кислоты, щавелевой кислоты, малеиновой кислоты, янтарной кислоты, лимонной кислоты, муравьиной кислоты, бромистоводородной кислоты, бензойной кислоты, виннокаменной кислоты, фумаровой кислоты, салициловой кислоты, манделовой кислоты и угольной кислоты. Фармацевтически приемлемые соли также включают те, в которых основное соединение функционирует как кислота и реагирует с приемлемым основанием с образованием, например, солей натрия, калия, кальция, магния, аммония и холина. Квалифицированному специалисту в данной области техники также является известным, что соли присоединения кислоты могут быть получены с помощью реакции соединения с приемлемой неорганической или органической кислотой с помощью целого ряда известных способов. Альтернативно, соли щелочных и щелочноземельных металлов могут быть получены путем осуществления реакции соединения с приемлемым основанием с помощью ряда известных способов. Приведенные ниже представляют собой примеры кислых солей, которые могут быть получены путем реакции с неорганическими или органическими кислотами: ацетаты, адипаты, альгинаты, цитраты, аспартаты, бензоаты, бензолсульфонаты, бисульфаты, бутираты, камфораты, диглюконаты, циклопентанпропионаты, додецилсульфаты, этансульфонаты, глюкогептаноаты, глицерофосфаты, гемисульфаты, гептаноаты, гексаноаты, фумараты, гидробромиды, гидроиодиды, 2-гидроксиэтансульфонаты, лактаты, малеаты, метансульфонаты, никотинаты, 2-нафталинсульфонаты, оксалаты, пальмоаты, пектинаты, персульфаты, 3-фенилпропионаты, пикраты, пивалаты, пропионаты, сукцинаты, тартраты, тиоцианаты, тозилаты, мезилаты и ундеканоаты.
Термин "пролекарственное средство" означает соединение, представляющее собой лекарственный предшественник, который при введении субъекту подвергается химическому превращению с помощью метаболических или химических процессов с получением активного остатка соединения. Приемлемые пролекарственные средства цефтаролина включают, например, цефтаролин фозамил (USAN, INN) и 7β-[2(Z)-этоксиимино-2-(5-фосфоноамино-1,2,4-тиадиазол-3-ил)ацетамидо]-3-[4-(1-метил-4-пиридинио)-2-тиазолитио]-3-цефем-4-карбоксилат.
Сольваты соединения могут образовываться, когда молекула(ы) растворителя встраивается(ются) в структуру кристаллической решетки молекулы соединения, например, во время процесса кристаллизации. Приемлемые сольваты включают, например, гидраты (моногидрат, сесквигидрат, дигидрат), сольваты с органическими соединениями (например, CH3CO2H, CH3CH2CO2H, CH3CN) и их комбинации.
ПРИМЕРЫ
Настоящее изобретение будет далее описано с помощью следующих нелимитирующих примеров. При использовании раскрытия этих примеров следует иметь в виду, что примеры являются иллюстрирующими для настоящего изобретения и не могут трактоваться как такие, которые ограничивают объем изобретения любым путем, поскольку большое количество вариаций и эквивалентов, которые охватываются настоящим изобретением, будут понятными специалисту в данной области техники при прочтении настоящего раскрытия.
Цефтаролин фозамил может быть получен так, как описано в патенте США №6,906,055.
Пример 1: рН профиль растворимости цефтаролина фозамила
Одночасовую и трехчасовую кинетическую растворимость цефтаролина фозамила измеряли при комнатной температуре (25°С) путем прибавления избытка цефтаролина фозамила к различным USP буферам с рН, значение которого колебалось от 1,2 до 9,0 при 0,05 М. Результаты представлены в Таблице 5.
Колебания состава USP буферов: рН=1-2: HCl/KCl; рН=3-5: ацетат натрия; рН=6-9: фосфат натрия
Как можно увидеть из Таблицы 5, растворимость цефтаролина фозамила колебалась от приблизительно 25 мг/мл до приблизительно 36 мг/мл в пределах широкого интервала рН (приблизительно от 3 до приблизительно 8, 0,05 М).
Пример 2: Растворимость ионных смесей цефтаролин фозамил-уксусная кислота/ацетат натрия
Влияние молярности иона ацетата на одночасовую кинетическую растворимость цефтаролина фозамила измеряли при комнатной температуре (25°С) путем добавления избытка цефтаролина фозамила к различным USP буферам со значением рН, которое колебалось от 1,2 до 9,0, при ионной силе иона ацетата, которая колебалась от 0,1 М до 2,0 М. Результаты представлены в Таблицах 6-9.
Колебания состава USP буферов: рН=1-1: HCl/KCl; рН=3-5: ацетат натрия; рН=6-9: фосфат натрия
Колебания состава USP буферов: рН=1-2: HCl/KCl; рН=3-5: ацетат натрия; рН=6-9: фосфат натрия
Колебания состава USP буферов: рН=1-2: HCl/KCl; рН=3-5: ацетат натрия; рН=6-9: фосфат натрия
Колебания состава USP буферов: рН=1-2: HCl/KCl; рН=3-5: ацетат натрия; рН=6-9: фосфат натрия
Как можно увидеть из Таблиц 6-9, растворимость цефтаролина фозамила значительно повышалась при увеличении ионной силы иона ацетата (например, растворимость является большей чем 200 мг/мл, при концентрациях ацетата 1,0 М и выше).
Пример 3: Растворимость ионных смесей цефтаролин фозамил-лимонная кислота/цитрат натрия
Влияние молярности иона цитрата на одночасовую кинетическую растворимость цефтаролина фозамила измеряли при комнатной температуре (25°С) путем добавления избытка цефтаролина фозамила к различным USP буферам при различной ионной силе иона цитрата, которая колебалась от 0,05 М до 1,0 М. Результаты представлены в Таблице 10.
Как можно увидеть из Таблицы 10, растворимость цефтаролина фозамила значительно повышалась при увеличении ионной силы иона цитрата (например, растворимость является большей чем 200 мг/мл, при концентрациях цитрата 0,5 М и выше).
Пример 4: Растворимость смесей цефтаролин фозамил - DL аргинин
Влияние молярности DL аргинина на одночасовую кинетическую растворимость цефтаролина фозамила измеряли при комнатной температуре (25°С) путем добавления избытка цефтаролина фозамила к различным USP буферам при различной ионной силе DL аргинина, которая колебалась от 0,05 М до 2,0 М. Результаты представлены в Таблице 11.
Как можно увидеть из Таблицы 11, растворимость цефтаролина фозамила значительно повышалась при увеличении ионной силы DL аргинина (например, растворимость является большей чем 200 мг/мл, при концентрациях DL аргинина 1,0 М и выше).
Пример 4: Растворимость смесей цефтаролин фозамил - L-аргинин
Влияние молярности L-аргинина на одночасовую кинетическую растворимость цефтаролина фозамила измеряли при комнатной температуре (25°С) путем добавления избытка цефтаролина фозамила к различным USP буферам при различной ионной силе L-аргинина, которая колебалась от 0,05 М до 0,5 М. Результаты представлены в Таблице 12.
Как можно увидеть из Таблицы 12, растворимость цефтаролина фозамила значительно повышалась при увеличении ионной силы L-аргинина (например, растворимость является большей чем 200 мг/мл, при концентрациях L-аргинина 0,5 М и выше).
Пример 5: Растворимость смесей цефтаролин фозамил-гистидин
Влияние молярности гистидина на одночасовую кинетическую растворимость цефтаролина фозамила измеряли при комнатной температуре (25°С) путем добавления избытка цефтаролина фозамила к различным USP буферам при различной ионной силе гистидина, которая колебалась от 0,05 М до 1,0 М. Результаты представлены в Таблице 13.
Как можно увидеть из Таблицы 13, растворимость цефтаролина фозамила значительно повышалась при увеличении ионной силы гистидина. Растворимость цефтаролина фозамила при концентрациях гистидина выше 0,1 М не может быть определена по причине нерастворимости гистидина в смеси.
Пример 6: Стабильность растворов, содержащих цефтаролин фозамил/L-аргинин
Готовили композицию, содержащую 668 мг цефтаролина фозамила и 400 мг L-аргинина. Стабильность водного раствора композиции (при концентрации 338 мг цефтаролина фозамила безводного, в пересчете на свободную от ацетата основу на мл) определяли при следующих условиях: (i) 25°С и (ii) 2-8°С. Результаты этих исследований представлены в Таблицах 14 и 15, соответственно.
Как можно увидеть из Таблицы 14, раствор цефтаролин фозамил/L-аргинин является стабильным при комнатной температуре в течение более чем 6 часов, и, таким образом, является приемлемым для ВМ введения.
Стабильность раствора цефтаролин фозамил/L-аргинин в 250 мл пакета для инфузии определяли при следующих условиях: (i) 25°С и относительной влажности окружающей среды (RH) и (U) 2-8°С при RH окружающей среды. Результаты представлены в Таблицах 16 и 17, соответственно.
Как можно увидеть из Таблиц 16 и 17, раствор цефтаролин фозамил/L-аргинин является стабильным при комнатной температуре в течение нескольких дней, и, таким образом, является приемлемым для ВВ инфузии.
Химическая стабильность смеси цефтаролин фозамил/L-аргинин в 0,9% растворе хлорида натрия в пакетах для ВВ введения определяли при концентрациях цефтаролина фозамила приблизительно 5 мг/мл при условиях замораживания (2-8°С) в течение 24 или 48 часов, после чего раствор помещали на 6 часов в условия комнатной температуры (25°С и при комнатном освещении). Результаты представлены в Таблице 18.
Как можно увидеть из Таблицы 18, значение рН раствора в процессе исследования не изменялось. Таким образом, раствор может использоваться для внутривенного введения.
Пример 7: Получение композиций, приемлемых для ВМ и ВВ введений
Примеры композиций, приемлемых для ВМ и ВВ введений, обеспечиваются в Таблицах 19-22.
Растворы с умноженной силой, приемлемые для ВМ или ВВ введения, могут быть получены из смеси цефтаролин фозамил/L-аргинин Примера 1 Таблицы 19 (то есть, 668 мг цефтаролина фозамила (USAN) (является эквивалентным 530 мг цефтаролина) и 400 мг L-аргинина) в соответствии со следующими процедурами:
223 мг цефтаролина фозамила (USAN) для ВМ введения:
Прибавляли приблизительно 2 мл стерильной воды для инъекций к смеси. Полученный раствор (2,6 мл) имел концентрацию, эквивалентную приблизительно 228 мг цефтаролина безводного, в пересчете на свободную от ацетата основу /мл. Вводили приблизительно 0,88 мл (является эквивалентным приблизительно 177 мг цефтаролина).
446 мг цефтаролина фозамила (USAN) для ВМ введения
Прибавляли приблизительно 2 мл стерильной воды для инъекций к смеси. Полученный раствор имел концентрацию приблизительно 228 мг цефтаролина безводного, в пересчете на свободную от ацетата основу/мл. Вводили приблизительно 1,75 мл (является эквивалентным приблизительно 353 мг цефтаролина).
668 мг цефтаролина фозамила CUSAN) для ВМ введения
Прибавляли приблизительно 3 мл стерильной воды для инъекций к смеси. Полученный раствор (приблизительно 3,6 мл) имел концентрацию приблизительно 165 мг цефтаролина безводного, в пересчете на свободную от ацетата основу/мл (является эквивалентным приблизительно 530 мг цефтаролина).
668 мг цефтаролина фозамила (USAN) для ВМ введения
Прибавляли приблизительно 2 мл стерильной воды для инъекций к смеси. Полученный раствор имел концентрацию приблизительно 228 мг цефтаролина безводного, в пересчете на свободную от ацетата основу/мл. Вводили приблизительно 2,6 мл (является эквивалентным приблизительно 530 мг цефтаролина).
1114 мг цефтаролина фозамила (USAN) для ВМ введения
Прибавляли приблизительно 2 мл стерильной воды для инъекций к двум флаконам, содержащим смесь. Полученный раствор имел концентрацию приблизительно 228 мг цефтаролина безводного, в пересчете на свободную от ацетата основу/мл. Вводили приблизительно 4,4 мл раствора (является эквивалентным приблизительно 883 мг цефтаролина).
Для введения более высоких доз, например, 2005 мг цефтаролина фозамила (USAN), инъекции могут осуществляться в два внутримышечных сайта пациента.
223 мг цефтаролина фозамила (USAN) в 250 мл инфузии для ВВ введения
Прибавляли приблизительно 20 мл стерильной воды для инъекций к смеси. Переносили приблизительно 6,67 мл в пакет для ВВ инфузии, например, на 250 мл стерильного 0,9% физиологического раствора или 5% декстрозы (является эквивалентным приблизительно 177 мг цефтаролина).
446 мг цефтаролина фозамила (USAN) в 250 мл инфузии для ВВ введения
Прибавляли приблизительно 20 мл стерильной воды для инъекций к смеси. Переносили приблизительно 13,3 мл в пакет для ВВ инфузии, например, на 250 мл стерильного 0,9% физиологического раствора или 5% декстрозы (является эквивалентным приблизительно 353 мг цефтаролина).
668 мг цефтаролина фозамила (USAN) в 250 мл инфузии для ВВ введения
Прибавляли приблизительно 20 мл стерильной воды для инъекций к смеси. Переносили содержимое (20 мл) в пакет для ВВ инфузии, например, на 250 мл стерильного 0,9% физиологического раствора или 5% декстрозы (является эквивалентным приблизительно 530 мг цефтаролина).
1337 мг цефтаролина фозамила в 250 мл инфузии для ВВ введения
Прибавляли приблизительно 20 мл стерильной воды для инъекций к смеси при использовании двух флаконов. Переносили содержимое в пакет для ВВ инфузии, например, на 250 мл стерильного 0,9% физиологического раствора или 5% декстрозы (является эквивалентным приблизительно 1060 мг цефтаролина).
2005 мг цефтаролина фозамила в 250 мл инфузии для ВВ введения
Прибавляли приблизительно 20 мл стерильной воды для инъекций к смесям при использовании трех флаконов. Переносили содержимое в пакет для ВВ инфузии, например, на 250 мл стерильного 0,9% физиологического раствора или 5% декстрозы (является эквивалентным приблизительно 1589 мг цефтаролина).
ПРИМЕР 8: Рандомизированное, состоящее из двух частей исследование единичной и множественных доз цефтаролина фозамила, парентерально введенных путем внутримышечной инъекции и внутривенной инъекции здоровым людям
Это было рандомизированное, состоящее из двух частей исследование единичной и множественных доз для определения фармакокинетики цефтаролина фозамила и его активного остатка, цефтаролина, который вводили парентерально (в виде внутримышечной инъекции и внутривенной инъекции).
Часть А исследования представляла собой исследование единичной дозы без контроля плацебо. Часть В исследования представляла собой исследование множественных доз.
Часть А
Двадцать четыре субъекта (шесть субъектов на группу лечения) были произвольным образом распределены в одну из четырех групп лечения (A-D): Вводили следующие дозы при использовании флаконов, содержащих 668 мг цефтаролина фозамила (USAN, молекулярная формула C22H21N8O8PS4. C2H4O2. H2O, молекулярный вес 762,75).
Группа A: День 1 - Однократная ВМ инъекция 400 мг цефтаролина фозамила (безводного, в пересчете на свободную от ацетата основу, 228 мг/мл раствора) (≡53 мг цефтаролина)
Группа B: День 1 - Однократная ВМ инъекция 600 мг цефтаролина фозамила (безводного, в пересчете на свободную от ацетата основу, 165 мг/мл раствора) (≡530 мг цефтаролина)
Группа C: День 1 - Однократная ВМ инъекция 600 мг цефтаролина фозамила (безводного, в пересчете на свободную от ацетата основу, 228 мг/мл раствора) (≡530 мг цефтаролина)
День 8 - Однократная ВМ инъекция (в течение 60 минут) 600 мг цефтаролина фозамила (безводного, в пересчете на свободную от ацетата основу) (≡530 мг цефтаролина)
Субъекты группы лечения С получали BB инфузию в День 8
Группа D: День 1 - Однократная ВМ инъекция 1000 мг цефтаролина фозамила (безводного, в пересчете на свободную от ацетата основу, 228 мг/мл раствора) (≡883 мг цефтаролина)
20 Часть В
Восемнадцать субъектов произвольно распределяли в одну из двух групп лечения. ВМ инъекцию осуществляли попеременно в различные стороны ягодичной мышцы каждого субъекта.
Группа E: Дни 1-4 - ВМ инъекция 600 мг цефтаролина фозамила (безводного, в 25 пересчете на свободную от ацетата основ, 228 мг/мл раствора) (≡530 мг цефтаролина) каждые 12 часов
День 5 - однократная ВМ инъекция 600 мг цефтаролина фозамила (безводного, в пересчете на свободную от ацетата основу, 228 мг/мл раствора) (≡530 мг цефтаролина) через 12 часов после введения последней дозы Дня 4
Контрольная группа F: Дни 1-4 - ВМ инъекция цефепима гидрохлорида 1000 мг каждые 12 часов
День 5 - однократная ВМ инъекция цефепима гидрохлорида 1000 мг через 12 часов после введения последней дозы Дня 4 использовалась в качестве контрольной группы
Длительность исследования для групп лечения Е и F составляла 11 дней (Дни - 1 до 10). Объем вводимой жидкости для каждой внутримышечной инъекции подсуммирован в Таблице 23. Дозирующие растворы для ВМ инъекции цефтаролина готовили при использовании стерильной воды для инъекций.
Фармакокинетические параметры цефтаролина фозамила и цефтаролина определяли при использовании стандартного анализа. Кровь для исследования фармакокинетических параметров брали у всех субъектов так, как описано ниже:
Первый образец крови брали через приблизительно 5 минут (приблизительно 0,06 часов) после завершения введения. Измерение считалось существенно равным нулю до этой точки.
Часть А: 5, 15, и 30 минут и 1, 2, 4, 6, 8, 12, 18, 24, 36 и 48 часов после инъекции. В дополнение, кровь брали у субъектов, которые получали BB инфузию непосредственно перед инъекцией лекарственного средства в день 8 и через 20,40, 60 (непосредственно перед окончанием инфузии исследуемого лекарственного средства), 65 и 75 минут, и 1, 5, 2, 3, 4, 6, 8, 12, 24, 36 и 48 часов после начала инфузии лекарственного средства в День 8.
Часть В: Инъекция лекарственного средства в дни 1 и 5, через 5, 15, и 30 минут и 1, 2, 4, 6, 8 часов после первой инъекции в День 1, непосредственно до (в пределах 15 минут) инъекции утренней дозы в День 4, через 12 часов после введения утренней дозы Дня 4 (перед введением вечерней дозы) и через 5, 15 и 30 минут и 1, 2, 4, 6, 8, 12, 24, 36 и 48 часов после последней инъекции (утренней) в День 5.
Фармакокинетические параметры цефтаролина фозамила, полученные в части А этого исследования, представлены в Таблице 24.
AUC0-∞ и Cmax значения повышались и снижались пропорционально с дозированием цефтаролина фозамила. Таким образом, квалифицированный специалист в данной области техники с учетом этого раскрытия может легко определить фармакокинетические параметры для любой специфической дозировки цефтаролина фозамила (или других пролекарственных форм цефтаролина), используемой в частной форме дозировки в соответствии с изобретением. Пролекарственное средство в крови быстро превращается в активный остаток цефтаролина.
Фармакокинетические параметры для цефтаролина, полученные из части А данного исследования, представлены в Таблице 25.
Вводили дозы при использовании флаконов, содержащих 668 мг цефтаролина фазомила (USAN, молекулярная формула C22H21N8O8PS4. C2H4O2. H2O, молекулярный вес 762,75). Как можно увидеть из Таблицы 25, системное воздействие (AUC0-∞) цефтаролина (активный остаток) после введения дозы 600 мг цефтаролина фозамила (INN) (≡530 мг цефтаролина) путем ВМ инъекции при концентрации 228 мг/мл, определенной в Таблице 23 (День 1), является приблизительно эквивалентным системному воздействию после ВВ инфузии эквивалента 600 мг цефтаролина фозамила (INN) (≡530 мг цефтаролина) (День 8), что приводило к абсолютной биодоступности приблизительно 100%. Значение Cmax цефтаролина для ВМ инъекции в группе лечения С было приблизительно на 57% ниже чем значение Cmax после ВВ инфузии. Tmax после ВМ инъекции составляло приблизительно от 1 до 2 часов, в то время, как Nmax после ВВ инфузии определялось около времени конца инфузии (~1 час).
Кроме того, как можно увидеть из Таблицы 25, концентрации в плазме крови после ВМ инъекции при использовании флаконов, содержащих 668 мг цефтаролина фозамила (USAN, молекулярная формула C22H21N8O8PS4. C2H4O2. H2O, молекулярный вес 762,75, что является эквивалентным 600 мг цефтаролина фозамила (INN) (≡530 мг цефтаролина) при концентрации 165 мг/мл (как определено в Таблице 23), было большим чем после ВМ инъекции 600 мг цефтаролина фозамила (INN) (≡530 мг цефтаролина) при концентрации 228 мг/мл (как определено в Таблице 23), что приводило к получению значений Cmax и AUC, которые составляли приблизительно 72% и 56%. ВМ раствор, содержащий эквивалент 600 мг цефтаролина фозамила (INN) при концентрации 165 мг/мл (как определено в Таблице 23), является на 50% более биодоступным чем ВВ раствор с той же силой. Это является неожиданным результатом.
Линейно подсчитанные фармакокинетические параметры для цефтаролина после ВМ инъекции единичной дозы цефтаролина фозамила при использовании флаконов, содержащих 668 мг цефтаролина фозамила (USAN) при концентрации 228 мг/мл, как определено в Таблице 23, представлены в Таблице 26.
Линейно подсчитанные фармакокинетические параметры цефтаролина фозамила (INN) после введения ВМ инъекции цефтаролина фозамила USAN (при концентрации цефтаролина фозамила (безводного, в пересчете на свободную от ацетата основу, 228 мг /мл, как определено в Таблице 23) показаны в Таблице 27.
Доза в отношении количества цефтаролина, например, 668 мг цефтаролина фозамила (USAN), является эквивалентной 530 мг цефтаролина. Значения для цефтаролина фозамила (USAN) 223, 557, 891, 1337 и 2005 мг подсчитывали на основе линейного условия.
Фармакокинетические параметры для цефтаролина, полученные из части В этого исследования, представлены в Таблице 28.
Доза в отношении количества цефтаролина, например, 668 мг цефтаролина фозамила (USAN) является эквивалентной 530 мг цефтаролина
Фармакокинетические параметры для цефтаролина фозамила, полученные из части В этого исследования, представлены в Таблице 29.
Доза в отношении количества цефтаролина, например, 668 мг цефтаролина фозамила (USAN) является эквивалентной 530 мг цефтаролина
Несмотря на то, что изобретение было отражено и описано путем ссылки на типичные воплощения изобретения, такая ссылка не может трактоваться как ограничение изобретения и никакого такого ограничения не предполагается. Изобретение может быть подвергнуто значительной модификации, изменению и применению эквивалентов в отношении формы и функции, как будет понятно среднему специалисту в соответствующей области техники, ознакомленному с данным раскрытием. Отображенные и описанные воплощения изобретения представляют собой только примеры и не являются исчерпывающими для объема изобретения. Следовательно, изобретение ограничивается только духом и объемом приложенных пунктов формулы изобретения, обеспечивая полное рассмотрение эквивалентов во всех отношениях.
Полное раскрытие всех патентов, патентных заявок и публикаций, цитированных в данной заявке, введены в нее в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ, ВКЛЮЧАЮЩИЕ ЦЕФТАРОЛИН | 2009 |
|
RU2524665C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2719450C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ, ВКЛЮЧАЮЩАЯ ФЕБУКСОСТАТ | 2011 |
|
RU2602188C2 |
| СОСТАВЫ, УСТРОЙСТВА И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ АЛКОГОЛЬНОЙ ЗАВИСИМОСТИ | 2017 |
|
RU2767062C2 |
| ЭСЛИКАРБАЗЕПИНА АЦЕТАТ И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2005 |
|
RU2417085C2 |
| ОРАЛЬНЫЕ ДОЗИРОВАННЫЕ ФОРМЫ ТОФАЦИТИНИБА С НЕПРЕРЫВНЫМ ВЫСВОБОЖДЕНИЕМ | 2014 |
|
RU2790166C2 |
| ПРЕПАРАТЫ МЕТАКСАЛОНА | 2014 |
|
RU2684914C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ОТ HELICOBACTER PYLORI | 2014 |
|
RU2671400C2 |
| ОРАЛЬНЫЕ ДОЗИРОВАННЫЕ ФОРМЫ ТОФАЦИТИНИБА С НЕПРЕРЫВНЫМ ВЫСВОБОЖДЕНИЕМ | 2014 |
|
RU2674345C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ ИННЕРВАЦИЙ (ВАРИАНТЫ) | 2013 |
|
RU2536269C1 |
Изобретение относится к медицине, конкретно к новым дозированным формам соединений цефема, полезным для лечения бактериальных инфекций. Дозированные формы являются стабильными, демонстрируют улучшенную растворимость и являются особенно приемлемыми для парентерального введения. 8 з.п. ф-лы, 29 табл., 8 пр.
1. Дозированная форма для парентерального введения, содержащая цефтаролин фозамил или его фармацевтически приемлемую соль, и солюбилизирующий агент, где молярность солюбилизирующего агента в водном растворе дозированной формы является большей чем приблизительно 1,0 М, и где цефтаролин фозамил представляет собой цефтаролин фозамил моногидрат (USAN) или цефтаролин фозамил-безводный, свободный от ацетата (INN), и где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 100 мг/мл.
2. Дозированная форма для парентерального введения в соответствии с п. 1, где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 200 мг/мл.
3. Дозированная форма для парентерального введения в соответствии с п. 1, где солюбилизирующий агент представляет собой L-аргинин.
4. Дозированная форма для парентерального введения в соответствии с п. 1, содержащая приблизительно 668 мг цефтаролина фозамила (USAN) и приблизительно 400 мг L-аргинина, где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 100 мг/мл.
5. Дозированная форма для парентерального введения в соответствии с п. 1, содержащая приблизительно 668 мг цефтаролина фозамила (USAN) и приблизительно 348 мг L-аргинина, где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 100 мг/мл.
6. Дозированная форма для парентерального введения в соответствии с п. 1, содержащая приблизительно 668 мг цефтаролина фозамила (USAN) и приблизительно 174 мг L-аргинина, где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 100 мг/мл.
7. Дозированная форма для парентерального введения в соответствии с п. 1, содержащая приблизительно 446 мг цефтаролина фозамила (USAN) и приблизительно 267 мг L-аргинина, где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 100 мг/мл.
8. Дозированная форма для парентерального введения в соответствии с п. 1, содержащая приблизительно 446 мг цефтаролина фозамила (USAN) и приблизительно 230 мг L-аргинина, где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 100 мг/мл.
9. Дозированная форма для парентерального введения в соответствии с п. 1, содержащая приблизительно 446 мг цефтаролина фозамила (USAN) и приблизительно 116 мг L-аргинина, где цефтаролин фозамил обладает растворимостью в воде, большей чем приблизительно 100 мг/мл.
| PRESCOTT et al, 46th Interscience Conference on Antimicrobial Agents and Chemotherapy, Vol.31, N11, November 2006, p | |||
| Мост | 1912 |
|
SU679A1 |
| US2003039956 A1, 27.02.2003 | |||
| Устройство для под водоохлаждающей среды к поршню двигателя внутреннего горения | 1931 |
|
SU27250A1 |
Авторы
Даты
2014-12-27—Публикация
2008-09-19—Подача