Изобретение относится к медицине, а именно к иммуногистохимическим исследованиям, и может быть использовано при иммунофенотипировании опухолей в условиях интраоперационной диагностики.
В настоящее время иммуногистохимические методы исследования являются неотъемлемой частью в диагностике опухолей. При исследовании тканей иммуногистохимическое заключение, с одной стороны, подтверждает морфологический диагноз, с другой стороны, при неясной морфологической картине помогает патологу определить гистогенез опухоли. Иммуногистохимия (ИГХ) - метод идентификации антигенных структур тканей. Это одна из самых современных методик дифференциальной диагностики онкологических заболеваний, позволяющая определить гистогенез опухоли на молекулярном уровне.
Утрата морфологических особенностей клеток в различных типах опухолей, особенно при метастазировании и недифференцированных новообразованиях мелкоклеточного и полиморфно-клеточного характера, не позволяет провести дифференциальную диагностику опухолей, используя только морфологические методы. Важнейший метод уточняющей диагностики - иммуногистохимический. Он позволяет определить иммунофенотип опухоли, исследовать ее биологические свойства, определить молекулярно-биологические факторы прогноза.
При некоторых патологических состояниях, особенно опухолях, бывает трудно и даже невозможно с помощью гисто- или цитологических окрасок определить тип ткани, ее происхождение. Подобные трудности возникают и при установлении вида возбудителя инфекции. Между тем, точная верификация процесса имеет большое значение для диагностики, выбора тактики лечения и прогнозирования заболевания. Поэтому целесообразно использовать различные дополнительные методы исследования. Одним из них является иммуногистохимический метод, принцип которого заключается в том, что на гисто- или цитологические препараты наносят растворы с антителами к искомым антигенам - опухолевым, вирусным, микробным, аутоантигенам и др. Антигены при обычных гистологических окрасках тканей не видны. Антитела в сыворотках несут на себе метку: либо флуорохром, т.е. краситель, светящийся в темном поле (иначе говоря, дающий флуоресценцию), либо красящий фермент. Если искомый антиген есть в исследуемых тканях, то возникший комплекс антиген-антитело плюс маркер точно укажут его наличие, локализацию, интенсивность окрашивания, помогут определить вид опухоли, изучить ее свойства. Наиболее распространен иммуноферментный метод. Антитела красящей сыворотки несут не флуорохром, а фермент - пероксидазу хрена, реже другой энзим, например щелочную фосфатазу. Существует несколько вариантов указанного метода. Наиболее часто используют два из них - пероксидазно-анти-пероксидазный (PAP-method, ПАП-метод) и метод авидин-биотинового комплекса (ABC-method, АВС-метод) (Immunocytochemistry. A Practical Approach. Ed. bу J.E.Beesley. Department of Pharmacology, Wellcome Research Laboratories, Beckenham, Kent / Oxford University Press, 1993, 248; Dodson A., Campbell F., Biotin inclusions: a Potential Pitfall in immunohistochemistry (letter). Histopathology, 1999; 34; 178-179; UK NEOAS Immunocytochemistry News. J. Cell. Pathol. 2001; 5:189; Руководство по иммуногистохимической диагностике опухолей человека. Под ред. С.В.Петрова, Н.Т.Райхлина. Казань «Титул», 2004, 451; Diagnostic Immunohistochemistry/Td. by D.Dabbs. Churchill Livingstone, 2006, 828). При ПАП-методе энзимное, т.е. пероксидазное, антитело связывается с первичным антителом, уже находящимся на антигене, посредством еще одного антитела-мостика. Последний как бы развернут к связываемым звеньям так, чтобы своими короткими иммуноглобулиновыми цепями связать их длинные цепи. Таким образом, имеется 3 слоя субстанций: антиген со связанным антителом в ткани, антитело-мост и ПАП-комплекс, в котором молекулы пероксидазы располагаются между двумя короткими цепями двух связанных антител, несущих энзим.
Использование высококачественных реагентов, упрощение и автоматизация иммуногистохимических исследований сделали данный метод необходимым инструментом для решения диагностических вопросов, встающих перед патологами.
Известен способ окраски хрящевой и костной ткани (патент РФ №2033610, 20.04.1995) путем воздействия красителями на гистологический срез, промывки в дистиллированной воде, обезвоживания, просветления и заключения в бальзам, отличающийся тем, что дополнительно поэтапно осуществляют докрашивание 0,1%-ным альциановым синим, приготовленным на буфере с рН 4,4 в течение 20-45 мин при 37°С в термостате и эозином, при этом докрашивание эозином осуществляют при комнатной температуре. К недостаткам данного метода относится его продолжительность, что затрудняет использование его для интраоперационной диагностики.
Известен способ иммуногистохимической детекции протеинов на парафиновых гистологических срезах (патент РФ №2098825, 10.12.1997), включающий их депарафинизацию, дегидратацию, блокирование эндогенной пероксидазы и затем неспецифической сорбции иммуноглобулинов, обработку гистологических срезов первичными антителами с последующей инкубацией их вторичными антителами, проявлением пероксидазной активности, окраской и детекцией протеинов по наличию коричневого окрашивания, отличающийся тем, что перед обработкой гистологических срезов первичными антителами в их раствор дополнительно вводят полиэтиленгликоль 6000 до конечной концентрации в растворе 5%.
Известно, что иммуногистохимическое окрашивание парафиновых срезов тканей занимает в среднем 4-5 часов (в зависимости от характеристик применяемых реагентов). Окраска криостатных срезов исключает длительные этапы депарафинизации, дегидратации, демаскировки антигенов, регидратации, что значительно ускоряет процедуру. Тем не менее, оставшиеся этапы обработки ткани занимают в среднем 75-80 минут, что не пригодны для интраоперационной диагностики.
Peter Ruck (Peter Ruck. EnVision™ for rapid immunostaining in intraoperative frozen section diagnosis. Institute of Pathology, University of Tubingen, Germany, 2001 Institute of Pathology, University of Tubingen, Germany, 2001) предложил протокол иммуногистохимического окрашивания криостатных срезов: способ окраски «Быстрая интраоперационная иммуногистохимическая диагностика на замороженных срезах», позволяющий получить результат через 12-13 минут.
Иммуногистохимическое окрашивание серийных криостатных срезов тканей производилось пероксидазным методом, используя моно- и поликлональные антитела и систему визуализации EnVision™ (DAKO). Рабочие концентрации первичных антител в 4-10 раз превышали концентрации, рекомендуемые прилагаемыми инструкциями. Для разведения первичных антител использовали растворитель антител, редуцирующий фоновое окрашивание (DAKO). Все этапы окрашивания проходили на нагревательном столике при температуре 37°С. Суммарное время реакции (без микроскопии и оценки полученных результатов): 12 мин 05 с. Учитывая время, необходимое для приготовления криостатных срезов, для микроскопии и оценки полученных результатов суммарное время колеблется в пределах 20-22 минут.
Данный способ принят нами за прототип. Главный недостаток прототипа состоит в том, что длительность выполнения исследования превышает 12 мин. В то время как одной из главных задач морфологического метода исследования является прижизненная диагностика патологических процессов по биопсийному и операционному материалу и, прежде всего, диагностика по криостатным срезам непосредственно в ходе оперативного вмешательства. Интраоперационная морфологическая диагностика является очень сложной задачей даже для опытных специалистов, поскольку она происходит в условиях дефицита времени (12-15 минут) и опирается исключительно на форму тканевых структур, размеры клеток и т.д., что не исключает эвристических ошибок. Вместе с тем от первичного морфологического диагноза зависит тактика хирургического лечения, определение возможности органосохраняющей операции, определение уровня иссечения тканей и т.д. В связи с этим высокоактуальным является внедрение в интраоперационнную морфологическую диагностику методики иммуногистохимического исследования тканей, позволяющей более быстро и точно определить гистогенез опухоли, ее злокачественный потенциал, выявить микрометастазы, оценить состояние края резекции, наличие в краях резекции опухолевых клеток и т.д.
Задачей данного изобретения является повышение эффективности интраоперационной диагностики за счет ускорения иммуногистохимической окраски тканевых криостатных срезов для дальнейшего микроскопического исследования.
Поставленная задача достигается тем, что осуществляют все необходимые этапы окрашивания: фиксацию срезов в ацетоне, воздействие первичных и вторичных антител на антигенные структуры ткани, промывку в Трис-буфере рН 7,4 и инкубацию с субстрат-хромогеном, промывку дистиллированной водой, контрастирование гематоксилином и заключение в бальзам. Но инкубация тканевых срезов со смесью первичных и вторичных антител проводится одновременно, для чего сначала на срезы наносят первичные антитела, а через 15 секунд инкубации (не промывая буфером) наносят вторичные антитела; для инкубации с субстрат-хромогеном используют свежеприготовленный раствор субстрат-хромогена непосредственно перед его нанесением; промывку осуществляют раствором буфера и дистиллированной водой, нагретыми до температуры 37°С. Все вышеперечисленные приемы позволяют существенно сократить время иммуногистохимической реакции. Таким образом, предлагаемый нами отход от стандартной методики вызван необходимостью максимально сократить время исследования опухолевой ткани в момент операции, когда хирурги вынуждены прервать операцию и ждать у операционного стола результатов иммуноморфологического исследования, определяющих дальнейшую тактику оперативного лечения.
Иммуногистохимическое окрашивание предоставляет уникальную возможность для оценки биологического потенциала опухолевых клеток: темп роста, прогноз течения опухолевого процесса, реакция на химиотерапию и гормональное лечение. Имеется высокая степень достоверности при ИГХ в определении фенотипа опухоли, а в ряде случаев ИГХ устраняет необходимость применения других более дорогостоящих и продолжительных по времени диагностических мероприятий.
Заявляемая методика позволяет использовать довольно широкий спектр антител. Нами были использованы маркеры: Cytokeratin (АЕ1/АЕ3), Cytokeratin 7 (OV-TL 12/30), Vimentin (V9), PLAP (8A9), LCA (2B11+PD7/26), S-100, Melanosom (HMB45), Synaptophysin(SY38), CD30 (Ber-H2), Ki-67 (MIB-1), р63 (4A4), Cytokeratin 34bE12 (34bE12), CA-125 (Ov185:1), PSA (ER-PR8), Galectin-3 (9C4), p504S (13H4), p53 (DO-7) (DAKO).
Первая серия наших исследований была посвящена интраоперационному изучению соответствующих тканей разработанной нами методикой быстрого иммуногистохимического окрашивания криостатных срезов тканей.
Во второй серии исследований было проведено послеоперационное иммуногистохимическое изучение соответствующих тканей на парафиновых срезах по стандартной методике с теми же маркерами и реагентами визуализации. Сравнительный анализ результатов окрашивания показал полное совпадение иммунофенотипических признаков опухолевых клеток, обнаруженных как на криостатных, так и на парафиновых срезах. Вариабельной была лишь интенсивность окраски.
В результате проведенного исследования разработанная нами методика иммунофенотипирования на криостатых тканях имеет продолжительность в 7-8 минут. Детали протокола представлены в таблице 2.
25°С
Суммарное время реакции: 7 мин 05 с.
Новыми приемами, в отличие от методики P.Ruck, являются:
1. Повышение температуры высушивания до 37°С, за счет чего сокращается время высушивания после фиксации в ацетоне.
2. Устранение этапа промывки буферным раствором после инкубации с первичными антителами за счет одновременной инкубации тканевых срезов со смесью первичных и вторичных антител (т.е. пункты №2 и №4 методики P.Ruck объединены в один пункт, а пункт №3 методики P.Ruck отменен). Т.о. сокращается время инкубации с первичными и вторичными антителами.
3. Первоначально наносят первичные антитела на тканевые срезы, а через 15 секунд инкубации (не промывая буфером) наносят вторичные антитела. Общее время инкубации на этом этапе - 4 мин.
4. Использование свежеприготовленного раствора субстрат-хромогена непосредственно перед его нанесением, за счет чего сокращается время инкубации с субстрат-хромогеном с 3 мин до 1 мин.
5. Использование раствора буфера и дистиллированной воды, нагретых до температуры 37°С, за счет чего сокращается время промывки тканевых срезов после инкубации.
6. После инкубации с гематоксилином сокращается время промывки водой на 15 с и время заключения в бальзам на 15 с.
Сравнительный анализ с прототипом показал, что заявляемый способ имеет новые существенные отличия от известных; в результате время выполнения иммуногистохимической реакции на замороженных срезах сокращается на 5 мин, что в условиях интраоперационной диагностики имеет существенное значение. Это позволяет сделать вывод о соответствии критериям «новизна», «существенные отличия» и «промышленная применимость».
Подробное описание способа и примеры его практического выполнения.
Изучают серийные криостатные срезы тканей, окрашенные гематоксилином и эозином, и производят иммуногистохимическое окрашивание пероксидазным методом, используя моно- и поликлональные антитела и систему визуализации EnVision™ (DAKO, Дания). Выбор системы визуализации определен ее высокой чувствительностью и двухшаговой процедурой окраски, занимающей меньше времени, чем ABC-метод. Рабочие концентрации первичных антител соответствуют рекомендациям прилагаемых инструкций или превышают их в 2-10 раз. Для разведения первичных антител используют растворитель антител, редуцирующий фоновое окрашивание (DAKO). Все этапы окрашивания проводят на нагревательном столике при температуре 37°С.
На криостатный тканевый срез, фиксированный в ацетоне в течение 50 секунд первоначально наносят первичные, а через 15 секунд инкубации (не промывая буфером) вторичные антитела и инкубируют 4 минуты при температуре 37°С с последующим окрашиванием субстрат-хромогеном и контрастированием гематоксилином. Раствор субстрат-хромогена готовят непосредственно перед его нанесением. Для промывки тканевых срезов используют раствор буфера и дистиллированную воду, нагретые до температуры 37°С.
Примеры работы с тканью предстательной железы:
Пример 1. Пациент Д. Иммуногистохимическое окрашивание криостатного среза ткани карциномы предстательной железы с антителами к высокомолекулярным цитокератинам, clone 34βЕ12, увеличение ×10 (фиг.1). На рисунке видна положительная мембранная окраска (коричневая) базальных клеток неопухолевых желез с антителами к высокомолекулярным цитокератинам, clone 34βЕ12 и отрицательная окраска с этими же антителами в участке опухолевых желез, что является иммуноморфологическим диагностическим признаком аденокарциномы предстательной железы. Время исследования - 7 минут.
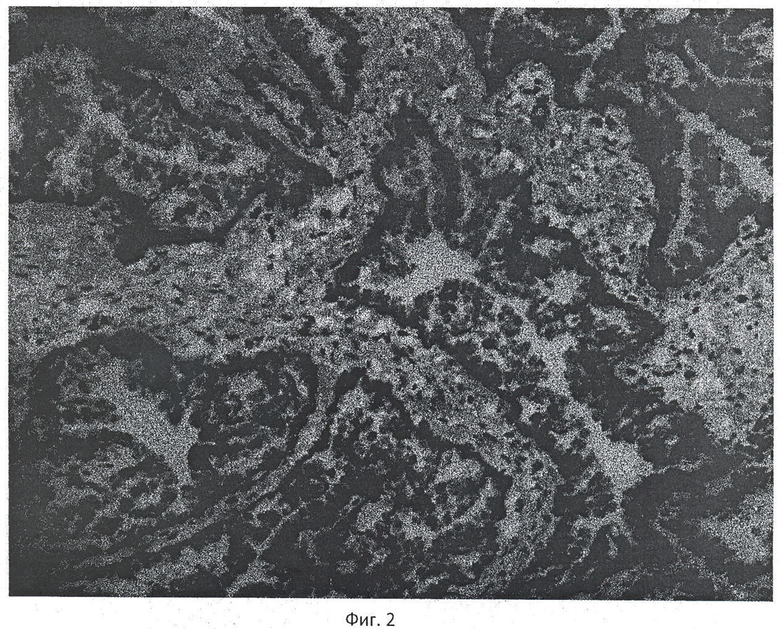
Пример 2. Пациент С. Иммуногистохимическое окрашивание криостатного среза ткани предстательной железы с антителами к высокомолекулярным цитокератинам, clone 34βE12, увеличение ×20 (фиг.2). На рисунке видна положительная мембранная окраска (коричневая) базальных клеток неопухолевых желез с антителами к высокомолекулярным цитокератинам, clone 34βЕ12. Участков аденокарциномы в исследованном материале нет. Время исследования - 7 минут 4 с.
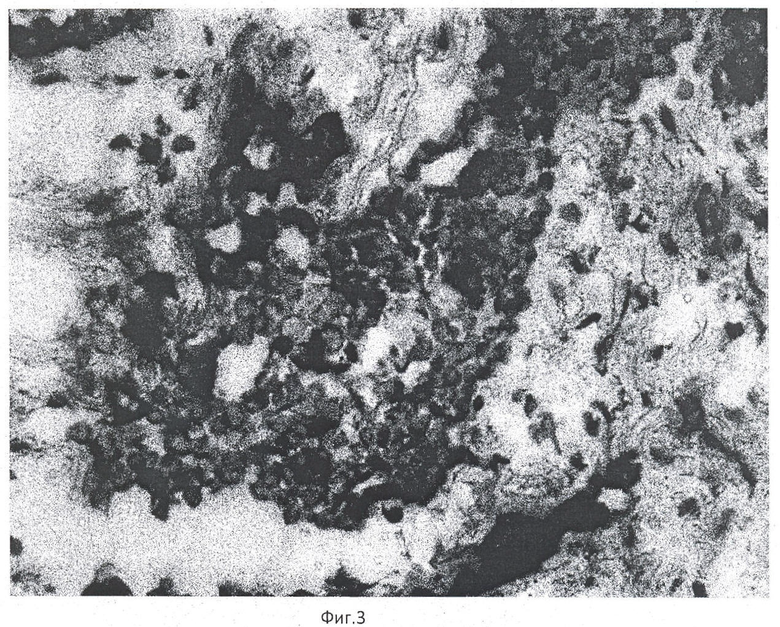
Пример 3. Пациент А. Иммуногистохимическое окрашивание криостатного среза ткани карциномы предстательной железы с антителами к p504S (clone 13Н4), увеличение ×40 (фиг.3). На рисунке видна положительная цитоплазматическая окраска (коричневая) части опухолевых клеток с антителами к p504S (clone 13Н4), что является признаком малигнизации. Время исследования - 7 минут 6 с.
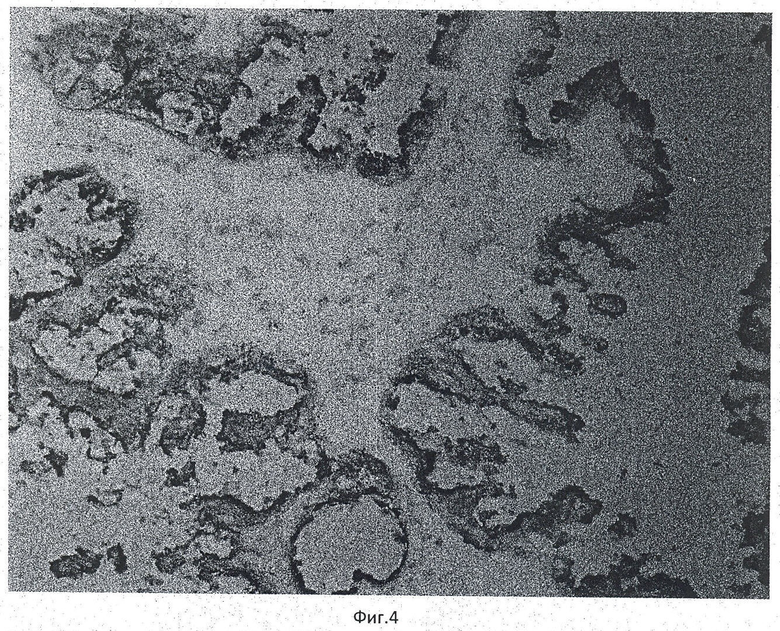
Пример 4. Пациент И. Иммуногистохимическое окрашивание криостатного среза ткани опухоли яичника с антителами к СА-125 (clone Ov185:1), увеличение ×20 (фиг.4). На рисунке видна положительная цитоплазматическая окраска (коричневая) опухолевых клеток с антителами к СА-125 (clone Ov185:1), что свидетельствует о происхождении опухоли из ткани яичника. Время исследования - 7 минут 5 с.
Пример 5. Пациент А. Иммуногистохимическое окрашивание криостатного среза ткани опухоли легкого с антителами к цитокератину 7 (clone OV-TL 12/30), увеличение ×20 (фиг.5). На рисунке видна положительная мембранная окраска (коричневая) опухолевых клеток с антителами к цитокератину 7 (clone OV-TL 12/30). Время исследования - 7 минут.
Пример 6. Пациент Р. Иммуногистохимическое окрашивание криостатного среза ткани опухоли толстой кишки с антителами к цитокератину (clone АЕ1/АЕ3), увеличение ×20 (фиг.6). На рисунке видна положительная цитоплазматическая окраска (коричневая) опухолевых клеток с антителами к панцитокератину (clone АЕ1/АЕ3). Время исследования - 7 минут 6 с.
Наши исследования выполнены на операционном материале Краевой клинической больницы №1 им. проф. С.В.Очаповского г.Краснодара. Исследовали удаленные части легких, бронхобиоптаты, биоптаты опухолей средостения, ткани краев резекции предстательной железы, ткани опухоли предстательной железы, ткани опухолей кишечника, яичников, щитовидной железы, полученные от 73 пациентов, находившихся на лечении с октября 2007 г. по март 2009 г. Результаты и качество иммуногистохимической окраски криостатных и парафиновых срезов тканей были идентичны во всех случаях.
Таким образом, в результате проведенных исследований нами разработан быстрый метод иммуногистохимической окраски на криостатных срезах, позволяющий сократить процедуру окрашивания в среднем до 7-8 минут, что делает актуальным его широкое использование при интраоперационной диагностике.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУННОГИСТОХИМИЧЕСКОЙ ДЕТЕКЦИИ ПРОТЕИНОВ НА ГИСТОЛОГИЧЕСКИХ СРЕЗАХ | 1994 |
|
RU2098825C1 |
| Штамм гибридных культивируемых клеток MUS мUSсULUS, используемый для получения моноклональных антител к глиальному фибриллярному кислому белку человека | 1990 |
|
SU1726512A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПСЕВДОСОСУДОВ, СФОРМИРОВАННЫХ МАКРОФАГАМИ, В МЕЛАНОМАХ ХОРИОИДЕИ В ПРОЦЕССЕ ПРИЖИЗНЕННОГО ПАТОЛОГО-АНАТОМИЧЕСКОГО ИССЛЕДОВАНИЯ | 2022 |
|
RU2790775C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ГРУПП ИЗОФОРМ ТКАНЕСПЕЦИФИЧЕСКОГО ТРАНСКРИПЦИОННОГО ФАКТОРА HNF4α В ГЕПАТОЦЕЛЛЮЛЯРНЫХ КАРЦИНОМАХ ЧЕЛОВЕКА | 2012 |
|
RU2522859C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННОЙ И ДОБРОКАЧЕСТВЕННОЙ ПАТОЛОГИИ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2530557C1 |
| ПРЯМОЙ ИММУНОГИСТОХИМИЧЕСКИЙ АНАЛИЗ | 2015 |
|
RU2744836C2 |
| Способ прогнозирования появления отдаленных метастазов меланомы хориоидеи | 2022 |
|
RU2790468C1 |
| Способ диагностики классической чумы свиней непрямым иммуногистохимическим анализом на основании моноклональных антител | 2021 |
|
RU2782275C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ И РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ГИСТОЛОГИЧЕСКИХ СРЕЗАХ | 1994 |
|
RU2107911C1 |
| Мышиная гибридома SI-CLP, клон 3D4 - продуцент моноклонального антитела, обладающего специфичностью к белку SI-CLP | 2019 |
|
RU2714685C1 |


Изобретение относится к области медицины. Осуществляют одновременную инкубацию тканевых срезов со смесью первичных и вторичных антител. Первоначально на тканевые срезы наносят первичные антитела, а через 15 секунд инкубации, не промывая буфером, наносят вторичные антитела. Затем проводят совместную инкубацию в течение 4 минут. Раствор субстрат-хромогена для инкубации готовят непосредственно перед его нанесением, промывку срезов осуществляют раствором буфера и дистиллированной водой, нагретыми до температуры 37°С. Способ позволяет быстро и точно установить гистогенез опухоли, выявить опухолевые клетки в краях резекции. 6 ил., 2 табл.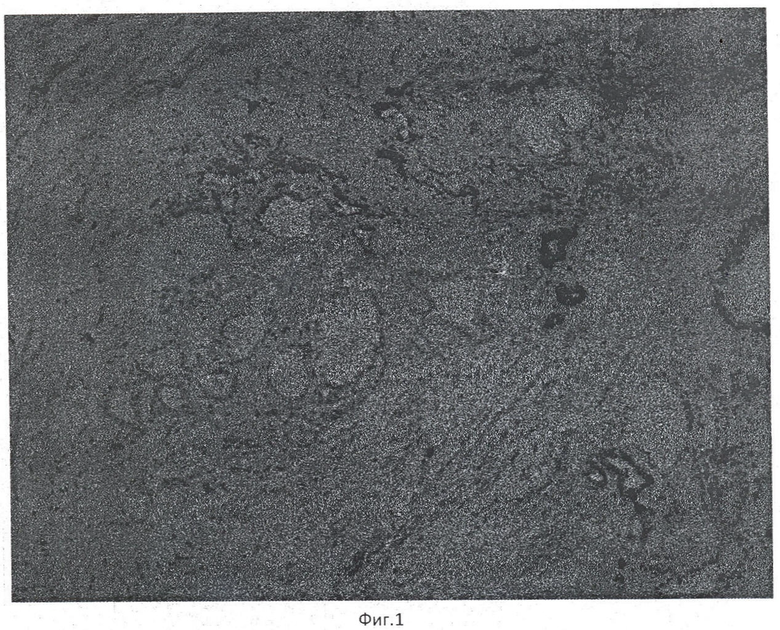
Способ иммуногистохимического окрашивания криостатных срезов тканей в условиях интраоперационной диагностики путем фиксации срезов в ацетоне, воздействия первичных и вторичных антител на тканевый срез, промывки в Трис-буфере рН 7,4 и инкубации с субстрат-хромогеном, промывки дистиллированной водой, контрастирования гематоксилином и заключения в бальзам, отличающийся тем, что осуществляют одновременную инкубацию тканевых срезов со смесью первичных и вторичных антител, для чего первоначально на тканевые срезы наносят первичные антитела, а через 15 с инкубации, не промывая буфером, наносят вторичные антитела и проводят совместную инкубацию в течение 4 мин, раствор субстрат-хромогена для инкубации готовят непосредственно перед его нанесением, промывку срезов осуществляют раствором буфера и дистиллированной водой, нагретыми до температуры 37°С.
| KAMMERER U | |||
| et al | |||
| A new rapid immunohistochemical staining technique using the EnVision antibody complex | |||
| J Histchem Cytochem, 2001, v.49 (5), p.623-630 | |||
| MONIG S.P | |||
| et al | |||
| Rapid immunohistochemical detection of tumor cells in gastric carcinoma | |||
| Oncology reports | |||
| Oncol | |||
| Rep | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПЛОСКОКЛЕТОЧНОГО РАКА КОЖИ И КЕРАТОАКАНТОМЫ | 2004 |
|
RU2279089C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАННИХ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ С РЕВМАТИЧЕСКИМИ ПОРОКАМИ СЕРДЦА | 2006 |
|
RU2336528C2 |
Авторы
Даты
2011-05-27—Публикация
2009-10-16—Подача