ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение включено в область приготовления модулирующих иммунный ответ агентов.
УРОВЕНЬ ТЕХНИКИ
TGF-β1 (трансформирующий фактор роста β1) является сильным иммуномодулятором, присутствующим на всех стадиях иммунного ответа, производящего различные эффекты. В настоящее время он известен в качестве сильного регулятора клеток иммунной системы, в том числе лимфоцитов, макрофагов и дендритных клеток (Letterio J.J., 1998).
Биологическая активность TGF-β1 сильно варьирует в зависимости от типа и стадии клеточной дифференциации, а также присутствия других цитокинов, что говорит о том, что изменение баланса этого набора цитокинов может также оказывать влияние на TGF-β1 и вносить вклад в развитие патологий, связанных с нарушением функции иммунной системы. TGF-β1 регулирует иммунный ответ сложным контекстнозависимым образом, выявленным с помощью использования экспериментальных моделей различных заболеваний, а также анализа генетически модифицированных мышей в отношении экспрессии TGF-β1, его рецепторов или регулирующих белков. TGF-β1 регулирует функцию и взаимодействие клеток иммунной системы при формировании гуморального, цитотоксического ответа и иммунологической толерантности и патологическое возникновение многих инфекционных и аутоиммунных заболеваний.
Т-лимфоциты, по-видимому, регулируются TGF-β1 на всех стадиях их развития (Fontana A. et al., 1992). Эффект TGF-β1 варьирует в соответствии со стадией дифференциации лимфоцита и типом сигнала активации, который он получил. В первых исследованиях эффекта TGF-β1 на лимфоциты человека обнаружена способность таких лимфоцитов продуцировать и секретировать TGF-β1 в качестве ингибитора зависимой от IL-2 пролиферации и цитолитической функции (Pardoux C. et al., 1997).
Дендритные клетки представляют собой популяцию лейкоцитов, дифференцирующихся, по-видимому, благодаря их функционированию в качестве антигенпрезентирующих клеток при активации ответов Т-лимфоцитов. Они являются высокоспециализированной клеточной популяцией, включающей эпидермальные клетки Лангерганса и фолликулярные дендритные клетки лимфатических узлов, причем TGF-β1 регулирует как их дифференциацию, так и их активность (Strobl H. Knapp W., 1999).
Установлено, что TGF-β1 усиливают in vitro функциональную дифференциацию дендритных клеток из предшественников CD34+, индуцированную присутствием других цитокинов (TNF-α, SCF и GM-CSF). TGF-β1 также увеличивает жизнеспособность дендритных клеток в культуре. С другой стороны, роль TGF-β1 для этого типа клеток также, по-видимому, связана с регуляторным механизмом, с помощью которого ингибируются ответы низкой специфичности для исключения аутоиммунных процессов.
При дифференциации, пролиферации В-клеток и продукции ими Ig (иммуноглобинов) TGF-β1 играет регуляторную роль через ингибирование уровней определенных поверхностных молекул, в том числе главного комплекса гистосовместимости типа II (MCH-II) как пре-В-лимфоцитов, так и зрелых В-клеток. С другой стороны, TGF-β1 ингибирует секрецию Ig в общем, но отчетливо индуцирует продукцию IgА, поэтому он выполняет важную роль в иммунном ответе, связанном с секретирующими слизь мембранами. Большинство исследований действия TGF-β1 в качестве ингибитора продукции всех типов Ig проводилось in vitro. Однако также была описана необходимость в культуре лимфоцитов определенных уровней TGF-β1, которые действуют на аутокринном уровне, для эффективной продукции IgG и IgE. Таким образом, функция TGF-β1 в индукции антител, как и во многих других процессах, является двойственной и противоположной в соответствии с контекстом иммунного ответа (Lebman D. A., Edmiston J.S., 1999).
В случае макрофагов действие TGF-β1 на тканевом уровне является, как правило, супрессивным и вносит вклад в окончательное формирование воспалительного ответа.
Вероятно, наиболее релевантное действие TGF-β1 на инактивацию макрофагов обусловлено его способностью ограничивать продукцию клетками, активированными IFN-γ или LPS, реагирующих с кислородом частиц и промежуточных продуктов метаболизма азота. Ферментом, ответственным за продукцию NO (оксида азота) активированными макрофагами, является индуцибельная форма фермента синтазы оксида азота (iNOS). Регуляция активности этого фермента различными цитокинами, в том числе TGF-β1, позволяет регулировать иммунный ответ в общем и, в частности, реакцию макрофагов на микроорганизмы и опухолевые клетки. TGF-β1 ингибирует фермент iNOS как на уровне транскрипции, уменьшая уровни мРНК, так и подавляя активность белка. TGF-β1 также ингибирует продукцию промежуточных реагирующих с кислородом частиц и окислительную цитотоксичность посредством инактивации макрофагов и контролирования моноцитов периферической крови (Ashcroft G.S., 1999).
Кроме того, активация или продукция TGF-β1, а также изменение его пути передачи сигнала описаны при многих заболеваниях, вызванных инфекцией различных микроорганизмов, в том числе Leishmania, Trypanosoma cruzi, вируса иммунодефицита человека, вируса гепатита С, …
Наиболее близкими к настоящему изобретению документами предшествующего уровня техники являются патент ES 2146552 и заявка на патент ES200302020. Первый документ относится к применению антагонистических в отношении соединения TGF-β1 с его рецепторами в организме пептидов, характеризующихся тем, что они имеют частичные аминокислотные последовательности, идентичные или схожие с последовательностями TGF-β1 и/или его рецепторов; а также к их применению для приготовления композиции, применимой при заболеваниях печени, в частности фиброзе печени. Этим документом защищен пептид р144 (SEQ ID NO:1), а также его упомянутое выше применение, хотя в нем нет упоминания о его применении для приготовления модулирующего иммунный ответ агента, являющегося целью настоящего изобретения.
Заявкой на патент ES200302020 защищаются ингибирующие биологическую активность TGF-β1-пептиды, полученные из библиотеки фагов, и их применение для лечения заболеваний, прогрессирующих при нарушении регуляции экспрессии TGF-β1, в частности фиброзных изменений. Этим документом защищен пептид р17 (SEQ ID NO:2) и указанное применение, но снова он не относится к его применению для приготовления имуномодулирующего агента.
Иммуномодулирующий иммунную систему эффект очень важен, поскольку он позволяет стимулировать или ингибировать различные аспекты иммунного ответа в соответствии с требованиями, и он даже может найти применение в качестве адъюванта при вакцинации.
Другим релевантным документом является заявка на патент WO 2005/059133A2, относящаяся к фармацевтической композиции, которая содержит по крайней мере один стимулятор функции иммунных клеток и по крайней мере одно вещество, ингибирующее пролиферацию клеток и/или индуцирующее гибель клеток. Антагонист TGF-β1, выбираемый из олигонуклеотидов, гибридизующихся с мРНК или ДНК, кодирующей TGF-β1, ингибирующих TGF-β1 белков и пептидов с молекулярной массой ниже 100 кДа, которые ингибируют TGF-β1, используется в качестве стимулятора функции иммунной системы. Кроме того, этот документ относится к применению указанной фармацевтической композиции для лечения опухолей. Тем не менее, в этом документе не применяется какой-либо пептид в качестве ингибитора TGF-β1 вместо олигонуклеотида, хотя и можно сделать вывод, что пептид с такими характеристиками будет иметь, в принципе, схожий эффект. Это невозможно подтвердить без значительного экспериментирования.
Ниже представлен список цитируемой в настоящей заявке литературы.
Ashcroft GS. (1999). Bidirectional regulation of macrophage function by TGF-beta. Microbes Infect. Dec; 1 (15): 1275-82.
Fontana A, Constam DB, Frei K, Malipiero U, Pfister HW. Modulation of the immune response by transforming growth factor beta. (1992) Int Arch Allergy Immunol.; 99(1): 1-7.
Lai M.Z., Ross D.T., Guillet J.G., Briner T.G., Gefter M.L., Smith J.A. (1987). T lymphocyte response to bacteriophage lambda repressor cl protein. Recognition of the same peptide present by la molecules of different haplotypes. J. Immunol 139, 3973-80.
Letterio J.J., Roberts A.B. (1998). Regulation of immune responses by TGF-beta. Annu Rev Immunol 16, 137-761.
Lebman DA, Edmiston JS. (1999). The role of TGF-beta in growth, differentiation and maturation of В lymphocytes. Microbes Infect. Dec; 1 (15): 1297-304.
Pardoux, C, Ma, X., Gobert, S., Pellegrini, S., Mayeux, P., Gay, F., Trinchieri, G., Chouaib, S. (1999). Downregulation of interleukin-12 (IL-12) responsiveness in human T cells by transforming growth factor-beta: relationship with IL-12 signaling. Blood 93, 1448-55.
Schini V.B., Durante W., Elizondo E., Scott-Burden Т., Junquero D.C., Schafer A.I., Vanhouette P.M. (1992). The induction of nitric oxide synthase activity is prohibited by TGF-beta 1, PDGFAB and PDGFBB in vascular smooth muscle cells. Eur J Pharmacol 216, 379-83.
Strobl H, Knapp W. (1999). TGF-beta1 regulation of dendritic cells. Microbes infect. Dec; 1 (15):1283-90.
Teicher B.A. (2001). Malignant cells, directors of the malignant process: Role of transforming: Role of transforming growth factor-beta. Cancer and Metastasis Reviews 20, 133-143.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для облегчения понимания текста настоящей заявки отмечается, что термин «пептид р144» относится к ингибирующему TGF-β1 пептиду, который отличается тем, что его аминокислотная последовательность соответствует последовательности, определенной в SEQ ID NO:1. Подобным образом термин «пептид р17» относится к ингибирующему активность TGF-β1 пептиду, который отличается тем, что его аминокислотная последовательность соответствует последовательности, определенной в SEQ ID NO:2.
«Неполный адъювант Фрейнда» относится к композиции, очень хорошо известной квалифицированному в данной области техники специалисту, которая характеризуется тем, что она состоит из эмульсии типа вода в масле, которая действует в качестве адъюванта, замедляющего высвобождение антигена.
Настоящее изобретение относится к модулирующему иммунный ответ агенту, отличающемуся тем, что он включает ингибирующий TGF-β1 пептид, выбираемый из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, и их фрагментов. В конкретном варианте осуществления настоящего изобретения указанный фрагмент ингибирующего TGF-β1 пептида выбирают из фрагмента р17(1-11), определенного в последовательности SEQ ID NO:3, фрагмента р17(1-11)am, который соответствует SEQ ID NO:4, и фрагмента Acp17(1-11)am, определенного последовательностью SEQ ID NO:5.
С другой стороны, настоящее изобретение также относится к применению указанного модулирующего агента для регуляции гуморального или клеточного иммунных ответов или обоих ответов. В предпочтительном варианте осуществления настоящее изобретение относится к применению модулирующего агента в качестве адъюванта при вакцинации. В конкретном варианте осуществления настоящего изобретения модулирующий иммунный ответ агент отличается тем, что он дополнительно содержит неполный адъювант Фрейнда.
В предпочтительном варианте осуществления настоящее изобретение относится к применению указанного модулирующего агента для приготовления фармацевтической композиции для лечения патологий, выбираемых из патологий, связанных с микроорганизмами, которые индуцируют опосредуемую TGF-β1 иммуносупрессию, и рака. Предпочтительно указанные микроорганизмы выбраны из Leishmania, Trypanosoma cruzi, вируса иммунодефицита человека, вируса гриппа и вируса простого герпеса. Подобным образом в конкретном варианте осуществления настоящего изобретения упомянутая выше композиция предназначена для лечения рака, выбираемого из рака молочной железы, рака предстательной железы, карциномы толстой кишки, рака поджелудочной железы, рака кожи, гепатокарциномы, множественной миеломы и рака желудка.
Настоящее изобретение относится к применению ингибирующего TGF-β1 пептида, выбираемого из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, и их фрагментов, для приготовления модулирующего иммунный ответ агента.
Кроме того, настоящее изобретение относится к способу применения ингибирующего TGF-β1 пептида, выбираемого из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, или их фрагментам для приготовления модулирующего иммунный ответ агента.
Кроме того, настоящее изобретение относится к применению фрагмента ингибирующего TGF-β1 пептида, полученного из пептида р17, выбираемого из фрагмента р17(1-11), определенного в последовательности SEQ ID NO:3, фрагмента р17(1-11)am, который соответствует SEQ ID NO:4, и фрагмента Acp17(1-11)am, определенного последовательностью SEQ ID NO:5. Для облегчения понимания текста настоящей заявки отмечается, что пептид р17(1-11)am соответствует фрагменту, соответствующему аминокислотам 1-11 пептида р17, причем аминокислота в положении 11 (триптофан) является амидированной; Acp17(1-11)am соответствует раннее указанному фрагменту, который дополнительно имеет ацетилированную аминокислоту в положении 1 (лизин).
Настоящее изобретение также относится к пептидам, которые гомологичны указанным пептидам на по крайней мере 70% и предпочтительно на 80% при условии, что они сохраняют способность ингибировать биологическую активность TGF-β1, а также к любому фрагменту вышеуказанных пептидов, который сохраняет способность ингибировать биологическую активность TGF-β1.
В предпочтительном варианте осуществления настоящее изобретение относится к применению упомянутого выше ингибирующего TGF-β1 пептида, отличающемуся тем, что упомянутый выше модулирующий агент регулирует гуморальный или клеточный иммунные ответы или оба этих ответа. В конкретном варианте осуществления настоящего изобретения указанный модулирующий агент оказывает стимулирующий эффект на иммунный ответ, предпочтительно в качестве адъюванта при вакцинации.
С другой стороны, предпочтительный вариант осуществления настоящего изобретения характеризуется тем, что указанный модулирующий агент оказывает ингибирующий эффект на иммунный ответ.
Кроме того, настоящее изобретение относится к применению последовательности ДНК, кодирующей ингибирующий TGF-β1 пептид, выбираемый из пептида р144, последовательность которого соответствует SEQ ID NO:1, пептида р17, последовательность которого соответствует SEQ ID NO:2, пептида, гомологичного вышеуказанным пептидам на по крайней мере 90%, и их фрагментов, для приготовления модулирующего иммунный ответ агента. Изобретение, кроме того, относится к применению рекомбинантной экспрессирующей системы, кодирующей пептид р144, пептид p17, пептид, гомологичный вышеуказанным пептидам на по крайней мере 90%, или их фрагменты, для приготовления модулирующего иммунный ответ агента. В предпочтительном варианте осуществления настоящего изобретения указанный модулирующий иммунный ответ агент оказывает эффект, выбираемый из стимулирующего и ингибирующего иммунный ответ эффектов.
С другой стороны, настоящее изобретение относится к применению ингибирующего TGF-β1 пептида, последовательность которого соответствует SEQ ID NO:1, пептида, гомологичного вышеуказанному пептиду на по крайней мере 90%, или фрагментов одного из вышеуказанных пептидов для приготовления композиции для лечения патологий, выбираемых из патологий, связанных с микроорганизмами, которые индуцируют опосредуемую TGF-β1 иммуносупрессию, и рака. В конкретном варианте осуществления настоящего изобретения указанные микроорганизмы выбраны из Leishmania, Trypanosoma cruzi, вируса иммунодефицита человека, вируса гриппа и вируса простого герпеса.
Конкретный вариант осуществления настоящего изобретения характеризуется тем, что указанная композиция будет вызывать эффект индукции иммунных ответов на укоренившиеся опухоли, ингибируя иммуносупрессивный эффект, связанный с продукцией и/или активацией TGF-β1 в различных типах опухолей (Teicher B.A., 2001): раке молочной железы, раке предстательной железы, карциноме толстой кишки, раке поджелудочной железы, раке кожи, гепатокарциноме, множественной миеломе и раке желудка.
Модулирующий агент, являющийся целью настоящего изобретения, можно использовать для любого вида млекопитающих, в том числе грызунов и приматов, и в предпочтительном варианте осуществления для людей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
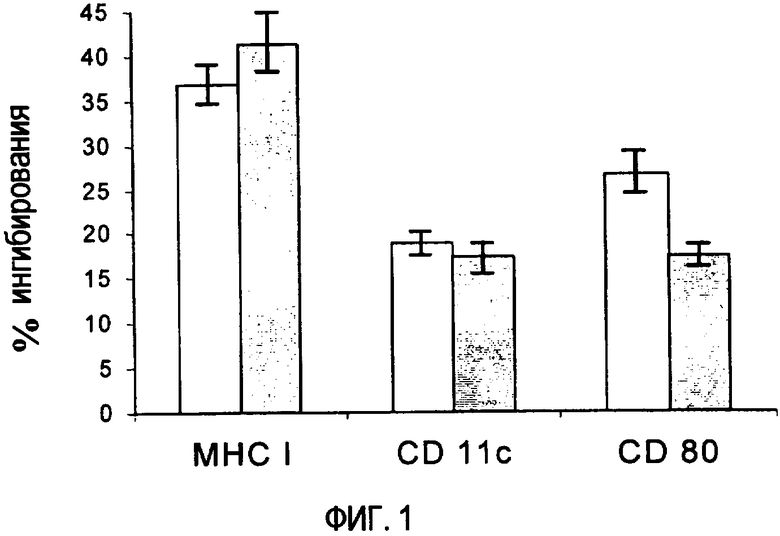
Фиг. 1. Ингибирование экспрессии различных маркеров во время созревания дендритных клеток после инкубации с р144 (заполненные прямоугольники) или антителами, нейтрализующими TGF-β1 (пустые прямоугольники). Экспрессию маркеров клеточной поверхности определяли с помощью проточной цитометрии.
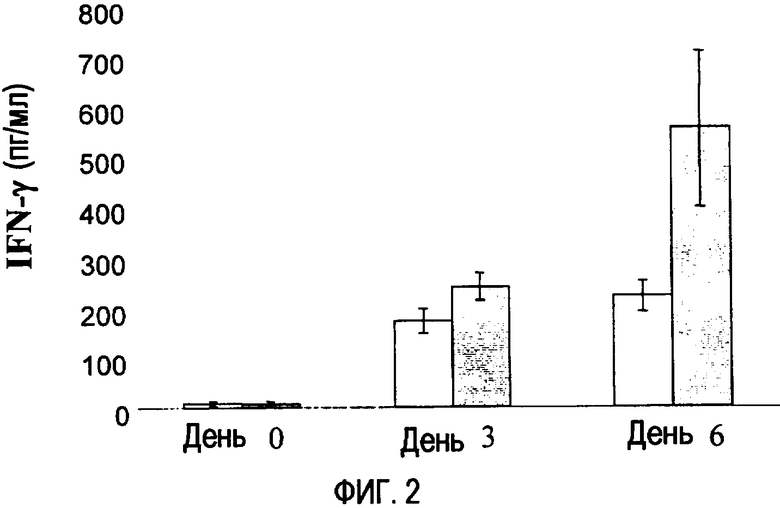
Фиг. 2. Эффект введения р144 и/или RАd-IL-12 мышам BALB/c на уровни IFN-γ в сыворотке в дни 0, 3 и 6. Внутрибрюшинно вводили 108 бляшкообразующих единиц RАd-IL-12 (пустые прямоугольники) или RАd-IL-12 + р144 (заполненные прямоугольники).
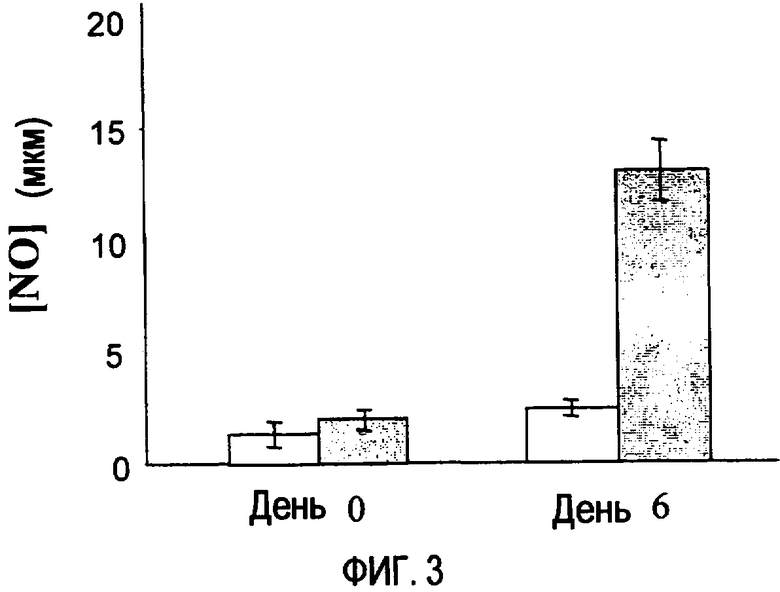
Фиг. 3. Уровни NO (мкМ) в сыворотке в дни 0 и 6 после внутрибрюшинного введения 108 бляшкообразующих единиц RАd-IL-12 вместе с р144 (заполненные прямоугольники) или без него (пустые прямоугольники).
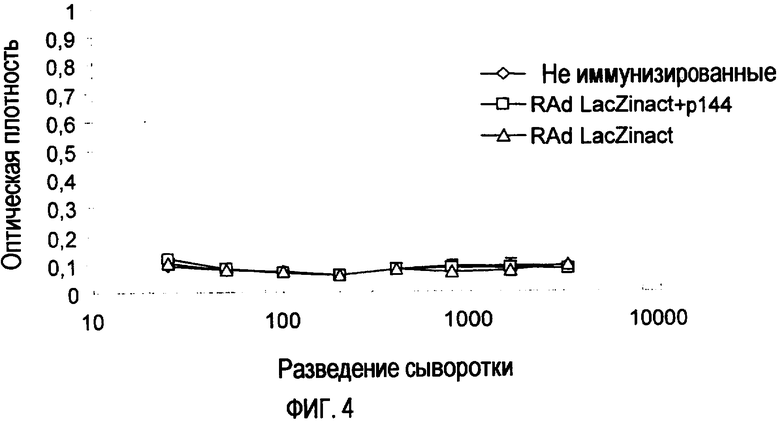
Фиг. 4. Гуморальный ответ, индуцированный RAd-LacZ, на 15-й день у мышей BALB/c после подкожной иммунизации (в FIA) RAd-LacZinact в присутствии или в отсутствие р144.
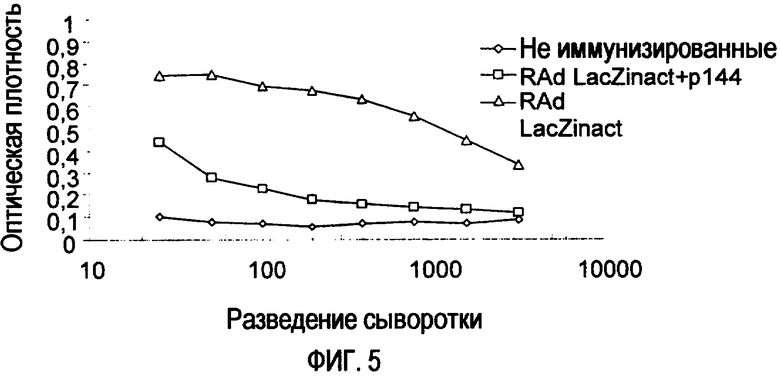
Фиг. 5. Гуморальный ответ, индуцированный RAd-LacZ, на 15-й день у мышей BALB/c после второй подкожной иммунизации (в FIA) RAd-LacZinact в присутствии или в отсутствие р144.
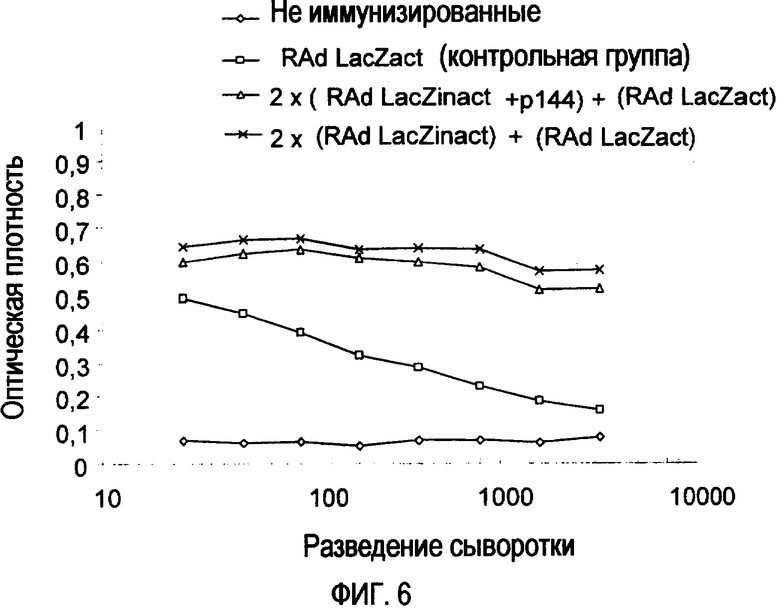
Фиг. 6. Гуморальный ответ, индуцированный у мышей на фиг. 5, на седьмой день после инфицирования с помощью внутривенного введения 4×108 бляшкообразующих единиц RAd-LacZact. Контрольная группа соответствует мышам, которым вводили внутривенно только 4×108 бляшкообразующих единиц RAd-LacZact.
Фиг. 7. Окрашивание красителем X-gal гистологических срезов образцов печени от мышей на фиг. 6 через 7 дней после внутривенного введения 4×108 бляшкообразующих единиц RAd-LacZact.
Фиг. 8. Эффект включения р144 в смеси для иммунизации с FIS на уровни IL-2 (А) и IFN-γ (В) в супернатантах культур лимфоцитов, происходящих из лимфатических узлов мышей, иммунизированных только FIS или FIS + р144. Продукцию цитокинов определяли in vitro после повторной стимуляции культур 6 мкМ (пустые прямоугольники) или 30 мкМ (заполненные прямоугольники) FIS или р144.
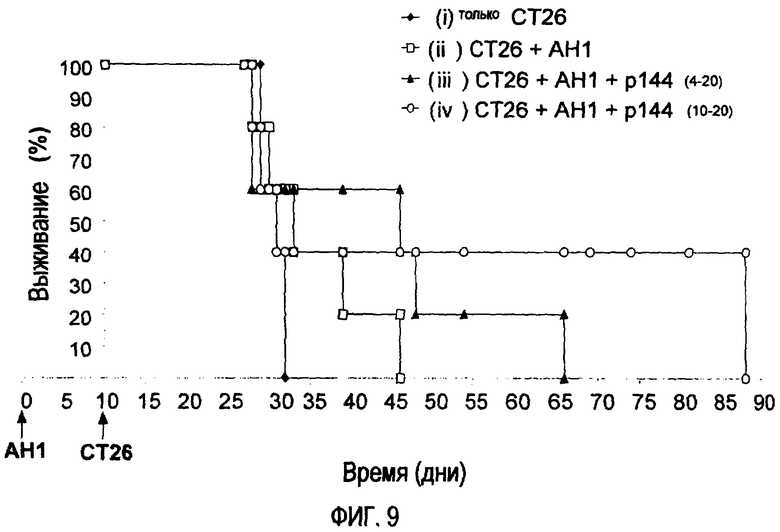
Фиг. 9. Выживание мышей BALB/c, которым внутривенно вводили 5×105 клеток СТ26 и которых подвергали различным обработкам (i)-(iv). За исключением контрольной группы, которая получила только 5×105 клеток СТ26 на 10-й день, три оставшиеся группы, кроме того, иммунизировали с помощью подкожного введения 50 мкг AH1 в FIA в день 0. Группы (iii) и (iv) дополнительно получали 50 мкг р144 с помощью внутрибрюшинного введения через день между днями 4-20 и 10-20 соответственно.
Фиг. 10. Добавление ингибирующего TGF-β1 пептида р17 в культуральную среду NK-клеток мыши ингибирует их пролиферацию в ответ на высокие концентрации IL-2. Во всех случаях сравнивали лимфоциты «природные киллеры», установленные точно одним и тем же способом, с и без пептида р17. А) Число клеток в указанные моменты времени в культуре спленоцитов в целом мыши RAG-/-. Представленное значение соответствует среднему подсчета в лунках диаметром 2×3,5 см, в каждом случае - абсолютное число. В) Число клеток в указанные моменты времени в культуре клеток DX5+, магнитно-очищенных из спленоцитов мыши RAG-/-, среди которых отсутствуют Т- и В-лимфоциты, представленное в виде среднего подсчета в лунках диаметром 2×0,4 см в каждом случае. С) Пролиферация клеток микрокультуры, сходных с представленными в В) клетками и в те же моменты времени, измеренная в виде включения меченного тритием тимидина в анализе через 6 часов.
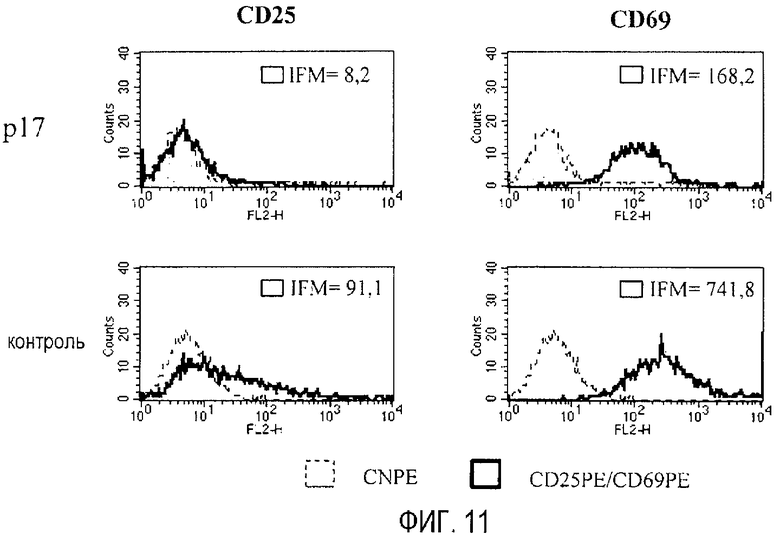
Фиг. 11. Пептид р17 уменьшает уровни экспрессии в мембране маркеров активации CD25 и CD69 в NK-клетках мыши. Гистограммы демонстрируют определяемый с помощью проточной цитометрии уровень экспрессии этих маркеров в клетках, культивируемых с и без пептида и активированных IL-2. Внутри каждой гистограммы указана средняя интенсивность флуоресценции (MFI) каждого маркера.
Фиг. 12. Пептид р17 увеличивает цитотоксичность NK-клеток мыши, активированных IL-2 против различных линий опухолевых клеток. Графики демонстрируют проценты лизиса клеточных линий с различной чувствительностью к цитотоксичности, проявляемой NK. Эффекторные клетки поддерживались в культуре с или без пептида в течение 6 дней, и во время анализа высвобождения хрома отмечались разы превышения над клетками-мишенями - соотношения между эффекторными лимфоцитами и клетками-мишенями.
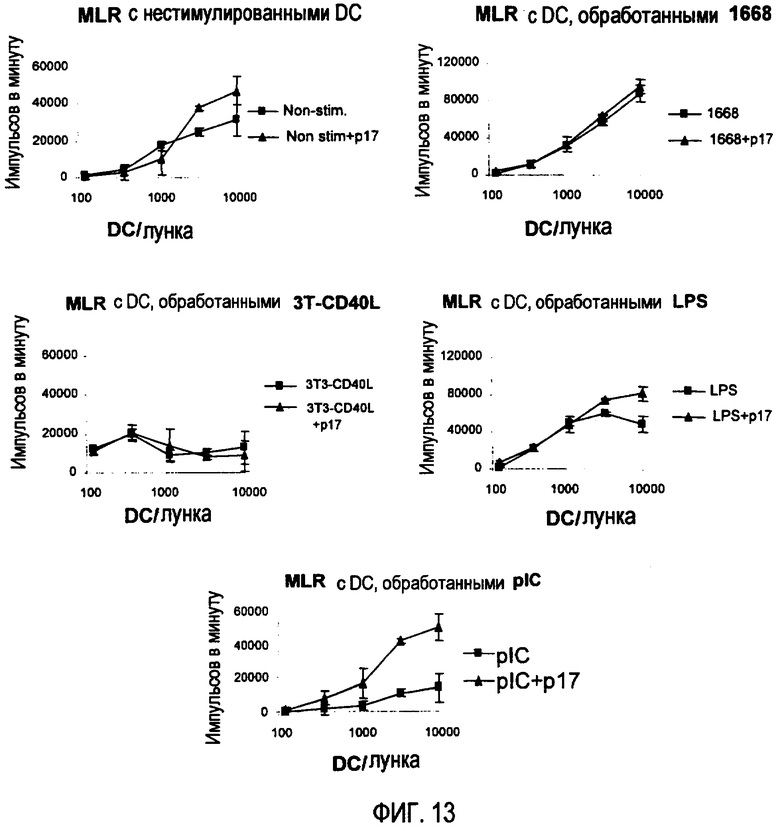
Фиг. 13. Графики демонстрируют пролиферацию клеток, измеренную по включению меченного тритием тимидина, в соответствии с количеством дендритных клеток (DC), присутствующих на лунку, в отсутствие или в присутствии различных предшествующих стимулов и в отсутствие или в присутствии пептида р17 (150 мкг/мл). Пептид р17 увеличивает пролиферацию лимфоцитов в анализах ответа смеси лимфоцитов (MCR) с использованием CD, не стимулированных или простимулированных LPS или pIC.
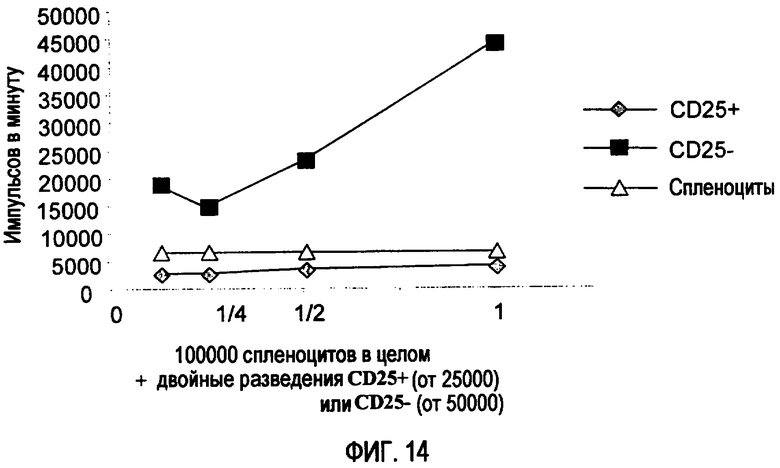
Фиг.14. Популяция CD25 оказывает супрессивный эффект на пролиферацию спленоцитов, активированных антителами против CD3 (0,5 мкл/лунка) (ромбы), клетки CD25- (квадраты) не способны оказывать такой эффект, что делает возможной пролиферацию клеток, сопоставимую с основной пролиферацией спленоцитов в отсутствие пролиферативных стимулов (треугольники).
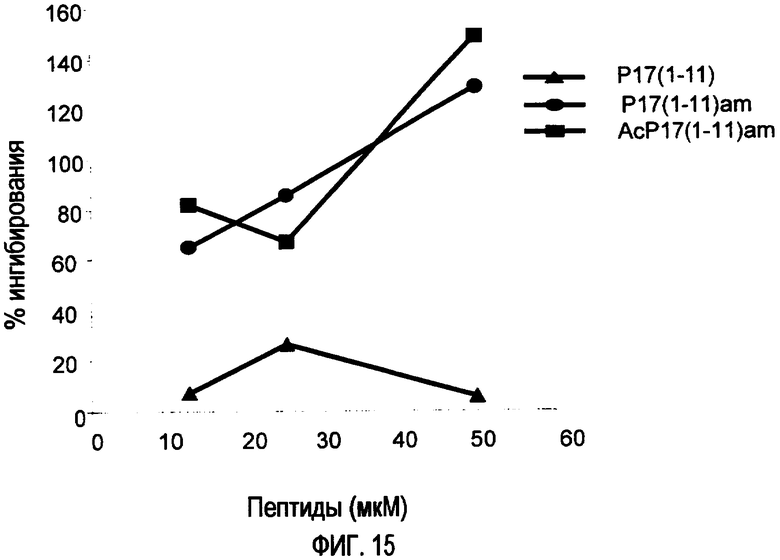
Фиг.15. Ингибирующие TGF-β1 пептиды (усеченные и модифицированные формы р17) в сокультуре регуляторных Т-клеток и активированных спленоцитов мыши ингибируют супрессивное действие, проявляемое регуляторными Т-лимфоцитами на пролиферацию клеток. Можно наблюдать зависимый от дозы эффект пептидов p17(1-11)am и Acp17(1-11)am на ингибиторное действие регуляторных Т-лимфоцитов. Проявляемое ингибирование зависит от дозы, p17(1-11) в концентрации 50 мкМ способен ингибировать супрессивный эффект на 20%, в концентрации 25 мкМ p17(1-11)am - на 128% и Acp17(1-11)am - на 148%.
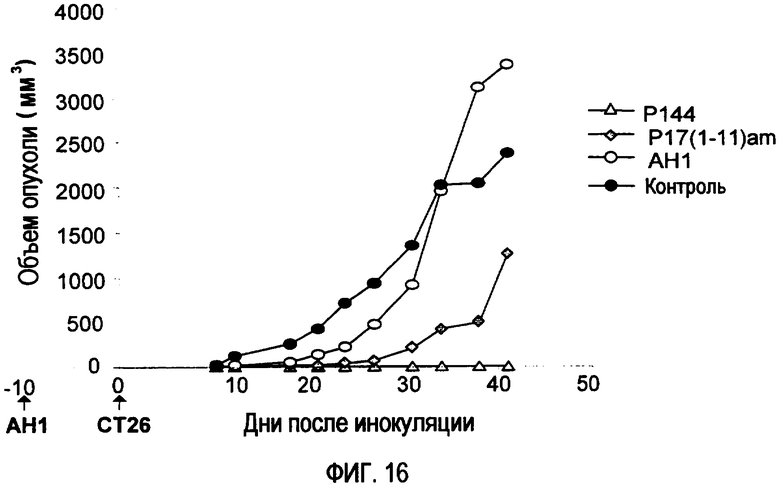
Фиг.16. Ингибирующие TGF-β1 пептиды, р144 и р17(1-11)am, введенные внутрибрюшинно между днями 6 и 10 (50 мкг/мышь/48 часов), задерживают рост опухоли при подкожной инокуляции 50000 клеток СТ26 в день 0 у животных, иммунизированных 10 днями ранее АН1.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Ниже представлены некоторые примеры функционирования изобретения с иллюстративной целью и в той степени, которая никоим образом не ограничивает его объем.
ПРИМЕР 1
В этом примере исследуется эффект пептида р144 в системе, в которой в качестве индуктора дифференциации популяции спленоцитов в направлении дендритных клеток используется TGF-β1.
Выделение и культивирование дендритных клеток
После умерщвления 8-недельного самца мыши С58 его селезенку извлекали в стерильных условиях и гомогенизировали в чашке с использованием чистой среды с получением клеточной суспензии. Клетки центрифугировали в течение 5 минут при 1000 об/мин и полученный клеточный осадок ресуспендировали с использованием 1 мл/селезенка раствора для лизиса АСК (0,15 М NH4Cl, 1 мМ KHCO3, 0,1 М раствор EDTA-натриевая соль, рН 7,2-7,4) в течение 1 минуты при 37°С. Затем клетки центрифугировали и промывали с использованием 10 мл холодной среды R10 (RPMI-1640, 10% FBS, глютамин, 2×10-5 M 2-меркаптоэтанол) с повторенными один раз центрифугированием и промывкой. Наконец, клетки ресуспендировали в 50 мл среды R10. Были приготовлены 6-луночные планшеты (Costar #3471) путем обработки их 1 мл на лунку среды R10 для дифференциации спленоцитов в направлении дендритных клеток [R10 + 10 нг/мл GM-CSF мыши (Peprotec, EC LTD, London, Соединенное Королевство) + 1 нг/мл TGF-β1 (RD Systems, Minneapolis, США)] в течение 15 минут при комнатной температуре. Затем в каждую лунку добавляли 2 мл клеточной суспензии и планшеты инкубировали при 37°С и 5% СО2. В течение первых недель среду меняли дважды путем удаления 1 мл супернатанта и добавления 1 мл свежей среды (R10 + GM-CSF + TGF-β1) для дендритных клеток. Спустя две недели среду отделяли. В планшеты добавляли по 1 мл на лунку среды для диссоциации в BPS без ферментов (GIBCO BRL), среду инкубировали при 37°С, затем ее удаляли и добавляли 2 мл умеренно теплой среды (R10 + GM-CSF + TGF-β1). Затем клетки собирали с помощью медленного отбора пипеткой и собранные клетки центрифугировали при 1000 об/мин, и их ресуспендировали в свежей среде (R10 + GM-CSF + TGF-β1). Полученные таким образом клетки можно реамплифицировать с помощью засева в планшет, повторяя первоначальный процесс.
Обработка дендритных клеток
Следующие обработки выполняли в течение 72 часов на 18-й неделе культивирования дендритных клеток, происходящих из спленоцитов.
Контрольная группа: клетки, обработанные средой для дендритных клеток (GM-CSF + TGF-β1) с 0,25% DMSO.
Антитело против TGF-β1: клетки, обработанные средой для дендритных клеток (GM-CSF + TGF-β1) с 0,25% DMSO, в которую добавляли нейтрализующее антитело против TGF-β1 (Pharmingen) в концентрации 20 мкг/мл.
Пептид р144: клетки, обработанные средой для дендритных клеток (GM-CSF + TGF-β1), в которую добавляли пептид р144 в растворе с DMSO до конечной концентрации пептида в растворе 50 мкг/мл при 25% DMSO.
Среды, соответствующие каждой обработке, заменяли новыми через 48 часов и в конце обработки клетки собирали с помощью отбора пипеткой после обработки средой для диссоциации (GIBCO BRL).
Анализ поверхностных маркеров с помощью проточной цитометрии
Определение поверхностных маркеров спленоцитов, прокультивированных при различных обработках, проводили с использованием проточной цитометрии (FACScalibur, Becton-Dickinson, San Jose, CA, США). Клетки промывали с использованием 2 мл физиологического раствора на лунку и затем добавляли 1 мл среды для диссоциации в РВS без ферментов (GIBCO BRL) и инкубировали в течение 10 минут при 37°С. Затем среду удаляли и добавляли 2 мл РВS. Клетки собирали с помощью медленного отбора пипеткой и собранные клетки центрифугировали при 1000 об/мин и ресуспендировали до концентрации 2×106 клетка/мл в PBS. 100 мкл/лунка полученной клеточной суспензии инкубировали с 1 мкл из флакончиков, содержащих мышиные моноклональные антитела против CD80, CD11c и MHC I (Becton-Dickinson, Pharmingen), конъюгированные с FITC (1 мг/мл), в 96-луночных планшетах в течение 30 минут при 4°С и в темноте. Затем клетки промывали 3 раза PBS с помощью центрифугирования планшета при 1500 об/мин (Centrifuge 5810R, Eppendorf) в течение 5 минут, удаления супернатанта и ресуспендирования клеток в 100 мкл PBS. В качестве отрицательного контроля использовали нереактивное моноклональное антитело, конъюгированное с FITC (Becton-Dickinson, Pharmingen).
Во время созревания спленоцитов in vitro присутствие определенных факторов и цитокинов в среде может привести к дифференциации клеток в направлении различных фенотипов лейкоцитов. В этом случае TGF-β1 описан в качестве фактора, необходимого in vitro для экспрессии определенными типами клеток на поверхности маркеров, связанных с дендритными клетками. При исследовании авторами настоящего изобретения эффекта инкубации дендритных клеток в течение 72 часов в присутствии р144 на маркеры этих клеток наблюдали, что р144 оказывал отрицательный эффект на экспрессию MHC I, CD11c и CD80. Этот эффект будет иметь то же значение и схожую величину, что и эффект, вызванный инкубацией клеток в присутствии антител против TGF-β1. Действительно, как видно на фиг. 1, уровни флуоресценции, связанные с каждым маркером, уменьшаются схожим образом при обработке р144 или антителом против TGF-β1. Эти результаты показывают важность TGF-β1 для созревания дендритных клеток и говорят о том, что применение ингибиторов этого цитокина в протоколах иммунизации может оказывать значительный эффект на гуморальный и клеточный ответы.
ПРИМЕР 2
In vivo активность рекомбинантного аденовируса, экспрессирующего IL-12 мыши
В этом примере исследуется эффект пептида р144 в in vivo системе, в которой TGF-β1 действует в качестве предполагаемого антагониста цитокинов, индуцированных в этой модели. Продукция IL-12 мыши при экспрессии трансгена, включенного в рекомбинантный аденовирус, индуцирует воспалительное состояние через индукцию каскада факторов, в том числе IFN-γ и оксида азота. TGF-β1 был описан как ингибитор продукции и биологического действия IL-12, IFN-γ и NO (Pardoux C. et al., 1999; Schini V.B. et al., 1992). В этой модели 1×108 бляшкообразующих единиц RАd-IL-12 мыши в 500 мкл физиологического раствора вводили внутрибрюшинно группам из 3 мышей BALB/c возрастом 4-8 недель (Harlan), распределяя животных по следующим группам:
- RАd-IL-12: эти животные получали 1×108 бляшкообразующих единиц RАd-IL-12 мыши в день 0.
- RАd-IL-12 + р144: эти животные подвергались такой же обработке, что и предшествующая группа, но им после введения аденовируса вводили пептид в течение 5 дней в ежедневной дозе 100 мкг пептида в PS, содержащей 0,66% DMSO.
Образцы крови брали у обеих групп в дни 6 и 9 после иммунизации для последующего количественного определения уровней IFN-γ и NO в сыворотке.
Определение уровней IFN-γ
Количество IFN-γ определяли с помощью коммерчески доступной ELISA (Mouse IFN-γ Duoset ELISA Development System, Genzyme, Cambridge и OPTEIA Mouse IFN-γ Set, Pharmingen, San Diego, США) в соответствии с инструкциями изготовителя. Результаты выражали в пг/мл IFN-γ с использованием стандартной кривой известных количеств IFN-γ.
Определение уровней оксида азота
Уровни продукции NO определяют в виде непрямых измерений уровней нитритов и нитратов в сыворотке. Эти измерения проводили с помощью хемилюминесцентного анализа с использованием детектора оксида азота Sievers NOA 280, следуя рекомендованному производителем методу (Sievers Instruments Inc. 1996).
Используемый метод позволяет измерять нитраты или нитраты + нитриты в зависимости от используемого процесса восстановления до NO. Присутствующие в образцах нитриты восстанавливали до NO путем инкубации с 350 мМ NaI в ледяной уксусной кислоте в соответствии со следующей реакцией:
I- + NO2 - + 2 H+ → NO + I2 + H2O
При измерении нитритов и нитратов их восстанавливали до NO путем инкубации с 50 мМ VCl3 в 1 н HCl при 90°С в соответствии со следующей реакцией:
2 NO3 - + 3 V+3 + 2 H2O → 2 NO + 3 VO2 + 4 H+
Восстановление до NO происходит в резервуаре с детектором. Получаемый в результате NO любой из этих двух предшествующих реакций перемещается в детектор с помощью вакуумного насоса. В детекторе происходит хемилюминесцентная реакция между NO и озоном:
NO + O3 → O2 + NO2 ∗ → NO2 + h•
Эмиссия NO2 ∗ находится в красной и инфракрасной области оптического спектра и обнаруживается с помощью фотоэлектронного умножителя, чувствительного к красной области оптического спектра. Определяют величину этого сигнала и полученные данные собирают и обрабатывают с помощью компьютера.
Введение мышам рекомбинантного аденовируса (RAd), экспрессирующего IL-12 мыши, вызывает каскад реакций, среди которых выступает значительное увеличение уровней в сыворотке IFN-γ и NO. Поскольку на процессы индукции IFN-γ и NO оказывает влияние TGF-β1 (Schini V.B. et al., 1992), авторы настоящего изобретения также исследовали эффект введения р144 на указанные уровни. На фиг. 2 и 3 соответственно показаны уровни IFN-γ и NO в сыворотке мышей, которым ввели дозу 1×108 бляшкообразующих единиц рекомбинантного аденовируса, экспрессирующего IL-12 мыши, (RАd-IL-12) с р144 или без него. На фиг. 2 демонстрируется, что введение пептида р144 вместе с RАd-IL-12 приводит к увеличению уровней индуцированного IFN-γ относительно уровней, достигаемых после введения только RАd-IL-12.
На фиг. 3 демонстрируется эффект введения RАd-IL-12 с р144 или без него на уровни NO в сыворотке. Совместное введение RАd-IL-12 и р144 приводит к достижению более высокого уровня NO в день 6 относительно уровня, достигаемого при введении только RАd-IL-12.
Эффект р144 в этой модели индукции провоспалительных цитокинов можно объяснить на основе действия TGF-β1 на регуляцию, экспрессию и активность IL-12 и процессы активации этого цитокина. Действительно, описано, что TGF-β1 проявляет антагонистическое в отношении экспрессии и активности IL-12 и IFN-γ действие. Следовательно, если р144 нейтрализует TGF-β1, он устраняет антагонистическое действие этого цитокина в отношении экспрессии и активности IL-12 и IFN-γ, и в результате происходит повышение уровней IFN-γ в сыворотке (фиг. 2). В итоге в этой модели TGF-β1 действует путем контролирования как экспрессии IL-12, так и (сопутствующим образом) экспрессии IFN-γ. В результате ингибирование TGF-β1 с помощью р144 приводит к увеличению экспрессии IFN-γ.
Что касается эффекта р144, выражающегося в увеличении NO, авторы настоящего изобретения полагают, что он может также быть объяснен ингибированием TGF-β1 с помощью р144. Действительно, поскольку TGF-β1 ингибирует экспрессию и активацию фермента iNOS, ответственного за продукцию NO, логично заключить, что при исключении цитокина уровни NO будут стремиться к увеличению, что наблюдается на фиг. 3 в день 6.
Поскольку IFN-γ индуцирует экспрессию и активность iNOS, результаты, представленные на фиг. 2 и 3, являются согласующимися, так как в день 6 наблюдают, что введение р144 соответственно приводит к увеличению уровней IFN-γ и NO.
ПРИМЕР 3
Индукция антител
Для анализа иммуномодулирующего эффекта пептида р144 на гуморальный ответ использовали самок мышей BALB/c (Harlan, Barcelona) возрастом 6-8 недель. Для индукции специфических антител инокулировали рекомбинантный аденовирус (RAd-LacZ), инактивированный нагреванием в бане при 100°С в течение 10 минут.
Группы животных и обработки
Иммунизировали трех мышей на группу путем внутрибрюшинного введения 200 мкл смеси, содержащей 1×108 бляшкообразующих единиц инактивированного аденовируса RАd-LacZ, физиологическую сыворотку (PS) или 50 мкг пептида р144, эмульгированных в полном адъюванте Фрейнда (FCA) в объемном соотношении 1:1, как указано в таблице 1. Спустя 30 дней после первой иммунизации животных повторно иммунизировали той же самой смесью, но эмульгированной в неполном адъюванте Фрейнда (FIA). Образцы крови брали из ретроорбитального венозного сплетения в дни 15 и 45 для количественного определения антител против аденовируса, образованных в каждом животном.
Для исследования возможного индуцирования аллергии на антиген у мышей, обработанных р144, на 50-й день после первой инъекции инокулировали внутривенно 4×108 бляшкообразующих единиц активного RАd-LacZ в 100 мкл RPMI-1640 мышам, включающим новую группу мышей (контроль внутривенно), которая только получала внутривенную дозу активного аденовируса LacZ. У всех групп образцы крови брали через 7 дней. Затем животных умерщвляли для получения образцов печени в OCT® (Tissue-Tek®, SAKURA, Нидерланды) для последующей оценки экспрессии LacZ в печени.
Композиция смесей для иммунизации различных групп инактивированным нагреванием аденовирусом
Количественное определение антител против RАd-LacZ в сыворотке
Для определения антител против RАd-LacZ в сыворотке выполняли анализ ELISA с использованием планшетов с 96 плоскодонными лунками Maxisorp® (Nunc, Roskilde, Дания), основанный на системе стрептавидин-биотин с использованием 2,2'-азино-бис-3-этилбензтиазолин-6-сульфокислоты (ABTS) в качестве проявителя. Планшеты инкубировали на протяжении ночи при 4°C с 50 мкл на лунку раствора 75 мкл 1010 бляшкообразующих единиц RАd-LacZ/мл в 10 мл 0,1 М Na2CO3 (pH 10,5). Затем осуществляли 3 промывки 200 мкл на лунку буфера для промывок PBST (pH 6 солевой фосфатный буфер с 0,1% Tween 20). Неспецифические связи блокировали инкубированием планшетов в течение одного часа при комнатной температуре с 400 мкл на лунку PBST с 1% порошкообразного молока (PLT). Планшеты опустошали и осуществляли три промывки PBST. Добавляли 4 мкл сыворотки в 100 мкл PLT, получая 8 двойных серийных разведений, и планшеты инкубировали в термостате в течение 1 часа при 37°С. Их промывали три раза PBST и инкубировали в течение 1 часа при 37°C с 50 мкл на лунку 1/1000 разведения биотинилированного антитела против IgG мыши, полученного из козы, (Amersham) в PBST. После инкубации в течение 1 часа выполняли три промывки PBST и планшеты проявляли. В качестве субстрата для проявления реакции использовали ABTS, дающий зеленое окрашивание в присутствии перекиси водорода и фермента пероксидазы. Готовили раствор с использованием 10 мл 0,6% уксусной кислоты (рН 4,6), 7,5 мкл 33% H2O2 (объем/объем) и 100 мкл 40 мМ ABTS. Добавляли 100 мкл на лунку и через час планшеты считывали при 405 нм в считывающем устройстве Multiskan Plus MKII (Labsystem, Helsinki, Финляндия).
In situ окрашивание на экспрессию трансгена (краситель X-gal)
Полученные с использованием криостата срезы (6 мкм) препаратов образцов печени, помещаемых в соединение для оптимальной для получения срезов температуры, сушили при комнатной температуре. Затем их фиксировали с использованием 0,5% глютальдегида в течение 10 минут, добавляя 200 мкл на препарат. Затем осуществляли 3 промывки в PBS и затем добавляли 200 мкл смеси красителя: 30 мМ K3Fe(CN)6, 30 мМ K4Fe(CN)6, 20 нг/мл X-Gal и MgCl2 в PBS. Препараты инкубировали в течение 12 часов при 37°С, после чего осуществляли 3 промывки в PBS и препараты один раз высушивали для их закрепления.
Использование некоторых рекомбинантных вирусов в качестве инструментов для генной терапии имеет недостаток, заключающийся в том, что их можно использовать небольшое число раз вследствие индукции антител против вируса. Действительно, если вирус вводить больше одного раза, его эффект будет весьма (или полностью) уменьшен вследствие того факта, что антитела, индуцированные при первых введениях, способны нейтрализовать вирус, вводимый при последующих обработках. По этой причине авторы настоящего изобретения решили изучить роль р144 в процессе индукции антител против рекомбинантного вируса. Основная идея этого эксперимента - исследование того, может или нет нейтрализация TGF-β1 с помощью р144 ингибировать индукцию антител или даже индуцировать иммунологическую толерантность к аденовирусу при последующих введениях. Таким образом, в первом эксперименте авторы настоящего изобретения иммунизировали мышей инактивированным нагреванием рекомбинантным аденовирусом, кодирующим Lac Z (RAd-LacZinact). Эту иммунизацию осуществляли в присутствии или в отсутствие р144. Как видно на фиг. 4, первая иммунизация не имела поддающегося количественному определению с помощью ELISA эффекта на продукцию антител против RAd-LacZ.
Тем не менее, совершенно иной эффект наблюдался после второй иммунизации (фиг. 5). Таким образом, в результате второй иммунизации инактивированным RAd-LacZ в присутствии р144 индуцировались высокие титры антител против RAd-LacZ. Тем не менее, поскольку смесь для иммунизации включала р144, титр антител против RAd-LacZ был отчетливо ниже титра, получаемого при использовании только инактивированного RAd-LacZ.
После получения этих результатов было решено исследовать, может ли у мышей, обработанных р144, выработаться некоторая степень толерантности к антигенам, представленным в форме инактивированного аденовируса. Для того чтобы это сделать, упомянутым выше группам мышей инокулировали внутривенно на 20-й день (после второй иммунизации) активный аденовирус LacZ (RAd-LacZact) в отсутствие пептида р144. Спустя семь дней трансген экспрессировался in vivo, и подвергались количественному определению как присутствующие в сыворотке антитела, так и экспрессия LacZ в печени. Как видно на фиг. 6, титры антител были приблизительно равными в двух группах мышей, что указывает на то, что толерантность не возникла и что р144 способен ингибировать гуморальный ответ только при его включении в смесь для иммунизации с антигеном, в настоящем случае инактивированным нагреванием аденовирусом.
Гистологический анализ на 7-й день печеней мышей на фиг. 6 демонстрирует, что только контрольная группа, инфицированная внутривенно RAd-LacZact, была положительной в отношении красителя для LacZ, что говорит о том, что в других группах присутствие в сыворотке антител против аденовируса было достаточным для нейтрализации вводимого вируса RAd-LacZact, приводящего к инфицированию печени и последующей экспрессии гена LacZ (фиг. 7).
ПРИМЕР 4
В этом примере изучается эффект присутствия пептида р144 в смеси для иммунизации с пептидом (FIS), действующим в качестве антигенной детерминанты Т-хелперов. Этот пептид индуцирует профиль цитокинов, благоприятный для продукции антител против различных антигенов.
Индукция ответов Т-хелперов
Пептид FIS определяется как антигенная детерминанта Т-хелперов, происходящая из миоглобина большого карликового кашалота, аминокислоты (106-108). Этот пептид широко использовался для индукции антител против пептидов - гаптенов. Авторы настоящего изобретения хотели проанализировать эффект пептида р144 на индукцию профиля цитокинов, характеризующегося среди прочих вещей увеличением IFN-γ и IL-12. В этой модели внутривенно вводили группам из 3 самок мышей BALB/c возрастом 4-8 недель (Harlan, Barcelona) следующее, распределяя животных по следующим группам обработок:
- FIS: мыши, которым внутривенно вводили 1:1 эмульсию неполного адъюванта Фрейнда и полной сыворотки, содержащей 50 мкг FIS.
- FIS + р144: мыши, которым внутривенно вводили 1:1 эмульсию неполного адъюванта Фрейнда и полной сыворотки, содержащей 50 мкг FIS и 50 мкг р144.
Через 10 дней после иммунизации животных умерщвляли и извлекали подколенные, ингвинальные и периаортальные лимфатические узлы. Узлы гомогенизировали с помощью шприца и их промывали три раза при 4°С средой для промывок (чистой средой RPMI 1640). Затем клетки ресуспендировали в полной среде (RPMI 1640 с 10% FBS, 2 мМ глютамина, 100 Е/мл пенициллина, 100 мкг/мл стрептомицина, 5×10-5 М β-меркаптоэтанола, 25 мМ Hepes и пирувата натрия) до концентрации 5,3×106 клеток/мл, добавляя 150 мкл в каждую лунку планшета с 96 плоскодонными лунками. Различные концентрации пептида (6 и 10 мМ) добавляли в трех повторах и в объеме 100 мкМ на лунку. Клетки культивировали в термостате при 37°С и с 5% СО2 в течение двух дней. Спустя 24 часа из 96-луночного планшета отбирали по 50 мкл супернатанта для измерения IL-2, продуцированного в этих клетках, и спустя 48 часов отбирали по 50 мкл супернатанта для измерения IFN-γ. Эти супернатанты замораживали при -20°С до определения концентрации цитокинов.
Определение уровней IFN-γ
Количество IFN-γ определяли с помощью коммерчески доступной ELISA (Mouse IFN-γ Duoset ELISA Development System, Genzyme, Cambridge и OPTEIA Mouse IFN-γ Set, Pharmingen, San Diego, США) в соответствии с инструкциями изготовителя. Результаты выражали в пг/мл IFN-γ с использованием стандартной кривой известных количеств IFN-γ.
Определение уровней IL-2
Количество IL-2 в каждом супернатанте определяли с помощью изучения пролиферации линии клеток CTL.L, рост которых зависит от IL-2 (Lai M. et al., 1987). Эту линию поддерживали в культуре с использованием полной среды, дополненной IL-2 в концентрации 10 Е/мл.
Для выполнения анализа супернатанты культивировали с 3000-5000 клеток CTL.L на лунку, разведенных до конечного объема 100 мкл. Через 24 часа культивирования добавляли 0,5 мкКи (25 Ки/моль) меченного тритием тимидина (Amersham) на лунку и через 20 часов клетки собирали на планшетах с фильтром (Unifilter-96 GF/C®, Perkin Elmer) с помощью коллектора (Filtermate 196 Harvester, Packard). Радиоактивность измеряли в сцинтилляционном счетчике (Top Count, Microplate Scintillation Counter, Packard) после добавления 25 мкл сцинтилляционной жидкости (MICROSCINT®, Packard, Bioscience Company) на лунку. Результаты счетов выражали в виде мЕ/мл IL-2, интерполируя счет в каждой лунке в стандартную кривую.
Пептид FIS представляет собой антигенную детерминанту Т-хелперов, включающую остатки 106-108 последовательности миоглобина большого карликового кашалота. Иммунизация мышей BALB/c FIS приводит к активации продуцирующих IFN-γ и IL-2 Т-лимфоцитов в ответ на этот пептид. Поскольку в индукции иммунного ответа играет роль TGF-β1, изучали эффект р144 на продукцию цитокинов после иммунизации мышей FIS в присутствии и в отсутствие р144. Для того чтобы это сделать, мышей BALB/c иммунизировали 50 мкг только FIS или 50 мкг FIS в присутствии 50 мкг р144.
Как видно на фиг. 8, присутствие пептида р144 в смесях для иммунизации уменьшало продукцию IL-2 и IFN-γ по сравнению с FIS. Важно отметить, что р144 также, вероятно, презентируется молекулами МНС класса II мышей BALB/c в виде DTh, поскольку при повторной стимуляции in vitro от р144 наблюдалась продукция IL-2, а также некоторая продукция IFN-γ. Эти результаты говорят о том, что включение р144 в смесь для иммунизации оказывает отрицательный эффект на хелперную способность DTh, что, вероятно, обусловлено нейтрализацией TGF-β1, который необходим во время индукции иммунного ответа.
ПРИМЕР 5
А. Эффект пептида р144 на смесь для иммунизации с DTc (AH1) и DTh (LQV) опухолевого антигена
DTc является пептидом, который презентируется MHC-II на поверхности презентирующих клеток, а DTh является пептидом, который презентируется MHC-I на поверхности презентирующих клеток и в опухолевых клетках. Известно, что совместная иммунизация DTc (пептидом AH1) и DTh (пептидом LQV), при этом оба пептида происходят из белка gp70 опухолевого антигена, экспрессируемого клетками СТ26, способна защитить против подкожного роста 500000 опухолевых клеток СТ26. Поскольку для процесса индукции иммунного ответа важен TGF-β1, авторы настоящего изобретения хотели изучить эффект пептида р144 на индукцию ответа, ответственного за защиту от роста клеток СТ26. Как показано в таблице 1, три группы мышей BALB/c иммунизировали следующими смесями неполного адъюванта Фрейнда с (i) АН1 + LVQ, (ii) АН1 + LVQ + р144 и (iii) только неполным адъювантом Фрейнда. Наблюдали, что только при иммунизации АН1 + LVQ удается защитить мышей, и, следовательно, включение р144 в смесь для иммунизации оказывает отрицательный эффект на защиту против роста клеток СТ26.
Введение р144 вместе с АН1 + LVQ оказывает отрицательный эффект на защиту против роста клеток СТ26, достигаемую после иммунизации мышей BALB/c АН1 + LVQ
Поскольку пептид р144 способен блокировать активность TGF-β1, полученные результаты говорят о том, что этот цитокин играет решающую роль в индукции эффективного противоопухолевого ответа и что его блокирование на этой стадии оказывает отрицательный эффект на индукцию защитных противоопухолевых ответов. Этот результат согласуется с другим предшествующим результатом (фиг. 8), что введение р144 вместе с DTh - FIS блокирует активацию ответов Т-хелперов (Th) на FIS.
В. Эффект пептида р144 после иммунизации DTc (AH1) в модели метастазов в легкие
Выдвигается концепция, что нейтрализация TGF-β1 после индукции иммунного ответа могла бы иметь благотворный эффект на его развитие. Для доказательства этой концепции изучили эффект введения р144 в различные моменты времени и с использованием различных протоколов иммунизации на выживаемость мышей в модели метастазов в легкие, индуцированной внутривенным введением 5×105 клеток СТ26.
Из предшествующего эксперимента известно, что иммунизация только DTc - AH1 вызывает некоторую задержку появления опухолей после внутривенного введения клеток СТ26. По этой причине в эксперименте по выживаемости сравнивали включение р144 в различные моменты времени после иммунизации AH1. Таким образом, животным группы (i) вводили только клетки СТ26, животных групп (ii), (iii) и (iv) иммунизировали в день 0 путем подкожного введения 50 мкг AH1 в FIA (неполном адъюванте Фрейнда) и затем в день 10 им внутривенно вводили 5×105 клеток СТ26. Группа (iii), кроме того, получала 50 мкг р144 в 500 мкл PS (физиологической сыворотке) с помощью внутрибрюшинного введения через день между днями 4 и 20. Группа (iv), как и группа (iii), получала 50 мкг р144 в 500 мкл PS с помощью внутрибрюшинного введения через день, но только между днями 10 и 20. Как видно на фиг. 9, иммунизация АН1 (ii) только опосредует незначительную задержку смерти животных относительно неиммунизированной контрольной группы (i). У животных, иммунизированных АН1, обработка р144 усиливает эффект выживания, особенно в группе (iv), которой р144 вводили между днями 10 и 20.
С. Эффект пептидов р144 после иммунизации DTc (AH1) в модели подкожных опухолей
Далее изучали эффект р144 в модели прогрессирования опухоли, которая была менее агрессивной, чем внутривенное введение СТ26. В этой новой модели мышей иммунизировали 50 мкг АН1 в день 0 и спустя 10 дней им вводили подкожно 5×105 клеток СТ26. Кроме того, с целью проверки эффекта блокирования TGF-β1 на защиту против опухолевых клеток СТ26 две другие группы мышей (группы 2 и 3) подвергали обработке с помощью внутрибрюшинного введения 50 мкг р144 через день между днями 10-30.
Введение р144 после иммунизации АН1 оказывает положительный эффект на защиту против роста клеток СТ26 у мышей BALB/c с АН1
Как можно видеть в таблице 3, блокирование TGF-β1 через десять дней после иммунизации АН1 формирует защиту против роста опухоли, измеряемого на 50-й день после подкожного введения опухолевых клеток. Эта защита наблюдается у 40% животных.
Установление увеличения эффективности защиты против роста опухолевых клеток благодаря нейтрализации TGF-β1 представляет большой интерес и может являться принимаемой стратегией для получения лучших противоопухолевых ответов.
ПРИМЕР 6
Модуляция NK-клеток
Материалы и методы
Культуры NK-клеток
Их получали из клеток селезенки мышей RAG1-/- без Т- и В-лимфоцитов. В некоторых случаях спленоциты в целом культивировали в 6-луночных планшетах при 4×106 клеток на мл среды RPMI, дополненной 10% SBF, L-глютамином, антибиотиками, заменимыми аминокислотами, β-меркаптоэтанолом и рекомбинантным интерлейкином-2 человека (Chiron) при 600 МЕ/мл. В половину лунок добавляли пептид р17 в концентрации 150 мкг/мл. Через 48 часов среду удаляли и лунки промывали средой RPMI для удаления не прикрепленных клеток. Затем добавляли свежую среду с/без пептида. На +5 день среду снова меняли, на этот раз возвращая все клетки и пептид р17 в соответствующие культуры. Осуществляли подсчет клеток с использованием трипанового синего в дни +5 и +6 этой культуры. В других случаях NK-клетки из спленоцитов мыши выделяли с помощью иммуномагнитного отбора с использованием системы MiniMACS, анти-DX5 шариков и MS-колонок (Miltenyi Biotech) в соответствии с инструкциями производителя. Полученные таким образом клетки культивировали в 48-луночных планшетах при 1,5×106 клеток/мл в упомянутой выше среде с/без пептида р17 в концентрации 150 мкг/мл. Через 48 часов к клеткам, имеющим р17, добавляли новый пептид, и подсчет осуществляли в дни +2 и +4.
Проточная цитометрия
Использовались следующие меченные РЕ крысиные антимышиные моноклональные антитела: анти-CD25, анти-CD69 и антитело контрольного изотипа, получаемые все от Pharmingen (BD). Сбор данных и анализ образцов осуществляли с использованием FACScalibur и программы CellQuest.
Анализ пролиферации с использованием меченного тритием тимидина
Для этого анализа использовали клетки DX5+ в дни 2 и 4 культивирования. Кратко, помещали 1000 клеток на лунку в трех повторах с или без пептида, измеряя включение ими меченного тритием тимидина в типичной среде для культивирования с 6000 МЕ/мл IL-2 через 6 часов после добавления тимидина.
Анализ высвобождения хрома
Цитотоксичность NK-клеток подтверждали с помощью стандартных анализов высвобождения 51Cr через 4,5 часа. Кратко, мишени инкубировали с 50 мкКи 51Cr в течение 2 ч, их промывали (3 раза) и затем добавляли эффекторные клетки в различных соотношениях, при этом максимальное соотношение составляло 40:1 (эффектор:мишени). Наконец, измеряли высвобождение 51Cr вследствие лизиса с помощью NK-клеток через 4,5 ч в сцинтилляционном счетчике TopCount (Perkin Elmer). Цитотоксичность измеряли как процент высвободившегося Cr относительно суммарного количества, приобретенного клетками.
Линии клеток
В качестве мишеней в анализах цитотоксичности с использованием NK-клеток использовали следующие линии опухолевых клеток: МС38 (карцинома толстой кишки) и LLC (карцинома легкого), возникшие у мышей C57BL/6 и СТ26 (карцинома толстой кишки), и RENCA (почечная карцинома) от мышей BALB/c. LLC и RENCA культивировали с использованием RPMI, дополненной фетальной бычьей сывороткой, антибиотиками и L глютамином, а МС38 и RENCA в DMEM, дополненной таким же образом.
Результаты
Пептид р17 проявляет очевидный антипролиферативный эффект в отношении популяции NK-клеток, полученной от мышей RAG1-/- и культивируемых in vitro (фиг. 10), в количественных анализах пролиферации с помощью прямого подсчета клеток или синтеза ДНК (включения меченного тритием тимидина). При анализе эффекта р17 на экспрессию на клеточной поверхности различных маркеров обнаружено, что р17 снижает уровни CD25 и CD69 (фиг. 11), измеренных в виде средней интенсивности флуоресценции. Маркеры CD25 и CD69 опосредуют иммуносупрессию и оба индуцируются TGF-β1. Таким образом, пептид р17 действует путем блокирования эффекта TGF-β1 на индукцию этих маркеров (CD25 и CD69) в этой популяции клеток иммунной системы. С другой стороны, в анализах цитотоксичности, в которых эта клеточная популяция противостоит различным линиям опухолей мыши (фиг. 12), присутствие пептида р17 увеличивает цитотоксическую активность этой популяции природных киллеров в большей или меньшей степени. Для всех экспериментальных моделей делают заключение, что пептид р17 проявляет очевидную биологическую активность в отношении пролиферации, дифференциации и эффекторной функции NK-клеток.
ПРИМЕР 7
Модуляция дендритных клеток
Материалы и методы
Получение дендритных клеток (DC) из костного мозга мышей
Сначала ноги отделяли и помешали в чашку с 10% RPMI FBS на льду. Для получения костного мозга необходимо отрезать головки бедренных костей и пропустить среду через внутреннюю часть кости с извлечением костного мозга в чашку с 10% RPMI FBS. Затем костный мозг разрушали с помощью шприца и содержимое собирали в пробирку Falcon, которую центрифугировали при 2000 об/мин в течение 5 минут; после центрифугирования супернатант удаляли и лизировали эритроциты с использованием буфера для лизиса АСК. После лизиса клеток осуществляли истощение в отношении не представляющих интерес популяций клеток; для этого использовали как коммерческие антитела, так и антитела асцитной жидкости, объединенные с комплементом кролика. Истощение осуществляли при концентрации клеток 2×107 клетка/мл, к которым добавляли следующую смесь:
- антиCD4 асциты при 100 мкг/мл;
- антиCD8 асциты при 100 мкг/мл;
- супернатант В220 в разведении 1/20 (В-антилимфоциты);
- 10 мкл/мл GR1 (антигранулоциты);
- комплемент в разведении 1/20.
Эту смесь инкубировали в течение 50 минут при 37°C с перемешиванием приблизительно каждые 15-20 минут. По прошествии этого времени осуществляли промывку с использованием чистой среды RPMI и определяли число полученных клеток. Наконец, клетки засевали в 12-луночные планшеты в конечной концентрации один миллион клеток на миллилитр (3 мл/лунка) и добавляли 20 мкг/мл цитокинов IL-4 и GM-CSF. В дни 3 и 5 после засева из каждой лунки удаляли 2 мл с замещением свежей средой вместе с цитокинами в концентрации, соответствующей этому объему.
На шестой день презентирующие клетки (CD) собирали, определяли их количество, и их помещали в 12-луночные планшеты в концентрации 1 миллион/мл (3 мл/лунка), добавляли 20 мкг/мл цитокинов IL-4 и GM-CSF и осуществляли следующие обработки:
Поли(I:C): синтетическая двухцепочечная РНК (полиинозиновая-полицитидиловая кислота)
1668: олигодезоксинуклеотид (ODN)
3ТС-CD40L: клеточная линия, продуцирующая лиганд CD40.
Клетки оставляли с различными стимулами на 48 часов; по прошествии этого времени их собирали и определяли их количество с целью выполнения анализа ответов смеси лейкоцитов, который состоит из аллогенной реакции, в которой не адгезивные клетки селезенки мыши, принадлежащей определенной линии, противопоставлены дендритным клеткам другой отличной линии мыши. Целью этого исследования является изучение презентирующей способности CD (антигенпрезентирующих клеток), которые вследствие принадлежности различным линиям мышей демонстрируют различную HLA-рестрикцию, узнаваемую лимфоцитами другой мыши, что приводит к их пролиферации. Степень пролиферации определяют благодаря включению меченного тритием тимидина. Этот параметр показывает эффективность, с которой CD презентируют антиген. В этом случае неадгезивные клетки были получены от мыши BALB/c, а дендритные клетки происходили от мыши С57.
Кроме того, клетки инкубировали с использованием различных стимулов для наблюдения эффекта р17 в этом контексте.
Результаты
Пептид р17 способен увеличивать пролиферацию лимфоцитов в анализах ответа смеси лейкоцитов (MLR) в результате увеличения эффективности, с которой клетки презентирует антиген. Этот эффект пептида р17 наблюдают с дендритными клетками, не стимулированными или простимулированными LPS или pIC (фиг. 13). Тем не менее, другие стимулы (1668 и 3Т-CD40L) не позволяют пептиду р17 опосредовать различие в эффективности презентации антигена и, следовательно, в ответе в виде пролиферации лимфоцитов. Эти результаты выявили у ингибирующего TGF-β1 пептида способность стимулировать антигенпрезентирующие клетки (CD) и увеличивать эффективность презентации антигена.
ПРИМЕР 8
Модуляция регуляторных Т-лимфоцитов
Материалы и методы
1. Получение спленоцитов в целом: Для получения спленоцитов от самок мышей BALB/c возрастом 6 недель умерщвляли 4 животных и после извлечения селезенок их переносили в чистую среду для их диспергирования с использованием кристаллов, гомогенат фильтровали (70-микронный фильтр) и переносили в 50-мл пробирки для последующих промывки и центрифугирования. Полученные клетки инкубировали в течение 1 минуты в буфере для лизиса, для элиминации эритроцитов, и их впоследствии промывали чистой средой для культивирования. Наконец, полученные клетки суспендировали в 1 мл среды AUTOMACS и их подсчитывали.
2. Очистка лимфоцитов CD25+: Очистку лимфоцитов CD25+ осуществляли с помощью использования магнитных колонок, меченных CD25РЕ, и после инкубации добавляли анти-РЕ магнитные микрошарики (Phycoerythrin). После инкубации, промывки и фильтрации (30-микронный фильтр) образцы самотеком пропускали через магнитную колонку, получая содержащий популяцию CD25- элюат. После удаления от колонки магнитного поля ее промывали под давлением с получением клеток CD25+.
3. Анализ супрессивной активности: Для подтверждения регулирующей способности популяции CD25+ 100000 спленоцитов в целом на лунку засевали в планшет с 96 лунками с U-образным дном в объеме 200 мкл на лунку и добавляли антитело против CD3 (0,5 мкл/лунка) только или в противопоставлении CD25- или CD25+, помещая 25000 клеток на лунку (CD25+) или 50000 клеток на лунку (CD25-) с осуществлением двойных разведений концентрации этих клеток.
4. Анализ ингибирования супрессивной активности с помощью пептидов: В планшет с 96 лунками с U-образным дном засевали 100000 спленоцитов на лунку в объеме 200 мкл и добавляли антитело против CD3 (0,5 мкл/лунка) плюс 25000 лимфоцитов CD25+ на лунку. К этим смесям добавляли пептиды (3 колонки/пептид, 50 мкМ в первом ряду и двойное разведение в последующих трех рядах). Анализировали 3 пептида: Р17(1-11) SEQ ID NO:3, P17(1-11)am SEQ ID NO:4 и AcP17(1-11)am SEQ ID NO:5. И при этом анализе, и при анализе супрессивной активности проводили инкубацию при 37°С в течение 48 часов, добавляли меченный тритием тимидин при 0,5 мкКи/лунка, осуществляли сбор через 8 часов с последующим определением импульсов в минуту, испускаемых клетками каждой лунки.
5. Подтверждение эффективного отделения Treg: Осуществляли мечение флуоресцентными антителами против CD4 и CD25 и анализ проточной цитометрией (89% магнитно-отделенной популяции являются CD4+CD25+)
Результаты
Отобранные клетки CD25+ являются Т-лимфоцитами с регуляторной активностью. На фиг. 14 демонстрируется, что популяция спленоцитов пролиферирует в присутствии соответствующего стимула (АнтиCD3) и в отсутствие регуляторных клеток. Присутствие лимфоцитов CD25+ приводит к полному ингибированию пролиферации спленоцитов в целом.
Ингибирующие TGF-β1 пептиды способны блокировать эту супрессивную активность регуляторных Т-лимфоцитов (CD25+): Основываясь на модели, установленной на фиг.14, пептиды, происходящие из пептида р17, способны зависимым от дозы образом блокировать антипролиферативный эффект популяции лимфоцитов CD25+. При концентрации 50 мкМ пептид АсР(1-11)am и Р17(1-11)am способны полностью ингибировать эффект регуляторных Т-лимфоцитов (фиг.15).
ПРИМЕР 9
Эффект на рост опухоли
Материалы и методы
Группы: 4 группы по 7 самок мышей BALB/c возрастом 6 недель/группа.
АН1+FIA подкожно
АН1+FIA подкожно + р144 (50 мкг внутрибрюшинно/доза/мышь)
АН1+FIA подкожно + р17(1-11)am (50 мкг внутрибрюшинно/доза/мышь)
Проект: АН1+FIA: день 10; пептиды: с дня 6 через день до дня 10; объем модельной опухоли: каждые 3 дня со дня 10 до дня 41. Введение в день 0 СТ26 (500000 клетка/мышь подкожно в бок).
Результаты
Уменьшение среднего объема опухоли у групп, обработанных пептидами: Эффект пептидов р144 и р17(1-11)am исследовали с использованием модели прогрессирования опухоли. В этой модели мышей иммунизировали 50 мкг АН1 за 10 дней до введения 5×105 клеток СТ26. Для подтверждения эффекта блокирования TGF-β1 на защиту против опухолевых клеток СТ две другие группы мышей подвергали обработке путем внутрибрюшинного введения пептидов р144 и р17(1-11)am через день между днями 6 и 10 (50 мкг/мышь/48 часов). Эти пептиды способны вызвать защиту против роста опухоли, измеряемого на 42-й день после подкожного введения опухолевых клеток. Эта защита наблюдалась у 100% животных в случае р144 (фиг. 16).
Из-за увеличения эффективности защиты против роста опухолевых клеток вследствие нейтрализации TGF-β1 огромный интерес будет многократно повторяться, и возможная разработка этих пептидов в стратегиях, принимаемых с целью улучшения противоопухолевых терапий, будет предприниматься снова и снова.


| название | год | авторы | номер документа |
|---|---|---|---|
| АГЕНТЫ И СПОСОБЫ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ДОМЕНА EDA ФИБРОНЕКТИНА | 2006 |
|
RU2430738C2 |
| КОНЪЮГАТЫ ДЛЯ ВВЕДЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2567667C2 |
| ИММУНОСТИМУЛИРУЮЩАЯ КОМБИНАЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГЕПАТИТА С | 2006 |
|
RU2431499C2 |
| ПЕПТИДЫ СО СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ СО СКУРФИНОМ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2502741C2 |
| ИММУНОГЕНЫ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИЧ | 2013 |
|
RU2648791C2 |
| АНТИ-ICOS АНТИТЕЛА | 2017 |
|
RU2764548C2 |
| ПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С TGF-β 1 И ИНГИБИРОВАТЬ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ TGF-β 1 IN VITRO И/ИЛИ IN VIVO, ПРИМЕНЕНИЕ ПЕПТИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, КОНСТРУКЦИЯ ДНК, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН И СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА | 2004 |
|
RU2333917C2 |
| ПРИМЕНЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ДНК, КОТОРАЯ КОДИРУЕТ ПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА β1 (ВАРИАНТЫ) | 2008 |
|
RU2455358C2 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2737765C2 |
| РЕКОМБИНАНТНЫЙ ХИМЕРНЫЙ БЕЛОК ANTH1, КОДИРУЮЩАЯ ЕГО НУКЛЕИНОВАЯ КИСЛОТА И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2322455C2 |




Изобретение относится к биотехнологии и представляет собой применение пептида с SEQ ID NO:1 или SEQ ID NO:2 или их фрагментов, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, для приготовления фармацевтической композиции для лечения рака. Кроме того, данные пептиды применяются после иммунизации для защиты против роста опухоли. Также пептиды применяются в смеси для иммунизации с агентом для ингибирования гуморального иммунного ответа, для стимуляции антигенпрезентирующих клеток, а также в качестве адъюванта при вакцинации. 5 н. и 1 з.п. ф-лы, 16 ил., 3 табл.
1. Применение пептидов с SEQ ID NO:1 или SEQ ID NO:2 или их фрагментов, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, для приготовления фармацевтической композиции для лечения рака.
2. Применение по п.1, где рак выбран из рака молочной железы, рака предстательной железы, карциномы толстой кишки, рака поджелудочной железы, рака кожи, гепатокарциномы, множественной миеломы и рака желудка.
3. Применение пептидов с SEQ ID NO:1 или SEQ ID NO:2 или их фрагментов, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, после иммунизации для защиты против роста опухоли.
4. Применение пептидов с SEQ ID NO:1 или SEQ ID NO:2 или их фрагментов, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, в смеси для иммунизации с антигеном для ингибирования гуморального иммунного ответа.
5. Применение пептидов с SEQ ID NO:1 или SEQ ID NO:2 или их фрагментов, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, для стимуляции антигенпрезентирующих клеток.
6. Применение пептидов с SEQ ID NO:1 или SEQ ID NO:2 или их фрагментов, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, в качестве адъюванта при вакцинации, причем антиген и указанный пептид с SEQ ID NO:1 или SEQ ID NO:2 или их фрагменты, включая фрагменты с амидированием в положении р11 и фрагменты с ацетилированием в положении р1 и амидированием в положении р11, вводят по отдельности в разное время и различными способами введения.
| Способ получения твердого сплава | 1932 |
|
SU31135A1 |
| WO 2005019244 A1, 03.03.2005 | |||
| LETTERIO J.J,, ET AL | |||
| Regulation of immune responses by TGF-beta | |||
| Annu Rev Immunol | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| FAN D., ET AL | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2011-06-10—Публикация
2005-10-24—Подача