Предпосылки изобретения
Настоящее изобретение относится к биологической науке, биотехнологии и медицинской науке, в частности к лекарственному средству, которое может ингибировать биологические активности интерлейкина-2 (IL-2) и гамма-интерферона (IFNγ), двух цитокинов, которые участвуют в регуляции нескольких функций организма и обнаруживаются в увеличенных количествах при патологическом состоянии. Это, в свою очередь, позволяет избежать инактивации иммунной системы, которая угрожает жизни пациентов.
Продуцирование цитокинов Т-хелперными лимфоцитами (CD4+) и цитотоксическими Т-лимфоцитами (CD8+) генерирует распределения (паттерны) продуцирования цитокинов, которые были идентифицированы как Тh1 и Th2. Th1-распределение характеризуется продуцированием IL-2, фактора некроза опухолей альфа (TNFα) и IFNγ, тогда как Тh2-распределение отвечает за продуцирование IL-4, IL-5, IL-6 и других. Этот тип реакции играет важную роль в защите организма, а также является стимулятором различных иммунопатологических реакций.
Имеется ряд ситуаций, в которых воспалительные и неконтролируемые иммунные реакции приводят к присутствию, развитию и сохранению воспалительных и аутоиммунных заболеваний. Продемонстрированы примеры патологической роли IL-2 и IFNγ в некоторых из этих заболеваний.
Рассеянный склероз является дегенеративным демиелинирующим аутоиммунным заболеванием. Роль IFNγ является очень хорошо выясненной для этого аутоиммунного нарушения. Таким образом, в клиническом испытании с использованием IFNγ было продемонстрировано, что введение IFNγ производит обострение этого заболевания (Panitch H.S. et al., Exacerbations of multiple sclerosis in patients treated with interferon gamma. Lancet 1, 893-5, 1987). Также было продемонстрировано, что уровни матричной РНК, а также белка, соответствующего IL-2 и IFNγ, являются более высокими у пациентов, страдающих от этого заболевания (Lin J. et al. IL-2, IFN-gamma and TNF-alpha mRNA expression in peripheral blood mononuclear cells in patients with multiple sclerosis. Chung Kuo I Hsueh Ko Hsueh Yuan Hsueh Page 19, 24-8, 1997). Продуцирование этих двух цитокинов клетками пациента предполагало их использование в качестве маркеров рецидива рассеянного склероза (Philippe J. et al. In vitro TNF-alpha, IL-2 and IFN-gamma production as markers of relapses in multiple sclerosis. Clin Neurol Neurosurg 98, 286-90, 1996). Наблюдали также, что IL-2 и IFNγ участвуют в активации неспецифических лимфоцитов, которые приводят к демиелинизации центральной нервной системы (Marino G. et al. Proinflammatory cytokines regulate antigen-independent T-cell activation by two separate calcium-signaling pathways in multiple sclerosis patients. Ann Neurol 43, 340-49, 1998). Проводится клиническое испытание с использованием анти-IL-2-антитела, известного как Daclizumab, на пациентах с этим заболеванием, которые не отвечают на терапию IFNβ.
Красная волчанка является другим системным аутоиммунным заболеванием, в котором присутствие высоких уровней IL-2 и IFNγ было связано с обострениями этого заболевания (Viallard J.F. et al. Th1 (IL-2, interferon-gamma (IFN-gamma)) and Th2 (IL-10, IL-4) cytokine production by peripheral blood mononuclear cells (PBMC) from patients with systemic lupus erythematosus (SLE). Clin Exp. Immunol 115, 189-95, 1999). С другой стороны, отсутствие рецептора для IFNγ уменьшает продуцирование аутоантител в моделях волчанки на животных (Haas C. et al. IFN-gamma receptor deletion prevents autoantibody production and glomerulonephritis in lupus-prone (NZB × NZW)F1 mice. J Immunol 160, 3713-18, 1998) и присутствие растворимого рецептора для IFNγ ингибирует присутствие этого заболевания (Ozmen L. et al. Experimental therapy of systemic lupus erythematosus: the treatment of NZB/W mice with mouse soluble interferon γ receptor inhibits the onset of glomerulonephritis, Eur J Immunol. 25, 6-12, 1995). Это было недавно испытано с использованием мышиной модели волчанки с химерным белком, содержащим внеклеточный участок IFNγ, слитый с Fc-фракцией иммуноглобулинов (Lawson BR. et al. Treatment of murine lupus with cDNA encoding IFN-gammaR/Fc. J Clin Invest. 106, 207-15, 2000). Однако эффективность этого типа молекулы в красной волчанке могла быть ограничена продемонстрированной дисфункцией Fc-рецептора у пациентов с красной волчанкой (Frank MM. et al. Defective reticuloendothelial system Fc-receptor function in systemic lupus erythematosus. N Engl J Med 300, 518-23, 1979, Dijstelbloem HM. et al. Fcgamma receptor polymorphisms in systemic lupus erythematosus: association with disease and in vivo clearance of immune complexes. Arthritis Rheum 43, 2793-800, 2000).
Тяжелая псевдопаралитическая миастения считается органспецифическим аутоиммунным заболеванием, опосредуемым аутоантителами к рецептору ацетилхолина и зависимым от Т-клеток, отличающимся мышечной слабостью и усталостью. Недавно было показано, что IFNγ благоприятствует образованию аутоантител к рецептору ацетилхолина; тогда как отсутствие рецептора IFNγ уменьшает восприимчивость к этому заболеванию в моделях животных (Zhang GX. et al. Mice with IFN-gamma receptor deficiency are less susceptible to experimental autoimmune myasthenia gravis. J Immunol 162, 3775-81, 1999). IL-2 и другие цитокины способствуют вместе с IFNγ развитию этого заболевания (Zhang GX. et al. Cytokines and the pathogenesis of myasthenia gravis. Muscle Nerve. 20, 543-51, 1997).
В диабете типа 1 (инсулинзависимом) или сахарном диабете бета-клетки поджелудочной железы разрушаются по аутоиммунному механизму. Существует доказательство in vitro, что IFNγ может быть токсичным для бета-клеток поджелудочной железы (Sternesjo J. et al. Effects of prolonged exposure in vitro to interferon gamma and tumor necrosis factor-alpha on nitric oxide and insulin production of rat pancreatic islets. Autoimmunity 20, 185-90, 1995, Dunger A. et al. Tumor necrosis factor-alpha and interferon-gamma inhibit insulin secretion and cause DNA damage in unweaned-rat islets. Extent of nitric oxide involvement. Diabetes 45, 183-9, 1996, Baldeon ME. et al. Interferon-gamma independently activates the MHC class I antigen processing pathway and diminishes glucose responsiveness in pancreatic beta-cell lines. Diabetes 46, 770-8, 1997). Однако другие исследования показывают, что действие IFNγ на клетки, продуцирующие инсулин в поджелудочной железе, является непрямым (Sarventick N. et al. Loss of pancreatic islet tolerance induced by beta-cell expression of interferon-gamma. Nature, 346, 844-7, 1990). Наиболее вероятно, что его действие активируется макрофагами для образования IL-1, TNFα и оксида азота, которые действуют на бета-клетки и стимулируют экспрессию МНС I в бета-клетках, что способствует деструкции цитотоксическими лимфоцитами (Thomas HE. et al. IFN-gamma action on pancreatic beta cells causes class I MHC upregulation but not diabetes. J Clin Unvest, 102, 1249-57, 1998, Thomas HE et al. Beta cell destruction in the development of autoimmune diabetes in the non-obese diabetic (NOD) mouse. Diabetes Metab Res Rev 16, 251-61, 2000). Было также показано, что отсутствие IFNγ задерживает появление диабета, хотя и не предотвращает его (Hultgren B. et al. Genetic absence of gamma-interferon delays but does not prevent diabetes in NOD mice. Diabetes 45, 812-7, 1996). Несколько сообщений показывают, каким образом инактивация биологической активности IFNγ может быть использована для предупреждения диабета (Debray-Scahs M. et al. Prevention of diabetes in NOD mice treated with antibody to murine IFN gamma. J Autoimmun 4, 237-48, 1991, Moosmayer D. et al. A bivalent immunoadhesin of the human interferon-gamma receptor is an effective inhibitor of IFN-gamma activity. J Interferon Cytokine Res 15, 1111-5, 1995, Prud'homme G.J. et al. Prevention of autoimmune diabetes by intramuscular gene therapy with a nonviral vector encoding an interferon-gamma receptor/IgG1 fusion protein. Gene Ther 6, 771-7, 1999). Наблюдали также, что IL-2 в качестве активатора Т-лимфоцитов может способствовать этой реакции в деструкции клеток, продуцирующих инсулин. Недавно было начато клиническое испытание в отношении лечения диабета типа 1 у детей/подростков в возрасте от 10 лет до 21 года с недавним диагнозом этого заболевания с использованием антитела к IL-2 Daclizumab (Riley Hospital for Children. Project: Prevention of Diabetes Progression Trial (PDPT). www.rileyhospital.org). Это исследование было предназначено для предупреждения прогрессирования разрушения бета-клеток у детей с недавним диагнозом.
Отторжение трансплантатов является сложным процессом, в котором клеточно-опосредованный иммунитет и циркулирующие в кровотоке антитела играют важную роль. Стандартные терапии против отторжения используют комбинации лекарственных средств, таких как циклоспорин, рапамицин, азатиоприн, стероиды и другие. Однако даже с использованием этой терапии более 50% лиц, получающих почки в качестве трансплантатов, медленно отторгают их трансплантат в пределах 10 лет. Эта реакция "трансплантат против хозяина" является главной причиной смерти среди пациентов с трансплантированным костным мозгом. В этих реакциях отторжения трансплантатов, которые ухудшают жизнь пациентов, было показано, что IL-2 и IFNγ способствуют их развитию (Hu H.Z. et al., Kinetics of interferon-gamma secretion and its regulatory factors in the early phase of acute graft-versus-host disease. Immunology 98, 379-85, 1999, Nakamura H. et al. Serum levels of soluble IL-2 receptor, IL-12, IL-18 and IFN-gamma in patients with acute graft-versus-host disease after allogeneic bone marrow transplantation. J Allergy Clin Immunol. 106, S45-50. 2000).
Ревматоидный артрит (RA) является хроническим системным нарушением неизвестной этиологии, характеризующимся воспалением, синовиальной гиперплазией и разрушением пораженных суставов. IL-2 считают обычно провоспалительным цитокином, который обостряет состояние заболеваний типа Тh1, таких как аутоиммунный артрит. Недавние исследования показали, что матричная РНК IL-2 увеличивается во время острой фазы артрита, индуцируемой коллагеном в модели животного (Thornton S. et al. Heterogeneous effects of IL-2 on collagen-induced arthritis. J Immunol 165, 1557-63, 2000). С другой стороны, в моделях животных было обнаружено, что обострение этого заболевания было связано с увеличением IFNγ (Tellander A.C. et al. Potent adjuvant effect by anti-CD40 in collagen-induced arthritis. Enhanced disease is accompanied by increased production of collagen type-II reactive IgG2a and IFN-gamma. J Autoimmun 14, 295-302, 2000). Как IL-2, так и IFNγ значимо увеличивались в синовиальной ткани пациентов с RA (Canete J.D. et al. Differential Th1/Th2 cytokine patterns in chronic arthritis: interferon gamma is highly expressed in synovium of rheumatoid arthritis compared with seronegative spondyloarthropathies. Ann Rheum Dis 59, 263-8, 2000).
Воспалительное заболевание кишечника состоит из двух желудочно-кишечных заболеваний: болезни Крона и язвенного колита. Эти заболевания характеризуются хроническим воспалением кишечника. Болезнь Крона является воспалительным нарушением, которое распространяется около внутренней линии кишечной стенки и проникает в ее более глубокие слои. Это воспаление может быть обнаружено в любой части пищеварительной системы (пищеводе, желудке, тонкой кишке, толстой кишке или анусе). Компания Protein Desig Labs объявила о начале клинических испытаний фазы I/II на пациентах с умеренной-тяжелой болезнью Крона с использованием антитела к IFNγ (SMART Anti-Gamma Interferon Antibody) (Fremont, CA. Protein Design Labs Announces Phase I/II Trial of SMART" Anti-Gamma-Interferon Antibody in Crohn's Disease. Protein Design Labs, Inc. (Nasdaq), January 10, 2001). Язвенный колит ограничивается слизистой оболочкой (мукозой) и субмукозой толстой кишки (ободочной кишки или прямой кишки). Недавно на Ежегодном Конгрессе Американской Ассоциации Гастроэнтерологии было показано, что уменьшение уровней IFNγ в кровотоке является маркером ремиссии в мышиной модели колита (Yaron I. Annual meeting of the American Gastroenterology Association. May 20-23, 2001. Georgia World Congress Center. Atlanta, Georgia).
Септический шок является результатом диссеминирования микроорганизмов обратными инфекциями через кровообращение. Он более часто вызывается грамотрицательными бациллами, приобретенными в больницах, и является более частым у пациентов с ослабленным иммунитетом и пациентов, имеющих хронические заболевания. У 1/3 этих пациентов он вызывается грамположительными микроорганизмами и Candida albicans. Как в случае септического шока, вызываемого грамотрицательными бактериями, так и в случае септического шока, вызываемого грамположительными бактериями, IFNγ и IL-2 способствуют летальности воспалительных реакций, в которых они участвуют. IFNγ является летальным медиатором в моделях животных с септическим шоком (Heremans H. et al. Interferon gamma, a mediator of lethal lipopolysaccharide-induced Shwartzman-like shock reactions in mice. J Exp Med 171, 1853-69, 1990, Wysocka M. et al. Interleukin-12 is required for interferon-gamma production and lethality in lipopolysaccharide-induced shock in mice. Eur J Immunol 25, 672-6, 1995, Kuschnaroff LM et al. Increased mortality and impaired clonal deletion after staphylococcal enterotoxin B injection in old mice: relation to cytokines and nitric oxide production. Scand J Immunol 469-78, 1997). Как и в случае животных моделей других заболеваний, отсутствие IFNγ-рецептора в этих животных делает их устойчивыми к эндотоксическому шоку (Car B.D. et al. Interferon gamma receptor deficient mice are resistant to endotoxic shock. Exp Med 179, 1437-44, 1994). Подобным образом несколько сообщений показывают участие IL-2 в развитии и летальности септического шока (Micusan V.V., et al. Production of human and murine interleukin-2 by toxic shock syndrome toxin-1. Immunology 58, 203-8, 1986, Arad G., et al. Superantigen antagonist protects against lethal shock and defines a new domain for T-cell activation. Nat. Med. 6, 378-9, 2000, Stevens DL. et al. Streptococcal toxic shock syndrome associated with necrotizing fasciitis. Annu Rev Med 51, 271-88, 2000). Мононуклеарные клетки, растущие in vitro с IL-2, выделяют вторичные цитокины, такие как IL-1, TNFα и IFNγ, и предполагается, что они участвуют в патофизиологии септического шока.
Обыкновенный псориаз является комплексным и мультигенным кожным заболеванием, которое потенциально опосредовано провоспалительными цитокинами, продуцируемыми поврежденными Т-клетками. Неадекватная хроническая экспрессия этих цитокинов приводит к иммунной активации клеток и к повреждению тканей. Псориаз характеризуется избыточным продуцированием клеток кожи и генерированием кровеносных сосудов, которые, вероятно, ответственны за красноту и образование пластинок, которые являются частью этого заболевания. Патологическая роль IFNγ и IL-2 была доказана для псориаза. Большинство эпидермальных клеток в случае обыкновенного псориаза продуцируют IL-2, IFNγ и TNFα, и эти клетки определяются как Т-цитотоксические клетки. Высокие уровни IFNγ и IL-2, но не IL-4, были детектированы у пациентов с псориазом. Это может быть связано с нарушением баланса в популяции Т-клеток, которое способствует пролонгированной или хронической иммунной активации этих клеток (Schaak JF et al. T-cells involved in psoriasis vulgaris belong to the Th1-subset. J Invest Dermatol 102, 145-9, 1994, Austin L.M., et al. The majority of epidermal T cells in Psoriasis vulgaris lesions can produce type 1 cytokines, interferon-gamma, interleukin-2, and tumor necrosis factor-alpha, defining Tc1 (cytotoxic T lymphocyte) and TH1 effector populations: a type 1 differentiation bias is also measured in circulating blood T cells in psoriatic patients. J Invest Dermatol 113, 752-9, 1999). Обнадеживающий результат был показан для лечения псориаза с использованием Daclizumab (Krueger J.M. et al. Successful in vivo blockade of CD25 (high-affinity interleukin 2 receptor) on T cells by administration of humanized anti-Tac antibody to patients with psoriasis. J Am. Acad. Dermatol. 43, 448-58, 2000). Недавно было начато новое испытание с этим лекарственным средством (Fremont, CA. Protein Design Labs Presents Three Humanized Antibodies in Clinical Development for Psoriasis at International Psoriasis Symposium. June 22, 2000. Protein Design Labs, Inc. (PDL) Nasdaq).
Имеются другие менее изученные заболевания, где применение антагониста против IL-2 и IFNγ может быть также использовано; в этом случае это может быть атеросклероз и ишемия/реперфузия. Атеросклероз и атеросклероз после трансплантации характеризуются расширением интимы (внутренней оболочки) артерий в результате инфильтрации мононуклеарных лейкоцитов, пролиферации клеток гладких мышц сосудов и накапливания внеклеточного матрикса, а также присутствия IFNγ (Ross R. Atherosclerosis - an inflamatory disease. N. Engl. J. Med. 340, 115-26, 1999, Hansson G.K. et al. Immune mechanisms in atherosclerosis. Arteriosclerosis 9, 567-78, 1989 и Libby P et al. Functions of vascular wall cells related to development of transplantation-associated coronary arteriosclerosis. Transplant. Proc. 21, 3677-84, 1989). Было показано, что экзогенный IFNγ увеличивает атеросклероз в модели животного (Whitman S.C. et al. Exogenous interferon-gamma enhances atherosclerosis in apolypoprotein E-/- mice. Am J Pathol 157, 1819-24, 2000). С другой стороны, было показано, что нейтрализация IFNγ в сыворотке, а также отсутствие его гена уменьшает распространение расширения интимы (внутренней оболочки) сосудов (Gupta S. et al. IFN γ potentiates atherosclerosis in ApoE knock-out mice. J. Clin. Invest. 99, 2752-61, 1997, Nagano H. et al. Interferon γ deficiency prevents coronary arteriosclerosis but not myocardial rejection in transplanted mouse hearts. J. Clin. Invest. 100, 550-57, 1997, Räisänen-Sokolowski A. et al. Reduced transplant arteriosclerosis in murine cardiac allografts placed in interferon γ knockout recipients. Am. J. Pathol. 152, 359-65, 1998). Недавно было доказано, что IFNγ стимулировал действие атеросклероза в отсутствие лейкоцитов (Tellides G. et al. Interferon γ elicits arteriosclerosis in the absence of leukocytes. Nature 403, 207-11, 2000). Ишемия и реперфузия характеризуются прерыванием кровотока в некотором участке, с последующей элиминацией подачи кислорода и питательных веществ и общим или частичным восстановлением кровотока в ткани, которая была ишемической, что часто происходит клинически. Это может наблюдаться во время гиповолемического и септического шока, инфаркта миокарда, эмболии, компартментального синдрома, обморожения, трансплантации органов и т.д. Гипоксия ткани, в любом случае, приводит к изменению клеточного метаболизма, в результате чего постоянно возникают более хорошо известные комплексные биохимические и молекулярные модификации. Повреждение, вызываемое реперфузией, приводит затем к клеточной смерти и эндотелиальной дисфункции, вызываемой восстановлением кроветворной ткани. Сообщалось, что IFNγ и IL-2 являются медиаторами повреждения, производимого на органах ишемией и реперфузией (Serrick C. et al. The early release of interleukin-2, tumor necrosis factor-alpha and interferon-gamma after ischemia reperfusion injury in the lung allograft. Transplantation 58, 1158-62, 1994, Marck A.R.C. et al. Ischemia/Reperfusion-Induced IFN-gamma Up-Regulation: Involvement of IL-12 and IL-18. The Journal of Immunology 162, 5506-10, 1999).
Некоторые авторы описали антагонисты против IFNγ. Ингибирование антивирусной активности IFNγ человека его рекомбинантным растворимым рецептором было описано в Европейском патенте ЕР 0393502 А1. Было также описано, что рекомбинантный растворимый рецептор мышиного IFNγ ингибирует присутствие гломерулонефрита у мышей (Ozmen L. et al. Experimental therapy of systemic lupus erythematosis: the treatment of NZB/W mice with mouse soluble interferon-gamma receptor inhibits the onset of glomerulonephritis. Eur. J Immunol. 25, 6-12, 1995). Были сконструированы три мышиных IFNγ. Они состоят из химерных белков, образованных внеклеточным участком рецептора мышей для IFNγ и константными доменами молекул иммуноглобулинов. Эти конструкции нейтрализуют антивирусную активность мышиного IFNγ и имеют пролонгированную среднюю продолжительность существования в крови (Cornelia K. et al. Construction, purification, and characterization of new interferon gamma (IFN γ) inhibitor protein. J. Biol. Chemistry. 267, 9354-60, 1992 и European patent EP 0614981 A1). Потенциальное применение фрагмента иммуноглобулина или его Fc-участка, слитых с растворимым рецептором IFNγ, для использования в красной волчанке у людей может быть ограничено продемонстрированной дисфункцией рецептора для Fc этого аутоиммунного нарушения (Frank M.M. et al. Defective reticuloendothelial system Fc-receptor function in systemic lupus erythematosus. N Engl J Med 300, 518-23, 1979). Этот тип ингибитора является монофункциональным и, следовательно, имеет более узкие рамки действия.
У мышей применение нейтрализующих анти-IFNγ-антител уменьшает проявления болезни "трансплантат против хозяина" (Mowat A. et al. Antibodies to IFN gamma prevent immunologically mediated intestinal damage in murine graft-versus-host reaction. Immunology 68, 18-23, 1989). В исследовании кожных аллотрансплантатов анти-IFNγ-антитела ингибировали отторжение только в том случае, если трансплантат был несовместимым с антигенами МНС класса II. Это может означать, что IFNγ способствует отторжению этого аллотрансплантата через индукцию антигенов МНС класса II (Rosenberg A. et al. Specific prolongation of MHC class II disparate skin allografts by in vivo administration of anti-IFN gamma monoclonal antibody. J. Immunol. 144, 4648-50, 1990). Одноцепочечные антитела с вариабельной областью (scFv) к IFNγ человека, экспрессируемые в бактериях, также были получены и оказались эффективными в нейтрализации биологической активности мышиного IFNγ (Froyen G. et al. Bacterial expression of single-strand antibody fragment (scFv) that neutralizes the biological activity of human interferon γ. Mol Immunol. 30, 805-12, 1993). Применение антител в терапии человека сталкивается с проблемой реакций хозяина против иммуногенных участков этих гетерологичных молекул, а в случае химерных и гуманизированных антител, с потерей аффинности и специфичности (Merluzzi S. et al. Humanized antibodies as potential drugs for therapeutic use. Adv Clin Path, 4, 77-85, 2000), а также с проявлениями токсичности (Clark M. et al. Antibodies to IFN gamma prevent immunologically mediated intestinal damage in murine graft-versus-host reaction. Immunology 68, 18-23, 2000).
Были описаны также другие аналогичные решения. Предлагались смеси цитокина с его растворимым рецептором, но целью этого было потенциирование действия цитокинов. В этом случае цитокин и его рецептор получают независимо и позднее смешивают в одном препарате, как показано в Американском патенте WO 94/21282.
Циклоспорин А, FK506 и рапамицин являются сильными супрессорами иммунной системы, в частности Т-клеток, которые используются для предотвращения отторжения трансплантата. Первые два ингибируют трансдукцию сигнала, запускаемую рецептором антигена к Т-клеткам, что приводит к транскрипции генов ранней активации. Это включает в себя транскрипцию гена, который кодирует IL-2, необходимый для перехода состояния покоя G0 к фазе G1 клеточного цикла. Рапамицин не влияет на ранний синтез цитокинов Т-клетками, но он ингибирует реакцию этих клеток на IL-2, требуемую для перехода от фазы G1 к S клеточного цикла (Waldmann T.A. et al. The IL-2/IL-2 receptor system: a target for rational immune intervention. Immunology Today 14, 264-70, 1993). Рапамицин делает возможной специфическую активацию Т-клеток, но позволяет избежать их клонального размножения посредством вмешательства в передачу сигнала с использованием бета-цепи IL-2-рецептора (RβIL-2) (Woerly G. et al. Effect of rapamycin on the expression of IL-2 receptor (CD25). Clin Exp Immunol 103, 322-7, 1996). Циклоспорин А значимо увеличивал выживание аллотрансплантатов почек, тогда как он также уменьшает аутоиммунные заболевания. Применение этих иммуносупрессоров было ограниченным вследствие их токсических действий, которые включают в себя желудочно-кишечные осложнения, гипертрофию десен и особенно зависимую от дозы нефротоксичность и гипертензию (Hortelano S. et al. Potentiation by nitric oxide of cyclosporin A and FK506-induced apoptosis in renal proximal tubule cells. J Am Soc Nephrol 11, 2315-23, 2000, Tsimaratos M. et al. Kidney function in cyclosporin-treated paediatric pulmonary transplant recipients. Transplantation 69, 2055-9, 2000). Моноклональные антитела, которые блокируют взаимодействие IL-2 с его рецептором, использовали в моделях животных для ингибирования болезни "трансплантат против хозяина" и отторжения аллотрансплантатов. Эти антитела использовали также в грызунах для супрессии аутоиммунных нарушений. В клинических испытаниях антитела против альфа-цепи IL-2-рецептора (RαIL-2) вызывали улучшение в случае болезни "трансплантат против хозяина", которая была нечувствительной к лечению стероидами. Однако эти эффекты являются ограниченными вследствие антигенности этих антител. Было обнаружено, что одноцепочечные антитела вариабельной области ингибируют соединение IL-2 с γ-субъединицей IL-2-рецептора и мешают биологической активности IL-2, тестируемой в мышиной клеточной линии CTLL-2, как описано в Европейском патенте ЕР 0621338 А2. Создание гуманизированных антител, которые улучшают этот тип терапии, все еще имеет недостатки, указанные ранее. В этом типе терапии испытывали также моноклональные антитела, конъюгированные с токсинами или радиоактивно меченые (Waldmann T.A. Genetically engineered monoclonal antibodies armed with radionuclides. Year Immunol. 7, 205-12, 1993). Использование токсинов, слитых с антителами анти-IL-2 или IL-2, для элиминации клеток, экспрессирующих рецептор для IL-2 и способствующих развитию патогенных стадий, было описано в Американском патенте WO 92/20701 и в Европейском патенте ЕР 0369316 А2. Неспецифическая токсичность этих иммунотоксинов (Frankel A.E. et al. Clinical trials of target toxins. Cancer Biology 6, 307-17, 1995), а также их иммуногенность (Chen S-Y. et al. Design of genetic immunotoxin to eliminate toxin immunogenicity. Gene Therapy 2, 116-23, 1995) сделали применение этих лекарственных средств едва ли рекомендуемым. Анти-IL-2-антитела разрабатываются для лечения RA (Simon LS. et al. New and future drug therapies for rheumatoid arthritis. Rheumatology (Oxford) 39 Suppl 1:36-42, 2000). Антитела, нацеленные против RαIL-2, используют во избежание отторжения трансплантатов почек (Olyaei AJ et al. Use of basiliximab and daclizumab in kidney transplantation. Prog Transplant 11, 33-7, 2001). Недостатки применения антител в продолжительных терапиях были описаны выше.
Нейтрализация провоспалительных цитокинов, таких как TNFα (Beutler B. et al. Passive immunization against cachectin/tumor necrosis factor protects mice from lethal effect of endotoxin. Science 229, 869-71, 1989) или IL-1 (Natanson C et al. Selected treatment strategies for septic shock based on proposed mechanism of pathogenesis. Ann. Intern. Med. 120, 771-83, 1994), уменьшает смертность вследствие сепсиса в нескольких моделях животных. Однако в клинических испытаниях с использованием антагонистов против IL-1 (антагониста IL-1-рецептора) (Fischer C.J. et al. Recombinant human interleukin-1 receptor antagonist in the treatment of patients with sepsis syndrome: results from randomized, double-blind, placebo-controlled trial. JAMA 271, 1836-43, 1994) и против TNFα (рекомбинантного химерного белка: растворимый рецептор TNF/Fc) (Fischer C.J. et al. Treatment of septic shock with tumor necrosis factor receptor/Fc fusion protein. N Engl J. Med. 334, 1697-1702, 1996) они не только не вызывали улучшения, но и увеличивали смертность вследствие инактивации иммунной системы. Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (FDA) одобрил два антагониста против TNFα (Lipsky PE. et al. Infliximab and Methotrexat in the Treatment of Rheumatoid Arthritis. N Engl J Med, 343, 1594-1602, 2000), которые показали благоприятные действия в лечении RA. Один из них является антителом к субъединице рецептора TNFα (Infliximab). Нейтрализация TNFα выше определенных уровней может вызывать инактивацию иммунной системы, как было показано в модели крыс, имеющих RA (Colagiovanni DB. et al. TNF-alpha blockade by a dimeric TNF type I receptor molecule selectively inhibits adaptive immune responses. Immunopharmacol Immunotoxicol 22, 627-51, 2000). Более высокую частоту инфицирований наблюдали у пациентов, получавших Infliximab, чем в контрольных группах без него (группах плацебо) (Schaible TF. Long term safety of infliximab. Can J Gastroenterol 14 Suppl C:29C-32C, 2000), а также появление аутоантител и развитие волчанки (Markham A. et al. Infliximab: a review of its use in the management of rheumatoid arthritis. Drugs 59, 1341-59, 2000). Этанерцепт является химерным белком, который связан с растворимым рецептором для TNFα и Fc-частью IgG1 (Moreland LW et al. Etanercept therapy in rheumatoid arthritis. A randomized, controlled trial. Ann Intern Med 130, 478-86, 1999). Прекращение этого лечения приводит к рецидиву у пациента; таким образом, это лекарственное средство не излечивает это заболевание. Это подразумевает, что пациент должен лечиться в течение продолжительных периодов. Хотя в краткосрочных исследованиях не было существенных вредных эффектов, пролонгированная терапия может генерировать присутствие антител к этой молекуле (Russel E. et al. Patients receiving etanercept may develop antibodies that interfere with monoclonal antibody laboratory assays. Arthritis Rheum 43, 944-47, 2000). Сообщалось несколько случаев, когда у пациентов, получавших этанерсепт, развивалась летальная апластическая анемия, а также панцитопения и синдромы демиелинизации (Klippel JH. Biologic Therapy for Rheumatoid Arthritis. N. Engl J Med., 343, 1640-1, 2000).
До настоящего времени ни один антагонист IFNγ не использовали клинически. Применение антагонистов цитокинов для предупреждения, уменьшения или элиминации аутоиммунных реакций, наносящих вред организму вследствие их временного изменения или их хронического характера, исследовали для многих цитокинов. Многие из них были неэффективными. В некоторых случаях антагонист ограничен молекулой цитокина, и его рамки действия и эффективность являются ограниченными, так как дозы не могут быть увеличены вследствие их токсичности. В случае тех антагонистов, которые были способны нейтрализовать цитокин, этот эффект был экстремальным и вызывал инактивацию важных для организма функций (иммунной системы).
IL-2 взаимодействует с RαIL-2. Эта субъединица способна интернализовать IL-2, что было продемонстрировано для Т- и В-лимфоцитов, и, вероятно, возвращается к поверхности, тогда как другие цепи этого рецептора разрушаются после интернализации (Hemar A. et al. Endocytosis of interleukin 2 receptors in human T lymphocytes: distinct intracellular localization and fate of the receptor alpha, beta, and gamma chains. J Cell Biol 129, 55-64, 1995). IFNγ интернализуется и разрушается, тогда как его рецептор подвергается рециклингу (используется повторно) (Celada A. et al. Internalization and degradation of receptor-bound interferon-gamma by murine macrophages. Demonstration of receptor recycling. J Immunol 130, 147-53, 1987). Характеристики интернализации IL-2 посредством его RαIL-2, а также интернализации IFNγ его рецептором свидетельствуют о потенциальном рециклинге по меньшей мере внеклеточной области рецептора IFNγ, образующего часть химерного антагониста AnTh1. Это будет приводить к пролонгированию присутствия этой молекулы в кровотоке и, следовательно, ее действия.
Объединение или конъюгация двух молекул часто приводит к значительному уменьшению или потере биологической активности связанных молекул вследствие имеющих место конформационных изменений или вследствие пространственной интерференции, происходящей в результате создания новой молекулы (Knusli, C. et al. Polyethylene glycol (PEG) modification of granulocyte-macrophage colony stimulating factor (GM-CSF) enhances neutrophil priming activity but not colony stimulating activity. Br J Haematol 82, 654-63, 1991). Использовали некоторые альтернативы, например, в Американском патенте US № 5073627, где имеется описание слитого пептида, который является слиянием колониестимулирующего фактора гранулоцитов и макрофагов (GM-CSF) с IL-3. Проблемой этого типа пептидов является то, что они могут быть жесткими и негибкими. В результате этот белок не может двигаться для приобретения точной конформации, позволяющей ему правильно выполнять его биологическую активность. Таким образом, необходимо также конструировать и находить пептиды, которые могут связывать две молекулы и в то же самое время позволять каждой из них принимать правильную конформацию с образованием биологически активной молекулы. С учетом этого требуются более безопасные, более эффективные и более специфические иммуносупрессоры (иммунодепрессанты) и противовоспалительные лекарственные средства. Таким образом, важно получить молекулу с большей функциональной многосторонностью, которая ингибирует все патологические активности или функции желаемых лекарственных средств, но, одновременно, может обеспечить возможность проявления важных для организма функций, делая возможным его продолжительное использование без угрозы для жизни пациентов. До сих пор еще не был сконструирован антагонист, который может препятствовать одновременному действию двух цитокинов и который может быть лишен паралитического действия на иммунную систему.
Подробное описание изобретения
Сущностью настоящего изобретения является рекомбинантный химерный белок, названный AnTH1, который образован фрагментом из 60 аминокислот N-концевого участка IL-2 человека, слитым через пептид из 4 аминокислот с N-концевым внеклеточным участком альфа-субъединицы рецептора IFNγ, содержащим 228 аминокислот. Этот белок имеет стимулирующую рост Т-клеток активность, он ингибирует стимулирующую рост Т-клеток активность, индуцируемую IL-2, он ингибирует индукцию HLA-II посредством IFNγ и он ингибирует антипролиферативную активность IFNγ. ДНК-последовательность, соответствующую первым 60 аминокислотам N-конца IL-2 человека и связывающему пептиду (SEQ ID NO:5), и последовательность этого связывающего пептида и ДНК, кодирующую 228 аминокислот внеклеточного участка RαIFNγ (SEQ ID NO:7), получали обратной транскрипцией поли А-РНК из клеток Jurkat и Raji соответственно и амплифицировали со специфическими праймерами при помощи ПЦР (см. пример 1, SEQ ID NO:1 и SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4). ДНК-последовательность, соответствующую связывающему пептиду (SEQ ID NO:6), конструировали для этой цели и добавляли к праймерам, используемым для амплификации этого участка растворимого рецептора RαIFNγ.
Настоящее изобретение описывает также вектор, используемый для продуцирования в E. coli рекомбинантного белка AnTH1, названный pHu(AnTH1), который был депонирован в Бельгийских Координированных Коллекциях Микроорганизмов (ВССМ) с номером доступа LMBP 4535 6 мая 2002 года. Этот вектор получали с использованием технологии рекомбинантных ДНК (Sambrook et al. Molecular Cloning: A Laboratory Manual, Second Ed. Cold Spring Harbor, New York, 1989). Последний вектор модифицировали, и он, в конце концов, содержит предпочтительный маркер, промотор триптофана и последовательность, которая кодирует 60 аминокислот IL-2 человека, связывающий пептид и 228 аминокислот внеклеточного участка RαIFNγ (SEQ ID NO:8). Конечная конструкция полученного вектора названа pHu(AnTH1), (см. пример 2, фиг.1).
Настоящее изобретение описывает также трансформированный штамм E. coli с вектором pHu(AnTH1). Этот вектор pHu(AnTH1) использовали для трансформации штамма E. coli W3110P3. Штамм E. coli W3110P3, содержащий вектор pHu(AnTH1), выращивали и индуцировали для экспрессии рекомбинантного химерного белка AnTH1. Этот штамм достигает высокой степени экспрессии этого белка (см. пример 4). Этот белок может экспрессироваться в других клетках-хозяевах (клетках насекомых, клетках млекопитающих и клетках растений с использованием подходящих векторов). Настоящее изобретение описывает также получение рекомбинантного химерного белка с достаточной степенью чистоты для оценки его биологической активности посредством способа, при помощи которого получают препарат с чистотой 80-90% биологически активного белка. Осадок клеток, полученный культивированием этого штамма после индукции, обрабатывали для экстракции рекомбинантного белка. Последовательные процедуры промывки осадка проводили с использованием солюбилизирующих агентов (денатурирующих агентов), которые позволяют экстрагировать представляющий интерес белок с минимальным количеством загрязняющих белков (белков-примесей) из E. coli. После получения достаточной степени чистоты (80-90%) с использованием этих процедур препарат, содержащий белок AnTH1, подвергали повторной укладке. Эта процедура состоит из медленной элиминации денатурирующих агентов. Этот процесс иллюстрирован в примере 5.
Настоящее изобретение описывает биологическую активность рекомбинантного белка AnTH1. Этот белок имеет стимулирующую рост Т-клеток активность (пример 7). Он способен препятствовать стимуляции пролиферации Т-клеток, производимой IL-2 человека, в линии CTLL-2 мышиных клеток (пример 8). Он способен ингибировать антипролиферативную активность IFNγ человека в линии клеток Нер-2 (пример 9), и он также ингибирует стимуляцию посредством IFNγ экспрессии HLA-II в линии клеток COLO 205 (пример 10). IL-2 человека, в противоположность IFNγ, может также действовать на мышиные клетки.
Этот рекомбинантный белок может быть использован в получении полезной фармацевтической композиции для заболеваний, в которых IL-2 и IFNγ играют патологическую роль. Эти заболевания могут быть заболеваниями аутоиммунного типа, такими как рассеянный склероз, системная красная волчанка, тяжелая псевдопаралитическая миастения, инсулинзависимый сахарный диабет, активный хронический гепатит и фульминантный (молниеносный) гепатит; заболеваниями аутоиммунного/воспалительного типа, такими как ревматоидный артрит и псориаз, а также такими заболеваниями, как отторжение органов, болезнь "трансплантат против хозяина", и воспалительными заболеваниями, такими как септический шок, а также атеросклерозом.
Настоящее изобретение обеспечивает новый способ для предупреждения, подавления и/или элиминации действий двух цитокинов, которые имеют патологические функции в различных заболеваниях. Таким образом, увеличивается мишень действия в более специфической форме. Применение химерного белка, который может нейтрализовать системы передачи сигналов двух цитокинов, участвующих в одинаковых патологических ситуациях, или препятствовать им, позволит расширить рамки путей воздействия на них и, следовательно, их эффективность. При наличии определенной стимулирующей рост Т-клеток активности этот способ позволит избежать нежелательной инактивации иммунной системы, что сделает возможным более продолжительное использование у пациентов и организмов, требующих этого. Таким образом, это лекарственное средство будет более безопасным и более эффективным. Целью настоящего изобретения является создание гетеро-бивалентного антагониста, который может препятствовать функциям IL-2 и IFNγ человека, с усилением терапевтических возможностей этой молекулы и элиминацией вредных побочных действий.
Депонирование микроорганизма:
Плазмида pHu(AnTH1) была депонирована согласно Будапештскому договору о международном признании депонирования микроорганизмов для целей патентной процедуры, в Бельгийских Координированных Коллекциях Микроорганизмов (ВССМ) с номером доступа LMBP 4535 6 мая 2002 года.
Описание чертежей
Фиг.1. Генетическое конструирование плазмиды pHu(AnTH1) для экспрессии рекомбинантного химерного белка AnTH1.
Фиг.2. Экспрессия в E. coli химерного белка AnTH1. Электрофорез в 12,5% полиакриламидном геле при восстанавливающих условиях, а: стандарт молекулярных масс; b, c, d: штамм отрицательного контроля, 0, 8 и 18 часов индукции; e, f, g: штамм, содержащий плазмиду pHu(AnTH1), в условиях индукции 0, 8, 18 часов.
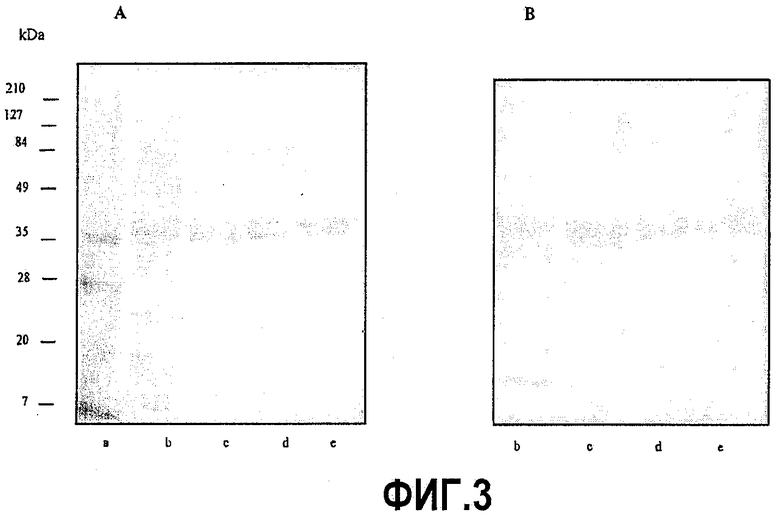
Фиг.3. Присутствие рекомбинантного химерного белка AnTH1 на различных стадиях процесса частичной очистки. А: Электрофорез в 12,5% полиакриламидном геле при восстанавливающих условиях. В дорожке а: стандарт молекулярных масс, b: ферментация, с: экстракция 8 М мочевиной, d: фракции смешанной гель-фильтрационной хроматографии, е: смесь фракций после диализа. В: Вестерн-блот с использованием анти-AnTH1-антисыворотки, разведенной 1:1000, в смеси 1% ЗФР/обезжиренное молоко, выделенной из антител к штамму E. coli W3110P3. В: в дорожках a, b, c, d нанесены те же самые пробы в том же самом порядке, который описан в электрофорезе фиг.А (стандарт молекулярных масс здесь не наносили).
Фиг.4. Идентификация химерного белка AnTH1 с использованием Вестерн-блота. Для идентификации использовали антисыворотки анти-IL-2 (А) и анти-AnTH1 (В). Коэффициент разведения в обоих случаях был 1:1000. Использовали препарат AnTH1, повторно уложенный после диализа (дорожка а), в дорожке b был нанесен IL-2.
Фиг.5. Анализ связывания IFNγ человека, меченого 125I, с химерным белком AnTH1 с использованием дот-блота. Приблизительно 1 мкл элюированных фракций из гель-фильтрационной хроматографии использовали в нитроцеллюлозной мембране. Полоски (стрипы) инкубировали с IFNγ, меченым 125I (35 мкКи/мкг), в отсутствие (дорожка а) и в присутствии (дорожка b) избытка (100 кратного) IFNγ человека.
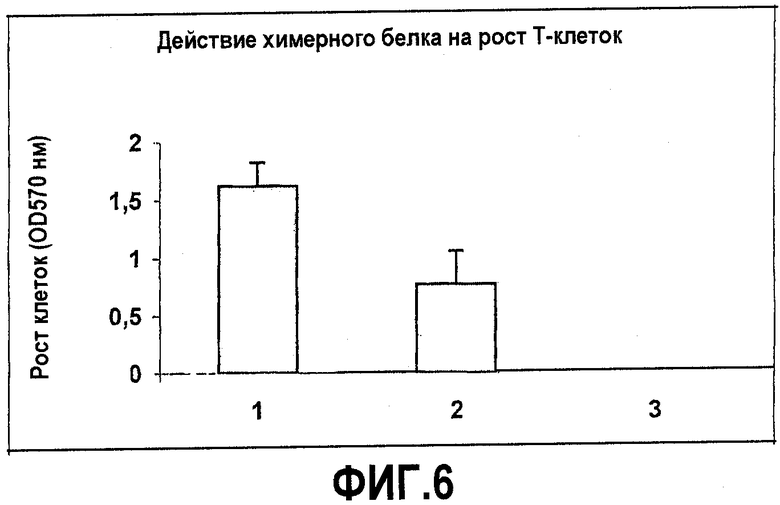
Фиг.6. Активность стимуляции роста Т-клеток рекомбинантного химерного белка AnTH1. Столбец 1: 2,8 нг/мл IL-2, столбец 2: 1,5 мкг/мл AnTH1, столбец 3: культуральная среда.
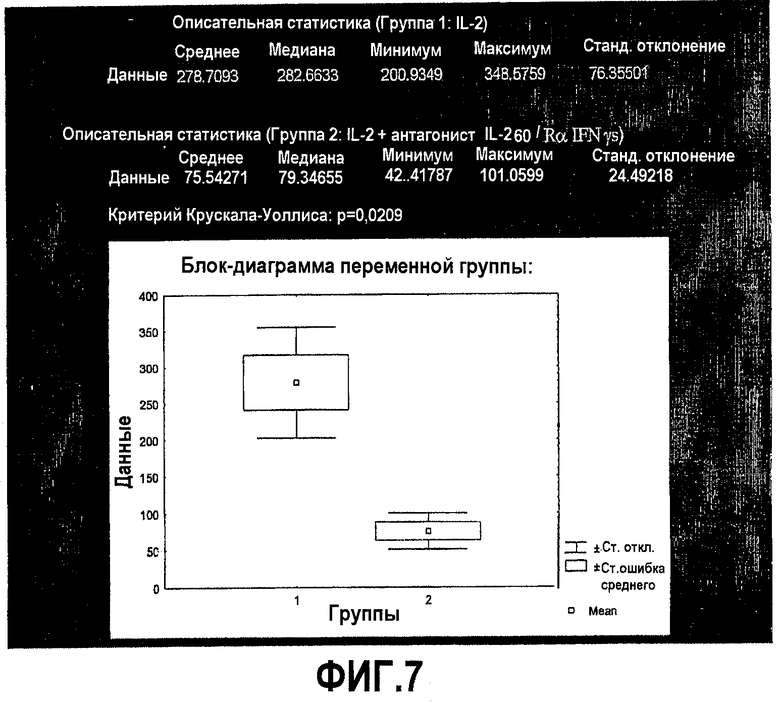
Фиг.7. Ингибирование рекомбинантным химерным белком AnTH1 стимулирующей рост активности IL-2 человека на линии клеток мышей CTLL-2 (результаты выражены в международных единицах IL-2).
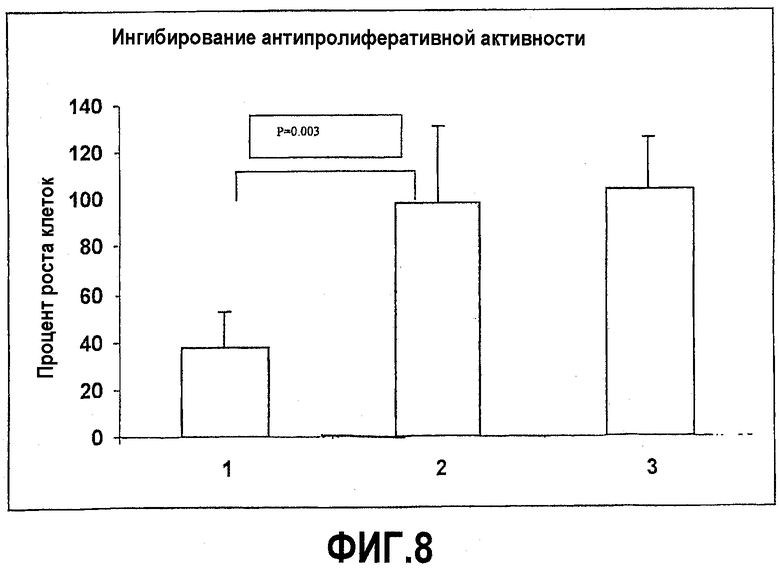
Фиг.8. Результаты ингибирования антипролиферативной активности IFNγ человека рекомбинантным химерным белком AnTH1. Столбец 1: 4 МЕ/мл IFNγ (4 нг/мл), столбец 2: 4 МЕ/мл IFNγ + 50 мкг/мл AnTH1, столбец 3: 50 мкг/мл AnTH1.
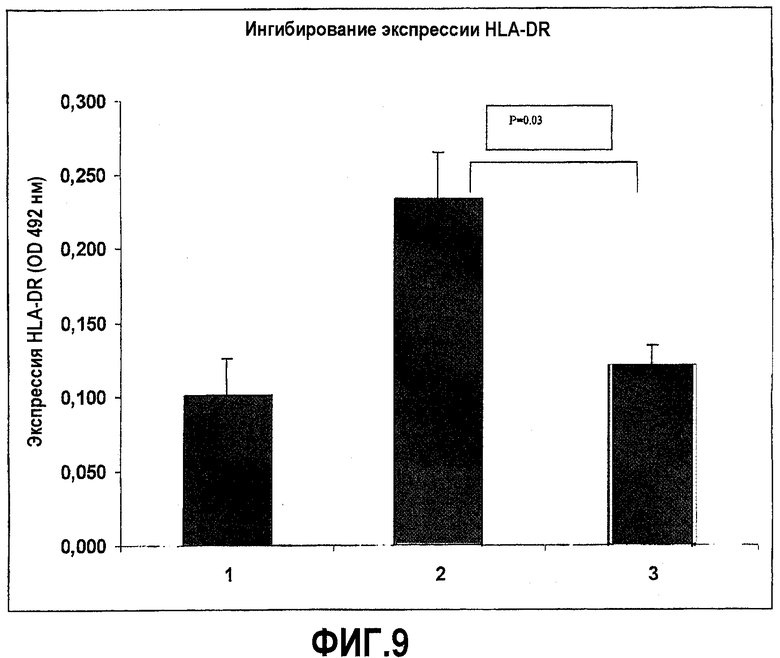
Фиг.9. Ингибирование индуцированного IFNγ HLA II рекомбинантным химерным белком AnTH1. Столбец 1: базовый уровень (фон) (IFNγ = 0 МЕ/мл), столбец 2: IFNγ 500 МЕ/мл (0,5 мкг/мл), столбец 3: IFNγ 500 МЕ/мл + 1,5 мкг/мл AnTH1.
Фиг.10. Аминокислотная последовательность рекомбинантного химерного белка AnTH1. Указаны пептиды, определенные масс-спектрометрией.
ПРИМЕРЫ
Пример 1
Выделение цепей комплементарной ДНК, которые кодируют первые 60 аминокислот IL-2 человека и внеклеточный участок α-субъединицы растворимого рецептора IFNγ человека (RαIFNγs)
Для выделения комплементарной ДНК человека клетки Raji (лимфомы Беркитта, АТСС:CCL-86) и Jurkat (острого Т-клеточного лейкоза человека, АТСС:TIB-152) выращивали в среде RPMI 1640, дополненной 10% фетальной телячьей сывороткой, в колбе на 5 л с осторожным качанием при 37°С в атмосфере 5% СО2. Экстракцию общей РНК из клеток Raji и Jurkat выполняли по способу Chomczyski (Chomczyski P. et al. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Anal. Biochem. 162, 156-9, 1987). Затем поли А-РНК экстрагировали с использованием коммерческой системы для выделения матричной РНК (Isolation System Life Technologies Messagemaker cat. #10551-018). Комплементарные ДНК, кодирующие первые 60 аминокислот IL-2 человека и 228 аминокислот внеклеточной аминоконцевой части RαIFNγs человека, выделяли обратной транскрипцией и амплифицировали при помощи ПЦР поли А-РНК из клеток Jurkat и Raji соответственно. Приблизительно 1-2 мкг поли А-РНК обрабатывали с использованием случайных гексамеров.
Последовательности олигонуклеотидов (праймеров), используемых для амплификации комплементарной цепи ДНК для первых 60 аминокислот IL-2 человека, описаны в SEQ ID NO:1 (праймер 1) и SEQ ID NO:2 (обратный праймер 1). Последовательности праймеров, используемых для амплификации комплементарной цепи ДНК для 228 аминокислот аминоконцевой части RαIFNγs человека, описаны в SEQ ID NO:3 (праймер 2) и SEQ ID NO:4 (обратный праймер 2).
Амплифицированную ДНК, кодирующую первые 60 аминокислот IL-2 человека и связывающий пептид (SEQ ID NO:5), расщепляли рестриктазой NcoI (подчеркнутой в последовательности праймера 1, SEQ ID NO:1). Затем проводили экстракцию смесью фенол-хлороформ для элиминации фермента и буфера. ДНК осаждали и ресуспендировали в подходящем буфере и хранили при -70°С. См. последовательность связывающего пептида (SEQ ID NO:6).
Амплифицированную ДНК, кодирующую связывающий пептид и 231 аминокислоту RαIFNγ (SEQ ID NO:7), достраивали на липких концах с использованием полимеразы Кленова и очищали, как описано ранее. Затем ее расщепляли рестриктазой BamHI (подчеркнутой в последовательности обратного праймера 2) и очищали, как описано выше. См. последовательность связывающего пептида (SEQ ID NO:6).
Амплифицированные полосы (SEQ ID NO:5 и 7) смешивали в рассчитанных пропорциях в подходящем буфере для получения амплификации новой полосы, содержащей ДНК-последовательность, соответствующую первым 60 аминокислотам IL-2 человека, связанную с соответствующей последовательностью для 231 аминокислоты внеклеточного района RαIFNγ человека последовательностью, соответствующей связывающему пептиду (SEQ ID NO:6). Эту новую полосу амплифицировали при помощи ПЦР.
Амплифицированную ДНК (SEQ ID NO:8) очищали, как описано выше. Очищенную ДНК расщепляли рестриктазой BamHI и обрабатывали для элиминации фермента и буфера, как описано. Позднее, эту ДНК опять расщепляли ферментом NcoI и очищали, как описано.
Пример 2
Генетическая конструкция для экспрессии рекомбинантного химерного белка AnTH1
Этот экспрессирующий вектор содержит сильный промотор триптофана. Вектор расщепляли ферментом BamHI. Затем проводили экстракцию смесью фенол-хлороформ для элиминации фермента и буфера и осаждали и ресуспендировали в подходящем буфере. После этого его расщепляли ферментом NcoI. Наконец, вектор разделяли в геле, как описано ранее. Таким образом, этот вектор содержит промотор триптофана, свободный липкий сайт NcoI, свободный липкий сайт BamHI, терминатор Т4 и ген устойчивости к ампициллину.
ДНК, соответствующую SEQ ID NO:8, лигировали в этот вектор с использованием лигазы Т4. Клетки E. coli трансформировали этой генетической конструкцией. Идентифицировали трансформанты, содержащие фрагмент комплементарной ДНК для первых аминокислот IL-2 человека, а также связывающий пептид и 231 аминокислоту RαIFNγs человека, в той же самой ориентации, в какой находится промотор триптофана, проведением рестрикционного анализа рестриктазами NcoI и EcoRI. Полученная плазмида была названа pHu(AnTH1) (см. фиг.1).
Пример 3
Секвенирование
Конечную генетическую конструкцию секвенировали. Секвенирование проводили согласно протоколу, основанному на процедуре Sanger (Sanger F et al. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. USA 74, 5463-67, 1977). Было показано, что эта конструкция имеет часть генов, кодирующих IL-2 (60 аминокислот, начинающихся от аминоконцевой группы) под контролем промотора, и затем последовательность нуклеотидов, кодирующую связывающий пептид (SEQ ID NO:6), связанную с участком, который кодирует 228 аминокислот аминоконца RαIFNγs. См. SEQ ID NO:8.
Пример 4
Экспрессия в E. coli рекомбинантного химерного белка AnTH1
Штаммом-хозяином была Escherichia coli W3110P3 (прототроф F-), а плазмидой была pHu(AnTH1). Для экспрессии эту плазмиду инокулировали в 5 мл LB-среды с ампициллином (50 мкг/мл) и L-триптофаном (100 мкг/мл) и инкубировали при 37°С в течение 6 часов при качании. Эту культуру добавляли к 50 мл среды LB и помещали в шюттель-аппарат (ротационный шейкер) при 100 об/мин на 6 часов при 37°С. Эту культуру добавляли к 500 мл среды М9 (33 мМ Na2HPO4, 2 мМ КН2РО4, 8,5 мМ NaCl, 18 мМ NH4Cl, 0,1 мМ CaCl2, 1 мМ MgSO4), обогащенной 0,2% гидролизованным казеином, 0,4% глюкозой, 50 мкг/мл ампициллина, таким образом, что начальная оптическая плотность культуры (620 нм) была 0,3. Затем ее инкубировали в течение 8 часов при описанных выше условиях и, наконец, осадок клеток собирали центрифугированием (см. фиг.2).
Пример 5
Экстракция, очистка и ренатурация рекомбинантного химерного белка AnTH1
Клетки гомогенизировали с использованием политрона при концентрации 0,1 г сырой биомассы на мл ТЭ-буфера (10 мМ Трис-HCl, 1 мМ ЭДТА рН 7,2). Эту суспензию подвергали ферментативному процессу разрушения лизоцимом. Осадок, полученный в предварительной стадии, подвергали промыванию растворами мочевины различных молярностей, от 1 М до 8 М, в 50 мМ Трис рН 7,2, 1 мМ ЭДТА. Гомогенизацию проводили с использованием политрона. Сначала осадок гомогенизировали в течение 1 минуты, оставляли в покое на 3 минуты и затем опять гомогенизировали в течение второй минуты. Весь процесс проводили при 4°С. Белки, которые солюбилизируются мочевиной, приблизительно 150 мл, наносили при скорости тока 3 мл/мин на колонку К9/60 (Pharmacia, Sweden), содержащую смолу Sephadex G-100, которую предварительно уравновешивали 3 объемами 50 мМ Трис-HCl рН 9, содержащего 4 М мочевину. Элюирование проводили в том же самом буфере. Фракции, содержащие белки, объединяли и диализовали против 0,1 М Трис-HCl рН 9. После этого диализ продолжали против забуференного фосфатом солевого раствора (ЗФР) рН 7,4 (см. фиг.3 и 4).
Пример 6
Связывание IFNγ с рекомбинантным химерным белком AnTH1
Один микролитр (приблизительно 1 мкг общего белка) рекомбинантного химерного белка AnTH1 наносили после укладки на полоски из нитроцеллюлозы. Эти полоски инкубировали с 10% обезжиренным молоком в течение 2 часов при комнатной температуре (RT). Эти мембраны промывали дважды забуференным фосфатом солевым раствором (ЗФР) в течение 5 минут. После промывки полоски инкубировали с IFNγ, меченным радиоактивным иодом (125I-IFN-гамма) 35 мкКи/мкг, в течение 1 часа при комнатной температуре в присутствии или в отсутствие избытка IFNγ, который не был меченым. После этого эти нитроцеллюлозные полоски промывали дважды ЗФР в течение 5 минут и затем ЗФР + 0,03% Твин 20 в течение 5 минут. Наконец, радиографические пленки накладывали на эти полоски и выдерживали при -70°С в течение 72 часов и затем проявляли. (См. фиг.5).
Пример 7
Активность стимуляции роста Т-клеток рекомбинантного химерного белка AnTH1
Биологическую активность рекомбинантного химерного белка AnTH1 испытывали с использованием клеточной линии мышиных Т-лимфоцитов, зависимых от IL-2. Эти клетки выращивали на среде RPMI 1640, содержащей 1 мМ пирувата, 2 мМ L-глутамата, 40 мМ HEPES, 100 Е/мл пенициллина, 50 мкг/мл стрептомицина, 50 мкМ 2-меркаптоэтанола и 10% фетальную телячью сыворотку, дополненной 8 МЕ/мл рекомбинантного интерлейкина-2 человека с удельной активностью 1,2107 МЕ/мг. Перед использованием эти клетки промывали 3 раза, ресуспендировали в полной культуральной среде без IL-2 и инкубировали в течение 1 часа при 37°С в увлажненной атмосфере СО2. Затем эти клетки промывали, ресуспендировали при плотности 4105 клеток/мл и распределяли в 96-луночных планшетах (100 мкл на лунку), содержащих в каждой лунке 100 мкл серийных разведений 1:2 rhIL-2 или проб (рекомбинантного химерного белка AnTH1), в полной среде. В этом испытании использовали международный стандарт IL-2010397. После 36 часов инкубирования при 37°С в каждую лунку добавляли 20 мкл 5 мг/мл МТТ (С18Н16N5SBr) и эти планшеты инкубировали в течение 4 часов в тех же самых условиях. Наконец, добавляли 50 мкл на лунку 10% ДСН, 0,1н. HCl, 50% изопропанола, планшеты качали в течение 1 часа при 37°С и считывали оптическую плотность при 570 нм с использованием планшет-ридера. (См. фиг.6).
Пример 8
Ингибирование активности стимуляции роста Т-клеток IL-2 с использованием рекомбинантного химерного белка AnTH1
Биологическую активность для IL-2 испытывали с использованием клеточной линии мышиных Т-лимфоцитов, зависимых от IL-2. Клетки выращивали в условиях, описанных в предыдущем эксперименте. Перед их использованием клетки промывали 3 раза, ресуспендировали в полной культуральной среде без IL-2 и инкубировали в течение 1 часа при 37°С в увлажненной атмосфере СО2. Затем клетки промывали, суспендировали при плотности 4105 клеток/мл и распределяли в 96-луночных планшетах (100 мкл на лунку), содержащих в каждой лунке 100 мкл серийных разведений 1:2 rhIL-2 или проб (rhIL-2 + рекомбинантный химерный белок AnTH1 или только рекомбинантный химерный белок AnTH1), в полной среде. В этом испытании использовали международный стандарт IL-2010397. После 36 часов инкубирования при 37°С в каждую лунку добавляли 20 мкл 5 мг/мл МТТ (С18Н16N5SBr) и планшеты инкубировали в течение 4 часов в тех же самых условиях. Наконец, добавляли 50 мкл на лунку 10% ДСН, 0,1н. HCl, 50% изопропанола, планшеты качали в течение 1 часа при 37°С и считывали оптическую плотность при 570 нм с использованием планшет-ридера. Результаты выражали в виде единиц rhIL-2 на основе анализов данных стандартной кривой разведений rhIL-2 и серийных разведений пробы (См. фиг.7).
Пример 9
Ингибирование антипролиферативной активности IFNγ рекомбинантным химерным белком AnTH1
Рост 2,5·103 клеток на лунку Нер-2, культивируемых в среде МЕМ CANE (эссенциальной минимальной среде с не являющимися незаменимыми аминокислотами), дополненной 10% фетальной телячьей сывороткой, происходил в 96-луночных планшетах. Их инкубировали в течение 24 часов при 37°С в термостате с 5% СО2. После этого периода времени среду заменяли и подлежащие оценке пробы добавляли в серийных разведениях, так же как и их соответствующие контроли. После 72 часов инкубирования эти клетки окрашивали 0,5% кристаллическим фиолетовым красителем в течение 2 минут и планшеты считывали с использованием планшет-ридера. (См. фиг.8).
Пример 10
Ингибирование индукции посредством IFNγ HLA II рекомбинантным химерным белком AnTH1
В этом испытании использовали ELISA на клетках, описанных Seeling G. et al. Development of receptor peptide antagonist to human γ-interferon and characterization of its ligand-bound conformation using transferred nuclear overhauser effect spectroscopy. J. Biol. Chem. 270, 9241-53, 1995. Использовали клеточную линию Colo 205. Клетки росли в культуральных 96-луночных планшетах, 2,5·105 клеток на лунку в 0,1 мл среды RPMI 1640, обогащенной 10% фетальной телячьей сывороткой. Клетки инкубировали в течение 12 часов при 37°С в термостате с 5% СО2. Затем к клеткам, росшим в культуральной среде, добавляли рекомбинантный химерный белок и IFNγ в объеме 0,1 мл и затем инкубировали в течение 1 часа при 37°С. После инкубирования среду удаляли и лунки промывали 3 раза культуральной средой. После этого в лунки добавляли аликвоты по 1,2 мл среды и планшеты инкубировали в течение 48 часов при 37°С для индукции антигенов HLA-DR. Лунки промывали ЗФР и клетки фиксировали чистым этанолом в течение 2 минут. Промывку повторяли и планшеты инкубировали в течение 1 часа при комнатной температуре с мышиным моноклональным антителом анти-HLA-DR, разведенным в ЗФР с 0,5% бычьим сывороточным альбумином. Лунки промывали ЗФР и инкубировали в тех же самых условиях с конъюгатом анти-IgG мыши-пероксидаза. Промывки повторяли 3 раза и проявляли добавлением 100 мкл на лунку 0,15% Н2О2 + 5 мг/мл о-фенилендиамина. Детекцию реакции выполняли с 50 мкл на лунку 2М H2SO4 и оптическую плотность измеряли при 492 нм с использованием планшет-ридера (фиг.9).
Пример 11
Масс-спектрометрический анализ
Аликвоту (0,5 мкг) очищенного белка анализировали электрофорезом в ДСН-ПААГ и обратно окрашивали с использованием Zn-имидазола (Castellanos-Serra L, et al. Detection of biomolecules in electrophoresis gels with salts of imidazole and zink II: a decade of research. Electrophoresis. 2002, 22, 864-7). Полосу вырезали и инкубировали с раствором лимонной кислоты (1%) в течение 5 минут до полного обесцвечивания и инкубировали еще в течение 10 минут в воде для удаления хелатирующего агента. Прозрачную полосу дополнительно нарезали на небольшие кубики приблизительно 1 мм3 и дегидратировали в 90% водном растворе ацетонитрила без ТФУ и полностью высушивали в speed-vac. Кусочки гелей повторно гидратировали в 20-30 мкл раствора NH4HCO3, содержащего 12,5 нг модифицированного трипсина, категории, пригодной для секвенирования (Promega (MA, USA)). Это расщепление внутри геля инкубировали в течение ночи при 37°С в термомиксере (Eppendorf, USA). Добавляли дополнительные 20 мкл 50 мМ раствора NH4HCO3 и инкубировали в течение дополнительных 45 минут и полученные триптические пептиды экстрагировали с использованием колонки ZipTips C18 (Millipore (USA)), предварительно активированной и уравновешенной в соответствии с рекомендациями изготовителя. Для экстракции этих триптических пептидов проводили двадцать циклов нанесения. Продукт расщепления подкисляли муравьиной кислотой, инкубировали в течение 45 минут при комнатной температуре и проводили еще двадцать циклов нанесения. Колонки ZipTips промывали интенсивно с использованием 5% раствора муравьиной кислоты и протеолитические пептиды элюировали в 2 мкл 60% ацетонитрила, содержащего 1% муравьиную кислоту.
Спектры МС/МС низкой энергии получали с использованием тандемного масс-спектрометра с гибридным квадрупольно-ортогональным ускорением QTOF (Micromass (Manchester, UK)), снабженного источником образуемых электрораспылением ионов Z-spray nanoflow. Этот масс-спектрометр работал с источником при 80°С и скоростью тока осушающего газа 50 л/час. Пептиды растворяли до достижения приблизительной концентрации 5 пмоль/мкл. Два микролитра триптических пептидов наносили на nanoflow-кончик из боросиликата и к этому nanoflow-кончику и к входному конусу прилагали потенциал 900 В и 35 В соответственно. Для получения МС/МС-спектров использовали способ, описанный Gonzalez, L. et al. Differentiating alpha- and beta-aspartic acids by electrospray ionization and low-energy tandem mass-spectrometry. Rapid. Commun. Mass Spectrom. 2000, 14, 2092-210. Первый квадруполь использовали для отбора иона-предшественника в пределах окна 4-5 Th. Давление ˜310-2 Па газа для столкновений (аргона) использовали в гексапольной ячейке для столкновений для получения ионов-фрагментов. Подходящую энергию столкновений использовали для уменьшения интенсивности иона-предшественника до более чем половины его исходной энергии. Получение и обработку данных выполняли с использованием системы MassLynx (v.3.5) (Micromass).
Ошибкаc)
b. Состояние заряда индивидуальных пептидов.
с. Показывает абсолютное различие массы между теоретической и экспериментальной молекулярными массами детектируемых пептидов.
d. Пептиды, секвенированные при помощи масс-спектрометрии ESI/MS.
е. Пептид, происходящий в результате неспецифического расщепления трипсином.
f. Пептид, содержащий свободный цистеин.
Преимущества предлагаемого решения
Настоящее изобретение объединяет в одной молекуле способность вмешательства в две системы передачи сигналов, влияющие на механизмы иммунорегуляции и воспалительные механизмы. Конструкция этого химерного белка состоит из слияния лиганда (IL-260) через пептид из 4 аминокислот с внеклеточным рецептором (RαIFNγ). Эта комбинация делает возможным связывание этого рекомбинантного химерного белка с клетками, содержащими на их поверхности RαIL-2. Эта субъединица присутствует в основном в неактивированных Т-клетках и в высокоаффинном IL-2-рецепторе (RαβγIL-2) в активированных Т-клетках (Smith, K.A. The interleukin-2 receptor. Annu. Rev. Cell. Biol. 5, 397-403, 1989 и Strom, T.B. et al. Interleukine-2 receptor-directed therapies: antibody- or cytokine-based targeting molecules. Annu. Rev. Med. 44, 343-50, 1993).
Если белок AnTH1 связывается с RαIL-2 в клетках, находящихся в покое, он может интернализовать этот белок, оставляя RαIFNγs в цитоплазме, в условиях рециклинга наружу и столкновения с IFNγ, который будет образовываться при активации этих клеток. Взаимодействие IFNγ из цитоплазмы с внутриклеточным участком мембранного рецептора, которое может генерировать биологическую активность IFNγ, было описано (Szente B.E. et al. Identification of IFN (receptor binding sites for JAK2 and enhancement of binding by IFN γ and its C-terminal peptide IFN γ (95-133). J. Immunol. 155, 5617-22, 1995). Во время заболевания, где может быть необходимость уменьшения действия IL-2, продуцируемого организмом, при добавлении белка AnTH1 он будет связываться через IL-260-часть с альфа-субъединицей в высокоаффинном комплексе (RαβγIL-2) в активированных клетках, он будет мешать связыванию полного (нативного) IL-2, секретируемого клетками иммунной системы, и будет мешать его биологической активности. С другой стороны, IFNγ, который уже секретировался активированными Т-клетками, может быть "конфискован" RαIFNγs-частью химерного белка, которая препятствует его присоединению к мембранному рецептору. Таким путем, аутоиммунная и/или воспалительная реакция может контролироваться в двух различных моментах, во время активации и в процессе распространения этой реакции.
Настоящее изобретение обеспечивает гетеро-бивалентный химерный белок, который может препятствовать биологической активности IL-2 и IFNγ. С учетом того, что рекомбинантный химерный белок AnTH1 имеет также стимулирующую рост Т-клеток активность, может ожидаться менее глубокая инактивация иммунной системы, которая будет провоцировать антицитокинины-антагонисты, которые уже были клинически подтверждены.







Изобретение относится к области генной инженерии и может быть использовано в медико-биологической промышленности. Предложен химерный белок (ANTH1), состоящий из последовательности, соответствующей 60 аминокислотам N-концевой области интерлейкина-2, и внеклеточной части N-концевой области альфа-цепи рецептора гамма-интерферона человека, которые связаны между собой пептидом Ala-His-Met-Met. ANTH1 обладает способностью ингибировать биологическую активность гамма-интерферона и/или интерлейкина-2, в связи с чем может быть использован при изготовлении медикаментов, предназначенных для лечения заболеваний, опосредованных активностью интерлейкина-2, гамма-интерферона или обоих этих цитокинов, в частности рассеянного склероза, системной красной волчанки, ревматоидного артрита, сахарного диабета и др. 9 н. и 4 з.п. ф-лы, 10 ил., 1 табл.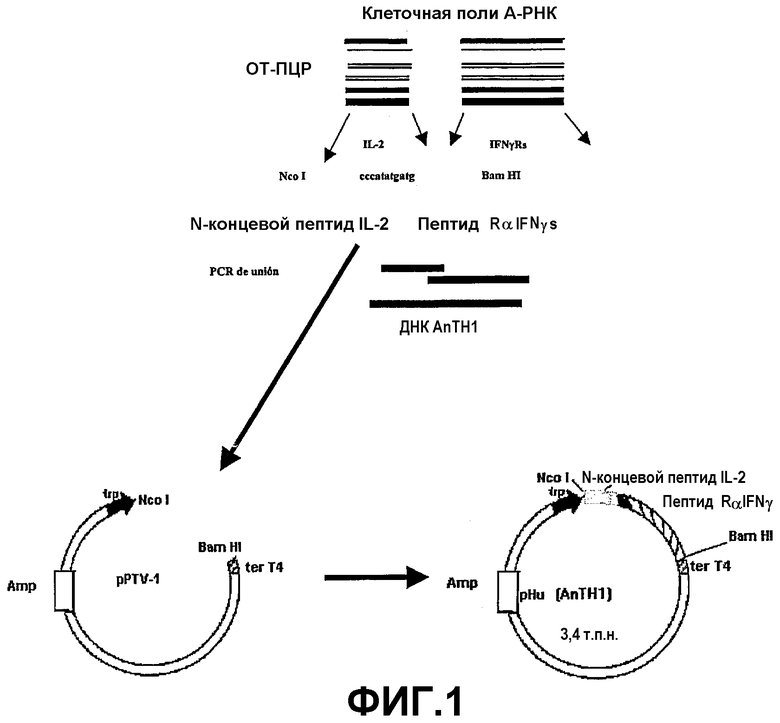
| BELLO ЕТ AL | |||
| Biotechnologia Aplicada, 12, no 3, 163-164, 1995 | |||
| CHEBATH J | |||
| ET.AL | |||
| Eur | |||
| Cytokine Netw., 8, no 4, 359-365, 1997. |
Авторы
Даты
2008-04-20—Публикация
2003-05-08—Подача