ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение касается белкового вектора для молекулярного транспорта к клеткам, которые экспрессируют рецептор TLR4 (Toll-подобный рецептор 4), получения указанного белкового вектора и его применения, с определенным охватом области получения и применения фармацевтических композиций, особенно иммунотерапевтических композиций, для лечения и профилактики инфекционных и опухолевых болезней.
ОПИСАНИЕ УРОВНЯ ТЕХНИКИ
Патогены и рак остаются лидирующими причинами смерти во всем мире. Разработка вакцин для профилактики болезней, для которых в настоящее время не существует ни одной вакцины, таких как СПИД или малярия, или для лечения хронических инфекций или рака, а также улучшение эффективности и безопасности существующих вакцин имеют приоритетное значение. В большинстве случаев разработка таких вакцин требует стратегий, обладающих способностью к специфическому стимулированию CD8+ цитотоксических Т-лимфоцитов (CTL).
CTL активируются путем презентации Т-клеточным рецепторам (TCR) коротких пептидов, связанных с молекулами класса I MHC. Эти комплексы пептидов МНС класса I присутствуют на поверхности антиген-презентирующих клеток (АРС), которые также способны к обеспечению костимулирующих сигналов, требуемых для оптимальной активации CTL.
Дендритные клетки (DC) представляют собой самые мощные АРС с уникальной способностью взаимодействовать с наивными Т-лимфоцитами и инициировать первичные иммунные ответы, активируя хелперные CD4+ и цитотоксические CD8+ Т-лимфоциты. Презентация антигена и Т-клеточная стимуляция ВС рассмотрены Guermonprez et al. ("Antigen presentation and Т cell stimulation by DC". Annu. Rev. Immunol. 2002, 20 : 621-627), который включен авторами путем ссылки.
В отсутствие продолжающихся воспалительных и иммунных ответов дендритные клетки патрулируют через кровь, периферические ткани, лимфу и вторичные лимфатические органы. В периферических тканях дендритные клетки захватывают собственные и несобственные антигены. Затем усвоенные антигены обрабатываются в протеолитические пептиды, и эти пептиды загружаются на молекулы класса I и II MHC (для активации CD8+ или CD4+ Т-лимфоцитов соответственно). Этот процесс захвата антигена, деградации и загрузки называют презентацией антигена. Однако, в отсутствие стимуляции, периферические дендритные клетки представляют антигены весьма неэффективно. Экзогенный(ые) сигнал(ы) от патогенов или эндогенный(ые) сигнал(ы) индуцирует(ют) вхождение дендритных клеток в программу развития под названием созревание, которая преобразовывает дендритные клетки в АРС и активаторы Т-лимфоцитов. Бактериальные и вирусные продукты, а также воспалительные цитокины и другие самомолекулы индуцируют созревание дендритных клеток путем прямого взаимодействия с собственными рецепторами поверхности дендритных клеток. Т-лимфоциты, через CD40-зависимые и независимые пути, и эндотелиальные клетки вносят свой вклад в окончательное созревание дендритных клеток через прямой контакт клетка-к-клетке и секрецию цитокинов. Вскоре после столкновения с опасным сигналом изменяется эффективность захвата антигена, внутриклеточный транспорт и деградация, а также внутриклеточное движение молекул МНС. Загрузка пептида, а также период полужизни и доставка к поверхности клетки молекул МНС увеличиваются. Поверхностная экспрессия Т-клеточных костимуляторных молекул также повышается. Таким образом, дендритные клетки становятся самыми мощными АРС и единственными, способными к активированию наивных Т-лимфоцитов и к инициированию адаптивных иммунных ответов. Одновременно с изменениями их антиген-презентирующих способностей, созревание также вызывает обширную миграцию дендритных клеток из периферических тканей. Изменения в экспрессии хемокиновых рецепторов и молекул адгезии, а также глубокие изменения организации цитоскелета способствуют миграции дендритных клеток, через лимфу, к вторичным лимфатическим органам.
Индукция созревания дендритных клеток
Дендритные клетки отвечают на два типа сигналов: прямое распознавание патогенов (через специфические рецепторы распознавания) и непрямое ощущение инфекции (через воспалительные цитокины, внутренние клеточные соединения и действующие специфические иммунные ответы). В ответ на эти сигналы дендритные клетки активируются и входят в программу созревания, которая преобразовывает дендритные клетки в эффективные стимуляторы Т-клеток. По крайней мере пять типов поверхностных рецепторов, как сообщалось, запускают созревание дендритных клеток: (i) Toll-подобные рецепторы (TLR), (ii) цитокиновые рецепторы, (iii) молекулы семейства TNF-рецепторов (TNF-R), (iv) FcR и (v) сенсоры для клеточной смерти. Некоторые из самых эффективных стимулов созревания опосредуются TLR (TLR1-9) взаимодействием с их соответствующими лигандами. Kaisho и Akira сделали обзор данных о Toll-подобных рецепторах ("Toll-like receptors as adjuvant receptors". Biochimica et Biophysica Acta, 2002, 1589: 1-13). TLR экспрессируются на макрофагах и дендритных клетках, а также на других клетках, таких как В-лимфоциты. Были также идентифицированы лиганды для нескольких TLR. Большинство этих лигандов получены из патогенов, но не обнаружены у хозяина, что свидетельствует о том, что TLR являются критическими для ощущения инвазии микроорганизмов. Распознавание лигандов с помощью TLR вызывает быструю активацию врожденного иммунитета путем индуцирования выроботки провоспалительных цитокинов и положительной регуляции костимуляторных молекул. Активированный собственный иммунитет впоследствии приводит к эффективному адаптивному имуннитету. Относительно TLR4, молекулярные типы, которые специфически распознаются, представляют собой LPS (Грам- бактерии), липотейхоевые кислоты (Грам+ бактерии), таксол, F белок (респираторносинцитиальный вирус), белок термического шока 60 и домен Фибронектина EDA.
Поэтому вакцина-кандидат, способная к индукции оптимальных ответов Т-клеток, должна соответствовать нескольким условиям. Во-первых, она должна нацеливаться на АРС для поставки антигенных Т-клеточных эпитопов молекулам класса I и/или II MHC. Таким образом, нацеливание на DC могло бы представлять главную цель в создании новых систем доставки для разработки вакцины. Кроме того, вектор должен доставлять соответствующие сигналы к DC, чтобы индуцировать их активацию. Доставка антигена к DC без сигнала созревания могла бы индуцировать толерантность, а не активацию Т-хелперных и цитотоксических клеток. Кроме того, на ее эффективность не должен влиять предварительно существующий иммунитет против вектора непосредственно.
Первый подход к доставке антигенных пептидов молекулам класса I и/или II МНС базируется на синтетических пептидных вакцинах, содержащих отобранные эпитопы, способные к связыванию непосредственно с этими молекулами на поверхности АРС. В некоторых случаях эти пептиды приводили к защите от опухоли или вирусной очистке на мышиных моделях, тогда как на других они привели к индукции толерантности. Испытания при участии людей, проводимые с различными типами пептидов, вызывали умеренные клинические ответы на рак.
В настоящее время разрабатывается большое количество различных стратегий. В основном их можно разделить на две категории. Первый тип основан на синтезе антигена АРС или его активной доставке в цитоплазму этих клеток и использует "классический" путь процессинга антигена МНС I. Второй тип использует возможность перекрестной презентации АРС и базируется на свободных или связанных с клеткой экзогенных антигенах. Доставка антигена в цитоплазму АРС была выполнена посредством бактериальных токсинов (Moron et al. "New tools for antigen delivery to the MHC class I pathway". TRENDS in Immunology, 2004; 25: 92-97). Например, ЕР 1188446 А1 касается белкового вектора, который основан на аденилатциклазном токсине Bordetella pertussis, для доставки молекул к CD11b экспрессирующим клеткам.
Настоящее изобретение касается экстра домена А фибронектина (EDA), возможного природного лиганда для TLR4, как теоретического средства для доставки антигена к TLR4 экспрессирующим клеткам, которые могли индуцировать соответствующий выбор и созревание АРС и, наконец, привести к эффективному специфическому ответу CTL. Фибронектиновые молекулы представляют собой продукты единственного гена, и полученный белок может существовать во множественных формах, которые являются результатом альтернативного сплайсинга одной пре-мРНК Pankov R. and Kenneth M.Y., "Fibronectin at a glance". Journal of Cell Science, 2002; 115: 3861-3863). Главный тип сплайсинга происходит в пределах центрального набора повторений типа III. Использование экзона или пропускание приводит к включению или исключению любого из двух повторений типа III: экстра домену В (также называемому EDB, EIIIB или EDII) и экстра домену А (также называемому EDA, EIIIA или EDI). Клеточные фибронектины, которые содержат полученные в результате альтернативного сплайсинга EDA и EDB, производятся в ответ на поражение ткани. Среди других биологических функций, показано, что EDA индуцирует высвобождение протеогликанов и экспрессию металлопротеиназ (ММР 1, 3, и 9) и провоспалительных цитокинов (для обзора см. Saito S. et al. "The Fibronectin Extradomain A activates matrix metalloproteinase gene expression by an interleukin-1-dependent mechanism", J. Biol. Chem. 1999; 161: 3071-3076). Также описано, что EDA способен к активированию TLR4, таким образом индуцируя LPS-подобные ответы (Okamura Y. et al., "The extra domain A of fibronectin activates Toll-like receptor 4", J. Biol. Chem. 2001; 276: 10229-10233).
Как указано прежде, разработка стратегий для укрепления иммунного ответа на антиген открывает дверь в область разработки вакцин для лечения рака или инфекционных болезней. Определенно, в случае вирусной инфекции гепатита С было описано, что иммунный ответ играет существенную роль в очистке от инфекции, поэтому использование усиливающих иммунитет стратегий составляет альтернативу для лечения и профилактики этой инфекции.
Вирус гепатита С (HCV) представляет собой вирус с однонитевой РНК, который принадлежит к семейству Flaviviridae (Miller R.H. and Purcell R.H. 1990. PNAS. 87: 2057). Этот вирус был признан одним из главных причинных агентов хронического гепатита и болезней печени, и по оценкам, он поражает 170 миллионов человек во всем мире (World-Health-Organisation. Hepatitis С. Wkly Epidemiol Rec. 1997; 72: 65). Одна из главных особенностей инфекции HCV состоит в ее высокой тенденции к хроническому течению (70% инфекций) и развитию цирроза печени (20%) с высоким риском развития карцином печени (Dienstag et al. Gastroenterology. 1983; 85: 439). Лечение с помощью IFN-α представляет наиболее распространенную терапию при инфекциях HCV, но она эффективна только у 20-30% пациентов, получающих лечение (Camps et al. J. Hepatol. 1993; 17: 390). Комбинация IFN-α и рибавирина улучшила эти результаты (30-40% пациентов очистились от вируса на длительный период), но все еще остается высоким процент пациентов, устойчивых к терапии (Poynard et al. Lancet. 1998; 352: 1426). Таким образом, разработка новых терапевтических стратегий для лечения хронического гепатита С имеет жизненно важное значение.
Геном HCV состоит из 9.6 килооснований, он содержит высококонсервативные некодирующие области на 5' и 3' концах, обрамляя достаточную рамку считывания, которая кодирует 3 структурных белка (ядро, Е1 и Е2) и по крайней мере 6 неструктурных белков (NS2, NS3, NS4a, NS5a и NS5b) (Major, ME and Feinstone SM. (1997). Hepatology, 25, 1527).
Вирусная очистка после острой инфекции HCV или после лечения с помощью IFN-α связана с присутствием сильного клеточного CD4 и CD8 иммунного ответа на вирусные белки. Особенно ответ CD4 на неструктурный белок NS3 HCV связан с вирусной очисткой после острой инфекции, тогда как отсутствие этого Т-клеточного ответа включает вирусную персистенцию и установление хронической инфекции (Diepolder et al. Lancet, 1995; 346: 1006, Раре et al. J. Viral Hepat, 1999; 6, Suppl 1: 26-40). Кроме того, различные исследования идентифицировали различные цитотоксические эпитопы в пределах белка NS3 у пациентов, инфицированных HCV. Эти данные свидетельствуют, что белок NS3 мог бы быть хорошей мишенью для индукции анти-HCV клеточного ответа.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение касается использования полипептида, включающего аминокислотную последовательность, соответствующую:
- домену EDA фибронектина (EDA), или
- фрагменту указанного домена EDA, обладающего способностью к связыванию TLR4, или
- варианту указанного домена EDA или фрагмента, обладающего способностью к связыванию TLR4 и имеющего более чем 70% гомологичности с какой-либо из природных форм или фрагментов домена EDA,
при создании иммунного клеточного ответа на антигенстимулирующий агент.
В настоящем изобретении этот агент включает и домен EDA фибронектина, и антиген, к которому желательно генерировать имунный ответ, причем эти компоненты присутствуют как отдельные объекты или связаны ковалентно.
В конкретном осуществлении изобретения указанный вариант домена EDA или фрагмента, способного к связыванию TLR4, процитированного в элементе с), отличается тем, что его аминокислотная последовательность получается в результате замены, добавления или делеции одной или нескольких аминокислот в полипептиде, определенном в элементах а) и b).
В предпочтительном осуществлении изобретения указанный фрагмент, способный к связыванию элемента с), отличается тем, что он имеет более чем 85% степень гомологичности с любой природной формой домена EDA или его соответствующим фрагментом, и в более предпочтительном осуществлении он имеет более чем 95% степень гомологичности с указанной природной формой домена EDA фибронектина или его соответствующим фрагментом.
Согласно изобретению в конкретном осуществлении аминокислотная последовательность домена EDA фибронектина представляет собой последовательность любой природной формы EDA, обладающей способностью к связыванию TLR4. Этот домен EDA может быть выбран среди природных форм домена у любых видов животных, особенно млекопитающих, например грызунов (мышей, крыс и т.д) или приматов (особенно людей).
В другом конкретном осуществлении иммуностимуляторные агенты включают частичную аминокислотную последовательность домена EDA, которая отличается тем, что обладает способностью к связыванию TLR4.
В еще одном конкретном осуществлении изобретения домен EDA представляет собой модифицированный вариант любой из природных форм или фрагментов указанного домена EDA и также отличается тем, что сохраняет способность связывания с TLR4. В конкретном варианте осуществления такой вариантный домен EDA имеет более чем 70% гомологичность с любой из природных форм домена EDA. Соответствующий модифицированный вариант может быть отобран путем первого сравнения последовательности природной формы домена EDA фибронектина или ее фрагмента с другими кандидатами полипептидных последовательностей. Любой алгоритм выравнивания (например, FASTA, Lipman DJ, Pearson WR. Rapid and sensitive protein similarity searches. Science. 1985 Mar 22; 227 (4693): 1435-41) или программное обеспечение (например, Jellifish от Labvelocity Inc или программное обеспечение Blast от NCBI) может использоваться для анализа гомологичности. Впоследствии кандидаты полипептидных последовательностей, имеющие больше чем 70% гомологичность, проверяются на их способность к TLR4 связыванию. Свойства связывания TLR4 можно оценить с помощью любого стандартного определения связывания, например при использовании проточной цитометрии, как описано в The Current Protocols in Immunology и в The current protocols in Protein Science, опубликованных John Wiley & Sons (под редакцией: John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober) (периодически обновляемые. Обновление по состоянию на 1 мая 2005 года).
В одном варианте осуществления изобретения домен EDA включает последовательность, отобранную из:
a) полной аминокислотной последовательности мышиного домена EDA (Entrez Protein: NM_010233, аминокислоты 1721-1810; SEQ. ID. NO: 2, аминокислоты 2-91);
b) полной аминокислотной последовательности человеческого домена EDA (Entrez Protein NM_002026, аминокислоты 1631-1716; SEQ. ID. NO: 4); и
c) фрагмента последовательностей а) и b), способного к связыванию с TLR4 экспрессирующими клетками.
В другом конкретном осуществлении указанный домен EDA включает последовательность, отобранную из:
a) аминокислот 2-57 из SEQ. ID. NO: 6, которая соответствует альтернативно соединенной форме домена EDA мышиного фибронектина;
b) SEQ. ID. NO: 8, которая является альтернативно соединенной формой человеческого домена EDA; и
c) фрагмента последовательностей а) и b), способного к связыванию с TLR4 экспрессирующими клетками.
В некоторых вариантах осуществления иммуностимуляторный агент может дополнительно включать одну или несколько рассматриваемых молекул. При присутствии в иммуностимуляторном агенте рассматриваемая молекула может вводиться в количестве, которое, в комбинации с другими компонентами агента, является эффективным для создания иммунного ответа против молекулы.
В предпочтительном осуществлении домен EDA (или его фрагмент или вариант) и рассматриваемая молекула соединены вместе в той же самой гибридной молекуле или белковом векторе.
В другом аспекте настоящее изобретение касается белкового вектора, описаного выше, в котором указанная рассматриваемая молекула выбирается из группы, состоящей из полипептидов, липопептидов, олигосахаридов, полисахаридов, нуклеиновых кислот, липидов и химических веществ.
В конкретном осуществлении белкового вектора указанная рассматриваемая молекула представляет собой антиген или эпитоп. В одном варианте осуществления изобретения антиген, соединенный с вектором, представляет собой вирусный антиген, бактериальный антиген, антиген гриба или паразитарный антиген. В конкретном осуществлении указанный вирусный антиген представляет собой вирусный антиген из вируса гепатита С и в предпочтительном осуществлении указанный антиген вируса гепатита С представляет собой NS3 белок или его антигенный фрагмент. Белок NS3 относится к неструктурному белку NS3 вируса гепатита С, 67 кДа белку, который включает два домена, серинпротеазу, которая включает 189 аминокислот с N-конца и геликазо-нуклеозид трифосфатазу, которая включает 442 аминокислоты с С-конца. Последовательность белка NS3, включенная в белковый вектор изобретения, может соответствовать любому штамму или изоляту из человеческого вируса гепатита С.
В другом варианте осуществления указанный антиген представляет собой опухолевый антиген или опухолевую антигенную детерминанту. Используемый авторами термин «эпитоп» касается пептидной последовательности, которая связывается с молекулами класса I или класса II МНС и может быть распознана Т-клеточными рецепторными молекулами CD8+ или CD4+ Т-клеток соответственно и индуцировать иммунный ответ.
В конкретном осуществлении указанная рассматриваемая молекула представляет собой антигенную цитотоксическую Т-детерминанту из яичного альбумина (OVA 257-264) или SIINFEKL (SEQ. ID. NO: 2, аминокислоты 95-102, которая фланкирована 3 дополнительными аминокислотами на С-конце и N-конце эпитопа, QLE-SIINFEKL-TEW).
Антиген может представлять собой любой материал, способный к созданию Th иммунного ответа, CD8+ Т лимфоцитарного ответа, NK клеточного ответа, γ/δ Т лимфоцитарного ответа или ответа антител. Не ограничиваясь ими, соответствующие антигены включают пептиды, полипептиды, липиды, гликолипиды, полисахариды, углеводы, полинуклеотиды, прионы, бактерии, вирус или живые или инактивированные грибы; и антигены, полученные из бактерий, вирусов, грибов, простейших, опухолей или микроорганизмов, токсинов или токсоидов.
В другом конкретном осуществлении белкового вектора указанная рассматриваемая молекула представляет собой аллерген.
Таким образом, домен EDA действует так же как вектор для доставки антигена к TLR4 экспрессирующим клеткам.
В другом особенно интересном осуществлении изобретения указанная рассматриваемая молекула представляет собой химическое вещество или препарат, химически или генетически соединенный с белковым вектором. Таким образом, указанный белковый вектор используется для специфического нацеливания препарата на TLR4 экспрессирующие клетки.
В конкретном осуществлении белковый вектор также отличается тем, что он также содержит Tag последовательность, например, N-терминальный гистидиновый хвост. Это упростит процесс очистки при получении белкового вектора с помощью методов генной инженерии. Например, последовательности SEQ. ID. NO: 2 и SEQ. ID. NO: 6 представляют собой конкретное осуществление белкового вектора изобретения. В конкретном неограничивающем осуществлении настоящего изобретения белковый вектор включает последовательность SEQ ID. NO: 10, которая содержит фрагмент белка NS3.
Домен EDA, включенный в белковый вектор, отличается тем, что он связывается с TLR4 и, кроме того, облегчает перемещение рассматриваемой молекулы в цитозоль TLR4 экспрессирующих клеток.
Изобретение также касается использования белкового вектора для нацеливания и перемещения рассматриваемой молекулы к TLR4 экспрессирующим клеткам. В конкретном осуществлении TLR4 экспрессирующие клетки представляют собой любой вид антиген-презентирующих клеток (АРС). В предпочтительном варианте осуществления такие АРС представляют собой дендритные клетки.
В конкретном осуществлении изобретения белковый вектор отличается тем, что он облегчает перемещение рассматриваемого антигена или эпитопа, дополнительно улучшая процессинг и погрузку на молекулы МНС для презентации антигена Т-лимфоцитам.
В другом осуществлении белковый вектор отличается тем, что он обладает способностью к стимулированию созревания нацеливаемых АРС, таким образом увеличивая экспрессию молекул МНС и костимулирующие сигналы. В конкретном преимущественном варианте осуществления белковый вектор отличается тем, что он обладает способностью к одновременному индуцированию презентации антигена и стимулированию созревания АРС, таким образом индуцируя эффективный антиген-специфический имунный ответ. В более предпочтительном варианте осуществления этот антиген-специфический имунный ответ представляет собой ответ CTL.
Белковый вектор изобретения может быть получен рекомбинантной технологией ДНК. Таким образом, в другом аспекте изобретение касается модифицированной нуклеиновой кислоты, кодирующей белковый вектор изобретения. Эта нуклеиновая кислота может легко быть выведена из аминокислотной последовательности белкового вектора.
Эта модифицированная нуклеиновая кислота может содержаться в пределах конструкции ДНК. Таким образом, изобретение предлагает конструкцию ДНК, включающую нуклеиновую кислоту, которая кодирует белковый вектор изобретения. Эта конструкция ДНК может включать контрольную последовательность, оперативно связанную с нуклеиновой кислотой, кодирующей белковый вектор изобретения. «Оперативно связанный», по отношению к нуклеиновым кислотам, означает, что нуклеиновые кислоты расположены в функциональной взаимосвязи с другой последовательностью нуклеиновых кислот. «Контрольные последовательности» представляют собой сигналы экспрессии, распознаваемые определенной клеткой-хозяином, которые регулируют функции, такие как транскрипция и трансляция определенных кодирующих последовательностей (к примерам контрольных последовательностей принадлежат промотеры, усилители, терминаторы транскрипции, рибосом-связывающиеся участки, сигнальные пептиды для секреции белка или для других подклеточных расположений). Соединение желательных последовательностей достигается путем лигации на удобных сайтах рестрикции. Если такие сайты не существуют, используются синтетические олигонуклеотидные адаптеры или линкеры в соответствии со стандартными методами. Преимущество в этом смысле представляет собой тот факт, что эта конструкция ДНК также включает маркер или ген, который кодирует мотив или фенотип, который позволяет выбирать трансформированную клетку-хозяина посредством конструкции ДНК. Модифицированная нуклеиновая кислота и конструкция ДНК, предоставленная в соответствии с этим изобретением, могут быть получены с помощью известных стандартных методов, которые подытожены во многих лабораторных руководствах (например, "Molecular Cloning: a Laboratory manual". Joseph Sambrook, David W. Russel Eds. 2001, 3rd ed. Cold Spring Harbor, New York).
В конкретном осуществлении модифицированная нуклеиновая кислота или конструкция ДНК, предложенная в соответствии с изобретением, включает SEQ ID. NO: 1, SEQ. ID. NO: 5, SEQ. ID. NO: 9 (EDA-NS3) или SEQ. ID. NO: 11 (EDA-OVA).
Модифицированная нуклеиновая кислота или конструкция ДНК, предложенная в соответствии с этим изобретением, может быть вставлена в соответствующий вектор. Таким образом, в другом аспекте изобретение касается вектора, такого как вектор экспрессии, который включает упомянутую модифицированную нуклеиновую кислоту или конструкцию ДНК. Выбор вектора будет зависеть от клетки-хозяина, в которую он должен быть вставлен. Например, вектор, в который вставляется нуклеиновая кислота, может представлять собой плазмиду или вирус, которые, при инсерции в клетку, могут или нет интегрироваться в геном клетки. Вектор может быть получен обычными методами (Sambrook и др., 2001, процитированный выше).
В другом аспекте изобретение касается клетки-хозяина, такой как трансформированная клетка-хозяин, которая включает модифицированную нуклеиновую кислоту или конструкцию ДНК, предложенную в соответствии с этим изобретением. Согласно изобретению клетка-хозяин экспрессии представляет собой прокариоту, например Escherichia coli, или эукариотического хозяина, то есть дрожжи (например, Saccharomyces cerevisiae, Pichia Pastoris), клетки насекомого или клетки млекопитающих.
В другом конкретном осуществлении изобретения вектор экспрессии, включающий модифицированную нуклеиновую кислоту или конструкцию ДНК, которая кодирует белковый вектор изобретения, предназначен для in vivo генного переноса или терапии. В более конкретном варианте осуществления указанный вектор экспрессии представляет собой вирусный вектор. Соответствующие вирусные векторы для этой цели включают: полученные из аденовируса векторы, аденоассоциированные векторы, полученные из ретровируса, лентивируса, альфавируса, гермевируса, коронавируса и т.д.
В другом аспекте изобретение касается способа для получения белкового вектора изобретения, включающего культивирование клетки-хозяина, содержащей модифицированную нуклеиновую кислоту или конструкцию ДНК изобретения, при условиях, позволяющих экспрессию белкового вектора. Условия для оптимизации культуры клетки-хозяина будут зависеть от типа применяемой клетки-хозяина. Если желательно, процедура для получения белкового вектора изобретения включает его выделение и очистку.
Альтернативно, белковый вектор изобретения может быть получен другими стандартными способами. Такие способы включают, например, твердофазный химический синтез; очистку с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ); и, если предпочтительно, анализ обычными методами, такими как секвенирование или масс-спектрометрия, аминокислотный анализ, методы магнитного резонанса и т.д.
В другом осуществлении белковый вектор изобретения может быть получен ковалентным связыванием полипептида с аминокислотной последовательностью, соответствующей домену EDA фибронектина (EDA), или фрагменту указанного домена EDA, способного к связыванию TLR4, или варианту указанного домена EDA, с рассматриваемой молекулой (например, полипептидами, липопептидами, олигосахаридами, полисахаридами, нуклеиновыми кислотами, липидами или другими химическими веществами). Это можно выполнить путем использования стандартных методов, подытоженных в лабораторных руководствах, например "The current protocols in protein chemistry", опубликованных John Wiley & Sons (periodically updated. Updated up to May 1, 2005), или "Immobilized affinity ligand Techniques", GT Hermanson, AK Mallia and PK. Smith, Academic Press, Inc. San Diego, CA, 1992.
Впоследствии согласно изобретению белковый вектор или модифицированная нуклеиновая кислота и конструкции ДНК, кодирующие его, или векторы экспрессии и клетки-хозяины экспрессии, включающие указанные нуклеиновые кислоты или конструкции ДНК, могут использоваться для получения фармацевтической композиции.
В другом варианте осуществления настоящее изобретение касается использования полипептида с аминокислотной последовательностью, соответствующей домену фибронектина EDA (EDA), или его фрагменту, или варианту, как предварительно описано, для получения иммуностимуляторного агента, отличающегося тем, что указанный агент представляет собой фармацевтическую композицию.
В определенных вариантах осуществления фармацевтическая композиция изобретения может использоваться для стимуляции созревания антиген-презентирующих клеток или для индукции эффективного иммунного ответа, специфического для рассматриваемой молекулы. В конкретном варианте осуществления указанная фармацевтическая композиция может использоваться для индукции Th1 иммунного ответа у субъекта, которому вводят иммуностимуляторную композицию. Используемый авторами термин "индуцирование Th1 иммунного ответа" может включать случаи, в которых иммуностимуляторная композиция индуцирует смешанный Th1/Th2 ответ. В других случаях, однако, иммуностимуляторная композиция может индуцировать Th1 имунный ответ с маленькой или практически отсутствующей индукцией Th2 иммунного ответа. В конкретном варианте осуществления указанная фармацевтическая композиция может использоваться для создания ответа CTL.
В некоторых вариантах осуществления иммуностимуляторная композиция может использоваться в качестве иммуностимуляторного адъюванта, например, в комбинации с одним или несколькими антигенами, с или без дополнительных адъювантов. Таким образом, в некоторых случаях иммуностимуляторная композиция может формировать вакцину. В других случаях иммуностимуляторная композиция может служить в качестве адъюванта, который может использоваться в связи с вакциной.
Иммуностимуляторная композиция, которая включает полипептидсодержащий домен фибронектина EDA (или его фрагмент или вариант), может увеличить развитие активизированных CD8+ Т-лимфоцитов, образование CD8+ Т-лимфоцитов памяти или и то, и другое. Таким образом, иммуностимуляторная композиция изобретения может увеличить антиген-специфический клеточный иммунитет у субъекта, который получает иммуностимуляторную композицию.
В конкретном осуществлении иммуностимуляторная композиция, включающая домен EDA фибронектина (или его фрагмент или вариант), используется для лечения и профилактики инфекционной болезни, опухолевой болезни или аллергической болезни. В конкретном варианте осуществления настоящего изобретения указанная композиция используется для лечения и профилактики гепатита С.
Иммуностимуляторная композиция, включающая домен EDA фибронектина (или его фрагмент или вариант), может дополнительно содержать носители, вспомогательные вещества и другие известные фармацевтически приемлемые компоненты.
Иммуностимуляторную композицию изобретения можно вводить животным, например млекопитающим (человеку или не человеку), домашней птице и т.п., согласно обычным методам, которые известны квалифицированным специалистам в данной области (например, перорально, подкожно, назально, местно).
Изобретение также предлагает терапевтический и/или профилактический способ, который включает введение иммуностимуляторной композиции, включающей домен EDA фибронектина (или его фрагмент или вариант), субъекту.
Подходящие пути введения включают трансдермальное или трансмукозальное всасывание, инъекцию (например, подкожную, внутрибрюшинную, внутримышечную, внутривенную и т.д.), пероральный прием, ингаляцию и т.п.
В другом дальнейшем аспекте изобретение касается фармацевтической композиции, которая включает по крайней мере один приемлемый фармацевтический носитель и эффективное количество белкового вектора в по крайней мере одной из его форм экспрессии или вариантах осуществления:
a) белковый вектор в полипептидной форме;
b) модифицированная нуклеиновая кислота, кодирующая указанный белковый вектор;
c) вектор экспрессии, включающий указанную модифицированную нуклеиновую кислоту; или
d) клетки-хозяины экспрессии, также включающие указанную модифицированную нуклеиновую кислоту.
В другом конкретном осуществлении фармацевтическая композиция отличается тем, что она включает эффективное количество дендритных клеток, указанные дендритные клетки были инкубированы in vitro с белковым вектором в по крайней мере одной из его форм экспрессии или вариантов осуществления. В более конкретном варианте осуществления указанная фармацевтическая композиция представляет собой вакцину или иммунотерапевтическую композицию.
Кроме того, авторами предлагаются некоторые дополнительные виды использования белкового вектора. В одном варианте осуществления изобретения белковый вектор в любой из его форм экспрессии используется для получения фармацевтической композиции, эффективной для индуцирования созревания дендритных клеток in vitro или in vivo.
В другом варианте осуществления указанный белковый вектор используется для получения фармацевтической композиции для индуцирования специфического иммунного ответа, специфического против рассматриваемой молекулы (антигена или эпитопа), соединенной с белковым вектором. Этот имунный ответ представляет собой гуморальный имунный ответ (продукцию антител против рассматриваемой молекулы), Т-хелперный ответ или цитотоксический Т-клеточный ответ. В предпочтительном варианте осуществления указанный иммунный ответ представляет собой ответ CTL.
В более конкретном осуществлении изобретение касается использования белкового вектора для получения фармацевтической композиции для лечения и профилактики инфекционной болезни. Указанная инфекционная болезнь может быть бактериальной, вирусной, грибковой или паразитарной инфекционной болезнью.
В другом конкретном осуществлении изобретение касается использования белкового вектора изобретения для получения фармацевтической композиции, полезной для лечения и профилактики опухолевой болезни.
В еще одном конкретном осуществлении изобретение касается использования белкового вектора для получения фармацевтической композиции, полезной для лечения и профилактики аллергической болезни. Множество аллергических болезней связано с активацией Th2 иммунного ответа. Таким образом, отклонение или переключение из Th2 на Th1 ответ при использовании белкового вектора, несущего специфический аллерген, могло бы иметь защитный или терапевтический эффект на аллергическую болезнь.
Согласно конкретному варианту осуществления изобретения предложенная фармацевтическая композиция используется для введения животному или человеческому хозяину. Может использоваться любой подходящий путь введения. В конкретном осуществлении фармацевтическая композиция вводится парентеральным путем (то есть внутривенным, подкожным, внутримышечным), трансдермальным путем или трансмукозальным путем.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Анализ SDS-PAGE полученных и очищенных EDA и EDA-SIINFEKL белков. Одна аликвота EDA и EDA-SIINFEKL белков была загружена на 15% полиакриламидный гель и подвергнута электрофорезу. Маркеры молекулярной массы (MWM) обозначены в кДа. Наблюдается полоса, соответствующая предполагаемой молекулярной массе EDA и EDA-SIINFEKL белков (13-14 кДа).
Фигура 2. Связывание белкового вектора EDA-SIINFEKL с TLR4. 2А. Прямое определение связывания. Клетки HEK293-LacZ (HEK293-LacZ) и клетки HEK293-TLR4/MD2/CD14 (HEK293-TLR4) пульсировали с помощью 1 мкМ EDA-SIINFEKL, зафиксировали параформальдегидом, промаркировали анти-His и анти-EDA антителами, образовавшимися с помощью IgG-FITC анти-мышь, и проанализировали проточной цитометрией. 2В. Способность EDA ингибировать связывание анти-TLR4 антител с TLR4-экспрессирующими клетками. Клетки HEK-TLR4 были инкубированы в течение 2 часов при 4°С в присутствие или отсутствие 500 нМ белка EDA-SIINFEKL. Клетки были промыты и инкубированы с анти-TLR4 антителами, окрашены с помощью FITC и проанализированы проточной цитометрией. 2С. Процент ингибирования связывания анти-TLR4 антитела с TLR4-экспрессирующими клетками посредством использования различных концентраций белка EDA-SIINFEKL. 2D. Испытания клеточной адгезии. HEK-hTLR4 или HEK-LacZ клетки, окрашенные с помощью меченного тритием тимидина, были диспергированы в лунке 96-лункового микропланшета, предварительно покрытого белком EDA, и инкубировались в течение 2 часов при 37°С. Неприлипающие клетки были устранены, тогда как прилипающие клетки были собраны, и определялась объединенная радиоактивность на сцинтиляционном счетчике Topcount. Число прилипающих клеток на лунку определялось с помощью стандартных кривых.
Фигура 3. EDA-SIINFEKL активирует TLR4 сигнальный путь. Колориметрическое определение человеческого гена секретируемой эмбриональной щелочной фосфатазы в культуре супернатантов HEK293/TLR4-MD2-CD14 или HEK293/LacZ экспрессирующих клеток, трансфецированных с помощью этого гена-репортера, экспрессия которого контролируется NF-κВ-индуцибельным ELAM-1 промотером. Спустя 24 часа после трансфекции клетки были инкубированы в присутствии или отсутствие различных концентраций LPS, 100 нМ белка EDA-SIINFEKL (EDA) или 100 нМ белка EDA-SIINFEKL, предварительно расщепленного с помощью протеиназы К. Столбики представляют NF-κВ-кратную индукцию (OD, полученная с супернатантами от HEK293/TLR4-MD2-CD14, разделенная на OD, полученную с супернатантами от HEK293/LacZ).
Фигура 4. EDA-SIINFEKL индуцирует секрецию провоспалительных цитокинов DC in vitro. Полученные из костного мозга DC in vitro были культивированы в присутствии LPS (1 мкг/мл), EDA-SIINFEKL (500 нМ), EDA-SIINFEKL (500 нМ), расщепленного с помощью протеиназы К, или солевого раствора. Спустя 24 ч присутствие IL-12 (А) и TNF-α (В) определяли в культуральном супернатанте с помощью ELISA.
Фигура 5. EDA-SIINFEKL индуцирует созревание CD11c DC in vivo. Созревание дендритных клеток является требованием для оптимальной стимуляции Т-клеточного ответа. Когда созревание происходит, АРС увеличивают экспрессию поверхностных молекул, таких как молекулы МНС класса I (H2Kb на нашей модели) и класса II (IAb на нашей модели), CD40, CD80 и CD86. Поэтому мы проанализировали, индуцирует ли EDA-SIINFEKL созревание CD11c экспрессирующих клеток in vivo. Мышей C57BL/6 wt иммунизировали в/в с помощью 25 мкг EDA-SIINFEKL, 25 мкг EDA-SIINFEKL, расщепленного с помощью протеиназы К, 25 мкг LPS или только PBS. Кроме того, мыши C57BL/6 TLR4 КО были иммунизированы с помощью 25 мкг EDA-SIINFEKL или только PBS. Пятнадцать часов спустя мышей умертвили и клетки CD11c очистили с помощью autoMACS. Клетки были помечены и проанализированы проточной цитометрией на экспрессию молекул H-2Kb, I-Ab, CD40, CD80 и CD86.
Фигура 6. EDA-SIINFEKL эффективно представляется дендритными клетками Т-клеткам, специфическим для SIINFEKL эпитопа. Мы охарактеризовали способность EDA-SIINFEKL, который будет захвачен АРС для презентации обработанного CTL эпитопа SIINFEKL Т-клеткам от трансгенных мышей ОТ-1, специфических для этого эпитопа. (A) IFN-γ продукция неприлипающими клетками от трансгенных мышей ОТ-1. Полученные из костного мозга DC культивировались в присутствии одной среды, различных концентрациях синтетического пептида SIINFEKL, SIINFEKL и EDA, EDA-SIINFEKL (слитого белка) или только EDA. Двадцать четыре часа спустя DC были собраны и использовались в качестве АРС в присутствии 105 неприлипающих клеток ОТ-1. Через следующие 24 часа супернатант был извлечен, и определялся секретированный IFN-γ. (В) TLR4 молекулярная зависимость. Клетки гибридомы B3Z (105 клеток/лунку) были инкубированы в присутствии клеток селезенки от мышей C57BL/6 wt или со спленоцитами от мышей «knock out» для молекулы TLR4 (105 клеток/лунку) и белка EDA-SIINFEKL (100 нМ). (С) Клетки из селезенки мышей C57BL76 wt были культивированы совместно с клетками гибридомы B3Z и белком EDA-SIINFEKL в присутствии или отсутствие анти-TLR4 антитела. (В и С) Количество IL-2, секретированного в культурный супернатант, определялось биоанализом, основанным на использовании клеточной линии CTLL. (D) Эффект хлорохина, моненсина, брефельдина или циклогексимида на презентацию антигена слитого белка EDA-SIINFEKL. Полученные из костного мозга дендритные клетки были инкубированы в течение 1 часа в отсутствие или присутствии 30 мМ хлорохина, брефельдина, моненсина или 4 мг/мл циклогексимида, перед добавлением EDA-SIINFEKL или синтетического пептида SIINFEKL (белые столбики). Через 10 часов в культуре, указанные DC были зафиксированы в глутаральдегиде и использовались как антиген-презентирующие клетки (АРС) (104 клеток/лунку) в сокультурах с неприлипающими клетками мыши ОТ-1 (105 клеток/лунку). 24 часа спустя количество секретированного IFN-γ определялось с помощью коммерческого ELISA.
Для изучения возможного улучшения процесса презентации экспрессией TLR4 на АРС мы культивировали клетки гибридомы B3Z (специфические для эпитопа SIINFEKL) в присутствии клеток селезенки от мышей C57BL/6 wt или от мышей TLR4 КО и различных концентраций EDA-SIINFEKL (нМ). Количество IL-2, высвобожденного в культурный супернатант, определялось биоанализом на основании CTLL (Фигура 6Е).
Фигура 7. Иммунизация мышей с помощью EDA-SIINFEKL индуцирует клеточный ответ, специфический для эпитопа SIINFEKL. Предыдущие результаты демонстрируют, что рекомбинантный белок EDA-SIINFEKL биологически активен и специфически активирует АРС. Индукция специфических Т-клеточных имунных ответов in vivo является критической для разработки вакцины. Таким образом, мы проверили, развивались ли у мышей, иммунизированных с помощью слитого белка EDA-SIINFEKL, специфические клеточные ответы против этого эпитопа. (А) Индукция IFN-γ продуцирующих клеток. В дни 0 и 10 мыши C57BL/6 были иммунизированы с помощью 1.5 нмоль EDA-SIINFEKL или с помощью 1.5 нмоль пептида SIINFEKL. В день 20 клетки селезенки были инкубированы в течение 48 часов в присутствии или отсутствие SIINFEKL, и количество секретированного IFN-γ определялось спомощью ELISA. (В) Анализ индукции SIINFEKL-специфического ответа CTL. Спленоциты от мышей, иммунизированных с помощью EDA-SIINFEKL или с помощью SIINFEKL, повторно стимулировались в течение 5 дней в присутствии пептида SIINFEKL. После этой инкубации определялась активность CTL против EL-4 клеток-мишеней, в отсутствие или присутствии пептида SIINFEKL с помощью стандартного испытания высвобождения хрома51. Данные представляют средние проценты значений чистого специфического лизиса (% лизиса клетки-мишени, пульсируемой с SIINFEKL, минус % лизиса непульсируемой клетки-мишени), полученные от тройных образцов.
Фигура 8. EDA-SIINFEKL защищает от опухолевой нагрузки EG7OVA экспрессирующими клетками. Для изучения способности слитого белка EDA-SIINFEKL защищать мышей от воздействия инъекции опухолевых клеток EG7ОVA, мыши были иммунизированы п/к в дни 0 и 10 с помощью 3 нмоль EDA-SIINFEKL, SIINFEKL или солевого раствора. Спустя двадцать дней после второй иммунизации мышам ввели п/к 105 клеток EG7ОVA. За ростом опухоли наблюдали, используя кронциркуль, и выражали в кубических миллиметрах, используя формулу V=(L×w2)/2, где L - длина; w - ширина. Мышей умертвили, когда размер опухоли достиг объема больше чем 8 см3.
Фигура 9. EDA действует как адъювант в индукции цитотоксических ответов после иммунизации с помощью белка OVA. Существует возможность, что если EDA способен к стимулированию созревания дендритных клеток in vivo, он может действовать в качестве адъювантного агента после иммунизации белком, содержащим цитотоксический эпитоп, но сам по себе быть неспособным к активации цитотоксического ответа. Чтобы проверить эту возможность, мы иммунизировали группу мышей с помощью 50 мкг EDA с 500 мкг белка OVA (А), а другую группу мышей с помощью 500 мкг OVA (В), не используя никакой другой тип адъюванта. Спустя одну неделю после иммунизации мышей умертвили и спленоциты культивировали в присутствии синтетического пептида SIINFEKL. После 5 дней в культуре, в стандартном испытании высвобождения Cr51 определялся цитотоксический ответ к EL-4 клеткам-мишеням, пульсируемым пептидом SIINFEKL.
Фигура 10. EDA может действовать как транспортирующий агент для больших антигенов. В предыдущих экспериментах было доказано, что белок EDA может действовать как транспортирующий агент для транспортировки цитотоксического эпитопа и способствования индукции ответа CTL против указанного эпитопа. В более поздней стадии мы хотели изучить наличие у EDA способности к транспортировке большего антигена и облегчения индукции клеточного ответа против указанного антигена. С этой целью мы сконструировали EDA-OVA слитой белок и выполнили следующие эксперименты in vitro и in vivo. (А) Анализ SDS-PAGE рекомбинантного белка EDA-OVA. Рекомбинантный EDA-OVA белок был экспрессирован в Е. coli, очищен аффинной хроматографией, обессолен, детоксифицирован, сконцентрирован и проанализирован SDS-PAGE. Наблюдалась полоса приблизительно 55 кДа, соответствующая предполагаемой молекулярной массе указанного белка. (В) Эксперименты по презентации антигена. Полученные из костного мозга DC были культивированы в присутствии или отсутствие OVA, EDA-OVA (слитого белка), EDA плюс OVA или только EDA. 24 часа спустя DC использовались в качестве антиген-презентирующих клеток в присутствии 105 неприлипающих клеток от мышей ОТ-1. Продукция IFN-γ неприлипающими клетками от мышей ОТ-1 в присутствии DC определялась количественно с помощью коммерческого ELISA. (С) EDA-OVA белок индуцирует OVA специфические CTL in vivo. Мыши C57BL/6 были иммунизированы с помощью 1 нмоль EDA-OVA или с помощью 1 нмоль OVA. Спустя семь дней после иммунизации спленоциты от иммунизированных мышей повторно стимулировались in vitro в течение 5 дней в присутствии пептида SIINFEKL. Впоследствии в стандартном испытании высвобождения Cr51 определялась специфичная активность CTL против EL-4 клеток, инкубированных в отсутствие или присутствии SIINFEKL. Данные представляют средние проценты от чистых значений специфического лизиса (% лизиса клетки-мишени, пульсируемой с SIINFEKL, минус % лизиса непульсируемой клетки-мишени), полученные от тройных образцов.
Фигура 11. Белок EDA-NS3 создает специфический ответ CTL против белка NS3 вируса гепатита С. Заметив, что белок EDA мог действовать в качестве транспортирующего агента для больших антигенов, была проанализирована способность EDA индуцировать антивирусный ответ на вирусный белок NS3 гепатита С (аминокислоты 1-196 от протеазного участка белка NS3), как стратегия прививки против инфицирования указанным вирусом. (А) Анализ SDS-PAGE рекомбинантного EDA-NS3 (1-196) белка. Рекомбинантный слитой белок EDA-NS3 был сконструирован и экспрессирован в Е. coli и проанализирован SDS-PAGE. (В) EDA-OVA белок индуцирует OVA специфический CTL in vivo. Мыши HHD (трансгенные для белка HLA-A2.1) были иммунизированы в/в путем с помощью 100 мкг/мыши белка EDA-NS3, растворенного в солевом растворе. Спустя неделю после иммунизации спленоциты повторно стимулировались in vitro с помощью NS3 1073 пептида (который содержит иммунодоминантную цитотоксическую Т-детерминанту от белка NS3 для рестрикции HLA-A2). После 5 дней в культуре, с помощью стандартного испытании высвобождения Cr51 определялась цитотоксическая активность против клеток-мишеней Т2, инкубированных с пептидом 1073 (V) (SEQ. ID. NO: 20, CVNGVCWTV), или с 1073 (L) вариантом указанного пептида (SEQ. ID. NO: 21, CLNGVCWTV), или в отсутствие пептида. (С) EDA-NS3 белок индуцирует мультиэпитопный ответ против различных эпитопов от белка NS3. Спленоциты, полученные от мышей, иммунизированных EDA-NS3, повторно стимулировали in vitro в течение 48 часов в присутствии пептидов 1038-1046, NS3 1073-1081 или NS3 1169-1177 (которые содержат три цитотоксические детерминанты для рестрикции HLA-A2 в пределах фрагмента 1-196 из белка NS3) или с рекомбинантным белком NS3 (Mikrogen). Количество IFN-γ, секретированного в супернатант, определялось с помощью коммерческого ELISA. (D) EDA-NS3 белок индуцирует длительный цитотоксический ответ. Мыши HHD были иммунизированы в/в путем с помощью 100 мкг/мыши белка EDA-NS3 в солевом растворе. Спустя шестьдесят дней после иммунизации мышей умертвили, и в стандартном испытании высвобождения Cr51 определялось присутствие CTL, специфических для пептида NS3 1073, с использованием Т2 клеток-мишеней, инкубированных в отсутствие или присутствии NS3 1073 пептида. (Е) Иммунизация мышей C57BL/6 с помощью DC, инкубированных с EDA-NS3, защищает мышей от инфекции рекомбинантным вирусом коровьей оспы vHCV (1-3011), который экспрессирует вирусные белки гепатита С. Мыши были иммунизированы с 106 DC, предварительно инкубированных с белком EDA-NS3, и 7 дней спустя им ввели 5×106 вируса коровьей оспы vHCV (1-3011) и/п путем. Спустя три дня после инфицирования мышей умертвили, и вирусный заряд был определен количественно/мг яичниковой ткани, посредством испытания инфицирования на клетках BSC-1.
ПРИМЕРЫ
Пример 1. Экстра домен А из фибронектина взаимодействует с TLR4 и активирует TLR4 сигнальный путь.
Материалы и методы
Экспрессия рекомбинантных белков EDA и EDA-SIINFEKL белкового вектора
Подготовка рекомбинантного белкового вектора
Экстра домен А фибронектина (EDA) был амплифицирован с помощью РТ-ПЦР, используя специфические праймеры и РНК из гепатоцитов, полученных от мышей, обработанных конканавалином-А для индуцирования поражения печени (Lasarte et al., Hepatology. 2003; 37(2): 461-70). Срезы ткани печени были гомогенизированы и лизированы в Ultraspec (Biotecx, Хьюстон, ТХ, США) с ипользованием Ultraturrax Driver Т.25 (Janke & Kunkel, Ika-Labortechnik, Германия). РНК была выделена согласно методам Chomczynski и Sacchi (Chomczynski P and Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem. 1987; 162: 156-159). РНК была обратно транскрибирована (60 минут при 37°С) с помощью 200 Е М-MuLV обратной транскриптазы (Gibco-BRL) в 20 мкл объеме 5×RT буфера (250 мМ Трис-HCl, рН 8.3, 375 мМ KCl, 15 мМ MgCl2) с добавкой 5 мМ дитиотреитола (DDT), 0.5 мМ деоксинуклеозидтрифосфата (Boehringer Mannheim, Мангейм, Германия), 25 Е ингибитора рибонуклеазы (Promega Corporation, Мадисон, WI, США) и 200 нг неупорядоченных гексамеров (Boehringer Mannheim). После нагревания (95°С, 1 мин) и быстрого охлаждения на льду 0.3 нг пула кДНК использовались для ПЦР амплификации в 20 мкл 10х буферного раствора (100 мМ Трис-HCl, рН 9.3, 500 мМ KCl, 1% Тритон Х-100), содержащего 0.08 мМ dNTP, восходящие и низходящие праймеры (по 40 нг), 1.5 мМ MgCl2 и 2 Е Taq ДНК полимеразы (Promega Corporation).
Восходящий праймер представлял собой (SEQ. ID. NO: 13)
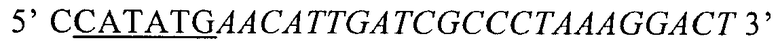
(подчеркнутые основания были добавлены к праймерам для введения последовательности, распознаваемой ферментом рестрикции NdeI, тогда как последовательность, обозначенная курсивом, соответствует началу EDA), и низходящий праймер (SEQ. ID. NO: 14)

(подчеркнутые основания были добавлены к праймерам для введения последовательности, распознаваемой ферментом рестрикции NotI, последовательность, обозначенная жирным шрифтом, соответствует последовательности, кодирующей OVA CTL эпитоп (SIINFEKL), обрамленной тремя аминокислотами на обеих концах QLESIINFEKLTEV, тогда как последовательность, обозначенная курсивом, соответствует началу EDA).
ПЦР амплифицированный фрагмент был клонирован в pCR2.1-TOPO с помощью набора клонирования ТОРО ТА (Invitrogen, Карлсбад, Калифорния, США). Эта плазмида была расщеплена с помощью NdeI и NotI, и полученный фрагмент ДНК был субклонирован в расщепленную NdeI/NotI плазмиду pET20b (Novagen), что позволяет экспрессировать слитые белки, несущие шесть остатков гистидина (6xHis таги) на карбоксильном конце.
Полученная плазмида рЕТ20b2-26, экспрессирующая слитой белок EDA-SIINFEKL-6xHis, была трансфицирована в BL21 (DE3) клетки для экспрессии рекомбинантного белкового вектора. Трансфецированные клетки выращивали в 1 л LB при 37°С, пока OD600 не достигло 0.5-1. IPTG был добавлен к культуре до конечной концентрации 0.4 мМ, и инкубировали со встряхиванием при комнатной температуре в течение ночи. Клетки были собраны центрифугированием, повторно суспендированы в 0.1 М Трис-HCl, рН 7.2, обработаны лизозимом, разрушены при использовании французского пресса (два прохождения при 20.000 pst), очищены центрифугированием и отфильтрованы. Слитой белок, присутствующий в растворимой фракции, был очищен аффинной хроматографией (Histrap, Pharmacia) с использованием платформы FPLC (АКТА, Pharmacia). Элюированный белок был обессолен с использованием обессоливающих колонок Hitrap (Pharmacia) и сконцентрирован с помощью центрифужного фильтра Amicon Ultra 4-5000 MWCO (Millipore Carrighwahill, Ирландия). Рекомбинантный белковый вектор был очищен от эндотоксинов при использовании колонок Endotrap (Profos Ag, Регенсбург, Германия) до тех пор, пока уровни эндотоксина не были ниже 0.2 ЭЕ/мкг белка (определялось LAL-тестом, Cambrex).
Чтобы получить плазмиду экспрессии для белка EDA, была выполнена ПЦР с использованием праймеров
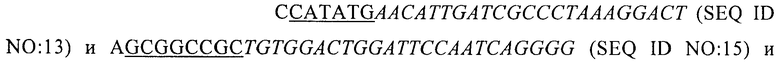
клонирующих тактик, подобных описанным для плазмиды EDA-SIINFEKL, что привело к получению плазмиды pET20bEDA1.2. 20 мкг белка были добавлены к каждому образцу в 15% SDS-акриламидном геле, после чего проводили окрашивание с помощью Coomassie blue. Наблюдалась полоса, соответствующая предполагаемой молекулярной массе (13 кДа).
1.1.2. Связывание EDA-SIINFEKL с TLR4. Проточная цитометрия и испытание адгезии
Для проверки способности рекомбинантного белка EDA-SIINFEKL связываться с TLR4 экспрессирующими клетками, мы использовали НЕК293, экспрессирующие человеческий TLR4-MD2-CD14 293 (от Invivogen). Мы также использовали клетки НЕК293, трансфецированные с помощью LacZ (Invivogen), в качестве отрицательного контроля. Клетки пульсировали с 1 мМ EDA-SIINFEKL в течение 1 часа при 4°С, промыли PBS и зафиксировали 4% параформальдегидом в PBS в течение 10 мин. После 3 промывок клетки были помечены 1/100 анти-His антителами (Qiagen) и 1/200 анти-CD16 (FcBlock, от Becton Dickinson) в течение 1 часа и 30 мин. После трех промывок клетки инкубировали в течение 30 минут с 1/100 разведением IgG анти-мышь, помеченного флуоресцеином, и проанализировали проточной цитометрией.
Альтернативно, определялась способность белка EDA-SIINFEKL ингибировать связывание FITC-окрашенного TLR4 антитела анти-человек с клетками НЕK-hTLR4. Для этого HЕK TLR4 клетки были инкубированы в течение 2 часов при 4°С в присутствии или отсутствие различной дозы EDA-SIINFEKL. Впоследствии клетки были промыты и инкубированы с анти-ТЕР4 антителами и проанализированы проточной цитометрией. Был вычислен процент ингибирования для различных оцененных концентраций EDA-SIINFEKL. Также проводилось испытание клеточной адгезии. НЕK LacZ или HЕK hTLR4 клетки были предварительно окрашены с помощью меченного тритием тимидина и распределены в 96-лунковые микропланшеты, предварительно покрытые белком EDA. После 2-часовой инкубации при 37°С неприлипающие клетки были устранены, тогда как прилипающие клетки были собраны, и определялась объединенная радиоактивность на сцинтиляционном счетчике Topcount. Число прилипающих клеток на лунку определялось с помощью стандартных кривых, полученных с использованием различных концентраций окрашенных клеток.
1.1.3. Активация TLR4 сигнального пути
HEK293/hTLR4-MD2-CD14 или HEK293/LacZ клетки экспрессии были трансфецированы плазмидой, несущей человеческий ген секретируемой эмбриональной щелочной фосфатазы (SEAP) согласно инструкциям производителя (Invivogen). Экспрессия SEAP контролируется NF-κВ-индуцибельным ELAM-1 промотером (pNiFty-SEAP (Invivogen)). Спустя двадцать четыре часа после трансфекции клетки были инкубированы в присутствии или отсутствие различных концентраций LPS, 100 нМ белка EDA-SIINFEKL или 100 нМ белка EDA-SIINFEKL, предварительно расщепленного протеиназой K. После 24 часов экспрессия гена-репортера определялась в культурных супернатантах колориметрическим испытанием (Invivogen). На Фигуре 3 столбики представляют кратный коэффициент NF-κВ индукции (OD, полученная на супернатантах из HEK293/TLR4-MD2-CD14 разделенная на OD, полученную на супернатантах из HEK293/LacZ). Количество эндотоксинов в препаратах EDA в этом испытании было ниже 0.0003 мкг/мл.
Результаты
1.2.1. Экспрессия EDA и EDA-SIINFEKL рекомбинантных слитых белков
Рекомбинантный белок EDA-SIINFEKL был экспрессирован в Е. coli как 6xHis слитый белок (SEQ. ID. NO: 2), очищенный аффинной хроматографией, обессолен и очищен от эндотоксинов, как описано в разделе методов. Полученные белки были проанализированы с помощью SDS-PAGE и вестерн-блота с использованием анти-his антител (Фигура 1). Полоса, соответствующая предполагаемой молекулярной массе (13 кДа), наблюдалась для каждого белка.
1.2.2. EDA-SIINFEKL слитый белок связывает TLR4
Было описано, что экстра домен А фибронектина активирует Toll-подобный рецептор 4 (Okamura et al., JBC, 2001; 276: 10229-10233). Однако нет никакого прямого доказательства физического связывания EDA с TLR4. Мы сначала проанализировали, имеет ли белок EDA-SIINFEKL способность связываться с клетками, экспрессирующими TLR4. НЕK293, экспрессирующие человеческий TLR4-MD2-CD14 или клетки НЕK293, трансфецированные с помощью LacZ (Invivogen), пульсировали с 1 мкМ белка EDA-SIINFEKL, помеченного анти-His антителами и IgG анти-мышь, помеченного флуоресцеином (см. методы) и проанализировали проточной цитометрией. Было обнаружено, что НЕK293 клетки, экспрессирующие человеческий TLR4-MD2-CD14, имели немного более высокую интенсивность флюоресценции, чем НЕK293 клетки, экспрессирующие LacZ (Фигура 2А). Была также определена способность белка EDA-SIINFEKL ингибировать связывание окрашенного флюоресцеином антитела с человеческим TLR4. Результаты показали, что предыдущая инкубация клеток HEK hTLR4 с 500 мМ белком EDA-SIINFEKL ингибировала приблизительно 50% указанного связывания антитела (Фигура 2В). Фигура 2С показывает ингибиторный эффект различных доз EDA-SIINFEKL на указанное связывание антитела. С другой стороны, мы определили способность НЕK hTLR4 и контрольных НЕK LacZ клеток связываться в испытании адгезии, с пластиковыми лунками, предварительно покрытыми белком EDA. Это показывает, что НЕK hTLR4 клетки способны к специфическому связыванию с лунками, которые содержат EDA. Все эти эксперименты указывают на то, что EDA и EDA-SIINFEKL белки способны к связыванию TLR4.
1.2.3. Слитый белок EDA-SIINFEKL активирует TLR4 сигнальный путь
Передача сигналов TLR4 приводит к транслокации NF-κВ, фактора транскрипции, который связывается с консенсусными элементами в пределах промотеров разных генов. Для определения возможности активации TLR4 рекомбинантным белком EDA-SIINFEKL мы использовали HEK293/hTLR4-MD2-CD14 или HEK293/LacZ клетки, трансфецированные плазмидой, несущей человеческий ген секретируемой эмбриональной щелочной фосфатазы (SEAP) под контролем NF-κВ-индуцибельного ELAM-1 промотера (pNiFty-SEAP (Invivogen)). Мы обнаружили, что белок EDA-SIINFEKL имел способность стимулировать экспрессию SEAP только в HEK293/hTLR4-MD2-CD14 трансфецированных клетках, достигая 7-кратной индукции NF-κВ, подобно обнаруженной при инкубации клеток с 0.01 мкг LPS (Фигура 3). Эта способность стимулировать NF-κВ ядерную транслокацию полностью нивелировалась, если белок EDA-SIINFEKL был предварительно расщеплен протеиназой K (Фигура 3), что свидетельствует о том, что активация EDA TLR4 не может быть объяснена потенциально возможным загрязнением LPS в препарате рекомбинантного белка.
Обсуждение
Мы сконструировали рекомбинантную плазмиду рЕТ20b2-26, которая позволила экспрессировать рекомбинантный слитый белок EDA-SIINFEKL 6xHis в Е. coli. Присутствие 6 гистидинов облегчает обнаружение и очистку слитого белка. Таким образом, мы смогли очистить от цитоплазматической фракции культуры Е. coli значительные количества слитого белка. Испытания связывания, проведенные на TLR4 экспрессирующих клетках, свидетельствуют, что белок EDA-SIINFEKL может связывать TLR4 специфически. Кроме того, мы показываем здесь, что EDA-SIINFEKL может активировать TLR4 сигнальный путь. Эта активация не связана с потенциальным загрязнением LPS белка, так как предыдущее расщепление протеиназой K полностью нивелирует способность стимулировать NF-κВ ядерную транслокацию. Кроме того, количество эндотоксинов в препарате EDA в этом испытании было ниже 0.0003 мкг/мл (как определялось LAL-тестом), что не способно активировать TLR4 сигнальный путь в этом испытании in vitro. Эти результаты свидетельствуют, что белок EDA мог использоваться в качестве белкового транспортного агента для нацеливания антигенов на TLR4 экспрессирующие клетки. Дендритные клетки, как известно, экспрессируют Tol-подобные рецепторы и, особенно TLR4. Также известно, что некоторые из самых мощных стимулов созревания для DC происходят от взаимодействия рецепторов TLR с их соответствующими лигандами. Таким образом, взаимодействие слитого белка, содержащего EDA, и определенного антигена могло способствовать быстрой активации врожденного иммунитета, вызывая продукцию провоспалительных цитокинов и положительную регуляцию костимуляторных молекул. Кроме того, нацеливание этого слитого белка на поверхность DC могло увеличить захват и эндоцитоз антигена DC и, следовательно, увеличить имунный ответ против этого антигена.
Пример 2. EDA содержащие слитые белки индуцируют созревание дендритных клеток in vitro и in vivo и позволяют индукцию цитотоксических Т-лимфоцитов
2.1 Материалы и методы
2.1.1. Поколение полученных из костного мозга дендритных клеток
Дендритные клетки были выращены из клеток костного мозга. После лизиса эритроцитов с помощью буфера АСK для лизиса, клетки были промыты и впоследствии лишены лимфоцитов и гранулоцитов путем инкубации со смесью антител против CD4 (GK1; АТСС, Manassas, VA), CD8 (53.6.72; АТСС), Ly-6G/Gr1 (BD-Pharmingen; San Diego CA) и CD45R/B220 (BD-Pharmingen), а потом комплемента кролика. Остающиеся клетки были выращены при 106 клеток/мл в 12-лунковых планшетах в полной среде с добавками 20 нг/мл mGM-CSF и 20 нг/мл mIL-4 (оба от Peprotech; Лондон, Великобритания). Каждые два дня среду заменяли свежей средой, содержащей цитокины. Неприлипающие дендритные клетки были собраны в день 7 и культивировались в присутствии или отсутствие 1 мкг/мл или 15 нг/мл LPS (Sigma), EDA-SIINFEKL (500 нМ) или SIINFEKL (10 мкМ) при 37°С и 5% СО2. В некоторых экспериментах полимиксин (10 мкг/мл) был добавлен к культурам для ингибирования воздействия эндотоксинов. Через 24 часа культивирования супернатанты были собраны, и IL-12 и TNF-α определялись с помощью ELISA (BD-Pharmingen) согласно инструкциям производителя.
2.1.2. Определение in vivo созревания клеток CD11с после иммунизации с помощью EDA-SIINFEKL. Эффект расщепления протеиназой K.
Созревание DC оценивалось in vitro проточной цитометрией, измеряющей экспрессию различных поверхностных маркеров. Мышам C57BL6 ввели в/в 25 мкг EDA-SIINFEKL, 25 мкг EDA-SIINFEKL, расщепленного протеиназой K, 25 мкг LPS или только PBS. Расщепление EDA-SIINFEKL протеиназой K было выполнено при использовании агарозы-протеиназы K (Sigma, St Louis). Кратко, 5 мг/мл гранул агарозы протеиназы, промытых в промывочном буфере (20 мМ Трис-HCl, рН 7.2, 1 мМ EDTA, 1 мМ ClCa2), использовались для расщепления белка EDA-SIINFEKL или LPS в течение 20 минут при 30°С. Гранулы агарозы-протеиназы K были удалены центрифугированием. Спустя пятнадцать часов после иммунизации мышей умертвили и клетки CD11с очистили с помощью autoMACS. Клетки пометили и проанализировали проточной цитометрией.
2.1.3. Исследования in vitro для анализа способности презентации антигена
Мы характеризовали способность EDA-SIINFEKL захватываться АРС для презентации обработанного CTL эпитопа SIINFEKL Т-клеткам от ОТ-1 трансгенных мышей или Т-гибридомой B3Z, обе из них специфические для этого эпитопа. Полученные из костного мозга DC культивировали в присутствии различных концентраций EDA-SIINFEKL, EDA и SIINFEKL (нековалентно связанных) или SIINFEKL. Через двадцати четыре часа культивирования были собраны супернатанты, и продукция IFN-γ определялась с помощью ELISA. Альтернативно, спустя 12 часов после инициирования культуры DC собрали, зафиксировали 0.05% глутаральдегидом и использовали как АРС в присутствии различных количеств неприлипающих клеток от ОТ-1 или в присутствии Т-клеточной линии гибридомы B3Z. В некоторых экспериментах DC инкубировали в присутствии или отсутствие хлорохина (3 мкМ), моненсина (1 мкл Golgystop, Pharmingen), брефельдина (1 мкл Golgyplug, Pharmingen), циклогексимида (4 мкг/мл) и затем инкубировали в присутствии EDA-SIINFEKL или SIINFEKL пептида. В некоторых случаях к культурам добавляли антитело анти-TLR4.
Активация клеток B3Z в присутствии обработанных АРС была выполнена путем определения продукции IL-2. Клетки гибридомы B3Z (105 клеток/лунку) были культивированы в полной среде (RPMI 1640 с добавками 10% FCS, 2 мМ глутамина, 100 Е/мл пенициллина, 100 мкг/мл стрептомицина и 5×10-5М 2-меркаптоэтанола) в течение 18 часов в присутствии клеток селезенки (105 клеток/лунку) от мышей C57BL/6 wt или от мышей TLR4 KО и различных концентраций EDA-SIINFEKL. Количество IL-2, высвобожденного в культурный супернатант, определялось биотестом на основе CTLL, как предварительно описано.
2.1.4. Определение индукции in vivo цитотоксических Т-лимфоцитов (CTL) и IFN-γ продуцирующих клеток после иммунизации
Мыши C57BL6 были иммунизированы в/в 50 мкг EDA-SIINFEKL или SIINFEKL в дни 0 и 10. В день 20 мышей умертвили для анализа ответа CTL против SIINFEKL. Спленоциты от иммунизированных животных были культивированы в присутствии 0.1 мкг/мл SIINFEKL при 5×106 клеток/мл (10 мл) в течение 5 дней в полной среде. В день 5 клетки были собраны для испытания высвобождения хрома. Была определена литическая активность путем инкубации в течение 4 часов различных количеств эффекторных клеток с 1×104 EL-4 клеток-мишеней, предварительно нагруженных 51Cr и, или без SIINFEKL. Процент специфического лизиса был вычислен согласно формуле: (cpm экспрериментальный - cpm спонтанный)/(cpm максимальный - cpm спонтанный)×100, где спонтанный лизис соответствует клеткам-мишеням, инкубированным в отсутствие эффекторных клеток, а максимальный лизис получают путем инкубирования клеток-мишеней с 5% Тритоном ×100.
Для определения продукции IFN-γ в ответ на SIINFEKL, спленоциты от иммунизированных мышей были помещены в 96-лунковые планшеты при 8×105 клеток/лунку только с полной средой или с 30 мкМ пептида в конечном объеме 0.25 мл. Супернатанты (50 мкл) были удалены 48 часов спустя, и IFN-γ определялся с помощью ELISA (Pharmingen, Сан-Диего, Калифорния) согласно инструкциям производителя.
В другой группе экспериментов была доказана способность белка EDA действовать в качестве адъюванта в смеси белков. В этом случае группа мышей C57BL/6 была иммунизирована в/в с помощью 50 мкг EDA-SIINFEKL в присутствии 500 мкг белка OVA в PBS, тогда как другая группа была иммунизирована с помощью 500 мкг только белка OVA в PBS. Через одну неделю мышей умертвили, чтобы определить ответ CTL против SIINFEKL в обеих группах, как обозначено выше.
2.1.5. Защита против нагрузки опухолевыми клетками EG7OVA
Мыши были иммунизированы п/к в дни 0 и 10 с помощью 3 нмоль EDA-SIINFEKL или SIINFEKL. Спустя двадцать дней после второй иммунизации мышам ввели п/к 105 клеток EG7OVA. Рост опухоли контролировался кронциркулем и выражался в мм3, используя формулу V=(L×w2)/2, где L - длина; w - ширина. Мышей умертвили, когда размер опухоли достиг объема больше чем 8 см3.
2.2. Результаты
2.2.1. Слитый белок EDA-SIINFEKL стимулирует продукцию IL-12 и TNF-α полученными из костного мозга дендритными клетками (BMDC).
Мы исследовали способность рекомбинантного белка EDA-SIINFEKL стимулировать BMDC продуцировать провоспалительные цитокины, такие как IL-12 или TNF-α. Таким образом, BMDC культивировали с SIINFEKL (10 мкМ), LPS (1 мкг/мл и 15 нг/мл) или EDA-SIINFEKL-6xHis (500 нМ). Двадцать четыре часа спустя IL-12 или TNF-α в культуральном супернатанте определяли с помощью ELISA. Обнаружено, что EDA-SIINFEKL способен стимулировать продукцию очень высоких уровней IL-12 или TNF-α BMDC (Фигура 4). Эта иммуностимуляторная способность исчезла, когда белок был предварительно обработан протеиназой K, что указывает на то, что эта активность не обусловлена возможными следами эндотоксина в образцах белка.
2.2.2. EDA-SIINFEKL индуцирует TLR4 зависимое in vivo созревание CD11c экспрессирующих DC.
Дендритные клетки (DC) являются наиболее мощными антиген-презентирующими клетками с уникальной способностью стимулировать наивные Т-клетки и вторичные ответы на антигены. DC имеют способность захватывать антигены, обрабатывать их в пептиды и представлять пептиды в ассоциации с молекулами МНС класса I или II цитотоксическим Т-клеткам (CTL) или Т-хелперным клеткам соответственно. Незрелые DC могут захватить антигены, но они должны дифференцироваться или созреть, чтобы стать способными к стимулированию наивных Т-клеток. Таким образом, созревание дендритных клеток является требованием для оптимальной стимуляции Т-клеточного ответа. Когда созревание происходит, АРС увеличивают экспрессию поверхностных молекул, таких как молекулы МНС класса I и класса II, CD40, CD80 и CD86. Поэтому мы проанализировали, мог ли EDA-SIINFEKL индуцировать созревание CD11c экспрессирующих клеток in vivo. Мышей C57BL6 иммунизировали в/в 25 мкг EDA-SIINFEKL, 25 мкг EDA-SIINFEKL, расщепленного протеиназой K, 25 мкг LPS или только PBS. Пятнадцать часов спустя мышей умертвили и клетки CD11c очистили с помощью autoMACS, пометили антителами и проанализировали проточной цитометрией. Мы обнаружили, что иммунизация EDA-SIINFEKL была в состоянии индуцировать экспрессию молекул МНС класса I и класса II, CD40 и CD86. Эта способность EDA-SIINFEKL была полностью нивелирована при расщеплении белка протеиназой K перед иммунизацией (Фигура 5). Расщепление LPS протеиназой K не имело никакого ингибиторного эффекта на способность LPS индуцировать экспрессию этих маркеров созревания (не показано). Мы проверили способность EDA-SIINFEKL индуцировать созревание клеток CD11с от C57BL/6 TLR4 КО мышей и обнаружили, что EDA-SIINFEKL не обладал способностью индуцировать сверхэкспрессию маркеров созревания, обнаруженных на мышах C57BL/6 wt (Фигура 5).
2.2.3. EDA-SIINFEKL эффективно представляется дендритными клетками Т-клеткам, специфическим для SIINFEKL эпитопа.
Мы характеризовали способность EDA-SIINFEKL, который захватывается АРС, представлять обработанный CTL эпитоп SIINFEKL Т-клеткам от ОТ-1 трансгенных мышей, специфическим для этого эпитопа. Полученные из костного мозга DC (105 клеток/лунку) культивировали в присутствии различных концентраций EDA-SIINFEKL, EDA+SIINFEKL, EDA или SIINFEKL пептида. Сорок восемь часов спустя были добавлены 105 неприлипающих клеток ОТ-1. Определялась продукция IFN-γ неприлипающими клетками ОТ-1 (Фигура 6А). Пептид SIINFEKL был эффективно представлен Т-клеткам от мышей ОТ-1, что доказано продукцией IFN-γ. EDA-SIINFEKL также индуцирует высокие уровни IFN-γ, хотя высокие дозы белка необходимы для получения уровней IFN-γ, подобных или еще более высоких, четко указывая на то, что белок EDA несет этот SIINFEKL эпитоп к молекулам МНС класса I. Добавление белка EDA к DC, инкубированным с пептидом SIINFEKL, не увеличивало продукцию IFN-γ Т-клетками от мышей ОТ-1. Как ожидается, DC, инкубированные только с EDA, не активируют Т-клетки от мышей ОТ-1. Для анализа возможности экспрессии молекул TLR4 в DC увеличивать презентацию EDA-SIINFEKL, SIINFEKL специфические клетки B3Z были инкубированы с различными концентрациями EDA-SIINFEKL в присутствии клеток селезенки от мышей C57BL/6 wt или TLR4KO. Презентация EDA-SIINFEKL клеткам B3Z было более эффективной в присутствии антиген-презентирующих клеток, которые экспрессировали TLR4 (Фигура 6В). Кроме того, презентация EDA-SIINFEKL клеткам B3Z была полностью блокирована добавлением анти-TLR4 антител (Фигура 6С), свидетельствуя, что TLR4 вовлечен в захват EDA-SIINFEKL. Впоследствии мы изучили эффект различных препаратов на процессинг EDA-SIINFEKL и обнаружили, что эта презентация полностью ингибировалась моненсином, брефельдином или циклогексимидом, но не хлорохином, известным ингибитором окисления в эндосомах и поздних лизосомах (Фигура 6D). Как ожидалось, на презентацию синтетического пептида SIINFEKL эти препараты не повлияли. Эти данные свидетельствуют, что интернализация EDA-SIINFEKL не опосредуется макропиноцитозом, и демонстрируют, что EDA-SIINFEKL обрабатывается через цитозольный путь процессинга класса I.
2.2.4. EDA-SIINFEKL индуцирует SIINFEKL специфический CTL in vivo.
Предыдущие результаты демонстрируют, что рекомбинантный белок EDA-SIINFEKL биологически активен и специфично активирует АРС. Индукция специфических Т-лимфоцитных имунных ответов in vivo является критической для разработки вакцины. Таким образом, мы проверили, развивались ли у мышей, иммунизированных слитым белком EDA-SIINFEKL, специфические ответы CTL против клеток-мишеней, пульсированных SIINFEKL эпитопом. Мыши C57BL6 были иммунизированы в/в с помощью 50 мкг EDA-SIINFEKL или SIINFEKL в PBS в дни 0 и 10. В день 20 мышей умертвили для анализа ответа CTL против SIINFEKL. Было обнаружено, что EDA-SIINFEKL мог индуцировать CTL против EL-4 клеток-мишеней, пульсируемых с SIINFEKL. С другой стороны, никакой активности CTL не было обнаружено, когда мышей иммунизировали с помощью только SIINFEKL (Фигура 7). Из-за способности EDA индуцировать in vivo созревание дендритных клеток способность EDA действовать в качестве адъюванта была также проанализирована при иммунизации с помощью белка OVA. В этом эксперименте мы заметили, что присутствие EDA в смеси для иммунизации обладает иммуностимуляторным эффектом и способно к усилению индукции ответа CTL против SIINFEKL, индуцированного белком OVA (сравните литическую активность между группами А и В Фигуры 9).
2.2.5. EDA-SIINFEKL защищает мышей от нагрузки опухолевыми клетками, экспрессирующими белок OVA.
Для изучения способности слитого белка EDA-SIINFEKL защищать мышей от инъекции опухолевых клеток EG7OVA мыши были иммунизированы п/к 3 нмоль EDA-SIINFEKL, SIINFEKL или солевым раствором. Спустя двадцать дней после второй иммунизации мышам ввели п/к 105 клеток EG7OVA. Мы обнаружили, что иммунизация EDA-SIINFEKL защищает мышей от роста опухоли. У всех мышей, иммунизированных с помощью SIINFEKL или солевым раствором, развивались опухоли, тогда как у 40% мышей, иммунизированных с помощью EDA-SIINFEKL, не отмечалось развитие опухолей, а у оставшихся 60% наблюдалось замедление роста опухоли (Фигура 8).
2.3. Обсуждение
В настоящем исследовании, используя рекомбинантный белок EDA в качестве вектора доставки эпитопа, мы установили стратегии для иммунизации, которые запускают ответы CTL in vivo, минуя потребность в адъюванте. Мы идентифицировали механизмы, которые вносят свой вклад в эффективность EDA содержащих слитых белков как вектора для доставки антигенов TLR-4 экспрессирующим клеткам и индукции клеточных имунных ответов против антигена.
Сначала мы обнаружили, что in vitro стимуляция BMDC с помощью EDA была в состоянии стимулировать продукцию провоспалительных цитокинов, таких как IL-12 и TNF-α. Эти цитокины, как известно, являются критическими для инициирования сильного иммунного ответа против антигена. Кроме того, обнаружено, что in vivo иммунизация с помощью EDA была в состоянии индуцировать созревание DC и увеличить экспрессию костимуляторных молекул на поверхности DC. Экспрессия этих костимуляторных молекул имеет большое значение для эффективной индукции имунных ответов против антигена. Обнаружено, что этот эффект зависит от присутствия TLR4, так как in vivo изолированные клетки CD11c от мышей C57BL/6 TLR4 КО, предварительно иммунизированные с помощью EDA, не демонстрировали никакого улучшения относительно состояния созревания по сравнению с обнаруженным у неиммунизированных животных.
Мы выявили, что присутствие молекулы TLR4 на АРС улучшает презентацию антигена после инкубации со слитым белком EDA-SIINFEKL и что на эту презентацию не оказывает влияние хлорохин, который ингибирует эндолизосомальный протеолизис. Эти данные свидетельствуют, что интернализация EDA-SIINFEKL не опосредуется макропиноцитозом и демонстрирует, что рекомбинантный белок EDA-SIINFEKL обрабатывается как цитозольный антиген, и подразумевает, что слитый белок нужно доставлять в цитозоль через плазменную мембрану АРС.
И что наиболее важно, мы обнаружили, что иммунизация мышей рекомбинантным слитым белком EDA-SIINFEKL в состоянии индуцировать in vivo ответ CTL, специфический против эпитопа SIINFEKL. Кроме того, иммунизация с EDA-SIINFEKL в состоянии защитить мышей от нагрузки опухолевыми клетками EG7OVA. Все эти данные показывают, что этот белковый вектор, содержащий EDA, способен: (i) нацеливать антигены к TLR4 экспрессирующим клеткам, и в особенности профессиональным АРС; (ii) поставлять векторизированный антиген классическому пути процессинга антигена Класса-I; (iii) индуцировать созревание дендритных клеток in vivo и in vitro; и (iv) запускать CTL in vivo против векторизированного антигена в отсутствие адъюванта, и, таким образом, может использоваться в тактиках прививки против инфекционных агентов или против рака. Кроме того, эти слитые белки, содержащие EDA, могут служить для цитозольной доставки фармацевтически приемлемых молекул к TLR4 экспрессирующим клеткам. Дополнительно, способность EDA для индукции in vivo созревания дендритных клеток позволяет использовать его в качестве адъюванта в лекарственных формах, содержащих антиген, против которого хотят создать иммуногенный ответ, открывая спектр возможностей для использования EDA в разработке вакцины.
Пример 3. Белок EDA может использоваться в качестве транспортного агента для транспортировки антигенов из по крайней мере 390 аминокислот.
3.1. Материалы и методы
3.1.1. Экспрессия рекомбинантных белков EDA-OVA и EDA-NS3
Для конструирования плазмиды экспрессии EDA-OVA, мРНК была извлечена из опухолевых клеток EG7OVA, экспрессирующих белок OVA. После обратной транскрипции и амплификации ПЦР с праймерами 
(подчеркнутые основания были добавлены для введения последовательности, распознаваемой ферментом рестрикции NotI, тогда как последовательность, обозначенная курсивом, принадлежит началу и концу яичного альбумина). Продукт ПЦР был клонирован в pCR2.1-TOPO с помощью набора ТОРО ТА (Invitrogen), расщеплен с помощью NotI и субклонирован в плазмиду pET20EDA 1.2 (которая экспрессирует белок EDA), предварительно расщепленную с помощью NotI. Правильная ориентация конструкции была подтверждена секвенированием. После индукции Е. coli, преобразованной плазмидными культурами, слитый белок, присутствующий в растворимой фракции, был очищен аффинной хроматографией (Histrap, Pharmacia) с использованием платформы FPLC (АКТА, Pharmacia). Белок был обессолен с помощью обессоливающих колонок Hitrap (Pharmacia) и сконцентрирован фильтровальным устройством путем центрифугирования Amicon Ultra 4-5000 MWCO (Millipore Carrighwahill, Ирландия). Рекомбинантный белковый вектор был очищен с использованием эндотоксиновой колонки Endotrap (Profbs Ag, Регенсбург, Германия) до тех пор, пока уровни эндотоксина не были ниже 0.2 ЭО/мкг белка (определялось LAL-тестом, Cambrex). Для конструирования белка EDA-NS3 соблюдалась подобная стратегия с использованием праймеров
которые позволяют экспрессию аминотерминального фрагмента белка NS3 (аминокислоты 1026-1221). В отличие от белка EDA-OVA, который был извлечен из растворимой фракции фракций Е. coli, в случае белка EDA-NS3, белок был очищен от телец включения, предварительно растворенных в 8 М мочевине. После аффинной хроматографии с использованием колонок Histrap, была выполнена ионная обменная хроматография (DEAE-сефароза). Очищенная фракция от этой второй хроматографии была повторно свернута по протоколу повторного сворачивания в колонке G25. После повторного сворачивания колонка EDA-NS3 была обессолена и очищена от эндотоксинов с использованием колонок Endotrap (Profos, Германия).
Таким образом, очищенные белки были проанализированы с помощью SDS-PAGE.
3.1.2. In vitro исследования для оценки антиген-презентирующей способности
Оценивалась способность EDA-OVA к захвату с помощью АРС и последующей презентации CTL эпитопа, обработанного SIINFEKL, Т-лимфоцитам от ОТ-1 трансгенных мышей. Полученные из костного мозга дендритные клетки (105 клеток/лунку) культивировали в присутствии различных концентраций EDA-OVA, EDA+OVA (нековалентно связанных), OVA или EDA. Через 12 часов были добавлены 105 клеток/лунку неприлипающих клеток от ОТ-1 трансгенных мышей. Через 24 часа от начала культуры были извлечены супернатанты для определения количества секретированного IFN-γ с помощью коммерческого анализа ELISA.
3.1.3. Измерение in vivo индукции Т-цитотоксических лимфоцитов (CTL) и IFN-γ продуцирующих клеток после иммунизации
C57BL6 или HHD (трансгенные для молекулы HLA-A2.1) мыши были иммунизированы в/в с помощью 50 мкг EDA-OVA или EDA-NS3 соответственно, в дни 0 и 10. В день 20 мышей умертвили для определения ответа CTL против SIINFEKL или против NS3 1073 пептида. Спленоциты от иммунизированных животных были культивированы в присутствии 0.1 мкг/мл SIINFEKL или 1 мкг/мл NS3 1073 при 5×106 клеток/мл (10 мл) в течение 5 дней в полной среде. В день 5 клетки были собраны для анализа высвобождения хрома. Литическая активность определялась путем инкубации в течение 4 часов различных количеств эффекторных клеток с 1×104 EL-4 клетками-мишенями, предварительно нагруженными 51Cr с или без пептида. Процент от специфического лизиса был вычислен согласно формуле (экспериментальный cpm - спонтанный cpm)/(максимальный cpm - спонтанный cpm)×100, где спонтанный лизис соответствует клеткам-мишеням, инкубированным в отсутствие эффекторных клеток, а максимальный лизис получают путем инкубации клеток-мишеней с 5% Тритоном ×100.
Для определения продукции IFN-γ в ответ на различные пептиды, спленоциты от иммунизированных мышей были распределены в 96-лунковых планшетах, 8×105 клеток/лунку, только с полной средой, или с 30 мкМ пептидов NS3 1038-1046 (SEQ ID NO: 23), 1073-1081 (SEQ ID NO: 20, CVNGVCWTV), 1169-1177 (SEQ ID NO: 22), или с 1 мкг/мл рекомбинантного NS3 в конечном объеме 0.25 мл. Супернатанты (50 мкл) были извлечены через 48 часов, и IFN-у определялся с помощью ELISA (Pharmingen, Сан-Диего, Калифорния) согласно инструкциям производителя.
3.1.4. Защита от инфицирования вирусом коровьей оспы vHCV 1-1031, который экспрессирует полипротеин вируса гепатита С
C57BL/6 были иммунизированы в дни 1 и 10 с помощью 1×106 полученных из костного мозга дендритных клеток, пульсированных белком EDA-NS3. Спустя десять дней после второй иммунизации мыши были заражены и/п 5×106 pfu рекомбинантного вируса коровьей оспы vHCV 1-1031. Спустя три дня после инфицирования животных умертвили, и вирусный заряд/мг яичниковой ткани был определен количественно с помощью испытания по количественному определению бляшкообразующего числа, основанному на использовании клеточной линии BSC-1.
3.2. Результаты
3.2.1. Экспрессия и очистка белков EDA-OVA и EDA-NS3
Как обозначено в разделе «Материалы и методы», EDA-OVA или EDA-NS3 были очищены из экстрактов трансформированной Е. coli, с использованием растворимой фракции в случае EDA-OVA и образования телец включения в случае EDA-NS3. На фигурах 10А и 11А показан результат SDS-PAGE для обоих белков. Были получены простые полосы, соответствующие белкам размеров 55 кДа и 32 кДа, что соответствует ожидаемым размерам для каждого из этих белков.
3.2.2. EDA связывание с белком OVA увеличивает презентацию антигена IVA Т-лимфоцитам от ОТ-1 трансгенных мышей.
Мы проанализировали EDA связывающую способность к белку OVA для увеличения презентации антигена SIINFEKL эпитопа Т-клеткам, специфическим для этого эпитопа. Мы заметили, что полученные из костного мозга дендритные клетки, культивированные в присутствии EDA-OVA, стимулировали более сильное производство IFN-γ неприлипающими клетками мышей ОТ-1, чем индуцированное эквимолярными количествами только белка OVA (Фигура 9В). Мы заметили, что продукция IFN-γ была также увеличена в сокультурах, которые содержали белок EDA и белок OVA, по сравнению с только белком OVA, свидетельствуя, что созревание DC, вызванное EDA, могло увеличить активацию Т-клеток.
3.2.3. EDA связывание с белком OVA или с белком NS3 увеличивает специфическую цитотоксическую индукцию Т-лимфоцитов in vivo.
Была проанализирована способность EDA-OVA и EDA-NS3 индуцировать ответ CTL против SIINFEKL эпитопа или против NS3 1073 эпитопа соответственно. Мы наблюдали, для белка EDA-OVA, что иммунизация этим белком, растворенным в солевом растворе, была способна к индуцированию цитотоксического ответа против клеток-мишеней, инкубированных с пептидом SIINFEKL, что иммунизация только белком OVA не способна к индуцированию (Фигура 9С). Таким же образом, иммунизация мышей HHD (трансгенных для HLA-A2.1) белком EDA-NS3 индуцирует эффективный цитотоксический ответ против клеток-мишеней, предварительно инкубированных с пептидом NS3 1073 (V) (SEQ. ID. NO: 20, CVNGNCWTV) и с вариантом 1073 (L) этого пептида (SEQ. ID. NO: 21, CLNGVCWTV). Фигура 11В. Мы также заметили, что иммунизация мышей HHD белком EDA-NS3 индуцирует активацию IFN-γ продуцирующих клеток, специфических для пептидов NS3 1038 (SEQ. ID. NO: 23), 1073 (SEQ. ID. NO: 20, CVNGVCWTV) и 1169 (SEQ. ID. NO: 22) (Фигура 11С). Кроме того, иммунизация мышей белком EDA-NS3 индуцирует длительный цитотоксический клеточный ответ, специфический против NS3 1073 пептида. В действительности, когда мышей, иммунизированных белком EDA-NS3, умертвили спустя 60 дней после иммунизации, мы обнаружили присутствие CTL, специфических для этого пептида (Фигура 11D).
3.2.4. Иммунизация мышей C57BL/6 дендритными клетками, инкубированными с белком EDA-NS3, защищает мышей от инфицирования вирусом коровьей оспы, который экспрессирует белки вируса гепатита С.
Мы хотели изучить, способна ли иммунизация дендритными клетками, инкубированными in vitro с белком EDA-NS3, стимулировать клеточный ответ, способный защитить мышей от нагрузки рекомбинантным вирусом, экспрессирующим белки вируса гепатита С. Поэтому мы иммунизировали мышей C57/BL6 полученными из костного мозга дендритными клетками, инкубированными с белком EDA-NS3, или дендритными клетками, которые не были предварительно инкубированы ни с каким антигеном. Спустя десять дней после второй иммунизации мыши были заражены 5×106 pfu рекомбинантного вируса коровьей оспы vHCV 1-3011 (подарок от Dr Rice, Washington University School of Medicine, St Louis, МО, и описанного Grakoui A, et al. J Virol. 1993; 67: 1385). Три дня спустя вирусная нагрузка была измерена в обеих группах мышей. В этом эксперименте мы наблюдали, что иммунизация с помощью DC, инкубированных с белком EDA-NS3, была способна защитить 66,7% мышей от инфицирования рекомбинантным вирусом коровьей оспы.
3.3. Обсуждение
Как показано в предыдущих результатах, белок EDA может служить полезным вектором для нацеливания SIINFEKL эпитопа от белка OVA к экспрессирующим молекулы TLR4 клеткам и увеличения их иммуногенности. Чтобы оценить способность EDA увеличивать иммуногенность больших белков, мы сконструировали слитые рекомбинантные белки EDA-OVA, которые содержали полный OVA (397 аминокислот) и белок EDA-NS3, содержащий фрагмент с протеазной активностью белка NS3 из вируса гепатита С.
Эти результаты демонстрируют, что белок EDA может действовать как очень эффективный вектор для нацеливания больших антигенов. Таким образом, мы обнаружили в испытании презентации антигена, что связывание OVA с EDA увеличивает захват антигена антиген-презентирующими клетками, увеличивая специфическую активацию Т-клеток. Кроме того, мы заметили, что иммунизация этими слитыми белками (EDA-OVA и EDA-NS3) позволяет индукцию специфических цитотоксических ответов против этих антигенов. Эти индуцированные ответы были длительными. Наконец, мы наблюдали, что введение белка EDA-NS3 с дендритными клетками позволяет индукцию защитного клеточного ответа против инфекции вирусом коровьей оспы, который экспрессирует белки вируса гепатита С,
Эти данные указывают, что белок EDA может быть очень адекватным белковым вектором для индукции клеточных ответов против рассматриваемого антигена. Конструкция слитых белков, основанных на белке EDA, является соответствующей тактикой в протоколах прививки против опухолевых болезней или болезней, вызванных инфекционными агентами.












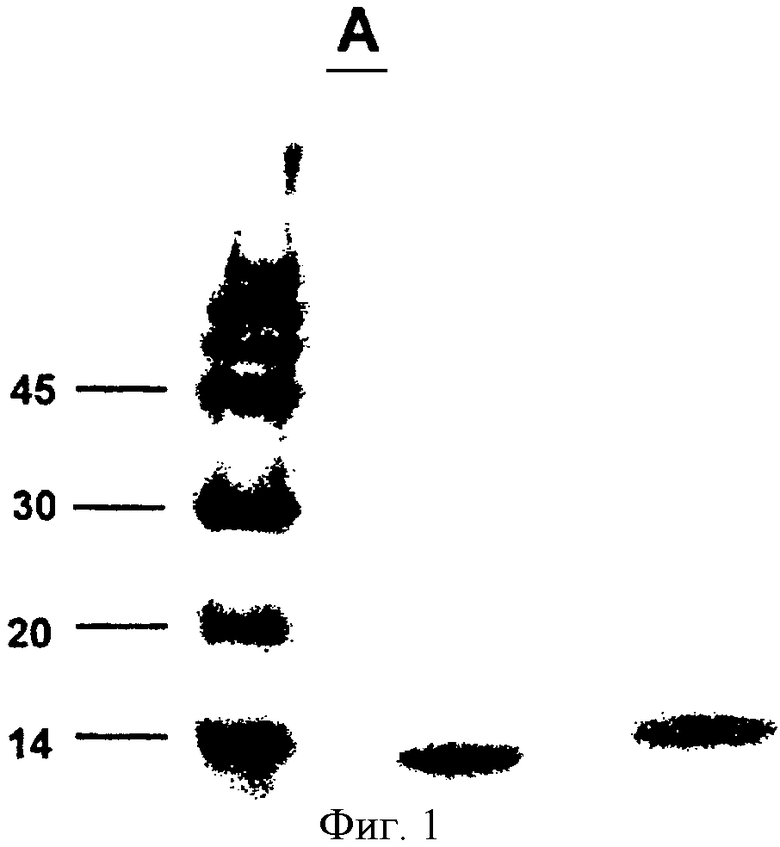

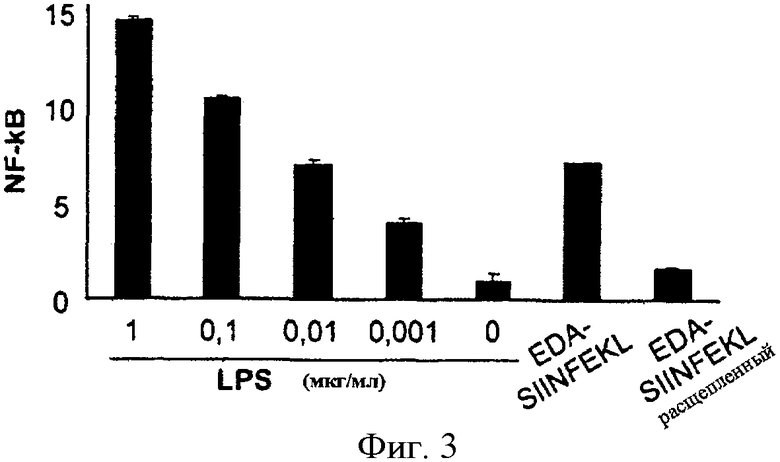
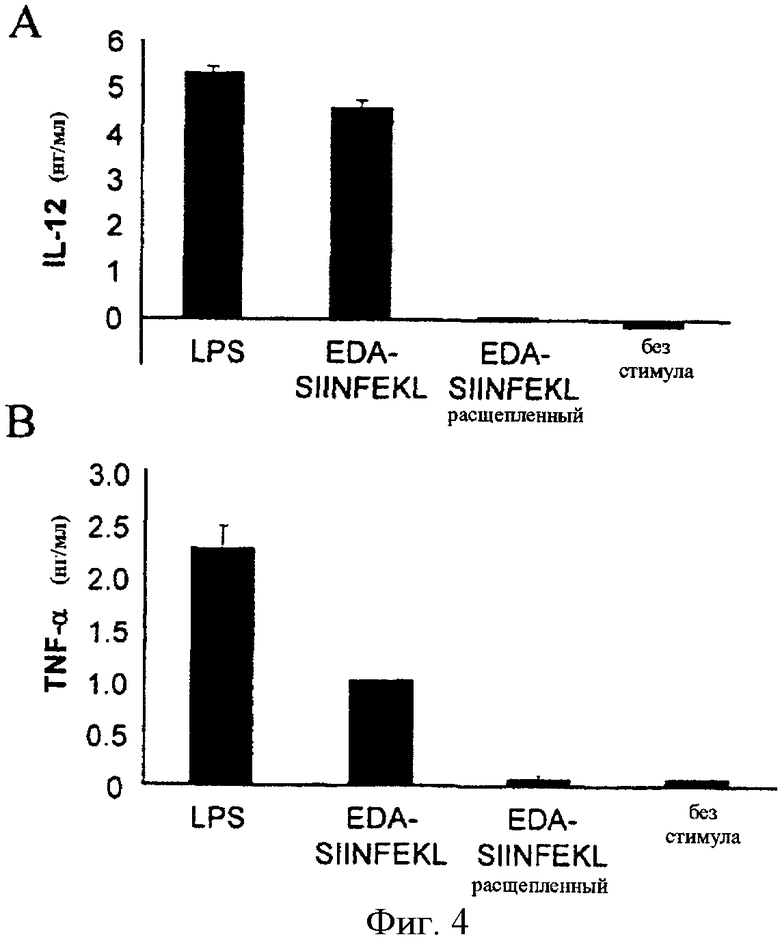
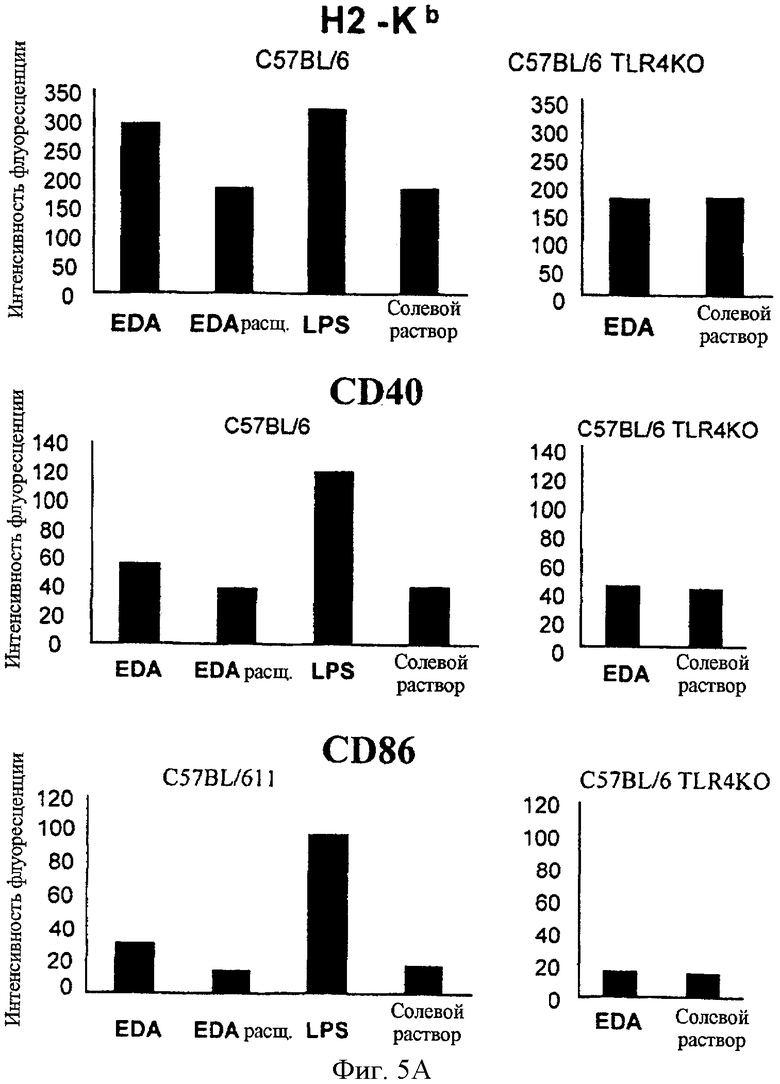
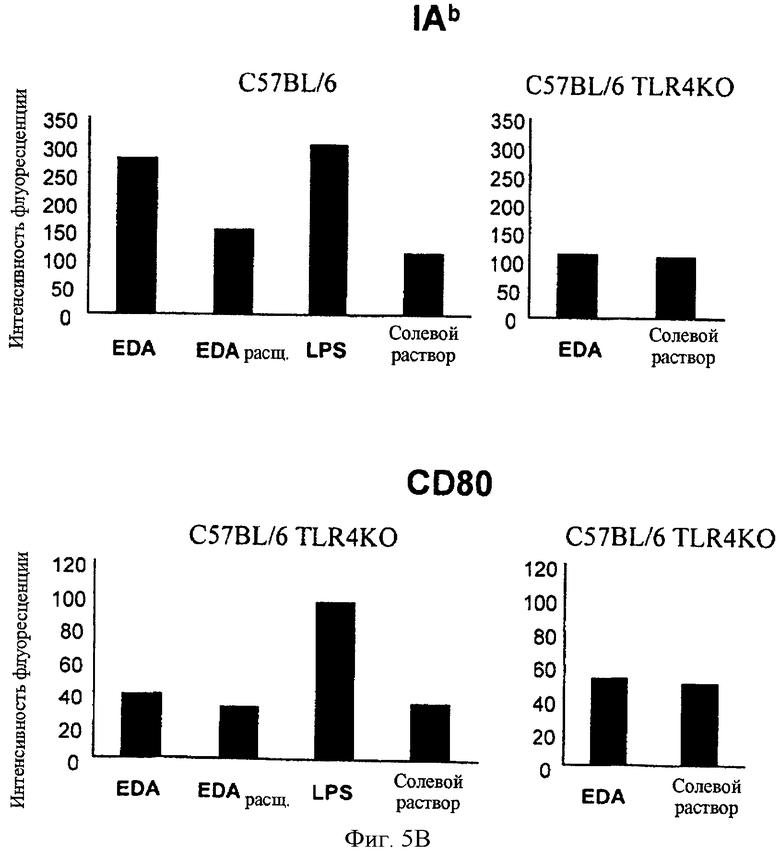
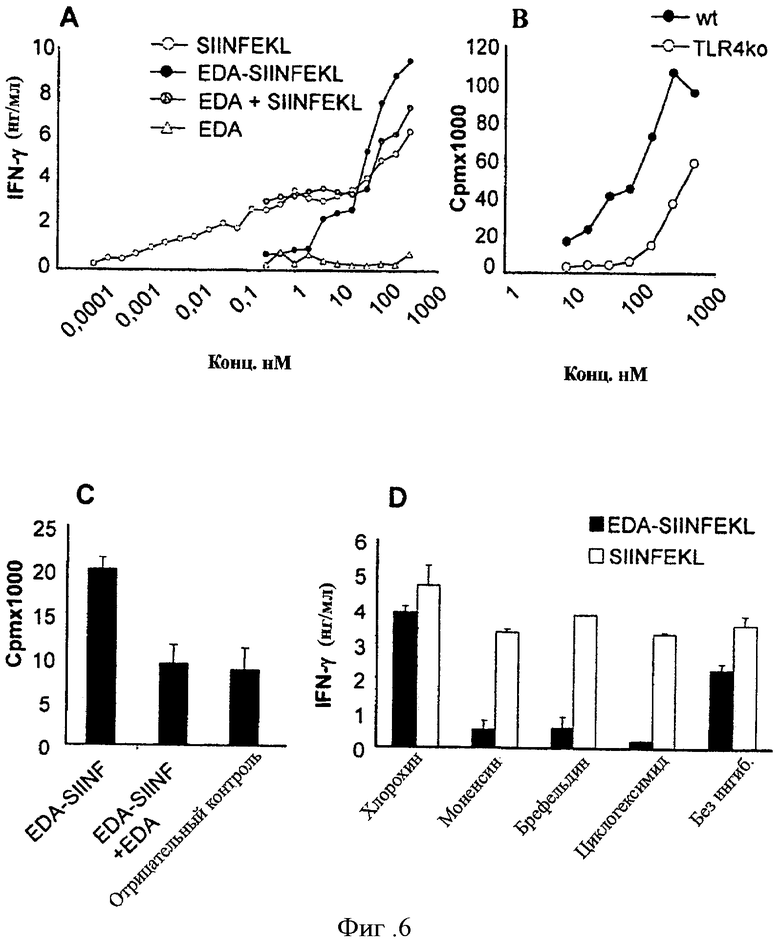
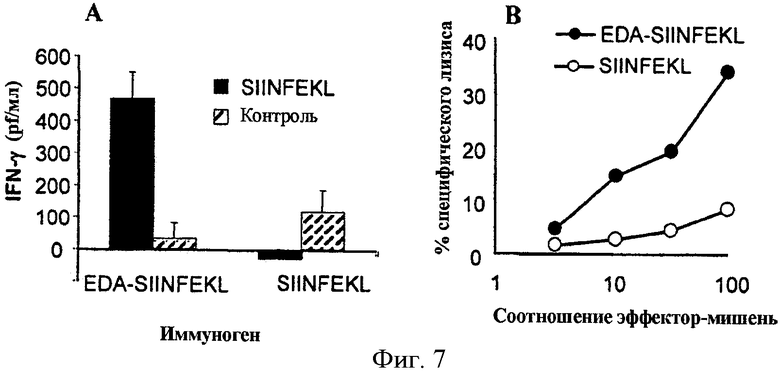

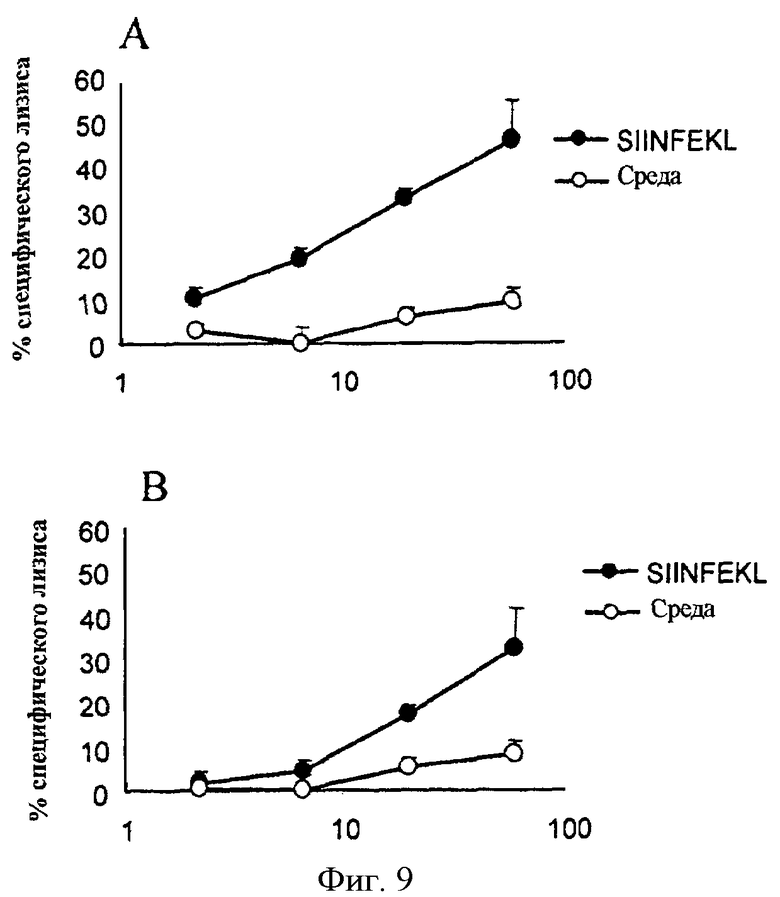
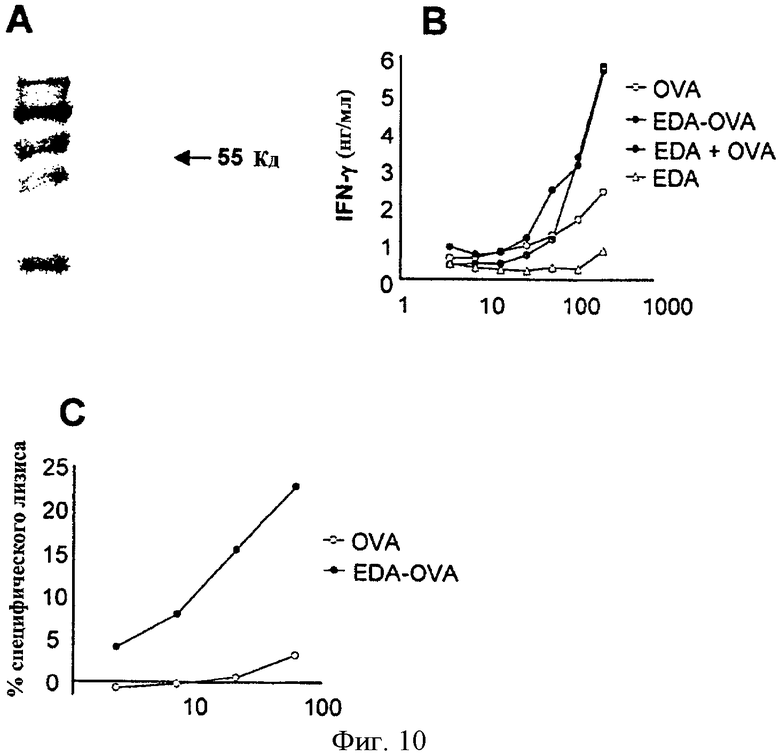
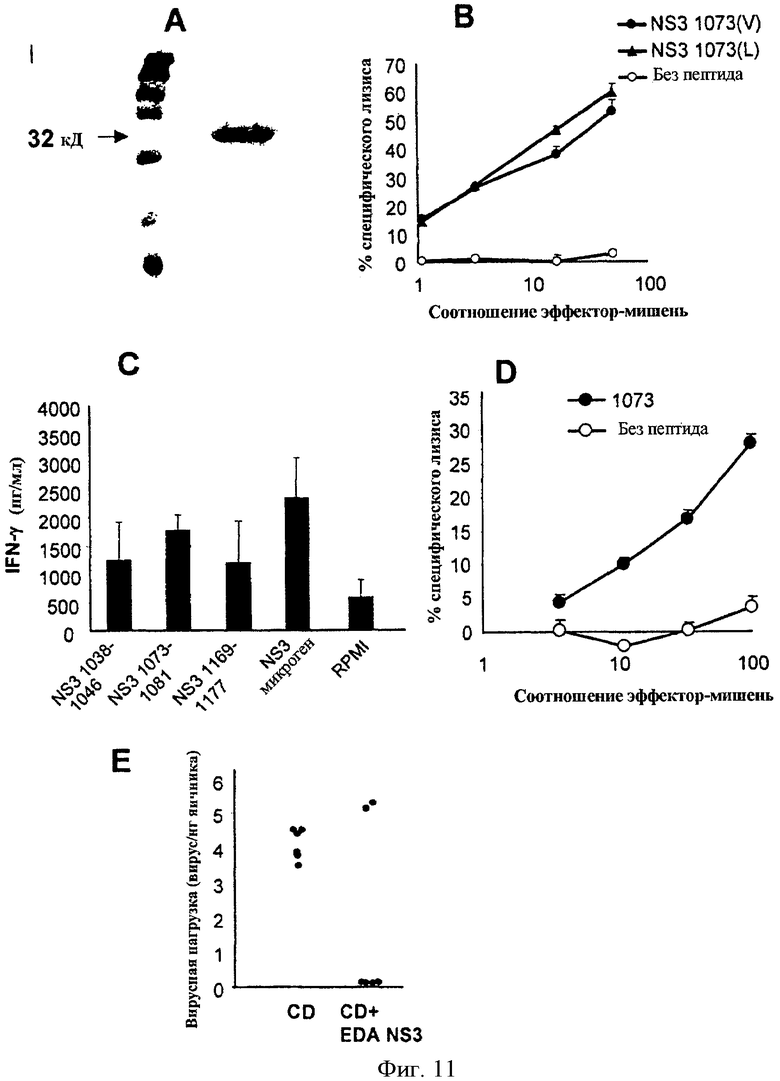
Изобретение относится к области медицины и касается агентов и способов, основанных на применении домена EDA фибронектина. Сущность изобретения включает применение полипептида, включающего аминокислотную последовательность домена EDA фибронектина, или его фрагмента, способного к связыванию TLR4, или варианта указанного домена для производства фармацевтической композиции, стимулирующей антиген-специфический иммунный ответ. Преимущество изобретения заключается в повышении стимулирующей способности. 9 н. и 27 з.п. ф-лы, 11 ил.
1. Применение полипептида, включающего аминокислотную последовательность, выбранную среди:
a) домена EDA фибронектина (EDA), способного к связыванию TLR4, или
b) фрагмента указанного домена EDA, способного к связыванию TLR4, или
c) варианта указанного домена EDA или фрагмента, способного к связыванию TLR4 и с более чем 70%-ной гомологичностью с любой из природных форм или фрагментов домена EDA,
для производства фармацевтической композиции, стимулирующей антигенспецифический иммунный ответ.
2. Применение полипептида по п.1 для производства фармацевтической композиции, стимулирующей антигенспецифический иммунный ответ для лечения и профилактики инфекционной, опухолевой и аллергической болезни.
3. Применение полипептида по п.2, отличающееся тем, что указанная фармацевтическая композиция предназначена для лечения и профилактики инфекционной болезни.
4. Применение полипептида по п.3, отличающееся тем, что указанная фармацевтическая композиция предназначена для лечения и профилактики гепатита С.
5. Применение полипептида по п.2, отличающееся тем, что указанная фармацевтическая композиция предназначена для лечения и профилактики опухолевой болезни.
6. Применение полипептида по п.2, отличающееся тем, что указанная фармацевтическая композиция предназначена для лечения и профилактики аллергической болезни.
7. Применение полипептида по п.1, отличающееся тем, что фрагмент, соответствующий домену EDA, включает последовательность, выбранную из:
a) аминокислот 2-91 из SEQ. ID. NO: 2;
b) SEQ. ID. NO: 4 и
c) фрагмента последовательностей а) и b), способного к связыванию с TLR4 экспрессирующими клетками.
8. Применение полипептида по п.1, отличающееся тем, что фрагмент, соответствующий области EDA, включает последовательность, выбранную из:
a) аминокислот 2-57 из SEQ. ID. NO: 6;
b) SEQ. ID. NO: 8 и
c) фрагмента последовательностей а) и b), способного к связыванию с TLR4 экспрессирующими клетками.
9. Применение полипептида по п.1, отличающееся тем, что указанная фармацевтическая композиция дополнительно включает одну или несколько рассматриваемых молекул, выбранных из антигена, эпитопа и аллергена.
10. Применение полипептида по п.9, отличающееся тем, что указанный полипептид связан с указанной рассматриваемой молекулой.
11. Применение полипептида по п.9, отличающееся тем, что указанный антиген является вирусным антигеном.
12. Применение полипептида по п.9, отличающееся тем, что указанный антиген представляет собой вирусный антиген из вируса гепатита С.
13. Применение полипептида по п.9, отличающееся тем, что антиген выбирается из опухолевого антигена и опухолевой антигенной детерминанты.
14. Применение полипептида по п.9, отличающееся тем, что указанная рассматриваемая молекула представляет собой аллерген.
15. Белковый вектор, способный связывать рецептор TLR4 и обеспечивающий молекулярную транслокацию в клетки, экспрессирующие рецептор TLR4, отличающийся тем, что он включает полипептид, аминокислотная последовательность которого выбрана из:
a) домена EDA фибронектина (EDA),
b) фрагмента указанного домена EDA, способного к связыванию TLR4, или
c) варианта указанного домена EDA или его фрагмента, способного к связыванию TLR4 и с более чем 70%-ной гомологичностью с любой из природных форм или фрагментов указанного домена EDA;
связан с рассматриваемой молекулой, выбранной из: антигена, эпитопа и аллергена.
16. Белковый вектор по п.15, отличающийся тем, что указанная рассматриваемая молекула является вирусным антигеном.
17. Белковый вектор по п.16, отличающийся тем, что указанная рассматриваемая молекула представляет собой вирусный антиген из вируса гепатита С.
18. Белковый вектор по п.17, отличающийся тем, что указанный вирусный антиген из вирусов гепатита С представляет собой белок NS3 или антигенный фрагмент указанного белка.
19. Белковый вектор по п.18, отличающийся тем, что указанная аминокислотная последовательность представляет собой SEQ ID NO: 10.
20. Белковый вектор по п.15, отличающийся тем, что указанная рассматриваемая молекула является опухолевым антигеном и опухолевой антигенной детерминантой.
21. Белковый вектор по п.15, отличающийся тем, что указанная рассматриваемая молекула представляет собой аллерген.
22. Белковый вектор по п.15, отличающийся тем, что он включает аминокислотную последовательность, выбранную из аминокислот 2-91 SEQ ID NO: 2 или аминокислот 2-57 SEQ ID NO: 6.
23. Модифицированная нуклеиновая кислота, отличающаяся тем, что она кодирует белковый вектор, определенный в любом из пп.15-22.
24. Модифицированная нуклеиновая кислота по п.23, отличающаяся тем, что она также включает функционально связанную контрольную последовательность, регулирующую экспрессию белкового вектора.
25. Модифицированная нуклеиновая кислота по п.23, отличающаяся тем, что она включает SEQ. ID. NO: 1 или SEQ. ID. NO: 5.
26. Модифицированная нуклеиновая кислота по п.23, отличающаяся тем, что она включает SEQ. ID. NO: 9.
27. Вектор экспрессии для генной экспрессии белкового вектора, определенного в любом из пп.15-22, отличающийся тем, что указанный вектор экспрессии включает модифицированную нуклеиновую кислоту, определенную в любом из пп.23-26.
28. Вектор экспрессии по п.27, отличающийся тем, что указанный вектор представляет собой вирусный вектор.
29. Клетка-хозяин экспрессии, отличающаяся тем, что она включает модифицированную нуклеиновую кислоту, определенную в любом из пп.23-26, или вектор экспрессии, определенный в пп.27 и 28.
30. Клетка-хозяин экспрессии по п.29, отличающаяся тем, что указанная клетка-хозяин экспрессии представляет собой Escherichia coli.
31. Способ для получения белкового вектора, определенного в любом из пп.15-22, отличающийся тем, что он включает культивирование клетки-хозяина экспрессии, определенной в п.29 или 30, при условиях, позволяющих производство указанного белкового вектора и его извлечение.
32. Применение модифицированной нуклеиновой кислоты, определенной в любом из пп.23-26, вектора экспрессии, определенного в пп.27 и 28, или клетки-хозяина, определенной в п.29 или 30, для получения фармацевтической композиции, стимулирующей антигенспецифический иммунный ответ, для лечения и профилактики инфекционной, опухолевой и аллергической болезни.
33. Фармацевтическая композиция, способная стимулировать антигенспецифический иммунный ответ, отличающаяся тем, что она включает по крайней мере один приемлемый фармацевтический носитель и по крайней мере один из следующих компонентов:
i) белковый вектор, определенный в любом из пп.15-22;
ii) модифицированную нуклеиновую кислоту, определенную в любом из пп.23-26;
iii) вектор экспрессии, включающий указанную модифицированную нуклеиновую кислоту, определенный в п.27 или 28; или
iv) клетку-хозяина экспрессии, также включающую указанную модифицированную нуклеиновую кислоту, определенную в п.29 или 30.
34. Фармацевтическая композиция, способная стимулировать антигенспецифический иммунный ответ, отличающаяся тем, что она включает количество дендритных клеток, в которой указанные дендритные клетки были инкубированы in vitro с по крайней мере одним из следующих компонентов:
i) белковым вектором, определенным в любом из пп.15-22;
ii) нуклеиновой кислотой, определенной в любом из пп.23-26; или iii)
вектором экспрессии, включающим указанную модифицированную нуклеиновую кислоту, определенную в пп.27 и 28.
35. Фармацевтическая композиция по п.33, отличающаяся тем, что композиция является вакциной или иммунотерапевтической композицией.
36. Фармацевтическая композиция по п.34, отличающаяся тем, что композиция является вакциной или иммунотерапевтической композицией.
| PAOLELLA G | |||
| et al | |||
| Sequence analisis and in vivo expression show that alternative splicing of ED-B and Ed-A regions of the human fibronectin gene are independent events | |||
| Nucleic Acids Research, 1988, v.16, №8, pp.3545-3557 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Криогенный резервуар | 1981 |
|
SU1188446A1 |
Авторы
Даты
2011-10-10—Публикация
2006-06-13—Подача