Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу извлечения полимерного хитозана из раствора. Изобретение далее относится к композициям, полученным по способу согласно изобретению, включающим биологически активные хитиновые полимеры и олигомеры, и их применению в фармацевтических композициях, композициях биоматериалов, медицинских приспособлениях и к процессам для получения упомянутых полимеров и олигомеров.
Уровень техники
Хитозан является биополимером природного происхождения, производным хитина, который получают из панциря ракообразных, но его можно также получать из других беспозвоночных и из грибов. Хитозан получают путем деацетилирования остатков N-ацетилглюкозамина хитинового полимера, обычно путем гидролиза N-ацетильных связей концентрированной щелочью. По определению, хитозан обычно описывают как сополимер D-глюкозамина (D) и N-ацетил-D-глюкозамина (А), который нерастворим в воде при рН выше 6,2 - изоэлектрической точки свободной аминогруппы - но растворяется при рН ниже приблизительно 6,2. Обычно 70-100% мономерных единиц в распространенном сополимере хитозана являются D-глюкозамином, что можно описать как 70-100% деацетилированный хитозан со степенью деацетилирования 70-100%. Когда степень деацетилирования ниже приблизительно 70%, полимер хитозана проявляет другие свойства растворимости, увеличенную биологическую активность и, в основном, повышенную способность к биологической деградации.
На химические и биологические свойства хитозана прямо влияет степень деацетилирования (СД) и степень полимеризации (СП), т.е. длина цепи полимера. В растворе при рН ниже 6,2, когда аминогруппы остатков D-глюкозамина протонированы, хитозан является положительно заряженным полимером. Будучи амином, хитозан является слабым основанием и может образовывать соли с кислотами, например с карбоновыми и минеральными кислотами. Большинство таких солей являются водорастворимыми. В своей природной форме хитин нерастворим в воде. Однако его можно сделать водорастворимым путем частичного деацетилирования с помощью щелочной обработки. Частично деацетилированный хитин с СД 35-50% растворим в воде в широком интервале рН. Показано, что эта форма частично деацетилированного хитина является биологически активной с потенциальными применениями в различных областях, например в биомедицине, фармакологии, косметике и т.д.
Одним из недостатков препаратов хитозана с СД более 60-70% является их тенденция к выпадению в осадок при рН выше 6,2. Это ограничивает спектр его применения, когда требуется растворимость при нейтральных или высоких рН. В этой связи частично деацетилированный хитин обладает большими преимуществами по сравнению с хитозаном с более высокой СД, поскольку его профиль растворимости покрывает более широкий интервал рН. Он сохранят большую часть физико-химических свойств хитозана и обладает более высокой емкостью удержания воды по сравнению с обычным хитозаном, что приводит к быстрому набуханию при контакте водой, и обладает уравновешенными гидрофильно-гидрофобными свойствами по сравнению с обычным хитозаном с более высокой СД. Эти свойства предоставляют огромные возможности для различных применений в биомедицинской, фармацевтической, косметической и других связанным с ними областях промышленности.
Биологическая активность хитина и хитозана широко документирована в литературе, и растущее число свидетельств указывает на то, что биологическая активность возрастает с понижением СД. Это идет рука об руку со свойствами улучшенной растворимости при физиологических рН.
Очистка хитозана обычно включает процесс растворения, чтобы удалить нерастворимые вещества или загрязнения из раствора. За этим следует процесс выделения (извлечения) путем осаждения хитозана из раствора. Полученный в виде осадка хитозан можно затем промыть для нейтрализации рН и для удаления соли. Такое выделение обычно не является проблемой для хитозана с СД 55% и выше, поскольку его легко осадить путем увеличения рН раствора выше 6,2. Однако подведение рН не является эффективным для частично деацетилированного хитина, обычно требуется органический растворитель для содействия процессу осаждения. Патент № CN 1554267 представляет применение этанола для промывки полимера, и еще примеры по применению растворителей можно найти в патентах JP 10072502, CN 1371922 и т.д. Дополнительно, согласно менее адекватному способу, раствор просто фильтруют и высушивают, так что в продукте присутствует соль (JP 2022301).
Показано, что хитозан является биосовместимым (биологически совместимым) и биодеградируемым (биологически деградируемым), что делает его привлекательным кандидатом в качестве ингредиента в биоматериалах для биоинженерных применений. Биоматериалы обычно определяют как синтетические материалы, применяемые для замещения части живой системы или для работы в тесном контакте с живыми тканями, и хитозан обычно считается подходящим инертным компонентом в формуляциях биоматериалов или в качестве матрицы для других веществ или ингредиентов. Хитозан предложен в качестве носителя для доставки лекарств, поскольку он может иммобилизовать большое количество биологически активных веществ путем адсорбции или путем ковалентного связывания таких веществ с помощью простых химических реакций.
WO 2004/028578 раскрывает композицию для образования и отвердевания кости при наращивании кости, включающую хитозан, триполифосфат и костный морфогенный белок (КМБ). Далее, US 2003/0124172 раскрывает способ получения основанных на хитозане пленок, включающих биодеградируемый полимер и КМБ для ускорения остеоинтеграции зубных протезов или в травматических случаях.
На биологическую активность материалов производных хитина указано, например, в ЕР 1435976, который раскрывает композиции хитоолигомеров, включающие гетероолигомеры N-ацетилглюкозамина и глюкозамина, являющиеся биологически активными, которые предложены в качестве активных ингредиентов медикаментов для лечения (патологических) состояний соединительной ткани, в частности артрита и остеоартрита.
В другом патентном приложении предполагается, что хитиназоподобные белки (XПБ), экспрессируемые геномом человека и других позвоночных, представляют рецепторы мишени, вовлеченные в биологическую активность этих хитоолигомеров, индуцирующие сигнальный ответ при связывании с хитоолигомерами. Такие хитиназоподобные белки происходят из семейства генов, экспрессирующих хитиназы семейства 18 у большинства форм живых организмов. Активный участок хитиназ семейства 18 хорошо сохранился у ХПБ за исключением того, что большинство этих белков утратили свою каталитическую активность из-за ключевой мутации в активном участке. Однако у человека, по меньшей мере, два из этих белков поддерживают хитолитическую активность, например уксусная хитиназа млекопитающих и хитотриозидаза.
Раскрытие изобретения
Объектом настоящего изобретения является предоставление способов и композиций высокоочищенного частично деацетилированного хитина для терапевтических применений. При глубоком гидролизе с помощью хитиназы семейства 18 in vitro или in vivo частично деацетилированные полимерные композиции образуют хитиновые гетерополисахариды с терапевтической активностью. В этой связи изобретение предоставляет две формы композиций, полимерные композиции, по существу очищенные от органических загрязнений, таких как бактериальные эндотоксины, подходящие в качестве активных ингредиентов для биоматериалов для применений с имплантатами, и олигомерные композиции, подходящие для системного применения. Такие полимерные и олигомерные композиции, далее называемые «хитобиомерами», обладают биологически релевантными свойствами, которые четко отличают их от обычных материалов, полученных из хитозана и хитина, ранее известных в данной области техники. Далее, олигомерные композиции, предоставленные настоящим изобретением, представляют оптимизацию терапевтической активности целых композиций хитобиомеров, включая биодоступность, биостабильность и биоактивность. Такие олигомерные композиции здесь называются «терапевтическими хитоолигосахаридами» (Т-ХОС). Полимерные композиции предоставляют превосходную систему доставки in situ, поскольку эндогенные хитиназы семейства 18, специфически экспрессируемые местными макрофагами, постепенно деградируют полимерный субстрат in situ, генерируя терапевтически активные Т-ХОС способные предотвращать образование рубцовой ткани и индуцирующие регенерацию ткани в поврежденных хрящевых или костных тканях. Это включает уменьшение или ингибирование активности фибробластов в поврежденной ткани с помощью Т-ХОС композиций параллельно с активацией тканеспецифичных хрящевых или костных клеток предшественников. Олигомерные композиции, однако, можно также получать in vitro на промышленной основе путем глубокого гидролиза композиций полимерных хитобиомеров с помощью хитиназы семейства 18, получая Т-ХОС для любого рода системной доставки, например орального, внутримышечного, подкожного или внутривенного применения, или местной доставки в составе композиции имплантата.
В первом аспекте настоящего изобретения предоставлена оптимизация процесса производства частично деацетилированного хитинового гетерополимера (хитобиомеров) с терапевтической активностью. Оптимизация включает способ очистки полностью растворенного частично деацетилированного полимера хитина, где способ включает этапы а) нейтрализации частично деацетилированного хитина после деацетилирования; б) растворения частично деацетилированного хитина в кислом растворе; в) удаления нерастворившихся частиц с помощью последовательных этапов фильтрации; г) доведения рН раствора до величины выше 8 и д) осаждения растворенного частично деацетилированного хитина путем увеличения хаотропного фактора в растворе за счет повышения температуры и добавления соли. Способ отличается отделением осадка после осаждения путем просеивания или центрифугирования, где температура осадка выше 50°С. Такая оптимизация в особенности достигается путем фокусировании на продуктах гидролиза, полученных при глубоком гидролизе полимерных хитобиомеров с помощью хитиназы семейства 18. Субстрат деградируют до гетероолигомеров, обладающих значительной устойчивостью ко всем хитиназам семейства 18. Путем точного контроля этапа деацетилирования в данном процессе как в плане гомогенности, так и степени деацетилирования можно контролировать относительный выход Т-ХОС композиций, образуемых во время этапа гидролиза. Это предоставляет оптимизацию терапевтической активности композиций хитобиомера. Определенные полимерные композиции хитобиомера находятся в интервал степени деацетилирования 30-70%, демонстрируя свойства растворимости, существенно отличные от таковых у обычного хитозана. Благодаря этому определению вся композиция хитобиомера проявляет растворимость при физиологическом рН.
Во втором аспекте настоящего изобретения представлена композиция частично деацетилированного хитина, которую получают согласно способу по изобретению. В воплощении этого изобретения представлена композиция, включающая биологически активные хитоолигомеры N-ацетил-D-глюкозамина (А) и глюкозамина (D). Композиция хитоолигомеров должна удовлетворять следующим критериям (а-г):
а) упомянутые олигомеры обладают длиной цепи в интервале 5-20 мономерных остатков,
б) каждая олигомерная цепь может иметь два остатка N-ацетил-D-глюкозамина (АА) на любом или на обоих концах олигомерной цепи,
в) остающаяся внутренняя часть олигомера включает максимальное количество А остатков,
г) последовательность упомянутой внутренней части цепи такова, что остаток N-ацетил-D-глюкозамина (А) не соседствует с другим остатком N-ацетил-D-глюкозамина (А) (например, АА).
В третьем аспекте настоящего изобретения предоставлено применение композиций согласно изобретению для производства биоматериалов/медикаментов.
В четвертом аспекте настоящего изобретения предоставлена фармацевтическая композиция, включающая олигомерные композиции хитобиомера, полученная согласно способу настоящего изобретения.
В дальнейшем аспекте настоящего изобретения полимерные композиции хитобиомеров применяются для модуляции активности воды в композите из фосфата кальция. Полимерные композиции с хитобиомерами ограничивают размеры кристаллов, образуемых во время нанесения и отвердения композита, и вместе с деградацией хитобиомеров с помощью хитиназы семейства 18, экспрессируемой на месте макрофагами; это усиливает способность композиции к биодеградации и помогает мигрирующим клеткам проникать в каркас, увеличивая остеокондуктивность.
Осуществление изобретения
Воплощения и определения, приведенные ниже, относятся к способам и композициям и применениям настоящего изобретения.
В одном воплощении настоящего изобретения степень деацетилирования (СД) частично деацетилированного хитинового полимера находится между 25 и 70%, например между 30 и 65%, например между 30 и 60%, например между 30 и 55%, где СД относится к среднему значению СД растворимой фракции частично деацетилированного хитина, и молекулярный вес такого хитобиомера выше приблизительно 10 кДа.
В настоящем контексте термин «нейтрализация» по отношению к смеси частично деацетилированного хитина после деацетилирования относится к понижению рН сильнощелочного раствора в процессе деацетилирования с помощью промывки водой или с помощью добавления сильной кислоты.
В одном воплощении настоящего изобретения нагревание раствора частично деацетилированного хитина включает повышение температуры до 45-100°С или даже кипячение, например до 55-90°С, например до 60-80°С или предпочтительно между 60 и 70°С.
В одном воплощении настоящего изобретения доведение раствора частично деацетилированного хитина включает повышение рН до рН 8-13, например до рН 9-12 или до 10-11.
В одном воплощении настоящего изобретения высаливание получают путем добавления соли или путем нейтрализации находящейся в растворе кислоты, где солью, применяемой для солевого осаждения, является хлористый натрий или соль любой органической кислоты, применяемой для растворения частично деацетилированного хитина, например уксусной кислоты или предпочтительно ди- или трикарбоновых кислот, например яблочной кислоты или лимонной кислоты. Эти соли можно получать путем нейтрализации раствора подходящим основанием. Далее, концентрация соли относится к любой концентрации, которая может привести к осаждению полимера, где концентрация соли находится между 2% и насыщением.
В одном воплощении настоящего изобретения хитин обрабатывают минеральной кислотой перед этапом деацетилирования для получения продукта с очень низким уровнем эндотоксина, например между 1 и 60 ФЕ/г или ниже 30 ФЕ/г. Кислота раскрывает полимер, делает доступными и разрушает эндотоксины. Любая концентрированная кислота, которая приводит к растворению хитинового полимера, например соляная, фосфорная, азотная, серная, может применяться. Результаты по содержанию эндотоксина выражены в ферментативных единицах (ФЕ) как ФЕ/мл или ФЕ/г.
В другом воплощении настоящего изобретения процессы применяют для изготовления биоматериалов/медикаментов для ускорения регенерации костей и гемостаза при заживлении переломов или тяжелого костного повреждения у млекопитающих. Такой медикамент ускоряет образование кости путем эндохондрального окостенения за счет активации тканеспецифичных клеток предшественников.
В одном воплощении настоящего изобретения биоматериал включает дополнительный компонент, выбранный из группы, включающей фосфаты кальция, включая гидроксиапатит, сульфат кальция, триполифосфат натрия, алгинат, коллаген и гиалуроновую кислоту.
Биодоступность, или способность данного вещества проникать через биологические мембраны, связана с гидрофобностью молекул. Поскольку все биологические мембраны обладают в основном гидрофобной природой, основное правило гласит, что чем более гидрофобным является вещество, тем лучше оно проникает через такие биологические мембраны. N-ацетилглюкозамин и полностью ацетилированные олигомеры хитина являются более гидрофобными, чем соответствующий мономер глюкозамина или высокодеацетилированные олигомеры хитозана, что позволяет предполагать, что гетероолигомеры хитина будут обладать повышенной биодоступностью при повышении ацетилирования. Таким образом, составы Т-ХОС оптимизированы так, чтобы содержать максимальное количество N-ацетилглюкозамина в своей молекулярной структуре, чтобы максимально увеличить их биодоступность, не угрожая их биостабильности. Данное изобретение предоставляет уникальные данные, демонстрирующие повышенную биодоступность композиций Т-ХОС у людей-добровольцев.
Биостабильность органического соединения относится к его подверженности действию эндогенных ферментов в живом организме и его времени полужизни (t1/2) в этом организме. Чем больше соединение подвержено действию ферментов, тем меньше его биостабильность. У человека хитинолитические ферменты можно подразделить на две группы: ферменты с высоким уровнем хитинолитической специфичности, например хитиназы семейства 18 (АМСаза, хитотриозидаза), обладающие высокой специфической активностью, или ферменты с меньшей хитинолитической специфичностью, например лизоцим и некоторые протеазы, которые, оказывается, деградируют хитин и хитозан, но с очень низкой специфической активностью. Путем частичного деацетилирования композиции с Т-ХОС оптимизированы для максимальной стабильности по отношению к гидролизу хитиназой семейства 18. Поскольку эти ферменты требуют последовательности из двух ли более следующих друг за другом остатков N-ацетилглюкозамина в качестве участка узнавания для расщепления, композиции с Т-ХОС специфически оптимизируют, чтобы исключить такие последовательности из внутренней части молекулы.
Биоактивность органического вещества или лиганда прямо связана со сродством лиганда к рецептору мишени, запускающему биологический ответ.Мало известно о биологической роли хитиновых соединений в организме человека, хотя есть указания на то, что олигомеры хитина играют жизненную роль в эмбриональном развитии. Это предполагает, что геном человека способен экспрессировать специфические рецепторы, которые специфически активируются при связывании олигомеров хитина. Единственными известными связывающими хитин белками в организме человека являются хитиназоподобные белки (ХПБ), генетически относящиеся к хитиназам семейства 18, но большинство из них утратили свою ферментативную активность.
Связывающие хитин домены этих белков хорошо сохранились и отличаются от активных участков хитиназ семейства 18 только одной или несколькими аминокислотами. Связывание полностью деацетилированных хитиновых олигосахаридов с активным участком белка обычно индуцирует конформационное изменение структуры белка, указывающее на сигнальную роль взаимодействия. Настоящее изобретение представляет данные, демонстрирующие, что связывающий участок одного из хитиназоподобных белков (YKL-40 или ХЧ-гп-39) обладает почти таким же сильным сродством (90%) к композициям частично деацетилированного Т-ХОС, как и к полностью ацетилированными олигосахаридам. Хитиназы семейства 18 являются высокоактивными по отношению к хитиновым субстратам и требуют присутствия соседних N-ацетильных групп в качестве участка узнавания для гидролиза, где одна из ацетильных групп принимает активное участие в реакции гидролиза в качестве донора протона. Это предполагает, что олигомеры хитина, которые полностью ацетилированы, будут быстро разрушены в организме человека (обладают плохой биостабильностью), особенно в связи с тем, что хитиновые структуры, по-видимому, индуцируют экспрессию соответствующих хитиназ семейства 18. Однако частичное деацетилирование олигомера хитина увеличит биостабильность, особенно если частичное деацетилирование приводит к последовательностям, где нет соседних ацетильных групп внутри олигомера. Это привело бы к молекуле, которая не могла бы расщепляться специфическими хитинолитическими ферментами вроде хитиназ семейства 18, а только медленно деградировала бы с помощью менее специализированных ферментов, способных расщеплять хитин, а также хитозан, но со значительно более низкой специфической активностью. Это предполагает, что композиции Т-ХОС обладают биодоступностью, биостабильностью и биоактивностью, требуемыми для терапевтической активности.
В костном имплантате полимерные хитобиомеры постепенно гидролизуются с помощью выделяемых макрофагами хитиназ семейства 18, образуя большую фракцию композиций с Т-ХОС. Такие хорошо растворимые олигомеры будут диффундировать сквозь композит и соседние ткани, действуя как факторы хемотаксиса или стимуляторы по отношению к макрофагам, а также клеткам предшественникам хрящевой и костной ткани, находящимся в костном мозге, а также в эндосте и надкостнице. Это придает остеоиндуктивность композиту костного имплантата.
Композиции согласно настоящему изобретению, включающие терапевтические хитоолигомеры и их полимерные предшественники (все вместе называемые хитобиомерами), получают с помощью процесса, который основан на нескольких ключевых этапах, которые критическим образом влияют на композицию и свойства получаемых материалов, например на растворимость и чистоту. Для максимальной чистоты при необходимости предоставлен этап предварительной обработки, где хитин из подходящего источника в значительной степени растворяют в подходящем растворе кислоты, предпочтительно, минеральной кислоты, например соляной (HCl), хотя также можно применять другие кислоты, включая карбоновые кислоты или минеральные кислоты, например серную кислоту, фосфорную кислоту или азотную кислоту. При применении соляной кислоты ее концентрация обычно составляет приблизительно 15-37% (мас./мас.), например 25% или выше, концентрацию других кислот подбирают так, чтобы получить сходные результаты. В одном воплощении растворенный в кислоте хитин обрабатывают окислителем, предпочтительно, перекисью водорода, хотя можно также применять другие окислители, например перекиси щелочных металлов, щелочные земли или пербораты щелочных металлов, перкарбонаты, пероксимоносульфаты, персульфаты, броматы, гипогалиты и дигалотразинетрионы. Кислотное растворение хитина раскрывает его кристаллическую структуру и делает доступными молекулы эндотоксина, погруженные в материал, разрешая эффективную экстракцию и деградацию загрязнений эндотоксина. Обработка окислителем при необходимости предназначена для содействия деградации молекул эндотоксина и таким образом дальнейшего уменьшения содержание эндотоксина в конечном продукте. Некоторая фрагментация цепи полимера произойдет на этом этапе процесса. Раствор по большей части растворенного хитина предпочтительно быстро разводят и в основном нейтрализуют достаточно очищенной водой или водным раствором щелочи, например, вливая раствор в значительной степени растворенного хитина в большой объем нейтрализующего водного раствора, так что значительная часть хитинового материала выпадает в осадок в виде аморфного коллоидного хитина. Вода обычно находится при повышенной температуре, например, в интервале 40-100°С, например в интервале 50-100°С, например в интервале 50-80°С. Температура влияет на компактность и затвердевание коллоидного хитина. После промывки (предпочтительно, ряда последовательных промывок) достаточно очищенной водой коллоидный хитин готов для деацетилирования.
В одном воплощении настоящего изобретения частично деацетилированный хитин и/или хитозан со степенью деацетилирования 30-100% СД смешивают с композитами фосфата кальция для того, чтобы регулировать физико-химические, механические и биологические свойства конечного композита. Этот способ предоставлен для контроля механических и биологических свойств композита из фосфата кальция путем смешивания хитобиомеров или хитозана различной степени деацетилирования с композитом. Это предоставляет мощный подход к регуляции важных свойств композита, таких как время размещения (наложения), время затвердевания, твердости и прочности, а также способности к биодеградации и доступности для мигрирующих клеток из ткани хозяина. Возможность регулировать эти основные свойства состоит в резком уменьшении емкости удержания воды у деацетилированных производных хитина при увеличении степени деацетилирования от 30 до 100% СД, т.е. чем меньше СД, тем больше емкость удержания воды. Поскольку кристаллизация фосфата кальция включает взаимодействие с водой, доступность воды в композите повлияет на образование кристаллов. Чем больше воды удерживается частично деацетилированным хитином, тем мельче кристаллы в композите. Это, в свою очередь, повлияет на механические свойства и способность композита к биодеградации. Чем ниже степень деацетилирования (СД) хитобиомера, тем легче фагоцитам, например макрофагам, захватить матрицу композита, открывая новые поры для других мигрирующих клеток, например клеток-предшественников хрящевой и костной ткани, а также васкулярных эндотелиальных клеток. Это является принципиальным свойством, поскольку это ускорит реконструкцию композита в здоровую работающую ткань. Путем оптимизации хитобиомера в процессе деацетилирования возможно увеличить выход Т-ХОС, образованных во время реконструкции композита, предоставляя эффективную стимуляцию эндохондральной регенерации кости в области костного повреждения.
Таким образом, сделано заключение, что путем точного контроля степени деацетилирования частично деацетилированного хитина, применяемого в композите, возможно оптимизировать остеокондуктивность, а также остеоиндуктивность композита.
Деацетилирование обычно проводят с сырым хитиновым материалом, растворенным в щелочной основной реакционной среде. Эта щелочная основная среда обычно является гидроокисью натрия, хотя другие основания также подходят, включая гидроокись калия, гидроокись лития, гидроокись кальция, фосфат натрия и аммиак. Соотношение сухого материала и щелочи может в некоторых воплощениях находиться в интервале от 1:5 до 1:100. Основной раствор обычно охлаждают перед смешиванием. Обнаружено, что путем замораживания и последующего оттаивания смеси щелочи с хитином и инкубации для деацетилирования можно существенно повысить гомогенность деацетилирования. Температуру инкубации в процессе деацетилирования можно, однако, поддерживать в относительно широком интервале значений 0-100°С, и время инкубации подбирают соответственно (более низкие температуры деацетилирования требуют более длительных времен инкубации и наоборот). В некоторых воплощениях деацетилирование проводят при температуре в интервале 5-50°С, более предпочтительно в интервале 10-40°С или в интервале 20-50°С, например в интервале 10-30°С, или в интервале 10-25°С, и более предпочтительно в интервале 12-25°С, например в интервале 15-25°С. Частично деацетилированный хитин осаждают в достаточно очищенной воде, предпочтительно при повышенной температуре, например в интервале приблизительно 30-80°С, включая интервал приблизительно 35-65°С, например интервал приблизительно 45-60°С или 40-50°С, и последовательно промывают такой очищенной водой. Как описано ранее, к раствору можно добавлять соль для дальнейшего содействия выпадению полимера в осадок. Материал можно далее промыть и высушить с помощью лиофилизации или распылительной сушки в зависимости от цели дальнейшего применения.
Описанный процесс приводит к гомогенному в значительной степени деацетилированию, что означает, что остатки N-ацетил-D-глюкозамина (А) и остатки глюкозамина (D) в полимере в основном распределены равномерно, что влияет на последующий гидролиз полимера до терапевтических хитоолигомеров. Это предлагает возможность оптимизировать выход Т-ХОС во время гидролиза с помощью хитиназы семейства 18 путем точного подбора средней степени деацетилирования частично деацетилированного хитина. Такой гидролиз может проходить до применения (например, in vitro, например, как описано ниже) или in vivo при применении полученного полимерного предшественника (хитобиомера) в качестве компонента лекарств, биоматериалов или медицинских приспособлений. Хитобиомер будет медленно гидролизоваться эндогенными ферментами, например хитотриозидазами, с получением терапевтических хитоолигомеров in situ.
Как применяется здесь, термин «хаотропный агент» означает агент, который вызывает нарушение молекулярной структуры, в частности, образованной нековалентными связями, такими как водородные связи, Ван-дер-Вальсовы взаимодействия и гидрофобные взаимодействия. Часто структурные свойства, определяемые с помощью кругового дихроизма, можно титровать зависимым от концентрации хаотропного агента образом.
Наиболее часто применяемыми хаотропными агентами являются 6-8 М мочевина и 6 М гуанидиний хлорид, где мочевина является незаряженной молекулой, а гуанидиний хлорид является солью соляной кислоты.
Высокоосновные (high generic) соли могут обладать хаотропными свойствами из-за защиты зарядов и предотвращения стабилизации солевых связей. Водородные связи сильнее в неполярной среде, так что соли, увеличивающие дипольный момент растворителя, могут также дестабилизировать водородные связи.
В настоящем контексте термин «добавление хаотропного агента, например соли» относится к добавлению соли, выбранной из следующих, но не ограничиваясь ими, гидроокиси натрия, сульфата аммония, мочевины, гуанидиний хлорида, любой соли кислоты, предпочтительно соли трикарбоновой органической кислоты (например, лимонной кислоты), далее соли дикарбоновой кислоты (например, яблочной), затем соли монокарбоновой кислоты. Соли с высокой хаотропностью.
Полученные частично деацетилированные хитобиомеры обладают определенными свойствами. Предварительное растворение хитина, образование коллоидного хитина и последующее растворение в щелочи перед деацетилированием значительно раскрывает кристаллическую структуру хитина и позволяет эффективно уменьшать уровень бактериальных эндотоксинов в материале хитина, доводя чистоту полимера до необходимой для применения в формуляциях с биоматериалом и/или в медицинских приспособлениях, предназначенных для применения с имплантатами.
Последовательности терапевтических хитоолигомеров прямо влияют на их биологическую активность, например, на то, как они переносятся через биологические мембраны (биодоступность), как быстро они разрушаются в живых системах (биостабильность) и как они взаимодействуют с хитиназоподобными белками и другими специфическими рецепторами, связывающими хитиновые последовательности (биоактивность).
Согласно механизму действия хитиназ семейства 18 узнавание участка расщепления в молекуле субстрата требует присутствия последовательности из двух или более соседних звеньев N-ацетил-D-глюкозамина (-АА-). Расщепление оставляет две ацетильные группы на восстанавливающем конце получившегося продукта, что означает, что если ферментативный гидролиз проходит полностью, у преобладающей части олигомеров на восстанавливающем конце будут два звена N-ацетил-D-глюкозамина. Это подразумевает, что терапевтический олигомер согласно изобретению с оптимальной биодоступностью, биостабильностью и биоактивностью будет частично ацетилированным хитоолигомером с максимальным ацетилированием при отсутствии двух соседних ацетильных групп во внутренней части молекулы. Постой расчет поэтому предполагает приблизительно 50% ацетилирование, когда два мономера перемежаются в молекулярной последовательности внутренней части (например, -DADADADA-). Когда такая структура взаимодействует со связывающим доменом хитиназ семейства 18, YKL-40 или любой из родственных им ХПБ, -DADADADA- структура обладает более сильным сродством к участку связывания по сравнению с преобладающей D последовательностью (например, -DDDDDD-). То же верно по отношению к биодоступности терапевтических хитоолигомеров, поскольку увеличенное ацетилирование также увеличивает гидрофобность молекулы. Настоящее изобретение предоставляет данные, демонстрирующие, что сродство связывания со связывающим доменом ХПБ возрастает с относительным числом А остатков (FA). Однако наши данные также показывают, что Т-ХОС композиции обладают по меньшей мере 90% сродства связывания, как измеряют относительно полностью ацетилированного гексамера хитина (А6).
Что касается загрязнения бактериальными эндотоксинами, материалы-производные хитина и хитозана, предназначенные для применения в имплантатах, требуют особого внимания, поскольку хитин, полученный из внешнего скелета, а также из кальмара и каракатицы, обычно содержит значительные уровни бактериальных эндотоксинов. К тому же хитозан приобретает значительное сродство к бактериальным эндотоксинам во время и после деацетилирования. Таким образом, любой процесс, предназначенный для получения в значительной степени очищенного хитозана для применения в имплантатах, требует включения специфических этапов для значительной экстракции и уменьшения бактериальных эндотоксинов в сыром материале субстрата.
Фармацевтические композиции, описанные здесь, включают терапевтические хитоолигомеры (Т-ХОС) согласно изобретению. Их можно применять системно и связывать с эндогенными ХПБ, многие из которых, как показано или предполагается, играют роль в серьезных заболеваниях и состояниях. Среди заболеваний и состояний, связанных с повышенной экспрессией ХПБ, находятся дегенеративные заболевания, такие как дегенеративные заболевания суставов, включая артриты (например, ревматоидный артрит и остеоартрит). Обнаружено, что композиции с Т-ХОС применимы для лечения и/или облегчения таких заболеваний, а также состояний, связанных с образованием костной ткани и таких состояний, как регенерация кости после хирургического вмешательства или травмы.
Композиция может еще включать фармацевтически приемлемый наполнитель, например вспомогательные или стабилизирующие агенты, растворители, ароматизаторы или красящие вещества или подходящие дополнительные биологически активные или неактивные ингредиенты.
Фармацевтическая композиция предпочтительно находится в форме, подходящей для орального применения, например в сухой форме, которая легко растворяется, например, в стакане воды. Такие формы включают сухой порошок, суспензию, гель, пленку, пену, соли, аэрозоль, гранулярную, хлопьевидную, волокнистую и пастообразную формы. Однако композиция может также содержаться в пилюлях или капсулах. Фармацевтические композиции могут далее включать фармацевтически приемлемый наполнитель.
В других применимых воплощениях композиция согласно изобретению находится в форме, подходящей для других форм системного применения, например внутримышечного, подкожного или внутривенного применения. Такие подходящие формы находятся в виде раствора с фармацевтически приемлемым носителем или наполнителем согласно стандартной фармацевтической практике. Упомянутые формы растворов являются стерильными, и их рН соответствующим образом доведен и забуферен. Для внутривенного применения общую концентрацию растворенных веществ следует контролировать, чтобы сделать препарат изотоничным.
Т-ХОС согласно изобретению можно по общепринятому способу предоставлять в практически сухой форме, включающей порошок, хлопья или волокнистый материал, который можно доставлять в капсулах, или таблетках, или растворенным, или в виде суспензии в водном растворе для заглатывания. Такая композиция может в основном состоять только из вышеупомянутых терапевтических олигомеров, например в интервале 80-100 весовых % хитоолигомеров. В применимых воплощениях композиция включает упомянутые Т-ХОС в интервале 20-100% по весу, включая приблизительно 25-95% по весу, например 50-90% по весу.
Оральное применение Т-ХОС согласно изобретению требует того, чтобы молекулярная структура Т-ХОС удовлетворяла нескольким требованиям; обладала адекватной биодоступностью, например количественно переносилась через биологические мембраны в желудочно-кишечном тракте, обладала адекватной биостабильностью, чтобы пережить начальную деградацию в желудочно-кишечном тракте, и эффективно распределялась в жидкостях организма до того, как будет разрушена и выведена из системы, и наконец они должны обладать необходимой биоактивностью посредством связывания с рецепторами мишени. Удовлетворение этих требований нуждается в компромиссе, когда некоторые или все критерии выполняются на субоптимальном уровне. Это требует глобального (всеобъемлющего) взгляда на концепцию оптимизации продукта для того, чтобы получить лучшую из возможных композицию, способную преодолеть барьеры абсорбции и биодеградацию обеспечивая то, что Т-ХОС достигают и взаимодействуют с рецепторами мишени.
В настоящем контексте термин «медицинское устройство» относится к прибору, аппарату, оборудованию/инвентарю, механизму, устройству, имплантату, in vitro реагенту или другим сходным или связанным с ними предметам, включая часть компонента или принадлежность, которые предназначены для применения в диагностике заболевания или других состояний, или для лечения, облегчения или предотвращения заболевания у человека или других животных, или предназначены для воздействия на структуру или какую-либо функцию организма человека или других животных. В этом контексте термин «биоматериальные продукт» применяется взаимозаменяемо с термином «медицинское устройство».
Хитобиомеры (полимеры и олигомеры) согласно изобретению особенно применимы в биоматериалах для различных целей. Помимо проявления всех преимуществ обычного хитозана (биосовместимости, способности смешиваться с другими компонентами для получения нужных смесей для медицинских приспособлений, например, механических имплантатов, приспособлений для доставки лекарств и т.д.), они обладают значительно повышенной растворимостью и биологической терапевтической активностью благодаря их высокому сродству с ХПБ в организме, как описано выше.
Составы биоматериалов могут соответственно включать другие органические и неорганические компоненты, например различные биополимеры (алгинаты и другие полисахариды и т.д.), коллаген, фосфаты кальция, включая гидроксилапатит, сульфат кальция, триполифосфат натрия, фосфат натрия однозамещенный, глицерофосфат натрия, окись кальция, гидроокись кальция и разные органические или карбоновые кислоты и т.д.
Биоматериалы согласно изобретению применяют в различных медицинских приспособлениях, которые используют преимущества свойств хитобиомеров, включающих композиции с биоматериалами.
В регенерации костной и других тканей есть два основных типа костей: трабекулярная (губчатая) кость и кортикальный слой. Трабекулярная кость является губчатой и образует внутреннюю часть большинства костей, включая позвоночник, тогда как кортикальный слой является плотным и образует поверхность костей. Трабекулярная сеть перегородок поддерживает кроветворные элементы в кости.
Термин «внутримембранное окостенение» относится к процессу образования новой кости, которая происходит из клеток-предшественников костной ткани, которые под действием необходимого сигнала запуска дифференцируются прямо в новую кость. Этот путь окостенения имеет место на стадиях эмбриогенеза, особенно при росте плоских костей, например костей свода черепа.
Термин «эндохондральное окостенение» относится к процессу образования кости, где вначале развивается хрящ, образуя остов будущей кости. Хрящевая ткань нуждается в меньшем местном давлении кислорода для своего образования и поддержания, чем зрелая костная ткань, и поэтому там, где система кровоснабжения не достигла своей конечной стадии развития, хрящевая ткань преобладает над костной. Хрящ замещается новой костью только после того, как васкуляризация достигла развитого состояния, гарантирующего требуемую доставку кислорода к развивающимся тканям. Такой процесс образования кости также обычно происходит во время эмбриогенеза, в частности в позвоночнике, длинных костях, грудине и т.д.
ПРИМЕРЫ
Пример 1. Получение высокоочищенного частично деацетилированного полимера хитина (хитобиомера)
1.1 Применение условий гомогенного деацетилирования для увеличения выхода композиций хитобиомера и значительного уменьшения уровня бактериальных эндотоксинов во время деацетилирования
Порошок хитина (1) добавляют (2) к 50% NaOH (3) при 15°С (соотношение хитин/ NaOH 1:15, вес./вес.) и перемешивают при постоянной скорости 36 об/мин (4) в течение 1 часа (5). Далее, к щелочной смеси (крошеву) добавляют мелко измельченный до 3-10 мм лед (соотношение щелочь/лед 1:3, вес./вес.) (6) для растворения хитина. Через два часа, когда хитин растворился и бактериальные эндотоксины полностью доступны для щелочного раствора, температуру (7) повышают и реакцию деацетилирования проводят при 16°С в течение 40 час. Затем реакцию деацетилирования останавливали добавлением кислоты (нейтрализация) и рН дополнительно понижали до 3,8 (8). Содержание эндотоксинов значительно уменьшалось (<30 ФЕ/г). За этим следует серия этапов фильтрации (9) для удаления посторонних частиц и нерастворившихся полимеров. Полимер далее получают путем осаждения с помощью нового способа высаливания посредством нейтрализации NaOH и нагревания раствора до температуры выше 65°С. Суспендированный осадок промывали на фильтре при температуре выше 65°С до тех пор, пока не получался нейтральный и обессоленный материал. После получения полимер промывают и гомогенизируют. Под конец суспензию высушивают распылением (10) для получения очищенного полимера. Этот процесс можно проводить в промышленном масштабе, и он увеличивает выход полностью растворимых композиций хитобиомера на 60% по сравнению с процессом гетерогенного деацетилирования. Уровни эндотоксинов значительно понижаются во время процесса, вероятно, потому, что молекулы эндотоксинов более доступны для действия раствора каустической соды по сравнению с ситуацией в процессе гетерогенного деацетилирования, где сырой материал хитина сохраняет свою кристаллическую структуру во время процесса и молекулы эндотоксинов, которые могут быть спрятаны в твердой хитиновой структуре, вероятно, защищены от каустической соды реакционной среды.
Примечание. Числа в скобках представляют этапы способа, которые можно варьировать согласно списку ниже.
(1) Размер частиц порошка может быть 2 мм или меньше. Пригодными являются источники хитина, включающие креветок, крабов, каракатицу, кальмара, криль и другие.
(2) Реактор, удовлетворяющий гигиеническим требованиям.
(3) Конечная концентрация щелочи может находиться в интервале от 5 до 90% (вес./вес.). Наиболее предпочтительной щелочью является гидроокись натрия. Другие щелочи также хорошо подходят, они включают концентрированный КОН, LiOH, Ca(OH)2, Na3PO4 и NH4OH. Соотношение сухого материала к щелочи может находиться в интервале от 1:3 до 1:100. Температура щелочи может находиться в интервале от 2 до 30°С.
(4) Скорость перемешивания может варьироваться от 0 до 80 об/мин. Наиболее предпочтительным интервалом для этого процесса является 20-40 об/мин.
(5) Время деацетилирования может быть в интервале от 0,5 до 1000 час, что в основном зависит от температуры и концентрации щелочи.
(6) Размер измельченного льда может находиться в интервале от 0,5 до 50 мм. Соотношение щелочи ко льду может находиться в интервале от 1:1 до 1:30.
(7) Температура деацетилирования может находиться в интервале от 10 до 100°С с оптимумом между 5-30°С, и время деацетилирования может находиться в интервале от 0,1 до 1000 час, что зависит от сочетания температуры и времени, которые применяют.
(8) Можно применять различные кислоты для процесса деацетилирования, они включают концентрированные карбоновые кислоты и концентрированные минеральные кислоты. Наиболее предпочтительной является соляная кислота. Концентрация соляной кислоты может находиться в интервале от 0,01 до 37% (вес./вес.).
(9) Можно применять различные технологии фильтрации, включая ультрафильтрацию и нанофильтрацию.
(10) Высушивание можно производить путем лиофилизации или распылительной сушки или с помощью любой другой подходящей технологии сушки.
1.2 Предварительная обработка хитинового сырья соляной кислотой для дальнейшего понижения уровня бактериальных эндотоксинов
Этот пример предоставляет дополнительный этап предварительной обработки хитинового сырья, включающий растворение порошка хитина в среде с сильной соляной кислотой (HCl), эффективную экстракцию бактериальных эндотоксинов из структуры растворенного хитина с последующим разрушением доступных эндотоксинов, находящихся в контакте с соляной кислотой и при необходимости с окислительным агентом (например, перекисью водорода). Далее, во время последующего процесса деацетилирования в жидкой фазе растворенный в щелочи хитин позволяет произойти дальнейшей экстракции и разрушению эндотоксинов, которые пережили кислотную обработку. Этот способ особенно полезен для обработки сырого материала, утратившего свою свежесть и подвергшегося росту бактерий во время сбора, хранения и транспортировки.
Пример подробного процесса производства
Порошок хитина (<150 мкм) (1) растворяют в 30% соляной кислоте (2) при комнатной температуре (соотношение хитин/HCl составляет 1:20, вес./вес.). Через 10 мин добавляют перекись водорода (конечная концентрация перекиси водорода 2%, вес./вес.) (3) и оставляют реагировать в течение 15 мин (4), затем раствор вливают в 75% изопропиловый спирт (GPA) (соотношение раствора хитина к 50% IPA составляет 1:40) (5) и промывают до нейтрального рН. Затем осадок дополнительно промывают свободной от эндотоксинов водой при 70°С (6). После удаления избытка воды к коллоидному хитину добавляют раствор концентрированной щелочи (конечная концентрация щелочи 25%, вес./вес.) (7). Затем смесь доводят до -25°С (8). За этим следует размораживание и растворение коллоидного хитина и деацетилирование при 60°С в течение 6 час (9). После деацетилирования частично деацетилированный хитин получают путем вливания его в горячую воду (70°С) (10) и промывают до нейтрального рН. Под конец нейтрализованную суспензию переносят в установку для лиофилизации/распылительной сушки для получения сухого вещества.
Уровень эндотоксинов в полученном хитобиомерном продукте обычно находится значительно ниже 30 ФЕ/г частично деацетилированного хитина, что определяют с помощью аналитического способа с лизатомамебецитов краба Limulus (LAL).
1.3 Очистка раствора частично деацетилированного хитина и извлечение полимера путем высаливания
Композиции согласно изобретению можно подходящим образом получать из хитинового сырья, например оболочек креветок. Хитин преимущественно деацетилируют с помощью сильного основания для получения частично деацетилированного хитинового полимера. Материал может быть также продуктом согласно 1.1 или 1.2 данного примера для увеличения выхода растворимых хитобиомеров и уменьшения уровня бактериальных эндотоксинов (ФЕ) до очистки. Время реакции и концентрация хитина может варьироваться в зависимости от нужной степени деацетилирования, и их можно легко оптимизировать для любой конкретной установки для получения и требуемой степени деацетилирования. Реакцию деацетилирования останавливают путем нейтрализации рН путем промывания частично деацетилированного хитина горячей водой или путем добавления подходящей кислоты. Затем можно применять очистку путем растворения полученного полимера в кислом растворе и фильтрации раствора для удаления постороннего или нерастворенного материала.
Для выделения частично деацетилированного полимера хитина температуру фильтрованного раствора вначале повышают до уровня выше 55°С. Затем рН доводят до уровня выше 8, предпочтительно, рН 10-11 для остановки реакции деацетилирования (нейтрализация) и, наконец, добавляют подходящую соль для начала процесса осаждения, причем температуру поддерживают выше 55°С. Затем осадок извлекают и промывают после осаждения на фильтре с использованием фильтра 150 мкм, причем применяют горячую воду для промывки осадка до получения нейтрального и обессоленного материала. После процесса промывки применяют подходящий способ сушки для высушивания материала.
Этот пример показывает, как можно выделить хорошо растворимый частично деацетилированный хитин (средняя степень деацетилирования между 30 и 55%) из такого профильтрованного раствора полимера без применения органических растворителей. Добавление соли при необходимости (NaCl) делается для увеличения компактности осадка для упрощения извлечения материала в промышленном процессе.
Избранные примеры
1.3.1 Диспергируют 1 г частично деацетилированного хитина с 43% СД (партия G060307P) в 100 г воды. Добавляют лимонную кислоту (2 г) для растворения полимера. Затем следует многоступенчатая фильтрация для получения прозрачного раствора. Температуру увеличивают до 60°С и по каплям добавляют NaOH (35% раствор) для увеличения рН до 11. Это приводит к выпадению полимера в осадок, который извлекают и промывают после осаждения на фильтре с использованием фильтра 300 мкм, причем используют горячую воду (выше 65°С) для промывки осадка, пока не получится нейтральный и обессоленный материал.
1.3.2 В опытном эксперименте (партия G060307P) с 1 кг хитина хитин вначале деацетилируют, промывают и растворяют в растворе 1% лимонной кислоты. За этим следует этап множественной фильтрации для получения прозрачного раствора. После нагревания до 65°С вносят 350 г NaOH для доведения рН до 10,5. Далее добавляют 4,5 кг NaCl, что приводит к образованию белых комьев осадка. Осадок интенсивно промывают водой с температурой 70°С до получения нейтрального рН и извлекают после осаждения фильтрованием с использованием фильтра 150 мкм. Осадок затем гомогенизируют и высушивают с помощью распылительной сушки для получения белого порошкообразного частично деацетилированного хитина. Препарат анализируют следующим образом:
средний размер частиц сухого порошка составляет 5 мкм (с распределением 3-10 мкм), степень деацетилирования 43%, кажущаяся вязкость 540 сантипуаз (1% продукт в 1% уксусной кислоте), мутность (1% продукт) <15 НЕМ (нефелометрических единиц мутности).
Фигура 1 иллюстрирует растворимость этого продукта (43% СД) по сравнению с хитозаном, деацетилированным на 70% и на 94%. Полимер с 43% СД полностью растворим при физиологическом рН 7,4 (нет изменения мутности). Полимер с 70% СД частично растворим при рН 7,4, а полимер хитозана с 94% СД выпадает в осадок (мутность >1000 НЕМ).
Результаты показывают, что с помощью растворения хитинового полимера в щелочи и во льду гомогенное деацетилирование можно проводить так, что распределение оставшегося N-ацетилглюкозамина можно контролировать. Эксперименты также показывают, что это можно делать в промышленном масштабе и что способ деацетилирования можно применять для повышения выхода Т-ХОС в препарате хитоолигомера, полученном с помощью хитиназы.
Пример 2. Получение и характеристика Т-ХОС
2.1 Получение партии G020418, гетерогенной тестируемой партии ХОС, количественное определение и секвенирование гомологов
Получение
Растворяют 25 кг гидроокиси натрия в 25 кг воды в измельчителе на 80 л и нагревают до 60°С. Добавляют 2,5 кг хитина из креветок Р. horealis (Genis ehf.) и перемешивают (15 об/мин) в течение 40 мин. Суспензию охлаждают водой и промывают в мешке из ячеистой ткани (200×40 см) в течение 10-15 мин. Хитиновый гель переносят в измельчитель на 200 л, доводят рН до 4,0 путем добавления 30% соляной кислоты и добавляют воду до получения объема 100 л. Добавляют эндо-хитиназу семейства 18 (10000 ед./кг субстрата), гель перемешивают в течение 22 час при 30°С. Фермент денатурируют путем доведения рН до 5,4 и нагревания раствора до 80°С в течение 10 мин. После охлаждения раствор олигомера (ХОС) пропускают через сито с размером меш 280 мкм. Раствор обессоливают с применением приспособления для нанофильтрации DSS LabStak M20 с мембраной 0,72 см2 с пределом пропускания 500 кДа при рН 4,8. Раствор далее подвергают распылительной сушке с применением роторного распыляющего приспособления при температуре на входе 190°С и температуре на выходе 80°С. Собирают 2 кг тонкого белого порошка ХОС и держат при комнатной температуре. Степень деацетилирования составляет 37% (или FA 0,63), как определяют прямым титрованием.
Аналитические способы
Анализ с помощью гель-проникающей хроматографии (ГПХ) на BioGel P4
Количество из 2,16 г порошка ХОС растворяют в 180 мл 0,05 М буфера из ацетата аммония при рН 4,2. Получившийся раствор фильтруют последовательно через мембраны из ацетата целлюлозы с порами 0,8 мкм и 0,2 мкм (Schleicher & Schuell) и подвергают ультрафильтрации с мембраной с пределом пропускания 3000 кДа (Amicon). Фильтрат лиофилизуют. Выход составляет 0,74 г (34%). Получившийся порошок (партия из 350 мг) далее разделяют с помощью гель-фильтрации (ГПХ) на BioGel P4 fine grade (BioRad, München, Germany). Размер колонки 5х200 см, подвижная фаза 0,05 М буфер из ацетата аммония, рН доведен до 4,2 с помощью 0,23 М уксусной кислоты, скорость тока 60 мл/час, измеритель показателя преломления (Shimadzu RID 6A). Собирают фракции объемом 20 мл, объединяют, как требуется, концентрируют до небольшого объема и под конец лиофилизуют.
Получение гомологов - ионообменная хроматография
Растворяют 4 мг лиофилизованой фракции после ГПХ в 200 мкл водной соляной кислоты при рН 3,0. Раствор фильтруют через фильтр для шприца на 0,45 мкм с мембраной Nylon (Nalgene). Гомологи разделяют с помощью ионообменной хроматографии высокого разрешения (HP-IEC) на установке Resource S (Amersham Pharmacia Biotech, Sweden). Объем слоя 1 мл, подвижная фаза: водная соляная кислота при рН 3,0 (А), 1 М водный раствор хлористого натрия при рН 3,04 (Б); профиль элюции: 0-5 мин 100% А, 5-45 мин 100% - 50% А, 45-46 мин 50% - 0% А, 46-55 мин 0% А, 55-56 мин 0% - 100% А, 56-80 мин 100% А; скорость тока 60 мл/час; УФ-детектор Jasco UV-MD-910. Собирают фракции 500 мкл, объединяют нужным образом, диализуют в мембранных приспособлениях floatalyzers™ (SpectraPor) против воды (2 л, 4 дня), концентрируют до небольшого объема и окончательно лиофилизуют. Образец порциями по 4 мг подвергают высокоэффективной ионообменной хроматографии (НР-IEC). Выходы см. в разделе «результаты и обсуждение».
Восстановительное аминирование ХОС 2-аминоакридоном (АМАС)
Растворяют 330 нмоль чистого ХОС или 60-80 нмоль смеси ХОС в 20 мкл 0,1 м раствора 2-аминоакридона в уксусной кислоте/ДМСО (объем/объем 3:17) и вручную перемешивают в течение 30 сек, затем добавляют 20 мкл 1 М раствора цианборгидрида натрия в воде и перемешивают еще 30 сек. Смесь нагревают в темноте в течение 30 мин при 90°С. Реакционный сосуд охлаждают до -20°С и реакционную смесь лиофилизуют. Осадок растворяют в 1 мл воды, диализуют против 1 л воды в течение 48 час и под конец лиофилизуют с получением светло-желтого порошка. Образцы анализируют немедленно или хранят в темноте при -20°С.
Масс-спектрометрия
Лиофилизованные АМАС-олигосахаридные производные растворяют в 200-500 мкл смеси метанол/вода (по объему 50:50). Аликвоту раствора (0,5 мкл) смешивают на мишени с 2 мкл раствора ДГБ (2,5-дигидроксибензойная кислота) в качестве матрицы (15 мг/мл) в 30% водном этаноле и каплю высушивают под слабым током воздуха. Обычно кристаллизация матрицы происходит спонтанно. В некоторых случаях кристаллизацию наблюдали после разведения раствора исходного образца приблизительно в 5 раз смесью метанол/вода (50:50 по объему).
MALDI TOF масс-спектры записывают с помощью прибора Bruker Reflex II (Bruker Daltonik, Bremen, Germany) в режиме положительного иона. Для ионизации применяют азотный лазер (337 нм, ширина импульса 3 нс, 3 Гц). Для оптимизации масс-спектров лазер направляют либо в центральную область образца, либо на самый край зоны кристаллизации. Все спектры снимают в режиме с отражателем с применением внешнего стандарта ангиотензин II.
Секвенирование ХОС гомологов - изобары
Все гомологи от СП3 до СП8, демонстрирующие соответствующий сигнал в спектрах масс MALDI TOF, секвенируют согласно способу, детально описанному в 1. Вкратце, 60-80 нмоль каждой лиофилизованной ГПХ фракции Ф3-Ф10 подвергают восстановительному аминированию с помощью 2-аминоакридона с получением гомологов с довеском на восстанавливающем конце 2. (MALDI TOF спектр масс фракции Ф7-АМАС см. ниже, остальные не показаны). Фракции анализируют с помощью тандемной MALDI масс-спектрометрии. Мононатриевые псевдомолекулярные ионы рассматриваемых гомологов отбирают в квадруполе масс-спектрометра и фрагментируют в коллизионной камере, получая ионы А-, В- и С-типа, которые образуются из невосстанавливающего конца, и ионы Х-, Y- и Z-типа из восстанавливающего конца. Благодаря довеску на восстанавливающем конце ионы Y-типа можно идентифицировать по инкременту массы 194 Да и олигосахаридную последовательность можно прочитать от восстанавливающего конца, применяя дерево последовательностей.
Результаты
Таблица 1 показывает СП каждого ХОС и гомологов каждой фракции, а также распределение масс фракций Ф1-Ф10. Таблица 2 показывает последовательности изобар, обнаруженных с помощью анализа последовательности гомологов ХОС.
Для основных соединений ХОС между СП5 и СП7 эти результаты можно оценить количественно (D2A3, D3A3, D2A4, D3A4).
Для получения количественной информации о смеси изобар требуется применить псевдомасс-спектрометрию (МС): образец фрагментируют в источнике (без предварительного отбора иона), ион фрагмента отбирают в квадруполе масс-спектрометра, фрагментируют в коллизионной камере и записывают спектр масс последней фрагментации.
Поскольку первую фрагментацию проводят без предварительного отбора ионов, образец должен быть чистым гомологом. В частности, никаких ионов с массами более низкими, чем у анализируемого вещества, не должно быть в MALDI TOF масс-спектре.
Для этой цели необходимо очищать ГПХ фракции до количественного анализа последовательности. Гомологи из ГПХ фракций Ф6-Ф9 разделяют по количеству зарядов на катионообменной колонке HPLC с получением чистых D2A3 (Ф6), D3A3 (Ф7), D2A4 (Ф8) и D3A4 (Ф9). В таблице 3 собраны результаты HP-IEC разделения ГПХ фракций Ф6-Ф9.
Чистые гомологи D2A3, D3A3, D2A4 и D3A4 подвергают восстановительному аминированию с помощью 2-аминоакридона с получением производных с довеском на восстанавливающем конце (MALDI TOF спектр масс D3A3-AMAC см. ниже, другие не приведены). Эти производные гомологов секвенируют, как описано выше, с помощью псевдоMALDI МС.
Относительные интенсивности (%) ионов фрагментов гомологов приписывают путем компьютерной оценки. Воспроизводимость относительных интенсивностей пиков подтверждают путем повторной фрагментации. Показано, что среднее стандартное отклонение составляет 1%. На фигуре 2 показано древо последовательностей для D3A3, дающее количественную оценку интенсивностей пиков, обусловленных ионами фрагментов различных последовательностей. Для ионов Y2-типа относительные количества DA (7,5%) и АА (92,5%) можно прямо получить из относительных интенсивностей пиков D1A1-AMAC и А2-АМАС.
Для ионов Y3-типа относительные количества DDA (5,9%) и ААА (6,5%) можно прямо получить из относительных интенсивностей пиков D2A1-AMAC и А3-АМАС. Относительное количество ADA (1,6%) можно получить по уравнению [DDA]+[ADA]=7,5%, относительное количество DAA (86,0%) - по уравнению [DAA]+[ААА]=92,5%.
Для ионов Y4-типа относительное количество DDDA (0,9%) можно прямо получить из относительной интенсивности пика D3A1-AMAC. Относительное количество ADDA (5,0%) можно получить по уравнению [DDDA]+[ADDA]=5,9%. Относительное количество DAAA составляет 6,5%, поскольку только DAAA-АМАС дает А3-АМАС, относительная интенсивность которого составляет 6,5%.
б число в скобках означает расчетное максимальное число изобар для гомолога DNAM: (N+M)!/(N!×М!).
б Анализ с помощью MALDI TOF масс-спектрометрии (MALDI TOF спектр масс для D3A3 см. ниже, другие не приведены).
в Выход рассчитан по площади пиков после детекции в УФ (с учетом того, что разное количество ацетильных групп в молекуле ведет к разным коэффициентам молярной абсорбции).
г Выход рассчитан по массам фракций.
При псевдомасс-спектрометрии (MS3) D1A3-AMAC относительные интенсивности пиков D1A1-AMAC и А2-АМАС составляют 1,0% и 99,0%. В MALDI тандем спектре масс D3A3-AMAC относительная интенсивность пика D1A3-AMAC составляет 22,1%. AADA является единственной последовательностью D1A3 (AADA, ADAA, DAAA), которая дает фрагмент D1A1-AMAC. По этой причине относительное количество AADA составляет 1% от 22,1%=0,2%. Относительное количество DADA (1,4%) можно рассчитать по уравнению [AADA]+[DADA]=1,6%. Относительное количество ADAA (15,4%) можно рассчитать по уравнению [AADA]+[ADAA]+[DAAA]=22,1%. Окончательно относительное количество DDAA (70,6) можно рассчитать по уравнению [ADAA]+[DDAA]=86,0%. Для ионов Y5-типа относительное количество ADDDA составляет 0,9%, поскольку только ADDDA-AMAC дает DDDA-AMAC, которому приписана относительная интенсивность пика 0,9%. Аналогичные соображения позволяют определить DAADA (0,2%), DADAA (15,4%) и DDAAA (6,5%).
В псевдомасс-спектрометрии D2A3-AMAC относительные интенсивности пиков D2A1-AMAC, D1A2-AMAC и А3-АМАС составляют 2,6%, 88,0% и 9,4%. В MALDI тандем спектре масс D3A3-AMAC относительная интенсивность пика D2A3-AMAC составляет 82,0%. AADDA является единственной последовательностью D2A3 (AADDA, ADADA, DAADA, ADDAA, DADAA, DDAAA), которая дает фрагмент D2A1-AMAC. По этой причине относительное количество AADDA составляет 2,6% от 82,0% = 2,1%. Относительное количество DADDA (2,9%) можно рассчитать по уравнению [DADDA]+[AADDA]=5,0%. В псевдомасс-спектрометрии D2A3-AMAC относительные интенсивности пиков D1A1-AMAC и А2-АМАС составляют 3,9% и 96,1%. ADDAA, DADAA и DDAAA являются теми последовательностями D2A3, которые дают А2-АМАС. По этой причине относительное количество ADDAA+DADAA+DDAAA составляет 96,1% из 82,0%=78,8%. По этому уравнению можно рассчитать относительное количество ADDAA (56,9%). Относительное количество DDDAA (13,7%) можно рассчитать по уравнению [DDDAA]+[ADDAA]=70,6%. Относительное количество DDADA (0,5%) можно рассчитать по уравнению [DDADA]+[ADDDA]+[DADDA]+[DDDAA]=18,0%, то же для ADADA (0,9%) по уравнению [DDADA]+[ADADA]=1,4%.
На фигурах 3А-3Г показаны относительные количества изобар гомологов D2A3, D3A3, D2A4 и D3A4. Изобары не включены в диаграммы, если рассчитанное количество менее 1%, поскольку данный способ не позволяет определять относительные интенсивности пиков менее 1%.
2.2 Получение партии G050421; улучшенный выход Т-ХОС при процессе гомогенного деацетилирования
Получение гомогенных хитоолигосахаридов G050421
Деацетилирование проводят, как описано в примере 1. После завершения процесса деацетилирования доводят рН до 3,8 с помощью соляной кислоты и доводят температуру до 35°С. К раствору добавляют эндо-хитиназу семейства 18 (10000 единиц/кг субстрата) и проводят реакцию гидролиза в течение 22 час до завершения гидролиза. За этим следует серия этапов фильтрации для удаления твердых частиц и этап ультрафильтрация для удаления остатков белка фермента и других полимеров. Под конец раствор высушивают с помощью распылительной сушки для получения порошкообразных терапевтических хитоолигосахаридов (Т-ХОС) (G050421).
Аналитические способы
ГПХ фракционирование на Biogel P4 проводят, как описано ранее. MALDI TOF масс-спектрометрию ГПХ-фракций проводят, как описано ранее.
Результаты
Степень деацетилирования гетерогенных деацетилированных Т-ХОС (полученных путем гетерогенного деацетилирования) составляет 39% и для гомогенных деацетилированных олигомеров (полученных путем гомогенного деацетилирования) (G050421) составляет 40% по данным прямого титрования.
Анализ распределения пиков и гомологов для гетерогенных деацетилированных олигомеров (G020418) показан на фигуре 4 и для гомогенных деацетилированных олигомеров (G050421) на фигуре 5. Наиболее значительное различие в распределении пиков наблюдается для более длинных олигомеров. Для гетерогенных деацетилированных олигомеров СП11-22 (площадь пика 0 на фигуре 4) составляет 35,5% общего материала, и количество возрастает с ростом СП от 11 до 22. В случае гомогенных деацетилированных олигомеров с другой стороны СП от 11 до 22 (площадь пика от 0 до -3 на фигуре 5) составляет только 12,9% от общего материала, и количество уменьшается с увеличением СП от 11 до 22, не оставляя буквально никакого вещества с СП18 и выше. Это также отражается в величине высокоактивных олигомеров (СП5-10). Гомогенные олигомеры обладают 41% СП5-10, а гетерогенные олигомеры - только 28% СП5-10.
Распределение гомологов приведено на фигуре 6 для олигомеров, полученных согласно этим двум способам деацетилирования. У гетерогенных олигомеров имеется гораздо меньше СП4 (A2D2 и A3D) и СП5 (A3D2), а также СП7 (A3D4) и СП8 (A4D4), чем у гомогенных олигомеров (фигура 6).
В итоге способ гомогенного деацетилирования с гораздо большей вероятностью дает ХОС с более высокой биоактивностью, чем гетерогенное деацетилирование. Значительное уменьшение продукции нежелательных длинных олигомеров с СП>15 наблюдается по этому способу.
2.3 Увеличение относительного количества Т-ХОС с помощью ультрафильтрации (партия G051128)
Для улучшения относительного количества Т-ХОС (СП5-15) проводят дополнительный этап ультрафильтрации, где раствор Т-ХОС фильтруют и концентрируют на мембранах 1 кДа UF (Helicon, Millipore), где количество небольших хитоолигомеров (СП2-5) значительно уменьшается и мономеры удаляются. То, что прошло сквозь мембрану, отбрасывают, удержанный материал собирают и подвергают распылительной сушке.
Для анализа тестируемого материала применяют HPLC с помощью системы Beckman Gold. Применяют колонку TSK-oligo (TosoHaas, Japan), разделяющую ХОС по молекулярному весу (СП1, СП2 и т.д.). Растворителем является 5 мМ гидроокись аммония рН 10,0, скорость тока 0,5 мл/мин, оптическое поглощение регистрируют при 205 нм, объем впрыскивания 20 мкл и концентрация ХОС 10 мг/мл.
На фигуре 7 показано относительное количество олигомеров для каждой СП до и после этапа ультрафильтрации. Мономер удален, и количества меньших олигомеров (СП2-5) значительно понижены.
Пример 3. Поглощение терапевтических хитоолигосахаридов в организме человека
Способы
Хитоолигомеры
Хитоолигомеры, состоящие из N-ацетилглюкозамина и глюкозамина, получены от Genis, Reykjavik, Iceland. Вкратце, хитин частично деацетилируют в щелочи, промывают и гидролизуют до олигомеров с помощью хитиназы. Олигомеры подвергают ультрафильтрации и сушат с помощью распылительной сушки с получением тонкого белого порошка. Средняя степень деацетилирования составляет 47% (FA 0,53). Анализ и определение количества олигомеров и гомологов проводят, применяя те же способы, как для образцов крови. Данные применяют для сравнения поглощения (поступления) различных гомологов в кровь.
Общая обработка образцов крови
Доброволец принимает ежедневно 1,8 г ХОС (Genis ehf; S041124-1K) в течение периода времени из четырех недель. Образцы крови отбирают в течение 6 недель. Первый образец отбирают до приема ХОС. Следующие четыре образца отбирают каждую неделю, начиная через неделю после первого приема. Образец 6 недели отбирают через 2 недели после прекращения приема ХОС. Объем каждого образца составляет 7,0 мл. Образцы крови центрифугируют в течение 30 мин при 3000 об/мин. Сыворотку собирают. Добавляют метанол и хлористый натрий до конечной концентрации 30% метанола и 0,1 мг/мл хлористого натрия с последующим еще одним этапом центрифугирования. Образцы по 500 мкл фильтруют через мембраны с пределом пропускания 3 кДа (ультрафильтрация). Супернатант пополняют три раза. Соответствующие фильтраты объединяют, удаляют метанол под вакуумом и под конец образцы лиофилизуют.
MALDI TOF масс-спектрометрия
Лиофилизованные образцы (приблизительно 100 мкг) растворяют в 100 мкл смеси метанол/вода (50:50 по объему). Аликвоты раствора смешивают на мишени с 2 мкл раствора ДГБ в 30% водном этаноле (15 мг/мл). Каплю высушивают под слабым током воздуха. Спектры масс записывают с помощью прибора Bruker Reflex II (Daltonik, Bremen, Germany) в режиме положительного иона. Для ионизации применяют азотный лазер (337 нм, ширина импульса 3 нс, 3 Гц). Все спектры регистрируют в режиме с отражателем, применяя внешний стандарт. Моноизотопные пики помечают во всех масс-спектрах.
Определение гомологов с помощью MALDI TOF масс-спектрометрии
Лиофилизованные образцы (приблизительно 100 мкг) растворяют в 100 мкл смеси метанол/окись дейтерия (50:50 по объему). Добавляют 10-кратный избыток гексадейтеро-уксусного ангидрида и три капли ледяной тетрадейтеро-уксусной кислоты. Раствор перемешивают при 30°С в течение 12 час. Реакцию останавливают добавлением эквимолярного количества аммиака. Растворы лиофилизуют и снова растворяют в 100 мкл аммиака. Концентрацию аммиака устанавливают как 10-кратный молярный избыток относительно молярного количества звеньев N-ацетилглюкозамина (GIcNAc или А). Раствор перемешивают при 22°С в течение ночи. Аммиак удаляют под вакуумом, затем лиофилизуют образцы. В случае, когда MALDI TOF масс-спектрометрия показывает присутствие O-ацетильных групп, лиофилизованные образцы снова растворяют в водном растворе гидроокиси натрия (100 мкл). Концентрацию гидроокиси калия устанавливают как 2-кратный молярный избыток относительно количества молей звеньев А (GIcNAc). Раствор перемешивают в течение 10 часов при комнатной температуре, нейтрализуют добавлением катионообменной смолы (в H+-форме) с последующей фильтрацией и лиофилизацией фильтрата.
MALDI TOF масс-спектры снимают, как описано в примере 4. Количественная оценка относительных интенсивностей сигнала дает состав гомологов в смеси.
Количественное определение ХОС с помощью MALDI TOF масс-спектроскопии
Образцы готовят, как описано в разделе «Определение гомологов с помощью MALDI TOF». Далее, добавляют стандарт к каждому образцу. Стандарт, олигомер хитина (An), должен иметь такую же СП±1, как и анализируемое вещество. Применяют последовательное разведение стандарта. Сравнение интенсивностей сигналов анализируемого образца и стандарта дает концентрацию анализируемого вещества.
Гель-проникающая хроматография (ГПХ)
Олигомеры разделяют с применением ГПХ на Biogel P4, как описано в примере 2. Соответствующие фракции объединяют, объем уменьшают под вакуумом с последующей лиофилизацией до постоянного веса для удаления ацетата аммония.
Высокоэффективная ионообменная хроматография (НРIЕС)
Смеси гомологов (и олигомеров), полученные после ГПХ-разделения, анализируют с помощью HPIEC. Условия: стационарная фаза (колонка с носителем): Resource S (Pharmacia, Uppsala, Sweden), объем носителя 1 мл, подвижная фаза: соляная кислота рН 3,5, градиент хлористого натрия 0-1 М от 5 до 60 мин, скорость тока 1 мл/мин, оборудование: установка для ВЭЖХ (Jasco, Gross-Umstadt, Germany) с УФ-детектором (длина волны регистрации 210 нм). Фракции после ВЭЖХ лиофилизуют. При необходимости фракции обессоливают с помощью диализа (Floatalyzer®, SpektraPor, Germany).
Количественное определение гомологов с помощью HPIEC
Эксперименты, в основном, проводят, как описано в разделе «Ионообменная хроматография высокого разрешения». К каждому образцу добавляют стандарт. Стандарт должен находиться в том же интервале концентраций, как анализируемый образец. Концентрацию анализируемого образца рассчитывают из сравнения площадей пиков стандарта и анализируемого образца. Площади пиков демонстрируют линейное соответствие количеству ацетильных групп у анализируемой молекулы.
Результаты
MALDI TOF масс-спектроскопия образца крови, отобранного до приема ХОС, не показывает никаких сигналов ХОС.
Через 1 неделю
В образце крови через 1 неделю после приема ХОС наблюдаются только следы олигомеров с СП2 (А2 гомолог) и СП3 (D1A1 гомолог) (данные не показаны).
Через 2 недели
В образце крови, отобранном через 2 недели после приема ХОС, присутствуют явные признаки гетерохитоолигомеров согласно MALDI TOF спектрам масс. На фигуре 8 показаны гомологи СП2-СП5; гомологи от СП2 (гомолог А2) до СП12 (гомолог D7A5) явно прослеживаются в спектрах масс. Количественное определение гомологов с помощью различных способов (см. раздел «Способы») выявляет общую концентрацию ХОС 0,16 мг/мл сыворотки через 2 недели после приема. Принимая общий объем крови за 5 л, общее количество поглощенных ХОС составляет 0,80 г или 44% ежедневной дозы.
Через 3 недели
MALDI TOF масс-спектрометрия выявляет олигомеры от СП2 до СП12 (фигура 9). На фигуре 10 сравнивают относительные интенсивности сигналов на спектре масс для олигомеров и гомологов исходного образца с образцом крови через три недели после приема. Наблюдается явный сдвиг в сторону более высоко ацетилированных гомологов (более высокие значения FA) в образце крови по сравнению с исходной смесью. Следы гомологов до СП15 обнаружены в образце крови через 3 недели после приема. Количественное определение гомологов с помощью различных способов (см. раздел «Способы») выявляет общую концентрацию ХОС 0,19 мг/мл сыворотки через 3 недели после приема.
2: количественное определение ХОС с помощью ГПХ и MALDI TOF
3: количественное определение ХОС с помощью ГПХ, HPIEC и MALDI TOF
A3
30
4
D1A3
110
16
D2A3
90
13
D3A3
D2A4
200
50
29
7
D4A3
D3A4
80
90
11
13
D4A4
40
6
D5A4
10
1
Выводы
Прием 1,8 г ХОС ежедневно приводит к поглощению этих сахаров в кровоток. Следы СП2 и СП3 олигомеров появляются через 1 неделю после приема. 84% максимального поглощения достигается через 2 недели, и максимум плато ХОС (100%) достигается через 3 недели после приема. Общая максимальная концентрация составляет приблизительно 190 мкг/мл крови, указывая на 53% максимальный выход поглощения от дозы ежедневного приема (5 л крови). Олигомеры с СП2-7 обнаружены с (довольно равными) концентрациями 14-40 мкг/мл крови. Олигомеры с СП8-9 обнаруживаются в низких концентрациях 3-10 мкг/мл. Олигомеры до СП15 не обнаружены в крови. Сравнение гомологов, обнаруженных в исходном образце, для приема и в крови показывает, что гомологи высокой степени ацетилирования предпочтительно проникают в кровоток.
Через две недели после прекращения приема никакие хитоолигомеры более не обнаруживаются в кровотоке.
Сделано заключение, что Т-ХОС композиции имеют тенденцию к большей биодоступности по сравнению с композициями гетероолигомеров, включая различные композиции, например FA значения. В свою очередь, это поддерживает заключение, что Т-ХОС композиции обладают более высокой терапевтической активностью по сравнению с другими гетероолигомерными композициями.
Пример 4. Т-ХОС гомологи как блокаторы (ингибиторы) активности хитиназы-А; модель биостабильности Т-ХОС композиций
Материалы и методы
Хитоолигосахариды (ХОС) (партии G020418 и G020218) разделяют на фракции гомологов путем ионообменной хроматографии, или путем гель-фильтрации, или с помощью сочетания этих способов. Продукты лиофилизуют и анализируют их структуру и последовательность с помощью MALDI TOF масс-спектрометрии. Три другие нефракционированные партии ХОС от Genis также анализируют тем же способом MALDI TOF (партии №№ G040823, G050421 и G050421UF, где UF означает «после ультрафильтрации через мембрану с пределом пропускания 1 кДа» для уменьшения содержания олигомеров с СП≤5).
Ультрафильтрацию проводят с партией G050421, полученной путем гидролиза частично деацетилированной партии хитина, которую деацетилировали гомогенным способом. Вкратце, 16 г ХОС растворяют в 180 мл дистиллированной воды и диафильтруют с помощью регенерированной целлюлозной мембраны с пределом пропускания 1 кДа (Millipore, USA), применяя ячейку Amicon. Конечный объем удержанного раствора составляет 65 мл с выходом 0,582 г ХОС (выход 33%). Общий объем, прошедший через мембрану, составляет 970 мл. Как удержанный, так и прошедший объемы анализируют с помощью хроматографии на Biogel P4 и MALDI TOF масс-спектрометрии, как описано в примере 4. Конечный ретентат лиофилизуют и называют G050421UF.
Очищенный препарат хитиназы А из S. marcescens применяют в качестве стандарта хитиназы семейства 18 и 4-метилумбеллиферил-β-D-N,N'-триацетилхитотриозид (4-МУ-А3), аналог хитинового тетрамера (А4) применяют в качестве стандартного субстрата хитиназы.
Стандартный раствор хитиназы А содержит 0,5 нМ (500 пМ) в 0,1 мг/мл БСА, 50 мМ фосфатный буфер рН 7,4 (Хит-А раствор), и раствор субстрата содержит 40 мкМ 4-МУ-А3 в 50 мМ фосфатном буфере рН 7,4.
Разные концентрации каждого очищенного гомолога ХОС (обычно 0, 25, 50, 100, 200, 400 и 800 мкМ) готовят на субстратном буфере. Для анализа смешивают 25 мкл раствора Хит-А с 25 мкл субстратного/блокирующего раствора, инкубируют при 37°С в течение 10 мин. Реакцию останавливают добавлением 1,95 мл 0,2 М буфера бикарбоната натрия (Na2CO3). Образование продукта, 4-метилумбеллиферона (4-МУ), измеряют для каждой реакции с помощью флуориметра Perken-Elmer LS 50В. Длина волны возбуждения 380 нм (щель 5 нм) и длина волны испускания 460 нм (щель 4 нм). Каждую реакцию повторяют три раза. Для оценки блокирования рассчитывают концентрацию 50% ингибирования (ИК50) для каждого гомолога ХОС с применением нелинейной регрессии по функции f=y0+a*exp(-b*x), где х означает специфическую активность хитиназы и f означает концентрацию олигосахарида (мкМ). Сродство каждого гомолога рассчитывают как величину, обратную ИК50. Применяемая формула 1/ИК50*1000.
Результаты и выводы
Хотя хитиназа А имеет оптимум активности при рН 5,5, рН для экспериментов по блокированию доводят до 7,4. Это делают для того, чтобы освободить от протонов аминогруппы ХОС, поскольку более ранние опыты в малой шкале, проведенные при рН 5,5, показали низкую блокирующую активность ХОС гомологов. Этот рН также более похож на физиологический рН крови и других физиологических жидкостей, лучше отражает поведение олигосахаридов в организме человека.
На фигуре 11 показана типичная блокирующая активность ХОС по отношению к активности хитиназы. Полученная ИК50 составляет 17 мкМ для A4D2 гомолога. В таблице 5 суммированы значения СП, гомолог, ИК50, рассчитанное сродство и последовательности всех протестированных гомологов. На фигуре 12 показано рассчитанное сродство для каждого протестированного гомолога. На фигуре 13 показано то же, что на фигуре 12, а также все последовательности (изобары), включающие каждый гомолог. Относительно блокирующей активности различных гомологов можно вывести два основные правила. Блокирование сильнее при увеличении СП и в то же время более ацетилированый гомолог (больше звеньев А на молекулу) демонстрирует более высокое сродство. Поэтому D6, D9 и D12 являются плохими блокаторами. A4D2, A4D3, A5D7 и A6D9 (СП6-12) демонстрируют самое сильное блокирование. Таким образом, такие гомологи могут считаться обладающими самой высокой биоактивностью из-за своего кажущегося сродства к активному участку хитиназы. СП12 (A5D7) показывает наивысшую активность, и при СП15 (A5D7) сродство не увеличивается значительно (фигура 12 и 13). Гомоолигомер А6 расщепляется хитиназой А на A3, А2 и А1 согласно MALDI-TOF.
Однако хитиназа А не расщепляет ни один из гетероолигомеров протестированных в условиях анализа (рН 5,5 и рН 7,4), как показывает MALDI-TOF масс-спектрометрия, что указывает на хорошую биостабильность гомологов. Причиной такой биостабильности является полный гидролиз субстрата хитиназой семейства 18 во время получения ХОС.
Когда нефракционированные препараты ХОС тестируют в той же ферментной системе, ИК50 составляет 70 мкг/мл для G040823 (фигура 14), 105 мкг/мл для G050421 и 67 мкг/мл для ультрафильтрованного G050421UF. Это показывает, что способ можно применять для оценки блокирующей активности и биостабильности гомологов в смесях ХОС, и он не требует разделения гомологов перед анализом. Поэтому такой способ можно применять для оценки средней блокирующей активности ХОС препарата, включающего смесь различных гомологов гетероолигосахаридов. Такая оценка даст значение среднего сродства связывания с активным участком фермента и средней биостабильности включенных гомологов.
* НБ = не обнаружено блокирования
A3D31 из G020418
A3D32 из G020218
Подписи к чертежам
Фигура 11. Блокирующее действие гомолога A4D2 на хитиназу А. Показана теоретическая кривая согласно нелинейной регрессии по функции f=y0+a*exp(-b*x). Концентрация 50% ингибирования (ИК50) для A4D2 определена как 17 мкМ.
Фигура 12. Рассчитанное сродство гомологов. Фигура показывает сродство каждого протестированного гомолога (по данным таблицы 5).
Фигура 13. Биоактивность и биостабиотность ХОС гомологов, как на фигуре 12 с последовательностями, см. детали в таблице 5.
Фигура 14. Блокирующее действие ХОС партии G040823 на хитиназу А. Рассчитанное значение ИК50 составляет 70 мкМ.
Пример 5. Связывание гетероолигосахаридов с 39 кДа гликопротеином хряща человека размером 39 кДа (ХЧ-гп-39)
Поскольку ХЧ-гп-39 является белком производным хитиназы, олигомеры хитина (помимо полимера хитина) демонстрируют сильнейше сродство к этому белку. С другой стороны, олигомеры хитина быстро расщепляются активными хитиназами семейства 18, которые также находятся в организме человека. Гетерохитоолигосахариды (состоящие из звеньев А и D), такие как Т-ХОС композиции, обладают значительно более высокой биостабильностью, чем олигомеры хитина (только А звенья или гомоолигосахариды). Таким образом, целью настоящей работы является исследование того, как сильно на сродство ХОС к ХЧ-гп-39 влияет FA и СП гетероолигосахаридов.
Материалы и методы
Качественный и количественный анализ последовательностей гетерохитоолигосахаридов проводят, как описано выше (пример 4).
Исследование сродства
Сродство нековалентных комплексов между ХОС и ХЧ-гп-39 анализируют с применением изменения собственной флуоресценции триптофана белка в условиях связывания. Изменения интенсивности флуоресценции обусловлены индуцированными лигандом изменениями сольватного окружения остатков триптофана и проявляют положительную корреляцию с концентрацией сахара.
ХЧ-гп-39 растворяют в 25 мМ Трис-HCl буфере рН 7,4, содержащем 1 мМ дитиотрейтол, в конечной концентрации 1,00 мкМ (раствор белка). Растворы с различными концентрациями гомологов готовят на 25 мМ Трис-HCl буфере рН 7,4, содержащем 1 мМ дитиотрейтол (раствор сахара). Для каждого гомолога готовят 4 раствора с разными концентрациями: раствор I 1,3-2,0 мкМ, раствор II 6,5-16,0 мкМ, раствор III 52,0-80,0 мкМ, раствор IV 130,0-200,0 мкМ (концентрации различаются между гомологами). Для анализа 50 мкл раствора белка и 50 мкл раствора каждого сахара (растворы I-IV) инкубируют по отдельности при 25°С на термостатированной качалке в течение 15 мин. Затем 50 мкл термостатированного раствора белка смешивают с 50 мкл раствора сахара (растворы I-IV по очереди). Смеси инкубируют в течение 7 мин при 25°С на термостатированной качалке. Флуоресценцию регистрируют для каждой реакции с помощью флуоресцентного спектрометра Perkin-Elmer LS 50В (Perkin-Elmer, Uberlingen, Germany). Длина волны возбуждения 295 нм (щель 5 нм) и длина волны испускания 340 нм (щель 10 нм) с пределом пропускания при 290 нм. Измерения для каждой реакции делают с тройным повтором.
Расчет констант диссоциации
Из полученных значений флуоресценции вычитают значение для контроля. Строят график зависимости значения F-F0 от концентрации гомолога и данные аппроксимируют с помощью нелинейной регрессии для модели с насыщением одного участка с применением программы SigmaPlot® для получения изотерм связывания.
y=Bmax*x/(Kd+x)
Bmax - интенсивность флуоресценции для насыщенного домена связывания ХЧ-гп-39;
Kd - константа диссоциации.
Корреляция между Kd и FA
Данные о константах диссоциации для серии гомологов с СП6 (D6, D3A3, D2A4 и А6) в зависимости от числа звеньев А аппроксимируют с помощью нелинейной регрессии (программа SigmaPlot®) для гиперболического затухания с двумя параметрами.
y=a*b/(b+x)
Корреляция между относительным сродством и FA
Данные о константах диссоциации переводят в значения относительного сродства, принимая за 100% значение относительного сродства для А6 и за 0% значение относительного сродства для D6. Значения относительного сродства для D3A3 и D2A4 рассчитывают согласно этой относительной шкале и строят график зависимости этих величин от числа А звеньев. Данные аппроксимируют по одиночной равносторонней гиперболической функции с двумя параметрами с помощью нелинейной регрессии (программа SigmaPlot®).
y=а*х/(b+х)
Результаты
Перед исследованием сродства все ХОС, применяемые в настоящей работе, анализируют на степень чистоты и состав последовательностей. Олигомер хитина А6 (Seikagaku Co., Japan) очищают и анализируют перед проведением исследования сродства. Все олигомеры проверяют на чистоту. В таблице 6 приведен состав последовательностей протестированных композиций.
Сродство комплексов между ХОС и ХЧ-гп-39 анализируют с помощью собственной флуоресценции триптофана белка. Изменение интенсивности флуоресценции зависит от концентрации сахара и объясняется реорганизацией молекул растворителя, покрывающих поверхность триптофана в условиях, когда нет связывания. Данные по зависимости флуоресценции от концентрации аппроксимируют с помощью нелинейной регрессии для модели с насыщением одного сайта (программа SigmaPlot®, см. фигуру 15). Константы диссоциации, обнаруженные для D6, D3A3, D2A4, А6 и D5A6, все находятся в микромолярном интервале (фигура 16).
Как ожидалось, величины констант диссоциации уменьшаются с увеличением FA ХОС. Уменьшение констант диссоциации с увеличением FA для серии СП6 гомологов (D6, D3A3, D2A4 и А6) не является линейной функцией. Данные наилучшим образом аппроксимируются гиперболической функцией (y=a*b/(b+x)); а=419,932; b=0,3839; R2=0,9986; фигура 17). Вставка на фигуре 17 показывает относительное сродство (%) (D6=0% и А6=100%) с максимальным сродством 90,8% для D3A3.
Значения констант диссоциации также уменьшаются с увеличением СП и констант FA, как показывает сравнение D3A3 (FA 0,5; Kd 51,1 мкМ) и D5A6 (FA 0,55; Kd 6,9 мкМ). Интересно, что значения Кd равномерно уменьшаются с увеличением числа звеньев D при постоянном числе звеньев А, как показывает сравнение А6 (6 звеньев A; Kd 13,6 мкМ) и D5A6 (6 звеньев А; Kd 6,9 мкМ) (Kd для D5A6 составляет 14% от Kd для D3A3).
Выводы
ХОС связываются с ХЧ-гп-39 со значениями сродства в микромолярном интервале (константы диссоциации). Сродство возрастает с увеличением FA и СП равномерно с увеличением числа звеньев D при постоянном числе звеньев А. Для серии СП6 гомологов 50% уменьшение FA (A6 и D3A3) обусловливает только 9,2% уменьшения сродства. Таким образом, ХОС с FA от 0,5 до 0,75 являются оптимальными партнерами связывания для ХЧ-гп-39 в организме человека. Они проявляют более 90% максимальной емкости связывания и содержат достаточно звеньев D (и таким образом, D-D, D-A, A-D связей) для проявления значительно повышенной биостабильности в человеческом организме. Эти композиции проявляют оптимальную терапевтическую активность, и поэтому они здесь названы терапевтическими хитоолигосахаридами (Т-ХОС).
Подписи к чертежам
Фигура 15. Изотермы связывания для D6, D3A3, D2A4, A6 и D5A6 с ХЧ-гп-39, где Bmax представляет относительную интенсивность флуоресценции при насыщении участка связывания.
Фигура 16. Константы диссоциации для связывания ХОС с ХЧ-гп-39 (логарифмическая шкала для Kd) в зависимости от FA гомолога/олигомера. Пунктирная линия связывает экспериментальные точки для СП6 гомологов.
Фигура 17. Константы диссоциации для СП6 гомологов как функция FA (числа звеньев А). Данные аппроксимируют гиперболической функцией с помощью нелинейной регрессии. Вставка показывает график зависимости относительного сродства СП6 гомологов от числа звеньев А.
Пример 6. Влияние степени деацетилирования хитобиомерного ингредиента на свойства композита «фосфат кальция-хитобиомер»
Композит хитобиомер/фосфат кальция получают путем смешивания твердой фракции (содержащей 5% хитобиомер или хитозан (80% СД), фосфат кальция и минералы) с соответствующим количеством кислой среды. В таблице 7 суммированы протестированные в данном примере композиции. Паста после смешивания является губчатой и гибкой, и время посадки значительно уменьшается с увеличением СД. Механическая прочность также значительно повышается с увеличением СД (40% СД << 70% СД<80% СД).
Как показано на фигуре 18, поверхность скола является пористой, и макропоры (поры диаметром больше 50 мкм) в большом количестве обнаруживаются в композите.
Различные типы (или размеры) кристаллов наблюдаются в композитах, полученных с полимерами разной степени деацетилирования (фигура 19). В композите с частично деацетилированным хитином (40% СД) преобладают палочкообразные кристаллы или частицы (фигура 20(а)), тогда как в композите с 80% СД хитозаном (фигура 20(в)) плотно упакованы пластинчатые кристаллы. В препарате с 70% СД хитозаном (фигура 20(б)) кристаллы занимают промежуточное положение между композитами с хитозаном с 40% СД и хитозаном с 80% СД, так что имеются как палочкобразные, так и пластинчатые кристаллы. Это показывает, что степень деацетилирования хитозана влияет на образование кристаллов в композите, и имеется видимый сдвиг от палочек к пластинчатым структурам при 70% СД. Это различие может быть связано с более высокой емкостью связывания воды у 40-70% СД хитобиомеров по сравнению с хитозаном (80% СД). Это влияет на доступность воды и таким образом воздействует на развитие кристаллов в композите.
Различие в образовании кристаллов в композите особенно важно, поскольку это может влиять на прочность композита и его подверженность биодеградации.
Этот пример показывает, что прочностью композита можно управлять с помощью степени деацетилирования хитобиомера или хитозана. Это модно применять в качестве контроля подверженности биодеградации каркаса композита и в этой связи доступа для проникновения в композит мигрирующих клеток типа макрофагов и остеокластов и таким образом создания пор для проникновения клеток-предшественников хряща и кости, а также эпителиальных клеток, создающих сосудистую сеть, необходимую для развития кости.
Подписи к чертежам
Фигура 18. Поверхность скола композита хитозан/фосфат кальция, содержащего 5% хитобиомера (40% СД). Фотографии СЭМ сняты после инкубации при 37°С в течение 7 дней. Увеличение 1000х.
Фигура 19. Влияние СД на образование кристаллов. Фотографии СЭМ сняты после инкубации при 37°С в течение 7 дней. (а) Хитобиомер (40% СД), увеличение 10000х, и (б) 80% хитозан, увеличение 943000х.
Фигура 20. СЭМ анализ композитов, инкубированных при 37 С в течение 7 дней. (а) Хитобиомер (40% СД), (б) хитобиомер 70% СД и (в) 80% хитозан, увеличение 100000х.
Пример 7.
Заживление кости путем эндохондрального окостенения в бедренной кости крысы
80 самок крыс применяют для проверки действия композита с 5% хитобиомера с фосфатами кальция (ФК). Всю группу животных делят на три подгруппы: 1) контрольная (необработанные); 2) обработанные фосфатами кальция и 3) обработанные ФК, содержащими 5% хитобиомер. Хитобиомер и ФК смешивают вместе в операционной комнате и доводят до консистенции теста.
Всех животных подвергают анестезии и их бедренные кости обнажают в средней части.
Применяют сверло (2 мм), приводимое в действие сжатым воздухом, чтобы произвести отверстие в одном кортикальном слое. Сверло проникает в пространство костного мозга, и свежее отверстие заполняют одним ФК или ФК, содержащим 5% хитобиомер. В одной группе крыс отверстия оставляют как есть, в то время как местное кровотечение контролируют у всех животных. На мышцы и покрывающую их кожу накладывают швы послойно и животным позволяют свободно передвигаться в своих индивидуальных клетках. У некоторых животных местные повреждения умышленно усугубляют путем проникновения через оба кортикальные слоя (насквозь) и путем расширения исходного диаметра области проникновения до 5 мм. Эти случаи считаются претерпевшими обширные повреждения кости по сравнению с другими группами животных, у которых отверстия в кости четко ограничены без повреждения противоположной кортикальной зоны на участке ранения.
Три подгруппы, упомянутые выше, далее делят и забивают животных через 2, 3, 4 и 5 недель после операции. При умерщвлении все образцы осматривают макроскопически и далее готовят для микроскопического исследования.
Результаты
Группа 1: контроль, необработанные животные (одиночное отверстие)
Через 2 недели брешь костного отверстия содержит островки нерегулярных частиц новой кости, отверстие еще не закрыто плотно от прилежащих тканей вне кости. Внутри раненой области также видна новая ткань костного мозга. Через 3 недели заметен тонкий слой кости, затягивающий отверстие в кости. Почти никакой трабекулярной кости не видно на месте ранения. Через 4 недели наблюдаемый, как описано выше, образец становится еще более выраженным. Новое костное покрытие кажется хрупким, как и новая трабекулярная кость под ним (фигура 21). Значительные трещины заметны в исходном кортикальном слое бедра на участке операции. Через 5 недель новое костное покрытие, целиком закрывающее костное отверстие, по-прежнему выглядит как хрупкая ткань, костный мозг не виден, в то же время кортикальном слое имеются множественные пустые лакуны, указывающие на разрушение и гибель остеоцитов.
Группа 2: животные, обработанные с помощью ФК (одиночное отверстие)
Через 2 недели тканевой ответ ограничен участком повреждения кости и проявляется в производстве большого числа новых трабекул в пространстве костного мозга под имплантированной пастой ФК. Большая масса ФК заметна на участке ее имплантации - внутри костного отверстия. Клеточный ответ не замечен вне кортикальных границ, например на надкостнице. Через 3 недели образец ответа близок к таковому, описанному выше, хотя больше костной ткани вовлечено в затягивание отверстия. Через 4 недели новое костное покрытие отделяет раненый костный мозг от внешнего окружения, оно выглядит более организованным и кажется непрерывным слоем и здоровой костью (фигура 22). Далее, под участком исходного отверстия видна вновь образованная ткань костного мозга вместе с рассеянными трабекулами кости. На этом отрезке времени никаких остатков имплантированного ФК нельзя более обнаружить. Через 5 недель процесс развивается в том же направлении, как отмечено за две предыдущие недели. Образование нового костного покрытия представляется завершенным, и оно таким образом отделяет восстанавливающуюся ткань костного мозга от окружающих тканей. К этому времени новая ткань костного мозга ясно видна, тогда как костные трабекулы в пространстве костного мозга демонстрируют множественные трещины внутри себя.
Группа 3: животные, обработанные с помощью хитобиомера с ФК (одиночное отверстие)
Через 2 недели участок повреждения проявляет ясные признаки тканевой реакции в форме образования нового хряща и кости вместе с тканью костного мозга (фигура 23). Участок проникающего повреждения уже полностью закрыт. Уникальной чертой, замеченной к этому времени, является заметный ответ исходной ткани костного мозга, которая занята хорошо развитой сетью новых костных трабекул. Эти последние окружены развитой (богатой) тканью костного мозга, включающей моноядерные клетки, тучные клетки и кровяные капилляры; дополнительная уникальная черта относится к клеточному ответу исходной кортикальной ткани. Это обнаруживается появлением множества клеток в самом кортексе - костных клеток, клеток соединительной ткани и капилляров. Через 3 недели костное покрытие завершено. Покрытие состоит из новой трабекулярной ткани, которая связана с исходным кортикальным слоем с обеих сторон просверленного отверстия. Внутри пространства костного мозга новые костные трабекулы соединяются с внутренней поверхностью исходного кортекса. Хорошо развитая ткань костного мозга ясно видна. Через 5 недель твердое покрытие из трабекулярной кости затягивает полностью место проникновения, и новый «пояс» трабекулярной кости окружает исходный кортекс. Остатки хитобиомера еще видны на месте исходной имплантации. На фигуре 24 показана гистология новой и здоровой костной ткани на 4 неделе после операции.
Обширный дефект кости
Через две недели обследуют обширный дефект (5-6 мм), индуцированный в одном кортикальном слое и обработанный смесью ФК + хитобиомер. К этому времени все внутреннее пространство костного мозга включает большую новую массу трабекулярной кости, которая сливается через проникающее отверстие с новой массой костных трабекул на другой поверхности кортикального слоя. Основная часть исходного кортикального слоя поглощена новым слоем трабекулярной кости, находящейся в прямом сообщении с внешней поверхностью кортикального слоя. В противоположность перепончатой ретикулофиброзной кости, наблюдаемой в сходном случае при обработке одним только ФК, новые трабекулы в пространстве костного мозга кажутся более организованными и более плотными. Исходный кортикальный слой бедренной кости в этом районе имеет множественные лакуны, населенные остеоцитами. Капилляры с эритроцитами также заметны внутри кортикального слоя. Другое животное из той же опытной группы (2 недели, хитобиомер, обширный дефект) демонстрирует большую массу хряща снаружи контура бедренной кости. Это проявление может быть результатом индуктивного стимула хитобиомера на клетки предшественника внутри надкостницы. Вновь образованный хрящ далее претерпевает минерализацию и превращается в активный участок эндохондрального окостенения. Образование новой кости снаружи бедренной кости происходит на таких обширных областях, что оно заканчивается развитием экзостоза, соединенного с исходной бедренной костью.
Через 3 недели мы обследовали случай, где сверло прошло сквозь оба кортикальных слоя. Довольно большие куски интактного кортикального слоя обнаруживаются как отдельные участки далеко от исходной кости. Несомненно, одной из наиболее заметных наблюдаемых черт (особенностей) являются большие массы образованного de novo хряща, которые происходят и поддерживают связь с надкостницей как отпавших кусков кортикального слоя, так и исходного кортикального слоя бедра. Вновь образованный хрящ поддерживает неразрывность с новой хрящевой тканью внутри пространства костного мозга. Новый хрящ обнаруживает все стадии дифференцировки ткани, свойственные данной ткани. Вначале клетки предшественников хрящевой ткани, затем следуют молодые хондробласты, затем зрелые хондроциты, затем гипертрофические хондроциты, затем минерализация вещества матрицы в процессе окостенения, столь характерная для эндохондрального типа окостенения.
Весь вышеописанный процесс продолжается только 3 недели, что указывает на огромный потенциал хитобиомера (5%) в индукции образования нового хряща из клеток-предшественников как внутри надкостницы, так и в ткани костного мозга. По всей видимости, поскольку хитобиомер обладает сильным остеоиндуктивным потенциалом, особенно в случаях более обширного и осложненного повреждения, где природные процессы не способны преодолеть это критическое повреждение таким путем, который привел бы к истиной регенерации исходной ткани, а именно кости, а скорее протекает только процесс заживления, заканчивающийся несрастанием.
Более того, ФК, который служит носителем хитобиомера, сам также не справляется с достижением тех результатов, что наблюдаются в случае образцов после обработки хитобиомером. ФК является хорошим остеоиндуктивным материалом, но не имеет той индуктивной способности, которой обладает хитобиомер, во-первых, в отношении образования хряща, и далее в отношении последующего окостенения.
В итоге, в экспериментах in vivo с применением взрослых самок в качестве модели обнаружено, что хитобиомер обладает остеоиндуктивными свойствами, которые напоминают в значительной степени таковые КМБ. Его мишенями являются генетически определенные клетки в надкостнице, эндосте и ткани костного мозга, которые при получении нужного сигнала запуска дифференцируются в клетки хряща, которые в конечном счете окостеневают. Концентрация, применяемая в настоящем исследовании: 5% представляется высокоактивной, исследование зависимости ответа от дозы необходимо для установления оптимального процента хитобиомера, необходимого для получения вышеописанных эффектов.
С применением поляризованного света во время микроскопических наблюдений участка кости анализируют ориентацию волокон коллагена (коллаген типа I). В интактной кости у этих волокон ориентация регулярная, тогда как в более «примитивной» кости эмбрионального типа такая ориентация отсутствует. Фигура показывает, что волокна обладают регулярной ориентацией, что указывает на то, что происходящее образование кости идет по пути эндохондрального окостенения. Показано, что макрофаги захватывают композит ФК-хитобииомер, что приводит к постепенному разрушению хитобиомера по мере замещения его новой хрящевой и костной тканью.
Выводы. В итоге в экспериментах in vivo с применением взрослых самок в качестве модели обнаружено, что хитобиомер обладает остеоиндуктивными свойствами, которые напоминают в значительной степени таковые КМБ. Образование кости идет по пути эндохондрального окостенения, как показано с помощью гистологических фигур. Процесс эндохондрального окостенения характеризуется образованием хряща до образования кости. Образование хряща не нуждается в кислороде, в противоположность этапу образования кости, так что образование новых кровеносных сосудов необходимо перед тем, как может произойти превращение хряща в кость.
Реакция на хитобиомер характеризуется образованием новой хрящевой ткани внутри имплантата с хитобиомером и индукцией обильного образования новой сосудистой ткани внутри нового хряща, что приводит к замещению хитобиомера новой тканью, так что только остатки хитобиомера обнаруживаются в имплантатах. Далее, клетки хряща образуются поблизости от остатков хитобиомера, и минерализованный хрящ обнаруживается присоединенным к вновь образованной костной ткани, указывая на то, что образование новой кости идет по пути эндохондрального окостенения. Хитобиомер обладает индуктивными свойствами на остеогенные клетки как в ткани костного мозга, так и в надкостнице. Хондроциты из хряща до образования кости и хондроциты на грани остеобласт-хондроцит претерпевают окончательную дифференциацию в гипертрофические хондроциты, экспрессирующие коллаген типа II и секретирующие ангиогенные факторы, которые минерализуют кальцифицированный хрящ.
Подписи к чертежам
Фигура 21. Необработанные животные через 4 недели после операции. Изображение показывает место имплантации, хрупкая ткань покрывает зев повреждения, и статус заживления характеризуется как несрастание.
Фигура 22. Животные, обработанные фосфатом кальция, через 4 недели после операции. Изображение показывает участок имплантата, остаточные кристаллы фосфата кальция погружены в хрупкую ткань, перекрывающую зев раны. Статус заживления характеризуется как несрастание.
Фигура 23. Животное, обработанное композитом из фосфата кальция-хитобиомера, через 2 недели после операции. Изображение показывает участок имплантата, кортикальный слой покрывает зев раны с плотной трабекулярной костью под новым кортикальным слоем. Статус заживления характеризуется как полное срастание.
Фигура 24. Животное, обработанное композитом из фосфата кальция-хитобиомера, через 4 недели после операции. Изображение показывает здоровую новую трабекулярную кость.
Пример 8. Действие Т-ХОС при ревматоидном артрите с применением модели индуцированного коллагеном типа II артрита крыс.
Материалы и способы
Препарат хитоолигомеров, включающих ≥60% Т-ХОС композиций, получен от Genis согласно примеру 2 (G051128), на фигуре 25 показана композиция. Субъектами животными в этом исследовании являются самки крысы линии Lewis весом 159-179 г (среднее 171 г) на 0 день исследования. Животных идентифицируют по внятным номерам у основания хвоста, отображающим номер группы и животного. После перемешивания все клетки помечают номером протокола, номерами группы и животного с помощью соответствующего цветового кода.
Животные (10 штук на группу для артрита, 4 штуки на группу для нормальных (контроля)) располагают по 4-5 в клетки, подвергают анестезии изофлураном и вводят 300 мкл неполного адъюванта Фрейнда, содержащего 2 мг/мл бычьего коллагена типа II, у основания хвоста и в два участка на спине на день 0 и 6. Обработка Т-ХОС в воде начинается на день 0 исследования и продолжается в течение 17 дней с уточнениями концентрации, производимыми на день 0, 6, 9-17 (дни взвешивания).
Экспериментальные группы показаны в таблице 8.
Основным тестируемым параметром является диаметр левой и правой лодыжки задней лапы крысы, который измеряют каждый день в течение периода воспаления. Другими исследуемыми параметрами являются гистологические оценки, снимаемые у животных на 17 день. Гистологическую оценку проводят на суставах лодыжки и колена. Суставы разрезают напополам вдоль (лодыжка) или по фронтальной плоскости (колено). Образцы сохраняют и освобождают от кальция (5% муравьиная кислота) и подвергают далее ступенчатой обработке спиртом и просветляющим агентом, инфильтруют и заключают в парафин, делают срезы и окрашивают толуидиновым синим. Все ткани от всех животных подвергают микроскопическому исследованию и данные наблюдений вводят в компьютеризованную систему обработки данных.
Действие Т-ХОС на воспаление анализируют с помощью ANOVA и t-критерия (параметрических и непараметрических тестов) по данным о диаметре лодыжки.
Результаты
Фигура 26 показывает основной способ мониторинга воспаления (оценка артрита). Диаметр левой и правой лодыжки измеряют ежедневно, начиная с 9 дня. Фигура 27 показывает оценка РА у крыс с введенным коллагеном без другой обработки. Воспаление определяется на 10 день и постепенно возрастает до дней 15-17.
Фигура 28 показывает действие различных доз Т-ХОС на степень раннего развития воспаления лодыжки (день 10-12). Имеется отчетливый эффект зависимости от дозы от группы АВ (0 доза) до группы А0,25, где уменьшение степени воспаления составляет 58% с высокой значимостью (р<0,01). Далее с более высокой дозой действие постепенно исчезает.
Фигура 29 показывает действие различных доз Т-ХОС на степень развития позднего воспаления (день 12-17). Ранее наблюдаемый эффект зависимости от дозы исчез.
Проводят также анализ всей линейной фазы воспаления лодыжки (день 9-15). Единственной группой, демонстрирующей значительное уменьшение степени воспаления за этот период, является А0,25 группа, где эффект составляет 28% (t-критерий, р<0,05, см. таблицу 9).
Для гистологической оценки воспаления и повреждения с 17 дня основные результаты суммированы в таблице 9 для наиболее активной группы. Это группа А0,25. Резорбция кости уменьшается на 48%, и это самое сильное проявление по всем гистологическим параметрам. Фигура 30 показывает ясный эффект дозы, но группа А0,25 представляется выпавшей из зависимости. Имеется 28% значительное уменьшение воспаления и 40% уменьшение образования рубцовой ткани (паннус) в воспаленной ткани. Имеется 29% уменьшение повреждения хряща за счет Т-ХОС, но это действие не является статистически значимым. Наконец, имеется значительное уменьшение (33%) гистопатологической оценки, но этот фактор является суммой оценок воспаления, паннуса, повреждения хряща и резорбции кости для каждой крысы.
Выводы
Имеется сильный значимый эффект Т-ХОС на ранней стадии индуцированного коллагеном типа II артрита у крыс. Уменьшение степени воспаления лодыжек составляет в наилучшем случае 58% на ранней стадии. Этот эффект зависит от дозы, демонстрируя максимальное действие в группе А0,25, что эквивалентно 0,5 г суточной дозы у человека. При более высоких дозах действие постепенно исчезает. Однако все гистологические оценки, кроме одной, показывают значительное уменьшение состояния артрита в ответ на оптимальную дозу Т-ХОС под конец эксперимента. Самое сильное действие наблюдается как уменьшение дегенерации кости (48%) и предотвращение паннуса (40%).
Сделано заключение, что оральное применение препарата Т-ХОС значительно уменьшает дегенерацию ткани и понижает формирование рубцовой ткани в воспаленных суставах. Это подтверждает другие результаты, указывающие на способность Т-ХОС к регенерации тканей (пример 7) и уменьшению роста фибробластов в культуре ткани (пример 9).
Подписи к чертежам
Фигура 25. ВЭЖХ анализ тестируемого Т-ХОС материала, партия G051128. Фигура показывает относительные количества сахаров различного молекулярного веса с СП от 2 до приблизительно 15.
Фигура 26. Измерение диаметра лодыжек в качестве индикации воспаления (оценка артрита).
Фигура 27. ЛД (диаметр лодыжки) как оценка артрита. Диаметр лодыжки (левая + правая лодыжка) у 10 крыс, инъецированных коллагеном на 0 день (группа 2, артрит + вода).
Фигура 28. Действие Т-ХОС (все дозы) на степень ранней стадии воспаления лодыжки (степень ранней стадии воспаления как среднее увеличение левой и правой лодыжек на день 10, 11 и 12). Приведены средние величины и стандартные ошибки.
Фигура 29. Действие Т-ХОС (все дозы) на степень поздней стадии воспаления лодыжки (степень поздней стадии воспаления как среднее увеличение левой и правой лодыжек на день 12-17). Приведены средние величины и стандартные ошибки.
Фигура 30. Действие Т-ХОС (все дозы) на резорбцию кости согласно гистологическому исследованию. Приведены средние величины и стандартные ошибки.
Пример 9. Ингибирование пролиферации фибробластов иммобилизованными Т-ХОС
Материалы и способы
Нанесение покрытия на микроплаты
Раствор для покрытия микроплат получают путем растворения желатина (Bio-Rad, USA) в сбалансированном солевом растворе Хенкса (HBSS) при 37°С до концентрации 0,1%. Половину этого раствора дополняют Т-ХОС до конечной концентрации 1000 мкг/мл, и другая половина служит в качестве контроля. Все растворы стерилизуют с помощью фильтрации (0,22 мкм фильтры Nalgene).
На микроплаты (96 ячеек, Nunc, Denmark) наносят покрытие путем добавления 100 мкл желатинового раствора в каждую ячейку и инкубации при 4°С в течение ночи. Избыток раствора отбрасывают и платы хранят с HBSS при 4°С.
Рассев и подсчет фибробластов
Фибробласты человека собирают с помощью обработки трипсином достигшего конфлюэнтности культурального флакона Т25 и рассевают при концентрации 1×105 клеток/мл в среде RPMI 1640 с 10% сывороткой в ячейки микроплаты с покрытием. Клетки выдерживают при 37°С и 5% CO2 в течение 3 дней перед определением числа клеток путем подсчета с помощью светового микроскопа. Каждое экспериментальное условие повторяют для 8 ячеек.
Количество клеток подсчитывают в определенном поле в каждой из 8 ячеек (плотность фибробластов). Подсчет производят после 1, 2 и 3 дней в культуре. Данные анализируют статистически (ANOVA).
Результаты
Статистический анализ выявляет ненормальное распределение данных. Поэтому применяют тесты ANOVA для рядов с последующим односторонним анализом по Крускал-Уоллис для рядов. Иммобилизованный в желатине Т-ХОС значительно задерживает рост фибробластов, как показано на фигурах 31 и 32.
Выводы
В этом эксперименте мы смогли продемонстрировать, что когда Т-ХОС помещены в желатин, покрывающий плату для культуры, они способны значительно уменьшить пролиферацию фибробластов на поверхности желатина.
Объединяя научные сообщения относительно действия хитозана на заживление ран, наши ранние опыты с хитобиомерами, как олигомерами, так и полимерами, и настоящие результаты, мы заключаем, что Т-ХОС способны подавлять образование фиброзной ткани фибробластами, в то же время ускоряя регенерацию аутентичных тканей, например костной, хрящевой и других твердых и мягких тканей. Такой механизм заживления ран обладает большими преимуществами, поскольку он не приводит к образованию рубцовой ткани и сохраняет целостность и функциональность исходной ткани.
Подписи к чертежам
Фигура 31. Рост фибробластов (плотность против времени) на желатиновом слое в присутствии и в отсутствие 100 мкг/мл иммобилизованных Т-ХОС. Среднее (n=7-8), ± стандартное отклонение.
Фигура 32. Статистическая оценка действия Т-ХОС на пролиферацию фибробластов во время инкубации в течение 3 дней (д1-д3). С обозначает необработанные и О обозначает обработанные клетки.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОБНЫЙ СПОСОБ И КОМПОЗИЦИЯ ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННОГО ПРИМЕНЕНИЯ | 2011 |
|
RU2718541C2 |
| ОЛИГОМЕР ХИТИНА ИЛИ ХИТОЗАНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1990 |
|
RU2057760C1 |
| СПОСОБ ПОЛУЧЕНИЯ СМЕСИ ГЛЮКОЗАМИНА, ОЛИГОСАХАРИДОВ ХИТОЗАНА И НИЗКОМОЛЕКУЛЯРНОГО ХИТОЗАНА (ВАРИАНТЫ) | 2003 |
|
RU2259783C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХИТОЗАНА | 2009 |
|
RU2548178C2 |
| ТРЕХМЕРНЫЙ ПОРИСТЫЙ КОМПОЗИТНЫЙ МАТЕРИАЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2714671C1 |
| СОДЕРЖАЩАЯ ХИТОЗАН КОМПОЗИЦИЯ, СТЕРИЛИЗОВАННАЯ ПУТЕМ НАГРЕВА, А ТАКЖЕ СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2712271C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИТОЗАНА | 1991 |
|
RU2067588C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФИТОХИТОДЕЗА | 2001 |
|
RU2204402C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМЫХ ФОРМ ХИТОЗАНА | 2001 |
|
RU2215749C2 |
| ХИТОЗАНОВАЯ КОМПОЗИЦИЯ | 2008 |
|
RU2482133C2 |
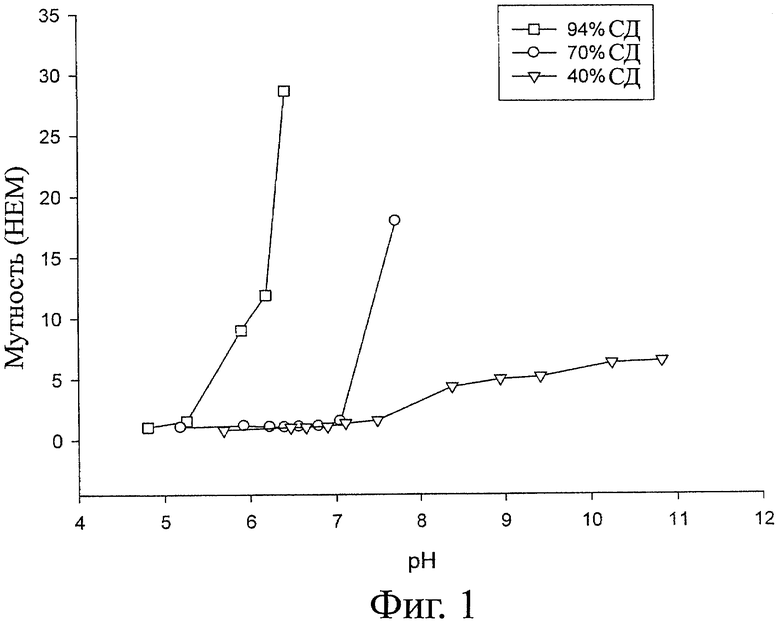
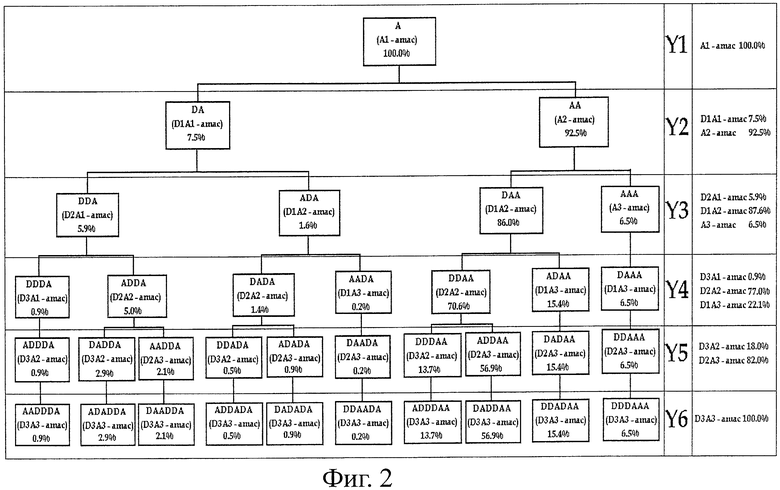
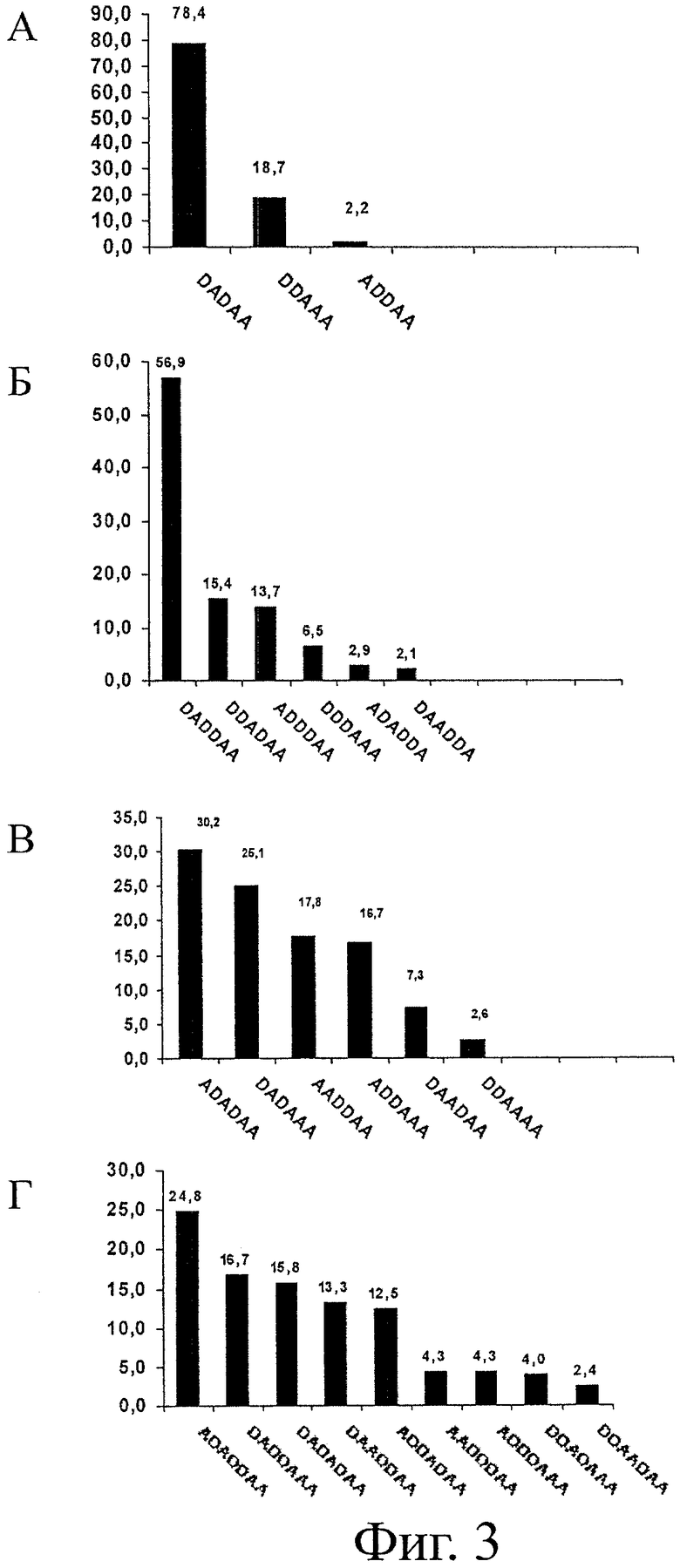
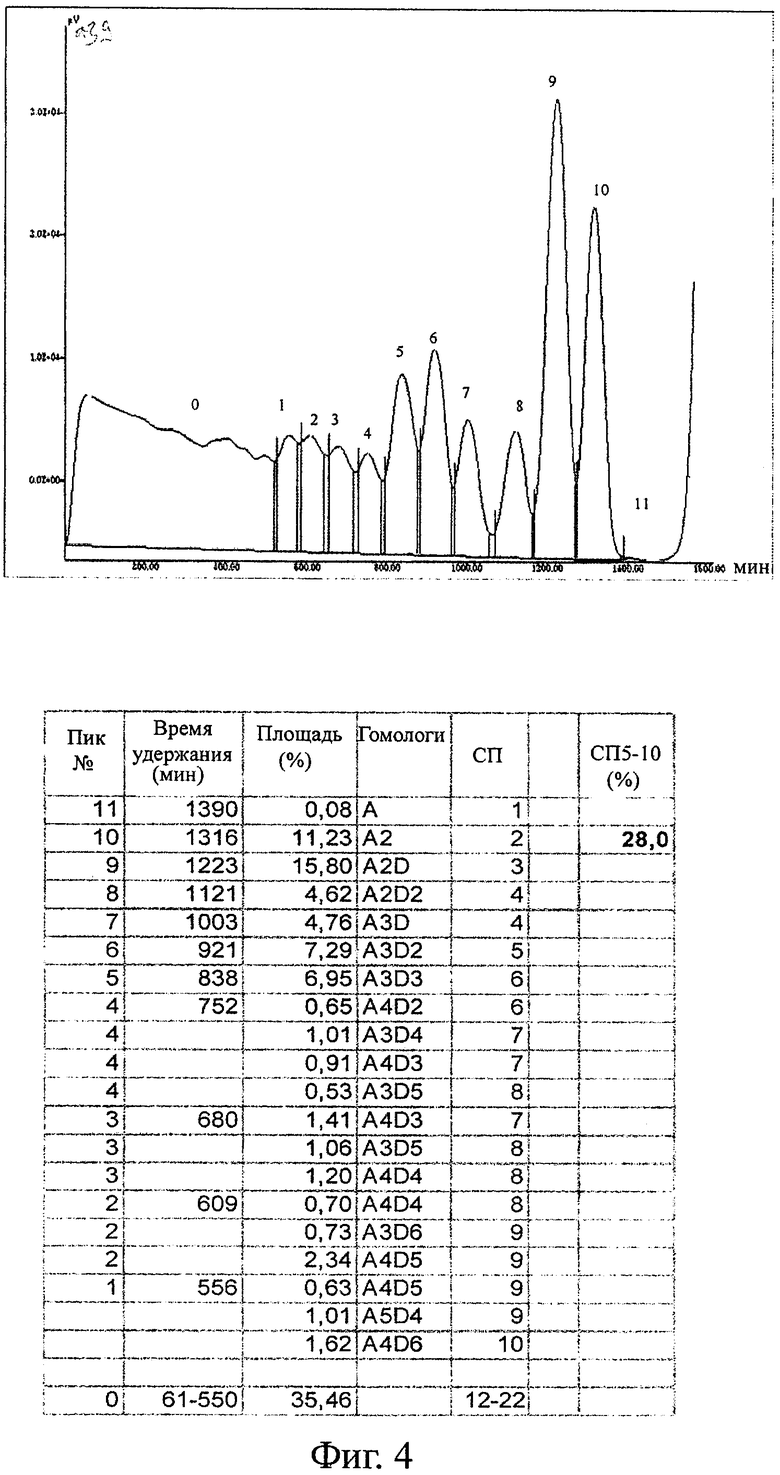
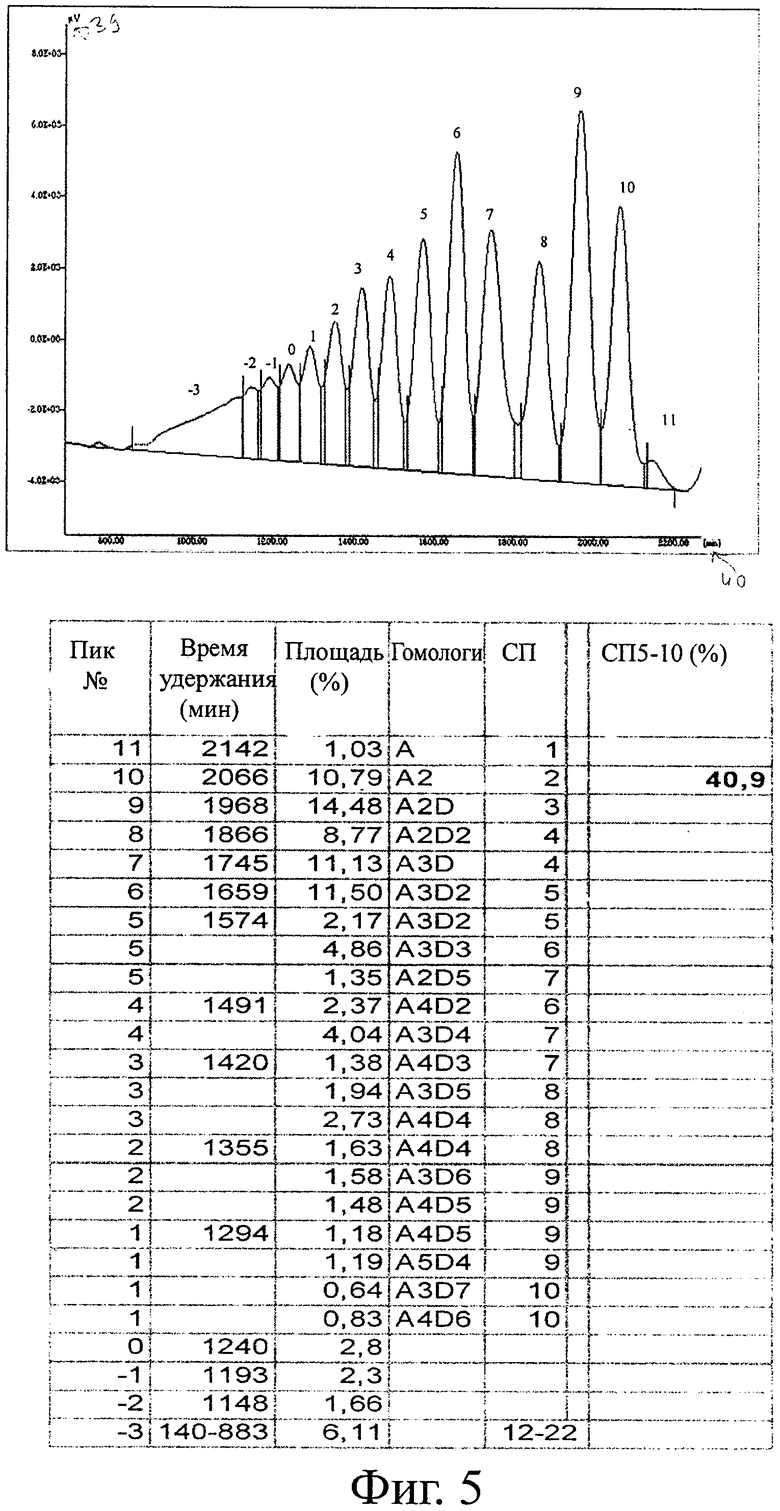
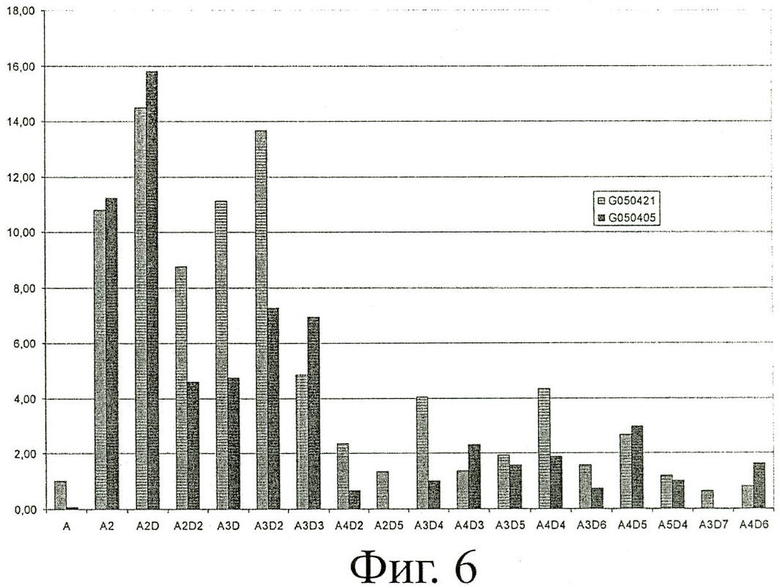
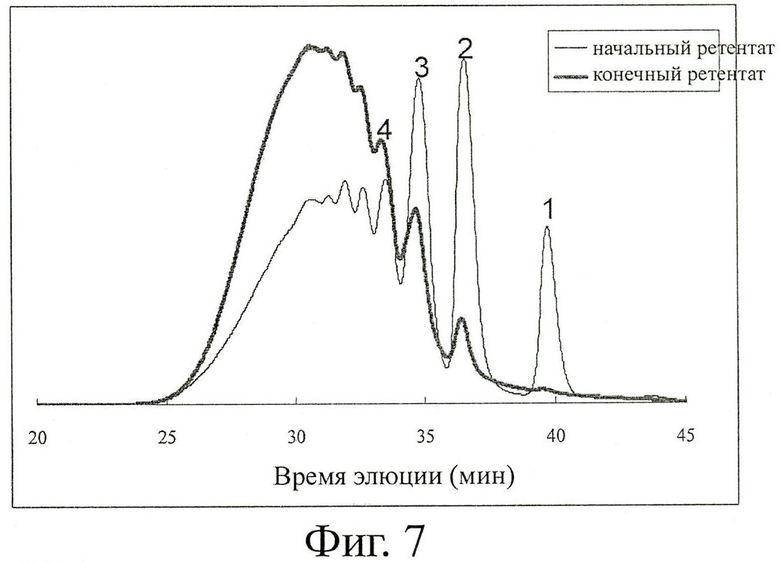
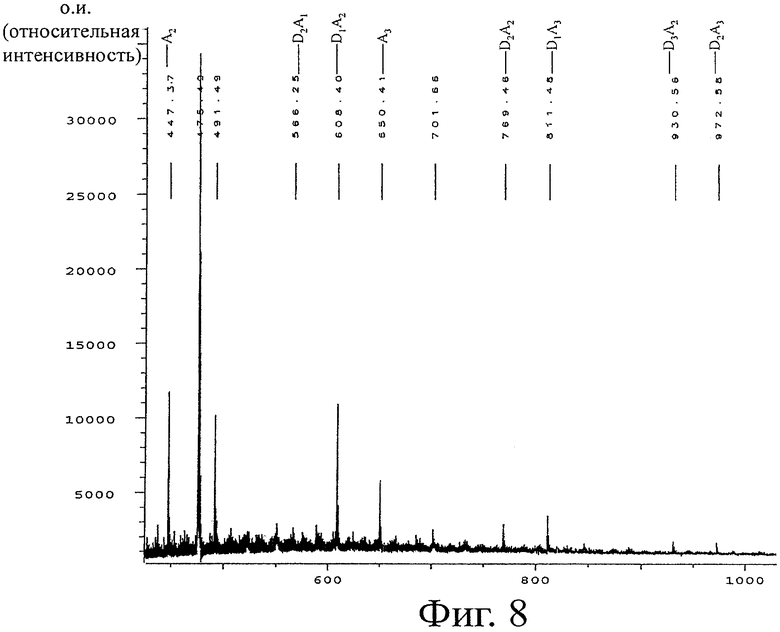
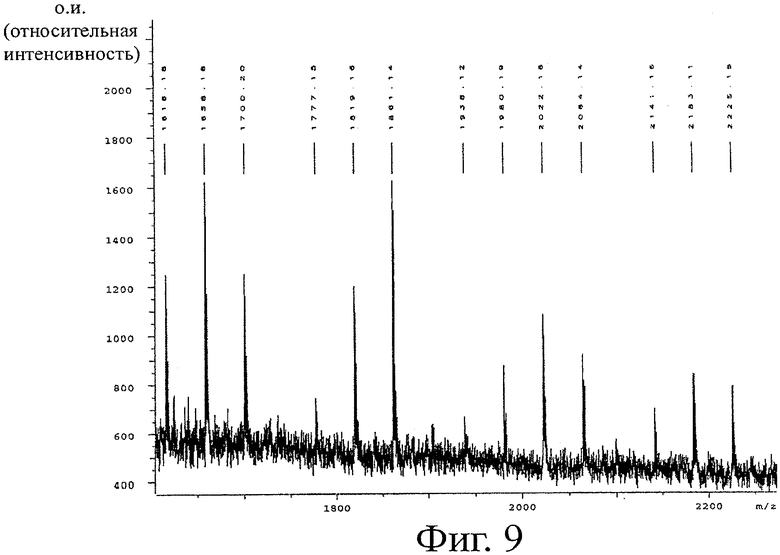
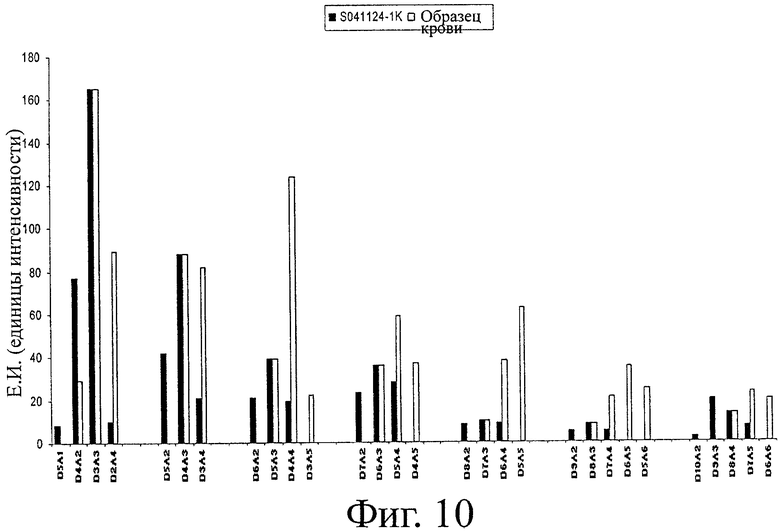
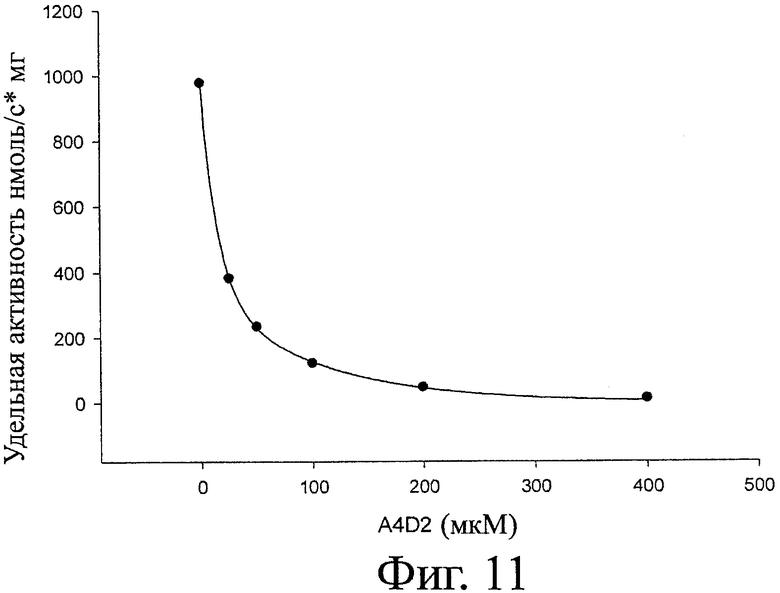
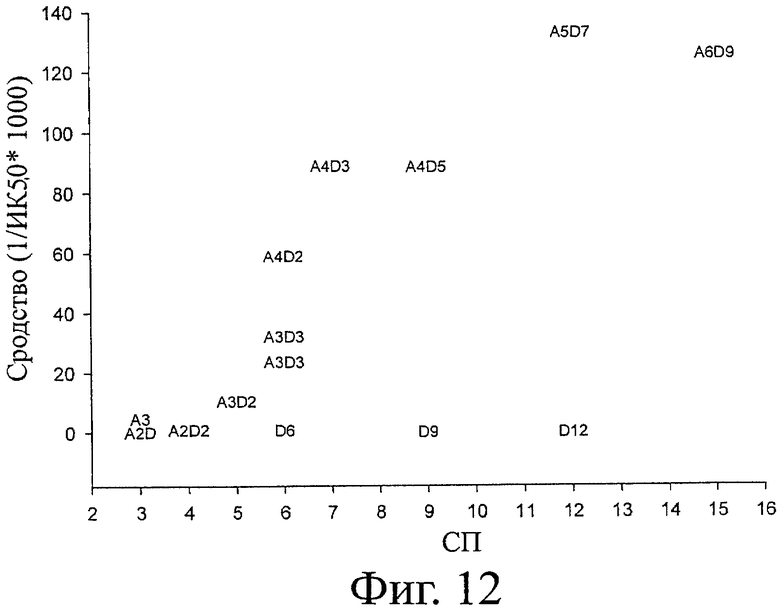
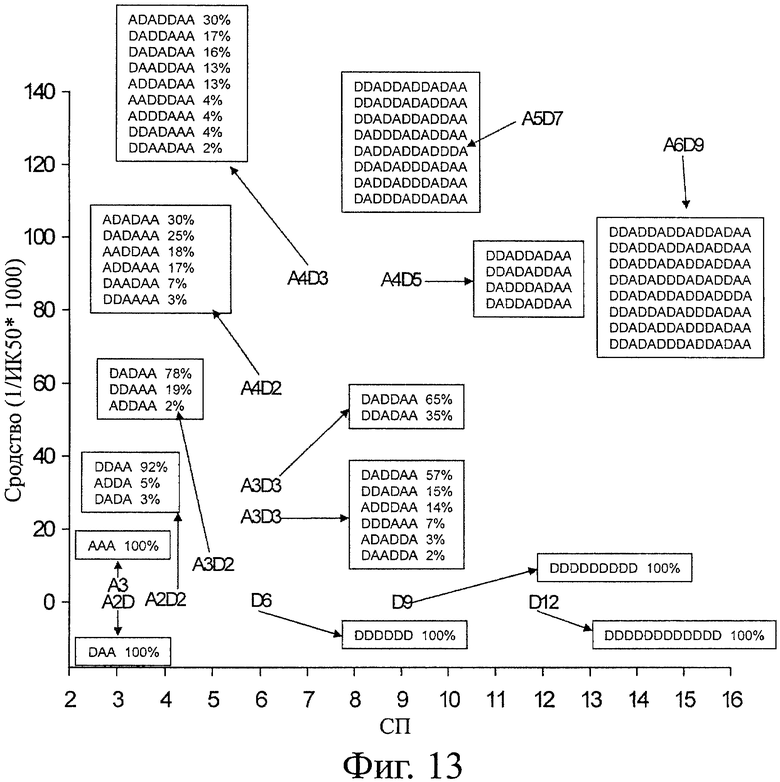
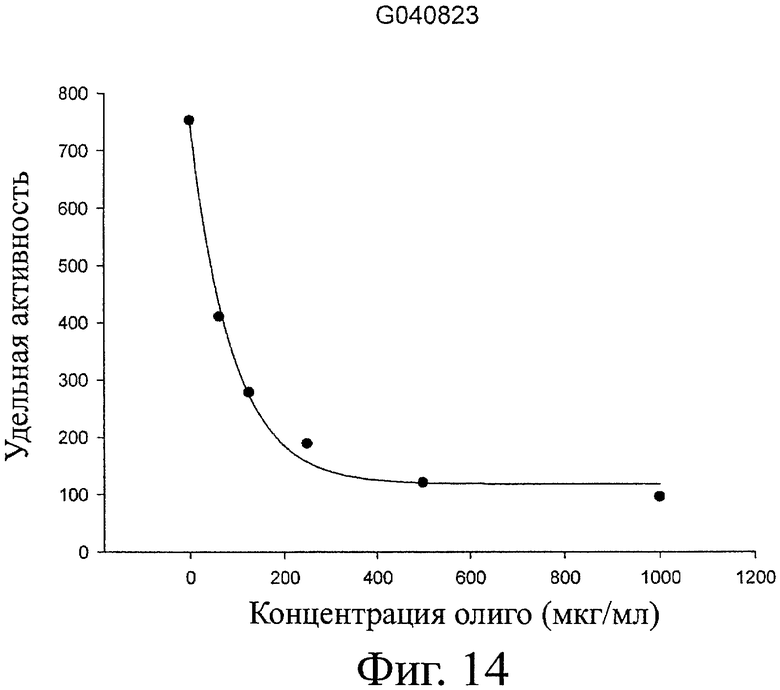
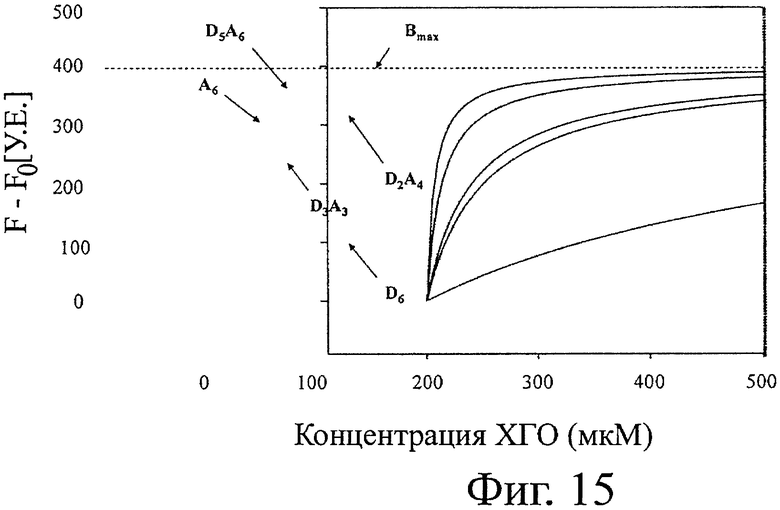

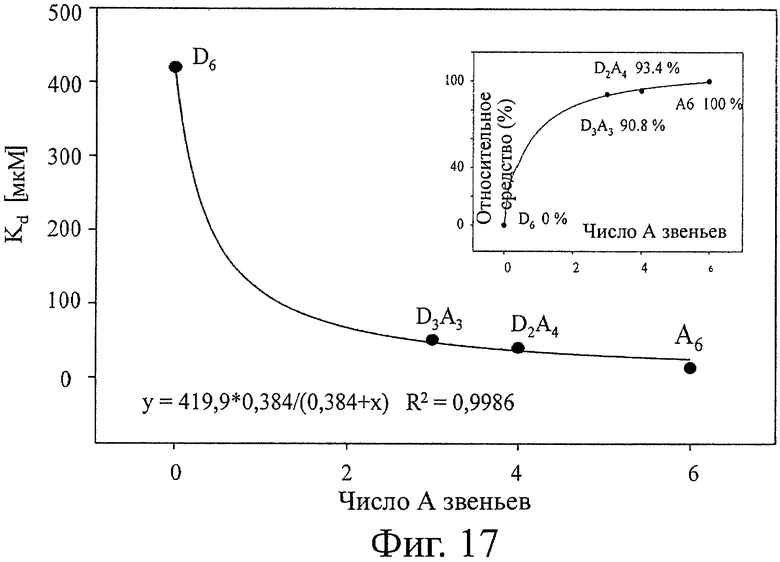

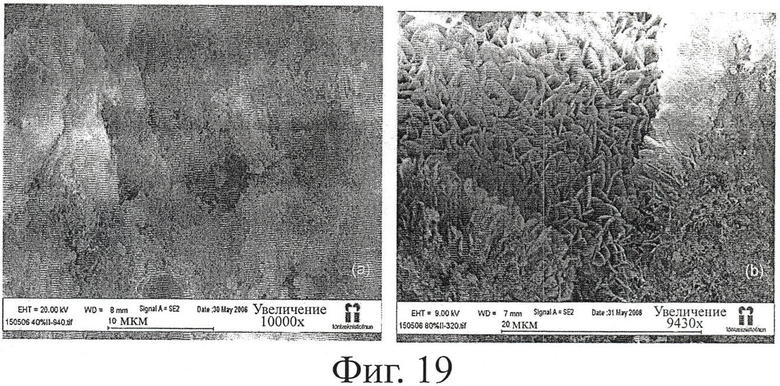
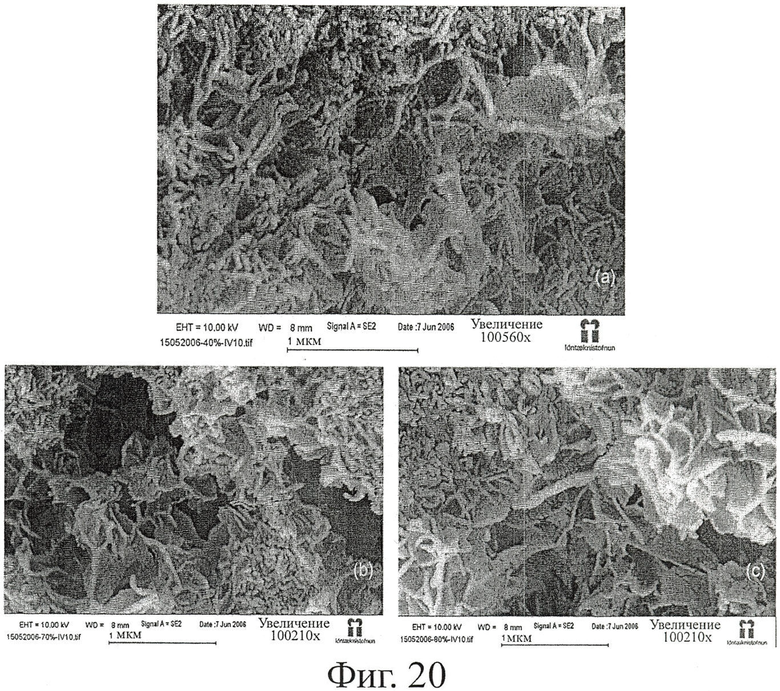
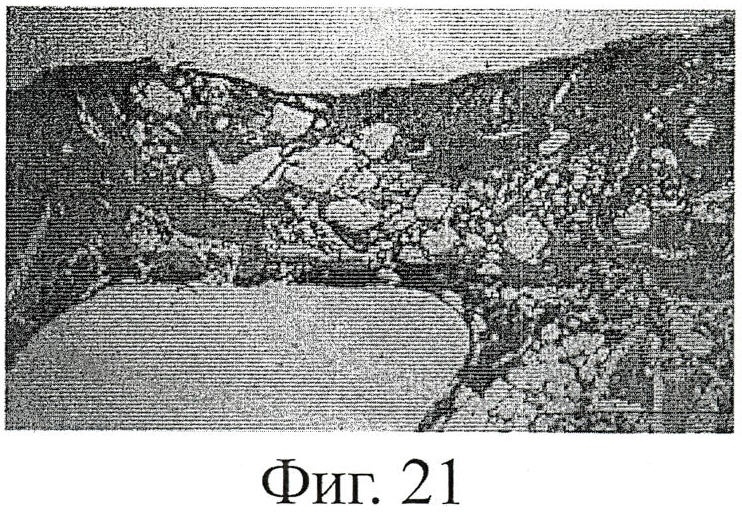
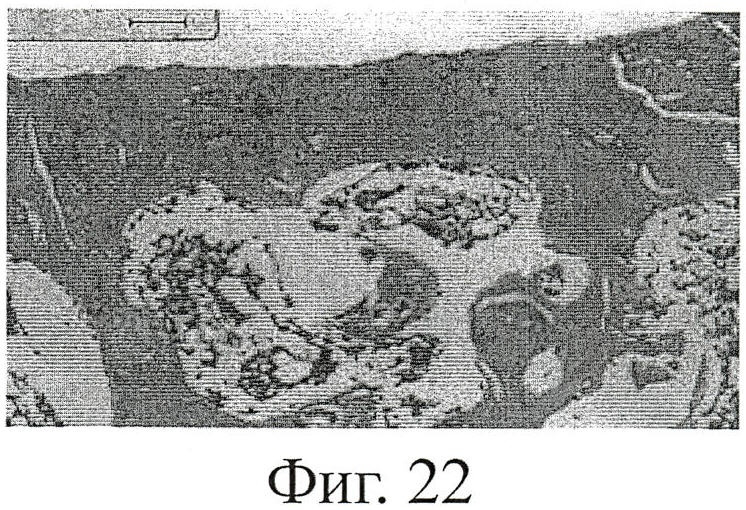
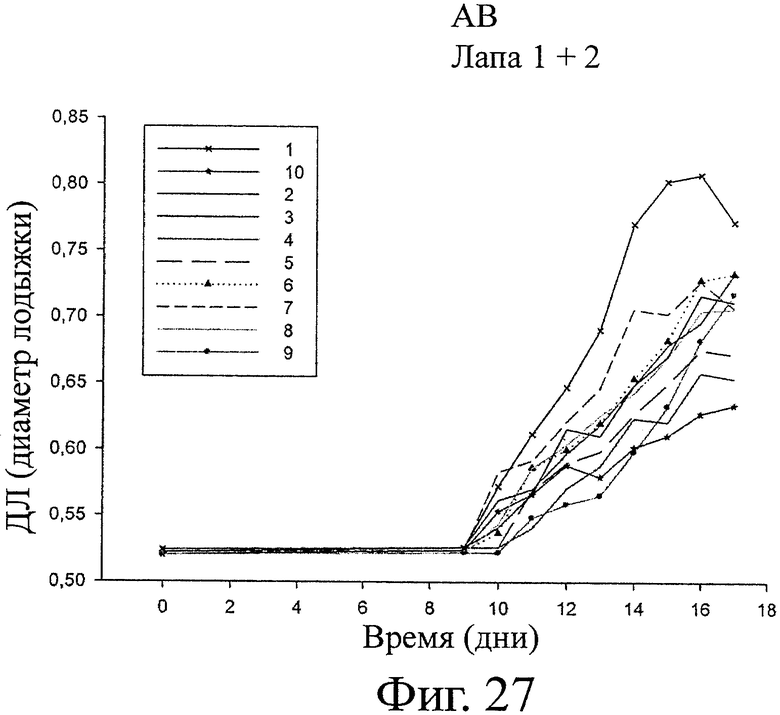
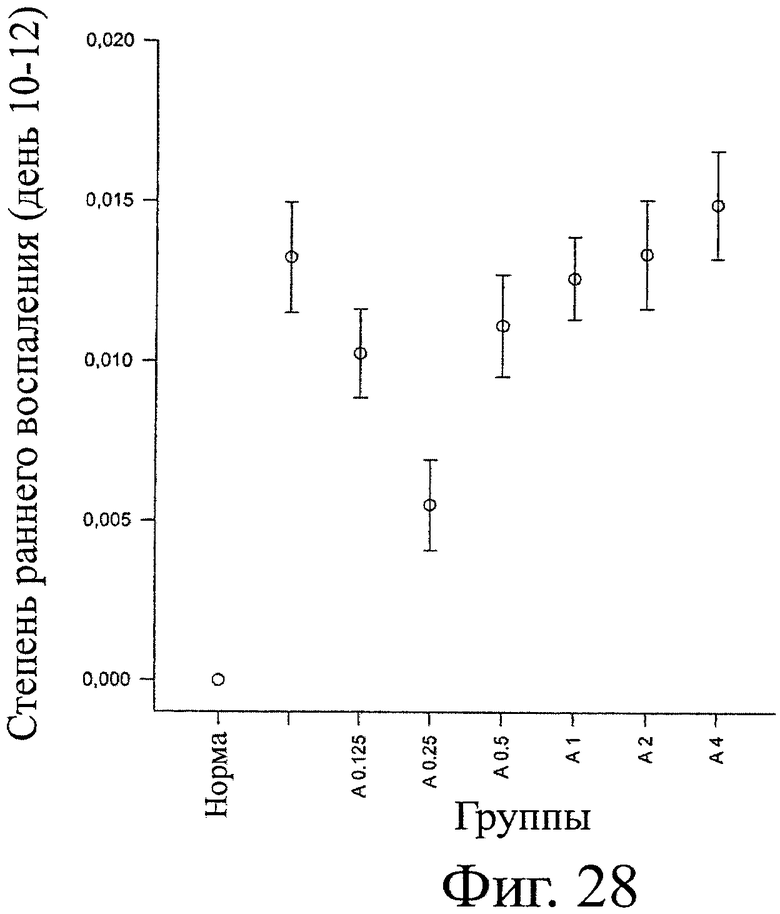
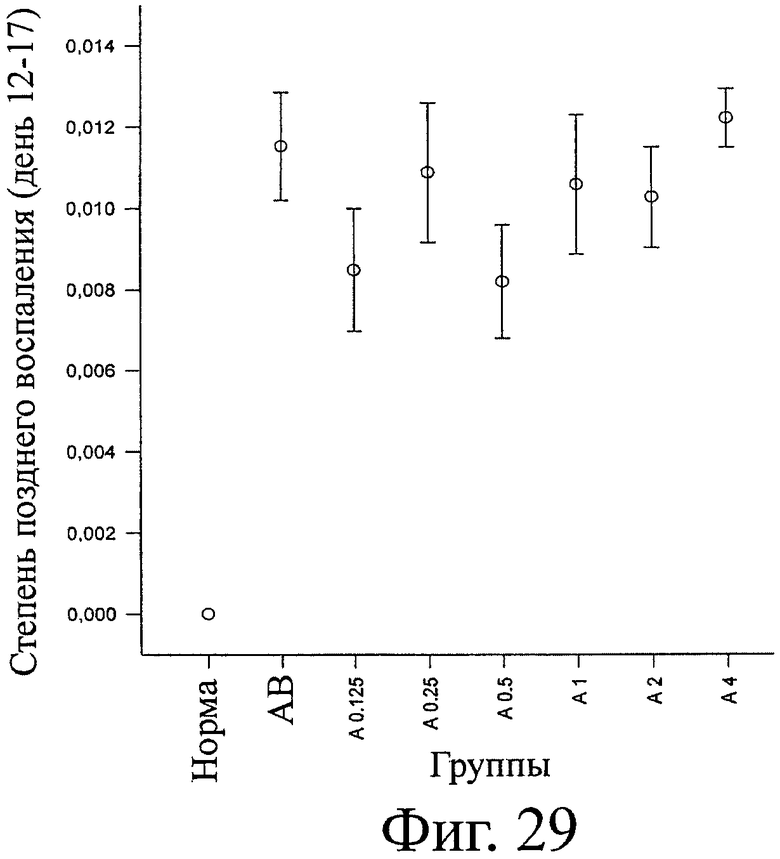
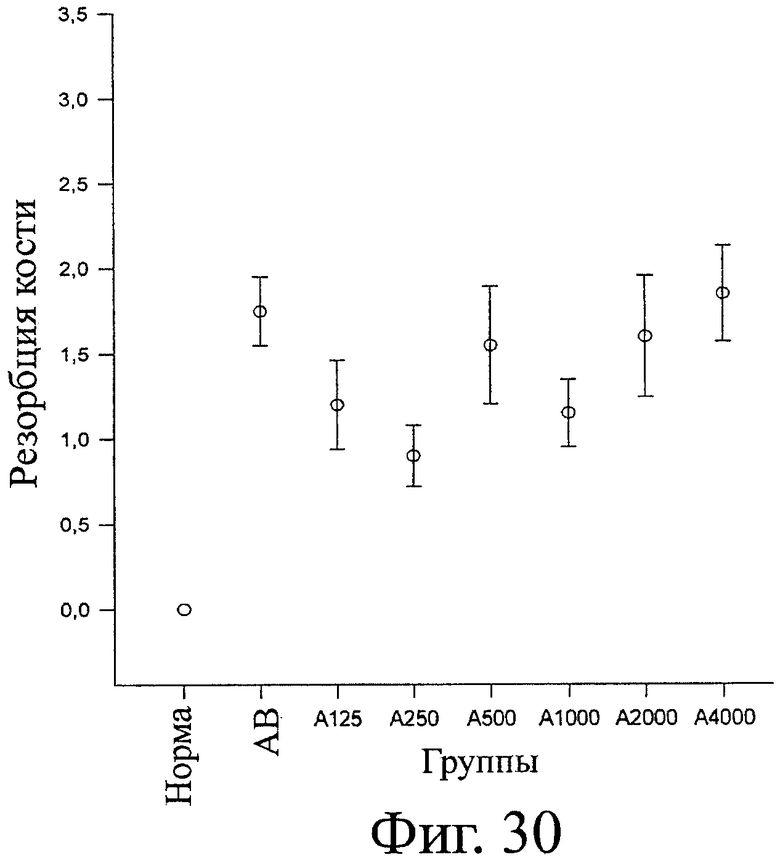
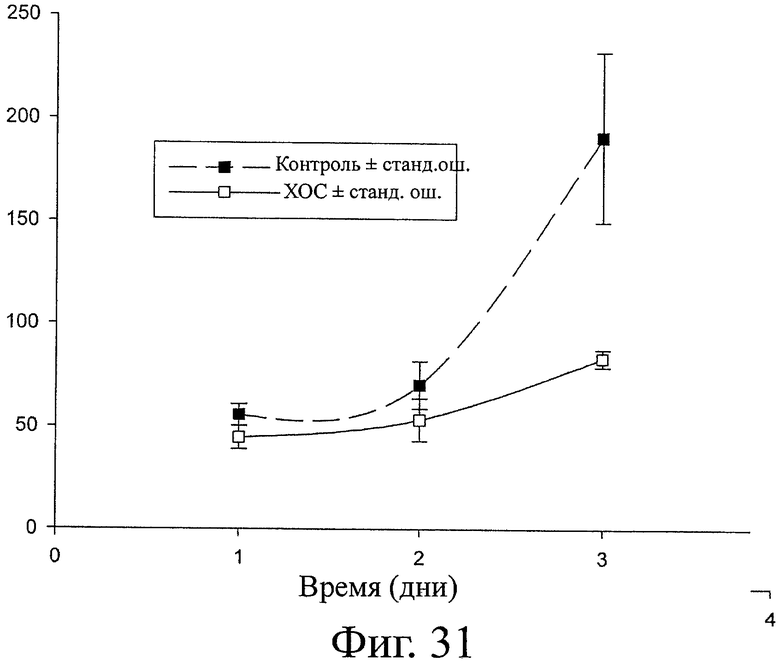
Изобретение относится к композициям, включающим биологически активные хитиновые олигомеры и их очищенные от эндотоксинов и частично деацетилированные хитиновые полимерные предшественники, и их применению в фармацевтических композициях для регенерации тканей, композициях с биоматериалами, медицинских приспособлениях и к процессам для получения упомянутых олигомеров. Способ извлечения высокоочищенного и полностью растворимого частично деацетилированного полимера хитина со степенью деацетилирования (СД) 30-60% включает этапы: нейтрализация частично деацетилированного хитина; растворение частично деацетилированного хитина в кислотном растворе; удаление нерастворившихся частиц с помощью последовательных этапов фильтрации; доведение рН раствора до величины выше 8; осаждение полностью растворенного и очищенного частично деацетилированного хитина в виде осадка путем повышения температуры и добавления соли, где осадок извлекают и промывают после осаждения путем фильтрования или центрифугирования и где температура промывной воды и осадка находится выше 40°С. Также изобретение относится к композиции для регенерации ткани, включающей терапевтически активные хитоолигомеры N-ацетилглюкозамина (А) и глюкозамина (D), где композиция включает гетерохитоолигомеры, которые должны удовлетворять следующим критериям: упомянутые олигомеры обладают длиной цепи в интервале 5-20 мономерных остатков; каждая олигомерная цепь может иметь два остатка N-ацетил-D-глюкозамина (АА) на любом или на обоих концах олигомерной цепи, остающаяся внутренняя часть олигомера имеет максимальное количество остатков А, последовательность упомянутой внутренней части цепи такова, что остаток N-ацетил-О-глюкозамина (А) не соседствует с другим остатком N-ацетил-О-глюкозамина (А) (как, например, АА). Биоматериал на основе указанных композиций усиливает регенерацию кости и гемостаз при заживлении сломанной или серьезно поврежденной кости. 4 н. и 17 з.п. ф-лы, 32 ил., 9 табл.
1. Способ извлечения высокоочищенного и полностью растворимого частично деацетилированного полимера хитина со степенью деацетилирования (СД) 30-60%, где способ включает этапы:
- нейтрализация частично деацетилированного хитина;
- растворение частично деацетилированного хитина в кислотном растворе;
- удаление нерастворившихся частиц с помощью последовательных этапов фильтрации;
- доведение рН раствора до величины выше 8;
- осаждение полностью растворенного и очищенного частично деацетилированного хитина в виде осадка путем повышения температуры и добавления соли,
где осадок извлекают и промывают после осаждения путем фильтрования или центрифугирования, и где температура промывной воды и осадка находится выше 40°С.
2. Способ по п.1, где молекулярная масса частично деацетилированного хитина выше 10 кДа.
3. Способ по п.1, где повышенная температура раствора частично деацетилированного хитина включает повышение температуры до 40-100°С.
4. Способ по п.1, где доведение раствора частично деацетилированного хитина включает повышение рН до величины от 8 до 13.
5. Способ по п.1, где солью, применяемой для высаливания, является любая соль с высокой хаотропностью, например, хлористый натрий или любая соль кислоты, применяемой для растворения полимера, предпочтительно соль трикарбоновой или дикарбоновой или монокарбоновой органической кислоты, например, лимонной кислоты, яблочной кислоты или уксусной кислоты, или любая другая соль, например, сульфат аммония, мочевина, гуанидиний хлорид.
6. Способ по п.1, где концентрация соли находится между 2% и насыщением.
7. Способ по п.1, где хитин обрабатывают неорганической или органической кислотой перед этапом деацетилирования.
8. Способ по п.1, где частично деацетилированный полимер хитина дополнительно экстенсивно обрабатывают с помощью эндо-хитиназ семейства 18 перед процессом извлечения по п.1.
9. Способ по п.1, где относительный выход терапевтически активных гетерополимеров и гетероолигомеров, образованных во время обработки эндо-хитиназами семейства 18, контролируют путем значительного растворения хитинового сырья в щелочном растворе перед гомогенным деацетилированием.
10. Способ по п.1, где частично деацетилированный хитин и/или хитозан со степенью деацетилирования (СД) 30-60% смешивают с композитами фосфата кальция, чтобы регулировать физико-химические, механические и биологические свойства конечного композита.
11. Композиция частично деацетилированного полимера хитина, полученного согласно способу по пп.1-8, обладающая эффектом регенерации ткани.
12. Композиция для регенерации ткани, включающая терапевтически активные хитоолигомеры N-ацетилглюкозамина (А) и глюкозамина (D), где композиция включает гетерохитоолигомеры, которые должны удовлетворять следующим критериям:
- упомянутые олигомеры обладают длиной цепи в интервале 5-20 мономерных остатков;
- каждая олигомерная цепь может иметь два остатка N-ацетил-D-глюкозамина (АА) на любом или на обоих концах олигомерной цепи,
- остающаяся внутренняя часть олигомера имеет максимальное количество остатков А,
- последовательность упомянутой внутренней части цепи такова, что остаток N-ацетил-D-глюкозамина (А) не соседствует с другим остатком N-ацетил-D-глюкозамина (А) не соседствует с другим остатком N-ацетил-D-глюкозамина (А) (как, например АА).
13. Композиция по п.12, где композицию частично деацетилированного полимера хитина дополнительно обрабатывают эндо-хитиназой семейства 18.
14. Фармацевтическая композиция для регенерации тканей, включающая частично деацетилированный полимер хитина по любому из пп.11-13.
15. Фармацевтическая композиция по п.14 в форме, выбранной из группы, состоящей из порошка, суспензии, геля, золя, аэрозоля, пасты, пленки, пены, пилюли и капсулы.
16. Фармацевтическая композиция по п.15, включающая фармацевтически приемлемый наполнитель.
17. Композиция по любому из пп.12 или 13 для производства биоматериала/медикамента.
18. Композиция по п.17 для производства биоматериала/медикамента для усиления регенерации тканей.
19. Композиция по п.18, где биоматериал усиливает регенерацию кости и гемостаз при заживлении сломанной или серьезно поврежденной кости у млекопитающего.
20. Композиция по п.18, где биоматериал включает дополнительный компонент, выбранный из следующих: фосфатов кальция включая гидроксиапатит, сульфата кальция, триполифосфата натрия, алгината, коллагена и гиалуроновой кислоты.
21. Композиция по любому из пп.12 или 13 для обработки поверхностей, экспонированных биологическому материалу и/или ткани, во время применения в медицинском устройстве.
| CN 1554267, 15.12.2004 | |||
| Многочастотный доплеровский способ измерений скорости течений в водной среде | 2022 |
|
RU2795579C1 |
| US 5077052 А, 31.12.1991 | |||
| МНОГОФУНКЦИОНАЛЬНОЕ ТРЕНИРОВОЧНОЕ УСТРОЙСТВО | 2019 |
|
RU2701266C2 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХИТОЗАНА | 1992 |
|
RU2065447C1 |
Авторы
Даты
2011-06-20—Публикация
2006-06-14—Подача