Настоящее изобретение относится к пиримидиновым производным и их применению в качестве ингибиторов фосфатидилинозитол-3-киназы (PI3K).
Фосфатидилинозитол (далее определяемый аббревиатурой “PI”) представляет собой один из ряда фосфолипидов, обнаруживаемых в клеточных мембранах. В последние годы стало ясно, что PI играет важную роль во внутриклеточной передаче сигналов. В конце 1980-х гг. было обнаружено, что PI3 киназа (Р13К) представляет собой фермент, который фосфорилирует положение 3 инозитольного кольца фосфатидилинозитола (D. Whitman et al., 1988, Nаture, 332, 664).
Первоначально РI3К считали единственным ферментом, но в настоящее время выяснилось, что в РI3К присутствует множество подтипов. Каждый подтип имеет свой собственный механизм регулирующей активности. 3 основных класса РI3К были идентифицированы на основании специфичности их субстрата in vitro (B. Vanhaesebroeck, 1997, Trend in Biol. Sci., 22, 267). Субстратами для РI3К класса I являются PI, PI-4-фосфата (РI4Р) и PI-4,5-бифосфат (PI(4,5)P2). РI3К класса I, кроме того, делятся на 2 группы, класс Ia и класс Ib с точки зрения механизма их активации. РI3К класса Iа включают подтипы РI3К р110α, р110β и р110δ, которые передают сигналы от рецепторов, соединенных с тирозинкиназой. РI3К класса Ib включает подтип р110γ, активируемый рецептором, соединенным с белком G. PI и PI(4)P известны как субстраты РI3К класса II. РI3К класса II включают подтипы РI3К С2α, С2β и С2γ, которые характеризуются содержанием доменов С2 на С-конце. Субстрат для РI3К класса III представляет собой только PI.
В подтипах РI3К к настоящему времени наиболее обширно был исследован подтип класса Ia. 3 подтипа класса Ia представляют собой гетеродимеры каталитической субъединицы 110 кДа и регуляторных субъединиц 85 кДа или 55 кДа. Регуляторные субъединицы содержат домены SH2 и связываются с тирозиновыми остатками, фосфорилированными рецепторами ростовых факторов с активностью тирозинкиназы или продуктами онкогена, посредством этого вызывая активность РI3К каталитической субъединицы р110, которая фосфорилирует его липидный субстрат. Таким образом, подтипы класса Ia считаются связанными с клеточной пролиферацией и канцерогенезом.
WO 01/083456 описывает ряд конденсированных гетероарильных производных, которые обладают активностью в качестве ингибиторов РI3К и которые подавляют рост раковых клеток.
Краткое описание сущности изобретения
В настоящее время было обнаружено, что новый класс конденсированных пиримидиновых соединений представляет собой эффективные ингибиторы РI3К с подобными лекарственному средству физико-химическими и фармакокинетическими свойствами. Соединения проявляют селективность в отношении РI3К класса Ia в сравнении с классом Ib, в частности, в отношении подтипа p110δ.
Соответственно, настоящее изобретение относится к соединению, которое представляет собой конденсированный пиримидин формулы (I):

где
А представляет тиофеновое или фурановое кольцо;
n=1 или 2;
R1 представляет собой группу формулы:

где
m=0 или 1;
R30 представляет собой водород или С1-С6 алкил;
R4 и R5 образуют вместе с атомом N, к которому они присоединены, 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, которая включает 0 или 1 дополнительный гетероатом, выбранный из N, S и О, которая может быть конденсирована с бензольным кольцом и которая является незамещенной или замещенной; или один из R4 и R5 представляет собой алкил, а другой представляет собой 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, как определено выше, или алкильную группу, которая замещена 5- или 6-членной насыщенной N-содержащей гетероциклической группой, как определено выше;
R2 выбран из
(а)
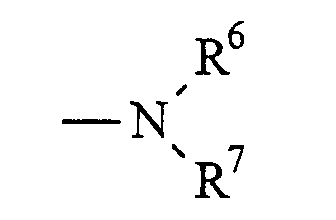
где R6 и R7 образуют вместе с атомом азота, к которому они присоединены, морфолиновую, тиоморфолиновую, пиперидиновую, пиперазиновую, оксазепановую или тиазепановую группу, которая является незамещенной или замещенной; и
(b)

где Y представляет собой цепь C2-C4алкилена, которая содержит между составляющими атомами углерода цепи и/или на одном или обоих концах цепи 1 или 2 гетероатома, выбранных из O, N и S, и которая является незамещенной или замещенной;
и R3 представляет собой индольную группу, которая является незамещенной или замещенной;
или его фармацевтически приемлемую соль.
Подробное описание изобретения
Тиофеновое или фурановое кольцо А в формуле (I) принимает любую из двух имеющихся регионально-химических ориентаций. Таким образом, формула (I) охватывает тиено[3,2-d]пиримидины и фурано[3,2-d]пиримидины следующей формулы (Ia), а также тиено[2,3-d]пиримидины и фурано[2,3-d]пиримидины следующей формулы (Ib):

где каждый из R1-R3 и n имеет значения, определенные выше, а Х представляет собой S или О.
В формуле (I) группа или группы R1, которые являются одинаковыми или различными, в данном соединении, когда n=2, могут быть связаны с любым или обоими из двух доступных положений колец на тиофеновом или фурановом кольце А. Поэтому, обращаясь к представленным выше структурам (Ia) и (Ib), когда n=1, то фурановое или тиофеновое кольцо является монозамещенным радикалом R1 в положении 2 или положении 3. Когда n=2, тиофеновое или фурановое кольцо является дизамещенным радикалом R1 в положениях 2 и 3.
Как определено в описании, алкильная группа представляет собой неразветвленный или разветвленный насыщенный углеводородный радикал, который является незамещенным или замещенным. Обычно она представляет собой C1-C20 алкил, например, C1-C10 алкил, такой как C1-C6 алкил или C1-C4 алкил, например, метил, этил, изопропил, н-пропил, трет-бутил, втор-бутил или н-бутил. Она может также представлять собой пентил, гексил, гептил, октил и ее различные разветвленные изомеры.
Когда алкильная группа замещена, то она обычно несет один или более заместителей R20, выбранных из галогена, алкокси, карбоциклила, 5- или 6-членной насыщенной N-содержащей гетероциклической группы, как определено выше, OH, SR, CN, нитро, NR2, -COOR, -C(O)R, -CH2OR, S(O)mR, -NRC(O)R, -S(O)mNR2, -OC(O)R, -OC(O)NR2, -NRS(O)mR, -NRC(O)NR2 и -CONR2, где каждый R представляет собой Н, незамещенный алкил или C3-C10 циклоалкил и m=1 или 2.
Обычно R20 выбран из галогена, алкокси, карбоциклила, 5- или 6-членной насыщенной N-содержащей гетероциклической группы, как определено выше, OH, CN, NR2, -COOR и -CONR2, где каждый R представляет собой Н или незамещенный алкил, как определено выше.
Замещенный алкил может представлять собой, например, галогеналкильную группу или группу -алк-N(R4)(R5), где алк представляет собой алкиленовую цепь, а R4 и R5 образуют вместе с атомом N, к которому они присоединены, 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, которая включает 0 или 1 дополнительный гетероатом, выбранный из N, S или O, которая может быть конденсирована с бензольным кольцом и которая является незамещенной или замещенной. Чаще, она представляет собой галогеналкильную группу -алк-N(R4)(R5), где «алк» представляет собой алкиленовую цепь, а R4 и R5 образуют вместе с атомом N, к которому они присоединены, 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, как определено выше.
Алкиленовая группа представляет собой незамещенную или замещенную, неразветвленную или разветвленную насыщенную двухвалентную углеводородную группу. Обычно она представляет собой C1-C8 алкилен, например, C1-C6 алкилен. Предпочтительно, она представляет собой C1-C4 алкилен, например, C2-C4 алкилен, такой как метилен, этилен, изопропилен, н-пропилен, трет-бутилен, втор-бутилен или н-бутилен. Она может также представлять собой пентилен, гексилен, гептилен, октилен и их различные разветвленные изомеры. Когда алкиленовая группа замещена, она обычно замещена группой R20, как определено выше, или алкилом, который является незамещенным или замещенным группой R20, как определено выше.
Алкенильная группа представляет собой незамещенный или замещенный, неразветвленный или разветвленный углеводородный радикал, имеющий одну или более двойных связей. Обычно, она представляет собой C2-C8 алкенил, например, C2-C6 алкенил, такой как аллил, бутенил, бутадиенил, пентенил или гексенил. Когда алкенильная группа замещена, она обычно замещена группой R20, как определено выше, или алкилом, который является незамещенным или замещенным группой R20, как определено выше.
Алкинильная группа представляет собой незамещенный или замещенный, неразветвленный или разветвленный углеводородный радикал, имеющий одну или более тройных связей. Обычно, она представляет собой C2-C8 алкинил, например, C2-C6 алкинил, такой как этинил, пропинил или бутинил. Когда алкинильная группа замещена, она обычно замещена группой R20, как определено выше, или алкилом, который является незамещенным или замещенным группой R20, как определено выше.
Галогеналкильная группа представляет собой алкильную группу, как определено выше, замещенную одним или более атомами галогена. Она может представлять собой пергалогеналкильную группу, например, трифторметил или перфторгексил.
Галоген представляет собой хлор, фтор, бром или йод. Он представляет собой обычно бром или йод.
Алкоксигруппа является неразветвленный или разветвленной. Она представляет собой обычно C1-C6 алкокси, например, C1-C4 алкокси, такой как метокси, этокси, изопропокси, н-пропокси, трет-бутокси, н-бутокси или втор-бутокси. Она является незамещенной или замещенной, например, группой R20, имеющей значения, определенные выше, или алкилом, который является незамещенным или замещенным определенной выше группой R20. Обычно она замещена карбоциклилом, морфолино, OH, CN, NR2, -COOR или -CONR2, где каждый R представляет собой Н или незамещенный алкил, как определено выше.
Карбоциклическая группа представляет собой неароматическое насыщенное или ненасыщенное моноциклическое углеводородное кольцо, обычно имеющее от 3 до 10 атомов углерода. Она может представлять собой C3-C8 циклоалкильную группу или C5-C10 циклоалкильную группу, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил. Альтернативно, она может представлять собой циклоалкенильную группу, обычно C4-C8 циклоалкенил, например, циклопентенил, циклогексенил, циклогексадиенил, циклогептенил, циклогептадиенил, циклооктенил или циклооктадиенил. Карбоциклическая группа может быть незамещенной или замещенной, например, группой R20, как определено выше, или алкилом, который является незамещенным или замещенным группой R20, как определено выше. Обычно, она замещена алкокси, мофролино, OH, CN, NR2, -COOR или -CONR2, где каждый R представляет собой Н или незамещенный алкил, как определено выше.
5- или 6-членная насыщенная N-содержащая гетероциклическая группа, которая включает 0 или 1 дополнительный гетероатом, выбранный из N, S и О, которая может быть конденсирована с бензольным кольцом и которая является незамещенной или замещенной, обычно выбрана из морфолина, пиперидина, пиперазина, пирролидина, тиоморфолина, хинолина, изохинолина, диазепана, оксазепана и тиазепана.
Когда 5- или 6-членная насыщенная N-содержащая гетероциклическая группа, как определено выше, замещена, то она может быть замещена группой R20, как определено выше, или алкилом, который является незамещенным или замещен группой R20, как определено выше. Обычно она замещена алкилом, который является незамещенным или замещенным, алкокси, который является незамещенным или замещенным, второй 5- или 6-членной насыщенной N-содержащей гетероциклической группой, как определено выше, 5- или 6-членной N-содержащей гетероарильной группой, которая является незамещенной или замещенной и которая может быть конденсирована с бензольным кольцом, -NR'R”, -алк-OR, -C(O)NR'R”', -алк-C(O)NR'R”', -алк-N(R)C(O)R, -C(O)N(R)-алк-OR, -S(O)2-алк-NR'D”, -N(R)-алк-OR, -COOR, оксо(=О), OR, -N(R)SO2R, -SO2NR2, -SO2R”' или -СО-алк-OR, где алк представляет собой алкиленовую цепь, R представляет собой Н или алкил, каждый из R' и R” представляет собой независимо Н, алкил или алкокси; или R' и R” вместе образуют 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, как определено выше, а R”' представляет собой алкил, который является незамещенным или замещен, например, NR2 или 5- или 6-членной насыщенной N-содержащей гетероциклической группой, как определено выше.
5-, 6- или 7-членная насыщенная гетероциклическая группа, которая содержит 1 или 2 гетероатома, выбранных из N, S и O, и которая является незамещенной или замещенной, обычно выбрана из тетрагидропирана, тетрагидротиопирана, тетрагидрофурана и тетрагидротиофурана.
Когда 5-, 6- или 7-членная насыщенная гетероциклическая группа, которая содержит 1 или 2 гетероатома, выбранных из N, S и O, является замещенной, она может быть замещена группой R20, как определено выше, или алкилом, который является незамещенным или замещен группой R20, как определено выше. Обычно она замещена одним или более заместителями, выбранными из алкила, который является незамещенным или замещен, например, группой R20, как определено выше, галогеналкила, как определено выше, алкокси, как определено выше, который является незамещенным или замещенным, галогена, гидрокси, CN, нитро, амино, оксо(=О), и -NR'R”, где каждый из R' и R” представляют собой независимо Н или алкил.
Гетероарильная группа представляет собой гетероарильную группу, которая содержит 1, 2, 3 или 4 кольцевых атома азота, и 0, 1 или 2 дополнительных гетероатома, выбранных из O, N и S, причем группа является моноциклической или бициклической, и которая является незамещенной или замещенной. Она обычно представляет собой 5-12-членное кольцо. Примеры гетероарильной группы включают пиррольную, пиразольную, триазольную, тетразольную, индазольную, тиазольную, изотиазольную, оксазольную, изооксазольную, индольную, изоиндольную, 1,3-дигидроиндол-2-оновую, пиридин-2-оновую, пиридиновую, пиридин-3-ольную, имидазольную, 1,3-дигидробензимидазолоновую, бензимидазольную, бензотиазольную, бензотиадиазольную, хинолиновую, изохинолиновую, хиноксалиновую, пиразолпиридиновую, аминопиразолиноновую, имидазопиридиновую, пиримидиновую, пиридазиновую, пиразиновую и изатиновую группы. Предпочтительные примеры включают индазольную, индольную, пиразольную и тетразольную группы. Эти группы могут быть незамещенными или замещенными, например, группой R20, как определено выше, или алкилом, который является незамещенными или замещенными группой R20, как определено выше.
5- или 6-членная N-содержащая гетероарильная группа, которая может быть конденсирована с бензольным кольцом, обычно выбрана из пиррола, пиразола, триазола, тетразола, индазола, тиазола, изотиазола, оксазола, изооксазола, индола, изоиндола, 1,3-дигидроиндол-2-она, пиридин-2-она, пиридина, пиридин-3-ола, имидазола, 1,3-дигидробензимидазолона, бензимидазола, бензотиазола, бензотиадиазола, хинолина, изохинолина, хиноксалина, пиразолпиридина, аминопиразолинона, имидазопиридина, пиримидина, пиридазина и пиразина. Когда такая гетероарильная группа замещена, она может быть замещена группой R20, как определено выше, или алкилом, который является незамещенным или замещенным группой R20, как определено выше.
В R1 m=0 или 1, обычно 1. R30 представляет собой обычно Н. R4 и R5 обычно образуют вместе с атомом N, к которому они присоединены, насыщенную N-содержащую гетероциклическую группу, выбранную из морфолина, тиоморфолина, пиперидина, пиперазина, пирролидина, хинолина, изохинолина, диазепана, оксазепана и тиазепана. Гетероциклическая группа, образованная R4 и R5, является незамещенной или замещенной, например, заместителями, перечисленными выше, такими как группа R20, как определено выше, или алкилом, который является незамещенной или замещенным, например, группой R20, как определено выше.
В определении (а) R2 в формуле (I) кольцо, образованное R6 и R7, представляет собой обычно морфолин, который является незамещенным или замещенным, например, группой R20, как определено выше, или алкилом, который является незамещенным или замещенным группой R20, как определено выше. Альтернативно оно может представлять собой группу, выбранную из тетрагидропирана, тетрагидротиопирана, тетрагидрофурана и тетрагидротиофурана, каждый из которых является незамещенным или замещенным, например, группой R20, как определено выше, или алкилом, который является незамещенным или замещенным группой R20, как определено выше. Когда кольцо, образованное R6 и R7, является замещенным, оно может быть замещено на любом кольцевом гетероатоме или кольцевом атоме углерода, например, группой R20, как определено выше, или алкильной группой, которая является незамещенной или замещенной, например, группой R20, как определено выше.
В определении (b) R2 в формуле (I) алкиленовая цепь, представленная Y, образует вместе с атомами углерода, к которым она присоединена, насыщенное 5-, 6- или 7-членное гетероциклическое кольцо, которое содержит 1 или 2 гетероатома, выбранных из O, N и S, и которое является незамещенным или замещенным. Примеры гетероциклического кольца включают тетрагидропиран, тетрагидрофуран, тетрагидротиопиран, тетрагидротиофуран и морфолин. Когда гетероциклическое кольцо замещено, оно обычно замещено одним или более заместителями, например, 1, 2 или 3 заместителями, выбранными из галогена, алкила, галогеналкила (например, трифторметила), алкокси, OH, CN, NR2, оксо (=O), -COOR и -CONR2, где каждый R представляет собой Н или незамещенный алкил, как определено выше.
Индольная группа R3 является незамещенной или замещенной. Если она замещена, она может быть замещена одним или более заместителями, выбранными из группы Z, где Z выбран из H, -OR, -SR, CH2OR, -CO2R, CF2OH, CH(CF3)OH, C(CF3)OH, -(CH2)qOR, -(CH2)qNR2, -C(O)N(R)2, -NR2, -N(R)C(O)R, -S(O)mN(R)2, -OC(O)R, OC(O)N(R)2, -N(R)S(O)mR, -NRC(O)N(R)2, CN, галоген и -NO2, где каждая R независимо выбрана из Н, С1-С6 алкил, С3-С10 циклоалкил и от 5- до 12-членной арильной или гетероарильной группы, причем группа является незамещенной или замещенной, m=1 или 2 и q=0, 1 или 2; одним или более заместителями, выбранными из галогена, алкила, алкенила, алкинила, CN, NO2, OR, SR, NR2, C(O)R, SOR, SO2R, SO2NR2, NRC(O)R и CO2R, где каждая R представляет собой независимо Н или алкил; и оксогруппу (=О). Обычно при замещении индольная группа замещена ОН, NH2 или оксогруппой. В одном варианте осуществления индольная группа является незамещенной.
Индольная группа R3 представляет собой изостер 3-гидроксифенильной или 4-гидроксифенильной группы. Используемый в описании термин «изостера» представляет собой функциональную группу, которая обладает свойствами связывания, являющимися такими же как или аналогичными свойствам 3-гидроксифенильной или 4-гидроксифенильной группы, в контексте структуры формулы (I).
В одном варианте осуществления конденсированный пиримидин имеет формулу (Ic):
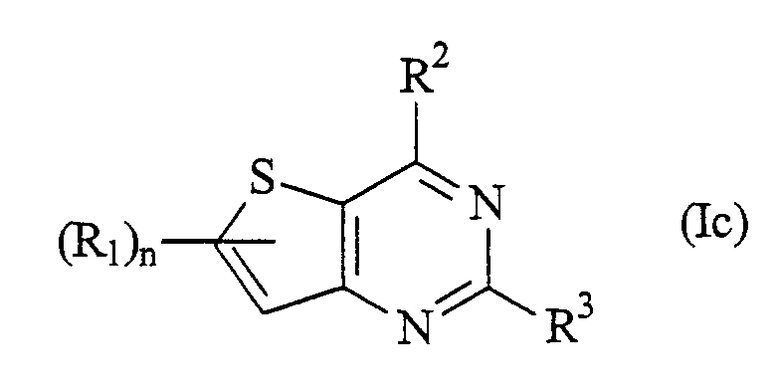
где
R2 и R3 имеют значения, определенные выше;
n=1; и
R1 представляют собой группу формулы:

где
m=0 или 1; и
R4 и R5 вместе с атомом N, к которому они присоединены, образуют 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, которая включает 0 или 1 дополнительный гетероатом, выбранный из O, N и S, и которая является незамещенной или замещенной алкилом, -S(O)2R, -C(O)-NR'R”, -алк-C(O)-NR'R”, -алк-N(R)C(O)R, -C(O)N(R)-алк-OR, -S(O)2-алк-NR'R”, -N(R)-алк-OR, -S(O)2-алк-NR'R”, -N(R)-алк-OR и -C(O)-алк-OR, где алк представляет собой алкиленовую цепь, R представляет собой Н или алкил, и каждый из R' и R” представляет собой независимо Н, алкил или алкокси; или R' и R”' вместе образуют 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, как определено выше. Обычно R' и R”' вместе образуют морфолиновую, пиперидиновую или пиперазиновую группу, чаще, морфолиновую группу.
В формуле (Ic) часть «алк» представляет собой обычно неразветвленную С1-С4 алкиленовую группу, чаще, С1-С3 алкилен, такой как -СН2-, -СН2СН2, или -СН2СН2СН2-. Гетероциклическая группа, образованная R4 и R5, обычно выбрана из морфолина, пиперидина и пиперазина, каждый из которых является незамещенным или замещенным, как определено выше. R2 обычно представляет собой морфолин. R3 представляет собой обычно индольную группу, которая является незамещенной.
Конкретные примеры соединений по изобретению включают
2-(1Н-индол-4-ил)-6-(4-метилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидин;
2-(1Н-индол-4-ил)-6-(4-метансульфонилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидин;
диметиламид 4-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты;
{4-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-ил}морфолин-4-илметанон;
(2-метоксиэтил)метиламид {4-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты;
{1-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперидин-4-ил}-(2-метоксиэтил)метиламин;
2-(1H-индол-4-ил)-4-морфолин-4-ил-6-пиперазин-1-илметилтиено[3,2-d]пиримидин;
2-(1H-индол-4-ил)-4-морфолин-4-ил-6-(4-морфолин-4-илпиперидин-1-илметил)тиено[3,2-d]пиримидин;
2-{4-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-ил}этанол;
{1-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперидин-4-ил}диметиламин;
4-((2-(1Н-индол-4-ил)-4-морфолинтиено[3,2-d]пиримидин-6-ил)метил)-N-(2-меоксиэтил)-N-метилпиперазин-1-карбоксамид; и
2-(4-((2-(1Н-индол-4-ил)-4-морфолинтиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-N,N-диметилацетамид;
и их фармацевтически приемлемые соли.
Соединения формулы (I) могут существовать в форме геометрических изомеров или таутомеров в зависимости от видов групп заместителей, и эти изомеры в их изолированных формах или смесях можно применять в настоящем изобретении. Когда соединения имеют асимметричные атомы углерода, оптические изомерные формы могут существовать, исходя из таких атомов углерода. Все смеси и изолированные формы этих оптических изомеров можно применять в настоящем изобретении.
Подходящий метод синтеза получения соединений формулы (I), в которых m=1, использует в качестве исходного продукта карбоксиальдегид формулы (II):

где А и R2 имеют значения, определенные выше. Исходя из этого предшественника, синтез включает выполнение в любом порядке реакции кросс-сочетания с использованием палладия (типа Suzuki) и восстановительного аминирования. Поэтому настоящее изобретение, кроме того, относится к способу получения соединения формулы (I), как определено выше, в которых m=1, причем способ включает
(а) обработку соединения формулы (II):

где А и R2 имеют значения, определенные выше, бороновой кислотой или ее сложным эфиром формулы R3B(OR15)2, в которой R3 определен выше, и каждый R15 представляет собой Н или С1-С6 алкил или 2 группы OR15 вместе с атомом бора, к которому они присоединены, образуют группу сложного эфира пинаколятбороната в присутствии палладиевого катализатора; и обработку полученного соединения формулы (III):
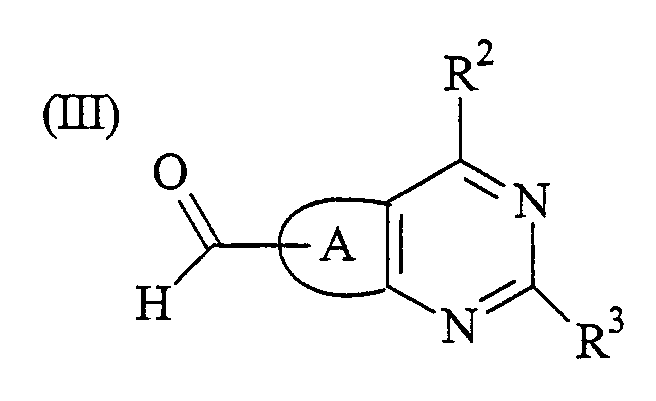
где А, R2 и R3 определены выше, с амином формулы NHR4R5, в которой R4 и R5 определены выше, в присутствии подходящего восстанавливающего агента; или
(b) обработку соединения формулы (II), как определено выше, с амином формулы NHR4R5, где R4 и R5 определены выше, в присутствии подходящего восстанавливающего агента; и обработку полученного соединения формулы (IV):
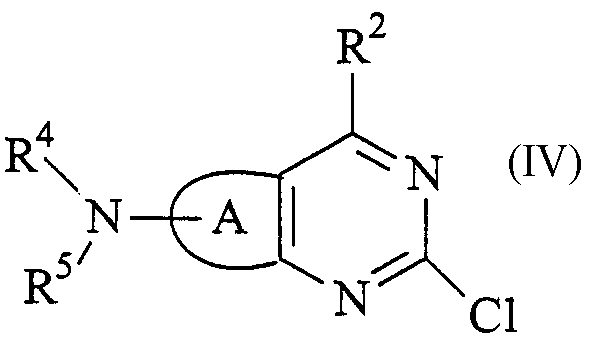
где А, R2 R4 и R5 определены выше, с бороновой кислотой или ее сложным эфиром формулы R3B(OR15)2, в которой R3 определен выше, и каждый R15 представляет собой Н или С1-С6 алкил или 2 группы OR15 вместе с атомом бора, к которому они присоединены, образуют группу сложного эфира пинаколятбороната, в присутствии палладиевого катализатора.
И стадия аминирования, и стадия кросс-сочетания с использованием Pd происходит в обычных условиях. Палладиевый катализатор может представлять собой любой, который обычно используется для кросс-сочетаний типа Suzuki, таких как PdCl2(PPh3)2. Восстанавливающий агент представляет собой обычно боргидрид, например, NaBH(OAc)3, NaBH4 или NaCNBH4, в частности, NaBH(OAc)3.
Соединение формулы (II), как определено выше, где R2 представляет собой -NR6R7, можно получить способом, который включает обработку соединения формулы (IX):
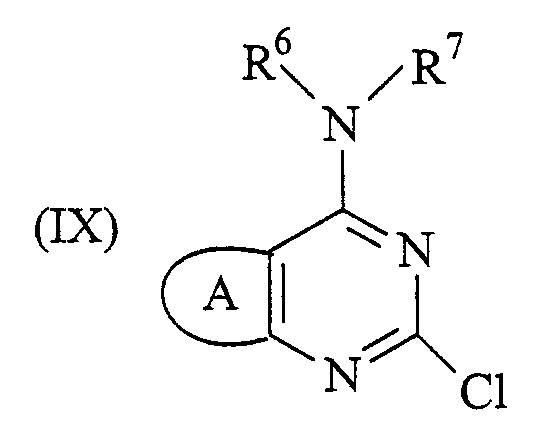
где А, R6 и R7 определены выше, литирующим агентом, с последующей обработкой N,N'-диметилформамидом (DMF). Реакцию обычно проводят путем добавления раствора литирующего агента, в неполярном органическом растворителе, например, углеводородном растворителе, таком как гексан, к суспензии соединения формулы (IX) в органическом растворителе, таком как тетрагидрофуран (ТГФ, THF). Если используется THF, то добавление происходит при низкой, примерно -78°С, температуре. Литирующий агент представляет собой обычно алкиллитий, например, н-бутиллитий.
Соединение формулы (IX), как определено выше, можно получить способом, который включает обработку соединения формулы (X):
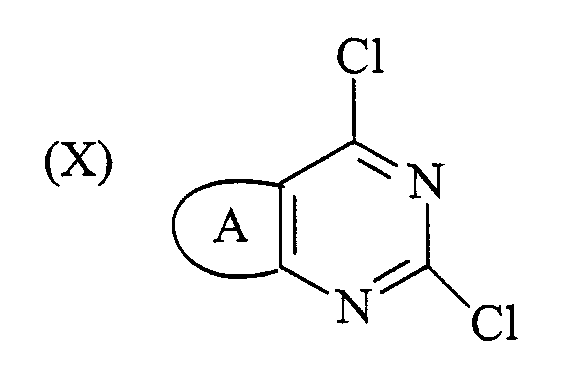
амином формулы NHR6R7, где R6 и R7 определены выше, в органическом растворителе. Растворитель представляет собой обычно спирт, такой как метанол. Реакцию в целом проводят при комнатной температуре.
Соединение формулы (Х) можно получить способом, описанным в ссылочном примере 1, с получением 2,4-дихлортиено[3,2-d]пиримидина, или по аналогии с таким способом.
Соединение формулы (II), как определено выше, где R2 имеет формулу
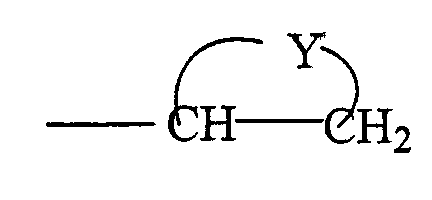
можно получить способом, который включает реакцию кросс-сочетания с использованием Pd соединения формулы (XI):
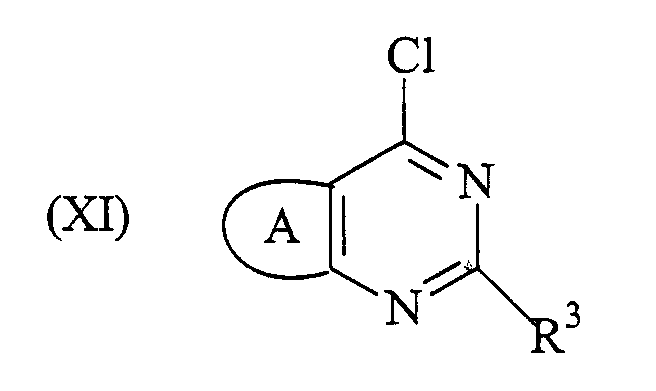
где А и R3 определены выше, с соединением формулы (XII):

где L представляет собой Н или группу, выбранную из галогена, -OSO2CF3, -B(OR)2, -Sn(R)3 и -Si(R)3, где R представляет собой Н или алкил, как определено выше, с последующим восстановлением, с получением соединения следующей формулы (XIII):

где А, R3 и Y определены выше.
Соединение формулы (XIII) можно превратить в соответствующий карбоксальдегид обработкой литирующим агентом, с последующей обработкой N,N'-диметилформамидом (DMF), например, в условиях, описанных выше, для превращения соединения формулы (IX) в соединение формулы (II). Литирующий агент определен выше. Затем полученный карбоксальдегид можно превратить в желательное конечное соединение формулы (I), как определено выше, в котором m=1, обработкой амином формулы NHR4R5, где R4 и R5 определены выше, в присутствии подходящего восстанавливающего агента, например, боргидрида, как определено выше, в частности, NaBH()Ac)3.
Соединение формулы (I), как определено выше, в котором m=0, можно получить путем включения азота, используя реакцию Бухвальда в присутствии палладия. Такой способ может включать обработку соединения формулы (XIV):

где А, R2 и R3 определены выше, и W представляет собой галоген, выбранный из Br и I, амином формулы NHR4R5, где R4 и R5 определены выше, в присутствии палладиевого катализатора.
Соединение формулы (XIV) можно получить обработкой соединения формулы (XV):

где А, R2 и R3 определены выше, литирующим агентом, и галогеном, выбранным из брома и йода. Литирующий агент, обычно представляет собой алкиллитий, например, бутиллитий. Галоген представляет собой обычно йод, который обеспечивает получение соединения формулы (XIV), в котором W представляет собой I.
Соединение формулы (I), как определено выше, в котором m=0, можно также получить реакцией полярного ароматического замещения (SNAr), например, в условиях, описанных D. Prim и G. Kirsch в Tetrahedron 55 (21), 6511-6526, 1999. Такой способ включает обработку соединения формулы (XIV), как определено выше, в котором W представляет собой Br, с амином формулы NHR4R5, где R4 и R5 определены выше, в воде при кипячении с обратным холодильником в течение 12 час.
Альтернативно соединение формулы (I), как определено выше, в котором m=0, можно получить обработкой соединения формулы (XIV), как определено выше, в котором W представляет собой I, амином формулы NHR4R5, где R4 и R5 определены выше, в 1,4-диоксане в присутствии CuI/En и K3PO4. Реакцию проводят при температуре примерно 110°С в течение 24 час. Эта процедура описана Kang S-K et al. в Synlett, (3), 427-430, 2002.
Конденсированный пиримидин формулы (I) можно превратить в фармацевтически приемлемую соль, и соль может быть превращена в свободное соединение обычными способами. Примеры фармацевтически приемлемых солей включают кислотно-аддитивные соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; и органическими кислотами, такими как муравьиная кислота, уксусная кислота, трифторуксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, аспарагиновая кислота и глутаминовая кислота.
В случае соединений по изобретению, несущих свободный карбоксильный заместитель, соли включают соли щелочных и щелочноземельных металлов и аммония, например, соли натрия, калия, магния, кальция и аммония. Последние получают обработкой свободного конденсированного пиримидина формулы (I) или его кислотно-аддитивной соли соответствующим основанием металла или аммиаком. Соединения формулы (I) и их соли могут существовать в виде гидратов или сольватов.
В биологических тестах было обнаружено, что соединения по настоящему изобретению являются ингибиторами PI3 киназы. Эти соединения избирательны в отношении к PI3 киназам класса Ia, в сравнении с классом Ib, и обычно проявляют, по меньшей мере, селективность в отношении класса Ia, в 20 раз превышающую селективность в отношении PI3 киназы класса Ib. В частности, эти соединения избирательны в отношении изоформы p110δ, в сравнении с р110γ.
Таким образом, соединение по настоящему изобретению можно применять в качестве ингибитора PI3 киназы, в частности PI3 киназы класса Ia. Соответственно, соединение по настоящему изобретению можно применять для лечения заболевания или расстройства, обусловленного патологическим клеточным ростом, функцией или поведением, связанным с PI3 киназой. Примеры таких заболеваний и расстройств обсуждены Drees et al. в Expert Opin. Ther. Patents (2004) 14(5): 703-732. Они включают рак, иммунные расстройства, сердечно-сосудистые заболевания, вирусную инфекцию, воспаление, метаболические/эндокринные расстройства и неврологические расстройства. Примеры метаболических/эндокринных расстройств включают диабет и ожирение. Примеры раковых заболеваний, для лечения которых можно применять настоящие соединения, включают лейкоз, опухоли мозга, рак почек, рак желудка и рак кожи, мочевого пузыря, молочной железы, матки, легких, толстой кишки, предстательной железы, яичников и поджелудочной железы.
Таким образом, пациента-человека или животного, страдающего иммунным расстройством, раком, сердечно-сосудистым заболеванием, вирусной инфекцией, воспалением, метаболическим/эндокринным расстройством или неврологическими расстройствами, можно лечить способом, включающим введение ему соединения по настоящему изобретению, как определено выше. Таким образом, можно улучшить или облегчить состояние пациента.
В дополнение к имеющейся биохимической активности соединения по изобретению проявляют физико-химические и фармакокинетические свойства, что делает их особенно подходящими для применения в виде лекарственного средства. Это показано, например, в результатах биологических анализов, описанных в следующем ниже примере 3. В частности, соединения обладают высокой растворимостью в воде при физиологическом рН; многие из них имеют растворимость, по меньшей мере, 40 мкМ, и значительное количество имеет растворимость более чем 100 мкМ. Высокая растворимость при физиологическом рН желательна, поскольку это способствует биологической доступности. Эти соединения также обладают высокой метаболической устойчивостью, как показано, в частности, анализом клиренса гепатоцитов, описанным в примере 3, при котором было показано, что большинство испытуемых соединений имеют низкий клиренс гепатоцитов. Низкий клиренс гепатоцитов коррелируется с низкой скоростью печеночного метаболизма. Поэтому видно, что соединения по настоящему изобретению обладают улучшенными физико-химическими и фармакокинетическими свойствами, в то же время сохраняя биохимическую активность в качестве ингибиторов PI3 киназы.
Соединение по настоящему изобретению можно вводить в разнообразных лекарственных формах, например, перорально, например, в форме таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий или парентерально, например, внутримышечно, внутривенно или подкожно. Поэтому соединение можно вводить инъекцией или вливанием.
Дозировка зависит от разнообразных факторов, включая возраст, массу и состояние пациента и пути введения. Суточные дозировки могут варьироваться в широких пределах и должны подбираться в соответствии с индивидуальными потребностями в каждом конкретном случае. Однако обычно дозировка, подобранная для каждого пути введения, когда соединение вводится отдельно взрослым людям, составляет от 0,0001 до 50 мг/кг, чаще всего в диапазоне от 0,001 до 10 мг/кг массы тела, например, от 0,01 до 1 мг/кг. Такую дозировку можно вводить, например, от 1 до 5 раз/день. Для внутривенной инъекции подходящая суточная доза составляет от 0,0001 до 1 мг/кг массы тела, предпочтительно, от 0,0001 до 0,1 мг/кг массы тела. Суточную дозу можно вводить в виде одной дозировки или в соответствии со схемой введения дробных доз.
Соединение включается в состав препаративной формы для применения в качестве фармацевтической или ветеринарной композиции, также включающей фармацевтически или в ветеринарии приемлемый носитель или разбавитель. Композиции обычно получают в соответствии с обычными способами и вводят в фармацевтически или ветеринарно подходящей форме. Соединение можно вводить в любой обычной форме, например, в следующей форме:
А) перорально, например, в виде таблеток, покрытых таблеток, драже, пастилок, лепешек, водных или маслянистых суспензий, жидких растворов, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального применения, можно получить в соответствии с любым способом, известным в данной области, для изготовления фармацевтических композиций, и такие композиции могут содержать одно или более средств, выбранных из группы, состоящей из подслащивающих веществ, ароматизирующих веществ, красящих веществ и консервирующих средств, для предоставления фармацевтически приемлемых и приятных на вкус препаратов.
Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые пригодны для изготовления таблеток. Эти наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, декстроза, сахароза, целлюлоза, кукурузный крахмал, картофельный крахмал, фосфат кальция или фосфат натрия; гранулирующие и разрыхляющие вещества, например, крахмал маиса, альгиновую кислоту, альгинаты или натрия крахмал-гликолят; связывающие вещества, например, крахмал, желатин или аравийскую камедь; смазывающие вещества, например, оксид кремния, стеарат магния или кальция, стеариновую кислоту или тальк; вспениваемые смеси; красящие вещества, подслащивающие вещества, смачивающие вещества, такие как лецитин, полисорбаты или лаурилсульфат. Таблетки могут быть непокрытыми, или они могут быть покрыты известными методиками для задержки разрушения и всасывания в желудочно-кишечном тракте и посредством этого обеспечить продолжительное действие в течение более длительного периода. Например, можно использовать материал для задержки разрушения и всасывания, такой как глицерилмоностеарат или глицерилдистеарат. Такие препараты можно изготовить известным образом, например, посредством способов смешивания, гранулирования, таблетирования, покрытия сахаром или пленкой.
Препаративные формы для перорального применения могут быть также представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент представлен сам по себе, или смешан с водой или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активные материалы в смеси с наполнителями, подходящими для изготовления водных суспензий. Такие наполнители представляют собой суспендирующие средства, например, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон трагакантовой камеди и аравийскую камедь; диспергирующие или смачивающие вещества могут представлять собой естественно встречающиеся фосфатиды, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, стеарат полиоксиэтилена, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксиэтанол, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот, и гексит, такой как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гексита, например, моноолеата полиоксиэтиленсорбитана.
Указанные водные суспензии могут также содержать один или более консервантов, например, этил- или п-гидроксибензоат н-пропила, одно или более красящих веществ, таких как сахароза или сахарин.
Масляные суспензии можно включать в препаративные формы суспендированием активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт.
Можно добавлять подслащивающие вещества, такие как указанные выше, и ароматизирующие вещества, для предоставления перорального препарата с приятным вкусом и ароматом. Эти композиции могут консервироваться добавлением антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, подходящие для получения водной суспензии добавлением воды, предоставляют активный ингредиент в смеси с диспергирующим или смачивающим веществом, суспендирующим веществом и одним или более консервантов. Подходящие диспергирующие или смачивающие вещества и суспендирующие вещества иллюстрируются веществами, уже указанными выше. Могут также присутствовать дополнительные наполнители, например, подслащивающие, ароматизирующие и красящие вещества.
Фармацевтические композиции по изобретению могут также быть представлены в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин или их смеси. Подходящие эмульгирующие средства могут представлять собой естественно встречающиеся смолы, например, аравийскую камедь или трагакантовую камедь, естественно встречающиеся фосфатиды, например, лецитин соевых бобов, и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и гекситангидриды, например, моноолеат сорбитана, и продукты конденсации указанных частичных сложных эфиров с этиленоксидом, например, моноолеат полиоксиэтиленсорбитана. Эмульсия может также содержать подслащивающие и ароматизирующие вещества. Сиропы и эликсиры могут включаться в препаративные формы с подслащивающими веществами, например, глицерином, сорбитом или сахарозой. В частности, сироп для пациентов с диабетом может содержать в качестве носителей только продукты, например, сорбит, которые не метаболизируются в глюкозу или которые метаболизируются в глюкозу лишь в очень небольшом количестве.
Такие препаративные формы могут также содержать смягчающее вещество, консервант и ароматизирующие и красящие вещества;
В) парентерально, или подкожно, или внутривенно, или внутримышечно, или внутристернально, или методиками вливания, в форме стерильных инъецируемых водных или масляных суспензий. Эту суспензию можно включать в препаративную форму, в соответствии с известными способами, используя те подходящие диспергирующие или смачивающие вещества и суспендирующие вещества, которые были указаны выше. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном, приемлемом разбавителе или растворителе, например, таком как раствор 1,3-бутандиола.
Среди приемлемых носителей и растворителей, которые можно использовать, имеются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, жидкие масла обычно используются в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое не раздражающее жидкое масло, включая синтетические моно- или диглицериды. Кроме того, при получении инъекционных препаратов находят применение жирные кислоты, такие как олеиновая кислота;
С) ингаляцией в форме аэрозолей или растворов для распылителей;
D) ректально в форме суппозиториев, полученных смешиванием лекарственного средства с подходящим не раздражающим наполнителем, который является твердым при обычной температуре, но жидким при ректальной температуре, и поэтому тает в прямой кишке с высвобождением лекарственного средства. Такие материалы представляют собой масло какао и полиэтиленгликоли;
Е) местно в форме кремов, мазей, желе, примочек, растворов или суспензий.
Далее изобретение будет описано в следующих примерах:
Ссылочный пример 1
2,4-дихлортиено[3,2-d]пиримидин (64)
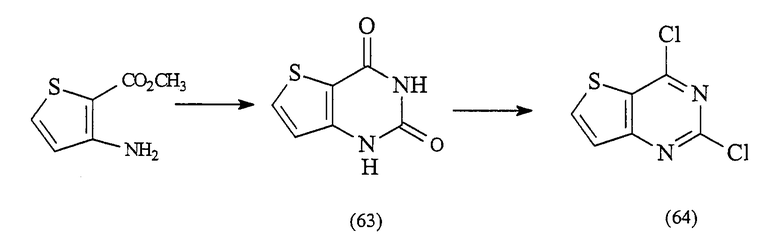
Смесь метил-3-амино-2-тиофенкарбоксилата (13,48 г, 85,85 ммоль) и мочевины (29,75 г, 5 экв.) нагревают при 190°С в течение 2 час. Горячую реакционную смесь затем выливают в раствор гидроксида натрия, и любое нерастворимое вещество удаляют фильтрацией. Затем смесь подкисляют (HCl, 2N) с получением 1Н-тиено[3,2-d]пиримидин-2,4-диона (63) в виде белого осадка, который собирают фильтрацией и сушат на воздухе (9,49 г, 66%).
1Н ЯМР (400 МГц, d6-ДМСО) 11,60-11,10 (2H, ушир.c), 8,10 (1H, д, J=5,2 Гц), 6,90 (1H, д, J=5,2 Гц).
Смесь 1Н-тиено[3,2-d]пиримидин-2,4-диона (9,49 г, 56,49 ммоль) и хлорокись фосфора (150 мл) нагревают при кипячении с обратным холодильником в течение 6 час. Реакционную смесь затем охлаждают и выливают в воду со льдом при энергичном перемешивании, получая осадок. Затем смесь фильтруют с получением 2,4-дихлортиено[3,2-d]пиримидина (64) в виде белого твердого вещества (8,68 г, 75%).
1Н (400 МГц, CDCl3) 8,13 (1H, д, J=5,5 Гц), 7,56 (1H, д, J=5,5 Гц).
Ссылочный пример 2
2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин (65)
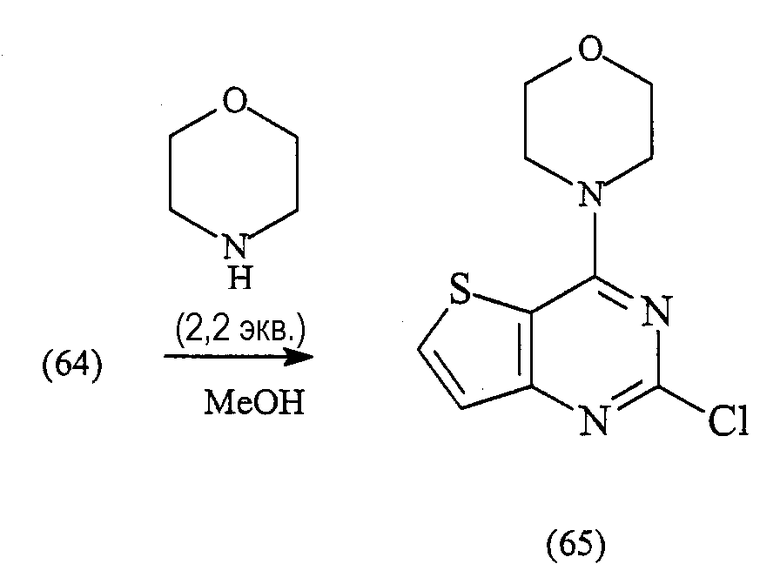
Смесь 2,4-дихлортиено[3,2-d]пиримидина (64) (8,68 г, 42,34 ммоль), морфолина (8,11 мл, 2,2 экв.) и MeOH (150 мл) перемешивают при комнатной температуре в течение 1 час. Реакционную смесь затем фильтруют, промывают водой и МеОН, получая указанное в заголовке соединение в виде белого твердого вещества (11,04 г, 100%).
1Н ЯМР (400 МГц, d6-ДМСО) 8,30 (1H, д, J=5,6 Гц), 7,40 (1H, д, J=5,6 Гц), 3,90 (4H, т, J=4,9 Гц), 3,74 (4H, т, J=4,9 Гц).
Ссылочный пример 3
2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-карбальдегид (66)
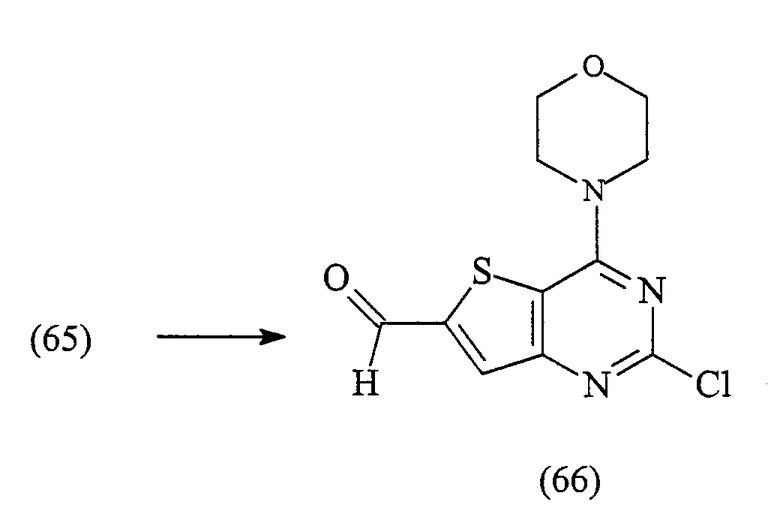
К суспензии 2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидина (65) (1,75 г, 6,85 ммоль) в сухом THF (40 мл) при -78°С добавляют 2,5 М раствор н-BuLi в гексане (3,3 мл, 1,2 экв.). После перемешивания в течение 1 час добавляют сухой N,N-диметилформамид (796 мкл, 1,5 экв.). Реакционную смесь перемешивают в течение 1 час при -78°С и затем дают медленно нагреться до комнатной температуры. Еще через 2 час при комнатной температуре реакционную смесь выливают в воду со льдом, получая желтый осадок. Его собирают фильтрацией и сушат на воздухе с получением указанного в заголовке соединения (1,50 г, 77%).
1Н ЯМР (400 МГц, d6-ДМСО) 10,20 (1H, c), 8,28 (1H, c), 3,95 (4H, т, J=4,9 Гц), 3,76 (4H, т, J=4,9 Гц).
Ссылочный пример 4
2-хлор-6-(4-метилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидин (72)

К смеси 2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-карбальдегида (66) (147 мг, 0,52 ммоль), 1-метилпиперазина (1,5 экв., 87 мкл) и уксусной кислоты (1,05 экв., 32 мкл) в 1,2-дихлорэтане (3 мл) добавляют триацетоксиборгидрид натрия (1,1 экв., 121 мг) и затем перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют дихлорметаном, промывают насыщенным раствором гидрокарбоната натрия, солевым раствором, отделяют и сушат (MgSO4). Неочищенный продукт выпаривают в вакууме и очищают хроматографией с получением указанного в заголовке соединения 72 в виде не совсем белого кристаллического твердого вещества (51 мг, 45%).
Пример 1
2-(1Н-индол-4-ил)-6-(4-метилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидин (61)
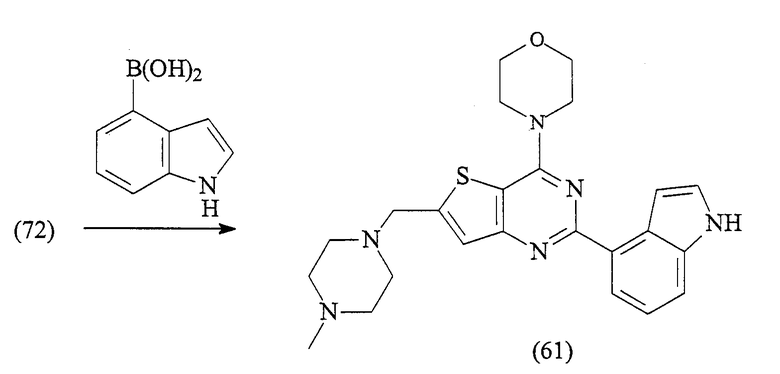
Смесь 2-хлор-6-(4-метилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидина (72) (100 мг, 0,27 ммоль), индол-4-бороновой кислоты (1,1 экв., 48 мг), гидрокарбоната натрия (3 экв., 69 мг) и хлорида бис(трифенилфосфин)палладия(II) (0,05 экв., 10 мг) в толуоле (2,5 мл), этаноле (1,5 мл) и воде (0,7 мл) продувают аргоном и нагревают в условиях микроволнового облучения при 120°С в течение 1 час. Реакционную смесь разделяют между дихлорметаном и водой, органический слой промывают рассолом, сушат над сульфатом магния, фильтруют и выпаривают в вакууме. Полученный остаток очищают, используя флэш-хроматографию, с получением указанного в заголовке соединения 61 (23 мг, 19%).
1H ЯМР (400 МГц, CDCl3) 2,33 (c, 3Н), 2,52 (ушир.м, 4H), 2,63 (ушир.м, 4H), 4,85 (c, 2H), 3,90-3,92 (м, 4H), 4,07-4,10 (м, 4H), 7,26-7,33 (м, 2H), 7,37 (c, 1H), 7,49 (д, 1H, J=8,0 Гц), 7,55 (м, 1H), 8,19 (д, 1H, J=7,3 Гц), 8,26 (ушир.c, 1H); MC (ESI+) 449,1 (MH+).
Пример 2
Другие соединения по изобретению
Следующие соединения по изобретению получают по аналогии со способом примера 1. Соединение 72 замещают в каждом случае соответствующим предшествующим хлорсоединением, полученным способом ссылочного примера 4, с использованием релевантного амина вместо 1-метилпиперазина. Получение амина описано ниже при необходимости. Данные ЯМР представлены для каждого из указанных в заголовке соединений по изобретению.
112: 2-(1Н-индол-4-ил)-6-(4-метансульфонилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидин
Получают исходя из 2-хлор-6-(4-метансульфонилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидина, полученного из 1-метансульфонилпиперазина.
1H ЯМР (400 МГц, CDCl3) 2,67-2,71 (4H, м), 2,81 (3H, c), 3,29-3,33 (4H, м), 3,89 (2H, c), 3,89-3,93 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,39 (1H, c), 7,50 (1H, д, J=8,2 Гц), 7,53-7,54 (1H, м), 8,19 (1H, д, J=8,0 Гц), 8,28 (1H, ушир.c); MC (ESI+) 513 (MH+).
113: Диметиламид 4-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты
Получают исходя из диметиламида 4-(2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил)пиперазин-1-карбоновой кислоты, полученного из диметиламида пиперазин-1-карбоновой кислоты.
Получение амина: к раствору 1-ВОС-пиперазина (867 мг) в сухом тетрагидрофуране (8 мл) добавляют триэтиламин (0,97 мл) с последующим добавлением диметилкарбамоилхлорида (0,51 мл). После перемешивания в течение 24 час реакционную смесь разбавляют дихлорметаном, промывают рассолом, сушат (MgSO4) и растворитель удаляют в вакууме с получением сложного трет-бутилового эфира 4-диметилкарбамоилпиперазин-1-карбоновой кислоты (940 мг). Обработка этого соединения HCl в дихлорметане/метаноле дает соединение 113.
1H ЯМР (400 МГц, CDCl3) 2,56-2,62 (4H, м), 2,83 (6H, c), 3,30-3,35 (4H, м), 3,87 (2Н, c), 3,92-3,96 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,38 (1H, c), 7,50 (1H, д, J=8,0 Гц), 7,56 (1H, c), 8,20 (1H, д, J=7,3 Гц), 8,30 (1H, ушир.м); MC (ESI+) 506 (MH+).
114: {4-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-ил}морфолин-4-илметанон.
Получают исходя из [4-(2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-ил]}морфолин-4-илметанона, полученного из морфолин-4-илпиперазин-1-илметанона;
1H ЯМР (400 МГц, CDCl3) 2,55-2,58 (4H, м), 3,28-3,32 (4H, м), 3,35-3,39 (4H, м), 3,67-3,71 (4H, м), 3,88 (2H, c), 3,92-3,96 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,38 (1H, c), 7,50 (1H, д, J=8,0 Гц), 7,56 (1H, c), 8,20 (1H, д, J=7,3 Гц), 8,30 (1H, ушир.м); (ESI+): MC (ESI+) 548 (MH+).
Получение амина: смесь 4-морфолинкарбонилхлорида (0,38 мл), 1-ВОС-пиперазина (552 мг) и карбоната калия (439 мг) в ацетонитриле (7 мл) перемешивают при комнатной температуре в течение 3 час. Затем реакционную смесь разбавляют дихлорметаном, промывают рассолом, сушат (MgSO4) и растворитель удаляют в вакууме с получением сложного трет-бутилового эфира 4-(морфолин-4-карбонил)пиперазин-1-карбоновой кислоты (865 мг). Обработка этого соединения HCl в дихлорметане/метаноле дает указанное в заголовке соединение, которое выделяют в виде хлористоводородной соли.
115: (2-метоксиэтил)метиламид {4-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты
Получают исходя из (2-метоксиэтил)метиламида 4-(2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты, полученного из (2-метоксиэтил)метиламида пиперазин-1-карбоновой кислоты.
Получение амина: к N-ВОС-пиперазину (500 мг) в дихлорметане (5 мл) и триэтиламине (0,41 мл) добавляют 4-нитрофенилхлорформиат (541 мг). Через 1 час реакционную смесь разбавляют дихлорметаном, промывают рассолом, сушат (MgSO4) и растворитель удаляют в вакууме с получением сложных трет-бутилового и 4-нитрофенилового эфиров пиперазин-1,4-дикарбоновой кислоты (940 мг).
К сложным трет-бутиловому и 4-нитрофениловому эфирам пиперазин-1,4-дикарбоновой кислоты (500 мг) в тетрагидрофуране (5 мл) добавляют N-(2-метоксиэтил)метиламин (254 мг) и реакционную смесь нагревают до кипения с обратным холодильником в течение 24 час. Реакционную смесь восстанавливают в вакууме и очищают, используя флэш-хроматографию, с получением сложного трет-бутилового эфира 4-[(2-метоксиэтил)метилкарбамоил]пиперазин-1-карбоновой кислоты (340 мг). Обработка этого соединения HCl в дихлорметане/метаноле дает указанное в заголовке соединение, которое выделяют в виде хлористоводородной соли.
1H ЯМР (400 МГц, CDCl3) 2,59-2,63 (4Н, м), 2,90 (3H, c), 3,27-3,30 (4H, м), 3,31 (3H, c), 3,48 (2H, т), 3,57 (2H, т), 3,90 (2H, c), 3,92-3,96 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,38 (1H, c), 7,50 (1H, д), 7,56 (1H, c), 8,20 (1H, д, J=7,3 Гц), 8,30 (1H, ушир.м); MC (ESI+) 550 (MH+).
116: {1-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперидин-4-ил}-(2-метоксиэтил)метиламин
Получают исходя из [1-(2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил)пиперидин-4-ил]-(2-метоксиэтил)метиламина, полученного из (2-метоксиэтил)метилпиперидин-4-иламина.
Получение амина: смесь N-BOC-4-пиперидина (500 мг), N-(2-метоксиэтил)метиламина (335 мг), уксусной кислоты (0,15 мл) и триацетоксиборгидрида натрия (797 мг) перемешивают при комнатной температуре в 1,2-дихлорэтане (5 мл). После перемешивания в течение ночи реакционную смесь разбавляют хлороформом, промывают раствором бикарбоната натрия, сушат (MgSO4) и растворитель удаляют в вакууме. Остаток очищают, используя флэш-хроматографию, с получением сложного трет-бутилового эфира 4-[(2-метоксиэтил)метиламино]пиперидин-1-карбоновой кислоты. Обработка этого соединения HCl в дихлорметане/метаноле дает указанное в заголовке соединение, которое выделяют в виде хлористоводородной соли.
1H ЯМР (400 МГц, CDCl3) 1,62-1,72 (2H, м), 1,76-1,84 (2H, м), 2,10-2,18 (2H, м), 2,36 (3H, c), 2,40-2,48 (1H, м), 2,68 (2H, т, J=6,0 Гц), 3,04-3,11 (2H, м), 3,38 (3H, c), 3,50 (2H, т, J=6,3 Гц), 3,85 (2H, c), 3,92-3,97 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,38 (1H, c), 7,50 (1H, д, J=8,0 Гц), 7,56 (1H, c), 8,20 (1H, д, J=7,3 Гц), 8,30 (1H, ушир.); MC (ESI+) 521 (MH+).
117: 2-(1H-индол-4-ил)-4-морфолин-4-ил-6-пиперазин-1-илметилтиено[3,2-d]пиримидин
Получают исходя из опосредованного эфирной HCl расщепления ВОС-группы сложного трет-бутилового эфира 4-[2-(1H-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты.
1H ЯМР (400 МГц, d6-ДМСО) 2,90-3,05 (4H, ушир.м), 3,15-3,28 (4H, ушир.м), 3,86-3,92 (2H+4H, м), 4,18-4,25 (4H, ушир.м), 7,05 (1H, ушир.м), 7,30 (1H, т, J=7,8 Гц), 7,60 (1H, c), 7,72 (1H, д, J=8,1 Гц), 7,78 (1H, ушир.c), 7,95 (1H, д, J=8,1 Гц), 9,30-9,40 (2H, ушир.м), 11,60 (1H, ушир.м); MC (ESI+) 435 (MH+).
118: 2-(1H-индол-4-ил)-4-морфолин-4-ил-6-(4-морфолин-4-илпиперидин-1-илметил)тиено[3,2-d]пиримидин
Получают исходя из 2-хлор-4-морфолин-4-ил-6-(4-морфолин-4-илпиперидин-1-илметил)тиено[3,2-d]пиримидина, полученного из 4-морфолинпиперидина (имеющегося в продаже).
1H ЯМР (400 МГц, CDCl3) 1,55-1,68 (2H, м), 1,83-1,90 (2H, м), 2,11-2,18 (2H, м), 2,18-2,25 (1H, м), 2,54-2,60 (4H, м), 3,05-3,11 (2H, м), 3,70-3,76 (4H, м), 3,84 (2H, c), 3,92-3,96 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,38 (1H, c), 7,50 (1H, д, J=8,0 Гц), 7,56 (1H, c), 8,20 (1H, д, J=7,3 Гц), 8,30 (1H, ушир.); MC (ESI+) 519 (MH+).
119: 2-{4-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-ил}этанол
Получают исходя из 2-[4-(2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-ил]этанола, полученного из N-(2-гидроксиэтил)пиперазина (имеющегося в продаже).
1H ЯМР (400 МГц, CDCl3) 2,63 (ушир.м, 10H, 2×CH2), 3,65 (м, 2H, CH2), 3,84 (2H, c), 3,92-3,96 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,38 (1H, c), 7,50 (1H, д, J=8,0 Гц), 7,56 (1H, c), 8,20 (1H, д, J=7,3 Гц), 8,30 (1H, ушир.); MC (ESI+) 479 (MH+).
120: {1-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперидин-4-ил}диметиламин
Получают исходя из [1-(2-хлор-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил)пиперидин-4-ил}диметиламина, полученного из 4-диметиламинопиперидина (имеющегося в продаже).
1H ЯМР (400 МГц, CDCl3) 1,58-1,68 (2H, ушир.м), 1,87-1,95 (2H, ушир.м), 2,10 (2H, ушир. т, J=10,7 Гц), 2,34 (1H, ушир.м), 2,37 (6H, ушир.c), 3,02 (2H, ушир.м), 3,84 (2H, c), 3,92-3,96 (4H, м), 4,08-4,12 (4H, м), 7,28-7,33 (2H, м), 7,38 (1H, c), 7,50 (1H, д, J=8,0 Гц), 7,56 (1H, c), 8,20 (1H, д, J=7,3 Гц), 8,30 (1H, ушир.м); MC (ESI+) 477 (MH+).
Пример 3
Биологическое испытание
Соединения по изобретению, полученные, как описано в предыдущих примерах, подвергли следующим сериям биологических анализов:
(i) Биохимический скрининг PI3К
Ингибирование PI3К соединениями определяли в радиометрическом анализе, используя очищенный рекомбинантный фермент и АТФ в концентрации 1 мкМ. Все соединения серийно разбавляли в 100% ДМСО. Реакционную смесь киназы инкубировали в течение 1 час при комнатной температуре и реакцию прекращали добавлением PBS (солевой раствор с фосфатным буфером). Величины IC50 (концентрации, ингибирующей на 50%) далее определяли, используя определение соответствия сигмовидной кривой зависимости реакции от дозы (вариабельный наклон кривой). Все проиллюстрированные соединения имели IC50 против PI3К 510 мкМ или менее. В частности, все соединения, испытанные против изоформы р110δ PI3К, имели IC50 0,1 мкМ или менее.
(ii) Ингибирование клеточной пролиферации
Клетки высевали при оптимальной плотности в 96-луночные планшеты и инкубировали в течение 4 дней в присутствии испытуемого соединения. К аналитической среде затем добавляли Alamar BlueTM и клетки инкубировали в течение 6 час перед считыванием при возбуждении 544 нм, эмиссии 590 нм. Величины ЕС50 рассчитывали, используя определение соответствия сигмовидной кривой зависимости реакции от дозы. Величины ЕС50 всех испытанных соединений составляли 50 мкМ или менее в диапазоне использованных линий клеток.
(iii) Проницаемость Сасо-2
Клетки Сасо-2 высевали на планшеты Millipore Multiscreen при 1×105 клеток/см2 и культивировали в течение 20 дней. В последующем проводили оценку проницаемости для соединения. Соединения наносили на апикальную поверхность (А) клеточных монослоев и измеряли проникновение соединения в нижнебоковой (В) компартмент. Это выполняли в обратном направлении (В-А) для исследования активного транспорта. Рассчитывали величину коэффициента проницаемости, Рарр, для каждого соединения, меру скорости проникновения соединения через мембрану. Соединения группировали на имеющие низкий (Рарр≤1,0×106 см/с) или высокий (Рарр≥1,0×106 см/с) потенциал поглощения на основании сравнения с контрольными соединениями с установленным всасыванием у людей.
Для оценки способности соединения подвергаться активному оттоку, определяли отношение нижнебокового (В) к апикальному (А) транспорту, по сравнению с А к В. Величины В-А/А-В≥1,0 указывали на возникновение активного клеточного оттока. У всех соединений, испытанных посредством скрининга проницаемости Сасо-2, величины Рарр≥1,0×106 см/с. У одного соединения, оцененного посредством двунаправленного анализа, РI540, имелся индекс асимметрии В-А/А-В менее чем 1,0, указывая на то, что соединение не подвергается активному клеточному оттоку.
(iv) Клиренс гепатоцитов
Использовали суспензии криоконсервированных человеческих гепатоцитов. Инкубации выполняли при концентрации соединений 1 мМ или 3 мкМ при плотности клеток 0,5×106 жизнеспособных клеток/мл. Конечная концентрация ДМСО при инкубации составила 0,25%. Также выполняли контрольные инкубации в отсутствие клеток для выявления какого-либо не ферментативного разрушения. По 2 образца (50 мкл) удаляли из инкубационной смеси через 0, 5, 10, 20, 40 и 60 мин (контрольный образец только через 60 мин) и добавляли к внутреннему стандарту (100 мкл), содержащему МеОН, для прекращения взаимодействия. Толбутамин, 7-гидроксикумарин и тестостерон использовали в качестве контрольных соединений. Образцы центрифугировали и надосадочные жидкости в каждую точку времени объединяли для анализа LC-MSMS (жидкостной хроматографией - масс-спектрометрией-масс-спектроскопией). По графику определяли изменение отношения площади пика ln (площадь пика исходного соединения/площадь пика внутреннего стандарта) с течением времени, внутренний клиренс (CLint) рассчитывали следующим образом: CLint (мкл/мин/миллион клеток) = V×k, где k представляет собой константу скорости выведения, полученную по градиенту концентрации ln, нанесенной на график ее изменения во времени; V представляет собой объем, выведенный из инкубационного объема, и выраженный в виде мкл 106 клеток-1.
Соединения классифицировали низким (CL≤4,6 мкл/мин/106 клеток), средним (CL≥4,6; ≤25,2 мкл/мин/106 клеток) и высоким (≥25,2 мкл/мин/106 клеток) клиренсом. Было определено, что большинство испытанных соединений по изобретению имели низкий клиренс гепатоцитов.
(v) Ингибирование цитохрома Р450
Проводили скрининг соединений по изобретению против пяти мишеней CYP450 (1A2, 2C9, 2C19, 2D6, 3A4) в 10 концентрациях в двух повторениях, при использовании максимальной концентрации 100 мкМ. В качестве контролей использовали стандартные ингибиторы (фурафиллин, сульфафеназол, транилципромин, хинидин, кетоконазол). Планшеты считывали с использованием прибора BMG Lab Technologies PolarStar в режиме флуоресценции. Большинство испытанных соединений, оценивавшихся в данном анализе, проявляли слабую активность (IC50≥5 мкМ) против всех изоформ CYP450.
(vi) Индукция цитохрома Р450
Свежевыделенные гепатоциты человека от одного донора культивировали в течение 48 час перед добавлением испытуемого соединения в трех концентрациях и инкубировали в течение 72 час. Зондовые субстраты для CYP3A4 и CYP1A2 добавляли в течение 30 мин и 1 час перед окончанием инкубации. Через 72 час клетки и среды удаляли и с помощью LC-MS/MS количественно определяли степень метаболизма каждого зондового субстрата. Эксперимент контролировали применением индукторов отдельных Р450, инкубированных в одной концентрации в трех повторениях. Соединения по изобретению, оцененные в этом анализе, показали воздействия на индукцию ферментов цитохрома Р450, которыми можно пренебречь.
(vii) Связывание белка плазмы
Получали растворы испытуемого соединения (5 мкм, 0,5% конечная концентрация ДМСО) в буфере и 10% плазме (об./об. в буфере). 96-луночный планшет для гемаглютинационного диализа собирали так, что каждая лунка была разделена на 2 полупроницаемой целлюлозной мембраной. Буферный раствор добавляли с одной стороны мембраны; инкубации затем проводили при 37°С в течение 2 час в трех повторениях. Ячейки в последующем опорожняли и растворы для каждой партии соединений объединяли в 2 группы (без плазмы и с содержанием плазмы), затем анализировали LC-MSMS, используя 2 набора калибровочных стандартов для лишенных плазмы (6 точек) и содержащих плазму (7 точек) растворов. Для каждого соединения рассчитывали величину несвязанной фракции: соединения с высокой связью с белками (связанные на ≥90%) имели Fu≤0,1. Соединения по изобретению, оцененные в данном анализе, имели величины Fu≥0,1.
(viii) Блокада каналов hERG
Соединения по изобретению оценивали для выявления их способности модулировать отток рубидия из клеток НЕК-294, устойчиво экспрессирующих hERG калиевые каналы, используя методику установленного потока. Клетки получали в среде, содержащей RbCl, и высевали на 96-луночные планшеты и выращивали в течение ночи для формирования монослоев. Эксперимент оттока начинали аспирацией среды и промыванием каждой лунки 3×100 мкл предварительно инкубированного буфера (содержащего низкую концентрацию калия [K+]) при комнатной температуре. После конечной аспирации в каждую лунку добавляли 50 мкл рабочего маточного (2×) соединения и инкубировали при комнатной температуре в течение 10 мин. Затем в каждую лунку добавляли 50 мкл стимулирующего буфера (содержащего высокую [K+]), обеспечивая конечную концентрацию испытуемого соединения. Затем клеточные планшеты инкубировали при комнатной температуре в течение еще 10 мин. Затем 80 мкл надосадочной жидкости из каждой лунки переносили в эквивалентные лунки 96-луночного планшета и анализировали посредством атомной эмиссионной спектроскопии. Скрининг соединений проводили в виде 10-точечных кривых IC50 в двух повторениях, n=2, от максимальной концентрации 100 мкМ.
Пример 4
Композиция для таблеток
Таблетки, каждая массой 0,15 г и содержащая 25 мг соединения по изобретению, изготавливают следующим образом:
Композиция для 10000 таблеток
Активное соединение (250 г)
Лактоза (800 г)
Кукурузный крахмал (415 г)
Порошок талька (30 г)
Стеарат магния (5 г)
Смешивают активное соединение, лактозу и половину кукурузного крахмала. Затем смесь продавливают через сито с размером ячеек, меш, 0,5 мм. Кукурузный крахмал (10 г) суспендируют в теплой воде (90 мл). Полученную пасту используют для гранулирования порошка. Гранулированную массу сушат и разрушают на мелкие фрагменты на сите с размером меш 1,4 мм. Добавляют оставшееся количество крахмала, талька и магния, тщательно смешивают и изготавливают таблетки.
Пример 5
Инъецируемая препаративная форма
Состав А
раствор гидроксида натрия 0,1М
Соединение по изобретению растворяют в большем количестве воды (35-40°С) и рН доводят до уровня 4,0-7,0 в зависимости от целесообразности хлористоводородной кислотой или гидроксидом натрия. Затем партию доводят до нужного объема водой и фильтруют через стерильный микропористый фильтр в стерильный флакон емкостью 10 мл из янтарного стекла (типа 1) и укупоривают стерильными пробками и дополнительным укупорочным средством.
Состав В
фосфатный буфер с рН 7
Активное соединение растворяют в гликофуроле. Затем добавляют бензиловый спирт и растворяют и добавляют воду до 3 мл. Затем смесь фильтруют через стерильный микропористый фильтр и укупоривают в стерильные стеклянные флакончики емкостью 3 мл (типа 1).
Пример 6
Препаративная форма в виде сиропа
Соединение по изобретению растворяют в смеси глицерина и большего количества очищенной воды. Затем к раствору добавляют водный раствор бензоата натрия с последующим добавлением раствора сорбита и, наконец, отдушку. Объем доводят очищенной водой и тщательно смешивают.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2005 |
|
RU2422449C2 |
| ИНГИБИТОРЫ ФОСФОИНОЗИТИД-3-КИНАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2468027C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2007 |
|
RU2443706C2 |
| АЗАИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Xa | 2004 |
|
RU2330853C2 |
| БОРСОДЕРЖАЩИЕ МАЛЫЕ МОЛЕКУЛЫ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ | 2007 |
|
RU2508113C2 |
| БОР-СОДЕРЖАЩИЕ МАЛЫЕ МОЛЕКУЛЫ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ | 2007 |
|
RU2642628C2 |
| ТРИАЗИНОВЫЕ, ПИРИМИДИНОВЫЕ И ПИРИДИНОВЫЕ АНАЛОГИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ И ДИАГНОСТИЧЕСКИХ ПРОБ | 2009 |
|
RU2537945C2 |
| СИГМА-ЛИГАНДЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРОФИЛАКТИКЕ И/ИЛИ ЛЕЧЕНИИ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ | 2011 |
|
RU2569055C2 |
| BCL-2-СЕЛЕКТИВНЫЕ АПОПТОЗ-ИНДУЦИРУЮЩИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РАКА И ИММУННЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2542994C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617424C2 |
Изобретение относится к новым конденсированным пиримидинам формулы (I) и их фармацевтически приемлемым солям, обладающим ингибирующими свойствами в отношении Р13 киназы. В формуле 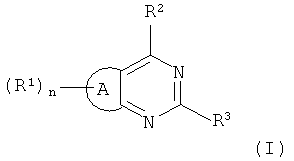
А представляет тиофеновое кольцо; n=1; R1 представляет собой группу формулы 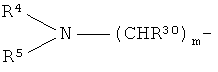 ,
,
где m=1; R30 представляет собой водород; R4 и R5 образуют вместе с атомом N, к которому они присоединены, 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, которая включает 1 дополнительный гетероатом, выбранный из N, которая является незамещенной или замещенной C1-С3алкилом, который может быть замещен ОН; S(O)2С1-3алкилом; С(O)N(диС1-С3алкилом); N(СН3)2; СОN(СН3)-СН2СН2OСН3; N(СН3)-СН2СН2OСН3; -С(O)морфолином или морфолином; R2 выбран из 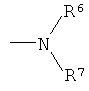 ,
,
где R6 и R7 образуют вместе с атомом азота, к которому они присоединены, морфолиновую группу, которая является незамещенной; и R3 представляет собой индольную группу, которая является незамещенной. Изобретение относится также к способу получения соединений формулы (I), фармацевтической композиции, их применению для получения лекарственного средства и способу ингибирования. 5 н. и 4 з.п. ф-лы.
1. Соединение, которое представляет собой конденсированный пиримидин формулы (I):
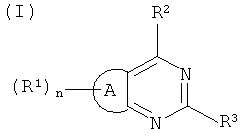
где А представляет тиофеновое кольцо;
n=1;
R1 представляет собой группу формулы:
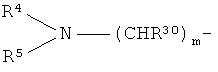
где m=1;
R30 представляет собой водород;
R4 и R5 образуют вместе с атомом N, к которому они присоединены, 5- или 6-членную насыщенную N-содержащую гетероциклическую группу, которая включает 1 дополнительный гетероатом, выбранный из N, которая является незамещенной или замещенной C1-С3алкилом, который может быть замещен ОН; S(O)2С1-3алкилом; С(O)N(диС1-С3алкилом); N(СН3)2; СОN(СН3)-СН2СН2OСН3; N(СН3)-СН2СН2OСН3;
-С(O)морфолином или морфолином;
R2 выбран из
(а)
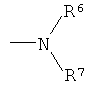
где R6 и R7 образуют вместе с атомом азота, к которому они присоединены, морфолиновую группу, которая является незамещенной; и
R3 представляет собой индольную группу, которая является незамещенной;
или его фармацевтически приемлемую соль.
2. Соединение по п.1, где конденсированный пиримидин имеет формулу (Iа):

где Х представляет собой S и R1, R2, R3 и n имеют значения, определенные в п.1.
3. Соединение по п.1, которое выбрано из
2-(1Н-индол-4-ил)-6-(4-метилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидина;
2-(1Н-индол-4-ил)-6-(4-метансульфонилпиперазин-1-илметил)-4-морфолин-4-илтиено[3,2-d]пиримидина;
диметиламида 4-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты;
{4-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-ил}морфолин-4-илметанона;
(2-метоксиэтил)метиламида {4-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперазин-1-карбоновой кислоты;
{1-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперидин-4-ил}-(2-метоксиэтил)метиламина;
2-(1Н-индол-4-ил)-4-морфолин-4-ил-6-пиперазин-1-илметилтиено[3,2-d]пиримидина;
2-(1Н-индол-4-ил)-4-морфолин-4-ил-6-(4-морфолин-4-илпиперидин-1-илметил)тиено[3,2-d]пиримидина;
2-{4-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено [3,2-d]пиримидин-6-илметил]пиперазин-1-ил}этанола;
{1-[2-(1Н-индол-4-ил)-4-морфолин-4-илтиено[3,2-d]пиримидин-6-илметил]пиперидин-4-ил}диметиламина;
и их фармацевтически приемлемых солей.
4. Способ получения соединения по п.1, где m=1, включающий обработку соединения формулы (II):
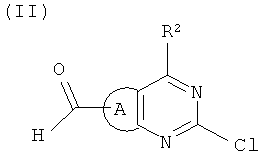
где А и R2 имеют значения, определенные в п.1,
амином формулы NHR4R5, где R4 и R5 определены в п.1, в присутствии подходящего восстанавливающего агента; и обработку полученного соединения формулы (IV):
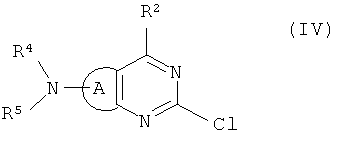
где А, R2, R4 и R5 определены выше, бороновой кислотой или ее сложным эфиром формулы R3B(OR15)2, в которой R3 определен в п.1, и каждый R15 представляет собой Н или C1-С6 алкил или 2 группы OR15 вместе с атомом бора, к которому они присоединены, образуют группу сложного эфира пинаколятбороната в присутствии палладиевого катализатора, и, при необходимости, с последующим превращением полученного соединения формулы (I) в его фармацевтически приемлемую соль.
5. Способ по п.4, который дополнительно включает превращение полученного соединения формулы (I) в его фармацевтически приемлемую соль.
6. Фармацевтическая композиция, обладающая ингибирующими свойствами в отношении Р13К, включающая фармацевтически приемлемый носитель или разбавитель и в качестве активного ингредиента соединение по п.1.
7. Соединение по п.1, обладающее ингибирующими свойствами в отношении Р13К.
8. Применение соединения по п.1 для получения лекарственного средства для лечения заболевания или расстройства, обусловленного патологическим ростом, функцией или поведением клеток, связанных с Р13 киназой.
9. Способ ингибирования Р13 киназы, включающий введение эффективного количества соединения по п.1.
| US 6187777 B1, 13.02.2001 | |||
| US 2003220365 A1, 27.11,2003 | |||
| EP 1277738 A1, 22.01.2003 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| US 4007187 A, 08.02.1977 | |||
| M.S.MANHAS et al, Heterocyclic compounds | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| HETEROCYCL | |||
| CHEM., 1976, 13, 633-638 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-МОРФОЛИНОТИЕНО-[3,2-йг]-ПИРИМИДИНА | 1971 |
|
SU422160A3 |
Авторы
Даты
2011-06-27—Публикация
2005-10-25—Подача