Изобретение относится к области биотехнологии, в частности к культивированию клеточных культур лекарственных растений. Область применения - фармацевтическая промышленность, получение нового вида сырья в качестве источника биологически активных веществ (БАВ) растительного происхождения.
В доступных отечественных и зарубежных источниках не заявлена питательная среда для получения и культивирования представителей рода Atragene sp., в том числе Atragene speciosa Weinm. (сем. Ranunculaceae).
Известны опубликованные работы зарубежных авторов по исследованию и культивированию других растений семейства Ranunculaceae. Ranunculaceae является одним из богатых БАВ семейств. В данном семействе хемотаксономическим признаком можно считать присутствие в растениях алкалоидов дитерпенового ряда, а также тритерпеновых гликозидов (сапонинов). В биотехнологии лекарственных растений широко применяются представители данного семейства - Aconitum sp.и Nigella sp., введенные в культуру in vitro.
Известна питательная среда для клеточной культуры Nigella sp. (Schmauder Н.-P. XIX Nigella spp.: In Vitro Culture, Regeneration, and the Formation of Secondary Metabolites / H.-P. Schmauder, P.Doebel // Biotechnology in Agriculture and Forestry 15. Medicinal and Aromatic Plants III.-Edited by Y.P.S. Bajaj. With 208 Figures.-Springer-Verlag Berlin Heidelberg. - 1991. - printed in Germany. - 1991. - P.311-336.). В видах рода Nigella проанализирован состав БАВ, включающий алкалоиды и сапонины. Скорость каллусогенеза от усиливалась добавлением в основную среду MS (Мурасиге и Скуга) сравнительно высокой концентрации синтетических ауксинов (2-4 мг/л 2,4-Д или НУК) (Schmauder Н.-Р., Doebel Р., 1991). Недостатками питательной среды для культивирования клеточной культуры Nigella spp. является то, что в качестве одного из гормонов роста культуры используют высокие концентрации синтетических ауксинов (2,4-Д или НУК) до 5 мг/л. Дорогостоящие синтетические гормоны в таких высоких концентрациях делают питательную среду экономически невыгодной, а 2,4-Д в концентрации 4-5 мг/л может способствовать хромосомной изменчивости и генетической нестабильности культуры in vitro.
Недостатками известных аналогов является их направленность на культивирование одного вида растений, следовательно, оптимизированная среда для выращивания этих видов не подойдет для выращивания Atragene speciosa Weinm. Вторым недостатком является использование большого количества различных регуляторов роста, таких как пантотенат кальция, глицин, гидролизат казеина, фолиевая кислота, биотин, кокосовое молоко и др. Их использование требует значительного капиталовложения.
В настоящем изобретении для культивирования каллусной и суспензионной культур Atragene speciosa Weinm. применяют среду Мурасиге-Скуга (МС), модифицированную добавлением гормонов и ростовых веществ. Также для культивирования каллусной и суспензионной культур используют регуляторы роста 2,4-Д (2,4-дихлорфеноксиуксусная кислота), НУК (α-нафтилуксусная кислота) и БАП (6-бензиламинопурин) в низких концентрациях. Для успешного культивирования и интенсификации ростовых процессов каллусной и суспензионной культур в питательную среду дополнительно добавляют мезоинозит.
Известна питательная среда для культивирования клеточной культуры Atragene speciosa Weinm. (Автореферат диссертации на соискание ученой степени кандидата биологических наук Дорофеева В.Ю. «Клеточная культура княжика сибирского (Atragene speciosa Weinm.) in vitro», Томск, 2005 г.), выбранная в качестве прототипа. Недостатком питательной среды для культивирования клеточной культуры Atragene speciosa Weinm. является то, что в качестве одного из гормонов роста культуры использован только синтетический ауксин (2,4-Д), который может способствовать хромосомной изменчивости и генетической нестабильности культуры in vitro. Также в данной работе общепринятый показатель ростовой активности биомассы - индекс роста (%) клеточной культуры Atragene speciosa Weinm. не превышает 395,4±0,4-405,2±0,2 при добавлении в питательную среду 2,4-Д (0,5 мг/л), БАП (0,3 мг/л) достигнутый в присутствии в питательной среде дорогостоящих жасмоновой кислоты и 24-эпибрассинолида. При этом культивирование каллусной культуры происходило на селективном свету, что является экономически не выгодным. Следующим недостатком питательной среды для культивирования клеточной культуры Atragene speciosa Weinm. является то, что в качестве одного из гормонов роста культуры использован только синтетический ауксин (2,4-Д), который может способствовать хромосомной изменчивости и генетической нестабильности культуры in vitro.
Задачей настоящего изобретения является разработка качественного и количественного состава питательной среды для культивирования клеточной (каллусной и суспензионной) культуры Atragene speciosa Weinm. с целью достижения технического результата путем увеличения биомассы клеток лекарственного растения Atragene speciosa Weinm. с ростовыми характеристиками выше, чем в прототипе.
Поставленная задача решается тем что, питательная среда для культивирования каллусной культуры Atragene speciosa Weinm., содержит питательную среду с макро и микросолями по Мурасиге и Скугу, гормоны, витамины и сахарозу, но в отличие от прототипа дополнительно добавляют мезоинозит при следующем соотношении компонентов, мг/л:
KNO3 - 1900
NH4NO3 - 1650
CaCl26H2O - 166-332
MgSO47H2O - 370
KH2PO4 - 170
FeSO47H2O - 27,85
Na2ЭДТА - 37,25
Н3ВО3 - 6,2
MnSO45H2O - 24,1
ZnSO47H2O - 8,6
Na2MoO4 - 0,25
KI - 0,83
CuSO45H2O - 0,025
CoCl26H2O - 0,025
Пиридоксин-HCl - 0,5-1,0
Тиамин-HCl - 0,5-1,0
Никотиновая кислота - 0,5-1,0
НУК-0,5-1,0
2,4-Д - 0,5-1,0
БАЛ - 0,2-0,8
Мезоинозит - 50-100
Сахароза - 20000-30000
Агар - 0,1-6700
Вода - до 1 л
Для приготовления питательной среды готовят концентрат макросолей, при этом каждая из макросолей растворяется последовательно в небольшом количестве воды, а затем объем доводится до 1 л. Аналогично готовятся концентраты микросолей, Fe-хелата, витаминов. Макро- и микросоли, Fe-хелат, витамины в виде концентратов смешивают в небольшом количестве воды. Затем к полученной смеси добавляют БАП, 2,4-Д и/или НУК, сахарозу и все тщательно перемешивают. Раствор доводят дистиллированной водой до 1 л. Для каллусной культуры в питательную среду добавляют агар в концентрации 0,1-6700 мг/л. Для суспензионной культуры добавляется раствор CaCl2 в концентрации вдвое меньше, чем для каллусной. Все сосуды (колбы) с питательными средами закрывают фольгой и стерилизуют в автоклаве в течение 20 мин при 1,0 атм. Чашки Петри, скальпель, пинцет стерилизуют в сухожаровом шкафу при 160°С. Питательные среды после их стерилизации помещают в сосуды для культивирования (колбы, флаконы, биореактор) каллусных и суспензионных клеток в стерильных условиях ламинарного бокса. Клеточную культуру высаживают в возрасте 30-40 суток. Культивирование каллусной культуры проводится при 26±1°С в условиях непрерывной темноты в сосудах объемом 100-250 мл. Суспензионную культуру субкультивируют в колбах Эрленмейера объемом 100 мл и 250 мл на шейкере и в биореакторе объемом 5 л в темноте или при освещении белым светом интенсивностью 1500-2000 Люкс с фотопериодом день/ночь (14/10 час). Основное максимальное количество биомассы каллусных клеток накапливается к 30 суткам культивирования, затем ткань переходит к фазе замедленного роста и к 35 суткам ее рост практически прекращается. Для сбора биомассы и дальнейшего субкультивирования используется культура 35-40 суток.
Пример 1.
Для приготовления питательной среды готовят концентрат макросолей (KNO3 - 1900 мг/л, NH4NO3 - 1650 мг/л, MgSO47H2O - 370 мг/л, KH2PO4 - 170 мг/л), при этом каждая из макросолей растворяется последовательно в небольшом количестве воды, а затем объем доводится до 1 л. Аналогично готовятся концентраты микросолей (H3BO3 - 6,2 мг/л, MnSO45H2O - 24,1 мг/л, ZnSO47H2O - 8,6 мг/л, Na2MoO42H2O - 0,25 мг/л, KI - 0,83 мг/л, CuSO45H2O - 0,025 мг/л, CoCl26H2O - 0,025 мг/л), Fe-хелата (FeSO47H2O - 27,85 мг/л, Na2ЭДТА - 37,25 мг/л), CaCl2 (CaCl26H2O - 166 мг/л для суспензионной культуры), мезоинозита (100 мг/л), витаминов (пиридоксин-HCl - 0,5 мг/л, тиамин-HCl - 0,5 мг/л, никотиновая кислота-HCl - 0,5 мг/л). Макро- и микросоли, Fe-хелат, CaCl2, витамины в виде концентратов смешивают в небольшом количестве воды. Затем к полученной смеси добавляют 2,4-Д (0,8 мг/л) и БАЛ (0,6 мг/л), сахарозу (30000 мг/л). В колбы с питательной средой для каллусной культуры добавляют 0,1 мг/л агара. Раствор доводят дистиллированной водой до 1 л. Колбы закрывают фольгой и стерилизуют в автоклаве 20 мин при 1,0 атм. Чашки Петри, посуду для культивирования, пинцеты и скальпель стерилизуют в течение 2,5 часа в сухожаровом шкафу при 160°С. Затем стерильную питательную среду в условиях ламинарного бокса размещают по культуральным флаконам - колбам Эрленмейера (100 и 250 мл) или в биореактор. Суспензионную культуру культивируют на шейкере при 100 об/мин или в биореакторе объемом 5 л. Культивирование суспензионной культуры проводится при 25±2°С в условиях темноты.
Пример 2.
Для приготовления питательной среды готовят концентрат макросолей (KNO3 - 1900 мг/л, NH4NO3 - 1650 мг/л, MgSO47H2O - 370 мг/л, KH2PO4 - 170 мг/л), при этом каждая из макросолей растворяется последовательно в небольшом количестве воды, а затем объем доводится до 1 л. Аналогично готовятся концентраты микросолей (H3BO3 - 6,2 мг/л, MnSO45H2O - 24,1 мг/л, ZnSO47H2O - 8,6 мг/л, Na2MoO42H2O - 0,25 мг/л, KI - 0,83 мг/л, CuSO45H2O - 0,025 мг/л, CoCl26H2O - 0,025 мг/л), Fe-хелата (FeSO47H2O - 27,85 мг/л, Na2ЭДTA - 37,25 мг/л), CaCl2 (CaCl26H2O - 332 мг/л), мезоинозит (100 мг/л) витаминов (пиридоксин-HCl - 0,5 мг/л, тиамин-HCl - 0,5 мг/л, никотиновая кислота-HCl - 0,5 мг/л). Макро- и микросоли, Fe-хелат, CaCl2, витамины в виде концентратов смешивают в небольшом количестве воды. Затем к полученной смеси добавляют НУК (0,5 мг/л) и БАП (0,2 мг/л), сахарозу (30000 мг/л). В колбы с питательной средой для каллусной культуры добавляют 6,7 г/л агара. Раствор доводят дистиллированной водой до 1 л. Колбы закрывают фольгой и стерилизуют в автоклаве в течение 20 мин при 1,0 атм. Чашки Петри, посуду для культивирования, пинцеты и скальпель стерилизуют в течение 2,5 часа в сухожаровом шкафу при 160°С. Стерильную питательную среду размещают в культуральные флаконы - колбы или микробиологические флаконы. Ткань высаживают в возрасте 30-40 суток. Культивирование каллусной культуры проводится при 25±2°С в условиях непрерывной абсолютной темноты. Таким образом, настоящее изобретения позволяет культивировать клеточную (каллусную и суспензионную) культуру Atragene speciosa Weinm.
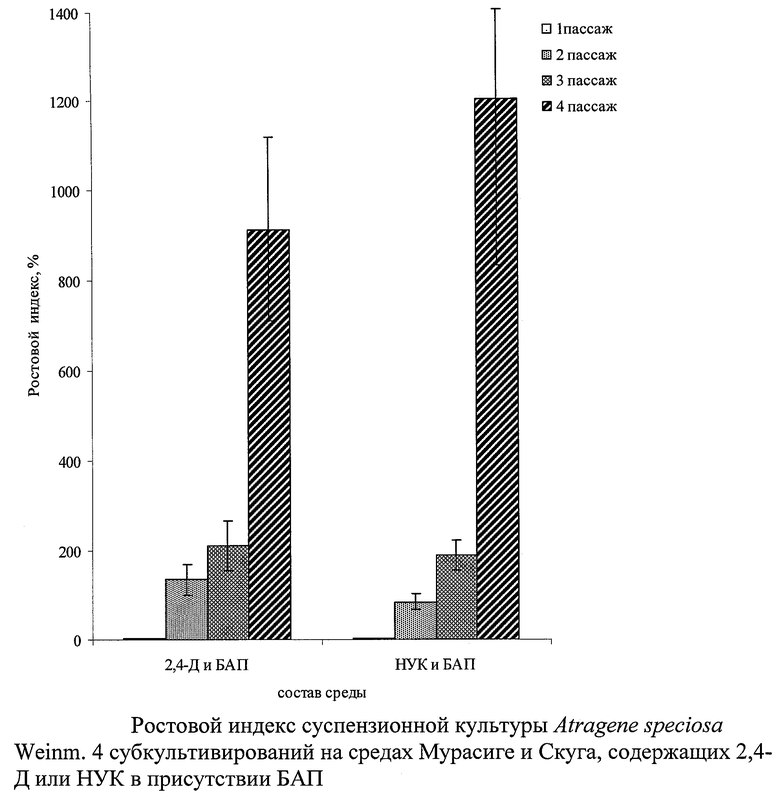
Таким образом, в заявляемом изобретении за счет использования в питательной среде, наряду с 2,4-Д, другого не мутагенного ауксина - НУК показан значительный выход биомассы клеток, приведенный на чертеже (ростовой индекс до 1200% в среднем).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КУЛЬТИВИРОВАНИЯ КАЛЛУСНОЙ ТКАНИ Centaurea scabiosa l | 2011 |
|
RU2458121C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОЧНОЙ КУЛЬТУРЫ SAUSSUREA ORGAADAYI V. KHAN. ET KRASNOB | 2010 |
|
RU2428472C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КАЛЛУСНОЙ КУЛЬТУРЫ БОЛИГОЛОВА ПЯТНИСТОГО (Conium maculatum L) | 2015 |
|
RU2596402C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КАЛЛУСНОЙ ТКАНИ SILENE VULGARIS (MOENCH) GARCKE | 1999 |
|
RU2169769C1 |
| Способ получения биологически активных веществ в клеточной культуре Conium maculatum L. (болиголова пятнистого) | 2015 |
|
RU2619182C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В КЛЕТОЧНОЙ КУЛЬТУРЕ ATRAGENE SPECIOSA WEINM. (КНЯЖИК СИБИРСКИЙ) | 2009 |
|
RU2428473C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КАЛЛУСНОЙ КУЛЬТУРЫ ARTEMISIA ANNUA L. | 2009 |
|
RU2393217C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫРАЩИВАНИЯ КУЛЬТУРЫ ТКАНИ GLYCYRRHIZA URALENSIS - ПРОДУЦЕНТА САПОНИНОВ | 1994 |
|
RU2123255C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАЛЛУСНОЙ КУЛЬТУРЫ БОЛИГОЛОВА ПЯТНИСТОГО (Conium maculatum L) | 2015 |
|
RU2590586C1 |
| Способ получения каллусной культуры борца бородатого (Aconitum barbatum Patr. ex Pers.) | 2016 |
|
RU2631927C1 |
Изобретение относится к области биотехнологии, в частности к культивированию клеточных культур лекарственных растений. Питательная среда для культивирования клеточной культуры Atragene speciosa Weinm. содержит питательную среду с макро- и микросолями по Мурасиге и Скугу, гормоны, витамины и сахарозу, с дополнительным добавлением мезоинозита при следующем соотношении компонентов, мг/л: MnSO45H2O - 24,1; ZnSO47H2O - 8,6; Na2MoO4 - 0,25; KI - 0,83; CuSO45H2O - 0,025; CoCl26H2O - 0,025; пиридоксин-HCl - 0,5-1,0; тиамин-HCl - 0,5-1,0; никотиновая кислота - 0,5-1,0; НУК - 0,5-1,0; 2,4-Д - 0,5-1,0; БАП - 0,2-0,8; мезоинозит - 50-100; сахароза - 20000-30000; агар - 0,1-6700; вода - до 1 л. Изобретение позволяет увеличить биомассу клеток лекарственного растения Atragene speciosa Weinm. 1 ил.
Питательная среда для культивирования клеточной культуры Atragene speciosa Weinm, содержащая питательную среду с макро- и микросолями по Мурасиге и Скугу, гормоны, витамины и сахарозу, отличающаяся тем, что дополнительно содержит мезоинозит при следующем соотношении компонентов, мг/л:
| ДОРОФЕЕВ В.Ю | |||
| Клеточная культура княжика сибирского (Atragene speciosa Weinm.) in vitro: Автореферат диссертации.- Томск, 2005 | |||
| ЛЯЗГИНА Т.Г | |||
| и др | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
Авторы
Даты
2011-06-27—Публикация
2009-10-05—Подача