Изобретение относится к гидрометаллургическим методам извлечения золота из сульфидных (пирротин, арсенопирит, пирит, антимонит) золотосодержащих концентратов RIP- и CIP-процессами с использованием бактериального окисления сульфидных минералов.
Известен способ получения биомассы [RU 94012998 А1, опубл. 27.03.1997], в котором для активации роста микроорганизмов в питательную среду, содержащую азот, углерод и минеральные соли, добавляют трис-(2-оксиэтил) аммониевую соль монохлорфеноксиуксусной кислоты и гибберсиб. Эта комбинация веществ хотя и повышает выход биомассы на (8-25)%, но не увеличивает дыхательную активность бактерий в процессе биоокисления сульфидов и не приводит к повышению скорости процесса. Кроме того, эти соединения дорогие и дефицитные и использование их в крупнотоннажном производстве потребует больших затрат на приобретение и транспортировку.
В способе подготовки реагента для бактериально-химического выщелачивания сульфидных руд [SU 1790229 А1, опубл. 10.11.1995] предлагается при подготовке биомассы к процессу активацию микроорганизмов вести торфо-щелочным реагентом с концентрацией (0,01-1) масс.%. Использование этого реагента приведет к увеличению расхода кислоты для нейтрализации щелочи, так как биоокисление сульфидных минералов осуществляется в кислых средах (рН 1,3-2,0), а углерод торфа активно сорбирует благородные металлы и цианиды, что снизит извлечение золота в процессах RIP или CIP.
Для повышения скорости бактериального окисления минерального сырья предложено в питательную среду Сильвермана и Люндгрена дозировать парамолибдат аммония [RU 2046937 С1, опубл. 27.10.1995]. Использование этого дорогого и дефицитного реагента приведет к повышению концентрации ионов аммония в биопульпе и образованию труднорастворимого осадка - ярозита железа (III) NH4Fе3(SO4)2·(ОН)6. Осаждение ярозита железа на поверхности MeS снижает скорость массообменных процессов, затрудняет доступ бактерий к минералам, лишает их субстрата и приводит к инактивации и лизису клеток. Все это обусловит уменьшение степени окисления сульфидной серы и снижение технико-экономических показателей процесса цианирования золота.
Наиболее близким по технической сущности и достигаемым результатам является метод активации бактерий углекислым газом СO2, подаваемым в биопульпу вместе с воздухом [Котляр Ю.А., Меретуков М.А. Металлургия благородных металлов. М.: АСМИ, 2002, 466 с.]. Однако подача большого количества углекислоты (0,1÷0,2% от объема воздуха) обеспечивает возрастание активности микроорганизмов всего на 30%. При большом объеме перерабатываемых концентратов транспортировка сжиженного газа СО2 на золотоизвлекательные фабрики (ЗИФ) Крайнего Севера, Якутии, Магадана и т.д. невозможна, а использование топочно-котельных газов с содержанием (12÷15)% СO2, серы, сероводорода, оксидов азота и других примесей без их предварительной очистки проблематично. Поэтому ЗИФ России при бактериальном окислении сульфидных золотоносных концентратов углекислый газ не используют для активации микроорганизмов.
Задачей изобретения является активация дыхательного процесса микроорганизмов и улучшение за счет этого технико-экономических показателей бактериального окисления сульфидных концентратов.
Поставленная задача достигается тем, что в способе бактериального окисления сульфидных золотосодержащих концентратов, включающем получение биопульпы из сероокисляющих бактерий и концентрата, подачу воздуха, окисление основной массы сульфида железа и подачу активатора, в качестве активатора используют карбонат железа (II) и подают его в биопульпу после окисления на 80-85% основной массы сульфида железа при расходе, соответствующем его концентрации в растворе 0,42÷0,52 г/л.
Сущность предлагаемого способа основана на том, что карбонат железа (II) с положительным поверхностным потенциалом адсорбируется на отрицательно заряженных поверхностях сульфидных минералов и, являясь источником двух жизненнонеобходимых для микроорганизмов компонентов - энергетического субстракта (Fe2+) и строительного материала для биомассы (углерод, СО3 2-, НСО3 -), способствует закреплению и функционированию бактерий на MeS. Наряду с этим карбонат железа (II) активирует дыхательную деятельность бактерий (усвоение кислорода) за счет окисления элементарной серы, концентрирующейся при неблагоприятных условиях в микроорганизмах. Механизм такой активации можно представить следующими химическими моделями.
Наличие в биопульпе углекислого газа обеспечивает медленное растворение карбоната железа (II):
Бикарбонат железа (II) «легко усваивается» железобактериями по реакции [Некрасов Б.В. Основы общей химии, т.2, М.: Химия, 1969,400 с.]:
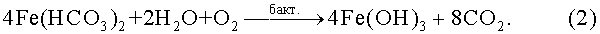
Гидроксид железа(III) адсорбируется на электроотрицательной поверхности элементарной серы, окисляет и растворяет ее:
В конечном итоге элементарная сера удаляется из бактерий и они начинают окислять сульфидную серу (дыхательная активность) по уравнению:
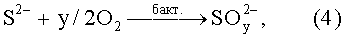
где у=2,3,4.
В карбонат- или бикарбонат-ионе энергия связи между углеродом и кислородом ~ в 2,3 раза меньше [Некрасов Б.В. Основы общей химии, т.2, М.: Химия, 1969, 400 с.], чем в CO2, поэтому синтез биомассы с добавками в биопульпу FеСО3 идет с большой скоростью.
Способ осуществляется следующим образом.
При снижении дыхательной способности бактерий в процессе бактериального окисления или низком исходном ее значении (менее 10÷15 мклO2/мл·15 мин) в биопульпу для активации микроорганизмов дозировали карбонат железа (II) при его концентрации в растворе 0,42÷0,52 г/л. По истечении определенного времени окислительную активность биомассы определяли с использованием модифицированного метода Барбурга на приборе ИПЛ-74-03.
По предлагаемому способу было проведено две серии лабораторных опытов. В первой серии варьировали расход карбоната железа (II) при продолжительности эксперимента 3 суток и концентрации двухвалентного железа 0,2 м/л. Влияние расхода FеСО3 на скорость окисления железа (II) и активность бактерий представлено в таблице 1.
Из результатов опытов следует, что при расходе карбоната железа (II) 0,415 ÷0,519 г/л наблюдается максимальная скорость окисления ионов Fe2+до трехвалентного состояния (5,56÷5,66)·10-3 г-ион/л·час и высокая дыхательная активность бактерий (67÷72) мклO2/мл·15 мин. Увеличение скорости окисления ионов Fe2+с активатором FеСО3 происходит в 4,6 раза.
При расходах FеСО3 менее 0,207 г/л скорость окисления железа (II) снижается ниже 4·10-3 г-ион/л·час, а активность бактерий практически остается на прежнем уровне (67 мклO2/мл·15 мин), таблица 1.
Увеличение расхода FеСО3 более 0,519 г/л не приводит к изменению дыхательной активности бактерий, но вызывает снижение скорости окисления Fe2+и повышает затраты на реагент (таблица 1).
Во второй серии опытов показано влияние добавки карбоната железа (II) на показатели бактериального окисления сульфидного золотосодержащего концентрата при расходе FеСО3 0,47 г/л, содержании твердого в пульпе 15%. Дозирование карбоната железа (II) осуществлялось при снижении активности бактерий менее 15 мклO2/мл·15 мин после окисления основной массы (80-85)% пирротина и арсенопирита.
Концентрация биомассы в биопульпе снижалась с 1,6 до 1,1 г/л, а дыхательная активность бактерий изменялась в пределах (40±25) мклO2/мл·15 мин. Влияние карбоната железа (II) на основные показатели биоокисления концентрата приведено в таблице 2.
Добавка карбоната железа (II) с оптимальным расходом 0,47 г/л (2,66 кг/т концентрата) в биопульпу с питательными солями, аналогичными по составу золотоизвлекательной фабрике №2 ЗАО «Полюс» [Совмен В.К., Гуськов В.Н., Белый А.В. и др. Переработка золотоносных руд с применением бактериального окисления в условиях Крайнего Севера. - Новосибирск, Наука, 2007, 144 с.] позволяет увеличить степень окисления минералов до (83,4÷96,9)%, сульфидной серы до 90,1%, а скорость окисления сульфидной серы на 32%.
Таким образом, оптимальной дозировкой карбоната железа (II) в пульпу бактериального окисления сульфидного концентрата является величина (0,42÷0,52)г/л, которая обеспечивает увеличение дыхательной активности железо- и сероокисляющих микроорганизмов до ~70 мклO2/мл·15 мин, повышение скорости окисления ионов Fe2+в 4,6 раза, а сульфидной серы на 32%.
Пример осуществления опытов
Пример 1. Активация процесса окисления ионов Fе2+в биорастворе
В титановый реактор с объемом 1,3 л воды загружалась соль FeSO4·7H2O из расчета получения концентрации железа (II) в растворе 0,2 м/л, добавлялись питательные соли, г/л: 3 (NH4)2SO4; 0,5 К2НРO4; 0,5 MgSO4·7H2O; 0,1 KCl; 0,01 Са(NO3)2 и разбавленная (1:1) серная кислота до рН 2,0. Раствор разбавлялся водой до 1,5 л, нагревался до (38÷39)°С, в него дозировался раствор инокулянта 0,5 л. После перемешивания раствора в течение 6 часов лопастной мешалкой с частотой 400 об/мин и подачей воздуха с расходом 1 л/мин в раствор загружался карбонат железа (II) в количестве 0,47 г/л. С этого момента начинался отсчет продолжительности опыта. Через каждые 4 часа отбирались пробы и определялось экспрессивным методом содержание ионов Fe2+и Fe3+ в растворе. При концентрации ионов Fe2+, равной 0, опыт заканчивался, так как все железо (II) было окислено до Fe3+. Продолжительность биоокисления железа (II) составила 36,3 часа, что соответствует скорости окисления ионов Fe2+, равной 0,0551 г-ион/л·час.
Пример 2. Бактериальное окисление сульфидного золотосодержащего концентрата состава, %: 24,69 Fe; 7,44 As; 4,91 Sb4 16,88 Ss; 1,78 Sso4; 89 г/т Au, прочие - до 100 Сульфиды в концентрате представлены минералами, %: 23,12 Fe7S8; 16,06 FeAsS; 5,69 FeS2; 5,45 Sb2S3.
Сульфидный концентрат массой 0,3 кг, в котором содержится 4,5% Са в виде кальцита, предварительно перемешивался с оборотным биофильтратом (состав биофильтрата, г/л: 20 Fe3+; 4 As; 0,9 Sb, pH 2,0) в течение 3 часов до рН пульпы 2,8. Полученная пульпа поступала на бактериальное окисление в реактор с механическим перемешиванием (частота вращения 400 об/мин), дозировались питательные соли, кг/т концентрата: 2,9 мочевина; 1,1 Н3РO4; 2,0 К2НРO4; 2,6 K2SO4, загружалось 0,5 л пульпы инокулянта с концентрацией железо- и сероокисляющих бактерий 2,6 г/л и дыхательной активностью ~50 мклO2/мл·15 мин, объем пульпы доводился до 2 л, подкислялся серной кислотой до рН 2,0. В реакторе поддерживалась температура 38÷39°С и подавался воздух с расходом 1 л/мин. После окисления основной массы (80÷85)% сульфидов железа, рН и Eh пульпы стабилизировались, а дыхательная активность бактерий снижалась до 10÷15 мклO2/мл·15 мин. Это служило признаком для загрузки активатора - карбоната железа (II). В биопульпу объемом 2 л было загружено 0,94 г FеСО3 в кашеобразном состоянии. Через 24-36 часов активность бактерий выросла до 60-70 мклO2/мл·15 мин и они продолжали окислять упорные сульфидные минералы пирит и антимонит. Окончание бактериального выщелачивания сульфидного концентрата устанавливалось по стабилизации рН, Eh, концентрации железа, мышьяка в жидкой фазе биопульпы и лизису бактерий. Продолжительность процесса составила 73 часа. В дальнейшем биопульпа фильтровалась и ее твердая часть - биокек - анализировался химическим и рентгенофазовым методами с определением сульфидной и элементарной серы, железа, мышьяка, сурьмы. По данным анализов рассчитывались степени окисления сульфидных минералов и сульфидной серы, определялась скорость ее окисления.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОДГОТОВКИ СУЛЬФИДНЫХ ЗОЛОТОСОДЕРЖАЩИХ КОНЦЕНТРАТОВ К БАКТЕРИАЛЬНОМУ ОКИСЛЕНИЮ ПРИ ИЗВЛЕЧЕНИИ ЗОЛОТА | 2010 |
|
RU2423538C1 |
| СПОСОБ БАКТЕРИАЛЬНОГО ОКИСЛЕНИЯ СУЛЬФИДНЫХ ЗОЛОТОНОСНЫХ КОНЦЕНТРАТОВ | 2010 |
|
RU2422544C1 |
| СПОСОБ БАКТЕРИАЛЬНОГО ОКИСЛЕНИЯ СУЛЬФИДНЫХ ЗОЛОТОСОДЕРЖАЩИХ КОНЦЕНТРАТОВ ДЛЯ ИЗВЛЕЧЕНИЯ ЗОЛОТА | 2010 |
|
RU2425898C1 |
| Способ биовыщелачивания упорных золотосодержащих сульфидных флотоконцентратов | 2016 |
|
RU2637204C1 |
| СПОСОБ ПЕРЕРАБОТКИ УПОРНОЙ ЗОЛОТОСОДЕРЖАЩЕЙ ПИРРОТИН-АРСЕНОПИРИТНОЙ РУДЫ | 2012 |
|
RU2483127C1 |
| СПОСОБ ПЕРЕРАБОТКИ УПОРНЫХ ПИРРОТИН-АРСЕНОПИРИТ-ПИРИТ-БЕРТЬЕРИТ-СТИБНИТОВЫХ ЗОЛОТОСОДЕРЖАЩИХ РУД (ВАРИАНТЫ) | 2023 |
|
RU2807003C1 |
| СПОСОБ ПЕРЕРАБОТКИ ПЕРВИЧНЫХ ЗОЛОТОСУЛЬФИДНЫХ РУД | 2004 |
|
RU2256712C1 |
| АССОЦИАЦИЯ МИКРООРГАНИЗМОВ SULFOBACILLUS OLYMPIADICUS, FERROPLASMA ACIDIPHILUM, LEPTOSPIRILLUM FERROOXIDANS ДЛЯ ОКИСЛЕНИЯ СУЛЬФИДНОГО ЗОЛОТОСОДЕРЖАЩЕГО КОНЦЕНТРАТА | 2006 |
|
RU2332455C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ЗОЛОТА ИЗ УПОРНЫХ ЗОЛОТОМЫШЬЯКОВЫХ РУД | 2005 |
|
RU2291909C1 |
| СПОСОБ ПЕРЕРАБОТКИ УПОРНЫХ ПИРРОТИН-АРСЕНОПИРИТ-ПИРИТ-БЕРТЬЕРИТ-СТИБНИТОВЫХ ЗОЛОТОСОДЕРЖАЩИХ РУД (ВАРИАНТЫ) | 2023 |
|
RU2807008C1 |
Изобретение относится к способу бактериального окисления сульфидных золотосодержащих концентратов. Способ включает получение биопульпы из сероокисляющих бактерий и концентрата, подачу воздуха, окисление основной массы сульфида железа и подачу активатора. В качестве активатора используют карбонат железа (II). Активатор подают в биопульпу после окисления на 80-85% основной массы сульфида железа при расходе, соответствующем его концентрации в растворе 0,42÷0,52 г/л. Технический результат заключается в активации дыхательного процесса микроорганизмов и улучшении за счет этого технико-экономических показателей бактериального окисления сульфидных концентратов. 2 табл.
Способ бактериального окисления сульфидных золотосодержащих концентратов, включающий получение биопульпы из сероокисляющих бактерий и концентрата, подачу воздуха, окисление основной массы сульфида железа и подачу активатора, отличающийся тем, что в качестве активатора используют карбонат железа (II) и подают его в биопульпу после окисления на 80-85% основной массы сульфида железа при расходе, соответствующем его концентрации в растворе 0,42÷0,52 г/л.
| КОТЛЯР Ю.А | |||
| МЕРЕТУКОВ М.А | |||
| Металлургия благородных металлов | |||
| - М.: АСМИ, 2002, с.400-401 | |||
| СПОСОБ ПОДГОТОВКИ УПОРНЫХ СУЛЬФИДНЫХ РУД И КОНЦЕНТРАТОВ К ВЫЩЕЛАЧИВАНИЮ | 2007 |
|
RU2361937C1 |
| US 5332559 А, 26.07.1994 | |||
| СПОСОБ ПЕРЕРАБОТКИ СУЛЬФИДНЫХ ЗОЛОТОСОДЕРЖАЩИХ КОНЦЕНТРАТОВ | 2005 |
|
RU2283358C1 |
| US US4822413 A, 18.04.1989 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 4740243 A, 26.04.1988 | |||
| Валкообразователь к разбрасывателю удобрений из куч | 1982 |
|
SU1050593A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАФТОРЭТИЛЕНА | 1991 |
|
RU2097369C1 |
Авторы
Даты
2011-07-10—Публикация
2010-03-26—Подача