Предпосылки изобретения
Область изобретения
Настоящее изобретение относится к средствам для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, которые обладают сродством к рецептору тромбопоэтина и агонистическим действием в отношении этого рецептора. В частности, оно относится к фармацевтическим композициям, включающим соединения, которые повышают число тромбоцитов через стимуляцию дифференциации и пролиферации гематопоэтических стволовых клеток, мегакариотических клеток-предшественников и мегакариоцитов, или соединениям для терапевтического ангиогенеза или обладающим активностью против артериосклероза, которые стимулируют дифференциацию и пролиферацию эндотелиальных клеток сосудов и эндотелиальных клеток-предшественников.
Предшествующий уровень техники
Тромбопоэтин представляет собой цитокин, состоящий из 332 аминокислот, который повышает продукцию тромбоцитов путем стимуляции дифференциации и пролиферации гематопоэтических стволовых клеток, мегакариотических клеток-предшественников и мегакариоцитов, опосредованной его рецептором, и поэтому является перспективным в качестве лекарственного средства от гематологических расстройств. Появившиеся в последнее время сообщения о том, что он стимулирует дифференциацию и пролиферацию эндотелиальных клеток сосудов и эндотелиальных клеток-предшественников, явились основанием для ожиданий терапевтического ангиогенеза, действия против артериосклероза и предотвращения сердечно-сосудистых расстройств (например, непатентный документ 1, непатентный документ 2 и непатентный документ 3).
Биологически активные вещества, которые, как было известно до настоящего времени, регулируют продукцию тромбоцитов через рецептор тромбопоэтина, включают, помимо самого тромбопоэтина, низкомолекулярные пептиды, обладающие сродством к рецептору тромбопоэтина (например, патентный документ 1, патентный документ 2, патентный документ 3 и патентный документ 4).
Как результат поиска непептидных низкомолекулярных соединений, которые повышают продукцию тромбоцитов, опосредованную рецептором тромбопоэтина, сообщалось о низкомолекулярных соединениях, обладающих сродством к рецептору тромбопоэтина (например, патентный документ 5 - патентный документ 26).
1) Заявки, поданные Hokuriku Seiyaku Co., Ltd., относящиеся к 1,4-бензодиазепиновым производным (патентные документы 5 и 6)
2) Международные выложенные патентные заявки, поданные Shionogi & Co., Ltd. (патентные документы 7-10)
3) Международные выложенные патентные заявки, поданные SmithKline Beecham Corp (патентные документы 11-19)
4) Японская выложенная патентная заявка, поданная Torii Pharmaceutical Co., Ltd. (патентный документ 20)
5) Международная выложенная патентная заявка, поданная Roche Diagnostics GMBH (патентный документ 21)
6) Международные выложенные патентные заявки, поданные Yamanouchi Pharmaceutical Co., Ltd. (патентный документ 22 и 23)
7) Японская выложенная патентная заявка, поданная Japan Tabacco Inc. (патентный документ 24)
8) Международная выложенная патентная заявка, поданная Nissan Chemical Industries, Ltd. (патентные документы 25 и 26)
Патентный документ 1 JP-A-10-72492
Патентный документ 2 WO96/40750
Патентный документ 3 WO96/40189
Патентный документ 4 WO98/25965
Патентный документ 5 JP-A-11-1477
Патентный документ 6 JP-A-11-152276
Патентный документ 7 WO01/07423
Патентный документ 8 WO01/53267
Патентный документ 9 WO02/059099
Патентный документ 10 WO02/059100
Патентный документ 11 WO00/35446
Патентный документ 12 WO00/66112
Патентный документ 13 WO01/34585
Патентный документ 14 WO01/17349
Патентный документ 15 WO01/39773
Патентный документ 16 WO01/21180
Патентный документ 17 WO01/89457
Патентный документ 18 WO02/49413
Патентный документ 19 WO02/085343
Патентный документ 20 JP-A-2001-97948
Патентный документ 21 WO99/11262
Патентный документ 22 WO02/062775
Патентный документ 23 WO03/062233
Патентный документ 24 JP-A-2003-238565
Патентный документ 25 WO04/033433
Патентный документ 26 WO04/108683
Непатентный документ 1 Microvasc. Res., 1999: 58, p,108-113
Непатентный документ 2 Circ. Res., 1999: 84, p.785-796
Непатентный документ 3 Blood 2001:98, p.71a-72a
Раскрытие изобретения
Тромбопоэтин и низкомолекулярные пептиды, обладающие сродством к рецептору тромбопоэтина, по-видимому, легко разлагаются в желудочно-кишечном тракте, и обычно их трудно вводить перорально. Что касается самого тромбопоэтина, сообщалось о появлении антител против тромбопоэтина.
Кроме того, хотя, вероятно, можно перорально вводить непептидные низкомолекулярные соединения, никаких представляющих практический интерес лекарственных средств не поступало на рынок.
Поэтому существовала потребность в перорально вводимых низкомолекулярных соединениях, обладающих отличным сродством к рецептору тромбопоэтина и агонистическим действием в отношении этого рецептора, как средств для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной. Конкретно, существовала потребность в низкомолекулярных соединениях, которые могут служить в качестве средств для повышения числа тромбоцитов или средств повышения числа других клеток крови путем стимуляции дифференциации и пролиферации гематопоэтических стволовых клеток, мегакариотических клеток-предшественников и мегакариоцитов, или низкомолекулярных соединениях, которые можно использовать для терапевтического ангиогенеза или в качестве средств для предотвращения и лечения артериосклероза путем стимуляции эндотелиальных клеток и эндотелиальных клеток-предшественников.
Авторы настоящего изобретения провели глубокие исследования по выявлению низкомолекулярных соединений, обладающих сродством и агонистическим действием в отношении рецептора тромбопоэтина, и, как результат, было обнаружено, что соединения по настоящему изобретению обладают высоким сродством и агонистическим действием, что позволяет им проявлять сильное действие по повышению числа тромбоцитов путем стимуляции дифференциации и пролиферации мегакариотических клеток-предшественников и мегакариоцитов. Настоящее изобретение было создано на основании этого открытия.
А именно, настоящее изобретение относится к:
1. Соединению, представленному формулой (I):
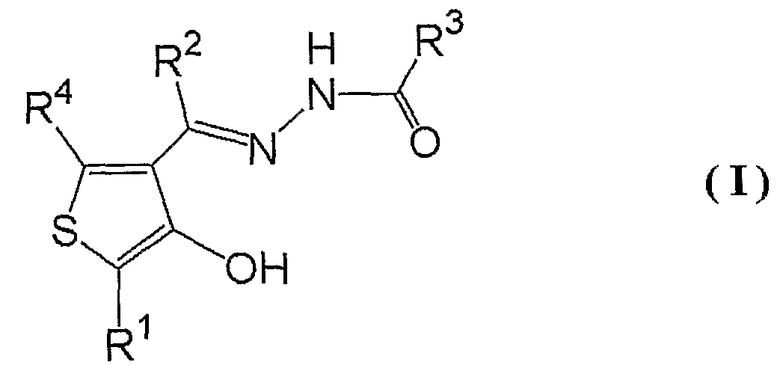
где R1 представляет собой фенильную группу (указанная фенильная группа может быть замещена одной или несколькими C1-6алкильными группами, одной или несколькими C1-3алкильными группами (указанные C1-3алкильные группы замещены одним или несколькими атомами галогена), одной или несколькими C1-3алкоксигруппами (указанные C1-3алкоксигруппы могут быть замещены одним или несколькими атомами галогена) или одним или несколькими атомами галогена),
R2 представляет собой атом водорода или C1-3алкильную группу (указанная C1-3алкильная группа может быть замещена одним или несколькими атомами галогена),
R3 представляет собой фенильную группу, пиридильную группу или тиенильную группу (указанная фенильная группа, указанная пиридильная группа и указанная тиенильная группа замещены одним или несколькими заместителями, выбранными из группы, включающей атомы водорода, нитрогруппы, атом галогена и C1-3алкильные группы (указанные C1-3алкильные группы могут быть замещены одним или несколькими атомами галогена) и группой (C=O)R5 (где R5 представляет собой NR6R7 (где R6 представляет собой атом водорода или C1-3алкильную группу (указанная C1-3алкильная группа может быть замещена одним или несколькими атомами галогена), и R7 представляет собой C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одним или несколькими атомами галогена, одной или несколькими гидроксильными группами, одной или несколькими C1-3алкоксигруппами или одной или несколькими C2-14арильными группами (указанные C2-14арильные группы могут быть замещены одной или несколькими C1-3алкильными группами, одной или несколькими C1-3алкоксигруппами, одной или несколькими карбоксильными группами, одной или несколькими карбамоильными группами, одной или несколькими цианогруппами или одним или несколькими атомами галогена, и в случае арильных групп, содержащих один или несколько атомов азота, могут находиться в форме их N-оксидов)), фенильную группу, тиенильную группу, пиридильную группу или пиридил-N-оксидную группу (указанная фенильная группа, указанная тиенильная группа, указанная пиридильная группа и указанная пиридил-N-оксидная группа могут быть замещены одним или несколькими атомами галогена), или NR6R7 представляет собой, в целом, азот-содержащую гетероциклильную группу (указанная азот-содержащая гетероциклильная группа может быть замещена одним или несколькими атомами водорода, одной или несколькими C1-6алкильными группами (указанные C1-6алкильные группы могут быть замещены одним или несколькими атомами галогена), одним или несколькими атомами галогена, одной или несколькими гидроксильными группами или одной или несколькими C1-3алкоксигруппами (указанные C1-3алкоксигруппы могут быть замещены одним или несколькими атомами галогена))) или C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одним или несколькими атомами галогена, одной или несколькими пиридильными группами, одной или несколькими пиридил-N-оксидными группами, одной или несколькими фурильными группами, одной или несколькими тиенильными группами или одной или несколькими фенильными группами и является замещенной одной или несколькими цианогруппами))), и
R4 представляет собой атом водорода или C1-3алкильную группу (указанная C1-3алкильная группа может быть замещена одним или несколькими атомами галогена), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
2. Соединению по п.1, где R2 представляет собой метильную группу, и R4 представляет собой атом водорода, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
3. Соединению по п.2, где R1 представляет собой 3,4-диметилфенильную группу, 4-трет-бутилфенильную группу, 4-трифторметилфенильную группу, 3-хлорфенильную группу, 4-хлорфенильную группу, 4-фторфенильную группу, 3,4-дихлорфенильную группу, 4-бромфенильную группу или 4-трифторметоксифенильную группу, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
4. Соединению по п.3, где R3 представлен формулой (II):
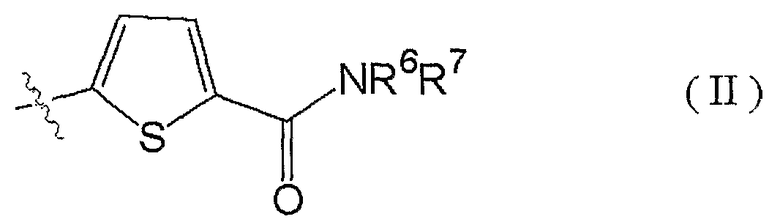
(где R6 представляет собой метильную группу или этильную группу, и R7 C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одной или несколькими метоксигруппами)), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
5. Соединению по п.3, где R3 представлен формулой (II):

(где R6 представляет собой метильную группу или этильную группу, и R7 представляет собой C1-3алкильную группу (указанная C1-3алкильная группа замещена одной или несколькими фенильными группами или одной или несколькими пиридильными группами)), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
6. Соединению по п.3, где R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой C1-6алкильную группу (указанная C1-6алкильная группа замещена одной или несколькими метоксигруппами) или пиридильную группу), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
7. Соединению по п.3, где R3 представлен формулой (II):

(где группа NR6R7, в целом, представлена формулой (III):
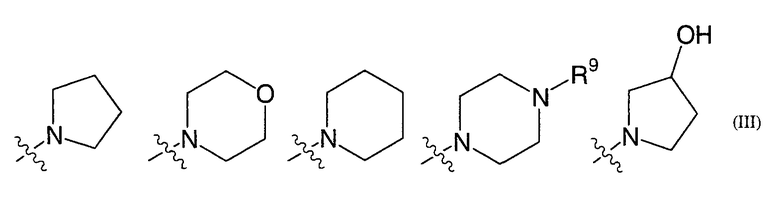
(где R9 представляет собой C1-3алкильную группу)), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
8. Соединению по п.3, где R3 представлен формулой (IV):
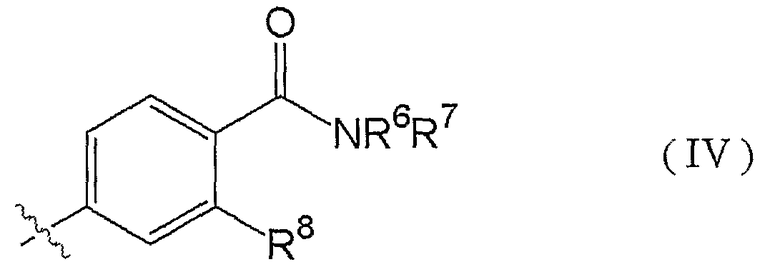
(где R6 представляет собой атом водорода, R7 представляет собой C1-3алкильную группу (указанная C1-3алкильная группа может быть замещена одной или несколькими гидроксильными группами), и R8 представляет собой метильную группу или атом хлора), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
9. Соединению по п.3, где R3 представлен формулой (V):
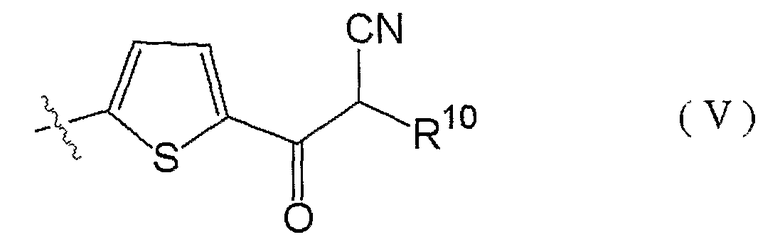
(где R10 представляет собой атом водорода или C1-3алкильную группу), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
10. Соединению по п.3, где R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой изопропильную группу, метильную группу, этильную группу или нормальную пропильную группу (указанная метильная группа, указанная этильная группа и указанная нормальная пропильная группа являются незамещенными или замещены одной или несколькими пиридильными группами, одной или несколькими пиридил-N-оксидными группами, одной или несколькими фурильными группами, одной или несколькими пиразинильными группами, одной или несколькими имидазолильными группами, одной или несколькими пиразолильными группами или одной или несколькими изоксазолильными группами (указанные пиридильные группы, указанные пиридил-N-оксидные группы, указанные фурильные группы, указанные пиразинильные группы, указанные имидазолильные группы, указанные пиразолильные группы и указанные изоксазолильные группы могут быть замещены одной или несколькими метильными группами, одной или несколькими метоксигруппами, одной или несколькими карбоксильными группами или одним или несколькими атомами галогена))), таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
11. Соединению по любому из п.п. 4-10, где R1 представляет собой 3,4-диметилфенильную группу, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
12. Соединению по любому из п.п. 4-10, где R1 представляет собой 3,4-дихлорфенильную группу, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
13. Соединению по любому из п.п. 4-10, где R1 представляет собой 4-хлорфенильную группу, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
14. Соединению по любому из п.п. 4-10, где R1 представляет собой 4-трифторметилфенильную группу, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
15. Соединению по любому из п.п. 4-10, где R1 представляет собой 4-бромфенильную группу, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
16. Соединению по любому из п.п. 4-10, где R1 представляет собой 4-трифторметоксифенильную группу, таутомеру, пролекарству или фармацевтически приемлемой соли такого соединения или их сольвату.
17. Активатору рецептора тромбопоэтина, содержащему соединение по любому из п.п. 1-16, таутомер, пролекарство или фармацевтически приемлемую соли такого соединения или их сольват, в качестве активного ингредиента.
18. Средству для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, которое содержит активатор рецептора тромбопоэтина по п.17 в качестве активного ингредиента.
19. Средству для повышения числа тромбоцитов, содержащему активатор рецептора тромбопоэтина по п.17 в качестве активного ингредиента.
20. Лекарственному средству, содержащему соединение по любому из п.п. 1-16, таутомер, пролекарство или фармацевтически приемлемую соль такого соединения или их сольват в качестве активного ингредиента.
Эффекты, обеспечиваемые настоящим изобретением
Тиофеновые соединения по настоящему изобретению обладают сродством к рецептору тромбопоэтина и агонистическим действием в отношении этого рецептора и демонстрируют сильное действие по повышению числа тромбоцитов через стимуляцию дифференциации и пролиферации мегакариотических клеток-предшественников и мегакариоцитов.
Тиофеновые соединения по настоящему изобретению легко абсорбируются из желудочно-кишечного тракта и оказывают сильное стимулирующее действие на образование колоний мегакариоцитов. Перорально абсорбируемые тиофеновые соединения удерживаются в крови в большом количестве и поэтому являются особенно полезными в качестве пероральных лекарственных средств.
Хотя патентный документ 26 раскрывает соединения, обладающие действием по повышению числа тромбоцитов, он не раскрывает тиофеновые соединения по настоящему изобретению в достаточной степени, чтобы предсказать особенно высокую пероральную абсорбируемость и высокую активность по стимуляции колоний мегакариоцитов тиофеновых соединений по настоящему изобретению.
Поэтому тиофеновые соединения по настоящему изобретению являются полезными в качестве лекарственных средств и применяются в качестве средств для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, особенно в качестве средств для повышения числа тромбоцитов.
Лучший способ осуществления изобретения
Далее представлено подробное описание настоящего изобретения.
В настоящем изобретении “н” означает нормальный, “втор” означает вторичный, “трет” означает третичный, “c” означает цикло, “o” означает орто, “м” означает мета, “п” означает пара, “Ph” означает фенил, “Py” означает пиридил, “Me” означает метил, “Et” означает этил, “Pr” означает пропил и “Bu” означает бутил.
Сначала будет представлено объяснение терминов в соответствующих заместителях R1 - R10.
В качестве атома галогена можно указать атом фтора, атом хлора, атом брома или атом йода.
C1-3алкильная группа может представлять собой линейную, разветвленную или C3циклоалкильную группу, и можно указать метильную, этильную, н-пропильную, изопропильную и циклопропильную группу и т.п.
C1-6алкильная группа может представлять собой линейную, разветвленную или a C3-6циклоалкильную группу, и в дополнение к указанным выше группам можно указать н-бутил, изобутил, втор-бутил, трет-бутил, циклобутил, 1-метилциклопропил, 2-метилциклопропил, н-пентил, 1-метил-н-бутил, 2-метил-н-бутил, 3-метил-н-бутил, 1,1-диметил-н-пропил, 1,2-диметил-н-пропил, 2,2-диметил-н-пропил, 1-этил-н-пропил, циклопентил, 1-метилциклобутил, 2-метилциклобутил, 3-метилциклобутил, 1,2-диметилциклопропил, 2,3-диметилциклопропил, 1-этилциклопропил, 2-этилциклопропил, н-гексил, 1-метил-н-пентил, 2-метил-н-пентил, 3-метил-н-пентил, 4-метил-н-пентил, 1,1-диметил-н-бутил, 1,2-диметил-н-бутил, 1,3-диметил-н-бутил, 2,2-диметил-н-бутил, 2,3-диметил-н-бутил, 3,3-диметил-н-бутил, 1-этил-н-бутил, 2-этил-н-бутил, 1,1,2-триметил-н-пропил, 1,2,2-триметил-н-пропил, 1-этил-1-метил-н-пропил, 1-этил-2-метил-н-пропил, циклогексил, 1-метилциклопентил, 2-метилциклопентил, 3-метилциклопентил, 1-этилциклобутил, 2-этилциклобутил, 3-этилциклобутил, 1,2-диметилциклобутил, 1,3-диметилциклобутил, 2,2-диметилциклобутил, 2,3-диметилциклобутил, 2,4-диметилциклобутил, 3,3-диметилциклобутил, 1-н-пропилциклопропил, 2-н-пропилциклопропил, 1-изопропилциклопропил, 2-изопропилциклопропил, 1,2,2-триметилциклопропил, 1,2,3-триметилциклопропил, 2,2,3-триметилциклопропил, 1-этил-2-метилциклопропил, 2-этил-1-метилциклопропил, 2-этил-2-метилциклопропил, 2-этил-3-метилциклопропил и т.п.
C1-3алкоксигруппа может включать линейную, разветвленную или C3циклоалкоксигруппу, можно указать и метокси, этокси, н-пропокси, изопропокси, циклопропокси и т.п.
C2-14арильная группа может представлять собой C6-14 арильную группу, не содержащую никаких гетероатомов в качестве составляющих кольцо атомов, или C2-9ароматическую гетероциклическую группу, и такая C2-9ароматическая гетероциклическая группа может представлять собой 5-7-членную C2-6гетеромоноциклическую группу или 8-10-членную C5-9 конденсированную гетеробициклическую группу, содержащую от 1 до 3 атомов кислорода, атомов азота или атомов серы, по отдельности или в сочетании.
В качестве C6-14арильной группы, не содержащей никаких гетероатомов, можно указать фенильную группу, 1-инденильную группу, 2-инденильную группу, 3-инденильную группу, 4-инденильную группу, 5-инденильную группу, 6-инденильную группу, 7-инденильную группу, и α-нафтильную группу, a β-нафтильную группу, 1-тетрагидронафтильную группу, 2-тетрагидронафтильную группу, 5-тетрагидронафтильную группу, 6-тетрагидронафтильную группу, и o-бифенилильную группу, м-бифенилильную группу, п-бифенилильную группу, 1-антрильную группу, 2-антрильную группу, 9-антрильную группу, 1-фенантрильную группу, 2-фенантрильную группу, 3-фенантрильную группу, 4-фенантрильную группу, 9-фенантрильную группу или т.п.
5-7-Членная C2-6гетеромоноциклическая группа может представлять собой 2-тиенильную группу, 3-тиенильную группу, 2-фурильную группу, 3-фурильную группу, 2-пиранильную группу, 3-пиранильную группу, 4-пиранильную группу, 1-пирролильную группу, 2-пирролильную группу, 3-пирролильную группу, 1-имидазолильную группу, 2-имидазолильную группу, 4-имидазолильную группу, 1-пиразолильную группу, 3-пиразолильную группу, 4-пиразолильную группу, 2-тиазолильную группу, 4-тиазолильную группу, 5-тиазолильную группу, 3-изотиазолильную группу, 4-изотиазолильную группу, 5-изотиазолильную группу, 2-оксазолильную группу, 4-оксазолильную группу, 5-оксазолильную группу, 3-изоксазолильную группу, 4-изоксазолильную группу, 5-изоксазолильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиразинильную группу, 2-пиримидинильную группу, 4-пиримидинильную группу, 5-пиримидинильную группу, 3-пиридазинильную группу, 4-пиридазинильную группу, 2-1,3,4-оксадиазолильную группу, 2-1,3,4-тиадиазолильную группу, 3-1,2,4-оксадиазолильную группу, 5-1,2,4-оксадиазолильную группу, 3-1,2,4-тиадиазолильную группу, 5-1,2,4-тиадиазолильную группу, 3-1,2,5-оксадиазолильную группу, 3-1,2,5-тиадиазолильную группу, 3-4H-1,2,4-триазолильную группу, 3-1H-1,2,4-триазолильную группу, 5-1H-1,2,4-триазолильную группу, 4-2H-1,2,3-триазолильную группу, 5-2H-1,2,3-триазолильную группу, 4-1H-1,2,3-триазолильную группу, 5-1H-1,2,3-триазолильную группу или т.п.
8-10-членная C5-9конденсированная гетероциклическая группа может представлять собой 2-бензофуранильную группу, 3-бензофуранильную группу, 4-бензофуранильную группу, 5-бензофуранильную группу, 6-бензофуранильную группу, 7-бензофуранильную группу, 1-изобензофуранильную группу, 4-изобензофуранильную группу, 5-изобензофуранильную группу, 2-бензотиенильную группу, 3-бензотиенильную группу, 4-бензотиенильную группу, 5-бензотиенильную группу, 6-бензотиенильную группу, 7-бензотиенильную группу, 1-изобензотиенильную группу, 4-изобензотиенильную группу, 5-изобензотиенильную группу, 2-хроменильную группу, 3-хроменильную группу, 4-хроменильную группу, 5-хроменильную группу, 6-хроменильную группу, 7-хроменильную группу, 8-хроменильную группу, 1-индолизинильную группу, 2-индолизинильную группу, 3-индолизинильную группу, 5-индолизинильную группу, 6-индолизинильную группу, 7-индолизинильную группу, 8-индолизинильную группу, 1-изоиндолильную группу, 2-изоиндолильную группу, 4-изоиндолильную группу, 5-изоиндолильную группу, 1-индолильную группу, 2-индолильную группу, 3-индолильную группу, 4-индолильную группу, 5-индолильную группу, 6-индолильную группу, 7-индолильную группу, 1-индазолильную группу, 2-индазолильную группу, 3-индазолильную группу, 4-индазолильную группу, 5-индазолильную группу, 6-индазолильную группу, 7-индазолильную группу, 1-пуринильную группу, 2-пуринильную группу, 3-пуринильную группу, 6-пуринильную группу, 7-пуринильную группу, 8-пуринильную группу, 2-хинолильную группу, 3-хинолильную группу, 4-хинолильную группу, 5-хинолильную группу, 6-хинолильную группу, 7-хинолильную группу, 8-хинолильную группу, 1-изохинолильную группу, 3-изохинолильную группу, 4-изохинолильную группу, 5-изохинолильную группу, 6-изохинолильную группу, 7-изохинолильную группу, 8-изохинолильную группу, 1-фталазинильную группу, 5-фталазинильную группу, 6-фталазинильную группу, 1-2,7-нафтиридинильную группу, 3-2,7-нафтиридинильную группу, 4-2,7-нафтиридинильную группу, 1-2,6-нафтиридинильную группу, 3-2,6-нафтиридинильную группу, 4-2,6-нафтиридинильную группу, 2-1,8-нафтиридинильную группу, 3-1,8-нафтиридинильную группу, 4-1,8-нафтиридинильную группу, 2-1,7-нафтиридинильную группу, 3-1,7-нафтиридинильную группу, 4-1,7-нафтиридинильную группу, 5-1,7-нафтиридинильную группу, 6-1,7-нафтиридинильную группу, 8-1,7-нафтиридинильную группу, 2-1,6-нафтиридинильную группу, 3-1,6-нафтиридинильную группу, 4-1,6-нафтиридинильную группу, 5-1,6-нафтиридинильную группу, 7-1,6-нафтиридинильную группу, 8-1,6-нафтиридинильную группу, 2-1,5-нафтиридинильную группу, 3-1,5-нафтиридинильную группу, 4-1,5-нафтиридинильную группу, 6-1,5-нафтиридинильную группу, 7-1,5-нафтиридинильную группу, 8-1,5-нафтиридинильную группу, 2-хиноксалинильную группу, 5-хиноксалинильную группу, 6-хиноксалинильную группу, 2-хиназолинильную группу, 4-хиназолинильную группу, 5-хиназолинильную группу, 6-хиназолинильную группу, 7-хиназолинильную группу, 8-хиназолинильную группу, 3-циннолинильную группу, 4-циннолинильную группу, 5-циннолинильную группу, 6-циннолинильную группу, 7-циннолинильную группу, 8-циннолинильную группу, 2-птердинильную группу, 4-птердинильную группу, 6-птердинильную группу, 7-птердинильную группу или т.п.
Азот-содержащая гетероциклильная группа представляет собой C2-9гетеромоноциклическую или конденсированную гетеробициклическую группу, которая содержит один или несколько атомов азота и может дополнительно содержать один или несколько атомов, необязательно, выбранных из атомов кислорода и атомов серы, и можно конкретно указать:
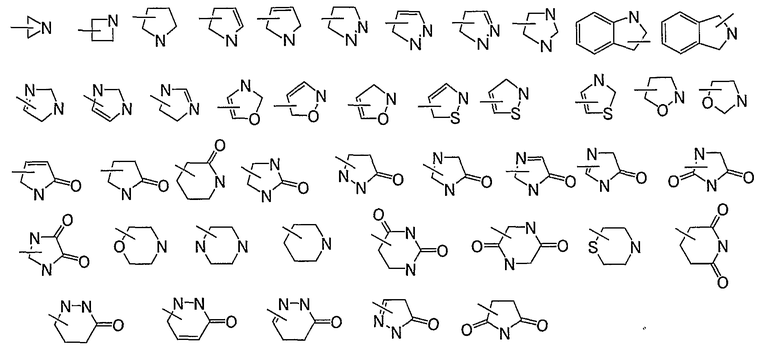
Конкретными предпочтительными примерами заместителя R1 являются фенильные группы, замещенные одним или несколькими из следующих заместителей.
Заместители: C1-6алкильная группа, C1-3алкильная группа (указанная C1-3алкильная группа замещена одним или несколькими атомами галогена), C1-3алкоксигруппа (указанная C1-3алкоксигруппа замещена одним или несколькими атомами галогена) и атом галогена.
Особенно предпочтительными примерами заместителя R1 являются 3,4-диметилфенильная группа, 4-трет-бутилфенильная группа, 4-трифторметилфенильная группа, 3-хлорфенильная группа, 4-хлорфенильная группа, 4-фторфенильная группа, 3,4-дихлорфенильная группа, 4-бромфенильная группа и 4-трифторметоксифенильная группа.
Конкретными предпочтительными примерами заместителя R2 являются атом водорода, метильная группа, этильная группа, изопропильная группа, н-пропильная группа и трифторметильная группа.
Особенно предпочтительным примером заместителя R2 является метильная группа.
Конкретными предпочтительными примерами заместителя R3 являются фенильная группа, пиридильные группы (2-пиридильная группа, 3-пиридильная группа и 4-пиридильная группа) и тиенильные группа (2-тиенильная группа и 3-тиенильная группа), замещенные одним или несколькими заместителями, выбранными из представленной ниже группы заместителей A, и одним или несколькими заместителями, выбранными из представленной ниже группы заместителей B.
Группа заместителей A: атом водорода, нитрогруппа, атом галогена, C1-3алкильная группа и C1-3алкильная группа, замещенная одним или несколькими атомами фтора.
Группа заместителей B: (C=O)R5 (где R5 представляет собой NR6R7 (где R6 представляет собой атом водорода или C1-3алкильную группу (указанная C1-3алкильная группа может быть замещена одним или несколькими атомами галогена), и R7 представляет собой C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одним или несколькими атомами галогена, одной или несколькими гидроксильными группами, одной или несколькими C1-3алкоксигруппами или одной или несколькими C2-14арильными группами (указанные C2-14арильные группы могут быть замещены одной или несколькими C1-3алкильными группами, одной или несколькими C1-3алкоксигруппами, одной или несколькими карбоксильными группами, одной или несколькими карбамоильными группами, одной или несколькими цианогруппами или одним или несколькими атомами галогена, и в случае арильных групп, содержащих один или несколько атомов азота, могут присутствовать их N-оксиды)), фенильную группу, тиенильную группу, пиридильную группу или пиридил-N-оксидную группу (указанные фенильная группа, тиенильная группа, пиридильная группа и пиридил-N-оксидная группа могут быть замещены одним или несколькими атомами галогена), или NR6R7, в целом, представляет собой азот-содержащую гетероциклильную группу (указанная азот-содержащая гетероциклильная группа может быть замещена одним или несколькими атомами водорода, одной или несколькими C1-6алкильными группами (указанные C1-6алкильные группы могут быть замещены одним или несколькими атомами галогена), одним или несколькими атомами галогена, одной или несколькими гидроксильными группами или одной или несколькими C1-3алкоксигруппами (указанные C1-3алкоксигруппы могут быть замещены одним или несколькими атомами галогена))), или C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одним или несколькими атомами галогена, одной или несколькими пиридильными группами, одной или несколькими пиридил-N-оксидными группами, одной или несколькими фурильными группами, одной или несколькими тиенильными группами или одной или несколькими фенильными группами, и является замещенной одной или несколькими цианогруппами)).
Особенно предпочтительный пример заместителя R3 представлен формулой (II):

(где R6 представляет собой метильную группу или этильную группу, и R7 представляет собой C1-6 алкильную группу (указанная C1-6алкильная группа может быть замещена одной или несколькими метоксигруппами)).
Другой особенно предпочтительный пример заместителя R3 представлен формулой (II):

(где R6 представляет собой метильную группу или этильную группу, и R7 представляет собой C1-3алкильную группу (указанная C1-3алкильная группа замещена одной или несколькими фенильными группами или одной или несколькими пиридильными группами)).
Еще один особенно предпочтительный пример заместителя R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой C1-6алкильную группу (указанная C1-6алкильная группа замещена одной или несколькими метоксигруппами) или пиридильную группу).
Следующий особенно предпочтительный пример заместителя R3 представлен формулой (IV):

(где R6 представляет собой атом водорода, R7 представляет собой C1-3алкильную группу (указанная C1-3алкильная группа может быть замещена одной или несколькими гидроксильными группами), и R8 представляет собой метильную группу или атом хлора).
Еще одним особенно предпочтительным примером заместителя R3 является группа, представленная формулой (II) или формулой (IV), где группа NR6R7, в целом, представлена формулой (III):

(где R9 представляет собой C1-3алкильную группу).
Другой особенно предпочтительный пример заместителя R3 представлен формулой (V):

(где R10 представляет собой атом водорода или C1-3алкильную группу).
Еще один особенно предпочтительный пример заместителя R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой изопропильную группу, метильную группу, этильную группу или нормальную пропильную группу (указанная метильная группа, указанная этил групп и указанная нормальная пропильная группа являются незамещенными или замещены одной или несколькими пиридильными группами, одной или несколькими пиридил-N-оксидными группами, одной или несколькими фурильными группами, одной или несколькими пиразинильными группами, одной или несколькими имидазолильными группами, одной или несколькими пиразолильными группами или одной или несколькими изоксазолильными группами (указанные пиридильные группы, пиридил-N-оксидные группы, фурильные группы, пиразинильные группы, имидазолильные группы, пиразолильные группы и изоксазолильные группы могут быть замещены одной или несколькими метильными группами, одной или несколькими метоксигруппами, одной или несколькими карбоксильными группами или одним или несколькими атомами галогена))).
Конкретными предпочтительными примерами заместителя R4 являются атом водорода, метильная группа, этильная группа, изопропильная группа, н-пропильная группа и трифторметильная группа.
Особенно предпочтительным примером заместителя R4 являются атом водорода.
Предпочтительными соединениями для использования в качестве активатора рецептора тромбопоэтина, средства для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, и средства для повышения числа тромбоцитов по настоящему изобретению являются следующие.
1) Соединения, представленные формулой (I), где R2 представляет собой метильную группу, и R4 представляет собой атом водорода, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
2) Соединения по п.1), где R1 представляет собой 3,4-диметилфенильную группу, 4-трет-бутилфенильную группу, 4-трифторметилфенильную группу, 3-хлорфенильную группу, 4-хлорфенильную группу, 4-фторфенильную группу, 3,4-дихлорфенильную группу, 4-бромфенильную группу или 4-трифторметоксифенильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их
3) Соединения по п.2), где R3 представлен формулой (II):

(где R6 представляет собой метильную группу или этильную группу, и R7 представляет собой C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одной или несколькими метоксигруппами)), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
4) Соединения по п.2), где R3 представлен формулой (II):

(где R6 представляет собой метильную группу или этильную группу, и R7 представляет собой C1-3алкильную группу (указанная C1-3алкильная группа замещена одной или несколькими фенильными группами или одной или несколькими пиридильными группами)), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
5) Соединения по п.2), где R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой C1-6алкильную группу (указанная C1-6алкильная группа замещена одной или несколькими метоксигруппами) или пиридильную группу), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
6) Соединения по п.2), где группа NR6R7 в формуле (II), в целом, представлена формулой (III):

(где R9 представляет собой C1-3алкильную группу), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
7) Соединения по п.2), где R3 представлен формулой (IV):

(где R6 представляет собой атом водорода, R7 представляет собой C1-3алкильную группу (указанная C1-3алкильная группа может быть замещена одной или несколькими гидроксильными группами), и R8 представляет собой метильную группу или атом хлора), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
8) Соединения по п.2), где R3 представлен формулой (V):

(где R10 представляет собой атом водорода или C1-3алкильную группу), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
9) Соединения по п.2), где R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой изопропильную группу, метильную группу, этильную группу или нормальную пропильную группу (указанная метильная группа, указанная этильная группа и указанная нормальная пропильная группа являются незамещенными или замещены одной или несколькими пиридильными группами, одной или несколькими пиридил-N-оксидными группами, одной или несколькими фурильными группами, одной или несколькими пиразинильными группами, одной или несколькими имидазолильными группами, одной или несколькими пиразолильными группами или одной или несколькими изоксазолильными группами (указанные пиридильные группы, пиридил-N-оксидные группы, фурильные группы, пиразинильные группы, имидазолильные группы, пиразолильные группы и изоксазолильные группы могут быть замещены одной или несколькими метильными группами, одной или несколькими метоксигруппами, одной или несколькими карбоксильными группами или одним или несколькими атомами галогена))), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
10) Соединения по любому из п.п. 3) - 9), где R1 представляет собой 3,4-диметилфенильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
11) Соединения по любому из п.п. 3) - 9), где R1 представляет собой 3,4-дихлорфенильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
12) Соединения по любому из п.п. 3) - 9), где R1 представляет собой 4-хлорфенильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
13) Соединения по любому из п.п. 3) - 9), где R1 представляет собой 4-трифторметилфенильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
14) Соединения по любому из п.п. 3) - 9), где R1 представляет собой 4-бромфенильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
15) Соединения по любому из п.п. 3) - 9), где R1 представляет собой 4-трифторметоксифенильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
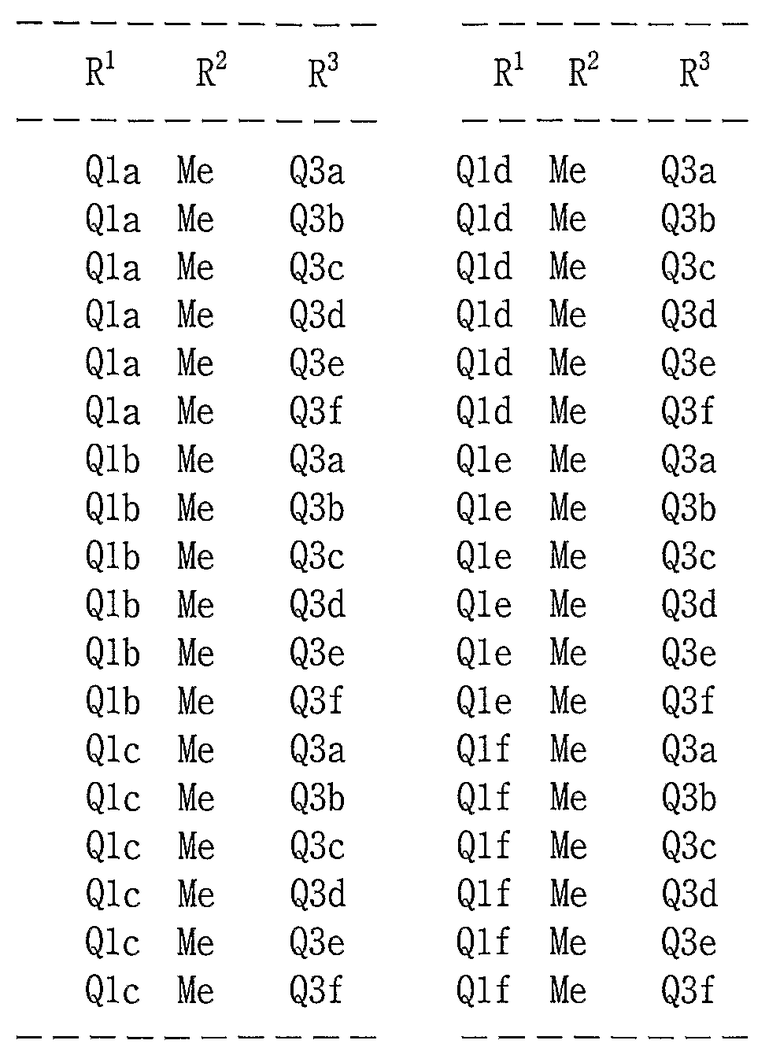
16) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 1, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
Представленные в таблице 1 символы обозначают следующие заместители.
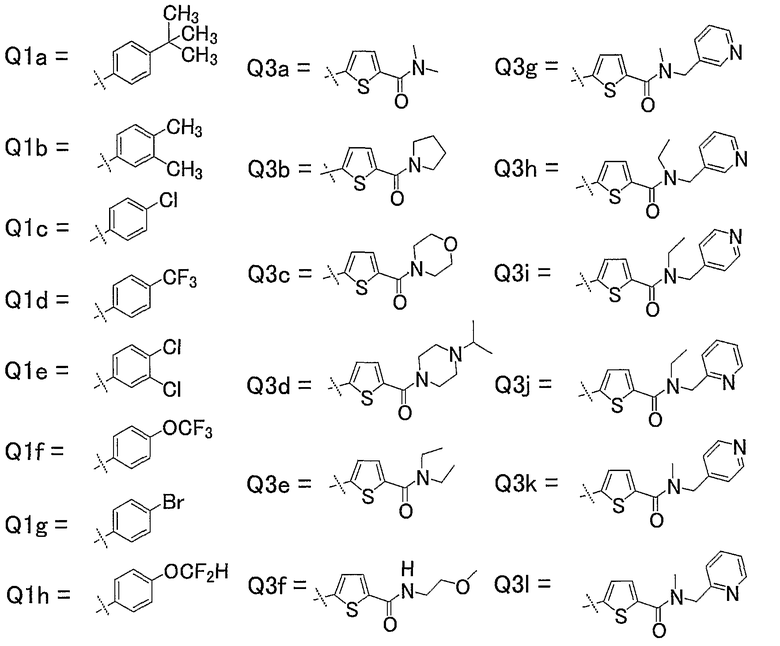
Таблица 1

Таблица 1 (продолжение)

17) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 1, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты (при условии, что в случае 17) Q1a, Q1b, Q1c, Q1d, Q1e, Q1f, Q1g, Q1h, Q3a, Q3b, Q3c, Q3d, Q3e, Q3f, Q3g, Q3h, Q3i, Q3j, Q3k и Q3l в представленной таблице обозначают следующие заместители).
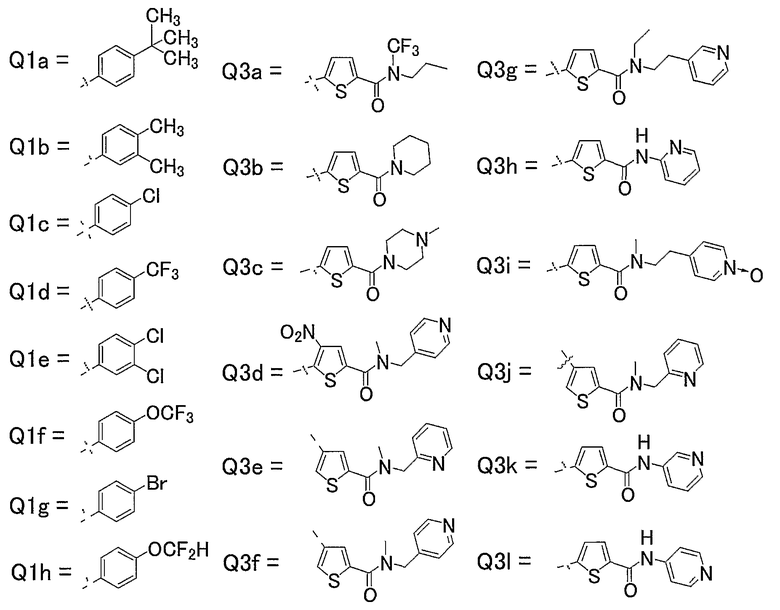
18) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 1, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты (при условии, что в случае 18) Q1a, Q1b, Q1c, Q1d, Q1e, Q1f, Q1g, Q1h, Q3a, Q3b, Q3c, Q3d, Q3e, Q3f, Q3g, Q3h, Q3i, Q3j, Q3k и Q3l в представленной таблице обозначают следующие заместители).
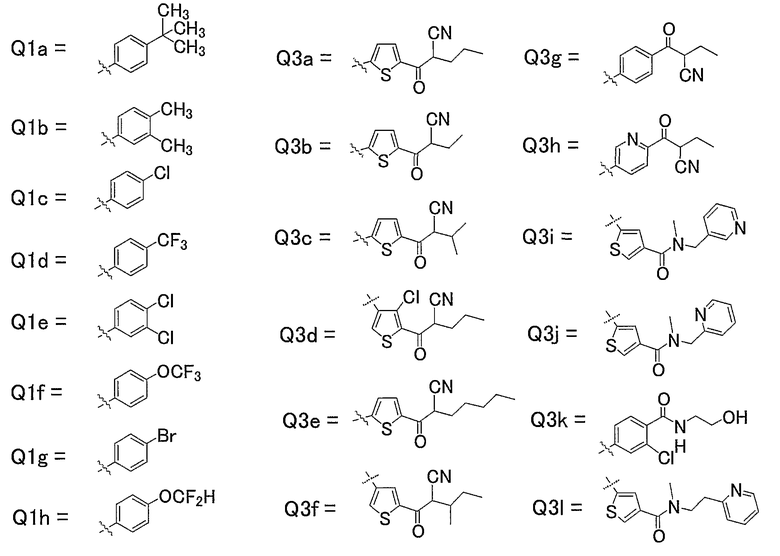
19) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 2, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
Представленные в таблице 2 символы обозначают следующие заместители.
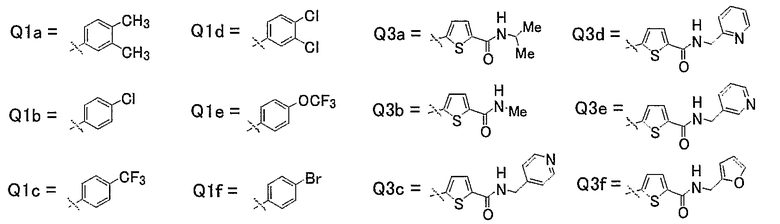
Таблица 2


20) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 3, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
Представленные в таблице 3 символы обозначают следующие заместители.
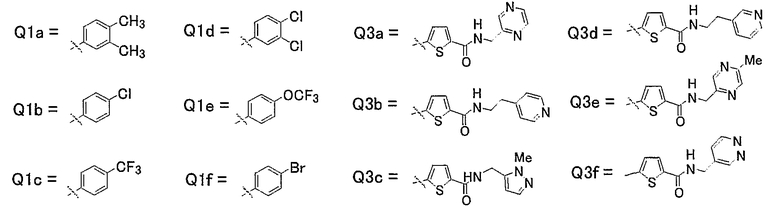
Таблица 3

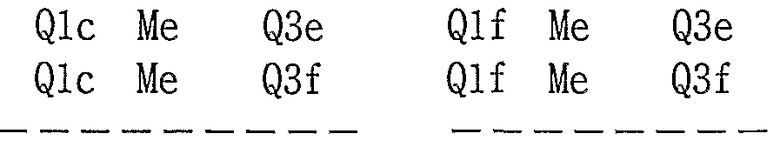
21) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 4, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
Представленные в таблице 4 символы обозначают следующие заместители.
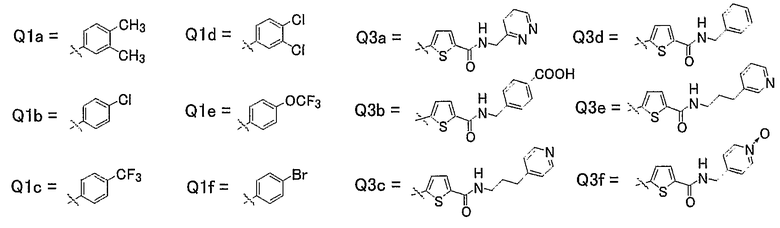
Таблица 4

22) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 5, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
Представленные в таблице 5 символы обозначают следующие заместители.
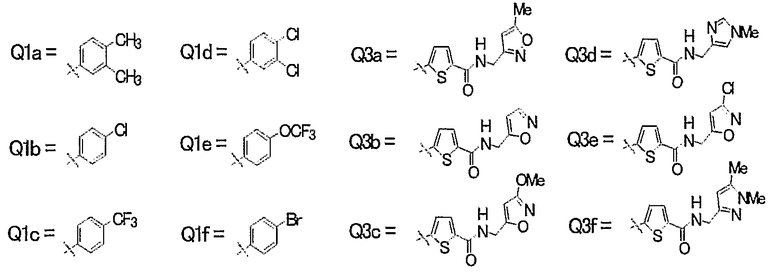
Таблица 5

23) Соединения, где R4 представляет собой атом водорода, и R1, R2 и R3 представляют собой любую из следующих комбинаций, представленных в таблице 6, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
Представленные в таблице 6 символы обозначают следующие заместители.
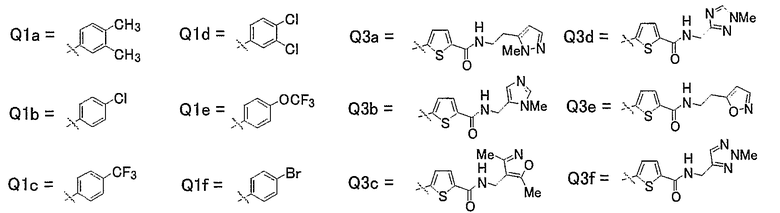
Таблица 6
24) Соединения по п.п. 16) - 23), где R2 преобразован в атом водорода, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
25) Соединения по п.п. 16) - 23), где R2 преобразован в трифторметильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
26) Соединения по п.п. 16) - 23), где R2 преобразован в этильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
27) Соединения по п.п. 16) - 23), где R2 преобразован в н-пропильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
28) Соединения по п.п. 16) - 23), где R2 преобразован в изопропил, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
29) Соединения по п.п. 16) - 28), где R4 преобразован в метильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
30) Соединения по п.п. 16) - 28), где R4 преобразован в трифторметильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
31) Соединения по п.п. 16) - 28), где R4 преобразован в этильную группу, таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты.
32) Активаторы рецептора тромбопоэтина, содержащие соединения по п.п. 1) - 31), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты в качестве активного ингредиента.
33) Средства для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, которые содержат активаторы рецептора тромбопоэтина по п.32) в качестве активного ингредиента.
34) Средства для повышения числа тромбоцитов, содержащие активаторы рецептора тромбопоэтина по п.32) в качестве активного ингредиента.
35) Лекарственные средства, содержащие любое из соединений по п.п. 1) - 31) или соединений, представленных формулой (I), таутомеры, пролекарства или фармацевтически приемлемые соли таких соединений или их сольваты в качестве активного ингредиента.
В настоящем изобретении соединения по настоящему изобретению, представленные формулой (I), могут присутствовать в форме таутомеров или геометрических изомеров, которые подвергаются эндоциклической или экзоциклической изомеризации, смесей таутомеров или геометрических изомеров или их смесей. Когда соединения по настоящему изобретению содержат асимметрический центр, независимо от того, является ли это результатом изомеризации, соединения по настоящему изобретению могут быть в форме разделенных оптических изомеров или в форме смесей, содержащих их в определенных соотношениях.
Соединения по настоящему изобретению, представленные формулой (I), или их фармацевтически приемлемые соли могут быть в форме произвольных кристаллов или произвольных гидратов, в зависимости от условий получения. Настоящее изобретение охватывает такие кристаллы, гидраты и смеси. Они могут быть в форме сольватов с органическими растворителями, такими как ацетон, этанол и тетрагидрофуран, и настоящее изобретение охватывает любые из таких форм.
Соединения по настоящему изобретению, представленные формулой (I), могут быть преобразованы в фармацевтически приемлемые соли или могут быть выделены из полученных солей, если это необходимо. Фармацевтически приемлемые соли по настоящему изобретению могут, например, представлять собой соли со щелочными металлами (такими как литий, натрий и калий), щелочно-земельными металлами (такими как магний и кальций), аммонием, органическими основаниями и аминокислотами. Они могут представлять собой соли с неорганическими кислотами (такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота) и органическими кислотами (такими как уксусная кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, винная кислота, бензолсульфоновая кислота и п-толуолсульфоновая кислота).
Соединения, которые служат в качестве пролекарств, представляют собой производные по настоящему изобретению, содержащие химически или метаболически разлагаемые группы, которые дают фармакологически активные соединения по настоящему изобретению в результате сольволиза или в физиологических условиях in vivo. Способы отбора или получения соответствующих пролекарств раскрыты, например, в Design of Prodrugs (Elsevier, Amsterdam 1985). В настоящем изобретении, когда соединение содержит гидроксильную группу, в качестве пролекарств можно указать, например, ацилокси-производные, полученные взаимодействием соединения с подходящими ацилгалогенидами или подходящими ангидридами кислот. Ацилоксипроизводные, особенно предпочтительные в качестве пролекарств, включают -OCOC2H5, -OCO(t-Bu), -OCOC15H31, -OCO(m-CO2Na-Ph), -OCOCH2CH2CO2Na, -OCOCH(NH2)CH3, -OCOCH2N(CH3)2 и т.п. Когда соединение по настоящему изобретению содержит аминогруппу, в качестве пролекарств можно указать, например, амидные производные, полученные взаимодействием соединения, содержащего аминогруппу, с подходящими галогенангидридами кислот или подходящими смешанными ангидридами кислот. Амиды, особенно предпочтительные в качестве пролекарств, включают -NHCO(CH2)20OCH3, -NHCOCH(NH2)CH3 и т.п. Когда соединение по настоящему изобретению содержит карбоксильную группу, в качестве пролекарств можно указать, например, эфиры карбоновых кислот с алифатическими спиртами или эфиры карбоновых кислот, полученные взаимодействием с неспиртовой гидроксильной группой 1,2- или 1,3-диглицеридов. Особенно предпочтительными пролекарствами являются сложные метиловые эфиры и сложные этиловые эфиры.
Средства для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, или средства для повышения числа тромбоцитов, которые содержат активаторы рецептора тромбопоэтина по настоящему изобретению в качестве активного ингредиента, как правило, можно вводить в виде пероральных лекарственных средств, таких как таблетки, капсулы, порошок, гранулы, пилюли и сироп, в виде ректальных лекарственных средств, чрескожных лекарственных средств или инъекций. Средства по настоящему изобретению можно вводить в виде единственного терапевтического средства или в виде смеси с другими терапевтическими средствами. Хотя их можно вводить как таковые, обычно их вводят в форме медицинских композиций. Такие фармацевтические препараты можно получить путем добавления фармакологически и фармацевтически приемлемых добавок традиционными способами. А именно, для пероральных лекарственных средств можно использовать обычные эксципиенты, смазывающие вещества, связующие, разрыхлители, увлажнители, пластификаторы и агенты покрытия. Пероральные жидкие препараты могут быть в форме водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут поставляться в виде сухих сиропов для смешивания с водой или другими подходящими растворителями перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие вещества, отдушки, разбавители и эмульгаторы. В случае ректального введения, их можно вводить в виде суппозиториев. В качестве основы суппозиториев можно использовать подходящие вещества, такие как масло какао, лауриновый жир, Макроголь, глицерожелатин, Witepsol, стеарат натрия и их смеси, и, если это необходимо, они могут содержать эмульгатор, суспендирующее вещество, консервант и т.п. Для инъекций можно использовать фармацевтические ингредиенты, такие как дистиллированная вода для инъекций, физиологический раствор, 5% раствор глюкозы, пропиленгликоль и другие растворители или солюбилизирующие вещества, регулятор pH, агент изотоничности и стабилизатор для получения водных лекарственных форм или лекарственных форм, которые необходимо растворить перед применением.
Доза средств по настоящему изобретению для введения человеку обычно составляет примерно от 0,1 до 1000 мг/человек/день в случае пероральных лекарственных средств или ректального введения для взрослых, и примерно от 0,05 мг до 500 мг/человек/день в случае инъекций для взрослых, хотя она зависит от возраста и состояния пациента. Указанные выше пределы приведены лишь в качестве примеров, и дозу следует определять в зависимости от состояния пациента.
Настоящее изобретение применяют, когда ожидается, что применение соединений, которые обладают сродством к рецептору тромбопоэтина и действуют как агонисты рецептора тромбопоэтина, улучшит патологическое состояние. Например, можно указать гематологические расстройства, сопровождаемые аномальным числом тромбоцитов. Конкретно, оно является эффективным для лечения или предотвращения заболеваний человека и млекопитающих, вызванных аномальным мегакариопоэзом, особенно тех, которые сопровождаются тромбоцитопенией. Примеры таких заболеваний включают тромбоцитопению при химиотерапии или радиотерапии рака, тромбоцитопению, возникающую при противовирусной терапии при лечении таких заболеваний, как гепатит C, тромбоцитопению, вызванную трансплантацией костного мозга, хирургическим вмешательством и тяжелыми инфекциями, или желудочно-кишечным кровотечением, но такие заболевания не ограничены вышеперечисленными. Типичные тромбоцитопении, такие как апластическая анемия, идиопатическая тромбоцитопеническая пурпура, миелодиспластический синдром, заболевания печени, ВИЧ-инфекция и дефицит тромбопоэтина, также являются мишенями для средств по настоящему изобретению. Настоящее изобретение можно использовать в качестве мобилизатора периферических стволовых клеток, индуктора дифференциации мегакариобластных или мегакариотических лейкозных клеток и средства для повышения числа тромбоцитов для доноров тромбоцитов. Кроме того, потенциальные применения включают терапевтический ангиогенез, основанный на дифференциации и пролиферации клеток эндотелия сосудов и эндотелиальных клеток-предшественников, предотвращение и лечение артериосклероза, инфаркта миокарда, нестабильной стенокардии, окклюзивного заболевания периферических артерий, но не существует никаких ограничений.
Соединения, представленные формулой (I), получают, например, способом, представленным формулой (1) ниже.
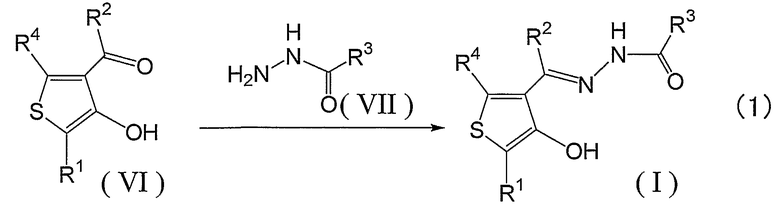
Взаимодействие соединения (IV) с аминосоединением (VII) в растворителе и, если это необходимо, в присутствии катализатора, при нагревании и перемешивании дает желаемое соединение или его предшественник. Предшественник можно, если это необходимо, подвергнуть гидролизу, удалению защиты, восстановлению или окислению до желаемого соединения. Соединения по настоящему изобретению обычно могут быть очищены колоночной хроматографией, тонкослойной хроматографией, высокоэффективной жидкостной хроматографией (ВЭЖХ) или высокоэффективной жидкостной хроматографией-масс-спектрометрией (ЖХ-МС) и, если это необходимо, они могут быть получены с высокой чистотой при помощи перекристаллизации или промывки растворителями.
Для синтеза промежуточных соединений (VI) можно, например, указать следующий способ, раскрытый в JP-A-48-026755:
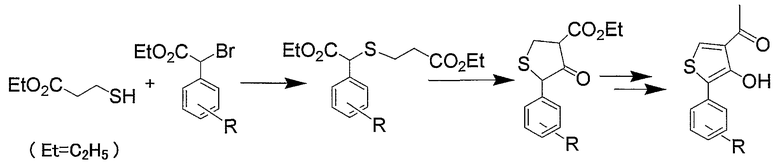
Для синтеза аминосоединений (VII), можно, например, указать способы, раскрытые в Synthetic Commun., 28(7), 1223-1231 (1998), J. Chem. Soc., 1225 (1948) и J. Chem. Soc., 2831 (1952).
Соединения, представленные формулой (I), также могут быть получены способом, представленным формулой (3) ниже.
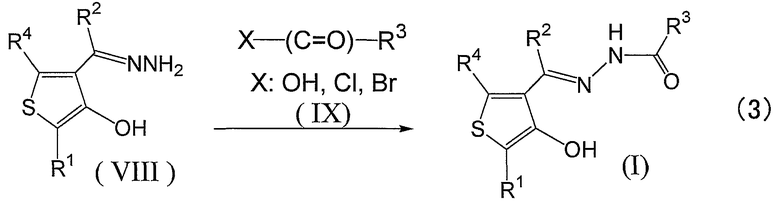
Взаимодействие соединения (VIII) с соединением (IX) в растворителе и, если это необходимо, в присутствии катализатора, дегидратирующего агента конденсации или основания, при нагревании и перемешивании дает желаемое соединение или его предшественник. Предшественник можно, если это необходимо, подвергнуть гидролизу, удалению защиты, восстановлению или окислению до желаемого соединения. Соединения по настоящему изобретению обычно могут быть очищены колоночной хроматографией, тонкослойной хроматографией, высокоэффективной жидкостной хроматографией (ВЭЖХ) или высокоэффективной жидкостной хроматографией-масс-спектрометрией (ЖХ-МС) и, если это необходимо, они могут быть получены с высокой чистотой при помощи перекристаллизации или промывки растворителями.
Соединение (VIII) может быть получено путем перемешивания соединения (VI) с гидразином или его производным в растворителе и, если это необходимо, в присутствии катализатора, при нагревании.
ПРИМЕРЫ
Далее настоящее изобретение будет описано более подробно со ссылкой на ссылочные примеры синтеза, примеры синтеза, примеры испытаний и примеры формулирования. Однако должно быть понятно, что настоящее изобретение не должно ограничиваться этими конкретными примерами.
Анализ 1H-ЯМР осуществляли при 300 МГц, и определения LC/MS осуществляли в следующих условиях.
ЖХ/МС, условие 1
Колонка: Waters SunFire C18 (3,5 мкм, 4,6×30 мм)
Элюент: ацетонитрил/0,1% водный раствор муравьиной кислоты (10/90 до 30/70)
ЖХ/МС, условие 2
Колонка: Waters SunFire C18 (3,5 мкм, 4,6×30 мм)
Элюент: ацетонитрил/0,1% водный раствор муравьиной кислоты (10/90 до 60/40)
ЖХ/МС, условия 3
Колонка: Waters SunFire C18 (3,5 мкм, 4,6×30 мм)
Элюент: ацетонитрил/0,1% водный раствор муравьиной кислоты (10/90 до 85/15)
ЖХ/МС, условия 4
Колонка: Waters Xterra MSC18 (5 мкм, 4,6×50 мм)
Элюент: ацетонитрил/0,1% водный раствор муравьиной кислоты (10/90 до 30/70)
ЖХ/МС, условия 5
Колонка: Waters Xterra MSC18 (5 мкм, 4,6×50 мм)
Элюент: ацетонитрил/0,1% водный раствор муравьиной кислоты (10/90 до 60/40)
ЖХ/МС, условия 6
Колонка: Waters Xterra MSC18 (5 мкм, 4,6×50 мм)
Элюент: ацетонитрил/0,1% водный раствор муравьиной кислоты (10/90 до 85/15)
ЖХ/МС, условия 7
Колонка: Waters Xterra MSC18 (5 мкм, 4,6×50 мм)
Элюент: ацетонитрил/0,1% водный раствор муравьиной кислоты (20/80 до 100/0)
ЖХ/МС, условия 8
Колонка: Waters Xterra MSC18 (3,5 мкм, 2,1×20 мм)
Элюент: ацетонитрил/0,2% водный раствор муравьиной кислоты (20/80 до 90/10)
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 1
Синтез 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбогидразида
Раствор 59 мг (0,02 ммоль) метил 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоксилата, растворенного в 2 мл этанола, нагревали с 100 мкл моногидрата гидразина при 80°C в течение 5 часов при кипячении с обратным холодильником. После охлаждения реакционный раствор выливали в жидкую смесь 5 мл воды и 5 мл насыщенного водного раствора хлорида натрия и экстрагировали 20 мл этилацетата и 20 мл хлороформа.
Экстракт сушили над сульфатом магния и растворитель выпаривали при 40°C с получением 30 мг желаемого продукта, 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбогидразида (выход 51%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 4, время удерживания 0,32 (мин)
ЖХ/МС (ESI+) m/z; 297 [M+1]+
ЖХ/МС (ESI-) m/z; 295 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 2
Синтез 5-(морфолин-4-карбонил)тиофен-2-карбогидразида
Следовали процедуре ссылочного примера синтеза 1, используя метил 5-(морфолин-4-карбонил)тиофен-2-карбоксилат, с получением желаемого продукта, 5-(морфолин-4-карбонил)тиофен-2-карбогидразида (выход 51%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 5, время удерживания 0,34 (мин)
ЖХ/МС (ESI+) m/z; 256 [M+1]+
ЖХ/МС (ESI-) m/z; 254 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 3
Синтез диэтиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 1, используя метил 5-(диэтилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, диэтиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 89%).
Морфология: белое твердое вещество
ЖХ/МС: условия 8, время удерживания 0,63 (мин)
ЖХ/МС (ESI+) m/z; 242 [M+1]+
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 4
Синтез 5-(пирролидин-1-карбонил)тиофен-2-карбогидразида
Следовали процедуре ссылочного примера синтеза 1, используя метил 5-(пирролидин-1-карбонил)тиофен-2-карбоксилат, с получением желаемого продукта, 5-(пирролидин-1-карбонил)тиофен-2-карбогидразида.
Морфология: белое твердое вещество
ЖХ/МС: условия 8, время удерживания 0,50 (мин)
ЖХ/МС (ESI+) m/z; 240 [M+1]+
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 5
Синтез диметиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 1, используя метил 5-(диметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, диметиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 23%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 6, время удерживания 0,37 (мин)
ЖХ/МС (ESI+) m/z; 214 [M+1]+
ЖХ/МС (ESI-) m/z; 212 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 6
Синтез 2-метоксиэтиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 1, используя метил 5-(2-метоксиэтилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, 2-метоксиэтиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 84%).
Морфология: белое твердое вещество
ЖХ/МС: условия 1 время удерживания 0,34 (мин)
ЖХ/МС (ESI+) m/z; 244 [M+1]+
ЖХ/МС (ESI-) m/z; 242 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 7
Синтез 3-пиридиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 1, используя метил 5-(3-пиридилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, 3-пиридиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 78%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 1, время удерживания 0,34 (мин)
ЖХ/МС (ESI+) m/z; 263 [M+1]+
ЖХ/МС (ESI-) m/z; 261 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 8
Синтез 2-хлор-4-гидразинокарбонил-N-(2-гидроксиэтил)бензамида
Следовали процедуре ссылочного примера синтеза 1, используя метиловый эфир метил 3-хлор-N-(2-гидроксиэтил)терефталевой кислоты, с получением желаемого продукта, 2-хлор-4-гидразинокарбонил-N-(2-гидроксиэтил)бензамида (выход 66%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 2, время удерживания 0,32 (мин)
ЖХ/МС (ESI+) m/z; 258, 260 [M+1]+
ЖХ/МС (ESI-) m/z; 256, 258 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 9
Синтез 5-(2-цианобутирил)тиофен-2-карбогидразида метил 5-(2-цианобутирил)тиофен-2-карбоксилат
К бутиронитрилу (957 мкл, 11 ммоль) в тетрагидрофуране добавляли гексаметилдисилазид лития (12,5 мл 1M раствор в тетрагидрофуране, 12,5 ммоль) при -78°C и полученный раствор перемешивали в течение 1 часа и добавляли по каплям к 5-метоксикарбонилтиофен-2-карбонилхлориду (1,02 г, 5 ммоль) в тетрагидрофуране при -78°C в течение 30 минут и полученную реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали, реакционный раствор смешивали с этилацетатом и промывали насыщенным водным раствором хлорида аммония и насыщенным раствором хлорида натрия и очищали колоночной хроматографией на силикагеле (элюент гексан/этилацетат = 3/1) с получением желаемого продукта, метил 5-(2-цианобутирил)тиофен-2-карбоксилата (выход 41%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 2,45 (мин)
ЖХ/МС (ESI+) m/z; 238 [M+1]+
ЖХ/МС (ESI-) m/z; 236 [M-1]-
5-(2-Цианобутирил)тиофен-2-карбогидразид
Метил 5-(2-цианобутирил)тиофен-2-карбоксилат (213 мг, 0,90 ммоль) в метаноле перемешивали с 0,1M гидроксида калия в метаноле (9,0 мл, 0,90 ммоль) при комнатной температуре в течение 10 минут и затем с моногидратом гидразина (225 мг, 4,50 мг) при 80°C в течение 6 часов. После добавления насыщенного водного раствора хлорида натрия реакционный раствор экстрагировали этилацетатом, сушили над безводным сульфатом магния и концентрировали с получением неочищенного желаемого продукта.
Морфология: желтое твердое вещество
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 10
Синтез метил-2-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 1, используя метил 5-(метил-2-пиколиламидо)тиофен-2-карбоксилат, с получением желаемого продукта, метил-2-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 77%).
Морфология: белое твердое вещество
ЖХ/МС: условия 8, время удерживания 0,45 (мин)
ЖХ/МС (ESI+) m/z; 291 [M+1]+
ЖХ/МС (ESI-) m/z; 289 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 11
Синтез 3-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Метил 5-(3-пиколилкарбамоил)тиофен-2-карбоксилат (860 мг, 3,11 ммоль) в этаноле (34 мл) перемешивали с моногидратом гидразина (1,57 мл, 31,1 ммоль) при 85°C в течение 12 часов. Реакционный раствор концентрировали и перемешивали с диэтиловым эфиром при 0°C в течение 1 часа. Осажденное твердое вещество выделяли фильтрованием и промывали жидкой смесью диэтилового эфира и этанола и сушили с получением желаемого продукта, 3-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 92%).
Морфология: белое твердое вещество
ЖХ/МС: условия 1, время удерживания 0,23 (мин)
ЖХ/МС (ESI+) m/z; 277 [M+1]+
ЖХ/МС (ESI+-) m/z; 275 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 12
Синтез 4-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 11, используя метил 5-(4-пиколилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, 4-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 81%).
Морфология: белое твердое вещество
ЖХ/МС: условия 1, время удерживания 0,23 (мин)
ЖХ/МС (ESI+) m/z; 277 [M+1]+
ЖХ/МС (ESI-) m/z; 275 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 13
Синтез (фуран-2-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 11, используя метил 5-(фуран-2-илметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, (фуран-2-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 86%).
Морфология: белое твердое вещество
ЖХ/МС: условия 3, время удерживания 1,50 (мин)
ЖХ/МС (ESI+) m/z; 266 [M+1]+
ЖХ/МС (ESI-) m/z; 264 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 14
Синтез метиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 11, используя метил 5-(метилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, метиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 83%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 0,37 (мин)
ЖХ/МС (ESI+) m/z; 200 [M+1]+
ЖХ/МС (ESI-) m/z; 198 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 15
Синтез изопропиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 11, используя метил 5-(изопропилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, изопропиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 45%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 1,07 (мин)
ЖХ/МС (ESI+) m/z; 228 [M+1]+
ЖХ/МС (ESI-) m/z; 226 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 16
Синтез 2-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 11, используя метил 5-(2-пиколилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, 2-пиколиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 81%).
Морфология: белое твердое вещество
ЖХ/МС: условия 1, время удерживания 0,28 (мин)
ЖХ/МС (ESI+) m/z; 277 [M+1]+
ЖХ/МС (ESI-) m/z; 275 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 17
Синтез (2-пиридин-4-ил)этиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Метил 5-[2-(пиридин-4-ил)этилкарбамоил]тиофен-2-карбоксилат (0,40 г, 1,4 ммоль) суспендировали в жидкой смеси метанола (4,0 мл) и тетрагидрофурана (2,0 мл) и оставляли при 55°С до подтверждения преобразования в гомогенный раствор янтарного цвета. После добавления 80% раствора моногидрата гидразина (0,17 мл, 2,8 ммоль) смесь оставляли выстаиваться при 55°С в течение 24 часов. После добавления 80% раствора моногидрат гидразина (0,17 мл, 2,8 ммоль) смесь оставляли выстаиваться при 55°С в течение 4,5 часов, а затем при комнатной температуре в течение 14 часов. Осажденное твердое вещество выделяли фильтрованием и сушили с получением желаемого продукта, (2-пиридин-4-ил)этиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 82%).
Морфология: белое твердое вещество
1H-ЯМР (ДМСО-d6) δ: 2,86 (т, J=7,0 Гц, 2Н), 3,50 (дт, J=5,5 и 7,0 Гц, 2Н), 4,52 (ушир.с, 2Н), 7,26 (д, J=6,0 Гц, 2Н), 8,46 (д, J=6,0 Гц, 2Н), 8,72 (т, J=5,5 Гц, 1Н), 9,90 (ушир.с, 1Н).
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 18
Синтез 5-(гидразинокарбонил)-N-[(1-метил-1Н-пиразол-5-ил)метил]тиофен-2-карбоксамида
Метил 5-(1-метил-1Н-пиразол-5-илметилкарбамоил)тиофен-2-карбоксилат (0,25 г, 0,90 ммоль) в метаноле (2,5 мл) перемешивали с моногидратом гидразина (0,17 мл, 3,6 ммоль) при 70°С в течение 3,5 часов. Осажденное твердое вещество выделяли фильтрованием, промывали хлороформом и сушили с получением желаемого продукта, 5-(гидразинокарбонил)-N-[(1-метил-1Н-пиразол-5-ил)метил]тиофен-2-карбоксамида (выход 49%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 0,40 (мин)
ЖХ/МС (ESI+) m/z; 280 [M+1]+
ЖХ/МС (ESI-) m/z; 278 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 19
Синтез (5-метилизоксазол-3-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 18, используя метил 5-(5-метилизоксазол-3-илметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта (5-метилизоксазол-3-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 47%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 1,00 (мин)
ЖХ/МС (ЕSI+) m/z; 281 [М+1]+
ЖХ/МС (ESI-) m/z; 279 [М-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 20
Синтез (5-метилпиразин-2-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Метил 5-(5-метилпиразин-2-илметилкарбамоил)тиофен-2-карбоксилат (304 мг, 1,04 ммоль) в метаноле (3 мл) перемешивали с моногидратом гидразина при 60°С в течение 12 часов. После добавления хлороформа смесь перемешивали при комнатной температуре в течение 5 часов. Осажденное твердое вещество выделяли фильтрованием с получением желаемого продукта (5-метилпиразин-2-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 72%).
Морфология: белое твердое вещество
ЖХ/МС: условия 3, время удерживания 0,69 (мин)
ЖХ/МС (ESI+) m/z; 292 [M+1]+
ЖХ/МС (ESI-) m/z; 290 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 21
Синтез (изоксазол-5-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 18, используя метил 5-(изоксазол-5-илметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта (изоксазол-5-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 46%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 0,62 (мин)
ЖХ/МС (ESI+) m/z; 267 [M+1]+
ЖХ/МС (ESI-) m/z; 265 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 22
Синтез (3-метоксиизоксазол-5-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 18, используя метил 5-(3-метоксиизоксазол-5-илметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта (3-метоксиизоксазол-5-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 50%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 2, время удерживания 1,25 (мин)
ЖХ/МС (ESI+) m/z; 297 [M+1]+
ЖХ/МС (ESI-) m/z; 295 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 23
Синтез (1,5-диметил-1H-пиразол-3-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 18, используя метил 5-(1,5-диметил-1H-пиразол-3-илметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта (1,5-диметил-1H-пиразол-3-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 59%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 1,00 (мин)
ЖХ/МС (ESI+) m/z; 294 [M+1]+
ЖХ/МС (ESI-) m/z; 292 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 24
Синтез (пиразин-2-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
Следовали процедуре ссылочного примера синтеза 18, используя метил 5-(пиразин-2-илметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта (пиразин-2-илметил)амида 5-гидразинокарбонилтиофен-2-карбоновой кислоты ((выход 82%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 0,37 (мин)
ЖХ/МС (ESI+) m/z; 278 [M+1]+
ЖХ/МС (ESI-) m/z; 276 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 25
a) Синтез 4-[{5-(метоксикарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксида
4-Пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты (0,20 г, 0,72 ммоль), полученный в Ссылочном примере синтеза 12, в хлороформе (4,0 мл) перемешивали с 65% мас. м-хлорпербензойной кислоты (0,21 г, 0,80 ммоль) при комнатной температуре в течение 9 часов, затем смесь оставляли выстаиваться в течение 18 часов и концентрировали досуха при пониженном давлении. К остатку добавляли хлороформ (30 мл), насыщенный водный раствор гидрокарбоната натрия (3 мл) и воду (7 мл) и органический слой отделяли. Водный слой экстрагировали хлороформом (10 мл ×2) и горячим хлороформом (10 мл ×1). Полученный органический слой концентрировали с получением желаемого неочищенного продукта, 4-[{5-(метоксикарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксида (чистота 80% масс, выход 62%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 1,77 (мин)
ЖХ/МС (ESI+) m/z; 293 [M+1]+
ЖХ/МС (ESI-) m/z; 291 [M-1]-
b) Синтез 4-[{5-гидразинокарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксида
4-[{5-(Метоксикарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксид (0,12 г, 0,34 ммоль), полученный выше, суспендированный в метаноле (2,0 мл), оставляли при 60°C. После добавления 80% раствора моногидрата гидразина (0,082 мл, 1,4 ммоль) смесь оставляли выстаиваться при 60°C в течение 3,5 часов, затем при комнатной температуре в течение 5,5 часов и при 0°C в течение 11,5 часов. Осажденное твердое вещество выделяли фильтрованием и сушили с получением желаемого продукта, 4-[{5-гидразинокарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксида (выход 51%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 2, время удерживания 0,37 (мин)
ЖХ/МС (ESI+) m/z; 293 [M+1]+
ЖХ/МС (ESI-) m/z; 291 [M-1]-
1H-ЯМР (ДМСО-d6) δ: 4,42 (ушир.с, 2H), 4,51 (ушир.с, 0,7H), 7,32 (д, J=7,0 Гц, 2H), 7,68 (д, J=4,0 Гц, 1H), 7,75 (д, J=7,0 Гц, 1H), 8,17 (д, J=7,0 Гц, 2H), 9,25 (т, J=6,0 Гц, 0,3H), 9,92 (ушир.с, 0,3H).
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 26
Синтез 3-(пиридин-4-ил)пропиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты
80% Раствор моногидрата гидразина (0,17 мл, 2,8 ммоль) добавляли к метил 5-[3-(пиридин-4-ил)пропилкарбамоил]тиофен-2-карбоксилату (0,28 г, 0,92 ммоль) в метаноле (10 мл) и реакционный раствор оставляли при 50°C в течение 95 часов. После добавления 80% раствора моногидрата гидразина (0,17 мл, 2,8 ммоль) смесь оставляли выстаиваться при 55°C еще в течение 14 часов и концентрировали досуха путем выпаривания растворителя при пониженном давлении. К остатку добавляли метанол (2 мл) и полученный раствор помещали в устройство для обработки ультразвуком. Осажденное твердое вещество выделяли фильтрованием и сушили с получением желаемого продукта, 3-(пиридин-4-ил)пропиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты (выход 61%).
Морфология: белое твердое вещество
1H-ЯМР (ДМСО-d6) δ: 1,84 (тт, J=7,5 и 6,5 Гц, 2Н), 2,64 (т, J=7,5 Гц, 2Н), 3,25 (дт, J=5,5 И 6,5 Гц, 2Н), 4,54 (ушир.с, 1,6Н), 7,26 (д, J=6,0 Гц, 2Н), 7,65 (д, J=4,0 Гц, 1Н), 7,67 (д, J=4,0 Гц, 1Н), 8,45 (д, J=6,0 Гц, 2Н), 8,65 (ушир.т, J=5,5 Гц, 0,9Н), 9,90 (ушир.с, 0,9Н).
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 27
Синтез 5-(гидразинокарбонил)-N-[(1-метил-1Н-имидазол-5-ил)метил]тиофен-2-карбоксамида
Следовали процедуре ссылочного примера синтеза 18, используя метил 5-(1-метил-1Н-имидазол-5-илметилкарбамоил)тиофен-2-карбоксилат, с получением желаемого продукта, 5-(гидразинокарбонил)-N-[(1-метил-1Н-имидазол-5-ил)метил]тиофен-2-карбоксамида (выход 70%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 0,30 (мин)
ЖХ/МС (ESI+) m/z; 280 [M+1]+
ЖХ/МС (ESI-) m/z; 278 [M-1]-
ССЫЛОЧНЫЙ ПРИМЕР СИНТЕЗА 28
Синтез 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбогидразида
Следовали процедуре ссылочного примера синтеза 18, используя метил 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбоксилат, с получением желаемого продукта, 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбогидразида (выход 53%).
Морфология: белое твердое вещество
ПРИМЕР СИНТЕЗА 1
Синтез {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты
{ 1-[5-(3,4-Дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты гидрохлорид
28 мг 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофена (синтезированного в соответствии с WO 2004/108683) и 29,7 мг 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбогидразида, полученного в Ссылочном примере синтеза 1, в 2 мл изопропилового спирта нагревали с 3 мг моногидрата п-толуолсульфоновой кислоты и 25 мкл (1 экв) раствора 4M хлористого водорода/диоксана при 105°C в течение 8 часов. Реакционный раствор снова нагревали с 2 мл диметилформамида при 105°C в течение 5 часов и охлаждали до комнатной температуры. Осажденное твердое вещество выделяли фильтрованием и промывали 1 мл изопропилового спирта и 1 мл хлороформа и полученные кристаллы сушили с получением желаемого продукта (выход 54%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 5, время удерживания 3,80 (мин)
ЖХ/МС (ESI+) m/z; 565, 567 [M+1]+
ЖХ/МС (ESI-) m/z; 563, 565 [M-1]-
{1-[5-(3,4-Дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты
{1-[5-(3,4-Дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты. гидрохлорид (14 мг, 0,025 ммоль) суспендировали в метаноле (2,7 мл) и добавляли раствор 0,1M гидроксида калия в метаноле (0,24 мл) и метанол (5,4 мл). Суспензию нагревали при 50°C и концентрировали досуха при пониженном давлении с получением желаемого продукта (выход 100%).
Морфология: светло-коричневое твердое вещество
ПРИМЕР СИНТЕЗА 2
Синтез калиевой соли {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(морфолин-4-карбонил)тиофен-2-карбоновой кислоты
{1-[5-(3,4-Дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(морфолин-4-карбонил)тиофен-2-карбоновой кислоты
28 мг 2-(3,4-Дихлорфенил)-3-гидрокси-4-метилкарбонилтиофена и 26 мг 5-(морфолин-4-карбонил)тиофен-2-карбогидразида, полученного в Ссылочном примере синтеза 2, нагревали в изопропиловом спирте с 3 мг моногидрата п-толуолсульфоновой кислоты при 105°C в течение 18 часов и охлаждали до комнатной температуры. Осажденное твердое вещество выделяли фильтрованием и промывали 1 мл изопропилового спирта и полученные кристаллы сушили с получением желаемого продукта (выход 86%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 5, время удерживания 4,89 (мин)
ЖХ/МС (ESI+) m/z; 524, 526 [M+1]+
ЖХ/МС (ESI-) m/z; 522, 524 [M-1]-
Калиевая соль {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(морфолин-4-карбонил)тиофен-2-карбоновой кислоты
{1-[5-(3,4-Дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(морфолин-4-карбонил)тиофен-2-карбоновой кислоты (20 мг, 0,038 ммоль) суспендировали в метаноле (2,4 мл) и добавляли раствор 0,1М гидроксида калия в метаноле (0,38 мл), а затем метанол (5,6 мл). Суспензию нагревали при 50°С и концентрировали досуха при пониженном давлении с получением желаемого продукта (выход 100%).
ПРИМЕР СИНТЕЗА 3
Синтез калиевой соли диэтиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Диэтиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и диэтиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 3 (выход 76%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 5, время удерживания 5,82 (мин)
ЖХ/МС (ESI+) m/z; 510, 512 [M+1]+
ЖХ/МС (ESI-) m/z; 508, 510 [M-1]-
Калиевая соль диэтиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя диэтиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты (выход 100%).
Морфология: оранжевое твердое вещество
ПРИМЕР СИНТЕЗА 4
Синтез калиевой соли {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты
{1-[5-(3,4-Дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонил)тиофен и 5-(пирролидин-1-карбонил)тиофен-2-карбогидразид, полученный в ссылочном примере синтеза 4 (выход 94%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 5, время удерживания 5,34 (мин)
ЖХ/МС (ESI+) m/z; 508, 510 [M+1]+
ЖХ/МС (ESI-) m/z; 506, 508 [M-1]-
Калиевая соль {1-[5-{3, 4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты (выход 100%).
Морфология: оранжевое твердое вещество
ПРИМЕР СИНТЕЗА 5
Синтез калиевой соли диметиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Диметиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил] этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и диметиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 5 (выход 65%).
Морфология: бесцветное твердое вещество
ЖХ/МС: условия 5, время удерживания 4,93 (мин)
ЖХ/МС (ESI+) m/z; 482, 484 [M+1]+
ЖХ/МС (ESI-) m/z; 480, 482 [M-1]-
Калиевая соль диметиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя диметиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты (выход 100%).
Морфология: оранжевое твердое вещество
ПРИМЕР СИНТЕЗА 6
Синтез калиевой соли 2-метоксиэтиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
2-Метоксиэтиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден)гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и 2-метоксиэтиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 6 (выход 80%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 7, время удерживания 3,15 (мин)
ЖХ/МС (ESI+) m/z; 512, 514 [M+1]+
ЖХ/МС (ESI-) m/z; 510, 512 [M-1]-
Калиевая соль 2-метоксиэтиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-метоксиэтиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты (выход 100%).
Морфология: оранжевое твердое вещество
ПРИМЕР СИНТЕЗА 7
Синтез калиевой соли 3-пиридиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
3-Пиридиламид5-[(2-{1-[5- (3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
28 мг 2-(3,4-Дихлорфенил)-3-гидрокси-4-метилкарбонилтиофена и 26 мг 3-пиридиламида 5-гидразинокарбонилтиофен-2-карбоновой кислоты растворяли в 2 мл диметилсульфоксида и нагревали при 100°С в течение 18 часов и растворитель выпаривали. Перекристаллизация из хлороформадиэтилового эфира давала желаемый продукт (выход 94%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 2, время удерживания 4,02 (мин)
ЖХ/МС (ESI+) m/z; 531, 533 [М+1]+
ЖХ/МС (ESI-) m/z; 529, 531 [M-1]-
Калиевая соль 3-пиридиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 3-пиридиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты (выход 76%).
Морфология: оранжевое твердое вещество
ПРИМЕР СИНТЕЗА 8
Синтез диэтиламида 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонилтиофен (синтезированного в соответствии с WO 2004/108683) и диэтиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 3 (выход 67%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 3,82 (мин)
ЖХ/МС (ESI-) m/z; 508 [M-1]-
ПРИМЕР СИНТЕЗА 9
Синтез калиевой соли {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты
{1-[5-(4-Трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 7, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонилтиофен и 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбогидразид, полученный в ссылочном примере синтеза 1 (выход 55%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 2,49 (мин)
ЖХ/МС (ESI+) m/z; 565 [M+1]+
ЖХ/МС (ESI-) m/z; 563 [M-1]-
Калиевая соль {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(4-Изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты (выход 100%).
Морфология: красное твердое вещество
ПРИМЕР СИНТЕЗА 10
Синтез калиевой соли {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты
{1-[5-(4-Трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонилтиофен и 5-(пирролидин-1-карбонил)тиофен-2-карбогидразид, полученный в ссылочном примере синтеза 4 (выход 82%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 8, время удерживания 5,10 (мин)
ЖХ/МС (ESI+) m/z; 508 [M+1]+
ЖХ/МС (ESI-) m/z; 506 [M-1]-
Калиевая соль {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты (выход 100%).
Морфология: красное твердое вещество
ПРИМЕР СИНТЕЗА 11
Синтез калиевой соли 2-хлор-4-(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразинокарбонил)-N-(2-гидроксиэтил)бензамида
2-хлор-4-(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразинокарбонил)-N-(2-гидроксиэтил) бензамида
К 2-(3,4-Дихлорфенил)-3-гидрокси-4-метилкарбонилтиофену (40 мг, 0,14 ммоль) и 2-хлор-4-гидразинокарбонил-N-(2-гидроксиэтил)бензамиду (43 мг, 0,17 ммоль), полученному в Ссылочном примере синтеза 8, в диметилформамиде (0,7 мл) добавляли концентрированную хлористоводородную кислоту (12 мкл, 0,14 ммоль) при комнатной температуре и полученную смесь перемешивали при комнатной температуре в течение 1 дня и перемешивали с 2-хлор-4-гидразинокарбонил-N-(2-гидроксиэтил) бензамидом (18 мг, 0,07 ммоль) в течение 1 дня. После добавления воды полученные кристаллы выделяли фильтрованием и сушили. Добавляли хлороформ и полученные кристаллы выделяли фильтрованием с получением желаемого продукта (выход 83%).
Морфология: бледно-зеленое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,42 (мин)
ЖХ/МС (ESI+) m/z; 526, 528 [M+1]+
ЖХ/МС (ЕSI-) m/z; 524, 526 [M-1]-
Калиевая соль 2-хлор-4-(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразинокарбонил)-N-(2-гидроксиэтил)бензамида
Синтез осуществляли таким же способом, как в примере синтеза 2,используя 2-хлор-4-(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен -3-ил]этилиден}гидразинокарбонил)-N-(2-гидроксиэтил)бензамида (выход 77%).
Морфология: красное твердое вещество
ПРИМЕР СИНТЕЗА 12
Синтез калиевой соли метил-2-пиколиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
Метил-2-пиколиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 7, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и метил-2-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 10 (выход 66%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3/57 (мин)
ЖХ/МС (ESI+) m/z; 559, 561 [M+1]+
ЖХ/МС (ESI-) m/z; 557, 559 [M-1]-
Калиевая соль метил-2-пиколиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя метил-2-пиколиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты (выход 100%).
Морфология: красное твердое вещество
ПРИМЕР СИНТЕЗА 13
Синтез калиевой соли метил-2-пиколиламида 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Метил-2-пиколиламид 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 7, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонилтиофен и метил-2-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 10.
Морфология: бледно-зеленое твердое вещество
Калиевая соль метил-2-пиколиламида 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя метил-2-пиколиламид 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты (выход 100%).
Морфология: оранжевое твердое вещество
ПРИМЕР СИНТЕЗА 14
Синтез калиевой соли {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
{1-[5-(3,4-Дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 7, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и 5-(2-цианобутирил)тиофен-2-карбогидразид, полученный в ссылочном примере синтеза 9 (выход 36%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,45 (мин)
ЖХ/МС (ESI+) m/z; 506, 508 [M+1]+
ЖХ/МС (ESI-) m/z; 504, 506 [M-1]-
Калиевая соль {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(2-цианобутирил)тиофен-2-карбоновой кислоты (выход 75%).
Морфология: красное твердое вещество
ПРИМЕР СИНТЕЗА 15
Синтез калиевой соли {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
{1-[5-(4-Трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 7, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонилтиофен и 5-(2-цианобутирил)тиофен-2-карбогидразид, полученный в Ссылочном примере синтеза 9 (выход 53%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,82 (мин)
ЖХ/МС (ESI+) m/z; 506 [M+1]+
ЖХ/МС (ESI-) m/z; 504 [M-1]-
Калиевая соль {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(2-цианобутирил)тиофен-2-карбоновой кислоты (выход 91%).
Морфология: красное твердое вещество
ПРИМЕР СИНТЕЗА 16
Синтез калиевой соли {1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
{1-[5-(4-Бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 7, используя 2-(4-бромфенил)-3-гидрокси-4-метилкарбонилтиофен (синтезированного в соответствии с WO2004/108684) и 5-(2-цианобутирил)тиофен-2-карбогидразид, полученный в Ссылочном примере синтеза 9 (выход 51%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,85 (мин)
ЖХ/МС (ESI+) m/z; 516, 518 [M+1]+
ЖХ/МС (ESI-) m/z; 514, 516 [M-1]-
Калиевая соль {1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил] этилиден}гидразида 5-(2-цианобутирил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя {1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразид 5-(2-цианобутирил)тиофен-2-карбоновой кислоты (выход 91%).
Морфология: красное твердое вещество
ПРИМЕР СИНТЕЗА 17
Синтез 3-пиколиламида5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
2-(4-Бромфенил)-3-гидрокси-4-метилкарбонилтиофен (50,5 мг, 0,17 ммоль) (синтезированный в соответствии с WO 2004/108683) и 3-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 11, растворяли в диметилсульфоксиде (4,0 мл) и нагревали при 110°С в течение 24 часов. Растворитель выпаривали и остаток промывали метанолом и водой с получением желаемого продукта (выход 81%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 4,15 (мин)
ЖХ/МС (ESI+) m/z; 555, 557 [M+1]+
ЖХ/МС (ESI-) m/z; 553, 555 [M-1]-
ПРИМЕР СИНТЕЗА 18
Синтез 4-пиколиламида5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(4-бромфенил)-3-гидроксил-4-метилкарбонилтиофен и 4-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 12 (выход 72%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 4,03 (мин)
ЖХ/МС (ESI+) m/z; 555, 557 [M+1]+
ЖХ/МС (ESI-) m/z; 553, 555 [M-1]-
ПРИМЕР СИНТЕЗА 19
Синтез фуран-2-илметиламида 5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
2-(4-Бромфенил)-3-гидрокси-4-метилкарбонилтиофен (50,1 мг, 0,17 ммоль) и (фуран-2-илметил)амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты (45,0 мг, 0,17 ммоль), полученный в Ссылочном примере синтеза 13, в 2-пропаноле (4,0 мл) нагревали с моногидратом п-толуолсульфоновой кислоты (6 мг) при 100°С в течение 7,5 часов и охлаждали до комнатной температуры. Осажденное твердое вещество выделяли фильтрованием, промывали 2-пропанолом (1 мл) и сушили с получением желаемого продукта (выход 72%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 4,98 (мин)
ЖХ/МС (ESI+) m/z; 544, 546 [М+1]+
ЖХ/МС (ESI-) m/z; 542, 544 [M-1]-
ПРИМЕР СИНТЕЗА 20
Синтез метиламида 5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 19, используя 2-(4-бромфенил)-3-гидрокси-4-метилкарбонилтиофен и метиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 14 (выход 65%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 4,67 (мин)
ЖХ/МС (ESI+) m/z; 478, 480 [M+1]+
ЖХ/МС (ЕSI)- m/z; 476, 478 [M-1]-
ПРИМЕР СИНТЕЗА 21
Синтез изопропиламида5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 19, используя 2-(4-бромфенил)-3-гидрокси-4-метилкарбонилтиофен и изопропиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 15 (выход 70%).
Морфология: белое твердое вещество
ЖХ/МС: условия 2, время удерживания 4,50 (мин)
ЖХ/МС (ЕSI+) m/z; 506, 508 [M+1]+
ЖХ/МС (ESI-) m/z; 504, 506 [M-1]-
ПРИМЕР СИНТЕЗА 22
Синтез 2-пиколиламида 5-[(2-{1-[4-гидрокси-5-(4-трифторметоксифенил)тиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 3-гидрокси-2-(4-трифторметоксифенил)-4-метилкарбонилтиофен (синтезированного в соответствии с WO 2004/108683) и 2-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 16 (выход 76%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 2, время удерживания 3,92 (мин)
ЖХ/МС (ESI+) m/z; 561 [M+1]+
ЖХ/МС (ЕSI-) m/z; 559 [М-1]-
ПРИМЕР СИНТЕЗА 23
Синтез изопропиламида 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 19, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонилтиофен (синтезированный в соответствии с WO 2004/108683) и изопропиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 15 (выход 83%).
Морфология: светло-серое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,65 (мин)
ЖХ/МС (ЕSI+) m/z; 496 [M+1]+
ЖХ/МС (ESI-) m/z; 494 [M-1]-
ПРИМЕР СИНТЕЗА 24
Синтез 4-пиколиламида 5-[(2-{1-[5-(4-хлорфенил)-4-гидрокситиофен-3-ил] этилиден)гидраэино) карбонил] тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(4-хлорфенил)-3-гидрокси-4-метилкарбонилтиофен (синтезированный в соответствии с WO 2004/108683) и 4-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 12 (выход 69%).
Морфология: светло-коричневое твердое вещество
ЖХ/МС: условия 3, время удерживания 2,55 (мин)
ЖХ/МС (ESI+) m/z; 511, 513 [M+1]+
ЖХ/МС (ЕSI-) m/z; 509, 511 [M-1]-
ПРИМЕР СИНТЕЗА 25
Синтез 2-пиколиламида 5-[(2-{1-[5-(4-хлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(4-хлорфенил)-3-гидрокси-4-метилкарбонилтиофен и 2-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 16 (выход 68%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,10 (мин)
ЖХ/МС (ESI+) m/z; 511, 513 [M+1]+
ЖХ/МС (ESI-) m/z; 509, 511 [M-1]-
ПРИМЕР СИНТЕЗА 26
Синтез 3-пиколиламида 5-[(2-{1-[5-(4-хлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(4-хлорфенил)-3-гидрокси-4-метилкарбонилтиофен и 3-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 11 (выход 50%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 2,72 (мин)
ЖХ/МС (ЕSI+) m/z; 511, 513 [M+1]+
ЖХ/МС (ESI-) m/z; 509, 511 [M-1]-
ПРИМЕР СИНТЕЗА 27
Синтез метиламида 5-[(2-{1-[5-(4-хлорфенил)-4-гидpoкcитиoфeн-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 19, используя 2-(4-хлорфенил)-3-гидрокси-4-метилкарбонилтиофен и метиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 14 (выход 82%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 4,62 (мин)
ЖХ/МС (ESI+) m/z; 434, 436 [M+1]+
ЖХ/МС (ЕSI-) m/z; 432, 434 [M-1]-
ПРИМЕР СИНТЕЗА 28
Синтез изопропиламида 5-[(2-{1-[5-(3,4-диметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 19, используя 2-(3,4-диметилфенил)-3-гидрокси-4-метилкарбонилтиофен (синтезированный в соответствии с WO 2004/108683) и изопропиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 15 (выход 71%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 2, время удерживания 4,40 (мин)
ЖХ/МС (ESI+) m/z; 456 [M+1]+
ЖХ/МС (ESI-) m/z; 454 [M-1]-
ПРИМЕР СИНТЕЗА 29
Синтез 2-пиколиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(3,4-дихлорфенил-3-гидрокси-4-метилкарбонилтиофен (синтезированный в соответствии с WO 2004/108683) и 2-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 16 (выход 65%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,30 (мин)
ЖХ/МС (ESI+) m/z; 545, 547 [M+1]+
ЖХ/МС (ЕSI-) m/z; 543, 545 [M-1]-
ПРИМЕР СИНТЕЗА 30
Синтез 4-пиколиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и 4-пиколиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 12 (выход 51%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 2, время удерживания 3,25 (мин)
ЖХ/МС (ESI+) m/z; 545, 547 [M+1]+
ЖХ/МС (ESI-) m/z; 543, 545 [M-1]-
ПРИМЕР СИНТЕЗА 31
Синтез 2-(пиридин-4-ил)этиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
2-(3,4-Дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен (0,11 г, 0,38 ммоль) и (2-пиридин-4-ил)этиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты (0,10 г, 0,34 ммоль), полученный в ссылочном примере синтеза 17, суспендировали в N,N-диметилформамиде (2,0 мл) и смесь оставляли выстаиваться при 100°С в течение 5 часов и затем при комнатной температуре в течение 20 часов. Добавляли воду (0,20 мл) при перемешивании и осажденное твердое вещество выделяли фильтрованием, промывали хлороформом и сушили с получением желаемого продукта, 2-(пиридин-4-ил)этиламида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты (выход 66%).
Морфология: белое твердое вещество
ЖХ/МС: условия 3, время удерживания 2,67 (мин)
ЖХ/МС (ESI+) m/z; 559, 561 [М+1]+
ПРИМЕР СИНТЕЗА 32
Синтез (1-метил-1Н-пиразол-5-илметил)амида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
2-(3,4-Дихлорфенил) -3-гидрокси-4-метилкарбонилтиофен (50 мг, 0,17 ммоль) и 5-(гидразинокарбонил)-N-[(1-метил-1Н-пирозол-5-ил)метил]тиофен-2-карбоксамид (49 мг, 0,17 ммоль), полученный в ссылочном примере синтеза 18, растворяли в N,N-диметилформамиде (0,50 мл) и нагревали при 70°С в течение 24 часов и охлаждали до комнатной температуры. После добавления воды осажденные кристаллы выделяли фильтрованием, промывали водой и хлороформом и сушили с получением желаемого продукта (выход 76%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,60 (мин)
ЖХ/МС (ESI+) m/z; 548, 550 [M+1]+
ЖХ/МС (ESI-) m/z; 546, 548 [M-1]-
ПРИМЕР СИНТЕЗА 33
Синтез (5-метилизоксазол-3-илметил)амида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 32, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и (5-метилизоксазол-3-илметил)амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 19 (выход 67%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,77 (мин)
ЖХ/МС (ESI+) m/z; 549, 551 [M+1]+
ЖХ/МС (ESI-) m/z; 547, 549 [M-1]-
ПРИМЕР СИНТЕЗА 34
Синтез (5-метилпиразин-2-илметил)амида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и (5-метилпиразин-2-илметил)амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 20 (выход 74%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,62 (мин)
ЖХ/МС (ESI+) m/z; 560, 562 [M+1]+
ЖХ/МС (ESI-) m/z; 558, 560 [M-1]-
ПРИМЕР СИНТЕЗА 35
Синтез (изоксазол-5-илметил)амида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 19, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и (изоксазол-5-илметил) амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 19 (выход 74%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,69 (мин)
ЖХ/МС (ESI+) m/z; 535, 537 [M+1]+
ЖХ/МС (ЕSI-) m/z; 533, 535 [M-1]-
ПРИМЕР СИНТЕЗА 36
Синтез (3-метоксиизоксазол-5-илметил)амида 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза синтеза 19, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и (3-метоксиизоксазол-5-илметил)амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 22 (выход 52%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,75 (мин)
ЖХ/МС (ESI+) m/z; 565, 567 [M+1]+
ЖХ/МС (ESI-) m/z; 563, 565 [M-1]-
ПРИМЕР СИНТЕЗА 37
Синтез (1,5-диметил-1H-пиразол-3-илметил)амида 5-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиденгидразинокарбонил}тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и (1,5-диметил-1H-пиразол-3-илметил)амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 23 (выход 86%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,65 (мин)
ЖХ/МС (ESI+) m/z; 562, 564 [M+1]+
ЖХ/МС (ESI-) m/z; 560, 562 [M-1]-
ПРИМЕР СИНТЕЗА 38
Синтез (пиразин-2-илметил)амида 5-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиденгидразинокарбонил}тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен и (пиразин-2-илметил)амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в Ссылочном примере синтеза 24 (выход 88%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,57 (мин)
ЖХ/МС (ESI+) m/z; 546, 548 [M+1]+
ЖХ/МС (ESI-) m/z; 544, 546 [M-1]-
ПРИМЕР СИНТЕЗА 39
Синтез 4-[{5-(2-[1-{5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил}этилиден]гидразинокарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксида
2-(3,4-Дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен (32 мг, 0,11 ммоль) и 4-[{5-гидразинокарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксид (30 мг, 0,10 ммоль), полученный в Ссылочном примере синтеза 25, суспендировали в N,N-диметилформамиде (0,60 мл) и перемешивали при 80°C в течение 90 часов. После добавления 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонилтиофена (26 мг, 0,091 ммоль) суспензию перемешивали при 80°C в течение 24 часов, оставляли при комнатной температуре в течение 5 часов и концентрировали досуха, с получением желтой неочищенной пасты (91 мг). Пасту суспендировали в хлороформе (2,0 мл) и нерастворимые вещества выделяли фильтрованием и сушили с получением желаемого продукта, 4-[{5-(2-[1-{5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил}этилиден]гидразинокарбонил)тиофен-2-карбоксамидо}метил]пиридин 1-оксида (выход 52%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 3, время удерживания 3,29 (мин)
ЖХ/МС (ESI+) m/z; 561, 563 [M+1]+
ЖХ/МС (ESI-) m/z; 559, 561 [M-1]-
ПРИМЕР СИНТЕЗА 40
Синтез 3-(пиридин-4-ил)пропиламида 5-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиденгидразинокарбонил}тиофен-2-карбоновой кислоты
2-(3,4-Дихлорфенил)-3-гидрокси-4-метилкарбонилтиофен (42 мг, 0,14 ммоль) и 3-(пиридин-4-ил)пропиламид 5-гидразинокарбонилтиофен-2-карбоновой кислоты (40 мг, 0,13 ммоль), полученный в Ссылочном примере синтеза 26, растворяли в N,N-диметилформамиде (1,0 мл) и смесь оставляли выстаиваться при 70°C в течение 16 часов и затем при комнатной температуре в течение 24 часов. Добавляли воду (0,36 мл) при перемешивании и осажденное твердое вещество выделяли фильтрованием с получением желаемого продукта, 3-(пиридин-4-ил)пропиламида 5-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиденгидразинокарбонил}тиофен-2-карбоновой кислоты (выход 95%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 2, время удерживания 3,31 (мин)
ЖХ/МС (ESI+) m/z; 573, 575 [M+1]+
ЖХ/МС (ESI-) m/z; 571, 573 [M-1]-
ПРИМЕР СИНТЕЗА 41
Синтез (1-метил-1H-имидазол-5-илметил)амида 5-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиденгидразинокарбонил}тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 17, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонилтиофен и (1-метил-1H-имидазол-5-илметил)амид 5-гидразинокарбонилтиофен-2-карбоновой кислоты, полученный в ссылочном примере синтеза 27 (выход 39%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 2, время удерживания 3,02 (мин)
ЖХ/МС (ESI+) m/z; 548 [M+1]+
ЖХ/МС (ESI-) m/z; 546 [M-1]-
ПРИМЕР СИНТЕЗА 42
Синтез {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(3,4-дихлорфенил)-3-гидрокси-4-метилкарбонил)тиофен и 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбогидразид, полученный в Ссылочном примере синтеза 28 (выход 97%).
Морфология: желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 3,47 (мин)
ЖХ/МС (ESI+) m/z; 524, 526 [M+1]+
ЖХ/МС (ESI-) m/z; 522, 524 [M-1]-
ПРИМЕР СИНТЕЗА 43
Синтез {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразида 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбоновой кислоты
Синтез осуществляли таким же способом, как в примере синтеза 2, используя 2-(4-трифторметилфенил)-3-гидрокси-4-метилкарбонил)тиофен и 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбогидразид, полученный в Ссылочном примере синтеза 28 (выход 84%).
Морфология: бледно-желтое твердое вещество
ЖХ/МС: условия 6, время удерживания 3,34 (мин)
ЖХ/МС (ESI+) m/z; 524, 525 [M+1]+
ЖХ/МС (ESI-) m/z; 522, 523 [M-1]-
Структуры соединений, полученных в ссылочных примерах синтеза и в примерах синтеза, представлены ниже.
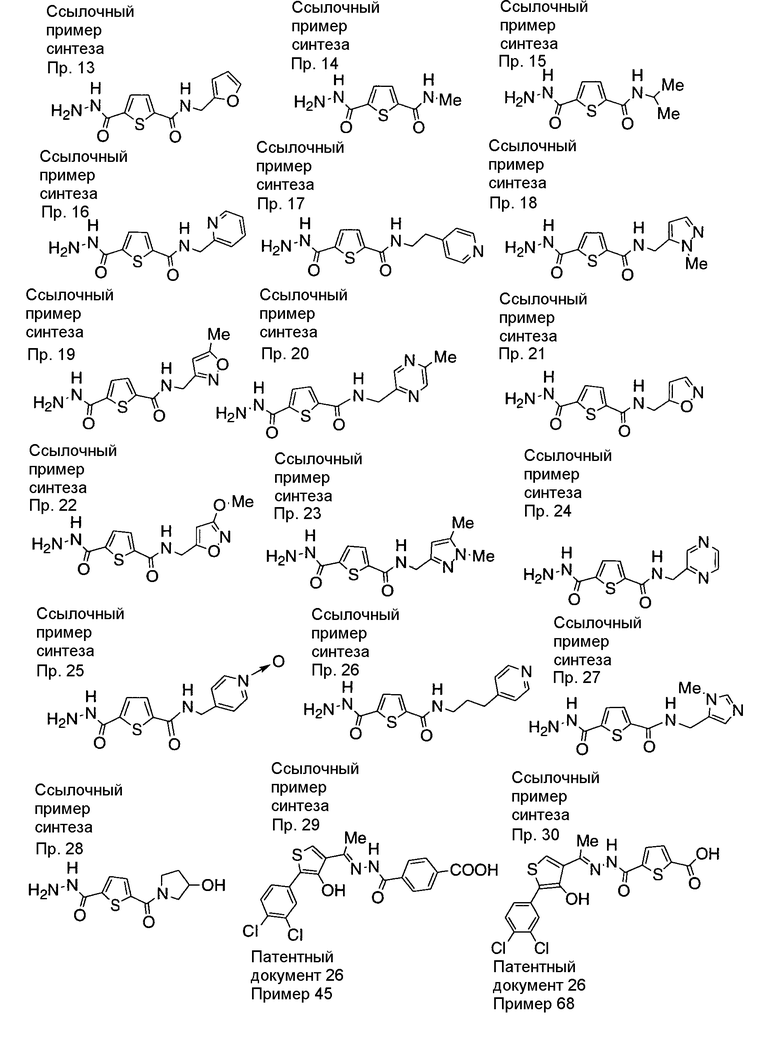
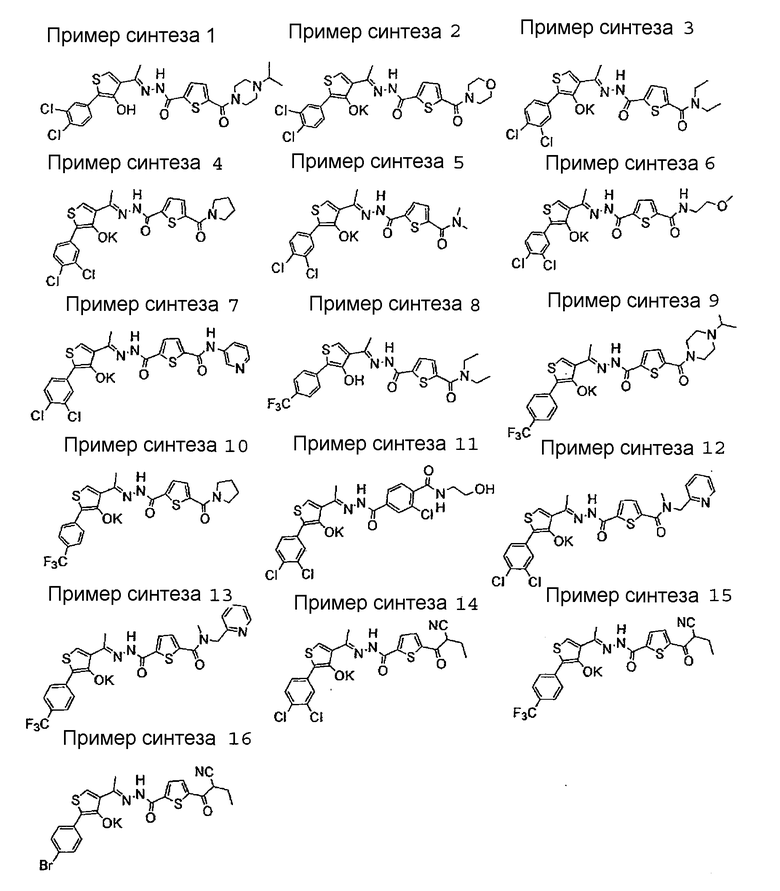
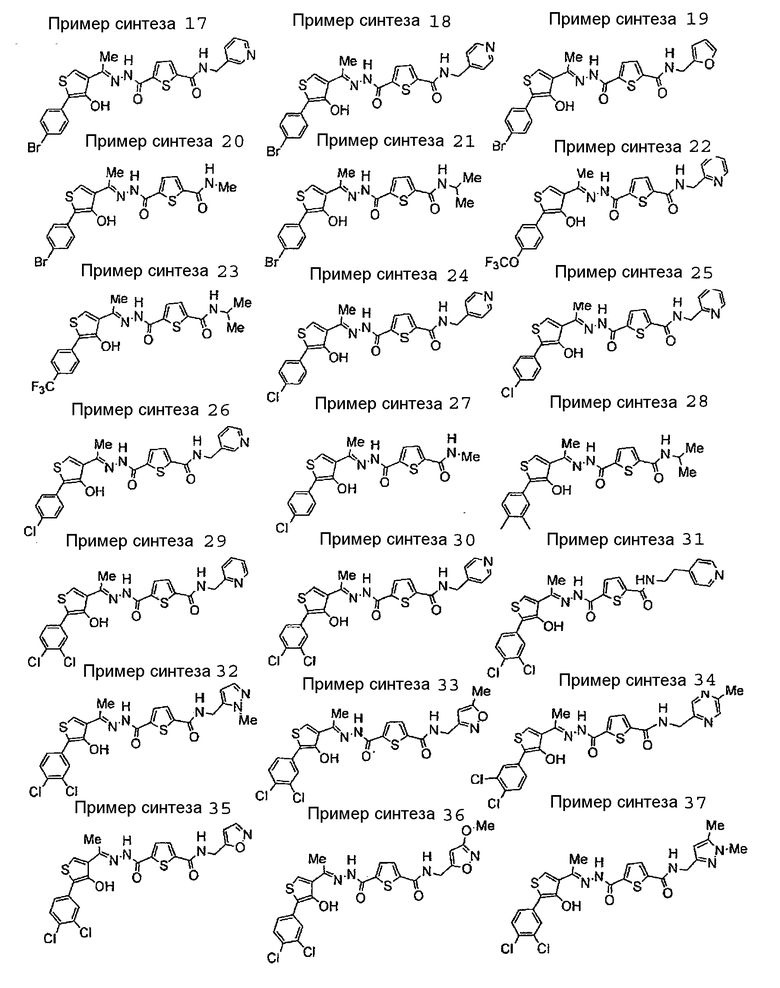
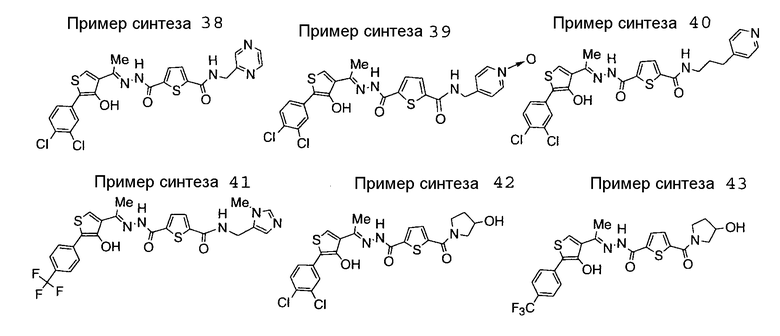
ПРИМЕР ИСПЫТАНИЯ 1
Стимуляция пролиферации тромбопоэтин-зависимой клеточной линии
Способность соединений примеров синтеза по настоящему изобретению к взаимодействию с рецептором тромбопоэтина (TPO) оценивали с использованием клеточной линии лейкоза человека UT7/EPO-mpl.
(1) Клетки и культура клеток
UT7/EPO-mpl представляет собой стабильно трансформированную клеточную линию, полученную введением в клеточную линию лейкоза человека UT7/EPO вектора, который индуцирует экспрессию рецептора тромбопоэтина человека (c-mp1) под контролем цитомегаловирусного предраннего промотора способом Takatoku et al. (J. Biol. Chem., 272:7259-7263 (1997)). Пролиферацию этой клеточной линии стимулируют тромбопоэтином, тогда как ее материнская клеточная линия UT7/EPO не демонстрирует никакого ответа на тромбопоэтин. Эти две клеточные линии субкультивировали в IMDM (GIBCO), содержащей 10% фетальную бычью сыворотку (Thermo Electron или BioWest), с использованием CO2 инкубатора (5% CO2, 37°C).
(2) Анализ клеточной пролиферации
Субкультивированные клетки, описанные выше, промывали два раза PBS и суспендировали в IMDM, содержащей 10% фетальную бычью сыворотку, при плотности клеток 6×104 клеток/мл. Клеточную суспензию переносили в 96-луночные культуральные планшеты (CORNING) в 100-мкл аликвотах. Затем либо тромбопоэтин (Pepro Tech EC), либо соединения Примеров синтеза, растворенные в диметилсульфоксиде, разбавляли 83-кратно IMDM, содержащей 10% фетальную бычью сыворотку, и добавляли к указанной выше суспензии клеток в 20-мкл аликвотах. Клеточную суспензию инкубировали в CO2 инкубаторе (5% CO2, 37°C) в течение 4 дней. Клеточную пролиферацию оценивали с использованием WST-8 реагента (Kishida Chemical Co., Ltd.) в соответствии с инструкциями изготовителя. К каждой лунке культурального планшета добавляли 10-мкл аликвоту раствора 5 мМ реагента WST-8 и планшет инкубировали при 37°C в течение 4 часов. Детекцию образовавшегося формазанового пигмента осуществляли путем измерения поглощения при 450 нм при помощи считывающего устройства для 96-луночных микропланшетов (Nihon Molecular Devices, Spectramax 190). Соединения Примеров синтеза по настоящему изобретению стимулировали пролиферацию тромбопоэтин-респонсивных клеток UT7/EPO-mpl зависимым от концентрации образом, в то время как не наблюдали никакого эффекта соединений Примеров синтеза на пролиферацию UT7/EPO, материнской клеточной линии. Эти результаты показывают, что соединения примеров синтеза по настоящему изобретению селективно действуют на рецептор тромбопоэтина как его активаторы.
Соединения примеров синтеза 1-43 (в свободных формах) были испытаны для определения концентрации каждого соединения, которая обеспечивает скорость роста, соответствующую 50% от роста клеточной линии лейкоза человек UT7/EPO-mpl, наблюдаемого в присутствии 10 нг/мл TPO (EC50). Все соединения примеров синтеза 1-43 показали значение EC50 около 10 нг/мл или ниже.
ПРИМЕР ИСПЫТАНИЯ 2
Каждое из соединений примеров синтеза суспендировали в 99/1 жидкой смеси 0,5% раствор метилцеллюлозы/полиоксиэтиленсорбитанмоноолеат и перорально вводили 7-недельным самцам крыс Sprague-Dawley (Japan SLC, Inc.) при дозе 10 мг/кг/10 мл через желудочный зонд. В промежутке от 0,5 до 2 часов после введения соединений периодически отбирали кровь из шейной вены с использованием гепарина в качестве антикоагулянта. Кровь центрифугировали при 3500 мин-1 в течение 10 минут с получением плазмы. Плазму добавляли в систему анализа для оценки пролиферации тромбопоэтин-зависимой клеточной линии UT7/EPO-mpl в Примере испытания 1 при конечной концентрации от 0,1 до 3%, и оценивали пролиферацию клеток. Концентрацию каждого соединения в плазме рассчитывали, исходя из клеточной пролиферации в присутствии плазмы, путем сравнения со стандартной кривой клеточной пролиферации против концентрации соединения, которая была получена для каждого соединения или определена методом ЖХ/МС (Agilent Technologies, Agilent 1100 series LC/MS D). Каждое из соединений примеров синтеза 1-16, 31 и 38 (соединения примеров синтеза 31 и 38 были испытаны в форме калиевых солей) достигало максимальной концентрации в крови (Cmax) около 300 нг/мл через 0,5-2 часа после перорального введения крысам.
ПРИМЕР ИСПЫТАНИЯ 3
Активность по стимулированию колонии мегакариоцитов
Действие соединений примеров синтеза 1-43 по настоящему изобретению и ссылочных примеров синтеза 29 и 30 на пролиферацию, дифференциацию и созревание мегакариоцитных клеток определяли методом колониеобразования мегакариоцитов с использованием клеток костного мозга человека (см.табл.7). Клетки костного мозга человека CD34+ (Cambrex Bio Science Walkersville) инкубировали на 2-луночном предметном стекле в течение 11 дней в CO2 инкубаторе (5% CO2, 37°C) с использованием MegaCultTM-C (StemCell Technologies), содержащей 0,1% (об./об.) соединений Примеров синтеза, растворенных в диметилсульфоксиде. После дегидратации и фиксации клетки окрашивали антигликопротеин IIb/IIIa антителом в соответствии с инструкциями изготовителя. Колонии, состоящие из по меньшей мере 8 окрашенных мегакариоцитных клеток в каждой лунке, подсчитывали под микроскопом. Число колоний мегакариоцитов в по меньшей мере 2 лунках усредняли.
Результаты показывают, что соединения по настоящему изобретению обладают отличной активностью по стимуляции колоний мегакариоцитов и повышению числа тромбоцитов через такую активность.
ПРИМЕР ФОРМУЛИРОВАНИЯ 1
Получают препарат в форме гранул, содержащих следующие ингредиенты
Соединение формулы (I) и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Их смешивают в смесителе V-типа. Порошкообразную смесь смешивают с водным раствором гидроксипропилцеллюлозы (HPC-L) низкой вязкости, гранулируют (экструзионное гранулирование, размер головки экструдера 0,5-1 мм) и сушат. Полученные сухие гранулы пропускают через вибрационное сито (12/60 меш) с получением гранулированного препарата.
ПРИМЕР ФОРМУЛИРОВАНИЯ 2
Получают препарат в виде порошка для инапсулирования, содержащий следующие ингредиенты
Соединение формулы (I) и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Их смешивают в смесителе V-типа. 10% порошок помещают в твердые желатиновые капсулы No. 5, по 100 мг в каждую.
ПРИМЕР ФОРМУЛИРОВАНИЯ 3
Получают препарат в форме гранул для инапсулирования, содержащий следующие ингредиенты
Соединение формулы (I) и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Компоненты смешивают в смесителе V-типа. Порошкообразную смесь смешивают с водным раствором гидроксипропилцеллюлозы (HPC-L) низкой вязкости, гранулируют и сушат. Полученные сухие гранулы пропускают через вибрационное сито (12/60 меш). Гранулы помещают в твердые капсулы No. 4, по 150 мг в каждую.
ПРИМЕР ФОРМУЛИРОВАНИЯ 4
Получают препарат в форме таблеток, содержащих следующие ингредиенты
Соединение формулы (I), лактозу, микрокристаллическую целлюлозу и CMC-Na (натриевая соль карбоксиметилцеллюлозы) пропускают через сито 60 меш и смешивают. Порошкообразную смесь смешивают со стеаратом магния с получением сыпучей порошкообразной смеси. Порошкообразную смесь непосредственно прессуют в 150 мг таблетки.
ПРИМЕР ФОРМУЛИРОВАНИЯ 5
Внутривенный препарат получают следующим образом:
Растворы, содержащие указанные выше композиции, обычно вводят пациенту внутривенно при скорости 1 мл в 1 минуту.
Промышленная применимость
Соединения по настоящему изобретению, которые обладают сродством к рецептору тромбопоэтина и действуют как агонисты рецептора тромбопоэтина, являются полезными в качестве средств для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, особенно в качестве лекарственных средств для лечения гематологических расстройств, сопровождаемых аномальным числом тромбоцитов, и в качестве лекарственных средств для лечения заболеваний, лечение или предотвращение которых можно осуществлять путем стимуляции дифференциации и пролиферации эндотелиальных клеток сосудов и эндотелиальных клеток-предшественников, и являются полезными в качестве лекарственных средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| 3-ЭТИЛИДЕНГИДРАЗИНО-ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АКТИВАТОРОВ РЕЦЕПТОРА ТРОМБОПОЭТИНА | 2005 |
|
RU2395505C2 |
| 3-АЛКИЛИДЕНГИДРАЗИНО-ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АКТИВАТОРОВ РЕЦЕПТОРА ТРОМБОПОЭТИНА | 2004 |
|
RU2358970C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТИОФЕНОВОГО ПРОИЗВОДНОГО И ЕГО ПРОМЕЖУТОЧНОГО ПРОДУКТА | 2009 |
|
RU2495877C2 |
| АМИДНЫЕ СОЕДИНЕНИЯ И АКТИВАТОРЫ РЕЦЕПТОРА ТРОМБОПОЭТИНА | 2005 |
|
RU2401259C2 |
| СОЕДИНЕНИЕ ТРИАЗИНОНА И ИНГИБИТОР КАЛЬЦИЕВЫХ КАНАЛОВ Т-ТИПА | 2013 |
|
RU2645158C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2711502C2 |
| ПРОИЗВОДНЫЕ ТИОФЕНА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА | 2013 |
|
RU2663835C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЛАМИДОМ ТИАЗОЛЫ, ПИРРОЛЫ И ТИОФЕНЫ | 2006 |
|
RU2425829C2 |
| (ДИГИДРО)ПИРРОЛО[2,1-А]ИЗОХИНОЛИНЫ | 2009 |
|
RU2495037C2 |
| СУЛЬФОНАМИДНЫЕ ПЕРИ-ЗАМЕЩЕННЫЕ БИЦИКЛЫ ДЛЯ ЛЕЧЕНИЯ ОККЛЮЗИОННОГО ПОРАЖЕНИЯ АРТЕРИЙ | 2005 |
|
RU2403240C2 |
Изобретение относится к соединению, представленному формулой (I):
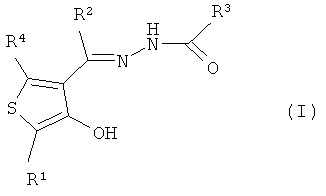
где R1 представляет собой фенильную группу (указанная фенильная группа замещена одной или несколькими C1-6алкильными группами, одной C1-3алкильной группой (указанная C1-3алкильная группа замещена одним или несколькими атомами галогена), одной C1-3алкоксигруппой (указанная С1-3алкоксигруппа замещена одним или несколькими атомами галогена) или одним или несколькими атомами галогена), R2 представляет собой С1-3алкильную группу, R3 представляет собой фенильную группу (указанная фенильная группа замещена одной или несколькими заместителями, выбранными из группы, состоящей из атомов галогена и группы (C=O)R5' (где R5' представляет собой NR6'R7' (где R6' представляет собой атом водорода, и R7' представляет собой C1-6алкильную группу, замещенную гидроксильной группой))), тиенильную группу (указанная тиенильная группа замещена одним или несколькими заместителями, выбранными из группы, включающей атомы водорода и группой (C=O)R5 (где R5 представляет собой NR6R7 (где R6 представляет собой атом водорода или С1-3алкильную группу, и R7 представляет собой C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одной или несколькими гидроксильными группами, одной С1-3алкоксигруппой или 5-6-членной ароматической гетероциклической группой, включающей 1-2 гетероатома, выбранных из кислорода или азота (где 5-6-членная ароматическая гетероциклическая группа может быть замещена одной или несколькими C1-3алкильными группами, одной или несколькими С1-3алкоксигруппами, и в случае 5-6-членной ароматической гетероциклической группы, включающей один атом азота, может находиться в форме N-оксидов)), пиридильную группу, или NR6R7 представляет собой, в целом, азот-содержащую гетероциклильную группу, которая является 5-6-членной гетеромоноциклической группой, которая включает один или два атома азота и может дополнительно включать один атом кислорода (указанная азот-содержащая гетероциклильная группа может быть замещена одним или несколькими атомами водорода, одной или несколькими C1-6алкильными группами, одной или несколькими гидроксильными группами)) или С1-6алкильную группу (указанная C1-6алкильная группа могут быть замещена одним или несколькими атомами галогена и является замещенной одной цианогруппой))), и R4 представляет собой атом водорода или к фармацевтически приемлемой соли указанного соединения. Изобретение также относится к лекарственному средству для предотвращения или лечения заболеваний, при которых активация рецептора тромбопоэтина является эффективной, на основе указанных соединений. Технический результат - получены новые соединения и средства на их основе, которые могут найти свое применение в медицине для повышения числа тромбоцитов. 10 н. и 23 з.п. ф-лы, 7 табл.
1. Соединение, представленное формулой (I):

где R1 представляет собой фенильную группу (указанная фенильная группа замещена одной или несколькими C1-6алкильными группами, одной C1-3алкильной группой (указанная C1-3алкильная группа замещена одним или несколькими атомами галогена), одной C1-3алкоксигруппой (указанная C1-3алкоксигруппа замещена одним или несколькими атомами галогена) или одним или несколькими атомами галогена),
R2 представляет собой C1-3алкильную группу,
R3 представляет собой фенильную группу (указанная фенильная группа замещена одной или несколькими заместителями, выбранными из группы, состоящей из атомов галогена и группы (C=O)R5', (где R5' представляет собой NR6'R7', (где R6' представляет собой атом водорода, и R7' представляет собой С1-6алкильную группу, замещенную гидроксильной группой))),
тиенильную группу (указанная тиенильная группа замещена одним или несколькими заместителями, выбранными из группы, включающей атомы водорода и группой (C=O)R5, (где R5 представляет собой NR6R7, (где R6 представляет собой атом водорода или C1-3алкильную группу, и R7 представляет собой C1-6алкильную группу (указанная С1-6алкильная группа может быть замещена одной или несколькими гидроксильными группами, одной C1-3алкоксигруппой или 5-6-членной ароматической гетероциклической группой, включающей 1-2 гетероатома, выбранных из кислорода или азота, (где 5-6-членная ароматическая гетероциклическая группа может быть замещена одной или несколькими C1-3алкильными группами, одной или несколькими С1-3алкоксигруппами, и в случае 5-6-членной ароматической гетероциклической группы, включающей один атом азота, может находиться в форме N-оксидов)), пиридильную группу, или NR6R7 представляет собой, в целом, азотсодержащую гетероциклильную группу, которая является 5-6-членной гетеромоноциклической группой, которая включает один или два атома азота и может дополнительно включать один атом кислорода (указанная азотсодержащая гетероциклильная группа может быть замещена одним или несколькими атомами водорода, одной или несколькими C1-6алкильными группами, одной или несколькими гидроксильными группами)) или С1-6алкильную группу (указанная C1-6алкильная группа могут быть замещена одним или несколькими атомами галогена и является замещенной одной цианогруппой))), и
R4 представляет собой атом водорода или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, где R2 представляет собой метильную группу, и R4 представляет собой атом водорода,
или фармацевтически приемлемая соль указанного соединения.
3. Соединение по п.2, где R1 представляет собой 3,4-диметилфенильную группу, 4-трет-бутилфенильную группу, 4-трифторметилфенильную группу, 3-хлорфенильную группу, 4-хлорфенильную группу, 4-фторфенильную группу, 3,4-дихлорфенильную группу, 4-бромфенильную группу или 4-трифторметоксифенильную группу,
или фармацевтически приемлемая соль указанного соединения.
4. Соединение по п.3, где R3 представлен формулой (II):
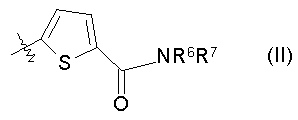
(где R6 представляет собой метильную группу или этильную группу, и R7 C1-6алкильную группу (указанная C1-6алкильная группа может быть замещена одной или несколькими метоксигруппами)), или фармацевтически приемлемая соль указанного соединения.
5. Соединение по п.3, где R3 представлен формулой (II):

(где R6 представляет собой метильную группу или этильную группу, и R7 представляет собой C1-3алкильную группу (указанная С1-3алкильная группа замещена одной или несколькими фенильными группами или одной или несколькими пиридильными группами)), или фармацевтически приемлемая соль указанного соединения.
6. Соединение по п.3, где R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой C1-6алкильную группу (указанная С1-6алкильная группа замещена одной или несколькими метоксигруппами) или пиридильную группу), или фармацевтически приемлемая соль указанного соединения.
7. Соединение по п.3, где R3 представлен формулой (II):

(где группа NR6R7, в целом, представлена формулой (III):
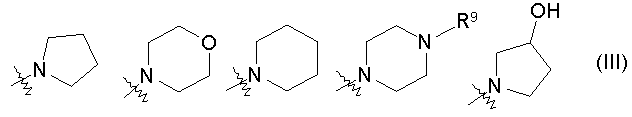
(где R9 представляет собой C1-3алкильную группу)), или фармацевтически приемлемая соль указанного соединения.
8. Соединение по п.3, где R3 представлен формулой (IV):
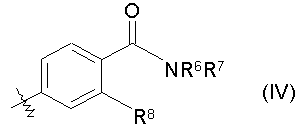
(где R6 представляет собой атом водорода, R7 представляет собой C1-3 алкильную группу (указанная С1-3 алкильная группа может быть замещена одной или несколькими гидроксильными группами), и R8 представляет собой атом хлора),
или фармацевтически приемлемая соль указанного соединения.
9. Соединение по п.3, где R3 представлен формулой (V):
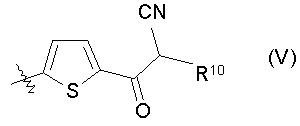
(где R10 представляет собой атом водорода или C1-3алкильную группу), или фармацевтически приемлемая соль указанного соединения.
10. Соединение по п.3, где R3 представлен формулой (II):

(где R6 представляет собой атом водорода, и R7 представляет собой изопропильную группу, метильную группу, этильную группу или нормальную пропильную группу (указанная метильная группа, указанная этильная группа и указанная нормальная пропильная группа являются незамещенными или замещены одной или несколькими пиридильными группами, одной или несколькими пиридил-N-оксидными группами, одной или несколькими фурильными группами, одной или несколькими пиразинильными группами, одной или несколькими имидазолильными группами, одной или несколькими пиразолильными группами или одной или несколькими изоксазолильными группами (указанные пиридильные группы, указанные пиридил-N-оксидные группы, указанные фурильные группы, указанные пиразинильные группы, указанные имидазолильные группы, указанные пиразолильные группы и указанные изоксазолильные группы могут быть замещены одной или несколькими метильными группами, одной или несколькими метоксигруппами))), или фармацевтически приемлемая соль указанного соединения.
11. Соединение по любому из пп.4-10, где R1 представляет собой 3,4-диметилфенильную группу,
или фармацевтически приемлемая соль указанного соединения.
12. Соединение по любому из пп.4-10, где R1 представляет собой 3, 4-дихлорфенильную группу,
или фармацевтически приемлемая соль указанного соединения.
13. Соединение по любому из пп.4-10, где R1 представляет собой 4-хлорфенильную группу,
или фармацевтически приемлемая соль указанного соединения.
14. Соединение по любому из пп.4-10, где R1 представляет собой 4-трифторметилфенильную группу,
или фармацевтически приемлемая соль указанного соединения.
15. Соединение по любому из пп.4-10, где R1 представляет собой 4-бромфенильную группу,
или фармацевтически приемлемая соль указанного соединения.
16. Соединение по любому из пп.4-10, где R1 представляет собой 4-трифторметоксифенильную группу,
или фармацевтически приемлемая соль указанного соединения.
17. Активатор рецептора тромбопоэтина, содержащий соединение по любому из пп.1-16, или фармацевтически приемлемую соль такого соединения, в качестве активного ингредиента.
18. Средство для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, которое содержит активатор рецептора тромбопоэтина по п.17 в качестве активного ингредиента.
19. Средство для повышения числа тромбоцитов, содержащее активатор рецептора тромбопоэтина по п.17 в качестве активного ингредиента.
20. Лекарственное средство для предотвращения или лечения заболеваний, при которых активация рецептора тромбопоэтина является эффективной, содержащее соединение по любому из пп.1-16, или фармацевтически приемлемую соль такого соединения в качестве активного ингредиента.
21. Соединение или его фармацевтически приемлемая соль, которое представляет собой:
(i) {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}-гидразид 5-(4-изопропилпиперазин-1-карбонил)тиофен-2-карбоновой кислоты;
(ii) {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}-гидразид 5-(морфолин-4-карбонил)тиофен-2-карбоновой кислоты;
(iii) {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}-гидразид 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты;
(iv) 2-метоксиэтиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-
гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(v) {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}-гидразид 5-(пирролидин-1-карбонил)тиофен-2-карбоновой кислоты;
(vi) 3-пиколиламид 5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(vii) метил-2-пиколиламид 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты;
(viii) 4-пиколиламид 5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(ix) фуран-2-илметиламид 5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(хi) изопропиламид 5-[(2-{1-[5-(4-бромфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xii) 2-пиколиламид 5-[(2-{1-[4-гидрокси-5-(4-трифторметоксифенил)тиофен-3-ил]этилиден}гидразино)-карбонил]-тиофен-2-карбоновой кислоты;
(xiii) изопропиламид 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xiv) 4-пиколиламид 5-[(2-{1-[5-(4-хлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xv) 2-пиколиламида 5-[(2-{1-[5-(4-хлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xvi) 3-пиколиламида 5-[(2-{1-[5-(4-хлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xvii) изопропиламид 5-[(2-{1-[5-(3,4-диметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты;
(xviii) 2-пиколиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xix) 4-пиколиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xx) 2-(пиридин-4-ил)этиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xxi) (1-метил-1Н-пиразол-5-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты;
(xxii) (5-метилизоксазол-3-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты;
(xxiii) (5-метилпиразин-2-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты;
(xxiv) (изоксазол-5-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты;
(xxv) (3-метоксиизоксазол-5-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты;
(xxvi) (1,5-диметил-1Н-пиразол-3-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты;
(xxvii) (пиразин-2-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xxviii) 4-пиколил-1-оксид амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты;
(xxix) 3-(пиридин-4-ил)пропиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]-тиофен-2-карбоновой кислоты;
(xxx) [(1-метил-1Н-имидазол-5-ил)метил]амида 5-[(2-{1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты;
(ххi) {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}-гидразид 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбоновой кислоты;
(xxxii) {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил] этилиден} гидразид 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбоновой кислоты.
22. Соединение по п.21, которое представляет собой 2-метоксиэтиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
23. Соединение по п.21, которое представляет собой {1-[5-(4-трифторметилфенил)-4-гидрокситиофен-3-ил]этилиден}-гидразид 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
24. Соединение по п.21, которое представляет собой 4-пиколиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил] этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
25. Соединение по п.21, которое представляет собой 2-(пиридин-4-ил)этиламид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил] этилиден} гидразино) карбонил] тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
26. Соединение по п.21, которое представляет собой (изоксазол-5-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
27. Соединение по п.21, которое представляет собой (3-метоксиизоксазол-5-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил] этилиден}гидразино)-карбонил]тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
28. Соединение по п.21, которое представляет собой (пиразин-2-илметил)амид 5-[(2-{1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил] этилиден}гидразино)карбонил]тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
29. Соединение по п.21, которое представляет собой {1-[5-(3,4-дихлорфенил)-4-гидрокситиофен-3-ил]этилиден}-гидразид 5-(3-гидроксипирролидин-1-карбонил)тиофен-2-карбоновой кислоты или его фармацевтически приемлемую соль.
30. Активатор рецептора тромбопоэтина, содержащий соединение по любому из пп.21-29 или фармацевтически приемлемую соль такого соединения, в качестве активного ингредиента.
31. Средство для предотвращения, лечения или улучшения состояния заболеваний, при которых активация рецептора тромбопоэтина является эффективной, которое содержит активатор рецептора тромбопоэтина по п.30 в качестве активного ингредиента.
32. Средство для повышения числа тромбоцитов, содержащее активатор рецептора тромбопоэтина по п.30 в качестве активного ингредиента.
33. Лекарственное средство для предотвращения или лечения заболеваний, при которых активация рецептора тромбопоэтина является эффективной, содержащее соединение по любому из пп.21-29 или фармацевтически приемлемую соль такого соединения в качестве активного ингредиента.
| WO 2004108683 A1, 16.12.2004 | |||
| 2004033433 A1, 22.04.2004. |
Авторы
Даты
2011-07-20—Публикация
2006-07-13—Подача