Настоящее изобретение относится к производным 5,6-дигидропирроло[2,1-a]изохинолина и пирроло[2,1-a]изохинолина, содержащим их фармацевтическим композициям, и применению указанных соединений для изготовления лекарственных средств для лечения бесплодия.
Гонадотропины выполняют важные функции в различных функциях тела, включающих в себя метаболизм, регулирование температуры и репродуктивный процесс. Гонадотропины действуют на определенные типы гонадных клеток для инициирования овариальной и тестикулярной дифференциации и стероидогенеза. Гипофизарный гонадотропин FSH (фолликулостимулирующий гормон), например, играет основную роль в стимуляции развитии и созревания фолликула, тогда как LH (лютеинизирующий гормон) индуцирует овуляцию [Sharp, R.M. Clin Endocrinol. 33,787-807 (1990); Dorrington and Armstrong, Recent Prog. Horm. Res. 35, 301-342 (1979)]. В настоящее время FSH применяют клинически для овариальной стимуляции, т.е. овариальной гиперстимуляции для оплодотворения in vitro (IVF) и индуцирования овуляции у бесплодных ановуляторных женщин [Insler, V., Int. J. Fertility 33, 85-97 (1988), Navot and Rosenwaks, J. Vitro Fert. Embryo Transfer 5, 3-13 (1988)], а также для мужского гипогонадизма и мужского бесплодия.
Гонадотропин FSH выделяется из аденогипофиза под воздействием гонадотропинвысвобождающего гормона гипоталмуса и эстрогенов и из плаценты во время беременности. У женщины FSH действует на яичники, промотируя развитие фолликулов, и является основным гормоном, регулирующим секрецию эстрогенов. У мужчины FSH является ответственным за целостность семенных канальцев и действует на клетки Сертоли для поддержки гаметогенеза. Очищенный FSH применяют клинически для лечения бесплодия у женщин и для некоторых типов недостаточности сперматогенеза у мужчин. Гонадотропины, предназначенные для терапевтических целей, можно выделить из мочевых источников человека, но они имеют низкую чистоту [Morse et al, Amer. J. Reproduct. Immunol. and Microbiology 17, 143 (1988)]. Альтернативно, их можно получить в виде рекомбинантных гонадотропинов. Рекомбинантный FSH человека является коммерчески доступным и его применяют в целях содействия репродукции. [Olijve et al. Mol. Hum. Reprod. 2, 371-381 (1996); Devroey et al. Lancet 339, 1170-1171 (1992)].
Действия гормона FSH опосредуются определенным рецептором мембраны, который является членом большого семейства G-белок-сопряженных рецепторов. Эти рецепторы состоят из одного полипептида с семью трансмембранными доменами и способны взаимодействовать с Gs-белком, что приводит к активации аденилатциклазы.
Рецептор FSH (FSHR) является очень специфической мишенью в процессе роста везикулярных яичковых фолликул и экспрессируется только в яичнике. Агонисты GSHR с низкой молекулярной массой можно применять для тех же клинических целей, как и нативный FSH, т.е. для лечения бесплодия и овариальной гиперстимуляции при проведении оплодотворения in vitro.
В Международной заявке WO 2003/004028 (AKZO NOBEL N.V.) недавно описаны некоторые производные тетрагидрохинолина в качестве веществ, модулирующих FSHR, обладающих либо агонистическими, либо антагонистическими свойствами.
Миметики FSH с низкой молекулярной массой и с агонистическими свойствами описаны в Международной заявке WO 2000/08015 (Applied Research Systems ARS Holding N.V.); WO 2004/031182 (Applied Research Systems ARS Holding N.V.); WO 2002/09706 (Affymax Research Institute); WO 2005/087765 (Arena Pharmaceuticals, Inc); WO 2006/117368 (AKZO NOBEL N.V.); WO 2006/117370 (AKZO NOBEL N.V.); WO 2006/117371 (AKZO NOBEL N.V.) и в WO 2006/117023 (AKZO NOBEL N.V.).
Поэтому явно существует потребность в миметиках гормонов с низкой молекулярной массой, которые селективно активируют рецептор FSH.
Для этой цели в настоящем изобретении предложены производные 5,6-дигидропирроло[2,1-a]изохинолина и пирроло[2,1-a]изохинолина.
Некоторые 5,6-дигидропирроло[2,1-a]изохинолины, а также их ненасыщенные аналоги, пирроло[2,1-a]изохинолины, известны в литературе.
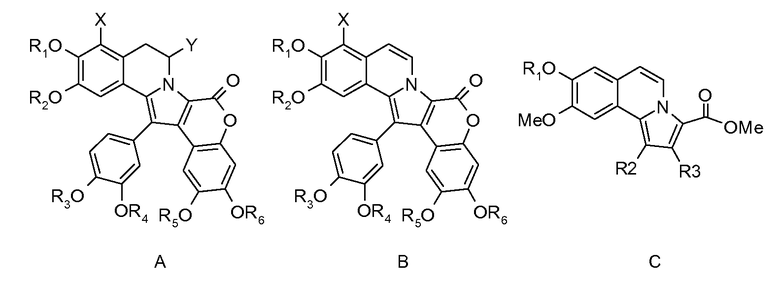
Ламелларины, семейство полиароматических пиррольных алкалоидов, некоторые из которых имеют структуру 5,6-дигидропирроло[2,1-a]изохинолина или пирроло[2,1-a]изохинолина (см. структуры А и В), рассматриваются в C. Bailly, Curr. Med. Chem. Anti-Cancer Agents, 4, 363-387 (2004) и Fan, H. et al Chem. Rev., 108, 264-287 (2008). Некоторые из этих соединений проявляют сильные цитотоксические активности в отношении опухолевых клеток in vitro.
Аналоги ламелларина D с открытой цепью, описанные в D. Pla et al., J. Med. Chem., 49, 3257 (2006), имеют общую формулу (С) и проявляют цитотоксичность в низком макромолекулярном диапазоне.
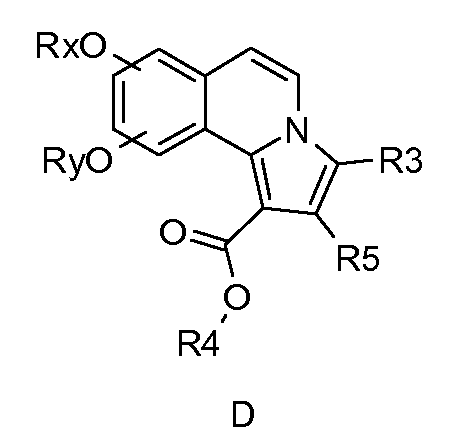
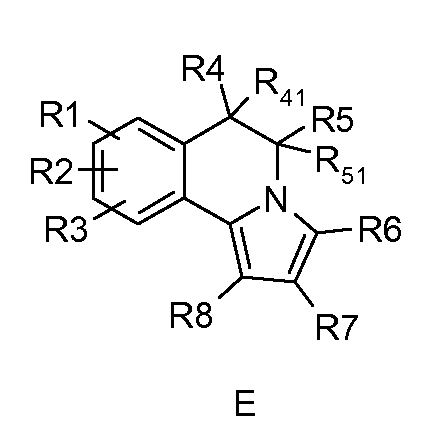
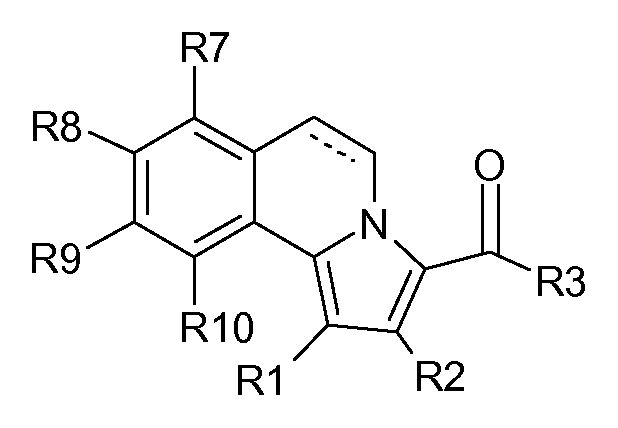
5,6-Дигидропирроло[2,1-a]изохинолины и пирроло[2,1-a]изохинолины формулы (D) и формулы (Е) описаны в WO 2006/089815; WO 2006/075012; WO 2005/002579; WO 2005/003129; WO 2005/003130; WO 2003/051877; WO 2003/014115; WO 2003/014116; WO 2003/014117 и WO 2002/48144. Указано, что эти соединения ингибируют фосфодиэстеразу 10А (PDE10A).
Настоящее изобретение относится к родственным соединениям согласно общей формуле I или их фармацевтически приемлемым солям.
Формула I
В этой формуле радикалы от R1 до R10 имеют следующие значения:
Связь в положении С5-С6 (пунктирная линия в формуле I) может быть либо насыщенной, либо ненасыщенной.
R1 представляет собой галоген, циано, (1-6С)алкил, (2-6C)алкенил, (2-6C)алкинил, (3-6C)циклоалкил, (5-6C)циклоалкенил или фенил или (1-5С)гетероарил, причем каждая из указанных фенильных и гетероарильных частей независимо необязательно замещена одним или несколькими заместителями, выбранными из R13.
R2 представляет собой H, циано, галоген, (1-4С)алкил, (1-4С)алкокси(1-4С)алкил, гидрокси(1-4С)алкил, формил, (1-4С)алкилкарбонил или C=N-OH, C=N-OCH3.
R3 представляет собой R15,R16-амино или
R3 представляет собой (1-6С)алкил, (3-6C)циклоалкил, (ди)[(1-4С)алкил]амино(1-4С)алкил, или
R3 представляет собой (2-6C)гетероциклоалкил(1-4С)алкил, (2-6C)гетероциклоалкильная часть которого необязательно может быть замещена (1-4С)алкилкарбонилом или (3-6C)циклоалкилкарбонилом, или
R3 представляет собой группу, выбранную из
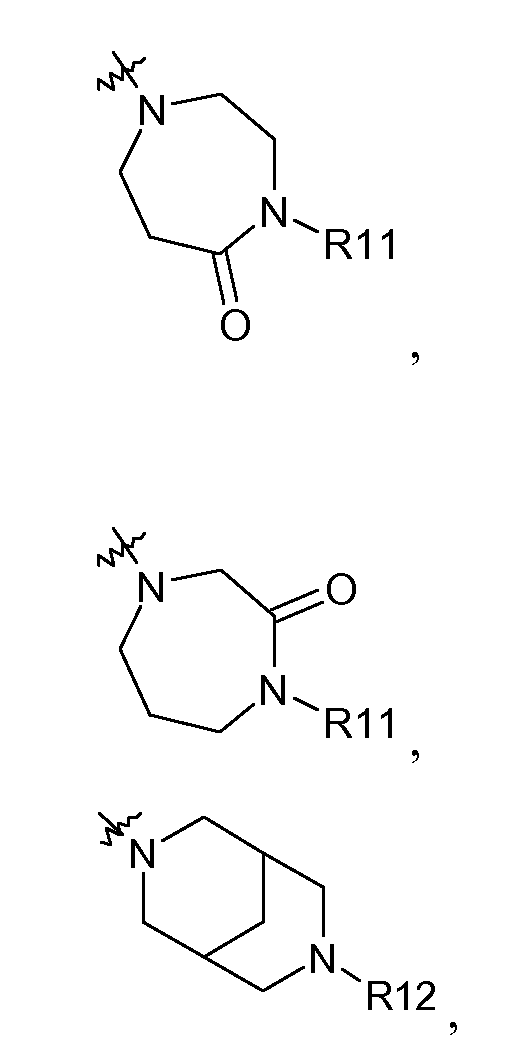
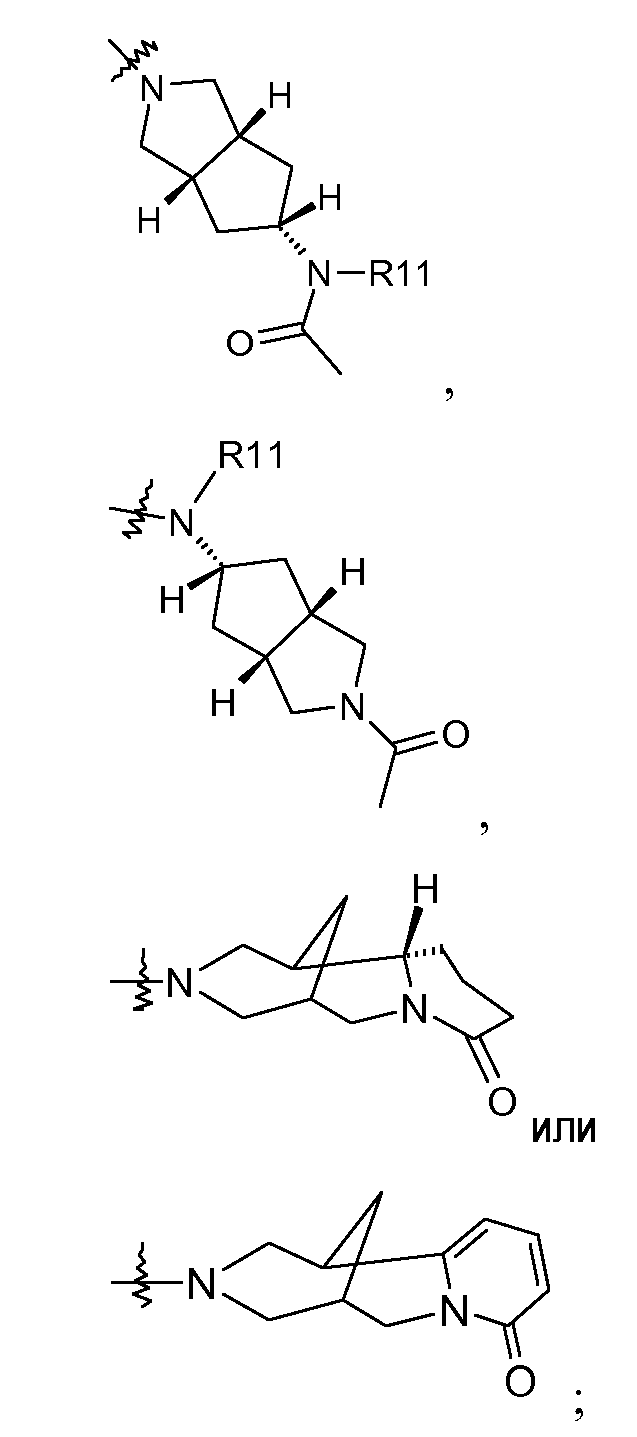
R7 представляет собой H, галоген или метил.
R8 представляет собой H, галоген, (1-4С)алкил, (1-4С)алкокси, (1-4С)алкокси(1-4С)алкил или гидрокси.
R9 представляет собой H, формил, галоген, гидрокси, амино, циано, нитро, (2-6C)алкинил, (3-6C)циклоалкокси, (2-6C)гетероциклоалкокси, (2-5C)гетероарилокси, (ди)[(1-4C)алкил]аминокарбокси, (1-6С)алкилкарбонил, (1-4C)алкоксикарбонил, (ди)[(1-4C)алкил]аминокарбонил, (2-6C)гетероциклоалкилкарбонил, (ди)[(1-4С)алкил]амино, (2-6C)гетероциклоалкилкарбониламино, (2-5C)гетероарилкарбониламино, (ди)[(1-4С)алкил]аминокарбониламино, (1-4C)алкоксикарбониламино, (ди)[(1-4C)алкил]аминосульфониламино, (1-4С)алкилсульфониламино, 1-имидазолидинил-2-он, 3-оксазолидинил-2-он или 1-пирролидинил-2-он, или
R9 представляет собой (1-6C)алкил, (1-6C)алкокси, (2-6C)алкенил, (1-6C)алкилкарбониламино или (2-6C)гетероциклоалкил, (2-5C)гетероариламинокарбонил, причем каждый из указанного алкила, алкокси, алкенила, гетероциклоалкила и гетероарила независимо необязательно замещен одним или несколькими заместителями, выбранными из R14,
или R9 представляет собой (1-5С)гетероарил, фенил или фенокси, причем каждый из указанного гетероарила, фенила и фенокси независимо необязательно замещен одним или несколькими заместителями, выбранными из R13.
R10 представляет собой H, метокси, галоген или метил.
Радикалы от R11 до R18, указываемые в одной из других групп R, имеют следующие значения:
R11 представляет собой H, (1-6С)алкил или (3-4C)алкенил.
R12 представляет собой (1-4С)алкилкарбонил или (3-6C)циклоалкилкарбонил, причем оба необязательно замещены одним или несколькими заместителями, выбранными из R13.
R13 представляет собой гидрокси, амино, галоген, нитро, трифторметил, циано, (1-4С)алкил, (1-4C)алкокси, (1-4С)алкилтио или (ди)[(1-4С)алкил]амино. В каждом из случаев R13 каждое значение для определенной группы может быть выбрано независимо.
R14 представляет собой гидрокси, амино, галоген, азидо, циано, (1-4С)алкил, (1-4С)алкокси, (1-4C)алкилтио, (ди)[(1-4С)алкил]амино, (3-6C)циклоалкил, (2-6C)гетероциклоалкил, (1-4C)алкилкарбониламино, (ди)[(1-4С)алкил]аминокарбониламино, (1-4C)алкилсульфониламино, (1-4С)алкоксикарбониламино, (1-4С)алкилкарбонил, (1-4C)алкоксикарбонил, (1-4С)алкилсульфокси, (2-6C)гетероциклоалкокси, (ди)[(1-4C)алкил]аминокарбонил, (1-4С)алкилсульфонил, (3-6C)циклоалкилкарбониламино или [(1-4С)алкил][(1-4С)алкилкарбонил]амино.
R15 и R16 в R3 независимо выбраны из H или (1-6С)алкила, (3-6C)циклоалкила, (2-6C)гетероциклоалкила или (ди)[(1-4С)алкил]амино, причем все необязательно замещены гидрокси, (1-4С)алкилом, (1-4C)алкокси, (1-4C)алкилкарбонилом, (1-4C)алкоксикарбонилом, (3-6C)циклоалкилкарбонилом, (ди)[(1-4С)алкил]амино, (ди)[(1-4C)алкил]аминокарбонилом или (ди)[(1-4C)алкокси(1-4С)алкил]амино.
Альтернативно, R15,R16-амино в R3 могут быть соединены с образованием (3-8C)гетероциклоалкильного кольца, где указанное кольцо может быть необязательно замещено R18.
В другом альтернативном случае, R15,R16-амино в R3 также могут быть соединены с образованием (4-8C)гетероциклоалкильного кольца или (4-6C)гетероциклоалкенильного кольца, причем оба кольца содержат один атом азота и каждое указанное кольцо независимо необязательно замещено одним или несколькими заместителями, выбранными из R17.
R17 и R18, указываемые в одной из других групп R имеют указанные ниже значения:
R17 представляет собой гидрокси, амино, галоген, (1-4C)алкил, (1-4C)алкокси, (ди)[(1-4C)алкил]амино, (1-4C)алкилкарбониламино, (ди)[(1-4C)алкил]аминокарбониламино, (1-4C)алкилсульфониламино, (1-4C)алкоксикарбониламино, (1-4C)алкилсульфокси, (3-6C)циклоалкилкарбониламино, [(1-4C)алкил][(1-4C)алкилкарбонил]амино или
R17 представляет собой фенил и (2-5C)гетероарил, оба из которых необязательно замещены одним или несколькими заместителями, выбранными из R13.
R18 представляет собой (1-4C)алкил, (3-6C)циклоалкил, (4-6C)циклоалкенилкарбонил, (ди)[(1-4C)алкил]аминокарбонил, (1-4C)алкилсульфонил, (ди)[(1-4C)алкил]аминосульфонил, (2-6C)гетероциклоалкилсульфонил, (2-5C)гетероарил, фенилкарбонил, (1-4C)алкилкарбонил, (3-6C)циклоалкилкарбонил, (2-5C)гетероарилкарбонил, фенил, фенилсульфонил, (2-5C)гетероарилсульфонил или (2-6C)гетероциклоалкилкарбонил, у которых (цикло)алкильная и (гетеро)арильная части могут быть замещены одним или несколькими заместителями, выбранными из R13.
Производные 5,6-дигидропирроло[2,1-a]изохинолина и пирроло[2,1-a]изохинолина согласно настоящему изобретению являются сильнодействующими активаторами рецептора FSH и их можно применять для таких же клинических целей, как и нативный FSH, поскольку они действуют подобно агонистам, имеют преимущество в том, что их можно получить синтетически, они могут проявлять измененные свойства стабильности и их можно вводить различным способом.
Так, агонисты FSH-рецептора настоящего изобретения можно применять для лечения нарушений фертильности, например, регулируемой овариальной стимуляции и процедур IVF.
Термин (1-4С)алкил, применяемый в определении, означает неразветвленную или разветвленную алкильную группу, имеющую 1-4 атома углерода и являющуюся метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, втор-бутилом и трет-бутилом.
Термин (1-6С)алкил означает неразветвленную или разветвленную алкильную группу, имеющую 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, трет-бутил, н-пентил и н-гексил. Предпочтительными являются (1-5С)алкильные группы, причем наиболее предпочтительным является (1-4С)алкил.
Термин (1-4С)алкилкарбонил означает алкилкарбонильную группу, алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (1-4С)алкилсульфонил означает алкилсульфонильную группу, алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (1-4С)алкилтио означает алкилтиогруппу, алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (1-4С)алкилсульфокси означает алкилсульфоксигруппу, алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (1-4С)алкилсульфониламино означает алкилсульфониламиногруппу, алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (1-6С)алкилкарбониламино означает алкилкарбониламиногруппу, алкильная группа которой содержит 1-6 атомов углерода и имеет такие же значения, как указаны ранее.
Термин (2-6С)алкенил означает неразветвленную или разветвленную алкенильную группу, имеющую 2-6 атомов углерода, такую как этенил, 2-бутенил и н-пентенил.
Термин (2-6С)алкинил означает неразветвленную или разветвленную алкинильную группу, имеющую 2-6 атомов углерода, такую как этинил, 2-бутинил и н-пентинил.
Термин (3-6С)циклоалкил означает циклоалкильную группу, имеющую 3-6 атомов углерода, такую как циклопропил, этилциклопропил, циклобутил, метилциклобутил, циклопентил и циклогексил.
Термин (3-6С)циклоалкилкарбонил означает циклоалкилкарбонильную группу, циклоалкильная группа которой содержит 3-6 атомов углерода и имеет такие же значения, как указаны ранее.
Термин (5-6С)циклоалкенил означает циклоалкенильную группу, имеющую 5-6 атомов углерода, такую как циклопентенил, метилциклопентенил и циклогексенил.
Термин (5-6С)циклоалкенилкарбонил означает циклоалкенилкарбонильную группу, циклоалкенильная группа которой содержит 5-6 атомов углерода и имеет такие же значения, как указаны ранее.
Термин (2-6С)гетероциклоалкил означает гетероциклоалкильную группу, имеющую 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, включающую 1-3 гетероатома, выбранные из N, O и/или S, которая может быть присоединена, если возможно, через атом азота или атом углерода. Предпочтительными гетероатомами являются N или О. Предпочтительным числом гетероатомов является один или два. Наиболее предпочтительными являются пиперидин-1-ил, морфолин-4-ил, пирролидин-1-ил и пиперазин-1-ил.
Термин (4-8C)гетероциклоалкил в R3 означает гетероциклоалкильную группу, имеющую 4-8 атомов углерода, предпочтительно 4-5 атомов углерода и включающую в себя один атом азота, причем такая группа присоединена через атом азота. Наиболее предпочтительными являются пиперидин-1-ил и пирролидин-1-ил.
Термин (3-8C)гетероциклоалкил в R3 означает гетероциклоалкильную группу, имеющую 3-8 атомов углерода, предпочтительно 4-5 атомов углерода, и включающую в себя 2-3 гетероатома, выбранные из N, O и/или S, причем такая группа может быть присоединена через атом азота, если возможно, или атом углерода. Предпочтительными гетероатомами являются N или О. Предпочтительным числом гетероатомов является два гетероатома, такие как N,N или N,O. Наиболее предпочтительным является [1,4]диазациклогептанил.
Термин (2-6C)гетероциклоалкокси означает гетероциклоалкильную группу, которая содержит 2-6 атомов углерода, имеет такие же значения, как указаны ранее, и присоединена через атом углерода к экзоциклическому атому кислорода.
Термин (2-6C)гетероциклоалкил(1-4C)алкил означает гетероциклоалкилалкильную группу, гетероциклоалкильная группа которой содержит 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и имеет такие же значения, как указаны ранее, и алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (2-6C)гетероциклоалкилкарбонил означает гетероциклоалкилкарбонильную группу, гетероциклоалкильная группа которой содержит 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и имеет такие же значения, как указаны ранее.
Термин (2-6C)гетероциклоалкилсульфонил означает гетероциклоалкилсульфонильную группу, гетероциклоалкильная группа которой содержит 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и имеет такие же значения, как указаны ранее.
Термин (2-6C)гетероциклоалкилкарбониламино означает гетероциклоалкилкарбониламиногруппу, гетероциклоалкильная группа которой содержит 2-6 атомов углерода, предпочтительно 3-5 атомов углерода, и имеет такие же значения, как указаны ранее.
Термин (4-6C)гетероциклоалкенил означает гетероциклоалкенильную группу, имеющую 4-6 атомов углерода, предпочтительно 3-5 атомов углерода, и включающую в себя 2-3 гетероатома, выбранные из N, O и/или S, причем такая группа может быть присоединена через атом азота, если возможно, или атом углерода. Предпочтительными гетероатомами являются N или О. Предпочтительное число гетероатомов один или два.
Термин (1-5C)гетероарил означает ароматическую группу, имеющую 1-5 атомов углерода и 1-4 гетероатома, выбранные из N, O и S, подобную имидазолилу, тиадиазолилу, пиридинилу, тиенилу, тетразолилу, оксазолилу, имидазолилу, пиразолилу или фурилу. Предпочтительное число гетероатомов один или два. Предпочтительными гетероарильными группами являются тиенил, оксазолил, имидазолил, пиразолил, пиримидинил, пиразинил, фурил и пиридинил. Наиболее предпочтительными являются тиенил, фурил и пиридинил. (1-5C)гетероарильная группа может быть присоединена через атом углерода или, если возможно, атом азота.
Термин (2-5C)гетероарил означает ароматическую группу, имеющую 2-5 атомов углерода и 1-3 гетероатома, выбранные из N, O и S, подобную имидазолилу, тиадиазолилу, пиридинилу, тиенилу или фурилу. Предпочтительными гетероарильными группами являются тиенил, пиримидинил, пиразинил, фурил и пиридинил. (2-5C)гетероарильная группа может быть присоединена через атом углерода или, если возможно, атом азота.
Термин (2-5C)гетероарилкарбонил означает гетероарилкарбонильную группу, гетероарильная группа которой содержит 2-5 атомов углерода и имеет такие же значения и предпочтения, как указано ранее.
Термин (2-5C)гетероариламинокарбонил означает гетероариламинокарбонильную группу, гетероарильная группа которой содержит 2-5 атомов углерода и имеет такие же значения и предпочтения, как указано ранее.
Термин (2-5C)гетероарилсульфонил означает гетероарилсульфонильную группу, гетероарильная группа которой содержит 2-5 атомов углерода и имеет такие же значения и предпочтения, как указано ранее.
Термин (2-5C)гетероарилокси означает гетероарилоксигруппу, гетероарильная группа которой содержит 2-5 атомов углерода и имеет такие же значения и предпочтения, как указано ранее, и присоединена через атом углерода к экзоциклическому атому кислорода.
Термин (1-4C)алкокси означает алкоксигруппу, имеющую 1-4 атома углерода, причем алкильная часть имеет такие же значения, как ранее указано. (1-3C)Алкоксигруппы являются предпочтительными.
Термин (1-4C)алкоксикарбонил означает алкоксикарбонильную группу, алкоксигруппа которой содержит 1-4 атома углерода и имеет такие же значения, как ранее указано. (1-2C)Алкоксикарбонильные группы являются предпочтительными.
Термин (1-4C)алкокси(1-4C)алкил означает алкоксиалкильную группу, алкоксигруппа которой содержит 1-4 атома углерода, имеет такие же значения, как указано ранее, присоединена к алкильной группе, содержащей 1-4 атома углерода и имеющей такие же значения, как указано ранее.
Термин (1-4C)алкоксикарбониламино означает алкоксикарбониламиногруппу, алкоксигруппа которой содержит 1-4 атома углерода и имеет такие же значения, как указано ранее.
Термин гидрокси(1-4C)алкил, применяемый в контексте, означает гидроксиалкильную группу, алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (ди)[(1-4C)алкил]амино, применяемый в контексте, означает аминогруппу, монозамещенную или дизамещенную алкильными группами, каждая из которых содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (ди)[(1-4C)алкил]аминокарбонил означает (ди)алкиламинокарбонильную группу, каждая алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (ди)[(1-4C)алкил]аминосульфонил означает (ди)алкиламиносульфонильную группу, каждая алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (ди)[(1-4C)алкил]аминокарбонилокси означает (ди)алкиламинокарбонилоксигруппу, каждая алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указаны ранее.
Термин (ди)[(1-4C)алкил]аминокарбониламино означает (ди)алкиламинокарбониламиногруппу, каждая алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указано ранее.
Термин (ди)(1-4C)алкиламино(1-4C)алкил, применяемый в контексте, означает (ди)алкиламиногруппу, каждая алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указано ранее, и которая соединена через аминогруппу с алкильной группой, которая содержит 1-4 атома углерода и имеет такие же значения, как указано ранее.
Термин (ди)[(1-4C)алкил]аминосульфониламино означает (ди)алкиламиносульфониламиногруппу, каждая алкильная группа которой содержит 1-4 атома углерода и имеет такие же значения, как указано ранее.
Термин галоген означает фтор, хлор, бром или иод.
Термин “замещенный” означает, что один или несколько атомов водорода у указанного атома заменены заместителем, выбранным из указанной группы, при условии, что нормальная валентность указанного атома не превышается в существующих случаях и что замещение приводит к образованию стабильного соединения. Комбинации заместителей и/или символов допустимы, только если такие комбинации приводят к образованию стабильных соединений. Термин “стабильное соединение” или “стабильная структура” означает соединение, которое достаточно устойчиво для сохранения его при выделении до применимой степени чистоты из реакционной смеси и изготовления из него эффективного терапевтического агента.
Термин “необязательно замещенный” означает необязательное замещение определенными группами, радикалами или частями.
В указанных выше определениях с многофункциональными группами местом присоединения является последняя группа.
Термин фармацевтически приемлемая соль означает такие соли, которые являются, в пределах объема медицинской оценки, подходящими для применения в контакте с тканями человека и низших животных без излишней токсичности, раздражения, аллергической реакции и тому подобное, и имеют приемлемое отношение польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Их можно получить во время конечного выделения и очистки соединений изобретения или отдельно реакцией функциональной группы свободного основания с подходящей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное. Кислотная функциональная группа может реагировать с органическим или неорганическим основанием, подобным гидроксиду натрия, гидроксиду калия или гидроксиду лития.
В одном аспекте изобретение относится к соединениям формулы I, в которой С5-С6-связь является насыщенной.
Изобретение относится также к соединениям формулы I, в которой R1 представляет собой (1-5С)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13.
В другом аспекте изобретение относится к соединениям формулы I, в которой R2 представляет собой H, циано, галоген, (1-4C)алкокси(1-4C)алкил или гидрокси(1-4C)алкил.
Еще в одном аспекте изобретение относится к соединениям формулы I, в которой R2 представляет собой H.
В другом аспекте изобретение относится к соединениям, у которых R3 представляет собой R15,R16-амино или
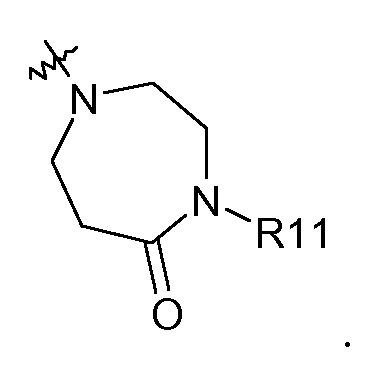
В другом аспекте изобретение относится к соединениям, у которых R3 представляет собой R15,R16-амино.
Еще в одном аспекте изобретение относится к соединениям формулы I, у которых R7 представляет собой Н.
Изобретение относится также к соединениям, у которых R8 представляет собой (1-4C)алкокси или гидрокси.
В другом аспекте изобретение относится к соединениям формулы I, у которых R9 представляет собой галоген, циано, нитро, (2-6C)алкинил, (3-6C)циклоалкокси, (2-5C)гетероциклоалкокси, (2-5C)гетероарилокси, (ди)[(1-4C)алкил]аминокарбонил, (2-6C)гетероциклоалкилкарбонил или (ди)[(1-4C)алкил]амино. R9 может быть также (1-6C)алкилом, (1-6C)алкокси, (2-6C)алкенилом, (1-6C)алкилкарбониламино или (2-5C)гетероариламинокарбонилом. Эти все последние группы могут быть независимо необязательно замещены одним или несколькими заместителями, выбранными из R14. Альтернативно, R9 может быть (1-5С)гетероарилом или фенокси, необязательно замещенным одним или несколькими заместителями, выбранными из R13.
Еще в одном аспекте изобретение относится к соединениям формулы I, у которых R9 представляет собой галоген, циано, нитро, (2-6C)алкинил или (ди)[(1-4C)алкил]амино или R9 представляет собой (1-6C)алкил, (1-6C)алкокси, (2-6C)алкенил или (1-6C)алкилкарбониламино, причем каждая из этих групп независимо необязательно замещена одним или несколькими заместителями, выбранными из R14, или
R9 представляет собой (1-5C)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13.
В другом аспекте изобретение относится к соединениям формулы I, в которой R9 представляет собой (2-6C)алкинил или в которой R9 представляет собой (1-6C)алкил, (1-6C)алкокси, (2-6C)алкенил или (1-6C)алкилкарбониламино, причем каждая из этих групп независимо необязательно замещена одним или несколькими заместителями, выбранными из R14, или в которой R9 представляет собой (1-5C)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13.
В другом аспекте изобретение относится к соединениям формулы I, в которой R10 представляет собой H.
В следующем аспекте изобретение относится к соединениям формулы I, в которой R1 представляет собой (1-5C)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13, R2 представляет собой H, R3 представляет собой R15,R16-амино, R7 представляет собой H, R8 представляет собой (1-4C)алкокси и R10 представляет собой H.
В еще одном аспекте изобретение относится к соединениям формулы I, в которой R14 представляет собой (2-6C)гетероциклоалкил, гидрокси, (1-4C)алкокси или (ди)[(1-4C)алкил]амино.
В еще одном аспекте изобретение относится к соединениям формулы I, в которой R15 и R16 могут быть независимо выбраны из (1-6C)алкила.
В другом аспекте изобретение относится к соединениям формулы I, в которой R3 представляет собой 1,4-диазациклогептан-1-ил, необязательно замещенный (1-4C)алкилкарбонилом или (3-6C)циклоалкилкарбонилом.
В еще одном аспекте изобретение относится к соединениям формулы I, в которой R15 представляет собой метил и R16 представляет собой трет-бутил.
В другом аспекте изобретение относится к соединениям формулы I, в которой R3 представляет собой 2,2-диметилпирролидин-1-ил.
Изобретение относится также к таким соединениям, у которых все конкретные определения для радикалов от R1 до R18 в различных аспектах изобретения, указываемые в контексте выше, имеют место в любой комбинации в пределах определения производного (дигидро)пирроло[2,1-a]изохинолина формулы I.
Все соединения изобретения имеют ЕС50 меньше, чем 10 мкМ.
В другом аспекте изобретение относится к соединениям формулы I, которые имеют ЕС50 меньше, чем 100 нМ. Еще в одном аспекте изобретение относится к соединениям формулы I, которые имеют ЕС50 10 нМ или меньше.
Изобретение относится также к соединениям, описанным в примерах 1-4, 7c, 7d, 8, 10, 11, 12a, 12b, 14a, 14d, 16, 20, 21, 36, 39-43, 51, 55, 58b, 58c, 59, 61-62, 64, 65d, 65f, 69, 70d, 81-84, 85b, 91a, 91d, 92-94, 96-98, 100, 101, 104, 111a, 111b, 121a, 121b, 122 и 123.
Еще в одном аспекте изобретение относится к соединениям, описанным в примерах 1, 2, 7d, 14a, 58b, 91d, 100 и 123.
Термин EC50 означает концентрацию испытуемого соединения, которая проявляет полумаксимальную (50%) стимуляцию по сравнению с максимально достижимым действием соединения. Величины можно определять, например, в клеточной линии, трансфицированной геном рецептора FSH и котрансфицированной цАМФ-чувствительным элементом/промотором, регулирующим экспрессию репортерного гена. Величины можно определять с применением программного обеспечения MathIQ (version 2.0, ID Business Solutions Limited).
Из изобретения исключено соединение 3-ацетилпирроло[2,1-a]изохинолин-1-карбонитрил.
Отказ от права имеется в описаниях в базе данных СА, регистрационный № 1994:655585.
Подходящие способы получения производных 5,6-дигидропирроло[2,1-a]изохинолина и пирроло[2,1-a]изохинолина указаны ниже.
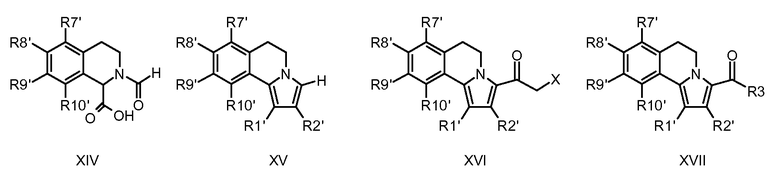
5,6-Дигидропирроло[2,1-a]изохинолины известны в литературе. Химические подходы к конкретным аналогам включают в себя общие синтезы, начинающиеся со сложноэфирных производных пиррола с последующими последовательными реакциями бромирования/опосредуемого металлорганическим соединением арилирования. Другие синтетические способы основаны на химическом синтезе типа Пикте-Шпенглера, приводящем к замещенным 1-метилентетрагидроизохинолинам, с последующей конденсацией типа Михаэля с получением требуемых производных дигидропирролоизохинолина или последующими реакциями 1,3-диполярного циклоприсоединения. В одном сообщении описывается синтез некоторых дигидропирролоизохинолинов посредством циклоприсоединения ацетиленов к N-оксидам 3,4-дигидроизохинолинов с последующей термической перегруппировкой образованных промежуточных Δ4-изоксазолинов с получением наиболее родственного соединения (см. ниже), этилового эфира 1-фенил-8,9-диметокси-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоновой кислоты.
См. подходящую для этого литературу: M. Alvarez et al., Tetrahedron Lett., 46, 2041 (2005); M. Alvarez et al., J. Org. Chem., 70, 8231 (2005); S. Handy, J. Org. Chem., 69, 2362 (2004); M. Vennemann et al., (Altana Pharma A.G) WO 05/003130; Niewoehner et al. (Bayer AG), WO 02/48144; Banwell et al. WO 99/67250, W. Anderson et al., J. Med. Chem., 27, 1321 (1984); S. Eguchi et al., Tetrahedron 52, 12049 (1996).
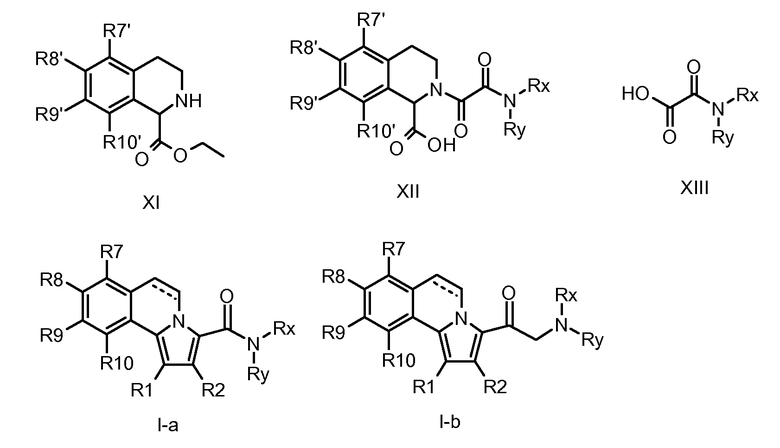
В контексте авторами описаны до настоящего времени неизвестные соединения общей формулы I и, более конкретно, 5,6-дигидропирроло[2,1-а]изохинолин-3-карбонамиды, 1-(5,6-дигидропирроло[2,1-а]изохинолин-3-ил)алкил-1-оны, циклоалкил-(5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метаноны и родственные им 2-амино-1-(5,6-дигидропирроло[2,1-а]изохинолин-3-ил)этаноны, а также их ненасыщенные аналоги, пирроло[2,1-а]изохинолин-3-карбонамиды, 1-(пирроло[2,1-а]изохинолин-3-ил)алкил-1-оны, циклоалкил(пирроло[2,1-а]изохинолин-3-ил)метаноны и 2-амино-1-(пирроло[2,1-а]изохинолин-3-ил)этаноны (формулы I с R3 = алкил или циклоалкил, формул I-a и I-b).
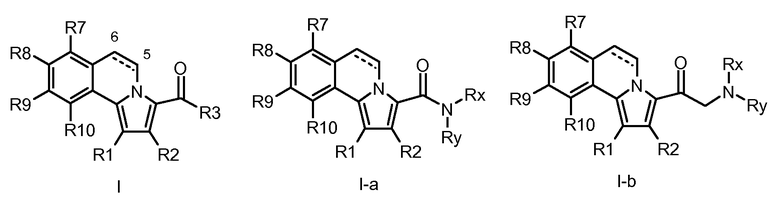
Авторы изобретения имели целью сделать доступными новые, определенным образом замещенные (5,6-дигидропирроло[2,1-а]изохинолины посредством реакций 1,3-диполярного циклоприсоединения ацетиленов с реакционноспособными мухноновыми промежуточными продуктами, полученными из тетрагидроизохинолино-1-карбоновых кислот (III). Основы этих химических реакций описаны R. Huisgen et al., Chem. Ber., 103, 2611 (1970) и дополнительно описаны в примерах F. Hershenson, J. Org. Chem., 40, 740 (1975).
Для своей цели (т.е. для введения карбонильной группы в положение С-3) авторы эту методологию модифицировали проведением реакций 1,3-диполярного циклоприсоединения с оксалатами (IV), получая непосредственно требуемые эфиры 3-карбоновых кислот (V), как предшественников, например, для амидов (I-a). Промежуточные тетрагидроизохинолин-1-карбоновые кислоты общей формулы III (необходимы для получения оксалатов IV) синтезировали замыканием цикла типа реакции Bishler-Napieralski из подходящим образом замещенных фенетиламинов (II) и глиоксиловой кислоты согласно опубликованной методике (S. Bajusz et al., WO 93/12091).
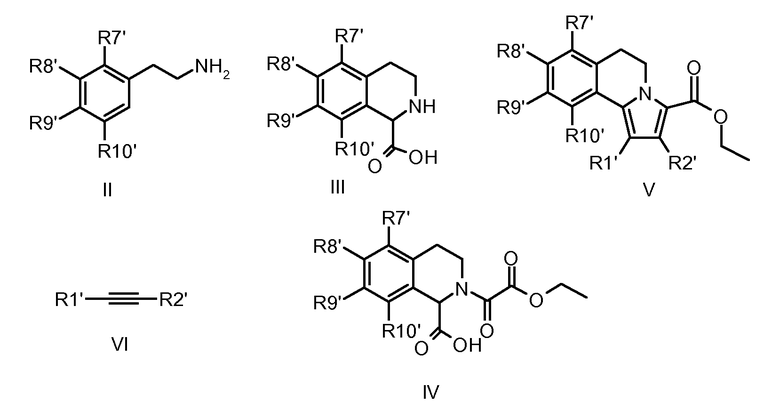
Для синтеза определенных соединений I-a и I-b (см. ниже) применяли общий подход, указанный выше, используя специально подобранные функционализированные промежуточные продукты. Это означает, что в зависимости от требуемых заместителей R1-R10 (где число у R относится к нумерации атома в структуре), требуемые заместители либо вводят в подходящее место в начале синтеза (т.е. R1 = R1', R2 = R2' и т.д.), либо вводят на любой стадии, считающейся подходящей, в ходе синтеза продуктов общей формулы I. В этом случае сначала вводят подходящие альтернативные функциональные группы, обозначенные как R1'-R10', которые можно превратить в требуемые R1-R10 посредством одной или нескольких дополнительных операций, причем R1-R10 имеют такие же значения, как указаны ранее.
Заместители ароматического кольца (R7-R10) часто можно ввести уже в фенетиламиновые предшественники (II), которые содержат эти заместители в неизмененном виде на протяжении дальнейшего синтетического процесса. Подходящие фенетиламины общей структуры II либо являются коммерчески доступными, либо их легко получают посредством хлорметилирования подходящим образом замещенных бензолов с последующим превращением в цианометилпроизводные и восстановлением нитрильной функциональной группы с получением требуемых фенетиламинов. Фенетиламины (II) можно получить также посредством реакции Хенри подходящим образом замещенных ароматических альдегидов с нитроалканами с последующим восстановлением продуктов реакции гидридными реагентами (LiAlH4, боранами и т.д.) согласно методикам, хорошо документированным в литературе. Альтернативно, требуемые R7-R10 можно ввести через латентные функциональные группы (указываемые выше), которые далее превращают в процессе синтетической процедуры (см. ниже).
Последующее превращение указанных фенетиламинов (II) в промежуточные продукты, 1,2,3,4-тетрагидроизохинолинкарбоновые кислоты (III), эффективно выполняют трехстадийной методикой сначала превращением фенетиламинов (II) в карбаматные производные (VII) и затем реакцией с глиоксиловой кислотой (приводящей к соединениям VIII) с последующим удалением карбаматной защитной группы. Здесь предпочтительно применяли аллоксикарбонильную (Alloc) группу (см. VII-a→VIII-a→III) вследствие легкости ее удаления. Способы Alloc-защиты и удаления такой защитной группы хорошо известны специалисту в данной области. В случаях, когда конечное удаление защитной группы в условиях восстановления было неподходящим, эффективными были также альтернативные карбаматные защитные группы, подобные 9-флуоренилметоксикарбонилу (Fmoc).
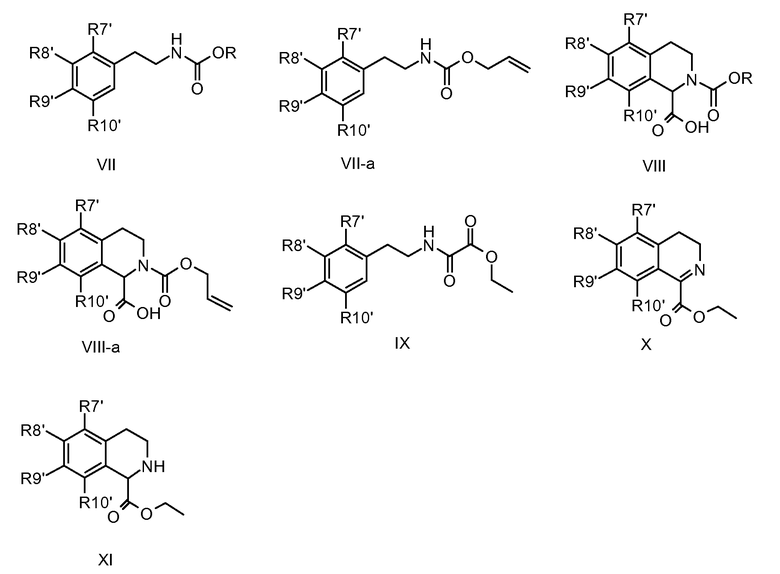
Альтернативный подход к образованию тетрагидроизохинолиновой системы, присутствующей в соединениях общей формулы III, содержит реакцию фенетиламинов (II) с этилоксалилхлоридом с получением оксаламидов IX, которые можно подвергнуть циклизации для превращения в дигидроизохинолины (Х) при обработке сильными кислотами в условиях дегидратации, например, метансульфоновой кислотой и пентаоксидом фосфора. Производные общей формулы Х можно затем восстановить в соответствующие тетрагидроизохинолины (XI), например восстановлением цианоборогидридом натрия в кислотных условиях. Омыление тетрагидрохинолинов (XI) в стандартных условиях, хорошо известное специалистам в данной области, может обеспечить получение производных общей формулы III.
Для получения соединений общей формулы I (или V) с разнообразными заместителями R7-R10 на фенильной части в качестве защищенных функциональных групп (R7'-R10') могут служить атомы галогена (предпочтительно брома и иода), которые превращают на последних стадиях синтеза в различные целевые заместители (R7-R10), например, посредством литиирования с последующей реакцией с электрофильными реагентами для превращения в карбоксилаты, карбоксальдегиды (служащие в качестве предшественников для олефинов путем последующей реакции Виттига или для аминов путем восстановительного аминирования) или гидроксиметильные группы (и полученные из них простые эфиры и сложные эфиры).
Альтернативно, арилгалогены (R7'-R10') можно применять в качестве реакционноспособных субстратов для хорошо известных металлорганических реакций, подобных реакциям Ульмана, Сузуки, Стилла, Соногашира, Хека и Бухвальда, для образования новой углерод-углеродной одинарной, двойной и тройной связей, связей углерод-азот (производные анилина) и нитрилов. Они, в свою очередь, могут служить в качестве субстратов для дальнейшей функционализации, подобной моно- и дигидроксилированию (из алкенов) или превращения в триазолы (из ацетиленов; “химия защелки”) и в тетразолы (из нитрилов).
Удаление защиты у фенольных ОН-групп, например, селективным расщеплением простых изопропоксиэфиров (R7'-R10') электрофильными реагентами, подобными BCl3, с последующим превращением в реакционноспособные сульфонатные эфиры (например, трифлаты) позволяет соединять гетероциклические структуры посредством гетероарилбороновых кислот или оловоорганических соединений, аналогично вышеуказанным протоколам, начинающимся с галогенированных арильных групп. Превращение арилгалогенов (R7'-R10') в бороновые кислоты (либо посредством литиирования, либо опосредуемого переходным металлом боронирования) с последующим окислением обеспечивает способ введения альтернативных кислородсодержащих функциональных групп, хорошо известный специалисту в данной области. Фенольные функциональные группы, появляющиеся после удаления защитных групп простых алкоксиэфиров, можно также применять для получения арилариловых и арилгетероариловых простых эфиров посредством Cu-опосредуемого сочетания с бороновыми кислотами и (гетеро)арилгалогенидами. Значение и применение этих реакций достаточно объясняется в некоторых выбранных литературных источниках, указанных ниже.
Для недавних ссылок см., например, A. Suzuki, Chem. Comm., 4759 (2005); Bach et al., Tetrahedron, 61, 2245 (2005); R. Rossi et al., Synthesis, 2419 (2004).
Трифлаты фенольных групп (R7'-R10') можно применять (аналогично тому, как описано для арилбромидов, см. ниже) для введения функциональных амино- и амидогрупп (R7-R10) в кольцо бензола опосредуемым палладием сочетанием любых карбаматов, карбонамидов, иминов и силиламидов способами, известными как реакции аминирования Бухвальда-Хартвига. Альтернативно, нитрогруппы, введенные на ранней стадии синтеза (R7'-R10'), позволяют получить целевые молекулы общей структуры I, включающие аминные и амидные функциональные группы.
Для “сборки” 5,6-дигидропирроло[2,1-a]изохинолинового скелета посредством реакции 1,3-диполярного циклоприсоединения (IV→V) в качестве реагентов требуются ацетилены (VI). Эта стадия предоставляет возможность введения требуемых С-1- и С-2-заместителей.
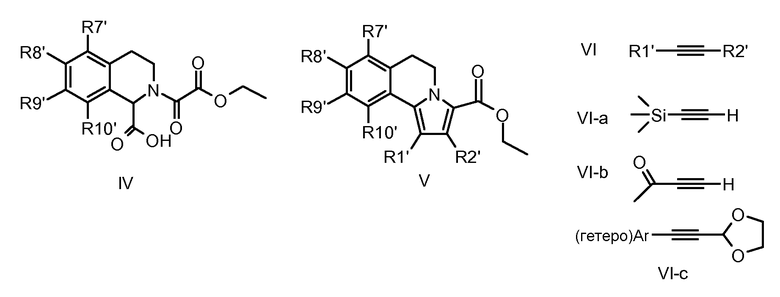
Эти реакции обычно можно проводить с хорошей региоселективностью, при которой наиболее объемный заместитель имеет предпочтение для положения 1 конечной структуры, если R1'/R2' являются достаточно разными. Следовательно, доступным является диапазон продуктов общей структуры V с R1' = (гетеро)арил (подобный 2-тиенилу, 3-тиенилу, 3-пиридилу и т.д.) и R2' = Н. Если R2' = Н, последующая реакция с электрофильными реагентами, подобными N-хлорсукцинимиду (NCS) или хлорсульфонилизоцианату, позволяет ввести заместители Cl или CN в С2-положение скелета (V, R2' = CN или Cl).
Применение силилированного ацетилена (VI-a) обеспечивает получение С1-силилированных 5,6-дигидропирроло[2,1-a]изохинолинов (V, R1' = триметилсилил), которые при обработке кислотой и бромировании дают 1-бромпроизводные (V, R1' = Br). Это позволяет синтезировать различные 1-замещенные аналоги общей формулы V, которые были недоступны при применении ранее описанного 1,3-диполярного циклоприсоединения; например, вследствие малой доступности подходящих ацетиленов VI или несовместимости некоторых субстратов с условиями реакции, например, при получении дигидропирролоизохинолинов V, у которых R1' = циано, этинил или этенил. В аналогичном способе, описываемом для превращения заместителей R7'-R10' в R7-R10 (см. ниже), обработка 1-бром-5,6-дигидропирроло[2,1-a]изохинолинов либо (гетеро)арилбор-, либо (гетеро)арилоловопроизводными дает 1-(гетеро)арилированные 5,6-дигидропирроло[2,1-a]изохинолины (подобные 1-оксазолил-, 1-тиазолил- и 1-пиридилпроизводным).
Гетероциклические заместители у R1, которые трудно получить способами, описанными выше, можно также ввести образованием требуемого гетероцикла из подходящей функциональной группы у С-1. Например, 1-циано-5,6-дигидропирроло[2,1-a]изохинолины (V, R1' = CN), полученные цианидным замещением соответствующих 1-бромидов (V, R1' = Br), можно применять в качестве исходных соединений для получения, например, 1-тетразолил-5,6-дигидропирроло[2,1-a]изохинолинов конденсацией с силилазидами. Аналогично этому, 1-этинил-5,6-дигидропирроло[2,1-a]изохинолины (V, R1' = этинил) можно превратить в 1-триазоло-5,6-дигидропирроло[2,1-a]изохинолины реакцией с триметилсилилазидом. 1-Ацетил-5,6-дигидропирроло[2,1-a]изохинолины (V-b), полученные реакцией IV с ацетиленами VI-b, можно затем превратить, например, в 1-тиадиазолопирроло[2,1-a]изохинолины (V, R1' = 5-тиадиазолил) реакцией с тионилхлоридом и гидразоном.
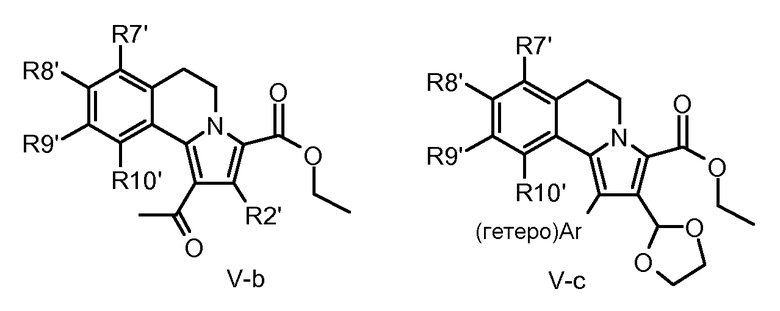
Если применяют ацетилены, снабженные защищенной альдегидной функциональной группой (например, VI-c), получают соответствующие 5,6-дигидропирроло[2,1-a]изохинолины (V-c), которые можно далее обработать для получения производных общей структуры I, имеющих заместители у С-2, подобные оксимным, альдегидным, аминоалкильным, алкенильным, (алкокси, гидрокси)алкильным и алкинильным группам.
Превращение карбоксилатного эфира у С-3 в 5,6-дигидропирроло[2,1-a]изохинолинах (V) в соответствующие амиды I-a можно проводить стандартной двухстадийной методикой, хорошо известной специалисту в данной области, содержащей омыление, например, водным NaOH в подходящем растворителе, таком как диоксан или ТГФ, с получением соответствующих 3-карбоновых кислот и последующую реакцию их с требуемым амином в присутствии (коммерчески доступного) агента сочетания пептидов, подобного DCC, TBTU, HATU, EEDC и т.д. Альтернативно, этиловые сложные эфиры общей формулы V можно превратить непосредственно в соответствующие амиды I-a с помощью металлпроизводных аминов (в литературе реакция известна как реакция Бодру), но можно также применять варианты; см., например, Bassett et al., J. Chem. Soc, 1188 (1954; Singh et al., Tetrahedron Lett., 321 (1971)). Стадия, на которой осуществляют превращение сложного эфира в амид у С-3, не обязательно является последней стадией синтеза, но считается, что она может быть разумно осуществима в любой момент во время описанных превращений.
Альтернативно, амидную функциональную группу у С-3 в соединениях общей формулы I-a можно ввести уже на стадии тетрагидроизохинолинового промежуточного продукта. Например, реакция соединений общей формулы XI с подходящим образом функционализированными моноамидированными производными щавелевой кислоты (XIII) в стандартных условиях сочетания пептидов, хорошо известная специалисту в данной области (см. выше), с последующим омылением оставшейся части этилового сложного эфира, может дать оксаламиды общей структуры XII. Требуемые амиды щавелевой кислоты общей формулы XIII можно получить реакцией подходящих аминов с этилоксалилхлоридом и последующим омылением этилового сложного эфира в стандартных условиях. Последующее 1,3-диполярное циклоприсоединение оксаламидов XII в присутствии подходящим образом функционализированных ацетиленов общей формулы VI, как описано выше, можно обеспечить доступ к требуемым производным общей формулы I-a.
Создание дополнительной двойной связи между С-5 и С-6 (сравни превращение 5,6-дигидропирроло[2,1-a]изохинолинов в их ароматические аналоги, пирроло[2,1-a]изохинолины) можно обычно достичь при помощи реагентов, которые выполняют дегидрирование/ароматизацию и являются известными специалисту в данной области. Для этой цели предпочтительно применяли 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ).
Для синтеза 3-аминометилкетонов общей структуры I-b, фактически С1-гомологов ранее указанных амидов I-a, общий применяемый подход был весьма сходным. Скелет 5,6-дигидропирроло[2,1-a]изохинолина, присутствующий в соединениях общей формулы XV (в этом случае R3 = H вместо карбоксилата), является достижимым реакцией N-формилзамещенных тетрагидроизохинолин-1-карбоновых кислот (XVI) с уксусным ангидридом и подходящим образом защищенными ацетиленами общей формулы VI. Для введения требуемой функциональной группы в положение С-3 сначала проводят ацилирование по реакции Фриделя-Крафтса подходящим образом функционализированными производными карбоновых кислот, приводящее к получению соединений общей формулы XVI (X = реакционноспособная группа, подобная галогену) или соединений общей формулы XVII (R3 = алкил или циклоалкил). Примеры таких реакций с производными пирролов достаточно документированы в литературе; см. M. Kakushima, et al., J. Org. Chem., 48, 3214 (1983); R.M. Silverstein, et al., J. Org. Chem., 20, 668 (1955). Последующие реакции этанонов XVI с подходящими аминами могут дать соединения общей структуры I-b.
Соединения изобретения могут образовывать гидраты или сольваты. Специалистам в данной области известно, что соединения с зарядами образуют гидратированные соединения при лиофилизации водой, или образуют сольватированные соединения, когда концентрируют в растворе с подходящим органическим растворителем. Соединения данного изобретения включают в себя пролекарства, гидраты или сольваты перечисленных соединений.
Обсуждение пролекарств представлено в публикациях T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems (1987) 14 of the A.C.S. Symposium Series, and in Bioreversible Carriers in Drug Design, (1987) Edward B. Roche, ed., American Pharmaceutical Association и Pergamon Press. Термин “пролекарство” означает соединение (например, предшественник лекарственного средства), которое превращается in vivo с образованием соединения формулы (I), или фармацевтически приемлемой соли, гидрата или сольвата такого соединения. Превращение может происходить по различным механизмам (например, метаболическими или химическими процессами), таким как, например, гидролиз в крови. Обсуждение применения пролекарств представлено в публикациях T. Higuchi and V. Stella, “Pro-drugs as Novel Delivery Systems”, Vol. 14 of the A.C.S. Symposium Series, and in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association и Pergamon Press, 1987.
Одно или несколько соединений изобретения могут находиться в несольватированных, а также сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное, и имеется в виду, что изобретение включает в себя как сольватированные, так и несольватированные формы. ”Сольват” означает физическую ассоциацию соединения данного изобретения с одной или несколькими молекулами растворителя. Эта физическая ассоциация включает в себя ассоциации с изменяющимися степенями ионного или ковалентного связывания, включая водородное связывание. В некоторых случаях сольват можно выделить, например, когда в кристаллическую решетку кристаллического твердого вещества включена одна или несколько молекул растворителя. Термин “сольват” включает в себя как сольваты в фазе раствора, так и выделяемые сольваты. Неограничивающие примеры подходящих сольватов включают в себя этаноляты, метаноляты и тому подобное. “Гидрат” является сольватом, у которого молекулой растворителя является Н2О.
Соединения формулы I могут образовывать соли, которые также находятся в пределах объема данного изобретения. Предполагается, что ссылка на соединение формулы I в контексте включает в себя ссылку на его соли, если не оговорено иначе. Термин “соль(и)”, применяемый в контексте, означает соли с кислотами, образованные с неорганическими и/или органическими кислотами, а также соли оснований, образованные с неорганическими и/или органическими основаниями. Кроме того, когда соединение формулы I содержит как основную часть, такую как, но без ограничения указанным, пиридин или имидазол, так и кислотную часть, такую как, но без ограничения указанным, карбоновую кислоту, могут быть образованы цвиттерионы (“внутренние соли”) и цвиттерионы включены в применяемый в контексте термин “соль(и)”. Фармацевтически приемлемые (т.е. нетоксичные, физиологически приемлемые) соли являются предпочтительными, хотя другие соли также являются применимыми. Соли соединений формулы I можно получить, например, реакцией соединения формулы I с количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как среда, в которой соль осаждается, или в водной среде с последующей лиофилизацией.
Соединения формулы (I) могут содержать асимметричные или хиральные центры и поэтому могут существовать в разных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений формулы (I), а также их смеси, включая рацемические смеси, образуют часть настоящего изобретения. Кроме того, настоящее изобретение включает в себя все геометрические и позиционные (изомеры положения) изомеры. Например, если соединение формулы (I) включает в себя двойную связь или конденсированное кольцо, в объем изобретения включены как цис-, так и транс-формы, а также их смеси.
Диастереомерные смеси можно разделять на их индивидуальные диастереомеры на основе их физико-химических различий способами, хорошо известными специалисту в данной области, такими как, например, хроматография и/или фракционная кристаллизация. Энантиомеры можно разделять превращением энантиомерной смеси в диастереомерную смесь реакцией с подходящим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделением диастереомеров и превращением (например, гидролизом) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Кроме того, некоторые соединения формулы (I) могут быть атропизомерами (например, замещенные биарилы) и рассматриваются как часть данного изобретения. Энантиомеры можно разделить также с применением колонки хиральной ВЭЖХ.
Соединения формулы (I) могут существовать также в разных таутомерных формах и все такие формы включены в объем изобретения. Кроме того, в изобретение включены, например, все кето-енольные и имин-енаминовые формы соединений.
Все стереоизомеры (например, геометрические изомеры, оптические изомеры и тому подобное) настоящего изобретения (включая соли, сольваты, сложные эфиры и пролекарства соединений, а также соли, сольваты и сложные эфиры пролекарств), такие как стереоизомеры, которые могут существовать вследствие асимметричных атомов углерода на различных заместителях, в том числе энантиомерные формы (которые могут существовать даже в отсутствие асимметричных атомов углерода), ротамерные формы, атропизомеры и диастереомерные формы, рассматриваются в объеме данного изобретения, когда являются изомерами положения. Индивидуальные стереоизомеры соединений изобретения могут быть, например, по существу свободными от других изомеров или могут быть смесью, например, в виде рацематов, или смесью со всеми другими стереоизомерами или другим выбранным стереоизомером. Хиральные центры соединений настоящего изобретения могут иметь S- или R-конфигурацию, как определено IUPAC 1974 Recommendations. Предполагается, что термины “соль”, “сольват”, “сложный эфир”, “пролекарство” и тому подобное в равной степени применяют для соли, сольвата, сложного эфира и пролекарства энантиомеров, стереоизомеров, ротамеров, таутомеров, изомеров положения, рацематов или пролекарств соединений изобретения.
Обнаружено, что производные (дигидро)пирроло[2,1-a]изохинолина изобретения стимулируют рецептор FSH. Способы определения связывания рецептора, а также анализы in vitro и in vivo для определения биологической активности гонадотропинов хорошо известны. Обычно экспрессированный рецептор инкубируют с испытуемым соединением и измеряют связывание или стимуляцию или ингибирование функциональной реакции.
Для измерения функциональной реакции выделенную ДНК, кодирующую ген рецептора FSH, предпочтительно рецептор человека, экспрессируют в подходящие клетки-хозяева. Такая клетка может быть клеткой яичника китайского хомячка, но подходящими являются также другие клетки. Предпочтительными являются клетки происхождения из организма млекопитающих (Jia et al, Mol. Endocrin., 5, 759-776, (1991)).
Способы конструирования клеточных линий, экспрессирующих рекомбинантный рецептор FSH, хорошо известны в данной области (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor). Экспрессию рецептора осуществляют экспрессией ДНК, кодирующей требуемый белок. Все методики для сайт-направленного мутагенеза, лигирования дополнительных последовательностей, ПЦР и конструирования подходящих систем экспрессии к настоящему времени хорошо известны в данной области. Части ДНК или всю ДНК, кодирующую требуемый белок, можно конструировать синтетическим способом с применением стандартных твердофазных методик, предпочтительно для включения сайтов рестрикции для облегчения лигирования. ДНК-кодирующие последовательности могут быть обеспечены подходящими контрольными элементами для транскрипции и трансляции включенной кодирующей последовательности. Как хорошо известно, системы экспрессии теперь являются доступными и совместимыми с большим числом хозяев, включающих в себя прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, клетки растений, клетки насекомых, клетки млекопитающих, птичьи клетки и тому подобное.
Клетки, экспрессирующие рецептор, затем инкубируют с испытуемым соединением для определения связывания испытуемого соединения или стимуляции функциональной реакции.
Альтернативно, для измерения связывания испытуемого соединения можно применять выделенные мембраны клеток, содержащие экспрессированный рецептор.
Для измерения связывания можно применять радиоактивные или флуоресцентные соединения. Такие соединения также являются частью изобретения.
В альтернативном варианте можно проводить также анализы на конкурентное связывание.
Другой анализ включает в себя скрининг соединений-агонистов рецептора FSH определением стимуляции опосредуемой рецептором аккумуляции цАМФ. Таким образом, такой способ включает в себя экспрессию рецептора в клетке-хозяине и воздействие на клетки испытуемого соединения. Затем измеряют количество цАМФ. Уровень цАМФ будет увеличиваться благодаря стимулирующему действию испытуемого соединения при связывании с рецептором.
Для измерения присущей активности в качестве эталонного соединения можно применять рекомбинантный FSH человека.
Помимо непосредственно измерения, например, уровней цАМФ в экспонированных клетках, можно применять клеточные линии, которые помимо трансфекции ДНК, кодирующей рецептор FSH, трансфицируют также второй ДНК, кодирующей репортерный ген, экспрессия которого соответствует уровню цАМФ. Такие репортерные гены могут быть цАМФ-индуцибельными или их можно конструировать таким путем, чтобы они соединялись с новыми цАМФ-восприимчивыми элементами. Обычно экспрессия репортерного гена может регулироваться любым восприимчивым элементом, реагирующим на изменяющиеся уровни цАМФ. Подходящими репортерными генами являются, например, гены LacZ, щелочной фосфатазы, люциферазы светляков и зеленого флуоресцентного белка. Принципы таких анализов трансактивации хорошо известны в данной области и описаны, например, в Stratowa, Ch., Himmler, A. and Czernilofsky, A.P., Curr. Opin. Biotechnol., 6, 574- 581 (1995).
Для изучения того, обладает ли агонист рецептора FSH LMW непосредственным действием на яичник, незрелых крыс можно обрабатывать перорально дважды в день в течение 3 дней с применением увеличения массы яичника в качестве конечного параметра (определенного на четвертый день). При совместном введении фиксированного количества hCG для максимизации продуцирования андрогена (также у животных с плацебо) это испытание является очень селективным для определения FSH-активности испытуемого соединения. Если может присутствовать любая LH-активность, она аннулируется активностью hCG. Это испытание является адаптацией анализа Steelman Pohley, применяемого для высвобождения рекомбинантного FSH (Steelman and Pohley, 1953).
Влияние агонистов рецептора FSH LMW на рост фолликул можно дополнительно изучать на модели, применяющей обработанных GnRH-антагонистом циклических крыс. Стимуляцию яичника можно определить по увеличенной массе яичника и по числу овулированных яйцеклеток (после индуцирования овуляции посредством hCG). Кроме того, можно определить клинически уместные биомаркеры, подобные эстрадиолу и ингибину В. В этой модели стимуляция FSH (агонистами) будет приводить к более эффективной овуляции (более чем 15 яйцеклеток).
Для изучения качества ооцитов животных можно также спаривать после индуцирования овуляции и можно определять фертильность.
Настоящее изобретение относится также к фармацевтической композиции, содержащей производное (дигидро)пирроло[2,1-a]изохинолина или его фармацевтически приемлемые соли, имеющие общую формулу I, в смеси с фармацевтически приемлемыми вспомогательными веществами и необязательно другими терапевтическими агентами. Вспомогательные вещества должны быть “приемлемыми” в смысле совместимости с другими ингредиентами композиции и не должны быть вредными для его реципиентов.
Композиции включают в себя, например, композиции, подходящие для перорального, сублингвального, подкожного, внутривенного, внутримышечного, назального, местного или ректального введения и тому подобное, все композиции предназначены для введения в виде унифицированных лекарственных форм.
Для перорального введения активный ингредиент может быть представлен в виде дискретных единиц (частей), таких как таблетки, капсулы, порошки, гранулы, растворы, суспензии и тому подобное.
Для перорального введения фармацевтическая композиция изобретения может быть представлена в контейнерах для одной дозы или многих доз, например, жидкостей для инъекции в предопределенных количествах, например, в герметизированных пузырьках и ампулах, и ее можно хранить в высушенном замораживанием (лиофилизованном) состоянии, требующем только добавление стерильного жидкого носителя, например, воды, перед применением.
В смеси с такими фармацевтически приемлемыми вспомогательными веществами, например, описываемыми в стандартной ссылке, Gennaro, A.R. et al., Remington: The Science и Practice of Pharmacy (20th Edition., Lippincott Williams & Wilkins, 2000, see especially Part 5: Pharmaceutical Manufacturing), активный агент можно прессовать в твердые унифицированные лекарственные формы, такие как пилюли, таблетки, или обрабатывать для получения капсул или суппозиториев. При помощи фармацевтически приемлемых жидкостей активный агент можно применять в виде жидкой композиции, например, в виде препарата для инъекции в форме раствора, суспензии, эмульсии, или в виде спрея, например, назального спрея.
Рассматривается применение общепринятых добавок, таких как наполнители, красящие вещества, полимерные связывающие вещества и тому подобное, для изготовления твердых унифицированных лекарственных форм. В общем, можно применять любую фармацевтически приемлемую добавку, которая не мешает функции активных соединений. Подходящие носители, с которыми активный агент изобретения можно вводить в виде твердых композиций, включают в себя лактозу, крахмал, производные целлюлозы и тому подобное или их смеси, применяемые в подходящих количествах. Для парентерального введения можно применять водные суспензии, изотонические солевые растворы и стерильные инъецируемые растворы, содержащие фармацевтически приемлемые диспергирующие агенты и/или смачивающие агенты, такие как пропиленгликоль или бутиленгликоль.
Изобретение далее включает в себя фармацевтическую композицию, описываемую ранее, в комбинации с упаковочным материалом, подходящим для указанной композиции, причем этот упаковочный материал включает в себя инструкции для применения композиции, как описано ранее.
Точная доза и схема введения активного ингредиента или его фармацевтической композиции могут варьировать в зависимости от конкретного соединения, пути введения и возраста и состояний отдельного субъекта, которому нужно ввести лекарственное средство.
Обычно для парентерального введения требуются более низкие дозы, чем для других способов введения, которые являются более зависимыми от абсорбции. Однако, подходящей дозой для людей может быть 0,05-25 мг на кг массы тела. Подходящая доза может быть представлена в виде одной дозы или в виде нескольких поддоз, вводимых через подходящие интервалы на всем протяжении дня, или, в случае реципиентов-женщин, в виде доз, которые вводят при подходящих суточных интервалах на протяжении менструального цикла. Доза, а также схема введения могут быть разными для реципиента-женщины и -мужчины.
Соединения согласно изобретению можно применять в терапии. Их можно применять для таких же клинических целей, как и нативный FSH.
Следующий аспект изобретения относится к применению производных (дигидро)пирроло[2,1-a]изохинолина, имеющих общую формулу I, для изготовления лекарственного средства, которое применяют для лечения нарушений, восприимчивых к опосредуемым рецептором FSH путям, предпочтительно для лечения нарушений фертильности. Таким образом, пациентам, нуждающимся в этом, можно вводить подходящие количества соединений согласно изобретению.
Еще в одном аспекте изобретение относится к применению производных (дигидро)пирроло[2,1-a]изохинолина, имеющих общую формулу I, для изготовления лекарственного средства, которое применяют для лечения бесплодия. В частности, соединения можно применять для индуцирования овуляции (OI) или в способах регулируемой овариальной стимуляции (COS).
Изобретение иллюстрируется следующими примерами.
ПРИМЕРЫ
Общие комментарии
В примерах применяют следующие аббревиатуры: DIPEA = N,N-диизопропилэтиламин, TFA = трифторуксусная кислота, HATU = гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, Fmoc = 9-флуоренилметоксикарбонил, Fmoc-Cl = 9-флуоренилметоксикарбонилхлорид, Alloc = аллилоксикарбонил, ДМФА = N,N-диметилформамид, DME = 1,2-диметоксиэтан, ТГФ = тетрагидрофуран, Вос = трет-бутоксикарбонил, NMP = N-метилпирролидон, TBTU = тетрафторборат О-бензотриазол-1-ил-N,N,N',N'-тетрабутилурония, ВОР = гексафторфосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония, HOBt = гидрат 1-гидроксибензотриазола, DMAP = 4-(диметиламино)пиридин.
Если не указано иначе, все конечные продукты примеров, приведенных ниже, лиофилизовали из смесей вода/1,4-диоксан, вода/трет-бутанол или вода/ацетонитрил. Если соединение получали в виде соли TFA, кислоту добавляли в подходящем количестве к смеси в растворителе перед лиофилизацией.
Названия конечных продуктов, описанных в примерах, создавали с применением Beilstein Autonom program (version: 2.02.304).
Для определения времен удерживания применяли следующие способы аналитической ВЭЖХ.
Способ 1: колонка: 5 мкм, Luna С-18(2), 150Ч4,6 мм; скорость потока: 1 мл/мин; детектирование: при 210 нм; температура колонки: 40°С; растворитель А: CH3CN/Н2О = 1/9 (об./об.); растворитель В: CH3CN; растворитель С: 0,1 М водная трифторуксусная кислота; градиент: растворитель А/В/С от 65/30/5 до 10/85/5 (об./об./об.) в течение 30,00 мин, затем постоянная концентрация А/В/С = 10/85/5 (об./об./об.) в течение дополнительных 10,00 мин.
Способ 2: идентичен способу 1, за исключением того, что применяли следующий градиент: растворитель А/В/С от 75/20/5 до 15/80/5 (об./об./об.) в течение 30,00 мин, затем постоянная концентрация А/В/С = 15/80/5 (об./об./об.) в течение дополнительных 10,00 мин.
Способ 3: идентичен способу 1, за исключением того, что применяли следующий градиент: растворитель А/В/С от 35/60/5 до 10/85/5 (об./об./об.) в течение 30,00 мин, затем постоянная концентрация А/В/С = 10/85/5 (об./об./об.) в течение дополнительных 10,00 мин.
Способ 4: идентичен способу 1, за исключением того, что применяли следующий градиент: растворитель А/В/С от 95/0/5 до 15/80/5 (об./об./об.) в течение 30,00 мин, затем постоянная концентрация А/В/С 15/80/5 (об./об./об.) в течение дополнительных 10,00 мин.
Способ 5: идентичен способу 1, за исключением того, что применяли следующий градиент: растворитель А/В/С от 75/20/0 до 0/100/0 (об./об./об.) в течение 30,00 мин, затем постоянная концентрация А/В/С = 0/100/0 (об./об./об.) в течение дополнительных 10,00 мин.
Способ 6: идентичен способу 1, за исключением того, что применяли следующий градиент: растворитель А/В/С от 60/40/0 до 0/100/0 (об./об./об.) в течение 30,00 мин, затем постоянный растворитель А/В/С = 0/100/0 (об./об./об.) в течение дополнительных 10,00 мин.
Способ 7: колонка: 3 мкм, Luna С-18(2), 100Ч2 мм (Phenomenex); скорость потока: 0,25 мл/мин; детектирование: при 210 нм; температура колонки: 40°С; растворитель А: CH3CN/Н2О = 1/9 (об./об.); растворитель В: CH3CN; градиент: растворитель А/В от 65/35 до 10/90 (об./об.) в течение 30,00 мин, до А/В = 0/100 (об./об.) в течение 2,00 минут, затем постоянная концентрация А/В = 0/100 (об./об./об.) в течение дополнительных 8,00 мин, затем до А/В = 65/35 (об./об.) в течение 1,00 минуты и, наконец, постоянная концентрация А/В = 65/35 (об./об.) в течение дополнительных 15,00 мин.
Способ 8: идентичен способу 7, за исключением того, что применяли следующий градиент: растворитель А/В = от 40/60 до 0/100 (об./об.) в течение 30,00 мин, затем А/В = 0/100 (об./об.) в течение 2,00 мин, затем постоянная концентрация А/В = 0/100 (об./об) в течение дополнительных 8,00 мин, затем до А/В = 40/60 (об./об.) в течение 1,00 минуты, и, наконец, постоянная концентрация А/В = 40/60 (об./об.) в течение 15,00 мин.
Способ 9: идентичен способу 7, за исключением того, что применяли следующий градиент: растворитель А/В от 100/0 до 50/50 (об./об.) в течение 30,00 мин, до А/В = 0/100 (об./об.) в течение 2,00 минут, затем постоянная концентрация А/В = 0/100 (об./об.) в течение дополнительных 8,00 мин, затем до А/В = 100/0 (об./об.) в течение 1,00 минуты, и, наконец, постоянная концентрация А/В = 100/0 (об./об.) в течение 15,00 мин.
Способ 10: колонка: 3 мкм, Luna С-18(2), 100Ч2 мм (Phenomenex); скорость потока: 0,25 мл/мин; детектирование: при 210 нм; температура колонки: 40°С; растворитель А: CH3CN/Н2О/TFA = 1/9/0,0035 (об./об.); растворитель В: CH3CN/TFA = 1/0,0035 (об./об.); градиент: растворитель А/В от 65/35 до 10/90 (об./об.) в течение 30,00 мин, до А/В = 0/100 (об./об.) в течение 2,00 минут, затем постоянная концентрация А/В = 0/100 (об./об.) в течение дополнительных 8,00 мин, затем до А/В = 65/35 (об./об.) в течение 1,00 минуты и, наконец, постоянная концентрация А/В = 65/35 (об./об.) в течение дополнительных 15,00 мин.
Способ 11: идентичен способу 10, за исключением того, что применяли следующий градиент: растворитель А/В от 40/60 до 0/100 (об./об.) в течение 30,00 мин, до А/В = 0/100 (об./об.) в течение 2,00 мин, затем постоянная концентрация А/В = 0/100 (об./об.) в течение дополнительных 8,00 мин, затем до А/В = 40/60 (об./об.) в течение 1,00 минуты, и, наконец, постоянная концентрация А/В = 40/60 (об./об.) в течение 15,00 мин.
Способ 12: идентичен способу 10, за исключением того, что применяли следующий градиент: растворитель А/В от 100/0 до 50/50 (об./об.) в течение 30,00 мин, до А/В = 0/100 (об./об.) в течение 2,00 мин, затем постоянная концентрация А/В = 0/100 (об./об.) в течение дополнительных 8,00 мин, затем до А/В = 100/0 (об./об.) в течение 1,00 минуты, и, наконец, постоянная концентрация А/В = 100/0 (об./об.) в течение 15,00 мин.
Способ 13: УЭЖХ/MC (Acquity Ultra Performance LC; Waters): колонка: Acquity UPLC BEH C18, 2,1Ч100 мм, 1,7 мкл; скорость потока: 0,65 мл/мин; детектирование: при 210 нм; МС: 100-1000 AMU; температура колонки: 40°С; растворитель А: CH3CN/Н2О = 1/9 (об./об.); растворитель В: CH3CN; градиент: растворитель А/В от 60/40 до 20/80 (об./об.) в течение 3,0 мин, до А/В = 0/100 (об./об.) в течение 0,2 мин, затем А/В = 0/100 (об./об.) в течение 0,49 мин, затем А/В = 60/40 в течение 0,1 мин, и, наконец, А/В = 60/40 (об./об.) в течение 1,3 мин.
Для очистки применяли следующие системы для препаративной ВЭЖХ.
Система 1: колонка Luna С18(2), 150Ч21,2 мм, 5 мкм, со смесями вода/ацетонитрил, необязательно в присутствии 0,1% водной TFA, с применением указанного градиента; скорость потока 20 мл/мин; детектирование: при 210 нм; время опыта: 30 минут.
Система 2: колонка Luna С18(2), 250Ч50,00 мм, 10 мкм, со смесями вода/ацетонитрил, необязательно в присутствии 0,1% водной TFA, с применением указанного градиента; скорость потока 50 мл/мин; детектирование: при 210 нм; время опыта: 60 минут.
Микроволновые реакции проводили в микроволновой печи Biotage (модель: Initiator) с автоматическим пробоотборником.
Тонкослойную хроматографию (ТСХ) проводили на пластинках ТСХ Merck (5Ч10 см) силикагеля 60 F254.
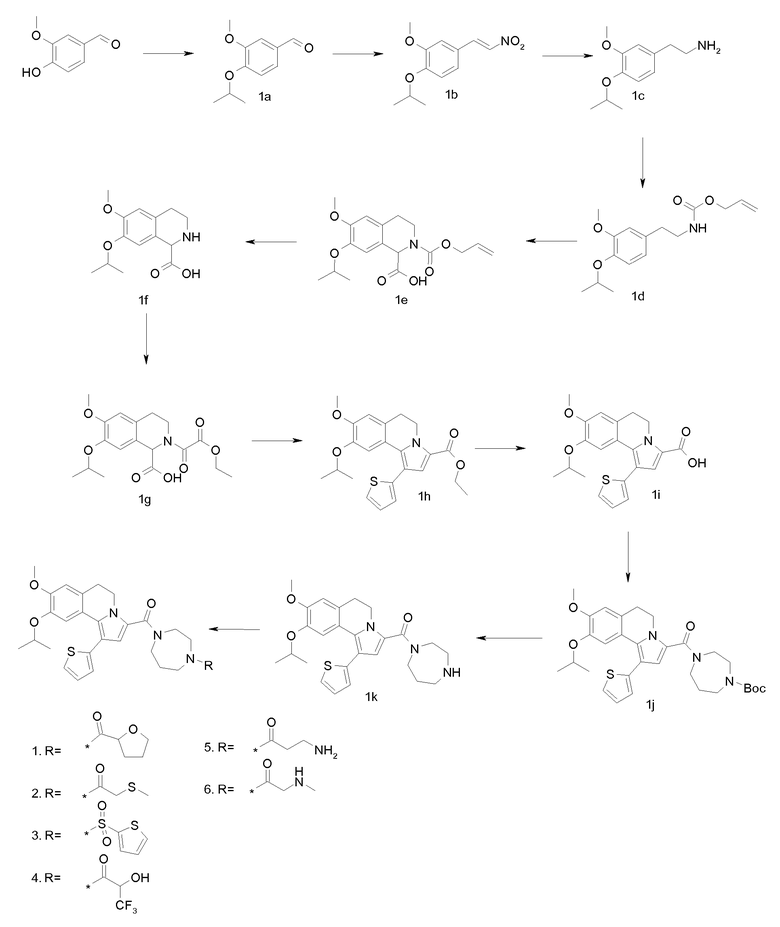
Пример 1
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(тетрагидрофуран-2-карбонил-[1,4]диазепан-1-ил]метанон
(a). 4-Изопропокси-3-метоксибензальдегид
Смесь 4-гидрокси-3-метоксибензальдегида (100 г), карбоната калия (182 г) и 2-бромпропана (81 мл) в ДМФА (500 мл) перемешивали при 65°С в течение 2 час. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход 124 г. 1Н ЯМР (CDCl3): δ 1,40 (с, 6H), 3,95 (с, 3H), 4,7 (м, 1H), 6,98 (д, 1H), 7,43 (м, 2H), 9,85 (с, 1H).
(b). 1-Изопропокси-2-метокси-4-((E)-2-нитровинил)бензол
Смесь продукта примера 1а (16,1 г), нитрометана (120 мл) и ацетата аммония (6,1 г) перемешивали при 70°С в течение 18 час (осторожно: реакцию можно проводить при более высокой температуре, но это не рекомендуется вследствие того, что может иметь место взрыв). При комнатной температуре осадок отделяли фильтрованием. Осадок промывали водой и холодным этанолом. Осадок растворяли в дихлорметане и промывали насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход 13,54 г. 1Н ЯМР (CDCl3): δ 1,40 (с, 6H), 3,9 (с, 3H), 4,65 (м, 1H), 6,9 (д, 1H), 7,0 (д, 1H), 7,15 (дд, 1H), 7,52 (д, 1H), 7,95 (д, 1H).
(c). 2-(4-Изопропокси-3-метоксифенил)этиламин
Продукт примера 1b (20 г) растворяли в ТГФ (80 мл) и по каплям добавляли к смеси литийалюминийгидрида (12,8 грамм) и сухого простого эфира (70 мл) и сухого ТГФ (70 мл). После завершения добавления реакционную смесь нагревали при кипячении с обратным холодильником в течение 2 час. Реакционную смесь гасили добавлением воды (15 мл) в ТГФ (50 мл). Затем добавляли водный раствор NaOH (30 мл 2 н раствора) и Н2О (4 мл). Образовавшуюся смесь фильтровали и фильтрат концентрировали в вакууме. Остаток растворяли в этилацетате и промывали водным раствором HCl (2 н). К водному слою добавляли твердый NaOH до рН=10. Водный слой экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 13,8 г. ЖХ/МС-ESI: [M+H]+ = 210,1.
(d). Аллиловый эфир [2-(4-изопропокси-3-метоксифенил)этил]церамовой кислоты
Аллилхлорформиат (25 мл) в дихлорметане (100 мл) добавляли к смеси продукта примера 1с (44,9 г) и DIPEA (75 мл) в дихлорметане (400 мл) при 0°С. После перемешивания при комнатной температуре в течение 1 час реакционную смесь промывали водным раствором HCl (2 н), водой и насыщ. водным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [3/2 (об./об.)] в качестве элюента.
Выход: 9,7 г. ЖХ/МС-ESI: [M+H]+ = 294,1.
(e). 2-Аллиловый эфир 7-изопропокси-6-метокси-3,4-дигидро-1H-изохинолин-1,2-дикарбоновой кислоты
Серную кислоту (120 мл) добавляли к раствору продукта примера 1d (45,6 г), глиоксиловой кислоты (21,5 г) и уксусной кислоты (350 мл) при 0°С. После перемешивания при комнатной температуре в течение 1 час реакционную смесь выливали в воду и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [95/5 (об./об.)] в качестве элюента.
Выход: 43,5 г. ЖХ/МС-ESI: [M+H]+ = 350,2.
(f). 7-Изопропокси-6-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Смесь продукта примера 1е (43,5 г), димедона (26,2 г) и Pd(PPh3)4 (500 мг) перемешивали в ТГФ при кипячении с обратным холодильником в течение 1 час. К реакционной смеси добавляли простой эфир (300 мл) и воду (20 мл) при комнатной температуре. Реакционную смесь охлаждали до 0°С и осадок отделяли фильтрованием и сушили в вакууме (50°С).
Выход: 27 г. ЖХ/МС-ESI: [M+H]+ = 266,2.
(g). 2-Этоксиоксалил-7-изопропокси-6-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Этилоксалилхлорид (1,85 мл) добавляли к суспензии продукта примера 1f (2,2 г) в кипящем с обратным холодильником ТГФ (200 мл). После перемешивания при кипячении с обратным холодильником в течение 30 мин реакционную смесь концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси метанол/дихлорметан [1/9 (об./об.)] в качестве элюента.
Выход: 2,75 г. ЖХ/МС-ESI: [M+H]+ = 366,2.
(h). Этиловый эфир 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 1g (601 мг), уксусного ангидрида (5 мл) и 2-этинилтиофена (178 мг) в ТГФ (5 мл) перемешивали при 140°С с применением микроволнового излучения в течение 15 мин. Реакционную смесь разбавляли этилацетатом и промывали водой, насыщ. водным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушили (MgSO4) и концентрировали в вакууме. Остаток суспендировали в этаноле и осадок отделяли фильтрованием и сушили в вакууме (50°С).
Выход: 1,34 г. ЖХ/МС-ESI: [M+H]+ = 412,2.
(i). 9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоновая кислота
KOH (1,2 г) добавляли к суспензии продукта примера 1h (2,8 г) в смеси EtOH/Н2О, 1/1, (об./об.) (80 мл). Реакционную смесь перемешивали при 78°С в течение 1 час. Реакционную смесь разбавляли этилацетатом и экстрагировали водным раствором NaOH (2 н). Водный слой подкисляли водным раствором HCl (2 н) и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 2,6 г. ЖХ/МС-ESI: [M+H]+ = 384,2.
(j). трет-Бутиловый эфир 4-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-карбоновой кислоты
Смесь продукта примера 1i (1 грамм), HATU (1,47 грамм) и трет-бутил-1,4-диазепан-1-карбоксилата (564 мкл) в дихлорметане (100 мл) перемешивали при комнатной температуре в течение 1 час. Реакционную смесь разбавляли дихлорметаном и промывали водным раствором HCl (1 н). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [2/3 (об./об.)] в качестве элюента.
Выход: 1,4 г. ЖХ/МС-ESI: [M+H]+ = 566,2.
(k) [1,4]Диазепан-1-ил-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
ТГФ (3 мл) добавляли к раствору продукта примера 1j (1,4 г) в дихлорметане (10 мл). После перемешивания при комнатной температуре в течение 18 час реакционную смесь разбавляли дихлорметаном и промывали водным раствором NaOH (2 н). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 1,3 г. ЖХ/МС-ESI: [M+H]+ = 466,2.
(l) (9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(тетрагидрофуран-2-карбонил)-[1,4]диазепан-1-ил]метанон
Смесь продукта примера 1k (100 мг), 2-тетрагидрофуранкарбоновой кислоты (31 мкл), HATU (160 мг) и DIPEA (110 мкл) в дихлорметане (2 мл) перемешивали при комнатной температуре в течение 4 час. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ (0→90% ацетонитрил; система 1).
Выход: 120 мг. ЖХ/МС-ESI: [M+H]+ = 564,2; анал. ВЭЖХ: Rt = 18,71 мин (способ 2); hFSHRago (CHO luc) EC50 = 0,9 нМ.
Пример 2
1-[4-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]-2-метилсульфанилэтанон
Получение амида продукта примера 1k (100 мг) реакцией с (метилтио)уксусной кислотой (33 мг) проводили согласно способу, описанному в примере 11.
Выход: 50 мг. ЖХ/МС-ESI: [M+H]+ = 554,2, анал. ВЭЖХ: Rt = 20,36 мин (способ 2); hFSHRago (CHO luc) EC50 = 0,5 нМ.
Пример 3
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(тиофен-2-сульфонил)-[1,4]диазепан-1-ил]метанон
Смесь продукта примера 1k (60 мг), триэтиламина (54 мкл) и 2-тиофенсульфонилхлорида (29 мг) в дихлорметане (2 мл) перемешивали в течение 1 час при комнатной температуре. Реакционную смесь разбавляли дихлорметаном и промывали Н2О и водным раствором HCl (1 н). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0→90% ацетонитрил; система 1).
Выход: 35 мг. ЖХ/МС-ESI: [M+H]+ = 612,2, анал. ВЭЖХ: Rt = 26,14 мин (способ 2); hFSHRago (CHO luc) EC50 = 4,6 нМ.
Пример 4
3,3,3-Трифтор-2-гидрокси-1-[4-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]пропан-1-он
Смесь продукта примера 1k (50 мг), 3,3,3-трифторуксусной кислоты (32 мг), DIPEA (90 мкл) и ВОР (114 мг) в дихлорметане (2,5 мл) перемешивали в течение 18 час при комнатной температуре. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ (10→90% ацетонитрил; система 1).
Выход: 17 мг. ЖХ/МС-ESI: [M+H]+ = 592,3; анал. ВЭЖХ: Rt = 21,77 мин (способ 2); hFSHRago (CHO luc) EC50 = 1,3 нМ.
Пример 5
3-Амино-1-[4-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]пропан-1-он
(a). трет-Бутиловый эфир {3-[4-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]-3-оксопропил}карбаминовой кислоты
Сочетание продукта примера 1k (100 мг) с 3-трет-бутоксикарбониламинопропионовой кислотой (60 мг) проводили согласно способу, описанному в примере 11.
Выход: 53 мг. ЖХ/МС-ESI: [M+H]+ = 637,2; ВЭЖХ: Rt = 21,63 мин (способ 2).
(b). 3-Амино-1-[4-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]пропан-1-он
Смесь продукта примера 5a (40 мг) и TFA (100 мкл) в дихлорметане перемешивали в течение 2 час при комнатной температуре. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной ВЭЖХ (0→90% ацетонитрил, 0,1% TFA; система 1).
Выход: 34 мг. ЖХ/МС-ESI: [M+H]+ = 537,2; ВЭЖХ: Rt = 9,97 мин (способ 2); hFSHRago (CHO luc) EC50 = 1400 нМ.
Пример 6
1-[4-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]-2-метиламиноэтанон
(a) трет-Бутиловый эфир {2-[4-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]-2-оксоэтил}метилкарбаминовой кислоты
Сочетание продукта примера 1k (100 мг) с N-трет-бутоксикарбонилсаркозином (64 мг)проводили согласно способу, описанному в примере 11.
Выход: 64 мг. ЖХ/МС-ESI: [M+H]+ = 637,2; анал. ВЭЖХ: Rt = 23,69 мин (способ 2).
(b) 1-[4-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]-2-метиламиноэтанон
Удаление защитной Boc-группы продукта примера 6a (40 мг) проводили согласно способу, описанному в примере 5b.
Выход: 32,7 мг. ЖХ/МС-ESI: [M+H]+ = 537,2; анал. ВЭЖХ: Rt = 10,11 мин (способ 2); hFSHRago (CHO luc) EC50 = 264,0 нМ.
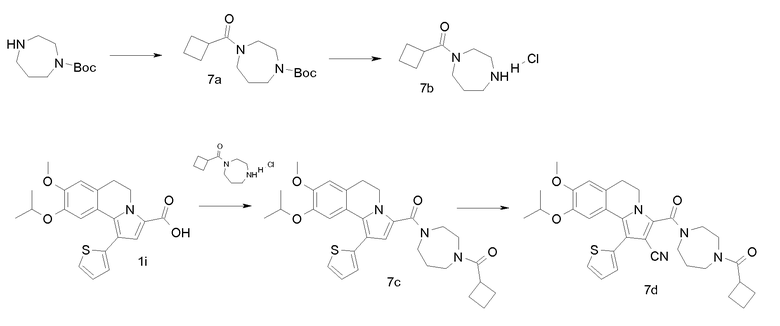
Пример 7
3-(4-Циклобутанкарбонил-[1,4]диазепан-1-карбонил)-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-2-карбонитрил и (4-циклобутанкарбонил-[1,4]диазепан-1-ил)-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
(a). трет-Бутиловый эфир 4-циклобутанкарбонил-[1,4]диазепан-1-карбоновой кислоты
Циклобутанкарбонилхлорид (3,7 мл) и триэтиламин (14 мл) добавляли к раствору трет-бутилового эфира [1,4]диазепан-1-карбоновой кислоты (4,9 мл) в дихлорметане (175 мл). После перемешивания в течение 1 час при комнатной температуре реакционную смесь промывали водой, водным раствором HCl (1 н), водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 7 г. ЖХ/МС-ESI: [M+H]+ = 283,4.
(b). Гидрохлорид циклобутил-[1,4]диазепан-1-илметанона
Смесь продукта примера 7a (7 г) и раствора HCl (33 мл, 4 н в диоксане) в дихлорметане (166 мл) перемешивали в течение 4 час при комнатной температуре. Реакционную смесь концентрировали в вакууме. Остаток обрабатывали диэтиловым простым эфиром и осадок отделяли фильтрованием и сушили в вакууме (50°С).
Выход: 4,76 г (в виде соли с HCl).
(c). (4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-ил)метанон
Смесь продукта примера 1i (250 мг), гидрохлорида циклобутил-[1,4]диазепан-1-илметанона, (214 мг), HATU (373 мг) и DIPEA (0,25 мл) в ДМФА (3 мл) перемешивали в течение 18 час при 50°С. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [100/0→95/5 (об./об.] в качестве элюента.
Выход: 355 мг. ЖХ/МС-ESI: [M+H]+ = 548,1; hFSHRago (CHO luc) EC50 = 1,7 нМ.
(d). 3-(4-Циклобутанкарбонил-[1,4]диазепан-1-карбонил)-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-2-карбонитрил
При -78°С хлорсульфонилизоцианат (0,112 мл) добавляли к раствору продукта примера 7с (350 мг) в ТГФ (3 мл). После перемешивания в течение 1 час при -78°С добавляли ДМФА (3 мл). После перемешивания в течение 2,5 час при комнатной температуре реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ [40%→60% ацетонитрил; система 2).
Выход: 74 мг. ЖХ/МС-ESI: [M+H]+ = 573,5; анал. ВЭЖХ: Rt = 14,18 мин (способ 10); hFSHRago (CHO luc) EC50 = 0,3 нМ.
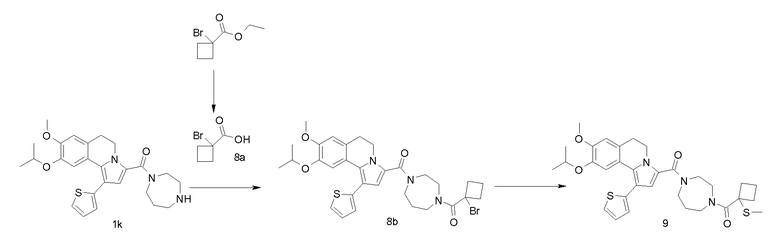
Пример 8
[4-(1-Бромциклобутанкарбонил)-[1,4]диазепан-1-ил]-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
(a). 1-Бромциклобутанкарбоновая кислота
Смесь этилового эфира 1-бромциклобутанкарбоновой кислоты (1,0 мл) в водном растворе NaOH (10 мл, 2 н) энергично перемешивали в течение 3 час при комнатной температуре. Реакционную смесь промывали диэтиловым простым эфиром. Водный слой подкисляли водным раствором HCl (2 н) и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 952 мг.
(b). [4-(1-Бромциклобутанкарбонил)-[1,4]диазепан-1-ил]-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Смесь ВОР (580 мг), DIPEA (540 мкл) и продукта примера 8а (280 мкл) в дихлорметане (3 мл) добавляли к раствору продукта примера 1k (330 мг) в дихлорметане (12 мл). После перемешивания при комнатной температуре в течение 2 час реакционную смесь выливали в водный раствор лимонной кислоты (5%) и экстрагировали дихлорметаном. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон [1/0→9/1 (об./об.] в качестве элюента.
Выход: 329 мг. ЖХ/МС-ESI: [M+H]+ = 626,3/628,3 (1:1); анал. ВЭЖХ: Rt = 26,32 мин (способ 2); hFSHRago (CHO luc) EC50 = 6,8 нМ.
Пример 9
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(1-метилсульфанилциклобутанкарбонил)-[1,4]диазепан-1-ил]метанон
Смесь продукта примера 8b (42 мг) и тиометоксида натрия (35 мг) в этаноле (5 мл) перемешивали в течение 4 час при 40°С, 2 дня при комнатной температуре и, наконец, 2 час при 50°С. Реакционную смесь концентрировали в вакууме, растворяли в водном растворе NaOH (0,5 н) и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон [1/0→9/1 (об./об.] в качестве элюента.
Выход: 20 мг. ЖХ/МС-ESI: [M+H]+ = 594,3; анал. ВЭЖХ: Rt = 26,36 мин (способ 2); hFSHRago (CHO luc) EC50 = 16,4 нМ.
Пример 10
[4-(1-Гидроксициклобутанкарбонил)-[1,4]диазепан-1-ил]-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
(a). 1-Гидроксициклобутанкарбоновая кислота
н-Бутиллитий (14 мл, 1,6 М в гептане) добавляли при 0°С к раствору диизопропиламина в ТГФ (30 мл). Спустя 30 мин реакционную смесь охлаждали до -20°С и добавляли циклобутанкарбоновую кислоту (960 мкл) в ТГФ (10 мл). После перемешивания при комнатной температуре в течение 30 мин через реакционную смесь в течение 1 час пропускали кислород и реакционную смесь перемешивали в течение 18 час в атмосфере кислорода. Реакционную смесь выливали в воду и промывали этилацетатом. Водный слой подкисляли водным раствором HCl (2 н) и экстрагировали этилацетатом (2х). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 690 мг.
(b). трет-Бутиловый эфир 4-(1-гидроксициклобутанкарбонил)-[1,4]диазепан-1-карбоновой кислоты
Смесь продукта примера 10a (340 мг), трет-бутил-1,4-диазепан-1-карбоксилата (694 мкл), DIPEA (2,4 мл) и BOP (1,9 г) в дихлорметане (15 мл) перемешивали в течение 18 час при комнатной температуре. Реакционную смесь выливали в водный раствор лимонной кислоты (5%) и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси толуол/ацетон [1/0 → 7/3 (об./об.)] в качестве элюента.
Выход: 732 мг.
(c). Гидрохлорид [1,4]диазепан-1-ил-(1-гидроксициклобутил)-метанона
Смесь раствора HCl (2 мл, 2,0 M в простом эфире) и продукта примера 10b (420 мг) в дихлорметане (18 мл) перемешивали в течение 4 час при комнатной температуре и концентрировали в вакууме.
Выход: 330 мг.
d). [4-(1-Гидроксициклобутанкарбонил)-[1,4]диазепан-1-ил]-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Смесь продукта примера 10с (330 мг), DIPEA (830 мкл), BOP (530 мг) и продукта примера 1k (383 мг) в дихлорметане (15 мл) перемешивали в течение 18 час при комнатной температуре. Реакционную смесь выливали в водный раствор лимонной кислоты (5%) и экстрагировали дихлорметаном (2х). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон [1/0 → 1/1 (об./об.)] в качестве элюента.
Выход: 538 мг. ЖХ/МС: [M+H]+ = 564,4; hFSHRago (CHO luc) EC50=1,4 нМ.
Пример 11
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(1-метоксициклобутанкарбонил)-[1,4]диазепан-1-ил]метанон
Смесь продукта примера 10d (82 мг), гидрида натрия (14 мг, 60% дисперсия в масле) и иодметана (70 мкл) в ДМФА (3 мл) перемешивали при комнатной температуре а течение 1 час. Реакционную смесь выливали в насыщ. водный раствор NH4Cl и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон [1/0 → 9/1 (об./об.)] в качестве элюента.
Выход: 46 мг. ЖХ/МС: [M+H]+ = 578,4; анал. ВЭЖХ: Rt = 24,57 мин (способ 2); hFSHRago (CHO luc) EC50 = 5,4 нМ.
Пример 12
1-[4-(2-Хлор-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбонил-[1,4]диазепан-1-ил]этанон и этиловый эфир 2-ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоновой кислоты
(а) Этиловый эфир 2-ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоновой кислоты
Смесь продукта примера 1i (160 мг), N-ацетилгомопиперазин (89 мг), DIPEA (370 мкл) и HATU (192 мг) в дихлорметане (5 мл) перемешивали при 40°С в течение 1 час. Реакционную смесь разбавляли этилацетатом и промывали водным раствором HCl (0,2 М), водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [10/0 → 8/2 (об./об.)] в качестве элюента.
Выход: 230 мг; hFSHRago (CHO luc) EC50 = 5,2 нМ.
(b). 1-[4-(2-Хлор-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]этанон
Смесь продукта примера 12a (230 мг) и N-хлорсукцинимида (64 мг) в ДМФА (3 мл) перемешивали и нагревали с применением микроволнового излучения при 120°С в течение 5 мин. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси этилацетат/[0→10% изопропиламина (об./об.)] в качестве элюента.
Выход: 150 мг. MS-ESI: [M+H]+ = 542,2; анал. ВЭЖХ: Rt = 10,98 (способ 7); hFSHRago (CHO luc) EC50 = 1,9 нМ.
Пример 13
1-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-5-он
BOP (111 мг), 2,3,6,7-тетрагидро-(1H)-1,4-диазепин-5(4H)-он (50 мг) и DIPEA (0,2 мл) добавляли к раствору продукта примера 1i (80 мг) в дихлорметане (4 мл). После перемешивания в течение 2 час при комнатной температуре реакционную смесь разбавляли дихлорметаном и промывали водным раствором HCl (0,5 н) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10%→90% ацетонитрил; система 1).
Выход: 38 мг. ЖХ/МС-ESI: [M+H]+ = 480,2; анал. ВЭЖХ: Rt = 15,51 мин (способ 2); hFSHRago (CHO luc) EC50 = 106,0 нМ.
Пример 14
4-Бутил-1-[9-(2-гидрокси-2-метилпропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил]-[1,4]диазепан-5-он, 4-бутил-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-5-он и этиловый эфир [3-(4-бутил-5-оксо-[1,4]диазепан-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]уксусной кислоты
(a). 4-Бутил-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-5-он
Гидрид натрия (160 мг, 60% дисперсия в масле) добавляли к раствору продукта примера 13 (767 мг) в ДМФА (24 мл). После перемешивания в течение 5 мин при комнатной температуре добавляли 1-иодбутан (1,46 мл) и перемешивание продолжали в течение 18 час при 60°С. Реакционную смесь выливали в насыщ. водный раствор NH4Cl и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [100/0→90/0 (об./об.)] в качестве элюента.
Выход: 1,26 г. ЖХ/МС-ESI: [M+H]+ = 536,4; hFSHRago (CHO luc) EC50 = 0,8 нМ.
(b). 4-Бутил-1-(9-гидрокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-5-он
При 0°С трихлорборан (3,2 мл) добавляли по каплям к раствору продукта примера 14а (857 мг) в дихлорметане (10 мл). После перемешивания в течение 18 час при комнатной температуре, реакционную смесь гасили водой и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [100/0 → 90/0 (об./об.)] в качестве элюента.
Выход: 318 мг. ЖХ/МС-ESI: [M+H]+ = 494,3.
(c). Этиловый эфир [3-(4-бутил-5-оксо-[1,4]диазепан-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]уксусной кислоты
Смесь продукта примера 14b (100 мг), карбоната цезия (198 мг) и этилбромацетата (27 мкл) в ДМФА (6 мл) перемешивали в течение 2 час при 90°С. Реакционную смесь выливали в воду и экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0%→100% ацетонитрила, система 1).
Выход: 43 мг. ЖХ/МС-ESI: [M+H]+ = 580,3; анал. ВЭЖХ: Rt = 11,76 мин (способ 10); hFSHRago (CHO luc) EC50 = 11 нМ.
(d). 4-Бутил-1-[9-(2-гидрокси-2-метилпропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил]-[1,4]диазепан-5-он
При 0°С метилмагнийхлорид (61 мкл) по каплям добавляли к раствору продукта примера 14с (36 мг) в ТГФ (2 мл). Реакционную смесь перемешивали в течение 2 час при комнатной температуре. После разбавления этилацетатом реакционную смесь обрабатывали насыщ. водным раствором NH4Cl. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0%→100% ацетонитрила, система 1).
Выход: 15,8 мг. ЖХ/MC-ESI: [M+H]+ = 566,3; анал. ВЭЖХ: Rt = 9,15 мин (способ 10); hFSHRago (CHO luc) EC50 = 1,5 нМ.
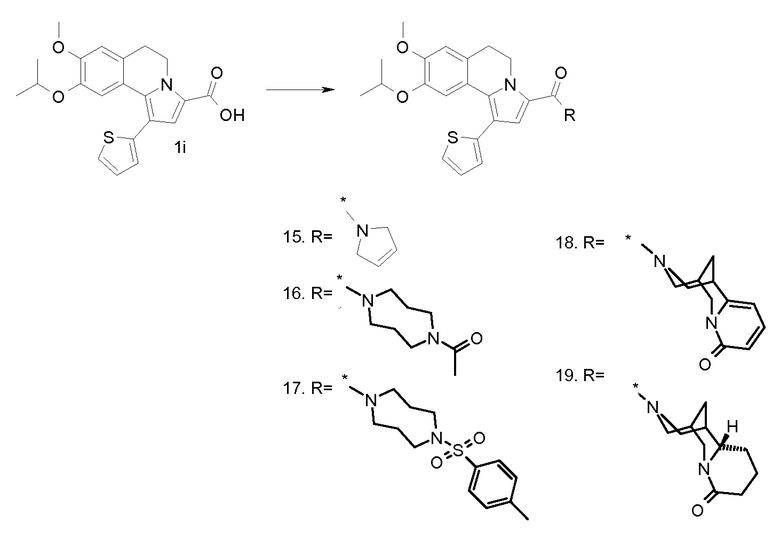
Пример 15
(2,5-Дигидропиррол-1-ил)-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
HATU (74,5 г), 2,5-дигидро-1H-пиррол (30 мкл) и DIPEA (0,114 мл) добавляли к раствору продукта примера 1i (50 мг) в ДМФА (2 мл). После перемешивания в течение 18 час при 50°С реакционную смесь разбавляли этилацетатом и промывали насыщ. водным раствором NH4Cl, водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20% → 100% ацетонитрил; система 1).
Выход: 16,5 мг. MC-ESI: [M+H]+ = 435,3; анал. ВЭЖХ: Rt = 20,78 мин (способ 1); hFSHRago (CHO luc) EC50 = 249,0 нМ
Пример 16
1-[5-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,5]диазокан-1-ил]этанон
(a). [1,5]Диазокан-1-ил-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
1,5-Диазациклооктан получали согласно хорошо документированным способам макроциклизации, описанным в литературе и основанным на протоколах Richman и Atkins: J.E. Richman, T.J. Atkins, J. Am. Chem. Soc. 96, 2268, (1974); R.C. Hoye, J.E. Richman, G.A. Dantas, M.F. Lightbourne, L. Scott Shinneman, J. Org. Chem. 66, 2722 (2001); G. Ewin, J.O. Hill, J. Chem. Res (M), 3501 (1985); J.A. Halfen, H.L. Moore, D.C. Fox, Inorg. Chem. 41, 3935 (2002).
Смесь продукта примера 1i (170 мг) и соли [1,5]диазокан.HBr (140 мг), N-этилморфолина (200 мкл) и HATU (250 мг) в ДМФА (2 мл) перемешивали в течение 16 час при комнатной температуре. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [8/1 → 1/1 (об./об.)] в качестве элюента.
Выход: 75 мг. ЖХ/MC-ESI: [M+H]+ = 480,5; ТСХ Rf = 0,45 (дихлорметан/метанол, 8/2).
(b). 1-[5-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,5]диазокан-1-ил]этанон
К раствору продукта примера 16а (75 мг) в пиридине (0,3 мл) добавляли уксусный ангидрид (75 мл) и DMAP (10 мг) и смесь перемешивали в течение 1 час при 60°С. Реакционную смесь разбавляли водой, подкисляли до рН 4 водным раствором HCl (2 н) и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон [9/1 → 1/1 (об./об.)] в качестве элюента.
Выход: 50 мг. Т.пл. 153-155°С ; ЖХ/MC-ESI: [M+H]+ = 522,5; ТСХ Rf = 0,35 (дихлорметан/ацетон, 8/2); hFSHRago (CHO luc) EC50 = 5,0 нМ.
Пример 17
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[5-(толуол-4-сульфонил)пергидро-1,5-диазоцин-1-ил]метанон
К смеси гидробромида 1-(толуол-4-сульфонил)пергидро-1,5-диазоцина (60 мг) и продукта примера 1i (50 мг) в ДМФА (1,5 мл) добавляли N-этилморфолин (50 мкл) и TBTU (100 мг). Реакционную смесь перемешивали при комнатной температуре в течение 16 час и выливали в водный раствор NH4Cl (5%). Смесь экстрагировали этилацетатом и органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле с применением смеси дихлорметан/этилацетат в качестве элюента, получая при этом белое твердое вещество.
Выход: 45 мг. ТСХ Rf = 0,60 (дихлорметан/этилацетат,1/1). ЖХ/MC-ESI: [M+H]+ = 634,5. 1Н ЯМР (ДМСО-d6) 6,40 (с, 1H, H2-пиррол), 6,85, 6,72 (2xc, 2H, H7 и H10), 7,40, 7,64 (2x дд, 4, тозил), 2,38 (с, 3, CH3-тозил), 4,13 (т, 2, H5), 2,95 (т, 2, H6), 3,75 (с, 3, CH3O), 1,08 (д, 6, iPr); hFSHRago (CHO luc) EC50 = 914,0 нМ.
Пример 18
3-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил-1,2,3,4,5,6-гексагидро-1,5-метанопиридо[1,2-а][1,5]диазоцин-8-он
Смесь продукта примера 1i (125 мг) и рацемического цитизина (80 мг), N-этилморфолина (50 мкл) и TBTU (200 мг) в ДМФА (2 мл) перемешивали при комнатной температуре в течение 3 час. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон в качестве элюента.
Выход: 130 мг. Т.пл. 260°С; ТСХ Rf = 0,50 (дихлорметан/ацетон, 1/1). ЖХ/MC-ESI: [M+H]+ = 556.
1Н ЯМР (ДМСО-d6): сигналы кольца пиридона при 6,16 (ушир. д, 1Н), 6,25 (дд, 1Н), 7,35 (дд, 1Н); hFSHRago (CHO luc) EC50 = 37,3 нМ.
Пример 19
3-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)декагидро-1,5-метанопиридо[1,2-а][1,5]диазоцин-8-он
Цитизин гидрировали согласно методике, описанной в M.J. Johansson, L. Schwartz, S. Mamedjkouh, N. Kann, Tetrahedron Asymmetry, 15, 3531 (2004). Т.пл. 98-102°С.
Смесь продукта примера 1i (125 мг) и 85 мг тетрагидроцитизина (85 мг), N-этилморфолина (50 мкл) и TBTU (225 мг) в ДМФА (2 мл) перемешивали при комнатной температуре в течение 16 час. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон с последующим растиранием в диэтиловом простом эфире.
Выход: 130 мг. Т.пл. 207-208°С; ТСХ Rf = 0,64 (дихлорметан/ацетон, 1/1); ЖХ/MC-ESI: [M+H]+ = 560; hFSHRago (CHO luc) EC50 = 29,4 нМ.
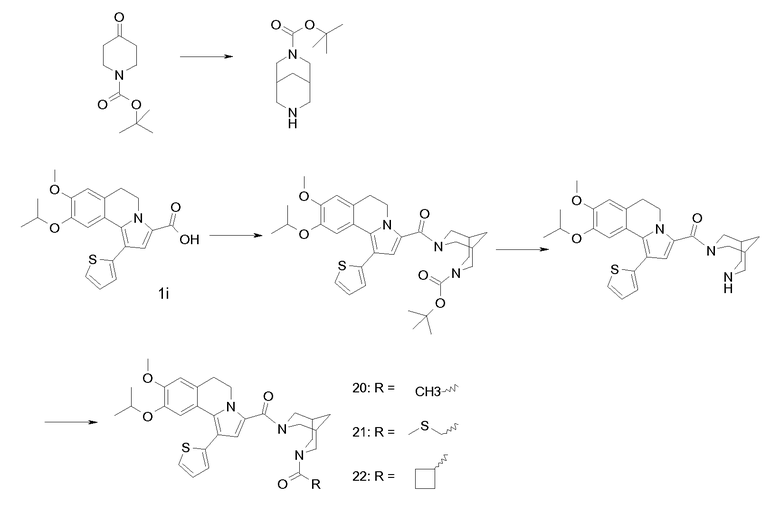
Пример 20
(a). трет-Бутиловый эфир 7-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-3,7-диазабицикло[3.3.1]нонан-3-карбоновой кислоты
Смесь продукта примера 1i (150 мг) и трет-бутилового эфира 3,7-диазабицикло[3.3.1]нонан-3-карбоновой кислоты (177 мг) [получен согласно O. Huttenloch, E. Laxman, H. Waldmann, Chem. Eur. J., 8(20), 4767 (2002)] в дихлорметане (2 мл) обрабатывали TBTU (188 мг) и диизопропиламином (350 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 16 час. Реакционную смесь обрабатывали добавлением водного раствора NH4Cl (5%) и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси толуол/ацетон в качестве элюента.
Выход: 153 мг. 1H ЯМР (CDCl3) δ 1,18 (д, 6H, изопропокси), 1,4 (ушир.с, 9Н, трет-Bu), 6,45 (с, 1H, H-2, пиррол), 6,69 (с, 1H, H7-Ar), 6,93 (с, 1H, H-9 Ar), 7,04, 7,27 (м, 3H, тиенил). ТСХ Rf = 0,62 (толуол/ацетон, 3/2). ЖХ/МС-ESI: [M+H]+ = 592.
(b). Гидрохлорид 3,7-диазабицикло[3.3.1]нон-3-ил)-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанона
К раствору продукта примера 20b (150 мг) в дихлорметане (10 мл) добавляли раствор HCl (3 мл, 2,0 M в простом эфире). Смесь перемешивали в течение 4 час и концентрировали в вакууме.
Выход: 110 мг (сырой продукт). ТСХ Rf = 0,23 (дихлорметан/метанол, 9/1).
(c). 1-[7-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-3,7-диазабицикло[3,3,1]нон-3-ил]этанон
Раствор сырого продукта примера 20b (66 мг) в дихлорметане (2 мл) обрабатывали диизопропиламином (100 мкл) и ацетилхлоридом (12 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 2 час и разбавляли водным раствором лимонной кислоты (10%) и экстрагировали дихлорметаном. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 100% ацетонитрил; система 1).
Выход: 29 мг. ТСХ Rf = 0,70 (дихлорметан/метанол, 9/1); ЖХ/MC-ESI: [M+H]+ = 534, 1H ЯМР (CDCl3) δ 1,18 (м, 6H, изопропил), 2,18 (с, 3H, ацетил), 3,85 (с, 3H, MeO), 3,0 (т, 2H, C6H2), 4,04 (т, 2H, C5H2), 6,33 (с, 1Н, Н пиррола), 6,69 (3, 1Н, Ar H7), 6,92 (с, 1Н, Ar H10); hFSHRago (CHO luc) EC50 = 8,2 нМ.
Пример 21
1-[7-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-3,7-диазабицикло[3.3.1]нон-3-ил]-2-метилсульфанилэтанон
Реакцию продукта примера 20b (55 мг) с метилсульфанилацетилхлоридом проводили согласно способу, описанному в примере 20c.
Выход: 36 мг. ЖХ/MC-ESI: [M+H]+ = 580. 1H ЯМР (CDCl3) δ 1,18 (м, 6, изопропил), 2,16 (с, 3, SCH3), 3,85 (с, 3, MeO), 3,0 (т, 2, C(6)H2) 4,04 (т, 2, C(5)H2), 6,35 (с, 1, Н пиррола), 6,70 (3, 1Н, Ar H7), 6,92 (с, 1, Ar H10); ); hFSHRago (CHO luc) EC50 = 77,8 нМ.
Пример 22
(7-Циклобутанкарбонил-3,7-диазабицикло[3.3.1]нон-3-ил)-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Сочетание продукта примера 20b (55 мг) с циклобутанкарбонилхлоридом проводили согласно способу, описанному в примере 20c.
Выход: 20 мг. ЖХ/МС-ESI: [M+H]+ = 574. hFSHRago (CHO luc) EC50 = 8,9 нМ.
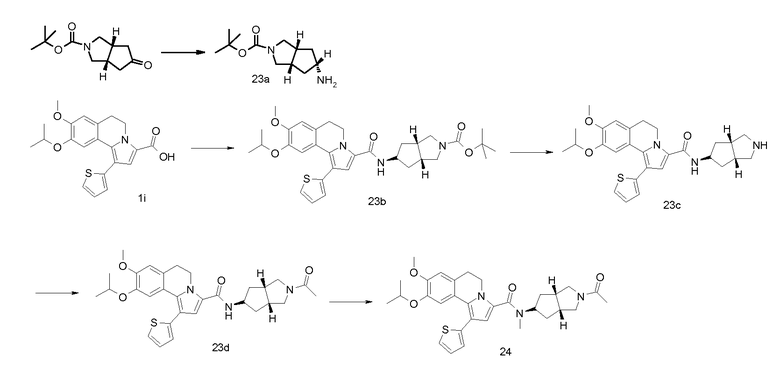
Пример 23
(2-Ацетилоктагидроциклопента[c]пиррол-5-(эндо)ил)амид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). трет-Бутиловый эфир (3aS,5R,6aR)-5-аминогесагидроциклопента[c]пиррол-2-карбоновой кислоты
Для синтеза карбоксамидов, получаемых из октагидроциклопента[c]пиррол-5-иламина, трет-бутиловый эфир 5-оксогексагидроциклопента[c]пиррол-2-карбоновой кислоты получали с применением хорошо документированных методик (реакция Pauson-Khand), исходя из аллилпропаргиламина; см. S.W. Brown, P.L. Pauson, J. Chem. Soc. Perkin Trans I 1205 (1990); D.P. Becker, D.L. Flynn, Tetrahedron Lett., 34(10) 2087 (1993); D.P. Decker, D.L. Flynn, Tetrahedron, 49(23), 5047 (1993); Y. Li, T. Marks, J. Am. Chem. Soc, 120, 1757 (1998).
Затем функциональную кетогруппу превращали в эндо-амин при помощи хорошо известной методики восстановительного аминирования через образование бензиламина с последующим восстановлением посредством Na(OAc)3BH и каталитическим дебензилированием (катализатор Pearlman).
(b). трет-Бутиловый эфир 5-(эндо)[(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)амино]гексагидроциклопента[c]пиррол-2-карбоновой кислоты
К смеси продукта примера 1i (220 мг) и продукта примера 23a (145 мг) в ДМФА (1,5 мл) добавляли N-этилморфолин (100 мкл) и TBTU (200 мг). Реакционную смесь перемешивали при комнатной температуре в течение 2 час. Добавляли воду (5 мл) с последующим фильтрованием и сушкой осадка. Растирание со смесью гептан/диизопропиловый простой эфир давало продукт.
Выход: 260 мг. Т.пл. 199-200°С; ТСХ Rf = 0,35 (гептан/этилацетат, 1/1).
(c). Гидрохлорид (октагидроциклопента[c]пиррол-5-(эндо)ил)амида 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К раствору продукта примера 23b (250 мг) в дихлорметане (10 мл) добавляли раствор HCl (4 мл, 2 M раствор в простом эфире). Реакционную смесь перемешивали в течение 2 час и концентрировали в вакууме. Остаток обрабатывали простым эфиром, получая при этом белое твердое вещество.
Выход: 210 мг. Т.пл. 140-142°С.
(d). (2-Ацетилоктагидроциклопента[c]пиррол-5-(эндо)ил)амид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Раствор продукта примера 23c (210 мг) в этилацетате (10 мл) обрабатывали водным насыщ. раствором NaHCO3 для выделения амина из его соли с HCl. Органический раствор концентрировали в вакууме. Остаток растворяли в пиридине (2 мл) и обрабатывали уксусным ангидридом (150 мкл) и DMAP (5 мг). Реакционную смесь перемешивали при 66°С в течение 10 мин. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Оставшийся остаток обрабатывали простым эфиром.
Выход: 170 мг. Т.пл. 207-208°С; ЖХ/МС-ESI: [M+H]+ = 534,5; ТСХ Rf = 0,45 (дихлорметан/ацетон, 1/1); hFSHRago (CHO luc) EC50 = 787,0 нМ.
Пример 24
(2-Ацетилоктагидроциклопента[c]пиррол-5-(эндо)ил)метиламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Раствор продукта примера 23d (50 мг) в сухом ДМФА (1 мл) обрабатывали гидридом натрия (17 мг, 60% дисперсия в масле) и перемешивали в течение 15 мин при 65°С. Затем смесь охлаждали до комнатной температуры и добавляли метилиодид (35 мкл). Спустя 30 мин метилирование было завершено. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/ацетон в качестве элюента, получая при этом аморфное белое твердое вещество.
Выход: 170 мг. ТСХ Rf = 0,45 (дихлорметан/ацетон, 1/1); ЖХ/МС-ESI: [M+H]+ = 548,5; hFSHRago (CHO luc) EC50 = 191,0 нМ.
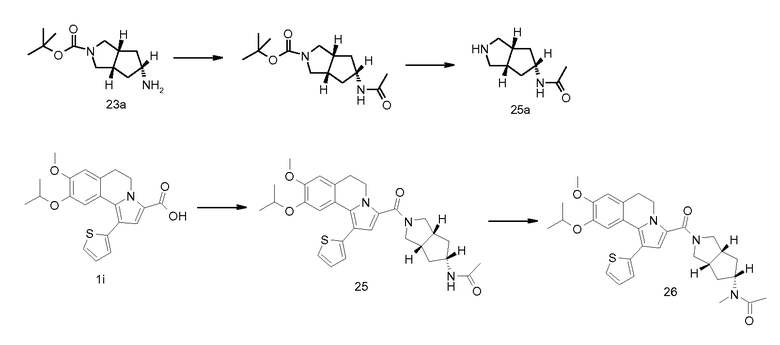
Пример 25
N-[2-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)октагидроциклопента[c]пиррол-5-эндо-ил]ацетамид
(a). 5-Эндо-N-(октагидроциклопента[c]пиррол-5-ил)ацетамид
Продукт примера 23a (100 мг) ацетилировали уксусным ангидридом в пиридине, удаляли его защитную группу посредством HCl в дихлорметане, получая при этом гигроскопичную гидрохлоридную соль.
Выход: 105 мг. ЖХ/МС-ESI: [M+H]+ = 169,3.
(b). N-[2-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)октагидроциклопента[c]пиррол-5-эндо-ил]ацетамид
Смесь продукта примера 1i (153 мг) и продукта примера 25a (75 мг) в сухом ДМФА (2 мл) обрабатывали N-этилморфолином (200 мкл) и TBTU (160 мг). Реакционную смесь перемешивали при комнатной температуре в течение 16 час, выливали в воду и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле в смеси дихлорметан/ацетон.
Выход: 130 мг. Т.пл. 106-112°С; ЖХ/МС-ESI: [M+H]+ = 534,5; ТСХ Rf = 0,52 (дихлорметан/ацетон, 1/1); hFSHRago (CHO luc) EC50 = 45,4 нМ.
Пример 26
N-[2-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбонил)октагидроциклопента[c]пиррол-5-ил]-N-метилацетамид
Метилирование продукта примера 25b (50 мг) проводили согласно способу, описанному в примере 24.
Выход: 35 мг. ТСХ Rf = 0,58 (дихлорметан/ацетон, 1/1); ЖХ/МС-ESI: [M+H]+ = 548,3; hFSHRago (CHO luc) EC50 = 173,0 нМ.
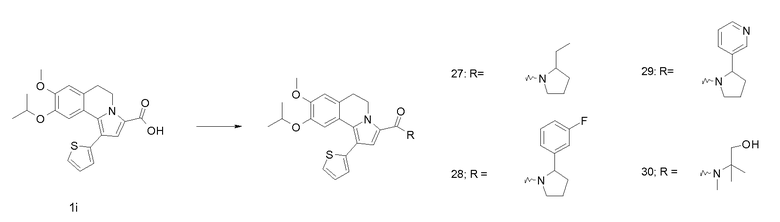
Пример 27
(2-Этилпирролидин-1-ил)-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Смесь продукта примера 1i (168 мг), 2-этилпирролидина (130 мг), N-этилморфолина (170 мкл) и TBTU (260 мг) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20% → 100% ацетонитрил; система 2).
Выход: 150 мг. ЖХ/МС-ESI: [M+H]+ = 465,3; hFSHRago (CHO luc) EC50 = 16,2 нМ.
Пример 28
[2-(3-Фторфенил)пирролидин-1-ил]-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Данный продукт получали из продукта примера 1i (168 мг) и 2-(3-фторфенил)пирролидина таким же способом, как описано для примера 27.
Выход: 187 мг. ЖХ/МС-ESI: [M+H]+ = 531,3; hFSHRago (CHO luc) EC50 = 752,0 нМ
Пример 29
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-(2-пиридин-3-илпирролидин-1-ил)метанон
Данный продукт получали из продукта примера 1i (168 мг) и 3-пирролидин-2-илпиридина способом, сходным со способом, описываемым для примера 27. Остаток очищали препаративной ВЭЖХ (20% → 100% ацетонитрил; система 2).
Выход: 174 мг. ЖХ/МС-ESI: [M+H]+ = 514,3; hFSHRago (CHO luc) EC50 = 624,0 нМ.
Пример 30
(2-Гидрокси-1,1-диметилэтил)метиламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Данный продукт получали из продукта примера 1i (60 мг) и 2-метил-2-метиламинопропан-1-ола [получен согласно S.G. Kuznetsov, A. V. Eltsov, J. Gen. Chem. USSR, 32, 502 (1962)] таким же способом, сходным со способом, описанным для примера 27.
Выход: 14 мг. ЖХ/МС-ESI: [M+H]+ = 469,5; т.пл. 150-152°С; hFSHRago (CHO luc) EC50 = 1,0 нМ.
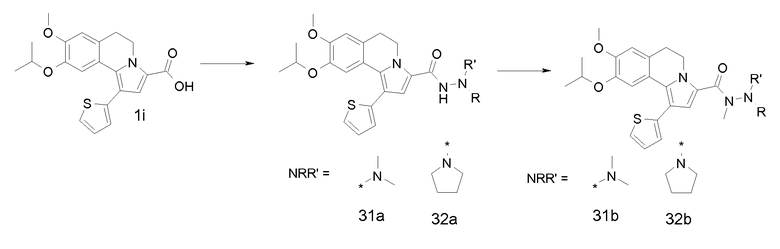
Пример 31
Триметилгидразид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(а) N',N'-Диметилгидразид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 1i (75 мг), DIPEA (0,171 мл), HATU (112 мг) и 1,1-диметилгидразина (19,5 мкл) в дихлорметане (2 мл) перемешивали в течение 1 час при комнатной температуре. Реакционную смесь разбавляли дихлорметаном и промывали насыщ. водным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния с применением смеси гептан/этилацетат [7/3 → 1/1 (об./об.)] в качестве элюента.
Выход: 75 мг. ЖХ/МС-ESI: [M+H]+ = 426,1.
(b). Триметилгидразид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Метилиодид (11 мкл) добавляли к раствору продукта примера 31а (72 мг) и KOH (10 мг) в ацетоне (5 мл). После перемешивания в течение 1 час при комнатной температуре реакционную смесь разбавляли этилацетатом и промывали насыщ. водным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10 → 90% ацетонитрил, 0,1% TFA; система 1).
Выход: 42 мг. ЖХ/МС-ESI: [M+H]+ = 440,1; анал. ВЭЖХ: Rt = 17,61 мин (способ 4); hFSHRago (CHO luc) EC50 = 241,0 нМ.
Пример 32
Метилпирролидин-1-иламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Пирролидин-1-иламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Получение гидразида реакцией продукта примера 1i (75 мг) с гидрохлоридом пирролидин-1-иламина (31 мг) проводили согласно способу, описанному в примере 31a.
Выход: 94 мг. ЖХ/МС-ESI: [M+H]+ = 452,1.
(b). Метилпирролидин-1-иламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Метилирование продукта примера 32a (94 мг) проводили согласно способу, описанному в примере 31b.
Выход: 51 мг. ЖХ/МС-ESI: [M+H]+ = 466,1; анал. ВЭЖХ: Rt= 18,92 мин (способ 4); hFSHRago (CHO luc) EC50 = 55,2 нМ.
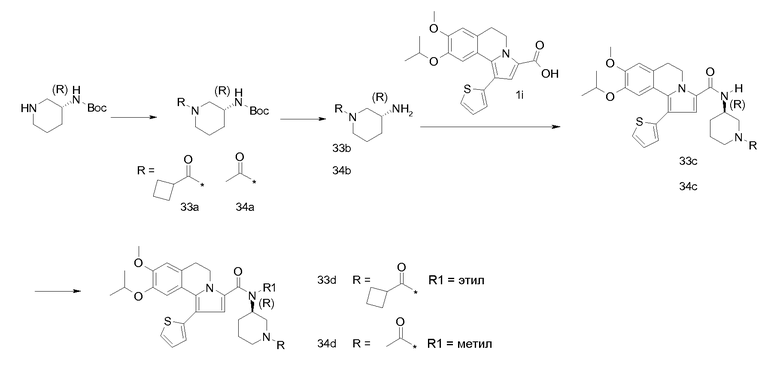
Пример 33
((R)-1-Циклобутанкарбонилпиперидин-3-ил)этиламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и ((R)-1-циклобутанкарбонилпиперидин-3-ил)амид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). трет-Бутиловый эфир ((R)-1-циклобутанкарбонилпиперидин-3-ил)карбаминовой кислоты
Ацилирование трет-бутилового эфира (R)-пиперидин-3-илкарбаминовой кислоты (300 мг) циклобутилкарбонилхлоридом (0,342 мл) проводили согласно способу, описанному для примера 20c. Остаток концентрировали в вакууме и применяли в следующей стадии без очистки.
Выход: 423 мг.
(b). ((R)-3-Аминопиперидин-1-ил)циклобутилметанон
Удаление защитной группы у продукта примера 33a (423 мг) проводили согласно способу, описанному для примера 7b.
Выход: 327 мг (в виде соли HCl).
(c). ((R)-1-Циклобутанкарбонилпиперидин-3-ил)амид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Получение амида реакцией продукта примера 33b (214 мг) с продуктом примера 1i (250 мг) проводили согласно способу, описанному для примера 13. Остаток очищали хроматографией на диоксиде кремния с применением смеси толуол/ацетон [100/0 → 6/4 (об./об.)] в качестве элюента.
Выход: 316 мг. MC-ESI: [M+H]+ = 548,5; анал. ВЭЖХ: Rt = 25,16 мин (способ 2); hFSHRago (CHO luc) EC50 = 252 нМ.
(d). ((R)-1-Циклобутанкарбонилпиперидин-3-ил)этиламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Этилиодид (80 мкл) и гидрид натрия (12,6 мг, 60% дисперсия в масле) добавляли к раствору продукта примера 33с (69 мг) в ДМФА (1 мл). После перемешивания в течение 3 час при 50°С реакционную смесь разбавляли дихлорметаном и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10% → 100% ацетонитрил; система 1).
Выход: 26,4 мг. MC-ESI: [M+H]+ = 576,5; анал. ВЭЖХ: Rt = 26,46 мин (способ 2); hFSHRago (CHO luc) EC50 = 279 нМ.
Пример 34
((R)-1-Ацетилпиперидин-3-ил)метиламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и ((R)-1-ацетилпиперидин-3-ил)амид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(а). трет-Бутиловый эфир ((R)-1-ацетилпиперидин-3-ил)карбаминовой кислоты
Ацилирование трет-бутилового эфира ((R)-1-ацетилпиперидин-3-ил)карбаминовой кислоты (300 мг) ацетилхлоридом (0,214 мл) проводили согласно способу, описанному для примера 20c. Остаток концентрировали в вакууме и применяли в следующей стадии без очистки.
Выход: 348 мг.
(b). 1-((R)-3-Аминопиперидин-1-ил)этанон
Удаление защитной группы у продукта примера 34а (348 мг) проводили согласно способу, описанному для примера 7b.
Выход: 256 мг (в виде соли HCl).
(c). ((R)-1-Ацетилпиперидин-3-ил)амид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Получение амида реакцией продукта примера 34b (175 мг) с продуктом примера 1i (250 мг) проводили согласно способу, описанному для примера 13. Остаток очищали хроматографией на диоксиде кремния с применением смеси толуол/ацетон [100/0 → 4/6 (об./об.)] в качестве элюента. Продукт очищали препаративной ВЭЖХ (10% → 90% ацетонитрил; система 1).
Выход: 32 мг. MC-ESI: [M+H]+ = 508,3; анал. ВЭЖХ: Rt = 18,32 мин (способ 1); hFSHRago (CHO luc) EC50 = 251 нМ.
(d). ((R)-1-Ацетилпиперидин-3-ил)метиламид 9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Алкилирование продукта примера 34c (50 мг) метилиодидом (62,3 мкл) проводили согласно способу, описанному для примера 33d.
Выход: 36,6 мг. МС-ESI: [M+H]+ = 522,5; анал. ВЭЖХ: Rt = 18,45 мин (способ 1); hFSHRago (CHO luc) EC50 = 496,0 нМ.
Пример 35
(9-Изопропокси-8-метокси-1-пиридин-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(пиридин-2-карбонил)-[1,4]диазепан-1-ил]метанон; соль трифторуксусной кислоты
(a). Этиловый эфир 9-изопропокси-8-метокси-1-пиридин-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 1f (800 мг) и этилоксалилхлорида (0,4 мл) в ТГФ (5 мл) перемешивали и нагревали с применением микроволнового излучения при 100°С в течение 5 мин. Реакционную смесь концентрировали в вакууме. Смесь остатка и 2-этинилпиридина (340 мкл) в уксусном ангидриде (5 мл) перемешивали и нагревали с применением микроволнового излучения при 140°С в течение 15 мин. При комнатной температуре реакционную смесь разбавляли этилацетатом и экстрагировали насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 960 мг. МС-ESI: [M+H]+ = 407,5.
(b). 9-Изопропокси-8-метокси-1-пиридин-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 35a (850 мг) и твердого KOH (500 мг) в этаноле (15 мл) и воде (15 мл) перемешивали при 80°С в течение 1 час. При комнатной температуре реакционную смесь нейтрализовали раствором HCl (1,0 M) до pH = 6-7 и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 673 мг. МС-ESI: [M+H]+ = 379,3.
(c). трет-Бутиловый эфир 4-(9-изопропокси-8-метокси-1-пиридин-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-карбоновой кислоты
К раствору продукта примера 35b (473 мг), DIPEA (1,0 мл) и трет-бутилового эфира [1,4]диазепан-1-карбоновой кислоты (370 [мкл) в дихлорметане (5 мл) добавляли HATU (950 мг). После перемешивания при комнатной температуре в течение 18 час реакционную смесь промывали насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 75% ацетонитрил; 0,1% TFA; система 2).
Выход: 768 мг. МС-ESI: [M+H]+ = 561,5.
(d). [1,4]Диазепан-1-ил-(9-изопропокси-8-метокси-1-пиридин-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
При комнатной температуре TFA (1 мл) добавляли по каплям к раствору продукта примера 35c (768 мг) в дихлорметане (9 мл). После перемешивания при комнатной температуре в течение 18 час реакционную смесь концентрировали в вакууме.
Выход: 630 мг. МС-ESI: [M+H]+ = 461,3.
(e). (9-Изопропокси-8-метокси-1-пиридин-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(пиридин-2-карбонил)-[1,4]диазепан-1-ил]метанон; соль трифторуксусной кислоты
Смесь продукта примера 35d (105 мг), DIPEA (200 мкл), пиридин-2-карбоновой кислоты (57 мг) и HATU (350 мг) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 75% ацетонитрил; 0,1% TFA; система 1).
Выход: 96 мг. МС-ESI: [M+H]+ = 566,5; анал. ВЭЖХ Rt = 15,08 мин (способ 4); hFSHRago (CHO luc) EC50 = 244,0 нМ.
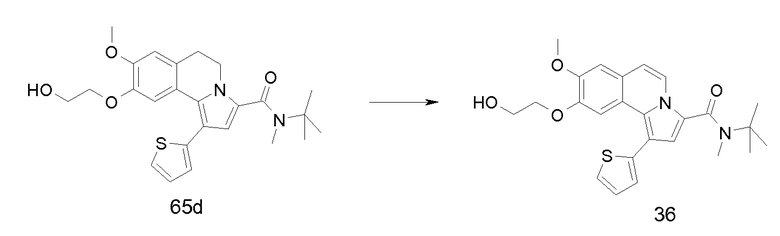
Пример 36
трет-Бутилметиламид 9-(2-гидроксиэтокси)-8-метокси-1-тиофен-2-илпирроло[2,1-а]изохинолин-3-карбоновой кислоты
2,3-Дихлор-5,6-дициано-1,4-бензохинон (197 мг) добавляли к раствору продукта примера 65d (376 мг) в толуоле (10 мл). После перемешивания в течение 7 час при комнатной температуре реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10 → 100% ацетонитрил; система 2).
Выход: 200 мг. ЖХ/МС-ESI: [M+H]+ = 453,2; анал. ВЭЖХ: Rt = 15,79 мин (способ 11); hFSHRago (CHO luc) EC50 = 2,5 нМ
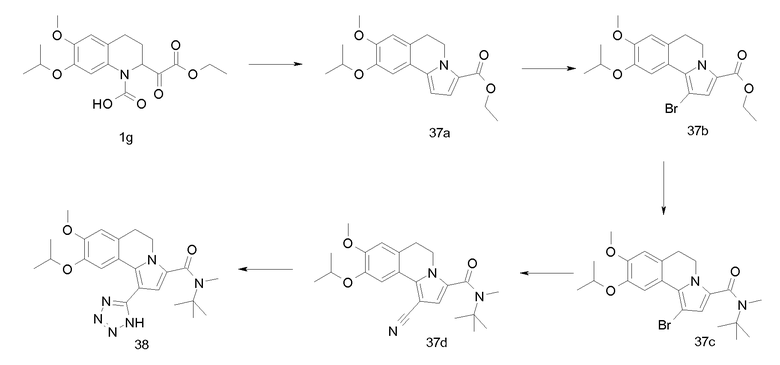
Пример 37
трет-Бутилметиламид 1-циано-9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и трет-бутилметиламид 1-бром-9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 1g (6,5 г) и триметилсилилацетилена (3,3 мл) в уксусном ангидриде (15 мл) перемешивали и нагревали с применением микроволнового излучения в течение 15 мин при 140°С. Реакционную смесь концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 3/1 (об./об.)] в качестве элюента.
Выход: 1,8 г. ЖХ/МС-ESI: [M+H]+ = 330,1.
(b). Этиловый эфир 1-бром-9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
N-Бромсукцинимид (980 мг) добавляли к раствору продукта примера 37a (1,8 г) в ДМФА (20 мл). После перемешивания в течение 3 час при комнатной температуре реакционную смесь концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [4/1 → 1/4 (об./об.)] в качестве элюента.
Выход: 1,65 г. ЖХ/МС-ESI: [M+H]+ = 408,1/410,1 (1:1).
(c). трет-Бутилметиламид 1-бром-9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Водный раствор NaOH (8 мл, 2 н) добавляли к раствору продукта примера 37b (1,6 г) в этаноле (50 мл). После перемешивания в течение 4 час при 70°С реакционную смесь концентрировали до малого объема, разбавляли этилацетатом и промывали водным раствором HCl (2 н) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Этот остаток растворяли в ДМФА (10 мл) и добавляли HATU (2,1 г), N-метил-N-трет-бутиламин (3,4 мл) и DIPEA (3,1 мл). После перемешивания в течение 18 час при комнатной температуре, реакционную смесь выливали в насыщ. водный раствор NH4Cl, твердые вещества собирали фильтрованием и промывали водой. Твердые вещества растворяли в этилацетате, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 1,76 г. ЖХ/МС-ESI: [M+H]+ = 409,1/412,1 (1:1); hFSHRago (CHO luc) EC50 = 234,0 нМ.
(d). трет-Бутилметиламид 1-циано-9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 37c (485 мг), иодида меди(I) (21 мг), симм.-диметилэтилендиамина (236 мкл) и цианида меди(I) (197 мг) в NMP (10 мл) перемешивали и нагревали с применением микроволнового излучения в течение 20 мин при 200°С. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали смесью насыщ. водный NaCl/насыщ. водный NH4Cl (1:1), сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 1/1 (об./об.)] в качестве элюента.
Выход: 326 мг. ЖХ/МС-ESI: [M+H]+ = 330,1; анал. ВЭЖХ: Rt = 15,88 мин (способ 7); hFSHRago (CHO luc) EC50 = 67,1 нМ.
Пример 38
трет-Бутилметиламид 9-изопропокси-8-метокси-1-(1H-тетразол-5-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 37d (22,5 мг) и азидотрибутилолова (20 мкл) в ксилоле (200 мкл) перемешивали при 110°С в течение 44 час. Реакционную смесь очищали непосредственно хроматографией на диоксиде кремния с применением смеси гептан/этилацетат [1/0 → 6/4 (об./об.)] в качестве элюента.
Выход: 9,6 мг. ЖХ/МС-ESI: [M+H]+ = 439,3; анал. ВЭЖХ: Rt= 11,49 мин (способ 10); hFSHRago (CHO luc) EC50 = 1640,0 нМ.
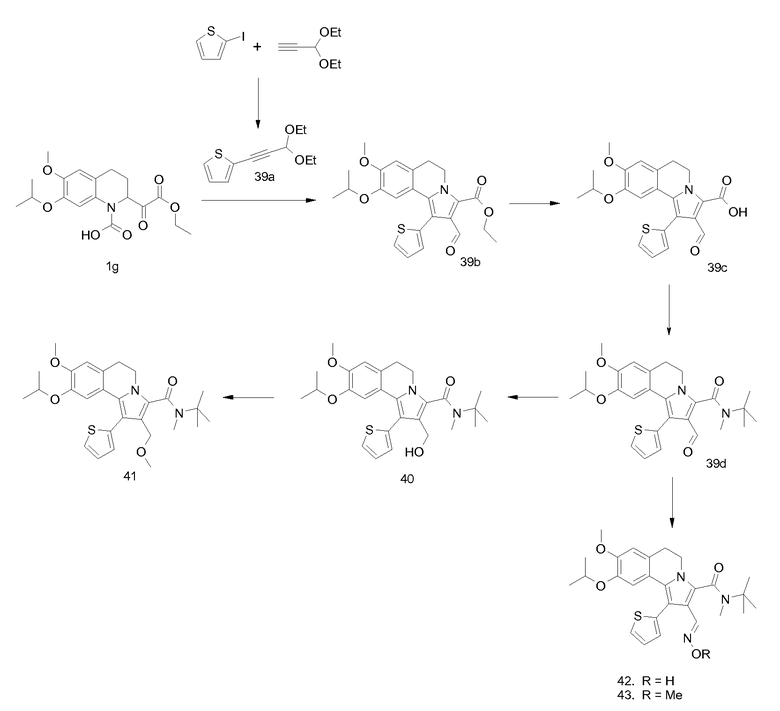
Пример 39
трет-Бутилметиламид 2-формил-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). 2-(3,3-Диэтоксипроп-1-инил)тиофен
К раствору диэтилацеталя пропаргилальдегида (405 мг) в диизопропиламине (8 мл) добавляли 2-иодтиофен (1,2 г) и моногидрат ацетата меди(II) (66,4 мг). Суспензию промывали струей N2. Добавляли Pd(PPh3)4 (75 мг), реакционную смесь снова промывали азотом. Суспензию перемешивали в течение 1 час при 55°С. Образовывался осадок и реакционную смесь было необходимо разбавить диизопропиламином (6 мл), чтобы ее можно было перемешивать. Реакционную смесь фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 17/3 (об./об.)] в качестве элюента.
Выход: 680 мг.
(b). Этиловый эфир 2-формил-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 1g (300 мг) и продукта примера 39a (350 мг) в уксусном ангидриде (6,5 мл) перемешивали и нагревали с применением микроволнового излучения в течение 12 мин при 140°С. Реакционную смесь концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 3/2 (об./об.)] в качестве элюента.
Выход: 283 мг. ЖХ/МС-ESI: [M+H]+ = 440,2.
(c). 2-Формил-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота (натриевая соль)
Водный раствор NaOH (5 мл, 2 н) добавляли к раствору продукта примера 39b (220 мг) в этаноле (10 мл). После перемешивания в течение 2 час при 60°С реакционную смесь концентрировали в вакууме.
Выход: 216 мг.
(d). трет-Бутилметиламид 2-формил-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
HATU (103 мг), N-метил-N-трет-бутиламин (125 мкл) и DIPEA (182 мкл) добавляли к раствору продукта примера 39c (86 мг) в NMP (5 мл). После перемешивания в течение 3 час при комнатной температуре реакционную смесь выливали в воду и экстрагировали этилацетатом (2x). Органические слои объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 45 мг. ЖХ/МС-ESI: [M+H]+ = 481,2; анал. ВЭЖХ: Rt = 16,90 мин (способ 7); hFSHRago (CHO luc) EC50 = 2,7 нМ.
Пример 40
трет-Бутилметиламид 2-гидроксиметил-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Борогидрид натрия (3,6 мг) добавляли к раствору продукта примера 39d (38 мг) в метаноле (5 мл). После перемешивания в течение 2 час при комнатной температуре добавляли дополнительное количество борогидрида натрия (3,6 мг) и реакционную смесь перемешивали в течение 18 час при комнатной температуре. Реакционную смесь концентрировали в вакууме и очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 1/1 (об./об.)] в качестве элюента.
Выход: 27 мг. ЖХ/МС-ESI: [M+H]+ = 482,3; анал. ВЭЖХ: Rt = 14,77 мин (способ 7); hFSHRago (CHO luc) EC50 = 8,8 нМ.
Пример 41
трет-Бутилметиламид 9-изопропокси-8-метокси-2-метоксиметил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 40 (20 мг), гидрида натрия (3,3 мг, 60% дисперсия в масле) и иодметана (13 мкл) в THF (2,5 мл) перемешивали в течение 18 час при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органические слои объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 1/1 (об./об.)] в качестве элюента.
Выход: 12 мг. ЖХ-MC: [M+H]+ = 497,3; анал. ВЭЖХ: Rt = 20,40 мин (способ 7); hFSHRago (CHO luc) EC50 = 2,8 нМ.
Пример 42
трет-Бутилметиламид 2-(гидроксииминометил)-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоновой кислоты
Смесь продукта примера 39d (74 мг) и гидрохлорида гидроксиламина (21,5 мг) в пиридине (1,5 мл) перемешивали в течение 18 час при комнатной температуре. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли. Органические слои объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 3/7 (об./об.)] в качестве элюента.
Выход: 40 мг. MC: [M+H]+ = 496,3; анал. ВЭЖХ: Rt = 15,33 мин (способ 7); hFSHRago (CHO luc) EC50 = 1,2 нМ.
Пример 43
трет-Бутилметиламид 9-изопропокси-8-метокси-2-(метоксииминометил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Получение метоксима реакцией продукта примера 39d (76 мг) с гидрохлоридом О-метилгидроксиламина (26,4 мг) проводили согласно способу, описанному в примере 42.
Выход: 60 мг. МС-ESI: [M+H]+ = 452,1; анал. ВЭЖХ; Rt = 22,60 мин (способ 7); hFSHRago (CHO luc) EC50 = 4,3 нМ.
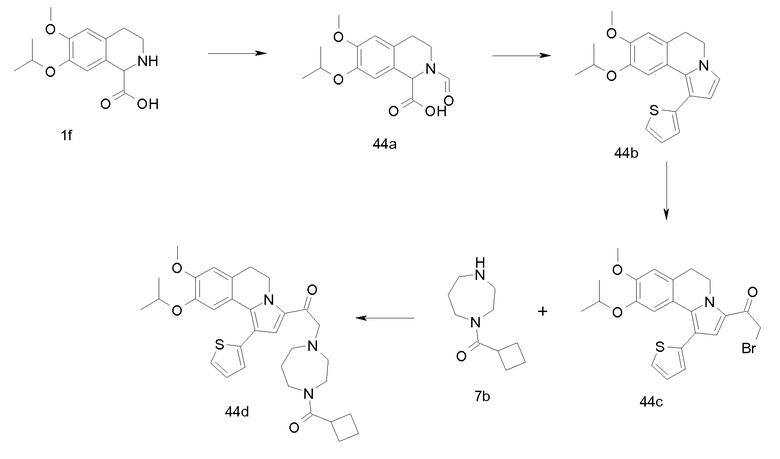
Пример 44
2-(4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)этанон
(a). 2-Формил-7-изопропокси-6-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Уксусный ангидрид (8,9 мл) добавляли по каплям к охлажденному раствору продукта примера 1f (5 г), растворенного в муравьиной кислоте (35,5 мл), при 5°С. Реакционную смесь разбавляли смесью лед-вода и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [95/5 (об./об.)] в качестве элюента.
Выход: 2,28 г. ЖХ/МС-ESI: [M+H]+ = 294,3.
(b). 9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин
Смесь продукта примера 44a (400 мг) и 2-этинилтиофена (134 мкл) в смеси тетрагидрофуран/уксусный ангидрид = 1:1 (об./об.) (10 мл) перемешивали и нагревали с применением микроволнового излучения при 140°С в течение 15 мин. Реакционную смесь нейтрализовали насыщ. водным раствором NaHCO3 и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [7/3 (об./об.)] в качестве элюента.
Выход: 209 мг. ЖХ/МС-ESI: [M+H]+ = 340,2.
(c). 2-Бром-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)этанон
Бромацетилбромид (902 мкл) добавляли по каплям к перемешиваемому раствору продукта примера 44b (1,17 г) в диоксане (50 мл). Спустя 1 час реакционную смесь гасили насыщ. водным раствором NaHCO3, промывали водой и насыщенным раствором соли. Органические слои объединяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме.
Выход: 209 мг. ЖХ/МС-ESI: [M+H]+ = 460,0/462,0.
(d). 2-(4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)этанон
Смесь продукта примера 44c (105 мг), DIPEA (200 мкл) и продукта примера 7b (125 мг) в ТГФ (4 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали водой и насыщенным раствором соли. Органические слои объединяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10→100% ацетонитрил, 0,1% TFA; система 1).
Выход: 15 мг (в виде соли TFA). ЖХ/МС-ESI: [M+H]+ = 562,3; анал. ВЭЖХ: Rt = 13,47 (способ 2); hFSHRago (CHO luc) EC50 = 1120,0 нМ.
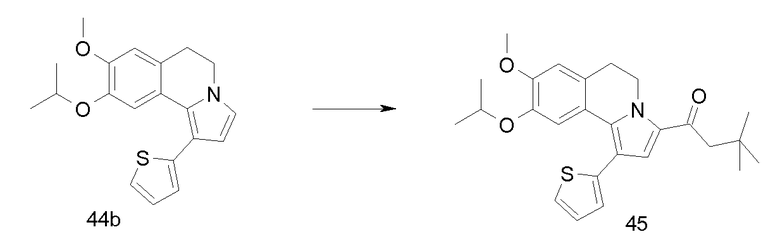
Пример 45
1-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-a]изохинолин-3-ил)-3,3-диметилбутан-1-он
Смесь продукта примера 44b (100 мг), 3,3-диметилбутирилхлорида (102 мкл) и AlCl3 (каталитическое количество) в диоксане (4 мл) перемешивали при комнатной температуре в течение 64 час. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (30→100% ацетонитрил; система 1).
Выход: 56 мг. ЖХ/МС-ESI: [M+H]+ = 438,1; анал. ВЭЖХ: Rt = 27,07 (способ 3); hFSHRago (CHO luc) EC50 = 65,1 нМ.
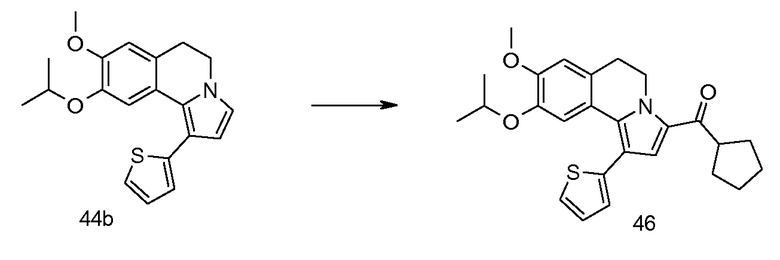
Пример 46
Циклопентил-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-а]изохинолин-3-ил)метанон
Смесь продукта примера 44b (100 мг), циклопентанкарбонилхлорида (90 мкл) и AlCl3 (40 мг) в диоксане (4 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли. Органические слои объединяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (30→100% ацетонитрил; система 1).
Выход: 29 мг. ЖХ/МС-ESI: [M+H]+ = 436,1; анал. ВЭЖХ: Rt = 26,71 (способ 3); hFSHRago (CHO luc) EC50 = 78,2 нМ.
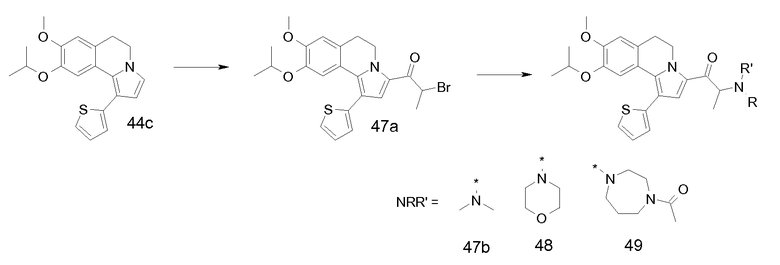
Пример 47
2-Диметиламино-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)пропан-1-он
(a). 2-Бром-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-ил)пропан-1-он
2-Бромпропионилбромид (0,625 мл) добавляли по каплям к раствору продукта примера 44b (500 мг) в диоксане (20 мл). После перемешивания в течение 18 час при комнатной температуре реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 700 мг. ЖХ/МС-ESI: [M+H]+ = 474/476.
(b). 2-Диметиламино-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)пропан-1-он
Смесь продукта примера 47a (50 мг) и диметиламина (0,133 мл, 40% масс. в воде) перемешивали в течение 1 час при 60°С. Реакционную смесь разбавляли дихлорметаном и промывали насыщ. водным раствором NaHCO3. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10% → 90% ацетонитрил, 0,1% TFA; система 1).
Выход: 20 мг. ЖХ/МС-ESI: [M+H]+ = 439,1; hFSHRago (CHO luc) EC50 = 149,0 нМ.
Пример 48
1-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-2-морфолин-4-илпропан-1-он
Замену брома в продукте примера 47a (68 мг) морфолином (38 мкл) проводили согласно способу, описанному в примере 47b.
Выход: 32 мг. МС-ESI: [M+H]+ = 481,3; анал. ВЭЖХ: Rt = 18,64 (способ 4); hFSHRago (CHO luc) EC50 = 89,4 нМ.
Пример 49
2-(4-Ацетил-[1,4]диазепан-1-ил)-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)пропан-1-он
Замену брома в продукте примера 47a (75 мг) 1-[1,4]диазепан-1-ил-этаноном (0,106 мл) проводили согласно способу, описанному в примере 47b.
Выход: 28 мг. МС-ESI: [M+H]+ = 536,5; анал. ВЭЖХ: Rt = 18,37 (способ 4); hFSHRago (CHO luc) EC50 = 200,0 нМ.
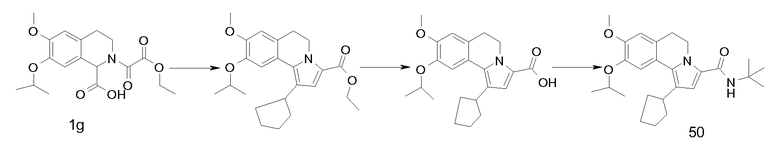
Пример 50
1-Циклопентил-9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-трет-бутиламид
Реакцию продукта примера 1g (270 мг) и этинилциклопентана (100 мг) проводили в условиях, аналогичных условиям примера 1, получая при этом 1-циклопентил-9-изопропокси-8-метокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновую кислоту. Кислоту (18 мг) обрабатывали трет-бутиламином в стандартных условиях амидного сочетания с HATU, как описано в примере 1j. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [0 → 100% изопропиламин (об./об.)] в качестве элюента.
Выход: 19 мг. ЖХ/МС-ESI: [M+H]+ = 425; hFSHRago (CHO luc) EC50 = 220,0 нМ.
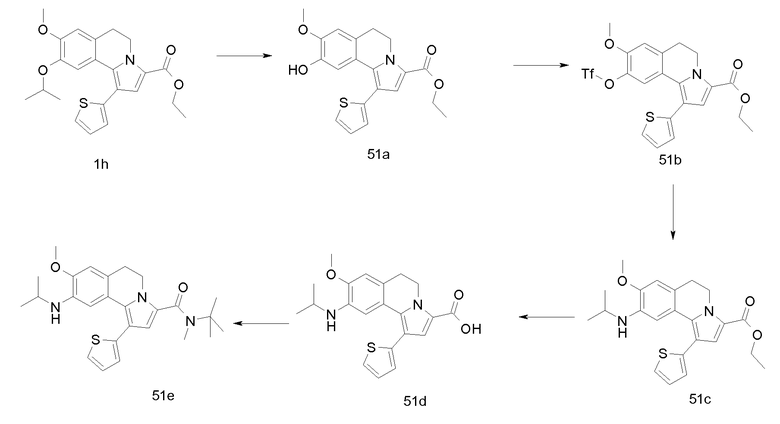
Пример 51
трет-Бутилметиламид 9-изопропиламино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 9-гидрокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Трихлорид бора (100 мл) добавляли по каплям к раствору продукта примера 1h (51,2 г) в дихлорметане (400 мл) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 3 час. Реакционную смесь выливали в воду и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [30→50% (об./об.)] в качестве элюента.
Выход: 44,3 г.
(b). Этиловый эфир 8-метокси-1-тиофен-2-ил-9-трифторметансульфонилокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Трифторметансульфоновый ангидрид (982 мкл) добавляли по каплям к раствору продукта примера 51a (716 мг) в пиридине (5 мл) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 18 час. Реакционную смесь разбавляли этилацетатом и промывали водным раствором HCl (1 н). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/1 (об./об.)] в качестве элюента.
Выход: 875 мг. ЖХ/МС-ESI: [M+H]+ = 502,1.
(c). Этиловый эфир 9-изопропиламино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 51b (100 мг), изопропиламина (42 мкл), трис(дибензилиденацетон)дипалладия(0) (5 мг), фосфата калия (130 мг) и 2-(ди-трет-бутилфосфино)бифенила (10 мг) перемешивали и нагревали с применением микроволнового излучения при 150°С в течение 1 час. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме. Остаток хроматографировали на силикагеле с применением смеси гептан/этилацетат [1/1 (об./об.)].
Выход: 73 мг. ЖХ/МС-ESI: [M+H]+ = 411,1.
(d). 9-Изопропиламино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 51c (73 мг) и KOH (избыток) в смеси метанол/вода [1/1 (2 мл)] перемешивали при кипячении с обратным холодильником в течение 1 час. Реакционную смесь выливали в воду, подкисляли водным раствором лимонной кислоты (1 M) и экстрагировали дихлорметаном. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 58 мг. ЖХ/МС-ESI: [M+H]+ = 383,2.
(e). трет-Бутилметиламид 9-изопропиламино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 51d (58 мг), DIPEA (79 мкл), HATU (86 мг) и N-метил-N-трет-бутиламина (187 мкл) в дихлорметане (3 мл) перемешивали при 40°С в течение 18 час. Реакционную смесь разбавляли дихлорметаном и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0→90% ацетонитрил; система 1).
Выход: 29,7 мг. MC-ESI: [M+H]+ = 452,3; анал. ВЭЖХ: Rt = 6,99 мин (способ 10); hFSHRago (CHO luc) EC50 = 4,2 нМ.
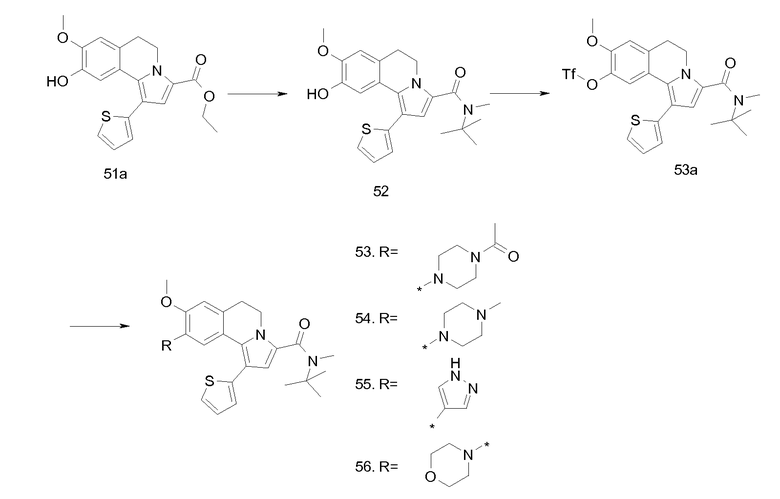
Пример 52
трет-Бутилметиламид 9-гидрокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3- карбоновой кислоты
Этилмагнийхлорид (50,8 мл 2 M раствора в ТГФ) добавляли к раствору N-метил-N-трет-бутиламина (13,4 мл) в сухом ТГФ (250 мл). Реакционную смесь перемешивали при 65°С течение 1 час. К реакционной смеси по каплям добавляли раствор продукта примера 51a (7,5 г) в сухом ТГФ (100 мл). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 1 час. Реакционную смесь гасили насыщ. водным раствором NH4Cl и экстрагировали этилацетатом. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток кристаллизовали из простого эфира.
Выход: 6,2 г. ЖХ/МС-ESI: [M+H]+ = 411,2; hFSHRago (CHO luc) EC50 = 356,0 нМ.
Пример 53
трет-Бутилметиламид 9-(4-ацетилпиперазин-1-ил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоновой кислоты
(a). 3-(трет-Бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-иловый эфир трифторметансульфоновой кислоты
Синтез 3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илового эфира трифторметансульфоновой кислоты 53а проводили согласно способу, описанному в примере 51b, исходя из 52 (6,2 г).
Выход: 7,45 г. ЖХ/МС-ESI: [M+H]+ = 543,1.
(b). трет-Бутилметиламид 9-(4-ацетилпиперазин-1-ил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоновой кислоты
Реакцию продукта примера 53a (100 мг) с 1-ацетилпиперазином (60 мг) проводили согласно способу, описанному в примере 51c.
Выход: 22 мг. МС-ESI [M+H]+ = 521,5; анал. ВЭЖХ: Rt = 8,71 мин (способ 10); hFSHRago (CHO luc) EC50 = 678,0 нМ.
Пример 54
трет-Бутилметиламид 8-метокси-9-(4-метилпиперазин-1-ил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Замена трифлатной части в продукте примера 53a (100 мг) 1-метилпиперазином (46 мг) проводили согласно способу, описанному в примере 51c.
Выход: 38 мг. МС-ESI [M+H]+ = 493,5; анал. ВЭЖХ: Rt = 27,45 мин (способ 12); hFSHRago (CHO luc) EC50 = 455,0 нМ.
Пример 55
трет-Бутилметиламид 8-метокси-9-(1H-пиразол-4-ил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Раствор продукта примера 53a (25,5 мг) в DME (2 мл) продували азотом. Добавляли Pd(PPh3)4 (0,5 мг) и раствор снова продували азотом. Затем добавляли K2CO3 (25,5 мг), пинаколовый эфир 1Н-пиразол-4-бороновой кислоты (26,8 мг) и воду (200 мкл). Реакционную смесь перемешивали при 90°С в течение 18 час. Реакционную смесь разбавляли дихлорметаном и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0→90% ацетонитрил, 0,1% TFA; система 1).
Выход: 10 мг. ЖХ/МС-ESI: [M+H]+ = 561,2, анал. ВЭЖХ: Rt = 36,38 мин (способ 12); hFSHRago (CHO luc) EC50 = 1,1 нМ.
Пример 56
трет-Бутилметиламид 8-метокси-9-морфолин-4-ил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Реакцию замещения продукта примера 53a (274 мг) морфолином (110 мкл) проводили согласно способу, описанному в примере 51c.
Выход: 65 мг. ЖХ/МС-ESI [M+H]+ = 480,3, анал. ВЭЖХ: Rt = 12,89 мин (способ 10); hFSHRago (CHO luc) EC50 = 15,7 нМ.
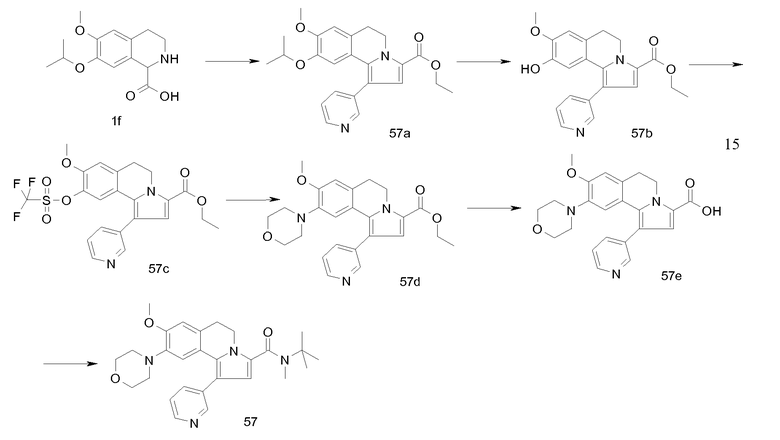
Пример 57
трет-Бутилметиламид 8-метокси-9-морфолин-4-ил-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты; соль трифторуксусной кислоты
(a). Этиловый эфир 9-изопропокси-8-метокси-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Синтез этилового эфира 9-изопропокси-8-метокси-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты (57a) проводят согласно способу, описанному для примера 35а, исходя из соединения 1f (1,5 г) и 3-этинилпиридина.
Выход: 2,08 г. МС-ESI: [M+H]+ = 407,4.
(b). Этиловый эфир 9-гидрокси-8-метокси-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Синтез этилового эфира 9-гидрокси-8-метокси-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты (57b) проводили согласно способу, описанному в примере 51а, исходя из соединения 57a (634 мг).
Выход: 613 мг. ЖХ/МС-ESI: [M+H]+ = 365,2.
(c). Этиловый эфир 8-метокси-1-пиридин-3-ил-9-трифторметансульфонилокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 57b (220 мг), Cs2CO3 (787 мг) и 1,1,1-трифтор-N-фенил-N-[(трифторметил)сульфонил]метансульфонамида (647 мг) в ДМФА (10 мл) перемешивали при 80°С в течение 2 час. При комнатной температуре реакционную смесь выливали в воду и экстрагировали дихлорметаном. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 140 мг. ЖХ/МС-ESI: [M+H]+ = 497,1.
(d). Этиловый эфир 8-метокси-9-морфолин-4-ил-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 57c (140 мг), морфолина (61 мкл), 2-(ди-трет-бутилфосфино)бифенила (каталитическое количество), фосфата калия (180 мг) и трис(дибензилиденацетон)дипалладия(0) (каталитическое количество) в DME (1 мл) перемешивали и нагревали с применением микроволнового излучения при 150°С в течение 1 час. При комнатной температуре реакционную смесь фильтровали и остаток промывали дихлорметаном. Фильтрат концентрировали в вакууме и очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:3 → 0:1 (об./об.)] в качестве элюента.
Выход: 101 мг. ЖХ/МС-ESI: [M+H]+ = 434,4.
(e). 8-Метокси-9-морфолин-4-ил-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 57d (101 мг), твердого KOH в этаноле (3 мл) и воде (3 мл) перемешивали при 78°С в течение 1 час. При комнатной температуре реакционную смесь подкисляли водным раствором лимонной кислоты (0,5 M) до pH = 5-6 и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 92 мг. ЖХ/МС-ESI: [M+H]+ = 406,1.
(f). трет-Бутилметиламид 8-метокси-9-морфолин-4-ил-1-пиридин-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты, соль трифторуксусной кислоты
HATU (129 мг) добавляли к раствору продукта примера 57e (92 мг), DIPEA (198 мкл) и N-метил-N-трет-бутиламина (54 мкл) в дихлорметане (5 мл). После перемешивания при комнатной температуре в течение 24 час реакционную смесь промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 100% ацетонитрил; 0,1% TFA; система 1).
Выход: 46 мг. Анал. ВЭЖХ Rt = 17,90 мин (способ 12); hFSHRago (CHO luc) EC50 = 276 нМ.
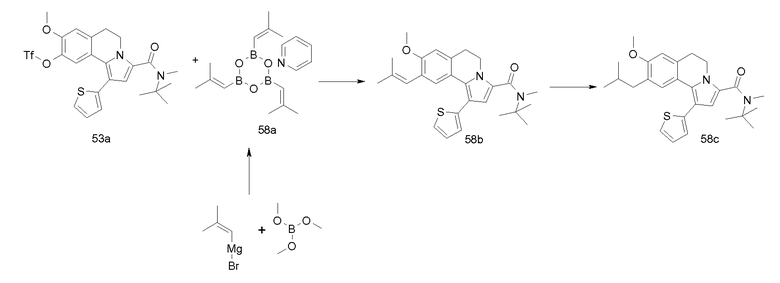
Пример 58
трет-Бутилметиламид 9-изобутил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и трет-бутилметиламид 8-метокси-9-(2-метилпропенил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). 2,4,6-Трис-(2-метилпропенил)-циклотрибороксанпиридин
2-Метил-1-пропенилмагнийбромид в ТГФ (536 мл, 0,5 M) добавляли по каплям к раствору триметилбората (54 мл) в ТГФ (320 мл) при -70°С. Реакционную смесь перемешивали при -70°С в течение 30 мин. К реакционной смеси добавляли водный раствор HCl (2 н) и реакционную смесь перемешивали при комнатной температуре в течение 1 час. pH регулировали до 4 водным раствором HCl (2 н). Реакционную смесь экстрагировали простым эфиром и промывали насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растворяли в пиридине (80 мл) и перемешивали на протяжении ночи при комнатной температуре. Реакционную смесь концентрировали в вакууме и остаточный пиридин удаляли совместным выпариванием с толуолом. Остаток сушили при комнатной температуре в вакууме (3 мм) в течение 1 час.
Выход: 27,5 г.
(b). трет-Бутилметиламид 8-метокси-9-(2-метилпропенил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Через раствор продукта примера 53a (5,39 г) в DME (150 мл) барботировали азот в течение 2 мин. Добавляли Pd(PPh3)4 (585 мг) и через раствор снова барботировали азот (газооб.) в течение 2 мин с последующим добавлением продукта примера 58a (4,98 г), K2CO3 (2 г) и воды (30 мл). Реакционную смесь перемешивали при 90°С в атмосфере азота на протяжении ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [0→50% (об./об.)].
Выход: 3 г. ЖХ/МС-ESI [M+H]+: 449,2; hFSHRago (CHO luc) EC50=0,7 нМ.
(c). трет-Бутилметиламид 9-изобутил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
10% палладий на угле (20 мг) добавляли к раствору продукта примера 58b (40 мг) в этилацетате (4 мл) и метаноле (4 мл). Реакционную смесь перемешивали в атмосфере водорода при комнатной температуре в течение 8 час. Реакционную смесь фильтровали, промывали этилацетатом и фильтрат концентрировали в вакууме.
Выход: 37 мг. ЖХ/МС-ESI [M+H]+: 451,2; анал. ВЭЖХ: Rt = 31,03 мин (способ 10); hFSHRago (CHO luc) EC50 = 4,3 нМ.
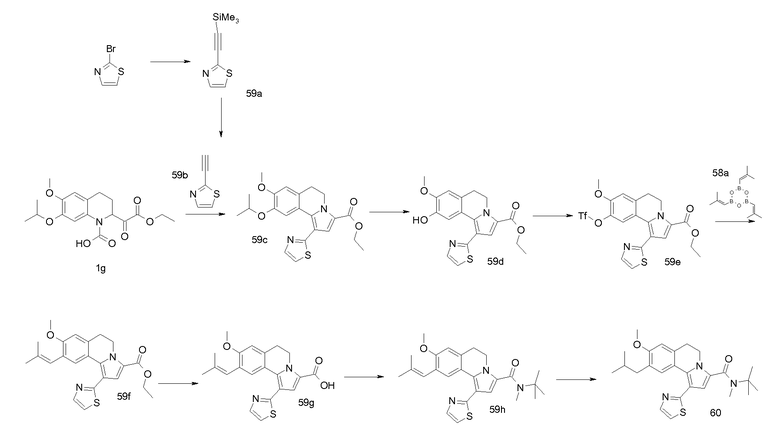
Пример 59
трет-Бутилметиламид 8-метокси-9-(2-метилпропенил)-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). 2-Триметилсиланилэтинилтиазол
При 50°С 2-бромтиазол (3 мл, свежеперегнанный) добавляли к раствору Pd(PPh3)4 (462 мг), Cu(OAc)2 (429 мг) и этинилтриметилсилана (10,5 мл) в диизопропиламине (200 мл, промыт азотом). После перемешивания в течение 2 час при 50°С реакционную смесь фильтровали через декалит и промывали этилацетатом. Фильтрат концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси толуол/этилацетат [9/1 (об./об.)] в качестве элюента.
Выход: 1,1 г. ЖХ/МС-ESI: [M+H]+ = 182,1.
(b). 2-Этинилтиазол
Водный раствор KOH (0,5 мл, 0,1 н) добавляли к раствору продукта примера 59a (1,1 г) в метаноле (5 мл). После перемешивания в течение 3 час при комнатной температуре реакционную смесь концентрировали до малого объема. Остаток разбавляли дихлорметаном и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 650 мг.
(c). Этиловый эфир 9-изопропокси-8-метокси-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 59b (650 мг) и продукта примера 1g (1,46 г) в уксусном ангидриде (10 мл) перемешивали и нагревали с применением микроволнового излучения в течение 15 мин при 140°С. Реакционную смесь концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния с применением смеси гептан/этилацетат [9/1 → 7/3 (об./об.)] в качестве элюента.
Выход: 580 мг. МС-ESI: [M+H]+ = 413,1.
(d). Этиловый эфир 9-гидрокси-8-метокси-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
При 0°С трихлорид бора (2,52 мл) добавляли по каплям к раствору продукта примера 59c (520 мг) в дихлорметане (12 мл). После перемешивания в течение 30 мин при комнатной температуре реакционную смесь разбавляли дихлорметаном и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 478 мг. ЖХ/МС-ESI: [M+H]+ = 371,2.
(e). Этиловый эфир 8-метокси-1-тиазол-2-ил-9-трифторметансульфонилокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь 1,1,1-трифтор-N-фенил-N-[(трифторметил)сульфонил]метансульфонамида (901 мг), Cs2CO3 (822 мг) и продукта примера 59d (467 мг) в ДМФА (25 мл) перемешивали в течение 2 час при 80°С. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния с применением смеси гептан/этилацетат [7/3 → 3/2 (об./об.)] в качестве элюента.
Выход: 601 мг. ЖХ/МС-ESI: [M+H]+ = 503,2.
(f). Этиловый эфир 8-метокси-9-(2-метилпропенил)-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь Pd(PPh3)4 (11 мг), K2CO3 (60 мг), продукта примера 58a (194 мг) и продукта примера 59e (200 мг) в DME (3 мл, продут азотом) перемешивали течение 18 час при 90°С. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния с применением смеси гептан/этилацетат [7/3 (об./об.)] в качестве элюента.
Выход: 127 мг. ЖХ/МС-ESI: [M+H]+ = 409,2.
(g). 8-Метокси-9-(2-метилпропенил)-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Водный раствор NaOH (4 мл, 1 н) добавляли к раствору продукта примера 59f (127 мг) в этаноле (8 мл). После перемешивания в течение 2 час при 60°С реакционную смесь разбавляли этилацетатом и промывали водным раствором лимонной кислоты (2 M), водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 117 мг. ЖХ/МС-ESI: [M+H]+ = 381,3.
(h). трет-Бутилметиламид 8-метокси-9-(2-метилпропенил)-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
HATU (175 мг), N-метил-N-трет-бутиламин (55 мкл) и DIPEA (0,286 мл) добавляли к раствору продукта примера 59g (117 мг) в ДМФА (5 мл). После перемешивания в течение 18 час при комнатной температуре реакционную смесь разбавляли этилацетатом и промывали водой, водным раствором HCl (2 н), водой, насыщ. водным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10% → 90% ацетонитрил; система 1).
Выход: 63 мг. ЖХ/МС-ESI: [M+H]+ = 450,3; анал. ВЭЖХ: Rt = 20,41 мин (способ 10); hFSHRago (CHO luc) EC50 = 2,6 нМ.
Пример 60
трет-Бутилметиламид 9-изобутил-8-метокси-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 59h (55 мг) и палладия на активированном угле (6 мг) встряхивали в течение 18 час в атмосфере водорода в аппарате Парра. Реакционную смесь фильтровали через декалит и промывали этилацетатом. Фильтрат концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10% → 90% ацетонитрил; система 1).
Выход: 50 мг. ЖХ/МС-ESI: [M+H]+ = 452,3; анал. ВЭЖХ: Rt = 22,92 мин (способ 5); hFSHRago (CHO luc) EC50 = 19,0 нМ.
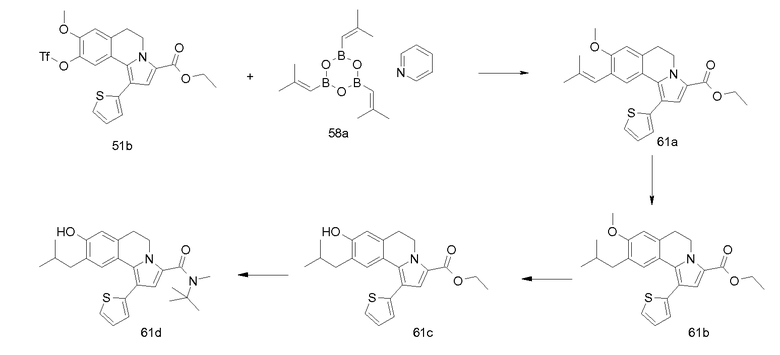
Пример 61
трет-Бутилметиламид 8-гидрокси-9-изобутил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 8-метокси-9-(2-метилпропенил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Через раствор продукта примера 51b (0,7 г) в DME (20 мл) барботировали азот в течение 5 мин. Добавляли Pd(PPh3)4 (82 мг). Через раствор снова барботировали азот в течение 1 мин с последующим добавлением продукта примера 58a (0,7 г), K2CO3 (0,3 г) и воды (4 мл). Реакционную смесь перемешивали при 90°С в течение 2 час. Затем добавляли дополнительное количество продукта примера 58a (200 мг). Реакционную смесь перемешивали в течение 18 час при 85°С. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [0→40% (об./об.)].
Выход: 519 мг. ЖХ/МС-ESI [M+H]+ = 408,2.
(b). Этиловый эфир 8-метокси-9-(2-метилпропенил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
10% Палладий на угле (25 мг) добавляли к раствору продукта примера 61a (155 мг) в этилацетате (4 мл) и метаноле (4 мл). Реакционную смесь встряхивали в атмосфере водорода (давление 3,2Ч105 Па (3,2 бар) при комнатной температуре в течение 48 час. Реакционную смесь фильтровали, промывали этилацетатом и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [0→40% (об./об.)].
Выход: 102 мг.
(c). Этиловый эфир 8-гидрокси-9-изобутил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Трибромид бора (118 мкл) добавляли при -20°С к раствору продукта примера 61b (100 мг) в дихлорметане (3 мл). Смесь перемешивали в течение 3 час при -20°С. Реакционную смесь нагревали до комнатной температуры, гасили метанолом и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [0→50% (об./об.)].
Выход: 48 мг.
(d). трет-Бутилметиламид 8-гидрокси-9-изобутил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Этилмагнийхлорид (419 мкл, 25% масс. в ТГФ) медленно добавляли к раствору N-метил-N-трет-бутиламина (146 мкл) в ТГФ (5 мл). После перемешивания в течение 1 час при 75°С по каплям добавляли продукт примера 61c (48 мг), растворенный в ТГФ (2 мл). После кипячения с обратным холодильником в течение 1 час охлажденную реакционную смесь выливали в насыщ. водный раствор NH4Cl и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20% → 100% ацетонитрил; система 1).
Выход: 32 мг. ЖХ/МС-ESI: [M+H]+ = 437,2; анал. ВЭЖХ: Rt = 23,06 мин (способ 2); hFSHRago (CHO luc) EC50 = 5,2 нМ.
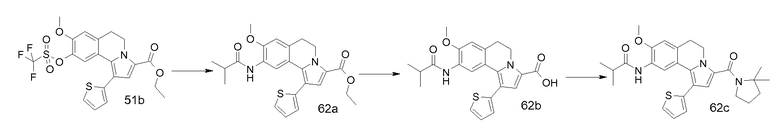
Пример 62
N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]изобутирамид
(a). Этиловый эфир 9-изобутириламино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 51b (1 г), изобутирамида (347 мг), Cs2CO3 (1,9 г), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (196 мг) и Pd2(dba)3 (310 мг) в диоксане (15 мл, продут азотом) перемешивали и нагревали с применением микроволнового излучения в течение 1 час при 150°С. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [100/0 → 7/3 (об./об.)] в качестве элюента.
Выход: 460 мг. ЖХ/МС-ESI: [M+H]+ = 439,2.
(b). 9-Изобутириламино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
KOH (588 мг) добавляли к раствору продукта примера 62a (460 мг) в смеси этанол/вода (24 мл, 2/1 (об./об.)). После перемешивания в течение 1,5 час при 80°С реакционную смесь разбавляли этилацетатом и промывали водным раствором лимонной кислоты (10%) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 462 мг.
(c). N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]изобутирамид
HATU (66 мг), 2,2-диметилпирролидин (50 мг) и DIPEA (0,120 мл) добавляли к раствору продукта примера 62b (30 мг) в дихлорметане (3 мл). После перемешивания в течение 18 час при комнатной температуре реакционную смесь разбавляли этилацетатом и промывали водным раствором лимонной кислоты (10%) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 100% ацетонитрил; система 1).
Выход: 17 мг. ЖХ/МС-ESI: [M+H]+ = 492,3; анал. ВЭЖХ: Rt = 17,90 мин (способ 10); hFSHRago (CHO luc) EC50 = 3,7 нМ.
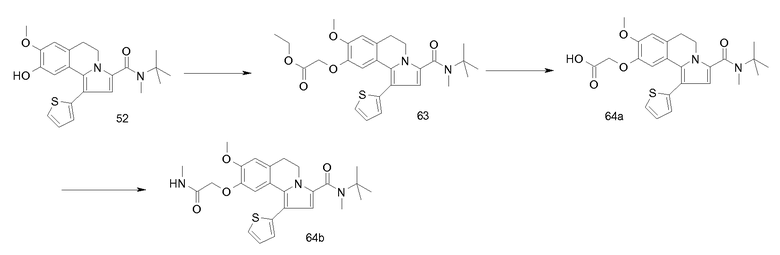
Пример 63
Этиловый эфир [3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]уксусной кислоты
Смесь продукта примера 52 (250 мг), этилового эфира бромуксусной кислоты (81 мкл) и Cs2CO3 (595 мг) в ДМФА (10 мл) перемешивали при 90°С в течение 1 час. Реакционной смеси давали возможность охладиться до комнатной температуры, затем выливали в воду и экстрагировали дихлорметаном. Органический слой промывали водным раствором HCl (0,5 M), насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/1 (об./об.)] в качестве элюента.
Выход: 270 мг. ЖХ/МС-ESI: [M+H]+ = 497,1; ЖХ/МС Rt = 4,60 мин; hFSHRago (CHO luc) EC50 = 252,0 нМ.
Пример 64
трет-Бутилметиламид 8-метокси-9-метилкарбамоилметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). [3-(трет-Бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]уксусная кислота
Смесь продукта примера 63 (150 мг) и твердого KOH (51 мг) в этаноле (5 мл) и воде (5 мл) перемешивали при 78°С в течение 1 час. При комнатной температуре реакционную смесь подкисляли водным раствором HCl (1,0 M) до pH = 1-2 и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 119 мг. ЖХ/МС-ESI: [M+H]+ = 469,0.
(b). трет-Бутилметиламид 8-метокси-9-метилкарбамоилметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 64a (50 мг), DIPEA (93 мкл), HATU (61 мг) и гидрохлорида метиламина (5,3 мг) в дихлорметане (3 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь разбавляли дихлорметаном и промывали водным раствором HCl (0,5 M), насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20 → 100% ацетонитрил система 1).
Выход: 28 мг. МС-ESI: [M+H]+ = 482,5; анал. ВЭЖХ: Rt = 11,73 мин (способ 7); hFSHRago (CHO luc) EC50 = 3,1 нМ.
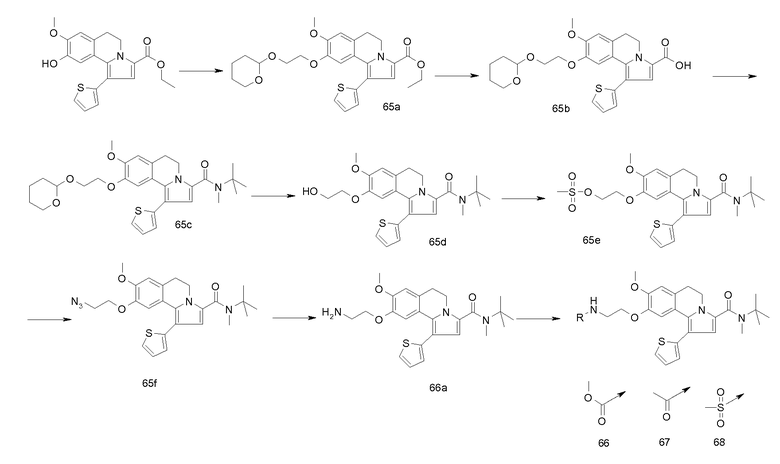
Пример 65
трет-Бутилметиламид 9-(2-азидоэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты, трет-бутилметиламид 8-метокси-9-[2-(тетрагидропиран-2-илокси)этокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты, трет-бутилметиламид 9-(2-гидроксиэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и 2-[3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]этиловый эфир метансульфоновой кислоты
(а). Этиловый эфир 8-метокси-9-[2-(тетрагидропиран-2-илокси)этокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 51a (600 мг), Cs2CO3 (1,32 г) и 2-(2-бромэтокси)тетрагидропирана (294 мкл) в ДМФА (15 мл) перемешивали при 100°С в течение 4 час. При комнатной температуре реакционную смесь выливали в воду и экстрагировали дихлорметаном. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 731 мг. МС-ESI: [M+H]+ = 498,3.
(b). 8-Метокси-9-[2-(тетрагидропиран-2-илокси)этокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 65a (731 мг) и твердого KOH (250 мг) в этаноле (10 мл) и воде (10 мл) перемешивали при 78°С в течение 2 час. При комнатной температуре реакционную смесь подкисляли водным раствором лимонной кислоты (2 M) до pH = 5-6 и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 682 мг. МС-ESI: [M+H]+ = 468,1.
(c). трет-Бутилметиламид 8-метокси-9-[2-(тетрагидропиран-2-илокси)этокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 65b (682 мг), DIPEA (1,27 мл), N-метил-N-трет-бутиламина (348 мкл) и HATU (827 мг) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 726 мг. МС-ESI: [M+H]+ = 539,5; hFSHRago (CHO luc) EC50 = 102,0 нМ.
(d). трет-Бутилметиламид 9-(2-гидроксиэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Водный раствор HCl (2 мл, 5 M) добавляли по каплям к смеси продукта примера 65c (716 мг) в метаноле (50 мл). После перемешивания при комнатной температуре в течение 1 час реакционную смесь выливали в насыщ. водный раствор NaHCO3 и экстрагировали дихлорметаном. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:2 (об./об.)] в качестве элюента.
Выход: 414 мг. ЖХ/МС-ESI: [M+H]+ = 455,0; hFSHRago (CHO luc) EC50 = 1,3 нМ.
(e). 2-[3-(трет-Бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]этиловый эфир метансульфоновой кислоты
Метансульфонилхлорид (85 мкл) добавляли по каплям к смеси продукта примера 65d (414 мг) и триэтиламина (380 мкл) в дихлорметане (25 мл). После перемешивания при комнатной температуре в течение 1 час реакционную смесь промывали насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1:2 (об./об.)] в качестве элюента.
Выход: 465 мг. ЖХ/МС-ESI: [M+H]+ = 533,0; hFSHRago (CHO luc) EC50 = 15 нМ.
(f). трет-Бутилметиламид 9-(2-азидоэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 65e (250 мг) и азида натрия (92 мг) в ДМФА (15 мл) перемешивали при 90°С в течение 1 час. При комнатной температуре реакционную смесь выливали в воду и экстрагировали дважды дихлорметаном. Органический слой промывали дважды водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 210 мг. ЖХ/МС-ESI: [M+H]+ = 480,0; анал. ВЭЖХ: Rt = 24,73 мин (способ 2); hFSHRago (CHO luc) EC50 = 7,1 нМ.
Пример 66
Метиловый эфир {2-[3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]этил}карбаминовой кислоты
(a). трет-Бутилметиламид 9-(2-аминоэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 65f (210 мг), связанного с полимером трифенилфосфина (290 мг; загрузка 3 ммоль/г смолы), воды (1 мл) в ТГФ (5 мл) и дихлорметане (5 мл) нагревали при кипячении с обратным холодильником в течение 18 час. Реакционную смесь фильтровали и остаток промывали дихлорметаном и метанолом. Фильтрат концентрировали в вакууме, растворяли в дихлорметане и промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 197 мг. ЖХ/МС-ESI: [M+H]+ = 454,1.
(b). Метиловый эфир {2-[3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-илокси]этил}карбаминовой кислоты
Метилхлорформиат (15 мкл) добавляли по каплям к смеси продукта примера 66a (66 мг) и DIPEA (76 мкл) в дихлорметане (5 мл). После перемешивания при комнатной температуре в течение 18 час реакционную смесь разбавляли дихлорметаном, промывали водным раствором HCl (0,5 M), насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20 → 100% ацетонитрил; система 1).
Выход: 42 мг. МС-ESI: [M+H]+ = 512,5; анал. ВЭЖХ: Rt = 15,50 мин (способ 7); hFSHRago (CHO luc) EC50 = 31,3 нМ.
Пример 67
трет-Бутилметиламид 9-(2-ацетиламиноэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Ацетилхлорид (13 мкл) добавляли по каплям к смеси продукта примера 66a (66 мг) и DIPEA (76 мкл) в дихлорметане (5 мл). После перемешивания при комнатной температуре в течение 18 час, реакционную смесь разбавляли дихлорметаном, промывали водным раствором HCl (0,5 M), насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20 → 100% ацетонитрил; система 1).
Выход: 49 мг. МС-ESI: [M+H]+ = 496,3; анал. ВЭЖХ: Rt = 10,67 мин (способ 7); hFSHRago (CHO luc) EC50 = 36,5 нМ.
Пример 68
трет-Бутилметиламид 9-(2-метансульфониламиноэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Метансульфонилхлорид (15 мкл) добавляли по каплям к смеси продукта примера 66a (66 мг) и DIPEA (76 мкл) в дихлорметане (5 мл). После перемешивания при комнатной температуре в течение 18 час реакционную смесь разбавляли дихлорметаном, промывали водным раствором HCl (0,5 M) и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20 → 100% ацетонитрил; система 1).
Выход: 49 мг. МС-ESI: [M+H]+ = 532,5; анал. ВЭЖХ: Rt = 13,94 мин (способ 7); hFSHRago (CHO luc) EC50 = 16,0 нМ.
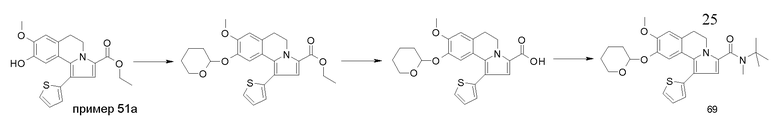
Пример 69
трет-Бутилметиламид 8-метокси-9-(тетрагидропиран-2-илокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 8-метокси-9-(тетрагидропиран-2-илокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
При 0°С 2,3-дигидропиран (50 мкл) и п-толуолсульфонат пиридиния (каталитическое количество) добавляли к раствору продукта примера 51a (100 мг) в дихлорметане (5 мл) и реакционную смесь перемешивали при 40°С в течение 18 час. Реакционную смесь разбавляли дихлорметаном и промывали насыщ. водным раствором NaHCO3 и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 100 мг. ЖХ/МС-ESI: [M+H]+ = 454,0.
(b). 8-Метокси-9-(тетрагидропиран-2-илокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 69a (100 мг) и твердого KOH (37 мг) в этаноле (4 мл) и воде (4 мл) перемешивали при 78°С в течение 2 час. При комнатной температуре реакционную смесь подкисляли до pH = 5 и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Выход: 100 мг. МС-ESI: [M+H]+ = 426,3.
(c). трет-Бутилметиламид 8-метокси-9-(тетрагидропиран-2-илокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 69b (100 мг), DIPEA (205 мкл), N-метил-N-трет-бутиламина (56 мкл) и HATU (134 мг) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 85 мг. МС-ESI: [M+H]+ = 495,5; анал. ВЭЖХ: Rt= 23,59 мин (способ 7); hFSHRago (CHO luc) EC50 = 6,9 нМ.
Пример 70
трет-Бутилметиламид 9-(3-аминопропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты, трет-бутилметиламид 8-метокси-9-[3-(тетрагидропиран-2-илокси)пропокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты, трет-бутилметиламид 9-(3-гидроксипропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты, 3-[3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-9-илокси]пропиловый эфир метансульфоновой кислоты и трет-бутилметиламид 9-(3-азидопропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a) Этиловый эфир 8-метокси-9-[3-(тетрагидропиран-2-илокси)пропокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 51a (1,31 г), K2CO3 (12,3 г) и 2-(1-бром-3-пропокси)тетрагидропирана (1,21 мл) в ДМФА (45 мл) перемешивали в течение 2 час при 60°С и 18 час при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 1,83 г. ЖХ/МС-ESI: [M+H]+ = 512,1.
(b). 8-Метокси-9-[3-(тетрагидропиран-2-илокси)пропокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
KOH (1 г) добавляли к раствору продукта примера 70a (1,83 г) в смеси этанол/вода (60 мл, 1/1 (об./об.)). После перемешивания в течение 1 час при 80°С, реакционную смесь разбавляли этилацетатом и промывали водным раствором лимонной кислоты (10%) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 1,63 г.
(c). трет-Бутилметиламид 8-метокси-9-[3-(тетрагидропиран-2-илокси)пропокси]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
HATU (1,93 г), N-метил-N-трет-бутиламин (2,02 мл) и DIPEA (2,79 мл) добавляли к раствору продукта примера 70b (1,63 г) в ДМФА (20 мл). После перемешивания в течение 2 час при 50°С реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1/0 → 6/4 (об./об.)] в качестве элюента.
Выход: 1,9 г. МС-ESI: [M+H]+ = 553,1; hFSHRago (CHO luc) EC50=155,0 нМ.
(d). трет-Бутилметиламид 9-(3-гидроксипропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 70c (1,83 г) и моногидрата п-толуолсульфоновой кислоты (942 мг) в метаноле (30 мл) перемешивали в течение 1 час при комнатной температуре. Реакционную смесь разбавляли этилацетатом и промывали насыщ. водным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [100/0 → 0/100 (об./об.)] в качестве элюента.
Выход: 1,28 г. МС-ESI: [M+H]+ = 469,2; hFSHRago (CHO luc) EC50 = 1,3 нМ.
(e). 3-[3-(трет-Бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-9-илокси]пропиловый эфир метансульфоновой кислоты
Мезилхлорид (0,99 мл) и триэтиламин (0,443 мл) добавляли к раствору продукта примера 70d (500 мг) в дихлорметане (25 мл). После перемешивания в течение 1 час при комнатной температуре реакционную смесь разбавляли дихлорметаном и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [100/0 → 1/1 (об./об.)] в качестве элюента.
Выход: 503 мг. МС-ESI: [M+H]+= 547,1.
(f). трет-Бутилметиламид 9-(3-азидопропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Азид натрия (179 мг) добавляли к раствору продукта примера 70e (503 мг) в ДМФА (25 мл). После перемешивания в течение 2 час при 90°С реакционную смесь разбавляли дихлорметаном и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 452 мг. МС-ESI: [M+H]+ = 494,1; hFSHRago (CHO luc) EC50 = 10,9 нМ.
(g). трет-Бутилметиламид 9-(3-аминопропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Воду (3 мл) и связанный с полимером трифенилфосфин (613 мг; загрузка 3 ммоль/г смолы) добавляли к раствору продукта примера 70f (454 мг) с применением смеси ТГФ/дихлорметан (30 мл, 1/1 (об./об.)). После перемешивания в течение 18 час при 40°С реакционную смесь фильтровали. Фильтрат концентрировали в вакууме.
Выход: 442 мг. МС-ESI: [M+H]+ = 468,2; hFSHRago (CHO luc) EC50 = 111,0 нМ.
Пример 71
трет-Бутилметиламид 8-метокси-9-(2-метилсульфанилэтокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 65e (124 мг) и метилсульфида натрия (32 мг) в ДМФА (5 мл) перемешивали при 50°С в течение 1 час. Реакционную смесь выливали в воду и экстрагировали дважды дихлорметаном. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:2 (об./об.)] в качестве элюента.
Выход: 97 мг. ЖХ/МС-ESI: [M+H]+ = 485,2; анал. ВЭЖХ: Rt = 22,30 мин (способ 7); hFSHRago (CHO luc) EC50 = 26,3 нМ.
Пример 72
трет-Бутилметиламид 9-(2-метансульфонилэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 71 (30 мг) и 3-хлорпербензойной кислоты (45,8 мг) в дихлорметане (3 мл) перемешивали при комнатной температуре в течение 1 час. Реакционную смесь разбавляли дихлорметаном и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20 → 100% ацетонитрил; система 1).
Выход: 12 мг. МС-ESI: [M+H]+ = 517,5; анал. ВЭЖХ: Rt = 15,23 мин (способ 7); hFSHRago (CHO luc) EC50 = 16,9 нМ.
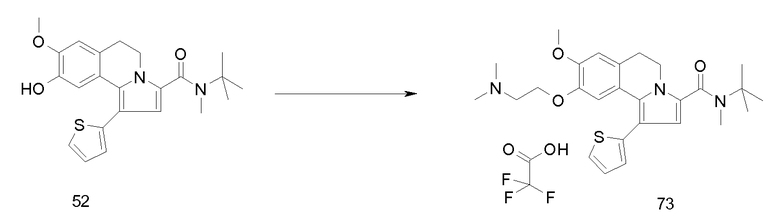
Пример 73
трет-Бутилметиламид 9-(2-диметиламиноэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты; соль трифторуксусной кислоты
Смесь продукта примера 52 (50 мг), Cs2CO3 (120 мг) и (2-хлорэтил)диметиламина (20 мг) в ДМФА (5 мл) перемешивали при 100°С в течение 2 час. Реакционной смеси давали возможность охладиться до комнатной температуры и разбавляли ее дихлорметаном. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 100% ацетонитрил; 0,1% TFA; система 1).
Выход: 42 мг. МС-ESI: [M+H]+ = 482,5; анал. ВЭЖХ: Rt = 11,98 мин (способ 2); hFSHRago (CHO luc) EC50 = 118 нМ.
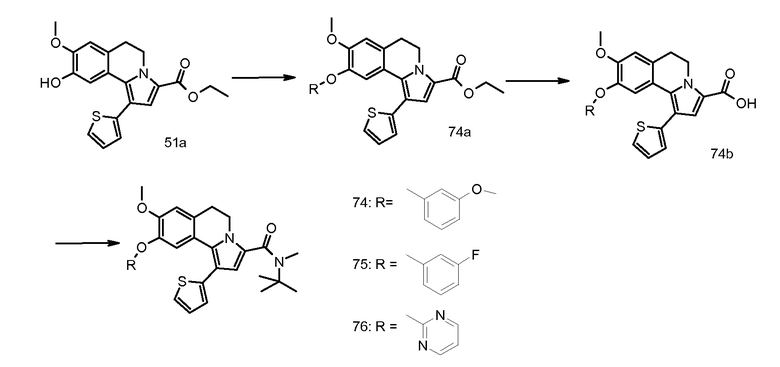
Пример 74
N-трет-Бутил-8-метокси-9-(3-метоксифенокси)-N-метил-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоксамид
(a). Этил-8-метокси-9-(3-метоксифенокси)-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоксилат
Смесь продукта примера 51a (150 мг), 3-метоксифенилбороновой кислоты (140 мг), дихлорметана (2,5 мл), Cu(OAc)2 (80 мг), пиридина (250 мкл), мол. сит 4Е (2 г) перемешивали при комнатной температуре в течение 24 час. Реакционную смесь разбавляли водой, насыщ. водным раствором NH4Cl и этилацетатом. Реакционную смесь перемешивали в течение 10 мин, фильтровали через Hyflo и экстрагировали этилацетатом. Органический раствор концентрировали в вакууме. Остаток фильтровали через короткую колонку с диоксидом кремния с применением смеси гептан/этилацетат в качестве элюента.
Выход: 160 мг. ТСХ Rf = 0,55 (гептан/этилацетат, 1/1); 1H ЯМР (ДМСО-d6) 3,70 (с, 3, OCH3), 3,78 (с, 3, OCH3), 3,10 (т, 2, C(6)H2), 4,55 (т, 2, C(5)H2), 6,85 (с, 1, H(3); ЖХ/МС-ESI: [M+H]+=476.
(b). 8-Метокси-9-(3-метоксифенокси)-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 74a (160 мг), диоксана (2 мл), воды (2 мл) и 100 мг KOH (100 мг) нагревали при 100°С в течение 90 мин. Реакционную смесь концентрировали до малого объема в вакууме и подкисляли водной лимонной кислотой (1 M) до pH 3-4. Продукт, который осаждался в виде белого кристаллического вещества, сушили в вакууме (50°С).
Выход: 120 мг. Т.пл.: 172-174°С (разлож.); ТСХ Rf = 0,15 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 448.
(c). N-трет-Бутил-8-метокси-9-(3-метоксифенокси)-N-метил-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоксамид
Смесь продукта примера 74b (120 мг), N-этилморфолина (120 мкл), 120 мкл N-метил-N-трет-бутиламина (120 мкл), 1 мл ДМФА (1 мл), HOBt (20 мг) и TBTU (160 мг) перемешивали при комнатной температуре в течение 18 час. Добавляли насыщ. водный раствор NH4Cl. Реакционную смесь перемешивали в течение 10 мин и экстрагировали этилацетатом. Объединенные органические слои промывали водой, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат в качестве элюента.
Выход: 75 мг. Т.пл.: 176-177°С; ТСХ Rf = 0,53 (гептан/ацетон, 1/1); ЖХ/МС-ESI: [M+H]+ = 517; hFSHRago (CHO luc) EC50 = 203,0 нМ.
Пример 75
трет-Бутилметиламид 9-(3-фторфенокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a) Этил-9-(3-фторфенокси)-8-метокси-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-a]изохинолин-3-карбоксилат
Данный продукт получали способом, аналогичным способу, описываемому для примера 74a, исходя из продукта примера 51a.
Т.пл.: 139-140°С; ТСХ Rf = 0,60 (гепт./этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 446.
(b) 9-(3-Фторфенокси)-8-метокси-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Данный продукт получали из продукта примера 75а (130 мг) способом, аналогичным способу, описываемому для примера 74b.
Выход: 100 мг. Т.пл.:179-183°С (декарбокс.); ТСХ Rf = 0,15 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 436.
(c) трет-Бутилметиламид 9-(3-фторфенокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Данный продукт получали из продукта примера 75b (200 мг) способом, аналогичным способу, описываемому для примера 74c.
Выход: 120 мг. Т.пл.: 158-159°С; 1H ЯМР (ДМСО-d6) δ 6,38 (с, 1Н, H2), 6,96 (с, 1Н, H7), 7,18 (с, 1Н, H10), 7,38 (дд, 1Н, тиофен), 6,98 (дд, 1Н, тиофен), 6,92 (м, 1Н, тиофен), 7,30, 6,85, 6,62 (м, 4H, 4F-Phe), 3,75 (с, 3H, OCH3), 4,18 (т, 2H, H6), 3,05 (м, 5H, H6 + NMe), 1,41 (с, 9H, трет-бутил); ЖХ/МС-ESI: [M+H]+ = 505,5; hFSHRago (CHO luc) EC50 = 16,3 нМ.
Пример 76
N-трет-Бутил-8-метокси-N-метил-9-(пиримидин-2-илокси)-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоксамид
(a). Этил-8-метокси-9-(пиримидин-2-илокси)-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоксилат
Смесь продукта примера 51a (100 мг), 2-бромпиримидина (50 мг), Cs2CO3 (300 мг), порошка Cu (9 мг) в ДМФА (2 мл) нагревали с применением микроволнового излучения при 140°С в течение 25 мин. Реакционную смесь разбавляли насыщ. водным раствором NH4Cl и экстрагировали этилацетатом. Объединенные органические слои промывали водой, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток пропускали через невысокий слой диоксида кремния (дихлорметан/этилацетат) и растирали с диизопропиловым простым эфиром, получая при этом белые кристаллы.
Выход: 145 мг. ТСХ Rf = 0,20 (гептан/этилацетат, 1/1), Rf ТГФ исходного вещества = 0,40; т.пл.: 163-164°С; ЖХ/МС-ESI: [M+H]+ = 448.
(b). 8-Метокси-9-(пиримидин-2-илокси)-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Данный продукт получали из продукта примера 76а (140 мг) способом, аналогичным способу, описываемому для примера 74b.
Выход: 95 мг. ТСХ Rf = 0,30 (дихлорметан/ацетон, 1/1, об./об.); т.пл.: 227°С.
(c) N-трет-Бутил-8-метокси-N-метил-9-(пиримидин-2-илокси)-1-(тиофен-2-ил)-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоксамид
Данный продукт получали из продукта примера 76b (90 мг) способом, аналогичным способу, описываемому для примера 74c.
Выход: 65 мг. Т.пл.: 164-165°С; ТСХ Rf = 0,45 (гептан/ацетон, 1/1); ЖХ/МС-ESI: [M+H]+ = 489,3; hFSHRago (CHO luc) EC50 = 18,9 нМ.
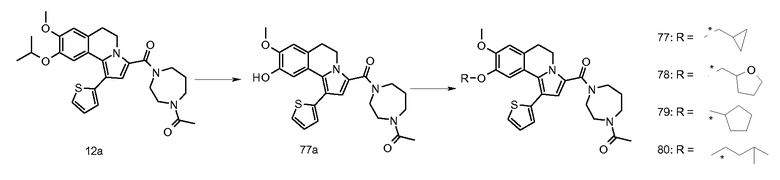
Пример 77
1-[4-(9-Циклопропилметокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбонил)пергидро-1,4-диазепин-1-ил]этанон
(a) 1-[4-(9-Гидрокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пергидро-1,4-диазепин-1-ил]этанон
К раствору продукта примера 12a (315 мг) в дихлорметане (20 мл) добавляли при -10°С раствор трихлорида бора (5 мл 1 M раствора в дихлорметане). Реакцию завершали через 15 мин и гасили добавлением воды. Органический слой отделяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растирали со смесью ацетон/простой эфир.
Выход: 284 мг. ЖХ/МС-ESI: [M+H]+ = 366.
(b). 1-[4-(9-Циклопропилметокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3-карбонил)пергидро-1,4-диазепин-1-ил]этанон
Смесь продукта примера 77a (36 мг), K2CO3 (70 мг) и циклопропилметилбромида (30 мг) в ДМФА (1 мл) перемешивали и нагревали с применением реактора с микроволновым излучением в течение 5 мин при 220°С. Реакционную смесь охлаждали, разбавляли водой и экстрагировали этилацетатом. Объединенные органические слои промывали водой, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20 → 100% ацетонитрил; система 1).
Выход: 15 мг. ЖХ/МС-ESI: [M+H]+ = 520; hFSHRago (CHO luc) EC50 = 57,6 нМ.
Пример 78
1-{4-[8-Метокси-9-(тетрагидрофуран-2-илметокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил]пергидро-1,4-диазепин-1-ил}этанон
Данный продукт получали из продукта примера 77а (15 мг) способом, аналогичным способу, описываемому для примера 77b.
Выход: 2,2 мг. ЖХ/МС-ESI: [M+H]+ = 550; hFSHRago (CHO luc) EC50 = 96,2 нМ.
Пример 79
1-[4-(9-Циклопентилокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пергидро-1,4-диазепин-1-ил]этанон
Данный продукт получали из продукта примера 77a (15 мг) способом, аналогичным способу, описываемому для примера 77b.
Выход: 4,4 мг. ЖХ/МС-ESI: [M+H]+ = 534; hFSHRago (CHO luc) EC50 = 14,2 нМ.
Пример 80
1-{4-[8-Метокси-9-(3-метилбутокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил]пергидро-1,4-диазепин-1-ил}этанон
Данный продукт получали из продукта примера 77a (215 мг) способом, аналогичным способу, описываемому для примера 77b.
Выход: 60 мг. ЖХ/МС-ESI: [M+H]+ = 536; hFSHRago (CHO luc) EC50 = 101,0 нМ.
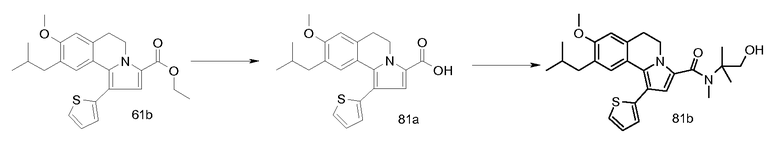
Пример 81
(2-Гидрокси-1,1-диметилэтил)метиламид 9-изобутил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). 9-Изобутил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Данный продукт получали способом, аналогичным способу, описываемому для примера 1i, исходя из продукта примера 61b (3,19 г).
Выход: 3,2 г. ЖХ/МС-ESI: [M+H]+ = 382,2.
(k). (2-гидрокси-1,1-диметилэтил)метиламид 9-изобутил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Суспензию продукта примера 81a (215 мг) в дихлорметане (2 мл) обрабатывали раствором оксалилхлорида (400 мкл 2 М раствора в дихлорметане). Добавляли каплю ДМФА. Смесь перемешивали при комнатной температуре в течение 1 час. Реакционную смесь концентрировали в вакууме и снова растворяли в дихлорметане (2 мл). Этот раствор обрабатывали 2-метил-2-метиламинопропан-1-олом (175 мг; получен способом, аналогичным способу, описываемому S.G. Kuznetsov, A.V. Eltsov, J. Gen. Chem. USSR, 32, 502 (1962)) и перемешивали в течение 1 час при комнатной температуре. Реакционную смесь выливали в водный раствор NaHCO3 (5%) и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растирали со смесью гептан/этилацетат, получая при этом кристаллическое вещество.
Выход: 80 мг. Т.пл. 114-116°С; ЖХ/МС-ESI: [M+H]+ = 476,5; hFSHRago (CHO luc) EC50 = 6,0 нМ.
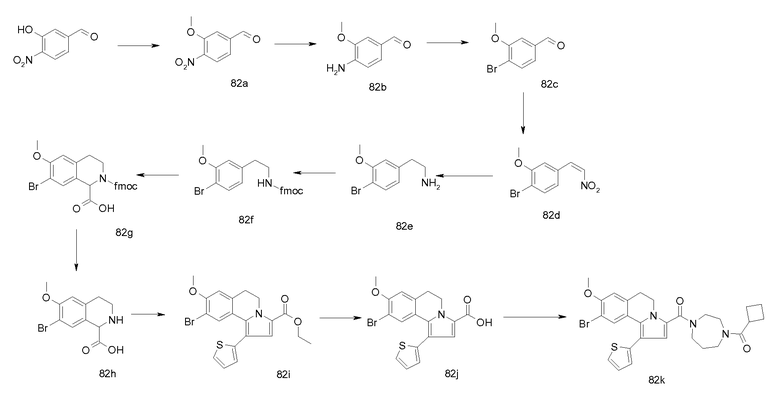
Пример 82
(9-Бром-8-метокси-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-а]изохинолин-3-ил)-(4-циклобутанкарбонил-[1,4]диазепан-1-ил)метанон
(a). 3-Метокси-4-нитробензальдегид
Смесь 3-гидрокси-4-нитробензальдегида (51,3 г), иодметана (38,3 мл) и K2CO3 (85 г) в ДМФА (250 мл) перемешивали при 60°С в течение 1 час. Реакционную смесь охлаждали до комнатной температуры и выливали в воду (600 мл). Твердые вещества собирали фильтрованием и сушили в вакууме (50°С).
Выход: 49,7 г.
(b). 4-Амино-3-метоксибензальдегид
Железо (112 г) добавляли к смеси продукта примера 82a (49,7 г) и хлорида аммония (103 г) в этаноле (500 мл) и воде (500 мл). После перемешивания механической мешалкой при 78°С в течение 2 час реакционную смесь охлаждали до комнатной температуры и экстрагировали диэтиловым простым эфиром (3Ч500 мл). Объединенные органические слои концентрировали в вакууме и к остатку добавляли воду (400 мл). Твердые вещества собирали фильтрованием и сушили в вакууме (50°С).
Выход: 38,3 г.
(c). 4-Бром-3-метоксибензальдегид
Раствор продукта примера 82b (38,3 г) в ацетонитриле (600 мл) добавляли по каплям к смеси н-бутилнитрита (43,1 мл) и бромида меди(I) (63,6 г) в ацетонитриле (1300 мл). После перемешивания в течение 18 час при комнатной температуре реакционную смесь разбавляли этилацетатом и промывали водным раствором HCl (1 н). Органический слой отделяли и промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1:1 (об./об.)].
Выход: 27,4 г. ЖХ/МС-ESI: [M+H]+ = 215,1/217,0.
(d). 1-Бром-2-метокси-4-((E)-2-нитровинил)бензол
Смесь продукта примера 82c (27,4 г), ацетата аммония (10,8 г) и нитрометана (35 мл) в уксусной кислоте (125 мл) перемешивали при 80°С в течение 18 час. Реакционную смесь охлаждали до комнатной температуры и выливали в воду (1 л). Твердые вещества собирали фильтрованием и растворяли в дихлорметане (2 л). Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 29,8 г.
(e). 2-(4-Бром-3-метоксифенил)этиламин
При 0°С и в атмосфере азота раствор комплекса боран-ТГФ (262 мл 1 M раствора) добавляли по каплям к раствору продукта примера 82d (15 г) в ТГФ (250 мл). После добавления ледяную баню убирали. Добавляли борогидрид натрия (0,11 г) (имела место слабая экзотермическая реакция). После перемешивания в течение 18 час при 65°С в атмосфере азота реакционную смесь охлаждали до комнатной температуры и выливали в водный раствор HCl (250 мл 2 M раствора). После перемешивания в течение 1,5 час при 70°С реакционную смесь охлаждали до комнатной температуры и экстрагировали дважды диэтиловым простым эфиром. Водный слой делали основным твердым NaOH до pH = 10 и экстрагировали три раза этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 13,5 г. ЖХ/МС-ESI: [M+H]+ = 230,1/232,1.
(f). 9H-Флуорен-9-илметиловый эфир [2-(4-бром-3-метоксифенил)этил]карбаминовой кислоты
Раствор 9-флуоренилметилхлорформиата (29,2 г) в дихлорметане (100 мл) добавляли по каплям к раствору продукта примера 82e (22,4 г) и DIPEA (51 мл) в дихлорметане (300 мл). После перемешивания в течение 18 час при комнатной температуре реакционную смесь промывали водным раствором HCl (1 M), водой, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растворяли в диэтиловом простом эфире и твердые вещества собирали фильтрованием и сушили в вакууме (50°С).
Выход: 35,1 г. ЖХ/МС-ESI: [M+Н]]+ = 454,1.
(g). 2-(9H-Флуорен-9-илметиловый) эфир 7-бром-6-метокси-3,4-дигидро-1H-изохинолин-1,2-дикарбоновой кислоты
При 0°С концентрированную серную кислоту (140 мл) добавляли по каплям к раствору продукта примера 82f (35,1 г) и гидрата глиоксиловой кислоты (8,57 г) в уксусной кислоте (700 мл). После перемешивания в течение 1 час при комнатной температуре реакционную смесь выливали на измельченный лед и экстрагировали дважды этилацетатом. Органический слой промывали водным раствором HCl (0,2 M), насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаточные растворители удаляли совместным выпариванием (дважды) с толуолом.
Выход: 39,8 г. ЖХ/МС-ESI: [M+H]+ = 508,1/510,1.
(h). 7-Бром-6-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Смесь продукта примера 82g (37,8 г) и пиперидина (36,7 мл) в ДМФА (350 мл) перемешивали при комнатной температуре в течение 15 мин. Реакционную смесь концентрировали в вакууме и остаток растворяли в ТГФ (200 мл) и диэтиловом простом эфире (200 мл). Твердые вещества собирали фильтрованием и сушили в вакууме (50°С).
Выход: 18,5 г.
(i). Этиловый эфир 9-бром-8-метокси-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 82h (3 г) и этилоксалилхлорида (1,4 мл) в ТГФ (25 мл) перемешивали при 65°С в течение 30 мин и реакционную смесь концентрировали в вакууме. Смесь остатка и 2-этинилтиофена (1,24 мл) в уксусном ангидриде (10 мл) нагревали с применением микроволнового излучения при 140°С в течение 15 мин. Реакционную смесь разбавляли дихлорметаном и промывали водой, насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [2/1 (об./об.)] в качестве элюента.
Выход: 3,82 г. ЖХ/МС-ESI: [M+H]+ = 432,0/434,0.
(j) 9-Бром-8-метокси-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 82i (200 мг) и твердого KOH (100 мг) в этаноле (4 мл) и воде (1 мл) перемешивали при 80°С в течение 1 час. При комнатной температуре реакционную смесь подкисляли водным раствором HCl (6 M). Водный слой экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4) фильтровали и концентрировали в вакууме.
Выход: 180 мг.
(k). (9-Бром-8-метокси-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-a]изохинолин-3-ил)-(4-циклобутанкарбонил-[1,4]диазепан-1-ил)метанон
Смесь продукта примера 82j (50 мг), DIPEA (150 мкл), BOP (137 мг) и циклобутил-[1,4]диазепан-1-илметанона (55 мг) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь экстрагировали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (30 → 90% ацетонитрил; система 1).
Выход: 42 мг. ЖХ/МС-ESI: [M+H]+ = 568,1/570,1; анал. ВЭЖХ: Rt = 23,89 мин; hFSHRago (CHO luc) EC50 = 5,8 нМ.
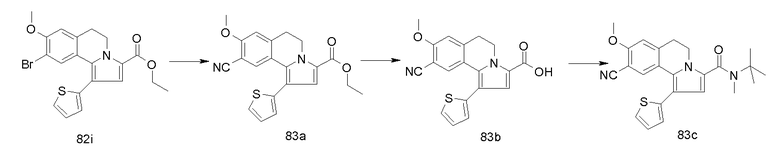
Пример 83
трет-Бутилметиламид 9-циано-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 9-циано-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 80i (48 мг), цианида меди(I) (20 мг) и иодида меди(I) (2,1 мг) в NMP (1 мл) нагревали с применением микроволнового излучения при 180°С течение 15 мин. Реакционную смесь концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 41 мг. МС-ESI: [M+H]+ = 379,3.
(b). 9-Циано-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 83a (41 мг) и твердого KOH (18 мг) в этаноле (2 мл) и воде (2 мл) перемешивали при 80°С в течение 4 час. При комнатной температуре реакционную смесь подкисляли водным раствором лимонной кислоты (2 M) и экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 43 мг. ЖХ/МС-ESI: [M+H]+ = 351,1.
(c). трет-Бутилметиламид 9-циано-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
HATU (70 мг) добавляли к раствору продукту примера 83b (43 мг), DIPEA (107 мкл) и N-метил-N-трет-бутиламина (29 мкл) в дихлорметане (5 мл). После перемешивания при комнатной температуре в течение 18 час реакционную смесь разбавляли дихлорметаном и промывали водным раствором HCl (0,5 M), насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 26 мг. ЖХ/МС-ESI: [M+H]+ = 420,2; анал. ВЭЖХ: Rt = 19,52 мин (способ 7); hFSHRago (CHO luc) EC50 = 4,3 нМ.
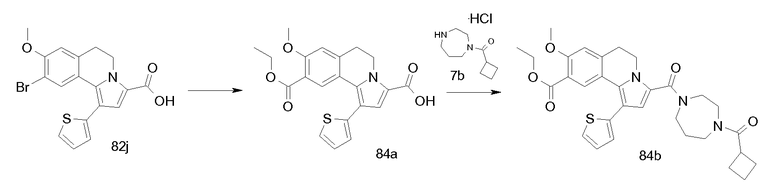
Пример 84
Этиловый эфир 3-(4-циклобутанкарбонил-[1,4]диазепан-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-карбоновой кислоты
(a). 9-Этиловый эфир 8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3,9-дикарбоновой кислоты
При -70°С н-бутиллитий (1,26 мл, 1,6 M раствор в гептане) добавляли по каплям к раствору продукта примера 80j (370 мг) в ТГФ (15 мл). После перемешивания в течение 30 мин при -70°С реакционную смесь обрабатывали этилхлорформиатом (0,4 мл). При комнатной температуре реакционную смесь разбавляли этилацетатом и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 100 мг.
(b). Этиловый эфир 3-(4-циклобутанкарбонил-[1,4]диазепан-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-карбоновой кислоты
Получение амида продукта примера 7b (50 мг) и продукта примера 84a (50 мг) проводили согласно способу, описанному для примера 13.
Выход: 52 мг. ЖХ/МС-ESI: [M+H]+ = 548,2; анал. ВЭЖХ: Rt = 17,3 мин (способ 2); hFSHRago (CHO luc) EC50 = 2,9 нМ.
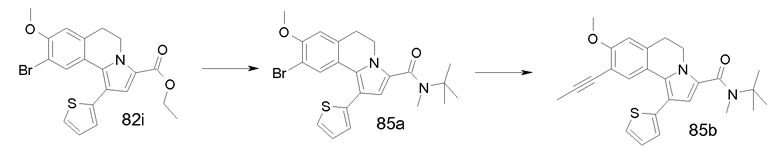
Пример 85
трет-Бутилметиламид 8-метокси-9-проп-1-инил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и трет-бутилметиламид 9-бром-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). трет-Бутилметиламид 9-бром-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Этилмагнийхлорид (6,6 мл, 25 масс.% раствор в ТГФ), растворенный в ТГФ (6 мл) медленно добавляли к раствору N-метил-N-трет-бутиламина (2,3 мл) в ТГФ (6 мл). После перемешивания в течение 1 час при 75°С по каплям добавляли продукт примера 82i (1,1 г), растворенный в ТГФ (3 мл). После перемешивания в течение дополнительного 1 час при 75°С реакционную смесь выливали в насыщ. водный раствор NH4Cl и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растворяли в минимальном количестве этанола с последующим добавлением небольшого количества воды. После охлаждения на ледяной бане осадок отделяли фильтрованием.
Выход: 667 мг. ЖХ/МС-ESI: [M+H]+ = 473/475; hFSHRago (CHO luc) EC50 = 11,3 нМ.
(b). трет-Бутилметиламид 8-метокси-9-проп-1-инил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 85a (50 мг), Pd(PPh3)4 (12,2 мг) и трибутил-(1-пропинил)олова (104 мг) в толуоле (1 мл, продут азотом) перемешивали и нагревали с применением микроволнового излучения в течение 20 мин при 150°С. Реакционную смесь фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10 → 90% ацетонитрил; система 1).
Выход: 10 мг. ЖХ/МС-ESI: [M+H]+ = 433,2; анал. ВЭЖХ: Rt = 24,47 мин (способ 5); hFSHRago (CHO luc) EC50 = 2,7 нМ
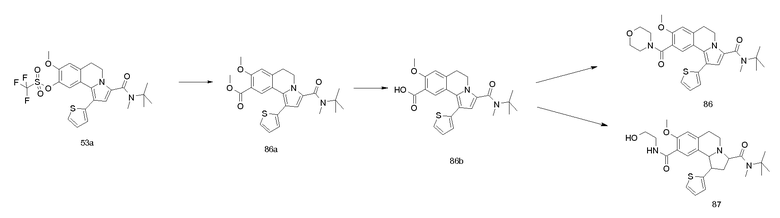
Пример 86
трет-Бутилметиламид 8-метокси-9-(морфолин-4-карбонил)-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Метиловый эфир 3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-карбоновой кислоты
Смесь продукта примера 53a (1 г), триэтиламина (0,771 мл) и 1,3-ди(фенилфосфино)пропана (184 мг) в 10 мл ДМФА и 10 мл метанола промывали струей СО (газ.) в течение 10 мин. Затем добавляли ацетат палладия(II) (103 мг). Реакционную смесь перемешивали при 70°С в атмосфере CO (газ.) в течение 72 час. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [0 → 50% этилацетат].
Выход: 476 мг. LC-МС-ESI: [M+H]+ = 453,2.
(b). 3-(трет-Бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6,6a,10а-тетрагидропирроло[2,1-а]изохинолин-9-карбоновая кислота
Продукт примера 86a (500 мг) суспендировали в метаноле (10 мл) и воде (10 мл). Добавляли KOH (620 мг) и реакционную смесь нагревали при кипячении с обратным холодильником в течение 2 час. Реакционную смесь разбавляли дихлорметаном и промывали водным раствором лимонной кислоты (2 н). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 485 мг. LC-МС-ESI: [M+H]+ = 439,2.
(c). трет-Бутилметиламид 8-метокси-9-(морфолин-4-карбонил)-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 86b (60 мг), HATU (86 мг), DIPEA (70 мкл) и морфолина (36 мкл) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 2 час. Реакционную смесь промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20→100% ацетонитрил; система 1).
Выход: 41 мг. ЖХ/МС-ESI: [M+H]+ = 508,2; анал. ВЭЖХ: Rt = 1,95 мин (способ 13); hFSHRago (CHO luc) EC50 = 69,4 нМ.
Пример 87
3-(трет-Бутилметиламид)-9-[(2-гидроксиэтил)амид] 8-метокси-1-тиофен-2-ил-5,6,6a,10а-тетрагидропирроло[2,1-а]изохинолин-3,9-дикарбоновой кислоты
Смесь продукта примера 86b (60 мг), HATU (186 мг), DIPEA (70 мкл) и этаноламина (25 мкл) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение 2 час. Реакционную смесь промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20→100% ацетонитрил; система 1).
Выход: 30 мг. ЖХ/МС-ESI: [M+H]+ = 482,2; анал. ВЭЖХ: Rt = 1,55 (способ 13); hFSHRago (CHO luc) EC50 = 23,9 нМ.
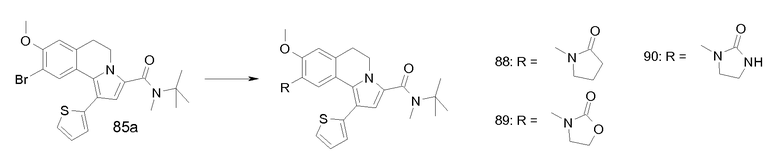
Пример 88
трет-Бутилметиламид 9-(2-оксопирролидин-1-ил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 85a (25 мг), 9,9-диметил-4,5-бис(дифенилфосфино)ксантена (6 мг), трис(дибензилиденацетон)дипалладия(0) (5 мг), Cs2CO3 (20 мг) и 2-пирролидинона (24 мг) в смеси диоксан/NMP [0,5 мл, 9/1 (об./об.)] перемешивали и нагревали с применением микроволнового излучения при 150°С в течение 5 мин. Реакционную смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [2/8 → 7/3 (об./об.)] в качестве элюента.
Выход: 1 мг. ЖХ/МС-ESI: [M+H]+ = 448; hFSHRago (CHO luc) EC50=310,0 нМ.
Пример 89
трет-Бутилметиламид 9-(2-оксооксазолидин-3-ил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Данный продукт получали способом, аналогичным способу, описываемому для примера 88, исходя из продукта примера 85а (25 мг).
Выход: 5 мг. ЖХ/МС-ESI: [M+H]+ = 450; hFSHRago (CHO luc) EC50=245,0 нМ.
Пример 90
трет-Бутилметиламид 9-(2-оксоимидазолидин-1-ил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Данный продукт получали способом, аналогичным способу, описываемому для примера 88, исходя из продукта примера 85a (25 мг).
Выход: 5 мг. ЖХ/МС-ESI: [M+H]+ = 449; hFSHRago (CHO luc) EC50=218,0 нМ.
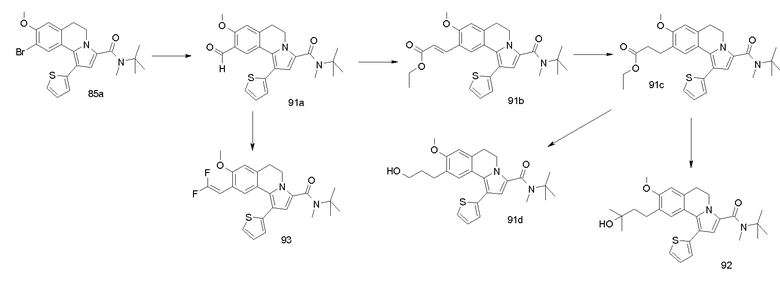
Пример 91
трет-Бутилметиламид 9-(3-гидроксипропил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и трет-бутилметиламид 9-формил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). трет-Бутилметиламид 9-формил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К суспензии продукта примера 85a (1,27 г) в смеси диэтилового простого эфира (12 мл) и ТГФ (3 мл) добавляли при -60°С раствор н-бутиллития (2 мл 1,6 M раствора в гептане). Смесь перемешивали в течение 30 мин при -60°С и затем обрабатывали ДМФА (300 мкл). Охлаждающее устройство удаляли и перемешивание продолжали в течение 30 мин при температуре окружающей среды. Реакцию гасили добавлением воды и экстрагировали этилацетатом. Органические слои объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией через короткую колонку диоксида кремния (смесь гептан/этилацетат в качестве элюента). Продукт растирали со смесью гептан/диизопропиловый простой эфир.
Выход: 650 мг. Т.пл. 93-194°С; ТСХ Rf = 0,35 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 423,3; hFSHRago (CHO luc) EC50 = 6 нМ.
(b). Этиловый эфир(E)-3-[3-(трет-Бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло-[2,1-а]изохинолин-9-ил]акриловой кислоты
Раствор триэтилфосфоноацетата (200 мкл) в ТГФ (2 мл) обрабатывали гидридом натрия (60 мг, 60% дисперсия в масле). После перемешивания в течение 20 мин маленькими порциями добавляли продукт примера 91a (400 мг). Реакция завершалась спустя 30 мин. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органические слои объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией через короткую колонку диоксида кремния и растирали с гептаном, получая при этом белое кристаллическое вещество.
Выход: 350 мг. Т.пл. 163-164°С; ТСХ Rf = 0,28 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 493,5.
(c). Этиловый эфир 3-[3-(трет-бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]пропионовой кислоты
Раствор продукта примера 91b (350 мг) в этаноле и этилацетате [20 мл, 1/2 (об./об.)] гидрировали при давлении 2Ч105 Па (2 бар) в присутствии 10% Pd/C (200 мг). Спустя 48 час медленное гидрирование было почти завершено. Продукт реакции очищали хроматографией через короткую колонку диоксида кремния и растирали с гептаном, получая при этом белое кристаллическое вещество.
Выход: 170 мг. Т.пл. 127-128°С. ТСХ Rf = 0,50 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 495,5.
(d). трет-Бутилметиламид 9-(3-гидроксипропил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Раствор продукта примера 91c (60 мг) в ТГФ (2 мл) обрабатывали LiAlH4 (6 мг). После перемешивания в течение 60 мин восстановление было завершено. Реакционную смесь разбавляли насыщ. водным раствором Na2SO4 и экстрагировали этилацетатом. Органические слои объединяли, сушили (MgSO4)), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией (гептан/этилацетат, 1/1) через колонку диоксида кремния с последующей обработкой смесью этилацетат/диэтиловый простой эфир, получая при этом белое твердое вещество.
Выход: 45 мг. Т.пл. 163-164°С. ТСХ Rf = 0,30 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 453,5; hFSHRago (CHO luc) EC50 = 0,4 нМ.
Пример 92
трет-Бутилметиламид 9-(3-гидрокси-3-метилбутил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Раствор продукта примера 91c (85 мг) в ТГФ (2 мл) обрабатывали метилмагнийхлоридом (200 мкл 2 M раствора в ТГФ) при комнатной температуре. После перемешивания в течение 1 час реакция была завершена. Добавляли раствор насыщ. водного раствора NH4Cl и смесь экстрагировали этилацетатом. Органические слои объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией через короткую колонку диоксида кремния с последующей кристаллизацией из простого эфира, получая при этом белое твердое вещество.
Выход: 70 мг. Т.пл. 153-154°С. ТСХ Rf = 0,24 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 481,5; hFSHRago (CHO luc) EC50 = 6,0 нМ.
Пример 93
трет-Бутилметиламид (9-(2,2-дифторвинил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К раствору LDA, полученному из диизопропиламина (50 мкл) и н-бутиллития (200 мкл 1,6 M раствора в гептане), в сухом ТГФ (2 мл) добавляли при -70°С раствор оксида дифторметилдифенилфосфина (75 мг; получен из дибромдифторметана и трифенилфосфина) в ТГФ (0,5 мл). Смесь перемешивали при -70°С в течение 20 мин и затем добавляли раствор продукта примера 91a (125 мг) в 0,5 мл сухого ТГФ. Реакционную смесь перемешивали при температуре окружающей среды в течение 10 мин и нагревали при 80°С в течение 30 мин. Добавляли воду и смесь экстрагировали этилацетатом. Органические слои объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния (гептан/этилацетат, 2/1). Выделенный продукт растирали с холодным гептаном.
Выход: 55 мг. Т.пл. 111-112°С. ТСХ Rf = 0,47 (гептан/этилацетат, 1/1), ТСХ Rf исходного вещества = 0,30; hFSHRago (CHO luc) EC50 = 3,0 нМ.
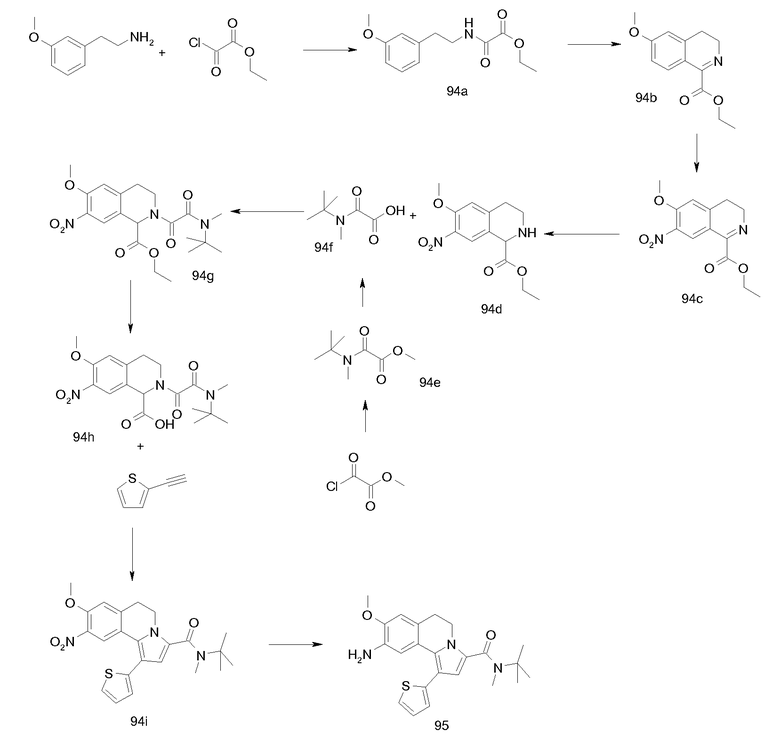
Пример 94
трет-Бутилметиламид 8-метокси-9-нитро-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир N-[2-(3-метоксифенил)этил]оксаламовой кислоты
Раствор этилоксалилхлорида (1,5 мл) в дихлорметане (5 мл) добавляли по каплям к раствору 3-метоксифенетиламина (2,0 мл) и DIPEA (4,8 мл) в дихлорметане (40 мл) при 0°С. Реакционную смесь перемешивали в течение 1 час, промывали водным раствором (2 M) лимонной кислоты, водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [6/4 (об./об.)] в качестве элюента.
Выход: 2,76 г. ЖХ/МС-ESI: [M+H]+ = 252,2.
(b). Этиловый эфир 6-метокси-3,4-дигидроизохинолин-1-карбоновой кислоты
Продукт примера 94a (10 г), растворенный в дихлорметане (20 мл) добавляли к раствору пентаоксида фосфора (10 г) в метансульфоновой кислоте (40 мл) при 80°С. После перемешивания в течение 2 час при 80°С, реакционную смесь выливали на твердый NaHCO3, разбавляли ледяной водой и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 9,3 г. ЖХ/МС-ESI: [M+H]+ = 234,2.
(c). Этиловый эфир 6-метокси-7-нитро-3,4-дигидроизохинолин-1-карбоновой кислоты
Нитрат калия (3,59 г) добавляли к перемешиваемому раствору продукта примера 94b (9,2 г) в серной кислоте (50 мл) при 0°С. После перемешивания в течение 2 час при комнатной температуре реакционную смесь выливали в ледяную воду, нейтрализовали NaHCO3 и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [2/8 (об./об.)] в качестве элюента.
Выход: 6,04 г. ЖХ/МС-ESI: [M+H]+ = 279,1.
(d). Этиловый эфир 6-метокси-7-нитро-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты
Цианоборогидрид натрия (10,64 г) добавляли порциями к перемешиваемому раствору продукта примера 94c (6,04 г) в уксусной кислоте (100 мл) на протяжении периода 15 мин. После перемешивания в течение 1 час реакционную смесь выливали в ледяную воду, смесь делали основной Na2CO3, экстрагировали этилацетатом и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [2/8 (об./об.)] в качестве элюента.
Выход: 3,6 г. ЖХ/МС-ESI: [M+H]+ = 281,1.
(e). Этиловый эфир N-трет-бутил-N-метилоксаламовой кислоты
Метил-трет-бутиламин (13,2 мл) добавляли по каплям к раствору метилоксалилхлорида (9,2 мл) и пиридина (10,5 мл) в дихлорметане (140 мл) при 0°С. После перемешивания в течение 1 час реакционную смесь промывали водным раствором HCl (2 M) и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 17,3 г.
(f). N-трет-Бутил-N-метилоксаламовая кислота
Гидроксид калия (6,2 г), растворенный в метаноле (100 мл) добавляли по каплям к раствору примера 94e (17,3 г) в метаноле (120 мл) при 0°С. Реакционную смесь нагревали до комнатной температуры и концентрировали в вакууме. Остаток растворяли в воде (50 мл), подкисляли раствором серной кислоты (10%) до pH = 4, фильтровали и сушили в вакууме.
Выход: 7 г.
(g). Этиловый эфир 2-(трет-бутилметиламинооксалил)-6-метокси-7-нитро-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты
Смесь продукта примера 94d (3,2 г), продукта примера 94f (2,0 г), TBTU (5,5 г) и DIPEA (9,94 мл) в дихлорметане (150 мл) перемешивали при комнатной температуре в течение 1 час. Реакционную смесь промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [3/7 (об./об.)] в качестве элюента.
Выход: 3,79 г. ЖХ/МС-ESI: [M+H]+= 422,2.
(h). 2-(трет-Бутилметиламинооксалил)-6-метокси-7-нитро-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Смесь продукта примера 94g (3,78 г) и гидроксида калия (1,0 г) в тетрагидрофуране (100 мл) и воде (50 мл) перемешивали при комнатной температуре в течение 1 час. Реакционную смесь подкисляли водным раствором HCl (10%) и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 3,11 г. ЖХ/МС-ESI: [M+H]+ = 394,2.
(i). трет-Бутилметиламид 8-метокси-9-нитро-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 94h (2,62 г) и 2-этинилтиофена (0,779 мл) в уксусном ангидриде (15 мл) нагревали с применением микроволнового излучения до 140°С в течение 15 мин. Реакционную смесь выливали в ледяную воду, делали основной NaHCO3 и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [2/8 (об./об.)] в качестве элюента.
Выход: 2,51 г. ЖХ/МС-ESI: [M+H]+ = 440,1; анал. ВЭЖХ: Rt = 19,67 (способ 12); hFSHRago (CHO luc) EC50 = 3,0 нМ.
Пример 95
трет-Бутилметиламид 9-амино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Уксусную кислоту (0,39 мл) добавляли порциями к раствору продукта примера 94 (300 мг) в ТГФ (10 мл) при 0°С с последующим добавлением порциями цинка (893 мг). После перемешивания в течение 2 час при комнатной температуре реакционную смесь фильтровали через декалит. Фильтрат концентрировали в вакууме и растворяли в этилацетате. Органический слой промывали насыщенным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 100% ацетонитрил; система 1). Выход: 159 мг. ЖХ/МС-ESI: [M+H]+ = 410,2; анал. ВЭЖХ: Rt = 26,18 мин (Способ 12); hFSHRago (CHO luc) EC50 = 44,8 нМ.
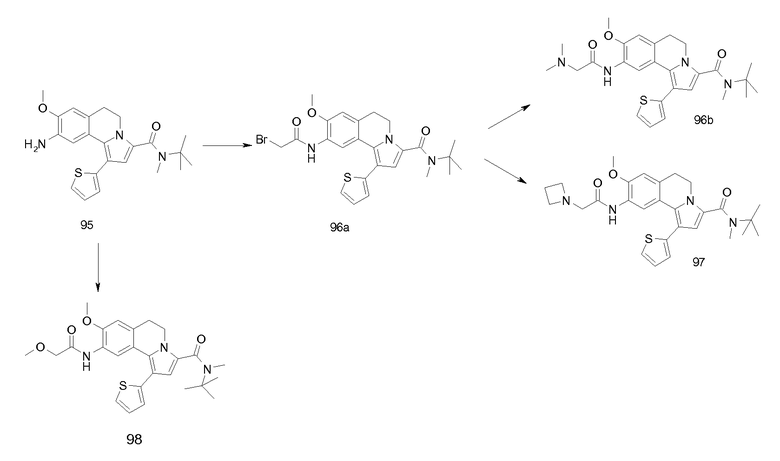
Пример 96
трет-Бутилметиламид 9-(2-диметиламиноацетиламино)-8-метокси-1-тиофен-2-ил-5,6,6a,10а-тетрагидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). трет-Бутилметиламид 9-(2-бромацетиламино)-8-метокси-1-тиофен-2-ил-5,6,6a,10a-тетрагидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Бромацетилбромид (0,137 мл) добавляли к перемешиваемому раствору продукта примера 95 (500 мг) и DIPEA (0,425 мл) в дихлорметане (20 мл) на протяжении периода 6 час. Реакционную смесь концентрировали в вакууме.
Выход: 648 мг. ЖХ/МС-ESI: [M+H]+ = 530,1/532,1.
(b). трет-Бутилметиламид 9-(2-диметиламиноацетиламино)-8-метокси-1-тиофен-2-ил-5,6,6a,10а-тетрагидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 96a (100 мг), DIPEA (0,165 мл) и соль N,N-диметиламина и хлористоводородной кислоты (66 мг) в ТГФ (4 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 80% ацетонитрил, 0,1% TFA; система 1).
Выход: 33 мг (в виде TFA-соли). ЖХ/МС-ESI: [M+H]+ = 495,2; анал. ВЭЖХ: Rt = 24,61 (способ 12); hFSHRago (CHO luc) EC50 = 2,8 нМ.
Пример 97
трет-Бутилметиламид 9-(2-азетидин-1-илацетиламино)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 96a (100 мг), DIPEA (0,165 мл) и азетидина (37 мг) в ТГФ (4 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 80% ацетонитрил, 0,1% TFA; система 1).
Выход: 11 мг. ЖХ/МС-ESI: [M+H]+ = 507,3; анал. ВЭЖХ: Rt = 25,06 (способ 12); hFSHRago (CHO luc) EC50 = 4,0 нМ.
Пример 98
трет-Бутилметиламид 8-метокси-9-(2-метоксиацетиламино)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 95 (30 мг), триэтиламина (10,2 мкл) и метоксиацетилхлорида (6,7 мкл) перемешивали при комнатной температуре в течение 3 час. Реакционную смесь разбавляли дихлорметаном и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0→90% ацетонитрил; система 1).
Выход: 16 мг. МС-ESI [M+H]+ = 482,5; анал. ВЭЖХ: Rt = 35,92 мин (способ 12); hFSHRago (CHO luc) EC50 = 1,4 нМ.
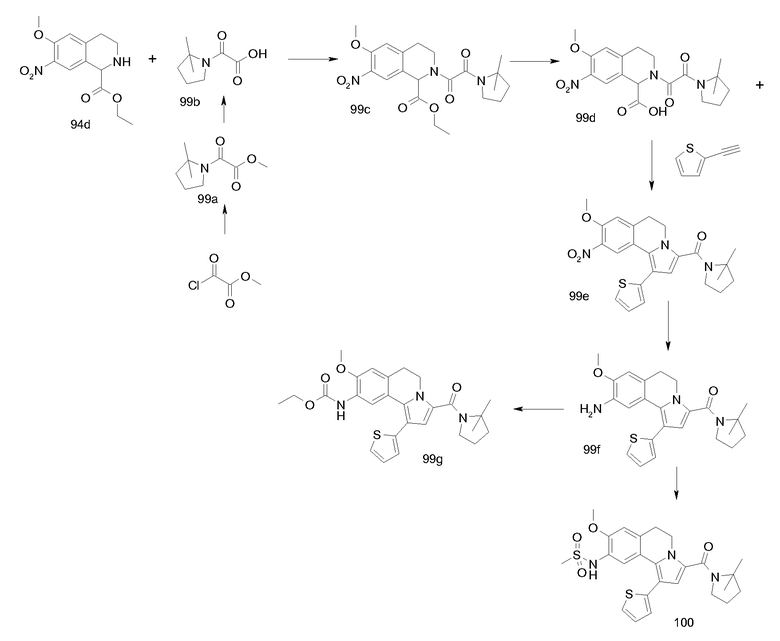
Пример 99
Этиловый эфир [3-(2,2-диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]карбаминовой кислоты
(a). Этиловый эфир (2,2-диметилпирролидин-1-ил)оксоуксусной кислоты
Метилоксалилхлорид (5 мл) добавляли по каплям к раствору 2,2-диметилпирролидина (8,11 г) и пиридина (5,7 мл) в дихлорметане (50 мл) при 0°С. После перемешивания в течение 1 час реакционную смесь промывали водным раствором HCl (2 н) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 6,62 г.
(b). (2,2-Диметилпирролидин-1-ил)оксоуксусной кислоты
KOH (2,20 г), растворенный в метаноле (100 мл), добавляли по каплям к раствору продукта примера 99a (6,62 г) в метаноле (120 мл) при 0°С. Реакционную смесь нагревали до комнатной температуры и концентрировали в вакууме. Остаток растворяли в воде (30 мл), подкисляли водным раствором H2SO4 (10%) до pH=4, фильтровали и сушили в вакууме.
Выход: 3,35 г.
(c) Этиловый эфир 2-[2-(2,2-диметилпирролидин-1-ил)-2-оксоацетил]-6-метокси-7-нитро-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты
Смесь продукта примера 94d (3,0 г), продукта примера 99b (2,2 г), TBTU (5,16 г) и DIPEA (9,3 мл) в дихлорметане (150 мл) перемешивали при комнатной температуре в течение 1 час. Реакционную смесь промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [10/0 → 0/10 (об./об.)] в качестве элюента.
Выход: 4,37 г. ЖХ/МС-ESI: [M+H]+=434,2.
(d). 2-[2-(2,2-Диметилпирролидин-1-ил)-2-оксоацетил]-6-метокси-7-нитро-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Смесь продукта примера 99c (4,37 г) и гидроксида калия (1,13 г) в ТГФ (100 мл) и воде (50 мл) перемешивали при комнатной температуре в течение 1 час. Реакционную смесь подкисляли водным раствором HCl (2 н) и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 3,18 г. ЖХ/МС-ESI: [M+H]+=406,2.
(e) (2,2-Диметилпирролидин-1-ил)-(8-метокси-9-нитро-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Смесь продукта примера 99d (3,18 г) и 2-этинилтиофена (1,82 мл) в уксусном ангидриде (15 мл) нагревали с применением микроволнового излучения при 140°С в течение 15 мин. Реакционную смесь выливали в ледяную воду, нейтрализовали NaHCO3 и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток кристаллизовали из диэтилового простого эфира.
Выход: 2,28 г. ЖХ/МС-ESI: [M+H]+=452,2.
(f) (9-Амино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-(2,2-диметилпирролидин-1-ил)метанон
Цинк (29,0 г) добавляли порциями к раствору продукта примера 99e (10,0 г) в ТГФ (500 мл) и уксусной кислоте (12,7 мл) при 0°С. После перемешивания в течение 18 час при комнатной температуре реакционную смесь фильтровали через декалит. Фильтрат промывали насыщенным водным раствором NaHCO3 и насыщенным раствором соли. Органический слой промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 10,36 г: ЖХ/МС-ESI: [M+H]+=422,18.
(g). Этиловый эфир [3-(2,2-диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]карбаминовой кислоты
Раствор продукта примера 99f (50 мг), DIPEA (0,041 мл) и этилхлорформиата (0,011 мл) в дихлорметане (2 мл) перемешивали при 20°С в течение 2 час. Реакционную смесь промывали водой и насыщенным раствором соли и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10→100% ацетонитрил; система 1).
Выход: 38 мг. ЖХ/МС-ESI: [M+H]+=494,1; анал. ВЭЖХ: Rt=15,28 (способ 10); hFSHRago (CHO luc) EC50=22 нМ.
Пример 100
N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]метансульфонамид
Раствор продукта примера 99f (50 мг), DIPEA (0,041 мл) и метансульфонилхлорида (0,011 мл) в дихлорметане (2 мл) перемешивали при 20°С в течение 2 час. Реакционную смесь промывали водой и насыщенным раствором соли и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0→80% ацетонитрил; система 1).
Выход: 25 мг. ЖХ/МС-ESI: [M+H]+=500,1; анал. ВЭЖХ: Rt=21,15 мин (способ 10); hFSHRago (CHO luc) EC50=1,0 нМ.
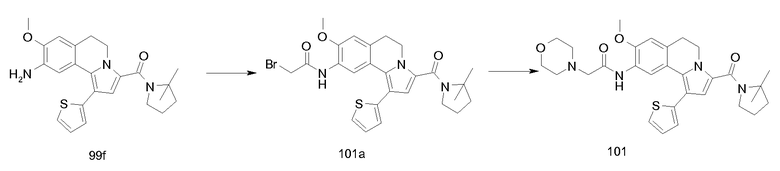
Пример 101
N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]-2-морфолин-4-илацетамид
(a). 2-Бром-N-[3-(2,2-диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]ацетамид
Бромацетилбромид (0,155 мл) добавляли к перемешиваемому раствору продукта примера 99f (500 мг) и DIPEA (0,413 мл) в дихлорметане (20 мл) на протяжении периода 6 час. Реакционную смесь концентрировали в вакууме.
Выход: 643 мг. ЖХ/МС-ESI: [M+H]+=542,0/544,0.
(b). N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]-2-морфолин-4-илацетамид
Смесь продукта примера 101a (100 мг), DIPEA (0,165 мл) и морфолина (62 мг) в ТГФ (4 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали водой и насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 80% ACN, 0,1% TFA; система 1).
Выход: 95 мг (в виде соли TFA). ЖХ/МС-ESI: [M+H]+=549,2; анал. ВЭЖХ: Rt = 27,19 мин (способ 12); hFSHRago (CHO luc) EC50=2,0 нМ.
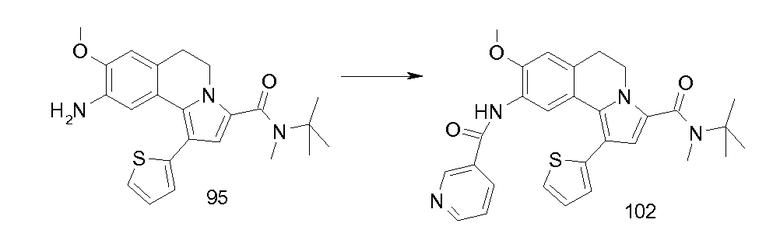
Пример 102
трет-Бутилметиламид 8-метокси-9-[(пиридин-3-карбонил)амино]-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 95 (50 мг), пиридин-3-карбоновой кислоты (30 мг), TBTU (150 мг), DIPEA (300 мкл) и HOBt (20 мг) в пиридине (1 мл) перемешивали в течение 1 час при комнатной температуре. Смесь разбавляли водой и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Сырое вещество очищали хроматографией (гептан/ацетон, 1/1, об./об.) и растирали с применением диэтилового простого эфира.
Выход: 30 мг. Т.пл. 223-224°С, ТСХ Rf=0,25 (гептан/ацетон, 1/1); ЖХ/МС-ESI: [M+H]+=515,3; hFSHRago (CHO luc) EC50=13,0 нМ.
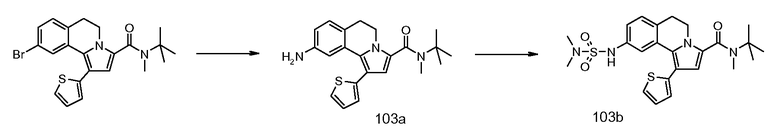
Пример 103
трет-Бутилметиламид 9-диметиламиносульфониламино-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). трет-Бутилметиламид 9-амино-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Раствор трет-бутилметиламида 9-бром-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты (500 мг), LiHMDS (1,25 мл 20% раствора в ТГФ), (трет-Bu)3P (3 мг), Pd2(dba)3 (10 мг) в толуоле (20 мл) промывали струей азота и затем нагревали при 100°С в течение 16 час. Реакционную смесь охлаждали и промывали раствором NaOH (10 мл 2 н раствора) и водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния (гептан/этилацетат).
Выход: 153 мг. ЖХ/МС-ESI: [M+H]+ = 380.
(b). трет-Бутилметиламид 9-диметиламиносульфониламино-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Раствор продукта примера 103a (36 мг), триэтиламина (20 мг) и диметилсульфамоилхлорида (15 мг) в дихлорметане (1 мл) перемешивали и нагревали с применением микроволнового излучения при 140°С в течение 5 мин. Реакционную смесь разбавляли дихлорметаном, промывали водным раствором HCl (2 н) и водным раствором NaHCO3 (10%). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали пропусканием через короткую колонку диоксида кремния с применением смеси толуол/EtOAc (2/1, об./об.) в качестве элюента.
Выход: 13 мг. ЖХ/МС-ESI: [M+H]+=487; hFSHRago (CHO luc) EC50=756,0 нМ.
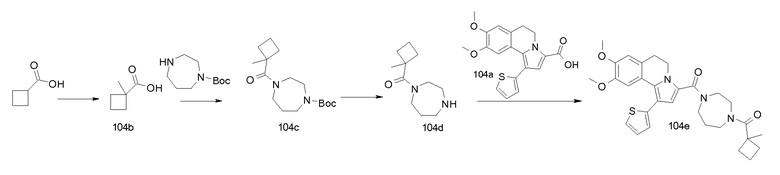
Пример 104
(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(1-метилциклобутанкарбонил)-[1,4]диазепан-1-ил]метанон
(a). 8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Синтез 8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты, исходя из 2-(3,4-диметоксифенил)этиламина, проводили согласно способу, описанному для примера 1i.
Выход: 3,16 г. МС-ESI: [M+H]+ = 356,0.
(b). 1-Метилциклобутанкарбоновая кислота
При 0°С н-бутиллитий (13,75 мл, 1,6 М раствор в гептане) добавляли по каплям к раствору диизопропиламина (3,08 мл) в ТГФ (30 мл). После перемешивания в течение 30 мин при 0°С реакционную смесь охлаждали до -20°С с последующим добавлением по каплям циклобутанкарбоновой кислоты (0,956 мл), растворенной в ТГФ (10 мл, сухой), получая при этом приблизительно 0,25 М раствор аниона. При 0°С к свежеполученному раствору аниона (20 мл, 0,25 M) по каплям добавляли метилиодид (1,0 мл). После перемешивания в течение 18 час при комнатной температуре реакционную смесь гасили насыщ. водным раствором NH4Cl и концентрировали в вакууме до небольшого объема. Остаток растворяли в водном растворе NaOH (5%) и экстрагировали диэтиловым простым эфиром. Водный слой подкисляли и экстрагировали дихлорметаном. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 470 мг.
(c). трет-Бутиловый эфир 4-(1-метилциклобутанкарбонил)-[1,4]диазепан-1-карбоновой кислоты
HATU (1,71 г), трет-бутиловый эфир [1,4]диазепан-1-карбоновой кислоты (0,813 мл) и DIPEA (3,58 мл) добавляли к раствору продукта примера 104b (470 мг) в дихлорметане (20 мл). После перемешивания в течение 2 час при комнатной температуре реакционную смесь выливали в водный раствор лимонной кислоты (10%) и экстрагировали этилацетатом. Органический слой промывали насыщ. водным раствором NaHCO3, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на диоксиде кремния с применением смеси толуол/ацетон [100/0 → 3/1 (об./об.)] в качестве элюента.
Выход: 591 мг. ЖХ/МС-ESI: [M+H]+ = 297,4.
(d). Гидрохлорид [1,4]диазепан-1-ил-(1-метилциклобутил)метанона
Раствор HCl (4 мл, 4 н в диоксане) добавляли к раствору продукта примера 104c (580 мг) в дихлорметане (25 мл). После перемешивания в течение 4 час при комнатной температуре реакционную смесь концентрировали в вакууме.
Выход: 473 мг (в виде HCl-соли).
(e). (8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(1-метилциклобутанкарбонил)-[1,4]диазепан-1-ил]метанон
Получение амида реакцией продукта примера 104d (85 мг) с продуктом примера 104a (64 мг) проводили согласно способу, описанному для примера 104c. Остаток очищали препаративной ВЭЖХ (20% → 100% ацетонитрил; система 1).
Выход: 60,4 мг. ЖХ/МС-ESI: [M+H]+ = 534,3; анал. ВЭЖХ: Rt= 18,67 мин (способ 2); hFSHRago (CHO luc) EC50 = 3,0 нМ.
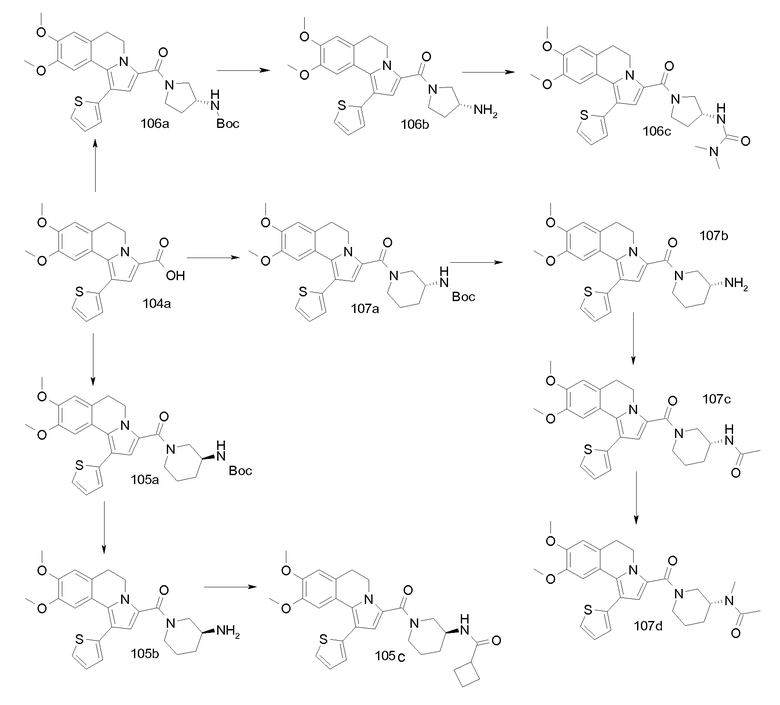
Пример 105
[(S)-1-(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пиперидин-3-ил]амид циклобутанкарбоновой кислоты
(a). трет-Бутиловый эфир [(S)-1-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пиперидин-3-ил]карбаминовой кислоты
Получение амида реакцией трет-бутилового эфира (S)-пиперидин-3-илкарбаминовой кислоты (168 мг) с продуктом примера 104a (200 мг) проводили согласно способу, описанному в примере 104c. Остаток очищали хроматографией на диоксиде кремния с применением смеси гептан/этилацетат [1/1 → 0/100 (об./об.)] в качестве элюента.
Выход: 345 мг. МС-ESI: [M+H]+ = 538,4.
(b). ((S)-3-Аминопиперидин-1-ил)-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Удаление защитной группы у продукта примера 105a (302 мг) проводили согласно способу, описанному в примере 104d.
Выход: 245 мг (в виде HCl-соли). ЖХ/МС-ESI: [M+H]+ = 438,2.
(c). [(S)-1-(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пиперидин-3-ил]амид циклобутанкарбоновой кислоты
Смесь BOP (280 мг), DIPEA (0,276 мл), циклобутанкарбоновой кислоты (45,7 мкл) и продукта примера 105b (150 мг) в дихлорметане (2 мл) перемешивали в течение 5 час при комнатной температуре. Реакционную смесь разбавляли дихлорметаном и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10 → 90% ацетонитрил; система 1).
Выход: 89 мг. МС-ESI: [M+H]+ = 520,4; анал. ВЭЖХ: Rt = 20,88 мин (способ 2); hFSHRago (CHO luc) EC50 = 1730,0 нМ.
Пример 106
3-[(R)-1-(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пирролидин-3-ил]-1,1-диметилмочевина
(a). трет-Бутиловый эфир [(R)-1-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пирролидин-3-ил]карбаминовой кислоты
Получение амида реакцией трет-бутилового эфира (R)-пирролидин-3-илкарбаминовой кислоты (428 мг) с продуктом примера 104a (400 мг) проводили согласно способу, описанному для примера 104c.
Выход: 720 мг.
(b). ((R)-3-Аминопирролидин-1-ил)-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Удаление защитной группы у продукта примера 106а (715 мг) проводили согласно способу, описанному в примере 104d.
Выход: 494 мг (в виде HCl-соли). ЖХ/МС-ESI: [M+H]+ = 424,2
(c). 3-[(R)-1-(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пирролидин-3-ил]-1,1-диметилмочевина
Ацилирование продукта примера 106b (50 мг) N,N-диметилкарбамоилхлоридом (48 мг) проводили согласно способу, описанному в примере 107c. Остаток очищали хроматографией на диоксиде кремния с применением смеси дихлорметан/метанол [100/0 → 95/5 (об./об.)] в качестве элюента.
Выход: 37,4 мг. ЖХ/МС-ESI: [M+H]+ = 495,2; анал. ВЭЖХ: Rt = 12,25 мин (способ 2); hFSHRago (CHO luc) EC50 = 755,0 нМ.
Пример 107
N-[(R)-1-(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пиперидин-3-ил]-N-метилацетамид
(a). трет-Бутиловый эфир [(R)-1-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пиперидин-3-ил]карбаминовой кислоты
Получение амида реакцией трет-бутилового эфира (R)-пиперидин-3-илкарбаминовой кислоты (168 мг) и продукта примера 104a (200 мг) проводили согласно способу, описанному в примере 104c. Остаток очищали хроматографией на диоксиде кремния с применением смеси гептан/(этилацетат/метанол, 95/5) [1/1 → 0/1 (об./об.)] в качестве элюента.
Выход: 303 мг. МС-ESI: [M+H]+ = 538,4.
(b). ((R)-3-Аминопиперидин-1-ил)-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Удаление защитной группы у продукта примера 107а (300 мг) проводили согласно способу, описанному в примере 104d.
Выход: 265 мг (в виде HCl-соли). ЖХ/МС-ESI: [M+H]+ = 438,2.
(c). N-[(R)-1-(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пиперидин-3-ил]ацетамид
Ацетилхлорид (29,9 мкл) и триэтиламин (116 мкл) добавляли к раствору продукта примера 107b (132 мг) в дихлорметане (2 мл). После перемешивания в течение 18 час при комнатной температуре реакционную смесь разбавляли дихлорметаном и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10% → 90% ацетонитрил; система 1).
Выход: 92 мг. МС-ESI: [M+H]+ = 480,4; анал. ВЭЖХ: Rt = 16,18 мин (способ 2).
(d). N-[(R)-1-(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)пиперидин-3-ил]-N-метилацетамид
Метилиодид (62,3 мкл) и гидрид натрия (7,3 мг, 60% дисперсия в масле) добавляли к раствору продукта примера 107c (35 мг) в ДМФА (1 мл). После перемешивания в течение 3 час при 50°С добавляли несколько капель воды и реакционную смесь концентрировали в вакууме. Остаток растворяли в этилацетате и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (10 → 90% ацетонитрил; система 1).
Выход: 25,6 мг. МС-ESI: [M+H]+ = 494,4; анал. ВЭЖХ: Rt = 18,51 мин (способ 2); hFSHRago (CHO luc) EC50 = 30,9 нМ.
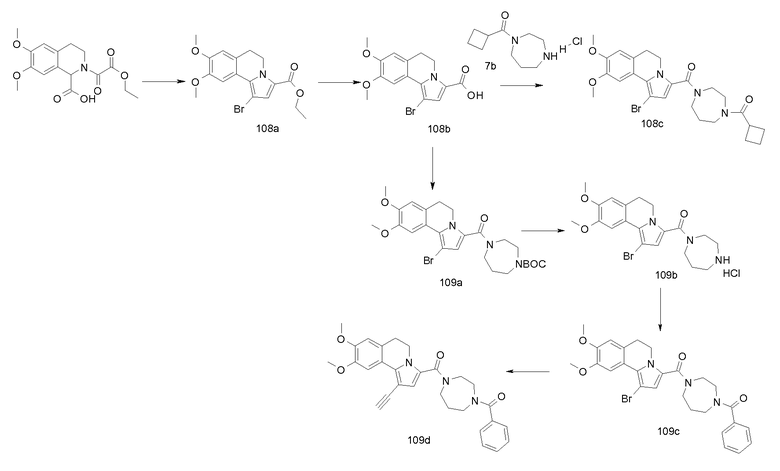
Пример 108
(1-Бром-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-(4-циклобутанкарбонил-[1,4]диазепан-1-ил)метанон и (1-бром-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-(4-циклобутанкарбонил-[1,4]диазепан-1-ил)метанон
(a). Этиловый эфир 1-бром-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
2-Этоксиоксалил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-карбоновую кислоту получали аналогично с примером 1g. Смесь 2-этоксиоксалил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты (3,4 г), триметилсилилацетилена (2 г) и уксусного ангидрида (10 мл) в ТГФ (10 мл) перемешивали и нагревали с применением микроволнового излучения при 150°С в течение 5 мин. Реакционную смесь выливали в воду и нейтрализовали карбонатом натрия. Смесь экстрагировали этилацетатом и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [10/0 → 6/4 (об./об.)] в качестве элюента.
К смеси выделенного продукта в ДМФА (20 мл) добавляли NBS (1,9 г). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин. Реакционную смесь разбавляли этилацетатом и водным раствором HCl (0,2 M) и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток перекристаллизовывали из метанола.
Выход: 2,6 г. МС-ESI: [M+H]+ = 380/382, анал. ВЭЖХ: Rt = 2,47 (способ 10).
(b). (1-Бром-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-(4-циклобутанкарбонил-[1,4]диазепан-1-ил)метанон
Смесь продукта примера 108a (2,6 г) и смеси водный раствор гидроксида лития (3 М)/диоксан [2:1 (об./об.), 15 мл] перемешивали и нагревали с применением микроволнового излучения при 150°С в течение 5 мин. Реакционную смесь подкисляли до pH=5 водным раствором HCl (6 M). Продукт фильтровали и выделяли.
Выход: 2,3 г; hFSHRago (CHO luc) EC50 = 99,2 нМ.
(c). Этилизопропиламид 2-ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 108b (1,06 г), DIPEA (2,6 мл) и HATU (1,37 г) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 30 мин. Добавляли продукт примера 7b и реакционную смесь перемешивали при температуре окружающей среды в течение 2 час. Реакционную смесь разбавляли этилацетатом и промывали водным раствором HCl (0,2 M), водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением этилацетата [0 → 10% изопропиламина (об./об.)] в качестве элюента.
Выход: 1,4 г. ЖХ/МС-ESI: [M+H]+ = 517/519, анал. ВЭЖХ: Rt = 2,92 мин (способ 10); hFSHRago (CHO luc) EC50 = 100 нМ.
Пример 109
(4-Бензоил-[1,4]диазепан-1-ил)-(1-этинил-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
(a). трет-Бутиловый эфир 4-(1-бром-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-карбоновой кислоты
Смесь продукта примера 108b (1,0 г), HATU (1,61 г), триэтиламина (0,8 мл) и трет-бутил-1,4-диазепан-1-карбоксилата (1,1 мл) в дихлорметане (30 мл) перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь промывали водным раствором лимонной кислоты (3%). Органический слой промывали водой, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [0→10% (об./об.)] в качестве элюента.
Выход: 1,39 г. ЖХ/МС-ESI: [M+H]+ = 536,0.
(b). Гидрохлорид (1-бром-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[1,4]диазепан-1-илметанона
HCl (6,3 мл, 4 н раствор в диоксане) добавляли к раствору продукта примера 109a (1,34 г) в диоксане (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 час. Реакционную смесь разбавляли диэтиловым простым эфиром и твердые вещества собирали фильтрованием.
Выход: 972 мг.
(c). (4-Бензоил-[1,4]диазепан-1-ил)-(1-бром-8,9-диметокси-5,6-дигидропирроло[2,1-a]изохинолин-3-ил)метанон
Смесь продукта примера 109b (972 мг), DIPEA (740 мкл) и бензоилхлорида (338 мкл) в дихлорметане (50 мл) перемешивали в течение 1 час при комнатной температуре. Реакционную смесь затем промывали водным раствором HCl (2 н), водой и насыщенным раствором соли. Органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [0→5% (об./об.)] в качестве элюента.
Выход: 1,08 г. ЖХ/МС-ESI: [M+H]+ = 536,0.
(d). (4-Бензоил-[1,4]диазепан-1-ил)-(1-этинил-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
К раствору продукта примера 109c (61 мг) в толуоле (3 мл) добавляли трибутилэтинилстаннан (67 мкл). Через реакционную смесь барботировали азот в течение 5 мин, добавляли Pd(PPh3)4 (9 мг) и раствор перемешивали в течение 30 мин при 100°С. Реакционную смесь концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [0→5% (об./об.)] в качестве элюента. Самые чистые фракции собирали, концентрировали и дополнительно очищали препаративной ВЭЖХ (20% → 70% ацетонитрил; система 1).
Выход: 15 мг. ЖХ/МС-ESI: [M+H]+ = 484,3; анал. ВЭЖХ: Rt = 14,36 мин (способ 2); hFSHRago (CHO luc) EC50 = 76,2 нМ.
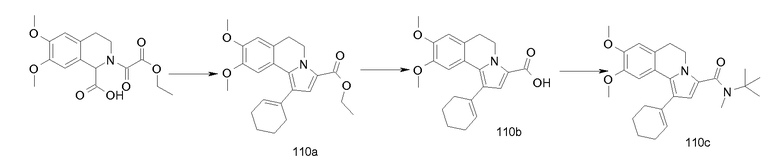
Пример 110
трет-Бутилметиламид 1-циклогекс-1-енил-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 1-циклогекс-1-енил-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь 2-этоксиоксалил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты (5 г), полученной аналогично примеру 1g, 1-этинилциклогексена (14 ммоль) и уксусного ангидрида (5 мл) в ТГФ (15 мл) перемешивали и нагревали с применением микроволнового излучения при 120°С в течение 15 мин. Реакционную смесь разбавляли этилацетатом и водным раствором гидроксида натрия (1 н) и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1/9 → 6/4 (об./об.)] в качестве элюента. Соединение выделяют в виде белого твердого вещества.
Выход: 1,8 г. МС-ESI: [M+H]+ = 440.
(b). 1-Циклогекс-1-енил-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 110a (935 мг) и смеси водный раствор LiOH (2 M)/диоксан [1:1 (об./об.), 40 мл] нагревали при кипячении с обратным холодильником в течение 1 час. Реакционную смесь охлаждали до комнатной температуры и подкисляли до pH = 5. Продукт фильтровали и выделяли в виде коричневого твердого вещества.
Выход: 680 мг.
(c). трет-Бутилметиламид 1-циклогекс-1-енил-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 110b (25 мг), N-метил-N-трет-бутиламина, HATU (40 мг) и DIPEA (61 мкл) в дихлорметане (1 мл) перемешивали и нагревали с применением микроволнового излучения при 100°С в течение 5 мин. Реакционную смесь разбавляли этилацетатом и промывали водой и водным раствором лимонной кислоты (3%). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [0 → 6/4 (об./об.)] в качестве элюента.
Выход: 9 мг. МС-ESI: [M+H]+ = 423; hFSHRago (CHO luc) EC50 = 76,5 нМ.
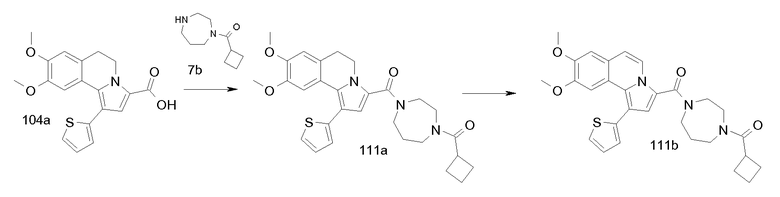
Пример 111
(4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-(8,9-диметокси-1-тиофен-2-илпирроло[2,1-а]изохинолин-3-ил)метанон и (4-циклобутанкарбонил-[1,4]диазепан-1-ил)-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
(a). (4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон
Получение амида реакцией продукта примера 7b (30 мг) и продукта примера 104a (70 мг) проводили согласно способу, описанному в примере 7c. Остаток очищали препаративной ВЭЖХ (10 → 90% ацетонитрил; система 1).
Выход: 40 мг. МС-ESI: [M+H]+ = 520,4; анал. ВЭЖХ: Rt = 20,15 мин (способ 2); hFSHRago (CHO luc) EC50 = 2,9 нМ.
(b). (4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-(8,9-диметокси-1-тиофен-2-илпирроло[2,1-а]изохинолин-3-ил)метанон
Окисление продукта примера 111a (15 мг) проводили согласно способу, описанному для примера 36. Остаток очищали хроматографией на диоксиде кремния с применением этилацетата в качестве элюента.
Выход: 12,7 мг. ЖХ/МС-ESI: [M+H]+ = 518,2; анал. ВЭЖХ: Rt = 2,64 мин (способ 2); hFSHRago (CHO luc) EC50 = 4,9 нМ.
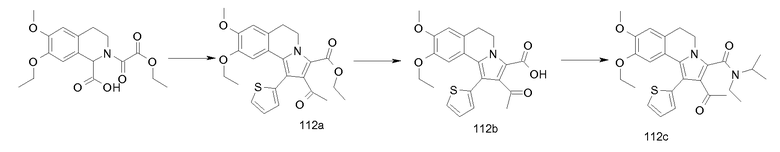
Пример 112
Этилизопропиламид 2-ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 2-ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
7-Этокси-2-этоксиоксалил-6-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновую кислоту получали аналогично примеру 1g. Смесь 7-этокси-2-этоксиоксалил-6-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты (5 г), 4-тиофен-2-илбут-3-ин-2-она (14 ммоль) и уксусного ангидрида (5 мл) в ТГФ (15 мл) перемешивали и нагревали с применением микроволнового излучения при 120°С в течение 15 мин. Реакционную смесь разбавляли этилацетатом и водным раствором NaOH (1 н) и промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1/9 → 6/4 (об./об.)] в качестве элюента, получая при этом белое твердое вещество.
Выход: 1,8 г. МС-ESI: [M+H]+ = 440.
(b). 2-Ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 112a (840 мг) и смеси водный раствор LiOH (2M)/диоксан [1:1 (об./об.), 4 мл] перемешивали и нагревали с применением микроволнового излучения при 150°С в течение 5 мин. Реакционную смесь подкисляли до pH=5. Продукт фильтровали и выделяли в виде белого твердого вещества.
Выход: 776 мг. МС-ESI: [M+H]+ = 354.
(c). Этилизопропиламид 2-ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 112b (20 мг), N-этилизопропиламина (12 мкл), CIP (20 мг) и DIPEA (42 мкл) в дихлорметане (1 мл) перемешивали и нагревали с применением микроволнового излучения при 100°С в течение 5 мин. Реакционную смесь концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (0 → 90% ацетонитрил; система 1). TFA удаляли промыванием продукта водным раствором бикарбоната натрия.
Выход: 9 мг. МС-ESI: [M+H]+ = 481; ВЭЖХ: Rt = 3,36 мин (способ 1); hFSHRago (CHO luc) EC50 = 200,0 нМ.
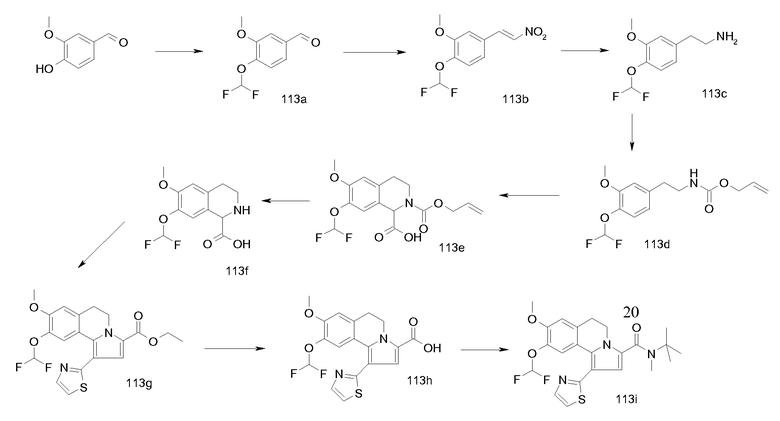
Пример 113
трет-Бутилметиламид 9-дифторметокси-8-метокси-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). 4-Дифторметокси-3-метоксибензальдегид
Смесь 4-гидрокси-3-метоксибензальдегида (6 г), Cs2CO3 (25,7 г) и метил-2-хлор-2,2-дифторацетата (5 мл) в ДМФА (50 мл) перемешивали при 90°С в течение 1 час. При комнатной температуре реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали дважды водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:1 (об./об.)] в качестве элюента.
Выход: 2,1 г. ЖХ/МС-ESI: [M+H]+ = 203,1.
(b). 1-Дифторметокси-2-метокси-4-((E)-2-нитровинил)бензол
Смесь продукта примера 113a (2,1 г) и ацетата аммония (0,76 г) в нитрометане (15 мл) перемешивали при 100°С в течение 1 час. Реакционную смесь концентрировали в вакууме и остаток растворяли в дихлорметане. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [2:1 (об./об.)] в качестве элюента.
Выход: 1,36 г. ЖХ/МС-ESI: [M+H]+ = 246,0.
(c). 2-(4-Дифторметокси-3-метоксифенил)этиламин
При 0°С раствор продукта примера 113b (1,36 г) в сухом ТГФ (5 мл) добавляли по каплям к смеси литийалюминийгидрида и сухого ТГФ (10 мл) и диэтилового эфира (10 мл). После перемешивания при 65°С в течение 2 час реакционной смеси давали возможность достичь комнатную температуру и гасили 5 мл воды в ТГФ (12 мл). Добавляли водный раствор NaOH (2,5 мл, 2 M) и воду (1,3 мл). Смесь фильтровали через декалит. Фильтрат концентрировали в вакууме и растворяли в этилацетате. Органический слой промывали дважды водным раствором HCl (1 M). Водный слой подщелачивали водным раствором NaOH (2 M) до pH=10 и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 760 мг. МС-ESI: [M+H]+ = 218,3.
(d). Аллиловый эфир [2-(4-дифторметокси-3-метоксифенил)этил]карбаминовой кислоты
При 0°С раствор аллилхлорформиата (450 мкл) в дихлорметане (5 мл) добавляли по каплям к раствору продукта примера 113c (760 мг) и DIPEA (0,9 мл) в дихлорметане (25 мл). После перемешивания при комнатной температуре в течение 2 час реакционную смесь промывали водным раствором HCl (1 M), насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [2:1 (об./об.)] в качестве элюента.
Выход: 669 мг. МС-ESI: [M+H]+ = 302,3.
(e). 2-Аллиловый эфир 7-дифторметокси-6-метокси-3,4-дигидро-1H-изохинолин-1,2-дикарбоновой кислоты
При 0°С концентрированную серную кислоту (2,5 мл) добавляли по каплям к смеси продукта примера 113d (670 мг) и моногидрата глиоксиловой кислоты (307 мг) в уксусной кислоте (8 мл). После перемешивания при комнатной температуре в течение 1 час реакционную смесь выливали на смесь лед-вода и экстрагировали дихлорметаном. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1:4 (об./об.)] в качестве элюента.
Выход: 613 мг.
(f). 7-Дифторметокси-6-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Смесь продукта примера 113e (610 мг), димедона (359 мг) и Pd(PPh3)4 (1,97 г) в ТГФ (5 мл) и воде (0,5 мл) перемешивали при 65°С в течение 1 час. Реакционная смесь становилась мутной. При комнатной температуре добавляли диэтиловый простой эфир (5 мл) и смесь охлаждали на ледяной бане. Твердые вещества собирали фильтрованием и сушили в вакууме (50°С) в течение 18 час.
Выход: 350 мг
(g). Этиловый эфир 9-дифторметокси-8-метокси-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 113f (85 мг) и этилоксалилхлорида (38 мкл) в ТГФ (2 мл) перемешивали и нагревали с применением микроволнового излучения при 100°С в течение 5 мин. Реакционную смесь концентрировали в вакууме. Смесь остатка и 2-этинилтиазола (102 мг) в уксусном ангидриде (3 мл) нагревали с применением микроволнового излучения при 140°С в течение 15 мин. Реакционную смесь разбавляли дихлорметаном и промывали насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [2:1 (об./об.)] в качестве элюента.
Выход: 48 мг. МС-ESI: [M+H]+ = 421,1.
(h). 9-Дифторметокси-8-метокси-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 113g (48 мг) и твердого KOH (19 мг) в этаноле (2 мл) и воде (2 мл) перемешивали при 80°С в течение 1 час. При комнатной температуре реакционную смесь подкисляли водным раствором лимонной кислоты (1,0 M). Водный слой экстрагировали дихлорметаном и органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 37 мг. МС-ESI: [M+H]+ = 392,9.
(i). трет-Бутилметиламид 9-дифторметокси-8-метокси-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 113h (37 мг), DIPEA (82 мкл), трет-бутилметиламина (23 мкл) и HATU (54 мг) в дихлорметане (3 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь промывали водным раствором HCl (0,1 н) и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (20 → 100% ацетонитрил; система 1).
Выход: 28 мг. МС-ESI: [M+H]+ = 462,3; анал. ВЭЖХ: Rt = 17,31 мин (способ 7); hFSHRago (CHO luc) EC50 = 39,6 нМ.
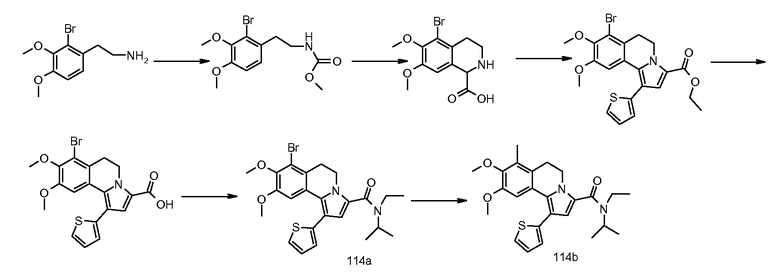
Пример 114
Этилизопропиламид 8,9-диметокси-7-метил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этилизопропиламид 7-бром-8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Этилизопропиламид 7-бром-8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты получали аналогично получению продукта примера 1 из 2-(2-бром-3,4-диметоксифенил)этиламина. Получение 2-(2-бром-3,4-диметоксифенил)этиламина можно найти в литературе: J. Weinstock, et al., J. Med. Chem., 29, 2315 (1986); J.E. Toth, P.R. Hamann and P.L. Fuchs, J. Org. Chem., 53, 4694 (1988).
1H ЯМР (CDCl3) 1,28 (9H, 3 x CH3), 3,15 (т, 2H, H-6), 4,20 (т, 2H, H-5), 4,65 (м, 1Н, CH-изопропил), 6,40 (с, 1Н, H2-пиррол), 6,97 (с, 1Н, H9), 3,48 (с, 3H, OCH3), 3,84 (с, 3H, OCH3); ЖХ/МС-ESI: [M+H]+ = 504.
(b). Этилизопропиламид 8,9-диметокси-7-метил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К раствору продукта примера 114a (50 мг) в сухом ТГФ (2 мл) добавляли при -70°С раствор н-бутиллития (70 мкл 1,6 M раствора в гептане). Смесь перемешивали в течение 30 мин. Добавляли метилиодид (100 мкл). Смесь перемешивали в течение 30 мин при -70°С и в течение 1 час при температуре окружающей среды. Смесь выливали в воду и экстрагировали этилацетатом. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали пропусканием через короткую колонку диоксида кремния, применяя смесь гептан/этилацетат (1/1, об./об.) в качестве элюента.
Выход: 25 мг. ЖХ/МС-ESI: [M+H]+ = 439; hFSHRago (CHO luc) EC50 = 321,0 нМ.
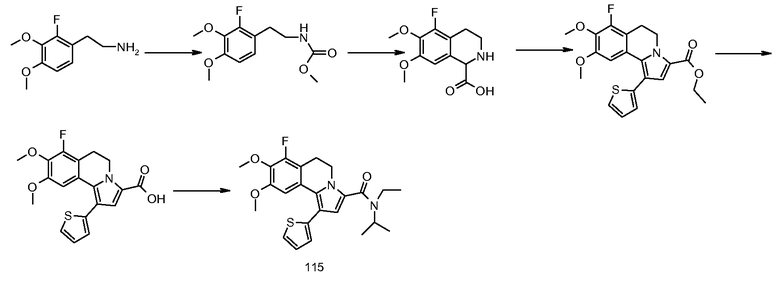
Пример 115
Этилизопропиламид 7-фтор-8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Данный продукт получали способом, сходным со способом, ранее описанным в примере 1, исходя из 2-(2-фтор-3,4-диметоксифенил)этиламина (D.L. Ladd and J. Weinstock, J. Org. Chem., 46, 203 (1981).
ЖХ/МС-ESI: [M+H]+ = 442; hFSHRago (CHO luc) EC50 = 937,0 нМ.
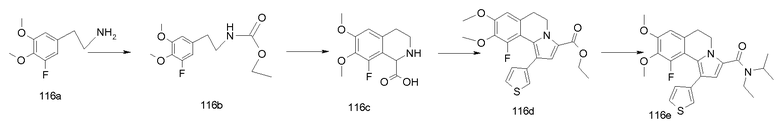
Пример 116
Этилизопропиламид 10-фтор-8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). 2-(3-Фтор-4,5-диметоксифенил)этиламин
Данный продукт можно получить из коммерчески доступного 3-фтор-5-гидрокси-4-метоксибензальдегида согласно общепринятым методикам: K.L. Kirk, D. Cantacuzene, B. Collins, G.T. Chen, Y. Nimit, C.R. Creveling, J. Med. Chem., 25, 680, (1982); J. Dixon, F. Ince, A.C. Tinker, Eur. Pat. App. 0,142,283 (1984). Альтернативно, из 2-аллилокси-1-фтор-3-метоксибензола, как описано M.T. Clark, D.D. Miller, Tetrahedron Lett., 26, 4299 (1985).
(b). Этиловый эфир [2-(3-фтор-4,5-диметоксифенил)этил]карбаминовой кислоты
К раствору 2-(3-фтор-4,5-диметоксифенил)этиламина (576 мг) и триэтиламина (0,8 мл) в дихлорметане (20 мл) добавляли по каплям при 0°С этилхлорформиат (300 мкл). Смесь перемешивали в течение 1 час, выливали в ледяную воду, нейтрализовали NaHCO3 и экстрагировали дихлорметаном. Органические слои отделяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток пропускали через короткую колонку диоксида кремния (смесь гептан/этилацетат применяли в качестве элюента).
Выход: 210 мг. 1H ЯМР (CDCl3): δ 6,54 (2, м, ArH), 4,65 (с, 1, NH), 4,1 и 2,75 (т, 2, -CH2-), 3,4 (м, 2, -CH2-), 1,2 (т, 3, этил), 4,1 (кв., 2, этил), 3,86, и 3,90 (2xc, 6, OCH3).
(c). 8-Фтор-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
К продукту примера 116b (210 мг) в уксусной кислоте (3 мл) добавляли моногидрат глиоксиловой кислоты (80 мг). При 0°С по каплям добавляли серную кислоту (1 мл). После перемешивания в течение 30 мин смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток обрабатывали водным раствором LiOH (3 мл, 3 M) при нагревании с применением микроволнового излучения при 190°С в течение 5 мин для гидролиза карбамата. pH реакционной смеси регулировали до 5,5 и смесь сушили вымораживанием.
Выход: 520 мг.
(d). Этиловый эфир 10-фтор-8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 116c (500 мг) и этилоксалилхлорида (250 мг) в ТГФ (3 мл) перемешивали при нагревании с применением микроволнового излучения при 100°С в течение 5 мин с получением N-оксалата. Затем добавляли уксусный ангидрид (1 мл) и 3-этинилтиофен (220 мг). Смесь нагревали при 140°С с применением микроволнового излучения в течение 5 мин. Смесь выливали в воду, перемешивали в течение 15 мин, экстрагировали этилацетатом и промывали до нейтральной реакции раствором NaHCO3. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (гептан/этилацетат).
Выход: 60 мг.
(e). Этилизопропиламид 10-фтор-8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Продукт примера 116d омыляли LiOH в смеси диоксан-вода (1:1, об./об.) и сочетали с этилдиизопропиламином с применением способа, описанного в примере 105c.
Выход: 9 мг. 1H ЯМР (CDCl3) δ 6,43 (с, 1Н, Н пиррола), 6,65 (ушир.с, 1Н, H7-Ar), 3,78 (с, 3H, OCH3), 3,90 (с, 3H, OCH3), 2,98 (т, 2H, H-6), 4,20 (т, 2H, H5), 1,25 (9H, СН3 изопропила и этила), 4,70 (м, 1Н, СН изопропила), 3,45 (м, 2H, NCH2); ЖХ/МС-ESI: [M+H]+ = 442; hFSHRago (CHO luc) EC50 = 318,0 нМ.
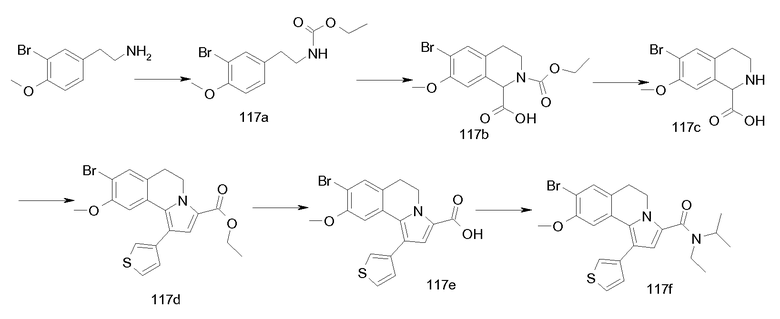
Пример 117
Этилизопропиламид 8-фтор-9-метокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир [2-(3-бром-4-метоксифенил)этил]карбаминовой кислоты
К раствору 3-метокси-4-бромфенетиламина (2,3 г) и триэтиламина (2,7 мл) в дихлорметане (20 мл) добавляли по каплям при 0°С этилхлорформиат (1,5 мл). После перемешивания в течение 3 час реакционную смесь промывали водой и 10% NaHCO3. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат (1/1, об./об.) в качестве элюента.
Выход: 2,9 г. ТСХ Rf = 0,35 (гептан/этилацетат, 1/1); ЖХ/МС-ESI: [M+H]+ = 302/304.
(b). 2-Этиловый эфир 6-бром-7-метокси-3,4-дигидро-1H-изохинолин-1,2-дикарбоновой кислоты
Раствор продукта 117a (2,7 г) и глиоксиловой кислоты (1,1 г) в уксусной кислоте (12 мл) обрабатывали серной кислотой (4 мл) при 5-10°С. Смесь перемешивали при комнатной температуре в течение 16 час и выливали в ледяную воду. Смесь экстрагировали дихлорметаном. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (смесь дихлорметан/метанол в качестве элюента).
Выход: 2,9 г. ТСХ Rf = 0,31 (дихлорметан/метанол, 9/1); ЖХ/МС-ESI: [M+H]+ = 358/360.
(c). 6-Бром-7-метокси-1,2,3,4-тетрагидроизохинолин-1-карбоновая кислота
Смесь продукта примера 117b (2,9 г) и воды (12 мл) обрабатывали LiOH (1,2 г) и нагревали в течение 5 мин с применением микроволнового излучения при 200°С. Смесь охлаждали и подкисляли до pH 5. Продукт фильтровали и оставшиеся твердые вещества сушили в вакууме.
Выход: 1,29 г. ЖХ/МС-ESI: [M+H]+ = 286/288.
(d). Этиловый эфир 8-бром-9-метокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К суспензии продукта примера 117c (645 мг) в ТГФ (4 мл) добавляли по каплям этилоксалилхлорид (250 мкл). Смесь затем нагревали при 100°С с применением микроволнового излучения в течение 5 мин. Смесь охлаждали. Добавляли уксусный ангидрид (2 мл) и 3-тиенилацетилен (220 мкл). Смесь перемешивали и снова нагревали с применением микроволнового излучения в течение 5 мин при 140°С. Реакционную смесь охлаждали, разбавляли 40 мл дихлорметана и промывали последовательно раствором NaOH (2 M) и водой. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (смесь гептан/этилацетат в качестве элюента).
Выход: 900 мг.
(e). 8-Бром-9-метокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Суспензию продукта примера 117e (900 мг) в диоксане (5 мл) обрабатывали раствором LiOH (2 мл, 3 M) и нагревали с применением микроволнового излучения в течение 5 мин при 180°С. Смесь охлаждали и подкисляли до pH 4 2 н HCl. Осадок сушили.
Выход: 850 мг.
(f). Этилизопропиламид 8-бром-9-метокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К суспензии продукта примера 117c (850 мг) в дихлорметане (8 мл) добавляли гексафторфосфат 2-хлор-1,3-диметилимидазолина (877 мг), N-этил-N-изопропиламин (1,5 мл) и DIPEA (0,5 мл). Смесь нагревали с применением микроволнового излучения при 100°С в течение 5 мин. Смесь затем концентрировали и очищали хроматографией на силикагеле (смесь гептан/этилацетат в качестве элюента).
Выход: 375 мг. 1Н ЯМР (CDCl3): δ 7,13, 7,27, 7,38 (3 м, тиенил-Н), 7,35 (с, C7-H), 6,87 (с, C10-), 6,36 (с, C2-H), 4,65 (м, 1, изопропил), 4,21 (т, 2, H5), 2,98 (т, 2, H6), 3,44 (кв., 2, этил), 3,51 (с, 3, метокси), 0,88 (т, 3, этил), 1,26 (м, 6, изопропил); hFSHRago (CHO luc) EC50 = 1100 нМ.
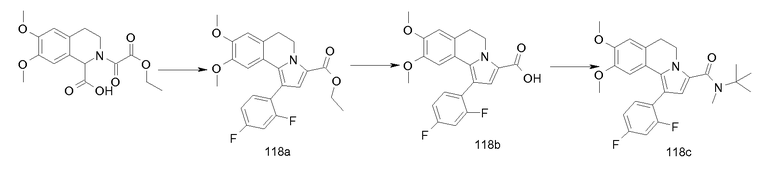
Пример 118
трет-Бутилметиламид 1-(2,4-дифторфенил)-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). Этиловый эфир 1-(2,4-дифторфенил)-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь 2-этоксиоксалил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты (1 г), 1-этинил-2,4-дифторбензола (450 мг) и уксусного ангидрида (1 мл) в ТГФ (3 мл) перемешивали и нагревали с применением микроволнового излучения при 120°С в течение 15 мин. Реакционную смесь разбавляли этилацетатом и водным раствором гидроксида натрия (1 н), промывали водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле c применением смеси гептан/этилацетат [1/0 → 6/4 (об./об.)] в качестве элюента. Соединение выделяли в виде белого твердого вещества.
Выход: 980 мг. МС-ESI: [M+H]+ = 414.
(b). 1-(2,4-Дифторфенил)-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 118a (980 мг) и смеси водный раствор LiOH (3 M)/диоксан [1:1 (об./об.), 6 мл] перемешивали и нагревали с применением микроволнового излучения при 150°С в течение 5 мин. Реакционную смесь охлаждали до комнатной температуры. Добавляли водный раствор хлорида аммония (10 мл 4 н раствора). Осадок отделяли фильтрованием и промывали водой. Продукт выделяли в виде белого твердого вещества.
Выход: 881 мг. МС-ESI: [M+H]+ = 386.
(c). трет-Бутилметиламид 1-(2,4-дифторфенил)-8,9-диметокси-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 118b (25 мг), N-метил-N-трет-бутиламина, HATU (37 мг) и DIPEA (57 мкл) в дихлорметане (1 мл) перемешивали и нагревали с применением микроволнового излучения при 110°С в течение 5 мин. Реакционную смесь разбавляли этилацетатом и промывали водой и водным раствором лимонной кислоты (3%). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [0 → 6/4 (об./об.)] в качестве элюента.
Выход: 14 мг. МС-ESI: [M+H]+ = 455; анал ВЭЖХ: Rt = 2,56 мин (способ 1); hFSHRago (CHO luc) EC50 = 48,3 нМ.
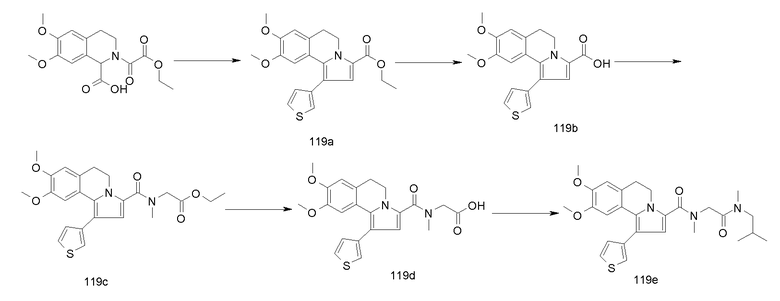
Пример 119
[(Изобутилметилкарбамоил)метил]метиламид 8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и этиловый эфир[(8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)метиламино]уксусной кислоты
(a). Этиловый эфир 8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Синтез этилового эфира 8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты (119a) проводили согласно способу, описанному для примера 1h, исходя из 2-этоксиоксалил-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-карбоновой кислоты.
Выход: 14,95 г. ЖХ/МС-ESI: [M+H]+ = 384,0.
(b). 8,9-Диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Смесь продукта примера 119a (4,45 г) и раствора LiOH в диоксане (88 мл 2 M раствора) нагревали при кипячении с обратным холодильником в течение 2 час. Реакционную смесь охлаждали до комнатной температуры и подкисляли водным раствором HCl (2 н) до pH=6. Твердые вещества собирали фильтрованием и сушили в вакууме.
Выход: 4 г. ЖХ/МС-ESI: [M+H]+ = 356,1.
(c). Этиловый эфир [(8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)метиламино]уксусной кислоты
Смесь продукта примера 119b (500 мг), триэтиламина (1,98 мл), CIP (1,96 г) и гидрохлорида этилового эфира саркозина (866 мг) в дихлорметане (100 мл) перемешивали при комнатной температуре в течение 18 час. Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на силикагеле с применением смеси дихлорметан/метанол [98/2 (об./об.)] в качестве элюента.
Выход: 430 мг. ЖХ/МС-ESI: [M+H]+ = 455,1; hFSHRago (CHO luc) EC50 = 42 нМ.
(d). [(8,9-Диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)метиламино]уксусная кислота
Смесь продукта примера 119c (430 мг) и водного раствора LiOH (4,8 мл, 2 M) в диоксане (4,8 мл) перемешивали при комнатной температуре в течение 2 час. Реакционную смесь подкисляли водным раствором HCl (2 н) до pH=6 и экстрагировали этилацетатом. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 360 мг. ЖХ/МС-ESI: [M+H]+ = 427,1.
(e). [(Изобутилметилкарбамоил)метил]метиламид 8,9-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 119d (15 мг), HATU (15 мг), DIPEA (12 мкл) и N-метил-N-изобутиламина (4 мг) в дихлорметане (1 мл) перемешивали в течение 48 час и концентрировали в вакууме. Остаток растворяли в этилацетате и промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [40 → 100% этилацетат] в качестве элюента.
Выход: 7,6 мг. ЖХ/МС-ESI: [M+H]+ = 496,1; hFSHRago (CHO luc) EC50 = 1080 нМ.
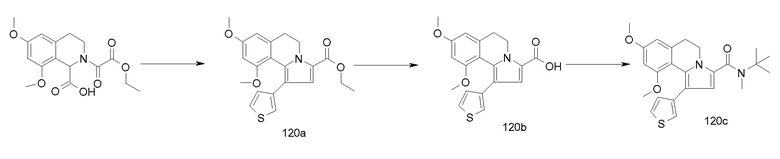
Пример 120
трет-Бутилметиламид 8,10-диметокси-1-тиофен-3-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Данный продукт получали, как ранее описано в примере 1a-1g, исходя из 3,5-диметоксифенетиламина.
ТСХ Rf = 0,34 (CH2Cl2-ацетон, 8/2); 1H ЯМР (CDCl3) δ 3,83, 3,22 (2Чс, 6H, OCH3), 6,4 (д, 1Н, 2H-пиррол), 6,28, 6,44 (2 Ч ушир. д, 2H, H7 и H9), 6,84, 7,02, 7,20 (3xм, 3H, H3, H4, H5-тиофен), 2,98 (м, 2H, H6), 4,20 (м, 2H, H5); hFSHRago (CHO luc) EC50 = 699,0 нМ.
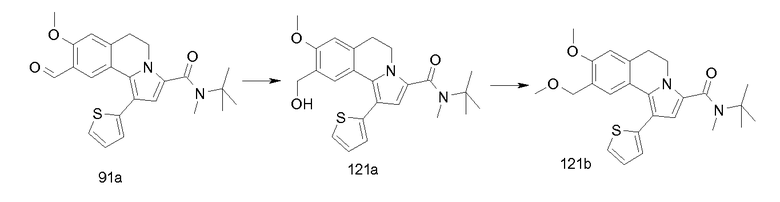
Пример 121
трет-Бутилметиламид 8-метокси-9-метоксиметил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты и трет-бутилметиламид 9-гидроксиметил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
(a). трет-Бутилметиламид 9-гидроксиметил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К раствору продукта примера 91a (450 мг) в смеси ТГФ и метанола [10 мл, 1/1 (об./об.)] порциями добавляли NaBH4 (80 мг). После перемешивания в течение 1 час смесь разбавляли водой и экстрагировали дихлорметаном. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растирали с диизопропиловым простым эфиром, получая при этом белое кристаллическое вещество.
Выход: 290 мг. Т.пл. 146-150°С. ТСХ Rf = 0,30 (гептан/этилацетат, 1/1). ЖХ/МС-ESI: [M+H]+ = 425,2. 1H ЯМР (CDCl3) δ 4,47 (с, 2H, CH2OH), 7,33 и 6,45 (2xc, 2H, H7 и H10), 6,75 (с, 1Н, H2 пиррол); hFSHRago (CHO luc) EC50 = 10 нМ.
(b). трет-Бутилметиламид 8-метокси-9-метоксиметил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
К раствору продукта примера 121a (156 мг) в ДМФА (3 мл) добавляли NaH (50 мг; 60% дисперсия в масле). Смесь перемешивали в течение 15 мин с последующим добавлением метилиодида (200 мкл). Реакционную смесь перемешивали в течение дополнительных 2 час и выливали в воду. Смесь экстрагировали этилацетатом. Органический слой промывали водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали на силикагеле с применением смеси гептан/этилацетат в качестве элюента. Продукт кристаллизовали из смеси диэтиловый простой эфир/гептан.
Выход: 75 мг. Т.пл. 128-130°С. ЖХ/МС-ESI: [M+H]+ = 439,2. 1H ЯМР (CDCl3) δ 3,22 и 3,85 (2xc, 6H, 2xOCH3), 3,17 (с, 3H, NCH3), 6,73 (с, 1Н, H2 пиррол), 6,45 и 7,40 (2xc, 2H, H7 и H10); hFSHRago (CHO luc) EC50 = 1,6 нМ.
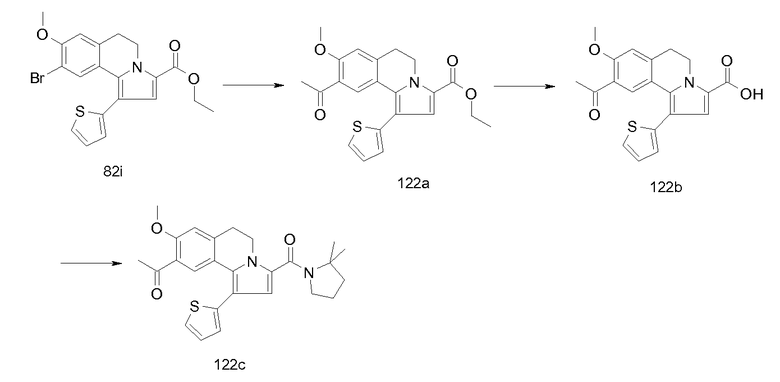
Пример 122
1-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]этанон
(a). Этиловый эфир 9-ацетил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты
Смесь продукта примера 82i (115 мг) и 1-этоксивинилтри-н-бутилолова (288 мг) в толуоле (4 мл) деоксигенировали пропусканием через нее газообразного азота в течение 2 мин. Добавляли бис(трифенилфосфин)палладий(II)хлорид (7,5 мг), суспензию снова деоксигенировали и перемешивали в течение 6 час при 110°С. Добавляли этилацетат (4 мл) и водный раствор HCl (1 н). Смесь энергично перемешивали в течение 5 мин. Слои разделяли. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [9/1 → 6/4 (об./об.)] в качестве элюента.
Выход: 95 мг. ЖХ/МС-ESI: [M+H]+ = 396,1.
(b). 9-Ацетил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновая кислота
Водный раствор NaOH (1 мл, 2 н) добавляли к раствору продукта примера 122a (90 мг) в этаноле (10 мл). После перемешивания в течение 6 час при 60°С реакционную смесь выливали в водный раствор лимонной кислоты (10%) и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме.
Выход: 84 мг. ЖХ/МС-ESI: [M+H]+ = 368,2.
(c). 1-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]этанон
TBTU (110 мг) добавляли к раствору продукта примера 122b (84 мг), DIPEA (200 мкл) и гидрохлорида 2,2-диметилпирролидина (62 мкл) в NMP (5 мл). После перемешивания при комнатной температуре в течение 2 час реакционную смесь выливали в насыщ. водный раствор NH4Cl и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси гептан/этилацетат [1/0 → 6/4 (об./об.)] в качестве элюента.
Выход: 76 мг. ЖХ/МС-ESI: [M+H]+ = 449,2; анал. ВЭЖХ: Rt = 20,08 мин (способ 7); hFSHRago (CHO luc) EC50 = 2,0 нМ.
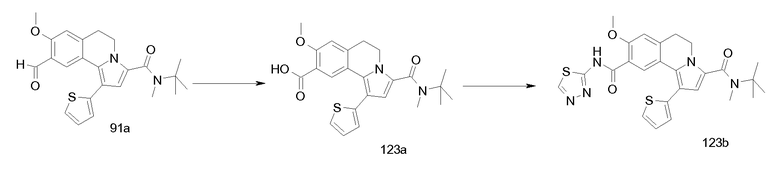
Пример 123
3-(трет-Бутилметиламид)-9-[1,3,4]тиадиазол-2-иламид 8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3,9-дикарбоновой кислоты
(a). 3-(трет-Бутилметилкарбамоил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-9-карбоновая кислота
Раствор продукта примера 91а (220 мг) в смеси трет-бутанола (15 мл), диоксана (2 мл) и 2-метил-2-бутена (0,5 мл) обрабатывали раствором NaClO2 (200 мг) и NaH2PO4 (350 мг) в воде (2 мл). После перемешивания в течение 1 час реакция была завершена. Добавляли воду (30 мл) с последующим добавлением насыщ. тиосульфата натрия (2 мл) и NaH2PO4 (0,5 г). Продукт экстрагировали этилацетатом. Объединенные органические слои промывали, сушили и концентрировали в вакууме. Остаток обрабатывали диизопропиловым простым эфиром, получая при этом светло-оранжевое твердое вещество.
Выход: 200 мг. Т.пл.: 215-217°С (этилацетат); Rf 0,42 (толуол/ацетон, 1/1); ЯМР (ДМСО-d6) δ 12,4 (ушир.с, 1, COOH), 7,78 (с, 1, H10), 7,12 (с, 1, H7), 6,4 (с, 1, пиррол Н3), 3,83 (с, 3, OCH3), 3,04 (с, 3, NCH3); МС-ESI: [M+1]+ 439,1.
(b). 3-(трет-Бутилметиламид)-9-1,3,4-тиадиазол-2-иламид 8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-a]изохинолин-3,9-дикарбоновой кислоты
Смесь продукта примера 123a (45 мг), 2-аминотиадиазола (25 мг), N-этилморфолина (40 мкл), TBTU (40 мг) и ДМФА (1 мл) перемешивали при к.т. в течение 16 час. Смесь выливали на 5% водный раствор NH4Cl и экстрагировали этилацетатом. Объединенные органические слои промывали водой, сушили и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с применением смеси толуол/ацетон в качестве элюента. Остаток растирали с простым эфиром, получая при этом белые кристаллы.
Выход: 26 мг. Т.пл.:149-152°С; МС-ESI: [M+H]+ 522,14; ЯМР (ДМСО-d6) δ 12,1 (с, 1, NH), 9,20 (с, 1, тиадиазол), 7,83 (с, 1, H10), 7,25 (с, 1, H7), 6,42 (с, 1, H3-пиррол), 3,97 (с, 3, OCH3), 3,07 (с, 3, NCH3); Rf (толуол/ацетон, 1/1) 0,34; hFSHRago (CHO luc) EC50 = 1 нМ.
Пример 124
Агонистическая активность соединений в отношении рецептора FSH человека в клетках CHO
Агонистическую активность соединений в отношении рецептора FSH человека определяли в клетках яичника китайского хомячка (CHO), стабильно трасфицированных геном рецептора FSH и котрансфицированных цАМФ-чувствительным элементом (CRE)/ промотором, регулирующим экспрессию репортерного гена люциферазы светляка. Связывание соединений со связанным с GS-белком рецептором FSH будет приводить к увеличению уровня цАМФ, которое, в свою очередь, будет индуцировать повышенную трансактивацию репортера люциферазы. Клетки (7500 клеток/лунку 384-луночного планшета) инкубировали в минимально эссенциальной F12 модифицированной среде Дульбекко (invitrogen), дополненной 1 мкг/мл бычьего инсулина, 5 мкг/мл апотрансферрина человека, 80 Е/мл пенициллина G и 80 мкг/мл стрептомицина, с испытуемыми соединениями (концентрация между 0,0316 нМ и 10,0 мкМ) в двух повторностях в увлажненной атмосфере (95%) с 5-7% СО2 и при 37°С. Конечная концентрация ДМСО была 1%. После 4 часов инкубации планшетам давали возможность достичь комнатной температуры в течение 1 час. Затем к лункам добавляли раствор Luclite (PerkinElmer) и клеткам давали возможность лизироваться в течение по меньшей мере 1 час при комнатной температуре. Затем активность люциферазы измеряли в люминесцентном счетчике. Сигнал выражали как число импульсов в секунду (cps). ЕС50 (концентрация испытуемого соединения, которая вызывает полумаксимальную (50%) стимуляцию люцеферазы по сравнению с максимально достижимым действием соединения) и величины эффективности (максимальное действие испытуемого соединения как процент максимального действия рекомбинантного FSH человека) соединений определяли с применением программного обеспечения MathIQ (version 2.0, ID Business Solutions Limited). Данные ЕС50 указаны в примерах синтеза.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕРВИЧНЫЕ КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ BТK | 2014 |
|
RU2708395C2 |
| ЗАМЕЩЕННЫЕ ХРОМАНЫ | 2015 |
|
RU2718060C2 |
| СОЕДИНЕНИЕ ТРИАЗИНОНА И ИНГИБИТОР КАЛЬЦИЕВЫХ КАНАЛОВ Т-ТИПА | 2013 |
|
RU2645158C2 |
| ПЕРИ-ЗАМЕЩЕННЫЕ АРИЛСУЛЬФОНАМИДНЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ОККЛЮЗИОННОГО ЗАБОЛЕВАНИЯ АРТЕРИЙ | 2005 |
|
RU2407736C2 |
| КОНДЕНСИРОВАННЫЕ БИЦИКЛИЧЕСКИЕ КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СХСR2 ДЛЯ ЛЕЧЕНИЯ ВОСПАЛЕНИЙ | 2005 |
|
RU2404962C2 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3 И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2654068C1 |
| МАКРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С | 2006 |
|
RU2419619C2 |
| Бензотиофены и родственные соединения в качестве агонистов STING | 2019 |
|
RU2806274C2 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3K И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2600927C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНОПИРРОЛИДИНА | 2002 |
|
RU2270192C2 |
Изобретение относится к производным 5,6-дигидропирроло[2,1-а]изохинолина и пирроло[2,1-а]изохинолина общей формулы (I):
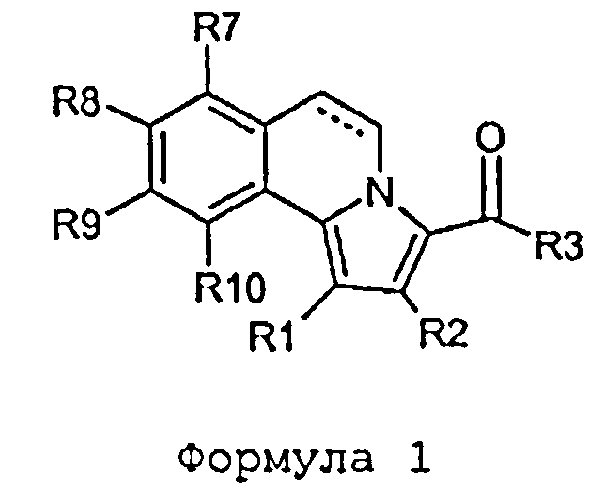
или его фармацевтически приемлемая соль, где C5-C6-связь может быть либо насыщенной, либо ненасыщенной, значения R1; R2; R3; R7; R8; R9; R10 представлены в п.1 формулы изобретения. Соединения можно применять для лечения бесплодия. 4 н. и 20 з.п. ф-лы, 124 пр.
1. Соединение согласно общей формуле I
или его фармацевтически приемлемая соль, где
C5-C6-связь может быть либо насыщенной, либо ненасыщенной,
R1 представляет собой галоген, циано, (2-6C)алкинил, (3-6C) циклоалкил, (5-6C)циклоалкенил или фенил или (1-5C)гетероарил, причем каждая из указанных фенильных и гетероарильных частей независимо необязательно замещена одним или несколькими заместителями, выбранными из R13;
R2 представляет собой H, циано, галоген, (1-4C)алкокси(1-4C)алкил, гидрокси(1-4C)алкил, формил, (1-4C)алкилкарбонил или C=N-OH, C=N-ОСН3;
R3 представляет собой R15, R16-амино или
R3 представляет собой (1-6C)алкил, (3-6C)циклоалкил, (ди)[(1-4С)алкил]амино(1-4C)алкил, или
R3 представляет собой (2-6C)гетероциклоалкил(1-4C)алкил, (2-6C)гетероциклоалкильная часть которого необязательно может быть замещена (1-4C)алкилкарбонилом или (3-6C)циклоалкилкарбонилом, или
R3 представляет собой группу, выбранную из
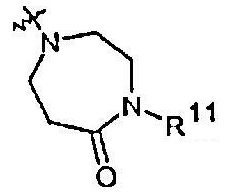
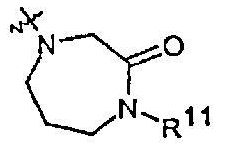
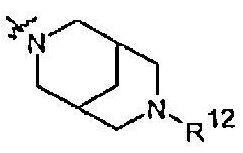
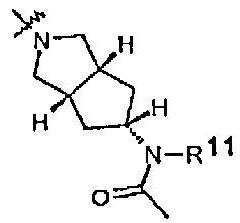
 или
или
R7 представляет собой Н, галоген или метил;
R8 представляет собой Н, галоген, (1-4C)алкил, (1-4C)алкокси, гидрокси;
R9 представляет собой Н, галоген, гидрокси, амино, циано, нитро, (2-6C)алкинил, (3-6C)циклоалкокси, (2-5C)гетероциклоалкокси, (2-5C)гетероарилокси, (1-6C)алкилкарбонил, (1-4C)алкоксикарбонил, (ди)[(1-4C)алкил]аминокарбонил, (2-6C)гетероциклоалкилкарбонил, (ди)[(1-4C)алкил]амино, (1-4C)алкоксикарбониламино, (ди)[(1-4C)алкил]аминосульфониламино, (1-4C)алкилсульфониламино, 1-имидазолидинил-2-он, 3-оксазолидинил-2-он, 1-пирролидинил-2-он, или
R9 представляет собой (1-6C)алкил, (1-6C)алкокси, (2-6C)алкенил, (1-6C)алкилкарбониламино или (2-6C)гетероциклоалкил, (2-5C)гетероариламинокарбонил, причем каждый из указанного алкила, алкокси, алкенила, гетероциклоалкила и гетероарила независимо необязательно замещен одним или несколькими заместителями, выбранными из R14, или
R9 представляет собой (1-5C)гетероарил, фенил или фенокси, причем все независимо необязательно замещены одним или несколькими заместителями, выбранными из R13;
R10 представляет собой H, метокси, галоген;
R11 представляет собой H, (1-6C)алкил;
R12 представляет собой (1-4C)алкилкарбонил или (3-6C)циклоалкилкарбонил, причем оба необязательно замещены одним или несколькими заместителями, выбранными из R13;
R13 представляет собой гидрокси, амино, галоген, трифторметил, (1-4C)алкил, (1-4C)алкокси, (1-4C)алкилтио или (ди)[(1-4C)алкил]амино;
R14 представляет собой гидрокси, амино, галоген, азид, (1-4C)алкил, (1-4C)алкокси, (1-4C)алкилтио, (ди)[(1-4C)алкил]амино, (3-6C)циклоалкил, (2-6C)гетероциклоалкил, (1-4C)алкилкарбониламино, (1-4C)алкилсульфониламино, (1-4C)алкоксикарбониламино, (1-4C)алкилкарбонил, (1-4C)алкоксикарбонил, (1-4C)алкилсульфокси, (2-6C)гетероциклоалкокси, (ди)[(1-4C)алкил]аминокарбонил, (1-4C)алкилсульфонил,;
R15 и R16 в R15, R16-амино независимо выбраны из Н или (1-6C)алкила, (2-6C)гетероциклоалкила или (ди)[(1-4C)алкил]амино, причем все необязательно замещены гидрокси, (1-4C)алкилкарбонилом, (1-4C)алкоксикарбонилом, (3-6С)циклоалкилкарбонилом, (ди)[(1-4С)алкил]амино; или
R15, R16-амино соединяются с образованием (3-8C)гетероциклоалкильного кольца, необязательно замещенного R18; или
R15, R16-амино соединяются с образованием (4-8С)гетероциклоалкильного кольца или (4-6C)гетероциклоалкенильного кольца, причем оба кольца содержат один атом азота и необязательно замещены одним или несколькими заместителями, выбранными из R17;
R17 представляет собой (1-4C)алкил, (ди)[(1-4С)алкил]аминокарбониламино, (1-4C)алкилсульфокси, (3-6C)циклоалкилкарбониламино, [(1-4C)алкил][(1-4С)алкилкарбонил]амино или
R17 представляет собой фенил и (2-5C)гетероарил, оба из которых необязательно замещены одним или несколькими заместителями, выбранными из R13; и
R18 представляет собой (1-4C)алкил, фенилкарбонил, (1-4C)алкилкарбонил, (3-6C)циклоалкилкарбонил, (2-5С)гетероарилкарбонил, фенил, фенилсульфонил, (2-5C)гетероарилсульфонил и (2-6C)гетероциклоалкилкарбонил, (цикло)алкильная и (гетеро)арильная части которых могут быть замещены одним или несколькими заместителями, выбранными из R13;
где гетероарильная или гетероциклильные части включают от 1 до 3 гетероатомов, выбранных от N, O и/или S,
с условием, что соединение не является 3-ацетилпирроло[2,1-а]изохинолин-1-карбонитрилом.
2. Соединение по п.1, у которого C5-C6-связь является насыщенной.
3. Соединение по п.1 или 2, у которого R1 представляет собой (1-5C)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13.
4. Соединение по п.1 или 2, у которого R2 представляет собой H, циано, галоген, (1-4C)алкокси(1-4C)алкил или гидрокси(1-4C)алкил.
5. Соединение по п.4, у которого R2 представляет собой H.
6. Соединение по п.1 или 2, у которого R3 представляет собой R15, R16-амино или

7. Соединение по п.6, у которого R3 представляет собой R15, R16-амино.
8. Соединение по п.1 или 2, у которого R7 представляет собой H.
9. Соединение по п.1 или 2, у которого R8 представляет собой (1-4C)алкокси или гидрокси.
10. Соединение по п.1 или 2, у которого R9 представляет собой галоген, циано, нитро, (2-6C)алкинил, (3-6C)циклоалкокси, (2-5C)гетероциклоалкокси, (2-5C)гетероарилокси, (ди)[(1-4C)алкил]аминокарбонил, (2-6C)гетероциклоалкилкарбонил или (ди)[(1-4C)алкил]амино или R9 представляет собой (1-6C)алкил, (1-6C)алкокси, (2-6C)алкенил, (1-6C)алкилкарбониламино или (2-5C)гетероариламинокарбонил, причем каждая из указанных алкильной, алкокси, алкенильной или гетероарильной групп независимо необязательно замещена одним или несколькими заместителями, выбранными из R14, или
R9 представляет собой (1-5C)гетероарил или фенокси, причем оба независимо необязательно замещены одним или несколькими заместителями, выбранными из R13.
11. Соединение по п.10, у которого R9 представляет собой галоген, циано, нитро, (2-6C)алкинил или (ди)[(1-4C)алкил]амино или
R9 представляет собой (1-6С)алкил, (1-6С)алкокси, (2-6С)алкенил или (1-6C)алкилкарбониламино, причем указанные алкильные, алкокси или алкенильные группы независимо необязательно замещены одним или несколькими заместителями, выбранными из R14, или
R9 представляет собой (1-5C)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13.
12. Соединение по п.11, у которого R9 представляет собой (2-6C)алкинил или
R9 представляет собой (1-6C)алкил, (1-6C)алкокси, (2-6C)алкенил или (1-6C)алкилкарбониламино, причем указанные алкильные, алкокси или алкенильные группы независимо необязательно замещены одним или несколькими заместителями, выбранными из R14, или
R9 представляет собой (1-5C)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13.
13. Соединение по п.12, у которого R9 представляет собой (1-6C)алкил.
14. Соединение по п.1 или 2, у которого R10 представляет собой Н.
15. Соединение по п.1 или 2, у которого R1 представляет собой (1-5C)гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из R13, R2 представляет собой H, R3 представляет собой R15, R16-амино, R7 представляет собой H, R8 представляет собой (1-4C)алкокси и R10 представляет собой H.
16. Соединение по п.1 или 2, у которого R14 представляет собой (2-6C)гетероциклоалкил, гидрокси, (1-4C)алкокси или (ди)[(1-4C)алкил]амино.
17. Соединение по п.1 или 2, у которого R15 и R16 могут быть независимо выбраны из (1-6C)алкила.
18. Соединение по п.17, у которого R15 представляет собой метил, и R16 представляет собой трет-бутил.
19. Соединение по п.1 или 2, у которого R3 представляет собой 1,4-диазациклогептан-1-ил, необязательно замещенный (1-4C)алкилкарбонилом или (3-6C)циклоалкилкарбонилом.
20. Соединение по п.1 или 2, у которого R3 представляет собой 2,2-диметилпирролидин-1-ил.
21. Соединение, выбранное из группы, включающей в себя
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(тетрагидрофуран-2-карбонил)-[1,4]диазепан-1-ил]метанон;
1-[4-(9-Изопропокси-8-метокси-1-тиофен-2-нл-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]-2-метилсульфанилэтанон;
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(тиофен-2-сульфонил)-[1,4]диазепан-1-ил]метанон;
3,3,3-Трифтор-2-гидрокси-1-[4-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]пропан-1-он;
(4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон;
3-(4-Циклобутанкарбонил-[1,4]диазепан-1-карбонил)-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-2-карбонитрил;
[4-(1-Бромциклобутанкарбонил)-[1,4]диазепан-1-ил]-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон;
[4-(1-Гидроксициклобутанкарбонил)-[1,4]диазепан-1-ил]-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидрпирроло[2,1-а]изохинолин-3-ил)метанон;
(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(1-метоксициклобутанкарбонил)-[1,4]диазепан-1-ил]метанон;
Этиловый эфир 2-ацетил-9-этокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
1-[4-(2-Хлор-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-1-ил]этанон;
4-Бутил-1-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,4]диазепан-5-он;
4-Бутил-1-[9-(2-гидрокси-2-метилпропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил]-[1,4]диазепан-5-он;
1-[5-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-[1,5]диазокан-1-ил]этанон;
трет-Бутиловый эфир 7-(9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-3,7-диазабицикло[3.3.1]нонан-3-карбоновой кислоты;
1-[7-(9-Изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбонил)-3,7-диазабицикло[3.3.1]нон-3-ил]-2-метилсульфанилэтанон;
трет-Бутилметиламид 9-(2-гидроксиэтокси)-8-метокси-1-тиофен-2-илпирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 2-формил-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 2-гидроксиметил-9-изопропокси-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-изопропокси-8-метокси-2-метоксиметил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 2-(гидроксииминометил)-9-изопропокси-6-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-изопропокси-8-метокси-2-(метоксииминометил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-изопропиламино-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-(1Н-пиразол-4-ил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-(2-метилпропенил)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-изобутил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-(2-метилпропенил)-1-тиазол-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-гидрокси-9-изобутил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]изобутирамид;
трет-Бутилметиламид 8-метокси-9-метилкарбамоилметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-(2-гидроксиэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-(2-азидоэтокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-(тетрагидропиран-2-илокси)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-(3-гидроксипропокси)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
(2-Гидрокси-1,1-диметилэтил)метиламид 9-изобутил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
(9-Бром-8-метокси-1-тиофен-2-ил-5,6,6а,10а-тетрагидропирроло[2,1-а]изохинолин-3-ил)-(4-циклобутанкарбонил-[1,4]диазепан-1-ил)-метанон;
трет-Бутилметиламид 9-циано-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
Этиловый эфир 3-(4-циклобутанкарбонил-[1,4]диазепан-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-проп-1-инил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-формил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-(3-гидроксипропил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-(3-гидрокси-3-метилбутил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид (9-(2,2-дифторвинил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-нитро-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-(2-диметиламиноацетиламино)-8-метокси-1-тиофен-2-ил-5,6,6а,10а-тетрагидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 9-(2-азетидин-1-илацетиламино)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-(2-метоксиацетиламино)-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]метансульфонамид;
N-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]-2-морфолин-4-илацетамид;
(8,9-Диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)-[4-(1-метилциклобутанкарбонил)-[1,4]диазепан-1-ил]метанон;
(4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-(8,9-диметокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-ил)метанон;
(4-Циклобутанкарбонил-[1,4]диазепан-1-ил)-(8,9-диметокси-1-тиофен-2-илпирроло[2,1-а]изохинолин-3-ил)метанон;
трет-Бутилметиламид 9-гидроксиметил-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
трет-Бутилметиламид 8-метокси-9-метоксиметил-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3-карбоновой кислоты;
1-[3-(2,2-Диметилпирролидин-1-карбонил)-8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-9-ил]этанон и
3-(трет-Бутилметиламид)-9-[1,3,4]тиадиазол-2-иламид 8-метокси-1-тиофен-2-ил-5,6-дигидропирроло[2,1-а]изохинолин-3,9-дикарбоновой кислоты.
22. Фармацевтическая композиция для лечения нарушений фертильности, которая содержит соединение формулы I по любому из пп.1-21 или его фармацевтически приемлемую соль и один или несколько фармацевтически приемлемых эксципиентов.
23. Соединение по любому из пп.1, 2 или 21 или его фармацевтически приемлемая соль для применения при лечении нарушений фертильности.
24. Применение соединения формулы I по любому из пп.1-21 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения нарушений фертильности.
| US 4933350 A1, 12.06.1990 | |||
| WO 03051877 A1, 26.06.2003 | |||
| СПОСОБ СУШКИ И ТЯЖКИ КОЖ | 0 |
|
SU248144A1 |
| US 5965575 A, 12.10.1999 | |||
| ПРОИЗВОДНЫЕ ПИРИДАЗИНО [4',5':3,4]ПИРРОЛО[2,1-А]ИЗОХИНОЛИНА И ИХ ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ СОЛИ С КИСЛОТАМИ И КОМПЛЕКСООБРАЗОВАТЕЛЯМИ | 1994 |
|
RU2138499C1 |
| Машина для прядения искусственного шелка | 1929 |
|
SU12110A1 |
Авторы
Даты
2013-10-10—Публикация
2009-02-06—Подача