Изобретение относится к химии аминов и их производных, а именно новой модификации реакции гидроаминирования (Лейкарта-Валлаха), как способу получения циклоалкиламинов общей формулы
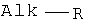
Где
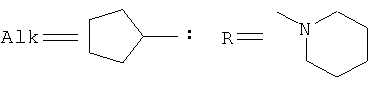
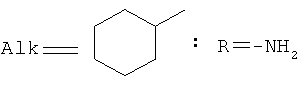 ,
, 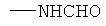 ,
, 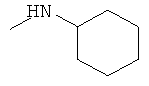 ,
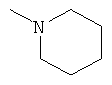
, 
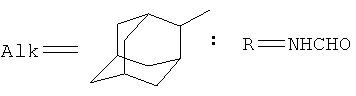 ,
, 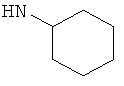 ,
, 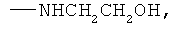
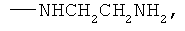
 ,
, 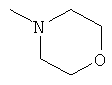 ,
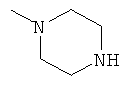
, 
которые могут представлять интерес в качестве полупродуктов в синтезе некоторых биологически активных веществ. В частности, некоторые из них являются структурными аналогами известного препарата «бромантан» (4-бром-фениламино-2-адамантана гидрохлорид), применявшегося в спортивной медицине [И.С.Морозов, В.И.Петров, С.А.Сергеева. Фармакология адамантанов. - Волгоград: Волгоградская медицинская академия, 2001, - 320 с.]. Кроме этого, 1-аминоадамантан и его производные применяются как противовирусные и противопаркинсонические средства. Производное циклогексиламина применяется для получения препарата «бромгексин» [Машковский М.Д. Лекарственные средства. В 2-х т., T.1. - Изд. 13-е, новое. - Харьков, Торсинг, 1998. - 560 с.].
Известен способ совместного получения N-метилциклогексиламина и дициклогексиламина из циклогексиламина путем каталитического алкилирования циклогексиламина метанолом в газовой фазе в токе водорода на медь-цинк-хром-алюминиевом катализаторе [МПК С07С 209/24, С07С 211/35. Патент РФ №2344120 С1. Опубликовано: 20.01.2009].
Недостатками этого метода являются использование достаточно сложных технологических условий, неприменимых в лабораторных условиях, а также то, что он непригоден для получения других соединений заявляемой структурной формулы.
Известен способ получения третичных аминов по реакции кетонов с вторичными аминами, где в качестве восстановителя используется триацетоксиборгидрид натрия и процесс протекает в дихлорэтане или тетрагидрофуране в присутствии уксусной кислоты при комнатной температуре в течение 0.5-75 часов [A.F.Abdel-Magid, K.G.Carson, В.D.Harris, С.А.Maryanoff, R.D.Shah. Reductive Amination of Aldehydes and Ketones with Sodium Triacetoxyborohydride. Studies on Direct and Indirect Reductive Animation Procedures. // J. Org. Chem., 1996, 61, 3849-3862; Ahmed F.Abdel-Magid, Steven J. Mehrman. A Review on the Use of Sodium Triacetoxyborohydride in the Reductive Amination of Ketones and Aldehydes. // Organic Process Research & Development 2006, 10, 971-1031].
Недостатками этого метода являются использование достаточно дорогостоящего и малодоступного восстановителя, длительное время синтеза для получения ряда соединений. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения вторичных и третичных аминов по реакции альдегидов или кетонов с аминами, где в качестве восстановителя используется декаборан и процесс протекает в метаноле при комнатной температуре в течение 0.5-12 часов [J.W.Bae, S.H.Lee, Y.J.Cho, С.М.Yoon. A reductive animation of carbonyls with amines using decaborane in methanol. // J. Chem. Soc., Perkin Trans. 1, 2000, 145-146].
Недостатками этого метода являются использование достаточно дорогостоящего и малодоступного восстановителя, его пожароопасность. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения производных арилалкиламинов по реакции альдегидов или кетонов с производными анилина, где в качестве восстановителя используется триацетоксиборгидрид натрия и процесс протекает в изопропаноле в присутствии 2 эквивалентов трифторуксусной кислоты при комнатной температуре в течение 10 минут [М.McLaughlin, M.Palucki, I.W.Davies. Efficient Access to Azaindoles and Indoles. // Org. Lett., 2006, 8, - pp.3307-3310].
Недостатком этого метода является использование достаточно дорогостоящего и малодоступного восстановителя. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения аминоспиртов по реакции альдегидов с вторичными аминами, где в качестве восстановителя используется триэтил-гидросилан и процесс протекает в 1,4-диоксане при 75°С в течение 8 часов в присутствии металлокомплексного катализатора, содержащего иридий [T.Mizuta, S.Sakaguchi, Y.Ishii. Catalytic Reductive Alkylation of Secondary Amine with Aldehyde and Silane by an Indium Compound. // J. Org. Chem., 2005, 70, 2195-2199].
Недостатком этого метода является использование дорогостоящего и малодоступного катализатора. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения третичных аминов по реакции β-гидроксикетонов с аминами, причем в качестве восстановителя используется полиметилгидросилан и процесс протекает в присутствии тетраизопропоксититана при 25-60°С, продолжительность до 48 часов [Dirk Menche, Fatih Arikan, Jun Li, Sven Rudolph. Directed Reductive Animation of β-Hydroxy-ketones: Convergent Assembly of the Ritonavir/Lopinavir Core. // Org. Lett., Vol.9, No.2, 2007. - p.267-270].
Недостатком этого метода является использование дорогостоящего и малодоступного восстановителя и катализатора. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения третичных аминов по реакции алифатических и ароматических кетонов с производными анилина, причем в качестве восстановителя используются производные эфира Ганча и процесс протекает в присутствии сложных хиральных катализаторов и молекулярных сит при 40°С в течение 72 часов [R.Ian Storer, Diane E.Carrera, Yike Ni, and David W.C.MacMillan. Enantioselective Organocatalytic Reductive Animation. // J. Am. Chem. Soc., Vol.128, No.1, 2006. - p.84-86].
Недостатками этого метода являются использование дорогостоящего и малодоступного восстановителя и катализатора, высокая длительность процесса. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения вторичных аминов по реакции ароматических и алифатических кетонов с ароматическими аминами, причем в качестве восстановителя используется смесь производного дигидропиридина и тиомочевины, процесс протекает в присутствии молекулярных сит 5 Å, продолжительность 24-48 часов [Dirk Menche, Jorma Hassfeld, Jun Li, Gerd Menche, Antje Ritter, Sven Rudolph. Hydrogen Bond Catalyzed Direct Reductive Amination of Ketones. // Org. Lett., Vol.8, No.4, 2006. - p.741-744]. Выходы продуктов 36-94%.
Недостатками этого метода являются использование малодоступного эфира Ганча, большая длительность процесса. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения третичных аминов по реакции алифатических и ароматических кетонов с формиатом аммония при температуре 70°С в среде метанола в течение 2-31 часа, причем в качестве катализатора используются металлокомплексные соединения металлов платиновой группы, в основном родия [Masato Kitamura, Donghyun Lee, Shinnosuke Hayashi, Shinji Tanaka, Masahiro Yoshimura. Catalytic Leuckart-Wallach-Type Reductive Amination of Ketones. // J. Org. Chem. 2002, 67, pp.8685-8687]. Выходы получаемых аминов составляют 3-99%.
Недостатком этого метода является использование малодоступного и дорогого катализатора. Кроме этого, таким способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения соединений аналогичной структуры по реакции Лейкарта-Валлаха, протекающей в течение 8-24 часов при значительном (до 20-кратного мольного) избытке формамида или его производного, в присутствии муравьиной кислоты (избыток до 10-кратного мольного). Температура процесса (за исключением альдегидов и низших кетонов) составляет не ниже 160°С, чаще 180-200°С [Органикум: В 2-х т. Т.2: Пер. с нем. - М.: Мир, 1992. - 474 с., ил.]. Выходы продуктов составляют от 40 до 80%.
Недостатком данного метода является то, что происходит значительное осмоление реакционной смеси вследствие длительного нагревания, используется значительный расход формамида и муравьиной кислоты, длительное время синтеза (до 12-18 ч), высокие требования к обезвоженности исходных реагентов. Кроме этого, по окончании реакции образуются не целевые амины, а соответствующие амиды муравьиной кислоты, требующие зачастую длительного гидролиза и последующего выделения продуктов. Данным способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения производных 2-аминоадамантана гидроаминированием 2-адамантанона до 2-аминоадамантана водородом под давлением над платиновым катализатором, последующим алкилированием 2-аминоадамантана или его ацилированием с дальнейшим восстановлением [2-Adamantanamines. Патент США №3532748, опубл. 1970. C07C 87/40, 91/14, 93/12; Pharmaceutical compositions and methods utilizing 2-aminoadamantane and its derivatives Патент США №3328251, опубл. 1967].
Недостатками данного способа являются его многостадийность, использование в ряде случаев пожароопасного алюмогидрида лития. Кроме этого, данным способом получено лишь одно соединение заявляемой общей формулы.
Известен способ получения производных 2-аминоадамантана гидроаминированием 2-адамантанона до 2-аминоадамантана водородом под давлением над платиновым катализатором, дальнейшим алкилированием 2-аминоадамантана или его ацилированием с последующим восстановлением [2-Adamantanone and derivatives. Патент США №3257456, опубл. 1966; Adamantane derivatives. Пат. Великобритании №1157143, опубл. 1969. C07C 87/40, 19/12].
Недостатками данного способа являются его многостадийность, использование водорода и дорогого катализатора, в ряде случаев также пожароопасного алюмогидрида лития. Кроме этого, данным способом получено лишь одно соединение заявляемой общей формулы.
Известен способ получения производных 2-аминоадамантана конденсацией адамантанона-2 с соответствующим амином и последующим восстановлением промежуточных иминов водородом под давлением над платиновым или никелевым катализатором в течение 48-72 часов [Патент США №5380947, опубл. 1995. C07C 211/62, C07C 211/63].
Недостатками данного способа являются его многостадийность, использование водорода и дорогого катализатора, кроме этого, данным способом не синтезировались соединения заявляемой структурной формулы.
Известен способ получения ароматических производных 2-аминоадамантана по реакции Лейкарта-Валлаха между адамантаноном-2 и производными анилина при 160°С в течение 10 часов [N-ADAMANTYL DERIVATIVES OF AROMATIC AMINES. PART I. SYNTHESIS AND NEU-ROTROPIC ACTIVITY OF N-(ADAMANT-2-YL)ANILINES. / I.S.Morozov, N.V.Klimova, L.N.Lavrova, N.I.Avdyunina, B.M.Pyatin, V.S.Troitskaya, N.P.Bykov. // Pharmaceutical Chemistry Journal Vol.32. No.1, 1998. - pp.1-4].
Недостатками данного способа являются достаточно жесткие условия проведения реакции, данным способом не получены соединения заявляемой общей формулы.
Наиболее близким к предполагаемому изобретению является способ получения производных 2-аминоадамантана по реакции 2-адамантанона или 2,6-аминоадамантандиона с аминами из ряда 4-броманилин, пирролидин, пиперазин, 4-аминомаслямая кислота и др. в присутствии муравьиной кислоты при температуре 140-160°С в течение 4-10 часов [Антикаталептическая активность гетероциклических производных 2-аминоадамантана. Морозов И.С, Вальдман Е.А., Воронина Т.А., Неробкова Л.Н., Климова Н.В., Лаврова Л.Н., Авдюнина Н.И., Пятин Б.М. // Хим. Фарм. Журнал, Вып.34, №.4, 2000. - с.27-30; ANTICATALEPTIC ACTIVITY OF HETEROCYCLIC 2-AMINOADAMANTANE DERIVATIVES. / I.S.Morozov, E.A.Val'dman, T.A.Voromna, L.N.Nerobkova, N.V.Klunova, L.N.Lavrova, N.I.Avdyunina, B.M.Pyatin. // Pharmaceutical Chemistry Journal Vol.34, No.4, 2000. - pp 189-192]. Выходы продуктов составляют 40-75%.
Недостатками данного метода являются невысокие в большинстве случаев выходы целевых продуктов при достаточно жестких условиях проведения реакции. Кроме этого, данным способом получалось только одно соединение заявляемой общей формулы.
Техническим результатом является разработка технологичного метода получения соединений заявляемой структурной формулы.
Задачей предлагаемого изобретения является разработка технологичного малостадийного метода синтеза циклоалкиламинов, протекающего с высоким выходом по исходным кетонам в относительно мягких условиях.
Поставленный технический результат достигается в новом способе получения циклоалкиламинов общей формулы
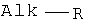
Где
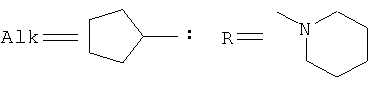
 ,
, 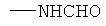 ,
,  ,
, 
 ,
,  ,
, 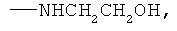
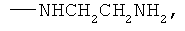
 ,
,  ,
, 
заключающемся во взаимодействии циклического кетона с производным амина и муравьиной кислотой, при этом в качестве циклических кетонов используют циклопентанон, циклогексанон или 2-адамантанон, а в качестве производного амина используют формамид, циклогексиламин, пиперидин, морфолин, пиперазин, 2-аминоэтанол, 1,2-этилендиамин, при этом реакция протекает при мольных соотношениях циклический кетон:производное амина:НСООН, равных 1:3-4:5-10, при температуре 100°С в течение 3-9 часов в присутствии каталитических количеств наночастиц меди. При этом наночастицы меди получают в реакционной смеси in-situ восстановлением хлорида меди II железом при перемешивании, или их получают предварительно восстановлением хлорида меди II железом при перемешивании в системе растворителей формамид-вода при массовом соотношении CuCl2*2H2O:формамид:вода, равном 1:4:1.5.
Сущностью метода является синтез циклоалкиламинов по реакции гидроаминирования циклических кетонов из ряда: циклопентанон, циклогексанон, 2-адамантанон при их взаимодействии с формамидом или формиатом амина или его производного из ряда циклогексиламин, пиперидин, морфолин, пиперазин, 2-аминоэтанол, 1,2-этилендиамин и муравьиной кислотой в присутствии каталитических количеств наночастиц меди.
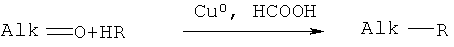
Где
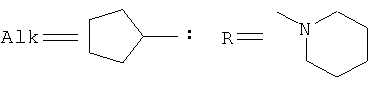
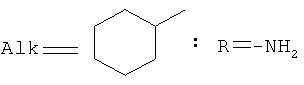 ,
, 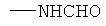 ,
,  ,
, 
 ,
,  ,
, 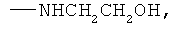

 ,
,  ,
, 
Реакция основана на ранее неизвестном свойстве наночастиц меди катализировать процесс гидроаминирования циклических кетонов. Разработанный способ позволяет получать достаточно широкий ряд циклоалкиламинов. Способ осуществляется следующим образом.
В плоскодонную колбу, снабженную магнитной мешалкой с железным (стальным) магнитным элементом без оболочки, термометром и обратным холодильником, загружают формамид или формиат соответствующего амина (полученный из амина и муравьиной кислоты), каталитическое количество концентрированного водного раствора CuCl2*2H2O и нагревают до 100°С при интенсивном перемешивании до окончания образования коллоидной меди. После образования красноватого прозрачного раствора добавляют циклоалкилкетон и муравьиную кислоту. Реакционную массу перемешивают при 100°С 3-9 часов, при этом происходит полная гомогенизация реакционной массы. При использовании формамида добавляют необходимое количество воды и соляной кислоты и гидролизуют формильное производное амина при кипении 1-1,5 часа, после чего амин осаждают из солянокислой соли водным раствором щелочи. При использовании формиата амина стадию гидролиза исключают и амин выделяют, осаждая свободное основание из соответствующей муравьинокислой соли водным раствором щелочи. После прибавления NaOH до слабощелочной среды смесь фильтруют от механических примесей на воронке Бюхнера. Свободное основание дважды экстрагируют небольшим количеством диэтилового эфира, эфир отгоняют, продукт перегоняют. Выходы продуктов заявляемой структурной формулы составляют 68-91%.
Возможно использование каталитического количества предварительно приготовленной коллоидной меди. Приготовление проводят в плоскодонной колбе на магнитной мешалке с использованием железного (стального) магнитного элемента без оболочки. В колбу загружают формамид и водный раствор CuCl2*2H2O, соблюдая массовое соотношение CuCl2*2H2O:формамид:вода, равное 1:4:1.5, и нагревают реакционную смесь до 80-100°С при перемешивании 2-3 часа до прекращения образования тонкодисперсного осадка меди. Масса реагирующего железного (стального) магнитного элемента должна быть достаточной для завершения реакции обмена. По окончании реакции смесь при необходимости разбавляют небольшим количеством воды и фильтруют на воронке Бюхнера с бумажным фильтром, добиваясь прозрачности фильтрата. Осадок красного или рыжего цвета промывают водой для удаления формамида, отсасывают для удаления избыточной влаги. Полученная коллоидная медь используется для проведения реакции немедленно или может храниться достаточно долго в закрытой емкости.
Обнаружено, что протекание реакции гидроаминирования в данных условиях не сильно зависит от безводности исходных веществ и протекает с удовлетворительной скоростью в присутствии до 10 масс.% воды. Показано, что избыток формамида, меньший 3-кратного, приводит к образованию наряду с формиламиноциклогексаноном формильного производного дициклогексиламина. При эквимолярном соотношении циклогексанона и формамида данные соединения образуются уже в близком к равному соотношении. Оптимальным соотношением кетон: формамид: НСООН является 1:3:5, при этом расход реагентов минимален, конверсия циклогексанона за 4-5 часов при 100°С, выход циклогексиламина после гидролиза формильного производного достигает 70%.
Найдено, что 2-адамантанон заметно уступает в реакционной способности циклогексанону при 100°С, в том числе из-за своей частичной сублимации в условиях реакции. Увеличение продолжительности реакции 2-адамантанона с формамидом до 6-7 часов и применения небольшого количества инертного растворителя (2-3 мл бензола), возвращающего адамантанон-2 в реакцию, позволило получить целевой продукт с выходом 82% после выделения. Обнаружено, что реакция 2-адамантанона с пиперидином в указанных условиях за 3 часа приводит к конверсии кетона только 55%, увеличение времени до 6 часов повышает конверсию до 90%, и только за 9 часов реакции наблюдалось полное исчезновение адамантанона-2.
При взаимодействии 2-адамантанона с соединениями, содержащими две аминогруппы (пиперазин, этилендиамин) необходимо использовать больший избыток муравьиной кислоты, расходуемой на образование диформиатов данных аминов. Найдено, что оптимальным мольным соотношением циклический кетон: производное амина: НСООН в данных случаях является 1:3-4:9-10.
Определено, что снижение температуры реакции до 90°С резко снижает выход целевых продуктов из-за низкой конверсии исходных реагентов. Повышение температуры до 130-160°С приводит к ускорению реакции, однако при этом помимо формиатов аминов или их производных образуются соответствующие производные формамида, требующие дополнительной стадии гидролиза, в связи с чем указанное повышение температуры является нецелесообразным.
Строение синтезированных циклоалкиламинов подтверждено ЯМР1Н-спектроскопией, свойства известных соединений соответствуют литературным данным.
Изобретение иллюстрируется следующими примерами:
Пример 1
Циклогексиламин 
В плоскодонную колбу, снабженную магнитной мешалкой, термометром и обратным холодильником, загружают 22.5 г (0.5 моль) формамида, 2 г (0,0116 моль) CuCl2*2H2O и 4 мл воды и нагревают при перемешивании до 80-100°С до образования красноватого раствора коллоидной меди, добавляют 16.3 г (0.167 моль) циклогексанона и 38.4 г (0.84 моль) муравьиной кислоты (мольное соотношение 1:3:5 соответственно). Реакционную массу перемешивают при 100°С 3 часа, при этом происходит полная гомогенизация реакционной массы и исчезновение запаха циклогексанона. Добавляют 100 мл воды, 50 мл 33% соляной кислоты и гидролизуют формильное производное циклогексиламина при кипении 1-1,5 часа. Смесь охлаждают, выпадают кристаллы солянокислого циклогексиламина. Прибавляют при взбалтывании NaOH до слабощелочной среды, фильтруют от механических примесей на воронке Бюхнера. Свободное основание дважды экстрагируют 20 мл диэтилового эфира, эфир отгоняют, продукт перегоняют, получая 11.4 г (0.117 моль, 70%) циклогексиламина, т.кип. 132-134°С, nD 20 1.4314 (лит. т.кип. 134°С, nD 20 1.4318 [Alfa Aesar. Research Chemicals, Metals and Materials. 2006-2007. - 2766 p.]).
Пример 2
Дициклогексиламин 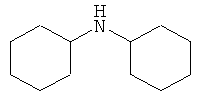
В плоскодонную колбу, снабженную магнитной мешалкой, термометром и обратным холодильником, загружают 9.9 г (0.1 моль) циклогексиламина и порциями прибавляют 4.6 г (0.1 моль) муравьиной кислоты. К расплаву полученной соли добавляют 1 г (0,0058 моль) CuCl2*2H2O и 2 мл воды и нагревают при перемешивании до 80-100°С до образования красноватого раствора коллоидной меди, после чего прибавляют 3.3 г (0.033 моль) циклогексанона, а затем 3 г (0.065 моль) муравьиной кислоты (мольное соотношение 1:3:5 соответственно). Реакционную массу перемешивают при 100°С 4 часа, охлаждают, добавляют 100 мл воды и прибавляют при взбалтывании NaOH до слабощелочной среды, фильтруют от механических примесей на воронке Бюхнера. Свободное основание дважды экстрагируют 20 мл диэтилового эфира, эфир отгоняют, продукт перегоняют, получая 4.1 г (0.022 моль, 68%) дициклогексиламина, т.кип. 269-270°С, nD 20 1.4839 (лит. т.кип. 270°С, nD 20 1.4842 [Alfa Aesar. Research Chemicals, Metals and Materials. 2006-2007. - 2766 p.]).
Пример 3
2-Формиламиноадамантан 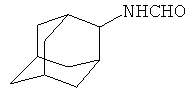
Смесь 4 г (0.0233 моль) CuCl2*2H2O, 16 г (0.355 моль) формамида и 6 мл (0,333 моль) воды (массовое соотношение реагентов 1:4:1.5) помещают в плоскодонную колбу, снабженную стальным магнитным элементом (стержень) массой 2.5 г, и нагревают при интенсивном перемешивании до 100°С 2-3 часа. Наблюдается изменение цвета с синего на коричневый и далее в красноватый, после чего из пересыщенного коллоидного раствора начинает выпадать мелкодисперсный оранжево-красный осадок меди. По окончании реакции реакционную массу охлаждают и фильтруют на воронке Бюхнера через бумажный фильтр, промывают осадок небольшим количеством воды.
В плоскодонную колбу, снабженную магнитной мешалкой, термометром и обратным холодильником, загружают 4.5 г (0.1 моль) формамида и 0.3 г приготовленной предварительно коллоидной меди и нагревают до 100°С. После растворения меди и образования красноватого прозрачного раствора добавляют 5 г (0.033 моль) 2-адамантанона, 3 мл бензола и 9.1 г (0.2 моль) муравьиной кислоты (мольное соотношение 1:3:6 соответственно). Реакционную массу перемешивают при 100°С 8 часов, при этом пары бензола смывают сублимирующийся 2-адамантанон, возвращая его в реакционную смесь. По окончании реакции отгоняют растворитель, при в реакционной массе этом не должно оставаться нерастворимого непрореагировавшего 2-адамантанона. Добавляют 100 мл воды, фильтруют выпавший белый осадок, промывают водой и сушат. Получают 5 г (0.03 моль, 91%) 2-формиламиноада-мантана. Спектр ЯМР 1Н, δ, м.д.: 1.57-2.03 м (14Н, 2-адамантил), 4.00 с (1Н, CH-N, 2-адамантил), 6.44 уш. с (1Н, NHCO), 1.97 с (2Н, CH2CO), 7.99 с (1Н, СНО).
Пример 4
N-2-Адамантилпиперидин 
Аналогично, из 5 г (0.033 моль) 2-адамантанона, 10 г (0.12 моль) пиперидина, 8.8 г (0.19 моль) муравьиной кислоты (мольное соотношение 1:3.6:5.6 соответственно) и 0.25 г коллоидной меди, предварительно полученной согласно примеру 3, при 100°С за время реакции 7.5 часов после выделения получают 5.55 г (0.025 моль, 76%) N-2-адамантилпиперидина, т.кип. 166-168°С/10 мм рт.ст. nD 20 1.5051. Спектр. ЯМР 1Н, δ, м.д.: 1.27-1.76 м (10Н, 2-адамантил, 6Н, (СН2)3), 1.92 с (1Н, CH-N, 2-адамантил), 2.00 с (4Н, адамантил), 2.28 уш. с (4Н, N(CH2)2).
Пример 5
N-2-Адамантилморфолин 
В плоскодонную колбу на магнитной мешалке, снабженной стальным магнитным элементом без оболочки, термометром и обратным холодильником, загружают 10 г (0.12 моль) морфолина, 5.5 г (0.12 моль) муравьиной кислоты. К расплаву полученной соли при 100°С добавляют 1.71 г (0.01 моль) CuCl2*2H2O и 2,5 мл воды и нагревают при перемешивании до образования красноватого раствора коллоидной меди, после чего прибавляют 5 г (0.033 моль) 2-адамантанона, а затем 2.3 г (0.05 моль) муравьиной кислоты (мольное соотношение 1:3.6:5.2 соответственно). Реакционную массу перемешивают при 100°С 6 часов, охлаждают, добавляют 100 мл воды и прибавляют при взбалтывании NaOH до слабощелочной среды, фильтруют от механических примесей на воронке Бюхнера. Свободное основание дважды экстрагируют 20 мл диэтилового эфира, эфир отгоняют, продукт перегоняют в вакууме. Получают 5.2 г (0.024 моль, 70%) N-2-адамантилморфолина, т.кип. 225-227°С/20 мм рт.ст., т.пл. 44-45°С. Спектр ЯМР 1Н, δ, м.д.: 1.25-1.78 м (10Н, 2-адамантил), 1.92 с (4Н, адамантил), 1.99 с (1Н, CH-N, 2-адамантил), 2.26 уш. с (4Н, N(CH2)2), 3.51 т (4Н, O(CH2)2).
Пример 6
N-2-Адамантилпиперазин 
Аналогично, за 9 часов при 100°С из 5 г (0.033 моль) 2-адамантанона, 11 г (0.13 моль) пиперазина, 15.2 г (0.33 моль) муравьиной кислоты (мольное соотношение 1:4:10 соответственно) и 0.3 г коллоидной меди, предварительно полученной согласно примеру 3, получают 5.4 г (0.025 моль, 74%) N-2-адамантилпиперазина, т.кип. 235-237°С/20 мм рт.ст. Спектр ЯМР 1Н, δ, м.д.: 0.82 уш. с (1Н, NH), 1.33-2.02 м (14Н, 2-адамантил), 1.99 с (1Н, CH-N, 2-адамантил), 2.36 м (4Н, N(CH2)2), 2.75 с (1Н, CH-N, 2-адамантил), 3.36 д. т (4Н, N(CH2)2.
Пример 7
N-2-Адамантилциклогексиламин 
Аналогично, за 6.5 часов при 100°С из 3 г (0.02 моль) 2-адамантанона, 6 г (0.06 моль) циклогексиламина, 4.6 г (0.1 моль) муравьиной кислоты (мольное соотношение 1:3:5 соответственно) и 0.25 г коллоидной меди, предварительно полученной согласно примеру 3, получают 3.3 г (0.014 моль, 71%) N-2-адамантилциклогексиламина, т.кип. 205-207°С/18 мм рт.ст. Спектр ЯМР 1Н, δ, м.д.: 0.60 уш. с (1Н, NH), 0.94-1.99 м (14Н, 2-адамантил, (CH2)5, циклогексил), 2.38 м (1Н, CH-N, циклогексил), 2.74 с (1Н, CH-N, 2-адамантил).
Пример 8
2-Адамантиламиноэтанол 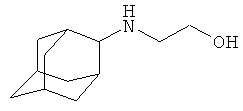
Аналогично, за 6 часов при 100°С из 5 г (0.033 моль) 2-адамантанона, 6.1 г (0.1 моль) 2-аминоэтанола, 8.8 г (0.19 моль) муравьиной кислоты (мольное соотношение 1:3:5.75 соответственно) и 0.25 г коллоидной меди, предварительно полученной согласно примеру 3, получают 5.1 г (0.26 моль, 78%) 2-адамантиламиноэтанола, т.пл. 118-120°С. Спектр ЯМР 1H, δ, м.д.: 0.82 уш. с (1Н, NH), 1.43-2.01 м (10Н, 2-адамантил), 1.92 с (4Н, адамантил), 2.63 с (1Н, CH-N, 2-адамантил), 2.75 т (2Н, NCH2), 2.87 уш. с (1Н, ОН), 3.61 т (2Н, ОСН2).
Пример 9
2-(2-Адамантил)аминоэтиламин 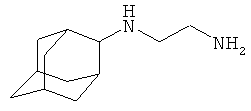
Аналогично, за 8.5 часов при 100°С из 5 г (0.033 моль) 2-адамантанона, 6.1 г (0.1 моль) этилендиамина, 14.4 г (0.313 моль) муравьиной кислоты (мольное соотношение 1:3:9.5 соответственно) и 0.3 г коллоидной меди, предварительно полученной согласно примеру 3, получают 5.3 г (0.27 моль, 83%) 2-(2-адамантил)аминоэтиламина, т.кип. 182-185°С/20 мм рт.ст. Спектр ЯМР 1Н, δ, м.д.: 0.80 уш. с (1Н, NH), 1.32-2.00 м (14Н, 2-адамантил), 2.87 с (1Н, CH-N, 2-адамантил), 2.99 т (2Н, NCH2), 3.57 т (2Н, NCH2), 2.56 уш. с (2Н, NH2).
Пример 10
N-Циклопентилпиперидин 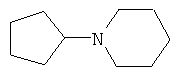
Аналогично, за 5 часов при 100°С из 11 г (0.13 моль) циклопентанона, 33.4 г (0.4 моль) пиперидина, 30 г (0.65 моль) муравьиной кислоты (мольное соотношение 1:3:5 соответственно) и 0.75 г коллоидной меди, предварительно полученной согласно примеру 3, получают 16.5 г (0.108 моль, 83%) N-циклопентилпиперидина, т.кип. 230-231°С, nD 20 1.4840. Лит. т.кип. 230°С [Preparation and Reactions of Sulfbnic Esters. V. Synthesis of Cyclic Tertiary Amines. / D.D.Reynolds, W.O.Kenyon. // J. Am. Chem. Soc., 1950, Vol.72. - p.1597-1598].
Пример 11
N-Циклогексилпиперидин 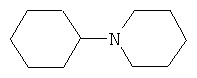
В плоскодонную колбу на магнитной мешалке, снабженной стальным магнитным элементом без оболочки, термометром и обратным холодильником, загружают 26 г (0.3 моль) пиперидина и 13.8 г (0.3 моль) муравьиной кислоты. К расплаву полученной соли при 100°С добавляют 3.42 г (0.02 моль) CuCl2*2H2O и 4 мл воды и нагревают при перемешивании до образования красноватого раствора коллоидной меди, после чего прибавляют 9.8 г (0.1 моль) циклогексанона, а затем 9.2 г (0.2 моль) муравьиной кислоты (мольное соотношение 1:3.6:5.2 соответственно). Реакционную массу нагревают при 100°С при интенсивном перемешивании 4 часа, после выделения, аналогичного примеру 1, получают 12.7 г (0.076 моль, 76%) N-циклогексилпиперидина, т.кип. 232-234°С, nD 20 1.4842. Лит. т.кип. 234°С [Preparation and Reactions of Sulfonic Esters. V. Synthesis of Cyclic Tertiary Amines. / D.D.Reynolds, W.O.Kenyon. // J. Am. Chem. Soc., 1950, Vol.72. - p.1597-1598].
Таким образом, вышеизложенные сведения свидетельствуют о выполнении при использовании заявленного изобретения следующей совокупности условий:
- средство, воплощающее заявленное изобретение при его осуществлении, предназначено для применения в различных отраслях промышленности;
- для заявленного изобретения в том виде, как оно охарактеризовано в независимом пункте нижеизложенной формулы изобретения, подтверждена возможность его осуществления с помощью вышеописанных в заявке или известных до даты приоритета средств и методов;
- средство, воплощающее заявленное изобретение, при его осуществлении способно обеспечить достижение технического результата.
Следовательно, заявленное изобретение соответствует требованию "промышленная применимость".
Выводы
Разработан новый технологичный малостадийный метод синтеза пиклоалкиламинов, протекающий с высоким выходом по исходным кетонам в относительно мягких условиях. Структура полученных соединений подтверждена масс-, ЯМР 1Н-спектроскопией и элементным анализом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРЕАМИДИРОВАНИЯ АМИДОВ КАРБОНОВЫХ КИСЛОТ | 2014 |
|
RU2558366C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНОМЕТИЛАЛКИЛ(АРИЛ)АМИНОАДАМАНТАНОВ | 2012 |
|
RU2484083C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО-2-ЦИАНОАДАМАНТАНА | 2013 |
|
RU2523462C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО-2-ЦИАНОАДАМАНТАНА | 2013 |
|
RU2523461C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ N-АДАМАНТИЛ-П-НИТРОЗОАРИЛАМИНОВ | 2005 |
|
RU2298544C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1-АДАМАНТИЛАЛКИЛ)ЦИКЛОАЛКИЛАМИНОВ | 2009 |
|
RU2404157C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-(4-БРОМФЕНИЛ)-N-(2-АДАМАНТИЛ)АМИНА (БРОМАНТАНА) | 2014 |
|
RU2547141C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРВИЧНЫХ ИЛИ ВТОРИЧНЫЙ СПИРТОВ | 2013 |
|
RU2519950C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНИЛИНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 2010 |
|
RU2433116C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2,2-АДАМАНТИЛЕНСПИРООКСИРАНА | 2013 |
|
RU2529025C1 |
Изобретение относится к способу получения циклоалкиламинов общей формулы Alk-R, где
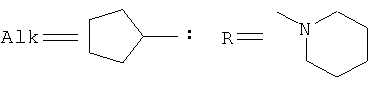
 ,
, 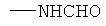 ,
,  ,
, 
 ,
,  ,
, 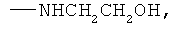

 ,
,  ,
, 
Способ осуществляют путем взаимодействия циклического кетона с производным амина и муравьиной кислотой в присутствии катализатора. В качестве циклических кетонов используют циклопентанон, циклогексанон или 2-адамантанон, а в качестве производного амина используют формамид, циклогексиламин, пиперидин, морфолин, пиперазин, 2-аминоэтанол, 1,2-этилендиамин, а в качестве катализатора используют наночастицы меди. Процесс проводят при мольных соотношениях циклический кетон: производное амина: HCOOH, равных 1:3-4:5-10 при температуре 100°С в течение 3-9 часов. При этом наночастицы меди могут быть получены как in situ, так и предварительно. Технический результат - повышение выхода циклоалкиламинов при более мягких условиях проведения процесса. 2 з.п. ф-лы.
1. Способ получения циклоалкиламинов общей формулы Alk-R
где
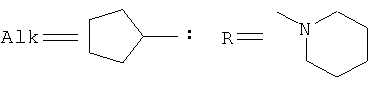
 ,
, 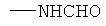 ,
,  ,
, 
 ,
,  ,
, 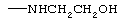 ,
, 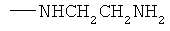 ,
,
 ,
,  ,
, 
заключающийся во взаимодействии циклического кетона с производным амина и муравьиной кислотой, отличающийся тем, что в качестве циклических кетонов используют циклопентанон, циклогексанон или 2-адамантанон, а в качестве производного амина используют формамид, циклогексиламин, пиперидин, морфолин, пиперазин, 2-аминоэтанол, 1,2-этилендиамин, при этом реакция протекает при мольных соотношениях циклический кетон: производное амина: НСООН, равном 1:3-4:5-10, при температуре 100°С в течение 3-9 ч в присутствии каталитических количеств наночастиц меди.
2. Способ по п.1, отличающийся тем, что наночастицы меди получают в реакционной смеси in-situ восстановлением хлорида меди II железом при перемешивании.
3. Способ по п.1, отличающийся тем, что наночастицы меди получают предварительно восстановлением хлорида меди II железом при перемешивании в системе растворителей формамид-вода при массовом соотношении CuCl2·2H2O:формамид:вода, равном 1:4:1,5.
| МОРОЗОВ И.С., ВАЛЬДМАН Е.А., ВОРОНИНА Т.А | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Химико-фармацевтический журнал | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| ВАЦУРО К.В., МИЩЕНКО Г.Л | |||
| Именные реакции в органической химии | |||
| Справочник | |||
| - М.: Химия, 1976, с.252-253 | |||
| Способ получения N-(2-адамантил)-пиперазина | 1977 |
|
SU635726A1 |
| ЛАВРОВА Л.Н., КЛИМОВА | |||
Авторы
Даты
2011-08-10—Публикация
2010-05-07—Подача