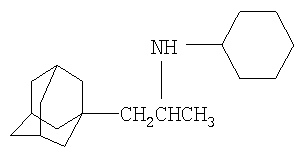
Изобретение относится к химии производных адамантана, а именно к новому способу получения аминопроизводных адамантана общей формулы:
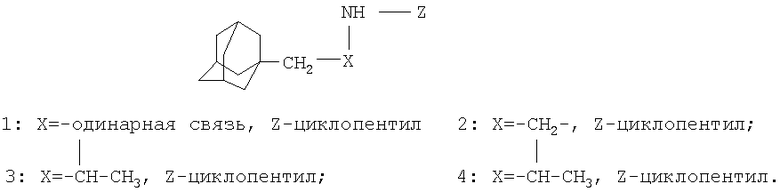
Амины каркасного строения, в том числе N-алкильные производные адамантана, проявляют различные виды биологической активности [Морозов, И.С. Фармакология адамантанов / И.С.Морозов, В.И.Петров, С.А.Сергеева; Волгогр. мед. акад. - Волгоград, 2001. - 320 с.]. Однако ассортимент таких производных недостаточен, а методы их синтеза далеки от совершенства.
В литературе описано несколько способов синтеза алкиламинопроизводных адамантана, в частности восстановлением N-(адамантилацетил)аминоэтанола алюмогидридом лития, предварительно полученного ацилированием этаноламина хлорангидридом 1-адамантануксусной кислоты, который приводит к образованию адамантил-аминоспирта с выходом 70% [Т.С.Куликова. Синтез фунционально-замещенных аминопроизводных адамантана / Т.С.Куликова, Е.О.Жилкина // Химия и технология каркасных соединений: тез. докл. IX Международной, науч. конф., 5-7 июня. 2001 г. - Волгоград, 2001. - С.147-148].
Однако данный способ синтеза обладает несколькими недостатками:
1) регеоселективность синтеза N-(адамантилацетил)аминоэтанола сильно зависит от условий проведения процесса, реакция может протекать как по амино-, так и по гидроксильной группе, что снижает выход целевых продуктов;
2) возможность образования комплексов, исходных соединений с восстановителем, приводящая к получению труднорастворимых осадков, что в свою очередь повышает расход восстановителя и продолжительность реакции (до 70 ч);
3) низкая концентрация реагирующих веществ;
4) использование безводных растворителей.
В литературе также описан способ синтеза N-алкильных производных адамантана с получением на первой стадии шифовых оснований (при взаимодействии аминов с бензальдегидом) с последующим алкилированим (йодистым метилом) при 100-200°С и гидролизом [Н.В.Стулин. Превращения 1-аминоадамантана в метил-(1-адамантил)амин / Н.В.Стулин, И.К.Моисеев // Перспективы развития химии каркасных соединений и их применение в народном хозяйстве: тез. докл. V всесоюз. науч. конф., 19-21 апр. 1989 г. - Куйбышев, 1989. - С.142].
Основным недостатком данного способа является невозможность получения широкого ассортимента продуктов (так как в данную реакцию вступают только метил- и этилиодиды, вторичные алкилгалогениды в реакцию не вступают) синтез проводят под давлением, что значительно усложняет технологический процесс и приводит к повышению стоимости конечных продуктов.
Известен способ непосредственного введения в адамантан аминогруппы [Amidation of Unfunctionalized Hydrocarbons Catalyzed by Ruthenium Cyclic Amine or Bipyridine Complexes / Sze-Man Au [etc.] // J. Org. Chem. - 2000. - Vol.65. - P. 7858-7864].
Однако недостатком данного способа является использование дорогостоящих каталитических систем на основе комплексов рутения.
Известен способ получения производных адамант-1-иламинов, состоящий в алкилировании аминов йодистыми алкилами при кипячении реагентов в течение 12-16 часов в ксилоле с последующей обработкой щелочью. Выход целевых продуктов- 60-70% [Пат.468341 Швейцария, МПК С07С 87/40 Verfahren zur Herstellung von 1-Aminoadamanderevaten / Marvin Paulshok, John Conway Watts; - 1969].
Недостатками данного способа являются: использование в качестве исходного реагента дорогостоящих йодистых алкилов, которые не нашли широкого применения в промышленности; протекание побочной реакции диалкилирования, приводящей к снижению выхода и чистоты целевых продуктов.
Также в литературе описан способ получения производных адамант-1-иламина путем взаимодействия 1-бромадмантана с соответствующими аминами или их производными (н-бутиламин, циклогексиламин, адамантиламин, бензиламин, пиперидин, морфолин, анилин и др.) в запаянной ампуле при 170-190°С, который приводит к образованию соответствующих адамантилсодержащих аминов с выходом 20-70% [Ф.Н.Степанов. Адамантан и его производные. Ч.XVIII. О взаимодействии 1-бромадамантана с аминами / Ф.Н.Степанов. 3.Е.Столяров // ЖОХ. - 1969. - Т.5, №3. - С.537-541].
Недостатками данного способа являются: низкий выход большинства продуктов, высокая температура проведения реакции, необходимость использования давления, что связано с относительно невысокой реакционной способностью 1-бромадантана.
Наиболее близким к предлагаемому является способ получения производных адамант-1-иламина, состоящий во взаимодействии адамантиламина с соответствующими альдегидами с получением промежуточных оснований Шиффа, которые далее восстанавливаются алюмогидридом лития до соответствующих аминов с общим выходом 50-60% [Пат. Норвегии 1006885, МПК С07С 87/64. - 1966].
Недостатками данного способа являются: его нетехнологичность, а именно: многостадийность, ограниченное число получаемых соединений, использование дорогостоющего и пожароопасного алюмогидрида лития, применение в синтезе безводных растворителей.
Техническим результатом предлагаемого способа является разработка технологичного способа получения М-(1-адамантилалкил)циклоалкиламинов с высоким выходом.
Поставленный технический результат достигается в способе получения N-(1-адамантилалкил)циклоалкиламинов общей формулы:

заключающийся в алкилировании адамантансодержащих аминов выбранных из ряда 1-(1-адамантил)пропан-2-амин, 1-адамантилметиламин, [2-(1-адамантил)этил]амин циклическими спиртами: циклопентанолом или циклогексанолом, в присутствии катализатора "Ni-Ренея" в течение 8-16 часов при температуре кипения циклического спирта, при мольном соотношении катализатор:адамантансодержащий амин:циклический спирт: 0,21-0,6:1:6-14,8.
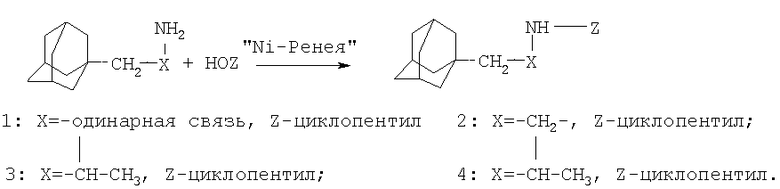
Катализатор получают по методике, приведенной в практикуме А.Е.Агрономов, Ю.С.Шабаров. Лабораторные работы в органическом практикуме. Изд. 2-е, пер. и доп. М.: Химия, 1974 г., с.376.
Для обоснования оптимальных мольных соотношений реагентов и условий проведения процесса в качестве модельного исходного соединения выбирают 1-(1-адамантил)пропан-2-амин. Выбор данного соединения обусловлен тем, что из представленного ряда 1-(1-адамантил)пропан-2-амин должен обладать наименьшей реакционной способностью. Реакцию проводят в кипящем циклогексаноле.
При исследовании влияния катализатора на выход N-[2-(1-адамантил)-1-метилэтил]циклогексанамина установлено, что при использовании мольного соотношения катализатор:1-(1-адамантил)пропан-2-амин ниже 0,21:1 наблюдается понижение выхода целевого продукта, вследствие неполной конверсии исходного 1-(1-адамантил)пропан-2-амина, а при увеличении мольного соотношения катализатор:1-(1-адамантил)пропан-2-амин выше 0,6:1 наблюдается снижение выхода в результате протекания побочных процессов, приводящих к образованию более высококипящих продуктов. Синтез проводят при кипении циклогексанола (161°С). При исследовании влияния мольного соотношения 1-(1-адамантил)пропан-2-амин:циклогексанол на выход целевого соединения было обнаружено, что при снижении избытка циклогексанола с 14,8 молей до 6 молей наблюдается уменьшение выхода целевого продукта (64%), вследствие ухудшения гомогенности реакционной массы. Увеличение мольного соотношения 1-(1-адамантил)пропан-2-амин: циклогексанол выше 1:14,8 не приводит к повышению выхода целевого продукта. Оптимальная продолжительность реакции 8-16 часов. Уменьшение или увеличение продолжительности процесса снижает выход целевого продукта (более значительно это сказывается в случае проведения реакции с циклопентанолом).
Нами установлено, что при проведении процесса в условиях: мольное соотношение (катализатор "Ni-Ренея":1-(1-адамантил)пропан-2-амин:циклопентанол): 0,42:1:10 и продолжительности синтеза 16 часов, выход N-[2-(1-адамантил)-1-метилэтил] циклопентанамина - 73%, а при мольном соотношении (катализатор "Ni-Ренея": 1-(1-адамантил)пропан-2-амин:циклогексанол): 0,42:1:14,8. выход N-[2-{1- адамантил)-1-метилэтил] циклогексанамина - 91%.
Новизна изобретения заключается в том, что в данном процессе используют катализатор "Ni-Ренея", циклические спирты. При этом удается проводить реакцию в одну стадию, а также повысить селективность процесса.
Добиться более высокой селективности процесса алкилирования адамантансодержащих аминов удается в связи с тем, что достаточно объемный адамантановый фрагмент (конформационно жесткий) с одной стороны и циклоалкильные фрагменты с другой стороны, создают значительные стерические препятствия протеканию последовательной реакции каталитического процесса алкилирования. В результате этого повышается выход и чистота целевого продукта, улучшается технологичность.
Способ осуществляют следующим образом. К раствору адамантансодержащего амина в циклическом спирте (при комнатной температуре) прибавляют катализатор "Ni-Ренея," при мольном соотношении катализатор:адамантансодержащий амин:спирт: 0,21-0,6:1:6-14,8, температуру реакционной массы повышают до кипения спирта, перемешивают при кипении в течение 8-16 часов, затем реакционную массу охлаждают и фильтруют (от "Ni-Ренея"), циклический спирт упаривают, N-(1-адамантилалкил)циклоалкиламин перегоняют под вакуумом. Отогнанный из синтеза циклический спирт регенирируется.
Структуры N-(1-адамантилалкил)циклоалкиламинов и индивидуальность подтверждали следующими методами анализа.
ИК-спектры снимают на ИК-Фурье спектрометре "Nicolet 6700". ПМР-спектры - на ЯМР-спектрометре (Varian) "Mercury-300 BB", внутренний стандарт - ГМДС, при частоте 300.73 МГц, растворитель CCl4. ГЖХ-анализ провадили на хроматографе "Perkin-Elmer" tн=50°С-230°С, tисп=250°С, Vнагр.=10°С/мин, Vг.нас.ит=30 см3/мин, 1кол=1м, фаза 15% СКТФТ-50% на интероне, газ-носитель азот.
1. Синтез N-(1-адамантилметил)циклопентанамина
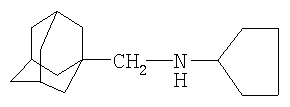
В трехгорловую колбу объемом 100 мл, снабженную перемешивающим устройством, холодильником с хлоркальциевой трубкой и термометром загружают 7 г (0,042 моля) 1-адамантилметиламина, 1 г (0,018 моля) "Ni-Ренея" и 36,5 г (0,42 моля) циклопентанола. Реакционную массу нагревают до температуры кипения циклопентанола и перемешивают в течение 16 часов. Затем ее фильтруют на фильтре Шотта (от катализатора) и перегоняют под вакуумом 178-180°С / 20 мм рт.ст. Выход 6,3 г (63% от теоретического). Отогнанный из синтеза циклопентанол регенирируется.
Мольное соотношение катализатор "Ni-Ренея": 1-адамантилметиламин: циклопентанол: 0,42:1:10.
ИК-спектр, ν, см-1: 2945, 2844, 1673, 1449, 1344, 1315, 1153, 1095, 1077, 1050, 997, 937, 894, 806, 738.
ЯМР 1H, δ, м. д., в CCl4: с 0,587 (1Н NH); м 1,198-1,671 (12H CH2 в Ad, 8H CH2 в циклопентане); с 1,894 (3Н СН в Ad); с 2.098 (2Н CH2NH); м 2,840-2,919(1H NHCH в циклопентане).
2. Синтез N-[2-(1-адамантил)этил]циклопентанамина}

Синтез проводят аналогично синтезу 1 за исключением использования 8,1 г (0,045 моля) [2-(1-адамантил)этил] амина. Выход N-[2-(1-адамантил)этил]циклопентанамина 7,5 г (68% от теоретического). Чистота 97% (по данным ГЖХ). Ткип 190-195°С / 20 мм рт.ст.
Мольное соотношение катализатор "Ni-Ренея": [2-(1-адамантил)этил]амин:циклопентанол: 0,42:1:10.
ИК-спектр, ν, см-1: 2945, 2843, 1672, 1448, 1344, 1314, 1097, 1049, 970, 812, 733, 682.
ЯМР 1H, δ, м.д., CCl4: с 0,708 (1Н NH); м 1,198-1,671 (12H CH2 в Ad, 2Н СН2 в -СН2СН2-, 8Н СН2 в циклопентане); с 1,879 (3Н СН в Ad); м 2,362-2,426 (2Н CH2NH); м 3,048-3,099 (1Н NHCH в циклопентане).
3. Синтез N-[2-(1-адамантил)-1-метилэтил]циклопентанамина
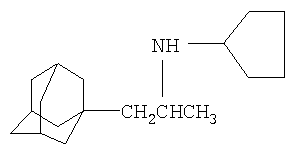
Синтез проводят аналогично синтезу 1 за исключением использования 8,7 г (0,045 моля) 1-(1-адамантил)пропан-2-амина. Выход N-[2-(1-адамантил)-1-метилэтил]циклопентанамина 8,6 г (73% от теоретического). Чистота 98% (по данным ГЖХ). Ткип 197-200°С / 20 мм. рт.ст.
Мольное соотношение катализатор "Ni-Ренея": 1-(1-адамантил)пропан-2-амина:циклопентанол: 0,42:1:10.
ИК-спектр, ν, см-1: 2945, 2844, 1673, 1449, 1348, 1314, 1185, 1103, 974, 708.
ЯМР 1H, δ, м.д., в CCl4: с 0,803 (1Н NH); д 0,879 (3Н СН3); м 1,198-1,739 (12Н СН2 в Ad, 2Н СН2СНСН3, 8Н СН2 в циклопентане); с 1,877 (3Н СН в Ad), м 2,647-2,696 (1Н NHCH в СН2СНСН3); м 3,013-3,052 (1HNHCH в циклопентане).
4. Синтез N-[2-(1-адамантил)-1-метилэтил]циклогексанамина
Синтез проводят аналогично синтезу 1 за исключением использования 8,7 г (0,045 моля) 1-(1-адамантил)пропан-2-амина, 67 г (0,67 моля) циклогексанола. Выход N-[2-(1-адамантил)-1-метилэтил]циклогексанамина 11,3 г (91%от теоретического). Чистота 98% (по данным ГЖХ). Ткип 220-223°С / 20 мм рт.ст.
Мольное соотношение катализатор "Ni-Ренея": 1-(1-адамантил)пропан-2-амин:циклогексанол: 0,42:1:14.8.
ИК-спектр, ν, см-1: 2945, 2845, 1600, 1504, 1448, 1371, 1314, 1256, 1185, 1103, 973, 887, 744, 724, 690.
ЯМР 1H, δ, м.д., в CCl4: с 0,836 (1Н NH); д 0,886 (3Н СН3), м 1,196-1,810 (2Н СН2СНСН3, 12Н-СН2 в Ad, 10Н-СН3 в циклогексане); с 1,876 (3Н СН в Ad); м 2,336-2,400 (1Н в СН2СНСН3); 2,782-2,816 (1Н NHCH в циклогексане).
4.1 Синтез N-[2-(1-адамантил)-1-метилэтил]циклогексанамина
Синтез проводят аналогично синтезу 1 за исключением использования 8,7 г (0,045 моля) 1-(1-адамантил)пропан-2-амина, 45 г (0,45 моля) циклогексанола и продолжительности процесса 8 часов. Выход N-[2-(1-адамантил)-1-метилэтил]циклогексанамина 7,3 г (59% от теоретического). Чистота 96% (по данным ГЖХ). Ткип 220-223°С / 20 мм рт.ст.
Мольное соотношение катализатор "Ni-Ренея": 1-(1-адамантил)пропан-2-амина: циклогексанол: 0,42:1:10.
Продолжительность процесса 8 часов.
4.2 Синтез N-[2-(1-адамантил)-1-метилэтил]циклогексанамина
Синтез проводят аналогично синтезу 1 за исключением использования 8,7 г (0,045 моля) 1-(1-адамантил)пропан-2-амина, 45 г (0,45 моля) циклогексанола и продолжительности процесса 12 часов. Выход N-[2-(1-адамантил)-1-метилэтил]циклогексанамина 10,1 г (81% от теоретического). Чистота 96% (по данным ГЖХ). Ткип 220-223°С / 20 мм рт.ст.
Мольное соотношение катализатор "Ni-Ренея": 1-(1-адамантил)пропан-2-амина:циклогексанол: 0,42:1:10.
Продолжительность процесса 12 часов.
4.3 Синтез №[2-(1-адамантил)-1-метилэтил]циклогексанамина
Синтез проводят аналогично синтезу 1 за исключением использования 8,7 г (0,045 моля) 1-(1-адамантил)пропан-2-амина, 45 г (0,45 моля) циклогексанола и 0,5 г (0,009 моля) "Ni-Ренея". Выход N-[2-(1-адамантил)-1-метилэтил]циклогексанамина 6,5 г (53% от теоретического). Чистота 96% (по данным ГЖХ). Ткип 220-223°С / 20 мм рт.ст. Мольное соотношение катализатор "Ni-Ренея":1-(1-адамантил)пропан-2-амина:циклогексанол: 0,21:1:10. Продолжительность процесса 16 часов.
4.4 Синтез N-[2-(1-адамантил)-1-метилэтил]циклогексанамина
Синтез проводят аналогично синтезу 1 за исключением использования 8,7 г (0,045 моля) 1-(1-адамантил)пропан-2-амина, 45 г (0,45 моля) циклогексанола и 1,4 г (0,0258 моля) "Ni-Ренея" продолжительности процесса 16 часов. Выход N-[2-(1-адамантил)-1-метилэтил]циклогексанамина 10,3 г (83% от теоретического). Чистота 94% (по данным ГЖХ). Ткип 220-223°С / 20 мм рт.ст.
Мольное соотношение катализатор "Ni-Ренея": 1-(1-адамантил)пропан-2-амина: циклогексанол: 0,60:1:10. Продолжительность процесса 16 часов.
4.5 Синтез N-[2-(1-адамантил)-1-метилэтил]циклогексанамина
Синтез проводят аналогично синтезу 1 за исключением использования 8,7 г (0,045 моля) 1-(1-адамантил)пропан-2-амина, 27 г (0,27 моля) циклогексанола и 1,4 г (0,0258 моля) "Ni-Ренея". Выход N-[2-(1-адамантил)-1-метилэтил]циклогексанамина 7,9 г (64% от теоретического). Чистота 94% (по данным ГЖХ). Ткип 220-223°С / 20 мм рт.ст.
Мольное соотношение катализатор "Ni-Ренея":1-(1-адамантил)пропан-2-амина:циклогексанол: 0,6:1:6.
Продолжительность процесса 16 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АМИНО)АЛКИЛАДАМАНТАНОВ | 2012 |
|
RU2495020C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-ГИДРОКСИ)АДАМАНТИЛАЛКИЛ(АРИЛ)КЕТОНОВ | 2009 |
|
RU2420511C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЛКИЛ(ДИАЛКИЛ)АМИНО)АДАМАНТИЛАЛКИЛ(АРИЛ)КЕТОНОВ | 2009 |
|
RU2408570C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ НИТРИЛОВ | 2003 |
|
RU2240310C1 |
| СПОСОБ ПОЛУЧЕНИЯ N,N-ДИАЛКИЛЗАМЕЩЕННЫХ АМИДОВ АДАМАНТИЛАЛКИЛКАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2348611C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-(1-АДАМАНТИЛ)-1,2-ДИАМИНОБЕНЗОЛА | 2011 |
|
RU2454401C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОАЛКИЛАМИНОВ | 2010 |
|
RU2425828C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АДАМАНТИЛСОДЕРЖАЩИХ АЛЬДЕГИДОВ | 2003 |
|
RU2240303C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(АДАМАНТ-1-ИЛ)ЭТИЛАМИНА И ЕГО ГОМОЛОГОВ | 1998 |
|
RU2152924C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИХЛОРАНГИДРИДОВ АДАМАНТИЛ-, АДАМАНТИЛАЛКИЛ- ИЛИ ГОМОАДАМАНТИЛФОСФОНОВЫХ КИСЛОТ | 1992 |
|
RU2057134C1 |
Изобретение относится к улучшенному способу получения N-(1-адамантилалкил)циклоалкиламинов общей формулы:
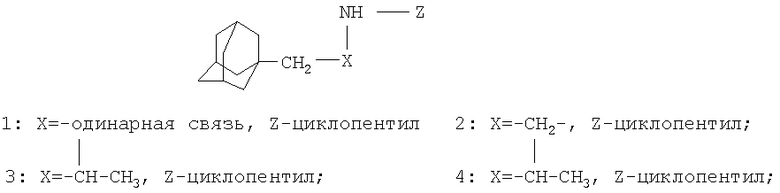
Способ заключается во взаимодействи b аминопроизводных адамантана с соответствующими циклическими спиртами (циклопентанолом и циклогексанолом) в присутствии катализатора "Ni-Ренея". Реакцию проводят в течение 8-16 часов, при мольном соотношении катализатор:адамантансодержащий амин:спирт: 0.21-0.6:1:6-14.8, что позволяет получать целевые продукты в одну стадию с высокой селективностью и выходами 53-91%.
Способ получения N-(1-адамантилалкил)циклоалкиламинов общей формулы
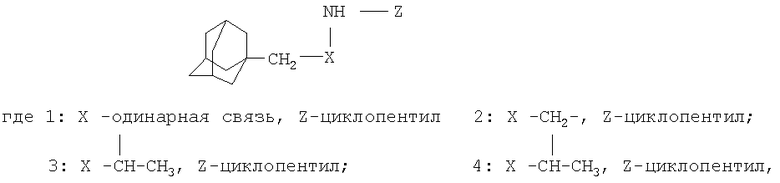
заключающийся в алкилировании адамантансодержащих аминов, выбранных из ряда 1-(1-адамантил)пропан-2-амин, 1-адамантилметиламин, [2-(1-адамантил)этил] амин, циклическими спиртами - циклопентанолом или циклогексанолом в присутствии катализатора "Ni-Ренея" в течение 8-16 ч при температуре кипения циклического спирта, при мольном соотношении катализатор: адамантансодержащий амин:циклический спирт 0,21-0,6:1:6-14,8 соответственно.
| ГРАВА И.Я | |||
| и др | |||
| Синтез и противовирусная активность производных ремантадина //Химико-фармацевтический журнал | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
| US 20030032623 A1, 13.02.2003 | |||
| PAUL E | |||
| ALDRICHET et al | |||
| "Antiviral agents | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
Авторы
Даты
2010-11-20—Публикация
2009-02-16—Подача