Изобретение относится к биотехнологии, генной инженерии и медицине и может быть использовано для создания лекарства и диагностического средства для HER2/neu-позитивных клеток рака молочной железы.
В последнее время особый интерес у исследователей вызывает разработка техники создания специфических антител к онкобелку HER2 (от Human Epidermal growth factor Receptor 2). Дело в том, что примерно у 30% больных раком молочной железы наблюдается наиболее опасная и устойчивая к терапевтическому воздействию форма, так называемая НЕР2-позитивная форма рака, приводящая к ускоренному метастазированию.
На фармацевтическом рынке имеется препарат герпептин (трастузумаб) (Hudziak et al., 1989 Mol Cel Biol 9, 1165-1175; Harries and Smith, 2002 Endocrine-Related Cancer 9 75-85) на основе моноклональных антител, представляющих собой имунноглобулин класса IgG и являющихся тетрамерами, состоящими из двух легких и двух тяжелых полипептидных цепей. Эти антитела специфически взаимодействуют с онкобелком HER2/neu и ингибируют пролиферацию раковых клеток SK-BR-3.
Упомянутые антитела производятся в культуре животных клеток-клеток опухоли яичника китайского хомячка. Технология получения этих антител сложна, стоимость их очень высока, и, кроме того, велика опасность контаминации белками животного происхождения и патогенными вирусами.
Задача изобретения - создание антитела указанного строения на основе растительного сырья, способного специфически взаимодействовать с онкобелком HER2/neu, ингибировать пролиферацию раковых клеток SK-BR-3 и пригодного для диагностики HER2-позитивного рака молочной железы. Решение этой задачи позволит значительно упростить технологию получения этого антитела и снизить его стоимость.
Поставленная задача решается тем, что антитело получают из листьев растения Nicotiana benthamiana путем транзиторной трансфекции экспрессионными векторами, причем это антитело выделяют как в гликозилированной, так и в негликозилированой форме.
Способ продукции антитела, специфически связывающего онкобелок HER2/neu, включает в себя введение в листья N. benthamiana векторов, обеспечивающих синтез тяжелой, легкой цепи антитела, культивирование растения в условиях, обеспечивающих совместную экспрессию в клетке указанных векторов, и последующее выделение и очистку антитела.
Тестирование антитела из растительного материала к онкогену HER2/neu проводят с помощью антител, специфических к легкой и тяжелой цепям антитела человека. Очистку антител осуществляют на оборудовании "AKTApurifier" (GE Healthcare), а последующий капиллярный электрофорез позволяет выявить как гликозилированные, так и негликозилированные формы белка.
Краткое описание чертежей, иллюстрирующих предлагаемое изобретение:
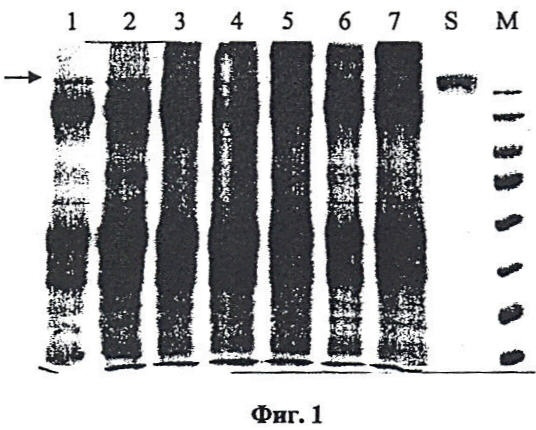
Фиг.1. Накопление антитела, полученного из листьев N. benthamiana.
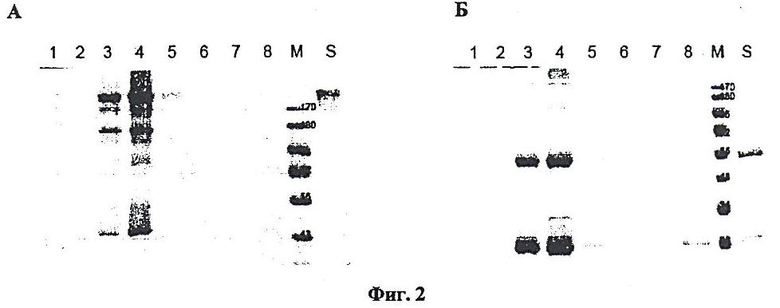
Фиг.2. Очистка антитела, полученного из листьев N. benthamiana.
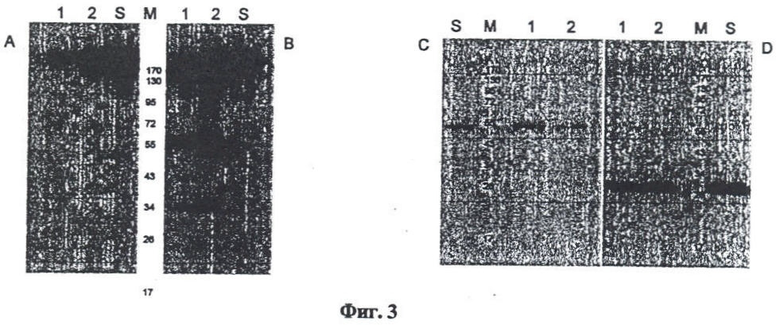
Фиг.3. Тестирование антитела, полученного из листьев N. benthamiana. Тест проводили с помощью коммерческих антител, специфических к легкой и тяжелой цепи антитела человека.
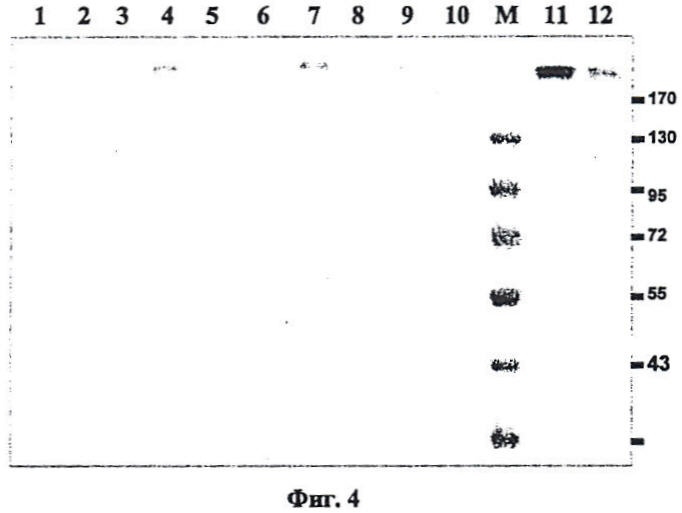
Фиг.4. Очистка на оборудовании "AKTApurifier" (GE Healthcare) антитела, полученного из листьев N. benthamiana.
Дорожки 1-10, очистка на колонке HiTrap Protein A HP; 11, очистка на мембране "Sartobind Q nano"; 12, элюция с Sartobind 1M NaCl.
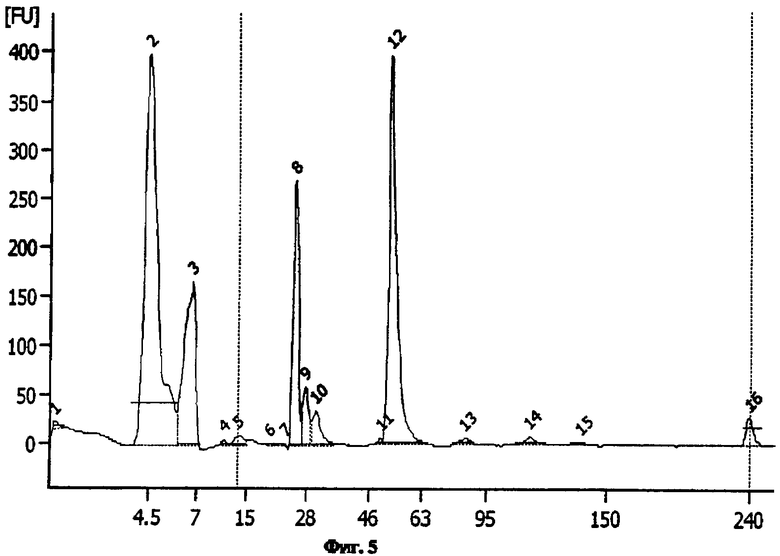
Фиг.5. Анализ при помощи капиллярного электрофореза в восстанавливающих условиях (в присутствии P-меркаптоэтанола) антитела, полученного из листьев N. benthamiana.
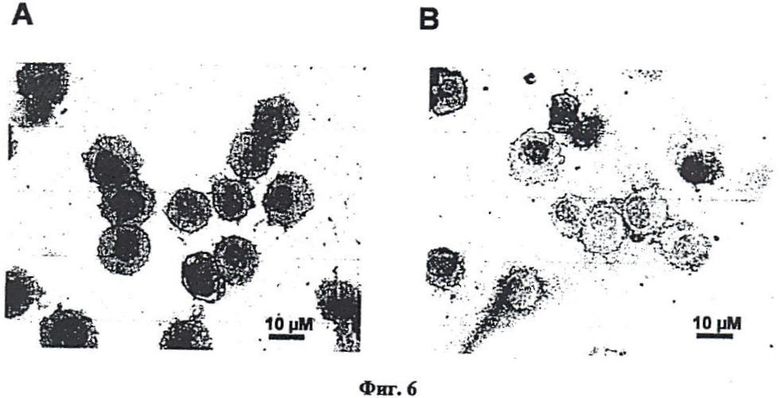
Фиг.6. Цитологический анализ клеток SK-BR-3, содержащих на своей поверхности.
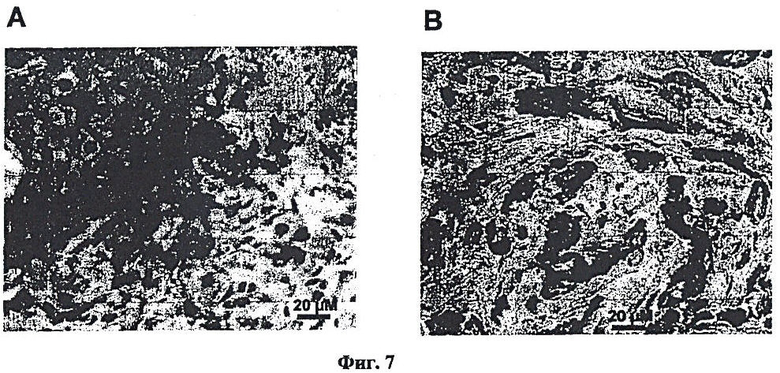
Фиг.7. Иммуногистохимическое окрашивание образцов ткани пациента с Her2/neu-позитивным раком молочной железы. A - антитела "Dako" (A0485), B - антитело, выделенное из листьев N. benthamiana.
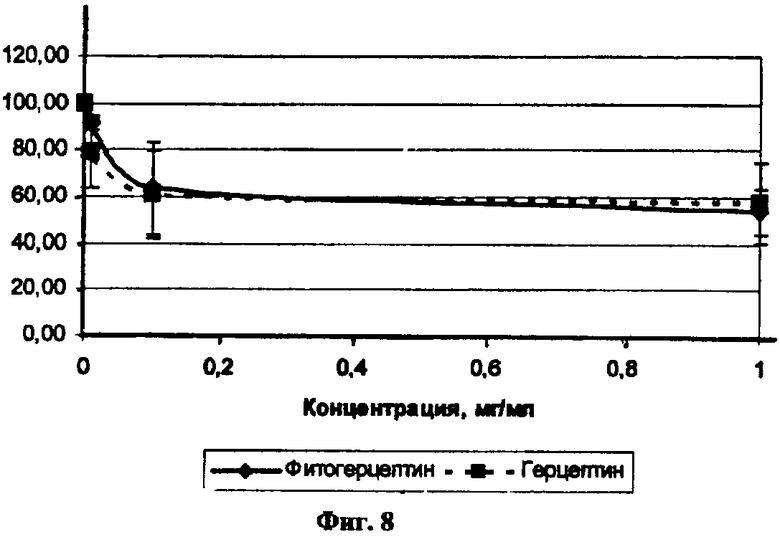
Фиг.8. Сравнение антипролиферативного действия Герцептина и антитела, выделенного из листьев N. benthamiana (фитогерпептин) в концентрациях 1-0,01 мг/мл. Митогенный метод по Crystal Violet.
Следующие примеры иллюстрируют предлагаемое изобретение.
Пример 1. Продуцирование, выделение и очистка антитела из листьев N. benthamiana.
Отдельные гены легкой и тяжелой цепи антитела против онкогена HER2/neu были клонированы в субклон pFF19, содержащий 35S-промотор по сайтам NcoI и XhoI. На следующем этапе гены по отдельности клонировали в вектор Bin19 (Bevan, 1984. Nucleic Acids Res. 12, 8711-8721) по сайтам HindIII-EcoRI с получением векторов. Agrobacterium tumefaciens с бинарными векторами, экспрессирующими тяжелую или легкую цепь антитела против онкогена HER2/neu, засевали в жидкую среду 2-YT и выращивали ночь при температуре 28°C. Ночную культуру осаждали центрифугированием при 5 тыс. об/мин в течение 3 мин. Затем осадок ресуспендировали в буфере для агроинфильтрации, содержащем 10 мМ MgCl2 и 10 мм MES pH 5,0, и вводили в лист в соответствующем разведении. Фиг.1 показывает накопление легкой цепи (L-цепь) антитела против онкогена Her2/neu в листьях N. benthamiana через 3 дня после агроинъекции бинарными векторами. Показаны результаты ЭФ в неденатурирующих условиях в 8% полиакриламидном геле. Дорожки 1-6, собранное антитело; 7 - неинфипированный материал; S, контрольные антитела человека (hIgG) -1 мкг. M - маркеры.
При одновременной коинъекции векторов в листья N. benthamiana накапливаются легкая и тяжелая цепи антитела, которые можно выделить и очистить аффинной хроматографией на колонке с протеин G-сефарозой. Оценку чистоты препаратов антител мы проводили ЭФ в полиакриламидном геле в невосстанавливающих и восстанавливающих условиях, т.е. в условиях соответственно отсутствия и при добавлении к образцам восстанавливающих агентов. На Фиг.2 показаны результаты ЭФ в полиакриламидном геле в невосстанавливающих (А) и восстанавливающих (Б) условиях; гель окрашен Кумасси синим. Дорожки 1-7, белковые фракции после очистки на колонке с протеин-A-сефарозой; дорожка 8 -промывочная фракция. M - маркеры, S, контрольные антитела человека (hIgG) - 1 мкг. Об интактности белка свидетельствуют также данные по тестированию в вестерн-блоте моноклональных антител из растительного материала с помощью известных антител, в свою очередь, специфичных к легкой и тяжелой цепи иммуноглобулина G человека. На Фиг.3 показано тестирование антитела из N. benthamiana с помощью антител, специфических к легкой и тяжелой цепям антитела человека. В данном случае показаны результаты ЭФ в полиакриламидном геле в невосстанавливающих (A, B) и восстанавливающих (C, D) условиях. Вестерн-блоты тестировали антителами к гамма (тяжелой)-цепи (A, C) и каппа (легкой)-цепи (B, D). Дорожки 1,2 - фракции после очистки на колонке с протеин-A-сефарозой. M - маркеры. S, контрольные антитела человека (hIgG) - 1 мкг. На конечной стадии очистки проводили хроматографию белка на оборудовании "AKTApurifier" (фирмы GE Healthcare) при использовании колонок HiTrap Protein A HP (объем 1 мл) (Фиг.4, дорожки 1-10). Таким образом, удалось очистить до высокого уровня чистоты 6 мг моноклональных антител из 50 г N. benthamiana.
Эти результаты в сочетании с результатами, представленными на Фиг.4 и 5, показывают, во-первых, высокий уровень чистоты, и, во-вторых, присутствие как гликозилированных, так и негликозилированных форм белка.
Пример 2. Взаимодействие антитела из N. benthamiana с раковыми клетками SK-BR-3.
Для доказательства активности полученного в листьях N. benthamiana антитела использовали иммуноцитохимический (ИЦХ) тест, описанный в работе Глузман Д.Ф., Скляренко Л.М., Надгорная В.А., Крячок И.А. Диагностическая иммунопитохимия опухолей. Киев, Морион; 2003, с.28-31. Использовали полученное антитело в ИЦХ раковых клеток SKBR-3, имеющих на своей поверхности онкоген HER2/Neu. Из Фиг.6 видно, что антитело обладает способностью связывать внеклеточный домен онкогена HER2/Neu. Таким образом, антитело, полученное в N. benthamiana, является полностью функциональным и способно специфически узнавать и связываться с онкогеном HER2/Neu.
Пример 3. Сравнение способности коммерческих антител и антител, выделенных из N. benthamiana выявлять раковые клетки в гистологических препаратах пациентов.
Иммуногистохимический анализ проводили на срезах с парафиновых блоков опухолей, предназначенных для стандартного морфологического исследования. В качестве первичных антител использовали поликлональные антитела против HER2/neu рецептора A0485 [Dako].
Парафиновые срезы депарафинировали и регидратировали по стандартной методике. Для "демаскировки" антигенов проводили прогревание срезов на водяной бане в предварительно нагретом до 95-99°C нитратном буфере в течение 30 минут. Затем стекла охлаждали при комнатной температуре в течение 15-20 минут и переносили в фосфатный буфер на 5 минут. Для блокирования эндогенной пероксидазы срезы инкубировали 20 минут в темноте с 3% перекисью водорода, приготовленной на дистиллированной воде, а затем промывали 5 минут в фосфатном буфере. Для блокирования неспецифического связывания антител срезы инкубировали 15 минут с 1% раствором бычьего сывороточного альбумина. Инкубацию с первичными антителами проводили при 4°C в течение 16 часов. После первичных антител стекла промывали в фосфатном буфере. Инкубацию с проявочной тест-системой ENVISION+rabbit kit, DAKO проводили при комнатной температуре в течение 25 минут, и затем срезы промывали. Для визуализации иммуногистохимической реакции использовали DAB+систему DAKO. Срезы докрашивали гематоксилином Майера и заключали в канадский бальзам.
Оценку результатов окрашивания проводили с применением светового микроскопа «Leica» (Германия) под увеличением ×10, ×20, ×40. Для всех маркеров оценивали локализацию окрашивания в клетке (ядро, цитоплазма, мембрана). Количество положительных клеток оценивали в зонах, содержащих их максимальное количество. Для оценки экспрессии HER2 использовали критерии: 0 - отсутствие окрашивания; 1+ - слабое окрашивание мембраны опухолевых клеток; 2+ - средняя интенсивность окрашивания более 10% опухолевых клеток; 3+ - сильная степень окрашивания более 10% опухолевых клеток. Опухоль, оцениваемую как 0 или 1+, считали отрицательной, а как 2+ или 3+ - положительной по HER2/neu.
Результаты, приведенные на Фиг.7, показывают эффективность использования антитела из N. benthamiana для диагностики HER-2-позитивного рака груди. Полученные результаты свидетельствуют о том, что антитело из N. benthamiana не отличается от поликлональных коммерческих антител A0485 [«Dako», Дания] в своей способности выявлять раковые клетки в гистологических препаратах пациентов.
Таким образом антитело из N. benthamiana не отличается от коммерческих антител A0485 [«Dako», Дания] в своей способности выявлять раковые клетки в гистологических препаратах пациентов.
Пример 4. Сравнение способности коммерческих антител и антител, выделенных из N. benthamiana, ингибировать пролиферацию опухолевых клеток SK-BR-3.
Исследование проводилось на клеточной линии рака молочной железы с гиперэкспрессией HER2/neu SK-BR-3. Клетки SK-BR-3 высаживались в низкой плотности (30 т клеток/мл) в триплетах на 48-луночный планшет в среде, содержащей 10% сыворотки FCS. На следующий день среда заменялась на среду с низким содержанием сыворотки (1%), добавлялись различные концентрации тестируемых препаратов. Среда, антибиотики и препараты менялись раз в 3-4 дня. Рост клеток определялся модифицированным «митогенным методом по Crystal Violet». Клетки промывались PBS и фиксировались 1% параформальдегидом на PBS и окрашивались 0,5% раствором Crystal Violet (Sigma Chemical Co) на этаноле. Краситель растворяли в этаноле и измеряли на спектрофотометре при 540-560 им.
Было проанализировано антипролиферативное действие антитела из N. benthamiana в сравнении с Герпептином. Результаты представлены на Фиг.8. Не обнаружено статистически значимых различий в количестве клеток при добавлении Герцептина и антитела из N. benthamiana. При концентрации препаратов 1 мг/мл ингибирование пролиферации составляет 45,97%±10,09 для антитела из N. benthamiana и 41,93%±17,25 для Герцептина, для концентраций 100 нг/мл ингибирование пролиферации составляет 36,6%±19,63 для антитела из N. benthamiana и 39,27%±18,96 для Герцептина и для концентрации 10 нг/мл - 8,45%±3,29 для антитела из N. benthamiana и 21,35%±14,81 для Герцептина. Таким образом, антитело з N. benthamiana блокирует пролиферацию клеточной линии рака молочной железы с гиперэкспрессией HER2/neu в концентрациях, сравнимых с концентрацией Герцептина. Таким образом, антитело, выделенное из листьев растения Nicotiana benthamian, получено с высокой степенью чистоты, включает как гликозилированную, так и негликозилированную форму, взаимодействует с раковыми клетками, способно выявлять раковые клетки SK-BR-3, а также обеспечивать ингибирование их пролиферации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СУПЕРПРОДУКЦИИ В РАСТЕНИИ АНТИТЕЛ ПРОТИВ ОНКОГЕНА HER2/neu | 2007 |
|
RU2370280C2 |
| Способ получения антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, в растении, антитело, полученное этим способом, и его применение | 2016 |
|
RU2648161C2 |
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| Мутантное полностью гуманизированное антитело против HER2 и кодирующий ген и их применение | 2015 |
|
RU2639531C1 |
| Антитело МАТ40, которое связывается с доменом I экстраклеточной части рецептора эпидермального фактора роста HER2/CD340, и его применение для лечения рака | 2015 |
|
RU2640259C2 |
| НАЦЕЛЕННЫЕ/ИММУНОМОДУЛИРУЮЩИЕ СЛИТЫЕ БЕЛКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2636342C2 |
| ИДЕНТИФИКАЦИЯ ПАЦИЕНТОВ, НУЖДАЮЩИХСЯ В СОВМЕСТНОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ИНГИБИТОРА PD-L1 | 2013 |
|
RU2692773C2 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ ОПУХОЛЕЙ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ АНТИТЕЛАМИ ПРОТИВ ErbB2 | 2003 |
|
RU2338751C2 |
| МОДИФИЦИРОВАННЫЕ АНТИТЕЛА, С КОТОРЫМИ СВЯЗАН МОТИВ, ВКЛЮЧАЮЩИЙ ОСТАТОК ЦИСТЕИНА, КОНЪЮГАТЫ ЭТИХ МОДИФИЦИРОВАННЫХ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2582259C2 |
| Способ диагностики рака молочной железы с экспрессией рецептора Her2/neu на мембране опухолевых клеток | 2018 |
|
RU2701356C1 |
Антитело по изобретениию получено из листьев растения Nicotiana benthamiana путем транзиторной трансфекции экспрессионных векторов. Это антитело представляет собой иммуноглобулин класса IgG и является тетрамером, состоящим из двух легких и двух тяжелых пептидных цепей и их более крупных супрамолекулярных ансамблей. Антитело выделяют как в гликозилированной, так и в негликозилированной форме. Антитело способно избирательно связывать онкобелок HER2/neu, ингибировать пролиферацию раковых клеток. С помощью антитела по изобретению можно диагносцировать НЕR2-позитивный рак молочной железы. Изобретение может быть использовано для создания лекарств и диагностического средства для рака молочной железы. 8 ил.
Антитело, полученное из листьев растения Nicotiana benthamiana путем транзиторной трансфекции экспрессионными векторами, представляющее собой иммуноглобулин класса IgG, состоящее из легких и тяжелых пептидных цепей, специфически взаимодействующее с HER2/neu, отличающееся тем, что оно является тетрамером, состоящим из двух легких и двух тяжелых пептидных цепей и их более крупных супрамолекулярных ансамблей, и выделенное как в гликозилированной, так и в негликозилированной форме.
| СПОСОБ СУПЕРПРОДУКЦИИ В РАСТЕНИИ АНТИТЕЛ ПРОТИВ ОНКОГЕНА HER2/neu | 2007 |
|
RU2370280C2 |
| КОМПОЗИЦИЯ АНТИТЕЛ К HER2 | 2005 |
|
RU2361880C2 |
| US 5772997, 30.07.1998 | |||
| MICHAEL M.WOLL et al | |||
| J | |||
| of Clinical Immunology, v.24, July 2004, p.p.449-461. | |||
Авторы
Даты
2011-08-10—Публикация
2010-04-09—Подача