Более чем три десятилетия прошло с тех пор, как Gold и Freedman впервые описали опухолевый карциномоэмбриональный антиген (CEA) в экстрактах ткани при раке толстого кишечника человека (Gold and Freedman; J. Exp. Med. 122 (1965); 467-481).
При этом обнаружили 28 других генов/псевдогенов, относящихся к семейству генов CEA. В попытке упростить номенклатуру, используемую для членов семейства генов CEA, семейство недавно переименовали в «родственные CEA молекулы клеточной адгезии» (CEACAM), и номенклатуру для его членов унифицировали (Beauchemin, Exp. Cell Res. 252 (1999), 243-249). Например, согласно этой номенклатуре CEA человека (CD66e) назван CEACAM5.
Семейство генов CEA человека кластеризовано на хромосоме 19q13.2 (Olsen et al. Genomics 23 (1994); 659-668). Его 29 генов и псевдогенов можно разделить на три подгруппы, т.е. подгруппу CEA, содержащую семь экспрессирующихся генов, подгруппу специфичного для беременности гликопротеина (PSG), содержащую одиннадцать экспрессирующихся генов, и третью подгруппу, содержащую только псевдогены (Hammarström, Sem. Cancer Biol. 9 (1999), 67-81; Beauchemin, Exp. Cell Res. 252 (1999), 243-249). Анализ аминокислотных последовательностей CEA и других членов семейства выявил, что они принадлежат к суперсемейству иммуноглобулинов (Ig) (Williams and Barclay, Annul. Rev. Immunol. 6 (1988), 381-405). Все члены подгруппы CEA присоединены к поверхностной мембране клетки: биллиарный гликопротеин (CEACAM1; BGP1; TM-CEA; CD66a), член семейства генов CEA 1 (CEACAM3; CGM1; CD66d) и член семейства генов CEA 7 (CEACAM4; CGM7) обладают гидрофобными трансмембранными доменами, тогда как карциномоэмбриональный антиген (родственная карциномоэмбриональному антигену молекула клеточной адгезии 5; CEACAM5; CEA; CD66e), неспецифический перекрестно-реагирующий антиген (CEACAM6; NCA; NCA-50/90; CD66c), член семейства генов CEA 2 (CEACAM7; CGM2) и член семейства генов CEA 6 (CEACAM8; CGM6; CD66b) связаны с плазматической мембраной посредством липидных групп гликозилфосфатидилинозитола (GPI). Белки CEA являются высоко гликозилированными с молекулярной массой вплоть до приблизительно 300 кДа, в зависимости от числа доменов Ig.
Что касается биологической активности белков CEA, исследования in vitro линий клеток опухоли позволили предположить, что несколько подсемейств CEA, включая биллиарный гликопротеин, CEA и неспецифический перекрестно-реагирующий антиген, могут действовать как гомофильные и гетеротипические молекулы клеточной адгезии при экспрессии на поверхности опухолевой клетки (Oikawa et al., Biochem. Biophys. Res. Commun. 186 (1992), 881-887; Zhou et al., Cancer Res. 53 (1993), 3817-3822). Более недавно обсуждали возможную роль CEA и неспецифического перекрестно-реагирующего антигена во врожденной иммунной защите, защищающей толстую кишку от микробного заражения (Hammarström and Baranov, Trends Microbiol. 9 (2001), p. 119-125). В частности, предположили, что эти белки связывают и удерживают микроорганизмы, предупреждая достижение ими эпителиальных клеток микроворсинок и проникновение в них.
Выдвинули гипотезу, что CEA представляет собой онкофетальный антиген, экспрессирующийся в течение эмбрионального периода, отсутствующий у здорового взрослого и реэкспрессирующийся при раке. Однако CEA экспрессируется также в нормальной ткани взрослых. Например, биллиарный гликопротеин, CEA, неспецифический перекрестно-реагирующий антиген и член семейства генов CEA 2 экспрессируются в нормальной толстой кишке человека, в частности, в зрелых столбчатых эпителиальных клетках, обращенных в просвет кишки, и в высоко дифференцированных клетках в устье крипт (Fröngsmyr et al., Cancer Res. 55 (1995), 2963-2967; Frängsmyr et al., Tumor Biol. 20 (1999), 277-292). Более конкретно, эти белки локализованы на гликокаликсе щеточной каймы зрелых колоноцитов, выстилающих свободную поверхность просвета. Биллиарный гликопротеин, CEA и неспецифический перекрестно-реагирующий антиген экспрессируются также в ряде опухолей эпителиального происхождения (Hammarström, Sem. Cancer Biol. 9 (1999), 67-81; Shively and Beatty CRC Crit. Rev. Oncol. Hematol. 2 (1985), 355-399).
Уже в поздние 1970 и ранние 1980 CEA стал преимущественным антигеном-мишенью для радиоиммунолокализации колоректальных и других эпителиальных опухолей. Это обусловлено фактом, что CEA сверхэкспрессирован в 95% гастроинтестинальных опухолей и опухолей поджелудочной железы, так же как в большинстве мелкоклеточных и немелкоклеточных карцином легкого. Он экспрессирован также в карциноме молочной железы и плоскоклеточной карциноме головы и шеи (Primus et al., Cancer 42 (1978), 1540-1545). Фактически CEA является одним из наиболее широко используемых клинических маркеров опухоли. Его используют как сывороточный опухолевый маркер для колоректального и некоторых других видов рака из-за его стабильности, его достаточно рестрицированной экспрессии в нормальной ткани взрослых и его высокой экспрессии в опухолях эпителиального происхождения. Основная часть CEA у здорового индивидуума продуцируется в толстой кишке. Там он высвобождается с апикальной поверхности зрелых столбчатых клеток в просвет кишки и исчезает с фекалиями. Таким образом, в норме можно наблюдать только очень низкие уровни в крови здоровых индивидуумов. Например, уровни CEA в крови здоровых индивидуумов составляют менее чем 2 мкг/л. В отличие от этого, уровни CEA в сыворотке пациентов с колоректальными и другими карциномами увеличены, находясь в диапазоне вплоть до более чем 2000 мкг/л (Thomson et al., PNAS 64 (1969), 161-167). В частности, прогрессирующие, злокачественные или находящиеся на поздних стадиях эпителиальные опухоли часто сопровождаются высокими концентрациями в сыворотке растворимого CEA (Fletcher; Ann. Intern. Med. 104 (1986), 66-73). Известно, что компоненты плазматической мембраны, включая CEA, непрерывно отслаиваются от поверхности в виде полученных из мембраны везикул (Taylor and Black, J. Natl. Cancer Inst. 74 (1985), 859-866; Sack et al., J Clin Invest. 82 (1988), 586-93), которые в результате дренирования лимфатических и кровеносных сосудов могут оказаться в крови. С увеличением размера опухоли больше CEA будет накапливаться в крови. Основным применением определений CEA в сыворотке в качестве опухолевого маркера является послеоперационное наблюдение рака толстого кишечника. Увеличенные уровни CEA являлись первым показателем рецидивирующего заболевания у 81% (Minton et al., Cancer 55 (1985), 1284-1290) и 89% (Wanebo et al., Surg. Gynecol. Obstet. 169 (1989), 479-487) пациентов, соответственно. Уровни CEA в сыворотке можно также использовать как прогностический показатель (Mulcahy and Benson, Curr. Oncol. Rep. 1 (1999), 168-172).
Из-за его сверхэкспрессии при многих видах эпителиального рака CEA используют не только как опухолевый маркер, но также как мишень для противоопухолевой терапии. Например, гастроинтестинальные виды рака отвечают за большую часть эпителиальных опухолей человека, предположительно с 21700 новых случаев рака желудка и 135400 новых случаев колоректального рака в Соединенных Штатах в 2001 году (Greenlee; CA Cancer J Clin 51 (2001), 15-36). Колоректальный рак является третьим из наиболее распространенных злокачественных опухолей и третьей из лидирующих причин смерти от рака как у мужчин, так и у женщин (Ries; Cancer 88 (2000), 2398-2424). В попытке найти новые лекарственные средства против этих опухолей, моноклональные антитела против CEA исследовали в качестве возможных лекарственных средств для CEA-положительных видов рака (Murakami et al., Immunol. Invest. 25 (1996), 23-35).
Одним примером способа, при котором пациентов с низкой опухолевой нагрузкой (соответствующей низким уровням CEA в сыворотке) успешно лечили, является исследование, проведенное Behr et al. По этому способу меченный 131I вариант лабетузумаба (лабетузумаб представляет собой гуманизированную форму моноклонального антитела против CEA MN-14; Behr et al., Cancer, 94: 1373-1381, (2002), 1559-64) анализировали в фазе II испытания, в котором зарегестрировали 30 пациентов с CRC с небольшим объемом метастазирующего заболевания, устойчивого к химиотерапии 5-фторурацилом и фолиновой кислотой, или при адъювантной терапии после метастазирования в печень. Вводили однократную инъекцию меченного 131I лабетузумаба. Из 19 оцениваемых пациентов 3 обладали частичными ремиссиями и для восьми наблюдали незначительные ответы продолжительностью вплоть до 15 месяцев. При адъювантной терапии у 7 из 9 пациентов заболевание не рецидивировало до 3 лет, тогда как частота рецидивов в контрольной группе составляла 67% в тот же период времени. Уровни CEA в сыворотке пациентов лежали в диапазоне 3,9-45 нг/мл (Behr et al., Cancer, 94: 1373-1381, 2002). В другом исследовании, характеризующемся пациентами с низкими уровнями CEA в сыворотке (<5нг/мл), показали, что радиоиммунотерапия CEA 131I-лабетузумабом (в приводившейся выше цитате) улучшала выживаемость после резекции по жизненным показаниям метастазов колоректального рака в печени. 23 пациентам вводили дозу 40-60 мКи/м2 131I-лабетузумаба. Пятилетняя выживаемость составляла 51,3% для обработанной и 7,4% для контрольной группы, соответственно (Liersch et al., JCO, 2005, ASCO Proc, Vol. 23, No 16S: 3627).
Тем не менее, терапевтические способы, применяемые при высоких концентрациях CEA в сыворотке, часто приводят к низким противоопухолевым ответам или отсутствию противоопухолевых ответов. Например, в клиническом исследовании, проводимом для оценки гуманизированного моноклонального антитела против CEA в клинике, CDR-привитый вариант MN-14 (hMN-14; Sharkey, Cancer Res. 55 (23 Suppl) (1995) 5935s-5945s.) метили 131I. 19 пациентам с запущенными CEA-продуцирующими опухолями вводили меченное 131I hMN-14. Биораспределение, нацеливание на опухоли и фармакокинетическое поведение hMN-14 являлись сходными с наблюдаемыми для мышиного MN-14. Однако у пациентов с повышенным уровнем CEA (> 200 нг/мл) в плазме более чем 30% меченого антитела связывались в течение 1 час после инъекции. У некоторых из этих пациентов увеличенное связывание приводило к увеличенному метаболизму антитела с более быстрым клиренсом из крови, чем наблюдали у пациентов с более низким уровнем CEA в плазме (Sharkey, в приводившейся выше цитате). В другом испытании фазы I, проводимом Yu et al., меченое 131I высокоаффинное мышиное моноклональные антитело (mAb) против CEA, COL-1 (Muraro, Cancer Res. 45 (1985), 5769-80) исследовали для пациентов с гастроинтестинальными злокачественными опухолями. В частности, анализировали влияние уровня CEA в сыворотке и объема опухоли на фармакокинетику. С этой целью 18 пациентам с запущенными гастроинтестинальными злокачественными опухолями вводили 20 мг COL-1, меченного 131I, в дозах от 10 мКи/м2 до 75 мКи/м2. Уровень CEA в сыворотке лежал в диапазоне от 6 до 2739 нг/мл (среднее +/- SD, 500 +/- 639). Положительными являлись 82% пораженных опухолями органов и 58% всех очагов. Однако опять наблюдали, что повышенный уровень CEA в сыворотке (> 500 нг/мл) и объем опухоли напрямую коррелируют с клиренсом радиоактивности в сыворотке. Авторы заключили, что у пациентов с сильно увеличенными уровнями циркулирующего CEA в сыворотке и/или увеличенным объемом опухоли клиренс меченного 131I COL-1 из кровотока происходит более быстро (Yu et al., J. Cli. Oncol. 14 (1996), 1798-1809). Сходные результаты получили в исследовании Hajjar et al. с использованием меченного иодом-131 гуманизированного моноклонального антитела против CEA MN-14 для пациентов с метастазирующим гастроинтестинальным и колоректальным раком. В фазе I этого испытания 21 пациента либо после предварительного внешнего направленного облучения, либо после стандартной химиотерапии лечили антителом. 7 из 21 пациентов обладали человеческими антителами против антител человека (HAHA), однако без неблагоприятных эффектов. Не наблюдали противоопухолевых ответов. Снова обнаружили, что увеличенные уровни CEA в плазме увеличивают клиренс антитела из крови и целого организма (Hajjar et al., Clin Colorectal Cancer, 2 (2002), 31-42), что, по меньшей мере частично, может предоставлять объяснение отсутствия противоопухолевого ответа, наблюдаемого в этом исследовании. Феномен быстрого клиренса терапевтического антитела из крови и организма можно объяснить увеличенным формированием иммунных комплексов, которые необходимо быстро удалить из организма, чтобы предотвратить повреждение органа. Невозможно было обнаружить терапевтический эффект у пациентов с опухолями, зарегистрированных в этих исследованиях, наиболее вероятно, из-за быстрого клиренса моноклональных антител.
Чтобы обойти проблемы, вызванные формированием иммунных комплексов и быстрым клиренсом терапевтических моноклональных антител, которые, наиболее вероятно, обусловлены Fc-частью антител, распознаваемых Fc-рецепторами иммунных клеток, получили и анализировали в клинике производные антител (например, конструкции scFv) или фрагменты антител (например, Fab и Fab2 фрагменты) без Fc-части. Большинство этих исследований направлены на получение изображения и детекцию/локализацию опухоли (см., например, Chester et al., Cancer Chemother Pharmacol, 46 (2000) Suppl: S8-12; Mayer et al., Clin Cancer Res, 6: (2000) 1711-1719; Begent et al., Nat Med, 2 (1996): 979-984). Только в немногих исследованиях исследовали терапевтическую эффективность таких производных/фрагментов антитела в клинике. Например, для клинического способа Francis et al. (Francis, Br. J. Cancer 87(6) (2002), 600-607) исследовали противоопухолевую активность конструкции scFv-карбоксипептидаза. В фазе I этого испытания направляемую антителом терапию с использованием фермента и пролекарственного соединения (ADEPT) использовали для пациентов с запущенной колоректальной карциномой или другими продуцирующими CEA опухолями. С этой целью использовали A5CP, состоящий из F(ab)2-фрагмента моноклонального антитела против CEA (A5B7), связанного с бактериальным ферментом карбоксипептидазой (CPG2) в качестве направляемого средства антитело-фермент и ZD2767P, пролекарство бис-иодфенол-иприт. В результате в исследовании не наблюдали клинических или радиологических ответов. Уровни CEA в сыворотке до лечения составляли вплоть до 1000 нг/мл. Эти высокие концентрации CEA в сыворотке пациентов с опухолями после лечения могут, по меньшей мере частично, отвечать за отсутствие противоопухолевого ответа, наблюдаемое в этом исследовании.
Принимая во внимание указанные выше проблемы, предоставление средств и способов для эффективной терапии для прогрессирующих, злокачественных или находящихся на поздней стадии эпителиальных опухолей является очень желательным.
Соответственно, один аспект изобретения относится к фармацевтической композиции, где указанная фармацевтическая композиция содержит биспецифическое одноцепочечное антитело, обладающее
(a) первым связывающим доменом, специфически связывающим CD3 человека, и
(b) вторым связывающим доменом, специфически связывающим CEA человека,
где указанный второй связывающий домен содержит по меньшей мере аминокислотную последовательность «DX1X2X3X4FYFDY» (SEQ ID NO:65), где «X1», «X2», «X3» или «X4» представляет собой любой аминокислотный остаток, и аминокислотный остаток «D» соответствует положению 95 по Kabat CDR-H3 моноклонального антитела мыши A5B7, и аминокислотные остатки «FYFDY» соответствуют положениям по Kabat 100, 100a, 100b, 101 и 102, соответственно, CDR-H3 моноклонального антитела мыши A5B7. В одном варианте осуществления «X1» представляет собой «R» (аргинин), «F» (фенилаланин), «M» (метионин), «E» (глутаминовую кислоту) или «T» (треонин); «X2» представляет собой «G» (глицин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту) или «S» (серин); «X3» представляет собой «L» (лейцин), «F» (фенилаланин), «M» (метионин), «E» (глутаминовую кислоту) или «T» (треонин); и «X4» представляет собой «R» (аргинин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту) или «S» (серин).
В одном варианте осуществления фармацевтической композиции по изобретению указанный второй связывающий домен, специфический для CEA человека, из биспецифического одноцепочечного антитела, определенного здесь, содержит по меньшей мере аминокислотную последовательность «DRGLRFYFDY» (SEQ ID NO:66), соответствующую положениям 95-102 по Kabat CDR-H3 моноклонального антитела мыши A5B7.
Настоящее изобретение относится к средствам и способам, в частности, подходящим для лечения пациентов с эпителиальной опухолью с высокими концентрациями растворимого CEA в плазме. Такие высокие концентрации растворимого CEA обнаружены в сыворотке/плазме пациентов с эпителиальной опухолью с прогрессирующими опухолями, рецидивирующими, метастазирующими опухолями, опухолями на поздних стадиях и для пациентов с большим объемом/массой опухоли. Обнаружено, что биспецифические одноцепочечные антитела со связывающим CEA доменом, содержащим аминокислотную последовательность «DRGLRFYFDY» (SEQ ID NO:66), связываются не только с CEA-положительными клетками-мишенями, но также с растворимым CEA; см. пример 3 и фигуру 2 настоящего изобретения; и EP B1 491031. Указанная аминокислотная последовательность «DRGLRFYFDY» соответствует положениям по Kabat 95-102 (SEQ ID NO:66) CDR-H3 моноклонального антитела мыши A5B7 (Harwood, Br J Cancer. 54 (1986), 75-82). Неожиданно, несмотря на связывание с растворимым CEA, указанные биспецифические одноцепочечные антитела убивают несущие CEA опухолевые клетки, даже в присутствии высоких концентраций растворимого CEA (тестировали вплоть до 1 мкг/мл растворимого CEA). Иными словами, растворимый CEA не ингибирует цитотоксическую активность указанных биспецифических конструкций против CEA-положительных опухолевых клеток.
Как показано в следующих ниже примерах 5 и 8 (в сочетании с фигурами 5, 6, 8, 10, 19, 20, 22 и 27), биспецифические одноцепочечные антитела со связывающим CEA доменом, содержащим аминокислотную последовательность «DRGLRFYFDY», опосредуют цитотоксичность против CEA-положительных опухолевых клеток в присутствии даже высоких концентраций растворимого CEA. Например, на фигуре 10 показан анализ цитотоксичности CEA-реактивных биспецифических одноцепочечных конструкций, перенаправляемых на клетки Kato III (линия CEA-положительных клеток карциномы желудка человека) в присутствии увеличивающихся количеств растворимого антигена CEA. Стимулированные CD8-положительные цитотоксические T-клетки человека (CTL) использовали в качестве эффекторных клеток. Цитотоксичность, опосредуемая CEAI VHVLxSEQ ID NO.77 VHVL, является устойчивой к растворимому CEA. В отличие от этого, опосредованную CEAII VHVLxSEQ ID NO.77 VHVL цитотоксическую активность ингибируют увеличивающиеся количества растворимого CEA. CEAI представляет собой вариабельную область, полученную из mAb мыши A5B7, в то время как CEAII VHVL получена из mAb T84.66.
Важно, что обнаружили, что аминокислотная последовательность «DRGLRFYFDY» является существенной, чтобы опосредовать устойчивость к растворимому CEA, при использовании в связывающем CEA домене человека (т.е. человеческом связывающем домене, специфически связывающемся с CEA человека) из биспецифических одноцепочечных антител анти-CEA x анти-CD3; см., например, фигуры 19, 20, 22 и 27. В дальнейшем биспецифические одноцепочечные антитела, как определено здесь, таким образом, обозначают как устойчивые к растворимому антигену CEA. Термин «устойчивый к растворимому антигену CEA», «устойчивый к растворимому CEA» или родственные термины, как применяют здесь, относятся к факту, что на цитотоксичность против CEA-положительной мишени или опухолевых клеток, опосредованную указанными биспецифическими одноцепочечными антителами, не влияют увеличивающиеся концентрации растворимого CEA. В частности, цитотоксическую активность не ингибируют даже высокие концентрации растворимого CEA (тестировали вплоть до 1 мкг/мл). Как указано выше, уровни CEA в крови здоровых индивидуумов составляют менее чем 2 нг/мл. Высокие концентрации растворимого CEA в сыворотке/плазме пациентов с опухолью являются характерными для прогрессирующих, рецидивирующих, метастатических опухолей или опухолей на поздней стадии и для пациентов с высокой опухолевой нагрузкой. Таким образом, настоящее изобретение относится к средствам и способам, в частности, подходящим для лечения пациентов с эпителиальной опухолью с такими высокими концентрациями растворимого CEA в плазме. Термин «высокие концентрации растворимого CEA», как применяют здесь, обозначает концентрацию растворимого CEA в сыворотке/плазме выше, чем 10, 20, 50, 70, 80, 90 или 100 нг/мл. Эту концентрацию CEA в сыворотке/плазме можно определить, среди прочего, посредством ELISA. Предпочтительно, указанная концентрация растворимого CEA в сыворотке/плазме превышает 100 нг/мл, как определено, например, посредством ELISA.
Получение указанных биспецифических одноцепочечных антител с устойчивостью к растворимому антигену CEA не являлось тривиальной задачей, как очевидно из нижеследующих примеров. Например, биспецифические одноцепочечные антитела со связывающим CEA доменом, полученным из моноклонального антитела (mAb), известного как связывающееся со связанным с мембраной CEA, но не с растворимым CEA, т.е. mAb PR1A3 (Durbin, Proc Natl Acad Sci USA, 91 (1994), 4313-7), не смогли получить: При использовании в формате биспецифического одноцепочечного антитела нельзя было достичь экспрессии/секреции биспецифической одноцепочечной конструкции анти-CD3 x анти-CEA. При использовании для получения гуманизированного варианта PR1A3 (Durbin, в приводившейся выше цитате) конструкция биспецифического одноцепочечного антитела экспрессировалась и секретировалась из клетки-хозяина. Однако не смогли получить связывания связывающего домена анти-CEA со связанным с мембраной CEA.
Когда получили биспецифические одноцепочечные антитела, полученные из хорошо описанных моноклональных антител T84.66 (Neumaier, M. et al., Cancer Res 50 (1990), 2128-34) или MFE-23 (Boehm, M. K. Biochem J 2 (2000), 519-28), эти биспецифические антитела являлись высокочувствительными к растворимому антигену CEA, т.е. их цитотоксическая активность против CEA-положительной мишени или опухолевых клеток являлась блокированной в присутствии растворимого антигена CEA. Поскольку обнаружили, что указанные конструкции связываются с растворимым CEA, заключили, что растворимый антиген CEA предупреждает связывание антитела со связанным с мембраной CEA, таким образом, блокируя опосредованную антителом цитотоксическую активность. Например, на фигуре 7 показан анализ цитотоксичности CEA-реактивной биспецифической одноцепочечной конструкции, перенаправленной на клетки CHO, трансфицированные CEA, в присутствии растворимого CEA человека. Стимулированные CD8-положительные цитотоксические T-клетки (CTL) человека использовали в качестве эффекторных клеток. Цитотоксическую активность CEAII VHVLxSEQ ID NO.77 VHVL явно ингибируют увеличивающиеся количества растворимого CEA. CEAII VHVL получен из mAb T84.66; SEQ ID NO.77 представляет собой домен анти-CD3 VH-VL.
Устойчивость к растворимому антигену CEA можно обнаружить только для биспецифических одноцепочечных антител, связывающий CEA домен которых содержит аминокислотную последовательность «DRGLRFYFDY» CDR-H3 моноклонального антитела мыши A5B7 (Harwood, Br J Cancer. 54 (1986), 75-82). Как и для полученных из MFE-23 и T84.66 биспецифических одноцепочечных конструкций, полученные из A5B7 биспецифические одноцепочечные антитела связываются с растворимым CEA. В свете результатов, полученных для полученных из MFE-23 и T84.66 биспецифических одноцепочечных конструкций, нельзя ожидать, что растворимый CEA не влияет на цитотоксическую активность полученных из A5B7 конструкций одноцепочечного биспецифического антитела.
Как указано выше, многим терапевтическим способам, направленным против несущих CEA эпителиальных опухолей у человека, серьезно препятствует присутствие высоких уровней растворимого антигена CEA в плазме пациентов с раком. Например, увеличение формирования иммунных комплексов и клиренса терапевтических моноклональных антител против CEA в присутствии высоких концентраций CEA в плазме наблюдали в нескольких клинических исследованиях. Кроме того, растворимый антиген CEA - часто присутствующий в высоких концентрациях в сыворотке пациентов с раком с прогрессирующими опухолями, рецидивирующим раком, метастазирующими опухолями, с большим объемом/массой опухоли, или опухолями на поздних стадиях - блокирует лекарственные средства, направленные против CEA-положительных опухолевых клеток, таким образом, предупреждая распознавание и разрушение опухолевой клетки. Таким образом, фактическое количество лекарственного средства, которое достигает опухоли, снижено, что приводит к уменьшенной, низкой или даже отсутствующей противоопухолевой активности. Это ограничение до настоящего времени ограничивает применение, например, основанных на антителах способах у пациентов с очень низкими количествами растворимого антигена CEA, с малой вероятностью предупреждающими взаимодействие лекарственное средство-опухолевая клетка.
По настоящему изобретению обнаружили, что возможно получить биспецифическое одноцепочечное антитело-лекарственное средство со специфичностью для CD3 человека и CEA человека, где цитотоксическая активность, направленная против опухолевых клеток, является устойчивой даже к высоким концентрациям растворимого антигена CEA (тестировали вплоть до 1 мкг/мл растворимого CEA). Это открытие является полностью неожиданным с точки зрения факта, что биспецифические одноцепочечные антитела по изобретению связываются с растворимым антигеном СЕА (см. пример 3 и фигуру 2 по настоящему изобретению; см. также ЕР В1 491031). Тем не менее, биспецифические одноцепочечные антитела, как определено здесь, являются полностью устойчивыми к присутствию даже высоких уровней растворимого СЕА по их цитотоксической активности по отношению к опухолевым клеткам. Таким образом, настоящее изобретение относится к средствам и способам, в частности, подходящим для лечения пациентов с опухолью с высокими концентрациями растворимого СЕА в плазме, как наблюдали, например, в течение прогрессии опухоли, для рецидивирующего рака, для метастазов, для пациентов с большим объемом/массой опухоли или для опухолей на поздней стадии.
Согласно этому изобретению термин «фармацевтическая композиция» относится к композиции для введения пациенту-человеку. Предпочтительно фармацевтическая композиция содержит подходящие составы носителей, стабилизаторов и/или эксципиентов. В предпочтительном варианте осуществления фармацевтическая композиция содержит композицию для парентерального, чрескожного, внутрипросветного, интраартериального, интратекального и/или интраназального введения или для прямой инъекции в ткань. В частности, предусматривают, что указанную композицию вводят пациенту посредством инфузии или инъекции. Введение подходящих композиций можно выполнять различными способами, например, посредством внутривенного, внутрибрюшинного, подкожного, внутримышечного, местного или внутрикожного введения. Композиция по настоящему изобретению может дополнительно содержать фармацевтически приемлемый носитель. Примеры подходящих фармацевтических носителей хорошо известны в данной области и включают в себя фосфатно-солевые буферные растворы, воду, различные типы увлажняющих веществ, стерильные растворы, липосомы и т.д. Композиции, содержащие такие носители, можно составлять посредством хорошо известных общепринятых способов. Эти композиции можно вводить субъекту в подходящей дозе, которую можно определить, например, посредством исследований увеличения дозы посредством введения увеличивающихся доз биспецифического одноцепочечного антитела, обладающего устойчивостью к растворимому антигену CEA в сыворотке, описанного здесь. Как указано выше, биспецифическое одноцепочечное антитело, описанное здесь, с устойчивостью к растворимому антигену CEA в сыворотке, можно преимущественно использовать для лечения пациентов с раком с высокими концентрациями CEA в сыворотке, таких как пациенты с прогрессирующими опухолями, рецидивирующим раком, метастазирующими опухолями, с большим объемом/массой опухоли или с опухолями на поздних стадиях. Эти композиции можно также вводить в сочетании с другими белковыми и небелковыми лекарственными средствами, например, в форме совместной терапии. Эти лекарственные средства можно вводить одновременно с композицией, содержащей биспецифическое одноцепочечное антитело, как определено здесь, или отдельно до или после введения указанного биспецифического антитела в заранее определенных интервалах и дозах. Режим дозирования будет определен лечащим врачом и клиническими факторами. Как хорошо известно в области медицины, дозы для каждого пациента зависят от множества факторов, включая размеры пациента, площадь поверхности тела, возраст, конкретное соединение, подлежащее введению, пол, время и способ введения, общее состояние здоровья и другие лекарственные средства, вводимые одновременно. Препараты для парентерального введения включают в себя стерильные водные или неводные растворы и суспензии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла и подходящие для инъекции органические сложные эфиры, такие как этилолеат. Водные носители включают в себя воду, водные растворы или суспензии, включая физиологический раствор и буферную среду. Парентеральные носители включают в себя раствор хлорида натрия, раствор декстрозы Рингера, декстрозу и хлорид натрия, или раствор Рингера с лактатом. Внутривенные носители включают в себя жидкие и питательные освежающие добавки, электролитные освежающие добавки (такие как основанные на растворе декстрозы Рингера) и т.п. Могут также присутствовать консерванты и другие добавки, например, такие как противомикробные средства, антиокислители, хелатирующие средства, инертные газы и т.п. Кроме того, композиция по настоящему изобретению может содержать белковые носители, например, подобные сывороточному альбумину или иммуноглобулину, предпочтительно, человеческого происхождения. Предусматривают, что совместная терапия включает в себя, в дополнение к биспецифическому одноцепочечному антителу, как определено здесь, дополнительные биологически активные средства, в зависимости от предназначенного применения композиции. Такие средства могут представлять собой лекарственные средства, действующие на желудочно-кишечную систему, лекарственные средства, действующие как антинеопластические средства, химиотерапевтические средства, цитостатики, лекарственные средства, предупреждающие гиперурикемию, лекарственные средства, ингибирующие иммунные реакции (например, кортикостероиды), лекарственные средства, модулирующие воспалительный ответ, лекарственные средства, действующие на систему кровообращения, и/или такие средства, как цитокины, известные в данной области.
Предпочтительно, биспецифическое одноцепочечное антитело, как определено здесь, составляют в буфере, стабилизаторе и поверхностно-активном веществе. Буфер может представлять собой фосфатный, цитратный, сукцинатный или ацетатный буфер. Стабилизатор может представлять собой аминокислоту(аминокислоты) и/или сахар. Поверхностно-активные вещества могут представлять собой детергенты, PEG или т.п. Более предпочтительно, биспецифическое одноцепочечное антитело, как определено здесь, составляют в цитрате, лизине, трегалозе и Tween 80. В качестве разбавителя для фармацевтической композиции по изобретению предпочтительным является изотонический физиологический раствор и Tween 80.
Как применяют здесь, «биспецифическое одноцепочечное антитело» обозначает одну полипептидную цепь, содержащую два связывающих домена. Каждый «связывающий домен», как применяют здесь, содержит одну вариабельную область из тяжелой цепи антитела («VH-область»), где VH-область первого связывающего домена специфически связывается с указанной первой молекулой, т.е. молекулой CD3 человека, и VH-область второго связывающего домена специфически связывается с CEA человека, как более подробно определено ниже. Два связывающих домена, необязательно, связаны один с другим коротким полипептидным спейсером, как правило, содержащим порядка 5 аминокислот. Каждый связывающий домен может дополнительно содержать одну вариабельную область из легкой цепи антитела («VL-область»), где VH-область и VL-область внутри каждого из первого и второго связывающих доменов связаны один с другим посредством полипептидного линкера, например линкера типа, описанного и заявленного в EP B1 623679, но в любом случае достаточно длинного, чтобы позволить VH-области и VL-области первого связывающего домена и VH-области и VL-области второго связывающего домена спариваться друг с другом, так что вместе они способны специфически связываться с соответствующей первой и второй молекулами. Расположение V-областей первого или второго связывающего домена может представлять собой VH-VL или VL-VH. Предпочтительно, расположение для первого связывающего домена, специфически связывающегося с CD3 человека, представляет собой VH-VL, как показано в следующих ниже примерах. Предусматривают, что первый связывающий домен может являться локализованным с N-конца или с C-конца от второго связывающего домена. Таким образом, расположение связывающих доменов биспецифических одноцепочечных антител, определенных здесь, может представлять собой VHCEA-VLCEA-VHCD3-VLCD3, VLCEA-VHCEA-VHCD3-VLCD3, VHCD3-VLCD3-VHCEA-VLCEA или VHCD3-VLCD3-VLCEA-VHCEA. Предпочтительно, указанный первый связывающий домен, специфический для CD3, локализован с C-конца от второго связывающего домена. Более предпочтительно, связывающие домены биспецифических одноцепочечных антител, определенных здесь, расположены в порядке VHCEA-VLCEA-VHCD3-VLCD3 или VLCEA-VHCEA-VHCD3-VLCD3. Даже более предпочтительно, порядок представляет собой VLCEA-VHCEA-VHCD3-VLCD3. Наиболее предпочтительной является конструкция биспецифического одноцепочечного антитела A240 VL-B9 VHxSEQ ID NO:77 VHVL, как определено в SEQ ID NO:34. Предусматривают, что указанные первый и/или второй связывающие домены биспецифического одноцепочечного антитела, определенного здесь, могут происходить не от человека (т.е. являться полученными из не относящихся к человеку последовательностей). Например, указанные первый и/или второй связывающие домены могут являться полученными из моноклональных антител мыши. Однако биспецифические одноцепочечные антитела, полученные из антител мыши, могут являться распознаваемыми как чужеродные при введении пациентам-людям. Таким образом, указанные первый и/или второй связывающие домены биспецифических одноцепочечных антител, определенных здесь, предпочтительно человеческого происхождения (т.е. получены из человеческих последовательностей). Такие человеческие связывающие домены, специфически связывающиеся с CEA или CD3, можно идентифицировать, например, посредством способов на основе фагового дисплея. Предусматривают также, что, например, VH-область первого (или второго) связывающего домена представляет собой VH-область человека, в то время как соответствующая VL-область первого (или второго) связывающего домена может происходить не от человека. Такие связывающие домены можно также обозначать как химерные связывающие домены. Или один из указанных связывающих доменов может происходить не от человека, тогда как другой - человеческого происхождения, что приводит к химерному биспецифическому одноцепочечному антителу. Указанный первый и/или второй связывающие домены можно далее модифицировать, чтобы уменьшить иммуногенность биспецифического одноцепочечного антитела, описанного здесь, при введении пациентам-людям. Например, по меньшей мере один из указанных первого или второго связывающих доменов биспецифических одноцепочечных антител, определенных здесь, может являться гуманизированным, CDR-привитым, химерным и/или деиммунизированным, или человеческим, как более подробно описано ниже. Предусматривают также, что полипептидный линкер, связывающий VH- и VL-область внутри первого и/или второго связывающего домена, является деиммунизированным. Предпочтительно, полипептидный линкер, связывающий VH- и VL-область внутри деиммунизированного первого связывающего домена (специфического для CD3), представляет собой деиммунизированный полипептидный линкер, обладающий последовательностью «GEGTSTGS(G2S)2GGAD» (SEQ ID NO:141). Более того, предусматривают, что один или оба из указанных связывающих доменов биспецифических одноцепочечных антител, определенных здесь, несут так называемые «метки», которые можно использовать, например, для экспрессии, очистки, детекции или обогащения белка, такие как Flag-метки, c-myc-метки, GST-метки или His-метки. Например, для Flag-метки наиболее общеупотребительным сейчас гидрофильным октапептидом является DYKDDDDK (Chubet and Brizzard, Biotechniques 20 (1996): 136-141), хотя недавние исследования позволили предположить, что более короткий пептид, DYKD, может узнавать почти с такой же аффинностью моноклональное антитело M1 (Knappik A, Pluckthun A; Biotechniques 17 (1994):754-761). Flag-метки, c-myc-метки, GST-метки, His-метки или т.п. можно помещать либо на N-конце, либо на C-конце биспецифических одноцепочечных антител, например, таких как метка-VHCEA-VLCEA-VHCD3-VLCD3 или VLCEA-VHCEA-VHCD3-VLCD3-метка. Источники и свойства таких меток для целей экспрессии, детекции или очистки хорошо описаны в данной области; см., например, Lichty, Protein Expr Purif. 41 (2005), 98-105.
Как применяют здесь, термин «одноцепочечное Fv» или «scFv» относится к фрагментам антитела, содержащим VH и VL домены антитела, где эти домены присутствуют в одной полипептидной цепи. Вариабельные домены могут быть расположены в порядке VH-VL или VL-VH. Как правило, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, позволяющий scFv формировать желательную структуру для связывания антигена. Обзор scFv см. в Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994). В конкретном варианте осуществления изобретение относится к анти-CEA scFv, полученным из биспецифических одноцепочечных антител, определенных здесь.
В соответствии с настоящим изобретением термин «связывающий домен» или «вариабельная область», применяемый в контексте унаследованного от Ig взаимодействия с антигеном, включает в себя фрагменты и производные полипептидов, содержащие по меньшей мере одну CDR, полученную из антитела, фрагмента антитела или его производного. По изобретению предусмотрено, что второй связывающий домен, специфически связывающийся с CEA человека, из биспецифического одноцепочечного антитела, определенного здесь, содержит по меньшей мере одну CDR, предпочтительно CDR-H3, более предпочтительно часть CDR-H3 моноклонального антитела мыши A5B7 с аминокислотной последовательностью «FYFDY» (SEQ ID NO:112), соответствующей положениям по Kabat 100, 100a, 100b, 101 и 102, соответственно, CDR-H3 моноклонального антитела мыши A5B7; даже более предпочтительно, с аминокислотной последовательностью «DX1X2X3X4FYFDY» (SEQ ID NO:65), где «X1», «X2», «X3» или «X4» представляет собой любой аминокислотный остаток, и аминокислотный остаток «D» соответствует положению по Kabat 95 CDR-H3 моноклонального антитела мыши A5B7, и аминокислотные остатки «FYFDY» соответствуют положениям по Kabat 100, 100a, 100b, 101 и 102, соответственно, CDR-H3 моноклонального антитела мыши A5B7. Предусматривают, что «X1», «X2», «X3» или «X4» соответствующие положениям по Kabat 96 («X1»), 97 («X2»), 98 («X3») и 99 («X4»), соответственно, CDR-H3 моноклонального антитела мыши A5B7, представляют собой аминокислотный остаток «R» (аргинин), «G» (глицин), «L» (лейцин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту), «S» (серин), «W» (триптофан), «F» (фенилаланин) или «T» (треонин). Здесь из объема изобретения исключено, что «X1», «X2», «X3» и «X4» представляют собой одну и ту же аминокислоту, например, что «X1», «X2», «X3» и «X4» все представляют собой «F» (фенилаланин). Предпочтительно, «X1» представляет собой «R» (аргинин), «F» (фенилаланин), «M» (метионин), «E» (глутаминовую кислоту) или «T» (треонин); «X2» представляет собой «G» (глицин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту) или «S» (серин); «X3» представляет собой «L» (лейцин), «F» (фенилаланин), «M» (метионин), «E» (глутаминовую кислоту) или «T» (треонин); и «X4» представляет собой «R» (аргинин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту) или «S» (серин). Или, наиболее предпочтительно, второй связывающий домен, специфически связывающийся с CEA человека, из биспецифического одноцепочечного антитела, определенного здесь, содержит полную CDR-H3 из A5B7 с аминокислотной последовательностью «DRGLRFYFDY» (SEQ ID NO:66), соответствующей положениям по Kabat 95-102 CDR-H3 из A5B7. Как показано в следующих ниже примерах, цитотоксическая активность против опухолевых клеток биспецифического одноцепочечного антитела, определенного здесь, содержащего указанную полученную из mAb A5B7 аминокислотную последовательность CDR-H3 «DRGLRFYFDY» (SEQ ID NO:66) во втором связывающем домене, взаимодействующем с CEA, является устойчивой к растворимому антигену CEA, таким образом позволяя лечение пациентов с опухолью с высокими сывороточными концентрациями CEA в плазме. Определение CDR известно специалистам в данной области; см., например, http://www.bioinf.org.uk/abs/#cdrid. Нумерацию аминокислотных последовательностей в антителах можно проводить, например, согласно схеме нумерации Kabat, описанной в данной области; см., например, Kabat, E. A., T. T. Wu, H. M. Perry, K. S. Gottesman, and C. Foeller. 1991. Sequences of Proteins of Immunological Interest, 5th ed. Bethesda, Md.: National Center Biotechnology Information, National Library of Medicine.
Наиболее предпочтительно и как документировано в прилагаемых примерах, «биспецифическое одноцепочечное антитело» для применения в фармацевтической композиции по изобретению представляет собой биспецифическое одноцепочечное Fv (scFv) с деиммунизированным связывающим доменом анти-CD3 (WO 2005/040220) и связывающим доменом анти-CEA человека, содержащим по меньшей мере аминокислотную последовательность «DRGLRFYFDY», соответствующую положениям по Kabat 95-102 (SEQ ID NO:66) CDR-H3 моноклонального антитела мыши A5B7. Биспецифические одноцепочечные молекулы известны в данной области и описаны, например, в WO 99/54440 или в Mack, PNAS, (1995), 92, 7021-7025.
Термин «одноцепочечный», как применяют в соответствии с настоящим изобретением, означает, что указанные первый и второй домены биспецифической одноцепочечной конструкции являются ковалентно связанными, предпочтительно, в форме колинеарной аминокислотной последовательности, кодируемой одной молекулой нуклеиновой кислоты.
Как применяют здесь, «человеческий» относится к виду Homo sapiens. «Человеческая» молекула, например, CEA человека или CD3 человека (CD3 эпсилон), таким образом, представляет собой вариант этой молекулы, как она естественно экспрессируется в Homo sapiens.
Термин «эпителиальная опухоль» как применяют здесь, обозначает опухоль эпителиального происхождения, являющуюся CEA-положительной (Cancer Medicine; 6th ed.; Kufe, Donald W.; Pollock, Raphael E.; Weichselbaum, Ralph R.; Bast, Robert C, Jr.; Gansler, Ted S.; Holland, James F.; Frei III, Emil, editors. Hamilton (Canada): BC Decker Inc. 2003; http://www.dkfz.de; http://www.krebsinformationsdienst.de/Krebsarten/index.html). Эпителиальная опухоль, подлежащая лечению, может представлять собой гастроинтестинальную аденокарциному, аденокарциному молочной железы или аденокарциному легкого. Указанная гастроинтестинальная аденокарцинома предпочтительно является колоректальной, панкреатической аденокарциномой, аденокарциномой пищевода или желудка. Как указано здесь, фармацевтическая композиция по изобретению является особенно преимущественной для лечения пациентов с прогрессирующими опухолями, метастазами, рецидивирующим раком, эпителиальными опухолями на поздних стадиях, с большим объемом/массой эпителиальной опухоли, или пациентов с опухолью с концентрацией CEA в сыворотке, превышающей 100 нг/мл (как определено, например, посредством ELISA), характеризующихся высокими уровнями растворимого антигена CEA в плазме пациентов с опухолью. В объем изобретения входит также то, что указанную фармацевтическую композицию используют после хирургического удаления первичной опухоли. Например, рассеянные остаточные опухолевые клетки, происходящие из продуцирующей CEA эпителиальной опухоли, также распространяют CEA в их микроокружение. Таким образом, в окружении этих опухолевых клеток уровень растворимого CEA также является высоким. Соответственно, устойчивость цитотоксической активности фармацевтической композиции по изобретению к растворимому CEA является также преимущественной для лечения минимального остаточного заболевания. Предусматривают, что указанные фармацевтические композиции можно вводить в период, когда уровни CEA в сыворотке уменьшены (из-за удаления источника CEA, т.е. первичной опухоли), чтобы убить оставшиеся опухолевые клетки. Фармацевтические композиции также могут являться применимыми после удаления первичной опухоли, в случае, когда уровни CEA в сыворотке увеличены из-за формирования вторичных опухолей или метастазов. Концентрацию CEA в сыворотке можно определить, например, посредством анализов CEA ELISA (см., например, IBL CEA EIA, IBL Hamburg, Germany). Как указано выше, во многих основанных на антителах терапевтических способах указанный уровень CEA в сыворотке ингибирует связывание антитела со связанным с мембраной CEA на опухолевых клетках и блокирует активность антитела, таким образом, ухудшая успех противоопухолевой терапии.
Как применяют здесь, термин «специфически связывается» или родственные выражения, такие как «специфическое связывание» или «специфическая реактивность с/против» и т.д., относятся к способности первого и/или второго связывающих доменов биспецифического одноцепочечного антитела, как определено здесь, к дискриминации между соответствующей первой и/или второй молекулой до такой степени, что из пула множества различных молекул, как потенциальных партнеров по связыванию, только указанная соответствующая первая и/или вторая молекула является/являются связанными или является/являются значительно связанными. Такие измерения связывания можно проводить общепринятым способом, например, на аппарате Biacore, посредством ELISA, анализа FACS или т.п. Более конкретно, первый связывающий домен биспецифического одноцепочечного антитела, как определено здесь, связывается с CD3 человека, предпочтительно с CD3 эпсилон человека. Второй связывающий домен биспецифических одноцепочечных антител, как определено здесь, связывается с антигеном эпителиальной опухоли, т.е. CEA человека (карциномоэмбриональный антиген, родственная карциномоэмбриональному антигену молекула клеточной адгезии 5; CEACAM5; CD66e), как указано ниже. Термин «специфическое связывание» согласно этому изобретению означает, что молекула биспецифического одноцепочечного антитела способна специфически взаимодействовать и/или связываться по меньшей мере с двумя, тремя, четырьмя, пятью, шестью, семью, восемью или даже более аминокислотами каждой из молекул-мишеней человека, как определено здесь. Указанный термин относится к специфичности молекулы антитела, т.е. к ее способности к дискриминации между специфическими областями молекулы-мишени человека, как определено здесь. Специфическое взаимодействие участка взаимодействия с антигеном с его специфическим антигеном может приводить к инициации сигнала, например, из-за индукции изменения конформации антигена, олигомеризации антигена и т.д. Кроме того, указанное связывание можно проиллюстрировать примером специфичности «по принципу ключ-замок». Таким образом, специфические мотивы в аминокислотной последовательности участка взаимодействия с антигеном и антигена связываются друг с другом на основании их первичной, вторичной или третичной структуры, так же как в результате вторичных модификаций указанной структуры. Специфическое взаимодействие участка взаимодействия с антигеном с его специфическим антигеном может приводить также к связыванию указанного участка с антигеном.
«Специфическое связывание» антитела характеризуют в первую очередь двумя параметрами: качественным параметром (связывающий эпитоп, или где связывается антитело) и количественным параметром (аффинность связывания, или насколько сильно оно связывается, где связывается). Какой из эпитопов связывает антитело, можно преимущественно определить, например, посредством известного способа FACS, точечного картирования пептидных эпитопов, масс-спектроскопии или ELISA пептидов. Силу связывания антитела с конкретным эпитопом можно преимущественно определить, например, посредством известных способов Biacore и/или ELISA. Сочетание таких способов позволяет вычисление соотношения сигнал:шум в качестве репрезентативного измерения специфичности связывания. В таком соотношении сигнал:шум сигнал представляет собой силу связывания антитела с интересующим эпитопом, тогда как шум представляет собой силу связывания антитела с другими, не родственными эпитопами, отличающимися от интересующего эпитопа. Предпочтительно, соотношение сигнал:шум для интересующего эпитопа, приблизительно в 50 раз превышающее соотношение для других эпитопов, отличающихся от интересующего эпитопа, можно принимать за показатель того, что оцениваемое антитело связывает интересующий эпитоп специфическим образом, т.е. представляет собой «специфически связывающее».
Термин «специфическое связывание» или «специфическое взаимодействие», как применяют в соответствии с настоящим изобретением, означает, что биспецифическая одноцепочечная конструкция не является или в основном не является перекрестно-реагирующей с полипептидами сходных структур. Перекрестную реактивность панели исследуемых биспецифических одноцепочечных конструкций можно тестировать, например, посредством оценки связывания указанной панели биспецифических одноцепочечных конструкций в общепринятых условиях (см., например, Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988 и Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1999) с интересующим полипептидом, так же как с рядом более или менее (структурно и/или функционально) близко родственных полипептидов. Например, в объем изобретения включено то, что первый связывающий домен биспецифического одноцепочечного антитела по изобретению связывается с CEA человека (карциномоэмбриональный антиген; CEACAM5; CEA; CD66e), т.е. как с растворимым антигеном CEA, так и со связанным с мембраной CEA, в то время как биспецифические антитела, связывающиеся с другими членами семейства CEA, такими как биллиарный гликопротеин (CEACAM1; BGP1; TM-CEA; CD66a), исключены из указанного объема.
Примеры специфического взаимодействия участка взаимодействия с антигеном со специфическим антигеном включают в себя специфичность лиганда для его рецептора. Указанное определение, в частности, включает в себя взаимодействие лигандов, индуцирующих сигнал после связывания с их специфическим рецептором. Примеры соответствующих лигандов включают в себя цитокины, взаимодействующие/связывающиеся с/с их специфическими рецепторами цитокинов. Также, в частности, указанное определение включает в себя связывание участка взаимодействия с антигеном с такими антигенами, как антигены семейства селектинов, интегрины и антигены семейства факторов роста, подобные EGF. Другой пример указанного взаимодействия, который также, в частности, включает в себя указанное определение, представляет собой взаимодействие антигенной детерминанты (эпитопа) с антигенсвязывающим участком антитела.
Термин «связывающийся с/взаимодействующий с» может также относиться к конформационному эпитопу, структурному эпитопу или прерывистому эпитопу, состоящему из двух областей молекулы-мишени человека или ее частей. В контексте этого изобретения, конформационный эпитоп определяют две или более отдельные аминокислотные последовательности, разделенные в первичной последовательности, которые собираются вместе на поверхности молекулы, когда полипептид сворачивается в нативный белок (Sela, (1969) Science 166, 1365 и Laver, (1990) Cell 61, 553-6).
Термин «прерывистый эпитоп» в контексте изобретения обозначает нелинейные эпитопы, собранные из остатков из отдаленных частей полипептидной цепи. Эти остатки собираются вместе на поверхности молекулы, когда полипептидная цепь сворачивается в трехмерную структуру, составляя конформационный/структурный эпитоп.
«CD3», как применяют здесь, обозначает антиген, который экспрессируется на T-клетках как часть мультимолекулярного комплекса T-клеточного рецептора и который состоит по меньшей мере из пяти различных цепей, CD3-гамма, -дельта, -эпсилон, -зета и -эта. Кластеризация CD3 на T-клетках, например, посредством иммобилизованных антител против CD3, приводит к активации T-клетки, сходной с активацией с вовлечением T-клеточного рецептора, но независимой от его клонотипической специфичности. Фактически, большинство антител против CD3 узнают эпсилон-цепь CD3. Аминокислотная последовательность CD3 эпсилон человека описана в GenBank под регистрационным номером NM_000733 и содержит SEQ ID NO:111.
«CEA» обозначает карциномоэмбриональный антиген (родственную карциномоэмбриональному антигену молекулу клеточной адгезии 5; CEACAM5; CEA; CD66e), антиген, экспрессированный в большом количестве опухолей эпителиального происхождения (Hammarström, Sem. Cancer Biol. 9 (1999), 67-81; Shively and Beatty CRC Crit. Rev. Oncol. Hematol. 2 (1985), 355-399). Аминокислотная последовательность CEA человека описана в GenBank под регистрационным номером NM_004363 и содержит SEQ ID NO:76.
В настоящем изобретении неожиданно обнаружили, что является возможным получить на основе антител лекарственные средства со специфичностью для CD3 человека и CEA человека, где цитотоксическая активность, направленная против опухолевых клеток, является устойчивой даже к высоким концентрациям растворимого антигена CEA. Это открытие является полностью неожиданным в свете того факта, что биспецифические одноцепочечные антитела по изобретению связываются с растворимым антигеном CEA. Например, когда получили конструкции биспецифических одноцепочечных антител, полученных из моноклональных антител T84.66 или MFE-23, эти антитела являлись высокочувствительными к растворимому антигену CEA, т.е. их цитотоксическая активность являлась блокированной в присутствии растворимого антигена CEA. Ингибирование цитотоксической активности указанных конструкций растворимым CEA не могли также преодолеть посредством увеличенных количеств антитела. Обнаружили также, что эти конструкции способны связываться с растворимым CEA. Ввиду этого, заключили, что растворимый антиген CEA предупреждает проявление цитотоксической активности антитела. В отличие от этого, биспецифические одноцепочечные антитела, как определено здесь, по их цитотоксической активности против опухолевых клеток, являются полностью устойчивыми к присутствию даже высоких уровней растворимого CEA. Более того, из-за их высокой цитотоксической активности, указанные биспецифические конструкции, как определено здесь, проявляют свою биологическую активность даже при низких концентрациях. Таким образом, низких количеств фармацевтических композиций, содержащих биспецифические одноцепочечные антитела, как определено здесь, достаточно для достижения терапевтического эффекта для пациентов с эпителиальными опухолями, характеризующимися высокими концентрациями растворимого CEA в сыворотке/плазме. Высокие концентрации растворимого CEA в сыворотке/плазме пациентов с эпителиальной опухолью являются характерными для прогрессирующих, рецидивирующих, метастазирующих опухолей или опухолей на поздних стадиях и для пациентов с высокой опухолевой нагрузкой. Даже более неожиданно, обнаружили, что аминокислотная последовательность «DRGLRFYFDY» (SEQ ID NO:66), соответствующая положениям по Kabat 95-102 CDR-H3 моноклонального антитела мыши A5B7, является достаточной, чтобы опосредовать устойчивость к растворимому антигену CEA при использовании в связывающем CEA человека домене (т.е. человеческих связывающих доменах, специфически связывающихся с CEA человека) из биспецифических одноцепочечных антител анти-CEA x анти-CD3. Из-за их человеческого происхождения указанные конструкции являются низкоиммуногенными или неиммуногенными при введении пациентам-людям с опухолью. Таким образом, фармацевтические композиции, содержащие биспецифические одноцепочечные антитела, как определено здесь, являются, в частности, применимыми для лечения пациентов с эпителиальной опухолью с высокими концентрациями растворимого CEA в плазме, как наблюдали, например, в ходе прогрессирования опухоли, для рецидивирующего рака, для метастазов, для пациентов с большим объемом/массой опухоли или для опухолей на поздних стадиях.
В другом предпочтительном варианте осуществления фармацевтической композиции по изобретению указанный первый связывающий домен, специфичный для CD3, из биспецифических одноцепочечных антител, определенных здесь, локализован к C-концу от второго связывающего домена.
В пределах объема изобретения и всех вариантов его осуществления порядок расположения первого и второго связывающих доменов на одной полипептидной цепи, т.е. внутри биспецифического одноцепочечного антитела, определенного здесь, является важным. Предусматривают, что порядок связывающих доменов биспецифических одноцепочечных антител, определенных здесь, может представлять собой VHCEA-VLCEA-VHCD3-VLCD3, VLCEA-VHCEA-VHCD3-VLCD3, VHCD3-VLCD3-VHCEA-VLCEA или VHCD3-VLCD3-VLCEA-VHCEA. Как показано в следующих ниже примерах, преимущества, как описано здесь выше, можно, в частности, реализовать, когда первый связывающий домен (специфически связывающийся с CD3) локализован на C-конце от второго связывающего домена, т.е. ближе к C-концу биспецифического одноцепочечного антитела, чем второй связывающий домен. Предпочтительно, чтобы первый связывающий домен, специфически связывающийся с CD3, являлся расположенным в ориентации VH-VL. Например, связывающие домены биспецифических одноцепочечных антител, определенных здесь, могут являться расположенным в порядке VHCEA-VLCEA-VHCD3-VLCD3 или VLCEA-VHCEA-VHCD3-VLCD3. Как применяют здесь, «на N-конце от» или «на C-конце от» и грамматические варианты этого обозначают относительную локализацию в первичной аминокислотной последовательности, а не размещение на абсолютном N- или C-конце биспецифического одноцепочечного антитела. Таким образом, в качестве неограничивающего примера, первый связывающий домен, который «локализован на C-конце от второго связывающего домена», просто означает, что первый связывающий домен локализован с карбоксильной стороны от второго связывающего домена в биспецифическом одноцепочечном антителе, и не исключает возможности, что дополнительная последовательность, например метка, как указано выше, или другое белковое или небелковое соединение, такое как радиоактивный изотоп, локализован на самом C-конце биспецифического одноцепочечного антитела.
Предпочтительно, указанные связывающие домены биспецифических одноцепочечных антител, определенных здесь, расположены в порядке VHCEA-VLCEA-VHCD3-VLCD3 или VLCEA-VHCEA-VHCD3-VLCD3. Даже более предпочтительно, порядок представляет собой VLCEA-VHCEA-VHCD3-VLCD3. Наиболее предпочтительной является конструкция биспецифического одноцепочечного антитела A240 VL-B9 VH x SEQ ID NO:77 VHVL, как определено в SEQ ID NO:34.
Является предпочтительным, чтобы второй связывающий домен, специфически связывающийся с CEA человека, из биспецифического одноцепочечного антитела, определенного здесь, содержал по меньшей мере одну CDR, предпочтительно CDR-H3, более предпочтительно, часть CDR-H3 моноклонального антитела мыши A5B7 с аминокислотной последовательностью «FYFDY» (SEQ ID NO:112), соответствующей положениям по Kabat 100, 100a, 100b, 101 и 102, соответственно, CDR-H3 моноклонального антитела мыши A5B7; даже более предпочтительно, с аминокислотной последовательностью «DX1X2X3X4FYFDY» (SEQ ID NO:65), где «X1», «X2», «X3» или «X4» представляет собой любой аминокислотный остаток, и аминокислотный остаток «D» соответствует положению по Kabat 95 CDR-H3 моноклонального антитела мыши A5B7, и аминокислотные остатки «FYFDY» соответствуют положениям по Kabat 100, 100a, 100b, 101 и 102, соответственно, CDR-H3 моноклонального антитела мыши A5B7. Здесь «X1», «X2», «X3» и «X4» соответствуют положениям по Kabat 96 («X1»), 97 («X2»), 98 («X3») и 99 («X4»), соответственно, CDR-H3 моноклонального антитела мыши A5B7. Предусматривают, что «X1», «X2», «X3» или «X4» представляют собой аминокислотный остаток «R» (аргинин), «G» (глицин), «L» (лейцин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту), «S» (серин), «W» (триптофан), «F» (фенилаланин) или «T» (треонин). Здесь исключено из объема формулы изобретения, что «X1», «X2», «X3» и «X4» представляют собой одну и ту же аминокислоту, например, что «X1», «X2», «X3» и «X4» все представляют собой «F» (фенилаланин). Предпочтительно, «X1» представляет собой «R» (аргинин), «F» (фенилаланин), «M» (метионин), «E» (глутаминовую кислоту) или «T» (треонин); «X2» представляет собой «G» (глицин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту) или «S» (серин); «X3» представляет собой «L» (лейцин), «F» (фенилаланин), «M» (метионин), «E» (глутаминовую кислоту) или «T» (треонин); и «X4» представляет собой «R» (аргинин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту) или «S» (серин). Даже более предпочтительно, чтобы второй связывающий домен, специфический для CEA человека, содержал по меньшей мере аминокислотную последовательность «RFYFDY» (SEQ ID NO:113), «LRFYFDY» (SEQ ID NO:114), «GLRFYFDY» (SEQ ID NO:115) или «RGLRFYFDY» (SEQ ID NO:116) из CDR-H3 моноклонального антитела A5B7. Наиболее предпочтительной является полная CDR-H3 из A5B7 с аминокислотной последовательностью «DRGLRFYFDY» (SEQ ID NO:66), соответствующей положениям по Kabat 95 («D», аспарагиновая кислота), 96 («R»; аргинин), 97 («G»; глицин), 98 («L»; лейцин), 99 («R»; аргинин), 100 («F»; фенилаланин), 100a («Y»; тирозин), 100b («F»; фенилаланин), 101 («D»; аспарагиновая кислота) и 102 («Y»; тирозин), соответственно. Нумерация согласно системе Kabat описана, например, в Kabat, E. A., T. T. Wu, H. M. Perry, K. S. Gottesman, and C. Foeller. 1991. Sequences of Proteins of Immunological Interest, 5th ed. Bethesda, Md.: National Center for Biotechnology Information, National Library of Medicine.
Как показано в следующих ниже примерах, цитотоксическая активность против опухолевых клеток биспецифического одноцепочечного антитела, определенного здесь, содержащего указанную полученную из CDR-H3 mAb A5B7 аминокислотную последовательность «DRGLRFYFDY» (SEQ ID NO:66) во втором связывающем домене, взаимодействующем с CEA, является устойчивой к растворимому антигену CEA, таким образом, позволяя лечение пациентов с опухолью с высокими сывороточными концентрациями CEA в плазме.
Может являться желательным дополнительно модифицировать эту полученную из A5B7 аминокислотную последовательность CDR-H3 «DRGLRFYFDY», например, чтобы улучшить аффинность для антигена-мишени CEA (на эпителиальных опухолевых клетках) и/или оптимизировать «тонкую специфичность» биспецифического одноцепочечного антитела, как определено здесь. С этой целью в аминокислотной последовательности «DX1X2X3X4FYFDY» (SEQ ID NO:65) можно тестировать различные аминокислотные остатки в положениях «X1», «X2», «X3» и/или «X4» (соответствующих положениям по Kabat 96 («X1»), 97 («X2»), 98 («X3») и 99 («X4»), соответственно, CDR-H3 моноклонального антитела мыши A5B7), чтобы идентифицировать модифицированную CDR-H3 с улучшенной аффинностью и/или тонкой специфичностью. Например, «X1», «X2», «X3» или «X4» может представлять собой аминокислотный остаток «R» (аргинин), «G» (глицин), «L» (лейцин), «Y» (тирозин), «A» (аланин), «D» (аспарагиновую кислоту), «S» (серин), «W» (триптофан), «F» (фенилаланин) или «T» (треонин). Здесь одно, два, три или все четыре из обозначенных «X» положений можно изменять по сравнению с исходной аминокислотной последовательностью «RGLR» в положениях по Kabat 96-99 в аминокислотной последовательности CDR-H3 «DRGLRFYFDY» (SEQ ID NO:66). Однако из объема формулы изобретения исключено, что «X1», «X2», «X3» и «X4» представляют собой одну и ту же аминокислоту, например, что «X1», «X2», «X3» и «X4» все представляют собой «F» (фенилаланин). Вышеупомянутую модификацию полученной из A5B7 аминокислотной последовательности CDR-H3 «DRGLRFYFDY» можно выполнять способами, известными в данной области, такими как ПЦР с использованием случайных праймеров, что позволяет получать биспецифические одноцепочечные антитела с такими модифицированными областями CDR-H3 в связывающем CEA домене. Аффинность или тонкую специфичность этих модифицированных биспецифических одноцепочечных антител можно тестировать способами, описанными в данной области, например, посредством анализов ELISA, Biacore или FACS. Устойчивость к растворимому антигену CEA биспецифического одноцепочечного антитела с такой модифицированной CDR-H3 можно тестировать в анализах цитотоксичности в присутствии увеличивающихся количеств растворимого CEA, как описано в следующих ниже примерах.
Более предпочтительно, указанный второй связывающий домен, специфический для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, содержит SEQ ID NO:65 или 66 и/или CDR-H1, обладающую аминокислотной последовательностью «SYWMH» (SEQ ID NO:68), и/или CDR-H2, обладающую аминокислотной последовательностью «FIRNKANGGTTEYAASVKG» (SEQ ID NO:67) или «FILNKANGGTTEYAASVKG» (SEQ ID NO:145). Таким образом, указанный второй связывающий домен, специфический для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, может содержать одну, две или три области CDR-H, как определено выше. Альтернативно, указанный второй связывающий домен, специфический для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, содержит SEQ ID NO:65 или 66 и/или CDR-H1, обладающую аминокислотной последовательностью «TYAMH» (SEQ ID NO:70), и/или CDR-H2, обладающую аминокислотной последовательностью «LISNDGSNKYYADSVKG» (SEQ ID NO:69). Таким образом, альтернативно, указанный второй связывающий домен, специфический для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, может содержать одну, две или три области CDR-H, как определено выше. Даже более предпочтительно, указанный второй связывающий домен, специфический для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, в дополнение к одной, двум или трем областям CDR-H, как описано выше, содержит CDR-L1, обладающую аминокислотной последовательностью «TLRRGINVGAYSIY» (SEQ ID NO:73), и/или CDR-L2, обладающую аминокислотной последовательностью «YKSDSDKQQGS» (SEQ ID NO:72), и/или CDR-L3, обладающую аминокислотной последовательностью «MIWHSGASAV» (SEQ ID NO:71).
Аминокислотная последовательность VH-области второго связывающего домена, специфического для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, предпочтительно представляет собой SEQ ID NO:60, содержащую «DRGLRFYFDY» (SEQ ID NO:66), соответствующую положениям по Kabat 95-102 CDR-H3 моноклонального антитела мыши A5B7, и CDR-H1, обладающую аминокислотной последовательностью «SYWMH» (SEQ ID NO:68), и CDR-H2, обладающую аминокислотной последовательностью «FIRNKANGGTTEYAASVKG» (SEQ ID NO:67).
Аминокислотная последовательность VH-области второго связывающего домена, специфического для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, предпочтительно представляет собой SEQ ID NO:146, содержащую «DRGLRFYFDY» (SEQ ID NO:66), соответствующую положениям по Kabat 95-102 CDR-H3 моноклонального антитела мыши A5B7, и CDR-H1, обладающую аминокислотной последовательностью «SYWMH» (SEQ ID NO:68), и CDR-H2, обладающую аминокислотной последовательностью «FILNKANGGTTEYAASVKG» (SEQ ID NO:145).
Аминокислотная последовательность VH-области второго связывающего домена, специфического для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, предпочтительно представляет собой SEQ ID NO:58 или SEQ ID NO:62, содержащую «DRGLRFYFDY» (SEQ ID NO:66), соответствующую положениям по Kabat 95-102 из CDR-H3 моноклонального антитела мыши A5B7, и CDR-H1, обладающую аминокислотной последовательностью «TYAMH» (SEQ ID NO:70), и CDR-H2, обладающую аминокислотной последовательностью «LISNDGSNKYYADSVKG» (SEQ ID NO:69).
VL-область второго связывающего домена, специфического для CEA человека, из биспецифических одноцепочечных антител, определенных здесь, предпочтительно представляет собой SEQ ID NO:64, содержащую CDR-L1, обладающую аминокислотной последовательностью «TLRRGINVGAYSIY» (SEQ ID NO:73), и CDR-L2, обладающую аминокислотной последовательностью «YKSDSDKQQGS» (SEQ ID NO:72), и CDR-L3, обладающую аминокислотной последовательностью «MIWHSGASAV» (SEQ ID NO:71).
Как указано выше, порядок или расположение вариабельных областей второго связывающего домена, специфически связывающегося с CEA, может представлять собой VH-VL или VL-VH. Оба расположения входят в объем изобретения. Для второго связывающего домена, содержащего VH из SEQ ID NO:60 и VL из SEQ ID NO:64, расположение VH-VL показано на SEQ ID NO:52, тогда как расположение VL-VH показано на SEQ ID NO:122. Для второго связывающего домена, содержащего VH из SEQ ID NO:146 и VL из SEQ ID NO:64, расположение VH-VL показано на SEQ ID NO:147.
Для второго связывающего домена, содержащего VH из SEQ ID NO:58 и VL из SEQ ID NO:64, расположение VH-VL показано на SEQ ID NO 50, тогда как расположение VL-VH показано на SEQ ID NO:120. Для второго связывающего домена, содержащего VH из SEQ ID NO:62 и VL из SEQ ID NO:64, расположение VH-VL показано на SEQ ID NO:54, тогда как расположение VL-VH показано на SEQ ID NO:124. Для второго связывающего домена, содержащего VH из SEQ ID NO:56 и VL из SEQ ID NO:64, расположение VH-VL показано на SEQ ID NO:48, тогда как расположение VL-VH показано на SEQ ID NO:118.
Даже более предпочтительно, V-области второго связывающего домена, специфического для CEA, из биспецифических одноцепочечных антител, определенных здесь, выбраны из группы, состоящей из:
(a) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:60, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:64;
(b) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:146, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:64;
(c) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:58, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:64;
(d) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:62, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:64; и
(e) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:56, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO:64.
Наиболее предпочтительно, указанное биспецифическое одноцепочечное антитело содержит аминокислотную последовательность, выбранную из группы, состоящей из
(a) любой аминокислотной последовательности, представленной как SEQ ID NO:6, 8, 16, 18, 24, 26, 32, 34, 40, 42, 126, 130, 134 или 143;
(b) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, как показано на SEQ ID NO:5, 7, 15, 17, 23, 25, 31, 33, 39, 41, 125, 129, 133 или 142;
(c) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, гибридизующейся в строгих условиях с комплементарной последовательностью нуклеиновой кислоты из (b);
(d) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, являющейся вырожденной в результате генетического кода по отношению к нуклеотидной последовательности из (b); и
(e) аминокислотной последовательности, по меньшей мере на 85% идентичной, более предпочтительно, по меньшей мере на 90% идентичной, наиболее предпочтительно, по меньшей мере на 95% идентичной аминокислотной последовательности из (a) или (b).
В другом предпочтительном варианте осуществления фармацевтической композиции по изобретению указанная опухоль, подлежащая лечению, представляет собой гастроинтестинальную аденокарциному, аденокарциному молочной железы или аденокарциному легкого. Указанная гастроинтестинальная аденокарцинома предпочтительно представляет собой колоректальную, панкреатическую аденокарциному, аденокарциному пищевода или желудка.
Более предпочтительно, указанная фармацевтическая композиция по изобретению предназначена для лечения прогрессирующих опухолей, опухолей на поздних стадиях, пациентов с опухолью с большим объемом/массой опухоли, метастазирующих опухолей или пациентов с опухолью с концентрацией CEA в сыворотке, превышающей 100 нг/мл. Указанную концентрацию CEA в сыворотке можно определить, например, посредством ELISA.
В следующем предпочтительном варианте осуществления фармацевтической композиции по изобретению по меньшей мере один из указанных первого или второго связывающего домена биспецифических одноцепочечных антител, определенных здесь, является химерным, гуманизированным, CDR-привитым и/или деиммунизированным, или человеческим.
Термин «химерный», как применяют здесь, определен выше. Термин «человеческий» связывающий домен, например связывающий домен человека, специфически связывающийся с CEA человека, как применяют здесь, следует понимать, как означающий, что биспецифическое одноцепочечное антитело, как определено здесь, содержит аминокислотную последовательность(последовательности), содержащуюся в репертуаре антител зародышевой линии человека или в репертуаре антител, обладающих по меньшей мере аминокислотной последовательностью «FYFDY», соответствующей положениям по Kabat 100, 100a, 100b, 101 и 102 (SEQ ID NO:112) из CDR-H3 моноклонального антитела мыши A5B7 или полученной из A5B7 CDR-H3, как определено выше. Биспецифическое одноцепочечное антитело, как определено здесь, можно также считать человеческим, если оно состоит из последовательности(последовательностей), отличающейся(отличающихся) от наиболее близкой (к ним) последовательности(последовательностей) зародышевой линии человека не более, чем можно ожидать из-за вклада соматической гипермутации. Кроме того, антитела многих не относящихся к человеку млекопитающих, например грызунов, таких как мыши и крысы, содержат аминокислотные последовательности VH CDR, которые, как можно ожидать, также существуют в репертуаре экспрессированных антител человека. Любую такую последовательность(последовательности), происходящие от человека или не от человека, которые, как можно ожидать, также существуют в репертуаре экспрессированных антител человека, также будут считать «человеческой» для целей настоящего изобретения.
Как применяют здесь, термин «гуманизированный», «гуманизация» или «подобный человеку» используют взаимозаменяемо как относящийся к биспецифическому одноцепочечному антителу, содержащему по меньшей мере в одном из его связывающих доменов по меньшей мере одну определяющую комплементарность область («CDR») из не относящегося к человеку антитела или его фрагмента. Способы гуманизации описаны, например, в WO 91/09968 и US 6407213. В качестве неограничивающих примеров, термин относится к случаю, в котором вариабельная область по меньшей мере одного связывающего домена содержит одну область CDR, например третью область CDR из VH, из другого не относящегося к человеку животного, например грызуна, так же как к случаю, в котором любая или обе вариабельная область/области содержат в каждой из их соответствующих первой, второй и третьей CDR CDR указанного не относящегося к человеку животного. В случае, когда все CDR связывающего домена биспецифического одноцепочечного антитела заменены их соответствующими эквивалентами, например, из грызуна, как правило, говорят о «CDR-прививке», и этот термин следует понимать как относящийся к термину «гуманизированный» или его грамматически родственным вариантам, как применяют здесь. Термин «гуманизированный» или его грамматически родственные варианты включает в себя также случаи, в которых, в дополнение к замене одной или нескольких областей CDR внутри VH и/или VL первого и/или второго связывающего домена, дополнительная мутация/мутации (например, замены) по меньшей мере одного отдельного аминокислотного остатка/остатков внутри каркасных областей («FR») между CDR выполнена/выполнены так, что аминокислоты в этом/этих положениях соответствуют/соответствует аминокислоте/аминокислотам в таком/таких положении/положениях у животного, от которого происходит/происходят области CDR, используемые для замены. Как известно в данной области, такие отдельные мутации часто выполняют в каркасных областях после CDR-прививки, чтобы восстановить исходную аффинность связывания не относящегося к человеку антитела, используемого в качестве CDR-донора, для его молекулы-мишени. Термин «гуманизированный», кроме того, может относиться к замене(заменам) аминокислот в областях CDR из не относящегося к человеку животного на аминокислоту(аминокислоты) соответствующей области CDR из антитела человека, в дополнение к заменам аминокислот в каркасных областях, как описано выше.
Как применяют здесь, термин «деиммунизированный» или «деиммунизация» обозначает модификацию первого и/или второго связывающего домена по сравнению с исходной конструкцией дикого типа, чтобы сделать указанную конструкцию дикого типа неиммуногенной или менее иммуногенной для человека. Способы деиммунизации показаны, например, в WO 00/34317, WO 98/52976, WO 02/079415 или WO 92/10755. Термин «деиммунизированный» также относится к конструкциям, обладающим сниженной способностью производить T-клеточные эпитопы. Согласно этому изобретению термин «сниженная способность производить T-клеточные эпитопы» относится к удалению T-клеточных эпитопов, приводящих к специфической активации T-клетки. Кроме того, «сниженная способность производить T-клеточные эпитопы» обозначает замену аминокислот, вносящих вклад в формирование T-клеточных эпитопов, т.е. замену аминокислот, необходимых для формирования T-клеточного эпитопа. Иными словами, «сниженная способность производить T-клеточные эпитопы» относится к сниженной иммуногенности или сниженной способности индуцировать независимую от антигена пролиферацию T-клеток. Термин «T-клеточный эпитоп» относится к коротким пептидным последовательностям, которые могут высвобождаться во время деградации пептидов, полипептидов или белков внутри клеток и затем являться представленными молекулами главного комплекса гистосовместимости (MHC), чтобы запускать активацию T-клеток; см. среди прочего WO 02/066514. В случае пептидов, представляемых MHC класса II, такая активация T-клеток может затем вызывать ответ антител посредством прямой стимуляции T-клеток для продукции таких антител. «Сниженную способность производить T-клеточные эпитопы» и/или «деиммунизацию» можно измерять посредством способов, известных в данной области. Предпочтительно, деиммунизацию белков можно тестировать in vitro посредством анализа пролиферации T-клеток. В этом анализе PBMC от доноров, представляющие >80% аллелей HLA-DR в мире, скринируют по пролиферации в ответ на пептиды, либо дикого типа, либо деиммунизированные. В идеале пролиферацию клеток детектируют только после нагрузки антигенпредставляющих клеток пептидами дикого типа. Альтернативно, можно тестировать деиммунизацию посредством экспрессии тетрамеров HLA-DR, представляющих все гаплотипы. Эти тетрамеры можно тестировать по связыванию пептидов или нагружать заменителями пептидов для антигенпредставляющих клеток в анализах пролиферации. Чтобы тестировать, представлены ли деиммунизированные пептиды на гаплотипах HLA-DR, можно измерить, например, связывание флуоресцентно меченных пептидов на PBMC. Кроме того, деиммунизацию можно доказать посредством определения, формируются ли антитела против деиммунизированных молекул после введения пациентам. Предпочтительно, полученные из антител молекулы являются деиммунизированными в каркасных областях, а большинство областей CDR не являются модифицированными, чтобы получить сниженную способность производить T-клеточные эпитопы, так чтобы не влиять на аффинность связывания областей CDR. Даже удаление одного T-клеточного эпитопа приводит к сниженной иммуногенности.
В общем, вышеописанные способы помогают снизить иммуногенность терапевтических биспецифических одноцепочечных антител, как определено здесь, при введении пациентам с эпителиальными опухолями. Например, первый связывающий домен, специфически связывающийся с CD3, как показано на SEQ ID NO:77, является деиммунизированным; см. также WO2005/040220. Предпочтительно, расположение V-областей в этом CD3-связывающем домене представляет собой VH-VL.
В другом аспекте изобретение относится к биспецифическому одноцепочечному антителу, содержащему аминокислотную последовательность, выбранную из группы, состоящей из
(a) любой аминокислотной последовательности, представленной как SEQ ID NO:6, 8, 16, 18, 24, 26, 32, 34, 40, 42, 126, 130, 134 или 143;
(b) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, как показано на SEQ ID NO:5, 7, 15, 17, 23, 25, 31, 33, 39, 41, 125, 129, 133 или 142;
(c) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, гибридизующейся в строгих условиях с комплементарной последовательностью нуклеиновой кислоты из (b);
(d) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, являющейся вырожденной в результате генетического кода по отношению к нуклеотидной последовательности из (b); и
(e) аминокислотной последовательности, по меньшей мере на 85% идентичной, более предпочтительно по меньшей мере на 90% идентичной, наиболее предпочтительно по меньшей мере на 95% идентичной аминокислотной последовательности из (a) или (b).
В одном варианте осуществления изобретение относится к композиции, содержащей биспецифические одноцепочечные антитела, как определено выше. Предпочтительно, указанные биспецифические одноцепочечные антитела, как определено выше, используют в качестве фармацевтических композиций для лечения эпителиальной опухоли или эпителиальных опухолей у человека. Указанная эпителиальная опухоль(опухоли) является(являются) CEA-положительной. Цитотоксическая активность против CEA-положительных клеток эпителиальной опухоли этих фармацевтических композиций является устойчивой даже к высоким концентрациям растворимого антигена CEA в плазме пациентов с опухолью. Более того, указанные биспецифические одноцепочечные антитела, как определено выше, или анти-CEA scFv, полученные из них, можно использовать в качестве диагностических композиций для детекции эпителиальной опухоли или эпителиальных опухолей у человека, как более подробно описано ниже.
Термин «гибридизующийся в строгих условиях», как применяют здесь, относится к последовательностям нуклеиновой кислоты, способным гибридизоваться в строгих условиях гибридизации с последовательностями, показанными на SEQ ID NO:5, 7, 15, 17, 23, 25, 31, 33, 39, 41, 125, 129, 133 или 142, или комплементарными им, и кодирующим биспецифическое одноцепочечное антитело, обладающее цитотоксической активностью против CEA-положительных опухолевых клеток. «Строгие условия гибридизации» относятся к инкубации в течение ночи при 42°C в растворе, содержащем 50% формамид, 5x SSC (750 мМ NaCl, 75 мМ цитрат тринатрия), 50 мМ фосфат натрия (pH 7,6), 5x раствор Денхардта, 10% декстрансульфат и 20 мкг/мл денатурированной, фрагментированной ДНК спермы лосося, с последующей промывкой фильтров в 0,1 x SSC при приблизительно 65°C.
Является ли какая-либо конкретная молекула нуклеиновой кислоты или полипептид по меньшей мере на 80, 85, 90, 95, 96, 97, 98 или 99% идентичной нуклеотидной или аминокислотной последовательности, определенной здесь, можно определить общепринятым способом с использованием известных компьютерных программ. Предпочтительный способ для определения наилучшего общего совпадения между запрашиваемой последовательностью (последовательностью, определенной здесь) и рассматриваемой последовательностью, обозначаемый также как глобальное выравнивание последовательности, можно осуществлять с использованием компьютерной программы FASTDB на основании алгоритма Brutlag et al. (Comp. App. Biosci. 6:237-245(1990)). При выравнивании последовательности запрашиваемая и рассматриваемая последовательности, обе, представляют собой последовательности ДНК. Последовательность РНК можно сравнивать посредством перевода U в T.
Изобретение относится также к фармацевтической композиции, содержащей последовательность нуклеиновой кислоты, кодирующей биспецифическое одноцепочечное антитело, как определено здесь. Указанную нуклеиновую кислоту можно использовать, например, для способов генотерапии, чтобы лечить эпителиальную опухоль у человека, как более подробно описано ниже.
Изобретение, кроме того, относится к фармацевтической композиции, содержащей вектор, содержащий последовательность нуклеиновой кислоты, как определено выше. Предпочтительно, указанный вектор дополнительно содержит регуляторную последовательность, функционально связанную с указанной последовательностью нуклеиновой кислоты, определенной выше. Более предпочтительно, указанный вектор представляет собой экспрессирующий вектор.
Более того, вектор по настоящему изобретению может также представлять собой вектор для переноса генов или нацеливания генов. Генотерапия, основанная на введении терапевтических генов или нуклеиновых кислот в клетки посредством способов ex vivo или in vivo, является одним из наиболее важных способов переноса генов. Подходящие векторы, способы или системы доставки генов для генотерапии in vitro или in vivo описаны в литературе и известны специалисту в данной области; см., например, Giordano, Nature Medicine 2 (1996), 534-539; Schaper, Circ. Res. 79 (1996), 911-919; Anderson, Science 256 (1992), 808-813, Isner, Lancet 348 (1996), 370-374; Muhlhauser, Circ. Res. 77 (1995), 1077-1086; Onodua, Blood 91 (1998), 30-36; Verzeletti, Hum. Gene Ther. 9 (1998), 2243-2251; Verma, Nature 389 (1997), 239-242; Anderson, Nature 392 (Supp. 1998), 25-30; Wang, Gene Therapy 4 (1997), 393-400; Wang, Nature Medicine 2 (1996), 714-716; WO 94/29469; WO 97/00957; US 5580859; US 5589466; US 4394448 или Schaper, Current Opinion in Biotechnology 7 (1996), 635-640, и процитированные здесь ссылки. Молекулы нуклеиновой кислоты и векторы, как определено здесь, можно сконструировать для прямого введения или для введения посредством липосом, вирусных векторов (например, аденовирусных, ретровирусных), электропорации или других систем доставки. Кроме того, бакуловирусную систему можно использовать в качестве эукариотической экспрессирующей системы для молекул нуклеиновой кислоты, как определено здесь. Способ введения и генотерапии должен, предпочтительно, приводить к экспрессии функциональной конструкции биспецифического одноцепочечного антитела, как определено здесь, в то время как указанная экспрессированная конструкция биспецифического одноцепочечного антитела, в частности, является применимой для лечения, облегчения и/или предупреждения эпителиальной опухоли у человека.
В следующем аспекте изобретение относится к фармацевтической композиции, содержащей хозяина, трансформированного или трансфицированного вектором или нуклеиновой кислотой, как определено выше.
В следующем аспекте изобретение относится к фармацевтической композиции, как определено здесь выше, дополнительно содержащей белковое соединение, способное обеспечивать сигнал активации для иммунных эффекторных клеток.
Предпочтительно, фармацевтическая композиция, кроме того, содержит подходящие составы носителей, стабилизаторов и/или наполнителей.
В другом аспекте изобретение относится к способу получения фармацевтической композиции, как определено выше, где указанный способ включает в себя культивирование хозяина, как определено выше, в условиях, позволяющих экспрессию биспецифического одноцепочечного антитела, как определено здесь выше, и выделение продуцированного биспецифического одноцепочечного антитела из культуры.
Дополнительный аспект изобретения относится к применению биспецифического одноцепочечного антитела, как определено здесь выше, или как получено посредством способа, как определено здесь выше, молекулы нуклеиновой кислоты, как определено здесь выше, вектора, как определено здесь выше, или хозяина, как определено здесь выше, для получения фармацевтической композиции для предупреждения, лечения или облегчения эпителиальной опухоли у человека. Другой аспект изобретения относится к способу предупреждения, лечения или облегчения эпителиальной опухоли у человека, где указанный способ включает в себя стадию введения эффективного количества фармацевтической композиции по изобретению или как получено согласно способу, указанному выше. Специалист в данной области, в частности лечащий врач, может оценить успешное лечение пациента, нуждающегося во введении биспецифической молекулы/биспецифического одноцепочечного антитела по изобретению. Соответственно, схему введения, так же как дозу и время введения, может оценить указанный специалист в данной области: Соответствующее подлежащее оценке «облегчение» и/или «лечение», определено ниже.
Как применяют здесь, «эффективное количество» или «терапевтически эффективное количество» фармацевтической композиции по изобретению в контексте эпителиальных опухолей относится к количеству терапевтического средства, достаточному для разрушения, модификации, контроля или удаления первичной, регионарной или метастазирующей опухолевой ткани. Терапевтически эффективное количество может относиться к количеству терапевтического средства, достаточному для отсрочки или минимизации распространения эпителиальной опухоли(опухолей). Терапевтически эффективное количество может также относиться к количеству терапевтического средства или фармацевтического средства, предоставляющему терапевтическое преимущество при лечении или при контроле за развитием эпителиальной опухоли(опухолей). Кроме того, терапевтически эффективное количество по отношению к терапевтическому средству или фармацевтическому средству по изобретению обозначает такое количество терапевтического средства или фармацевтического средства, которое отдельно или в сочетании с другими видами терапии предоставляет терапевтическое преимущество при лечении или управлении течением эпителиальной опухоли. Применяемый в связи с количеством биспецифического одноцепочечного антитела, определенного здесь, термин может включать в себя количество, улучшающее общую терапию, уменьшающее или предотвращающее нежелательные эффекты, или усиливающее терапевтическую эффективность другого терапевтического средства, или действующее синергически (как определено здесь) с другим терапевтическим средством. Предпочтительно, терапевтически эффективное количество терапевтического средства улучшает общую терапию, уменьшает или предотвращает нежелательные эффекты, или усиливает терапевтическую эффективность другого терапевтического средства, или действует синергически с другим терапевтическим средством при лечении эпителиальной опухоли(опухолей). Например, биспецифическое одноцепочечное антитело, как определено здесь, может вызывать уменьшение диаметра эпителиальной опухоли на 20% при введении пациенту в качестве монотерапии. В отличие от этого, второе терапевтическое средство, например противораковое средство, как определено ниже, может вызывать уменьшение опухоли на 10%. Однако, если и биспецифическое одноцепочечное антитело, как определено здесь, и указанное второе терапевтическое средство вводят в сочетании в форме совместной терапии, можно наблюдать уменьшение опухоли на 50%. Такой эффект понимают как синергический эффект, как применяют здесь.
Как обозначают здесь, термин «терапия» относится к любой схеме введения, способу и/или средству, которые можно использовать для предупреждения, лечения или облегчения эпителиальной опухоли. Термин «предупреждение, лечение или облегчение эпителиальной опухоли» более подробно описан ниже. Термины «виды терапии» и «терапия» могут относиться к биологической терапии, поддерживающей терапии, химиотерапии, лучевой терапии и/или другим видам терапии, применяемым для предупреждения, лечения или облегчения эпителиальной опухоли или одного или нескольких ее симптомов.
Как применяют здесь, термины «лечить», «лечение» и «подвергаемый лечению» в контексте введения терапии или видов терапии пациенту относятся к уменьшению или облегчению прогрессии, тяжести, и/или длительности эпителиальной опухоли. Указанная эпителиальная опухоль(опухоли) может быть связана с измененной экспрессией, например, сверхэкспрессией, или активностью CEA, и/или облегчение одного или нескольких ее симптомов происходит в результате введения одного или нескольких видов терапии (включая введение одного или нескольких фармацевтических или лекарственных средств).
Наиболее предпочтительным способом введения является внутривенное введение в течение данного времени/периода времени. В то время как биспецифическое одноцепочечное антитело, как определено здесь, можно вводить отдельно, предпочтительным является введение в фармацевтически приемлемом носителе. Примеры подходящих фармацевтических носителей хорошо известны в данной области и включают в себя растворы фосфатно-солевого буфера, воду, липосомы, различные типы увлажняющих веществ, стерильные растворы и т.д. Композиции, содержащие такие носители, можно составлять посредством хорошо известных общепринятых способов. Эти фармацевтические композиции можно вводить субъекту в подходящей дозе. Режим дозирования будет определен лечащим врачом и клиническими факторами. Как хорошо известно в области медицины, дозы для каждого пациента зависят от множества факторов, включая размеры пациента, площадь поверхности тела, возраст, конкретное соединение, подлежащее введению, пол, время и способ введения, общее состояние здоровья, и другие лекарственные средства, вводимые одновременно. Препараты для парентерального введения включают в себя стерильные водные или неводные растворы и суспензии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль и подходящие для инъекции органические сложные эфиры, такие как этилолеат. Водные носители включают в себя воду, водные растворы или суспензии, включая физиологический раствор и буферную среду. Парентеральные носители включают в себя раствор хлорида натрия, раствор декстрозы Рингера, декстрозу и хлорид натрия, раствор Рингера с лактатом или жирные масла. Внутривенные носители включают в себя жидкие и питательные освежающие добавки, электролитные освежающие добавки (такие как основанные на растворе декстрозы Рингера) и т.п. Могут также присутствовать консерванты и другие добавки, например, такие как противомикробные средства, антиокислители, хелатирующие средства, инертные газы и т.п. Кроме того, композиция может содержать белковые носители, например, подобные сывороточному альбумину или иммуноглобулину, предпочтительно, человеческого происхождения. Предусматривают, что совместная терапия может включать в себя, в дополнение к белковому биспецифическому одноцепочечному антителу, дополнительные биологически активные средства, в зависимости от предназначенного применения фармацевтической композиции. Такие средства могут представлять собой лекарственные средства, действующие на желудочно-кишечную систему, средства, действующие как цитостатики, средства, предупреждающие гиперурикемию, средства, ингибирующие иммунные реакции (например, кортикостероиды, FK506), лекарственные средства, действующие на систему кровообращения, и/или такие средства, как костимулирующие молекулы T-клеток или цитокины, известные в данной области. Предпочтительно, биспецифическое одноцепочечное антитело, как определено здесь, составляют в буфере, стабилизаторе и поверхностно-активном веществе. Буфер может представлять собой фосфатный, цитратный, сукцинатный или ацетатный буфер. Стабилизатор может представлять собой аминокислоту(аминокислоты) и/или сахар. Поверхностно-активные вещества могут представлять собой детергенты, PEG или т.п. Более предпочтительно, биспецифическое одноцепочечное антитело, как определено здесь, составляют в цитрате, лизине, трегалозе и Tween 80. В качестве разбавителя для фармацевтической композиции по изобретению предпочтительным является изотонический физиологический раствор и Tween 80.
Термин «облегчение», как применяют здесь, относится к улучшению или ослаблению тяжести заболевания, т.е. эпителиальной опухоли. Например, таким облегчением может являться достижение стабильного заболевания - или даже более предпочтительно - уменьшение эпителиальной опухоли(опухолей), т.е. минимальный, частичный ответ или полный ответ, вызванный введением фармацевтических композиций по изобретению. «Стабильное заболевание» относится к стадии заболевания, при которой прогрессию/рост опухоли или значительные прогрессию/рост опухоли нельзя наблюдать или детектировать клиническими и/или гистологическими диагностическими способами. Например, уменьшение опухоли, превышающее 50% уменьшение суммы площадей поперечного сечения индексируемых очагов можно рассматривать как «частичный ответ». «Полный ответ» обозначает состояние, при котором ни одного очага(очагов) нельзя более детектировать после лечения. Ответ с уменьшением опухоли между стабильным заболеванием и частичным ответом можно рассматривать как минимальный ответ. Например, 20%, 25% или 30% уменьшение суммы площадей поперечного сечения индексируемых очагов можно рассматривать как минимальный ответ.
Термин «облегчение», как применяют здесь, относится также к уменьшению числа эпителиальных опухолей. Он, кроме того, обозначает предупреждение/замедление прогрессирования опухоли. Кроме того, улучшение общей выживаемости пациентов с опухолью после лечения по сравнению с пациентами с опухолью без лечения можно считать «облегчением», как применяют здесь. Это относится, с учетом необходимых изменений, к улучшению выживаемости без прогрессии или к улучшению выживаемости без рецидивов пациентов с опухолью после лечения по сравнению с пациентами с опухолью без лечения. Кроме того, термин «облегчение» может также относиться к уменьшению интенсивности симптомов эпителиальной опухоли, что приводит, например, к улучшению качества жизни пациентов с опухолью после лечения.
Термин «предупреждение эпителиальной опухоли», как применяют здесь, следует понимать следующим образом: после хирургического удаления первичной эпителиальной опухоли(опухолей) у пациента-человека и/или после химиотерапевтического или радиологического лечения первичной эпителиальной опухоли(опухолей), может случиться, что не все опухолевые клетки можно удалить из организма. Однако эти оставшиеся опухолевые клетки могут давать начало рецидивирующему раку, т.е. местному рецидиву и/или метастазам у пациента. Метастазирование представляет собой частое осложнение при раке, хотя процесс, посредством которого раковые клетки могут распространяться из первичной опухоли(опухолей) для формирования отдаленных колоний, недостаточно изучен. Метастазирующие раки почти без исключения являются неизлечимыми, что приводит к необходимости новых терапевтических способов. Фармацевтическую композицию по изобретению можно использовать для уничтожения этих распространившихся опухолевых клеток, чтобы предупредить формирование вторичных опухолей (происходящих из опухолевых клеток, остающихся в организме после первичной терапии). Таким образом, фармацевтическая композиция помогает предупреждать формирование местного рецидива и/или метастазов у пациентов с опухолью.
Успех противоопухолевой терапии можно мониторировать посредством общепринятых стандартных способов для соответствующих нозологических форм, например посредством компьютерной томографии, рентгенографии, магнитно-резонансной томографии (например, для оценки ответа на основании критериев Национального института рака [Cheson (1999), J. Clin. Oncol.; 17(4):1244]), позитронно-эмиссионного томографического сканирования, эндоскопии, активированной флуоресценцией сортировки клеток, аспирации костного мозга, плевральной или перитонеальной жидкости, ткани/гистологии и различных специфических для эпителиальной опухоли параметров клинической химии (например, концентрации растворимого CEA в сыворотке), и можно использовать другие общепринятые стандартные способы. Кроме того, можно использовать анализы, определяющие активацию T-клеток; см., например, WO99/054440. Можно также использовать статистику для определения общей выживаемости, улучшения выживаемости без прогрессии или улучшения выживаемости без рецидивов пациентов с опухолью после лечения по сравнению с пациентами с опухолью без лечения.
Предпочтительно, указанная эпителиальная опухоль представляет собой гастроинтестинальную аденокарциному, аденокарциному молочной железы или аденокарциному легкого. Указанная гастроинтестинальная аденокарцинома, более предпочтительно, представляет собой колоректальную, панкреатическую аденокарциному, аденокарциному пищевода или желудка.
Даже более предпочтительно, указанная фармацевтическая композиция по изобретению предназначена для лечения прогрессирующих опухолей, опухолей на поздних стадиях, пациентов с опухолью с большим объемом/массой опухоли, метастазирующих опухолей или пациентов с опухолью с концентрацией CEA в сыворотке, превышающей 100 нг/мл (как определено, например, посредством ELISA).
В другом предпочтительном варианте осуществления применений или способов по изобретению указанная фармацевтическая композиция, как определено здесь выше, является подходящей для введения в сочетании с дополнительным лекарственным средством, т.е. как часть совместной терапии.
В конкретных вариантах осуществления биспецифическое одноцепочечное антитело или фармацевтическую композицию, как определено здесь, вводят в сочетании с одним или несколькими другими видами терапии. В конкретных вариантах осуществления биспецифическое одноцепочечное антитело или фармацевтическую композицию, как определено здесь, вводят пациенту одновременно с одним или несколькими другими видами терапии. Предпочтительно, такие виды терапии являются применимыми для лечения эпителиальных опухолей. Термин «одновременно» не является ограниченным введением фармацевтической композиции или лекарственных средств точно в одно и то же время, а скорее означает, что биспецифическое одноцепочечное антитело или фармацевтическую композицию, как определено здесь, и другое средство(средства) вводят пациенту в такой последовательности и внутри такого интервала времени, что биспецифическое одноцепочечное антитело или фармацевтическая композиция, как определено здесь, может действовать совместно с другим средством для предоставления увеличенного преимущества по сравнению с тем, когда их вводят по-другому. Например, каждое терапевтическое средство можно вводить в одно и то же время или последовательно в любом порядке в различные временные точки; однако при введении не в одно и то же время их следует вводить достаточно близко по времени, чтобы обеспечивать желательный терапевтический эффект.
Каждое терапевтическое средство можно вводить отдельно, в любой подходящей форме и любым подходящим способом. В других вариантах осуществления биспецифическое одноцепочечное антитело или фармацевтическую композицию, как определено здесь, вводят до, во время или после хирургической операции. Предпочтительно, при операции полностью удаляют локализованные эпителиальные опухоли или уменьшают размер больших эпителиальных опухолей. Хирургическую операцию можно проводить также в качестве предупреждающей меры или для уменьшения боли.
Размер доз и частота введения, представленные здесь, входят в объем термина «терапевтически эффективный», как определено выше. Доза и частота, как правило, будут дополнительно меняться в соответствии с факторами, специфическими для каждого пациента, в зависимости от конкретных вводимых терапевтических или профилактических средств, тяжести и типа эпителиальной опухоли, способа введения, так же как от возраста, массы тела, ответа и истории болезни пациента. Специалист в данной области может выбрать подходящие режимы с учетом таких факторов и следуя, например, дозам, опубликованным в литературе и рекомендованным в Physicians' Desk Reference (59th ed., 2005).
В некоторых вариантах осуществления терапию посредством введения биспецифического одноцепочечного антитела или фармацевтической композиции, как определено здесь, сочетают с введением одного или нескольких видов терапии, таких как виды химиотерапии, радиотерапии, гормональной терапии и/или биологической терапии/иммунотерапии. Лекарственные средства включают в себя в качестве неограничивающих примеров, белковые молекулы, включая, в качестве неограничивающих примеров, пептиды, полипептиды, белки, включая посттранскрипционно модифицированные белки, антитела и т.д.; или малые молекулы (менее чем 1000 Да), неорганические или органические соединения; или молекулы нуклеиновой кислоты, включая двухцепочечную или одноцепочечную ДНК, или двухцепочечную или одноцепочечную РНК, так же как трехспиральные молекулы нуклеиновой кислоты. Лекарственные средства можно получать из любого известного организма (включая, в качестве неограничивающих примеров, животных, растения, бактерии, грибы и протисты или вирусы) или из библиотеки синтетических молекул.
В конкретном варианте осуществления способы и применения по изобретению включают в себя введение биспецифического одноцепочечного антитела или фармацевтической композиции, как определено здесь, в сочетании с введением одного или нескольких лекарственных средств, являющихся ингибиторами киназы, таких как гефитиниб (иресса), эрлотиниб (тарцева), антитела против EGFR (например, цетуксимаб; эрбитукс), или антитела против Her2/neu (например, трастузумаб; герцептин), описанных в данной области; см., например, Hardie and Hanks (1995). The Protein Kinase Facts Book, I and II, Academic Press, San Diego, California.
В другом конкретном варианте осуществления способы и применения по изобретению включают в себя введение биспецифического одноцепочечного антитела или фармацевтической композиции, как определено здесь, в сочетании с введением одного или нескольких лекарственных средств, являющихся ингибиторами ангиогенеза, таких как антитела против VEGF (например, бевацизумаб; авастин), низкомолекулярные соединения (например, ваталаниб или сорафениб) или COX-ингибиторы, описанные в данной области.
В другом конкретном варианте осуществления способы и применения по изобретению включают в себя введение биспецифического одноцепочечного антитела или фармацевтической композиции, как определено здесь, в сочетании с введением одного или нескольких лекарственных средств, являющихся противораковыми средствами, таких как 5-фторурацил, лейковорин, капецитабин, оксалиплатин, иринотекан, гемцитабин, доксорубицин, эпирубицин, этопозид, цисплатин, карбоплатин, таксаны (например, доцетаксел, паклитаксел), описанные в данной области.
Предпочтительно, совместная терапия для пациента с эпителиальной опухолью с использованием биспецифического одноцепочечного антитела или фармацевтической композиции, как определено здесь, в сочетании с дополнительным терапевтическим средством(средствами) приводит к синергическому эффекту. Как применяют здесь, термин «синергический» относится к сочетанию видов терапии (например, сочетанию биспецифического одноцепочечного антитела, как определено здесь, и дополнительного терапевтического средства(средств), как указано выше), которое проявляет больший эффект, чем аддитивные эффекты любых двух или более отдельных видов терапии (например, одного или нескольких лекарственных средств). Например, биспецифическое одноцепочечное антитело, как определено здесь, может вызывать уменьшение диаметра эпителиальной опухоли на 20% при введении пациенту в качестве монотерапии. В отличие от этого, второе терапевтическое средство, например противораковое средство, как определено ниже, может вызывать уменьшение опухоли на 10%. Однако, если и биспецифическое одноцепочечное антитело, как определено здесь, и указанное второе терапевтическое средство вводят в сочетании в форме совместной терапии, можно наблюдать уменьшение опухоли на 50%.
Синергический эффект сочетания видов терапии (например, сочетания биспецифического одноцепочечного антитела, как определено здесь, и дополнительного терапевтического средства(средств), как указано выше) позволяет использование более низких доз одного или нескольких видов терапии (например, одного или нескольких лекарственных средств) и/или менее частое введение указанных видов терапии пациенту с заболеванием, например, с эпителиальной опухолью. Возможность использовать более низкие дозы видов терапии (например, лекарственных средств) и/или вводить указанные лекарственные средства менее часто снижает токсичность, связанную с введением указанных видов терапии субъекту, без уменьшения эффективности указанных видов терапии для предупреждения или лечения заболевания, например, эпителиальной опухоли. Кроме того, синергический эффект может приводить к улучшенной эффективности видов терапии (например, лекарственных средств) для предупреждения, управления течением, лечения и/или облегчения эпителиальной опухоли (которая может являться связанной с измененной экспрессией (например, сверхэкспрессией) или активностью CEA). Наконец, синергический эффект сочетания нескольких видов терапии (например, лекарственных средств) может прекращать или уменьшать неблагоприятные или нежелательные побочные эффекты, связанные с использованием любого отдельного вида терапии.
При указанной совместной терапии активное средство можно, необязательно, включать в ту же самую фармацевтическую композицию, что и биспецифическое одноцепочечное антитело, определенное здесь, или можно включать в отдельные фармацевтические композиции. В этом последнем случае указанная отдельная фармацевтическая композиция пригодна для введения до, во время или после введения указанной фармацевтической композиции, содержащей биспецифическое одноцепочечное антитело, как определено здесь. Дополнительное лекарственное средство или фармацевтическая композиция может представлять собой небелковое соединение или белковое соединение. В случае, когда дополнительное лекарственное средство представляет собой белковое соединение, является преимущественным, чтобы белковое соединение являлось способным обеспечивать сигнал активации для иммунных эффекторных клеток.
Предпочтительно, указанное белковое соединение или небелковое соединение можно вводить одновременно или не одновременно с биспецифическим одноцепочечным антителом, как определено здесь выше, с молекулой нуклеиновой кислоты, как определено здесь выше, с вектором как определено здесь выше, или с хозяином, как определено здесь выше. Предпочтительно, указанный субъект, подлежащий лечению, представляет собой человека.
В следующем варианте осуществления одноцепочечное биспецифическое антитело или анти-CEA scFv, как определено здесь, можно конъюгировать с диагностическим или подлежащим детекции средством. Такую диагностику и детекцию можно осуществлять посредством объединения антитела или scFv с веществами, которые можно детектировать, например, с различными ферментами, такими как пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза или ацетилхолинэстераза; простетическими группами, такими как стрептавидин/биотин и авидин/биотин; флуоресцентными веществами, такими как умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламин флуоресцеина, дансилхлорид или фикоэритрин; люминесцентными веществами, такими как люминол; биолюминесцентными веществами, такими как люцифераза, люциферин, и экворин; радиоактивными веществами и изотопами, такими как кобальт (57Co), индий (115In, 113In, 112In, 111In), иод (131I, 125I, 123I, 121I) или иттрий (90Y), испускающими позитроны металлами, с использованием различных видов позитронно-эмиссионной томографии и нерадиоактивных парамагнитных ионов металлов.
Способы конъюгации веществ с антителами хорошо известны. Вещества можно конъюгировать с антителами любым способом, известным в данной области, включая, в качестве неограничивающих примеров, альдегид/шиффову связь, сульфгидрильную связь, кислотно-лабильную связь, цис-аконитиловую связь, гидразоновую связь, подверженную ферментативной деградации связь; см., в общем, Garnett, 2002, Adv. Drug Deliv. Rev. 53:171-216. Хорошо известны дополнительные способы для конъюгации групп с антителами, см., например, Arnon et al., Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy. In Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985). Способы для слияния или конъюгации антител с полипептидными группами известны в данной области; см., например; Ashkenazi et al., 1991, PNAS 88: 10535-10539. Слияние антитела с группой необязательно должно являться непосредственным, но может происходить через линкерные последовательности. Такие линкерные молекулы хорошо известны в данной области и описаны в Denardo et al., 1998, Clin Cancer Res. 4:2483-90; Peterson et al., 1999, Bioconjug. Chem. 10:553.
В следующем аспекте изобретение относится к набору, содержащему биспецифическое одноцепочечное антитело, как определено здесь выше, молекулу нуклеиновой кислоты, как определено здесь выше, вектор, как определено здесь выше, или хозяина, как определено здесь выше.
Эти и другие варианты осуществления описаны и охвачены описанием и примерами по настоящему изобретению. Рекомбинантные способы и методы в иммунологии описаны, например, в Sambrook et al. Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press, 3rd edition 2001; Lefkovits; Immunology Methods Manual; The Comprehensive Sourcebook of Techniques; Academic Press, 1997; Golemis; Protein-Protein Interactions: A Molecular Cloning Manual; Cold Spring Laboratory Press, 2002. Дополнительную литературу относительно любых антител, способов, применений и соединений для использования в соответствии с настоящим изобретением можно найти в общедоступных библиотеках и базах данных, с использованием, например, электронных устройств. Например, общедоступную базу данных «Medline», доступную в интернете, можно использовать, например по http://www.ncbi.nlm. nih.gov/PubMed/medline.html. Дополнительные базы данных и адреса, такие как http://www.ncbi.nim.nih.gov/, http://www.infobioaen.fr/, http://www.fmi.ch/bioloqv/research tools.html, http://www.tiqr.orQ/, известны специалистам в данной области и их можно также получить с использованием, например, http://www.lvcos.com. Связанные с опухолями темы см., например, на http://www.nih.gov или http://www.dkfz.de.
На чертежах показано:
Фигура 1: Анализ связывания FACS различных реактивных для CEA человека биспецифических одноцепочечных конструкций с клетками CHO, трансфицированными CEA человека, и CD3-положительными клетками HPB-AII соответственно. В качестве положительного контроля для связывания с CEA использовали моноклональное антитело Col-1. Для контроля связывания с CD3 человека использовали биспецифическую одноцепочечную конструкцию CD19xCD3, как описано в WO 99/054440. Для этого положительного контроля толстой линией представлены клетки, инкубированные с 10 мкг/мл очищенного биспецифического одноцепочечного антитела CD19xCD3, которые затем инкубировали с антителом анти-His и антителом для детекции. Тонкой линией графика отражен отрицательный контроль: клетки, инкубированные с антителом анти-His и с антителом для детекции. Активность связывания для человеческого (связанного с мембраной) CEA и человеческого CD3 являлось возможным детектировать для CEAI VHVLxSEQ ID NO.77 VHVL, CEAI VLVHxSEQ ID NO.77 VHVL, CEAII VHVLxSEQ ID NO.77 VHVL, CEAIII VLVHxSEQ ID NO.77 VHVL и CEAIII VHVLxSEQ ID NO.77 VHVL. На соответствующих графиках, соответствующих биспецифическим одноцепочечным антителам, как описано по изобретению, тонкой линией представлен отрицательный контроль, светлой толстой линией представлены клетки, инкубированные с культуральным супернатантом, тогда как темной толстой (крайней справа) линией представлены клетки, инкубированные с 10 мкг/мл очищенного биспецифического одноцепочечного антитела.
Фигура 2: Сигналы связывания биспецифических одноцепочечных антител анти-CEA/анти-CD3 CEAI VHVLxSEQ ID NO:77 VHVL, CEAII VHVLxSEQ ID NO:77 VHVL и CEAIII VHVLxSEQ ID NO:77 VHVL и анти-CEA антитела Col-1 с растворимым CEA, детектированного прямым ELISA. Биспецифические одноцепочечные антитела CEAI VHVLxSEQ ID NO:77 VHVL (анти-CEA связывающий домен, полученный из mAb A5B7), CEAII VHVLxSEQ ID NO.77 VHVL (анти-CEA связывающий домен, полученный из mAb T84.66) и CEAIII VHVLxSEQ ID NO.77 VHVL (анти-CEA связывающий домен, полученный из mAb MFE-23) и моноклональное антитело мыши Col-1 специфически связывают иммобилизованный растворимый CEA человека. Не обнаружено сигналов связывания в отсутствие растворимого антигена CEA (контроль с PBS).
Фигура 3: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляли T-клетки на лизис клеток CHO, трансфицированных CEA, в отсутствие растворимого CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Чтобы продемонстрировать специфичность перенаправленного лизиса, не реактивную для CEA биспецифическую одноцепочечную конструкцию включали в качестве отрицательного контроля. Являлось возможным показать цитотоксическую активность против клеток-мишеней, трансфицированных CEA человека (клеток CHO-CEA+), для различного расположения доменов, т.е. для SEQ ID NO.77 VHVLxCEAI VHVL и SEQ ID NO.77 VHVLxCEAI VLVH (обе конструкции с анти-CD3 связывающим доменом на N-конце), так же как для CEAI VLVHxSEQ ID NO.77 VHVL и CEAI VHVLxSEQ ID NO.77 VHVL (анти-CD3 связывающий домен на C-конце). Нетрансфицированные клетки CHO (с отсутствием CEA человека) использовали в качестве отрицательного контроля.
Фигура 4: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляли T-клетки на лизис клеток CHO, трансфицированных CEA, в отсутствие растворимого CEA. Чтобы показать специфичность перенаправленного лизиса, нетрансфицированные клетки CHO включали в качестве отрицательного контроля. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Для CEA I-HL (CEAI VHVLxSEQ ID NO.77 VHVL), CEA III-LH (CEAIII VLVHxSEQ ID NO.77 VHVL), CEA III-HL (CEAIII VHVLxSEQ ID NO.77 VHVL) и CEA II HL (CEAII VHVLxSEQ ID NO.77 VHVL) показали цитотоксическую активность против трансфицированных CEA человека клеток CHO. Нетрансфицированные клетки CHO (с отсутствием CEA человека) использовали в качестве отрицательного контроля для CEA I-LH (CEAI VLVHxSEQ ID NO.77 VHVL), CEA III-HL (CEAIII VHVLxSEQ ID NO.77 VHVL) и CEA II HL (CEAII VHVLxSEQ ID NO.77 VHVL). CEAI обозначает вариабельную область, полученную из mAb A5B7 мыши, CEAII представляет собой вариабельную область, полученную из mAb T84.66 мыши, и CEAIII относится к вариабельной области из mAb MFE-23 мыши.
Фигура 5: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток CHO, трансфицированных CEA, в присутствии растворимого CEA человека. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Цитотоксическую активность, опосредованную CEAI VLVHxSEQ ID NO.77 VHVL и CEAI VHVLxSEQ ID NO.77 VHVL, не ингибировали увеличивающиеся количества растворимого CEA человека, вплоть до 1 мкг/мл. CEAI представляет собой вариабельную область, полученную из mAb A5B7 мыши.
Фигура 6: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток CHO, трансфицированных CEA, в присутствии растворимого CEA человека. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Цитотоксическую активность, опосредованную SEQ ID NO.77 VHVLxCEAI VHVL и SEQ ID NO.77 VHVLxCEAI VLVH, не ингибировали увеличивающиеся количества растворимого CEA человека, вплоть до 1 мкг/мл. CEAI представляет собой вариабельную область, полученную из mAb A5B7 мыши.
Фигура 7: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток CHO, трансфицированных CEA, в присутствии растворимого CEA человека. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Цитотоксическую активность CEAII VHVLxSEQ ID NO.77 VHVL ингибировали увеличивающиеся количества растворимого CEA. CEAII VHVL получена из mAb T84.66.
Фигура 8: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток CHO, трансфицированных CEA, в присутствии растворимого CEA человека. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. В то время как опосредованная CEAI VHVLxSEQ ID NO.77 VHVL цитотоксичность является устойчивой к ингибированию растворимым антигеном CEA, опосредованную CEAIII VHVLxSEQ ID NO.77 VHVL цитотоксическую активность ингибируют даже низкие количества растворимого CEA. CEAIII VHVL получена из mAb MFE-23, в то время как CEAI представляет собой вариабельную область, полученную из mAb A5B7 мыши.
Фигура 9: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток Kato III в присутствии увеличивающихся количеств растворимого антигена CEA. Нативные PBMC человека использовали в качестве эффекторных клеток. Опосредованная CEAII VHVLxSEQ ID NO:77 цитотоксическая активность не является устойчивой к растворимому CEA. CEAII VHVL получена из mAb T84.66.
Фигура 10: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток Kato III в присутствии увеличивающихся количеств растворимого антигена CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Опосредованная CEAI VHVLxSEQ ID NO.77 VHVL цитотоксичность является устойчивой к растворимому CEA. В отличие от этого, опосредованную CEAII VHVLxSEQ ID NO.77 VHVL цитотоксическую активность ингибируют увеличивающиеся количества растворимого CEA. CEAII VHVL получена из mAb T84.66, тогда как CEAI представляет собой вариабельную область, полученную из mAb A5B7 мыши.
Фигура 11: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток CHO, трансфицированных CEA, в присутствии увеличивающихся количеств растворимого антигена CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Опосредованную CEAII VHVLxSEQ ID NO.77 VHVL цитотоксическую активность ингибируют увеличивающиеся количества растворимого CEA. CEAII VHVL получена из mAb T84.66.
Фигура 12: Анализ проточной цитометрии периплазматических препаратов, содержащих Flag-меченные фрагменты белка scFv из выбранных клонов. Периплазматические препараты растворимых фрагментов белка scFv добавляли к 100000-200000 трансфицированных CEA клеток CHO. Для детекции использовали моноклональное антитело анти-Flag, затем PE-меченное поликлональное антитело против антител мыши. Связывание ScFv с клетками измеряли по увеличению интенсивности флуоресценции по сравнению с клетками, которые инкубировали с одним PBS. Интенсивность флуоресценции отмечали точками по оси X, число событий отмечали точками по оси Y. Отрицательный контроль (PBS и реагенты для детекции) показан как закрашенная кривая, соответствующие scFv показаны серыми линиями. Сдвиг вправо указывает на положительное связывание с клетками. Все scFv, т.е. A-121, A-183, A-240, A-313, A-290, A-315, A4-35, A4-52 и MP2-A5, связывались со связанным с мембраной CEA на клетках CHO. Каждый из scFv состоял из VH-области A5B7 мыши и VL-области человека, как описано в примере 6.
Фигура 13: Анализ проточной цитометрии периплазматических препаратов, содержащих Flag-меченные фрагменты белка scFv из выбранных клонов. Периплазматические препараты растворимых фрагментов белка scFv добавляли к 100000-200000 трансфицированных CEA клеток CHO. Детекцию проводили посредством моноклонального анти-Flag антитела, затем PE-меченного поликлонального антитела против антител мыши. Связывание ScFv с клетками измеряли по увеличению интенсивности флуоресценции по сравнению с клетками, которые инкубировали с одним PBS. Интенсивность флуоресценции отмечали точками по оси X, число событий отмечали точками по оси Y. Отрицательный контроль (PBS и реагенты для детекции) показан как закрашенная кривая, соответствующие scFv показаны серыми линиями. Сдвиг вправо указывает на положительное связывание с клетками. Полностью человеческие конструкции scFv MP510_3-A5.3, MP510_3-B9.1 и MP510_3-D8.1 связываются со связанным с мембраной CEA на клетках CHO. Каждый из этих scFv состоит из VH-области человека и VL-области человека A240, как описано в примере 7. 240 Vlambda.3 представляет собой scFv, состоящий из VH-области A5B7 мыши и области VL A-240 человека. Эта конструкция также обладает активностью связывания CEA.
Фигура 14: Анализ FACS связывания различных реактивных для CEA человека биспецифических одноцепочечных конструкций с клетками Kato III и клетками HPB-AII соответственно. Толстой линией представлены клетки, инкубированные с супернатантом культуры клеток от трансфицированных клеток CHO, инкубированных с антителом анти-His и антителом для детекции. Тонкая линия на графике отражает отрицательный контроль: клетки, инкубированные с антителом анти-His и антителом для детекции. Конструкции человеческого биспецифического одноцепочечного антитела A5 VH- A240 VLxSEQ ID NO.77 VHVL, B9 VH-A240 VLxSEQ ID NO.77 VHVL и D8 VH-A240 VLxSEQ ID NO.77 VHVL связываются с CEA человека на клетках Kato и с CD3 человека на клетках HPB-AII. CEAI VH-A240 VLxSEQ ID NO.77 VHVL с VH-областью из связывающего CEA домена, полученного из mAb A5B7, обладает такой же активностью связывания.
Фигура 15: Анализ цитотоксичности указанных CEA-реактивных биспецифических одноцепочечных конструкций, перенаправленных на клетки CHO, трансфицированные CEA, в отсутствие растворимого CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Цитотоксическую активность являлось возможным детектировать для A5 VH-A240 VLxSEQ ID NO.77 VHVL, B9 VH-A240 VLxSEQ ID NO.77 VHVL, D8 VH-A240 VLxSEQ ID NO.77 VHVL и CEAI VH-A240 VLxSEQ ID NO.77 VHVL. CEAI VH представляет собой VH-область, полученную из mAb A5B7.
Фигура 16: Анализ цитотоксичности указанных CEA-реактивных биспецифических одноцепочечных конструкций, перенаправленных на клетки CHO, трансфицированные CEA, в отсутствие растворимого CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. На этой фигуре показана цитотоксическая активность для A240 VL-A5 VHxSEQ ID NO.77 VHVL, A240 VL-B9 VHxSEQ ID NO.77 VHVL, A240 VL-D8 VHxSEQ ID NO.77 VHVL и A240 VL-CEAI VHxSEQ ID NO.77 VHVL.
Фигура 17: Анализ цитотоксичности указанных CEA-реактивных биспецифических одноцепочечных конструкций, перенаправленных на клетки CHO, трансфицированные CEA, в отсутствие растворимого CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Цитотоксичность против CEA+ клеток-мишеней показали для SEQ ID NO.77 VHVLxA5 VH-A240 VL, SEQ ID NO.77 VHVLxB9 VH-A240 VL, SEQ ID NO.77 VHVLxD8 VH-A240 VL, SEQ ID NO.77 VHVLxCEAI VH-A240 VL и SEQ ID NO.77 VHVLxCEAI VLVH.
Фигура 18: Анализ цитотоксичности указанных CEA-реактивных биспецифических одноцепочечных конструкций, перенаправленных на клетки CHO, трансфицированные CEA, в отсутствие растворимого CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Цитотоксическую активность показали для SEQ ID NO.77 VHVLxA240 VL-A5 VH, SEQ ID NO.77 VHVLxA240 VL-B9 VH, SEQ ID NO.77 VHVLxA240 VL-D8 VH, SEQ ID NO.77 VHVLxA240VL-CEAI VH и SEQ ID NO.77 VHVLxCEAI VLVH.
Фигура 19: Анализ цитотоксичности указанных CEA-реактивных биспецифических одноцепочечных конструкций, перенаправленных на клетки CHO, трансфицированные CEA, в присутствии увеличивающихся количеств растворимого антигена CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. На фигуре показана устойчивость цитотоксической активности конструкций человеческого биспецифического одноцепочечного антитела к растворимому антигену CEA, как приведено в качестве примера для A5 VH-A240 VLxSEQ ID NO.77 VHVL и B9 VH-A240 VLxSEQ ID NO.77 VHVL.
Фигура 20: Анализ цитотоксичности указанных CEA-реактивных биспецифических одноцепочечных конструкций, перенаправленных на клетки CHO, трансфицированные CEA, в присутствии увеличивающихся количеств растворимого антигена CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Для конструкций человеческого биспецифического одноцепочечного антитела D8 VH-A240 VLxSEQ ID NO.77 VHVL и CEAI VH-A240 VLxSEQ ID NO.77 VHVL также показали устойчивость к растворимому антигену CEA.
Фигура 21: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток CHO, трансфицированных CEA, в отсутствие растворимого CEA. Чтобы продемонстрировать специфичность перенаправленного лизиса, нетрансфицированные клетки CHO включали в качестве отрицательного контроля. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. Для A240 VL-B9 VHxSEQ ID NO.77 VHVL, SEQ ID NO.77 VHVLxA240 VL-B9 VH, SEQ ID NO.77 VHVLxB9 VH-A240 VL, B9 VH-A240 VLxSEQ ID NO.77 VHVL и SEQ ID NO.77 VHVLxCEA I VHVL выявили цитотоксическую активность против трансфицированных CEA человека клеток CHO.
Фигура 22: Указанные CEA-реактивные биспецифические одноцепочечные конструкции перенаправляют T-клетки на лизис клеток CHO-CEA+ в присутствии увеличивающихся количеств растворимого антигена CEA. Стимулированные CD8+ T-клетки человека использовали в качестве эффекторных клеток. Опосредованная A240 VL-B9 VHxSEQ ID NO.77 VHVL цитотоксическая активность является устойчивой к растворимому CEA.
Фигура 23: На высокоразрешающей катионообменной хроматограмме для биспецифической одноцепочечной конструкции A240 VL-B9 VHxSEQ ID NO.77 VHVL синей линией (верхняя кривая) показаны все заряженные изоформы белка. Детектировали один отдельный пик, показывающий высокую гомогенность конструкции.
Фигура 24: Анализ стабильности белка, основанный на оценке цитотоксичности после инкубации в плазме человека в течение 24 часов. CEA-реактивную биспецифическую одноцепочечную конструкцию перенаправляли на клетки CHO, трансфицированные CEA, в отсутствие растворимого CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. На фигуре показана стабильность в плазме человека биспецифической одноцепочечной конструкции A240 VL-B9 VHxSEQ ID NO.77 VHVL. На цитотоксическую активность конструкции не влияют белки плазмы в физиологических условиях.
Фигура 25: На высокоразрешающей катионообменной хроматограмме для биспецифической одноцепочечной конструкции SEQ ID NO.77 VHVLxE12 VH-A240 VL синей линией (верхняя кривая) показаны все заряженные изоформы белка. На фигуре показана гомогенность биспецифической одноцепочечной конструкции SEQ ID NO.77 VHVLxE12 VH-A240 VL.
Фигура 26: Анализ стабильности белка, основанный на оценке цитотоксичности после инкубации в плазме человека в течение 24 часов. CEA-реактивную биспецифическую одноцепочечную конструкцию перенаправляли на клетки CHO, трансфицированные CEA, в отсутствие растворимого CEA. Стимулированные CD8-положительные CTL человека использовали в качестве эффекторных клеток. На этой фигуре показана стабильность в плазме человека биспецифической одноцепочечной конструкции SEQ ID NO.77 VHVLxE12 VH-A240 VL. На цитотоксическую активность конструкции не влияют белки плазмы в физиологических условиях.
Фигура 27: Указанная CEA-реактивная биспецифическая одноцепочечная конструкция перенаправляет T-клетки на лизис клеток CHO-CEA+ в присутствии увеличивающихся количеств растворимого антигена CEA. Стимулированные CD8+ T-клетки человека использовали в качестве эффекторных клеток. Биспецифическая одноцепочечная конструкция SEQ ID NO.77 VHVLxE12 VH-A240 VL опосредует цитотоксическую активность, устойчивую к растворимому CEA.
Следующие примеры иллюстрируют изобретение.
ПРИМЕР 1: Получение клеток CHO, трансфицированных CEA человека (родственная карциномоэмбриональному антигену молекула клеточной адгезии 5; CEACAM5)
CEA-положительные клетки Kato III (линия клеток карциномы желудка человека; ATCC HTB-103) использовали для получения суммарной РНК, которую выделяли согласно инструкциям из руководства к набору (Qiagen, RNeasy Mini Kit). Полученную РНК использовали для синтеза кДНК посредством обратной транскрипции со случайным образом синтезированными праймерами. Для клонирования полноразмерной последовательности антигена CEA использовали следующие олигонуклеотиды: 5' CEACAM5 EcoRI GAATTCGCCACCATGGAGTCTCCCTCGGCCCC (SEQ ID NO:74) и 3' CEACAM5 Sal I GTCGACCTATATCAGAGCAACCCC (SEQ ID NO:75). ПЦР (денатурация при 93°C в течение 5 мин, отжиг при 58°C в течение 1 мин, удлинение при 72°C в течение 1 мин в течение первого цикла; денатурация при 93°C в течение 1 мин, отжиг при 58°C в течение 1 мин, удлинение при 72°C в течение 1 мин в течение 30 циклов; конечное удлинение при 72°C в течение 5 мин) использовали для амплификации кодирующей последовательности. Затем продукт ПЦР расщепляли EcoRI и SalI, лигировали в расщепленный соответствующим образом экспрессирующий вектор pEF-DHFR и трансформировали E.coli. Выделенную плазмидную ДНК секвенировали и сравнивали с установленной нуклеотидной последовательностью CEACAM5 (NM_004363 в Национальном центре биотехнологической информации, http://www.ncbi.nlm.nih.gov/). Вышеописанные способы осуществляли в соответствии со стандартными протоколами (Sambrook, Molecular Cloning; A Laboratory Manual, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (1989; 2001)). Клон с верифицированной нуклеотидной последовательностью трансфицировали в дефицитные по DHFR клетки CHO для эукариотической экспрессии конструкции. Эукариотическую экспрессию белка в дефицитных по DHFR клетках CHO осуществляли, как описано Kaufmann (Kaufmann R.J., Methods Enzymol. 185 (1990), 537-566). Амплификацию гена в конструкции индуцировали посредством увеличивающихся концентраций MTX до конечной концентрации вплоть до 20 нМ MTX. Затем трансфицированные клетки тестировали по экспрессии антигена CEA с использованием анализа FACS. Для этой цели 2,5x105 трансфицированных клеток инкубировали с 5 мкг/мл моноклонального антитела COL-1 мыши (NO:MS-613-P1ABX, Neomakers; Fremont, CA, USA). Связывание антитела детектировали с помощью конъюгированного с R-фикоэритрином аффинно очищенного F(ab')2 фрагмента антитела козы против IgG мыши, специфического для фрагмента Fc-гамма, разведенного 1:100 в 50 мкл PBS с 2% FCS (полученного из Dianova, Hamburg, Germany). Клетки анализировали проточной цитометрией на FACS-Calibur (Becton Dickinson, Heidelberg). Окрашивание для FACS и измерение интенсивности флуоресценции проводили, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002). В результате для трансфектантов было показано явное положительное окрашивание для антигена CEA человека.
ПРИМЕР 2: Получение биспецифических одноцепочечных антител CEAxCD3
В общем, молекулы биспецифического одноцепочечного антитела, каждая из которых содержит домен со специфичностью связывания для антигена CEA человека, так же как деиммунизированный домен со специфичностью связывания для антигена CD3 человека, показанный на SEQ ID NO.77, конструировали, как описано в таблице 1. Расположение V-областей в этом связывающем CD3 домене всегда представляет собой VH-VL. Этот деиммунизированный анти-CD3 связывающий домен, применяемый в биспецифических одноцепочечных антителах, как определено здесь, описан ранее, например, в WO2005/040220.
1. Форматы молекул биспецифического одноцепочечного антитела, обладающего специфичностями анти-CEA и анти-CD3
(N-конец → C-конец)
Вышеупомянутые конструкции, содержащие области вариабельной легкой цепи (VL) и вариабельной тяжелой цепи (VH), специфические для антигена CEA человека, полученные из моноклональных антител, гибридом или полученные посредством направляемого фаговым дисплеем отбора (PDGS), получали посредством синтеза гена и последующего клонирования в экспрессирующем векторе, содержащем сочетания специфических для CD3 VH и VL. Получение указанных биспецифических одноцепочечных конструкций можно также проводить согласно рекомбинантным способам, описанным, например, в Sambrook (в приводившейся выше цитате). Подробная инструкция для этого приведена, например, в WO 99/054440.
Связывающий домен анти-CD3 соответствует деиммунизированному домену со специфичностью связывания для антигена CD3 человека. Расположение V-областей деиммунизированного связывающего домена анти-CD3 в биспецифических одноцепочечных конструкциях, описанных здесь, всегда представляет собой VH-VL. Соответствующая аминокислотная последовательность указанного домена VH-VL описана на SEQ ID NO:77. CEAI, CEAII и CEAIII, специфические для карциномоэмбрионального антигена человека, содержат области вариабельной легкой цепи (VL) и вариабельной тяжелой цепи (VH), полученные из mAb A5B7 (Chester, K. A. et al., Int J Cancer 57 (1994), 67-72), T84.66 (Neumaier, M. et al., Cancer Res 50 (1990), 2128-34) и MFE-23 (Boehm, M. K. Biochem J 2 (2000), 519-28) соответственно. A5, B9, D8 и E12 представляют собой VH-области человека, специфические для CEA человека, тогда как A240 представляет собой VL-область человека с той же самой специфичностью. Получение V-областей человека A5, B9, D8, E12 и A240 подробно описано в примерах 6 и 7. Соответствующие нуклеотидные и аминокислотные последовательности всех биспецифических одноцепочечных антител, описанных здесь, показаны в списке последовательностей.
В дальнейшем получение конструкции CEA I VLVH x SEQ ID NO.77 VHVL (SEQ ID NO.6) описано более подробно. Получение других конструкций, упомянутых выше, можно осуществлять, с выполнением необходимых модификаций, согласно способам, полностью находящимся в компетенции специалистов в данной области.
Для получения молекул биспецифического одноцепочечного антитела, обладающих вышеупомянутой специфичностью CEAI и деиммунизированной специфичностью анти-CD3 (SEQ ID NO.77), сначала вариабельные области CEAI, полученные синтезом генов в соответствии со стандартными протоколами, необходимо модифицировать посредством ПЦР для получения соответствующего фрагмента одноцепочечного антитела Fv. С этой целью использовали двухступенчатую сливающую ПЦР для амплификации последовательности, кодирующей вариабельные области. Сконструировали набор соответствующих праймеров для выполнения основанных на ПЦР стадий клонирования, в конечном счете получая одноцепочечное антитело с соединением двух вариабельных доменов линкером из 15 аминокислот ([Gly4Ser]3) в порядке VL-линкер-VH.
Коротко, использовали следующие сочетания праймеров:
+ 3'CEAI LH
Нуклеотидные последовательности олигонуклеотидных праймеров приведены ниже:
Для получения одноцепочечного антитела проводили две ПЦР с соответствующими сочетаниями праймеров, описанными выше, в качестве стадий ПЦР 1 и 2. Во время этой ПЦР в продукты ПЦР вводили перекрывающиеся комплементарные последовательности (происходящие от соответствующих линкерных праймеров), объединяемые для формирования кодирующей последовательности линкера из 15 аминокислот во время последующей сливающей ПЦР. Затем амплифицированные домены VH и VL объединяли в этой сливающей ПЦР, для которой необходимы только внешние праймеры и оба продукта ПЦР. Полученное антитело scFv фланкировано на 5'-конце участком узнавания для рестрикционного фермента BsrGI, а на 3'-конце - участком узнавания для рестрикционного фермента BspEI. Добавление участка для BsrGI выполняли так, чтобы позволить слияние в рамке считывания с кодирующей последовательностью лидерного пептида иммуноглобулина мыши, как описано в WO2005/040220. Участок для BspEI получали так, чтобы позволить слияние в рамке считывания с последовательностью, кодирующей специфическое для CD3 одноцепочечное антитело, для получения биспецифического одноцепочечного антитела. Чтобы завершить слияние одноцепочечного антитела Fv и чтобы позволить эукариотическую экспрессию, кодирующую последовательность специфического для CEA одноцепочечного антитела Fv клонировали посредством BsrGI и BspEI в экспрессирующий вектор pEFDHFR (pEFDHFR описан в Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025), содержащий деиммунизированное анти-CD3 одноцепочечное антитело Fv, как описано в WO2005/040220; в настоящем изобретении обозначено как SEQ ID NO.77. Отдельные клоны конструкции выделяли и секвенировали с праймерами, комплементарными фланкирующим областям в экспрессирующем векторе, в соответствии со стандартными протоколами (Sambrock, Molecular Cloning; A Laboratory Manual, 2nd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (1989)). Для дальнейших экспериментов выбирали клон конструкции с верифицированной нуклеотидной последовательностью.
2. Экспрессия и очистка биспецифических одноцепочечных антител CEAxCD3
Биспецифические одноцепочечные антитела экспрессировали в клетках яичника китайского хомяка (CHO). Эукариотическую экспрессию белка в дефицитных по DHFR клетках CHO осуществляли, как описано в Kaufmann (в приводившейся выше цитате). Амплификацию генов конструкций индуцировали увеличивающимися концентрациями MTX до конечной концентрации вплоть до 20 нМ MTX. После двух пассажей стационарную культуру клеток выращивали во вращающихся флаконах с модифицированной для CHO средой DMEM (HiQ®, HiClone) в течение 7 суток перед сбором. Клетки удаляли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°C.
Систему FPLC Dkta® (Pharmacia) и программное обеспечение Unicorn® использовали для хроматографии. Все химические вещества были высокой степени чистоты для исследований и закуплены из Sigma (Deisenhofen) или Merck (Darmstadt). Аффинную хроматографию с иммобилизованным металлом («IMAC») проводили с использованием колонки Fractogel® (Merck), заполненной ZnCl2, согласно протоколу, предоставленному производителем. Колонку уравновешивали буфером A2 (20 мМ натрий-фосфатный буфер pH 7,5, 0,4 M NaCl) и супернатант культуры клеток (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером A2 для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием 2-ступенчатого градиента буфера B2 (20 мМ натрий-фосфатный буфер pH 7,5, 0,4 M NaCl, 0,5 M имидазол) согласно следующему:
Стадия 1: 6 объемов колонки 20% буфера B2;
Стадия 2: 6 объемов колонки 100% буфера B2.
Элюированные фракции белка со стадии 2 объединяли для дальнейшей очистки.
Гель-фильтрационную хроматографию проводили на колонке Sephadex S200 HiPrep (Pharmacia), уравновешенной PBS (Gibco). Образцы элюированного белка (скорость потока 1 мл/мин) подвергали общепринятому SDS-PAGE и Вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрации белка определяли с использованием красителя для анализа белка (MicroBCA, Pierce) и IgG (Biorad) в качестве стандартного белка.
Биспецифические одноцепочечные антитела CEAxCD3 выделяли способом двухступенчатой очистки IMAC и гель-фильтрацией. Основной продукт обладал молекулярной массой приблизительно 52 кДа в нативных условиях, как определили гель-фильтрацией в PBS. Эта молекулярная масса соответствует биспецифическому одноцепочечному антителу. Все конструкции очищали согласно этому способу.
Очищенное биспецифическое одноцепочечное антитело анализировали в SDS PAGE в восстанавливающих условиях, проводимом в предварительно залитых 4-12% бис-Трис-гелях (Invitrogen). Подготовку и нанесение образцов выполняли согласно протоколу, предоставленному производителем. Молекулярную массу определяли по белковому стандарту MultiMark (Invitrogen). Гель окрашивали коллоидным Кумасси (протокол Invitrogen). Чистота выделенного белка составляла >95%, как определяли посредством SDS-PAGE.
Вестерн-блоттинг выполняли с использованием мембраны Optitran® BA-S83 и модуля для блоттинга Invitrogen согласно протоколу, предоставленному производителем. Использовали антитела, направленные против метки His (Penta His, Qiagen), и антитела козы против Ig мыши, меченные щелочной фосфатазой (AP) (Sigma) и BCIP/NBT (Sigma), в качестве субстрата. Биспецифическое одноцепочечное антитело можно специфически детектировать посредством Вестерн-блоттинга. Детектировали отдельную полосу 52 кДа, соответствующую молекуле очищенного биспецифического одноцепочечного антитела.
3. Анализ проточной цитометрией связывания биспецифических одноцепочечных антител CEAxCD3
Чтобы тестировать функциональность конструкций по отношению к связывающей способности для связанного с мембраной CEA человека и CD3 человека, проводили анализ FACS. Для этой цели использовали трансфицированные CEA человека клетки CHO и CD3-положительные T-клетки линии клеток лейкоза человека HPB-AII (DSMZ, Braunschweig, ACC483). 200000 CEA-положительных клеток CHO или 200000 клеток HPB-AII инкубировали в течение 30 мин на льду с 50 мкл чистого супернатанта клеток из культур клеток CHO, каждая из которых экспрессирует биспецифические антитела с различными расположением VH- и VL-областей CEA и CD3 (как описано выше). Клетки дважды промывали в PBS и связывание конструкции детектировали с немеченным антителом мыши Penta His (разведенным 1:20 в 50 мкл PBS с 2% FCS; Qiagen), которое специфически связывается со связанной с клетками конструкцией посредством гистидиновой метки на C-конце конструкции. Затем проводили стадию промывки для удаления несвязавшегося антитела мыши Penta His. Связанные антитела анти-His детектировали с помощью специфического для Fc-гамма антитела (Dianova), конъюгированного с фикоэритрином, разведенного 1:100 в 50 мкл PBS с 2% FCS. В качестве положительного контроля для связывания с CEA человека использовали моноклональное антитело Col-1 (см. пример 3). Для контроля связывания с CD3 человека использовали биспецифическую одноцепочечную конструкцию CD19×CD3, как описано в WO 99/054440. В качестве отрицательного контроля вместо супернатанта культуры использовали свежую культуральную среду.
Клетки анализировали проточной цитометрией (FACS-Calibur; Becton Dickinson, Heidelberg). Окрашивание для FACS и измерение интенсивности флуоресценции выполняли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Как показано на фигуре 1, при нескольких расположениях доменов биспецифические одноцепочечные антитела, т.е. CEAI VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:8), CEAI VLVHxSEQ ID NO.77 VHVL (SEQ ID NO:6), CEAII VHVL×SEQ ID NO.77 VHVL (SEQ ID NO:10), CEAIII VLVH×SEQ ID NO.77 VHVL (SEQ ID NO:12) и CEAIII VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:14), связываются со связанным с мембраной CEA человека и CD3 человека. В качестве отрицательного контроля использовали культуральную среду и 1. и 2. антитела для детекции.
ПРИМЕР 3: Связывание биспецифических одноцепочечных антител CEAxCD3 с растворимым CEA человека
Чтобы определить специфичность против растворимого CEA человека, различные биспецифические одноцепочечные антитела CEAxCD3 тестировали в ELISA. Для этой цели растворимый антиген CEA человека сначала биотинилировали. Биотинилирование проводили в PBS, содержащем 5% DMSO (Sigma) с пятнадцатимолярным избытком EZ-Link сульфо-NHS-LC-LC-биотина (Pierce) в течение 1 часа при комнатной температуре в смесителе для образцов (Dynal). Для разделения свободного биотина и биотинилированного антигена CEA смесь для анализа подвергали избыточному диализу против PBS в соответствии со стандартными протоколами. Оставшуюся биологическую активность меченного биотином CEA подтверждали в экспериментах связывания ELISA.
Прямой ELISA для определения специфичности биспецифического одноцепочечного антитела CEAxCD3 против растворимого CEA человека проводили согласно общепринятым способам. Коротко, 50 мкл/лунку PBS или растворимого биотинилированного CEA человека (Abcam; 5 мкг/мл в 1×PBS) иммобилизовали на 96-луночном покрытом стрептавидином планшете для ELISA (Nunc) посредством инкубации при 4°C в течение приблизительно 16 часов. После промывки 200 мкл воды на лунку добавляли 200 мкл блокирующего раствора (PBS/3% BSA). После блокирования в течение 1 ч при комнатной температуре блокирующий раствор удаляли. Все последующие стадии промывки (200 мкл/лунку 1×PBS/0,05% (об./об.) Tween 20) и инкубации проводили при комнатной температуре. После одной промывки биспецифические одноцепочечные антитела CEAI VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:8; часть анти-CEA, полученная из mAb A5B7), CEAII VHVL×SEQ ID NO.77 VHVL (SEQ ID NO:10; часть анти-CEA, полученная из mAb T84.66), и CEAIII VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:14; часть анти-CEA, полученная из mAb MFE-23), и моноклональное антитело мыши CEA/CD66 Ab-3 (Col-1; Dunn) инкубировали в различных концентрациях (0,5 мкг/мл и 5 мкг/мл в 1xPBS; 50 мкл/лунку) в течение 1 часа. 1×PBS (50 мкл/лунку) добавляли в качестве контроля неспецифического связывания. После 3 стадий промывки добавляли 50 мкл/лунку Penta-His IgG (Qiagen; 2 мкг/мл в 1×PBS) для детекции His-меченных биспецифических одноцепочечных антител. Затем лунки промывали 3 раза и инкубировали с 50 мкл меченного пероксидазой хрена антитела козы против антител мыши, специфического для Fc гамма (Jackson ImmuneResearch; 1:1000 в 1xPBS), в течение 1 часа. После 3 раз промывки ELISA проявляли посредством добавления раствора субстрата ABTS (Roche), и измеряли поглощение при длине волны 405 нм.
На фигуре 2 показано поглощение для различных биспецифических одноцепочечных антител, детектированное в ELISA. Биспецифические одноцепочечные антитела CEAI VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:8; часть анти-CEA, полученная из mAb A5B7), CEAII VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:10; часть анти-CEA, полученная из mAb T84.66) и CEAIII VHVL×SEQ ID NO.77 VHVL (SEQ ID NO:14; часть анти-CEA, полученная из mAb MFE-23), и моноклональное антитело Col-1 мыши специфически связывают растворимый CEA человека. Не получили сигнала связывания в отсутствие антигена CEA (контроль с PBS). В общем, анти-CEA связывающие домены, полученные из mAb A5B7, T84.66 и MFE-23, связываются как с растворимым, так и со связанным с мембраной CEA.
ПРИМЕР 4: Биологическая активность биспецифических одноцепочечных антител CEAxCD3
Биологическую активность полученных биспецифических одноцепочечных антител CEAxCD3 анализировали посредством анализов цитотоксичности с высвобождением хрома in vitro с использованием линии клеток карциномы желудка человека Kato III или трансфицированных CEA человека клеток CHO в качестве клеток-мишеней и стимулированных CD8-положительных T-клеток человека или нативных PBMC в качестве эффекторных клеток соответственно.
Получение стимулированных CD8+ T-клеток осуществляли следующим образом. Чашку Петри (диаметром 145 мм, greiner bio-one) предварительно покрывали антителом против CD3 (OKT3 Janssen-Cilag GmbH, Orthoclone 1 мг/мл; конечная концентрация 1 мкг/мл) и антителом против CD28 (BD, 1 мг/мл; конечная концентрация 1 мкг/мл) в течение 1 часа при 37°C. После периода инкубации несвязавшийся белок удаляли одной стадией промывки в PBS. Свежие PBMC выделяли из периферической крови (30-50 мл) посредством центрифугирования в градиенте фиколла в соответствии со стандартными протоколами. 3-5×107 PBMC наносили в предварительно покрытую чашку Петри в 150 мл RPMI 1640/10% FCS/IL-2 20 ед./мл (Proleukin, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали, один раз промывали RPMI 1640 и переносили в большой культуральный флакон. Добавляли IL-2 до конечной концентрации 20 ед./мл и снова культивировали в течение одних суток. Выделяли CD8+ CTL с помощью набора для выделения отрицательных по CD8 клеток (Dynal Biotech), следуя инструкциям в руководстве. Нативные PBMC использовали непосредственно после центрифугирования в градиенте фиколла без процедуры стимуляции. Клетки-мишени дважды промывали PBS и метили 11,1 МБк 51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°C. Затем меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали для анализа цитотоксичности. Анализ проводили в 96-луночном круглодонном планшете в общем объеме 250 мкл дополненной RPMI (как выше) с соотношением E:T 10:1, соответствующим 5000 клеток-мишеней и 50000 эффекторных клеток на лунку. Для оценки конструкций применяли начальную концентрацию 1 мкг/мл биспецифических одноцепочечных молекул в объеме смеси для анализа и 12 трехкратных разведений. Время анализа составляло 18 часов, и цитотоксичность измеряли как относительные количества высвобожденного хрома в супернатанте по отношению к разнице максимального лизиса (с добавлением Triton-X) и спонтанного лизиса (без эффекторных клеток). Все измерения проводили в трех параллелях. Измерения активности хрома в супернатантах проводили с помощью гамма-счетчика Wizard 3 (Perkin Elmer Life Sciences GmbH, Köln, Germany). Анализ экспериментальных данных проводили с помощью Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые зависимости доза-эффект, как правило, обладали значениями R2 >0,90, как определяли посредством программного обеспечения. Значения EC50, рассчитанные программой для анализа, использовали для сравнения биологической активности.
На фигуре 3 показана цитотоксическая активность против трансфицированных CEA человека клеток-мишеней (клеток CHO-CEA+) для различных расположений доменов, т.е. для SEQ ID NO.77 VHVLxCEAI VHVL (SEQ ID NO:4) и SEQ ID NO.77 VHVLxCEAI VLVH (SEQ ID NO:2) (обе конструкции с частью анти-CD3 на N-конце), так же как для CEAI VLVHxSEQ ID NO.77 VHVL (SEQ ID NO:6) и CEAI VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:8) (анти-CD3 на C-конце). Нетрансфицированные клетки CHO (без CEA человека) использовали в качестве отрицательного контроля.
На фигуре 4 для CEAI VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:8), CEAIII VLVHxSEQ ID NO.77 VHVL (SEQ ID NO:12), CEAIII VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:14) и CEAII VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:10) показана цитотоксическая активность против трансфицированных CEA человека клеток CHO. Нетрансфицированные клетки CHO (без CEA человека) использовали в качестве отрицательного контроля. Как указано выше, CEAI обозначает вариабельную область, полученную из mAb A5B7 мыши, CEAII представляет собой вариабельную область, полученную из mAb T84.66 мыши, и CEAIII относится к вариабельной области из mAb MFE-23 мыши.
В общем, для всех тестированных конструкций показали цитотоксическую активность против экспрессирующих CEA (человека) клеток Kato III и трансфицированных CEA человека клеток CHO, в отсутствие растворимого CEA человека.
ПРИМЕР 5: Биологическая активность биспецифических одноцепочечных антител CEAxCD3, специфических в присутствии растворимого антигена CEA
Конкурентные анализы проводили, как описано в примере 4, со следующим исключением: биологическую активность биспецифических одноцепочечных антител CEAxCD3 тестировали в присутствии различных концентраций растворимого антигена CEA человека. Используемый растворимый антиген CEA человека (AbCAM Ltd. Cambridge UK) выделяли из метастазов карциномы толстой кишки из печени одного пациента. Экспериментально конкурентный анализ проводили посредством предварительной инкубации данного количества биспецифического одноцепочечного антитела с увеличивающимися количествами растворимого антигена CEA человека (или 0 мкг/мл; 0,1 мкг/мл; 1 мкг/мл, или 0 мкг/мл; 0,004 мкг/мл; 0,02 мкг/мл; 0,1 мкг/мл; 0,5 мкг/мл; 1 мкг/мл) в течение 30 минут при 37°C перед добавлением к клеткам. Остальной анализ проводили, как описано в примере 4. Результаты этих конкурентных экспериментов показаны на фигурах 5-11.
Цитотоксическую активность биспецифических одноцепочечных антител CEAII VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:10; см. фигуры 7 и 9-11) с частью анти-CEA, полученной из mAb T84.66, и CEAIII VLVHxSEQ ID NO.77 VHVL (SEQ ID NO:12; см. фигуру 8) с областью анти-CEA, полученной из mAb MFE-23, против клеток-мишеней, положительных по CEA человека, существенно ингибировали увеличивающиеся количества растворимого антигена CEA человека. Как указано выше, указанные конструкции связываются как со связанным с мембраной, так и с растворимым антигеном CEA человека; см., например, примеры 2 и 3 и фигуры 1 и 2. Таким образом, наиболее вероятно, растворимый CEA человека предупреждает связывание части анти-CEA указанных биспецифических одноцепочечных антител со связанным с мембраной CEA человека на клетках-мишенях, например, CHO-CEA+ или опухолевых клетках Kato III, таким образом ингибируя цитотоксическую активность, опосредованную указанными конструкциями антител.
В отличие от этого, неожиданно обнаружили, что биспецифические одноцепочечные антитела с частью анти-CEA, полученной из mAb A5B7, являются устойчивыми к растворимому CEA человека. Например, цитотоксическую активность, опосредованную CEAI VLVHxSEQ ID NO.77 VHVL (SEQ ID NO:6; см. фигуру 5), CEAI VHVLxSEQ ID NO.77 VHVL (SEQ ID NO:8; см. фигуры 5, 8 и 10), SEQ ID NO.77 VHVL×CEAI VHVL (SEQ ID NO:4; см. фигуру 6) и SEQ ID NO.77 VHVL×CEAI VLVH (SEQ ID NO:2; см. фигуру 6) не ингибируют увеличивающиеся количества растворимого CEA человека, даже при высоких концентрациях (1 мкг/мл). Этого нельзя было ожидать в свете того факта, что часть анти-CEA указанных биспецифических одноцепочечных антител связывается с растворимым CEA человека (фигура 2). Скорее можно было ожидать ингибирования цитотоксической активности против CEA-положительных клеток-мишеней увеличивающимися количествами растворимого CEA человека, как в случае полученных из T84.66 и MFE-23 конструкций; см. выше.
Таким образом, настоящее изобретение относится к фармацевтическим композициям с цитотоксической противоопухолевой активностью в присутствии даже высоких уровней растворимого антигена CEA. Таким образом, эти фармацевтические композиции, в частности, пригодны для лечения пациентов с опухолью с высокими концентрациями растворимого антигена CEA в плазме, таких как пациенты с прогрессирующими эпителиальными опухолями, метастазирующими эпителиальными опухолями, с большим объемом/массой опухоли, с эпителиальными опухолями на поздних стадиях или пациентов с опухолями с концентрацией CEA в сыворотке, превышающей 100 нг/мл, как определено посредством ELISA.
ПРИМЕР 6: Отбор VL-областей человека
Чтобы предоставить фармацевтические композиции с уменьшенной иммуногенностью при введении пациентам с раком, получены человеческие биспецифические одноцепочечные антитела с устойчивостью к растворимому антигену CEA. На первой стадии выделили VL-области человека с устойчивостью к растворимому CEA. Таким образом, целью данного эксперимента является отбор VL-областей человека, которые могут спариваться с материнской, мышиной VH из моноклонального антитела (mAb) A5B7.
1. Биотинилирование растворимого антигена CEA человека
Для отбора из библиотеки фагов растворимый антиген CEA биотинилировали. Биотинилирование осуществляли в PBS, содержащем 5% DMSO (Sigma) с пятнадцатимолярным избытком EZ-Link сульфо-NHS-LC-LC-биотина (Pierce) в течение 1 часа при комнатной температуре в смесителе для образцов (Dynal). Для разделения свободного биотина и биотинилированного антигена CEA смесь для анализа подвергали избыточному диализу против PBS в соответствии со стандартными протоколами.
Оставшуюся биологическую активность меченного биотином CEA подтверждали в экспериментах связывания ELISA.
2. Выделение РНК B-клеток человека
По 100 мл крови отбирали у пяти здоровых доноров-людей. Мононуклеарные клетки периферической крови (PBMC) выделяли посредством градиента фиколла согласно общепринятым способам. Суммарную РНК выделяли из выделенных клеток с использованием набора RNeasy® Midi Kit (QIAGEN) согласно инструкциям производителя. кДНК синтезировали согласно общепринятым способам (Sambrook, Cold Spring Harbor Laboratory Press 1989, 2001).
3. ПЦР-амплификация вариабельных областей легких цепей (VL-областей)
Для выделения ДНК V-области легкой цепи проводили RT-ПЦР с использованием наборов праймеров для V-каппа- (5'-huVK1-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CCAGATGACC CAGTCTCC-3') (SEQ ID NO:78), 5'-huVK2/4-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CGTGATGACY CAGTCTCC-3') (SEQ ID NO:79), 5'-huVK3-SaI-2001 (5'-GAGCCGCACG AGCCCGAGCT CGTGWTGACR CAGTCTCC-3') (SEQ ID NO:80), 5'-huVK5-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CACACTCACG CAGTCTCC-3') (SEQ ID NO:81), 5'-huVK6-SacI-2001 (5'-GAGCCGCACG AGCCCGAGCT CGTGCTGACT CAGTCTCC-3') (SEQ ID NO:82), 3'-hu-Vk-J1-SpeI-BsiWI (5'-GACGACACTA GTTGCAGCCA CCGTACGTTT GATTTCCACC TTGGTCC-3') (SEQ ID NO:83), 3'-hu-Vk-J2/4-SpeI-BsiWI (5'-GACGACACTA GTTGCAGCCA CCGTACGTTT GATCTCCASC TTGGTCC-3') (SEQ ID NO:84), 3'-hu-Vk-J3-SpeI-BsiWI (5'-GACGACACTA GTTGCAGCCA CCGTACGTTT GATATCCACT TTGGTCC-3') (SEQ ID NO:85), 3'-hu-Vk-J5-SpeI-BsiWI (5'-GACGACACTA GTTGCAGCCA CCGTACGTTT AATCTCCAGT CGTGTCC-3') (SEQ ID NO:86)) и V лямбда (5'-huVL1a-SacI-2001 (GAG CCG CAC GAG CCC GAG CTC GTG TTG ACG CAG CCG CCC TC) (SEQ ID NO:87), 5'-huVL1b-SacI-2001 (GAG CCG CAC GAG CCC GAG CTC GTG CTG ACT CAG CCA CCC TC) (SEQ ID NO:88), 5'-huVL2-SacI-2001 (GAG CCG CAG GAG CCC GAG CTC GCC CTG ACT CAG CCT SCC TCC GT) (SEQ ID NO:89), 5'-huVL4-SacI-2001 (ACC TGC GAG CTC GTG CTG ACT CAR YCM YCC TCT GC) (SEQ ID NO:90), 5'-huVL5-SacI-2001 (ACC TGC GAG CTC GTG CTG ACT CAG CCR SCT TCC) (SEQ ID NO:91), 5'-huVL6-SacI-2001 (ACC TGC GAG CTC ATG CTG ACT CAG CCC CAC TC) (SEQ ID NO:92), 5'-huVL3/9-SacI-2001 (GAG CCG CAC GAG CCC GAG CTC GWG CTG ACT CAG CCA CCY TC) (SEQ ID NO:93), 5'-huVL7/8-SacI-2001 (GAG CCG CAC GAG CCC GAG CTC GTG GTG ACY CAG GAG CCM TC) (SEQ ID NO:94), 3'-hu-Vlam-BlnI-SpeI-2001 (CGT GGG ACT AGT CTT GGG CTG ACC TAG GAC GGT) (SEQ ID NO:95), 3'-hu-Vlam2-BlnI-SpeI-2002: CGT GGG ACT AGT CTT GGG CTG ACC GAG GAC GGT) (SEQ ID NO:96).
РНК из B-клеток человека транскрибировали в кДНК (как описано выше) и использовали в качестве ДНК-матрицы в реакциях ПЦР. Для реакции ПЦР один 5'-праймер сочетали с одним 3'-праймером. Число различных реакций ПЦР определяли по числу возможных сочетаний 5'- и 3'-праймеров. Следующую ПЦР-программу использовали для амплификации. Денатурацию при 94°C в течение 15 секунд, отжиг праймеров при 52°C в течение 50 секунд и удлинение праймера при 72°C в течение 90 секунд проводили в течение 40 циклов с последующим конечным удлинением при 72°C в течение 10 минут. Затем V-фрагменты ДНК легкой цепи выделяли в соответствии со стандартными протоколами.
4. Конструирование библиотеки - клонирование пула VL человека
Библиотеку фагового дисплея, в общем, конструировали на основе общепринятых способов, например, как описано в «Phage Display: A Laboratory Manual»; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor Laboratory Press, 2001.
Праймеры, выбранные для амплификации ПЦР, обеспечивали участки узнавания 5'-SacI и 3'-SpeI для V-фрагментов легкой цепи. Получали четыре реакционных смеси для лигирования, каждая из которых состояла из 400 нг фрагментов легкой цепи (расщепленных SacI-SpeI, 2 x каппа и 2 x лямбда) и 1400 нг фагмиды pComb3H5BHis (расщепленной SacI-SpeI; большой фрагмент; этот вектор описан в изложении диссертации Dr. Ralf Lutterbüse. Затем каждым из четырех полученных пулов V-легких цепей антитела трансформировали 300 мкл электрокомпетентных Escherichia coli XL1 Blue посредством электропорации (2,5 кВ, кювета с зазором 0,2 см, 25 мкФ, 200 Ом, Biorad gene-pulser), получая размеры библиотек
независимых клонов.
Массу ДНК-фрагментов каппа (легкой цепи) из различных амплификаций ПЦР определяли для каждого лигирования следующим образом. Каждый 5'-праймер определяет специфическую группу. Внутри этих групп 3'-праймеры определяют подгруппы. Массу подгрупп каппа определяли как 1:2:1:1, что соответствует праймерам 3'-hu-Vk-J1-SpeI-BsiWI : 3'-hu-Vk-J2/4-SpeI-BsiWI : 3'-hu-Vk-J3-SpeI-BsiWI : 3'-hu-Vk-J5-SpeI-BsiWI. Массу групп определяли согласно их распределению в зародышевой линии 1:1:1:0,2:0,2, что соответствует праймерам 5'-huVK1-Sac-2001 : 5'-huVK3-Sac-2001 : 5'-huVK2/4-Sac-2001 : 5'- huVK5-Sac-2001 : 5'-huVK6-Sac-2001.
Массу ДНК-фрагментов лямбда (легкой цепи) из различных амплификаций ПЦР определяли для каждого лигирования следующим образом. Каждый 5'-праймер определяет специфическую группу. Внутри этих групп 3'-праймеры определяют подгруппы. Массу подгрупп лямбда определяли как 3:1, что соответствует праймерам 3'-hu-Vlam-BlnI-SpeI-2001 : 3'-hu-Vlam2-BlnI-SpeI-2002.
Массу групп определяли согласно их распределению в зародышевой линии 1:1:2:2:2:3, что соответствует праймерам 5'-huVL1a-SacI-2001 : 5'-huVL1b-SacI-2001 : 5'- huVL2-SacI-2001 : 5'-huVL4-SacI-2001 + 5'-huVL5-Sacl-2001 : 5'-huVL6-SacI-2001 + 5'-huVL7/8-SacI-2001 : 5'-huVL3/9-SacI-2001.
После электропорации каждую реакционную смесь инкубировали в среде SOC (Fluka) для экспрессии фенотипа. Две культуры каппа объединяли, так же как две культуры лямбда. Каждую из полученной культуры каппа и полученной культуры лямбда инкубировали в 500 мл среды для отбора SB, содержащей 50 мкг/мл карбенициллина и 2% мас./об. глюкозы в течение ночи. На следующие сутки клетки собирали центрифугированием и проводили выделение плазмиды с использованием коммерчески доступного набора для выделения плазмиды (Qiagen).
5. Конструирование библиотеки антител - VL человека - материнская VH
Проводили ПЦР для амплификации материнской VH mAb A5B7 из вектора, содержащего указанную материнскую VH. Для амплификации следовали протоколу ПЦР согласно общепринятым способам с использованием 5'-праймера 5'-AVH-XhoI (5'-GTC ACA CTC GAG TCA GGA GGA GGC TTG GTA C-3') (SEQ ID NO:97) и 3'-праймера 3'-AVH-BstEII (5'-GTC ACA GGT GAC CGT GGT CCC TTG GCC CCA G-3' (SEQ ID NO:98). После очистки продукта амплификации приблизительно 350 п.н. из аналитического агарозного геля фрагмент ДНК разрезали ферментами рестрикции BstEII и XhoI. Фагмиду pComb3H5BHis (этот вектор описан в изложении диссертации Dr. Ralf Lutterbüse) расщепляли соответственно, и большой фрагмент лигировали с вышеупомянутым фрагментом. После трансформации E. coli XL1 blue, отдельный клон культивировали в 100 мл среды SB (содержащей 50 мкг/мл карбенициллина), и получали плазмиду в соответствии со стандартными протоколами. Успешное клонирование подтвердили секвенированием вставки (Sequiserve, Munich).
Этот вектор pComb3H5BHis/материнская VH mAb A5B7 расщепляли ферментами рестрикции SacI и SpeI. Выделяли большой фрагмент вектора. Плазмидную ДНК, содержащую библиотеку V каппа и V лямбда, расщепляли ферментами рестрикции SacI и SpeI. Малый фрагмент V каппа - и соответствующий фрагмент V лямбда (каждый приблизительно 350 п.н.) выделяли в соответствии со стандартными протоколами. 1200 нг фрагмента вектора лигировали со смесью по 200 нг каждого из фрагментов V каппа и V лямбда. Реакционной смесью для лигирования трансформировали 300 мкл электрокомпетентных E. coli XL1 Blue посредством электропорации (2,5 кВ, кювета с зазором 0,2 см, 25 мкФ, 200 Ом), получая общий объем библиотеки scFv 1,2×108 независимых клонов.
После экспрессии фенотипа и медленной адаптации к карбенициллину библиотеку антител переносили в среду для отбора SB-карбенициллина (50 мкг/мл). Затем библиотеку антител инфицировали инфекционной дозой 1 x 1012 частиц фага-помощника VCSM13, получая продукцию и секрецию нитевидного фага M13, где каждая фаговая частица содержит одноцепочечную ДНК pComb3H5BHis, кодирующую наполовину человеческий scFv-фрагмент, и экспонирует соответствующий scFv-белок в виде белка, трансляционно слитого с белком оболочки фага III.
6. Отбор VL человека с помощью фагового дисплея
Фаговые частицы, несущие репертуар scFv, собирали из культурального супернатанта посредством преципитации PEG8000/NaCl и центрифугирования. Затем приблизительно 1×1011 - 1×1012 фаговых частиц с scFv ресуспендировали в 0,5 мл TBS/1% BSA и инкубировали с биотинилированным растворимым CEA, иммобилизованным на покрытых стрептавидином лунках планшета для ELISA (Nunc) в течение 1 часа. 10 мкг антигена/мл раствора PBS (50 мкл) инкубировали в течение ночи при 4°C в покрытых стрептавидином лунках, один раз промывали водой с последующим блокированием в течение 1 часа при 37°C с помощью 200 мкл 3% BSA в TBS, который удаляли после инкубации. Фаг scFv, который не связывался специфически с антигеном-мишенью, удаляли посредством стадий промывки TBS/0,05% Tween. Эту процедуру промывки повторяли вплоть до 10 раз в последующих циклах.
После промывки связавшиеся молекулы элюировали с использованием HCl-глицина, pH 2,2. После нейтрализации 2 M Трис, pH 12, элюат использовали для инфекции свежей неинфицированной культуры E. coli XL1 Blue.
Для элюции оставшихся сильно связавшихся молекул 50 мкл свежей культуры E. coli XL1 blue (OD600 ≥ 0,5) наносили в лунки и инкубировали в течение 15 минут. Затем обе культуры смешивали и клетки, успешно трансдуцированные копией фагмиды, кодирующей фрагмент scFv человека, опять отбирали по устойчивости к карбенициллину и затем инфицировали фагом-помощником VCMS13, чтобы начать второй цикл дисплея антител и отбора in vitro.
Плазмидную ДНК, соответствующую 4 циклам пэннинга, выделяли из культур E. coli. Для получения растворимого scFv-белка фрагменты ДНК VH-VL вырезали из плазмид (XhoI-SpeI) и клонировали посредством тех же самых участков рестрикции в плазмиду pComb3H5BFlag/His, в которой экспрессирующаяся конструкция (например, scFv) содержит Flag-метку (TGDYKDDDDK) (SEQ ID NO:99) между scFv и His6-меткой, и дополнительные фаговые белки делетированы.
После лигирования каждым пулом (из различных циклов пэннинга) плазмидной ДНК трансформировали 100 мкл компетентных для теплового шока E. coli TG 1 и рассевали на LB-агар с карбенициллином. Отбирали отдельные колонии и инокулировали в 120 мкл LB-карб. (50 мкг/мл) с 1% глюкозой в 96-луночных планшетах (Greiner). Лунки заклеивали полупроницаемой мембраной (Greiner), и планшеты инкубировали в течение ночи при 37°C в инкубаторе со встряхиванием (эталонный планшет). Затем по 10 мкл культур из эталонного планшета переносили во второй 96-луночный планшет (рабочий планшет), содержащий 90 мкл LB-карб. (50 мкг/мл) с 0,1% глюкозы на лунку. После инкубации в течение 4 часов при 37°C в инкубаторе со встряхиванием, продукцию scFv индуцировали добавлением 20 мкл LB-карб. с 6 мМ IPTG в каждую лунку. После другой стадии инкубации в течение ночи при 30°C с встряхиванием клетки лизировали инкубацией в течение 1 часа при комнатной температуре с 40 мкл буфера для лизиса (400 мМ борная кислота, 320 мМ NaCl, 4 мМ ЭДТА pH 8, 2,5 мг/мл лизоцима). Оставшиеся клетки и клеточный дебрис отделяли центрифугированием в течение 12 минут при 1900×g (Hettich).
Затем супернатанты, содержащие молекулы scFv, тестировали по связыванию в анализах связывания проточной цитометрией. Клетки CHO, трансфицированные CEA человека, использовали в качестве CEA-положительной линии клеток. Анализы связывания клеток осуществляли посредством исходной инкубации 100000 и 200000 клеток с периплазматическим препаратом, содержащим scFv человека или соответствующие контроли. После инкубации клетки промывали в PBS/1% FCS (эмбриональная телячья сыворотка) и далее инкубировали с 5-10 мкг/мл антитела анти-FLAG M2 (Sigma). После того как клетки снова промывали, их инкубировали с поликлональными, PE-меченными антителами против антител мыши (Dianova) и затем анализировали проточной цитометрией. Приблизительно 600 клонов тестировали по сигналам связывания на CEA-положительных клетках CHO. Получили 27 положительных клонов. После секвенирования соответствующей ДНК scFv получили всего 9 различных последовательностей.
На фигуре 12 показано связывание девяти различных конструкций наполовину человеческих scFv (т.е. VH A5B7 мыши - VL человека) с различными линиями клеток, как измеряли посредством анализа проточной цитометрии. Фигура 12 содержит несколько диаграмм, по одной для каждой тестируемой конструкции. В каждой данной диаграмме черным распределением показана интенсивность флуоресценции для клеток, инкубированных только с одним PBS в отсутствие какой-либо конструкции, но со всеми соответствующими средствами для детекции, какие использовали для детекции scFv. Таким образом, любой наблюдаемый сдвиг флуоресценции можно определенно отнести к конструкции scFv, а не к средствам для детекции или буферу. Сдвиги флуоресценции, которые являются показательными для связывания конструкции с соответствующей линией клеток, изображены серой линией на каждой диаграмме. В общем, сдвиг большей величины отдаленности, т.е. дальше от (черного) контроля указывает на более сильное связывание, тогда как сдвиг меньшей величины отдаленности, т.е. ближе к (черному) контролю указывает на более слабое связывание.
Из фигуры 12 можно видеть, что конструкции A-121, A-183, A-240, A-313, A-290, A-315, A4-35, A4-52, MP2-A5 показали четко различимые сдвиги интенсивности флуоресценции по сравнению с соответствующим контролем, что указывает на связывание scFv со связанным с мембраной CEA на клетках-мишенях CHO. В дальнейшем выбрали VL-область человека из scFv A-240 (SEQ ID NO:48) и использовали для выделения VH-области человека. Указанная VL-область человека изображена на SEQ ID NO:63 (нуклеотидная последовательность) и 64 (аминокислотная последовательность).
ПРИМЕР 7: Конструирование библиотек антител и отбор с помощью фагового дисплея VH-областей человека, устойчивых к растворимому антигену CEA
Целью следующих экспериментов является отбор набора VH-областей человека, устойчивых к растворимому антигену CEA, которые спариваются с VL-областью человека из scFv A-240, отобранной, как описано в примере 6. Указанная VL-область человека изображена на SEQ ID NO:63 (нуклеотидная последовательность) и 64 (аминокислотная последовательность).
1. Выделение РНК из мононуклеарных клеток периферической крови (PBMC)
По 100 мл крови отбирали у пяти здоровых доноров-людей. Мононуклеарные клетки периферической крови (PBMC) выделяли посредством градиента фиколла согласно общепринятым способам. Суммарную РНК выделяли из PBMC с использованием набора RNeasy® Midi Kit (QIAGEN) согласно инструкциям производителя. кДНК синтезировали согласно общепринятым способам (Sambrook, Cold Spring Harbor Laboratory Press 1989, 2001).
2. ПЦР-амплификация вариабельных областей тяжелых цепей (VH-областей)
Сконструировали библиотеку VH и обозначили Lib 134-VH. Эта VH-библиотека состоит из репертуара FR1-CDR1-FR2-CDR2-FR3 человека из амплифицированных ПЦР VH-областей из вышеуказанного пула PBMC, функционально связанных с CDR3 VH из материнского антитела с последующей зародышевой последовательностью FR4 человека.
Для выделения матриц - VH-областей человека, проводили RT-ПЦР с использованием 5'-VH-специфического набора праймеров (5'-huVH1,3,5-XhoI-2001 (5'-AGG TGC AGC TGC TCG AGT CTG G-3') (SEQ ID NO:100), 5'-huVH4-XhoI-2001 (5'-CAG GTG CAG CTG CTC GAG TCG GG-3') (SEQ ID NO:101), 5'-huVH4B-XhoI-2001 (5'-CAG GTG CAG CTA CTC GAG TGG GG-3') (SEQ ID NO:102)) и набора двух 3'-VH-специфических праймеров (3'-hu-VH-BstEII-2001 (5'-CTG AGG AGA CGG TGA CC-3') (SEQ ID NO:103), 3'-hu-VH-J3-BstEII-2001 (5'-CTG AAG AGA CGG TGA CC-3') (SEQ ID NO:104)). Для реакции ПЦР один 5'-праймер сочетали с одним 3'-праймером; число различных реакций ПЦР определяли по числу возможных сочетаний 5'- и 3'-праймеров. кДНК PBMC от пяти доноров использовали в качестве источника VH-генов. Следующую ПЦР-программу использовали для амплификации. Денатурацию при 94°C в течение 15 секунд, отжиг праймеров при 52°C в течение 50 секунд и удлинение праймера при 72°C в течение 60 секунд проводили в течение 40 циклов с последующим конечным удлинением при 72°C в течение 10 минут. Продукты амплификации с размером приблизительно 350 п.н. выделяли согласно общепринятым способам.
Для выделения Lib 134-VH-областей, RT-ПЦР проводили в две стадии. Сначала VH-фрагменты тяжелой цепи человека (FR1-CDR1-FR2-CDR2-FR3) амплифицировали ПЦР из выделенных матриц - VH-фрагментов с использованием того же самого набора 5'-VH-специфических праймеров, как описано выше (5'-huVH1,3,5-XhoI-2001, 5'-huVH4-XhoI-2001, 5'- huVH4B-XhoI-2001; SEQ ID NO:100-102) и набора 3'-специфических праймеров (3'-A134-VH1A (5'-GTA GTC AAA GTA GAA CCG TAG CCC CCT ATC TCT YGC ACA GTA ATA CAC GGC -3') (SEQ ID NO:105), 3'-A134-VH1B (5'-GTA GTC AAA GTA GAA CCG TAG CCC CCT ATC TCT YGC ACA GTA ATA CAY RGC -3') (SEQ ID NO:106), 3'-A134-VH3A (5'-GTA GTC AAA GTA GAA CCG TAG CCC CCT ATC TCT TGY ACA GTA ATA CAC RGC -3') (SEQ ID NO:107), где отмеченный «T» можно также заменять на «A», «C» или «G», 3'-A134-VH3B (5'-GTA GTC AAA GTA GAA CCG TAG CCC CCT ATC TCT TGC ACA GTA ATA CAA RGC -3') (SEQ ID NO:108), где отмеченный «T» можно также заменять на «A», «C» или «G», 3'-A134-VH4 (5'- GTA GTC AAA GTA GAA CCG TAG CCC CCT ATC TCT SGC ACA GTA ATA CAC RGC -3') (SEQ ID NO:109)), для подсемейств VH человека 1, 3 и 4, совпадающих в самой концевой области FR3.
Использовали следующие сочетания праймеров:
a) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH1A
b) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH1B
c) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH3A
d) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH3B
e) 5'-huVH4-XhoI-2001 × 3'-A134-VH4
f) 5'-huVH4B-XhoI-2001 × 3'-A134-VH4
Для реакции ПЦР один 5'-праймер сочетали с 3'-праймером; число различных реакций ПЦР определяли по числу возможных сочетаний 5'- и 3'-праймеров. Следующую ПЦР-программу использовали для амплификации. Денатурацию при 94°C в течение 15 секунд, отжиг праймеров при 52°C в течение 50 секунд и удлинение праймера при 72°C в течение 90 секунд проводили в течение 40 циклов с последующим конечным удлинением при 72°C в течение 10 минут. Посредством этой стадии ПЦР и соответствующей последовательности 3'-праймера, фрагменты VH человека удлиняют на часть материнской CDR3 VH, которая, в свою очередь, представляет собой участок праймирования для 3'-праймера для второй стадии ПЦР.
Затем эти ДНК-фрагменты VH-(FR1-CDR1-FR2-CDR2-FR3) использовали в качестве матриц для второй реакции ПЦР с использованием снова соответствующего 5'VH-специфического праймера и универсального 3'-праймера, совпадающего с универсальным 3'-концом амплифицированных фрагментов ДНК (3' A134-JH6-BstEII, 5'- CGA GAC GGT GAC CGT GGT CCC TTG GCC CCA GTA GTC AAA GTA GAA CCG TAG CC -3') (SEQ ID NO:110).
Следующую ПЦР-программу использовали для амплификации. Денатурацию при 94°C в течение 15 секунд, отжиг праймеров при 52°C в течение 50 секунд и удлинение праймера при 72°C в течение 60 секунд проводили в течение 40 циклов с последующим конечным удлинением при 72°C в течение 10 минут. V-фрагменты ДНК выделяли в соответствии со стандартными протоколами.
3. Конструирование библиотеки - клонирование пула VH человека
Во втором цикле вышеуказанного способа VL человека из scFv A-240, идентифицированные в первом, предварительном отборе (см. пример 6), выбирали и затем сочетали с библиотекой фрагментов VH человека с целью получения человеческого scFv. Библиотеку фагового дисплея, в общем, конструировали на основе общепринятых способов, например, как описано в «Phage Display: A Laboratory Manual»; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor Laboratory Press, 2001. Массу ДНК-фрагментов тяжелой цепи из различных амплификаций ПЦР определяли для каждого лигирования следующим образом:
a:b:c:d:e:f = 3:1:3:1:1:1, где a-f обладают следующими значениями:
a) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH1A
b) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH1B
c) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH3A
d) 5'-huVH1,3,5-XhoI-2001 × 3'-A134-VH3B
e) 5'-huVH4-XhoI-2001 × 3'-A134-VH4
f) 5'-huVH4B-XhoI-2001 × 3'-A134-VH4
Проводили одну реакцию лигирования, содержащую 400 нг пула человеческих фрагментов Lib 134-VH (расщепленных XhoI-BstEII) и 1200 нг плазмиды pComb3H5BHis/A-240 VL (ДНК, кодирующую VL-область scFv A-240, клонировали посредством участков рестрикции SacI и SpeI в pComb3H5BHis согласно общепринятым способам). Затем полученным пулом антител с VH человека трансформировали 300 мкл электрокомпетентных Escherichia coli XL1 Blue посредством электропорации (2,5 кВ, кювета с зазором 0,2 см, 25 мкФ, 200 Ом, Biorad gene-pulser), получая общий объем библиотеки 0,8×108 независимых клонов.
После электропорации смесь для анализа инкубировали в среде SOC (Fluka) для экспрессии фенотипа. Затем каждую из культур инкубировали в 500 мл среды для отбора SB, содержащей 50 мкг/мл карбенициллина и 2% об./об. глюкозы в течение ночи. На следующие сутки клетки из культур собирали центрифугированием и проводили выделение плазмиды с использованием коммерчески доступного набора для выделения плазмиды (Qiagen) для сохранения библиотеки ДНК.
Затем 1,5 мкг этого пула плазмид, кодирующих соответствующий пул scFv, вводили электропорацией в E. coli XL1 blue (2,5 кВ, кювета с зазором 0,2 см, 25 мкФ, 200 Ом, Biorad gene-pulser), получая общий объем библиотеки 2,4×109 независимых клонов. После экспрессии фенотипа и медленной адаптации к карбенициллину библиотеку антител переносили в среду для отбора SB-карбенициллин (50 мкг/мл). Затем библиотеку антител инфицировали инфекционной дозой 1×1012 частиц фага-помощника VCSM13, получая продукцию и секрецию нитевидного фага M13, где каждая фаговая частица содержит одноцепочечную ДНК pComb3H5BHis, кодирующую человеческий scFv-фрагмент, и экспонирует соответствующий scFv-белок в виде белка, трансляционно слитого с белком оболочки фага III.
4. Отбор VH человека с помощью фагового дисплея
Фаговые частицы, несущие репертуар человеческих scFv, собирали из культурального супернатанта посредством преципитации PEG8000/NaCl и центрифугирования. Затем приблизительно 1×1011-1×1012 фаговых частиц с scFv ресуспендировали в 0,5 мл TBS/1% BSA и инкубировали с биотинилированным растворимым CEA, иммобилизованным на покрытых стрептавидином лунках планшета для ELISA (Nunc) в течение 1 часа. 10 мкг антигена/мл раствора PBS (50 мкл) инкубировали в течение ночи при 4°C в покрытых стрептавидином лунках, один раз промывали водой с последующим блокированием в течение 1 часа при 37°C с помощью 200 мкл 3% BSA в TBS, который удаляли после инкубации.
Фаг scFv, который не связывался специфически с антигеном-мишенью, удаляли посредством стадий промывки TBS/0,05% Tween. Эту процедуру промывки повторяли вплоть до 10 раз в последующих циклах.
После промывки связавшиеся молекулы элюировали с использованием HCl-глицина, pH 2,2. После нейтрализации 2 M Трис, pH 12, элюат использовали для инфекции свежей неинфицированной культуры E. coli XL1 Blue.
Для элюции оставшихся сильно связавшихся молекул 50 мкл свежей культуры E. coli XL1 blue (OD600 ≥0,5) добавляли к лункам и инкубировали в течение 15 минут. Затем обе культуры смешивали и клетки, успешно трансдуцированные копией фагмиды, кодирующей фрагмент scFv человека, опять отбирали по устойчивости к карбенициллину и затем инфицировали фагом-помощником VCMS13, чтобы начать второй цикл дисплея антител и отбора in vitro.
Плазмидную ДНК, соответствующую 4 циклам пэннинга, выделяли из культур E. coli. Для получения растворимого scFv-белка фрагменты ДНК VH-VL вырезали из плазмид (XhoI-SpeI), и клонировали посредством тех же самых участков рестрикции в плазмиду pComb3H5BFlag/His, в которой экспрессирующаяся конструкция (например, scFv) содержит Flag-метку (TGDYKDDDDK; SEQ ID NO:99) между scFv и His6-меткой, и дополнительные фаговые белки делетированы.
После лигирования каждым пулом (из различных циклов пэннинга) плазмидной ДНК трансформировали 100 мкл компетентных для теплового шока E. coli TG1 и рассевали на LB-агар с карбенициллином. Отбирали отдельные колонии и инокулировали в 120 мкл LB-карб. (50 мкг/мл) с 1% глюкозой в 96-луночных планшетах (Greiner). Лунки заклеивали полупроницаемой мембраной (Greiner), и планшеты инкубировали в течение ночи при 37°C в инкубаторе со встряхиванием (эталонный планшет). Затем по 10 мкл культур из эталонного планшета переносили во второй 96-луночный планшет (рабочий планшет), содержащий 90 мкл LB-карб. (50 мкг/мл) с 0,1% глюкозы на лунку. После инкубации в течение 4 часов при 37°C в инкубаторе со встряхиванием продукцию scFv индуцировали добавлением 20 мкл LB-карб. с 6 мМ IPTG в каждую лунку. После другой стадии инкубации в течение ночи при 30°C с встряхиванием клетки лизировали инкубацией в течение 1 часа при комнатной температуре с 40 мкл буфера для лизиса (400 мМ борная кислота, 320 мМ NaCl, 4 мМ ЭДТА pH 8, 2,5 мг/мл лизоцима). Оставшиеся клетки и клеточный дебрис отделяли центрифугированием в течение 12 минут при 1900×g (Hettich).
Затем супернатанты, содержащие молекулы scFv, тестировали по связыванию в анализах связывания проточной цитометрией.
CHO-клетки, трансфицированные CEA человека, использовали в качестве CEA-положительной линии клеток. Анализы связывания клеток осуществляли посредством исходной инкубации между 100000 и 200000 клеток с периплазматическим препаратом, содержащим scFv человека или соответствующие контроли. После инкубации клетки промывали в PBS/1% FCS (эмбриональная телячья сыворотка) и далее инкубировали с 5-10 мкг/мл антитела анти-FLAG M2. После того как клетки снова промывали, их инкубировали с поликлональными, PE-меченными антителами против антител мыши (Dianova) и затем анализировали проточной цитометрией. 46 клонов тестировали по сигналам связывания на CEA-положительных клетках CHO. Для всех из них показали положительные сигналы. После секвенирования соответствующей ДНК scFv получили всего 9 различных последовательностей, для восьми из которых показали высокую степень гомологии. Человеческие конструкции MP510_3-A5.3 (MP510-A5; SEQ ID NO:50), MP510_3-B9.1 (MP511-B9; SEQ ID NO:52), MP510_3-D8.1 (MP511-D8; SEQ ID NO:54) выбрали для дальнейшей характеризации. Соответствующие аминокислотные последовательности показаны в списке последовательностей.
Периплазматические экстракты с указанными человеческими конструкциями MP510-A5, MP511-B9, MP511-D8, так же как с наполовину человеческой конструкцией A-240 Vlambda.3 (VH A5B7 мыши/VL A240 человека; SEQ ID NO:48) далее анализировали в экспериментах проточной цитометрии с CEA-положительными и -отрицательными линиями клеток. Как можно видеть из фигуры 13, для человеческих конструкций MP510-A5 (SEQ ID NO:50), MP511-B9 (SEQ ID NO:52), MP511-D8 (SEQ ID NO:54) показали четко различимые сдвиги интенсивности флуоресценции по сравнению с соответствующим наполовину человеческим контролем A-240 Vlambda.3 (VH A5B7 мыши/VL A240 человека; SEQ ID NO:48). Таким образом, для человеческих конструкций scFv показали более сильную активность связывания со связанным с мембраной CEA человека, чем для наполовину человеческой конструкции A-240 Vlambda.3. Кроме того, для всех человеческих конструкций показали четкое связывание с CEA-положительными клетками KATO III человека (линия клеток рака желудка человека), в то время как ни для одной из них не показали связывания с CEA-отрицательными, нетрансфицированными клетками CHO, так же как с CEA-отрицательными клетками человека NALM 6 (линия B-клеток человека) (данные не представлены).
ПРИМЕР 8: Получение и цитотоксическая активность человеческих биспецифических одноцепочечных антител CEA x CD3
1. Расположения
На следующей стадии получили молекулы человеческого биспецифического одноцепочечного антитела с различными расположениями доменов. Эти молекулы, содержащие анти-CEA связывающий домен человека (получение которого описано в примере 7, выше) и деиммунизированный связывающий домен со специфичностью для антигена CD3 человека, показанный на SEQ ID NO.77 VHVL, конструировали, как указано в таблице 1; см. также пример 2, выше. Все конструкции биспецифического одноцепочечного антитела с человеческими связывающими доменами анти-CEA, описанными здесь (очевидно), связываются с растворимым антигеном CEA человека, поскольку их выделяли после четырех циклов отбора с помощью фагового дисплея на растворимом антигене CEA, иммобилизованном на планшетах для ELISA.
В частности, получили следующие расположения:
(a) человеческая часть анти-CEA, локализованная на N-конце:
(i) VH-VL ориентация анти-CEA:
A5 VH-A240 VLxSEQ ID NO.77 VHVL (SEQ ID NO:24),
A5 VH-A240 VL#×SEQ ID NO.77 VHVL (SEQ ID NO:126),
B9 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:32),
B9 VH-A240 VL#×SEQ ID NO.77 VHVL (SEQ ID NO:130),
D8 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:40),
D8 VH-A240 VL#×SEQ ID NO.77 VHVL (SEQ ID NO:134) и
CEAI VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:16).
(ii) VL-VH ориентация анти-CEA:
A240 VL-A5 VH×SEQ ID NO.77 VHVL (SEQ ID NO:26),
A240 VL-B9 VH×SEQ ID NO.77 VHVL (SEQ ID NO:34),
A240 VL-D8 VH×SEQ ID NO.77 VHVL (SEQ ID NO:42)
и A240 VL-CEAI VH×SEQ ID NO.77 VHVL (SEQ ID NO:18).
(b) человеческая часть анти-CEA, локализованная на C-конце:
(i) VH-VL ориентация анти-CEA:
SEQ ID NO.77 VHVL×A5 VH-A240VL (SEQ ID NO:30),
SEQ ID NO.77 VHVL×A5 VH-A240VL# (SEQ ID NO:128),
SEQ ID NO.77 VHVL×B9 VH-A240VL (SEQ ID NO:36),
SEQ ID NO.77 VHVL×E12 VH-A240VL (SEQ ID NO:143),
SEQ ID NO.77 VHVL×B9 VH-A240VL# (SEQ ID NO:132),
SEQ ID NO.77 VHVL×D8 VH-A240VL (SEQ ID NO:44),
SEQ ID NO.77 VHVL×D8 VH-A240VL# (SEQ ID NO:136)
и SEQ ID NO.77 VHVL×CEAI VH-A240VL (SEQ ID NO:20).
(ii) VL-VH ориентация анти-CEA:
SEQ ID NO.77 VHVL×A240VL-A5 VH (SEQ ID NO:28),
SEQ ID NO.77 VHVL×A240VL-B9VH (SEQ ID NO:38),
SEQ ID NO.77 VHVL×A240VL-D8VH (SEQ ID NO:46) и
SEQ ID NO.77 VHVL×A240VL-CEAI VH (SEQ ID NO:22).
CEAI VH (SEQ ID NO:56) обозначает VH-область, полученную из mAb A5B7 мыши, в то время как CEAI VHVL или CEAI VLVH относятся к домену VH-VL и домену VL-VH соответственно, полученным из mAb A5B7. A240 соответствует VL-области человека (см. SEQ ID NO:64 и пример 7). Соответственно, например, CEAI VH-A240 VLxSEQ ID NO.77 VHVL (SEQ ID NO.16) соответствует биспецифической конструкции с наполовину человеческим связывающим CEA доменом, обладающим мышиной VH-областью из mAb7 и человеческой VL-областью A240. Для клонирования библиотеки человеческих антител нуклеотидные последовательности, кодирующие исходные N-концы VL-области A240, необходимо перевести в участки рестрикции. В A5 VH-A240 VL# × SEQ ID NO.77 VHVL (SEQ ID NO:126), SEQ ID NO.77 VHVL×A5 VH-A240VL# (SEQ ID NO:128), B9 VH-A240 VL# × SEQ ID NO.77 VHVL (SEQ ID NO:130), SEQ ID NO.77 VHVL×B9 VH-A240VL# (SEQ ID NO:132), D8 VH-A240 VL# × SEQ ID NO.77 VHVL (SEQ ID NO:134), и SEQ ID NO.77 VHVL×D8 VH-A240VL# (SEQ ID NO:136), исходные N-концы вводили снова.
Конструкция биспецифического одноцепочечного антитела SEQ ID NO.77 VHVL×E12 VH-A240VL (SEQ ID NO:143) отличается от конструкции SEQ ID NO.77 VHVL×B9 VH-A240VL (SEQ ID NO:36) только одним аминокислотным остатком. Последовательность CDR-H2 в E12 VH читается «FILNKANGGTTEYAASVKG» (SEQ ID NO:145), тогда как B9 VH она читается «FIRNKANGGTTEYAASVKG» (SEQ ID NO:67). Человеческую VH-область E12 выделяли, как указано в примере 7.
2. Экспрессия, очистка и анализ проточной цитометрией
Экспрессию, очистку и анализ проточной цитометрией этих человеческих биспецифических одноцепочечных антител CEA x CD3 проводили способами, описанными в примере 2, выше.
3. Активность связывания
Как показано в качестве примера на фигуре 14, конструкции человеческого биспецифического одноцепочечного антитела A5 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:24), B9 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:32), D8 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:40) и CEAI VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:16) связываются с CEA-положительными клетками человека Kato III и с CD3-положительными клетками HPB-ALL.
4. Цитотоксическая активность в отсутствие растворимого антигена CEA
Цитотоксическую активность против клеток-мишеней CHO-CEA+ показали для следующих расположений доменов человеческих биспецифических одноцепочечных антител.
В случае конструкций с частью анти-CEA, локализованной на N-конце и ориентацией VH-VL части анти-CEA, на фигуре 15 показана цитотоксическая активность для A5 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:24), B9 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:32), D8 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:40) и CEAI VH-A240 VLxSEQ ID NO.77 VHVL (SEQ ID NO:16). На фигуре 16 показана цитотоксическая активность для ориентации VL-VH в анти-CEA домене (локализованном на N-конце) для A240 VL-A5 VHxSEQ ID NO.77 VHVL (SEQ ID NO:26), A240 VL-B9 VH×SEQ ID NO.77 VHVL (SEQ ID NO:34), A240 VL-D8 VH×SEQ ID NO.77 VHVL (SEQ ID NO:42) и A240 VL-CEAI VH×SEQ ID NO.77 VHVL (SEQ ID NO:18).
В случае конструкций с частью анти-CEA, локализованной на C-конце и ориентацией VH-VL части анти-CEA, на фигуре 17 показана цитотоксичность против клеток-мишеней CEA+ для SEQ ID NO.77 VHVL×A5 VH-A240VL (SEQ ID NO:30), SEQ ID NO.77 VHVL×B9 VH-A240VL (SEQ ID NO:36), SEQ ID NO.77 VHVL×D8 VH-A240VL (SEQ ID NO:44), и SEQ ID NO.77 VHVL×CEAI VH-A240VL (SEQ ID NO:20). SEQ ID NO.77 VHVLxCEAI LH использовали в качестве положительного контроля. На фигуре 18 показана цитотоксическая активность конструкций с ориентацией VL-VH анти-CEA домена (локализованного на C-конце) для SEQ ID NO.77 VHVL×A240VL-A5 VH (SEQ ID NO:28), SEQ ID NO.77 VHVL×A240VL-B9VH (SEQ ID NO:38), SEQ ID NO.77 VHVL×A240VL-D8VH (SEQ ID NO:46) и SEQ ID NO.77 VHVL×A240VL-CEAIVH (SEQ ID NO:22). SEQ ID NO.77 VHVL×CEAI LH (SEQ ID NO:2) использовали в качестве положительного контроля.
На фигуре 21 показана цитотоксическая активность конструкций биспецифического одноцепочечного антитела, содержащих человеческую VH-область B9 и человеческую VL-область A240 в различных расположениях: для A240 VL-B9 VH×SEQ ID NO.77 VHVL (SEQ ID NO:34), SEQ ID NO.77 VHVL×A240 VL-B9 VH (SEQ ID NO:38), SEQ ID NO.77 VHVL×B9 VH-A240 VL (SEQ ID NO:36) и B9 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:32) выявили цитотоксическую активность против трансфицированных CEA человека клеток CHO.
5. Устойчивость человеческих биспецифических одноцепочечных антител CEA x CD3 к растворимому антигену CEA
Конкурентные анализы в присутствии растворимого антигена CEA человека для человеческих биспецифических одноцепочечных антител проводили, как описано в примере 5, выше. На фигурах 19 и 20 показана устойчивость цитотоксической активности к растворимому антигену CEA также для человеческих конструкций, как показано на примере конструкций A5 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:24), B9 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:32), D8 VH-A240 VL×SEQ ID NO.77 VHVL (SEQ ID NO:40) и CEAI VH-A240 VLxSEQ ID NO.77 VHVL (SEQ ID NO:16); устойчивость к растворимому CEA биспецифических одноцепочечных антител мышиного происхождения см. в примере 5. Более того, на фигуре 22 показано, что CEA-реактивная биспецифическая одноцепочечная конструкция A240 VL-B9 VHxSEQ ID NO.77 VHVL (SEQ ID NO:34) перенаправляет T-клетки на лизис клеток CHO-CEA+ в присутствии увеличивающихся количеств растворимого антигена CEA. Этот эксперимент показал, что опосредованная VHVL A240 VL-B9 VHxSEQ ID NO.77 цитотоксическая активность также является устойчивой к растворимому CEA. Наконец, как можно вывести из фигуры 27, опосредованная биспецифической одноцепочечной конструкцией SEQ ID NO.77 VHVL×E12 VH-A240 VL (SEQ ID NO:143) цитотоксическая активность является устойчивой к растворимому CEA.
Таким образом, настоящее изобретение относится к фармацевтическим композициям с цитотоксической противоопухолевой активностью в присутствии даже высоких уровней растворимого антигена CEA. Как указано выше, высокие концентрации CEA в сыворотке у пациентов с эпителиальными опухолями уменьшают успех лекарственных средств на основе антител анти-CEA. Таким образом, фармацевтические композиции по изобретению, в частности, пригодны для лечения пациентов с прогрессирующими эпителиальными опухолями (например, вторичными, метастазирующими опухолями после хирургического удаления первичной опухоли (опухолей)), злокачественными эпителиальными опухолями, (эпителиальной) опухоли с большим объемом и эпителиальными опухолями на поздних стадиях, характеризующимися высокими концентрациями растворимого антигена CEA в сыворотке/плазме указанных пациентов. Кроме того, ожидают также, что фармацевтические композиции по изобретению будут вводить в низких дозах. Кроме того, указанные фармацевтические композиции маловероятно являются иммуногенными при введении пациентам из-за человеческого происхождения части анти-CEA и деиммунизированной части анти-CD3 биспецифических одноцепочечных антител в фармацевтических композициях по изобретению. Более того, ожидают, что фармацевтические композиции по изобретению будут обеспечивать высокое проникновение в опухоли благодаря низкой молекулярной массе и малому размеру биспецифических одноцепочечных конструкций. Кроме того, для лечения опухоли будут использовать малые количества биспецифических одноцепочечных антител из-за высокой цитотоксической активности указанных молекул. Поскольку ожидают, что пациентам будут вводить малые количества, ожидают также, что неблагоприятные эффекты для пациентов также будут уменьшены. Наконец, биспецифические одноцепочечные антитела без устойчивости к растворимому CEA будут высоко чувствительными даже к низким концентрациям растворимого антигена CEA в плазме пациентов с опухолями, поскольку их будут вводить в низких концентрациях, как указано выше. Эту проблему также преодолевают посредством фармацевтических композиций по изобретению.
ПРИМЕР 9: Оценка гомогенности белка очищенного мономера A240 VL - B9 VHxSEQ ID NO.77 VHVL (SEQ ID NO:34) посредством высокоразрешающей катионообменной хроматографии
Для дальнейшей характеристики гомогенности очищенной конструкции A240 VL - B9 VHxSEQ ID NO.77 VHVL (SEQ ID NO:34) выделенную фракцию мономера подвергали высокоразрешающей катионообменной хроматографии. Хроматографию проводили на колонке MiniS (Mini S PE 4.6/50 CatX 0,8 мл; GE Healthcare 17-5005-01), уравновешенной 20 мМ буфером MES pH 5,5. Образец разводили 1:3 тем же самым буфером перед нанесением на колонку. Связавшийся белок элюировали градиентом буфера для уравновешивания, содержащим 1 M NaCl: 0-30% в 60 объемах колонки. Оставшийся белок элюировали 3 объемами колонки 1 М NaCl. Полученная хроматограмма показана на фигуре 23 и показывает гомогенную фракцию белка с отдельным главным пиком.
ПРИМЕР 10: Стабильность в плазме A240 VL-B9 VHxSEQ ID NO.77 VHVL (SEQ ID NO:34)
Стабильность в плазме конструкции A240 VL - B9 VHxSEQ ID NO.77 VHVL (SEQ ID NO:34) тестировали в различных условиях инкубации, следуя стандартному анализу цитотоксичности с высвобождением 51-хрома, как описано в примере 4.
Пул плазмы человека из крови пяти здоровых доноров получали посредством сбора крови в покрытые ЭДТА шприцы. Клеточные компоненты удаляли центрифугированием, верхнюю фазу плазмы собирали и затем объединяли. Конструкцию A240 VL - B9 VH×SEQ ID NO.77 VHVL (SEQ ID NO:34) инкубировали при 37°C или 4°C в присутствии или в отсутствие плазмы. В качестве контролей конструкцию разводили непосредственно перед анализом цитотоксичности в плазме или в среде RPMI 1640 соответственно. CHO-CEA+ служили клетками-мишенями; стимулированные CD8+ T-клетки использовали в качестве эффекторных клеток. Соотношение эффектор:мишень составляло 10:1. Продолжительность анализа составляла 18 часов.
Как показано на фигуре 24, доказали, что CEA-реактивная биспецифическая одноцепочечная конструкция A240 VL - B9 VHxSEQ ID NO.77 VHVL (SEQ ID NO:34) является очень стабильной; не смогли детектировать потери цитотоксической активности после инкубации в плазме человека в течение 24 часов при 37°C.
ПРИМЕР 11: Оценка гомогенности белка очищенного мономера SEQ ID NO.77 VHVL×E12 VH-A240 VL (SEQ ID NO:143) посредством высокоразрешающей катионообменной хроматографии
Эксперимент проводили по аналогии с примером 9, за исключением того, что анализировали SEQ ID NO.77 VHVLxE12 VH-A240 VL (SEQ ID NO:143). Полученная хроматограмма показана на фигуре 25 и показывает гомогенную фракцию белка с отдельным главным пиком.
ПРИМЕР 12: Стабильность в плазме SEQ ID NO.77 VHVL×E12 VH-A240 VL (SEQ ID NO:143)
Эксперимент проводили по аналогии с примером 10, за исключением того, что анализировали SEQ ID NO.77 VHVL × E12 VH-A240 VL (SEQ ID NO:143). Как показано на фигуре 26, доказали, что CEA-реактивная биспецифическая одноцепочечная конструкция SEQ ID NO.77 VHVL × E12 VH-A240 VL (SEQ ID NO:143) является очень стабильной; не смогли детектировать потери цитотоксической активности после инкубации в плазме человека в течение 24 часов при 37°C.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С УСТОЙЧИВОСТЬЮ К РАСТВОРИМОМУ СЕА | 2010 |
|
RU2573893C2 |
| PSCAXCD3, CD19XCD3, C-METXCD3, ЭНДОСИАЛИНXCD3, EPCAMXCD3, IGF-1RXCD3 ИЛИ FAP-АЛЬФАXCD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2547600C2 |
| БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО К PSMAxCD3 С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2011 |
|
RU2617942C2 |
| PSMA×CD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2559531C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ CEACAM5 И CD47 | 2019 |
|
RU2798246C2 |
| АНТИТЕЛО, НАЦЕЛИВАЮЩЕЕСЯ НА CD3, БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2808138C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ CEACAM5 И CD3 | 2020 |
|
RU2827106C1 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2008 |
|
RU2535992C2 |
| CD3-ЭПСИЛОН-СВЯЗЫВАЮЩИЙ ДОМЕН С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2008 |
|
RU2561457C2 |
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2678127C2 |






































































































































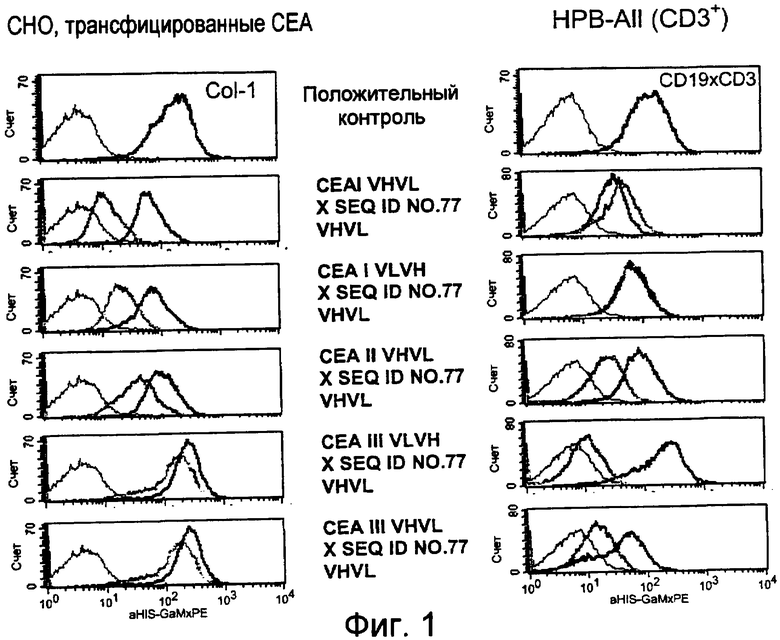
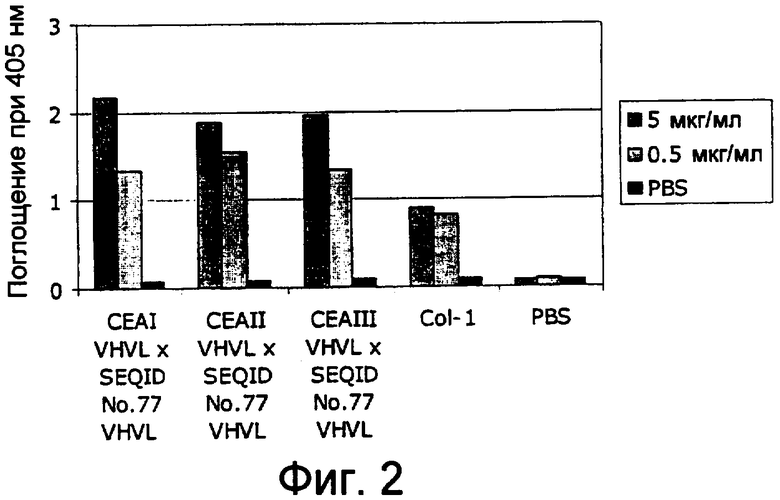

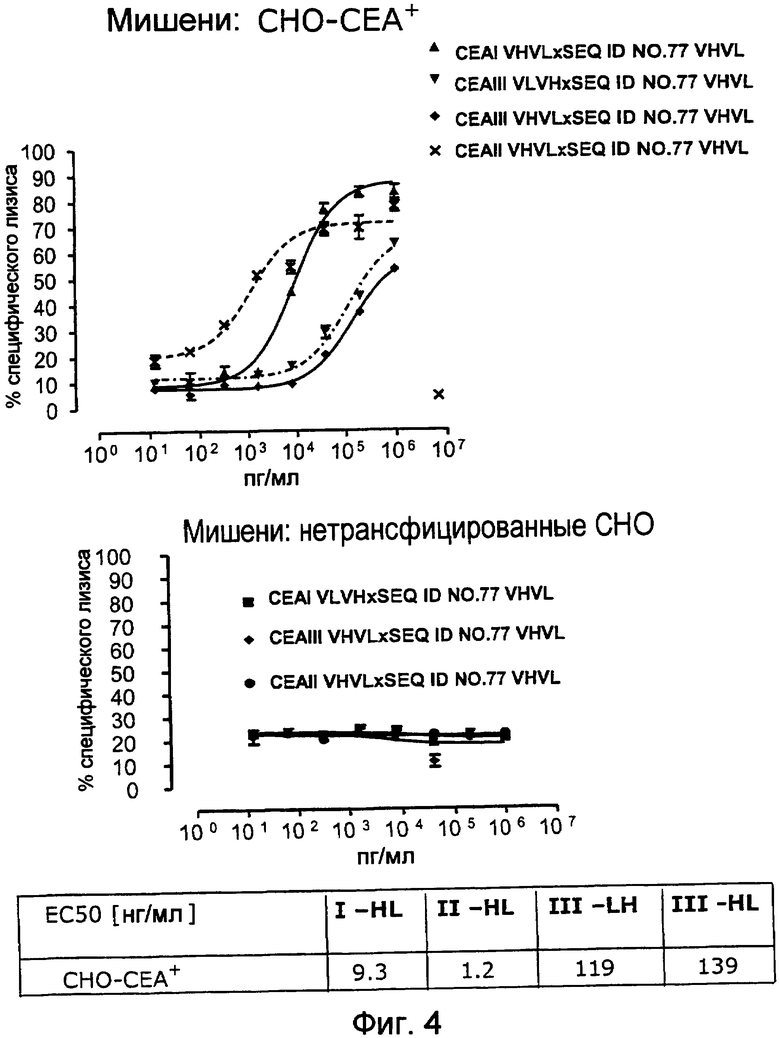
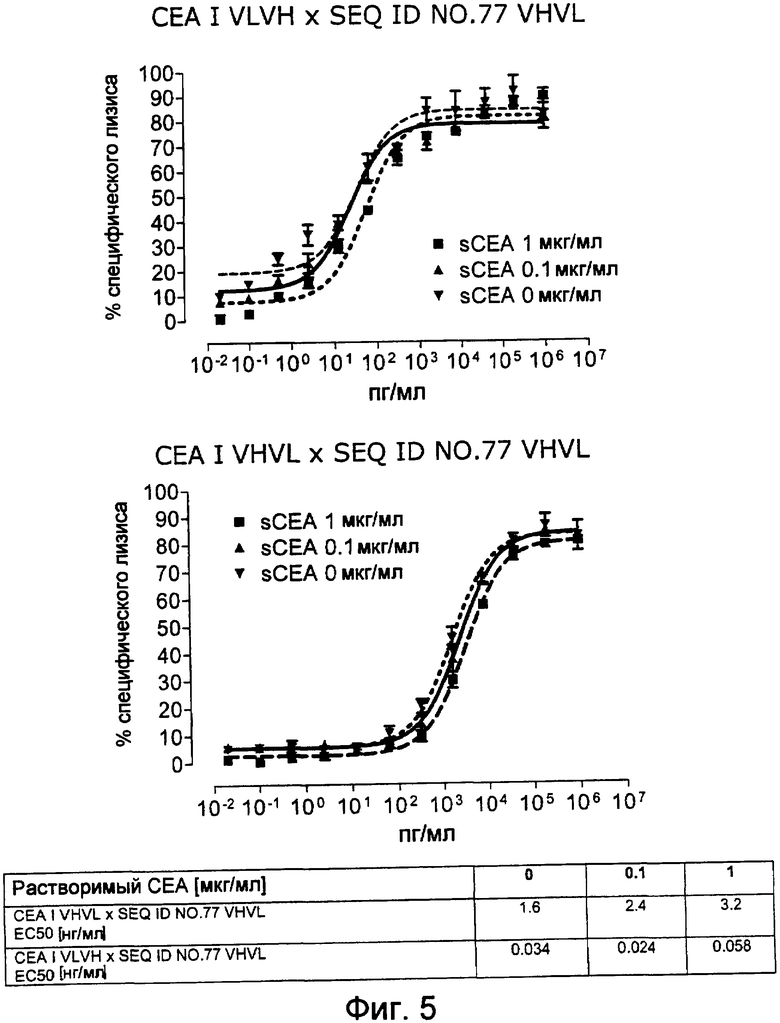
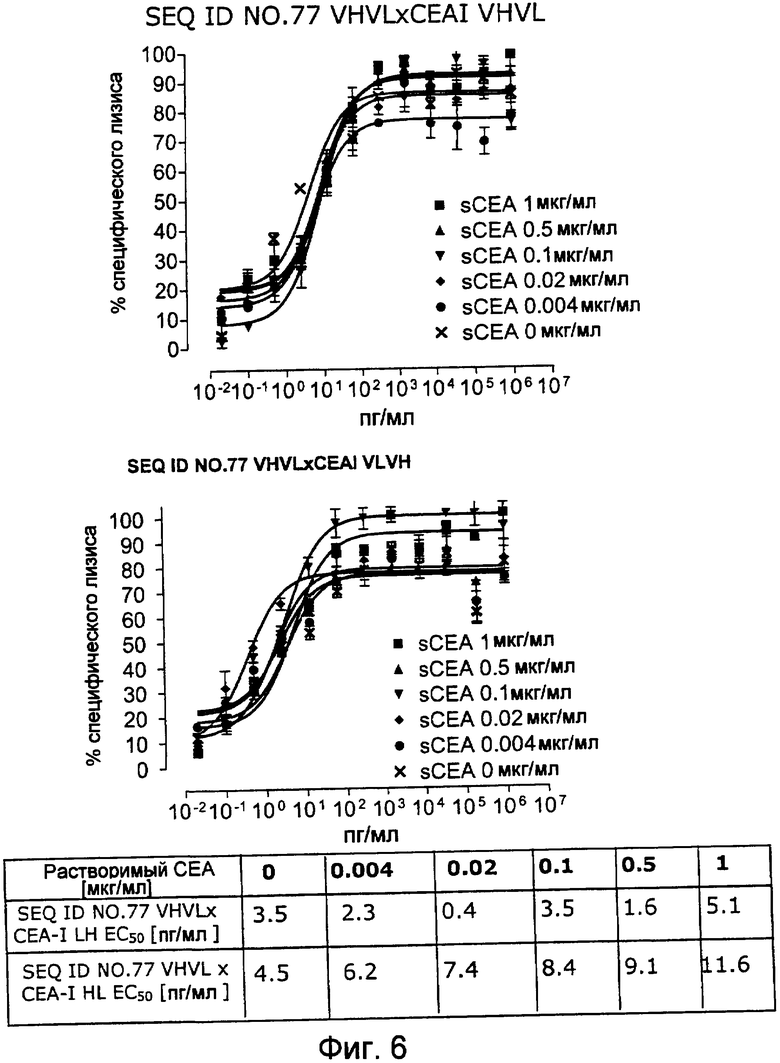
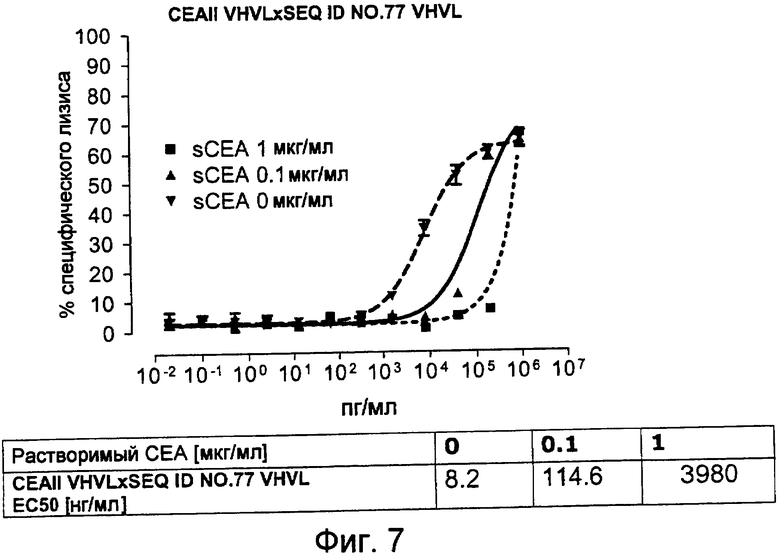

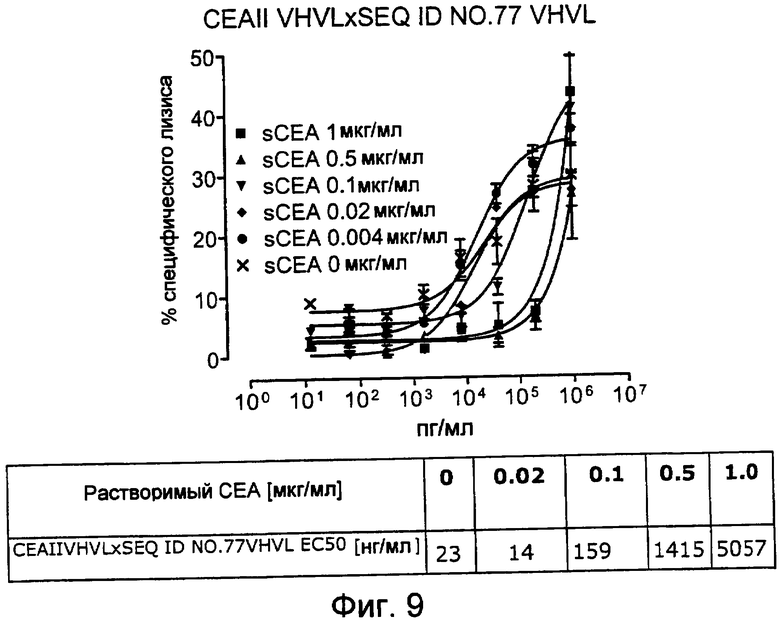
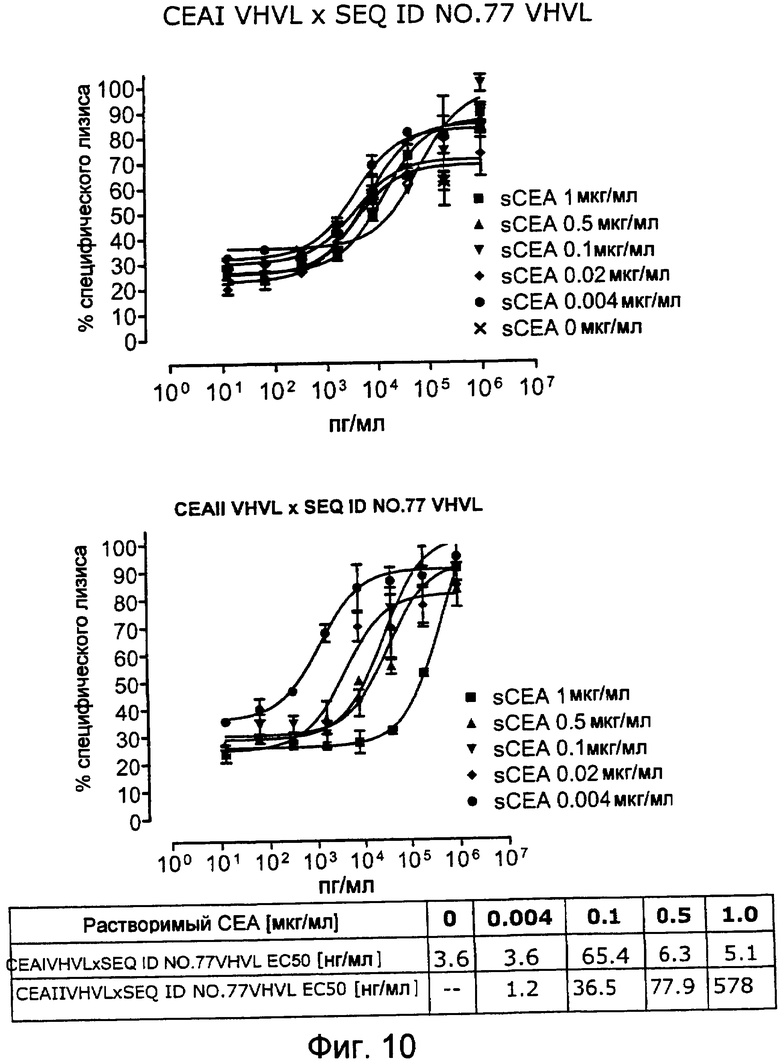

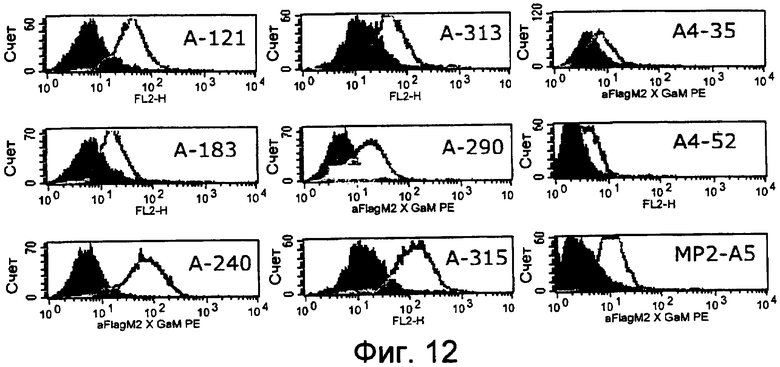
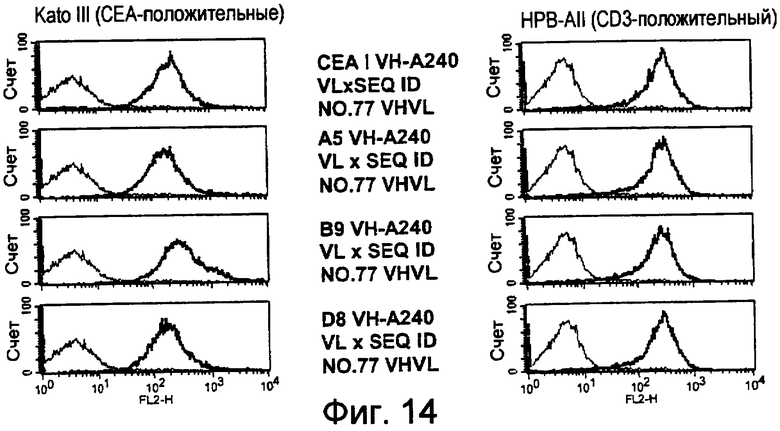

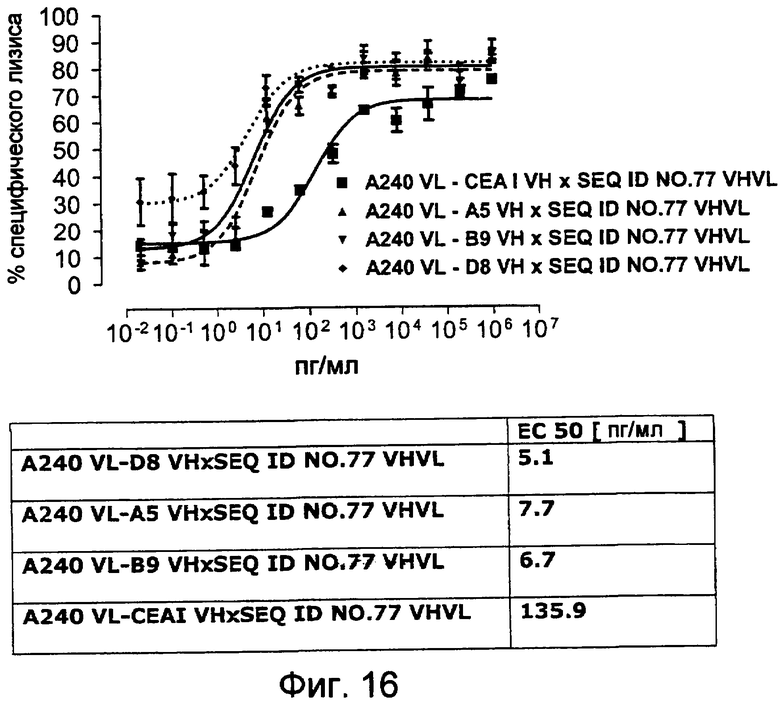

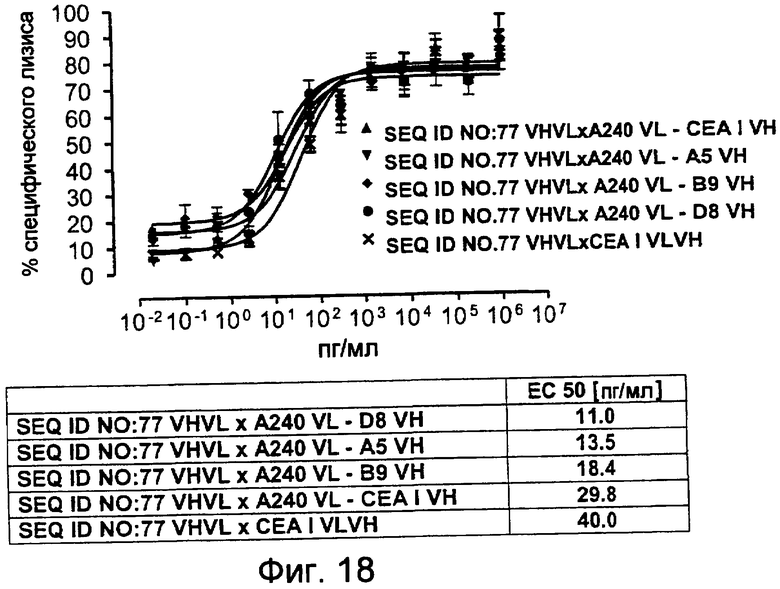
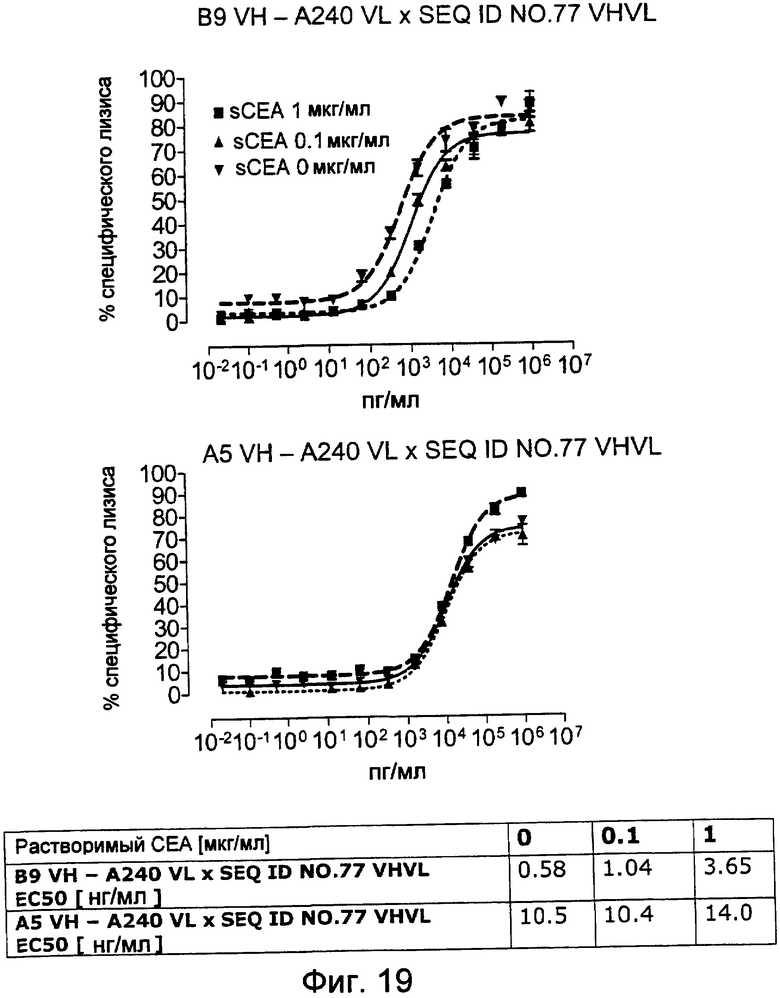
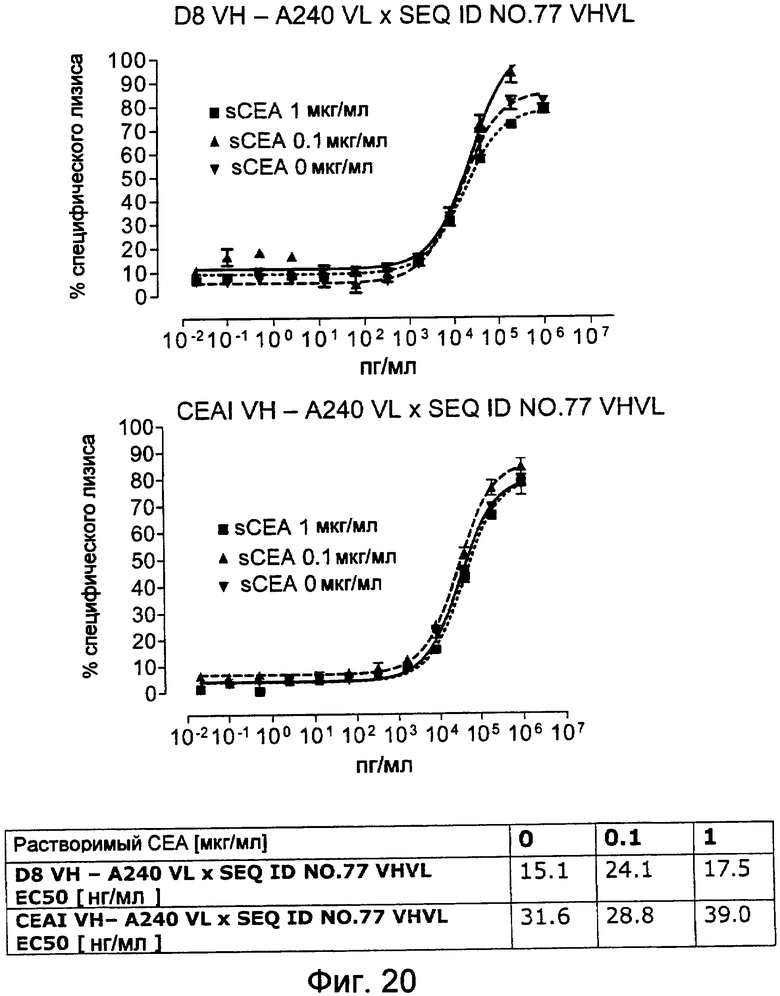
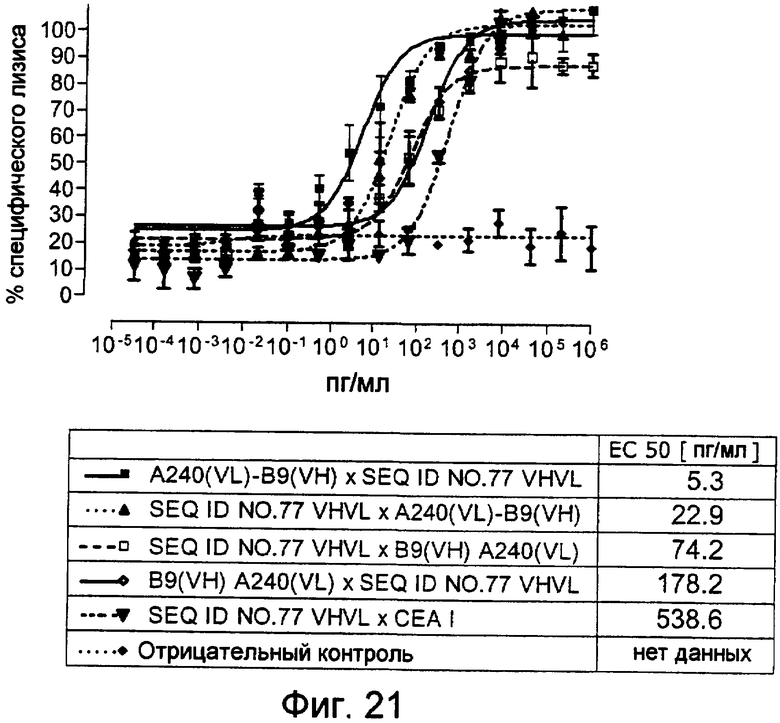
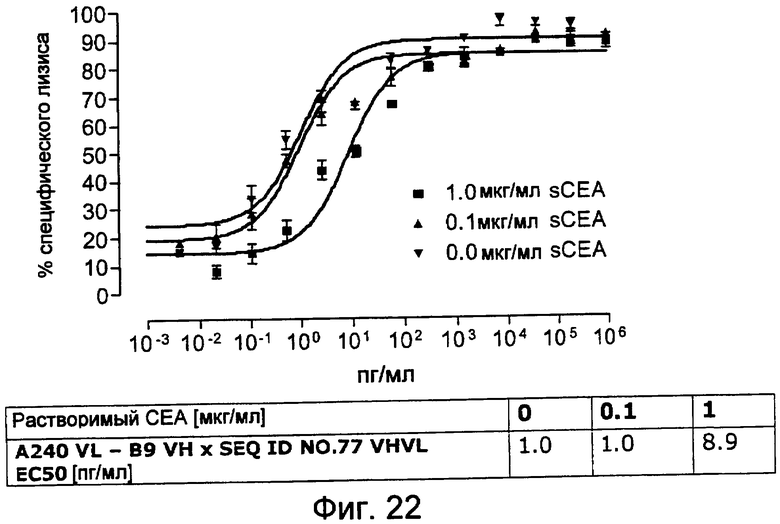
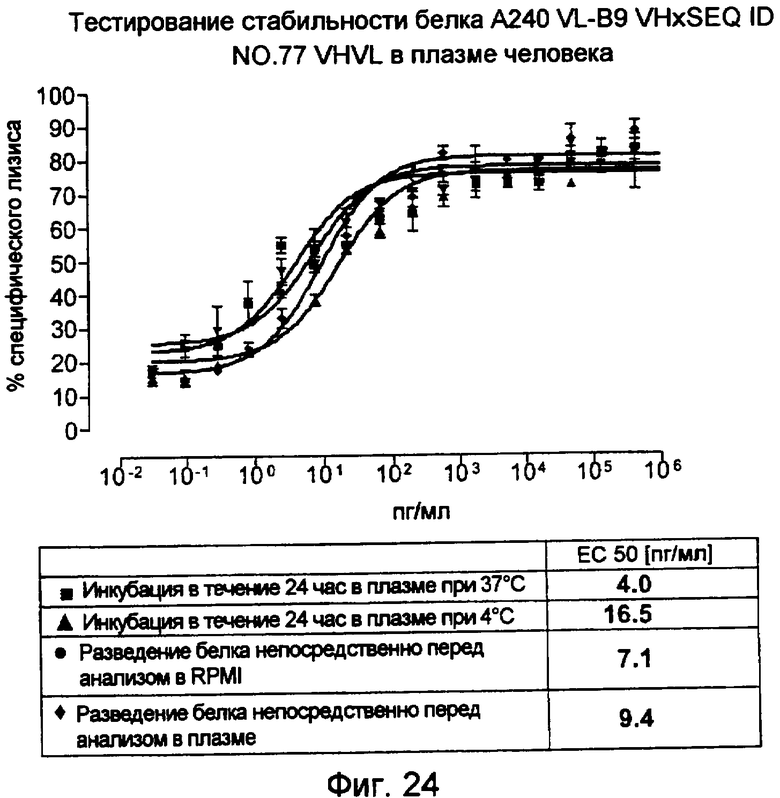
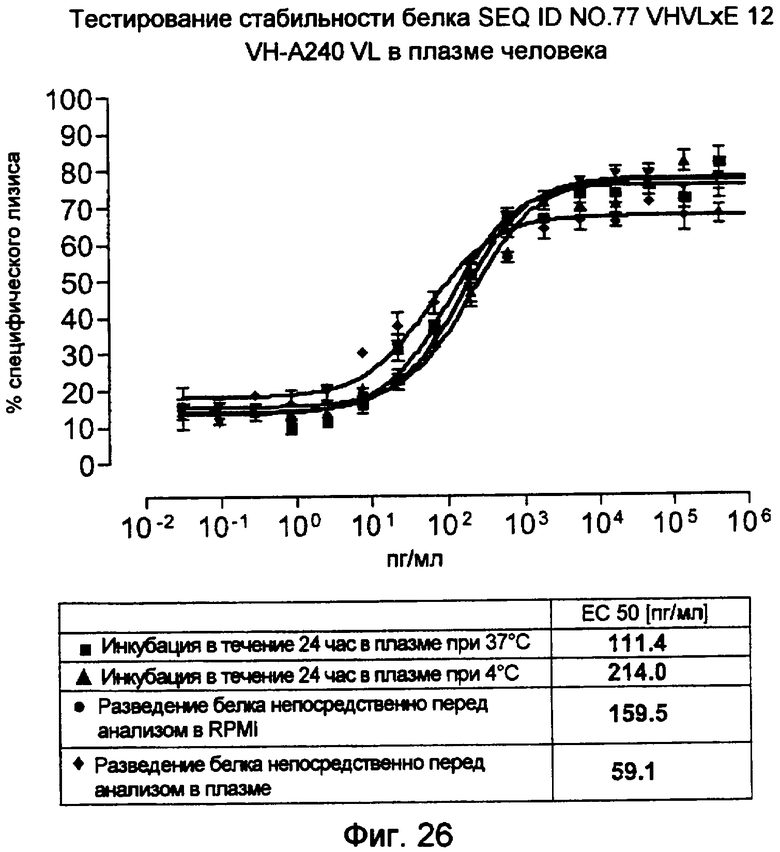

Изобретение относится к биотехнологии и представляет собой фармацевтическую композицию для лечения эпителиальной опухоли у человека, где указанная фармацевтическая композиция содержит биспецифическое одноцепочечное антитело, обладающее первым связывающим доменом, специфически связывающимся с CD3 человека, и вторым связывающим доменом, специфически связывающимся с СЕА человека. Кроме того, описаны способы получения указанной фармацевтической композиции, способ и набор для предупреждения, лечения или облегчения эпителиальной опухоли. Изобретение может эффективно использоваться для лечения эпителиальной опухоли. 4 н. и 24 з.п. ф-лы, 27 ил., 1 табл.
1. Фармацевтическая композиция для профилактики, лечения или ослабления симптомов эпителиальной опухоли у человека, где указанная фармацевтическая композиция содержит биспецифическое одноцепочечное антитело, обладающее
(a) первым связывающим доменом, специфически связывающимся с CD3 человека, и
(b) вторым связывающим доменом, специфически связывающимся с СЕА человека,
где указанный второй связывающий домен, специфический для СЕА человека, содержит CDR-H1, обладающую аминокислотной последовательностью «SYWMH» (SEQ ID NO.68), и CDR-H2, обладающую аминокислотной последовательностью «FIRNKANGGTTEYAASVKG» (SEQ ID NO.67) или «FILNKANGGTTEYAASVKG» (SEQ ID NO.145); или
где указанный второй связывающий домен, специфический для СЕА человека, содержит CDR-H1, обладающую аминокислотной последовательностью «TYAMH» (SEQ ID NO.70), и CDR-H2, обладающую аминокислотной последовательностью «LISNDGSNKYYADSVKG» (SEQ ID NO.69); и
где указанный второй связывающий домен, специфический для СЕА человека, содержит CDR-L1, обладающую аминокислотной последовательностью «TLRRGINVGAYSIY» (SEQ ID NO.73), и CDR-L2, обладающую аминокислотной последовательностью «YKSDSDKQQGS» (SEQ ID NO.72), и CDR-L3, обладающую аминокислотной последовательностью «MIWHSGASAV» (SEQ ID NO.71); и
где указанный второй связывающий домен содержит по меньшей мере аминокислотную последовательность «DRGLRFYFDY» (SEQ ID NO.66), соответствующую положениям по Kabat 95-102 CDR-H3 моноклонального антитела мыши А5В7.
2. Фармацевтическая композиция по п.1, где указанный первый связывающий домен, специфический для CD3, локализован на С-конце.
3. Фармацевтическая композиция по п.1, где указанные связывающие домены расположены в порядке VHCEA-VLCEA-VHCD3-VLCD3 или VLCEA-VHCEA-VHCD3-VLCD3.
4. Фармацевтическая композиция по п.1, где аминокислотная последовательность VH-области второго связывающего домена, специфического для СЕА человека, представляет собой SEQ ID NO.60 или 146.
5. Фармацевтическая композиция по п.1, где аминокислотная последовательность VH-области второго связывающего домена, специфического для СЕА человека, представляет собой SEQ ID NO.58 или SEQ ID NO.62.
6. Фармацевтическая композиция по п.1, где аминокислотная последовательность VL-области второго связывающего домена, специфического для СЕА человека, представляет собой SEQ ID NO.64.
7. Фармацевтическая композиция по п.1, где V-области второго связывающего домена, специфического для СЕА, выбраны из группы, состоящей из
(а) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.60, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.64;
(b) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.146, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.64;
(c) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.58, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.64;
(d) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.62, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.64; и
(e) VH-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.56, и VL-области, состоящей из аминокислотной последовательности, показанной на SEQ ID NO.64.
8. Фармацевтическая композиция по п.1, где указанное биспецифическое одноцепочечное антитело содержит аминокислотную последовательность, выбранную из группы, состоящей из
(a) аминокислотной последовательности, как показано на любой из SEQ ID NO.6, 8, 16, 18, 24, 26, 32, 34, 40, 42, 126, 130, 134 или 143;
(b) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, как показано на SEQ ID NO.5, 7, 15, 17, 23, 25, 31, 33, 39, 41, 125, 129, 133 или 142;
(c) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, гибридизующейся в строгих условиях с комплементарной последовательностью нуклеиновой кислоты из (b);
(d) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, которая является вырожденной в результате генетического кода по отношению к нуклеотидной последовательности из (b).
9. Фармацевтическая композиция по п.1, где указанная эпителиальная опухоль представляет собой гастроинтестинальную аденокарциному, аденокарциному молочной железы или аденокарциному легкого.
10. Фармацевтическая композиция по п.1, где указанная фармацевтическая композиция предназначена для лечения прогрессирующих опухолей, опухолей на поздних стадиях, пациентов с опухолью с большим объемом/массой опухоли, метастазирующих опухолей или пациентов с опухолью с концентрацией СЕА в сыворотке, превышающей 100 нг/мл.
11. Фармацевтическая композиция по п.10, где указанную концентрацию СЕА в сыворотке определяют посредством ELISA.
12. Фармацевтическая композиция по п.1, где по меньшей мере один из указанного первого или второго связывающего домена является химерным, гуманизированным, CDR-привитым, и/или деиммунизированным, или человеческим.
13. Фармацевтическая композиция по п.1, дополнительно содержащая белковое соединение, способное обеспечивать сигнал активации для иммунных эффекторных клеток.
14. Фармацевтическая композиция по п.1, дополнительно содержащая подходящие составы носителей, стабилизаторов и/или эксципиентов.
15. Фармацевтическая композиция по п.1, где указанная фармацевтическая композиция пригодна для введения в сочетании с дополнительным лекарственным средством.
16. Способ получения фармацевтической композиции по любому из пп.1-13, где указанный способ включает в себя
культивирование хозяина, трансформированного или трансфицированного молекулой нуклеиновой кислоты, кодирующей биспецифическое одноцепочечное антитело, как оно определено в любом из пп.1-12, или трансформированного или трансфицированного вектором, содержащим указанную молекулу нуклеиновой кислоты, в условиях, позволяющих экспрессию биспецифического одноцепочечного антитела, как определено в любом из пп.1-12,
выделение продуцированного биспецифического одноцепочечного антитела из культуры и
смешивание выделенного антитела с подходящими составами носителей, стабилизаторов и/или эксципиентов.
17. Способ по п.16, где указанный вектор дополнительно содержит регуляторную последовательность, функционально связанную с указанной нуклеиновой кислотой.
18. Способ предупреждения, лечения или облегчения эпителиальной опухоли у нуждающегося в этом субъекта, где указанный способ включает в себя стадию введения эффективного количества фармацевтической композиции по любому из пп.1-12, или как получено способом по п.16, в течение достаточного периода времени.
19. Способ по п.18, где указанная эпителиальная опухоль представляет собой гастроинтестинальную аденокарциному, аденокарциному молочной железы или аденокарциному легкого.
20. Способ по п.18, где фармацевтическая композиция предназначена для лечения прогрессирующих опухолей, опухолей на поздних стадиях, пациентов с опухолью с большим объемом/массой опухоли, метастазирующих опухолей или пациентов с опухолью с концентрацией СЕА в сыворотке, превышающей 100 нг/мл.
21. Способ по п.20, где указанную концентрацию СЕА в сыворотке определяют посредством ELISA.
22. Способ по п.18, где указанную фармацевтическую композицию вводят в сочетании с дополнительным лекарственным средством.
23. Способ по п.22, где указанное лекарственное средство представляет собой небелковое соединение или белковое соединение.
24. Способ по п.23, включающий в себя введение белкового соединения, способного обеспечивать сигнал активации для иммунных эффекторных клеток.
25. Способ по п.23, где указанное белковое соединение или небелковое соединение вводят одновременно или не одновременно с биспецифическим одноцепочечным антителом, как оно определено в любом из пп.1-12.
26. Способ по п.18, где указанный субъект представляет собой человека.
27. Набор для профилактики, лечения или ослабления симптомов эпителиальной опухоли у человека, содержащий биспецифическое одноцепочечное антитело, как оно определено в любом из пп.1-12, молекулу нуклеиновой кислоты, кодирующую биспецифическое одноцепочечное антитело, вектор, содержащий указанную молекулу нуклеиновой кислоты, и/или хозяина, трансформированного или транфицированного указанной молекулой нуклеиновой кислоты или указанным вектором.
28. Набор по п.27, где указанный вектор дополнительно содержит регуляторную последовательность, функционально связанную с указанной нуклеиновой кислотой.
| KONTERMANN R.E | |||
| "Recombinant bispecific antibodies for cancer therapy" | |||
| Acta | |||
| Pharmacol | |||
| Sin | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| HOLLIGER P, ET AL | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Cancer Res | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
Авторы
Даты
2011-08-20—Публикация
2006-12-21—Подача