Настоящее изобретение относится к молекуле биспецифического одноцепочечного антитела, содержащего первый связывающий домен, способный связываться с эпитопом CD3 эпсилон-цепи человека и примата, не являющегося шимпанзе, где указанный эпитоп представляет собой часть аминокислотной последовательности, входящую в группу, состоящую из SEQ ID NO:2, 4, 6 и 8, и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA). В изобретении также предложены нуклеиновые кислоты, кодирующие указанную молекулу биспецифического одноцепочечного антитела, а также векторы и клетки-хозяева и способ его получения. Кроме того, изобретение относится к фармацевтическим композициям, содержащим указанную молекулу биспецифического одноцепочечного антитела, и медицинским применениям указанной молекулы биспецифического одноцепочечного антитела.
Т-клеточное распознавание опосредуется клонотипически распределенными альфа/бета и гамма/дельта рецепторами Т-клеток (TcR), которые взаимодействуют с пептид-нагруженными молекулами (комплекса) пептид-МНС (главный комплекс гистосовместимости) (рМНС) (Davis & Bjorkman, Nature 334 (1988), 395-402). Антиген-специфические цепи TcR не имеют доменов для сигнализации, но вместо этого соединены с консервативным мультисубъединичным сигнальным аппаратом CD3 (Call, Cell 111 (2002), 967-979, Alarcon, Immunol. Rev. 191 (2003), 38-46, Malissen Immunol. Rev. 191 (2003), 7-27). Механизм, посредством которого лигирование TcR непосредственно обеспечивает связь с сигнальным аппаратом, остается фундаментальным вопросом в Т-клеточной биологии (Alarcon, там же; Davis, Cell 110 (2002), 285-287). Кажется очевидным, что устойчивые Т-клеточные ответы вовлекают взаимодействие корецепторов, олигомеризацию TcR и расположение комплексов TcR-pMHC более высокого порядка в иммунологическом синапсе (Davis & van der Merwe, Curr. Biol. 11 (2001), R289-R291, Davis, Nat. Immunol. 4 (2003), 217-224). Однако очень ранняя передача сигнала с TcR происходит в отсутствие этих событий и может вовлекать лиганд-индуцированное конформационное изменение в CD3-эпсилон (Alarcon, там же, Davis (2002), там же, Gil. J. Biol. Chem. 276 (2001), 11174-11179, Gil, Cell 109 (2002), 901-912). Эпсилон-, гамма-, дельта- и дзета-субъединицы сигнального комплекса ассоциируют друг с другом с образованием CD3-эпсилон-гамма гетеродимера, CD3-эпсилон-дельта. гетеродимера и CD3-дзета-дзета гомодимера (Call, там же). Различные исследования показали, что молекулы CD3 важны для правильной клеточно-поверхностной экспрессии альфа/бета-TcR и нормального развития Т-клеток (Berkhout, J. Biol. Chem. 263 (1988), 8528-8536, Wang, J. Exp. Med. 188 (1998), 1375-1380, Kappes, Curr. Opin. Immunol. 7 (1995), 441-447). Структура эктодоменных фрагментов мышиного CD3-эпсилон-гамма гетеродимера в растворе показала, что обе эпсилон-гамма-субъединицы представляют собой С2-подобные (C2-set) lg-домены, которые взаимодействуют друг с другом с образованием необычной димерной конфигурации по типу "side-to-side" (Sun, Cell 105 (2001), 913-923). Хотя цистеин-богатый стебель (stalk), по-видимому, играет важную роль в управлении димеризации CD3 (Su, там же, Borroto, J. Biol. Chem. 273 (1998), 12807-12816), взаимодействие с помощью внеклеточных доменов CD3-эпсилон и CD3-гамма является достаточным для сборки этих белков с TcR-бета (Manolios, Eur. J. Immunol. 24 (1994), 84-92, Manolios & Li, Immunol. Cell Biol. 73 (1995), 532-536). Хотя до сих пор до конца неясно, доминирующая стехиометрия TcR, скорее всего, содержит один альфа-бета TcR, один CD3-эпсилон-гамма гетеродимер, один CD3-эпсилон-дельта гетеродимер и один CD3-дзета-дзета гомородимер (Call, там же). Учитывая центральную роль человеческого CD3-эпсилон-гамма гетеродимера в иммунном ответе, недавно была выяснена кристаллическая структура этого комплекса, связанного с терапевтическим антителом OKT3 (Kjer-Nielsen, PNAS 101, (2004), 7675-7680).
Многие терапевтические стратегии модулируют Т-клеточный иммунитет посредством нацеливания на TcR-сигнальный путь, в частности, моноклональные антитела (mAbs) против человеческого CD3, которые широко используются клинически в иммуносупрессивных режимах. CD3-специфическое мышиное mAb OKT3 было первым mAb, лицензированным для применения у людей (Sgro, Toxicology 105 (1995), 23-29) и широко использовалось в клинике в качестве иммуносупрессивного агента при трансплантации (Chatenoud, Clin. Transplant 7 (1993), 422-430. Chatenoud, Nat. Rev. Immunol. 3 (2003), 123-132, Kumar, Transplant. Proc. 30 (1998), 1351-1352), диабете 1 типа (Chatenoud (2003), там же) и псориазе (Utset, J. Rheumatol. 29 (2002), 1907-1913). Более того, анти-CD3 mAbs могут индуцировать частичную Т-клеточную сигнализацию и клональную толерантность (Smith, J. Exp. Med. 185 (1997), 1413-1422). OKT3 было описано в литературе в качестве мощного Т-клеточного митогена (Van Wauve, J. Immunol. 124 (1980), 2708-18), а также мощного Т-клеточного киллера (Wong, Transplantation 50 (1990), 683-9). OKT3 демонстрирует обе эти активности в зависимости от времени; после ранней активации Т-клеток, приводящей к высвобождению цитокина, при дальнейшем введении OKT3 впоследствии блокирует все известные Т-клеточные функции. Именно благодаря этому позднему блокированию Т-клеточной функции, OKT3 нашло такое широкое применение в качестве иммунодепрессанта в терапевтических режимах для снижения или даже отмены реакции отторжения тканевого аллотрансплантата.
OKT3 обращает реакцию отторжения аллотрансплантата ткани, скорее всего, благодаря блокированию функции всех Т-клеток, которые играют главную роль в острой реакции отторжения. OKT3 реагирует и блокирует функцию CD3-комплекса в мембране человеческих Т-клеток, который ассоциирован с антиген-распознающей структурой Т-клеток (TCR) и имеет важное значение для трансдукции сигнала. Какая субъединица TCR/CD3 связывается OKT3, является предметом многочисленных исследований. Некоторые доказательства указали на специфичность OKT3 в отношении эпсилон-субъединицы комплекса TCR/CD3 (Tunnacliffe, Int. Immunol. 1 (1989), 546-50; Kjer-Nielsen, PNAS 101, (2004), 7675-7680). Дополнительные доказательства показали, что OKT3 связывание комплекса TCR/CD3 требует присутствия других субъединиц этого комплекса (Salmeron, J. Immunol. 147 (1991), 3047-52).
Другие хорошо известные антитела, специфичные в отношении молекулы CD3, перечислены в Tunnacliffe, Int. Immunol. 1 (1989), 546-50. Как указано выше, такие CD3-специфические антитела способны индуцировать различные Т-клеточные ответы, такие как продукция лимфокинов (Von Wussow, J. Immunol. 127 (1981), 1197; Palacious, J. Immunol. 128 (1982), 337), пролиферация (Van Wauve, J. Immunol. 124 (1980), 2708-18) и индукция супрессора Т-клеток (Kunicka, в "Lymphocyte Typing II" 1 (1986), 223). То есть, в зависимости от условий эксперимента, CD3-специфическое моноклональное антитело может либо ингибировать, либо индуцировать цитотоксичность (Leewenberg, J. Immunol. 134 (1985), 3770; Phillips, J. Immunol. 136 (1986) 1579; Platsoucas, Proc. Natl. Acad. Sci. USA 78 (1981), 4500; Itoh, Cell. Immunol. 108 (1987), 283-96; Mentzer, J. Immunol. 135 (1985), 34; Landegren, J. Exp. Med. 155 (1982), 1579; Choi (2001), Eur. J. Immunol. 31, 94-106; Xu (2000), Cell Immunol. 200, 16-26; Kimball (1995), Transpl. Immunol. 3, 212-221).
Хотя многие из CD3 антител, описанных в данной области техники, как сообщается, распознают CD3-эпсилон субъединицу CD3-комплекса, многие из них связываются фактически с конформационными эпитопами и, таким образом, распознают только CD3-эпсилон в нативном окружении TCR. Конформационные эпитопы характеризуются наличием двух или более отдельных аминокислотных остатков, которые разделены в первичной последовательности, но собираются вместе на поверхности молекулы, когда полипептид сворачивается в нативный белок/антиген (Sela, (1969) Science 166, 1365 and Laver, (1990) Cell 61, 553-6). Конформационные эпитопы, связывающиеся CD3-эпсилон антителами, описанными в данной области техники, можно разделить на две группы. В основной группе указанные эпитопы образуются двумя субъединицами CD3, например, CD3-эпсилон цепью и CD3-гамма или CD3-дельта цепью. Например, в нескольких исследованиях было обнаружено, что наиболее широко используемые CD3-эпсилон моноклональные антитела OKT3, WT31, UCHT1, 7D6 и Leu-4 не связываются с клетками, однократно трансфицированными CD3-эпсилон цепью. Однако эти антитела окрашивали клетки, трансфицированные комбинацией CD3-эпсилон плюс либо CD3-гамма, либо CD3-дельта (Tunnacliffe, там же; Law, Int. Immunol. 14 (2002), 389-400; Salmeron, J. Immunol. 147 (1991), 3047-52; Coulie, Eur. J. Immunol. 21 (1991), 1703-9). Во второй меньшей группе конформационный эпитоп образуется в пределах самой CD3-эпсилон-субъединицы. Членом этой группы является, например, mAb АРА 1/1, которое было получено против денатурированной CD3-эпсилон (Risueno, Blood 106 (2005), 601-8). Взятые вместе, большинство CD3-эпсилон антител, описанных в данной области техники, распознают Конформационные эпитопы, локализованные на двух или более субъединицах CD3. Отдельные аминокислотные остатки, образующие третичную структуру этих эпитопов, таким образом, могут быть локализованы либо на самой CD3-эпсилон-субъединице, либо на CD3-эпсилон-субъединице и других субъединицах CD3, таких как CD3-гамма или CD3-дельта.
Другая проблема в отношении CD3 антител заключается в том, что многие CD3 антитела, как было обнаружено, являются видоспецифическими. Анти-CD3 моноклональные антитела - что справедливо для любых других моноклональных антител - функционируют путем высокоспецифического распознавания их целевых молекул. Они распознают только один сайт или эпитоп на их целевой молекуле CD3. Например, одним из наиболее широко используемых и лучше всего охарактеризованных моноклональных антител, специфичных в отношении CD3-комплекса, является OKT-3. Это антитело взаимодействует с CD3 шимпанзе, но не с гомологом CD3 других приматов, таких как макаки или с CD3 собаки (Sandusky et al., J. Med. Primatol. 15 (1986), 441-451). Аналогично, в WO 2005/118635 или WO 2007/033230 описаны моноклональные антитела к CD3-эпсилон человека, которые взаимодействуют с CD3-эпсилон человека, но не с CD3-эпсилон мыши, крысы, кролика или приматов, не являющихся шимпанзе, таких как макак-резус, яванский макак или бабуин. Анти-CD3 моноклональное антитело UCHT-1 также реагирует с CD3 шимпанзе, но не с CD3 макаков (собственные данные). С другой стороны, существуют также примеры моноклональных антител, которые распознают антигены макаков, но не их человеческие аналоги. Одним примером из этой группы является моноклональное антитело FN-18, направленное на CD3 макак (Uda et al., J. Med. Primatol. 30 (2001), 141-147). Примечательно, что, как обнаружили, лимфоциты периферической крови от примерно 12% яванских макаков лишены способности взаимодействовать с моноклональным антителом (FN-18) против CD3 макака-резуса из-за полиморфизма антигена CD3 у макак. Uda и др. описали замену двух аминокислот в последовательности CD3 яванских макак, которые не взаимодействуют с антителами FN-18, по сравнению с CD3, происходящими от других животных, которые взаимодействуют с антителами FN-18 (Uda et al., J Med. Primatol. 32 (2003), 105-10; Uda et al., J. Med. Primatol. 33 (2004), 34-7).
Избирательная способность, т.е. видовая специфичность, свойственная не только моноклональным антителам (и их фрагментам) против CD3, но и моноклональным антителам в целом, является существенным препятствием для их разработки в качестве терапевтических агентов для лечения заболеваний человека. Для того чтобы получить разрешение на продажу, любое новое лекарственное средство-кандидат должно пройти через строгое тестирование. Это тестирование можно подразделить на доклиническую и клиническую фазы: в то время как последнюю, дополнительно подразделяемую на общеизвестные клинические фазы I, II и III, проводят на пациентах-людях, предшествующую проводят на животных. Цель доклинического тестирования заключается в доказательстве того, что лекарственное средство-кандидат обладает желаемой активностью и, что наиболее важно, является безопасным. Только после установления на животных безопасности и возможной эффективности лекарственного средства-кандидата в доклиническом тестировании, это лекарственное средство-кандидат будет одобрено соответствующим контролирующим органом для клинического тестирования на людях. Лекарственные средства-кандидаты могут быть протестированы в отношении безопасности на животных следующими тремя путями: (1) на релевантном виде, т.е. виде, у которого лекарственные средства-кандидаты могут распознавать ортологичные антигены, (2) на трансгенном животном, содержащем человеческие антигены, и (3) путем использования имитатора лекарственного средства-кандидата, который может связываться с ортологичными антигенами, присутствующими в животном. Ограничения, касающиеся трансгенных животных, заключаются в том, что эта технология обычно ограничивается грызунами. Между грызунами и человеком имеются существенные различия в физиологии и результаты по безопасности нельзя с легкостью экстраполировать на людей. Ограничения, касающиеся имитатора лекарственного средства-кандидата, заключаются в иной композиции вещества по сравнению с реальным лекарственным средством-кандидатом, и зачастую используемыми животными являются грызуны с тем ограничением, которое рассмотрено выше. Таким образом, доклинические результаты, полученные на грызунах, обладают ограниченной прогностической ценностью в отношении лекарственного средства-кандидата. Подход к выбору тестирования безопасности состоит в использовании релевантного вида, предпочтительно низшего примата. В настоящее время ограничение, касающееся моноклональных антител, подходящих для терапевтического вмешательства у людей и описанных в данной области техники, заключается в том, что релевантными видами являются высшие приматы, в частности, шимпанзе. Шимпанзе считаются вымирающим видом, и вследствие их человекоподобной природы, использование таких животных для тестирования безопасности лекарственных средств запрещено в Европе и строго ограничено в других странах. CD3 также был с успехом использован в качестве мишени для биспецифических одноцепочечных антител для того, чтобы перенаправить цитотоксические Т-клетки на патологические клетки, приводя к истощению больных клеток в соответствующем организме (WO 99/54440; WO 04/106380). Например, Bargou et al. (Science 321 (2008):974-7) недавно сообщил о клинической активности биспецифической антительной конструкции CD19xCD3, называемой блинатумомабом, которая обладает потенциалом к привлечению всех цитотоксических Т-клетков для лизиса раковых клеток у пациентов-людей. Дозы уже 0,005 миллиграммов на квадратный метр в сутки у больных с неходжкинской лимфомой приводили к ликвидации клеток-мишеней в крови. Частичная и полная регрессия опухоли впервые была обнаружена при дозовом уровне 0,015 миллиграммов, и все семь пациентов, которых лечили дозой 0,06 миллиграммов, испытали регрессию опухоли. Блинатумомаб также приводит к клиренсу опухолевых клеток из костного мозга и печени. Хотя это исследование обосновало клиническое доказательство концепции терапевтической эффективности формата биспецифического одноцепочечного антитела в лечении рака, происходящего из клеток крови, существует потребность в успешных концепциях лечения других типов рака.
В 2008 г. у 186320 мужчин будет впервые диагностирован рак предстательной железы в США и около 28660 мужчин умрут от этой болезни. Самый последний доклад о смертности от рака показал, что в 2004 г. общая смертность от рака предстательной железы среди американских мужчин составляла 25 на 100000 мужчин. В конце 1980-х гг. широкое внедрение теста на специфический антиген предстательной железы (PSA) стало основным усовершенствованием в управлении раком предстательной железы. В этом тесте измеряют количество белка PSA в крови, которое часто повышено у пациентов с раком предстательной железы. В 1986 г. Управление США по надзору за качеством пищевых продуктов и лекарственных средств одобрило применение теста на PSA для мониторинга пациентов с раком предстательной железы и в 1994 г.дополнительно одобрило его применение в качестве скринингового теста для этого заболевания. Благодаря широкому внедрению PSA тестирования в США, приблизительно 90 процентов всех случаев рака предстательной железы в настоящее время диагностируют на ранней стадии и, следовательно, мужчины дольше живут после постановки диагноза. Однако результаты двух продолжающихся клинических испытаний: NCI-спонсируемого скринингового испытания в отношении предстательной железы, легких, толстой кишки и яичника (PLCO) и Европейского скринингового исследования рака предстательной железы (ERSPC), необходимы для определения того, действительно ли скрининг PSA сохраняет жизни. В продолжающихся клинических испытаниях в течение последних 25 лет исследовали эффективность природных и синтетических соединений в профилактике рака предстательной железы. Например, в испытании по предотвращению рака предстательной железы (РСРТ), в котором приняли участие около 19000 здоровых мужчин, обнаружили, что финастерид - препарат, одобренный для лечения доброкачественной гиперплазии предстательной железы (ВРН), которая представляет собой доброкачественное увеличение предстательной железы, снижает риск развития рака предстательной железы на 25 процентов. В другом испытании по предупреждению рака с помощью селена и витамина Е (SELECT) исследуют более 35000 мужчин для определения того, могут ли ежедневные добавки селена и витамина Е снижать частоту возникновения рака предстательной железы у здоровых мужчин. В других испытаниях по предупреждению рака предстательной железы в настоящее время оценивают защитный потенциал поливитаминов, витаминов С и D, сои, зеленого чая и ликопина, который является природным соединением, обнаруженным в томатах. Одно исследование, опубликованное в 2005 г., показало, что определенные гены слиты в 60-80 процентах проанализированных опухолей предстательной железы. Это исследование представляет собой первое наблюдение неслучайных перегруппировок генов при раке предстательной железы. Это генетическое изменение со временем может быть использовано в качестве биомаркера, способного помочь в диагностике и, возможно, лечении этого заболевания. Другие исследования показали, что генетические вариации в конкретном районе хромосомы 8 может увеличить риск развития рака предстательной железы у мужчин. Эти генетические вариации являются причиной приблизительно 25 процентов случаев рака предстательной железы, которые наблюдаются у белых мужчин. Они являются первыми подтвержденными генетическими вариантами, которые увеличивают риск развития рака предстательной железы и могут помочь ученым лучше понять генетические причины этого заболевания. Также имеется продолжающееся исследование, в котором изучают, как белки, циркулирующие в крови пациента, могут быть использованы для улучшения диагностики рака предстательной железы и Других видов рака. В 2005 г. ученые идентифицировали группу специфических белков, которые продуцируются иммунной системой пациента в ответ на опухоли предстательной железы. Эти белки типа аутоантител были способны обнаружить присутствие клеток рака предстательной железы в образцах крови с точностью больше чем 90 процентов. При использовании в комбинации с PSA, эти и другие белки крови можно в конечном счете использовать для уменьшения числа ложно-положительных результатов, полученных с тестированием только PSA и, следовательно, сократить большое число ненужных биопсий предстательной железы, которые выполняют каждый год из-за ложно-положительных результатов PSA теста.
Кроме PSA было идентифицировано несколько других маркеров рака предстательной железы, включая, например, шестидоменный трансмембранный эпителиальный антиген предстательной железы (STEAP) (Hubert et al., PNAS 96 (1999), 14523-14528), антиген стволовых клеток предстательной железы (PSCA) (Reiteret al., Proc. Nat. Acad. Sci. 95:1735-1740, 1998) и специфический мембранный антиген предстательной железы (PSMA; PSM) (Israeli et al., Cancer Res. 53 (1993). PSMA был первоначально определен с помощью моноклонального антитела (MAb) 7E11, полученного в результате иммунизации частично очищенным мембранным препаратом из клеточной линии лимфатических узлов аденокарциномы предстательной железы (LNCaP) (Horoszewicz et al., Anticancer Res. 7 (1987), 927-35). Фрагмент кДНК длиной 2,65 т.п.н., кодирующий белок PSMA, клонировали, а затем картировали на хромосоме 11р11.2 (Israeli et al., там же; O’Keefe et al., Biochem. Biophys. Acta 1443 (1998), 113-127). Первоначальный анализ PSMA продемонстрировал повсеместную экспрессию в пределах клеток секреторного эпителия предстательной железы. Иммуногистохимическое окрашивание продемонстрировало умеренную экспрессию PSMA в гиперплазированных и доброкачественных тканях, в то время как злокачественные ткани окрашивались с наибольшей интенсивностью (Horoszewicz et al., там же). Последующие исследования воспроизвели эти результаты и доказали, что экспрессия PSMA является универсальным признаком практически в каждой ткани предстательной железы, проанализированной на сегодняшний день. Эти сообщения дополнительно демонстрируют, что экспрессия PSMA резко увеличивается пропорционально агрессивности опухоли (Burger et al., Int. J. Cancer 100 (2002), 228-237; Chang et al., Cancer Res. 59 (1999), 3192-98; Chang et al., Urology 57 (2001), 1179-83), Kawakami and Nakayama, Cancer Res. 57 (1997), 2321-24; Liu et al., Cancer Res. 57 (1997), 3629-34; Lopes et al., Cancer Res. 50 (1990), 6423-29; Silver et al., Clin. Cancer Res. 9 (2003), 6357-62; Sweat et al., Urology 52 (1998), 637-40; Troyer et al., Int. J. Cancer 62 (1995), 552-558; Wright et al., Urology 48 (1996), 326-334). В соответствии с корреляцией между экспрессией PSMA и опухолевой стадией, повышенные уровни PSMA связаны с андроген-независимым раком предстательной железы (РСа). Анализ образцов тканей пациентов с раком предстательной железы продемонстрировал повышенные уровни PSMA после физической кастрации или андроген-депривационной терапии. В отличие от экспрессии специфического антигена предстательной железы, которая подавляется после удаления андрогенов, экспрессия PSMA значительно увеличивается как в первичных, так и в метастатических образцах опухолей (Kawakami et al., Wright et al., там же). В соответствии с повышенной экспрессией PSMA в андроген-независимых опухолях, также известно, что транскрипция PSMA подавляется стероидами, и введение тестостерона опосредует резкое снижение уровней белка PSMA и мРНК (Israeli et al., Cancer Res. 54 (1994), 1807-11; Wright et al., там же). PSMA также имеет высокий уровень экспрессии во вторичных опухолях предстательной железы и скрытом метастатическом заболевании. Иммуногистохимический анализ выявил относительно интенсивную и гомогенную экспрессию PSMA в пределах метастатических поражений, локализованных в лимфатических узлах, костях, мягких тканях и легких, по сравнению с доброкачественными тканями предстательной железы (Chang et al. (2001), там же; Murphy et al., Cancer 78 (1996), 809-818; Sweat et al., там же). Некоторые сообщения также показали ограниченную экспрессию PSMA в экстрапростатических тканях, включая субпопуляцию проксимальных почечных канальцев, некоторые клетки мембраны щеточной каемки кишечника и некоторые клетки крипт толстой кишки (Chang et al. (1999), Horoszewicz et al., Israeli et al. (1994), Lopes et al., Troyer et al., там же). Однако уровни PSMA в этих тканях, как правило, на два или три порядка меньше величин, наблюдаемых в предстательной железе (Sokoloff et al., Prostate 43 (2000), 150-157). PSMA, также экспрессирующийся в опухолеассоциированных новообразованных сосудах большинства солидных опухолей, исследованных на данный момент, отсутствует в нормальном сосудистом эндотелии (Chang et al. (1999), Liu et al., Silver et al., там же). Хотя значение экспрессии PSMA в сосудистой системе неизвестно, специфичность опухолеассоциированного эндотелия делает PSMA потенциальной мишенью для лечения многих форм злокачественных опухолей.
Хотя было затрачено много сил на идентификацию новых мишеней для подходов к лечению рака, рак до сих пор является одним из наиболее часто диагностируемых заболеваний. В свете этого, существует потребность в эффективных способах лечения рака.
В настоящем изобретении предложена молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, способный связываться с эпитопом CD3ε (эпсилон)-цепи человека и примата, не являющегося шимпанзе, где указанный эпитоп представляет собой часть аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO:2, 4, 6 и 8; и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA).
Хотя вовлекающие Т-клетки биспецифические одноцепочечные антитела, описанные в данной области техники, имеют большой терапевтический потенциал для лечения злокачественных заболеваний, большинство этих биспецифических молекул ограничены тем, что они являются видоспецифическими и распознают только человеческий антиген и - благодаря генетическому сходству - вероятно, аналогичный антиген шимпанзе. Преимуществом настоящего изобретения является обеспечение биспецифического одноцепочечного антитела, содержащего связывающий домен, демонстрирующий межвидовую специфичность к CD3-эпсилон цепи человека и примата, не являющегося шимпанзе.
В настоящем изобретении неожиданно идентифицировали N-концевой 1-27-аминокислотный полипептидный фрагмент внеклеточного домена CD3-эпсилон, который, в отличие от всех других известных эпитопов CD3-эпсилон, описанных в данной области техники, сохраняет свою трехмерную структурную целостность, если он извлечен из своего нативного окружения в CD3-комплексе (и возможно слит с гетерологичной аминокислотной последовательностью, такой как ЕрСАМ или Fc-часть иммуноглобулина). Таким образом, в настоящем изобретении предложена молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, способный связываться с эпитопом N-концевого 1-27 аминокислотного полипептидного фрагмента внеклеточного домена CD3-эпсилон (который (CD3-эпсилон) извлечен, например, из своего природного окружения и/или содержится (представлен на поверхности) Т-клетки) человека и по меньшей мере одной CD3-эпсилон цепи примата, не являющегося шимпанзе, где указанный эпитоп представляет собой часть аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO:2, 4, 6 и 8; и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA). Предпочтительные приматы, не являющиеся шимпанзе, упомянуты в данной заявке ниже. По меньшей мере один (их группа или все) примат(ы), выбранный(е) из обыкновенной игрунки (Callithrix jacchus); эдипова тамарина (Saguinus oedipus), обыкновенной беличьей обезьяны (Saimiri sciureus) и длиннохвостого (яванского) макака (Масаса fascicularis) (либо SEQ ID 631, либо 632, либо обе), является (являются) особенно предпочтительным(и). Масаса mulatta, также известный как макак-резус, также рассматривается в качестве другого предпочтительного примата. Таким образом, предполагается, что антитела по изобретению связываются (способны связываться) с независимым от окружения эпитопом N-концевого 1-27-аминокислотного полипептидного фрагмента внеклеточного домена CD3-эпсилон человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinus oedipus), обыкновенной беличьей обезьяны (Saimiri sciureus) и длиннохвостого макака (Масаса fascicularis) (либо SEQ ID 631, либо 632, либо обе), и возможно также макака-резуса (Масаса mulatta). Молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, как определено здесь, может быть получено (можно получить) или может быть изготовлено в соответствии с протоколом, изложенным в WO 2008/119567 (в частности, в Примере 2 WO 2008/119567). С этой целью предусматривается: (а) иммунизация мышей N-концевым 1-27-аминокислотным полипептидным фрагментом внеклеточного домена CD3-эпсилон человека и/или обыкновенной беличьей обезьяны (Saimiri sciureus); (б) получение иммунной библиотеки мышиных антител scFv; (в) идентификация CD3-эпсилон-специфических связывающих агентов посредством тестирования способности связываться по меньшей мере с SEQ ID NO:2, 4, 6 и 8.
Независимый от окружения эпитоп CD3, предложенный в данном изобретении, соответствует первым 27 N-концевым аминокислотам CD3-эпсилон или функциональным фрагментам этого 27-аминокислотного участка. Фраза "независимый от окружения", как использовано здесь в отношении эпитопа CD3, означает, что связывание описанных в данном изобретении связывающих молекул/молекул антител не приводит к изменению или модификации конформации, последовательности или структуры, окружающей антигенную детерминанту или эпитоп. В отличие от этого, эпитоп CD3, распознаваемый обычной CD3-связывающей молекулой (например, описанной в WO 99/54440 или WO 04/106380), локализован на С-конце CD3-эпсилон цепи относительно N-концевых 1-27 аминокислот независимого от окружения эпитопа, где он принимает правильную конформацию только в том случае, если погружен в остальную часть эпсилон-цепи и удерживается в правильном стерическом положении посредством гетеродимеризации эпсилон-цепи либо с CD3-гамма-, либо дельта-цепью.
Анти-CD3-связывающие домены, как часть биспецифической одноцепочечной молекулы к PSMAxCD3, предложенной в данном изобретении, были описаны в WO 2008/119567. Эти связывающие домены, полученные (и направленные) против независимого от окружения эпитопа CD3, обеспечивают неожиданное клиническое улучшение в отношении перераспределения Т-клеток и, таким образом, более благоприятный профиль безопасности. Не вдаваясь в теорию, поскольку эпитоп CD3 является независимым от окружения, образуя автономный самодостаточный субдомен без существенного влияния на остальную часть CD3-комплекса, CD3-связывающий домен биспецифической одноцепочечной молекулы к PSMAxCD3, предложенной в данной заявке, индуцирует меньше аллостерических изменений в конформации CD3, чем традиционные CD3-связывающие молекулы (подобные молекулам, предложенным в WO 99/54440 или WO 04/106380), которые распознают зависимые от окружения эпитопы CD3.
Независимость от окружения эпитопа CD3, который распознается CD3-связывающим доменом биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению, связана с меньшим или полным отсутствием перераспределения Т-клеток (перераспределение Т-клеток соответствует начальному падению и последующему восстановлению абсолютного числа Т-клеток) во время начальной фазы лечения указанным биспецифическим одноцепочечным антителом к PSMAxCD3 по изобретению. Это приводит к лучшему профилю безопасности биспецифического одноцепочечного антитела к PSMAxCD3 no изобретению по сравнению с традиционными CD3-связывающими молекулами, известными в данной области техники, которые распознают зависимые от окружения эпитопы CD3. В частности, поскольку перераспределение Т-клеток во время начальной фазы лечения с помощью CD3-связывающих молекул является основным фактором риска побочных событий, таких как побочные эффекты в отношении ЦНС (центральная нервная система), биспецифическое одноцепочечное антитело к PSMAxCD3 по изобретению посредством распознавания независимого от окружения, а не зависимого от окружения эпитопа CD3, имеет существенное преимущество безопасности по сравнению с CD3-связывающими молекулами, известными в данной области техники. Пациенты с такими побочными эффектами в отношении ЦНС, связанными с перераспределением Т-клеток во время начальной фазы лечения традиционными CD3-связывающими молекулами, обычно страдают от спутанности сознания и дезориентации, в некоторых случаях также от недержания мочи. Спутанность сознания представляет собой изменение психического состояния, при котором пациент не способен думать с обычным для него или для нее уровнем ясности. Пациенту обычно трудно сконцентрироваться и его мышление является не только размытым и неясным, но часто значительно замедленным. Пациенты с побочными эффектами в отношении ЦНС, связанными с перераспределение Т-клеток во время начальной фазы лечения традиционными CD3-связывающими молекулами, также могут страдать от потери памяти. Часто спутанность сознания приводит к потере способности узнавать людей, места, время или дату. Чувство дезориентации является характерным для спутанности сознания, при этом нарушается способность принимать решения. Побочные эффекты в отношении ЦНС, связанные с перераспределением Т-клеток во время начальной фазы лечения традиционными CD3-связывающими молекулами, могут дополнительно включать несвязную речь и/или трудности в поиске слов. Это расстройство может привести к нарушению как выражения, так и понимания языка, а также чтения и записи. Кроме недержания мочи, вертиго и головокружение также могут сопровождать побочные эффекты в отношении ЦНС, связанные с перераспределением Т-клеток во время начальной фазы лечения традиционными CD3-связывающими молекулами у некоторых пациентов.
Сохранение трехмерной структуры в пределах упомянутого 27-аминокислотного N-концевого полипептидного фрагмента CD3-эпсилон можно использовать для получения предпочтительно человеческих связывающих доменов, которые способны связываться с N-концевым полипептидным фрагментом CD3-эпсилон in vitro и с нативным (CD3-эпсилон субъединица) CD3-комплексом на Т-клетках in vivo с одинаковой аффинностью связывания. Эти данные убедительно свидетельствуют о том, что N-концевой фрагмент, как описано в данном изобретении, образует третичную конформацию, которая сходна со структурой, в норме существующей in vivo. Был выполнен очень чувствительный тест на значение структурной целостности аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон. Отдельные аминокислоты из аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон заменяли на аланин (сканирование аланином) для тестирования чувствительности аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон к незначительным нарушениям. CD3-специфические связывающие домены как часть биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению использовали для тестирования связывания с аланин-мутантами аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон (см. WO 2008/119567). Отдельные обмены первых пяти аминокислотных остатков в самом N-концевом фрагменте и двух аминокислот в положениях 23 и 25 аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон имели критическое значение для связывания молекул антитела. Замена аминокислотных остатков в районе положения 1-5, содержащем остатки Q (глутамин в положении 1), D (аспарагиновая кислота в положении 2), G (глицин в положении 3), N (аспарагин в положении 4), и Е (глутаминовая кислота в положении 5) на аланин ликвидировала связывание предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению с указанным фрагментом. Наряду с тем, для по меньшей мере некоторых из биспецифических одноцепочечных антител к PSMAxCD3 по изобретению предпочтительно человеческого биспецифического одноцепоческого антитела к PSMAxCD3, два аминокислотных остатка на С-конце упомянутого фрагмента Т (треонин в положении 23) и 1 (изолейцин в положении 25) уменьшали энергию связывания с предпочтительно человеческим биспецифическим одноцепочечным антителом к PSMAxCD3 по изобретению.
Неожиданно обнаружили, что выделенное таким образом предпочтительно человеческое биспецифическое одноцепочечное антитело к PSMAxCD3 по изобретению распознает не только человеческий М-концевой фрагмент CD3-эпсилон, но также соответствующие гомологичные фрагменты CD3-эпсилон различных приматов, включая обезьян Нового Света (игрунковые, обыкновенная игрунка {Callithrix jacchus); эдипов тамарин (Saguinus oedipus); обыкновенная беличья обезьяна (Saimiri sciureus)) и обезьян Старого Света (длиннохвостый макак (Масаса fascicularis), также известный как яванский макак; или Масаса mulatta, также известный как макак-резус). Таким образом, обнаружили специфичность биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению в отношении множества приматов. Следующие анализы последовательности подтвердили, что человек и приматы имеют общий участок с высоко гомологичной последовательностью на N-конце внеклеточного домена CD3-эпсилон.
Аминокислотная последовательность вышеупомянутых N-концевых фрагментов CD3-эпсилон представлена в SEQ ID NO:2 (человек), SEQ ID NO:4 (обыкновенная игрунка (Callithrix jacchus)); SEQ ID NO:6 (эдипов тамарин (Saguinus oedipus)); SEQ ID NO:8 (обыкновенная беличья обезьяна (Saimiri sciureus)); SEQ ID NO:631 QDGNEEMGSITQTPYQVSISGTTILTC или SEQ ID NO:632 QDGNEEMGSITQTPYQVSISGTTVILT (Масаса fascicularis, также известный как яванский макак, или макак-крабоед (Cynomolgus monkey)) и SEQ ID NO:633 QDGNEEMGSITQTPYHVSISGTTVILT (Масаса mulatta, также известный как макак-резус).
Второй связывающий домен биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению связывается со специфическим мембранным антигеном предстательной железы (PSMA). Предпочтительно, второй связывающий домен биспецифического одноцепочечного антитела к PSMAxCDS связывается с человеческим PSMA или PSMA примата, не являющегося шимпанзе; более предпочтительно он связывается с человеческим PSMA и PSMA примата, не являющегося шимпанзе, и, следовательно, обладает межвидовой специфичностью; еще более предпочтительно с человеческим PSMA и PSMA макака (и, следовательно, также обладает межвидовой специфичностью). Особенно предпочтительно, PSMA макака представляет собой PSMA яванского макака и/или PSMA макака-резуса. Однако из объема настоящего изобретения не исключено, что второй связывающий домен также может связываться с гомологами PSMA из других видов, таких как гомолог PSMA у грызунов.
Рак предстательной железы является вторым наиболее распространенным раком у мужчин. Для 2008 г. было установлено, что у 186320 мужчин будет впервые диагностирован рак предстательной железы в США и примерно 28660 мужчин умрут от этого заболевания. Риск заболевания раком предстательной железы тесно связан с возрастом: всего несколько случаев зарегистрированы у мужчин до 50 лет и три четверти случаев встречаются у мужчин старше 65 лет. Наибольшее число случаев диагностируется у лиц в возрасте 70-74 лет. В настоящее время темпы роста численности пожилого населения значительно выше, чем общей численности населения. К 2025-2030 гг. по прогнозам население старше 60 лет будет расти в 3,5 раза быстрее, чем общая численность населения. Доля пожилых людей по прогнозам увеличится более чем в два раза по всему миру в течение следующей половины столетия, что означает, что следует ожидать дальнейшего увеличения заболеваемости диагностированного рака предстательной железы в будущем. Весьма ограниченная экспрессия PSMA и его повышающая регуляция на поздних стадиях и при метастатическом раке предстательной железы, а также его роль в качестве неоантигена на сосудистой сети многих других типов различных солидных опухолей определяет PSMA в качестве привлекательного целевого антигена противоопухолевой терапии на основе антител. Как показано в следующих примерах, биспецифическое одноцепочечное антитело к PSMAxCD3 по изобретению обеспечивает эффективный инструмент для уничтожения PSMA-экспрессирующих раковых клеток, как показано на примере клеточной линии рака предстательной железы человека LNCaP. Кроме того, цитотоксическая активность биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению выше. чем цитотоксическая активность антител, описанных в данной области техники. Поскольку предпочтительно, чтобы CD3 и PSMA-связывающий.домен биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению обладал межвидовой специфичностью, т.е. взаимодействовал с антигенами человека и приматов, не являющихся шимпанзе, его можно использовать для доклинической оценки безопасности, активности и/или фармакокинетического профиля этих связывающих доменов у приматов и - в идентичной форме - в качестве лекарственного средства у людей.
Предпочтительно, в настоящем изобретении также предложено биспецифическое одноцепочечное антитело к PSMAxCD3, содержащее второй связывающий домен, который связывается как с человеческим PSMA, так и с гомологом PSMA макака, т.е. гомологом примата, не являющегося шимпанзе. В предпочтительном воплощении биспецифическое одноцепочечное антитело, таким образом, содержит второй связывающий домен, демонстрирующий межвидовую специфичность к PSMA человека и PSMA примата, не являющегося шимпанзе. В этом случае идентичную молекулу биспецифического одноцепочечного антитела можно использовать для доклинической оценки безопасности, активности и/или фармакокинетического профиля этих связывающих доменов у приматов, а также в качестве лекарственного средства у людей. Другими словами, одну и ту же молекулу можно использовать в доклинических исследованиях на животных, а также в клинических исследований на людях. Это приводит к высоко сравнимым результатам и гораздо более эффективной предсказывающей способности исследований на животных по сравнению с видоспецифическими молекулами-имитаторами. Поскольку как CD3-, так и PSMA-связывающий домен биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению обладает межвидовой специфичностью, т.е. реагирует с антигенами человека и приматов, не являющихся шимпанзе, его можно использовать для доклинической оценки безопасности, активности и/или фармакокинетического профиля этих связывающих доменов у приматов и - в идентичной форме - в качестве лекарственного средства у людей. Следует понимать, что в предпочтительном воплощении межвидовая специфичность первого и второго связывающего домена антител по изобретению является идентичной.
В настоящем изобретении обнаружили, что можно создать предпочтительно человеческое биспецифическое одноцепочечное антитело к PSMAxCDS, где идентичную молекулу можно использовать в доклиническом исследовании на животных, а также в клинических исследованиях и даже терапии человека. Это связано с неожиданной идентификацией предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS, которое, в дополнение к связыванию с человеческим CD3-эпсилон и PSMA, соответственно (и, по-видимому, благодаря генетическому сходству с аналогом шимпанзе), также связывается с гомологами указанных антигенов приматов, не являющихся шимпанзе, включая обезьян Нового Света (New-World Monkeys) и обезьян Старого Света (Old-World Monkeys). Как показано в следующих Примерах, указанное предпочтительно человеческое биспецифическое одноцепочечное антитело к PSMAxCDS по изобретению можно использовать в качестве терапевтического агента против различных заболеваний, включая, но не ограничиваясь этим, рак. Биспецифическое одноцепочечное антитело к PSMAxCDS особенно предпочтительно для терапии рака, предпочтительно солидных опухолей, более предпочтительно карцином и рака предстательной железы. В свете вышеизложенного, необходимость конструировать суррогатное биспецифическое одноцепочечное антитело к PSMAxCDS для тестирования на филогенетически отдаленном (от людей) виде отпадает. В результате, в доклиническом тестировании на животных может быть использована та же молекула, которая предназначена для введения людям в клиническом тестировании, а также для последующего получения разрешения на продажу и введения в качестве терапевтического лекарственного средства. Возможность использовать ту же самую молекулу для доклинического тестирования на животных, как и при более позднем введении людям, фактически исключает или по меньшей мере значительно уменьшает опасность того, что данные, полученные в доклиническом тестировании на животных, будут иметь ограниченную применимость в случае человека. Кратко, получение доклинических данных по безопасности на животных с использованием той же молекулы, которую фактически будут вводить людям, в значительной степени гарантирует применимость этих данных для сценария, подходящего для людей. И наоборот, в традиционных подходах с использованием молекул-имитаторов, указанные молекулы-имитаторы должны быть адаптированы на молекулярном уровне к животной тест-системе, используемой для доклинической оценки безопасности. Таким образом, молекула, которая подлежит использованию в терапии людей, в действительности отличается по последовательности и также, вероятно, по структуре от молекулы-имитатора, используемой в доклиническом тестировании, по фармакокинетическим параметрам и/или биологической активности, вследствие чего данные, полученные в доклиническом тестировании на животных, имеют ограниченную применимость/пригодность в случае людей. Использование молекул-имитаторов требует конструирования, получения, очистки и характеристики полностью новой конструкции. Это ведет к дополнительным затратам средств и времени на разработку, необходимым для получения такой молекулы. В целом, имитаторы должны разрабатываться отдельно в дополнение к реальному лекарственному средству, которое будет использоваться в терапии людей, таким образом, должны проводиться две линии разработки для двух молекул. Следовательно, главное преимущество предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS по изобретению, демонстрирующего межвидовую специфичность, описанную в данном изобретении, заключается в том, что одна и та же молекула может быть использована для терапевтических агентов у людей и в доклиническом тестировании на животных.
Предпочтительно, чтобы по меньшей мере один из указанных первых или вторых связывающих доменов биспецифического одноцепочечного антитела по изобретению был CDR-привитым, гуманизированным или человеческим, как представлено более подробно ниже. Предпочтительно, оба первых и вторых связывающих доменов биспецифического одноцепочечного антитела по изобретению являются CDR-привитыми, гуманизированными или человеческими. Для предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS по изобретению получение иммунной реакции против указанной связывающей молекулы исключается в максимально возможной степени при введении молекулы пациентам-людям.
Другим главным преимуществом предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS по изобретению является его применимость для доклинического тестирования у различных приматов. Поведение лекарственного средства-кандидата у животных в идеальном случае будет показателем ожидаемого поведения этого лекарственного средства-кандидата после введения людям. В результате, данные, полученные в результате такого доклинического тестирования, таким образом обычно будут иметь высокую прогностическую ценность в случае человека. Однако, как понятно из трагического результата фазы 1 недавнего клинического исследования на TGN1412 (моноклональное антитело CD28), лекарственное средство-кандидат может по-разному действовать на вид приматов и на людей: Несмотря на то, что при доклиническом тестировании указанного антитела не наблюдались или наблюдались лишь ограниченные неблагоприятные эффекты в исследованиях на животных, проводимых с яванскими макаками, у 6 пациентов-людей развилась полиорганная недостаточность после введения указанного антитела (Lancet 368 (2006), 2206-7). Результаты этих драматических, нежелательных негативных событий показывают, что ограничение доклинического тестирования только одним видом (примата, не являющегося шимпанзе) может быть недостаточным. Тот факт, что биспецифическое одноцепочечное антитело к PSMAxCD3 по изобретению связывается с рядом обезьян Нового Света и Старого Света может помочь преодолеть проблемы, с которыми столкнулись в упомянутом выше случае. Соответственно, в настоящем изобретении предложены средства и способы минимизации видовых различий в эффектах при разработке и тестировании лекарственных средств для терапии людей.
С предпочтительно человеческим биспецифическим одноцепочечным антителом к PSMAxCD3 с межвидовой специфичностью по изобретению также больше нет необходимости адаптировать тестируемое животное к лекарственному средству-кандидату, предназначенному для введения людям, как, например, при создании трансгенных животных. Предпочтительно, человеческое биспецифическое одноцепочечное антитело к PSMAxCD3 по изобретению, демонстрирующее межвидовую специфичность согласно применению и способам по изобретению, можно непосредственно использовать для доклинического тестирования на приматах, не являющихся шимпанзе, без каких-либо генетических манипуляций с животными. Как хорошо известно специалистам в данной области техники, подходы, при которых тестируемое животное адаптируют к лекарственному средству-кандидату, всегда несут риск того, что результаты, полученные в доклиническом тестировании безопасности, будут менее репрезентативными и прогностическими для людей вследствие модификации животного. Например, у трансгенных животных белки, кодируемые трансгенами, часто являются сверхэкспрессирующимися в высокой степени. Таким образом, данные, полученные для биологической активности антитела против этого белкового антигена, могут быть ограничены в своей прогностической ценности для людей, у которых этот белок экспрессируется на гораздо более низких, более физиологических уровнях.
Другим преимуществом применений предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS по изобретению, демонстрирующего межвидовую специфичность, является тот факт, что шимпанзе, как вымирающий вид, исключают из проводимого на животных тестирования. Шимпанзе являются ближайшими родственниками людей и недавно были сгруппированы в семейство гоминид на основе данных по секвенированию генома (Wildman et al., PNAS 100 (2003), 7181). Поэтому обычно считается, что данные, полученные на шимпанзе, обладают высокой прогностической ценностью для людей. Однако, благодаря своему статусу вымирающего вида, количество шимпанзе, которое может быть использовано для медицинских экспериментов, сильно ограничено. Как указано выше, обеспечение шимпанзе для тестирования на животных является поэтому дорогостоящим и этически проблематичным. Применение предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS по изобретению лишено как этических возражений, так и финансовых затрат во время доклинического тестирования без ущерба для качества, т.е. применимости полученных на животных результатов тестирования. В свете этого, применение предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS по изобретению обеспечивают разумную альтернативу исследованиям на шимпанзе.
Еще одним преимуществом предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCDS по изобретению является возможность отбора множества образцов крови при использовании его в качестве части доклинического тестирования на животных, например, в ходе фармакокинетических исследований на животных. Многократные заборы крови можно гораздо легче получить с использованием примата, не являющегося шимпанзе, чем с использованием низших животных, например, мыши. Отбор множества образцов крови позволяет проводить непрерывное тестирование параметров крови для определения биологических эффектов, индуцированных предпочтительно человеческим PSMAxCD3 биспецифическим одноцепочечным антителом по изобретению. Кроме того, отбор множества образцов крови позволяет исследователю оценить фармакокинетический профиль предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению, как определено здесь. Кроме того, возможные побочные эффекты, которые могут быть индуцированы указанным предпочтительно человеческим PSMAxCD3 биспецифическим одноцепочечным антителом по изобретению, отраженные в параметрах крови, могут быть измерены в различных образцах крови, отобранных во время введения указанного антитела. Это позволяет определить возможный профиль токсичности предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению, как определено здесь.
Преимущества предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению, как определено здесь, демонстрирующего межвидовую специфичность, можно кратко суммировать, как изложено ниже:
Во-первых, предпочтительно человеческое биспецифическое одноцепочечное антитело к PSMAxCD3 по изобретению, как определено здесь, используемое в доклиническом тестировании, то же самое, что используется в терапии человека. Таким образом, больше нет необходимости в разработке двух независимых молекул, которые могут отличаться по своим фармакокинетическим свойствам и биологической активности. Огромное преимущество заключается в том, что, например, фармакокинетические результаты можно более непосредственно переносить и применять к ситуации с человеком, чем в случае, например, традиционных подходов с использованием имитаторов.
Во-вторых, применение предпочтительно человеческого биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению, как определено здесь, для получения терапевтических средств для человека является менее дорогостоящим и трудоемким процессом, чем подходы с использованием имитаторов.
В-третьих, предпочтительно человеческое биспецифическое одноцепочечное антитело к PSMAxCDS по изобретению, как определено здесь, можно использовать для доклинического тестирования не только на одном виде приматов, но и на ряде других видов приматов, тем самым ограничивая риск потенциальных различий между видами приматов и человеком.
В-четвертых, шимпанзе, как вымирающий вид, можно исключить из тестирования на животных, при желании.
В-пятых, для проведения всесторонних фармакокинетических исследований можно проводить отбор множества образцов крови.
В-шестых, благодаря человеческому происхождению предпочтительно человеческих связывающих молекул в соответствии с предпочтительным воплощением изобретения, развитие иммунной реакции против указанных связывающих молекул минимизировано при введении пациентам-людям. Индукция иммунного ответа антителами, специфичными к лекарственному средству-кандидату, происходящему из вида, не являющегося человеком, как, например мыши, приводящая к развитию человеческих антимышиных антител (НАМА) против терапевтических молекул мышиного происхождения, исключена.
Последнее, но не менее важное, терапевтическое применение биспецифического одноцепочечного антитела к PSMAxCDS по изобретению обеспечивает новый и изобретательский подход для лечения рака, предпочтительно солидных опухолей, более предпочтительно карцином и рака предстательной железы. Как показано в следующих примерах, биспецифическое одноцепочечное антитело к PSMAxCD3 по изобретению обеспечивает эффективный инструмент для уничтожения PSMA-экспрессирующих клеток рака предстательной железы человека. Кроме того, цитотоксическая активность биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению выше, чем активность антител, описанных в данной области техники.
Как отмечалось выше, в настоящем изобретении предложены полипептиды, т.е. биспецифические одноцепочечные антитела, содержащие первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, и второй связывающий домен, способный связываться с PSMA. Второй связывающий домен предпочтительно связывается с PSMA человека и PSMA примата, не являющегося шимпанзе. Преимущество молекул биспецифических одноцепочечных антител в качестве лекарственных средств-кандидатов, удовлетворяющих требованиям для предпочтительного биспецифического одноцепочечного антитела по изобретению, заключается в применении таких молекул в доклинических исследованиях на животных, а также в клинических исследованиях и даже для терапии человека. В предпочтительном воплощении биспецифического одноцепочечного антитела с межвидовой специфичностью по изобретению второй связывающий домен; связывающийся с PSMA, является человеческим. В биспецифической молекуле с межвидовой специфичностью в соответствии с изобретением связывающий домен, связывающийся с эпитопом CD3-эпсилон цепи человека и примата, не являющегося шимпанзе, располагается в порядке VH-VL или VL-VH на N-конце или С-конце биспецифической молекулы. Примеры биспецифических молекул с межвидовой специфичностью согласно изобретению с различным расположением VH- и VL-цепи в первом и втором связывающем домене описаны в прилагаемых примерах.
Используемое в данной заявке "биспецифическое одноцепочечное антитело" означает единичную полипептидную цепь, содержащую два связывающих домена. Каждый связывающий домен содержит одну вариабельную область из тяжелой цепи антитела ("VH-область"), где VH-область первого связывающего домена специфически связывается с CD3ε молекулой, а VH-область второго связывающего домена специфически связывается с PSMA. Два связывающих домена возможно связаны друг с другом посредством короткого полипептидного спейсера. Неограничивающим примером полипептидного спейсера является Gly-Gly-Gly-Gly-Ser (G-G-G-G-S) и его повторы. Каждый связывающий домен может дополнительно содержать одну вариабельную область из легкой цепи антитела ("VL-область"), где VH-область и VL-область в пределах каждого первого и второго связывающих доменов связаны друг с другом посредством полипептидного линкера, например типа, описанного и заявленного в ЕР 623679 В1, но в любом случае достаточно длинного, чтобы позволить VH-области и VL-области первого связывающего домена и VH-области и VL-области второго связывающего домена образовывать пары друг с другом таким образом, чтобы, будучи вместе, они были способны специфически связываться с соответствующими первым и вторым связывающими доменами.
Термин "белок" хорошо известен в данной области техники и описывает биологические соединения. Белки содержат одну или более аминокислотных цепей (полипептидов), в которых аминокислоты связаны друг с другом посредством пептидной связи. Термин "полипептид", используемый в данной заявке, описывает группу молекул, которые состоят более чем из 30 аминокислот. Согласно изобретению эта группа полипептидов содержит "белки" при условии, что белки состоят из одной полипептидной цепи. Также в соответствии с определением, термин "полипептид" описывает фрагменты белков при условии, что эти фрагменты состоят более чем из 30 аминокислот.Полипептиды также могут образовывать мультимеры, такие как димеры, тримеры и высшие олигомеры, т.е. состоящие из более чем одной полипептидной молекулы. Полипептидные молекулы, образующие такие димеры, тримеры и т.д., могут быть идентичными или неидентичными. Соответствующие структуры более высокого порядка таких мультимеров обозначаются, следовательно, как гомо- или гетеродимеры, гомо- или гетеротримеры и т.д. Примером гетеромультимера является молекула антитела, которая, в ее существующей в природе форме, состоит из двух идентичных легких полипептидных цепей и двух идентичных тяжелых полипептидных цепей. Термины "полипептид" и "белок" также относятся к естественно модифицированным полипептидам/белкам, в которых модификация осуществляется, например, посредством посттрансляционных модификаций, таких как гликозилирование, ацетилирование, фосфорилирование и т.п. Такие модификации хорошо известны в данной области техники.
Термин "связывающий домен" характеризует в связи с настоящим изобретением домен полипептида, который специфически связывается/взаимодействует с данной(ым) целевой(ым) структурой/антигеном/эпитопом. Таким образом, связывающий домен представляет собой "сайт взаимодействия с антигеном". Термин "сайт взаимодействия с антигеном" определяет, согласно настоящему изобретению, мотив полипептида, который способен специфически взаимодействовать со специфическим антигеном или специфической группой антигенов, например, идентичным антигеном у различных видов. Также понятно, что указанное связывание/взаимодействие определяет "специфическое распознавание". Термин "специфически распознающий" означает в соответствии с данным изобретением то, что молекула антитела способна специфически взаимодействовать и/или связывать по меньшей мере два, предпочтительно по меньшей мере три, более предпочтительно по меньшей мере четыре аминокислоты антигена, например антигена CD3 человека, как определено здесь. Такое связывание может быть проиллюстрировано специфичностью в соответствии с "принципом замка и ключа". Таким образом, специфические мотивы аминокислотной последовательности связывающего домена и антигена связываются друг с другом вследствие их первичной, вторичной или третичной структуры, а также вследствие вторичных модификаций указанной структуры. Специфическое взаимодействие данного "сайта взаимодействия с антигеном" с его специфическим антигеном также может приводить просто к связыванию указанного сайта с антигеном. Кроме того, специфическое взаимодействие данного "сайта взаимодействия с антигеном" с его специфическим антигеном альтернативно может вызывать инициацию сигнала, например вследствие индукции изменения конформации антигена, олигомеризации антигена и т.д. Предпочтительным примером связывающего домена в соответствии с настоящим изобретением является антитело. Связывающий домен может представлять собой моноклональное или поликлональное антитело или происходить из моноклонального или поликлонального антитела.
Термин "антитело" включает в себя производные или их функциональные фрагменты, которые все еще сохраняют специфичность связывания. Методики получения антител хорошо известны в данной области техники и описаны, например, в Harlow and Lane "Antibodies, A Laboratory Manual", Cold Spring Harbor Laboratory Press, 1988, Harlow and Lane "Using Antibodies: A Laboratory Manual" Cold Spring Harbor Laboratory Press, 1999 и Little "Recombinant Antibodies for Immunotherapy" Cambridge University Press 2009. Термин "антитело" также включает в себя иммуноглобулины (Ig) различных классов (т.е. IgA, IgG, IgM, IgD и IgE) и подклассов (таких как IgG1, IgG2 и т.д.).
Определение термина "антитело" также включает воплощения, такие как химерные, одноцепочечные и гуманизированные антитела, а также фрагменты антител, подобные, среди прочего, Fab-фрагментам. Фрагменты или производные антител также содержат фрагменты F(ab’)2, Fv, scFv (одноцепочечный Fv) или однодоменные антитела, антитела, состоящие из единичного вариабельного домена, или иммуноглобулиновый единичный вариабельный домен, содержащий только один вариабельный домен, который может представлять собой VH или VL, которые специфически связываются с антигеном или эпитопом независимо от других V-областей или -доменов; см., например. Harlow and Lane (1988) и (1999) и Little (2009), там же. Такой иммуноглобулиновый единичный вариабельный домен охватывает не только выделенный полипептид единичного вариабельного домена антитела, но также более крупные полипептиды, которые содержат один или более мономеров полипептидной последовательности единичного вариабельного домена антитела.
В данной области техники известны различные методики, которые можно использовать для получения таких антител и/или фрагментов. Так, производные (антител) также могут быть получены с использованием пептидомиметиков. Кроме того, методики, описанные для получения одноцепочечных антител (см., в частности, патент US 4,946,778), могут быть адаптированы для получения одноцепочечных антител, специфичных в отношении выбранного(ых) полипептида(ов). Кроме того, для экспрессии гуманизированных антител, специфичных к полипептидам и слитым белкам по данному изобретению, можно использовать трансгенных животных. Для получения моноклональных антител можно использовать любую методику, обеспечивающую получение антител, продуцируемых культурами стабильных клеточных линий. Примеры таких методик включают гибридомную методику (Kohler and Milstein Nature 256 (1975), 495-497), триомную методику, гибридомную методику с использованием В-клеток человека (Kozbor, Immunology Today 4 (1983), 72) и EBV-гибридомную методику (EBV - вирус Эпштейна-Барр) для получения человеческих моноклональных антител (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. (1985), 77-96). Поверхностный плазменный резонанс, который применен в системе BIAcore, может быть использован для увеличения эффективности фаговых антител, которые связываются с эпитопом целевого полипептида, таким как CD3-эпсилон или PSMA (Schier, Human Antibodies Hybridomas 7 (1996), 97-105; Malmborg, J. Immunol. Methods 183 (1995), 7-13). В контексте данного изобретения также предусматривается, что термин "антитело" включает в себя антительные конструкции, которые могут быть экспрессированы в хозяине, описанном в данном изобретении ниже, например антительные конструкции, которые могут быть трансфицированы и/или трансдуцированы с использованием, среди прочего, вирусных или плазмидных векторов.
Термин "специфическое взаимодействие", как он использован в соответствии с настоящим изобретением, означает, что связывающий домен не обладает перекрестной реактивностью или не обладает значительной перекрестной реактивностью в отношении полипептидов, имеющих похожую структуру, что и полипептиды, которые связываются связывающим доменом и которые могли бы экспрессироваться теми же клетками, что и представляющий интерес полипептид. Перекрестную реактивность панели исследуемых связывающих доменов можно протестировать, например, путем оценки связывания указанной панели связывающих доменов в стандартных условиях (см., например, Harlow and Lane (1988) and (1999) and Little (2009), там же. Примеры специфического взаимодействия связывающего домена с конкретным антигеном включают в себя специфичность лиганда к его рецептору. Указанное определение, в частности, включает в себя взаимодействие лигандов, которые индуцируют сигнал после связывания с его специфическим рецептором. Примером указанного взаимодействия, которое, в частности, также охватывается указанным определением, является взаимодействие антигенной детерминанты (эпитопа) со связывающим доменом (антигенсвязывающим сайтом) антитела.
Термин "перекрестно-видовая специфичность" или "межвидовая специфичность", как он использован в данной заявке, означает связывание связывающего домена, описанного в данном изобретении, с одной и той же молекулой-мишенью у людей и приматов, не являющихся шимпанзе. Таким образом, "перекрестно-видовую специфичность" или "межвидовую специфичность" следует понимать как межвидовую реактивность к одинаковой молекуле X, экспрессирующейся в разных видах, а не к молекуле, отличающейся от X. Межвидовая специфичность моноклонального антитела, распознающего, например, CD3-эпсилон человека, в отношении CD3-эпсилон примата, не являющегося шимпанзе, например CD3-эпсилон макака, может быть определена, например, с помощью FACS-анализа (сортировка клеток с активацией флуоресценции (fluorescence activated cell sorting)). FACS-анализ осуществляют таким образом, что соответствующее моноклональное антитело тестируют на связывание с клетками человека и примата, не являющегося шимпанзе, например клетками макака, экспрессирующими указанные антигены CD3-эпсилон человека и примата, не являющегося шимпанзе, соответственно. Соответствующий анализ показан в следующих ниже примерах. Вышеупомянутый объект изобретения относится, с соответствующими изменениями, к антигену PSMA: Межвидовую специфичность моноклонального антитела, распознающего, например, PSMA человека, PSMA примата, не являющегося шимпанзе, например PSMA макака, можно определить, например, посредством FACS-анализа. FACS-анализ осуществляют таким образом, что соответствующее моноклональное антитело тестируют на связывание с клетками человека и примата, не являющегося шимпанзе, например клетками макака, экспрессирующими указанные антигены PSMA человека и примата, не являющегося шимпанзе, соответственно.
Как использовано в данной заявке, термин "CD3-эпсилон" означает молекулу, экспрессирующуюся как часть Т-клеточного рецептора, и имеет значение, обычно приписываемое ему в предшествующем уровне техники. У человека он включает индивидуальную или независимо комбинированную форму всех известных субъединиц CD3, например CD3-эпсилон, CD3-дельта, CD3-гамма, CD3-дзета, CD3-альфа и CD3-бета. Нечеловеческие CD3 антигены примата, не являющегося шимпанзе, упомянутые здесь, представляют собой, например, CD3 Масаса fascicularis и CD3 Macaca mulatta. У Масаса fascicularis он охватывает CD3-эпалпон FN-18-отрицательный и CD3-эпсилон FN-18-положительный, CD3-гамма и CD3-дельта. У Масаса mulatta он охватывает CD3-эпсилон, CD3-гамма и CD3-дельта. Предпочтительно, указанный CD3, используемый в данной заявке, представляет собой CD3-эпсилон.
CD3-эпсилон человека указан в GenBank под № доступа NM_000733 и содержит SEQ ID NO:1. CD3-гамма человека указан в GenBank под № доступа NM_000073. CD3-дельта человека указан в GenBank под № доступа NM_000732.
CD3-эпсилон "FN-18-отрицательный" Масаса fascicularis (т.е. CD3-эпсилон, не распознаваемый моноклональным антителом FN-18 вследствие полиморфизма, как изложено выше) указан в GenBank под № доступа АВ073994.
CD3-эпсилон "FN-18-положительный" Масаса fascicularis (т.е. CD3-эпсилон, распознаваемый моноклональным антителом FN-18) указан в GenBank под № доступа АВ073993. CD3-гамма Масаса fascicularis указан в GenBank под № доступа АВ073992. CD3-дельта Масаса fascicularis указан в GenBank под № доступа АВ073991.
Нуклеиновокислотные последовательности и аминокислотные последовательности соответствующих CD3-эпсилон, гамма- и дельта-гомологов Масаса mulatta можно идентифицировать и выделить с помощью рекомбинантных методов, описанных в данной области техники (Sambrook et al. Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press, 3rd edition 2001). Это относится, с соответствующими изменениями, к CD3-эпсилон, гамма- и дельта-гомологам других приматов, не являющихся шимпанзе, как определено здесь. Идентификация аминокислотной последовательности обыкновенной игрунки (Callithrix jacchus), обыкновенной беличьей обезьяны (Saimiri sciureus) и эдипова тамарина (Saguinus oedipus) описана в прилагаемых примерах. Аминокислотная последовательность внеклеточного домена CD3-эпсилон Callithrix jacchus представлена в SEQ ID NO:3, та же последовательность Saguinus oedipus представлена в SEQ ID NO:5, и та же последовательность Saimiri sciureus представлена в SEQ ID NO:7.
PSMA человека указан в GenBank под № доступа ‘AY101595’. Клонирование гомолога PSMA макака продемонстрировано в следующих примерах, соответствующие последовательтности кДНК и аминокислотные последовательности показаны в SEQ ID NO:223 и 224, соответственно.
В соответствии с вышеизложенным, термин "эпитоп" определяет, антигенную детерминанту, которая специфически связывается с/идентифицируется связывающей молекулой, которая определена выше. Связывающий домен может специфически связываться/взаимодействовать с конформационными или непрерывными эпитопами, которые являются уникальными для целевой структуры, например, CD3-эпсилон-цепи человека и примата, не являющегося шимпанзе, или PSMA человека и примата, не являющегося шимпанзе. Конформационный или прерывистый эпитоп полипептидных антигенов характеризуется присутствием двух или более дискретных аминокислотных остатков, которые разделены в первичной последовательности, но сближаются на поверхности молекулы, когда полипептид сворачивается в нативный белок/антиген (Sela, (1969) Science 166, 1365 and Laver, (1990) Cell 61, 553-6). Два или более дискретных аминокислотных остатков, вносящих вклад в эпитоп, присутствуют на отдельных участках одной или более чем одной полипептидной цепи. Эти остатки сближаются на поверхности молекулы, когда полипептидная(ые) цепь(и) сворачивается(ются) в трехмерную структуру, с образованием эпитопа. И наоборот, непрерывный или линейный эпитоп состоит из двух или более дискретных аминокислотных остатков, которые присутствуют в единственном линейном сегменте полипептидной цепи. В настоящем изобретении "зависимый от окружения" эпитоп CD3 относится к конформации указанного эпитопа. Такой зависимый от окружения эпитоп, расположенный на эпсилон-цепи CD3, может складываться в правильную конформацию, только если он погружен в остаток эпсилон-цепи и удерживается в правильном положении посредством гетеродимеризации эпсилон-цепи либо с гамма-, либо с дельта-цепью CD3. И наоборот, независимый от окружения эпитоп CD3, как он предложен в данной заявке, относится к N-концевому 1-27-аминокислотному полипептиду или его функциональному фрагменту CD3-эпсипон. Этот N-концевой 1-27-аминокислотный полипептид или его функциональный фрагмент сохраняет свою трехмерную структурную целостность и правильную конформацию, когда его удаляют из нативного окружения в CD3-комплексе. Независимость от окружения N-концевого 1-27-аминокислотного полипептида или его функционального фрагмента, являющегося частью внеклеточного домена CD3-эпсилон, представляет собой, таким образом, эпитоп, который полностью отличается от эпитопов CD3-эпсилон, описанных в WO 2004/106380 в связи со способом получения человеческих связывающих молекул. В указанном способе использовали отдельно экспрессированный рекомбинантный CD3-эпсилон. Конформация этого отдельно экспрессированного рекомбинантного CD3-эпсилон отличалась от конформации, адаптированной к его природной форме, т.е. форме, в которой CD3-эпсилон субъединица TCR/CD3-комплекса существует как часть нековалентного комплекса либо с CD3-депьта, либо с CD3-гамма субъединицей TCR/CD3-комплекса. Если в качестве антигена для селекции антител из библиотеки антител используют такой отдельно экспрессированный рекомбинантный белок CD3-эпсилон, то из данной библиотеки идентифицируют антитела, специфичные к этому антигену, хотя такая библиотека не содержит антитела со специфичностью к собственным антигенам/аутоантигенам. Это связано с тем, что отдельно экспрессированный рекомбинантный белок CD3-эпсилон не существует in vivo; он не является аутоантигеном. Следовательно, субпопуляции В-клеток, экспрессирующих антитела, специфичные к этому белку, не были истощены in vivo; библиотека антител, сконструированная из таких В-клеток, будет содержать генетический материал для антител, специфичных к этому отдельно экспрессированному рекомбинантному белку CD3-эпсилон.
Однако, поскольку независимый от окружения N-концевой 1-27-аминокислотный полипептид или его функциональный фрагмент представляет собой эпитоп, который сворачивается в свою нативную форму, связывающие домены по настоящему изобретению не могут быть идентифицированы способами, основанными на подходе, описанном в WO 2004/106380. Поэтому можно проверить в тестах, что связывающие молекулы, описанные в WO 04/106380, не способны связываться с N-концевыми аминокислотными остатками 1-27 CD3-эпсилон цепи. Следовательно, традиционные анти-CD3-связывающие молекулы или молекулы антител против CD3 (например, описанные в WO 99/54440) связывают CD3-эпсилон цепь в положении, которое находится ближе к С-концу, чем независимый от окружения N-концевой 1-27-аминокислотный полипептид или функциональный фрагмент, предложенный в данной заявке. Молекулы антител OKT3 и UCHT-1 из предшествующего уровня техники обладают специфичностью также в отношении эпсилон-субъединицы TCR/CD3-комплекса между аминокислотными остатками 35 и 85 и, соответственно, эпитоп этих антител также располагается ближе к С-концу. В дополнение к этому, UCHT-1 связывается с CD3-эпсилон цепью в области между аминокислотными остатками 43 и 77 (Tunnacliffe, Int. Immunol. 1 (1989), 546-50; Kjer-Nielsen, PNAS 101, (2004), 7675-7680; Salmeron, J. Immunol. 147 (1991), 3047-52). Следовательно, анти-CD3-молекулы из предшествующего уровня техники не связываются с определенным в данной заявке независимым от окружения N-концевым 1-27-аминокислотным эпитопом (или его функциональным фрагментом) и не направлены против него. В частности, существующий уровень техники не может предложить анти-CD3 молекулы, которые специфически связываются с независимым от окружения N-концевым 1-27-аминокислотным эпитопом и которые обладают межвидовой специфичностью, т.е. связываются с CD3-эпсилон человека и примата, не являющегося шимпанзе.
Для получения предпочтительно человеческого связывающего домена, содержащегося в молекуле биспецифического одноцепочечного антитела по изобретению, могут быть использованы, например, моноклональные антитела, связывающиеся с CD3-эпсилон как человека, так и примата, не являющегося шимпанзе (например, CD3-эпсилон макака), или моноклональные антитела, связывающиеся с PMSA человека и примата, не являющегося шимпанзе.
Как использовано в данной заявке, "человеческий" и "человек" относится к виду Homo sapiens. Поскольку говорится о медицинских применениях конструкций, описанных в данном изобретении, то пациенты-люди будут подвергаться лечению с помощью такой же молекулой.
Предпочтительно, чтобы по меньшей мере один из указанных первых или вторых связывающих доменов биспецифического одноцепочечного антитела по изобретению был CDR-привитым, гуманизированным или человеческим. Предпочтительно, чтобы и первый, и второй связывающие домены биспецифического одноцепочечного антитела по изобретению были CDR-привитыми, гуманизированными или человеческими.
Термин "человеческое" антитело, используемый в данной заявке, означает, что биспецифическое одноцепочечное антитело, как оно определено здесь, включает аминокислотную(ые) последовательность(и), содержащуюся (содержащиеся) в репертуаре антител зародышевой линии человека. Согласно этому определению, указанное биспецифическое одноцепочечное антитело поэтому можно считать человеческим, если оно состоит из (а) аминокислотной(ых) последовательности(ей) зародышевой линии человека, т.е. если аминокислотная(ые) последовательность(и) биспецифического одноцепочечного антитела, представляющего интерес, идентична(ы) экспрессируемой(ым) аминокислотной(ым) последовательности(ям) зародышевой линии человека. Биспецифическое одноцепочечное антитело, как оно определено здесь, также можно считать человеческим, если оно состоит из (а) последовательности(ей), которая(ые) происходит(ят) из его(их) ближайшей(их) последовательности(ей) зародышевой линии человека не более, чем можно было бы ожидать в связи с соматическим гипермутированием. Кроме того, антитела многих млекопитающих, не являющихся людьми, например, грызунов, таких как мыши и крысы, содержат аминокислотные последовательности CDR3 VH, которые, как можно ожидать, также существуют в репертуаре экспрессируемых человеческих антител. Любая(ые) такая(ие) последовательность(и) человеческого или нечеловеческого происхождения, которые, как можно ожидать, существуют в экспрессируемом человеческом репертуаре, также можно считать "человеческими" для целей настоящего изобретения.
Используемый в данной заявке термин "гуманизированный", "гуманизация", "человекоподобный" или их грамматически родственные варианты используются взаимозаменяемо в отношении биспецифического одноцепочечного антитела, содержащего по меньшей мере в одном из его связывающих доменов по меньшей мере один участок, определяющий комплементарность ("CDR") из нечеловеческого антитела или его фрагмента. Подходы к гуманизации описаны, например, в WO 91/09968 и US 6407213. В качестве неограничивающих примеров, данный термин охватывает случай, когда вариабельная область по меньшей мере одного связывающего домена содержит один CDR участок, например, третий CDR участок VH (CDRH3) от другого животного, не являющегося человеком, например грызуна, а также случай, когда обе вариабельные области содержат в каждом соответствующем первом, втором и третьем CDRs CDRs от указанного животного, не являющегося человеком. В случае, когда все CDRs связывающего домена биспецифического одноцепочечного антитела были заменены их соответствующими эквивалентами, например, от грызуна, как правило, говорят о "CDR-прививке", и этот термин следует понимать, как охватываемый термином "гуманизированный" или его грамматически родственными вариантами, используемыми в данной заявке. Термин "гуманизированный" или его грамматически родственные варианты также охватывают случаи, когда в дополнение к замене одного или более CDR участков в пределах VH и/или VL первого и/или второго связывающего домена дополнительная(ые) мутация(и) (например, замены) по меньшей мере одного единичного аминокислотного остатка(ов) в пределах каркасных ("FR") участков между CDRs была(и) осуществлена(ы) таким образом, что аминокислоты в этом положении/этих положениях соответствует(ют) аминокислоте(ам) в этом положении/этих положениях у животного, от которого(ых) происходят CDR участки, используемые для замены. Как известно в данной области техники, такие индивидуальные мутации часто делают в каркасных участках после CDR-прививки с целью восстановления первоначальной аффинности связывания нечеловеческого антитела, используемого в качестве CDR-донора для его целевой молекулы. Термин "гуманизированный" также может охватывать аминокислотную(ые) замену(ы) в CDR участках от животного, не являющегося человеком, на аминокислоту(ы) соответствующего CDR участка из человеческого антитела, в дополнение к аминокислотным заменам в каркасных участках, как описано выше.
Используемый в данной заявке термин "гомолог" или "гомология" следует понимать следующим образом: Вывод о гомологии среди белков и ДНК часто делают на основании сходства последовательностей, особенно в области биоинформатики. Например, в общем, если два или более генов имеют очень сходные последовательности ДНК, вполне вероятно, что они гомологичны. Но сходство последовательностей может возникнуть в результате разных событий: короткие последовательности могут быть похожи случайно, и последовательности могут быть сходными, так как обе были выбраны для связывания с конкретным белком, таким как транскрипционный фактор. Такие последовательности являются сходными, но не гомологичными. Участки последовательностей, которые являются гомологичными, также называются консервативными. Это не следует путать с консервативностью в аминокислотных последовательностях, при которой аминокислота в определенном положении была заменена, но физико-химические свойства аминокислоты оставались неизменными. Гомологичные последовательности бывают двух типов: ортологичные и паралогичные. Гомологичные последовательности являются ортологичными, если они были отделены друг от друга в результате видообразования: когда вид расходится на два отдельных вида, дивергентные копии одного гена в образовавшихся видах считают ортологичными. Ортологи или ортологичные гены представляют собой гены у различных видов, которые сходны друг с другом, так как они произошли от общего предшественника. Самым веским доказательством, что два сходных гена являются ортологичными, является результат филогенетического анализа генной линии. Гены, которые обнаружены в пределах одной клады, представляют собой ортологи, происходящие от общего предшественника. Ортологи часто, но не всегда, имеют одинаковую функцию. Ортологичные последовательности обеспечивают полезную информацию в исследованиях таксономической классификации организмов. Картину генетической дивергенции можно использовать для того, чтобы проследить родство организмов. Два близко родственных организма, по-видимому, демонстрируют очень сходные последовательности ДНК между двумя ортологами. В свою очередь, организм, который эволюционно дополнительно удален от другого организма, вероятно, демонстрирует ббльшую дивергенцию в последовательности изучаемых ортологов. Гомологичные последовательности являются паралогичными, если они были разделены посредством события дупликации генов: если ген в организме дуплицируется, чтобы занять два различных положения в том же геноме, тогда две копии являются паралогичными. Набор последовательностей, которые являются паралогичными, называют паралогами друг друга. Паралоги, как правило, имеет такую же или сходную функцию, но иногда нет: в связи с отсутствием исходного селективного давления на одну копию дуплицированного гена, эта копия свободно мутирует и приобретает новые функции. Пример можно найти у грызунов, таких как крысы и мыши. Грызуны имеют пару паралогичных инсулиновых генов, хотя неясно, произошло ли какое-нибудь расхождение в функции. Паралогичные гены часто принадлежат к одному и тому же виду, но не обязательно: например, ген гемоглобина человека и ген миоглобина шимпанзе являются паралогами. Это общая проблема биоинформатики: при секвенировании геномов различных видов и обнаружении гомологичных генов, невозможно сразу сделать вывод о том, что эти гены имеют одинаковую или сходную функцию, так как они могут быть паралогами, функции которых дивергировали.
Как использовано в данной заявке, термин "примат, не являющийся шимпанзе" или "примат, не являющийся шимп.", или его грамматические варианты относятся к любому животному-примату (т.е. не человеку), отличному от шимпанзе, т.е. отличному от животного, принадлежащего к роду Pan и включающего виды Pan paniscus (карликовый шимпанзе, бонобо) и Pan troglodytes (обыкновенный шимпанзе), также известные как Anthropopithecus troglodytes (обыкновенный шимпанзе) или Simia satyrus (орангутан). Однако следует понимать, что вполне возможно, что антитела по изобретению также могут связываться с помощью их первого и/или второго связывающего домена с соответствующими эпитопами/фрагментами и т.д. указанных шимпанзе. Изобретению следует лишь избегать тестов на животных, выполняемых на шимпанзе, при необходимости. Таким образом, также предусматривается, что в другом воплощении антитела по настоящему изобретению также связываются с помощью их первого и/или второго связывающего домена с соответствующими эпитопами шимпанзе. "Примат", "вид приматов", "приматы" или их грамматические варианты означают отряд плацентарных млекопитающих, разделенных на два подотряда полуобезьян и антропоидов и включающий в себя человекообразных обезьян, обезьян и лемуров. Конкретно, термин "приматы", как он использован в данной заявке, включает подотряд Strepsirrhini (мокроносые обезьяны) (полуобезьяны, не являющиеся долгопятами (non-tarsier prosimians)), включая инфраотряд Lemuriformes (лемурообразные) (включающий в себя надсемейства Cheirogaleoidea (карликовые лемуры) и Lemuroidea (лемуриды)), инфраотряд Chiromyiformes (руконожкообразные) (включающий в себя семейство Daubentoniidae (руконожковые)) и инфраотряд Lorisiformes (лориобразные) (включающий в себя семейства Lorisidae (лориевые) и Galagidae (галаговые)). Термин "приматы", как он использован в данной заявке, также включает подотряд Haplorrhini (сухоносые обезьяны), включая инфраотряд Tarsiiformes (долгопятообразные) (включающий в себя семейство Tarsiidae (долгопятовые)), инфраотряд Simiiformes (обезьянообразные) (включающий в себя Platyrrhini (широконосые обезьяны) или обезьян Нового Света, и Catarrhini (узконосые обезьяны), включая Cercopithecidea (мартышкообразные) или обезьян Старого Света)).
В рамках изобретения вид приматов, не являющийся шимпанзе, можно понимать как представляющий собой лемура, долгопята, гиббона, игрунку (принадлежащую к обезьянам Нового Света семейства Cebidae (цепкохвостые)) или обезьяну Старого Света (принадлежащую к надсемейству Cercopithecoidea (собакоподобные)).
Как использовано в данной заявке, термин "обезьяна Старого Света" включает в себя любую обезьяну, попадающую в надсемейство Cercopithecoidea, которое само разделено на семейства: Cercopithecinae (мартышковые обезьяны), которые встречаются главным образом в Африке, но включают в себя другой род макаков, встречающихся в Азии и Северной Африке; и Colobinae (тонкотелые), которые включают в себя большинство встречающихся в Азии родов, а также африканских представителей толстотелых обезьян.
Конкретно, в пределах подсемейства Cercopithecinae предпочтительный примат, не являющийся шимпанзе, может происходить из трибы мартышковых (Cercopithecini), в пределах рода Allenopithecus (болотная обезьяна Аллена, Allenopithecus nigroviridis); в пределах рода Miopithecus (мартышка карликовая талапойн, Miopithecus talapoin; габонский талапойн, Miopithecus ogouensis); в пределах рода Erythrocebus (мартышка обыкновенная гусар, Erythrocebus pates); в пределах рода Chlorocebus (мартышка зеленая, Chlorocebus sabaceus; мартышка зеленая гривет, Chlorocebus aethiops; мартышка горнобейлская вервет, Chlorocebus djamdjamensis; мартышка танталусская, Chlorocebus tantalus; верветка, Chlorocebus pygerythrus; малбрук, Chlorocebus cynosures); или в пределах рода Cercopithecus (мартышка dryas или мартышка салонгойская, Cercopithecus dryas; мартышка Диана, Cercopithecus diana; мартышка роловейская, Cercopithecus roloway, большая белоносая мартышка, Cercopithecus nictitans; мартышка голубая, Cercopithecus mitis; мартышка серебряная, Cercopithecus doggetti; мартышка золотистая, Cercopithecus kandti; мартышка Сикса, Cercopithecus albogularis; мартышка мона, Cercopithecus mona; мартышка мона Кэмпбелла, Cercopithecus campbelli; мартышка мона Лоуи, Cercopithecus lowei; мартышка мона хохлатая, Cercopithecus pogonias; мартышка мона Вольфа, Cercopithecus wolfi; мартышка мона Дента, Cercopithecus denti; мартышка малая белоносая, Cercopithecus petaurista; мартышка белогорлая, Cercopithecus erythrogaster, мартышка Склатера, Cercopithecus sclateri; мартышка красноухая, Cercopithecus erythrotis; мартышка голуболицая [усатая], Cercopithecus cephus; мартышка краснохвостая, Cercopithecus ascanius; мартышка Л’Хоеста, Cercopithecus Ihoesti; мартышка Преусса, Cercopithecus preussi; мартышка солнцехвостая, Cercopithecus solatus; мартышка совинолицая, Cercopithecus hamlyni; мартышка де Брасса, Cercopithecus neglectus).
Альтернативно, предпочтительный примат, не являющийся шимпанзе, также в пределах подсемейства Cercopithecinae, но в пределах трибы павиановых (Papionini), может происходить из рода макаков (Масаса) (обезьяна варварийская, Масаса sylvanus; макак львинохвостый, Масаса silenus; макак южный свинохвостый или берук (Beruk), Масаса nemestrina; макак северный свинохвостый, Масаса leonina; макак пагайский или Bokkoi, Масаса pagensis; макак сиберу, Масаса siberu; макак Моора, Масаса тайга; макак обутый, Масаса ochreata; макак тонкинский, Масаса tonkeana; макак Гека, Масаса hecki; макак горонталский, Масаса nigriscens; макак целебесский хохлатый или черная обезьяна, Масаса nigra; макак яванский (Cynomolgus monkey) или макак-крабоед, или макак длиннохвостый или кера (Kera), Масаса fascicularis; макак короткохвостый или макак медвежий, Масаса arctoides; макак-резус, Масаса mulatta; макак формозский горный, Масаса cyclopis; макак японский, Масаса fuscata; макак цейлонский, Масаса sinica; макак индийский, Масаса radiata; макак бесхвостый, Масаса sylvanmus; макак ассамский, Масаса assamensis; макак тибетский или макак Милна-Эдвардса, Масаса thibetana; макак аруначалский или "обезьяна из глубины леса", Масаса munzala); в пределах рода Lophocebus (мангобей серощекий, Lophocebus albigena; Lophocebus albigena albigena; Lophocebus albigena osmani; Lophocebus albigena johnstoni; мангобей чернохохлый, Lophocebus atenimus; мангобей Опденбоха, Lophocebus opdenboschi; мангобей высокогорный, Lophocebus kipunji); в пределах рода Papio (павиан гамадрил, Papio hamadryas; сфинкс, или гвинейский павиан, Papio papio; павиан анубис, Papio anubis; павиан бабуин, или желтый павиан, Papio cynocephalus; чакма, или павиан медвежий, Papio ursinus); в пределах рода Theropithecus (гелада, Theropithecus gelada); в пределах рода Cercocebus (мангобей дымчатый, Cercocebus atys; Cercocebus atys atys; Cercocebus atys lunulatus; мангобей красноголовый, Cercocebus torquatus; мангобей проворный, Cercocebus agilis; мангобей золотистобрюхий, Cercocebus chrysogaster, мангобей речной (танский), Cercocebus galeritus; мангобей Санье, Cercocebus sanjei); или в пределах рода Mandrillus (мандрил, Mandrillus sphinx; дрил, Mandrillus leucophaeus).
Наиболее предпочтительным является Масаса fascicularis (также известный как макак яванский (Cynomolgus monkey), и поэтому обозначенный в Примерах как "Cynomolgus") и Масаса mulatta (макак-резус, обозначенный как "резус").
В пределах подсемейства Colobinae предпочтительный примат, не являющийся шимпанзе, может происходить из африканской группы, в пределах рода Colobus (колобус черный, Colobus satanas; колобус ангольский, Colobus angolensis; колобус королевский, Colobus polykomos; колобус медвежий, Colobus vellerosus; черно-белая гвереца, Colobus guereza); в пределах рода Piliocolobus (колобус красный западный, Piliocolobus badius; Piliocolobus badius badius; Piliocolobus badius temminckii; Piliocolobus badius waldronae; колобус Пеннанта, Piliocolobus pennantii; Piliocolobus pennantii pennantii; Piliocolobus pennantii epieni; Piliocolobus pennantii bouvien; колобус красный Преусса, Piliocolobus preussi; колобус красный Фолона, Piliocolobus tholloni; колобус красный центрально-африканский, Piliocolobus foai; Piliocolobus foai foai; Piliocolobus foai ellioti; Piliocolobus foai oustaleti; Piliocolobus foai semliklensis; Piliocolobus foai parmentierorum; колобус красный угандийский, Piliocolobus tephrosceles; колобус красный узунгвайский, Piliocolobus gordonorum; колобус красный занзибарский, Piliocolobus kirkii; колобус красный речной (танский), Piliocolobus rufomitratus); или в пределах рода Procolobus (колобус оливковый, Procolobus verus).
В пределах подсемейства Colobinae предпочтительный примат, не являющийся шимпанзе, альтернативно может быть из группы лангуров (тонкотелов), в пределах рода Semnopithecus (лангур серый непальский, Semnopithecus schistaceus; лангур серый кашмирский, Semnopithecus ajax; лангур серый тарайский, Semnopithecus hector, лангур североравнинный серый, Semnopithecus entellus; лангур серый черностопый, Semnopithecus hypoleucos; лангур южноравнинный серый, Semnopithecus dussumieri; лангур серый опушенный, Semnopithecus priam); в пределах группы T. vetulus рода Trachypithecus (лангур пурпуролицый, Trachypithecus vetulus; лангур Нилгири, Trachypithecus johnii); в пределах группы Т. cristatus рода Trachypithecus (лангур яванский, Trachypithecus auratus; тонкотел серебристый, или лангур серебристый, Trachypithecus cristatus; лангур индокитайский, Trachypithecus germaini; лангур тенассерский, Trachypithecus barbei); в пределах группы Т. obscurus рода Trachypithecus (лангур дымчатый, или очковый, Trachypithecus obscurus; лангур Фейра, Trachypithecus phayrei); в пределах группы Т. pileatus вида Trachypithecus (лангур шапочниковый, Trachypithecus pileatus; лангур Шортриджа, Trachypithecus shortridgei; лангур золотой, или трахипитек Гее, Trachypithecus geei); в пределах группы Т. francoisi рода Trachypithecus (лангур Франсуа, Trachypithecus francoisi; лангур хатинхенский, Trachypithecus hatinhensis; лангур белоголовый, Trachypithecus poliocephalus; лангур лаотийский, Trachypithecus laotum; лангур Делакура, Trachypithecus delacouri; лангур черный индокитайский, Trachypithecus ebenus); или в пределах рода Presbytis (сюрили суматранский, Presbytis melalophos; тонкотел полосатый, Presbytis femoralis; тонкотел саравакский, Presbytis chrysomelas; тонкотел белобедрый, Presbytis siamensis; тонкотел белолобый, Presbytis frontata; тонкотел яванский, Presbytis comata; тонкотел Томаса, Presbytis thomasi; тонкотел Хоуза, Presbytis hosei; тонкотел каштановый, Presbytis rubicunda; лангур ментавайский или Joja, Presbytis potenziani; тонкотел натунский, Presbytis natunae).
В пределах подсемейства Colobinae предпочтительный примат, не являющийся шимпанзе, альтернативно может быть из группы курносых (Odd-Nosed) обезьян, в пределах рода Pygathrix (пигатрикс красноплюсный, Pygathrix nemaeus; пигатрикс черноплюсный, Pygathrix nigripes; пигатрикс сероплюсный, Pygathrix cinerea); в пределах рода Rhinopithecus (обезьяна курносая золотистая, Rhinopithecus roxellana; обезьяна курносая черная, Rhinopithecus bieti; обезьяна курносая серая, Rhinopithecus brelichi; лангур тонкинский курносый, Rhinopithecus avunculus); в пределах рода Nasalis (носач обыкновенный, Nasalis larvatus); или в пределах рода Simias (лангур свинохвостый, Simias concolor).
Как использовано в данной заявке, термин "игрунка, или мармозетка" означает любых обезьян Нового Света из рода Callithrix, например, принадлежащих к мармозеткам Атлантического побережья подрода Callithrix (так!) (игрунка обыкновенная, или мармозетка, Callithrix (Callithrix) jacchus; мармозетка черноухая, Callithrix (Callithrix) penicillata; мармозетка Вида (Wied’s marmoset), Callithrix (Callithrix) kuhlii; мармозетка белоголовая, Callithrix (Callithrix) geoffroyi; игрунка желтоголовая, Callithrix (Callithrix) flaviceps; игрунка белоухая, Callithrix (Callithrix) aurita); принадлежащих к мармозеткам лесов Амазонии подрода Mico (шелковые игрунки) (игрунка Рио-Акари, Callithrix (Mico) acariensis; игрунка Manicore, Callithrix (Mico) manicorensis; игрунка серебристая, Callithrix (Mico) argentata; игрунка белая, Callithrix (Mico) leucippe; игрунка Эмилия (Emilia’s marmoset), Callithrix (Mico) emiliae; мармозетка чернокисточная, Callithrix (Mico) nigriceps; игрунка Марка (Marca’s marmoset), Callithrix (Mico) marcai; мармозетка чернохвостая, Callithrix (Mico) melanura; игрунка белоплечая, Callithrix (Mico) humeralifera; мармозетка Maues, Callithrix (Mico) mauesi; мармозетка золотистая (gold-and-white marmoset), Callithrix (Mico) chrysoleuca; мармозетка Гершковица (Hershkovitz’s marmoset), Callithrix (Mico) intermedia; мармозетка Satere, Callithrix (Mico) saterei); мармозетку Roosmalens’ Dwarf, принадлежащую к подроду Callibella (Callithrix (Callibella) humilis); или карликовую игрунку, принадлежащую к подроду Cebuella (Callithrix (Cebuella) pygmaea).
Другие роды обезьян Нового Света включают тамаринов (или сагуинов) рода Saguinus (включающего группу S. oedipus, группу S. midas, группу S. nigricollis, группу S. mystax, группу S. bicolor и группу S. inustus) и беличьих обезьян рода Saimiri (например, Saimiri sciureus, Saimiri oerstedii, Saimiri ustus, Saimiri boliviensis, Saimiri vanzolini).
В предпочтительном воплощении молекулы биспецифического одноцепочечного антитела по изобретению приматом, не являющимся шимпанзе, является обезьяна Старого Света. В более предпочтительном воплощении полипептида обезьяной Старого Света является обезьяна рода Papio (павианы) или рода макаков. Наиболее предпочтительно, обезьяной рода макаков является ассамский макак (Масаса assamensis), варварийская обезьяна (Масаса sylvanus), индийский макак, или боннет (Масаса radiata), макак обутый (Масаса ochreata), макак целебесский хохлатый (Масаса nigra), макак формозский горный (Масаса cyclopis), снежная обезьяна или японский макак (Масаса fuscata), яванский макак, или макак-крабоед, или длиннохвостый макак, или яванский макак (Масаса fascicularis), львинохвостый макак (Масаса silenus), макак южный свинохвостый (Масаса nemestrina), макак-резус (Масаса mulatta), макак тибетский короткохвостый (Масаса thibetana), макак тонкинский (Масаса tonkeana), макак цейлонский (Масаса sinica), макак короткохвостый, или макак краснолицый, или макак медвежий (Масаса arctoides) или макак Моора (Масаса maurus). Наиболее предпочтительно, обезьяной рода павианов является Hamadryas Baboon, Papio hamadryas; Guinea Baboon, Papio papio; Olive Baboon, Papio anubis; Yellow Baboon, Papio cynocephalus; Chacma Baboon, Papio ursinus.
В альтернативном предпочтительном воплощении молекулы биспецифического одноцепочечного антитела по изобретению приматом, не являющимся шимпанзе, является обезьяна Нового Света. В более предпочтительном воплощении полипептида обезьяной Нового Света является обезьяна рода Callithrix (игрунковые), рода Saguinus (тамарины или сагуины) или рода Saimiri (беличьи обезьяны). Наиболее предпочтительно, обезьяной рода Callithrix является Callithrix jacchus (игрунка обыкновенная), обезьяной рода Saguinus является Saguinus oedipus (эдипов тамарин), а обезьяной рода Saimiri является Saimiri sciureus (обыкновенная беличья обезьяна).
Термин "антиген клеточной поверхности", используемый в данной заявке, означает молекулу, которая представлена на поверхности клетки. В большинстве случаев эта молекула находится внутри или на цитоплазматической мембране клетки, так что по меньшей мере часть этой молекулы остается доступной за пределами клетки в третичной форме. Неограничивающий пример молекулы клеточной поверхности, которая находится в цитоплазматической мембране, представляет собой трансмембранный белок, содержащий, в своей третичной конформации, участки гидрофильности и гидрофобности. Здесь по меньшей мере один гидрофобный участок позволяет молекуле клеточной поверхности быть погруженной или встроенной в гидрофобную цитоплазматическую мембрану клетки, в то время как гидрофильные участки распространяются с обеих сторон цитоплазматической мембраны в цитоплазму и внеклеточное пространство, соответственно. Неограничивающие примеры молекул клеточной поверхности, которые расположены на цитоплазматической мембране, представляют собой белки, - которые были модифицированы по остатку цистеина для переноса пальмитоильной группы; белки, модифицированные по C-концевому остатку цистеина для переноса фарнезильной группы, или белки, которые были модифицированы по С-концу для переноса гликозилфосфатидилинозитольного ("GPI") якоря. Эти группы делают возможным ковалентное присоединение белков к наружной поверхности цитоплазматической мембраны, где они остаются доступными для распознавания внеклеточными молекулами, такими как антитела. Примерами антигенов клеточной поверхности являются CD3-эпсилон и PSMA. Как описано в данной заявке выше, PSMA представляет собой антиген клеточной поверхности, который является мишенью для терапии рака, включая, но не ограничиваясь этим, солидные опухоли, предпочтительно карциномы и рак предстательной железы.
В свете этого, PSMA также может быть охарактеризован как опухолевый антиген. Термин "опухолевый антиген", используемый в данной заявке, следует понимать как антигены, которые представлены на опухолевых клетках. Эти антигены могут быть представлены на клеточной поверхности с внеклеточной частью, которая часто комбинируется с трансмембранной и цитоплазматической частью молекулы. Эти антигены иногда могут презентироваться только опухолевыми клетками и никогда нормальными клетками. Опухолевые антигены могут эксрессироваться исключительно на опухолевых клетках или могут представлять опухолеспецифические мутации по сравнению с нормальными клетками. В этом случае они называются опухолеспецифическими антигенами. Более распространенными являются антигены, которые презентируются опухолевыми клетками и нормальными клетками, и они называются опухолеассоциированными антигенами. Эти опухолеассоциированные антигены могут сверхэкспрессироваться по сравнению с нормальными клетками или быть доступными для связывания с антителами в опухолевых клетках вследствие менее компактной структуры опухолевой ткани по сравнению с нормальной тканью. Одним примером опухолевого антигена согласно настоящему изобретению является PSMA.
Как описано выше в данной заявке, молекула биспецифического одноцепочечного антитела по изобретению связывается с первым связывающим доменом эпитопа CD3ε (эпсилон)-цепи человека и примата, не являющегося шимпанзе, где указанный эпитоп представляет собой часть аминокислотной последовательности, входящей в группу, состоящую из 27 аминокислотных остатков, как представлено в SEQ ID NO:2, 4, 6 или 8, или его функционального фрагмента.
Согласно настоящему изобретению предпочтительно для молекулы биспецифического одноцепочечного антитела по изобретению, чтобы указанный эпитоп являлся частью аминокислотной последовательности, содержащей 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 аминокислот.
Более предпочтительно, чтобы указанный эпитоп содержал по меньшей мере аминокислотную последовательность Gln-Asp-Gly-Asn-Glu (Q-D-G-N-E).
В пределах настоящего изобретения функциональный фрагмент из N-концевых 1-27 аминокислотных остатков означает, что указанный функциональный фрагмент все еще представляет собой независимый от окружения эпитоп, сохраняющий свою трехмерную структурную целостность, когда выделен из естественного окружения в CDS-комплексе (и слит с гетерологичной аминокислотной последовательностью, такой как ЕрСАМ или Fc-часть иммуноглобулина, например, как показано в Примере 3.1 из WO 2008/119567). Сохранение трехмерной структуры в пределах 27-аминокислотного N-концевого полипептида или его функционального фрагмента CD3-эпсилон можно использовать для получения связывающих доменов, которые связываются с N-концевым полипептидным фрагментом CD3-эпсилон in vitro и с нативным (CD3-эпсилон субъединица) CD3-комплексом на Т-клетках in vivo с такой же аффинностью связывания. В пределах настоящего изобретения функциональный фрагмент N-концевых 1-27 аминокислотных остатков означает, что CD3-связывающие домены, предложенные здесь, все еще могут связываться с такими функциональными фрагментами независимым от окружения способом. Специалист в данной области техники знает способы эпитопного картирования для определения аминокислотных остатков эпитопа, которые распознаются такими анти-CD3 связывающими доменами (например, сканирование аланином; см. примеры в WO 2008/119567).
В одном воплощении изобретения молекула биспецифического одноцепочечного антитела по изобретению содержит (первый) связывающий домен, способный связываться с эпитопом CD3ε цепи человека и примата, не являющегося шимпанзе, и второй связывающий домен, способный связываться с антигеном клеточной поверхности PSMA.
В пределах настоящего изобретения также предпочтительно, чтобы второй связывающий домен связывался с антигеном клеточной поверхности PSMA человека и/или PSMA примата, не являющегося шимпанзе. Особенно предпочтительно, чтобы второй связывающий домен связывался с PSMA человека и PSMA примата, не являющегося шимпанзе, предпочтительно PSMA макака. Следует понимать, что второй связывающий домен связывается по меньшей мере с одним PSMA примата, не являющегося шимпанзе, однако он также может связываться с двумя, тремя или более гомологами PSMA примата, не являющегося шимпанзе. Например, второй связывающий домен может связываться с PSMA яванского макака и PSMA макака-резуса.
Настоящее изобретение, включающее способы, применения, наборы и т.д., описанные в данной заявке, также относится ко вторым связывающим доменам как таковым (т.е. не в контексте биспецифического одноцепочечного антитела). "Как таковой" дополнительно включает антительные форматы, отличные от биспецифических одноцепочечных антител, описанных в данной заявке, например, фрагменты антитела (содержащие второй домен), гуманизированные антитела, слитые белки, содержащие второй домен и т.д. Антительные форматы, отличные от биспецифических одноцепочечных антител по настоящему изобретению, также описаны в данной заявке выше.
Для создания второго связывающего домена молекулы биспецифического одноцепочечного антитела по изобретению, например, биспецифических одноцепочечных антител, как определено здесь, могут быть использованы моноклональные антитела, связывающиеся с соответствующим антигеном клеточной поверхности человека и/или примата, не являющегося шимпанзе, таким как PSMA. Подходящие связывающие домены для биспецифического полипептида, как определено здесь, например, могут быть получена из моноклональных антител с межвидовой специфичностью с помощью рекомбинантных методов, описанных в данной области техники. Моноклональное антитело, связывающееся с антигеном клеточной поверхности человека и с гомологом указанного антигена клеточной поверхности у примата, не являющегося шимпанзе, можно протестировать с помощью FACS-анализов, как изложено выше. Специалистам в данной области техники понятно, что антитела с межвидовой специфичностью также могут быть получены с помощью гибридомных методов, описанных в литературе (Milstein and Kohler, Nature 256 (1975), 495-7). Например, мышей можно альтернативно иммунизировать антигеном клеточной поверхности человека и примата, не являющегося шимпанзе, таким как PSMA. Из этих мышей выделяют гибридомные клетки, продуцирующие антитела с межвидовой специфичностью, с помощью гибридомной технологии и анализируют с помощью FACS, как изложено выше. Получение и анализ биспецифических полипептидов, таких как биспецифические одноцепочечные антитела, демонстрирующие межвидовую специфичность, как описано в данной заявке, показано в следующих примерах. Преимущества биспецифических одноцепочечных антител, демонстрирующих межвидовую специфичность, включают перечисленные здесь пункты.
Особенно предпочтительно для молекулы биспецифического одноцепочечного антитела по изобретению, чтобы первый связывающий домен, способный связываться с эпитопом CD3ε цепи человека и примата, не являющегося шимпанзе, содержал VL-область, содержал CDR-L1, CDR-L2 и CDR-L3, выбранные из:
(а) CDR-L1, как представлено в SEQ ID NO:27, CDR-L2, как представлено в SEQ ID NO:28, и CDR-L3, как представлено в SEQ ID NO:29;
(б) CDR-L1, как представлено в SEQ ID NO:117, CDR-L2, как представлено в SEQ ID NO:118, и CDR-L3, как представлено в SEQ ID NO:119; и
(в) CDR-L1, как представлено в SEQ ID NO:153, CDR-L2, как представлено в SEQ ID NO:154, и CDR-L3, как представлено в SEQ ID NO:155.
Понятно, что вариабельные области, т.е. вариабельная легкая цепь ("L" или "VL") и вариабельная тяжелая цепь ("Н" или "VH") в данной области техники обеспечивают связывающий домен антитела. Эти вариабельные области содержат участки, определяющие комплементарность.
Термин "участок, определяющий комплементарность" (CDR) хорошо известен в данной области техники для определения антигенной специфичности антитела. Термин "CDR-L" или "L CDR" или "LCDR" относится к CDRs в VL, в то время как термин "CDR-H" или "Н CDR" или HCDR" относится к CDRs в VH.
В альтернативно предпочтительном воплощении молекулы биспецифического одноцепочечного антитела по изобретению первый связывающий домен, способный связываться с эпитопом CD3ε цепи человека и примата, не являющегося шимпанзе, содержит VH-область, содержащую CDR-Н1, CDR-H2 и CDR-H3, выбранные из:
(а) CDR-H1, как представлено в SEQ ID NO:12, CDR-H2, как представлено в SEQ ID NO:13, и CDR-H3, как представлено в SEQ ID NO:14;
(б) CDR-H1, как представлено в SEQ ID NO:30, CDR-H2, как представлено в SEQ ID NO:31, и CDR-H3, как представлено в SEQ ID NO:32;
(в) CDR-H1, как представлено в SEQ ID NO:48, CDR-H2, как представлено в SEQ ID NO:49, и CDR-H3, как представлено в SEQ ID NO:50;
(г) CDR-H1, как представлено в SEQ ID NO:66, CDR-H2, как представлено в SEQ ID NO:67, и CDR-H3, как представлено в SEQ ID NO:68;
(д) CDR-H1, как представлено в SEQ ID NO:84, CDR-H2, как представлено в SEQ ID NO:85, и CDR-H3, как представлено в SEQ ID NO:86;
(е) CDR-H1, как представлено в SEQ ID NO:102, CDR-H2, как представлено в SEQ ID NO:103, и CDR-H3, как представлено в SEQ ID NO:104;
(ж) CDR-H1, как представлено в SEQ ID NO:120, CDR-H2, как представлено в SEQ ID NO:121, и CDR-H3, как представлено в SEQ ID NO:122;
(з) CDR-H1, как представлено в SEQ ID NO:138, CDR-H2, как представлено в SEQ ID NO:139, и CDR-H3, как представлено в SEQ ID NO:140;
(и) CDR-H1, как представлено в SEQ ID NO:156, CDR-H2, как представлено в SEQ ID NO:157, и CDR-H3, как представлено в SEQ ID NO:158; и
(к) CDR-H1, как представлено в SEQ ID NO:174, CDR-H2, как представлено в SEQ ID NO:175, и CDR-H3, как представлено в SEQ ID NO:176.
Кроме того, предпочтительно, чтобы связывающий домен, способный связываться с эпитопом CD3ε цепи человека и примата, не являющегося шимпанзе, содержал VL-область, выбранную из группы, состоящей из VL-области, как представлено в SEQ ID NO:35, 39, 125, 129, 161 или 165.
В альтернативно предпочтительном воплощении первый связывающий домен, способный связываться с эпитопом CD3ε цепи человека и примата, не являющегося шимпанзе, содержит VH-область, выбранную из группы, состоящей из VH-области, как представлено в SEQ ID NO:15, 19, 33, 37, 51, 55, 69, 73, 87, 91, 105, 109, 123, 127, 141, 145, 159, 163, 177 или 181.
Более предпочтительно, когда молекула биспецифического одноцепочечного антитела по изобретению характеризуется первым связывающим доменом, способным связываться с эпитопом CD3ε цепи человека и примата, не являющегося шимпанзе, который содержит VL-область и VH-область, выбранную из группы, состоящей из:
(а) VL-область, как представлено в SEQ ID NO:17 или 21, и VH-область, как представлено в SEQ ID NO:15 или 19;
(б) VL-область, как представлено в SEQ ID NO:35 или 39, и VH-область, как представлено в SEQ ID NO:33 или 37;
(в) VL-область, как представлено в SEQ ID NO:53 или 57, и VH-область, как представлено в SEQ ID NO:51 или 55;
(г) а VL-область, как представлено в SEQ ID NO:71 или 75, и VH-область, как представлено в SEQ ID NO:69 или 73;
(д) а VL-область, как представлено в SEQ ID NO:89 или 93, и VH-область, как представлено в SEQ ID NO:87 или 91;
(е) а VL-область, как представлено в SEQ ID NO:107 или 111, и VH-область, как представлено в SEQ ID NO:105 или 109;
(ж) а VL-область, как представлено в SEQ ID NO:125 или 129, и VH-область, как представлено в SEQ ID NO:123 или 127;
(з) VL-область, как представлено в SEQ ID NO:143 или 147, и VH-область, как представлено в SEQ ID NO:141 или 145;
(и) VL-область, как представлено в SEQ ID NO:161 или 165, и VH-область, как представлено в SEQ ID NO:159 или 163; и
(к) VL-область, как представлено в SEQ ID NO:179 или 183, и VH-область, как представлено в SEQ ID NO:177 или 181.
В соответствии с предпочтительным воплощением молекулы биспецифического одноцепочечного антитела по изобретению, пары VH-областей и VL-областей в первом связывающем домене, связывающимся с CD3-эпсилон, находятся в формате одноцепочечного антитела (scFv). VH- и VL-области расположены в порядке VH-VL или VL-VH. Предпочтительно, чтобы VH-область располагалась на N-конце относительно линкерной последовательности. VL-область располагается на С-конце линкерной последовательности. Другими словами, порядок доменом в CD3-связывающем домене молекулы биспецифического одноцепочечного антитела по изобретению представляет собой предпочтительно VH-VL, где указанный CD3-связывающий домен, расположенный на С-конце относительно второго (антиген клеточной поверхности, такой как PSMA) связывающего домена. Предпочтительно, VH-VL содержит или представляет собой SEQ ID NO:185.
Предпочтительное воплощение вышеописанной молекулы биспецифического одноцепочечного антитела по изобретению характеризуется первым связывающим доменом, способным связываться с эпитопом CD3ε цепи человека и примата, не являющегося шимпанзе, содержащей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:23, 25, 41, 43, 59, 61, 77, 79, 95, 97, 113, 115, 131, 133, 149, 151, 167, 169, 185 или 187.
Изобретение дополнительно относится к вышеописанному биспецифическому одноцепочечному антителу, где второй связывающий домен связывается с антигеном клеточной поверхности PSMA.
В соответствии с предпочтительным воплощением изобретения охарактеризованная выше молекула биспецифического одноцепочечного антитела содержит группу следующих последовательностей, таких как CDR H1, CDR H2, CDR Н3, CDR L1, CDR L2 и CDR L3 во втором связывающем домене, выбранном из группы, состоящей из:
a) CDR H1-3 из SEQ ID NO:226-228 и CDR L1-3 из SEQ ID NO:231-233;
б) CDR H1-3 из SEQ ID NO:240-242 и CDR L1-3 из SEQ ID NO:245-247;
в) CDR H1-3 из SEQ ID NO:254-256 и CDR L1-3 из SEQ ID NO:259-261;
г) CDR H1-3 из SEQ ID NO:268-270 и CDR L1-3 из SEQ ID NO:273-275;
д) CDR H1-3 из SEQ ID NO:618-620 и CDR L1-3 из SEQ ID NO:623-625;
e CDR H1-3 из SEQ ID NO:282-284 и CDR L1-3 из SEQ ID NO:287-289;
ж) CDR H1-3 из SEQ ID NO:296-298 и CDR L1-3 из SEQ ID NO:301-303;
з) CDR H1-3 из SEQ ID NO:310-312 и CDR L1-3 из SEQ ID NO:315-317;
и) CDR H1-3 из SEQ ID NO:324-326 и CDR L1-3 из SEQ ID NO:329-331;
к) CDR H1-3 из SEQ ID NO:338-340 и CDR L1-3 из SEQ ID NO:343-345;
л) CDR H1-3 из SEQ ID NO:352-354 и CDR L1-3 из SEQ ID NO:357-359;
м) CDR H1-3 из SEQ ID NO:366-368 и CDR L1-3 из SEQ ID NO:371-373;
н) CDR H1-3 из SEQ ID NO:380-382 и CDR L1-3 из SEQ ID NO:385-387;
о) CDR H1-3 из SEQ ID NO:394-396 и CDR L1-3 из SEQ ID NO:399-401;
п) CDR H1-3 из SEQ ID NO:408-410 и CDR L1-3 из SEQ ID NO:413-415;
p) CDR H1-3 из SEQ ID NO:422-424 и CDR L1-3 из SEQ ID NO:427-429;
с) CDR H1-3 из SEQ ID NO:436-438 и CDR L1-3 из SEQ ID NO:441-443;
т) CDR H1-3 из SEQ ID NO:450-452 и CDR L1-3 из SEQ ID NO:455-457;
у) CDR H1-3 из SEQ ID NO:464-466 и CDR L1-3 из SEQ ID NO:469-471;
ф) CDR H1-3 из SEQ ID NO:478-480 и CDR L1-3 из SEQ ID NO:483-485;
x) CDR H1-3 из SEQ ID NO:492-494 и CDR L1-3 из SEQ ID NO:497-499;
ц) CDR H1-3 из SEQ ID NO:506-508 и CDR L1-3 из SEQ ID NO:511-513;
ч) CDR H1-3 из SEQ ID NO:520-522 и CDR L1-3 из SEQ ID NO:525-527;
ш) CDR H1-3 из SEQ ID NO:534-536 и CDR L1-3 из SEQ ID NO:539-541;
щ) CDR H1-3 из SEQ ID NO:548-550 и CDR L1-3 из SEQ ID NO:553-555;
ы) CDR H1-3 из SEQ ID NO:562-564 и CDR L1-3 из SEQ ID NO:567-569;
э) CDR H1-3 из SEQ ID NO:576-578 и CDR L1-3 из SEQ ID NO:581-583;
ю) CDR H1-3 из SEQ ID NO:590-592 и CDR L1-3 из SEQ ID NO:595-597; и
я) CDR H1-3 из SEQ ID NO:604-606 и CDR L1-3 из SEQ ID NO:609-611.
Предпочтительная группа молекул биспецифического одноцепочечного антитела содержит группу следующих последовательностей, таких как CDR H1, CDR H2, CDR НЗ, CDR L1, CDR L2 и CDR L3 во втором связывающем домене, выбранном из группы, состоящей из:
а) CDR H1-3 из SEQ ID NO:226-228 и CDR L1-3 из SEQ ID NO:231-233;
б) CDR H1-3 из SEQ ID NO:240-242 и CDR L1-3 из SEQ ID NO:245-247;
в) CDR H1-3 из SEQ ID NO:254-256 и CDR L1-3 из SEQ ID NO:259-261;
г) CDR H1-3 из SEQ ID NO:268-270 и CDR L1-3 из SEQ ID NO:273-275; и
д) CDR H1-3 из SEQ ID NO:618-620 и CDR L1-3 из SEQ ID NO:623-625.
Эти молекулы содержат второй связывающий домен, который связывается с антигеном клеточной поверхности PSMA, состоящим из VH-цепи, происходящей из специфической связывающей молекулы родительского PSMA, и VL-цепи, происходящей из связывающей молекулы, имеющей специфичность к другому антигену, т.е. к эпителиальной молекуле клеточной адгезии (ЕрСАМ), также известной как CD326. Неожиданно было обнаружено, что связывающие молекулы с этой специфической комбинацией VH-цепи, происходящей из специфической связывающей молекулы родительского PSMA, и VL-цепи, происходящей из специфической связывающей молекулы родительского ЕрСАМ, связываются исключительно с PSMA, но не с ЕрСАМ. Специфичности связывания этой группы специфических связывающих доменов PSMA, содержащихся в молекуле биспецифического одноцепочечного антитела по изобретению, описана в прилагаемом примере 3.
Другая предпочтительная группа молекул биспецифического одноцепочечного антитела содержит группу следующих последовательностей, таких как CDR H1, CDR H2, CDR НЗ, CDR L1, CDR L2 и CDR L3 во втором связывающем домене, выбранном из группы, состоящей из:
а) CDR H1-3 из SEQ ID NO:282-284 и CDR L1-3 из SEQ ID NO:287-289;
б) CDR H1-3 из SEQ ID NO:296-298 и CDR L1-3 из SEQ ID NO:301-303;
в) CDR H1-3 из SEQ ID NO:310-312 и CDR L1-3 из SEQ ID NO:315-317;
г) CDR H1-3 из SEQ ID NO:324-326 и CDR L1-3 из SEQ ID NO:329-331;
д) CDR H1-3 из SEQ ID NO:338-341 и CDR L1-3 из SEQ ID NO:343-345;
e) CDR H1-3 из SEQ ID NO:352-354 и CDR L1-3 из SEQ ID NO:357-359; и
ж) CDR H1-3 из SEQ ID NO:366-368 и CDR L1-3 из SEQ ID NO:371-373.
Другая также предпочтительная группа молекул биспецифического одноцепочечного антитела содержит группу следующих последовательностей, таких как CDR H1, CDR H2, CDR Н3, CDR L1, CDR L2 и CDR L3 во втором связывающем домене, выбранном из группы, состоящей из:
a) CDR H1-3 из SEQ ID NO:380-382 и CDR L1-3 из SEQ ID NO:385-387;
б) CDR H1-3 из SEQ ID NO:394-396 и CDR L1-3 из SEQ ID NO:399-401;
в) CDR H1-3 из SEQ ID NO:408-410 и CDR L1-3 из SEQ ID NO:413-415;
г) CDR H1-3 из SEQ ID NO:422-424 и CDR L1-3 из SEQ ID NO:427-429;
д) CDR H1-3 из SEQ ID NO:436-438 и CDR L1-3 из SEQ ID NO:441-443;
e) CDR H1-3 из SEQ ID NO:450-452 и CDR L1-3 из SEQ ID NO:455-457;
ж) CDR H1-3 из SEQ ID NO:464-466 и CDR L1-3 из SEQ ID NO:469-471;
з) CDR H1-3 из SEQ ID NO:478-480 и CDR L1-3 из SEQ ID NO:483-485;
и) CDR H1-3 из SEQ ID NO:492-494 и CDR L1-3 из SEQ ID NO:497-499;
к) CDR H1-3 из SEQ ID NO:506-508 и CDR L1-3 из SEQ ID NO:511-513;
л) CDR H1-3 из SEQ ID NO:520-522 и CDR L1-3 из SEQ ID NO:525-527;
м) CDR H1-3 из SEQ ID NO:534-536 и CDR L1-3 из SEQ ID NO:539-541;
н) CDR H1-3 из SEQ ID NO:548-550 и CDR L1-3 из SEQ ID NO:553-555;
о) CDR H1-3 из SEQ ID NO:562-564 и CDR L1-3 из SEQ ID NO:567-569;
п) CDR H1-3 из SEQ ID NO:576-578 и CDR L1-3 из SEQ ID NO:581-583;
p) CDR H1-3 из SEQ ID NO:590-592 и CDR L1-3 из SEQ ID NO:595-597; и
с) CDR H1-3 из SEQ ID NO:604-606 и CDR L1-3 из SEQ ID NO:609-611.
Предпочтительно для молекулы биспецифического одноцепочечного антитела по изобретению, чтобы второй связывающий домен, который связывается с антигеном, клеточной поверхности PSMA, содержал группу следующих последовательностей, таких как VH- и VL-цепи во втором связывающем домене, выбранном из группы, состоящей из:
а) VH-цепь из SEQ ID NO:225 и VL-цепь из SEQ ID NO:230;
б) VH-цепь из SEQ ID NO:239 и VL-цепь из SEQ ID NO:244;
в) VH-цепь из SEQ ID NO:253 и VL-цепь из SEQ ID NO:258;
г) VH-цепь из SEQ ID NO:267 и VL-цепь из SEQ ID NO:272;
д) VH-цепь из SEQ ID NO:617 и VL-цепь из SEQ ID NO:622;
e) VH-цепь из SEQ ID NO:281 и VL-цепь из SEQ ID NO:286;
ж) VH-цепь из SEQ ID NO:295 и VL-цепь из SEQ ID NO:300;
з) VH-цепь из SEQ ID NO:309 и VL-цепь из SEQ ID NO:314;
и) VH-цепь из SEQ ID NO:323 и VL-цепь из SEQ ID NO:328;
к) VH-цепь из SEQ ID NO:337 и VL-цепь из SEQ ID NO:342;
л) VH-цепь из SEQ ID NO:351 и VL-цепь из SEQ ID NO:356;
м) VH-цепь из SEQ ID NO:365 и VL-цепь из SEQ ID NO:370;
н) VH-цепь из SEQ ID NO:379 и VL-цепь из SEQ ID NO:384;
о) VH-цепь из SEQ ID NO:393 и VL-цепь из SEQ ID NO:398;
п) VH-цепь из SEQ ID NO:407 и VL-цепь из SEQ ID NO:412;
p) VH-цепь из SEQ ID NO:421 и VL-цепь из SEQ ID NO:426;
с) VH-цепь из SEQ ID NO:435 и VL-цепь из SEQ ID NO:440;
т) VH-цепь из SEQ ID NO:449 и VL-цепь из SEQ ID NO:454;
у) VH-цепь из SEQ ID NO:463 и VL-цепь из SEQ ID NO:468;
ф) VH-цепь из SEQ ID NO:477 и VL-цепь из SEQ ID NO:482;
x) VH-цепь из SEQ ID NO:491 и VL-цепь из SEQ ID NO:496;
ц) VH-цепь из SEQ ID NO:505 и VL-цепь из SEQ ID NO:510;
ч) VH-цепь из SEQ ID NO:519 и VL-цепь из SEQ ID NO:524;
ш) VH-цепь из SEQ ID NO:533 и VL-цепь из SEQ ID NO:538;
щ) VH-цепь из SEQ ID NO:547 и VL-цепь из SEQ ID NO:552;
ы) VH-цепь из SEQ ID NO:561 и VL-цепь из SEQ ID NO:566;
э) VH-цепь из SEQ ID NO:575 и VL-цепь из SEQ ID NO:580;
ю) VH-цепь из SEQ ID NO:589 и VL-цепь из SEQ ID NO:594; и
я) VH-цепь из SEQ ID NO:603 и VL-цепь из SEQ ID NO:608.
Вышеприведенные VH- и VL-цепи также представлены в SEQ ID NO:235, 249, 263, 277, 627, 291, 305, 319, 333, 347, 361, 375, 389, 403, 417, 431, 445, 459, 473, 487, 501, 515, 529, 543, 557, 571, 585, 599 и 613, соответственно.
Последовательности (аминокислотная последовательность и нуклеотидная последовательность) соответствущих VL- и VH-областей второго связывающего домена молекулы биспецифического одноцепочечного антитела по изобретению, а также соответствующих scFvs показаны в перечне последовательностей.
В молекуле биспецифического одноцепочечного антитела по изобретению связывающие домены расположены в порядке VL-VH-VH-VL, VL-VH-VL-VH, VH-VL-VH-VL или VH-VL-VL-VH, как проиллюстрировано в прилагаемых примерах. Предпочтительно, связывающие домены расположены в порядке VH PSMA-VL PSMA-VH CD3-VL CD3 или VL PSMA-VH PSMA-VH CD3-VL CD3.
Особенно предпочтительное воплощение изобретения касается охарактеризованного выше полипептида, где молекула биспецифического одноцепочечного антитела содержит последовательность, выбранную из:
(а) аминокислотной последовательности, представленной в любой из SEQ ID NO:237, 251, 265, 279, 629, 293, 307, 321, 335, 349, 363,377, 391, 405, 419, 433, 447, 461, 475, 489, 503, 517, 531, 545, 559, 573, 587, 601 или 615;
(б) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, представленной в любой из SEQ ID NO:238, 252, 266, 280, 630, 294, 308, 322, 336, 350, 364, 378, 392, 406, 420, 434, 448, 462, 476, 490, 504, 518, 532, 546, 560, 574, 588, 602 или 616.
Изобретение относится к молекуле биспецифического одноцепочечного антитела, содержащей аминокислотную последовательность, как представлено в любой из SEQ ID NO:237, 251, 265, 279, 629, 293, 307, 321, 335, 349, 363, 377, 391, 405, 419, 433, 447, 461, 475, 489, 503, 517, 531, 545, 559, 573, 587, 601 или 615, а также к аминокислотным последовательностям, по меньшей мере на 96% идентичным, предпочтительно на 97%, более предпочтительно по меньшей мере на 98% идентичным, наиболее предпочтительно по меньшей мере на 99% идентичным аминокислотной последовательности SEQ ID NO:237, 251, 265, 279, 629, 293, 307, 321, 335, 349, 363, 377, 391, 405, 419, 433, 447, 461, 475, 489, 503, 517, 531, 545, 559, 573, 587, 601 или 615. Изобретение также относится к соответствующим последовательностям нуклеиновой кислоты, как представлено в любой из SEQ ID NO:238, 252, 266, 280, 630, 294, 308, 322, 336, 350, 364, 378, 392, 406, 420, 434, 448, 462, 476, 490, 504, 518, 532, 546, 560, 574, 588, 602 или 616, а также к последовательностям нуклеиновой кислоты, по меньшей мере на 96% идентичным, предпочтительно на 97%, более предпочтительно по меньшей мере на 98% идентичным, наиболее предпочтительно по меньшей мере на 99% идентичным последовательностям нуклеиновой кислоты, представленным в SEQ ID NO:238, 252, 266, 280, 630, 294, 308, 322, 336, 350, 364, 378, 392, 406, 420, 434, 448, 462, 476, 490, 504, 518, 532, 546, 560, 574, 588, 602 или 616. Следует понимать, что идентичность последовательностей определяется на протяжении всей нуклеотидной или аминокислотной последовательности. Для выравнивания последовательностей, например, могут быть использованы программы Gap или BestFit (Needleman and Wunsch J. Mol. Biol. 48 (1970), 443-453; Smith and Waterman, Adv. Appl. Math 2 (1981), 482-489), которые содержатся в пакете программного обеспечения GCG (Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, USA 53711 (1991). Для специалистов в данной области техники это рутинный способ определения и идентификации нуклеотидной или аминокислотной последовательности, имеющей, например, 96%-ную (97%, 98% или 99%) идентичность последовательностей с нуклеотидной или аминокислотной последовательностью биспецифического одноцепочечного антитела по изобретению, с использованием, например, одной из вышеупомянутых программ. Например, в соответствии с Вобл-гипотезой Крика (Crick’s Wobble hypothesis), 5’-основание на антикодоне так пространственно не ограничено, как два других основания и, таким образом, может иметь нестандартное спаривание оснований. Другими словами: третье положение в кодоновом триплете может варьироваться таким образом, что два триплета, которые отличаются своим третьим положением, могут кодировать один и тот же аминокислотный остаток. Указанная гипотеза хорошо известна специалисту в данной области техники (см., например, http://en.wikipedia.org/wiki/Wobble_Hypothesis; Crick, J Mol Biol 19 (1966):548-55).
Предпочтительные расположения доменов в конструкциях биспецифического одноцепочечного антитела к PSMAxCD3 по изобретению показаны в следующих примерах.
В предпочтительном воплощении изобретения биспецифические одноцепочечные антитела обладают межвидовой специфичностью к CD3-эпсилон и к антигену клеточной поверхности PSMA человека и примата, не являющегося шимпанзе, распознаваемого их вторым связывающим доменом.
В альтернативном воплощении в настоящем изобретении предложена последовательность. нуклеиновой кислоты, кодирующая вышеописанную молекулу биспецифического одноцепочечного антитела по изобретению.
Настоящее изобретение также относится к вектору, содержащему молекулу нуклеиновой кислоты по настоящему изобретению.
Многие подходящие векторы, выбор которых будет зависеть от желаемой функции, известны специалистам в молекулярной биологии и включают плазмиды, космиды, вирусы, бактериофаги и другие векторы, используемые традиционно в генетической инженерии. Для конструирования различных плазмид и векторов могут быть использованы способы, которые хорошо известные специалистам в данной области техники; см., например, способы, описанные в Sambrook et al. (там же) и Ausubel, Current Protocols in Molecular Biology, Green Publishing Associates and Wiley Interscience, N.Y. (1989), (1994). Альтернативно, полинуклеотиды и векторы по изобретению могут быть преобразованы в липосомы для доставки в клетки-мишени. Как обсуждается более подробно ниже, клонирующий вектор использовали для выделения индивидуальных последовательностей ДНК. Соответствующие последовательности можно перенести в экспрессирующие векторы, если требуется экспрессия конкретного полипептида. Типичные клонирующие векторы включают pBluescript SK, pGEM, pUC9, pBR322 и pGBT9. Типичные экспрессирующие векторы включают pTRE, pCAL-n-EK, pESP-1, pOP13CAT.
Предпочтительно, указанный вектор содержит последовательность нуклеиновой кислоты, которая представляет собой регуляторную последовательность, функциональным образом связанную с указанной последовательностью нуклеиновой кислоты, определенной в данной заявке.
Термин "регуляторная (regulatory) последовательность" относится к последовательностям ДНК, которые необходимы для воздействия на экспрессию кодирующих последовательностей, с которыми они лигированы. Природа таких регуляторных (control) последовательностей различается в зависимости от организма-хозяина. У прокариот, регуляторные последовательности, как правило, включают промотор, сайт связывания рибосом и терминаторы. У эукариот, как правило, регуляторные последовательности включают промоторы, терминаторы и, в некоторых случаях, энхансеры, трансактиваторы или транскрипционные факторы. Термин "регуляторная последовательность" предназначен для включения, как минимум, всех компонентов, присутствие которых необходимо для экспрессии, и также может включать в себя дополнительные полезные компоненты.
Термин "функциональным образом связанный" относится к смежному положению, где компоненты, описанные таким образом, находятся во взаимосвязи, позволяющей им функционировать надлежащим образом. Регуляторная последовательность, "функциональным образом связанная" с кодирующей последовательностью, лигирована таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с регуляторными последовательностями. В том случае, когда регуляторная последовательность представляет собой промотор, специалисту очевидно, что предпочтительно использовать двухцепочечную нуклеиновую кислоту.
Таким образом, описанный вектор предпочтительно представляет собой экспрессирующий вектор. "Экспрессирующий вектор" представляет собой конструкцию, которая может быть использована для трансформации выбранного хозяина и обеспечивает экспрессию кодирующей последовательности в выбранном хозяине. Экспрессирующие векторы могут представлять собой, например, клонирующие векторы, бинарные векторы или интегрирующие векторы. Экспрессия включает транскрипцию молекулы нуклеиновой кислоты предпочтительно в транслируемую (область) мРНК. Регуляторные элементы, обеспечивающие экспрессию в прокариотических и/или эукариотических клетках, хорошо известны специалистам в данной области техники. В случае эукариотических клеток, они, как правило, содержат промоторы, обеспечивающие инициацию транскрипции, и возможно поли-А сигналы, обеспечивающие терминацию транскрипции и стабилизацию транскрипта. Возможные регуляторные элементы, обеспечивающие экспрессию в прокариотических клетках-хозяевах, содержат, например, PL, lac, trp или tac промотор в E.coli, и примеры регуляторных элементов, позволяющих осуществлять экспрессию в эукариотических клетках-хозяевах, представляют собой АОХ1 или GAL1 промотор в дрожжах или CMV-, SV40-, RSV-промотор (вирус саркомы Рауса), CMV-энхансер, SV40-энхансер или глобиновый интрон в клетках млекопитающих и других животных.
Кроме элементов, которые отвечают за инициацию транскрипции, такие регуляторные элементы также могут содержать сигналы терминации транскрипции, такие как сайт SV40-поли-А или сайт tk-поли-А, расположенный ниже данного полинуклеотида. Кроме того, в зависимости от используемой экспрессирующей системы, к кодирующей последовательности описанной последовательности нуклеиновой кислоты могут быть добавлены лидерные последовательности, способные направлять данный полипептид в клеточный компартмент или секретировать его в среду, и они хорошо известны в данной области техники; см., например, WO 2008/119567. Лидерная(ые) последовательность(и) собирается(собираются) в соответствующей фазе с последовательностями трансляции, инициации и терминации, и предпочтительно, чтобы лидерная последовательность была способна направлять секрецию транслированного белка или его участка в периплазматическое пространство или внеклеточную среду. Возможно, гетерологичная последовательность может кодировать слитый белок, включающий N-концевой идентифицирующий пептид, обеспечивающий желаемые характеристики, например, стабилизацию или упрощенную очистку экспрессированного рекомбинантного продукта; см. выше. В этом контексте в данной области техники известны подходящие экспрессирующие векторы, такие как Okayama-Berg кДНК-экспрессирующий вектор pcDV1 (Pharmacia), pCDM8, pRc/CMV, pcDNA1, pcDNA3 (In-vitrogene), pEF-DHFR, рЕР-АОАили pEF-neo (Mack et al. PNAS (1995) 92, 7021-7025 и Raum et al. Cancer Immunol Immunother (2001) 50(3), 141-150) или pSPORT1 (GIBCO BRL).
Предпочтительно, экспрессирующие регуляторные последовательности будут представлять собой эукариотические промоторные системы в векторах, способных трансформировать трансфицируемые эукариотические клетки-хозяева, но также можно использовать регуляторные последовательности прокариотических хозяев. После того, как вектор будет включен в соответствующего хозяина, этот хозяин поддерживается в условиях, подходящих для обеспечения высокого уровня экспрессии нуклеотидных последовательностей, и при желании, дальше могут следовать сбор и очистка молекулы биспецифического одноцепочечного антитела по изобретению; см., например, прилагаемые Примеры.
Альтернативной экспрессирующей системой, которая может быть использована для экспрессии белка, активного в отношении клеточного цикла, является система насекомых. В одной из таких систем в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или в личинках Trichoplusia используется вирус ядерного полиэдроза Autographa californica (AcNPV). Кодирующая последовательность описанной молекулы нуклеиновой кислоты может быть клонирована в несущественную область вируса, такую как полиэдриновый ген, и помещена под контроль полиэдринового промотора. Успешная вставка указанной кодирующей последовательности будет инактивировать полиэдриновый ген и приводить к получению рекомбинантного вируса, лишенного белка оболочки. Эти рекомбинантные вирусы затем используют для инфицирования клеток S. frugiperda или личинок Trichoplusia, в которых экспрессируется белок по изобретению (Smith, J. Virol. 46 (1983), 584; Engelhard, Proc. Nat. Acad. Sci. USA 91 (1994), 3224-3227).
Дополнительные регуляторные элементы могут включать транскрипционные, а также трансляционные энхансеры. Предпочтительно, описанные выше векторы по изобретению содержат селектируемый и/или сравнительный маркер (scorable marker).
Селектируемые маркерные гены, полезные для селекции трансформированных клеток и, например, растительной ткани и растений, хорошо известны специалистам в данной области техники и придают, например, устойчивость к антиметаболитам в качестве основы селекции для dhfr, который обеспечивает устойчивость к метотрексату (Reiss, Plant Physiol. (Life Sci. Adv.) 13 (1994), 143-149); npt, который придает устойчивость к аминогликозидам неомицину, канамицину и паромицину (Herrera-Estrella, EMBO J. 2 (1983), 987-995) и hygro, который придает устойчивость к гигромицину (Marsh, Gene 32 (1984), 481-485). Были описаны дополнительные селектируемые гены, а именно trpB, который позволяет клеткам утилизировать индол вместо триптофана; hisD, который позволяет клеткам утилизировать гистинол вместо гистидина (Hartman, Proc. Natl. Acad. Sci. USA 85 (1988), 8047); манноза-6-фосфатизомераза, которая позволяет клеткам утилизировать маннозу (WO 94/20627), и ODC (орнитиндекарбоксилаза), которая придает устойчивость к ингибитору орнитиндекарбоксилазы 2-(дифторметил)-DL-орнитину (DFMO) (McConlogue, 1987, In: Current Communications in Molecular Biology, Cold Spring Harbor Laboratory ed.), или дезаминаза из Aspergillus terreus, которая придает устойчивость к бластицидину S (Tamura, Biosci, Biotechnol. Biochem. 59 (1995), 2336-2338).
Полезные сравнительные маркеры также известны специалистам в данной области техники и имеются в продаже. Предпочтительно, когда указанным маркером является ген, кодирующий люциферазу (Giacomin, PI. Sci. 116 (1996), 59-72; Scikantha, J. Bact. 178 (1996), 121), зеленый флуоресцентный белок (Gerdes, FEBS Lett. 389 (1996), 44-47) или В-глюкуронидазу (Jefferson, EMBO J. 6 (1987), 3901-3907). Это воплощение, в частности, полезно для простого и быстрого скрининга клеток, тканей и организмов, содержащих упомянутый вектор.
Как описано выше, описанная молекула нуклеиновой кислоты может быть использована сама по себе или как часть вектора для экспрессии молекулы биспецифического одноцепочечного антитела по изобретению в клетках, например, для очистки, а также для целей генной терапии. Молекулы нуклеиновой кислоты или векторы, содержащие последовательность(и) ДНК, кодирующую(ие) любую. из вышеописанных молекул биспецифического одноцепочечного антитела по изобретению, вводят в клетки, которые в свою очередь продуцируют интересующий полипептид. Генная терапия, которая основана на введении терапевтических генов в клетки с использованием методов ex vivo или in vivo, представляет собой одно из наиболее важных применений генного переноса. Подходящие векторы, способы или системы доставки генов для генной терапии in vitro или in vivo описаны в литературе и известны специалисту в данной области техники; см., например, Giordano, Nature Medicine 2 (1996), 534-539; Schaper, Circ. Res. 79 (1996), 911-919; Anderson, Science 256 (1992), 808-813; Verma, Nature 389 (1994), 239; Isner, Lancet 348 (1996), 370-374; Muhlhauser, Circ. Res. 77 (1995), 1077-1086; Onodera, Blood 91 (1998), 30-36; Verma, Gene Ther. 5 (1998), 692-699; Nabel, Ann. N.Y. Acad. Sci. 811 (1997), 289-292; Verzeletti, Hum. Gene Ther. 9 (1998), 2243-51; Wang, Nature Medicine 2 (1996), 714-716; WO 94/29469; WO 97/00957, US 5,580,859; US 5,589,466; или Schaper, Current Opinion in Biotechnology 7 (1996), 635-640; dos Santos Coura and Nardi Virol J. (2007), 4:99. Описанные молекулы Нуклеиновой кислоты и векторы могут быть сконструированы для непосредственного введения или для введения посредством липосом или вирусных векторов (например, аденовирусного, ретровирусного) в клетку. Предпочтительно, чтобы указанная клетка представляла собой клетку зародышевой линии, эмбриональную клетку или яйцеклетку или происходила из них, наиболее предпочтительно, чтобы указанная клетка представляла собой стволовую клетку. Примером эмбриональной стволовой клетки может быть, среди прочего, стволовая клетка, как описано в Nagy, Proc. Natl. Acad. Sci. USA 90 (1993), 8424-8428.
В изобретении также предложен хозяин, трансформированный или трансфицированный вектором по изобретению. Указанный хозяин может быть получен путем введения описанного выше вектора по изобретению или описанной выше молекулы нуклеиновой кислоты по изобретению в хозяина. Присутствие по меньшей мере одного вектора или по меньшей мере одной молекулы нуклеиновой кислоты в хозяине может опосредовать экспрессию гена, кодирующего описанные выше конструкции одноцепочечных антител.
Описанные молекула нуклеиновой кислоты или вектор по изобретению, которые вводят хозяину, могут быть либо встроены в геном хозяина, либо поддерживаться внехромосомно.
Хозяином может быть любая прокариотическая или эукариотическая клетка.
Термин "прокариот" предназначен для включения всех бактерий, которые могут быть трансформированы или трансфицированы молекулами ДНК или РНК для экспрессии белка по изобретению. Прокариотические хозяева могут включать грамотрицательные, а также грамположительные бактерии, такие как, например, Е.coli, S. typhimurium, Serratia marcescens и Bacillus subtilis. Термин "эукариотический" предназначен для включения клеток дрожжей, высших растений, насекомых и предпочтительно млекопитающих. В зависимости от хозяина, используемого в процедуре рекомбинантного получения, белок, кодируемый полинуклеотидом по настоящему изобретению, может быть гликозилированным или может быть негликозилированным. Особенно предпочтительно использование плазмиды или вируса, содержащих кодирующую последовательность молекулы биспецифического одноцепочечного антитела по изобретению и генетически слитого с N-концевым FLAG-метки и/или C-концевым His-метки. Предпочтительно, длина указанной FLAG-метки составляет примерно 4-8 аминокислот, наиболее предпочтительно 8 аминокислот. Описанный выше полинуклеотид можно использовать для трансформации или трансфекции хозяина, применяя любой из методов, общепризнанных среди специалистов обычной квалификации в данной области техники. Кроме того, способы получения слитых, функциональным образом связанных генов и их экспрессии, например, в клетках млекопитающих и бактериях, хорошо известны в данной области техники (Sambrook, там же).
Предпочтительно, указанным хозяином является бактерия или клетка насекомого, гриба, растения или животного.
В частности предусматривается, что указанный хозяин может представлять собой клетку млекопитающего. Особенно предпочтительные клетки-хозяева включают клетки СНО (яичник китайского хомячка), клетки COS (фибробласты африканской зеленой мартышки), линии миеломных клеток типа SP2/0 или NS/0. Как проиллюстрировано в примерах из WO 2008/119567 для других молекул того же класса, в качестве хозяев особенно предпочтительными являются клетки СНО.
Более предпочтительно, указанная клетка-хозяин представляет собой человеческую клетку или человеческую клеточную линию, например рег.с6 (Kroos, Biotechnol. Prog., 2003, 19:163-168).
В другом воплощении настоящее изобретение, таким образом, относится к способу получения молекулы биспецифического одноцепочечного антитела по изобретению, включающему культивирование хозяина по изобретению в условиях, обеспечивающих экспрессию молекулы биспецифического одноцепочечного антитела по изобретению, и извлечение продуцируемого полипептида из культуры.
Трансформированные хозяева могут выращиваться в ферментерах и культивироваться в соответствии с методами, известными в данной области техники для достижения оптимального роста клеток. Молекулу биспецифического одноцепочечного антитела по изобретению затем можно выделить из ростовой среды, клеточных лизатов или клеточных мембранных фракций. Выделение и очистка, например, экспрессируемых в микробах молекул биспецифического одноцепочечного антитела по изобретению, могут быть осуществлены любыми традиционными методами, такими как, например, препаративные хроматографические разделения и иммунологические разделения, как, например, разделения, вовлекающие применение моноклональных или поликлональных антител, направленных, например, против метки (tag) молекулы биспецифического одноцепочечного антитела по изобретению или как описано в прилагаемых примерах.
Условия культивирования хозяина, которые позволяют осуществлять экспрессию, известны в данной области техники как зависимые от системы хозяина и экспрессирующей системы/экспрессирующего вектора, используемых в таком способе. Параметры, которые должны быть модифицированы для достижения условий, способствующих экспрессии рекомбинантного полипептида, известны в данной области техники. Таким образом, подходящие условия могут быть определены специалистом в данной области техники в отсутствие дополнительного изобретательского вклада.
После проведения экспрессии молекулу биспецифического одноцепочечного антитела изобретение можно очистить в соответствии со стандартными в данной области техники процедурами, включая осаждение сульфатом. аммония, аффинные колонки, колоночную хроматографию, электрофорез в геле и тому подобное; см. Scopes, "Protein Purification", Springer-Verlag, N.Y. (1982). Для фармацевтических применений предпочтительны по существу чистые полипептиды с гомогенностью по меньшей мере примерно 90-95% и наиболее предпочтительны с гомогенностью 98-99% или более. После очистки, частичной или до гомогенности, при желании, молекулу биспецифического одноцепочечного антитела по изобретению затем можно использовать в терапевтических целях (в том числе экстракорпорально) или для разработки и проведения аналитических процедур. Кроме того, примеры способов выделения молекулы биспецифического одноцепочечного антитела по изобретению из культуры подробно описаны в прилагаемых примерах WO 2008/119567 для других молекул того же класса. Извлечения также можно достичь с помощью способа выделения молекулы биспецифического одноцепочечного антитела по изобретению, способной связываться с эпитопом CD3-эпсилон человека и примата, не являющегося шимпанзе (CD3ε, способ, включающий стадии:
(а) приведение полипептида(ов) в контакт с N-концевым фрагментом внеклеточного домена CD3ε, состоящим максимально из 27 аминокислот, содержащих аминокислотную последовательность Gln-Asp-Gly-Asn-Glu-Glu-Met-Gly (SEQ ID NO:211) или Gln-Asp-Gly-Asn-Glu-Glu-Ile-Gly (SEQ ID NO:212), фиксированным посредством его С-конца на твердой фазе;
(б) элюирование связанного(ых) полипептида(ов) с указанного фрагмента; и
(в) выделение полипептида(ов) из элюата (б).
Предпочтительно, чтобы полипептид(ы), выделенный(е) с помощью вышеуказанного способа по изобретению, имел(и) человеческое происхождение.
Способ выделения молекулы биспецифического одноцепочечного антитела по изобретению следует понимать как способ выделения одного или более различных полипептидов с такой же специфичностью к фрагменту внеклеточного домена CD3ε, содержащего на своем N-конце аминокислотную последовательность Gln-Asp-Gly-Asn-Glu-Glu-Met-Gly (SEQ ID NO:211) или Gln-Asp-Gly-Asn-Glu-Glu-lle-Gly (SEQ ID NO:212), из множества полипептидов-кандидатов, а также способ очистки полипептида из раствора. Неограничивающий пример последнего способа очистки молекулы биспецифического одноцепочечного антитела из раствора представляет собой, например, очистку рекомбинантно экспрессируемой молекулы биспецифического одноцепочечного антитела из культурального супернатанта или препарата такой культуры.
Как указано выше. фрагмент, используемый в этом способе, представляет собой N-концевой фрагмент внеклеточного домена молекулы CD3ε примата. Аминокислотная последовательность внеклеточного домена молекулы CD3ε разных видов представлена в SEQ ID NO:1, 3, 5 и 7. Две формы N-концевого октамера представлены в SEQ ID NO:211 и 212. Предпочтительно, чтобы этот N-конец был доступен без ограничений для связывания полипептидов, подлежащих идентификации способом по изобретению. Термин "доступный без ограничений" в контексте изобретения понимают как не имеющий дополнительных мотивов, таких как His-метка. Интерференция такой His-метки со связывающей молекулой, описанной в данной заявке, описана в WO 2008/119567.
Согласно данному способу указанный фрагмент фиксируют через его С-конец на твердой фазе. Специалист в данной области техники сможет легко и без каких-либо изобретательских трудностей выбрать подходящую твердофазную подложку в зависимости от используемого воплощения способа по изобретению. Примеры твердой подложки включают, но не ограничиваются этим, матрицы типа гранул (например, агарозные гранулы, сефарозные гранулы, полистирольные гранулы, декстрановые гранулы), планшеты (культуральные планшеты или планшеты MultiWell), а также чипы, известные, например от Biacore®. Выбор средств и способов фиксации/иммобилизации фрагмента на указанной твердой подложке зависит от выбора твердой подложки. Обычно используемым способом фиксации/иммобилизации является связывание через N-гидроксисукцинимидный (NHS) сложный эфир. Лежащая в основе этого связывания химия, а также альтернативные способы фиксации/иммобилизации известны специалисту в данной области техники, например, из Hermanson "Bioconjugate Techniques", Academic Press, Inc. (1996). Для фиксации/иммобилизации на хроматографических подложках обычно используют следующие средства: NHS-активированную сефарозу (например, HiTrap-NHS от GE Life Science - Amersham), CnBr-активированную сефарозу (например, GE Life Science - Amersham), NHS-активированные декстрановые гранулы (Sigma) или активированный полиметакрилат.Эти реагенты также могут быть использованы в периодическом подходе. Более того, в периодическом подходе могут быть использованы декстрановые гранулы, содержащие оксид железа (например, доступные от Miltenyi). Эти гранулы могут быть использованы в комбинации с магнитом для отделения гранул от раствора. Полипептиды могут быть иммобилизованы на чипе Biacore (например, чипах СМ5) путем применения NHS-активированного карбоксиметилдекстрана. Дополнительными примерами соответствующей твердой подложки являются планшеты MultiWell с реакционно-способными аминогруппами (например, планшеты Nunc Immobilizer™).
Согласно данному способу указанный фрагмент внеклеточного домена CD3-эпсилон может быть связан с твердой подложкой напрямую или через фрагмент аминокислот, который может представлять собой линкерную или другую белковую/полипептидную группировку. Альтернативно, внеклеточный домен CD3-эпсилон может быть связан непосредственно через одну или более чем одну адапторную молекулу.
Средства и способы элюирования пептида или полипептида, связанного с иммобилизованным эпитопом, хорошо известны в данной области техники. То же самое справедливо для способов выделения идентифицируемого(ых) полипептида(ов) из элюата.
Способ выделения одной или более различных молекул биспецифического одноцепочечного антитела с одинаковой специфичностью к фрагменту внеклеточного домена CD3ε, содержащего на своем М-конце аминокислотную последовательность Gln-Asp-Gly-Asn-Glu-Glu-X-Gly (где Х представляет собой Met или Ile), из множества полипептидов-кандидатов может включать одну или более стадий следующих способов селекции антиген-специфических структур:
CD3ε-специфические связывающие молекулы могут быть выбраны из репертуаров антител. Фаг-дисплейная библиотека может быть сконструирована на основании стандартных процедур, как описано, например, в "Phage Display: A Laboratory Manual"; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor Laboratory Press, 2001. Форматом фрагментов антител в библиотеке антител может быть scFv, но в общем случае также может быть Fab-фрагмент или даже фрагмент однодоменного антитела. Для выделения фрагментов антител могут быть использованы библиотеки фрагментов "наивных" антител. Для отбора связывающих структур с возможно низкой иммуногенностью при их последующем терапевтическом применении предпочтительными могут быть библиотеки фрагментов человеческих антител для прямой селекции фрагментов человеческих антител. В некоторых случаях они могут образовывать основу для библиотек синтетических антител (Knappik et al. J. Mol. Biol., 2000, 296:57). Соответствующим форматом может быть Fab, scFv (как описано ниже) или доменные антитела (dAb, обзор которых приведен в Holt et al., Trends Biotechnol., 2003, 21:484 ff).
В данной области техники также известно, что во многих случаях нет доступного источника иммунных человеческих антител против целевого антигена. Поэтому животных иммунизируют целевым антигеном, и соответствующие библиотеки антител выделяют из животной ткани, например, селезенки или РВМС (мононуклеарные клетки периферической крови). N-концевой фрагмент может быть биотинилирован или ковалентно связан с белками типа KLH (гемоцианин лимфы улитки) или бычьего сывороточного альбумина (БСА). Согласно общим подходам, для иммунизации используют грызунов. Некоторые репертуары иммунных антител нечеловеческого происхождения могут быть особенно полезными по другим причинам, например, из-за присутствия однодоменных антител (VHH), происходящих из видов верблюдов (cameloid species) (как описано в Muyldermans, J. Biotechnol., 74:277; De Genst et al., Dev Como Immunol., 2006, 30:187 ff). Поэтому соответствующий формат библиотеки антител может представлять собой Fab, scFv (как описано ниже) или однодоменные антитела (VHH).
В одном из возможных подходов десятинедельных мышей F1, полученных в результате скрещиваний balb/c x C57black, можно иммунизировать целыми клетками, например, экспрессирующими трансмембранную ЕрСАМ, экспонирующую на N-конце в качестве трансляционного слияния N-концевые аминокислоты 1-27 зрелой CD3ε-цепи. Альтернативно, мыши могут быть иммунизированы слитым белком 1-27 CD3-эпсилон-Fc (соответствующий подход описан в примерах WO 2008/119567). После бустерной(ых) иммунизации(ий) могут быть отобраны образцы крови и сывороточный титр антител против CD3-положительных Т-клеток может быть протестирован, например, в FACS-анализе. Обычно сывороточные титры значительно выше у иммунизированных, чем у неиммунизированных животных.
Иммунизированные животные могут стать основой для конструирования библиотек иммунных. антител. Примеры таких библиотек включают фаг-дисплейные библиотеки. Такие библиотеки в общем случае могут быть сконструированы на основании стандартных процедур, как описано, например, в "Phage Display: A Laboratory Manual"; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor Laboratory Press, 2001.
Нечеловеческие антитела также могут быть гуманизированы посредством фагового дисплея благодаря созданию библиотек более вариабельных антител, которые впоследствии могут быть обогащены в отношении связывающих агентов (binders) в процессе селекции.
В подходе с применением фагового дисплея любой из пулов фагов, который экспонирует библиотеки антител, образует основу для селекции связывающих структур с использованием соответствующего антигена в качестве молекулы-мишени. Центральная стадия, на которой выделяют антиген-специфические, антиген-связанные фаги, обозначается как пэннинг. Благодаря экспонированию фрагментов антител на поверхности фагов, этот общий способ называется фаговым дисплеем. Один из предпочтительных способов селекции заключается в применении небольших белков, таких как домен N2 нитевидного фага, трансляционно слитый с N-концом scFv, экспонируемых данным фагом. Другим дисплейным методом, известным в данной области техники, который может быть использован для выделения связывающих структур, является метод рибосомного дисплея (обзор которого приведен в Groves & Osbourn, Expert Opin Biol Ther. 2005, 5:125 ff; Lipovsek & Pluckthun, J Immunol Methods 2004, 290:52 ff). Для того чтобы продемонстрировать связывание scFv фаговых частиц со слитым белком 1-27 CD3ε-Fc, фаговая библиотека, несущая клонированный scFv-репертуар, может быть получена из соответствующего культурального супернатанта с использованием ПЭГ (полиэтиленгликоль). scFv фаговые частицы могут быть проинкубированы с иммобилизованным слитым белком CD3ε-Fc. Иммобилизованный слитый белок CD3ε-Fc может быть нанесен на твердую фазу. Связывающие структуры могут быть элюированы, и этот элюат может быть использован для заражения свежей порции неинфицированных бактериальных хозяев. Бактериальные хозяева, успешно трансдуцированные фагмидной копией, кодирующей человеческий scFv-фрагмент, вновь могут быть подвергнуты селекции на устойчивость к карбенициллину и затем инфицированы, например, хелперным фагом VCMS 13 для начала второго раунда экспонирования антител (antibody display) и селекции in vitro. В общей сложности, осуществляют от 4 до 5 циклов селекции. Связывание выделенных связывающих структур можно протестировать на CD3 эпсилон-положительных клетках Jurkat, клетках HPBall, PBMC или трансфицированных эукариотических клетках, которые несут М-концевую CD3ε-последовательность, слитую с экспонируемой на поверхности ЕрСАМ, используя проточно-цитометрический анализ (см. WO 2008/119567).
Предпочтительно, вышеописанный способ может быть способом, где фрагмент внеклеточного домена CD3ε состоит из одного или более фрагментов полипептида, имеющего аминокислотную последовательность любой последовательности, представленной в SEQ ID NO:2, 4, 6 или 8. Более предпочтительно, указанный фрагмент имеет длину 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 аминокислотных остатков.
Этот способ идентификации молекулы биспецифического одноцепочечного антитела может быть способом скрининга множества молекул биспецифических одноцепочечных антител, содержащих связывающий домен с межвидовой специфичностью, связывающийся с эпитопом CD3ε человека и примата, не являющегося шимпанзе. Альтернативно, способ идентификации представляет собой способ очистки/выделения молекулы биспецифического одноцепочечного антитела, содержащей связывающий домен с межвидовой специфичностью, связывающийся с эпитопом CD3ε человека и примата, не являющегося шимпанзе.
Кроме того, в изобретении предложена композиция, содержащая молекулу биспецифического одноцепочечного антитела по изобретению или биспецифическое одноцепочечное антитело, полученное способом, раскрытым выше. Предпочтительно, указанная композиция представляет собой фармацевтическую композицию.
В изобретении также предложена молекула биспецифического одноцепочечного антитела, как определено здесь, или полученная согласно; способу, как определено здесь, где указанная молекула биспецифического одноцепочечного антитела используется для предупреждения, лечения или облегчения рака. Предпочтительно, указанный рак представляет собой солидную опухоль, более предпочтительно карциному или рак предстательной железы. Предпочтительно, чтобы биспецифическое одноцепочечное антитело дополнительно содержало подходящие композиции носителей, стабилизаторов и/или эксципиентов. Более того, предпочтительно, чтобы указанная молекула биспецифического одноцепочечного антитела подходила для введения в комбинации с дополнительным лекарственным средством. Указанное лекарственное средство может представлять собой небелковое соединение или белковое соединение и может вводиться одновременно или неодновременно с молекулой биспецифического одноцепочечного антитела, как определено здесь.
В соответствии с изобретением, термин "фармацевтическая композиция" относится к композиции для введения пациенту, предпочтительно пациенту-человеку. Конкретная предпочтительная фармацевтическая композиция по данному изобретению содержит биспецифические одноцепочечные антитела, направленные и полученные против независимых от окружения эпитопов CD3. Предпочтительно, фармацевтическая композиция содержит подходящие композиции носителей, стабилизаторов и/или эксципиентов. В предпочтительном воплощении фармацевтическая композиция содержит композицию для парентерального, трансдермального, внутрипросветного, внутриартериального, интратекального и/или интраназального введения или введения посредством прямой инъекции в ткань. В частности, предусматривается, что указанную композицию вводят пациенту посредством инфузии или инъекции. Введение подходящих композиций может быть осуществлено разными путями, например, посредством внутривенного, внутрибрюшинного, подкожного, внутримышечного, местного или интрадермального введения. В частности, согласно настоящему изобретению предложено непрерывное введение подходящей композиции. В качестве неограничивающего примера непрерывное, т.е. постоянное введение может быть реализовано посредством небольшой насосной системы, приводимой в действие пациентом для дозирования поступления терапевтического агента в организм пациента. Фармацевтическая композиция, содержащая биспецифические одноцепочечные антитела, направленные и полученные против независимых от окружения эпитопов CD3 по изобретению, может быть введена с использованием указанных насосных систем. Такие насосные системы в общем случае известны в данной области техники и обычно рассчитаны на периодическую замену картриджей, содержащих терапевтический агент, подлежащий введению посредством инфузии. При замене картриджа в такой насосной системе может произойти временное прекращение в иных случаях непрерывного потока терапевтического агента в организм пациента. В таком случае фаза введения перед заменой картриджа и фаза введения после замены картриджа все же будут рассматриваться в пределах значения фармацевтических средств и способов по изобретению как составляющие "непрерывное введение" такого терапевтического агента.
Постоянное или непрерывное введение таких биспецифических одноцепочечных антител, направленных и полученных против независимых от окружения эпитопов CD3 по данному изобретению, может быть внутривенным или подкожным с использованием устройства для доставки жидкости или небольшой насосной системы, включающей механизм подачи жидкости для подачи жидкости из резервуара и запускающий механизм для приведения в действие приводного механизма. Насосные системы для подкожного введения могут включать иглу или канюлю для протыкания кожи пациента и доставки подходящей композиции в организм пациента. Указанные насосные системы могут быть непосредственно зафиксированы на коже или прикреплены к коже пациента изолированно от венозного, артериального или кровеносного сосуда, тем самым обеспечивая прямой контакт между насосной системой и кожей пациента. Насосная система может быть прикреплена к коже пациента в течение периода времени от 24 часов до нескольких суток включительно. Насосная система может быть небольшого размера с резервуаром для небольших объемов. В качестве неограничивающего примера, объем резервуара для подходящей фармацевтической композиции, подлежащей введению, может составлять от 0,1 до 50 мл.
Непрерывное введение может быть трансдермальным с использованием пластыря, накладываемого на кожу и заменяемого через определенные промежутки времени. Специалист в данной области техники осведомлен о системах с использованием пластырей для доставки лекарственного средства, подходящих для этой цели. Следует отметить, что трансдермальное введение особенно подходит для непрерывного введения, поскольку замена первого использованного пластыря предпочтительно может быть осуществлена одновременно с размещением нового, второго пластыря, например, на поверхности кожи, непосредственно примыкающей к первому использованному пластырю и непосредственно перед удалением первого использованного пластыря. Проблем с прерыванием потока или сильным повреждением клеток не возникает.
Композиция по настоящему изобретению, содержащая, в частности, биспецифические одноцепочечные антитела, направленные и полученные против не зависимых от окружения эпитопов CD3, могут дополнительно содержать фармацевтически приемлемый носитель. Примеры подходящих фармацевтических носителей хорошо известны в данной области техники и включают растворы, например забуференные фосфатами физиологические растворы, воду, эмульсии, такие как эмульсии масло/вода, различные типы увлажняющих агентов, стерильные растворы, липосомы и т.д. Композиции, содержащие такие носители, могут быть изготовлены общеизвестными традиционными способами. Композиции могут содержать углеводы, буферные растворы, аминокислоты и/или поверхностно-активные вещества. Углеводы могут представлять собой невосстанавливающие сахара, предпочтительно трегалозу, сахарозу, октасульфат, сорбит или ксилит. Такие композиции могут быть использованы для непрерывных введений, которые могут быть внутривенными или подкожными с использованием и/или без использования насосных систем. Аминокислоты могут представлять собой заряженные аминокислоты, предпочтительно лизин, ацетат лизина, аргинин, глутамат и/или гистидин. Поверхностно-активные вещества могут представлять собой детергенты, предпочтительно с молекулярной массой более 1,2 кДа, и/или простой полиэфир, предпочтительно с молекулярной массой более 3 кДа. Неограничивающими примерами предпочтительных детергентов являются Tween 20, Tween 40, Tween 60, Tween 80 или Tween 85. Неограничивающими примерами предпочтительных простых полиэфиров являются ПЭГ 3000, ПЭГ 3350, ПЭГ 4000 или ПЭГ 5000. Буферные системы, используемые в настоящем изобретении, может иметь предпочтительное значение рН 5-9 и могут содержать цитрат, сукцинат, фосфат, гистидин и ацетат. Композиции по настоящему изобретению можно вводить субъекту в подходящей дозе, которая может быть определена, например, в результате исследований с применением возрастающих доз посредством введения увеличивающихся доз молекулы биспецифического одноцепочечного антитела по изобретению, демонстрирующего межвидовую специфичность, описанную в данном изобретении в отношении приматов, не являющихся шимпанзе, например макаков. Как указано выше, молекула биспецифического одноцепочечного антитела по изобретению, демонстрирующая межвидовую специфичность, описанную в данном изобретении, может быть предпочтительно использована в идентичной форме в доклиническом тестировании на приматах, не являющихся шимпанзе, и в виде лекарственного средства у людей. Эти композиции также можно вводить в комбинации с другими белковыми и небелковыми лекарственными средствами. Эти лекарственные средства можно вводить одновременно с композицией, содержащей молекулу биспецифического одноцепочечного антитела по изобретению, как определено в данной заявке, или отдельно до или после введения указанного полипептида в соответствии с определенными временными интервалами и дозами. Режим дозирования будет определяться лечащим врачом и клиническими показателями. Как хорошо известно в области медицины, дозировки для любого пациента зависят от многих факторов, включая размер пациента, площадь поверхности тела, возраст, конкретное вводимое соединение, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, подлежащие совместному введению. Композиции для парентерального введения включают стерильные водные или неводные растворы, суспензии и. эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и забуференные среды. Парентеральные носители включают раствор хлорида натрия, декстрозу в растворе Рингера, декстрозу и хлорид натрия, раствор Рингера с лактозой или нелетучие масла. Внутривенные носители включают жидкие и питательные наполнители, электролиты-наполнители (например, на основе декстрозы в растворе Рингера) и тому подобное. Также могут присутствовать консерванты и другие добавки, такие как, например, антимикробные средства, антиоксиданты, хелатирующие агенты, инертные газы и тому подобное. В дополнение к этому, композиция по настоящему изобретению может содержать белковые носители, такие как, например, сывороточный альбумин или иммуноглобулин, предпочтительно человеческого происхождения. Предусматривается, что композиция по изобретению может содержать, в дополнение к молекуле биспецифического одноцепочечного антитела по изобретению, определенной в данной заявке, дополнительные биологически активные агенты, в зависимости от предполагаемого применения композиции. Такими агентами могут быть лекарственные средства, действующие на желудочно-кишечную систему, лекарственные средства, действующие в качестве цитостатических средств, лекарственные средства, предупреждающие гиперурикемию, лекарственные средства, подавляющие иммунные реакции (например, кортикостероиды), лекарственные средства, модулирующие воспалительный ответ, лекарственные средства, действующие на систему кровообращения, и/или такие агенты, как цитокины, известные в данной области техники.
Биологическая активность фармацевтической композиции, определенной в данной заявке, может быть определена, например, посредством анализов цитотоксичности, как описано в следующих ниже примерах, в WO 99/54440 или у Schlereth et al. (Cancer Immunol. Immunother. 20 (2005), 1-12). "Эффективность" или "эффективность in vivo", как использовано в данной заявке, относится к реакции на терапию с использованием фармацевтической композиции по изобретению, полученной с применением, например, стандартизированных критериев оценки ответа NCI (Национальный институт рака США). Успех или эффективность терапии in vivo с использованием фармацевтической композиции по изобретению относится к эффективности композиции для ее предполагаемой цели, т.е. к способности композиции вызывать ее желаемый эффект, т.е. истощение патологических клеток, например, опухолевых клеток. Эффективность in vivo может быть проконтролирована в соответствии с утвержденными стандартными способами определения соответствующих нозологических форм, включая, но не ограничиваясь этим, определение количества лейкоцитов, дифференциальный анализ крови, сортировку клеток с активацией флуоресценции, аспирацию костного мозга. В дополнение к этому, могут быть использованы методы определения клинико-химических параметров, специфичных для различных заболеваний, и другие утвержденные стандартные методы. Кроме того, могут быть использованы компьютерная томография, рентгеновская, ядерно-магнитно-резонансная томография (например, для оценки ответа на основе критериев Национального института рака США [Cheson BD, Horning SJ, Coiffier В, Shipp MA, Fisher RI, Connors JM, Lister ТА, Vose J, Grillo-Lopez A, Hagenbeek A, Cabanillas F, Klippensten D, Hiddemann W, Castellino R, Harris NL, Armitage JO, Carter W, Hoppe R, Canellos GP. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomas. NCI Sponsored International Working Group.J. Clin. Oncol., 1999 Apr; 17(4):1244]), позитронно-эмиссионное томографическое сканирование, определение количества лейкоцитов, дифференциальный анализ крови, сортировка клеток с активацией флуоресценции, аспирация костного мозга, биопсии/гистологии лимфатических узлов и различные опухолеспецифические клинико-химические параметры (например, лактатдегидрогеназа) и другие утвержденные стандартные методы.
Другой главной проблемой в разработке лекарственных средств, таких как фармацевтическая композиция по изобретению, является прогнозируемая модуляция фармакокинетических свойств. С этой целью определяют фармакокинетический профиль лекарственного средства-кандидата, т.е. профиль фармакокинетических параметров, которые влияют на способность конкретного лекарственного средства лечить заданное состояние. Фармакокинетические параметры лекарственного средства, влияющие на способность лекарственного средства лечить конкретное болезненное состояние, включают, но не ограничиваются этим: период полувыведения, объем распределения, метаболизм первого прохождения через печень и степень связывания с сывороткой крови. На эффективность заданного лекарственного агента может оказывать влияние каждый из упомянутых выше параметров.
"Период полувыведения" означает время, за которое 50% введенного лекарственного средства выводится посредством биологических процессов, например, метаболизма, экскреции и т.д.
Под "метаболизмом первого прохождения через печень" подразумевают способность лекарственного средства метаболизироваться после первого контакта с печенью, т.е. в процессе его первого прохождения через печень.
"Объем распределения" означает степень удерживания лекарственного средства в различных компартментах организма, таких как, например, внутриклеточные и внеклеточные пространства, ткани и органы и т.д., и распределение лекарственного средства в этих компартментах.
"Степень связывания с сывороткой крови" означает способность лекарственного средства взаимодействовать или связываться с белками сыворотки крови, такими как альбумин, что приводит к снижению или потере биологической активности лекарственного средства.
Фармакокинетические параметры также включают биодоступность, латентный период (Tlag), Tmax (время достижения максимальной концентрации), скорости всасывания, время начала и/или Cmax для заданного количества вводимого лекарственного средства.
"Биодоступность" означает количество лекарственного средства в компартменте крови.
"Латентный период" означает отставание по времени между введением лекарственного средства и его детекцией и возможностью измерения в крови или плазме.
"Tmax" представляет собой время, после которого достигается максимальная концентрация лекарственного средства в крови, а "Cmax" представляет собой максимальную концентрацию в крови, полученную при использовании данного лекарственного средства. На промежуток времени для достижения концентрации лекарственного средства в крови или ткани, который необходим для его биологического эффекта, оказывают влияние все параметры. Фармакокинетические параметры биспецифических одноцепочечных антител, демонстрирующих межвидовую специфичность, которые могут быть определены в доклиническом тестировании на животных - приматах, не являющихся шимпанзе, перечисленных выше, также изложены, например, в публикации Schlereth и др. (Cancer Immunol. Immunother., 20 (2005), 1-12).
Термин "токсичность", как он использован в данной заявке, относится к токсическим эффектам лекарственного средства, выражающимся в неблагоприятных событиях или тяжелых неблагоприятных событиях. Эти побочные явления можно было бы отнести к отсутствию переносимости лекарственного средства в целом и/или отсутствию локальной переносимости после введения. Токсичность также могла бы включать тератогенные или карциногенные эффекты, вызываемые этим лекарственным средством.
Термин "безопасность", "безопасность in vivo" или "переносимость", как использовано в данной заявке, определяет введение лекарственного средства без индуцирования тяжелых неблагоприятных событий сразу после введения (локальная переносимость) и в течение более продолжительного периода применения лекарственного средства. "Безопасность", "безопасность in vivo" или "переносимость" могут быть оценены, например, через регулярные интервалы во время лечения и последующего наблюдения. Измерения включают клиническую оценку, например, органных манифестаций, и скрининг лабораторных аномалий. В соответствии со стандартами NCI-CTC и/или MedDRA может быть проведена клиническая оценка и зарегистрировано/закодировано отклонение относительно нормальных данных. Органные манифестации могут включать такие критерии, как аллергия/иммунология, кровь/костный мозг, сердечная аритмия, свертывание и тому подобное, как изложено, например, в Общих терминологических критериях для неблагоприятных событий (Common Terminology Criteria for adverse events) v3.0 (CTCAE). Лабораторные параметры, которые могут быть протестированы, включают, например, гематологию, клиническую химию, профиль коагуляции и анализ мочи, и исследование других жидкостей организма, таких как сыворотка, плазма, лимфоидная или цереброспинальная жидкость, ликвор и тому подобное. Таким образом, безопасность может быть оценена, например, с помощью медицинского осмотра, методов визуализации (т.е. ультразвук, рентгеновские лучи, СТ-сканирования, магнитно-резонансная визуализация (MRI)), других измерений с применением технических устройств (т.е. электрокардиограмма), основных показателей состояния организма, путем измерения лабораторных параметров и регистрации неблагоприятных событий. Например, неблагоприятные события у приматов, не являющихся шимпанзе, в применениях и способах по изобретению могут быть исследованы гистопатологическими и/или гистохимическими методами.
Термин "эффективная и нетоксичная доза", как он использован в данной заявке, относится к переносимой дозе биспецифического одноцепочечного антитела, как оно определено в данной заявке, которая достаточно высока для того, чтобы вызвать истощение патологических клеток, устранение опухоли, сокращение опухоли или стабилизацию заболевания без или по существу без основных токсических эффектов. Такие эффективные и нетоксичные дозы могут быть определены, например, в исследованиях действия возрастающих доз, описанных в данной области техники, и они должны быть ниже дозы, индуцирующей тяжелые неблагоприятные побочные явления (дозолимитирующая токсичность (dose limiting toxicity, DLT)).
На вышеупомянутые термины также ссылаются, например, в Preclinical safety evaluation of biotechnology-derived pharmaceuticals (Доклиническая оценка безопасности биотехнологически произведенных фармацевтических средств) S6; ICH Harmonised Tripartite Guideline; ICH Steering Committee meeting on July 16, 1997.
Кроме того, изобретение относится к фармацевтической композиции, содержащей молекулу биспецифического одноцепочечного антитела по данному изобретению, или получаемой в соответствии со способом по изобретению для предупреждения, лечения или ослабления рака. Предпочтительно, указанный рак представляет собой солидную опухоль, предпочтительно карциному или рак предстательной железы. Предпочтительно, указанная фармацевтическая композиция дополнительно содержит подходящие композиции носителей, стабилизаторов и/или эксципиентов.
Другой аспект изобретения относится к применению молекулы биспецифического одноцепочечного антитела/полипептида, как определено в данной заявке выше или получено согласно способу, определенному в данной заявке выше, для изготовления фармацевтической композиции для предупреждения, лечения или ослабления заболевания. Предпочтительно, указанное заболевание представляет собой рак. Более предпочтительно, указанный рак представляет собой солидную опухоль, предпочтительно карциному или рак предстательной железы.
В другом предпочтительном воплощении применения молекулы биспецифического одноцепочечного антитела по изобретению указанная фармацевтическая композиция подходит для введения в комбинации с дополнительным лекарственным средством, т.е. как часть комбинированной терапии. В указанной комбинированной терапии активный агент, возможно, может быть включен в ту же фармацевтическую композицию, что и молекула биспецифического одноцепочечного антитела по изобретению, или может быть включен в отдельную фармацевтическую композицию. В этом последнем случае, указанная отдельная фармацевтическая композиция подходит для введения до, одновременно или после введения указанной фармацевтической композиции, содержащей молекулу биспецифического одноцепочечного антитела по изобретению. Дополнительное лекарственное средство или фармацевтическая композиция могут представлять собой небелковое соединение или белковое соединение. В случае, когда дополнительным лекарственным средством является белковое соединение, предпочтительно, чтобы это белковое соединение могло обеспечивать сигнал активации для иммунных эффекторных клеток.
Предпочтительно, указанное белковое соединение или небелковое соединение можно вводить одновременно или неодновременно с молекулой биспецифического одноцепочечного антитела по изобретению, молекулой нуклеиновой кислоты, как они определены в данной заявке выше, вектором, как он определен в данной заявке выше, или хозяином, как он определен в данной заявке выше.
Другой аспект изобретения относится к способу предупреждения, лечения или ослабления заболевания у субъекта, нуждающегося в этом, включающему стадию введения эффективного количества фармацевтической композиции по изобретению. Предпочтительно, указанное заболевание представляет собой рак. Предпочтительно, указанный рак представляет собой солидную опухоль, предпочтительно карциному или рак предстательной железы.
В другом предпочтительном воплощении способа по изобретению указанная фармацевтическая композиция подходит для введения в комбинации с дополнительным лекарственным средством, т.е. как часть комбинированной терапии. В указанной комбинированной терапии активный агент, возможно, может быть включен в ту же фармацевтическую композицию, что и молекула биспецифического одноцепочечного антитела по изобретению, или может быть включен в отдельную фармацевтическую композицию. В этом последнем случае указанная отдельная фармацевтическая композиция подходит для введения до, одновременно или после введения указанной фармацевтической композиции, содержащей молекулу биспецифического одноцепочечного антитела по изобретению. Дополнительное лекарственное средство или фармацевтическая композиция могут представлять собой небелковое соединение или белковое соединение. В случае, когда дополнительным лекарственным средством является белковое соединение, предпочтительно, чтобы это белковое соединение могло обеспечивать сигнал активации для эффекторных клеток иммунной системы.
Предпочтительно, указанное белковое соединение или небелковое соединение можно вводить одновременно или не одновременно с молекулой биспецифического одноцепочечного антитела по изобретению, молекулой нуклеиновой кислоты, как они определены в данной заявке выше, вектором, как он определен в данной заявке выше, или хозяином, как он определен в данной заявке выше.
Предпочтительно для описанного выше способа по изобретению, указанный субъект представляет собой человека.
В другом аспекте изобретение относится к набору, содержащему молекулу биспецифического одноцепочечного антитела по изобретению, молекулу нуклеиновой кислоты по изобретению, вектор по изобретению или хозяина по изобретению.
Эти и другие воплощения описаны и включены в описание и Примеры настоящего изобретения. Рекомбинантные методы и иммунологические методы описаны, например, в Sambrook et al. Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press, 3rd edition 2001; Lefkovits; Immunology Methods Manual; The Comprehensive Sourcebook of Techniques; Academic Press, 1997; Golemis; Protein-Protein Interactions: A Molecular Cloning Manual; Cold Spring Laboratory Press, 2002. Дополнительная литература, касающаяся любого из антител, способов, применений и соединений, используемых в соответствии с настоящим изобретением, может быть получена из общедоступных библиотек и баз данных, с использованием, например, электронных устройств. Например, можно использовать общую базу данных "Medline", доступную через Интернет, например по адресу http://www.ncbi.nlm.nih.gov/PubMed/medline.html. Дополнительные базы данных и адреса, такие как http://www.ncbi.nlm.nih.gov/ или перечисленные на домашней странице сервиса EMBL (European Molecular Biology Laboratory) под адресом http://www.embl.de/services/index.html, известны специалисту в данной области техники и также могут быть получены с использованием, например, http://www.google.com.
Графические материалы демонстрируют следующее:
Фиг.1
Анализ связывания FACS сконструированных биспецифических одноцепочечных конструкций с межвидовой специфичностью в клетках СНО, трансфицированных PSMA человека, человеческой CD3+ Т-клеточной линии HPB-ALL, клетках СНО, трансфицированных PSMA макака, и Т-клеточной линии 4119 LnPx макака. FACS окрашивание осуществляют, как описано в Примере 2.1. Толстая линия представляет клетки, инкубированные с клеточным культуральным супернатантом, которые затем инкубируют с анти-his антителом и РЕ-меченным детектирующим антителом. Тонкая линия гистограммы отражает отрицательный контроль: клетки, инкубированные только с анти-his антителом и детектирующим антителом.
Фиг.2:
Цитотоксическую активность, индуцированную сконструированными биспецифическими одноцепочечными конструкциями с межвидовой специфичностью, перенацеливали на клеточные линии-мишени. Стимулированные CD4-/CD56- человеческие Т-клетки используют в качестве эффекторных клеток, клетки СНО, трансфицированные человеческим PSMA в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 2.2.
Настоящее изобретение дополнительно описано с помощью следующих иллюстративных неограничивающих примеров, которые обеспечивают лучшее понимание настоящего изобретения и его многочисленные преимущества.
ПРИМЕРЫ
1. Получение и характеристика молекул биспецифических одноцепочечных антител к PSMA и CD3 с межвидовой специфичностью
1.1 Клонирование и экспрессия человеческого антигена PSMA на клетках СНО
Последовательность человеческого антигена PSMA (‘AY101595’, мРНК специфического мембранного антигена предстательной железы Homo sapiens, полная кодирующая последовательность (complete cds), Национальный Центр Биотехнологической Информации, http://www.ncbi.nlm.nih.gov/entrez) использовали для получения синтетической молекулы посредством генного синтеза в соответствии со стандартными протоколами. Фрагмент синтетического гена также сконструирован таким образом, чтобы содержать сайт Козака для эукариотической экспрессии конструкции и сайты рестрикции в начале и в конце ДНК. Введенные сайты рестрикции XbaI на 5’-конце и SalI на 3’-конце использовали во время стадии клонирования в экспрессирующей плазмиде, обозначенной pEFDHFR, как описано в Mack et al. (Mack M et al., Proc Natl Acad Sci USA 1995:92:7021-5, и Raum et al. Cancer Immunol Immunother (2001) 50(3)). После проверки последовательности плазмиду использовали для трансфекции CHO/dhfr- клеток следующим образом. Плазмиду с проверенной последовательностью использовали для трансфекции CHO/dhfr- клеток (АТСС № CRL 9096; культивирование в RPMI 1640 со стабилизированным глутамином, полученной от Biochrom AG Berlin, Германия, дополненной 10% FCS (эмбриональная телячья сыворотка), 1% пенициллина/стрептомицина, полученных от Biochrom AG Berlin, Германия, и нуклеозидами из концентрированного раствора реагентов для культивирования клеток, полученных от Sigma-Aldrich Chemie GmbH, Taufkirchen, Германия, до конечной концентрации 10 мкг/мл аденозина, 10 мкг/мл дезоксиаденозина и 10 мкг/мл тимидина, в инкубаторе при 37°С, 95% влажности и 7% CO2). Трансфекцию осуществляли с использованием реагента для трансфекции PolyFect (Qiagen GmbH, Hilden, Германия) и 5 мкг плазмидной ДНК в соответствии с протоколом производителя. После культивирования в течение 24 часов клетки промывали один раз PBS и снова культивировали в вышеупомянутой клеточной культуральной среде, за исключением того, что среда не дополнена нуклеозидами и диализованной FCS (получена от Biochrom AG Berlin, Германия). Таким образом, клеточная культуральная среда не содержала нуклеозиды, и, таким образом, селекцию осуществляли на трансфицированных клетках. Приблизительно через 14 суток после трансфекции наблюдали рост резистентных клеток. После дополнительных 7-14 суток тестировали положительные трансфектанты в отношении экспрессии конструкции посредством FACS. Экспрессию эукариотического белка в DHFR-дефектных клетках СНО осуществляют, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцируют с помощью увеличивающихся концентраций метотрексата (МТХ) до конечной концентрации вплоть до 20 нМ МТХ.
1.2 Клонирование и экспрессия антигена PSMA макака на клетках СНО
Последовательность кДНК PSMA макака (cynomolgus) получали с помощью набора из пяти ПЦР на кДНК предстательной железы макака, полученного в соответствии с стандартными протоколами. Использовали следующие условия реакции: 1 цикл при 94°С в течение 2 минут, затем 40 циклов при 94°С в течение 1 минуты, 52°С в течение 1 минуты и 72°С в течение 1,5 минуты, затем конечный цикл 72°С в течение 3 минут, и следующие праймеры:
- прямой праймер: 5’-cactgtggcccaggttcgagg-3’ (SEQ ID NO:213) обратный праймер: 5’-gacataccacacaaattcaatacgg-3’ (SEQ ID NO:214)
- прямой праймер: 5’-gctctgctcgcgccgagatgtgg-3’ (SEQ ID NO:215) обратный праймер: 5’-acgctggacaccacctccagg-3’ (SEQ ID NO:216)
- прямой праймер: 5’-ggttctactgagtgggcagagg-3’ (SEQ ID NO:217) обратный праймер: 5’-acttgttgtggctgcttggagc-3’ (SEQ ID NO:218)
- прямой праймер: 5’-gggtgaagtcctatccagatgg-3’ (SEQ ID NO:219) обратный праймер: 5’-gtgctctgcctgaagcaattcc-3’ (SEQ ID NO:220)
- прямой праймер: 5’-ctcggcttcctcttcgggtgg-3’ (SEQ ID NO:221) обратный праймер: 5’-gcatattcatttgctgggtaacctgg-3’ (SEQ ID NO:222)
В результате ПЦР реакций получили пять перекрывающихся фрагментов, которые выделяли и секвенировали в соответствии со стандартными протоколами, используя ПЦР-праймеры и тем самым обеспечивая часть последовательности кДНК, кодирующей PSMA макака от кодона 3 до последнего кодона зрелого белка. Для создания конструкции для экспрессии PSMA макака получали фрагмент кДНК посредством генного синтеза в соответствии со стандартными протоколами (кДНК и аминокислотная последовательность конструкции показаны в SEQ ID NO:223 и 224). В этой конструкции кодирующая последовательность PSMA макака от аминокислоты 3 до последней аминокислоты зрелого PSMA белка с последующим стоп-кодоном подвергали слиянию в рамке с кодирующей последовательностью первых двух аминокислот человеческого белка PSMA. Фрагмент синтетического гена также конструировали таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии конструкции и сайты рестрикции в начале и в конце фрагмента, содержащего кДНК. Введенные сайты рестрикции: XbaI на 5’-конце и SalI на 3’-конце, использовали в следующих процедурах клонирования. Синтезированный фрагмент гена клонировали через Xbal и SalI в плазмиду, обозначенную как pEF-DHFR, в соответствии со стандартными протоколами. Вышеупомянутые процедуры осуществляют в соответствии со стандартными протоколами (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с последовательность-проверенной нуклеотидной последовательностью трансфицировали в DHFR-дефектные клетки СНО для эукариотической экспрессии конструкции. Экспрессию эукариотического белка в DHFR-дефектных клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали с помощью увеличивающихся концентраций метотрексата (МТХ) до конечной концентрации вплоть до 20 нМ МТХ.
Пример 2
2.1 Анализ связывания с помощью проточной цитометрии биспецифических антител к PSMA и CD3 с межвидовой специфичностью
Для того чтобы оценить функциональность конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с PSMA человека и макака и с CD3 человека и макака, осуществляют FACS-анализ. Для этого клетки СНО, трансфицированные человеческим PSMA, и человеческую CD3 положительную Т-клеточную лейкозную клеточную линию HPB-ALL (DSMZ, Braunschweig, ACC483) использовали для оценки связывания человеческих антигенов. Реактивность связывания с антигенами макака тестировали с использованием полученного трансфектанта PSMA макака и Т-клеточной линии макака 4119LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликовано Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61).
Анализ проточной цитометрии осуществляют следующим образом:
200000 клеток соответствующих клеточных линий инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биоспецифического антитела с межвидовой специфичностью (2 мкг/мл) или с супернатантом клеточной культуры трансфицированных клеток, экспрессирующих конструкции биоспецифического антитела с межвидовой специфичностью. Клетки промывали дважды PBS с 2% FCS, и связывание конструкции определяли мышиным анти-His антителом (Penta His антитело; Qiagen; разведенное 1:20 в 50 мкл PBS с 2% FCS). После промывки связанные анти-His антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разведенного 1:100 в PBS с 2% FCS. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля связывания с Т-клеточными линиями. Одноцепочечную конструкцию с неподходящей целевой специфичностью использовали в качестве отрицательного контроля связывания с PSMA-трансфицированными клетками СНО.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; программное обеспечение CellQuest использовали для получения и анализа данных (Becton Dickinson biosciences, Heidelberg). FACS окрашивание и измерение интенсивности флуоресценции проводили, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-lnterscience, 2002).
Совершенно ясно обнаружили биспецифическое связывание одноцепочечных молекул, которые обладают межвидовой специфичностью к PSMA и межвидовой специфичностью к CD3 человека и макака, как показано на Фиг.1. В FACS-анализе все конструкции показали связывание с CD3 и PSMA, по сравнению с соответствующими отрицательными контролями. Была продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 человека и макака и PSMA человека и макака.
2.2 Биоактивность биспецифических одноцепочечных антител к PSMA и CD3 с межвидовой специфичностью
Биоактивность полученных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro с использованием человеческой PSMA-положительной клеточной линии СНО. В качестве эффекторных клеток использовали стимулированные человеческие CD4/CD56 обедненные РВМС.
Получение стимулированных CD4/CD56 обедненных РВМС осуществляли следующим образом:
Нанесение покрытия на чашки Петри (145 мм в диаметре, Greiner bio-one GmbH, Frickenhausen) осуществляли с помощью коммерчески доступного анти-CD3 специфического антитела (например, OKT3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязанный белок удаляли посредством одной стадии промывки PBS. Свежие РВМС выделяли из периферической крови (30-50 мл человеческой крови) с помощью центрифугирования в градиенте Ficoll в соответствии со стандартными протоколами. 3-5×107 РВМС добавляли к предварительно покрытым чашкам Петри в 120 мл RPMI 1640 со стабилизированным глутамином/10% PCS /IL-2 20 Ед/мл (Proleukin, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. IL-2 добавляли до конечной концентрации 20 Ед/мл и клетки снова культивировали в течение одних суток в той же культуральной среде, что и выше. Посредством истощения CD4+ Т-клеток и CD56+ NK клеток в соответствии со стандартными протоколами были обогащены CD8+ цитотоксические Т-лимфоциты (CTLs).
Клетки-мишени дважды промывали PBS и метили 11,1 МБк 51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С. Впоследствии меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в общем объеме 250 мкл дополненной RPMI (как выше) с соотношением Е:Т 10:1. Применяли 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 его трехкратных разведении. Время анализа составляло 18 часов и цитотоксичность измеряли по относительным значениям высвобожденного хрома в супернатанте по сравнению с максимальным лизисом (добавление Triton-X) и спонтанным лизисом (без эффекторных клеток). Все измерения проводили в четырех повторностях. Измерение активности хрома в супернатантах осуществляли с помощью гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Германия). Анализ экспериментальных данных осуществляли с применением Prism 5 для Windows (версия 5.01, GraphPad Software Inc., San Diego, California, США). Сигмоидальные кривые дозовой зависимости, как правило, имеют значения R2 более 0,90, как определено с помощью программного обеспечения. Значения EC50, рассчитанные на основе программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.2, все полученные конструкции биспецифических одноцепочечных антител с межвидовой специфичностью демонстрируют цитотоксическую активность против человеческих PSMA-положительных клеток-мишеней, индуцированных стимулированными человеческими CD4/CD56 обедненными РВМС.
Пример 3: Анализ связывания scFvs против различных клеточных линий
3.1. Экспрессия конструкций одноцепочечного антитела в E.coli
scFv молекулы ЕрСАМ 4-7 (WO 99/25818), PM74-G3, РМ52-Н3, РМ52-С3, РМ75-А10 и РМ91-В6 экспрессируются с использованием плазмиды pComb3H5BFlag/His, где экспрессирующие конструкции (например, scFv) включают Flag-метку (DYKDDDDK) и His6-метку. Плазмидную ДНК каждой scFv молекулы используют для трансформации 100 мкл обработанных тепловым шоком компетентных клеток E.coli TG1 и высевают на карбенициллин LB-агар. E.coli, трансформированные pComb3H5BFlag/His, содержащим VL- и VH-сегмент, продуцируют растворимые scFv в достаточных количествах после индукции 1 мМ IPTG (изопропилтиогалактозид). Благодаря подходящей сигнальной последовательности, scFv-цепь экспортируется в периплазму, где она сворачивается в функциональную конформацию.
Одиночные бактериальные колонии E.coli TG1 из планшетов для трансформации собирают для периплазаматических маломасштабных препаратов и выращивают в SB-среде (например, 10 мл), дополненной 20 мМ MgCl2 и 50 мкг/мл карбенициллина и перерастворяют в PBS (например, 1 мл) после сбора. После четырех раундов замораживания при -70°С и оттаивания при. 37°С, наружная. мембрана бактерий разрушается под действием температурного шока и растворимые периплазматические белки, включающие scFvs, высвобождаются в супернатант. После удаления интактных клеток и клеточного дебриса посредством центрифугирования собирают супернатант, содержащий анти-PSMA scFvs, и используют для определения связывания с различными клеточными линиями.
3.2. Анализ связывания конструкций одноцепочечных антител с различными клеточными линиями с помощью проточной цитометрии
Периплазматические препараты клонов Е.coli, продуцирующих scFv молекулы ЕрСАМ 4-7, PM74-G3, РМ52-Н3, РМ52-С3, РМ75-А10 и РМ91-В6, используют для анализа специфического связывания с клеточными линиями, трансфицированными человеческим PSMA или человеческим ЕрСАМ. В качестве отрицательного контроля используют нетрансфицированные клетки СНО.
Для проточной цитометрии 2,5×105 клеток инкубируют с 50 мкл scFv периплазматического препарата. Связывание scFv с клетками определяют с помощью анти-His антитела (Penta-His антитело, без БСА, Qiagen GmbH, Hilden, FRG) при 2 мкг/мл в 50 мкл PBS с 2% FCS. В качестве реагента второй стадии используют R-фикоэритрин-конъюгированный, аффинно очищенный F(ab’)2-фрагмент, козлиный антимышиный IgG (специфический в отношении Fc-гамма фрагмента), разведенный 1:100 в 50 мкл PBS с 2% FCS (Dianova, Hamburg, FRG). Образцы измеряют на FACSscan (BD biosciences, Heidelberg, FRG).
Проточную цитометрию осуществляют на аппарате FACS-Calibur; программное обеспечение CellQuest используют для получения и анализа данных (Becton Dickinson biosciences, Heidelberg). FACS окрашивание и измерение интенсивности флуоресценции проводят, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-lnterscience, 2002).
scFv EpCAM 4-7 продемонстрировало сильное связывание с клеточной линией СНО, трансфицированной человеческим EpCAM, но никакого значительного связывания с клетками, трансфицированными человеческим PSMA, и нетрансфицированными клетками. Напротив, scFvs PM74-G3, РМ52-Н3, РМ52-С3, РМ75-А10 и РМ91-В6 показали сильное связывание с клетками СНО, трансфицированными человеческим PSMA, но не с клетками, трансфицированными человеческим EpCAM, или нетрансфицированными клетками. (Результаты связывания периплазматических клеточных экстрактов соответствующих scFvs на различных трансфицированных клеточных линиях показаны в таблице 1).
| название | год | авторы | номер документа |
|---|---|---|---|
| PSMA×CD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2559531C2 |
| PSCAXCD3, CD19XCD3, C-METXCD3, ЭНДОСИАЛИНXCD3, EPCAMXCD3, IGF-1RXCD3 ИЛИ FAP-АЛЬФАXCD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2547600C2 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2008 |
|
RU2535992C2 |
| CD3-ЭПСИЛОН-СВЯЗЫВАЮЩИЙ ДОМЕН С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2008 |
|
RU2561457C2 |
| АНТИТЕЛО, НАЦЕЛИВАЮЩЕЕСЯ НА CD3, БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2808138C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С УСТОЙЧИВОСТЬЮ К РАСТВОРИМОМУ СЕА | 2006 |
|
RU2426743C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С УСТОЙЧИВОСТЬЮ К РАСТВОРИМОМУ СЕА | 2010 |
|
RU2573893C2 |
| НОВОЕ PSMA-СВЯЗЫВАЮЩЕЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЯ | 2017 |
|
RU2762704C2 |
| АНТИТЕЛА К LY6G6D И СПОСОБЫ ПРИМЕНЕНИЯ | 2020 |
|
RU2818569C1 |
| ПРИМЕНЕНИЕ БИСПЕЦИФИЧЕСКИХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ, КОТОРЫЕ СВЯЗЫВАЮТ PSMA И CD3, В КОМБИНАЦИИ С КОСТИМУЛЯЦИЕЙ 4-1BB | 2020 |
|
RU2822092C2 |















































































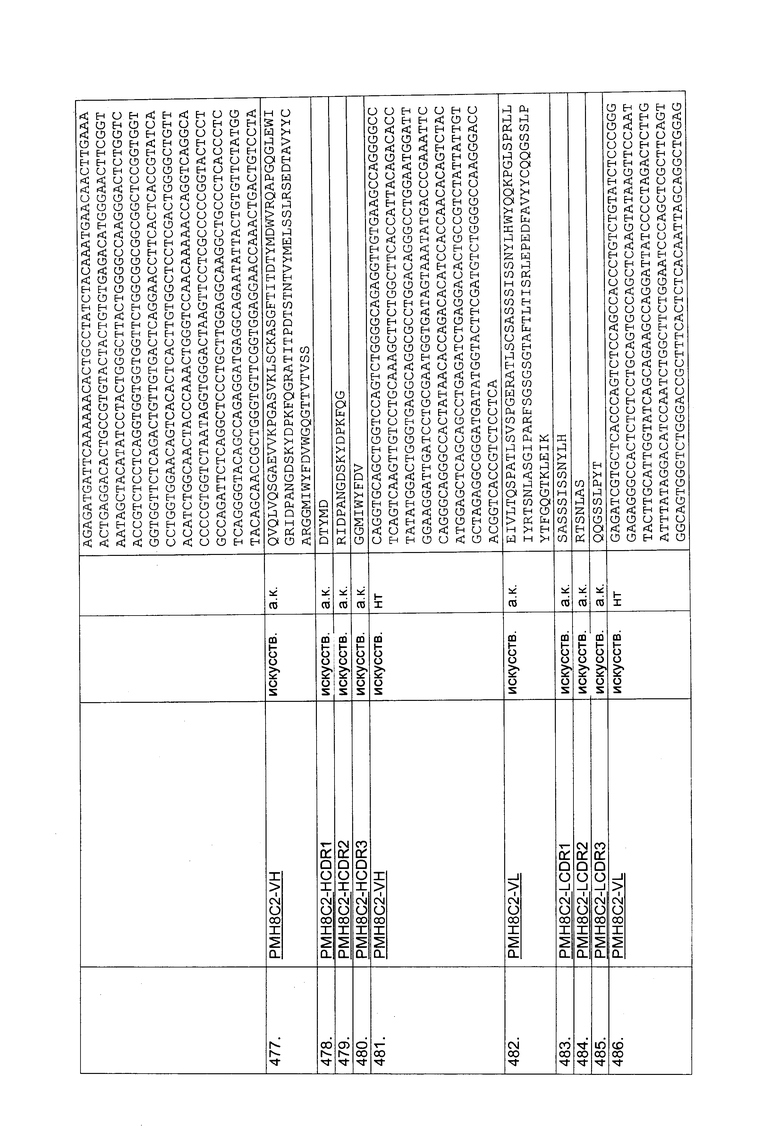
























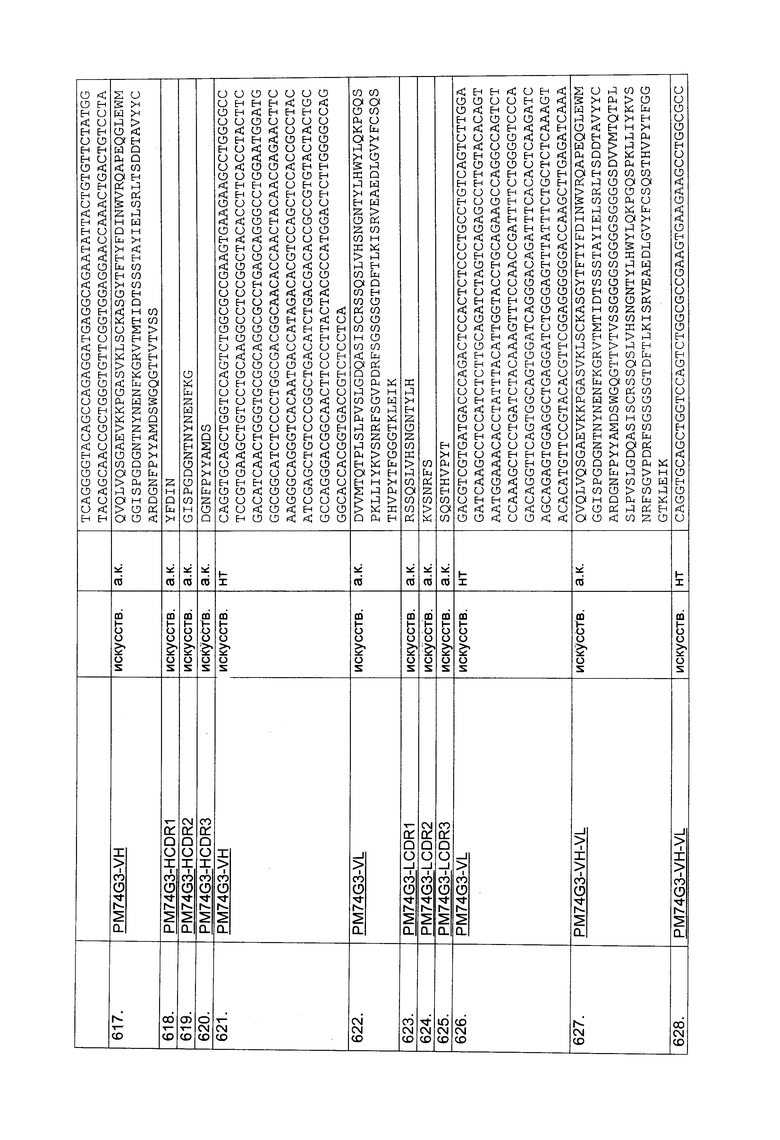




































































































































































































































































































































Данное изобретение относится к области биотехнологии. Предложена молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, способный связываться с эпитопом CD3ε (эпсилон)-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), где указанный эпитоп содержит по меньшей мере аминокислотную последовательность Gln-Asp-Gly-Asn-Glu (QDGNE), и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA) человека и яванского макака. Кроме того, описаны нуклеиновая кислота, кодирующая молекулу биспецифического одноцепочечного антитела, клетка-хозяин и способ получения молекулы биспецифического одноцепочечного антитела по изобретению. Также рассмотрены фармацевтическая композиция для предупреждения, лечения или облегчения рака, ассоциированного с экспрессией PSMA, и применение молекулы биспецифического одноцепочечного антитела для изготовления такой фармацевтической композиции. Данное изобретение может найти дальнейшее применение в терапии заболеваний, ассоциированных с PSMA. 6 н. и 10 з.п. ф-лы, 2 ил., 1 табл., 3 пр.
1. Молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, который представляет собой сайт взаимодействия с антигеном, способный связываться с эпитопом CD3ε (эпсилон)-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), где указанный эпитоп представляет собой часть аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO: 2, 4, 6 или 8, и содержит по меньшей мере аминокислотную последовательность Gln-Asp-Gly-Asn-Glu (QDGNE), и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA) человека и яванского макака, где указанная молекула биспецифического одноцепочечного антитела содержит группу следующих последовательностей, в качестве CDR Н1, CDR Н2, CDR Н3, CDR L1, CDR L2 и CDR L3, во втором связывающем домене, выбранную из:
а) CDR Н1-3 из SEQ ID NO: 226-228 и CDR L1-3 из SEQ ID NO: 231-233;
б) CDR H1-3 из SEQ ID NO: 240-242 и CDR L1-3 из SEQ ID NO: 245-247;
в) CDR H1-3 из SEQ ID NO: 254-256 и CDR L1-3 из SEQ ID NO: 259-261;
г) CDR H1-3 из SEQ ID NO: 268-270 и CDR L1-3 из SEQ ID NO: 273-275;
д) CDR H1-3 из SEQ ID NO: 618-620 и CDR L1-3 из SEQ ID NO: 623-625;
е) CDR H1-3 из SEQ ID NO: 282-284 и CDR L1-3 из SEQ ID NO: 287-289;
ж) CDR H1-3 из SEQ ID NO: 296-298 и CDR L1-3 из SEQ ID NO: 301-303;
з) CDR H1-3 из SEQ ID NO: 310-312 и CDR L1-3 из SEQ ID NO: 315-317;
и) CDR H1-3 из SEQ ID NO: 324-326 и CDR L1-3 из SEQ ID NO: 329-331;
к) CDR H1-3 из SEQ ID NO: 338-340 и CDR L1-3 из SEQ ID NO: 343-345;
л) CDR H1-3 из SEQ ID NO: 352-354 и CDR L1-3 из SEQ ID NO: 357-359;
м) CDR H1-3 из SEQ ID NO: 366-368 и CDR L1-3 из SEQ ID NO: 371-373;
н) CDR H1-3 из SEQ ID NO: 380-382 и CDR L1-3 из SEQ ID NO: 385-387;
о) CDR H1-3 из SEQ ID NO: 394-396 и CDR L1-3 из SEQ ID NO: 399-401;
п) CDR H1-3 из SEQ ID NO: 408-410 и CDR L1-3 из SEQ ID NO: 413-415;
р) CDR H1-3 из SEQ ID NO: 422-424 и CDR L1-3 из SEQ ID NO: 427-429;
с) CDR H1-3 из SEQ ID NO: 436-438 и CDR L1-3 из SEQ ID NO: 441-443;
т) CDR H1-3 из SEQ ID NO: 450-452 и CDR L1-3 из SEQ ID NO: 455-457;
у) CDR Н1-3 из SEQ ID NO: 464-466 и CDR L1-3 из SEQ ID NO: 469-471;
ф) CDR H1-3 из SEQ ID NO: 478-480 и CDR L1-3 из SEQ ID NO: 483-485;
х) CDR H1-3 из SEQ ID NO: 492-494 и CDR L1-3 из SEQ ID NO: 497-499;
ц) CDR H1-3 из SEQ ID NO: 506-508 и CDR L1-3 из SEQ ID NO: 511-513;
ч) CDR H1-3 из SEQ ID NO: 520-522 и CDR L1-3 из SEQ ID NO: 525-527;
ш) CDR H1-3 из SEQ ID NO: 534-536 и CDR L1-3 из SEQ ID NO: 539-541;
щ) CDR H1-3 из SEQ ID NO: 548-550 и CDR L1-3 из SEQ ID NO: 553-555;
ы) CDR H1-3 из SEQ ID NO: 562-564 и CDR L1-3 из SEQ ID NO: 567-569;
э) CDR H1-3 из SEQ ID NO: 576-578 и CDR L1-3 из SEQ ID NO: 581-583;
ю) CDR H1-3 из SEQ ID NO: 590-592 и CDR L1-3 из SEQ ID NO: 595-597; и
я) CDR H1-3 из SEQ ID NO: 604-606 и CDR L1-3 из SEQ ID NO: 609-611.
2. Молекула биспецифического одноцепочечного антитела по п.1, где первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), содержит VL-область, содержащую CDR-L1, CDR-L2 и CDR-L3, выбранную из:
(а) CDR-L1, как представлено в SEQ ID NO: 27, CDR-L2, как представлено в SEQ ID NO: 28, и CDR-L3, как представлено в SEQ ID NO: 29;
(б) CDR-L1, как представлено в SEQ ID NO: 117, CDR-L2, как представлено в SEQ ID NO: 118, и CDR-L3, как представлено в SEQ ID NO: 119; и
(в) CDR-L1, как представлено в SEQ ID NO: 153, CDR-L2, как представлено в SEQ ID NO: 154, и CDR-L3, как представлено в SEQ ID NO: 155.
3. Молекула биспецифического одноцепочечного антитела по п.1, где первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), содержит VH-область, содержащую CDR-H1, CDR-H2 и CDR-H3, выбранную из:
(а) CDR-H1, как представлено в SEQ ID NO: 12, CDR-H2, как представлено в SEQ ID NO: 13, и CDR-H3, как представлено в SEQ ID NO: 14;
(б) CDR-H1, как представлено в SEQ ID NO: 30, CDR-H2, как представлено в SEQ ID NO: 31, и CDR-H3, как представлено в SEQ ID NO: 32;
(в) CDR-H1, как представлено в SEQ ID NO: 48, CDR-H2, как представлено в SEQ ID NO: 49, и CDR-H3, как представлено в SEQ ID NO: 50;
(г) CDR-H1, как представлено в SEQ ID NO: 66, CDR-H2, как представлено в SEQ ID NO: 67, и CDR-H3, как представлено в SEQ ID NO: 68;
(д) CDR-H1, как представлено в SEQ ID NO: 84, CDR-H2, как представлено в SEQ ID NO: 85, и CDR-H3, как представлено в SEQ ID NO: 86;
(е) CDR-H1, как представлено в SEQ ID NO: 102, CDR-H2, как представлено в SEQ ID NO: 103, и CDR-H3, как представлено в SEQ ID NO: 104;
(ж) CDR-H1, как представлено в SEQ ID NO: 120, CDR-H2, как представлено в SEQ ID NO: 121, и CDR-H3, как представлено в SEQ ID NO: 122;
(з) CDR-H1, как представлено в SEQ ID NO: 138, CDR-H2, как представлено в SEQ ID NO: 139, и CDR-H3, как представлено в SEQ ID NO: 140;
(и) CDR-H1, как представлено в SEQ ID NO: 156, CDR-H2, как представлено в SEQ ID NO: 157, и CDR-H3, как представлено в SEQ ID NO: 158; и
(к) CDR-H1, как представлено в SEQ ID NO: 174, CDR-H2, как представлено в SEQ ID NO: 175, и CDR-H3, как представлено в SEQ ID NO: 176.
4. Молекула биспецифического одноцепочечного антитела по п.1, где первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), содержит VL-область, выбранную из группы, состоящей из VL-области, как представлено в SEQ ID NO: 35, 39, 125, 129, 161 или 165.
5. Молекула биспецифического одноцепочечного антитела по п.1, где первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), содержит VH-область, выбранную из группы, состоящей из VH-области, как представлено в SEQ ID NO: 15, 19, 33, 37, 51, 55, 69, 73, 87, 91, 105, 109, 123, 127, 141, 145, 159, 163, 177 или 181.
6. Молекула биспецифического одноцепочечного антитела по п.1, где первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), содержит VL-область и VH-область, выбранные из группы, состоящей из:
(а) VL-область, как представлено в SEQ ID NO: 17 или 21, и VH-область, как представлено в SEQ ID NO: 15 или 19;
(б) VL-область, как представлено в SEQ ID NO: 35 или 39, и VH-область, как представлено в SEQ ID NO: 33 или 37;
(в) VL-область, как представлено в SEQ ID NO: 53 или 57, и VH-область, как представлено в SEQ ID NO: 51 или 55;
(г) VL-область, как представлено в SEQ ID NO: 71 или 75, и VH-область, как представлено в SEQ ID NO: 69 или 73;
(д) VL-область, как представлено в SEQ ID NO: 89 или 93, и VH-область, как представлено в SEQ ID NO: 87 или 91;
(ж) VL-область, как представлено в SEQ ID NO: 107 или 111, и VH-область, как представлено в SEQ ID NO: 105 или 109;
(з) VL-область, как представлено в SEQ ID NO: 125 или 129, и VH-область, как представлено в SEQ ID NO: 123 или 127;
(и) VL-область, как представлено в SEQ ID NO: 143 или 147, и VH-область, как представлено в SEQ ID NO: 141 или 145;
(к) VL-область, как представлено в SEQ ID NO: 161 или 165, и VH-область, как представлено в SEQ ID NO: 159 или 163; и
(л) VL-область, как представлено в SEQ ID NO: 179 или 183, и VH-область, как представлено в SEQ ID NO: 177 или 181.
7. Молекула биспецифического одноцепочечного антитела по п.6, где первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinis oedipus) или обыкновенной беличьей обезьяны (Saimiri sciureus), содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, 25, 41, 43, 59, 61, 77, 79, 95, 97, 113, 115, 131, 133, 149, 151, 167, 169, 185 или 187.
8. Молекула биспецифического одноцепочечного антитела по п.1, которая содержит последовательность, выбранную из:
(а) аминокислотной последовательности, как представлено в любой из SEQ ID NO: 237, 251, 265, 279, 629, 293, 307, 321, 335, 349, 363, 377, 391, 405, 419, 433, 447, 461, 475, 489, 503, 517, 531, 545, 559, 573, 587, 601 или 615; и
(б) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, как представлено в любой из SEQ ID NO: 238, 252, 266, 280, 630, 294, 308, 322, 336, 350, 364, 378, 392, 406, 420, 434, 448, 462, 476, 490, 504, 518, 532, 546, 560, 574, 588, 602 или 616.
9. Молекула биспецифического одноцепочечного антитела по любому из пп.1-8, где биспецифическое одноцепочечное антитело содержит метку, предпочтительно С-концевую His-метку.
10. Нуклеиновая кислота, кодирующая молекулу биспецифического одноцепочечного антитела по любому из пп.1-9.
11. Клетка-хозяин для получения молекулы биспецифического одноцепочечного антитела по любому из пп.1-9, трансформированная или трансфицированная вектором, содержащим нуклеиновую кислоту по п.10.
12. Способ получения молекулы биспецифического одноцепочечного антитела по любому из пп.1-9, включающий культивирование клетки-хозяина по п.11 в условиях, обеспечивающих экспрессию молекулы биспецифического одноцепочечного антитела по любому из пп.1-9, и выделение продуцируемого полипептида из культуры.
13. Фармацевтическая композиция для предупреждения, лечения или облегчения рака, ассоциированного с экспрессией PSMA, содержащая молекулу биспецифического одноцепочечного антитела по любому из пп.1-9.
14. Применение молекулы биспецифического одноцепочечного антитела по любому из пп.1-9 для изготовления фармацевтической композиции для предупреждения, лечения или облегчения рака, ассоциированного с экспрессией PSMA.
15. Применение по п.14, где указанный рак представляет собой солидную опухоль, предпочтительно карциному или рак предстательной железы.
16. Применение по п.14 или 15, где указанную фармацевтическую композицию вводят в комбинации с дополнительным лекарственным средством.
| BÜHLER P | |||
| et al., "A bispecific diabody directed against prostate-specific membrane antigen and CD3 induces T-cell mediated lysis of prostate cancer cells", Cancer Immunology, Immunotherapy, 2008; 57(1): 43-52 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| WOLF E | |||
| et al., "BiTEs: bispecific antibody constructs with unique anti-tumor activity", Drug discovery today, 2005, 10(18):1237-1244 | |||
| PORTOLES P | |||
| et al., "Monoclonal antibodies to murine CD3 ε define distinct epitopes, one of which may interact with CD4 during T cell activation", J Immunology, 1989; 142(12): 4169-4175 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2017-04-28—Публикация
2011-04-01—Подача