Данная заявка заявляет преимущество предварительных заявок США № 60/758701, поданной 13 января 2006, и 60/850145, поданной 6 октября 2006.
Данное изобретение относится, несомненно, к новым 6-(полизамещенный арил)-4-аминопиколинатам и их производным и к применению этих соединений в качестве гербицидов.
В данной области техники описан ряд пиколиновых кислот и их пестицидные свойства. В Патенте США 6784137 В2 описан ряд 6-арил-4-аминопиколиновых кислот и их производных, а также их применение в качестве гербицидов. В настоящее время обнаружено, что определенные отдельные подклассы ряда соединений, описанных в «137», имеют значительно улучшенные гербицидную активность и селективность.
В настоящее время обнаружено, что определенные 6-(полизамещенный арил)-4-аминопиколиновые кислоты и их производные являются превосходными гербицидами с широким спектром борьбы с сорняками, травами и осокой, также как с лиственными породами и с превосходной селективностью по отношению к сельскохозяйственным культурам. Данные соединения, кроме того, обладают превосходными токсикологическими и экологическими показателями.
Данное изобретение относится к соединениям формулы I:
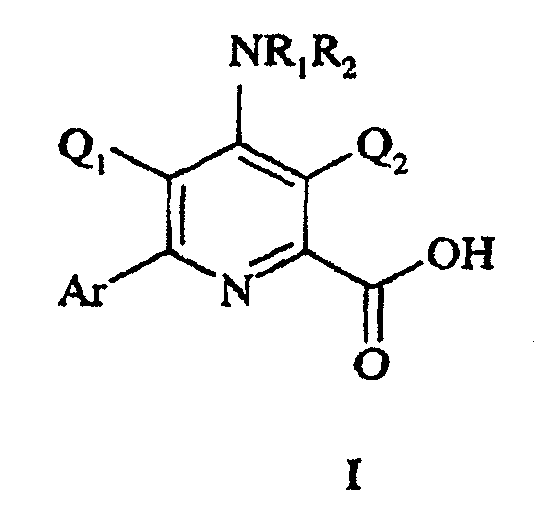
в которой
Q1 представляет H или F;
Q2 представляет галоген при условии, что когда Q1 представляет Н, Q2 представляет Cl или Br;
R1 и R2 независимо представляют Н, С1-С6-алкил, С3-С6-алкенил, С3-С6-алкинил, гидрокси, С1-С6-алкокси, амино, С1-С6-ацил, С1-С6-карбоалкокси, С1-С6-алкилкарбамил, С1-С6-алкилсульфонил, С1-С6-триалкилсилил или С1-С6-диалкилфосфонил или R1 и R2, взятые вместе с N, представляют 5- или 6-членное насыщенное кольцо; и
Ar представляет полизамещенную арильную группу, выбранную из группы, состоящей из
а)
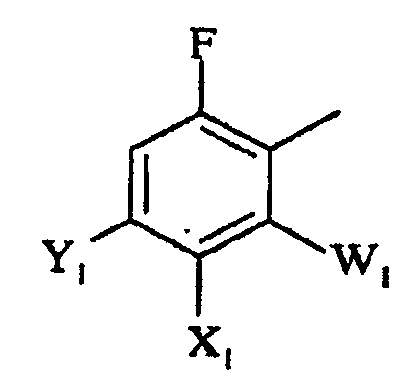
в которой
W1 представляет галоген;
X1 представляет F, Cl, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С1-С4-галогеналкокси, С1-С4-алкоксизамещенный С1-С4-алкил, С1-С4-алкоксизамещенный С1-С4-алкокси, -CN, -NR3R4 или фторированный ацетил или пропионил;
Y1 представляет С1-С4-алкил, С1-С4-галогеналкил, галоген или -CN, или, когда X1 и Y1 взяты вместе, представляет -O(CH2)nO-, где n =1 или 2; и
R3 и R4 независимо представляют H или С1-С4-алкил;
b)
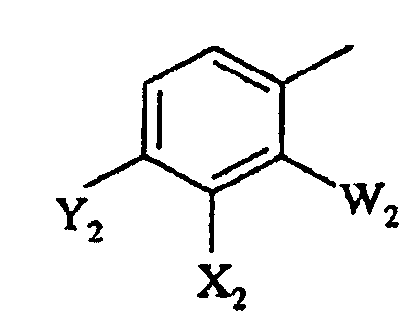
в которой
W2 представляет F или Cl;
X2 представляет F, Cl, -CN, -NO2, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С1-С4-галогеналкокси, С1-С4-алкоксизамещенный С1-С4-алкил, С1-С4-алкоксизамещенный С1-С4-алкокси, -NR3R4 или фторированный ацетил или пропионил;
Y2 представляет галоген, С1-С4-алкил, С1-С4-галогеналкил или -CN, или когда W2 представляет F, X2 и Y2, взятые вместе, представляет -O(CH2)nO-, где n =1 или 2; и
R3 и R4 независимо представляют H или С1-С6-алкил; и
с)
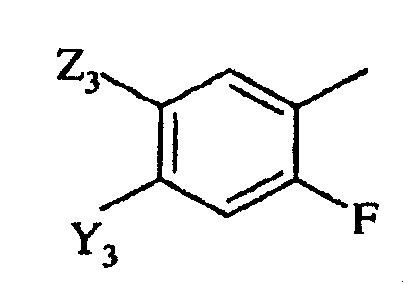
в которой
Y3 представляет галоген, -CN или CF3;
Z3 представляет F, Cl, -CN, -NO2, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С1-С4-галогеналкокси, С1-С4-алкоксизамещенный С1-С4-алкил, С1-С4-алкоксизамещенный С1-С4-алкокси, -NR3R4 или фторированный ацетил или пропионил; и
R3 и R4 независимо представляют H или С1-С6-алкил; и
пригодным в сельском хозяйстве производным по карбоксильной группе.
Независимо предпочтительны соединения формулы I, где Y1, Y2 и Y3 представляют Cl, Br или CF3, где W1 и W2 представляют Cl или F; где X1 или X2 представляют С1-С4-алкокси, С1-С4-тиоалкокси, С1-С4-галогеналкил или -NR3R4 и где Z представляет С1-С4-алкокси, С1-С4-тиоалкокси, С1-С4-галогеналкил или -NR3R4.
Данное изобретение относится к гербицидным композициям, содержащим эффективное в качестве гербицида количество соединения формулы I, и пригодным в сельском хозяйстве производным по карбоксильной группе в смеси с пригодным в сельском хозяйстве вспомогательным веществом или носителем. Изобретение также относится к способу применения соединений и композиций настоящего изобретения, чтобы уничтожать или бороться с нежелательными растениями с помощью применения эффективного в качестве гербицида количества соединения на растениях или на площади, занимаемой растениями, также как на почве до появления растений. Изобретение, кроме того, относится к промежуточным соединениям для приготовления соединений.
Соединения настоящего изобретения, обладающие гербицидной активностью, являются производными 4-аминопиколиновых кислот формулы II:
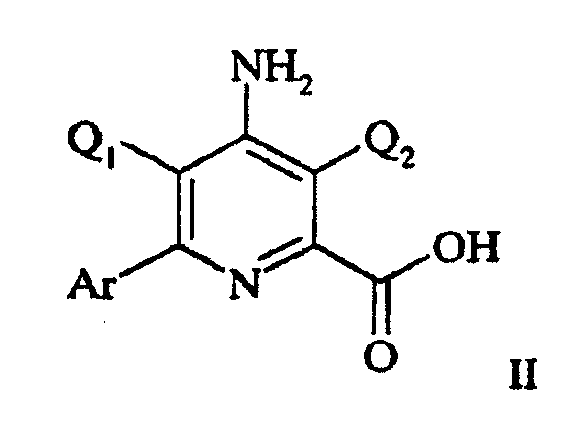
в которой
Q1 представляет H или F;
Q2 представляет галоген при условии, что когда Q1 представляет Н, Q2 представляет Cl или Br; и
Ar представляет полизамещенную арильную группу, выбранную из группы, состоящей из
а)
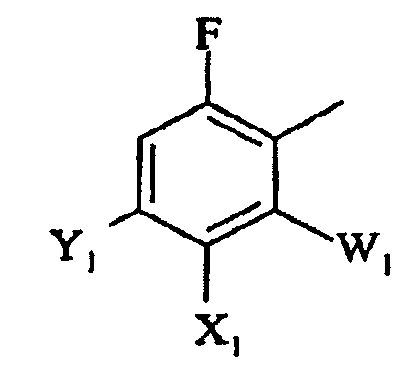
в которой
W1 представляет галоген;
X1 представляет F, Cl, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С1-С4-галогеналкокси, С1-С4-алкоксизамещенный С1-С4-алкил, С1-С4-алкоксизамещенный С1-С4-алкокси, -CN, -NR3R4, фторированный ацетил или пропионил;
Y1 представляет С1-С4-алкил, С1-С4-галогеналкил, галоген или -CN, или, когда X1 и Y1, взяты вместе, представляет -O(CH2)nO-, где n = 1 или 2; и
R3 и R4 независимо представляют H или С1-С4-алкил;
b)
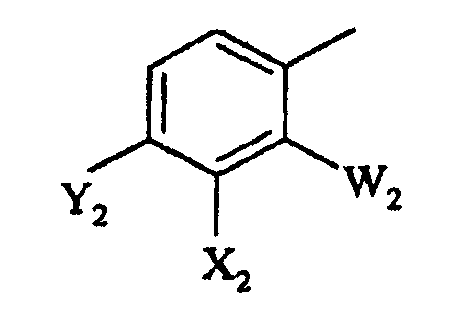
в которой
W2 представляет F или Cl;
X2 представляет F, Cl, -CN, -NO2, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С1-С4-галогеналкокси, С1-С4-алкоксизамещенный С1-С4-алкил, С1-С4-алкоксизамещенный С1-С4-алкокси, -NR3R4, фторированный ацетил или пропионил;
Y2 представляет галоген, С1-С4-алкил, С1-С4-галогеналкил или -CN, или когда W2 представляет F, X2 и Y2, взятые вместе, представляют -O(CH2)nO-, где n = 1 или 2; и
R3 и R4 независимо представляют H или С1-С6-алкил; и
с)
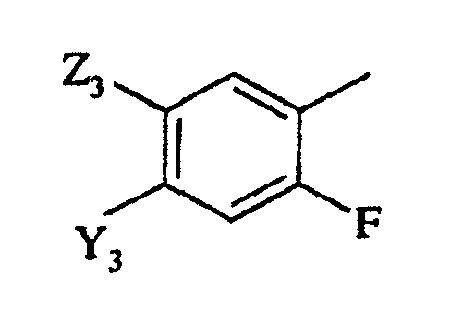
в которой
Y3 представляет галоген, -CN или CF3;
Z3 представляет F, Cl, -CN, -NO2, С1-С4-алкил, С1-С4-алкокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, С1-С4-галогеналкил, С1-С4-галогеналкокси, С1-С4-алкоксизамещенный С1-С4-алкил, С1-С4-алкоксизамещенный С1-С4-алкокси, -NR3R4, фторированный ацетил или пропионил; и
R3 и R4 независимо представляют H или С1-С6-алкил.
Эти соединения характеризуются тем, что имеют Cl или F в 3-положении, H или F в 5-положении и три- или тетразамещенную арильную группу в 6-положении пиридинового кольца. В основном предпочтительны соединения, в которых в 3-положении находится Cl и в 5-положении находится H. Предпочтительные замещенные арильные группы включают 2,3,4-тризамещенные, 2-фтор-4,5-тризамещенные и 2-фтор-4,5,6-тетразамещенные фенильные группы. Особенно предпочтительные замещенные арильные группы включают такие, в которых Y1, Y2 и Y3 представляют Cl, Br или CF3, в которых W1 и W2 представляют Cl или F; в которых X1 или X2 представляют С1-С4-алкокси, С1-С4-тиоалкокси, С1-С4-галогеналкил или -NR3R4 и в которых Z представляет С1-С4-алкокси, С1-С4-тиоалкокси, С1-С4-галогеналкил или -NR3R4.
Аминогруппа в 4-положении пиридинового кольца может быть незамещенной или замещенной одним или более С1-С6-алкил, С3-С6-алкенил, С3-С6-алкинил, гидрокси, С1-С6-алкокси или аминозаместителями. Аминогруппа, кроме того, может быть преобразована в амид, карбамат, мочевину, сульфаниламид, силиламин или фосфорамидат. Такие соединения способны расщепляться до амина. Незамещенная аминогруппа предпочтительна.
Считают, что карбоновые кислоты формулы I являются соединениями, которые действительно уничтожают или осуществляют борьбу с нежелательными растениями, и они обычно предпочтительны. Аналоги этих соединений, в которых карбоксильная группа пиколиновой кислоты преобразована так, чтобы образовать группу, которая может быть трансформирована в растениях или окружающей среде в карбоксильную группу, обладают по существу таким же гербицидным действием и включены в объем данного изобретения. Следовательно, пригодное в сельском хозяйстве производное, при использовании, чтобы описать карбоксильную функцию во 2-положении, определяют как любую соль, эфир, ацилгидразид, имидат, тиоимидат, амидин, амид, ортоэфир, ацилцианид, ацилгалогенид, тиоэфир, эфир тионовой кислоты, тиоэфир тионовой кислоты, нитрил или любое другое хорошо известное в данной области техники производное кислоты, которое (а) не влияет значительно на гербицидную активность активного ингредиента, т.е. 6-арил-4-аминопиколиновой кислоты, и (b) гидролизуется (или может гидролизоваться), окисляется (или может быть окислено), метаболизируется (или может быть метаболизировано) в растениях или почве до пиколиновой кислоты формулы I, которая, в зависимости от pH, находится в диссоциированной или не диссоциированной форме. Предпочтительными пригодными в сельском хозяйстве производными карбоновой кислоты являются пригодные в сельском хозяйстве соли, эфиры и амиды. Точно так же пригодное в сельском хозяйстве производное, при использовании, чтобы описать аминофункцию в 4-положении, определяют как любую соль, силиламин, фосфориламин, фосфинимин, фосфорамидат, сульфонамид, сульфилимин, сульфоксимин, аминал, гемиаминал, амид, тиоамид, карбамат, тиокарбамат, амидин, мочевина, имин, нитро, нитрозо, азид или любое другое хорошо известное в данной области техники азотсодержащее производное, которое (а) не влияет значительно на гербицидную активность активного ингредиента, т.е. 6-арил-4-аминопиколиновой кислоты, и (b) гидролизуется (или может гидролизоваться) в растениях или почве до свободного амина формулы II. N-Оксиды, которые также способны расщепляться до исходного пиколина формулы II, также входят в объем данного изобретения.
Подходящие соли включают производные щелочных и щелочноземельных металлов и производные аммиака и аминов. Предпочтительные катионы включают натрий, калий, магний и катионы аминия формулы:
R 5 R 6 R 7 NH + ,
в которой каждый R5, R6 и R7 независимо представляет водород или C1-C12-алкил, C3-C12-алкенил или C3-C12-алкинил, каждый из которых, необязательно, замещен одной или более гидрокси, C1-C4-алкокси, C1-C4-алкилтио или фенильной группой, при условии, если R5, R6 и R7 стерически совместимы. Дополнительно, любые две из R5, R6 и R7 вместе могут представлять алифатическую бифункциональную группу, содержащую 1-12 атомов углерода и вплоть до двух атомов кислорода или серы. Соли соединений формулы I можно приготовить обработкой соединения формулы I гидроксидом металла, таким как гидроксид натрия или амином, таким как аммиак, триметиламин, диэтаноламин, 2-метилтиопропиламин, бисаллиламин, 2-бутоксиэтиламин, морфолин, циклододециламин или бензиламин. Соли аминов часто являются предпочтительными формами соединений формулы I, потому что они растворяются в воде и пригодны для приготовления необходимых водных основных гербицидных составов.
Подходящие сложные эфиры включают производные C1-C12-алкиловых, C3-C12-алкениловых или C3-C12-алкиниловых спиртов, таких как метанол, изопропанол, бутанол, 2-этилгексанол, бутоксиэтанол, метоксипропанол, аллиловый спирт, пропаргиловый спирт и циклогексанол. Сложные эфиры можно приготовить с помощью конденсации пиколиновой кислоты со спиртом, используя любое число подходящих активирующих агентов, таких как такие, что используются в пептидной конденсации, такие как дициклогексилкарбодиимид (DCC) или карбонилдиимидазол (CDI), реакцией соответствующего хлорангидрида пиколиновой кислоты формулы I с подходящим спиртом или реакцией соответствующей пиколиновой кислоты формулы I с подходящим спиртом в присутствии кислого катализатора. Подходящие амиды включают производные аммиака или C1-C12-алкил, C3-C12-алкенил или C3-C12-алкинил моно- или дизамещенных аминов, такие как, но не ограничиваются ими, диметиламин, диэтаноламин, 2-метилтиопропиламин, бисаллиламин, 2-бутоксиэтиламин, циклододециламин, бензиламин или циклические или ароматические амины с или без дополнительных гетероатомов, такие как, но не ограничиваются ими, азиридин, азетидин, пирролидин, пиррол, имидазол, тетразол или морфолин. Амиды можно приготовить реакцией соответствующего хлорангидрида пиколиновой кислоты, смешанного ангидрида или эфира карбоновой кислоты формулы I с аммиаком или подходящим амином.
Термины «алкил», «алкенил» и «алкинил», также как производные от них термины «алкокси», «ацил», «алкилтио» и «алкилсульфонил», как используется в описании данного изобретения, включают в себя разветвленные, неразветвленные цепи и циклические части. Термины «алкенил» и «алкинил» включают одну или более ненасыщенных связей.
Термин «арил», также как производные термины, такие как «арилокси», относится к фенилу.
Если не указаны особые ограничения, термин «галоген», включающий производные термины, такие как «гало», относится к фтору, хлору, брому и йоду. Термины «галогеналкил» или «галогеналкокси» относятся к алкильным или алкокси группам, замещенным от одного до максимально возможного количества атомов галогена.
Соединения формулы I можно получить, используя хорошо известные химические методики. Необходимые исходные вещества имеются в продаже или их легко синтезировать, используя стандартные методики.
6-замещенные арилпиколины формулы I можно приготовить рядом способов, которые хорошо известны в данной области техники, например, реакцией подходящего замещенного пиридина с легко уходящей группой в 6-положении (III) c металлоорганическим соединением типа (IV) в инертном растворителе в присутствии катализатора - переходного металла.
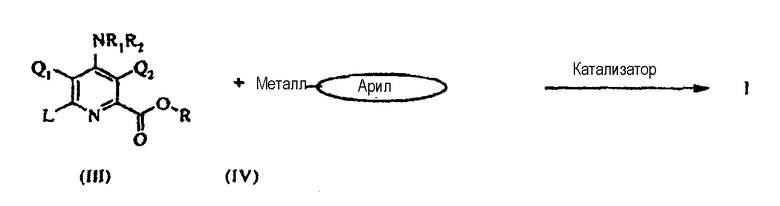
В этом случае «L» может быть хлором, бромом, йодом или трифторметансульфонатом, «металлом» может быть Mg-галоген, Zn-галоген, олово(C1-C4-алкил)3, литий, медь или B(OR8)(OR9), в котором R8 и R9 независимо друг от друга представляют водород, C1-C4-алкил или, взятые вместе, образуют этиленовую или пропиленовую группу, и «катализатором» является катализатор - переходный металл, в частности палладиевый катализатор, такой как диацетат палладия, бис(трифенилфосфин)дихлорид палладия (II) или никелевый катализатор, такой как ацетилацетонат никеля (II), бис(трифенилфосфин)хлорид никеля (II).
Альтернативно, соединения формулы I можно приготовить реакцией подходящего замещенного 6-металзамещенного пиридина (V) с арильным соединением типа (VI) в инертном растворителе в присутствии катализатора - переходного металла.
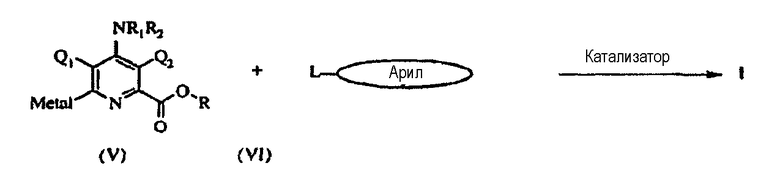
В этом случае «L» может быть хлором, бромом, йодом или трифторметансульфонатом, «металлом» может быть Mg-галоген, Zn-галоген, олово(C1-C4-алкил)3, литий, медь или B(OR8)(OR9), в котором R8 и R9 независимо друг от друга представляют водород, C1-C4-алкил или, взятые вместе, образуют этиленовую или пропиленовую группу, и «катализатором» является катализатор - переходный металл, в частности палладиевый катализатор, такой как диацетат палладия, бис(трифенилфосфин)дихлорид палладия (II) или никелевый катализатор, такой как ацетилацетонат никеля (II), бис(трифенилфосфин)хлорид никеля (II).
Реакции с бороновыми кислотами или эфирами хорошо известны и представлены следующими ссылками:
(1) W.J. Thompson and J. Gaudino, J. Org. Chem., 49, 5223 (1984);
(2) S. Gronowitz and K. Lawitz, Chem. Ser., 24, 5 (1984);
(3) S. Gronowitz et al., Chem. Ser., 26, 305 (1986);
(4) J. Stavenuiter et al., Heterocycles, 26, 2711 (1987);
(5) V. Snieckus et al., Tetrahedron Letters, 28, 5093 (1987);
(6) V. Snieckus et al., Tetrahedron Letters, 29, 2135 (1988);
(7) M.B. Mitchell et al., Tetrahedron Letters, 32, 2273 (1991); Tetrahedron, 48, 8117 (1992);
(8) JP-A 93/301870.
Реакции с соединениями Гриньяра (металл - Mg-галоген):
(9) L.N. Pridgen, J. Heterocyclic Chem., 12, 443 (1975);
(10) M. Kumada et al., Tetrahedron Letters, 21, 845 (1980);
(11) A. Minato et al., J. Chem. Soc. Chem. Commun., 5319 (1984).
Реакция с цинкорганическими соединениями (металл - Zn-галоген):
(12) A. S. Bell et al., Synthesis, 843 (1987);
(13) A.S. Bell et al., Tetrahedron Letters, 29, 5013 (1988);
(14) J.W. Tilley and S. Zawoiski, J. Org. Chem., 53, 386 (1988); см. также (9).
Реакции с оловоорганическими соединениями (метал - Sn(C1-C4-алкил)3):
(15) T.R. Bailey et al., Tetrahedron Letters, 27, 4407 (1986);
(16) Y.Yamamoto et al., Synthesis, 564 (1986); см. Также (6).
Конденсация III+IV или V+VI может, по необходимости, сопровождаться реакциями на любом кольце, чтобы получить дополнительные производные соединений формулы I.
Подходящие замещенные пиридины формулы III, в которой L является хлором, бромом, йодом или трифторметансульфонатом, можно легко получить хорошо известными способами; смотри WO 0151468. Например, 6-бром аналоги можно приготовить восстановлением нескольких ключевых промежуточных соединений, например, соответствующих 6-бром-4-азидо, 6-бром-4-нитро и N-оксидо-6-бром-4-нитропиридиновых аналогов. Эти промежуточные соединения, в свою очередь, можно приготовить как нуклеофильным замещением в 6-бромо-4-галогеновых аналогах с помощью NaN3, так и электрофильным нитрованием соответствующих N-оксидо-6-бромпиридинов. Альтернативно, такие аналоги можно приготовить прямым аминированием соответствующих 4,6-дибром аналогов.
4-N-амидные, карбаматные, карбамидные, сульфонамидные, силиламинные и фосфорамидатамино производные можно приготовить реакцией свободной аминогруппы, например, с подходящим хлорангидридом кислоты, хлорформиатом, карбамилхлоридом, сульфонилхлоридом, силилхлоридом или хлорфосфатом.
Замещенные 4-амино аналоги можно приготовить реакцией соответствующего 4-галогенпиридин-2-карбоксилата или любого другого способного к замещению 4-замещенного соединения с замещенным амином.
Соединения формулы I, полученные любым из этих способов, можно восстановить общепринятыми способами. Обычно, реакционную смесь подкисляют водной кислотой, такой как соляная кислота и экстрагируют органическим растворителем, таким как этилацетат или метиленхлорид. Органический растворитель и другие летучие компоненты можно удалить перегонкой или выпариванием, чтобы получить необходимое соединение формулы I, которое можно очищать с помощью стандартных методик, таких как перекристаллизация или хроматография.
Найдено, что соединения формулы I пригодны в качестве гербицидов до и после появления всходов вредных растений. Их можно использовать с неселективными (более высокими) дозами внесения, чтобы бороться с широким спектром растений на площади применения, или с более низкими дозами внесения, чтобы селективно контролировать вредные растения. Площадь применения включает выгоны и пастбища, придорожные полосы и трассы, силовые линии и промышленные зоны, где желательна борьба с вредными растениями. Другим использованием является борьба с вредными растениями при выращивании сельскохозяйственных культур, таких как кукуруза, рис и зерновые культуры. Их можно также использовать, чтобы бороться с вредными растениями при выращивании древесных культур, таких как цитрусовые растения, яблони, каучуковое дерево, масличная пальма, лесов и других. Обычно предпочтительно применять соединения после появления всходов вредных растений. Кроме того, обычно предпочтительно использовать соединения, чтобы бороться с широким спектром древесных растений, лиственных пород, сорняков и осокой. Особенно отмечают использование соединений, чтобы бороться с вредными растениями, когда культурные растения дают всходы. Несмотря на то, что каждое из 6-арил-4-аминопиколинатных соединений, выраженных формулой I, включено в объем данного изобретения, степень гербицидной активности, селективность по отношению к сельскохозяйственной культуре и полученный спектр борьбы с сорняками варьируются в зависимости от присутствующих в молекуле заместителей. Подходящее соединение для любого конкретного использования в качестве гербицида можно определить с помощью имеющейся в данном описании информации или с помощью стандартных испытаний.
Термин гербицид используют в данном описании, чтобы обозначить активный ингредиент, который уничтожает, борется или, с другой стороны, оказывает неблагоприятное влияние на рост растений. Эффективным в качестве гербицида количеством или количеством, необходимым для борьбы с растениями, является количество активного ингредиента, которое оказывает неблагоприятный модифицирующий эффект и включает отклонение от естественного развития, уничтожение, регуляцию, десикацию, ретардацию и подобные. Термины растения и растительность включают проросшие зерна, появившиеся всходы и укоренившуюся растительность.
Гербицидная активность проявляется соединениями настоящего изобретения, когда их применяют непосредственно на растении или на площади, занимаемой растением, на любой стадии роста или до посадки и появления всходов. Наблюдаемый эффект зависит от вида растения, с которым нужно бороться, стадии роста растения, используемых параметров разбавления и размера распыляемых капель, размера частиц твердых компонентов, условий окружающей среды в момент использования, конкретного используемого соединения, конкретных используемых вспомогательных веществ и носителей, типа почвы, и подобных, также как от количества используемого химического вещества. Эти и другие факторы можно подобрать, как известно в данной области техники, чтобы оказать неселективный или селективный гербицидный эффект. Обычно предпочтительно использовать соединения формулы I после появления относительно незрелой вредной растительности, чтобы достигнуть максимальной степени борьбы с сорняками.
После появления всходов обычно используют дозы внесения 0,1-1000 г/га; для применения до появления всходов обычно используют дозы внесения 1-2000 г/га. При определенных более высоких дозах в основном осуществляется неселективная борьба с широким разнообразием вредной растительности. При более низких дозах обычно осуществляется селективная борьба и эти дозы можно использовать на площадях, занимаемых сельскохозяйственными культурами.
Гербицидные соединения настоящего изобретения часто применяют в смеси с одним или более другими гербицидами, чтобы бороться с широким разнообразием вредной растительности. При использовании в смеси с другими гербицидами соединения, заявленные в настоящем изобретении, можно смешивать с другим гербицидом или гербицидами, смешивать в емкости с другим гербицидом или гербицидами или применять последовательно с другим гербицидом или гербицидами. Некоторые гербициды, которые можно применять в смеси с соединениями настоящего изобретения, включают: амидные гербициды, такие как аллидохлор, бефлубутамид, бензадокс, бензипрам, бромобутид, кафенстрол, CDEA, хлортиамид, ципразол, диметенамид, диметенамид-P, дифенамид, эпроназ, этнипромид, фентразамид, флупоксам, фомесафен, галосафен, изокарбамид, изоксабен, напропамид, нафталам, петоксамид, пропизамид, хинонамид и тебутам; анилидные гербициды, такие как хлоранокрил, цисанилид, кломепром, ципромид, дифлуфеникан, этобензанид, фенасулам, флуфенацет, флуфеникан, мефенацет, мефлуидид, метамифоп, моналид, напроанилид, пентанохлор, пиколинафен и пропанил; арилаланиновые гербициды, такие как бензоилпроп, флампроп и флампроп-М; хлорацетанилидные гербициды, такие как ацетохлор, алахлор, бутахлор, бутенахлор, делахлор, диэтатил, диметахлор, метазахлор, метолахлор, S-метолахлор, претилахлор, пропахлор, прописохлор, принахлор, тербухлор, тенилхлор и ксилахлор; сульфанилидные гербициды, такие как бензофтор, перфлуидон, пиримисульфан и профлуазол; сульфамидные гербициды, такие как асулам, карбасулам, фенасулам и оризалин; гербициды - антибиотики, такие как биланафос; гербициды - производные бензойной кислоты, такие как хлорамбен, дикамба, 2,3,6-TBA и трикамба; гербициды - производные пиримидинилоксибензойной кислоты, такие как биспирибак и пириминобак; гербициды - производные пиримидинилтиобензойной кислоты, такие как пиритиобак; гербициды - производные фталевой кислоты, такие как хлортал; гербициды - производные пиколиновой кислоты, такие как аминопиралид; клопиралид и пиклорам; гербициды - производные хинолинкарбоновой кислоты, такие как хинклорак и хинмерак; гербициды, содержащие мышьяк, такие как какодиловая кислота, CMA, DSMA, гексафлурат, MAA, MAMA, MSMA, арсенит калия и арсенит натрия; гербициды - производные бензоилциклогександиона, такие как мезотрион, сулкотрион, тефурилтрион и темботрион; бензофуранильные алкилсульфонатные гербициды, такие как бенфуресат и этофумесат; карбаматные гербициды, такие как асулам, карбоксазол, хлорпрокарб, дихлормат, фенасулам, карбутилат и тербукарб; карбанилатные гербициды, такие как барбан, BCPC, карбасулам, карбетамид, CEPC, хлорбуфам, хлорпрофам, CPPC, десмедифам, фенисофам, фенмедифам, фенмедифам-этил, профам и свеп; циклогексеноксимные гербициды, такие как аллоксидим, бутроксидим, клетодим, клопроксидим, циклоксидим, профоксидим, сетоксидим, тепралоксидим и тралкоксидим; циклопропилизоксазольные гербициды, такие как изоксахлортол и изоксафлутол; дикарбоксимидные гербициды, такие как бензфендизон, цинидон-этил, флумезин, флумиклорак, флумиоксазин и флумипропин; динитроанилиновые гербициды, такие как бенфлуралин, бутралин, динитрамин, эталфлуралин, флухлоралин, изопропалин, металпропалин, нитралин, оризалин, пендиметалин, продиамин, профлуралин и трифлуралин; динитрофенольные гербициды, такие как динофенат, динопроп, диносам, диносеб, динотерб, DNOC, этинофен и мединотерб; гербициды - производные дифенилового эфира, такие как этоксифен; гербициды - производные нитрофенилового эфира, такие как ацифлуорфен, аклонифен, бифенокс, хлометоксифен, хлорнитрофен, этнипромид, фтордифен, фторгликофен, фторнитрофен, фомесафен, фурилоксифен, галосафен, лактофен, нитрофен, нитрофторфен и оксифторфен; дитиокарбаматные гербициды, такие как дазомет и метам; галогенированные алифатические гербициды, такие как алорак, хлоропон, далапон, флупропанат, гексахлорацетон, йодметан, метилбромид, монохлоруксусная кислота, SMA и TCA; имидазолиноновые гербициды, такие как имазаметабенз, имазамокс, имазапик, имазапир, имазахин и имазетапир; неорганические гербициды, такие как сульфамат аммония, боракс, хлорат кальция, сульфат меди, сульфат железа (II), азид калия, цианат калия, азид натрия, хлорат натрия и серная кислота; нитрильные гербициды, такие как бромобонил, бромоксинил, хлороксинил, дихлорбенил, йодбонил, иоксинил и пираклонил; фосфоорганические гербициды, такие как амипрофос-метил, анилофос, бенсулид, биланафос, бутамифос, 2,4-DEP, DMPA, EBEP, фосамин, глуфосинат, глуфосат и пиперофос; фенокси гербициды, такие как бромфеноксим, кломепроп, 2,4-DEB, 2,4-DEP, дифенопентен, дисул, эрбон, этнипромид, фентеракол и трифопсим; феноксиуксусные гербициды, такие как 4-CPA, 2,4-D, 3,4-DA, MCPA, MCPA-тиоэтил и 2,4,5-T; гербициды - производные феноксимасляной кислоты, такие как 4-CPB, 2,4-DB, 3,4-DB, MCPB и 2,4,5-TB; гербициды - производные феноксипропионовой кислоты, такие как клопроп, 4-CPP, дихлорпроп, дихлорпроп-P, 3,4-DP, фенопроп, мекопроп и мекопроп-P; гербициды - производные арилоксифеноксипропионовой кислоты, такие как хлоразифоп, клодинафоп, клофоп, цигалофоп, диклофоп, феноксапроп, феноксапроп-P, фентиапроп, флуазифоп, флуазифоп-P, галоксифоп, галоксифоп-P, изоксапирифоп, метамифоп, пропаквизафоп, квизалофоп, квизалофоп-P и трифоп; фенилендиаминовые гербициды, такие как динитрамин и продиамин; пиразолильные гербициды, такие как бензофенап, пиразолинат, пирасульфотол, пиразоксифен, пироксасульфон и топрамезон; пиразолилфенильные гербициды, такие как флуазолат и пирафлуфен; пиридазиновые гербициды, такие как кредазин, пиридафол и пиридат; пиридазиноновые гербициды, такие как бромпиразон, хлоридазон, димидазон, флуфенпир, метфлуразон, норфлуразон, оксапиразон и пиданон; пиридиновые гербициды, такие как аминопиралид, клиодинат, клопиралид, дитиопир, флуроксипир, галоксидин, пиклорам, пиколинафен, пириклор, тиазопир и триклопир; пиримидиндиаминовые гербициды, такие как ипримидам и тиоклорим; гербициды - производные четвертичного аммония, такие как циперкват, диэтамкват, дифензокват, дикват, морфамкват и паракват; тиокарбаматные гербициды, такие как бутилат, циклоат, ди-аллат, EPTC, эспрокарб, этиолат, изополинат, метиобенкарб, молинат, орбенкарб, пебулат, просульфокарб, пирибутикарб, сульфаллат, тиобенкарб, тиокарбазил, три-аллат и вернолат; тиокарбонатные гербициды, такие как димексано, EXD и проксан; гербициды - производные тиомочевины, такие как метиурон; триазиновые гербициды, такие как дипропетрин, триазифлам и тригидрокситриазин; хлортриазиновые гербициды, такие как атразин, хлоразин, цианазин, ципразин, эглиназин, ипазин, месопразин, проциазин, проглиназин, пропазин, себутилазин, симазин, тербутилазин и триэтазин; метокситриазиновые гербициды, такие как атратон, метометон, прометон, секбуметон, симетон и тербуметон; метилтиотриазиновые гербициды, такие как аметрин, азипротрин, цианатрин, десметрин, диметаметрин, метопротрин, прометрин, симетрин и тербутрин; триазиноновые гербициды, такие как аметридион, амибузин, гексазинон, изометиозин, метамитрон и метрибузин; триазольные гербициды, такие как амитрол, кафенстрол, эпроназ и флупоксам; триазолоновые гербициды, такие как амикарбазон, бенкарбазон, карфентразон, флукарбазон, пропоксикарбазон, сульфентразон и тиенкарбазон-метил; триазолпиримидиновые гербициды, такие как клорансулам, диклосулам, флорасулам, флуметсулам, метосулам, пеноксулам и пироксулам; гербициды - производные урацила, такие как бутафенацил, бромацил, флупропацил, изоцил, ленацил и тербацил; 3-фенилурацилы; гербициды - производные мочевины, такие как бензтиазурон, кумилурон, циклурон, дихлоралмочевина, дифлуфензопир, изонорурон, изоурон, метабензтиазурон, монисоурон и норурон; гербициды - производные фенилмочевины, такие как анисурон, бутурон, хлорбромурон, хлоретурон, хлортолурон, хлороксурон, даимурон, дифеноксурон, димефурон, диурон, фенурон, флуометурон, флуотиурон, изопротурон, линурон, метиурон, метилдимрон, метобензурон, метобромурон, метоксурон, монолинурон, монурон, небурон, парафлурон, фенобензурон, сидурон, тетрафлурон и тидиазурон; гербициды - производные пиримидинсульфонилмочевины, такие как амидосульфурон, азимсульфурон, бенсульфурон, хлоримурон, циклосульфамурон, этоксисульфурон, флазасульфурон, флуцетосульфурон, флупирсульфурон, форамсульфурон, галосульфурон, имазосульфурон, мезосульфурон, никосульфурон, ортосульфамурон, оксасульфурон, примисульфурон, пиразосульфурон, римсульфурон, сульфометурон, сульфосульфурон и трифлоксисульфурон; гербициды - производные триазинилсульфонилмочевины, такие как хлорсульфурон, циносульфурон, этаметсульфурон, йодосульфурон, метсульфурон, просульфурон, тифенсульфурон, триасульфурон, трибенурон, трифлусульфурон и тритосульфурон; гербициды - производные тиадиазолилмочевины, такие как бутиурон, этидимурон, тебутиурон, тиазафлурон и тидиазурон; и гербициды, не вошедшие в другие классы, такие как акролеин, аллиловый спирт, азафенидин, беназолин, бентазон, бензобициклон, бутидазол, цианамид кальция, кембендихлор, хлорфенак, хлорфенпроп, хлорфлуразол, хлорфлуренол, цинметилин, кломазон, CPMF, крезол, орто-дихлорбензол, димепиперат, эндотал, фтормидин, флуридон, флурохлоридон, флуртамон, флутиацет, инданофан, метазол, метилизотиоцианат, нипираклофен, OCH, оксадиаргил, оксадиазон, оксазикломефон, пентахлорфенол, пентоксазон, ацетат фенилртути, пиноксаден, просульфалин, пирибензоксим, пирифталид, хинокламин, родетанил, сулгликапин, тидиазимин, тридифан, триметурон, трипропиндан и тритак. Гербицидные соединения настоящего изобретения можно, кроме того, использовать в смеси с глифосатом, глуфосинатом или 2,4-D на устойчивых к глифосату, глуфосинату или 2,4-D сельскохозяйственных культурах. Обычно предпочтительно использовать соединения изобретения в комбинации с гербицидами, которые являются селективными к обрабатываемой сельскохозяйственной культуре и которые дополняют спектр борьбы с сорняками этих соединений при использованной дозе внесения. Кроме того, обычно предпочтительно применять соединения данного изобретения и другие дополнительные гербициды в одно и тоже время, как в виде комбинированного состава, так и в виде тэнковой смеси.
Соединения настоящего изобретения обычно применяют в комбинации с известными гербицидными антидотами, такими как беноксакор, бентиокарб, брассинолид, клоквинтосет (мексил), циометринил, даимурон, дихлормид, дициклонон, димепиперат, дисульфотон, фенхлоразол-этил, фенклорим, флуразол, флуксофеним, фурилазол, изоксадифен-этил, мефенпир-диэтил, MG 191, MON 4660, нафталиновый ангидрид (NA), оксабетринил, R29148 и амиды N-фенилсульфонилбензойной кислоты, чтобы повысить их селективность. Они могут применяться дополнительно, чтобы бороться с вредной растительностью во многих сельскохозяйственных культурах, которые делают устойчивыми или невосприимчивыми к ним или другим гербицидам с помощью генетических манипуляций или мутаций, или селекции. Например, можно обрабатывать кукурузу, пшеницу, рис, сою, сахарную свеклу, хлопок, канолу и другие сельскохозяйственные культуры, которые делаются устойчивыми или невосприимчивыми к соединениям, которые являются ингибиторами ацетолактат-синтазы у чувствительных растений. Многие сельскохозяйственные культуры, устойчивые к глифосатам и глуфосинатам, можно также обрабатывать как отдельно, так и в комбинации с этими гербицидами. Некоторые сельскохозяйственные культуры (например, хлопок) сделали толерантным к ауксиновым гербицидам, таким как 2,4-дихлорфеноксиуксусная кислота. Эти гербициды можно использовать, чтобы обрабатывать такие устойчивые сельскохозяйственные культуры и другие сельскохозяйственные культуры, устойчивые к ауксинам.
Когда возможно использовать 6-арил-4-аминопиколинатные соединения формулы I непосредственно в качестве гербицидов, предпочтительно использовать их в смеси, содержащей эффективное в качестве гербицида количество соединения вместе с, по крайней мере, одним подходящим в области сельского хозяйства вспомогательным веществом или носителем. Подходящие вспомогательные вещества или носители не должны быть фитотоксичными для ценных сельскохозяйственных культур, в частности при используемых концентрациях при применении композиций для селективной борьбы с сорняками в присутствии сельскохозяйственных культур и они не должны реагировать химически с соединениями формулы I или другими ингредиентами композиции. Такие смеси можно создать для применения непосредственно на сорняках или местах их роста, или они могут быть концентратами или составами, которые обычно разбавляют дополнительными носителями или вспомогательными веществами перед применением. Они могут быть твердыми веществами, такими как, например, порошки, гранулы, водорастворимые гранулы, или смачивающимися порошками, или жидкостями, такими как, например, концентраты эмульсий, растворы, эмульсии и суспензии.
Подходящие в области сельского хозяйства вспомогательные вещества и носители, которые пригодны для приготовления гербицидных смесей данного изобретения, хорошо известны специалистам в данной области техники.
Жидкие носители, которые можно использовать, включают воду, толуол, ксилен, петролейный эфир, кукурузное масло, ацетон, метилэтилкетон, циклогексанон, трихлорэтилен, перхлорэтилен, этилацетат, амилацетат, бутилацетат, монометиловый эфир пропиленгликоля и монометиловый эфир диэтиленгликоля, метанол, этанол, изопропанол, амиловый спирт, этиленгликоль, пропиленгликоль, глицерин и подобные. Для разбавления концентратов в качестве носителя обычно выбирают воду.
Подходящие твердые носители включают тальк, пирофиллитовую глину, двуокись кремния, аттапульгированную глину, каолиновую глину, кизельгур, мел, диатомит, известь, карбонат кальция, бентонитовую глину, фуллерову землю, кожуру хлопковых семян, пшеничную муку, соевую муку, пемзу, древесную муку, муку орехового дерева, лигнин и подобные.
В композиции настоящего изобретения обычно желательно вводить один или более поверхностно-активных агентов. Такие поверхностно-активные агенты преимущественно используют как в твердых, так и в жидких композициях, особенно в тех, которые предполагают разбавление носителем перед применением. Поверхностно-активные агенты могут быть анионными, катионными или не ионными по характеру и могут использоваться в качестве эмульгаторов, смачивающих агентов, суспендирующих агентов или для других целей. Стандартные поверхностно-активные агенты включают соли алкилсульфатов, такие как лаурилсульфат диэтаноламмония; алкиларилсульфонатные соли, такие как додецилбензолсульфонат кальция; продукты присоединения алкилфенола-алкиленоксида, такие как нонилфенол-С18 этоксилат; продукты присоединения спирт-алкиленоксид, такие как тридецил спирт-С16 этоксилат; мыла, такие как стеарат натрия; алкилнафталинсульфонатные соли, такие как дибутилнафталинсульфонат натрия; диалкиловые эфиры сульфосукцинатных солей, такие как ди(2-этилгексил)сульфосукцинат натрия; эфиры сорбитола, такие как олеат сорбитола; четвертичные амины, такие как лаурилтриметиламмонийхлорид; полиэтиленгликолевые эфиры жирных кислот, такие как полиэтиленгликольстеарат; блочные сополимеры этиленоксида и пропиленоксида; и соли моно- и диалкил фосфоэфиров.
Другие вспомогательные вещества, обычно используемые в композициях для сельского хозяйства, включают агенты, улучшающие совместимость, антивспенивающие агенты, стабилизирующие агенты, нейтрализующие агенты и буферы, ингибиторы коррозии, красители, одоранты, лиофилизирующие добавки, вещества, способствующие проникновению, агенты, придающие липкость, диспергирующие агенты, сгустители, понизители температуры замерзания, антимикробные агенты и подобные. Композиции также могут содержать другие совместимые компоненты, например, другие гербициды, регуляторы роста растений, фунгициды, инсектициды и подобные и могут быть смешаны с жидкими удобрениями или твердыми удобрениями в виде частиц, используемыми в качестве носителей, такими как нитрат аммония, мочевина и подобные.
Концентрация активных агентов в гербицидных композициях данного изобретения обычно 0,001-98% по весу. Часто используют концентрации 0,01-90% по весу. В композициях, разработанных для использования в виде концентратов, активный ингредиент обычно присутствует в концентрации 5-98% по весу, предпочтительно 10-90% по весу. Такие композиции обычно разбавляют инертным носителем, таким как вода, перед использованием. Разбавленные композиции, обычно применяемые на сорняках или местах их роста, обычно содержат 0,0001-1% по весу активного ингредиента и предпочтительно содержат 0,001-0,05% по весу.
Представленные композиции можно применять на сорняках или местах их роста при использовании общепринятых устройств для измельчения или воздушных распылителей, опрыскивателей и машин для внесения гранул, с помощью добавления оросительной воды и с помощью других общепринятых известных специалистам способов.
Многие из исходных веществ, используемые для приготовления соединений настоящего изобретения, например, 4-амино-3,6-дихлорпиридин-2-карбоновая кислота, 4-амино-3,5,6-трифтор-2-цианопиридин, метил 4-амино-6-бром-3,5-дифторпиридин-2-карбоксилат и метил 4-амино-6-бром-3-хлорпиридин-2-карбоксилат, описаны в патенте США 6297197 В1.
Примеры:
1. Получение 3-бром-6-хлор-2-фторфенола
Раствор 1-бром-4-хлор-2-фторбензола (20,4 г, 0,100 моль) в тетрагидрофуране (ТГФ; 50 мл) медленно добавляли к диизопропиламиду лития (LDA; 0,125 моль) в ТГФ (600 мл) при -50°С. После добавления раствор нагревали до -20°С и затем охлаждали до -50°С и медленно добавляли раствор триметилбората (13,5 г, 0,130 моль) в тетрагидрофуране (20 мл) и температуру повышали до -20°С. Затем смесь охлаждали до -70°С и медленно добавляли раствор перуксусной кислоты (32% в уксусной кислоте, 0,150 моль), и смесь нагревали до температуры окружающей среды. Добавляли воду (250 мл), и раствор экстрагировали этилацетатом (2 × 200 мл). Объединенные органические фазы сушили и концентрировали. Черное масло очищали колоночной хроматографией (20% этилацетата в гексане), чтобы получить 3-бром-6-хлор-2-фторфенол (14,1 г, 0,063 моль): 1Н-ЯМР (CDCl3): δ 7,05 (м, 2Н), 5,5 (уш.с, 1Н).
Следующие соединения получали в соответствии с методикой примера 1.
3-бром-2,6-дихлорфенол:т.пл. 69-70°С.
3-бром-2-фтор-6-трифторметилфенол: 1Н-ЯМР (CDCl3): δ 7,20 (м, 2Н), 5,85 (уш.с, 1Н).
3-бром-2-хлор-6-фторфенол: LC/MS (m/z = 225).
2. Получение 1-бром-4-хлор-2-фтор-3-метоксибензола
Гетерогенную смесь 3-бром-6-хлор-2-фторфенола (14,4 г, 0,064 моль), метилйодида (13,5 г, 0,096 моль) и карбоната калия (8,8 г, 0,064 моль) в ацетонитриле (100 мл) кипятили с обратным холодильником в течение 2 часов. Смесь охлаждали, разбавляли водой (100 мл) и экстрагировали этилацетатом (2 × 150 мл). Объединенные экстракты сушили и концентрировали. Черное масло очищали колоночной хроматографией (5% этилацетата в гексане), чтобы получить 1-бром-4-хлор-2-фтор-3-метоксибензол (14,8 г, 0,062 моль): 1Н-ЯМР (CDCl3): δ 7,20 (м, 1Н), 7,10 (дд, 1Н), 4,0 (с, 3Н).
Следующие соединения получали в соответствии с методикой примера 2.
1-бром-4-хлор-3-этокси-2-фторбензол: 1Н-ЯМР (CDCl3): δ 7,20 (м, 1Н), 7,10 (дд, 1Н), 4,20 (кв, 2Н), 1,50 (т, 3Н).
1-бром-4-хлор-2-фтор-3-изопропоксибензол: 1Н-ЯМР (CDCl3): δ 7,20 (м, 1Н), 7,10 (дд, 1Н), 4,5 (м, 1Н), 1,40 (д, 6Н).
1-бром-4-хлор-2-фтор-3-(2-метоксиэтокси)бензол: 1Н-ЯМР (CDCl3): δ 7,25 (м, 1Н), 7,15 (дд, 1Н), 4,25 (т, 2Н), 3,75 (т, 2Н), 3,5 (с, 3Н).
1-бром-2-фтор-3-метокси-4-трифторметилбензол: 1Н-ЯМР (CDCl3): δ 7,39 (д, 1Н), 7,21 (д, 1Н), 6,18 (тт, 1Н), 4,24 (тд, 2Н).
1-бром-2,4-дихлор-3-этоксибензол: 1Н-ЯМР (CDCl3): δ 7,32 (д, 1Н), 7,17 (д, 1Н), 4,10 (кв, 2Н), 1,47 (т, 3Н).
1-бром-2,4-дихлор-3-метоксибензол: 1Н-ЯМР (CDCl3): δ 7,35 (д, 1Н), 7,15 (д, 1Н), 3,95 (с, 3Н).
1-хлор-3,5-дифтор-2-метоксибензол: GC-MS (m/z = 178).
1-хлор-3,5-дифтор-2-этоксибензол: GC-MS (m/z = 192), т.кип. 80-85°C / 30 мм.
1,3-дихлор-5-фтор-2-метоксибензол: GC-MS (m/z = 194).
1-бром-3-бутокси-4-хлор-2-фторбензол: GC-PCI (m/z = 180).
1-бром-4-хлор-2-фтор-3-метоксиметоксибензол: GC-MS (m/z = 269).
1-бром-2-хлор-4-фтор-3-метоксибензол: GC-MS (m/z = 239).
3-хлор-5-фтор-2-метоксибензальдегид: GC-MS (m/z = 188).
1,3-дифтор-3-этоксибензол: GC-MS (m/z = 158).
3. Получение 1-бром-4-хлор-2-фтор-5-метоксибензола
Раствор 4-хлор-2-фтор-5-метоксианилина (25,0 г, 0,143 моль) в 10% HBr (250 мл) охлаждали до 0°С и медленно добавляли раствор нитрита натрия (15,0 г, 0,218 моль) в воде (20 мл). Медленно добавляли хлористый метилен (50 мл) и бромид меди (30,0 г, 0,244 моль) и затем смесь нагревали до температуры окружающей среды и перемешивали в течение 1 часа. Реакционную смесь фильтровали через слой целлита и экстрагировали хлористым метиленом (2 × 100 мл) и объединенные органические фазы сушили (сульфат натрия) и концентрировали. Хроматографирование черного масла (5% этилацетата в гексане) давало 1-бром-4-хлор-2-фтор-5-метоксибензол (16,6 г, 0,070 моль): 1Н-ЯМР (CDCl3): δ 7,20 (м, 1Н), 7,05 (дд, 1Н), 4,00 (с, 3Н).
4. Получение 1-бром-4-хлор-2-фтор-3-дифторметоксибензола
К раствору 3-бром-6-хлор-2-фторфенола (1,00 г, 4,44 ммоль) и хлордифторацетата натрия в диметилформамиде (DMF; 9 мл) добавляли карбонат калия (1,22 г, 5,32 ммоль) и воду (1,77 мл) и полученную в результате реакционную смесь грели при 100°С в течение 4 часов. Раствор охлаждали до температуры окружающей среды и добавляли концентрированную соляную кислоту (2,5 мл) и воду (4 мл) и перемешивали при температуре окружающей среды в течение ночи. Раствор охлаждали в ледяной бане и нейтрализовали 2N гидроксидом натрия и затем экстрагировали этилацетатом (2 × 25 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали, получая 1-бром-4-хлор-2-фтор-3-дифторметоксибензол (1,20 г, 4,2 ммоль). Это соединение использовали на следующей стадии без дополнительной очистки.
5. Получение 1-бром-4-хлор-3-(2,2-дифторэтокси)-2-фторбензола
Раствор 3-бром-6-хлор-2-фторфенола (15,4 г, 0,068 моль) в DMF (25 мл) медленно добавляли к суспензии гидрида натрия (60% дисперсия в минеральном масле) (4,0 г, 0,10 моль) в DMF (100 мл) и смесь перемешивали в течение 1 часа. Медленно добавляли раствор 2,2-дифторэтилового эфира метансульфокислоты (17,5 г, 0,109 моль) в DMF (10 мл). Полученный в результате раствор грели при 70°С в течение 18 часов. Раствор разбавляли водой (200 мл) и экстрагировали этилацетатом. Объединенные органические фазы сушили (сульфат натрия) и концентрировали. Масло - остаток очищали колоночной хроматографией (в гексане), чтобы получить 1-бром-4-хлор-3-(2,2-дифторэтокси)-2-фторбензол (9,0 г, 0,031 моль): 1Н-ЯМР (CDCl3): δ 7,3 (м, 1Н), 7,10 (дд, 1Н), 6,15 (дт, 1Н), 4,35 (м, 2Н).
Следующие соединения получали в соответствии с методикой примера 5.
1-бром-2,4-дихлор-3-(2,2-дифторэтокси)бензол: 1Н-ЯМР (CDCl3): δ 7,35 (м, 1Н), 7,15 (дд, 1Н), 6,15 (тт, 1Н), 4,35 (дт, 2Н).
6. Получение 1-бром-4-хлор-2-фтор-3-(метилтио)бензола
Раствор 1-бром-4-хлор-2-фторбензола (20,4 г, 0,100 моль) в ТГФ (50 мл) медленно добавляли к LDA (0,125 моль) в ТГФ (600 мл) при -50°С. После добавления раствор нагревали до -20°С и затем охлаждали до -50°С и медленно добавляли раствор диметилдисульфида (18,8 г, 0,20 моль) в тетрагидрофуране (50 мл), и смесь нагревали до температуры окружающей среды. Реакцию гасили водой (200 мл) и экстрагировали этилацетатом (2 × 150 мл) и объединенные органические фазы сушили (сульфат натрия) и концентрировали. Остаток - красное масло очищали колоночной хроматографией (5% этилацетата в гексане), чтобы получить 1-бром-4-хлор-2-фтор-3-(метилтио)бензол (23,9 г, 0,094 моль): 1Н-ЯМР (CDCl3): δ 7,40 (м, 1Н), 7,15 (дд, 1Н), 2,50 (с, 3Н).
Следующие соединения получали в соответствии с методикой примера 6.
1-бром-2,4-дихлор-3-(метилтио)бензол: 1Н-ЯМР (CDCl3): δ 7,52 (д, 1Н), 7,25 (д, 1Н), 2,46 (с, 3Н).
7. Получение 3-бром-6-хлор-2-фторбензальдегида
Раствор 1-бром-4-хлор-2-фторбензола (20,4 г, 0,100 моль) в ТГФ (50 мл) медленно добавляли к LDA (0,125 моль) в ТГФ (600 мл) при -50°С. После добавления раствор нагревали до -20°С и затем охлаждали до -50°С и медленно добавляли раствор DMF (14,6 г, 0,20 моль) в тетрагидрофуране (50 мл), и смесь нагревали до температуры окружающей среды. Реакцию гасили водой (250 мл) и экстрагировали этилацетатом (2 × 150 мл) и объединенные органические фазы сушили (сульфат натрия) и концентрировали. Твердый остаток перекристаллизовывали из гексана, чтобы получить 3-бром-6-хлор-2-фторбензальдегид (40,0 г, 0,169 моль): т.пл. 92-93°C.
Следующие соединения получали в соответствии с методикой примера 7 гашением подходящего электрофила, например, альдегида, сложного эфира или кетона.
1-(3-бром-6-хлор-2-фторфенил)-1-этанол: 1Н-ЯМР (CDCl3): δ 7,40 (м, 1Н), 7,15 (м, 1Н), 5,40 (м, 1Н), 2,50 (м, 1Н), 1,85 (д, 3Н).
3-бром-2,4-дихлорбензальдегид: т.пл. 96-97°С.
1-(3-бром-2,4-дихлорфенил)-1-этанол: 1Н-ЯМР (CDCl3): δ 7,60 (д, 1Н), 7,15 (д, 1Н), 5,45 (м, 1Н), 3,0 (д, 1Н), 1,85 (д, 3Н).
1-бром-4-хлор-3-этил-2-фторбензол: GC/PCI (m/z = 236).
1-(3-бром-6-хлор-2-фторфенил)-2,2,2-трифторэтанон: GC/PCI (m/z = 304).
1-(3-бром-6-хлор-2-фторфенил)-1-пропанол: 1Н-ЯМР (CDCl3): δ 7,40 (м, 1Н), 7,15 (м, 1Н), 5,40 (м, 1Н), 2,50 (м, 1Н), 1,90 (м, 4Н), 1,00 (т, 3Н).
2-(3-бром-6-хлор-2-фторфенил)-2-пропанол: 1Н-ЯМР (CDCl3): δ 7,40 (м, 1Н), 7,15 (м, 1Н), 3,45 (с, 1Н), 1,80 (м, 6Н).
8. Получение 3-хлор-5-фтор-2-гидроксибензальдегида
Раствор 2-хлор-4-фторфенола (15,0 г, 102 ммоль) в 150 г 50% гидроксиде натрия, воды (30 мл) и хлороформа (45 мл) кипятили с обратным холодильником в течение 8 часов, добавляли дополнительное количество хлороформа (45 мл) каждые 2 часа. Затем смесь охлаждали и оставляли отстаиваться на 18 часов и собирали выпавшую натриевую соль. Твердый остаток суспендировали в воде (200 мл) и pH выравнивали до 1,5 6 N соляной кислотой и затем экстрагировали этилацетатом (2 × 100 мл). Объединенные экстракты промывали соляным раствором, сушили и концентрировали. Остаток очищали хроматографией (1:1 хлористый метилен/гексан), чтобы получить 3-хлор-5-фтор-2-гидроксибензальдегид (5,0 г, 29 ммоль): LC/MS (m/z = 174).
9. Получение 1-бром-4-хлор-2-фтор-3-дифторметилбензола
(Диэтиламино)трифторид серы (15,3 г, 0,096 моль) медленно добавляли к раствору 3-бром-6-хлор-2-фторбензальдегида (7,50 г, 0,032 моль) в хлористом метилене при 0°С и смесь перемешивали в течение 1 часа после нагревания раствора до температуры окружающей среды. Реакцию осторожно гасили насыщенным раствором бикарбоната натрия в воде (100 мл) и экстрагировали метиленхлоридом (2 × 75 мл) и объединенные экстракты сушили (сульфат натрия) и концентрировали, получая 1-бром-4-хлор-2-фтор-3-дифторметилбензол (7,20 г, 0,028 моль): 1Н-ЯМР (CDCl3): δ 7,60 (м, 1Н), 7,05 (м, 1Н), 7,00 (д, 1Н).
Следующие соединения получали в соответствии с методикой примера 9.
1-бром-2,4-дихлор-3-дифторметилбензол: LC/MS ESI (m/z = 271).
1-дифторметил-3-фтор-4-йод-2-метоксибензол: LC/MS (m/z = 302).
2-хлор-4-дифторметил-3-метокси-1-нитробензол: LC/MS (m/z = 237) (использовали без полной очистки).
3-хлор-1-дифторметил-2-метоксибензол LC/MS (m/z = 210).
10. Получение 2-хлор-4-дифторметил-3-метоксианилина
Раствор неочищенного 2-хлор-4-дифторметил-3-метокси-1-нитробензола в этаноле (50 мл), содержащем 5% палладия на угле (250 мг), гидрировали (50 пси) в течение 5 часов. Раствор фильтровали и концентрировали, получая 2-хлор-4-дифторметил-3-метоксианилин (1,3 г, 48 ммоль): LC/MS (m/z = 207).
11. Получение N-пивалоил-2-бром-4-хлор-3-метоксианилина
К раствору N-пивалоил-4-хлор-3-метоксианилина (5,0 г, 21 ммоль) в тетрагидрофуране (60 мл) при -60°С добавляли н-бутиллитий (2,5 М, 44 ммоль). Раствор нагревали до 0°С и перемешивали в течение 3 часов. Добавляли этилендибромид (9,9 г, 53 ммоль) и раствор перемешивали в течение 18 часов до гашения хлоридом аммония (насыщенный раствор, 20 мл) и экстрагировали этиловым эфиром (2 × 50 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (10% этилацетата в гексане), получая N-пивалоил-2-бром-4-хлор-3-метоксианилин (3,7 г, 1,2 ммоль): LC/MS (m/z = 320).
12. Получение 2-бром-4-хлор-1-йод-3-метоксибензола
Раствор N-пивалоил-2-бром-4-хлор-3-метоксианилина (3,7 г, 1,2 ммоль) в диоксане (35 мл) обрабатывали концентрированной соляной кислотой (35 мл) и раствор кипятили с обратным холодильником в течение 2 часов. После этого раствор охлаждали, pH выравнивали до 10 добавлением гидроксида натрия (50% раствор) и экстрагировали этилацетатом (2 × 50 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Неочищенный анилин растворяли в 2N соляной кислоте и добавляли нитрит натрия (750 мг, 11 ммоль) и раствор перемешивали в течение 20 минут. Раствор выливали в энергично перемешиваемый раствор йодида натрия (3,3 г, 22 ммоль) в воде (20 мл) и метиленхлориде (30 мл) и перемешивали в течение 20 минут. Затем раствор экстрагировали метиленхлоридом (2 × 25 мл) и объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (гексан), получая 2-бром-4-хлор-1-йод-3-метоксибензол (1,5 г, 0,6 ммоль): LC/MS (m/z = 267).
Следующие соединения получали в соответствии с методикой примера 12.
4-хлор-2,6-дифтор-5-метил-1-йодбензол: т.кип. 60-70°C/0,75 мм.
2-хлор-4-дифторметил-3-метокси-1-йодбензол: LC/MS (m/z = 318).
1-хлор-2-дифторметил-3,5-дифтор-4-йодбензол: LC/MS (m/z = 324).
13. Получение 3-хлор-2-метокси-4-нитротолуола
Раствор 4-нитро-2-гидрокситолуола (5,0 г, 33 ммоль) в хлороформе (40 мл) кипятили с обратным холодильником и обрабатывали потоком хлора в течение 1 часа. После охлаждения раствор промывали бикарбонатом натрия (насыщенный раствор), соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток растворяли в ацетонитриле (75 мл), обрабатывали карбонатом калия (9,1 г, 66 ммоль) и йодметаном (2,5 мл, 5,7 г, 40 ммоль) и кипятили с обратным холодильником в течение 2 часов. После охлаждения раствор концентрировали, и остаток растворяли в этиловом эфире (75 мл) и промывали водой (50 мл), соляным раствором, сушили (сульфат натрия) и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле с 1-5% этилацетата в гексане, чтобы получая 3-хлор-2-метокси-4-нитротолуол (3,0 г, 15 ммоль): LC/MS (m/z = 201).
14. Получение 3-хлор-2-метокси-4-нитробензальдегида
Раствор 3-хлор-2-метокси-4-нитротолуола (1,0 г, 5,0 ммоль) в уксусной кислоте (10 мл) и уксусном ангидриде (10 мл) охлаждали до 5°С и обрабатывали 1 мл конц. H2SO4. Оксид хрома (VI) (1,4 г, 14 ммоль) добавляли порциями в течение 10 минут, при этом температуру реакции поддерживали в диапазоне 0-5°С. Через 30 минут при этой температуре смесь выливали в ледяную воду (20 г) и смесь экстрагировали этилацетатом (2 × 25 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Неочищенный бисацетат объединяли с водой (10 мл), этанолом (10 мл) и концентрированной серной кислотой (1 мл) и кипятили с обратным холодильником в течение 40 минут. После охлаждения смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (2 × 50 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Неочищенную смесь хроматографировали (10% этилацетата в гексане), получая 3-хлор-2-метокси-4-нитробензальдегид (400 мг, 1,9 ммоль): LC/MS (m/z = 215).
15. Получение (3-бром-6-хлор-2-фторфенил)метанола
К раствору 3-бром-6-хлор-2-фторбензальдегида (20,0 г, 0,084 моль) в этаноле (250 мл) добавляли боргидрид натрия (6,4 г, 0,168 моль) и реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь разбавляли водой (300 мл) и экстрагировали этилацетатом (2 × 200 мл), сушили (сульфат натрия) и концентрировали. Неочищенный твердый остаток перекристаллизовывали из гексана, получая (3-бром-6-хлор-2-фторфенил)метанол (10,4 г, 0,043 моль): 1Н-ЯМР (CDCl3): δ 7,50 (м, 1Н), 7,15 (дт, 1Н), 4,90 (с, 2Н), 2,10 (уш.с, 1Н).
Следующие соединения получали в соответствии с методикой примера 15.
1-(3-бром-6-хлор-2-фторфенил)-2,2,2-трифторэтанол: GC/PCI (m/z = 306).
(3-фтор-4-йод-2-метоксифенил)метанол: LC/MS (m/z = 282).
16. Получение 1-бром-4-хлор-3-фторметил-2-фторбензола
Раствор (диэтиламино)-трифторида серы (7,6 г, 0,047 моль) в метиленхлориде (25 мл) медленно добавляли к (3-бром-6-хлор-2-фторфенил)метанолу (10,3 г, 0,043 моль) в метиленхлориде (150 мл) при 0°С. Раствор перемешивали при температуре окружающей среды в течение 1 часа. Осторожно добавляли насыщенный раствор бикарбоната натрия (100 мл) и смесь экстрагировали метиленхлоридом (2 × 100 мл). Объединенные органические фазы сушили (сульфат натрия) и концентрировали. Остаток - черное масло очищали хроматографией (5% этилацетата в гексане), чтобы получить 1-бром-4-хлор-3-фторметил-2-фторбензол (6,20 г, 0,024 моль): 1Н-ЯМР (CDCl3): δ 7,55 (м, 1Н), 7,18 (дд, 1Н), 5,6 (д, 2Н).
Следующие соединения получали в соответствии с методикой примера 16.
1-бром-4-хлор-2-фтор-3-(1-фтор-1-метилэтил)бензол: 1Н-ЯМР (CDCl3): δ 7,42 (м, 1Н), 7,10 (м, 1Н), 6,05 (дкв, 1Н), 1,95 (дд, 6Н).
1-бром-2,4-дихлор-3-(1-фторэтил)бензол: GC/PCI (m/z = 270).
1-бром-4-хлор-2-фтор-3-(1-фторэтил)бензол: GC/PCI (m/z = 255).
1-бром-4-хлор-2-фтор-3-(1,2,2,2-тетрафторэтил)бензол: GC/ЕI (m/z = 308).
1-бром-4-хлор-2-фтор-3-(1-фторпропил)бензол: GC/ЕI (m/z = 267).
2-фтор-4-фторметил-1-йод-3-метоксибензол: LC/MS (m/z = 284).
17. Получение 1-бром-4-хлор-2-фтор-3-метоксиметилбензола
Раствор 1-бром-4-хлор-2-фторбензола (20,4 г, 0,100 моль) в ТГФ (50 мл) медленно добавляли к LDA (0,125 моль) в ТГФ (600 мл) при -50°С. После добавления раствор нагревали до -20°С и затем охлаждали до -50°С и медленно добавляли раствор бромметоксиметана (25,0 г, 0,200 моль) в тетрагидрофуране (25 мл), и реакционную смесь нагревали до температуры окружающей среды. Реакцию гасили водой (400 мл) и экстрагировали диэтиловым эфиром (2 × 150 мл). Объединенные органические фазы сушили (сульфат натрия) и концентрировали. Остаток - масло перегоняли (70-75°С/0,5 мм), чтобы получить 1-бром-4-хлор-2-фтор-3-метоксиметилбензол (18,0 г, 0,071 моль): 1Н-ЯМР (CDCl3): δ 7,50 (м, 1Н), 7,15 (дд, 1Н), 4,65 (с, 1Н), 3,40 (с, 1Н).
Следующие соединения получали в соответствии с методикой примера 17.
1-бром-4-хлор-2-фтор-3-метилбензол: 1Н-ЯМР (CDCl3): δ 7,30 (м, 1Н), 7,05 (дд, 1Н), 2,35 (с, 3Н).
18. Получение 2-(4-хлор-2-фтор-3-метоксифенил)-[1,3,2]-диоксаборинана
К раствору 1-бром-4-хлор-2-фтор-3-метоксибензола (10,4 г, 0,043 моль) в диэтиловом эфире (150 мл) при -78°С медленно добавляли н-бутиллитий (2,5 М, 19,0 мл, 0,0475 моль) и раствор перемешивали в течение 30 минут. Медленно добавляли раствор триизопропилбората (12,0 г, 0,064 моль) в ТГФ (25 мл) и раствор нагревали до 0°С. Добавляли ацетилхлорид (10,0 г, 0,13 моль). После перемешивания в течение 1 часа раствор концентрировали и твердый остаток растворяли в этилацетате (150 мл) и 1N растворе гидроксида натрия (50 мл). К водной фазе добавляли лед, которую затем подкисляли достаточно концентрированной соляной кислотой, чтобы получить pH 2. Гетерогенную смесь экстрагировали этилацетатом (2 × 150 мл) и объединенные органические фазы сушили (сульфат натрия) и концентрировали. Твердый остаток суспендировали в толуоле и добавляли пропан-1,3-диол (6,6 г, 0,09 моль) и смесь кипятили с отгонкой воды с помощью ловушки Дина-Старка. Через 2 часа смесь охлаждали и концентрировали. Остаток - масло растворяли в метиленхлориде (50 мл) и промывали водой (25 мл), затем сушили (сульфат натрия) и концентрировали, получая 2-(4-хлор-2-фтор-3-метоксифенил)-[1,3,2]-диоксаборинан (6,4 г, 0,062 моль): 1Н-ЯМР (CDCl3): δ 7,15 (м, 1Н), 6,95 (дд, 1Н), 4,05 (т, 4Н), 3,8 (с, 3Н), 1,95 (т, 2Н).
Следующие соединения получали в соответствии с методикой примера 18.
2-(4-хлор-2-фтор-5-метоксифенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,25 (д, 1Н), 7,05 (д, 1Н), 4,20 (т, 4Н), 4,15 (с, 3Н), 2,10 (т, 2Н).
2-(4-хлор-2-фтор-3-этоксифенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,30 (м, 1Н), 7,05 (дд, 1Н), 4,20 (м, 7Н), 2,05 (т, 3Н), 1,50 (т, 3Н).
2-(4-хлор-2-фтор-3-(метилтио)фенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,50 (м, 1Н), 7,18 (дд, 1Н), 4,20 (т, 4Н), 2,50 (с, 3Н), 2,05 (т, 2Н).
2-(4-хлор-2-фтор-3-метоксиметилфенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,6 (дт, 1Н), 7,25 (дд, 1Н), 4,76 (с, 2Н), 4,20 (т, 4Н), 3,40 (с, 3Н), 2,05 (т, 2Н).
2-(4-хлор-2-фтор-3-изопропилфенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,25 (м, 1Н), 7,15 (дд, 1Н), 4,5 (кв, 1Н), 4,20 (т, 4Н), 2,05 (т, 2Н), 1,50 (д, 6Н).
2-(4-хлор-2-фтор-3-дифторметилфенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,75 (м, 1Н), 7,15 (дд, 1Н), 6,90-7,15 (т, 1Н), 4,20 (т, 4Н), 2,05 (т, 2Н).
2-(4-хлор-2-фтор-3-фторметилфенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,70 (м, 1Н), 7,25 (дд, 1Н), 5,8 (д, 2Н), 4,20 (т, 4Н), 2,05 (т, 2Н).
4-[1,3,2]-диоксаборинан-2-ил-3-фтор-2-метоксибензонитрил: 1Н-ЯМР (CDCl3): δ 7,40 (м, 1Н), 7,3 (дд, 1Н), 4,25 (т, 4Н), 4,15 (с, 3Н), 2,10 (т, 3Н).
2-(4-хлор-2-фтор-3-метоксиэтоксифенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,35 (м, 1Н), 7,15 (дд, 1Н), 4,25 (м, 6Н), 3,75 (д, 2Н), 3,48 (с, 3Н), 2,15 (т, 3Н).
2-(2,4-дихлор-3-этоксифенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (ДМСО-d6): δ 7,40 (д, 1Н), 7,29 (д, 1Н), 4,08 (м, 4Н), 4,00 (кв, 2Н), 1,99 (м, 2Н), 1,34 (т, 3Н).
2-[4-хлор-2-фтор-3-(2,2-дифторэтоксифенил]-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,45 (м, 1Н), 7,15 (дд, 1Н), 6,15 (тт, 1Н), 4,38 (т, 4Н), 4,20 (т, 2Н), 2,10 (т, 2Н).
2-(4-хлор-2-фтор-5-этоксифенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,25 (д, 1Н), 7,05 (д, 1Н), 4,20 (т, 4Н), 4,15 (т, 2Н), 2,10 (т, 2Н), 1,45 (т, 3Н).
2-(2,4-дихлор-3-(метилтио)фенил)-[1,3,2]-диоксаборинан: 1Н-ЯМР (CDCl3): δ 7,45-7,28 (м, 2Н), 3,86 (м, 4Н), 2,42 (с, 3Н), 1,80 (м, 2Н).
6-хлор-3-[1,3,2]-диоксаборинан-2-ил-2-фторбензонитрил: 1Н-ЯМР (CDCl3): δ 7,85 (м, 1Н), 6,25 (м, 1Н), 4,20 (м, 4Н), 2,10 (м, 2Н).
19. Получение 1-фтор-2,3-метилендиоксибензола
Alliquat 336 (метилтриоктиламмонийхлорид, 0,63 г, 1,6 ммоль), дибромметан (40,7 г, 234,2 ммоль) и воду (31 мл) помещали в 500 мл трехгорлую колбу, снабженную капельной воронкой, холодильником и магнитной мешалкой. В капельную воронку помещали раствор 3-фторкатехола (20,0 г, 160 ммоль) в 5М гидроксиде натрия (80 мл). Смесь в колбе нагревали до температуры кипения и добавляли по каплям раствор катехола в течение 2 часов при хорошем перемешивании и полученную в результате черную смесь дополнительно кипятили с обратным холодильником 2 часа. После охлаждения до комнатной температуры реакционную смесь разбавляли метиленхлоридом и разделяли слои. Водный слой экстрагировали метиленхлоридом и объединенные органические слои сушили (Na2SO4 c активированным углем). Фильтрат концентрировали до постоянного веса на роторном испарителе, получая 1-фтор-2,3-метилендиоксибензол (14,6 г, 104,2 ммоль) в виде темно-желтого масла: 1Н-ЯМР (CDCl3): δ 6,80 (м, 1Н), 6,68 (м, 2Н), 6,04 (с, 2Н).
20. Получение 2-фтор-3,4-метилендиоксифенилбороновой кислоты
1-фтор-2,3-метилендиоксибензол (5,0 г, 35,7 ммоль) растворяли в ТГФ (70 мл) и раствор охлаждали до -65°С в бане с сухим льдом и ацетоном. Добавляли через шприц при перемешивании н-бутиллитий (2,5 г, 15,7 мл, 39,3 ммоль). Реакционную смесь нагревали до -35°С в течение 1 часа, затем повторно охлаждали до -65°С и обрабатывали триметилборатом (4,1 г, 39,3 ммоль) через шприц. Реакционную смесь медленно нагревали до комнатной температуры, затем реакцию гасили 1N HCl (50 мл), перемешивали в течение 15 минут, затем разбавляли эфиром и слои разделяли. Органический слой экстрагировали 1N гидроксидом натрия и этот экстракт отделяли от эфира и подкисляли 1N соляной кислотой. Кислый водный слой экстрагировали двумя порциями эфира и эти объединенные эфирные экстракты сушили (сульфат натрия), фильтровали и концентрировали до маслянистого остатка, который растирали с дихлорметаном. Полученный в результате твердый остаток собирали фильтрацией, промывали дихлорметаном и сушили, чтобы получить 1-фтор-2,3-метилендиоксифенилбороновую кислоту (1,4 г, 7,6 ммоль) в виде желтовато-коричневого твердого остатка: 1Н-ЯМР (ДМСО-d6): δ 8,05 (уш.с, 2Н), 7,08 (дд, 1Н), 6,76 (д, 1Н), 6,08 (с, 2Н).
Следующие соединения получали в соответствии с методикой примера 20.
2-фтор-3-метокси-4-метилфенилбороновая кислота: 1Н-ЯМР (300 МГц, d6-ДМСО+Н2О): δ 7,32 (уш.с, 2Н), 7,11 (дд, 1Н, J=7,2, 5,7 Гц), 6,92 (д, 1Н, J=7,2 Гц), 3,74 (с, 3Н), 2,19 (с, 3Н).
4-бром-2-фтор-3-метоксифенилбороновая кислота: 1Н-ЯМР (300 МГц, ДМСО d6 +D2О): δ 8,36 (уш.с, 2Н), 7,38 (дд, 1Н, J=8,4), 7,17 (дд, 1Н), 3,82 (д, 3Н).
21. Получение 2-(2-фтор-3,4-метилендиоксифенил)-[1,3,2]-диоксаборинана
2-фтор-3,4-метилендиоксифенилбороновую кислоту (1,4 г, 7,6 ммоль) суспендировали в толуоле и пропан-1,3-диоле (0,6 г, 7,9 ммоль) и смесь кипятили с обратным холодильником в течение 0,5 часа. Смесь охлаждали, фильтровали через стеклянную вату и концентрировали, получая 2-(2-фтор-3,4-метилендиоксифенил)-[1,3,2]-диоксаборинана (1,6 г, 7,1 ммоль): 1Н-ЯМР (ДМСО-d6): δ 7,12 (дд, 1Н, J=7,8, 5,7 Гц), 6,75 (д, 1Н), 6,09 (с, 2Н), 4,06 (т, 4Н), 1,98 (м, 2Н).
22. Получение 3-бром-6-хлор-2-фторбензонитрила
Суспензию 3-бром-6-хлор-2-фторбензальдегида (9,0 г, 0,04 моль) и гидроксиамин O-сульфиновой кислоты (7,50 г, 0,07 моль) в воде (300 мл) грели при 50°С в течение 18 часов. Суспензию охлаждали, и твердый остаток собирали, получая 3-бром-6-хлор-2-фторбензонитрил (8,8 г, 0,04 моль): 1Н-ЯМР (CDCl3): δ 7,75 (м, 1Н), 7,25 (м, 1Н).
23. Получение 3-бром-2-фтор-6-хлорбензамида
Концентрированную серную кислоту (15 мл) помещали в 100 мл 3-горлую колбу, оснащенную внутренним термометром и затем нагревали до 55°С. К кислоте добавляли порциями 3-бром-2-фтор-6-хлорбензонитрил (11,0 г, 47 ммоль) и перемешивали, поддерживая температуру выше 50°С. Черный раствор грели при 65°С в течение 24 часов, затем охлаждали до комнатной температуры и выливали в лед и осторожно нейтрализовали концентрированным гидроксидом аммония. Смесь экстрагировали двумя порциями этилацетата и объединенные органические слои сушили над Na2SO4 (с активированным углем). После фильтрации и концентрирования получали 3-бром-2-фтор-6-хлорбензамид (11,5 г, 45,5 ммоль) в виде светло-оранжевого твердого остатка: т.пл. 157-158°C, 1Н-ЯМР (CDCl3): δ 7,54 (т, 1Н), 7,14 (дд, 1Н),6,03 (уш.с, 1Н), 5,81 (уш.с, 1Н).
24. Получение 3-бром-2,6-дихлорбензамида
3-бром-2,6-дихлорбензойную кислоту (7,2 г, 26,7 ммоль) обрабатывали тионилхлоридом (30 мл, 400,0 ммоль) в 250 мл круглодонной колбе и смесь кипятили с обратным холодильником в течение 1 часа, затем охлаждали до комнатной температуры. Удаляли приблизительно одну треть светло-желтого раствора и концентрировали в вакууме. Остаток растворяли в ТГФ (16 мл) и обрабатывали концентрированным гидроксидом аммония (6 мл) при интенсивном перемешивании. Смесь распределяли между этилацетатом и насыщенным NaHCO3 и слои разделяли, и органический слой сушили над Na2SO4. После фильтрации и концентрирования получали 3-бром-2,6-дихлорбензамид (2,19 г) в виде пены: т.пл. 117-119°C, 1Н-ЯМР (300 МГц, d6-ДМСО): δ 8,10 (уш.с, 1Н), 7,88 (уш.с, 1Н), 7,79 (д, 1Н, J=8), 7,44 (д, 1Н).
25. Получение 3-бром-6-хлор-2-фторанилина
Гидроксид натрия (4,0 г, 100,0 ммоль) растворяли в воде (70 мл) в 250 мл круглодонной колбе и полученный в результате раствор охлаждали в ледяной бане и обрабатывали бромом (4,7 г, 29,7 ммоль), чтобы получить желтый раствор. 3-бром-2-фтор-6-хлорбензолкарбоксамид (5,0 г, 19,9 ммоль) медленно добавляли в твердом виде при интенсивном перемешивании и оранжевую смесь кипятили с обратным холодильником в течение 2 часов. Охлажденную реакционную смесь разбавляли дихлорметаном и слои разделяли и дихлорметан сушили (Na2SO4). Кристаллизация концентрированного фильтрата из холодного гексана давала 3-бром-6-хлор-2-фторанилин (2,8 г, 12,6 ммоль) в виде серовато-белого твердого остатка: т.пл. 61-62°C, 1Н-ЯМР (CDCl3): δ 6,94 (дд, 1Н), 6,83 (дд, 1Н), 4,16 (уш.с, 2Н).
Следующие соединения получали в соответствии с методикой примера 25.
3-бром-2,6-дихлоранилин: т.пл. 71-72°C.
26. Получение N-(3-бром-6-хлор-2-фторфенил)-N,N-диметиламина
3-бром-6-хлор-2-фторанилин (2,5 г, 11,1 ммоль) растворяли в ТГФ (25 мл) в продутой азотом 250 мл круглодонной колбе и обрабатывали 37% формальдегидом (0,84 г, 2,1 мл, 27,8 ммоль), дихлоридом дибутилолова (0,07 г, 0,22 ммоль) и фенилсиланом (1,33 г, 12,3 ммоль) и перемешивали при комнатной температуре в атмосфере азота в течение 48 часов. Реакционную смесь концентрировали в вакууме и очищали флэш-хроматографией на силикагеле (гексан), получая N-(3-бром-6-хлор-2-фторфенил)-N,N-диметиламин (2,0 г, 7,9 ммоль) в виде масла: 1Н-ЯМР (CDCl3): δ 7,19 (дд, 1Н), 7,04 (дд, 1Н), 2,88 (с, 3Н), 2,87 (с, 3Н).
Следующие соединения получали в соответствии с методикой примера 26.
N-(3-бром-6-хлор-2-фторфенил)-N,N-диэтиламин: 1Н-ЯМР (300 МГц, CDCl3): δ 7,24 (дд, 1Н), 7,07 (дд, 1Н), 3,16 (дд, 4Н), 1,01 (т, 6Н).
N-(3-бром-2,6-дихлорфенил)-N,N-диметиламин: 1Н-ЯМР (300 МГц, CDCl3): δ 7,33 (д, 1Н), 7,13 (д, 1Н), 2,88 (с, 6Н).
N-(2-хлор-4,6-дифторфенил)-N,N-диметиламин: бесцветное масло. 1Н-ЯМР (300 МГц, CDCl3): δ 6,93 (ддд, 1Н), 6,73 (м, 1Н), 2,82 (д, 6Н).
27. Получение N-(3-бром-2-фторфенил)-N-метиламина
3-бром-6-хлор-2-фторанилин (1,2 г, 5,2 ммоль) растворяли в ТГФ (12 мл) в 100 мл круглодонной колбе и обрабатывали тетра-N-бутиламмоний бромидом (0,015 г, 0,05 ммоль) и растертым в порошок гидроксидом натрия (0,83 г, 20,9 ммоль) при перемешивании. Через 5 минут черную смесь обрабатывали диметилсульфатом (1,3 г, 10,4 ммоль) и смесь грели при 60°С в течение 2 часов. Контроль с помощью ТСХ (гексан:этилацетат 20/1) показал наличие некоторого количества исходного вещества. Добавляли дополнительное количество диметилсульфата (0,66 г, 5,2 ммоль) и продолжали нагревать в течение 1,5 часов, затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь распределяли между диэтиловым эфиром и водой, слои разделяли и водную фазу экстрагировали эфиром. Объединенные эфирные слои промывали водой и сушили (MgSO4). Фильтрация, концентрирование и очистка флэш-хроматографией на силикагеле (гексан) давали N-(3-бром-6-хлор-2-фторфенил)-N-метиламин (0,81 г) в виде бесцветного масла: 1Н-ЯМР (300 МГц, CDCl3): δ 6,93 (дд, 1Н, J=8,4), 6,83 (дд, 1Н), 4,00 (уш.с, 1Н), 3,09 (д, 3Н).
28. Получение 1,3-дифтор-2-йод-4-метокси-5-метилбензола
Раствор 1,5-дифтор-2-метокси-3-метилбензола (0,65 г, 4,1 ммоль) в ТГФ (1 мл) добавляли к LDA (4,3 ммоль) в ТГФ (10 мл) при -55°С и раствор перемешивали в течение 45 минут. Добавляли твердый йод (1,15 г, 4,5 ммоль) и раствор нагревали до температуры окружающей среды. Раствор разбавляли этилацетатом и промывали бикарбонатом натрия (насыщенный раствор, 15 мл) и тиосульфатом натрия (насыщенный раствор, 15 мл), сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (гексан), получая 1,3-дифтор-2-йод-4-метокси-5-метилбензол: 1Н-ЯМР (300 МГц, CDCl3): δ 6,72 (дд, 1Н), 3,84 (д, 3Н), 2,26 (с, 3Н).
Следующие соединения получали в соответствии с методикой примера 28.
3,5-дифтор-4-йод-2-метоксибензонитрил: т.пл. 106-110°C.
N-(6-хлор-2,4-дифтор-3-йодфенил)-N,N-диметиламин: 1Н-ЯМР (300 МГц, CDCl3): δ 6,98 (дд, 1Н), 2,82 (д, 6Н).
1,3-дихлор-5-фтор-4-йод-2-метоксибензол: GC-MS (m/z = 320).
1,3-дифтор-2-йод-4-метокси-5-метилбензол: 1Н-ЯМР (CDCl3): δ 6,72 (дд, 1Н), 3,84 (д, 3Н), 2,26 (с, 3Н).
2,3-дифтор-4-йод-бензонитрил: LC/MS (m/z = 265).
3-хлор-1-дифторметил-5-фтор-4-йод-2-метоксибензол: LC/MS (m/z = 336).
2-этокси-1,3-дифтор-4-йодбензол: GC-MS (m/z = 284).
1,3-дифтор-2-йод-4-метокси-5-метилбензол: 1Н-ЯМР (CDCl3): δ 6,72 (дд, 1Н), 3,84 (д, 3Н), 2,26 (с, 3Н).
3,5-дифтор-4-йод-2-метоксибензонитрил: т.пл. 106-110°C.
(6-хлор-2,4-дифтор-3-йодфенил)диметиламин: 1Н-ЯМР (CDCl3): δ 6,98 (дд, 1Н), 2,82 (д, 6Н).
2,4,6-трифтор-3-йод-бензонитрил: LC/MS (m/z = 283).
1-бром-3,5-дифтор-4-йод-2-метоксибензол: LC/MS (m/z = 349).
1,3-дихлор-5-фтор-4-йод-2-метоксибензол: GC-MS (m/z = 320).
29. Получение 1-хлор-3,5-дифтор-4-йод-2-метоксибензола
К раствору 1-хлор-3,5-дифтор-2-метоксибензола (2,0 г, 0,01 моль) в ТГФ при -75°С добавляли н-бутиллитий (2,5 М в гексане, 6,7 мл) и полученный в результате раствор перемешивали при -75°С в течение 1 часа. Добавляли раствор йода (5,1 г, 0,02 моль) в ТГФ (10 мл) и реакционную смесь нагревали до температуры окружающей среды. Реакционную смесь разбавляли этиловым эфиром (50 мл) и добавляли водный тиосульфат натрия (10%, 50 мл) и перемешивали в течение 1 часа. После разделения фаз органическую фазу сушили (Na2SO4) и концентрировали, получая 1-хлор-3,5-дифтор-4-йод-2-метоксибензол в виде белого твердого остатка: т.пл. 62-64°C.
Следующие соединения получали в соответствии с методикой примера 29.
1-хлор-2-этокси-3,5-дифтор-4-йодбензол: GC-MS (m/z = 178).
30. Получение 3-фтор-4-йод-2-метоксибензонитрила.
Гидрид натрия (60 мг, 2,5 ммоль) суспендировали в DMF (15 мл) и обрабатывали сухим метанолом (120 мкл, 96 мг, 3,0 ммоль). После перемешивания в течение 10 минут при 25°С раствор охлаждали до -25°С и обрабатывали 2,3-дифтор-4-йод-бензонитрилом (500 мг, 1,9 ммоль). Через 25 минут смесь гасили добавлением 10% раствора лимонной кислоты (5 мл) и нагревали до 25°С. Смесь экстрагировали этиловым эфиром (2 Ч 15 мл), объединенные эфирные фазы промывали водой (5 мл), соляным раствором, сушили (сульфат натрия) и упаривали, чтобы получить 3-фтор-4-йод-2-метоксибензонитрил (500 мг, 1,8 ммоль): LC/MS (m/z = 277).
31. Получение 3-фтор-4-йод-2-метоксибензальдегида.
3-фтор-4-йод-2-метоксибензонитрил (1,0 г, 3,6 ммоль) растворяли в толуоле (7 мл), охлаждали до 0°С и обрабатывали порциями 25% по весу диизобутилалюмогидридом (DIBAL) в толуоле (3,1 мл, 4,7 ммоль). Через 30 минут реакцию гасили добавлением метанола (5 мл), выливали в 1М серную кислоту (15 мл) и экстрагировали этилацетатом (2 × 15 мл). Объединенные экстракты промывали водой (5 мл), соляным раствором, сушили (сульфат натрия) и упаривали, чтобы получить 3-фтор-4-йод-2-метоксибензальдегид (450 мг, 1,6 ммоль): LC/MS (m/z = 260).
32. Получение 3-хлор-4-йод-2-метоксианилина.
3-хлор-2-метоксианилин (1 г, 6,4 ммоль) растворяли в хлористом метилене (10 мл) в 250 мл круглодонной колбе и обрабатывали водой (10 мл), NaHCO3 (1,1 г, 12,7 ммоль) и йодом (1,61 г, 6,4 ммоль) и полученную в результате смесь кипятили с обратным холодильником в течение 2 часов, после которых ТСХ (гексан/этилацетат 4:1) показало практически полное завершение превращения. Реакционную смесь разбавляли этилацетатом и промывали насыщенным Na2S2O3. Органический слой отделяли и сушили (Na2SO4). Фильтрация, концентрирование и очистка флэш-хроматографией на силикагеле (гексан/этилацетат 8:1) давали 0,71 г красного масла, которое, как определили, является смесью 2,5:1 3-хлор-4-йод-2-метоксианилина и исходного соединения: 1Н-ЯМР (300 МГц, CDCl3): δ 7,36 (д, 1Н, J=8,4 Гц), 6,45 (д, 1Н, J=8,4 Гц), 4,10 (уш.с, 2Н), 3,82 (с, 3Н) . Другие опыты с избытком йода давали аналогичные результаты. Смесь объединяли со смесью предыдущего опыта и использовали без дополнительной очистки.
33. Получение 4-хлор-2,6-дифтор-3-метиланилина
Раствор 2,6-дифтор-3-метиланилина (15 г, 105 ммоль) в уксусной кислоте (80 мл) нагревали до 70°С и добавляли по каплям в течение 20 минут раствор сульфурилхлорида (16,0 г, 115 ммоль) в уксусной кислоте (40 мл). Температуру выдерживали в течение 3 часов, затем охлаждали и концентрировали. Остаток растворяли в воде (100 мл) и pH доводили до 9 2N гидроксидом натрия и затем экстрагировали метиленхлоридом (2 × 75 мл) и объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток перегоняли, получая 4-хлор-2,6-дифтор-3-метиланилин (12,2 г, 69 ммоль): т.кип. 55-65°C/55 мм.
34. Получение 1-бром-3-хлор-4-йод-2-метоксибензола
Смесь 3-хлор-2-метоксианилина и 3-хлор-4-йод-2-метоксианилина (2,8 г, 2,5:1) растворяли в диоксане (20 мл) и полученный в результате раствор охлаждали в ледяной бане, обрабатывая 48% HBr (20 мл). Затем темно-фиолетовую смесь обрабатывали NaNO2 (1,4 г, 19,5 ммоль) в воде (6 мл) при интенсивном перемешивании. Через 10 минут добавляли CuBr (5,1 г, 35,5 ммоль) и смесь вынимали из ледяной бани, нагревали до комнатной температуры и перемешивали в течение 0,5 часа. Темно-фиолетовую смесь разбавляли этилацетатом и водой, затем фильтровали через целит, используя этилацетат. Слои разделяли и органический слой промывали насыщенным раствором сульфита натрия и насыщенным раствором хлорида аммония и сушили (Na2SO4). Фильтрация, концентрирование и очистка флэш-хроматографией на силикагеле (гексан) давали 2,95 г бесцветного масла, которое, как определили, является смесью 2,3:1 1-бром-3-хлор-2-метоксибензола и 1-бром-3-хлор-4-йод-2-метоксибензола, которую использовали без дополнительной очистки: 1Н-ЯМР (300 МГц, CDCl3): δ 7,49 (д, 1Н), 7,19 (д, 1Н), 3,90 (с, 3Н).
35. Получение 1-хлор-3,5-дифтор-4-триметилсилилбензола
К раствору 3,5-дифтор-1-хлорбензола (10,0 г, 67 ммоль) и тетраметилендиамина (TMEDA; 7,8 г, 67 ммоль) в ТГФ (75 мл) при -75°С добавляли н-бутиллитий (2,5М, 68 ммоль) и полученный в результате раствор перемешивали в течение 30 минут. Добавляли раствор триметилсилилхлорида (7,6 г, 70 ммоль) в ТГФ (15 мл) и раствор нагревали до температуры окружающей среды и перемешивали в течение 25 часов. Добавляли хлорид аммония (насыщенный раствор, 15 мл) и смесь экстрагировали этиловым эфиром (2 × 100 мл) и объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток - масло перегоняли, получая 1-хлор-3,5-дифтор-4-триметилсилилбензол (13,0 г, 60 ммоль): т.кип. 70-75°C.
36. Получение 6-хлор-2,4-дифтор-3-триметилсилилбензальдегида
Раствор 1-хлор-3,5-дифтор-4-триметилсилилбензола (1,5 г, 6,8 ммоль) в ТГФ (10 мл) добавляли к раствору тетраметилпиперидин лития (14 ммоль) в ТГФ (15 мл) при -75°С. Раствор перемешивали в течение 2 часов, затем добавляли DMF (1,5 г, 20 ммоль) и раствор нагревали до температуры окружающей среды. Реакцию гасили насыщенным раствором хлорида аммония (25 мл) и экстрагировали этилацетатом (2 × 25 мл) и объединенные экстракты сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (гексан), чтобы получить 6-хлор-2,4-дифтор-3-триметилсилилбензальдегид (1,4 г, 5,6 ммоль): LC/MS (m/z = 248).
37. Получение 6-хлор-2,4-дифтор-3-йодбензальдегида
Раствор 6-хлор-2,4-дифтор-3-триметилсилилбензальдегида (600 мг, 2,4 ммоль) в метиленхлориде (7 мл) охлаждали до 0°С и обрабатывали раствором йодхлорида (780 мг, 4,8 ммоль) в метиленхлориде (10 мл) и перемешивали при температуре окружающей среды в течение 2 часов. Добавляли дополнительное количество йодхлорида (900 мг) и раствор кипятили с обратным холодильником в течение 40 минут. Раствор охлаждали и промывали бисульфитом натрия (15 мл, 5% раствор), водой (10 мл) и насыщенным раствором бикарбоната натрия (10 мл). Органическую фазу сушили (сульфат натрия) и концентрировали, получая 6-хлор-2,4-дифтор-3-йодбензальдегид (620 мг, 3,9 моль): LC/MS (m/z = 302).
38. Получение 1-бром-2,4-дифтор-5-метоксибензола
К раствору 1,3-дибром-4,6-дифторбензола (10,0 г, 37 ммоль) в ТГФ (50 мл) при -20°С добавляли изопропилмагнийхлорид (2,0 М в ТГФ, 42 ммоль) и полученную в результате смесь нагревали до 0°С и перемешивали в течение 30 минут. Добавляли триметилборат (4,7 г, 45 ммоль) и смесь перемешивали при температуре окружающей среды в течение 1 часа. Раствор повторно охлаждали до -20°С и добавляли перуксусную кислоту (32%, 50 ммоль) и раствор перемешивали при температуре окружающей среды в течение 30 минут. Затем раствор гасили бисульфитом натрия (5% раствор, 75 мл) и затем подкисляли 6N соляной кислотой и экстрагировали этиловым эфиром (2 × 75 мл). Объединенные экстракты сушили (сульфат натрия) и концентрировали. Неочищенный фенол растворяли в ацетонитриле (40 мл) и добавляли карбонат калия (10 г, 74 ммоль) и йодметан (5,7 г, 40 ммоль) и перемешивали при температуре окружающей среды в течение 20 часов. Раствор концентрировали и остаток растворяли в воде (50 мл) и экстрагировали этиловым эфиром (2 × 75 мл) и объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (гексан), чтобы получить 1-бром-2,4-дифтор-5-метоксибензол (2,0 г, 8,6 ммоль): LC/MS (m/z = 223).
39. Получение 2-хлор-4,6-дифтор-1-йод-3-метоксибензола
Раствор 4-хлор-2,6-дифтор-1-йод-3-метоксибензол (2,0 г, 6,6 ммоль) в ТГФ (7 мл) добавляли к LDA (8,0 ммоль) в ТГФ (15 мл) при -55°С и реакционную смесь перемешивали в течение 2 часов. Раствор разбавляли этиловым эфиром (50 мл) и промывали хлоридом аммония (насыщенный раствор, 25 мл), соляным раствором и затем сушили (сульфат натрия) и концентрировали. Остаток - масло очищали хроматографией с обращенной фазой (70% ацетонитрила в воде), чтобы получить 2-хлор-4,6-дифтор-1-йод-3-метоксибензол (500 мг, 1,7 ммоль): LC/MS (m/z = 304).
40. Получение 4-хлор-3-(диметиламино)-2-фторфенилбороновой кислоты
N-(3-бром-6-хлор-2-фторфенил)-N,N-диметиланилин (0,88 г, 3,5 ммоль) растворяли в эфире (10 мл) в высушенной в сушильном шкафу, продутой азотом 50 мл 3-горлой колбе, снабженной термометром. Раствор охлаждали до -60°С в атмосфере азота. Добавляли по каплям через шприц н-бутиллитий (0,23 г, 3,6 ммоль, 1,45 мл 2,5 М раствора), поддерживая температуру ниже -55°С. Через 0,5 часа добавляли через шприц триметилборат (0,40 г, 0,38 ммоль) и реакционную смесь нагревали до комнатной температуры. Добавляли 1N HCl (3,5 мл) и смесь перемешивали в течение 0,5 часа. Смесь разбавляли водой и эфиром и эфирный слой отделяли и сушили над Nа2SO4. Фильтрация и концентрирование давало 0,753 г пены, которую растирали с гексаном. Полученный в результате твердый остаток собирали фильтрацией и сушили, чтобы получить 4-хлор-3-(диметиламино)-2-фторфенилбороновую кислоту (0,5 г, 2,3 ммоль) в виде грязно-белого твердого остатка: с помощью 1H ЯМР (ДМСО-d 6) обнаружили, что остаток является смесью того, что, по-видимому, является бороновой кислотой и ангидридами. Твердый остаток использовали без дополнительной очистки и характеризации.
Следующие соединения получали в соответствии с методикой примера 40.
4-хлор-3-(диэтиламино)-2-фторфенилбороновая кислота: 1Н-ЯМР (300 МГц, ДМСО d6 + D2O): δ 8,26 (уш.с, 2Н), 7,26 (м, 2Н), 3,05 (кв, 4Н), 0,91 (т, 6Н).
2,4-дихлор-3-диметиламинофенилбороновая кислота. Вещество выделяли в виде маслянистой смеси бороновой кислоты и ангидрида и использовали без дополнительной очистки или характеризации.
2-хлор-4-фтор-3-метоксифенилбороновая кислота (использовали без очистки)
41. Получение [3-хлор-2-фтор-3-(4,4,5,5-тетраметил-{1,3,2}диоксоборолан-2-ил)фенилметиламина
N-(3-бром-6-хлор-2-фторфенил)-N-метиламин (0,84 г, 3,5 ммоль) растворяли в DMF (10 мл) в продутой азотом 50 мл 3-горлой колбе и полученный в результате раствор продували азотом в течение 0,5 часа. Одновременно добавляли бис(пинаколато)диборон (0,98 г, 3,9 ммоль), ацетат калия (1,04 г, 10,6 ммоль) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорид палладия (II) · CH2Cl2 (0,14 г, 0,18 ммоль) и смесь нагревали до 110°С с помощью продувания азотом до 60°С и, затем, в открытой атмосфере азота в течение 1,5 часов. Реакционную смесь охлаждали до комнатной температуры и распределяли между этилацетатом и соляным раствором и слои разделяли. Водный слой экстрагировали этилацетатом и объединенные органические слои промывали соляным раствором и сушили (Na2SO4). Фильтрация, концентрирование и очистка флэш-хроматографией на силикагеле (гексан:этилацетат / 5:1) дали [3-хлор-2-фтор-3-(4,4,5,5-тетраметил-{1,3,2}диоксоборолан-2-ил)фенилметиламин (0,85 г): светло-зеленый твердый остаток: 1Н-ЯМР (300 МГц, CDCl3): δ 7,05 (м, 2Н), 3,96 (уш.с, 1Н), 3,06 (д, 3Н), 1,35 (с, 12Н).
42. Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-тиометил)фенил)пиридин-2-карбоновой кислоты (соединение 1).
Раствор метилового эфира 4-амино-3,6-дихлорпиридин-2-карбоновой кислоты (2,6 г, 0,012 моль), 2-(4-хлор-2-фтор-3-тиометилфенил)-[1,3,2]диоксаборинана (4,1 г, 0,016 моль), 1,4-бис(дифенилфосфин)бутана (0,610 мг, 0,0015 моль) и фторида цезия (6,7 г, 0,045 моль) в ацетонитриле (75 мл) дегазировали азотом в течение 15 минут. Добавляли ацетат палладия (0,30 г, 0,0015 моль) и смесь кипятили с обратным холодильником в течение 4 часов. Реакционную смесь гасили водой и экстрагировали этилацетатом (2 × 100 мл) и объединенные экстракты сушили (сульфат натрия) и концентрировали. Твердый остаток очищали хроматографией (25-40% этилацетата в гексане), чтобы получить метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-тиометилфенил)пиридин-2-карбоновой кислоты (2,0 г, 0,005 моль): 1Н-ЯМР (ДМСО-d6): δ 7,78 (т, 1Н), 7,50 (д, 1Н), 7,25 (с, 1Н), 3,95 (с, 3Н), 2,50 (с, 3Н).
Следующие соединения получали в соответствии с методикой примера 42 (в некоторых случаях вместо эфира использовали неочищенную бороновую кислоту).
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-3-циано-2-фторфенил)пиридин-2-карбоновой кислоты (соединение 2): т.пл. 189-190°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксиметилфенил)пиридин-2-карбоновой кислоты (соединение 3): т.пл. 116-117°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-дифторметилфенил)пиридин-2-карбоновой кислоты (соединение 4): т.пл. 145-146°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-фторметилфенил)пиридин-2-карбоновой кислоты (соединение 5): 1Н-ЯМР (CDCl3): δ 8,05 (дт, 1Н), 7,25 (д, 1Н), 7,15 (с, 1Н), 5,65 (дд, 2Н), 4,95 (уш.с, 2Н), 4,00 (с, 3Н).
Метиловый эфир 4-амино-3-хлор-6-(4-циано-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 6): 1Н-ЯМР (CDCl3): δ 7,70 (м, 1Н), 7,20 (дд, 1Н), 7,10 (д, 1Н), 4,95 (уш.с, 2Н), 4,00 (с, 3Н).
Метиловый эфир 4-амино-3-хлор-6-(2,4-дихлор-3-этоксифенил)пиридин-2-карбоновой кислоты (соединение 7): т.пл. 132-133°C.
Метиловый эфир 4-амино-3-хлор-6-[4-дихлор-2-фтор-3-(2,2-дифторэтокси)фенил]пиридин-2-карбоновой кислоты (соединение 8): т.пл. 134-136°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-5-этоксифенил)пиридин-2-карбоновой кислоты (соединение 9): т.пл. 115-116°C.
Метиловый эфир 4-амино-3-хлор-6-[2,4-дихлор-3-(2,2-дифторэтокси)фенил]пиридин-2-карбоновой кислоты (соединение 10): т.пл. 113-115°C.
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(метоксиэтокси)фенил]пиридин-2-карбоновой кислоты (соединение 11): т.пл. 89-90°C.
Метиловый эфир 4-амино-3-хлор-5-фтор-6-(2-фтор-3,4-метилендиоксифенил)пиридин-2-карбоновой кислоты (соединение 12): т.пл. 151-152°C.
Метиловый эфир 4-амино-3-хлор-6-(2,4-дихлор-3-метилтиофенил)пиридин-2-карбоновой кислоты (соединение 13): 1Н-ЯМР (CDCl3): δ 7,45 (д, 1Н), 7,40 (д, 1Н), 6,98 (с, 1Н), 4,97 (уш.с, 2Н), 3,98 (с, 3Н), 2,44 (с, 3Н).
Метиловый эфир 4-амино-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 14): т.пл. 172-173°C.
Метиловый эфир 4-амино-3-хлор-5-фтор-6-(4-хлор-2-фтор-5-метоксифенил)пиридин-2-карбоновой кислоты (соединение 15): т.пл. 168-169°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-3-диметиламино-2-фторфенил)пиридин-2-карбоновой кислоты (соединение 16): т.пл. 104-106°C.
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-3-(диэтиламино)-2-фторфенил)пиридин-2-карбоновой кислоты (соединение 17): т.пл. 120-121°C.
43. Получение метилового эфира 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-5-метоксифенил)пиридин-2-карбоновой кислоты (соединение 18).
Раствор метилового эфира 4-ацетиламино-3,6-дихлорпиридинкарбоновой кислоты (4,3 г, 0,016 моль), 2-(4-хлор-2-фтор-5-метоксифенил)-[1,3,2]-диоксаборинана (4,5 г, 0,018 моль), фторида цезия (3,5 г, 0,025 моль) и 1,4-бис(дифенилфосфин)бутана (0,360 г, 0,0016 моль) в ацетонитриле (100 мл) дегазировали азотом в течение 15 минут перед добавлением ацетата палладия (0,180 г, 0,0016 моль) и раствор кипятили с обратным холодильником в течение 18 часов. Добавляли воду (150 мл) и полученный в результате твердый остаток собирали и сушили, чтобы получить метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-5-метоксифенил)пиридин-2-карбоновой кислоты (4,5 г, 0,012 моль): т.пл. 180-182°C.
Следующие соединения получали в соответствии с методикой примера 43.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-3-метилфенил)пиридин-2-карбоновой кислоты (соединение 19): т.пл. 151-152°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 20): т.пл. 159-160°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-3-этоксифенил)пиридин-2-карбоновой кислоты (соединение 21): 1Н-ЯМР (CDCl3): δ 9,00 (уш.с, 1Н), 8,00 (м, 1Н), 7,60 (м, 1Н), 7,25 (с, 1Н), 4,25 (кв, 2Н), 4,00 (с, 3Н), 2,35 (с, 3Н), 1,50 (т, 3Н).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,4-дихлор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 22): 1Н-ЯМР (CDCl3): δ 8,90 (с, 1Н), 8,05 (с, 1Н), 7,40 (д, 1Н), 7,30 (д, 1Н), 4,05 (с, 3Н), 3,95 (с, 3Н), 2,35 (с, 3Н).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2-фтор-3,4-метилендиоксифенил)пиридин-2-карбоновой кислоты: т.пл. 132-134°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,4-дихлор-3-этокси-2-фторфенил)пиридин-2-карбоновой кислоты: 1Н-ЯМР (CDCl3): δ 8,86 (с, 1Н), 8,00 (уш.с, 1Н), 7,37 (д, 1Н), 7,26 (д, 1Н), 4,11 (кв, 2Н), 4,00 (с, 3Н), 2,32 (с, 3Н), 1,47 (т, 3Н).
Метиловый эфир 4-ацетиламино-3-хлор-6-[2,4-дихлор-3-(2,2-дифторэтокси)фенил]пиридин-2-карбоновой кислоты: 1Н-ЯМР (CDCl3): δ 8,81 (с, 1Н), 8,10 (уш.с, 1Н), 7,32 (д, 1Н), 7,29 (д, 1Н), 6,16 (тт, 1Н), 4,22 (тд, 2Н), 3,95 (с, 3Н), 2,28 (с, 3Н).
44. Получение метилового эфира 4-ацетиламино-3-хлор-6-(2,4-дифтор-3-метилфенил)пиридин-2-карбоновой кислоты (соединение 23).
Раствор 1-бром-2,4-дифтор-3-метилбензола (2,10 г, 0,09 моль), метилового эфира 4-ацетиламино-3-хлор-6-триметилстаннилпиридин-2-карбоновой кислоты (4,00 г, 0,01 моль), 1,4-бис(дифенилфосфин)бутана (0,140 г, 0,0003 моль) и фторида цезия (4,5 г, 0,03 моль) в ацетонитриле (100 мл) дегазировали азотом. Добавляли ацетат палладия (0,70 г, 0,0003 моль) и смесь кипятили с обратным холодильником в течение 2 часов. Реакционную смесь фильтровали через целит и фильтрат разбавляли водой (200 мл) и затем экстрагировали этилацетатом (2 × 150 мл). Объединенные органические фазы сушили и концентрировали и твердый остаток очищали хроматографией (50% этилацетата в гексане), чтобы получить метиловый эфир 4-ацетиламино-3-хлор-6-(2,4-дифтор-3-метилфенил)пиридин-2-карбоновой кислоты (0,800 г, 0,002 моль): т.пл. 152-153°C.
Следующие соединения получали в соответствии с методикой примера 44.
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,4-дихлор-3-метилфенил)пиридин-2-карбоновой кислоты (соединение 24): т.пл. 172-174°C.
45. Получение (2-фтор-3-метокси-4-трифторметилфенил)-триметилстаннана.
Диоксан (28 мг) добавляли в высушенную в сушильном шкафу, продутую азотом 100 мл 3-горлую колбу, оборудованную холодильником и магнитной мешалкой, продували азотом в течение 15 минут. Добавляли гексаметилдиолово (5,0 г, 15,3 ммоль) и 1-бром-2-фтор-3-метокси-4-(трифторметил)бензол (3,8 г, 13,9 ммоль) и продувание продолжали в течение 5 минут. Добавляли 1,4-бис(дифенилфосфин)бутан (0,6 г, 1,4 ммоль) и ацетат палладия (0,3 г, 1,4 моль) и свободное пространство реакционного сосуда продували азотом при нагревании до температуры кипения при перемешивании. Затем реакцию перемешивали при кипячении с обратным холодильником в открытой атмосфере азота в течение 6 часов. ТСХ (гексан) показала полное исчезновение исходного соединения. Охлажденную реакционную смесь концентрировали и очищали флэш-хроматографией на силикагеле (гексан), чтобы получить (2-фтор-3-метокси-4-трифторметилфенил)триметилстаннан (3,93 г, 11,0 ммоль) в виде масла: 1Н-ЯМР (CDCl3): δ 7,31 (д, 1Н), 7,11 (дд, 1Н), 3,98 (д, 3Н), 0,38 (с, 9Н). Все сигналы имели соответствующие сателлиты олова.
Следующие соединения получали в соответствии с методикой примера 45.
(3-бутокси-4-хлор-2-фторфенил)триметилстаннан (использовали без очистки).
4-хлор-2-фтор-3-(1-фтор-1-метилэтил)триметилстаннан (использовали без очистки).
46. Получение метилового эфира 4-ацетиламино-3-хлор-6-(2-фтор-3-метокси-4-трифторметилфенил)пиридин-2-карбоновой кислоты.
В высушенной в сушильном шкафу, продутой азотом 100 мл 3-горлой колбе, оборудованной холодильником и магнитной мешалкой, растворяли метил-4-ацетиламино-3,6-дихлорпиридин-2-карбоксилат (1,2 г, 4,6 ммоль) и (2-фтор-3-метокси-4-трифторметилфенил)триметилстаннан (1,7 г, 4,6 ммоль) в ацетонитриле (15 мл) и полученный в результате раствор повторно продували азотом в течение 15 минут. Добавляли фторид цезия (2,1 г, 13,9 ммоль), 1,4-бис(дифенилфосфин)бутана (0,2 г, 046 ммоль) и ацетат палладия (0,1 г, 0,46 ммоль) и свободное пространство в реакционном сосуде продували азотом при перемешивании по мере того, как реакционная смесь нагревалась до температуры кипения. Затем реакционную смесь перемешивали в открытой атмосфере азота в течение 5 часов, после которых ТСХ (гексан:этилацетат / 1:2) показало полное превращение исходного соединения. Охлажденную реакционную смесь фильтровали через целит, используя этилацетат, и фильтрат концентрировали и очищали флэш-хроматографией на силикагеле (гексан:этилацетат/2:1), получая метиловый эфир 4-ацетиламино-3-хлор-6-(2-фтор-3-метокси-4-трифторметилфенил)пиридин-2-карбоновой кислоты (0,19 г, 0,46 ммоль) в виде масла: 1Н-ЯМР (CDCl3): δ 9,03 (д, 1Н), 8,02 (уш.с, 1Н), 7,68 (уш.т, 1Н), 7,42 (уш.д, 1Н), 4,03 (д, 3Н), 4,01 (с, 3Н), 2,33 (с, 3Н).
Следующие соединения получали в соответствии с методикой примера 46.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-3-бутокси-2-фторфенил)пиридин-2-карбоновой кислоты: LC/ESI (m/z = 428).
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(1-фтор-1-метилэтил)фенил]пиридин-2-карбоновой кислоты (соединение 25): т.пл. 122-123°C.
47. Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-5-нитрофенил)пиридин-2-карбоновой кислоты.
Добавляли метил-4-амино-3-хлор-6-(4-хлор-2-фторфенил)пиридин-2-карбоксилат (1,0 г, 3,2 ммоль) в виде твердого вещества к интенсивно перемешиваемой концентрированной серной кислоте (16 мл) при 0°С. Добавляли нитрат натрия (0,29 г, 3,5 ммоль) к смеси и полученный в результате желтый раствор перемешивали при 0°С в течение 1,5 часов, затем разбавляли большим количеством льда и нагревали до комнатной температуры. Раствор фильтровали, чтобы удалить твердые вещества, затем фильтрат экстрагировали 3 раза этилацетатом и объединенные этилацетатные слои промывали насыщенным водным раствором NaHCO3 и сушили (Na2SO4). Фильтрация и концентрирование давали метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-5-нитрофенил)пиридин-2-карбоновой кислоты (0,96 г, 2,7 ммоль) в виде желтого твердого остатка: т.пл. 161-163°C: 1Н-ЯМР (CDCl3): δ 8,73 (д, 1Н), 7,36 (д, 1Н), 7,24 (д, 1Н), 4,93 (уш.с, 2Н), 4,02 (с, 3Н).
48. Получение метилового эфира 4-амино-3-хлор-6-(5-амино-4-хлор-2-фторфенил)пиридин-2-карбоновой кислоты.
Железный порошок (0,78 г, 13,9 ммоль) добавляли к суспензии метил-4-амино-3-хлор-6-(4-хлор-2-фтор-5-нитрофенил)пиридин-2-карбоксилата (0,5 г, 1,39 ммоль) в уксусной кислоте (20 мл) в 100 мл круглодонной колбе. Смесь нагревали до 85°С в течение 15 минут, затем охлаждали до комнатной температуры и фильтровали через целит, используя этанол, и фильтрат концентрировали в вакууме. Остаток распределяли между этилацетатом и насыщенным NaHCO3, слои разделяли, водную фазу экстрагировали этилацетатом и объединенные органические фазы сушили (Na2SO4). Фильтрация и концентрирование давали метиловый эфир 4-амино-3-хлор-6-(5-амино-4-хлор-2-фторфенил)пиридин-2-карбоновой кислоты (0,44 г, 1,33 ммоль) в виде светло-коричневого твердого остатка: т.пл. 99-101°C.
49. Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-5-диметиламино-2-фторфенил)пиридин-2-карбоновой кислоты (соединение 26).
Метил-4-амино-3-хлор-6-(5-амино-4-хлор-2-фторфенил)пиридин-2-карбоксилат (0,38 г, 1,13 ммоль) растворяли в ТГФ (10 мл) в продутой азотом 250 мл круглодонной колбе и обрабатывали 37% формальдегидом (0,068 г, 0,17 мл, 2,27 ммоль), дихлоридом дибутилолова (0,007 г, 0,023 ммоль) и фенилсиланом (0,135 г, 1,25 ммоль) и перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь концентрировали в вакууме и очищали флэш-хроматографией на силикагеле (гексан:этилацетат / 2:1), чтобы получить метиловый эфир 4-амино-3-хлор-6-(4-хлор-5-диметиламино-2-фторфенил)пиридин-2-карбоновой кислоты (0,283 г, 0,8 ммоль) в виде рыхлого белого остатка: т.пл. 113-115°C, 1Н-ЯМР (CDCl3): δ 7,66 (д, 1Н), 7,14 (д, 1Н), 7,14 (д, 1Н), 4,91 (уш.с, 2Н), 3,99 (с, 3Н), 2,79 (с, 6Н).
50. Получение метилового эфира 4-ацетиламино-3-хлор-6-йодпиридин-2-карбоновой кислоты.
К раствору метилового эфира 4-ацетиламино-3-хлор-6-триметилстаннанилпиридин-2-карбоновой кислоты (21,0 г, 54 ммоль) в метиленхлориде (200 мл) добавляли йод (13,7 г, 108 ммоль) и раствор перемешивали в течение 1 часа при температуре окружающей среды. Раствор фильтровали через слой целита и затем промывали тиосульфатом натрия (50 мл, 10% раствор), сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (10% этилацетата в гексане), чтобы получить метиловый эфир 4-ацетиламино-3-хлор-6-йод-пиридин-2-карбоновой кислоты (5,6 г, 18 ммоль): GC-MS (m/z = 354).
51. Получение метилового эфира 4-амино-3-хлор-6-йод-пиридин-2-карбоновой кислоты.
К раствору метилового эфира 4-ацетиламино-3-хлор-6-йодпиридин-2-карбоновой кислоты (5,0 г, 14 ммоль) в метаноле (25 мл) добавляли ацетилхлорид (1 мл) и раствор кипятили с обратным холодильником в течение 1 часа. Раствор охлаждали и добавляли воду (25 мл) и осадок собирали. Перекристаллизация из метанола давала метиловый эфир 4-амино-3-хлор-6-йодпиридин-2-карбоновой кислоты (3,5 г, 11 ммоль): т.пл. 152-153°C.
52. Получение метилового эфира 4-амино-6-(4-бром-2-фтор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты (соединение 27).
Раствор метилового эфира 4-амино-3-хлор-6-йодпиридин-2-карбоновой кислоты (1,1 г, 3,0 ммоль), 4-бром-2-фтор-3-метоксифенилбороновой кислоты (1,3 г, 4,5 ммоль) и фторида цезия (0,60 г, 4,0 ммоль) в диметоксиэтане (2 мл) и воде (2 мл) продували азотом в течение 15 минут перед добавлением дихлорбис(трифенилфосфин)палладия (0,25 г, 0,4 ммоль) и затем грели при 85°С в течение 2 часов. Реакционную смесь разбавляли водой (15 мл) и экстрагировали этилацетатом (2 × 15 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (33% этилацетата в гексане), получая метиловый эфир 4-ацетиламино-6-(4-бром-2-фтор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты (1,2 г, 2,8 ммоль): т.пл. 164-165°C.
Следующие соединения получали в соответствии с методикой примера 52.
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,4,6-трифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-(2,4-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 28): т.пл. 114-115°C.
Метиловый эфир 4-ацетиламино-3-хлор-(2-хлор-4-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 29): т.пл. 153-154,5°C.
53. Получение метилового эфира 4-ацетиламино-3-хлор-6-[2,4-дихлор-3-(1-фторэтил)фенил]пиридин-2-карбоновой кислоты.
Раствор 2,4-дихлор-3-(1-фторэтил)бромбензола (3,4 г, 12,5 ммоль), метилового эфира 4-ацетиламино-3-хлор-6-триметилстаннилпиридин-2-карбоновой кислоты (4,7 г, 12,5 ммоль), йодида меди (0,4 г, 2,1 ммоль), фторида цезия (3,6 г, 25 ммоль) и дихлорбис(трифенилфосфин) палладия (0,14 г, 2 ммоль) в DMF (50 мл) грели при 70°С в течение 2 часов. Добавляли воду (100 мл) и смесь экстрагировали этилацетатом (2 × 100 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (15-30% этилацетата в гексане), чтобы получить метиловый эфир 4-ацетиламино-3-хлор-6-[2,4-дихлор-3-(1-фторэтил)фенил]пиридин-2-карбоновой кислоты, который использовали без дополнительной очистки.
Следующие соединения получали в соответствии с методикой примера 53.
Метиловый эфир 4-ацетиламино-3-хлор-(2,6-дифтор-3-метокси-4-метилфенил)пиридин-2-карбоновой кислоты: т.пл. 134-136°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты: т.пл. 146-147°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-3-диметиламино-2,6-дифторфенил)пиридин-2-карбоновой кислоты: (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты: (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,4-дихлор-6-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты: (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2,6-дифтор-3-этоксифенил)пиридин-2-карбоновой кислоты: (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-[4-хлор-2-фтор-3-(1-фторэтил)фенил]пиридин-2-карбоновой кислоты: (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-[2,4-дихлор-3-(дифторметил)фенил]пиридин-2-карбоновой кислоты (соединение 30): т.пл. 152-153°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-3-этил-2-фторфенил)пиридин-2-карбоновой кислоты: GC/PCI (m/z = 236).
Метиловый эфир 4-ацетиламино-3-хлор-6-[4-хлор-2-фтор-3-(1,2,2,2-тетрафторэтил)фенил]пиридин-2-карбоновой кислоты (соединение 31): LC/MS ESI (m/z = 456).
Метиловый эфир 4-ацетиламино-3-хлор-6-[4-хлор-2-фтор-3-(1-фторпропил)фенил]пиридин-2-карбоновой кислоты (соединение 32): LC/MS ESI (m/z = 416).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,3,4-трифторфенил)пиридин-2-карбоновой кислоты (соединение 33): т.пл. 169-171°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-3-метоксиметоксифенил)пиридин-2-карбоновой кислоты (соединение 34): т.пл. 122-123°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-3-дифторметоксифенил)пиридин-2-карбоновой кислоты (соединение 35): т.пл. 146°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-дифторметил-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2-фтор-4-фторметил-3-метоксифенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2,6-дифтор-3-метилфенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-6-(2-бром-4-хлор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-6-(4-бром-2,6-дифтор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(3-дифторметил-2,4,6-трифторфенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2-хлор-4-дифторметил-3-метоксифенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2,6-дифтор-3-дифторметилфенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2-хлор-4,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,4-дифтор-3-этоксифенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-3-циклопропил-2-фторфенил)пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
Метиловый эфир 4-ацетиламино-3-хлор-6-[4-хлор-2-фтор-3-(2,2,2-трифторацетил)фенил]пиридин-2-карбоновой кислоты (использовали без дополнительной очистки).
54. Получение метилового эфира 4-амино-3-хлор-6-(2-фтор-3-метокси-4-метилфенил)пиридин-2-карбоновой кислоты (соединение 36).
Раствор метилового эфира 4-амино-3,6-дихлорпиридин-2-карбоновой кислоты (0,24 г, 1,1 ммоль), 2-фтор-3-метокси-4-метилфенилбороновой кислоты (0,30 г, 1,63 ммоль) и фторида цезия (3,0 г, 3,26 ммоль) в диметоксиэтане (2 мл) и воде (2 мл) продували азотом в течение 15 минут перед добавлением дихлорбис(трифенилфосфин) палладия (0,07 г, 0,1 ммоль) и затем грели при 85°С в течение 2 часов. Реакционную смесь разбавляли водой (15 мл) и экстрагировали этилацетатом (2 × 15 мл). Объединенные экстракты промывали соляным раствором, сушили (сульфат натрия) и концентрировали. Остаток очищали хроматографией (33% этилацетата в гексане), чтобы получить метилового эфира 4-амино-3-хлор-6-(2-фтор-3-метокси-4-метилфенил)пиридин-2-карбоновой кислоты (0,08 г, 0,2 ммоль): т.пл. 95-96°C.
Следующие соединения получали в соответствии с методикой примера 52.
Метиловый эфир 4-амино-3-хлор-6-[2,4-дихлор-3-(диметиламино)фенил]пиридин-2-карбоновой кислоты (соединение 37): 1Н-ЯМР (300 МГц, CDCl3): δ 7,30 (д, 1Н), 7,19 (д, 1Н), 6,93 (с, 1Н), 4,88 (уш.с, 2Н), 3,96 (с, 3Н), 2,88 (с, 6Н).
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(метиламино)фенил]пиридин-2-карбоновой кислоты (соединение 38): т.пл. 148-149°C.
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(метоксикарбонил)фенил]пиридин-2-карбоновой кислоты (соединение 39): 1Н-ЯМР (300 МГц, CDCl3): δ 7,53 (д, 1Н), 7,37 (д, 1Н), 6,94 (с, 1Н), 4,97 (уш.с, 2Н), 3,97 (с, 3Н), 3,96 (с, 3Н).
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты: т.пл. 146-147°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-[4-хлор-3-(диметиламино)-2,6-дифторфенил]пиридин-2-карбоновой кислоты: 1Н-ЯМР (300 МГц, CDCl3): δ 8,70 (с, 1Н), 8,03 (уш.с, 1Н), 7,03 (дд, 1Н), 4,00 (с, 3Н), 2,83 (д, 6Н), 2,32 (с, 3Н).
Метиловый эфир 4-ацетиламино-3-хлор-6-(2,6-дифтор-3-метокси-4-метилфенил)пиридин-2-карбоновой кислоты: т.пл. 134-136°C.
Метиловый эфир 4-ацетиламино-6-(4-бром-2-хлор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты: т.пл. 129-130°C.
Метиловый эфир 4-ацетиламино-3-хлор-6-(4-хлор-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 40): т.пл. 144-144,5°C.
55. Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-этоксифенил)пиридин-2-карбоновой кислоты (соединение 41).
К раствору метилового эфира 4-ацетиламино-3-хлор-6-(4-хлор-2-фтор-3-этоксифенил)пиридин-2-карбоновой кислоты (0,5 г, 0,0013 моль) в метаноле (10 мл) добавляли ацетилхлорид (1 мл) и раствор кипятили с обратным холодильником в течение 1 часа. Добавляли воду (2 мл) и полученный в результате твердый остаток собирали и сушили, чтобы получить метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-этоксифенил)пиридин-2-карбоновой кислоты: т.пл. 154-156°C.
Следующие соединения получали в соответствии с методикой примера 55.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 42): т.пл. 141-142°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-5-метоксифенил)пиридин-2-карбоновой кислоты (соединение 43): 1Н-ЯМР (CDCl3): δ 7,60 (д, 1Н), 7,25 (с, 1Н), 7,20 (м, 1Н), 4,95 (уш.с, 2Н), 4,05 (с, 3Н), 3,95 (с, 3Н).
Метиловый эфир 4-амино-3-хлор-6-(2,4-дихлор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 44): т.пл. 168-170°C.
Метиловый эфир 4-амино-3-хлор-6-(2-фтор-3-метокси-4-трифторметилфенил)пиридин-2-карбоновой кислоты (соединение 45): т.пл. 144-146°C.
Метиловый эфир 4-амино-3-хлор-6-(2-фтор-3,4-метилендиоксифенил)пиридин-2-карбоновой кислоты (соединение 46): т.пл. 139-141°C.
Метиловый эфир 4-амино-3-хлор-6-(2,4-дифтор-3-метилфенил)пиридин-2-карбоновой кислоты (соединение 47): т.пл. 129-130°C.
Метиловый эфир 4-амино-3-хлор-6-(2,4-дихлор-3-метилфенил)пиридин-2-карбоновой кислоты (соединение 48): 1Н-ЯМР (CDCl3): δ 7,30 (д, 1Н), 7,25 (д, 1Н), 6,95 (с, 1Н).
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метилфенил)пиридин-2-карбоновой кислоты (соединение 49): т.пл. 116-118°C.
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-3-(диметиламино)-2,6-дифторфенил]пиридин-2-карбоновой кислоты (соединение 50): 1Н-ЯМР (300 МГц, CDCl3): δ 7,00 (дд, 1Н), 6,81 (с, 1Н), 4,93 (уш.с, 2Н), 3,96 (с, 3Н), 2,81 (д, 6Н).
Метиловый эфир 4-амино-3-хлор-6-(2,6-дифтор-3-метокси-4-метилфенил)пиридин-2-карбоновой кислоты (соединение 51): грязно-белая пена, 1Н-ЯМР (300 МГц, CDCl3): δ 6,83 (с, 1Н), 6,74 (дд, 1Н), 4,88 (уш.с, 2Н), 3,97 (с, 3Н), 3,84 (д, 3Н), 2,28 (с, 3Н).
Метиловый эфир 4-амино-6-(4-бром-2-хлор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты (соединение 52): т.пл. 154-155°C.
Метиловый эфир 4-амино-3-хлор-6-(2-хлор-4-дифторметил-6-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 53): LC/MS (m/z = 380).
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-3-дифторметил-2,6-дифторфенил)пиридин-2-карбоновой кислоты (соединение 54): LC/MS (m/z = 383).
Метиловый эфир 4-амино-3-хлор-(2-хлор-4,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 55): LC/MS (m/z = 348).
Метиловый эфир 4-амино-3-хлор-6-(2,4,6-трифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 56): HPLC-MS (m/z = 346).
Метиловый эфир 4-амино-3-хлор-6-(2,4-дихлор-6-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 57): HPLC-MS (m/z = 378).
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 58): HPLC-MS (m/z = 362).
Метиловый эфир 4-амино-3-хлор-6-(4-дихлор-2,6-дифтор-3-этоксифенил)пиридин-2-карбоновой кислоты (соединение 59): HPLC-MS (m/z = 376).
Метиловый эфир 4-амино-3-хлор-6-(4-дихлор-3-бутокси-2-фторфенил)пиридин-2-карбоновой кислоты (соединение 60): LC/MS ESI (m/z = 386).
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(1-фторэтил)фенил]пиридин-2-карбоновой кислоты (соединение 61): LC/MS ESI (m/z = 360).
Метиловый эфир 4-амино-3-хлор-6-(2,4-дихлор-3-дифторметилфенил)пиридин-2-карбоновой кислоты (соединение 62): LC/MS ESI (m/z = 380).
Метиловый эфир 4-амино-3-хлор-6-[2,4-дихлор-3-(1-фтор-1-этилфенил]пиридин-2-карбоновой кислоты (соединение 63): LC/MS ESI (m/z = 362).
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-3-этил-2-фторфенил)пиридин-2-карбоновой кислоты (соединение 64): т.пл. 120-122°C.
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(1,2,2,2-тетрафторэтил)фенил]пиридин-2-карбоновой кислоты (соединение 65): LC/MS ESI (m/z = 414).
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(1-фторпропил)фенил]пиридин-2-карбоновой кислоты (соединение 66): 1Н-ЯМР (300 МГц, CDCl3): δ 7,90 (м, 1Н), 7,25 (м, 1Н), 7,10 (с, 1Н), 5,96 (дкв, 1Н), 4,90 (уш.с, 2Н), 4,05 (с, 3Н), 2,30 (м, 1Н), 2,05 (м, 1Н), 1,05 (т, 3Н).
Метиловый эфир 4-амино-3-хлор-6-(2,3,4-трифторфенил)пиридин-2-карбоновой кислоты (соединение 67): т.пл. 163-164°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксиметоксифенил)пиридин-2-карбоновой кислоты (соединение 68): т.пл. 99°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-дифторметоксифенил)пиридин-2-карбоновой кислоты (соединение 69): т.пл. 164°C.
Метиловый эфир 4-амино-3-хлор-6-(2,4-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 70): LC/MS (m/z = 328).
Метиловый эфир 4-амино-3-хлор-6-(4-дифторметил-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 71): т.пл. 145-147°C.
Метиловый эфир 4-амино-3-хлор-6-(2-фтор-4-фторметил-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 72): LC/MS (m/z = 342).
Метиловый эфир 4-амино-3-хлор-6-(2,4-дифтор-5-метоксифенил)пиридин-2-карбоновой кислоты (соединение 73): т.пл. 128-130°C.
Метиловый эфир 4-амино-3-хлор-6-(2-хлор-4-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 74): т.пл. 145-146°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-2,6-дифтор-3-метилфенил)пиридин-2-карбоновой кислоты (соединение 75): LC/MS (m/z = 346).
Метиловый эфир 4-амино-6-(2-бром-4-хлор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты (соединение 76): LC/MS (m/z = 405).
Метиловый эфир 4-амино-6-(4-бром-2,6-дифтор-3-метоксифенил)-3-хлорпиридин-2-карбоновой кислоты (соединение 77): LC/MS (m/z = 407).
Метиловый эфир 4-амино-3-хлор-6-(3-дифторметил-2,4,6-трифторфенил)пиридин-2-карбоновой кислоты (соединение 78): LC/MS (m/z = 366).
Метиловый эфир 4-амино-3-хлор-6-(2-хлор-4-дифторметил-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 79): т.пл. 134-136°C.
Метиловый эфир 4-амино-3-хлор-6-(2,4-дифтор-3-этоксифенил)пиридин-2-карбоновой кислоты (соединение 80): т.пл. 158-159°C.
Метиловый эфир 4-амино-3-хлор-6-(4-хлор-3-циклопропил-2-фторфенил)пиридин-2-карбоновой кислоты (соединение 81): т.пл. 135-136,5°C.
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(2,2,2-трифторацетил)фенил]пиридин-2-карбоновой кислоты (соединение 82): LC/MS (m/z = 410).
56. Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метансульфинилфенил)пиридин-2-карбоновой кислоты (соединение 83) и метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метансульфонилфенил)пиридин-2-карбоновой кислоты (соединение 84).
К раствору метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метилтиофенил)пиридин-2-карбоновой кислоты (0,800 г, 2 ммоль) в метиленхлориде (20 мл) медленно добавляли перуксусную кислоту (32% в уксусной кислоте, 0,004 моль). Реакционную смесь гасили бисульфитом натрия (10% в воде, 20 мл) и экстрагировали метиленхлоридом (20 мл). Органическую фазу сушили (сульфат натрия) и концентрировали. Твердый остаток очищали хроматографией (15-50% этилацетата в гексане). Первой фракцией был метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метансульфонилфенил)пиридин-2-карбоновой кислоты (0,250 г, 0,7 ммоль): т.пл. 108-110°C. Второй фракцией был метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метансульфинилфенил)пиридин-2-карбоновой кислоты (0,100 г, 0,03 ммоль): т.пл. 122-124°C.
57. Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-фторметилтиофенил)пиридин-2-карбоновой кислоты (соединение 85).
К раствору метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метилтиофенил)пиридин-2-карбоновой кислоты (1,50 г, 4,1 ммоль) в ацетонитриле (40 мл) добавляли 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октан-бис(тетрафторборат) (F-TEDA; SELECTFLUORTM фторирующий агент; 1,48 г, 8,2 ммоль) и раствор перемешивали при температуре окружающей среды в течение 2 часов. Добавляли насыщенный раствор бикарбоната натрия (25 мл) и раствор экстрагировали метиленхлоридом (2 × 50 мл). Объединенные экстракты сушили (сульфат натрия) и концентрировали, и остаток очищали хроматографией (20-50% этилацетата в гексане), чтобы получить метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-фторметилтиофенил)пиридин-2-карбоновой кислоты (0,09 г, 0,2 ммоль): т.пл. 104-105°C.
58. Получение этилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 86).
К раствору метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (200 мг, 0,9 ммоль) в этаноле (5 мл) добавляли каталитическое количество тетраизопропоксида титана, и раствор кипятили с обратным холодильником в течение 2 часов. Раствор охлаждали и распределяли между этилацетатом (10 мл) и водой (10 мл) и органическую фазу сушили (сульфат натрия) и концентрировали. Остаток пропускали через слой силикагеля (1:1 этилацетат:гексан), получая этиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (150 мг, 0,6 ммоль): т.пл. 74-75°C.
Следующие соединения получали в соответствии с методикой примера 58.
2-бутоксиэтиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 87): LC/MS (m/z = 430).
Бутиловый эфир 4-амино-3-хлор-6-(4-хлор-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 88): LC/MS (m/z = 404).
Бутиловый эфир 4-амино-3-хлор-6-(2,4-дихлор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 89): LC/MS ESI (m/z = 402).
Бутиловый эфир 4-амино-3-хлор-6-(4-бром-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 90): LC/MS ESI (m/z = 430).
Бутиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(1-фторэтил)фенил]пиридин-2-карбоновой кислоты (соединение 91): LC/MS ESI (m/z = 402).
2-бутоксиэтиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 92): т.пл. 72-74°C.
59. Получение 4-амино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты.
Суспензию 4-ацетиламино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин (0,13 г, 0,33 ммоль) в метаноле (5 мл) обрабатывали 1N гидроксидом натрия (1,7 мл) и перемешивали при температуре окружающей среды в течение 1 часа. Раствор разбавляли водой (15 мл) и подкисляли 1N соляной кислотой (1,7 мл) и собирали твердый остаток (0,095 г). Анализ 1H ЯМР показал 4-амино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновую кислоту и примеси. Вещество использовали без дополнительной очистки.
Следующие соединения получали в соответствии с методикой примера 59.
4-амино-3-хлор-6-(2,6-дифтор-3-метокси-4-метилфенил)пиридин-2-карбоновая кислота (соединение 93): т.пл. 167-168°C.
4-амино-3-хлор-6-(4-хлор-2,6-дифтор-3-диметиламинофенил)пиридин-2-карбоновая кислота (соединение 94): т.пл. 171-172°C.
60. Получение метилового эфира 4-амино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 95).
Суспензию 4-амино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты в тетрагидрофуране (10 мл) и метаноле (3 мл) обрабатывали триметилсилилдиазометаном (0,64 г, 0,28 мл 2M раствора в гексане) при температуре окружающей среды. Через 1 час реакционную смесь гасили уксусной кислотой (2 мл) и водой (10 мл). Смесь экстрагировали этилацетатом (2 × 20 мл) и объединенные экстракты сушили (Na2SO4) и концентрировали. Остаток очищали хроматографией (30-100% этилацетата в гексане), получая метиловый эфир 4-амино-3-хлор-6-(4-циано-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновой кислоты (0,083 г, 0,24 ммоль): 1Н-ЯМР (CDCl3): δ 7,15 (дд, 1Н), 6,85 (с, 1Н), 4,98 (уш.с, 2Н), 4,08 (д, 3Н), 3,98 (с, 3Н).
61. Получение 4-амино-3-хлор-6-(4-хлор-2-фтор-3-(2,2-дифторэтокси)фенил)пиридин-2-карбоновой кислоты (соединение 96).
Раствор метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-(2,2-дифторэтокси)фенил)пиридин-2-карбоновой кислоты (0,300 г, 0,0008 моль) в метаноле (5 мл) и гидроксид натрия (1N, 2 мл) обрабатывали при кипячении с обратным холодильником в течение 1 часа и затем подкисляли до pH 3 (концентрированной соляной кислотой) и охлаждали. Полученный в результате твердый остаток собирали и сушили, получая 4-амино-3-хлор-6-(4-хлор-2-фтор-3-(2,2-дифторэтокси)фенил)пиридин-2-карбоновую кислоту (0,270 г, 0,0007 моль): т.пл. 183-184°C дек.
Следующие соединения получали в соответствии с методикой примера 61.
4-амино-3-хлор-(2,4-дифтор-3-метилфенил)пиридин-2-карбоновая кислота (соединение 97): т.пл. 189-190°C дек.
4-амино-3-хлор-6-(2,4-дихлор-3-метилфенил)пиридин-2-карбоновая кислота (соединение 98): т.пл. 170-172°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-3-метилфенил)пиридин-2-карбоновая кислота (соединение 99): т.пл. 179-181°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновая кислота (соединение 100): т.пл. 174-175°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-5-метоксифенил)пиридин-2-карбоновая кислота (соединение 101): 1Н-ЯМР (ДМСО-d6): δ 13,80 (уш.с, 1Н), 7,55 (м, 2Н), 7,25 (с, 1Н), 3,95 (с, 3Н).
4-амино-3-хлор-6-(4-хлор-2-фтор-3-этоксифенил)пиридин-2-карбоновая кислота (соединение 102): т.пл. 177-178°C дек.
4-амино-3-хлор-6-(2,4-дихлор-3-метоксифенил)пиридин-2-карбоновая кислота (соединение 103): т.пл. 179-180°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-3-метилтиофенил)пиридин-2-карбоновая кислота (соединение 104): 1Н-ЯМР (ДМСО-d6): δ 13,80 (уш.с, 1Н), 7,90 (т, 1Н), 7,55 (д, 1Н), 7,10 (с, 1Н), 6,95 (уш.с, 2Н), 2,50 (с, 3Н).
4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксиметилфенил)пиридин-2-карбоновая кислота (соединение 105): т.пл. 187-188°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-3-дифторметилфенил)пиридин-2-карбоновая кислота (соединение 106): т.пл. 182-183°C дек.
4-амино-3-хлор-6-(2-фтор-3-метокси-4-трифторметилфенил)пиридин-2-карбоновая кислота (соединение 107): т.пл. 177-178°C дек.
4-амино-3-хлор-6-(2-фтор-3,4-метилендиоксифенил)пиридин-2-карбоновая кислота (соединение 108): т.пл. 202-203°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-5-этоксифенил)пиридин-2-карбоновая кислота (соединение 109): т.пл. 178-179°C дек.
4-амино-3-хлор-6-(2,4-дихлор-3-метоксифенил)пиридин-2-карбоновая кислота (соединение 110): т.пл. 187-188°C дек.
4-амино-3-хлор-6-(4-хлор-5-диметиламино-2-фторфенил)пиридин-2-карбоновая кислота (соединение 111): т.пл. 180-181°C дек.
4-амино-3-хлор-6-(4-хлор-3-диметиламино-2-фторфенил)пиридин-2-карбоновая кислота (соединение 112): т.пл. 185-186°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксиэтоксифенил)пиридин-2-карбоновая кислота (соединение 113): т.пл. 169-170°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-3-фторметилфенил)пиридин-2-карбоновая кислота (соединение 114): 1Н-ЯМР (ДМСО-d6): δ 8,00 (дт, 1Н), 7,50 (дд, 1Н), 6,90 (уш.с, 2Н), 5,60 (дд, 1Н).
4-амино-3-хлор-5-фтор-6-(2-фтор-3,4-метилендиоксифенил)пиридин-2-карбоновая кислота (соединение 115): т.пл. 179-180°C.
4-амино-3-хлор-6-[4-хлор-3-(диэтиламино)-2-фторфенил]пиридин-2-карбоновая кислота (соединение 116): т.пл. 174-175°C.
4-амино-3-хлор-6-[2,4-дихлор-3-(диметиламино)фенил]пиридин-2-карбоновая кислота (соединение 117): т.пл. 177-178°C.
4-амино-3-хлор-6-[4-хлор-2-фтор-3-(метиламино)фенил]пиридин-2-карбоновая кислота (соединение 118): т.пл. 185-186°C.
4-амино-3-хлор-6-(2-фтор-3-метокси-4-метилфенил)пиридин-2-карбоновая кислота (соединение 119): т.пл. 178-179°C.
4-амино-6-(4-бром-2-фтор-3-метоксифенил)-3-хлорпиридин-2-карбоновая кислота (соединение 120): т.пл. 176-177°C.
4-амино-6-(4-бром-2-хлор-3-метоксифенил)-3-хлорпиридин-2-карбоновая кислота (соединение 121): т.пл. 192-193°C.
4-амино-3-хлор-6-(4-хлор-2-фтор-5-метоксифенил)-5-фторпиридин-2-карбоновая кислота (соединение 122): т.пл. 180-181°C.
4-амино-3-хлор-6-(4-хлор-2-хлор-3-метоксифенил)-5-фторпиридин-2-карбоновая кислота (соединение 123): т.пл. 178-179°C.
4-амино-3-хлор-6-(4-хлор-3-бутокси-2-фторфенил)пиридин-2-карбоновая кислота (соединение 124): т.пл. 157-158°C дек.
4-амино-6-[2,4-дихлор-3-(1-фторэтил)фенил]пиридин-2-карбоновая кислота (соединение 125): т.пл. 169-170°C дек.
4-амино-3-хлор-6-(2,4-дихлор-3-дифторметилфенил)пиридин-2-карбоновая кислота (соединение 126): т.пл. 182-183°C дек.
4-амино-3-хлор-6-[2,4-дихлор-3-(1-фтор-1-метилэтил)фенил]пиридин-2-карбоновая кислота (соединение 127): т.пл. > 250°C.
4-амино-3-хлор-6-(4-хлор-3-этил-2-фторфенил)пиридин-2-карбоновая кислота (соединение 128): т.пл. 192-193°C дек.
4-амино-3-хлор-6-[4-хлор-2-фтор-3-(1,2,2,2-тетрафторэтил)фенил]пиридин-2-карбоновая кислота (соединение 129): т.пл. 175-176°C дек.
Метиловый эфир 4-амино-3-хлор-6-[4-хлор-2-фтор-3-(1-фторпропил)фенил]пиридин-2-карбоновая кислота (соединение 130): т.пл. 165-167°C дек.
4-амино-3-хлор-6-(2,3,4-трифторфенил)пиридин-2-карбоновая кислота (соединение 131): т.пл. 178-179°C дек.
4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксиметоксифенил)пиридин-2-карбоновая кислота (соединение 132): т.пл. 159°C дек.
4-амино-3-хлор-6-(4-хлор-2,6-дифтор-3-метоксифенил)пиридин-2-карбоновая кислота (соединение 133): LC/MS (m/z = 293).
4-амино-3-хлор-6-(4-хлор-3-дифторметокси-2-фтор-фенил)пиридин-2-карбоновая кислота (соединение 134): т.пл. 179°C дек.
62. Получение триэтиламмониевой соли 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 135).
К раствору 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (1,0 г, 3,1 ммоль) в метаноле (30 мл) добавляли триэтиламин (10 мл) и раствор перемешивали при температуре окружающей среды в течение 1 часа и затем концентрировали, чтобы получить триэтиламмониевую соль 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (1,1 г, 2,6 ммоль): 1Н-ЯМР (ДМСО-d6): δ 7,60 (м, 1Н), 7,45 (м, 1Н), 7,00 (с, 1Н), 4,00 (с, 3Н), 3,00 (т, 6Н), 1,15 (кв, 9Н).
Следующие соединения получали в соответствии с методикой примера 62.
триэтиламмониевая соль 4-амино-3-хлор-6-(2,4-дихлор-3-метоксифенил)пиридин-2-карбоновой кислоты (соединение 136): 1Н-ЯМР (ДМСО-d6): δ 7,55 (д, 1Н), 7,435 (д, 1Н), 7,00 (с, 1Н), 4,00 (с, 3Н), 3,00 (т, 6Н), 1,15 (кв, 9Н).
63. Получение гербицидных композиций
В следующих представленных композициях части и проценты выражены по весу.
Концентраты эмульсии
Неионный эмульсификатор (ди-сек-бутил)фенил-поли(оксипропилен)блочный полимер с (оксиэтиленом). Содержание полиоксиэтилена составляет 12 молей.
Эти концентраты можно разбавлять водой, чтобы получить эмульсии подходящих концентраций для борьбы с сорняками.
Смачивающиеся порошки
Активный ингредиент применяют с соответствующими носителями и затем смешивают и измельчают, чтобы получить смачивающиеся порошки с превосходной смачиваемостью и способностью образовывать суспензии. Разбавляя эти порошки водой можно получить суспензии подходящей концентрации для борьбы с сорняками.
Гранулы, образующие дисперсии в воде
Активный ингредиент добавляли к гидрату двуокиси кремния, который затем смешивали с другими ингредиентами и измельчали до порошка. Порошок слипался при действии воды и его просеивали, чтобы получить гранулы с размерами, соответствующими размерам сит от -10 до +60 меш. Диспергируя эти гранулы в воде можно получить суспензии подходящих концентраций для борьбы с сорняками.
Гранулы
Активный ингредиент добавляли к полярному растворителю, такому как N-метилпирролидону, циклогексанону, γ-бутиролактон и т.д., к носителю Celetom MP-88 или другим подходящим носителям. Полученные в результате гранулы можно применять ручным способом, с помощью машины для внесения гранул, самолета и т.д. для того, чтобы бороться с сорняками.
Все вещества перемешивали и измельчали до порошка, затем прибавляли воду и глиняную смесь перемешивали до образования пасты. Смесь нарезали с помощью штанцевого ножа, чтобы получить гранулы нужных размеров.
Растворимые в воде жидкости
Активный ингредиент растворяли в подходящем количестве воды и добавляли дополнительно моноэтаноламин в качестве буфера. Можно добавлять растворимый в воде сурфактант. Можно добавить другие вспомогательные вещества, чтобы улучшить физические, химические и/или свойства состава.
64. Измерение гербицидной активности после появления всходов.
Семена или орехи необходимых испытуемых видов растений высаживали в посевную смесь Sun Gro MetroMix® 306, которая обычно имеет pH 6,0-6,8 и содержит 30% органических веществ, в пластиковых горшках с площадью поверхности 64 квадратных сантиметра. При необходимости обеспечить хорошее прорастание и здоровые растения использовали фунгицидную обработку и/или другую химическую или физическую обработку. Растения выращивали в течение 7-21 дня в парнике с приблизительно 15 часовым фотопериодом, поддерживая температуру в диапазоне 23-29°С днем и 22-28°С ночью. Регулярно добавляли питательные вещества и воду и, при необходимости, обеспечивали дополнительным светом с помощью верхних 1000 Вт металлогалогенидных ламп. Растения использовали в испытании, когда они достигали первой или второй стадии настоящего листа.
Взвешенное количество, определенное с помощью самой большой дозы, которую надо протестировать, каждого испытуемого вещества помещали в 25 мл стеклянную пробирку и растворяли в 4 мл 97/3 объем/объем смеси ацетона и диметилсульфоксида (ДМСО), чтобы получить концентрированные базовые растворы. Если испытуемое вещество плохо растворялось, смесь нагревали и/или облучали ультразвуком. Полученные концентрированные базовые растворы разбавляли 20 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Atplus 411F и сурфактант Triton® X-155 в соотношении 48,5:39:10:1,5:1,0:0,02 объем/объем, чтобы получить растворы для опрыскивания, содержащие самые большие дозы внесения. Дополнительные дозы внесения получали последовательным разбавлением 12 мл раствора с высокой дозой в растворе, содержащем 2 мл 97/3 объем/объем смеси ацетон и диметилсульфоксид (ДМСО), и 10 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Atplus 411F и сурфактант Triton® X-155 в соотношении 48,5:39:10:1,5:1,0:0,02 объем/объем, чтобы получить 1/2Х, 1/4Х, 1/8Х и 1/ 16Х дозы высокой дозы. Требуемые количества веществ определяют, исходя из 12 мл используемого объема при дозе 187 л/га. Приготовленные смеси соединении использовали на растениях с помощью верхнего опрыскивателя Мандела, оборудованного насадками 8002Е, калиброванными так, чтобы доставлять 187 л/га на используемой площади 0,503 квадратных метра при высоте разбрызгивания 18 дюймов (43 см) над средней высотой яруса растений. Контрольные растения опрыскивали таким же способом с помощью холостого растворителя.
Обработанные растения и контрольные растения помещали в парник, как описано выше, и поливали с помощью подземного орошения, чтобы предотвратить смывание испытуемых соединений. Через 14 дней состояние испытуемых растений, при сравнении с состоянием растений, не подвергнутых обработке, определяли визуально и оценивали от 0 до 100%, где 0 соответствует отсутствию повреждений и 100 соответствует полному уничтожению.
При использовании общепринятых пробит-анализов, как описано J. Berkson в «Journal of the American Statistical Society», 48, 565 (1953) и D. Finney в «Probit Analysis» Cambridge University Press (1952), вышеупомянутые данные можно использовать для расчета значений GR50 и GR80, которые определяют как факторы снижения роста, которые соответствуют эффективным дозам гербицида, требуемым для того, чтобы уничтожить или контролировать 50% или 80%, соответственно, растения-мишени.
В таблице 1 представлены некоторые испытуемые вещества, используемые дозы внесения, испытуемые виды растений и результаты.
Борьба с сорняками после появления всходов.
(г ai/га)
AMARE - амарант колосистый (Amaranthus retroflexus)
CHEAL - марь белая (Chenopodium album)
65. Оценка гербицидной активности перед прорастанием.
Семена необходимых испытуемых видов растений высаживали на почвенную основу, приготовленную смешением глинистой почвы (43% ила, 19% глины, 38% песка, с pH 8,1 и содержанием органических веществ 1,5%) и песка в соотношении 70 к 30. Почвенную основу помещали в пластиковые горшки с площадью поверхности 113 квадратных сантиметров. При необходимости обеспечить хорошее прорастание и здоровые растения, использовали фунгицидную обработку и/или другую химическую или физическую обработку.
Взвешенное количество, определенное с помощью самой большой дозы, которую надо протестировать, каждого испытуемого вещества помещали в 25 мл стеклянную пробирку и растворяли в 6 мл 97/3 объем/объем смеси ацетона и диметилсульфоксида (ДМСО), чтобы получить концентрированные базовые растворы. Если испытуемое вещество плохо растворялось, смесь нагревали и/или облучали ультразвуком. Полученные концентрированные базовые растворы разбавляли 18 мл 0,1% объем/объем водного раствора сурфактанта Tween® 20, чтобы получить растворы для опрыскивания, содержащие самые большие дозы внесения. Дополнительные дозы внесения получали последовательным разбавлением 12 мл раствора с высокой дозой в растворе, содержащем 3 мл 97/3 объем/объем смеси ацетон и диметилсульфоксид (ДМСО), и 9 мл 0,1% объем/объем водного раствора сурфактанта Tween® 20, чтобы получить 1/2Х, 1/4Х, 1/8Х и 1/16Х дозы высокой дозы. Требуемые количества веществ определяют, исходя из 12 мл используемого объема при дозе 187 л/га. Приготовленные смеси соединений использовали на растениях с помощью верхнего опрыскивателя Мандела, оборудованного насадками 8002Е, калиброванными так, чтобы доставлять 187 л/га на используемой площади 0,503 квадратных метра при высоте разбрызгивания 18 дюймов (43 см) над средней высотой яруса растений. Контрольные растения опрыскивали таким же способом с помощью холостого растворителя.
Обработанные горшки и контрольные горшки помещали в парник, поддерживая приблизительно 15-часовой фотопериод и температуру в диапазоне 23-29°С днем и 22-28°С ночью. Регулярно добавляли питательные вещества и воду и, при необходимости, обеспечивали дополнительным светом с помощью верхних 1000 Вт металлогалогенидных ламп. Воду добавляли с помощью верхнего орошения. Через 20-22 дня состояние испытуемых растений, которые проросли и выросли, при сравнении с состоянием растений, которые появились и выросли, определяли визуально и оценивали от 0 до 100%, где 0 соответствует отсутствию повреждений и 100 соответствует полному уничтожению или отсутствию всходов.
В таблице 2 представлены некоторые испытуемые вещества, используемые дозы внесения, испытуемые виды растений и результаты.
Борьба с сорняками перед прорастанием.
(г ai/га)
AMARE - амарант колосистый (Amaranthus retroflexus)
CHEAL - марь белая (Chenopodium album)
66. Оценка гербицидной активности на пересаженном рисе-падде.
Семена или орехи сорняка требуемых видов испытуемых растений высаживали в загрубевшей почве (торф), полученной смешением нестерилизованной минеральной почвы (28% ила, 18% глины, 54% песка, с pH 7,3-7,8 и содержанием органических веществ 1%) и воды при соотношении 100 кг почвы на 19 л воды. Приготовленный торф распределяли на 250 мл аликвоты в 480 мл сплошных пластиковых горшках с площадью поверхности 91,6 квадратный сантиметр, оставляя в каждом горшке 3 см свободного пространства над землей. Семена риса высаживали в посевную смесь Sun Gro MetroMix® 306, которая обычно имеет pH 6,0-6,8 и содержит 30% органических веществ, в пластиковых лотках. Саженцы на второй и третей стадии роста листа пересаживали в 650 мл торфа, находящегося в 960 мл сплошных пластиковых горшках с площадью поверхности 91,6 квадратный сантиметр за 4 дня до применения гербицида. «Рисовое поле» создавали наполнением водой 3 см горшка над поверхностью земли. При необходимости обеспечить хорошее прорастание и здоровые растения использовали фунгицидную обработку и/или другую химическую или физическую обработку. Растения выращивали в течение 4-14 дней в теплице, поддерживая приблизительно 14 часовой фотопериод и температуру в диапазоне 29°С днем и 26°С ночью. Питательные вещества добавляли в виде Osmocote (17:6:10 N:P:K + второстепенные питательные вещества) по 2 г в каждый горшок. Регулярно добавляли воду, чтобы поддерживать затопление, и обеспечивали дополнительным светом с помощью верхних 1000 Вт металлогалогенидных ламп. Растения использовали в испытаниях, когда они достигали второй или третьей стадии настоящего листа.
Взвешенное количество, определенное с помощью самой большой дозы, которую надо протестировать, каждого испытуемого вещества помещали в 120 мл стеклянную пробирку и растворяли в 20 мл ацетона, чтобы получить концентрированные базовые растворы. Если испытуемое вещество плохо растворялось, смесь нагревали и/или облучали ультразвуком. Полученные концентрированные базовые растворы разбавляли 20 мл 0,01% объем/объем водного раствора сурфактанта Tween® 20. Были получены дозы внесения 1/2X, 1/4X, 1/8X и 1/16X высокой дозы внесением необходимого количества базового раствора в водный слой «рисового поля». Контрольные растения опрыскивали таким же способом с помощью холостого растворителя.
Обработанные растения и контрольные растения помещали в парник, как описано выше, и, по необходимости, добавляли воду, чтобы поддерживать затопление. Через 3 недели состояние испытуемых растений, при сравнении с состоянием растений, не подвергнутых обработке, определяли визуально и оценивали от 0 до 100%, где 0 соответствует отсутствию повреждений и 100 соответствует полному уничтожению.
В таблице 3 представлены некоторые испытуемые вещества, используемые дозы внесения, испытуемые виды растений и результаты.
Гербицидная активность для пересаженного риса.
(г ai/га)
ECHCG - куриное просо (Echinochloa crus-galli)
SCPJU - камыш ситниковидный (Scirpus juncoides)
CYPDI - сыть разнородная (Cyperus difformis)
MOOVA - монохория влагалищная (Monochoria vaginalis)
67. Оценка гербицидной активности после появления всходов в зерновых культурах.
Семена необходимых испытуемых видов растений высаживали в посевную смесь Sun Gro MetroMix® 306, которая обычно имеет pH 6,0-6,8 и содержит 30% органических веществ, в пластиковых горшках с площадью поверхности 103,2 квадратных сантиметра. При необходимости обеспечить хорошее прорастание и здоровые растения, использовали фунгицидную обработку и/или другую химическую или физическую обработку. Растения выращивали в течение 7-36 дней в парнике с приблизительно 14 часовым фотопериодом, поддерживая температуру в диапазоне 18°С днем и 17°С ночью. Регулярно добавляли питательные вещества и воду и, при необходимости, обеспечивали дополнительным светом с помощью верхних 1000 Вт металлогалогенидных ламп. Растения использовали в испытании, когда они достигали второй или третьей стадии настоящего листа.
Взвешенное количество, определенное с помощью самой большой дозы, которую надо протестировать, каждого испытуемого вещества помещали в 25 мл стеклянную пробирку и растворяли в 8 мл 97/3 объем/объем смеси ацетона и диметилсульфоксида (ДМСО), чтобы получить концентрированные базовые растворы. Если испытуемое вещество плохо растворялось, смесь нагревали и/или облучали ультразвуком. Полученные концентрированные базовые растворы разбавляли 16 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agridex и сурфактант Triton® X-77 в соотношении 64,7:26,0:6,7:2,0:0,7:0,01 объем/объем, чтобы получить растворы для опрыскивания, содержащие самые большие дозы внесения. Дополнительные дозы внесения получали последовательным разбавлением 12 мл раствора с высокой дозой в растворе, содержащем 4 мл 97/3 объем/объем смеси ацетон и диметилсульфоксид (ДМСО), и 8 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agridex и сурфактант Triton® X-77 в соотношении 48,5:39:10:1,5:1,0:0,02 объем/объем, чтобы получить 1/2Х, 1/4Х, 1/8Х и 1/16Х дозы высокой дозы. Требуемые количества веществ определяют, исходя из 12 мл используемого объема при дозе 187 л/га. Приготовленные смеси соединении использовали на растениях с помощью верхнего опрыскивателя Мандела, оборудованного насадками 8002Е, калиброванными так, чтобы доставлять 187 л/га на используемой площади 0,503 квадратных метра при высоте разбрызгивания 18 дюймов (43 см) над средней высотой яруса растений. Контрольные растения опрыскивали таким же способом с помощью холостого растворителя.
Обработанные растения и контрольные растения помещали в парник, как описано выше, и поливали с помощью подземного орошения, чтобы предотвратить смывание испытуемых соединений. Через 20-22 дня состояние испытуемых растений, при сравнении с состоянием растений, не подвергнутых обработке, определяли визуально и оценивали от 0 до 100%, где 0 соответствует отсутствию повреждений и 100 соответствует полному уничтожению.
В таблице 4 представлены некоторые испытуемые вещества, используемые дозы внесения, испытуемые виды растений и результаты.
Контроль после появления всходов нескольких основных сорняков в зерновых культурах.
(г ai/га)
HORVS - ячмень посевной (Hordeum vulare)
GALAP - подмаренник цепкий (Galium aparine)
LAMPU - яснотка пурпурная (Lamium purpureum)
PAPRH - мак - самосейка (Papaver rhoeas)
VERPE - вероника персидская (Veronica persica)
68. Оценка гербицидной защиты после появления всходов в зерновых культурах.
Семена необходимых испытуемых видов растений высаживали в посевную смесь Sun Gro MetroMix® 306, которая обычно имеет pH 6,0-6,8 и содержит 30% органических веществ, в пластиковых горшках с площадью поверхности 103,2 квадратных сантиметра. При необходимости обеспечить хорошее прорастание и здоровые растения использовали фунгицидную обработку и/или другую химическую или физическую обработку. Растения выращивали в течение 7-36 дней в парнике с приблизительно 14 часовым фотопериодом, поддерживая температуру в диапазоне 18°С днем и 17°С ночью. Регулярно добавляли питательные вещества и воду и, при необходимости, обеспечивали дополнительным светом с помощью верхних 1000 Вт металлогалогенидных ламп. Растения использовали в испытании, когда они достигали второй или третьей стадии настоящего листа.
Обработки включали обработки соединением 42 и клоквинтоцетмексилом по отдельности и в комбинации. Взвешенное количество помещали в 25 мл стеклянные пробирки и растворяли в объеме 97/3 объем/объем смеси ацетона и диметилсульфоксида (ДМСО), чтобы получить базовые растворы 9 мг аi/мл. Концентрированные базовые растворы разбавляли до 3 мл аi/мл добавлением 2 объемов водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agridex и сурфактант Triton® X-77 в соотношении 64,7:26,0:6,7:2,0:0,7:0,01 объем/объем. Разбавленный раствор приготавливали смешением 1 объема 97/3 объем/объем смеси ацетона и диметилсульфоксида (ДМСО) и 2 объемов водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agridex и сурфактант Triton® X-77 в соотношении 64,7:26,0:6,7:2,0:0,7:0,01 объем/объем. Требуемые количества веществ определяют, исходя из 12 мл используемого объема при дозе 187 л/га. Растворы для опрыскивания смесей клоквинтоцетмексила и соединения 42 получали добавлением базового раствора к подходящему количеству разбавителя, чтобы получить 12 мл раствора для распыления с соотношением активных ингредиентов 1:1, 1:2 и 1:4 (гербицид:антидот). Приготовленные смеси использовали на растениях с помощью верхнего опрыскивателя Мандела, оборудованного насадками 8002Е, калиброванными так, чтобы доставлять 187 л/га на используемой площади 0,503 квадратных метра при высоте разбрызгивания 18 дюймов (43 см) над средней высотой яруса растений. Контрольные растения опрыскивали таким же способом с помощью холостого растворителя.
Обработанные растения и контрольные растения помещали в парник, как описано выше, и поливали с помощью подземного орошения, чтобы предотвратить смывание испытуемых соединений. Через 3 недели состояние испытуемых растений, при сравнении с состоянием растений, не подвергнутых обработке, определяли визуально и оценивали от 0 до 100%, где 0 соответствует отсутствию повреждений и 100 соответствует полному уничтожению.
Использовали уравнение Колби, чтобы определить предполагаемый гербицидный эффект от смеси (Colby, S.R. 1967. Calculation of the synergistic and antagonistic response of herbicide combinations. Weeds 15:20-22).
Использовали следующее уравнение, чтобы рассчитать предполагаемую активность смеси, содержащей два ингредиента, A и B:
Предполагаемая = A + B - (A × B/100)
A = наблюдаемая эффективность активного ингредиента А при такой же концентрации, как используемая в смеси.
В = наблюдаемая эффективность активного ингредиента В при такой же концентрации, как используемая в смеси.
В таблице 5 представлены некоторые испытуемые вещества, используемые дозы внесения, испытуемые виды растений и результаты.
Защита от гербицидного повреждения зерновых культур
Доза (г ai/га)
цетмексил
70
0
40
-
15
-
100
-
100
-
0
0
0
70
140
280
0
0
0
-
-
-
0
0
0
-
-
-
0
0
0
-
-
-
0
0
0
-
-
-
35
35
70
140
0
0
35
35
0
0
0
0
100
100
99
99
100
100
100
100
70
70
140
280
0
0
40
40
0
0
15
15
100
100
100
100
100
100
100
100
HORVW - ячмень обыкновенный (Hordeum vulgare)
GALAP - подмаренник цепкий (Galium aparine)
PAPRH - мак - самосейка (Papaver rhoeas)
Ob - наблюдаемая величина
Ex - предполагаемая, рассчитанная величина
69. Оценка гербицидной активности смеси после появления всходов в зерновых культур.
Семена необходимых испытуемых видов растений высаживали и выращивали, как описано в «Оценке гербицидной защиты после появления всходов в зерновых культурах».
Обработка включала обработку соединением (перечислены в таблицах 6 и 7), флуоксипирметилгептиловым эфиром (MHE) и моноэтаноламиновой (MEA) солью клопиралида по отдельности и в комбинации. Взвешенное количество помещали в 25 мл стеклянные пробирки и растворяли в объеме 97/3 объем/объем смеси ацетона и диметилсульфоксида (ДМСО), чтобы получить базовые растворы 4,5 мг аi/мл. Если испытуемое вещество плохо растворялось, смесь нагревали и/или облучали ультразвуком. Концентрированные базовые растворы разбавляли до 1,5 мл аi/мл добавлением 2 объемов водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agridex и сурфактант Triton® X-77 в соотношении 64,7:26,0:6,7:2,0:0,7:0,01 объем/объем. Разбавленный раствор приготавливали смешением 1 объема 97/3 объем/объем смеси ацетона и диметилсульфоксида (ДМСО) и 2 объемов водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agridex и сурфактант Triton® X-77 в соотношении 64,7:26,0:6,7:2,0:0,7:0,01 объем/объем. Требуемые количества веществ определяют, исходя из 12 мл используемого объема при дозе 187 л/га. Растворы для опрыскивания флуроксипир MHE, клопиралид MEA и смесей экспериментальных соединений получали добавлением базового раствора к подходящему количеству разбавителя, чтобы получить 12 мл раствора для распыления с активными ингредиентами в комбинации по два и по три. Приготовленные смеси использовали на растениях с помощью верхнего опрыскивателя Мандела, оборудованного насадками 8002Е, калиброванными так, чтобы доставлять 187 л/га на используемой площади 0,503 квадратных метра при высоте разбрызгивания 18 дюймов (43 см) над средней высотой яруса растений. Контрольные растения опрыскивали таким же способом с помощью холостого растворителя.
Обработанные растения и контрольные растения помещали в парник, как описано выше, и поливали с помощью подземного орошения, чтобы предотвратить смывание испытуемых соединений. Через 3 недели состояние испытуемых растений, при сравнении с состоянием растений, не подвергнутых обработке, определяли визуально и оценивали от 0 до 100%, где 0 соответствует отсутствию повреждений и 100 соответствует полному уничтожению.
Использовали уравнение Колби, чтобы определить предполагаемый гербицидный эффект от смеси (Colby, S.R. 1967. Calculation of the synergistic and antagonistic response of herbicide combinations. Weeds 15:20-22).
Использовали следующее уравнение, чтобы рассчитать предполагаемую активность смеси, содержащей два ингредиента, A и B:
Предполагаемая = A + B - (A × B/100)
A = наблюдаемая эффективность активного ингредиента А при такой же концентрации, как используемая в смеси.
В = наблюдаемая эффективность активного ингредиента В при такой же концентрации, как используемая в смеси.
Использовали следующее уравнение, чтобы рассчитать предполагаемую активность смеси, содержащей три ингредиента, A, B и С:
Предполагаемая = A + B + С - (A × B + В × С + А × С)/100+ (А × В × С)/10000
A = наблюдаемая эффективность активного ингредиента А при такой же концентрации, как используемая в смеси.
В = наблюдаемая эффективность активного ингредиента В при такой же концентрации, как используемая в смеси.
С = наблюдаемая эффективность активного ингредиента С при такой же концентрации, как используемая в смеси.
В таблицах 6 и 7 представлены некоторые испытуемые вещества, используемые дозы внесения, испытуемые виды растений и результаты.
Защита и синергическая активность смесей гербицидов.
Доза (г ai/га)
МНЕ
МЕА
0
0
0
0
0
0
35
35
0
35
0
0
-
0
0
0
-
0
0
25
-
20
35
-
-
35
35
0
15
0
10
85
56
-
35
-
35
35
10
25
0
0
80
28
-
-
35
35
35
30
35
10
15
70
20
HORVW - ячмень обыкновенный (Hordeum vulgare)
MATCH - ромашка аптечная (Matricaria chamomilla)
MHE - метилгептиловый эфир
MEA - моноэтаноламиновая соль
Ob - наблюдаемая величина
Ex - предполагаемая, рассчитанная величина
Защита и синергическая активность смесей гербицидов.
Доза (г ai/га)
42
МЕА
МНЕ
70
0
0
45
-
30
-
60
-
0
70
0
0
-
0
-
40
-
0
0
70
0
-
0
-
0
-
0
70
70
0
0
0
0
20
40
70
70
0
40
45
25
30
100
76
70
0
70
35
45
20
30
90
60
70
35
35
70
70
70
35
35
70
35
70
35
30
20
10
30
45
30
30
45
25
15
15
25
30
25
25
30
99
99
99
70
76
70
52
62
HORVW - ячмень обыкновенный (Hordeum vulgare)
MATCH - ромашка аптечная (Matricaria chamomilla)
MHE - метилгептиловый эфир
MEA - моноэтаноламиновая соль
Ob - наблюдаемая величина
Ex - предполагаемая, рассчитанная величина
| название | год | авторы | номер документа |
|---|---|---|---|
| 3-ГАЛОГЕН-6-(АРИЛ)-ИМИНОТЕТРАГИДРОПИКОЛИНАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2010 |
|
RU2527954C2 |
| 6-АЛКИЛ ИЛИ АЛКЕНИЛ-4-АМИНОПИКОЛИНАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2004 |
|
RU2332404C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-АРИЛ-4-АМИНОПИКОЛИНАТОВ | 2010 |
|
RU2525918C2 |
| АЦИЛИРОВАННЫЕ ИНДАНИЛАМИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2339614C2 |
| ПИРРОЛОПИРИДАЗИНОВЫЕ ПРОИЗВОДНЫЕ | 2001 |
|
RU2254335C2 |
| ЗАМЕЩЕННЫЕ АЦИЛАМИНОБЕНЗАМИДЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1990 |
|
RU2034829C1 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха | 2004 |
|
RU2346944C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ | 1991 |
|
RU2137761C1 |
| (АЗА)ИНДОЛ-, БЕНЗОТИОФЕН- И БЕНЗОФУРАН-3-СУЛЬФОНАМИДЫ | 2017 |
|
RU2767904C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИНГИБИТОР НАТРИЙЗАВИСИМОГО ПЕРЕНОСЧИКА ФОСФАТА | 2015 |
|
RU2811864C1 |
Изобретение относится к соединению формулы I, применяемом в качестве гербицидов, в которой Q1 представляет Н или F; Q2 представляет галоген при условии, что когда Q1 представляет Н, Q2 представляет Сl или Вr; R1 и R2 независимо представляют Н, C1-C6-ацил; и Аr представляет полизамещенную арильную группу, выбранную из группы, состоящей из а), b), с), в которой W1 представляет галоген; X1 представляет С1-С4-алкил, C1-С4-алкокси, C1-C4- галогеналкил, -NR3R4; Y1 представляет С1-С4-алкил, C1-С4-галогеналкил, галоген или -CN, или, когда X1 и Y1 взяты вместе, представляет -O(СН2)nО-, в котором n=1; и R3 и R4 независимо представляют Н или С1-С4-алкил; W2 представляет F или Сl; X2 представляет F, Сl, -CN, С1-С4-алкил, С1-С4-алкокси, C1-C4- алкилтио, С1-С4-алкилсульфинил, C1-C4-алкилсульфонил, C1-C4- галогеналкил, С1-С4-галогеналкокси, С1-C4-алкоксизамещенный C1-C4- алкил, С1-С4-алкоксизамещенный С1-С4-алкокси, -NR3R4 или фторированный ацетил; Y2 представляет галоген, С1-С4-алкил, С1-С4-галогеналкил или -CN, или когда W2 представляет F, X2 и Y2, взятые вместе, представляют -O(СН2)nО-, в котором n=1; и R3 и R4 независимо представляют Н или C1-С6-алкил; Y3 представляет галоген или -CN; Z3, представляет F, Сl, -NO2, С1-С4-алкокси, -NR3R4; и R3 и R4 независимо представляют H; пригодные в сельском хозяйстве производные по карбоксильной группе. Данные соединения являются превосходными гербицидами с широким спектром борьбы с сорняками и с превосходной селективностью по отношению к сельскохозяйственным культурам, 4 н. и 15 з.п. ф-лы, 7 табл.
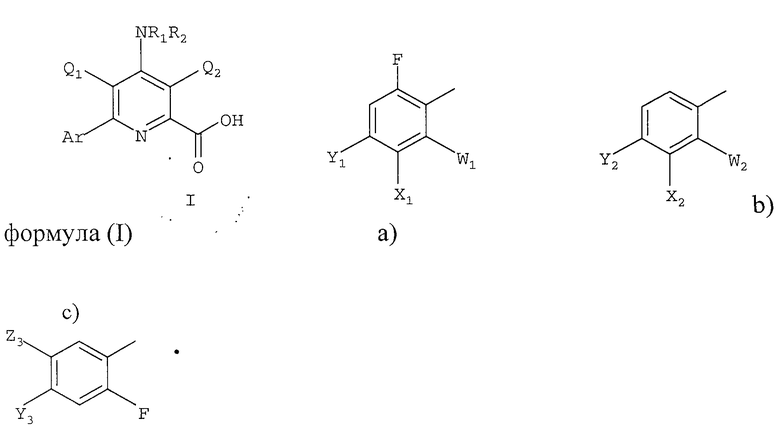
1. Соединение формулы 1
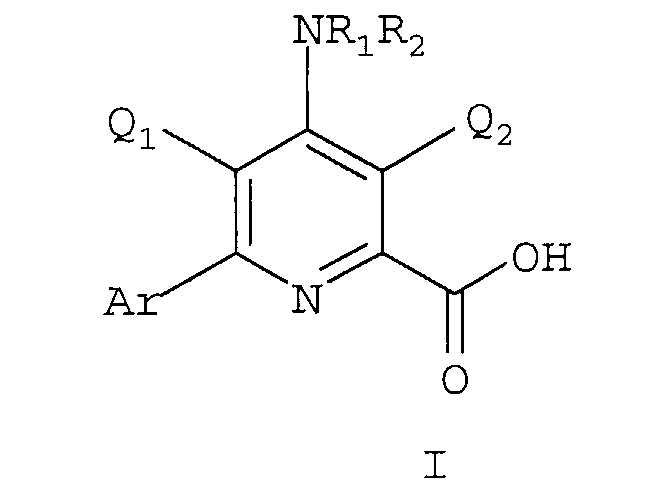
в которой Q1 представляет Н или F;
Q2 представляет галоген при условии, что когда Q1 представляет Н, Q2 представляет Сl или Вr;
R1 и R2 независимо представляют Н, C1-С6-ацил; и
Аr представляет полизамещенную арильную группу, выбранную из
группы, состоящей из
а)
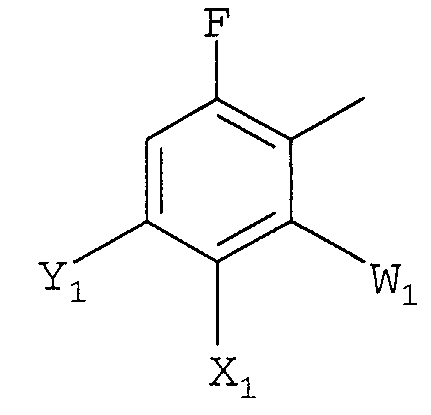
в которой W1 представляет галоген;
X1 представляет С1-С4-алкил, С1-С4-алкокси, C1-C4-галогеналкил, -НR3R4;
Y1 представляет С1-С4-алкил, С1-С4-галогеналкил, галоген или -CN, или, когда X1 и Y1 взяты вместе, представляет -O(СН2)nО-, в котором n=1; и R3 и R4 независимо представляют Н или С1-С4-алкил;
b)
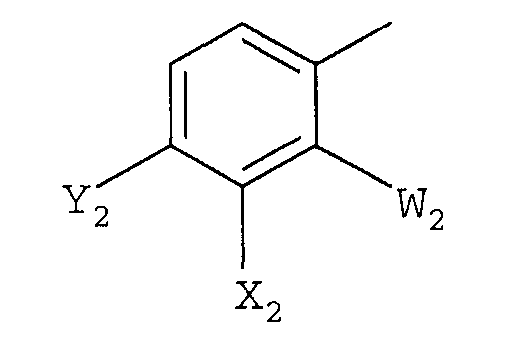
в которой W2 представляет F или Сl;
Х2 представляет F, Сl, -CN, С1-С4-алкил, С1-С4-алкокси, C1-C4- алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, C1-C4- галогеналкил, C1-C4-галогеналкокси, С1-С4-алкоксизамещенный C1-C4-алкил, C1-C4-алкоксизамещенный С1-С4-алкокси, -NR3R4 или фторированный ацетил;
Y2 представляет галоген, С1-С4-алкил, С1-С4-галогеналкил или -CN, или когда W2 представляет F, X2 и Y2, взятые вместе, представляют -O(СН2)nО-,
в котором n=1; и
R3 и R4 независимо представляют Н или C1-С6-алкил; и
с)
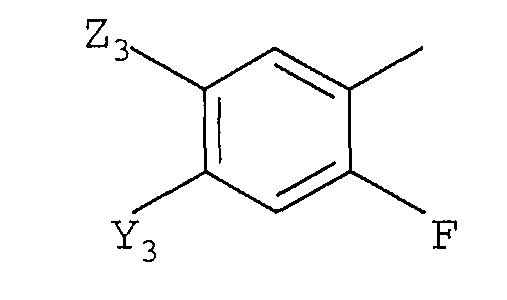
в которой Y3 представляет галоген или -CN;
Z3 представляет F, Cl, -NO2, С1-С4-алкокси, -NR3R4; и
R3 и R4 независимо представляют Н; и
пригодные в сельском хозяйстве производные по карбоксильной группе.
2. Соединение по п.1, в котором R1 и R2 представляют Н.
3. Соединение по п.1, в котором Q1 представляет Н.
4. Соединение по п.1, в котором Q2 представляет Сl.
5. Соединение по п.1, в котором Q1 представляет Н и Q2 представляет Сl.
6. Соединение по п.1, в котором Аr представляет

в которой W1 представляет галоген;
X1 представляет С1-С4-алкил, С1-С4-алкокси, C1-C4-галогеналкил, -NR3R4;
Y1 представляет С1-С4-алкил, С1-С4-галогеналкил, галоген или -CN, или, когда X1 и Y1, взяты вместе, представляет -O(СН2)nО-, в котором n=1; и R3 и R4 независимо представляют Н или С1-С4-алкил.
7. Соединение по п.6, в котором W1 представляет Сl или F.
8. Соединение по п.6, в котором X1 представляет C1-C4-алкокси, С1-С4-галогеналкил или -NR3R4.
9. Соединение по п.6, в котором Y1 представляет Сl, Вr или -СF3.
10. Соединение по п.1, в котором Аr представляет
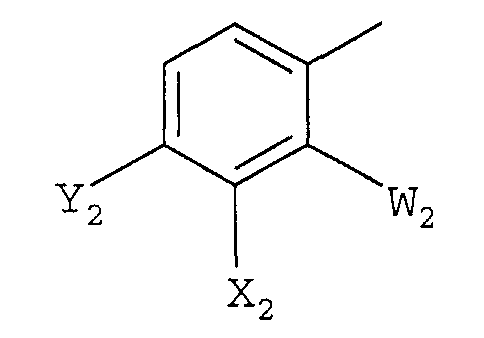
в которой W2 представляет F или Сl;
Х2 представляет F, Сl, -CN, С1-С4-алкил, С1-С4-алкокси, C1-C4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, C1-C4-галогеналкил, С1-С4-галогеналкокси, С1-С4-алкоксизамещенный C1-C4-алкил, C1-C4-алкоксизамещенный С1-С4-алкокси,
-NR3R4, фторированный ацетил;
Y2 представляет галоген, С1-С4-алкил, С1-С4-галогеналкил или -CN, или когда W2 представляет F, Х2 и Y2, взятые вместе, представляют -O(СН2)nО-, в котором n=1; и R3 и R4 независимо представляют Н или C1-С6-алкил.
11. Соединение по п.10, в котором X2 представляет C1-C4- алкокси, C1-C4-алкилтио, С1-С4-галогеналкил или -NR3R4.
12. Соединение по п.10, в котором Y2 представляет Сl, Вr или -СF3.
13. Соединение по п.1, в котором Аr представляет
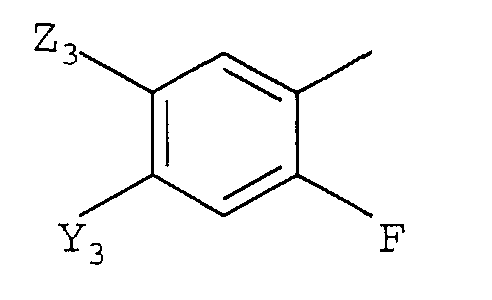
в которой Y3 представляет галоген или -CN;
Z3 представляет F, Cl, -NO2, С1-С4-алкокси, -NR3R4; и R3 и R4 независимо представляют Н.
14. Соединение по п.13, в котором Y3 представляет Cl.
15. Соединение по п.13, в котором Z3 представляет C1-C4- алкокси или -NR3R4.
16. Гербицидная композиция, содержащая эффективное в качестве гербицида количество соединения формулы I по п.1 в смеси с приемлемым в сельском хозяйстве вспомогательным веществом или носителем.
17. Способ борьбы с вредной растительностью, который включает контактирование эффективного в качестве гербицида количества соединения формулы I по п.1 с растительностью или занимаемой ею поверхностью или применение его на почву, чтобы предотвратить появление растительности.
18. Соединение формулы ArMetal, в котором Аr представляет полизамещенную арильную группу, выбранную из группы, состоящей из
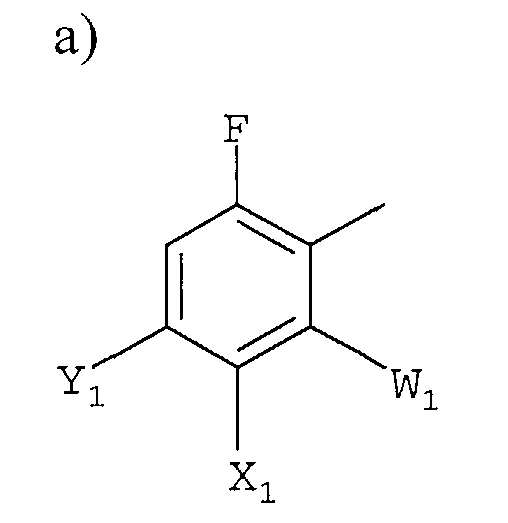
в которой W1 представляет галоген;
X1 представляет С1-С4-алкил, С1-С4-алкокси, С1-С4-галогеналкил или -NR3R4;
Y1 представляет С1-С4-алкил, С1-С4-галогеналкил, галоген или -CN, или, когда X1 и Y1 взяты вместе, представляет -O(СН2)nО-, в котором n=1; и R3 и R4 независимо представляют Н или С1-С4-алкил;
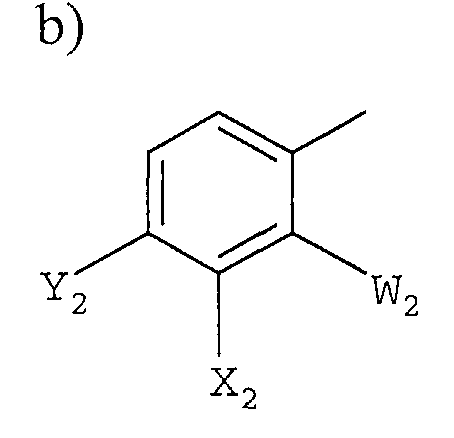
в которой W2 представляет F или Сl;
Х2 представляет F, Сl, -CN, С1-С4-алкил, С1-С4-алкокси, C1-C4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, C1-C4-галогеналкил, C1-C4-галогеналкокси, С1-С4-алкоксизамещенный C1-C4-алкил, C1-C4-алкоксизамещенный С1-С4-алкокси,
-NR3R4 или фторированный ацетил;
Y2 представляет галоген, С1-С4-алкил, С1-С4-галогеналкил или -CN, или когда W2 представляет F, Х2 и Y2, взятые вместе, представляют -O(CH2)nO, в котором n=1; и R3 и R4 независимо представляют Н или C1-С6-алкил; и
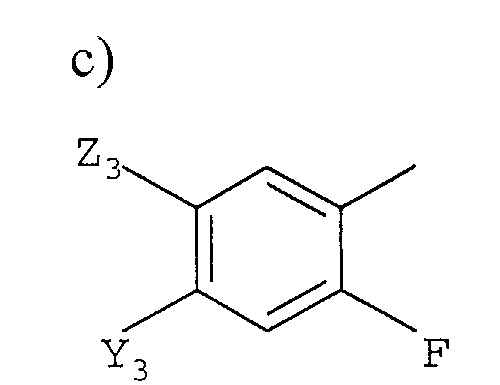
в которой Y3 представляет галоген, -CN;
Z3 представляет F, Cl, -NO2, С1-С4-алкокси или -NR3R4; и
R3 и R4 независимо представляют Н; и
Metal представляет (С1-С4-алкил)3 олово или B(OR8)(OR9), в которой R8 и R9 независимо друг от друга представляют водород, С1-С4-алкил.
19. Соединение по п.18, выбранное из группы, состоящей из:
2-(4-хлор-2-фтор-3-метоксифенил)-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-5-метоксифенил)-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-3-этоксифенил)-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-3-(метилтио)фенил)-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-3-метоксиметилфенил)-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-3-изопропоксифенил)-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-3-дифторметилфенил)-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-3-фторметилфенил)-[1,3,2]-диоксаборинана;
4- [1,3,2]-диоксаборинан-2-ил-3-фтор-2-метоксибензонитрила;
2-(4-хлор-2-фтор-3-метоксиэтоксифенил)-[1,3,2]-диоксаборинана;
2-(2,4-дихлор-3-этоксифенил)-[1,3,2]-диоксаборинана;
2-[4-хлор-2-фтор-3-(2,2-дифторэтокси)фенил]-[1,3,2]-диоксаборинана;
2-(4-хлор-2-фтор-5-этоксифенил)-[1,3,2]-диоксаборинана;
2-(2,4-дихлор-3-(метилтио)фенил)-[1,3,2]-диоксаборинана;
2-фтор-3,4-метилендиоксифенилбороновой кислоты;
2-фтор-3-метокси-4-метилфенилбороновой кислоты;
4-бром-2-фтор-3-метоксифенилбороновой кислоты;
2-(2-фтор-3,4-метилендиоксифенил)-[1,3,2]-диоксаборинана;
4-хлор-3-(диэтиламино)-2-фторфенилбороновой кислоты;
2,4-дихлор-3-диметиламинофенилбороновой кислоты;
2-хлор-4-фтор-3-метоксифенилбороновой кислоты;
3-хлор-2-фтор-3-(4,4,5,5-тетраметил-{1,3,2}-диоксоборолан-2-ил)фенилметил;
(2-фтор-3-метокси-4-трифторметилфенил)триметилстаннана;
(3-бутокси-4-хлор-2-фторфенил)триметилстаннана; и
4-хлор-2-фтор-3-(1-фтор-1-метилэтил)триметилстаннана.
| WO 03011853 A1, 13.02.2003 | |||
| 4-АМИНОПИКОЛИНАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2001 |
|
RU2220959C1 |
| US 5087764, 11.02.1992 | |||
| FIGNER G С et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| JOURNAL OF FLUORINE CHEMISTRY, 1974. | |||
Авторы
Даты
2011-09-10—Публикация
2007-01-12—Подача