Данная заявка заявляет положительный эффект предварительной заявки Соединенных Штатов с регистрационным номером 61/184871, направленной на рассмотрение 8 июня 2009 г. Настоящее изобретение относится к некоторым 3-галоген-6-(арил)-4-иминотетрагидропиколинатам и их производным и к применению таких соединений в качестве гербицидов.
В данной области техники описан ряд пиколиновых кислот и их пестицидные свойства. В патентах США 6784137 В2 и 7314849 В2 описан класс 6-арил-4-аминопиколиновых кислот и их производных и их применение в качестве гербицидов. В настоящее время установлено, что 3-галоген-6-(арил)-4-иминотетрагидропиколинаты проявляют похожую гербицидную активность и селективность.
Некоторые 3-галоген-6-(арил)-4-иминотетрагидропиколиновые кислоты и их производные являются гербицидами с широким спектром подавления сорняков относительно ряда сорняков, включая злаковые и широколиственные.
Изобретение включает соединения формулы I:
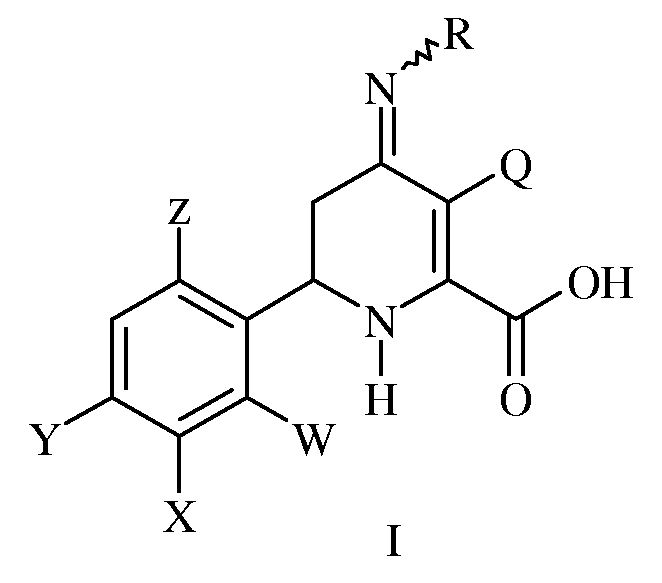
где
R представляет собой -OS(O)2R1, -OC(O)R1 или -OC(O)OR1;
R1 представляет собой С1-С4-алкил или незамещенный или замещенный фенил;
Q представляет собой Cl или Br;
W представляет собой Н, F или Cl;
Х представляет собой Н, F, Cl или С1-С4-алкокси-группу;
Y представляет собой атом галогена;
Z представляет собой Н или F; и
сельскохозяйственно-приемлемые производные по карбоксильной группе кислоты.
Соединения формулы I, где W представляет собой Н или F, Х представляет собой Н, F или С1-С4-алкокси-группу, Y представляет собой Cl и Z представляет собой Н, независимо друг от друга являются предпочтительными.
Изобретение включает гербицидные композиции, содержащие гербицидно-эффективное количество соединения формулы I и сельскохозяйственно-приемлемые производные по карбоксильной группе кислоты в смеси с сельскохозяйственно-приемлемым адъювантом или носителем. Изобретение также включает способ применения соединений и композиций настоящего изобретения для уничтожения нежелательной растительности или подавления нежелательной растительности путем нанесения гербицидного количества соединения на растительность или на место нахождения растительности, а также на почву до всходов растительности.
Другой аспект настоящего изобретения составляет способ получения сложных эфиров 3-галоген-6-(арил)-4-иминотетрагидропиколиновой кислоты формулы:
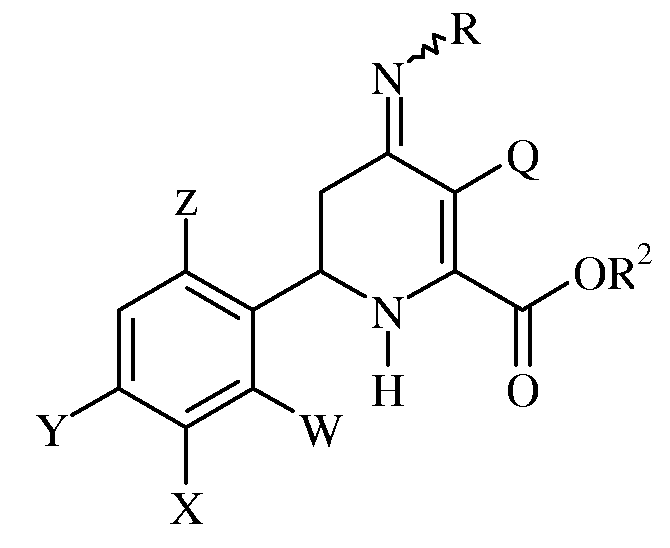
где R представляет собой -OS(O)2R1, -OC(O)R1 или -OC(O)OR1;
R1 представляет собой С1-С4-алкил или незамещенный или замещенный фенил;
R2 представляет собой С1-С4-алкил;
Q представляет собой Cl или Br;
W представляет собой Н, F или Cl;
Х представляет собой Н, F, Cl или С1-С4-алкокси-группу;
Y представляет собой атом галогена; и
Z представляет собой Н или F;
включающий стадии:
а) взаимодействия 4-оксо-тетрагидропиколината формулы:
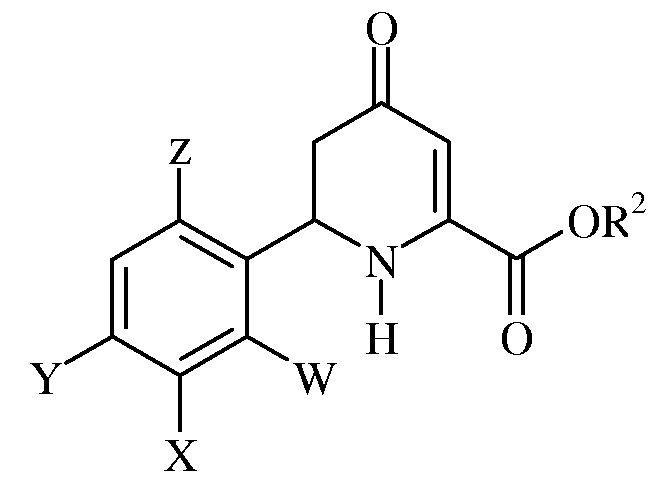
где W, X, Y, Z и R2 имеют ранее определенные значения, с гидроксиламином или гидрохлоридом гидроксиламина в присутствии основания с получением оксима формулы:
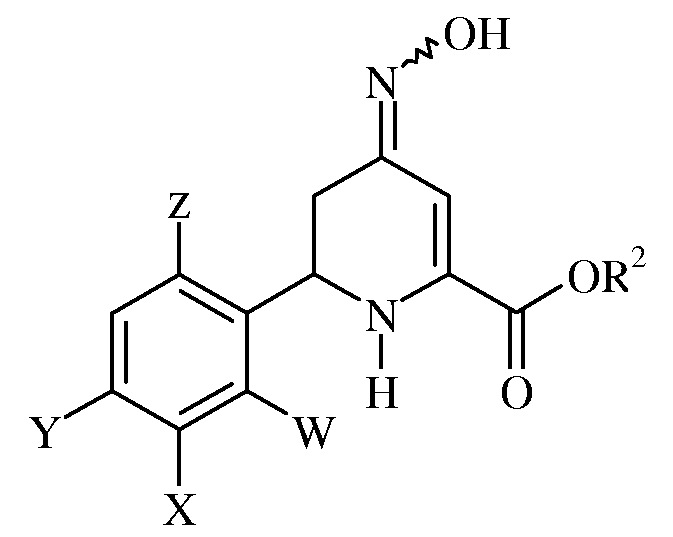
где W, X, Y, Z и R2 имеют ранее определенные значения;
b) взаимодействия оксима с сульфонилхлоридом, ацилхлоридом, алкилхлорформиатом или арилхлорформиатом в присутствии основания с получением соответствующих сульфонилированных, ацилированных или карбонатсодержащих оксимов формулы:
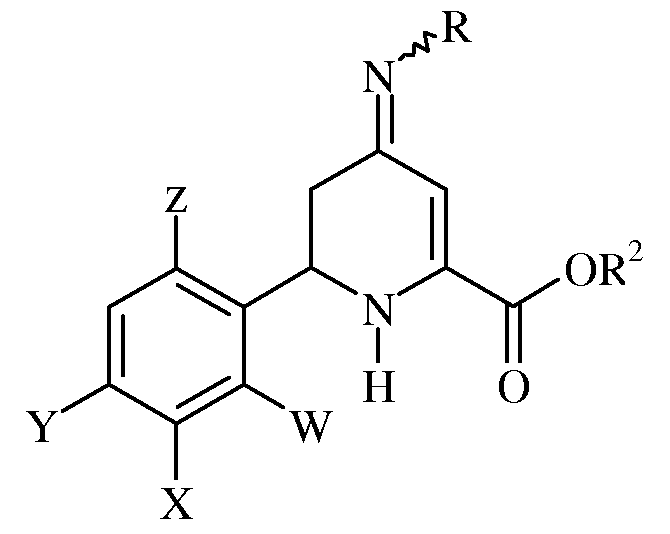
где W, X, Y, Z, R, R1 и R2 имеют ранее определенные значения; и
c) хлорирования или бромирования сульфонилированных, ацилированных или карбонатсодержащих оксимов хлорирующим или бромирующим агентом.
Гербицидные соединения настоящего изобретения представляют собой производные 4-иминотетрагидропиколиновых кислот формулы I:
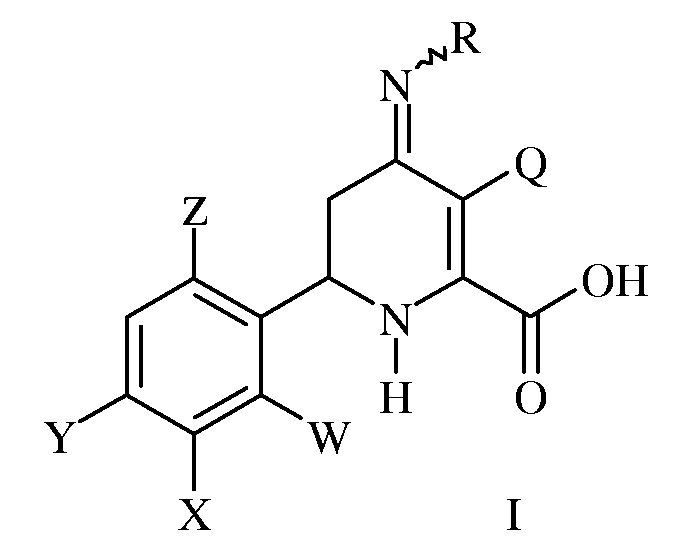
где R представляет собой -OS(O)2R1, -OC(O)R1 или -OC(O)OR1;
R1 представляет собой С1-С4-алкил или незамещенный или замещенный фенил;
Q представляет собой Cl или Br;
W представляет собой Н, F или Cl;
Х представляет собой Н, F или С1-С4-алкокси-группу;
Y представляет собой атом галогена;
Z представляет собой Н или F.
Такие соединения характеризуются тем, что они имеют карбоксильную группу или ее производное во 2-м положении, Cl или Br в 3-м положении, замещенную имино-группу в 4-м положении и моно-, ди-, три- или тетразамещенную фенильную группу в 6-м положении тетрагидропиридинового кольца. Соединения, в которых Cl находится в 3-м положении, в общем случае являются предпочтительными. Предпочтительная замещенная фенильная группа включает 2,3,4-тризамещенные, 3,4-дизамещенные и 4-монозамещенные фенильные группы. Особенно предпочтительными замещенными фенильными группами являются группы, где Y представляет собой Cl, W представляет собой Н или F, Х представляет собой Н, F или C1-C4-алкокси-группу и Z представляет собой Н.
Карбоновые кислоты формулы I, как полагают, представляют собой соединения, которые фактически уничтожают или подавляют нежелательную растительность и являются, как правило, предпочтительными. Аналоги таких соединений, в которых кислотная группа тетрагидропиколиновой кислоты дериватизирована с образованием соответствующего заместителя, который может быть преобразован в растениях или в окружающей среде в кислотную группу, обладают, по существу, таким же гербицидным эффектом и находятся в объеме настоящего изобретения. Таким образом, определение «сельскохозяйственно-приемлемое производное», когда его используют для описания функциональности карбоновой кислоты во 2-м положении, означает любую соль, сложный эфир, ацилгидразид, имидат, тиоимидат, амидин, амид, ортоэфир, ацилцианид, ацилгалогенид, сложный тиоэфир, сложный тионоэфир, сложный дитиоэфир, нитрил или любое другое производное кислоты, хорошо известное в данной области техники, которое (а) по существу не оказывает влияния на гербицидную активность активного ингредиента, то есть 3-галоген-6-(арил)-4-иминотетрагидропиколиновой кислоты; и (b) гидролизуется, окисляется или метаболизирует или может быть гидролизовано, окислено или метаболизировано в растениях или в почве до тетрагидропиколиновой кислоты формулы I, которая, в зависимости от рН, находится в диссоциированной или недиссоциированной форме. Предпочтительными сельскохозяйственно-приемлемыми производными карбоновой кислоты являются сельскохозяйственно-приемлемые соли, сложные эфиры и амиды.
Подходящими солями являются соли, образованные из щелочных или щелочноземельных металлов, и соли, образованные из аммиака и аминов. Предпочтительными катионами являются натрий, калий, магний и аммонийные катионы формулы:
R4R5R6NH+,
где R4, R5 и R6 каждый независимо друг от друга представляет собой водород или С1-С12-алкил, С3-С12-алкенил или С3-С12-алкинил, каждый из которых необязательно замещен одной или несколькими гидрокси-, С1-С4-алкокси-, С1-С4-алкилтио- или фенильными группами, при условии, что R4, R5 и R6 являются стерически совместимыми. Кроме того, любые два заместителя из R4, R5 и R6 вместе могут представлять собой алифатический дифункциональный остаток, содержащий от одного до двенадцати атомов углерода и до двух атомов кислорода или серы. Соли соединений формулы I могут быть получены обработкой соединений формулы I гидроксидом металла, таким как гидроксид натрия, или амином, таким как аммиак, триэтиламин, диэтаноламин, 2-метилтиопропиламин, бисаллиламин, 2-бутоксиэтиламин, морфолин, циклододециламин или бензиламин. Аминные соли часто представляют собой предпочтительные формы соединений формулы I, так как они являются растворимыми в воде и сами по себе подходят для получения желаемых гербицидных композиций на водной основе.
Подходящими сложными эфирами являются сложные эфиры, образованные из С1-С12-алкиловых, С3-С12-алкеновых или С3-С12-алкиниловых спиртов, таких как метиловый спирт, изопропиловый спирт, 1-бутанол, 2-этилгексанол, бутоксиэтанол, метоксипропанол, аллиловый спирт, пропаргиловый спирт или циклогексанол. Сложные эфиры могут быть получены путем сочетания тетрагидропиколиновой кислоты со спиртом с использованием любого количества подходящих активирующих агентов, таких как агенты, используемые для пептидного сочетания, такие как дициклогексилкарбодиимид (DCC) или карбонилдиимидазол (CDI), реакцией соответствующего хлорангидрида тетрагидропиколиновой кислоты формулы I с подходящим спиртом, или реакцией соответствующей пиколиновой кислоты формулы I с подходящим спиртом в присутствии кислого катализатора. Подходящими амидами являются амиды, образованные из аммиака или С1-С12-алкил-, С3-С12-алкенил- или С3-С12-алкинил- моно- или дизамещенных аминов, таких как, но без ограничения ими, диметиламин, диэтаноламин, 2-метилтиопропиламин, бисаллиламин, 2-бутоксиэтиламин, циклододециламин, бензиламин или циклические или ароматические амины с дополнительным гетероатомом или без него, такие как, но без ограничения, азиридин, азетидин, пирролидин, пиррол, имидазол, тетразол или морфолин. Амиды могут быть получены при взаимодействии соответствующего хлорангидрида тетрагидропиколиновой кислоты, смешанного ангидрида или карбонового эфира формулы I с аммиаком или соответствующим амином.
Определение «алкил», а также производные определения, такие как «алкокси», используемые в данном описании, включают в рамки своего определения линейные, разветвленные и циклические остатки.
Определение «незамещенный или замещенный фенил» относится к фенильной группе, которая является незамещенной или может быть замещена одним или несколькими атомами галогена, С1-С4-алкилом, С1-С4-алкокси-группой или нитро-группой.
Если специально не ограничено, то определение «галоген», включая производные определения, такие как «гало», относится к атомам фтора, хлора, брома и йода. Соединения формулы I могут быть получены с использованием хорошо известных химических методик. Требуемые исходные материалы являются коммерчески доступными или могут быть легко синтезированы с использованием стандартных методик.
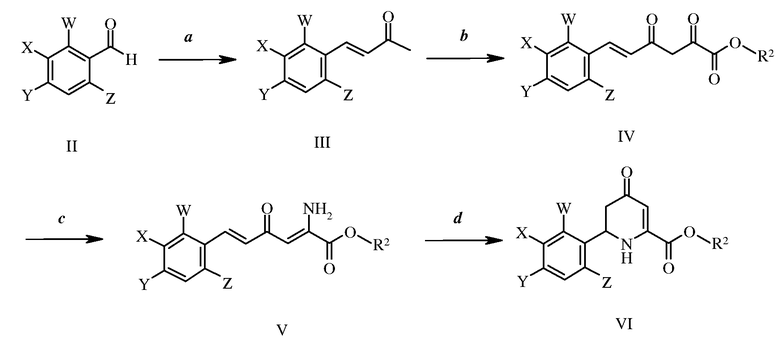
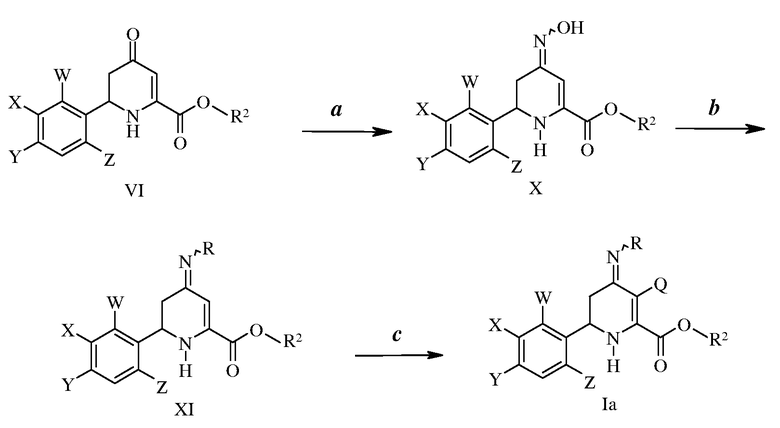
3-Галоген-6-(арил)-4-иминотетрагидропиколинаты формулы I могут быть получены рядом путей. На стадии а схемы I ароматический альдегид формулы II, где W, X, Y и Z имеют ранее определенные значения, могут быть конденсированы с кетоном, таким как ацетон, в присутствии основания, такого как гидроксид натрия, с получением α,β-ненасыщенного кетона формулы III. Такие соединения затем могут быть введены в реакцию с основанием, таким как этоксид натрия, в присутствии диалкил-оксалата с образованием β-дикетоэфира формулы IV, как на стадии b, где R2 представляет собой С1-С4-алкил, например, как в патенте США № 4304728. На стадии с схемы I взаимодействие источника амина, такого как ацетат аммония, с соединениями формулы IV, приводит к образованию енамина формулы V. В этой реакции необходимо отношение β-дикетоэфира формулы IV к источнику амина приблизительно 1:2. Реакцию проводят при температурах от 25 до 80°С. Температуры от 60 до 80°С обычно предпочтительны. Реакцию предпочтительно проводят в полярном протонном растворителе. Предпочтительными растворителями являются спирты. Или метиловый спирт, или этиловый спирт являются наиболее предпочтительным растворителем. И, наконец, на стадии d схемы I 4-оксо-тетрагидропиколинаты формулы VI получают путем нагревания соединений формул V при высоких температурах в автоклаве. Реакцию проводят при температурах от 125 до 200°С. Температуры от 150 до 200°С в целом являются предпочтительными. Реакцию предпочтительно проводят в полярном апротонном растворителе. Предпочтительными растворителями являются простые эфиры, такие как 1,4-диоксан.
Схема I
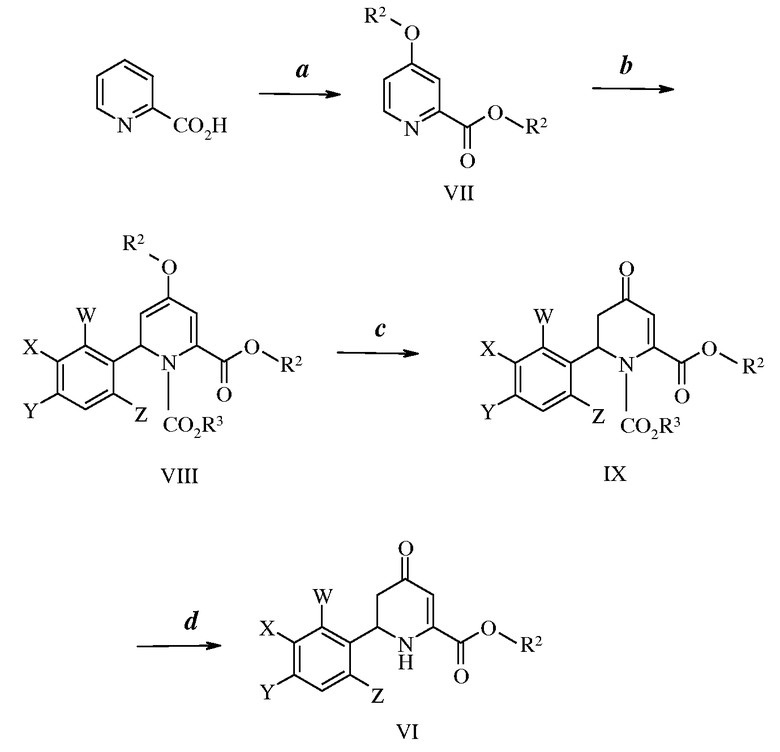
Другой путь получения 4-оксо-тетрагидропиколинатов формулы VI можно найти на схеме II. На стадии а схемы II 2-пиколиновую кислоту обрабатывают тионилхлоридом и спиртом, таким как метиловый спирт, с получением сложного эфира 4-алкокси-2-пиколиновой кислоты формулы VII, где R2 имеет ранее определенные значения. Обработка соединений формулы VII хлорформиатом с последующим добавлением in situ галогенида арилцинка, где W, X, Y и Z имеют ранее определенные значения, к полученной смеси дает дигидропиколинат формулы VIII, как показано на стадии b, где R3 представляет собой фенил. В первой части этого двухступенчатого протокола реакции в одной емкости необходим небольшой избыток хлорформиата относительно соединения формулы VII. Реакцию проводят при температурах от -5°С до 20°С. Температуры от -5°С до 10оС обычно являются предпочтительными. Реакцию предпочтительно проводят в полярном апротонном растворителе. Предпочтительными растворителями являются простые эфиры. Или тетрагидрофуран (ТГФ), или диэтиловый эфир является наиболее предпочтительным растворителем. Во второй части этой стадии требуется небольшой избыток галогенида арилцинка относительно соединения формулы VII и реакцию проводят при температурах от -5°С до 30°С. Температуры от 20°С до 30°С обычно предпочтительны. На стадии с схемы II кислый гидролиз соединений формулы VIII в полярном апротонном растворителе, таком как ТГФ, дает 4-оксо-тетрагидропиколинат формы IX, защищенный в виде карбамата. В этой реакции требуется избыток кислоты относительно соединения формулы VIII. Реакцию проводят при температурах от -5°С до 30°С. Температуры от 20°С до 30°С обычно предпочтительны. Реакцию предпочтительно проводят в смеси полярных растворителей. Предпочтительными растворителями являются смеси простой эфир/вода, например, ТГФ/вода. И, наконец, на стадии d схемы II обработка соединений формулы IX основанием, таким как метоксид натрия, с последующей водной обработкой дает 4-оксо-тетрагидропиколинат формулы VI. В этой реакции требуется небольшой избыток основания относительно соединения формулы IX. Реакцию проводят при температурах от -5°С до 20°С. Температуры от -5°С до 10°С обычно предпочтительны. Реакцию предпочтительно проводят в полярном протонном растворителе. Предпочтительными растворителями являются спирты, например, метиловый спирт.
Схема II
Соединения формулы VI, где W, X, Y, Z и R2 имеют ранее определенные значения, могут быть превращены в соответствующие оксимы формулы X по реакции с гидроксиламином или гидрохлоридом гидроксиламина в присутствии основания, такого как пиридин, и в растворителе, таком как толуол или метанол, как на стадии а схемы III. В реакции требуется избыток гидроксиламина относительно соединения формулы VI. Реакцию проводят при температурах от 25°С до 80°С. Температуры от 60°С до 80°С обычно предпочтительны. Реакцию предпочтительно проводят в полярном протонном растворителе. Предпочтительными растворителями являются спирты. Наиболее предпочтительным растворителем является или метиловый спирт, или этиловый спирт. На стадии b схемы III оксимы формулы X могут быть обработаны сульфонилхлоридом, ацилхлоридом, алкилхлорформиатом или арилхлорформиатом в присутствии основания с получением соответствующих сульфонилированных, ацилированных или карбонатсодержащих оксимов формулы XI, где R представляет собой -OS(O)2R1, -OC(O)R1 или -OC(O)OR1 и R1 имеет ранее определенные значения. В данной реакции требуется отношение сульфонилирующего, ацилирующего или карбонилирующего реагента к соединению формулы Х почти 2:1. Требуется, по меньшей мере, один эквивалент третичного аминного основания, причем предпочтительным является количество от 1 до 2 эквивалентов. Реакцию проводят при температурах от -5°С до 30°С. Температуры от -5°С до 20°С обычно предпочтительны. Предпочтительными растворителями являются инертные растворители, такие как хлорированные углеводороды. Взаимодействие замещенных оксимов формулы XIa с хлорирующим агентом, таким как сульфурилхлорид, или бромирующим агентом, таким как бром или N-бромсукцинимид, дает 3-галоген-(6-арил)-4-иминотетрагидропиколинаты формулы I, где Q имеет ранее определенные значения, как показано на стадии с схемы III. В этой реакции необходимы приблизительно эквимолярные количества хлорирующего или бромирующего агента и соединения формулы XIa. Реакцию проводят при температурах от -5°С до 30°С. Температуры от -5°С до 20°С обычно предпочтительны. Предпочтительными растворителями являются инертные растворители, такие как дихлорметан. С другой стороны, образование соединений формулы Ia может быть проведено путем обработки соединений формулы VI в другом порядке - стадии с, а и затем стадия b.
Схема III
Соединения формулы I, полученные любым из этих способов, могут быть выделены с помощью обычных средств. Как правило, реакционную смесь подкисляют водной кислотой, такой как соляная кислота, и экстрагируют органическим растворителем, таким как этилацетат или дихлорметан. Органический растворитель и другие летучие компоненты могут быть удалены отгонкой или упариванием с получением целевого соединения формулы I, которое может быть очищено с помощью стандартных методик, таких как перекристаллизация или хроматография.
Соединения формулы I, как установлено, могут быть полезны в качестве довсходовых и послевсходовых гербицидов. Они могут быть применены при неселективных (более высоких) нормах расхода при применении, чтобы контролировать широкий спектр растительности на участке, или при более низких нормах расхода при применении для селективного подавления нежелательной растительности. Области применения включают пастбища, полигоны, обочины дорог и полосы отчуждения, силовые линии и любые промышленные участки, где необходим контроль нежелательной растительности. Другим применением является контроль нежелательной растительности в культурах, таких как кукуруза, рис и зерновые. Другим применением является контроль нежелательной растительности в древесных культурах, таких как цитрусовые, яблони, каучуковые, масличная пальма, лесопосадки и другие. Обычно предпочтительно применять соединения после всходов. Также предпочтительно применение соединений для контроля широкого спектра широколиственных и злаковых сорняков. Применение соединений для контроля нежелательной растительности в укоренившихся культурах определено специально. Хотя каждое из 3-галоген-6-(арил)-4-иминотетра-гидропиколинатных соединений, охваченных формулой I, находится в рамках изобретения, получаемая степень гербицидной активности, селективность для культуры и спектр контроля сорняков меняются в зависимости от присутствующих заместителей. Подходящее соединение для любого конкретного гербицидного применения может быть определено за счет использования информации, представленной в данном случае, и с помощью обычных испытаний.
Определение «гербицид» используют в данном случае для обозначения активного ингредиента, который уничтожает, контролирует или другим образом отрицательно модифицирует рост растений. Гербицидно-эффективное или контролирующее растительность количество представляет собой количество активного ингредиента, которое вызывает отрицательно модифицирующий эффект и включает отклонения от естественного развития, уничтожение, регулирование, высыхание, подавление и т.д. Определения «растения» и «растительность» включают проростки семян, прорастающую рассаду, наземные и подземные части растений, такие как побеги, корни, клубни, ризомы (корневища) и т.д., и укоренившуюся растительность.
Гербицидную активность соединения настоящего изобретения проявляют, когда их наносят непосредственно на растение или на место нахождения растения на любой стадии роста или до высадки или всходов. Наблюдаемый эффект зависит от вида растения, развитие которого необходимо контролировать, стадии роста растения, параметров применения разбавления и размера капель при распылении, размера частиц твердых компонентов, условий окружающей среды во время применения, конкретных используемых соединений, конкретных используемых адъювантов и носителей, типа почвы и т.д., а также от количества нанесенного химиката. Эти и другие факторы можно регулировать, как это известно в данной области техники, чтобы стимулировать неселективное или селективное гербицидное действие. Как правило, предпочтительно наносить соединения формулы I после всходов на относительно молодую нежелательную растительность, чтобы получить максимальный контроль сорняков.
Нормы расхода при применении от 1 до 4000 граммов на гектар (г/га) обычно используют при послевсходовых обработках; в случае довсходового применения обычно используют нормы расхода от 1 до 4000 г/га. Предполагаемые более высокие нормы расхода обычно обеспечивают неселективный контроль широкого спектра нежелательной растительности. Более низкие нормы расхода обычно дают селективный контроль и могут быть использованы в месте нахождения культур.
Гербицидные соединения настоящего изобретения часто применяют в комбинации с одним или несколькими другими гербицидами, чтобы контролировать более широкий ряд нежелательной растительности. При использовании в комбинации с другими гербицидами заявляемые в настоящее время соединения могут быть приготовлены в рецептуре с другим гербицидом или другими гербицидами, смешаны в баке с другим гербицидом или другими гербицидами или нанесены последовательно с другим гербицидом или другими гербицидами. Некоторые из гербицидов, которые могут быть использованы в комбинации с соединениями настоящего изобретения, представляют собой: амидные гербициды: такие как, аллидохлор, бефлубутамид, бензадокс, бензипрам, бромобутид, кафенстрол, CDEA, хлортиамид, ципразол, диметенамид, диметенамид-Р, дифенамид, эпроназ, этнипромид, фентразамид, флупоксам, фомесафен, галосафен, изокарбамид, изоксабен, напропамид, напталам, петоксамид, пропизамид, хинонамид и тебутам; анилидные гербициды: такие как, хлоранокрил, цисанилид, кломепроп, ципромид, дифлуфеникан, этобензанид, фенасулам, флуфенацет, флуфеникан, мефенацет, мефлуидид, метамифоп, моналид, напроанилид, пентанохлор, пиколинафен и пропанил; арилаланиновые гербициды: такие как бензоилпроп, флампроп и флампроп-М; хлорацетанилидные гербициды: такие как, ацетохлор, алахлор, бутахлор, бутенахлор, делахлор, диетатил, диметахлор, метазахлор, метолахлор, S-метолахлор, претилахлор, пропахлор, пропизохлор, принахлор, тербухлор, тенилхлор и ксилахлор; сульфонанилидные гербициды: такие как бензофтор, перфлуидон, пиримисульфан и профлуазол; сульфонамидные гербициды: такие как асулам, карбасулам, фенасулам и оризалин; антибиотические гербициды: такие как биланафос; гербициды на основе бензойной кислоты: такие как хлорамбен, дикамба, 2,3,6-ТБА и трикамба; гербициды на основе пиримидинилоксибензойной кислоты: такие как биспирибак и пириминобак; гербициды на основе пиримидинилтиобензойной кислоты: такие как пиритиобак; гербициды на основе фталевой кислоты: такие как хлортал; гербициды на основе пиколиновой кислоты: такие как аминопиралид, клопиралид и пиклорам; гербициды на основе хинолинкарбоновой кислоты: такие как квинклорак и квинмерак; мышьяковистые гербициды: такие как кокадиловая кислота, СМА, DSMA, гексафлурат, МАА, МАМА, MSMA, арсенит калия и арсенит натрия; бензоилциклогесандионовые гербициды: такие как мезотрион и сулкотрион; бензофуранилалкилсульфонатные гербициды: такие как бенфурезат и этофумезат; карбаматные гербициды: такие как асулам, карбоксазол, хлорпрокарб, дихлормат, фенасулам, карбутилат и тербукарб; карбанилатные гербициды: такие как барбан, ВСРС, карбасулам, карбетамид, СЕРС, хлорбуфам, хлорпрофам, СРРС, десмедифам, фенизофам, фенмедифам, фенмедифам-этил, профам и свип; циклогексеноксимные гербициды: такие как аллоксидим, бутроксидим, клетодим, клопроксидим, циклоксидим, профоксидим, сетоксидим, тепралоксидим и тралоксидим; циклопропилизоксазоловые гербициды: такие как изоксахлортол и изоксафлутол; дикарбоксимидные гербициды: такие как бензфендизон, цинидон-этил, флумезин, флумиклорак, флумиоксазин и флумипропин; динитроанилиновые гербициды, такие как бенфлуралин, бутралин, динитрамин, эталфлуралин, флухлоралин, изопропалин, металпропалин, нитралин, оризалин, пендиметалин, продиамин, профлюралин и трифлюралин; динитрофенольные гербициды: такие как динофенат, динопроп, диносам, диносеб, динотерб, DNOC, этинофен и мединотерб; гербициды на основе дифенилового эфира, такие как этоксифен; гербициды на основе нитрофенилового эфира, такие как ацифлуорфен, аклонифен, бифенокс, хлометоксифен, хлорнитрофен, этнипромид, флуородифен, флуорогликофен, флуоронитрофен, фомезафен, фурилоксифен, галосафен, лактофен, нитрофен, нитрофлуорфен и оксифлуорфен; дитиокарбаматные гербициды, такие как дазомет и метам; галогенированные алифатические гербициды, такие как алорак, хлоропон, далопон, флупропанат, гексахлорацетон, йодометан, метилбромид, монохлоруксусная кислота, SMA и ТСА; имидазолиноновые гербициды, такие как имазаметабенз, имазамокс, имазапик, имазапир, имазахин и имазетапир; неорганические гербициды, такие как сульфамат аммония, боракс, хлорат кальция, сульфат меди, сульфат железа, азид калия, цианат калия, азид натрия, хлорат натрия и серная кислоты; нитриловые гербициды, такие как бромобонил, бромоксинил, хлороксинил, дихлобенил, йодобонил, йоксинил и пираклонил; фосфорорганические гербициды, такие как амипрофос-метил, анилофос, бенсулид, биланафос, бутамифос, 2,4-DEP, DMPA, EBEP, фосамин, глюфосинат, глифосат и пиперофос; фенокси-гербициды, такие как бромофеноксим, кломепроп, 2,4-DEB, 2,4-DEP, дифенопентен, дисул, эрбон, этнипромид, фентеракол и трифопсим; феноксиуксусные гербициды, такие как 4-СРА, 2,4-Д, 3,4-DA, МСРА, МСРА-тиоэтил и 2,4,5-Т; феноксимасляные гербициды, такие как 4-СРВ, 2,4-DB, 3,4-DB, МСРВ и 2,4,5-ТВ; феноксипропионовые гербициды, такие как клопроп, 4-СРР, дихлорпроп, дихлорпроп-П, 3,4-DP, фенопроп, мекопроп и мекопроп-П; арилоксифеноксипропионовые гербициды, такие как хлоразифоп, клодинафоп, клофоп, цигалофоп, диклофоп, феноксапроп, феноксапроп-Р, фентиапроп, флуазифоп, флуазифоп-Р, галоксифоп, галоксифоп-Р, изоксапирифоп, метамифоп, пропаквизафоп, квизалофоп, квизалофоп-Р и трифоп; фенилендиаминовые гербициды, такие как динитрамин и продиамин; фенилпиразолил-кетоновые гербициды, такие как бензофенап, пиразолинат, пирасульфотол, пиразоксифен и топрамезон; пиразолилфенильные гербициды, такие как флуазолат и пирафлуфен; пиридазиновые гербициды, такие как кредазин, пиридафол и пиридат; пиридазиноновые гербициды, такие как бромпиразон, хлоридазон, димидазон, флуфенпир, метфлуразон, норфлуразон, оксапиразон и пиданон; пиридиновые гербициды, такие как аминопиралид, клиодинат, клопиралид, дитиопир, флуроксипир, галоксидин, пиклорам, пиколинафен, пириклор, тиазопир и триклопир; пиримидиндиаминные гербициды, такие как ипримидам и тиоклорим; четвертичные аммонийные гербициды, такие как циперкват, диэтамкват, дифензокват, дикват, морфамкват и паракват; тиокарбаматные гербициды: такие как бутилат, циклоат, диаллат, ЕРТС, эспрокарб, этиолат, изополинат, метиобенкарб, молинат, орбенкарб, пебулат, просульфокарб, пирибутикарб, сульфаллат, тиобенкарб, тиокарбазил, три-аллат и вернолат; тиокарбонатные гербициды, такие как димексано, EXD и проксан; тиомочевинные гербициды, такие как метиурон; триазиновые гербициды, такие как дипропетрин, триазифам и тригидрокситриазин; хлортриазиновые гербициды, такие как атразин, хлоразин, цианазин, ципразин, эглиназин, ипазин, мезопразин, проциазин, проглиназин, пропазин, себутилазин, симазин, тербутилазин и триэтазин; фторалкилтриазиновые гербициды, такие как индазифлам; метокситриазиновые гербициды: такие как атратон, метометон, прометон, секбуметон, симетон и тербуметон; метилтиотриазиновые гербициды, такие как аметрин, азипротрин, цианатрин, десметрин, диметаметрин, метопротрин, прометрин, симетрин и тербутрин; триазиноновые гербициды, такие как аметридион, амибузин, гексазинон, изометиозин, метамитрон и метрибузин; триазольные гербициды: такие как амитрол, кафенстрол, эпроназ и флупоксам; триазолоновые гербициды, такие как амикарбазон, бенкарбазон, карфентразон, флукарбазон, пропоксикарбазон и сульфентразон; триазолопиримидиновые гербициды, такие как клорансулам, диклосулам, флорасулам, флуметсулам, метосулам, пеноксулам и пироксулам; урациловые гербициды, такие как бутафенацил, бромацил, флупропацил, изоцил, ленацил и тербацил; 3-фенилурацилы; мочевинные гербициды, такие как бензтиазурон, кумилурон, циклурон, дихлоралмочевина, дифлуфензопир, изонорурон, изоурон, метабензтиазурон, монисоурон и норурон; фенилмочевинные гербициды, такие как анизурон, бутурон, хлорбромурон, хлоретурон, хлоротолурон, хлороксурон, даимурон, дифеноксурон, димефурон, диурон, фенурон, флуометурон, флуотиурон, изопротурон, линурон, метиурон, метилдимрон, метобензурон, метобромурон, метоксурон, монолинурон, монурон, небурон, парафлурон, фенобензурон, сидурон, тетрафлурон и тиадиазурон; пиримидинилсульфонилмочевинные гербициды, такие как амидосульфурон, азимсульфурон, бенсульфурон, хлоримурон, циклосульфамурон, этоксисульфурон, флазасульфурон, флуцетосульфурон, флупирсульфурон, форамсульфурон, галосульфурон, имазосульфурон, мезосульфурон, никосульфурон, ортосульфамурон, оксасульфурон, примисульфурон, пиразосульфурон, римсульфурон, сульфометурон, сульфосульфурон и трифлоксисульфурон; триазинилсульфонилмочевинные гербициды, такие как хлорсульфурон, циносульфурон, этаметсульфурон, йодосульфурон, метсульфурон, просульфурон, тифенсульфурон, триасульфурон, трибенурон, трифлусульфурон и тритосульфурон; тиадиазолилмочевинные гербициды, такие как бутиурон, этидимурон, тебутиурон, тиазафлурон и тиадиазурон; и неклассифицированные гербициды, такие как акролеин, аллиловый спирт, аминоциклопирахлор, азафенидин, беназолин, бентазон, бензобициклон, бутидазол, цианамид кальция, камбендихлор, хлорфенак, хлорфенпроп, хлорфлуразол, хлорфлуренол, цинметилин, кломазон, CPMF, крезол, орто-дихлорбензол, димепиперат, эндотал, флуоромидин, флуридон, флурохлоридон, флуртамон, флутиацет, инданофан, метазол, метилтиоцианат, нипираклофен, ОСН, оксадиаргил, оксадиазон, оксазикломефон, пентахлорофенол, пентоксазон, ацетат фенилртути, пиноксаден, просульфалин, пирибензоксим, пирифталид, хинокламин, родетанил, сулгликапин, тидиазимин, тридифан, триметурон, трипропиндан и тритак.
Кроме того, соединения настоящего изобретения могут быть использованы для контроля нежелательной растительности во многих культурах, которые сделаны устойчивыми к ним или резистентными к ним или к другим гербицидам за счет генетической манипуляции или за счет мутации или селекции. Гербицидные соединения настоящего изобретения также могут быть использованы в комбинации с глифосатом, глуфосинатом, дикамбой, имидазолиноном или 2,4-Д на устойчивых к глифосату, устойчивых к глуфосинату, устойчивых к дикамбе, устойчивых к имидазолинону или устойчивых к 2,4-Д культурам. В целом предпочтительно использовать соединения настоящего изобретения в комбинации с гербицидами, которые являются селективными для культуры, подвергаемой обработке, и которые дополняют спектр сорняков, контролируемых этими соединениями в используемых нормах расхода при применении. Также в целом предпочтительно применять соединения настоящего изобретения и другие добавочные гербициды одновременно, или в виде комбинированного препарата или в виде баковой смеси. Аналогично гербицидные соединения настоящего изобретения могут быть использованы в комбинации с ингибиторами ацетолактатсинтазы на культурах, устойчивых к ингибиторам ацетолактатсинтазы.
Соединения настоящего изобретения обычно применяют в комбинации с известными гербицидными антидотами, такими как беноксакор, бентиокарб, брассинолид, клоквинтосет (мексил), циометринил, даимурон, дихлормид, дициклонон, димепиперат, дисульфотон, фенхлоразол-этил, фенклорим, флуразол, флуксофеним, фурилазол, изоксадифен-этил, мефенпир-диэтил, MG 191, MON 4660, нафталиновый ангидрид (NA), оксабетринил, R29148 и амиды N-фенилсульфонилбензойной кислоты, для усиления их селективности.
Хотя возможно использование 3-галоген-6-(арил)-4-иминотетрагидропиколинатных соединений формулы I непосредственно в качестве гербицидов, предпочтительно их использование в смесях, содержащих гербицидно-эффективное количество соединения вместе с, по меньшей мере, одним сельскохозяйственно-приемлемым адъювантом или носителем. Подходящие адъюванты или носители не должны быть фитотоксичными для полезных культур, особенно в концентрациях, используемых при применении композиций для селективного контроля сорняков в присутствии культур, и не должны реагировать химически с соединениями формулы I или другими ингредиентами композиции. Такие смеси могут быть созданы для нанесения непосредственно на сорняки или их места нахождения или могут представлять собой концентраты или препараты, которые обычно разбавляют дополнительными носителями и адъювантами перед применением. Они могут быть твердыми, такими как, например, дусты, гранулы, вододиспергируемые гранулы или смачивающиеся порошки; или жидкими, такими как, например, эмульгирующиеся концентраты, растворы, эмульсии или суспензии. Они также могут быть представлены в виде премикса или баковой смеси.
Подходящие сельскохозяйственные адъюванты и носители, которые могут быть полезны при получении гербицидных смесей настоящего изобретения, хорошо известны специалистам в данной области техники. Некоторые из таких адъювантов включают, но не ограничиваются ими, масляные концентраты (минеральное масло (85%) + эмульгаторы (15%)); этоксилаты нонилфенола; четвертичные бензилкокоалкилдиметиламмонийные соли; смесь нефтяного углеводорода, сложных алкиловых эфиров, органической кислоты и анионного поверхностно-активного вещества; С9-С11-алкилполигликозид; этоксилат фосфатированного спирта; этоксилат природного первичного спирта (С12-С16); ди-втор-бутилфенол-ЭО-ПО-блок-сополимер; полисилоксан с метильным концом; (этоксилат нонилфенола) + (мочевина, нитрат аммония); эмульгированное метилированное растительное масло; этоксилат (8ЭО) тридецилового (синтетический) спирта; этоксилат (15ЭО) твердого амина; диолеат-99 ПЭГ (400).
Жидкие носители, которые могут быть использованы, включают воду и органические растворители. Органические растворители, как правило, представляют собой, но не ограничиваются ими, нефтяные фракции или углеводороды, такие как минеральное масло, ароматические растворители, парафиновые масла и т.д.; растительные масла, такие как соевое масло, рапсовое масло, оливковое масло, касторовое масло, подсолнечное масло, кокосовое масло, кукурузное масло, хлопковое масло, льняное масло, пальмовое масло, сафлоровое масло, кунжутное масло, тунговое масло и т.д.; сложные эфиры описанных выше растительных масел; сложные эфиры моноспиртов или двухатомных, трехатомных или других низших полиспиртов (содержащих 4-6 гидроксильных групп), такие как 2-этилгексилстеарат, н-бутил-олеат, изопропилмиристат, диолеат пропиленгликоля, ди-октил-сукцинат, дибутиладипат, диоктилфталат и т.д.; сложные эфиры моно-, ди- и поликарбоновых кислот и т.д. Конкретными органическими растворителями являются толуол, ксилол, нафта, растительное масло, ацетон, метилэтилкетон, циклогексанон, трихлорэтилен, перхлорэтилен, этилацетат, амилацетат, бутил-ацетат, монометиловый эфир пропиленгликоля и монометиловый эфир диэтиленгликоля, метиловый спирт, этиловый спирт, изопропиловый спирт, амиловый спирт, этиленгликоль, пропиленгликоль, глицерин, N-метил-2-пирролидон, N,N-диметилалкиламиды, диметилсульфоксид, жидкие питательные вещества и т.д. Вода обычно является выбираемым носителем для разбавления концентратов.
Подходящими твердыми носителями являются тальк, пирофиллитовая глина, диоксид кремния, аттапульгитовая глина, каолиновая глина, кизельгур, мел, диатомовая земля, известь, карбонат кальция, бентонитовая глина, фуллерова земля, шелуха хлопковых семян, пшеничная мука, соевая мука, пемза, древесная мука, мука из скорлупы грецкого ореха, лигнин и т.д.
Обычно желательно вводить одно или несколько поверхностно-активных веществ в композиции настоящего изобретения. Такие поверхностно-активные агенты преимущественно используют как в твердых, так и в жидких композициях, особенно в композициях, предназначенных для разбавления носителем перед применением. Поверхностно-активные агенты могут быть анионными, катионными или неионными по характеру и могут быть использованы в качестве эмульгирующих агентов, смачивающих агентов, суспендирующих агентов или для других целей. Поверхностно-активные вещества, используемые в области приготовления рецептур и которые могут быть также использованы в рассматриваемых препаратах, описаны, в частности, в публикации McCutcheon's Detergents and Emulsifiers Annual, VC Publishing Corp., Ridgewood, New Jersey, 1998, и в публикации Encyclopedia of Surfactants, Vol. I-III, Chemical Publishing Co., New York, 1980-81. Типичными поверхностно-активными агентами являются алкилсульфаты, такие как лаурилсульфат диэтаноламмония; алкиларилсульфонатные соли, такие как додецилбензолсульфонат кальция; алкилфенол-алкиленоксидные продукты присоединения, такие как нонилфенол-С18-этоксилат; спирт-алкиленоксидные продукты присоединения, такие как (тридециловый спирт)-С16-этоксилат; мыла, такие как стеарат натрия; алкилнафталинсульфонатные соли, такие как дибутилнафталинсульфонат натрия; диалкиловые эфиры сульфосукцинататных солей, такие как ди(2-этилгексил)-сульфосукцинат натрия; сложные эфиры сорбита, такие как олеат сорбита; четвертичные амины, такие как лаурилтриметиламмонийхлорид; полиэтиленгликолевые эфиры жирных кислот, такие как стеарат полиэтиленгликоля; блок-сополимеры этиленоксида и пропиленоксида; соли моно- и диалкилфосфатных эфиров; растительные масла, такие как соевое масло, рапсовое масло, оливковое масло, касторовое масло, подсолнечное масло, кокосовое масло, кукурузное масло, хлопковое масло, льняное масло, пальмовое масло, арахисовое масло, сафлоровое масло, кунжутное масло, тунговое масло и т.д.; и сложные эфиры приведенных выше растительных масел.
Другие адъюванты, обычно используемые в сельскохозяйственных композициях, включают совмещающие агенты, противопенные агенты, пассиваторы, нейтрализующие агенты и буферы, ингибиторы коррозии, красители, одоранты, распределители, пенетранты, агенты, способствующие прилипанию, диспергирующие агенты, загустители, агенты, понижающие точку замерзания, противомикробные агенты и т.д. Композиции также могут содержать другие совместимые компоненты, например другие гербициды, регуляторы роста растений, фунгициды, инсектициды и т.д., и могут быть получены с жидкими удобрениями или твердыми удобрениями-носителями в форме частиц, такими как нитрат аммония, мочевина и т.д.
Концентрация активных ингредиентов в гербицидных композициях настоящего изобретения обычно составляет от 0,001 до 98% масс. Часто используют концентрации от 0,01 до 90% масс. В композициях, предназначенных для применения в виде концентратов, активный ингредиент обычно присутствует в концентрации от 5 до 98% масс., предпочтительно от 10 до 90% масс. Такие композиции перед применением обычно разбавляют инертным носителем, таким как вода. Разбавленные композиции, обычно наносимые на сорняки или места нахождения сорняков, обычно содержат от 0,0001 до 1% масс. активного ингредиента и предпочтительно содержат от 0,001 до 0,05% масс.
Рассматриваемые композиции могут быть нанесены на сорняки или места их нахождения путем использования обычных наземных или воздушных распылителей, опрыскивателей и машин для внесения гранул, путем добавления в поливную воду и с помощью других средств, известных в специалисту в данной области техники.
Следующие примеры представлены для иллюстрации различных аспектов настоящего изобретения и не должны рассматриваться как ограничивающие формулу изобретения.
ПРИМЕРЫ
Пример 1. Получение (Е)-4-(4-хлор-2-фторфенил)бут-3-ен-2-она (1)
К раствору 4-хлор-2-фторбензальдегида (23,8 г, 0,15 моль) в ацетоне (100 мл) при механическом перемешивании при комнатной температуре в течение 20 минут добавляют раствор гидроксида натрия (NaOH, 6,6 г, 0,165 моль) в воде (Н2О, 400 мл). После перемешивания реакционной смеси в течение ночи добавляют дихлорметан (CH2Cl2, 100 мл). Водный слой отделяют и экстрагируют CH2Cl2 (100 мл), объединенные органические экстракты промывают рассолом и сушат над сульфатом магния (MgSO4). Удаление растворителя, после чего следует вакуумная перегонка (Kugelrohr), дает 4-(4-хлор-2-фторфенил)-3-бутен-2-он (1; 22,5 г, 76%) в виде бесцветной жидкости, которая твердеет при стоянии: т.кип. 70-80°С, 0,1 мм рт.ст. (13,33 Па).
1H ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=16,5 Гц, 1Н), 7,50 (т, J=8,1 Гц, 1Н), 7,22-7,12 (м, 2H), 6,76 (д, J=16,5 Гц, 1Н), 2,39 (с, 3H); МСВР-ЭС (масс-спектрометрия высокого разрешения с ионизацией электроспреем, HRMS-ESI) (m/z): вычислено для C10H8ClFO, 198,024; найдено 198,025.
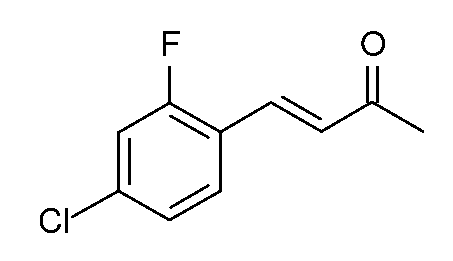
(Е)-4-(4-Хлор-2-фтор-3-метоксифенил)-бут-3-ен-2-он (2)
С использованием методики примера 1 4-хлор-2-фтор-3-метоксибензальдегид (200 г, 1,6 моль), NaOH (46,6 г, 1,16 моль) и ацетон (1 л) вводят в реакцию с получением (Е)-4-(4-хлор-2-фтор-3-метоксифенил)-3-бутен-2-она (2; 180 г, 74%, чистота по данным ВЭЖХ 93%) в виде светло-коричневой жидкости. 1H ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=16,5 Гц, 1Н), 7,50 (т, J=8,1 Гц, 1Н), 7,26-7,07 (м, 2H), 6,76 (д, J=16,5 Гц, 1Н), 2,39 (с, 3H); МСВР-ЭС (m/z): вычислено для C11H10ClFO2, 228,035; найдено 228,036.
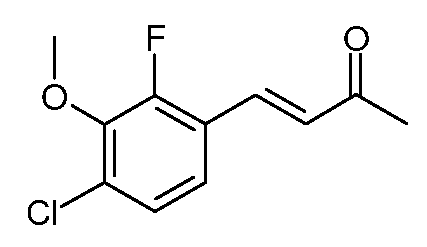
Пример 2. Получение этилового эфира (Е)-6-(4-хлор-2-фторфенил)-2,4-диоксо-гекс-5-еновой кислоты (3)
Гранулы натрия (2,88 г, 0,125 моль) медленно добавляют к абсолютному этиловому спирту (EtOH, 125 мл). После того как натрий прореагирует, растворитель удаляют при пониженном давлении и добавляют безводный эфир (200 мл). Реакционную смесь охлаждают до -5°С и в течение 30 минут добавляют раствор (Е)-4-(4-хлор-2-фторфенил)-бут-3-ен-2-она (1; 24,75 г, 0,125 моль) и диэтилоксалата (21,9 г, 0,15 моль) в безводном эфире (25 мл). После перемешивания в течение 2 дней при комнатной температуре желтое твердое вещество отфильтровывают и промывают эфиром. После сушки 1 час при комнатной температуре твердое вещество распределяют между CH2Cl2 (200 мл) и 1 н. серной кислотой (H2SO4, 150 мл). Органический слой сушат (MgSO4) и растворитель удаляют, получают этиловый эфир (Е)-6-(4-хлор-2-фторфенил)-2,4-диоксо-гекс-5-еновой кислоты (3; 32,3 г, 86%) в виде желтого твердого вещества. Небольшой образец перекристаллизовывают из EtOH, получают желтые кристаллы: т.пл. 84-85°С. 1H ЯМР (400 МГц, CDCl3) δ 14,72 (с, 1Н), 7,76 (д, J=16,1 Гц, 1Н), 7,49 (д, J=8,3 Гц, 1Н), 7,24-7,12 (м, 2H), 6,73 (д, J=16,1 Гц, 1Н), 6,53 (с, 1Н), 4,38 (кв, J=7,1 Гц, 2H), 1,40 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C14H12ClFO4, 298,041; найдено 298,041.
Этиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксо-гекс-5-еновой кислоты (4)
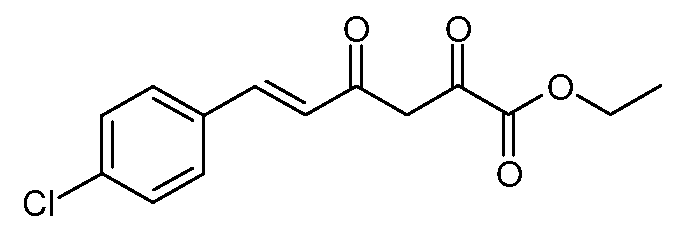
С использованием методики примера 2 вводят в реакцию гранулы натрия (6,33 г, 0,275 моль), (Е)-4-(4-хлорфенил)бут-3-ен-2-он (45,16 г, 0,25 моль) и диэтилоксалат (43,8 г, 0,30 моль), получают этиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксо-гекс-5-еновой кислоты (4; 61,1 г, 87%) в виде желтых кристаллов: т.пл. 117-118°С. 1H ЯМР (400 МГц, CDCl3) δ 14,80 (с, 1Н), 7,68 (д, J=15,9 Гц, 1Н), 7,53-7,35 (м, 4H), 6,62 (д, J=15,9 Гц, 1Н), 6,53 (с, 1Н), 4,38 (кв, J=7,2 Гц, 2H), 1,40 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C14H13ClO4, 280,050; найдено 280,050.
Этиловый эфир (Е)-6-(4-хлор-2-фтор-3-метоксифенил)-2,4-диоксо-гекс-5-еновой кислоты (5)
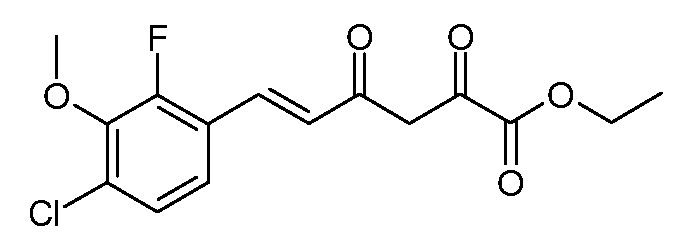
С использованием методики примера 2 вводят в реакцию гранулы натрия (5,52 г, 0,24 моль), (Е)-4-(4-хлор-2-фтор-3-метоксифенил)бут-3-ен-2-он (2; 45,73 г, 0,20 моль) и диэтилоксалат (36,54 г, 0,25 моль), получают этиловый эфир (Е)-6-(4-хлор-2-фтор-3-метоксифенил)-2,4-диоксо-гекс-5-еновой кислоты (5; 61,1 г, 93%) в виде желтых кристаллов: т.пл. 67,5-69°С. 1H ЯМР (400 МГц, CDCl3) δ 14,71 (с, 1Н), 7,78 (д, J=16,1 Гц, 1Н), 7,27-7,18 (м, 2H), 6,73 (д, J=16,1 Гц, 1Н), 6,54 (с, 1Н), 4,38 (кв, J=7,1 Гц, 2H), 3,99 (д, J=1,2 Гц, 3H), 1,41 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C15H14ClFNO5, 328,051; найдено 328,051.
Пример 3. Получение метилового эфира (Е)-6-(4-хлорфенил)-2,4-диоксо-гекс-5-еновой кислоты (6)
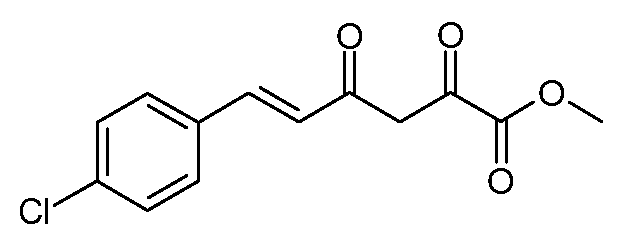
Раствор этилового эфира (Е)-6-(4-хлорфенил)-2,4-диоксо-гекс-5-еновой кислоты (4; 33,39 г, 0,12 моль) и конц. H2SO4 (0,5 мл) перемешивают при кипении с обратным холодильником в течение 6 часов в метиловом спирте (MeOH, 400 мл). При охлаждении и снижении концентрации растворителя собирают метиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксо-гекс-5-еновой кислоты (6; 22,7 г, 71%) в виде желтых кристаллов: п.пл. 135-136°С. 1H ЯМР (400 МГц, CDCl3) δ 14,74 (с, 1Н), 7,67 (д, J=15,9 Гц, 1Н), 7,49 (д, J=8,5 Гц, 2H), 7,38 (д, J=8,5 Гц, 2H), 6,61 (д, J=15,9 Гц, 1Н), 6,53 (с, 1Н), 3,92 (с, 3H); МСВР-ЭС (m/z): вычислено для C13H11ClO4, 266,034; найдено 266,034.
Пример 4. Получение этилового эфира (2Z,5E)-2-амино-6-(4-хлор-2-фторфенил)-4-оксо-гекса-2,5-диеновой кислоты (7)
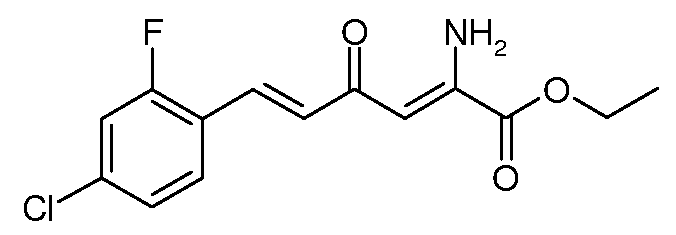
Смесь этилового эфира (Е)-6-(4-хлор-2-фторфенил)-2,4-диоксо-гекс-5-еновой кислоты (3; 15,0 г, 0,05 моль) и ацетата аммония (7,7 г, 0,1 моль) в EtOH (100 мл) перемешивают и нагревают при кипении с обратным холодильником 1 час. Растворитель удаляют при пониженном давлении, остаток растворяют в CH2Cl2 (200 мл) и промывают насыщенным водным раствором карбоната натрия (Na2CO3, 100 мл). После сушки над MgSO4 добавляют силикагель (50 г) и растворитель упаривают. Остаток промывают смесью (20% этилацетат (EtOAc))/гексаны (300 мл), получают после удаления растворителя этиловый эфир (2Z,5E)-2-амино-6-(4-хлор-2-фторфенил)-4-оксо-гекса-2,5-диеновой кислоты (7; 6,1 г, 41%) в виде светло-оранжевого твердого вещества: т.пл. 102-103°С. 1H ЯМР (400 МГц, CDCl3) δ 9,4 (уш.с, 1Н), 7,62 (д, J=15,9 Гц, 1Н), 7,52 (т, J=8,5 Гц, 1Н), 7,49 (д, J=8,3 Гц, 1Н), 7,19-7,08 (м, 2H), 6,87 (д, J=15,9 Гц, 1Н), 6,14 (с, 1Н), 6,05 (уш.с, 1Н), 4,37 (кв, J=7,1 Гц, 2H), 1,39 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C14H13ClFNO3, 297,056; найдено 297,056. После промывки силикагеля смесью 40% EtOAc/гексаны (400 мл) получают еще этиловый эфир (2Z,5E)-2-амино-6-(4-хлор-2-фторфенил)-4-оксо-гекса-2,5-диеновой кислоты (7; 8,8 г, чистота по данным спектроскопии 1Н ЯМР 70%), всего 12,2 г (82%).
Этиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксо-гекса-2,5-диеновой кислоты (8)
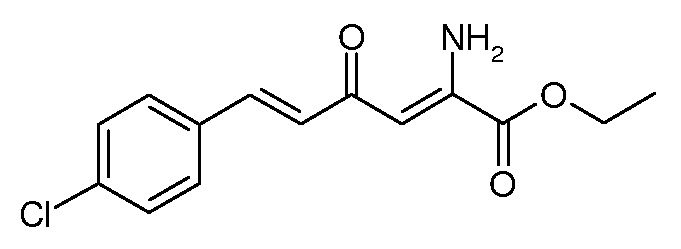
С использованием методики примера 4 этиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксо-гекс-5-еновой кислоты (4; 79,5 г, 0,284 моль) и ацетат аммония (43,78 г, 0,568 моль) вводят в реакцию в EtOH (795 мл), получают этиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксо-гекса-2,5-диеновой кислоты (8; 47 г, 86%) в виде желтого твердого вещества: т.пл. 105-107°С. 1H ЯМР (400 МГц, CDCl3) δ 9,40 (уш.с, 1Н), 7,52 (д, J=15,9 Гц, 1Н), 7,50-7,47 (м, 2H), 7,38-7,32 (м, 2H), 6,78 (д, J=15,9 Гц, 1Н), 6,14 (с, 1Н), 6,01 (с, 1Н), 4,37 (кв, J=7,1 Гц, 2H), 1,39 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C14H14ClNO3, 279,067; найдено 279,066.
Метиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксо-гекса-2,5-диеновой кислоты (9)
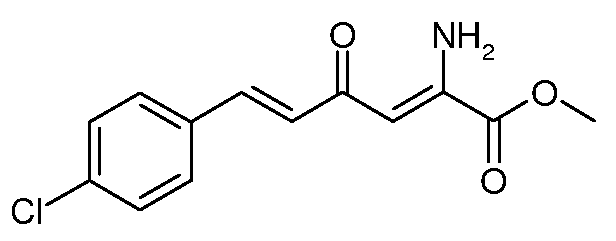
С использованием методики примера 4 метиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксо-гекс-5-еновой кислоты (6; 21,3 г, 0,008 моль) и ацетат аммония (12,33 г, 0,16 моль) вводят в реакцию в MeOH (150 мл), получают метиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксо-гекса-2,5-диеновой кислоты (9; 15,7 г, 74%) в виде желтого твердого вещества: т.пл. 112-113°С. 1H ЯМР (400 МГц, CDCl3) δ 9,37 (уш.с, 1Н), 7,64-7,42 (м, 3H), 7,38-7,32 (м, 2H), 6,75 (д, J=15,9 Гц, 1Н), 6,14 (с, 1Н), 5,99 (уш.с, 1Н), 3,91 (с, 3H); МСВР-ЭС (m/z): вычислено для C13H12ClNO3, 265,050; найдено 265,050.
Этиловый эфир (2Z,5E)-2-амино-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-гекса-2,5-диеновой кислоты (10)
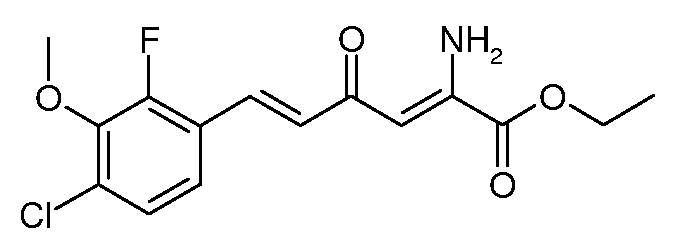
С использованием методики примера 4 этиловый эфир (Е)-6-(4-хлор-2-фтор-3-метоксифенил)-2,4-диоксо-гекс-5-еновой кислоты (5; 37,8 г, 0,115 моль) и ацетат аммония (15,4 г, 0,2 моль) вводят в реакцию в EtOH (200 мл), получают этиловый эфир (2Z,5E)-2-амино-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-гекса-2,5-диеновой кислоты (10; 38,5 г, 92%, чистота по данным спектроскопии 1Н ЯМР 90%) в виде темно-оранжевого твердого вещества. Обработка силикагелем (50 г), после чего следует элюирование смесью (40% EtOAc)/гексаны (400 мл), дает желтое твердое вещество (25,3 г, 67%): т.пл. 103-104°С. 1H ЯМР (400 МГц, CDCl3) δ 9,44 (уш.с, 1Н), 7,63 (д, J=16,1 Гц, 1Н), 7,23 (дд, J=8,6, 7,0 Гц, 1Н), 7,16 (дд, J=8,6, 1,6 Гц, 1Н), 6,87 (д, J=16,1 Гц, 1Н), 6,15 (с, 1Н), 6,04 (уш.с, 1Н), 4,37 (кв, J=7,1 Гц, 2H), 3,98 (д, J=1,2 Гц, 3H), 1,40 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C15H15ClFNO4, 327,067; найдено 327,068.
Пример 5. Получение этилового эфира 6-(4-хлор-2-фтор-фенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11)
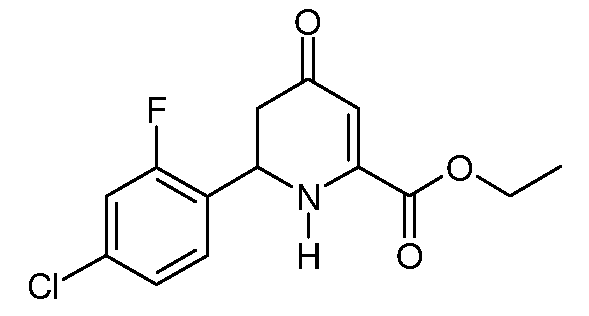
Раствор этилового эфира (2Z,5E)-2-амино-6-(4-хлор-2-фторфенил)-4-оксо-гекса-2,5-диеновой кислоты (7; 5,26 г, 0,0177 моль) в безводном 1,4-диоксане (100 мл) нагревают до 185°С в реакторе Парра объемом 200 мл при положительном давлении азота (N2). Через 9 часов реактор охлаждают, растворитель удаляют при пониженном давлении, получают темно-оранжевое масло (5,85 г). По данным спектроскопии 1Н ЯМР материал содержит 75% целевого этилового эфира 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11) наряду с 25% нециклизированного соединения 7. Очистка на основном оксиде алюминия с элюированием смесью (40% EtOAc)/гексаны дает почти белое твердое вещество (1,4 г, 26%): т.пл. 107-109°С. 1H ЯМР (400 МГц, CDCl3) δ 7,40 (т, J=8,1 Гц, 1Н), 7,22-7,06 (м, 2H), 5,84 (с, 1Н), 5,73 (с, 1Н), 5,09 (т, J=8,9 Гц, 1Н), 4,35 (кв, J=7,1 Гц, 2H), 2,69 (д, J=8,9 Гц, 2H), 1,36 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C14H13ClFNO3, 297,057; найдено 297,057.
При использовании методики примера 5 этиловый эфир (2Z,5E)-2-амино-6-(4-хлор-2-фторфенил)-4-оксо-гекса-2,5-диеновой кислоты (7; 88 г, 0,296 моль) в 1,4-диоксане (880 мл) в реакторе Парра объемом 2 литра, с последующей очисткой хроматографией на силикагеле с элюированием смесью (40% EtOAc/гексаны), дает этиловый эфир 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11; 43 г, 49%, чистота по данным ВЭЖХ 96%) в виде бежевого твердого вещества.
Этиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидро-пиридин-2-карбоновой кислоты (12)
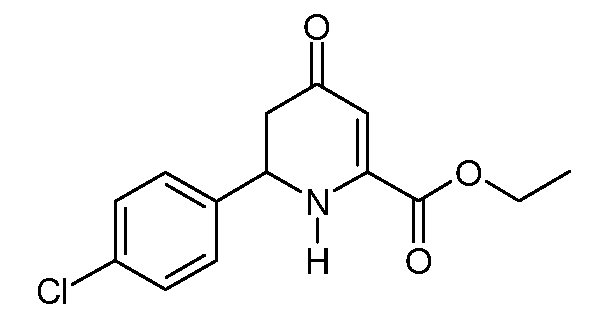
При использовании методики примера 5 этиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксо-гекса-2,5-диеновой кислоты (8; 47 г, 0,168 моль) в 1,4-диоксане (470 мл) в реакторе Парра объемом 2 литра, с последующей очисткой хроматографией на силикагеле с элюированием смесью (40% EtOAc/гексаны), дает этиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (12; 35 г, 49%, чистота по данным ВЭЖХ 99%) в виде почти белого твердого вещества: т.пл. 93-94°С. 1H ЯМР (400 МГц, CDCl3) δ 7,36 (кв, J=8,6 Гц, 4H), 5,82 (с, 1Н), 5,72 (уш.с, 1Н), 4,74 (дд, J=14,2, 5,0 Гц, 1Н), 4,35 (кв, J=7,1 Гц, 2H), 2,68 (дд, J=16,3, 14,2 Гц, 1Н), 2,58 (дд, J=16,4, 5,0 Гц, 1Н), 1,36 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C14H14ClNO3, 279,067; найдено 279,066.
Метиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидро-пиридин-2-карбоновой кислоты (13)
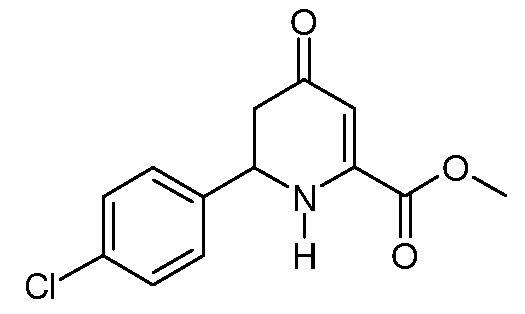
При использовании методики примера 5 метиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксо-гекса-2,5-диеновой кислоты (9; 6,64 г, 0,025 моль) в 1,4-диоксане (100 мл) в реакторе Парра объемом 200 мл после растирания со смесью эфир/пентан дает метиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (13; 6,12 г, 91%, чистота по данным ГХ 98%) в виде почти белого твердого вещества: т.пл. 113-114°С. 1H ЯМР (400 МГц, CDCl3) δ 7,36 (кв, J=8,6 Гц, 4H), 5,82 (с, 1Н), 5,72 (уш.с, 1Н), 4,74 (дд, J=14,2, 5,0 Гц, 1Н), 4,74 (дд, J=14,2, 5,0 Гц, 1Н), 3,90 (с, 3H), 2,68 (дд, J=16,3, 14,2 Гц, 1Н), 2,58 (дд, J=16,4, 5,0 Гц, 1Н); МСВР-ЭС (m/z): вычислено для C13H12ClNO3, 265,050; найдено 265,051.
Этиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (14)
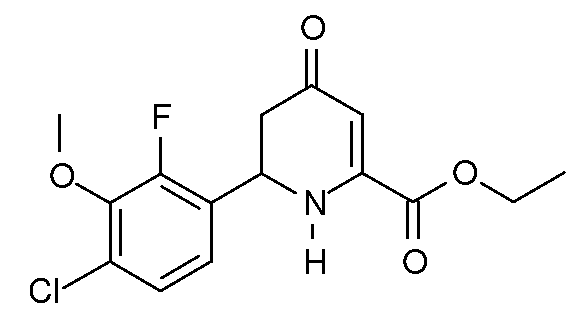
При использовании методики примера 5 этиловый эфир (2Z,5E)-2-амино-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-гекса-2,5-диеновой кислоты (10; 6,55 г, 0,02 моль) в 1,4-диоксане (100 мл) в реакторе Парра объемом 200 мл после растирания со смесью эфир/пентан дает этиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (14; 5,9 г, 90%, чистота по данным ГХ 98%) в виде почти белого твердого вещества: т.пл. 116-118°С. 1H ЯМР (400 МГц, CDCl3) δ 7,22 (дд, J=8,5, 1,8 Гц, 1Н), 7,09 (дд, J=8,4, 7,1 Гц, 1Н), 5,93 (с, 1Н), 5,90 (с, 1Н), 5,21-5,08 (м, 1Н), 4,37 (кв, J=7,1 Гц, 2H), 3,99 (д, J=1,3 Гц, 3H), 2,87-2,73 (м, 2H), 1,38 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): вычислено для C15H15ClFNO4, 327,067; найдено 327,067.
Пример 6. Получение 2-метилового эфира 1-фенилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-5,6-дигидро-4Н-пиридин-1,2-дикарбоновой кислоты (15)
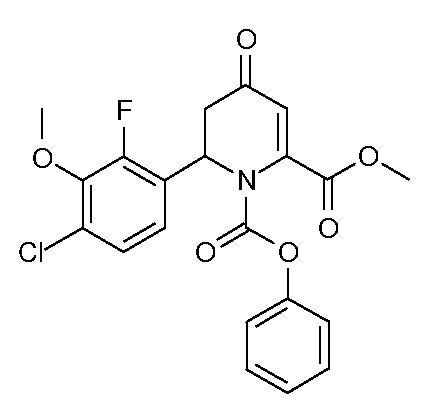
2-Хлор-6-фторанизол (24,5 г, 0,153 моль) растворяют в безводном ТГФ (150 мл) в атмосфере азота. Раствор охлаждают до -60°С и добавляют по каплям в течение 30 минут н-BuLi (67 мл, 2,5 М раствор в гексанах, 0,168 мл). При добавлении реакционная смесь нагревается до -48°С. Реакционную смесь перемешивают 30 минут при -50°С и затем охлаждают до -60°С. Безводный ZnCl2 (25 г, 0,183 моль) добавляют к реакционной смеси вначале путем добавления в виде твердого вещества и затем путем добавления в виде раствора в безводном ТГФ. Реакционную смесь перемешивают при -45°С в течение 2,5 часа, пока почти весь твердый ZnCl2 не растворится. Реакционному раствору дают нагреться до комнатной температуры, и растворитель упаривают путем продувки азота. Остаток снова растворяют в ТГФ, получают исходный раствор.
Метил-4-метоксипиколинат (11,92 г, 0,0713 моль) растворяют в безводном ТГФ (300 мл) в N2. Раствор охлаждают на ледяной бане. Добавляют чистый фенилхлорформиат (10,5 мл, 0,0837 моль). Через 45 минут исходный раствор хлорида (4-хлор-2-фтор-3-метоксифенил)цинка(II) (1,19 М в ТГФ, 76,0 мл, 0,0904 моль) добавляют по каплям в течение 1 часа. Раствор перемешивают при комнатной температуре в течение 3 дней и затем реакцию останавливают путем добавления насыщенного водного раствора хлорида аммония (NH4Cl) (200 мл). Органический слой отделяют, и водный слой экстрагируют эфиром (2 × 100 мл). Объединенные органические экстракты промывают H2O и затем рассолом. Раствор сушат (MgSO4) и упаривают до ярко-желтой жидкости, которую растворяют в ТГФ (250 мл) и 1 М HCl (250 мл). Реакционную смесь перемешивают при комнатной температуре 2 дня и затем нейтрализуют насыщенным раствором NaHCO3. Реакционную смесь экстрагируют эфиром. Эфирные экстракты промывают Н2О, затем рассолом, сушат (MgSO4) и упаривают с получением желтого масла. Сырой продукт очищают хроматографией на силикагеле (градиент гексан/EtOAc), получают желтое масло. Масло кристаллизуют из МеОН, получают 2-метиловый эфир 1-фениловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-5,6-дигидро-4Н-пиридин-1,2-дикарбоновой кислоты (15; 17,67 г, 57%) в виде белого твердого вещества: т.пл. 112-114°С. 1H ЯМР (300 МГц, CDCl3) δ 7,40 (м, 2H), 7,27 (м, 1Н), 7,14 (м, 4H), 6,22 (д, J=6,6 Гц, 1Н, H6), 5,90 (д, J=1,2 Гц, 1Н, H3), 3,97 (д, JF_H=0,9 Гц, 3H, OMe), 3,87 (с, 3H, CO2Me), 3,30 (дд, J=6,6, 17,4 Гц, 1Н, H5a), 3,05 (д, J=18 Гц, 1Н, H5b); 13C{1H} ЯМР (75,4 МГц, CDCl3) δ 191,7 (C4), 163,8 (CO2Me), 153,9 (д, JF-C=250 Гц, C2'), 151,0, 150,3, 145,0, 144,8, 129,6 (мета Ph), 128,8 (д, JF-C=3 Гц, C4'), 126,5 (пара Ph), 125,2 (д, JF-C=3 Гц, C5'), 124,5 (д, JF-C=12 Гц, C1'), 121,0 (д, JF-C=4 Гц, C6'), 120,9 (орто Ph), 114,5 (C3), 61,6 (д, JF-C=5 Гц, OMe), 53,8, 53,4, 41,6; Элементный анализ для C21H17ClFNO6: Вычислено: С 58,14; Н 3,95; N 3,23. Найдено: С 57,82; Н 3,90; N 3,18.
Пример 7. Получение метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16)
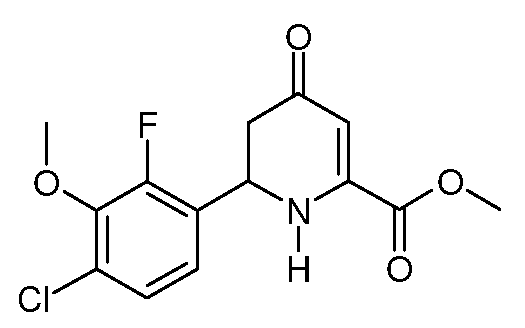
2-Метиловый эфир 1-фениловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-5,6-дигидро-4Н-пиридин-1,2-дикарбоновой кислоты (15; 7,213 г, 0,0166 моль) перемешивают в МеОН (80 мл). Суспензию охлаждают на ледяной бане и добавляют твердый метоксид натрия (NaOMe, 1,08 г, 0,02 моль). Через 1 час реакцию останавливают насыщенным водным раствором NH4Cl (80 мл) и Н2О (50 мл) и затем охлаждают льдом. Остаток отфильтровывают, промывают Н2О, затем холодным МеОН и сушат на воздухе, получают метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16; 4,93 г, 94%) в виде белого порошка: т.пл. 164,9-166,2°С. 1H ЯМР (300 МГц, CDCl3) δ 7,20 (дд, JF-H=1,8 Гц, JH-H=8,7 Гц, 1Н, ароматический), 7,10 (дд, JF-H=6,9 Гц, JH-H=8,7 Гц, 1Н, ароматический), 5,84 (д, J=0,9 Гц, 1Н, H3), 5,68 (уш.с, 1Н, NH), 5,10 (т, J=9,3 Гц, 1Н, H6), 3,98 (д, JF-H=1,5 Гц, 3H, OMe), 3,91 (с, 3H, CO2Me), 2,71 (д, J=9 Гц, 2H, H5); 13C{1H} ЯМР (75,4 МГц, CDCl3) δ 193,0 (C4), 163,6 (CO2Me), 153,8 (д, JF-C=251 Гц, C2'), 147,9 (C2), 144,6 (д, JF-C=13 Гц, C3'), 128,6 (д, JF-C=3 Гц, C1'/C4'), 126,8 (д, JF-C=11 Гц, C1'/C4'), 125,5 (д, JF-C=3 Гц, C5'), 121,5 (д, JF-C=4 Гц, C6'), 102,0 (C3), 61,6 (д, JF-C=5 Гц, OMe), 53,4, 50,8, 42,0; МСВР-ЭС (m/z): вычислено для C14H13ClFNO4, 313,0512; найдено 313,0511. Элементный анализ: Вычислено для C14H13ClFNO4: С 53,60; Н 4,18; N 4,46. Найдено: С 53,30; Н 4,14; N 4,35.
Пример 8. Получение этилового эфира 6-(4-хлор-2-фторфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (17)
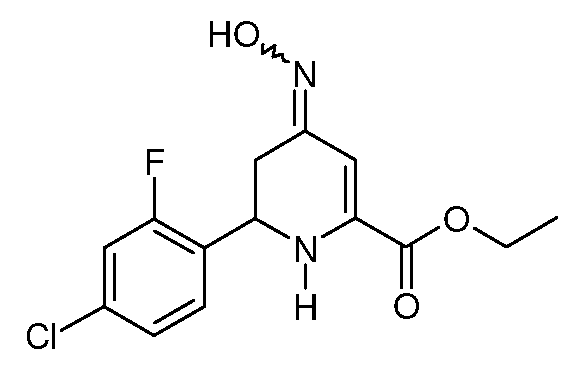
Смесь этилового эфира 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11; 41 г, 0,138 моль), гидрохлорида гидроксиламина (38,3 г, 0,552 моль) и пиридина (82 мл) в EtOH (400 мл) нагревают при кипении с обратным холодильником в течение 1 час. Реакционную смесь охлаждают до комнатной температуры и растворитель удаляют. Остаток растирают со смесью лед-Н2О, получают смесь (3:2) син- и анти-изомеров этилового эфира 6-(4-хлор-2-фторфенил)-4-гидрокси-имино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (17; 24 г, 56%, чистота по данным ВЭЖХ 98%) в виде бежевого твердого вещества: т.пл. 124-126°С. 1H ЯМР (400 МГц, DMSO-d6) основной изомер δ 9,3 (уш.с, 1Н), 7,40 (м, 1Н), 7,27 (м, 2H), 6,76 (уш.с, 1Н), 6,21 (с, 1Н), 4,80 (уш.с, 1Н), 4,42-4,13 (м, 2H), 2,69 (дд, J=14,9, 4,9 Гц, 1Н), 2,62-2,45 (м, 1Н), 1,30 (т, J=6,8 Гц, 3H); 1H ЯМР (400 МГц, DMSO-d6) минорный изомер δ 9,3 (уш.с, 1Н), 7,40 (м, 1Н), 7,27 (м, 2H), 6,12 (уш.с, 1Н), 5,95 (с, 1Н), 4,64 (дд, J=8,4, 5,1 Гц, 1Н), 4,42-4,13 (м, 2H), 2,91 (дд, J=16,5, 4,9 Гц, 1Н), 2,52 (м, 1Н), 1,27 (т, J=6,5 Гц, 3H); МСВР-ЭС (m/z): Вычислено для C14H14ClFN2O3, 312,068; найдено: 312,067.
Метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18)
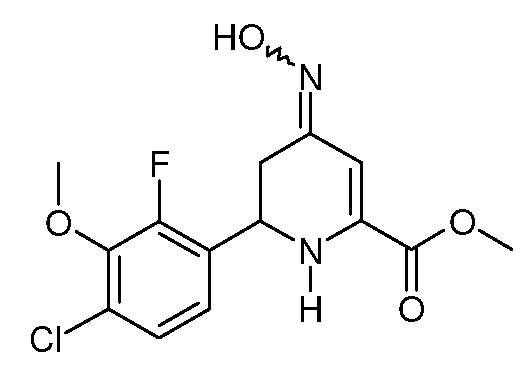
Метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16; 5,19 г, 16,5 ммоль) суспендируют в метаноле (160 мл). Добавляют гидрохлорид гидроксиламина (3,35 г, 48,3 ммоль), затем пиридин (10,0 мл, 123 ммоль). Реакционную смесь перемешивают при кипении с обратным холодильником в течение 120 минут. Метанол упаривают в вакууме. Добавляют Н2О (200 мл) и остаток экстрагируют эфиром (4 × 150 мл). Объединенные экстракты промывают рассолом, сушат (MgSO4) и упаривают в вакууме, получают метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 4,54 г, 80%) в виде белого твердого веществе: т.пл. 136-138°С. Данные спектроскопии ЯМР и ВЭЖХ показывают смесь син- и антиизомеров, 1:1. 1H ЯМР (400 МГц, C6D6) δ 8,34 (уш., 1Н, NOH), 8,25 (уш., 1Н, NOH), 7,00 (с, 1Н, H3), 6,71 (дд, JF-H=1,5 Гц, JH-H=9 Гц, 1Н, ароматический), 6,69 (дд, JF-H=1,8 Гц, JH-H=9 Гц, 1Н, ароматический), 6,57 (дд, JF-H=JH-H=7,5 Гц, 1Н, ароматический), 6,53 (с, 1Н, H3), 6,50 (дд, JF-H=JH-H=7,5 Гц, 1Н, ароматический), 4,72 (с, 1Н, NH), 4,52 (с, 1Н, NH), 4,38 (дд, JH-H=3,6, 10,2 Гц, 1Н, H6, изомер A), 4,23 (дд, JH-H=3,9, 11,4 Гц, 1Н, H6, изомер B), 3,53 (с, 6H, CO2Me), 3,24 (с, 3H, OMe), 3,23 (с, 3H, OMe), 3,30 (дд, JH-H=4,2, 16,8 Гц, 1Н, H5, изомер B), 2,63 (дд, JH-H=4,2, 15,3 Гц, 1Н, H5, изомер A), 2,44 (дд, JH-H=10,5, 15,3 Гц, 1Н, H5, изомер A), 2,33 (дд, JH-H=11,1, 16,8 Гц, 1Н, H5, изомер B); 13C{1H} ЯМР (CDCl3) δ 164,2 (CO2Me), 163,9 (CO2Me), 153,7 (д, JF-C=250 Гц, C2'), 153,6 (д, JF-C=251 Гц, C2'), 152,6 (C4), 149,6 (C4), 144,3 (д, JF-C=3 Гц, C3'), 144,1 (д, JF-C=3 Гц, C3'), 139,2, 138,3, 128,6 (д, JF-C=12 Гц), 127,9 (д, JF-C=11 Гц), 127,8 (д, JF-C=3 Гц), 127,7 (д, JF-C=3 Гц), 125,3, 121,7, 101,7 (C3), 92,6 (C3), 61,42, 61,38, 52,7, 52,6, 49,3, 48,3, 33,6 (C5), 28,7 (C5). МСВР-ЭС (m/z): Вычислено для C14H14ClFN2O4, 328,0621; найдено: 328,0620. Элементный анализ: Вычислено для C14H14ClFN2O4: С 51,15; Н 4,29; N 8,52. Найдено: С 51,31; Н 4,34; N 8,40.
Пример 9. Получение этилового эфира 6-(4-хлорфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (19)
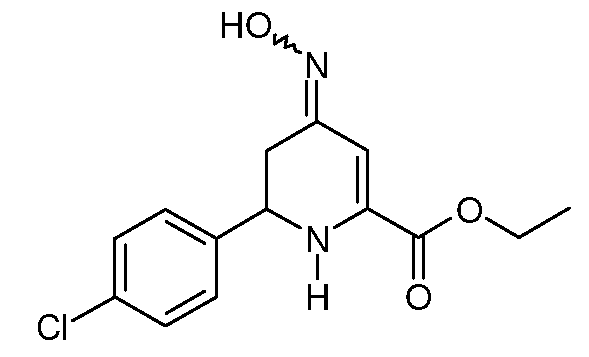
Смесь этилового эфира 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (12; 5,6 г, 0,02 моль) и 50%-ного водного гидроксиламина (3 мл, 0,045 моль) в толуоле (100 мл) перемешивают при кипении с обратным холодильником в течение 2 часов. После удаления растворителя остаток добавляют в CH2Cl2 (100 мл), промывают насыщенным водным раствором NaCl, сушат (MgSO4) и растворитель удаляют, получая оранжевое твердое вещество (5,8 г). Растирание в смеси эфир/пентан дает смесь син- и антиизомеров (3:2) этилового эфира 6-(4-хлорфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (19; 4,85 г, 85%) в виде почти белого твердого вещества: т.пл. 159-160°С. 1H ЯМР (400 МГц, CDCl3) основной изомер δ 9,3 (уш., 1Н), 7,35-7,25 (м, 4H), 6,19 (с, 1Н), 4,88 (с, 1Н), 4,36-4,25 (м, 3H), 3,35-3,23 (м, 1Н), 2,35 (дд, J=16,8, 12,8 Гц, 1Н), 1,34 (т, J=7,1 Гц, 3H); 1H ЯМР (400 МГц, CDCl3) минорный изомер δ 9,3 (уш.с, 1Н), 7,35-7,25 (м, 4H), 6,57 (с, 1Н), 5,19 (с, 1Н), 4,57-4,38 (м, 1Н), 4,36-4,25 (м, 2H), 2,72-2,54 (м, 2H), 1,34-1,31 (м, 3H); МСВР-ЭС (m/z): Вычислено для C14H15ClN2O3, 294,077; найдено: 294,077.
Пример 10. Получение этилового эфира 6-(4-хлор-2-фторфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (20)
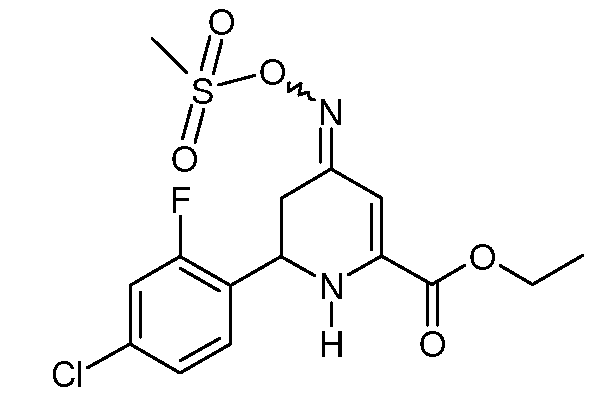
К раствору этилового эфира 6-(4-хлор-2-фторфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (17; 22,0 г, 0,0705 моль) в CH2Cl2 (220 мл) при механическом перемешивании добавляют триэтиламин (19,6 мл, 0,141 моль). Реакционную смесь охлаждают на ледяной бане и по каплям в течение 30 минут добавляют метансульфонилхлорид (8,8 мл, 0,113 моль). При нагревании до комнатной температуры в течение ночи реакционную смесь разбавляют CH2Cl2 (200 мл), промывают насыщенными водными растворами NaHCO3 и NaCl и сушат (Na2SO4). Растворитель удаляют, затем растирают в смеси эфир/пентан, получают смесь изомеров (8:1) этилового эфира 6-(4-хлор-2-фторфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (20; 10,5 г, 39%, чистота по данным 1Н ЯМР 95%) в виде почти белого твердого вещества: т.пл. 114-116°С. 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,36 (т, J=8,1 Гц, 1Н), 7,19 (дд, J=8,3, 1,6 Гц, 1Н), 7,15 (дд, J=10,1, 1,9 Гц, 1Н), 6,37 (с, 1Н), 5,59 (с, 1Н), 4,93 (дд, J=10,9, 4,4 Гц, 1Н), 4,35 (кв, J=7,1 Гц, 2H), 3,15 (с, 3H), 2,92-2,68 (м, 2H), 1,38 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): Вычислено для C15H16ClFN2O5S, 390,0447; найдено: 390,0444.
Метиловый эфир 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (21)
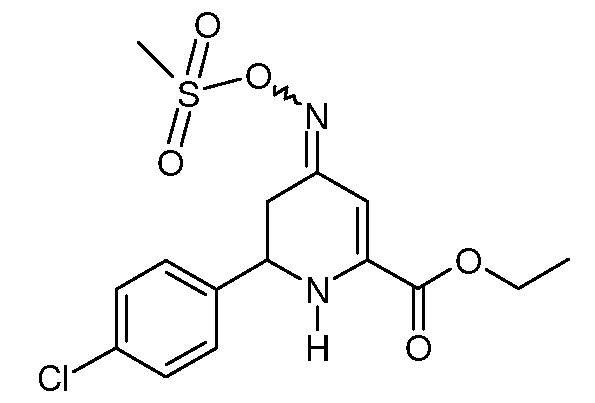
При использовании методики примера 10 этиловый эфир 6-(4-хлорфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (19; 13,0 Г, 0,0442 моль), метансульфонилхлорид (5,5 мл 0,0707 моль) и триэтиламин (12,3 мл, 0,0884 моль) дают смесь изомеров (8:1) этилового эфира 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (21; 10,5 г, 86%, чистота по данным ВЭЖХ 97%) в виде почти белого твердого вещества: т.пл. 113-115°С. 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,45-7,29 (м, 4H), 6,36 (с, 1Н), 5,59 (с, 1Н), 4,56 (дд, J=11,7, 5,3 Гц, 1Н), 4,35 (кв, J=7,1, 1,3 Гц, 2H), 3,15 (с, 3H), 2,82-2,67 (м, 2H), 1,38 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): Вычислено для C15H17ClN2O5S, 372,055; найдено: 372,055.
Пример 11. Получение метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (22)
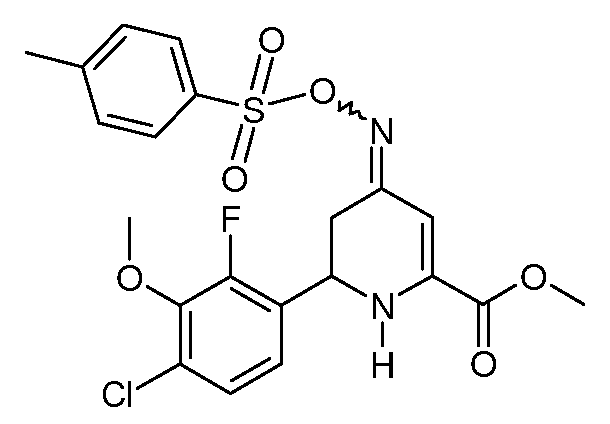
К раствору метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 0,657 г, 0,002 моль) в пиридине (5 мл), охлажденном на ледяной бане, при механическом перемешивании в течение 5 минут добавляют п-толуолсульфонилхлорид (0,572 г, 0,003 моль). После нагревания реакционной смеси до комнатной температуры в течение 2 дней растворитель удаляют при пониженном давлении. Остаток растворяют в CH2Cl2 (50 мл), промывают насыщенными водными растворами NaHCO3 и NaCl и сушат (MgSO4). Растворитель удаляют, получают вязкое оранжевое масло (1,12 г). Растирание в смеси эфир/пентан дает смесь изомеров (4:1) метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (22; 0,818 г, 85%) в виде почти белого твердого вещества: т.пл. 147-148°С. 1H ЯМР (400 МГц, CDCl3) δ 7,85 (д, J=8,3 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,11 (дд, J=8,5, 1,7 Гц, 1Н), 6,95 (дд, J=8,3, 7,2 Гц, 1Н), 6,39 (с, 1Н), 5,47 (с, 1Н), 4,84 (дд, J=10,6, 4,5 Гц, 1Н), 3,95 (д, J=1,1 Гц, 3H), 3,89 (с, 3H), 2,71 (ддд, J=26,3, 15,5, 7,7 Гц, 2H), 2,45 (с, 3H); МСВР-ЭС (m/z): Вычислено для C21H20ClFN2O6S, 482,0709; найдено: 482,0701.
Пример 12. Получение метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23)
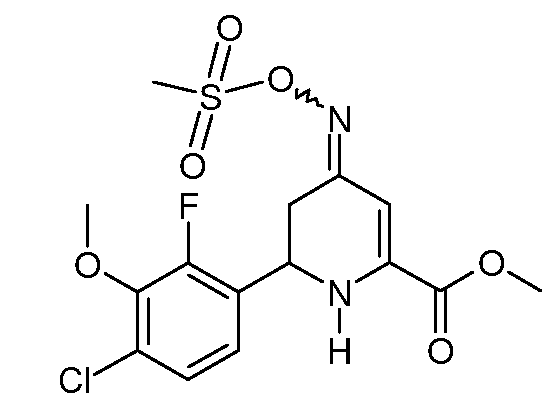
Стадия А: К раствору метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16; 4,70 г, 0,015 моль) в МеОН (100 мл) при механическом перемешивании при комнатной температуре добавляют гидрохлорид гидроксиламина (2,08 г, 0,03 моль), затем добавляют пиридин (8 мл). После кипячения смеси с обратным холодильником в течение 1 часа растворитель удаляют при пониженном давлении. Остаток растворяют в CH2Cl2 (100 мл) и промывают насыщенными водными растворами NaHCO3 и NaCl. После сушки (MgSO4) удаление растворителя дает смесь изомеров (1:1) метилового эфира 6-(4-хлор-2-фторфенил-3-метоксифенил)-4-гидрокси-имино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 4,95 г, сырой выход 100%) в виде желтого твердого вещества.
Стадия В: К раствору метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 4,95 г, 0,015 моль) в пиридине (30 мл), охлажденном на ледяной бане, при механическом перемешивании в течение 5 минут добавляют метансульфонилхлорид (3,43 г, 0,03 моль). После нагревания реакционной смеси до комнатной температуры в течение 2 дней растворитель удаляют при пониженном давлении. Остаток растворяют в CH2Cl2 (100 мл), промывают насыщенными водными растворами NaHCO3 и NaCl и сушат (MgSO4). Удаление растворителя дает липкое светло-оранжевое твердое вещество (5,5 г). Растирание в смеси эфир/пентан дает смесь изомеров (8:1) метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23; 4,14 г, 68%) в виде белого твердого вещества: т.пл. 134-135°С. 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,20 (дд, J=8,8, 1,3 Гц, 1Н), 7,06 (дд, J=8,5, 6,7 Гц, 1Н), 6,4 (с, 1Н), 5,59 (уш.с, 1Н), 4,93 (дд, J=10,8, 4,7 Гц, 1Н), 3,96 (с, 3H), 3,90 (с, 3H), 3,15 (с, 3H), 2,81 (м, 2H); МСВР-ЭС (m/z): Вычислено для C15H16ClFN2O6S, 406,040; найдено: 406,040.
Метиловый эфир 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (24)
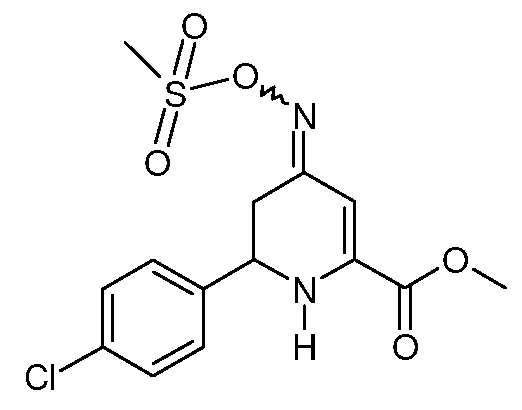
При использовании методики примера 12 метиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (13; 6,64 г, 0,025 моль), гидрохлорид гидроксиламина (3,47 г, 0,05 моль) и пиридин (10 мл) после обработки дают оранжевое масло (9,1 г). Этот материал снова растворяют в пиридине (40 мл) и обрабатывают метансульфонилхлоридом (5,72 г, 0,05 моль), получают смесь изомеров (4:1) метилового эфира 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (24; 3,5 г, 39%, чистота по данным 1Н ЯМР 95%) в виде почти белого твердого вещества: т.пл. 62-64°С. 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,42-7,28 (м, 4H), 6,39 (с, 1Н), 5,55 (с, 1Н), 4,57 (дд, J=11,6, 5,1 Гц, 1Н), 3,90 (с, 3H), 3,14 (с, 3H), 2,93-2,65 (м, 2H); минорный изомер δ 7,45-7,28 (м, 4H), 6,15 (с, 1Н), 5,23 (с, 1Н), 4,41 (дд, J=13,4, 4,3 Гц, 1Н), 3,90 (с, 3H), 3,30 (дд, J=17,2, 4,3 Гц, 1Н), 3,15 (с, 3H), 2,56 (дд, J=17,1, 13,5 Гц, 1Н); МСВР-ЭС (m/z): Вычислено для C14H15ClN2O5S, 358,0384; найдено: 358,0385.
Этиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (25)
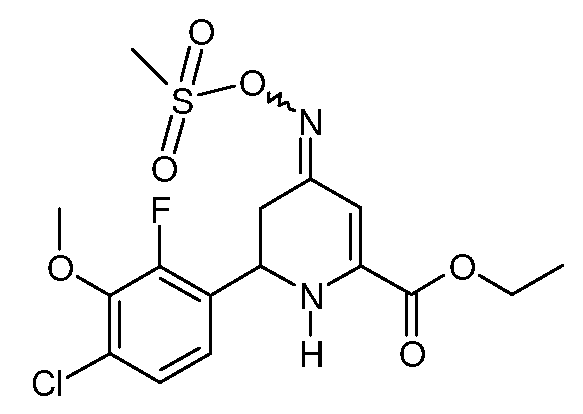
При использовании методики примера 12 этиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (14; 3,93 г, 0,012 моль), гидрохлорид гидроксиламина (2,08 г, 0,03 моль) и пиридин (8 мл) после обработки дают липкое оранжевое твердое вещество (5,1 г). Этот материал снова растворяют в пиридине (30 мл) и обрабатывают метансульфонилхлоридом (2,75 г, 0,024 моль), получают смесь изомеров (4:1) этилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (25; 2,6 г, 52%, чистота по данным 1Н ЯМР 95%) в виде белого твердого вещества: т.пл. 130-132°С. 1H ЯМР (400 МГц, CDCl3) δ 7,20 (дд, J=8,5, 1,5 Гц, 1Н), 7,10-7,05 (м, 1Н), 6,37 (с, 1Н), 5,60 (с, 1Н), 4,93 (дд, J=11,1, 4,4 Гц, 1Н), 4,45-4,34 (м, 2H), 3,98 (д, J=1,1 Гц, 3H), 3,16 (с, 3H), 2,95-2,74 (м, 2H), 1,40 (д, J=7,1 Гц, 3H); МСВР-ЭС (m/z): Вычислено для C16H18ClFN2O6S, 420,056; найдено: 420,056.
Пример 13. Получение метилового эфира 3-хлор-6-(4-хлор-2-фторфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (26)
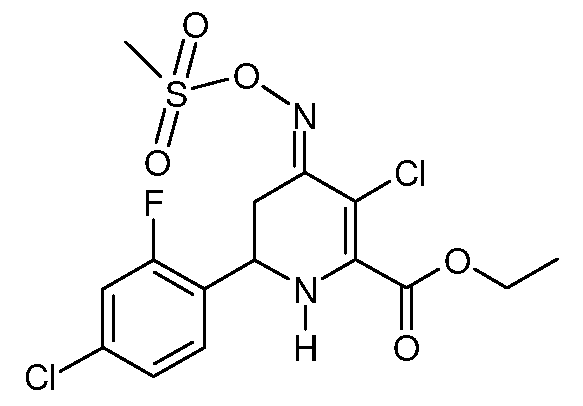
К раствору этилового эфира 6-(4-хлор-2-фторфенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (20; 2,74 г, 0,007 моль) в CH2Cl2 (20 мл), охлажденном на ледяной бане, при механическом перемешивании в течение 5 минут добавляют раствор сульфурилхлорида (SO2Cl2, 0,94 г, 0,007 моль) в CH2Cl2. После нагревания реакционной смеси до комнатной температуры в течение 1 часа добавляют CH2Cl2 (50 мл). После промывки реакционной смеси насыщенным водным раствором NaCl и сушки (MgSO4) растворитель удаляют, получают этиловый эфир 3-хлор-6-(4-хлор-2-фторфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (26; 2,91 г, 98%, чистота по данным 1Н ЯМР 95%) в виде пушистого светло-желтого твердого вещества: т.пл. 63-64°С. 1H ЯМР (400 МГц, CDCl3) δ 7,37 (т, J=8,1 Гц, 1Н), 7,20 (дд, J=8,4, 1,7 Гц, 1Н), 7,16 (дд, J=10,1, 2,0 Гц, 1Н), 5,31 (с, 1Н), 4,78 (дд, J=12,6, 4,5 Гц, 1Н), 4,41 (кв, J=7,1 Гц, 2H), 3,39 (дд, J=16,9, 4,4 Гц, 1Н), 3,22 (с, 3H), 2,91-2,76 (м, 1Н), 1,40 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): Вычислено для C15H15Cl2FN2O5S, 425,240; найдено 425,240.
Метиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (27)
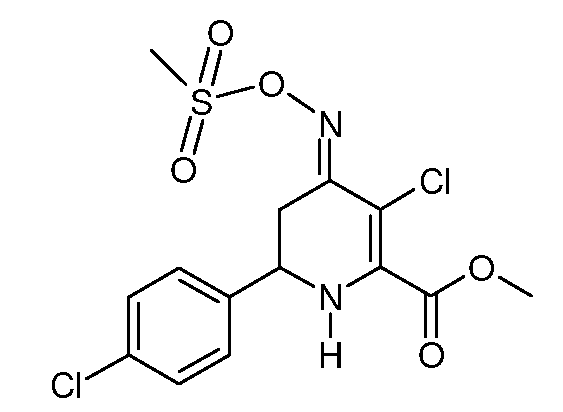
При использовании методики примера 13 метиловый эфир 6-(4-хлор-фенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (24; 2,78 г, 0,008 моль) и SO2Cl2 (1,08 г, 0,005 моль) в CH2Cl2 (25 мл) дают метиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(E)-метансульфонилоксимино]-3-хлор-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (27; 3,20 г, 99%, чистота по данным 1Н ЯМР 95%) в виде пушистого светло-желтого твердого вещества: т.пл. 60-62°С. 1H ЯМР (400 МГц, CDCl3) δ 7,41-7,29 (м, 4H), 5,33 (с, 1Н), 4,44 (дд, J=13,8, 4,1 Гц, 1Н), 3,94 (с, 3H), 3,40 (ддд, J=16,9, 4,2, 1,8 Гц, 1Н), 3,21 (с, 3H), 2,88-2,57 (м, 1Н); МСВР-ЭС (m/z): Вычислено для C15H14Cl2N2O5S, 391,9995; найдено 391,9997.
Этиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (28)
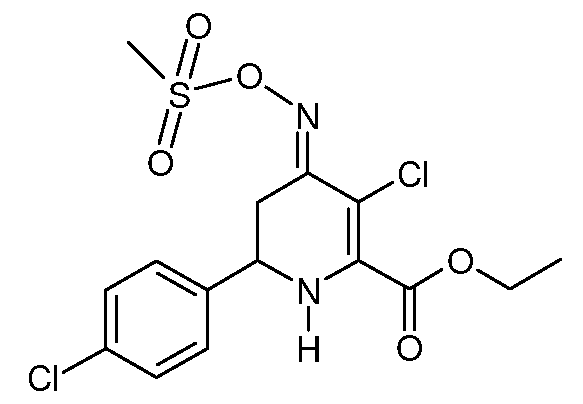
При использовании методики примера 13 этиловый эфир 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (21; 5,97 г, 0,016 моль) и SO2Cl2 (2,16 г, 0,016 моль) в CH2Cl2 (50 мл) дают этиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (28; 6,43 г, 99%, чистота по данным 1Н ЯМР 92%) в виде пушистого светло-желтого твердого вещества: т.пл. 57-59°С. 1H ЯМР (400 МГц, CDCl3) δ 7,35 (м, 4H), 5,35 (с, 1Н), 4,44 (дд, J=13,0, 3,2 Гц, 1Н), 4,39 (т, J=7,1 Гц, 2H), 3,39 (ддд, J=16,9, 4,2, 1,8 Гц, 1Н), 3,22 (с, 3H), 2,65 (дд, J=16,9, 13,9 Гц, 1Н), 1,40 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): Вычислено для C125H16Cl2N2O5S, 406,015; найдено 406,016.
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (29)
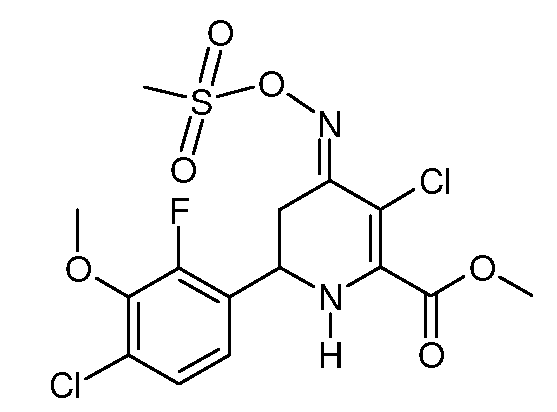
При использовании методики примера 13 метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23; 2,04 г, 0,005 моль) и SO2Cl2 (0,68 г, 0,005 моль) в CH2Cl2 (10 мл) дают метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (29; 2,18 г, 99%, чистота по данным 1Н ЯМР 95%) в виде пушистого светло-желтого твердого вещества: т.пл. 64-66°С. 1H ЯМР (400 МГц, CDCl3) δ 7,24 (дд, J=8,8, 1,3 Гц, 1Н), 7,09 (дд, J=8,5, 6,7 Гц, 1Н), 5,38 (с, 1Н), 4,78 (дд, J=12,7, 4,5 Гц, 1Н), 3,98 (с, 3H), 3,93 (с, 3H), 3,42 (дд, J=16,7, 4,5 Гц, 1Н), 3,24 (с, 3H), 2,77 (дд, J=16,9, 12,8 Гц, 1Н); МСВР-ЭС (m/z): Вычислено для C15H15ClFN2O5S, 441,001; найдено 441,002.
Этиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (30)
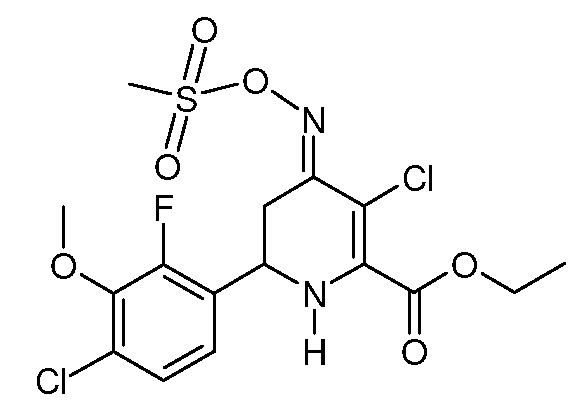
При использовании методики примера 13 метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (25; 2,11 г, 0,005 моль) и SO2Cl2 (0,68 г, 0,005 моль) в CH2Cl2 (10 мл) дают этиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (30; 2,21 г, 97%, чистота по данным 1Н ЯМР 95%) в виде пушистого светло-желтого твердого вещества: т.пл. 60-62°С. 1H ЯМР (400 МГц, CDCl3) δ 7,21 (дд, J=8,5, 1,8 Гц, 1Н), 7,08 (дд, J=8,6, 6,9 Гц, 1Н), 5,32 (с, 1Н), 4,78 (дд, J=12,8, 4,5 Гц, 1Н), 4,41 (кв, J=7,1 Гц, 2H), 3,99 (д, J=1,3 Гц, 3H), 3,41 (дд, J=16,9, 4,5 Гц, 1Н), 3,23 (с, 3H), 2,76 (дд, J=11,7, 5,2 Гц, 1Н), 1,40 (т, J=7,1 Гц, 3H); МСВР-ЭС (m/z): Вычислено для C16H17Cl2FNO6S, 454,016; найдено 454,017.
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (31)
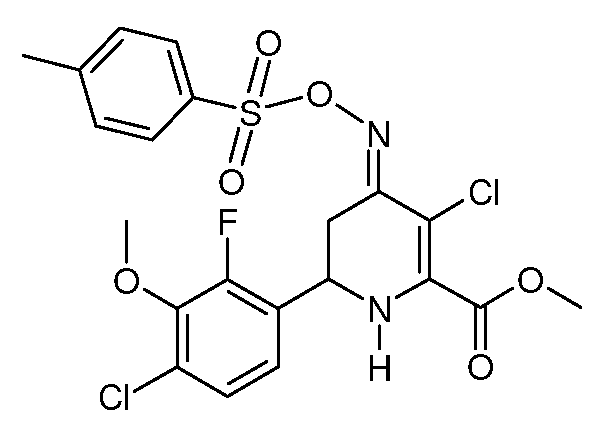
При использовании методики примера 13 метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (22; 0,628 г, 0,0013 моль) и SO2Cl2 (0,175 г, 0,0013 моль) в CH2Cl2 (5 мл) дают метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (31; 0,616 г, 98%, чистота по данным 1Н ЯМР 95%) в виде пушистого светло-желтого твердого вещества: т.пл. 62-64°С. 1H ЯМР (400 МГц, CDCl3) δ 7,91 (д, J=8,3 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H), 7,16 (дд, J=8,5, 1,7 Гц, 1Н), 7,01 (дд, J=8,4, 7,1 Гц, 1Н), 5,25 (с, 1Н), 4,70 (дд, J=12,6, 4,3 Гц, 1Н), 3,97 (д, J=1,2 Гц, 3H), 3,91 (с, 3H), 3,33 (ддд, J=16,8, 4,4, 1,6 Гц, 1Н), 2,88-2,64 (м, 1Н), 2,45 (с, 3H); МСВР-ЭС (m/z): Вычислено для C21H19Cl2FN2O5S, 516,0322; найдено 516,0319.
Пример 14. Получение метилового эфира 3-бром-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (32)
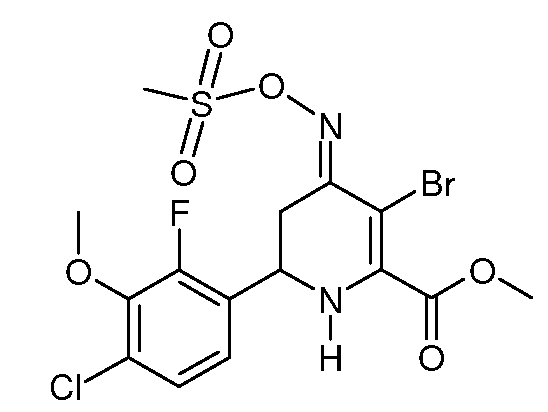
Добавляют N-бромсукцинимид (0,512 г, 2,88 ммоль) к раствору метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23; 1,17 г, 2,88 ммоль) в CH2Cl2 (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и затем разбавляют CH2Cl2 и промывают Н2О. Органический слой отделяют и сушат с помощью Biotage Phase Separator SPE. Растворитель удаляют в вакууме, получают коричневое масло (1,4 г). Очистка хроматографией на силикагеле (40% EtOAc/10% CH2Cl2/50% пентан) дает метиловый эфир 3-бром-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (32; 1,17 г, 84%) в виде желтого стеклообразного вещества. 1H ЯМР (300 МГц, CDCl3) δ 7,21 (дд, J=8,6, 1,8 Гц, 1Н), 7,07 (дд, J=8,4, 6,7 Гц, 1Н), 5,39 (с, 1Н), 4,81 (д, J=12,2 Гц, 1Н), 4,01-3,97 (м, 4H), 3,94 (д, J=2,0 Гц, 3H), 3,43 (дд, J=16,8, 2,8 Гц, 1Н), 3,23 (д, J=1,9 Гц, 3H), 2,79 (дд, J=16,8, 12,7 Гц, 1Н); МСВР-ЭС (m/z): Вычислено для C15H17BrClFN2O6S, 485,9663; найдено 485,9663.
Пример 15. Получение метилового эфира 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (33)
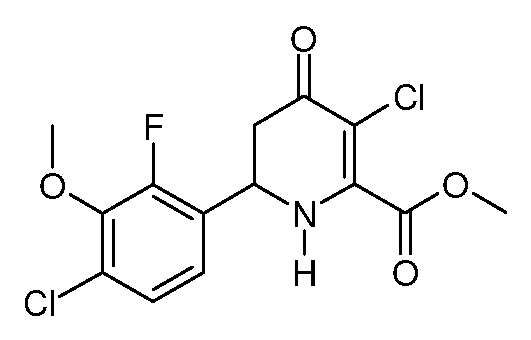
Метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16; 483 мг, 1,54 ммоль) суспендируют в CH2Cl2 (10 мл) и охлаждают на ледяной бане. По каплям добавляют раствор SO2Cl2 (209 мг, 1,55 ммоль) в CH2Cl2 (5 мл). Через 30 минут реакционный раствор гасят 10% водным раствором бисульфита натрия. Органический слой отделяют, промывают насыщенным водным раствором NaHCO3, Н2О и рассолом, затем сушат (MgSO4). Раствор упаривают до желтого масла, которое кристаллизуют из холодного метанола, получают метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (33; 0,437 г, 81%) в виде светло-желтого твердого вещества: т.пл. 127-129°С. 1H ЯМР (300 МГц, CDCl3) δ 7,20 (дд, JF-H=1,5 Гц, JH-H=8,1 Гц, 1Н, ароматический), 7,10 (дд, JF-H=6,9 Гц, JH-H=8,1 Гц, 1Н, ароматический), 5,82 (уш.с, 1Н, NH), 5,10 (т, J=9,3 Гц, 1Н, H6), 3,98 (д, JF-H=1,5 Гц, 3H, OCH3), 3,97 (с, 3H, CO2CH3), 2,88 (д, J=9 Гц, 2H, H5); МС(ЭС) (ESIMS) (m/z): 347,9 ([М+Н]+).
Пример 16. Получение метилового эфира 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (34)
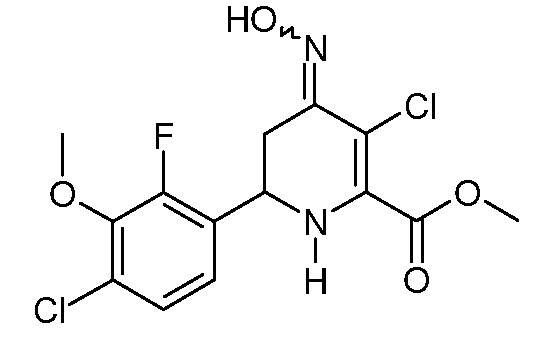
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-3-хлор-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (33; 1,612 г, 4,63 ммоль) суспендируют в МеОН (20 мл). Добавляют гидрохлорид гидроксиламина (966 мг, 13,9 ммоль), затем пиридин (3 мл). Реакционную смесь перемешивают в течение 18 часов при комнатной температуре и затем в течение 4 часов при 40°С. Растворитель упаривают на роторном испарителе. Добавляют Н2О (100 мл), полученное твердое вещество отфильтровывают, промывают Н2О, затем МеОН, получают метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (34; 1,353 г, 81%) в виде белого порошка: т.пл. 174-176°С. 1H ЯМР (300 МГц, DMSO-d6) δ 11,23 (с, 1Н, NOH), 7,35 (дд, JF-H=1,5 Гц, JH-H=8,7 Гц, 1Н, ароматический), 7,17 (дд, JF-H=JH-H=8,7 Гц, 1Н, ароматический), 6,93 (уш.с, 1Н, NH), 4,69 (м, 1Н, H6), 3,88 (с, 3H), 3,79 (с, 3H), 3,03 (дд, J=4,5, 16 Гц, 1Н, H5a), 2,74 (дд, J=9,0, 16 Гц, 1Н, H5b); Элементный анализ: Вычислено для C14H13Cl2FN2O4: С 46,30; Н 3,61; N 7,71. Найдено: С 46,77; Н 3,64; N 7,42.
Пример 17. Получение метилового эфира 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-ацетоксиоксимино]-3-хлор-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (35)
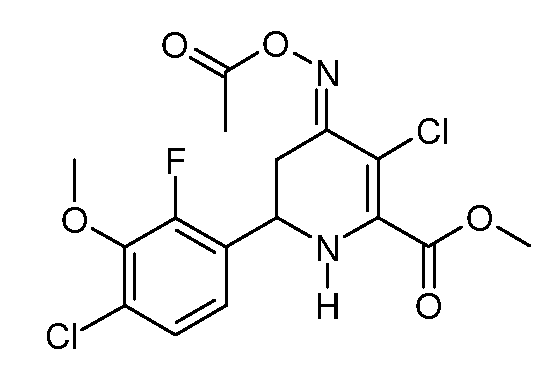
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-3-хлор-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (34; 756 мг, 2,08 ммоль) суспендируют в ледяной уксусной кислоте (10 мл). При комнатной температуре по каплям добавляют уксусный ангидрид (241 мг, 2,36 ммоль). Реакционную смесь нагревают при 80°С в течение 2 часов. Раствор концентрируют в вакууме, остаток растворяют в CH2Cl2 (50 мл) и промывают насыщенным водным раствором NaHCO3. Экстракты промывают рассолом, сушат (MgSO4) и упаривают, получают метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-ацетоксиоксимино]-3-хлор-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (35; 842 мг, 99%) в виде светло-оранжевого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,21 (дд, JF-H=1,5 Гц, JH-H=8,4 Гц, 1Н, ароматический), 7,11 (дд, JF-H=6,9 Гц, JH-H=8,4 Гц, 1Н, ароматический), 5,24 (уш.с, 1Н, NH), 4,76 (дд, J=4,2, 12,3 Гц, 1Н, H5a), 3,98 (д, JF-H=1,5 Гц, 3H, OMe), 3,94 (с, 3H, CO2Me), 3,40 (ддд, JF-H=1,8 Гц, JH-H=4,2, 16,5 Гц, 1Н, H6), 2,72 (дд, J=12,3, 16,5 Гц, 1Н, H5b), 2,23 (с, 3H, NOAc). МСВР: вычислено для C16H15Cl2FN2O5, 404,034; найдено 404,034.
Пример 18. Получение гербицидных композиций
В приведенных ниже иллюстративных композициях части и проценты являются массовыми (% масс.).
ЭМУЛЬГИРУЮЩИЕСЯ КОНЦЕНТРАТЫ
Такие концентраты могут быть разбавлены водой с получением эмульсий с концентрациями, подходящими для контроля сорняков.
СМАЧИВАЮЩИЕСЯ ПОРОШКИ
Активный ингредиент наносят на соответствующие носители и затем их смешивают и измельчают с получением смачивающихся порошков с прекрасной смачиваемостью и эффективностью суспензии. При разбавлении таких смачивающихся порошков водой можно получить суспензии с концентрациями, приемлемыми для контроля сорняков.
ВОДОДИСПЕРГИРУЮЩИЕСЯ ГРАНУЛЫ
Активный ингредиент добавляют к гидратированному диоксиду кремния, который затем смешивают с другими ингредиентами и измельчают в порошок. Порошок агломерируют с помощью воды и просеивают, получают гранулы в интервале от -10 до +60 меш. Путем диспергирования таких гранул в воде можно получать суспензии с концентрациями, подходящими для контроля сорняков.
ГРАНУЛЫ
Активный ингредиент наносят в полярном растворителе, таком как N-метилпирролидон, циклогексанон, гамма-бутиролактон и т.д., на носитель Celetom MP 88 или на другие подходящие носители. Полученные гранулы могут быть применены вручную, с помощью машины для внесения гранул, самолетом и т.д. для контроля сорняков.
Все материалы смешивают и измельчают до порошка, затем добавляют воду и глиняную смесь смешивают до тех пор, пока не образуется паста. Смесь экструдируют через фильеру, получают гранулы подходящего размера.
Активный ингредиент растворяют в подходящем количестве воды и в качестве буфера добавляют еще моноэтаноламин. Можно добавить водорастворимое поверхностно-активное вещество. Могут быть введены другие добавки для улучшения физических, химических и/или рецептурных свойств.
Пример 19. Оценка гербицидной активности
Послевсходовое испытание I: Семена сорняков получают от промышленных поставщиков и высаживают в круглые 5-дюймовые (12,7 см) горшки, содержащие микс беспочвенной среды (Merto-Mix 360®, Sun Gro Horticulture Canada CM Ltd., Vancouver, British Columbia), за 8-12 дней до применения и выращивают в теплице, оборудованной дополнительными источниками света, чтобы обеспечить 16-часовой световой период при 24-29 оС. Все горшки орошают поверхностно.
Соединения растворяют в смеси (97:3 об./об.) ацетона и диметилсульфоксида (ДМСО) и разбавляют до подходящей концентрации в конечном растворе для нанесения, содержащем воду, ацетон, изопропиловый спирт, ДМСО и Agri-dex (масляный концентрат), в соотношении 59:23:15:1,0:1,5 (об/об) и 0,02% масс/об Triton X-155, получают раствор для опрыскивания, содержащий наиболее высокую норму расхода при применении. Высокую норму расхода при применении последовательно разбавляют с помощью указанного выше раствора для применения, чтобы обеспечить доставку соединения при нормах расхода 1/2, 1/4 и 1/8 от наиболее высокой нормы расхода (эквивалентно 4,0, 2,0, 1,0 и 0,5 кг/га, соответственно).
Соединение в виде препарата (2,7 мл) наносят с использованием пневматического опрыскивателя DeVilbiss® при давлении 2-4 фунт/кв.дюйм (0,29-0,58 килопаскалей (кПа)). После обработки горшкам дают высохнуть перед возвращением в теплицу для продолжения опыта и при необходимости проводят подпочвенное орошение. Все горшки удобряют один раз в неделю путем подпочвенного орошения с удобрением Peters Peat-Lite Special® (20-10-20).
Баллную оценку фитотоксичности получают через 10 дней после обработки. Все оценки проводят по шкале от 0 до 100, где 0 означает отсутствие активности, а 100 означает полную гибель растения. Некоторые испытуемые соединения, используемые нормы расхода при применении, испытанные виды растений и полученные результаты представлены в таблице 1.
Послевсходовые испытания I: Контроль сорняков
г а.и./га
HELAN: подсолнечник однолетний (Helianthus annuus)
IPOHE: ипомея утренняя слава (Ipomoea hederacea)
AVEFA: овсюг (Avena fatua)
SETFA: щетинник большой (Setaria faberi)
Довсходовое испытание I: Семена сорняков получают от промышленных поставщиков и высаживают в круглые пластиковые горшки (диаметр 5 дюймов (12,7 см)), содержащие суглинистую почву (23% песка, 52% ила, 29% глины, 2,9% органического вещества, емкость катионного обмена (ЭКО, СЕС) 16,6, рН 7,2). После высадки все горшки подвергают подпочвенному орошению за 16 часов до применения соединения.
Соединения растворяют в смеси (97:3, об/об) ацетона и ДМСО и разбавляют до подходящей концентрации в конечном растворе для нанесения, содержащем воду, ацетон, изопропиловый спирт, ДМСО и Agri-dex (масляный концентрат), в соотношении 59:23:15:1,0:1,5 (об/об) и 0,02% масс/об Triton X-155, получают раствор для опрыскивания, содержащий наиболее высокую норму расхода при применении. Высокую норму расхода последовательно разбавляют указанным выше раствором для применения, чтобы обеспечить доставку соединения при нормах расхода 1/2, 1/4 и 1/8 от наиболее высокой нормы расхода (что эквивалентно 4,0, 2,0, 1,0 и 0,5 кг/га, соответственно).
Соединение в виде препарата (2,7 мл) наносят пипеткой равномерно на поверхность почвы с последующим введением с помощью воды (15 мл). После обработки горшки возвращают в теплицу для продолжения опыта. Теплицу программируют приблизительно на 15-часовой световой период, при котором поддерживают температуру 23-29°С днем и 22-28°С ночью. Регулярно добавляют питательные вещества и воду путем поверхностного орошения и при необходимости обеспечивают дополнительное облучение с помощью подвесных металлгалогеновых ламп мощностью 1000 Вт.
Балльную оценку гербицидной активности получают через 14 дней после обработки. Все оценки проводят относительно подходящих контролей по шкале от 0 до 100, где 0 означает отсутствие гербицидного эффекта, а 100 означает гибель растения или отсутствие всходов из почвы. Некоторые испытуемые соединения, используемые нормы расхода при применении, испытанные виды растений и полученные результаты представлены в таблице 2.
Довсходовые испытания I: Контроль сорняков
г а.и./га
HELAN: подсолнечник однолетний (Helianthus annuus)
IPOHE: ипомея утренняя слава (Ipomoea hederacea)
AVEFA: овсюг (Avena fatua)
SETFA: щетинник большой (Setaria faberi)
Послевсходовые испытания II: Семена или орехи целевых видов испытуемых растений высаживают в посевную смесь Sun Gro Metro-Mix® 360, которая обычно имеет рН от 6,0 до 6,8 и содержание органического вещества 30%, в пластиковые горшки с площадью поверхности 64 см2. Если требуется обеспечить хорошее прорастание и здоровые растения, проводят обработку фунгицидом и/или другую химическую, или физическую обработку. Растения выращивают в течение 7-21 дня в теплице приблизительно с 15-часовым световым периодом, при этом поддерживают температуру 23-29°С днем и 22-28°С ночью. Регулярно добавляют питательные вещества и воду путем поверхностного орошения и при необходимости обеспечивают дополнительное облучение с помощью подвесных металлгалогеновых ламп мощностью 1000 Вт. Растения используют для испытаний, когда они достигают стадии первого или второго настоящего листа.
Взвешенное количество, определенное по наиболее высокой норме расхода, которая должна быть испытана, каждого испытуемого соединения помещают в стеклянный сосуд объемом 25 мл и растворяют в 4 мл смеси ацетона и ДМСО (97:3 об/об), чтобы получить концентрированные исходные растворы. Если испытуемое соединение не растворяется легко, смесь нагревают и/или обрабатывают ультразвуком. Полученные концентрированные исходные растворы разбавляют 20 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, масляный концентрат растительного масла Atplus 411F и поверхностно-активное вещество Triton® X-155 в соотношении 48,5:39:10:1,5:1,0:0,02 об/об с получением опрыскивающих растворов, содержащих наиболее высокие нормы расхода при применении. Дополнительные нормы расхода для применения получают путем последовательного разбавления 12 мл раствора с высокой нормой расхода в растворе, содержащем 2 мл смеси ацетона и ДМСО (97:3 об/об) и 10 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Atplus 411F и поверхностно-активное вещество Triton® X-155, в соотношении 48,5:39:10:1,5:1,0:0,02 об/об с получением 1/2, 1/4, 1/8 и 1/16 от высокой нормы расхода. Требования по соединению основаны на объеме применения 12 мл при норме расхода 187 литров на гектар (л/га). Соединения в форме препарата наносят на растительный материал с помощью подвесного полевого опрыскивателя, оборудованного насадками 8002Е, калиброванными для высвобождения 187 л/га на площадь нанесения 0,503 м2, при высоте опрыскивания 18 дюймов (43 см) над средней высотой растительного покрова. Контрольные растения опрыскивают таким же образом с помощью чистого раствора.
Обработанные растения и контрольные растения помещают в теплицу, описанную выше, и обводняют путем подпочвенного орошения, чтобы предупредить смыв испытуемых соединений. Через 14 дней состояние испытуемых растений в сравнении с состоянием необработанных растений определяют визуально и ранжируют по шкале от 0 до 100%, где 0 соответствует отсутствию повреждений и 100 соответствует полной гибели. Некоторые испытанные соединения, использованные нормы расхода при применении, испытанные виды растений и результаты приведены в таблице 3.
Послевсходовые испытания II: Контроль сорняков
г а.и./га
CHEAL: лебеда белая (Chenopodium album)
POLCO: горец вьюнковый (Polygonum convolvulus)
ABUTH: канатник Теофраста (Abutilon theophrasti)
ECHCG: просо петушье (Echinochloa crus-galli).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 6-АРИЛ-4-АМИНОПИКОЛИНАТОВ | 2010 |
|
RU2525918C2 |
| СЛОЖНЫЕ АРИЛАЛКИЛОВЫЕ ЭФИРЫ 4-АМИНО-6-(ЗАМЕЩЕННЫЙ ФЕНИЛ)ПИКОЛИНАТОВ И 6-АМИНО-2-(ЗАМЕЩЕННЫЙ ФЕНИЛ)-4-ПИРИМИДИНКАРБОКСИЛАТОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2012 |
|
RU2566760C2 |
| 6-АМИНО-2-ЗАМЕЩЕННЫЕ-5- ВИНИЛСИЛИЛПИРИМИДИН-4-КАРБОНОВЫЕ КИСЛОТЫ И СЛОЖНЫЕ ЭФИРЫ И 4-АМИНО-6-ЗАМЕЩЕННЫЕ-3-ВИНИЛСИЛИЛПИРИДИН-ПИКОЛИНОВЫЕ КИСЛОТЫ И СЛОЖНЫЕ ЭФИРЫ КАК ГЕРБИЦИДЫ | 2012 |
|
RU2556000C2 |
| 6-(ПОЛИЗАМЕЩЕННЫЙ АРИЛ)-4-АМИНОПИКОЛИНАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2007 |
|
RU2428416C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2013 |
|
RU2632203C2 |
| НОВОЕ ПРОИЗВОДНОЕ ТЕТРАГИДРОИЗОХИНОЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, ПРИМЕНЕНИЕ ЕГО И СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЗАБОЛЕВАНИЯ | 2009 |
|
RU2474575C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2528046C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛЫ | 2001 |
|
RU2286343C2 |
| АРИЛКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2340605C2 |
| БЕНЗОИМИДАЗОЛЫ КАК ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ | 2009 |
|
RU2531354C2 |
Изобретение относится к галоген-6-(арил)-4-иминотетрагидропиколиновым кислотам формулы I:
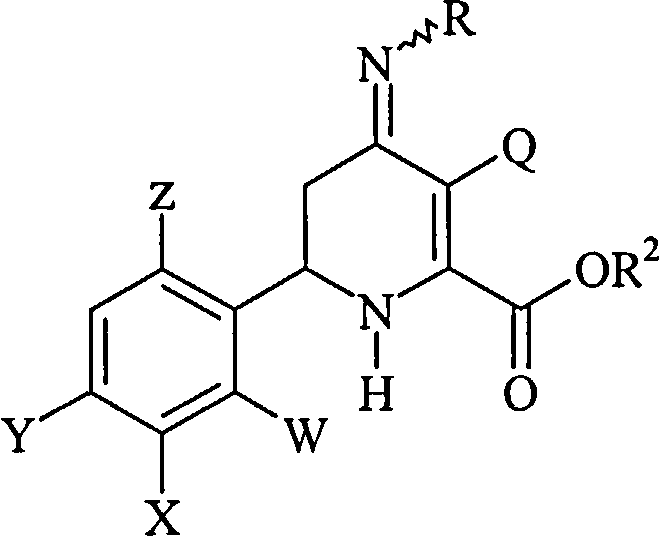 ,
,
где R представляет собой -ОS(O)2R1 или -OC(O)R1; R1 представляет собой С1-С4-алкил или фенил, замещенный C1-С4-алкилом; R2 представляет собой С1-С4-алкил; Q представляет собой Сl или Вr; W представляет собой Н, F или Сl; Х представляет собой Н или С1-С4-алкокси-группу; Y представляет собой атом галогена; и Z представляет собой Н или F. Изобретение также относится к гербицидным композициям на основе указанного соединения формулы (I). Технический результат: получены новые соединения и гербицидные композиции на их основе, которые могут найти применение в сельском хозяйстве для подавления нежелательной растительности. 3 н. и 1 з.п. ф-лы, 3 табл., 19 пр.
1. Соединение формулы I:

где
R представляет собой -ОS(O)2R1 или -OC(O)R1;
R1 представляет собой С1-С4-алкил или фенил, замещенный C1-С4-алкилом;
R2 представляет собой С1-С4-алкил;
Q представляет собой Сl или Вr;
W представляет собой Н, F или Сl;
Х представляет собой Н или С1-С4-алкокси-группу;
Y представляет собой атом галогена; и
Z представляет собой Н или F.
2. Соединение по п.1, в котором W представляет собой Н или F, Х представляет собой Н или С1-С4-алкокси-группу, Y представляет собой Сl и Z представляет собой Н.
3. Гербицидные композиции, содержащие гербицидно-эффективное количество соединения формулы I по п.1 в смеси с сельскохозяйственно-приемлемым адъювантом или носителем.
4. Способ подавления нежелательной растительности, который включает контактирование растительности или места ее нахождения с гербицидно-эффективным количеством соединения формулы I по п.1 или нанесение на почву гербицидно-эффективного количества соединения формулы I по п.1 для предупреждения прорастания растительности.
| WO 2007082098 А2, 19.07.2007 | |||
| US 20030114311 A1, 19.06.2003 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-ИМИНО-1,4- ДИГИДРОПИРИДИНОВ | 1969 |
|
SU415872A3 |
Авторы
Даты
2014-09-10—Публикация
2010-06-08—Подача